Способ получения фармацевтической системы доставки - RU2693491C2
Код документа: RU2693491C2
Чертежи
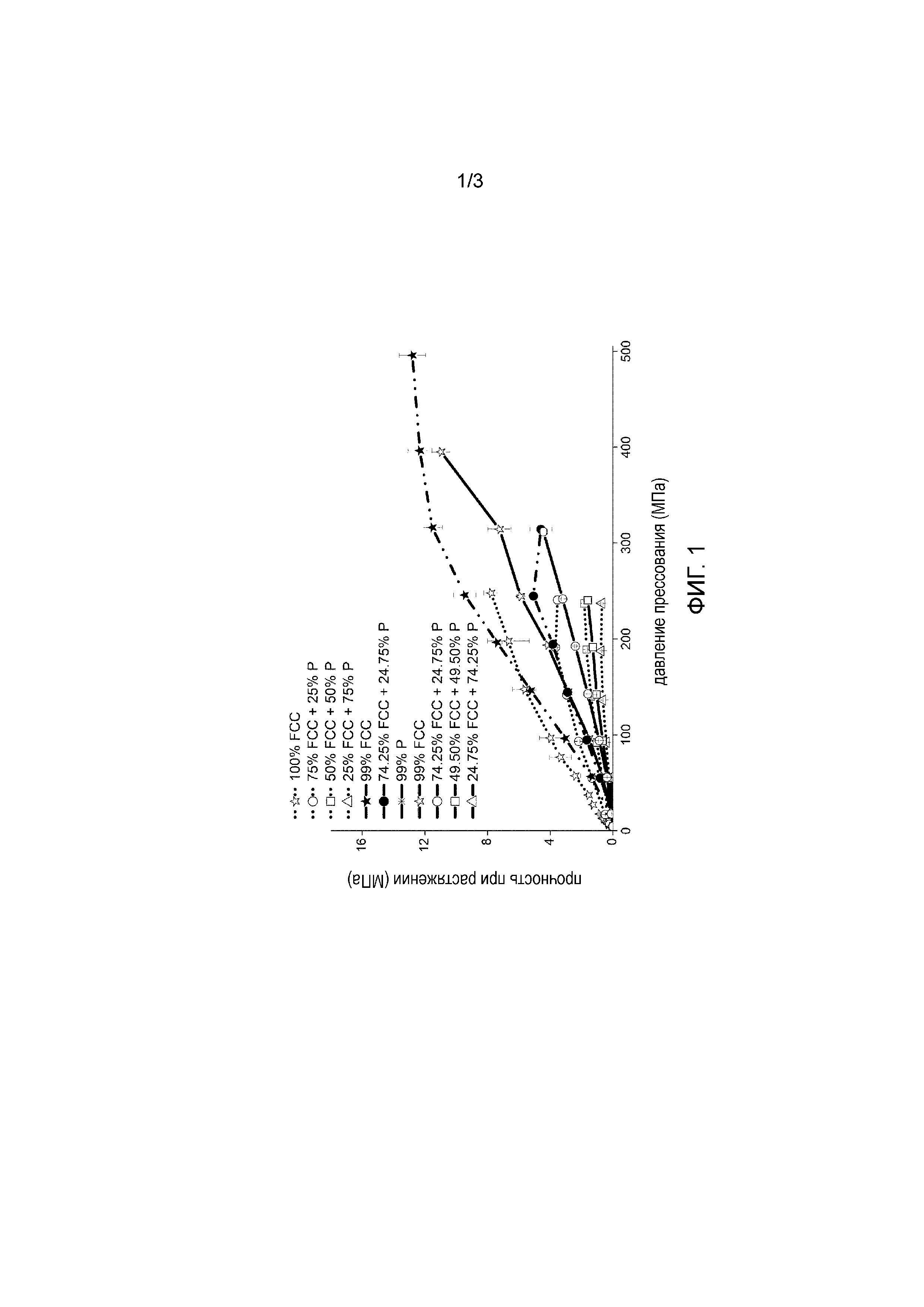
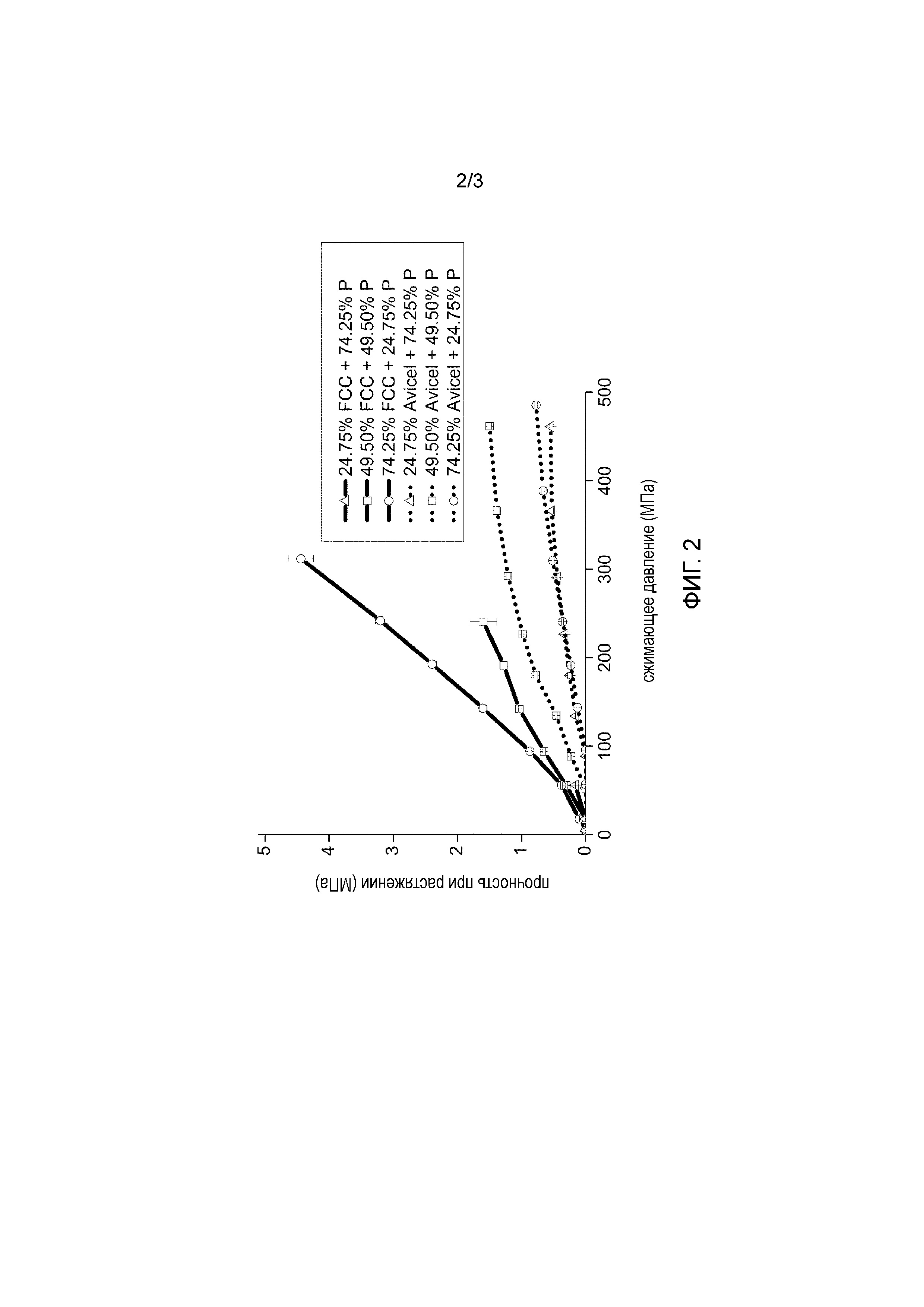

Описание
Настоящее изобретение относится к способу получения фармацевтической системы доставки, применению карбоната кальция с реакционно-модифицированной поверхностью для улучшения хрупкости фармацевтической системы доставки, а также для улучшения сыпучести фармацевтической системы доставки, и к полученной этим способом фармацевтической системе доставки.
Фармацевтические системы доставки разрабатываются для высвобождения фармацевтически активных агентов в организм человека или животного. В таких системах применялись многочисленные носители, включающие воски, масла, жиры, растворимые полимеры, и тому подобные. В еще одном подходе предусматривается диспергирование фармацевтически активного агента во всем объеме материала твердой матрицы, через которую указанный активный агент высвобождается диффузией. Еще один дополнительный подход предусматривает заключение фармацевтически активного агента внутри капсулы, имеющей полимерные стенки, через которые указанный активный агент может проходить в процессе диффузии.
Например, авторы Pawar и др. (Gastroretentive dosage forms: A review with special emphasis on floating drug delivery systems. Drug Delivery, февраль 2011; том 18 (№ 2): стр. 97-110) рассматривают флотирующие системы доставки (FDDS) как простой и логичный подход в отношении составления и технических аспектов для разработки GRDDS (гастроретентивных систем доставки лекарственных средств).
Патентный документ US 3,976,764 раскрывает моментально флотирующую таблетку, имеющую полую сферу на основе желатина, покрытую несколькими связующими слоями, в которой терапевтически активный ингредиент содержится в одном из связующих слоев.
Патентный документ DE 35 27 852 А1 раскрывает фармацевтическую композицию с удельной плотностью ниже 1, в которой вещество, формирующее гель в воде, смешано с фармацевтически активным агентом и жиром/маслом, которые являются твердыми при комнатной температуре. При этом формирующее гель вещество является производным целлюлозы, декстрана или крахмала.
Патентный документ ЕР 0 338 861 А2 относится к антацидным композициям с пролонгированным временем пребывания в желудке. Такой антацид, как гидротальцит или амальгат, формирует твердую сердцевину, которая окружена твердой наружной фазой, содержащей гидрофобное вещество, например, сложный эфир глицерина с пальмитиновой или стеариновой кислотой, гидроксилированный полиалкен и неионный эмульгатор.
Патентный документ ЕР 0 717 988 А1 относится к набухающей формовке, которая представляет собой расширяющуюся структуру, имеющую ячеистое поперечное сечение и кажущуюся плотность менее 1, каковая структура главным образом представляет собой кислотостойкое полимерное соединение, и дополнительно содержащее по меньшей мере один вспомогательный порообразователь и лекарственный препарат. Благодаря своей ячеистой структуре в поперечном сечении, набухающая формовка согласно изобретению имеет многочисленные тончайшие внутренние поры, которые являются сплошными или прерывистыми. Указанное кислотостойкое полимерное соединение выбирают, например, из сукцината или фталата ацетата гидроксипропилметилцеллюлозы.
Патентный документ US 4,451,260 имеет отношение к многослойной структуре, включающей фармацевтически активный ингредиент, причем в многослойной структуре захвачен воздух, обеспечивая тем самым флотацию.
Патентный документ US 4,814,179 имеет отношение к флотирующей терапевтической композиции пролонгированного действия. Непрессованные таблетки пролонгированного действия содержат гидроколлоидный гелеобразующий агент, терапевтически приемлемое инертное масло, выбранный терапевтический агент и воду.
Патентный документ ЕР 2 719 376 А1 относится к композиции гастроретентивного лекарственного средства и системам доставки с использованием функционализированного карбоната кальция, и к способу ее получения.
В этом отношении карбонат кальция представляется многообещающим для получения фармацевтической системы доставки, так как он проявляет высокопористую ячеистую структуру с пластинчатой структурой поверхности, которая прочно скрепляет частицы между собой, например, смотри патентный документ ЕР 2 719 373 А1. Тем самым он открывает возможность формирования из него гранул, пилюль, капсул, или спрессовывания его в таблетки или мини-таблетки.
Новый тип карбоната кальция с реакционно-модифицированной поверхностью был впервые описан в патентном документе FR 2787802 В1 в 1998 году, затем в патентных документах WO 00/39222 А1 и US 2004/0020410 А1, и основывается на реакции природного размолотого карбоната кальция с газообразным СО2 и с одним или многими источниками Н3О+-ионов из кислот от средней силы до сильных. Полученный продукт представляет собой пористый карбонат кальция, имеющий особенную поверхностную структуру, пористость и удельную площадь поверхности, обусловливающие сокращение веса бумаги для постоянной площади поверхности без утраты физических свойств, когда он используется в качестве пигмента или покровного наполнителя для указанной бумаги.
В патентном документе WO 2004/083316 А1 описана дополнительная благоприятная модификация в получении этого карбоната кальция с реакционно-модифицированной поверхностью, причем предусматривается применение силиката алюминия, синтетического кремнезема, силиката кальция, силикатов и/или одновалентной соли, и который также применим в области производства бумаги. Кроме того, патентный документ WO 2005/121257 А2 относится к добавлению полезных добавок при изготовлении указанного карбоната кальция с реакционно-модифицированной поверхностью, причем добавляются одно или более соединений формулы R-Х, которые, например, выбираются из жирных кислот, алифатических аминов или алифатических спиртов. Патентный документ WO 2009/074492 А1 в особенности представляет оптимизацию известного способа в отношении именно осажденного карбоната кальция, так как оказалось, что вследствие особенных условий осаждения карбоната кальция способ, пригодный для природного размолотого карбоната кальция, не обеспечивает таких же хороших результатов, как для поверхностной реакции синтетического осажденного карбоната кальция. Несколько дополнительных оптимизаций и модификаций способа получения карбоната кальция с реакционно-модифицированной поверхностью, таких, как описанные в патентных документах EP 2 264 108 A1 (WO 2010/146530 A1) и EP 2 264 109 A1 (WO 2010/146531 A1), предусматривают применение слабых кислот при получении карбоната кальция с реакционно-модифицированной поверхностью.
Патентный документ WO2014/001063 относится к водной суспензии минерального наполнителя с высоким содержанием твердых веществ, которая сохраняет свои механические свойства суспензии при низких температурах и в кислотной среде.
Однако ни один из вышеуказанных документов напрямую не упоминает эффективные способы прессования для получения фармацевтических систем доставки, включающих карбонат кальция с реакционно-модифицированной поверхностью.
Таким образом, существует постоянная потребность в фармацевтических системах доставки и способах их получения, которые обеспечивают лучшие технические характеристики, нежели существующие фармацевтические системы доставки, и в особенности позволяют получать фармацевтическую систему доставки, имеющую улучшенную хрупкость и/или сыпучесть по сравнению с традиционными фармацевтическими системами доставки с использованием микрокристаллической целлюлозы вместо карбоната кальция с реакционно-модифицированной поверхностью. Кроме того, является желательным создание способов получения фармацевтических систем доставки, которые является эффективными и обеспечивают возможность достаточного уплотнения системы.
Таким образом, целью настоящего изобретения является создание способа получения фармацевтической системы доставки. Еще одна цель также может представляться в создании высокоэффективного способа уплотнения для получения фармацевтической системы доставки. Дополнительная цель может представляться в создании способа получения фармацевтической системы доставки, имеющей улучшенные хрупкость и/или сыпучесть по сравнению с традиционной фармацевтической системой доставки, в которой используется микрокристаллическая целлюлоза вместо карбоната кальция с реакционно-модифицированной поверхностью.
Одна или более из вышеуказанных и прочих проблем разрешаются предметом изобретения, как определенным в независимых пунктах формулы изобретения. Предпочтительные варианты осуществления настоящего изобретения определены в соответствующих зависимых пунктах формулы изобретения.
Первый аспект настоящего изобретения относится к способу получения фармацевтической системы доставки. Способ включает стадии, в которых:
а) формируют карбонат кальция с реакционно-модифицированной поверхностью, который представляет собой продукт реакции природного размолотого или осажденного карбоната кальция с диоксидом углерода и одной или более кислотами в водной среде, причем диоксид углерода образуется in-situ при кислотной обработке и/или подается от внешнего источника;
b) подготавливают по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор;
с) подготавливают по меньшей мере одну рецептурную вспомогательную добавку;
d) смешивают карбонат кальция с реакционно-модифицированной поверхностью из стадии а), по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор из стадии b) и по меньшей мере одну рецептурную вспомогательную добавку из стадии с); и
е) уплотняют смесь, полученную в стадии d), с помощью роликового уплотнителя при давлении прессования в диапазоне от 4 до 20 бар; и
f) спрессовывают уплотненную прокаткой смесь, полученную в стадии е), для получения фармацевтической системы доставки.
Согласно еще одному аспекту настоящего изобретения, предусматривается применение карбоната кальция с реакционно-модифицированной поверхностью для улучшения хрупкости фармацевтической системы доставки, причем карбонат кальция с реакционно-модифицированной поверхностью представляет собой продукт реакции природного размолотого или осажденного карбоната кальция с диоксидом углерода и одной или более кислотами в водной среде, причем диоксид углерода образуется in-situ при кислотной обработке и/или подается от внешнего источника, причем фармацевтическая система доставки а) имеет хрупкость ≤1,10%, измеренную согласно Европейской Фармакопее Ph.Eur.4 на таблетках, спрессованных под давлением 100 МПа; и/или b) удовлетворяет формуле (I)
(FRRCPh)/(FRRCPl)≥1,2 (I)
в которой
(FRRCPh) представляет хрупкость (в %), измеренную согласно Ph.Eur.4, фармацевтической системы доставки RCPh, в которой давление прессования в стадии е) составляет по меньшей мере 15 бар;
(FRRCPl) представляет хрупкость (в %), измеренную согласно Ph.Eur.4, фармацевтической системы доставки RCPl, в которой давление прессования в стадии е) является меньшим, чем давление прессования, использованное для получения фармацевтической системы доставки RCPh.
Согласно еще одному аспекту настоящего изобретения, предусматривается применение карбоната кальция с реакционно-модифицированной поверхностью для улучшения сыпучести фармацевтической системы доставки, причем карбонат кальция с реакционно-модифицированной поверхностью представляет собой продукт реакции природного размолотого или осажденного карбоната кальция с диоксидом углерода и одной или более кислотами в водной среде, причем диоксид углерода образуется in-situ при кислотной обработке и/или подается от внешнего источника, причем фармацевтическая система доставки удовлетворяет формуле (II)
(FLRCP)/(FLreference)≥1,1 (II)
в которой
(FLRCP) представляет сыпучесть (в г/с), измеренную согласно Ph.Eur.4 на отверстии с диаметром 7 мм, фармацевтической системы доставки;
(FLreference) представляет сыпучесть (в г/с), измеренную согласно Ph.Eur.4 на отверстии с диаметром 7 мм, такой же фармацевтической системы доставки, в которой карбонат кальция с реакционно-модифицированной поверхностью заменен микрокристаллической целлюлозой.
Согласно еще одному дополнительному аспекту настоящего изобретения, способ получения фармацевтической системы доставки включает стадии, в которых:
а) формируют карбонат кальция с реакционно-модифицированной поверхностью, который представляет собой продукт реакции природного размолотого или осажденного карбоната кальция с диоксидом углерода и одной или более кислотами в водной среде, причем диоксид углерода образуется in-situ при кислотной обработке и/или подается от внешнего источника;
b) уплотняют карбонат кальция с реакционно-модифицированной поверхностью из стадии а) без любых связующего материала и/или технологических добавок, с помощью роликового уплотнителя и при давлении прессования в диапазоне от 4 до 20 бар для получения уплотненного в роликовом уплотнителе материала; и
с) необязательно преобразуют уплотненный прокаткой материал, полученный в стадии b), для получения фармацевтической системы доставки, включающей таблетки, мини-таблетки, капсулы, пилюли или гранулы.
Согласно еще одному варианту исполнения вышеупомянутого способа, полученный в стадии b) уплотненный прокаткой материал подвергают обработке в стадии размалывания и стадии сортировки, причем уплотненный в роликовом уплотнителе материал после сортировки имеет зерна с размерами от 180 мкм до 710 мкм. Такая стадия сортировки может быть выполнена, например, просеиванием через сита с различными размерами ячеек. Такие размеры ячеек предпочтительно составляют 710 мкм, 500 мкм, 355 мкм, 250 мкм и 180 мкм.
Согласно еще одному варианту исполнения вышеупомянутого способа, уплотненный прокаткой материал, полученный в стадии b), находится в форме гранул.
Еще одним дополнительным аспектом настоящего изобретения являются гранулы, полученные вышеуказанным способом, причем гранулы представляют собой спрессованный карбонат кальция с реакционно-модифицированной поверхностью без любых связующего материала и/или технологических добавок, имеющий частицы с размерами от 180 мкм до 710 мкм, и причем карбонат кальция с реакционно-модифицированной поверхностью i) имеет удельную площадь поверхности по методу BET от 20,0 м2/г до 200,0 м2/г, предпочтительно от 20,0 м2/г до 180,0 м2/г, более предпочтительно от 30,0 м2/г до 160,0 м2/г, еще более предпочтительно от 40,0 м2/г до 150,0 м2/г, и наиболее предпочтительно от 50,0 м2/г до 140,0 м2/г, измеренную с использованием азота и метода BET согласно стандарту ISO 9277; и/или ii) включает частицы, имеющие объемный медианный диаметр d50 зерен от 2,0 до 50,0 мкм, предпочтительно от 2,5 до 25,0 мкм, более предпочтительно от 2,8 до 20,0 мкм, еще более предпочтительно от 3,0 до 10,0 мкм, и наиболее предпочтительно от 4,0 до 8,0 мкм; и/или iii) имеет внутричастичный интрузионный удельный поровый объем в пределах диапазона всех значений от 0,15 до 1,35 см3/г, предпочтительно от 0,30 до 1,30 см3/г, и наиболее предпочтительно от 0,40 до 1,25 см3/г, рассчитанный по измерению методом ртутной интрузионной порометрии, как описывается в экспериментальной части.
Согласно еще одному дополнительному аспекту настоящего изобретения, представлена фармацевтическая система доставки, предпочтительно таблетка, мини-таблетка, капсула или пилюля, полученные этим способом.
Согласно одному варианту исполнения данного способа, природный размолотый карбонат кальция выбирают из содержащих карбонат кальция минералов, выбранных из группы, включающей мрамор, мел, доломит, известняк, и их смеси; или осажденный карбонат кальция выбирают из группы, включающей осажденные карбонаты кальция, имеющие арагонитовую, ватеритовую или кальцитовую минералогические кристаллические формы, и их смеси.
Согласно еще одному варианту исполнения данного способа, карбонат кальция с реакционно-модифицированной поверхностью а) имеет удельную площадь поверхности по методу BET от 20,0 м2/г до 200,0 м2/г, предпочтительно от 20,0 м2/г до 180,0 м2/г, более предпочтительно от 30,0 м2/г до 160,0 м2/г, еще более предпочтительно от 40,0 м2/г до 150,0 м2/г, и наиболее предпочтительно от 50,0 м2/г до 140,0 м2/г, измеренную с использованием азота и метода BET согласно стандарту ISO 9277; и/или b) включает частицы, имеющие объемный медианный диаметр d50 зерен от 2,0 до 50,0 мкм, предпочтительно от 2,5 до 25,0 мкм, более предпочтительно от 2,8 до 20,0 мкм, еще более предпочтительно от 3,0 до 10,0 мкм, и наиболее предпочтительно от 4,0 до 8,0 мкм; и/или с) имеет внутричастичный интрузионный удельный поровый объем в пределах диапазона от 0,15 до 1,35 см3/г, предпочтительно от 0,30 до 1,30 см3/г, и наиболее предпочтительно от 0,40 до 1,25 см3/г, рассчитанный по измерению методом ртутной интрузионной порометрии.
Согласно еще одному дополнительному варианту исполнения данного способа, по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор выбирают из группы, включающей фармацевтически активный агент или его фармацевтически неактивный прекурсор синтетического происхождения, полусинтетического происхождения, природного происхождения, и их комбинации.
Согласно одному варианту исполнения данного способа, по меньшей мере одна рецептурная вспомогательная добавка а) представляет собой по меньшей мере одно смазочное средство внутренней фазы и/или смазочное средство внешней фазы; и/или присутствует в общем количестве от около 0,1 вес.% до около 10,0 вес.%, предпочтительно от около 0,3 вес.% до около 5,0 вес.%, более предпочтительно от около 0,5 вес.% до около 2,5 вес.%, в расчете на совокупный вес фармацевтической системы доставки.
Согласно еще одному варианту исполнения данного способа, стадию е) уплотнения прокаткой проводят при давлении уплотнения в роликовом уплотнителе в диапазоне от 4 до 15 бар, более предпочтительно в диапазоне от 4 до 10 бар, и наиболее предпочтительно в диапазоне от 4 до 7 бар.
Согласно еще одному дополнительному варианту исполнения данного способа, стадия f) прессования представляет собой стадию гранулирования или таблетирования.
Согласно одному дополнительному варианту исполнения данного способа, уплотненную прокаткой смесь, полученную в стадии е) уплотнения в роликовом уплотнителе, подвергают обработке в стадии размалывания перед проведением стадии f) прессования.
Согласно еще одному варианту исполнения данного способа, уплотненная прокаткой смесь имеет зерна с размерами от 180 до 710 мкм, полученные просеиванием через сита с различными размерами ячеек, предпочтительно с размерами ячеек 180 мкм, 250 мкм, 355 мкм, 500 мкм и 710 мкм.
Согласно еще одному дополнительному варианту исполнения данного способа, фармацевтическая система доставки а) имеет хрупкость ≤1,10%, измеренную согласно Ph.Eur.4 на таблетках, спрессованных под давлением 100 МПа; и/или b) удовлетворяет формуле (I)
(FRRCPh)/(FRRCPl)≥1,2 (I)
в которой
(FRRCPh) представляет хрупкость (в %), измеренную согласно Ph.Eur.4, фармацевтической системы доставки RCPh, в которой давление прессования в стадии е) составляет по меньшей мере 15 бар;
(FRRCPl) представляет хрупкость (в %), измеренную согласно Ph.Eur.4, фармацевтической системы доставки RCPl, в которой давление прессования в стадии е) является меньшим, чем давление прессования, использованное для получения фармацевтической системы доставки RCPh.
Согласно одному варианту исполнения данного способа, фармацевтическая система доставки удовлетворяет формуле (II)
(FLRCP)/(FLreference)≥1,1 (II)
в которой
(FLRCP) представляет сыпучесть (в г/с), измеренную согласно Ph.Eur.4 на отверстии с диаметром 7 мм, фармацевтической системы доставки;
(FLreference) представляет сыпучесть (в г/с), измеренную согласно Ph.Eur.4 на отверстии с диаметром 7 мм, такой же фармацевтической системы доставки, в которой карбонат кальция с реакционно-модифицированной поверхностью заменен микрокристаллической целлюлозой.
Согласно еще одному варианту исполнения данного способа, фармацевтическая система доставки представляет собой таблетку, мини-таблетку, капсулу или гранулу.
Должно быть понятно, что для цели настоящего изобретения нижеследующие термины имеют следующее значение.
Для цели настоящего изобретения, «кислота» определяется как кислота по Бренстеду-Лоури, иначе говоря, она представляет собой источник Н3О+-ионов. «Соль кислоты» определяется как источник Н3О+-ионов, например, содержащая водород соль, которая частично нейтрализована электроположительным элементом. «Соль» определяется как электрически нейтральное ионное соединение, образованное из анионов и катионов. «Частично кристаллическая соль» определяется как соль, которая, согласно рентгеноструктурному (XRD) анализу, дает по существу дискретную картину дифракции.
В соответствии с настоящим изобретением, рКа представляет символ, описывающий константу диссоциации кислоты, связанную с данным ионизируемым водородом в данной кислоте, и является показателем естественной степени диссоциации этого водорода из этой кислоты в равновесии с водой при данной температуре. Такие значения рКа можно найти в справочных изданиях, таких как Harris, D. C. «Quantitative Chemical Analysis: 3RD Edition», 1991, W.H. Freeman & Co. (USA), ISBN 0-7167-2170-8.
«Природный размолотый карбонат кальция» (GCC) в смысле настоящего изобретения представляет собой карбонат кальция, полученный из природных источников, таких как известняк, мрамор, доломит, или мел, и подвергнутый мокрой и/или сухой обработке, такой как измельчение, просеивание и/или фракционирование, например, с использованием циклона или сепаратора.
«Осажденный карбонат кальция» (PCC) в смысле настоящего изобретения представляет собой синтетический материал, полученный осаждением, происходящим при реакции диоксида углерода и известняка в водной, полусухой или влажной среде, или осаждением источника ионов кальция и карбонат-ионов в воде. PCC может быть в ватеритовой, кальцитовой или арагонитовой кристаллической форме.
Для цели настоящего изобретения «карбонат кальция с реакционно-модифицированной поверхностью» представляет собой материал, включающий карбонат кальция и нерастворимую в воде, по меньшей мере частично кристаллическую, некарбонатную соль кальция, предпочтительно распространенную от поверхности по меньшей мере части карбоната кальция. Ионы кальция, формирующие указанную по меньшей мере частично кристаллическую некарбонатную соль кальция, происходят в значительной степени из исходного материала карбоната кальция, который также служит для формирования сердцевины карбоната кальция с реакционно-модифицированной поверхностью. Такие соли могут включать ОН--анионы и/или кристаллизационную воду.
В смысле настоящего изобретения «нерастворимые в воде» материалы определяются как материалы, которые, будучи смешанными с деминерализованной водой и отфильтрованными на фильтре, имеющем размер пор 0,2 мкм, при температуре 20°С для выделения жидкостного фильтрата, остаются в количестве, меньшем или равном 0,1 г извлеченного твердого материала, при выпаривании при температуре от 95 до 100°С 100 г указанного жидкостного фильтрата. «Водорастворимые» материалы определяются как материалы, приводящие к извлечению свыше 0,1 г выделенного твердого материала при выпаривании при температуре от 95 до 100°С 100 г указанного жидкостного фильтрата.
На всем протяжении данного документа «размер частиц» карбоната кальция и других материалов описывается распределением размеров их частиц. Значение dx представляет диаметр, относительно которого х % по весу частиц имеют диаметры менее, чем dx. Это значит, что значение d20 представляет размер частиц, при котором 20 вес.% всех частиц являются более мелкими, и значение d75 представляет размер частиц, при котором 75 вес.% всех частиц являются более мелкими. Значение d50 тем самым представляет весовой медианный размер частиц, то есть, 50 вес.% всех зерен являются более крупными, и остальные 50 вес.% зерен являются более мелкими, чем этот размер частиц. Для цели настоящего изобретения размер частиц задается как средневзвешенный размер частиц d50, если не оговаривается иное. Для определения значения весового медианного размера частиц d50 может быть использован анализатор Sedigraph. Для цели настоящего изобретения «размер частиц» карбоната кальция с реакционно-модифицированной поверхностью описывается как определенные по объему распределения частиц по размеру. Для измерения определенного по объему распределения частиц по размеру, например, объемного медианного диаметра зерен (d50) или определенного по объему верхнего предельного размера частиц (d98) карбоната кальция с реакционно-модифицированной поверхностью, может быть использован анализатор Malvern Mastersizer 2000. Определенное по весу распределение частиц по размеру может соответствовать определенному по объему распределению частиц по размеру, если плотность всех частиц является одинаковой.
«Удельная площадь поверхности (SSA)» карбоната кальция в смысле настоящего изобретения определяется как площадь поверхности карбоната кальция, деленная на его массу. Как используемая здесь, удельная площадь поверхности измеряется по адсорбции газообразного азота с использованием BET-изотермы (стандарт ISO 9277:2010), и выражается в м2/г.
Для цели настоящего изобретения «пористость» или «поровый объем» имеют отношение к внутричастичному интрузионному удельному поровому объему. Пористость или поровый объем измеряют с использованием ртутного порометра Micromeritics Autopore IV 9500, имеющего максимальное прилагаемое давление 414 МПа, эквивалентное диаметру сужения Лапласа 0,004 мкм.
«Суспензия» или «взвесь» в смысле настоящего изобретения включает нерастворимые твердые вещества и воду, и необязательно дополнительные добавки, и обычно содержит большие количества твердых веществ, и тем самым является более вязкой, и может иметь более высокую плотность, чем жидкость, из которой она сформирована.
Термин «прессование» в смысле настоящего изобретения означает сокращение пористости и повышение твердости таблетки, которая получается под давлением.
Там, где в данном описании и в пунктах формулы изобретения применяется термин «включающий», это не исключает другие элементы. Для целей настоящего изобретения термин «состоящий из» рассматривается как предпочтительный вариант исполнения термина «включающий». Если далее группа определяется как включающая по меньшей мере определенное число вариантов исполнения, это также должно пониматься как представление группы, которая предпочтительно состоит только из этих вариантов исполнения.
Где неопределенный или определенный артикль применяется, когда имеет отношение к существительному в единственном числе, например, «a», «an» или «the», это включает множественное число этого существительного, если что-нибудь еще не указано конкретно.
Термины типа «получаемый» или «определимый», и «полученный» или «определенный», используются взаимозаменяемо. Например, это означает, что, если контекст четко не предписывает иное, термин «полученный» не подразумевает указания на то, что, например, вариант исполнения должен быть получен, например, в последовательности стадий после термина «получен», хотя такое ограниченное понимание всегда предполагается терминами «полученный» или «определенный» как предпочтительный вариант исполнения.
Согласно настоящему изобретению, было найдено, что карбонат кальция, который был подвергнут поверхностной обработке определенным путем, может быть использован в качестве формообразующего наполнителя в фармацевтических системах доставки, и обеспечивает возможность эффективного уплотнения фармацевтических систем доставки.
В последующем описываются дополнительные подробности настоящего изобретения, и в особенности вышеуказанные стадии способа получения фармацевтической системы доставки.
Согласно стадии а) данного способа, получается карбонат кальция с реакционно-модифицированной поверхностью, который представляет собой продукт реакции природного размолотого или осажденного карбоната кальция с диоксидом углерода и одной или более кислотами в водной среде, причем диоксид углерода образуется in-situ при кислотной обработке и/или подводится от внешнего источника.
Карбонат кальция с реакционно-модифицированной поверхностью, используемый согласно настоящему изобретению, представляет собой продукт реакции природного размолотого или осажденного карбоната кальция с диоксидом углерода и по меньшей мере одной кислотой в водной среде, причем диоксид углерода образуется in-situ при кислотной обработке и/или подается от внешнего источника.
Выражение «кислотная обработка» в смысле настоящего изобретения подразумевает реакцию природного размолотого или осажденного карбоната кальция и по меньшей мере одной кислоты в водной среде. В результате этой реакции диоксид углерода может образовываться in-situ в водной среде.
Природный размолотый карбонат кальция (GCC) понимается как форма карбоната кальция природного происхождения, добываемого из осадочных горных пород, таких как известняк или мел, или метаморфических мраморных пород. Как известно, карбонат кальция существует главным образом в виде трех типов кристаллических полиформных модификаций: кальцита, арагонита и ватерита. Кальцит, как наиболее распространенная кристаллическая полиформная модификация, считается наиболее стабильной кристаллической формой карбоната кальция. Менее распространенным является арагонит, который имеет дискретную или кластерную игольчатую орторомбическую кристаллическую структуру. Ватерит представляет собой самый редкий полиморф карбоната кальция и, как правило, нестабилен. Природный карбонат кальция почти исключительно состоит из кальцитовой полиформной модификации, которая считается тригонально-ромбоэдрической, и представляет наиболее стабильные полиморфы карбоната кальция. Термин «источник» карбоната кальция в смысле настоящего изобретения подразумевает минеральный материал природного происхождения, из которого получается карбонат кальция. Источник карбоната кальция может включать дополнительные встречающиеся в природе компоненты, такие как карбонат магния, алюмосиликаты, и т.д.
Согласно одному варианту исполнения, природный размолотый карбонат кальция выбирают из содержащих карбонат кальция минералов, выбираемых из группы, состоящей из мрамора, мела, доломита, известняка, и их смесей.
Согласно одному варианту осуществления настоящего изобретения, GCC получают сухим размалыванием. Согласно еще одному варианту осуществления настоящего изобретения, GCC получают мокрым размалыванием и, необязательно, последующим высушиванием.
Как правило, стадия размалывания может быть проведена с использованием любого традиционного размалывающего устройства, например, в таких условиях, что размельчение главным образом достигается ударами вторичного тела, то есть, в одном или более из: шаровой мельницы, стержневой мельницы, вибрационной мельницы, валковой дробилки, центробежно-ударной мельницы, вертикальной шаровой мельницы, дисковой дробилки, штырьковой мельницы, молотковой дробилки, мельницы тонкого помола, измельчителя, разрыхлителя, ножевидного резака, или другого такого оборудования, известного квалифицированному специалисту. В случае содержащего карбонат кальция минерального материала, включающего размолотый мокрым способом содержащий карбонат кальция минеральный материал, стадия размалывания может быть выполнена в таких условиях, что происходит самопроизвольное измельчение, и/или с использованием горизонтальной шаровой мельницы, и/или других таких способов, известных квалифицированному специалисту. Следует отметить, что такие же способы измельчения могут быть использованы для сухого размалывания содержащего карбонат кальция минерального материала. Измельченный мокрым способом содержащий карбонат кальция минеральный материал, полученный таким путем, может быть промыт и обезвожен общеизвестными способами, например, флокуляцией, фильтрацией или принудительным испарением перед высушиванием. Последующая стадия сушки может быть проведена в одну стадию, такую как распылительная сушка, или по меньшей мере в две стадии. Также является общепринятым, что такой минеральный материал подвергают обработке в стадии обогащения (такого как флотация, отбеливание или стадия магнитной сепарации) для удаления загрязняющих примесей.
«Осажденный карбонат кальция» (PCC) в смысле настоящего изобретения представляет собой синтезированный материал, как правило, получаемый осаждением в ходе реакции диоксида углерода и извести в водной среде, или осаждением источника ионов кальция и карбонат-ионов в воде, или осаждением ионов кальция и карбонат-ионов, например, CaCl2 и Na2CO3, из раствора. Дополнительные возможные пути получения PCC представляют собой известково-содовый процесс, или метод Сольве, в котором PCC представляет собой побочный продукт производства аммиака. Осажденный карбонат кальция существует в трех основных кристаллических формах: кальцита, арагонита и ватерита, и имеются многие различные полиморфы (кристаллические габитусы) для каждой из трех кристаллических форм. Кальцит имеет тригональную структуру с типичными кристаллическими габитусами, такими как скаленоэдрический (S-PCC), ромбоэдрический (R-PCC), гексагонально-призматический, пинакоидальный, коллоидальный (C-PCC), кубический, и призматический (P-PCC). Арагонит представляет собой орторомбическую структуру с типичными кристаллическими габитусами двойниковых гексагонально-призматических кристаллов, а также многообразный ассортимент тонких удлиненных призматических, изогнутых чешуйчатых, высоких пирамидальных, кристаллов в форме стамески, разветвленных древовидных и имеющих форму коралла или червеобразную форму. Ватерит принадлежит к гексагональной кристаллической системе. Полученная суспензия PCC может быть механически обезвожена и высушена.
Согласно одному варианту осуществления настоящего изобретения, осажденный карбонат кальция выбирают из группы, состоящей из осажденных карбонатов кальция, имеющих арагонитовую, ватеритовую или кальцитовую минералогические кристаллические формы, и их смесей.
В предпочтительном варианте исполнения природный размолотый или осажденный карбонат кальция размалывают перед обработкой по меньшей мере одной кислотой и диоксидом углерода. Стадия размалывания может быть проведена с использованием любого размалывающего устройства, такого как бегуны мелкого помола, известного квалифицированному специалисту.
В предпочтительном способе природный размолотый или осажденный карбонат кальция, либо тонко измельченный, например, размалыванием, либо нет, суспендируют в воде. Взвесь предпочтительно имеет содержание природного размолотого или осажденного карбоната кальция в пределах диапазона от 1 вес.% до 80 вес.%, более предпочтительно от 3 вес.% до 60 вес.%, и еще более предпочтительно от 5 вес.% до 40 вес.%, в расчете на вес суспензии.
Согласно одному варианту осуществления настоящего изобретения, природный размолотый или осажденный карбонат кальция имеет весовой медианный размер частиц d50 от 0,1 до 50 мкм, предпочтительно от 0,5 до 25 мкм, более предпочтительно от 0,8 до 20 мкм, еще более предпочтительно от 1,0 до 10 мкм, и наиболее предпочтительно от 1,2 до 8 мкм.
В следующей стадии к водной суспензии, содержащей природный размолотый или осажденный карбонат кальция, добавляют по меньшей мере одну кислоту. По меньшей мере одна кислота может быть любой сильной кислотой, кислотой средней силы или слабой кислотой, или их смесью, выделяющей Н3О+-ионы в условиях приготовления. Согласно настоящему изобретению, по меньшей мере одна кислота также может представлять собой кислую соль, генерирующую Н3О+-ионы в условиях приготовления.
Согласно одному варианту исполнения, по меньшей мере одна кислота представляет собой сильную кислоту, имеющую значение рКа 0 или менее при температуре 20°С. Согласно еще одному варианту исполнения, по меньшей мере одна кислота представляет собой кислоту средней силы, имеющую значение рКа от 0 до 2,5 при температуре 20°С. Если рКа при температуре 20°С составляет 0 или менее, кислоту предпочтительно выбирают из серной кислоты, соляной кислоты, или их смесей. Если рКа при температуре 20°С составляет 0 до 2,5, кислоту предпочтительно выбирают из H2SO3, H3PO4, щавелевой кислоты, или их смесей. Согласно предпочтительному варианту исполнения, по меньшей мере одна кислота представляет собой H3PO4. По меньшей мере одна кислота также может быть кислой солью, например, с анионом HSO4- или Н2РО4-, будучи по меньшей мере частично нейтрализованной соответствующим катионом, таким как Li+, Na+ или K+, или HPО42-, будучи по меньшей мере частично нейтрализованной таким катионом, как Li+, Na+, K+, Mg2+ или Ca2+. По меньшей мере одна кислота также может представлять собой смесь одной или более кислот и одной или более кислых солей.
Согласно еще одному дополнительному варианту исполнения, по меньшей мере одна кислота является слабой кислотой, имеющей значение рКа свыше 2,5, и меньшее или равной 7, когда измеряется при температуре 20°С, связанное с ионизацией первого подходящего водорода, и имеющей соответствующий анион, образованный потерей этого первого подходящего водорода, который способен образовывать водорастворимые соли кальция. Согласно предпочтительному варианту исполнения, слабая кислота имеет значение рКа от 2,6 до 5 при температуре 20°С, и более предпочтительно слабую кислоту выбирают из группы, состоящей из уксусной кислоты, муравьиной кислоты, пропионовой кислоты, и их смесей.
В случае применения слабой кислоты, после добавления указанной кислоты к водной суспензии, содержащей природный размолотый или осажденный карбонат кальция, дополнительно добавляют по меньшей мере одну водорастворимую соль, которая в случае содержащей водород соли имеет рКа более 7, по измерению при температуре 20°С, связанное с ионизацией первого подходящего водорода, и анион каковой соли способен формировать нерастворимые в воде соли кальция. Катион указанной водорастворимой соли предпочтительно выбирают из группы, состоящей из калия, натрия, лития, и их смесей. В более предпочтительном варианте исполнения указанный катион представляет собой натрий. Следует отметить, что в зависимости от заряда аниона, для образования электрически нейтрального ионного соединения может присутствовать более чем один из указанных катионов. Анион указанной водорастворимой соли предпочтительно выбирают из группы, состоящей из фосфата, дигидрофосфата, моногидрофосфата, оксалата, силиката, их смесей и их гидратов. В более предпочтительном варианте исполнения указанный анион выбирают из группы, состоящей из фосфата, дигидрофосфата, моногидрофосфата, их смесей и их гидратов. В наиболее предпочтительном варианте исполнения указанный анион выбирают из группы, состоящей из дигидрофосфата, моногидрофосфата, их смесей и их гидратов. Добавление водорастворимой соли может быть выполнено по каплям или в один прием. В случае добавления по каплям это добавление предпочтительно происходит в пределах периода времени 15 минут. Более предпочтительным является добавление указанной соли в один прием.
Согласно одному варианту осуществления настоящего изобретения, по меньшей мере одну кислоту выбирают из группы, состоящей из соляной кислоты, серной кислоты, сернистой кислоты, фосфорной кислоты, лимонной кислоты, щавелевой кислоты, уксусной кислоты, муравьиной кислоты, и их смесей. По меньшей мере одну кислоту предпочтительно выбирают из группы, состоящей из соляной кислоты, серной кислоты, сернистой кислоты, фосфорной кислоты, щавелевой кислоты, Н2РО4-, по меньшей мере частично нейтрализованной соответствующим катионом, таким как Li+, Na+ или K+, НРО42-, по меньшей мере частично нейтрализованной соответствующим катионом, таким как Li+, Na+, K+, Mg2+ или Ca2+, и их смесей, более предпочтительно по меньшей мере одну кислоту выбирают из группы, состоящей из соляной кислоты, серной кислоты, сернистой кислоты, фосфорной кислоты, щавелевой кислоты, или их смесей, и наиболее предпочтительно по меньшей мере одна кислота представляет собой фосфорную кислоту.
Согласно еще одному варианту осуществления настоящего изобретения, по меньшей мере одна кислота представляет собой смесь одной или более кислот. Например, по меньшей мере одна кислота является смесью фосфорной кислоты и лимонной кислоты. Одна или многие кислоты могут быть добавлены одновременно или последовательно.
По меньшей мере одна кислота может быть добавлена к суспензии в виде концентрированного раствора или более разбавленного раствора. Согласно одному варианту исполнения, молярное отношение по меньшей мере одной кислоты к природному размолотому или осажденному карбонату кальция составляет от 0,01 до 0,6, предпочтительно от 0,05 до 0,55, и более предпочтительно от 0,1 до 0,5. В качестве альтернативного варианта, также возможно добавление по меньшей мере одной кислоты к воде перед суспендированием природного размолотого или осажденного карбоната кальция.
В следующей стадии природный размолотый или осажденный карбонат кальция обрабатывают диоксидом углерода. Диоксид углерода может быть образован in-situ в ходе кислотной обработки, и/или может быть подведен от внешнего источника. Если для кислотной обработки природного размолотого или осажденного карбоната кальция применяется сильная кислота, такая как серная кислота или соляная кислота, или кислота средней силы, такая как фосфорная кислота, диоксид углерода автоматически образуется в достаточном количестве для достижения требуемой молярной концентрации. Альтернативно или дополнительно, диоксид углерода может быть подведен из внешнего источника.
Согласно одному варианту исполнения, карбонат кальция с реакционно-модифицированной поверхностью представляет собой продукт реакции природного размолотого или осажденного карбоната кальция с диоксидом углерода и по меньшей мере одной кислотой, причем диоксид углерода образуется in-situ в результате взаимодействия по меньшей мере с одной кислотой с природным размолотым или осажденным карбонатом кальция, и/или подается из внешнего источника.
Кислотная обработка и обработка диоксидом углерода могут быть проведены одновременно, что представляет собой ситуацию, когда применяется сильная кислота или кислота средней силы. Также можно проводить кислотную обработку первой, например, кислотой средней силы, имеющей рКав диапазоне от 0 до 2,5 при температуре 20°С, причем диоксид углерода образуется in-situ, и тем самым обработка диоксидом углерода будет автоматически проводиться одновременно с кислотной обработкой, с последующей дополнительной обработкой диоксидом углерода, подводимым от внешнего источника.
Концентрация газообразного диоксида углерода в суспензии предпочтительно является, в единицах объема, такой, что отношение (объем суспензии):(объем газообразного СО2) составляет от 1:0,05 до 1:20, еще более предпочтительно от 1:0,05 до 1:5.
В предпочтительном варианте исполнения стадию кислотной обработки и/или стадию обработки диоксидом углерода повторяют по меньшей мере один раз, более предпочтительно несколько раз.
После кислотной обработки и обработки диоксидом углерода величина рН водной суспензии, измеренная при температуре 20°С, естественным образом достигает значения свыше 6,0, предпочтительно более 6,5, более предпочтительно свыше 7,0, еще более предпочтительно свыше 7,5, тем самым с образованием природного размолотого или осажденного карбоната кальция с реакционно-модифицированной поверхностью в виде водной суспензии, имеющей значение рН свыше 6,0, предпочтительно более 6,5, более предпочтительно свыше 7,0, еще более предпочтительно свыше 7,5. Если водную суспензию оставляют до достижения равновесного состояния, значение рН составляет более 7. Величина рН более 6,0 может быть скорректирована без добавления основания, когда перемешивание водной суспензии продолжают в течение достаточного периода времени, предпочтительно от 1 часа до 10 часов, более предпочтительно от 1 до 5 часов.
В альтернативном варианте, до достижения равновесного состояния, которое возникает при рН свыше 7, значение рН водной суспензии может быть повышено до величины более 6 добавлением основания после обработки диоксидом углерода. Может быть использовано любое обычное основание, такое как гидроксид натрия или гидроксид калия.
Дополнительные подробности относительно получения карбоната кальция с реакционно-модифицированной поверхностью раскрыты в патентных документах WO 00/39222, WO 2004/083316, WO 2005/121257, WO 2009/074492, EP 2 264 108, EP 2 264 109 и US 2004/0020410.
Подобным образом получают осажденный карбонат кальция с реакционно-модифицированной поверхностью. Как может быть заимствовано в подробностях из патентного документа EP 2 070 991, осажденный карбонат кальция с реакционно-модифицированной поверхностью получают приведением в контакт осажденного карбоната кальция с Н3О+-ионами и с анионами, растворимыми в водной среде и способными образовывать нерастворимые в воде соли кальция, в водной среде с образованием суспензии осажденного карбоната кальция с реакционно-модифицированной поверхностью, причем указанный осажденный карбонат кальция с реакционно-модифицированной поверхностью включает нерастворимую, по меньшей мере частично кристаллическую соль кальция с указанным анионом, сформированную на поверхности по меньшей мере части осажденного карбоната кальция.
Указанные растворимые ионы кальция соответствуют избытку растворимых ионов кальция относительно растворимых ионов кальция, естественным образом образующихся при растворении осажденного карбоната кальция Н3О+-ионами, где указанные Н3О+-ионы присутствуют только в форме противоиона для аниона, то есть, путем добавления аниона в форме кислоты или некальциевой соли кислоты, и в отсутствие любого дополнительного иона кальция или источника, генерирующего ион кальция.
Указанные избыточные растворимые ионы кальция предпочтительно вводятся добавлением растворимой нейтральной или кислой соли кальция, или добавлением кислоты или нейтральной или кислой некальциевой соли, которая генерирует in-situ растворимую нейтральную или кислую соль кальция.
Указанные Н3О+-ионы могут быть введены добавлением кислоты или кислой соли с указанным анионом, или добавлением кислоты или кислой соли, которая одновременно служит для введения всех или части указанных избыточных растворимых ионов кальция.
Согласно одному варианту осуществления настоящего изобретения, карбонат кальция с реакционно-модифицированной поверхностью получают способом, включающим стадии, в которых:
а) формируют суспензию природного размолотого или осажденного карбоната кальция,
b) добавляют по меньшей мере одну кислоту, имеющую значение рКа 0 или менее при температуре 20°С, или имеющую значение рКа от 0 до 2,5 при температуре 20°С, к суспензии из стадии а), и
с) обрабатывают суспензию из стадии а) диоксидом углерода до, во время или после стадии b).
Согласно одному варианту исполнения, в стадии b) к суспензии из стадии а) добавляют по меньшей мере одну кислоту, имеющую значение рКа 0 или менее при температуре 20°С. Согласно еще одному варианту исполнения, в стадии b) к суспензии из стадии а) добавляют по меньшей мере одну кислоту, имеющую значение рКа от 0 до 2,5 при температуре 20°С.
Диоксид углерода, применяемый в стадии с), может быть образован in-situ при кислотной обработке в стадии b), и/или может быть подведен от внешнего источника.
Согласно одному варианту осуществления настоящего изобретения, карбонат кальция с реакционно-модифицированной поверхностью получают способом, включающим стадии, в которых:
А) подготавливают природный размолотый или осажденный карбонат кальция,
В) подготавливают по меньшей мере одну водорастворимую кислоту,
С) подготавливают газообразный СО2,
D) приводят указанный природный размолотый или осажденный карбонат кальция из стадии А) в контакт по меньшей мере с одной кислотой из стадии В) и с СО2 из стадии С),
отличающимся тем, что:
i) по меньшей мере одна кислота из стадии В) имеет значение рКа свыше 2,5 и меньшее или равное 7 при температуре 20°С, обусловленное ионизацией ее первого подходящего водорода, и при потере этого первого подходящего водорода образуется соответствующий анион, способный формировать водорастворимую соль кальция, и
ii) после контактирования по меньшей мере одной кислоты с природным размолотым или осажденным карбонатом кальция дополнительно вводят по меньшей мере одну водорастворимую соль, которая в случае содержащей водород соли имеет значение рКа свыше 7 при температуре 20°С, обусловленное ионизацией ее первого подходящего водорода, и анион каковой соли способен образовывать нерастворимые в воде соли кальция.
Согласно одному варианту исполнения получения природного размолотого или осажденного карбоната кальция с реакционно-модифицированной поверхностью, природный размолотый или осажденный карбонат кальция вводят в реакцию по меньшей мере с одной кислотой и/или диоксидом углерода в присутствии по меньшей мере одного соединения, выбранного из группы, состоящей из силиката, оксида магния, лимонной кислоты, сульфата алюминия, нитрата алюминия, хлорида алюминия, и их смесей. Эти компоненты могут быть добавлены к водной суспензии, включающей природный размолотый или осажденный карбонат кальция, до добавления по меньшей мере одной кислоты и/или диоксида углерода.
Природный или синтетический карбонат кальция с реакционно-модифицированной поверхностью может выдерживаться в суспензии. В альтернативном варианте, описанная выше водная суспензия может быть высушена.
Природный или осажденный карбонат кальция с реакционно-модифицированной поверхностью, используемый в настоящем изобретении, предпочтительно получают в форме высушенного порошка. Последующая стадия высушивания может быть проведена любым способом, известным квалифицированному специалисту. Например, высушивание может быть проведено в одну стадию, такую как распылительная сушка, или по меньшей мере в две стадии, например, применением первой стадии нагревания карбоната кальция с реакционно-модифицированной поверхностью, чтобы снизить содержание связанной влаги, и проведением второй стадии нагревания карбоната кальция с реакционно-модифицированной поверхностью, чтобы сократить содержание остаточной влаги.
Термин «сухой» карбонат кальция с реакционно-модифицированной поверхностью понимается как карбонат кальция с реакционно-модифицированной поверхностью, имеющий менее 1,8% по весу воды относительно веса карбоната кальция с реакционно-модифицированной поверхностью. Количество воды в % может быть определено нагреванием карбоната кальция с реакционно-модифицированной поверхностью до температуры 105°С в сушильной камере с использованием метода согласно стандарту ISO 787-2.
Природный размолотый или осажденный карбонат кальция с реакционно-модифицированной поверхностью, используемый в настоящем изобретении, получается в сухой форме. Карбонат кальция с реакционно-модифицированной поверхностью предпочтительно находится в форме пыли или порошка, и наиболее предпочтительно в форме порошка.
Согласно одному варианту осуществления настоящего изобретения, карбонат кальция с реакционно-модифицированной поверхностью включает нерастворимую, по меньшей мере частично кристаллическую соль кальция с анионом по меньшей мере одной кислоты, которая образуется на поверхности природного размолотого или осажденного карбоната кальция. Согласно одному варианту исполнения, нерастворимая, по меньшей мере частично кристаллическая соль кальция с анионом по меньшей мере одной кислоты покрывает поверхность природного размолотого или осажденного карбоната кальция по меньшей мере частично, предпочтительно полностью. В зависимости от используемой по меньшей мере одной кислоты, анион может представлять собой сульфат, сульфит, фосфат, цитрат, оксалат, ацетат и/или формиат.
Согласно одному предпочтительному варианту исполнения, карбонат кальция с реакционно-модифицированной поверхностью представляет собой продукт реакции природного размолотого карбоната кальция и по меньшей мере одной кислоты, предпочтительно фосфорной кислоты. Согласно еще одному предпочтительному варианту исполнения, карбонат кальция с реакционно-модифицированной поверхностью представляет собой продукт реакции природного размолотого карбоната кальция и фосфорной кислоты в комбинации с лимонной кислотой.
Кроме того, в предпочтительном варианте исполнения карбонат кальция с реакционно-модифицированной поверхностью имеет удельную площадь поверхности по методу BET от 20,0 м2/г до 200,0 м2/г, предпочтительно от 20,0 м2/г до 180,0 м2/г, более предпочтительно от 30,0 м2/г до 160,0 м2/г, еще более предпочтительно от 40,0 м2/г до 150,0 м2/г, и наиболее предпочтительно от 50,0 м2/г до 140,0 м2/г, измеренную с использованием азота и метода BET согласно стандарту ISO 9277 77.
Согласно одному варианту исполнения, карбонат кальция с реакционно-модифицированной поверхностью включает частицы, имеющие объемный медианный диаметр d50 зерен от 2,0 до 50,0 мкм, предпочтительно от 2,5 до 25,0 мкм, более предпочтительно от 2,8 до 20,0 мкм, еще более предпочтительно от 3,0 до 10,0 мкм, и наиболее предпочтительно от 4,0 до 8,0 мкм. Объемный медианный диаметр зерен предпочтительно измеряют с использованием системы лазерной дифракции Malvern Mastersizer 2000. Метод и прибор известны квалифицированному специалисту и обычно применяются для определения размеров зерен наполнителей и пигментов.
Дополнительно или альтернативно, карбонат кальция с реакционно-модифицированной поверхностью включает частицы, имеющие верхний предельный размер частиц (d98), меньший или равный 40,0 мкм, предпочтительно меньший или равный 30,0 мкм, более предпочтительно меньший или равный 20,0 мкм, еще более предпочтительно меньший или равный 17,0 мкм, более предпочтительно меньший или равный 14,0 мкм. Карбонат кальция с реакционно-модифицированной поверхностью предпочтительно включает частицы, имеющие верхний предельный размер частиц (d98) в диапазоне от 5,0 до 40 мкм, предпочтительно от 6 до 30 мкм, более предпочтительно от 7,0 до 20,0 мкм, еще более предпочтительно от 8,0 до 17,0 мкм, более предпочтительно от 11,0 до 14,0 мкм.
Карбонат кальция с реакционно-модифицированной поверхностью предпочтительно имеет внутричастичный интрузионный удельный поровый объем в пределах диапазона от 0,15 до 1,35 см3/г, предпочтительно от 0,30 до 1,30 см3/г, и наиболее предпочтительно от 0,40 до 1,25 см3/г, рассчитанный по измерению методом ртутной интрузионной порометрии, как описывается в экспериментальной части. Общий поровый объем, выявленный по данным совокупной интрузии, может быть подразделен на две области с данными интрузии от 214 мкм с уменьшением до около 1-4 мкм, показывающими неплотную упаковку образца между любыми агломерированными структурами, вносящими основной вклад. Ниже этих диаметров находится плотная межчастичная упаковка самих частиц. Если они также имеют внутричастичные поры, то эта область проявляется бимодальной. Сумма этих трех областей дает совокупный поровый объем порошка, но весьма зависит от уплотнения/оседания исходного образца порошка на концевом участке кривой распределения крупных пор.
Принимая первую производную кривой распределений поровых размеров по совокупной интрузии на основе эквивалентного диаметра Лапласа, неизбежно обнаруживается наличие маскировки пор. Дифференциальные кривые четко показывают область поровой структуры крупных агломератов, область межчастичных пор и внутричастичных пор, если они присутствуют. При знании диапазона диаметров внутричастичных пор можно вычесть остальной поровый объем между частицами и между агломератами из общего порового объема для получения желательного удельного порового объема только внутренних пор как удельного порового объема в расчете на единицу массы. Тот же принцип вычитания, разумеется, применим для обособления любой из других областей представляющего интерес порового объема.
Диаметр пор карбоната кальция с реакционно-модифицированной поверхностью предпочтительно варьирует в диапазоне от 4 до 500 нм, более предпочтительно в диапазоне между 20 и 80 нм, в особенности от 30 до 70 нм, например, 50 нм, по определению измерением методом ртутной порометрии.
Согласно предпочтительному варианту исполнения, внутри- и/или межчастичные поры карбоната кальция с реакционно-модифицированной поверхностью являются полыми, и поэтому карбонат кальция с реакционно-модифицированной поверхностью является незагруженным. Другими словами, карбонат кальция с реакционно-модифицированной поверхностью не используется в качестве носителя.
Карбонат кальция с реакционно-модифицированной поверхностью предпочтительно имеет межчастичные полости в пределах диапазона от 50 об.% (объем/объем) до 99 об.% (объем/объем), предпочтительно от 70 об.% (объем/объем) до 98 об.% (объем/объем), в особенности от 80 об.% (объем/объем) до 95 об.% (объем/объем), рассчитанные по измерению методом ртутной порометрии, как описывается в экспериментальной части.
Дополнительно или альтернативно, карбонат кальция с реакционно-модифицированной поверхностью имеет сердцевинные полости в пределах диапазона от 1 об.% (объем/объем) до 30 об.% (объем/объем), предпочтительно от 5 об.% (объем/объем) до 20 об.% (объем/объем), в особенности от 10 об.% (объем/объем) до 15 об.% (объем/объем), рассчитанные по измерению методом ртутной порометрии, как описывается в экспериментальной части.
Карбонат кальция с реакционно-модифицированной поверхностью может быть в форме пыли или порошка, и предпочтительно в форме порошка.
Согласно одному варианту исполнения, карбонат кальция с реакционно-модифицированной поверхностью не содержит наноразмерные частицы, например, частицы по меньшей мере с одним измерением менее 200 нм. «Наноразмерные частицы» в смысле настоящего изобретения имеют отношение к тонкодисперсным частицам по меньшей мере с одним измерением менее 200 нм. Согласно одному варианту осуществления настоящего изобретения, карбонат кальция с реакционно-модифицированной поверхностью не содержит частицы, которые имеют среднечисленный размер частиц d50 менее 200 нм. Для определения значения среднечисленного размера частиц d50 может быть применен анализатор Malvern Zetasizer Nano ZS, в котором используется динамическое рассеяние света для определения эквивалентного сферического гидродинамического диаметра Стокса.
Согласно стадии b) данного способа, подготавливается по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор.
Выражение «по меньшей мере один» фармацевтически активный агент или его фармацевтически неактивный прекурсор означает, что в стадии b) способа могут предусматриваться один или более фармацевтически активных агентов или их фармацевтически неактивных прекурсоров.
Согласно одному варианту осуществления настоящего изобретения, в стадии b) способа предусматриваться только один фармацевтически активный агент или его фармацевтически неактивный прекурсор. Согласно еще одному варианту осуществления настоящего изобретения, в стадии b) способа предусматриваться смесь двух или более фармацевтически активных агентов или их фармацевтически неактивных прекурсоров. Например, в стадии b) способа используется смесь двух или трех фармацевтически активных агентов или их фармацевтически неактивных прекурсоров.
В стадии b) способа предпочтительно используется только один фармацевтически активный агент или его фармацевтически неактивный прекурсор.
По меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор предпочтительно выбирают из группы, включающей фармацевтически активный агент или его фармацевтически неактивный прекурсор синтетического происхождения, полусинтетического происхождения, природного происхождения, и их комбинации.
Таким образом, фармацевтически активный агент имеет отношение к фармацевтически активным агентам, которые имеют синтетическое происхождение, полусинтетическое происхождение, природное происхождение, и их комбинации. Кроме того, фармацевтически неактивный прекурсор фармацевтически активного агента имеет отношение к фармацевтически неактивным прекурсорам, которые имеют синтетическое происхождение, полусинтетическое происхождение, природное происхождение, и их комбинации, и будут активированы на более поздней стадии с образованием соответствующего фармацевтически активного агента.
Активация такого фармацевтически неактивного прекурсора известна квалифицированному специалисту и является общепринятой на практике, например, активация в желудке и/или в желудочно-кишечном тракте, такая как кислотная активация или расщепление трипсином или химотрипсином.
В пределы компетенции квалифицированного специалиста входит то, что упомянутые способы активации имеют всего лишь иллюстративный характер, и не предполагаются имеющими ограничительный характер.
Следует отметить, что по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор может быть любым соединением, известным квалифицированному специалисту.
Таким образом, фармацевтически активные агенты включают любое соединение, которое проявляет профилактическое и/или терапевтическое действие, когда вводится человеку и/или животному. Примеры включают, но не ограничиваются таковыми, фармацевтические препараты, терапевтические препараты, ветеринарные препараты, нутрицевтики и регуляторы роста.
Например, по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор представляет собой средство против зубного камня. Применимые здесь средства против зубного камня включают фосфаты. Фосфаты включают пирофосфаты, полифосфаты, полифосфонаты, и их смеси. Пирофосфаты относятся к хорошо известным фосфатам для применения в продуктах для стоматологической помощи. Пирофосфат-ионы, нанесенные на зубы, являются производными пирофосфатных солей. Пирофосфатные соли, применимые в настоящей фармацевтической системе доставки, включают пирофосфатные соли с двумя катионами щелочных металлов, пирофосфатные соли с четырьмя катионами щелочных металлов, и их смеси. Предпочтительны дигидропирофосфат динатрия (Na2H2P2O7), пирофосфат тетранатрия (Na4P2O7) и пирофосфат тетракалия (K4P2O7) в их негидратированной, а также в гидратированной формах. Фосфатные средства против зубных отложений включают пирофосфаты калия и натрия; триполифосфат натрия; дифосфонаты, такие как этан-1-гидрокси-1,1-дифосфонат; 1-азациклогептан-1,1-дифосфонат; и линейные алкилдифосфонаты; линейные карбоновые кислоты и цитрат натрия и цинка.
Агенты, которые могут быть использованы вместо вышеуказанной пирофосфатной соли или в сочетании с нею, включают такие материалы, как синтетические анионные полимеры, в том числе полиакрилаты и сополимеры малеиновых ангидрида или кислоты и простого метилвинилового эфира, например, Gantrez, как описано, например, в Патенте США № 4,627,977, на имя Gaffar и др., включенном здесь ссылкой во всей своей полноте, как описании таких агентов, а также, например, полиаминопропансульфоновая кислота (AMPS), тригидрат цитрата цинка, полифосфаты, например, триполифосфат и гексаметафосфат, дифосфонаты, например, EHDP и AMP, полипептиды, такие как полиаспарагиновая и полиглутаминовая кислоты, и их смеси.
В фармацевтической системе доставки согласно настоящему изобретению также могут присутствовать антимикробные агенты как оральные агенты и/или соматические препараты. Такие агенты могут включать, но не ограничиваются таковыми, 5-хлор-2-(2,4-дихлорфенокси)-фенол, обычно называемый триклозаном, хлоргексидин, алексидин, гексетидин, сангвинарин, бензалкония хлорид, салициламид, домифена бромид, хлорид цетилпиридиния (CPC), хлорид тетрадецилпиридиния (TPC); хлорид N-тетрадецил-4-этилпиридиния (TDEPC); октенидин; делмопинол, октапинол, и другие производные пиперидина, ниациновые препараты; агенты на основе цинка/олова(II); антибиотики, такие как AUGMENTIN, амоксициллин, тетрациклин, доксициклин, миноциклин, и метронидазол; и аналоги, производные и соли вышеуказанных антимикробных агентов, и их смеси.
В фармацевтической системе доставки согласно настоящему изобретению также могут присутствовать противовоспалительные средства как оральные агенты и/или соматические препараты. Такие агенты могут включать, но не ограничиваются таковыми, нестероидные противовоспалительные средства, или NSAID, такие как производные пропионовой кислоты; производные уксусной кислоты; производные N-фенилантраниловой кислоты; производные бифенилкарбоновой кислоты; и оксикамы. Все из этих NSAID полностью описаны в Патенте США № 4,985,459 на имя Sunshine и др., включенном здесь ссылкой во всей своей полноте, как описании таких NSAID. Примеры применимых NSAIDs включают ацетилсалициловую кислоту, ибупрофен, напроксен, беноксапрофен, флурбипрофен, фенопрофен, фенбуфен, кетопрофен, индопрофен, пирпрофен, карпрофен, оксапрозин, пранопрофен, микропрофен, тиоксапрофен, супрофен, алминопрофен, тиапрофеновую кислоту, флупрофен, буклоксовую кислоту, и их смеси.
Также применимыми являются стероидные противовоспалительные лекарственные средства, такие как гидрокортизон и тому подобные, и ингибиторы COX-2, такие как мелоксикам, целекоксиб, рофекоксиб, вальдекоксиб, эторикоксиб, или их смеси. Могут быть применены смеси любых из вышеуказанных противовоспалительных препаратов.
Другие материалы, которые могут быть использованы в настоящей фармацевтической системе доставки, включают общеизвестные продукты для ухода за полостью рта и лечения горла. Эти продукты включают, но не ограничиваются таковыми, средства для верхних дыхательных путей, такие как фенилэфрин, дифенгидрамин, декстрометорфан, бромгексин и хлорфенирамин, желудочно-кишечные средства, такие как фамотидин, лоперамид и симетикон, противогрибковые препараты, такие как миконазола нитрат, антибиотики и анальгетики, такие как кетопрофен и флурибупрофен.
По меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор также могут быть выбраны из витамина Е, то есть, токоферолов, витамина С, то есть, аскорбиновой кислоты и ее солей, пиросульфита натрия, бутилгидрокситолуола, бутилированного гидроксианизола; и консервантов, включающих парабены, бензалкония хлорид, хлорбутанол, бензиловый спирт, бета-фенилэтиловый спирт, хлорид цетилпиридиния, лимонную кислоту, винную кислоту, молочную кислоту, яблочную кислоту, уксусную кислоту, бензойную кислоту, и сорбиновую кислоту и ее соли; и хелатирующих агентов, таких как EDTA; и галлатов, таких как пропилгаллат.
По меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор также могут быть выбраны из витаминов, таких как витамины В, С и Е; минералов, таких как фториды, в особенности фторид натрия, монофторфосфат натрия и фторид олова(II); нейтрализаторов запаха, таких как цинк и циклодекстрины; пропеллентов, таких как 1,1,2,2-тетрафторэтан (HFC-134a), необязательно сжиженный, и 1,1,1,2,3,3,3-гептафторпропан (HFC-227), необязательно сжиженный.
По меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор также могут быть выбраны из эфедрина, магалдрата, псевдоэфедрина, силденафила, ксилокаина, бензалкония хлорида, кофеина, фенилэфрина, амфепрамона, орлистата, сибутрамина, ацетаминофена, аспирина, аминоацетата алюминия, аминоацетата алюминия в комбинации с оксидом магния, гидрата оксида алюминия в комбинации с оксидом магния, карбоната кальция в комбинации с гидроксидом магния, карбоната кальция, дигидроксиалюминия натрия карбоната, оксида магния, глитазонов, метформина, хлорпромазина, дименгидрината, домперидона, меклозина, метоклопрамида, ондансетрона, преднизолона, прометазина, акривастина, цетиризина, циннаризина, клемастина, циклизина, дезлоратадина, дексхлорфенирамин, дименгидрината, эбастина, фексофенадина, ибупрофена, леволевопрорицина, лоратадина, меклозина, мизоластина, прометазина, миконазола, витамина В12, фолиевой кислоты, соединений железа (II), витамина С, хлоргексидина диацетата, фторида, декапептида KSL, фторида алюминия, аминохелата кальция, фторида аммония, фторсиликата аммония, монофторфосфата аммония, фторида кальция, глюконата кальция, глицерофосфата кальция, лактата кальция, монофторфосфата кальция, карбоната кальция, карбамида, хлорида цетилпиридиния, хлоргексидина, хлоргексидина диглюконата, хлоргексидина хлорида, хлоргексидина диацетата, казеин-фосфопептида CPP, гексетидина, фторида октадецентиламмония, фторсиликата калия, хлорида калия, монофторфосфата калия, бикарбоната натрия, карбоната натрия, фторида натрия, фторсиликата натрия, монофторфосфата натрия, триполифосфата натрия, фторида олова(II), дигидрофторида стеарилтригидроксиэтилпропилендиамина, хлорида стронция, пирофосфата тетракалия, пирофосфата тетранатрия, ортофосфата трикалия, ортофосфата тринатрия, альгиновой кислоты, гидроксида алюминия, бикарбоната натрия, силденафила, тадалафила, варденафила, йохимбина, циметидина, низатидина, ранитидина, ацетилсалициловой кислоты, клопидогрела, ацетилцистеина, бромгексина, кодеина, декстрометорфана, дифенгидрамина, носкапина, фенилпропаноламина, витамина D, симвастатина, бисакодила, лактитола, лактулозы, оксида магния, пикосульфата натрия, гликозидов сенны, бензокаина, лидокаина, тетракаина, алмотриптана, элетриптана, наратриптана, ризатриптана, суматриптана, золмитриптана, кальция, хрома, меди, иода, железа, магния, марганца, молибдена, фосфора, селена, цинка, хлорамина, пероксида водорода, метронидазола, триамцинолона ацетонида, бензетония хлорида, хлорида цетилпиридиния, хлоргексидина, фторида, лидокаина, амфотерицина, миконазола, нистатина, рыбьего жира, гинкго билоба, женьшеня, имбиря, эхинацеи пурпурной, серенои ползучей, цетиризина, левоцетиризина, лоратадина, диклофенака, флурбипрофена, акривастина псевдоэфедрина, лоратадина псевдоэфедрина, глюкозамина, гиалуроновой кислоты, декапептида KSL-W, декапептида KSL, ресвератрола, мизопростола, бупропиона, ондансетрона·HCl, эзомепразола, лансопразола, омепразола, пантопразола, рабепразола, бактерий и тому подобных, лоперамида, симетикона, ацетилсалициловой кислоты и других, сукральфата, витамина A, витамина B1, витамина B12, витамина B2, витамина B6, биотина, витамина C, витамина D, витамина E, фолиновой кислоты, витамина K, ниацина, коэнзима Q10, клотримазола, флуконазола, итраконазола, кетоконазола, тербинафина, аллопуринола, пробенецида, аторвастатина, флувастатина, ловастатина, никотиновой кислоты, правастатина, розувастатина, симвастатина, пилокарпина, напроксена, алендроната, этидроната, ралоксифена, ризедроната, бензодиазепинов, дисульфирама, налтрексона, бупренорфина, кодеина, декстропропоксифена, фентанила, гидроморфона, кетобемидона, кетопрофена, метадона, морфина, напроксена, никоморфина, оксикодона, петидина, трамадола, амоксициллина, ампициллина, азитромицина, ципрофлоксацина, кларитромицина, доксициклина, эритромицина, фусидовой кислоты, лимециклина, метронидазола, моксифлоксацина, офлоксацина, окситетрациклина, феноксиметилпенициллина, рифамицинов, рокситромицина, сульфаметизола, тетрациклина, триметоприма, ванкомицина, акарбозы, глибенкламида, гликлазида, глимепирида, глипизида, инсулина, репаглинида, толбутамида, осельтамивира, ацикловира, фамцикловира, пенцикловира, валганцикловира, амлодипина, дилтиазема, фелодипина, нифедипина, верапамила, финастерида, миноксидила, кокаина, бупренорфина, клонидина, метадона, налтрексона, антагонистов кальция, клонидина, эрготамина, β- блокаторов, ацеклофенака, целекоксиба, дексипрофена, этодолака, индометацина, кетопрофена, кеторолака, лорноксикама, мелоксикама, набуметона, оироксикама, парекоксиба, фенилбутазона, пироксикама, тиапрофеновой кислоты, толфенамовой кислоты, арипипразола, хлорпромазина, хлорпротиксена, клозапина, флупентиксола, флуфеназина, галоперидола, карбоната лития, цитрата лития, мелперона, пенфлуридола, перициазина, перфеназина, пимозида, пипамперона, прохлорперазина, рисперидона, тиоридизина, флуконазола, итраконазола, кетоконазола, вориконазола, опия, бензодиазепинов, гидроксина, мепробамата, фенотиазина, аминоацетата алюминия, эзомепразола, фамотидина, оксида магния, низатида, омепразола, пантопразола, флуконазола, итраконазола, кетоконазола, метронидазола, амфетамина, атенолола, бисопролола фумарата, метопролола, метрополола, пиндолола, пропранолола, ауранофина, и бендазака.
Дополнительные примеры применимого по меньшей мере одного из фармацевтически активных агентов или их фармацевтически неактивных прекурсоров включают активные ингредиенты, выбранные из терапевтических групп, включающих: анальгетики, анестетики, жаропонижающие средства, антиаллергенные препараты, антиаритмические средства, подавители аппетита, противогрибковые средства, противовоспалительные препараты, бронходилататоры, сердечно-сосудистые лекарственные средства, коронарные дилататоры, церебральные дилататоры, периферические вазодилататоры, антибактериальные средства, психотропные препараты, противоманиакальные средства, стимуляторы, антигистаминные препараты, слабительные средства, противоотечные препараты, желудочно-кишечные седативные средства, средства против сексуальной дисфункции, дезинфицирующие препараты, противодиарейные средства, антиангинальные препараты, вазодилататоры, противогипертонические средства, сосудосужающие препараты, средства для лечения мигрени, антибиотики, транквилизаторы, нейролептические препараты, противоопухолевые лекарственные средства, антикоагулянты, антитромботические препараты, снотворные препараты, седативные средства, противорвотные средства, препараты против тошноты, антиконвульсивные средства, нервно-мышечные агенты, гипер- и гипогликемические средства, тиреоидные и антитиреоидные препараты, диуретики, спазмолитики, средства для расслабления матки, препараты против ожирения, аноретики, спазмолитики, анаболические средства, эритропоэтические препараты, антиастматические средства, отхаркивающие средства, средства от кашля, муколитики, средства против урикемии, дентальные наполнители, освежители дыхания, антациды, антидиуретики, средства против метеоризма, бета-блокаторы, отбеливатели зубов, ферменты, коферменты, белки, энергетические напитки, волокна, пробиотики, пребиотики, противомикробные агенты, нестероидные противовоспалительные препараты (NSAID), противокашлевые средства, противозастойные средства, антигистаминные препараты, отхаркивающие средства, противодиарейные средства, антагонисты Н2-рецепторов гистамина, ингибиторы протонной помпы, неселективные депрессанты ЦНС общего действия, неселективные стимуляторы ЦНС общего действия, лекарственные препараты селективного модифицирования функции ЦНС, средства против болезни Паркинсона, наркотические анальгетики, анальгетики-антипиретики, психофармакологические лекарственные средства, и препараты против сексуальной дисфункции.
Примеры применимого по меньшей мере одного из фармацевтически активных агентов или их фармацевтически неактивных прекурсоров также могут включать: гликомакропептид казеина (CGMP), триклозан, хлорид цетилпиридиния, домифена бромид, четвертичные аммониевые соли, цинковые компоненты, сангвинарин, фториды, алексидин, октонидин, этилендиаминтетраукусусную кислоту (EDTA), аспирин, ацетаминофен, ибупрофен, кетопрофен, дифлунизал, фенопрофен кальция, напроксен, толметин натрия, индометацин, бензонатат, карамифен эдисилат, ментол, декстрометорфана гидробромид, теобромина гидрохлорид, хлорфендианола гидрохлорид, псевдоэфедрина гидрохлорид, фенилэфрин, фенилпропаноламин, псевдоэфедрина сульфат, бромфенирамина малеинат, хлорфенирамина малеинат, карбиноксамина малеинат, клемастина фумарат, дексхлорфенирамина малеинат, дефенгидрамина гидрохлорид, дифенпиралида гидрохлорид, азатадина малеинат, дифенгидрамина цитрат, доксиламина сукцинат, прометазина гидрохлорид, пириламина малеинат, трипеленамина цитрат, трипролидина гидрохлорид, акривастин, лоратадин, бромфенирамин, дексбромфенирамин, гвайфенезин, ипекак, иодид калия, терпингидрат, лоперамид, фамотидин, ранитидин, омепразол, лансопразол, алифатические спирты, барбитураты, кофеин, стрихнин, пикротоксин, пентилентетразол, фенилгидантоин, фенобарбитал, примидон, карбамазапин, этосуксимид, метсуксимид, фенсуксимид, триметадион, диазепам, бензодиазепины, фенасемид, фенетурид, ацетазоламид, сультиам, бромид, леводопу, амантадин, морфин, героин, гидроморфин, метопон, оксиморфон, левофанол, кодеин, гидрокодон, ксикодон, налорфин, налоксон, налтрексон, салицилаты, фенилбутазон, индометацин, фенацетин, хлорпромазин, метотримепразин, галоперидол, клозапин, резерпин, имипрамин, транилципромин, фенелзин, литий, силденафила цитрат, тадалафил, и варденафила хлорид.
Примеры применимого по меньшей мере одного из фармацевтически активных агентов или их фармацевтически неактивных прекурсоров могут включать активные ингредиенты, выбранные из групп ингибиторов АПФ, антиангинальных лекарственных препаратов, антиаритмических средств, антиастматиков, антихолестериновых средств, анальгетиков, анестетиков, антиконвульсантов, антидепрессантов, антидиабетических агентов, препаратов против диареи, антидотов, антигистаминных препаратов, антигипертензивных лекарственных средств, противовоспалительных средств, антилипидных агентов, противоманиакальных средств, средств против тошноты, средств против инсульта, антитиреоидных препаратов, противоопухолевых лекарственных средств, антивирусных агентов, лекарств против угревой сыпи, алкалоидов, аминокислотных препаратов, противокашлевых лекарств, антиуремических препаратов, антивирусных лекарств, анаболиков, системных и несистемных дезинфицирующих средств, антинеопластонов, средств против болезни Паркинсона, противоревматических средств, стимуляторов аппетита, модификаторов биологического отклика, модификаторов крови, регуляторов метаболизма кости, сердечно-сосудистых препаратов, стимуляторов центральной нервной системы, ингибиторов холинэстеразы, контрацептивов, противоотечных средств, пищевых добавок, агонистов дофаминовых рецепторов, средств регуляции эндометриоза, ферментов, лекарственных средств против эректильной дисфункции, таких как силденафила цитрат, который в настоящее время продается на рынке как ViagraTM, половых факторов, желудочно-кишечных агентов, гомеопатических лекарств, гормонов, средств регуляции гиперкальциемии и гипокальциемии, иммуномодуляторов, иммунодепрессантов, препаратов против мигрени, средств для лечения морской болезни, миорелаксантов, средств регуляции ожирения, препаратов против остеопороза, родостимуляторов, парасимпатолитиков, парасимпатомиметиков, простагландинов, психотерапевтических агентов, средств против респираторных заболеваний, седативных препаратов, препаратов для помощи в отказе от курения, таких как бромокриптин, симпатолитиков, препаратов против тремора, средств для лечения мочевых путей, вазодилататоров, слабительных средств, антацидов, ионообменных смол, антипиретиков, подавителей аппетита, отхаркивающих средств, успокаивающих препаратов, противоязвенных препаратов, противовоспалительных препаратов, коронарных дилататоров, церебральных дилататоров, периферических вазодилататоров, психотропных препаратов, стимуляторов, противогипертонических лекарств, сосудосужающих средств, препаратов для лечения мигрени, антибиотиков, транквилизаторов, нейролептиков, противоопухолевых лекарственных препаратов, антикоагулянтов, антитромботических средств, снотворных средств, противорвотных средств, препаратов против тошноты, антиконвульсантов, нейромышечных лекарств, средств против гипер- и гипогликемии, тиреоидных или антитиреоидных препаратов, диуретиков, спазмолитиков, средств для расслабления матки, средств против ожирения, эритропоэтических препаратов, антиастматиков, препаратов для подавления кашля, муколитиков, препаратов для модификации ДНК и генетических модификаций, и их комбинаций.
Примеры применимого по меньшей мере одного из фармацевтически активных агентов или их фармацевтически неактивных прекурсоров, предусматриваемых для применения в настоящей фармацевтической системе доставки, могут включать антациды, H2-антагонисты и анальгетики. Например, дозировки антацидов могут быть приготовлены с использованием ингредиентов карбоната кальция по отдельности или в комбинации с гидроксидом магния и/или гидроксидом алюминия. Кроме того, антациды могут быть использованы в комбинации с H2-антагонистами.
Анальгетики включают опиаты и производные опиатов, такие как Oxycontin™, ибупрофен, аспирин, ацетаминофен, и их комбинации, которые необязательно могут включать кофеин.
Прочие применимые по меньшей мере один из фармацевтически активных агентов или их фармацевтически неактивных прекурсоров для использования в вариантах исполнения могут включать средства против диареи, такие как Immodium™ AD, антигистаминные препараты, противокашлевые препараты, противозастойные препараты, витамины, и освежители дыхания. Также предусматриваются для применения здесь анксиолитики, такие как Xanax™; нейролептики, такие как Clozaril™ и Haldol™; нестероидные противовоспалительные средства (NSAID), такие как ибупрофен, напроксен натрия, Voltaren™ и Lodine™, антигистаминные препараты, такие как Claritin™, Hismanal™, Relafen™, и Tavist™; противорвотные средства, такие как KytrilTM и Cesamet™; бронходилататоры, такие как Bentolin™, Proventil™; антидепрессанты, такие как Prozac™, Zoloft™, и Paxil™; средства против мигрени, такие как Imigra™, АПФ-ингибиторы, такие как Vasotec™, Capoten™ и Zestril™; средства против болезни Альцгеймера, такие как Nicergoline™; и CaH-антагонисты, такие как Procardia™, Adalat™, и Calan™.
Широко распространенные H2-антагонисты, которые предусматриваются для применениея в настоящем изобретении, включают циметидин, ранитидина гидрохлорид, фамотидин, низатидин, эбротидин, мифентидин, роксатидин, пизатидин и ацероксатидин.
Активные антацидные ингредиенты могут включать, но не ограничиваются таковыми, следующие вещества: гидроксид алюминия, аминоацетат дигидроксиалюминия, аминоуксусную кислоту, фосфат алюминия, карбонат дигидроксиалюминия-натрия, бикарбонат, алюминат висмута, карбонат висмута, субкарбонат висмута, субгаллат висмута, субнитрат висмута, субсалицилат висмута, фосфат кальция, источник цитрат-иона (кислоту или соль), аминоуксусную кислоту, гидрат алюмината-сульфата магния, магалдрат, алюмосиликат магния, карбонат магния, глицинат магния, гидроксид магния, оксид магния, трисиликат магния, сухие вещества молока, одно- или двухосновный алюмофосфат кальция, трикальцийфосфат, бикарбонат калия, тартрат натрия, бикарбонат натрия, алюмосиликаты магния, винные кислоты и соли. В качестве по меньшей мере одного из фармацевтически активного агента или его фармацевтически неактивного прекурсора могут быть также использованы многообразные пищевые добавки, по существу включающие любые витамины или минералы. Например, могут быть использованы витамин A, витамин C, витамин D, витамин E, витамин K, витамин B6, витамин B12, тиамин, рибофлавин, биотин, фолиевая кислота, ниацин, пантотеновая кислота, натрий, калий, кальций, магний, фосфор, сера, хлор, железо, медь, иод, цинк, селен, марганец, холин, хром, молибден, фтор, кобальт, и их комбинации. Примеры пищевых добавок, которые могут быть использованы в качестве активных ингредиентов, изложены в Публикациях Патентных Заявок США №№ 2003/0157213 A1, 2003/0206993 и 2003/0099741 A1, которые включены здесь ссылкой во всей их полноте для всех целей. В качестве по меньшей мере одного из фармацевтически активного агента или его фармацевтически неактивного прекурсора могут быть также использованы также могут быть применены разнообразные травяные препараты, такие как имеющие медикаментозные свойства или свойства пищевых добавок. Травяные препараты, как правило, представляют собой ароматические растения или части растений, и/или экстракты из них, которые могут быть использованы для медицинских целей или в качестве приправы. Пригодные травяные препараты могут быть использованы самостоятельно или в разнообразных смесях. Обычно применяемые травы включают эхинацею, желтокорень канадский, календулу, розмарин, чабрец, перец опьяняющий, алоэ, лапчатку, экстракт из семян грейпфрута, воронец красный, женьшень, гуарану, клюкву, гинкго билоба, травы Джона Ворта, масло примулы вечерней, кору йохимбе, зеленый чай, хвойник китайский, маку, чернику, лютеин, и их комбинации.
В некоторых вариантах исполнения могут быть включены минералы, но без ограничения такими, как натрий, магний, хром, иод, железо, марганец, медь, фторид, калий, фосфор, молибден, селен, цинк, и их комбинации.
В некоторых вариантах исполнения по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор может включать, но не ограничивается таковыми, L-карнитин, холин, кофермент Q10, альфа-липоевую кислоту, омега-3-жирные кислоты, пепсин, фитазу, трипсин, липазы, протеазы, целлюлазы, и их комбинации.
По меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор также могут включать аскорбиновую кислоту, лимонную кислоту, розмариновое масло, витамин A, витамин E, витамина E фосфат, токоферолы, ди-альфа-токоферилфосфат, токотриенолы, альфа-липоевую кислоту, дигидролипоевую кислоту, ксантофиллы, бета-криптоксантин, ликопин, лютеин, зеаксантин, астаксантин, бета-каротин, каротины, смешанные каротиноиды, полифенолы, флавоноиды, и их комбинации.
В некоторых вариантах исполнения по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор могут быть выбраны из фитохимических препаратов, таких как каротиноиды, хлорофилл, хлорофиллин, волокно, флавоноиды, антоцианины, цианидин, дельфинидин, мальвидин, пеларгонидин, пеонидин, петунидин, флаванолы, катехин, эпикатехин, эпигаллокатехин, эпигаллокатехина галлат, теафлавины, теарубигины, проантоцианины, флавонолы, кверцетин, кемпферол, мирицетин, изорамнетин, флавоношесперитин, нарингенин, эриодиктиол, танжеритин, флавоны, апигенин, лютеолин, лигнаны, фитоэстрогены, ресвератрол, изофлавоны, даидзеин, генистеин, глицитеин, соевые изофлавоны, и их комбинации.
В некоторых вариантах исполнения по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор могут быть выбраны из анальгетиков/анестетиков, таких как ментол, фенол, гексилрезорцин, бензокаин, диклонина гидрохлорид, бензиловый спирт, салициловый спирт, и их комбинации. В некоторых вариантах исполнения по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор могут быть выбраны из уменьшающих раздражение средств, таких как кора скользкого вяза, пектин, желатин, и их комбинации. В некоторых вариантах исполнения по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор могут быть выбраны из антисептических ингредиентов, таких как хлорид цетилпиридиния, домифена бромид, деквалиния хлорид, и их комбинации.
В некоторых вариантах исполнения по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор могут быть выбраны из противокашлевых ингредиентов, таких как клофедианола гидрохлорид, кодеин, кодеина фосфат, кодеина сульфат, декстрометорфан, декстрометорфана гидробромид, дифенгидрамина цитрат, и дифенгидрамина гидрохлорид, и их комбинации.
В некоторых вариантах исполнения по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор могут быть выбраны из средств для смягчения горла, таких как мед, прополис, алоэ вера, глицерин, ментол, и могут быть включены их комбинации. В еще других вариантах исполнения по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор могут быть выбраны из подавителей кашля. Такие подавители кашля могут быть подразделены на две группы: такие, которые изменяют текстуру или формирование флегмы, такие как муколитики и отхаркивающие средства; и такие, которые подавляют кашлевой рефлекс, такие как кодеин (наркотические подавители кашля), антигистамины, декстрометорфан и изопротеренол (ненаркотические подавители кашля). В некоторых вариантах исполнения могут быть включены ингредиенты из одной или обеих групп.
В других дополнительных вариантах исполнения по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор могут представлять собой противокашлевые средства, выбранные из группы, включающей кодеин, декстрометорфан, декстрорфан, дифенгидрамин, гидрокодон, носкапин, оксикодон, пентоксиверин, и их комбинации. В некоторых вариантах исполнения по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор могут быть выбраны из антигистаминных препаратов, таких как акривастин, азатадин, бромфенирамин, хлорфенирамин, клемастин, ципрогептадин, дексбромфенирамин, дименгидринат, дифенгидрамин, доксиламин, гидроксизин, меклизин, фениндамин, фенилтолоксамин, прометазин, пириламин, трипеленамин, трипролидин, и их комбинации. В некоторых вариантах исполнения по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор могут быть выбраны из неседативных антигистаминных препаратов, таких как астемизол, цетиризин, эбастин, фексофенадин, лоратидин, терфенадин, и их комбинации.
В некоторых вариантах исполнения по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор могут быть выбраны из отхаркивающих средств, таких как хлорид аммония, гвайфенезин, экстракт сока ипекакуаны, иодид калия, и их комбинации. В некоторых вариантах исполнения по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор могут быть выбраны из муколитиков, таких как ацетилцистеин, амброксол, бромгексин, и их комбинации. В некоторых вариантах исполнения по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор могут быть выбраны из анальгетиков, антипиретиков и противовоспалительных препаратов, таких как ацетаминофен, аспирин, диклофенак, дифлунизал, этодолак, фенопрофен, флурбипрофен, ибупрофен, кетопрофен, кеторолак, набуметон, напроксен, пироксикам, кофеин, и их смеси. В некоторых вариантах исполнения по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор могут быть выбраны из местных анестетиков, таких как лидокаин, бензокаин, фенол, диклонин, бензонотат, и их смеси. В некоторых вариантах исполнения по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор могут быть выбраны из средств против заложенности носа и ингредиентов, которые обеспечивают ощущение освобождения носа. В некоторых вариантах исполнения такие средства против заложенности носа могут включать, но не ограничиваются таковыми, фенилпропаноламин, псевдоэфедрин, эфедрин, фенилэфрин, оксиметазолин, и их комбинации. В некоторых вариантах исполнения по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор могут быть выбраны из ингредиентов, которые обеспечивают ощущение освобождения носа, таких как ментол, камфора, борнеол, эфедрин, эвкалиптовое масло, масло мяты перечной, метилсалицилат, борнилацетат, лавандовое масло, экстракты васаби, экстракты хрена, и их комбинации. В некоторых вариантах исполнения ощущение освобождения носа может быть достигнуто с использованием пахучих эфирных масел, экстрактов из деревьев, камедей, цветов и прочих ботанических источников, смол, выделений животных, и синтетических ароматических материалов.
Например, по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор представляет собой парацетамол.
Понятно, что фармацевтическая система доставки может дополнительно содержать добавки, которые обычно используются в таких системах, такие как окрашивающие агенты, отдушки, дезинтегранты, такие как кроскармеллоза натрия, кросповидон или крахмальный гликолят натрия, пирогенный кремнезем, такой как Aerosil®, например, Aerosil® 200 производства фирмы Evonik Industries AG, Германия, и т.д.
Согласно стадии с) данного способа, подготавливают по меньшей мере одну рецептурную вспомогательную добавку.
Выражение «по меньшей мере одна» рецептурная вспомогательная добавка подразумевает, что в стадии с) способа могут быть подготовлены одна или многие рецептурные вспомогательные добавки.
Согласно одному варианту осуществления настоящего изобретения, в стадии с) способа подготавливают только одну рецептурную вспомогательную добавку. Согласно еще одному варианту осуществления настоящего изобретения, в стадии с) способа подготавливают смесь двух или более рецептурных вспомогательных добавок. Например, в стадии с) способа подготавливают смесь двух или трех рецептурных вспомогательных добавок.
В стадии с) способа предпочтительно подготавливают только одну рецептурную вспомогательную добавку.
В одном варианте исполнения по меньшей мере одна рецептурная вспомогательная добавка представляет собой по меньшей мере одно смазочное средство внутренней фазы и/или смазочное средство внешней фазы. Например, по меньшей мере одна рецептурная вспомогательная добавка представляет собой по меньшей мере одно смазочное средство внутренней фазы или смазочное средство внешней фазы, предпочтительно по меньшей мере одно смазочное средство внутренней фазы. В альтернативном варианте, по меньшей мере одна рецептурная вспомогательная добавка представляет собой по меньшей мере одно смазочное средство внутренней фазы и смазочное средство внешней фазы.
Указанное по меньшей мере одно смазочное средство внутренней фазы может быть выбрано из группы, включающей сложные эфиры сорбитана с жирными кислотами и полиоксиэтилированное гидрированное касторовое масло (например, продукт, продаваемый под торговым наименованием CREMOPHOR®), блок-сополимеры этиленоксида и пропиленоксида (например, продукты, продаваемые под торговыми наименованиями PLURONIC® и POLOXAMER), простые эфиры полиоксиэтилена и алифатических спиртов, сложные эфиры полиоксиэтиленсорбитана и жирных кислот, сложные эфиры сорбитана с жирными кислотами и сложные эфиры полиоксиэтилена и стеариновой кислоты, стеариловый спирт, дибегенат глицерина, стеарилфумарат натрия, дистеарат глицерина, и их комбинации. Указанное по меньшей мере одно смазочное средство внутренней фазы предпочтительно представляет собой стеарилфумарат натрия.
Указанное по меньшей мере одно смазочное средство внешней фазы может быть выбрано из группы, включающей лецитин, полиоксиэтиленстеарат, сложные эфиры полиоксиэтиленсорбитана и жирных кислот, соли жирных кислот, сложные эфиры моно- и диацетилвинной кислоты с моно- и диглицеридами пригодных в пищу жирных кислот, сложные эфиры лимонной кислоты с моно- и диглицеридами пригодных в пищу жирных кислот, сложные эфиры сахарозы и жирных кислот, сложные эфиры полиглицерина и жирных кислот, сложные эфиры полиглицерина и взаимоэстерифицированных рициноловых кислот (Е476), стеароиллактилат натрия, стеарат магния и/или кальция, гидрированные растительные масла, стеариновую кислоту, лаурилсульфат натрия, лаурилсульфат магния, коллоидальный кремнезем, тальк, и их комбинации. Указанное по меньшей мере одно смазочное средство внешней фазы предпочтительно представляет собой стеарат магния и/или кальция, более предпочтительно стеарат магния.
В одном варианте исполнения по меньшей мере одну рецептурную вспомогательную добавку подготавливают в общем количестве от около 0,1 вес.% до около 10,0 вес.%, предпочтительно от около 0,3 вес.% до около 5,0 вес.%, более предпочтительно от около 0,5 вес.% до около 2,5 вес.%, в расчете на общий вес фармацевтической системы доставки.
Согласно стадии d) данного способа, смешивают карбонат кальция с реакционно-модифицированной поверхностью из стадии а), по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор из стадии b), и по меньшей мере одну рецептурную вспомогательную добавку из стадии с).
Смешение карбоната кальция с реакционно-модифицированной поверхностью из стадии а) по меньшей мере с одним фармацевтически активным агентом или его фармацевтически неактивным прекурсором из стадии b) и по меньшей мере одной рецептурной вспомогательной добавкой из стадии с) может быть проведено одновременно или по отдельности в любом порядке с образованием смеси.
В одном варианте осуществления настоящего изобретения стадию d) способа проводят таким образом, что карбонат кальция с реакционно-модифицированной поверхностью из стадии а) объединяют одновременно по меньшей мере с одним фармацевтически активным агентом или его фармацевтически неактивным прекурсором из стадии b) и по меньшей мере одной рецептурной вспомогательной добавкой из стадии с). Например, стадию d) способа проводят таким образом, что карбонат кальция с реакционно-модифицированной поверхностью из стадии а) смешивают со смесью, состоящей по меньшей мере из одного фармацевтически активного агента или его фармацевтически неактивного прекурсора из стадии b) и по меньшей мере одной рецептурной вспомогательной добавки из стадии с). Иначе говоря, указанные по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор из стадии b) и по меньшей мере одна рецептурная вспомогательная добавка из стадии с) могут быть предварительно смешаны перед добавлением указанного карбоната кальция с реакционно-модифицированной поверхностью из стадии а).
Стадию d) смешения предпочтительно проводят таким образом, что по меньшей мере один фармацевтически активный агент или его фармацевтически неактивный прекурсор из стадии b) и по меньшей мере одну рецептурную вспомогательную добавку из стадии с) добавляют независимо друг от друга к карбонату кальция с реакционно-модифицированной поверхностью из стадии а).
Для целей настоящего изобретения может быть использовано любое пригодное известное в технологии смесительное устройство. Однако стадия d) смешения предпочтительно проводится в смесителе и/или блендере, предпочтительно в смесителе, таком как барабанный смеситель.
Предпочтительно, чтобы смесь, полученная в стадии d) способа, не содержала агломератов. Таким образом, полученную в стадии d) способа смесь предпочтительно просеивают, например, через сито с размером ячеек 1000 мкм, перед проведением стадии е) способа.
Согласно стадии е) данного способа, полученную в стадии d) способа смесь уплотняют с помощью роликового уплотнителя при давлении прессования в диапазоне от 4 до 20 бар.
Термин «уплотнение прокаткой» имеет отношение к процессу, в котором тонкие порошки сдавливают между двумя вращающимися в противоположные стороны валиками и спрессовывают с образованием твердой формовки или ленты.
Для целей настоящего изобретения уплотнение прокаткой может быть проведено с помощью любого роликового уплотнителя, известного квалифицированному специалисту. Например, уплотнение прокаткой проводят на роликовом уплотнителе Fitzpatrick® Chilsonator IR220 производства фирмы Fitzpatrick Company, США.
Одним необходимым условием данного способа является то, что стадию е) способа проводят при давлении прессования в диапазоне в диапазоне от 4 до 20 бар. Стадию е) уплотнение прокаткой предпочтительно проводят при давлении уплотнения прокаткой в диапазоне от 4 до 15 бар, более предпочтительно S диапазоне от 4 до 10 бар, и наиболее предпочтительно в диапазоне от 4 до 7 бар.
Дополнительно или альтернативно, скорость подачи и/или скорость вращения роликов во время стадии е) уплотнения прокаткой регулируют так, что получается лента с толщиной от 0,4 до 0,8 мм, предпочтительно от 0,5 до 0,7 мм, и наиболее предпочтительно около 0,6 мм. Например, скорость подачи или скорость вращения роликов во время стадии е) уплотнения прокаткой регулируют так, что получается лента с толщиной от 0,4 до 0,8 мм, предпочтительно от 0,5 до 0,7 мм, и наиболее предпочтительно около 0,6 мм. В альтернативном варианте, скорость подачи и скорость вращения роликов во время стадии е) уплотнения прокаткой регулируют так, что получается лента с толщиной от 0,4 до 0,8 мм, предпочтительно от 0,5 до 0,7 мм, и наиболее предпочтительно около 0,6 мм.
Согласно стадии f) данного способа, подвергнутую уплотнению прокаткой смесь, полученную в стадии е), спрессовывают для получения фармацевтической системы доставки.
Прессование может быть проведено с использованием любого стандартного уплотнителя, известного квалифицированному специалисту. Например, прессование проводят с использованием таблетировочного пресса, такого как таблетировочный пресс Styl'One 105 ml от фирмы Medel'Pharm, Франция.
Стадия f) прессования предпочтительно представляет собой стадию гранулирования или стадию таблетирования.
Термин «гранулирование» в смысле настоящего изобретения подразумевает процесс прессования или формования материала в форму гранулы. Термин «таблетирование» в смысле настоящего изобретения подразумевает процесс прессования или формования материала в форму таблетки.
Предпочтительно, чтобы стадия f) способа проводилась при давлении прессования в диапазоне от 5 до 500 МПа. Следует отметить, что давление прессования, применяемое в стадии f), зависит от специфики по меньшей мере одного фармацевтически активного агента или его фармацевтически неактивного прекурсора, подготовленного в стадии b). Тем самым квалифицированный специалист будет соответственно корректировать давление прессования. Стадию f) прессования предпочтительно проводят при давлении прессования в диапазоне от 6 до 400 МПа, и наиболее предпочтительно в диапазоне от 10 до 400 МПа. Например, стадию f) прессования предпочтительно проводят при давлении прессования в диапазоне от 50 до 300 МПа, и наиболее предпочтительно в диапазоне от 50 до 200 МПа, или от 100 до 200 МПа.
В одном варианте исполнения уплотненную прокаткой смесь, полученную в стадии е) уплотнения прокаткой, подвергают обработке в стадии размалывания перед проведением стадии f) прессования.
Размалывание может быть проведено с использованием любой традиционной мельницы, известной квалифицированному специалисту. Например, размалывание проводят на мельнице FitzMill® производства фирмы Fitzpatrick Company, США.
Дополнительно или альтернативно, уплотненную прокаткой смесь, полученную в стадии е) уплотнения прокаткой, подвергают обработке в стадии просеивания перед проведением стадии f) прессования.
Если способ включает размалывание и просеивание смеси, полученной в стадии е) уплотнения прокаткой, указанную смесь предпочтительно сначала подвергают обработке в стадии размалывания, с последующей стадией просеивания перед проведением стадии f) прессования. Другими словами, обработке в стадии f) прессования подвергают материал, полученный просеиванием.
Просеивание может быть проведено с использованием любого традиционного просеивающего устройства, известного квалифицированному специалисту. Например, просеивание проводят с использованием вибрационной ситчатой колонны производства фирмы Vibro Retsch, Швейцария.
Чтобы получить прочную фармацевтическую систему доставки, уплотненная прокаткой смесь, подвергнутая обработке в стадии f) прессования, предпочтительно имеет заданную стабильность. Указанную стабильность предпочтительно определяют в испытании на стабильность.
Стабильность уплотненной прокаткой смеси, подвергнутой прессованию в стадии f), предпочтительно определяют по остаточной фракции уплотненной прокаткой смеси. Уплотненная прокаткой смесь, подвергнутая прессованию в стадии f), предпочтительно имеет остаточную фракцию по меньшей мере 60 вес.% после просеивания уплотненной прокаткой смеси на сите, имеющем ячейки с размером 500 мкм, причем остаточная фракция рассчитывается по Формуле (III)

в которой mtot представляет общую массу (г), первоначально помещенную на сито, и mres представляет оставшееся на сите количество (г) после встряхивания в течение 10 минут.
В одном варианте осуществления настоящего изобретения благоприятные фармацевтические системы доставки получают, если уплотненная прокаткой смесь, подвергнутая прессованию в стадии f), имеет заданное распределение зерен по размеру. Так, предпочтительно, чтобы уплотненная прокаткой смесь, подвергнутая прессованию в стадии f), имела зерна с размером в диапазоне от 180 до 710 мкм, полученные просеиванием через сита с различной величиной ячеек, предпочтительно просеиванием через сита с величиной ячеек в порядке 180 мкм, 250 мкм, 355 мкм, 500 мкм и 710 мкм. Более предпочтительным является просеивание с величиной ячеек в порядке 180 мкм, 250 мкм, 355 мкм, 500 мкм и 710 мкм, и объединение просеянной уплотненной прокаткой смеси так, что исключаются зерна с размерами менее 180 мкм и свыше 710 мкм.
Таким образом, способ получения фармацевтической системы доставки предпочтительно предусматривает, что стабильную уплотненную прокаткой смесь, имеющую остаточную фракцию по меньшей мере 60% после просеивания уплотненной прокаткой смеси на сите, имеющем ячейки с размером 500 мкм, как описано выше, подвергают размалыванию и просеиванию так, что полученная уплотненная прокаткой смесь имеет зерна с размером от 180 до 710 мкм, полученные просеиванием на ситах с различной величиной ячеек. В этом случае уплотненную прокаткой смесь, полученную в стадии е), предпочтительно сначала подвергают испытанию на стабильность, как описано выше, с последующим размалыванием и просеиванием стабильной уплотненной прокаткой смеси так, что уплотненная прокаткой смесь имеет зерна с размером от 180 до 710 мкм, полученные просеиванием на ситах с различной величиной ячеек, перед тем, как проводится стадия f) прессования. Иначе говоря, прессованию в стадии f) подвергают материал, полученный таким просеиванием, что уплотненная прокаткой смесь имеет зерна с размером от 180 до 710 мкм, полученные просеиванием на ситах с различной величиной ячеек.
Полученная фармацевтическая система доставки может представлять собой таблетку, минитаблетку, капсулу или гранулу.
Таким образом, фармацевтическая система доставки может быть изготовлена в широком диапазоне размеров, причем фракции с различными размерами могут быть разделены стандартным путем, таким как просеивание.
Как правило, фармацевтическая система доставки может иметь средневзвешенный размер частиц от 0,1 до 20,0 мм, предпочтительно от 0,2 до 15,0 мм, и более предпочтительно от 0,3 до 10,0 мм.
Фармацевтическая система доставки, полученная способом согласно настоящему изобретению, оказалась имеющей низкую хрупкость. Фармацевтическая система доставки предпочтительно имеет хрупкость ≤1,10%, измеренную согласно Ph.Eur.4 на таблетках, спрессованных под давлением 100 МПа. Более предпочтительно, фармацевтическая система доставки имеет хрупкость ≤1,0%, еще более предпочтительно ≤0,8%, и наиболее предпочтительно ≤0,6%, такую как от 0,4 до 0,6%, по измерению согласно Ph.Eur.4 на таблетках, спрессованных под давлением 100 МПа.
Дополнительно или альтернативно, фармацевтическая система доставки удовлетворяет формуле (I)
(FRRCPh)/(FRRCPl)≥1,2 (I)
в которой
(FRRCPh) представляет хрупкость (в %), измеренную согласно Ph.Eur.4, фармацевтической системы доставки RCPh, в которой давление прессования в стадии е) составляет по меньшей мере 15 бар;
(FRRCPl) представляет хрупкость (в %), измеренную согласно Ph.Eur.4, фармацевтической системы доставки RCPl, в которой давление прессования в стадии е) является меньшим, чем давление прессования, использованное для получения фармацевтической системы доставки RCPh.
Фармацевтическая система доставки предпочтительно удовлетворяет формуле (Iа), более предпочтительно (Ib), и наиболее предпочтительно (Iс)
(FRRCPh)/(FRRCPl)≥1,5 (Iа)
(FRRCPh)/(FRRCPl)≥1,7 (Ib)
2,5≥(FRRCPh)/(FRRCPl)≥1,7 (Ic)
в которых
(FRRCPh) представляет хрупкость (в %), измеренную согласно Ph.Eur.4, фармацевтической системы доставки RCPh, в которой давление прессования в стадии е) составляет по меньшей мере 15 бар;
(FRRCPl) представляет хрупкость (в %), измеренную согласно Ph.Eur.4, фармацевтической системы доставки RCPl, в которой давление прессования в стадии е) является меньшим, чем давление прессования, использованное для получения фармацевтической системы доставки RCPh.
Дополнительно или альтернативно, фармацевтическая система доставки, полученная способом согласно настоящему изобретению, оказалась имеющей высокую сыпучесть. Фармацевтическая система доставки предпочтительно удовлетворяет формуле (II)
(FLRCP)/(FLreference)≥1,1 (II)
в которой
(FLRCP) представляет сыпучесть (в г/с), измеренную согласно Ph.Eur.4 на отверстии с диаметром 7 мм, фармацевтической системы доставки;
(FLreference) представляет сыпучесть (в г/с), измеренную согласно Ph.Eur.4 на отверстии с диаметром 7 мм, такой же фармацевтической системы доставки, в которой карбонат кальция с реакционно-модифицированной поверхностью заменен микрокристаллической целлюлозой.
Фармацевтическая система доставки предпочтительно удовлетворяет формуле (IIа), более предпочтительно (IIb), и наиболее предпочтительно (IIс)
2,0≥(FLRCP)/(FLreference)≥1,1 (IIa)
1,8≥(FLRCP)/(FLreference)≥1,1 (IIb)
1,5≥(FLRCP)/(FLreference)≥1,1 (IIc)
в которых
(FLRCP) представляет сыпучесть (в г/с), измеренную согласно Ph.Eur.4 на отверстии с диаметром 7 мм, фармацевтической системы доставки;
(FLreference) представляет сыпучесть (в г/с), измеренную согласно Ph.Eur.4 на отверстии с диаметром 7 мм, такой же фармацевтической системы доставки, в которой карбонат кальция с реакционно-модифицированной поверхностью заменен микрокристаллической целлюлозой.
Ввиду хороших полученных результатов, настоящее изобретение в еще одном аспекте относится к фармацевтической системе доставки, предпочтительно таблетке, минитаблетке, капсуле или грануле, полученным этим способом.
Еще один аспект относится к применению карбоната кальция с реакционно-модифицированной поверхностью для улучшения хрупкости фармацевтической системы доставки, причем карбонат кальция с реакционно-модифицированной поверхностью представляет собой продукт реакции природного размолотого или осажденного карбоната кальция с диоксидом углерода и одной или более кислотами в водной среде, причем диоксид углерода образуется in-situ при кислотной обработке и/или подается от внешнего источника, причем фармацевтическая система доставки
а) имеет хрупкость ≤1,10%, измеренную согласно Европейской фармакопее Ph.Eur.4 на таблетках, спрессованных под давлением 100 МПа; и/или
b) удовлетворяет Формуле (I)
(FRRCPh)/(FRRCPl)≥1,2 (I)
в которой
(FRRCPh) представляет хрупкость (в %), измеренную согласно Ph.Eur.4, фармацевтической системы доставки RCPh, в которой давление прессования в стадии е) составляет по меньшей мере 15 бар;
(FRRCPl) представляет хрупкость (в %), измеренную согласно Ph.Eur.4, фармацевтической системы доставки RCPl, в которой давление прессования в стадии е) является меньшим, чем давление прессования, использованное для получения фармацевтической системы доставки RCPh.
В отношении определения карбоната кальция с реакционно-модифицированной поверхностью, фармацевтической системы доставки и предпочтительных вариантов ее исполнения, дается ссылка на приведенные выше формулировки, когда обсуждаются технические подробности карбоната кальция с реакционно-модифицированной поверхностью и фармацевтической системы доставки согласно настоящему изобретению.
В одном варианте исполнения фармацевтическая система доставки имеет хрупкость ≤1,0%, еще более предпочтительно ≤0,8%, и наиболее предпочтительно ≤0,6%, такую как от 0,4 до 0,6%, по измерению согласно Ph.Eur.4 на таблетках, спрессованных под давлением 100 МПа.
Дополнительно или альтернативно, фармацевтическая система доставки удовлетворяет формуле (Iа), более предпочтительно (Ib), и наиболее предпочтительно (Iс)
(FRRCPh)/(FRRCPl)≥1,5 (Iа)
(FRRCPh)/(FRRCPl)≥1,7 (Ib)
2,5≥(FRRCPh)/(FRRCPl)≥1,7 (Ic)
в которых
(FRRCPh) представляет хрупкость (в %), измеренную согласно Ph.Eur.4, фармацевтической системы доставки RCPh, в которой давление прессования в стадии е) составляет по меньшей мере 15 бар;
(FRRCPl) представляет хрупкость (в %), измеренную согласно Ph.Eur.4, фармацевтической системы доставки RCPl, в которой давление прессования в стадии е) является меньшим, чем давление прессования, использованное для получения фармацевтической системы доставки RCPh.
Дополнительный аспект настоящего изобретения относится к применению карбоната кальция с реакционно-модифицированной поверхностью для улучшения сыпучести фармацевтической системы доставки, причем карбонат кальция с реакционно-модифицированной поверхностью представляет собой продукт реакции природного размолотого или осажденного карбоната кальция с диоксидом углерода и одной или более кислотами в водной среде, причем диоксид углерода образуется in-situ при кислотной обработке и/или подается от внешнего источника, причем фармацевтическая система доставки удовлетворяет формуле (II)
(FLRCP)/(FLreference)≥1,1 (II)
в которой
(FLRCP) представляет сыпучесть (в г/с), измеренную согласно Ph.Eur.4 на отверстии с диаметром 7 мм, фармацевтической системы доставки;
(FLreference) представляет сыпучесть (в г/с), измеренную согласно Ph.Eur.4 на отверстии с диаметром 7 мм, такой же фармацевтической системы доставки, в которой карбонат кальция с реакционно-модифицированной поверхностью заменен микрокристаллической целлюлозой
В отношении определения карбоната кальция с реакционно-модифицированной поверхностью, фармацевтической системы доставки и предпочтительных вариантов ее исполнения, дается ссылка на приведенные выше формулировки, когда обсуждаются технические подробности карбоната кальция с реакционно-модифицированной поверхностью и фармацевтической системы доставки согласно настоящему изобретению.
В одном варианте осуществления настоящего изобретения фармацевтическая система удовлетворяет формуле (IIа), более предпочтительно (IIb), и наиболее предпочтительно (IIс)
2,0≥(FLRCP)/(FLreference)≥1,1 (IIa)
1,8≥(FLRCP)/(FLreference)≥1,1 (IIb)
1,5≥(FLRCP)/(FLreference)≥1,1 (IIc)
в которых
(FLRCP) представляет сыпучесть (в г/с), измеренную согласно Ph.Eur.4 на отверстии с диаметром 7 мм, фармацевтической системы доставки;
(FLreference) представляет сыпучесть (в г/с), измеренную согласно Ph.Eur.4 на отверстии с диаметром 7 мм, такой же фармацевтической системы доставки, в которой карбонат кальция с реакционно-модифицированной поверхностью заменен микрокристаллической целлюлозой.
Краткое описание фигур
Фиг. 1: прочность на растяжение таблеточных композиций на основе функционализированного карбоната кальция (FCC) в зависимости от давления прессования. Таблетки, содержащие переменные количества парацетамола (Р), были изготовлены с использованием FCC-порошка (пунктирные линии) или FCC-гранул, полученных уплотнением прокаткой при давлении 5 бар (штрих-пунктирная линия и темный символ) или 20 бар (черная сплошная линия). Все гранулы содержали 1 вес.% стеарилфумарата натрия. Значения представляют средние величины±стандартное отклонение (SD) из n=3 экспериментов.
Фиг. 2: прессование гранул, содержащих смеси парацетамола (Р) и FCC или Avicel. Сравнение прочности на растяжение таблеток в зависимости от давления прессования. Все композиции были гранулированы при давлении 20 бар и содержали 1 вес.% стеарилфумарата натрия. Значения представляют средние величины±стандартное отклонение из n=3 экспериментов.
Фиг. 3: пористость FCC после прессования. Сравнение спрессованного FCC-порошка (P-FCC) или FCC-гранул (G-FCC). G-FCC был гранулирован при давлении 5 бар. Для анализа распределения пор по размерам в FCC использовали ртутную порометрию при повышении давлений прессования. Значения представляют средние величины из n=2 измерений.
Нижеследующие примеры и испытания будут иллюстрировать настоящее изобретение, но не предполагаются ограничивающими изобретение никоим образом.
Примеры
Материалы и методы
1.1 Материалы
Функционализированный карбонат кальция (FCC), (фирмы Omya International AG, Швейцария) сравнивали с микрокристаллической целлюлозой (Avicel® PH 102, фирмы FMC BioPolymer, Ирландия). Дополнительные подробности в отношении функционализированного карбоната кальция обобщены в нижеследующей таблице 1:
Таблица 1:
В качестве фармацевтически активного агента был выбран парацетамол (ацетаминофен USP/парацетамол (ЕФ), порошок, фирмы Mallinckrodt, США).
Стеарилфумарат натрия (SSF, LubriSanaq®, фирмы Pharmatrans Sanaq AG, Швейцария) использовали в качестве смазочного средства внутренней фазы во время уплотнения прокаткой, тогда как стеарат магния (MgSt, фирмы Sandoz, Швейцария) применяли в качестве смазочного средства внешней фазы во время таблетирования.
Ртуть (фирмы Sigma-Aldrich, Германия) использовали для измерений ртутной интрузионной порометрией под давлением в качестве несмачивающей жидкости.
1.2 Методы
1.2.1 Уплотнение прокаткой и размалывание
Перед уплотнением прокаткой каждый порошок просеяли через сито с ячейками величиной 1000 мкм для разрушения агломератов. Формообразующие наполнители смешали с парацетамолом для получения величин относительного содержания парацетамола 24,75% (вес/вес), 49,50% (вес/вес), 74,25% (вес/вес), и 99% (вес/вес). В дополнение, приготовили контрольные композиции без парацетамола. В целях сравнения все композиции содержали 1 вес.% стеарилфумарата натрия в качестве внутреннего смазочного средства. Порошки смешивали в течение 10 минут в барабанном смесителе (Turbula T2C, фирмы Willy A. Bachofen AG, Швейцария) при скорости вращения 32 об/мин. Гранулирование выполняли с использованием роликового уплотнителя Fitzpatrick® Chilsonator IR220 (фирмы The Fitzpatrick Company, США). Давление регулировали либо на 5 бар, либо на 20 бар. Скорость подачи и скорость вращения роликов регулировали для получения ленты толщиной 0,6 мм. После уплотнения прокаткой ленту размалывали с использованием мельницы FitzMill® L1A (фирмы The Fitzpatrick Company, США) при скорости вращения 500 об/мин.
1.2.2 Просеивание
Выполняли просеивание. Для каждой композиции 10 г соответствующей ленты поместили на сито с величиной ячеек 500 мкм. Сито встряхивали в течение 10 минут с помощью вибрационной ситчатой колонны (Vibro Retsch, Швейцария) при амплитуде смещений при встряхивании на 1,5 мм. Остаточную фракцию (RF) рассчитывали с помощью следующего уравнения:
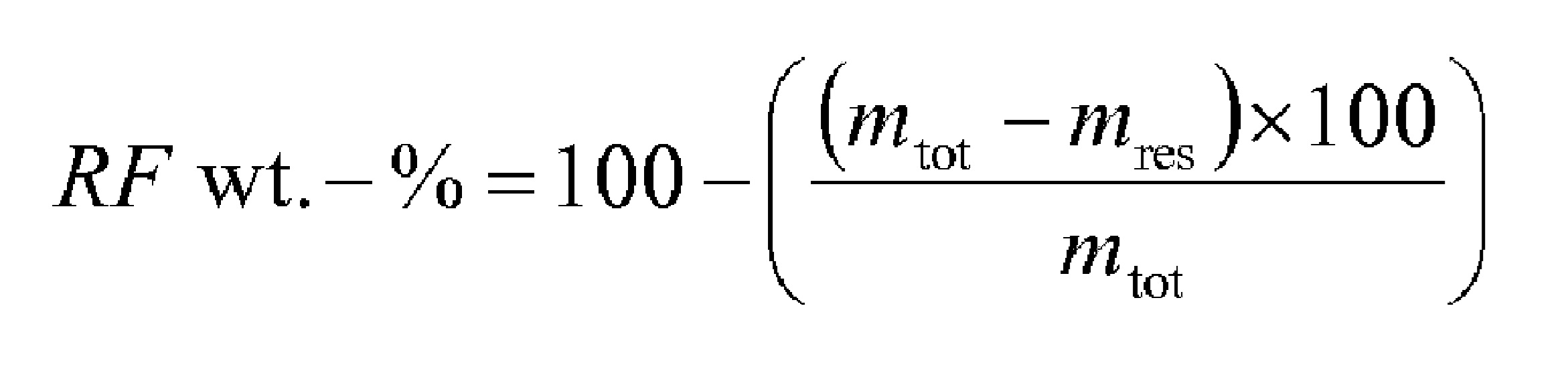
где mtotпредставляет общую массу (г), первоначально помещенную на сито, и mresпредставляет оставшееся на сите количество (г) после встряхивания в течение 10 минут.
Композиции с остаточной фракцией свыше 60% рассматривались как достаточно прочные для процесса таблетирования.
1.2.3 Анализ гранул
Для определения тонкодисперсной фракции, полученной в процессе уплотнения прокаткой, собрали продукт процесса уплотнения прокаткой (ленты, включающие мелкие фракции), взвесили (mtot) и просеяли через сито с ячейками величиной 180 мкм. Просеивание проводили так, что соответствующий продукт, полученный из процесса уплотнения прокаткой, помещали на сито с ячейками величиной 180 мкм. Сито встряхивали в течение 10 минут с помощью вибрационной ситчатой колонны (Vibro Retsch, Швейцария) при амплитуде смещений при встряхивании на 1,5 мм.
Анализ гранулометрического состава выполняли с использованием вибрационной ситчатой колонны (Vibro Retsch, Швейцария). Ситчатую колонну встряхивали в течение 10 минут при амплитуде смещений при встряхивании на 1,5 мм. Использовали сита из стальной проволоки (Vibro Retsch, 200×25 мм, Германия) с размерами ячеек в порядке 180 мкм, 250 мкм, 355 мкм, 500 мкм, и 710 мкм. Взвешивали количество порошка, остающегося на каждом сите. Гранулы с размером менее 180 мкм и свыше 710 мкм отбрасывали.
Высокодисперсную фракцию (FF) рассчитывали с помощью следующего уравнения:
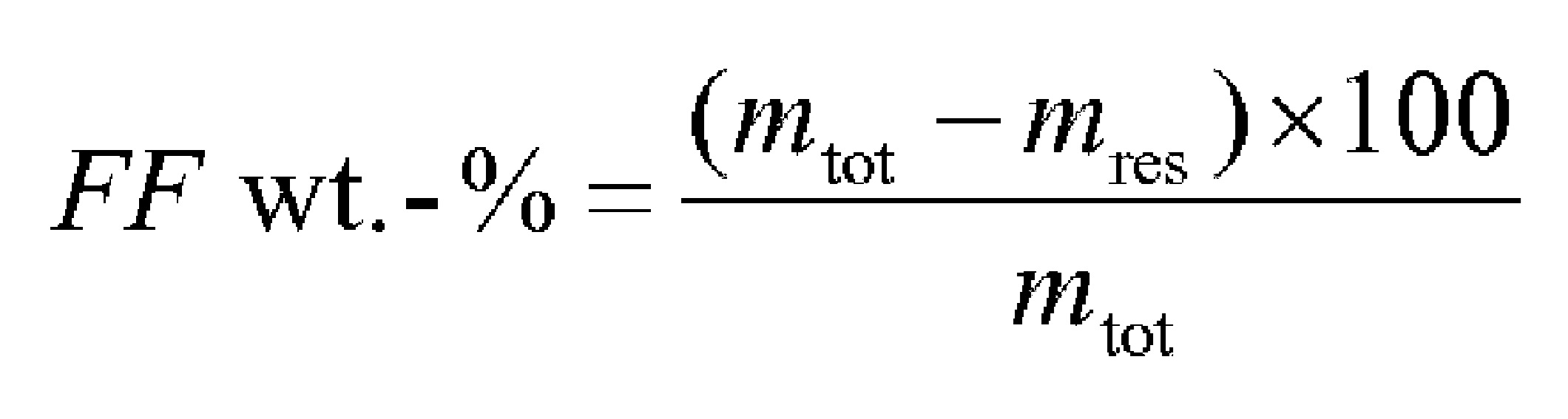
где mtotпредставляет общую массу (г), первоначально помещенную на сито, и mresпредставляет оставшееся на сите количество (г) после встряхивания в течение 10 минут.
Фракцию гранул с размером от 180 мкм до 710 мкм объединили и подвергли следующим испытаниям:
Сыпучесть, а также объемную плотность и насыпную плотность после уплотнения измеряли для выбранных гранулированных фракций согласно Ph Eur (European Pharmacopeia (Европейская Фармакопея), 7-ое издание, Страсбург (Франция): Council of Europe; 2011). Для измерения сыпучести использовали весы Mettler PM460 (фирмы Mettler Toledo, Швейцария). Были выбраны три различных отверстия (5 мм, 7 мм, и 9 мм).
Объемную плотность и насыпную плотность после уплотнения измеряли с использованием волюметра STAV 2003 (фирмы J. Engelsmann, Германия).
Отношение Хауснера (насыпная плотность после уплотнения/объемная плотность) рассчитывали согласно Ph Eur (European Pharmacopeia, 7-ое издание, Страсбург (Франция): Council of Europe; 2011).
1.2.4 Изготовление таблеток
Для изготовления таблеток использовали все гранулы с размером между 180 мкм и 710 мкм. Гранулы высушивали в течение ночи (12-15 часов) в потоке азота в вакуумной сушильной камере типа KVTS 11 (фирмы Salvis, Швейцария) перед тем, как смешали их в барабанном смесителе (Turbula T2C, фирмы Willy A. Bachofen AG, Швейцария) в течение 10 минут при скорости вращения 32 об/мин. Гранулы подвергли прессованию с помощью 10 мм круглого, плоского инструмента, с использованием таблетировочного пресса Styl'One 105 ml (фирмы Medel'Pharm, Франция). Таблетировочный пресс был оснащен пакетом программ Analis, версия 2.01 (фирмы Medel'Pharm, Франция). Во время прессования объем таблетки поддерживался постоянным при наименьшем давлении прессования вследствие весьма переменных уровней пористости сырьевых материалов. Зазор пуансонов регулировали для каждой композиции для получения таблетки с высотой 6 мм при давлении прессования 6,37 МПа (0,50 кH). Зазор пуансонов поддерживали постоянным в пределах всего диапазона давлений прессования для каждой композиции. Композиции подвергали прессованию в трех повторениях при 10 различных давлениях прессования, варьирующих от 6 МПа до 500 МПа. Если ниже 500 МПа происходило расплющивание, дальнейшее повышение давления прессования прекращали. Пуансоны и матрицу смазывали вручную стеаратом магния. Таблетки спрессовывали при минимально возможном времени задержки настройкой нижнего пуансона на подъем и опускание на 750 мсек и фазы «выдерживания» на 0 мсек.
Температура и относительная влажность во время изготовления таблеток и анализа составляли между 22,3°С и 25,9°С, и 28,5% и 50,0%, соответственно.
1.2.5 Анализ таблеток (вес, размеры, высота, усилие раздавливания, прочность при растяжении, и хрупкость)
Вес, размеры, высоту и усилие раздавливания таблеток измеряли в трех повторениях непосредственно после прессования таблеток. Вес определяли с использованием весов Delta Range AX204 (фирмы Mettler Toledo, Швейцария). Диаметр и высоту измеряли микрометрическим винтом типа CD-15CPX (фирмы Mitutoyo, Япония). Усилия раздавливания ниже 400 Н измеряли с использованием тестера твердости таблеток (8M, фирмы Dr. Schleuniger Pharmatron, Швейцария) при скорости удара 1 мм/сек. Более твердые таблетки (>400 Н) испытывали с использованием таблетировочного пресса Styl'One 105 ml (фирмы Medel'Pharm, Франция), как описано авторами Stirnimann T, и др., Compaction of functionalized calcium carbonate, a porous and crystalline microparticulate material with a lamellar surface. International Journal of Pharmaceutics. 15 мая 2014; том 466 (№№ l-2): стр. 266-275.
Прочность при растяжении рассчитывали по следующему уравнению:
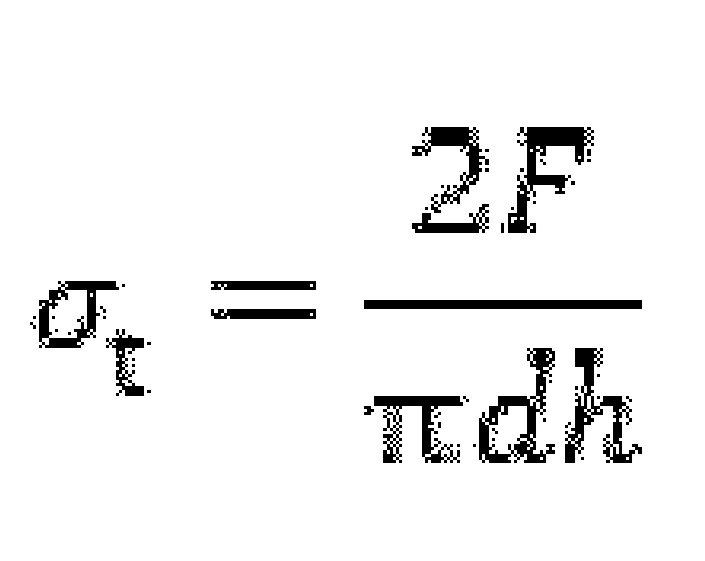
где σt представляет радиальную прочность при растяжении (МПа), F представляет усилие раздавливания (Н), d представляет диаметр таблетки (мм) и h представляет высоту таблетки (мм).
Хрупкость таблеток, спрессованных при давлении 100 МПа, измеряли с помощью барабана (фирмы Erweka, Германия) согласно Ph Eur (European Pharmacopeia, 7-ое издание, Страсбург (Франция): Council of Europe; 2011).
1.2.6 Уравнение Хекеля и модифицированное уравнение Хекеля
С помощью пакета программ OriginPro, версия 8.5 (фирмы OriginLab Corporation, США), выражение Хекеля (смотри также работы Heckel R.W., Density-pressure relationships in powder compaction. Trans Metall Soc AIME. 1961; 221: стр.671-675, и Heckel R. W., An analysis of powder compaction phenomena. Trans Metall Soc AIME. 1961; 221: стр. 1001-1008) адаптировали согласно следующему уравнению:

где ρ представляет плотность таблетки (г/см3), k представляет параметр Хекеля (МПа-1), σ представляет давление прессования (МПа), и A является константой. Для анализа Хекеля рассматривали 4 точки измерения между 50 МПа и 200 МПа.
Плотность (ρ) рассчитывали согласно следующему уравнению:
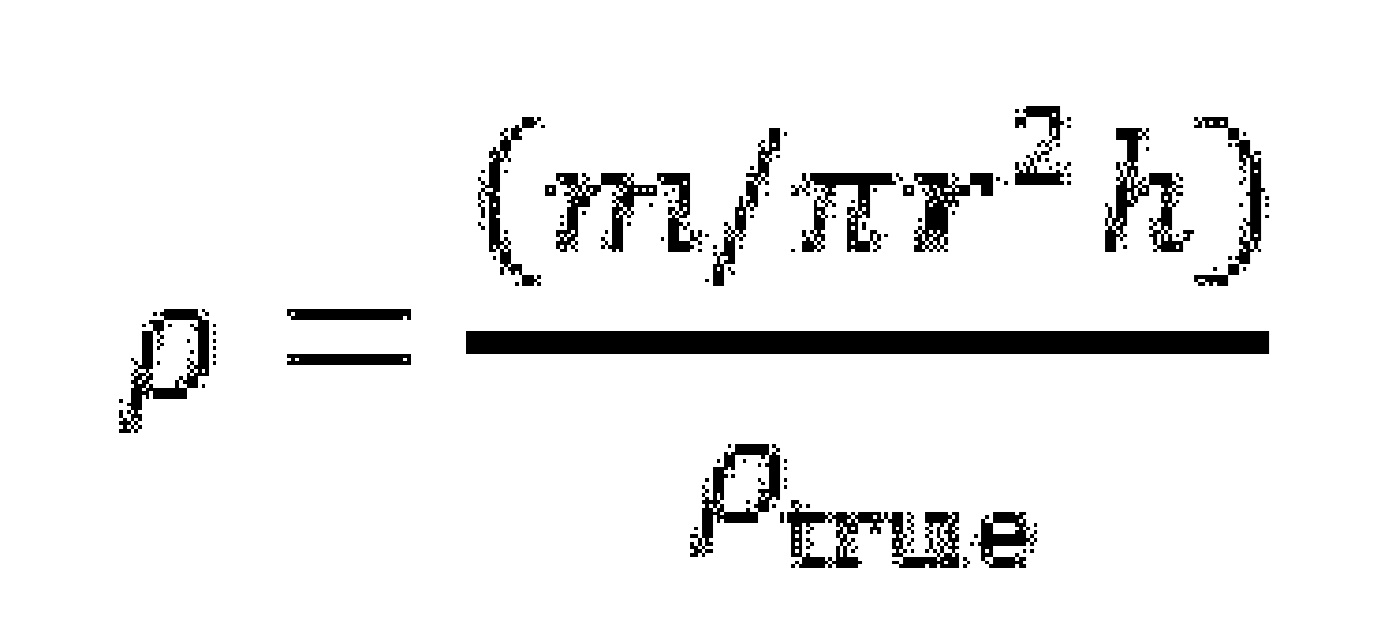
где m представляет массу таблетки (г), r представляет радиус таблетки (см), h представляет высоту таблетки (см), и ρtrue представляет истинную плотность образующего каркас вещества внутри пористой таблетки (г/см3).
Средний предел текучести (σy, МПа) рассчитывали по следующему уравнению:
где k представляет параметр Хекеля (МПа-1).
Модифицированное уравнение Хекеля (смотри также работу авторов M. Kuentz и др., Pressure susceptibility of polymer tablets as a critical property: A modified Heckel equation. Journal of Pharmaceutical Sciences. 1999; 88 (2): стр. 174-179) адаптировали согласно следующему уравнению:

где σ представляет давление прессования (МПа), C является константой (МПа-1), ρrc представляет относительную критическую плотность, и ρ представляет относительную плотность таблетки. Для модифицированного анализа по Хекелю рассматривали 6 точек измерения между 5 МПа и 200 МПа.
1.2.7 Распределение пор по размерам в таблетках
Для измерения распределения пор по размерам приготовили таблетки, как описано в разделе 1.2.4. Анализ выполняли с использованием ртутного порометра Auto Pore IV 9500 (фирмы Micromeritics, США). Интрузия ртути при низком давлении и высоком давлении варьировала от 3,59 кПа до 206,64 кПа и от 206,78 кПа до 206,78 МПа, соответственно. Время установления равновесия было настроено на 10 сек по всему диапазону давлений.
Результаты и обсуждение
2.1 Просеивание
Для таблетирования гранулы предпочтительно должны проявлять определенную жесткость для последующей обработки. Тонкодисперсная фракция (<500 мкм) создает возможность придания жесткости ленте. Просеивание 18 композиций дало 10 представляющих интерес композиций, поскольку все они проявляли остаточную фракцию (>500 мкм) в количестве свыше 60% (вес/вес). Это значит, что только 40% твердого вещества (в форме ленты) разрушаются с образованием тонкодисперсных фракций с размером менее 500 мкм после встряхивания в течение 10 минут.
FCC со стеарилфумаратом натрия (SSF) показывали очень высокую остаточную фракцию (приблизительно 90%) во время уплотнения прокаткой, независимо от прилагаемого роликами давления (значение для остаточной фракции в случае гранул, полученных при давлении 20 бар, находится в пределах стандартного отклонения от значения для 5 бар). Этот результат показал, что жесткие ленты, изготовленные из FCC, могли бы быть уплотнены прокаткой даже при низких давлениях (5 бар). В общем, обнаруживались более высокие количества остаточных фракций; таким образом, более жесткие ленты для порошковых смесей, которые были уплотнены прокаткой при более высоком давлении (20 бар). Этот эффект был более выраженным для смесей, содержащих микрокристаллическую целлюлозу Avicel. Avicel в смесях с SSF, обработанных при давлении 5 бар давления роликов, проявлял только 10% (вес/вес) остаточной фракции, что является показателем очень хрупкой ленты. Тем самым предполагается, что, в отличие от FCC, давление в 5 бар было недостаточным для Avicel, чтобы сформировать достаточное число связей между частицами. При давлении 20 бар смесь Avicel и SSF-порошка не входила в область прессования и приводила к сбою внутри зоны подачи роликового уплотнителя.
2.2 Свойства гранул
Таблица 2 показывает тонкодисперсные фракции во время уплотнения прокаткой для полученных композиций. Можно сделать выводы, что FCC-смеси проявляли 50%-ное сокращение тонкодисперсной фракции после повышения давления прессования во время уплотнения прокаткой от 5 бар до 20 бар. Сравнимо с микрокристаллической целлюлозой согласно прототипу (Avicel), более высокие тонкодисперсные фракции наблюдались для FCC в результате увеличения количества парацетамола в смесях. Однако тонкодисперсная фракция при 74,25%-ном содержании лекарственного препарата была гораздо меньшей, чем наблюдалось для прототипной микрокристаллической целлюлозы (Avicel).
Применением уплотнения прокаткой FCC было возможным значительное повышение сыпучести FCC. Что касается сыпучести, таблица 1 показывает, что при одинаковом содержании лекарственного препарата и одинаковом давлении прессования во время уплотнения прокаткой FCC-смеси всегда были прочнее, чем смеси согласно прототипу (включающие Avicel).
Таблица 2 дополнительно показывает, что уплотненные при давлении 5 бар гранулы проявляли более низкие плотности по сравнению с давлением 20 бар вследствие более рыхлой упаковки, обусловленной более низким приложенным давлением во время уплотнения прокаткой. Как правило, плотности FCC-смесей всегда были более высокими сравнительно с Avicel-смесями).
Отношение Хауснера составляет величину между 1,04 и 1,11 для всех смесей, чем подразумевается, что укрупнение во время уплотнения было минимальным. Следует отметить, что отношение Хауснера становилось меньшим с возрастанием количества парацетамола. Возможной причиной является структура и гладкая текстура поверхности парацетамола, которая не позволяет перегруппировку после начальной упаковки. Тонкие слои FCC и волокна Avicel могут взаимно сцепляться и предотвращать формирование более плотной упаковки частиц. Чем выше количество парацетамола в композиции, тем слабее эффекты взаимного сцепления Avicel и FCC, снижая тем самым отношение Хауснера.
2.3 Свойства таблеток
Таблица 2 показывает веса полученных таблеток для различных композиций. Гранулы, уплотненные прокаткой при давлении 5 бар, образовывали более легкие таблетки, чем гранулы при давлении 20 бар, вследствие меньшего уплотнения во время уплотнения прокаткой. Среди смесей с парацетамолом, обработанных при давлении 20 бар, смеси FCC с парацетамолом образовывали более тяжелые таблетки, по сравнению со смесями Avicel и парацетамола при таком же соотношении лекарственного препарата и формообразующего наполнителя, вследствие более высокой объемной плотности FCC (около 0,64 г/см3), сравнительно с микрокристаллической целлюлозой Avicel согласно прототипу (около 0,57 г/см3).
Таблица 2 также показывает, что хрупкость таблеток была значительно более низкой для смесей FCC и парацетамола, чем для смесей Avicel с парацетамолом. Среди композиций с микрокристаллической целлюлозой Avicel хрупкость удалось измерить только для таблеток с 49,50%-ным содержанием лекарственного препарата. Как предполагается, упругие свойства парацетамола могли бы не компенсироваться целлюлозой Avicel, и в результате таблетки не проявляли достаточной физической прочности, чтобы пройти испытание на хрупкость.
Значение хрупкости для FCC со смесями стеарилфумарата натрия (независимо от давления, приложенного во время уплотнения прокаткой), и FCC в комбинации с низким содержанием лекарственного препарата (уплотненного прокаткой при давлении 5 бар), составляло ниже 1%. Кроме того, FCC-гранулы, полученный при давлении 5 бар), образовали таблетки со значительно более низкой хрупкостью, чем таблетки, спрессованные при давлении 20 бар. Этот результат также разъясняется в Фигуре 1.
Фигура 1 показывает значения прочности при растяжении таблеток из таблеточных композиций на основе FCC в зависимости от давлений прессования. Вплоть до давления 250 МПа прочность при растяжении с повышением давления прессования возрастает почти линейно для всех композиций. В частности, хрупкость зависит от прочности таблетки при растяжении, которая является функцией поверхности, доступной для контактов. Чем выше давление во время уплотнения прокаткой, тем более плотной является упаковка частиц и больше сокращение площади поверхности.
При очень высоких давлениях (~400 МПа) прочности таблетки при растяжении, изготовленных из гранул при давлении 5 бар и из гранул при давлении 20 бар, были сравнимыми. При таких напряжениях гранулы (и также частицы внутри гранул) могли бы раздавливаться, и тем самым создавать дополнительную площадь поверхности для образующих связи контактов. Для гранул, спрессованных при давлении 20 бар, было необходимым более высокое давление прессования для разрушения частиц, в отличие от гранул, полученных при давлении 5 бар. В отличие от таблеток, изготовленных из порошковых смесей, риск расслоения таблеток снижался при более высоких давлениях прессования с использованием FCC-гранул.
Позитивное влияние высокой удельной поверхности на стабильность таблеток подкрепляется результатами прочности таблетки при растяжении для смесей FCC и парацетамола и Avicel с парацетамолом.
Фигура 2 показывает прочности при растяжении в зависимости от давления прессования для смесей парацетамола с FCC и Avicel. Смеси с FCC достигали гораздо более высоких значений прочности при растяжении, чем смеси Avicel и парацетамола, за исключением композиции с 24,75% FCC. Для смеси с 74,25% парацетамола FCC достигал максимальной прочности при растяжении (0,16 МПа) уже при давлении 50 МПа. Композиция с Avicel при таком же содержании лекарственного препарата достигала этого значения после того, как было приложено давление прессования 150 МПа. Композиция с Avicel с 74,25%-ным содержанием лекарственного препарата достигала в 3,4 раза более высокой прочности при растяжении, чем FCC в комбинации с парацетамолом, но требовалось в 10 раз более высокое давление для достижения этого значения. При более высоком содержании лекарственного препарата FCC проявлял превосходные свойства по сравнению с Avicel, в особенности в диапазоне низких давлений.
Таблица 3 показывает значения анализа Хекеля и модифицированного анализа Хекеля. Чем выше давления во время уплотнения прокаткой, тем ниже значения параметра Хекеля (k) для таблеток. Низкое значение «k» означает, что для получения стабильной таблетки требуется более высокое давление при такой же прочности при растяжении. Значения относительно критической плотности (ρrc), то есть, плотность таблетки, при которой может быть сначала сформированы стабильные формовки, подкрепляли результаты анализа Хекеля.
2.4 Ртутная порометрия
Фигура 3 показывает график распределения пор по размерам по результатам ртутной порометрии для таблеток из FCC, изготовленных из порошка и гранулятов. Таблетки были спрессованы при трех различных давлениях прессования. По мере возрастания давления прессования характеристические пики смещались до меньших диаметров пор (Фигура 3) в результате уплотнения FCC и слияния слоев на поверхности частиц. Графики для таблеток, спрессованных при одинаковом давлении прессования, были почти совпадающими для всех типов исходного материала (порошка или гранул). Только одним заметным отличием является более высокий поровый объем гранул при бóльших диаметрах пор сравнительно с порошками. На внутричастичную структуру FCC (поры с диаметром менее 0,02 мкм) не оказывают влияния ни процесс уплотнения прокаткой, ни таблетирование.
Таблица 2: Свойства гранул и таблеток. «х» обозначает, что таблетка не была получена при 100 МПа (недостаточная стабильность/расслоение). «Fail» означает, что образец не прошел испытание вследствие разрушения таблеток.
Таблица 3: Параметры Хекеля и модифицированные параметры Хекеля. Значения смесей, содержащих Avicel и парацетамол, не показаны, так как некоторые значения отсутствовали для адаптирования в выбранном диапазоне давлений.
Заключение
Уплотнение прокаткой FCC создает жесткие ленты при низкой тонкодисперсной фракции, даже при низких давлениях уплотнения прокаткой. Полученные гранулы, выполненные из FCC и фармацевтически активного агента, проявили лучшие характеристики сыпучести, чем соответствующие композиции на основе микрокристаллической целлюлозы (Avicel). Кроме того, таблетки, состоящие из гранулированного FCC и фармацевтически активного агента, проявили значительно более высокие характеристики прочности при растяжении по всему диапазону давлений, чем соответствующие композиции на основе микрокристаллической целлюлозы (Avicel). Таким образом, гранулированные композиции из FCC имеют превосходные свойства в отношении сыпучести и пригодности к уплотнению по сравнению с композициями на основе микрокристаллической целлюлозы (Avicel) или композициями из негранулированного FCC.
Реферат
Настоящее изобретение относится к способу получения фармацевтической системы доставки. Способ включает формирование карбоната кальция с реакционно-модифицированной поверхностью, который представляет собой продукт реакции природного размолотого или осажденного карбоната кальция с диоксидом углерода и одной или более кислотами в водной среде, причем диоксид углерода образуется in-situ при кислотной обработке и/или подается от внешнего источника. Указанный карбонат кальция смешивают с фармацевтически активным агентом и вспомогательной добавкой, уплотняют смесь с помощью роликового уплотнителя при давлении прессования от 4 до 20 бар, затем спрессовывают уплотненную прокаткой смесь с получением фармацевтической системы доставки, представляющей собой таблетку, мини-таблетку, капсулу или гранулу. Использование карбоната кальция с реакционно-модифицированной поверхностью обеспечивает улучшение хрупкости и сыпучести фармацевтической системы доставки. 4 н. и 11 з.п. ф-лы, 3 ил., 3 табл.
Формула
Документы, цитированные в отчёте о поиске
Гранулы на основе крахмала и лактозы, способ их получения и таблетка, содержащая их
Способ получения системы доставки фрагментов нуклеиновых кислот в клетки млекопитающих

Комментарии