Способ получения системы доставки фрагментов нуклеиновых кислот в клетки млекопитающих - RU2646113C1
Код документа: RU2646113C1
Чертежи
Описание
Изобретение относится к области молекулярной биологии, биоорганической химии и медицины и может быть использовано для создания систем доставки лекарственных средств (в частности, олигонуклеотидов) в клетки.
Использование фрагментов нуклеиновых кислот и их аналогов (ФНК) для селективного воздействия на внутриклеточный генетический материал является одной из важнейших задач современной биологии и фундаментальной медицины. В случае решения этой проблемы открывается возможность широкого использования этого подхода в практической медицине. Однако до конца не решенной проблемой является отсутствие эффективного способа доставки фрагментов нуклеиновых кислот и их аналогов внутрь клетки, поскольку известно, что сами по себе они проникают в клетки в очень малой степени, в первую очередь, из-за гидрофобного характера клеточной мембраны.
Известны способы доставки ФНК в клетки с помощью вирусных векторов [Bouard, D. еt al., British Journal of Pharmacology, 2009, v. 157, 153-165], путем включения в липосомы [Deshpande, D. et al., Pharm. Res., 1998, v. 15, p. 1340-1347], путем конъюгирования с катионными полимерами различной природы [Smedt, S.C. et al., Pharm. Res., 2000, v. 17, 113-126], с помощью электропорации [Baum С.et al., Biotechniques. 1994, v. 17, 1058-1062] и др. Однако проблема доставки пока не нашла окончательного решения и продолжает оставаться актуальной задачей.
Известно использование наночастиц различной природы, в частности, неорганических наночастиц в качестве агентов доставки реакционноспособных олигонуклеотидов, обеспечивая тем самым высокоэффективное взаимодействие с внутриклеточными нуклеиновыми кислотами.
Описано использование наночастиц фосфата кальция для доставки плазмидной ДНК в стволовые клетки [Cao X, et al., Int. J. Nanomedicine, 2011; 6, 3335-3349]; наночастиц фосфатов магния и марганца для доставки олигонуклеотидов в клетки HeLa [Bhakta G, et al., Biomaterials. 2005, v. 26, 2157-2163], наночастиц карбонат-апатита для доставки ДНК в клетки млекопитающих [Hossain S, et al., Anal. Biochem., 2010, v. 397, 156-161]; наночастиц благородных металлов для детекции ДНК и их доставки в клетки [Chen XJ, et al., Wiley Interdiscip.Rev. Nanomed. Nanobiotechnol., 2012, doi: 10.1002/wnan. 1159].
Известен способ получения наноразмерной системы доставки ФНК в клетки млекопитающих, включающий синтез наночастиц диоксида титана (ТiO2) размером ~5 нм и последующую иммобилизацию на них допамин-содержащего олигонуклеотида [Paunesku Т. et al., Nat. Mater. 2003, v. 2, 343-346; Thurn К.Т. et al., Small 2009, v. 5, 1318-1325; Kurepa, J. et al., Nano Lett. 2010, v. 10, 2296-2302].
Наиболее близким к заявляемому способу – прототипом - является способ получения наноразмерной системы доставки олигонуклеотидов, включающий синтез наночастиц диоксида титана, синтез конъюгатов наночастиц диоксида титана с полилизином (TiO2-PL), иммобилизацию олигонуклеотидов на TiO2-PL, при этом иммобилизацию олигонуклеотида проводят в водном растворе при комнатной температуре, а не связавшийся с частицами конъюгат отмывают раствором NaCl. ФНК связываются с TiO2-PL за счет электростатического взаимодействия положительно заряженных аминогрупп полилизина (NH2) и отрицательно заряженных межнуклеотидных фосфатных групп олигонуклеотида (р). Получают наноразмерную систему доставки ФНК в клетки, представляющую собой нанокомпозит TiO2-PL⋅ФНК с емкостью по ФНК, составляющей 0.2-60 нмоль/мг. Длительность способа получения системы доставки составляет 1.5-2 часа, а с учетом времени приготовления TiO2-наночастиц -2-3 суток. Получаемая таким способом наноразмерная система доставки ФНК в клетки состоит из наночастиц диоксида титана, покрытых полилизином, на которых иммобилизованы ФНК, способные проникать в эукариотические клетки путем обычного эндоцитоза. В качестве линкера используют полиамины, содержащие от 3 до 1000 аминогрупп в молекуле, преимущественно полилизин, полиэтиленимин или спермин (патент RU 2444571 С2, опубл. 10.03.2012).
Недостатками известного способа является необходимость предварительного синтеза конъюгатов наночастиц диоксида титана с полилизином (TiO2-PL), что требует использования относительно дорогого реактива (полилизина) и дополнительного времени, а также ограниченные функциональные возможности вследствие того, что в качестве основы для системы доставки используются нестабильные золи диоксида титана, склонные к агрегации, что может быть препятствием для использования нанокомпозитов TiO2-PL⋅ФНК в медицинской практике.
Техническим результатом является упрощение и сокращение длительности способа, а также расширение его функциональных возможностей.
Технический результат достигается заявляемым способом, заключающимся в следующем.
Предварительно получают основу (носитель) для системы доставки. Для этого 3-аминопропилтриэтоксисилан (в концентрации 1-4 мг/мл в пересчете на Si) гидролизуют добавлением его по каплям к дистиллированной воде при значениях рН 10-11 и температуре от 20 до 70°С и перемешиванием в течение 8-15 ч. Полученный аминозамещенный силанол (Si~NH2) представляет собой прозрачный раствор, содержащий Si(OH)3(C3H6NH2) в виде мономера или димера или смеси мономера, димера и слабоконденсированных цепочек с соотношением Si/NH2=1:1. Высушенный на воздухе гидролизованный продукт представляет собой бесцветную стекловидную пленку. По данным рентгенофазового анализа (РФА) и просвечивающей электронной микроскопии (ПЭМ) сухой продукт является аморфным веществом.
Перед иммобилизацией ФНК к раствору гидролизованного продукта добавляют 0.5-1%-ную уксусную кислоту до значений рН 8-9 и получают раствор Si~NH2 с концентрацией 1-4 мг/мл в пересчете на Si и соотношением Si/NH2=1:(0.4-0.5). К полученному раствору Si~NH2 (2-25 мкл, 1-4 мг Si/мл) добавляют 10-50 мкл 10-3-10-7 М раствора соответствующего ФНК длиной 10-1500 звеньев с соотношением 5-100 нмоль ФНК на 1 мг Si и инкубируют в 0.1-0.2М растворе NaCl, при комнатной температуре в течение 20-30 минут. ФНК количественно связываются с Si~NH2 за счет сильного электростатического взаимодействия положительно заряженных аминогрупп и отрицательно заряженных межнуклеотидных фосфатных групп олигонуклеотида. Получают систему доставки ФНК в клетки, представляющую собой нанокомпозит Si~NH2⋅ФНК с размером частиц от 1 до 8 нм (по данным атомной силовой микроскопии) с концентрацией 0.25-1 мг/мл по Si и с емкостью по ФНК, составляющей 10-100 нмоль/мг. Длительность способа получения системы доставки ФНК составляет не более 0.5 часа, а с учетом приготовления основы для доставки (Si~NH2) - не более 20 часов.
Получаемая заявляемым способом система доставки ФНК в клетки представляет собой растворимый нанокомпозит, состоящий из аминосиланола, с аминогруппами которого электростатически связаны ФНК, способные проникать в эукариотические клетки предположительно путем обычного эндоцитоза, без использования дополнительных внешних методов трансфекции, и направленно воздействовать на внутриклеточный генетический материал и подавлять его дальнейшее функционирование.
Определяющими отличительными признаками предлагаемого способа от прототипа являются:
1) В качестве основы для доставки ФНК в клетки используют аминозамещенный силанол (Si~NH2) в концентрации 1-4 мг Si/мл, который получают гидролизом в воде аминопропилтриэтоксисилана при рН 10-11 и температуре 20-70°С с последующей нейтрализацией до рН 8-9, что позволяет упростить способ и сократить его длительность за счет сокращения стадий, удешевить за счет исключения дорогого препарата полилизина и обеспечить получение растворимого препарата, что является преимуществом для использования в медицинской практике.
2) Последующую иммобилизацию ФНК на Si~NH2 осуществляют путем добавления рассчитанного количества 10-3-10-7М раствора соответствующего ФНК к прозрачному раствору Si~NH2 с концентрацией 1-4 мг/мл в пересчете на Si в 0.1-0.2 М NaCl при рН 8-9 и перемешивания при комнатной температуре в течение 20-30 минут, что обеспечивает прочное связывание ФНК с Si~NH2 за счет электростатического взаимодействия отрицательно заряженных фосфатных групп ФНК с положительно заряженными аминогруппами.
Заявляемый способ обеспечивает получение нанокомпозита с практически такой же емкостью по ФНК, как и известный способ (прототип), и высокой прочностью связывания ФНК с Si~NH2, основанной на сильном электростатическом взаимодействии фосфатных групп с аминогруппами. Предлагаемый способ, как и известный способ (прототип), обеспечивает возможность присоединять к Si~NH2 любые ФНК и их аналоги, содержащие отрицательные заряды на межнуклеотидных фосфатных группах. Предлагаемый способ, как и известный способ (прототип), обеспечивает высокую противовирусную активность получаемых препаратов в отношении вируса гриппа А. Кроме этого, предлагаемый способ обеспечивает возможность получения прозрачных растворов нанокомпозитов, не содержащих агрегированных наночастиц, склонных к осаждению.
Изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример 1. Получение Si~NH2.
К 120 мл нагретой на водяной бане до 70°С дистиллированной воде по каплям добавляют 4 г 3-аминопропилтриэтоксисилана (508 мг по Si) до рН 10 и перемешивают при этой температуре 8 ч. Концентрация продукта составляет 4.2 мг Si/мл. По данным титрования продукта мольное соотношение NH2/Si в образце составляет 1:1. После охлаждения до комнатной температуры к раствору добавляют 0.5% раствор уксусную кислоту до рН 8. Концентрация наночастиц Si~NH2 после нейтрализации составляет 4 мг Si/мл. По данным титрования продукта мольное соотношение NH2/Si после нейтрализации составляет 0.5. Размер наночастиц - 1-8 нм по данным атомной силовой микроскопии.
Пример 2. Получение Si~NH2.
Способ осуществляют аналогично примеру 1, за исключением того, что гидролиз 3-аминопропилтриэтоксисилана проводят при 20°С и рН 11 и перемешивают при этой температуре 15 ч. После гидролиза раствор нейтрализуют 1%-ный раствор уксусной кислотой до значений рН 9.
Пример 3. Получение Si~NH2.
Способ осуществляют аналогично примеру 1, за исключением того, что в реакции гидролиза используют 127 мг 3-аминопропилтриэтоксисилана (в пересчете на Si). Концентрация продукта после нейтрализации составляет 1 мг Si/мл.
Пример 4. Получение композита Si~NH2⋅oligo1
К 25 мкл Si~NH2, полученному по примеру 1, добавляют 65 мкл 0.16 М NaCl и 10 мкл 10-3 М (10 нмоль) раствора 10-звенного олигонуклеотида d(5'CATCCAGGATp)* (oligo1). Реакционную смесь инкубируют при комнатной температуре в течение 30 минут. Получают продукт Si~NH2⋅oligo1 с концентрацией 1 мг/мл (по Si) и емкостью по олигонуклеотиду 100 нмоль/мг Si.
Пример 5. Получение композитов Si~NH2⋅oligo2 и Si~NH2⋅oligo3.
Способ осуществляют аналогично примеру 4, кроме того, что в качестве олигонуклеотидов используют 10-4 М растворы 21-звенных олигодезоксирибонуклеотидов d(5'GCAAAAGCAGGGTAGATAATCp) (oligo2) или d(5'GATCAACTCCATATGCCATGTp) (oligo3) (по 25 мкл, 2.5 нмоль), и реакцию проводят в 0.2 М NaCl, для чего в реакционную смесь добавляют 50 мкл 0.4 М NaCl. Получают композиты Si~NH2⋅oligo2 и Si~NH2⋅oligo3 с концентрацией 1 мг/мл (по Si) и с емкостью по олигонуклеотиду 25 нмоль/мг Si.
Пример 6. Получение композита Si~NH2⋅oligo4 и Si~NH2⋅oligo5.
Способ аналогичен примеру 5, отличается тем, что в качестве олигонуклеотида используют 50 мкл 10-4 М (5 нмоль) раствора 30-звенного олигорибонуклеотида5'CUGCUGUACAUGGCACAUGGAAUUGAUUA (oligo4) или 50 мкл 10-4 М раствора 16-звенного аналога олигодезоксирибонуклеотида dps(5'CCGTCGGTACCGGCCG) (oligo5), содержащего межнуклеотидные тиофосфатные группы (ps), и реакцию проводят в 0.1 М NaCl, для чего в реакционную смесь добавляют 25 мкл 0.4 М NaCl. Получают нанокомпозиты Si~NH2⋅oligo4 и Si~NH2⋅oligo5 с концентрацией 1 мг/мл (по Si) и с емкостью по олигонуклеотидам 50 нмоль/мг Si.
Пример 7. Получение композита Si~NH2⋅oligo5.
Способ аналогичен примеру 4, отличается тем, что в качестве олигонуклеотида используют 50 мкл 1500-звенного фрагмента ДНК (oligo5) с концентрацией 2⋅10-7 М (1⋅10-2 нмоль), 2 мкл Si~NH2, полученного по примеру 3 и 48 мкл 0.4 М NaCl. Получают нанокомпозит Si~NH2⋅oligo5 с концентрацией 0.02 мг/мл (по Si) и с емкостью по олигонуклеотиду 5 нмоль/мг Si.
Пример 8. Оценка способности нанокомпозита Si~NH2⋅ФНК проникать в клетки.
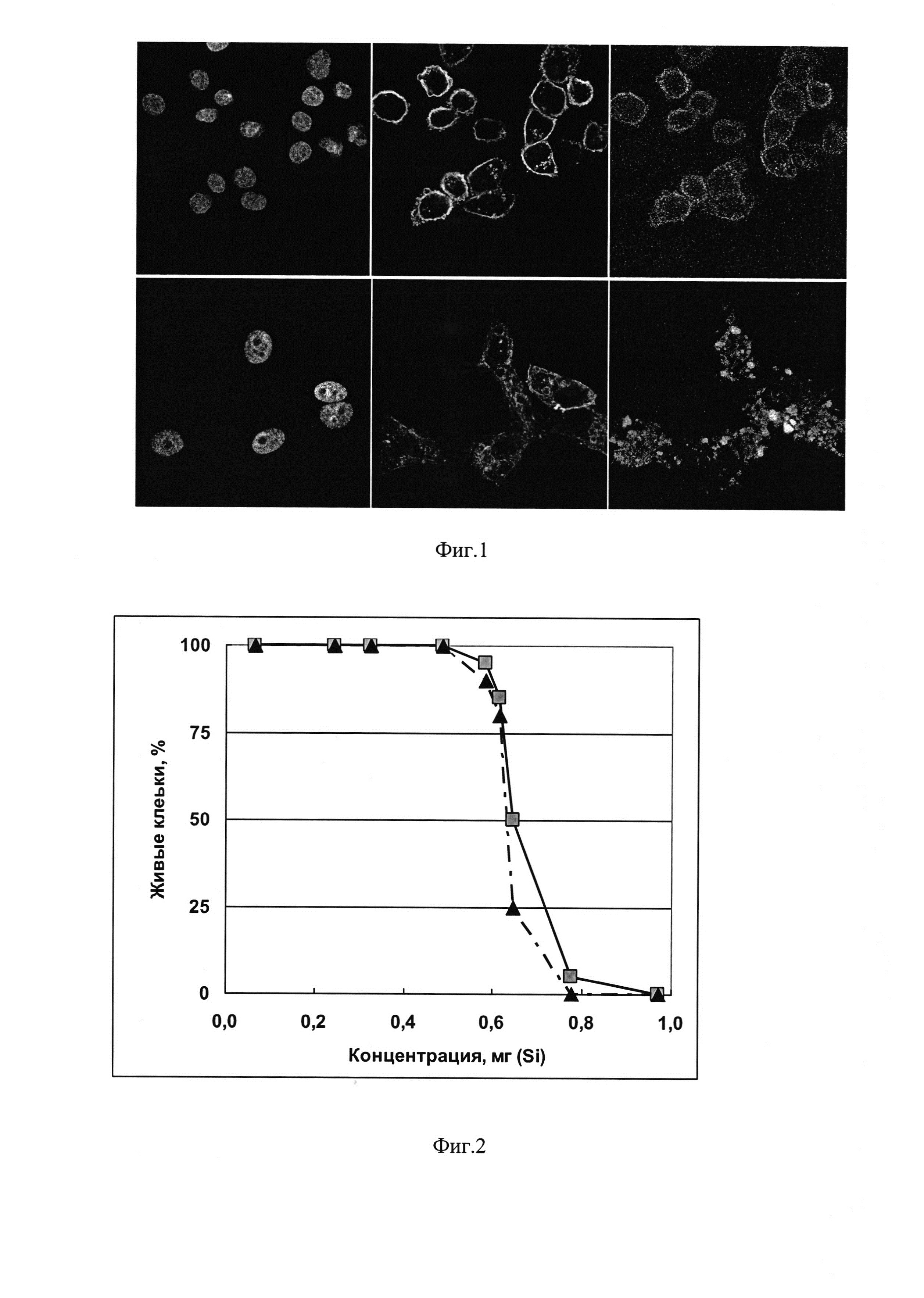
В эксперименте используют клетки линий HeLa и MDCK (полученные из коллекции культур клеток ФБУН ГНЦ ВБ «Вектор», п. Кольцово, Новосибирская обл.), красители для окрашивания клеточных ядер и мембран (DAPI и Cell Mask Plasma Membrane Stain) и питательную среду для клеток DMEM, эмбриональную телячью сыворотку (ЭТС), антибиотики, буфер PBS (Invitrogen, США). Для приготовления образцов для конфокальной микроскопии клетки культивируют в полной среде DMEM в 8-луночных камерах до достижения 70% монослоя, после этого полную среду заменяют на среду без сыворотки, стрептомицина и пенициллина (160 мкл). Затем добавляют исследуемый нанокомпозит SiO2 Si~NH2⋅oligo2(Flu), полученный, как описано в примере 5 с использованием олигонуклеотида, меченного флуоресцеином (40 мкл в лунку) до конечной концентрации 0.01 мг/мл по Si и 0.25 нмоль/мл по олигонуклеотиду. После 24-ч инкубации клетки отмывают буфером PBS, фиксируют и окрашивают красителями (DAPI для ядер, и Cell Mask Plasma Membrane Stain для клеточных мембран) в течение 10 мин. Препараты анализируют с помощью конфокального лазерного сканирующего микроскопа LSM 510 UV MetaMicroscope (Carl Zeiss, Inc.). На фиг. 1 представлены изображения клеток HeLa (А) и MDCK (Б) (а - ядра, б - границы клеток и внутриклеточные актиновые филаменты, в - флуоресцеин-меченные нанокомпозиты). Видно, что в случае обоих типов клеток (HeLa и MDCK) нанокомпозит Sid Si~NH2⋅oligo2(Flu) обнаруживается внутри клеток.
Пример 9. Оценка цитотоксичности нанокомпозитов.
Для тестирования цитотоксичности препаратов используют перевиваемую культуру клеток MDCK, полученную из коллекции культур клеток ФБУН ГНЦ ВБ «Вектор». По 100 мкл суспензии клеток MDCK с концентрацией 100 000 кл./мл в среде RPMI-1640, содержащей 5% сыворотки крови плодов коровы, вносят в 96-луночные планшеты 12-канальной автоматической пипеткой. Планшеты с клетками помещают в термостат при температуре 37°С, 5% СО2 и 100% влажности на 2 сут до образования клеточного монослоя.
Для определения токсических концентраций образец разбавляют в несколько раз (в 2, 4, 8, 16, 20 раз, 32, 64 раза) средой RPMI-1640, содержащей 5% сыворотки крови плодов коровы. Образец после каждого разведения вносят на монослой клеток MDCK в 4-х лунках по 100 мкл/лунку планшета и оставляют в термостате при температуре 37°С, 5% СО2 и 100% влажности. Токсическое действие образца на монослой клеток MDCK оценивают через 2 суток по соотношению живых и мертвых клеток с помощью инвертированного микроскопа.
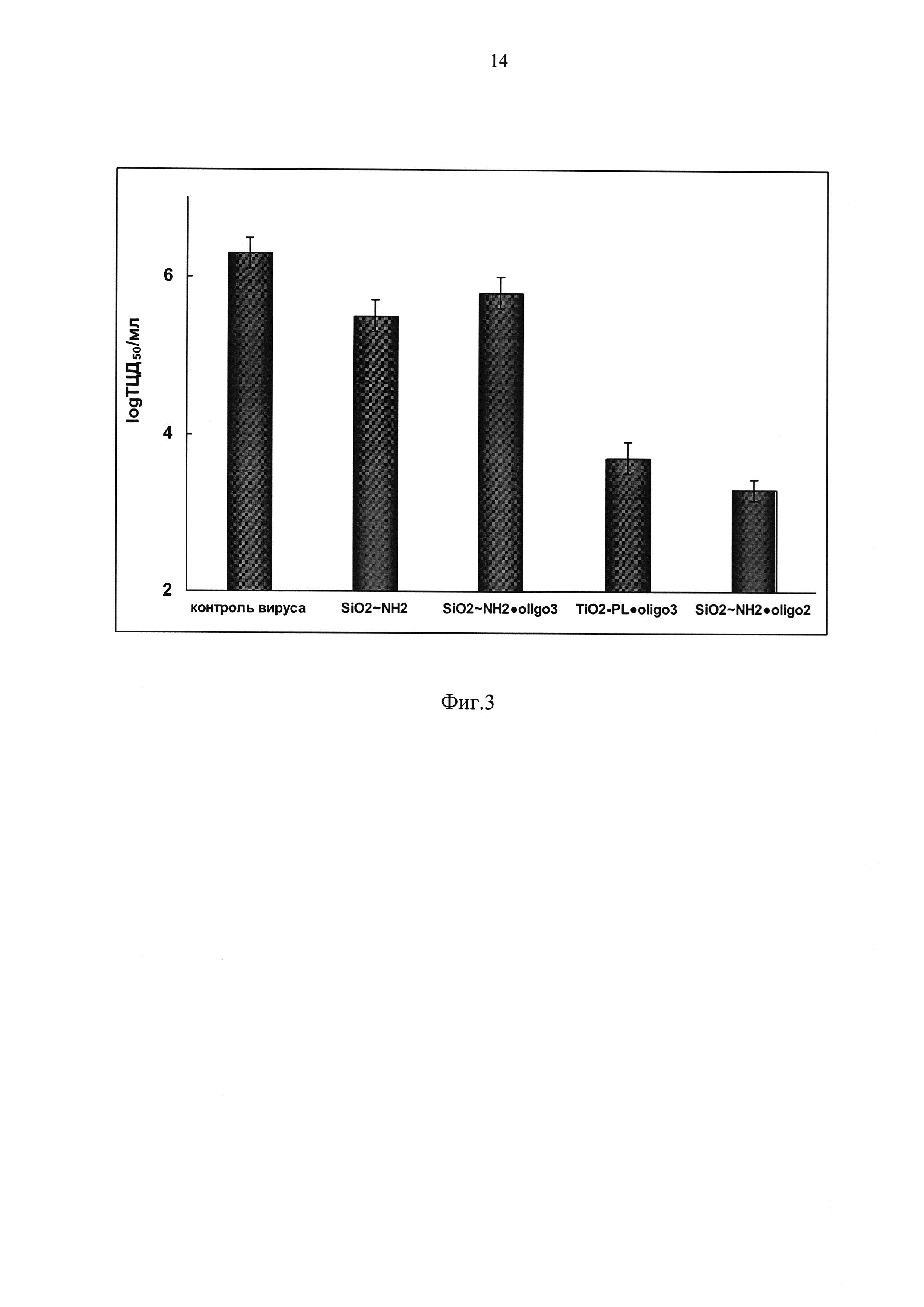
Эксперименты повторены 2-3 раза. Результаты представлены на фиг. 2, где квадраты - Si~NH2, треугольники - Si~NH2⋅oligo2. Из фиг. 2 видно, что выживаемость клеток примерно одинакова для исследуемых образцов, и величина ТС50 (концентрация препарата, при которой гибнет 50% клеток) составляет ~0.65 мг/мл в пересчете на Si.
Пример 10. Исследование противовирусной активности нанокомпозитов.
В экспериментах используют вирус гриппа A/chicken/Kurgan/05/2005 (H5N1) с исходным титром 106,5 ТЦД50/мл. Исследуют противовирусные свойства композитов Si~NH2⋅oligo2 и Si~NH2⋅oligo3, полученных как описано в примере 5, контрольного образца Si~NH2, полученного как в примере 1, а также образца TiO2-PL⋅oligo2, полученного известным способом (прототип). В качестве олигонуклеотидной части нанокомпозитов используют олигонуклеотиды: oligo2, комплементарный 3'-концу вирусной (-)РНК и имеющий выраженные противовирусные свойства по отношению к вирусу гриппа A H5N1, и oligo3, имеющий случайную последовательность той же длины.
Противовирусные свойства нанокомпозитов исследованы на культуре клеток MDCK. Используют среду DMEM с добавлением 2% FBS, глютамина и антибиотиков. Клетки культивируют, как описано в примере 13. Препараты разводят средой RPMI-1640, содержащей 2 мкг/мл трипсина, и вносят на монослой отмытых от сыворотки клеток MDCK в объеме 50 мкл на лунку 96-луночного планшета из расчета 0.1 мкМ по олигонуклеотиду (4 мкг/мл по Si) в конечной реакционной смеси. Концентрация препарата примерно в 150 раз меньше значения ТС50 (фиг. 2), т.е. используется нетоксическая концентрация. Реакционные смеси инкубируют при 37°С и 100% влажности в СО2-инкубаторе в течение 1 ч. Затем вносят вирус A/chicken/Kurgan/05/2005 (H5N1) в разведениях на среде RPMI-1640, содержащей 2 мкг/мл трипсина, от -1 до -8 с десятикратным шагом в объеме 50 мкл/лунку. В качестве контроля используют вирус A/chicken/Kurgan/05/2005 (H5N1) без добавления исследуемых препаратов. Инкубируют в течение 2 суток в CO2-термостате при 37°С и 100% влажности; определяют наличие вируса визуально под микроскопом по ЦПД и в РГА с 1% эритроцитами петуха. Все препараты были проверены на противовирусную активность при n=6.
На фиг. 3 приведены значения титра вируса (в единицах log ТЦД50/мл) в клетках МДСК, зараженных вирусом и обработанных исследуемыми препаратами. Из фиг. 3 следует, что контрольные образцы Si~NН2 (исходный силанол) и Si~NH2⋅oligo3 (содержащий случайную нуклеотидную последовательность, не комплементарную вирусной РНК) не проявляют заметной противовирусной активности, т.е. не происходит достоверно значимого снижения титра вируса в клетках. Образец Si~NH2⋅oligo2 обладает высокой противовируной активностью, которая даже несколько превосходит таковую для образца TiO2-PL⋅oligo2, полученного известным способом (прототип): разница между значениями титра вируса в контроле и опытах с соответствующими образцами составляет 3.2 log и 2.6 log, что соответствует подавлению репродукции вируса в 1000 и 400 раз соответственно.
Предлагаемый способ позволяет существенно упростить и сократить длительность, а также расширить функциональные возможности известного способа (прототипа) и обеспечить получение нанокомпозитов, представляющих собой систему доставки фрагментов нуклеиновых кислот и их аналогов в клетки млекопитающих. При этом получаемые заявляемым способом нанокомпозиты обладают свойствами, подобными нанокомпозитам, получаемым известным способом, а именно: такой же емкостью по ФНК, в частности олигодезоксирибонуклеотиду, высокой прочностью связывания олигонуклеотида с основой, способностью проникать через клеточную мембрану, низкой цитотоксичностью и специфической противовирусной активностью по отношению к вирусу гриппа А.
Реферат
Изобретение относится к области молекулярной биологии, биоорганической химии и медицины. Предложен способ получения системы доставки фрагментов нуклеиновых кислот (ФНК) в клетки млекопитающих. Осуществляют синтез основы для доставки ФНК. В качестве основы используют аминозамещенный силанол (Si~NH2) в концентрации 1-4 мг Si/мл. Si~NH2 получают гидролизом в воде аминопропилтриэтоксисилана при рН 10-11 и температуре 20-70°С с последующей нейтрализацией силанола 0,5-1%-ным раствором уксусной кислоты до рН 8-9. К полученному раствору Si~NH2 добавляют рассчитанное количество 10-3-10-7 М раствора соответствующего ФНК в соотношении 5-100 нмоль ФНК на 1 мг Si и инкубируют в 0,1-0,2 М растворе NaCl при комнатной температуре в течение 20-30 мин. Получают систему доставки ФНК в клетки, представляющую собой композит Si~NH2⋅ФHK с емкостью по ФНК 10-100 нмоль/мг Si, обладающий высокой прочностью связывания олигонуклеотида с основой, способностью проникать через клеточную мембрану и низкой цитотоксичностью. 3 ил., 10 пр.

Комментарии