Многоцелевой сосудистый имплант - RU2551938C1
Код документа: RU2551938C1
Чертежи






Описание
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к медицине, а именно к многоцелевым сосудистым имплантам, и может быть использовано в рентгенохирургии для улавливания сгустков крови в сосудах или в качестве стента.
УРОВЕНЬ ТЕХНИКИ
Известен интравенозный фильтр (патент РФ №2000814, Савельев B.C. и др., опубл. 15.10.1993, А61М 1/34), включающий сетку, образованную совокупностью непересекающихся продольных нитей, концы одной из сторон которых соединены между собой в одной точке, а концы другой стороны закреплены на фиксирующих элементах, снабженных крючками. Сетка также образована поперечными нитями, расположенными симметрично относительно друг друга и центральной продольной оси фильтра. Поперечные нити выполнены в виде двух колец разного диаметра, соединенных с продольными элементами сетки. Угол наклона плоскости колец к центральной продольной оси фильтра составляет 90°. Сетка выполнена из материала на основе полигликолидов, например, типа «Викрил», обеспечивающего ее рассасывание в кровопотоке. Фильтр имплантируют чрезкожно.
Конструкция известного фильтра имеет ряд недостатков. Во-первых, известная конструкция не позволяет производить установку фильтра из любого доступа, в том числе и бедренного, а позволяет осуществлять установку только через яремный и подключичный доступ, который более опасен для пациентов в связи с возможностью их повреждения и кровотечения. Во-вторых, из-за отсутствия контакта, по меньшей мере, центральной части каждой из продольных нитей сетки с внутренней полостью сосуда, тромбы, которые "прилетают" в фильтр, не фиксируются к стенке вены и при рассасывании устройства проходят дальше по кровеносному руслу. К тому же идет дополнительная нагрузка на конструкцию фильтра за счет совокупности гидродинамического давления и силы «сжатия стенки вены», что способствует ее фрагментации. Кроме того, она может вызывать перфорацию вены своим основанием или миграцию при недостаточной опытности хирурга. В-третьих, данный фильтр имеет ограниченное применение, например, его нельзя дополнительно применять в качестве венозного стента в местах сжатия вен артериями. Помимо этого нити Викрила, которые хоть и крепятся к укрепляющему нити кольцу, являются настолько тонкими, что не будут держать прочность каркаса сетки. К тому же данные нити рассасываются в течение 40 дней, что, например, не дает в полной мере вести профилактику тромбоэмболии легочной артерии (ТЭЛА). Она может возникать в течение 90 дней с момента первоначальной диагностики флотирующего тромбоза.
Известен биоразлагаемый фильтр (заявка США №20100016881, COOK INCORPORATED, опубл. 21.01.2010, А61М 29/00), каркас которого образован совокупностью непересекающихся друг с другом продольных элементов из биоразлагаемого материала на основе полилактида и полигликолида, концы одной из сторон которых соединены между собой посредством биоразлагаемого центратора. Каркас фильтра дополнительно снабжен поперечными зигзагообразными элементами в форме кольца, выполненными из неразлагаемого материала, например, проволоки из нержавеющей стали, Нитинола и др. Кольца разного диаметра расположены симметрично относительно друг друга и центральной продольной оси фильтра и соединены с продольными элементами каркаса. Угол наклона плоскости колец к центральной продольной оси фильтра составляет 90°.
Конструкция известного фильтра имеет ряд недостатков. Во-первых, только часть фильтра создана из биодеградируемых материалов, а значит, при растворении устройства остаются его части из нитинола, стали и т.д., которые впоследствии являются причиной образования тромбов, а также необходимостью постоянного приема антикоагулянтов. С частичной растворимостью также связаны отдаленные осложнения, такие как перфорация и миграция фильтра, ведь материал со временем начинает менять свою форму, а поперечные элементы фильтра и с самого начала могут травмировать стенку сосуда. К тому же поперечные элементы фильтра после того, как проткнули вену, могут приводить к его фиксации в "заваленном состоянии" из-за отсутствия равномерного контакта преимущественно в центральной части каждого из продольных элементов с внутренней полостью вены, что может стать, например, причиной ТЭЛА. Дополнительным недостатком является время деструкции (рассасывания) в 4-6 недель, поскольку желательное время составляет от 90 дней для того, чтобы повторов смертельного заболевания не наступало.
Известен стент простого переплетения (заявка США №20140114389, BOARD OF REGENTA, THE UNIVERSITY OF TEXAS SYSTEM, опубл. 24.04.2014, A61A 2/07), каркас которого образован совокупностью продольных нитей из биоразлагаемого материала на основе полил-L-актида, переплетенных между собой с образованием объемной сетки. Концы каждой из двух сторон нитей переплетены между собой и закреплены на крючке.
Недостатком известного изобретения является то, что конструкция из множества нитей ставит под вопрос безопасность изделия, поскольку нити могут изменять положение, и устройство будет мигрировать. К тому же в упомянутом патенте не указано, что за материал использован и за какое время он биодеградирует.
Наиболее близким аналогом (прототипом) предлагаемого изобретения является рассасывающийся васкулярный фильтр (заявка США №20120221040, Mitchell Donn Rggers, опубл. 30.08.2012, A61F 2/01), каркас которого образован совокупностью непересекающихся друг с другом продольных пластичных нитей из биоразлагаемого материала (например, на основе PLGA 50/50), концы одной из сторон которых соединены между собой в одной точке, а концы другой стороны выполнены свободными. Фильтр дополнительно содержит две нитевидные поперечные пластичные перемычки из биоразлагаемого материала в форме колец, расположенных симметрично относительно друг друга и центральной продольной оси фильтра. Угол наклона плоскости колец к центральной продольной оси составляет 90°.
Конструкция известного фильтра имеет ряд недостатков. Во-первых, материал нитей является пластичным для образования каркасов, представленных в упомянутом патенте, что говорит о недостаточной прочности и упругости для фиксации устройства в полой вене. К тому же при растворении гемодинамическая нагрузка будет падать на несколько нитей, что приведет к отлому кусков, на которых они держатся. Если нити будут крупные, то они вызовут окклюзию вены и станут причиной тромбозов в ней. Кроме того, из-за отсутствия контакта центральной части каждой из продольных нитей с внутренней полостью сосуда отсутствует самоцентрация каркаса фильтра. Во-вторых, наличие одиночных поперечных нитевидных перемычек между продольными нитями, прежде всего, будет способствовать утрате механической упругости устройства, потере конструкцией формы и миграции по кровеносному руслу, или же утрате функции фильтра. Дополнительным недостатком конструкции является то, что биоразлагаемый материал не растворяется в период 90-180 дней.
Предлагаемое изобретение позволяет избежать указанные выше недостатки аналогов и прототипа.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Задача изобретения заключается в создании нового многоцелевого сосудистого импланта, конструкция которого обеспечивает его надлежащую фиксацию в сосуде при сохранении надежной фильтрации тромбоэмболов, и который может служить фильтром и стентом, устанавливаться из любого доступа лицам любого возраста, а также при разнообразных причинах ТЭЛА, без необходимости последующего удаления.
Технический результат, достигаемый при использовании изобретения, заключается в повышении надежности фиксации импланта в сосуде при одновременном увеличении безопасности и расширении области его применения.
Поставленная задача и требуемый технический результат достигаются за счет того, что многоцелевой сосудистый имплант, каркас которого образован совокупностью непересекающихся между собой продольных элементов из биоразлагаемого материала, концы одной из сторон которых соединены между собой в одной точке, и, по меньше мере, двумя поперечными элементами из биоразлагаемого материала, согласно изобретению, поперечные элементы выполнены упругими с возможностью обеспечения контакта, по меньшей мере, центральной части каждого из продольных элементов с внутренней поверхностью полости сосуда, достаточного для самоцентрирования каркаса импланта по сосуду с момента его установки в полость сосуда до момента его полного рассасывания, а концы другой стороны продольных элементов также соединены между собой в одной точке симметрично противоположным концам, при этом соотношение максимального расстояния между двумя внешними точками каркаса, расположенными на одной прямой, перпендикулярной центральной продольной оси импланта, к длине импланта в свободном состоянии составляет от 2:3 до 4:5, предпочтительно 3:4, причем продольные элементы также выполнены упругими, а поперечные элементы выполнены заодно целое с продольными элементами или расположены поверх них, а именно, поперечные элементы соединены с продольными элементами изнутри и/или снаружи каркаса, причем поперечные упругие элементы расположены симметрично относительно друг друга и центральной продольной оси фильтра и выполнены в виде фиксирующих колец, каждое из которых соединено с продольными элементами каркаса, по меньшей мере, двумя точками, где угол наклона плоскости колец к центральной продольной оси импланта составляет 30-90°, или в виде фиксирующих дуг, каждая из которых соединена с по меньшей мере двумя продольными элементами, и тем, что упругие продольные элементы или упругие поперечные элементы или упругие продольные и поперечные элементы выполнены из одного и того же биоразлагаемого материала или из разных биоразлагаемых материалов, где в качестве биоразлагаемого материала используют сополимер D,L-лактида и гликолида с молекулярной массой 75000-200000 Да в мольном соотношении 50,00-99,99:0,01-50,00 или сополимер триметилдекарбоната и гликолида с молекулярной массой 75000-200000 Да в мольном соотношении 75,00-99,99:0,01-25,00 или сополимер D,L-лактида и гликолида с молекулярной массой 75000-200000 Да в мольном соотношении 0,01-75,00:25,00-99,99 или сополимер D,L-лактида, триметилдекарбоната и гликолида с молекулярной массой 75000-200000 Да в мольном соотношении 0,01-75,00:0,01-99,98:0,01-24,99.
Существенной особенностью предлагаемого самоцентрируемого многоцелевого импланта является взаиморасположение и взаимосоединение выполненных упругими продольных и выполненных упругими поперечных элементов друг с другом, обеспечивающих увеличенную и безопасную симметрично распределенную (одновременно и относительно центральной продольной оси самого каркаса и относительно поверхности вены) площадь контакта каркаса со стенками вены. Расположение поперечных элементов позволяет, по меньшей мере, центральной части каждого из продольных элементов одновременно контактировать с внутренней поверхностью полости сосуда. За счет чего, помимо увеличения безопасной симметрично распределенной площади, каркас обладает механической упругостью и сохраняет свою форму, что повышает надежность устройства и расширяет область его применения. Увеличенная площадь контакта с веной предотвращают возможную перфорацию стенки сосуда и последующих органов и кровотечение, т.е. повышает безопасность устройства. А симметричное распределение площади контакта повышает надежность фиксации каркаса и обеспечивает равномерное рассредоточение гемодинамической нагрузки на каркас при растворении, благодаря чему само растворение происходит равномерно, без отрыва и миграции как самого каркаса, так и его отдельных кусков, что также повышает безопасность устройства. Устройство не смещается кровотоком, и его позиция не требует корректировки. Каркас сохраняет свойства упругости и надлежащей фиксации в малых и больших сосудах и надежной фильтрации кровотока.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг. 1 представлено трехмерное изображение импланта (в свободном состоянии), в котором поперечные элементы выполнены в виде фиксирующих колец, расположенных под углом к продольной центральной оси каркаса.
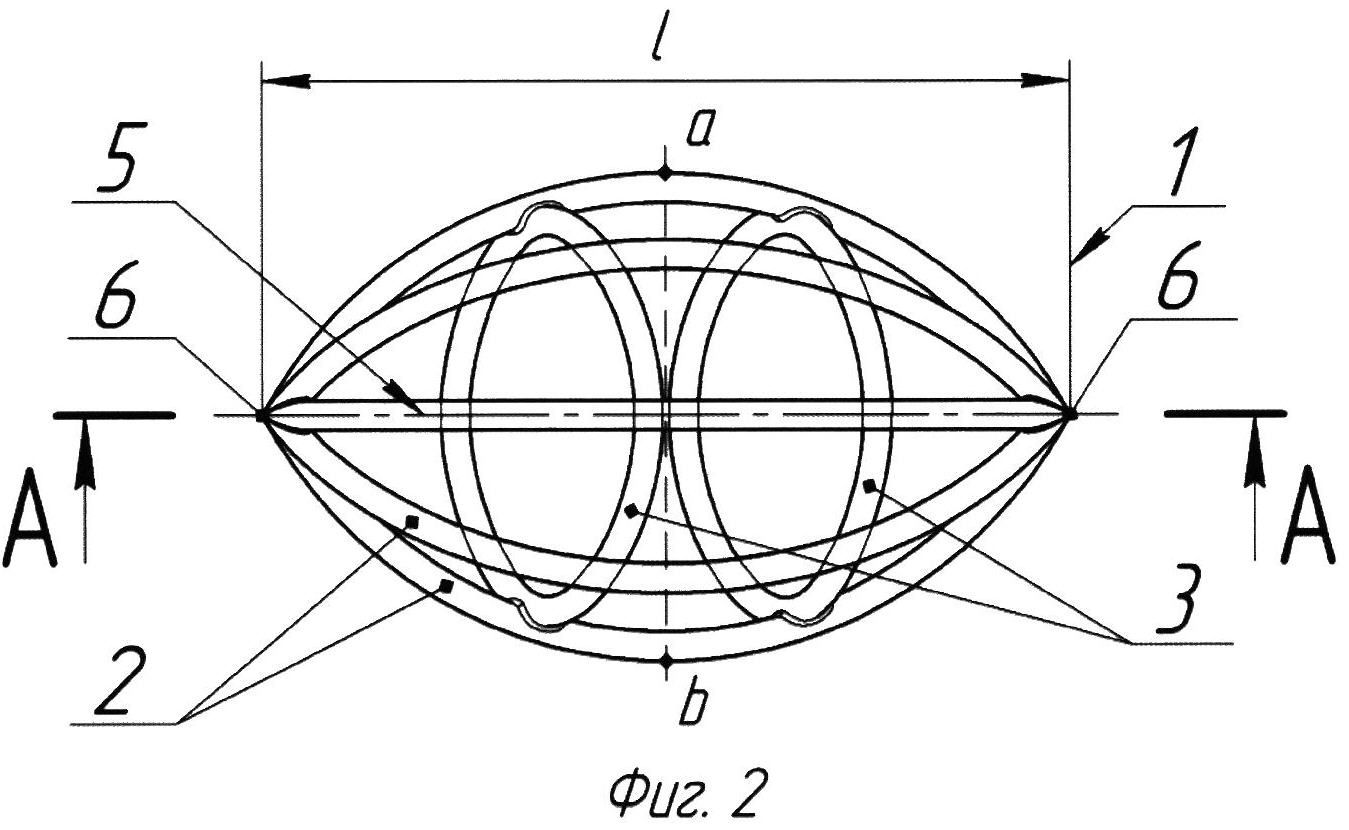
На Фиг. 2 представлен вид сбоку импланта, изображенного на Фиг. 1.
На Фиг. 3 представлен имплант, изображенный на Фиг. 1, в разрезе по линии А-А согласно Фиг. 2.
На Фиг. 4 представлено трехмерное изображение импланта (в свободном состоянии), в котором поперечные элементы выполнены в виде фиксирующего кольца, расположенного под углом к продольной центральной оси каркаса, и фиксирующих дуг (в комбинации).
На Фиг. 5 представлен вид сбоку импланта, изображенного на Фиг. 4.
На Фиг. 6 представлен имплант, изображенный на Фиг.4, в разрезе по линии Б-Б согласно Фиг. 5.
На Фиг. 7 представлено трехмерное изображение импланта (в свободном состоянии), в котором поперечные элементы выполнены в виде фиксирующих дуг.
На Фиг. 8 представлен вид сбоку импланта, изображенного на Фиг. 7.
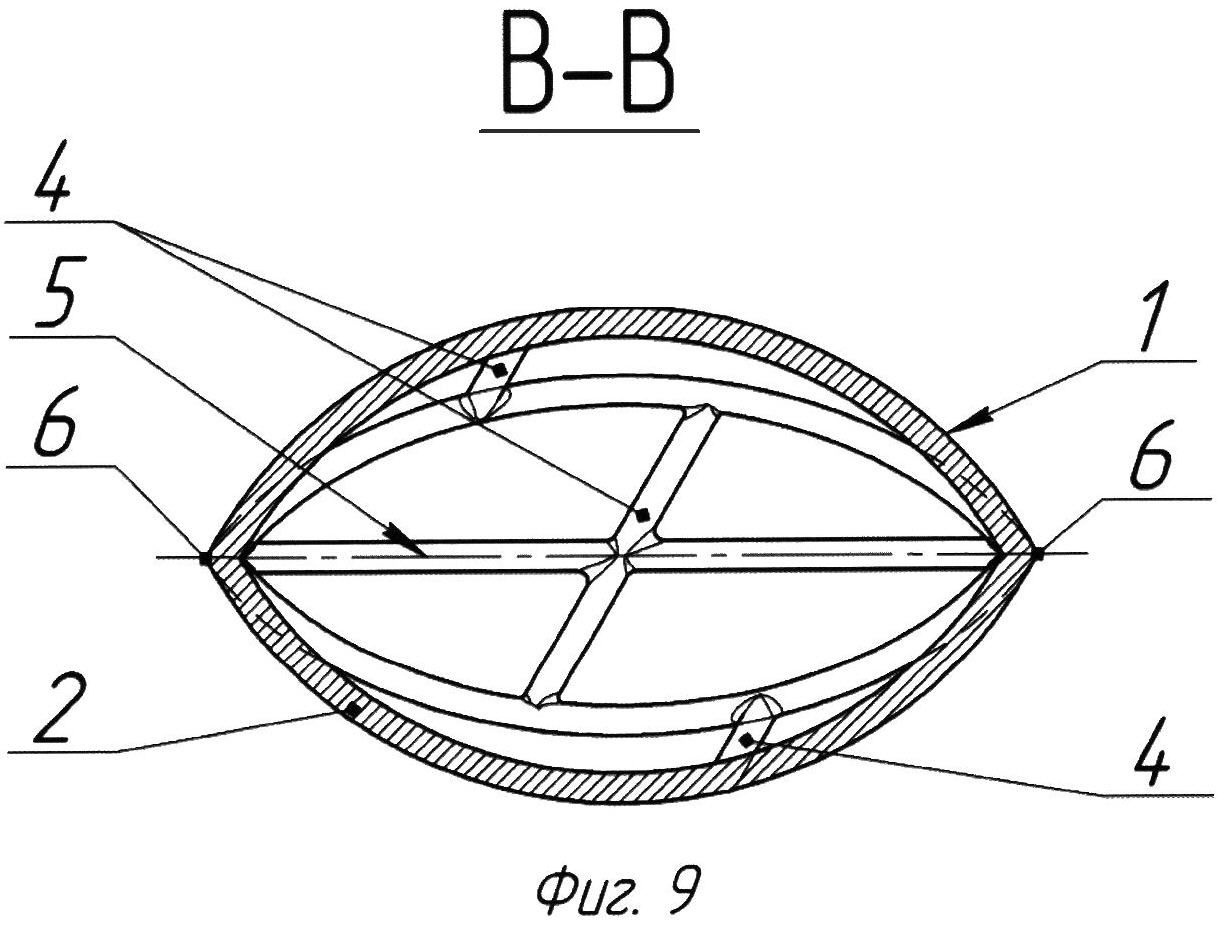
На Фиг. 9 представлен имплант, изображенный на Фиг.7, в разрезе по линии В-В согласно Фиг. 8.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Многоцелевой сосудистый имплант имеет каркас 1, образованный упругими продольными элементами 2 и упругими поперечными элементами, выполненными в виде фиксирующих колец 3 (Фиг. 1) или фиксирующих дуг 4 (Фиг. 4). В частности, использование фиксирующих дуг 4 облегчит функционирование импланта в нижней полой вене. Непересекающиеся между собой продольные элементы 2 соединены обоими концами друг с другом по линии центральной продольной оси 5 импланта, а также с поперечными элементами 3, 4 (Фиг. 1, 4, 7), выполненными из того же или иного биоразлагаемого материала. Упругие поперечные элементы 3, 4 могут быть выполнены заодно целое с продольными элементами 2 (на чертежах не показано) или расположены поверх них (на чертежах не показано), а именно, поперечные элементы 3, 4 могут быть соединены с продольными элементами 2 изнутри (Фиг. 2, 5, 8) и/или снаружи (на чертежах не показано) каркаса 1 импланта. Поперечные упругие элементы 3, 4 должны быть расположены симметрично относительно друг друга и центральной продольной оси 5 импланта. Упругих поперечных элементов 3, 4 может быть два и более. Упругие поперечные элементы должны быть расположены в каркасе и соединены с продольными элементами таким образом, чтобы диаметр поперечного сечения каркаса равномерно (симметрично) уменьшался от центра каркаса (середина прямой, соединяющей две обоймы) к обоймам, симметрично расположенным друг относительно друга.
Что касается фиксирующих колец 3, предпочтительно использование двух колец, так как при большем их количестве фильтр может не помещаться в катетер-интродьюсер. Угол наклона плоскости фиксирующих колец 3 к центральной продольной оси 5 фильтра составляет 30-90°. Фиксирующие кольца 3 могут иметь как одинаковые углы наклона (Фиг. 1), так и разные (на чертежах не показано). Если указанный угол наклона составляет менее 30°, то не обеспечивается развертывание конструкции. Если указанный угол наклона составляет более 90°, то не обеспечивается сжатие фильтра в катетер. Предпочтительно плоскость фиксирующих колец 3 расположена в плоскости поперечного сечения импланта, чтобы обеспечить сжатие фильтра для того, чтобы поместить его в катетер. Если угол между кольцами и продольной осью составляет 70°, то плоскость фиксирующих колец 3 должна делить центральную продольную ось на равные расстояния между обоймами 6 импланта (началом и концом) и кольцами 3. При других углах расстояние между кольцами 3 остается то же, а расстояние между обоймами 6 уменьшается пропорционально. Чем больше указанный угол наклона, тем дальше кольца 3 находятся от обойм 6. Например, если указанный угол равен 70°, то отношение радиуса колец 3 к длине каркаса в свободном состоянии будет равно 1 к 2 (на чертежах не показано). В любом случае, соотношение максимального расстояния между двумя внешними точками (а) и (b) каркаса 1, расположенными на одной прямой, перпендикулярной центральной продольной оси 5, к длине (1) каркаса 1 (Фиг. 2) в свободном состоянии должно составлять от 2:3 до 4:5, предпочтительно 3:4.
Для обеспечения эластичности конструкции импланта фиксирующие кольца 3 соединены с продольными элементами 2, предпочтительно противоположными (Фиг. 2, 5), по меньшей мере, двумя точками, также как и каждая из фиксирующих дуг 4 соединена с, по меньшей мере, двумя продольными элементами 2, предпочтительно соседними (Фиг. 5, 8). Это позволяет осуществлять параллельный поворот обеих обойм и складывание каркаса 1 в катетер на стадии изготовления.
Фиксация и самоцентрирование каркаса 1 в сосуде (вене) обеспечивается за счет силы упругости импланта и вены, в результате влияния неоэпителизации, которая начинается при постановке импланта в организм. Диапазон оказываемого давления на стенку вены, которому должны удовлетворять биоразлагаемые материалы, составляет от 2 до 7 Ньютонов.
Опорную поверхность самоцентрируемого каркаса 1 в сосуде (вене) создают и поддерживают все упругие поперечные элементы 3, 4, располагаемые в сосуде враспор ввиду их положения поперек сосуда, а также центральная часть продольных элементов 2 между обоймами 6, образующими в этой части практически цилиндрическую поверхность. Продольные элементы 2 в силу изогнутой геометрической формы, упругости материала каркаса 1 и соединения с обоймами б также устанавливаются враспор. Увеличение числа продольных элементов 2 увеличивает надежность фильтрации тромбоэмболов и фиксации самоцентрируемого каркаса 1 в сосуде. Вместе с тем, каркас 1 не должен создавать сопротивление кровотоку. Для выполнения таких условий целесообразно обеспечить линейный размер d ячеек между элементами 2 и 3, 4 в раскрытом рабочем положении каркаса 3-6 мм.
В качестве материала элементов каркаса 1 с необходимыми указанными выше упругими свойствами и достаточными сроками абсорбции 90-180 дней может быть использован сополимер D,L-лактида и гликолида с молекулярной массой 75 000-200 000 Да в мольном соотношении 50,00-99,99:0,01-50,00, сополимер триметилдекарбоната и гликолида с молекулярной массой 75000-200000 Да в мольном соотношении 75,00-99,99:0,01-25,00, сополимер D,L-лактида и гликолида с молекулярной массой 75000-200000 Да в мольном соотношении 0,01-75,00:25,00-99,99, сополимер D,L-лактида, триметилдекарбоната и гликолида с молекулярной массой 75000-200000 Да в мольном соотношении 0,01-75,00:0,01-99,98:0,01-24,99. Указанный период саморассасывания фильтра в кровеносном русле достаточен для завершения лечебно-профилактических процедур. Кроме того, перечисленные полимеры обеспечивают восстановление в сосуде объемной формы каркаса 1, предварительно размещенного в сложенном виде внутри катетера.
Например, поли(лактид-D,L-гликолид) синтезируется с последующим изготовлением упругих продольных элементов следующим образом. Полимер L-лактид (LLA) изготавливается путем поликонденсации L-молочной кислоты с последующими термическим разложением и циклизацией. Гликолид (GA) изготавливается из гликолевой кислоты в аналогичных условиях. Оба мономера очищаются пять раз с помощью перекристаллизации из этилацетата. LLA, GA и сушатся в вакууме при комнатной температуре в течение 72 часов. Мономеры и сополимеры синтезируются с раскрытием кольца при полимеризации соответствующих мономерных потоков, используя SnOct2 в качестве катализатора. Мольное соотношение остается постоянным и равным 2000/1. Мономеры и катализатор загружаются в силановую трубку полимеризации. После дегазации трубку герметизируют под вакуумом, после чего полимеризация протекает при температуре в 130°С, в течение 72 часов. Полученные полимеры восстанавливаются путем растворения в дихлорметане, а осадки в метаноле, после чего сушатся в вакууме при комнатной температуре. Затем данный сополимер используется для получения упругих продольных и поперечных элементов необходимого диаметра. Для этого его, например, экструдируют через фильеру, используя одношнековый экструдер (диаметр шнека = 3 мм). Скорость шнека поддерживается на 40 оборотах в минуту. Температура барабана составляет от 150 до 170°C. Окончательные размеры упругих продольных элементов составляют от 1,0-2,0 мм в диаметре и 12,0 мм в длину.
Возможность и срок разложения материала каркаса 1 импланта в крови зависит от структуры, морфологии и молекулярной массы используемых полимеров.
Так как большинство ферментокаталитических реакций протекают в водной среде, гидрофильно-гидрофобный характер связей в синтетических полимерах сильно влияет на их биоразлагаемость. Предлагаемые полимеры и сополимер, содержащие как гидрофильные, так и гидрофобные сегменты, проявляют более высокую способность к биоразлагаемости, чем те, которые содержат только гидрофобный или только гидрофильный сегмент. В связи с этим разложение полимеров начинается уже в кровеносном русле за счет гидролиза.
Синтетические биоразлагаемые полимеры содержат гидролизуемые связи по всей длине полимерной цепочки. Например, такие типы связей, как амидные, эфирные, углекислые, карбомидные и уретановые связи, восприимчивы к биоразложению микроорганизмами и гидролитическими ферментами. Поэтому при разложении полимера более мелкие части материала поглощаются нейтрофильными гранулоцитами и моноцитами, обладающие фагоцитарной активностью, подвергая полимер гидролитическому растворению за счет ферментов.
Биоразложение в биологической среде, клетках, тканях и межклеточной жидкости происходит не так, как химическое разложение, потому что в процесс вовлечены ферменты и биологические реагенты в клеточных органеллах и жидкостях. Кристалличные области под действием ферментов разлагаются гораздо быстрее, чем при гидролизе. Поперечный размер кристаллитов сильно влияет на скорость разложения, так как из-за специфичности упаковки разложение происходит именно на краю кристаллита. Меньший поперечный размер приводит к большей поверхности краев кристаллитов во всем объеме полимера и поэтому он ведет к более высокой скорости разложения.
Молекулярная масса влияет на скорость гидролиза - это определяется затрудненностью доступа воды к высокомолекулярным полимерным материалам.
Изготовление конструкции импланта осуществляется литьем под давлением и последующей сваркой свободных концов продольных и/или поперечных элементов или с применением 3D-принтера на базе указанных выше полимеров. В случае применения применением 3D-принтера очистка конструкции от материала поддержки осуществляется вручную. Размеры продольных и поперечных элементов составляют от 0,5-1,5 мм в диаметре. Далее осуществляется установка импланта в катетер-интродьюссер диаметром 15 F (френчей) и стерилизация устройства в собранном виде. После стерилизации устройство упаковывается в стерильную упаковку.
Имплантация многоцелевого сосудистого импланта проводится после диагностического исследования, установившего тромбоэмболию легочной артерии или флотирующий тромбоз нижней полой, глубоких вен нижней конечности, подвздошной либо бедренных вен, а также у больных с повторными тромбоэмболиями легочных артерий с не выявленным источником рецидива.
Имплант снабжен катетером-толкателем (на чертежах не показано) с рентгеноконтрастными метками. Каркас 1 под рентген-контролем имплантируется в нижнюю полую вену просветом колпачка (на чертежах не показано) катетера вниз. При имплантации устройства используется любой доступ, например, чрезкожная катетеризация подключичной, правой внутренней яремной или бедренной вен.
При проталкивании через катетер имплант находится в сжатом состоянии. При достижении нижней полой вены имплант проводится толкателем (на чертежах не показано) через просвет колпачка в сосудистое русло, где раскрывается, принимая объемную форму, и продольные и поперечные элементы устанавливаются в стенки вены враспор, каркас самоцентрируется. При раскрытии каркаса в вене положение поперечных элементов может отличаться от преимущественного в плоскости поперечного сечения на величину а до 30°, что практически не влияет на упругость каркаса, его объемную форму и самоцентрацию. После установки каркаса 1 в вене катетер удаляется. Каркас 1 надежно фиксируется и самоцентрируется в сосуде за счет увеличенной и безопасной площади контакта со стенками вены. Увеличенная площадь контакта с веной предотвращают возможную перфорацию стенки сосуда и последующих органов и кровотечение. Экспериментально подтверждено, что каркас 1 импланта не смещается кровотоком, и его позиция не требует корректировки. Каркас 1 импланта сохраняет свойства упругости, самоцентрации и надлежащей фиксации в малых и больших сосудах и надежной фильтрации кровотока. Саморассасывающийся имплант не имеет металлических деталей собственно каркаса 1, поскольку не требует применения прочных крючков, петель и т.п., необходимых в прототипе для извлечения фильтра по окончанию периода лечения, за счет чего повышается безопасность предлагаемого импланта и одновременно расширяется область его применения. За счет новой конструкции многоцелевой имплант может использоваться, например, в качестве стента при «синдроме Щелкунчика», когда артерия пережимает собой вену. Сейчас при данном заболевании используют венозные стенты из нитинола.
Имплант начинает терять свою форму при рассасывании через 90-180 дней после установки в тело пациента. Сначала растворяются обоймы, после чего фильтр переходит в стентовую форму. Затем начинают растворяться продольные элементы, при этом они не мигрируют в кровотоке, поскольку за время функционирования в вене эти участки устройства эпителизируются. После чего вена возвращается в исходное состояние. На протяжении растворения у фильтра сохраняются свойства самоцентрирования, поскольку они срастаются с сосудом.
Предлагаемый многоцелевой сосудистый имплант может быть изготовлен на существующем оборудовании с использованием материалов, разрешенных к применению в медицинской практике.
Например, известные производители хирургического материала из полигликолид-лактида: а) медицинская компания ООО «Ситек Сервис», Москва, производит материал под собственным товарным знаком «SITEK MED»; ПГЛА (PGLA) синтетический рассасывающийся стерильный хирургический материал обладает эластичностью; нити ПГЛА не обладают антигенными и пирогенными свойствами и при рассасывании вызывают слабовыраженную тканевую реакцию. После имплантации в ткани нити ПГЛА через две недели теряют 40% первоначальной прочности, полная абсорбция в тканях происходит через 90 суток; б) ООО «Производственно-техническое объединение «МЕДТЕХНИКА», Татарстан, г. Казань, производит шовный материал, используя импортное сырье из Англии, Германии, Кореи, в частности, из полигликолид-со лактида (PGLA).
Предложенное изобретение не ограничено описанными вариантами осуществления, а наоборот оно охватывает различные модификации и варианты в рамках сущности и объема предлагаемой формулы изобретения.
Реферат
Изобретение относится к медицине, а именно к многоцелевым сосудистым имплантам, и может быть использовано для улавливания сгустков крови в сосудах или в качестве стента. В сосудистом импланте каркас 1 образован совокупностью непересекающихся между собой продольных элементов 2 из биоразлагаемого материала, концы одной из сторон которых соединены между собой в одной точке, и, по меньше мере, двумя поперечными элементами 4 из биоразлагаемого материала. Поперечные элементы 4 выполнены упругими с возможностью обеспечения контакта, по меньшей мере, центральной части каждого из продольных элементов 2 с внутренней поверхностью полости сосуда, достаточного для самоцентрирования каркаса 1 импланта по сосуду с момента его установки в полость сосуда до момента его полного рассасывания. Концы другой стороны продольных элементов 2 также соединены между собой в одной точке симметрично противоположным концам. Продольные элементы 2 выполнены упругими. Соотношение максимального расстояния между двумя внешними точками каркаса, расположенными на одной прямой, перпендикулярной центральной продольной оси 5 импланта, к длине импланта в свободном состоянии составляет от 2:3 до 4:5. Изобретение позволяет повысить надежность фиксации импланта в сосуде при одновременном увеличении безопасности и расширении области применения. 13 з.п. ф-лы, 9 ил.
Формула
Документы, цитированные в отчёте о поиске
Биоразрушаемое средство для поддержания просвета сосудов

Комментарии