Биоразрушаемое средство для поддержания просвета сосудов - RU2452517C2
Код документа: RU2452517C2
Описание
Настоящее изобретение относится к биоразрушаемым стентам, состоящим из внутреннего биоразрушаемого металлического каркаса и внешнего полимерного покрытия. Биоразрушаемое покрытие состоит предпочтительно из биоразрушаемых полимеров и дополнительно может содержать по меньшей мере одно фармакологически активное вещество, такое как противовоспалительный, цитостатический, цитотоксический, антипролиферативный агент, агент против образования микротрубочек, антиангиогенный, антирестенозный (против рестеноза), антифунгицидный, противоопухолевый, антимиграционный, гипокоагулирующий и/или противотромбообразующий агент.
В настоящее время имплантация стентов является обычной хирургической процедурой для лечения стенозов. Последние исследования показали, что васкулярные стенозные сосуды не нужно постоянно расширять при помощи эндопротезов, особенно стента. Достаточно расширить ткань при помощи эндопротеза временно, поскольку в присутствии протеза-стента ткань может регенерироваться в части васкулярного стеноза и затем оставаться расширенной даже без поддержки, например, стента. Это означает, что после определенного времени протез, поддерживающий ткань, по существу теряет свое действие, поскольку регенерированная ткань снова позволяет поддерживать нормальный диаметр сосуда сама собой, так что никакой рестеноз не может иметь место после удаления протеза.
Биоразрушаемый металлический стент, главным образом изготовляемый из магния, описан в Европейском патенте ЕР 1419793 В1. В заявке на патент Германии DE 10207161 А1 описаны стенты, изготовленные из сплавов магния и сплавов цинка. В заявке на патент Германии DE 19856983 А1 описаны биоразрушаемые стенты, изготовленные из магния, кальция, титана, циркония, ниобия, тантала, цинка или кремния или сплавов или смесей вышеуказанных веществ. Приведены конкретные примеры стентов, изготовленных из сплава цинк/кальций.
Дополнительные биоразрушаемые металлические стенты, изготовленные из магния, титана, циркония, ниобия, тантала, цинка и/или кремния в качестве компонента А и лития, натрия, калия, кальция, марганца и/или железа в качестве компонента В описаны в заявке на Европейский патент ЕР 0966979 А2. Приведены конкретные примеры стентов, изготовленных из сплава цинк/титан с массовым процентом титана от 0,1 до 1% и сплава цинка/кальция с отношением массовых процентов цинка и кальция 21:1.
С одной стороны, эти стенты имеют недостатком слишком быстрое растворение и, кроме того, растворение происходит нерегулируемым образом, так что некоторые из них дезинтегрируются уже после двух недель.
Другим недостатком таких стентов является требуемая степень прочности сегментов, которая по сравнению со стентами из обычных материалов, как например, стенты из медицинской нержавеющей стали, нитинола и сплава кобальт/хром, распорки (стойки) стента имеют более широкую, а также более толстую конструкцию. Результатом этого является увеличенная поверхность контактирования с окружающей средой, с другой стороны, стент далее проникает в полость сосуда и может оказывать влияние на кровоток. Кроме того, тем самым включение в васкулярную стенку замедляется, вследствие чего должна быть покрыта увеличенная поверхность стента. Кроме того, поскольку процесс растворения начинается до включения стента в васкулярную стенку, могут отщепляться фрагменты, которые могут переноситься посредством кровотока и таким образом могут вызвать инфаркт сердца.
Следующим недостатком описанных биорезорбируемых металлических стентов является то, что они обеспечивают только очень ограниченные возможности для включения фармакологически активного агента в металлический каркас, который будет высвобождать его во время разрушения стента.
Задачей настоящего изобретения является обеспечение стента, который проявляет свою функцию поддержания просвета сосуда только в течение времени, до того как регенерированная ткань снова становится способной выполнять эту функцию, и лишен недостатков общепринятых стентов.
Эта задача решается согласно независимым пунктам формулы изобретения. Более подходящие варианты осуществления изобретения следуют из зависимых пунктов изобретения, описания и примеров.
Настоящее изобретение относится к биоразрушаемым стентам, состоящим из внутреннего биоразрушаемого каркаса, содержащего по меньшей мере один металл и окруженного полимерным биоразрушаемым покрытием.
Полимерный слой уменьшается сам собой на распорках стента или может оборачивать все пустоты, подобно чулку, либо на стороне, противоположной люминальной стороне, либо на люминальной стороне тела стента, или может заполнять свободные промежутки тела стента таким образом, чтобы оболочка лежала на той же плоскости, что и таким же образом обернутые распорки стента. Формы покрытия могут быть пригодным образом комбинированы.
Согласно изобретению, внутренний каркас стента состоит из металла, сплава металлов, оксида металла, хлорида металла, нитрида металла или смеси указанных веществ. Особенно предпочтительно, когда внутренний каркас состоит из сплава металлов, содержащего до 3 мас.%, предпочтительно, до 20 мас.% и особенно предпочтительно, только до 10 мас.% оксидов металлов, солей металлов, карбидов металлов и/или нитридов металлов. Кроме того, в состав композиции или сплава может быть включено до 1 мас.% других компонентов, таких как углеродные, азотные, кислородные примеси, неметаллы или органические вещества.
Кроме того, внутренний металлический каркас обладает свойством растворения более быстрым, чем полимерное внешнее покрытие, т.е. внутренняя структура стента подвергается более быстрому биоразрушению, чем полимерное покрытие, в физиологических условиях. При применении разных биоразрушаемых полимеров на стенте имеется дополнительная возможность применения полимеров, которые различаются по времени разрушения. Так, может быть выгодным, чтобы покрытие на люминальной стороне растворялось медленнее, чем покрытие на стороне, противоположной люминальной стороне стента. Таким образом, например, замедляется разрушение стента кровотоком. Другим преимуществом является стабилизация тела стента, так что никакие фрагменты не могут отщепляться преждевременно. Полное обертывание на всем протяжении внутренней поверхности тела стента может дополнительно регулировать эти действия.
Сплав металлов предпочтительно превращается внутри полимерной оболочки в его соответствующие соли металлов, которые проходят через полимерное покрытие.
Подходящие металлические внутренние каркасы стента изготавливают из металлических материалов, проявляющих разность потенциалов по меньшей мере -0,48 эВ, предпочтительно, по меньшей мере -0,53 эВ, более предпочтительно, по меньшей мере -0,58 эВ и особенно предпочтительно, по меньшей мере -0,63 эВ, по сравнению с каломельным электродом или проявляющих разность потенциалов в диапазоне от -0,3 до -2,5 эВ, предпочтительно, от -0,4 до -1,5 эВ, более предпочтительно, от -0,45 до -1,25 эВ и особенно предпочтительно, от -0,5 до -1,0 эВ по сравнению с каломельным электродом.
Для регистрации измеренной разности потенциалов применяют электрохимическое расположение двух электродов. Поскольку разность потенциалов нужно определить воспроизводимым образом, необходима точка отсчета, которая будет изменяться во время измерения.
Для этой цели обычно применяют электроды второго типа. Эти металлические электроды покрывают их нерастворимыми солями, и вокруг них течет раствор соли более высокой концентрации. К этой группе относится, например, каломельный электрод (уточнено: насыщенный каломельный электрод, SCE). Название “каломель” происходит от тривиального названия нерастворимого быстро хлорида ртути(I).
Каломельный электрод (а также некоторые другие электроды металл/соль металла) оказались сами на практике пригодными в качестве электродов сравнения. Например, практическим применением является измерение разности потенциалов в растворе при помощи каломельного электрода. Такое измерение можно также применять для определения подходящего металла, особенно подходящего сплава металлов.
Разность потенциалов обычно описывают известным уравнением Нернста:
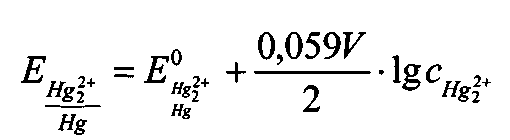
Как можно легко понять, потенциал Е зависит исключительно от концентрации нерастворимой быстро соли ртути. Если концентрация аниона, т.е. концентрация противоиона, сохраняется постоянной, то Е также остается постоянной. Этого можно достичь выбором очень высокой концентрации аниона.
Каломельный электрод состоит из ртути, самого электрода, покрытого твердым Hg2Cl2, и погруженного в насыщенный раствор KCl (высокая концентрация ионов Cl-). Солевой мостик применяют для точных измерений, чтобы подавить диффузионные потенциалы. Таблицы, содержащие величины, определенные таким устройством, следует всегда составлять из величин по отношению к такой точке отсчета (каломельный электрод).
Таким образом, каломельный электрод в качестве электрода второго типа является весьма подходящим в качестве электрода сравнения для измерений потенциалов. Каломельный электрод в качестве электрода сравнения выбран также в настоящем изобретении.
Устройство, указанное выше, можно теперь применять для выбора подходящих материалов, которые являются менее благородными, чем каломель, т.е. их потенциал сравнения находится в диапазоне от 0,3 до 2,5 эВ, предпочтительно, от 0,35 до 2,2 эВ, более предпочтительно, от 0,4 до 1,8 эВ, более предпочтительно, от 0,45 до 1,4 эВ, более предпочтительно, от 0,48 до 1,2 эВ, более предпочтительно, от 0,50 до 1,0 эВ, более предпочтительно, от 0,50 до 0,9 эВ, более предпочтительно, от 0,50 до 0,80 эВ, и особенно предпочтительно, от 0,50 до 0,70 эВ (указаны в абсолютных величинах, т.е. без алгебраического обозначения) по сравнению с каломельным электродом.
Особенно предпочтительным является внутренний каркас, состоящий из сплава, содержащего магний, кальций, марганец, железо, цинк, кремний, иттрий, цирконий и/или гадолиний, и более предпочтительно из сплава магния, кальция, марганца, железа, цинка, кремния, иттрия, циркония или гадолиния, содержание их в этом сплаве для более высоких массовых процентов указывается как масс.%.
Чтобы избежать возможность того, что металлический каркас растворяется слишком быстро и дезинтегрирует на фрагменты, которые могут вымываться из кровотока и вызывать инфаркт сердца, внутренний биорезорбируемый каркас из металла, соли металла, оксида металла и/или сплава металлов заключают в полимерное покрытие, покрывающее распорки стента или, как уже указывалось, все цилиндрическое тело стента.
Согласно изобретению, полимерное покрытие действует таким образом, что внутренний металлический каркас может сам растворяться внутри покрытия и ионы металлов могут выходить из покрытия в окружающую ткань. Так, например, полимерное покрытие является пористым или обеспечено каналами или отверстиями и действует таким образом, что ионы (анионы, а также катионы) могут выходить из него.
Согласно изобретению, полимерное покрытие может быть представлено в форме ионопроницаемой мембраны или может иметь нано- или микропоры, которые дают возможность проникать воде, а также выходить ионам.
Такие покрытия, пористые или обеспеченные каналами или отверстиями, можно получить либо нанесением полимерного покрытия на стент, что приводит к созданию проницаемого полимерного слоя, либо приданием полимерному покрытию проницаемости после нанесения покрытия. Термин “проницаемый” будет означать, что полимерное покрытие является пористым или имеет каналы, поры или отверстия, которые позволяют входить воде и выходить ионам.
Такие покрытия можно получить либо при помощи полимеров, которые сами образуют пористое покрытие на поверхности стента, либо при помощи раствора олигомеров и/или полимеров, которые наносят на поверхность стента и которые подвергают затем дополнительному сшиванию (например, глутаровым альдегидом и/или другими диальдегидами) после нанесения и несшитые олигомеры и полимеры затем вымывают из покрытия предпочтительно растворителем или применением самопроизвольно полимеризуемого вещества, такого как ненасыщенные жирные кислоты и производные ненасыщенных жирных кислот, где неполимеризованные вещества предпочтительно вымывают с поверхности стента растворителем. Следующими возможностями для генерации проницаемого полимерного покрытия на стенте являются нанесения сравнительно неэластичного или твердого, соответственно хрупкого полимерного покрытия, которое лопается при расширении стента и образует трещинки и таким образом становится проницаемым, предпочтительно, после раздувания стента. Кроме того, к полимерному раствору для покрытия можно добавить одно или несколько веществ, которые можно смыть после нанесения покрытия на стент и образования проницаемой структуры. Предпочтительным здесь является добавление солей в форме порошка, частиц или также в растворенной форме. Образованные соли полимерного покрытия могут быть вымыты из полимерного покрытия, предпочтительно, водой, с образованием пористой структуры покрытия. Конечно, соли можно не вымывать до имплантации стента. Стент с полимерным покрытием вместе со всеми включенными фармакологически приемлемыми солями можно также имплантировать еще в непроницаемой форме, соли затем естественным образом вымываются посредством кровотока, поскольку проницаемое покрытие генерируется только после того, как физиологически приемлемые соли, такие как NaCl, NaBr, NaI, NaSO4, KCl, NaHCO3 или другие физиологически приемлемые соли, известные специалисту в данной области, вымываются из полимерного покрытия.
Наконец, имеется возможность генерации непроницаемого полимерного покрытия на стенте, которому затем придают проницаемость при помощи химических, механических, оптических или других способов. Например, применение оснований или кислот может сделать полимерное покрытие проницаемым, этого можно также достичь применением лазеров или других механических способов полировки, таких как способы химической полировки или пескоструйной обработки. Такие способы известны специалисту в данной области и, конечно, их нужно приспосабливать для соответствующего покрытия, его толщины и твердости и для применяемых полимеров.
Гарантируется, что этим вариантом осуществления, по меньшей мере вначале, обеспечивается присутствие металлсодержащего внутреннего каркаса, который может оказывать достаточное расширяющее воздействие на сосуд для сохранения его открытым и предотвращения самопроизвольного возврата к прежнему состоянию, т.е. самопроизвольного спадения стенок сосуда после расширения вследствие поврежденных или расслабленных васкулярных мышц. Поскольку сосуд может восстанавливать свою эластичность и упругость спустя некоторое время, нет необходимости сохранять сосуд перманентно открытым стентом как постоянным имплантатом, т.е. как бионеразрушаемым или только медленно биоразрушаемым имплантатом.
Кроме того, имеется проблема рестеноза или стеноза (сужения) в бионеразрушаемых стентах, поскольку сосуд сдавливается или закупоривается внутри из-за зарастания стента клетками гладких мышц. Дополнительно имеется проблема помещения другого стента в месте, в которое был уже имплантирован бионеразрушаемый стент.
Кроме того, существует опасность позднего тромбоза при применении высвобождающих вещество стентов, изготовленных из известных бионеразрушаемых материалов, которые могут самопроизвольно привести, часто спустя даже один год, к острой закупорке. Такие тревожные результаты стали известны летом 2006 года. Поверхность стента, которая все же не составляет единое целое, вследствие цитотоксических действий активного агента, была названа как причина позднего тромбоза, имеющего место после этого времени. В связи с этим польза от применения высвобождающих вещество стентов до сих пор подвергается сильному сомнению.
Эти недостатки также устраняются стентом согласно изобретению, поскольку он растворяется полностью регулируемым образом после определенного времени. Полимерная оболочка согласно изобретению дает возможность проведения биологического разрушения металлического внутреннего каркаса без опасности отделения фрагментов, поскольку полимерная оболочка покрывает внутренний каркас полностью таким образом, что большие или также маленькие фрагменты не могут проникнуть через полимерное покрытие. В противоположность этому, возможным является проникновение ионов и солей, которые образуются из металлического каркаса в физиологических условиях.
Такие ионы металлов, а также их противоионы могут проникать через полимерное покрытие, соответственно, выходя через поры от нано- до микроразмера.
В особенно предпочтительном варианте осуществления настоящего изобретения внутренний металлический или металлсодержащий каркас разрушается быстрее в физиологических условиях, чем внешняя полимерная оболочка, так что пустая полимерная оболочка, проросшая в васкулярную стенку, остается там в течение некоторого времени, но при этом является эластичной, больше не оказывает значительного давления на васкулярную стенку и даже близко соответствует новой форме сосуда. Затем эта полимерная оболочка также биоразрушается, так что спустя 2-12 месяцев биоразрушаемый стент полностью растворяется. Таким образом, согласно изобретению, полимерное покрытие растворяется медленнее, чем металлическая внутренняя структура и предоставляет возможность для проникновения солей и ионов, так что внутренняя структура может раствориться и соли и ионы могут ресорбироваться из окружающей ткани. В этом особенно предпочтительном варианте осуществления настоящего изобретения покрытый стент сконструирован таким образом, что стент врастает в ткань до того, как биорезорбируемое покрытие начинает растворяться. Растворение внутреннего каркаса стента может происходить до того, как стент врастает в васкулярную ткань, тогда как предпочтительно, чтобы врастание и растворение внутреннего каркаса стента по существу имело место одновременно. Наоборот, скорость растворения внутренней структуры стента по сравнению с покрытием, нанесенным на него, является существенной в таком особенно предпочтительном варианте осуществления. Полимерное покрытие предпочтительно должно растворяться максимально до 15 масс.%, более предпочтительно, до 10 масс.% и особенно предпочтительно, до 5 масс.%, когда внутреннее тело стента растворяется полностью. Термин «полимерное покрытие» относится только к компонентам, образующим полимерное покрытие, а не к компонентам покрытия, которые не связываются в полимерную форму, такие как частицы соли, которые будут вымываться из покрытия посредством кровотока. Другими словами, скорость растворения внутреннего каркаса стента в отношении к полимерному покрытию будет составлять по меньшей мере до 10:1, предпочтительно, до 20:1, более предпочтительно, до 30:1, еще более предпочтительно, до 40:1 и особенно предпочтительно, до 50:1. Отношение 20:1 здесь означает, что по меньшей мере 20 масс.% внутреннего каркаса стента растворилось и высвободилось через полимерное покрытие, когда максимально 1 масс.% полимерного покрытия растворилось или биоразрушилось.
Способ определения кинетики растворения непокрытого металлического стента согласно изобретению состоит в помещении стента в трубку между двумя пористыми мембранами или пластинками-фильтрами и пропусканием физиологического солевого раствора, буфера PBS (фосфатный буфер с 14,24 г NaH2PO4, 2,72 г K2HPO4 и 9 г NaCl; рН 7,4; Т=37°С) или сыворотки крови через трубку, предпочтительно с такой же скоростью, что и скорость кровотока в сосудах тела человека.
Скорость растворения полимерного покрытия можно определить нанесением полимерного покрытия на бионеразрушаемый стент, например стент из нержавеющей стали, и помещением его подобным образом между двумя мембранами в трубке, через которую пропускают физиологический солевой раствор, буфер PBS или сыворотку крови.
Растворение стента можно изучать оптическим способом и дополнительно количественным измерением массы.
В другом варианте осуществления согласно изобретению полимерное покрытие демонстрирует углубления, отверстия и/или каналы, которые делают возможным проникновение солей или ионов, но имеют размеры не такие большие, чтобы через них могли пройти фрагменты металлического внутреннего каркаса.
Эти углубления, отверстия и/или каналы предпочтительно ориентированы перпендикулярно центральной оси отдельных стоек стента и, кроме того, они предпочтительно не расположены на концах стоек стента. Эти углубления, отверстия и/или каналы можно создать механическим, химическим, термическим или оптическим действием на полимер, например, механической обработкой, такой как пескоструйная обработка, химическими способами, такими как травление или окисление, механическими-химическими способами, такими как способы полирования, термическими способами, такими как плавление или выжигание, или оптическими способами, такими как лазерная обработка.
В другом особенно предпочтительном варианте осуществления углубления, отверстия и/или каналы заполняют фармакологически активным агентом. Подходящие активные агенты перечислены дополнительно ниже. Активный агент(ы), который вводят в углубления, отверстия и/или каналы, можно смешать с фармацевтически приемлемым носителем, таким как соль, контрастная среда, наполнитель, олигомер, органические соединения, такие как аминокислоты, витамины, углеводы, жирные кислоты, масла, жиры, воски, белки, пептиды, нуклеотиды или растворитель.
В качестве фармакологически приемлемого носителя можно применять, например, лактозу, крахмал, натриевую соль карбоксиметилкрахмала, сорбит, сахарозу, стеарат магния, дикальцийфосфат, сульфат кальция, тальк, маннит, этиловый спирт, поливиниловые спирты, поливинилпирролидоны, желатин, природные сахара, природные, а также синтетические камеди, такие как аравийская камедь или гуаровая камедь, альгинат натрия, бензоат натрия, ацетат натрия, глицериды, миристаты, такие как изопропилмиристат, пальмитаты, трибутил- и триэтилцитраты и их ацетилпроизводные, фталаты, такие как диметилфталат или дибутилфталат, бензиловый эфир бензойной кислоты, триацетин, 2-пирролидон, борную кислоту, силикаты магния и алюминия, природную carob-камедь, камедь карайи, гуаровую камедь, трагакант, агар, каррагенаны, целлюлозу, производные целлюлозы, такие как метилцеллюлоза, натриевую соль карбоксиметилцеллюлозы, гидроксипропилметилцеллюлозу, микрокристаллическую целлюлозу, а также альгинаты, оксиды алюминия и бентониты, полиэтиленгликоль, а также воски, такие как пчелиный воск, карнаубский воск, канделильский воск и тому подобное.
Дополнительными носителями могут быть витамины, такие как витамин А, витамин С (аскорбиновая кислота), витамин D, витамин Н, витамин K, витамин Е, витамин В1, витамин В2, витамин В3, витамин В5, витамин В6, витамин В12, тиамин, рибофлавин, ниацин, пиридоксин и фолиевая кислота.
Дополнительными подходящими носителями являются гепарин, сульфат гепарина, хитозан, хитин, сульфат хондроитина, коллаген, фибрин, ксантоны, флавоноиды, терпеноиды, целлюлоза, вискозное волокно, пептиды с 50-500 аминокислотами, нуклеотиды с 20-300 парами оснований, а также сахариды с 20-400 мономерами сахара, жирные кислоты, эфиры жирных кислот, производные жирных кислот, простые эфиры, липиды, липоиды, глицериды, триглицериды, сложный эфир гликоля, сложный эфир глицерина и масла, такие как льняное масло, конопляное масло, кукурузное масло, ореховое масло, рапсовое масло, соевое масло, подсолнечное масло, маковое масло, сафлоровое масло, жир зародышей пшеницы, шафранное масло, виноградное масло, масло энотеры, масло бурачника, масло чернушки посевной, масло водорослей, рыбий жир, жир печени трески и/или смеси вышеуказанных масел.
Подходящими аминокислотами являются глицин, аланин, валин, лейцин, изолейцин, серин, треонин, фенилаланин, тирозин, триптофан, лизин, аргинин, гистидин, аспартат, глутамат, аспарагин, глутамин, цистеин, метионин, пролин, 4-гидроксипролин, N,N,N-триметиллизин, 3-метилгистидин, 5-гидроксилизин, О-фосфоносерин, γ-карбоксиглутамат, ε-N-ацетиллизин, ω-N-метиларгинин, цитруллин, орнитин.
Кроме того, подходящими носителями являются нижеследующие жирные кислоты и эфиры нижеследующих жирных кислот: эйкозапентаеновая кислота (ЕРА), тимнодоновая кислота, докозагексаеновая кислота (DHA), α-линоленовая кислота, γ-линоленовая кислота, миристолеиновая кислота, пальмитолеиновая кислота, петрозелиновая кислота, олеиновая кислота, вакценовая кислота, гадолеиновая кислота, гондолеиновая кислота, гондоиновая кислота, эруциновая кислота, нервоновая кислота, элаидиновая кислота, трет-вацценовая кислота, линолевая кислота, γ-линоленовая кислота, дигомо-γ-линоленовая кислота, арахидоновая кислота, α-линоленовая кислота, стеаридоновая кислота, DPA, меадиновая кислота, стеллагептаеновая кислота, таксоловая кислота, пиноленовая кислота, сциадоновая кислота, таририновая кислота, санталбиновая или ксимениновая кислота, стеаролиновая кислота, 6,9-октадецениновая кислота, пирулиновая кислота, крепениновая кислота, гейстериновая кислота, ETYA, лауриновая кислота, миристиновая кислота, пальмитиновая кислота, маргариновая кислота, стеариновая кислота, арахиновая кислота, бегеновая кислота и лигноцериновая кислота, а также производные и смеси вышеуказанных жирных кислот.
Особенно предпочтительным, однако, является растворение по меньшей мере одного противовоспалительного, цитостатического, цитотоксического, антипролиферативного, агента против образования микротрубочек, антиангиогенного, антирестенозного (против рестеноза), антифунгицидного, противоопухолевого, антимиграционного, гипокоагулирующего и/или противотромбообразующего агента в растворителе и введение его в виде по существу чистого активного агента в углубления, отверстия и/или каналы в полимерном покрытии, что можно достичь посредством способа разбрызгивания или пипетирования. После выпаривания растворителя активный агент остается внутри углублений, отверстий и/или каналов.
Обычные органические растворители, такие как диметилсульфоксид, простой эфир, такой как диоксан, тетрагидрофуран (ТГФ), петролейный эфир, диэтиловый эфир, метил-трет-бутиловый эфир, кетоны, такие как ацетон, бутанон или пентанон, спирты, такие как метанол, этанол, пропанол, изопропанол, карбоновые кислоты, такие как муравьиная кислота, уксусная кислота, пропионовая кислота, амиды, такие как диметилформамид (DFA) или диметилацетамид, ароматические растворители, такие как толуол, бензол, ксилол, чистые углеводородные растворители, такие как пентан, гексан, циклогексан, галогенированные растворители, такие как хлороформ, метиленхлорид, тетрахлорид углерода, а также эфиры карбоновых кислот, такие как метиловый эфир уксусной кислоты и этиловый эфир уксусной кислоты, а также вода, служат в качестве растворителя в зависимости от растворимости активного агента.
Кроме того, особенно предпочтительным является добавление активного агента к контрастной среде или аналогу контрастной среды и введение его в этой форме в углубления, отверстия и/или каналы.
В качестве контрастных сред или аналогов контрастных сред можно применять обычные радиографические контрастные среды (позитивные, а также негативные контрастные среды), такие как контрастные среды, обычно применяемые для способов получения изображений (в артрографии, радиографии, компьютерной томографии (СТ), ядерной спиновой томографии, магнитной резонансной томографии (MRT)). Контрастные среды и/или аналоги контрастных сред обычно содержат барий, иод, марганец, железо, лантан, церий, празеодим, неодим, самарий, европий, гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий и/или лутеций, предпочтительно, в виде ионов в связанной и/или комплексной форме, где предпочтительными являются содержащие иод контрастные среды.
Следующие примеры можно назвать иодсодержащими контрастными средами:

Амидотризоевая кислота

Иотролан

Иопамидол
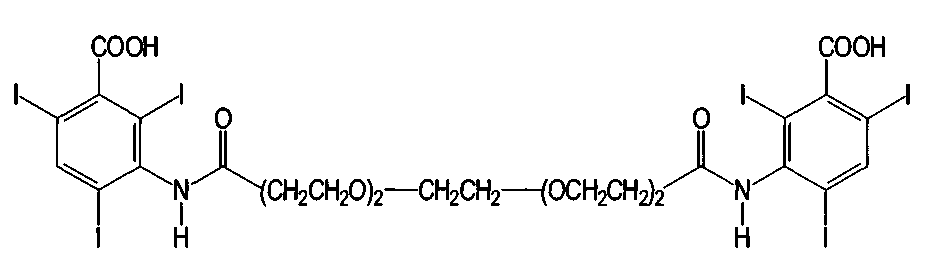
Иодоксамовая кислота
Следующим примером является иодлипиодол®, иодированный олеум папаверис, маковое масло. Исходное вещество иодированных контрастных сред, амидотризоат в форме натриевой и меглуминовой солей, является коммерчески доступным под торговым знаком гастрографин® и гастролюкс® (Германия, Швейцария).
Предпочтительными являются также гадолинийсодержащие или суперпарамагнитные частицы оксида железа, а также ферримагнитные или ферромагнитные частицы железа, такие как наночастицы.
Другим классом предпочтительных контрастных сред являются парамагнитные контрастные среды, которые обычно содержат лантаноид.
Среди парамагнитных веществ с неспаренными электронами имеется, например, гадолиний (Gd+3), имеющий всего семь неспаренных электронов. Кроме того, к этой группе относятся европий (Eu2+, Eu3+), диспрозий (Dy3+) и гольмий (Но3+). Эти лантаноиды можно также применять в хелатированной форме с применением, например, гемоглобина, хлорофилла, полиазакислот, поликарбоновых кислот и особенно EDTA, DTPA, DMSA, DMPS и DOTA в качестве хелатирующих агентов.
Примерами гадолинийсодержащих контрастных средств являются гадолиний и диэтилентриаминпентауксусная кислота.
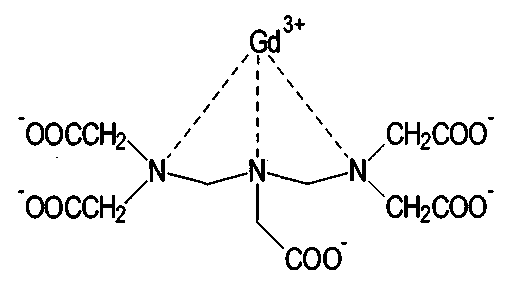
Гадопентетовая кислота (Gd-DPTA)
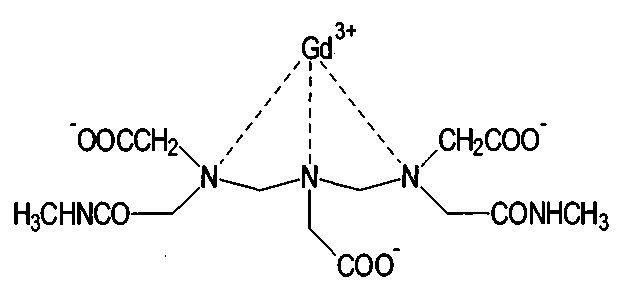
Гадодиамид

Гадотерат меглумина

Гадотеридол
Для увеличения переноса активного агента можно применять так называемые медиаторы переноса, которыми, однако, могут быть сами активные агенты. Особенно интересными в качестве медиаторов переноса являются химические соединения с низкой молекулярной массой, которые ускоряют или облегчают поглощение активного агента в васкулярную стенку, так чтобы присутствующий активный агент или комбинацию активных агентов можно было перенести регулируемым способом и в предполагаемой дозе во время краткосрочного контактирования. Такие свойства обнаружены у веществ, взаимодействующих непосредственно с липидным двойным слоем клеточной мембраны или с рецепторами на клеточной мембране, или проникающих в цитозоль через мембранные транспортные белки, действующие в качестве носителей, или каналов (ионные насосы), где они изменяют мембранный потенциал и таким образом мембранную проницаемость клеток. Поглощение активного агента в клетке таким образом облегчается и, соответственно, ускоряется.
К таким применимым соединениям относятся, например, сосудорасширяющие агенты, такие как брадикинин, каллидин, гистамин или NOS-синтаза, которая высвобождает сосудорасширяющий NO из L-аргинина, вещества растительного происхождения, такие как экстракт гингко билоба, ДМСО, ксантоны, флавоноиды, терпеноиды, растительные и животные красители, пищевые красители, NO-высвобождающие вещества, такие как тетранитрат пентаэритрита (PETN). Указанные выше контрастные среды и аналоги контрастных сред относятся к этой категории.
Углубления, отверстия и/или каналы, наполненные активным агентом или композицией активных агентов таким способом, что содержимое их растворяется относительно быстро и высвобождается, таким образом раскрывая или открывая углубления, отверстия и/или каналы непосредственно после имплантации стента. Активный агент внутри углублений, отверстий и/или каналов высвобождается очень быстро, так что это можно характеризовать как быстрое высвобождение, т.е. быстрое высвобождение, которое занимает время предпочтительно от нескольких часов до 2 дней.
Проблему рестеноза, соответственно направленное врастание стента в васкулярную стенку, можно, таким образом, устранить посредством начального высвобождения активного агента.
Такое быстрое высвобождение активного агента можно дополнительно сочетать с медленным высвобождением активного агента, принимая во внимание то, что это может быть тот же самый или другой активный агент. Этот активный агент наносят на полимерное покрытие так, чтобы полимерное покрытие действовало также в качестве носителя.
В полимерном покрытии предпочтительно содержится цитостатическая доза противовоспалительного, цитостатического, цитотоксического, антипролиферативного агента против образования микротрубочек, антиангиогенного, антирестенозного (против рестеноза), антифунгицидного, противоопухолевого, антимиграционного, гипокоагулирующего и/или противотромбообразующего агента. Этот активный агент затем высвобождается в количестве, соответствующем биоразрушению полимерного покрытия.
Таким образом, биорезорбируемый стент согласно изобретению дополнительно обеспечивает возможность высвобождения активного агента и особенно комбинации быстрого и медленного высвобождения активного агента. Кроме того, активные агенты, противодействующие адгезии тромбоцитов и соответственно образованию тромбов, можно применять направленным способом, обертыванием тела стента на люминальной стороне. Такие возможности позволяют направленным образом высвобождать активный агент или комбинацию активных агентов, которые особенно адаптированы к окружающей среде. Активные агенты можно применять в одном и том же стенте направленным способом и независимо друг от друга.
Таким образом, стент согласно изобретению имеет ряд убедительных преимуществ относительно известных вариантов осуществления. Первое, полимерная оболочка предотвращает дезинтеграцию и разрушение металлического каркаса, которые могут привести к серьезным последствиям. В особенно предпочтительных вариантах осуществления более быстрое биоразрушение внутреннего металлического или металлсодержащего каркаса по сравнению с полимерным покрытием гарантирует, что внутренний каркас растворяется первым, и его продукты растворения высвобождаются регулируемым способом и резорбируются тканью. Когда сосуд может возвращать подходящую поддержку своего расширения, внутренний каркас уже находится в состоянии растворения. После растворения внутренней структуры полимерная наружная оболочка также биоразрушается.
Вследствие структуры полимерной наружной оболочки с углублениями, отверстиями, каналами и/или порами получают систему, которая дополнительно сочетает быстрое и медленное высвобождение активного агента или комбинации активных агентов направленным способом.
Углубления, отверстия, каналы и/или поры можно заполнять активным агентом или композицией, содержащей активный агент, направленным способом, и активный агент может быстро высвобождаться из этих полостей, или всю поверхность или часть поверхности внешней полимерной оболочки покрывают активным агентом или композицией, содержащей активный агент. Здесь может быть предложен и реализован любой вариант осуществления.
Кроме того, имеется возможность внедрения в полимерный биоразрушаемый слой одного или также нескольких активных агентов, которые затем будут медленно высвобождаться в такой же степени, в какой полимерная наружная оболочка растворяется, т.е. биоразрушается.
Система является очень эластичной, имеет преимущества общепринятого элюирующего лекарственное средство стента и дополнительно сочетает быстрое лечение активным агентом с локальной длительной терапией и, кроме того, является полностью биоразрушаемой, так что после некоторого времени в теле пациента больше не присутствует чужеродное тело. Например, проблема позднего рестеноза из-за стента, которая в настоящее время беспокоит экспертов, может быть таким образом устранена на 100%.
Например, резорбируемый стент согласно изобретению может состоять из по меньшей мере 30 масс.%, предпочтительно, по меньшей мере 40 масс.%, более предпочтительно, по меньшей мере 50 масс.%, более предпочтительно, по меньшей мере 60 масс.%, более предпочтительно, по меньшей мере 70 масс.%, более предпочтительно, по меньшей мере 80 масс.% и особенно предпочтительно, по меньшей мере 90 масс.% металла цинка, кальция, марганца или железа.
Далее предпочтительно, чтобы имплантат согласно изобретению дополнительно содержал 0-60 масс.%, предпочтительно, 0,01-59 масс.%, более предпочтительно, 0,1-59%, еще более предпочтительно, 0,1-58 масс.% кальция. Особенно предпочтительно, когда масса кальция находится в диапазоне 1,5-50 масс.%, 2,0-40 масс.%, 2,5-30 масс.%, 3,0-20 масс.% и особенно предпочтительно, 3,5-10 масс.%
Вместо кальция или комбинации с кальцием имплантат согласно изобретению может содержать 0-80 масс.%, предпочтительно, 0,01-70 масс.%, более предпочтительно, 0,1-60 масс.%, более предпочтительно, 1-50 масс.% магния. Масса магния предпочтительно находится в диапазоне 0,1-80 масс.%, 5,0-70 масс.%, 7,5-60 масс.%, 10,0-50 масс.% и особенно предпочтительно, в диапазоне 20-40 масс.%.
Помимо цинка и/или железа и необязательно кальция и/или магния стент изобретения может дополнительно содержать по меньшей мере один металл, выбранный из группы, содержащей литий, натрий, магний, алюминий, калий, кальций, скандий, титан, ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, галлий, кремний, иттрий, цирконий, ниобий, молибден, технеций, рутений, родий, палладий, серебро, индий, олово, лантан, церий, празеодим, неодим, прометий, самарий, европий, гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий, лутеций, тантал, вольфрам, рений, платину, золото, свинец и/или по меньшей мере одну соль металла с катионом, выбранным из группы, содержащей Li+, Na+, Mg2+, K+, Ca2+, Sc3+, Ti2+, Ti4+, V2+, V3+, V4+, V5+, Cr3+, Cr4+, Cr6+, Mn2+, Mn3+, Mn4+, Mn5+, Mn6+, Mn7+, Fe2+, Fe3+, Co2+, Co3+, Ni2+, Cu+, Cu2+, Zn2+, Ga+, Ga3+, Al3+, Si4+, Y3+, Zr2+, Zr4+, Nb2+, Nb4+, Nb5+, Mo4+, Mo6+, Tc2+, Tc3+, Tc4+, Tc5+, Tc6+, Tc7+, Ru3+, Ru4+, Ru5+, Ru6+, Ru7+, Ru8+, Rh3+, Rh4+, Pd2+, Pd3+, Ag+, In+, In3+, Ta4+, Ta5+, W4+, W6+, Pt2+, Pt3+, Pt4+, Pt5+, Pt6+, Au+, Au3+, Au5+, Sn2+, Sn4+, Pb2+, Pb4+, La3+, Ce3+, Ce4+, Gd3+, Nd3+, Pr3+, Tb3+, Pr3+, Pm3+, Sm3+, Eu2+, Dy3+, Ho3+, Er3+, Tm3+, Yb3+. Помимо указанных выше металлов и солей металлов, которые взятые вместе присутствуют в количестве меньше 5 масс.%, могут присутствовать небольшие количества неметаллов, углерода, серы, азота, кислорода и/или водорода.
В частности может быть подходящим присутствие иттрия в количествах 0,01-10 масс.%, предпочтительно, 0,1-9 масс.%, более предпочтительно, 0,5-8 масс.%, более предпочтительно, 1,0-7,0 масс.%, более предпочтительно, 2,0-6,0 масс.% и особенно предпочтительно, 3,0-5,0 масс.%.
Предпочтительная композиция имплантата изобретения содержит, например,
50% (масс./масс.) - 90% (масс./масс.) цинка
0,0% (масс./масс.) - 50% (масс./масс.) магния
0,0% (масс./масс.) - 50% (масс./масс.) кальция
0,0% (масс./масс.) - 10% (масс./масс.) иттрия
0,0% (масс./масс.) - 10% (масс./масс.) редких земель
0,0% (масс./масс.) - 5% (масс./масс.) других металлов, солей металлов, неметаллов, углерода, серы, азота, кислорода, водорода.
Углерод, сера, азот, кислород, водород или другие неметаллы или полуметаллы могут присутствовать в форме анионов и/или полимеров.
Следующими предпочтительными композициями являются:
55% (масс./масс.) - 100% (масс./масс.) цинка
0,1% (масс./масс.) - 40% (масс./масс.) магния
0,1% (масс./масс.) - 40% (масс./масс.) кальция
0,01% (масс./масс.) - 9% (масс./масс.) иттрия
0,01% (масс./масс.) - 7% (масс./масс.) редких земель
0,01% (масс./масс.) - 4% (масс./масс.) других металлов, солей металлов, неметаллов, углерода, серы, азота, кислорода, водорода.
75% (масс./масс.) - 95% (масс./масс.) цинка
0,01% (масс./масс.) - 15% (масс./масс.) магния
0,01% (масс./масс.) - 15% (масс./масс.) кальция
0,01% (масс./масс.) - 6% (масс./масс.) иттрия
0,01% (масс./масс.) - 3% (масс./масс.) редких земель
0,01% (масс./масс.) - 2% (масс./масс.) других металлов, солей металлов, неметаллов, углерода, серы, азота, кислорода, водорода.
41% (масс./масс.) - 91% (масс./масс.) цинка
7,0% (масс./масс.) - 55% (масс./масс.) магния
0,00% (масс./масс.) - 10% (масс./масс.) кальция
0,00% (масс./масс.) - 6% (масс./масс.) иттрия
0,01% (масс./масс.) - 2% (масс./масс.) редких земель, других металлов, солей металлов, неметаллов, углерода, серы, азота, кислорода, водорода.
30% (масс./масс.) - 93% (масс./масс.) цинка
0,00% (масс./масс.) - 10% (масс./масс.) магния
2,0% (масс./масс.) - 69% (масс./масс.) кальция
0,00% (масс./масс.) - 6% (масс./масс.) иттрия
0,01% (масс./масс.) - 2% (масс./масс.) редких земель, других металлов, солей металлов, неметаллов, углерода, серы, азота, кислорода, водорода.
55% (масс./масс.) - 100% (масс./масс.) железа
0,1% (масс./масс.) - 40% (масс./масс.) магния
0,1% (масс./масс.) - 40% (масс./масс.) кальция
0,01% (масс./масс.) - 9% (масс./масс.) иттрия
0,01% (масс./масс.) - 7% (масс./масс.) редких земель
0,01% (масс./масс.) - 4% (масс./масс.) других металлов, солей металлов, неметаллов, углерода, серы, азота, кислорода, водорода.
55% (масс./масс.) - 100% (масс./масс.) железа
0,1% (масс./масс.) - 40% (масс./масс.) цинка
0,1% (масс./масс.) - 40% (масс./масс.) кальция
0,01% (масс./масс.) - 9% (масс./масс.) иттрия
0,01% (масс./масс.) - 7% (масс./масс.) редких земель
0,01% (масс./масс.) - 4% (масс./масс.) других металлов, солей металлов, неметаллов, углерода, серы, азота, кислорода, водорода.
55% (масс./масс.) - 100% (масс./масс.) железа
0,1% (масс./масс.) - 40% (масс./масс.) цинка
0,1% (масс./масс.) - 40% (масс./масс.) магния
0,01% (масс./масс.) - 9% (масс./масс.) иттрия
0,01% (масс./масс.) - 7% (масс./масс.) редких земель
0,01% (масс./масс.) - 4% (масс./масс.) других металлов, солей металлов, неметаллов, углерода, серы, азота, кислорода, водорода.
0,1% (масс./масс.) - 30% (масс./масс.) железа
0,1% (масс./масс.) - 30% (масс./масс.) цинка
0,1% (масс./масс.) - 30% (масс./масс.) кальция
0,1% (масс./масс.) - 30% (масс./масс.) магния
0,01% (масс./масс.) - 10% (масс./масс.) иттрия
0,01% (масс./масс.) - 4% (масс./масс.) редких земель
0,01% (масс./масс.) - 4% (масс./масс.) других металлов, солей металлов, неметаллов, углерода, серы, азота, кислорода, водорода.
55,0% (масс./масс.) - 75,0% (масс./масс.) магния
10,0% (масс./масс.) - 20,0% (масс./масс.) кальция
5,0% (масс./масс.) - 15,0% (масс./масс.) иттрия
5,0% (масс./масс.) - 10,0% (масс./масс.) других металлов, солей металлов или редких земель
0,5% (масс./масс.) - 10,0% (масс./масс.) неметаллов, углерода, серы, азота, кислорода, водорода.
20,0% (масс./масс.) - 40,0% (масс./масс.) магния
20,0% (масс./масс.) - 40,0% (масс./масс.) кальция
20,0% (масс./масс.) - 40,0% (масс./масс.) цинка
0,0% (масс./масс.) - 5,0% (масс./масс.) иттрия
0,1% (масс./масс.) - 5,0% (масс./масс.) других металлов, солей металлов или редких земель
0,1% (масс./масс.) - 5,0% (масс./масс.) неметаллов, углерода, серы, азота, кислорода, водорода.
80% (масс./масс.) - 95% (масс./масс.) магния
0,0% (масс./масс.) - 4% (масс./масс.) кальция
0,1% (масс./масс.) - 4% (масс./масс.) иттрия
0,0% (масс./масс.) - 4% (масс./масс.) других металлов, солей металлов или редких земель
0,1% (масс./масс.) - 4% (масс./масс.) неметаллов, углерода, серы, азота, кислорода, водорода.
Очевидно, что для перечисленных композиций сумма всех компонентов должна быть 100,00 масс.%.
Термин “другие металлы” относится предпочтительно к титану, цирконию, ниобию, танталу, кремнию, литию, натрию, калию и марганцу и термин “неметаллы” предпочтительно относится к углероду, азоту и кислороду.
Термин “резорбируемый” в настоящем изобретении означает, что имплантат медленно растворяется в организме в течение некоторого времени и в некоторой точке присутствуют только его продукты разложения в растворенной форме. В этой точке твердые компоненты или фрагменты имплантата больше не присутствуют. Продукты разложения должны быть по существу безвредными в физиологических условиях и должны привести к образованию ионов или молекул, которые либо, как бы то ни было, находятся в организме, либо могут разрушаться организмом в безвредные вещества, либо могут быть экскретированы.
Металлами, которые можно применять в комбинации с цинком, предпочтительно являются следующие металлы: литий, натрий, магний, алюминий, калий, кальций, скандий, титан, ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, галлий, кремний, иттрий, цирконий, ниобий, молибден, технеций, рутений, родий, палладий, серебро, индий, олово, лантан, церий, празеодим, неодим, прометий, самарий, европий, гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий, лютеций, тантал, вольфрам, рений, платина, золото, свинец. Особенно предпочтительными являются магний, кальций, железо, иттрий. Следующими предпочтительными являются комбинации цинка с одним из вышеуказанных металлов или без него вместе с солями металлов. Такие комбинации можно описать как содержащие соль металла бани с расплавом цинка или как содержащие соль металла сплавы цинка. Содержание солей металлов может быть только таким высоким, чтобы гарантировать достаточную эластичность материала. Расширяемость также не должна значительно ухудшаться. Подходящими солями металлов являются соли металлов, указанные дополнительно ниже, и особенно соли магния, кальция, железа и иттрия.
Лучшим, чем применение металлов, является, однако, применение резорбируемых сплавов, которые, например, могут содержать вместе с цинком следующие металлы: литий, натрий, магний, алюминий, калий, кальций, скандий, титан, ванадий, хром, марганец, железо, кобальт, никель, медь, цинк, галлий, кремний, иттрий, цирконий, ниобий, молибден, технеций, рутений, родий, палладий, серебро, индий, олово, тантал, церий, празеодим, неодим, прометий, самарий, европий, гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий, лютеций, тантал, вольфрам, рений, платину, золото, свинец. Такие металлы частично включают только в малых количествах.
Предпочтительными являются сплавы магний/цинк, содержащие цинк в диапазоне 10-78 масс.%, предпочтительно, 25-68 масс.% и особенно предпочтительно, 36-53 масс.%. Далее предпочтительно, чтобы этот сплав магний/цинк дополнительно содержал скандий, титан, ванадий, иттрий, цирконий, ниобий, молибден, технеций, рутений, родий, палладий, серебро или индий и особенно иттрий в количестве 0,3-11, предпочтительно, 0,7-10, более предпочтительно, 1,1-8,5 и особенно предпочтительно, 2-7 масс.%.
Далее предпочтительными являются сплавы, содержащие помимо цинка в основном кальций, магний, железо, олово, цинк или литий вместе с до 10 масс.% скандия, иттрия, лантана, церия, празеодима, неодима, прометия, самария, европия, гадолиния, тербия, диспрозия, гольмия, эрбия, тулия и/или иттербия.
Кроме того, особенно предпочтительными являются соли вышеуказанных металлов. Такие соли металлов содержат предпочтительно по меньшей мере один из следующих ионов металлов: Li+, Ве2+, Na+, Mg2+, K+, Ca2+, Sc3+, Ti2+, Ti4+, V2+, V3+, V4+, V5+, Cr2+, Cr3+, Cr4+, Cr6+, Mn2+, Mn3+, Mn4+, Mn5+, Mn6+, Mn7+, Fe2+, Fe3+, Co2+, Co3+, Ni2+, Cu+, Cu2+, Zn2+, Ga+, Ga3+, Al3+, Si4+, Y3+, Zr2+, Zr4+, Nb2+, Nb4+, Nb5+, Mo4+, Mo6+, Tc2+, Tc3+, Tc4+, Tc5+, Tc6+, Tc7+, Ru3+, Ru4+, Ru5+, Ru6+, Ru7+, Ru8+, Rh3+, Rh4+, Pd2+, Pd3+, Ag+, In+, In3+, Ta4+, Ta5+, W4+, W6+, Pt2+, Pt3+, Pt4+, Pt5+, Pt6+, Au+, Au3+, Au5+, Sn2+, Sn4+, Pb2+, Pb4+, La3+, Ce3+, Ce4+, Gd3+, Nd3+, Pr3+, Tb3+, Pr3+, Pm3+, Sm3+, Eu2+, Dy3+, Ho3+, Er3+, Tm3+, Yb3+.
Применяемые анионы включают в себя галогены, такие как F-, Cl-, Br-, оксиды и гидроксиды, такие как ОН-, О2-, сульфаты, карбонаты, оксалаты, фосфаты, такие как HSO4-, SO42-, HCO3-, CO32-, HC2O4-, C2O42-, H2PO4-, HPO42-, PO43-, и особенно карбоксилаты, такие как НСОО-, СН3СОО-, С2Н5СОО-, С3Н7СОО-, С4Н9СОО-, С5Н11СОО-, С6Н13СОО-, С7Н15СОО-, С8Н17СОО-, С9Н19СОО-, PhCOO-, PhCH2COO-.
Кроме того, предпочтительными являются соли следующих кислот: серной кислоты, сульфоновой кислоты, фосфорной кислоты, азотной кислоты, азотистой кислоты, перхлорной кислоты, бромистоводородной кислоты, хлористоводородной кислоты, муравьиной кислоты, уксусной кислоты, пропионовой кислоты, янтарной кислоты, щавелевой кислоты, глюконовой кислоты (гликоновой кислоты, декстроновой кислоты), молочной кислоты, яблочной кислоты, винной кислоты, тартроновой кислоты (гидроксималоновой кислоты, гидроксипропандиовой кислоты), фумаровой кислоты, лимонной кислоты, аскорбиновой кислоты, малеиновой кислоты, малоновой кислоты, гидроксималеиновой кислоты, пировиноградной кислоты, фенилуксусной кислоты, (о-, м- или п-), толуиловой кислоты, бензойной кислоты, п-аминобензойной кислоты, п-гидроксибензойной кислоты, салициловой кислоты, п-аминосалициловой кислоты, метансульфоновой кислоты, этансульфоновой кислоты, гидроксиэтансульфоновой кислоты, этиленсульфоновой кислоты, п-толуолсульфоновой кислоты, нафтилсульфоновой кислоты, нафтиламиносульфоновой кислоты, сульфаниловой кислоты, камфорасульфоновой кислоты, тунговой кислоты, хинной кислоты, о-метилминдальной кислоты, бензолсульфоной кислоты, метионина, триптофана, лизина, аргинина, пикриновой кислоты (2,4,6-тринитрофенола), адипиновой кислоты, d-о-толилвинной кислоты, глутаровой кислоты.
Кроме того, предпочтительными являются соли аминокислот, содержащие, например, одну или несколько из следующих аминокислот: глицина, аланина, валина, лейцина, изолейцина, серина, треонина, фенилаланина, тирозина, триптофана, лизина, аргинина, гистидина, аспартата, глутамата, аспаразина, глутамина, цистеина, метионина, пролина, 4-гидроксипролина, N,N,N-триметиллизина, 3-метилгистидина, 5-гидроксилизина, О-фосфосерина, γ-карбоксиглутамата, ε-N-ацетиллизина, ω-N-метиларгинина, цитруллина, орнитина. Обычно применяют аминокислоты, имеющие L-конфигурацию. В другом предпочтительном варианте осуществления по меньшей мере некоторые из применяемых аминокислот имеют D-конфигурацию.
Другими предпочтительными резорбируемыми веществами для изготовления имплантата являются соли металлов, такие как хлорид кальция, сульфат кальция, фосфат кальция, цитрат кальция, хлорид цинка, сульфат цинка, оксид цинка, цитрат цинка, сульфат железа, фосфат железа, хлорид железа, оксид железа, цинк, хлорид магния, сульфат магния, фосфат магния или цитрат магния. Такие соли металлов предпочтительно применяют в количествах 0,01-12 масс.%.
Другим предпочтительным вариантом осуществления является комбинация резорбируемого металла, или резорбируемой соли, или резорбируемого сплава металлов вместе с резорбируемым полимером. Такая комбинация может означать, что имплантат был изготовлен из смеси, содержащей металл, сплав металлов и/или соль металла вместе с биорезорбируемым полимером. Такая комбинация может означать, что имплантат был изготовлен из смеси, содержащей металл, сплав металлов и/или соль металла вместе и биоразрушаемый полимер, или что имплантат построен из разных слоев, где один слой содержит преимущественно или исключительно метал, соль металла и/или сплав металлов и другой или несколько других слоев состоят из одного или нескольких биорезорбируемых полимеров.
Особенно подходящими для получения биорезорбируемой внешней оболочки являются нижеследующие биорезорбируемые полимеры. Эти биорезорбируемые полимеры, однако, можно добавлять к металлу, соли металла или сплаву металлов, образующих внутреннюю структуру, где массовый процент органических полимеров не должен превышать 50 масс.% общей внутренней структуры, предпочтительно, должен быть меньше 40 масс.%, более предпочтительно, меньше 30 масс.% и особенно предпочтительно, меньше 20 масс.%.
Согласно изобретению, в качестве резорбируемых или биоразрушаемых полимеров можно применять следующие полимеры: полидиоксанон, поликапролактон, полиглюконат, сополимер поли(молочной кислоты) и полиэтиленоксида, модифицированную целлюлозу, полигидроксибутират, полиаминокислоты, полимер фосфатного эфира, поливалеролактон, поли-ε-декалактон, полилактоновую кислоту, полигликолевую кислоту, полилактиды, полигликолиды, сополимеры полилактидов и полигликолидов, поли-ε-капролактон, полигидроксимасляную кислоту, полигидроксибутираты, полигидроксивалераты, полигидроксибутират-со-валерат, поли-(1,4-диоксан-2,3-он), поли-(1,3-диоксан-2-он), поли-пара-диоксанон, полиангидриды, полимеры ангидрида малеиновой кислоты, полигидроксиметакрилаты, фибрин, полицианоакрилаты, поликапролактондиметилакрилаты, поли-β-малеиновую кислоту, поликапролактонбутилакрилаты, мультиблоксополимеры из олигокапролактондиолов и олигодиоксанондиолов, мультиблоксополимеры полимера простого и полимера сложного эфира из ПЭГ и поли(бутилентерефталатов, полипиволатолактоны, полимеры триметилкарбонатов гликолевой кислоты, поликапролактонгликолиды, поли-(γ-этилглутамат), поли(DTH-иминокарбонат), поли(DTE-со-DT-карбонат), поли(бисфенол А-иминокарбонат), полиортоэфиры, полимер триметилкарбоната гликолевой кислоты, политриметилкарбонаты, полииминокарбонаты, поли-(N-винил)пирролидон, поливиниловые спирты, поли(сложный эфир)амиды, гликолизированные сложные полиэфиры, полифосфоэфиры, полифосфазены, поли-[п-карбоксифенокси)пропан], полиангидриды полигидроксипентановой кислоты, полиэтиленоксидпропиленоксид, мягкие полиуретаны, полиуретаны, имеющие аминокислотные остатки в главной цепи, полимеры простых эфиров и сложных эфиров, такие как полиэтиленоксид, полиалкеноксалаты, полиортоэфиры, а также их сополимеры, липиды, каррагенаны, фибриноген, крахмал, коллаген, полимеры на основе белков, полиаминокислоты, синтетические полиаминокислоты, зеин, полигидроксиалканоаты, пектиновую кислоту, актиновую кислоту, карбоксиметилсульфат, альбумин, гиалуроновую кислоту, хитозан и его производные, гепарансульфаты и их производные, гепарины, хондроитинсульфат, декстран, β-циклодекстрины, сополимеры с ПЭГ и полипропиленгликолем, гуммиарабик, гуар, желатин, коллаген-N-гидроксисукцинимид, липиды, фосфолипиды, полиакриловую кислоту, полиакрилаты, полиметилметакрилат, полибутилметакрилат, полиакриламид, полиакрилонитрилы, полиамиды, поли(простой эфир)амиды, полиэтиленамин, полиимины, поликарбонаты, поликарбоуретаны, поливинилкетоны, поливинилгалогениды, поливинилиденгалогениды, поливиниловые простые эфиры, полиизобутилены, поливинилароматические соединения, поливиниловые сложные эфиры, поливинилпирролидоны, полиоксиметилены, политетраметиленоксид, полиэтилен, полипропилен, политетрафторэтилен, полиуретаны, поли(простой эфир)уретаны, силиконполи(простой эфир)уретаны, силиконполиуретаны, силиконполикарбонатуретаны, полиолефиновые эластомеры, камеди EPDM, фторсиликоны, карбоксиметилхитозаны, поли(ариловый простой эфир)(простой эфир)кетоны, поли(простой эфир)(простой эфир)кетоны, полиэтилентерефталат, поливалераты, карбоксиметилцеллюлоза, целлюлоза, гидратцеллюлозное волокно, триацетаты гидратцеллюлозного волокна, нитраты целлюлозы, ацетаты целлюлозы, гидроксиэтилцеллюлоза, бутираты целлюлозы, ацетобутираты целлюлозы, этилвинилацетатные сополимеры, полисульфоны, эпоксидные смолы, смолы ABS, камеди EPDM, силиконы, такие как полисилоксаны, полидиметилсилоксаны, поливинилгалогены и сополимеры, простые эфиры целлюлозы, триацетаты целлюлозы, хитозаны и сополимеры и/или смеси указанных выше полимеров.
Особенно предпочтительными биоразрушаемыми полимерами являются полидиоксанон, поликапролактон, полиглюконат, полиамиды, сополимер поли(молочной кислоты) и полиэтиленоксида, полисахариды, такие как гиалуроновая кислота, хитозан, регенерированная целлюлоза, модифицированная целлюлоза, гидроксипропилметилцеллюлоза, коллаген, желатин, полигидроксибутират (РНВТ) и сополимеры полигидроксибутирата, полиангидриды (PAN), полифосфоэфиры, сложный полиэфир, полиаминокислоты, полигликолевая кислота, поли-ε-капролактон, полифосфатный эфир, полиортоэфиры, поли-(L-лактид) (PLLA), поли-(D,L-лактид) (PLA), полигликолид (PGA), поли-(L-лактид-со-D,L-лактид) (PLLA/PLA), поли-(L-лактид-со-гликолид) (PLLA/PGA), поли-(D,L-лактид-со-гликолид) (PLA/PGA), поли(гликолид-со-триметиленкарбонат) (PGA/PTMC), полиэтиленоксид (РЕО), полидиоксанон (PDS), полипропиленфумарат, поли(этилглутамат-со-глутаминовая кислота), поли(трет-бутоксикарбонилметилглутамат), поликапролактон (PCL), поликапролактон-со-бутилакрилат, полифосфазен, поли-(D,L-лактид-со-капролактон) (PLA/PCL), поли(гликолид-со-капролактон) (PGA/PCL), ангидрид малеиновой кислоты и его сополимеры, полиаминокислоты, полидепсипиптиды, сополимеры ангидрида малеиновой кислоты, полифосфазены, полииминокарбонаты, поли[(97,5% диметилтриметиленкарбонат)-со-(2,5% триметиленкарбонат)], цианоакрилат, полиэтиленоксид, а также сополимеры и смеси вышеуказанных полимеров.
Далее предпочтительными являются полиненасыщенные жирные кислоты, сшиваемые посредством автополимеризации, такие как эйкозапентаеновая кислота, тимнодоновая кислота, докозагексаеновая кислота, арахидоновая кислота, линолевая кислота, α-линоленовая кислота, γ-линоленовая кислота, а также смеси вышеуказанных жирных кислот и особенно смеси чистых ненасыщенных соединений. Таким образом, можно применять также масла, такие как льняное масло, конопляное масло, кукурузное масло, ореховое масло, рапсовое масло, соевое масло, подсолнечное масло, маковое масло, сафлоровое масло, жир проростков пшеницы, масло Safflor, виноградное масло, масло энотеры, масло бурачника, масло чернушки посевной, масло водорослей, рыбий жир, жир печени трески, содержащие также большое количество ненасыщенных жирных кислот. Следующими предпочтительными веществами для полимерного покрытия являются омега-3- и омега-6-жирные кислоты, а также все вещества, которые содержат по меньшей мере один остаток омега-3- и/или омега-6-жирной кислоты. Такие вещества обладают значительной способностью к автополимеризации.
Способность к отверждению, т.е. способность к автополимеризации, определяется составом масел, называемых также высыхающими маслами, и основана на высоком содержании незаменимых жирных кислот, именно на двойных связях ненасыщенных жирных кислот. На воздухе радикалы, образующиеся при помощи кислорода у двойных связей молекул жирных кислот, инициируют радикальную полимеризацию и развитие реакции, так что жирные кислоты образуют поперечные связи в своих молекулах, тем самым теряя свои двойные связи. Автополимеризацию называют также самополимеризацией и она может, например, инициироваться при помощи кислорода, особенно кислорода из воздуха, или другими инициаторами образования радикалов. Другая возможность состоит в инициировании автополимеризации при помощи электромагнитного излучения, особенно света.
Следующими предпочтительными резорбируемыми полимерами являются полиметилметакрилаты (РММА), политетрафторэтилен (PTFE), полиуретаны, поливинилхлориды (ПВХ), полидиметилсилоксаны (PDMS), сложные полиэфиры, найлоны и полилактиды и полигликолиды.
Особенно предпочтительными для получения внешней полимерной оболочки являются сложные полиэфиры, полилактиды, а также сополимеры диолов и сложных эфиров или диолов и лактидов. В качестве диолов можно применять, например, этан-1,2-диол, пропан-1,2-диол или бутан-1,2-диол.
Для полимерного слоя согласно изобретению особенно применяют сложные полиэфиры. Из группы сложных полимеров предпочтительными являются такие полимеры, которые имеют следующее повторяющееся звено:

В изображенных повторяющихся звеньях R, R', R” и R”' представляют собой алкильный остаток с 1-5 атомами углерода, особенно метил, этил, пропил, изопропил, н-бутил, втор-бутил, трет-бутил, изобутил, н-пентил или циклопентил и предпочтительно метил или этил. Y равно целому числу от 1 до 9 и Х означает степень полимеризации. Особенно предпочтительными являются следующие полимеры с показанными повторяющимися звеньями:
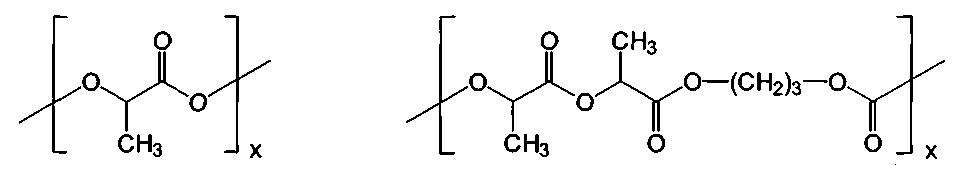
Эти резорбируемые полимеры получают на основе молочной и гликолевой кислот. Применение резорбируемых полимеров является по существу особенно предпочтительным в настоящем изобретении. При получении резорбируемых медицинских имплантатов главным образом применяют гомополимеры молочной кислоты (полилактиды). Сополимеры молочной и гликолевой кислот можно применять в качестве исходных материалов при получении капсул с активным агентом для регулируемого высвобождения фармацевтически активных агентов.
Таким образом, особенно полимеры на основе молочной и гликолевой кислот и сополимеры (чередующиеся или статические) и блок-сополимеры (например, триблок-сополимеры) обеих кислот являются предпочтительными для применения согласно изобретению.
Следующими представителями резорбируемых полимеров могут быть биорезорбирумые полимеры, названные резормерами®, от Boehringer Ingelheim GmbH, а именно поли(L-лактиды) общей формулы -(C6H8O4)n-, такие как L 210, L 210 S, L 207 S, L 209 S, поли(L-лактид-со-D,L-лактиды) общей формулы -(C6H8O4)n-, такие как LR 706, LR 708, L 214 S, LR 704, поли(L-лактид-со-триметилкарбонаты) общей формулы -[(C6H8O4)x-(C4H6O3)y]n-, такие как LT 706, поли(L-лактид-со-гликолиды) общей формулы -[(C6H8O4)x-(C4H4O4)y]n-, такие как LG 824, LG 857, поли(L-лактид-со-ε-капролактоны) общей формулы -[(C6H8O4)x-(C6H10O2)y]n-, такие как LC 703, поли(D,L-лактид-со-гликолиды) общей формулы -[(C6H8O4)x-(C4H4O4)y]n-, такие как RG 509 S, RG 502 H, RG 503 H, RG 504 H, RG 502, RG 503, RG 504, поли(D,L-лактиды) общей формулы -(C6H8O4)n-, такие как R 202 S, R 202 Н, R 203 S и R 203 H. Резомер® 203 S является здесь последующим членом особенно предпочтительного полимера резормера® R 203. Особенно предпочтительным является применение R203 и LT 706 в массовом отношении 70 масс.% к 30 масс.%.
Следует указать снова, что предметом настоящего изобретения не является предоставление биорезорбируемого стента или предоставление биорезорбируемого сплава металлов для стента, а комбинация биорезорбируемого каркаса стента с полимерным биорезорбируемым покрытием, которое делает возможным вхождение воды и выпуск ионов, и в особенно предпочтительных вариантах осуществления внутренний каркас стента значительно быстрее разрушается, чем внешнее покрытие.
Металлы и сплавы металлов, подходящие для получения биоразрушаемых каркасов стентов, являются достаточно известными из литературы. По существу можно применять любой сплав металлов, содержащий в качестве основного компонента магний, цинк, кальций или железо.
Изобретение состоит только в нанесении полимерного покрытия на биоразрушаемые металлические каркасы, где полимерное покрытие высвобождает продукты разрушения внутреннего каркаса стента в окружающую среду, т.е. они проходят через полимерное покрытие, и в предпочтительном варианте осуществления полимерное покрытие начинает растворяться не раньше, чем внутренний каркас стента уже по существу биоразрушится. Это означает, что полимерное покрытие содержит в сохранности внутренний каркас стента или фрагменты внутреннего каркаса стента в течение длительного времени до тех пор, пока стент не врастет в окружающую ткань или фрагменты внутреннего каркаса стента, которые могут вызвать инфаркт сердца, не смогут больше проходить через полимерное покрытие. Эту проблему можно разрешить согласно изобретению множеством вариантов осуществления, в которых специалист в данной области знает биоразрушаемые материалы стента, соответственно сплавы металлов, а также биоразрушаемые полимерные покрытия и в которых их следует сочетать только согласно идее настоящего изобретения. Когда специалист в данной области знает идею настоящего изобретения, такие комбинации больше не обладают признаками изобретения, но требуют только некоторых стандартных испытаний для определения проницаемости ионов и скорости разрушения каркаса стента и полимерного покрытия.
Проницаемость ионов можно определить, например, помещением стента, покрытого согласно изобретению, в водный раствор и измерением электрической проводимости раствора после некоторых интервалов времени или определением осмотического давления, или определением содержания ионов раствора при помощи спектроскопических способов.
Особенно предпочтительный вариант осуществления настоящего изобретения относится к имплантатам с внутренней металлической структурой, которая покрыта биоразрушаемым полимером, выбранным из полиметилметакрилата (РММА), политетрафторэтилена (PTFE), полиуретана, поливинилхлорида (ПВХ), полидиметилсилоксана (PDMS), сложного полиэфира, найлона или полилактида, и особенно сложного полиэфира и/или полилактида. Полимерное покрытие далее обнаруживает углубления, отверстия или каналы, которые расположены перпендикулярно продольной оси соответствующей распорки стента.
Поры, углубления, отверстия или каналы предпочтительно равномерно распределены по всей поверхности стента и по существу расположены в полимере перпендикулярно по направлению к внутреннему металлическому каркасу. Предпочтительно имеется 1-20 таких пор, углублений, отверстий или каналов на 1 мм2 поверхности распорки стента.
Вся поверхность стента, т.е. поверхность полимерной оболочки, а также поры, углубления, отверстия или каналы, или часть поверхности стента и часть пор, углублений, отверстий или каналов, или только часть пор, углублений, отверстий или каналов может быть заполнена активным агентом или композицией, содержащей по меньшей мере один активный агент.
Полимерное покрытие наносят известными способами, такими как способ разбрызгивания, способ погружения, способ плазменного нанесения, способ нанесения щеткой, способ нанесения шприцем, способ электровращения или способ пипетирования, на структуру основного каркаса, причем покрытие предпочтительно прилипает к каркасу. Обычно поры, углубления, отверстия или каналы создают в покрытии только после процедуры покрытия при помощи лазерного, температурного, механического контактного или химического воздействия, причем создание пор, углублений, отверстий или каналов является относительно простым при применении лазера, но не самым подходящим способом для всех типов полимеров.
Следующие подходящие варианты осуществления настоящего изобретения включают в себя резорбируемые имплантаты, содержащие по меньшей мере одно фармакологически активное вещество в биоразлагаемом слое и необязательно на биоразлагаемом слое. Предпочтительными фармакологически активными веществами являются антипролиферативные, антимиграционные, антиангиогенные, противовоспалительные, цитостатические, цитотоксические и/или противотромбообразующие активные агенты, агенты, активные против рестеноза, кортикоиды, половые гормоны, статины, эпотилоны, простациклины, индукторы ангиогенеза. Среди этих веществ предпочтительными являются антипролиферативные, противовоспалительные, противоопухолевые, антимиграционные, цитостатические, цитотоксические агенты и/или противотромбообразующие агенты и антирестенозный (против рестеноза).
Примерами противовоспалительных, цитостатических, цитотоксических, антипролиферативных агентов, агентов против образования микротрубочек, антиангиогенных агентов, агентов против рестеноза (антирестенозных), антифунгицидных, противоопухолевых, антимиграционных, гипокоагулирующих и/или противотромбообразующих агентов являются абциксимаб, ацеметацин, ацетилвисмион В, акларубицин, адеметионин, адриамицин, аэсцин, афромозон, акагерин, алдеслейкин, амидорон, аминоглутетимид, амсакрин, анакинра, анастрозол, анемонин, аноптерин, антимикотики, антитромботики, апоцимарин, аргатробан, аристолактам-AII, аристолоховая кислота, аскомицин, аспарагиназа, аспирин, аторвастатин, ауранофин, азатиоприн, азитромицин, баккатин, бафиломицин, базиликсимаб, бендамустин, бензокаин, берберин, бетулин, бетулиновая кислота, билобол, биспартенолидин, блеомицин, бомбрестатин, босвелловые кислоты и их производные, бруцеанол А, В и С, бриофиллин А, бусулфан, антитромбин, бивалирудин, кадхерины, камптотецин, капецитабин, о-карбамоилфеноксиуксусная кислота, карбоплатин, кармустин, целекоксиб, цефарантин, церивастатин, ингибиторы СЕТР, хлорамбуцил, хлорохина фосфат, цикутоксин, ципрофлоксацин, цисплатин, кладрибин, кларитромицин, колхицин, конканамицин, кумадин, натрийуретический пептид С-типа (CNP), кудраизофлавон А, куркумин, циклофосфамид, циклоспорин А, цитарабин, дакарбазин, даклизумаб, дактиномицин, дапзон, даунорубицин, диклофенак, 1,11-диметоксикантин-6-он, доцетакел, доксорубицин, даунамицин, эпирубицин, эпотилон А и В, эритромицин, эстрамустин, этопозид, эверолимус, филграстим, фторбластин, флувастатин, флударабин, флударабин-5'-дигидрофосфат, фторурацил, фолимицин, фосфестрол, гемцитабин, галакинозид, гинкгол, гинкголовая кислота, гликозид 1а, 4-гидроксиоксициклофосфамид, идарубицин, ифосфамид, жозамицин, лапахол, ломустин, ловастатин, мелфалан, мидекамицин, митоксантрон, нимустин, питавастатин, правастатин, прокарбазин, митомицин, метотрексат, меркаптопурин, тиогуанин, оксалиплатин, иринотекан, топотекан, гидроксикарбамид, милтефозин, пентостатин, пегаспаргаза, эксеместан, летрозол, форместан, ингибитор 2ω пролиферации smc, митоксантрон, микофенолят, антисмысловой c-myc, антисмысловой b-myc, β-лапахон, подофиллотоксин, полофилловой кислоты 2-этилгидразид, молграмостим (rhuGM-CSF), пэгинтерферон α-2b, ленограстим (r-HuG-CSF), макрогол, селектин (антагонист цитокина), ингибиторы цитокинина, ингибитор СОХ-2, NFkB, ангиопептин, моноклональные антитела, ингибирующие пролиферацию мышечных клеток, антагонисты bFGF, пробукол, простагландины, 1-гидрокси-11-метоксиксантин-6-он, скополетин, доноры NO, такие как пентаэритрита тетранитрат и сиднонимины, S-нитрозопроизводные, тамоксифен, стауроспорин, β-эстрадиол, α-эстрадиол, эстриол, эстрон, этинилэстрадиол, медроксипрогестерон, эстрадиола ципионаты, эстрадиола бензоаты, траниласт, камебакаурин и другие терпеноиды, применяемые в терапии рака, верапамил, ингибиторы тирозинкиназы (тирфостины), паклитаксел и его производные, такие как 6-α-гидроксипаклитаксел, таксотеры, субоксиды углерода (MCS) и их макроциклические олигомеры, мофебутазон, лоназолак, лидокаин, кетопрофен, мефенамовая кислота, пироксикам, мелоксикам, пеницилламин, гидроксихлорохин, натрия ауротиомалат, оксацепрол, β-ситостерин, миртекаин, полидоканол, нонивамид, левоментол, эллиптицин, D-24851 (Calbiochem), колцемид, цитохалазин А-Е, инданоцин, нокодазол, белок S 100, бацитрацин, антагонисты рецептора витронектина, азеластин, стимулятор гуанидилциклазы, тканевый ингибитор металлпротеиназы-1 и -2, свободные нуклеиновые кислоты, нуклеиновые кислоты, включенные в переносчики вирусов, ДНК- и РНК-фрагменты, ингибитор 1 активатора плазминогена, ингибитор 2 активатора плазминогена, антисмысловые олигонуклеотиды, ингибиторы VEGF, IGF 1, активные агенты из группы антибиотиков, такие как цефадроксил, цефазолин, цефаклор, цефокситин, тобрамицин, гентамицин, пенициллины, такие как диклоксациллин, оксациллин, сульфонамиды, метронидазол, эноксапарин, десульфатированный и N-реацетилированный гепарин, активатор тканевого плазминогена, рецептор мембраны тромбоцитов GpIIb/IIIa, антитела против ингибитора фактора Ха, гепарин, гирудин, r-гирудин, РРАСК, протамин, проурокиназа, стрептокиназа, варфарин, урокиназа, вазодилаторы, такие как дипирамидол, трапидил, нитропруссиды, антагонисты PDGF, такие как тразолопиримидин и серамин, ингибиторы АСЕ, такие как каптоприл, цилазаприл, лизиноприл, эналаприл, лозартан, ингибиторы тиопротеазы, простациклин, вапипрост, интерфероны α, β и γ, антагонисты гистамина, блокаторы серотонина, ингибиторы апоптоза, регуляторы апоптоза, такие как р65, NF-kB или BcI-xL, антисмысловые олигонуклеотиды, галофугинон, нифедипин, токоферол, траниласт, молзидомин, полифенолы чая, эпикатехина галлат, эпигаллокатехина галлат, лефлуномид, этанерцепт, сульфазалазин, этопозид, диклоксациллин, тетрациклин, триамцинолон, мутамицин, прокаинимид, ретиноевая кислота, хинидин, дизопиримид, флекаинид, пропафенон, соталол, природные и синтетически полученные стероиды, такие как инотодиол, маквирозид А, галакинозид, манзонин, стреблозид, гидрокортизон, бетаметазон, дексаметазон, нестероидные вещества (NSAIDS), такие как фенопрофен, ибупрофен, индометацин, напроксен, фенилбутазон и другие антивирусные агенты, такие как ацикловир, ганцикловир и зидовудин, клотримазол, флуцитозин, гризеофульвин, кетоконазол, миконазол, нистатин, тербинафин, антипротозойные агенты, такие как хлорохин, мефлохин, хинин, кроме того, природные терпеноиды, такие как гиппокаэскулин, баррингтогенол-С21-ангелат, 14-дегидроагростистахин, агроскерин, агростистахин, 17-гидроксиагростистахин, оватодиолиды, 4,7-оксициклоанисомеловая кислота, бакхариноиды В1, В2, В3 и В7, тубеимозид, бруцеантинозид С, яданзиозиды N и Р, изодеоксиэлефантопин, томенфантопины А и В, коронарин А, В, С и D, урсоловая кислота, гиптатовая кислота А, изоиридогерманал, майтенфолиол, эффусантин А, эксцисанин А и В, лонгикаурин В, скулпонеатин С, камебаунин, лейкаменин А и В, 13,18-дегидро-6-альфа-сенециоилоксихапаррин, таксамаирин А и В, регениол, триптолид, цимарин, гидроксианоптерин, протоанемонин, хелибуринхлорид, синококулин А и В, дигидронитидин, нитидинхлорид, 12-β-гидроксипрегнадиен-3,20-дион, геленалин, индицин, индицин-N-оксид, лазиокарпин, инотодиол, подофиллотоксин, юстицидин А и В, ларреатин, маллотерин, маллотохроманол, изобутирилмаллотохроманол, маквирозид А, мархантин А, майтанзин, ликоридицин, маргетин, панкратистатин, лириоденин, биспартенолидин, оксоушинсунин, периплокозид А, урсоловая кислота, деоксипсороспермин, психорубин, рицин А, сангуинарин, кислота пшеницы manwu, метилсорбифолин, хромоны spathelia, стизофиллин, манзонин, стреблозид, дигидроузамбараензин, гидроксиузамбарин, стрихнопентамин, стрихнофиллин, узамбарин, узамбарензин, тириоденин, оксоушинсунин, дафноретин, ларицирезинол, метоксиларицирезинол, сирингарезинол, сиролимус (рапамицин), соматостатин, такролимус, рокситромицин, тролеандромицин, симвастатин, розувастатин, винбластин, винкристин, виндезин, тенипозид, винорелбин, трофосфамид, треосульфан, темозоломид, тиотепа, третиноин, спирамицин, умбеллиферон, дезацетилвисмион А, висмион А и В, зеорин.
Предпочтительными активными агентами являются паклитаксел и его производные, такие как 6-α-гидроксипаклитаксел или баккатин, и другие таксотеры, сиролимус, эверолимус, биолимус А9, пимекролимус, зотаролимус, такролимус, эритромицин, мидекамицин, жозамицин и триазолопиримидин.
Особенно предпочтительными являются паклитаксел (таксол®) и все производные паклитаксела, такие как 6-α-гидроксипаклитаксел и сиролимус и их производные.
Резорбируемые имплантаты согласно изобретению предпочтительно являются поддерживающими протезами для подобных каналам структур и, в частности, стентами для кровеносных сосудов, мочевых путей, дыхательных путей, пищевода, желчных протоков или кишечника.
Среди этих стентов предпочтительными являются стенты для кровеносных сосудов или в общем для сердечно-сосудистой системы.
В общем, эти стенты являются саморасширяемыми или баллон-расширяемыми стентами, содержащими предпочтительно по меньшей мере один противовоспалительный, цитостатический, цитотоксический, антипролиферативный агент, агент против образования микротрубочек, антиангиогенный агент, агент против рестеноза (антирестенозный), антифунгицидный, противоопухолевый, антимиграционный, гипокоагуляционный и/или противотромбообразующий агент, предпочтительно в полимерном покрытии и/или углублениях, отверстиях, порах и/или каналах.
Биоразрушаемый слой обычно служит в качестве носителя для по меньшей мере одного противовоспалительного, цитостатического, цитотоксического, антипролиферативного агента, агента против образования микротрубочек, антиангиогенного агента, агента против рестеноза (антирестенозного), антифунгицидного, противоопухолевого, антимиграционного, гипокоагулирующего и/или противотромбообразующего агента. Этот агент предотвращает воспаление, которое может быть вызвано стентом, и регулирует рост в основном клеток гладких мышц (особенно коронарных эндотелиальных клеток) на стенте. Стент обеспечивает возможность регенерации поддерживающей ткани или секции поддерживающего сосуда. Когда ткань регенерируется, она способна самостоятельно поддерживать сосуд и не требует больше дополнительной поддержки при помощи стента. На этой стадии стент, вросший в васкулярную стенку, уже значительно разрушен и обычно внутренняя структура больше не существует. Процесс разрушения продолжается до тех пор, пока стент полностью не раствориться без дезинтеграции на твердые фрагменты, которые могут свободно двигаться в кровотоке.
Термин “резорбируемый” или “разрушаемый”, или “биоразрушаемый” относится к тому факту, что тело человека или животного способно медленно растворять имплантат на компоненты, которые присутствуют в крови или растворяются в других жидкостях тела.
Предпочтительные стенты изготовляют в подобной решетке форме, в которой отдельные распорки структуры решетки имеют сходные площади поперечного сечения. Отношение, меньше чем 2, является предпочтительным для самой большой и самой маленькой площади поперечного сечения. Сходные площади поперечного сечения распорок приводят к одинаковому разрушению стента.
Кроме того, предпочтительно, чтобы кольцеобразные распорки соединялись посредством соединяющих распорок, где соединяющие распорки предпочтительно имеют меньшую площадь поперечного сечения или меньший минимальный диаметр, чем распорки, образующие кольцеобразные распорки. Это приводит к более быстрому разрушению соединяющих пластин в теле человека или животного по сравнению с пластинками круглой формы. Поэтому аксиальная гибкость стента увеличивается быстрее, чем снижается поддерживающая способность стента как следствие разрушения пластинок круглой формы.
Медицинский имплантат, особенно стент, можно покрыть способом разбрызгивания, пипетирования, способом нанесения щеткой, шприцем, плазменным способом, погружением, электровращением или способом “мыльного пузырька”, причем полимер растворяют в растворителе и раствор наносят на имплантат.
Полимер можно также формовать заранее в подобную трубке форму и наносить на внешнюю и внутреннюю поверхность стента.
Подходящие растворители включают в себя воду и предпочтительно органические растворители, такие как хлороформ, метиленхлорид (дихлорметан), ацетон, тетрагидрофуран (ТГФ), диэтиловый простой эфир, метанол, этанол, пропанол, изопропанол, диэтилкетон, диметилформамид (ДМФА), диметилацетамид, метиловый эфир уксусной кислоты, этиловый эфир уксусной кислоты, диметилсульфоксид (ДМСО), бензол, толуол, ксилол, трет-бутилметиловый простой эфир (МТВЕ), петролейный эфир (РЕ), циклогексан, пентан, гексан, гептан, где особенно предпочтительными являются хлороформ и этиловый эфир уксусной кислоты.
По меньшей мере один применяемый активный агент можно растворить, эмульгировать, суспендировать или диспергировать в подходящем растворителе или даже вместе с полимером. Потенциальные вещества, которые применяют, включают в себя указанные выше фармакологически активные агенты и описанные выше полимеры.
Полимерное покрытие должно быть относительно одинаковым и должно иметь толщину от 0,01 до 10 мкм. Требуемая толщина слоя зависит также от соответствующего полимера и может быть достигнута несколькими стадиями покрытия.
Примеры
Пример 1
Стент согласно изобретению состоит из
90% (масс./масс.) цинка
6% (масс./масс.) магния
1% (масс./масс.) кальция
2% (масс./масс.) иттрия
1% (масс./масс.) других металлов, солей металлов, неметаллов, углерода, серы, азота, кислорода, водорода.
Стент согласно примеру 1 покрывают способом погружения в раствор полигликоля и доксорубицина. После сушки процесс погружения повторяют еще два раза.
Пример 2
Стент согласно изобретению состоит из
46% (масс./масс.) цинка
46% (масс./масс.) магния
6% (масс./масс.) иттрия
2% (масс./масс.) других металлов, солей металлов, неметаллов, углерода, серы, азота, кислорода, водорода.
Стент согласно примеру 2 покрывают способом разбрызгивания при временных интервалах раствором полилактида и активного агента паклитаксела в хлороформе. После сушки полимерное покрытие частично расплавляют при помощи теплоносителя для образования углублений. Затем отверстия заполняют раствором паклитаксела в ДМСО и сушат.
Пример 3
Стент согласно изобретению состоит из
75% (масс./масс.) цинка
15% (масс./масс.) кальция
4% (масс./масс.) иттрия
0,7% (масс./масс.) марганца
0,8% (масс./масс.) железа
4,5 (масс./масс.) других металлов, солей металлов, неметаллов, углерода, серы, азота, кислорода, водорода.
Стент согласно примеру 2 покрывают способом разбрызгивания при временных интервалах раствором полиглюконата в метиленхлориде. После сушки полимерное покрытие частично расплавляют посредством обработки кислотой для образования углублений. После полного удаления возможной оставшейся кислоты посредством нескольких промываний и сушек стента углубления заполняют при помощи пипетки раствором этанола, содержащим 30 масс.% паклитаксела и контрастную среду иопромид. Затем проводят сушку в слабом потоке воздуха при комнатной температуре.
Пример 4
Стент согласно изобретению состоит из
29% (масс./масс.) железа
13% (масс./масс.) кальция
53% (масс./масс) магния
3% (масс./масс.) иттрия
0,2% (масс./масс.) марганца
0,8% (масс./масс.) железа
1,0% (масс./масс.) других металлов, солей металлов, неметаллов, углерода, серы, азота, кислорода, водорода.
Стент согласно примеру 4 покрывают способом разбрызгивания при временных интервалах раствором полиангидрида и рапамицина в хлороформе. После сушки лазером вырезают каналы вдоль стоек в полимерном покрытии. На поверхность стента разбрызгивают рапамицин в эфире жирной кислоты, таком как изопропилпальмитат, до достижения концентрации активного агента 3 мкг рапамицина на 1 мм2 поверхности стента.
Пример 5
Стент согласно изобретению состоит из
7% (масс./масс.) железа
72% (масс./масс.) кальция
16% (масс./масс.) цинка
1,1% (масс./масс.) иттрия
3,9% (масс./масс.) других металлов, солей металлов, неметаллов, углерода, серы, азота, кислорода, водорода.
Стент согласно примеру 5 покрывают способом разбрызгивания при временных интервалах раствором поли-ε-капролактона в метиленхлориде. После сушки полимерное покрытие делают грубым посредством пескоструйного способа, так чтобы образовывались углубления, каналы и отверстия до металлического внутреннего каркаса. Затем углубления наполняют раствором симвастатина в ацетоне при помощи способа пипетирования.
Пример 6
Стент согласно изобретению состоит из
5% (масс./масс.) железа
40% (масс./масс.) кальция
40% (масс./масс.) магния
5% (масс./масс.) цинка
0,3% (масс./масс.) иттрия
9,7% (масс./масс.) других металлов, солей металлов, неметаллов, углерода, серы, азота, кислорода, водорода.
Стент согласно примеру 6 покрывают способом разбрызгивания при временных интервалах раствором полиуретана и трапидила в метиленхлориде. После сушки полимерное покрытие делают грубым посредством пескоструйного способа, так чтобы образовывались углубления, каналы и отверстия до металлического внутреннего каркаса. Затем на всю поверхность стента два раза разбрызгивают раствор паклитаксела в метаноле и сушат после каждой стадии разбрызгивания.
Пример 7
Стент согласно изобретению состоит из
5% (масс./масс.) натрия
44% (масс./масс.) кальция
44% (масс./масс.) магния
1% (масс./масс.) цинка
1% (масс./масс.) тантала
0,5% (масс./масс.) иттрия
4,5% (масс./масс.) других металлов, солей металлов, неметаллов, углерода, серы, азота, кислорода, водорода.
Стент согласно примеру 6 покрывают способом с применением щетки вязким раствором гидроксиметилцеллюлозы и 2-метилтиазолидин-2,4-дикарбоновой кислоты в метаноле. После сушки посредством бомбардировки ионами образовывают микропоры, которые достигают металлического внутреннего каркаса. Затем на всю поверхность стента два раза разбрызгивают паклитаксел, растворенный в хлороформе, и сушат после каждой стадии разбрызгивания.
Пример 8
Определение поведения элюирования паклитаксела в буфере PBS
2 мл Буфера PBS добавляют к одному стенту соответственно в достаточно малом контейнере, герметизируют Parafilm и инкубируют в сушильном отделении при 37°С. После каждого выбранного интервала времени супернатант отбирают пипеткой и его УФ-поглощение измеряют при 306 нм.
Пример 9
Биосовместимое покрытие биоразрушаемого стента с льняным маслом и α-линоленовой кислотой
После очистки стентов ацетоном и этанолом приготовляют смесь 0,2% льняного масла и 0,5% линоленовой кислоты, растворенную в этаноле, равномерно разбрызгивают на стент.
Пример 10
Биосовместимое покрытие биоразрушаемого стента с льняным маслом и синтетическим полимером поливинилпирролидоном (PVP) в двухслойной системе при добавлении агента, ингибирующего рестеноз
После очистки стентов на стенты наносят разбрызгиванием первый слой 0,35 масс.% рапамицина, растворенного в хлороформе. После сушки этого слоя при комнатной температуре для нанесения второго слоя разбрызгивают раствор в хлороформе 0,25% льняного масла и 0,1% PVO.
Пример 11
Ковалентное гемосовместимое покрытие биоразрушаемых стентов
Пример 11а
Получение десульфатированного реацетилированного гепарина
100 мл Катионообменной смолы амберлит IR-122 помещали в колонку диаметром 2 см, превращали ее 400 мл 3 М HCl в Н+-форму и промывали дистиллированной водой до тех пор, пока элюат не был свободен от хлорида и значение рН было нейтральным. 1 г Натриевой соли гепарина растворяли в 10 мл воды, вводили в колонку с ионообменной смолой и элюировали 400 мл воды. Элюат прикапывали в приемник с 0,7 г пиридина и затем титровали пиридином до рН 6 и сушили вымораживанием. 90 мл смеси 6/3/1 ДМСО/1,4-диоксан/метанол (об./об./об.) добавляли к 0,9 г пиридиниевой соли гепарина в круглодонной колбе с парциальным конденсатором горячего орошения и нагревали до 90°С в течение 24 час. Затем добавляли 823 мг хлорида пиридиния и нагревали до 90°С в течение еще 70 час. Затем смесь разбавляли 100 мл воды и титровали до рН 9 разбавленным гидроксидом натрия. Десульфатированный гепарин диализовали против воды и сушили вымораживанием. 100 мг Десульфатированного гепарина растворяли в 10 мл воды, охлаждали до 0°С и при перемешивании добавляли 1,5 мл метанола. К этому раствору добавляли 4 мл анионообменной смолы Dowex 1×4 в форме ОН- и затем 150 мкл ангидрида уксусной кислоты и смесь перемешивали в течение 2 час при 4°С. После этого смолу отделяли фильтрованием и раствор диализовали против воды и сушили вымораживанием.
Пример 11b
Ковалентное покрытие стентов
Стенты обезжиривали в ультразвуковой ванне с ацетоном и этанолом в течение 15 мин и сушили в сушильном отделении при 100°С. Затем их погружали в 2% раствор 3-аминопропилтриэтоксисилана в смеси этанол/вода (50/50: (об./об.)) в течение 5 мин и затем сушили при 100°С в течение 5 мин. После этого стенты промывали на протяжении ночи деминерализованной водой.
3 мг Десульфатированного и реацетилированного гепарина растворяли в 30 мл 0,1 М MES-буфере (2-(N-морфолино)этансульфоновой кислоты) при 4°С и рН 4,75 и добавляли 30 мг N-циклогексил-N'-(2-морфолиноэтил)карбодиимидметил-п-толуолсульфоната. 10 стентов перемешивали в этом растворе в течение 15 час при 4°С. Затем их промывали водой, 4 М раствором NaCl и водой в течение 2 час каждый. Стенты экстенсивно сушили в потоке воздуха и в вакуумном эксикаторе и хранили.
Пример 12
Покрытие биоразрушаемого стента активным агентом в углублениях полностью покрывающей матрицы, изготовленной из биоразрушаемого полимера
а) Покрытие стентов чистой матрицей способом разбрызгивания
Получение раствора для разбрызгивания
Взвешивали 176 мг PLGA и добавляли хлороформ до 20 г. На каждый стент разбрызгивали 3 мл раствора для разбрызгивания и затем их сушили на протяжении ночи.
Или
Покрытие матрицей, нагруженной активным агентом
Раствор для разбрызгивания: в раствор PLGA/таксол с 145,2 мг PLGA и 48,4 мг таксола добавляли хлороформ до 22 г. На каждый стент разбрызгивали 3 мл раствора для разбрызгивания и затем их сушили на протяжении ночи.
b) Образование углублений способом пипетирования
После полного высушивания стентов, покрытых полимером, делали углубления на стороне поверхности стента, противоположной люминальной стороне, селективным травлением пятен на полимерном слое определенным количеством хлороформа или другого подходящего растворителя таким образом, чтобы углубления были равномерно распределены на распорках всего тела стента. Возможно оставшийся растворитель удаляют в потоке воздуха сразу после образования каждого углубления.
с) Покрытие углублений гидрофильными полимерами, нагруженными активным агентом, способом пипетирования
Посредством способа пипетирования образованные углубления заполняют вязким раствором, загруженным активным агентом. Раствор должен быть таким вязким, чтобы он не мог вытекать из углубления, соответственно растворитель выпаривают так быстро, чтобы раствор отверждался и окружающая матрица не растворялась. Можно применять, например, раствор рапамицин/PVP, в котором содержание рапамицина достигает 35%. При сочетании с одним или несколькими активными агентами содержание рапамицина не должно быть меньше 30%. Затем таким образом заполненный, покрытый стент сушат.
Пример 13
Покрытие углублений чистым активным агентом способом пипетирования
Для этого к 8,8 мг таксола добавляют хлороформ до 2 г и смесь пипетируют в углубления.
Пример 14
Покрытие углублений активным агентом и веществом, которое повышает проницаемость мембраны, способом пипетирования
Для этого 450 мкл этанола смешивают с 100 мкл изопропилмиристата. Этот раствор добавляют к раствору 4,5 ацетона и 150 мг эпотилона А. Затем углубления заполняют посредством способа пипетирования и сушат.
Пример 15
Полное покрытие цилиндрического тела стента
а. Предварительное покрытие стентов способом разбрызгивания
Стент согласно примерам 1-7 фиксируют на стержне ротатора и обрызгивают 1% раствором полиуретана при низкой скорости вращения с очень медленными движениями распылителя вверх и вниз.
b. Полное покрытие стента, предварительно покрытого разбрызгиванием, способом погружения
Полиуретан растворяют в ТГФ так, чтобы получить 14% раствор. Стент, предварительно покрытый согласно примеру 15а, осторожно переносят на подходящее закрепляющее устройство. Устройство с закрепленным стентом сначала предварительно погружают в чистый ТГФ на короткое время. Затем его медленно погружают в 14% раствор уретана. Спустя 15 сек устройство со стентом снова медленно вытаскивают и дополнительно вращают так, чтобы PU равномерно распределился на стенте, и стент сушат. Когда стент больше не изменяется, его сушат под вытяжным колпаком и затем выдерживают в сушильном отделении при 95°С. После охлаждения стент, включающий в себя оболочку PU, очень осторожно удаляют из закрепляющего устройства. Это нужно сделать осторожно, чтобы на оболочке PU не появлялись никакие трещины или отверстия. Очистку стентов, полностью покрытых таким способом, проводят очень тщательно под струей возможно теплой воды.
Пример 16
Покрытие всей поверхности стента, обработанного разбрызгиванием, смесью PU/тергурид способом погружения
Раствор для погружения состоит из 30 масс.% тергурида в полимере, раствор затем разбавляют до 10% в ТГФ. Дополнительную обработку проводят, как в примере 15b.
Пример 17
Частичное покрытие биоразрушаемого стента (d=3 мм)
Раствор: 3,2 мг PU, растворенного в 20 мл N-метил-2-пирролидона
Покрытый разбрызгиванием стент переносят на подходящее, свободно поворачивающееся закрепляющее устройство так, чтобы он находился полностью в покое на ровном основании. Нанесение покрытия выполняют по меньшей мере в двух стадиях, в которых раствор набирают в волоски щетки и наносят на площадь, которую нужно покрыть, до тех пор, пока площадь полностью не будет покрыта раствором. Когда каждая выбранная покрываемая площадь наполняется до требуемой толщины покрытия, стент сушат при 90°С. После охлаждения стент удаляют из закрепляющего устройства.
Пример 18
Биоразрушаемый стент следующего состава:
магний 91% (масс./масс.)
иттрий 4% (масс./масс.)
неодим 4% (масс./масс.)
другие 1% (масс./масс.)
получают согласно ЕР 1419793 В1.
“Другими” являются другие металлы, соли металлов, неметаллы, углерод, сера, азот, кислород, водород.
Этот магниевый стент снабжен биорезорбируемым покрытием PLLA/PGA, и скорость разрушения непокрытого стента, полимерного покрытия PLLA/PGA на стенте из нержавеющей стали, а также покрытого стента определяли согласно примеру 18.
Непокрытый магниевый стент растворялся полностью в PBS-буфере (фосфатный буфер с 14,24 г NaH2PO4, 2,72 г К2НРО4 и 9 г NaCl; рН 7,4; Т=37°С) в течение 10 дней, тогда как непокрытый стент согласно примеру 18 растворялся полностью внутри покрытия в течение приблизительно 12 дней.
Покрытия PLLA/PGA на стенте из нержавеющей стали, а также на стенте согласно примеру 18 растворялись в PBS-буфере (фосфатный буфер с 14,24 г NaH2PO4, 2,72 г К2НРО4 и 9 г NaCl; рН 7,4; Т=37°С) после приблизительно 6-8 недель.
Оптический анализ стента согласно примеру 18 после 10, 20, 30 и 40 дней выдерживания в PBS-буфере показывает, что уже после 20 дней внутренний каркас стента полностью растворяется и вымывается из полимерного покрытия, тогда как PLLA/PGA еще не обнаруживает значительное растворение и по меньшей мере видимые отверстия.
Пример 19
Покрытие биоразрушаемых стентов на люминальной и противоположной люминальной сторонах двумя полилактидами (PLGA 75/25 и PLGA 50/50), которые разрушаются с разными скоростями
Биоразрушаемый стент согласно примерам 1-7 подвешивают горизонтально на тонкий металлический пруток (d=0,2 мм), который установлен на оси вращения устройства для вращения и продвижения, так чтобы внутренняя сторона стента не контактировала с прутком. При медленном вращении вокруг его продольной оси быстрее разрушаемый полимер (PLGA 50/50), растворенный в хлороформе, наносится на распорки стента на стороне, противоположной люминальной стороне поверхности стента, с применением непрерывного способа пипетирования (необязательно способа разбрызгивания щеткой, способа впрыскивания струей, способа по типу шариковой ручки). Сушку осуществляют в слабом потоке воздуха при комнатной температуре. Стент, покрытый со стороны, противоположной люминальной стороне, теперь покрывают с люминальной стороны медленнее разрушаемым полилактидом (PLGA 75/25). Для этого стенты покрывают вдоль стоек полимерным раствором при помощи волосков щетки. Затем сушку снова осуществляют в слабой струе воздуха при комнатной температуре.
Полимерный раствор: взвешивают 176 мг полилактида и добавляют до 20 г хлороформ.
Активные агенты или комбинации активных агентов необязательно можно смешивать с полимерным раствором. Например, противовоспалительный, антипролиферативный агент, такой как рапамицин, является очень подходящим для нанесения на сторону, противоположную люминальной стороне, которая обращена в сторону васкулярной стенки, тогда как противотромбообразующий агент находится на люминальной поверхности, которая подвергается воздействию кровотока и обеспечивает необходимую профилактику тромбоза, например:
а) на стороне, противоположной люминальной стороне, имеется полилактид PLGA 50/50 и рапамицин (в раствор 145,2 мг полилактида и 48,4 мг рапамицина добавляют хлороформ до 22 г),
b) на люминальной стороне имеется полилактид PLGA 75/25 и клопидогрел (в раствор 145,2 мг полилактида и 48,4 мг клопидогрела добавляют хлороформ до 22 г).
Пример 20
Биосовместимое покрытие биоразрушаемых стентов льняным маслом и паклитакселом
Льняное масло и паклитаксел (80:20) растворяют в отношении 1:1 в хлороформе и затем разбрызгивают на равномерно вращающийся стент. После выпаривания хлороформа в слабой струе воздуха стент выдерживают в сушильном отделении при 80°С.
Пример 21
Биосовместимое покрытие стентов льняным маслом и поливинилпирролидоном (PVP) в двухслойной системе при добавлении паклитаксела
После очистки стентов на стент разбрызгиванием наносят первый слой 0,25 масс.% паклитаксела, растворенного в хлороформе. После сушки этого слоя при комнатной температуре наносят второй слой разбрызгиванием раствора 0,25% льняного масла и 0,1% PVP в хлороформе и сушат на протяжении ночи при 70°С.
Пример 22
Измерение разложения биорезорбируемого материала стента
а) Получение сплава посредством порошковой металлургии
Отдельные компоненты размалывают, хорошо смешивают и прессуют под высоким давлением в требуемую форму и, наконец, спекают. Таким получением можно изготовить компактные и почти герметизированные тела без необходимости процесса плавления (ванна для плавления).
b) Измерение разрушения
Данный изучаемый объект, полученный в виде трубки и взвешенный до четвертого десятичного знака, помещают в подходящую силиконовую трубку, подобную стенту. Концы трубки помещают в контейнер, заполненный PBS-буфером (фосфатный буфер с 14,24 г NaH2PO4, 2,72 г К2НРО4 и 9 г NaCl; рН 7,4, Т=37°С). При помощи присоединенного перистальтического насоса буфер перекачивают из контейнера через трубку и выпускают снова в контейнер, в котором фильтр у конца трубки гарантирует, что возможно присутствующие частицы не перекачиваются через систему. В то же самое время фильтр служит в качестве первого контроля для нежелательного образования и отделения больших частиц во время разрушения материала. После окончания заранее определенного времени эксперимента сегмент трубки, включающий оставшийся материал, осторожно отрезают, вынимают без потери материала, сушат, взвешивают и описывают. Ход разрушения сплава по времени документируют проведением нескольких описанных экспериментальных опытов, которые заканчивают после установления различных интервалов времени. Таким способом ход разрушения по времени можно получить на основании зависимой от времени потери массы (при физиологических условиях 37°С и рН 7,4 в нестатической системе).
Пример 23
Измерение разрушения полимера в проточной системе
Разрушение биоразрушаемых полимеров исследуют при физиологических условиях (рН 7,4; Т=37°С) в PBS-буфере (фосфатный буфер). Для этого биоразрушаемый полимер сначала растворяют в летучем растворителе, таком как хлороформ. Затем формуют тонкую пластинку и сушат ее до постоянной массы в вакууме. Точно взвешенную пластинку вводят в так называемую камеру Baumgartner, модифицированную согласно Sakarassien et al., J Lab-Clin. Med 102(4): 522 (1983) (см. систему горизонтальной перфузии), и PBS-буфер пропускают над поверхностью пластинки при выбранной скорости потока при помощи перистальтического насоса. Эксперимент проводят при различных экспериментальных временных интервалах, и поведение разложения фиксируют на основании массы пластинки (после сушки в вакууме до тех пор, пока не отмечают постоянную массу и соответственно состояние изменений характеристик полимера).
Пример 24
Биоразрушаемый стент следующего состава:
магний 90% (масс./масс.)
иттрий 5% (масс./масс.)
цирконий 4% (масс./масс.)
другие 1% (масс./масс.)
получают согласно ЕР 1419793 В1.
“Другими” являются другие металлы, соли металлов, неметаллы, углерод, сера, азот, кислород, водород.
Этот магниевый стент был снабжен биоразрушаемым покрытием PGA/PTMC, и скорость разрушения непокрытого стента и полимерного покрытия PGA/PTMC на стенте из нержавеющей стали, а также покрытого стента определяли согласно примеру 24.
Непокрытый магниевый стент растворялся полностью в PBS-буфере (фосфатный буфер с 14,24 г NaH2PO4, 2,72 г К2НРО4 и 9 г NaCl; рН 7,4, Т=37°С) в течение 13 дней, тогда как покрытый стент согласно примеру 24 растворялся полностью внутри покрытия в течение приблизительно 15 дней.
Покрытие PGA/PTMC на стенте из нержавеющей стали, а также на стенте согласно примеру 24 растворялось в PBS-буфере (фосфатный буфер с 14,24 г NaH2PO4, 2,72 г К2НРО4 и 9 г NaCl; рН 7,4, Т=37°С) после приблизительно 15-18 недель.
Оптический анализ стента согласно примеру 24 после 20 дней и после 40 дней выдерживания в PBS-буфере показал, что уже после 20 дней внутренний каркас стента полностью растворялся и вымывался из полимерного покрытия, тогда как PLLA/PGA не обнаружил характерные черты значительного растворения и по меньшей мере видимые отверстия. Таким образом, полимерное покрытие было все же полностью неповрежденным, тогда как внутренний каркас полностью растворялся, и ионы металлов высвобождались через полимер в буферный раствор.
Реферат
Настоящее изобретение относится к медицине, конкретно к биоразрушаемым стентам, состоящим из внутреннего биоразрушаемого металлического каркаса и внешнего полимерного покрытия. Биоразрушаемое покрытие состоит из биоразрушаемых полимеров и может дополнительно включать в себя по меньшей мере одно фармакологически активное вещество, такое как противовоспалительный, цитостатический, цитотоксический, антипролиферативный агент, агент против образования микротрубочек, антиангиогенный, антирестенозный (против рестеноза), антифунгицидный, противоопухолевый, антимиграционный, гипокоагулирующий и/или противотромбообразующий агент. Стент проявляет функцию поддержания просвета сосуда только в течение времени, до того как регенерированная ткань снова становится способной выполнять эту функцию. 11 з.п. ф-лы, 24 пр.

Комментарии