Твердые фармацевтические композиции для перорального введения на основе изоксазолиновых соединений - RU2646483C2
Код документа: RU2646483C2
Чертежи
Описание
Предшествующий уровень техники
Ряд паразитов могут заражать или инфицировать домашних животных, в частности также животных-компаньонов, таких как кошки и собаки. Эти насекомые-вредители и паразиты являются источником огромной опасности как для животных, так и для их владельцев.
Изоксазолиновые соединения известны из уровня техники, и эти соединения и их применение в качестве антипаразитарных средств описаны, например, в заявке на патент США US 2007/0066617 и в международных патентных заявках: WO 2005/085216, WO 2007/079162, WO 2009/002809, WO 2009/024541, WO 2009/003075, WO 2009/080250, WO 2010/070068 и WO 2010/079077, раскрытие которых, а также и цитируемая литература включены в данный документ посредством ссылки.
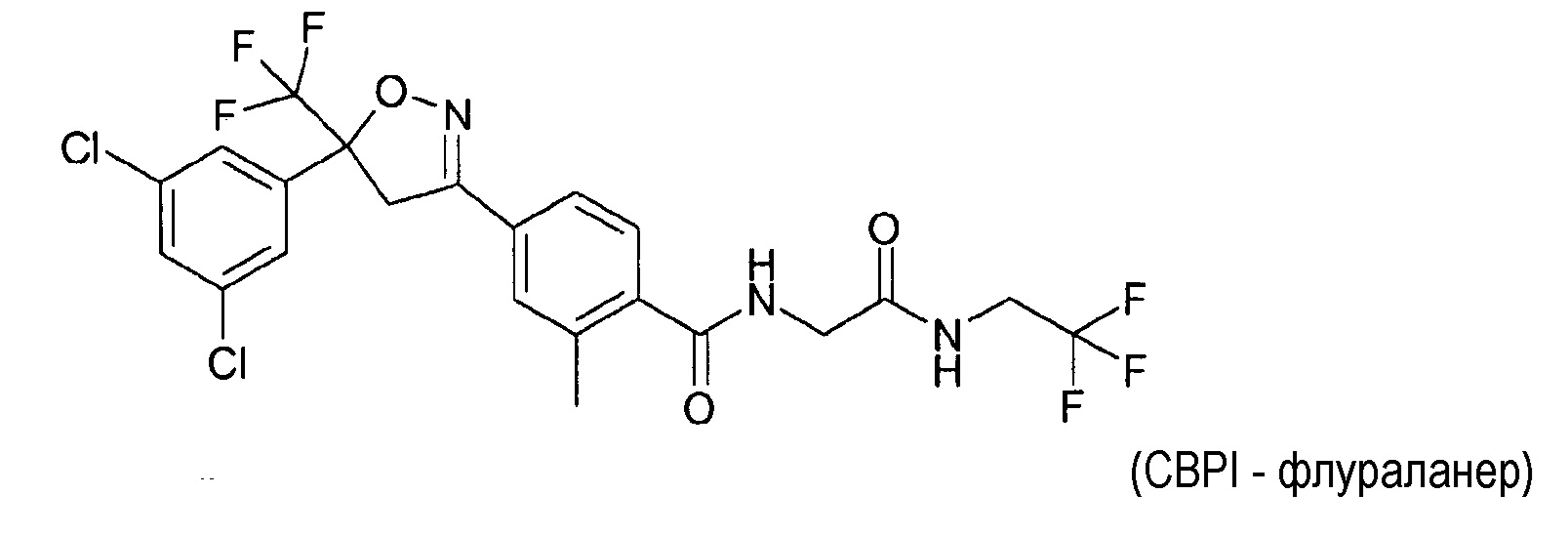
Этот класс соединений, как известно, обладает исключительной активностью против эктопаразитов, т.е. насекомых-паразитов и клещей-паразитов, таких как иксодовые клещи и блохи, и против эндопаразитов, таких как нематоды. Примеры изоксазолиновых соединений представляют собой соединения карбамоилбензамидфенилизоксазолина (CBPI). Конкретным примером CBPI соединения является 4-[5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-2-метил-N-[(2,2,2-трифторэтилкарбамоил)метил]бензамид (CAS RN [864731-61-3]) - USAN флураланер.
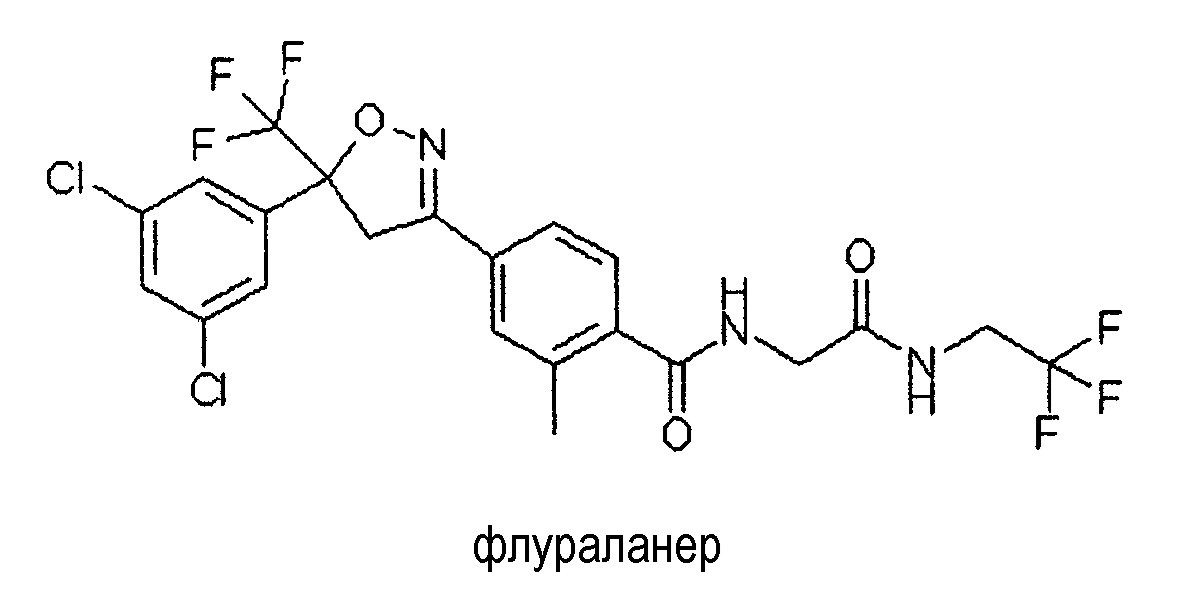
CBPI соединение флураланер раскрыто в патентной заявке WO 2005/085216.
Поскольку эти изоксазолиновые соединения были первоначально исследованы для их применения в области сельского хозяйства, необходимо определить конкретные композиции, обеспечивающие возможность их применения в ветеринарии, т.e. безопасного введения для эффективной борьбы с паразитами у животных.
Общеизвестный и удобный способ введения эктопаразитицидного соединения животному представляет собой пероральное введение, например, в виде твердой композиции для перорального введения, такой как таблетки или мягкие жевательные формы, которые обладают высокой биодоступностью, обеспечивающей возможность борьбы с паразитами при низкой дозировке эктопаразитицидного соединения, перорально введенного животному.
Сущность изобретения
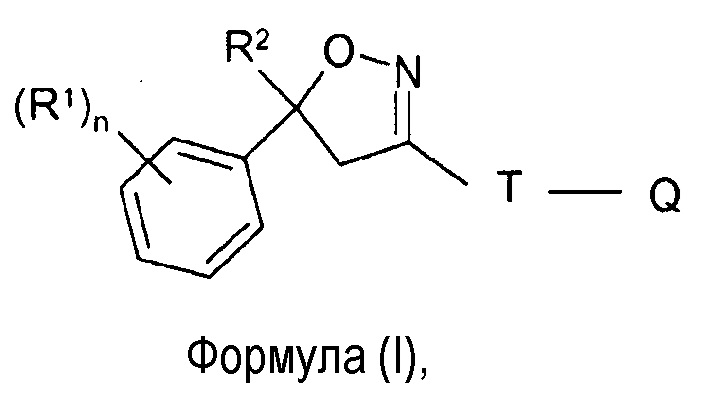
В одном аспекте настоящее изобретение относится к твердой фармацевтической композиции для перорального введения, содержащей эффективное количество по меньшей мере одного изоксазолинового соединения формулы (I)
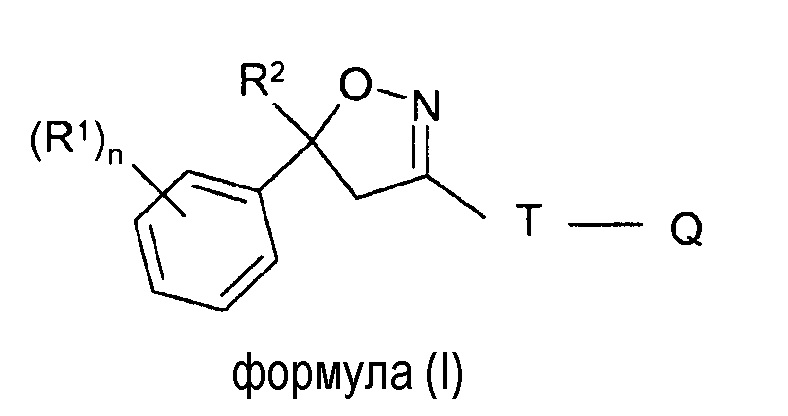
где
R1 = галоген, CF3, OCF3, CN,
n = целое число от 0 до 3, предпочтительно 1, 2 или 3,
R2 = C1-C3-галогеналкил, предпочтительно CF3 или CF2Cl,
T = 5- или 6-членное кольцо, необязательно замещенное одним или несколькими радикалами Y,
Y = метил, галогенметил, галоген, CN, NO2, NH2-C=S, или два соседних радикала Y вместе образуют цепь, в частности, трех- или четырехчленную цепь;
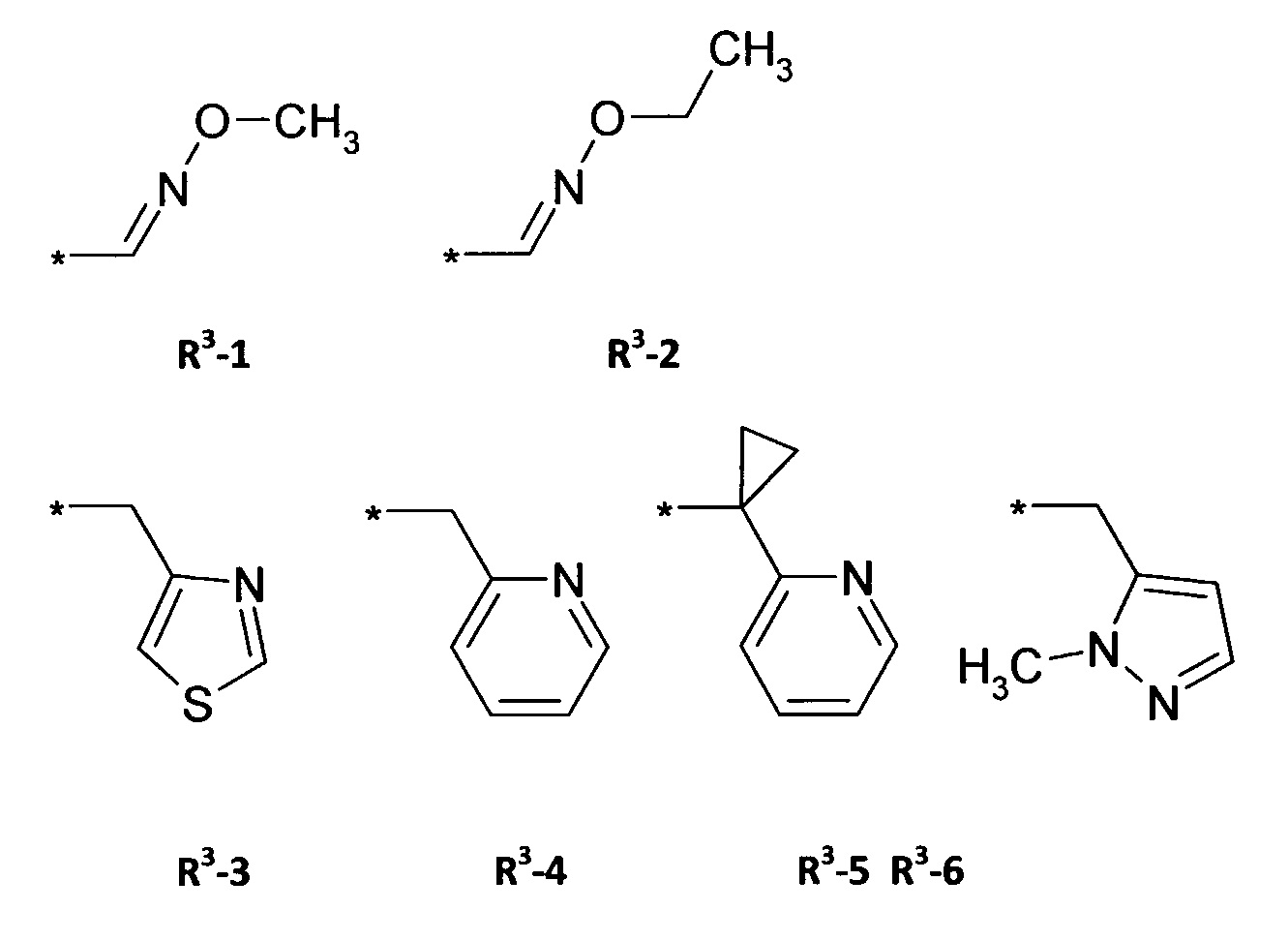
Q = X-NR3R4 или 5-членное N-гетероарильное кольцо, необязательно замещенное одним или несколькими радикалами;
X = CH2, CH(CH3), CH(CN), CO, CS,
R3 = водород, метил, галогенэтил, галогенпропил, галогенбутил, метоксиметил, метоксиэтил, галогенметоксиметил, этоксиметил, галогенэтоксиметил, пропоксиметил, этиламинокарбонилметил, этиламинокарбонилэтил, диметоксиэтил, пропиниламинокарбонилметил, N-фенил-N-метиламино, галогенэтиламинокарбонилметил, галогенэтиламинокарбонилэтил, тетрагидрофурил, метиламинокарбонилметил, (N,N-диметиламино)карбонилметил, пропиламинокарбонилметил, циклопропиламинокарбонилметил, пропениламинокарбонилметил, галогенэтиламинокарбонилциклопропил,
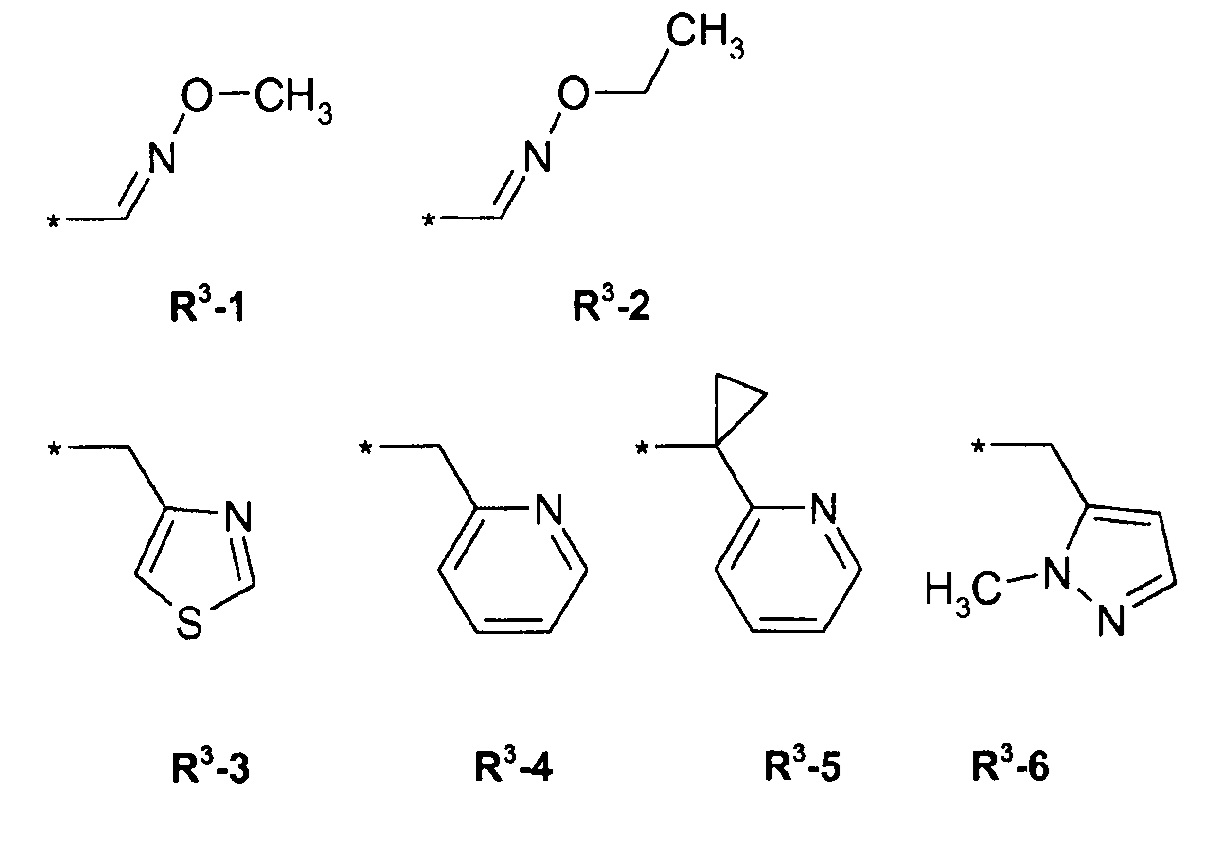
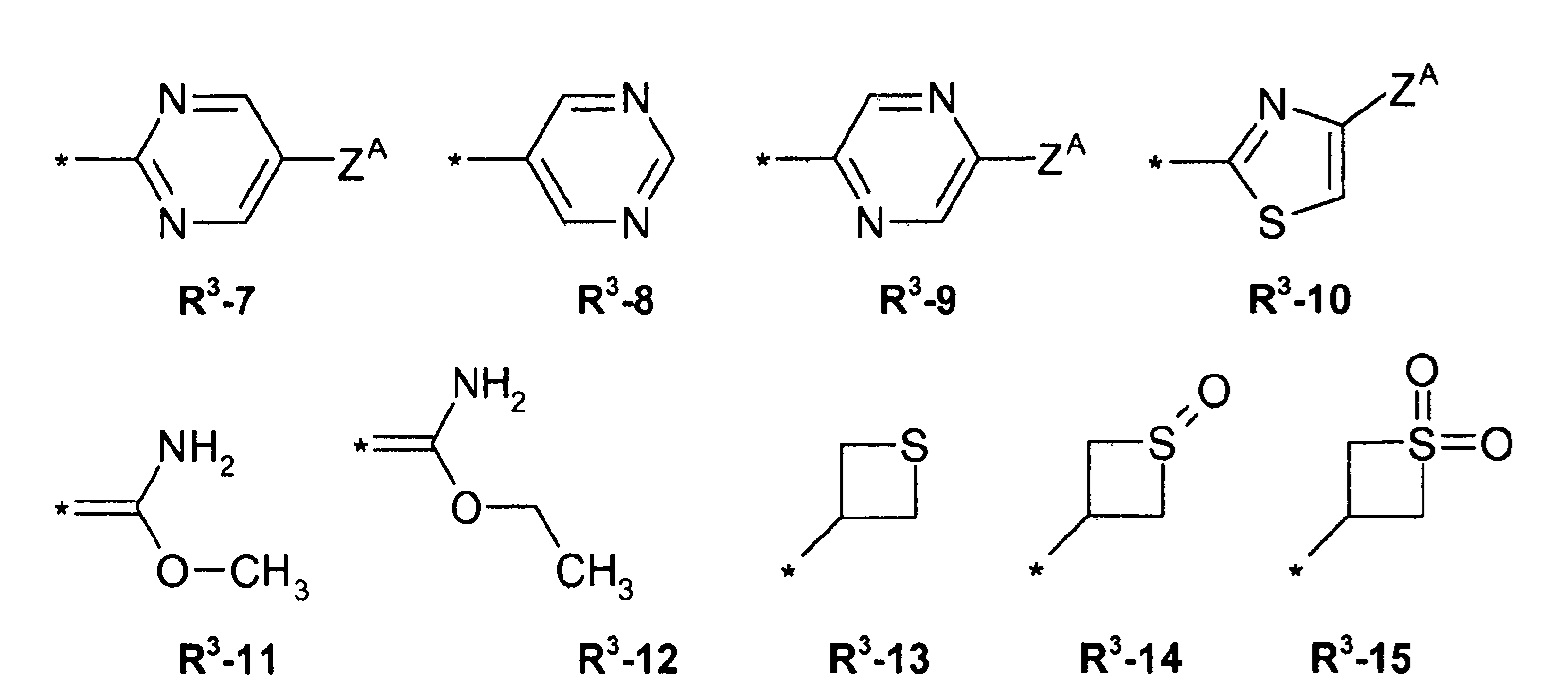
где ZA = водород, галоген, циано, галогенметил (CF3);
R4 = водород, этил, метоксиметил, галогенметоксиметил, этоксиметил, галогенэтоксиметил, пропоксиметил, метилкарбонил, этилкарбонил, пропилкарбонил, циклопропилкарбонил, метоксикарбонил, метоксиметилкарбонил, аминокарбонил, этиламинокарбонилметил, этиламинокарбонилэтил, диметоксиэтил, пропиниламинокарбонилметил, галогенэтиламинокарбонилметил, цианометиламинокарбонилметил или галогенэтиламинокарбонилэтил;
или R3 и R4 вместе образуют заместитель, выбираемый из группы, состоящей из:

или его соль или сольват, твердый носитель и растворитель, при этом растворитель выбирается из 2-пирролидона, диметилацетамида или их смесей.
В предпочтительном варианте осуществления изобретения твердая фармацевтическая композиция для перорального введения представляет собой мягкую жевательную фармацевтическую композицию для применения в ветеринарии посредством перорального введения.
В предпочтительном варианте осуществления изобретения твердый носитель представляет собой микрокристаллическую целлюлозу.
В одном из вариантов осуществления изобретения композиция дополнительно содержат памоевую кислоту или ее фармацевтически приемлемую соль.
В одном из вариантов осуществления изобретения изоксазолиновое соединение представляет собой флураланер.
В одном из вариантов осуществления изобретения изоксазолиновое соединение представляет собой 4-[5-(3,5-дихлорфенил)-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-N-[(Z)-(метоксиимино)метил]-2-метилбензамид.
В одном из вариантов осуществления изобретения изоксазолиновое соединение представляет собой афоксоланер.
В одном из вариантов осуществления изобретения изоксазолиновое соединение представляет собой 4-[5-(3,5-дихлорфенил)-5-(трифторметил)-4H-изоксазол-3-ил]-2-метил-N-(тиетан-3-ил)бензамид.
В одном из вариантов осуществления изобретения изоксазолиновое соединение представляет собой 5-[5-(3,5-дихлорфенил)-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-3-метил-N-[2-оксо-2-[(2,2,2-трифторэтил)амино]этил]-2-тиофенкарбоксамид.
В одном из вариантов осуществления изобретения твердая фармацевтическая композиция для перорального введения содержит дополнительное фармацевтически активное соединение.
В одном из вариантов осуществления изобретения дополнительное фармацевтически активное соединение представляет собой макроциклический лактон, выбираемый из группы: ивермектин, мильбемицин и моксидектин.
В одном из вариантов осуществления изобретения твердая фармацевтическая композиция для перорального введения содержит изоксазолиновое соединение формулы (I) или его соль или сольват, 2-пирролидон, микрокристаллическую целлюлозу, натриевую соль гликолята крахмала, лаурилсульфат натрия, памоат натрия, стеарат магния, аспартам, глицерин, соевое масло и полиэтиленгликоль.
В другом варианте осуществления изобретения твердая фармацевтическая композиция для перорального введения содержит изоксазолиновое соединение формулы (I) или его соль или сольват, диметилацетамид, микрокристаллическую целлюлозу, натриевую соль гликолята крахмала, лаурилсульфат натрия, памоат натрия, стеарат магния, аспартам, глицерин, соевое масло и полиэтиленгликоль.
Другой аспект изобретения представляет собой способ получения твердой фармацевтической композиции, включающий растворение изоксазолинового соединения, указанного выше, в растворителе, и затем адсорбирование полученного раствора вспомогательным веществом (эксципиентом) в виде твердого носителя.
В одном из вариантов осуществления изобретения по этому способу твердый носитель представляет собой микрокристаллическую целлюлозу.
В другом варианте осуществления изобретения по этому способу растворитель представляет собой 2-пирролидон или диметилацетамид.
Другой аспект настоящего изобретения представляет собой способ борьбы с заражением животных паразитами, включающий введение животному терапевтически эффективного количества композиции, как описано выше.
Другой аспект настоящего изобретения представляет собой твердую фармацевтическую композицию для перорального введения, содержащую изоксазолиновое соединение формулы (I) или его соль или сольват и 2-пирролидон.
В одном из вариантов осуществления изобретения изоксазолиновое соединение представляет собой флураланер.
В одном из вариантов осуществления изобретения изоксазолиновое соединение представляет собой 4-[5-(3,5-дихлорфенил)-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-N-[(Z)-(метоксиимино)метил]-2-метилбензамид.
В одном из вариантов осуществления изобретения изоксазолиновое соединение представляет собой афоксоланер.
В одном из вариантов осуществления изобретения изоксазолиновое соединение представляет собой 4-[5-(3,5-дихлорфенил)-5-(трифторметил)-4H-изоксазол-3-ил]-2-метил-N-(тиетан-3-ил)бензамид.
В одном из вариантов осуществления изобретения изоксазолиновое соединение представляет собой 5-[5-(3,5-дихлорфенил)-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-3-метил-N-[2-оксо-2-[(2,2,2-трифторэтил)амино]этил]-2-тиофенкарбоксамид.
В одном из вариантов осуществления изобретения твердая фармацевтическая композиция для перорального введения представляет собой мягкую жевательную фармацевтическую композицию для применения в ветеринарии посредством перорального введения.
Другой аспект настоящего изобретения представляет собой способ борьбы с заражением животных паразитами, включающий введение животному терапевтически эффективного количества композиции, как описано выше.
Краткое описание фигур
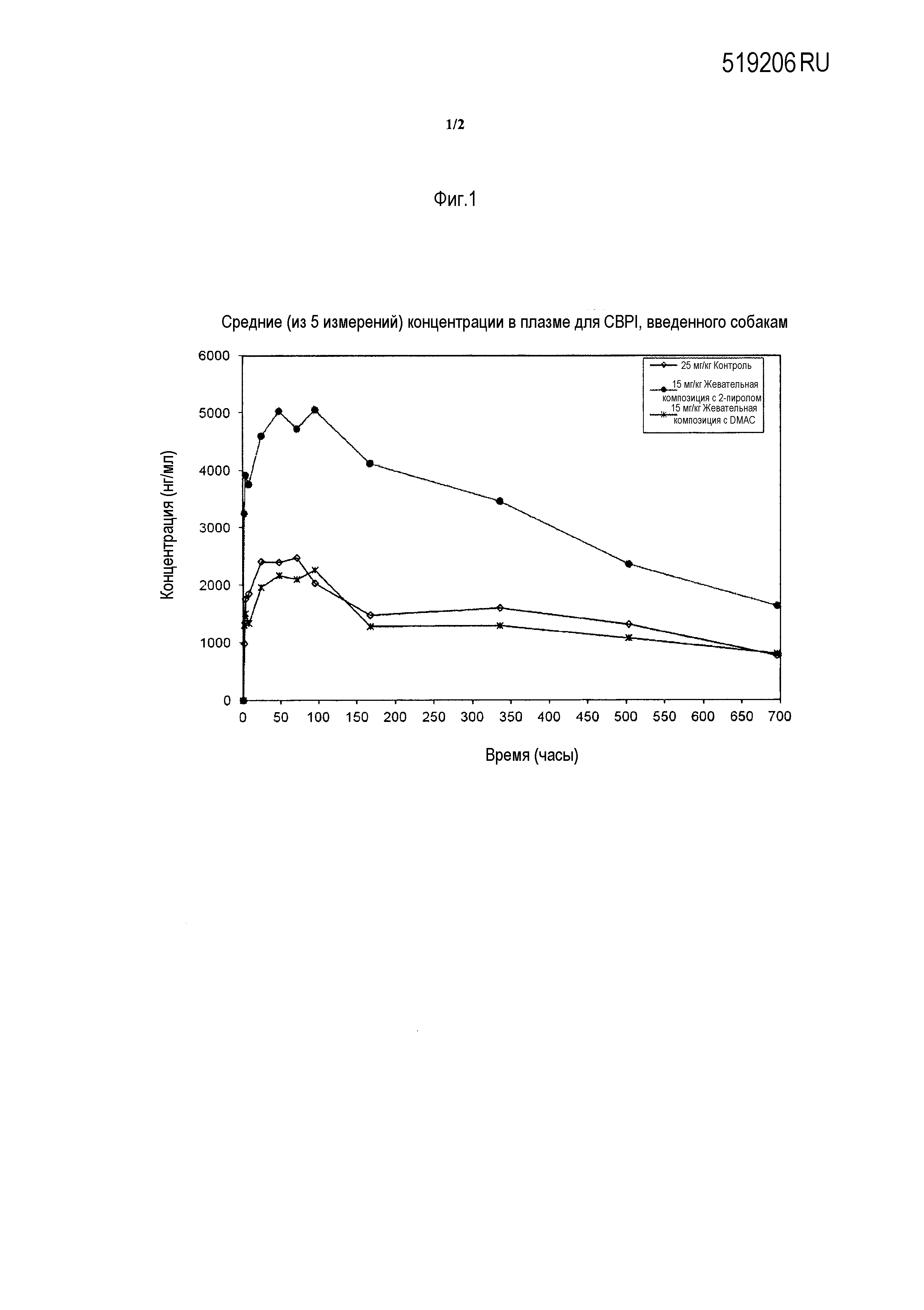
Фигура 1 - средняя концентрация в плазме для CBPI соединения флураланер, введенного собакам перорально.
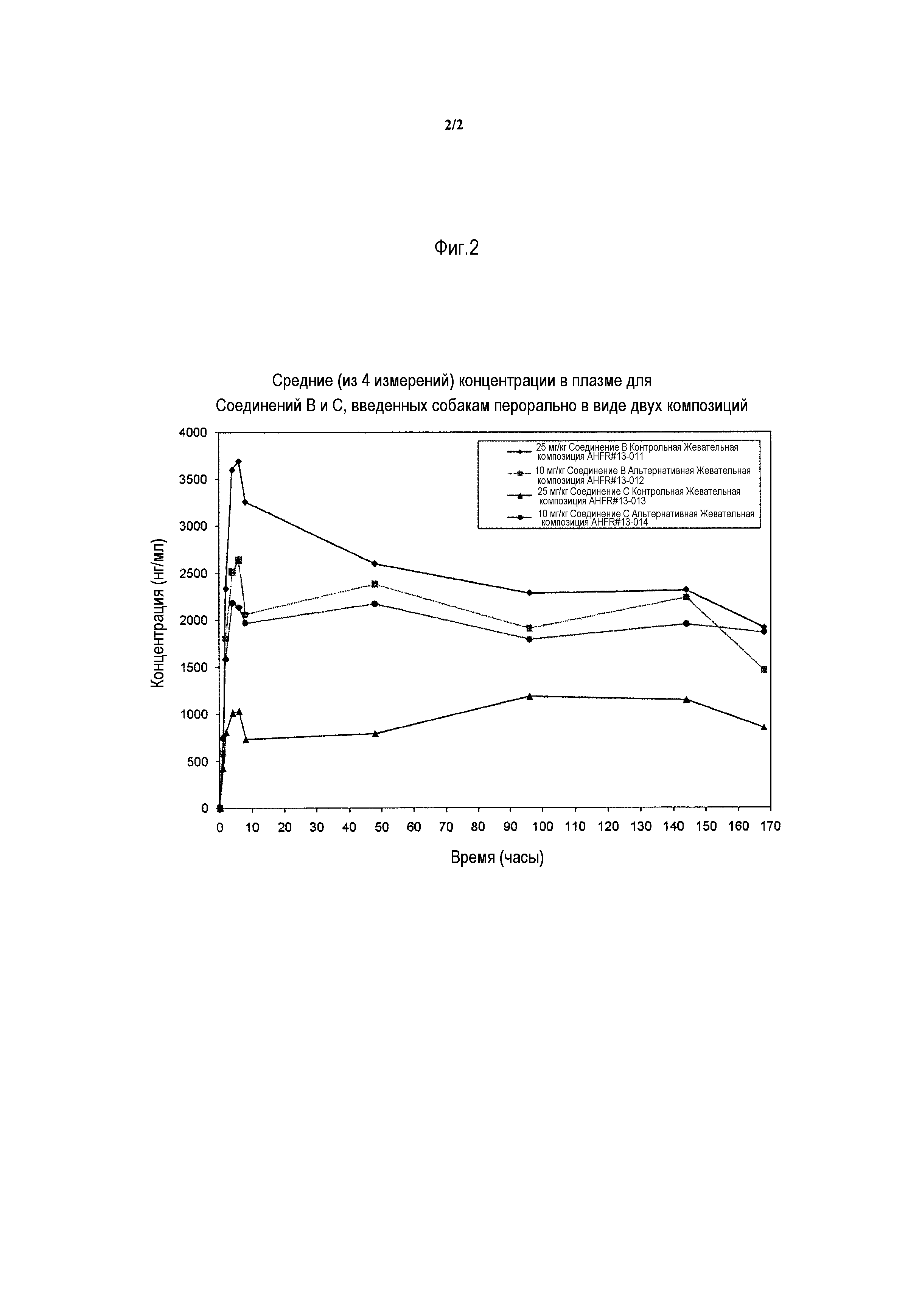
Фигура 2 - средняя концентрация в плазме для изоксазолиновых соединений афоксоланер и -[5-(3,5-дихлорфенил)-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-3-метил-N-[2-оксо-2-[(2,2,2-трифторэтил)амино]этил]-2-тиофенкарбоксамид, введенных собакам перорально.
Подробное описание изобретения
Настоящее изобретение относится к композиции в виде твердой дозированной формы для перорального введения (в ряде случаев именуемой твердой фармацевтической композицией), содержащей изоксазолиновое соединение формулы (I) (как описано ниже), которая обеспечивает существенное увеличение биодоступности такого изоксазолинового соединения после введения животному.
Конкретно, для получения такой композиции изоксазолиновое соединение формулы (I) растворяют в растворителе. Этот раствор лекарственного средства затем адсорбируют на твердый носитель, который включают в традиционную твердую дозированную форму для перорального введения. Применение предварительно растворенных изоксазолиновых соединений формулы (I) в композиции существенно увеличивает биодоступность активного лекарственного вещества по сравнению с традиционными твердыми дозированными формами для перорального введения, содержащими активное лекарственное вещество, включенное в виде твердого вещества.
Как указано в примере, изобретатели обнаружили, что в случае диметилацетамида (DMAC) в качестве растворителя изоксазолиновых соединений в твердой дозированной форме для перорального введения аналогичные фармакокинетические профили были получены при введении в более низкой дозе по сравнению с дозированными формами с активным компонентом, включенным в более высокой дозировке в виде твердого вещества.
В случае, когда 2-пирролидон (2-пирол) использовали в качестве растворителя в композиции, наблюдали существенно более высокие уровни содержания в плазме по сравнению с контролем, даже если композиция включала введение изоксазолинового соединения в более низкой дозе.
Этот подход к получению композиции предоставляет возможность неожиданно существенного улучшения биодоступности, позволяя существенно более низкую дозировку, необходимую для достижения аналогичных или улучшенных фармакокинетических профилей. Вследствие этого, могут быть достигнуты аналогичные уровни содержания в крови, что приводит к одинаковым показателям эффективности в борьбе с паразитами, но при пониженной дозе изоксазолинового соединения.
Твердая дозированная форма для перорального введения согласно изобретению содержит изоксазолиновое соединение формулы (I)
где
R1 = галоген, CF3, OCF3, CN,
n = целое число от 0 до 3, предпочтительно 1, 2 или 3,
R2 = С1-C3-галогеналкил, предпочтительно CF3 или CF2Cl,
T = 5- или 6-членное кольцо, необязательно замещенное одним или несколькими радикалами Y,
Y = метил, галогенметил, галоген, CN, NO2, NH2-C=S, или два соседних радикала Y вместе образуют цепь CH-CH=CH-CH, N-CH=CH-CH, CH-N=CH-CH, CH-CH=N-CH или CH-CH=CH-N, HC=HC-CH, CH-CH=CH, CH=CH-N, N-CH=CH;
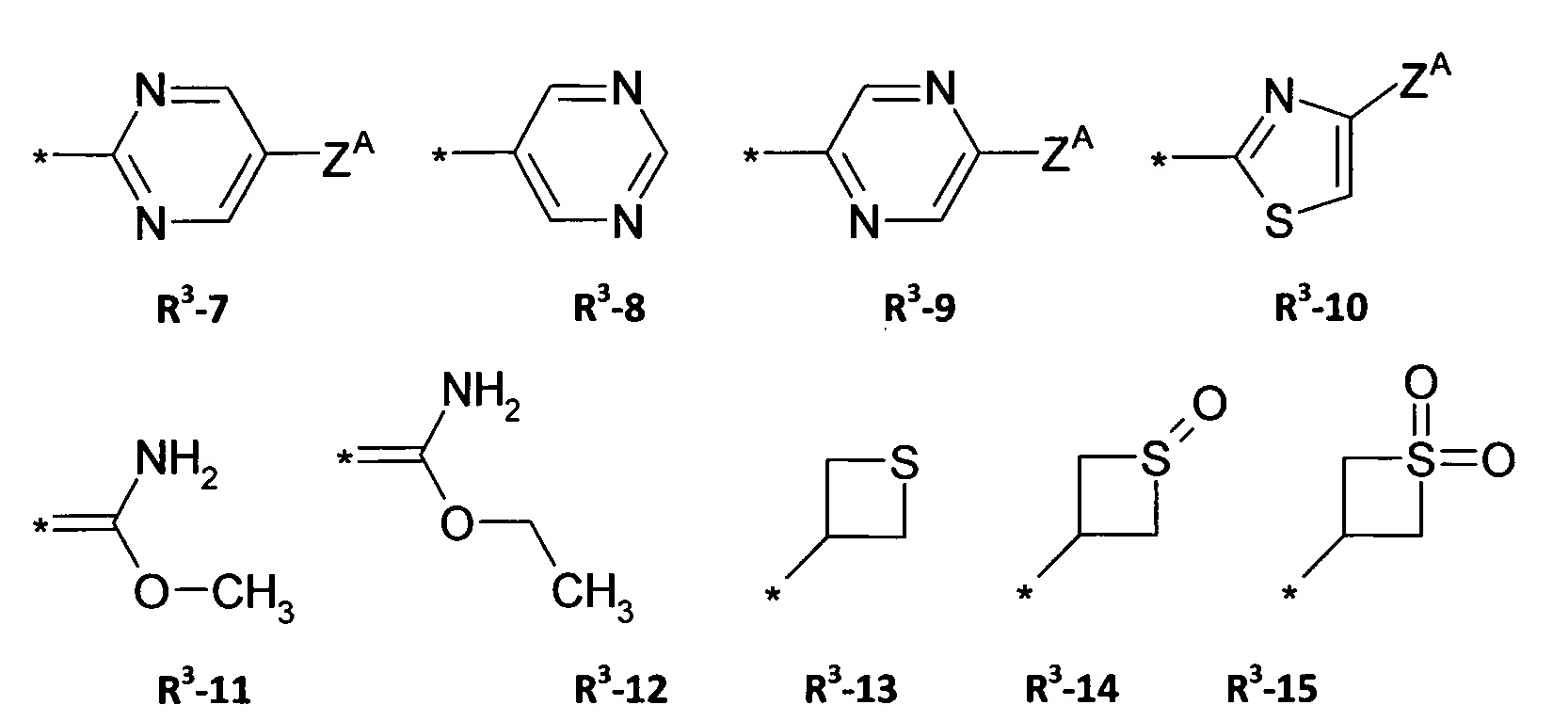
Q = X-NR3R4 или 5-членное N-гетероарильное кольцо, необязательно замещенное одним или несколькими радикалами ZA, ZB ZD;
X = CH2, CH(CH3), CH(CN), CO, CS,
R3 = водород, метил, галогенэтил, галогенпропил, галогенбутил, метоксиметил, метоксиэтил, галогенметоксиметил, этоксиметил, галогенэтоксиметил, пропоксиметил, этиламинокарбонилметил, этиламинокарбонилэтил, диметоксиэтил, пропиниламинокарбонилметил, N-фенил-N-метиламино, галогенэтиламинокарбонилметил, галогенэтиламинокарбонилэтил, тетрагидрофурил, метиламинокарбонилметил, (N,N-диметиламино)карбонилметил, пропиламинокарбонилметил, циклопропиламинокарбонилметил, пропениламинокарбонилметил, галогенэтиламинокарбонилциклопропил,
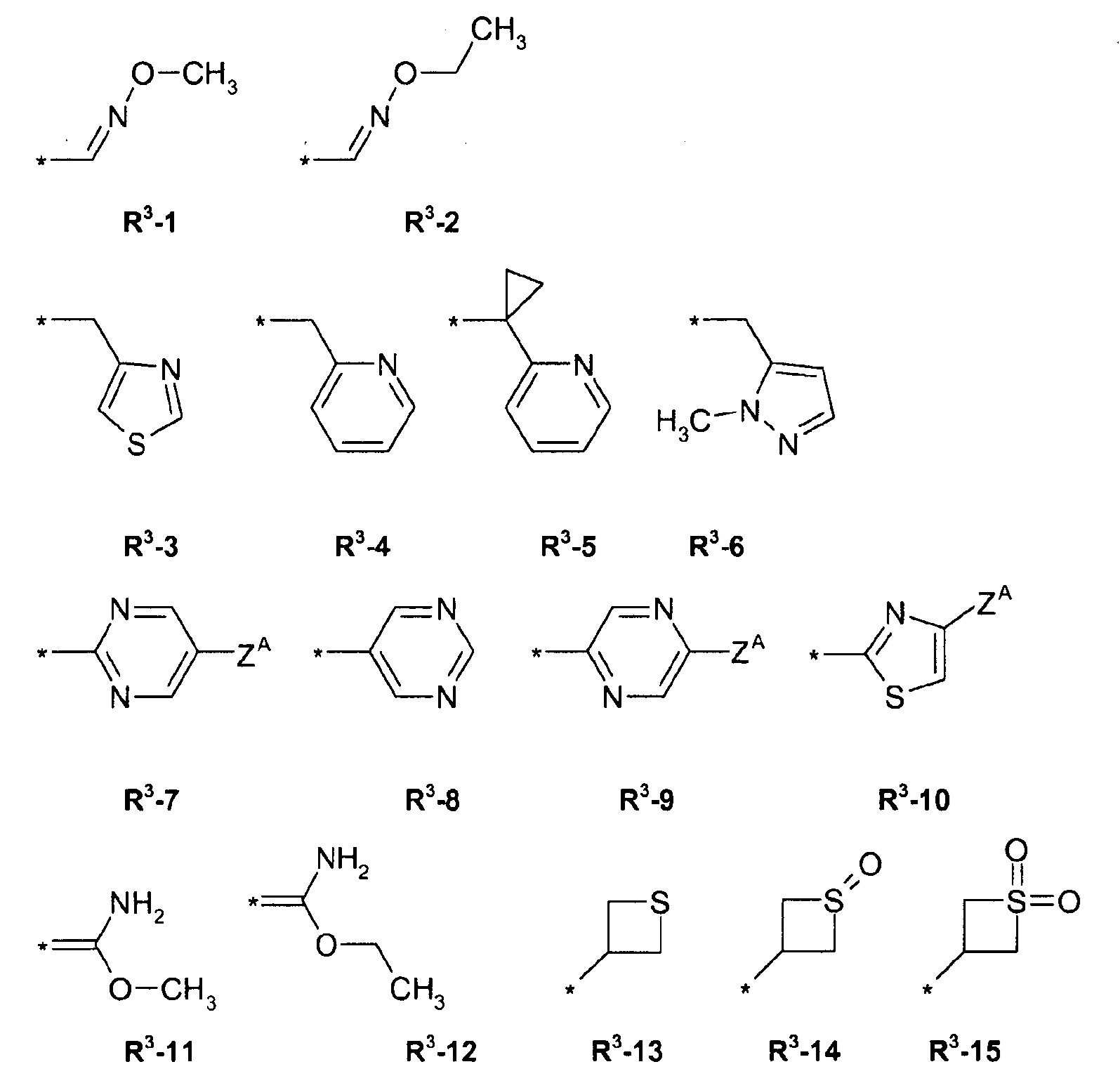
R4 = водород, этил, метоксиметил, галогенметоксиметил, этоксиметил, галогенэтоксиметил, пропоксиметил, метилкарбонил, этилкарбонил, пропилкарбонил, циклопропилкарбонил, метоксикарбонил, метоксиметилкарбонил, аминокарбонил, этиламинокарбонилметил, этиламинокарбонилэтил, диметоксиэтил, пропиниламинокарбонилметил, галогенэтиламинокарбонилметил, цианометиламинокарбонилметил или галогенэтиламинокарбонилэтил; или
R3 и R4 вместе образуют заместитель, выбираемый из группы, состоящей из:

где ZA = водород, галоген, циано, галогенметил (CF3); или его соль или сольват, твердый носитель и растворитель, при этом растворитель выбирают из 2-пирролидона, диметилацетамида или их смесей.
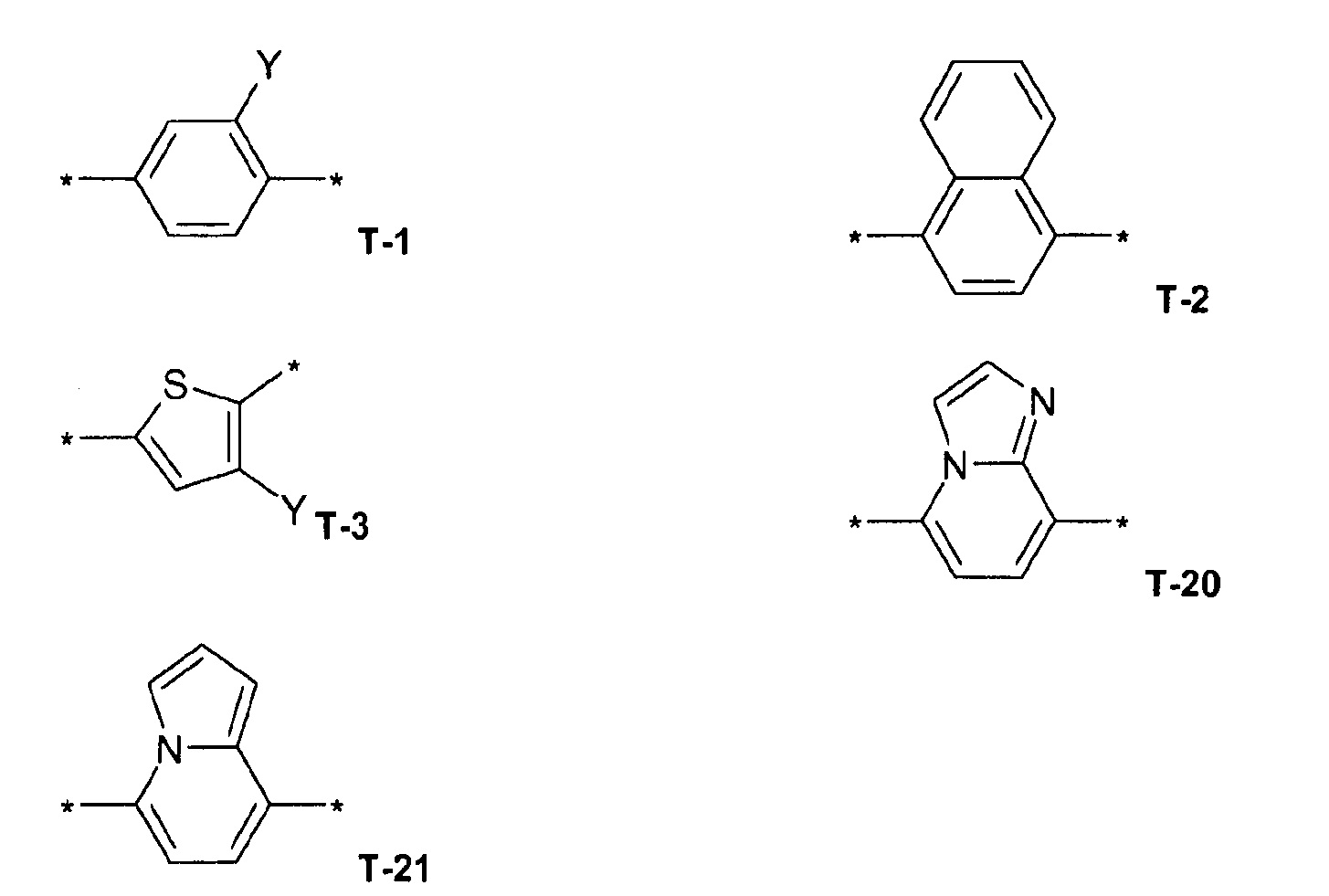
В одном предпочтительном варианте осуществления изобретения в формуле (I) T выбирают из











где в T-1, T-3 и T-4 радикал Y представляет собой водород, галоген, метил, галогенметил, этил, галогенэтил.
В предпочтительном варианте осуществления изобретения в формуле (I) Q выбирают из
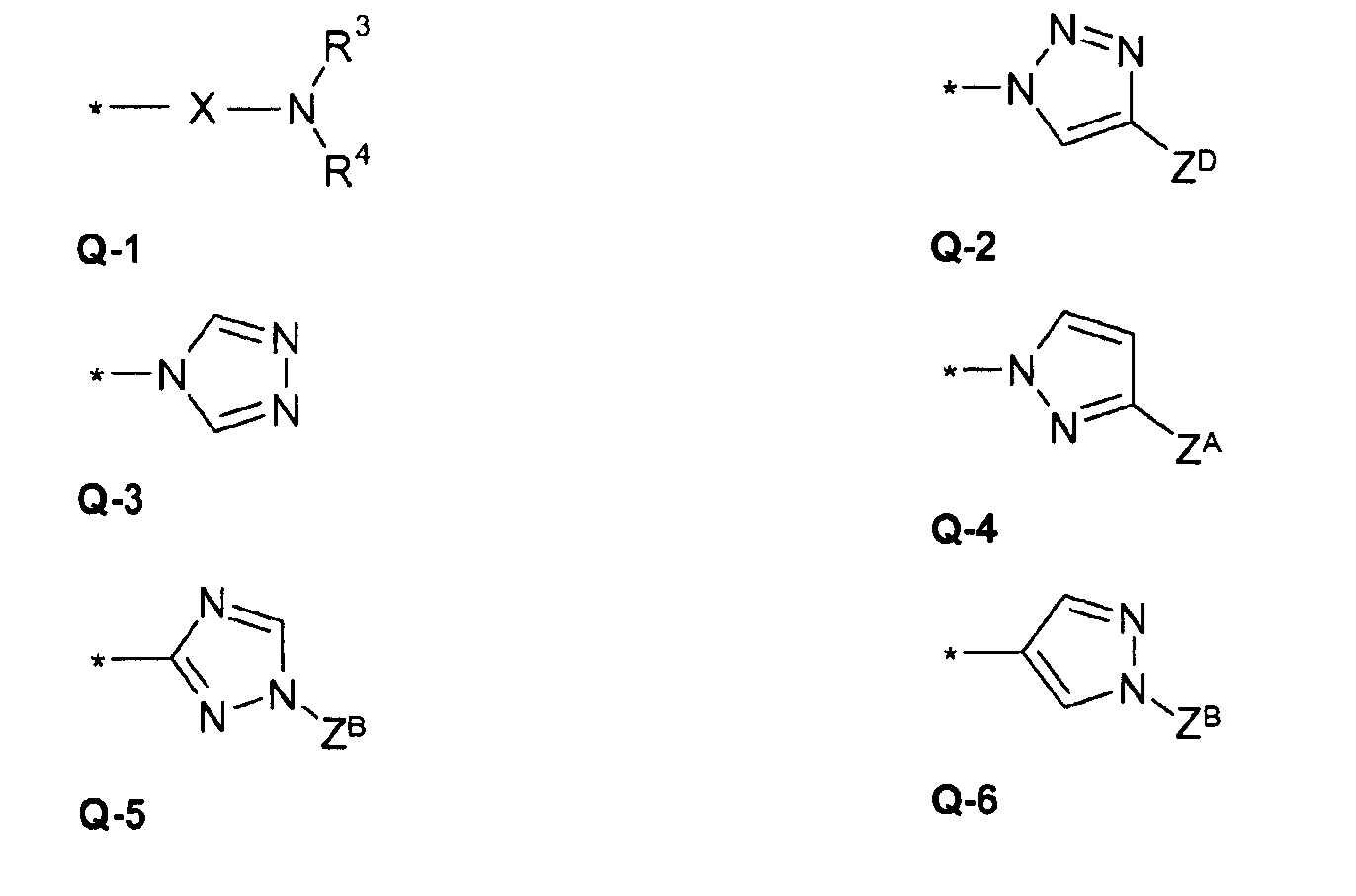
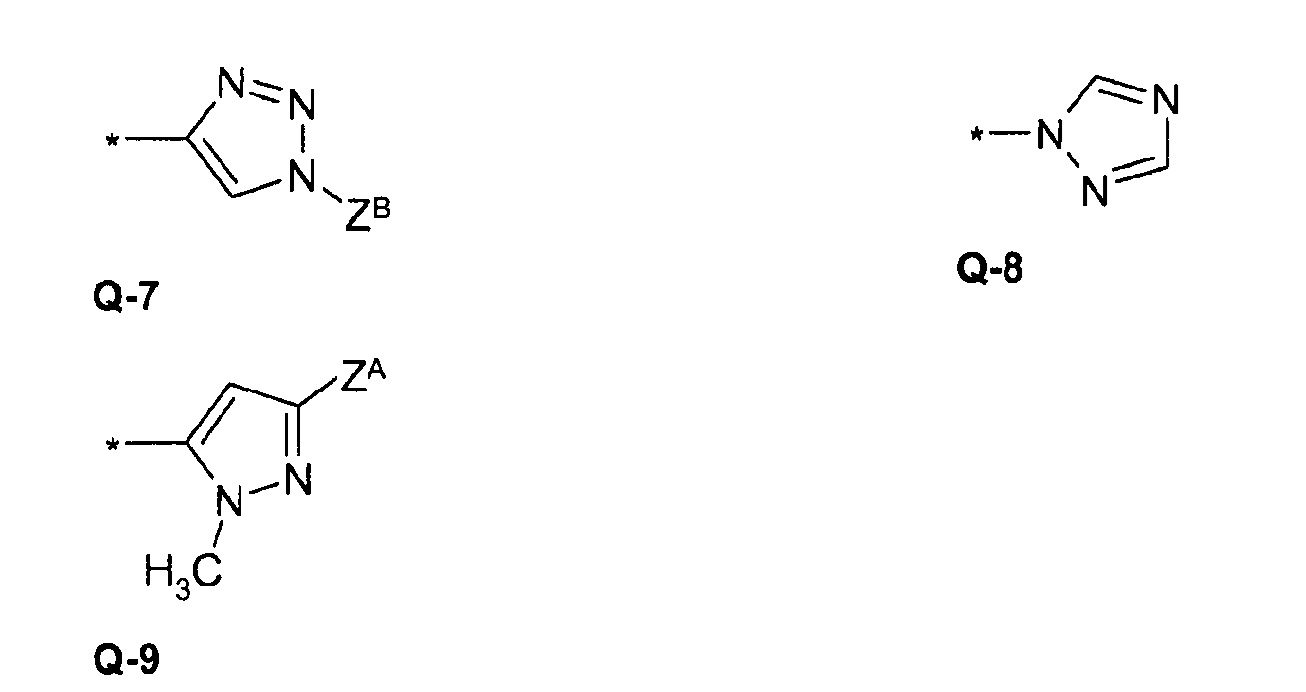
где R3, R4 X и ZА являются такими, как определено выше.
ZВ =
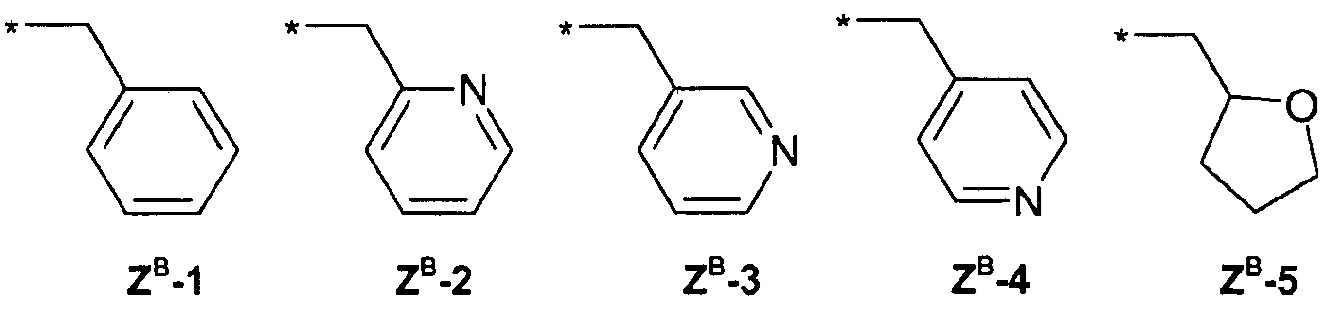
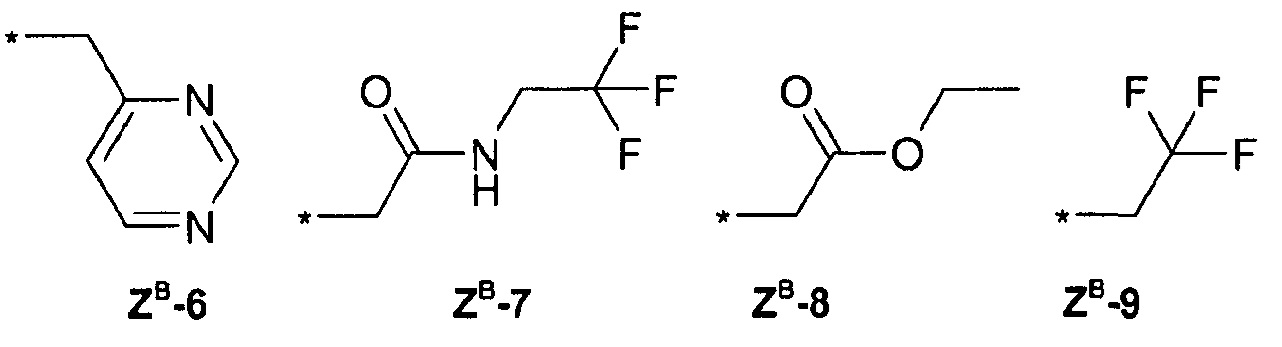
ZD =
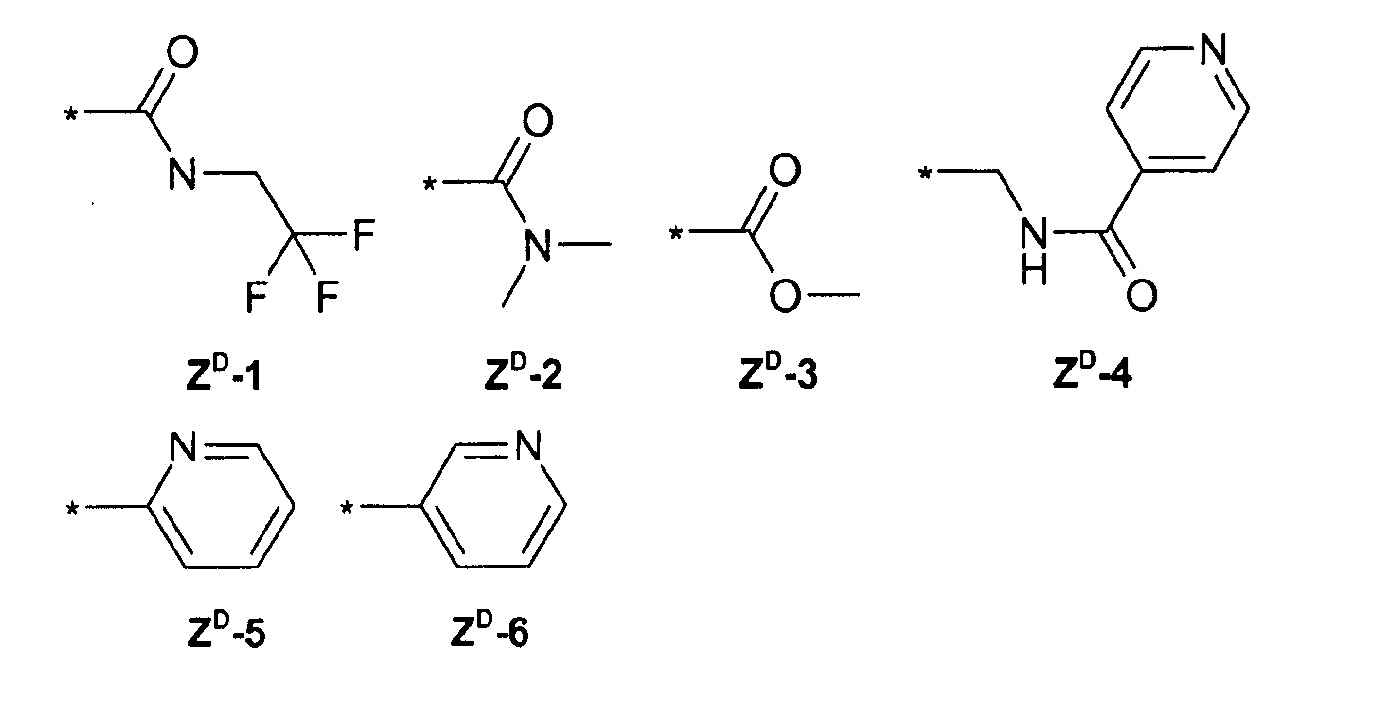
Предпочтительные соединения формулы (I) представляют собой:
Особенно предпочтительные соединения формулы (I) представляют собой:
Более предпочтительное соединение имеет формулу (II),
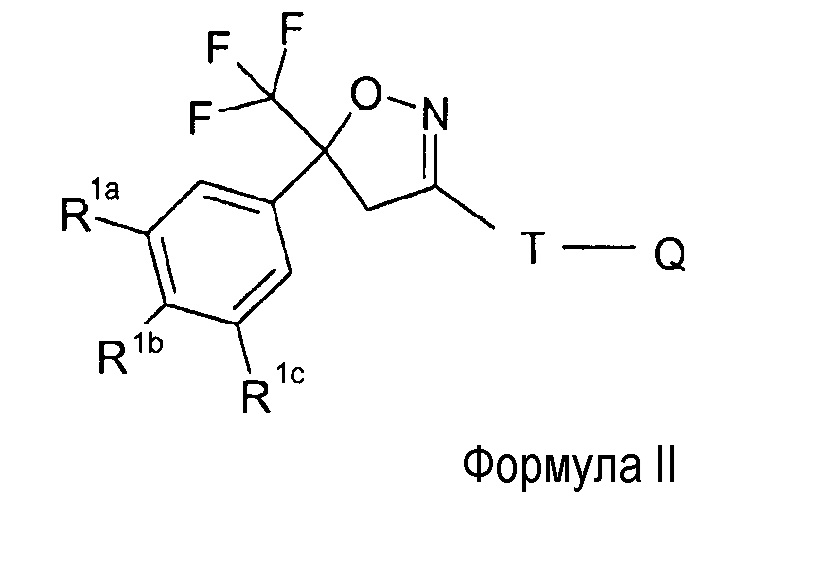
где
R1a, R1b, R1c представляют собой, независимо друг от друга, водород, Cl или CF3, предпочтительно R1a и R1c представляют собой Cl или CF3, и R1b представляет собой водород,
T представляет собой
где Y представляет собой метил, бром, Cl, F, CN или C(S)NH2, и
Q имеет описанные выше значения.
В другом предпочтительном варианте осуществления изобретения R3 представляет собой H, и R4 представляет собой -CH2-C(О)-NH-CH2-CF3, -CH2-C(О)-NH-CH2-CH3, -CH2-CH2-CF3 или -CH2-CF3.
В из одном вариантов осуществления изобретения соединение формулы (I) представляет собой 4-[5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-2-метил-N-[(2,2,2-трифторэтилкарбамоил)метил]бензамид (CAS RN 864731-61-3 - USAN флураланер).
В другом варианте осуществления изобретения соединение формулы (I) представляет собой (Z)-4-[5-(3,5-дихлорфенил)-5-трифторметил-4,5-дигидроизоксазол-3-ил]-N-[(метоксиимино)метил]-2-метилбензамид (CAS RN 928789-76-8).
В другом варианте осуществления изобретения соединение формулы (I) представляет собой 4-[5-(3,5-дихлорфенил)-5-(трифторметил)-4H-изоксазол-3-ил]-2-метил-N-(тиетан-3-ил)бензамид (CAS RN 1164267-94-0), который был раскрыт в WO 2009/0080250.
В другом варианте осуществления изобретения соединение формулы (I) представляет собой 4-[5-[3-хлор-5-(трифторметил)фенил]-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-N-[2-оксо-2-[(2,2,2-трифторэтил)амино]этил]-1-нафталинкарбоксамид (CAS RN 1093861-60-9, USAN - афоксоланер), который был раскрыт в WO 2007/079162.
В другом варианте осуществления изобретения соединение формулы (I) представляет собой 5-[5-(3,5-дихлорфенил)-4,5-дигидро-5-(трифторметил)-3-изоксазолил]-3-метил-N-[2-оксо-2-[(2,2,2-трифторэтил)амино]этил]-2-тиофенкарбоксамид (CAS RN 1231754-09-8), который был раскрыт в WO 2010/070068.
Особенно предпочтительное соединение представляет собой
Особенно предпочтительные соединения формулы (II) представляют собой:
Изоксазолиновые соединения известны из уровня техники, и эти соединения и их применение в качестве паразитицидов описаны, например, в заявке США на патент № US 2007/0066617 и в международных патентных заявках WO 2007/079162, WO 2009/002809, WO 2009/024541, WO 2009/003075, WO 2009/080250, WO 2010/070068, WO 2010/079077, WO 2011/075591 и WO 2011/124998, раскрытия которых, а также и ссылки, цитируемые в данном документе, включены посредством ссылки. Этот класс соединений, как известно, обладает исключительной активностью против эктопаразитов, таких как иксодовые клещи и блохи.
Изоксазолиновые соединения могут существовать в различных изомерных формах. Ссылка на изоксазолиновое соединение всегда включает все возможные изомерные формы такого соединения. Если не указано иное, структура соединения, для которой не указана определенная конформация, подразумевает охват композиций всех возможных конформационных изомеров соединения, а также композиций, включающих меньше, чем все возможные конформационные изомеры. В некоторых вариантах осуществления изобретения соединение представляет собой хиральное соединение. В некоторых вариантах осуществления изобретения соединение не является хиральным соединением.
Изоксазолиновые соединения формулы (I) могут быть получены в соответствии с теми или другими способами, описанными, например, в патентных заявках US 2007/0066617, WO 2007/079162, WO 2009/002809, WO 2009/080250, WO 2010/070068, WO 2010/079077, WO 2011/075591 и WO 2011/124998, или любым другим способом, относящимся к компетенции специалиста в данной области техники, являющегося экспертом в области химического синтеза. В случае химического получения продуктов по изобретению, специалистом в данной области техники считается имеющий в своем распоряжении, среди прочего, полный информационный ресурс “Chemical Abstracts” и документы, которые цитируются в описании.
Композиции согласно изобретению являются эффективными в течение длительного периода времени при лечении млекопитающих животных от эктопаразитов и, в частности, от блох и иксодовых клещей у мелких млекопитающих, таких как собаки и кошки.
Количество изоксазолинового соединения формулы (I) в композиции может находиться в диапазоне 1-15% масс./масс. В альтернативном варианте осуществления изобретения количество такого соединения может находиться в диапазоне 2,0-7,5% масс./масс. Предпочтительный диапазон составляет 3,0-4,5% масс./масс.
В одном из вариантов осуществления изобретения композиция включает твердый носитель, например, микрокристаллическую целлюлозу, коллоидную двуокись кремния, поливинилпирролидон или другой твердый носитель как вспомогательное вещество с подходящими характеристиками эксплуатационных свойств.
В одном из вариантов осуществления изобретения твердый носитель представляет собой микрокристаллическую целлюлозу (10,0-50,0% масс./масс., предпочтительно 15,0-25,0% масс./масс.).
В композиции согласно изобретению один из предпочтительных растворителей представляет собой пирролидоновый растворитель, в частности 2-пирролидон. Альтернативно, могут быть использованы другие пирролидоновые растворители, такие как N-метилпирролидон.
Другой предпочтительный растворитель представляет собой диметилацетамид (DMAC). Предпочтительный диапазон содержания диметилацетамида (DMAC) составляет 2,0-35,0% масс./масс. Альтернативные растворители для использования в настоящем изобретении: диметилсульфоксид, диметилформамид, моноэтиловый эфир диэтиленгликоля, этиллактат, этилен-монометиловый эфир, гликофурол, N,N-диэтил-м-толуамид (DEET) или другой растворитель с подходящей растворяющей способностью для соединения формулы (I). Комбинации растворителей также могут быть использованы в композиции в соответствии с изобретением. Предпочтительный диапазон содержания таких других растворителей составляет 2,0-35,0% масс./масс.
Количество пирролидонового растворителя, конкретно, 2-пирролидона, в композиции может находиться в диапазоне 2,5-30,0% масс./масс. Предпочтительный диапазон составляет 7,0-12,0% масс./масс. Предпочтительный диапазон другого растворителя, диметилацетамида, составляет 2,0-35,0% масс./масс.
В одном из вариантов осуществления изобретения твердая дозированная форма для перорального введения представляет собой мягкую жевательную форму. В другом варианте осуществления изобретения твердая дозированная форма для перорального введения представляет собой традиционную (твердую) таблетку. Такая таблетка может включать покрывающую оболочку или может включать вспомогательные вещества для замедленного высвобождения активного компонента, которые известны в данной области техники. Еще одном варианте осуществления изобретения используются гранулы для перорального введения или капсулы.
«Мягкая жевательная форма» или «мягкий жевательный фармацевтический продукт для применения в ветеринарии» предназначены для обозначения продукта, который является твердым при комнатной температуре и который является мягким при жевании, и который при целевом использовании поддается жеванию, поскольку продукт имеет некую пластичную текстуру в течение процесса пережевывания в ротовой полости. Такие мягкие жевательные формы обладают мягкостью, которая аналогична мягкости котлеты из мясного фарша, прошедшей тепловую обработку.
В мягких жевательных композициях важными являются формообразующее вещество для текстуры мягкой жевательной формы и возможность формирования единичных мягких жевательных форм из пастообразной массы, которые остаются неповрежденными и отдельными. Формообразующие вещества представляют собой вещества, придающие текстуре характеристики мягкого жевательного продукта, например, такие как полиэтиленгликоль (PEG), микрокристаллический воск, цетиловый спирт или поливинилпирролидон (PVP). В варианте осуществления изобретения формообразующее вещество представляет собой полиэтиленгликоль (PEG). Кроме того, в зависимости от требуемой консистенции мягкой жевательной формы может быть использован PEG с разной молекулярной массой. В варианте осуществления изобретения используется PEG 8000. Однако выбранный PEG представляет собой приблизительный результат выбора, и молекулярная масса может быть выше или ниже чем 8000, но предпочтительно выше чем 600. Альтернативно, может быть использован PEG 3500.
В варианте осуществления изобретения формообразующее вещество составляет от приблизительно 3,0% до приблизительно 35% масс./масс. фармацевтической композиции. В альтернативном варианте осуществления изобретения формообразующее вещество составляет от приблизительно 4,5% до приблизительно, 30% масс./масс.% фармацевтической композиции. В альтернативном варианте осуществления изобретения формообразующее вещество составляет от приблизительно 10% до приблизительно 20% масс./масс. фармацевтической композиции. В случае, когда формообразующее вещество представляет собой поливинилпирролидон, например, 2, 4, 5, 6 или 9% масс./масс. присутствуют в мягкой жевательной форме.
Предпочтительный состав для твердой пероральной фармацевтической композиции может быть следующим:
4,4% масс./масс. соединения формулы (I), а именно флураланера
10,5% масс./масс. 2-пирролидона
25,0% масс./масс. микрокристаллической целлюлозы
5,1% масс./масс. натриевой соли гликолята крахмала
15,0% масс./масс. вкусового ароматизирующего вещества
2,0% масс./масс. лаурилсульфата натрия
2,5% масс./масс. памоата натрия
0,5% масс./масс. аспартама
0,5% масс./масс. стеарата магния
1,5% масс./масс. глицерина
17,25% масс./масс. соевого масла
15,75% масс./масс. PEG 8000
Количество глицерина в композиции может изменяться в диапазоне 0-12,0%, с предпочтением диапазона 0,5-10,0%. Количество соевого масла может изменяться в диапазоне 5,0-25,0%, с предпочтением диапазона 10,0-22,0%. Желательные диапазоны содержания других вспомогательных веществ могут быть следующими: натриевая соль гликолята крахмала (2,0-15,0%), вкусовое ароматизирующее вещество (5-25%), лаурилсульфат натрия (0,05-5,0%), памоат натрия (0,01-5,0%), аспартам (0,01-2,0%) и стеарат магния (0,01-2,0%).
Композиция, в соответствии с настоящим изобретением, обычно дополнительно включает физиологически приемлемые для композиции вспомогательные вещества, известные в данной области техники, например, описанные в публикации “Gennaro, Remington: The Science and Practice of Pharmacy” (20th Edition, 2000), включенной в данный документ посредством ссылки. Все такие ингредиенты, носители и вспомогательные вещества должны быть по существу фармацевтически чистыми или чистыми для применения в ветеринарии и нетоксичными в применяемых количествах, а также должны быть совместимыми с фармацевтически активными ингредиентами.
Дополнительные вспомогательные вещества, которые могут присутствовать в композиции, представляют собой, например, один или несколько наполнителей, одно или несколько вкусовых ароматизирующих веществ или подсластителей, поверхностно-активные вещества, стабилизирующие вещества, добавки для повышения текучести, регулирующие распадаемость вещества, консервирующие вещества и/или смазывающие вещества.
Настоящее изобретение также относится к композициям, как описано выше, с комбинациями, включающими более одного фармацевтически активного ингредиента, например, в дополнение к соединению формулы (I) другое соединение формулы (I) или фармацевтически активный ингредиент с иной структурой.
Предпочтительные комбинации, включающие активные ингредиенты, выбирают из группы, состоящей из изоксазолиновых соединений формулы (I) или (II) и авермектинов и мильбемицинов. В одном из вариантов осуществления изобретения композиция, особенно мягкая жевательная форма, включает комбинацию изоксазолинового соединения формулы (I), а именно флураланера или афоксоланера, с ивермектином. В другом варианте осуществления изобретения мягкая жевательная форма включает комбинацию изоксазолинового соединения формулы (I), а именно флураланера или афоксоланера, с мильбемицином или с моксидектином.
Другие комбинации по настоящему изобретению могут включать регуляторы роста насекомых или клещей (AGR или IGR), такие как, например, феноксикарб, люфенурон, дифлубензурон, новалурон, трифлумурон, флуазурон, циромазин, метопрен, пирипроксифен и т.д., тем самым обеспечивая как первоначальную, так и длительную борьбу с паразитами (на всех стадиях развития насекомого, включая яйца) у субъекта животного происхождения, а также в среде обитания подопытного животного.
Изобретатели обнаружили, что могут быть получены твердые дозированные формы для перорального применения изоксазолиновых соединений формулы (I), как описано выше, особенно флураланера, афоксоланера, что обеспечит более высокую биодоступность изоксазолинового соединения после введения животным. В таких способах получения изоксазолиновое соединение формулы (I) сначала растворяется в подходящем растворителе (например, 2-пироле или DMAC), и затем прилипает к твердому носителю (например, микрокристаллической целлюлозе). Такой способ может быть использован в целом для разнообразных твердых дозированных форм для перорального введения, таких как твердые таблетки, гранулы, капсулы или мягкие жевательные формы (мягкие жевательные таблетки).
Общий способ получения твердой дозированной формы для перорального введения, такой как мягкая жевательная таблетка, включает стадии:
1. Растворение изоксазолинового соединения (например, флураланера или афоксоланера) в растворителе (например, 2-пирролидоне) с образованием раствора.
2. Добавление изоксазолинового раствора к твердому носителю (например, к микрокристаллической целлюлозе) и смешивание с образованием первой сухой смеси.
3. Добавление всех других сухих вспомогательных веществ к первой сухой смеси и смешивание с образованием второй сухой смеси.
4. Добавление жидких ингредиентов, глицерина и соевого масла ко второй сухой смеси. Смешивание с образованием влажной массы.
5. Расплавление воска (например, полиэтиленгликоля 8000) и добавление его к влажной массе. Хорошее перемешивание с образованием итоговой массы нефасованного продукта.
6. Формирование жевательных таблеток соответствующего размера.
В варианте осуществления изобретения таблетки могут быть сформированы из итоговой массы нефасованного продукта с использованием формовочной машины. Альтернативно, таблетки могут быть сформированы другими способами, известными в данной области техники. Например, таблетки могут быть сформированы вручную.
Способы применения твердых фармацевтических композиций для перорального введения
В одном из вариантов осуществления продукт по изобретению предназначается для применения в борьбе с насекомыми-паразитами, клещами и/или гельминтами, особенно с заражением насекомыми-паразитами и/или клещами. Термин «борьба с заражением насекомыми-паразитами и/или клещами» относится к предотвращению, сокращению или устранению заражения такими паразитами животных, предпочтительно посредством уничтожения насекомых и/или клещей-паразитов или нематодных паразитов в срок, исчисляемый часами или днями.
Термин «насекомое-паразит и клещ» относится к эктопаразитам, например, к вредителям из числа насекомых и клещей, которые обычно заражают или инфицируют животных. Примеры таких эктопаразитов включают стадии яйца, личинки, куколки, нимфальную и взрослую для вшей, блох, комаров, клещей, иксодовых клещей и кусающих или раздражающих летучих видов. Главным образом, это блохи и иксодовые клещи, особенно в период их взрослой стадии.
Примеры беспозвоночных паразитических вредителей, с которыми борются путем введения животному, подлежащему защите, твердой композиции для перорального введения по настоящему изобретению, включают эктопаразитов (членистоногие, клещи и т.д.) и эндопаразитов (гельминты, например, нематоды, трематоды, цестоды, скребни и т.д.).
В частности, композиции по настоящему изобретению эффективны против эктопаразитов, включая: мух, таких как Haematobia (Lyperosia) irritans (жигалка коровья малая), Stomoxys calcitrans (жигалка обыкновенная), Simulium spp. (мошки), Glossina spp. (муха цеце), Hydrotaea irritans (головная муха), Musca autumnalis (муха полевая), Musca domestica (комнатная муха), Morellia simplex (пастбищная муха), Tabanus spp. (слепень), Hypoderma bovis, Hypoderma lineatum, Lucilia sericata, Lucilia cuprina (зеленая падальница), Calliphora spp. (мясная муха), Protophormia spp., Oestrus ovis (носоглоточные оводы), Culicoides spp. (комары-дергуны), Hippobosca equine, Gastrophilus instestinalis, Gastrophilus haemorrhoidalis и Gastrophilus naslis; вшей, таких как Bovicola (Damalinia) bovis, Bovicola equi, Haematopinus asini, Felicola subrostratus, Heterodoxus spiniger, Lignonathus setosus и Trichodectes canis; кровососок овечьих, таких как Melophagus ovinus; клещей, таких как Psoroptes spp., Sarcoptes scabei, Chorioptes bovis, Demodex equi, Cheyletiella spp., Notoedres cati, Trombicula spp. и Otodectes cyanotis (ушные клещи); иксодовых клещей, таких как Ixodes spp., Boophilus spp., Rhipicephalus spp., Amblyomma spp., Dermacentor spp., Hyalomma spp. и Haemaphysalis spp.; и блох, таких как Ctenocephalides felis (блоха кошачья) и Ctenocephalides canis (блоха собачья).
Как правило, композиции согласно изобретению будут содержать эффективное количество изоксазолиновых соединений формулы (I), определенной выше, что означает нетоксичное, но достаточное количество для обеспечения желательного эффекта в борьбе с паразитами. Специалист в данной области техники, используя стандартную методику экспериментальной работы, может определить подходящее «эффективное» количество в любом конкретном случае. Такое количество будет зависеть от возраста, патологического состояния, массы и вида целевого животного.
Твердые дозированные формы для перорального введения могут быть составлены так, чтобы содержать количество изоксазолинового соединения формулы (I), которое корректируется для животных в конкретном диапазоне массы. Животные могут получать дозу твердой дозированной формы для перорального введения согласно изобретению каждые 2, 3, 4, 5 или 6 месяцев, или использовать месячный, недельный или суточный режим дозирования. Лечение может быть, например, непрерывным или сезонным. Период времени между курсами лечения зависит от таких факторов, как: от какого паразита(ов) проводится лечение, степень заражения паразитами, вид млекопитающего или птицы и среда их постоянного обитания. Известно, что в рамках профессионального уровня специалист-практик может определить соответствующий период введения для конкретного случая.
Твердые дозированные формы для перорального введения по настоящему изобретению особенно подходят для противодействия паразитам, которые заражают млекопитающих (включая человека). Млекопитающие субъекты включают приматов (например, нечеловекообразные обезьяны), крупный рогатый скот (например, быки, коровы или молочные коровы), животных семейства свинообразных (например, кабаны или свиньи), мелких жвачных животных (например, козы или овцы), животных семейства лошадиных (например, лошади), животных семейства псовых (например, собаки), животных семейства кошачьих (например, домашние кошки), верблюдов, оленей, ослов, буйволов, антилоп, кроликов и животных отряда грызунов (например, морские свинки, белки, крысы, мыши, карликовые песчанки и хомяки). Особо следует отметить вариант осуществления изобретения, где животными, подлежащими защите, являются домашние собаки (т.е. Canis lupus familiaris) и домашние кошки (т.е. Felis catus).
В некоторых вариантах осуществления настоящего изобретения твердую дозированную форму для перорального введения изоксазолина формулы (I) вводят с целью лечения паразитоза у животных (или для изготовления лекарственного средства для лечения паразитоза у животных). Термин «паразитоз» включает патологические состояния и заболевания, непосредственно связанные с или вызываемые одним или несколькими эктопаразитами, такие как, например, анемия и вызванный блохами аллергический дерматит. Он также включает патологические состояния или заболевания, связанные с тем, что их вызывают один или несколько патогенов переносчиков трансмиссивных заболеваний, такие как, например, болезнь Лайма, Эрлихиоз (прежде всего, эрлихиоз у собак) и пятнистая лихорадка Скалистых гор от переносчика, представляющего собой иксодовые клещи.
Настоящее изобретение также относится к способам лечения, в которых, по меньшей мере, дополнительным показателем борьбы с эктопаразитами у животных и/или на животных является контроль над заражением эктопаразитами окружающего пространства, которое заселяется (периодически или постоянно) животными. В некоторых таких вариантах осуществления изобретения, например, животное представляет собой домашнее животное-компаньон (например, кошку или собаку). Окружающее пространство может быть, например, домом или другим жилищем; комнатой; клеткой, стойлом или другими ограждающими приспособлениями; подложкой и т.д.
Настоящее изобретение также относится к наборам, которые, например, удобны для использования при осуществлении способов лечения, описанных выше. Как правило, такой набор будет включать твердую дозированную форму для перорального введения согласно изобретению, содержащую терапевтически эффективное количество изоксазолина формулы (I) и дополнительный компонент(ы). Дополнительный компонент(ы) может представлять собой, например, один или несколько из следующих компонентов: средство диагностики, инструкции для введения композиции, инструменты для введения композиции, контейнер, содержащий вспомогательное вещество или другой активный ингредиент, предназначенный для смешивания или вводимый в сочетании с композицией, или памятка счетчика доз (например, марка для наклеивания на календарь для напоминания хозяину животного о времени введения следующей дозы композиции).
Так, как используется в данном документе, термин «масс./масс.» обозначает масса/масса, термин «масс./об.» обозначает масса/объем, и термин «мг/кг» обозначает миллиграммы на килограмм массы тела. Так, как используется в данном документе, % масс./масс. представляет собой процентное содержание по массе для ингредиента в составе продукта.
Изобретение было полностью описано, его практическое осуществление иллюстрируется примерами, представленными ниже. Примеры не ограничивают объем изобретения, который сформулирован целиком и полностью в прилагаемой формуле изобретения.
Примеры
Пример 1
Вариант осуществления изобретения для полученной способом прямого прессования таблетки, содержащей два активных ингредиента, включает:
0,015% масс./масс. ивермектина
2,5% масс./масс. флураланера
0,1% масс./масс. лимонной кислоты
0,5% масс./масс. Кремафора RH40
4,5% масс./масс. 2-пирролидона
50,0% масс./масс. микрокристаллической целлюлозы
33,735% масс./масс. кукурузного крахмала
8,0% масс./масс. вкусового ароматизирующего вещества
0,5% стеарата магния
0,1% масс./масс. аспартама
0,05% масс./масс. красного оксида железа
Пример 2
Вариант осуществления изобретения для мягких жевательных таблеток, содержащих два активных ингредиента, включает:
0,42% масс./масс. моксидектина
1,67% масс./масс. флураланера
0,2% масс./масс. лимонной кислоты
4,0% масс./масс. 2-пирола
10,0% масс./масс. микрокристаллической целлюлозы
3,0% масс./масс. вкусового ароматизирующего вещества
0,2% масс./масс. аспартама
4,0% масс./масс. Клуцела
30,51% масс./масс. соевой крупы
4,0% масс./масс. пропиленгликоля
4,0% масс./масс. Миглиола 812
8,0% масс./масс. цетилового спирта
10,0% масс./масс. Кремафора RH40
20,0% масс./масс. натриевой соли гликолята крахмала
Пример 3
Дополнительные варианты осуществления изобретения для мягких жевательных таблеток включают:
5,333% масс./масс. флураланера
9,0% масс./масс. 2-пирролидона
11,0% масс./масс. микрокристаллической целлюлозы
5,0% масс./масс. Плюроника 127
5,0% масс./масс. лаурилсульфата натрия
10,0% масс./масс. вкусового ароматизирующего вещества
5,0% масс./масс. натриевой соли гликолята крахмала
16,667% соевой крупы
2,0% масс./масс. Лабразола
13,0% масс./масс. Лабрафака PG
18,0% масс./масс. PEG 3350
Пример 4
7,25% масс./масс. флураланера
10,5% масс./масс. 2-пирролидона
22,75% микрокристаллической целлюлозы
2,0% коллоидной двуокиси кремния
3,5% масс./масс. Лутрола Микро 127
3,5% масс./масс. лаурилсульфата натрия
15,0% масс./масс. вкусового ароматизирующего вещества
0,5% масс./масс. аспартама
0,5% масс./масс. стеарата магния
2,0% масс./масс. Лабразола
14,75% масс./масс. соевого масла
15,25% масс./масс. PEG 8000
Пример 5
7,5% масс./масс. флураланера
7,0% масс./масс. диметилацетамида
23,5% микрокристаллической целлюлозы
15,0% масс./масс. вкусового ароматизирующего вещества
7,5% масс./масс. натриевой соли гликолята крахмала
3,5% масс./масс. лаурилсульфата натрия
2,0% масс./масс. памоата натрия
0,5% масс./масс. стеарата магния
0,5% масс./масс. аспартама
7,0% масс./масс. глицерина
10,0% масс./масс. соевого масла
16,0% масс./масс. PEG 8000
Пример 6
4,4% масс./масс. флураланера
10,5% масс./масс. 2-пирролидона
25,0% микрокристаллической целлюлозы
15,0% масс./масс. вкусового ароматизирующего вещества
5,1% масс./масс. натриевой соли гликолята крахмала
3,5% масс./масс. лаурилсульфата натрия
2,5% масс./масс. памоата натрия
0,5% масс./масс. стеарата магния
0,5% масс./масс. аспартама
3,0% масс./масс. глицерина
14,25% масс./масс. соевого масла
15,75% масс./масс. PEG 8000
Пример 7
Многочисленные композиции были исследованы для определения их влияния на биодоступность флураланера в случае получения его в виде мягкой жевательной таблетки.
Описания выбранных композиций перечислены ниже.
Диметилацетамид (DMAC) представляет собой хороший растворитель для активного ингредиента (A-1443) с растворяющей способностью 791,5 мг/мл. Однако, в случае его использования в этом типе подхода к технологии получения композиции, сходные фармакокинетические профили были получены при сравнении с жевательными таблетками с включением активного ингредиента в виде твердого вещества (контроль). Учитывая, что композицию с DMAC вводили в более низкой дозе (15 мг/кг по сравнению с 25 мг/кг в случае контроля), эти результаты представляют собой улучшения в подборе дозы по фармакокинетическим измерениям (Cмакс и AUC) по сравнению с контролем (см. таблицу 2 и фигуру 1).
В случае использования 2-пирролидона (2-пирола) в качестве растворителя в композиции (растворяющая способность 775,41 мг/мл), наблюдали существенно более высокие уровни содержания в плазме по сравнению с контролем, даже при введении композиции в более низкой дозе (15 мг/кг по сравнению с 25 мг/кг для контроля). Нормализованные фармакокинетические измерения дозы (Cмакс и AUC) в случае композиции с 2-пиролом превышают более чем в два раза таковые показатели для композиции с DMAC и превышают более чем в три раза таковые показатели для контроля (см. таблицу 2 и фигуру 1). Эти результаты были неожиданными.
Такой подход к композиции обеспечивает существенное улучшение биодоступности, предоставляя возможность существенно более низкой дозировки, необходимой для достижения аналогичных и даже превосходящих фармакокинетических профилей.
Пример 8
Фармакокинетический профиль после перорального введения жевательных композиций изоксазолиновых соединений
Целью данного исследования является сравнение фармакокинетического профиля для плазмы крови в случае трех различных изоксазолиновых соединений в двух различных жевательных композициях после однократного перорального (PO) введения собакам.
Тестовые композиции:
На основе нижеприведенных соединений были получены композиции согласно изобретению. В частности, изоксазолиновое соединение сначала растворяли в растворителе, т.е. 2-пирролидоне. Этот лекарственный раствор затем адсорбировали на твердый носитель, т.е. микрокристаллическую целлюлозу, который включали в твердую дозированную форму для перорального введения, как изложено в описании, со вспомогательными веществами, как указано в таблице 3. Сравнительный пример композиции с идентификационным номером (ID) 13-009, 13-011 и 13-013 содержит активное лекарственное вещество, включенное в виде твердого вещества, которое было получено так, как в общем виде изложено в описании, без предшествующего предварительного растворения активного ингредиента и адсорбирования на твердом носителе.
(Изоксазолин) Соединение A
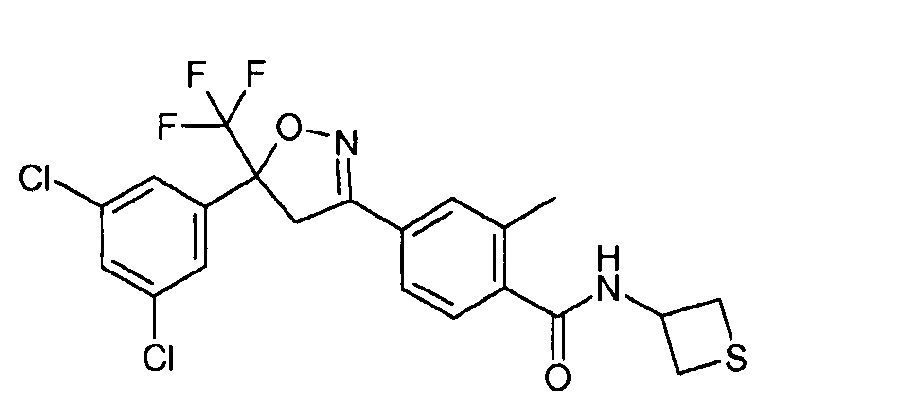
(Изоксазолин) Соединение B
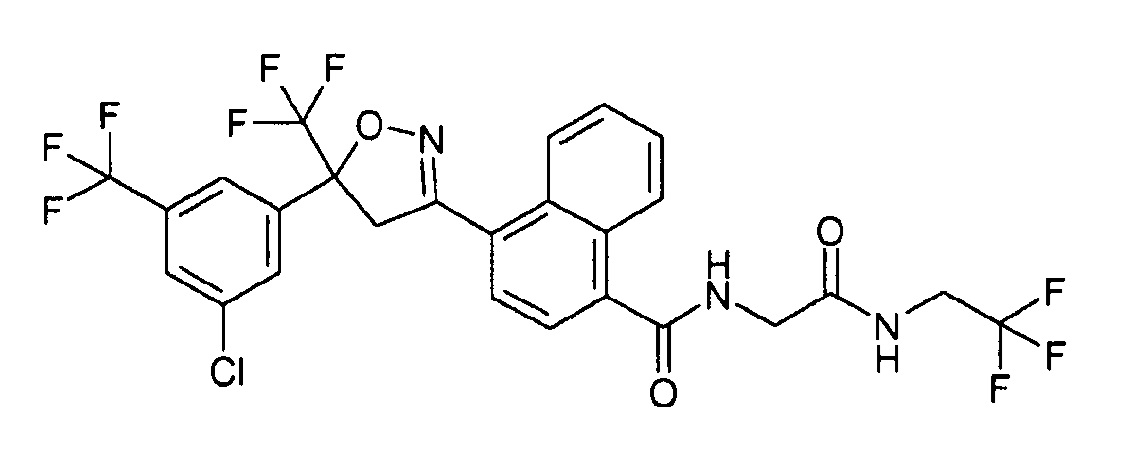
(Изоксазолин) Соединение C
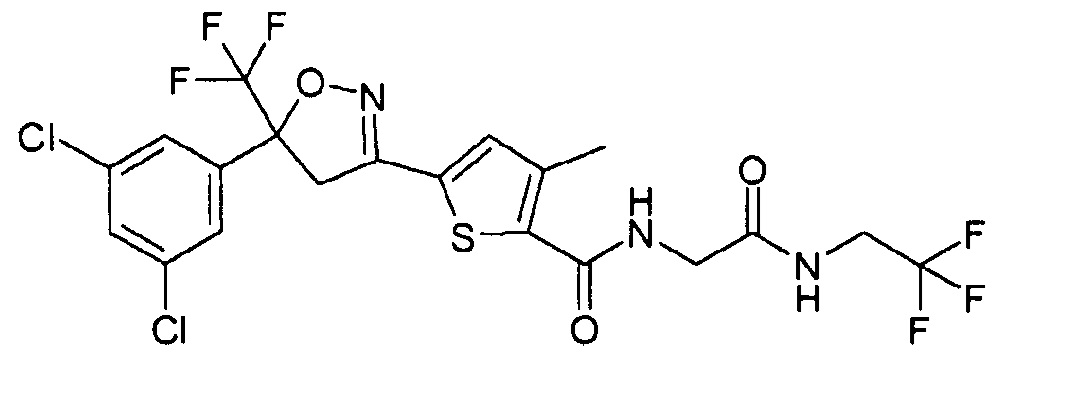
План исследования
Тестовые соединения вводили перорально четырем собакам породы бигль на дозируемую группу, в итоге всего были задействованы двадцать четыре собаки.
Экспериментальный план: Рандомизированный полноблочный план
Каждому животному вводили таблетку или жевательную форму, помещая ее в задней части ротовой полости, поверх языка, инициируя глотание.
Плазму получали из отобранных проб крови и анализировали концентрации тестовых соединений. Индивидуальные пробы образцов крови (приблизительно 4,5 мл на образец) были отобраны из яремной вены в пробирки с цитратом натрия у всех собак для анализа лекарственного средства. Образцы крови отбирали в нижеуказанные моменты времени: перед лечением (не позднее чем за 2 часа перед дозированием лекарственного средства) и приблизительно спустя 1, 2, 4, 6, 8, 24, 48, 72 часов после введения дозы лекарственного средства (±15 мин). Конечный образец крови отбирали у каждой собаки на 7 день эксперимента (±2 ч после времени введения дозы лекарственного средства в 0 день).
Результаты:
В случае использования 2-пирролидона (2-пирола) в качестве растворителя в композиции (альтернативной жевательной форме), похожие или даже более высокие уровни содержания лекарственного средства в плазме крови наблюдали по сравнению с контрольной жевательной формой, даже в случае введения композиции в более низкой дозе (10 мг/кг по сравнению с 25 мг/кг для контроля) - см. фигуру 2.
Фармакокинетический анализ проводили на основе данных о концентрации лекарственного средства в плазме крови, используя компьютерную программу Pharsight WinNonlin Enterprise, Version 4.0.1, или более позднюю версию (Model 200: данные в плазме, экстраваскулярные исходные).
Нормализованные фармакокинетические измерения доз (Cмакс и AUC) в случае композиции с 2-пиролом (альтернативная жевательная форма) значительно превышают, в некоторых случаях более чем в два-пять раз, таковые для контрольной композиции (см. таблицу 5).
Такой подход к получению композиции обеспечивает существенное улучшение биодоступности по сравнению с контрольной композицией, предоставляя возможность существенно более низких дозировок, необходимых для достижения аналогичных и даже превосходящих фармакокинетических профилей. Эти результаты были неожиданными.
Пример 9
Эффективность против коричневых собачьих клещей (R. sanguineus) у собак
Была получена твердая фармацевтическая композиция согласно изобретению с нижеуказанными эксципиентами (вспомогательными веществами).
Собаки были рандомизированно разделены на 4 подвергаемые лечению группы, каждая из 8 животных, и одну не подвергаемую лечению группу из 8 животных. Собак в подвергаемых лечению группах лечили с помощью композиции, как описано выше, с нулевого дня, как показано в таблице 6:
Собак заражали паразитами в День-2 с помощью приблизительно 50 взрослых ненакормленных иксодовых клещей (R. sanguineus) и в Дни 28 и 56. Иксодовых клещей подсчитывали приблизительно через 48 ч после заражения паразитами и в Дни 30 и 58 (приблизительно через 48 часов после каждого повторного заражения после лечения), чтобы оценить убивающее клещей действие в подвергаемых лечению группах.
В таблице 7 показан зарегистрированный подсчет иксодовых клещей:
Реферат
Изобретение относится к медицине, в частности к способу получения мягкой жевательной фармацевтической композиции для применения в ветеринарии посредством перорального введения, содержащей изоксазолиновое соединение. Способ получения мягкой жевательной фармацевтической композиции включает стадии растворения изоксазолинового соединения в растворителе, добавления полученного раствора к твердому носителю и смешивания с образованием первой сухой смеси, добавления всех других сухих вспомогательных веществ к первой сухой смеси, добавления жидких ингредиентов, глицерина и масла к образованной второй сухой смеси, смешивания с образованием влажной массы, расплавления формообразующего вещества полиэтиленгликоля и добавления к влажной массе, перемешивания и формирования мягких жевательных таблеток. Осуществление изобретения позволяет получить мягкую жевательную фармацевтическую композицию с улучшенной биодоступностью, что позволяет существенно снизить дозировки активного вещества. 10 з.п. ф-лы, 9 пр., 2 ил., 7 табл.
Формула
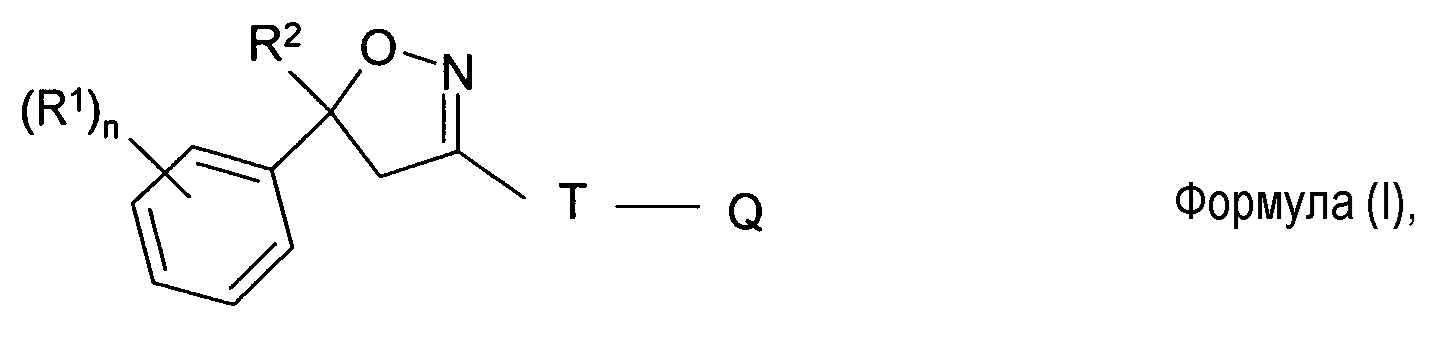

Документы, цитированные в отчёте о поиске
Изоксазолины для борьбы с беспозвоночными вредителями

Комментарии