Перенос генов, опосредованный лентивирусным вектором, и их использование - RU2288742C2
Код документа: RU2288742C2
Чертежи






































Описание
Предпосылки создания изобретения
Область, к которой относится изобретение
В общих чертах настоящее изобретение относится к области молекулярной биологии векторов и генотерапии. Более конкретно, настоящее изобретение относится к использованию лентивирусных векторов в генотерапии человека для лечения врожденных и пролиферативных глазных болезней.
Описание предшествующего уровня техники
Одной из наиболее распространенных причин слепоты человека является аномальная внутриглазная пролиферация клеток, которая в большинстве случаев, приводит к потере прозрачности зрительной оси или к отделению сетчатки от пигментного эпителия сетчатки (RPE), обусловленному силой натяжения, прилагаемой непосредственно к поверхности сетчатки. Пролиферативное отслоение сетчатки, независимо от того, ассоциируется ли оно с пролиферативным диабетическим заболеванием (PDR), с ретинопатией недоношенных (ROP), с пролиферирующей витреоретинопатией (PRV) или с реваскулярной дегенерацией желтого пятна, связанной со старением (AMD), в конечном счете, приводит к перманентной потере зрения, если оно не подвергалось лечению.
Аномальная пролиферация новых кровеносных сосудов глаза, т.е. неоваскуляризация глаза, является одной из наиболее распространенных причин перманентной слепоты у людей в развивитых странах. В большинстве случаев с развитием внутриглазной неоваскуляризации ассоциируются три заболевания: диабет, ретинопатия недоношенных и дегенерация желтого пятна, ассоциированная со старением. Хотя все эти три нозологические формы отличаются друг от друга и поражают различные группы пациентов, однако, все они имеют один и тот же конечный путь, который приводит к неконтролируемому делению эндотелиальных клеток и тем самым к образованию новых кровеносных сосудов, которые в конечном счете нарушают функцию сетчатки. В целом, в Соединенных Штатах такие состояния приблизительно в 60% случаях являются причиной не поддающейся лечению потери зрения.
Пролиферация васкулярных эндотелиальных клеток в сетчатке инициирует процесс развития пролиферативной диабетической ретинопатии (PDR). Если заболевание не подвергается лечению, то эти эндотелиальные клетки продолжают делиться и в конечном счете образуют фиброваскулярные мембраны, которые простираются вдоль всей внутренней поверхности сетчатки или проникают в стекловидную полость. Сокращение задней поверхности стекловидного тела приводит к натяжению на участках витреофиброваскулярной адгезии и в конечном счете приводит к отслоению сетчатки. Приблизительно у 50% пациентов с диабетом типа 1 пролиферативная диабетическая ретинопатия развивается в течение 20 лет после установления диагноза диабета, и у 10% пациентов с диабетом типа 2 через те же самые промежутки времени также может наблюдаться пролиферативная диабетическая ретинопатия.
Кровеносные сосуды обычно развиваются в соответствии с одним из двух механизмов, таким как образование и развитие сосудов или ангиогенез. В процессе неоваскуляризации еще не развившаяся сеть капилляров образуется во время эмбриогенеза в результате созревания полипотентных мезенхимальных предшественников. В противоположность этому ангиогенез представляет собой процесс ремоделирования с вовлечением уже имеющихся сосудов. При ангиогенезе из уже имеющихся старых сосудов образуются новые сосудистые зачаточные структуры, которые затем внедряются в окружающую ткань. В сетчатке после образования нормальной сосудистой сети ремоделирование этой сети происходит главным образом под действием низкой концентрации кислорода в ткани, то есть при гипоксии (кислородной недостаточности), которая стимулирует ангиогенез. Этот процесс приводит к слепоте у миллионов людей, страдающих диабетом, у недоношенных детей или у людей преклонного возраста.
Следовательно, внутриглазные заболевания, такие как дегенерация желтого пятна, ассоциированная со старением, пролиферативная диабетическая ретинопатия, ретинопатия недоношенных, глаукома и пролиферативная витреоретинопатия, характеризуются аномальной пролиферацией или другими состояниями, для лечения которых может применяться генотерапия. Однако осуществление трансдукции гена в клетки млекопитающих с достаточно высокой эффективностью является трудной задачей. Кроме того, использование таких стандартных векторов, как аденовирусные векторы, липосомы и реагенты на основе дендримеров, дает лишь кратковременный эффект. Введение этих векторов в глаз, но без индуцирования сильного воспалительного ответа также остается проблематичным.
Таким образом, в литературе пока не описан способ трансдукции терминально дифференцированных клеток или пролиферирующих клеток глаза человека или клеток, происходящих из глазной ткани. Настоящее изобретение позволяет решить эту давно назревшую проблему, с которой сталкиваются специалисты в данной области.
Краткое описание изобретения
Целью настоящего изобретения является получение лентивирусных векторов и разработка способов с использованием этих векторов в генотерапии человека для лечения наследственных и пролиферативных глазных болезней. Описано также использование лентивирусных векторов для трансдукции в сетчатку, роговицу, в сосудистый эндотелий, в клетки, ассоциированные с витреоретинопатией, и в пигментные эпителиальные клетки роговицы человека.
В одном из вариантов осуществления настоящего изобретения была продемонстрирована возможность ингибирования деления клеток внутриглазной ткани путем введения конститутивно активного (мутантного или вариантного) гена ретинобластомы (СА-rb), доставляемого лентивирусом. Были протестированы in vitro глазные клетки человека и были также протестированы in vivo две модели внутриглазного пролиферативного заболевания (пролиферативной витреоретинопатии и помутнения задней капсулы после извлечения хрусталика). Для многих различных типов клеток наблюдалось значительное и продолжительное ингибирование деления клеток in vitro. In vivo также наблюдалось ослабление тяжести пролиферативной витреоретинопатии и помутнение задней капсулы после извлечения хрусталика.
В другом варианте осуществления настоящего изобретения было продемонстрировано, что опосредуемый лентивирусом перенос генов, о которых известно, что они играют важную роль в развитии и ингибировании образования новых кровеносных сосудов (ангиогенеза) или в запрограммированной клеточной гибели (апоптоза), может быть использован для лечения патологического глазного ангиогенеза (например, диабетической ретинопатии или ассоциированной со старением дегенерации "мокрого" желтого пятна) или патологической клеточной гибели (например, ассоциированной со старением дегенерации "сухого" желтого пятна). Эти гены помещали под контроль одного из двух отдельных сильных промоторов, о которых известно, что они являются активными в сетчатке, роговице и в пигментных эпителиальных клетках роговицы человека, и ингибирование неоваскуляризации было продемонстрировано на кроличьей модели.
Кроме того, с помощью этой системы доставки векторов в том случае, если в этих векторах имеются гены, которые, как известно, отсутствуют у пациентов с наследственной глазной болезнью, можно осуществлять перенос этих генов в клетки глаза человека. Перенос этих генов с помощью такой системы лежит в основе терапии, которая может быть использована для лечения пациентов с глазными болезнями.
Настоящее изобретение относится к способу ингибирования внутриглазной пролиферации клеток у индивидуума с глазной болезнью, нуждающегося в таком лечении. Этот способ включает стадию введения указанному индивидууму фармакологически эффективной дозы лентивирусного вектора, содержащего терапевтический ген, который ингибирует внутриглазную пролиферацию клеток.
Настоящее изобретение также относится к способу ингибирования внутриглазной неоваскуляризации у индивидуума с глазной болезнью, включающему стадию введения указанному индивидууму фармакологически эффективной дозы лентивирусного вектора, содержащего терапевтический ген, который ингибирует внутриглазную неоваскуляризацию.
Другие и дополнительные аспекты, признаки и преимущества настоящего изобретения будут очевидны из нижеследующего описания предпочтительных вариантов осуществления изобретения. Эти варианты осуществления изобретения приводятся лишь в иллюстративных целях.
Краткое описание
Для того чтобы все вышеописанные признаки, преимущества и цели настоящего изобретения, а также другие его аспекты были более ясными, легко осуществимыми и более понятными в деталях, ниже приводится более конкретное описание кратко сформулированного выше изобретения, которое сопровождается ссылками на некоторые варианты его осуществления и на прилагаемые чертежи. Эти чертежи являются частью описания. Однако следует отметить, что прилагаемые чертежи иллюстрирует предпочтительные варианты осуществления изобретения, а поэтому они не должны рассматриваться как ограничение изобретения.
На фиг.1 показан вектор (предоставленный Dr. Inder Verma, Salk Institute, San Diego, CA). ВИЧ: вирус иммунодефицита человека; LTR: длинные концевые повторы; GAG: ген GAG ВИЧ; POL: обратная транскриптаза ВИЧ; ENV: ген оболочки ВИЧ; rre: rev-восприимчивый элемент; CMV: цитомегаловирус; VSV: вирус везикулярного стоматита; Poly A: сигнал полиаденилирования; специфический промотор: может быть использован любой усиливающий транскрипцию промотор так, чтобы он модулировал пространственные, временные или количественные аспекты экспрессии терапевтического гена; терапевтический ген: может быть использован любой терапевтически потенциальный ген, включая, но не ограничиваясь им, например, конститутивно активный ген ретинобластомы или гены, дефицит которых приводит к заболеванию.
На фигуре 2 проиллюстрирована in vitro трансдукция нижеследующих клеточных линий человека: пигментных эпителиальных клеток сетчатки человека (RPE), эндотелиальных клеток пупочной вены человека (HUVEC), хороидальных фибробластов (CF), клеток ретинобластомы человека (выделенных из сетчатки) (Weri-Rb-1 и Y79). Эти клеточные линии были трансдуцированы с помощью лентивирусных частиц, содержащих маркерный ген (ген белка после стимуляции флуоресцентным зеленым), и фракцию клеток, экспрессирующих маркерный ген, определяли на флуоресцентно-активированном клеточном сортере. Наблюдаемый дозозависимый ответ свидетельствует о том, что большее число клеток трансдуцируется большим числом лентивирусных частиц (множественность заражения - m.o.i.).
На фиг.3А продемонстрирована лентивирусная трансдукция культивированных пигментных эпителиальных клеток сетчатки. Экспрессия маркерного гена (eGFP) приводит к зеленому флуоресцентному окрашиванию клеток. На фиг.3 В проиллюстрирован анализ эффективности трансдукции, проводимый методом сортировки клеток по интенсивности флуоресценции. Данные за пределами дискриминационного окна R2, представленные на первой панели, указывают на отсутствие флуоресценции перед трансдукцией. На второй панели продемонстрирован сдвиг флуоресценции до >95% после трансдукции.
На фиг.4 проиллюстрирована митотическая активность и эффективность трансдукции в пигментных эпителиальных клетках сетчатки человека. Пигментные эпителиальные клетки сетчатки были трансдуцированы лентивирусными векторами или векторами на основе вируса мышиного лейкоза (MLV). Во время экспонирования вектором клетки были митотически неактивными (конфлюентными) или митотически активными (растущими). Эти результаты, показанные на фиг.4, продемонстрировали очень высокую способность лентивирусных векторов трансдуцировать неделящиеся клетки, в отличие от других ретровирусных векторов.
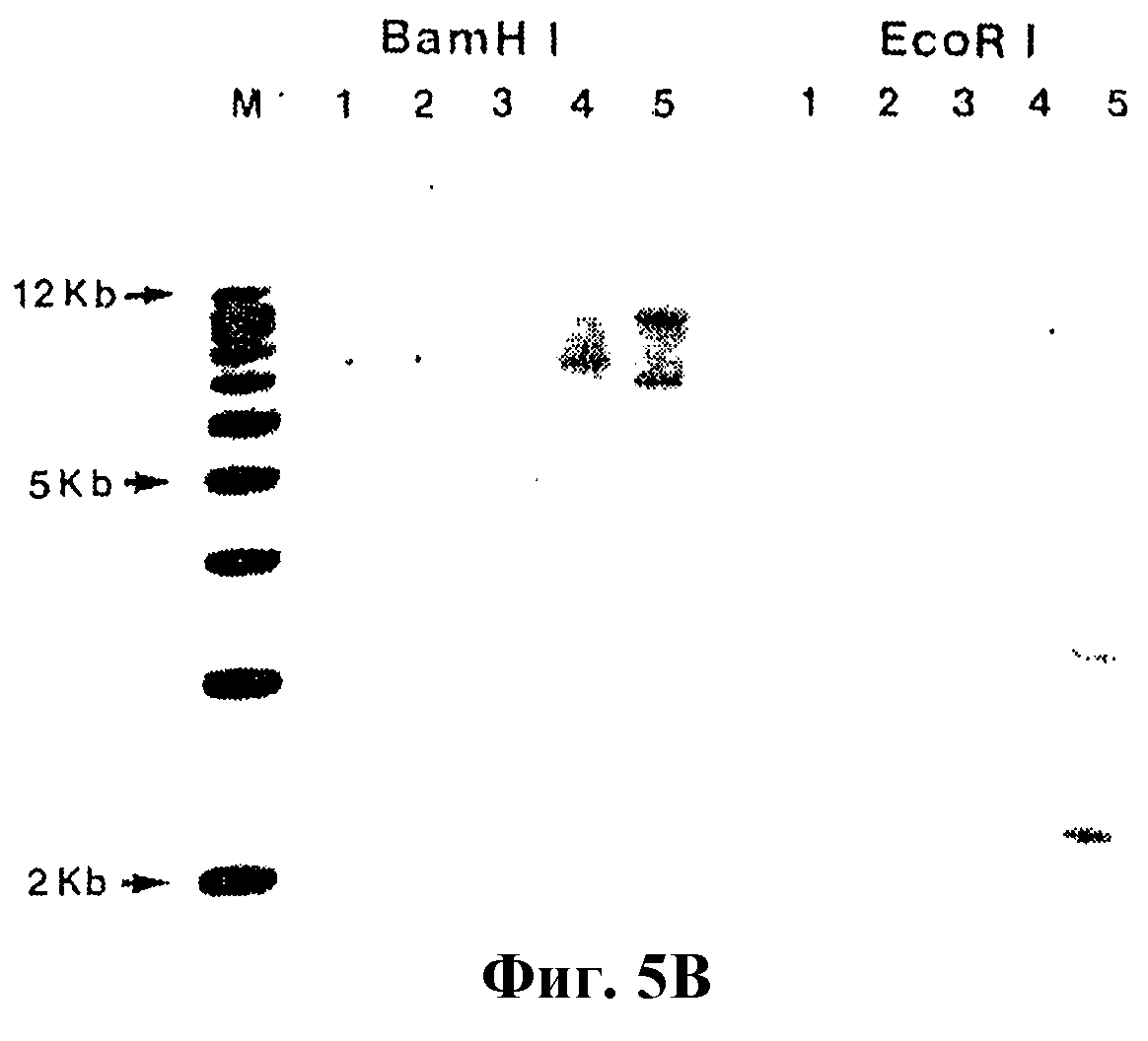
На фиг.5 проиллюстрирована стабильность экспрессии в пигментных эпителиальных клетках сетчатки человека. Клетки экспонировали eGFP-содержащими лентивирусными векторами, а затем их выдерживали, по крайней мере, в течение 120 дней в непрерывной культуре. На фиг.5А проиллюстрирована стабильность экспрессии eGFP в этих клетках, а также отсутствие отбора на (или против) трансдуцированные лентивирусом клетки (фракция трансдуцированных клеток все время оставалась постоянной). На фиг.5 В представлены результаты Саузерн-анализа на 5 клональных популяциях клеток. Дорожка 1 содержит геномную ДНК от нетрансдуцированной родительской линии. Дорожки 2 и 3 содержат ДНК, происходящей из клеток, которые были экспонированы вектором, но не были окрашены зеленым цветом (нетрансдуцированные). Дорожки 4 и 5 содержат ДНК, происходящей из трансдуцированных зеленых клеток. Клетки оставались eGFP-позитивными в результате геномной интеграции.
На фиг.6 проиллюстрирована экспрессия трансгена фетальных клеток человека. На этой диаграмме проиллюстрирован высокоэффективный метод трансдукции фетальных человеческих клеток, осуществляемый с использованием лентивирусных векторов, по сравнению с использованием нелентивирусного ретровирусного вектора (MND-eGFP) или без использования вирусного вектора (контроль).
На фиг.7 продемонстрирована трансдукция клеток роговицы. На фиг.7А схематически изображена роговица человека. На фиг.7 В продемонстрирована трансдукция эндотелиальных клеток роговицы человека eGFP-содержащими лентивирусными векторами. Шишкоподобные образования на человеческой роговице, удаленные во время трансплантации роговицы, экспонировали лентивирусными частицами. Затем Десцеметову оболочку удаляли и фотографировали при комнатном освещении (слева) и в условиях, подходящих для детекции флуоресценции (справа). На фиг.7С продемонстрирован опосредованный лентивирусом перенос гена eGFP в эпителиальные клетки человеческой роговицы. На субпанели А представлена сделанная на оптическом микроскопе фотография роговицы человека, из которой был искусственно удален эпителиальный слой. Флуоресцентная микроскопия (субпанель В) выявила эпителиальную флуоресценцию.
На фиг.8 приведен пример переноса лентивирусного гена, дефицит которого приводит к развитию заболевания у человека. Нормальная ткань человеческой сетчатки или пигментная эпителиальная ткань сетчатки (RPE), хирургически удаленная во время энуклеации ретинобластомы, обрабатывали лентивирусными векторами, у которых либо отсутствовал терапевтический ген (контроль), либо присутствовал ген периферина человека. Известно, что наследственный дефицит этого гена у человека приводит к различным видам нарушения фенотипов. Представлены результаты полимеразной цепной реакции, проводимой с помощью обратной транскриптазы (ОТ-ПЦР) и с использованием праймеров, сконструированных для распознавания лишь трансдуцированного гена периферина. Была ясно продемонстрирована экспрессия человеческого периферина в эпителии сетчатки и в пигментном эпителии сетчатки.
На фиг.9 продемонстрирована опосредованная лентивирусом экспрессия мРНК СА-rb. На этой фигуре представлены результаты полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР), проводимой с использованием праймеров, сконструированных для распознавания лишь конститутивно активной формы гена ретинобластомы. Дорожка 1: маркер; дорожка 2: результат реакции с РНК, выделенной из клеток, трансдуцированных eGFP-лентивирусом; дорожка 3: результат реакции с РНК, выделенной из клеток, трансдуцированных СА-rb-лентивирусом. Продукт реакции имел ожидаемый размер.
На фиг.10 проиллюстрировано ингибирующее действие лентивирусного вектора, содержащего конститутивно активный ген ретинобластомы, на деление ретинальных и хороидальных клеток человека. Клетки обрабатывали уменьшающимися разведениями исходного раствора одного лентивируса (разведение 1:400-1:50), и рост этих клеток сравнивали с ростом клеток, обработанных лентивирусными векторами, которые не содержали конститутивно активного гена ретинобластомы. Ингибирующее действие на деление клеток явно прослеживалось в течение всего времени наблюдения, и это действие было дозозависимым.
На фиг.11 проиллюстрировано ингибирующее действие лентивирусного СА-rb на деление эпителиальных клеток хрусталика человека. Клетки, удаленные из человеческого глаза при операции по поводу катаракты, обрабатывали уменьшающимися разведениями исходного раствора одного лентивируса (разведение 1:400 - 1:50), и рост этих клеток сравнивали с ростом клеток, обработанных лентивирусными векторами, которые не содержали конститутивно активного гена ретинобластомы. Ингибирующее действие на деление клеток явно прослеживалось в течение всего времени наблюдения, и это действие было дозозависимым.
На фиг.12 проиллюстрировано ингибирующее действие in vivo лентивирусного СА-rb на внутриглазную пролиферацию клеток, приводящую к слепоте. Пролиферативная витреоретинопатия была индуцирована у трех групп кроликов. Одну группу не обрабатывали, одну группу обрабатывали лентивирусными векторами, не содержащими конститутивно активного гена ретинобластомы, а последнюю группу интравитреально обрабатывали лентивирусным СА-rb. В первых двух группах наблюдалась высокая частота (>90%) развития пролиферативной витреоретинопатии и отслоения сетчатки. В группе, обработанной конститутивно активным геном ретинобластомы, число животных, у которых наблюдалось отслоение сетчатки, было значительно меньше (26%). На этой фигуре также представлены две фотографии сетчатки. Глаз слева имел целую сетчатку без каких-либо признаков отслоения и был обработан конститутивно активным геном ретинобластомы. Глаз справа имел полностью отслоенную сетчатку, что явилось следствием внутриглазной витреоретинопатической пролиферации клеток, и этот глаз был обработан лентивирусными векторами, не содержащими гена СА-rb.
На фиг.13 проиллюстрировано in vivo ингибирующее действие лентивирусного СА-rb на процесс помутнения задней капсулы после удаления хрусталика. Три группы кроликов подвергали стандартной факоэмульсификации для удаления природного хрусталика. Первую группу (группу 1) ничем не обрабатывали, две других группы обрабатывали либо "пустыми" лентивирусными конструкциями (не содержащими терапевтического гена, группа 2), либо лентивирусными СА-rb (группа 3), вводимыми в капсулярную сумку интактного хрусталика во время закрытия раны после экстракции катаракты. Животных постадийно оценивали на присутствие помутнения задней капсулы. Наличие помутнения оценивали по 5 балльной шкале, где оценка 1 означает отсутствие помутнения, а оценка 5 означает помутнение, которое является достаточно серьезным и не позволяет визуализировать сетчатку путем непрямой бинокулярной офтальмоскопии. Эти результаты статистически не отличались от результатов, полученных для групп 1 и 2 (необработанной группы и группы, обработанной "пустым" вектором). Представленный здесь график иллюстрирует сильное ингибирующее действие лентивирусного СА-rb на развитие помутнения задней капсулы. На день 28 у контрольных животных наблюдалось помутнение, оцененное в среднем 4,4, тогда как у животных, обработанных лентивирусным СА-rb, наблюдалось помутнение, оцененное в среднем 2,1.
На фиг.14 представлена карта гибридного гена эндостатина-18/ангиостатина, доставляемого лентивирусным вектором.
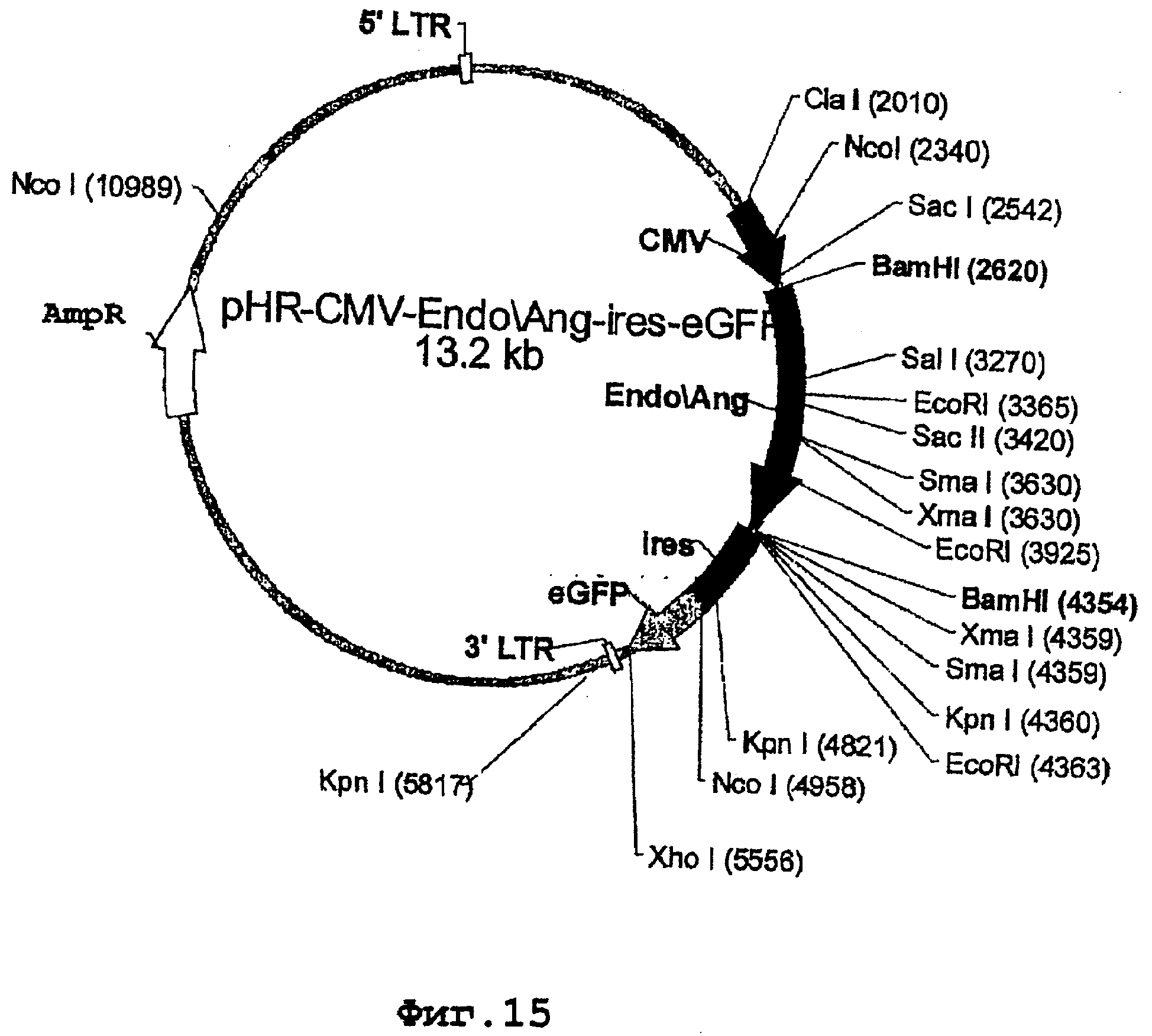
На фиг.15 представлена карта лентивирусного вектора pHR-CMV-Endo/Ang-ires-eGFP, несущего гибридный ген эндостатина/ан-гиостатина.
На фиг.16 представлена карта лентивирусного вектора pHR-CMV-BIK-ires-eGFP, несущего ген BIK.
На фиг.17 представлена карта лентивирусного вектора pHR-CMV-Endo/Kringle-ires-eGFP, несущего гибридный ген эндостатина/крингла.
На фиг.18 представлена карта лентивирусного вектора pHR-CMV-KDR-ires-eGFP, несущего ген KDR.
На фиг.19 представлена карта лентивирусного вектора pHR-CMV-Р16-ires-eGFP, несущего ген Р16.
На фиг.20 представлена карта лентивирусного вектора pHR-CMV-Р21-ires-eGFP, несущего ген р21.
На фиг.21 представлена карта лентивирусного вектора pHR-CMV-Timp1-ires-eGFP, несущего ген Timp1.
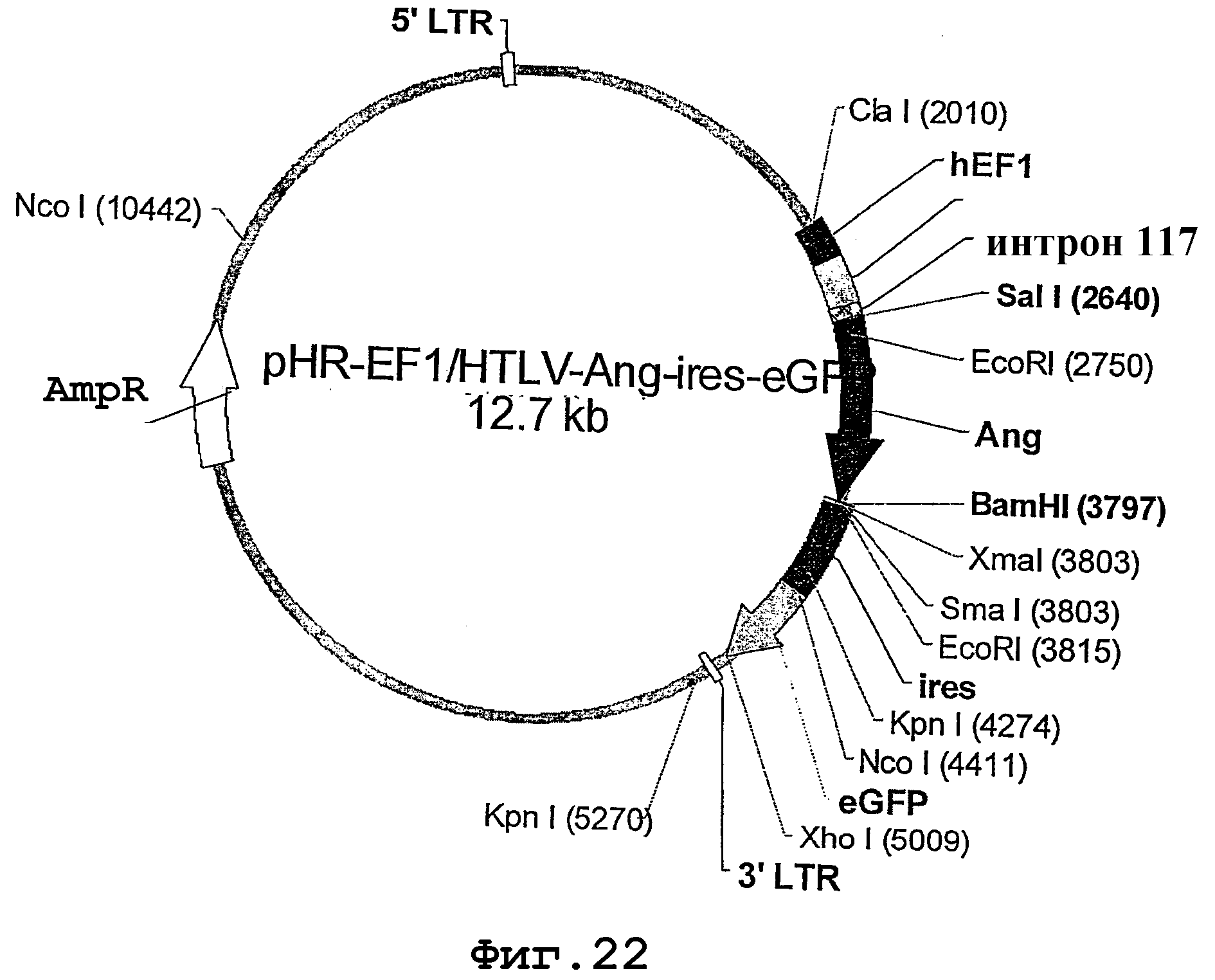
На фиг.22 представлена карта лентивирусного вектора pHR-EF1/HTLV-Ang-ires-eGFP, несущего ген ангиостатина.
На фиг.23 представлена карта лентивирусного вектора pHR-EF1/HTLV-Endo XV-ires-eGFP, несущего ген эндостатина XV.
На фиг.24 представлена карта лентивирусного вектора pHR-EF1/HTLV-EndoAng-ires-eGFP, несущего гибридный ген эндостатина/ангиостатина.
На фиг.25 представлена карта лентивирусного вектора pHR-EF1/HTLV-EndoKringle-ires-eGFP, несущего гибридный ген эндостатина/крингла.
На фиг.26 представлена карта лентивирусного вектора pHR-EF1/HTLV-Kringle 1-5-ires-eGFP, несущего ген крингла.
На фиг.27 представлена карта лентивирусного вектора pHR-EF1/HTLV-MigIP10-ires-eGFP, несущего гибридный ген Mig/IP10.
На фиг.28 представлена карта лентивирусного вектора pHR-EF1/HTLV-Timp1-ires-eGFP, несущего ген Timp1.
На фиг.29 представлена карта лентивирусного вектора pHR-EF1/HTLV-Timp4-ires-eGFP, несущего ген Timp4.
На фиг.30 представлена карта лентивирусного вектора pHR-EF1/HTLV-Р21-ires-eGFP, несущего ген р21.
На фиг.31 представлена карта лентивирусного вектора pHR-EF1/HTLV-Endo XVIII-ires-eGFP, несущего ген эндостатина XVIII.
На фиг.32 проиллюстрирована ОТ-ПЦР мРНК, выделенной из микрососудистого русла эндотелиальных клеток кожи человека (hDMVE), трансдуцированных гибридным геном эндостатина-18/ангиостатина. Дорожка 1: смесь леддеров 1000/100 п.н.; дорожки 2-5: ОТ-ПЦР мРНК, выделенной из клеток hDMVE, трансдуцированных 1 мкл, 5 мкл, 10 мкл и 20 мкл супернатанта вируса pHR'-eF1?/HTLV-Endo::Ang-IRES-eGFP из одной лунки 12-луночного планшета; дорожка 6: ОТ-ПЦР мРНК, выделенной из клеток hDMVE, инкубированных с 20 ?л PBS; дорожка 7: негативный контроль (H2O в качестве матрицы для ОТ-ПЦР); дорожка 8: 100 п.н.-лэддер.
На фиг.33 показано присутствие eGFP в микрокармане роговицы у обработанных животных. На фиг.33А представлена микрофотография, полученная на люминесцентном микроскопе и демонстрирующая наличие экспрессии eGFP в микрокармане. На фиг.33 В представлена полученная на нелюминисцентном микроскопе микрофотография аналогично обработанной ткани, взятой от необработанного животного. На фиг.33С представлена микрофотография, полученная на люминисцентном микроскопе, аналогичной ткани, взятой из необработанного животного.
На фиг.34 проиллюстрировано ингибирующее действие на неоваскуляризацию у животных, обработанных лентивирусным вектором Mig/IP10. На фиг.34А представлена фотография нормальной (необработанной, нестимулированной) роговицы. На фиг.34 В представлена фотография обработанной щелочью роговицы животного, которому был введен лентивирусный вектор Mig/IP10. Отмечалось отсутствие кровеносных сосудов в роговице. На фиг.34С представлена фотография обработанной щелочью роговицы животного, которому был введен контрольный лентивирусный вектор без терапевтического антиангиогенного гена. Отмечалось прорастание кровеносных сосудов в роговицу. На фиг.34D представлена фотография обработанной щелочью роговицы необработанного животного. Отмечалось прорастание кровеносных сосудов в роговицу.
Подробное описание изобретения
Лентивирусы представляют собой медленные вирусы, природная патогенность которых сохраняется в течение периода времени от нескольких месяцев до нескольких лет. К вирусам этого рода относятся такие ретровирусы, как ВИЧ. Известно, что эти вирусы инфицируют и трансдуцируют широкий ряд терминально дифференцированных митотически активных или неактивных типов человеческих клеток. Эффективность их трансдукции является очень высокой, и этим вектором могут быть трансдуцированы даже клеточные линии, которые обычно невосприимчивы к переносу генов, например, такие как человеческие клетки сетчатки, клетки роговицы, трабекулярные клетки, лентикулярные клетки, пигментные эпителиальные клетки роговицы, пролиферативные витреоретинопатические клетки и васкулярные эндотелиальные клетки.
После инфицирования лентивирусом вирусный генетический материал сам интегрируется в геном хозяина. Таким образом, вирусные гены становятся перманентной частью генетического материала клетки-хозяина, а экспрессия гена является постоянной на протяжении всего жизненного цикла клетки. Каждая клетка, трансдуцированная лентивирусом, может передавать генетическую информацию потомству. Использование лентивирусов в качестве векторов в генотерапии для лечения внутриглазных болезней возможно только после создания естественных условий инфицирования родительским вирусом, который является внутриглазным патогеном, не ассоциирующимся с воспалительным ответом. Предшествующая работа с этим вирусом продемонстрировала его успешное использование для трансдукции в нервные клетки и в клетки сетчатки (Naldini et al., 1996; Miyoshi et al.,1997).
Настоящее изобретение относится к новому лентивирусному вектору, который включает элемент IRES (внутренний сайт связывания с рибосомой), расположенный между двумя сайтами клонирования. Элемент IRES обеспечивает связывание мРНК с рибосомой и синтез белка. Этот остов может вмещать два различных экспрессируемых гена. В трансдуцированных клетках продуцируется одна матричная РНК, однако благодаря элементу IRES эта матричная РНК является функционально бицистронной и может управлять синтезом двух различных белков. Эти два гена помещают под контроль сильных промоторов, таких как промоторы CMV или HTLV. Альтернативно любой специалист может с таким же успехом использовать и другие промоторы, о которых известно, что они являются активными в клетках человеческой сетчатки, роговицы или пигментных эпителиальных клеток сетчатки. Таким образом, каждый из потенциально терапевтических генов, обсуждаемых ниже, может быть сцеплен с маркерным геном (например, с геном, усиленным флуоресцентным зеленым-геном eGFP), так чтобы трансдуцированные клетки могли быть одновременно меченными и обладали способностью экспрессировать нужный терапевтический ген. Меченые клетки могут быть легко выделены in vitro и исследованы in vivo. Для специалиста очевидно, что, помимо гена белка, усиленного флуоресцентным зеленым, в лентивирусный вектор могут быть введены и другие маркерные гены. Поскольку за последние годы средний уровень знаний специалистов в области генной инженерии и клонирования значительно возрос, то любой специалист в данной области сможет легко сконструировать лентивирусные векторы, содержащие, помимо описанных здесь генов, и другие нужные терапевтические гены. Кроме того, используемая здесь система лентивирусных векторов может обеспечивать перенос генов, о которых известно, что они являются дефицитными у пациентов-людей с наследственными глазными болезнями или другими заболеваниями. Перенос этих генов в клетки человеческого глаза или в другие ткани с помощью указанной системы лежит в основе терапевтического лечения пациентов с различными заболеваниями.
Основное описанное здесь открытие продемонстрировало, что лентивирусные векторы могут быть использованы в целях переноса ряда генов для модифицирования аномальной внутриглазной пролиферации, тем самым снижая частоты неоваскулярных заболеваний, отслоения сетчатки или помутнения задней капсулы после удаления катаракты. В клинике для in vivo ингибирования внутриглазного деления клеток может быть использован ряд терапевтических генов. Эти гены включают ряд недавно идентифицированных модуляторов процесса развития новых кровеносных сосудов (ангиогенеза) или апоптоза. Очевидно, что генетическая регуляция экспрессии этих модуляторов посредством опосредуемого лентивирусом переноса генов должна подтверждать их ценность для лечения ассоциированных с неоваскуляризацией глазных заболеваний, таких как связанная со старением дегенерация желтого пятна (СДП), ретинопатия недоношенных (РНД) и пролиферативная диабетическая ретинопатития (ПДР).
Описанные здесь лентивирусные векторы могут быть легко использованы в клинических условиях.
Васкулярные эндотелиальные клетки играют главную роль как в образовании и развитии сосудов, так и в ангиогенезе. Эти клетки обнаруживают митогенный ответ (становятся активными с точки зрения деления или миграции клеток) на ряд белковых цитокинов. Так, например, васкулярный эндотелиальный фактор роста (VEGF), ангиогенин, ангиопоэтин-1 (Ang1) и ангиотропин представляют собой цитокины, стимулирующие деление и миграцию эндотелиальных клеток или межклеточную адгезию, и таким образом, оказывают благоприятное действие на процесс ангиогенеза. Эндостатин, растворимые рецепторы (ловушки) VEGF (sflt), и тромбоспондин представляют собой эндогенные белковые цитокины, которые ингибируют ангиогенез. В настоящем изобретении продемонстрировано, что многие из этих ингибирующих белков, доставляемых лентивирусными векторами, могут быть использованы для лечения внутриглазной неоваскуляризации. Примерами генов, которые могут быть включены в лентивирусные векторы настоящего изобретения, являются, но не ограничиваются ими, следующие гены.
Тканевые ингибиторы металлопротеиназ
Тканевые ингибиторы металлопротеиназ (TIMP) представляют собой семейство широко распространенных белков, которые являются природными ингибиторами металлопротеиназ матрикса (ММР). Металлопротеиназы матрикса представляют собой группу цинк-связывающих эндопептидаз, участвующих в ремоделировании соединительной ткани матрикса и деградации внеклеточного матрикса (ЕСМ), в главной стадии прорастание опухоли, ангиогенеза и метастазов. Каждая из ММР имеет различные специфичности к субстрату в ЕСМ и играет важную роль в его деградации. Анализ ММР при патологии молочной железы человека показал, что в деградации ЕСМ участвуют несколько ММР, а именно в деградации фибриллярных интерстициальных коллагенов участвует коллагеназа (ММР1); в деградации коллагена типа IV участвует главным образом желатиназа (ММР2); а стромелизин (ММР3) имеет широкий спектр действия (Bramhall et al., 1996, 1997). Семейство TIMP включает четыре члена. TIMP-1 и TIMP-2 способны ингибировать рост опухоли, ее прорастание и метастазы, ассоциированные с ММР-ингибирующей активностью. Кроме того, как TIMP-1, так и TIMP-2 участвуют в ингибировании ангиогенеза. В отличие от других членов семейства TIMP, TIMP-3 был обнаружен только в ЕСМ, а поэтому он может служить маркером для терминальной дифференцировки. И, наконец, предполагается, что TIMP-4 участвует в тканеспецифическом гемостазе внеклеточного матрикса (Gomez et al., 1997).
TIMP-1
Тканевый ингибитор металлопротеиназы-1 (TIMP-1) представляет собой 23 кД-белок, также известный как ингибитор металлопротеиназы-1, ингибитор коллагеназы фибробластов, ингибитор коллагеназы и эритроид-потенциирующей активности (ЕРА). Ген, кодирующий TIMP-1, был описан Docherty et al. (1985). Комплексы TIMP-1 с металлопротеиназами (такими как коллагеназы) вызывают необратимую инактивацию. Эффекты TIMP-1 были исследованы на моделях трансгенных мышей: одной модели со сверхэкспрессией TIMP-1 в печени и другой модели с экспрессией онкогена обезьяньего вируса 40, антигена Т (Tag), приводящего к развитию наследственной гепатоцеллюлярной карциномы. В экспериментах с использованием двух трансгенов (TIMP-1-линия была скрещена с трансгенной TAg-линией), было обнаружено, что сверхэкспрессия TIMP-1 в печени блокирует развитие TAg-индуцированной гепатокарциномы, например, путем ингибирования ее роста и ангиогенеза (Martin et al., 1996).
TIMP-2
Тканевый ингибитор металлопротеиназы-2 (TIMP-2) представляет собой 24 кД-белок, который также известен как ингибитор металлопротеиназы 2. Ген, кодирующей TIMP-2, был описан Stetler-Stevenson et al. (1990). Металлопротеиназа (ММР2), которая играет важную роль в прорастании опухоли, является комплексной и ингибируется TIMP-2. Таким образом, TIMP-2 может быть использован для ингибирования метастазов рака (Musso et al., 1997). При трансфекции клеток мышиной меланомы В16F10 (в высокой степени инвазивной и метастазирующей клеточной линии) плазмидой, кодирующей человеческий TIMP-2 и ее подкожной инъекции мышам, сверхэкспрессия TIMP-2 ограничивала рост опухоли и неоангиогенез in vivo (Valente et al., 1998).
TIMP-3
Тканевый ингибитор металлопротеиназы-3 (TIMP-3) также известен как ингибитор металлопротеиназы 3. При трансфекции клеточных линий карциномы молочной железы и злокачественной мышиной меланомы TIMP-3-содержащими плазмидами и ее подкожной инъекции бестимусным ("голым") мышам наблюдалось ингибирование роста опухоли (Anand-Apte et al., 1996). Однако сверхэкспрессия TIMP-3 не оказывала какого-либо воздействия на рост клеток этих двух клеточных линий in vitro. Таким образом, это позволяет предположить, что TIMP-3, высвобождаемый опухолевыми клетками в окружающий ЕМС ингибирует рост опухоли путем подавления высвобождения отдельных факторов роста в ЕСМ или путем ингибирования ангиогенеза (Anand-Apte et al., 1996).
TIMP-4
Тканевый ингибитор металлопротеиназы-4 (TIMP-4) также известен как ингибитор металлопротеиназы 4. Ген TIMP-4 и его локализация в тканях были описаны Greene et al. (1996). Биохимические исследования показали, что TIMP-4 связывается с человеческой желатиназой А аналогично TIMP-2 (Bigg et al., 1997). Влияние модуляции TIMP-4 на рост клеток рака молочной железы человека in vivo было исследовано Wang et al. (1997). Было обнаружено, что сверхэкспрессия TIMP-4 ингибирует возможность прорастания клеток in vitro, а после инъекции "голым" мышам с TIMP-4-трансфектантов опухолевых клеток in vivo рост опухоли значительно снижался (Wang et al., 1997).
Эндостатин, ангиостатин, РЕХ, крингл-5 и гибридные гены
J. Folkman и его коллеги (Boehm et al., 1997) показали, что введение мышам клеток карциномы легких Льюиса в комбинации с белками эндостатина + ангиостатина индуцировало полную регрессию опухолей, и эти мыши в течение всей своей жизни оставались здоровыми. Этот эффект был достигнут после проведения лишь одного цикла (25 дней) обработки комбинацией эндостатин + ангиостатин, тогда как при использовании только эндостатина для индуцирования торможения опухолевого роста потребовалось 6 циклов его введения.
D. Hanahan и его коллеги (Bergers et al., 1999) продемонстрировали превосходное противоопухолевое действие комбинации белков "эндостатин + ангиостатин" в мышиной модели карциномы панкреатических островков. Комбинация "эндостатин + ангиостатин" давала значительную регрессию опухолей, тогда как введение только эндостатина или только ангиостатина не давало никакого эффекта.
Эндостатин XVIII
Эндостатин, ингибитор ангиогенеза, продуцируемый гемангиоэндотелиомой, был впервые идентифицирован O'Reilly et al. (1997). Эндостатин представляет собой С-концевой 20 кД-фрагмент коллагена XVIII, который специфически ингибирует эндотелиальную пролиферацию и является сильным ингибитором ангиогенеза и роста опухоли. Действительно, было показано что, первичные опухоли, после введения рекомбинантного эндостатина, регрессировали в "пассивные" микроскопические поражения (O'Reilly et al., 1997). Сообщалось, что эндостатин ингибирует ангиогенез посредством его связывания с протеогликанами сульфата гепарина, участвующими в передаче сигналов фактора роста (Zetter, 1998).
Эндостатин XV
Недавно было показано, что С-концевой фрагмент коллагена XV (эндостатин XV) ингибирует ангиогенез подобно эндостатину XVIII, но с некоторыми функциональными различиями (Sasaki et al., 2000).
Ангиостатин
Ангиостатин, внутренний фрагмент плазминогена, содержащего первые четыре крингл-структуры, является одним из самых сильных эндогенных ингибиторов ангиогенеза, известных в настоящее время. Было показано, что системное введение ангиостатина эффективно подавляет рост злокачественной глиомы in vivo (Kirsch et al., 1998). Введение ангиостатина также комбинировали с лучевой терапией, что приводило к полному исчезновению опухоли и при этом не оказывало какого-либо токсического действия in vivo (Mauceri et al., 1998). Другие исследования продемонстрировали, что опосредованный ретровирусами и аденовирусами перенос кДНК гена ангиостатина приводил к ингибированию роста эндотелиальных клеток in vitro и ангиогенеза in vivo. Ингибирование индуцированного опухолью ангиогенеза приводило к усилению гибели опухолевых клеток (Tanaka et al., 1998). Было показано, что перенос кДНК гена, кодирующего мышиный ангиостатин, в мышиные клетки фибросаркомы Т241 подавлял рост первичной опухоли и опухолевых метастазов in vivo (Cao et al., 1998).
РЕХ
РЕХ представляет собой С-концевой домен гемопексина ММР-2, который ингибирует связывание ММР-2 с интегрином альфабета-3, блокирующим коллагенолитическую активность клеточной поверхности, необходимую для ангиогенеза и роста опухоли, и который был клонирован и описан Brooks et al. (1998).
Крингл-5
Было показано, что крингл-домен 5 человеческого плазминогена, который имеет высокую степень гомологии с четырьмя крингл-доменами ангиостатина, является специфическим ингибитором пролиферации эндотелиальных клеток. Оказалось, что крингл-5 является более сильным ингибитором пролиферации капиллярных эндотелиальных клеток, стимулированной основным фактором роста фибробластов, чем ангиостатин (Cao et al., 1997). Помимо своих антипролиферативных свойств, крингл-5 также проявляет антимиграционную активность, аналогичную активности ангиостатина, и обладает селективным действием на эндотелиальные клетки (Ji et al., 1998).
Ангиостатические гибридные гены
Новые ангиостатические гибридные гены могут быть клонированы с использованием пептидного мотива эластина (Val-Pro-Gly-Val-Gly) в качестве линкера. Эти гибриды объединяют два сильных ангиостатических гена, в результате чего повышается уровень супрессии опухолевого ангиогенеза. Поскольку эти молекулы действуют в соответствии с различными механизмами, то их комбинация может приводить к синергическим эффектам. Примерами ангиостатических гибридных белков являются, но не ограничиваются ими, гибрид эндостатина 18 и ангиостатина (endo/ang), эндостатина 18 и мотива крингл-5 плазминогена (endo/k5), а также монокин, индуцированный интерфероном-гамма и индуцируемый интерфероном-альфа белок 10 (MIG/IP10).
Хемокины
Хемокины представляют собой низкомолекулярные провоспалительные цитокины, способные осуществлять хемотаксис лейкоцитов. В зависимости от рассматриваемого хемокина, хемоатракция является специфичной для некоторых типов лейкоцитов. Экспрессия генов хемокинов в опухоли может приводить к более эффективному рекрутингу лейкоцитов, обладающих противоопухолевой активностью. Более того, помимо своей хемотаксической активности, некоторые хемокины обладают антиангиогенной активностью: они ингибируют образование кровеносных сосудов, питающих опухоль. По этой причине эти хемокины могут быть использованы для лечения рака.
Mig
Mig, монокин, индуцированный интерфероном-гамма, представляет собой хемокин СХС, родственный IP10 и продуцируемый моноцитами. Mig представляет собой хемоатрактант для активированных Т-клеток, а также обладает сильным ангиостатическим действием. Внутриопухолевые инъекции Mig индуцируют некроз опухоли (Sgadari et al., 1997).
IP-10
IP-10, индуцируемый интерфероном-альфа белок 10, является членом семейства хемокинов СХС. IP-10 продуцируется главным образом моноцитами, а также Т-клетками, фибробластами и эндотелиальными клетками. IP-10 обладает хемотаксической активностью по отношению к лимфоидным клеткам, таким как Т-клетки, моноциты и NK-клетки. IP-10 также является сильным ингибитором ангиогенеза; он ингибирует неоваскуляризацию посредством супрессии дифференцировки эндотелиальных клеток. Поскольку хемотаксическая активность IP-10 направлена на иммунные клетки, то этот белок рассматривается как хороший кандидат для усиления противоопухолевых иммунных ответов. Перенос гена IP-10 в опухолевые клетки снижает их онкогенность и продуцирует продолжительный протективный иммунный ответ (Luster & Leder, 1993). Было также показано, что ангиостатическая активность IP-10 опосредует регрессию опухоли: опухолевые клетки, экспрессирующие IP-10, подвергаются некрозу in vivo (Sgadari et al., 1996). Было также показано, что IP-10 опосредует ангиостатические эффекты IL-12, приводящие к регрессии опухоли (Tannenbaum et al., 1998).
Растворимые рецепторы VEGF
FLT-1 (fms-подобный рецептор тирозинкиназы 1) представляет собой мембрано-ассоциированный рецептор VEGF (рецептор VEGF 1). Было показано, что растворимый фрагмент FLT-1 (sFLT-1) обладает ангиостатическими свойствами, обусловленными его антагонистической активностью против VEGF. Растворимый FLT-1 действует посредством связывания с VEGF, а также посредством связывания и блокирования внешнего домена мембрано-ассоциированного FLT-1 (Kendall & Thomas, 1993, Goldman et al., 1998). Одним из примеров sFLT-1 является человеческий sFLT-1, охватывающий 7 иммуноглобулино-подобных доменов внешней части FLT-1.
sFLK-1/KDR
FLK-1 или KDR (рецептор киназы со встроенным доменом) представляет собой мембрано-ассоциированный рецептор VEGF (рецептор VEGF 2). Было показано, что растворимый фрагмент KDR (sKDR) обладает ангиостатическими свойствами, обусловленными его антагонистической активностью против VEGF, вероятно, благодаря его связыванию с VEGF, а также его связыванию и блокированию внешнего домена мембранно-ассоциированного KDR (Kendall & Thomas, 1996, Millauer et al., 1994). Одним из примеров sKDR является человеческий sKDR, охватывающий 7 иммуноглобулино-подобных доменов внешней части KDR.
Апоптоз
Термин "апоптоз" используется для описания процесса запрограммированной гибели клеток или "суицида" клеток. Этот процесс представляет собой нормальную фазу развивающихся и здоровых многоклеточных организмов. Аномальная регуляция апоптоза является причиной ряда патологических расстройств от рака до аутоиммунных заболеваний.
BIK
BIK представляет собой сильный про-апоптотический белок размером 18 кД (160 аминокислот), также известный как взаимодействующий с Вс1 киллер, индуктор апопотоза NBK, ВР4 и BIP1. Bik кодируется геном bik (или nbk). Функция Bik заключается в ускорении запрограммированной клеточной гибели посредством образования комплекса с различными репрессорами апоптоза, такими как Вс1-XL, BHRF1, Bcl-2 или с гомологичным ему аденовирусным белком Е1 В. В исследованиях по кратковременной трансфекции было обнаружено, что Bik стимулировал клеточную гибель аналогично про-апоптотическим членам семейства Вс1-2, Вах и Вак (Boyd et al., 1995).
Вак
Вак, гомолог Bc1-2, представляет собой про-апоптотический белок, который стимулирует апоптоз путем связывания с членами антиапоптотического семейства, включая Bcl-2 и Bcl-XL, и ингибирует их активность, как было описано для Bik (Chittenden et al., 1995).
Вах
Вах представляет собой белок размером 21 кД, который действует как регулятор апоптоза. Вах ускоряет запрограммированную клеточную гибель путем димеризации с репрессором апоптоза Bcl-2 и его ингибирования. Очевидно, что отношение этих димеров белка зависит от инициации апоптоза. Эффект экспрессии рекомбинантного Вах в клетках эритролейкоза К562 был исследован Kobayashi et al. (1998). Трансфекция вектора Вах в клетки К562 приводили к индуцированию апоптоза. Кроме того, было обнаружено, что клетки, стабильно трансфецированные Вах, являются более восприимчивыми к хемотерапевтическим агентам ara-X, доксорубицину и SN-38 (Kobayashi et al., 1998).
Bad
Белок Bad (связывающийся с Bcl-2 компонент 6, ген bad или bbc6 или bc1218) представляет собой небольшой белок (168 аминокислот, 18 кДа), который стимулирует клеточную гибель. Он успешно конкурирует за связывание с Bcl-XL и Bcl-2 и тем самым оказывает влияние на уровень гетеродимеризации обоих этих белков с Вах. Он может способствовать реверсии активности репрессора клеточной гибели, Bcl-XL, но не активности Bcl-2.
Bcl-2
Белок В-клеточного лейкоза/лимфомы-2 (Bcl-2) представляет собой член-прототип семейства белков-регуляторов клеточной гибели. Bcl-2 обнаруживается, главным образом, в митохондриях и блокирует апоптоз посредством воздействия на активацию каспаз. Было показано, что перенос гена Bcl-2 в опухолевые клетки усиливает их метастатический потенциал (Miyake et al., 1999). Ген Bcl-2 может быть введен в трансплантат костного мозга, поскольку Bcl-2 усиливает уровень выживаемости гемопоэтических стволовых клеток после восстановительной терапии пациента, подвергнутого облучению (Innes et al., 1999). Так как экспрессия Bcl-2 в нейронах обеспечивает защиту клеток от апоптоза, то перенос гена Bcl-2 может быть также использован для лечения нейродегенеративных заболеваний (Saille et al., 1999).
Bcl-XS
Bcl-XS (короткая изоформа) представляет собой доминантно-негативный репрессор Bcl-2 и Bcl-XL. Он был использован в экспериментах по генотерапии для инициации апоптоза в опухолях, экспрессирующих Bcl-2 и Bcl-XL. Экспрессия Bcl-XS приводит к уменьшению размера опухоли (Ealovega et al., 1996) и делает опухолевые клетки чувствительными к хемотерапевтическим агентам (Sumatran et al., 1995), что позволяет предположить, что Bcl-XS играет определенную роль в инициации клеточной гибели в опухолях, экспрессирующих Bcl-2 или Bcl-XL (Dole et al., 1996).
Gax
Gax представляет собой ген гомеобокса, кодирующий фактор транскрипции, который ингибирует пролиферацию клеток р21-зависимым образом. Gax является негативно регулируемым в том случае, когда происходит стимуляция клеток для их пролиферации. Сверхэкспрессия Gax приводит к негативной регуляции Bcl-2 и позитивной регуляции Вах в активированных митогеном клетках (Perlman et al., 1998). Таким образом, Gax может быть использован для ингибирования роста некоторых опухолевых клеток. Более того, сверхэкспрессия Gax в клетках гладких мышц сосудов ингибирует их пролиферацию (Perlman et al., 1999). Следовательно, перенос гена Gax может ограничивать стеноз сосудов после их повреждения.
Гены-супрессоры опухоли
Различные мутации в генах-супрессорах опухоли ассоциируются с различными видами рака. В этих случаях в качестве методов противораковой терапии рассматривалась соматическая генотератия с использованием вариантов генов-супрессоров опухоли дикого типа. р16, р21, р27 и р53 ингибируют клеточный цикл путем воздействия на циклин-зависимые киназы.
Р16
Р16, 15 кД-белок (148 аминокислот), также известен как CDK4I, р16-INK4, р16-INK4А или мультиопухолевый супрессор 1 (МТS1). р16 кодируется геном сdkn2a или cdkn2. Р16 образует гетеродимер с циклин-зависимой киназой 4 и 6 и тем самым предотвращает их взаимодействие с циклином D как in vitro, так и in vivo. Таким образом, р16 действует как негативный регулятор пролиферации нормальных клеток. Мутации Р16 (cdkn2) приводят к образованию опухолей в тканях широкого ряда. cdkn2а является гомозиготно делетированным, мутированным или каким-либо иным способом, инактивированным в большинстве опухолевых клеточных линий и в некоторых первичных опухолях, включая меланомы и опухоли желчных протоков, поджелудочной железы и желудка (Biden et al., 1997; Castellano et al., 1997). Отсутствие экспрессии гена р16INK4а обычно наблюдается в мезотелиомах и в других клеточных линиях. Было показано, что опосредованная экспрессирующим аденовирусом трансдукция р16INK4а в клетки мезотелиомы приводит к снижению роста клеток и к гибели трансдуцированных клеток (Frizelle et al., 1998).
Кроме того, перенос опосредованного аденовирусом гена р16 дикого типа в три клеточные линии глиомы человека (U251 MG, U-87 MG и D54 MG), которые не экспрессировали эндогенный ген р16/CDKN2, приводил к прекращению роста клеток на фазах G0 и G1 (Fueyo et al., 1996). Кроме того, опосредуемый аденовирусом перенос гена р16-INK4A дикого типа в клеточные линии рака легких, которые не экспрессировали p16-INK4A, приводил к ингибированию пролиферации опухоли как in vitro, так и in vivo (Jin et al., 1995). Таким образом, восстановление белка р16 дикого типа в опухолевых клетках может рассматриваться как терапевтический способ лечения рака.
р21
Р21 представляет собой 18 кД-белок (164 аминокислоты), также известный как ингибитор циклин-зависимой киназы 1 (CDKN1), белок 6, ассоциированный с дифференцировкой клеток меланомы (MDA-6), и белок 1, взаимодействующий с CDK. р21 кодируется геном CDKN1 (Harper et al. 1993), известным также как CIP1 и WAF1. р21 может быть ценным промежуточным соединением, с помощью которого р53 опосредует его роль как ингибитора клеточной пролиферации в ответ на повреждение ДНК. р21 может связываться с циклин-зависимой киназой и ингибировать ее активность, предотвращая тем самым фосфорилирование субстратов, необходимых для циклин-зависимой киназы, и блокирование прохождения клеточного цикла и пролиферации клеток. р21 экспрессируется во всех тканях взрослого человека. Перенос гена р21 в опухолевые клетки может быть использован для ингибирования роста опухоли. Опосредованный рекомбинантным аденовирусом перенос гена р21 в две клеточные линии немелкоклеточного рака легких (NSCLC), приводил к дозозависимому индуцированию р21 и к последующему ингибированию клеточного роста, обусловленному остановкой клеточного цикла на фазе GO/G1. Кроме того, инъекция р21-несущих аденовирусов в уже развившиеся опухоли NSCLC у мышей приводила к снижению роста опухоли и к повышению выживаемости этих животных (Joshi et al., 1998). Эти результаты подтверждают эффективность р21 при генотерапии рака.
В соответствии с настоящим изобретением могут быть использованы традиционные методы молекулярной биологии, микробиологии и техники рекомбинантных ДНК, известные специалистам. Такие методы подробно описаны в литературе. См., например, Maniatis, Fritsch & Sambrook, "Molecular Cloning: A Laboratory Manual (1982); "DNA Cloning: A Practical Approach," Volumes I and II (D.N. Glover ed. 1985); "Oligonucleotide Synthesis" (M.J. Gait ed. 1984); "Nucleic Acid Hybridization" (B.D. Hames & S.J. Higgins eds. (1985)); "Transcription and Translation" (B.D. Hames & S.J. Higgins eds. (1984)); "Animal Cell Culture" [R.I. Freshney, ed. (1986)); "Immobilized Cells And Enzymes" (IRL Press, (1986)); B. Perbal, "A Practical Guide To Molecular Cloning" (1984).
Термин "вектор" означает репликон, такой как плазмида, фаг или космида, к которым может быть присоединен другой ДНК-сегмент так, чтобы это проводило к репликации присоединенного сегмента.
Термин "промоторная последовательность" означает регуляторную ДНК-область, способную связываться с РНК-полимеразой в клетке и инициировать транскрипцию нижерасположенной (в направлении 3') кодирующей последовательности. Для более конкретного описания настоящего изобретения следует отметить, что промоторная последовательность у своего 3'-конца связана с сайтом инициации транскрипции, простирается выше (в направлении 5') и включает минимальное число оснований или элементов, необходимых для инициации транскрипции на уровнях, детектируемых как уровни, превышающие фон. В промоторной последовательности находится сайт инициации транскрипции (обычно определяемый путем картирования с использованием нуклеазы S1), а также белок-связывающие домены (консенсусные последовательности), ответственные за связывание с РНК-полимеразой. В большинстве случаев, но не всегда, эукариотические промоторы содержат "ТАТА"-боксы и "САТ"-боксы. Для управления векторами могут быть использованы различные промоторы.
Клетка является "трансдуцированной" экзогенной или гетерологичной ДНК, если такая ДНК была введена вовнутрь клетки обычно с помощью вирусного вектора. Трансдуцирующая ДНК может быть (в случае лентивирусных векторов), а может и не быть интегрирована (ковалентно связана) в геном клетки. Например, в прокариотах, дрожжах и в клетках млекопитающих ДНК может находиться на эписомном элементе, таком как плазмида. Что касается эукариотических клеток, то стабильно трансформированной клеткой является клетка, в которой трансформирующая ДНК интегрирована в хромосому так, что она наследуется дочерними клетками посредством хромосомной репликации. Эта стабильность была продемонстрирована способностью эукариотических клеток к установлению клеточных линий или клонов, состоящих из популяции дочерних клеток, содержащих трансформирующие ДНК. Термин "клон" представляет собой популяцию клеток, образовавшихся из одной клетки или общего предшественника путем митоза. Термин "клеточная линия" означает клон первичных клеток, способный к стабильному росту in vitro на протяжении многих поколений.
Термин "терапевтический ген" означает ген, который придает нужный фенотип.Так, например, конститутивно активный ген ретинобластомы (CA-rb) используется для предупреждения внутриглазной пролиферации или восстановления генетического дефицита посредством переноса гена периферина.
Используемый здесь термин "маркерный ген" означает кодирующую последовательность, которая присоединена к элементам гетерологичного промотора или энхансера и продукт которой может быть легко и количественно проанализирован в том случае, когда эта конструкция введена в ткани или в клетки. Обычно используемыми маркерами являются радиоактивные элементы, ферменты, белки (такие как белок, усиленный флуоресцирующим зеленым) или химические соединения, которые флуоресцируют при их облучении ультрафиолетовым светом, и др.
Настоящее изобретение относится к новым возможностям лечения наследственных или пролиферативных заболеваний, приводящих к потере зрения, путем переноса гена, опосредованного лентивирусом. Таким образом, настоящее изобретение относится к лентивирусному вектору, который несет ДНК-последовательность, кодирующую ген, пригодный для лечения таких заболеваний. В качестве примеров могут служить, но не ограничиваются ими, ген периферина, конститутивно активная форма гена rb и различные терапевтические гены, обсуждаемые выше.
Настоящее изобретение относится к способу ингибирования внутриглазной пролиферации клеток у индивидуума с глазной болезнью, включающему стадию введения указанному индивидууму фармакологически эффективной дозы лентивирусного вектора, содержащего терапевтический ген, ингибирующий внутриглазную клеточную пролиферацию клеток. Репрезентативными примерами глазных болезней, которые могут быть подвергнуты лечению указанным способом настоящего изобретения, являются дегенерация желтого пятна, ассоциированная со старением, пролиферативная диабетическая ретинопатия, ретинопатия недоношенных, глаукома и пролиферативная витреоретинопатия. Терапевтическим геном может быть конститутивно активная форма гена ретинобластомы, ген р16 или ген р21. Указанный лентивирусный вектор предпочтительно вводят в капсулярное, стекловидное или субретинальное пространство в дозе, составляющей примерно 106-109 трансдуцирующих единиц.
Настоящее изобретение также относится к способу ингибирования внутриглазной неоваскуляризации у индивидуума с глазной болезнью, включающему стадию введения указанному индивидууму фармакологически эффективной дозы лентивирусного вектора, содержащего терапевтический ген, который ингибирует внутриглазную неоваскуляризацию. Репрезентативными примерами глазных болезней, которые могут быть подвергнуты лечению указанным способом настоящего изобретения, являются дегенерация желтого пятна, ассоциированная со старением, пролиферативная диабетическая ретинопатия, ретинопатия недоношенных, глаукома и пролиферативная витреоретинопатия. Терапевтическим геном может быть ген, который регулирует ангиогенез или апоптоз. В общих чертах, генами, которые регулируют ангиогенез, являются гены, кодирующие тканевый ингибитор металлопротеиназы TIMP-1; TIMP-2; TIMP-3; TIMP-4; эндостатин; ангиостатин; эндостатин XVIII; эндостатин XV; С-концевой гемопексиновый домен матриксной металлопротеиназы-2; крингл-домен 5 человеческого плазминогена; гибридный белок эндостатина и крингл-домена 5 человеческого плазминогена; монокин, индуцируемый интерфероном гамма (Mig); белок 10 (IP10), индуцируемый интерфероном альфа; гибридный белок Mig и IP-10: растворимый FLT-1 (fms-подобный рецептор тирозинкиназы 1) и киназный рецептор со встроенным доменом (KDR), а генами, которые регулируют апоптоз, являются гены, кодирующие Bcl-2, Bad, Bak, Bax, Bik, короткую изоформу Bcl-X и Gax. Лентивирусный вектор предпочтительно вводят в капсулярное, стекловидное или субретинальное пространство в дозе, составляющей примерно 106-109 трансдуцирующих единиц.
Нижеследующие примеры приводятся в целях иллюстрации различных вариантов осуществления настоящего изобретения и не должны рассматриваться как ограничение его объема.
Пример 1
Клетки и ткани
Получали первичные эксплантаты хороидальных фибробластов человека (HCF), эндотелиальных клеток пупочной вены человека (HUVEC) и фетальных пигментных эпителиальных клеток сетчатки человека (HRPE); и эти эксплантаты культивировали в условиях, либо стимулирующих, либо не стимулирующих митотическую активность. Были также культивированы стабильные клетки фоторецепторов сетчатки (Y-9 и Weri-Rb-1).
Человеческая сетчатка и RPE, полученные во время энуклеации ретинобластомы, были использованы для демонстрации способности лентивирусных векторов трансдуцировать эти митотически неактивные клетки и индуцировать экспрессию экзогенного трансгена периферина человека. Роговицу человека, полученную во время хирургической трансплантации роговицы, использовали для демонстрации способности лентивирусных векторов трансдуцировать эти митотически неактивные клетки вместе с маркерным геном, то есть геном белка, усиленным зеленым флуоресцентным красителем.
Пример 2
Лентивирусный вектор
Была использована система лентивирусных векторов, сконструированная на основе трех плазмид и псевдотипированная оболочкой вируса везикулярного стоматита (VSV), причем указанная система содержала ген зеленого флуоресцирующего белка (GFP) и используемого в качестве маркера (фиг.1). Рекомбинантные лентивирусы были продуцированы, как описано Naldini et al. Промотор предраннего гена цитомегаловируса (CMV) направлял экспрессию eGFP в плазмиду pHR'-CMV-eGFP. Исходный вирусный материал генерировали следующим образом. Клетки почек человека 293Т (5×106) культивировали на 10 см-планшетах, и на следующий день котрансфецировали вместе с 10 мкг pCMV (R8.91 (плазмида с упаковывающей функцией), 10 мкг pHR'-CMV-eGFP (плазмида с маркерным геном) и 2 мкг pMD.G (плазмида, содержащая белок оболочки VSV-G) путем преципитации фосфатом кальция в культуральной среде D10 (среде DMEM с высоким содержанием глюкозы, в которую были добавлены 10% фетальной бычьей сыворотки и антибиотики). После выдерживания в течение 12-16 часов при 37оС среду удаляли и добавляли свежую культуральную среду D10. Клетки культивировали еще 10 часов. Затем в эти клетки добавляли свежую среду D10, содержащую 10 мМ бутирата натрия и 20 мМ буфера Hepes, после чего клетки культивировали еще 12 часов. После этого среду заменяли новой средой D10, содержащей 20 мМ буфера Hepes, и через 12 часов вирус-содержащую среду собирали. Затем добавляли свежую среду и через каждые 24 часа в течение 4 дней собирали супернатант. Вирусный супернатант хранили при -80°С сразу после сбора.
Исходный вирусный материал концентрировали путем ультрацентрифугирования супернатанта (19000 об/мин, ротор Beckman SW28) в течение 140 минут при комнатной температуре, и полученный вирусный осадок ресуспендировали в 1-3 мл забуференного фосфатом физиологического раствора. Аликвоты исходного вирусного материала титровали с клетками 293, а оставшиеся образцы хранили при -80°С.
Все супернатанты лентивирусного вектора анализировали на присутствие компетентного по репликации ретровируса (RCR) путем инфицирования мононуклеарных клеток периферической крови человека, стимулированных фитогемаглютинином, с последующим анализом культуральной среды на р24 gag с помощью ELISA. RCR не детектировался ни в одном из продуцированных супернатантов.
Пример 3
Трансдукция лентивирусным вектором
Супернатанты, содержащие 2×106 дефицитных по репликации лентивирусных частиц/мл, продуцировали путем трансфекции клеток 293Т лентивирусным вектором, описанным выше. Клетки культивировали с вирусными частицами в течение 24 часов, а затем восстанавливали на нормальной среде в течение четырех дней для оценки экспрессии GFP на флуоресцентно-активированном клеточном сортере (фиг.2-3).
Эффективность трансдукции определяли в зависимости от множественности заражения (m.o.i.) в диапазоне от 1 до 1000. Результаты in vitro-трансдукции ряда клеточных линий человека продемонстрировали положительную зависимость между m.o.i. и эффективностью трансдукции, то есть количество трансдуцированных клеток возрастало с увеличением количества лентивирусных частиц (фиг.2).
Была оценена способность лентивирусного вектора трансдуцировать неделящиеся клетки. Эпителиальные клетки пигмента человеческой сетчатки были трансдуцированы лентивирусным вектором или вектором, полученным на основе вируса мышиного лейкоза. Во время обработки вектором эти клетки были митотически неактивными (конфлюентными) или митотически активными (растущими). Результаты, представленные на фиг.4, продемонстрировали очень высокую способность лентивирусных векторов трансдуцировать неделящиеся клетки по сравнению с ретровирусными векторами. Лентивирусный вектор по сравнению с нелентивирусным ретровирусным вектором также обнаруживал высокую эффективность в трансдукции человеческих фетальных клеток (фиг.6).
Для определения продолжительности экспрессии трансгена eGFP клетки, трансдуцированные лентивирусным вектором, тестировали в течение 120 дней. Результаты Саузерн-блот-анализа, проведенного на клональной популяции трансдуцированных клеток, показали, что лентивирусный eGFP-вектор был интегрирован в геном хозяина (фиг.5 В). Экспрессия интегрированного трансгена eGFP была стабильной в течение 120 дней и не обнаруживала какого-либо селективного предпочтения в пользу или против трансдуцированных клеток (фиг.5А).
Пример 4
Трансдукция клеток роговицы in situ
Утолщения роговицы, полученные во время операции по трансплантации роговицы, были использованы для демонстрации способности лентивирусных векторов трансдуцировать эти митотически неактивные клетки с маркерным геном, усиленным геном зеленого флуоресцирующего белка (фиг.7). Эндотелиальные клетки, прикрепленные к Десметовой мембране, собирали из трансдуцированной ткани роговицы и оценивали под световым и люминесцентным микроскопом. Эндотелий роговицы показал положительный результат на eGFP, что указывало на эффективный перенос гена и осуществление его экспрессии (фиг.7 В). Также наблюдалась эффективная трансдукция in situ и экспрессия eGFP в эпителиальном слое (фиг.7С).
В заключение можно сделать вывод, что эти результаты показали, что дефектный по репликации лентивирусный вектор способен эффективно переносить трансген в эпителий человеческой роговицы и в эпителиальные клетки in situ, и что при этом может быть достигнута продолжительная экспрессия трансгена. Этот вектор может быть использован для лечения заболеваний, ассоциированых с нарушениями эндотелия или эпителия роговицы, и он может быть также использован для модификации генетической организации донорной ткани роговицы ex vivo перед трансплантацией, так чтобы это обеспечивало перманентную модуляцию процесса отторжения трансплантата.
Пример 5
Терапия пролиферативных заболеваний, основанная на подавлении роста.
Человеческий ген периферина был использован как пример терапевтического гена. Известно, что генетический дефицит гена периферина у человека приводит к различным видам нарушения фенотипов. Нормальную ткань человеческой сетчатки или пигментную эпителиальную ткань сетчатки (RPE), извлеченную во время хирургической операции по поводу удаления ретинобластомы, обрабатывали лентивирусными векторами, в которых либо отсутствовал терапевтический ген, либо присутствовал ген периферина человека. Результаты, представленные на фиг.8, продемонстрировали, что ген периферина был эффективно перенесен в человеческую ткань сетчатки указанным лентивирусным вектором.
В другом примере переноса терапевтического гена была использована конститутивно активная форма гена ретинобластомы (CA-rb). Описанный здесь лентивирусный вектор опосредовал эффективный перенос конститутивно активной формы гена ретинобластомы (фиг.9). Перенесенный ген CA-rb проявлял дозозависимое ингибирующее действие на пролиферацию человеческих ретинальных и хороидальных клеток (фиг.10) и эпителиальных клеток хрусталика человека (фиг.11).
Конститутивно активная форма гена ретинобластомы, перенесенного под действием лентивирусного вектора, также ингибировала внутриглазную клеточную пролиферацию in vivo. Были протестированы in vivo две модели внутриглазных пролиферативных заболеваний (пролиферативная витреоретинопатия и помутнение задней капсулы после извлечения хрусталика). Пролиферативная витреоретинопатия была индуцирована у трех групп кроликов (фиг.12). Одну группу не обрабатывали, одну группу обрабатывали лентивирусными векторами, в которых отсутствовал ген CA-rb, а последнюю группу обрабатывали путем интравитреального введения лентивирусного CA-rb. В первых двух группах, пролиферативная витреоретонопатия наблюдалась с высокой частотой (>90%), тогда как в группе животных, обработанных CA-rb, фракция животных, у которых наблюдалось отслаивание сетчатки, была существенно меньше (26%).
Результаты, представленные на фиг.13, продемонстрировали ингибирующее действие in vivo лентивирусного CA-rb на процесс помутнения капсулы после удаления хрусталика. Три группы кроликов были подвергнуты стандартной факоэмульсификации для удаления природных хрусталликов. Первую группу (группу 1) ничем не обрабатывали, две другие группы обрабатывали либо "пустыми" лентивирусными конструкциями (не содержащими терапевтического гена, группа 2), либо лентивирусным CA-rb (группа 3), вводимым в капсулярную сумку интактного хрусталика во время закрытия раны после экстракции катаракты. Животных постадийно оценивали на присутствие помутнения задней капсулы. Наличие помутнения оценивали по 5-ти бальной шкале, где оценка 1 означала отсутствие помутнения, а оценка 5 означала помутнение, которое было достаточно серьезным и не позволяло визуализировать сетчатку путем непрямой бинокулярной офтальмоскопии. Эти результаты статистически не отличались от результатов, полученных для групп 1 и 2 (необработанной группы и группы, обработанной "пустым" вектором), в то время как наблюдалось сильное ингибирующее действие лентивирусного СА-rb на развитие помутнения задней капсулы. На день 28 у контрольных животных наблюдалось помутнение, оцененное в среднем 4,4, тогда как у животных, обработанных лентивирусным СА-rb, наблюдалось помутнение, оцененное в среднем 2,1.
Пример 6
Лентивирусный вектор с "двумя генами"
Был сконструирован новый лентивирусный вектор, который включал элемент IRES (внутренний сайт связывания с рибосомой) между двумя сайтами клонирования. Элемент IRES обеспечивает связывание мРНК с рибосомой и синтез белка. Этот остов может вмещать два различных экспрессируемых гена. В трансдуцированных клетках продуцируется одна матричная РНК, однако, благодаря элементу IRES, эта матричная РНК является функционально би-цистронной и может управлять синтезом двух различных белков. Таким образом, каждый из возможных терапевтических генов, обсуждаемых выше, может быть сцеплен с маркерным геном (например, с геном, усиленным флуоресцентым зеленым - геном eGFP), так чтобы трансдуцированные клетки могли быть одновременно меченными и обладали способностью экспрессировать нужный терапевтический ген. Меченые клетки могут быть легко выделены in vitro и исследованы in vivo. Генетические карты для ряда лентивирусных векторов, несущих различные терапевтические гены, показаны на фиг.15-31. Поскольку за последние годы средний уровень знаний специалистов в области генной инженерии и клонирования значительно возрос, то любой специалист в данной области сможет легко сконструировать лентивирусные векторы, содержащие, помимо описанных здесь генов, и другие нужные терапевтически ценные гены.
Пример 7
Анти-неоваскуляризационная генотерапия
"Наивные" клетки (клетки, о которых известно, что они не экспрессируют терапевтический ген) экспонировали вышеупомянутыми лентивирусными векторами в течение 24 часов. Через два дня после экспонирования из этих клеток выделяли РНК и тестировали на экспрессию трансгена посредством полимеразной цепной реакции с использованием обратной транскриптазы (ОТ-ПЦР). На фиг.32 показан ОТ-ПЦР-продукт, который был позитивным в отношении мРНК гибридного гена эндостатина-18/ангиостатина, выделенного мРНК из эндотелиальных клеток микрососудистого русла кожи человека. После демонстрации in vitro переноса гена, опосредованного лентивирусом, как показано выше, оценивали способность этого гена ингибировать неоваскуляризацию in vivo. Неоваскуляризацию индуцировали в тканях роговицы кроликов следующим образом.
Создание внутристромального роговичного микрокармана и введение найлонового сита, пропитанного лентивирусом
Кроликов подвергали общей анестезии путем наложения маски с изофлуораном (4 л/мин) и кислородом (2 л/мин). Одну каплю пропаракаина вводили в свод под местной анестезией. Подачу изофлорана снижали до 2,5 л/мин. Затем в свод в течение 30 секунд вводили бетадин и промывали BSS (сбалансированным физиологическим раствором, Alcon Inc). В глаз помещали векорасширитель. Для вхождения в строму роговицы с помощью 2,8 мм-микрокератома делали разрез, соответствующий 12-часовому положению стрелки на циферблате часов. В этом внутристромальном кармане с помощью пинцетов Макферсона делали интрастромальный разрез размером 5х5 мм и загрязнения с радужки удаляли с помощью специальной щеточки путем помахивания взад и вперед. Затем на любой стороне ножницами Ваннаса делали разрез, соответствующий 12-часовому положению стрелки на циферблате часов, размером 4,5 мм. Используемое для гибридизации найлоновое сито Amersham размером 4×4 мм (Amersham Bioscientist RPN 2519), пропитанное 10 л лентивируса, вводили в предварительно созданный карман. На роговицу наносили одну каплю тобрамицина. Подачу изофлурана прерывали, а интраназальную подачу кислорода увеличивали до 4 л/мин. Таким образом, через 20 минут кроликов успешно выводили из анестезии и возвращали в их клетки с нормальными жизненными функциями. Для анестезии кроликам подкожно (SQ) вводили 0,2 см3 бупренекса (0,3 мг/см3) дважды в день. Кроликам также вводили одну каплю атропина и одну каплю тобрамицина в течение двух дней для устранения послеоперационной циклоплегии и для обработки антибиотиком. В первый день после операции каждому кролику местно наносили каплю пропаракаина для анестезии, и найлоновое сито удаляли из внутристромального роговичного кармана пинцетом калибра 0,12. Послеоперационное обезболивание и ежедневный уход обеспечивался в течение двух недель.
Неоваскуляризация, индуцированная щелочью
Через две недели после первой хирургической операции роговицу обрабатывали фильтровальными дисками размером 6 мм (Whatman #3), пропитанными 20 л 1,0М NaOH, в течение 1 минуты. Затем все роговицы обильно промывали BSS. Кроликам вводили одну каплю атропина и одну каплю тобрацимина в течение двух дней для устранения послеоперационной циклоплегии и для обработки антибиотиком. Затем неоваскулярный ответ регистрировали путем фотографирования цифровой фотокамерой. Неоваскулярный ответ оценивали с помощью щелевой лампы, фиксируя часовой угол и длину сосудов на день 1, 3, 5, 7 и 10 после травмы. Неоваскуляризацию количественно определяли путем вычисления площади пролиферации сосудов, как описано ниже.
Для стандартизованного метода оценки неоваскуляризации роговицы были разработаны нижеследующий протокол и формула для сравнения неоваскуляризации после прижигания щелочью. Формулу для площади неоваскуляризации получали путем вычисления площади большего сектора, ограниченного радиусом RT, и вычитанием площади меньшего сектора, ограниченного радиусом R2. Площадь большего сектора, ограниченного радиусом RT, представляет собой число часовых углов, деленное на 12 и умноженное на πRT2. Площадь меньшего сектора, ограниченного радиусом R2, представляет собой число часовых углов, деленное на 12 и умноженное на π(R2)2. Площадь, полученная путем вычитания двух секторов, является площадью неоваскуляризации. Для регистрации экспрессии белка, флуоресцирующего в зеленом диапазоне спектра, то есть маркерного гена, включенного в лентивирусный бицистронный мессенжер, осуществляли конфокальную микроскопию. На фиг.33 показаны микрофотографии, которые продемонстрировали присутствие eGFP в роговичном микрокармане у животных, обработанных лентивирусным вектором. Для иллюстрации ингибирующего действия на неоваскуляризацию у животных индуцировали неоваскуляризацию, как описано выше. После обработки лентивирусным вектором, содержащим гибридный ген Mig/IP10, наблюдался ингибирующий эффект (фиг.34). Как показано в таблице 1, значительное снижение уровня неоваскуляризации наблюдалось у животных, обработанных гибридным геном Mig/IP10 или геном крингла 1-5, перенесенным лентивирусными векторами.
Ниже приводятся следующие ссылки:
Naldini et al., (1996) Science 272: 263-267. Miyoshi et al., (1997) Proc. Natl. Acad. Sci. USA 94: 10319-10323.
Все патенты и публикации, упомянутые в настоящем описании, указывают на уровень техники, предшествующий настоящему изобретению. Кроме того, эти патенты и публикации вводятся в настоящее описание посредством ссылки так, как если бы каждая публикация была конкретно и независимо введена в описание настоящего изобретения.
Для каждого специалиста очевидно, что настоящее изобретение может быть легко адаптировано для достижения вышеуказанных целей, результатов и преимуществ, а также тех целей, результатов и преимуществ, которые являются неотъемлемыми признаками настоящего изобретения. Примеры настоящего изобретения, наряду со способами, процедурами, обработками, молекулами и конкретными соединениями, описанными в настоящей заявке, иллюстрируют предпочтительные варианты осуществления настоящего изобретения и не должны рассматриваться как ограничение его объема. Возможны различные изменения и другие применения настоящего изобретения, которые входят в объем изобретения, определенный в представленной ниже формуле изобретения.
Реферат
Настоящее изобретение относится к медицине, в частности к офтальмологии, и может быть использовано для лечения глазных болезней, обусловленных патологической пролиферацией клеток. Для этого в различные отделы глаза вводят терапевтически эффективные дозы лентивирусного вектора, содержащего ген, регулирующий ангиогенез. Такое выполнение способа обеспечивает эффективное ингибирование внутриглазной пролиферации клеток и неоваскуляризации за счет оптимального сочетания терапевтического гена и вирусного носителя. 2 н. и 6 з.п. ф-лы, 1 табл, 34 ил.

Формула
Документы, цитированные в отчёте о поиске
Способ направления (индукции) иммунного ответа, днк, вектор, способ лечения

Комментарии