Рекомбинантные гликопротеины с сиалированными о-гликанами и линии клеток для их продукции - RU2714209C2
Код документа: RU2714209C2
Чертежи
















Описание
Настоящее изобретения относится к линиям клеток, которые генетически модифицированы для сверхэкспрессии β-галактозид-α-2,3-сиалилтрансферазы 1 (ST3Gal1), предпочтительно ST3Gal1 человека, которые могут быть использованы для продукции рекомбинантных гликопротеинов, содержащих в высокой степени или полностью сиалированные O-связанные с использованием GalNac гликаны (GalNAc-O-гликаны), предпочтительно имеющие остов 1 GalNAc-О-гликаны, а также к соответствующим рекомбинантным гликопротеинам. Кроме того, настоящее изобретение относится к соответствующим способам экспрессии рекомбинантных гликопротеинов, способам увеличения степени сиалирования рекомбинантных гликопротеинов, а также способам уменьшения микронеоднородности GalNac-O-гликанов. Наконец, настоящее изобретение относится к соответствующим применениям указанных выше линий клеток для продукции рекомбинантных гликопротеинов, для увеличения степени сиалирования рекомбинантных гликопротеинов, а также для уменьшения микронеоднородности O-связанных с использованием GalNac гликанов рекомбинантных гликопротеинов.
Вследствие их клинической значимости, разработка терапевтических белков очень ускорилась на протяжении последних лет. Однако разработка терапевтических белков часто останавливается, в частности, в случае сложных гликозилированных белков, из-за трудностей получения белков с выгодным характером гликозилирования. Это часто приводит к неоптимальным фармакологическим свойствам, таким как, например, уменьшенный полупериод существования в сыворотке или увеличенная иммуногенность.
Другим недостатком является неоднородность терапевтических белков вследствие вариаций посттрансляционной модификации, в частности, гликоструктур. Это может привести к несоответствию качества продуктов между различными партиями продукции. Поэтому с целью продвижения разработки терапевтических белков важно достижение однородной посттрансляционной модификации.
Гликозилирование является самой распространенной посттрансляционной модификацией. Почти все биофармацевтические препараты должны быть правильно гликозилированы для проявления оптимальной терапевтической эффективности. В общем, гликозилирование относится к ковалентному присоединению сахаров к поверхности белка, причем сахара либо соединяются с остатками аспарагина, приводя к N-связанным гликанам (N-гликанам), либо с остатками серина или треонина, приводя к О-связанным гликанам (О-гликанам). Самой распространенной группой О-связанных гликанов являются GalNac-O-гликаны, в которых серин или треонин связан с N-ацетилгалактозамином (GalNAc), который в свою очередь связан с дополнительными моносахаридами. Используемые здесь термины «О-связанный гликан» или «O-гликан» всегда относятся к GalNac-О-гликанам. Как упоминалось выше, характер гликозилирования может весьма отличаться от молекулы к молекуле, поскольку присоединяемые формы могут отличаться последовательностью моносахаридов, характером ветвления и длиной (микронеоднородность). Кроме того, не все сайты гликозилирования полностью заняты (макронеоднородность).
Гликозилирование влияет на растворимость белков, их устойчивость к протеолизу и характеристики их связывания с другими белками или с белковыми рецепторами, такими как, например, ASGPR (асиалогликопротеиновый рецептор), а, следовательно, влияет на полупериод существования гликопротеина в плазме.
В случае белков небольшого размера меньше приблизительно 50 кДа клиренс происходит в основном за счет почечного клиренса. Помимо размера белка, также заряд поверхности белка оказывает влияние на почечный клиренс, поскольку фильтрация сильно заряженных белков в почках уменьшается.
В случае белков большого размера клиренс происходит в основном в печени путем специфического и/или неспецифического печеночного захвата. Примерами медиатора специфического захвата мог бы быть ASGPR, который специфически связывается с несиалированными N-связанными гликопротеинами с концевой галактозой. Благодаря действию этого рецептора, гликопротеины с концевыми сиаловыми кислотами, защищающими соседний углевод, галактозу, характеризуются увеличением вплоть до 100 раз полупериода существования по сравнению с их несиалированными аналогами с концевыми остатками галактозы в их N-связанных гликанах. Другие рецепторы специфически связываются с маннозой, N-ацетилглюкозамином, или фукозой и выводят гликопротеины с этими концевыми сахарами из системы.
С этой точки зрения, встречающийся в природе характер N-гликозилирования, в том числе высокая степень сиалирования конца, имеет решающее значение для терапевтических белков, поскольку он определяет фармакокинетические свойства терапевтического белка. Кроме того, концевые сиаловые кислоты с надлежащей связью в гликопротеинах уменьшают иммуногенность гликопротеинов.
Передовой стратегией для получения почти нативных гликоструктур и высокой степени сиалирования является продуцирование рекомбинантных белков в линиях клеток, способных к связыванию гликоструктур вроде таковых млекопитающих с белками, например, в клетках СНО (клетках яичника китайского хомячка). Однако в клетках СНО отсутствует фермент, необходимый для катализа 2,6-связи сиаловых кислот, и, следовательно, они могут только катализировать 2,3-связь. Кроме того, в дополнении к N-ацетилнейраминовой кислоте (сиаловой кислоте; NeuAc), они также связывают с гликанами N-гликолилнейраминовую кислоту (NeuGc), сахар, не синтезируемый в организме человека и, следовательно, являющийся иммуногенным при введении в организме человека. Таким образом, лучшей стратегией было бы образование терапевтических белков, исходя из линий клеток, происходящих из клеток человека вроде клеток CAP (производных амниоцитов человека) или клеток HEK293 (производных клеток почек эмбриона человека). Однако сиалирование терапевтических белков, секретируемых из линий клеток млекопитающих во время ферментации, часто бывает неполным.
Вследствие важности сиалирования для фармакокинетического профиля белка, было предпринято много усилий с целью увеличения степени сиалирования. Положительный эффект полного сиалирования в случае N-гликозилирования хорошо известен, но относительно мало известно об эффекте O-гликозилирования. Следовательно, до сих пор все усилия по конструированию клеток, направленные на увеличение сиалирования, нацелены на N-связанные гликоструктуры.
О-связанные с использованием GalNac гликаны всегда содержат остаток α-связанного N-ацетилгалактозамина, связанный с серином или треонином. GalNAc может быть удлинен за счет остатков вроде галактозы, GlcNAc, фукозы или сиаловой кислоты. В случае О-гликозилирования с использованием GalNAc могут быть выделены четыре основные структуры остовов, остов 1 (GalGalNAc), остов 2 (GalGlcNAcGalNAc), остов 3 (GlcNAcGalNAc) и остов 4 (GlcNAc2GalNAc) (фиг. 1). Терминальные концы часто дополнительно модифицированы, например, фосфатами, сульфатами, карбоновыми кислотами или сиаловыми кислотами. О-связанные с использованием GalNac гликаны играют определенную роль в поддержании структур полностью свернутых белков, придании устойчивости к протеазам. На фиг. 2 продемонстрирован биосинтез GalNAc-O-гликанов, имеющих остов 1 и остов 2.
Хотя точно установлено существенное положительное влияние концевых сиаловых кислот в N-связанных гликанах, касающееся увеличения полупериода существования терапевтических белков, не в достаточной степени известно о возможном влиянии концевых сиаловых кислот в О-связанных с использованием GalNAc гликанах и точном внешнем виде О-связанных структур.
Связывающийся с инсулиноподобным фактором роста человеческий белок-6 (IGFBP6) имеет пять сайтов О-гликозилирования, и клиренс из крови снижается в случае O- гликозилированной формы по сравнению с дегликозилированной формой, что указывает на общее участие О-связанных гликанов, в то время как роль сиаловых кислот остается неясной. Рецептор 3 активирующего В-клетки фактора (BR3)-Fc имеет множество сайтов О-гликозилирования, и уровни сиалирования изменяются в процессе производства. При разделении различных форм смогли установить, что незащищенная галактоза в десиалированных О-связанных гликанах BR3-Fc была связана с быстрым клиренсом вследствие захвата и деградации в печени, в частности, путем клиренса с использованием непаренхиматозных клеток. Интересно отметить, что уменьшение скорости клиренса, которое было связано с увеличением сиалированного Gal, также отмечалось в случае увеличения асиало-GalNAc, что свидетельствует о том, что концевой асиало-Gal может быть сигналом для клиренса. Адипонектин, секретируемый адипоцитами, инсулин-сенсибилизирующий гормон, имеет три предполагаемых сайта О-гликозилирования, которые не являются необходимыми для образования мультимеров, но плазменный клиренс десиалированного белка был ускоренным по сравнению с таковым сиалированного белка. До сих пор не были описаны способы, которые будут влиять на сиалирование или структуру О-связанных с использованием GalNAc гликанов во время рекомбинантной экспрессии гликопротеинов.
Соответственно, техническая проблема, лежащая в основе настоящего изобретения, заключается в обеспечении рекомбинантных гликопротеинов, содержащих в высокой степени или полностью сиалированные GalNac-O-гликаны, а также линий клеток, которые способны к рекомбинантной продукции таких белков. Кроме того, должны быть предусмотрены соответствующие способы экспрессии рекомбинантных гликопротеинов, увеличения степени сиалирования рекомбинантных гликопротеинов и уменьшения микронеоднородности О-связанных с использованием GalNAc гликанов, а также применения указанных выше линий клеток для продукции рекомбинантных гликопротеинов, увеличения степени сиалирования рекомбинантных гликопротеинов и уменьшения микронеоднородности О-связанных с использованием GalNAc гликанов.
Решение вышеуказанной технической задачи достигается с помощью вариантов осуществления, охарактеризованных в формуле изобретения.
В частности, в первом аспекте, настоящее изобретение относится к линии клеток животных, предпочтительно линии клеток насекомых, птиц или млекопитающих, более предпочтительно линии клеток млекопитающего, в частности человека, которая генетически модифицирована для сверхэкспрессии β-галактозид-α-2,3-сиалилтрансферазы 1 (ST3Gal1).
Термин «линия клеток, генетически модифицированная для сверхэкспрессии в ST3Gal1», используемый здесь, а также в контексте других трансфераз в дальнейшем, означает, что при генетической модификации, отдельные клетки клеточной линии демонстрируют более высокую активность белка, например сиалилтрансферазы, чем они демонстрировали до генетической модификации.
Генетические модификации, которые делают возможной сверхэкспрессию данного белка, особенно не ограничиваются и известны в данной области техники. В конкретном примере, линия клеток, такая как, например, линии клеток человека, содержит эндогенный ген, кодирующий ST3Gal1. В таких случаях, клетки могут быть генетически модифицированы путем вставки промотора, энхансера и/или стабилизирующего элемента в геном клетки в положении, подходящем для вызова сверхэкспрессии указанной нуклеиновой кислоты. Это может быть сделано путем гомологичной рекомбинации с использованием TALEN, белков Zn-пальцев, CRISPR-CAS9, или других способов, известных в данной области техники. Таким образом, в предпочтительных вариантах осуществления, линия клеток содержит эндогенный ген, кодирующий ST3Gal1, и необязательно эндогенные гены, кодирующие ST3Gal4 и/или ST6Gal1, и, кроме того, содержит по крайней мере один генетический элемент, выбираемый из группы, состоящей из промотора, энхансера и стабилизирующего элемента, вставленный в геном в одном или более положений, подходящих для вызова сверхэкспрессии ST3Gal1 и необязательно ST3Gal4 и/или ST6Gal1. Подходящие промоторы, энхансеры и стабилизирующие элементы особенно не ограничиваются и известны в данной области техники. Например, промоторы включают конститутивные промоторы, например, промотор CMV, EF1α, SV40, RSV, UbC, CAG, BOS или PGK, и индуцируемые промоторы, например, тетрациклин-индуцируемые промоторы или другие индуцируемые промоторы, известные в данной области техники. Кроме того, энхансеры (усиливающие элементы) включают энхансер CMV, энхансер β-глобина, энхансер иммуноглобулина и PGK-энхансер. Кроме того, стабилизирующие элементы (элементы хроматина) включают участки прикрепления к матриксу (MAR), локус-контролирующие участки (LCR), а также повсеместно действующие элементы открытия хроматина (UCOE).
В качестве альтернативы, в случае, когда клетки не содержат эндогенный ген, кодирующий ST3Gal1, или дополнительно, в тех случаях, когда клетки действительно содержат эндогенный ген, кодирующий ST3Gal1, генетическая модификация клеток может быть достигнута путем введения нуклеиновой кислоты, кодирующей ST3Gal1, в клетки. Способы введения нуклеиновых кислот в клетки, особенно не ограничиваются и известны в данной области техники. Например, указанные нуклеиновые кислоты могли бы быть введены в кольцевой или линеаризованной форме в клетки путем электропорации, нуклеофекции, микроинъекции, с помощью вирусных векторов, например, лентивирусных векторов, методов на основе реагентов, например, липидов, фосфата кальция, катионных полимеров, или другими способами, известными в данной области техники. Нуклеиновые кислоты могут быть транзиторно или стабильно введены в клетку с помощью эписомных систем или путем стабильной интеграции нуклеиновой кислоты в геном. Указанные нуклеиновые кислоты могут присутствовать в клетках в виде одного или более экспрессионных векторов, например, рсDNA, рСЕР, pLenti, pEntr, pDest, pEF, pEAK, pCMV, pStbl или других экспрессионных векторов, известных в данной области техники. Экспрессия ST3Gal1 может находиться под контролем конститутивного промотора, например, промотора CMV, EF1α, SV40, RSV, UbC, CAG, BOS или PGK, эндогенного промотора, или индуцируемого промотора, например, тетрациклин-индуцируемого промотора или других индуцируемых промоторов, известных в данной области техники. Кроме того, нуклеиновые кислоты, кодирующие ST3Gal1, могут присутствовать в виде одной непрерывной нуклеиновой кислоты, или могут быть представлены в виде отдельных нуклеиновых кислот, например, в виде отдельных экспрессионных векторов. Указанные нуклеиновые кислоты могут содержать, в дополнение к кодирующей области и промотора, подходящие сайты рестрикции, последовательности Козак, сайты связывания рибосом, модулирующие хроматин элементы, кассеты для осуществления отбора, системы репликации эписом, например, ядерный антиген вируса Эпштейна-Барра и ori P, или ori SV40 и Т-антиген большой SV40, внутренние сайты связывания рибосом (IRES), сигналы сплайсинга, а также сигналы полиаденилирования, известные в данной области техники. Таким образом, в предпочтительных вариантах осуществления линия клеток содержит экзогенную нуклеиновую кислоту, кодирующую β-галактозид-α-2,3-сиалилтрансферазу 1 (ST3Gal1), и необязательно экзогенные нуклеиновые кислоты, кодирующие β-галактозид-α-2,3-сиалилтрансферазу 4 (ST3Gal4) и/или β-галактозид-α-2,6-сиалилтрансферазу 1 (ST6Gal1).
Подходящие гены, кодирующие ST3Gal1, для трансфекции линий клеток особенно не ограничиваются и включают любые гены любого происхождения, которые кодируют белок, обладающий активностью ST3Gal1, т.е. белок, который катализирует связь сиаловой кислоты со структурой Gal-β-1,3-GalNAc, связанной с Thr или Ser. Предпочтительно, когда такие гены выбирают из генов ST3Gal1, кодирующих белок ST3Gal1, содержащий в своей аминокислотной последовательности, в частности в мотиве 3 С-концевого акцепторного сайта связывания, консервативную консенсусную последовательность (H/C/R)(Y/H/F)(W/Y/F)(E/D/H/Y), причем последовательность HYWE (SEQ ID NO: 5) является особенно предпочтительной. На фиг. 14 представлено совмещение аминокислотных последовательностей ST3Gal1 различных видов, охватывающих аминокислоты с 191 по 340 ST3Gal1 человека, включающих каталитический домен, и продемонстрирована указанная консенсусная последовательность. Более предпочтительно, когда ген выбирают из генов ST3Gal1, кодирующих белок ST3Gal1, включающий аминокислотную последовательность, которая идентична на по крайней мере 50%, предпочтительно 75% и более предпочтительно 90% аминокислотам с 263 по 321 ST3Gal1 человека. Более предпочтительно, когда ген выбирают из группы, состоящей из генов ST3Gal1, полученных от вида, выбираемого из группы, состоящей из Homo sapiens (SEQ ID NO: 1), Pan troglodytes (SEQ ID NO: 6), Macaca mulatta (SEQ ID NO: 7), Sus scrofa (SEQ ID NO: 8), Rattus norvegicus (SEQ ID NO: 9), Mus musculus (SEQ ID NO: 10), Nannospalax galili (SEQ ID NO: 11), Monodelphis domestica (SEQ ID NO: 12), Oryctolagus cuniculus (SEQ ID NO: 13), Cricetulus griseus (SEQ ID NO: 14), Canis familiaris (SEQ ID NO: 15), Felis catus (SEQ ID NO: 16), Equus caballus (SEQ ID NO: 17), Gallus gallus (SEQ ID NO: 18), Columba livia (SEQ ID NO: 19), Alligator sinensis (SEQ ID NO: 20), Latimeria chalumnae (SEQ ID NO: 21) и Ciona intestinalis (SEQ ID NO: 22), причем гены S3Gal1 млекопитающих, в частности, ген ST3Gal1 человека, являются особенно предпочтительными.
В других предпочтительных вариантах осуществления линия клеток дополнительно генетически модифицирована для сверхэкспрессии β-галактозид-α-2,3-сиалилтрансферазы 4 (ST3Gal4), предпочтительно ST3Gal4 человека, и/или дополнительно генетически модифицирована для сверхэкспрессии β-галактозид-α-2,6-сиалилтрансферазы 1 (ST6Gal1), предпочтительно ST6Gal1 человека. Предпочтительно соответствующие генетические модификации являются такими, как те, которые определено выше для ST3Gal1. Кроме того, подходящие гены, кодирующие ST3Gal4, и подходящие гены, кодирующие ST6Gal1, особенно не ограничиваются и включают любые гены любого происхождения, которые кодируют белок, обладающий соответствующей активностью. Опять же, являются особенно предпочтительными гены млекопитающих, в частности гены человека.
Линии клеток в соответствии с настоящим изобретением могут быть производными линий клеток, например, линий клеток млекопитающих, известных в данной области техники. В предпочтительных вариантах осуществления линия клеток настоящего изобретения может быть производной клеток мускусной утки (AGE.CR®), эпителиальных клеток почки африканской зеленой мартышки (Vero), клеток Мадин-Дарби почки собаки (MDCK), клеток почки детеныша хомячка (ВНК), клеток яичника китайского хомячка (СНО), линий клеток гепатокарциномы человека (HepG2, Huh7), клеток почки эмбриона человека 293 (НЕК293), клеток-предшественников нейронов человека (AGE1.HN® и NC5T11), ретинобластов у эмбриона человека (PER.C6), линий клеток миеломы (HMCL, MM.1, U266, RPMI8226), линий опухолевых клеток CML (NM, NM-F9), гибридных НЕК293 и лимфомных клеток (HKB11), или амниоцитов человека (САР; см. ЕР 1230354 В1), причем предпочтительными являются клетки СНО, клетки НЕК293 и клетки CAP, а особенно предпочтительными являются клетки CAP.
В этой связи, клетки CAP являются постоянными амниотическими клеточными линиями, содержащими нуклеиновую кислоту, кодирующую продукты генов районов Е1А и Е1В аденовируса, в частности аденовируса типа 5 (Ad5). Клетки CAP происходят от первичных амниоцитов человека, которые трансформируют нуклеиновой кислотой, кодирующей E1A и Е1B Ad5.
Соответственно, в предпочтительном варианте осуществления, линии клеток в соответствии с настоящим изобретением могут происходить от первичных амниоцитов человека, содержащих по крайней мере одну нуклеиновую кислоту, кодирующую продукты генов района Е1 и pIX аденовируса, предпочтительно района E1 и pIX аденовируса типа 5 (Ad5) от нуклеотида 505 до 4079, в которой Е1А находится под контролем промотора фосфоглицераткиназы (pgk) мыши, тогда как экспрессия Е1В и pIX контролируется их природными промоторами. Находящийся 3' от Е1В интрон, акцепторный сайт сплайсинга и сигнал полиА заменены соответствующими мотивами из SV40.
Любые или все из указанных выше предпочтительных и/или конкретных вариантов осуществления, описанных для линий клеток млекопитающих, могут быть объединены друг с другом любым образом.
В еще одном аспекте настоящее изобретение относится к рекомбинантному гликопротеину, содержащему GalNac O-гликаны, которые сиалированы до степени, составляющей по крайней мере 80%.
Используемый здесь термин «рекомбинантный гликопротеин» означает, что соответствующие гликопротеины продуцируются биотехнологически в генетически модифицированных организмах или клетках.
Гликопротеины в соответствии с настоящим изобретением содержат GalNac-O-гликаны, которые сиалированы до степени, составляющей по крайней мере 80%, предпочтительно по крайней мере 82%, более предпочтительно по крайней мере 84%, по крайней мере 86%, по крайней мере 88%, по крайней мере 90%, по крайней 91%, по крайней мере 92%, по крайней мере 93%, по крайней мере 94%, по крайней мере 95%, по крайней мере 95,5%, по крайней мере 96%, по крайней мере 96,5%, по крайней мере 97%, по крайней мере 97,5%, по крайней мере 98%, по крайней мере 98,5% или по крайней мере 99%. Предпочтительно, когда гликопротеины в соответствии с настоящим изобретением содержат GalNac-O-гликаны, которые сиалированы до степени, составляющей 95% или выше. В этом контексте, используемый здесь термин «O-гликаны, которые сиалированы до степени, составляющей по крайней мере X%», означает, что Х% всех концевых моносахаридных остатков GalNac-O-гликанов в данном препарате гликопротеина представляют собой сиаловую кислоту (N-ацетилнейраминовую кислота; NeuAc).
В предпочтительных вариантах осуществления по крайней мере 80%, предпочтительно по крайней мере 82%, более предпочтительно по крайней мере 84%, по крайней мере 86%, по крайней мере 88%, по крайней мере 90%, по крайней мере 91%, по крайней мере 92%, по крайней мере 93%, по крайней мере 94%, по крайней мере 95%, по крайней мере 95,5%, по крайней мере 96%, по крайней мере 96,5%, по крайней мере 97%, по крайней мере 97,5% или по крайней мере 98% GalNac-O-гликанов гликопротеинов настоящего изобретения представляют собой GalNac-O-гликаны, имеющие остов 1, т.е. GalNac-O-гликаны, имеющие структуру остова
GP-Ser/Thr-O-GalNAc-Gal-
где GP представляет собой гликопротеин, Ser/Thr-O представляет собой боковую цепь аминокислоты серина или треонина гликопротеина, GalNAc представляет собой N-ацетилгалактозамин, и Gal представляет собой галактозу (фиг. 1).
В предпочтительных вариантах осуществления гликопротеины в соответствии с настоящим изобретением содержат имеющие остов 1 GalNac-O-гликаны, которые дисиалированы до степени, составляющей по крайней мере 25%, предпочтительно по крайней мере 30%, более предпочтительно по крайней мере 35%, по крайней мере 37,5%, по крайней мере 40%, по крайней мере 42,5% или по крайней мере 45%. В этом контексте, используемый здесь термин «имеющие остов 1 GalNac-O-гликаны, которые дисиалированы до степени, составляющей по крайней мере X%», означает, что Х% всех имеющих остов 1 GalNac-O-гликанов имеют два концевых компонента в виде сиаловой кислоты. В этой связи на фиг. 11 представлены относительные количества шести основных видов O-гликанов в различных препаратах ингибитора гликопротеин-С1-эстеразы (C1-Inh).
Соответствующие рекомбинантные гликопротеины могут быть продуцированы, как здесь описано, например, путем сверхэкспрессии β-галактозид-α-2,3-сиалилтрансферазы 1 (ST3Gal1) вместе с рекомбинантным гликопротеином, и, необязательно, путем дополнительной сверхэкспрессии β-галактозид-α-2,3-сиалилтрансферазы 4 (ST3Gal4) и/или β-галактозид-α-2,6-сиалилтрансферазы 1 (ST6Gal1). Предпочтительно, когда указанные гликопротеины продуцируют в линии клеток в соответствии с настоящим изобретением, как здесь описано.
В связанном варианте осуществления GalNac-O-гликаны рекомбинантных гликопротеинов настоящего изобретения характеризуются уменьшенной микронеоднородностью, т.е. уменьшенным разнообразием структуры GalNAc-O-гликанов и их состава внутри данного препарата гликопротеина. Соответствующие рекомбинантные гликопротеины могут быть продуцированы, как здесь описано, например, путем сверхэкспрессии ST3Gal1 вместе с рекомбинантным гликопротеином, и, необязательно, путем дополнительной сверхэкспрессии ST3Gal4 и/или ST6Gal1. Предпочтительно, когда указанные гликопротеины продуцируют в линии клеток в соответствии с настоящим изобретением, как здесь описано.
Конкретные гликопротеины в соответствии с настоящим изобретением особенно не ограничиваются, при условии, что указанные гликопротеины содержат GalNac-O-гликаны и удовлетворяют соответствующим требованиям к сиалированию GalNac-О-гликанов. Предпочтительно, когда указанные гликопротеины являются гликопротеинами млекопитающих, более предпочтительно человека. Гликопротеины могут быть выбраны из группы, состоящей из факторов роста, пептидных гормонов, цитокинов, ферментов, антител, фрагментов антител, факторов свертывания крови и ингибиторов протеаз. Предпочтительно, когда гликопротеин выбирают из группы, состоящей из фактора роста гепатоцитов (HGF), эритропоэтина (ЕРО), фактора VIII (FVIII), фактора IX (FIX), фактора фон Виллебранда (vWF) и ингибитора C1-эстеразы (С1-ингибитора; C1-Inh), причем C1-Inh является особенно предпочтительным.
Таким образом, в особенно предпочтительном варианте осуществления настоящее изобретение относится к рекомбинантному ингибитору С1-эстеразы (С1-ингибитору; C1-Inh), предпочтительно рекомбинантному C1-Inh человека, содержащему GalNac-O-гликаны, которые сиалированы до степени, составляющей по крайней мере 80%. Все приведенные выше предпочтительные и/или конкретные варианты осуществления, описанные для рекомбинантных гликопротеинов в целом, применимы также к этому конкретному варианту осуществления рекомбинантного C1-Inh (человека).
Любые или все из указанных выше предпочтительных и/или конкретных вариантов осуществления, описанных для рекомбинантных гликопротеинов, могут быть объединены друг с другом любым образом.
В дополнительных аспектах настоящее изобретение относится к способу экспрессии рекомбинантных гликопротеинов, содержащих GalNac-O-гликаны, которые сиалированы до степени, составляющей по крайней мере 80%, к способу увеличения степени сиалирования GalNac-О-гликанов рекомбинантных гликопротеинов, а также к способу уменьшения микронеоднородности GalNac-O-гликанов рекомбинантных гликопротеинов, при этом все указанные способы включают стадию сверхэкспрессии вместе с рекомбинантными гликопротеинами β-галактозид-α-2,3-сиалилтрансферазы 1 (ST3Gal1).
В конкретных вариантах осуществления указанные способы включают стадии:
(a) обеспечения линии клеток в соответствии с настоящим изобретением;
(b) экспрессии представляющего интерес гликопротеина в указанной линии клеток; и
(c) сверхэкспрессии ST3Gal1 и необязательно одного или более ферментов, выбираемых из группы, состоящей из ST3Gal4 и ST6Gal1, вместе с представляющим интерес гликопротеином.
Кроме того, способы настоящего изобретения могут включать стадию (d) выделение представляющего интерес гликопротеина.
В этих аспектах, все определения и предпочтительные и/или конкретные варианты осуществления, описанные для рекомбинантных гликопротеинов настоящего изобретения и линий клеток настоящего изобретению, применяются аналогичным образом, где это уместно.
В частности, рекомбинантные гликопротеины, продуцированные в указанных способах, или рекомбинантные гликопротеины, степень сиалирования которых увеличивается в указанных способах, или рекомбинантные гликопротеины, микронеоднородность GalNac-O-гликанов которых уменьшается в указанных способах, могут представлять собой любые гликопротеины настоящего изобретение, определенные выше. Кроме того, линии клеток, обеспечиваемые на стадии (а) способах настоящего изобретения, могут представлять собой любую линию клеток настоящего изобретения, определенную выше.
Способы экспрессии белков в линиях клеток настоящего изобретения особенно не ограничиваются и известны в данной области техники. В связи с этим стадия (b) экспрессии представляющего интерес гликопротеина в указанной линии клеток включает трансфекцию соответствующей кодирующей нуклеиновой кислоты в указанную линию клеток до фактической экспрессии гликопротеина. Кроме того, способы выделения представляющего интерес гликопротеина из клеточной культуры особенно не ограничиваются и известны в данной области техники.
В связанных аспектах настоящее изобретение относится к применению линии клеток в соответствии с настоящим изобретением для продукции рекомбинантных гликопротеинов, содержащих GalNac-О-гликаны, которые сиалированы до степени, составляющей по крайней мере 80%, и/или для увеличения степени сиалирования рекомбинантных гликопротеинов, и/или для уменьшения микронеоднородности GalNac-О-гликанов рекомбинантных гликопротеинов.
В этих аспектах, все определения и предпочтительные и/или конкретные варианты осуществления, описанные для рекомбинантных гликопротеинов настоящего изобретения и линий клеток настоящего изобретению, применяются аналогичным образом, где это уместно.
В частности, рекомбинантные гликопротеины, продуцированные при указанном применении, или рекомбинантные гликопротеины, степень сиалирования которых увеличивается при указанном применении, или рекомбинантные гликопротеины, микронеоднородность GalNac-О-гликанов которых уменьшается при указанном применении, могут быть любыми гликопротеинами настоящего изобретение, определенными выше. Кроме того, используемые линии клеток настоящего изобретения могут представлять собой любые линии клеток настоящего изобретения, определенные выше.
Фигуры демонстрируют:
Фиг. 1: Можно выделить четыре основные остовные структуры О-гликозирования с использованием GalNAc.
О-связанный с использованием GalNac гликан содержит остаток α-связанного N-ацетилгалактозамина, связанный с серином или треонином. GalNAc может быть удлинен за счет остатков вроде галактозы, GlcNAc, фукозы или сиаловой кислоты. Можно выделить четыре основные структуры остовов, остов 1 (GalGalNAc), остов 2 (GalGlcNAcGalNAc), остов 3 (GlcNAcGalNAc) и остов 4 (GlcNAc2GalNAc). Эти структуры остовов могут быть дополнительно удлинены и разветвлены.
Фиг. 2: Биосинтез GalNac-О-гликанов с остовом 1 и остовом 2.
Первой стадией в биосинтезе является соединение GalNAc с конкретным остатком серина или треонина в белковом остове, что дает в результате так называемый Tn-антиген. Фермент С1GalT-1 катализирует затем связывание галактозы с GalNAc, образуя вследствие этого основу для структуры с остовом 1, также называемой Т-антигеном. Остов 1 служит в качестве субстрата для либо C2Gnt, который катализирует синтез β1-6-связанных с GlcNAc ветвей, что дает в результате структуры с остовом 2. Структуры с остовом 1 могут также быть дополнительно сиалированы с помощью ST3Gal1, приводя к моносиалированному Gal1-3(NeuAc2-6)GalNAc или дисиалированному NeuAc2-3Gal1-3(NeuAc2-6)GalNAc.
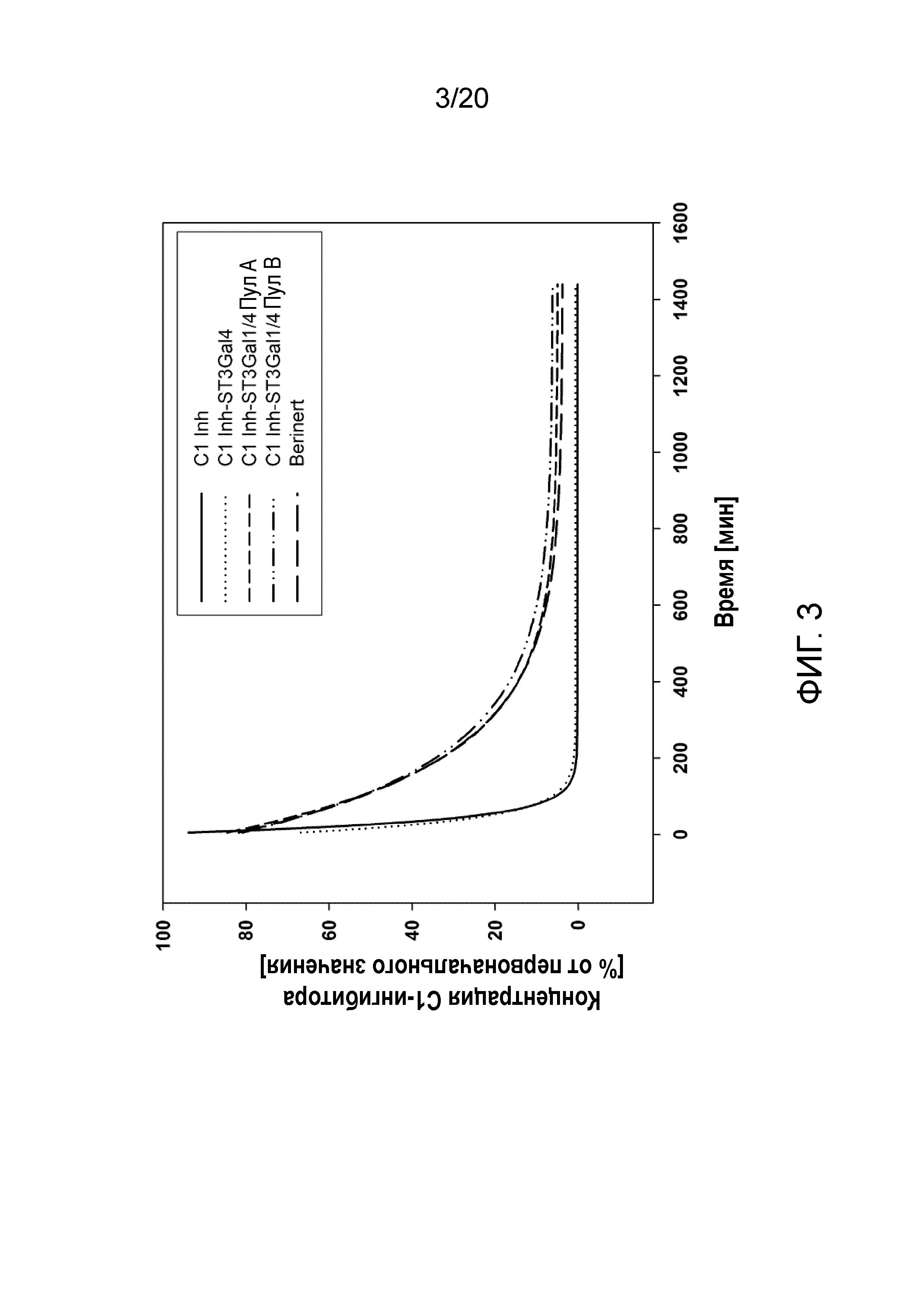
Фиг. 3: Концентрация в сыворотке С1-Inh после однократной внутривенной инъекции рекомбинантного C1-Inh (CAP C1-Inh, CAP C1-Inh ST3Gal4, CAP C1-Inh ST3Gal1/ST3GAL4 пула А и пула B) или Berinert у крыс.
Фармакокинетические исследования были выполнены на крысах, которым вводили или Berinert (C1-Inh, полученный из плазмы крови человека), или рекомбинантный C1-Inh, экспрессированный в CAP C1 Inh, CAP C1 Inh ST3Gal4 или CAP C1 Inh ST3Gal1/ST3GAL4. Остаточные количества hС1 Inh после внутривенной болюсной инъекции составляющей 10 мг/кг дозы самках крыс Sprague Dawley определяли в различные моменты времени: 5 мин, 10 мин, 15 мин, 20 мин, 30 мин, 60 мин, 2 ч, 4 ч, 6 ч и 24 ч. Процент остаточного C1 Inh устанавливали с помощью ELISA. Для каждого животного концентрация С1 Inh была нормализована к концентрации в 5 мин=100%. Значения наносили по точкам, и строили график зависимости от времени после инъекции. Представлен график для одного репрезентативного животного из каждой группы (n=4, за исключением Berinert n=7).
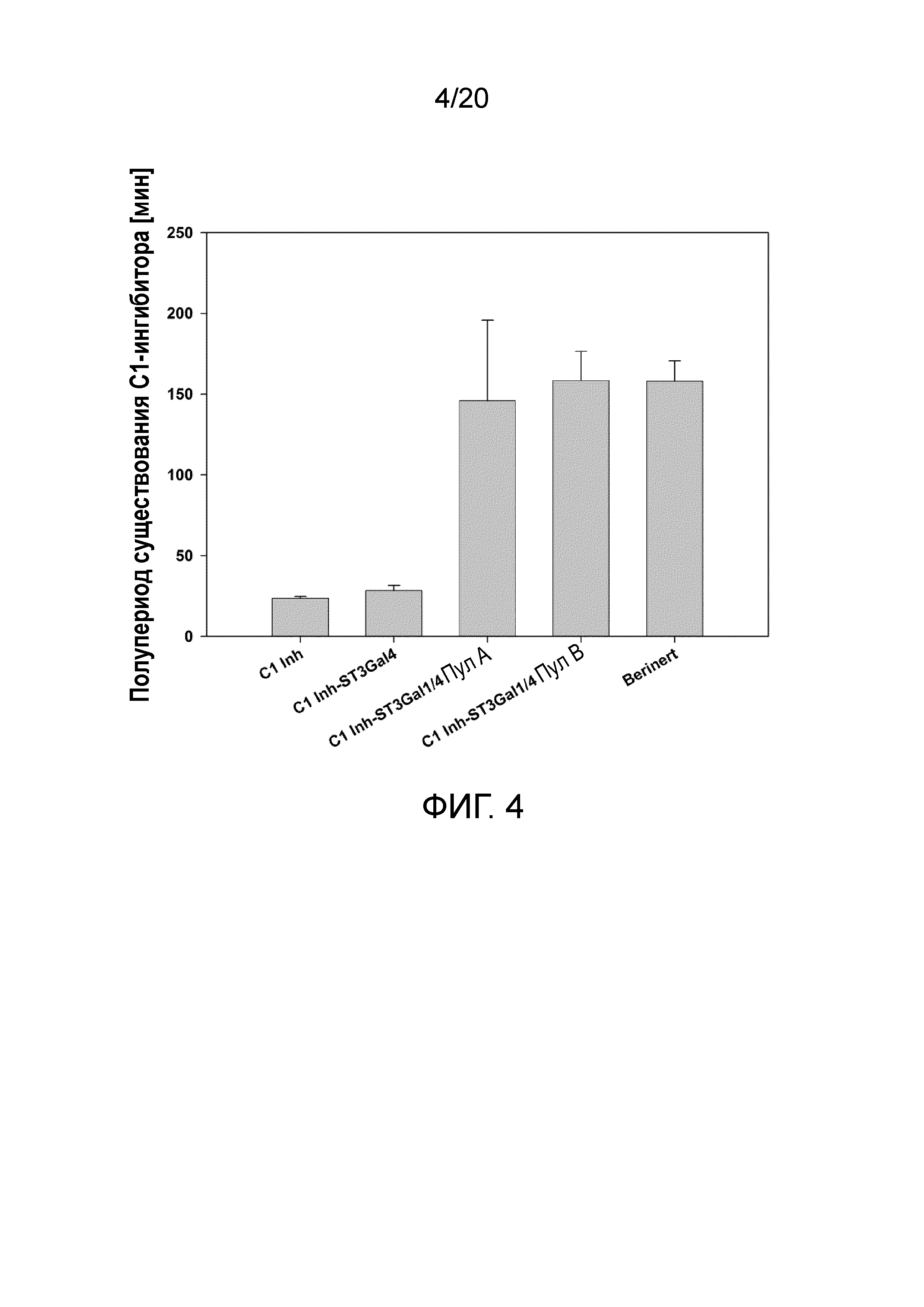
Фиг. 4: Полупериод существования в сыворотке C1 Inh после однократной внутривенной инъекции рекомбинантного C1-Inh (CAP C1-Inh, CAP C1-Inh ST3Gal4, CAP C1-Inh ST3Gal1/ST3GAL4 пула А и пула B) или Berinert у крыс.
Фармакокинетические исследования были выполнены на крысах, которым вводили или Berinert (C1 Inh, полученный из плазмы крови человека), или рекомбинантный C1 Inh, экспрессированный в CAP C1 Inh, CAP C1 Inh ST3Gal4 или CAP C1 Inh ST3Gal1/ST3GAL4. Остаточные количества hС1 Inh после внутривенной болюсной инъекции составляющей 10 мг/кг дозы самках крыс Sprague Dawley определяли в различные моменты времени: 5 мин, 10 мин, 15 мин, 20 мин, 30 мин, 60 мин, 2 ч, 4 ч, 6 ч и 24 ч. Процент остаточного C1 Inh устанавливали с помощью ELISA. Для каждого животного концентрация С1 Inh была нормализована к концентрации в 5 мин=100%. Значения наносили по точкам, и строили график зависимости от времени после инъекции. Представлены средние значения для t1/2(n=4, Berinert n=7), «усы»=±SD (среднеквадратическое отклонение).
Фиг. 5: Определенные значения AUC для переменного рекомбинантного C1 Inh (CAP C1 Inh, CAP C1 Inh ST3Gal4, CAP C1 Inh ST3Gal1/ST3GAL4 пул А и пул B) или Berinert.
Сравнение биодоступности между различными образцами рекомбинантных, имеющих оптимизированные гликоструктуры С1 Inh. Представлены средние значения для AUC (n=4, Berinert n=7), «усы»=±SD (среднеквадратическое отклонение).
Фиг. 6: Анализ N-гликозилирования С1-Inh, экспрессированного, исходя из линий клеток CAP, с и без связанной экспрессии(ей) ST3Gal1 и/или ST3Gal4 и анализ с помощью Вестерн-блоттинга в качестве дополнения.
Очищенный рекомбинантный C1-Inh, экспрессированный в клетках CAP, мигрирует медленнее при электрофорезе в SDS-ПААГ по сравнению с Berinert. Экспрессия ST3Gal1 и ST3Gal4 вызывает смещение рекомбинантного C1-Inh к Berinert после устранения N-гликозилирования с помощью PNGase, что указывает на уменьшение массы остающихся О-связанных гликанов. 100 нг очищенного рекомбинантного C1-In, экспрессированного в линиях клеток, экспрессирующих C1-In с улучшенной гликоструктурой, расщепляли с использованием 500 Е PNGaseF (NEB) в течение 1 ч при 37οС, с последующим разделением в 4-12% Bis-Tris-геле. (Маркер молекулярной массы: MagicMark™ XP Western Protein Standard).
Фиг. 7: Иммуноблоттинг с использованием лектина ECL рекомбинантного C1 Inh, экспрессированного в клетках CAP в присутствии или в отсутствие сиалилтрансфераз.
Лектин Erythrina crista galli (ECL) выявляет β1-4-связанную концевую галактозу в N-связанных гликанах. Поэтому уменьшенный сигнал на блоте с использованием ECL означает повышенную степень сиалирования. N-связанные гликаны Berinert почти полностью сиалированы, С1 Inh из клеток CAP, сверхэкспрессирующих ST3Gal4, также почти полностью сиалированы. С1 Inh из клеток CAP, сверхэкспрессирующих ST3Gal1/4, демонстрируют немного более высокое количество асиало-N-гликанов (несиалированных N-гликанов). Для сравнения, немодифицированный С1 Inh, очищенный из клеток CAP без сверхэкспрессии сиалилтрансферазы, дает сильный сигнал на блоте с использованием ECL, что указывает на определенное количество асиало-N-гликанов. В качестве контроля нанесения те же образцы были обработаны нейраминидазой для удаления всего содержания сиаловых кислот из гликановых структур. (Маркер молекулярной массы: MagicMark™ XP Western Protein Standard).
Фиг. 8: Иммуноблоттинг с использованием лектина PNA рекомбинантного C1 Inh, экспрессированного в клетках CAP в присутствии или в отсутствие сиалилтрансфераз.
Степень сиалирования О-связанных гликанов рекомбинантного C1 Inh в клетках CAP при сверхэкспрессии ST3Gal1 была проверена с помощью иммуноблоттингов с использованием лектина PNA. Агглютинин арахиса (PNA) выявляет β1-3-связанную концевую галактозу в О-связанных гликанах. Поэтому уменьшенный сигнал на блоте с использованием лектина PNA означает повышенный уровень сиалирования остатков галактозы О-гликанов. C1 Inh, очищенный из супернатантов культур клеток CAP, сверхэкспрессирующих ST3Gal1, не демонстрирует никакой сигнал, что указывает на полное сиалирование О-гликанов. То же самое справедливо для полученного из плазмы C1 Inh, Berinert. (Маркер молекулярной массы: MagicMark™ XP Western Protein Standard).
Фиг. 9: Сравнение типов изоформ rhC1 INH с помощью анализа ИЭФ.
Поскольку остовы различных C1 Inh идентичны, изменения в ИЭФ, скорее всего, обусловлены изменениями содержания сиаловой кислоты. C1 Inh, экспрессированный в CAP с дополнительной экспрессией ST3Gal4, приводит к модифицированному C1 Inh, который смещается, по сравнению с немодифицированным C1 Inh, очень незначительно в сторону анода, что указывает на небольшое увеличение общего количества сиаловых кислот на молекулу. В противоположность этому, дополнительная экспрессия ST3Gal1 приводит к отчетливому смещению C1 Inh к аноду, что указывает на значительное увеличение общего количества сиаловых кислот на молекулу.
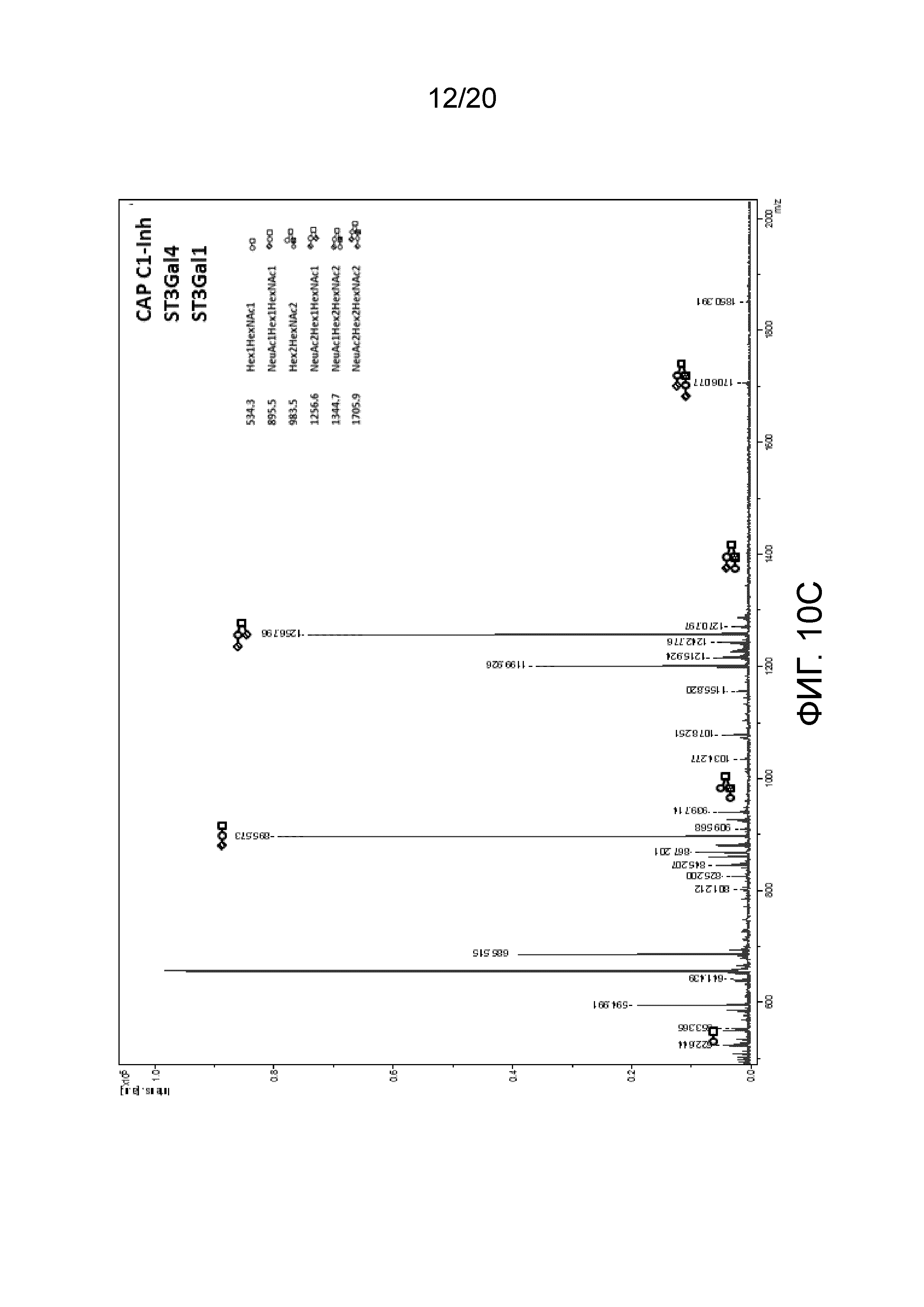
Фиг. 10: MALDI-TOF масс-спектральный анализ O-гликанов белка CAP C1 Inh, экспрессированного с или без дополнительной сверхэкспрессии(ей) ST3Gal1 и/или ST3GAL4, по сравнению с Berinert.
(А) Анализ образца CAP С1 Inh выявил высокое относительное количество моносиалированных O-гликанов со структурой остова 2 и концевой галактозой. (В) Экспрессия С1 Inh в сочетании со сверхэкспрессией ST3Gal4 также приводит к большим количествам моносиалированных O-гликанов со структурой остова 2 и концевой галактозой. (С) Экспрессия С1 Inh в сочетании со сверхэкспрессией ST3Gal4 и ST3Gal1 приводит к смещению в сторону структур О-гликанов с остовом 1, которые являются моно- или дисиалированными, но без каких-либо концевых остатков галактозы. Структуры с остовом 2 едва выявляются. (D) Анализ O-гликаков Berinert выявляет только О-гликаны с остовом 1, которые являются в основном моносиалированными без концевых остатков галактозы.
Фиг. 11: Сводка результатов MALDI-TOF масс-спектрального анализа C1 Inh, экспрессированного в клетках CAP в сочетании с или без сверхэкспрессии ST3Gal1 и/или ST3GAL4, по сравнению с Berinert.
Показаны количества шести основных видов гликанами относительно общей суммы тех же гликаны. Фрагменты гликанов, образованные в ходе MALDI-TOF, или ничтожно малый сигнал не использовались для этого анализа. В образцах CAP C1 Inh без дополнительной сверхэкспрессии ST3Gal1 или ST3Gal4, а именно CAP C1 Inh, в основном выявляются O-гликаны со структурой остова 2 (Gal1-3(Gal1-GlcNAc1-6)GalNAc-ол_Остов 2) (m/z 983), или NeuAc2-3Gal1-3(Gal1-4GlcNAc1-6)GalNAc-ол (m/z 1344), Gal1-3(NeuAc2-3Gal1-4GlcNAc1-6)GalNAc-ол (m/z 1344) и NeuAc2-3Gal1-3(NeuAc2-3Gal1-4GlcNAc1-6)GalNAc-ол (m/z 1706)). Структуры с остовом 1 выявляются лишь очень редко. Дополнительная экспрессия ST3Gal4 приводит к незначительному смещению в сторону структур с остовом 1 (NeuAc2-3Gal1-3GalNAc-ол_Остов 1). Интересно отметить, что экспрессия C1 Inh в клетках CAP в сочетании со сверхэкспрессией ST3Gal1 приводит к исключительной экспрессии NeuAc2-3Gal1-3GalNAc-ол (с остовом 1) относительно Gal1-3(NeuAc2-6)GalNAc-ол (m/z 895) и NeuAc2-3Gal1-3(NeuAc2-6)GalNAc-ол (m/z 1256). «Hex» на этой фигуре обозначает гексозу.
Фиг. 12: Различные структуры GalNac-O-гликанов с остовом 1 и остовом 2.
MALDI-TOF-масс-спектральный анализ выявил, что различные образцы распределяются по двум различным группам структур О-гликанов или с остовом 1, или с остовом 2.
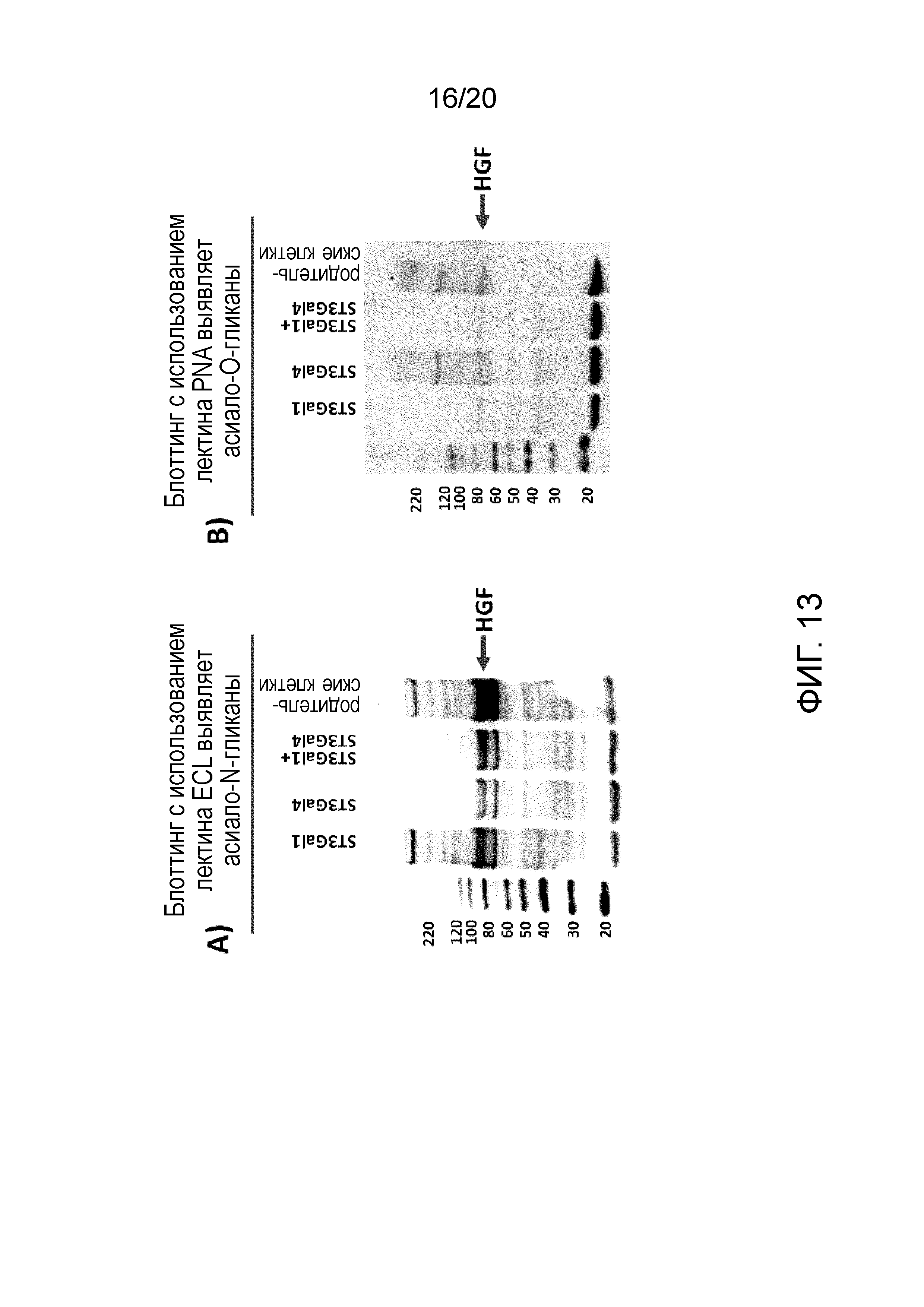
Фиг. 13: Иммуноблоттинги с использованием лектинов ECL и PNA рекомбинантного HGF, экспрессированного в клетках CAP в присутствии или в отсутствие сиалилтрансфераз.
(А) Лектин Erythrina crista galli (ECL) выявляет β1-4-связанную концевую галактозу в N-связанных гликанах. Поэтому уменьшенный сигнал на блоте с использованием ECL означает повышенную степень сиалирования. Сверхэкспрессия ST3Gal4 или ST3Gal1/4 приводит к увеличению сиалирования N-связанных гликанов, тогда как сверхэкспрессия ST3Gal1 не оказывает никакого эффекта по сравнению с немодифицированным C1 Inh. (В) Степень сиалирования рекомбинантного HGF в клетках CAP при сверхэкспрессии ST3Gal1 была проверена с помощью иммуноблоттингов с использованием лектина PNA. Агглютинин арахиса (PNA) выявляет β1-3-связанную концевую галактозу в О-связанных гликанах. Поэтому уменьшенный сигнал на блоте с использованием лектина PNA означает повышенный уровень сиалирования остатков галактозы О-гликанов. Супернатант культуры клеток CAP, сверхэкспрессирующих ST3Gal1, приводит к значительному уменьшению сигнала, что свидетельствует об увеличении сиалирования O-гликана. (Маркер молекулярной массы: MagicMark™ XP Western Protein Standard).
Фиг. 14: Доменная структура и совмещение последовательностей ST3Gal1.
А) Доменная структура сиалилтрансфераз ST3Gal1. TM, трансмембранный домен; Stem, стволовой район; L, участвующий в сиалировании мотив L (длинный); S, участвующий в сиалировании мотив S (короткий); 3, участвующий в сиалировании мотив III; VS, участвующий в сиалировании мотив VS (очень короткий). Мотив L вовлечен в связывание CMP-Sia, мотив S вовлечен в связывание CMP-Sia, а также акцептора, мотиве 3 и VS содержит каталитическую консенсусную последовательность и вовлечен в связывание акцептора. В) Совмещение С-концевых последовательностей ST3Gal1 человека, млекопитающих, птиц, рептилий, рыб и асцидий. Аминокислотные остатки, идентичные у всех видов, заштрихованы в светло-серый цвет, идентичные в большинстве видов аминокислоты - в темно-серый цвет, а блоки схожих аминокислот - в умеренно серый цвет. Консенсусная последовательность для каталитически активных аминокислот в мотиве 3 прочитывается (H/C/R)(Y/H/F)(W/Y/F)(E/D/H/Y) (предпочтительные аминокислоты в соответствующем положении указаны жирным шрифтом).
Фиг. 15: Иммуноблоттинги с использованием лектинов ECL и PNA рекомбинантного C1 Inh, экспрессированного в клетках 293F в присутствии или в отсутствие сиалилтрансфераз.
(А) Лектин Erythrina crista galli (ECL) выявляет β1-4-связанную концевую галактозу в N-связанных гликанах. Сверхэкспрессия ST3Gal4 или ST3Gal1/4 приводит к увеличению сиалирования N-связанных гликанов, тогда как сверхэкспрессия только ST3Gal1 не оказывает никакого эффекта по сравнению с немодифицированным C1 Inh. Нейраминидаза катализируют гидролиз остатков N-ацетилнейраминовой кислоты из олигосахаридов, соответственно, обработанные нейраминидазой образцы служат в качестве положительного контроля. (В) Степень сиалирования рекомбинантного C1 Inh в клетках 293F при сверхэкспрессии ST3Gal1 была проверена с помощью иммуноблоттингов с использованием лектина PNA. Супернатант культуры клеток 293F, сверхэкспрессирующих ST3Gal1, приводит к значительному уменьшению сигнала, что свидетельствует об увеличении сиалирования O-гликана. Обработанные нейраминидазой образцы служат в качестве положительного контроля. (Маркер молекулярной массы: MagicMark™ XP Western Protein Standard).
Фиг. 16: Иммуноблоттинги с использованием лектина PNA рекомбинантного C1 Inh, экспрессированного в клетках СНО-К1 в присутствии или в отсутствие сиалилтрансфераз.
Степень сиалирования рекомбинантного C1 Inh в клетках СНО-К1 при сверхэкспрессии ST3Gal1 была проверена с помощью иммуноблоттингов с использованием лектина PNA. Супернатант культуры клеток СНО-К1, сверхэкспрессирующих ST3Gal1, демонстрирует значительное уменьшение сигнала, что свидетельствует об увеличении сиалирования O-гликана по сравнению с С1 Inh, очищенным из контрольных клеток СНО-К1 С1 INH. Вестерн-блот-анализ тех же образцов белка служил в качестве контроля нанесения. (Маркер молекулярной массы: MagicMark™ XP Western Protein Standard).
Фиг. 17: Иммуноблоттинги с использованием лектинов ECL и PNA рекомбинантного C1 Inh, экспрессированного в клетках MDCK.1 в присутствии или в отсутствие сиалилтрансфераз.
(А) Лектин Erythrina crista galli (ECL) выявляет β1-4-связанную концевую галактозу в N-связанных гликанах. Сверхэкспрессия ST3Gal1 в клетках MDCK.1 не оказывает никакого эффекта на степень сиалирования N-связанных гликанов. (В) Степень сиалирования рекомбинантного C1 Inh при сверхэкспрессии ST3Gal1 в клетках MDCK.1 была проверена с помощью иммуноблоттингов с использованием лектина PNA. Супернатант культуры клеток MDCK.1, сверхэкспрессирующих ST3Gal1, демонстрирует значительное уменьшение сигнала, что свидетельствует об увеличении сиалирования O-гликана. (Маркер молекулярной массы: MagicMark™ XP Western Protein Standard).
Настоящее изобретение будет далее проиллюстрировано в следующих примерах без ограничения ими.
Примеры
Экспериментальные процедуры:
Культивирование клеток и ферментация
Линию постоянных клеток амниоцитов CAP 1D5 культивировали в суспензии, либо в среде с известным химическим составом, не содержащей компоненты животного происхождения CAP-CDM (CEVEC Pharmaceuticals, Германия) с добавлением 6 мМ стабильного глютамина (Biochrom, Германия), либо в бессывороточной среде PEM (Life Technologies) с добавлением 4 мМ стабильного глютамина (Biochrom, Германия).
Клетки 293F от Life Technologies культивировали в суспензии в среде для экспрессии Freestyle 293 (Life Technologies) с добавлением 4 мМ стабильного глютамина (Biochrom, Германия).
Адгезивные клетки СНО-К1 (АТСС, CCL-61) культивировали в среде F12-K (Life Technologies) с добавлением 10% FBS и 2 мМ стабильного глютамина (Biochrom, Германия).
Адгезивные клетки MDCK.1 (ATCC, CRL-2935) культивировали либо в среде EMEM (АТСС), либо в среде DMEM F-12 (АТСС) с добавлением 10% FBS и 2 мМ стабильного глютамина (Biochrom, Германия).
Клетки CAP и клетки 293F культивировали при 37οС в смесительных колбах (Corning, 125 мл (с рабочим объемом=25 мл) или 3000 мл (с рабочим объемом=1000 мл) при 5% CO2 и 185 оборотов в минуту. Во время ферментации клетки CAP снабжали в день (d) 3, d5 и d7 10% питательным раствором CAP-CDM (CEVEC Pharmaceuticals, Германия) и 4 мМ стабильным глютамином (Biochrom, Германия). Адгезивные клетки СНО-K1 и MDCK.1 культивировали при 37οС, 5% CO2 в чашках для культивирования клеток диаметром 6 см или 10 см (ТPP) или матрацах для культивирования клеток площадью 225 см2(BD).
Клонирование
С целью создания линий клеток, используемых в настоящем изобретении, клетки последовательно подвергали нуклеофекции с использованием конструкций нуклеиновых кислот, кодирующих модифицирующие гликоструктуру ферменты ST3Gal1 и/или ST3Gal4, а также специфический рекомбинантный белок. Только стабильные клеточные линии были использованы. В таблице 1 перечислены все созданные линии клеток.
Таблица 1: Стабильные линии клеток, используемые в настоящем изобретении.
Для конструирования кДНК для ST3Gal1, информация о последовательности белка-предшественника и зрелого белка основывалась на записи в базе данных UniProt Q11201 (SEQ ID NO: 1). Для клонирования, сайт рестрикции для ClaI и последовательность Козак были добавлены 5' от инициирующего кодона кДНК для ST3Gal1 человека, и сайт рестрикции для EcoRV был добавлен 3' от стоп-кодона, чтобы осуществить вставку между сайтами рестрикции ClaI и EcoRV в векторе pStbl-Puro-CMV-MCS(-), что дает в результате экспрессионную плазмиду pStbl-Puro-CMV-ST3Gal1. Этот вектор содержит промотор CMV, управляющий экспрессией представляющего интерес гена, за которым следует интрон SV40 для улучшения переноса преобразуемой в результате сплайсинга мРНК и сайт множественного клонирования для вставки представляющего интерес гена. Селективный маркер (Пуромицин) приводится в действие с помощью промотора убиквитина (UbC) человека. Синтез кДНК проводили в GeneArt (Германия, Life Technologies).
Для конструирования кДНК для ST3Gal4, информация о последовательности белка-предшественника и зрелого белка основывалась на записи в базе данных UniProt Q11206 (SEQ ID NO: 2). Для клонирования, сайт рестрикции для ClaI и последовательность Козак были добавлены 5' от инициирующего кодона кДНК для ST3Gal4 человека, и сайт рестрикции для EcoRV был добавлен 3' от стоп-кодона, чтобы осуществить вставку между сайтами рестрикции ClaI и EcoRV в векторе pStbl-Puro-CMV-MCS(-), что дает в результате экспрессионную плазмиду pStbl-Puro-CMV-ST3Gal4. Синтез кДНК проводили в GeneArt (Германия, Life Technologies).
Нуклеофекция и создание пулов
Нуклеофекцию проводили с использованием Nucleofector (Lonza) с соответствующим набором Nucleofector Kit (KitV; клетки CAP клетки, 293F и CHO, или KitT; клетки MDCK.1) в соответствии с протоколом производителя. Вкратце, во время экспоненциальной фазы роста культуры 1×107 клеток собирали с помощью центрифугирования (150хg в течение 5 мин) и ресуспендировали в 100 мкл полного раствора Nucleofector и смешивали в общей сложности с 5 пг плазмиды. Нуклеофекцию проводили, используя программу X001 (клетки CAP и 293F), программу U024 (CHO-K1) или программу P029 (MDCK.1). После посылки импульса, клетки возвращали в полную среду для культивирования клеток. Клетки культивировали, как и раньше.
Клетки через 72-96 часов после нуклеофекции отбирали с использованием 5 мкг/мл бластицидина (терапевтического белка) и/или 200 мкг/мл неомицина (pStbl-neo-CMV-ST3Gal4) и/или 2 мкг/мл пуромицина (pStbl-Puro-CMV-ST3Gal1), в целях получения стабильных пулов.
Фармакокинетические исследования рекомбинантного C1 Inh на крысах
Сопоставимые фармакокинетические исследования были выполнены на крысах, которым вводили или Berinert (C1-Inh, полученный из плазмы крови человека), или очищенный рекомбинантный C1-Inh, экспрессированный в CAP C1 Inh, CAP C1 Inh ST3Gal4 или CAP C1 Inh ST3Gal1/ST3GAL4. Остаточные концентрации hС1 Inh после внутривенной болюсной инъекции дозы 10 мг/кг самках крыс Sprague Dawley были определены в различные моменты времени: 5 мин, 10 мин, 15 мин, 20 мин, 30 мин, 60 мин, 2 ч, 4 ч, 6 ч и 24 ч.
На фиг. 3 представлена концентрация в сыворотке С1 Inh после однократной внутривенной инъекции рекомбинантного C1 Inh или Berinert. Процент остаточного C1 Inh устанавливали с помощью ELISA. Для каждого животного концентрации С1 Inh были нормализованы к концентрации в 5 мин=100%. Значения наносили по точкам, и строили график зависимости от времени после инъекции. Представлен график для одного репрезентативного животного из каждой группы (n=4, за исключением Berinert n=7). На фиг. 5 продемонстрированы вычисления площади под кривой (AUC) для различных форм C1 Inh.
MALDI-TOF-масс-спектральный анализ (времяпролетная масс-спектрометрия с лазерной ионизацией и десорбцией из жидкой матрицы)
Для обессоливания образцов, 100 мкг белка дважды осаждали, используя хлороформ-метанол, и сушили при вращении в вакууме. Гликаны были подвергнуты β-элиминированию в 50 мкл NaBH4 (1 М в 50 мМ NaOH) в атмосфере аргона при инкубации в течение ночи при 50οC. После обессоливания с использованием Dowex50×8 (H+) и удаления бората при кодистилляции метилового эфира из подкисленного метанола, сухие остатки подвергали метилированию, как известно в данной области техники. MALDI-МС проводили на приборе UltrafleXtreme (Bruker Daltonics). Метилированные гликановые альдиты наносили на мишень из нержавеющей стали при смешивании 1:1 с матрицей (α-циано-4-гидроксикоричной кислотой в 50% ацетонитриле/0,1% TFA). Анализы проводились путем обнаружения положительных ионов в MS1 и MS2 (Post-Source-Decay-Modus). Идентификация различных видов гликанов была основана на i) ионах молекул, которые дают информацию о составе моносахаридов, и ii) фрагментации в анализе MS2 (ионах B, C, Y и Z).
Расщепление с помощью PNGaseF
PNGaseF представляет собой амидазу, которая расщепляет между самым внутренним GlcNAc и остатками аспарагина в N-связанных гликопротеинах. Следовательно, после обработки белков C1-INH с помощью PNGaseF белковый остов и О-связанные гликаны остаются. Поскольку белковый остов полученного из плазмы C1-Inh человека и C1-Inh, экспрессированного в клетках CAP, является одинаковым, обработка PNGaseF содержит в себе косвенную информацию о структуре О-гликанов.
Расщепление с помощью PNGaseF было осуществлено, как описано в инструкциях изготовителя. Вкратце, 100 нг очищенного белка инкубировали с 500 Е PNGaseF (NEB) в течение 1 ч при 37οС. Впоследствии образцы разделяли в NuPAGE Novex 4-12% Bis-Tris- геле в восстанавливающих условиях, в соответствии с инструкциями изготовителя. Разделенные белки переносили с помощью Blot Module (Invitrogen) (30 В в течение 60 мин при комнатной температуре) на мембрану Amersham Hybond ECL (100 В в течение 60 мин при комнатной температуре). Мембрану блокировали в течение 1 ч при комнатной температуре с использованием PBSTB (забуференного фосфатом солевого раствора, рН=7,4, с добавлением 0,1% Tween 20 и 1% BSA). После этого мембрану инкубировали с мышиным моноклональным антителом, специфическим для C1-Inh, меченным HRP, разведенным 1:10000 в PBSTB. После промывки мембраны с использованием PBST (забуференного фосфатом солевого раствора, рН=7,4, с добавлением 0,1% Tween 20), белки детектировали, используя набор Pierce ECL-WB Substrate Kit, с помощью детектора хемилюминесценции (INTAS).
Иммуноблоттинг с использованием лектинов
Лектины представляют собой белки, которые связываются со специфическими углеводными структурами. По этой причине связанные с биотином лектины могут использоваться для анализа N-связанных и О-связанных гликанов. Лектин Erythrina crista galli (ECL) выявляет β1-4-связанную концевую галактозу в N-связанных гликанах, агглютинин арахиса (PNA) выявляет β1-3-связанную концевую галактозу в О-связанных гликанах, агглютинин Sambucus nigra (SNA) преимущественно связывается с 2,6-связанной сиаловой кислотой, в то время как лектин Maackia amurensis (MAL) преимущественно связывается с 2,3-связанными сиаловыми кислотами.
Очищенный белок или супернатанты клеточных культур с или без коэкспрессии(ей) ST3Gal1 и/или ST3Gal4 разделяли, как описаны выше, и переносили на нитроцеллюлозную мембрану Hybond ECL (GE Healthcare). Мембрану блокировали в течение 1 ч при комнатной температуре с использованием PBSTB (забуференного фосфатом солевого раствора, рН=7,4, с добавлением 0,1% Tween 20 и 1% BSA). После этого мембрану инкубировали с лектином, разведенным 1:2000 (MAL 1:400) в PBSTB. После промывки мембраны с использованием PBST (забуференного фосфатом солевого раствора, рН=7,4, с добавлением 0,1% Tween 20), мембрану окрашивали связанной со стрептавидином пероксидазой хрена в течение 1 ч при комнатной температуре (с разведением 1:1000 в PBSTB). Сигнал HRP амплифицировали, используя IgG против стрептавидина и антитело против IgG, конъюгированное с HRP. Белки детектировали, используя набор Pierce ECL-WB Substrate Kit, с помощью детектора хемилюминесценции (INTAS).
Анализ с использованием ИЭФ
Изоэлектрическое фокусирование (ИЭФ) было выполнено с целью анализа изоэлектрической точки (pI) C1 Inh, очищенного из клеток CAP C1 Inh, или клеток CAP C1 Inh, трансфецированных ST3Gal4 и/или ST3Gal1, соответственно. Степень сиалирования коррелирует с кислотностью данных белков и, следовательно, с его pI. Анализ с использованием ИЭФ был выполнен в соответствии с протоколом производителя (Invitrogen). Вкратце, 5 мкг очищенного белка наносили на pH3-7 гели и подвергали электрофорезу (1 ч 100 В, 1 ч 200 В, 30 мин 500 В). Белки окрашивали SimplyBlue SafeStain в соответствии с протоколом производителя (Invitrogen).
Пример 1:
Являющийся ингибитором протеазы ингибитор С1-эстеразы (C1-Inh) относится к суперсемейству серпинов. Его основной функцией является ингибирование системы комплемента для предотвращения самопроизвольной активации. Белок из 500 аминокислот является очень гликозилированным с 7 предсказанными N-гликанами и 8 предсказанными О-связанными гликанами.
Клетки линии клеток амниоцитов человека CAP 1D5, предварительно стабильно трансфецированные для экспрессии рекомбинантного C1-ингибитора человека (rhC1 Inh, SEQ ID NO: 3) (CAP-C1-Inh), были подвергнуты нуклеофекции вектором, кодирующим ST3Gal4, линеаризованным с помощью ScaI для облегчения стабильной интеграции конструкции в геном. Вектор содержит экспрессирующую лекарственное средство кассету, для отбора стабильной интеграции линеаризованной конструкции в геном. После создания пула, полученный стабильный пул CAP-С1 Inh-ST3Gal4 был подвергнут клонированию одной клетки с помощью предельного разведения. Отобранные клоны были проанализированы для доказательства экспрессии ST3Gal4. Клоны одной клетки CAP, экспрессирующие ST3Gal4, были затем дополнительно подвергнуты нуклеофекции геном, кодирующим ген ST3Gal1. Клетки были подвергнуты отбору с помощью антибиотиков, чтобы получить пул клеток, стабильно коэкспрессирующих rhC1 Inh, ST3Gal4 и ST3Gal1 человека (CAP-С1-Inh ST3Gal1/4).
Для получения достаточных количеств рекомбинантного C1 Inh, созданные линии клеток CAP-С1 Inh, сверхэкспрессирующие C1 Inh человека, были подвергнуты культивированию, как описано в экспериментальных процедурах. Впоследствии, C1 Inh очищали из супернатанта культуры клеток следующих линий клеток: CAP-C1 Inh, CAP-C1 Inh-ST3Gal4 и CAP-C1 Inh-ST3Gal1/4 (пул A и B), как описано ниже.
Супернатанты клеточных культур или очищенный рекомбинантный C1-Inh и Berinert были проанализированы с целью определения гликоструктур.
Иммуноблоттинг с использованием специфического для C1-Inh антитела (фиг. 6) показывает, что C1-Inh, очищенный от плазмы, (Berinert) мигрирует быстрее при электрофорезе, что указывает на уменьшенную массу по сравнению с рекомбинантным C1 Inh из клеток CAP. Сверхэкспрессия сиалилтрансфераз ST3Gal1 в сочетании с ST3Gal4 также увеличивает скорость миграции. Этот эффект еще более очевиден после отщепления N-связанных гликанов от белкового остова с помощью расщеплений PNGase, что свидетельствует о том, что более быстрая миграция на самом деле обусловлена различиями в размерах остающихся О-связанных гликанов.
С целью определения степени сиалирования N-связанных гликанов был выполнен иммуноблоттинг с использованием лектина ECL. Лектин Erythrina crista galli (ECL) выявляет β1-4-связанную концевую галактозу в N-связанных гликанах. Поэтому уменьшенный сигнал на блоте с использованием ECL означает повышенную степень сиалирования. Как показано на фиг. 7, N-связанные гликаны Berinert почти полностью сиалированы. N-гликаны С1 Inh из клеток CAP, сверхэкспрессирующих ST3Gal4, сиалированы в равной степени, С1 Inh из клеток CAP, сверхэкспрессирующих ST3Gal1/4, демонстрируют немного более высокое количество асиало-N-гликанов. Для сравнения, С1 Inh, очищенный из клеток CAP без сверхэкспрессии сиалилтрансферазы, дает сильный сигнал на блоте с использованием ECL, что указывает на большое количество асиало-N-гликанов.
Степень сиалирования О-связанных гликанов рекомбинантного C1 Inh в клетках CAP при сверхэкспрессии ST3Gal1 была сначала проверена с помощью иммуноблоттингов с использованием лектина PNA. Агглютинин арахиса (PNA) выявляет β1-3-связанную концевую галактозу в О-связанных гликанах. Поэтому уменьшенный сигнал на блоте с использованием лектина PNA означает повышенный уровень сиалирования остатков галактозы О-гликанов. Как показано на фиг. 8, C1 Inh, очищенный из супернатантов культур клеток CAP, сверхэкспрессирующих ST3Gal1, не демонстрирует никакой сигнал, что указывает на полное сиалирование О-гликанов. То же самое справедливо для полученного из плазмы C1 Inh, Berinert.
Результаты блоттинга с использованием лектина можно было подтвердить с помощью изоэлектрического фокусирования (ИЭФ). Поскольку остовы различных C1 Inh идентичны, изменения в ИЭФ, скорее всего, обусловлены изменениями содержания сиаловой кислоты. Как показано на фиг. 9, при дополнительной экспрессии ST3Gal4, результирующий модифицированный C1 Inh очень незначительно смещается в сторону анода, что указывает на небольшое увеличение общего количества сиаловых кислот на молекулу. В противоположность этому, дополнительная экспрессия ST3Gal1 приводит к отчетливому смещению C1 Inh к аноду, что указывает на значительное увеличение общего количества сиаловых кислот.
На фиг. 10A-10D представлены детальные MALDI-TOF-масс-спектры О-связанных гликанов. На фиг. 11 эти данные обобщены путем приведения максимальной интенсивности для различных структур O-гликанов. На фиг. 12 показана интерпретация полученных данных. В образцах CAP C1 Inh без дополнительной сверхэкспрессии ST3Gal1 или ST3Gal4, а именно CAP C1 Inh, 75% выявляемых O-гликанов представляют собой структуру с остовом 2, при этом только 35% сиалированных O-гликанов без концевых остатков галактозы (Gal1-3(Gal1-GlcNAc1-6)GalNAc-ол_Остов 2) (m/z 983), или NeuAc2-3Gal1-3(Gal1-4GlcNAc1-6)GalNAc-ол (m/z 1344), Gal1-3(NeuAc2-3Gal1-4GlcNAc1-6)GalNAc-ол (m/z 1344) и NeuAc2-3Gal1-3(NeuAc2-3Gal1-4GlcNAc1-6)GalNAc-ол (m/z 1706)). Структуры с остовом 1 выявляются очень редко. Дополнительная экспрессия ST3Gal4 приводит к смещению в сторону структур с остовом 1 (68,7%)(NeuAc2-3Gal1-3GalNAc-ол_Остов 1). Интересно отметить, что экспрессия C1 Inh в клетках CAP в сочетании со сверхэкспрессией ST3Gal1 приводит к исключительной экспрессии O-гликанов с остовом 1 (99,1%), которые почти полностью сиалированы (98,5%) без каких-либо концевых остатков галактозы, в частности (NeuAc2-3Gal1-3GalNAc-ол относительно Gal1-3(NeuAc2-6)GalNAc-ол (m/z 895) и NeuAc2-3Gal1-3(NeuAc2-6)GalNAc-ол (m/z 1256).
Для определения полупериода существования в сыворотке имеющих различные улучшенные гликоструктуры рекомбинантных C1-Inh, CAP-C1 Inh-ST3Gal4 и CAP-C1 Inh-ST3Gal1/4, по сравнению с рекомбинантным C1 Inh из клеток CAP (дикого типа), или полученным из плазмы C1 Inh (Berinert), были проведены фармакокинетические исследования.
После нормализации графиков зависимости концентрации от времени для различных образцов, стало ясно, что различные образцы распределяются по двум разным группам с почти одной и той же формой и кривой прогрессии: с одной стороны, CAP C1 Inh без дополнительной экспрессии каких-либо сиалилтрансфераз вместе с CAP-C1 Inh-ST3Gal4 и, с другой стороны, CAP-C1 Inh ST3Gal1/4 вместе с полученным из плазмы C1 Inh человека, Berinert (фиг. 3). Вещества в одной группе элиминируются из кровотока одинаково, следуя одной и той же фармакокинетике.
В то время как сверхэкспрессия только ST3Gal4 не оказывала положительный эффект на полупериод существования в сыворотке рекомбинантно экспресированного C1 Inh, дополнительная коэкспрессия ST3Gal1 увеличивала полупериод существования в сыворотке приблизительно в 6 раз (фиг. 4). AUC и, следовательно, биодоступность увеличивается приблизительно в 6 раз по сравнению с немодифицированным C1 Inh и равна значениям AUC, определенным для Berinert (фиг. 5). Вкратце, эти результаты указывают на то, что для гликопротеинов, у которых обнаруживаются N-гликаны, а также O-гликаны, обширное сиалирование О-гликанов так же важно, как и для N-гликанов.
Пример 2:
Фактор роста гепатоцитов является сильным митогеном для зрелых клеток гепатоцитов паренхимы, является, по всей видимости, гепатотрофическим фактором и функционирует в качестве фактора роста для широкого спектра тканей и типов клеток. Белок размером 728 аминокислот содержит 4 предсказанных N-гликана и 1 предсказанный О-связанный гликан.
Клетки CAP 1D5, стабильно экспрессирующие рекомбинантный фактор роста гепатоцитов человека (SEQ ID NO: 4), были подвергнуты нуклеофекции вектором, кодирующим ST3Gal4, ST3Gal1, или ST3Gal4 и ST3Gal1, линеаризованным с помощью ScaI для облегчения стабильной интеграции конструкции в геном. Векторы содержат экспрессирующую лекарственное средство кассету, которая облегчает отбор клеток со стабильной интеграцией линеаризованной конструкции в геном. После создания пулов, полученные стабильные пулы клеток CAP, CAP-HGF, CAP-HGF-ST3Gal1, CAP-HGF-ST3Gal4 и CAP-HGF-ST3Gal1/4, культивировали, как описано в экспериментальных процедурах. Супернатанты клеточных культур, содержащих рекомбинантный HGF человека, были исследованы с помощью блоттингов с использованием лектинов ECL и PNA для определения существующих N- и О-связанных гликоструктур.
Лектин Erythrina crista galli (ECL) выявляет β1-4-связанную концевую галактозу в N-связанных гликанах. Поэтому уменьшенный сигнал на блоте с использованием ECL означает повышенную степень сиалирования. Как показано на фиг. 13, сверхэкспрессия ST3Gal4 или ST3Gal1/4 приводит к увеличению сиалирования N-связанных гликанов, тогда как сверхэкспрессия ST3Gal1 не оказывает никакого эффекта.
Степень сиалирования рекомбинантного HGF в клетках CAP при сверхэкспрессии ST3Gal1 была проверена с помощью иммуноблоттингов с использованием лектина PNA. Агглютинин арахиса (PNA) выявляет β1-3-связанную концевую галактозу в О-связанных гликанах. Поэтому уменьшенный сигнал на блоте с использованием лектина PNA означает повышенный уровень сиалирования остатков галактозы О-гликанов. Как показано на фиг. 13, сверхэкспрессия ST3Gal1 в одиночку или в комбинации с ST3Gal4 привела к значительному увеличению сиалирования O-гликанов рекомбинантного HGF.
Пример 3:
Следующий эксперимент был выполнен с целью исследования того, является ли отмечаемое увеличенное сиалирование О-гликанов гликопротеинов при сверхэкспрессии сиалилтрансферазы ST3Gal1 общей чертой, разделяемой различными линиями клеток, используемыми для производства рекомбинантных белков или вирусов для фармацевтического производства и/или медико-биологические исследования.
Клетки 293F (Life Technologies, R-970-07), иммортализованные клетки почек эмбриона человека, были подвергнуты нуклеофекции вектором, кодирующим или ST3Gal1, или ST3Gal1 и ST3Gal4, линеаризованным с помощью ScaI для облегчения стабильной интеграции конструкции в геном. Векторы содержат экспрессирующую лекарственное средство кассету, которая облегчает отбор клеток со стабильной интеграцией линеаризованной конструкции в геном. После создания пулов, полученные стабильные пулы клеток 293F, 293F-ST3Gal1 и 293F-ST3Gal1/4, и клетки 293F дикого типа были дополнительно подвергнуты нуклеофекции геном, кодирующим hС1 Inh. Клетки подвергали отбору с использованием антибиотиков для получения пулов клеток, стабильно экспрессирующих i) rhC1 Inh, ii) rhC1 Inh и ST3Gal1 человека, iii) rhC1 Inh, ST3Gal1 человека и ST3Gal4 человека. C1 Inh очищали из содержащего C1 Inh супернатанта клеточной культуры, как описано в разделе, относящемся к способам, и исследовали с помощью блоттингов с использованием лектинов ECL и PNA для определения существующих N- и О-связанных гликоструктур.
Лектин Erythrina crista galli (ECL) выявляет β1-4-связанную концевую галактозу в N-связанных гликанах. Поэтому уменьшенный сигнал на блоте с использованием ECL означает повышенную степень сиалирования. Как показано на фиг. 15, сверхэкспрессия ST3Gal1/4 приводит к увеличению сиалирования N-связанных гликанов, тогда как сверхэкспрессия только ST3Gal1 не оказывает никакого эффекта.
Степень сиалирования рекомбинантного C1 Inh в клетках 293F при сверхэкспрессии ST3Gal1 была проверена с помощью иммуноблоттингов с использованием лектина PNA. Агглютинин арахиса (PNA) выявляет β1-3-связанную концевую галактозу в О-связанных гликанах. Поэтому уменьшенный сигнал на блоте с использованием лектина PNA означает повышенный уровень сиалирования остатков галактозы О-гликанов. Как показано на фиг. 15, сверхэкспрессия ST3Gal1 в одиночку или в комбинации с ST3Gal4 привела к значительному увеличению сиалирования O-гликанов рекомбинантного C1 Inh человека.
Пример 4:
Линия клеток СНО-К1 (АТСС, CCL-61) была получена в виде субклона из исходной линии клеток СНО, инициированной исходя из биопсии яичника взрослого китайского хомячка.
С целью исследования, имеет ли место отмечаемое повышенное сиалирование О-связанных гликанов при сверхэкспрессии сиалилтрансферазы человека ST3Gal1 также в линиях клеток млекопитающих, отличных от человека, C1 Inh человека был экспрессирован в этих клетках в присутствии или в отсутствие сиалилтрансферазы ST3Gal1.
Клетки CHO-K1 были подвергнуты нуклеофекции вектором, кодирующим ST3Gal1, линеаризованным с помощью ScaI для облегчения стабильной интеграции конструкции в геном. Вектор содержит экспрессирующую лекарственное средство кассету, которая облегчает отбор клеток со стабильной интеграцией линеаризованной конструкции в геном. После создания пулов, полученные стабильные пулы клеток СНО-К1, СНО-ST3Gal1, и клетки CHO-K1 дикого типа были дополнительно подвергнуты нуклеофекции геном, кодирующим hС1 Inh. Клетки подвергали отбору с использованием антибиотиков для получения пулов клеток, стабильно экспрессирующих i) rhC1 Inh, ii) rhC1 Inh и ST3Gal1 человека.
Клетки размножали, как описано в относящемся к методам разделе. Для получения супернатанта клеточной культуры, содержащего C1 Inh человека, клетки высевали в чашки для культивирования клеток диаметром 10 см, через 3 дня после высева клетки интенсивно промывали 1xPBS для удаления фетальной телячьей сыворотки, затем добавляя свежую бессывороточную среду. Через четыре дня супернатант клеточной культуры собирали, клетки и клеточный дебрис удаляли с помощью центрифугирования и фильтрования через 0,22 мкм фильтр. C1 Inh очищали, как описано в относящемся к методам разделе.
Степень сиалирования O-гликанов рекомбинантного C1 Inh в клетках CHO-K1 при сверхэкспрессии ST3Gal1 была проверена с помощью иммуноблоттингов с использованием лектина PNA. Агглютинин арахиса (PNA) выявляет β1-3-связанную концевую галактозу в О-связанных гликанах. Поэтому уменьшенный сигнал на блоте с использованием лектина PNA означает повышенный уровень сиалирования остатков галактозы О-гликанов. Как показано на фиг. 16, сверхэкспрессия только ST3Gal1 приводила к значительному увеличению сиалирования O-гликана рекомбинантного C1 Inh человека.
Пример 5:
Клетки MDCK.1 собаки (ATCC, CRL-2935) были стабильно трансфецированы. Результирующий стабильный пул клеток MDCK.1, MDCK.1-ST3Gal1, и клетки MDCK.1 дикого типа были в дальнейшем стабильно трансфецированы для получения пулов клеток, стабильно экспрессирующих i) rhC1 Inh, ii) rhC1 Inh и ST3Gal1 человека.
Клетки MDCK.1 размножали, как описано в относящемся к методам разделе. Для получения супернатанта клеточной культуры, содержащего C1 Inh человека, клетки высевали в матрасы для культивирования клеток площадью 225 см2, через 2 дня после высева клетки интенсивно промывали 1xPBS для удаления фетальной телячьей сыворотки, затем добавляя свежую бессывороточную среду. Через пять дней супернатант клеточной культуры собирали, клетки и клеточный дебрис удаляли с помощью центрифугирования и фильтрования через 0,22 мкм фильтр. C1 Inh очищали, как описано в относящемся к методам разделе, и исследовали с помощью блоттингов с использованием лектинов ECL и PNA для определения существующие N- и О-связанных гликоструктур.
Лектин Erythrina crista galli (ECL) выявляет β1-4-связанную концевую галактозу в N-связанных гликанах. Поэтому уменьшенный сигнал на блоте с использованием ECL означает повышенную степень сиалирования. Как показано на фиг. 17, сверхэкспрессия ST3Gal1 не приводит к увеличению сиалирования N-связанных гликанов.
Степень сиалирования O-гликанов рекомбинантного C1 Inh в клетках MDCK.1 при сверхэкспрессии ST3Gal1 была проверена с помощью иммуноблоттингов с использованием лектина PNA. Агглютинин арахиса (PNA) выявляет β1-3-связанную концевую галактозу в О-связанных гликанах. Поэтому уменьшенный сигнал на блоте с использованием лектина PNA означает повышенный уровень сиалирования остатков галактозы О-гликанов. Как показано на фиг. 17, сверхэкспрессия только ST3Gal1 приводила к значительному увеличению сиалирования O-гликанов рекомбинантного C1 Inh человека.
Обсуждение:
В представленных выше экспериментах фермент ST3Gal1, катализирующий перенос сиаловой кислоты из ЦМФ-сиаловой кислоты на содержащие галактозу субстраты, была сверхэкспрессирована в клетках млекопитающих, либо отдельно, либо в сочетании с ST3Gal4.
Сверхэкспрессия ST3Gal1 приводила к почти полному сиалированию коэкспрессированных O-гликозилированных рекомбинантных белков. Кроме того, была значительно уменьшена неоднородность GalNAc-O-гликанов.
Неожиданно, сверхэкспрессия только ST3Gal4 не оказывала никакого эффекта на фармакокинетический профиль исследуемого гликопротеина, в то время как дополнительная сверхэкспрессия ST3Gal1 и результирующее увеличение степени сиалирования GalNAc O-гликанов увеличивали полупериод существования в сыворотке приблизительно в 6 раз.
Изменение структуры гликанов терапевтических белков с целью улучшения их фармакокинетического профиля является очень мощным средством. В случае настоящего изобретения, в частности, подходят к решению двух распространенных недостатков терапевтических белков, во-первых, ограниченного полупериода существования в сыворотке и, во-вторых, неоднородности гликоструктур. Это может быть достигнуто за счет принудительной экспрессии фермента ST3Gal1, что дает в результате секретируемые гликопротеины, демонстрирующие почти полное сиалирование GalNAc-О-гликанов.
Это изобретение не ограничивается одной конкретной линией клеток от одного хозяина, но скорее применимо к широкому ряду линий клеток животных. Кроме того, оно не ограничивается одной конкретной группой гликопротеинов, но применимо к широкому ряду гликопротеинов, содержащих по крайней мере один О-связанный с использованием GalNAc гликан, например, факторам роста, пептидным гормонам, цитокинам, ферментам, антителам, фрагментам антител, факторам свертывания крови или ингибиторам протеаз.
Настоящее изобретение относится к следующим аминокислотным и нуклеотидным последовательностям.
SEQ ID NO: 1
ST3Gal1 человека
MVTLRKRTLK VLTFLVLFIF LTSFFLNYSH TMVATTWFPK QMVLELSENL KRLIKHRPCT 60
CTHCIGQRKL SAWFDERFNQ TMQPLLTAQN ALLEDDTYRW WLRLQREKKP NNLNDTIKEL 120
FRVVPGNVDP MLEKRSVGCR RCAVVGNSGN LRESSYGPEI DSHDFVLRMN KAPTAGFEAD 180
VGTKTTHHLV YPESFRELGD NVSMILVPFK TIDLEWVVSA ITTGTISHTY IPVPAKIRVK 240
QDKILIYHPA FIKYVFDNWL QGHGRYPSTG ILSVIFSMHV CDEVDLYGFG ADSKGNWHHY 300
WENNPSAGAF RKTGVHDADF ESNVTATLAS INKIRIFKGR 340
SEQ ID NO: 2
ST3Gal4 человека
MVSKSRWKLL AMLALVLVVM VWYSISREDR YIELFYFPIP EKKEPCLQGE AESKASKLFG 60
NYSRDQPIFL RLEDYFWVKT PSAYELPYGT KGSEDLLLRV LAITSSSIPK NIQSLRCRRC 120
VVVGNGHRLR NSSLGDAINK YDVVIRLNNA PVAGYEGDVG SKTTMRLFYP ESAHFDPKVE 180
NNPDTLLVLV AFKAMDFHWI ETILSDKKRV RKGFWKQPPL IWDVNPKQIR ILNPFFMEIA 240
ADKLLSLPMQ QPRKIKQKPT TGLLAITLAL HLCDLVHIAG FGYPDAYNKK QTIHYYEQIT 300
LKSMAGSGHN VSQEALAIKR MLEMGAIKNL TSF 333
SEQ ID NO: 3
C1 Inh человека
MASRLTLLTL LLLLLAGDRA SSNPNATSSS SQDPESLQDR GEGKVATTVI SKMLFVEPIL 60
EVSSLPTTNS TTNSATKITA NTTDEPTTQP TTEPTTQPTI QPTQPTTQLP TDSPTQPTTG 120
SFCPGPVTLC SDLESHSTEA VLGDALVDFS LKLYHAFSAM KKVETNMAFS PFSIASLLTQ 180
VLLGAGENTK TNLESILSYP KDFTCVHQAL KGFTTKGVTS VSQIFHSPDL AIRDTFVNAS 240
RTLYSSSPRV LSNNSDANLE LINTWVAKNT NNKISRLLDS LPSDTRLVLL NAIYLSAKWK 300
TTFDPKKTRM EPFHFKNSVI KVPMMNSKKY PVAHFIDQTL KAKVGQLQLS HNLSLVILVP 360
QNLKHRLEDM EQALSPSVFK AIMEKLEMSK FQPTLLTLPR IKVTTSQDML SIMEKLEFFD 420
FSYDLNLCGL TEDPDLQVSA MQHQTVLELT ETGVEAAAAS AISVARTLLV FEVQQPFLFV 480
LWDQQHKFPV FMGRVYDPRA 500
SEQ ID NO: 4
HGF человека
MWVTKLLPAL LLQHVLLHLL LLPIAIPYAE GQRKRRNTIH EFKKSAKTTL IKIDPALKIK 60
TKKVNTADQC ANRCTRNKGL PFTCKAFVFD KARKQCLWFP FNSMSSGVKK EFGHEFDLYE 120
NKDYIRNCII GKGRSYKGTV SITKSGIKCQ PWSSMIPHEH SFLPSSYRGK DLQENYCRNP 180
RGEEGGPWCF TSNPEVRYEV CDIPQCSEVE CMTCNGESYR GLMDHTESGK ICQRWDHQTP 240
HRHKFLPERY PDKGFDDNYC RNPDGQPRPW CYTLDPHTRW EYCAIKTCAD NTMNDTDVPL 300
ETTECIQGQG EGYRGTVNTI WNGIPCQRWD SQYPHEHDMT PENFKCKDLR ENYCRNPDGS 360
ESPWCFTTDP NIRVGYCSQI PNCDMSHGQD CYRGNGKNYM GNLSQTRSGL TCSMWDKNME 420
DLHRHIFWEP DASKLNENYC RNPDDDAHGP WCYTGNPLIP WDYCPISRCE GDTTPTIVNL 480
DHPVISCAKT KQLRVVNGIP TRTNIGWMVS LRYRNKHICG GSLIKESWVL TARQCFPSRD 540
LKDYEAWLGI HDVHGRGDEK CKQVLNVSQL VYGPEGSDLV LMKLARPAVL DDFVSTIDLP 600
NYGCTIPEKT SCSVYGWGYT GLINYDGLLR VAHLYIMGNE KCSQHHRGKV TLNESEICAG 660
AEKIGSGPCE GDYGGPLVCE QHKMRMVLGV IVPGRGCAIP NRPGIFVRVA YYAKWIHKII 720
LTYKVPQS 728
SEQ ID NO: 5
Консенсусная последовательность мотива 3 ST3Gal1
HYWE 4
SEQ ID NO: 6
ST3Gal1 Pan troglodytes
MVTLRKRTLK VLTFLVLFIF LTSFFLNYSH TMVATTWFPK QMVLELSENL KRLIKHRPCT 60
CTHCIGQRKL SAWFDERFNQ TVQPLLTAQN ALLEDDTYRW WLRLQREKKP NNLNDTIKEL 120
FRVVPGNVDP MLEKRSVGCR RCAVVGNSGN LRESSYGPEI DSHDFVLRMN KAPTAGFEAD 180
VGTKTTHHLV YPESFRELGD NVSMILVPFK TIDLEWVVSA ITTGTISHTY VPVPAKIRVK 240
QDKILIYHPA FIKYVFDNWL QGHGRYPSTG ILSVIFSMHV CDEVDLYGFG ADSKGNWHHY 300
WENNPSAGAF RKTGVHDADF ESNVTATLAS INKIRIFKGR 340
SEQ ID NO: 7
ST3Gal1 Macaca mulatta
MVTLRKRTLK VLTFLVLFIF LTSFFLNYSH TMVTTTWFPK QMVLELSENL KRLIKHRPCT 60
CTHCIGQRKL SVWFDERFNQ TVQPLLTAQN ALLEDDTYRW WLRLQREKKP NNLNDTIKEL 120
FRVVPGNVDP MLEKRSVGCR RCAVVGNSGN LRESSYGPEI DRHDFVLRMN KAPTAGFEAD 180
VGTKTTHHLV YPESFRELGD NVSMILVPFK TIDLEWVVSA TTTGTISHTY VPVPAKIRVK 240
QDKILIYHPA FIKYVFDNWL QGHGRYPSTG ILSVIFSMHV CDEVDLYGFG ADSKGNWHHY 300
WENNPSAGAF RKTGVHDADF ESNVTATLAS INKIRIFKGR 340
SEQ ID NO: 8
ST3Gal1 Sus scrofa
MAPMRKKSTL KLLTLLVLFI FLTSFFLNYS HTVVTTAWFP KQMVIELSEN FKKLMKYPYR 60
PCTCTRCIEE QRVSAWFDER FNRSMQPLLT AKNAHLEEDT YKWWLRLQRE KQPNNLNDTI 120
RELFQVVPGN VDPLLEKRLV SCRRCAVVGN SGNLKESYYG PQIDSHDFVL RMNKAPTEGF 180
EADVGSKTTH HFVYPESFRE LAQEVSMILV PFKTTDLEWV ISATTTGRIS HTYVPVPAKI 240
KVKKEKILIY HPAFIKYVFD RWLQGHGRYP STGILSVIFS LHICDEVDLY GFGADSKGNW 300
HHYWENNPSA GAFRKTGVHD GDFESNVTTI LASINKIRIF KGR 343
SEQ ID NO: 9
ST3Gal1 Rattus norvegicus
MVNMRKRTLK YLTFFLLFIF LTSFVLNYSN SGVPSAWFPK QMVLEFSENF RKFIKSQPCT 60
CRHCISQGKV SYWFDQRFNK TMQPLLTAHN ALMEEDTYRW WLRLQRERKP NNLSDTVKEL 120
FRLVPGNVDP MLNKRLVGCR RCAVVGNSGN LKDSSYGPEI DSHDFVLRMN RAPTVGFEAD 180
VGSRTTHHLV YPESFRELGE NVNMVLVPFK ITDLQWVISA TTTGTITHTY VPVPPKIKVK 240
QEKILIYHPA FIKYVFDNWL QGHGRYPSTG ILSVIFSIHI CDEVDLYGFG ADSKGNWHHY 300
WENNPSAGAF RKTGVHDGDF EYNVTTTLAA INKIRIFKGR 340
SEQ ID NO: 10
ST3Gal1 Mus musculus
MRRKTLKYLT FFLLFIFLTS FVLNYSNTGV PSAWFPKQML LELSENFRRF IKSQPCTCRH 60
CISQDKVSYW FDQRFNKTMQ PLLTVHNALM EEDTYRWWLR LQRERKPNNL SDTVKELFRL 120
VPGNVDPMLN KRLVGCRRCA VVGNSGNLKD SSYGPEIDSH DFVLRMNKAP TVGFEADVGS 180
RTTHHLVYPE SFRELGENVN MVLVPFKTTD LQWVISATTT GTITHTYVPV PPKIKVKQEK 240
ILIYHPAFIK YVFDNWLQGH GRYPSTGILS IIFSIHICDE VDLYGFGADS KGNWHHYWEN 300
NPSAGAFRKT GVHDGDFEYN ITTTLAAINK IRIFKGR 337
SEQ ID NO: 11
ST3Gal1 Nannospalax galili
MVNLRKKIVK WLTFLLLFVF LTSCFLNYSN SGVPITWFPK QMVLELSENF QKLIKQRPCT 60
CTHCISQSKV SSWFDQRFNQ TMQPLLTASN AMMEEDTYQW WLRLQRERKP NNLSDIVKEL 120
FSLVPGNVDP VLDKRSVGCR RCAVVGNSGN LRASSYGSDI DSHDFVLRMN RAPTVGFEAD 180
VGSRTTHHLV YPESFRELGE NVNMVLVPFK TTDLQWVISA TTTGTITHTY VPVPPKIKVK 240
QEKILIYHPA FIKYVFDNWL QGHGRYPSTG ILSVIFSMHV CDEVDLYGFG ADSKGNWHHY 300
WENNPSAGAF RKTGVHDGDF ESNVTTTLAS INKIRIFKGR 340
SEQ ID NO: 12
ST3Gal1 Monodelphis domestica
MAAIKKKRLK VFTFVLLLVS LTSFFLNYAH TTATYTWFPK QMVMHFSEHF KRFMKYPQRP 60
CSCSQCISET GFAPWFDERF NHTMQPLLNR QNAFLENDTY TWWMKLQRER TPKRLNETFM 120
DLFSIIPGDV DPLLQKGPLI CRRCAVVGNS GNLKESHYGK DIDSHDFVLR MNRAPTAGFE 180
VDVGRKTTHH LVYPESFREL AGNVSMILVP FKTMDLQWLI SALTKGTINF TYVPVPRKIH 240
VNREKILIYH PAFIKYVFDS WLQAHGRYPS TGILSVILSL HICDKVDLYG FGADSKGNWH 300
HYWENNPSAG AFRKTGVHDG DFESNVTSTL ASLNKIRIFK GR 342
SEQ ID NO: 13
ST3Gal1 Oryctolagus cuniculus
MVTPRKRTLK ALAFLMLFIF LTSFLLNYSH TMVATTWFPK QMVLEFSENL RKLIKTRPCT 60
CAHCVGQRKL SAWFDERFNQ TMQPLLTAHN ALMEEDTYRW WLKLQREKKP NNLNDTIKEL 120
FSVVPGDVDP VLEKRSVGCR RCAVVGNSGN LRESSYGPDI DSHDFVLRMN KAPTVGFEGD 180
VGSKTTHHLV YPESFRELGE NVSMVLVPFK TIDLQWVVSA TTTGTISHTY VPVPAKIKVK 240
QDKILIYHPA FIKYVFDNWL QGHGRYPSTG ILSVIFSMHI CDEVDLYGFG ADSKGNWHHY 300
WENNPSAGAF RKTGVHDADF ESNVTATLAA INKIRIFKGR 340
SEQ ID NO: 14
ST3Gal1 Cricetulus griseus
MMTTQKKVLK VLTFLVLLIF LTSFVLNFAH TTVPAAWFPK QMVLELSQNL RKLIKPPPCT 60
CTHCISQRKV SAWFDKRFNQ TVQPLLTAHN AVLEEDTYQW WLRLQREKKP SNLSDTIREL 120
FSVVPGNVDP VLEKKSGSCR RCAVVGNSGN LRESSYGPEI DSHDFVLRMN RAPTVGFEAD 180
VGSKTTHHLV YPESFRELGE DVSMILVPFK TIDLQWVVSA TTTGTISHTY VPVPKKIKVK 240
QDKILIYHPA FIKYVFDNWL QGHGRYPSTG ILSVIFSLHV CDEVDLYGFG ADSKGNWHHY 300
WENNPSAGAF RKTGVHDGDF ESNVTATLAA INKIRIFTGR 340
SEQ ID NO: 15
ST3Gal1 Canis familiaris
MVTMRKRTLK VLTLLVLFIF LTSFFLNYSH TMVTTTWFPK QMVVELSENF KKFMKYTHRP 60
CTCARCIGQQ RVSAWFDERF NRSMQPLLTA QNALLEEDTY SWWLRLQREK QPNNLNDTIR 120
ELFQVVPGNV DPLLEKRSVG CRRCAVVGNS GNLRESWYGP QIDSHDFVLR MNKAPTAGFE 180
MDVGSKTTHH LVYPESFREL AENVSMVLVP FKTTDLEWVV SATTTGTISH TYVPVPAKIK 240
VKKDKILIYH PAFIKYVFDS WLQGHGRYPS TGILSVIFSL HICDEVDLYG FGADSKGNWH 300
HYWENNPSAG AFRKTGVHDG DFESNVTATL ASINKIRIFK GR 342
SEQ ID NO: 16
ST3Gal1 Felis catus
MVTVRKRTLK VLTLLVLFIF LTSFFLNYSH TMVATTWFPK QMVVELSENF KKFMKYAHRP 60
CTCARCIGQQ RVSPWFDERF NRSMQPLLTA QNALLEEDTY SWWLRLQREK QPNNLNDTIK 120
ELFQVVPGNV DPLLEKKSGG CRRCAVVGNS GNLRESWYGP QIDGHDFVLR MNKAPTAGFE 180
ADVGSKTTHH LVYPESFREL GENVSMVLVP FKTTDLEWVV SATTTGTISH TYVPVPAKIK 240
VKKNKILIYH PAFIKYVFDN WLQGHGRYPS TGILSVIFSL HICDEVDLYG FGADSKGNWH 300
HYWENNPSAG AFRKTGVHDG DFESNVTATL ASINKIRIFK GR 342
SEQ ID NO: 17
ST3Gal1 Equus caballus
MATHRRRILK VLTLLILFIF LTSFFLNYSH TVVTTAWFPK QMVLELSENF KKLVQYSHRP 60
CSCARCIGQQ KVSSWFDERF NRSMQPLLTV QNAFLEEDAY NWWLRLQREK EPSNLNDTIK 120
ELFRVVPGNV DPLLGKRSVG CRRCAVVGNS GNLKESSYGP QIDSHDFVLR MNKAPTAGFE 180
AYVGSKTTHH LVYPESFREL GENVSMVLVP FKTTDLEWVV SATTTGTISH TYVPVPAKIK 240
VKQDKILIYH PAFIKYVFDN WLQGHGRYPS TGILSVIFSL HICDEVDLYG FGADSRGNWH 300
HYWENNPSAG AFRKTGVHDG DFESNVTATL ASIDKIRIFK GR 342
SEQ ID NO: 18
ST3Gal1 Gallus
MVTVRKRNVK VFTFAFVLIT VTSFLLNYKH QVTMTTWDPK HIISQFSEQV RKLIKFPRRP 60
CSCSTCISEL GHSLWFDQRF NSTMQPFLTS QNALIPEDSY RWWLKLQGEK SPKNINDTLK 120
ELFGIIPGDR DPLQERGTFS CRRCAVVGNS GNLRQSQYGQ DIDSHDFVLR MNRAPTIGYE 180
SDVGSKTTHH FVYPESYKEL AENVSMIVIP FKTLDLRWIV TALTTGTINF TYVPVPRKIK 240
VRKEKVLIYN PSFIKYVYEN WLQNHGRYPS TGLLSVIFAL HVCDEVNVYG FGADSKGHWH 300
HYWENNASAG AFRQTGVHDG DFEFNVTLTL ASIEKIKFFK GR 342
SEQ ID NO: 19
ST3Gal1 Columba livia
MVVVRRRNVK VFTFAFLLIT VTSFLLNYTH QVTTTTWDPR HLVMQFSEQV QKLFKYPRRP 60
CSCRSCISEL GHSLWFDQRF NSTMQPFLTS QNALIPEDSY RWWLKLQGEK TPKNINATLK 120
ELFEFIPGDG DPLQERGTST CRRCAVVGNS GNLLQSQYGQ DIDSHDFVLR MNRAPTTGYE 180
SDVGSKTTHH FVYPESYKEL AENVSMILIP FKTLDLRWIV TALTTGTINF TYVPVPRKIK 240
VKKEKILIYN PTFMKYVYEN WLQHHGRYPS TGLLSLIFAL HVCDEVNVYG FGADSRGHWH 300
HYWENNGSAG AFRKTGVHDG DFEFNVTLTL ASIEKINFFK GR 342
SEQ ID NO: 20
ST3Gal1 Alligator sinensis
MRRRHLKMFS FLFVFIAAMS FFLNYNHYEA MVTWAPQQIV MQFSEQFKKL MKHPRRPCSC 60
KACVSELGLS LWFDERFNQT MQPLLTTQNA LISQDSYRWW LKLQGEKNPK NINETIKELF 120
ETISGDGSQL QERSSSMCRR CAVVGNSGNL RQSHYGQDID SHDFVLRMNR APTVGFESDV 180
GSKTTHHFVY PESFKELPEN VSMIVIPFKT LDLRWIVSAL TTGTINHTYV PVPRKIKVKK 240
EKILVYHPDF LKYVFDHWLQ RHGRYPSTGI LSVVFALHVC DEVNLYGFGA NSKGHWHHYW 300
ENNPSAGAFR QTGVHDGDFE SNITSTLAAV NKIHLFKGR 339
SEQ ID NO: 21
ST3Gal1 Latimeria chalumnae
MARHNHRIMW LLTIILLLCV YMVIYDMGED KQKLIKIPSI RRLSGRTIVL DKKLCSCEKC 60
VSEKEESAWF DERFDPNFQP ILMTEVQDIP SHALQWWLSL QAGNKNYNLS ESIAKLFTVV 120
PRTNHSGIRD PAHCRKCAVV GNSGNLKGSN HGKEIDAHHF VIRMNRARTA GFEPDVGIKT 180
THHLMYPESS QDLQPGVHLV LLPFKIMDFE WIRSALTTGE ITRTYFRVQQ FIKADKDKVL 240
IINPTFFKYV CDHWTEHHGR YPSTGMTALV FALHICDEVS VFGYGADSNG NWHHYWENNR 300
NGGAFRRTGV HSGDFESQII KKLADEGKII FYK 333
SEQ ID NO: 22
ST3Gal1 Ciona intestinalis
MLINFKLSRV IAMLLVVAIF LTYSWLLLWS TKTALQTNRK NKAGQDEVPV INVIKEDSYV 60
QQKTQNLNKG KRFDLGRVNH SHPREEIQQN NKCGHQLDAS QTRWFRARFN PEIEPVWTQS 120
ALEIDYLVYD WWLSLQSSEA ENLDKTFEAL YKEGVPRKDP FARLTHDREA GCRSCAVVGN 180
SGNILNSNYG NVIDGHDFVI RMNKGPTYNY ENDVGSKTTH RFMYPTTAAS SLPQGVSLVL 240
VPFQPLDIKW LLSALTTGEI TRTYQPLVRR VTCDKSKITI ISPTFIRYVH DRWTQHHGRY 300
PSTGLLALIY ALHECDEVDV YGFGANRAGN WHHYWEDLPP HVAGAFRKTG VHDSAQENEI 360
IDQLHIHGLL RVHRSEQSS 379
Реферат
Настоящее изобретение относится к линиям клеток, которые генетически модифицированы для сверхэкспрессии β-галактозид-α-2,3-сиалилтрансферазы 1 (ST3Gal1), предпочтительно ST3Gal1 человека, которые могут быть использованы для продукции рекомбинантных гликопротеинов, содержащих в высокой степени или полностью сиалированные O-связанные с использованием GalNac гликаны (GalNAc-O-гликаны), предпочтительно имеющие остов 1 GalNAc-О-гликаны, а также к соответствующим рекомбинантным гликопротеинам. Кроме того, настоящее изобретение относится к соответствующим способам экспрессии рекомбинантных гликопротеинов. 2 н. и 2 з.п. ф-лы, 17 ил., 1 табл., 5 пр.
Формула
Документы, цитированные в отчёте о поиске
Продукция гликопротеинов с модифицированным фукозилированием
Патенты аналоги
Продукция гликопротеинов с модифицированным фукозилированием

Комментарии