Композиция для индукции иммунной реакции у млекопитающего и способ введения млекопитающему активного ингредиента - RU2126270C1
Код документа: RU2126270C1
Чертежи
Описание
Настоящее изобретение выполнено при частичном финансировании правительством США, и правительство США обладает некоторыми правами на это изобретение.
Настоящее изобретение касается общих вопросов, связанных с пассивной иммунной защитой через слизистую оболочку, с поли-1g-иммунными реактивами и способами. Здесь термин "поли-1g" распространяется на полимерные классы антител, т.е. на 1gA и 1gM. 1gM-антитела обычно образуются на ранней стадии иммунной реакции и не являются важным фактором в защитном иммунителе слизистой оболочки. Таким образом, изобретение в общем относится к полимерным 1g-антителам, и применительно ко всем аспектам настоящего изобретения обычными и преимущественными антителами являются антитела класса 1gA, которые обычно вырабатываются в димерной форме и в меньшей степени в форме высших 1gA-полимеров.
Многие патогенные бактерии и вирусы попадают в организм, проникая через клеточные выстилки (эпителиальные ткани) желудочно-кишечного, дыхательного или полового трактов. Специализированный класс антител - антитела 1gA - осуществляет защиту этих поверхностей. 1gA-антитела представляет собой димерные или полимерные молекулы, вырабатываемые клетками, расположенными в тканях, находящихся под эпителиальными поверхностями. Они переносятся эпителиальными клетками в выделения слизистой оболочки, где они связывают или покрывают патогенные микроорганизмы, которые еще не попали в организм, мешая им контактировать с эпителиальными клетками и прилипать к ним. Таким образом, 1gA-антитела оказывают воздействие на патогенные микроорганизмы, которые находятся вне организма, и защищают организм, препятствуя попаданию в него микробов через эпителиальные поверхности.
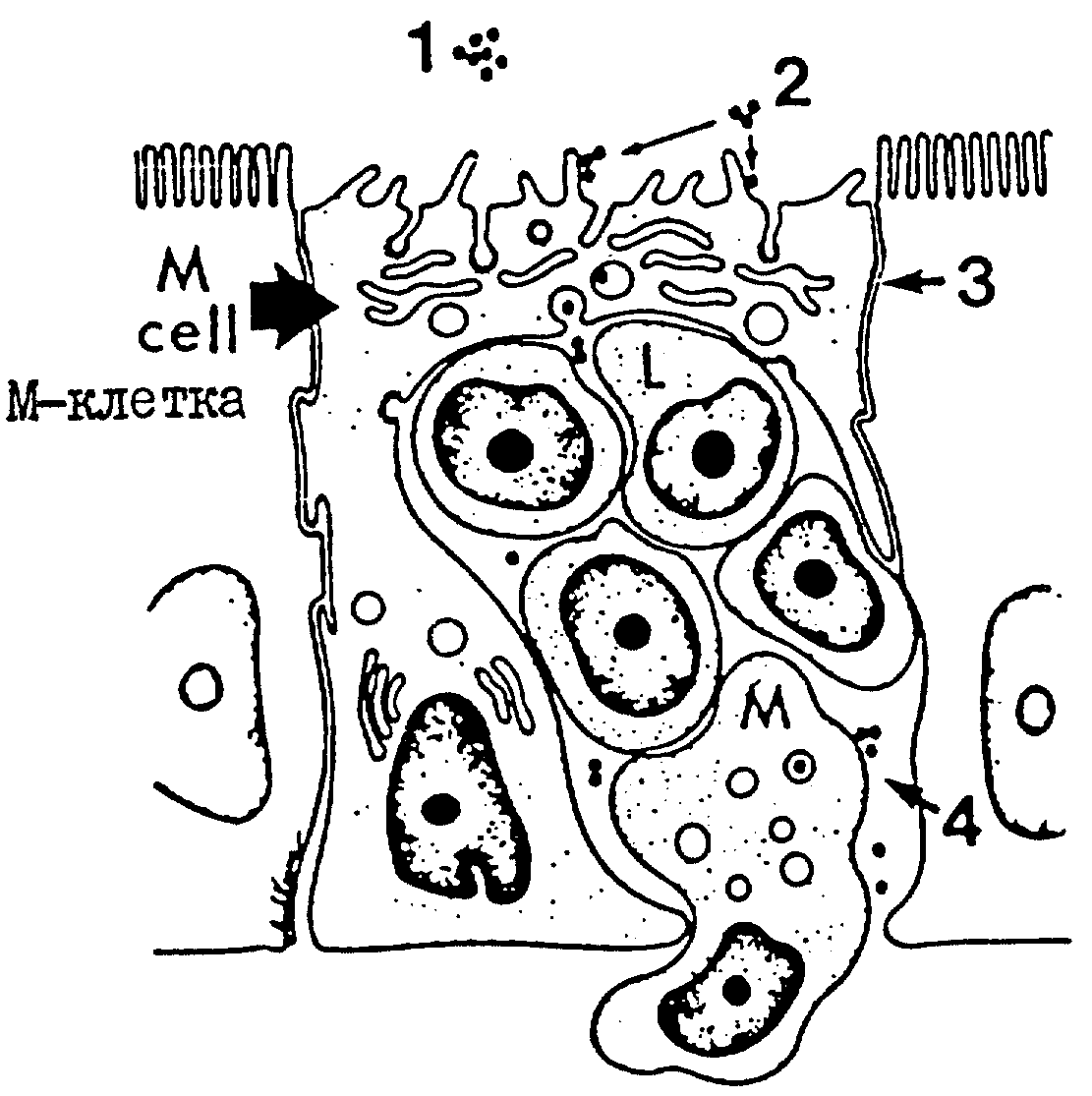
Иммунная реакция с участием 1gA-антител, происходящая в естественных условиях, запускается антигеном, попадающим на поверхности, покрытые слизистой оболочкой. Антиген поступает в организм через специфические заборные участки (называемые микроскладкой, или М-клетками), на которых происходит трансэпителиальный перенос антигена в области слизистого покрытия, содержащего специализированные упорядоченные совокупности клеток иммунной системы слизистой оболочки. Как видно из чертежа, антигены А (показаны в виде закрашенных кружков), находящиеся в полости 1, связываются с поверхностью полости, где находятся клетки М, в месте 2. Антигены проникают внутрь и проходят в клетку в месте 3, освобождаясь в интраэпителиальном кармане 4, содержащем лимфоидные клетки 1 (клетки В и Т), и клетки по выявлению и обработке антигенов, такие как макрофаги (М).
1gA-антитела у хозяина, иммунизированного естественным образом, переносятся в выделения посредством связывания со специфическим рецептором (называемым поли-1g-рецептором), находящимся на базальных (внутренних) поверхностях эпителиальных и гландулярных клеток в пределах дыхательной и пищеварительной систем, полового тракта и молочных желез. См.литературу: Solari, Kraehenbuhl, "Peceptor-Meodiated Transepthelial Transport of Polymeric Immunogolobulins", с. 269-298 в книге The Mammary Gland, Nelville, Daniel, редакторы, изд-во "Пленум паблишинг", г.Кеймбридж (1987); Mestecky (1987), J. Clin Immunol., 7: 265 - 276. Комплексы рецептора и 1gA-антитела переносятся через эти клетки и претерпевают экзоцитов, попадая на клеточные поверхности полости (во внешнюю область), где рецептор ферментативно отщепляется, освобождая 1gA-антитело, поступающее в выделения вместе с фрагментом рецептора, называемым секреторным компонентом. См. литературу: Mostov et al. (1980) Proc. Nat, 1 Acad. Sci. U.S.A. 77-7257-7261; Solari, R., Kraehenbuhl, J.P., Cell 36: 61-71 (1984); Kuhn, Kraehenbuhl, J. Biol.Chem. 256:12490-12495 (1981). Сообщают, что секреторный компонент понижает протеолитический распад антитела 1gA-типа. См. литературу: Lindh, J. J. Immunol. 114: 284-286; (1975); Brown, Neucomb, Ishizaka, J.Clin.Invest. 49:1374 (1974).
В целом существующий механизм иммунизации, который включает введение антигенов, сводится к инициированию образования антител класса 1gA, которые систематически циркулируют и нейтрализуют патогенные микроорганизмы после попадания их в организм. Введение антигенов в общем случае не сопровождается появлением существенного количества 1gA антител.
Усилия, направленные на повышение эффективности защитного действия 1gA-антител на границах со слизистой оболочкой, включали оральную иммунизацию, проводимую либо с целью активной защиты иммунизированного млекопитающего, либо с целью пассивной защиты какого-то другого млекопитающего, достигаемой посредством использования слизистого выделения иммунизированного млекопитающего. См. Литературу: Class et al., New Eng.I.Med., 308:1389-1392 (1983); Fubara et al, J.Immunol., 111(2):(395-403 (1973). Были получены моноклональные антитела класса 1gA, которые с целью защиты от проникновения патогеных микроорганизмов были внесены прямо на поверхности дыхательной системы, покрытые слизистой оболочкой. См. литературу: Mazanec et al., I. Virol., 61: 2624-2625 (1987).
Активная иммунизация может производиться посредством провокационного воздействия на слизистую поверхность интактными (убитыми) бактериями или вирусами. Для устранения опасности, которая в случае некоторых патогенных микроорганизмов может возникать при применении этого подхода, на поверхность слизистой оболочки наносили антигенные компоненты, такие, как иммуногенные поверхностные компоненты патогенного микроорганизма. В некоторых случаях антигены сопрягали с большими молекулами. Например, сопрягали с антигенами, холероген подгруппы В. См. работу Черкинского (Czerkinsky) и др., которые в журнальной статье (Infection and Immunity, 57:1072-1077 (1989) сообщают об оральном введении стрептококкового антигена, сопряженного с холерогеном подгруппы В. В качестве носителя антигена использовали также биологически разрушаемые микросферы. Например, Элдридж (Eldridge) и др. в журнальной статье (Curr Top.Microbial Immunol., 146:59 и далее (1989)) сообщают о введении антигена в биологически разрушаемые микросферы. Сухой белковый антиген диспергируют в сополимерной матрице, не прибегая к химическому сопряжению.
При создании настоящего изобретения также был принят во внимание известный факт повышения иммуногенности при введении одновременно с антигеном фосфата кальция [Salk J.E., Proc.Soc.Exptl.Biol. Med., v. 46, p. 709, 1941 и v.101, p.122, 1945].
Обнаружено, что особенно приемлемым носителем для терапии, проводимой с введением через слизистые поверхности является гидроксилированный фосфат кальция в виде частиц. Сложные образования из гидроксилированного фосфата кальция и терапевтически активных ингредиентов (например, биологически активных веществ, таких как антигены или лекарственные препараты) переносятся через эпителий, где они дают желаемую терапевтическую реакцию, например, они вызвают поли-1g-иммунную реакцию.
В самом общем виде изобретение сводится к введению активного ингредиента млекопитающему посредством наложения комплекса из гидроксилированного фосфата кальция и активного ингредиента на слизистую поверхность млекопитающего.
Один специфический вариант реализации изобретения в общем представляет собой способ генерации сенсибилизированных антигеном лимфобластов, выделяющих 1gA-антитела у млекопитающих. В случае этого способа иммуноген, включающий в себя антиген или смесь антигенов, в сочетании с гидроксилированным фосфатом кальция в виде частиц наносят на слизистую поверхность млекопитающего. В случае преимущественных вариантов реализации этого первого аспекта настоящего изобретения сенсибилизированные антигеном лимфобласты извлекают и иммортализуют для получения 1g-A-продуцирующей гибридомы.
Второй специфический вариант реализации изобретения составляют способ вакцинации млекопитающего (особенно людей), включающий в себя введение описанного выше иммуногена на поверхность слизистой оболочки млекопитающего.
Другие возможные варианты сводятся к введению терапевтических средств (например, лекарственных препаратов) через слизистую оболочку.
Изобретение также распространяется в общем случае на состав, включающий в себя активный ингредиент в сочетании с гидроксилированным фосфатом кальция в виде частичек, размер которых является приемлемым для прохождения через эпителий.
В случае любого из предпочтительных вариантов реализации настоящего изобретения гидроксилированный фосфат кальция находится именно в виде микрочастиц, приемлемых для прохождения через эпителий. Желательно также, чтобы антиген включал в себя внешне доступную детерминанту патогенного микроорганизма или сперматозоидов, такую как вирусная оболочка или белок оболочка, липополисахарид или белок клеточной поверхности. Одной из форм гидроксилированного фосфата кальция является гидроксиапатит (ГАП), выпускаемый промышленностью кристаллический гидроксилированный фосфат кальция, обсуждаемый ниже.
К предпочтительным способам введения активного ингредиента, отвечающего настоящему изобретению, относятся оральный, вагинальный, назальный, ректальный, глазной способы, а также способ с введением в среднее ухо. При оральном способе введения препарат может попадать и в другую гастроинтенстинальную слизистую оболочку, включая кишечную слизистую оболочку.
Изобретение обеспечивает получение эффективно действующего поливалентного комплекса, который может прилипать к слизистой оболочке и может эффективно проходить через эпителиальный барьер, оказывая свойственный ему биологический эффект, например, сводящийся к проявлению иммунной системы слизистой оболочки. Процесс адсорбции активных ингредиентов, особенно белков, гидроксилированным фосфатом кальция является относительно простым, быстрым и дешевым, что делает изобретение экономически выгодным. Более того, гидроксилированный фосфат кальция обладает высоким общим сродством к антигенам, представляющим интерес, включая белки и другие антигены, чем обеспечивается широкая применимость изобретения. Гидроксилированный фосфат кальция в общем является нетоксичным, что следует из того факта, что гидроксиапатит является составной частью костей, и иммунная система организма неизменно сталкивается с ним при обычной костной резорбции, процессе, который постоянно идет на микроскопическом уровне у здоровых индивидуумов. В соответствии со сказанным выше чистый ГАП может, по-видимому, вводиться хозяину без опасения возникновения иммунной реакции, и введение может быть повторно с использованием его в качестве носителя для того же или различных антигенов без возникновения иммунной реакции в отношении носителя. Более того, гидроксилированный фосфат кальция, особенно ГАП, является относительно недорогим препаратом. Он может быть легко доведен до размеров, приемлемых для осуществления трансэпителиального переноса М-клетками; при таких пониженных размерах он оказывается приемлемым для захвата макрофагами и другими клетками ретикулоэндотелиальной системы, чем достигается усиление имунной реакции. И, наконец, М-клеточный захват и перенос иммуногенов, отвечающих настоящему изобретению, носит сравнительно селективный характер.
Другие особенности и преимущества изобретения станут очевидными из приведенного ниже описания преимущественных вариантов реализации такового.
На чертеже дано схематическое представление трансцитоза антигена через М-клетки.
Реактивы.
В целом методы и материалы, описанные ниже, могут быть использованы как часть методических подходов по 1gA-защите, которые раскрыты с большими подробностями в совместной патентной заявке, поданной Ньютра (Neutra), Краегенбулем (Kraehenbuh 1) и Велцином (Welzin) одновременно с этой заявкой под названием синтетический поли-1g-рецептор, комплексы рецептор-антитело, получение и использование таковых, которая учитывается здесь посредством ссылки. В частности, иммуногены и способы, отвечающие настоящему изобретению, могут быть использованы с белковым стабилизатором так, как это описано в приведенной выше ссылке на заявку, в результате чего получают поли-1g-реактивы, необходимые для проведения пассивной иммунизации.
В преимущественных вариантах реализации настоящего изобретения говорится о гидроксиапатит-антигенных образованиях и их использовании. В частности, ГАП представляет собой модифицированную форму кристаллического фосфата кальция Са10(РО4)6(ОН)2. Его используют в качестве реактива для фракционирования белков, что обусловлено наличием у него общей связывающей способности к белкам. Выпускаемый промышленностью ГАП обычно состоит из пластинчатых кристаллов, которые в химическом и физическом отношении являются аналогичными неорганическому гидроксиапатиту, содержащемуся в обычной костной ткани. До тех пор пока исходный материал является свободным от загрязнений, введение ГАП в организм должно быть сравнительно безопасным, на что указывает существование питательных кальций-фосфорных добавок, получаемых из молотых костей, которые предназначены для введения в организм.
Промышленный ГАП высокой степени рассасывания (выпускаемый фирмой (Calbiochem) состоит из кристаллов, размер которых меняется в широких пределах. В поставляемом виде кристаллы ГАП являются, по-видимому, в общем слишком большими, чтобы они могли проходить через эпителиальные барьеры. Например, кристаллы с длиной более 1 мкм вряд ли могут быть захвачены М-клетками. По этой причине применительно к использованию в настоящем изобретении промышленные кристаллы гидроксивпатита разрушают, получая небольшие, сравнительно однородные кристаллические фрагменты, что достигается, например, посредством ультразвукового воздействия.
У кристаллов, полученных после воздействия ультразвука, размеры варьируют, однако они обычно не превышают 1 мкм. Желательно, чтобы существенная часть гидроксиапатита находилась в виде фрагментов с размерами, находящимися примерно в области 0,01-0,1 мкм. Степень фрагментации можно установить, либо пользуясь электронным микроскопом, либо по рассеянию света с применением стандратных методик.
Гидроксиапатит при низких или физиологически безопасных концентрациях связывает большинство белков достаточно прочно и с высокой скоростью. Полагают, что процесс связывания зависит от взаимодействия кальциевых центров с кислотными и фосфатными группами белков и взаимодействия фосфатов с основными белковыми группами. Белки с повышенным молекулярным весом характеризуются тенденцией к более прочной адсорбции на гидроксиапатите, но при этом роль также играет и нагрузка по белку. Один грамм гидроксиапатита может, например, связать примерно 30 мг бычьего сывороточного альбумина. Таким образом, гидроксиапатит может эффективно захватывать белковый антиген из разбавленных растворов, не требуя добавления сшивающих химических веществ, не требуя создания жестких или денатурирующих условий и не допуская потери ценного чистого антигена.
Адсорбированные на гидроксиапатите антигены могут быть использованы для проведения активной вакцинации людей или других млекопитающих. Изобретение является особенно полезным для защиты от Pseudomonas aeruginosa, Hemophilus influenzae, Vibro cholerae, Bordetella pertussis, Corynebacterium diphtherial, Esherichia coli, Salmonella typhi и typhimurium, Clostridium perfringens и другие брюшные clostridiae, Shigella dysenteriae, Shigella flexnerii Neisseria gonorrheae, Trichomonas, Entameba histolytica, Giardia iamblia, Streptococcus, распираторно-синцитиального вируса, человеческого иммунодефицита, человеческого Т-клеточного лимфотропного вируса типов 1 и 11, полиовируса, риновируса, вируса гриппа, вирусов герпеса, вируса бородавки человека, патогенных микроорганизмов СПИД 2o, таких как Pneumocystis, и дрожжевых культур, таких как кандиозы, Изобретение является полезным в отношении защиты от аллергенов, которые контактируют с поверхностями слизистой оболочки дыхательной или пищеварительной системы. Оно является также полезным в плане предохранения от беременности посредством связывания сперматозоидов во влагалище и предотвращения их продвижения через шейку и матку.
В каждом случае используют надлежащий известный антиген, например, весь патогенный микроорганизм или специфическую часть антигенов такую, как вирусный оболочечный белок или бактериальные поверхностно-клеточные белки, белок фимбрия, липополисахариды, вирусный капсид или белок оболочки, поверхностный компонент протозойной клеточной мембраны, поверхностные белки сперматозоида или аллергены дыхательной системы. Могут быть также использованы токсоиды, например, СРМ-197, и инактивированный токсин diphtheria, как это следует из работы Утида (Uchida) и др. (J.Biol.Chem., 248:3838-3844 (1973)). Антиген используют по описанной выше методике, генерируя гибридомы, выделяющие требуемые защитные антитела. Приводя всего лишь несколько примеров, можно сослаться на патент W088/08437 (включенный сюда со ссылкой), в котором раскрывается tcРА-фимбриевый белок, пригодный для образования анти-V, cholerrae моноклональных поли-1g-антител. В патенте США N 4725669 раскрывается Н1V (HTLV-III)-оболочечный гликопротеид, пригодный для образования анти-H1V-поли-1g-моноклональных антител. В следующих патентах и патентных заявках раскрывается получение антител для защиты от стрептококковых инфекций и особенно инфекций группы В Streptococcus: патенты США с номерами 4367221, 4367222, 4367223, 4356263, 4207414 (RE 31672) и WO 87/06267.
Другие приемлемые антигены раскрыты в трудах Bacterial Vaccines and Local Immunity Международной конференции (Sciavo International Conf.), проведенной в г.Сиена, Италия, 17-19 ноября 1986 г. Специфические реактивы, пригодные для H1V-антигенов, раскрыты в Программе по исследовательским и эталонным реактивам в области борьбы со СПИД (AlDS Research and Reference Reagent Program. ), Национальный институт здравоохранения, июнь 1989 г. Например, препарат gp 120 продает фирма "Микрогенезис, Инк.". Поверхностно-клеточные антигены сперматозоидов такие, как LDH-C4, являются также известными. См. , например, следующую литературу: Shaha et al. and Talwar et al., Vaccine, 7:97-100 (1989), Saha et al., Int. J.Androl., 11:479 (1988).
Особый интерес при выборе антигенов применительно к практическому использованию изобретения представляет вариант слизистой защиты с прошиванием, при котором устраняется попадание в организм (в случае этого механизма не требуется, чтобы полимерное антитело убивало или "нейтрализовало" патогенный микроорганизм). В противоположность сказанному защита (1gG-антителами) всего организма включает связывание, при котором, чтобы достигалась эффективность, обычно должна происходить нейтрализация патогенного микроорганизма. Таким образом, не каждое 1gG-антитело, которое связывается c патогенным микроорганизмом, выполняет защитную функцию. Это, например, иллюстрируется существованием моноклональных антител, которые специфически связывают Vibrio cholerae, но не нейтрализуют вибрион в смысле устранения колонизации, роста и проявления клинических симптомов у его хозяина.
Антиген, адсорбированный на ГАП, получают по способу, описанному выше, с надлежащими видоизменениями, допускающими получение больших количеств. Адсорбированный на гидроксиапатите антиген или адсорбированную смесь антигенов готовят в физиологически приемлемом носителе, и либо наносят непосредственно, либо вводят в слизистую поверхностную ткань, например, наносят на оральную, назальную, ректальную или (одновременно или по отдельности) вагинальную поверхности. Препарат вводят в виде аэрозоли, суспензии, капсулы или (одновременно или по отдельности) суппозитория. Специалисты, работающие в этой области, знают приемы составления таких носителей известными способами.
Изобретение также может быть использовано для изготовления 1gA-продуцирующим гибридом. Такие гибридомы легко получают, производя у млекопитающего провакационную пробу, например, нанося описанный выше состав на поверхности слизистой оболочки, а затем извлекая лимфоидную клетку из слизистой оболочки пейеровых бляшек или иной слизистой оболочки, которая является богатой лимфоидной тканью и, далее сращивая лимфоидную клетку с миеломной клеткой известными способами. См. , например, упомянутую выше и одновременно поданную совместную патентную заявку США с серийным номером 07/510161.
Следующие примеры приведены с целью иллюстрации, но не ограничения рамок изобретения.
Пример 1.
ГАП в количестве 2 г (фирма Calbiochem), суспендированный в 20 мл фосфатно-солевого буферного раствора, подвергают ультразвуковой обработке посредством соникатора со щупом в течение 30 мин при комнатной температуре с настройкой на высокочастотную область (140, скважность 80%) ячеечного разрушающего устройства типа Microson (фирма Heat Systems Ultrasonics Inc., г. Фармингдейл, шт. Нью-Йорк). После ультразвуковой обработки средний размер кристаллов составлял примерно 0,01 мкм на 0,1 мкм (установлено методом электронной микроскопии). Результат ультразвуковой обработки может быть адекватным образом проконтролирован спектрофотометрически. Например, оптическая плотность (замеренная на 650 нм) у суспензии с концентрацией 2 мг/мл перед ультразвуковой обработкой составляла 0,108 единиц по шкале оптической плотности, а после уменьшения размера кристаллов (как это описано выше) она возрастала до 2,060 единиц.
Пример 2.
Кристаллы ГАП указанного размера, покрытые до насыщения белками различных размеров, меняющихся в диапазоне от 65 кДа (альбумин) до 450 кДа (ферритин), вводят в кишечную полость мышей и кроликов, подвергая избирательному связыванию и транспортированию М-клетками пейеровой бляшки. Этим способом можно эффективно подавать белки к клеткам слизистой иммунной системы в корпускулярной иммуногенной форме.
Оральную иммунизацию мыши весом 25 г проводят следующим образом. Небольшое количество (например, 30 мкг) белка, находящегося в 200 мкл фосфатно-солевого буферного раствора, смешивают с надлежащим количеством (например, 1 мг гидроксиапатита на 30 мкг белка) предварительно обработанного ультразвуком и промытого гидроксиапатита. Смесь перемешивают в течение одного часа при 4oC, и гидроксиапатит затем осаждают центрифугированием в течение 2 мин со скоростью 10000 об/мин в микроцентрифуге. Остаток от центрифугирования вновь суспендируют круговым движением или воздействием ультразвука в 200 мкл воды, которая может содержать буферную смесь, позволяющую нейтрализовать желудочную кислоту.
Пример 3.
В качестве испытуемого иммуногена используют ферритин из селезенки лошадей (Polysciences Cat #00217), так как этот растворимый белок не прилепает к слизистой кишечника, и требуется ряд больших пероральных доз (приблизительно 2 мг) для образования поддающегося измерению s1gA в кишечных секретах мыши. Ферритин адсорбируют на обработанном ультразвуком гидроксиапатите в соотношении 1 мг ферритина на 2 мг ГАП и вводят внутрижелудочно мышам как 3 дозы в дни 0, 10 и 20. Каждая доза содержит 2 мг ферритина, 4 мг ГАП, суспендированного в 0,5 мл 0,1 М NaHCO3, и 5 мкг холерного токсина как адъюванта. Контрольные мыши получают 2 мг ферритина и холерного токсина, как указано выше, но без ГАП. Вторую контрольную группу мышей не обрабатывают. Эксперимент проводят на трех группах мышей по пять мышей в каждой. Мышей умерщвляют на 28-й день, получают сыворотку и анализируют содержимое кишечника и методикой ELISA на антиферриновый 1gA.
Пример 4.
Рекомбинантный слитый белок используют как второй испытуемый антиген для того, чтобы продемонстрировать полезность ГАП как носителя для рекомбинантных антигенов. Рекомбинантный слитый белок получают в E.coli. Этот белок с мол. м. 58 кД состоит из фрагмента размером 180 аминокислот белка gp120 оболочки ВИЧ, связанного с бактериальной триптофанэстеразой. Сырой препарат р58 выделяют из бактериальной культуры, вызывая лизис бактерий и получая белковый осадок с использованием стандартных методик. Белок р58 извлекают из бактериальных лизатов в виде "тел включения", которые относительно нерастворимы и образуют агрегаты, 30 мг р58 адсорбируют на 1 г обработанного ультразвуком ГАП, суспендированного в 9 мл 0,1М NaHCO3. Мышам дают три внутрижелудочных дозы в дни 0, 10 и 20. Каждая доза содержит 2 мг р58 на ГАП и 5 мкг холерного токсина как адъюванта в 0,5 мл 0,1М NaHCO3. Контрольные мыши получают 2 мг р58 в указанном выше растворе, но без ГАП. В каждой из этих двух групп по пять мышей. Пробы сыворотки и содержимого кишечника отбирают на 28-й день и анализируют ELISA на присутствие анти-р58 1gA.
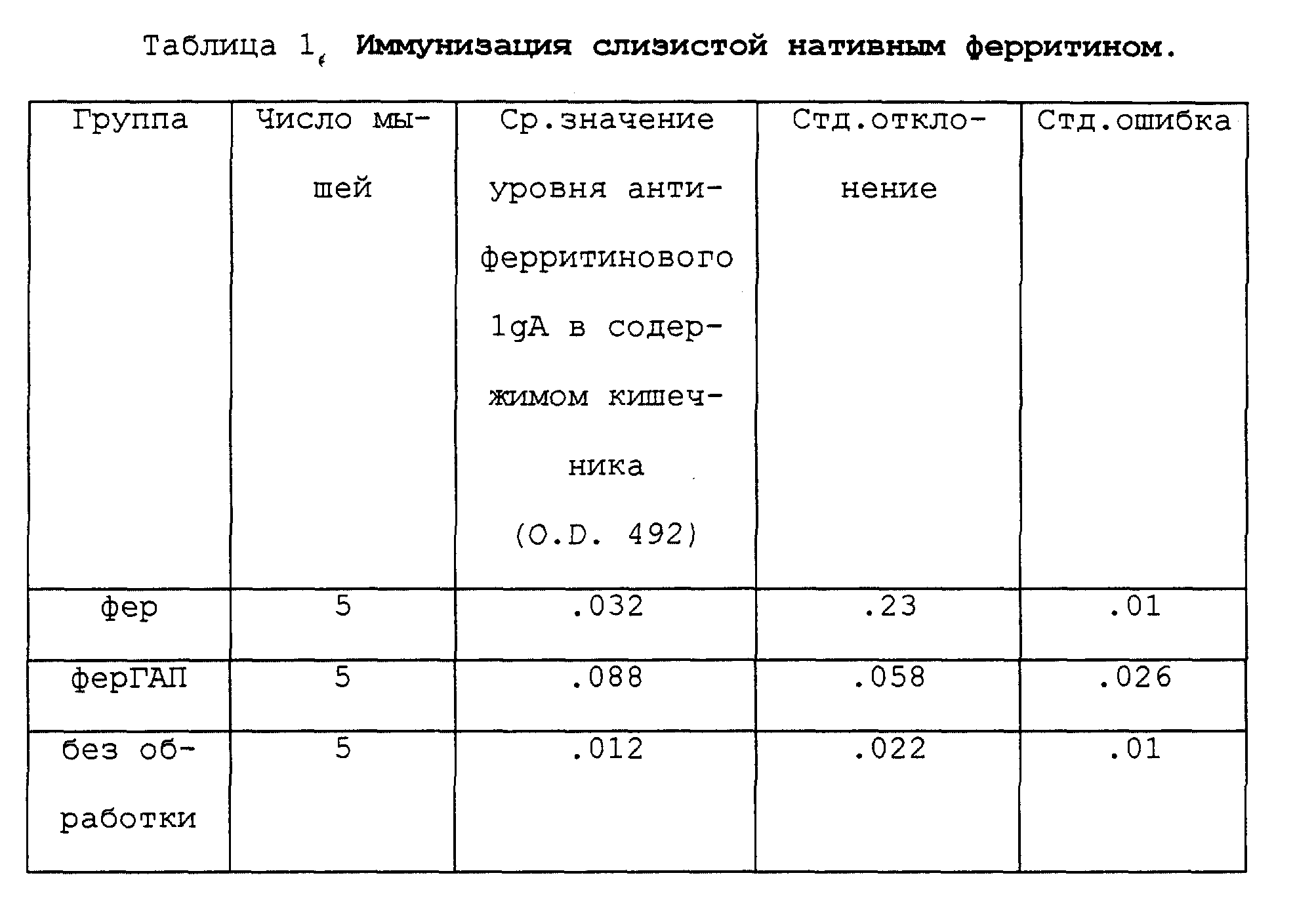
Результаты, полученные согласно примеру 3 и приведенные в табл. 1 показывают, что присутствие ГАП связано по меньшей мере с двукратным повышением внутрикишечных уровней секретированного 1gA, направленного против ферритина.
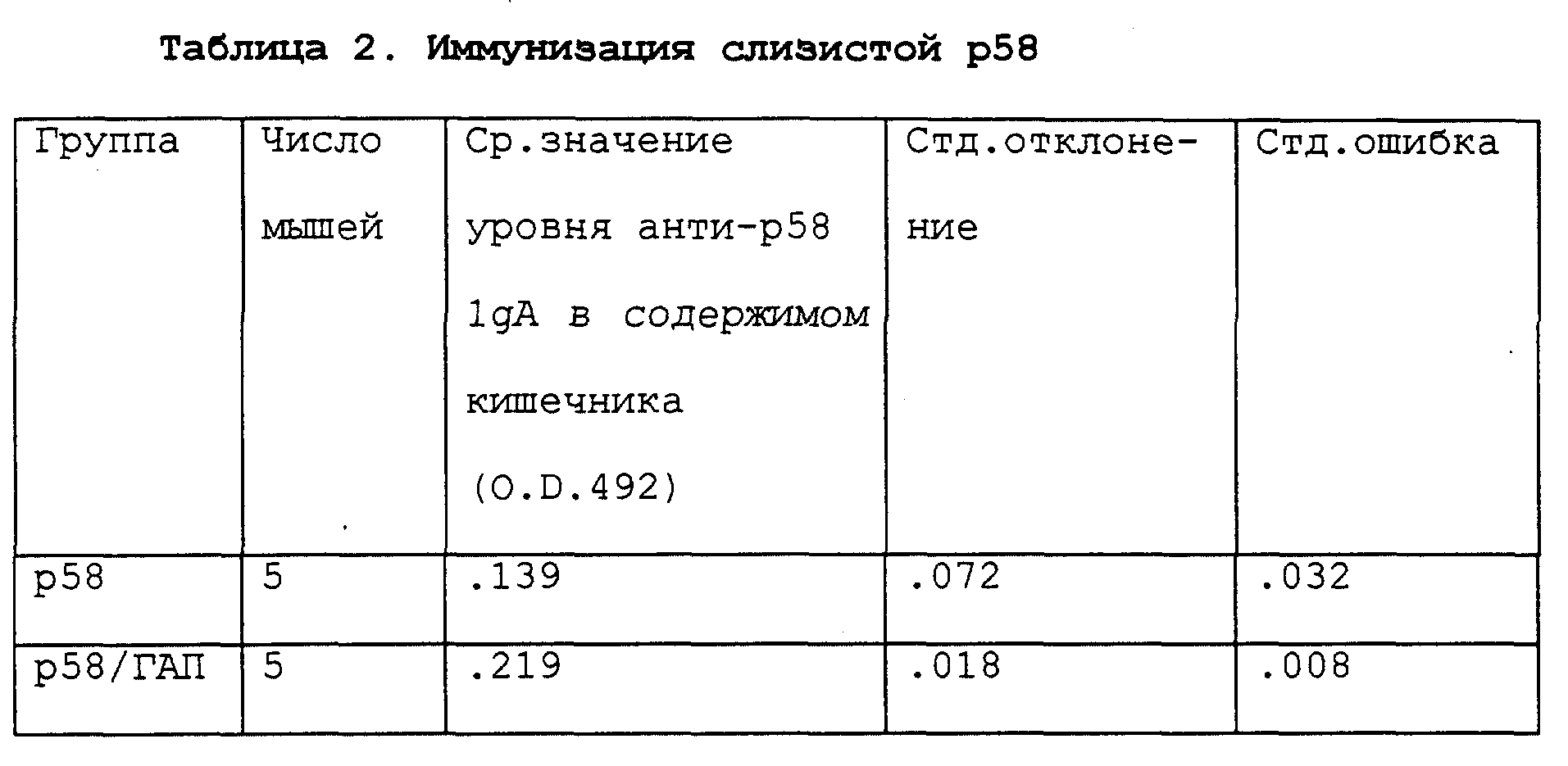
Результаты, полученные согласно примеру 4 и приведенные в табл. 2 показывают, что присутствие ГАП значительно увеличивает внутрикишечные уровни 1gA-антител, направленных против слитого белка. Степень усовершенствования, привносимого ГАП, менее заметна, чем для ферритина, возможно, из-за того, что агрегаты слитого белка сами по себе являются относительно эффективными иммуногенами слизистой.
Статистическую значимость результатов с ферритином (пример 3) оценивают, используя дисперсионный анализ (соответствующий экспериментам с 3 или более группами). Статистическую значимость результатов с р58 (пример 4) оценивают, используя Т-тест (соответствующий экспериментам с 2 группами). Эти тесты разработаны для определения вероятности того, насколько наблюдаемые величины могли быть получены случайно. Как это принято в биологических науках, если эта вероятность менее 5% (р < 5), следует заключить, что наблюдаемые различия несущественны. При использовании такого критерия измеренный ответ (специфическая секреция 1gA в содержимом кишечника) значительно выше при включении ГАП как с р58 (р < 0,03), так и с ферритином (p < 0,05).
Реферат
Изобретение относится к медицине, а именно к области иммунологии, и касается композиции для индукции иммунной реакции у млекопитающего и способа введения млекопитающему активного ингредиента. Задача изобретения заключается в разработке метода пассивной иммунной защиты через слизистую оболочку. Сущность изобретения заключается в создании композиции, содержащей активный ингредиент и гидроксиапатит в виде микрокапсул размером 0,01 - 1 мкм, данную композицию наносят на слизистую поверхность. Композиция и способ обеспечивают инициирование образования антител класса JgA. 2 с. и 2 з.п. ф-лы, 2 табл. , 1 ил.

Комментарии