Нуклеиновая кислота, содержащая или кодирующая структуру "стебель-петля" гистонов и последовательность поли(а) или сигнал полиаденилирования, для повышения экспрессии кодируемого патогенного антигена - RU2639528C2
Код документа: RU2639528C2
Чертежи






















































Описание
Настоящее изобретение относится к последовательности нуклеиновой кислоты, содержащей или кодирующей кодирующую область, кодирующую по меньшей мере один пептид или белок, содержащий патогенный антиген или его фрагмент, вариант или производное, по меньшей мере одну структуру "стебель-петля" гистонов и последовательность поли(А) или сигнал полиаденилирования. Кроме того, настоящее изобретение относится к применению нуклеиновой кислоты для повышения экспрессии указанного кодируемого пептида или белка. Также описано применение для получения фармацевтической композиции, в частности, вакцины, например, для применения для лечения инфекционных заболеваний. Настоящее изобретение, кроме того, относится к способу повышения экспрессии пептида или белка, содержащего патогенный антиген или его фрагмент, вариант или производное, используя нуклеиновую кислоту, содержащую или кодирующую структуру "стебель-петля" гистонов и последовательность поли(А) или сигнал полиаденилирования.
Целью усиления приобретенного иммунитета посредством вакцинации является обеспечение эффективного ответа на специфичные антигены, присутствующие в патогенных организмах in vivo. Обычные способы вакцинации с использованием живых аттенуированных или убитых нагреванием патогенных организмов были успешными для профилактики и лечения таких инфекционных заболеваний, как натуральная оспа, полиомиелит и дифтерия, но существует множество заболеваний, для которых не существует эффективной вакцины (например, малярия и ВИЧ), или при которых доступная вакцина обеспечивает только временную или частичную защиту (например, холера и грипп). Новые подходы направлены на доставку выбранных антигенов к субпопуляциям антиген-презентирующих клеток и придание иммунной системы направления иммунного ответа по типу Th1 и/или Th2, связанного с защитой от конкретного патогенного организма. Эти узконаправленные подходы также могут приводить к разработке терапевтических вакцин, способных устранять некоторые виды иммунодефицита, индуцируемые патогенными микроорганизмами для ускользания от механизмов иммунологического надзора (Gamvrellis, A., D. Leong et al. (2004), Immunology and Cell Biology 82, 506-516). Одним из этих новых подходов является генетическая вакцинация.
Генная терапия и генетическая вакцинация представляют собой способы молекулярной медицины, которые уже зарекомендовали себя в лечении и профилактики заболеваний и, как правило, демонстрируют значительный эффект в повседневной медицинской практике, в частности, для лечения заболеваний, как указано выше. Оба способа, генная терапия и генетическая вакцинация, основаны на введении в клетки или ткани пациента нуклеиновых кислот и дальнейшем процессинге информации, кодируемой нуклеиновой кислотой, которую ввели в клетки или ткани, то есть (белковой) экспрессии желаемых полипептидов.
При генотерапевтических подходах, как правило, используют ДНК, хотя в недавних разработках также появилась информация об использовании РНК. Важно отметить, что во всех этих генотерапевтических подходах мРНК действует как посредник для информации о последовательности кодируемого белка, вне зависимости от того, используется ДНК или вирусная РНК или мРНК.
Как правило, РНК считают нестабильной молекулой: РНКазы встречаются повсеместно и известно, что они трудно поддаются инактивации. Кроме того, РНК химически более лабильна, чем ДНК. Таким образом, вероятно является неожиданностью тот факт, что "состояние по умолчанию" для мРНК в эукариотической клетке характеризуется относительной стабильностью и для разрушения отдельных мРНК необходимы специфические сигналы. Основной причиной этого обнаружения, по-видимому, является тот факт, что разрушение мРНК в клетках катализируют практически только экзонуклеазы. Однако концы эукариотических мРНК защищены от этих ферментов специфическими концевыми структурами и связанными с ними белками: кэпом m7GpppN на 5'-конце и, как правило, последовательностью поли(А) на 3'-конце. Таким образом, удаление двух концевых модификаций считают лимитирующим скорость разрушения мРНК. Хотя в 3'-UTR мРНК альфа-глобина охарактеризован стабилизирующий элемент, последовательности РНК, воздействующие на функциональный цикл эукариотических мРНК, как правило, действуют как промотор разрушения, как правило, ускоряя деаденилирование (обзор Meyer, S., С. Temme, et al. (2004), Crit Rev Biochem Mol Biol 39(4): 197-216).
Как указано выше, 5'-концы эукариотических мРНК, как правило, посттранскрипционно модифицированы метилированной кэпирующей структурой, например, m7GpppN. Кроме ее роли в сплайсинге, стабилизации и транспорте РНК, кэпирующая структура значительно повышает привлечение субъединицы 40S рибосомы к 5'-концу мРНК при инициации трансляции. Для реализации последней функции требуется распознавание кэпирующей структуры комплексом факторов инициации эукариот eIF4F. Последовательность поли(А) дополнительно стимулирует трансляцию посредством повышенного привлечения субъединицы 4 OS к мРНК, эффект, требующий вмешательства связывающего поли(А) белка (РАВР). Недавно было показано, что в свою очередь РАВР физически взаимодействует с eIF4G, который является частью связанного с кэпом комплекса eIF4F. Таким образом, была постулирована модель закрытой петли инициации трансляции на копированной полиаденилированной мРНК закрытой петли (Michel, Y.М., D. Poncet, et al. (2000), J Biol Chem 275(41): 32268-76).
Такой последовательностью поли(A), которую добавляют на их 3'-конец повсеместно встречающаяся система расщепления/полиаденилирования, заканчиваются почти все эукариотические мРНК. Наличие последовательности поли(А) на 3'-конце является одной из наиболее распознаваемых характеристик эукариотических мРНК. После расщепления большинство пре-мРНК, за исключением зависимых от репликации транскриптов гистонов, получают полиаденилированный хвост. В этом контексте, процессинг 31-конца представляет собой ядерный совместный с транскрипцией процесс, который способствует транспорту мРНК из ядра в цитоплазму и влияет на стабильность и трансляцию мРНК.
Формирование 3'-конца происходит в двухстадийной реакции под управлением системы расщепления/полиаденилирования и зависит от присутствия двух элементов последовательности в предшественниках мРНК (пре-мРНК), высококонсервативного гексануклеотида AAUAAA (сигнала полиаденилирования) и расположенной ниже
последовательности, богатой G/U. На первой стадии происходит расщепление пре-мРНК между двумя этими элементами. На второй стадии, тесно связанной с первой стадией, происходит достройка вновь сформированного 3'-конца посредством добавления последовательности поли(А), состоящей из 200-250 аденилатов, которые затем влияют на все аспекты метаболизма мРНК, включая экспорт, стабильность и трансляцию мРНК (Dominski, Z. и W.F. Marzluff (2007), Gene 396(2): 373-90).
Единственным известным исключением из этого правила являются зависимые от репликации мРНК гистоны, которые вместо последовательности поли(А) заканчиваются структурой "стебель-петля" гистонов. Примеры последовательностей структуры "стебель-петля" гистонов описаны в Lopez et al. (Davila Lopez, M., & Samuelsson, T. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10.126l/rna.782308).
Как правило, за структурами "стебель-петля" в пре-мРНК гистонов расположена последовательность, богатая пуринами, известная как нижерасположенный элемент гистонов (HDE). Эти пре-мРНК подвергаются процессингу в ядре посредством одного эндонуклеолитического расщепления приблизительно на 5 нуклеотидов ниже структуры "стебель-петля", катализируемого мяРНП U7 посредством спаривания оснований мяРНК U7 с HDE.
Последовательность 3'-UTR, содержащую структуру "стебель-петля" гистонов и нижерасположенный элемент гистонов (HDE) (участок связывания мяРНП U7), как правило, обозначают как 3'-сигнал процессинга гистонов (см. например, Chodchoy, N., N.В. Pandey, et al. (1991). Mol Cell Biol 11(1): 497-509).
Из-за необходимости упаковки вновь синтезированной ДНК в хроматин, синтез гистонов контролируется согласованно с клеточным циклом. Повышенный синтез гистоновых белков в течение S-фазы достигается посредством активации транскрипции генов гистонов, а также посттранскрипционной регуляции уровней мРНК гистонов. Можно показать, что структура "стебель-петля" гистонов необходима для всех посттранскрипционных стадий регуляции экспрессии гистонов. Она необходима для эффективного процессинга, экспорта мРНК в цитоплазму, помещения в полирибосомы и регуляции стабильности мРНК.
В указанном выше случае идентифицирован белок 32 кДа, который в ядре и цитоплазме связан со структурой "стебель-петля" гистонов на 3'-конце мРНК гистонов. Уровень экспрессии этого связывающего структуру "стебель-петля" белка (SLBP) регулируется клеточным циклом и наибольшим является в течение S-фазы, когда повышены уровни мРНК гистонов. SLBP необходим для эффективного 3'-концевого процессинга пре-мРНК гистонов посредством мяРНП U7. После завершения процессинга SLBP остается связанным со структурой "стебель-петля" на конце зрелых мРНК гистонов и стимулирует их трансляцию в гистоновые белки в цитоплазме. (Dominski, Z. and W.F. Marzluff (2007), Gene 396(2): 373-90). Интересен тот факт, что РНК-связывающий домен SLBP является консервативным у всех представителей метазоа и протозоа (Davila Lopez, М., & Samuelsson, Т. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10.1261/rna.782308), и можно показать, что его связывание с последовательностью структуры "стебель-петля" гистонов зависит от структуры "стебель-петля", и что минимальный участок связывания содержит по меньшей мере 3 нуклеотида с 5'-конца и 2 нуклеотида с 3'-конца от структуры "стебель-петля" (Pandey, N.В., et al. (1994), Molecular and Cellular Biology, 14(3), 1709-1720 и Williams, A.S., & Marzluff, W.F., (1995), Nucleic Acids Research, 23(4), 654-662).
Хотя гены гистонов, как правило, классифицируют как "зависимые от репликации", дающие начало мРНК, оканчивающимся структурой "стебель-петля" гистонов, или "заместительного типа", дающие начало мРНК, несущим вместо этого поли(А)-хвост, в некоторых редких случаях идентифицированы природные мРНК, содержащие и структуру "стебель-петля" гистонов и поли(А) или олиго(А) с 3'-конца. Sanchez et al. изучали действие природных олиго(А)-хвостов, добавляемых с 3'-конца от структуры "стебель-петля" гистонов в мРНК гистонов, при оогенезе Xenopus с использованием в качестве репортерного белка люциферазы и выявили, что олиго(А)-хвост является активной частью механизма репрессии трансляции, который осуществляет сайленсинг мРНК гистонов при оогенезе, и его удаление является частью механизма, который активирует трансляцию мРНК гистонов (Sanchez, R. and W.F. Marzluff (2004), Mol Cell Biol 24(6): 2513-25).
Кроме того, исследовали необходимые условия регуляции зависимых от репликации гистонов на уровне процессинга пре-мРНК и стабильности мРНК, используя искусственные конструкции, кодирующие маркерный белок альфа-глобин, используя преимущество того факта, что ген глобина, в отличие от безинтронных генов гистонов, содержит интроны. Для этой цели получали конструкции, в которых после кодирующей последовательности альфа-глобина располагалась сигнальная последовательность структуры "стебель-петля" гистонов (структура "стебель-петля" гистонов с последующим нижерасположенным элементом гистонов) и сигнал полиаденилирования (Whitelaw, Е., et al. (1986). Nucleic Acids Research, 14(17), 7059-7070.; Pandey, N.В., & Marzluff, W.F. (1987). Molecular and Cellular Biology, 7(12), 4557-4559.; Pandey, N. В., et al. (1990). Nucleic Acids Research, 18(11), 3161-3170).
В другом подходе Lüischer et al. исследовали зависимую от клеточного цикла регуляцию гена рекомбинантного гистона Н4. Получали конструкции, в которых после кодирующей последовательности Н4 располагалась сигнальная последовательность структуры "стебель-петля" и сигнал полиаденилирования, два сигнала процессинга, независимо разделенные кодирующей последовательностью галактокиназы (Liischer, В. et al., (1985). Proc. Natl. Acad. Sci. USA, 82(13), 4389-4393).
Кроме того, Stauber et al. идентифицировали минимальную последовательность, необходимую для зависимой от клеточного цикла регуляции на уровне мРНК гистона Н4. Для этих исследований использовали конструкции, содержащие кодирующую последовательность селективного маркера ксантин:гуанин фосфорибозилтрансферазы (GPT), предшествующую сигнальной последовательности структуры "стебель-петля" гистонов со следующим за ней сигналом полиаденилирования (Stauber, С.et al., (1986). EMBO J, 5(12), 3297-3303).
Исследуя процессинг пре-мРНК гистонов Wagner et al. идентифицировали факторы, необходимые для расщепления пре-мРНК гистонов, с использованием репортерной конструкции, где между сигнальной последовательностью структуры "стебель-петля" гистонов и сигналом полиаденилирования помещен EGFP так, что EGFP экспрессируется только в случае нарушения процессинга пре-мРНК гистонов (Wagner, Е.J. et al., (2007). Mol Cell 28(4), 692-9).
Следует отметить, что трансляция полиаденилированной мРНК, как правило, требует, чтобы 3'-последовательность поли(А) сблизилась с 5'-кэпом. Это опосредовано белок-белковым взаимодействием между связывающим поли(А) белком и эукариотическим фактором инициации eIF4G. В отношении зависимых от репликации мРНК гистонов был обнаружен аналогичный механизм. Для этого случая Gallie et al. показали, что структура "стебель-петля" гистонов функционально сходна с последовательностью поли(А) в том, что увеличивает эффективность трансляции и одновременно зависит от 5'-кэпа для обеспечения эффективного уровня трансляции. Они показали, что структура "стебель-петля" гистонов необходима и достаточна для усиления трансляции репортерной мРНК трансфицированных клеток яичника китайского хомяка, но для оптимального функционирования она должна находиться на 3'-конце. Таким образом, подобно поли(А)-хвосту других мРНК, 3'-конец этих мРНК гистонов, по-видимому, необходим для трансляции in vivo и функционально аналогичен поли(А)-хвосту (Gallie, D.R., Lewis, N.J., & Marzluff, W.F. (1996), Nucleic Acids Research, 24(10), 1954-1962).
Кроме того, можно показать, что SLBP связан с цитоплазматической мРНК гистонов и необходим для ее трансляции. Хотя SLBP не взаимодействует с eIF4G напрямую, домен, необходимый для трансляции мРНК гистонов, взаимодействует с недавно выявленным белком SLIP1. На следующей стадии, SLIP1 взаимодействует с eIF4G и обеспечивает циркуляризацию мРНК гистонов и поддержку эффективной трансляция мРНК гистонов по механизму, сходному с трансляцией полиаденилированных мРНК.
Как указано выше, в генотерапевтических подходах для переноса кодирующей информации в клетку в норме используют ДНК, которая затем транскрибируется в мРНК, несущую природные элементы мРНК, в частности, 5'-копирующую структуру и 3'-последовательность поли(А), для экспрессии кодируемого терапевтического или антигенного белка.
Однако во многих случаях экспрессирующие системы на основе введения таких нуклеиновых кислот в клетки или ткани пациента и последующей экспрессии желаемых полипептидов, кодируемых этими нуклеиновыми кислотами, не демонстрируют желаемого или даже необходимого уровня экспрессии, которым мог бы обеспечить эффективную терапию, вне зависимости от того используют ли ДНК или РНК.
В уровне техники ранее принимались различные попытки повышения выхода экспрессии кодируемого белка, в частности, используя улучшенные экспрессирующие системы, in vitro и/или in vivo. Способы повышения экспрессии, в основном описанные в уровне техники, как правило, основаны на использовании векторов экспрессии или кассет, содержащих специфические промоторы и соответствующие регуляторные элементы. Так как эти векторы экспрессии или кассеты, как правило, ограничены конкретными клеточными системами, то эти экспрессирующие системы необходимо адаптировать для использования в других клеточных системах. Затем такие адаптированные экспрессирующие векторы или кассеты, как правило, трансфицировали в клетки и, как правило, обрабатывали в зависимости от конкретной линии клеток. Таким образом, предпочтение отдают преимущественно тем молекулам нуклеиновой кислоты, которые способны экспрессировать кодируемые белки в клетке-мишени посредством систем, характерных для клетки, вне зависимости от промоторов и регуляторных элементов, которые специфичны для конкретных типов клеток. В этом контексте, можно различать стабилизирующие мРНК элементы и элементы, которые увеличивают эффективность трансляции мРНК.
мРНК с оптимизированной кодирующей последовательностью и в основном подходящие для такой цели описаны в заявке WO 02/098443 (CureVac GmbH). Например, в WO 02/098443 описаны мРНК, стабилизированные в основной форме и оптимизированные для трансляция кодирующих областей. В WO 02/098443, кроме того, описан способ определения модификаций последовательности. В WO 02/098443 дополнительно описаны возможности замены адениновых и урациловых нуклеотидов в последовательностях мРНК для повышения содержания в последовательностях гуанина/цитозина (G/C). По WO 02/098443 такие замены и адаптации с повышением содержания G/C можно использовать для генотерапевтических приложений, а также для генетических вакцин для лечения злокачественных опухолей или инфекционных заболеваний. В этом контексте, в WO 02/098443, как правило, указаны последовательности в виде основных последовательностей для таких модификаций, в которых модифицированная мРНК кодирует по меньшей мере один биологически активный пептид или полипептид, который у пациента, получаемого лечение, например, не транслируется или транслируется некорректно или с дефектами. Альтернативно, в WO 02/098443 предоставлены мРНК, кодирующие антигены, например, патогенные антигены или вирусные антигены, в виде основных последовательностей для таких модификаций.
В дополнительном подходе в отношении повышения экспрессии кодируемого белка в заявке WO 2007/036366 описано положительное действие длинных последовательностей поли(А) (особенно длиннее 120 п. н.) и комбинации по меньшей мере двух 3'-нетранслируемых областей гена бета-глобина на стабильность и активность трансляции мРНК.
Однако хотя во всех этих последних документах уровня техники были уже сделаны попытки получить достаточно эффективные инструменты для генотерапевтических подходов и дополнительно повысить стабильность и активность трансляции мРНК, все еще остается проблема по существу меньшей стабильности при использовании РНК-вакцин по сравнению с ДНК-вакцинами и с генотерапевтическими подходами на основе ДНК. Таким образом, в данной области существует необходимость получения улучшенных инструментов для генотерапевтических подходов и генетической вакцинации или как дополнительная терапия для общепринятых способов лечения, как указано выше, которые позволят обеспечить кодируемыми белками in vivo, например, посредством дополнительно увеличенной стабильности и/или активности трансляции мРНК, предпочтительно, для генной терапии и генетической вакцинации.
Кроме того несмотря на общий прогресс в данной области, эффективная экспрессия кодируемого пептида или белка в бесклеточных системах, клетках или организмах (рекомбинантная экспрессия) все еще остается серьезной проблемой.
Таким образом, целью настоящего изобретения является получение дополнительных и/или альтернативных способов повышения экспрессии кодируемого белка, предпочтительно, за счет дополнительной стабилизации мРНК и/или повышения эффективности трансляции такой мРНК в отношении таких нуклеиновых кислот, которые, как известно из уровня техники, используются для генетической вакцинации для терапевтического или профилактического лечения инфекционных заболеваний.
Эту задачу решают благодаря объектам, перечисленным в приложенной формуле изобретения. В частности, целью настоящего изобретения является в соответствии с первым аспектом последовательность нуклеиновой кислоты по изобретению, содержащая или кодирующая
a) кодирующую область, кодирующую по меньшей мере один пептид или белок, который содержит патогенный антиген или его фрагмент, вариант или производное;
b) по меньшей мере одну структуру "стебель-петля" гистонов и
с) последовательность поли(А) или сигнал полиаденилирования,
предпочтительно, для повышения экспрессии указанного кодируемого пептида или белка.
Альтернативно, в соответствии с настоящем изобретением во всех его аспектах и вариантах осуществления можно использовать любую подходящую последовательность структуры "стебель-петля", отличающуюся от последовательности структуры "стебель-петля" гистонов (получаемую из генов гистонов, в частности, генов гистонов семейств H1, Н2А, Н2В, Н3 и Н4).
В этом контексте особенно предпочтительно, что нуклеиновую кислоту по изобретению в соответствии с первым аспектом настоящего изобретения получают, по меньшей мере частично, посредством синтеза ДНК или РНК, предпочтительно, как описано в настоящем документе, или нуклеиновая кислота представляет собой выделенную нуклеиновую кислоту.
Настоящее изобретение основано на неожиданном обнаружении авторами настоящего изобретения, что комбинация последовательности поли(А) или сигнала полиаденилирования и по меньшей мере одной структуры "стебель-петля" гистонов, несмотря на то, что обе в природе являются альтернативными механизмами, действует синергически, так как эта комбинация повышает экспрессию белка значительно выше уровня, наблюдаемого при использовании любого из элементов отдельно. Синергическое действие комбинации поли(А) и по меньшей мере одной структуры "стебель-петля" гистонов отличают вне зависимости от порядка поли(А) и структуры "стебель-петля" гистонов и вне зависимости от длины последовательности поли(А).
Таким образом, особенно предпочтительной является последовательность нуклеиновой кислоты по изобретению, которая содержит или кодирует а) кодирующую область, кодирующую по меньшей мере один пептид или белок, который содержит патогенный антиген или его фрагмент, вариант или производное; b) по меньшей мере одну структуру "стебель-петля" гистонов и с) последовательность поли(А) или последовательность полиаденилирования; предпочтительно, для повышения уровня экспрессии указанного кодируемого пептида или белка, где кодируемый белок, предпочтительно, не является гистоновым белком, в частности, не является гистоновым белком гистоновых семейств Н4, Н3, Н2А и/или Н2В или его фрагментом, производным или вариантом, сохраняющим гистоновую (гистоноподобную) функцию), а именно, возможность формирования нуклеосомы. Также кодируемый белок, как правило, не является линкерным гистоновым белком семейства гистонов H1. Как правило, молекула нуклеиновой кислоты по изобретению не содержит никаких регуляторных сигнальных последовательностей (с 5'-конца и/или, особенно, с 3'-конца от гена гистона мышь, в частности, гена гистона Н2А мыши, и, кроме того, наиболее предпочтительно, гена гистона Н2А614 мыши. В частности, она не содержит гистон со структурой "стебель-петля" и/или сигнальную последовательность процессинга гистона со структурами "стебель-петля" из гена гистона мыши, в частности, гена гистона Н2А мыши и, наиболее предпочтительно, гена гистона Н2А614 мыши.
Также нуклеиновая кислота по изобретению, как правило, не кодирует в своем элементе репортерный белок (например, люциферазу, GFP, EGFP, β-галактозидазу, в частности, EGFP), галактокиназу (galK) и/или маркерный или селективный белок (например, альфа-глобин, галактокиназу и ксантин:гуанинфосфорибозилтрансферазу (GPT)) или бактериальный репортерный белок, например, хлорамфеникол ацетилтрансферазу (CAT) или другие белки устойчивости к бактериальным антибиотикам, например, происходящие из бактериального гена neo.
Как правило, понимают, что репортерный, маркерный или селективный белок не является антигенным белком по изобретению. Репортерные, маркерные или селективные белки или кодирующие их гены широко используют в качестве инструмента исследования у бактерий, в культуре клеток, у животных или растений. Они обеспечивают экспрессирующим их организмам (предпочтительно, гетерологично) возможность простоты идентификации для измерения или что обеспечивает селекцию. Конкретно, маркерные или селективные белки обладают селективным действием. Как правило, такие селективные, маркерные или репортерные белки не встречаются у людей или других млекопитающих в норме, но их получают из других организмов, в частности, из бактерий или растений. Таким образом, белки с селективным, маркерным или репортерным действием, происходящие из низших видов (например, бактерий), предпочтительно, исключают из подразумеваемых в качестве "антигенного белка" по настоящему изобретению. В связи с этим понимают, что антигенный белок соответствует белку, который запускает иммунную реакцию, которая обеспечивает индивидууму иммунологическую защиту от инфекции организмом или вирусом, которые вызывают патологическую реакцию у индивидуума, приводящую к болезни. В частности, селективный, маркерный или репортерный белок обеспечивают идентификацию трансформированных клеток посредством анализов in vitro, например, на основе флуоресценции, или другими спектроскопическими способами и на основе устойчивости к антибиотикам. Подразумевают, таким образом, что, как правило, селективные, репортерные или маркерные гены, придающие такие свойства трансформированным клеткам, являются не патогенными антигенными белками по изобретению.
В любом случае, репортерные, маркерные или селективные белки, как правило, не проявляют никаких антигенных свойств в результате иммунного ответа (индивидуума, получаемого лечение) на патогенный антиген. Однако, если любой конкретный репортерный, маркерный или селективный белок вызывает такое действие (кроме своих репортерного, селективного или маркерного действия), в рамках настоящего изобретения, предпочтительно, подразумевают, что такой репортерный, маркерный или селективный белок не является "патогенным антигеном".
Напротив, патогенный антиген (в том числе, его фрагменты, варианты и производные), в частности, кроме генов гистонов семейств H1, Н2А, Н2В, Н3 и Н4, по настоящему изобретению, как правило, не проявляет селективного, маркерного или репортерного действия. Однако если любой конкретный "патогенный антиген" вызывает такое действие, то (кроме своих антигенных свойств), в рамках настоящего изобретения, предпочтительно, подразумевают, что такой патогенный антиген не является "селективным, маркерным или репортерным белком".
Наиболее предпочтительно, патогенный антиген по изобретению происходит из патогенных организмов, предпочтительно, бактерий или вирусов, проявляя иммунологическое действие. Как правило, такие антигены подходят под определение селективного, маркерного или репортерного белка.
Таким образом, предпочтительно, кодирующая область (а), кодирующая по меньшей мере один пептид или белок, является гетерологичной по меньшей мере (b) по меньшей мере одной структуре "стебель-петля" гистонов или, более широко, любой подходящей структуре "стебель-петля". Другими словами, "гетерологичный" в контексте настоящего изобретения означает, что по меньшей мере одна последовательность структуры "стебель-петля" не встречается в природе как (регуляторная) последовательность (например, как 3'-UTR) конкретного гена, кодирующего (патогенный) антигенный белок или пептид, элемента (а) нуклеиновой кислоты по изобретению. Таким образом, структура "стебель-петля" (гистонов) нуклеиновой кислоты по изобретению, предпочтительно, происходит из 3'-UTR гена, отличного от гена, содержащего кодирующую область элемента (а) нуклеиновой кислоты по изобретению. Например, кодирующая область элемента (а) не кодирует гистоновый белок или его фрагмент, вариант или производное (сохраняющие функцию гистонового белка), если нуклеиновая кислота по изобретению является гетерологичной, а кодирует любой другой пептид или последовательность (того же или другого вида), который проявляет биологическое действие, предпочтительно, антигенное действие, отличное от гистонового (гистоноподобного) действия, например, кодирует антигенный белок (проявляющий антигенное действие, например, запуская реакцию иммунной системы индивидуума, например, посредством реакции антителами, таким образом, обеспечивая действие нуклеиновой кислоты по изобретению в качестве вакцины, например, у млекопитающих, в частности, у людей.
В этом контексте особенно предпочтительна нуклеиновая кислота по изобретению в направлении от 5' к 3', которая содержит или кодирует:
a) кодирующую область, кодирующую по меньшей мере один пептид или белок, который содержит патогенный антиген или его фрагмент, вариант или производное;
b) по меньшей мере одну структуру "стебель-петля" гистонов, необязательно без нижерасположенного элемента гистона (HDE) с 3'-конца от структуры "стебель-петля" гистонов;
c) последовательность поли(А) или сигнал полиаденилирования.
Термин "нижерасположенный элемент гистона (HDE)" относится к полинуклеотидному участку, богатому пуринами, длиной приблизительно от 15 до 20 нуклеотидов с 3'-конца от природных структур "стебель-петля" гистонов, который представляет собой участок связывания мяРНК U7, вовлеченной в процессинг пре-мРНК гистонов в зрелую мРНК гистонов. Например, у морских ежей HDE представляет собой CAAGAAAGA (Dominski, Z. and W.F. Marzluff (2007), Gene 396(2): 373-90).
Кроме того, предпочтительно, чтобы нуклеиновая кислота по изобретению в первом аспекте настоящего изобретения, не содержала интронов.
В другом конкретном предпочтительном варианте осуществления последовательность нуклеиновой кислоты по изобретению в первом аспекте настоящего изобретения в направлении от 5'-конца к 3'-концу содержит или кодирует:
a) кодирующую область, предпочтительно, кодирующую по меньшей мере один пептид или белок, который содержит патогенный антиген или его фрагмент, вариант или производное;
с) последовательность поли(А) и
b) по меньшей мере одну структуру "стебель-петля" гистонов.
Последовательность нуклеиновой кислоты по изобретению по первому варианту осуществления настоящего изобретения содержит любую подходящую нуклеиновую кислоту, например, выбранную из любой (одноцепочечной или двухцепочечной) ДНК, предпочтительно, без ограничения ими, например, из геномной ДНК, плазмидной ДНК, одноцепочечных молекул ДНК, двухцепочечных молекул ДНК, или ее можно выбирать, например, из любых ПНК (пептидные нуклеиновые кислоты), или ее можно выбирать, например, из любой (одноцепочечной или двухцепочечной) РНК, предпочтительно, матричной РНК (мРНК); и т.д. Также последовательность нуклеиновой кислоты по изобретению может содержать вирусную РНК (вРНК). Однако последовательность нуклеиновой кислоты по изобретению может не быть вирусной РНК или может не содержать вирусной РНК. Более конкретно, последовательность нуклеиновой кислоты по изобретению может не содержать элементов вирусных последовательностей, например, вирусных энхансеров, или вирусных промоторов (например, не содержать инактивированного вирусного промотора или элементов последовательностей, более конкретно, не инактивированных посредством стратегий замен), или других элементов вирусных последовательностей, или последовательностей нуклеиновых кислот вирусов или ретровирусов. Более конкретно, последовательность нуклеиновой кислоты по изобретению может не быть ретровирусным или вирусным вектором или модифицированным ретровирусным или вирусным вектором.
В любом случае, последовательность нуклеиновой кислоты по изобретению может содержать или не содержать энхансерную и/или промоторную последовательности, которые могут быть модифицированными или нет или которые могут быть активированными или нет. Энхансер и/или промотор могут быть экспрессируемыми или неэкспрессируемыми у растений, и/или экспрессируемыми или неэкспрессируемыми у эукариот, и/или экспрессируемыми или неэкспрессируемыми у прокариот. Последовательность нуклеиновой кислоты по изобретению может содержать последовательность, кодирующую (самосплайсируемый) рибозим, или нет.
В конкретных вариантах осуществления последовательность нуклеиновой кислоты по изобретению может представлять собой или может содержать самореплицирующуюся РНК (репликон).
Предпочтительно, последовательность нуклеиновой кислоты по изобретению представляет собой плазмидную ДНК или РНК, в частности, мРНК.
В конкретных вариантах осуществления первого аспекта настоящего изобретения нуклеиновая кислота по изобретению представляет собой последовательность нуклеиновой кислоты, содержащуюся в нуклеиновой кислоте, подходящей для транскрипции in vitro, в частности, в подходящем векторе для транскрипции in vitro (например, в плазмиде или в линейной последовательности нуклеиновой кислоты, содержащей специфические промоторы для транскрипции in vitro, такие как промоторы Т3, Т7 или Sp6).
В дополнительных конкретных предпочтительных вариантах осуществления первого аспекта настоящего изобретения нуклеиновая кислота по изобретению содержится в нуклеиновой кислоте, подходящей для транскрипции и/или трансляции в экспрессирующей системе (например, в экспрессирующих векторе или плазмиде), в частности, в прокариотической (например, бактерии, такие как Е. coli) или эукариотической (например, клетки млекопитающих, такие как клетки СНО, дрожжевые клетки или клетки насекомых, или целые организмы, такие как растения или животные) экспрессирующей системе.
Термин "экспрессирующая система" означает систему (культуру клеток или целые организмы), которая подходит для продукции пептидов, белков или РНК, особенно мРНК (рекомбинантная экспрессия).
Последовательность нуклеиновой кислоты по изобретению в первом аспекте настоящего изобретения содержит или кодирует по меньшей мере одну структуру "стебель-петля" гистонов. В контексте настоящего изобретения такую структуру "стебель-петля" гистонов, как правило, получают из генов гистонов, и она содержит внутримолекулярное спаривание оснований двух соседних полностью или частично обратно комплементарных последовательностей, таким образом, формируя структуру "стебель-петля". Вообще, структура "стебель-петля", вне зависимости от того, является ли она структурой "стебель-петля" гистонов или нет, может встречаться в одноцепочечной ДНК или, более часто, в РНК. Структура также известна как шпилька или петля шпилька и, как правило, состоит из стебля и (концевой) петли в пределах непрерывной последовательности, где стебель формируется двумя соседними полностью или частично обратно комплементарными последовательностями, разделенными короткой последовательностью в качестве своего рода спейсера, который формирует петлю структуры "стебель-петля". Две соседних полностью или частично обратно комплементарных последовательности можно определять, например, как элементы структуры "стебля-петли" стебель1 и стебель2. Структура "стебель-петля" формируется, когда эти две соседних полностью или частично обратно комплементарных последовательности, например, элементы структуры "стебель-петля" стебель1 и стебель2, формируют пары оснований друг с другом, что приводит к образованию участка двухцепочечной последовательности нуклеиновой кислоты, содержащего на своем конце неспаренную петлю, сформированную короткой последовательностью, расположенной между элементами структуры "стебель-петля" стебель 1 и стебель2 на непрерывной последовательности. Таким образом, неспаренная петля, как правило, представляет собой область нуклеиновой кислоты, которая не способна к спариванию оснований ни с каким из этих элементов структуры "стебель-петля". Полученная в результате структура в форме леденца на палочке представляет собой ключевой структурный элемент многих вторичных структур РНК. таким образом формирование структуры "стебель-петля" зависит от стабильности образующихся областей стебля и петли, где первым необходимым условием, как правило, является присутствие последовательностей, которая может загибаться сама на себя с формированием спаренной двойной цепи. Стабильность спаренных элементов структуры "стебель-петля" определяется длиной, количеством содержащихся в ней несоответствий или выпетливаний (небольшое количество несоответствий, как правило, допустимо, особенно в большом двухцепочечном участке) и составом оснований спаренной области. В контексте настоящего изобретения, допустима длина петли от 3 до 15 оснований, хотя более предпочтительная оптимальная длина петли составляет 3-10 оснований, более предпочтительно, от 3 до 8, от 3 до 7, от 3 до 6 или, еще более предпочтительно, от 4 до 5 оснований, и наиболее предпочтительно, 4 основания. Длина последовательности стебля, формирующей двухцепочечную структуру, как правило, составляет от 5 до 10 оснований, более предпочтительно, - от 5 до 8 оснований.
В контексте настоящего изобретения, структура "стебель-петля" гистонов, как правило, происходит из генов гистонов (например, гены семейств гистонов H1, Н2А, Н2В, Н3, Н4) и содержит внутримолекулярное спаривание оснований двух соседних полностью или частично обратно комплементарных последовательностей, таким образом, формируя структуру "стебель-петля". Как правило, 3'-UTR структура "стебель-петля" гистонов представляет собой элемент РНК, вовлеченный в ядерно-цитоплазматический транспорт мРНК гистонов и в регуляцию стабильности и эффективности трансляции в цитоплазме. В мРНК генов гистонов многоклеточных отсутствует полиаденилирование и поли-А хвост, вместо этого 3'-концевой процессинг происходит в участке между этими высококонсервативными структурой "стебель-петля" и богатой пуринами областью приблизительно на 20 нуклеотидов ниже (нижерасположенный элемент гистона, или HDE). Структуру "стебель-петля" гистонов связывает связывающий структуру "стебель-петля" белок массой 31 кДа (SLBP, также называемый связывающий шпильку гистонов белок или НВР). Такие структуры "стебель-петля" гистонов, предпочтительно, используют в настоящем изобретении в комбинации с другими элементами и структурами последовательностей, которые не встречаются в природе (что означает у нетрансформированных живых организмов/клеток) в генах гистонов, но которые комбинируют - по изобретению - для получения искусственной, гетерологичной нуклеиновой кислоты. Таким образом, настоящее изобретение, в частности, основано на том открытии, что искусственная (неприродная) комбинация структуры "стебель-петля" гистонов с другими гетерологичными элементами последовательностей, которые не встречаются в генах гистонов или генах гистонов многоклеточных и выделены из функциональных и/или регуляторных областей последовательностей (влияющих на транскрипцию и/или трансляцию) генов, кодирующих белки, отличные от гистонов, обеспечивает благоприятное действие. Таким образом, в одном из аспектов изобретения предоставлена комбинация структуры "стебель-петля" гистонов с последовательностью поли(А) или последовательностью, представляющей сигнал полиаденилирования (с 3'-конца от кодирующей области), которая не встречается в генах гистонов многоклеточных. В другом предпочтительном аспекте изобретения в настоящем описании предоставлена комбинация структуры "стебель-петля" гистонов с кодирующей областью, кодирующей патогенный антиген, который предпочтительно, не встречается в генах гистонов многоклеточных (кодирующая область и последовательность структуры "стебель-петля" гистонов являются гетерологичными). Предпочтительно, если такие патогенные антигены вообще не встречаются у многоклеточных, а происходят из одноклеточных организмов, например, бактерий, или из вирусов. В еще одном дополнительном предпочтительном варианте осуществления все элементы (а), (b) и (с) нуклеиновой кислоты по изобретению являются гетерологичными друг другу и искусственно комбинированы из трех различных источников, например, кодирующая антиген область из бактерий или вируса, структура "стебель-петля" гистонов из гена гистона многоклеточного, а последовательность поли(А) или сигнал полиаденилирования, например, из гена многоклеточных, отличного от гена гистона.
Таким образом, структура "стебель-петля" гистонов представляет собой структуру "стебель-петля", как описано в настоящем документе, которая, если предпочтительно, функционально определена, проявляет/сохраняет свойство связывания с ее природным партнером по связыванию, связывающим структуру "стебель-петля" белком (SLBP, также называемым связывающим шпильку гистонов белком или НВР).
По настоящему изобретению последовательность структуры "стебель-петля" гистонов в соответствии с компонентом (b) по п. 1 может не происходить из гистонового белка мыши. Более конкретно, последовательность структуры "стебель-петля" гистонов может не происходить из гена гистона Н2А614 мыши. Также, нуклеиновая кислота по изобретению может не содержать ни последовательности структуры "стебель-петля" гистонов мыши, ни гена гистона Н2А614 мыши. Кроме того, последовательность нуклеиновой кислоты по изобретению может не содержать сигнал процессинга структуры "стебель-петля", более конкретно, сигнал процессинга гистонов мыши и, точнее говоря, может не содержать сигнал процессинга структуры "стебель-петля" H2kA614 мыши, даже если последовательность нуклеиновой кислоты по изобретению может содержать по меньшей мере один ген гистона млекопитающих. Однако по меньшей мере один ген гистона млекопитающих может не представлять собой SEQ ID NO:7 из WO 01/12824.
В одном из предпочтительных вариантов осуществления первого аспекта изобретения последовательность нуклеиновой кислоты по изобретению содержит или кодирует по меньшей мере одну последовательность структуры "стебель-петля" гистонов, предпочтительно, по меньшей мере по одной из следующих формул (I) или (II):
формула (I) (последовательность структуры "стебель-петля" без граничащих со стеблем элементов):

формула (II) (последовательность структуры "стебель-петля" с граничащими со стеблем элементами):

где:
граничащие со стеблем1 или стеблем2 элементы N1-6 представляют собой непрерывные последовательности из N в количестве от 1 до 6, предпочтительно, от 2 до 6, более предпочтительно, от 2 до 5, еще более предпочтительно, от 3 до 5, наиболее предпочтительно, от 4 до 5 или 5, где каждый N независимо от другого выбран из нуклеотидов, выбранных из A, U, Т, G и С или аналогов этих нуклеотидов;
стебель1 [N0-2GN3-5] является обратно комплементарным или частично обратно комплементарным с элементом стебель2 и представляет собой непрерывную последовательность длиной от 5 до 7 нуклеотидов;
где N0-2 представляет собой непрерывную последовательность из N в количестве от 0 до 2, предпочтительно, от 0 до 1, более предпочтительно, 1, где каждый N независимо от другого выбран из нуклеотидов, выбранных из A, U, Т, G и С или аналогов этих нуклеотидов;
где N3-5 представляет собой непрерывную последовательность из N в количестве от 3 до 5, предпочтительно, от 4 до 5, более предпочтительно, 4, где каждый N независимо от другого выбран из нуклеотидов, выбранных из A, U, Т, G и С или аналогов этих нуклеотидов, и
где G представляет собой гуанозин или его аналог и необязательно может быть замещен цитидином или его аналогом, при условии, что комплементарный ему нуклеотид цитидин в стебле 2 замещен гуанозином;
последовательность петли [N0-4 (U/T) N0-4] расположена между элементами стебель 1 и стебель2, и представляет собой непрерывную последовательность из нуклеотидов в количестве от 3 до 5, более предпочтительно, из 4 нуклеотидов;
где каждая N0-4 не зависит от другой непрерывной последовательности из N в количестве от 0 до 4, предпочтительно, от 1 до 3, более предпочтительно, от 1 до 2, где каждый N независимо от другого выбран из нуклеотидов, выбранных из A, U, Т, G и С или аналогов этих нуклеотидов; и
где U/T представляет собой уридин или необязательно тимидин;
стебель 2 [N3-5CN0-2] является обратно комплементарным или частично обратно комплементарным с элементом стебель 1 и представляет собой непрерывную последовательность из нуклеотидов в количестве от 5 до 7;
где N3-5 представляет собой непрерывную последовательность из N в количестве от 3 до 5, предпочтительно, от 4 до 5, более предпочтительно, 4, где каждый N независимо от другого выбран из нуклеотидов, выбранных из A, U, Т, G и С или аналогов этих нуклеотидов;
где N0-2 представляет собой непрерывную последовательность из N в количестве от 0 до 2, предпочтительно, от 0 до 1, более предпочтительно, 1, где каждый N независимо от другого выбран из нуклеотидов, выбранных из A, U, Т, G или С или аналогов этих нуклеотидов; и
где С представляет собой цитидин или его аналог и необязательно может быть замещен гуанозином или его аналогом при условии, что комплементарный ему нуклеотид гуанозин в стебле 1 замещен цитидином;
где
стебель 1 и стебель 2 способны к спариванию оснований друг с другом с формированием обратно комплементарной последовательности, где спаривание оснований может происходить между стеблем 1 и стеблем 2, например, посредством спаривания оснований по Уотсону-Крику нуклеотидов А и U/T или G и С или посредством не уотсон-криковского спаривания оснований, например, спаривания неоднозначных пар оснований, обратного спаривания оснований по Уотсону-Крику, хугстиновского спаривания оснований, обратного хугстиновского спаривания оснований, или они способны к спариванию оснований друг с другом с формированием частично обратно комплементарной последовательности, где между стеблем 1 и стеблем 2 может происходить неполное спаривание оснований на основании того, что одно или несколько оснований в одном из стеблей не имеют комплементарного основания в обратно комплементарной последовательности другого стебля.
В указанном выше контексте спаривание неоднозначных пар оснований,, как правило, представляет собой не уотсон-криковское спаривание оснований двух нуклеотидов. В контексте настоящего изобретения четыре основные неоднозначные пары оснований, которые можно использовать, представляют собой гуанозин-уридин, инозин-уридин, инозин-аденозин, инозин-цитидин (G-U/T, I-U/T, I-А и I-C) и аденозин-цитидин (А-С).
Таким образом, в контексте настоящего изобретения, неоднозначное основание представляет собой основание, которое формирует неоднозначную пару оснований с другим основанием, как описано выше. Таким образом, в стебле структуры "стебель-петля" гистонов по настоящему изобретению может встречаться не уотсон-криковское спаривание оснований, например, спаривание неоднозначных пар оснований.
В указанном выше контексте частично обратно комплементарная последовательность в структуре стебля последовательности структуры "стебель-петля" содержит максимально 2,
предпочтительно, только одно несоответствие, формируемое спариванием оснований стебля 1 и стебля 2. Другими словами, стебель 1 и стебель 2, предпочтительно, способны к (полному) спариванию оснований друг с другом на всем протяжении всех последовательностей стебель 1 и стебель 2 (100% из возможных корректных уотсон-криковских или не уотсон-криковских спариваний оснований), таким образом, формируя обратно комплементарную последовательность, где каждое основание имеет свое корректное уотсон-криковское или не уотсон-криковское дополнительное основание в качестве комплементарного партнера по связыванию. Альтернативно, стебель1 и стебель2, предпочтительно, способны к частичному спариванию оснований друг с другом на всем протяжении всех последовательностей стебель1 и стебель2, где по меньшей мере приблизительно 70%, 75%, 80%, 85%, 90% или 95% из 100% возможных корректных уотсон-криковских или не уотсон-криковских спариваний оснований участвуют в корректном уотсон-криковском или не уотсон-криковском спаривании оснований, а максимум приблизительно 30%, 25%, 20%, 15%, 10% или 5% из оставшихся оснований являются неспаренными.
В предпочтительно варианте осуществления первого аспекта изобретения по меньшей мере одна последовательность структуры "стебель-петля" гистонов (с граничащими со стеблем элементами) длина последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, составляет приблизительно от 15 до приблизительно 45 нуклеотидов, предпочтительно, приблизительно от 15 до приблизительно 40 нуклеотидов, предпочтительно, приблизительно от 15 до приблизительно 35 нуклеотидов, предпочтительно, приблизительно от 15 до приблизительно 30 нуклеотидов и еще более предпочтительно, приблизительно от 20 до приблизительно 30, а наиболее предпочтительно, приблизительно от 24 до приблизительно 28 нуклеотидов.
В дополнительном предпочтительном варианте осуществления первого аспекта изобретения по меньшей мере длина одной последовательности структуры "стебель-петля" гистонов (без граничащих со стеблем элементов) последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, составляет приблизительно от 10 до приблизительно 30 нуклеотидов, предпочтительно, приблизительно от 10 до приблизительно 20 нуклеотидов, предпочтительно, приблизительно от 12 до приблизительно 20 нуклеотидов, предпочтительно, приблизительно от 14 до приблизительно 20 нуклеотидов и еще более предпочтительно, приблизительно от 16 до приблизительно 17, а наиболее предпочтительно, приблизительно 16 нуклеотидов.
В дополнительном предпочтительном варианте осуществления первого аспекта изобретения последовательность нуклеиновой кислоты по изобретению в первом аспекте настоящего изобретения может содержать или кодировать по меньшей мере одну последовательность структуры "стебель-петля" гистонов по меньшей мере по одной из следующих определенных формул (Ia) или (IIa):
формула (Ia) (последовательность структуры "стебель-петля" без граничащих со стеблем элементов):

формула (IIa) (последовательность структуры "стебель-петля" с граничащими со стеблем элементами):

где:
N, С, G, Т и U являются такими, как определено выше.
В дополнительном еще более предпочтительном варианте первого аспекта последовательность нуклеиновой кислоты по изобретению может содержать или кодировать по меньшей мере одну последовательность структуры "стебель-петля" гистонов по меньшей мере по одной из следующих определенных формул (Ib) или (IIb):
формула (Ib) (последовательность структуры "стебель-петля" без граничащих со стеблем элементов):

формула (IIb) (последовательность структуры "стебель-петля" с граничащими со стеблем элементами):

где: N, С, G, Т и U являются такими, как определено выше.
В еще более предпочтительном варианте осуществления первого аспекта изобретения последовательность нуклеиновой кислоты по изобретению первого аспекта настоящего изобретения может содержать или кодировать по меньшей мере одну последовательность структуры "стебель-петля" гистонов по меньшей мере по одной из следующих определенных формул (Ic) - (In) или (IIe) - (IIh), альтернативно представленной в виде ее структуры "стебель-петля" и в виде линейной последовательности, представляющей последовательности структур "стебель-петля" гистонов как получают в соответствии с
Примером 1:
формула (Ic): (консенсусная последовательность структуры "стебель-петля" гистонов многоклеточных и простейших без граничащих со стеблем элементов):


(линейная последовательность) (SEQ ID NO: 1),
формула (IIe): (консенсусная последовательность структуры "стебель-петля" гистонов многоклеточных и простейших с граничащими со стеблем элементами):

(линейная последовательность) (SEQ ID NO: 2),
формула (Id): (без граничащих со стеблем элементов)

(линейная последовательность) (SEQ ID NO: 3),
формула (IId): (с граничащими со стеблем элементами)

(линейная последовательность) (SEQ ID NO: 4),
формула (Ie): (консенсусная последовательность структуры "стебель-петля" гистонов простейших без граничащих со стеблем элементов)
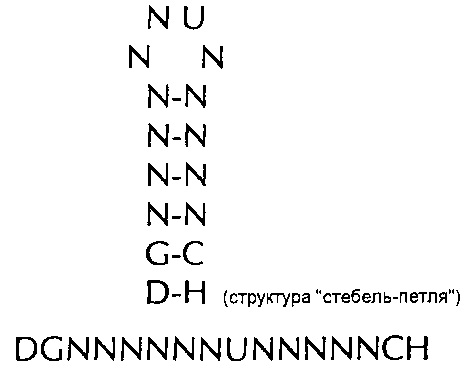
(линейная последовательность) (SEQ ID NO: 5),
формула (IIe): (консенсусная последовательность структуры "стебель-петля" гистонов простейших с граничащими со стеблем элементами)

(линейная последовательность) (SEQ ID NO: 6),
формула (If): (консенсусная последовательность структуры "стебель-петля" гистонов многоклеточных без граничащих со стеблем элементов)

(линейная последовательность) (SEQ ID NO: 7),
формула (IIf): (консенсусная последовательность структуры "стебель-петля" гистонов многоклеточных с граничащими со стеблем элементами)

(линейная последовательность) (SEQ ID NO: 8)
формула (Ig): (консенсусная последовательность структуры "стебель-петля" гистонов позвоночных без граничащих со стеблем элементов)
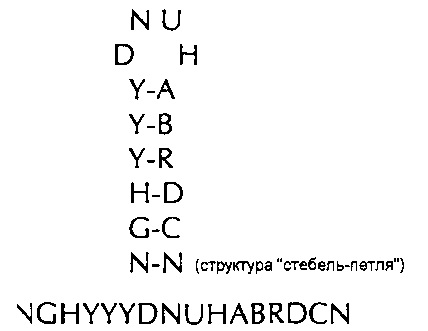
(линейная последовательность) (SEQ ID NO: 9),
формула (IIg): (консенсусная последовательность структуры "стебель-петля" гистонов позвоночных с граничащими со стеблем элементами)

(линейная последовательность) (SEQ ID NO: 10),
формула (In): (консенсусная последовательность структуры "стебель-петля" гистонов человека (Homo sapiens) без граничащих со стеблем элементов)

(линейная последовательность) (SEQ ID NO: 11),
формула (IIh): (консенсусная последовательность структуры "стебель-петля" гистонов человека (Homo sapiens) с граничащими со стеблем элементами)

(линейная последовательность) (SEQ ID NO: 12), где в каждой из указанных выше формул (Ic)-(In) или (IIe)-(IIh): N, С, G, А, Т и U являются такими, как определено выше; каждый U можно замещать Т; каждый (высоко)консервативный G или С в элементах стебля 1 и 2 можно замещать комплементарным ему нуклеотидным основанием С или G, при условии, что комплементарный ему нуклеотид в соответствующем стебле параллельно замещен комплементарным ему нуклеотидом; и/или- G, А, Т, U, С, R, Y, М, K, S, W, Н, В, V, D и N представляют собой нуклеотидные основания, как определено в следующей таблице:

В этом контексте особенно предпочтительно, чтобы последовательность структуры "стебель-петля" гистонов по меньшей мере по одной из формул (I) или (Ia)-(In), или (II), или (IIa)-(IIh) по настоящему изобретению была выбрана из природных последовательностей структур "стебель-петля" гистонов, еще более предпочтительно, из последовательностей структур "стебель-петля" гистонов простейших или многоклеточных, и даже еще более предпочтительно, из последовательностей структур "стебель-петля" гистонов позвоночных, а наиболее предпочтительно, млекопитающих, особенно из последовательностей структур "стебель-петля" гистонов человека.
В особенно предпочтительном варианте осуществления первого аспекта последовательность структуры "стебель-петля" гистонов по меньшей мере по одной из определенных формул (I) или (Ia)-(In) или (II) или (IIa)-(IIh) по настоящему изобретению представляет собой последовательность структуры "стебель-петля" гистонов, в каждом положении нуклеотида содержащая наиболее часто встречающийся нуклеотид или любой из наиболее часто встречающегося или второго по частоте встречаемости нуклеотида природных последовательностей структур "стебель-петля" гистонов многоклеточных и простейших (фиг. 1), простейших (фиг. 2), многоклеточных (фиг. 3), позвоночных (фиг. 4) и человека (фиг. 5), как представлено на фиг. 1-5. В этом контексте особенно предпочтительно, чтобы по меньшей мере 80%, предпочтительно, по меньшей мере 85% или, наиболее предпочтительно, по меньшей мере 90% всех нуклеотидов соответствовали нуклеотидам, наиболее часто встречающимся в природных последовательностей структур "стебель-петля" гистонов.
В дополнительном конкретном варианте первого аспекта последовательность структуры "стебель-петля" гистонов по меньшей мере по одной из конкретных формул (I) или (Ia) - (In) по настоящему изобретению выбрана из приведенных ниже последовательностей структур "стебель-петля" гистонов (без граничащих со стеблем элементов), представляющих последовательности структур "стебель-петля" гистонов, как получено в соответствии с примером 1:


Кроме того, в этом контексте особенно предпочтительными являются приведенные ниже последовательности структур "стебель-петля" гистонов (с граничащими со стеблем элементами), как получено в соответствии с примером 1 по одной из определенных формул (II) или (IIa) - (IIh):


В дополнительном предпочтительном варианте осуществления первого аспекта изобретения последовательность нуклеиновой кислоты по изобретению содержит или кодирует по меньшей мере одну последовательность структуры "стебель-петля" гистонов демонстрирующую по меньшей мере приблизительно 80%, предпочтительно, по меньшей мере приблизительно 85%, более предпочтительно, по меньшей мере приблизительно 90% или еще более предпочтительно, по меньшей мере приблизительно 95% идентичности последовательности не со 100% консервативных нуклеотидов в последовательностях структур "стебель-петля" гистонов по меньшей мере по одной из определенных формул (I) или (Ia)-(In) или (II) или (IIa)-(IIh) или с природной последовательностью структуры "стебель-петля" гистонов.
В предпочтительном варианте осуществления последовательность структуры "стебель-петля" гистонов не содержит последовательность петли 5'-UUUC-3'. Более конкретно, структура "стебель-петля" гистонов не содержит последовательность стебель1 5'-GGCUCU-3' и/или последовательность стебель 2 5'-AGAGCC-3', соответственно. В другом предпочтительном варианте осуществления последовательность структуры "стебель-петля" не содержит последовательность петли 5'-CCUGCCC-3' или последовательность петли 5'-UGAAU-3'. Более конкретно, стебель-петля не содержит последовательность стебель 1 5'-CCUGAGC-3' или не содержит последовательность стебель 1 5'-ACCUUUCUCCA-3' и/или последовательность стебель 2 5'-GCUCAGG-3' или 5'-UGGAGAAAGGU-3', соответственно. Также, поскольку изобретение конкретно не ограничено последовательностями структур "стебель-петля" гистонов, последовательности структур "стебель-петля" предпочтительно, не происходят из 3'-нетранслируемой области рецептора инсулина млекопитающих. Также предпочтительно, нуклеиновая кислота по изобретению может не содержать сигналы процессинга структур "стебель-петля" гистонов, в частности, не содержать сигналы процессинга структур "стебель-петля" гистонов, происходящие из гена гистона Н2А614 мыши (H2kA614).
Последовательность нуклеиновой кислоты по изобретению в первом аспекте настоящего изобретения, необязательно, может содержать или кодировать последовательность поли(А). Если присутствует, то такая последовательность поли(А) содержит последовательность длиной приблизительно 30 или, более предпочтительно, приблизительно от 25 до приблизительно 400 аденозиновых нуклеотидов, предпочтительно, последовательность длиной приблизительно от 50 до приблизительно 400 аденозиновых нуклеотидов, более предпочтительно, последовательность длиной приблизительно от 50 до приблизительно 300 аденозиновых нуклеотидов, еще более предпочтительно, последовательность длиной приблизительно от 50 до приблизительно 250 аденозиновых нуклеотидов, наиболее предпочтительно, последовательность длиной приблизительно от 60 до приблизительно 250 аденозиновых нуклеотидов. В этом контексте термин "приблизительно" относится к отклонению ±10% от значения(ий), к которому он добавлен. Таким образом, последовательность поли(А) содержит по меньшей мере 25 или более чем 25, более предпочтительно, по меньшей мере 30, более предпочтительно, по меньшей мере 50 аденозиновых нуклеотидов. Таким образом, такая последовательность поли(А), как правило, не содержит менее 20 аденозиновых нуклеотидов. Более конкретно, последовательность не содержит 10 и/или менее 10 аденозиновых нуклеотидов.
Предпочтительно, нуклеиновая кислота по настоящему изобретению не содержит одного или двух, или по меньшей мере одного или всех, но один или все из компонентов из группы, состоящей из: последовательности, кодирующей рибозим (предпочтительно, самосплайсируемый рибозим), вирусной последовательности нуклеиновой кислоты, сигнала процессинга структуры "стебель-петля" гистонов, в частности, последовательности процессинга структуры "стебель-петля" гистонов, происходящей из гена гистона Н2А614 мыши, гена Neo, инактивированной промоторной последовательности и инактивированной энхансерной последовательности. Еще более предпочтительно, нуклеиновая кислота по изобретению не содержит рибозима, предпочтительно, самосплайсируемого рибозима, и одного элемента из группы, состоящей из: гена Neo, инактивированной промоторной последовательности, инактивированной энхансерной последовательности, сигнала процессинга структуры "стебель-петля" гистонов, в частности, последовательности процессинга структуры "стебель-петля" гистонов, происходящей из гена гистона Н2А614 мыши. Таким образом, нуклеинов кислота в предпочтительном варианте осуществления может не содержать ни рибозима, предпочтительно, самосплайсируемого рибозима, ни гена Neo или, альтернативно, ни рибозима, предпочтительно, самосплайсируемого рибозима, ни какого-либо гена устойчивости (например, как правило, используемого для отбора). В другом предпочтительном варианте осуществления нуклеиновая кислота по изобретению может не содержать ни рибозима, предпочтительно, самосплайсируемого рибозима, ни сигнала процессинга структуры "стебель-петля" гистонов, в частности, последовательности процессинга структуры "стебель-петля" гистонов, происходящей из гена гистона Н2А614 мыши
Альтернативно, в первом аспекте настоящего изобретения нуклеотидная последовательность по изобретению необязательно содержит сигнал полиаденилирования, который определен в настоящем документе как сигнал, который осуществляет полиаденилирование (транскрибируемой) мРНК посредством специфических белковых факторов (например, специфического фактора расщепления и полиаденилирования (CPSF), фактора стимуляции расщепления (CstF), факторов расщепления I и II (CF I и CF II), поли(А)-полимеразы (РАР)). В этом контексте консенсусный сигнал полиаденилирования, предпочтительно, содержит консенсусную последовательность NN(U/T)ANA. В конкретном предпочтительном аспекте сигнал полиаденилирования содержит одну из следующих последовательностей: AA(U/T)AAA или A(U/T)(U/T)AAA (где уридин, как правило, присутствует в РНК, а тимидин, как правило, присутствует в ДНК). В некоторых вариантах осуществления сигнал полиаденилирования, используемый в нуклеиновой кислоте по изобретению, не соответствует последовательностям мяРНК U3, U5, сигнала процессинга полиаденилирования из гена G-CSF человека или сигнала полиаденилирования SV40. В частности, указанные выше сигналы полиаденилирования не комбинируют ни с какими генам устойчивости к антибиотикам (или какими-либо другими репортерными, маркерными или селективными генами), в частности, не с геном устойчивости пео (неомицинфосфотрансфераза) (в качестве гена кодирующей области в соответствии с элементом (а) нуклеиновой кислоты по изобретению. И в нуклеиновой кислоте по изобретению никакой из указанных выше сигналов полиаденилирования (которые, как правило, не присутствуют в нуклеиновой кислоте по изобретению), предпочтительно, не комбинируют со структурой "стебель-петля" гистонов или сигналом процессинга структуры "стебель-петля" гистонов из гена гистона Н2А614 мыши.
Кроме того, последовательность нуклеиновой кислоты по изобретению в первом аспекте настоящего изобретения может кодировать белок или пептид, который содержит патогенный антиген или его фрагмент, вариант или производное. Такие патогенные антигены происходят из патогенных организмов, в частности, бактериальных, вирусных или простейших (многоклеточных) патогенных организмов, которые вызывают иммунную реакцию у индивидуума, в частности, млекопитающего, более конкретно, человека. Более конкретно, патогенные антигены, предпочтительно, представляют собой поверхностные антигены, например, белки (или фрагменты белков, например, внешнюю часть поверхностного антигена), расположенные на поверхности вирусного или бактериального или простейшего организма.
Патогенные антигены представляют собой пептидные или белковые антигены, предпочтительно, происходящие из патогенных организмов, связанных с инфекционными заболеваниями, которые предпочтительно, выбраны из антигенов, происходящих из патогенных микроорганизмов Acinetobacter baumannii, рода Anaplasma, Anaplasma phagocytophilum, Ancylostoma braziliense, Ancylostoma duodenale, Arcanobacterium haemolyticum, Ascaris lumbricoides, рода Aspergillus, Astroviridae, рода Babesia, Bacillus anthracis, Bacillus cereus, Bartonella henselae, вируса BK, Blastocystis hominis, Blastomyces dermatitidis, Bordetella pertussis, Borrelia burgdorferi, рода Borrelia, видов Borrelia, рода Brucella, Brugia malayi, семейства Bunyaviridae, Burkholderia cepacia и других видов Burkholderia, Burkholderia mallei, Burkholderia pseudomallei, семейства Caliciviridae, рода Campylobacter, Candida albicans, видов Candida, Chlamydia trachomatis, Chlamydophila pneumoniae, Chlamydophila psittaci, приона CJD, Clonorchis sinensis, Clostridium botulinum, Clostridium difficile, Clostridium perfringens, Clostridium perfringens, видов Clostridium, Clostridium tetani, видов Coccidioides, коронавирусов, Corynebacterium diphtheriae, Coxiella burnetii, вируса конго-крымской геморрагической лихорадки, Cryptococcus neoformans, рода Cryptosporidium, цитoмeгaлoвиpycf (CMV), вирусов Денге (DEN-1, DEN-2, DEN-3 и DEN-4), Dientamoeba fragilis, эболавируса (EBOV), рода Echinococcus, Ehrlichia chaffeensis, Ehrlichia ewingii, рода Ehrlichia, Entamoeba histolytica, рода Enterococcus, рода Enterovirus, энтеровирусов, в основном вируса Коксаки А и энтеровируса 71 (EV71), видов Epidermophyton, вируса Эпштейна-Барр (EBV), Escherichia coli 0157:Н7, 0111 и О104:Н4, Fasciola hepatica и Fasciola gigantica, приона FFI, суперсемейства Filarioidea, флавивирусов, Francisella tularensis, рода Fusobacterium, Geotrichum candidum, Giardia intestinalis, видов Gnathostoma, приона GSS, вируса Гуанарито, Haemophilus ducreyi, Haemophilus influenzae, Helicobacter pylori, генипавируса (вируса Хендра вируса Нипах), вируса гепатита А, вируса гепатита В (HBV), вируса гепатита С (HCV), вируса гепатита D, вируса гепатита Е, вируса простого герпеса 1 и 2 (HSV-1 и HSV-2), Histoplasma capsulatum, ВИЧ (вируса иммунодефицита человека), Hortaea werneckii, бокавируса человека (HBoV), вируса герпеса 6 человека (HHV-6) и вируса герпеса 7 человека (HHV-7), метапневмовируса человека (hMPV), вируса папилломы человека (HPV), вирусы парагриппа человека (HPIV), вируса японского энцефалита, вируса JC, вируса Junin, Kingella kingae, Klebsiella granulomatis, приона Kuru, вируса Jlacca, Legionella pneumophila, рода Leishmania, рода Leptospira, Listeria monocytogenes, вируса лимфоцитарного хориоменингита (LCMV), вируса Machupo, видов Malassezia, вируса марбургской лихорадки, вируса кори, Metagonimus yokagawai, Microsporidia phylum, вируса контагиозного моллюска (MCV), вируса эпидемического паротита, Mycobacterium leprae и Mycobacterium lepromatosis, Mycobacterium tuberculosis, Mycobacterium ulcerans, Mycoplasma pneumoniae, Naegleria fowleri, Necator americanus, Neisseria gonorrhoeae, Neisseria meningitidis, Nocardia asteroides, видов Nocardia, Onchocerca volvulus, Orientia tsutsugamushi, семейства Orthomyxoviridae (гриппа), Paracoccidioides brasiliensis, видов Paragonimus, Paragonimus westermani, парвовируса B19, рода Pasteurella, рода Plasmodium, Pneumocystis j irovecii, полиовируса, вируса бешенства, респираторно-синцитиального вируса (RSV), риновируса, риновирусов, Rickettsia akari, рода Rickettsia, Rickettsia prowazekii, Rickettsia rickettsii, Rickettsia typhi, вируса лихорадки долины Рифт, ротавируса, вируса краснухи, вируса Sabia, рода Salmonella, Sarcoptes scabiei, коронавируса SARS, рода Schistosoma, рода Shigella, вируса Sin Nombre, хантавируса, Sporothrix schenckii, рода Staphylococcus, рода Staphylococcus, Streptococcus agalactiae, Streptococcus pneumoniae, Streptococcus pyogenes, Strongyloides stercoralis, рода Taenia, Taenia solium, вируса клещевого вирусного энцефалита (TBEV), Toxocara canis или Toxocara cati, Toxoplasma gondii, Treponema pallidum, Trichinella spiralis, Trichomonas vaginalis, видов Trichophyton, Trichuris trichiura, Trypanosoma brucei, Trypanosoma cruzi, Ureaplasma urealyticum, вируса ветряной оспы (VZV), вируса ветряной оспы (VZV), Variola major или Variola minor, приона vCJD, вируса венесуэльского энцефалита лошадей, Vibrio cholerae, вируса лихорадки Западного Нила, вируса западного энцефалита лошадей, Wuchereria bancrofti, вирус желтой лихорадки, Yersinia enterocolitica, Yersinia pestis, и Yersinia pseudotuberculosis.
В этом контексте особенно предпочтительными являются антигены патогенных микроорганизмов, выбранных из вируса гриппа, респираторно-синцитиального вируса (RSV), вируса простого герпеса (HSV), вируса папилломы человека (HPV), вируса иммунодефицита человека (ВИЧ), плазмодия, Staphylococcus aureus, вируса Денге, Chlamydia trachomatis, цитомегаловируса (CMV), вируса гепатита В (HBV), Mycobacterium tuberculosis, вируса бешенства и вируса желтой лихорадки.
Кроме того, патогенный антиген (антиген, происходящий из патогенного организма, связанного с инфекционным заболеванием), предпочтительно, можно выбирать из следующих антигенов: белок наружной мембраны А ОmрА, связанный с биопленкой белок Вар, транспортный белок MucK (Acinetobacter baumannii, инфекция Acinetobacters)); вариабельный поверхностный гликопротеин VSG, связанный с микротрубочками белок МАРР15, транс-сиалидаза TSA (Trypanosoma brucei, африканская сонная болезнь (African trypanosomiasis)); антиген р24 ВИЧ, белки оболочки ВИЧ (Gp120, Gp41, Gp160), полипротеин GAG, белок негативного регуляторного фактора Nef, трансактиватор транскрипции Tat (ВИЧ (вирус иммунодефицита человека), СПИД (синдром приобретенного иммунодефицита)); ингибируемый галактозой белок адгезии GIAP, антиген 29 кДа Еh29, лектин Gal/GalNAc, белок CRT, иммунодоминантный антиген 125 кДа, белок М17, адгезии ADH112, белок STIRP (Entamoeba histolytica, амебиаз); основные поверхностные белки 1-5 (MSP1a, MSP1b, MSP2, MSP3, MSP4, MSP5), белки системы секреции типа IV (VirB2, VirB7, VirB11, VirD4) (рода Anaplasma, анаплазмоз); протективный антиген РА, отечный фактор EF, летальный фактор LF, белки поверхностной гомологии SLH (Bacillus anthracis, сибирская язва); акранолизин, фосфолипаза D, коллаген-связывающий белок CbpA (Arcanobacterium haemolyticum, инфекция Arcanobacterium haemolyticum); нуклеокапсидный белок NP, гликопротеиновый предшественник GPC, гликопротеин GP1, гликопротеин GP2 (вирус Junin, аргентинская геморрагическая лихорадка); белки слоя хитиновых белков, поверхностный антиген 14 кДа А14, основной белок спермы MSP, организующий полимеризацию MSP белок МРОР, белок волокон MSP 2 MFP2, активирующая полимеризацию MSP киназа МРАК, ABA-1-подобный белок ALB, белок АВА-1, кутикулин CUT-1 (Ascaris lumbricoides, аскаридоз); аллерген 41 кДа Asp v13, аллерген Asp f3, основной конидиальный поверхностный белок rodlet А, протеаза Peplp, заякоренный в GPI белок Gel1p, заякоренный в GPI белок Crflp (род Aspergillus, аспергиллез); белок семейства VP26, белок VP29 (Astroviridae, инфекция астровирусами); связанный с роптрией белок 1 RAP-1, мерозоитные поверхностные антигены MSA-1, MSA-2 (a1, a2, b, c), 12D3, 11C5, 21B4, P29, вариант эритроцитарного поверхностного антигена VESA1, антиген апикальной мембраны 1 АМА-1 (род Babesia, бабезиоз); гемолизин, энтеротоксин С, PXO1-51, гликолатоксидаза, переносчик ABC, пенициллинсвязывающий белок, белок семейства переносчиков цинка, псевдоуридинсинтетаза Rsu, белок репликации плазмид RepX, олигоэндопептидаза F, белок мембраны профага, белок HemK, жгутиковый антиген Н, клеточный поверхностный антиген 28,5 кДа (Bacillus cereus, инфекция Bacillus cereus); большой Т-клеточный антиген LT, малый Т-клеточный антиген, капсидный белок VP1, капсидный белок VP2 (вирус BK, инфекция вирусом BK); белок 29 кДа, подобные каспазе-3 антигены, гликопротеины (Blastocystis hominis, инфекция Blastocystis hominis); поверхностный адгезии дрожжей WI-1 (Blastomyces dermatitidis, бластомикоз); нуклеопротеин N, полимераза L, белок матрикса Z, гликопротеин GP (вирус Machupo, боливийская геморрагическая лихорадка); белок внешней поверхности A OspA, белок внешней поверхности OspB, белок внешней поверхности OspC, связывающий декорин белок A DbpA, связывающий декорин белок В DbpB, коровый белок жгутикового филамента 41 кДа Fla, предшественник основного мембранного белка А ВmрА (иммунодоминантный антиген Р39), предшественник липопротеина внешней поверхности 22 кДа (антиген IPLA7), вариабельный поверхностный липопротеин vlsE (род Borrelia, инфекция Borrelia); ботулинические нейротоксины BoNT/A1, BONT/A2, BoNT/АЗ, BoNT/B, BoNT/C, BoNT/D, BoNT/E, BoNT/F, BoNT/G, домен He рекомбинантного ботулинического токсина F FHc (Clostridium botulinum, ботулизм (и детский ботулизм)); нуклеокапсид, предшественник гликопротеина (вирус Sabia, бразильская геморрагическая лихорадка); супероксиддисмутаза меди/цинка SodC, бактериоферритин Bfr, белок 50S рибосом RplL, подобный ОтрА содержащий трансмембранный домен белок Omp31, иммуногенный белок 39 кДа М5 Р39, переносчик цинка ABC связывающий периплазматический цинк белок znuA, периплазматический иммуногенный белок Вр26, белок 30S рибосом S12 RpsL, глицеральдегид-3-фосфатдегидрогеназа GAP, предшественник иммуногенного белка внешней мембраны 25 кДа Omp25, инвазивный белок В lalB, фактор инициации Tig, молекулярный шаперон DnaK, предполагаемая пептидилпролил-цис-транс-изомераза SurA, липопротеин Omp19, белок наружной мембраны MotY Omp16, консервативный белок наружной мембраны D15, малатдегидрогеназа Mdh, компонент системы секреции типа IV (T4SS) VirJ, липопротеин с неизвестной функцией ВАВ1_0187 (род Brucella, бруцеллез); представители семейства переносчика АБС (LolC, ОррА и PotF), предполагаемый трансмембранный белок системы высвобождения липопротеинов LolC/E, флагеллин FliC, белок внутриклеточной подвижности A Burkholderia BimA, бактериальный фактор элонгации Tu EF-Tu, подобный ОтрА белок 17 кДа, boaA, кодирующий белок, boaB, кодирующий белок (Burkholderia cepacia и другие виды Burkholderia, инфекция Burkholderia); миколилтрансфераза Ag85A, белок теплового шока Hsp65, белок ТВ10.4, антиген 19 кДа, белок PstS3, белок теплового шока Hsp70 (Mycobacterium ulcerans, язва Бурули); основной и минорный белки вирусного капсида норовирусов VP1 и VP2, геномный полипротеин, капсидный белок саповируса VP1, белок Vp3, геномный полипротеин (семейство Caliciviridae, инфекция Calicivirus (норовирус и саповирус)); основной белок наружной мембраны PorA, флагеллин FlaA, поверхностный антиген CjaA, связывающий фибронектин белок CadF, связывающий аспартат/глутаминат белок-переносчик ABC Peb1A, белок FspA1, белок FspA2 (род Campylobacter, кампилобактериоз); гликолитический фермент енолаза, секретируемые аспартилпротеиназы SAP1-10, связанный с гликофосфатидилинозитолом (GPI) белок клеточной стенки, белок Hyr1, родственный рецептору комплемента 3 белок CR3-RP, адгезии Als3p, белок теплового шока 90 кДа hsp90, гидрофобный белок клеточной поверхности CSH (как правило, Candida albicans и другие виды Candida, кандидоз); антиген 17 кДа, белок Р26, тримерные адгезины-автопереносчики ТАА, адгезии Bartonella А BadA, белки наружной мембраны с вариабельной экспрессией Vomp, белок Рар3, белок HbpA, связанная с оболочкой протеаза HtrA, белок ОМР89, белок GroEL, белок LalB, белок ОМР43, дигидролипоамидсукцинилтрансфераза SucB (Bartonella henselae, болезнь кошачьих царапин); поверхностный белок амастигот 2, специфичный для амастигот поверхностный белок SSP4, крузипейн, транс-сиалидаза TS, поверхностный гликопротеин трипомастигот TSA-1, регуляторный белок комплемента CRP-10, белок G4, белок G2, белок параксонемального тяжа PAR2, компонент околожгутикового тяжа Par1, муцинсвязанные поверхностные белки MPSP (Trypanosoma cruzi, болезнь Шагаса (американский трипаносомоз)); оболочечный гликопротеины (gB, gC, gE, gH, gI, gK, gL) (вирус ветряной оспы (VZV), ветрянки); основной белок наружной мембраны МОМР, предполагаемый белок наружной мембраны РМРС, белок комплекса наружной мембраны В OmcB, белки теплового шока Hsp60, HSP10, белок IncA, белки системы секреции типа III, белок малой цепи рибонуклеотидредуктазы NrdB, плазмидный белок Pgp3, наружный белок хламидий N CopN, антиген СТ521, антиген СТ425, антиген СТ043, антиген ТС0052, антиген ТС0189, антиген ТС0582, антиген ТС0660, антиген ТС0726, антиген ТС0816, антиген ТС0828 (Chlamydia trachomatis, Chlamydia); белок низкого кальциевого ответа Е LCrE, наружный белок хламидий N CopN, серин/треониновая протеинкиназа PknD, S-малонилтрансфераза белка-носителя кислотных групп FabD, связывающий одноцепочечную ДНК белок Ssb, основной белок наружной мембраны МОМР, белок наружной мембраны 2 Omp2, семейство полиморфных мембранных белков (Pmp1, Pmp2, Pmp3, Pmp4, Pmp5, Pmp6, Pmp7, Pmp8, Pmp9, Pmp10, Pmp11, Pmp12, Pmp13, Pmp14, Pmp15, Pmp16, Pmp17, Pmp18, Pmp19, Pmp20, Pmp21) (Chlamydophila pneumoniae, инфекция Chlamydophila pneumoniae); холерный токсин В СТВ, регулируемый совместно с токсином пилин А ТсрА, регулируемый совместно с токсином пилин TcpF, регулируемый. совместно с токсином белок биосинтеза пилей F TcpF, субъединица холерного энтеротоксина А, субъединица холерного энтеротоксина В, термостабильный энтеротоксин ST, чувствительный к маннозе гемагглютинин MSHA, белок наружной мембраны U порин ompU, образующий поры белок В, полиморфный мембранный белок-D (Vibrio cholerae, холера); пропионил-KoA-карбоксилаза РСС, белок 14-3-3, прохибитин, цистеиновые протеазы, глутатионтрансферазы, гельзолин, катепсин-L-протеиназа CatL, белок оболочки 20,8 кДа ТР20,8, белок оболочки 31,8 кДа ТР31,8, лизофосфатидиловая кислая фосфатаза LPAP, (Clonorchis sinensis, клонорхоз); белки поверхностного слоя SLP, глутаминатдегидрогеназный антиген GDH, токсин А, токсин В, цистеиновая протеаза Cwp84, цистеиновая протеаза Cwp13, цистеиновая протеаза Cwp19, белок клеточной стенки CwpV, жгутиковый белок FliC, жгутиковый белок FliD (Clostridium difficile, инфекция Clostridium difficile); риновирусы: капсидные белки VP1, VP2, VP3, VP4; коронавирусы: белки стержня S, оболочечные белки Е, мембранные белки М, нуклеокапсидные белки N (как правило, риновирусы и коронавирусы, вирусная инфекция верхних дыхательных путей (Острый вирусный ринофарингит; острый ринит)); прионный белок Ргр (прион CJD, болезнь Крейтцфельдта-Якоба (CJD)); оболочечный белок Gc, оболочечный белок Gn, нуклеокапсидные белки (вирус конго-крымской геморрагической лихорадки, конго-крымская геморрагическая лихорадка (CCHF)); связанная с вирулентностью РНК-геликаза DEAD-бокса VAD1, галактозилманнановый белок GalXM, глюкуроноксилманнан GXM, маннопротеин MP (Cryptococcus neoformans, криптококкоз); кислый рибосомный белок Р2 СрР2, муциновые антигены Muc1, Muc2, Мис3 Мис4, Мис5, Мис6, Мис7, белок адгезии к поверхности СР20, белок адгезии к поверхности СР23, поверхностный белок СР12, поверхностный белок СР21, поверхностный белок СР40, поверхностный белок СР60, поверхностный белок СР15, связанные с поверхностью гликопептиды gp40, связанные с поверхностью гликопептиды gp15, белок стенки ооцисты АВ, профилин PRF, апираза (род Cryptosporidium, криптоспоридиоз); связывающий жирные кислоты и ретинол белок-1 FAR-1, тканевой ингибитор металлопротеиназы TIMP (ТМР), цистеиновая протеиназа ACEY-1, цистеиновая протеиназа АССР-1, поверхностный антиген Ас-16, секретируемый белок 2 ASP-2, металлопротеаза 1 МТР-1, ингибитор аспартилпротеазы API-1, связанный с поверхностью антиген SAA-1, специфичный для взрослых ингибитор сериновой протеазы секретируемого фактора Ха антикоагулянт АР, подобная катепсину D аспарагиновая протеаза ARR-1 (как правило, Ancylostoma braziliense; множество других паразитов, "блуждающая подкожная личинка" (CLM)); подобные катепсину L протеазы, антиген 53/25 кДа, представители семейства 8 кДа, белок цистицерков с концевой трипсиноподобной активностью TsAg5, белок онкосферы TSOL18, белок онкосферы TSOL45-1A, лактатдегидрогеназа A LDHA, лактатдегидрогеназа В LDHB (Taenia solium, цистицеркоз); антиген рр65, мембранный белок рр15, белок проксимальной оболочки капсида рр150, белок М45, ДНК-полимераза UL54, геликаза UL105, гликопротеин gM, гликопротеин gN, гликопротеин Н, гликопротеин В gB, белок UL83, белок UL94, белок UL99 (цитомегаловирус (CMV), цитомегаловирусная инфекция); капсидный белок С, премембранный белок prM, мембранный белок М, оболочечный белок Е (домен I, домен II, домен II), белок NS1, белок NS2A, белок NS2B, белок NS3, белок NS4A, белок 2K, белок NS4B, белок NS5 (вирусы Денге (DEN-1, DEN-2, DEN-3 и DEN-4)-флавивирусы,. лихорадка Денге); белок 39 кДа (Dientamoeba fragilis, диентамебиаз); предшественник дифтерийного токсина Тох, дифтерийный токсин DT, пилин-специфическая сортаза SrtA, стержневой пилиновый белок SpaA, концевой пилиновый белок SpaC, минорный пилиновый белок SpaB, связанный с поверхностью белок DIP1281 (Corynebacterium diphtheriae, дифтерия); гликопротеин GP, нуклеопротеин NP, минорный белок матрикса VP24, основной белок матрикса VP40, активатор транскрипции VP30, кофактор полимеразы VP35, РНК-полимераза L (вирус Эбола (EBOV), геморрагическая лихорадка Эбола); прионный белок (прион vCJD, вариант болезни Крейтцфельдта-Якоба (vCJD, nvCJD)); белок системы UvrABC В, белок Flp1, белок Flp2, белок Flp3, белок TadA, рецептор гемоглобина HgbA, белок наружной мембраны TdhA, белок CpsRA, регулятор CpxR, белок SapA, антиген 18 кДа, белок наружной мембраны NcaA, белок LspA, белок LspA1, белок LspA2, белок LspB, компонент наружной мембраны DsrA, лектин DltA, липопротеин Hlp, основной белок наружной мембраны ОМР, белок наружной мембраны OmpA2 (Haemophilus ducreyi, шанкроид); аспартилпротеаза 1 Pep1, фосфолипаза В PLB, альфа-маннозидаза 1 AMN1, глюканозилтрансфераза GEL1, уреаза URE, пероксисомальный белок матрикса Pmp1, богатый пролином антиген Pra, Т-клеточный реактивный белок человека TcrP (Coccidioides immitis и Coccidioides posadasii, кокцидиоидомикоз); аллерген Tri r 2, белок теплового шока 60 Hsp60, актин грибов Act, антиген Tri r2, антиген Tri r4, антиген Tri t1, белок IV, глицерин-3-фосфатдегидрогеназа Gpd1, осморецептор HwSho1A, осморецептор HwSho1B, гистидинкиназа HwHhk7B, аллерген Mala s 1, аллерген Mala s 11, тиоредоксин Trx Mala s 13, аллерген Mala f, аллерген Mala s (как правило, виды Trichophyton, виды Epidermophyton, виды Malassezia, Hortaea werneckii, дерматофитоз); белок EG95, белок EG10, белок EG18, белок EgA31, белок ЕМ18, антиген ЕРС1, антиген В, антиген 5, белок Р29, белок 14-3-3, белок 8 кДа, миофилин, белок теплового шока 20 HSP20, гликопротеин GP-89, связывающий жирные кислоты белок FAPB (род Echinococcus, эхинококкоз), основной поверхностный белок 2 MSP2, основной поверхностный белок 4 MSP4, вариант MSP SGV1, вариант MSP SGV2, белок наружной мембраны ОМР, белок наружной мембраны 19 ОМР-19, основной антигенный белок MAP1, основной антигенный белок МАР1-2, основной антигенный белок МАР1В, основной антигенный белок МАР1-3, Erum2510, кодирующий белок, белок GroEL, белок GroES, основные белки наружной мембраны 3 0 кДа, белок GE 100 кДа, белок GE 130 кДа, белок GE 160 кДа (род Ehrlichia, эрлихиоз); секретируемый антиген SagA, подобные sagA белки Sa1A и Sa1B, коллагенадгезин Scm, поверхностные белки Fmsl (EbpA(fm), Fms5 (EbpB(fm), Fms9 (EpbC(fm) и Fms10, белок EbpC(fm), иммунопротективный гликопротеин 96 кДа G1 (род Enterococcus, инфекция Enterococcus); геномный полипротеин, полимераза 3D, вирусный капсидный белок VP1, вирусный капсидный белок VP2, вирусный капсидный белок VP3, вирусный капсидный белок VP4, протеаза 2А, протеаза 3С (род энтеровирусов, энтеровирусная инфекция); белки наружной мембраны ОМ, белок наружной мембраны 60 кДа, клеточный поверхностный антиген OmpA, клеточный поверхностный антиген OmpB (sca5), белок наружной мембраны 134 кДа, белок наружной мембраны 31 кДа, белок наружной мембраны 2 9,5 кДа, белок клеточной поверхности SCA4, белок. клеточной поверхности Adr1 (RP827), белок клеточной поверхности Adr2 (RP828), белок клеточной поверхности SCA1, инвазивный белок invA, белок клеточного деления fts, секреторные белки семейства sec 0, вирулентные белки virB, tlyA, tlyC, подобный парвулину белок Plp, препропротеин транслоказа SecA, поверхностный белковый антиген 120 кДа SPA, комплексный антиген 138 кДа, основной белок 100 кДа (белок I), внутрицитоплазматический белок D, протективный поверхностный белковый антиген SPA (Rickettsia prowazekii, эпидемический тиф); ядерные антигены вируса Эпштейна-Барр (EBNA-1, EBNA-2, EBNA-3A, EBNA-3B, EBNA-3C, лидерный белок EBNA (EBNA-LP)), скрытые мембранные белки (LMP-1, LMP-2A, LMP-2B), ранний антиген EBV-EA, мембранный антиген EBV-МА, антиген вирусного капсида EBV-VCA, щелочная нуклеаза EBV-AN, гликопротеин Н, гликопротеин др350, гликопротеин gp110, гликопротеин gp42, гликопротеин gHgL, гликопротеин gB (вирус Эпштейна-Барр (EBV), инфекционный мононуклеоз вирусом Эпштейна-Барр); капсидный белок VP2, капсидный белок VP1, основной белок NS1 (парвовирус В19, инфекционная эритема (пятая болезнь)); антиген ррб5, гликопротеин 105, основной капсидный белок, оболочечный гликопротеин Н, белок U51 (вирус герпеса 6 человека (HHV-6) и вирус герпеса 7 человека (HHV-7), внезапная экзантема); тиоредоксинглутатионредуктаза TGR, катепсины L1 и L2, белок типа Kunitz КТМ, лейциновая аминопептидаза LAP, цистеиновая протеиназа Fas2, подобный сапонинам белок-2 SAP-2, тиоредоксинпероксидазы ТРх, Prx-1, Prx-2, цистеиновая протеиназа катепсин l CL3, протеаза катепсин L CL1, фосфоглицераткиназа PGK, секреторный белок 27 кДа, белок 60 кДа HSP35alpha, глутатионтрансфераза GST, оболочечный антиген 28,5 кДа ТА 28,5 кДа, протеаза катепсин В3 CatB3, цистатин стефин-1 типа I, катепсин L5, катепсин L1g и катепсин В, связывающий жирные кислоты белок FABP, лейциновые аминопептидазы LAP (Fasciola hepatica и Fasciola gigantica, фасциолез); прионный белок (прион FFI, летальная семейная бессонница (FFI)); подобный гомологу ядовитого аллергена белок VAL-1, сильно экспрессированный личиночный транскрипт ALT-1, сильноэкспрессированный личиночный транскрипт ALT-2, тиоредоксинпероксидаза ТРХ, гомолог осиного аллергена VAH, тиоредоксинпероксидаза 2 ТРХ-2, антигенный белок SXP (пептиды N, N1, N2, и N3), связанный с активацией белок-1 ASP-1, тиоредоксин TRX, трансглутаминаза BmTGA, глутатион-S-трансферазы GST, миозин, гомолог осиного аллергена VAH, коллагеназа 175 кДа, глицеральдегид-3-фосфатдегидрогеназа GAPDH, кутикулярный коллаген Col-4, секретируемые личиночные кислые белки SLAP, хитиназа CHI-1, связывающий мальтозу белок МБР, гликолитический фермент фруктозо-1,6-бисфосфатальдолаза Fba, тропомиозин TMY-1, специфичный для нематод продукт гена OvB20, онхоцистатин CPI-2, Сох-2 (суперсемейство Filarioidea, филяриоз); фосфолипаза С PLC, термолабильный энтеротоксин В, компонент йота-токсина Ib, белок СРЕ1281, пируватферредоксиноксидоредуктаза, фактор элонгации G EF-G, перфринголизин О Pfo, глицеральдегид-3-фосфатдегидрогеназа GapC, фруктозобисфосфатальдолаза Alf2, энтеротоксин Clostridium perfringens CPE, альфа-токсин AT, альфа-анатоксин ATd, эпсилон-анатоксин ETd, белок HP, большой цитотоксин TpeL, эндо-бета-N-ацетилглюкозаминидаза Naglu, фосфоглицеромутаза Pgm (Clostridium perfringens, пищевое отравление Clostridium perfringens); лейкотоксин lktA, белок адгезии FadA, белок наружной мембраны RadD, высокомолекулярный аргининсвязывающий белок (род Fusobacterium, инфекция Fusobacterium); фосфолипаза С PLC, термолабильный энтеротоксин В, компонент йота-токсина Ib, белок СРЕ1281, пируватферредоксиноксидоредуктаза, фактор элонгации G EF-G, перфринголизин О Pfo, глицеральдегид-3-фосфатдегидрогеназа GapC, фруктоза-бисфосфатальдолаза Alf2, энтеротоксин Clostridium perfringens CPE, альфа-токсин AT, альфа-анатоксин ATd, эпсилон-анатоксин ETd, белок HP, большой цитотоксин TpeL, эндо-бета-N-ацетилглюкозаминидаза Naglu, фосфоглицеромутаза Pgm (как правило, Clostridium perfringens; другие виды Clostridium, газовая гангрена (клостридиальный мионекроз)); липаза А, липаза В, пероксидаза Decl (Geotrichum candidum, геотрихоз); прионный белок (прион GSS, синдром Герстманна-Штреусслера-Шейнкера (GSS)); белки стенки цисты CWP1, CWP2, CWP3, вариант поверхностного белка VSP, VSP1, VSP2, VSP3, VSP4, VSP5, VSP6, антиген 56 кДа, пируватферредоксиноксидоредуктаза PFOR, алкогольдегидрогеназа Е ADHE, альфа-гиардин, альфа8-гиардин, альфа1-гиардин, бета-гиардин, цистеиновые протеазы, глутатион-S-трансфераза GST, аргининдезиминаза ADI, фруктозо-1,6-бифосфатальдолаза FBA, антигены Giardia trophozoite GTA (GTA1, GTA2), орнитинкарбоксилтрансфераза OCT, подобный белку сборки поперечно-полосатых волокон белок SALP, уридинфосфосфорилоподобный белок UPL, альфа-тубулин, бета-тубулин (Giardia intestinalis, гиардиоз); представители семейства переносчика ABC (LolC, ОррА, и PotF), предполагаемый трансмембранный белок системы высвобождения липопротеинов LolC/E, флагеллин FliC, белок внутриклеточной подвижности Burkholderia A BimA, бактериальный фактор элонгации Tu EF-Tu, подобный OmpA белок 17 кДа, boaA, кодирующий белок (Burkholderia mallei, сап); циклофилин СуР, белок личинки третьей стадии 24 кДа GS24, продукты экскреции-секреции ESP (40, 80, 120 и 208 кДа) (Gnathostoma spinigerum и Gnathostoma hispidum, гнатостомоз); пилиновые белки, минорная связанная с пилинами субъединица pile, большая субъединица пилина и варианты pilE, pilS, белок фазовой вариации porA, порин В PorB, белок TraD, антиген наружной мембраны нейссерий Н.8, антиген 70 кДа, основной белок наружной мембраны PI, белки наружной мембраны Р1А и Р1В, антиген W, поверхностный белок A NspA, связывающий трансферрин белок TbpA, связывающий трансферрин белок TbpB, РВР2, mtrR, кодирующий белок, ponA, кодирующий белок, мембранная пермеаза FbpBC, белковая система FbpABC, белки LbpAB, белок наружной мембраны Ора, переносчик наружной мембраны FetA, ингибируемый железом регулятор MpeR (Neisseria gonorrhoeae, гонорея); белок наружной мембраны А OmpA, белок наружной мембраны С OmpC, белок наружной мембраны K17 OmpK17 (Klebsiella granulomatis, паховая гранулема (донованоз)); связывающий фибронектин белок Sfb, связывающий фибронектин/фибриноген белок FBP54, связывающий фибронектин белок FbaA, белок М типа 1 Emm1, белок М типа 6 Emm6, связывающий иммуноглобулины белок 35 Sib35, поверхностный белок R28 Spr28, супероксиддисмутаза SOD, пептидаза С5а ScpA, антиген I/II AgI/II, адгезии AspA, родственный G-белкам связывающий альфа2-макроглобулин белок GRAB, поверхностный фибриллярный белок М5 (Streptococcus pyogenes, инфекция стрептококком группы А); β-антиген С-белка, аргининдезиминазные белки, адгезии BibA, белок 105 кДа BPS, поверхностные антигены с, поверхностные антигены R, поверхностные антигены X, устойчивый к трипсину белок R1, устойчивый к трипсину белок R3, устойчивый к трипсину белок R4, поверхностный иммуногенный белок Sip, поверхностный белок Rib, белок с богатыми лейцином повторами LrrG, белок с богатыми серином повторами Srr-2, альфа-антиген С-белка Вса, бета-антиген Bag, поверхностный антиген эпсилон, подобный альфа-белку белок ALP1, подобный альфа-белку белок ALP5, поверхностный антиген дельта, подобный альфа-белку белок ALP2, подобный альфа-белку белок ALP3, подобный альфа-белку белок ALP4, белок Cbeta Вас (Streptococcus agalactiae, инфекция стрептококком группы В); связывающий трансферрин белок 2 Tbp2, фосфатаза Р4, белок наружной мембраны Р6, связанный с пептидогликанами липопротеин Pal, белок D, белок Е, белок адгезии и пенетрации Нар, белок наружной мембраны 26 Omp26, белок наружной мембраны Р5 (фимбрин), белок наружной мембраны D15, белок наружной мембраны OmpP2, 5'-нуклеотидаза NucA, белок наружной мембраны Р1, белок наружной мембраны Р2, липопротеин наружной мембраны Рср, липопротеин Е, белок наружной мембраны Р4, фукулокиназа FucK, [Cu,Zn]-супероксиддисмутаза SodC, протеаза HtrA, белок O145, альфа-галактозилцерамид (Haemophilus influenzae, инфекция Haemophilus influenzae); полимераза 3D, вирусный капсидный белок VP1, вирусный капсидный белок VP2, вирусный капсидный белок VP3, вирусный капсидный белок VP4, протеаза 2А, протеаза 3С (энтеровирусы, в основном вирус Коксаки А и энтеровирус 71 (EV71), болезнь рук, ног и рта (HFMD)); РНК-полимераза L, белок L, гликопротеин Gn, гликопротеин Gc, нуклеокапсидный белок S, оболочечный гликопротеин G1, нуклеопротеин NP, белок N, полипротеин М (вирус Sin Nombre, хантавирус, легочный синдром хантавируса (HPS)); белок теплового шока HspA, белок теплового шока HspB, цитратсинтетаза GltA, белок UreB, белок теплового шока Hsp60, активирующий нейтрофилы белок NAP, каталаза KatA, вакуолизированный цитотоксин VacA, уреаза альфа UreA, уреаза бета Ureb, белок Cpn10, белок groES, белок теплового шока Hsp10, белок МорВ, связанный с цитотоксичностью белок 10 кДа CAG, антиген 36 кДа, бета-лактамаза НсрА, бета-лактамаза НсрВ (Helicobacter pylori, инфекция Helicobacter. pylori); интегральный мембранные белки, предрасположенные к агрегации белки, О-антиген, токсины-антигены Stx2B, токсин-антиген Stx1B, фрагмент адгезионного антигена Int28, белок EspA, белок EspB, интимин, белок Tir, белок IntC300, белок Еае (Escherichia coli O157:Н7, O111 и О104:Н4, гемолитический уремический синдром (HUS)); РНК-полимераза L, белок L, гликопротеин Gn, гликопротеин Gc, нуклеокапсидный белок S, оболочечный гликопротеин G1, нуклеопротеин NP, белок N, полипротеин М (семейство Bunyaviridae, геморрагическая лихорадка с почечным синдромом (HFRS)); гликопротеин G, белок матрикса М, нуклеопротеин N, белок слияния F, полимераза L, белок W, белок С, фосфопротеин р, неструктурный белок V (генипавирус (вирус Хендра вирус Нипах), инфекция генипавирусами); полипротеин, гликопротеин Gp2, поверхностный антиген гепатита А HBAg, белок 2А, вирусный белок VP1, вирусный белок VP2, вирусный белок VP3, вирусный белок VP4, белок Р1В, белок Р2А, белок Р3АВ, белок P3D (вирус гепатита А, гепатит А); поверхностный антиген гепатита В HBsAg, коровый антиген гепатита В HbcAg, полимераза, белок Hbx, срединный поверхностный белок preS2, поверхностный белок L, большой белок S, вирусный белок VP1, вирусный белок VP2, вирусный белок VP3, вирусный белок VP4 (вирус гепатита В (HBV), гепатит В); оболочечный гликопротеин E1 gp32 gp35, оболочечный гликопротеин Е2 NS1 gp68 gp70, капсидный белок С, коровый белок Core, полипротеин, вирусный белок VP1, вирусный белок VP2, вирусный белок VP3, вирусный белок VP4, антиген G, белок NS3, белок NS5A, (вирус гепатита С, гепатит С); вирусный белок VP1, вирусный белок VP2, вирусный белок VP3, вирусный белок VP4, большой антиген гепатита дельта, малый антиген гепатита дельта (вирус гепатита D, гепатит D); вирусный белок VP1, вирусный белок VP2, вирусный белок VP3, вирусный белок VP4, капсидный белок Е2 (вирус гепатита Е, гепатит Е); гликопротеин L UL1, урацил-ДНК гликозилаза UL2, белок UL3, белок UL4, белок репликации ДНК UL5, портальный белок UL6, белок созревания вириона UL7, ДНК-геликаза UL8, связывающий участок начала репликации белок UL9, гликопротеин М UL10, белок UL11, щелочная экзонуклеаза UL12, серин-треониновая протеинкиназа UL13, белок оболочки UL14, терминаза UL15, белок оболочки UL16, белок UL17, капсидный белок VP23 UL18, основной капсидный белок VP5 UL19, мембранный белок UL20, белок оболочки UL21, гликопротеин Н (UL22), тимидинкиназа UL23, белок UL24, белок UL25, капсидный белок Р40 (UL26, VP24, VP22A), гликопротеин В (UL27), белок ICP18.5 (UL28), основной связывающий ДНК белок ICP8 (UL29), ДНК-полимераза UL30, белок ядерного матрикса UL31, оболочечный гликопротеин UL32, белок UL33, белок внутренней ядерной мембраны UL34, капсидный белок VP26 (UL35), большой белок оболочки UL36, белок сборки капсида UL37, белок VP19C (UL38), рибонуклеотидредуктаза (большая субъединица) UL39, рибонуклеотидредуктаза (малая субъединица) UL40, белок оболочки/белок изоляции от хозяина вириона (UL41), фактор процессивности ДНК-полимеразы UL42, мембранный белок UL43, гликопротеин С (UL44), мембранный белок UL45, белки оболочки VP11/12 (UL46), белок оболочки VP13/14 (UL47), белок созревания вириона VP16 (UL48, альфа-TIF), оболочечный белок UL49, дУТФ-дифосфатаза UL50, белок оболочки UL51, ДНК-геликаза/белок праймазного комплекса UL52, гликопротеин К (UL53), белок регуляции транскрипции IE63 (ICP27, UL54), белок UL55, белок UL56, белок репликации вируса ICP22 (IE68, US1), белок US2, серин/треониновая протеинкиназа US3, гликопротеин G (US4), гликопротеин J (US5), гликопротеин D (US6), гликопротеин I (US7), гликопротеин Е (US8), белок оболочки US9, белок капсида/оболочки US10, белок Vraw21 (US11), белок ICP47 (IE12, US12), основной активатор транскрипции ICP4 (IE175, RSI), ЕЗ убиквитинлигаза ICPO (IE110), связанный с задержкой белок 1 LRP1, связанный с задержкой белок 2 LRP2, фактор нейровирулентности RL1 (1СР34,5), связанный с задержкой транскрипт LAT (вирус простого герпеса 1 и 2 (HSV-1 и HSV-2), Herpes simplex); белок теплового шока Hsp60, белок клеточной поверхности Н1С, дипептидилпептидаза типа IV DppIV, антиген М, белок 70 кДа, гистоноподобный белок 17 кДа (Histoplasma capsulatum, гистоплазмоз); связывающий жирные кислоты и ретинол белок-1 FAR-1, тканевой ингибитор металлопротеиназы TIMP (ТМР), цистеиновая протеиназа ACEY-1, цистеиновая протеиназа АССР-1, поверхностный антиген Ас-16, секретируемый белок 2 ASP-2, металлопротеаза 1 МТР-1, ингибитор аспартилпротеазы API-1, связанный с поверхностью антиген SAA-1, связанный с поверхностью антиген SAA-2, специфичный для взрослых секретируемый фактор Ха, серии ингибитор протеазы антикоагулянт АР, подобная катепсину D аспарагиновая протеаза ARR-1, глутатион-Б-трансфераза GST, аспарагиновая протеаза APR-1, ацетилхолинэстераза АСЪЕ (Ancylostoma duodenale и Necator americanus, анкилостомоз); белок NS1, белок NP1, белок VP1, белок VP2, белок VP3 (бокавирус человека (HBoV), инфекция бокавирусом человека); основной поверхностный белок 2 MSP2, основной поверхностный белок 4 MSP4, вариант MSP SGV1, вариант MSP SGV2, белок наружной мембраны ОМР, белок наружной мембраны 19 ОМР-19, основной антигенный белок MAPI, основной антигенный белок МАР1-2, основной антигенный белок МАР1В, основной антигенный белок МАР1-3, Erum2510, кодирующий белок, белок GroEL, белок GroES, основные белки наружной мембраны 30 кДа, белок GE 10 0 кДа, белок GE 130 кДа, белок GE 160 кДа (Ehrlichia ewingii, эрлихиоз Ehrlichia ewingii человека); основные поверхностные белки 1-5 (MSP1a, MSP1b, MSP2, MSP3, MSP4, MSP5), белки системы секреции типа IV VirB2, VirB7, VirBll, VirD4 (Anaplasma phagocytophilum, гранулоцитарный анаплазмоз человека (HGA)); белок NS1, малый гидрофобный белок NS2, белок SH, белок слияния F, гликопротеин G, белок матрикса М, белок матрикса М2-1, белок матрикса М2-2, фосфопротеин Р, нуклеопротеин N, полимераза L (метапневмовирус человека (hMPV), инфекция метапневмовирусом человека); основной поверхностный белок 2 MSP2, основной поверхностный белок 4 MSP4, вариант MSP SGV1, вариант MSP SGV2, белок наружной мембраны ОМР, белок наружной мембраны 19 ОМР-19, основной антигенный белок MAPI, основной антигенный белок МАР1-2, основной антигенный белок МАР1В, основной антигенный белок МАР1-3, Erum2510, кодирующий белок, белок GroEL, белок GroES, основные белки наружной мембраны 30 кДа, белок GE 100 кДа, белок GE 130 кДа, белок GE 160 кДа (Ehrlichia chaffeensis, моноцитарный эрлихиоз человека); белок репликации Е1, регуляторный белок Е2, белок Е3, белок Е4, белок Е5, белок Е6, белок Е7, белок Е8, основной капсидный белок L1, минорный капсидный белок L2 (вирус папилломы человека (HPV), инфекция вирусом папилломы человека (HPV)); белок слияния F, гемагглютинин-нейраминидаза HN, гликопротеин G, белок матрикса М, фосфопротеин Р, нуклеопротеин N, полимераза L (вирусы парагриппа человека (HPIV), инфекция вирусом парагриппа человека); гемагглютинин (НА), нейраминидаза (NA), нуклеопротеин (NP), белок M1, белок М2, белок NS1, белок NS2 (белок NEP: белок экспорта из ядра), белок РА, белок РВ1 (белок основной полимеразы 1), белок PB1-F2 и белок РВ2 (семейство Orthomyxoviridae, вирус гриппа (flu)); геномный полипротеин, белок Е, белок М, капсидный белок С (вирус японского энцефалита, японский энцефалит); токсин RTX, пили типа IV, основная субъединица пилей PilA, регуляторные факторы транскрипции PilS и PilR, белок sigma54, белки наружной мембраны (Kingella kingae, инфекция Kingella kingae); прионный белок (прион Kuru, Kuru); нуклеопротеин N, полимераза L, белок матрикса Z, гликопротеин GP (вирус Ласса, лихорадка Ласса); связанный с пептидогликанами липопротеин PAL, шаперонин 60 кДа Cpn60 (groEL, HspB), пилин типа IV PilE, белок наружной мембраны MIP, основной белок наружной мембраны MompS, цинковая металлопротеиназа MSP (Legionella pneumophila, легионеллез (болезнь легионеров, понтиакская лихорадка)); нуклеаза Р4, белок WD, рибонуклеотидредуктаза М2, гликопротеин поверхностной мембраны Pg46, цистеиновая протеиназа CP, регулируемый глюкозой белок 78 GRP-78, стадиоспецифический подобный S-антигену белок А2, АТФаза F1, бета-тубулин, белок теплового шока 70 Hsp70, КМР-11, гликопротеин GP63, белок ВТ1, нуклеозидгидролаза NH, белок клеточной поверхности В1, подобный рибосомальному белку Р1 белок Р1, стерин-24-с-метилтрансфераза SMT, белок LACK, гистон H1, белок SPB1, тиолспецифический антиоксидант TSA, белковый антиген ST11, сигнальная пептидаза SP, гистон Н2В, поверхностный антиген PSA-2, цистеиновая протеиназа b Cpb (род Leishmania, лейшманиоз); основной мембранный белок I, богатый серином антиген 45 кДа, шаперонин 10 кДа GroES, антиген HSP кДа, аминооксононаноатсинтетаза AONS, белок рекомбиназа A RecA, ацетил/пропионил-кофермент А-карбоксилаза альфа, аланинрацемаза, шаперонин 60 кДа 2, подобный ESAT-6 белок ЕсхВ (L-ESAT-6), белок Lsr2, белок ML0276, связывающий гепарин гемагглютинин НВНА, белок теплового шока 65 Hsp65, mycPl или ML0041, кодирующие белки, htrA2 или ML0176, кодирующие белки, htrA4 или ML2659, кодирующие белки, дер или ML03 79, кодирующие белки, clpC или ML0235, кодирующие белки (Mycobacterium leprae и Mycobacterium lepromatosis, лепра); белок наружной мембраны LipL32, мембранный белок LIC1025 8, мембранный белок LP30, мембранный белок LIC12238, подобный Оmpa белок Lsa66, поверхностный белок LigA, поверхностный белок LigB, основной белок наружной мембраны OmpL1, белок наружной мембраны LipL41, белок LigAni, поверхностный белок LcpA, белок адгезии LipL53, белок наружной мембраны UpL32, поверхностный белок Lsa63, флагеллин FlaB1, мембранный липопротеин LipL21, мембранный белок pL40, лептоспиральный поверхностный адгезии Lsa27, белок наружной мембраны OmpL36, белок наружной мембраны OmpL37, белок наружной мембраны OmpL47, белок наружной мембраны OmpL54, ацилтрансфераза LpxA (род Leptospira, лептоспироз); предшественник листериолизина О Hly (LLO), связанный с инвазией белок lap (Р60), листериолизиновый регуляторный белок PrfA, цинковая металлопротеиназа Mpl, фосфатидилинозитолспецифическая фосфолипаза С PLC (P1cA, P1cB), O-ацетилтрансфераза Oat, пермеаза переносчик ABC Im.G_1771, белок адгезии LAP, рецептор LAP Hsp60, адгезии LapB, гемолизин листериолизин О LLO, белок ActA, интерналин A In1A, белок ln1B (Listeria monocytogenes, листериоз); белок внешней поверхности A OspA, белок внешней поверхности OspB, белок внешней поверхности OspC, связывающий декорин белок A DbpA, связывающий декорин белок В DbpB, коровый белок жгутикового филамента 41 кДа Fla, основной мембранный белок А BmpA (иммунодоминантный антиген Р39), предшественник липопротеина внешней поверхности 22 кДа (антиген IPLA7), вариабельный поверхностный липопротеин vlsE (как правило, Borrelia burgdorferi и другие виды Borrelia, болезнь Лайма (боррелиоз Лайма)); подобный гомологу ядовитого аллергена белок VAL-1, сильноэкспрессированный личиночный транскрипт ALT-1, сильноэкспрессированный личиночный транскрипт ALT-2, тиоредоксинпероксидаза ТРХ, гомолог осиного аллергена VAH, тиоредоксинпероксидаза 2 ТРХ-2, антигенный белок SXP (пептиды N, N1, N2, и N3), связанный с активацией белок-1 ASP-1, тиоредоксин TRX, трансглутаминаза BmTGA, глутатион-S-трансферазы GST, миозин, гомолог осиного аллергена VAH, коллагеназа 175 кДа, глицеральдегид-3-фосфатдегидрогеназа GAPDH, кутикулярный коллаген Col-4, секретируемые личиночные кислые белки SLAPs, хитиназа CHI-1, связывающий мальтозу белок МБР, гликолитический фермент фруктозо-1,6-бисфосфатальдолаза Fba, тропомиозин TMY-1, специфичный для нематод продукт гена OvB20, онхоцистатин CPI-2, белок Сох-2 (Wuchereria bancrofti и Brugia malayi, лимфатический филяриатоз (слоновость)); гликопротеин GP, белок матрикса Z, полимераза L, нуклеопротеин N (вирус лимфоцитарного хориоменингита (LCMV), лимфоцитарный хориоменингит); родственный тромбоспондину безымянный белок TRAP, спорозоитный поверхностный белок 2 SSP2, антиген апикальной мембраны 1 АМА1, мембранный антиген роптрии RMA1, кислый антиген с основными повторами ABRA, белок прохождения в клетку PF, белок Pvs25, мерозоитный поверхностный белок 1 MSP-1, мерозоитный поверхностный белок 2 MSP-2, поверхностный антиген эритроцитов, инфицированных кольцевидным трофозоитом RESA, антиген печеночной стадии 3 LSA-3, белок Eba-175, антиген сериновых повторов 5 SERA-5, спорозоитный белок CS, мерозоитный поверхностный белок 3 MSP3, мерозоитный поверхностный белок 8 MSP8, енолаза PF10, гепатоцитарный эритроцитарный белок 17 кДа НЕР17, белок мембраны эритроцита 1 ЕМР1, белок Kbeta, мерозоитный поверхностный белок 4/5 MSP 4/5, белок теплового шока Hsp90, богатый глутаминатом белок GLURP, мерозоитный поверхностный белок 4 MSP-4, белок STARP, предшественник родственного спорозоитному белку антигена CRA (род плазмодиев, малярия); нуклеопротеин N, связанный с мембраной белок VP24, минорный нуклеопротеин VP30, кофактор полимеразы VP35, полимераза L, белок матрикса VP40, оболочечный гликопротеин GP (вирус марбургской лихорадки, марбургская геморрагическая лихорадка (MHF)); белок С, белок матрикса М, фосфопротеин Р, неструктурный белок V, гемагглютинин гликопротеин Н, полимераза L, нуклеопротеин N, белок слияния F (вирус кори, корь); представители семейства переносчика ABC (LolC, ОррА и PotF), предполагаемый трансмембранный белок системы высвобождения липопротеинов LolC/E, флагеллин FliC, белок внутриклеточной подвижности Burkholderia A BimA, бактериальный фактор элонгации-Tu EF-Tu, подобный OmpA белок 17 кДа, boaA, кодирующий белок, boaB, кодирующий белок (Burkholderia pseudomallei, мелиоидоз (болезнь Уитмора)); пилиновые белки, минорная связанная с пилинами субъединица pile, большая субъединица пилина и варианты pilE, pilS, белок фазовой вариации porA, порин В PorB, белок TraD, антиген наружной мембраны нейсерий Н.8, антиген 70 кДа, основной белок наружной мембраны PI, белки наружной мембраны Р1А и Р1В, антиген W, поверхностный белок A NspA, связывающий трансферрин белок TbpA, связывающий трансферрин белок TbpB, РВР2, mtrR, кодирующий белок, ponA, кодирующий белок, мембранная пермеаза FbpBC, белковая система FbpABC, белки LbpAB, белок наружной мембраны Ора, переносчик наружной мембраны FetA, ингибируемый железом регулятор MpeR, связывающий фактор Н белок fHbp, адгезии NadA, белок NhbA, репрессор FarR (Neisseria meningitidis, менингококковое заболевание); белок 66 кДа, белок 22 кДа (как правило, Metagonimus yokagawai, метагонимиаз);. белки полярных трубочек (34, 75 и 170 кДа у Glugea, 35, 55 и 150 кДа у Encephalitozoon), родственный кинезину белок, наибольшая субъединица РНК-полимеразы II, сходный или интегральный мембранный белок YIPA, антисайленсинговый белок 1, фактор транскрипции теплового шока HSF, протеинкиназа, тимидинкиназа, подобный NOP-2 ядерный белок (Microsporidia phylum, микроспоридиоз); подобный CASP8 и FADD регулятор апоптоза, глутатионпероксидаза GPX1, РНК-геликаза NPH-II NPH2, каталитическая субъединица поли(А)-полимеразы PAPL, основной белок оболочки P43K, субъединица 70 кДа раннего фактора транскрипции VETFS, субъединица 82 кДа раннего фактора транскрипции VETFL, металлоэндопептидаза типа G1, нуклеозидтрифосфатаза I NPH1, подобный белку репликации А28 MC134L, субъединица 7 кДа РНК-полимеразы RP07 (вирус контагиозного моллюска (MCV), контагиозный моллюск (МС)); белок матрикса М, фосфопротеин P/V, малый гидрофобный белок SH, нуклеопротеин N, белок V, гликопротеин слияния F, гемагглютининнейраминидаза HN, РНК-полимераза L (вирус эпидемического паротита, эпидемический паротит); белки наружной мембраны ОМ, клеточный поверхностный антиген OmpA, клеточный поверхностный антиген OmpB (sca5), белок клеточной поверхности SCA4, белок клеточной поверхности SCA1, внутрицитоплазматический белок D, кристаллический белок поверхностного слоя SLP, протективный поверхностный белковый антиген SPA (Rickettsia typhi, тиф мышей (эндемический тиф)); адгезии Р1, адгезии Р30, белок р116, белок Р40, белок цитоскелета HMW1, белок цитоскелета HMW2, белок цитоскелета HMW3, MPN152, кодирующий белок, MPN426, кодирующий белок, MPN456, кодирующий белок, MPN-500, кодирующий белок (Mycoplasma pneumoniae, микоплазменная пневмония); NocA, зависимый от железа регуляторный белок, VapA, VapD, VapF, VapG, казеинолитическая протеаза, связанный с верхушкой филамента белок 43 кДа, белок Р24, белок Р61, белок 15 кДа, белок 56 кДа (как правило, Nocardia asteroides и другие виды Nocardia, нокардиоз); подобный гомологу ядовитого аллергена белок VAL-1, сильноэкспрессированный личиночный транскрипт ALT-1, сильноэкспрессированный личиночный транскрипт ALT-2, тиоредоксинпероксидаза ТРХ, гомолог осиного аллергена VAH, тиоредоксинпероксидаза 2 ТРХ-2, антигенный белок SXP (пептиды N, N1, N2, и N3), связанный с активацией белок-1 ASP-1, тиоредоксин TRX, трансглутаминаза BmTGA, глутатион-3-трансферазы GST, миозин, гомолог осиного аллергена VAH, 175 кДа коллагеназа, глицеральдегид-3-фосфатдегидрогеназа GAPDH, кутикулярный коллаген Col-4, секретируемые личиночные кислые белки SLAP, хитиназа СНТ-1, связывающий мальтозу белок МБР, гликолитический фермент фруктозо-1,6-бисфосфатальдолаза Fba, тропомиозин TMY-1, специфичный для нематод продукт гена OvB20, онхоцистатин CPI-2, Сох-2 (Onchocerca volvulus, онхоцеркоз (речная слепота)); секретируемый гликопротеин 43 кДа, гликопротеин gp0, гликопротеин gp75, антиген Pb27, антиген Pb40, белок теплового шока Hsp65, белок теплового шока Hsp70, белок теплового шока Hsp90, белок Р10, триозофосфатизомераза TPI, связывающий N-ацетилглюкозамин лектин паракокцин, белок 28 кДа Pb28 (Paracoccidioides brasiliensis, паракокцидиоидоз (южноамериканский бластомикоз)); подобная крузипейну цистеиновая протеаза 28 кДа Pw28CCP (как правило, Paragonimus westermani и другие виды Paragonimus, парагонимоз); белок наружной мембраны OmpH, белок наружной мембраны Отр28, белок РМ1539, белок РМ03 55, белок РМ1417, белок восстановления MutL, белок BcbC, белок РМ0305, формиатдегидрогеназа-N, белок РМ0698, белок РМ1422, ДНК-гираза, липопротеин PlpE, адгезивный белок Ср39, рецептор системы доступа к тему HasR, капсульный белок 39 кДа, регулируемый железом ОМР IROMP, белок наружной мембраны OmpA87, фимбриальный белок Ptf, субъединица фимбриального белка PtfA, связывающий трансферрин белок Tbpl, фермент эстераза MesA, токсин Pasteurella multocida РМТ, адгезивный белок Ср39 (род Pasteurella, пастереллез); "филаментозный гемагглютинин FhaB, аденилатциклаза СуаА, предшественник субъединицы токсина коклюша 4 PtxD, предшественник пертактина Prn, субъединица токсина 1 PtxA, белок Cpn60, белок brkA, предшественник субъединицы токсина коклюша 2 PtxB, предшественник субъединицэ токсина коклюша 3 PtxC, предшественник субъединицз токсина коклюша 5 PtxE, пертактин Prn, белок Fim2, белок Fim3; "(Bordetella pertussis, коклюш (судорожный кашель)); "капсульный антиген F1, связанный с вирулентностью антиген V, секретируемый эффекторный белок LcrV, антиген V, протеаза наружной мембраны Р1а, секретируемый эффекторный белок YopD, предполагаемая тирозинфосфатаза секретируемого белка YopH, большая субъединица комплекса шпильки YscF, протеинкиназа YopO, предполагаемый белок-автопереносчик YapF, переносчик внутренней мембраны ABC YbtQ (Irp7), предполагаемый связывающий сахара белок YPO0612, белок теплового шока 90 HtpG, предполагаемый белок сульфатазы YdeN, белок-носитель липопротеинов внешней мембраны LolA, шаперон для секреции YerA, предполагаемый липопротеин YPO0420, белок активатор гемолизина HpmB, рецептор пестицина/иерсиниабактина наружной мембраны Psn, секретируемый эффекторный белок YopE, секретируемый эффекторный белок YopF, секретируемый эффекторный белок YopK, белок наружной мембраны YopN, белок наружной мембраны YopM, предшественник коагулазы/фибринолизина Pla; " (Yersinia pestis, чума); белок PhpA, поверхностный адгезии PsaA, пневмолизин Ply, АТФ-зависимая протеаза Clp, липоатпротеинлигаза LplA, заякоренной на поверхности клеточной стенки белок psrP, сортаза SrtA, глутамил-тРНК синтетаза GltX, связывающий холин белок А CbpA, поверхностный белок А пневмококков PspA, поверхностный белок С пневмококков PspC, 6-фосфоглюконатдегидрогеназа Gnd, связывающий железо белок PiaA, муреингидролаза LytB, протеон LytC, протеаза A1 (Streptococcus pneumoniae, пневмококковая инфекция); основной поверхностный белок В, кексиноподобная протеаза KEX1, белок А12, антиген 55 кДа Р55, основной поверхностный гликопротеин Msg (Pneumocystis jirovecii, пневмоцистная пневмония (РСР)); геномный полипротеин, полимераза 3D, вирусный капсидный белок VP1, вирусный капсидный белок VP2, вирусный капсидный белок VP3, вирусный капсидный белок VP4, протеаза 2А, протеаза 3С (полиовирус, полиомиелит); белок Nfal, экзендин-3, секреторная липаза, подобная катепсину В протеаза, цистеиновая протеаза, катепсин, пероксиредоксин, белок CrylAc (как правило, Naegleria fowleri, первичный амебный менингоэнцефалит (РАМ)); агнопротеин, большой Т-клеточный антиген, малый Т-клеточный антиген, основной капсидный белок VP1, минорный капсидный белок Vp2 (вирус JC, прогрессирующая многоочаговая лейкоэнцефалопатия); белок низкого кальциевого ответа Е LCrE, наружный белок хламидий N CopN, серин/треониновая протеинкиназа PknD, S-малонилтрансфераза белка-носителя кислотных групп FabD, связывающий одноцепочечную ДНК белок Ssb, основной белок наружной мембраны МОМР, белок наружной мембраны 2 Omp2, семейство полиморфных мембранных белков (Pmp1, Pmp2, Pmp3, Pmp4, Pmp5, Pmp6, Pmp7, Pmp8, Pmp9, Pmp10, Pmp11, Pmp12, Pmp13, Pmp14, Pmp15, Pmp16, Pmp17, Pmp18, Pmp19, Pmp20, Pmp21) (Chlamydophila psittaci, пситтакоз); белок наружной мембраны P1, белок теплового шока В HspB, пептид-переносчик ABC, GTP-связывающий белок, белок IcmB, рибонуклеаза R, фосфатаза SixA, белок DsbD, белок наружной мембраны TolC, ДНК-связывающий белок PhoB, АТФаза DotB, белок теплового шока В HspB, мембранный белок Coml, белок 28 кДа, ДНК-3-метиладенингликозидаза I, белок наружной мембраны OmpH, белок наружной мембраны AdaA, Т-белок системы расщепления глицина (Coxiella burnetii, лихорадка Q); нуклеопротеин N, большой структурный белок L, фосфопротеин Р, белок матрикса М, гликопротеин G (вирус бешенства, бешенство); белок слияния F, нуклеопротеин N, белок матрикса М, белок матрикса М2-1, белок матрикса М2-2, фосфопротеин Р, малый гидрофобный белок SH, основной поверхностный гликопротеин G, полимераза L, неструктурный белок 1 NS1, неструктурный белок 2 NS2 (респираторно-синцитиальный вирус (RSV), инфекция респираторно-синцитиальным вирусом); геномный полипротеин, полимераза 3D, вирусный капсидный белок VP1, вирусный капсидный белок VP2, вирусный капсидный белок VP3, вирусный капсидный белок VP4, протеаза 2А, протеаза 3С (риновирус, инфекция риновирусом); белки наружной мембраны ОМ, клеточный поверхностный антиген OmpA, клеточный поверхностный антиген OmpB (sca5), белок клеточной поверхности SCA4, белок клеточной поверхности SCA1, белок PS120, внутрицитоплазматический белок D, протективный поверхностный белковый антиген SPA (род Rickettsia, риккетсиозная инфекция); белки наружной мембраны ОМ, клеточный поверхностный антиген OmpA, клеточный поверхностный антиген OmpB (sca5), белок клеточной поверхности SCA4, белок клеточной поверхности SCA1, внутрицитоплазматический белок D (Rickettsia akari, везикулезный риккетсиоз); оболочечный гликопротеин GP, полимераза L, нуклеопротеин N, неструктурный белок NSS (вирус лихорадки долины Рифт, лихорадка долины Рифт (RVF)); белки наружной мембраны ОМ, клеточный поверхностный антиген OmpA, клеточный поверхностный антиген OmpB (sca5), белок клеточной поверхности SCA4, белок клеточной поверхности SCA1, внутрицитоплазматический белок D (Rickettsia rickettsii, пятнистая лихорадка Скалистых гор (RMSF)); "неструктурный белок 6 NS6, неструктурный белок 2 NS2, промежуточный капсидный белок VP6, внутренний капсидный белок VP2, неструктурный белок 3 NS3, РНК-зависимая РНК-полимераза L, белок VP3, неструктурный белок 1 NS1, неструктурный белок 5 NS5, внешний капсидный гликопротеин VP7, неструктурный гликопротеин 4 NS4, внешний капсидный белок VP4; "(ротавирус, ротавирусная инфекция); полипротеин Р200, гликопротеин E1, гликопротеин Е2, белок NS2, капсидный белок С (вирус краснухи, краснуха); шаперонин GroEL (МорА), инозитолфосфатфосфатаза SopB, белок теплового шока HslU, шапероновый белок DnaJ, белок TviB, белок IroN, флагеллин FliC, инвазивный белок SipC, гликопротеин др43, белок наружной мембраны LamB, белок наружной мембраны PagC, белок наружной мембраны TolC, белок наружной мембраны NmpC, белок наружной мембраны FadL, транспортный белок SadA, трансфераза WgaP, эффекторные белки SifA, SteC, SseL, SseJ и SseF (род Salmonella, сальмонеллез); "белок 14, неструктурный белок NS7b, неструктурный белок NS8a, белок 9b, белок 3а, нуклеопротеин N, неструктурный белок NS3b, неструктурный белок NS6, белок 7а, неструктурный белок NS8b, мембранный белок М, малый оболочечный мембранный белок EsM, полипротеинрепликаза 1а, гликопротеин стержня S, полипротеинрепликаза 1ab; " (коронавирусная SARS, SARS (тяжелый острый респираторный синдром)); сериновая протеаза, атипичный антиген Sarcoptes 1 ASA1, глутатион-S-трансферазы GST, цистеиновая протеаза, сериновая протеаза, аполипопротеин (Sarcoptes scabiei, чесотка); глутатион-S-трансферазы GST, парамиозин, гемоглобиназа SM32, основной антиген яйца, связывающий жирные кислоты белок 14 кДа Sm14, основной поверхностный личиночный антиген Р37, оболочечный антиген 22,6 кДа, кальпаин CANP, трифосфатизомераза Tim, поверхностный белок 9В, внешний капсидный белок VP2, интегральный мембранный белок 23 кДа Sm23, Cu/Zn-супероксиддисмутаза, гликопротеин Gp, миозин (род Schistosoma, шистомоз (бильгарциоз)); шаперонин 60 кДа, типоспецифический антиген 56 кДа, пируватфосфатдикиназа, 4-гидроксибензоатоктапренилтрансфераза (Orientia tsutsugamushi, кустарниковый тиф); дегидрогеназа GuaB, инвазивный белок Spa32, инвазии IpaA, инвазии IpaB, инвазии IpaC, инвазии IpaD, инвазии IpaH, инвазии IpaJ (род Shigella, шигеллез (бактериальная дизентерия)); белок Р53, гомолог белка вириона US10, регулятор транскрипции IE63, трансактиватор транскрипции IE62, протеаза Р33, белок транс-индуцирующего фактора альфа 74 кДа, дезоксиуридин-5'-трифосфатнуклеотидгидролаза, трансактиватор транскрипции IE4, гомолог мембранного белка UL4 3, гомолог ядерного фосфопротеина UL3, гомолог ядерного белка UL4, связывающий участок начала репликации белок, мембранный белок 2, фосфопротеин 32, белок 57, фактор процессивности ДНК-полимеразы, портальный белок 54, ДНК-праймаза, гомолог белка оболочки UL14, гомолог белка оболочки UL21, гомолог белка оболочки UL55, гомолог субъединицы состоящей из трех субъединиц терминазы UL33, гомолог субъединицы состоящей из трех субъединиц терминазы UL15, связывающий капсид белок 44, белок упаковки вириона 43 (вирус ветряной оспы (VZV), шинглез (опоясывающий лишай)); укороченный гомолог 3-бетагидрокси-5-енстероидной дегидрогеназы, мембранный белок вириона А13, белок А19, белок А31, укороченный гомолог белка А35, гомолог белка А37.5, белок А47, белок А49, белок А51, подобный семафорину белок А4 3, ингибитор сериновых протеиназ 1, ингибитор сериновых протеиназ 2, ингибитор сериновых протеиназ 3, белок А6, белок В15, белок С1, белок С5, белок С6, белок F7, белок F8, белок F9, белок F11, белок F14, белок F15, белок F16 (Variola major или Variola minor, натуральная оспа (оспа)); адгезин/гликопротеин gp70, протеазы (Sporothrix schenckii, споротрихоз); связывающий железо тема белок IsdB, коллагенадгезин Cna, фактор агглютинации A ClfA, белок МесА, связывающий фибронектин белок A FnbA, энтеротоксин типа A EntA, энтеротоксин типа В EntB, энтеротоксин типа С EntC1, энтеротоксин типа С EntC2, энтеротоксин типа D EntD, энтеротоксин типа Е EntE, токсин синдрома токсического шока-1 TSST-1, стафилокиназа, связывающий пенициллин белок 2а РВР2а (МесА), секреторный антиген SssA (род Staphylococcus, стафилококковое пищевое отравление); связывающий железо тема белок IsdB, коллагенадгезин Cna, фактор агглютинации A ClfA, белок МесА, связывающий фибронектин белок A FnbA, энтеротоксин типа A EntA, энтеротоксин типа В EntB, энтеротоксин типа С EntC1, энтеротоксин типа С EntC2, энтеротоксин типа D EntD, энтеротоксин типа Е EntE, токсин синдрома токсического шока-1 TSST-1, стафилокиназа, связывающий пенициллин белок 2а РВР2а (МесА), секреторный антиген SssA (род Staphylococcus, например, aureus, стафилококковая инфекция); антиген Ss-IR, антиген NIE, стронгиластацин, Na+-K+ АТФаза Sseat-6, тропомиозин SsTmy-1, белок LEC-5, антиген 41 кДа Р5, личиночный белок 41 кДа, личиночный белок 31 кДа, личиночный белок 28 кДа (Strongyloid.es stercoralis, стронгилоидоз); глицерофосфодиэфирфосфодиэстераза GlpQ (Gpd), белок наружной мембраны TmpB, белок Тр92, антиген TpF1, белок с повторами Tpr, белок с повторами F TprF, белок с повторами G TprG, белок с повторами I TprI, белок с повторами J TprJ, белок с повторами К TprK, мембранный белок А трепонемы TmpA, липопротеин, Трр15 15 кДа, мембранный антиген 47 кДа, миниферритин TpF1, адгезии Тр0751, липопротеин ТР0136, белок TpN17, белок TpN47, белок наружной мембраны ТР0136, белок наружной мембраны ТР0155, белок наружной мембраны ТР0326, белок наружной мембраны ТР0483, белок наружной мембраны ТР0956 (Treponema pallidum, сифилис); подобные катепсину L протеазы, 53/25-кДа антиген, представители семейства 8 кДа, белок цистицерков с концевой трипсиноподобной активностью TsAg5, белок онкосферы TS0L18, белок онкосферы TSOL4 5-1A, лактатдегидрогеназа A LDHA, лактатдегидрогеназа В LDHB (род Taenia, тениоз); столбнячный токсин TetX, столбнячный токсин С ТТС, белок S-слоя 140 кДа, бета-субъединица флавопротеина СТ3, фосфолипаза (лецитиназа), белок-носитель фосфогрупп HPr (Clostridium tetani, Столбняк (тризм)); геномный полипротеин, белок Е, белок М, капсидный белок С (вирус клещевого вирусного энцефалита (TBEV), клещевой вирусный энцефалит); антиген 58 кДа, антигены 68 кДа, экскреторный-секреторный антиген Toxocara larvae TES, гликопротеин 32 кДа, гликопротеин TES-70, гликопротеин GP31, экскреторный-секреторный антиген TcES-57, антиген околокишечной жидкости Ре, растворимые антигены экстракта Ех, экскреторные/секреторные личиночные антигены ES, антиген TES-12 0, полипротеин аллерген ТВА-1, подобная катепсину L цистеиновая протеаза c-cpl-1, белок 26 кДа (Toxocara canis или Toxocara cati, токсокариоз (глазная форма "блуждающей личинки" (OLM) и висцеральная форма "блуждающей личинки" (VLM))); микронемные белки (MIC1, MIC2, MIC3, MIC4, MIC5, MIC6, MIC7, MIC8), белок роптрии Rop2, белки роптрии (Rop1, Rop2, Rop3, Rop4, Rop5, Rop6, Rop7, Rop16, Rjop17), белок SRI, поверхностный антиген Р22, основной антиген р24, основной поверхностный антиген рЗО, белки плотной гранулы (GRA1, GRA2(GRA3, GRA4, GRA5, GRA6, GRA7, GRA8, GRA9, GRA10), антиген 28 кДа, поверхностный антиген SAG1, родственный SAG2 антиген, нуклеозидтрифосфатаза 1, нуклеозидтрифосфатаза 2, белок Stt3, белок, содержащий подобный HesB домен, ромбовидная протеаза 5, токсомепсин 1 (Toxoplasma gondii, токсоплазмоз); секретируемый гликопротеин 43 кДа, секретируемый гликопротеин 53 кДа, парамиозин, антиген Ts21, антиген Ts87, антиген р46000, TSL-1 антигены, кавеолин-1 CAV-1, антиген новорожденной личинки 49 кДа, гомолог просапозина, сериновая протеаза, ингибитор сериновых протеиназ, гликопротеин 45 кДа Gp45 (Trichinella spiralis, трихинеллез); подобные Myb транскрипционные факторы (Myb1 Myb2, Myb3), белок адгезии АР23, белок адгезии АР33, адгезии белок АР33-3, адгезины АР51, адгезии АР65, белок адгезии АР65-1, альфа-актинин, связанный с кинезином белок, теневрин, протеиназа 62 кДа, подобная субтилизину сериновая протеаза SUB1, ген цистеиновой протеиназы 3 СР3, альфа-енолаза Enol, цистеиновая протеиназа СР30, белки теплового шока (Hsp70, Hsp60), иммуногенный белок Р270, (Trichomonas vaginalis, трихомоноз); бета-тубулин, белок 47 кДа, секреторная протеиназа, подобная протеиназе лейкоцитов-1, SLP-1, белок 50 кДа ТТ50, антиген 17 кДа, 43/47 кДа белок (Trichuris trichiura, инфекция Trichuriasis (трихоцефал)); белок ESAT-6 (EsxA), антиген фильтрата 10 кДа EsxB, секретируемый антиген 85-В FBPB, связывающий фибронектин белок A FbpA (Ag85A), сериновая протеаза РерА, белок семейства РРЕ РРЕ18, связывающий фибронектин белок D FbpD, иммуногенный белок МРТ64, секретируемый белок МРТ51, каталаза-пероксидаза-пероксинитритаза Т KATG, связывающий периплазматический фосфат липопротеин PSTS3 (РВР-3, Phos-1), регулируемый железом гепаринсвязывающий гемагглютинин Hbha, белок семейства РРЕ РРЕ14, белок семейства РРЕ РРЕ68, белок Mtb72F, белок Ара, иммуногенный белок МРТ63, связывающий периплазматический фосфат липопротеин PSTS1 (РВР-1), молекулярный шаперон DnaK, липопротеин клеточной поверхности Mpt83, липопротеин Р23, пермеазный белок системы переноса фосфатов pstA, антиген 14 кДа, связывающий фибронектин белок С FbpC1, аланиндегидрогеназа ТВ43, глутаминсинтетаза 1, белок ESX-1, белок CFP10, ТВ10,4 белок, белок МРТ83, белок МТВ12, белок МТВ8, подобные Rpf белки, белок МТВ32, белок МТВ39, кристаллин, белок теплового шока HSP65, белок PST-S (как правило, Mycobacterium tuberculosis, туберкулез); белок наружной мембраны FobA, белок наружной мембраны FobB, локус внутриклеточного роста IglC1, локус внутриклеточного роста IglC2, аминотрансфераза Wbtl, шаперонин GroEL, основной мембранный белок 17 кДа TUL4, липопротеин LpnA, белок семейства хитиназ 18, изоцитратдегидрогеназа, белок семейства Nif3, белок гликозилирования пилей типа IV, белок наружной мембраны tolC, Белок семейства связывания FAD, мультимерный белок наружной мембраны пилин типа IV, двухкомпонентный рецепторный белок KdpD, шапероновый белок DnaK, белок TolQ (Francisella tularensis, туляремия); "антиген MB, уреаза, белок GyrA, белок GyrB, белок ParC, белок ParE, связанные с липидами мембранные белки LAMP, тимидинкиназа TK, фосфолипаза PL-A1, фосфолипаза PL-A2, фосфолипаза PL-C, экспрессированный на поверхности антиген 96 кДа; "(Ureaplasma urealyticum, инфекция Ureaplasma urealyticum); неструктурный полипротеин, структурный полипротеин, капсидный белок CP, белок Е1, белок Е2, белок Е3, протеаза Р1, протеаза Р2, протеаза Р3 (вирус венесуэльского энцефалита лошадей, венесуэльский энцефалит лошадей); гликопротеин GP, белок матрикса Z, полимераза L, нуклеопротеин N (вирус Guanarito, венесуэльская геморрагическая лихорадка); полипротеин, белок Е, белок М, капсидный белок С, протеаза NS3, белок NS1, белок NS2A, белок AS2B, белок NS4A, белок NS4B, белок NS5 (вирус лихорадки Западного Нила, лихорадка Западного Нила); капсидный белок CP, белок Е1, белок Е2, белок Е3, протеаза Р2 (вирус западного энцефалита лошадей, западный энцефалит лошадей); геномный полипротеин, белок Е, белок М, капсидный белок С, протеаза NS3, белок NS1, белок NS2A, белок AS2B, белок NS4A, белок NS4B, белок NS5 (вирус желтой лихорадки, желтая лихорадка); предполагаемый белок, направленный к Yop YobB, эффекторный белок YopD, эффекторный белок YopE, белок YopH, эффекторный белок YopJ, белок транслокации белков YopK, эффекторный белок YopT, белок YpkA, белок биосинтеза жгутиков FlhA., пептидаза М48, система выброса калия KefA, регулятор транскрипции RovA, адгезии Ifp, белок переноса LcrV, белок PcrV, инвазии Inv, белок наружной мембраны подобный OmpF порин, адгезии YadA, протеинкиназа С, фосфолипаза С1, белок PsaA, подобный маннозилтрансферазе белок WbyK, белок YscU, антиген YPMa (Yersinia pseudotuberculosis, инфекция Yersinia pseudotuberculosis); эффекторный белок YopB, шаперонин 60 кДа, белок WbcP, белок тирозинфосфотаза YopH, белок YopQ, энтеротоксин, галактозидпермеаза, редуктаза NrdE, белок YasN, инвазии Inv, адгезии YadA, порин наружной мембраны F OmpF, белок UspA1, белок EibA, белок Hia, белок клеточной поверхности Ail, шаперон SycD, белок LcrD, белок LcrG, белок LcrV, белок SycE, белок YopE, регуляторный белок ТуеА, белок YopM, белок YopN, белок YopO, белок YopT, белок YopD, протеаза ClpP, белок MyfA, белок FilA и белок PsaA (Yersinia enterocolitica, иерсиниоз).
(В скобках приведены конкретные патогенные организмы или семейства патогенных микроорганизмов, из которых происходят антигены и инфекционные заболевания, с которыми связаны патогенные организмы.)
Кодирующая область нуклеиновой кислоты по изобретению в первом аспекте настоящего изобретения может присутствовать в виде моно-, ди- или даже полицистронной нуклеиновой кислоты, т.е. нуклеиновой кислоты, несущей кодирующие последовательности одного, двух или более белков или пептидов. Такие кодирующие последовательности в ди- или даже полицистронных нуклеиновых кислотах могут быть разделены по меньшей мере одной последовательностью внутреннего участка связывания рибосомы (IRES), например, как описано в настоящем документе или сигнальными пептидами, которые индуцируют расщепление полученного полипептида, содержащего несколько белков или пептидов.
В первом аспекте настоящего изобретения, последовательность нуклеиновой кислоты по изобретению содержит кодирующую область, кодирующую пептид или белок, который содержит патогенный антиген или его фрагмент, вариант или производное. Предпочтительно, кодируемый патогенный антиген не является гистоновым белком. В контексте настоящего изобретения такой гистоновый белок, как правило, представляет собой сильнощелочной белок, находящийся в ядрах эукариотических клеток, который упаковывает и упорядочивает ДНК в структурные единицы, называемые нуклеосомами. Гистоновые белки являются главными белковыми компонентами хроматина, действующими в качестве катушек, вокруг которых закручивается ДНК, и играют роль в регуляции генов. Без гистонов незакрученная ДНК в хромосомах могла бы быть очень длинной. (отношение длины к ширине в ДНК человека более 10 миллионов к одному). Например, каждая клетка человека содержит приблизительно 1,8 метров ДНК, но закрученная на гистоны она составляет приблизительно 90 миллиметров хроматина, что при дупликации и конденсации во время митоза приводит приблизительно к 120 микрометрам хромосом. Более предпочтительно, в контексте настоящего изобретения такой гистоновый белок, как правило, определяют как высококонсервативный белок, выбранный из одного из следующих пяти основных классов гистонов: Н1/Н5, Н2А, Н2 В, Н3 и Н4'', предпочтительно, выбранный из гистонов млекопитающих, более предпочтительно, из гистонов или гистоновых белков человека. Такие гистоны или гистоновые белки, как правило, организованы в два суперкласса, определяемых как коровые гистоны, содержащие гистоны Н2А, Н2В, Н3 и Н4, и линкерные гистоны, содержащие гистоны H1 и Н5.
В этом контексте, линкерные гистоны предпочтительно, исключаемые из области защиты рассматриваемого изобретения, предпочтительно, линкерные гистоны млекопитающих, более предпочтительно, линкерные гистоны человека, как правило, выбраны из H1, включая H1F, в частности, включая H1F0, H1FNT, H1FOO, H1FX, и Н1Н1, в частности, включая HIST1H1A, HIST1H1B, HIST1H1C, HIST1H1D, HIST1H1E, HIST1H1T.
Кроме того, коровые гистоны, предпочтительно, исключаемые из области защиты рассматриваемого изобретения, предпочтительно, коровые гистоны млекопитающих, более предпочтительно, коровые гистоны человека, как правило, выбраны из Н2А, включая H2AF, в частности, включая H2AFB1, H2AFB2, H2AFB3, H2AFJ, H2AFV, H2AFX, H2AFY, H2AFY2, H2AFZ и Н2А1, в частности, включая HIST1H2AA, HIST1H2AB, HIST1H2AC, HIST1H2AD, HIST1H2AE, HIST1H2AG, HIST1H2AI, HIST1H2AJ, HIST1H2AK, HIST1H2AL, HIST1H2AM и Н2А2, в частности, включая HIST2H2AA3, HIST2H2AC; Н2В, включая H2BF, в частности, включая H2BFM, H2BFO, H2BFS, H2BFWT Н2 В1, в частности, включая HIST1H2BA, HIST1H2BB, HIST1H2BC, HIST1H2BD, HIST1H2BE, HIST1H2BF, HIST1H2BG, HIST1H2BH, HIST1H2BI, HIST1H2BJ, HIST1H2BK, HIST1H2BL, HIST1H2BM, HIST1H2BN, HIST1H2B0 и Н2В2, в частности, включая HIST2H2BE; Н3, включая Н3А1, в частности, включая HIST1H3A, HIST1H3B, HIST1H3C, HIST1H3D, HIST1H3E, HIST1H3F, HIST1H3G, HIST1H3H, HIST1H3I, HIST1H3J и Н3А2, в частности, включая HIST2H3C и Н3А3, в частности, включая HIST3H3; Н4, включая Н41, в частности, включая HIST1H4A, HIST1H4B, HIST1H4C, HIST1H4D, HIST1H4E, HIST1H4F, HIST1H4G, HIST1H4H, HIST1H4I, HIST1H4J, HIST1H4K, HIST1H4 л и Н44, в частности, включая HIST4H4 и Н5.
В первом аспекте настоящего изобретения последовательность нуклеиновой кислоты по изобретению содержит кодирующую область, кодирующую пептид или белок, который содержит патогенный антиген или его фрагмент, вариант или производное. Предпочтительно, кодируемый патогенный антиген не является репортерным белком (например, люциферазой, зеленым флуоресцентным белком (GFP), улучшенным зеленым флуоресцентным белком (EGFP), β-галактозидазой) и не является маркерным или селективным белком (например, альфа-глобином, галактокиназой и ксантин:гуанинфосфорибозилтрансферазой (GPT)). Предпочтительно, последовательность нуклеиновой кислоты по изобретению не содержит гена устойчивости к антибиотикам, например, последовательности (бактериального) гена пео (гена устойчивости к неомицину) или последовательности гена CAT (кодирующей ацетилтрансферазу хлорамфеникола; ген устойчивости к хлорамфениколу).
Нуклеиновая кислота по изобретению, как определено выше, содержит или кодирует а) кодирующую область, кодирующую пептид или белок, который содержит патогенный антиген или его фрагмент, вариант или производное; b) по меньшей мере одну структуру "стебель-петля" гистонов и с) последовательность поли(А) или сигнал полиаденилирования; предпочтительно, для повышения экспрессии указанного кодируемого пептида или белка, где кодируемый пептид или белок, предпочтительно, не является гистоновым белком, не является репортерным белком и/или не является маркерным или селективным белком, как определено выше. Элементы b)-с) нуклеиновой кислоты по изобретению могут присутствовать в нуклеиновой кислоте по изобретению в любом порядке, т.е. элементы а), b) и с) могут присутствовать в последовательности нуклеиновой кислоты по изобретению в направлении от 5'-конца к 3'-концу в порядке а), b) и с) или а), с) и b), где также могут содержаться дополнительные элементы, как описано в настоящем документе, такие как 5'-копирующая структура, последовательность поли(С), стабилизирующие последовательности, последовательности IRES и т.д. Также каждый из элементов а)-с) нуклеиновой кислоты по изобретению, особенно а) в ди- или полицистронных конструкциях и/или каждый из элементов b) и с), более предпочтительно, элемент b), в нуклеиновой кислоте по изобретению могут повторяться по меньшей мере однократно, предпочтительно, дважды или более. В качестве примера нуклеиновая кислота по изобретению может содержать элементы своей последовательности а), b) и необязательно с), например, в следующем порядке
5' - кодирующая область - структура "стебель-петля" гистонов - последовательность поли(А) - 3'; или
5' - кодирующая область - структура "стебель-петля" гистонов - сигнал полиаденилирования - 3'; или
5' - кодирующая область - последовательность поли(А) структура "стебель-петля" гистонов - 3'; или
5' - кодирующая область - сигнал полиаденилирования-структура "стебель-петля" гистонов - 3'; или
5' - кодирующая область - кодирующая область - структура "стебель-петля" гистонов - сигнал полиаденилирования - 3'; или
5' - кодирующая область - структура "стебель-петля" гистонов - структура "стебель-петля" гистонов последовательность поли(А) - 3'; или
5' - кодирующая область - структура "стебель-петля" гистонов - структура "стебель-петля" гистонов - сигнал полиаденилирования-3'; и т.д.
В этом контексте особенно предпочтительно
последовательность нуклеиновой кислоты по изобретению содержит или кодирует а) кодирующую область, кодирующую пептид или белок, который содержит патогенный антиген или его фрагмент, вариант или производное; b) по меньшей мере одну структуру "стебель-петля" гистонов и с) последовательность поли(А) или последовательность полиаденилирования; предпочтительно, для повышения уровня экспрессии указанного кодируемого пептида или белка, где кодируемый белок, предпочтительно, не является гистоновым белком, не является репортерным белком (например, люциферазой, GFP, EGFP, (3-галактозидазой, в частности, EGFP) и/или не является маркерным или селективным белком (например, альфа-глобином, галактокиназой и ксантин:гуанинфосфорибозилтрансферазой (GPT)).
В дополнительном предпочтительном варианте осуществления первого аспекта последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, также может находиться в форме модифицированной нуклеиновой кислоты.
В этом контексте последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, можно модифицировать для получения "стабилизированной нуклеиновой кислоты", предпочтительно, стабилизированной РНК, более предпочтительно, РНК, которая по существу устойчива к разрушению in vivo (например, экзо- или эндонуклеазами). Например, стабилизированную нуклеиновую кислоту можно получать посредством модификации содержания G/C в кодирующей области последовательности нуклеиновой кислоты по изобретению, посредством введения аналогов нуклеотидов (например, нуклеотидов с модификациями каркаса, модификациями сахаров или модификациями оснований) или посредством введения стабилизирующих последовательностей в 3'- и/или 5'-нетранслируемые области последовательности нуклеиновой кислоты по изобретению.
Как указано выше, последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе может содержать аналоги/модификации нуклеотидов, например, модификации каркаса, модификации сахаров или модификации оснований. Модификация каркаса в применении к настоящему изобретению представляет собой модификацию, при которой фосфаты каркаса нуклеотидов, содержащихся в последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, химически модифицируют. Модификация сахаров в применении к настоящему изобретению представляет собой химическую модификацию сахара нуклеотидов последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе. Кроме того, модификация оснований в применении к настоящему изобретению представляет собой химическую модификацию молекулы основания нуклеотидов молекулы нуклеиновой кислоты последовательности нуклеиновой кислоты по изобретению. В этом контексте аналоги или модификации нуклеотидов, предпочтительно, выбраны из аналогов нуклеотидов, которые пригодны для транскрипции и/или трансляции.
В конкретном предпочтительном варианте первого аспекта настоящего изобретения определенные в настоящем документе аналоги/модификации нуклеотидов выбраны из модификаций оснований, которые дополнительно увеличивают экспрессию кодируемого белка и которые, предпочтительно, выбраны из 2-амино-6-хлорпуринрибозид-5'-трифосфата, 2-аминоаденозин-5'-трифосфата, 2-тиоцитидин-5'-трифосфата, 2-тиоуридин-5'-трифосфата, 4-тиоуридин-5'-трифосфата, 5-аминоаллилцитидин-5'-трифосфата, 5-аминоаллилуридин-5'-трифосфата, 5-бромцитидин-5'-трифосфата, 5-бромуридин-5'-трифосфата, 5-йодцитидин-5'-трифосфата, 5-йодуридин-5'-трифосфата, 5-метилцитидин-5'-трифосфата, 5-метилуридин-5'-трифосфата, 6-азацитидин-5'-трифосфата, 6-азауридин-5'-трифосфата, 6-хлорпуринрибозид-5'-трифосфата, 7-деазааденозин-5'-трифосфата, 7-деазагуанозин-5'-трифосфата, 8-азааденозин-5'-трифосфата, 8-азидоаденозин-5'-трифосфата, бензимидазолрибозид-5'-трифосфата, N1-метиладенозин-5'-трифосфата, N1-метилгуанозин-5'-трифосфата, N6-метиладенозин-5'-трифосфата, О6-метилгуанозин-5'-трифосфата, псевдоуридин-5'-трифосфата, или пуромицин-5'-трифосфата, ксантинозин-5'-трифосфата. Конкретное предпочтение отдается нуклеотидам с модификациями оснований, выбранными из группы нуклеотидов с модифицированными основаниями, состоящей из 5-метилцитидин-5'-трифосфата, 7-деазагуанозин-5'-трифосфата, 5-бромцитидин-5'-трифосфата и псевдоуридин-5'-трифосфата.
В дополнительном варианте осуществления в последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, может присутствовать модификация липидами. Такая модифицированная липидами нуклеиновая кислота, как правило, содержит нуклеиновую кислоту, как определено в настоящем документе. Такая модифицированная липидами молекула нуклеиновой кислоты последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, как правило, дополнительно содержит по меньшей мере один линкер, ковалентно связанный с этой молекулой нуклеиновой кислоты, и по меньшей мере один липид, ковалентно связанный с соответствующим линкером. Альтернативно, модифицированная липидами молекула нуклеиновой кислоты содержит по меньшей мере одну молекулу нуклеиновой кислоты, как определено в настоящем документе, и по меньшей мере один (бифункциональный) липид, ковалентно связанный (без линкера) с этой молекулой нуклеиновой кислоты. В соответствии с третьей альтернативой модифицированная липидами молекула нуклеиновой кислоты содержит молекулу нуклеиновой кислоты, как определено в настоящем документе, по меньшей мере один линкер, ковалентно связанный с этой молекулой нуклеиновой кислоты, и по меньшей мере один липид, ковалентно связанный с соответствующим линкером, а также по меньшей мере один (бифункциональный) липид, ковалентно связанный (без линкера) с этой молекулой нуклеиновой кислоты. В этом контексте особенно предпочтительно, чтобы модификацию липидами проводили на концах линейной последовательности нуклеиновой кислоты по изобретению.
В другом предпочтительном варианте осуществления первого аспекта изобретения последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, особенно, если предоставлена в виде (м)РНК, таким образом, можно стабилизировать для противостояния разрушению РНКазами посредством добавления структуры так называемого "5'-кэпа".
В дополнительном предпочтительном варианте осуществления первого аспекта изобретения, последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, можно модифицировать посредством последовательности по меньшей мере из 10 остатков цитидина, предпочтительно, по меньшей мере 20 остатков цитидина, более предпочтительно, по меньшей мере 30 остатков цитидина (так называем "последовательность поли(С)"). В частности, последовательность нуклеиновой кислоты по изобретению может содержать или кодировать последовательность поли(С) длиной, как правило, приблизительно от 10 до 200 цитидиновых нуклеотидов, предпочтительно, приблизительно от 10 до 100 цитидиновых нуклеотидов, более предпочтительно, приблизительно от 10 до 70 цитидиновых нуклеотидов или еще более предпочтительно, приблизительно от 20 до 50 или даже от 20 до 30 цитидиновых нуклеотидов. Последовательность поли(С) предпочтительно, расположена с 3'-конца от кодирующей области, содержащейся в нуклеиновой кислоте в первом аспекте настоящего изобретения.
В особенно предпочтительном варианте осуществления настоящего изобретения в последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, изменяют содержание G/C кодирующей области, кодирующей по меньшей мере один пептид или белок, который содержит патогенный антиген или его фрагмент, вариант или производное, в частности, увеличивают, по сравнению с содержанием G/C в этой конкретной кодирующей области дикого типа, т.е. немодифицированной кодирующей области. Кодируемую кодирующей областью аминокислотную последовательность по сравнению с кодируемой аминокислотной последовательностью конкретной кодирующей областью дикого типа, предпочтительно, не модифицируют.
Изменение содержания G/C кодирующей области последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, основано на том факте, что для эффективной трансляции этой мРНК важна последовательность любой области мРНК для трансляции. Таким образом, важны состав и последовательность различных нуклеотидов. В частности, последовательности мРНК с повышенным содержанием G (гуанозина)/С (цитозина) являются более стабильными, чем последовательности мРНК с повышенным содержанием А (аденозина)/U (урацила). Таким образом, в соответствии с изобретением, кодоны кодирующей области изменяют по сравнению с этой кодирующей областью дикого типа, сохраняя транслируемую аминокислотную последовательность, так, что они включают увеличенное количество нуклеотиды G/C. В соответствии с тем фактом, что одну и ту же аминокислоту кодируют несколько кодонов (так называемая вырожденность генетического кода), можно определять наиболее подходящие для стабильности кодоны (так называемое альтернативное использование кодонов).
В зависимости от аминокислоты, кодируемой кодирующей областью последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, существуют различные возможности модификации последовательности нуклеиновой кислоты, например, кодирующей области, по сравнению с этой кодирующей областью дикого типа. В случае аминокислот, которые кодируют кодоны, содержащие исключительно нуклеотиды G или С, никакой замены кодонов не нужно. Таким образом, кодоны для Pro (ССС или CCG), Arg (CGC или CGG), Ala (GCC или GCG) и Gly (GGC или GGG) не требуют модификации, так как в них не присутствует А или U.
В отличие от этого, кодоны, которые содержат нуклеотиды А и/или U можно модифицировать, посредством замены на другие кодоны, которые кодируют те же аминокислоты, но не содержат А и/или U. Их примеры представляют собой:
кодоны для Pro можно модифицировать с CCU или ССА на ССС или CCG;
кодоны для Arg можно модифицировать с CGU или CGA или AGA или AGG на CGC или CGG;
кодоны для Ala можно модифицировать с GCU или GCA на GCC или GCG;
кодоны для Gly можно модифицировать с GGU или GGA на GGC или GGG.
В других случаях, хотя нуклеотиды А или U нельзя удалить из кодонов, однако возможно снизить содержание А и U, используя кодоны, которые содержат меньшее количество нуклеотидов А и/или U. Их примеры представляют собой:
кодоны для Phe можно модифицировать с UUU на UUC;
кодоны для Leu можно модифицировать с UUA, UUG, CUU или CUA на CUC или CUG;
кодоны для Ser можно модифицировать с UCU или UCA или AGU на UCC, UCG или AGC;
кодон для Туг можно модифицировать с UAU на UAC;
кодон для Cys можно модифицировать с UGU на UGC;
кодон для His можно модифицировать с CAU на САС;
кодон для Gln можно модифицировать с САА на CAG;
кодоны для Ile можно модифицировать с AUU или AUA на AUC;
кодоны для Thr можно модифицировать с ACU или АСА на АСС или ACG;
кодон для Asn можно модифицировать с AAU на ААС;
кодон для Lys можно модифицировать с AAA на AAG;
кодоны для Val можно модифицировать с GUU или GUA на GUC или GUG;
кодон для Asp можно модифицировать с GAU на GAC;
кодон для Glu можно модифицировать с GAA на GAG;
стоп-кодон UAA можно модифицировать на UAG или UGA.
С другой стороны, в случае кодонов для Met (AUG) и Trp (UGG) возможностей для модификации последовательности нет.
Перечисленные выше замены для увеличения содержания G/C кодирующей области последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, по сравнению с этой конкретной кодирующей областью дикого типа (т.е. исходной последовательностью) можно использовать отдельно или во всех возможных комбинациях. Таким образом, например, все кодоны для Thr, встречающиеся в последовательности дикого типа можно заменить на АСС (или ACG).
В указанном выше контексте представлены кодоны, присутствующие в мРНК. Таким образом, уридин, присутствующий в мРНК, также может присутствовать в виде тимидина в соответствующей ДНК, кодирующей конкретную мРНК.
Предпочтительно, содержание G/C кодирующей области последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, по сравнению с содержанием G/C в кодирующей области дикого типа увеличивают по меньшей мере на 7%, более предпочтительно, по меньшей мере на 15%, в частности, предпочтительно, по меньшей мере на 20%. В конкретном варианте осуществления в кодирующей области, кодирующей по меньшей мере один пептид или белок, который содержит патогенный антиген или его фрагмент, вариант или производное, замещены по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, более предпочтительно, по меньшей мере 70%, еще более предпочтительно, по меньшей мере 80%, а наиболее предпочтительно, по меньшей мере 90%, 95% или даже 100% из замещаемых кодонов, таким образом, увеличивая содержание G/C в указанной кодирующей области.
В этом контексте, особенно предпочтительно, повысить содержание G/C кодирующей области последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, по сравнению с кодирующей областью дикого типа до максимума (т.е. 100% замещаемых кодонов).
По изобретению дополнительная предпочтительная модификация кодирующей области последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, кодирующей по меньшей мере один пептид или белок, который содержит патогенный антиген или его фрагмент, вариант или производное, основана на том открытии, что эффективность трансляции также определена различной частотой встречаемости тРНК в клетках. Таким образом, если в кодирующей области последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, в большей степени присутствуют так называемые "редкие кодоны", соответствующая модифицированная последовательность нуклеиновой кислоты транслируется в значительно меньшей степени, чем в случае, когда присутствуют кодоны, кодирующие относительно "частые" тРНК.
В этом контексте кодирующая область последовательности нуклеиновой кислоты по изобретению, предпочтительно, модифицирована по сравнению с соответствующей кодирующей областью дикого типа там, что по меньшей мере один кодон последовательности дикого типа, который кодирует тРНК, которая в клетке является относительно редкой, заменяют на кодон, который кодирует тРНК, которая в клетке является относительно частой и кодирует ту же аминокислоту, что и относительно редкая тРНК. Посредством этой модификации, кодирующую область последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, модифицируют так, что вводят кодоны, для которых доступны часто встречающиеся тРНК. Другими словами, в изобретении посредством этой модификации все кодоны кодирующей области дикого типа, которые кодируют тРНК, которая в клетке является относительно редкой, в каждом случае можно заменить на кодоны, которые кодируют тРНК, которая в клетке является относительно частой и которая, в каждом случае, кодирует ту же аминокислоту, что и относительно редкая тРНК.
Некоторые тРНК встречаются в клетке относительно часто, а некоторые, напротив, встречаются относительно редко, как известно специалисту в данной области; см. например, Akashi, Curr. Opin. Genet. Dev. 2001, 11(6): 660-666. Особенно предпочтительными являются кодоны, которые используются для конкретной аминокислоты в тРНК, которая встречается наиболее часто, например, кодон для Gly, который используется в тРНК, которая наиболее часто наиболее часто встречается в клетке (человека).
По изобретению особенно предпочтительно, связывать непрерывное содержание G/C, которое в кодирующей области последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, увеличено, в частности, максимизировано, с "частыми" кодонами без модификации аминокислотной последовательности пептида или белка, кодируемого кодирующей областью последовательности нуклеиновой кислоты. Этот предпочтительный вариант осуществления обеспечивает получение особенно эффективно транслируемой и стабилизированной (модифицированной) последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе.
В другом предпочтительном варианте осуществления первого аспекта изобретения последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, предпочтительно, дополнительно содержит по меньшей мере одну 5' и/или 3' стабилизирующую последовательность. Эти стабилизирующие последовательности в 5' - и/или 3'-нетранслируемых областях обладают эффектом увеличения времени полужизни нуклеиновой кислоты, в частности, мРНК в цитозоле. Эти стабилизирующие последовательности могут быть на 100% идентичны с природными последовательностями, которые встречаются в вирусах, бактериях и эукариотах, но также могут быть частично или полностью синтетическими. В качестве примера стабилизирующих последовательностей, которые можно использовать в настоящем изобретении для стабилизированной нуклеиновой кислоты, можно указать нетранслируемые последовательности (UTR) гена (альфа-)глобина, например, Homo sapiens или Xenopus laevis. Другой пример стабилизирующей последовательности имеет общую формулу (C/U) CCANXCCC(U/A) PyxUC(C/U) СС (SEQ ID NO: 55), которая содержится в 3'-UTR очень стабильных РНК, которые кодируют (альфа-)глобин, коллаген типа(I), липоксигеназу 15 или тирозингидроксилазу (см. Holcik et al., Proc. Natl. Acad. Sci. USA 1997, 94: 2410-2414). Конечно, такие стабилизирующие последовательности можно использовать отдельно или в комбинации с любой другой, а также в комбинации с другими стабилизирующими последовательностями, известными специалисту в данной области. В этом контексте особенно предпочтительно, чтобы с 3'-конца кодирующей области, кодирующей по меньшей мере один пептид или белок, который содержит патогенный антиген или его фрагмент, вариант или производное, содержащейся в последовательности нуклеиновой кислоты по изобретению в первом аспекте настоящего изобретения, располагалась последовательность 3'-UTR гена альфа-глобина.
Замены, добавления или удаления оснований в последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, предпочтительно, проводят с использованием матричной ДНК для получения последовательности нуклеиновой кислоты способами, хорошо известного сайт-специфического мутагенеза, или стратегией лигирования олигонуклеотидов (см. например, Maniatis et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 3rd ed., Cold Spring Harbor, NY, 2001). Для последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, а также для любой нуклеиновой кислоты, как используют в контексте настоящего изобретения, можно использовать любые из указанных выше модификаций, и их можно, если подходит или необходимо, комбинировать друг с другом в любой комбинации, при условии, что эти комбинации модификаций в соответствующей нуклеиновой кислоте не мешают друг другу. Специалист в данной области может сделать соответствующий выбор.
Последовательности нуклеиновой кислоты, используемые по настоящему изобретению, как определено в настоящем документе, можно получать с использованием любого известного в данной области способа, включая способы синтеза, например, такие как твердофазный синтез, а также способы in vitro, такие как реакции транскрипции in vitro или реакции транскрипции in vivo, такие как размножение плазмидных ДНК в бактериях in vivo.
В таком способе для получения последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, особенно если нуклеиновая кислота находится в форме мРНК, соответствующую молекулу ДНК можно транскрибировать in vitro. Эта матричная ДНК, предпочтительно, содержит подходящий промотор, например, промотор Т7 или SP6, для транскрипции in vitro, за которым расположена желаемая для получения молекулы нуклеиновой кислоты, например, мРНК, последовательность нуклеотидов, и сигнал терминации для транскрипции in vitro. Молекула ДНК, формирующая матрицу по меньшей мере для одной из представляющих интерес РНК, можно получать посредством ферментативной пролиферация и последующего выделения в качестве части плазмиды, которую можно реплицировать в бактериях. Плазмиды, которые можно указать, как подходящие для настоящего изобретения, например, представляют собой плазмиды рТ7Т (номер доступа GenBank U26404; Lai et al., Development 1995, 121: 2349-2360), ряд pGEM®, например, pGEM®-l (номер доступа GenBank X65300; из Promega) и pSP64 (номер доступа GenBank Х65327); также см. Mezei and Storts, Purification of PCR Products, in: Griffin and Griffin (ed.), PCR Technology: Current Innovation, CRC Press, Boca Raton, FL, 2001.
Последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, а также белки или пептиды, как их кодирует эта последовательность нуклеиновой кислоты, могут содержать фрагменты или варианты этих последовательностей. Такие фрагменты или варианты, как правило, могут содержать последовательность, идентичную с одной из указанных выше нуклеиновых кислот или с одним из белков или пептидов или одной из последовательностей, если их кодирует последовательность нуклеиновой кислоты по изобретению, по меньшей мере на 5%, 10%, 20%, 30%, 40%, 50%, 60%, предпочтительно, по меньшей мере на 70%, более предпочтительно, по меньшей мере на 80%, также более предпочтительно, по меньшей мере на 85%, еще более предпочтительно, по меньшей мере на 90% и наиболее предпочтительно, по меньшей мере на 95% или даже на 97%, 98% или 99% от полной последовательности дикого типа на уровне нуклеиновой кислоты или на уровне аминокислот.
"Фрагменты" белков или пептидов в контексте настоящего изобретения (например, как их кодирует последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе) могут содержать последовательность белка или пептида, как определено в настоящем документе, которая в отношении ее аминокислотной последовательности (или кодирующей ее молекулы нуклеиновой кислоты), с N-конца, С-конца и/или внутри последовательности обрезана/укорочена по сравнению с аминокислотной последовательностью исходного (нативного) белка (или кодирующей ее молекулой нуклеиновой кислоты). Таким образом, такое укорочение может происходить на уровне аминокислот или, соответственно, на уровне нуклеиновой кислоты. Таким образом, идентичность последовательности в отношении такого фрагмент, как определено в настоящем документе, предпочтительно, может относиться к целому белку или пептиду, как определено в настоящем документе, или целой (кодирующей) молекуле нуклеиновой кислоты для такого белка или пептида. Подобным образом, "фрагменты" нуклеиновых кислот в контексте настоящего изобретения могут содержать последовательность нуклеиновой кислоты, как определено в настоящем документе, которая, в отношении ее молекулы нуклеиновой кислоты, с 5'-конца, 3'-конца и/или внутри последовательности обрезана/укорочена по сравнению с молекулой нуклеиновой кислоты исходной (нативной) молекулы нуклеиновой кислоты. Таким образом, идентичность последовательности в отношении такого фрагмента, как определено в настоящем документе, предпочтительно, может относиться к целой нуклеиновой кислоте, как определено в настоящем документе, и предпочтительный уровень идентичности последовательностей является таким, как указано в настоящем документе. Фрагменты обладают той же биологической функцией или специфической активностью или по меньшей мере сохраняют активность природного полноразмерного белка по меньшей мере на 50%, более предпочтительно, по меньшей мере на 70%, еще более предпочтительно, по меньшей мере на 90% (как измеряют в подходящем функциональном анализе, например, посредством количественного определения В-клеточного ответа организма) по сравнению с полноразмерным нативным пептидом или белком, например, его специфические антигенные свойства. Таким образом, в предпочтительном варианте осуществления "фрагмент" представляет собой часть полноразмерного антигенного белка, которая проявляет антигенные свойства в отношении иммунной системы, как описано в настоящем документе.
Кроме того, фрагменты белков или пептидов в контексте настоящего изобретения (например, как их кодирует последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе) могут содержать последовательность белка или пептида, как определено в настоящем документе с длиной приблизительно от 6 до приблизительно 20 или даже более аминокислот, например, такие фрагменты, как после процессинга и презентации молекулами МНС класса I, предпочтительно, с длиной приблизительно от 8 до приблизительно 10 аминокислот, например, 8, 9 или 10, (или даже 6, 7, 11 или 12 аминокислот), или такие фрагменты, как после процессинга и презентации молекулами МНС класса II, предпочтительно, с длиной приблизительно 13 или более аминокислот, например, 13, 14, 15, 16, 17, 18, 19, 20 или даже более аминокислот, где эти фрагменты можно выбирать из любой части аминокислотной последовательности. Как правило, эти фрагменты распознают Т-клетки в форме комплекса, состоящего из пептидного фрагмента и молекулы МНС, т.е., как правило, фрагменты не распознаются в их нативной форме. Фрагменты белков или пептидов, как определено в настоящем документе, могут содержать по меньшей мере один эпитоп этих белков или пептидов. Кроме того, можно понять, что фрагмент белка также содержат домены белка, подобные внеклеточному домену, внутриклеточному домену или трансмембранному домену, и укороченные или обрезанные версии белка.
Фрагменты белков или пептидов, как определено в настоящем документе (например, как их кодирует последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе), также могут содержать эпитопы этих белков или пептидов. Т-клеточные эпитопы или части белков в контексте настоящего изобретения могут содержать фрагменты, предпочтительно, с длиной приблизительно от 6 до приблизительно 20 или даже более аминокислот, например, фрагменты после процессинга и презентации молекулами МНС класса I, предпочтительно, с длиной приблизительно от 8 до приблизительно 10 аминокислот, например, 8, 9 или 10, (или даже 11 или 12 аминокислот), фрагменты после процессинга и презентации молекулами МНС класса II, предпочтительно, с длиной приблизительно 13 или более аминокислот, например, 13, 14, 15, 16, 17, 18, 19, 20 или даже более аминокислот, где эти фрагменты можно выбирать из любой части аминокислотной последовательности. Как правило, эти фрагменты распознают Т-клетками в форме комплекса, состоящего из пептидного фрагмента и молекулы МНС, т.е., как правило, фрагменты не распознаются в их нативной форме.
Как правило, В-клеточные эпитопы представляют собой фрагменты, расположенные на внешних поверхностях (нативных) белковых или пептидных антигенов, как определено в настоящем документе, предпочтительно, с длиной от 5 до 15 аминокислот, более предпочтительно, с длиной от 5 до 12 аминокислот, еще более предпочтительно, с длиной от 6 до 9 аминокислот, которые могут распознавать антитела, т.е. в их нативной форме.
Кроме того, такие эпитопы белков или пептидов можно выбирать из любых указанных в настоящем документе вариантов таких белков или пептидов. В этом контексте антигенные детерминанты могут представлять собой конформационные или прерывистые эпитопы, которые состоят из участков белков или пептидов, как определено в настоящем документе, которые прерываются в аминокислотных последовательностях белков или пептидов, как определено в настоящем документе, но находятся рядом в трехмерной структуре, или непрерывные или линейные эпитопы, которые состоят из одной полипептидной цепи.
Последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, может кодировать "варианты" белков или пептидов, как определено в контексте настоящего изобретения. Таким образом, можно получать белок или пептид с аминокислотной последовательностью, которая отличается от исходной последовательности одной или несколькими мутациями (2, 3, 4, 5, 6, 7 или более) такими, как одна или несколько замещенных, вставленных и/или удаленных аминокислот.
Предпочтительным уровнем идентичности последовательностей "вариантов", учитывая последовательности полноразмерных белков, как правило, является такой, как указано в настоящем документе. Предпочтительно, эти фрагменты и/или варианты имеют ту же биологическую функцию или специфическую активность или по меньшей мере сохраняют активность природного полноразмерного белка по меньшей мере на 50%, более предпочтительно, по меньшей мере на 70%, еще более предпочтительно, по меньшей мере на 90% (как измеряют в подходящем функциональном анализе, например, посредством количественного определения В-клеточного иммунного ответа организма) по сравнению с полноразмерным природным пептидом или белком, например, его специфические антигенные свойства. Таким образом, в предпочтительном варианте осуществления "вариант" представляет собой вариант полноразмерного антигенного белка, который проявляет антигенные свойства в отношении иммунной системы, в объеме описанного в настоящем документе.
"Варианты" белков или пептидов, как определено в контексте настоящего изобретения (например, как кодирует нуклеиновая кислота, как определено в настоящем документе), могут содержать консервативную аминокислотную замену(ы) по сравнению с их нативной, т.е. немутированной физиологической последовательностью. Эти аминокислотные последовательности, а также кодирующие их нуклеотидные последовательности в том числе соответствуют термину варианты, как определено в настоящем документе. Замены, где друг на друга заменяют аминокислоты, происходящие из одного и того же класса, называют консервативными заменами. В частности, они представляют собой аминокислоты с алифатическими боковыми цепями, положительно или отрицательно заряженными боковыми цепями, ароматическими группами в боковых цепях или аминокислоты, боковые цепи которых могут участвовать в водородных мостиках, например, боковые цепи, которые содержат гидроксильную функциональную группу. Это означает, что, например, аминокислоту с полярной боковой цепью замещают другой аминокислотой с подобной полярной боковой цепью, или, например, аминокислоту, характеризующуюся гидрофобной боковой цепью, заменяют другой аминокислотой с подобной гидрофобной боковой цепью (например, серии (треонин) треонином (серином) или лейцин (изолейцин) изолейцином (лейцином)). Возможны вставки и замены, в частности, в тех положениях последовательности, которые не вызывают модификаций трехмерной структуры или не влияют на связывающую область. Модификации трехмерной структуры при вставке(ах) или делеции(ях) можно легко определять, например, с использованием спектра CD (спектр кругового дихроизма) (Urry, 1985, Absorption, Circular Dichroism and ORD of Polypeptides, in: Modern Physical Methods in Biochemistry, Neuberger et al. (ed.), Elsevier, Amsterdam).
Кроме того, варианты белков или пептидов, как определено в настоящем документе, которые может кодировать последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, также могут содержать последовательности, где нуклеотиды нуклеиновой кислоты заменены в соответствии с вырожденностью генетического кода без вызова изменения соответствующей аминокислотной последовательности белка или пептида, т.е. в пределах указанного выше определения аминокислотная последовательность или по меньшей мере ее часть могут не отличаться от исходной последовательности одной или несколькими мутациями.
Для определения процентов идентичности двух последовательностей, например, последовательностей нуклеиновой кислоты или аминокислотных последовательностей, как определено в настоящем документе, предпочтительно, аминокислотных последовательностей, кодируемых последовательностями нуклеиновой кислоты по изобретению, как определено в настоящем документе, или самих аминокислотных последовательностей, последовательности можно выравнивать для последующего сравнения одной с другой. Таким образом, например, положение первой последовательности можно сравнивать с соответствующим положением второй последовательности. Если в положении первой последовательности находится тот же компонент, то и в случае положения во второй последовательности, две последовательности являются идентичными в этом положении. Если это не так, последовательности отличаются в этом положении. Если во второй последовательности по сравнению с первой последовательностью находятся вставки, в первую последовательность можно ввести пропуски для обеспечения дополнительного выравнивания. Если во второй последовательности по сравнению с первой находятся делеции, для обеспечения дополнительного выравнивания пропуски можно вводить во вторую последовательность. Затем, проценты идентичности двух последовательностей, являются функцией количества идентичных положений, деленных на общее количество положений, включающих положения, где присутствует только одна последовательность. Проценты идентичности двух последовательностей можно определять с использованием математического алгоритма. Предпочтительно, но без ограничения, примером математического алгоритма, который можно использовать, является алгоритм Karlin et al. (1993), PNAS USA, 90:5873-5877 или Altschul et al. (1997), Nucleic Acids Res., 25:3389-3402. Такой алгоритм интегрирован в программу BLAST. Последовательности, до определенной степени идентичные с последовательностями по настоящему изобретению можно идентифицировать этой программой.
Последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, может кодировать производные пептида или белка. Такое производное пептида или белка представляет собой молекулу, которая происходит из другой молекулы, такой как указанный пептид или белок. Как правило, "производное" содержит полноразмерную последовательность природного пептида или белка и дополнительные элементы последовательности, например, на N- или на С-концах, которые могут обеспечивать природному полноразмерному пептиду/белку дополнительную функцию. Также такие производные обладают той же биологической функцией или специфической активностью или по меньшей мере сохраняют активность природного полноразмерного белка по меньшей мере на 50%, более предпочтительно, по меньшей мере на 70%, еще более предпочтительно, по меньшей мере на 90% (как измеряют в подходящем функциональном анализе), например, его специфические антигенные свойства. Таким образом, "производное" также включает (химерные) слитые белки/пептиды, содержащие пептид или белок, используемый в настоящем изобретении, или природный полноразмерный белок (или его вариант или фрагмент), слитый с другим пептидом/белком, например, придающим слитому пептиду/белку две или более биологических функции. Например, слияние содержит метку, такую как, например, эпитоп, например, эпитоп FLAG, или эпитоп V5, или эпитоп НА. Например, эпитоп представляет собой эпитоп FLAG. Такая метка пригодна, например, для очистки слитого белка.
В этом контексте "вариант" белка или пептида может содержать по меньшей мере 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99% идентичных аминокислот на участке 10, 20, 30, 50, 75 или 100 аминокислот такого белка или пептида. Аналогично, "вариант" или, в частности, "фрагмент" последовательности нуклеиновой кислоты может содержать по меньшей мере 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99% идентичных нуклеотидов на участке 10, 20, 30, 50, 75 или 100 нуклеотидов такой последовательность нуклеиновой кислоты; однако, как правило, в отношении к природной полноразмерной последовательности. В случае "фрагментов" идентичность последовательности для фрагмента, как правило, определяют по длине (фрагмента) на части полноразмерного белка (соответствующей такой же длине, как у фрагмента), которая демонстрирует наибольший уровень идентичности последовательностей.
В дополнительном предпочтительном варианте осуществления первого аспекта настоящего изобретения последовательность нуклеиновой кислоты по изобретению для повышения эффективности трансфекции и/или иммуностимулирующих свойств последовательности нуклеиновой кислоты по изобретению связана с носителем, средством для трансфекции или комплексообразования. Особенно предпочтительными в этом контексте средствами, подходящими для повышения эффективности трансфекции, являются катионные или поликатионные соединения, включая протамин, нуклеолин, спермин или спермидин, или другие катионные пептиды или белки, такие как поли-L-лизин (PLL), полиаргинин, основные полипептиды, пептиды для проникновения в клетку (СРР), включая связывающие ВИЧ пептиды, Tat ВИЧ-1 (ВИЧ), происходящие из Tat пептиды, пенетратин, происходящие из VP22 или аналогичные пептиды, VP22 HSV (Herpes simplex), MAP, KALA или домены белковой трансдукции (PTD), PpT62 0, богатые пролином пептиды, богатые аргинином пептиды, богатые лизином пептиды, MPG-пептид(ы), Рер-1, L-олигомеры, пептид(ы) кальцитонина, получаемые у Antennapedia пептиды (в частности у Drosophila antennapedia), pAntp, pIsl, FGF, лактоферрин, транспортан, буфорин-2, Вас715-24, SynB, SynB(1), pVEC, происходящие из hCT пептиды, SAP или гистоны. Кроме того, предпочтительные катионные или поликатионные белки или пептиды можно выбирать из приведенных ниже белков или пептидов со следующей общей формулой:

а l, m, n или о независимо друг от друга могут представлять собой любое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, при условии, что общее содержание Arg, Lys, His и Orn составляет по меньшей мере 50% от всех аминокислот олигопептида; и Хаа может представлять собой любую аминокислоту, выбранную из природных (=встречающихся в природе) или неприродных аминокислот, исключая Arg, Lys, His или Orn; и х может представлять собой любое число, выбранное из 0, 1, 2, 3 или 4, при условии, что общее содержание Хаа не превышает 50% всех аминокислот олигопептида. Особенно предпочтительными катионными пептидами в этом контексте являются, например, Arg7, Arg8, Arg9, H3R9, R9H3, H3R9H3, YSSR9SSY, (RKH)4, Y(RKH)2R и т.д. Дополнительные предпочтительные катионные или поликатионные соединения, которые можно использовать в качестве средства для трансфекции, могут включать катионные полисахариды, например, хитозан, полибрен, катионные полимеры, например, полиэтиленимин (PEI), катионные липиды, например, DOTMA: [1-(2,3-сиолеилокси)пропил)]-N,N,N-триметилхлорид аммония, DMRIE, ди-С14-амидин, DOTIM, SAINT, DC-Choi, BGTC, СТАР, DOPC, DODAP, DOPE: диолеилфосфатидилэтаноламин, DOSPA, DODAB, DOIC, DMEPC, DOGS: диоктадециламидоглицилспермин, DIMRI: бромид димиристооксипропилдиметилгидроксиэтиламмония, DOTAP: диолеоилокси-3-(триметиламмонио)пропан, DC-6-14: хлорид O,O-дитетрадеканоил-N-(а-триметиламмониоацетил)диэтаноламина, CLIP1: рац-[(2,3-диоктадецилоксипропил) (2-гидроксиэтил)]диметилхлорид аммония, CLIP6: рац-[2(2,3-дигексадецилоксипропилоксиметилокси)этил]триметиламмоний, CLIP9: рац-[2(2,3-дигексадецилоксипропилоксисукцинилокси)этил]триметиламмоний, олигофектамин, или катионные или поликатионные полимеры, например, модифицированные полиаминокислоты, такие как (3-аминокислотные полимеры или обращенные полиамиды и т.п., модифицированные полиэтилены, такие как PVP (бромид поли(N-этил-4-винилпиридиния)) и т.п., модифицированные акрилаты, такие как pDMAEMA (поли(диметиламиноэтилметилакрилат)) и т.п., модифицированные амидоамины, такие как рАМАМ (поли(амидоамин)) и т.д., модифицированные сложные полибетааминоэфиры (РВАЕ), такие как модифицированные по диаминовому концу полимеры 1,4-бутандиолдиакрилата и 5-амино-1-пентанола и т.п., дендримеры, такие как полипропиламиновые дендримеры или дендримеры на основе рАМАМ и т.п., полиимины, такие как PEI: поли(этиленимин), поли(пропиленимин) и т.п., полиаллиламин, полимеры на основе каркаса из сахаров, такие как полимеры на основе циклодекстрина, полимеры на основе декстрана, хитозан и т.п., полимеры на основе силанового каркаса, такие как сополимеры PMOXA-PDMS и т.п., блок-полимеры, состоящие из комбинации одного или нескольких катионных блоков (например, выбранных из катионных полимеров, как указано выше) и одного или нескольких гидрофильных или гидрофобных блоков (например, полиэтиленгликоля); и т.п.
В этом контексте особенно предпочтительно, чтобы нуклеиновая кислота по изобретению образовывала комплекс, по меньшей мере частично, с катионным или поликатионным соединением, предпочтительно, катионными белками или пептидами. Частично означает, что только часть нуклеиновой кислоты по изобретению образовывает комплекс с катионным или поликатионным соединением, и что остаток нуклеиновой кислоты по изобретению находится в форме без образования комплекса ("свободной"). Предпочтительно, соотношение образующей комплекс нуклеиновой кислоты к свободной нуклеиновой кислоте выбрано из отношений приблизительно от 5:1 (масс./масс.) до приблизительно 1:10 (масс./масс.), более предпочтительно, из отношений приблизительно от 4:1 (масс./масс.) до приблизительно 1:8 (масс./масс.), еще более предпочтительно, из отношений приблизительно от 3:1 (масс./масс.) до приблизительно 1:5 (масс./масс.) или 1:3 (масс./масс.), а наиболее предпочтительно, отношение образующей комплекс нуклеиновой кислоты к свободной нуклеиновой кислоте выбрано из отношения приблизительно 1:1 (масс./масс.).
Предпочтительно, чтобы последовательность нуклеиновой кислоты по изобретению была предоставлена в свободной форме или в форме комплекса, например, с поликатионным соединением какой-либо химической структуры, предпочтительно, с поликатионными (поли)пептидами или синтетическими поликатионными соединениями. Предпочтительно, последовательность нуклеиновой кислоты не предоставляют вместе с упаковывающей клеткой.
В дополнительном аспекте изобретение относится к композиции или набору или набор частей, содержащих множество или более одной, предпочтительно, от 2 до 10, более предпочтительно, от 2 до 5, наиболее предпочтительно, от 2 до 4 последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе. Эти композиции по изобретению содержат более одной последовательности нуклеиновой кислоты по изобретению, предпочтительно, кодирующих различные пептиды или белки, которые содержат, предпочтительно, различные патогенные антигены или их фрагменты, варианты или производные.
В дополнительном аспекте настоящее изобретение также относится к способу повышения экспрессии кодируемого пептида или белка, включающему стадии, например, а) получения последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, b) внесения или введения последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, в экспрессирующую систему, например, в бесклеточную экспрессирующую систему, клетку (например, экспрессирующую клетку-хозяина или соматическую клетку), ткань или организм. Способ можно использовать в лабораторных, исследовательских, диагностических целях, в целях коммерческого получения пептидов или белков и/или в терапевтических целях. В этом контексте, как правило, после получения последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, ее, как правило, вносят или вводят в бесклеточную экспрессирующую систему, клетку (например, экспрессирующую клетку-хозяина или соматическую клетку), ткань или организм, например, в свободной или образующей комплекс форме или в виде фармацевтической композиции или вакцины, как описано в настоящем документе, предпочтительно, посредством трансфекции или любыми способами введения, как описано в настоящем документе. Способ можно проводить in vitro, in vivo или ex vivo. Кроме того, способ можно проводить в отношении лечения конкретного заболевания, в частности, для лечения инфекционных заболеваний, предпочтительно, как определено в настоящем документе.
В этом контексте in vitro в настоящем документе определяют как трансфекцию или трансдукцию нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, в клетки в культуре вне организма; in vivo в настоящем документе определяют как трансфекцию или трансдукцию нуклеиновой кислоты по изобретению или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению в клетки посредством внесения нуклеиновой кислоты по изобретению или композиции по изобретению в целый организм или индивидууму; и ех vivo в настоящем документе определяют как трансфекцию или трансдукцию нуклеиновой кислоты по изобретению или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению в клетки вне организма или индивидуума и последующее внесение трансфицированных клеток в организм или индивидууму.
Подобным образом, в другом аспекте настоящее изобретение также относится к использованию последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем. документе, предпочтительно, в диагностических или терапевтических целях, повышения экспрессии кодируемого пептида или белка, например, посредством внесения или введения последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, например, в бесклеточную экспрессирующую систему, клетку (например, экспрессирующую клетку-хозяина или соматическую клетку), ткань или организм. Использование можно проводить в лабораторных, исследовательских, диагностических целях, в целях коммерческого получения пептидов или белков и/или в терапевтических целях. В этом контексте, как правило, после получения последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, ее, как правило, вносят или вводят в бесклеточную экспрессирующую систему, клетку (например, экспрессирующую клетку-хозяина или соматическую клетку), ткань или организм, предпочтительно, в свободной или образующей комплекс форме или в виде фармацевтической композиции или вакцины, как описано в настоящем документе, предпочтительно, посредством трансфекции или любыми способами введения, как описано в настоящем документе. Использование можно проводить in vitro, in vivo или ex vivo. Кроме того, использование можно проводить в отношении лечения конкретного заболевания, в частности, для лечения инфекционных заболеваний, предпочтительно, как определено в настоящем документе.
В еще одном аспекте настоящее изобретение также относится к экспрессирующей системе по изобретению, содержащей последовательность нуклеиновой кислоты по изобретению, или экспрессирующему вектору или плазмиде в первом аспекте настоящего изобретения. В этом контексте экспрессирующая система может представлять собой бесклеточную экспрессирующую систему (например, систему транскрипции/трансляции in vitro), клеточную экспрессирующую систему (например, клетки млекопитающих, такие как клетки СНО, клетки насекомых, дрожжевые клетки, клетки бактерий, таких как Е. coli) или организмы, используемые для экспрессии пептидов или белков (например, растения или животные, такие как коровы).
Кроме того, в другом аспекте настоящее изобретение также относится к использованию нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению (что, как правило, означает более 1, 2, 3, 4, 5, 6 или более 10 нуклеиновых кислот, например, от 2 до 10, предпочтительно, от 2 до 5 нуклеиновых кислот), как определено в настоящем документе, для получения фармацевтической композиции для повышения экспрессии кодируемого пептида или белка, например, для лечения инфекционного заболевания, предпочтительно, как определено в настоящем документе, например, для внесения или введения нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, в клетку (например, экспрессирующую клетку-хозяина или соматическую клетка), ткань или организм, предпочтительно, в свободной форме или образующей комплекс форме или в виде фармацевтической композиции или вакцины, как описано в настоящем документе, более предпочтительно, любыми способами введения, как описано в настоящем документе.
Таким образом, в конкретном предпочтительном аспекте, настоящее изобретение также относится к фармацевтической композиции, содержащей нуклеиновую кислоту по изобретению, как определено в настоящем документе, или композицию по изобретению, содержащую множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, и необязательно фармацевтически приемлемый носитель и/или транспортер.
В качестве первого ингредиента фармацевтическая композиция по изобретению содержит по меньшей мере одну нуклеиновую кислоту по изобретению, как определено в настоящем документе.
В качестве второго ингредиента фармацевтическая композиция по изобретению необязательно может сдержать по меньшей мере один дополнительный фармацевтически активный компонент.
Фармацевтически активный компонент в этом контексте представляет собой соединение, которое оказывает терапевтическое действие в отношении лечения, улучшения состояния или предотвращения конкретного симптома или заболевания, как указано в настоящем документе, предпочтительно, инфекционных заболеваний. Такие соединения, не подразумевая каких-либо ограничений, включают пептиды или белки, предпочтительно, как определено в настоящем документе, нуклеиновые кислоты, предпочтительно, как определено в настоящем документе, (терапевтически активные) низкомолекулярные органические или неорганические соединения (молекулярная масса менее 5000, предпочтительно, менее 1000), сахара, антигены или антитела, предпочтительно, как определено в настоящем документе, терапевтические средства, уже существующие на известном уровне техники, антигенные клетки, антигенные клеточные фрагменты, клеточные фракции; компоненты клеточной стенки (например, полисахариды), модифицированные, аттенуированные или деактивированные (например, химически или посредством облучения) патогенные микроорганизмы (вирусы, бактерии и т.п.), адъюванты, предпочтительно, как определено в настоящем документе, и тому подобное.
Кроме того, фармацевтическая композиция по изобретению может содержать фармацевтически приемлемый носитель и/или транспортер. В контексте настоящего изобретения фармацевтически приемлемый носитель, как правило, включает жидкую или нежидкую основу фармацевтической композиции по изобретению. Если фармацевтическая композиция по изобретению предоставлена в жидкой форме, носитель, как правило, представляет собой апирогенную воду; изотонический солевой раствор или забуференные (водные) растворы, например, забуференные фосфатом, цитратом и т.д. растворы. Инъекционный буфер по отношению к конкретному эталонному носителю может быть гипертоническим, изотоническим или гипотоническим, т.е. буфер может иметь более высокое, идентичное или меньшее содержание солей по сравнению с конкретным эталонным носителем, где, предпочтительно, можно использовать такие концентрации указанных выше солей, которые не приводят к повреждению клеток вследствие осмоса или других концентрационных эффектов. Эталонные носители представляют собой, например, жидкости, существующие в способах "in vivo", такие как кровь, лимфа, цитозольные жидкости, или другие жидкости организма, или, например, жидкости, которые можно использовать в качестве эталонных носителей в способах "in vitro", такие как общие буферы или жидкости. Такие общие буферы или жидкости известны специалисту. В качестве жидкого основания особенно предпочтителен лактатный раствор Рингера.
Однако для фармацевтической композиции по изобретению также можно использовать один или несколько совместимых твердых или жидких наполнителей или разбавителей или инкапсулирующих соединений, которые подходят для введения пациенту, получаемому лечение. Как используют в настоящем документе, термин "совместимый" обозначает, что эти составляющие фармацевтической композиции по изобретению можно смешивать с нуклеиновой кислотой по изобретению, как определено в настоящем документе, таким образом, что не происходит интеркаляции, которая может значительно снижать фармацевтическую эффективность фармацевтической композиции по изобретению в типичных условиях использования.
В конкретном варианте осуществления фармацевтическая композиция по изобретению может содержать адъювант. В этом контексте адъювант можно понимать как любое соединение, которое подходит для инициации или усиления иммунного ответа врожденной иммунной системы, т.е. неспецифического иммунного ответа. Другими словами, при введении, фармацевтическая композиция по изобретению, благодаря адъюванту, необязательно содержащемуся в ней, предпочтительно, вызывает врожденный иммунный ответ. Предпочтительно, такой адъювант можно выбирать из адъювантов, известных специалисту и подходящих для настоящего случая, т.е. поддержки индукции врожденного иммунного ответа у млекопитающего, например, адъювантного белка, как определено выше, или адъюванта, как определено далее.
Особенно предпочтительными в качестве адъювантов, подходящих для хранения и доставки, являются катионные или поликатионные соединения, как определено выше для последовательности нуклеиновой кислоты по изобретению в качестве носителя, средства для трансфекции или образования комплекса.
Дополнительно, при желании, фармацевтическая композиция по изобретению может содержать одно или несколько вспомогательных веществ для увеличения ее иммуногенности или способности к иммуностимуляции. Таким образом, предпочтительно, достигают, синергического действия последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, и вспомогательного вещества, которое необязательно может содержаться в фармацевтической композиция по изобретению. В этом отношении, в зависимости от различных типов вспомогательных веществ, в рассматриваемые факторы можно принимать различные механизмы. Например, соединения, которые обеспечивают созревание дендритных клеток (DC), например, липополисахариды, TNF-альфа или лиганд CD40, из первого класса подходящих вспомогательных веществ. Как правило, в качестве вспомогательного вещества можно использовать любое средство, которое действует на иммунную систему подобно "сигналу тревоги" (LPS, GP96 и т.д.) или цитокинам, таким как GM-CFS, которые обеспечивают усиление иммунного ответа и/или целевым образом влияют на него. Особенно предпочтительными вспомогательными веществами являются цитокины, такие как монокины, лимфокины, интерлейкины или хемокины, которые дополнительно стимулируют врожденный иммунный ответ, такие как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, IL-20, IL-21, IL-22, IL-23, IL-24, IL-25, IL-26, IL-27, IL-28, IL-29, IL-30, IL-31, IL-32, IL-33, IFN-альфа, IFN-бета, IFN-гамма, GM-CSF, G-CSF, M-CSF, LT-бета или TNF-альфа, факторы роста, такие как hGH.
Дополнительные добавки, которые можно включать в фармацевтическую композицию по изобретению, представляют собой эмульгаторы, такие как, например, Tween®; средства для смачивания, такие как, например, лаурилсульфат натрия; красители; придающие вкус средства, фармацевтические носители; формирующие таблетку средства; стабилизаторы; антиоксиданты; консерванты.
Кроме того, фармацевтическая композиция по изобретению может содержать любое дополнительное соединение, которое известно как иммуностимулирующее ввиду его аффинности связывания (в качестве лиганда) с Toll-подобными рецепторами человека TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10 или ввиду его аффинности связывания (в качестве лиганда) с Toll-подобными рецепторами мыши TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13.
Фармацевтическую композицию по изобретению можно вводить перорально, парентерально, посредством ингаляционного спрея, местно, ректально, назально, буккально, вагинально или посредством имплантируемого резервуара. Как используют в настоящем документе, термин парентеральный включает подкожный, внутривенный, внутримышечный, внутрисуставный, интрасиновиальный, интрастернальный, интратекальный, внутрипеченочный, внутриочаговый, интракраниальный, трансдермальный, интрадермальный, внутрилегочный, интраперитонеальный, интракардиальный, внутриартериальный и сублингвальный способы инъекции или инфузии.
Предпочтительно, фармацевтическую композицию по изобретению можно вводить посредством парентеральной инъекции, более предпочтительно, посредством подкожного, внутривенного, внутримышечного, внутрисуставного, интрасиновиального, интрастернального, интратекального, внутрипеченочного, внутриочагового, интракраниального, трансдермального, интрадермального, внутрилегочного, интраперитонеального, интракардиального, внутриартериального и сублингвального способов инъекции или инфузии. Особенно предпочтительной является интрадермальная и внутримышечная инъекция. Стерильными инъецируемыми формами фармацевтических композиций по изобретению могут быть водная или масляная суспензии. Эти суспензии можно формулировать способами, известными в данной области, с использованием подходящих диспергирующих средств или средств для смачивания и суспендирующих средств.
Фармацевтическую композицию по изобретению, как определено в настоящем документе, также можно вводить перорально в любой перорально приемлемой лекарственной форме, включая в качестве неограничивающих примеров, капсулы, таблетки, водные суспензии или растворы.
Фармацевтическую композицию по изобретению также можно вводить местно, особенно, когда цель лечения включает области и органы, легко доступные при местном применении, например, включая заболевании кожи или любой другой доступной эпителиальной ткани. Для каждого из этих областей или органов легко получать подходящие местные составы. Для местного применения фармацевтическую композицию по изобретению можно формулировать в подходящей мази, содержащей нуклеиновую кислоту по изобретению, как определено в настоящем документе, суспендированной или растворенной в одном или нескольких носителях.
Как правило, фармацевтическая композиция по изобретению содержит "безопасное и эффективное количество" компонентов фармацевтической композиции по изобретению, в частности, последовательности(ей) нуклеиновой кислоты по изобретению, как определено в настоящем документе. Как используют в настоящем документе, "безопасное и эффективное количество" означает такое количество последовательности(ей) нуклеиновой кислоты по изобретению, как определено в настоящем документе, как количество, которого достаточно для значимой индукции положительного изменения заболевания или нарушения, как определено в настоящем документе. Однако, в то же время, "безопасное и эффективное количество" является достаточно малым, чтобы избежать серьезных побочных эффектов и обеспечить оптимальную отношение между преимуществом и риском. Как правило, определение этих пределов находится в пределах заключения врача.
Фармацевтическую композицию по изобретению можно использовать в медицинских целях для человека, а также для ветеринарии, предпочтительно, в медицинских целях для человека, в основном в виде фармацевтической композиции или в виде вакцины.
В другом особенно предпочтительном аспекте фармацевтическую композицию по изобретению (или последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композицию по изобретению, содержащую множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе) можно предоставлять или использовать в качестве вакцины. Как правило, такая вакцина является такой, как определено выше для фармацевтических композиций. Кроме того, такая вакцина, как правило, содержит нуклеиновую кислоту по изобретению, как определено в настоящем документе, или композицию по изобретению, содержащую множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе.
Вакцина по изобретению также может содержать фармацевтически приемлемый носитель, адъювант и/или носитель, как определено в настоящем документе для фармацевтической композиции по изобретению. В конкретном контексте вакцины по изобретению, выбор фармацевтически приемлемого носителя в основном определяет способ, которым вводят вакцину по изобретению. Вакцину по изобретению можно вводить, например, системно или местно. Маршруты для системного введения в основном включают, например, трансдермальный, пероральный, парентеральный маршруты, включающие способы введения посредством подкожной, внутривенной, внутримышечной, внутриартериальной, интрадермальной и интраперитонеальной инъекции и/или интраназально. Маршруты для местного введения в основном включают, например, местные способы введения, а также интрадермальную, трансдермальную, подкожную или внутримышечную инъекции или внутриочаговую, интракраниальную, внутрилегочную, интракардиальную и сублингвальную инъекции. Более предпочтительно, вакцины можно вводить интрадермальным, подкожным или внутримышечным способом. Таким образом, вакцины по изобретению, предпочтительно, формулируют в жидкой (или иногда в твердой) форме.
Кроме того, вакцина по изобретению, при желании, может содержать одно или несколько вспомогательных веществ для усиления ее иммуногенности или способности к иммуностимуляции. Особенно предпочтительными в качестве вспомогательных веществ или добавок являются адъюванты, как определено для фармацевтической композиции.
Кроме того, настоящее изобретение относится к определенным применениям и использованиям последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, композиций по изобретению, содержащих множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, фармацевтической композиции по изобретению, вакцины по изобретению, где все содержат последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, или наборов, содержащих их.
В одном конкретном аспекте настоящее изобретение относится к первому медицинскому применению последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, в качестве лекарственного средства, предпочтительно, в качестве вакцины, в частности, для лечения инфекционных заболеваний.
В другом аспекте настоящее изобретение относится ко второму медицинскому применению последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, для лечения инфекционных заболеваний, как определено в настоящем документе, предпочтительно, к использованию последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, фармацевтической композиции или вакцины, содержащих их, или наборов, содержащих их, для получения лекарственного средства для профилактики, лечения и/или улучшение состояния инфекционных заболеваний, как определено в настоящем документе. Предпочтительно, фармацевтическую композицию или вакцину для этой цели используют или следует вводить нуждающемуся в этом пациенту.
Предпочтительно, инфекционные заболевания, как указано в настоящем документе, предпочтительно, выбраны из вирусных, бактериальных, протозойных и прионных инфекционных заболеваний. Такие инфекционные заболевания, как правило, выбраны из списка, в котором представлены инфекции Acinetobacter, африканская сонная болезнь (African trypanosomiasis), СПИД (синдром приобретенного иммунодефицита), амебиаз, анаплазмоз, сибирская язва, аппендицит, инфекция Arcanobacterium haemolyticums, аргентинская геморрагическая лихорадка, аскаридоз, аспергиллез, инфекция астровирусами, стопа атлета, бабезиоз, инфекция Bacillus cereuss, бактериальн менингит, бактериальн пневмония, бактериальный вагиноз (BV), инфекция Bacteroidess, балантидиозная инфекция, инфекции Baylisascaris, бильгарциоз, инфекции вирусом ВК, Black piedra, инфекция Blastocystis hominiss, бластомикоз, боливийская геморрагическая лихорадка, инфекция Borrelia (боррелиоз), ботулизм (и детский ботулизм), Bovine ленточный червь, бразильская геморрагическая лихорадка, бруцеллезная инфекция, Burkholderia, язва Бурули, инфекция калицивирусами (норовирус и саповирус), кампилобактериоз, кандидиаз (кандидоз), инфекция собачьих ленточных червей, болезнь кошачьих царапин, болезнь Шагаса (американский трипаносомоз), шанкроид, ветряночная инфекция, хламидиоз, инфекция Chlamydia trachomatiss, инфекция Chlamydophila pneumoniaes, холера, хромобластомикоз, Climatic bubo, клонорхоз, инфекция Clostridium diffidles, кокцидиоидомикоз, Cold, колорадская клещевая лихорадка (CTF), вирусная инфекция верхних дыхательных путей (острый вирусный ринофарингит; острый ринит), остроконечная кондилома, конъюнктивит, болезнь Крейтцфельдта-Якоба (CJD), конго-крымская геморрагическая лихорадка (CCHF), криптококкоз, криптоспоридиоз, подкожная "блуждающая личинка" (CLM), кожный лейшманиоз, циклоспороз, цистицеркозная инфекция, цитомегаловирусы, лихорадка Денге, дерматофитоз, диентамебиаз, дифтерия, диботриоцефалез, донованоз, драконтиаз, ранний летний менингоэнцефалит (FSME), геморрагическая лихорадка Эбола, эхинококкоз, эрлихиоз, энтеробиозная инфекция (острицы), инфекция Enterococcuss, энтеровирусные инфекции, эпидемический тиф, эпиглоттит, инфекционный мононуклеоз вирусом Эпштейна-Барр, инфекционная эритема (пятая болезнь), внезапная экзантема, фасциолопсиоз, фасциолез, летальная семейная бессонница (FFI), пятая болезнь, филяриоз, пищевое отравление рыбой (сигуатера), рыбный ленточный червь, грипп, пищевое отравление Clostridium perfringens, лисий ленточный червь, инфекция свободноживущими амебами, инфекция Fusobacterium, газовая гангрена, геотрихоз, синдром Герстманна-Штреусслера-Шейнкера (GSS), гиардиоз, сап, гнатостомоз, гонорея, паховая гранулема (донованоз), инфекции стрептококком группы А, инфекции стрептококком группы В, инфекция Haemophilus influenzaes, болезнь рук, ног и рта (HFMD), легочный хантавирусный синдром (HPS), инфекции Helicobacter pylori, гемолитический уремический синдром (HUS), геморрагическая лихорадка с почечным синдромом (HFRS), инфекция генипавирусами, гепатит А, гепатит В, гепатит С, гепатит D, гепатит Е, Herpes simplex, Herpes simplex типа I, Herpes simplex типа II, опоясывающ лишай, гистоплазмоз, Hollow warts, анкилостомозэ, инфекции бокавирусами человека, эрлихиоз Ehrlichia ewingii человека, гранулоцитарный анаплазмоз человека (HGA), метапневмовирусные инфекции человека, моноцитарный эрлихиоз человека, инфекции вирусами папилломы человека (HPV), инфекции вирусом парагриппа человека, Гименолепидоз, грипп, Изоспороз, японский энцефалит, болезнь Кавасаки, кератит, инфекция Kingella kingaes, куру, Лямблиоз (гиардиоз), лихорадка Ласса, легионеллез (болезнь легионеров, понтиакская лихорадка), лейшманиоз, лепра, лептоспироз, вши, листериоз, Боррелиоз Лайма, болезнь Лайма, лимфатический филяриатоз (слоновость), лимфоцитарный хориоменингит, малярия, марбургская геморрагическая лихорадка (MHF), вирус марбургской лихорадки, корь, мелиоидоз (болезнь Уитмора), менингит, менингококковое заболевание, метагонимиаз, микроспоридиоз, малый ленточный червь, самопроизвольный выкидыш (воспаление предстательной железы), контагиозный моллюск (МС), мононуклеоз, эпидемическ паротит, мышиный тиф (эндемический тиф), Мицетома, Mycoplasma hominis, микоплазменная пневмония, миаз, подгузниковый/пеленочный дерматит, неонатальный конъюнктивит (Ophthalmia neonatorum), неонатальный сепсис (Хориоамнионит), нокардиоз, Нома, инфекции норовирусами, онхоцеркоз (речная слепота), остеомиелит, отит среднего уха, паракокцидиоидоз (южно-американский бластомикоз), парагонимоз, паратиф, пастереллез, головной педикулез (головные вши), нательный педикулез (тельные вши), лобковый педикулез (лобковые вши), воспалительное заболевание таза (PID), коклюш (судорожный кашель), железистая лихорадка Пфейффера, чумная инфекция, пневмококкоз, пневмоцистная пневмония (РСР), пневмония, полиомиелит (детская хромота), полиомиелит, ленточный червь свиней, инфекции Prevotella, первичный амебный менингоэнцефалит (РАМ), прогрессирующая многоочаговая лейкоэнцефалопатия, псевдокруп, пситтакоз, лихорадка Q, кроличья лихорадка, бешенство, лихорадка от укусов крыс, синдром Рейтера, инфекции респираторно-синцитиальными вирусами (RSV), риноспоридиозная инфекция, риновирусы, риккетсиозные инфекции, везикулезный риккетсиоз, лихорадка долины Рифт (RVF), пятнистая лихорадка скалистых гор (RMSF), инфекции ротавирусами, краснуха, сальмонеллезный паратиф, Salmonella typhus, сальмонеллез, SARS (тяжелый острый респираторный синдром), чесотка, скарлатина, шистомоз (бильгарциоз), кустарниковый тиф, сепсис, шигеллез (бактериальная дизентерия), опоясывающий лишай, натуральная оспа (оспа), мягкий шанкр, споротрихоз, стафилококковое пищевое отравление, стафилококковые инфекции, стронгилоидоз, сифилис, тениоз, столбняк, трехсуточная лихорадка, вирусный клещевой энцефалит, дерматомикоз бороды и усов (паразитарный сикоз), стригущий лишай (трихофития волосистой части головы), кожный лишая (трихофития гладкой кожи), трихофития промежности (паховая эпидермофития), дерматомикоз (трихофития рук), черный лишай, дерматофития стоп (стопа атлета), дерматофитный онихомикоз (онихомикоз), разноцветный лишай (отрубевидный лишай), токсокариоз (глазная форма "блуждающей личинки" (OLM) и висцеральная форма "блуждающей личинки" (VLM)), токсоплазмоз, трихинеллез, трихомоноз, трихиуриазные инфекции (трихоцефалы), гоноррея, трипанозомоз (сонная болезнь), болезнь Цуцугамуши, туберкулез, туляремия, тиф, сыпной тиф, инфекция Ureaplasma urealyticums, вагинит (кольпит), вариант болезни Крейтцфельдта-Якоба (vCJD, nvCJD), венесуэльский энцефалит лошадей, венесуэльская геморрагическая лихорадка, вирусная пневмония, висцеральный лейшманиоз, кандиломы, лихорадка Западного Нила, западный энцефалит лошадей, белая пьедра (белый лишай), судорожный кашель, сыпь дрожжевых грибков, желтая лихорадка, инфекции Yersinia pseudotuberculosis, иерсиниоз и зигомикоз.
В дополнительном предпочтительном аспекте последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композицию по изобретению, содержащую множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, можно использовать для получения фармацевтической композиции или вакцины, в частности, для целей, как определено в настоящем документе.
Кроме того, фармацевтическую композицию или вакцину по изобретению можно использовать для лечения заболевания или нарушения, предпочтительно, инфекционных заболеваний, как определено в настоящем документе.
В последнем аспекте настоящее изобретение также относится к наборам, в частности, наборам частей. Такие наборы, в частности, наборы частей, как правило в качестве компоненты содержат, отдельно или в комбинации с дополнительными компонентами, как определено в настоящем документе, по меньшей мере одну последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, фармацевтическую композицию по изобретению или вакцину, содержащую последовательность нуклеиновой кислоты по изобретению. По меньшей мере одна последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, например, необязательно находится в комбинации с дополнительными компонентами, как определено в настоящем документе, таким образом по меньшей мере одна нуклеиновая кислота по изобретению предоставлено отдельно (первая часть набора) от по меньшей мере одной другой части набора, содержащей один или несколько других компонентов. Например, фармацевтическая композиция по изобретению и/или вакцина по изобретению могут находиться в одной или разных частях набора. В качестве примера, например, по меньшей мере одна часть набора может содержать по меньшей мере одну последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, и по меньшей мере одна дополнительная часть набора по меньшей мере один другой компонент, как определено в настоящем документе, например, по меньшей мере одна другая часть набора может содержать по меньшей мере одну фармацевтическую композицию или вакцину или их часть, например, по меньшей мере одна часть набора может содержать последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, по меньшей мере одна дополнительная часть набора по меньшей мере один другой компонент, как определено в настоящем документе, по меньшей мере одна дополнительная часть набора по меньшей мере один компонент фармацевтической композиции по изобретению, или вакцину, или фармацевтическую композиция по изобретению, или вакцину, как целое, и по меньшей мере одна дополнительная часть набора, например, по меньшей мере один фармацевтический носитель или транспортер и т.д. В случае, если набор или набор частей содержит множество последовательностей нуклеиновой кислоты по изобретению (что означает, как правило, более 1, 2, 3, 4, 5, 6 или более 10 нуклеиновых кислот, например, от 2 до 10, предпочтительно, от 2 до 5 нуклеиновых кислот), один компонент набора может содержать только одну, несколько или все последовательности нуклеиновой кислоты по изобретению, содержащиеся в наборе. В альтернативном варианте осуществления каждая последовательность нуклеиновой кислоты по изобретению может содержаться в различных/отдельных компонентах набора так, что каждый компонент формирует часть набора. Также, в первом компоненте в качестве части набора может содержаться более одной нуклеиновой кислоты, при этом один или несколько других (второй, третий и т.д.) компоненты (предоставляющих одну или несколько других частей набора) могут содержать одну или более одной нуклеиновых кислот по изобретению, которые могут быть идентичны или частично идентичны или отличаться от первого компонента. Кроме того, набор или набор частей может содержать технические инструкции с информацией о введении и дозировании последовательностей нуклеиновой кислоты по изобретению, фармацевтической композиции по изобретению или вакцины по изобретению или любого из его компонентов или частей, например, если набор получают в виде набора частей.
В совокупности изобретение относится к последовательности нуклеиновой кислоты, содержащей или кодирующей
a) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов,
и
c) последовательность поли(А) или сигнал полиаденилирования;
где указанный пептид или белок содержит патогенный антиген или его фрагмент, вариант или производное, в частности, антиген из патогенного организма, связанного с инфекционным заболеванием, предпочтительно, связанного с инфекционным заболеванием, которое представляет собой бактериальную инфекцию, вирусную инфекцию, протозойную инфекцию, грибковую инфекцию или т.п. Изобретение дополнительно относится к композиции или набору или набору частей, содержащим по меньшей мере одну из таких последовательностей нуклеиновой кислоты. Кроме того, изобретение относится к использованию такой последовательности нуклеиновой кислоты в качестве лекарственного средства, предпочтительно, для лечения инфекционных заболеваний, более предпочтительно, в фармацевтической композиции для лечения инфекционных заболеваний, содержащей дополнительный фармацевтически приемлемый носитель. Кроме того, изобретение относится к способу повышения экспрессии кодируемого пептида или белка, включающему стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты и внесения или введения последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань и/или организм.
Кроме того, предпочтительно, изобретение относится к последовательности нуклеиновой кислоты, содержащей или кодирующей
a) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов,
и
c) последовательность поли(А) или сигнал полиаденилирования;
где указанный пептид или белок содержит патогенный антиген или его фрагмент, вариант или производное, в частности, антиген из патогенного организма, связанного с инфекционным заболеванием, предпочтительно, связанного с инфекционным заболеванием, которое представляет собой бактериальную инфекцию, вирусную инфекцию, протозойную инфекцию, грибковую инфекцию или т.п., более предпочтительно, где патогенный антиген происходит из патогенных микроорганизмов, выбранных из вируса гриппа, респираторно-синцитиального вируса (RSV), вируса простого герпеса (HSV), вируса папилломы человека (HPV), вируса иммунодефицита человека (ВИЧ), плазмодия, Staphylococcus aureus, вируса Денге, Chlamydia trachomatis, цитомегаловируса (CMV), вируса гепатита В (HBV), Mycobacterium tuberculosis, вируса бешенства и вируса желтой лихорадки. Изобретение дополнительно относится к композиции или набору или набору частей, содержащим по меньшей мере одну из таких последовательностей нуклеиновой кислоты. Кроме того, изобретение относится к использованию такой последовательности нуклеиновой кислоты в качестве лекарственного средства, предпочтительно, для лечения инфекционных заболеваний, более предпочтительно, в фармацевтической композиции для лечения инфекционных заболеваний, содержащей дополнительный фармацевтически приемлемый носитель. Кроме того, изобретение относится к способу повышения экспрессии кодируемого пептида или белка, включающему стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты и внесения или введения последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань и/или организм.
Кроме того, предпочтительно, изобретение относится к последовательности нуклеиновой кислоты, содержащей или кодирующей
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов,
и
c) последовательность поли(А) или сигнал полиаденилирования;
где указанный пептид или белок содержит патогенный антиген или его фрагмент, вариант или производное, в частности, антиген из патогенного организма, связанного с инфекционным заболеванием, предпочтительно, связанного с инфекционным заболеванием, которое представляет собой бактериальную инфекцию, вирусную инфекцию, протозойную инфекцию, грибковую инфекцию или т.п., более предпочтительно, где патогенный антиген происходит из патогенных микроорганизмов, выбранных из вируса гриппа, респираторно-синцитиального вируса (RSV), вируса простого герпеса (HSV), вируса папилломы человека (HPV), вируса иммунодефицита человека (ВИЧ), плазмодия, Staphylococcus aureus, вируса Денге, Chlamydia trachomatis, цитомегаловируса (CMV), вируса гепатита В (HBV), Mycobacterium tuberculosis, вируса бешенства и вируса желтой лихорадки, еще более предпочтительно, антиген выбран из антигена р24 ВИЧ, белков оболочки ВИЧ (Gp120, Gp41, Gp160), полипротеина GAG, белка негативного регуляторного фактора Nef, трансактиватора транскрипции Tat, если инфекционное заболевание представляет собой ВИЧ, инфекцию предпочтительно, вирусом иммунодефицита человека. Изобретение дополнительно относится к композиции или набору или набору частей, содержащим по меньшей мере одну из таких последовательностей нуклеиновой кислоты. Кроме того, изобретение относится к использованию такой последовательности нуклеиновой кислоты в качестве лекарственного средства, предпочтительно, для лечения инфекционных заболеваний, более предпочтительно, в фармацевтической композиции для лечения инфекционных заболеваний, содержащей дополнительный фармацевтически приемлемый носитель. Кроме того, изобретение относится к способу повышения экспрессии кодируемого пептида или белка, включающему стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты и внесения или введения последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань и/или организм.
Кроме того, предпочтительно, изобретение относится к последовательности нуклеиновой кислоты, содержащей или кодирующей
a) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов,
и
c) последовательность поли(А) или сигнал полиаденилирования;
где указанный пептид или белок содержит патогенный антиген или его фрагмент, вариант или производное, в частности, антиген из патогенного организма, связанного с инфекционным заболеванием, предпочтительно, связанного с инфекционным заболеванием, которое представляет собой бактериальную инфекцию, вирусную инфекцию, протозойную инфекцию, грибковую инфекцию или т.п., более предпочтительно, где патогенный антиген происходит из патогенных микроорганизмов, выбранных из вируса гриппа, респираторно-синцитиального вируса (RSV), вируса простого герпеса (HSV), вируса папилломы человека (HPV), вируса иммунодефицита человека (ВИЧ), плазмодия, Staphylococcus aureus, вируса Денге, Chlamydia trachomatis, цитомегаловируса (CMV), вируса гепатита В (HBV), Mycobacterium tuberculosis, вируса бешенства и вируса желтой лихорадки, еще более предпочтительно, антиген выбран из основного белка наружной мембраны МОМР, предполагаемого белка наружной мембраны РМРС, белка комплекса наружной мембраны В OmcB, белков теплового шока Hsp60 HSP10, белка IncA, белков системы секреции типа III, белка малой цепи рибонуклеотидредуктазы NrdB, плазмидного белка Pgp3, наружного белка хламидий N CopN, антигена СТ521, антигена СТ425, антигена СТ043, антигена ТС0052, антигена ТС0189, антигена ТС0582, антигена ТС0660, антигена ТС0726, антигена ТС0816, антигена ТС0828, если инфекционное заболевание представляет собой инфекцию Chlamydia trachomatis. Изобретение дополнительно относится к композиции или набору или набору частей, содержащим по меньшей мере одну из таких последовательностей нуклеиновой кислоты. Кроме того, изобретение относится к использованию такой последовательности нуклеиновой кислоты в качестве лекарственного средства, предпочтительно, для лечения инфекционных заболеваний, более предпочтительно, в фармацевтической композиции для лечения инфекционных заболеваний, содержащей дополнительный фармацевтически приемлемый носитель. Кроме того, изобретение относится к способу повышения экспрессии кодируемого пептида или белка, включающему стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты и внесения или введения последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань и/или организм.
Кроме того, предпочтительно, изобретение относится к последовательности нуклеиновой кислоты, содержащей или кодирующей
a) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов,
и
c) последовательность поли(А) или сигнал полиаденилирования;
где указанный пептид или белок содержит патогенный антиген или его фрагмент, вариант или производное, в частности, антиген из патогенного организма, связанного с инфекционным заболеванием, предпочтительно, связанного с инфекционным заболеванием, которое представляет собой бактериальную инфекцию, вирусную инфекцию, протозойную инфекцию, грибковую инфекцию или т.п., более предпочтительно, где патогенный антиген происходит из патогенных микроорганизмов, выбранных из вируса гриппа, респираторно-синцитиального вируса (RSV), вируса простого герпеса (HSV), вируса папилломы человека (HPV), вируса иммунодефицита человека (ВИЧ), плазмодия, Staphylococcus aureus, вируса Денге, Chlamydia trachomatis, цитомегаловируса (CMV), вируса гепатита В (HBV), Mycobacterium tuberculosis, вируса бешенства и вируса желтой лихорадки, еще более предпочтительно, антиген выбран из антигена рр65, мембранного белка рр15, белка проксимальной оболочки капсида рр150, белка М45, ДНК-полимеразы UL54, геликазы UL105, гликопротеина gM, гликопротеина gN, гликопротеина Н, гликопротеина В gB, белка UL8 3, белка UL94, белка UL99, если инфекционное заболевание представляет собой цитомегаловирусную инфекцию, инфекцию предпочтительно, цитомегаловирусами (CMV). Изобретение дополнительно относится к композиции или набору или набору частей, содержащим по меньшей мере одну из таких последовательностей нуклеиновой кислоты. Кроме того, изобретение относится к использованию такой последовательности нуклеиновой кислоты в качестве лекарственного средства, предпочтительно, для лечения инфекционных заболеваний, более предпочтительно, в фармацевтической композиции для лечения инфекционных заболеваний, содержащей дополнительный фармацевтически приемлемый носитель. Кроме того, изобретение относится к способу повышения экспрессии кодируемого пептида или белка, включающему стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты и внесения или введения последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань и/или организм.
Кроме того, предпочтительно, изобретение относится к последовательности нуклеиновой кислоты, содержащей или кодирующей
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов,
и
c) последовательность поли(А) или сигнал полиаденилирования;
где указанный пептид или белок содержит патогенный антиген или его фрагмент, вариант или производное, в частности, антиген из патогенного организма, связанного с инфекционным заболеванием, предпочтительно, связанного с инфекционным заболеванием, которое представляет собой бактериальную инфекцию, вирусную инфекцию, протозойную инфекцию, грибковую инфекцию или т.п., более предпочтительно, где патогенный антиген происходит из патогенных микроорганизмов, выбранных из вируса гриппа, респираторно-синцитиального вируса (RSV), вируса простого герпеса (HSV), вируса папилломы человека (HPV), вируса иммунодефицита человека (ВИЧ), плазмодия, Staphylococcus aureus, вируса Денге, Chlamydia trachomatis, цитомегаловируса (CMV), вируса гепатита В (HBV), Mycobacterium tuberculosis, вируса бешенства и вируса желтой лихорадки, еще более предпочтительно, антиген выбран из капсидного белка С, премембранного белка prM, мембранного белка М, оболочечного белка Е (домена I, домена II, домена II), белка NS1, белка NS2A, белка NS2B, белка NS3, белка NS4A, белка 2K, белка NS4B, белка NS5, если инфекционное заболевание представляет собой лихорадку Денге, инфекцию, предпочтительно, вирусами Денге (DEN-1, DEN-2, DEN-3 и DEN-4)-флавивирусами. Изобретение дополнительно относится к композиции или набору или набору частей, содержащим по меньшей мере одну из таких последовательностей нуклеиновой кислоты. Кроме того, изобретение относится к использованию такой последовательности нуклеиновой кислоты в качестве лекарственного средства, предпочтительно, для лечения инфекционных заболеваний, более предпочтительно, в фармацевтической композиции для лечения инфекционных заболеваний, содержащей дополнительный фармацевтически приемлемый носитель. Кроме того, изобретение относится к способу повышения экспрессии кодируемого пептида или белка, включающему стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты и внесения или введения последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань и/или организм.
Кроме того, предпочтительно, изобретение относится к последовательности нуклеиновой кислоты, содержащей или кодирующей
a) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов,
и
c) последовательность поли(А) или сигнал полиаденилирования;
где указанный пептид или белок содержит патогенный антиген или его фрагмент, вариант или производное, в частности, антиген из патогенного организма, связанного с инфекционным заболеванием, предпочтительно, связанного с инфекционным заболеванием, которое представляет собой бактериальную инфекцию, вирусную инфекцию, протозойную инфекцию, грибковую инфекцию или т.п., более предпочтительно, где патогенный антиген происходит из патогенных микроорганизмов, выбранных из вируса гриппа, респираторно-синцитиального вируса (RSV), вируса простого герпеса (HSV), вируса папилломы человека (HPV), вируса иммунодефицита человека (ВИЧ), плазмодия, Staphylococcus aureus, вируса Денге, Chlamydia trachomatis, цитомегаловируса (CMV), вируса гепатита В (HBV), Mycobacterium tuberculosis, вируса бешенства и вируса желтой лихорадки, еще более предпочтительно, антиген выбран из поверхностного антигена гепатита В HBsAg, корового антигена гепатита В HbcAg, полимеразы, белка Hbx, preS2 срединного поверхностного белка, поверхностного белка L, большого белка S, вирусного белка VP1, вирусного белка VP2, вирусного белка VP3, вирусного белка VP4, если инфекционное заболевание представляет собой гепатит В, инфекцию, предпочтительно, вирусом гепатита В (HBV). Изобретение дополнительно относится к композиции или набору или набору частей, содержащим по меньшей мере одну из таких последовательностей нуклеиновой кислоты. Кроме того, изобретение относится к.использованию такой последовательности нуклеиновой кислоты в качестве лекарственного средства, предпочтительно, для лечения инфекционных заболеваний, более предпочтительно, в фармацевтической композиции для лечения инфекционных заболеваний, содержащей дополнительный фармацевтически приемлемый носитель. Кроме того, изобретение относится к способу повышения экспрессии кодируемого пептида или белка, включающему стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты и внесения или введения последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань и/или организм.
Кроме того, предпочтительно, изобретение относится к последовательности нуклеиновой кислоты, содержащей или кодирующей
a) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов,
и
c) последовательность поли(А) или сигнал полиаденилирования;
где указанный пептид или белок содержит патогенный антиген или его фрагмент, вариант или производное, в частности, антиген из патогенного организма, связанного с инфекционным заболеванием, предпочтительно, связанного с инфекционным заболеванием, которое представляет собой бактериальную инфекцию, вирусную инфекцию, протозойную инфекцию, грибковую инфекцию или т.п., более предпочтительно, где патогенный антиген происходит из патогенных микроорганизмов, выбранных из вируса гриппа, респираторно-синцитиального вируса (RSV), вируса простого герпеса (HSV), вируса папилломы человека (HPV), вируса иммунодефицита человека (ВИЧ), плазмодия, Staphylococcus aureus, вируса Денге, Chlamydia trachomatis, цитомегаловируса (CMV), вируса гепатита В (HBV), Mycobacterium tuberculosis, вируса бешенства и вируса желтой лихорадки, еще более предпочтительно, антиген выбран из белка репликации Е1, регуляторного белка Е2, белка Е3, белка Е4, белка Е5, белка Е6, белка Е7, белка Е8, основного капсидного белка L1, минорного капсидного белка L2, если инфекционное заболевание представляет собой инфекцию вирусом папилломы человека (HPV), инфекция, предпочтительно, вирусом папилломы человека (HPV). Изобретение дополнительно относится к композиции или набору или набору частей, содержащим по меньшей мере одну из таких последовательностей нуклеиновой кислоты. Кроме того, изобретение относится к использованию такой последовательности нуклеиновой кислоты в качестве лекарственного средства, предпочтительно, для лечения инфекционных заболеваний, более предпочтительно, в фармацевтической композиции для лечения инфекционных заболеваний, содержащей дополнительный фармацевтически приемлемый носитель. Кроме того, изобретение относится к способу повышения экспрессии кодируемого пептида или белка, включающему стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты и внесения или введения последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань и/или организм.
Кроме того, предпочтительно, изобретение относится к последовательности нуклеиновой кислоты, содержащей или кодирующей
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов,
и
c) последовательность поли(А) или сигнал полиаденилирования;
где указанный пептид или белок содержит патогенный антиген или его фрагмент, вариант или производное, в частности, антиген из патогенного организма, связанного с инфекционным заболеванием, предпочтительно, связанного с инфекционным заболеванием, которое представляет собой бактериальную инфекцию, вирусную инфекцию, протозойную инфекцию, грибковую инфекцию или т.п., более предпочтительно, где патогенный антиген происходит из патогенных микроорганизмов, выбранных из вируса гриппа, респираторно-синцитиального вируса (RSV), вируса простого герпеса (HSV), вируса папилломы человека (HPV), вируса иммунодефицита человека (ВИЧ), плазмодия, Staphylococcus aureus, вируса Денге, Chlamydia trachomatis, цитомегаловируса (CMV), вируса гепатита В (HBV), Mycobacterium tuberculosis, вируса бешенства и вируса желтой лихорадки, еще более предпочтительно, антиген выбран из слитого белка F, гемагглютинин-нейраминидазы HN, гликопротеина G, белка матрикса М, фосфопротеина Р, нуклеопротеина N, полимеразы L, если инфекционное заболевание представляет собой инфекцию вирусом парагриппа человека, инфекцию предпочтительно, вирусами парагриппа человека (HPIV). Изобретение дополнительно относится к композиции или набору или набору частей, содержащим по меньшей мере одну из таких последовательностей нуклеиновой кислоты. Кроме того, изобретение относится к использованию такой последовательности нуклеиновой кислоты в качестве лекарственного средства, предпочтительно, для лечения инфекционных заболеваний, более предпочтительно, в фармацевтической композиции для лечения инфекционных заболеваний, содержащей дополнительный фармацевтически приемлемый носитель. Кроме того, изобретение относится к способу повышения экспрессии кодируемого пептида или белка, включающему стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты и внесения или введения последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань и/или организм.
Кроме того, предпочтительно, изобретение относится к последовательности нуклеиновой кислоты, содержащей или кодирующей
a) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов,
и
c) последовательность поли(А) или сигнал полиаденилирования;
где указанный пептид или белок содержит патогенный антиген или его фрагмент, вариант или производное, в частности, антиген из патогенного организма, связанного с инфекционным заболеванием, предпочтительно, связанного с инфекционным заболеванием, которое представляет собой бактериальную инфекцию, вирусную инфекцию, протозойную инфекцию, грибковую инфекцию или т.п., более предпочтительно, где патогенный антиген происходит из патогенных микроорганизмов, выбранных из вируса гриппа, респираторно-синцитиального вируса (RSV), вируса простого герпеса (HSV), вируса папилломы человека (HPV), вируса иммунодефицита человека (ВИЧ), плазмодия, Staphylococcus aureus, вируса Денге, Chlamydia trachomatis, цитомегаловируса (CMV), вируса гепатита В (HBV), Mycobacterium tuberculosis, вируса бешенства и вируса желтой лихорадки, еще более предпочтительно, антиген выбран из гемагглютинина (НА), нейраминидазы (NA), нуклеопротеина (NP), белка Ml, белка М2, белка NS1, белка NS2 (белка NEP: белка экспорта из ядра), белка РА, белка РВ1 (белок основной полимеразы 1), белка PB1-F2 и белка РВ2 (семейство Orthomyxoviridae, вирус гриппа (грипп)); нуклеопротеина N, большого структурного белка L, фосфопротеина Р, белка матрикса М, гликопротеина G, если инфекционное заболевание представляет собой бешенство, инфекцию предпочтительно, вирусом бешенства; наиболее предпочтительно, антиген происходит из вируса Orthomyxoviridae, наиболее предпочтительно, вируса гриппа, наиболее предпочтительно, из гемагглютинина (НА), нейраминидазы (NA), нуклеопротеина (NP), оного или обоих матриксных белков (M1) и (М2), полимеразных белков (РВ1), (РВ2) и белков NS1 и NS2. Изобретение дополнительно относится к композиции или набору или набору частей, содержащим по меньшей мере одну из таких последовательностей нуклеиновой кислоты. Кроме того, изобретение относится к использованию такой последовательности нуклеиновой кислоты в качестве лекарственного средства, предпочтительно, для лечения инфекционных заболеваний, более предпочтительно, в фармацевтической композиции для лечения инфекционных заболеваний, содержащей дополнительный фармацевтически приемлемый носитель. Кроме того, изобретение относится к способу повышения экспрессии кодируемого пептида или белка, включающему стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты и внесения или введения последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань и/или организм.
Кроме того, предпочтительно, изобретение относится к последовательности нуклеиновой кислоты, содержащей или кодирующей
a) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов,
и
c) последовательность поли(А) или сигнал полиаденилирования;
где указанный пептид или белок содержит патогенный антиген или его фрагмент, вариант или производное, в частности, антиген из патогенного организма, связанного с инфекционным заболеванием, предпочтительно, связанного с инфекционным заболеванием, которое представляет собой бактериальную инфекцию, вирусную инфекцию, протозойную инфекцию, грибковую инфекцию или т.п., более предпочтительно, где патогенный антиген происходит из патогенных микроорганизмов, выбранных из вируса гриппа, респираторно-синцитиального вируса (RSV), вируса простого герпеса (HSV), вируса папилломы человека (HPV), вируса иммунодефицита человека (ВИЧ), плазмодия, Staphylococcus aureus, вируса Денге, Chlamydia trachomatis, цитомегаловируса (CMV), вируса гепатита В (HBV), Mycobacterium tuberculosis, вируса бешенства и вируса желтой лихорадки, еще более предпочтительно, антиген выбран из слитого белка F, нуклеопротеина N, белка матрикса М, белка матрикса М2-1, белка матрикса М2-2, фосфопротеина Р, малого гидрофобного белка SH, основного поверхностного гликопротеина G, полимеразы L, неструктурного белка 1 NS1, неструктурного белка 2 NS2, если инфекционное заболевание представляет собой инфекцию респираторно-синцитиальным вирусом, инфекцию, предпочтительно, респираторно-синцитиальным вирусом (RSV).
Кроме того, предпочтительно, изобретение относится к последовательности нуклеиновой кислоты, содержащей или кодирующей
a) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов,
и
c) последовательность поли(А) или сигнал полиаденилирования;
где указанный пептид или белок содержит патогенный антиген или его фрагмент, вариант или производное, в частности, антиген из патогенного организма, связанного с инфекционным заболеванием, предпочтительно, связанного с инфекционным заболеванием, которое представляет собой бактериальную инфекцию, вирусную инфекцию, протозойную инфекцию, грибковую инфекцию или т.п., более предпочтительно, где патогенный антиген происходит из патогенных микроорганизмов, выбранных из вируса гриппа, респираторно-синцитиального вируса (RSV), вируса простого герпеса (HSV), вируса папилломы человека (HPV), вируса иммунодефицита человека (ВИЧ), плазмодия, Staphylococcus aureus, вируса Денге, Chlamydia trachomatis, цитомегаловируса (CMV), вируса гепатита В (HBV), Mycobacterium tuberculosis, вируса бешенства и вируса желтой лихорадки, еще более предпочтительно, антиген выбран из секреторного антигена SssA (род Staphylococcus, стафилококковое пищевое отравление); секреторного антигена SssA (род Staphylococcus, например, aureus, стафилококковая инфекция); молекулярного шаперона DnaK, липопротеина клеточной поверхности Mpt83, липопротеина Р23, пермеазного белка системы переноса фосфатов pstA, антигена 14 кДа, связывающего фибронектин белка С FbpC1, аланиндегидрогеназы ТВ43, глутаминсинтетазы 1, белка ESX-1, белка CFP10, белка ТВ10.4, белка МРТ8 3, белка МТВ12, белка МТБ8, подобных Rpf белков, белка МТВ32, белка МТВ39, кристаллина, белка теплового шока HSP65, белка PST-S, если инфекционное заболевание представляет собой туберкулез, инфекцию, предпочтительно, Mycobacterium tuberculosis. Изобретение дополнительно относится к композиции или набору или набору частей, содержащим по меньшей мере одну из таких последовательностей нуклеиновой кислоты. Кроме того, изобретение относится к использованию такой последовательности нуклеиновой кислоты в качестве лекарственного средства, предпочтительно, для лечения инфекционных заболеваний, более предпочтительно, в фармацевтической композиции для лечения инфекционных заболеваний, содержащей дополнительный фармацевтически приемлемый носитель. Кроме того, изобретение относится к способу повышения экспрессии кодируемого пептида или белка, включающему стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты и внесения или введения последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань и/или организм.
Кроме того, предпочтительно, изобретение относится к последовательности нуклеиновой кислоты, содержащей или кодирующей
a) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов,
и
c) последовательность поли(А) или сигнал полиаденилирования;
где указанный пептид или белок содержит патогенный антиген или его фрагмент, вариант или производное, в частности, антиген из патогенного организма, связанного с инфекционным заболеванием, предпочтительно, связанного с инфекционным заболеванием, которое представляет собой бактериальную инфекцию, вирусную инфекцию, протозойную инфекцию, грибковую инфекцию или т.п., более предпочтительно, где патогенный антиген происходит из патогенных микроорганизмов, выбранных из вируса гриппа, респираторно-синцитиального вируса (RSV), вируса простого герпеса (HSV), вируса папилломы человека (HPV), вируса иммунодефицита человека (ВИЧ), плазмодия, Staphylococcus aureus, вируса Денге, Chlamydia trachomatis, цитомегаловируса (CMV), вируса гепатита В (HBV), Mycobacterium tuberculosis, вируса бешенства и вируса желтой лихорадки, еще более предпочтительно, антиген выбран из геномного полипротеина, белка Е, белка М, капсидного белка С, протеазы NS3, белка NS1, белка NS2A, белка AS2B, белка NS4A, белка NS4B, белка NS5, если инфекционное заболевание представляет собой желтую лихорадку, инфекцию, предпочтительно, вирусом желтой лихорадки. Изобретение дополнительно относится к композиции или набору или набору частей, содержащим по меньшей мере одну из таких последовательностей нуклеиновой кислоты. Кроме того, изобретение относится к использованию такой последовательности нуклеиновой кислоты в качестве лекарственного средства, предпочтительно, для лечения инфекционных заболеваний, более предпочтительно, в фармацевтической композиции для лечения инфекционных заболеваний, содержащей дополнительный фармацевтически приемлемый носитель. Кроме того, изобретение относится к способу повышения экспрессии кодируемого пептида или белка, включающему стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты и внесения или введения последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань и/или организм.
В настоящем изобретении, если не указано иначе, различные свойства альтернатив и вариантов осуществления можно комбинировать друг с другом. Кроме того, термин "содержащий" не следует рассматривать, как означающий "состоящий из", если это конкретно не указано. Однако, если это применимо в контексте настоящего изобретения, термин "содержащий" можно заменять термином "состоящий из".
Фигуры:
Приведенные ниже фигуры предназначены для дополнительной иллюстрации изобретения, и их не следует рассматривать в качестве дополнительного ограничения настоящего изобретения.
Фигура 1: представлена консенсусная последовательность структуры "стебель-петля" гистонов, полученная из последовательностей структур "стебель-петля" многоклеточных и простейших (как опубликовано в Davila Lopez, М., & Samuelsson, Т. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10.1261/rna.782308). Выровнено 4001 последовательности структур "стебель-петля" гистонов из многоклеточных и простейших и для каждого положения в последовательности структуры "стебель-петля" указано количество встречающихся нуклеотидов. Полученная консенсусная последовательность, представляющая все нуклеотиды, присутствующие в анализируемых последовательностях, приведена с использованием однобуквенного кода нуклеотидов. В дополнение к консенсусной последовательности приведены последовательности, представляющие по меньшей мере 99%, 95% и 90% нуклеотидов, присутствующих в анализируемых последовательностях.
Фигура 2: представлена консенсусная последовательность структуры "стебель-петля" гистонов, полученная из последовательности структур "стебель-петля" простейших (как опубликовано в Davila Lopez, М., & Samuelsson, Т. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10,1261/rna.782308). Выровнено 131 последовательность структур "стебель-петля" гистонов из простейших и для каждого положения в последовательности структуры "стебель-петля" указано количество встречающихся нуклеотидов. Полученная консенсусная последовательность, представляющая все нуклеотиды, присутствующие в анализируемых последовательностях, приведена с использованием однобуквенного кода нуклеотидов. В дополнение к консенсусной последовательности приведены последовательности, представляющие по меньшей мере 99%, 95% и 90% нуклеотидов, присутствующих в анализируемых последовательностях.
Фигура 3: представлена консенсусная последовательность структуры "стебель-петля" гистонов, полученная из последовательности структур "стебель-петля" многоклеточных (как опубликовано в Davila Lopez, М., & Samuelsson, Т. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10,1261/rna.782308). Выровнено 3870 последовательностей структур "стебель-петля" гистонов из многоклеточных и для каждого положения в последовательности структуры "стебель-петля" указано количество встречающихся нуклеотидов. Полученная консенсусная последовательность, представляющая все нуклеотиды, присутствующие в анализируемых последовательностях, приведена с использованием однобуквенного кода нуклеотидов. В дополнение к консенсусной последовательности приведены последовательности, представляющие по меньшей мере 99%, 95% и 90% нуклеотидов, присутствующих в анализируемых последовательностях.
Фигура 4: представлена консенсусная последовательность структуры "стебель-петля" гистонов, полученная из последовательности структур "стебель-петля" позвоночных (как опубликовано в Davila Lopez, М., & Samuelsson, Т. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10,1261/rna.782308). Выровнено 1333 последовательностей структур "стебель-петля" гистонов позвоночных и для каждого положения в последовательности структуры "стебель-петля" указано количество встречающихся нуклеотидов. Полученная консенсусная последовательность, представляющая все нуклеотиды, присутствующие в анализируемых последовательностях, приведена с использованием однобуквенного кода нуклеотидов. В дополнение к консенсусной последовательности приведены последовательности, представляющие по меньшей мере 99%, 95% и 90% нуклеотидов, присутствующих в анализируемых последовательностях.
Фигура 5: представлена консенсусная последовательность структуры "стебель-петля" гистонов, полученная из последовательности структур "стебель-петля" человека (Homo sapiens) (как опубликовано в Davila Lopez, М., & Samuelsson, Т. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10,1261/rna.782308). Выровнены 84 последовательности структур "стебель-петля" гистонов человека и для каждого положения в последовательности структуры "стебель-петля" указано количество встречающихся нуклеотидов. Полученная консенсусная последовательность, представляющая все нуклеотиды, присутствующие в анализируемых последовательностях, приведена с использованием однобуквенного кода нуклеотидов. В дополнение к консенсусной последовательности приведены последовательности, представляющие по меньшей мере 99%, 95% и 90% нуклеотидов, присутствующих в анализируемых последовательностях.
Фигуры 6-19: представлена мРНК после транскрипции in vitro.
Приведены обозначения и последовательность мРНК, полученных транскрипцией in vitro. Используют следующие сокращения:
ppLuc (GC): обогащенная GC последовательность мРНК, кодирующая люциферазу Photinus pyralis;
ag: 3'-нетранслируемая область (UTR) гена альфа-глобина;
А64: последовательность поли(А) с 64 остатками аденилата;
А120: последовательность поли(А) с 120 остатками аденилата;
histoneSL: структура "стебель-петля" гистонов;
aCPSL: структура "стебель-петля", которую выбрали из библиотеки вследствие ее специфического связывания с белком ссСР-2KL;
PolioCL: 5'-лист клевера геномной РНК вируса полиомиелита;
G30: последовательность поли(С) с 30 остатками гуанилата;
U30: последовательность поли(U) с 30 остатками уридилата;
SL: неспецифическая/искусственная стебель-петля;
N32: неспецифическая последовательность из 32 нуклеотидов;
В последовательностях выделены следующие элементы: кодирующая область (ORF) (заглавные буквы), ад (жирным), histoneSL (подчеркнуто), различные дополнительные тестированные последовательности (курсив).
Фигура 6: представлена последовательность мРНК ppLuc(GC)-ag (SEQ ID NO: 43).
Посредством линеаризации исходного вектора в участке рестрикции непосредственно после 3'-UTR альфа-глобина (ag) получена мРНК без последовательности поли(А).
Фигура 7: представлена последовательность мРНК ppLuc(GC) -ag-A64 (SEQ ID NO: 44).
Посредством линеаризации исходного вектора в участке рестрикции непосредственно после последовательность поли(А) А64 получена мРНК, заканчивающаяся последовательностью поли(А) А64.
Фигура 8: представлена последовательность мРНК ppLuc(GC)-ag-histoneSL (SEQ ID NO: 45).
Последовательность поли(A) A64 замещена histoneSL. Последовательность структуры "стебель-петля" гистонов, используемую в примерах, получали по Cakmakci et al. (2008). Molecular and Cellular Biology, 28(3), 1182-1194.
Фигура 9: представлена последовательность мРНК ppLuc(GC)-ag-A64-histoneSL (SEQ ID NO: 46).
С 3'-конца от поли(A) А64 добавляли histoneSL.
Фигура 10: представлена последовательность мРНК ppLuc(GC)-ag-A120 (SEQ ID NO: 47).
Последовательность поли(A) A64 замещали последовательностью поли(A) А120.
Фигура 11: представлена последовательность мРНК ppLuc(GC)-ag-A64-ag (SEQ ID NO: 48).
С 3'-конца от поли(A) А64 добавляли вторую 3'-UTR альфа-глобина.
Фигура 12: представлена последовательность мРНК ppLuc(GC)-ag-A64-aCPSL (SEQ ID NO: 49).
С 3'-конца от поли(A) А64 добавляли структуру "стебель-петля". Структуру "стебель-петля" выбирали из библиотеки вследствие ее специфического связывания с белком αCP-2KL (Thisted et al., (2001), The Journal of Biological Chemistry, 276(20), 17484-17496). αCP-2KL представляет собой изоформу αCP-2, наиболее сильно экспрессированного белка αСР (связывающего поли(С) мРНК альфа-глобина белок) (Makeyev et al., (2000), Genomics, 67(3), 301-316), группы связывающих РНК белков, которые связываются с 3'-UTR альфа-глобина (Chkheidze et al., (1999), Molecular and Cellular Biology, 19(7), 4572-4581).
Фигура 13: представлена последовательность мРНК ppLuc(GC)-ag-A64-PolioCL (SEQ ID NO: 50).
С 3'-конца от поли(A) А64 добавляли 5'-лист клевера из геномной РНК вируса полиомиелита.
Фигура 14: представлена последовательность мРНК ppLuc(GC)-ag-A64-G30 (SEQ ID NO: 51).
С 3'-конца от поли(A) А64 добавляли участок из 30 остатков гуанилата.
Фигура 15: представлена последовательность мРНК ppLuc(GC)-ag-A64-U30 (SEQ ID NO: 52).
С 3'-конца от поли(A) А64 добавляли участок из 30 остатков уридилата.
Фигура 16: представлена последовательность мРНК ppLuc(GC)-ag-A64-SL (SEQ ID NO: 53).
С 3'-конца от поли(A) А64 добавляли структуру "стебель-петля". Верхняя часть стебля и петли получали по (Babendure et al., (2006), RNA (New York, N.Y.), 12(5), 851-861). Структура "стебель-петля" состоит из 17 пар оснований, богатого CG стебля и петли из 6 оснований.
Фигура 17: представлена ppLuc(GC)-ag-A64-N32 (SEQ ID NO: 54).
Посредством линеаризации исходного вектора в альтернативном участке рестрикции получена мРНК с 32 дополнительными нуклеотидами после поли(А).
Фигура 18: представлена последовательность мРНК НА (H1N1/PR8) (GC)-ag-A64-C30 (SEQ ID NO: 55).
Фигура 19: представлена последовательность мРНК НА (H1N1/PR8) (GC)-ag-A64-C30 - histoneSL (SEQ ID NO: 56).
Фигура 20: показано, что комбинация поли(А) и histoneSL повышает экспрессию белка с мРНК синергическим образом.
Исследовали влияние последовательности поли(А), histoneSL и комбинации поли(А) и histoneSL на экспрессию люциферазы с мРНК. Таким образом, различные мРНК электропорировали в клетки HeLa. Уровни люциферазы измеряли через 6, 24 и 48 часов после трансфекции. С последовательности мРНК не содержащей ни последовательности поли(А), ни histoneSL, экспрессировалось мало люциферазы. Последовательность поли(А) или histoneSL увеличивают уровень люциферазы. Однако удивительно, что комбинация поли(А) и histoneSL дополнительно сильно увеличивает уровень люциферазы, во много раз выше уровня, наблюдаемого при использовании любого из элементов отдельно, таким образом действуй синергически. Данные нанесены на диаграмму в виде среднего количества RLU±SD (относительных световых единиц ± стандартное отклонение) из трансфекций в трех повторениях. Конкретные RLU приведены в примере 11.2.
Фигура 21: показано, что комбинация поли(А) и histoneSL повышает экспрессию белка с мРНК вне зависимости от их порядка.
Исследовали влияние последовательности поли(A), histoneSL, комбинации поли(А) и histoneSL и их порядка на экспрессию люциферазы с мРНК. Таким образом, в клетки HeLa посредством липофекции вводили различные мРНК. Уровни люциферазы измеряли через 6, 24 и 48 часов после начала трансфекции. Последовательность поли(А) А64 или histoneSL обеспечивали сравнимые уровни люциферазы. Увеличение длины последовательности поли (А) с А64 до А120 или до А300 умеренно увеличивает уровень люциферазы. В отличие от этого комбинация поли(А) и histoneSL увеличивает уровень люциферазы намного больше, чем удлинение последовательности поли(А). Комбинация поли(А) и histoneSL действует синергически так как это увеличивает уровень люциферазы во много раз выше уровня, наблюдаемого при использовании любого из элементов отдельно. Синергическое действие комбинации поли(А) и histoneSL наблюдают вне зависимости от порядка поли(А) и histoneSL и вне зависимости от длины поли(А) мРНК с А64-histoneSL или histoneSL-A250. Данные нанесены на диаграмму в виде среднего количества RLU±SD из трансфекций в трех повторениях. Конкретные RLU приведены в примере 11.3.
Фигура 22: показано, что повышение экспрессии белка комбинацией поли(А) и histoneSL является специфическим.
Исследовали влияние комбинирования поли(А) и histoneSL или поли(А) и альтернативных последовательностей на экспрессию люциферазы с мРНК. Таким образом в клетки HeLa электропорировали различные мРНК. Уровни люциферазы измеряли через 6, 24 и 48 часов после трансфекции. Последовательность поли(А) или histoneSL обеспечивали сравнимые уровни люциферазы. Комбинация поли(А) и histoneSL сильно увеличивает уровень люциферазы, во много раз выше уровня, наблюдаемого при использовании любого из элементов отдельно, таким образом, действуя синергически. В отличие от этого, комбинирования поли(А) с любой из других последовательностей не оказывало влияние на уровень люциферазы по сравнению с мРНК, содержащей только последовательность поли(А). Таким образом, комбинация поли(А) и histoneSL действует специфически и синергически. Данные нанесены на диаграмму в виде среднего количества RLU±SD из трансфекций в трех повторениях. Конкретные RLU приведены в примере 11.4.
Фигура 23: показано, что комбинация поли(А) и histoneSL повышает экспрессию белка с мРНК синергическим образом in vivo.
Исследовали влияние последовательности поли(А), histoneSL и комбинация поли(А) и histoneSL на экспрессию люциферазы с мРНК in vivo. Таким образом, мышам интрадермально инъецировали различные мРНК. Через 16 часов после инъекции мышей умерщвляли и измеряли уровни люциферазы в участках инъекций. Люцифераза экспрессируется с мРНК, содержащих histoneSL или последовательностью поли(А). Однако удивительно, что комбинация поли(А) и histoneSL сильно увеличивает уровень люциферазы, во много раз выше уровня, наблюдаемого при использовании любого из элементов отдельно, таким образом, действуя синергически. Данные нанесены на диаграмму в виде среднего количества RLU±SEM (относительные световые единицы ± стандартная ошибка среднего).
Конкретные RLU приведены в примере 11.5.
Фигура 24: показано, что комбинация поли(А) и histoneSL увеличивает уровень антител, индуцируемых при вакцинации мРНК.
Исследовали влияние последовательности поли(А) и комбинации поли(А) и histoneSL на индукцию антител к НА, индуцируемых вакцинацией мРНК. Таким образом, мышей Balb/c интрадермально вакцинировали различными мРНК. Уровень специфичных к НА антител у вакцинированных и контрольных мышей анализировали посредством ELISA с серийными разведениями сыворотки. IgG1 к НА индуцируют мРНК только с последовательностью поли(А). Однако удивительно, что комбинация поли(А) и histoneSL сильно увеличивает уровень IgG1 к НА выше уровня, наблюдаемого только с последовательностью поли(А).
Примеры:
Приведенные ниже примеры предназначены для дополнительной иллюстрации изобретения, и их не следует рассматривать в качестве дополнительного ограничения настоящего изобретения.
1. Получение консенсусных последовательностей гистон-стебель-петля
Перед проведением экспериментов определяли консенсусные последовательности структур "стебель-петля" гистонов на основе последовательностей структур "стебель-петля" гистонов многоклеточных и простейших. Последовательности получали из приложения, предоставленного Lopez et al. (Davila Lopez, M., & Samuelsson, T. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10.1261/rna.782308), где определено большое количество природных последовательностей структур "стебель-петля" гистонов посредством поиска геномных последовательностей и маркеров экспрессируемых последовательностей. Сначала все последовательности многоклеточных и простейших (4001 последовательность), или все последовательности простейших (131 последовательность), или, альтернативно, многоклеточных (3870 последовательностей), или позвоночных (1333 последовательности) или людей (84 последовательности) группировали и выравнивали. Затем определяли количество встречающихся нуклеотидов в каждом положении. На основе полученных таким образом таблиц получали консенсусные последовательности для 5 различных групп последовательностей, представляющие все нуклеотиды, присутствующие в анализируемых последовательностях. Кроме того, также получали более ограниченные консенсусные последовательности, более выделяя консервативные нуклеотиды.
2. Получение матричных ДНК
Конструировали вектор для транскрипции in vitro, содержащий промотор Т7 с последующей обогащенной GC последовательностью, кодирующей люциферазу Photinus pyralis (ppLuc(GC)), центральной частью 3'-нетранслируемой области (UTR) альфа-глобина (ад) и последовательностью поли(А). Непосредственно за последовательностью поли(А) следовал участок рестрикции, используемый для линеаризации вектора перед транскрипцией in vitro для получения мРНК, заканчивающейся последовательностью поли(А) А64. мРНК, получаемую из этого вектора, соответственно, посредством транскрипции in vitro, обозначают как "ppLuc(GC)-ag-А64".
Линеаризация этого вектора в альтернативных участках рестрикции перед транскрипцией in vitro позволяла получать мРНК дополненную дополнительными нуклеотидами с 3'-конца от А64 или с отсутствием А64. Кроме того, исходный вектор модифицировали для включения альтернативных последовательностей. В итоге из этих векторов посредством транскрипции in vitro получали представленные ниже мРНК (последовательности мРНК представлены на фигурах 6-17):

Кроме того, таким образом, как описано выше, получали последовательности плазмидной ДНК, кодирующие патогенный антиген НА (H1N1/PR8).
В итоге, с этих векторов посредством транскрипции in vitro получали приводимые ниже мРНК (последовательности мРНК приведены на фигурах 18-19):

3. Транскрипция in vitro
Матричную ДНК по примеру 2 линеаризировали и транскрибировали in vitro с использованием полимеразы Т7. Затем матричную ДНК расщепляли посредством обработки ДНКазой. Все транскрипты мРНК содержали 5'-копирующую структуру, полученную посредством добавления избытка N7-метилгуанозин-5'-трифосфат-5'-гуанозина к реакции транскрипции. Полученную таким образом мРНК очищали и ресуспендировали в воде.
4. Ферментативное аденилирование мРНК Две мРНК ферментативно аденилировали: ppLuc(GC)-ag-A64 и ppLuc(GC)-ag-histoneSL.
С этой целью, РНК инкубировали с поли(А)-полимеразой Е. coli и АТФ (набор Poly(A) Polymerase Tailing Kit, Epicentre, Madison, USA) по инструкциям производителя. мРНК с достроенной последовательностью поли(А) очищали и ресуспендировали в воде. Длину последовательности поли(А) определяли посредством электрофореза в агарозном геле. Начальную мРНК достраивали приблизительно 250 остатками аденилата, полученные мРНК обозначают как
ppLuc(GC)-ag-А300 и ppLuc(GC)-ag-histoneSL-A250, соответственно.
5. Экспрессия люциферазы посредством электропорации мРНК
Клетки HeLa трипсинизировали и промывали в опти-МЕМ. 1×105 клеток в 200 мкл опти-МЕМ электропорировали 0,5 мкг кодирующей ppLuc мРНК. В качестве контроля, отдельно проводили электропорацию мРНК, не кодирующей ppLuc. Электропорированные клетки высевали в 24-луночные планшеты в 1 мл среды RPMI 1640. Через 6, 24 или 4 8 часов после трансфекции среду отбирали и клетки лизировали в 200 мкл лизирующего буфера (25 мМ Tris, рН 7,5 (HCl), 2 мМ ЭДТА, 10% глицерин, 1% Triton Х-100, 2 мМ DTT, 1 мМ PMSF). Лизаты хранили при -20°С до измерения активности ppLuc.
6. Экспрессия люциферазы посредством липофекции мРНК
Клетки HeLa высевали в 96-луночные планшеты при плотности 2×104 клеток на лунку. Через сутки клетки отмывали в опти-МЕМ, а затем трансфицировали 0,25 мкг образующей комплекс с липофектином кодирующей ppLuc мРНК в 150 мкл опти-МЕМ. В качестве контроля отдельно проводили липофекцию мРНК, не кодирующей ppLuc. Через 6 часов после начала трансфекции в некоторых лунках опти-МЕМ отбирали и клетки лизировали в 200 мкл лизирующего буфера. В это время в оставшихся лунках опти-МЕМ заменяли на среду RPMI 1640. В этих лунках среду отбирали и клетки лизировали в 200 мкл лизирующего буфера через 24 или 48 часов после начала трансфекции. Лизаты хранили при -20°С до измерения активности ppLuc.
7. Измерение активности люциферазы
Активность ppLuc измеряли в виде относительных световых единиц (RLU) в планшетном спектрофотометре BioTek SynergyHT при времени измерения 5 секунд с использованием 50 мкл лизата и 200 мкл люциферинового буфера (25 мМ глицилглицин, рН 7,8 (NaOH), 15 мМ MgSO4, 2 мМ АТФ, 75 мкМ люциферин). Конкретные RLU рассчитывали, вычитая RLU контрольной РНК из общих RLU.
8. Экспрессия люциферазы посредством интрадермальной инъекции мРНК (экспрессия люциферазы in vivo)
Мышей анестезировали смесью ромпуна и кетавета. Каждую кодирующую ppLuc мРНК инъецировали интрадермально (0,5 мкг мРНК в 50 мкл на инъекцию). В качестве контроля отдельно инъецировали мРНК, не кодирующую ppLuc. Через 16 часов после инъекции мышей умерщвляли и собирали ткань. Образцы ткани быстро замораживали в жидком азоте и лизировали в устройстве для лизиса ткани (Qiagen) в 800 мкл лизирующего буфера (25 мМ Tris, рН 7,5 (HCl), 2 мМ ЭДТА, 10% глицерин, 1% Triton Х-100, 2 мМ DTT, 1 мМ PMSF). Затем образцы центрифугировали при 13500 об./мин. при 4°С в течение 10 минут. Лизаты хранили при -80°С до измерения активности ppLuc (см. 7. измерение активности люциферазы).
9. Детекция специфичного к антигену В-клеточного иммунного ответа (антител)
Мышей BALB/c (8 мышей на группу) дважды интрадермально вакцинировали в пределах 7 суток вакциной, содержащей 10 мкг мРНК, кодирующей НА (гемагглютинин A/Puerto Rico/8/34, в соответствии с SEQ ID NO: 55 и 56). В качестве отрицательного контроля мышей обрабатывали буфером.
Детекцию специфичного к антигену иммунного ответа проводили посредством детекции специфичных к белку НА антител. Таким образом, у вакцинированных мышей через четыре недели после последней вакцинации забирали образцы крови и получали сыворотку. Планшеты MaxiSorp® (Nalgene Nunc International) покрывали белком НА (Charles River Laboratories). После блокирования 1×PBS, содержащим 0,05% Tween-20 и 1% BSA, планшеты инкубировали с разбавленной сывороткой мыши (1:50). Затем добавляли связанное с биотином вторичное антитело (антитело к IgG мышь Dianova, кат. №115035003). После отмывки планшет инкубировали с пероксидазой хрена-стрептавидином, а затем определяли преобразование субстрата ABTS (2,2'-азино-бис(3-этил-бензтиазолин-6-сульфоновой кислоты). Результаты этого эксперимента представлены на фигуре 24.
10. Детекция специфичного к антигену клеточного иммунного ответа (Т-клеточный иммунный ответ) посредством ELISPOT:
Мышей C57BL/6 интрадермально вакцинировали кодирующей НА мРНК (гемагглютинин A/Puerto Rico/8/34, в соответствии с SEQ ID NO 55 и 56), образующей комплекс с протамином (2 раза в пределах 7 суток). Контрольных мышей обрабатывают буфером. Через 1 неделю после последней вакцинации мышей умерщвляют, удаляют селезенку и выделяют спленоциты. Спленоциты повторно стимулируют в течение 7 суток в присутствии пептидов указанного выше антигена (пептидная библиотека) или совместно инкубируют с дендритными клетками, полученными из клеток костного мозга нативных сингенных мышей, которые электропорировали мРНК, кодирующей антиген. Для определения специфичного к антигену клеточного иммунного ответа измеряли секрецию INF-гамма после повторной стимуляции. Для детекции INF-гамма покрытый планшет Multiscreen (Millipore) инкубируют в течение ночи с покрывающим буфером (0,1 М карбонатбикарбонатный буфер рН 9,6, 10,59 г/л Na2CO3, 8,4 г/л NaHCO3), содержащим антитела к INFy (BD Pharmingen, Heidelberg, Germany). Стимулирующие и эффекторные клетки совместно инкубируют в планшете в отношении 1:20 в течение 24 часов. Планшет отмывают 1×PBS и инкубируют со связанными с биотином вторичными антителами. После отмывки 1×PBS/0,05% Tween-20 к планшету добавляют субстрат (жидкая субстратная система 5-бром-4-хлор-3-индолилфосфат/нитросиний тетразолий из Sigma Aldrich, Taufkirchen, Germany) и преобразование субстрата можно детектировать визуально.
11. РЕЗУЛЬТАТЫ
11.1. Последовательности структуры "стебель-петля" гистонов:
Для характеристики последовательностей структуры "стебель -петля" гистонов группировали и выравнивали последовательности многоклеточных и простейших (4001 последовательность), или простейших (131 последовательность) или альтернативно многоклеточных (3870 последовательностей) или позвоночных (1333 последовательности) или людей (84 последовательности). Затем определяли количество встречающихся нуклеотидов в каждом положении. На основе полученных таким образом таблиц получали консенсусные последовательности для 5 различных групп последовательностей, представляющие все нуклеотиды, присутствующие в анализируемых последовательностях. В комбинированной консенсусной последовательности многоклеточных и простейших 3 нуклеотида являются консервативными, T/U в петле и G и С в стебле, формирующих пары оснований. Как правило, структурно формируется стебель из 6 пар оснований и петля из 4 нуклеотидов. Однако обычными являются измененные структуры: из 84 структур "стебель-петля" гистонов, принадлежащих человеку, две содержат стебель только из 5 нуклеотидов, содержащий 4 пары оснований и одно несоответствие. Другая структура "стебель-петля" гистонов человека содержит стебель только из 5 пар оснований. Еще четыре структуры "стебель-петля" гистонов человека содержат стебель длиной 6 нуклеотидов, но содержат одно несоответствие в трех различных положениях, соответственно. Кроме того, четыре структуры "стебель-петля" гистонов человека содержат одну пару неоднозначных оснований в двух различных положениях, соответственно. В отношении петли, по-видимому, длина в 4 нуклеотида необходима не строго, так как у D. discoideum идентифицирована петля из 5 нуклеотидов.
В дополнение к консенсусной последовательности, представляющей все нуклеотиды, присутствующие в анализируемых последовательностях, также получали более ограниченные консенсусные последовательности, более выделяя консервативные нуклеотиды. В итоге, получали следующие последовательности:
(Конс): представляет все присутствующие нуклеотиды.
(99%): представляет по меньшей мере 99% всех присутствующих нуклеотидов.
(95%): представляет по меньшей мере 95% всех присутствующих нуклеотидов.
(90%): представляет по меньшей мере 90% всех присутствующих нуклеотидов.
Результаты анализа последовательностей структуры "стебель-петля" гистонов обобщены в приведенных ниже таблицах 1-5 (также см. фиг. 1-5):





где использованные сокращения определяли следующим образом:
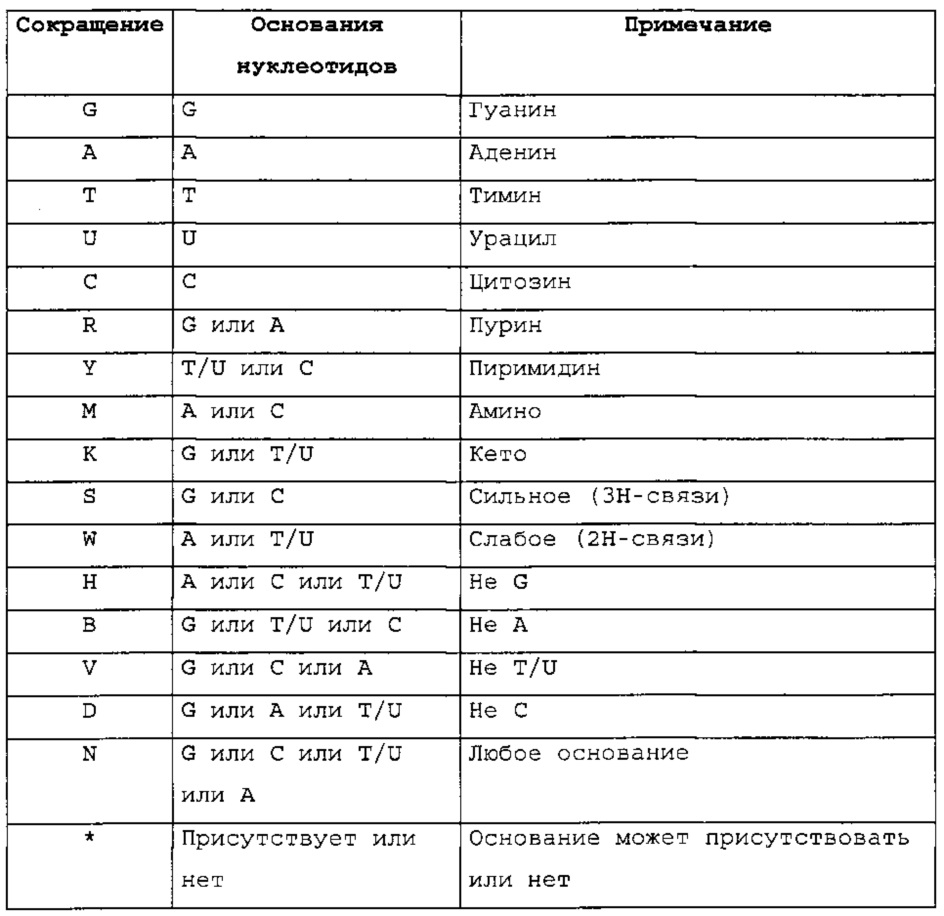
11.2. Комбинация поли(А) и histoneSL повышает экспрессию белка с мРНК синергичным образом.
Для исследования влияния комбинации поли(А) и histoneSL на экспрессию белка с мРНК синтезировали мРНК с различными последовательностями с 3'-конца от 3'-UTR альфа-глобина: мРНК, на 3'-конце просто заканчивающиеся 3'-UTR, таким образом, не имея последовательности поли(А) и histoneSL, или содержащие с 3'-конца от 3'-UTR последовательность поли(А) А64 или histoneSL в качестве альтернативы друг другу, или и поли(А) А64, и histoneSL. Кодирующую люциферазу мРНК или контрольную мРНК электропорировали в клетки HeLa. Уровни люциферазы измеряли через 6, 24 и 48 часов после трансфекции (см. приведенную ниже таблицу 6 и фигуру 20).

С последовательности мРНК не содержащей ни последовательности поли(А), ни histoneSL, экспрессировалось мало люциферазы. Последовательность поли(А) или histoneSL увеличивают уровень в сходной степени. Любая мРНК обеспечивала уровень люциферазы, намного больший, чем мРНК с отсутствием поли(А) и histoneSL. Однако удивительно, что комбинация поли(А) и histoneSL дополнительно сильно увеличивала уровень люциферазы, во много раз выше уровня, наблюдаемого при использовании любого из элементов отдельно. Величина повышения уровня люциферазы при комбинировании поли(А) и histoneSL в одной и той же мРНК демонстрирует, что они действуют синергически.
Синергию между поли(А) и histoneSL количественно определяли деля сигнал от мРНК с поли(A)-histoneSL (+/+) на сумму сигналов от мРНК с histoneSL (-/+) и мРНК с поли (А) (+/-) (см. приведенную ниже таблицу 7).

Рассчитанный таким образом показатель указывает на то, насколько уровень люциферазы с мРНК с комбинацией поли(А) и histoneSL превышает уровень, который можно было бы ожидать, если бы влияние поли(А) и histoneSL было чисто аддитивным. Уровень люциферазы с мРНК с комбинацией поли(А) и histoneSL до величины в 16,6 раз превышал уровень, который мог бы присутствовать, если бы их эффекты были чисто аддитивными. Этот результат подтверждает, что комбинация поли(А) и histoneSL действует, существенно синергически увеличивая экспрессию белка.
11.3. Комбинация поли(А) и histoneSL повышает экспрессию белка с мРНК вне зависимости от их порядка.
Влияние комбинации поли(А) и histoneSL может зависеть от длины последовательности поли(А) и порядка поли(А) и histoneSL. Таким образом, синтезировали мРНК с увеличенной длиной последовательности поли(А) и мРНК с поли(А) и histoneSL в обратном порядке: две мРНК содержали с 3'-конца от 3'-UTR последовательность поли(А) А120 или А300. Одна дополнительная мРНК с 3'-конца от 3'-UTR содержала сначала histoneSL с последующей последовательностью поли(А) А250. Кодирующую люциферазу мРНК или контрольную мРНК посредством липофекции вводили в клетки HeLa. Уровни люциферазы измеряли через 6, 24 и 48 часов после начала трансфекции (см. приведенную ниже таблицу 8 и фигуру 21).
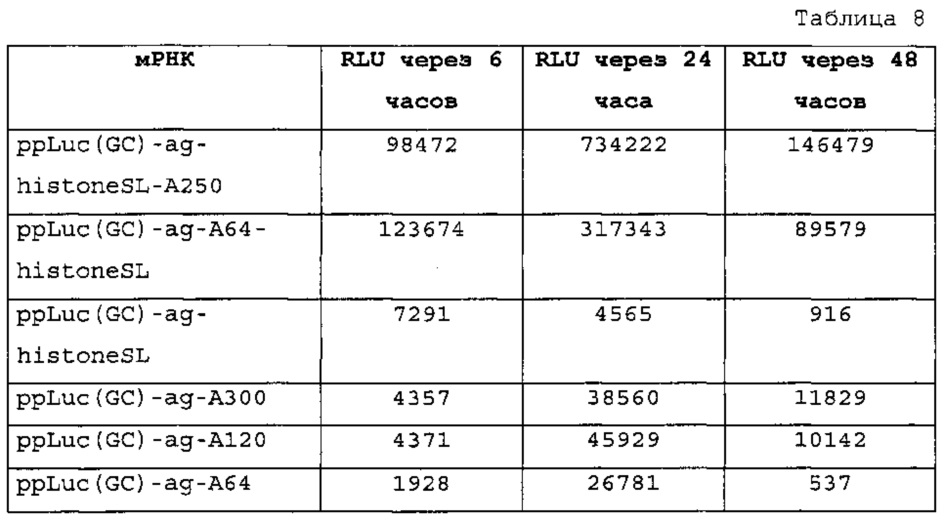
Последовательность поли(А) А64 или histoneSL обеспечивали сравнимые уровни люциферазы. В соответствии с предыдущим экспериментом комбинация А64 и histoneSL сильно увеличивала уровень люциферазы, во много раз выше уровня, наблюдаемого при использовании любого из элементов отдельно. Величина подъема уровня люциферазы при комбинации поли(А) и histoneSL в одной мРНК демонстрируют, что они действуют синергически. Синергию между А64 и histoneSL количественно определяли как и ранее на основе уровней люциферазы мРНК с А64-histoneSL, Аб4 и histoneSL (см. приведенную ниже таблицу 9). Уровень люциферазы, получаемой с мРНК с комбинацией А64 и histoneSL, до величины в 61,7 раз превышал уровень, который мог бы присутствовать, если бы эффекты поли(А) и histoneSL были чисто аддитивными.

В отличие от этого, увеличение длины последовательности поли (А) с А64 до А120 или до А300 только умеренно увеличивало уровень люциферазы (см. таблицу 8 и фигуру 19). мРНК с наибольшей последовательностью поли(А), А300, также сравнивали с мРНК, в которой последовательность поли(А) сходной длины комбинировали с histoneSL, histoneSL-A250. В дополнение к наличию длинной последовательности поли(А) в этой мРНК относительно мРНК с А64-histoneSL изменяли порядок histoneSL и поли(А). Комбинация А250 и histoneSL сильно увеличивала уровень люциферазы, во много раз выше уровня, наблюдаемого или с histoneSL, или с А300. Также, синергию между А250 и histoneSL количественно определяли как ранее, сравнивая RLU, полученные для мРНК с histoneSL-A2 50, с RLU, полученные для мРНК с A300 и мРНК с histoneSL (см. приведенную ниже таблицу 10). Уровень люциферазы с мРНК, комбинирующей А250 и histoneSL до величины в 17,0 раз превышал уровень, мог бы присутствовать, если бы эффекты поли(А) и histoneSL были чисто аддитивными.

Таким образом, высокое синергическое действие комбинации histoneSL и поли(А) на экспрессию белка с мРНК показано для значительно различающихся длин поли(А) и вне зависимости от порядка поли(А) и histoneSL.
11.4. Повышение экспрессии белка посредством комбинации поли(А) и histoneSL является специфичным
Для исследования специфичности влияния комбинации поли(А) и histoneSL на экспрессию белка с мРНК, синтезировали мРНК с альтернативными последовательностями в комбинации с поли(А): эти мРНК с 3'-конца от А64 содержали одну из семи различных последовательностей, соответственно. Кодирующую люциферазу мРНК или контрольную мРНК электропорировали в клетки HeLa. Уровни люциферазы измеряли через 6, 24 и 4 8 часов после трансфекции (см. приведенную ниже таблицу 11 и фигуру 22).
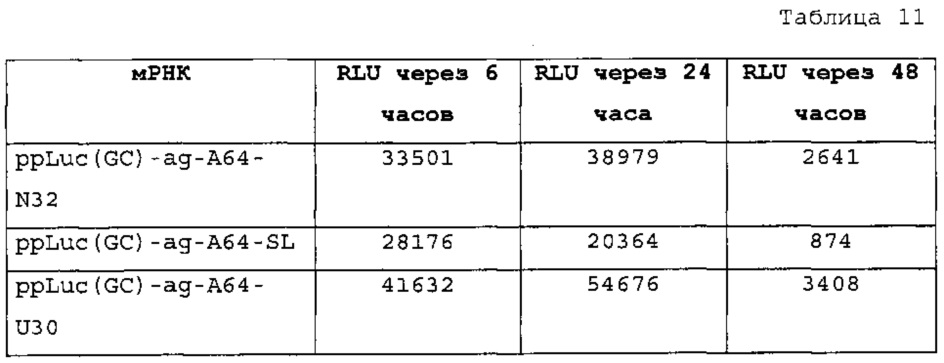

Последовательность поли(А) или histoneSL обеспечивали сравнимые уровни люциферазы. Также, комбинация поли(А) и histoneSL сильно увеличивала уровень люциферазы, во много раз выше уровня, наблюдаемого при использовании любого из элементов отдельно, таким образом, действуя синергически. В отличие от этого, комбинирование поли(А) с любой из альтернативных последовательностей не демонстрировала действия на уровень люциферазы по сравнению с мРНК, содержащей только последовательность поли(А). Таким образом, комбинация поли(А) и histoneSL повышает экспрессию белка с мРНК синергичным образом, и это влияние является специфичным.
11.5. Комбинация поли(А) и histoneSL повышает экспрессию белка с мРНК синергичным образом in vivo.
Для исследования влияния комбинации поли(А) и histoneSL на экспрессию белка с мРНК in vivo, мышам интрадермально инъецировали кодирующую люциферазу мРНК с различными последовательностями с 3'-конца от 3'-UTR альфа-глобина или контрольную мРНК: мРНК с 3'-конца от 3'-UTR содержали последовательность поли(А) А64 или histoneSL в качестве альтернативы друг другу, или и поли(А) А64, и histoneSL. Уровни люциферазы измеряли через 16 часов после инъекция (см. приведенную ниже таблицу 12 и фигуру 23).

Люцифераза экспрессировалась с мРНК с histoneSL или с последовательностью поли(А). Однако удивительно, что комбинация поли(А) и histoneSL дополнительно сильно увеличивала уровень люциферазы, во много раз выше уровня, наблюдаемого при использовании любого из элементов отдельно. Величина повышения уровня люциферазы при комбинировании поли(А) и histoneSL в одной мРНК демонстрирует, что они действуют синергически.
Синергию между поли(А) и histoneSL количественно определяли, деля сигнал от мРНК с поли(A)-histoneSL (+/+) на сумму сигналов от мРНК с histoneSL (-/+) и мРНК с поли (А) (+/-) (см. приведенную ниже таблицу 13).
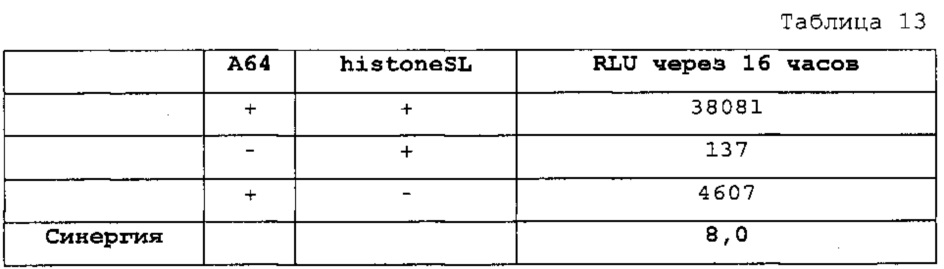
Рассчитанный таким образом показатель указывает на то, насколько уровень люциферазы с мРНК с комбинацией поли(А) и histoneSL превышает уровень, который можно было бы ожидать, если бы влияние поли(А) и histoneSL было чисто аддитивным. Уровень люциферазы с мРНК с комбинацией поли(А) и histoneSL до величины в 8 раз превышал уровень, который мог бы присутствовать, если бы их эффекты были чисто аддитивными. Этот результат подтверждает, что комбинация поли(А) и histoneSL действует, существенно синергически увеличивая экспрессию белка in vivo.
11.6. Комбинация поли(А) и histoneSL увеличивает уровень антител, индуцируемых вакцинацией посредством мРНК.
Для исследования влияния комбинации поли(А) и histoneSL на индукцию антител, индуцируемых вакцинацией посредством мРНК, мышей Balb/c интрадермально вакцинировали кодирующей НА мРНК с различными последовательностями с 3'-конца от мутированной 3'-UTR альфа-глобина. мРНК с 3'-конца от the 3'-UTR содержала последовательность поли(А) А64 или поли(А) А64 и histoneSL. Уровень специфичных к НА антител у вакцинированных и контрольных мышей анализировали посредством ELISA с серийными разведениями сыворотки (см. фигура 24).
IgG1 к НА индуцировала мРНК, содержащая только последовательность поли(А). Однако удивительно, что комбинация поли(А) и histoneSL сильно увеличивала уровень IgG1 к НА, выше уровня, наблюдаемого только с последовательностью поли(А).
Реферат
Группа изобретений относится к области биотехнологии. Предложены нуклеиновая кислота, кодирующая белок, являющийся патогенным антигеном, структуру "стебель-петля" гистонов и последовательность поли(А) или сигнал полиаденилирования, набор и фармацевтическая композиция, содержащие одну или более указанную нуклеиновую кислоту, для лечения инфекционного заболевания, а также способ повышения экспрессии кодируемого белка и применение указанных нуклеиновой кислоты, набора или композиции для повышения экспрессии кодируемого белка. Строение предложенной нуклеиновой кислоты, заключающееся в комбинации элементов последовательности поли(А) или сигнала полиаденилирования совместно со структурой "стебель-петля" гистонов, обеспечивает повышение экспрессии белка значительно выше уровня, наблюдаемого при использовании указанных элементов отдельно. Предложенная группа изобретений может быть использована в медицине при лечении инфекционных заболеваний. 6 н. и 20 з.п. ф-лы, 24 ил., 15 табл., 11 пр.
Формула

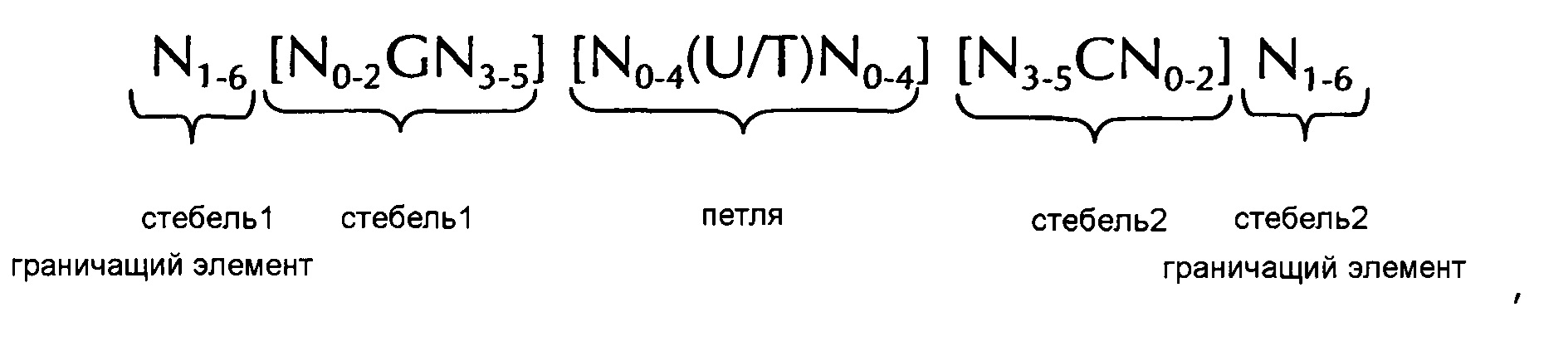


Документы, цитированные в отчёте о поиске
Днк, повышающая продуцирование белка, и ее применение

Комментарии