Самоудерживающиеся шовные материалы, выделяющие лекарственные средства, и относящиеся к ним методы - RU2608237C2
Код документа: RU2608237C2
Чертежи






















Описание
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящая заявка истребует приоритет согласно разделу 35 свода законов США, § 119(e), заявленный в предварительной заявке на патент США № 61/409 731, поданной 3 ноября 2010 года, содержание которой полностью включено в настоящий документ путем ссылки.
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение в целом относится к самоудерживающимся системам для хирургических процедур, а также методам изготовления самоудерживающихся систем для хирургических процедур и методам их применения.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Устройства для закрытия ран, такие как шовные материалы, скобы и заклепки, широко используют при выполнении поверхностных и глубоких хирургических процедур у человека и животных для закрытия ран, восстановления травматических повреждений или дефектов, соединения тканей (сближения разорванных тканей, закрытия анатомических полостей, фиксации одного или множества слоев тканей, наложения анастомоза между двумя полыми/просветными структурами, смыкания ткани, присоединения или повторного соединения тканей в соответствующем месте анатомической локализации), присоединения инородных элементов к тканям (фиксации медицинских имплантатов, устройств, протезов и других функциональных или поддерживающих устройств), а также для репозиции тканей с новой анатомической локализацией (восстановление, элевация ткани, пересадка ткани и сопутствующие процедуры и многие другие примеры).
Часто в качестве устройств для закрытия ран используют шовные материалы. Шовный материал, как правило, состоит из волокнистой лигатуры, присоединенной к игле с острым наконечником. Шовные нити могут быть сделаны из самых разнообразных материалов, в том числе биоабсорбируемых (т.е. биорассасывающихся - полностью разлагаемых в организме с течением времени) или нерассасывающихся (постоянных, неразлагаемых) материалов. Установлено, что рассасывающиеся швы особенно полезны в тех случаях, когда удаление шовного материала может поставить под угрозу восстановление тканей, а также когда поддержка шовного материала после заживления оказывается ненужной, например при неосложненных кожных ранах. Неразлагаемые (нерассасывающиеся) швы используются в ситуациях, когда заживление занимает продолжительное время, а также когда необходима физическая поддержка раны шовным материалом в течение длительного времени (например, восстановление глубоких тканей, раны с высоким натяжением, разнообразные ортопедические методы лечения и некоторые типы хирургических анастомозов). Кроме того, существует большое множество разнообразных хирургических игл. Форма и размер тела иглы, а также конфигурация ее кончика, как правило, выбираются в зависимости от потребностей конкретного применения.
При использовании стандартной нити хирургическую иглу проводят через необходимую ткань с одной стороны раны и затем с другой стороны раны. Затем шовный материал формирует «петлю», завершающуюся узлом на шовном материале для удержания раны в закрытом состоянии. Завязывание узлов отнимает много времени и вызывает ряд осложнений, включая следующие (но не ограничиваясь ими): (i) выпячивания (состояние, когда шовный материал, как правило узел, проталкивается сквозь кожу после закрытия раны), (ii) инфицирование (бактерии способны прикрепляться и размножаться в пространствах, образованных узлом), (iii) накопление массы (значительное количество шовного материала, входящего в узел, остается в ране), (iv) проскальзывание (узлы могут скользить или развязываться), (v) раздражение (узел является инородным телом в ране). Шовные петли, используемые при создании узла, могут привести к ишемии (узлы создают точки сдавления тканей, которые могут ограничивать регионарный кровоток) и повышению риска расхождения краев хирургической раны, а также ее разрыва. Завязывание узлов является достаточно трудоемким процессом. Оно может отнимать значительную часть времени, которое тратится на закрытие хирургической раны. Дополнительное операционное время не только опасно для пациента (возрастает вероятность осложнений по мере увеличения времени, проведенного под анестезией), но также увеличивает общую стоимость операции (средняя стоимость многих хирургических процедур составляет от 15 до 30 $ за минуту операционного времени).
Самоудерживающийся шовный материал (включая шовный материал с зазубринами) отличается от стандартного шовного материала тем, что самоудерживающийся шовный материал имеет многочисленные фиксаторы (такие как зазубрины), фиксирующие самоудерживающийся шовный материал в ткани после наложения шва и препятствующие движению шовного материала в направлении, противоположном направлению, в котором обращены фиксаторы, устраняя тем самым необходимость создания узлов для скрепления соседних тканей (закрытие без «узлов»). Устройства для соединения тканей без узлов, имеющие зазубрины, были описаны ранее, например в патенте США № 5374268, описывающем элементы крепления с рычагами, выступающие по типу зазубрин, в то время как шовный хирургический материал, имеющий боковые элементы в виде зазубрин, описан в патентах США № 5584859 и 6264675. Шовные материалы, имеющие множество зазубрин, расположенных вдоль большей части шовного материала, описаны в патенте США № 5931855, раскрывающем однонаправленный шовный материал с зазубринами, и в патенте США № 6241747, описывающем двунаправленный шовный материал с зазубринами. Способы и устройство для формирования зазубрин на шовных материалах описаны, например, в патенте США № 6848152. Самоудерживающиеся системы для закрытия ран обеспечивают лучшее приближение краев раны за счет равномерного распределения напряжения по всей ее длине (сокращаются области напряжения, которые могут привести к разрыву раны или ишемии). Такие системы снижают накопление шовного материала в ране (за счет устранения узлов) и способствуют меньшему выбуханию, т.е. экструзии шовного материала, как правило из узлов, сквозь поверхность кожи. Предполагается, что все данные свойства способствуют сокращению рубцевания, улучшению эстетического вида и повышению стабильности раны по сравнению с закрытием ран при помощи гладких шовных материалов или скоб. Таким образом, самоудерживающиеся шовные материалы избавляют хирурга от завязывания узлов, улучшают клинический исход для пациента, а также экономят время и расходы, связанные с расширением хирургического вмешательства и последующих процедур. Необходимо отметить, что все патенты, патентные заявки и публикации патентов, упоминаемые в настоящем документе, полностью включены в настоящий документ путем ссылки.
Способность самоудерживающихся шовных материалов закреплять и удерживать ткани на месте даже при отсутствии натяжения, оказываемого на шовные материалы узлом, также представляет собой свойство, обеспечивающее им превосходство над гладкими шовными материалами. При закрытии раны под натяжением данное преимущество выражается в следующем: (i) самоудерживающиеся нити имеют множество фиксаторов, способных равномерно распределять натяжение по всей длине нити (путем создания сотен точек «фиксации», что позволяет получить лучший косметический результат и снижает риск «проскальзывания» или прохождения нити наружу) в противоположность нитям, используемым для наложения узловых швов, при использовании которых натяжение концентрируется в отдельных точках; (ii) возможность равномерного закрытия ран со сложной геометрией (круглые, дугообразные, раны с зубчатыми краями) с большей точностью и аккуратностью, чем при наложении узлового шва; (iii) самоудерживающиеся шовные материалы устраняют необходимость в «третьей руке», которая часто возникает, когда требуется поддерживать напряжение по всей длине раны во время наложения швов или завязывания узла (для предотвращения «соскальзывания» нити при снятии напряжения); (iv) самоудерживающиеся шовные материалы обнаруживают максимальные преимущества при проведении процедур, в которых завязывание узлов представляется технически сложным (например, при закрывании глубоких ран или при лапароскопических/эндоскопических процедурах); (v) самоудерживающиеся шовные материалы можно использовать для сближения краев и удержания раны перед окончательным закрытием. В результате самоудерживающиеся нити оказываются более простыми при использовании в ограниченных и глубоких анатомических структурах (таких как почечная лоханка, брюшная полость и грудная клетка), а также облегчают сближение тканей в ходе лапароскопических (эндоскопических) и малоинвазивных процедур; при этом нет необходимости фиксировать закрытие раны при помощи узла. Повышенная точность позволяет использовать самоудерживающиеся шовные материалы для более сложных закрытий (таких как раны с расходящимся диаметром, более крупные дефекты или раны, требующие наложения кисетного шва), что невозможно выполнить с использованием гладких шовных материалов.
Самоудерживающийся шовный материал может быть однонаправленным, при котором один или более фиксаторов ориентированы в одном направлении вдоль длины лигатуры, или двунаправленным, при котором, как правило, один или несколько фиксаторов ориентированы в одном направлении вдоль части лигатуры, а еще один или несколько фиксаторов ориентированы в другом (часто противоположном) направлении вдоль другой части лигатуры (это описано для фиксаторов с зазубринами в патентах США № 5931855 и 6241747). Хотя существует множество непрерывных или прерывистых конфигураций фиксаторов, стандартная форма двунаправленной самоудерживающейся нити включает в себя иглу на одном конце лигатуры с зазубринами, кончики которых выходят в направлении от иглы вплоть до переходной точки (часто середины) нити; в переходной точке конфигурация зазубрин меняется в противоположном направлении приблизительно на 180° и сохраняется таковой на протяжении всей оставшейся длины шовной лигатуры до присоединения второй иглы на противоположном конце (в результате кончики зазубрин на любой части шовного материала оказываются направлены в сторону от ближайшей иглы). Это означает, что кончик зазубрины находится дальше от иглы и часть шовного материала с этой зазубриной более легко проходит через ткань в направлении движения иглы (по сравнению с противоположным направлением). Другими словами, зазубрины на обеих «половинах» обычной двунаправленной самоудерживающейся нити имеют кончики, которые направлены к середине, между ними расположен переходный сегмент (в котором зазубрины отсутствуют), а к одному из концов нити прикреплена игла.
Во время хирургических процедур важным преимуществом является возможность доставки к операционному полю лекарственного препарата. Для эффективного заживления раны требуется, чтобы препарат доставлялся в нужное место в надлежащей концентрации. Таким образом, возможность доставки лекарственных препаратов с применением шовного материала во время хирургической процедуры представляется значительным преимуществом.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Несмотря на множество положительных качеств однонаправленных и двунаправленных самоудерживающихся шовных материалов, остается необходимость улучшения их конструкции для обеспечения дополнительных терапевтических преимуществ.
Желательно, чтобы усовершенствованные самоудерживающиеся шовные материалы имели возможность закрепления в окружающей ткани, имели хорошую способность к удерживанию и дополнительные терапевтические преимущества.
В соответствии с вышеизложенными общими сведениями и ограничениями предшествующего уровня техники настоящее изобретение представляет усовершенствованный самоудерживающийся шовный материал, способный закрепляться в окружающей ткани, имеющий хорошую удерживающую способность, улучшенную клиническую эффективность и дополнительные терапевтические преимущества, а также методы изготовления и использования таких самоудерживающихся шовных материалов.
В соответствии с одним аспектом настоящего изобретения самоудерживающийся шовный материал сконструирован так, что после его размещения он обеспечивает эффективное распределение напряжения или сопротивление напряжению, а также доставку лекарственных препаратов в ткань.
В другом аспекте настоящего изобретения корпус самоудерживающегося шовного материала пропитывается лекарственным препаратом до формирования фиксаторов.
В другом аспекте настоящего изобретения лекарственный препарат изотропным или анизотропным образом распределяется по длине самоудерживающегося шовного материала.
В другом аспекте настоящего изобретения лекарственный препарат изотропным или анизотропным образом распределяется по радиусу самоудерживающегося шовного материала.
В другом аспекте настоящего изобретения шовный материал снабжается одним или более фиксаторами ткани, которые влияют на кинетику высвобождения лекарственного препарата в шовном материале.
В другом аспекте настоящего изобретения шовный материал может включать один или более фиксаторов ткани, имеющих неровную или шероховатую поверхность, которая влияет на кинетику высвобождения лекарственного препарата, связанного с шовным материалом.
В другом аспекте настоящего изобретения шовный материал снабжается одним или более фиксаторами ткани, которые влияют на место высвобождения лекарственного препарата, связанного с шовным материалом.
В другом аспекте настоящего изобретения шовный материал снабжается одним или более фиксаторами ткани, которые анизотропным образом влияют на место высвобождения лекарственного препарата, связанного с шовным материалом.
В другом аспекте настоящего изобретения самоудерживающийся шовный материал включает участок без фиксаторов ткани, который удален от обоих концов лигатуры и влияет на высвобождение лекарственного препарата, связанного с шовным материалом.
В другом аспекте настоящего изобретения самоудерживающийся шовный материал включает удлиненный участок, удаленный от обоих концов лигатуры, который влияет на высвобождение лекарственного препарата, связанного с шовным материалом.
В другом аспекте настоящего изобретения шовный материал с фиксаторами включает нейротрофический ростовой фактор (НРФ) - лекарственный препарат, используемый для восстановления нервов.
В другом аспекте настоящего изобретения метод использования включает шовный материал с НРФ (лекарственный препарат, способствующий восстановлению нервов).
Один или более вариантов осуществления подробно описаны ниже. Другие свойства, цели и преимущества будут понятны из описания, чертежей и формулы изобретения. Кроме того, содержание всех упоминаемых в настоящем документе патентов и заявок на патент полностью включено в настоящий документ путем ссылки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Свойства настоящего изобретения, его сущность и многочисленные преимущества станут понятны благодаря сопроводительным чертежам и приведенному ниже подробному описанию различных вариантов осуществления.
На фиг. 1A и 1B показан вид в перспективе самоудерживающегося шовного материала, включающего лекарственный препарат, в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 1C и 1D показан альтернативный вид в разрезе волокон шовного материала из фиг. 1A и 1B, а также параметры распределения лекарственного препарата.
На фиг. 1E и 1F приведены увеличенные поперечные срезы лигатуры самоудерживающейся шовной системы, изображенные на фиг. 1А и 1В (показаны параметры фиксаторов и их распределение на лигатуре).
На фиг. 2A, 2B и 2C представлены поперечные среды, которые иллюстрируют этапы создания фиксатора на самоудерживающемся шовном материале, включающем лекарственный препарат, согласно варианту осуществления настоящего изобретения.
На фиг. 2D представлен поперечный срез, который иллюстрирует альтернативный этап создания фиксатора на самоудерживающемся шовном материале, включающем лекарственный препарат, согласно варианту осуществления настоящего изобретения.
На фиг. 3А показан способ и устройство для совместной экструзии нескольких материалов для формирования композитного волокна, подходящего для создания самоудерживающегося шовного материала, содержащего лекарственный препарат, в соответствии с вариантом осуществления настоящего изобретения.
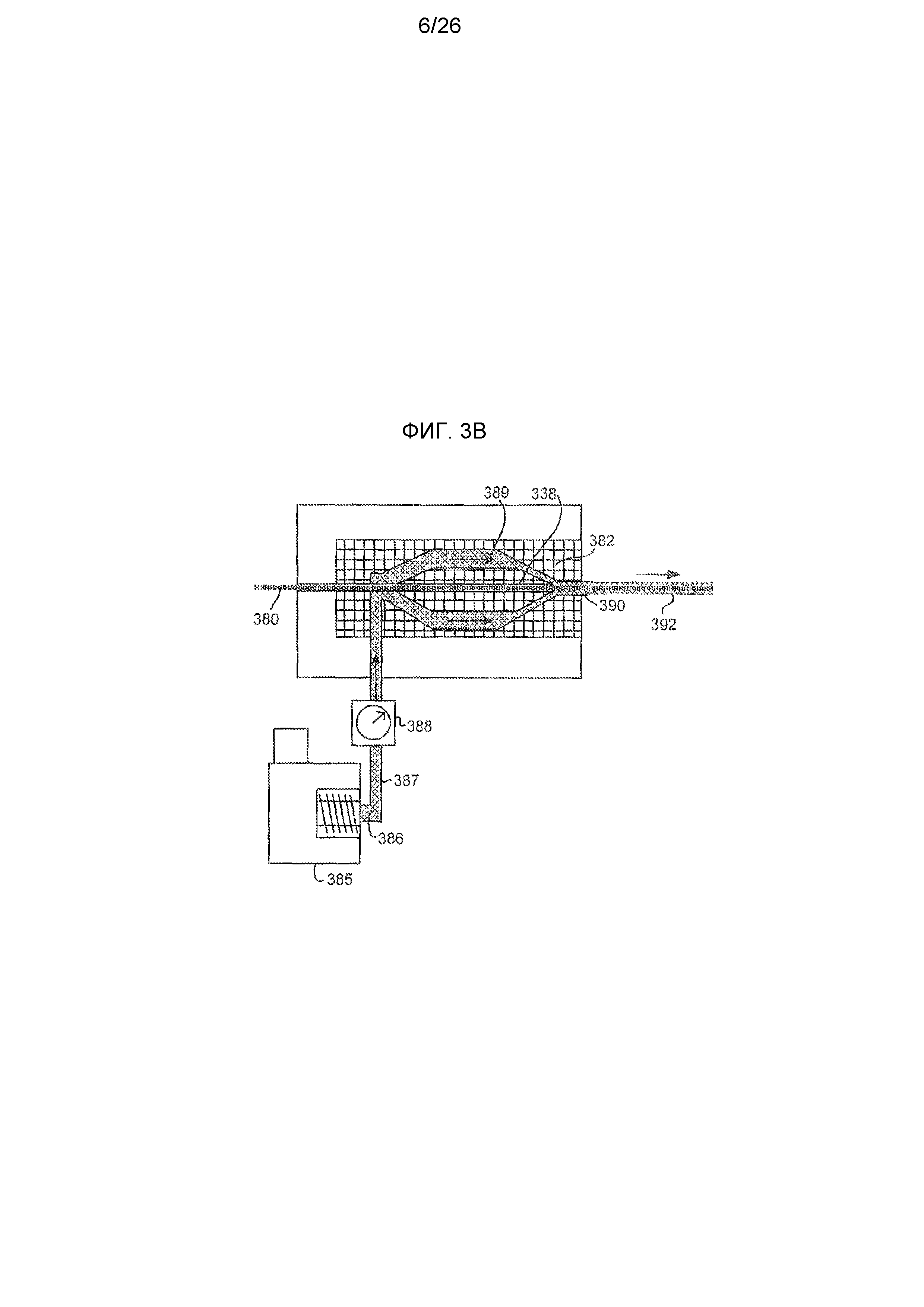
На фиг. 3В показан способ и устройство для экструзии материала на предварительно подготовленное волокно в целях создания композитного волокна самоудерживающегося шовного материала, содержащего лекарственный препарат, в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 3C показаны альтернативный способ и устройство для нанесения материала на предварительно подготовленное волокно для создания композитного волокна самоудерживающегося шовного материала, содержащего лекарственный препарат, в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 3D-3F показаны альтернативные конфигурации самоудерживающихся волокон и структур, подходящих для создания самоудерживающихся шовных материалов, содержащих лекарственный препарат, в соответствии с вариантами осуществления настоящего изобретения.
На фиг. 4А-4Е показаны альтернативные конфигурации совместно экструдированного запаса шовного материала, пригодного для создания самоудерживающегося шовного материала, содержащего лекарственный препарат, в соответствии с вариантами осуществления настоящего изобретения.
На фиг. 4F-4I показаны альтернативные геометрические варианты совместно экструдированного запаса шовного материала, пригодного для создания самоудерживающегося шовного материала, содержащего лекарственный препарат, в соответствии с вариантами осуществления настоящего изобретения.
На фиг. 5А-5С показаны некоторые варианты осуществления фиксаторов, используемых в самоудерживающемся шовном материале, содержащем лекарственный препарат, в соответствии с вариантами осуществления настоящего изобретения.
На фиг. 5D показана конфигурация сапфирового лезвия для вырезания фиксаторов, приведенных на фиг. 5А-5С, в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 5E показана альтернативная конфигурация сапфирового лезвия для вырезания фиксаторов самоудерживающегося шовного материала в соответствии с вариантами осуществления настоящего изобретения.
На фиг. 5F показан изогнутая конфигурация сапфирового лезвия для вырезания фиксаторов на самоудерживающемся шовном материале в соответствии с вариантами осуществления настоящего изобретения.
На фиг. 5G показана круговая конфигурация лезвия для вырезания фиксаторов на самоудерживающемся шовном материале в соответствии с вариантами осуществления настоящего изобретения.
На фиг. 6A показано распределение фиксаторов в виде одиночной спирали на самоудерживающемся шовном материале, выделяющем лекарственный препарат, в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 6B показано распределение фиксаторов в виде двойной спирали на самоудерживающемся шовном материале, выделяющем лекарственный препарат, в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 6C показано распределение фиксаторов в виде четверной спирали высокой плотности на самоудерживающемся шовном материале, выделяющем лекарственный препарат, в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 6D-6F показаны альтернативные формы фиксаторов на самоудерживающемся шовном материале, выделяющем лекарственный препарат, согласно различным вариантам осуществления изобретения.
На фиг. 6G приведены размеры шовного материала, реализованные в различных вариантах осуществления настоящего изобретения.
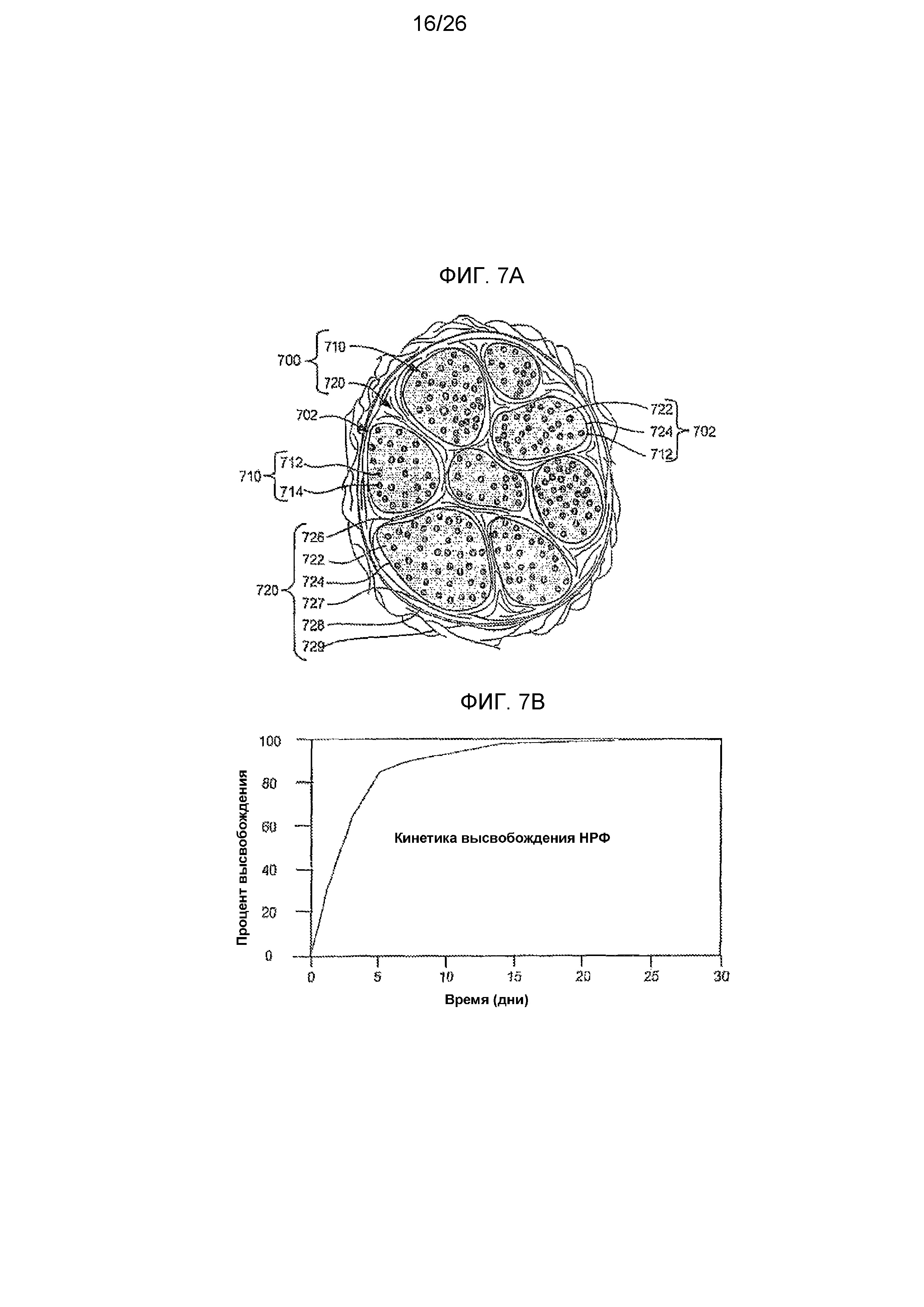
На фиг. 7A в справочных целях показан поперечный срез нерва.
На фиг. 7B приведена кинетика высвобождения НРФ из самоудерживающегося шовного материала, выделяющего лекарственный препарат, согласно одному из вариантов осуществления настоящего изобретения.
На фиг. 7C-7I показана процедура восстановления нерва с использованием выделяющего лекарственный препарат самоудерживающегося шовного материала в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 8A и 8B показан способ восстановления дефекта нерва с помощью выделяющих лекарственный препарат самоудерживающихся шовных материалов.
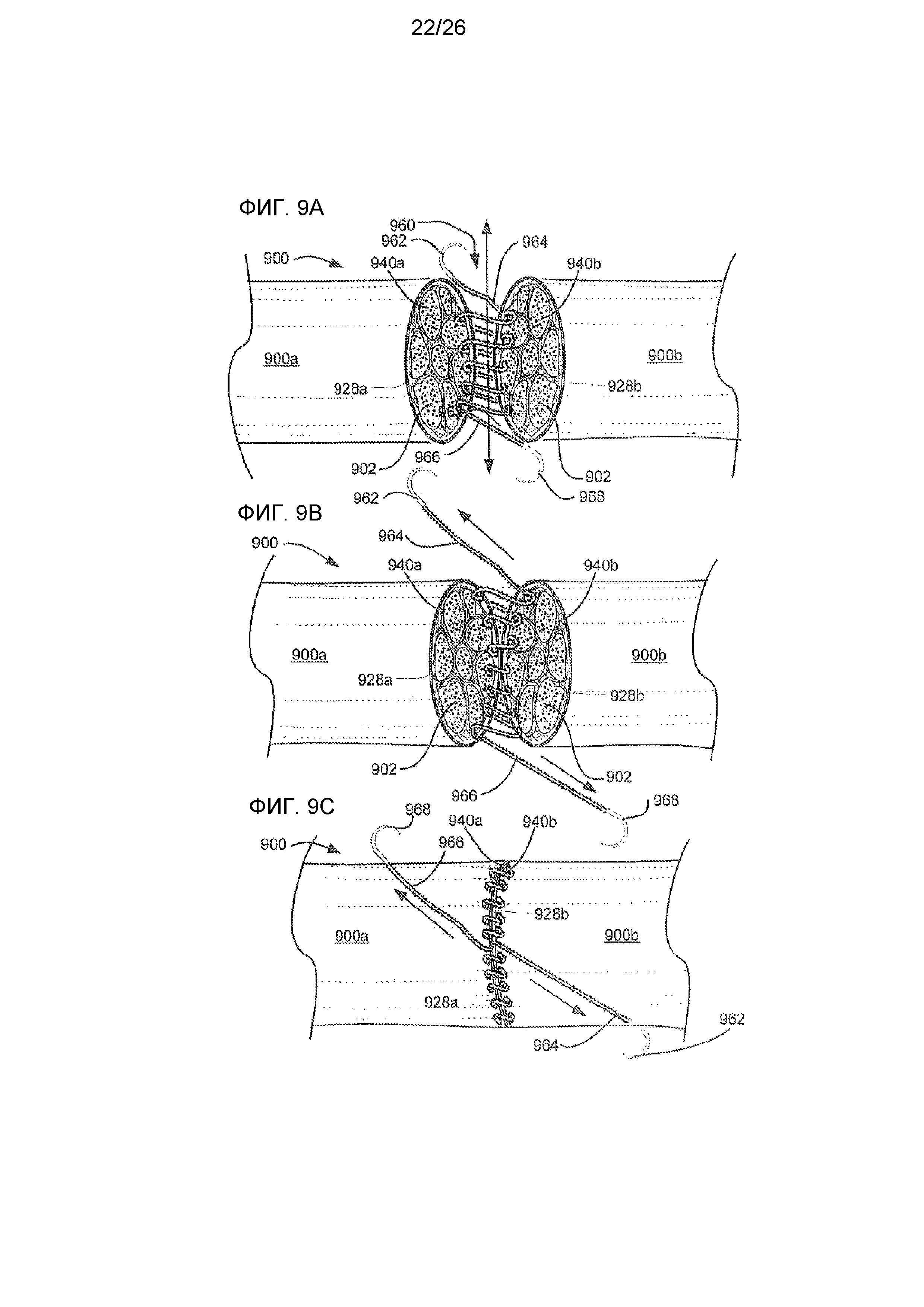
На фиг. 9A, 9B и 9C показан альтернативный метод повторного присоединения рассеченного нерва с использованием одного или более самоудерживающихся шовных материалов, выделяющих лекарственный препарат.
На фиг. 10A и 10B показана динамика развития клеточной культуры PC12 при воздействии шовного материала с НРФ и шовного материала без НРФ.
На фиг. 11A-11D показана динамика развития клеточной культуры PC12 при воздействии шовного материала с НРФ и шовных материалов с различными количествами НРФ (окраска фаллоидином зеленым).
На фиг. 12A-12C показана реакция клеточной культуры PC12 (фазоконтрастный анализ) на шовный материал без НРФ, а также на шовные материалы с НРФ длиной 5 и 10 см соответственно.
На фиг. 13 представлена диаграмма дозозависимого ответа клеточных культур PC12 на шовный материал с НРФ различной длины.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
Ниже представлены определения отдельных терминов, которые могут быть использованы в настоящем документе.
Термин «готовый к использованию шовный материал» относится к шовному материалу, имеющему хирургическую иглу по меньшей мере на одном конце для наложения шва.
Термин «двунаправленный шовный материал» относится к самоудерживающемуся шовному материалу, имеющему фиксаторы, на одном конце ориентированные в одном направлении, а на другом конце ориентированные в другом направлении. Двунаправленная нить, как правило, имеет иглу на каждом конце лигатуры. Большинство двунаправленных нитей имеют переходный участок, расположенный между участками с зазубринами, ориентированными в разных направлениях.
«Оплетенный шовный материал» относится к шовному материалу, содержащему поливолоконную лигатуру. Волокна в таких лигатурах, как правило, сплетены, скручены или сотканы вместе.
Термин «рассасывающийся шовный материал» (также обозначаемый как «биологически рассасывающийся шовный материал» или «абсорбируемый шовный материал») относится к шовному материалу, который разлагается или абсорбируется организмом после введения в ткань. Как правило, процесс распада является по меньшей мере частично опосредованным или протекает в рамках биологической системы. Термин «распад» используется для обозначения процесса разрыва цепи, в ходе которого полимерная цепь распадается на олигомеры и мономеры. Разрыв цепи можно реализовать посредством различных механизмов, включая, например, химическую реакцию (например, гидролиз, окислительно-восстановительные, ферментативные реакции или их комбинацию) или термические или фотолитические процессы. Распад полимера можно зарегистрировать, например, с помощью гель-проникающей хроматографии (ГПХ) - этим методом можно обнаружить изменения молекулярной массы полимера во время эрозии и разложения. Рассасывающийся шовный материал может включать полимеры, такие как полидиоксанон (PDO), полигликолевая кислота, сополимеры лактида и гликолида, сополимеры триметиленкарбоната и гликолида с диэтиленгликолем (например, MAXON™, Tyco Healthcare Group), тройной сополимер гликолида, триметиленкарбоната и диоксанона (например, BIOSYNTM [гликолид (60%), триметиленкарбонат (26%), диоксанон (14%)], Tyco Healthcare Group), а также сополимеры гликолида, капролактона, триметиленкарбоната и лактида (например, CAPROSYNTM, Tyco Healthcare Group). Растворяемый шовный материал также может включать в себя частично деацетилированный поливиниловый спирт. Полимеры, допустимые для использования в составе рассасывающихся шовных материалов, могут представлять собой линейные полимеры, разветвленные полимеры или мультиаксиальные полимеры. Примеры использования мультаксиальных полимеров в лигатурах описаны в заявках на публикацию патентов США № 20020161168, 20040024169 и 20040116620. Шовные материалы, выполненные из рассасывающегося шовного материала, теряют свою прочность по мере разложения материала. Рассасывающиеся шовные материалы могут быть как оплетенными моноволоконными (монофиламентными), так и поливолоконными (полифиламентными).
Лекарственный препарат - это химическое вещество, способное проникнуть в организм и изменить его физиологию. Предпочтительно под лекарственным препаратом понимается вещество, предназначенное для лечения или профилактики заболеваний. Понятие «лекарственный препарат» включает проактивные, активированные, метаболизированные и неметаболизированные средства. Лекарственные препараты включают, например, синтетические и природные токсины, биологически активные вещества, а также известные фармацевтические средства, в том числе средства, приведенные в справочнике «2010 Physicians' Desk Reference®» (PDR® 2009), который включен в настоящий документ посредством ссылки. Понятие «лекарственный препарат» также охватывает фармацевтические средства, которые имеют указанные свойства, но обнаружены или вышли на рынок после даты подачи настоящей заявки.
Под термином «шовный материал, выделяющий лекарственный препарат» понимается шовный материал, который связан с лекарственным препаратом во время имплантации в ткань пациента, а также шовный материал, который выделяет лекарственный препарат в ткани пациента после имплантации. Связывание лекарственного препарата с шовным материалом может быть выполнено различными способами. Шовный материал может быть пропитан лекарственным препаратом до, после или во время создания волокна. Лекарственный препарат может быть нанесен на волокна до или после формирования в самоудерживающемся шовном материале фиксаторов. Препарат внедряется следующими способами (примеры): (а) непосредственное нанесение на шовный материал лекарственного препарата (например, путем распыления полимерной/лекарственной пленки или путем погружения шовного материала в полимерный/лекарственный раствор); (б) нанесение покрытия или пропитка шовного материала специальным веществом (таким как гидрогель), которое будет поглощать лекарственный препарат или уже содержит его на этапе покрытия или пропитки шовного материала; (в) вплетение лигатуры с лекарственным покрытием (или самого полимера, сформированного в виде лигатуре) в структуру шовного материала (в случае многоволоконных шовных материалов); (г) изготовление шовного материала из материалов, содержащих лекарственный препарат (материал изготовления может сам относиться к лекарственным препаратам).
Термины «медицинское устройство» или «имплантат» относятся к любому предмету, помещенному в организм для восстановления физиологической функции, уменьшения (устранения) симптомов, связанных с заболеванием и (или) восстановления и (или) замены поврежденных или пораженных органов и тканей. Медицинские устройства могут быть экзогенными, то есть быть изготовленными из биологически совместимых синтетических материалов (например, медицинской нержавеющей стали, титана и других металлов, полимеров, таких как полиуретан, кремний, PLA, PLGA, PDO, а также других материалов). Некоторые медицинские устройства и имплантаты включают материалы, полученные от животных (например, ксенотрансплантаты, т.е. целые органы животных; животные ткани, такие как клапаны сердца; молекулы природного происхождения или химически модифицированные молекулы, такие как коллаген, гиалуроновая кислота, белки, карбогидраты и т.п.), материалы от человеческих доноров (например, «аллотрансплантаты», такие как целые органы; ткани, такие как костные трансплантаты, кожные трансплантаты и т.п.) или собственные трансплантаты пациента (например, «аутотрансплантаты», такие как сафенные венозные трансплантаты, кожные трансплантаты, трансплантаты сухожилий, связок, мышц). Медицинские устройства, которые можно использовать при выполнении процедур, связанных с настоящим изобретением, без ограничений включают в себя ортопедические имплантаты (искусственные суставы, связки и сухожилия; болты, пластины и другие вживляемые конструкции), зубные имплантаты, внутрисосудистые имплантаты (артериальные и венозные обходные сосудистые шунты, имплантаты, обеспечивающие доступ для гемодиализа; как аутологические, так и синтетические), кожные трансплантаты (аутологические, синтетические), трубки, дренажи, имплантируемые агенты-наполнители, насосы, шунты, уплотнители, хирургические сетки (например, сетки, применяемые для герниопластики, каркасы для ткани), средства лечения фистулы, позвоночные имплантаты (например, искусственные межпозвоночные диски, устройства для артродеза позвонков и т.п.) и т.п.
«Монофиламентный шовный материал» относится к шовному материалу, содержащему монофиламентную лигатуру.
Термин «прикрепление иглы» относится к прикреплению иглы к шовному материалу, необходимой для наложения шва на ткань, и может включать в себя такие способы, как обжатие, горячая штамповка, использование клеевых соединений и т.п. Лигатуру прикрепляют к хирургической игле такими способами, как обжатие, горячая штамповка, использование клеевых соединений. Способы прикрепления лигатур к хирургическим иглам описаны в патентах США № 3981307, 5084063, 5102418, 5123911, 5500991, 5722991, 6012216 и 6163948, а также в заявке на публикацию патента США № US 20040088003. Место прикрепления шовного материала к игле называется штампом.
«Диаметр иглы» относится к диаметру иглы для наложения шва в самой широкой части данной иглы. Хотя термин «диаметр» часто ассоциируется с периметром круга, следует понимать, что в рамках настоящего документа данный термин используется для обозначения размера поперечного сечения, относящегося к периметру любой формы.
Термин «нерассасывающаяся нить» (также обозначаемый как «неабсорбирующая нить») относится к нити, содержащей материал, не подверженный разложению путем разрыва цепи, например в ходе химической реакции (например, гидролиз, окислительно-восстановительные, ферментативные реакции или их комбинация) или в ходе термического или фотолитического процесса. Нерассасывающийся шовный материал включает полиамид (также известный как нейлон, например нейлон 6 и нейлон 6,6), полиэстер (например, полиэтилентерефталат), политетрафторэтилен (например, вспененный политетрафторэтилен), полиэфир (полиэстер), такой как полибутэстер (блоковый сополимер бутилентерефталата и метиленового эфира политетрафторэтиленгликоля), полиуретан, сплавы металлов, металлы (например, проволока из нержавеющей стали), полипропилен, полиэтилен, шелк и хлопок. Шовные материалы, изготовленные из нерассасывающегося шовного материала, пригодны для использования в тех случаях, когда шовный материал должен постоянно оставаться на месте или подразумевает физическое удаление из организма.
Термин «конфигурации фиксаторов» относится к конфигурациям фиксаторов ткани и может включать в себя такие свойства, как размер, форма, гибкость, характеристики поверхности и т.п. Иногда данные конфигурации также обозначаются в тексте как «конфигурации зазубрин».
Термин «самоудерживающийся шовный материал» (нить) относится к нити, в которой на шовном волокне имеются структурные элементы для зацепления ткани без помощи узла или шовного фиксатора.
Термин «самоудерживающаяся система» относится к самоудерживающейся нити вместе с устройствами для наложения шва на ткань. Такие устройства для наложения швов включают в себя без ограничений хирургические иглы и другие устройства для наложения швов, в том числе достаточно жесткие и острые концы нити, позволяющие прокалывать ткань.
Термин «конец нити для введения в ткань» относится к концу нити, вводимому в ткань при наложении шва; один или оба конца шовного материала могут являться концами шовного материала для наложения шва. Конец шовного материала для наложения шва можно соединить с устройством для наложения шва, таким как хирургическая игла, или он может быть достаточно острым и жестким для пенетрации ткани без использования дополнительных устройств.
Термин «диаметр шовного материала» относится к диаметру тела шовного материала. Следует понимать, что в составе шовных материалов, описанных в настоящем документе, допускается использование нитей различной длины, и, хотя термин «диаметр» часто ассоциируется с периметром круга, следует понимать, что в рамках настоящего документа данный термин используется для обозначения размера в сечении, относящегося к периметру любой формы. Размер шовного материала определяется исходя из величины диаметра. Размеры нити согласно Фармакопее Соединенных Штатов Америки («USP») обозначаются от 0 до 7 в крупном диапазоне и от 1-0 до 11-0 в малом диапазоне; в малом диапазоне чем больше значение, предшествующее отделенному дефисом нулю, тем меньше диаметр нити. Фактический диаметр шовного материала зависит от материала нити, например хирургическая нить размером 5-0, изготовленная из коллагена, будет иметь диаметр 0,15 мм, тогда как каждая из хирургических нитей, имеющих такой же размер согласно USP, но изготовленных из синтетического абсорбируемого материала или неабсорбируемого материала, будет иметь диаметр 0,1 мм. Выбор размера нити для конкретной цели зависит от таких факторов, как природа сшиваемой ткани и важность косметических соображений; хотя в условиях труднодоступного хирургического поля легче использовать шовные материалы малого диаметра, которые помимо прочего сокращают рубцевание, сила натяжения шовного материала, изготовленного из указанного материала, с уменьшением размера также уменьшается. Следует понимать, что описанные в настоящем документе нити и способы производства нитей охватывают различные диаметры, включая без ограничений следующие: 7, 6, 5, 4, 3, 2, 1, 0, 1-0, 2-0, 3-0, 4-0, 5-0, 6-0, 7-0, 8-0, 9-0, 10-0 и 11-0.
Термин «хирургическая игла» относится к иглам, используемым для наложения швов на ткань, которые могут иметь различную форму, внешний вид и композиции. Существует два основных вида игл: травматические иглы и атравматические иглы. Травматические иглы имеют каналы или просверленные концы (т.е. отверстие или ушко) и поставляются отдельно от лигатуры, а игла вдевается на месте. У атравматических игл нет ушка, их прикрепляют к шовному материалу на фабрике путем горячей штамповки или другими способами, при этом шовный материал вставляют в канал на тупом конце иглы, которому потом придают конечную форму, позволяющую удерживать шовный материал и иглу вместе. Таким образом, на месте не требуется дополнительного времени для вдевания нити в атравматическую иглу, и конец шовного материала в месте прикрепления к игле в целом меньше тела иглы. В травматической игле нить выходит с обеих сторон ушка иглы, и часто нить в определенной степени разрывает ткани при наложении шва. Самые современные шовные материалы приштампованы к атравматическим иглам. Атравматические иглы могут быть приштампованы к шовному материалу на постоянной основе или могут быть разработаны с возможностью удаления от шовного материала посредством резкого сильного рывка. Данные «отрывания» часто используют для узловых швов, когда каждый раз делают один стежок, а затем завязывают нить. Для зазубренных шовных материалов, которые не прерываются, предпочтительными являются атравматические иглы. Хирургические иглы также можно классифицировать в соответствии с геометрией наконечника или острия иглы. Например, иглы могут быть: (i) «коническими», когда тело иглы имеет круглую форму, плавно сходящую на конус к острию; (ii) «режущими», когда тело иглы имеет треугольную форму и заостренный режущий край на внутренней стороне; (iii) «обратно режущими», когда режущий край находится на внешней стороне; (iv) «троакарными» или «конусными режущими», когда тело иглы имеет круглую форму и сходит на конус, но концы имеют маленькое режущее острие треугольной формы; (v) «притупленными» для зашивания тканей, имеющих рыхлую структуру; (vi) иглами «с боковым режущим краем» или «иглами-шпателями», когда игла имеет плоскую форму сверху и снизу с режущим краем вдоль передней части к одной стороне (данные иглы, как правило, используют в хирургии глаза). Хирургические иглы также могут иметь различную форму, включая (i) прямую, (ii) полуизогнутую или лыжеобразную, (iii) 1/4 круга, (iv) 3/8 круга, (v) 1/2 круга, (vi) 5/8 круга и (v) со сложной кривизной. Шовные нити описаны, например, в патентах США № 6322581 и 6214030 (Mani, Inc., Япония), и 5464422 (W.L. Gore, Newark, DE, США), и 5941899, 5425746, 5306288 и 5156615 (US Surgical Corp., Norwalk, CT, США), и 5312422 (Linvatec Corp., Largo, FL, США), и 7063716 (Tyco Healthcare, North Haven, CT, США). Другие хирургические иглы описаны, например, в патентах США № 6129741, 5897572, 5676675 и 5693072. Шовные материалы, описанные в настоящем документе, можно использовать вместе с различными типами игл (включая без ограничений изогнутые, прямые, длинные, короткие, микроиглы и т.п.), режущими поверхностями игл (включая без ограничений режущие, конические и т.п.) и техниками прикрепления иглы (включая без ограничений просверленный конец, обжатие и т.п.). Более того, шовные материалы, описанные в настоящем документе, могут включать в себя достаточно жесткие и острые концы и не требуют иглы для наложения шва.
Термин «лигатура» относится к волокнистому телу нити. Шовная лигатура может состоять из одного волокна или множества волокон (например, в случае плетеного шовного материала). Лигатуру можно изготовить из любого допустимого биосовместимого материала и можно дополнительно обработать любым допустимым биосовместимым материалом как для повышения прочности нити, эластичности, долговечности или других качественных характеристик, так и для придания нити дополнительных функций помимо функций соединения тканей, перерасположения тканей или прикрепления к тканям инородных элементов.
Термин «процедура элевации (поднятия) ткани» относится к хирургической процедуре перерасположения ткани с нижних участков на более высокие участки (например, перемещение ткани в направлении, противоположном направлению силы тяжести). Поддерживающие связки лица поддерживают мягкие ткани лица в нормальном анатомическом положении. Однако с возрастом гравитационное воздействие и потеря объема ткани вызывают миграцию ткани вниз, и жировые отложения спускаются в пространство между поверхностной и глубокой оболочкой лица, вызывая таким образом провисание ткани лица. Процедуры подтягивания кожи лица служат для поднятия данных обвисших тканей и представляют собой один из примеров более общего класса медицинских процедур, известных как процедура элевации ткани. По существу, процедура элевации ткани обращает изменения внешности, возникающие со временем в результате старения или действия силы тяжести, и другие временные явления, вызывающие обвисание ткани, такие как генетические факторы. Следует отметить, что ткань также может быть репозиционирована без подъема; при выполнении некоторых процедур ткани могут быть репозиционированы латерально (в направлении от средней линии), медиально (в направлении к средней линии) или вниз (в нижнем направлении) для восстановления симметрии (т.е. репозиционированы таким образом, чтобы левая и правая стороны тела «соответствовали друг другу»).
Термин «фиксатор ткани» (или просто «фиксатор») относится к рельефному образованию волокна шовного материала, который способен механически захватывать ткань и сопротивляться движению шовного материала по меньшей мере в одном аксиальном направлении. Только в качестве примера: фиксатор ткани или фиксаторы могут включать в себя крючки, зубцы, зазубрины, острие, выступы, утолщения, элементы крепления, бугорки, шпоры, гофры, заостренные наконечники, звездочки, устройства захвата ткани, устройства сцепления, шероховатую поверхность, неровные поверхности, поверхностные дефекты, края, грани и т.п. В отдельных конфигурациях фиксаторы ткани выполнены с возможностью зацепления за ткань и сопротивления перемещению шовного материала в направлении, противоположном направлению, в котором хирург накладывает шов на ткань, при этом фиксаторы по существу ориентированы в направлении наложения шва. В некоторых вариантах осуществления фиксаторы прилегают к поверхности при протягивании шовного материала в направлении наложения шва и открываются или «разветвляются» при протягивании шовного материала в направлении, противоположном направлению наложения шва. Поскольку конец каждого фиксатора, прокалывающий ткань, при продвижении через ткань в процессе наложения шва обращен в направлении, противоположном направлению наложения шва, фиксаторы ткани не цепляют ткань на данной стадии. После наложения самоудерживающейся нити при воздействии усилия, направленного в другом направлении (часто по существу противоположном направлению наложения шва), фиксаторы выходят из положения, в котором они находились при наложении шва (т.е. из положения, в котором они по существу уложены вдоль тела нити), и концы фиксаторов отходят (или «раскрываются») от тела нити, зацепляясь за и проникая в окружающую ткань, и таким образом захватывая ткань между фиксатором и телом нити, тем самым «закрепляя» или фиксируя самоудерживающуюся нить на месте. В других определенных вариантах осуществления фиксаторы ткани сконфигурированы так, что они допускают движение шовного материала в одном направлении и сопротивляются его движению в другом направлении (без нарушения целостности/разворачивания волокна). В некоторых других конфигурациях фиксаторы ткани способны (самостоятельно или в сочетании с другими фиксаторами) противостоять движению волокна в обоих направлениях. Как правило, нить с такими фиксаторами накладывают через устройство, такое как канюля, препятствующее контакту фиксаторов с тканью до того момента, пока нить не окажется в требуемом месте.
Термин «переходный сегмент» относится к части двунаправленного шовного материала без фиксаторов, которая расположена между первым набором фиксаторов, ориентированных в одном направлении, и вторым набором фиксаторов, ориентированных в другом направлении. Переходный участок может располагаться приблизительно в середине самоудерживающейся нити или ближе к одному концу самоудерживающейся нити с образованием асимметричной системы самоудерживающейся нити.
Термин «закрытие раны» относится к хирургической процедуре закрытия раны. Любая травма, особенно такая, при которой происходит порез, разрыв, прокол или иное повреждение кожи или другой внешней или внутренней поверхности, называется раной. Обычно рана возникает при нарушении целостности какой-либо ткани (например, разрыв или ожог кожи, разрыв мышцы или переломы кости). Возникновение раны может быть вызвано каким-либо действием, например проколом, падением или хирургической процедурой, инфекционным заболеванием или другим имеющимся у пациента соматическим заболеванием. Хирургическое закрытие раны способствует биологическому процессу заживления благодаря соединению или плотному сближению краев данных ран в месте разрыва, пореза или иного разделения ткани. Хирургическое закрытие раны обеспечивает непосредственное смыкание или сближение слоев ткани, что снижает объем формирования новой ткани, необходимой для ликвидации разрыва между двумя краями раны. Закрытие может одновременно выполнять как функциональные, так и эстетические задачи. Данные задачи включают в себя устранение мертвого пространства путем сближения подкожных тканей, сведение к минимуму риска рубцевания путем тщательного совмещения эпидермиса и предотвращение формирования атрофического рубца путем точной эверсии краев раны.
Выделяющие лекарственный препарат самоудерживающиеся шовные материалы
Как описано выше, варианты осуществления настоящего изобретения включают состав, конфигурации, методы изготовления и использования самоудерживающихся систем в хирургических процедурах. При использовании существует возможность закрепления шовного материала в окружающей ткани с определенной удерживающей силой, которая обеспечивает улучшенную клиническую эффективность процедуры, а также выделение в окружающую ткань лекарственного препарата.
Самоудерживающаяся шовная система
На фиг. 1А изображена двунаправленная самоудерживающаяся шовная система 100. Система самоудерживающейся нити 100 содержит иглы 110, 112, прикрепленные к самоудерживающейся лигатуре 102. Самоудерживающаяся лигатура 102 включает в себя множество фиксаторов 130, распределенных на поверхности волокна 120. На вводном участке 140 волокна 120 нет фиксаторов 130. На участке 142 волокна 120 присутствует множество фиксаторов 130, которые позволяют шовному материалу разворачиваться в направлении иглы 110, но не допускают его движения в направлении иглы 112. На переходном участке 144 отсутствуют фиксаторы 130. На участке 146 существует множество фиксаторов 130, которые расположены так, что шовный материал может быть развернут в направлении иглы 112, но затрудняется его движение в направлении иглы 110. На вводном участке 148 волокна 120 отсутствуют фиксаторы 130. На каждом из участков 140, 142, 144, 146 и 148 предусмотрен пробел, показывающий, что длину каждого участка можно варьировать и выбирать в зависимости от конкретного случая применения шовного материала. Несмотря на то что на фигуре представлена двунаправленная самоудерживающаяся шовная система 100, настоящее изобретение включает самоудерживающийся шовный материал с широким ассортиментом конфигураций фиксаторов и игл, описанных выше. Аналогично конфигурация каждой из игл 110 и 112 может быть подобна любой из диапазона разных хирургических игл, разработанных для использования при выполнении различных процедур. Иглы 110 и 112 могут иметь одинаковую конфигурацию или различные конфигурации.
Волокно 120 включает лекарственный препарат 152 (фиг. 1C, 1D). Лекарственный препарат 152 находится в покровном слое волокна 120 или внедрен в материал 150 волокна 120 путем пропитки. Существуют различные способы изготовления шовных материалов с лекарственными препаратами. Например, такие способы включают прямую экструзию, как описано в патенте США № 6596296 (TissueGen, Inc, Dallas, TX, США), при которой формируются волокна, в которых равномерно распределен лекарственный препарат (см. фиг. 1С). Конфигурация «сердцевина/оболочка» и другие многокомпонентные конфигурации, показанные на фиг. 1D, также могут быть изготовлены путем экструзии, как описано в патенте США № 7033603 (TissueGen, Inc, Dallas, TX, США). Патенты № 6596296 и 7033603 включены в настоящий документ посредством ссылки. Также могут быть использованы альтернативные методы, такие как покрывание (например, путем распыления или погружения) шовного материала или его части, а также экструзия «по проволоке», как описано в патенте США № 6858222 (TissueGen, Inc, Dallas, TX, США). Кроме того, в некоторых случаях предпочтительным является неравномерное (градиентное) распределение лекарственного препарата вдоль шовного материала. Такие линейные анизотропии описаны в патентах США № 6596296, 6858222 и 7514095 (TissueGen, Inc, Dallas, TX, США), последний из которых также включен в настоящий документ в посредством ссылки. Кроме того, шовные системы сами по себе могут быть выполнены (по крайней мере частично) из материалов, которые обладают фармацевтической активностью непосредственно в месте имплантации или вставки или недалеко от этого места. В некоторых вариантах осуществления только отдельные части (например, средние участки или самоудерживающиеся участки) самоудерживающихся шовных материалов покрыты лекарственным препаратом или иным образом включают лекарственный препарат или препараты. В некоторых других вариантах осуществления участки шовного материла избирательно остаются не связанными с лекарственным препаратом или связываются с другими препаратами, отличными от тех, которые включены в другие части шовного материала. Например, в некоторых вариантах осуществления поверхности между фиксатором и основной частью (корпусом) шовного материала, которые избирательно захватывают ткань, связаны с одним или более препаратами, которые улучшают заживление и предотвращают образование рубцов. В других вариантах осуществления предполагается временное поэтапное высвобождение одного или нескольких лекарственных препаратов во время различных этапов процесса заживления (препараты могут уменьшать образование рубцов и способствовать естественным процессам заживления в организме). Это может быть достигнуто, например, за счет использования многослойных волокон, описанных в патенте США № 7033603, или за счет использования нескольких способов внедрения препарата в основной материал волокна, например при использовании наночастиц и микросфер в пределах одного волокна, как описано в патенте США № 6858222. В некоторых других вариантах осуществления поверхность шовного материала может содержать одну или несколько лунок, содержащих один или более препаратов. В других вариантах осуществления все участки шовного материала покрыты препаратами (или препаратом). Препарат наносится на шовный материал следующими способами (примеры): (а) экструзия; (б) непосредственное нанесение вещества на шовный материал (например, путем распыления полимерной/лекарственной пленки или путем погружения шовного материала в полимерный/лекарственный раствор); (в) нанесение покрытия или пропитка шовного материала специальным веществом (таким как гидрогель), которое будет поглощать лекарственный препарат или уже содержит его на этапе покрытия или пропитки шовного материала; (г) вплетение лигатуры с лекарственным покрытием (или самого полимера, сформированного в виде лигатуры) в структуру шовного материала (в случае многоволоконных шовных материалов); (д) изготовление шовного материала из материалов, содержащих лекарственный препарат (материал изготовления может сам относиться к лекарственным препаратам).
Самоудерживающиеся шовные системы 100, выделяющие лекарственные препараты (в том числе шовные материалы с зазубринами), отличаются от обычных шовных материалов тем, что в дополнение к доставке лекарств непосредственно в интересующую ткань они обладают многочисленными фиксаторами ткани 130 (например, зазубринами), которые удерживают шовную систему 100 в ткани после развертывания и сопротивляются движению шовного материала в направлении, противоположном тому, в котором ориентированы фиксаторы, тем самым устраняя необходимость завязывания узлов для скрепления прилегающих друг к другу тканей («безузловое» закрытие ран). Выделяющие лекарственные препараты самоудерживающиеся шовные системы для закрытия ран также обеспечивают лучшее сближение краев раны, равномерное распределение напряжения по всей длине раны (сокращаются области напряжения, которые могут привести к разрыву раны или ишемии), уменьшение объема шовного материала, остающегося в ране (за счет устранения узлов) и уменьшение выбухания (экструзии шовного материала, как правило узлового, сквозь поверхность кожи). Предполагается, что все данные свойства способствуют сокращению рубцевания, улучшению эстетического вида и повышению стабильности раны по сравнению с закрытием ран при помощи гладких шовных материалов или скоб. Таким образом, самоудерживающиеся шовные материалы избавляют хирурга от завязывания узлов, улучшают клинический исход для пациента, а также экономят время и расходы, связанные с расширением хирургического вмешательства и последующих процедур. Кроме того, самоудерживающиеся шовные материалы, выделяющие лекарственные препараты, позволяют избежать высокой локальной концентрации этих препаратов в узловых пространствах.
Способность самоудерживающихся шовных материалов, выделяющих лекарственные препараты, закреплять и удерживать ткани на месте даже при отсутствии натяжения, оказываемого на шовные материалы узлом, также представляет собой свойство, обеспечивающее им превосходство над гладкими шовными материалами. При закрытии раны под натяжением данное преимущество выражается в следующем: (i) самоудерживающиеся нити имеют множество фиксаторов, способных равномерно распределять натяжение по всей длине нити (путем создания сотен точек «фиксации», что позволяет получить лучший косметический результат и снижает риск «проскальзывания» или прохождения нити наружу) в противоположность нитям, используемым для наложения узловых швов, при использовании которых натяжение концентрируется в отдельных точках; (ii) возможность равномерного закрытия ран со сложной геометрией (круглые, дугообразные, раны с зубчатыми краями) с большей точностью и аккуратностью, чем при наложении узлового шва; (iii) самоудерживающиеся шовные материалы устраняют необходимость в «третьей руке», которая часто возникает, когда требуется поддерживать напряжение по всей длине раны во время наложения швов или завязывания узла (для предотвращения «соскальзывания» нити при снятии напряжения); (iv) самоудерживающиеся шовные материалы обнаруживают максимальные преимущества при проведении процедур, в которых завязывание узлов представляется технически сложным (например, при закрывании глубоких ран или при лапароскопических/эндоскопических процедурах); (v) самоудерживающиеся шовные материалы можно использовать для сближения краев и удержания раны перед окончательным закрытием; (vi) самоудерживающиеся шовные нити способны более равномерно доставить лекарственный препарат в ткань (за счет более широкого и равномерного распределения препарата в ткани); (vii) фиксаторы на самоудерживающихся шовных материалах представляют дополнительное средство распределения лекарственных препаратов в ткани.
Лекарственные препараты, внедряемые в самоудерживающиеся шовные материалы
Предназначение самоудерживающегося шовного материала определяет тип препарата, который наносится или внедряется в шовный материал. Примеры: самоудерживающиеся шовные материалы с антипролиферативными лекарственными препаратами применяются при закрытии ран, оставшихся после иссечения опухоли; самоудерживающиеся шовные материалы, содержащие нейротрофический ростовой фактор (НРФ), могут быть использованы при восстановлении поврежденных нервов; самоудерживающиеся шовные материалы с фиброзирующими препаратами могут быть использованы в процедурах по репозиции тканей; наконец, шовные материалы с противорубцовыми препаратами могут использоваться для закрытия кожных ран. Костные факторы роста, например костные морфогенетические белки (КМБ), также могут быть внедрены в шовный материал. Препараты могут также включать в себя множество композиций (смесей). Композиция может полностью покрывать шовный материал либо покрывать некоторые его части. Композиции могут быть выбраны для различных целей (например, комбинации факторов роста, анальгетиков, антибиотиков и противорубцовых веществ) или для обеспечения синергического эффекта.
Препараты, входящие в состав или нанесенные на самоудерживающийся шовный материал в вариантах осуществления настоящего изобретения, включают, например, композиции, которые ускоряют заживление и предотвращают нежелательные эффекты, такие как образование рубцов, инфицирование, боль и так далее. Лекарственные препараты включают (без ограничения) факторы роста, например нейротрофический ростовой фактор (НРФ), костный ростовой фактор (КРФ), факторы восстановления тканей, трофические факторы, направляющие восстановление тканей, вещества, подавляющие факторы, которые ингибируют восстановление тканей, митогенные агенты, содействующие делению клеток, антипролиферативные, антиангиогенные, противоинфекционные, индуцирующие фиброз, противовоспалительные, противорубцовые, смазывающие агенты, эхогенные агенты, ингибиторы клеточного цикла, анальгетики и антимикротубулиновые агенты. В одном варианте осуществления препарат может быть использован в сочетании с шовным материалом (введен отдельно или присоединен к шовному материалу либо внедрен в него) для провоцирования фиброза. Индуцирующие фиброз препараты, которые могут быть использованы в сочетании с выделяющим лекарственный препарат самоудерживающимся шовным материалом, согласно настоящему изобретению, описаны в патенте США № 7166570 под названием «Медицинские имплантаты и индуцирующие фиброз агенты» под авторством Hunter и соавт., который включен в настоящий документ посредством ссылки. Другие препараты, которые могут быть использованы в сочетании с выделяющим лекарственный препарат самоудерживающимся шовным материалом, согласно настоящему изобретению, включают в себя все препараты и агенты, описанные в патентной заявке США № 12/162572 под названием «Шовные материалы и противорубцовые агенты» под авторством Avelar et al., которая включена в настоящий документ посредством ссылки.
В некоторых вариантах осуществления (фиг. 1С) препарат 152 равномерно распределен в материале 150 волокна 120. В других вариантах осуществления (фиг. 1D) препарат 152 распределен анизотропно. Например, волокно 120 может иметь более высокие концентрации препарата в наружном слое материала по сравнению с внутренним ядром материала, или наоборот. Кроме того, например, волокно 120 может иметь более высокую концентрацию препарата на одном конце по сравнению с другим концом. Также, например, волокно 120 может иметь более высокую концентрацию препарата в средней части по сравнению с концами. В случае анизотропного распределения препаратов в волокне 120 концентрация препарата 152 может градиентно (постепенно) или неградиентно меняться от участка к участку. Разные участки волокна 120, имеющие различные концентрации препарата, могут соответствовать участкам волокна 120, имеющим фиксаторы, не имеющим фиксаторы или имеющим фиксаторы в одной ориентации (по сравнению с другой ориентацией). В случае анизотропного распределения лекарственного препарат 152 внутри волокна 120 волокно 120 может быть снабжено видимыми (или поддающимися обнаружению другими способами) маркерами, которые указывают участки большей или меньшей концентрации препарата 152. Это позволяет идентифицировать указанные участки в процессе производства и/или использования самоудерживающихся шовных систем 100.
В других вариантах осуществления очень тонкое покрытие, включающее один или несколько препаратов, может быть нанесено на шовный материал с помощью любого из вышеупомянутых методов перед формированием фиксаторов. Таким образом, когда фиксаторы входят в контакт с тканью, они практически не имеют лекарственного покрытия. Таким образом, сшиваемая ткань входит в контакт с покрытием шовного материала по мере его введения, однако, когда с тканью контактирует фиксатор, в этом участвует непокрытая поверхность фиксатора. Другие варианты осуществления, в которых могут быть реализованы поверхности шовного материала, покрытые лекарственным препаратом, включают шовные материалы, экструдированные с равномерно распределенным препаратом (фиг. 1C), шовные материалы, экструдированные в виде многослойной конструкции «сердцевина/оболочка» (фиг. 1D), а также шовные материалы, покрытые после или во время формирования фиксаторов на теле шовного материала (например, когда требуется полностью покрытый, но не избирательно покрытый шовный материал). В еще одном альтернативном варианте осуществления шовные материалы избирательно покрывается после или во время формирования фиксаторов (покрываются только избранные участки шовного материала).
Конкретные терапевтические задачи при использовании шовного материала или лекарственной композиции могут определять, какой материал должен быть использован: полностью или избирательно покрытый. Например, фиброзирующий агент может наноситься на весь шовный материал или его отдельные части, контактирующие с тканью. Покрытия, например покрытия, содержащие факторы роста, могут быть подходящим образом нанесены на всю шовную систему и/или внедрены в материал, из которого изготовлено волокно перед формированием фиксаторов. Способы изготовления волокон, нагруженных лекарственными препаратами, описаны в следующих документах: патент США № 7514095, «Изготовление биоразлагаемых полимерных волокон, нагруженных лекарственными препаратами»; патент США № 7033603, «Биоразлагаемое волокно, выделяющее лекарственный препарат, применяющееся в терапевтических процедурах». Оба вышеуказанных патента включены в настоящую заявку посредством ссылки. Могут использоваться дополнительные методы загрузки лекарственных препаратов в предварительно подготовленные волокна, в том числе без ограничения погружение, распыление, полив и/или химическое осаждение (например, химическое осаждение из паровой фазы). Кроме того, если материал 152d из волокон 120d (фиг. 1D) представляет собой пористый материал, то лекарственный препарат 152d может быть внедрен в волокно 120d путем погружения волокна 120d в раствор препарата 152d. Препарат 152d диффундирует из наружной части волокна 120d по направлению к его центру с течением времени. Концентрация препарата 152d в центре 162 может быть меньше, чем концентрация в оболочке 160.
Структура шовного материала может влиять на выбор и степень нанесения и/или внедрения препарата или препаратов; например, шовные материалы, имеющие расширенный сегмент, могут включать в себя индуцирующие фиброз композиции в расширенном сегменте (или на нем), которые дополнительно закрепляют сегмент на месте в ткани. Шовные материалы, используемые при восстановлении тканей, могут включать, например, градиент концентрации трофических факторов (такой шовный материал градиентным образом, т.е. постепенно, доставляет трофические факторы в ткань). Структура шовного материала и фиксаторов может влиять на кинетику высвобождения препарата или препаратов. Место внедрения лекарственного покрытия препарата также влияет на кинетику высвобождения лекарственного препарата.
Из-за того что шовные материалы выполняются в различных конфигурациях и размерах, точная доза вводимого лекарственного препарата будет зависеть от размера, длины, диаметра, площади поверхности и конструкции шовного материала, а также конфигурации покрываемых частей. Тем не менее при реализации данной техники могут быть применены некоторые принципы. Например, в случае покрытых препаратами шовным материалов доза препарата может быть рассчитана как функция дозы на единицу площади (на участке шовного материала, на который наносится покрытие) или общей дозы препарата. Общая доза вводимого лекарственного препарата может быть измерена, и соответствующие поверхностные концентрации активного препарата могут быть определены. Общая доза препарата, как правило, будет существенно меньше, чем эквивалентная системная доза. Из-за того что препарат связан с самоудерживающимся шовным материалом, он будет распределяться непосредственно вблизи ткани-мишени, но не равномерно по всему организму. Независимо от способа нанесения препарата, предпочтительные агенты, используемые по отдельности или в комбинации, следует вводить при соблюдении следующих принципов дозирования.
В вариантах осуществления настоящего изобретения лекарственные препараты используются в концентрациях в несколько раз выше (50, 20, 10, 5%) или даже меньше 1% концентрации, обычно используемой при системном введении. В определенных вариантах осуществления лекарственный препарат высвобождается из композиции в эффективных концентрациях в течение периода времени, который измеряется с момента проникновения в ткань, прилегающую к шовному материалу, - приблизительно от 1 дня (и менее) до 180 дней. Время высвобождения может также составлять (приблизительно) от 1 дня (и менее) до 180 дней, приблизительно от 7 до 14 дней, приблизительно от 14 до 28 дней, приблизительно от 28 до 56 дней, приблизительно от 56 до 90 дней, приблизительно от 90 до 180 дней. Кинетика высвобождения зависит от площади поверхности фиксаторов на конкретном участке. Для достижения желаемой конечной кинетики необходимо проверить конкретную конфигурацию.
Например, если с самоудерживающимся шовным материалом связаны противоинфекционные агенты (по отдельности или в комбинации), их можно вводить при соблюдении следующих принципов дозирования. Общее количество (доза) противоинфекционного агента в композиции может находиться в диапазоне (приблизительно) 0,01-1 мкг, 1-10 мкг, 10-100 мкг, 100 мкг - 1 мг, 1-10 мг, 10-100 мг или 100-250 мг. Эта доза используется при нанесении на шовный материал (или его участок) либо при проникновении агента в ткань, в которую имплантируется шовный материал. В случае проникновения в ткань, в которую имплантируется шовный материал, может также использоваться диапазон доз 250-1000 мг. В некоторых вариантах осуществления настоящего изобретения доза (количество) противоинфекционного агента на единицу площади шовного материала или поверхности ткани, на которую наносится агент, может лежать в диапазоне (приблизительно) от 0,01 до 1 мкг/мм2, от 1 до 10 мкг/мм2, от 10 до 100 мкг/мм2, от 100 до 250 мкг/мм2. Так как различные материалы волокна или конфигурации фиксаторов высвобождают противоинфекционный агент с различной скоростью, указанные выше параметры дозирования должны использоваться в сочетании со скоростью высвобождения лекарственного препарата из волокон и фиксаторов так, что при минимальной концентрации (приблизительно) от 10−8 до 10−7 M, от 10−7 до 10−6 M, от 10−6 до 10−5 M, от 10−5 до 10−4 M агент высвобождается вблизи или на поверхности ткани для поддержания желаемого терапевтического эффекта в течение требуемого периода времени. Требуемая минимальная концентрация зависит от активности рассматриваемого агента и может быть определена с помощью стандартных тестов, таких как тест минимальной ингибирующей концентрации (МИК).
На фиг. 1B показан увеличенный вид самоудерживающихся шовных материалов 102 в области 142. Как показано на фиг. 1B, по поверхности волокна 120 распределено множество фиксаторов 130. Фиксация самоудерживающихся швов после развертывания в ткани влечет за собой проникновение концов фиксаторов в окружающие ткани, в результате чего ткань захватывается между фиксаторами и корпусом шовного материала. Внутренняя поверхность фиксатора, которая входит в контакт с тканью, захваченной между фиксатором 130 и волокном 120, называется контактирующей с тканью поверхностью или внутренней поверхностью фиксатора. Эта поверхность может быть адаптирована для более активного контактирования с тканью, а также для лучшего распределения препаратов в ткани. Как показано на фиг. 1B, каждый фиксатор 130 имеет кончик 132 и поверхность фиксатора ткани 134. Когда самоудерживающийся шовный материал 102 перемещается в направлении, указанном стрелкой 138а, фиксатор 130 плотно прилегает к корпусу волокна 120. Однако, когда самоудерживающаяся шовная лигатура 102 перемещается в направлении, указанном стрелкой 138b, наконечник 132 или фиксатор 130 входят в контакт с тканью, которая окружает волокно 120, что приводит к разрыхлению фиксаторов 130 из волокна 120. В этом случае фиксаторы контактируют с тканью лицевой частью 134, что предотвращает движение шовного материала в данном направлении и обеспечивает наличие дополнительных контактирующих с тканью поверхностей, содержащих препарат. Следует отметить, что площадь поверхности волокна 120 также увеличивается за счет наличия фиксаторов 130 по сравнению с участками волокна без фиксаторов.
На фиг. 1C показано поперечное сечение волокна 120. Как можно видеть на фиг. 1C, волокно 120 включает в себя материал 150 и лекарственный препарат 152. В варианте осуществления, изображенном на фиг. 1C, распределение препарата 152 является изотропным (гомогенным) по всему радиусу волокна 120. На фиг. 1D показано поперечное сечение альтернативного варианта волокна 120d. Как можно видеть на фиг. 1D, волокно 120d включает материал 150d и лекарственный препарат 152d. В варианте осуществления, изображенном на фиг. 1D, распределение препарата 152d является анизотропным по всему радиусу волокна 120. В частности, концентрация лекарственного препарата 152d выше в оболочке 160 волокна 120d по сравнению с сердцевиной 162.
В альтернативных вариантах осуществления фиксатор 130 может включать материал оболочки 160, а также некоторую часть участка ядра (сердцевины) 162 или другой не являющийся оболочкой материал. В подобных вариантах осуществления материалы выбирают таким образом, чтобы свойства материалов в фиксаторе обеспечивали или совершенствовали его функцию (способствовали поднятию фиксатора 130). Поскольку большая часть лекарственного препарата 152d находится ближе к поверхности волокон 120d по сравнению с вариантом на фиг. 1С, можно ожидать, что препарат 152d будет развернут в ткани быстрее, чем в варианте, показанном на фиг. 1С. И наоборот, если более высокая концентрации препарата обнаруживается в области сердцевины 162, можно ожидать, что препарат 152d будет развернут в ткани менее быстро. Таким образом, распределение концентрации лекарственного препарата может быть использовано для управления кинетикой его высвобождения и/или для регулирования последовательности высвобождения препаратов из самоудерживающегося шовного материала. В альтернативных вариантах осуществления в сердцевине 162 и оболочке 160 представлены разные лекарственные препараты. В этом случае препарат в оболочке 160 будет доставлен в ткань быстрее, чем препарат в сердцевине 162. Таким образом обеспечивается временная последовательность распределения лекарственных препаратов в ткани.
Волокно 120d сформировано любым способом, который используется в данной области техники для изготовления волокон, связанных с лекарственными препаратами и имеющих один или несколько компонентов (например, сердцевину и/или оболочку). Одним из подходящих методов является совместная экструзия материалов, имеющих необходимую концентрацию препарата, описанная в патенте США № 7033603 и раскрытая далее (см. фиг. 3А). Другим подходящим методом является экструзия материала на предварительно сформированные волокна, как описано в патенте США № 6596296 (TissueGen, Inc, Dallas, TX, США), который включен в настоящий документ посредством ссылки (см. фиг. 3В). В случае если препараты внедряются в материал 150d до или во время изготовления волокон 120d, нужно с особой осторожностью следить за тем, чтобы процесс изготовления не привел к денатурации препарата 152d. Кроме того, должны применяться определенные меры контроля, которые бы не допустили перекрестного загрязнения препаратами из разных серий шовных материалов в ходе процессов изготовления волокон и фиксаторов.
На фиг. 1E схематично показано поперечное сечение через фиксатор 130. Обратите внимание, что там, где фиксатор 130 врезается в волокно 120, он оставляет вырезанное углубление 136. Вырезанное углубление 136 имеет кончик 135, соответствующий наконечнику 132 фиксатора 130. Геометрия фиксатора 130 (угол, длина, глубина, расстояние разреза и т.д.) и/или пространственное расположение фиксаторов 130 изменяются с целью усиления способности фиксаторов захватывать ткань. Фиксатор 130 приподнят над волокном 120 для демонстрации параметров, связанных с фиксатором и его поднятием.
Параметры, показанные на фиг. 1E, включают продольную ось шовного материала А-А, диаметр шовного материала SD, длину фиксатора L, глубину разреза фиксатора D, угол разреза фиксатора Θ (тета), угол поднятия фиксатора ε (эпсилон), а также расстояние разреза фиксатора P. Расстояние разреза фиксатора P - это расстояние между соседними фиксаторами, измеренное вдоль продольной оси. Оно может быть измерено как расстояние от одного режущего наконечника 135 до прилегающего режущего наконечника 139. Угол разреза фиксатора Θ представляет собой угол между вырезанным углублением 136 и продольной осью A-A поверхности волокна 120. Угол разреза Θ может быть измерен между вырезанным углублением 136 и поверхностью волокна 120, которая лежит параллельно продольной оси А-А. Угол поднятия фиксатора ε представляет собой угол между внутренней поверхностью фиксатора 134 и поверхностью вырезанного углубления 136. Угол спиральности α является углом поворота вокруг продольной оси между прилегающими режущими наконечниками 135 и 139. В случаях, когда прилегающие фиксаторы располагаются на противоположных сторонах волокна 120, как показано на фиг. 1E, угол спиральности α составляет 180 градусов. На фиг. 1F показано сечение альтернативной конфигурации волокна нити вдоль продольной оси. Как показано на фиг. 1F, угол спиральности α составляет 120 градусов. На фиг. 1F также показана прямая линия, которая отмечает расположение основания 137 вырезанного углубления 136. В случае прямого разреза, как показано на фиг. 1F, глубина разреза D является максимальным расстоянием между основанием 137 и поверхностью волокна 120.
Формирование и поднятие фиксаторов
Самоудерживающиеся шовные лигатуры, описанные в настоящем документе, изготовляются любым подходящим способом, включая без ограничения литье под давлением, штамповку, резку, лазерную резку, экструзию и т.д. Что касается резки, полимерные лигатуры или волокна изготовляются или приобретаются в качестве корпуса (тела) шовного материала, а затем в нем вырезаются фиксаторы; фиксаторы вырезаются вручную, путем лазерной резки либо механически с использованием лезвий, отрезных кругов, шлифовальных кругов и так далее. Препарат наносят на волокна (или волокна пропитываются им) до, во время или после создания волокна. Во время резки режущее устройство или шовная лигатура перемещается по отношению друг к другу. Это необходимо для контроля размера, формы и глубины разрезов и фиксаторов. Конкретные способы нарезки зазубрин на волокне описаны в заявке на патент США № 09/943733, «Способ формирования зазубрин на нити и устройство для его осуществления», поданной Genova et al., и в заявке на патент США № 10/065280, «Нити с зазубринами», поданной Leung et al.; обе заявки включены в настоящий документ путем ссылки.
См. фиг. 2A, 2B и 2C, где показан примерный процесс изготовления фиксаторов 130 в волокнах 120d. На фиг. 2A показано продольное сечение волокна 120d. Как показано на фиг. 2A, волокно 120d включает в себя сердцевину 162, имеющую более низкую концентрацию лекарственного препарата 152d в материале 150d, и оболочку 160, имеющую более высокую концентрацию препарата 152d. В альтернативных вариантах осуществления в сердцевине 162 могут находиться другие лекарственные препараты, отличные от препаратов в оболочке 160. В альтернативных вариантах осуществления одинаковая концентрация препаратов используется на всем радиусе волокна 120d.
Как показано на фиг. 2B, фиксатор 130 формируется на волокне 120d путем выполнения разреза 210 в оболочке 160 волокна 120d. Разрез 210 может быть выполнен с использованием широкого спектра технологий. Такие технологии включают в себя ручную резку, лазерную резку, механическую (машинную) резку с использованием лезвий, отрезных кругов, шлифовальных кругов и так далее. Обратите внимание, что в этом варианте осуществления глубина разреза была выбрана таким образом, что разрез 210 находится в пределах оболочки 160 и не проникает в сердцевину 162. Как показано на фиг. 2В, фиксатор 130 может по-прежнему лежать на поверхности волокна 120D после выполнения в материале оболочки 160 разреза 210.
Чтобы фиксатор 130 более эффективно контактировал с тканью после развертывания, наконечник 132 предпочтительно приподнят над поверхностью волокна 120d. Как показано на фиг. 2C, после этапа вырезания фиксатора, показанного на фиг. 2B, фиксатор 130 механически отгибается от корпуса волокна 120d в направлении, показанном стрелкой 220. Наконечник 132 перемещается над поверхностью волокна 120d, и оголяется контактирующая с тканью поверхность 134. Поверхность разреза 234 волокна также оголяется. Поднятие фиксатора 130 может быть достигнуто за счет ряда механизмов. В простом примере режущее лезвие используется для формирования разреза 210, затем оно удаляется из разреза 210 таким образом, что фиксатор 130 отгибается от корпуса волокна 120d. В качестве альтернативного примера можно привести механическое поднятие фиксатора с помощью устройства, отличного от лезвия. В случаях, когда препарат 152d внедрен в волокно 120d до формирования фиксаторов 130, необходимо позаботиться о том, чтобы процесс формирования фиксаторов не привел к денатурации препарата 152d.
Если материал 150d слишком эластичный, фиксатор 130 будет отскакивать обратно в предыдущее положение на одном уровне с поверхностью волокна 120d (как показано пунктирной линией) после его поднятия. Это также верно в случае, если материал не обладает способностью к необратимой деформации. Таким образом, в соответствии с конкретным вариантом осуществления настоящего изобретения материал 150d выбирают так, чтобы он был достаточно пластически деформируемым после того, как фиксатор 130 перемещен от волокна 120d. В этом случае фиксатор 130d остается в своей новой деформированной форме, при этом наконечник 132 фиксатора 130 существенно приподнят над поверхностью волокна 120d, что приводит к оголению контактирующей с тканью поверхности 134. Материал оболочки 150d выбран так, чтобы механическое движение наконечника 132 фиксатора в направлении от волокна 120d было достаточным для пластической деформации участка 230 материала оболочки 160 в основании фиксатора 130 (это должно приводить к тому, что фиксатор обретает новую постоянную форму). В некоторых вариантах осуществления сердцевина 162 изготовлена из другого материала, отличного от материала оболочки. Материал 162 выбирают так, чтобы он обладал значительно меньшей пластичностью и значительно большей эластичностью и/или прочностью на разрыв (по сравнению с оболочкой). В других вариантах осуществления волокно состоит из одного полимера. В других вариантах осуществления волокно изготовлено из одного полимера, но полимер содержит различные концентрации препарата в различных участках.
Когда фиксатор 130 сформирован в волокне 120d, площадь поверхности волокна 120d и фиксатора 130 увеличивается (по сравнению с волокном без фиксаторов). По существу, площадь увеличивается за счет контактирующей с тканью поверхности 134 и поверхности разреза волокна 234. В случаях, когда лекарственный препарат 152d пропитывает материал 150d волокна 120d, кинетика высвобождения препарата зависит от площади поверхности. Поскольку фиксаторы 130d сформированы на поверхности волокна 120d, фиксаторы 130d в настоящем варианте осуществления полностью выполнены из оболочки 160, которая имеет более высокую концентрацию препарата 152d. Кроме того, в определенных вариантах осуществления настоящего изобретения фиксаторы 130d включают лишь небольшую часть сердцевины 162 (или не включают ее вообще). Таким образом, размер, количество и плотность фиксаторов 130 (наряду с другими факторами) могут влиять на кинетику высвобождения лекарственного препарата на участках волокна с фиксаторами 130. Кинетика высвобождения зависит от площади поверхности фиксаторов на конкретном участке. Для достижения желаемой конечной кинетики необходимо проверить конкретную конфигурацию.
В некоторых вариантах осуществления лекарственный препарат может быть гомогенно распределен по всей длине волокна 120d, однако кинетика его высвобождения меняется в соответствии с анизотропными распределением, формой или размером фиксаторов 130. Например, на участках волокна 120 с наибольшей плотностью фиксаторов 130 лекарственный препарат высвобождается в ткань быстрее, чем на участке с меньшим количеством или отсутствием фиксаторов. Кроме того, участок волокна 102d, не имеющий фиксаторов, способен высвобождать лекарственное средство медленнее, в течение более длительного периода времени. Лекарственный препарат распределяется гетерогенно в различных участках волокна 102d, что обеспечивает относительно гомогенную кинетику высвобождения на участках с большим и малым количеством фиксаторов (а также на участках без фиксаторов). Кроме того, в некоторых вариантах осуществления волокно 120d снабжено покрытием (не показано), которое задерживает или предотвращает миграцию препарата 152d из волокна 120d. В таком случае препарат 152d будет мигрировать из волокон 120d предпочтительным образом там, где фиксаторы 130 нарушают целостность покрытия и открывают внутренние волокна 120d на контактирующей с тканью поверхностью 134 и поверхностью среза 234.
В других вариантах осуществления фиксатор 130 формируется в процессе, отличающемся от разреза оболочки волокна. Например, как показано на фиг. 2D, фиксаторы могут быть образованы путем расплавления материала 150d в области 240 с последующим забором материал из волокон 120d с помощью устройства 244, формирующего фиксаторы 130, и охлаждением материала 150d. В этом варианте осуществления материал 150d выбирают таким образом, чтобы он мог быть расплавлен без нарушения прочности на разрыв в сердцевине волокна 162. В альтернативных вариантах осуществления предварительно сформированный фиксатор прикрепляется механически, приклеивается или приплавляется к оболочке. Материал оболочки в этом варианте осуществления выбран таким образом, чтобы обеспечить прикрепление фиксатора к волокну, а волокна - к фиксатору. В другом варианте осуществления расплавленный материал наносится на оболочку в форме фиксатора, а затем приплавляется к нему. Материал в этом случае выбирается для того, чтобы улучшить прикрепление (приплавление) к прилагаемому извне расплавленному материалу. В некоторых случаях расплавленный материал - это тот же материал, из которого выполнено волокно 120d, которое может включать лекарственный препарат 152d. В случаях, когда лекарственный препарат 152d включен в материал волокна или фиксатора 120d, перед формированием фиксаторов 130 необходимо убедиться, что процесс формирования не приведет к денатурации препарата 152d.
В других определенных вариантах осуществления шовный материал представляет собой относительно короткую нить с заостренными наконечниками. Такой шовный материал может функционировать аналогично скобкам, которые используются для соединения ткани, и, следовательно, позволяет хирургу быстро и надежно закреплять края раны или изменять конфигурацию ткани без необходимости выполнения множества стежков или использования сложных инструментов и/или методов для вставления шовного материала. Этот тип шовного материала может упоминаться как шовный соединитель. В некоторых вариантах осуществления шовный соединитель представляет собой двунаправленную самоудерживающуюся шовную систему. В других определенных вариантах осуществления шовный соединитель может состоять из двух связанных, относительно коротких однонаправленных самоудерживающихся шовных материалов, которые формируют двунаправленную нить (см. патент США № 6241747). В других вариантах осуществления выделяющий лекарственный препарат самоудерживающийся шовный материал используется для закрепления двух- или трехмерной каркасной структуры, которая включает плетеные, неплетеные (узловые) сетчатые структуры, при этом указанные объекты могут включать любую композицию из тех, что описаны выше. Сетка может включать дополнительные волокна, которые могут выделять или не выделять лекарственный препарат.
Материалы волокон
Материал выбирается так, чтобы иметь свойства, полезные для формирования, поднятия и развертывания фиксаторов, а также для обеспечения прочности и гибкости самоудерживающегося шовного материала. В некоторых вариантах осуществления в сердцевине шовного материала используется материал, отличный от материала оболочки. В таких случаях материал сердцевины выбирается в зависимости от его свойств (необходимо, чтобы он обладал достаточной прочностью и гибкостью, а также имел свойства, полезные для формирования, поднятия и развертывания фиксаторов). Шовные материалы являются биологически разлагаемыми или неразлагаемыми при условии, что материал пригоден для нанесения покрытия или внедрения лекарственного препарата, а высвобождение указанного лекарственного препарата выполняется в естественных условиях с подходящей кинетикой. Подходящие материалы включают многие вещества, которые в настоящее время используются для изготовления шовных систем. Кинетика высвобождения зависит от площади поверхности фиксаторов на конкретном участке. Для достижения желаемой конечной кинетики необходимо проверить конкретную конфигурацию.
Подходящие неразлагаемые (нерассасывающиеся) шовные материалы включают полиамид (также известный как нейлон, например нейлон 6 и нейлон 6,6), полиэстер (например, полиэтилентерефталат), политетрафторэтилен (например, вспененный политетрафторэтилен), полиэфир (полиэстер), такой как полибутэстер (блоковый сополимер бутилентерефталата и метиленового эфира политетрафторэтиленгликоля), 4-гидроксибутират, полигидроксиалканоат, полиуретан, сплавы металлов, металлы (например, проволока из нержавеющей стали), полипропилен, полиэтилен, шелк и хлопок и/или комбинации указанных веществ.
Подходящие биоразлагаемые материалы для волокон включают одиночный полимер, сополимер или смесь полимеров поли-L-молочной кислоты, поли-p-диоксанона, поли-DL-молочной кислоты, поликапролактона, полигликолевой кислоты и полиангидрида, полигликолевые кислоты, гомополимер, сополимеры гликолида и ε-капролактона, сополимеры гликолида и лактида, сополимеры триметиленкарбоната и гликолида с диэтиленгликолем (например, MAXON™, Tyco Healthcare Group), полигидроксиалканоаты (например, поли-4-гидроксибутират или поли-4-гидроксибутират-со-3-гидроксибутират), терполимер, состоящий из гликолида, триметилен карбоната и диоксанона (например, BIOSYN™ [гликолид (60%), триметиленкарбонат (26%) и диоксанон (14%)], Tyco Healthcare Group), сополимеры гликолида, капролактона, триметиленкарбоната и лактидоа (например, CAPROSYN™, Tyco Healthcare Group). Могут быть также использованы природные полимеры, такие как восстановленный коллаген, фибрин или природный шелк, целлюлоза, крахмал, хитин, полипептиды, модифицированные полисахаридами, модифицированные белки и/или комбинации вышеуказанных синтетических шовных материалов. Другие полимеры, которые могут быть использованы в выделяющих лекарственные препараты самоудерживающихся шовных материалах, согласно настоящему изобретению, включают все полимеры, описанные в патентной заявке США № 12/162572 под названием «Шовные материалы и противорубцовые агенты» под авторством Avelar et zl., которая включена в настоящий документ посредством ссылки.
Изготовление готовых волокон
Как описано выше, выделяющее лекарственный препарат волокно может быть изготовлены множеством различных способов. В соответствии с одним вариантом осуществления настоящего изобретения, включающего термостабильный лекарственный препарат, моноволокно 320 формируется путем совместной экструзии двух материалов. Как показано на фиг. 3А, сателлитный экструдер 310 нагревает, плавит и экструдирует первый материал 311 по трубопроводу 312 к главному экструдеру 330. Дозировочный насос 313 на трубопроводе 312 регулирует ток первого материала 311 к главному экструдеру 330. Второй сателлитный экструдер 315 нагревает, плавит и экструдирует второй материал 316 по трубопроводу 317 к главному экструдеру 330. Дозировочный насос 318 на трубопроводе 317 регулирует ток второго материала 316 к главному экструдеру 330.
В главном экструдере 330 два расплавленных материала (311, 316) текут по двум маршрутам (336, 338) через экструзионную головку 332, которая контролирует расположение двух материалов (311, 316), когда они соединяются в проточном канале 339. Эти два материала могут содержать различные концентрации лекарственного препарата. Два материала соединяются в проточном канале 339, как показано, а затем экструдируются из головки 332 через выход 334. Головка 332 и проточные каналы 336, 338, 339 сконструированы и работают таким образом, что материалы 311 и 316 не смешиваются в проточном канале 339. Волокно 340, который все еще находится в расплавленном состоянии, затем затвердевает на воздухе или за счет охлаждающей жидкости в блоке охлаждения 350. Блок охлаждения 350 опционально включает ванну 352, используемую для жидкостного охлаждения. Затвердевшее волокно 342 затем забирается в аппарат для протягивания 360. Как правило, затвердевшее волокно протягивается при температуре в пределах 30-80% температуры плавления (в градусах Цельсия). Обычно шовный материал экструдируется, а затем протягивается на нескольких валиках с уменьшающейся температурой. Протягивание волокна приводит к уменьшению его диаметра, надлежащему ориентированию молекул полимеров и повышению прочности волокна на разрыв. Обычно протягивание представляет собой непрерывный процесс, в ходе которого волокно протягивается вокруг серии валиков, при этом каждый следующий валик имеет чуть большую скорость намотки волокна. Разность скоростей валиков приводит к растяжению волокна по мере его прохождения от валика к валику. Волокно может быть также закалено в ходе одного или нескольких этапов нагрева и охлаждения (до, во время или после процесса протягивания). Как показано на фиг. 3А, протягиваемое волокно 344 закаляется в закаляющем аппарате 370 по мере своего прохождения через нагревательный элемент 372. После протягивания готовое моноволокно 346 подается на блок намотки 364, где оно наматывается на барабан 366 (и хранится на нем, пока не потребуется для изготовления самоудерживающегося шовного материала). Если лекарственный препарат внедряется в материал 311 и/или 316 до или во время изготовления волокна 342, необходимо убедиться, что процесс изготовления волокна не приведет к денатурации лекарственного препарата. Лекарственный препарат также может наноситься (в т.ч. путем пропитки) на волокно во время или после экструзии волокна.
На фиг. 3В показан альтернативный способ изготовления волокна, который подходит для использования в вариантах осуществления настоящего изобретения, включающих термостабильные лекарственные препараты. Как показано на фиг. 3В, волокно сердцевины 380 протягивается через экструзионную головку 382. Сателлитный экструдер 385 нагревает, плавит и экструдирует материал оболочки 386 через трубопровод 387 к головке 382. Дозировочный насос 388 регулирует ток материала оболочки 386 на маршруте 389 из головки 382. Скорость подачи материала оболочки 386 и скорости перемещения волокна сердцевины 380 регулируются таким образом, что материал оболочки 386 равномерно наносится на волокно сердцевины 380 с требуемым поперечным сечением, которое определяется поперечным сечением экструзионного сопла 390. Подходящий способ изготовления волокна с покрытой сердцевиной из экструдируемого материала описан в патенте США № 6183499 под названием «Изготовление хирургических волокон» под авторством Fisher et al., который включен в настоящий документ посредством ссылки. Готовое волокно 392, включающее сердечную часть 380 (сердцевину) и материал оболочки 386, может быть охлаждено, закалено и протянуто, а затем намотано на барабан, как показано на фиг. 3А. Тем не менее в некоторых вариантах осуществления волокно сердцевины 380 может быть уже протянуто (в этом случае может не требоваться дополнительное протягивание или завершение волокна 392). В некоторых вариантах осуществления сердечная часть волокна может быть экструдирована из материала, а затем протянута. Затем этот же материал можно экструдировать на волокно сердцевины (как показано на фиг. 3В) без последующего протягивания. Полученное волокно имеет сердцевину (ядро) и оболочку из одного и того же материала, однако материал оболочки имеет другие физические свойства, отличные от свойств сердцевины (оболочка не прошла процесс протягивания). Если лекарственный препарат внедряется в материал 380 и/или 386 до или во время изготовления волокна 392, необходимо убедиться, что процесс изготовления волокна не приведет к денатурации лекарственного препарата.
В другом варианте осуществления материалы могут быть сформированы в волокна, которые будут использованы в моно- или поливолокнистых шовных материалах. Для изготовления волокон, имеющих сердцевину и оболочку (см. фиг. 1), материалы оболочки и сердцевины расплавляются по отдельности. Материалы отдельно подаются в виде расплавов полимеров в прядильный аппарат и объединяются в нем непосредственно перед выходным отверстием. Вращающее устройство может иметь один или множество прядильных аппаратов. Волокно, изготовляемое в прядильном аппарате, в последующем подвергается обработке (охлаждению, протягиванию и закалке); в результате получается волокно, подходящее для использования в вариантах осуществления настоящего изобретения. Конкретное устройство и способы формирования моноволокон, пригодных для использования в настоящем изобретении, приведены в патенте США № 7070610 под названием «Шовное моноволокно и способ его изготовления» под авторством Im et al., а также в патенте США № 6315788 под названием «Материалы и хирургические изделия, изготовленные из них» под авторством Roby. Оба указанных патента включены в настоящий документ посредством ссылки. Несмотря на то что на фиг. 3A и 3B показана экструзия, для формирования волокон, используемых в качестве готового материала в вариантах осуществления настоящего изобретения, может быть применен любой подходящий технологический процесс.
В вариантах осуществления, в которых лекарственный препарат не является термостабильным, для достижения той же конфигурации «сердцевина/оболочка» и «нанесение на волокно» могут применяться другие способы изготовления. Такие способы включают способы, описанные в патенте США № 6596296 (TissueGen, Inc, Dalls, TX, США), который включен в данный документ посредством ссылки. В соответствии с одним из таких вариантов осуществления изобретения оболочка наносится на плетеную или сотканную сердцевину. На фиг. 3C показан один способ, посредством которого может быть выполнено такое нанесение. Как показано на фиг. 3C, устройство для подачи прекурсора полимера подает прекурсор 316а по трубопроводу 317a к камере покрытия 301. Дозирующий насос 318а на трубопроводе 317a регулирует поток прекурсора полимера 316а в камеру покрытия 301. Предварительно сформированная плетеная сердцевина 381 протягивается через камеру покрытия 301, где она покрывается прекурсором полимера 316a. Скорость подачи прекурсора полимерной оболочки 316а и скорость перемещения плетеной сердцевины 381 регулируются таким образом, чтобы обеспечить равномерное нанесение прекурсора 316а на сердцевину 381. Плетеная сердцевина 381, покрытая прекурсором полимера 316а, переходит из камеры покрытия 301 в камеру полимеризации 302.
Как показано на фиг. 3C, устройство, подающее агент полимеризации 316b, подает его по трубопроводу 317b к камере полимеризации 302. Дозирующий насос 318b на трубопроводе 317b регулирует ток агента полимеризации 316b в камеру полимеризации 302. Предварительно сформированная плетеная сердцевина 381 протягивается сквозь камеру полимеризации 301. Покрытие из прекурсора полимера 316а входит в контакт с агентом полимеризации 316b, что приводит к полимеризации (начиная с поверхности). Скорость подачи агента полимеризации 316b и скорость перемещения плетеной сердцевины 381 регулируются таким образом, чтобы прекурсор 316а был равномерно полимеризован на сердцевине 381. Плетеная сердцевина 381, покрытая полимерной оболочкой 355, проходит в камеру полимеризации 302 через сопло 391, которое регулирует конфигурацию полимерной оболочки. Готовый шовный материал 356 с плетеной сердцевиной 381 и полимерной оболочкой 355 может быть подвергнут соответствующей последующей обработке, а затем намотан на барабан, где он будет храниться, пока он не станет готов к формированию фиксаторов ткани.
В некоторых вариантах осуществления может быть необходимым или желательным протягивание законченного шовного материала 356 после формирования полимерной оболочкой 355. Например, в некоторых вариантах осуществления волокна для изготовления плетеной сердцевины 381 экструдируются и протягиваются, а затем сплетаются, формируя сердцевину 381. После этого плетеная сердцевина 381 не может протянута. В дальнейшем полимерная оболочка 355 размещается на плетеной сердцевине 381 (как показано на фиг. 3C). Тем не менее готовый шовный материал 356 не протягивается после размещения полимерной оболочки 355. В некоторых вариантах осуществления полимерная оболочка 355 может быть выполнена из того же полимера, что и плетеная сердцевина 381, но обладать при этом другими физическими свойствами. Это связано с различиями в обработке (плетеная сердцевина может иметь физические свойства, отличные от свойств полимерной оболочки, из-за того, что волокна сердцевины был протянуты до плетения, а материал оболочки не был протянут после полимеризации).
В некоторых вариантах осуществления лекарственный препарат связывается с полимерной оболочкой 355 во время этапов покрытия и полимеризации. В других вариантах осуществления лекарственный препарат связывается с плетеной сердцевиной 381 перед ее изготовлением или после, но до размещения полимерной оболочки 355. Например, лекарственный препарат может быть связан с плетеной сердцевиной 381 путем окунания в раствор, содержащий лекарственный препарат (так, чтобы дать возможность раствору впитаться в плетеную сердцевину). В дальнейшем наносится полимерная оболочка 355, которая «запирает» лекарственный препарат внутри плетеной сердцевины 381 до момента имплантации и его высвобождения сквозь оболочку. В других вариантах осуществления лекарственный препарат связывается и с плетеной сердцевиной 381, и с полимерной оболочкой 355.
Множество различных плетеных лигатур и/или шовных нитей могут использоваться в качестве плетеной сердцевины 381 самоудерживающегося плетеного шовного материала в соответствии с вариантам осуществления настоящего изобретения. Например, сердцевина 381 может представлять собой традиционный плетеный шовный материал. Например, плетеные шовные материалы, такие как VICRYL™, SURGICRYL™, BIOVEK™, VISORB™, POLYSORB™, SURGISORB™ и DEXON™. могут поставляться вместе с биоразлагаемой оболочкой, которая подходит для формирования фиксаторов. Получаемый самоудерживающийся плетеный шовный материал будет полезен в применениях, в которых желательно наличие самоудерживающегося рассасывающегося шовного материала, который сохраняет свою прочность на разрыв в течение периода от трех до четырех недель и полностью подвергается гидролизу в течение десяти недель. Эти шовные системы изготовляются с использованием плетеных материалов из полигликолевой кислоты (PGA) и могут быть покрыты полимерной оболочкой, в которой могут быть вырезаны фиксаторы. Фиксаторы могут быть сформированы в слое оболочки самоудерживающегося плетеного шовного материала в соответствии с вариантами осуществления настоящего изобретения.
В другом примере плетеные шовные материалы, такие как ARTHREX™ FIBERWIRE™, могут иметь нерассасывающуюся оболочку, которая подходит для формирования фиксаторов. Такое решение уместно в ситуациях, когда требуется прочный нерассасывающийся (небиоразлагаемый) плетеный шовный материал. Материал FIBERWIRE™ включает смесь из поливоколоконной сердцевины из сверхвысокомолекулярного полиэтилена и плетеной обертки из полиэстера; этот материал может быть покрыт экструдированным полиэстером, в котором могут быть вырезаны фиксаторы. Фиксаторы могут быть сформированы в слое оболочки самоудерживающегося плетеного шовного материала в соответствии с вариантами осуществления настоящего изобретения. Прочные фиксаторы подходят для захватывания мягких тканей (например, для сближения мягких тканей и кости). Фиксаторы должны эффективно захватывать целевые ткани, например жесткие ткани, такие как фасции, капсулы, структуры, схожие с мениском, суставные губы в плечевых суставах, сухожилия сгибателей, другие сухожилия, соединительнотканные элементы мышц-вращателей. Как правило, шовные материалы прикрепляют такие ткани к кости или надкостнице. Таким образом, плетеный шовный материал может включать шовную петлю (крепящее устройство) на одном конце для захватывания костного туннеля, кости, надкостницы или другой устойчивой анатомической структуры. Подобные плетеные шовные материалы могут быть использованы в артроскопических применениях, в которых желательно использование прочного нерассасывающегося плетеного шовного материала.
Конфигурации волокон
В зависимости от конфигурации экструдеров, головки, блока вращения, прядильного аппарата и другого производственного оборудования волокна, подходящего для изготовления выделяющих лекарственный препарат самоудерживающихся шовных материалов, согласно вариантам осуществления настоящего изобретения, могут быть созданы с различным расположением различных материалов. Кроме того, волокна могут быть выполнены с использованием двух, трех, четырех или более различных компонентов и/или различных лекарственных препаратов или концентраций лекарственных препаратов (если таковое является необходимым или желательным для конкретного применения). Различные конфигурации волокон являются полезными в конкретных вариантах осуществления настоящего изобретения и описаны ниже со ссылками на фиг. 3D-3F и 4A-4I. Для регулирования кинетики высвобождения лекарственных препаратов, содержащихся в волокне, могут использоваться различные методы расположения материалов, лекарственных препаратов и их концентраций в волокне. Кинетика высвобождения зависит от площади поверхности фиксаторов на конкретном участке. Для достижения желаемой конечной кинетики необходимо проверить конкретную конфигурацию.
На фиг. 3D показаны вид в перспективе и поперечное сечение выделяющего лекарственный препарат самоудерживающегося шовного материала 356d с плетеной сердцевиной 381d и полимерной оболочкой 355d. Плетеный шовный материал 356d может быть сформирован любым способом, используемым в данной области техники для изготовления плетеного шовного материала с оболочкой, нанесенной на плетеную сердцевину (и оболочка и сердцевина имеют свойства и лекарственное содержимое, требуемые для функционирования материала в качестве шовного волокна или лигатуры). Одним из подходящих методов является экструзия или размещение материала на предварительно сформированную плетеную сердцевину, как описано ранее. Могут использоваться другие способы формирования оболочки на предварительно сформированной плетеной сердцевине, включая (без ограничения) окунание, распыление, полив и/или химическое осаждение (например, химическое осаждение из паровой фазы).
Как показано на фиг. 3D, фиксатор 357d формируется на выделяющем лекарственный препарат самоудерживающемся шовном материале 356d, например путем выполнения разреза в оболочке 355d. Фиксатор 357d может быть сформирован с использованием любого из описанных выше технологических методов. Глубина разреза может быть выбрана таким образом, чтобы разрез полностью приходился на материал оболочки 355d, как показано на фиг. 3D, и не проникал в плетеную сердцевину 381d. Выбор глубины разреза представляет собой компромисс между прочностью фиксаторов и прочностью на разрыв шовного материала. Слишком большая глубина разреза может привести к снижению прочности шовного материала. Слишком малая глубина разреза может привести к тому, что фиксаторы не будут обладать достаточной прочностью для захватывания ткани. Как правило, выбирается глубина разреза, составляющая от 10 до 50% диаметра плетеного шовного материала. Глубина разреза может составлять от 20 до 30% диаметра плетеного шовного материала.
В плетеном шовном материале 356d, как показано на фиг. 3D, прочность на разрыв в большей степени обеспечиваются сердцевиной 381d. Таким образом, глубина разреза предпочтительно выбирается так, чтобы режущий инструмент не доходил до сердцевины 381d. Толщина оболочки может быть увеличена или уменьшена для обеспечения большей или меньшей глубины разреза. При выборе глубины оболочки нужно учитывать то, что фиксаторы должны быть достаточно прочными для эффективного захватывания ткани. Кроме того, высокая прочность сердцевины 381d освобождает оболочку 355d от большей части нагрузки самоудерживающегося шовного материала 356d. Это позволяет использовать для изготовления оболочки 355d выделяющие лекарственные препараты материалы, которые в противном случае были бы недостаточно прочными для изготовления шовного материала. В некоторых случаях глубина разреза, выполняемого для формирования фиксатора, может быть приблизительно равна глубине слоя оболочки. В таких случаях прочность на разрыв получившегося плетеного шовного материала будет полностью зависеть от прочности на разрыв сердцевины.
Как показано на фиг. 3E и 3F, волокнам можно придать форму, отличную от круглой формы хирургических лигатур. Например, в варианте осуществления на фиг. 3E волокна сплетены в виде двухмерных структур (лент или листов). На фиг. 3E показана плоская лента 381e, включающая множество плетеных волокон. На плоскую ленту 381e нанесена оболочка 355e, в которой сформировано множество фиксаторов 357e. Выделяющая лекарственный препарат самоудерживающаяся лента 356e, в частности, может оказаться полезной для поддержания тканей и/или закрытия просветов в ткани. В плоскую ленту 381e и/или оболочку 355e могут быть внедрены лекарственные препараты, они также могут быть нанесены на выделяющую лекарственный препарат самоудерживающуюся ленту 356e. Выделяющая лекарственный препарат самоудерживающаяся лента 356e затем способна доставлять эти препараты в ткани, в которые она имплантирована.
Как показано на фиг. 3F, волокна также могут быть сплетены в трехмерную структуру, например кольцо или трубку. На фиг. 3F показана круговая плетеная трубка 381f, включающая множество сплетенных вместе волокон. Плетеная трубка 381f имеет оболочку 355f, в которой сформировано множество фиксаторов 357f. Выделяющая лекарственный препарат самоудерживающаяся трубка 357f может быть особенно полезной для поддержания тканей и/или окружения отверстий в тканях в определенных применениях. Конкретные трехмерные структуры могут быть сплетены для соответствия конкретному применению. В трубку 381f и/или оболочку 355f могут быть внедрены лекарственные препараты, они также могут быть нанесены на выделяющую лекарственный препарат самоудерживающуюся трубку 357f. Кроме того, один (или более) лекарственный препарат может быть использован для заполнения просвета 359f выделяющей лекарственный препарат самоудерживающейся трубки 357f (на жидком, гелеобразном или твердом носителе). Выделяющая лекарственный препарат самоудерживающаяся трубка 357f может затем доставлять лекарственный препарат из оболочки 355f, плетеной трубки 381f или просвета 359f в ткани, в которые она имплантирована.
Как показано на фиг. 4А и 4В, простые волокна 410, 420 состоят из двух материалов, при этом один материал представляет собой сердцевину, а второй материал представляет собой оболочку, расположенную поверх сердцевины. Такое расположение материалов в волокне может быть достигнуто путем совместной экструзии двух материалов. Материалы могут представлять собой один и тот же полимер, однако иметь различные концентрации лекарственных препаратов. В простом варианте два материала могут быть использованы в различных количествах в зависимости от применения. Например (см. фиг. 4A), материал сердцевины 412 занимает приблизительно 25% площади поперечного сечения волокна 410, при этом материал оболочки 414 занимает 75% площади поперечного сечения. Для сравнения: на фиг. 4B материал сердцевины 422 и материал оболочки 424 занимают приблизительно по 50% площади поперечного сечения. В общем, материал сердцевины может составлять от 10 до 90% общей площади поперечного сечения волокна. Предпочтительно, чтобы материал сердцевины составлял от 25 до 90% общей площади поперечного сечения волокна. Наиболее предпочтительно, чтобы материал сердцевины составлял более 50% общей площади поперечного сечения волокна. Конфигурация материалов будет зависеть от характеристик материалов и количества материалов, необходимого для выполнения задачи волокна и достижения желаемой кинетики высвобождения лекарственных препаратов, внедренных в волокно. Кинетика высвобождения зависит от площади поверхности фиксаторов на конкретном участке. Для достижения желаемой конечной кинетики необходимо проверить конкретную конфигурацию.
На фиг. 4C показано альтернативное волокно 430, в котором имеется множество «островков» 432 в окружающем «море» 434 второго материала. Множество «островков» 432 совместно образуют сегментированную сердцевину 433 волокна 430. «Море» второго материала 434 включает оболочку. Оно также заполняет промежутки между сегментами 432 сегментированной сердцевины 433. Материалы могут представлять собой один и тот же полимер, однако иметь различные концентрации лекарственных препаратов. Такое расположение материалов в волокне 430 может быть достигнуто путем совместной экструзии двух материалов. Получаемое в результате волокно может обнаруживать полезное сочетание характеристик обоих материалов. Конкретные конфигурации моноволокон могут быть найдены в патенте США № 7070610 под названием «Шовное моноволокно и способ его изготовления» под авторством Im et al., который включен в настоящий документ посредством ссылки, а также в вышеупомянутом патенте США № 7033603.
На фиг. 4D показано другое альтернативное волокно 440, используемое в настоящем изобретении. Волокно на фиг. 4D состоит из трех различных материалов. Первый материал образует сердцевину 442 волокна 440. Второй материал 444 образует оболочку на наружной поверхности волокна 442. Третий материал зажат между сердцевиной 440 и оболочкой 444 в промежуточном слое 446. Материалы могут представлять собой один и тот же полимер, однако иметь различные концентрации лекарственных препаратов. Такое расположение материалов в волокне может быть достигнуто путем совместной экструзии трех материалов. При выборе материала промежуточного слоя 446 могут быть учтены, например, его механические свойства (он будет использован в качестве сопрягающего слоя между сердечником 442 и оболочкой 444). Материал промежуточного слоя 446 может быть выбран с учетом желательного взаимодействия с тканями (этот слой будет оголен для контакта с тканью только при вырезании фиксаторов в волокне 440). Например, материал промежуточного слоя 446 может включать адгезивный компонент, терапевтический компонент или материал, способствующий прикреплению фиксатора к ткани или заживлению раны (см. ниже).
На фиг. 4Е показан другой альтернативный вариант осуществления, в котором сердцевина 462 волокна 460 содержит множество нитей 461, сплетенных вместе. Сердцевина 460 окружена оболочкой 464. Материалы могут представлять собой один и тот же полимер, однако иметь различные концентрации лекарственных препаратов. Это волокно может быть изготовлено на основе плетеной лигатуры (например, плетеного шовного материала), на которую экструдируется оболочка по мере прохождения через экструзионную головку. В этом варианте осуществления плетеная лигатура может быть погружена в раствор лекарственного препарата перед экструзией оболочки 464. Во время погружения лекарственный препарат будет мигрировать в плетеную лигатуру. Обратите внимание, что, как и прежде, оболочка 464 имеет толщину, достаточную для формирования фиксаторов на поверхности волокна 460 (при вырезании фиксаторов режущий инструмент не дойдет до сердцевины 462 или волокон 461 сердцевины 462). Например, максимальная глубина прямого разреза для фиксатора показана на фигуре пунктирной линией E-E. Таким образом, сердцевина 462 и материал ее волокон 461 могут быть сконструированы так, чтобы были обеспечены высокая прочность на разрыв и гибкость, в то время как оболочка 464 выбирается с учетом способности формировать, поднимать и разворачивать фиксаторы. Подходящий способ получения волокна, включающего плетеную сердцевину, описан в патенте США № 6183499 под названием «Изготовление хирургического волокна» под авторством Fisher et al., который включен в настоящий документ посредством ссылки.
На фиг. 4F показан альтернативный вариант осуществления, в котором сердцевина и оболочка волокна 450 имеют различную форму. В варианте осуществления на фиг. 4F сердцевина 452 имеет круглое поперечное сечение, в то время как оболочка 454 имеет треугольное поперечное сечение. Такая конфигурация обеспечивает больший объем второго материала в вершинах треугольника, при этом материал сердцевины по-прежнему занимает большую часть общей площади поперечного сечения волокна. Материалы могут представлять собой один и тот же полимер, однако иметь различные концентрации лекарственных препаратов. В этом варианте осуществления фиксаторы вырезаются в вершинах треугольного поперечного сечения так, что используется оптимальное количество материала оболочки 454. Кроме того, конфигурация фиксатора может быть выбрана таким образом, что фиксаторы с дугообразными основаниями вырезались в вершинах треугольника. Пунктирная линия F-F обозначает разрез для формирования дугообразного основания фиксатора. Видно, что разрез проходит через больший объем оболочки 454, чем прямой разрез. Способы изготовления самоудерживающихся шовных материалов из волокон с треугольными и другими многогранными поперечными сечениями раскрыты в патенте США № 5342376 под названием «Устройство вставки для зазубренного тканевого соединителя» под авторством Ruff, который включен в настоящий документ посредством ссылки. Конфигурация материалов волокна, изображенная на фиг. 4F, может быть достигнута путем совместной экструзии двух материалов. Сопло экструдера выбирают так, чтобы волокно приобрело желаемую форму. Форма поперечного сечения волокна совпадает с формой сопла экструдера. Волокна могут быть сформированы так, как показано на фиг. 4А. Затем материалу оболочки 454 может быть придана треугольная форма с помощью постэкструзионных манипуляций (использование валиков для зажимания материала с последующим нагреванием и закаливанием полимера в выбранной форме до вырезания фиксаторов).
Естественно, возможны другие геометрические конфигурации материалов, например оболочка может иметь квадратное, пятиугольное, шестиугольное или другое многоугольное поперечное сечение. На фиг. 4G показано волокно 470 с оболочкой, содержащей три сегмента (474, 475, 476) на круглой сердцевине 472. В этом варианте оболочка не является непрерывной, но состоит из трех элементов, расположенных вокруг сердцевины 472. В этом варианте осуществления фиксаторы вырезаются в вершинах сегментов оболочки 474, 475, 476 так, что обеспечивается оптимальное использование материала оболочки (большая часть площади поперечного сечения приходится на сердцевину 472). На фиг. 4H показано волокно 480, имеющее квадратную оболочку, которая состоит из четырех сегментов (484, 485, 486, 487) на квадратной сердцевине 482. В этом варианте осуществления фиксаторы вырезаются в вершинах сегментов оболочки 484, 485, 486, 487 так, что обеспечивается оптимальное использование материала оболочки (при этом большая часть поперечного сечения приходится на сердцевину 482). На фиг. 4I показано волокно 490 с круглым поперечным сечением, в котором сердцевина 492 имеет треугольное поперечное сечение. В этом варианте фиксаторы предпочтительно вырезают в толстых участках оболочки 494, 495, 496. Материалы могут представлять собой один и тот же полимер, однако иметь различные концентрации лекарственных препаратов.
Лезвия для вырезания фиксаторов, фиксаторы и их распределение
Как показано на фиг. 5А и 5В, вариант осуществления самоудерживающегося шовного материала 500 в соответствии с настоящим изобретением может включать в себя фиксатор 502 с верхней поверхностью 512, проходящей от периферии 510 волокна 518, и нижнюю поверхность 514, имеющую по меньшей мере две грани 516. Как показано на виде спереди на фиг. 5B, фиксатор может иметь форму «куска пирога» (клина). Увеличенный основной момент инерции сечения (также называемый моментом инерции площади) фиксатора повышает прочность и сопротивление обратному складыванию фиксатора, а также облегчает движение шовного материала через ткань, как описано выше. Такой фиксатор дополнительно снижает накопление напряжения вдоль нижней поверхности фиксатора и шовного материала (по сравнению с фиксаторами, показанными на фиг. 2А-2С, которые имеют прямой разрез). Фиксатор не обязательно имеет форму идеального клина, однако имеет как минимум две грани, которые повышают устойчивость к обратному сгибанию. Так, например, фиксатор может иметь почти трапециевидную форму с тремя гранями. На фиг. 5C показан самоудерживающийся шовный материал 500c с альтернативным фиксатором 502с с двумя гранями 516c, между которыми имеется канатик 517c, связывающий фиксатор 502c с волокном 518C. Канатик 517c предназначен для стабилизации поднятия фиксатора 502c (это улучшает захватывание ткани фиксатором 502c в некоторых применениях).
На фиг. 5D изображен вариант осуществления механизма, формирующего фиксатор 502 в волокне 518, показанном на фиг. 5A и 5B. V-образный режущий край 520 включает два лезвия (522, 524), расположенные близко друг к другу. Они формируют требуемый режущий угол α, который напоминает по форме букву V. В предпочтительном варианте осуществления лезвия 522, 524 расположены близко друг к другу под углом α, равным 90°. В альтернативных вариантах осуществления лезвия 522, 524 образуют тупой или острый угол. В других вариантах осуществления любая из поверхностей V-образного лезвия может быть выпуклой или вогнутой. Это позволяет выбирать желаемую конструкцию, увеличивая момент инерции фиксатора 502 или оставшуюся площадь поперечного сечения волокна 518. Режущий край 520 может регулироваться температурой. Температура должна быть достаточной для формирования фиксатора 502 и не должна приводить к денатурации какого-либо лекарственного препарата, внедренного в волокно 518 или нанесенного на него.
В предпочтительном варианте осуществления лезвия 522, 524 режущего края 520 являются сапфировыми. Сапфировые лезвия - это керамические лезвия, у которых радиус закругления режущей кромки на одну или две величины ниже, чем такой радиус у стального лезвия. Это обеспечивает точное вырезание фиксаторов на волокнах размером 6-0, 8-0 USP и меньше. Кроме того, сапфировые лезвия в целом сохраняют свои механические характеристики в пределах температурного диапазона, требуемого для нарезки полимерных и сополимерных материалов. Сохранение механических характеристик (например, геометрии выполняемого разреза) может быть желательным, если фиксаторы обладают очень маленьким размером и, следовательно, чувствительны даже к незначительным изменениям. Дополнительно сапфировые лезвия обладают большей износостойкостью в отличие, например, от обычных стальных лезвий, обеспечивая более повторяемые результаты в течение продолжительного периода использования. Кроме того, сапфировые лезвия поддаются затачиванию легче, чем стальные лезвия. В альтернативных вариантах осуществления лезвия 522, 524 могут быть выполнены из металла, минерального или керамического вещества с твердым, минеральным, керамическим и/или углеродным покрытием. Например, лезвия могут иметь: углеродное покрытие, алмазное покрытие, алмазоподобное покрытие, нанокерамическое покрытие, керамическое покрытие, сапфировое покрытие и/или иттриево-циркониевое покрытие либо керамический материал с достаточными остротой или прочностью. Могут использовать другие закаленные лезвия или лезвия с твердым покрытием.
Волокно 518 может быть намотано или иным образом подано или протянуто в направлении Z после экструзии при почти постоянной скорости по крученому или некрученому маршруту. В альтернативных вариантах осуществления скорость можно регулировать для управления распределением - более низкая скорость приводит к более высокой плотности фиксаторов, более высокая скорость приводит к более низкой плотности фиксаторов. Для изготовления шовного материала с фиксаторами, расположенными в одном направлении, режущий край 520 может быть расположен в каждом из четырех квадрантов круга. Сапфировые лезвия колеблются в направлении Z так, что режущий край 520 поочередно проникает в шовный материал 520 и отрывается от разреза. Например, режущий край может колебаться под воздействием кулачкового устройства. Таким образом, колебание располагает фиксаторы вдоль волокна 518 по мере того, как волокно 518 подается в направлении Z. Для изготовления шовного материала с фиксаторами, расположенными в двух направлениях, режущий край может быть расположен в каждом из четырех квадрантов круга в каждом из двух направлений проникновения (в результате чего используются восемь режущих краев). Режущий край может включать сапфировые лезвия, которые колеблются так, что режущий край поочередно проникает в шовный материал и извлекается из него.
Для формирования различных конфигураций могут применяться альтернативные варианты осуществления механизмов, формирующих фиксаторы в волокне. Например, режущий край могут быть расположен в каждой из трех зон для формирования фиксаторов, которые выступают в трех точках окружности вдоль шовного материала. Кроме того, один (или более) режущий край и одно (или более) волокно могут вращаться вокруг продольной оси 120 волокна по мере того, как волокно протягивается в направлении Z. В этом случае фиксаторы будут расположены в виде спирали. Кроме того, может быть увеличена или уменьшена частота колебаний режущего края. Колебания также могут быть вообще остановлены. Это может приводить к увеличению или уменьшению плотности фиксаторов, а также к остановке формирования фиксаторов на отдельных шовных материалах или их участках. Могут быть созданы различные паттерны расположения фиксаторов в соответствии с хирургической или косметической процедурами или применением, а также в соответствии со свойствами материала на месте проведения процедуры или применения. Как указано выше, паттерны расположения фиксаторов могут быть выбраны для адаптации поверхности волокна, выделяющего лекарственный препарат, так, чтобы была достигнута нужная кинетика высвобождения лекарственного средства в получившемся самоудерживающемся шовном материале или на его участке.
В конкретных вариантах осуществления режущий край 520 является терморегулируемым. Это оптимизирует формирование и поднятие фиксаторов 502 с сохранением активности лекарственного препарата, внедренного в волокно 518 или нанесенного на него. Для регулирования температуры режущего края 520 при установке сапфировых лезвий обеспечивается проводящее соединение между лезвием и терморегулируемой медной пластиной 530. Медная пластина 530 может эффективно нагревать или охлаждать режущий край 520 до желаемой температуры за счет проводимости. Медная пластина 530 является терморегулируемой. Она использует твердофазную или жидкостную систему переноса тепла, а также регулятор температуры замкнутого цикла. Температура режущего края 520 может достаточно точно регулироваться в требуемом диапазоне. Это обеспечивает удовлетворительное формирование фиксаторов, а также не допускает денатурации лекарственного препарата, который внедрен или другим образом нанесен на волокно 518. Кроме того, волокно 518 может также быть терморегулируемым до, во время и после формирования фиксаторов. Это предотвращает или уменьшает любые вредные эффекты, связанные с формированием фиксаторов, на активность лекарственного препарата, который внедрен или другим способом нанесен на волокно 518. Кроме того, время контакта между режущим краем 520 и волокном 518 может модулироваться, чтобы уменьшать степень, с которой температура режущего лезвия изменяет температуру волокна 518 в процессе резки. Например, в предпочтительном варианте осуществления режущий край 520 находится в проводящей близости к волокну 518 (от четырех до пяти миллисекунд) при формировании фиксатора 502. Таким образом, воздействие температуры режущего лезвия ограничено небольшой областью волокна 518, находящейся в непосредственной близости к режущему краю 520.
На фиг. 5E показан альтернативный режущий механизм, в котором режущий край 520e включает в себя два сапфировых лезвия (522e, 524e), которые находятся на некотором конечном расстоянии от режущей поверхности. В результате этого фиксатор 502 напоминает фиксатор 502c, показанный на фиг. 5C. Кроме того, показана альтернативная терморегулируемая медная пластина 530e, которая контактирует с поверхностью лезвий 522e, 524e, но не с задними краями лезвий 522e, 524e.
На фиг. 5F показан альтернативный режущий механизм 550 имеющий изогнутое сапфировое лезвие 552. Изогнутые сапфировые лезвия 552 при резке волокна 518 двигаются поперечно (как показано стрелкой 559) к оси Z волокна 518 для вырезания фиксатора (не показан на фигуре) в волокне 518. Волокно 518 перемещается в направлении оси Z для вырезания фиксаторов в различных позициях. Волокно 518 также может быть повернуто вокруг оси Z, как показано стрелкой 558, чтобы сократить количество фиксаторов на множестве угловых позиций вокруг оси Z. Угол изогнутого сапфирового лезвия 552 и высота лезвия 552 регулируются по отношению к волокну 518 таким образом, чтобы изменить форму и размер формируемого механизмом фиксатора и обеспечить адекватную площадь поперечного сечения волокна 518 после формирования фиксатора. В режущем механизме 550 изогнутое сапфировое лезвие 552 установлено в трубке 556. Трубка 556 устанавливается на режущее оборудование таким образом, что сохраняется возможность извлечения, замены и угловой корректировки лезвия 552. В показанном варианте осуществления изогнутое сапфировое лезвие 552 имеет полусферический краевой наконечник 554. В альтернативных вариантах осуществления лезвия из любого материала являются прямыми или изогнутыми, также могут быть полусферическими, параболическими или иметь любую другую искривленную форму, подходящую для вырезания фиксатора. В вариантах осуществления настоящего изобретения сапфировое лезвие 552 используется для вырезания фиксаторов на волокнах, которые используются для создания самоудерживающихся шовных материалов размером USP 6-0, 8-0 и меньше.
На фиг. 5G показан альтернативный режущий механизм 560 с круглым стальным лезвием 562. Изогнутое стальное лезвие 562 при резке волокна 518 двигается поперечно (как показано стрелкой 569) к оси Z или продольной оси волокна 518 для вырезания фиксатора (не показан на фигуре) в волокне 518. Волокно 518 перемещается в направлении оси Z для вырезания фиксаторов в различных позициях. Волокно 518 также может быть повернуто вокруг оси Z, как показано стрелкой 568, чтобы сократить количество фиксаторов на множестве угловых позиций вокруг оси Z. Угол кругового стального лезвия 562 и высота лезвия 562 регулируются по отношению к волокну 518 таким образом, чтобы изменить форму и размер формируемого механизмом фиксатора и обеспечить адекватную площадь поперечного сечения волокна 518 после формирования фиксатора. В режущем механизме 560 изогнутое стальное лезвие 562 прикреплено к блоку 566. Блок 566 устанавливается на режущее оборудование таким образом, что сохраняется возможность извлечения, замены и угловой корректировки лезвия 562.
Фиксаторы самоудерживающихся шовных материалов могут быть вырезаны без лезвий. Например, в альтернативном варианте осуществления настоящего изобретения для формирования фиксаторов используется пикосекундный лазер, который выполняет абляцию материала. Лазер может регулироваться оптически и не входить в физический контакт с волокном, тем самым обеспечивая очень точное формирование и размещение фиксаторов на волокне. Другие возможные способы формирование фиксаторов включают электроразрядную механическую обработку, жидкостное травление, сухое травление, чеканку, штамповку и т.п.
На фиг. 6А, 6В и 6С показан диапазон и паттерны распределения фиксаторов, которые могут быть использованы при обработке выделяющих лекарственный препарат самоудерживающихся шовных материалов. На фиг. 6D, 6E и 6F показан диапазон форм фиксаторов, которые могут быть использованы при обработке выделяющих лекарственный препарат самоудерживающихся шовных материалов. На фиг. 6G показан диапазон габаритов шовных материалов, которые могут использоваться в вариантах осуществления настоящего изобретения. На фиг. 6А показано распределение фиксаторов в виде одиночной спирали на выделяющем лекарственный препарат самоудерживающемся шовном материале согласно варианту осуществления настоящего изобретения. На фиг. 6B показано распределение фиксаторов в виде двойной спирали на выделяющем лекарственный препарат самоудерживающемся шовном материале согласно варианту осуществления настоящего изобретения. На фиг. 6C показано распределение фиксаторов с высокой плотностью на выделяющем лекарственный препарат самоудерживающемся шовном материале согласно варианту осуществления настоящего изобретения.
Обратите внимание на фиг. 6A, на котором показано распределение фиксаторов 604 в виде одиночной спирали на выделяющем лекарственный препарат самоудерживающемся шовном материале. Как показано на фиг. 6В, самоудерживающийся шовный материал 620 имеет волокно 602 размером USP 6-0, 7-0, 8-0, 9-0, 10-0 или ниже. Как показано на фиг. 6А, волокно имеет диаметр 0,25 мм, который соответствует шовному материалу размером 4-0. Самоудерживающийся шовный материал 600 включает множество фиксаторов 604, расположенных по спирали вокруг и вдоль волокна 602. Как показано на фиг. 6А, спираль имеет шаг 4,46 мм (5,7 оборота на дюйм). Каждый фиксатор находится на расстоянии 0,5 мм от кончика до основания вырезанного углубления (аксиальное измерение, см. стрелку 616). Расстояние между основанием одного фиксатора и основанием соседнего фиксатора в одной спирали составляет 0,6 мм (аксиальное измерение, см. стрелку 618). В варианте осуществления самоудерживающийся шовный материал имеет участок с зазубринами 612 длиной по меньшей мере 60 мм, а также промежутки без зазубрин 610, 614 длиной по 100 мм с обеих сторон от участка с зазубринами 612. Участок с зазубринами 612 может иметь однонаправленные или разнонаправленные фиксаторы 604.
См. фиг. 6B, на котором показано распределение фиксаторов 624 в виде двойной спирали на выделяющем лекарственный препарат самоудерживающемся шовном материале 620. Как показано на фиг. 6В, самоудерживающийся шовный материал 620 имеет волокно 622 размером USP 6-0, 7-0, 8-0, 9-0, 10-0 или ниже. Как показано на фиг. 6B, волокно имеет диаметр 0,25 мм, который соответствует шовному материалу размером 4-0. Самоудерживающийся шовный материал 620 включает множество фиксаторов 624, расположенных в виде двойной спирали вокруг и вдоль волокна 622. Как показано на фиг. 6B, каждая спираль имеет шаг 6 мм (4,2 оборота на дюйм). Спирали смещены аксиально на 0,49 мм относительно друг друга. Каждый фиксатор находится на расстоянии 0,31 мм от кончика до основания вырезанного углубления (аксиальное измерение, см. стрелку 636). Расстояние между основанием одного фиксатора и основанием соседнего фиксатора в одной спирали составляет 1 мм (аксиальное измерение, см. стрелку 638). В варианте осуществления самоудерживающийся шовный материал имеет участок с зазубринами 632 длиной по меньшей мере 100 мм, а также промежутки без зазубрин 630, 634 длиной по 100 мм с обеих сторон от участка с зазубринами 632. Участок с зазубринами 632 может иметь однонаправленные или разнонаправленные фиксаторы 624.
См. фиг. 6C, на котором показано распределение фиксаторов 644 с высокой плотностью в виде двойной спирали на выделяющем лекарственный препарат самоудерживающемся шовном материале 640. Как показано на фиг. 6C, самоудерживающийся шовный материал 640 имеет волокно 642 размером USP 6-0, 7-0, 8-0, 9-0, 10-0 или ниже. Как показано на фиг. 6С, волокно имеет диаметр 0,25 мм, который соответствует шовному материалу размером 4-0. Самоудерживающийся шовный материал 640 включает множество фиксаторов 644, расположенных в группах по четыре, которые расположены на расстоянии 90 градусов (по окружности) друг от друга. Каждая соседняя группа из четырех фиксаторов смещена относительно соседних групп на 45 градусов. Каждый фиксатор находится на расстоянии 0,18 мм от кончика до основания вырезанного углубления (аксиальное измерение, см. стрелку 656). Расстояние между основанием фиксатора в одной группе и основаниями соседних фиксаторов составляет 0,28 мм (аксиальное измерение, см. стрелку 658). В варианте осуществления самоудерживающийся шовный материал имеет участок с зазубринами 652 длиной по меньшей мере 60 мм, а также промежутки без зазубрин 650, 654 длиной по 100 мм с обеих сторон от участка с зазубринами 652. Участок с зазубринами 652 может иметь однонаправленные или разнонаправленные фиксаторы 644.
На фиг. 6D, 6E и 6F показан диапазон форм фиксаторов, которые могут быть использованы при обработке выделяющих лекарственный препарат самоудерживающихся шовных материалов для каждого фиксатора используется шовное волокно 660 размером USP 4-0. На фиг. 6D показан параболический фиксатор 664, который используется в односпиральной (фиг. 6А) или двухспиральной (фиг. 6В) конфигурации. Глубина разреза D (поперечное измерение) составляет 0,060 мм. Длина разреза L (аксиальное измерение) составляет 0,250 мм. На фиг. 6E показан параболический фиксатор 662, который используется с паттернами распределения (фиг. 6C) высокой плотности. Глубина разреза D (поперечное измерение) составляет 0,036 мм. Длина разреза L (аксиальное измерение) составляет 0,170 мм. На фиг. 6F показан альтернативный фиксатор 668. В этом случае разрез выполняется под углом входа 30 градусов, а затем продолжается параллельно оси шовного материала. Глубина разреза D (поперечное измерение) составляет 0,036 мм. Длина разреза L (аксиальное измерение) составляет 0,234 мм. Угол входа θ составляет 30 градусов (относительно оси шовного материала). Эти и другие формы фиксаторов могут использоваться для обеспечения плотности и способа распределения фиксаторов, требуемых для конкретного применения и волокон с конкретным диаметром. Альтернативные формы фиксаторов и способы их распределения раскрыты в заявке на патент США № 12/101885 под названием «Самоудерживающиеся системы для хирургических процедур», поданной 11 апреля 2008 г., которая включена в настоящий документ посредством ссылки.
Восстановление периферических нервов
Как описано выше, предназначение шовного материала определяет тип лекарственного препарата, который наносится на шовный материал или внедряется в него. Также имеют значение диаметр волокна, форма, размер и способ распределения фиксаторов. В одном примере выделяющие лекарственный препарат самоудерживающиеся шовные материалы содержат нейротрофический ростовой фактор (НРФ) (или покрыты НРФ), который способствует заживлению поврежденных нервов. Спектр повреждений нервов включает в себя простое сдавление, полное рассечение и тяжелые разрывы. Адекватное и своевременное вмешательство имеет решающее значение для достижения хорошего клинического результата. Вмешательство предпочтительно облегчает и/или усиливает естественный процесс заживления.
Для справки: на фиг. 7А представлен поперечный срез нерва 700. Нерв 700 включает множество нервных волокон 710, окруженных соединительной тканью 720. Нервные волокна 710 включают в себя аксоны 712, окруженные миелинизирующими шванновскми клетками (клетками невролеммы) 714. К нервным волокнам 710 непосредственно прилегает первый слой соединительной ткани 722 - эндоневрий. Группы нервных волокон и эндоневрия окружены фасциями 724, которые формируют пучок 702. Пучки 702 также окружены соединительной тканью, которая называется периневрием 726. Периневрий и пучки окружены внутренним эпиневрием 727 и внешним эпиневрием 728. Внешний эпиневрий представляет собой непрерывную фасцию, которая окружает группу пучков и соединительную ткань. Внешний эпиневрий 728 окружен слоем соединительной ткани, которая называется мезоневрием 729. В ходе восстановления нерва шовные материалы могут быть применены к соединительной ткани для воссоединения отрезанных концов нерва. Первым этапом восстановления простого рассечения нерва является подготовка нервных окончаний.
Повреждение периферического нерва провоцирует естественный процесс заживления. В ходе естественного процесса заживления часть аксона, расположенная дистальнее разреза, отрывается от тела аксона и быстро разлагается. Шванновские клетки, окружающие дистальную часть аксона, быстро теряют миелин (он поглощается макрофагами, которые проникают в нерв). Это важный этап процесса восстановления аксона, т.к. миелин является ингибитором аксонального роста. Шванновские клетки, окружающие дистальную часть аксона, стимулируются к пролиферации и миграции, что позволяет им закрыть небольшой дефект нерва (если присутствует фибриновая матрица). Шванновские клетки вокруг проксимальной части аксона проходят тот же процесс (в области, прилегающей к повреждению). В проксимальной части аксона повреждение внутриклеточно сообщается с ядром. Это инициирует экспрессию генов, необходимых для восстановления аксона. Растущий аксон реагирует на контактные и химические сигналы из шванновских клеток, окружающих дистальную часть аксона. Эти сигналы регулируют отрастания аксона к целевым мышечным или сенсорным клеткам.
В одном из вариантов осуществления настоящего изобретения выделяющий лекарственный препарат самоудерживающийся шовный материал используется для подачи препарата (или препаратов) (например, НРФ) в поврежденный нерв во время критически важного периода, который следует сразу после повреждения. Кинетика высвобождения НРФ из самоудерживающихся шовных материалов в нервную ткань, прилегающую к области повреждения, выбирается так, что НРФ доставлялся в нужный период, когда он будет способствовать восстановлению нерва. Факторы, которые могут быть использованы для регулирования кинетики высвобождения НРФ, включают: количество НРФ в волокне, диаметр волокна, распределение НРФ в волокне, состав/пористость материала волокна, форму и способ распределения фиксаторов на волокне. Кинетика высвобождения зависит от площади поверхности фиксаторов на конкретном участке. Для достижения желаемой конечной кинетики необходимо проверить конкретную конфигурацию.
В одном варианте осуществления используется кинетика первоочередного «взрывного» высвобождения. Диаграмма на фиг. 7В иллюстрирует кинетику первоочередного «взрывного» высвобождения НРФ in vitro (IVR), например, из самоудерживающегося шовного материала размером 8-0, подходящего для восстановления нерва. Более 80% НРФ доставляется в течение первых 5 дней после имплантации in vivo. Оставшаяся часть НРФ высвобождается в ближайшие 20-25 дней. Таким образом, самоудерживающийся шовный материал с НРФ подходит для восстановления и поддержки разорванных или рассеченных нервов и доставки НРФ в критический важный ранний период заживления, что улучшает заживление и приводит к более благоприятному клиническому исходу. Кроме НРФ могут применяться и другие агенты, которые способствуют заживлению нервов, как описано в настоящем документе (эти агенты могут быть использованы вместо или в дополнение к НРФ).
Известно, что кроме НРФ существуют и другие препараты, стимулирующие рост/восстановление нервов. В вариантах осуществления настоящего изобретения препараты наносятся в виде покрытия, пропитывают или иным образом внедряются в самоудерживающиеся шовные материалы так, что обеспечивается подходящая кинетика высвобождения лекарственного препарата в области повреждения нерва. Лекарственные препараты, подходящие для стимулирования роста/восстановления нервов, включают: нейротрофические агенты, например нейротрофический ростовой фактор (НРФ), тромбоцитарный ростовой фактор (ТРФ), мозговой нейротрофический фактор (МНФ), нейротрофин-3 (NT-3), нейротрофин-4/5 (NT4/5), нейрокины, например цилиарный нейротрофический фактор (ЦНФ), фактор, ингибирующий лейкемию (ФИЛ); трансформирующие ростовые факторы, например трансформирующие ростовые факторы-бета (ТРФ-бета), глиальный нейротрофический ростовой фактор (ГНРФ). Другие лекарственные препараты, стимулирующие рост нервов, включают фактор роста фибробластов (ФРФ-2), инсулиноподобные факторы роста I и II, а также другие агенты, способные к стимулированию роста и восстановления периферических нервов. Кроме того, в целях улучшения регенерации нервов могут также использоваться лекарственные препараты, которые направленно действуют на миелин-ассоциированные ингибиторы регенерации (они противодействуют этим ингибиторам). Агонисты миелин-ассоциированных ингибиторов включают, например, антитела, такие как антитела anti-NOGO, которые способствуют росту аксонов и их функциональному восстановлению. Кроме того, могут быть использованы другие препараты для блокирования ингибирующего эффекта, направленного на рост аксонов. Такие препараты могут нарушать работу Rho-киназного сигнального пути в аксоне, который реагирует на миелин-ассоциированный ингибиторы регенерации.
Варианты осуществления настоящего изобретения могут включать в себя рассасывающиеся шовные материалы размером 8-0 (или меньше), выполненные из PGA или PDO, которые могут быть пропитаны в процессе формирования одним или более препаратами (такими как НРФ). Получающиеся в результате шовные материалы могут иметь зазубрины и быть сформированы в шовные нити. Кинетика высвобождения НРФ может быть адаптирована для ускорения заживления разрывов и рассечений нервов. Может использоваться кинетика первоочередного «взрывного» высвобождения. Сочетание сцепляющей способности шовного материала из PGA размером 8-0 (для поддержания позиции ткани) и НРФ может приводить к лучшему заживлению нерва и более благоприятному функциональному исходу. Несмотря на то что в настоящем документе большое внимание уделяется НРФ, важно отметить, что с шовными материалами может быть использовано большое множество нейротрофических факторов, факторов роста и нейрональных цитокинов. Варианты осуществления в концепции настоящего изобретения могут быть распространены на общее понятие «выделяющего лекарственный препарат шовного материала», который используется для усиления заживления поврежденной (ятрогенно или неятрогенно) ткани с использованием подходящих лекарственных препаратов/факторов роста, добавляемых в шовный материал в процессе его изготовления.
Паттерн расположения зазубрин в виде двойной (фиг. 6B) или четверной спирали (фиг. 6C) может быть использован для усиления удерживающей способности. Следует отметить, что увеличение площади поверхности самоудерживающегося шовного материала, пропитанного лекарственным препаратом, может также привести к росту кинетики высвобождения; это может быть достигнуто несколькими способами, например: за счет увеличения плотности фиксаторов (например, зазубрин) на единицу площади поверхности шовного материала; за счет увеличивая размера фиксаторов и, соответственно, площади поверхности захватываемой фиксаторами ткани.
Под повреждением нерва понимается широкий диапазон механических повреждений от простого сдавления до полного рассечение и тяжелых разрывов. Восстановление разрыва и рассечения нерва включает четыре этапа: (1) подготовка нервных окончаний, (2) приближение нервных окончаний, (3) сопоставление нервных окончаний, (4) поддержка сопоставления нервных окончаний. Для этапов 2-4 требуется возможность удерживания нервной ткани на месте (функция времени). Опубликованные литературные данные показывают, что современные методы не всегда позволяют добиться надлежащего удержания, что неблагоприятно влияет на восстановление. Шовные материалы способны привести ткань в требуемое положение под высоким напряжением и поддерживать ее в этом положении. Самоудерживающиеся шовные материалы, предназначенные для восстановления нервов, могут помочь добиться желаемого эффекта и избавляют от накопления шовной массы (за счет отсутствия узлов). Отсутствие узлов может редуцировать воспаление в окружающей ткани. Добавление НРФ и использование таких шовных материалов в качестве средства доставки лекарственных препаратов обеспечивают контролируемый механизм, который содействует активному заживлению, ускоряет тем самым процесс нейронального восстановления и улучшает клинический исход.
Традиционные нейлоновые и рассасывающиеся шовные материалы, силиконовые трубки, клеи (фибриновые и синтетические), гидрогели из полиэтиленгликоля, отдельно или в комбинации - все это было использовано для сопоставления рваных и резаных повреждений нервов. Все эти материалы обладают недостаточной способностью контролировать напряжение или полагаются на точку фиксации. Таким образом, они представляют собой менее чем оптимальные способы репозиции нервной ткани.
На фиг. 7С-7F показаны некоторые этапы восстановления разрезанного периферического нерва 700 с использованием выделяющего лекарственный препарат самоудерживающегося шовного материала. Сначала необходимо открыть доступ к месту травмы, чтобы визуализировать повреждение нерва. Чтобы восстановить нерв 700, в первую очередь необходимо (как показано на фиг. 7C) подготовить разделенные концы 740a и 740b двух частей 700a, 700b нерва 700. Необходимо определить зону поврежденной/некротической ткани. Для удаления некротических тканей используется пара острых микроножниц 750 или хирургическое лезвие (не показано). Удаление выполняется так, чтобы разделенные концы 740a, 740b были способны к прикреплению. Надлежащая некрэктомия поврежденных концов обеспечивает «чистые» края пучков.
На фиг. 7D показан следующий этап восстановления периферического нерва, в ходе которого разделенные концы 740a, 740b частей нервов 700a, 700b приближаются друг к другу. Этап приближения обычно требует мобилизации срезов (для устранения пространственного дефекта (разрыва), вызванного повреждением и некротизацией). Срезы нерва 700а, 700b мобилизуются путем их сепарации от окружающих тканей в области, прилегающей к разделенным концам 740a, 740b. Разделенные концы 740a, 740b затем сближаются, как показано стрелками 752а, 752b. Разделенные концы также поворачиваются, как показано стрелкой 753. Это необходимо для сопоставления групп пучков 702 и/или продольных эпиневральных тяжей (не показаны). Если концы нерва втянулись в окружающие ткани, они могут быть сближены путем размещения шовного материала (через эпиневрий) в мягких тканях, прилегающих к каждому разделенному концу 740a, 740b.
После приближения и сопоставления разделенных концов 740a, 740b концы 740a, 740b сшивают друг с другом различными способами. На фиг. 7E, 7F и 7G показаны методы наложения швов с использованием четырех двунаправленных, выделяющих лекарственный препарат самоудерживающихся шовных материалов 760A, 760B, 760C, 760D. На фиг. 7E показан первый этап наложения швов. Как показано на фиг. 7E, каждый из четырех шовных материалов снабжен прямой иглой 762a, 762b, 762c, 762d на одном конце. Игла прикреплена к части 764a, 764b, 764c, 764d шовного материала с фиксаторами, ориентированными так, что допускается движение в направлении иглы 762 (но не в других направлениях). Каждая часть 764a, 764b, 764c, 764d соединена со второй частью 766a шовного материала 766b, 766c, 766d с фиксаторами, ориентированными так, что допускается движение в направлении второй прямой иглы 768a, 768b, 768c, 768d (но не в других направлениях). На первом этапе, как показано на фиг. 7E, первые иглы 762a, 762b проникают в продольном направлении в эпиневрий, окружающий разделенный конец 740а, а вторые иглы 762c, 762d проникают в эпиневральную ткань разделенного конца 740b. Иглы расположены по периметру разделенных концов 740a, 740b. Первые иглы 762a, 762b, 762c, 762d затем используются для вытягивания первых частей 764a, 764b, 764c, 764d шовного материала в эпиневрий до тех пор, пока вторые части 766A, 766b, 766c, 766d шовного материала не войдут в контакт с эпиневрием, что предотвращает дальнейшее продвижение шовного материала в направлении первых игл 762a, 762b, 762c, 762d. В этот момент первые иглы 762a, 762b, 762c, 762d и первые части 764a, 764b, 764c, 764d, выступающие из эпиневрия 727, 728, отрезаются и удаляются из операционного поля. Остается только продольный сегмент первых частей 764a, 764b, 764c, 764d, внедренный в эпиневрий 727, 728.
На фиг. 7F и 7G показан второй этап наложения шва. На втором этапе, как показано на фиг. 7F, вторые иглы 768а, 768b проникают в продольном направлении в эпиневрий, окружающий разделенный конец 740b, а вторые иглы 768c, 768d проникают в эпиневральную ткань, окружающую разделенный конец 740a. Иглы расположены по периметру разделенных концов 740a, 740b. Сопоставление (выравнивание) местоположений вторых игл 768a, 768b, 768c, 768d c соответствующими местоположениями первых игл 762a, 762b, 762c, 762d требует особой аккуратности. Вторые иглы 768a, 768b, 768c, 768d затем используются для продвижения вторых частей 766a, 766b, 766c, 766d шовного материала в эпиневрии до тех пор, пока вторые части 766a, 766b, 766c, 766d не провиснут (без напряжения, как показано на фиг. 7G). Из положения, показанного на фиг. 7G. Как показано на фиг. 7G, вторые иглы 768a, 768b, 768c, 768d выходят из эпиневрия 727, 728 нерва 700a, 780b на некотором расстоянии от разделенных концов 740a, 740b.
На фиг. 7H показан окончательный этап наложения шва. Как показано на фиг. 7Н, вторые иглы 768a, 768b, 768c, 768d одновременно отдаляются от разделенных концов 740a, 740b, как показано стрелками 770. Вторые иглы протягивают вторые части 766a, 766b, 766c, 766d шовного материала через эпиневрий 727, 728. Из-за того что первые части 764a, 764b, 764c, 764d шовного материала вошли в эпиневрий 727, 728 на противоположной стороне разделенных концов 740a, 740b, протягивание вторых частей 766a, 766b, 766c, 766d приводит к тому, что разделенные концы 740a, 740b приводятся и сопоставляются друг с другом (как показано стрелками 772). Сегменты вторых частей 766a, 766b, 766c, 766d (внешних по отношению к нерву) и прикрепленные вторые иглы 768a, 768b, 768c, 768d могут быть отрезаны и удалены из операционного поля. Части нерва 700a, 700b остаются присоединенными друг к другу. Разделенные концы 740a сопоставлены и примыкают друг к другу, как показано на фиг. 7I. Дополнительные традиционные или самоудерживающиеся шовные материалы могут быть использованы для дальнейшего укрепления соединения между нервами 700a, 700b. Альтернативно (или дополнительно) соединение между нервами 700a, 700b может быть усилено с помощью хирургического клея на основе фибрина.
Как показано на фиг. 7I, сегменты 761a, 761b, 761c (не показан), 761d каждого из самоудерживающихся шовных материалов 760a, 760b, 760c (не показан), 760d встраиваются в нервы 700a, 700b внутри внешнего эпиневрия (не показан) и охватывают разделенные концы 740a, 740b. Сегменты 761a, 761b, 761c (не показан), 761d также равномерно распределены по нерву. Сегменты самоудерживающихся шовных материалов 761a, 761b, 761c (не показан), 761d распределяют механическое напряжение в нерве 700a, 700b по всем сегментам 761a, 761b, 761c (не показан), 761d шовного материала (напряжение не концентрируется на разделенных концах 740a, 740b). Сегменты расположены внутри внешнего эпиневрия идеальным образом, который обеспечивает доставку лекарственного препарата, улучшающего регенерацию нерва 700a, 700b. Кроме того, поскольку длина сегментов 761a, 761b, 761c (не показан), 761d самоудерживающихся шовных материалов, внедренных в эпиневрий, может легко регулироваться хирургом, количество препарата, который будет высвобождаться шовным материалом, определено в каждом сегменте. В предпочтительном варианте осуществления шовный материал имеет видимые маркеры (например, окраску), которые подсказывают хирургу и помогают ему выбрать нужную длину внедряемого сегмента (и/или расположение перехода от фиксаторов, ориентированных в одном направлении, к фиксаторам, ориентированным в другом направлении). Хирург может также руководствоваться длиной первых игл 762a, 762b, 762c, 762d и вторых игл 768a, 768b, 768c, 768d, которая определяет размер проникновения в эпиневрий. В альтернативных вариантах осуществления в хирургическом восстановлении нервов могут использоваться 2, 4, 6, 8 или более самоудерживающихся шовных материалов.
На фиг. 8A и 8B показаны техники восстановления дефекта нерва с использованием выделяющих лекарственный препарат самоудерживающихся шовных материалов. Как показано на фиг. 8A, невозможно привести разделенные концы 740a, 740b нерва 700a, 700b в непосредственный контакт. В результате остается небольшой пространственный дефект (зазор) 800 между разделенными концами 740a, 740b, как показано на фиг. 8A. Дефект 800 нерва закрывается за счет образуемого естественным образом фибринового мостика между разделенными концами 740a, 740b. Кровь и плазма, вытекающая из разделенных концов 740a, 740b, замыкает дефект 800, а затем шванновские клетки мигрируют в дефект, используя фибриновые структуры в качестве направляющих. Самоудерживающиеся шовные материалы 760a, 760b, 760c, 760d, охватывающие дефект 800 в продольном направлении, как показано на фиг. 8А, могут служить направляющими для коагуляции фибрина, а также направляющими для последующей миграции шванновских клеток. При необходимости в дефекте можно развернуть дополнительные выделяющие лекарственный препарат самоудерживающиеся шовные материалы, которые будут служить дополнительными направляющими и поддерживающими элементами для аксональной миграции.
Как показано на фиг. 8B, в некоторых применениях может оказаться необходимой или желательной дополнительная защита во время процесса заживления. Так, может быть желательным закрытие дефекта 812, поддерживаемого выделяющими лекарственный препарат самоудерживающимися шовными материалами, с помощью трубки 810. Трубка 810 защищает дефект, а также служит способом концентрирования лекарственных препаратов, выделяющихся из самоудерживающихся шовных материалов 760a, 760b, 760c, 760d в непосредственной близости от дефекта 812. Для облегчения использования трубки 810 вторые иглы 768a, 768b, 768c, 768d и вторые концы 766a, 766b, 766c, 766d самоудерживающихся шовных материалов 760a, 760b, 760c, 760d вставляются через трубку между этапами, показанными на фиг. 7E и 7F. Когда вторые концы протягиваются на этапе, показанном на фиг. 7Н, разделенные концы 740a, 740b будет втянуты в трубку 810 навстречу друг другу. Полученная конфигурация показана на фиг. 8B: трубка 810 расположена вокруг самоудерживающихся шовных материалов 760a, 760b, 760c, 760d и дефекта 812 нерва 700a, 700b.
На фиг. 9A, 9B и 9C показаны альтернативные техники воссоединения разорванного нерва с использованием одного или нескольких выделяющих лекарственный препарат самоудерживающихся шовных материалов. В способе, показанном на фиг. 9А, 9В и 9С, выделяющий лекарственный препарат самоудерживающийся шовный материал используется для соединения разделенных концов 940a, 940b нерва 900, разрезанного на две части: 900a и 900b. Сначала необходимо открыть доступ к месту травмы, чтобы визуализировать повреждение нерва. Затем разделенные концы 940a и 940b двух частей (900a, 900b) нерва 900 должны подвергнуться некрэктомии (удалению всех некротических тканей для подготовки разделенных концов 940a, 940b к прикреплению). Надлежащая некрэктомия поврежденных концов обеспечивает «чистые» края пучков. Разделенные концы 940a, 940b частей нерва 900а, 900b приближаются друг к другу. Этап приближения обычно требует мобилизации срезов (для устранения пространственного дефекта (разрыва), вызванного повреждением и некротизацией). Срезы нерва 900а, 900b мобилизуются путем их сепарации от окружающих тканей в области, прилегающей к разделенным концам 940a, 940b. Разделенные концы 940a, 940b затем сближаются и поворачиваются, как описано ранее, для сопоставления групп пучков 902 и/или продольных эпиневральных тяжей (не показаны).
После сближения и сопоставления (выравнивания) разделенные концы нерва 940a, 940b сшиваются друг с другом с применением техники создания анастомоза, в которой используется выделяющий лекарственный препарат самоудерживающийся шовный материал 960. На фиг. 9А показан первый этап наложения швов. Как показано на фиг. 9A, самоудерживающийся шовный материал 960 снабжен изогнутой иглой 962 на одном конце. Игла прикреплена к первой части 964 шовного материала с фиксаторами, ориентированными так, что допускается движение в направлении иглы 962 (но не в другом направлении). Первая часть 964 соединена со второй частью 966 шовного материала с фиксаторами, которые ориентированы так, что допускается движение в направлении второй изогнутой иглы 968 (но не в другом направлении).
На первом этапе, показанном на фиг. 9А, первая игла 962 проходит через эпиневрий 928a разделенного конца 940a. Вторая игла 968 проходит через эпиневрий 928b разделенного конца 940b. Лучше всего начинать с дистальной стороны нерва 900a, 900b и работать в проксимальном направлении. Первая и вторая части самоудерживающихся шовных материалов 964 и 966 протягиваются до тех пор, пока переходная точка не окажется равноудаленной от двух разделенных концов 940a, 940b. После этого каждая из игл 962, 968 используется для проникновения сквозь эпиневрий противоположного разделенного конца (выполняется перемещение от исходной точки входа). Как показано на фиг. 9А, первая игла 962 и вторая игла 968 движутся в противоположных направлениях вокруг разделенных концов 940a, 940b. На данном первом этапе к первой и второй частям 964, 966 самоудерживающегося шовного материала не применяется никакого напряжения.
Как показано на фиг. 9В, когда первая и вторая части 964, 966 достигают противоположных сторон разделенных концов 940a, 940b, самоудерживающийся шовный материал можно натянуть (для сближения разделенных концов 940a и 940b на 1/2 дефекта). Следует проявлять осторожность, чтобы обеспечить равномерное затягивание шовного материала (на разделенных концах 940a, 940b не должно концентрироваться напряжение или давление).
Как показано на фиг. 9C, следующим этапом является продолжение попеременного продвижения первой и второй частей шовного материала 964, 966 в направлении друг к другу вокруг проксимальных краев разделенных концов 940a, 940b. Когда первая и вторая части 964, 966 достигнут средней точки на проксимальных сторонах разделенных концов 940a, 940b, самоудерживающийся шовный материал может быть натянут, что приведет к сближению разделенных концов 940a и 940b вдоль проксимальной половины дефекта. Следует проявлять осторожность, чтобы обеспечить равномерное затягивание шовного материала (на разделенных концах 940a, 940b не должно концентрироваться напряжение или давление). Возможность неравномерного распределения давления также уменьшается за счет того, что при работе с самоудерживающимся шовным материалом не используются узлы. Дополнительный стежок через эпиневрий может быть выполнен, если требуется зафиксировать концы первой и второй частей самоудерживающегося шовного материала до отсечения его избыточной части вместе с иглами 962, 968.
Как показано на фиг. 9С, стежки самоудерживающегося шовного материала 960 выполняются внутри нерва 900 через внешний эпиневрий (не показан) и охватывают разделенные концы 940a, 940b. Стежки самоудерживающегося шовного материала равномерно располагаются вокруг разделенных концов 940a, 940b. Самоудерживающийся шовный материал 960 способен распределять напряжение в нерве 900 на всем протяжении дефекта (без концентрирования напряжения в одном или нескольких местах). Самоудерживающийся шовный материал расположен во внешнем эпиневрии так, что обеспечивается оптимальная доставка лекарственного препарата, улучшающего регенерацию нерва 900. Кроме того, поскольку длина самоудерживающегося шовного материала, внедренного в эпиневрий, зависит от окружности нерва, количество лекарственного препарата, которое будет высвобождаться из шовного материала, практически точно соответствует дефекту. В предпочтительном варианте осуществления шовный материал имеет видимые маркеры (например, окраску), которые подсказывают хирургу и помогают ему выбрать нужную длину внедряемого сегмента (и/или расположение перехода от фиксаторов, ориентированных в одном направлении, к фиксаторам, ориентированным в другом направлении). Хирург может также руководствоваться длиной и формой изогнутых игл 962, 968, которые определяют размер проникновения в эпиневрий 928a, 928b. В альтернативных вариантах осуществления в хирургическом восстановлении нервов могут использоваться 2, 4 или более самоудерживающихся шовных материалов. В случаях, когда развертываются два самоудерживающихся шовных материала, начало их развертывания должно выполняться на противоположных сторонах разделенных концов 940a, 940b.
Биоактивность лекарственного препарата, выделяемого шовными материалами с лекарственной нагрузкой
Биорассасывающийся полидиоксанон (PDO), нагруженный наночастицами НРФ, используется при изготовлении шовных материалов с диаметром, равным приблизительно 0,045 мм (то есть в пределах диапазона USP для шовных материалов размером 8-0), в соответствии со способами, раскрытыми в патенте США № 6596296. Шовные материалы имеют целевую нагрузку НРФ, составляющую 10 нг/см длины. (Дополнительные шовные материалы изготавливаются с более низкими целевыми концентрациями НРФ, включая 1 и 0,1 нг/см; они не были использованы в описаниях, приведенных ниже.)
Для шовных материалов, выделяющих лекарственный препарат, с размером USP от 12-0 до 7-0 (с диаметром, составляющим приблизительно 0,001-0,069 мм), а также для шовных материалов, выделяющих белковые лекарственные препараты (включая без ограничения НРФ и фактор роста эндотелия сосудов, ФРЭС), диапазон концентраций препарата на единицу длины может составлять приблизительно от 100 до 0,001 нгПРЕПАРАТА/смШОВНОГО МАТЕРИАЛА. Для шовных материалов, выделяющих лекарственный препарат, с размером USP от 6-0 до 5-0 (с диаметром, составляющим приблизительно 0,070-0,799 мм) диапазон концентраций препарата на единицу длины шва может составлять приблизительно от 15% весаПРЕПАРАТА/весаШОВНОГО МАТЕРИАЛА до 0,001 нгПРЕПАРАТА/смШОВНОГО МАТЕРИАЛА.
Шовные материалы, содержащие волокна, выполненные из различных материалов, и различные выделяемые препараты (например, белковые препараты НРФ и ФРЭС) будут высвобождать препараты с разной скоростью. Параметры дозирования должны использоваться в сочетании со скоростью высвобождения лекарственного препарата из волокон и фиксаторов так, что при минимальной концентрация (приблизительно) от 10−13 до 10−12 M, от 10−12 до 10−11 M, от 10−11 до 10−10 M, от 10−10 до 10−9 M, от 10−9 до 10−8 M, от 10−8 до 10−7 M агент высвобождается вблизи или на поверхности ткани для поддержания желаемого терапевтического эффекта в течение требуемого периода времени. Требуемая минимальная концентрация зависит от активности рассматриваемого агента и желаемого терапевтического эффекта.
Партии шовных материалов из PDO, нагруженных НРФ, с диаметром, равным приблизительно 0,045 мм (то есть в пределах диапазона USP для шовного материала размером 8-0, предназначенного для восстановления нервов), были протестированы на клеточных культурах РС12 для определения выделения биологически активного НРФ из шовного материала. Клеточная линия PC12 получена из феохромоцитомы мозгового вещества надпочечника крысы. В присутствии НРФ в концентрации от 0,5 до 50 нг/мл и сывороточной среды клеточные линии претерпевают резкое изменение фенотипа - они начинают «подражать» росту симпатических нейронов, т.е. создают длинные невриты. Это делает их очень полезным исследовательским объектом для обнаружения биологической активности НРФ. Кроме того, поддержание нейритов клетками PC12 требует постоянного присутствия НРФ. Если экспозиция НРФ прекращается, то нейриты клеток PC12 втягиваются обратно или дегенерируют (клетки PC12 возобновляют нормальную пролиферацию в течение приблизительно недельного срока). Две клеточные культуры (одна в присутствии шовного материала, нагруженного НРФ, другая в присутствии шовного материала без НРФ) выращивали в течение двух дней.
На фиг. 10А показаны недифференцированные клетки PC12 с сывороточной средой, которые НЕ подверглись воздействию шовного материала с НРФ. Клетки PC12 пролиферировали без дифференцирования или образования длинных нейрональных структур. На фиг. 10B показаны дифференцированные клетки РС12 с сывороточной средой, которые подверглись воздействию шовного материала с НРФ. Клетки PC12 прекратили пролиферирацию и начали дифференцироваться путем образования длинных нейрональных структур. Эти структуры хорошо видны на фиг. 10B. Как известно, такой фенотип дифференциации обнаруживается только тогда, когда клетки РС12 подвергаются воздействию НРФ в диапазоне концентрации от 0,5 до 50 нг/мл. Клеточная фенотипическая дифференциация, показанная на фиг. 10B, отражает следующее: (1) имеет место биологическая активность НРФ, выделяемого из нагруженного шовного материала; (2) концентрация биологически активного НРФ находится в диапазоне от 0,5 до 50 нг/мл.
На клеточной линии PC12 также была исследована корреляция между реакцией клеток на НРФ и площадью поверхности нагруженного шовного материала. Сравнивалась биологическая реакции клеток PC12 на короткие (5 см) отрезки и длинные (10 см) отрезки шовного материала, нагруженного НРФ. (Теоретическая концентрация в шовных материалах составляла 500 нг НРФ на мм материала. Нужно отметить, что фактическое выделение НРФ происходит в диапазоне концентрации от 0,5 до 50 нг/мл, о чем свидетельствует фенотипическая дифференциация клеток PC12. Если фактическая концентрация выделения превышает указанный диапазон, такой дифференциации не наблюдается). Шовные материалы имели одинаковый диаметр. Дозозависимая реакция коррелировала с площадью поверхности шовного материала и, следовательно, со степенью воздействия НРФ. На фиг. 11 и 12 показана дифференциация клеток РС12 в присутствии длинного (10 см) и короткого (5 см) отрезков шовного материала, нагруженного НРФ. На фиг. 11A-11D показаны клеточные культуры PC12 (окраска зеленый фаллоидином), которые были подвергнуты воздействию шовного материала, не нагруженного НРФ (фиг. 11А), воздействию короткого отрезка (5 см) шовного материала, нагруженного НРФ (фиг. 11В и 11В), и воздействию длинного отрезка (10 см) шовного материала, нагруженного НРФ (фиг. 11D). Схожим образом, на фиг. 12А-12С показаны клеточные культуры PC12 (фазоконтрастный анализ), которые были подвергнуты воздействию шовного материала, не нагруженного НРФ (фиг. 12А), воздействию короткого отрезка (5 см) шовного материала, нагруженного НРФ (фиг. 12В), а также воздействию длинного отрезка (10 см) шовного материала, нагруженного НРФ (фиг. 12C). В соответствии с данными, приведенными на сравнительной гистограмме (фиг. 13), образование нейритов в клеточных культурах с большей общей площадью поверхности выделения лекарственного препарата (шовный материал длиной 10 см) было значительно более выраженным по сравнению с меньшей общей площадью выделения лекарственного препарата (шовный материал длиной 5 см). Таким образом, увеличение площади выделения лекарственного препарата коррелирует с увеличением кинетики высвобождения препарата, что в свою очередь коррелирует с усилением дозозависимой реакции ткани.
Дополнительное клиническое применение
В дополнение к стандартным способам применения (закрытие ран и восстановление мягких тканей) выделяющие лекарственный препарат самоудерживающиеся шовные материалы могут использоваться по другим различным показаниям. Выделяющий лекарственный препарат самоудерживающийся шовный материал может быть имплантирован во множество разных участков организма, включая следующие: ткани кожи, ткани сердца, мягкие ткани, нервы, глаза, артерии, вены, протоки, желчные протоки, мочеточники, мочеиспускательный канал, трахею, пищевод, тонкую кишку, толстую кишку, соединительную ткань (сухожилия, связки, мышцы и кости). Преимущества выделяющих лекарственный препарат самоудерживающихся шовных материалов заключаются в том, что они обеспечивают не только локальную доставку лекарственного препарата, но и механическую поддержку и удержание тканей без использования узлов или скобок.
Самоудерживающиеся шовные материалы, описанные в настоящем документе, могут быть использованы в различных стоматологических процедурах, т.е. в челюстно-лицевой хирургии. Следовательно, они могут упоминаться как самоудерживающийся стоматологический шовный материал. Вышеупомянутые процедуры включают в себя (без ограничений) следующие: стоматологические операции (например, удаление пораженных или сломанных зубов), операции по наращиванию костной ткани, пластику зубно-лицевых дефектов, восстановление после травмы (например, после переломов и других повреждений костей лицевого черепа), хирургическое лечение одонтогенных и неодонтогенных опухолей, реконструктивные операции, пластику заячьей губы или волчьей пасти, пластику врожденных челюстно-лицевых дефектов, эстетические операции на лице. Самоудерживающиеся стоматологические шовные материалы могут быть разлагаемыми или неразлагаемыми. Размер таких материалов, как правило, варьирует от USP 2-0 до USP 6-0.
Самоудерживающиеся шовные материалы, описанные в настоящем документе, могут быть также использованы в хирургических процедурах по репозиционированию тканей. Следовательно, они могут упоминаться как самоудерживающиеся шовные материалы для репозиционирования тканей. Такие хирургические процедуры включают (без ограничения) подтяжку лица, шеи, бровей, бедер и молочных желез. Тип самоудерживающихся шовных материалов, используемых при репозиционировании тканей, варьирует в зависимости от целевых тканей; например, шовные материалы с крупными и разнесенными далеко друг от друга фиксаторами хорошо подходят для работы с относительно мягкими тканями (например, с жировой тканью).
Самоудерживающиеся шовные материалы, описанные в настоящем документе, могут быть также использованы в микрохирургических операциях, которые выполняются с использованием хирургического микроскопа. Следовательно, они могут упоминаться как самоудерживающиеся шовные микроматериалы. Такие хирургические процедуры включают (без ограничения) следующие: воссоединение и восстановление периферических нервов, микрохирургию спинного мозга, микрохирургию кисти, различные пластические микрохирургические процедуры (например, лицевую реконструкцию), микрохирургию мужской или женской репродуктивной системы, а также различные типы реконструктивной микрохирургии. Микрохирургическую реконструктивную пластику используют в ситуациях сложных реконструктивных хирургических проблем, когда другие средства, такие как первичное закрытие, вторичное заживление, пересадка кожи, пересадка местных лоскутов и донорских лоскутов, оказываются неэффективными. Самоудерживающиеся шовные микроматериалы имеют очень малый размер. Как правило, их размер не превышает USP 9-0 или USP 10-0 (к таким материалам могут быть приложены иглы соответствующего размера). Шовные микроматериалы могут быть разлагаемыми или неразлагаемыми.
Самоудерживающиеся шовные материалы, описанные в настоящем документе, могут быть также использованы для улучшения заживления костных переломов. Самоудерживающиеся шовные материалы могут быть обернуты вокруг кости и/или имплантированы в кость из других тканей в месте перелома. Такие шовные материалы высвобождают лекарственные препараты, содействующие заживлению костных переломов (например, гормоны роста). Самоудерживающиеся шовные материалы также могут быть использованы в виде двухмерных и трехмерных сетчатых структур, которые облегчают размещение шовного материала и/или доставку препарата из материала в целевую ткань.
Самоудерживающиеся шовные материалы малого калибра (диаметра), как описано в настоящем документе, могут быть использованы в офтальмологических хирургических процедурах. Следовательно, они могут упоминаться как офтальмологические самоудерживающиеся шовные материалы. Такие процедуры включают (без ограничения) кератопластику, операции по удалению катаракты, операции на стекловидном теле, микрохирургические процедуры на сетчатке. Офтальмологические самоудерживающиеся шовные материалы могут быть рассасывающимися или нерассасывающимися, а также к ним может быть прикреплена игла соответствующего малого размера.
Самоудерживающиеся шовные материалы могут быть использованы в различных ветеринарных применениях (в широком диапазоне хирургических и травматических показаний в ветеринарии).
Стерилизация
Выделяющие лекарственный препарат самоудерживающиеся шовные материалы, согласно настоящему изобретению, должны иметь стабильный срок хранения в течение нескольких месяцев, а также изготовляться и поддерживаться в стерильных условиях. Композиции или шовные материалы могут быть стерильными (за счет подготовки в асептических условиях и/или проведения окончательной стерилизации с использованием методов, доступных в данной области техники). Многие фармацевтические/медицинские устройства изготавливаются стерильными в соответствии с правилами Фармакопеи США (см. www.usp.org, Rockville, Md), стандартами AAMI, определенными Ассоциацией по содействию развитию медицинской техники, или стандартами ISO, определенными Международной организацией по стандартизации (ISO) или Европейским комитетом по стандартизации (CEN). Стерилизация может выполняться одним из множества способов, включая, например, стерилизацию газом или ионизирующим излучением. Допустимые газы, используемые при стерилизации, включают этиленоксид. Допустимые типы излучения, используемые при стерилизации, включают гамма-излучение (например, излучение источника кобальта-60 и электронный пучок). Типичная доза гамма-излучения составляет 2,5 мегарад. Стерилизация может также быть завершающей (с использованием гамма-излучения или электронного пучка). В процессе подготовки стерильных композиций и шовных материалов могут применяться сочетания указанных методов. Способ стерилизации и/или дозы излучения выбирается так, чтобы лекарственный препарат, находящийся в шовном материале, сохранил достаточную активность для достижения желаемого терапевтического эффекта. При выборе способа стерилизации и/или излучения учитываются следующие аспекты: способность данного способа и/или дозы излучения вызывать денатурацию лекарственного препарата, приводить к образованию свободных радикалов (что может снизить стабильность препарата во время хранения шовного материала), приводить к потере активности лекарственного препарата (например, путем пассивной диффузии в случае методов стерилизации с водными растворами). Также должна учитываться стоимость способа стерилизации или дозы излучения.
Опциональные варианты осуществления
Конкретные варианты осуществления, раскрытые в настоящем документе, включают следующее.
Шовный материал, включающий: волокно; лекарственный препарат, связанный с волокном; множество фиксаторов ткани, сформированных в волокне; при этом кинетика высвобождения терапевтического агента определяется распределением терапевтического агента по крайней мере в одном из двух компонентов (волокне или фиксаторе). Опционально указанные волокна включают сердцевину и оболочку, которая покрывает указанную сердцевину, при этом указанный препарат представлен по меньшей мере в сердцевине или оболочке, при этом в одном варианте осуществления препарат размещен в сердцевине (опционально только в сердцевине), а в другом варианте осуществления представлен в оболочке (опционально только в оболочке). Лекарственный препарат может быть распределен в указанной сердцевине изотропно или анизотропно. Лекарственный препарат может быть распределен в указанной оболочке изотропно или анизотропно. Фиксаторы могут быть сформированы в оболочке. В таком варианте осуществления лекарственный препарат может быть связан с фиксаторами и опционально высвобождаться из них анизотропным способом. Лекарственный препарат может быть связан с волокном для обеспечения анизотропного высвобождения лекарственного препарата и изотропного высвобождения терапевтического агента. Лекарственный препарат может быть распределен в указанной сердцевине так, чтобы обеспечивалось по меньшей мере одно из двух - изотропное или анизотропное высвобождение терапевтического агента. Лекарственный препарат может быть распределен в указанной оболочке так, чтобы обеспечивалось по меньшей мере одно из двух - изотропное или анизотропное высвобождение лекарственного препарата. Существует четыре способа подготовки шовного материала: формирование оболочки путем экструдирования двухкомпонентных волокон, имеющих конструкцию «сердцевина/оболочка»; экструдирование материала оболочки на сердцевину; распыление материала оболочки на сердцевину; погружение (окунание) сердцевины в композицию, содержащую материал оболочки, а также (в каждом случае) материалы-прекурсоры оболочки. В одном варианте осуществления волокно включает в себя одно из двух: нейротрофический ростовой фактор (НРФ) или костный морфогенетический белок (КМБ). Опционально волокно включает в себя множество плетеных шовных лигатур. Опционально один из компонентов (сердцевина либо оболочка) имеет более высокую концентрацию указанного лекарственного препарата, чем другой компонент. Опционально указанное волокно включает первую концевую часть, вторую концевую часть и среднюю часть, при этом по меньшей мере один из указанных компонентов (первая концевая часть, вторая концевая часть и средняя часть) имеет более высокую концентрацию указанного лекарственного препарата, чем другие компоненты. В одном опциональном варианте осуществления местоположение лекарственного препарата идентифицируется маркером, который поддается обнаружению. Кинетика высвобождения лекарственного средства в самоудерживающихся шовных материалах может, в частности, определяться по крайней мере одним из следующих факторов: распределением фиксаторов, плотностью фиксаторов, размером фиксаторов, площадью поверхности фиксаторов и формой фиксаторов. Каждый из этих различных вариантов осуществления может сочетаться с одним или более опциональными вариантами осуществления, описанными в настоящем документе.
Шовный материал, включающий: волокно; лекарственный препарат, связанный с волокном; множество фиксаторов ткани, сформированных в волокне; при этом кинетика высвобождения лекарственного препарата определяется распределением лекарственного препарата в шовном материале; при этом указанное волокно включает в себя сердцевину и оболочку, которая покрывает указанную сердцевину, где указанный лекарственный препарат представлен по меньшей мере в одном из указанных компонентов (сердцевина или оболочка) с одним из вариантов распределения (изотропным или анизотропным). Опционально один из компонентов (сердцевина или оболочка) имеет более высокую концентрацию указанного лекарственного средства, чем другой компонент.
Шовный материал, включающий: волокно; лекарственный препарат, связанный с волокном; множество фиксаторов ткани, сформированных в волокне; при этом кинетика высвобождения лекарственного препарата определяется распределением терапевтического агента в шовном материале; при этом указанное волокно включает в себя сердцевину, которая включает множество плетеных лигатур, и оболочку, которая покрывает указанную сердцевину, где указанный лекарственный препарат представлен по меньшей мере в одном из указанных компонентов (сердцевина или оболочка) с одним из вариантов распределения (изотропным или анизотропным). Опционально один из компонентов (сердцевина или оболочка) имеет более высокую концентрацию указанного терапевтического агента, чем другой компонент.
Самоудерживающийся шовный материал, содержащий: волокно; лекарственный препарат, связанный с волокном; множество фиксаторов ткани, сформированных в волокне; при этом после имплантации в ткань волокно и фиксаторы высвобождают лекарственный препарат в ткань, а кинетика высвобождения лекарственного препарата изменяется в соответствии с формой и распределением фиксаторов (по сравнению с одним волокном без фиксаторов).
Способ восстановления нерва, включающий следующие этапы: выбор шовного материала для восстановления нерва; шовный материал должен включать нейротрофический ростовой фактор (НРФ) и множество распределенных фиксаторов так, чтобы обеспечивалось восстановление нерва и равномерное распределение напряжения вдоль нерва шовным материалом в ходе восстановления; применение шовного материала к нерву для восстановления нерва. Опционально данный способ включает в себя выбор шовного материала, который обеспечивает высвобождение более 80% НРФ в течение первых пяти дней после применения шовного материала. Опционально этап применения включает использование по меньшей мере двух шовных материалов с двунаправленными фиксаторами, при этом шовные материалы сближают нерв в направлении, параллельном анатомическому ходу нерва. Опционально этап применения включает в себя использования шовного материала для восстановления нерва с помощью техники создания анастомоза. На этапе применения может также опционально использоваться по меньшей мере одно из двух: рассеченный нерв или разорванный нерв. Опционально перед этапом применения завершается этап удаления некротических тканей из поврежденного нерва (некрэктомия). Опционально на указанном этапе применения указанный шовный материал может использоваться для закрытия дефекта нерва. Кроме того, на указанном этапе применения опционально может выполняться восстановление нерва без концентрирования давления (или напряжения) вдоль нерва.
Способ восстановления нерва, включающий следующие этапы: выбор шовного материала для восстановления нерва (шовный материал должен включать нейротрофический ростовой фактор (НРФ) и множество распределенных фиксаторов); применение шовного материала к нерву для его восстановления, при этом этап выбора включает выбор шовного материала, который обеспечивает высвобождение более 80% НРФ в течение первых пяти дней после применения шовного материала; при этом указанный этап применения включает восстановление нерва без концентрирования давления (или напряжения) вдоль нерва. Опционально этап применения в данном способе включает использование по меньшей мере двух шовных материалов с двунаправленными фиксаторами, при этом шовные материалы сближают нерв в направлении, параллельном анатомическому ходу нерва. Опционально этап применения может включать в себя использования шовного материала для восстановления нерва с помощью техники создания анастомоза. Кроме того, на указанном этапе применения может также опционально использоваться по меньшей мере одно из двух: рассеченный нерв или разорванный нерв. Данный способ может включать этап удаления некротических тканей из поврежденного нерва (некрэктомия) перед этапом применения шовного материала. Опционально на указанном этапе применения указанный шовный материал может использоваться для закрытия дефекта нерва.
Способ восстановления нерва, включающий следующие этапы: выбор шовного материала для восстановления нерва (шовный материал должен включать нейротрофический ростовой фактор (НРФ) и множество распределенных фиксаторов); применение шовного материала к нерву для восстановления нерва, при этом этап выбора включает выбор подходящего шовного материала, который обеспечивает кинетику первоочередного «взрывного» высвобождения НРФ; при этом указанный этап применения включает восстановление нерва без концентрирования давления (или напряжения) вдоль нерва. Опционально этап применения в данном способе включает использование по меньшей мере двух шовных материалов с двунаправленными фиксаторами, при этом шовные материалы сближают нерв в направлении, параллельном анатомическому ходу нерва. В другом опциональном варианте осуществления этап применения включает применение шовного материала для восстановления нерва с использованием техники создания анастомоза. Указанный этап применения опционально может быть проведен на одной из двух анатомических структур: разорванном нерве или рассеченном нерве. Данный способ может включать этап удаления некротических тканей из поврежденного нерва (некрэктомия) перед этапом применения шовного материала. Указанный этап применения может опционально включать использование указанного шовного материала для закрытия дефекта нерва. В одном варианте осуществления этап выбора включает выбор шовного материала, который обеспечивает кинетику первоочередного «взрывного» высвобождения НРФ.
Различные опциональные варианты осуществления, изложенные выше, могут сочетаться с одним или более опциональными вариантами осуществления, изложенными в настоящем документе, для обеспечения заявки на настоящее изобретение.
Хотя настоящее изобретение было проиллюстрировано и подробно описано со ссылкой на немногочисленные примеры осуществления настоящего изобретения, специалистам в данной области следует понимать, что настоящее изобретение не ограничивается описанными вариантами осуществления. Описанные варианты осуществления допускают различные модификации, опущения или добавления без существенного отклонения от новых идей и преимуществ настоящего изобретения, в частности с учетом идей, описанных выше. Таким образом, настоящее изобретение покрывает все такие модификации, опущения, добавления и эквиваленты, которые могут составлять суть и объем настоящего изобретения, определяемого следующей формулой изобретения.
Реферат
Изобретение относится к хирургии. Шовный материал включает волокно, лекарственный препарат, связанный с волокном, множество фиксаторов ткани, сформированных в волокне, указанное волокно включает сердцевину и оболочку, которая покрывает указанную сердцевину, сердцевина и оболочка имеют поперечное сечение, выбранное из группы: круглое, квадратное, пятиугольное, шестиугольное или другое многоугольное поперечное сечение, при этом выбранный вид поперечного сечения сердцевины и оболочки не совпадает. Способ позволяет уменьшить количество шовного материала в ране, уменьшить риск расхождения раны. 14 з.п.ф-лы, 13 ил.
Формула
Документы, цитированные в отчёте о поиске
Способы лечения боли, обусловленной раком кости, путем введения антагониста фактора роста нервов

Комментарии