Способ очистки антител с низкой изоэлектрической точкой - RU2714967C2
Код документа: RU2714967C2
Чертежи









Описание
Область настоящего изобретения
В настоящем изобретении предлагаются способы очистки антител и, прежде всего, способы очистки антител с низкой изоэлектрической точкой (ИЭТ).
Предпосылки создания настоящего изобретения
С развитием технологий рекомбинантных ДНК стали доступны стабильные поставки различных белковых составов. Более подробно, в последние годы с использованием технологий рекомбинантных ДНК были разработаны лечебные антитела с более высокой селективностью по сравнению со стандартными лекарственными препаратами и начаты их клинические испытания.
При очистке лекарственных препаратов, содержащих биологически активные белки, полученных с использованием таких рекомбинантных технологий, необходимо удалять белки и ДНК из клеток организма-хозяина, а также фрагменты лигандов хроматографических смол, которые являются исходными материалами, используемыми для очистки, а также агрегаты или фрагменты белка, подвергаемого очистке. Более того, для обеспечения безопасности лекарственных препаратов в отношении вирусов на стадии очистки необходимо удалять или инактивировать вирусы. В настоящее время данные всемирной организации здравоохранения (ВОЗ) указывают на то, что приемлемое количество ДНК в биологическом медицинском продукте составляет 100 пг ДНК на 1 дозу или менее. Кроме того, по данным ВОЗ, в случае присутствия в культуральной среде частиц, подобных ретровирусам, лекарственный препарат должен содержать не более одной вирусной частицы на 106 доз с учетом возможности удаления или инактивирования ретровирусов на стадии очистки. В основном для соответствия указанному критерию примеси из водной культуральной среды, содержащей биологически активный белок, полученный из клеток организма-хозяина, удаляют методами афинной хроматографии, катионообменной хроматографии, анионообменной хроматографии, хроматографии на гидроксиапатите или гидрофобной хроматографии или их комбинации. Кроме того, большое внимание в последнее время уделяют разработке новых лигандов для очистки, а также используют хроматографию на мультимодальных разделительных матрицах, которая характеризуется двумя функциями - ионообменного действия и гидрофобных взаимодействий.
Прежде всего, если биологически активным белком является антитело, которое можно получить из клеток млекопитающих, используемых в качестве организмов-хозяев, то его очищают колоночной аффинной хроматографией на иммобилизованном белке A или G, которые обладают свойствами связываться с областью Fc IgG, а затем антитело очищают различными хроматографическими методами.
Например, в заявке на выдачу патента Японии Kohyo №(JP-A) Н05-504579 (не прошедшая экспертизу заявка на выдачу патента Японии в национальной фазе, соответствующая международной неяпонской заявке) (патентный документ 1) водную культуральную среду клеток млекопитающих, содержащую антитела, очищали колоночной аффинной хроматографией на иммобилизованном белке A или G, на которых адсорбируются антитела. Затем антитела элюировали кислотным раствором (лимонная кислота в концентрации приблизительно 0,1 М, pH 3,0-3,5), и полученный кислотный элюат очищали последовательно ионообменной колоночной хроматографией и эксклюзионной колоночной хроматографией.
Для повышения удерживания в крови или кинетики in vivo существуют технологии замены аминокислотных остатков для контроля ИЭТ антитела, прежде всего методика изменения аминокислотных остатка(ов), расположенных на поверхности антитела, для контроля ИЭТ антитела (WO 07/114319) (патентный документ 2). ИЭТ нативного антитела находится в интервале приблизительно от 7,5 до 9,5 и является относительно высокой. Ожидается, что снижение ИЭТ за счет модификации аминокислотных остатков такого антитела должно привести к увеличению продолжительности удерживания в плазме и времени полураспада антитела, что приведет к снижению количества антител, вводимых в виде лекарственного средства, и к увеличению интервалов между введениями.
Однако к настоящему времени не изучены методы очистки, пригодные для антител с низкими ИЭТ, не существующих в природе, или не изучены аспекты, специфичные для антител с низкими ИЭТ в процессах очистки. Таким образом, отсутствует информация о способах очистки антител с низкими ИЭТ.
Документы предшествующего уровня техники
Патентные документы
Патентный документ 1
Заявка на выдачу патента Японии Kohyo №(JP-A) Н05-504579 (не прошедшая экспертизу заявка на выдачу патента Японии в национальной фазе, соответствующая международной неяпонской заявке)
Патентный документ 2
WO 07/114319
Краткое описание сущности настоящего изобретения
Проблемы, решенные в настоящем изобретении
В настоящем изобретении предлагаются способы очистки антител, предназначенные для эффективного удаления примесей прежде всего из композиции, содержащей антитела с низкой ИЭТ.
В основном для грубой очистки антител из культуральной среды используют колонки с иммобилизованным белком А. В этом случае обычно на стадии элюирования продукта из колонки используют кислотный раствор, осуществляют инактивацию вирусов за счет поддержания кислотной среды в течение предварительно определенного времени с последующим добавлением требуемого количества кислоты и после нейтрализации раствора продукт немедленно подвергают следующему процессу очистки.
Авторами настоящего изобретения было установлено, что прежде всего при очистке модифицированных антител с низкой ИЭТ, с использованием стандартных способов очистки возникает проблема дополнительного образования агрегатов после завершения процесса очистки. В результате анализа основных причин авторами настоящего изобретения было установлено, что при выдерживании антител в кислотных условиях в течение определенного периода времени и последующей нейтрализации постепенно происходит необратимая агрегация некоторых антител в течение определенного периода времени.
Основное количество антител характеризуется высокой ИЭТ и они проявляют основные свойства и, следовательно, такие антитела можно очищать аффинной хроматографией на иммобилизованном белке A с последующей очисткой на катионообменной смоле в режиме связывания/элюирования и на анионообменной смоле, в последнем случае антитела не связываются со смолой за счет их основности и выходят в свободном объеме колонки. Известно, что обычно на катионообменных хроматографических смолах удаляют агрегаты, а на анионобменных хроматографических смолах удаляют примеси, такие как ДНК, белки клеток организма-хозяина и вирусы за счет их адсорбции. Однако результаты исследования показали, что стандартные методы очистки антител с низкими ИЭТ не обеспечивают эффективное удаление примесей, содержащихся в культуральной среде антител.
Способы решения проблемы
В результате специальных исследований для достижения описанной выше цели изобретения, авторами настоящего изобретения было установлено, что дополнительную агрегацию антител с низкими ИЭТ можно исключить при удалении агрегатов антител, образовавшихся через определенный период времени, с последующей очисткой на колонке с иммобилизованным белком A и нейтрализацией.
Кроме того, авторами настоящего изобретения было установлено, что использование анионообменной хроматографической смолы в режиме связывание/элюирование для очистки антител с низкой ИЭТ приводит к более эффективному удалению примесей по сравнению со стандартными способами. Более того, установлено, что дополнительное удаление примесей можно осуществить с использованием хроматографии на мультимодальных разделительных матрицах или хроматографии гидрофобных взаимодействий (гидрофобной хроматографии) в дополнение к анионообменной хроматографии.
Более подробно, в настоящем изобретении предлагаются следующие объекты 1-19:
(1) способ очистки композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, включающий следующие стадии:
(а) обработка композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, в кислотных условиях,
(б) нейтрализация кислотной композиции, полученной на стадии (а), и
(в) удаление агрегатов из нейтрализованной композиции, полученной на стадии (б), по крайней мере через 1 ч после нейтрализации,
(2) способ по п. 1, где стадия (а) представляет собой стадию инактивации вирусов, которую выполняют после очистки антител с ИЭТ от 3,0 до 8,0 на колонке с иммобилизованным белком A,
(3) способ по п.п. 1 или 2, где стадия (в) представляет собой стадию удаления агрегатов после выдерживания нейтрализованной композиции, полученной на стадии (б), в течение по крайней мере 1 ч после нейтрализации,
(4) способ по любому из п.п. (1)-(3), где удаление агрегатов проводят анионообменной хроматографией, гидрофобной хроматографией, мультимодальной хроматографией или хроматографией на гидроксиапатите,
(5) способ по любому из п.п. (1)-(4), где ИЭТ антител составляет от 5,0 до 7,5,
(6) способ по любому из п.п. (1)-(4), где ИЭТ антител составляет от 5,0 до 6,5,
(7) способ удаления примесей из композиции, содержащий антитела с ИЭТ от 3,0 до 8,0, включающий следующие стадии:
(а) нанесение композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, на анионообменную хроматографическую смолу, и
(б) элюирование антител с ИЭТ от 3,0 до 8,0 из анионообменной смолы в режиме связывание/элюирование с использованием раствора для элюирования с более высокой концентрацией соли по сравнению с концентрацией соли в композиции, полученной на стадии (а),
(8) способ по п. 7, включающий стадию промывки анионообменной смолы раствором для промывки перед стадией (б),
(9) способ по п.п. (7) или (8), где раствором для элюирования на стадии (б) является раствор, содержащий по крайней мере одну соль, которую выбирают из группы, включающей хлорид натрия, трис, сульфат натрия и фосфат натрия,
(10) способ по любому из п.п. 7-9, который дополнительно включает стадию нанесения элюированного продукта, содержащего антитела с ИЭТ от 3,0 до 8,0, полученного на стадии (б), на хроматографическую колонку со смолой, содержащей гидрофобный лиганд и/или мультимодальный лиганд, и получение проточной фракции (выходящей в свободном объеме колонки) и/или элюированной фракции,
(11) способ по любому из п.п. 1-6, где удаление агрегатов проводят с использованием способа, описанного в любом из п.п. 7-10,
(12) способ по любому из п.п. 1-11, где антитело является гуманизированным антителом или антителом человека,
(13) способ по любому из п.п. 1-12, где антитело является антителом к рецептору IL-6 или антителом к рецептору IL-31,
(14) способ получения композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, в которой относительное содержание агрегатов антител составляет 3% или менее, с использованием способов по любому из п.п. 1-13,
(15) композиция, содержащая антитела с ИЭТ от 3,0 до 8,0, в которой относительное содержание агрегатов антител составляет 3% или менее,
(16) композиция, содержащая антитела с ИЭТ от 3,0 до 8,0, полученная с использованием способа по п. 14, в которой относительное содержание агрегатов антител составляет 3% или менее,
(17) способ получения фармацевтической композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, в которой относительное содержание агрегатов антител составляет 3% или менее, где указанный способ включает стадии:
1) получение антител с ИЭТ от 3,0 до 8,0 и/или композиции, содержащей такие антитела, с использованием способа по п. 14, и
2) получение антител с ИЭТ от 3,0 до 8,0 и/или композиции, содержащей такие антитела, полученных на стадии 1), при смешивании их с фармацевтически приемлемым носителем и/или добавкой,
(18) способ удаления агрегатов антител из композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, включающий стадии:
(а) обработка композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, в кислотных условиях,
(б) нейтрализация кислотной композиции, полученной на стадии (а), и
(в) удаление агрегатов из нейтрализованной композиции, полученной на стадии (б), по крайней мере через 1 ч после нейтрализации, и
(19) способ очистки композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, включающий стадии:
(а) обработка композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, в кислотных условиях,
(б) нейтрализация кислотной композиции, полученной на стадии (а), и
(в) удаление агрегатов из нейтрализованной композиции, полученной на стадии (б), через период времени, достаточный для формирования агрегатов.
Способы осуществления настоящего изобретения
Ниже приведено подробное описание настоящего изобретения.
В настоящем изобретении предлагается способ удаления агрегатов антител и примесей из композиции, содержащей антитела с низкой изоэлектрической точкой (ИЭТ). Более подробно, в настоящем изобретении предлагается способ удаления агрегатов из композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, включающий следующие стадии:
(а) обработка композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, в кислотных условиях,
(б) нейтрализация кислотной композиции, полученной на стадии (а), и
(в) удаление агрегатов из нейтрализованной композиции, полученной на стадии (б), по крайней мере через 1 ч после нейтрализации.
Согласно настоящему изобретению дополнительное формирование агрегатов после очистки можно исключить при удалении агрегатов из композиции через период времени, достаточный для формирования агрегатов в нейтрализованной композиции, полученной на стадии (б).
Более подробно, дополнительное формирование агрегатов можно исключить при удалении агрегатов из нейтрализованной композиции, полученной на стадии (б), по крайней мере через 1 ч после нейтрализации.
Более подробно, стадию (в) настоящего изобретения можно осуществить следующим образом:
- удаление агрегатов из нейтрализованной композиции, полученной на стадии (б), через период времени, достаточный для образования агрегатов,
- удаление агрегатов из композиции после формирования по крайней мере 80% агрегатов или более в расчете на количество агрегатов, которое может образоваться в нейтрализованной композиции, полученной на стадии (б),
- удаление агрегатов из композиции после формирования по крайней мере 80% агрегатов или более в расчете на количество агрегатов, которое может образоваться после выдерживания нейтрализованной композиции, полученной на стадии (б), в течение по крайней мере 24 ч,
- удаление агрегатов из композиции после завершения формирования по крайней мере 80% агрегатов или более в расчете на количество агрегатов, которое может образоваться в нейтрализованной композиции, полученной на стадии (б), и
- удаление агрегатов из композиции по крайней мере за 1 ч до завершения формирования агрегатов в нейтрализованной композиции, полученной на стадии (б).
Кроме того, в настоящем изобретении предлагается способ удаления примесей из композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, включающий следующие стадии:
(а) нанесение композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, на смолу для анионообменной хроматографии, и
(б) элюирование антител с ИЭТ от 3,0 до 8,0 из смолы для анионообменной хроматографии в режиме связывание/элюирование раствором для элюирования с более высокой концентрацией соли по сравнению с концентрацией соли в композиции по п. (а).
В описанном выше способе перед стадией (б) можно включить стадию промывки смолы для анионообменной хроматографии раствором для промывки.
Согласно настоящему изобретению способ удаления агрегатов антител из композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, можно также назвать способом очистки антител (мономеров антител) из композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, способом удаления примесей из композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, способом исключения формирования агрегатов антител с ИЭТ от 3,0 до 8,0 и т.п.
Кроме того, способ удаления примесей из композиции, содержащей антитела с ИЭТ от 3,0 до 8,0 можно также назвать способом очистки антител (мономеров антител) из композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, способом удаления агрегатов антител из композиции, содержащей антитела с ИЭТ от 3,0 до 8,0 и т.п.
Согласно настоящему изобретению композиция, содержащая антитела, может также представлять собой раствор, содержащий антитела, культуральный раствор антител, культуральную среду антител и т.п.
Антителами согласно настоящему изобретению являются практически любые антитела, способные связываться с требуемыми антигенами и, в то время как они могут представлять собой поликлональные антитела или моноклональные антитела, предпочтительными являются моноклональные антитела, поскольку они способны стабильно продуцировать гомогенные антитела.
Моноклональные антитела, использованные в настоящем изобретении, включают не только антитела из живых организмов, таких как человек, мыши, крысы, хомяки, кролики, овцы, верблюды и обезьяны, но и искусственно созданные рекомбинантные антитела, такие как химерные антитела, гуманизированные антитела и биспецифичные антитела. Такие антитела также включают рекомбинантные антитела, образующиеся в результате генной инженерии константных областей антитела для изменения физических свойств молекулы антитела (более подробно, изменение ИЭТ, изменение аффинности к рецептору Fc и т.д.) с целью повышения удерживания в крови или улучшения кинетики in vivo.
Класс иммуноглобулинов антител по настоящему изобретению особо не ограничен и включает любой класс, включая IgG, такие как IgG1, IgG2, IgG3, IgG4, IgA, IgD, IgE и IgM. Однако предпочтительными являются IgG и IgM.
Антитела по настоящему изобретению включают не только антитела, содержащие константные и вариабельные области (полные антитела), но также и фрагменты антител, такие как Fv, Fab и F(ab)2, и низкомолекулярные антитела (миниантитела), такие как моно-, ди- и многовалентные одноцепные фрагменты Fv (scFv, sc(Fv)2), образующиеся в результате связывания вариабельных областей антител через линкер, такой как пептидный линкер, диантитела, такие как димер scFv, однако предпочтительными являются полные антитела.
Описанные выше антитела, использованные в настоящем изобретении, можно получать с использованием способов, известных специалистам в данной области техники. В основном гибридомы, продуцирующие моноклональные антитела, можно получать по стандартным методикам, описанным ниже. Более подробно, иммунизацию проводят по стандартным методикам иммунизации с использованием требуемого антигена или клеток, экспрессирующих требуемый антиген в качестве сенсибилизирующего антигена. Образующиеся иммунные клетки объединяют с известными родительскими клетками по стандартной методике слияния клеток. Объединенные клетки сортируют по наличию клеток, продуцирующих моноклональные антитела (гибридомы) по стандартным методикам скрининга для продуцирования антител. Гибридомы можно получать, например, по методике, описанной в статье Milstein и др. (Kohler G. и Milstein С., Methods Enzymol., т. 73: 3-46 (1981)). В случае низкой иммуногенности антигена иммунизацию можно проводить при присоединении антигена к иммуногенной макромолекуле, такой как альбумин.
В другом варианте можно использовать рекомбинантные антитела, полученные с использованием технологии рекомбинантных ДНК, согласно которым гены антител клонируют из гибридом и вставляют в соответствующие векторы, а полученные векторы включают в организм-хозяина (см., например, книгу Carl А.K. Borrebaeck, James W. Larrick, THERAPEUTIC MONOCLONAL ANTIBODIES, опубликованную в Великобритании, изд. MACMILLAN PUBLISHERS LTD, 1990). Более подробно, кДНК для вариабельных областей антител (области V) синтезируют из мРНК гибридом с использованием обратной транскриптазы. При получении ДНК, кодирующей область V требуемого антитела, она присоединена к ДНК, кодирующей константную область требуемого антитела (область С). Полученную конструкцию вставляют в вектор экспрессии. В другом варианте ДНК, кодирующую область V антитела, можно вставлять в вектор экспрессии, несущий ДНК области С. Полученную конструкцию вставляют в вектор экспрессии таким образом, чтобы экспрессия происходила под контролем регулирующей экспрессию области, например, энхансера или промотера. Затем клетки организма-хозяина трансформируют вектором экспрессии для экспрессии антитела.
Согласно настоящему изобретению, искусственно модифицированные рекомбинантные антитела, например, химерные и гуманизированные антитела, можно использовать для снижения гетерологичной антигенности в отношении человека и т.п. Такие модифицированные антитела получают по стандартным методикам. Химерным антителом является антитело, содержащее вариабельные области тяжелой и легкой цепей антитела, полученного из крови млекопитающих (не человека), таких как мышь, и константные области тяжелой и легкой цепей антитела человека. Химерное антитело можно получить присоединением ДНК, кодирующей вариабельные области мышиного антитела, к ДНК, кодирующей константные области человеческого антитела, включением полученной конструкции в вектор экспрессии с последующим включением вектора в организм-хозяина для продуцирования антитела.
Гуманизированные антитела относят также к реконструированным антителам человека и их получают трансплантацией определяющей комплементарность области (CRD) антитела, полученного из крови млекопитающего (не человека), такого как мышь, в определяющую комплементарность область антитела человека. В литературе описаны основные методики генетической рекомбинации. Более подробно, последовательность ДНК создают таким образом, чтобы она содержала CRD мышиного антитела, соединенную с каркасной областью (FR) человеческого антитела, и ее получают методом ПЦР с использованием нескольких олигонуклеотидов с перекрывающимися концевыми участками. Полученную ДНК лигируют с ДНК, кодирующей константную область антитела человека, и ее затем вставляют в экпрессирующий вектор. Экспрессирующий вектор затем вставляют в организм-хозяина для продуцирования гуманизированного антитела (см. публикацию заявки на выдачу Европейского патента ЕР 239400 или WO 96/02576). Соединенную с CRD область FR антитела человека выбирают таким образом, чтобы CRD образовывала предпочтительный участок для связывания с антигеном. Аминокислотные остатки в FR вариабельной области антитела можно замещать таким образом, чтобы CRD в составе модифицированного антитела человека образовывала пригодный участок для связывания с антигеном (Sato K. и др., Cancer Res., т. 53, сс. 851-856 (1993)).
Методики замещения аминокислотных остатков для повышения активности, физических свойств, фармакокинетики, безопасности и т.п. антитела известны и примеры таких методик описаны ниже. Антитела по настоящему изобретению включают также антитела с замещенными аминокислотными остатками (включая делеции и вставки).
В литературе описаны методики замены аминокислотных остатков в вариабельных областях антител IgG и включают гуманизацию (Tsurushita N., Hinton P.R., Kumar S., Design of humanized antibodies: from anti-Tac to Zenapax., Methods., т. 36, №1, cc. 69-83 (май 2005)), "созревание аффинности" для повышения связывающей активности за счет замены аминокислотных остатков в CRD (Rajpal A., Beyaz N., Haber L., Cappuccilli G, Yee H., Bhatt R.R., Takeuchi Т., Lerner R.A., Crea R., A general method for greatly improving the affinity of antibodies by using combinatorial libraries., Proc Natl Acad Sci USA, т. 102, №24, cc. 8466-8471 (июнь 2005)) и улучшение физико-химической стабильности за счет замены аминокислотных остатков в FR (Ewert S., Honegger A., Pluckthun А., Stability improvement of antibodies for extracellular and intracellular applications: CDR grafting to stable frameworks and structure-based framework engineering., Methods, т. 34, №2, cc. 184-199 (октябрь 2004)). Кроме того, известны методики повышения антителозависимой клеточной цитотоксичности (ADCC) и комплиментзависимой клеточной цитотоксичности (CDC) за счет замены аминокислотных остатков в области Fc антитела IgG (Kim S.J., Park Y., Hong H.J., Antibody engineering for the development of therapeutic antibodies., Mol Cells., т. 20, №1, cc. 17-29 (август 2005)). Кроме описанных выше методик повышения эффекторной функции описаны методики повышения периода полураспада антител в крови за счет замены аминокислотного(ых) остатков в области Fc (Hinton P.R., Xiong J.M., Johlfs M.G., Tang M.T., Keller S., Tsurushita N., An engineered human IgG1 antibody with longer serum half-life., J Immunol., т.176, №1, cc. 346-356 (январь 2006), Ghetie V., Popov S., Borvak J., Radu C., Matesoi D., Medesan C., Ober R.J., Ward E.S., Increasing the serum persistence of an IgG fragment by random mutagenesis., Nat. Biotechnol., т.15, №7, cc. 637-640 (июль 1997)). Описаны также различные методики замены аминокислотного(ых) остатков в константных областях для улучшения физических свойств антител (WO 09/41613).
Описаны также способы получения антител человека. Например, требуемые антитела человека с антиген-связывающей активностью можно получать при сенсибилизации лимфоцитов человека in vitro исследуемыми антигенами или клетками, экспрессирующими исследуемые антигены, и при слиянии сенсибилизированных лимфоцитов с клетками миеломы человека, такими как U266 (см. публикацию заявки на выдачу патента Kokoku Японии №(JR-B) Н01-59878 (заявка на выдачу патента Японии, прошедшая экспертизу и опубликованная для опротестования). В другом варианте требуемые антитела человека можно также получать иммунизацией трансгенных животных, содержащих полный набор генов человеческих антител, антигеном (см. заявки №№ WO 93/12227, WO 92/03918, WO 94/02602, WO 94/25585, WO 96/34096 и WO 96/33735). Кроме того, известны методики получения антител человека с использованием пэннинга библиотеки антител человека. Например, вариабельные области человека экспрессируются в виде одноцепочечных антител (scFvs) на поверхности фагов с использованием метода фагового отображения с последующим выбором фагов, которые связываются с антигеном. Гены выбранных фагов можно анализировать для определения последовательностей ДНК, кодирующих вариабельные области антител человека, связывающихся с антигеном. После идентификации последовательностей ДНК scFv, связывающихся с антигеном, для получения антител человека можно сконструировать соответствующие векторы экспрессии, несущие эти последовательности. Такие методы хорошо известны в литературе (см. заявки №№ WO 92/01047, WO 92/20791, WO 93/06213, WO 93/11236, WO 93/19172, WO 95/01438 и WO 95/15388). Антитела по настоящему изобретению также включают такие антитела человека.
После выделения гена антитела и введения в соответствующие организмы-хозяина для продуцирования антител, организмы-хозяина и векторы экспрессии можно использовать в соответствующих комбинациях. При использовании в качестве организма-хозяина эукариотических клеток можно использовать клетки животных, растений и грибов. Известные клетки животных включают: (1) клетки млекопитающих, например, клетки яичника китайского хомячка (СНО), сокультивируемые стромальные клетки (COS), клетки миеломы, клетки почки новорожденного хомячка (ВНК), клетки HeLa и клетки Vero, (2) клетки амфибий, например, ооциты Xenopus и (3) клетки насекомых sf9, sf21 и Tn5. Известные клетки растений включают клетки семейства Nicotiana, такие как Nicotiana tabacum, которые можно получить в виде каллусной культуры. Известные клетки грибов включают дрожжи, такие как семейство Saccharomyces, например, Saccharomyces cerevisiae, и мицелиальные грибы, такие как семейство Aspergillus, например, Aspergillus niger. При использовании прокариотических клеток можно использовать системы для продуцирования, включающие бактериальные клетки. Известные бактериальные клетки включают Escherichia coli (Е. coli) и Bacillus subtilis. Антитела можно получать путем введения исследуемых генов антител в клетки при трансформации с последующим культивированием трансформированных клеток in vitro.
Антитела по настоящему изобретению включают также фрагменты антител, миниантитела и продукты модификации антител. Фрагменты антител и миниантитела включают, например, Fab, F(ab')2, Fv, или одно-, двух- или многовалентные одноцепные Fv (scFv, sc(Fv)2, или аналогичные им), образующиеся в результате связывания цепи Н и цепи L Fvs через соответствующие линкеры (см. Huston J.S. и др., Proc. Natl. Acad. Sci. U.S.A., 85, 5879-5883 (1988)). Более подробно, такие фрагменты антител получают при обработке антител ферментами, такими как папаин или пепсин. В другом варианте конструируют гены, кодирующие такие фрагменты антител, вставляют в векторы экспрессии и затем экспрессируют в соответствующих клетках организма-хозяина (см., например, Со M.S. и др., J. Immunol., 152, 2968-2976 (1994), Better M., Horwitz A. H., Methods Enzymol., 178, 476-496 (1989), Pluckthun A., Skerra A., Methods Enzymol., 178, 497-515 (1989), Lamoyi E., Methods Enzymol., 121, 652-663 (1986), Rousseaux J. и др., Methods Enzymol., 121, 663-669 (1986), Bird R.E., Walker B.W., Trends Biotechnol., 9, 132-137 (1991)).
Антитела, соединенные с различными соединениями, такими как полиэтиленгликоль (ПЭГ), или цитотоксичными агентами, можно использовать в качестве продуктов модификации антител (см. Farmaco, 54 (8), 497-516 (август 30, 1999), Cancer J., 14 (3), 154-169 (май-июнь, 2008)). Антитела по настоящему изобретению включают также такие продукты модификации антител. Такие продукты модификации антител получают химической модификацией антител. Эти методы известны в данной области техники.
Антитела по настоящему изобретению включают, но не ограничиваясь только ими, антитела к антитканевым факторам, антитела к рецепторам IL-6, антитела к IL-6, моноклональные антитела к антигену НМ1.24, антитела к паратиреоидному гормонсвязывающему пептиду (анти-PTHrP), антитела к глипикану-3, антитела к ганглиозиду GM3, антитела к агонисту рецептора ТРО, антитела, замещающие фактор коагуляции VIII, антитела к рецептору IL31, антитела к HLA, антитела к AXL, антитела к CXCR4, антитела к NR10 и биспецифичные антитела к фактору IX и фактору X.
Предпочтительные реконструированные антитела по настоящему изобретению включают, но не ограничиваясь только ими, гуманизированные антитела к рецептору интерлейкина 6 (IL-6) (тоцилизумаб, hPM-1 или MRA) (см. заявку WO 92/19759), гуманизированные моноклональные антитела к антигену НМ1.24 (см. заявку WO 98/14580), гуманизированные антитела к паратиреоидному гормонсвязывающему пептиду (антитела к PTHrP) (см. заявку WO 98/13388), гуманизированные антитела к тканевому фактору (см. заявку WO 99/51743), гуманизированные антитела к глипикану-3 IgG1κ (см. заявку PCT/JP05/013103), гуманизированные антитела к NR10 (см. заявку WO 2009/072604 и биспецифичные гуманизированные антитела кв фактору IX и фактору X. Наиболее предпочтительные гуманизированные антитела по настоящему изобретению включают гуманизированные антитела к рецептору IL-6, гуманизированные антитела к NR10 и биспецифичные антитела к фактору IX и фактору X.
Предпочтительные антитела человека IgM включают рекомбинантные антитела человека IgM к ганглиозиду GM3 (см. заявку WO 05/05636).
Предпочтительные миниантитела включают диантитела к агонисту рецептора ТРО (см. заявку WO 02/33072) и диантитела к агонисту CD47 (см. заявку WO 01/66737).
Термин "антитела с низкой изоэлектрической точкой (антитела с низкой ИЭТ)", использованный в данном контексте, означают антитела с низкой ИЭТ, редко встречающиеся в природе. ИЭТ таких антител составляет, но не ограничиваясь только ими, например, от 3,0 до 8,0, предпочтительно от 5,0 до 7,5, более предпочтительно от 5,0 до 7,0, даже более предпочтительно от 5,0 до 6,8, еще более предпочтительно от 5,0 до 6,5 и наиболее предпочтительно от 5,0 до 6,0. Природные (или обычные антитела) характеризуются ИЭТ от 7,5 до 9,5.
Кроме того, предпочтительные антитела для применения в настоящем изобретении включают антитела с модифицированной ИЭТ, в которых аминокислотный остаток(ки), экспонированный(ые) на поверхности антитела, модифицируют для снижения ИЭТ антитела. Такие антитела с модифицированной ИЭТ включают антитела, ИЭТ которых снижена на 1 единицу или более, предпочтительно на 2 единицы или более и более предпочтительно на 3 единицы или более по сравнению с ИЭТ антитела до модификации. Как описано в разделе Примеры ниже, ИЭТ антител Mab1, полученных модификацией аминокислотной последовательности антитела Mab3 (ИЭТ 9,4) для регулировки ИЭТ, составляет 5,8. Кроме того, полностью гуманизированное антитело NS22 (ИЭТ 7,8), полученное по методике, описанной в примере 12 заявки WO 2009/072604, подвергали модификации аминокислотной последовательности для регулировки ИЭТ и получали антитело Mab2 с ИЭТ 5,6.
Антитела с улучшенной ИЭТ включают, но не ограничиваясь только ими, например, антитела Mab1 (цепь H/SEQ ID NO: 1; цепь L / SEQ ID NO: 2), представляющее собой антитело к рецептору IL-6, описанное в заявке WO 2009/041621, гуманизированные антитела к NR10 и полностью гуманизированные антитела NS22 (цепь H/SEQ ID NO: 3; цепь L / SEQ ID NO: 4), полученное по методике, описанной в примере 12 заявки WO 2009/072604.
В случае вариабельной области цепи Н примеры аминокислотных остатков, экспонированных на поверхности антитела, включают аминокислотные остатки, которые выбирают из аминокислотных остатков, но не ограничиваясь только ими, H1, Н3, Н5, Н8, Н10, Н12, Н13, Н15, Н16, Н19, Н23, Н25, Н26, Н31, Н39, Н42, Н43, Н44, Н46, Н61, Н62, Н64, Н65, Н68, Н71, Н72, Н73, Н75, Н76, Н81, H82b, Н83, Н85, Н86, Н105, Н108, Н110 и H112 согласно нумерации Кабата. В случае вариабельной области цепи L, примеры включают аминокислотные остатки, которые выбирают из аминокислотных остатков, но не ограничиваясь только ими, LI, L3, L7, L8, L9, L11, L12, L16, L17, L18, L20, L22, L24, L27, L38, L39, L41, L42, L43, L45, L46, L49, L53, L54, L55, L57, L60, L63, L65, L66, L68, L69, L70, L74, L76, L77, L79, L80, L81, L85, L100, L103, L105, L106 и L107 согласно нумерации Кабата.
Термин "модификация", использованный в настоящем контексте, означает замену исходного аминокислотного остатка на другой аминокислотный остаток, делецию исходного аминокислотного остатка, вставку нового аминокислотного остатка и т.п., но в предпочтительном варианте этот термин означает замену исходного аминокислотного остатка на другой аминокислотный остаток.
Некоторые аминокислоты являются заряженными. В основном к положительно заряженным аминокислотам относятся лизин (K), аргинин (R) и гистидин (Н) (катионные аминокислоты). К отрицательно заряженным аминокислотам относятся аспарагиновая кислота (D), глутаминовая кислота (Е) и т.п. (анионные аминокислоты). Другие аминокислоты являются незаряженными.
В настоящем изобретении предпочтительно, чтобы аминокислотные остатки после модификации были выбраны из аминокислотных остатков, включенных в одну из групп (а) и (б), представленных ниже, но не ограничиваясь только ими:
(а) глутаминовая кислота (Е) и аспарагиновая кислота (D), и
(б) лизин (K), аргинин (R) и гистидин (Н).
В предпочтительном варианте осуществления настоящего изобретения заряженный до модификации аминокислотный остаток можно модифицировать и получать незаряженный аминокислотный остаток.
Более подробно, модификация по настоящему изобретению включает: (1) замену заряженной аминокислоты на незаряженную аминокислоту, (2) замену заряженной аминокислоты на противоположно заряженную аминокислоту и (3) замену незаряженной аминокислоты на заряженную аминокислоту.
Величину ИЭТ определяют методом изоэлектрического фокусирования, известным специалистам в данной области техники. Теоретические величины изоэлектрических точек рассчитывают с использованием программного обеспечения для анализа нуклеотидных или аминокислотных последовательностей (например, Genetyx).
Антитела с модифицированным зарядом аминокислот получают модификацией нуклеиновых кислот, кодирующих антитела, культивированием таких нуклеиновых кислот в клетки организма-хозяина и очисткой антител из культуры клеток организма-хозяина. Термин "модификация нуклеиновых кислот", использованный в настоящем контексте, означает модификацию последовательностей нуклеиновых кислот таким образом, чтобы они включали кодоны, соответствующие остаткам модифицированных аминокислот. Более подробно, термин означает модификацию нуклеотидной последовательности таким образом, чтобы заменить кодон, кодирующий остаток исходной аминокислоты, на кодон, кодирующий модифицированный остаток. Таким образом, кодон, кодирующий остаток аминокислоты, предназначенной для модификации, заменяется на кодон, кодирующий остаток модифицированной аминокислоты. Такие модификации нуклеиновых кислот могут проводить соответствующим образом специалисты в данной области техники, владеющие известными методиками, такими как, сайт-специфический мутагенез или ПЦР мутагенез.
В предпочтительном варианте осуществления настоящего изобретения способ, включающий следующие стадии, обеспечивает эффективное удаление агрегатов, образующихся в композиции, содержащий антитела с ИЭТ от 3,0 до 8,0:
(а) обработка композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, в кислотных условиях,
(б) нейтрализация кислотной композиции, полученной на стадии (а) и
(в) удаление агрегатов из нейтрализованной композиции, полученной на стадии (б), по крайней мере через 1 ч после нейтрализации.
Примеры агрегатов антител с ИЭТ от 3,0 до 8,0 по настоящему изобретению включают, но не ограничиваясь только ими, 1,5-меры, димеры, тримеры, тетрамеры, пентамеры и т.п.
Способы по настоящему изобретению позволяют эффективно удалять агрегаты антител с низкой ИЭТ, образующиеся в растворе, и обеспечивают снижение риска последующего образования новых агрегатов. Согласно настоящему изобретению примеры кислотных условий для обработки композиции, содержащей антитела, в основном включают, но не ограничиваясь только ими, интервал pH от 2,0 до 4,0, предпочтительно от 3,0 до 3,9 и более предпочтительно от 3,1 до 3,8.
Способ обработки композиции, содержащей антитела, в кислотных условиях, включает, но не ограничиваясь только ими, способ добавления известных кислот, таких как хлористоводородная кислота, лимонная кислота, фосфорная кислота или уксусная кислота, в композицию, содержащую антитела.
Согласно настоящему изобретению, композицию, содержащую антитела, предпочтительно выдерживают в кислотных условиях в течение определенного периода времени. Время выдерживания составляет, но не ограничиваясь только ими, например, от 15 мин до 4 ч, предпочтительно от 30 мин до 2 ч и более предпочтительно от 1 до 1,5 ч.
Согласно настоящему изобретению стадия нейтрализации кислотной композиции относится к стадии нейтрализации композиции, содержащей антитела с ИЭТ от 3,0 до 8,0 и которую обрабатывали в кислотных условиях. Величина pH композиции после нейтрализации обычно находится в интервале, но не ограничиваясь только ими, от 4,5 до 8,5, предпочтительно от 6,5 до 8,5 и более предпочтительно от 7,0 до 8,5.
Результаты, полученные при осуществлении примеров настоящей заявки, свидетельствуют о том, что агрегаты образуются в каждом случае, когда упомянутую выше стадию повышения pH кислотной композиции (такую как стадию нейтрализации) проводят периодически в ходе очистки антител по настоящему изобретению. Следовательно, согласно способу очистки антител или удаления агрегатов по настоящему изобретению, стадию удаления образующихся агрегатов антител предпочтительно проводят после завершения конечной стадии повышения pH (такой как стадии нейтрализации). Более того, предпочтительно стадию повышения pH не осуществляют повторно после удаления агрегатов.
Кроме того, согласно настоящему изобретению после нейтрализации кислотной композиции, содержащей антитела, и после выдерживания композиции в течение определенного периода времени при pH ниже ИЭТ антитела, можно добавить стадию доведения pH композиции выше ИЭТ антитела и выдерживания данной композиции в течение определенного периода времени. Более подробно, в настоящем изобретении предлагается способ очистки композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, включающий следующие стадии:
(а) обработка композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, в кислотных условиях,
(б) нейтрализация кислотной композиции, полученной на стадии (а), и выдерживание композиции при pH ниже ИЭТ антитела, и
(в) доведение pH нейтрализованной композиции, полученной на стадии (б), до величины выше ИЭТ антител, и
(г) удаление агрегатов из нейтрализованной композиции, полученной на стадии (б), через по крайней мере 1 ч после нейтрализации. Примеры величин pH выше ИЭТ антитела, включают, но не ограничиваясь только ими, pH ниже ИЭТ антитела на 0,3 единицы или более, предпочтительно на 0,5 единицы или более и более предпочтительно на 1,0 единицы или более. С другой стороны, примеры величин pH выше ИЭТ антитела, включают, но не ограничиваясь только ими,pH выше ИЭТ антитела на 0,3 единицы или более, предпочтительно на 0,5 единицы или более и более предпочтительно на 1,0 единицы или более. Кроме того, интервалы выдерживания нейтрализованной композиции включают, но не ограничиваясь только ими, 1 ч или более (например, от 1 ч до 7 сут, предпочтительно от 1 до 3 сут), предпочтительно 2 ч или более (например, от 2 ч до 7 сут, предпочтительно от 2 ч до 72 ч), более предпочтительно 6 ч или более (например, от 6 ч до 7 сут, предпочтительно от 6 ч до 72 ч) и еще более предпочтительно 12 ч или более (например, от 12 ч до 7 сут, предпочтительно от 12 ч до 72 ч).
Нейтрализацию проводят с использованием буферного вещества. Буферные вещества, используемые для нейтрализации, включают без особого ограничения любые стандартные буферные вещества, используемые для доведения pH, и их примеры включают, но не ограничиваясь только ими, трис и дигидрофосфат натрия, и предпочтительным является трис.
Настоящее изобретение характеризуется установлением нового факта, который заключается в том, что после нейтрализации кислотного раствора, содержащего антитела, необратимое образование агрегатов продолжается в течение определенного периода времени. Данное явление не наблюдается для стандартных антител с немодифицированной ИЭТ (антитела с ИЭТ приблизительно 9). Несмотря на то, что причина необратимого образования агрегатов не установлена, данное явление может быть вызвано переведением антитела с низкой ИЭТ в кислотные условия, доведением pH композиции приблизительно до ИЭТ антитела и изменением заряда молекул антитела в результате доведения pH композиции до ИЭТ антитела. В любом случае, согласно способам по настоящему изобретению, удаление образовавшихся агрегатов антител через некоторое время после нейтрализации обработанных кислотой антител с ИЭТ от 3,0 до 8,0 предотвращает образование новых агрегатов после их удаления.
Более подробно, интервал времени до удаления агрегатов нейтрализованных антител обычно составляет, но не ограничиваясь только ими, 1 ч или более (например, от 1 ч до 7 сут, предпочтительно от 1 до 3 сут), предпочтительно 2 ч или более (например, от 2 ч до 7 сут, предпочтительно от 2 ч до 72 ч), более предпочтительно 6 ч или более (например, от 6 ч до 7 сут, предпочтительно от 6 ч до 72 ч) и еще более предпочтительно 12 ч или более (например, от 12 ч до 7 сут, предпочтительно от 12 ч до 72 ч) и наиболее предпочтительно 20 ч, 23 ч, 24 ч, 66 ч или более.
В другом варианте осуществления настоящего изобретения через определенное время, достаточное для образования агрегатов, агрегаты удаляют из нейтрализованной композиции. Термин "время, достаточное для образования агрегатов", использованный в настоящем контексте, означает время, необходимое для антител, для которых ожидается образование агрегатов в нейтрализованной композиции. Время, достаточное для образования агрегатов по настоящему изобретению, включает не только время, необходимое для всех антител, для которых ожидается образование агрегатов, но также и время, необходимое для образования по крайней мере 50% или более, предпочтительно 70% или более, более предпочтительно 80% или более и наиболее предпочтительно 90% или более агрегатов антител, для которых ожидается образование агрегатов. Принимая во внимание время образования агрегатов, представленное в табл. 1, специалисты в данной области техники могут определить продолжительность периода до удаления агрегатов после нейтрализации.
В другом варианте агрегаты можно удалять из нейтрализованной композиции после образования 50% агрегатов или более, предпочтительно 70% агрегатов или более, более предпочтительно 80% агрегатов или более и наиболее предпочтительно 90% агрегатов или более в расчете на количество агрегатов, которое может образоваться в композиции. Согласно настоящему изобретению, количество агрегатов, которое может образоваться в нейтрализованной композиции, означает количество агрегатов, образующихся из антител, для которых ожидается образование агрегатов в нейтрализованной композиции. Примеры количеств агрегатов, которые могут образоваться в нейтрализованной композиции, включают, но не ограничиваясь только ими, количество агрегатов, в основном образующихся после выдерживания композиции в течение 1 ч или более (например, от 1 ч до 7 сут, предпочтительно от 1 до 3 сут), предпочтительно 2 ч или более (например, от 2 ч до 7 сут, предпочтительно от 2 ч до 72 ч), более предпочтительно 6 ч или более (например, от 6 ч до 7 сут, предпочтительно от 6 ч до 72 ч) и еще более предпочтительно в течение 24 ч после нейтрализации.
В еще одном варианте агрегаты можно удалять из нейтрализованной композиции после завершения образования 50% агрегатов или более, предпочтительно 70% агрегатов или более, более предпочтительно 80% агрегатов или более и наиболее предпочтительно 90% агрегатов или более в расчете на количество агрегатов, которое может образоваться в композиции. Согласно настоящему изобретению, возможное количество агрегатов, которое может образоваться в нейтрализованной композиции, означает количество агрегатов, образующихся из антител, для которых ожидается образование агрегатов в нейтрализованной композиции.
В другом варианте агрегаты можно удалять из нейтрализованной композиции по крайней мере за 1 ч до завершения образования агрегатов. Термин "завершение образования агрегатов", использованный в настоящем контексте, означает завершение образования агрегатов антител, для которых ожидается образование агрегатов. Завершение образования агрегатов по настоящему изобретению относится не только к образованию агрегатов из всех антител, для которых ожидается образование агрегатов, но также и к завершению образования по крайней мере 50% или более агрегатов, предпочтительно 70% или более, более предпочтительно 80% или более агрегатов и наиболее предпочтительно 90% или более агрегатов антител, для которых ожидается образование агрегатов.
Завершение образования агрегатов можно оценить, например, при анализе нейтрализованной композиции по настоящему изобретению с течением времени с использованием эксклюзионной хроматографии (SEC) после нейтрализации и введением количества образующихся агрегатов в столбцы таблицы, как описано в приведенном ниже разделе Примеры.
Согласно настоящему изобретению образовавшиеся агрегаты можно удалять с использованием известных методик анионообменной хроматографии, хроматографии на мультимодальных разделительных матрицах, гидрофобной хроматографии, хроматографии на гидроксиапатите и т.п. Наиболее предпочтительным является использование анионообменной хроматографии или хроматографии на гидроксиапатите.
Кроме того, агрегаты по настоящему изобретению можно эффективно удалять с использованием стадии очистки на анионообменной смоле в режиме связывания/элюирования, как описано ниже.
Анионообменные смолы по настоящему изобретению включают все смолы с анионообменными свойствами. Анионообменные смолы включают, но не ограничиваясь только ими:
YMC-BioPro (фирмы YMC Co. Ltd.),
Q Sepharose High Performance (фирмы GE Healthcare),
Q Sepharose Fast Flow (фирмы GE Healthcare),
Q Sepharose XL (фирмы GE Healthcare),
Capto Q ImpRes (фирмы GE Healthcare),
Capto Q (фирмы GE Healthcare),
Capto DEAE (фирмы GE Healthcare),
SOURCE 30Q (фирмы GE Healthcare),
SOURCE 15Q (фирмы GE Healthcare),
POROS HQ (фирмы Life Technologies, Inc.),
POROS D (фирмы Life Technologies, Inc.),
POROS PI (фирмы Life Technologies, Inc.),
Eshumuno Q (фирмы Merck Millipore Corp.),
Fractogel TMAE (фирмы Merck Millipore Corp.),
Fractogel DEAE (фирмы Merck Millipore Corp.),
Macro-Prep Q (фирмы Bio-Rad Laboratories Inc.),
Macro-Prep DEAE (фирмы Bio-Rad Laboratories Inc.),
Giga Cap Q-650M (фирмы TOSOH Corp.),
Giga Cap DEAE-650M (фирмы TOSOH Corp.) и
Q HyperCel (фирмы PALL Corp.).
Кроме того, примеры смол для колоночной хроматографии на гидроксиапатите включают, но не ограничиваясь только ими:
Ceramic Hydroxyapatite (фирмы Bio-Rad Laboratories Inc.),
Ceramic Fluoloapatite (фирмы Bio-Rad Laboratories Inc.),
MPC Ceramic Hydroxyfluoloapatite (фирмы Bio-Rad Laboratories Inc.) и
HA Ultragel (фирмы PALL Corp.).
Примеры смол для хроматографии на мультимодальных разделительных матрицах включают, но не ограничиваясь только ими:
Capto Adhere (фирмы GE Healthcare),
Capto MMC (фирмы GE Healthcare) и
Eshumuno HCX (фирмы Merck Millipore Corp.).
Примеры смол для гидрофобной хроматографии включают, но не ограничиваясь только ими:
Phenyl Sepharose High Performance (фирмы GE Healthcare),
Butyl Sepharose High Performance (фирмы GE Healthcare),
Phenyl Sepharose 6 Fast Flow (фирмы GE Healthcare),
Butyl-S Sepharose 6 Fast Flow (фирмы GE Healthcare),
Butyl Sepharose 4 Fast Flow (фирмы GE Healthcare),
Octyl Sepharose 4 Fast Flow (фирмы GE Healthcare),
Capto Phenyl ImpRes (фирмы GE Healthcare),
Capto Phenyl (фирмы GE Healthcare),
Capto Butyl (фирмы GE Healthcare),
Capto Octyl (фирмы GE Healthcare),
Fractogel Phenyl фирмы (Merck Millipore Corp.),
Fractogel Propyl (фирмы Merck Millipore Corp.),
TOYOPEARL Butyl (фирмы TOSOH Corp.),
TOYOPEARL Ether (фирмы TOSOH Corp.),
TOYOPEARL Hexyl (фирмы TOSOH Corp.),
TOYOPEARL Phenyl (фирмы TOSOH Corp.),
TOYOPEARL PPG (фирмы TOSOH Corp.),
TOYOPEARL SuperButyl (фирмы TOSOH Corp.),
TOYOPEARL Butyl-600 (фирмы TOSOH Corp.) и
Macro-Prep HIC (фирмы Bio-Rad Laboratories Inc.).
Степень удаления агрегатов можно определить с использованием методов, известных специалистам в данной области техники, такими как эксклюзионная хроматография, но не ограничиваясь только ими.
Согласно настоящему изобретению, композиция, содержащая антитела и обработанная в кислотных условиях, может представлять собой композицию, очищенную с использованием стандартных методов очистки, таких как колоночная хроматография на иммобилизованном белке A. Таким образом, способ удаления агрегатов по настоящему изобретению включает "стадию очистки композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, с использованием колоночной хроматографии на иммобилизованном белке A", которую проводят перед "(а) стадией обработки композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, в кислотных условиях".
Кроме того, согласно настоящему изобретению, после стадий (а)-(в), описанных выше для удаления агрегатов антител с ИЭТ от 3,0 до 8,0, можно включать описанную позднее стадию очистки с использованием анионообменной хроматографии в режиме связывания/элюирования и/или стадию очистки с использованием мультимодальной хроматографии в проточном режиме или гидрофобной хроматографии в проточном режиме. Если объединять эти стадии, можно эффективно очищать антитела с ИЭТ от 3,0 до 8,0, включая удаление других примесей, отличающихся от агрегатов.
Более подробно, настоящее изобретение относится к способу эффективного удаления примесей из композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, с использованием способа, включающего следующие стадии:
(а) нанесение композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, на анионообменную смолу, и
(б) элюирование антител с ИЭТ от 3,0 до 8,0 из анионообменной смолы в режиме связывание/элюирование с использованием раствора для элюирования, концентрация соли в котором превышает концентрацию соли в композиции на стадии (а).
В описанный выше метод перед стадией (б) можно включить стадию промывки анионообменной смолы раствором для промывки.
Как описано ниже, согласно настоящему изобретению фракцию, элюированную из анионообменной смолы, можно дополнительно очистить хроматографией на мультимодальных разделительных матрицах или гидрофобной хроматографией. При этом достигается дополнительное удаление примесей.
Примесями, предназначенными для удаления, являются любые соединения, не являющиеся исследуемым белком. Примеры примесей включают, но не ограничиваясь только ими, белки и ДНК из клеток организма-хозяина, белок A (вымываемый из колонки), фрагменты и агрегаты, образовавшиеся из исследуемого белка, вирусы, эндотоксины, компонент среды Hy-Fish(FL), инсулиноподобный фактор роста IGF, инсулин, антибиотики, противовспениватели. В предпочтительном варианте, можно удалять, но не ограничиваясь только ими, белки и ДНК из клеток организма-хозяина, белок A, фрагменты и агрегаты, образовавшиеся из исследуемого белка (например, агрегаты антител), и вирусы.
Согласно способу по настоящему изобретению можно удалять любые вирусы. Вирусы по настоящему изобретению включают ДНК-вирусы и РНК-вирусы. ДНК-вирусы включают, но не ограничиваясь только ими, парвовирусы, такие как мелкий вирус мышей MVM, и РНК-вирусы включают ретровирусы, такие как MuLV, и реовирусы, такие как Reo 3. Более подробно, примеры вирусов, удаляемых с использованием способа по настоящему изобретению, включают, но не ограничиваясь только ими, вирусы, такие как MuLV, PRV, Reo 3, MVM, SV40, вирус везикулярного стоматита VSV, простого герпеса, CHV, Синдбис, вирус эпидемического паротита, вирус осповакцины, цистицеркоз, краснуха, вирус гриппа, вирус опоясывающего герпеса, цитомегаловирус, вирус парагриппа, ЕВ, HIV, НА, НВ, NANB, ATL, ECHO и парвовирус, и предпочтительно вирусы, такие как MuLV, Reo 3, MVM, PRV и SV40, но не ограничиваясь только ими.
Согласно настоящему изобретению, характеристики антител с низкой ИЭТ впервые использовали для разработки способа очистки антител с использованием анионообменной колонки в режиме связывания/элюирования, которую нельзя использовать для обычных антител с относительно высокой ИЭТ. Кроме того, впервые разработан способ очистки, позволяющий дополнительно удалять примеси при совместном использовании мультимодальной и гидрофобной хроматографии.
Согласно способам по настоящему изобретению в качестве условий для очистки композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, с использованием анионообменной смолы, обычно используют колонку, уравновешенную буферным раствором, pH от 6 до 9, содержащим трис, BIS-TRIS и гистидин в концентрации от 1 ммоль/л до 100 ммоль/л с добавлением хлоридных и ацетатных ионов в качестве противоионов. В предпочтительном варианте, но не ограничиваясь только ими, очистку проводят с использованием колонки, уравновешенной буферным раствором, pH от 7 до 8, таким как трис, в концентрации от 10 ммоль/л до 50 ммоль/л с добавлением хлоридных или ацетатных ионов в качестве противоионов.
Кроме того, способы по настоящему изобретению могут включать стадию промывки анионообменной колонки, на которую адсорбируются антитела с ИЭТ от 3,0 до 8,0. Промывку проводят в условиях, аналогичных стандартным условиям уравновешивания, или с использованием буферного раствора с равным или более высоким pH или с меньшей концентрацией соли по сравнению с буферными растворами для элюирования. Более подробно, промывку проводят с использованием колонки, уравновешенной буферным раствором, pH от 6 до 9, содержащим трис, BIS-TRIS и гистидин в концентрации от 1 ммоль/л до 100 ммоль/л с добавлением хлоридных и ацетатных ионов в качестве противоионов. В предпочтительном варианте, но не ограничиваясь только ими, промывку проводят с использованием колонки, уравновешенной буферным раствором, pH от 7 до 8, содержащим трис в концентрации от 10 ммоль/л до 50 ммоль/л с добавлением хлоридных или ацетатных ионов в качестве противоионов.
Кроме того, согласно способам по настоящему изобретению антитела элюируют из анионообменной смолы в режиме связывания/элюирования с использованием раствора для элюирования, концентрация соли в котором превышает концентрацию соли в композиции, содержащей антитела с ИЭТ от 3,0 до 8,0. Условия элюирования обычно включают использование буферного раствора, от 6 до 9, содержащего трис, BIS-TRIS и гистидин в концентрации от 1 ммоль/л до 500 ммоль/л с добавлением хлоридных или ацетатных ионов в качестве противоионов, и также с добавлением при необходимости хлорида натрия, хлорида калия, сульфата натрия и фосфата натрия. В предпочтительном варианте, но не ограничиваясь только ими, элюирование проводят с использованием буферного раствора с pH от 7 до 8, содержащего трис в концентрации от 10 ммоль/л до 500 ммоль/л с добавлением хлоридных или ацетатных ионов в качестве противоионов, и также с добавлением при необходимости хлорида натрия, сульфата натрия и фосфата натрия в концентрации от 50 ммоль/л до 500 ммоль/л. Примеры концентраций соли, превышающих концентрацию соли в композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, включают, но не ограничиваясь только ими, 5 ммоль/л или более и предпочтительно 10 ммоль/ или более. Растворы для элюирования включают, но не ограничиваясь только ими, растворы, содержащие по крайней мере одну соль, которую выбирают из группы, включающей хлорид натрия, трис, сульфат натрия и фосфат натрия.
Согласно настоящему изобретению элюируемую фракцию (элюат), содержащую антитела с ИЭТ от 3,0 до 8,0, полученную из анионообменной смолы, можно дополнительно очищать мультимодальной хроматографией (например, с использованием смол, обладающих одновременно гидрофобными и анионообменными свойствами).
Очистку композиций, содержащих антитела, на мультимодальных хроматографических смолах обычно проводят с использованием буферного раствора, pH от 4 до 9, содержащего трис, BIS-TRIS и гистидин в концентрации от 1 ммоль/л до 500 ммоль/л с добавлением хлоридных и ацетатных ионов в качестве противоионов, и также с добавлением при необходимости хлорида натрия, хлорида калия, сульфата натрия, сульфата аммония, цитрата натрия и аргинина. В предпочтительном варианте, но не ограничиваясь только ими, очистку проводят с использованием колонки, уравновешенной буферным раствором, pH от 6 до 7, содержащего трис, в концентрации от 10 ммоль/л до 500 ммоль/л с добавлением хлоридных или ацетатных ионов в качестве противоионов, и также с добавлением при необходимости хлорида натрия и/или сульфата натрия в концентрации от 50 ммоль/л до 500 ммоль/л.
Фракцию, содержащую исследуемые антитела с ИЭТ от 3,0 до 8,0, можно получать в виде проточной фракции, выходящей в свободном объеме, и/или фракции элюата с мультимодальной колонки при нанесении фракции элюата из анионообменной колонки, полученной согласно способу по настоящему изобретению. Обычно pH проточной фракции предварительно доводят до pH, при котором уравновешивают колонку, и, при необходимости, можно добавлять соли, аналогичные солям в буферных растворах для уравновешивания.
Согласно настоящему изобретению проточная фракция означает фракции, которые после нанесения на колонку проходят через сорбент без адсорбции (примеси адсорбируются на колонку, а исследуемое вещество не адсорбируется на нее). С другой стороны, элюированная фракция означает фракции, которые собирают при пропускании через сорбент буферного раствора, концентрация соли в котором превышает концентрацию соли во фракции для нанесения (исследуемое вещество адсорбируется на колонку и в некоторых случаях примеси также адсорбируются).
Кроме того, согласно настоящему изобретению, элюированную фракцию (элюат), содержащую антитела с ИЭТ от 3,0 до 8,0, полученную из анионообменной хроматографической смолы, можно дополнительно очищать гидрофобной хроматографией.
Очистку композиций, содержащих антитела, на хроматографических гидрофобных смолах обычно проводят с использованием буферного раствора, pH от 4 до 9, содержащего трис, BIS-TRIS и гистидин в концентрации от 1 ммоль/л до 500 ммоль/л с добавлением хлоридных или ацетатных ионов в качестве противоионов, и также с добавлением при необходимости хлорида натрия, хлорида калия, сульфата натрия, сульфата аммония, цитрата натрия и аргинина. В предпочтительном варианте, без особого ограничения, очистку проводят с использованием колонки, уравновешенной буферным раствором, pH от 7 до 8, содержащим трис в концентрации от 10 ммоль/л до 500 ммоль/л с добавлением хлоридных или ацетатных ионов в качестве противоионов, и также с добавлением при необходимости хлорида натрия и/или сульфата натрия в концентрации от 50 ммоль/л до 500 ммоль/л.
Фракции, содержащие исследуемые антитела с ИЭТ от 3,0 до 8,0, можно получать в виде проточной фракции и/или элюата, полученных после гидрофобной хроматографии, и которые получают при нанесении элюата из анионообменной колонки согласно способу по настоящему изобретению. Обычно pH фракции для нанесения предварительно доводят до pH, при котором уравновешивали колонку, и, при необходимости, добавляют соли, аналогичные солям, содержащимся в буферных растворах для уравновешивания.
Согласно способам по настоящему изобретению, если исключить добавление хлоридных ионов в буферные растворы и фракции для нанесения, можно предотвратить коррозию в резервуарах для буферных растворов и фракций.
Согласно способам по настоящему изобретению, для удаления примесей из композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, композицией, которую наносят на анионообменную хроматографическую смолу, может являться композиция, которую перед нанесением на анионообменную хроматографическую смолу очищали известными способами очистки, такими как колоночная хроматография на иммобилизованном белке А. Композицией, которую наносят на анионообменную смолу, может являться композиция, обработанная на следующих стадиях (а)-(в):
(а) выдерживание композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, в кислотных условиях,
(б) нейтрализация кислотной композиции, полученной на стадии (а), и
(в) удаление агрегатов из нейтрализованной композиции, полученной на стадии (б), по крайней мере через 1 ч после нейтрализации.
Если примесями являются белки, то степень удаления примесей можно определить с использованием эксклюзионной хроматографии (SEC), без особого ограничения.
В случае ДНК определение проводят количественным методом ПЦР, пороговым методом и т.п., но не ограничиваясь только ими.
В случае белков клеток организма-хозяина (НСР) определение проводят методом ИФА, в котором используются антитела против НСР, но не ограничиваясь только ими.
В случае белка A определение проводят методом ИФА, в котором используются антитела против белка A, но не ограничиваясь только ими.
В случае вирусов определение проводят количественным методом ПЦР, методом инфицирования тканей, методом бляшек и т.п., но не ограничиваясь только ими.
В случае IGF определение проводят с использованием ИФА, в котором используются антитела против инсулиноподобного фактора роста IGF, но не ограничиваясь только ими.
В случае инсулина определение проводят методом ИФА, в котором используются антитела против инсулина, но не ограничиваясь только ими.
В случае компонента среды FL определение проводят методом ИФА, в котором используются антитела против FL, но не ограничиваясь только ими.
В случае противовспенивающих агентов определение проводят методом ЯМР, но не ограничиваясь только им.
В случае эндотоксина определение проводят колориметрическим методом или методом турбидиметрии, основанных на реакции, активирующей лизат амебоцитов мечехвоста (LAL), который является компонентом, экстрагированным из клеток крови мечехвоста, но не ограничиваясь только им.
В случае антибиотиков их концентрации определяют методом ИФА, в котором используют антитела, специфично распознающие антибиотики, такие как гентамицин, но не ограничиваясь только ими.
Кроме того, в настоящем изобретении предлагается способ очистки антител с ИЭТ от 3,0 до 8,0, включающий стадию удаления агрегатов антител и/или примесей из композиции, содержащей антитела с ИЭТ от 3,0 до 8,0. Кроме того, в настоящем изобретении предлагается способ получения композиции, содержащей антитела с ИЭТ от 3,0 до 8,0. Этот способ включает следующие стадии:
(а) получение композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, и
(б) очистка антител с ИЭТ от 3,0 до 8,0 из композиции, полученной на стадии (а), например, с использованием способа очистки, описанного в настоящем контексте.
Очистка антител включает удаление агрегатов антител и/или примесей из композиций, содержащих антитела. Уровень агрегатов, содержащихся в композиции по настоящему изобретению, включающей антитела с ИЭТ от 3,0 до 8,0, составляет, например, 5% или менее, предпочтительно 4% или менее и наиболее предпочтительно 3% или менее, но не ограничиваясь только ими. Термин "уровень антител", использованный в настоящем изобретении, означает долю антител, образующих агрегаты, относительно количества антител в композиции.
Кроме того, в настоящем изобретении предлагаются антитела с ИЭТ от 3,0 до 8,0, полученные с использованием способов очистки или аналогичных способов или способов продуцирования, описанных в настоящем контексте, или фармацевтические композиции, содержащие такие антитела. Фармацевтические композиции по настоящему изобретению могут содержать фармацевтически приемлемые носители и/или добавки.
Кроме того, в настоящем изобретении предлагается способ получения фармацевтической композиции, содержащей антитела с ИЭТ от 3,0 до 8,0, включающий следующие стадии:
1) получение антител с ИЭТ от 3,0 до 8,0 с использованием способа, описанного в настоящем контексте, и
2) получение композиции из антител с ИЭТ от 3,0 до 8,0, полученных на стадии 1), при их смешивании с фармацевтически приемлемым носителем и/или добавкой.
Фармацевтические композиции по настоящему изобретению могут представлять собой жидкие композиции (жидкие композиции, содержащие антитела) или лиофилизированные композиции. Жидкие композиции по настоящему изобретению включают растворы до лиофилизации в процессе получения лиофилизированных композиций, или растворы после повторного растворения. Жидкие композиции по настоящему изобретению предпочтительно представляют собой жидкие композиции, полученные без включения в процесс их получения стадии лиофилизации. Лиофилизированные агенты можно получать при лиофилизации жидких композиций по настоящему изобретению с использованием способов, известных специалистам в данной области техники.
Композиции по настоящему изобретению могут при необходимости включать добавки, такие как криозащитные добавки, суспендирующие агенты, солюбилизирующие агенты, изотонизирующие агенты, консерванты, агенты, предотвращающие адсорбцию, разбавители, эксципиенты, регуляторы кислотности, обезболивающие агенты, серосодержащие восстановители, антиоксиданты и носители.
Примеры криозащитных агентов включают, но не ограничиваясь только ими, такие как, трегалоза, сахароза и сорбит.
Примеры солюбилизирующих агентов включают, но не ограничиваясь только ими, полиоксиэтиленированное гидрированное касторовое масло, полисорбат 80, никотинамид, полиоксиэтиленированный сорбитанмонолаурат, макрогол и этиловый эфир касторового масла и жирной кислоты.
Примеры изотонизирующих агентов включают, но не ограничиваясь только ими, хлорид натрия, хлорид калия и хлорид кальция.
Примеры консервантов включают, но не ограничиваясь только ими, метил-пара-гидроксибензоат, этил-пара-гидроксибензоат, сорбиновую кислоту, фенол, крезол и хлоркрезол.
Примеры агентов, предотвращающих адсорбцию, включают, но не ограничиваясь только ими, сывороточный альбумин человека, лецитин, декстран, сополимер этиленоксида и пропиленоксида, гидроксипропилцеллюлозу, метилцеллюлозу, полиоксиэтиленированное гидрированное касторовое масло и полиэтиленгликоль.
Примеры серосодержащих восстановителей включают, но не ограничиваясь только ими, N-ацетилцистеин, N-гомоцистеин, липоевую кислоту, тиодигликоль, тиоэтаноламин, тиоглицерин, тиосорбит, тиогликолевую кислоту и ее соли, тиосульфат натрия, глютатион и соединения с сульфогидрильными группами, такие как тиоалкановые кислоты, содержащие от 1 до 7 атомов углерода.
Примеры антиоксиданотов включают, но не ограничиваясь только ими, изоаскорбиновую кислоту, дибутигидрокситолуол, бутилгидроксианизол, α-токоферол, ацетат токоферола, L-аскорбиновую кислоту и ее соли, L-аскорбилпальмитат, L-аскорбилстеарат, гидросульфит натрия, триамилгаллат, пропилгаллат или хелатные агенты, такие как динатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА), пирофосфат натрия и метафосфат натрия.
Композицию по настоящему изобретению можно вводить перорально или парентерально, но обычно его вводят парентеральным способом. Более подробно, ее вводят с использованием инъекций, чрескожным способом, чресслизистым способом, трансназальным способом, транспульмональным способом и т.п. Примеры типов инъекций включают подкожные инъекции, внутривенные инъекции, внутримышечные инъекции и инъекции, обеспечивающие системное или местное введение. При подкожных инъекциях существует ограничение количества раствора для инъекции, но количество антител, вводимых за одну инъекцию, может быть большим (от 100 до 200 мг или т.п.). Таким образом, композиции по настоящему изобретению являются прежде всего пригодными для подкожного введения (с помощью инъекций).
Все документы, цитированные в описании, включены в настоящее изобретение в качестве ссылок.
Примеры
Настоящее изобретение подробно описано в настоящем контексте со ссылкой на примеры, однако объем изобретения не ограничивается только ими.
Пример 1
Подавление образования агрегатов на следующих стадиях при выдерживании после инактивации вирусов и нейтрализации B примерах использовали следующие антитела.
Mab1: антитела к рецептору IL-6, описанные в заявке WO 2009/041621, ИЭТ которых доводили до 5,8 в результате модификации аминокислот Mab3. Аминокислотные последовательности антитела Mab1 представляют собой цепь Н / SEQ ID NO: 1 и цепь L / SEQ ID NO: 2.
Mab2: антитела к NR10 (рецептор IL-31), которые являются полностью гуманизированными антителами NS22, полученными, как описано в примере 12 заявки WO 2009/072604. Такие антитела относятся к классу IgG2, и их получают снижением ИЭТ до 5,6 в результате модификации аминокислотных последовательностей. Аминокислотные последовательности антитела Mab2 представляют собой цепь Н / SEQ ID NO: 3 и цепь L / SEQ ID NO: 4.
Mab3: тоцилизумаб (цепь Н / SEQ ID NO: 5 и цепь L / SEQ ID NO: 6). ИЭТ составляет 9,4.
Упомянутые выше антитела экспрессировали по методикам, известным специалистам в данной области техники, с использованием стабильно экспрессирующей клеточной линии СНО, затем очищали по методикам, известным специалистам в данной области техники, включая колоночную хроматографию на иммобилизованном белке A, и затем использовали для оценки степени удаления агрегатов в приведенных ниже примерах.
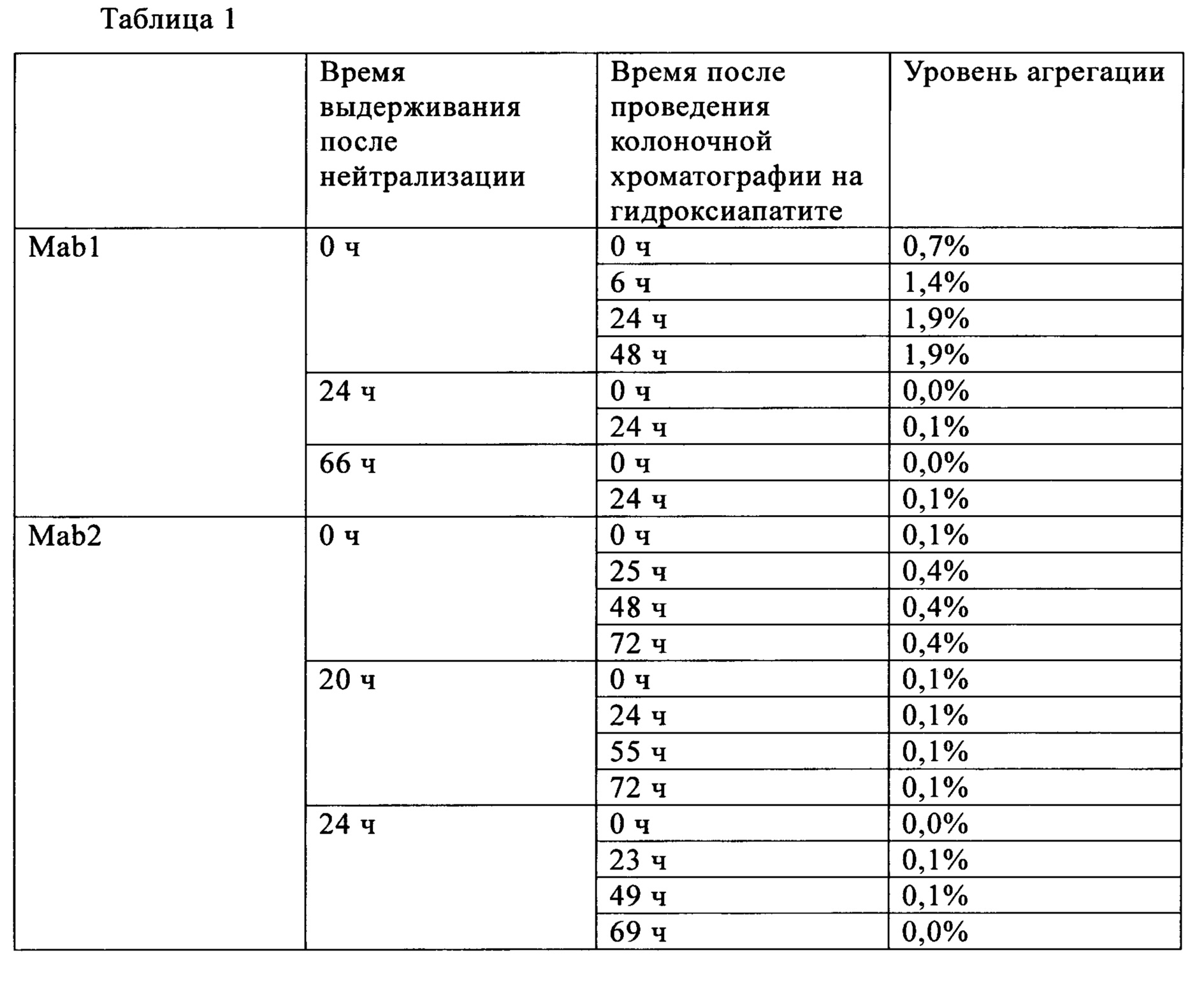
При имитации стадии инактивации вируса в реальных процессах продуцирования и очистки, растворы очищенных антител Mab1 и Mab2, после добавления в них 1 моль/л хлористоводородной кислоты, выдерживали при pH 3,8 или менее в течение 30 мин или более. Выдержанные фракции обрабатывали буферным раствором трис в концентрации от 1 до 2 моль/л для нейтрализации до pH 6,5 или более. Фракции, выдержанные в течение различных периодов времени после нейтрализации, характеризовались высокой степенью очистки после удаления агрегатов по методикам, известным специалистам в данной области техники, включая колоночную хроматографию на гидроксиапатите, или по методикам, включающим анионообменную хроматографию. Фракции с удаленными агрегатами затем выдерживали, и количество агрегатов, присутствующих в зависимости от времени выдерживания после очистки, рассчитывали по площади пика в процентах с использованием эксклюзионной хроматографии (SEC).
Для хроматографии на гидроксиапатите антител Mab1 колонку уравновешивали фосфатным буферным раствором в концентрации 10 ммоль/л (pH 6,5), и затем на нее наносили нейтрализованную фракцию. После промывки колонки фосфатным буферным раствором в концентрации 10 ммоль/л (pH 6,5) концентрацию соли повышали с использованием раствора хлорида натрия в концентрации 500 ммоль/л и антитела Mab1 элюировали фосфатным буферным раствором в концентрации 10 ммоль/л. Для очистки антител Mab2 колонку уравновешивали фосфатным буферным раствором в концентрации 10 ммоль/л (pH 6,5), и затем на нее наносили нейтрализованную фракцию. После промывки колонки фосфатным буферным раствором в концентрации 10 ммоль/л (pH 6,5), содержащим 100 ммоль/л MES, концентрацию соли повышали с использованием раствора хлорида натрия в концентрации 200 ммоль/л и антитела Маb2 элюировали фосфатным буферным раствором в концентрации 17,5 ммоль/л (pH 6,6).
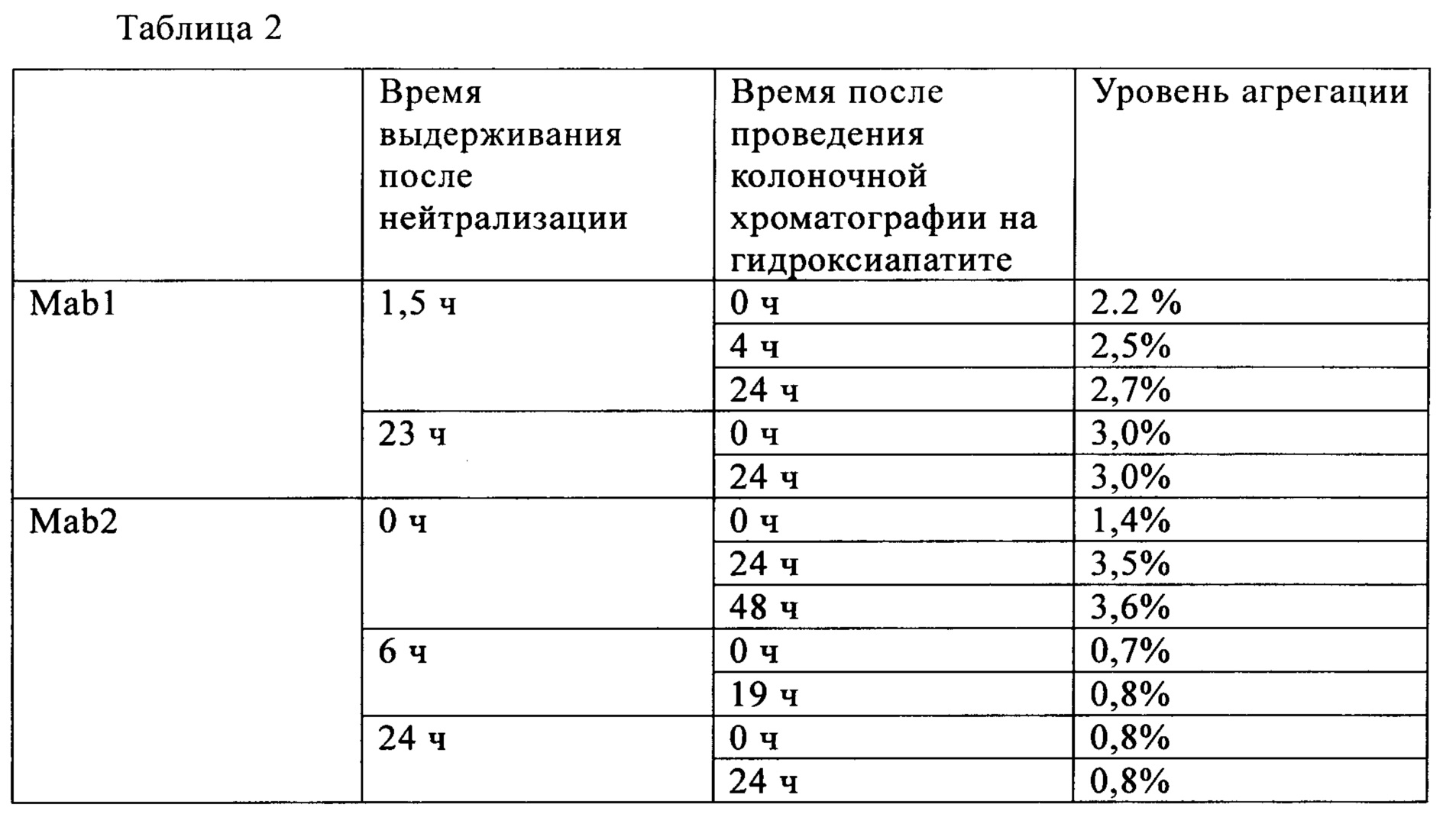
Для очистки антител Mab1 анионообменной хроматографией колонку уравновешивали 20 ммоль/л трис-ацетатным буферным раствором (pH 8,0) и наносили нейтрализованную фракцию. После промывки колонки 20 ммоль/л трис-ацетатным буферным раствором (pH 8,0) концентрацию соли повышали с использованием 267 ммоль/л трис-ацетатного буферного раствора, которым затем элюировали Mab1. Для очистки антител Маb2 колонку уравновешивали 20 ммоль/л буферным раствором трис-HCl и затем наносили нейтрализованную фракцию. После промывки колонки 20 ммоль/л буферным раствором трис-HCl (pH 7,0) концентрацию соли повышали с использованием раствора NaCl в концентрации от 350 до 360 ммоль/л и антитела Маb2 элюировали 20 ммоль/л буферным раствором трис-HCl (pH 7,0-7,2).
Антитела Маb3 аналогичным образом выдерживали в хлористоводородной кислоте и затем нейтрализовали. Затем рассчитывали количество агрегатов, образовавшихся в течение времени выдерживания после нейтрализации.
Для анализа количества агрегатов, образовавшихся через каждый период выдерживания, использовали эксклюзионную хроматографию. Каждый образец разбавляли до концентрации приблизительно 1,0 г/л с использованием мобильной фазы, как описано ниже, и полученные образцы анализировали на колонке G3000SWXL (фирмы Tosoh). В качестве мобильной фазы использовали 50 ммоль/л фосфатный буферный раствор (pH 7,5), содержащий 300 ммоль/л NaCl, и анализ проводили при скорости потока 0,5 мл/мин. Пик, элюированный перед пиком мономера, содержит агрегаты, и содержание (в %) мономера и агрегатов рассчитывали по площади пика в процентах.
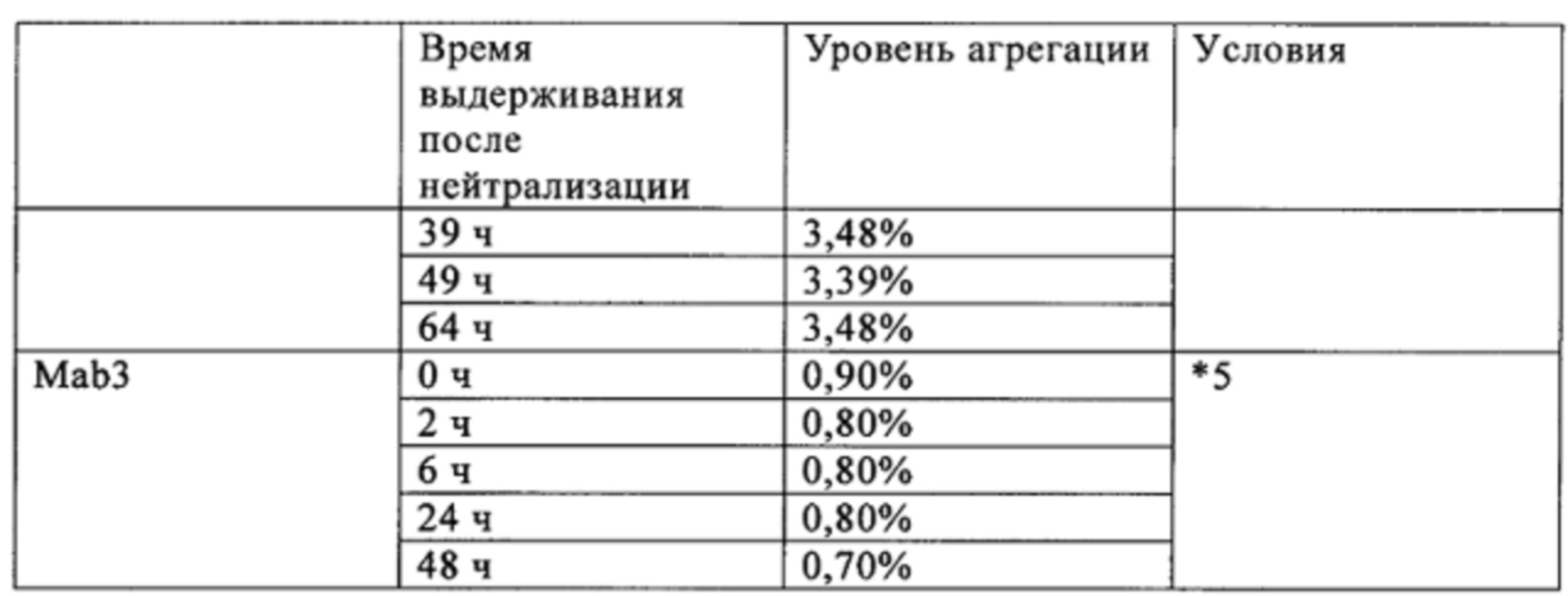
Время выдерживания после нейтрализации и количество агрегатов после проведения хроматографии на гидроксиапатите (доля агрегатов) для антител Mab1 и Маb2 представлена в табл. 1. Количество агрегатов, присутствующих после проведения анионообменной хроматографии, представлено в табл. 2. Для антител Mab1, Маb2 и Маb3 количество агрегатов в зависимости от времени выдерживания после нейтрализации представлено в табл. 3. Полученные результаты свидетельствуют о том, что в случае обоих антител Mab1 и Маb2 агрегаты образуются снова, если их удаляли хроматографией немедленно после нейтрализации, в то время как увеличение количества агрегатов после очистки не наблюдалось, если очистку проводили через определенные интервалы времени после нейтрализации. В то же время, увеличение количества агрегатов после нейтрализации не наблюдали в случае антител Маb3, и можно считать, что нет необходимости в выдерживании антител Маb3 перед следующей стадией.
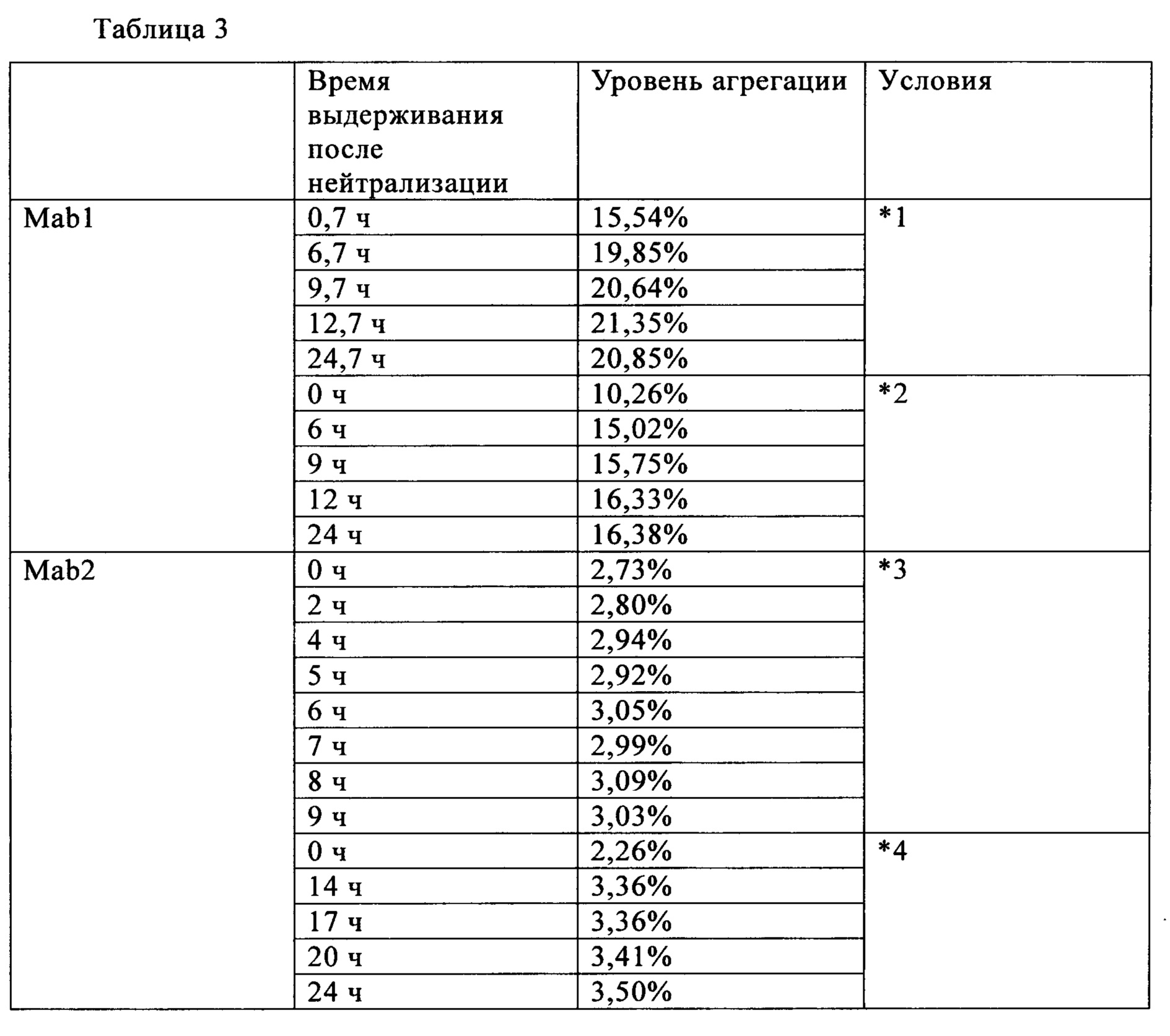
*1 Выдерживание в течение 1 ч при низком pH 3,1 с последующей нейтрализацией до pH 7,0 (концентрация уксусной кислоты в растворе антител после очистки на колонке с иммобилизованным белком A составляет 50 мМ)
*2 Выдерживание в течение 1 ч при низком pH 3,1 с последующей нейтрализацией до pH 7,0 (концентрация уксусной кислоты в растворе антител после очистки на колонке с иммобилизованным белком A составляет 20 мМ)
*3 Выдерживание в течение 1 ч при низком pH 3,6 с последующей нейтрализацией до pH 7,0 (концентрация уксусной кислоты в растворе антител после очистки на колонке с иммобилизованным белком A составляет 50 мМ
*4 Выдерживание в течение 1 ч при низком pH 3,4 с последующей нейтрализацией до pH 7,0 (концентрация уксусной кислоты в растворе антител после очистки на колонке с иммобилизованным белком A составляет 20 мМ)
*5 Выдерживание в течение 1 ч при низком pH 3,4 с последующей нейтрализацией до pH 7,0 (концентрация соляной кислоты в растворе антител после очистки на колонке с иммобилизованным белком A составляет 2,5 мМ)
Пример 2
Процесс очистки антител с низкой ИЭТ
Пример 2-1
Удаление агрегатов антител Mab1 с помощью анионообменной хроматографии при элюировании раствором, содержащим хлорид натрия
Антитело Mab1, представляющее собой антитело к рецептору против IL-6, является генно-инженерным антителом с низкой ИЭТ (ИЭТ <8, ИЭТ 5,8). Его экспрессировали с использованием методов, известных специалистам в данной области техники, с использованием стабильно экспрессирующей клеточной линии СНО, затем очищали по методикам, известным специалистам в данной области техники, включая колоночную хроматографию на иммобилизованном белке A, и получали антитело с высокой степенью очистки, а затем использовали для очистки в следующем примере.
При имитации стадии инактивации вируса в процессе очистки в промышленном масштабе, раствор очищенных антител Mab1, после добавления в него 1 моль/л хлористоводородной кислоты, выдерживали при pH 3,6 или менее в течение 30 мин или более. Выдержанные фракции обрабатывали буферным раствором трис в концентрации 1 моль/л для нейтрализации до pH 7 или более. Затем раствор выдерживали в течение 24 ч или более и использовали для очистки.
Очистку проводили с использованием коммерческих смол, представленных в табл. 4, таких как смолы для анионообменной хроматографии. Колонку уравновешивали 20 ммоль/л буферным раствором трис-HCl (pH 8,0) и затем наносили нейтрализованную фракцию. После промывки колонки 20 ммоль/л буферным раствором трис-HCl (pH 8,0) концентрацию соли повышали с использованием 20 ммоль/л буферного раствора трис-HCl (pH 8,0), содержащего NaCl в концентрации от 100 до 150 ммоль/л и антитела Mab1 элюировали указанным буферным раствором. Количество агрегатов после очистки рассчитывали с использованием эксклюзионной хроматографии SEC по площади пика в процентах.

Для анализа количества агрегатов антител, образовавшихся через каждый период выдерживания, использовали экслюзионную хроматографию. Каждый образец разбавляли до концентрации приблизительно 1,0 г/л с использованием мобильной фазы, как описано ниже, и полученные образцы анализировали на колонке G3000SWXL (фирмы Tosoh). В качестве мобильной фазы использовали 50 ммоль/л фосфатный буферный раствор (pH 7,5), содержащий 300 ммоль/л NaCl, и анализ проводили при скорости потока 0,5 мл/мин. Пик, элюированный перед пиком мономера, содержит агрегаты, и содержание (в %) мономера и агрегатов рассчитывали по площади пика в процентах.
В случае антител Mab1 количество агрегатов, присутствующих после очистки анионообменной хроматографией, представлено в табл. 5. Полученные результаты свидетельствуют о том, что мономер и агрегаты антител Mab1 разделяются анионообменной хроматографией.

Пример 2-2
Удаление агрегатов антител Маb2 с использованием анионообменной хроматографии при элюировании раствором, содержащим хлорид натрия
Антитело Маb2, представляющее собой антитело к рецептору IL-31, является генно-инженерным антителом с низкой ИЭТ (ИЭТ<8, ИЭТ 5,6). Его экспрессировали с использованием методов, известных специалистам в данной области техники, с использованием стабильно экспрессирующей клеточной линии СНО, затем очищали по методикам, известным специалистам в данной области техники, включая колоночную хроматографию на иммобилизованном белке A, и получали антитело с высокой степенью очистки, а затем использовали для очистки в следующем примере.
При имитации стадии инактивации вируса в процессе очистки в промышленном масштабе, раствор очищенного антитела Маb2, после добавления в него 1 моль/л хлористоводородной кислоты, выдерживали при pH 3,6 или менее в течение 30 мин или более. Выдержанные фракции обрабатывали буферным раствором трис в концентрации 1 моль/л для нейтрализации до pH 7 или более. Затем их выдерживали в течение 20 ч или более и использовали для очистки.
Очистку проводили с использованием коммерческих смол, представленных в табл. 6, таких как смолы для анионообменной хроматографии. Колонку уравновешивали 20 ммоль/л буферным раствором трис-HCl (pH 7,0 или 8,0) и затем наносили нейтрализованную фракцию. После промывки колонки 20 ммоль/л буферным раствором трис-HCl (pH 7,0) концентрацию соли повышали с использованием 20 ммоль/л буферного раствора трис-HCl (pH 7,0), содержащим NaCl в концентрации от 200 до 300 ммоль/л и антитела Маb2 элюировали указанным буферным раствором. Количество агрегатов после очистки рассчитывали с использованием эксклюзионной хроматографии по площади пика в процентах.
Количество агрегатов антител Маb2, присутствующих во фракциях после очистки анионообменной хроматографией, представлено в табл. 7. Полученные результаты свидетельствуют о том, что мономер и агрегаты антител Маb2 разделяются с использованием анионообменной хроматографии.

Пример 2-3
Удаление агрегатов Mab1 анионообменной хроматографией с использованием различных растворов для элюции
При имитации стадии инактивации вируса в процессе очистки в промышленном масштабе, раствор очищенных антител Mab1, после добавления в него 1 моль/л хлористоводородной кислоты, выдерживали при pH 3,6 или менее в течение 30 мин или более. Выдержанные фракции обрабатывали буферным раствором трис в концентрации 1 моль/л для нейтрализации до pH 7,0 или более. Затем раствор выдерживали в течение 24 ч или более и использовали для очистки.
Очистку проводили с использованием коммерческих смол, представленных в табл.8, таких как смолы для анионообменной хроматографии. Колонку уравновешивали 20 ммоль/л буферным раствором трис-HCl (pH 8,0) или 20 ммоль/л трис-ацетатным буферным раствором (pH 8,0) и затем наносили нейтрализованную фракцию. После промывки колонки 20 ммоль/л буферным раствором трис-HCl (pH 8,0) или 20 ммоль/л трис-ацетатным буферным раствором (pH 8,0) концентрацию соли повышали с использованием 240 ммоль/л-270 ммоль/л трис-ацетатного буферного раствора (pH 8,0), 40 ммоль/л-60 ммоль/л Na-фосфатного буферного раствора (pH 8,0) или 20 ммоль/л буферного раствора Трис-HCl, содержащего от 20 ммоль/л от 50 ммоль/л сульфата натрия в и антитела Mab1 элюировали с использованием указанных растворов. Количество агрегатов после очистки рассчитывали с использованием эксклюзионной хроматографии по площади пика в процентах.

Количество агрегатов антител Mab1, присутствовавших во фракциях после очистки анионообменной хроматографией, представлено в табл. 9. Полученные результаты свидетельствуют о том, что мономер и агрегаты антител Mab1 разделяются с использованием анионообменной хроматографии.
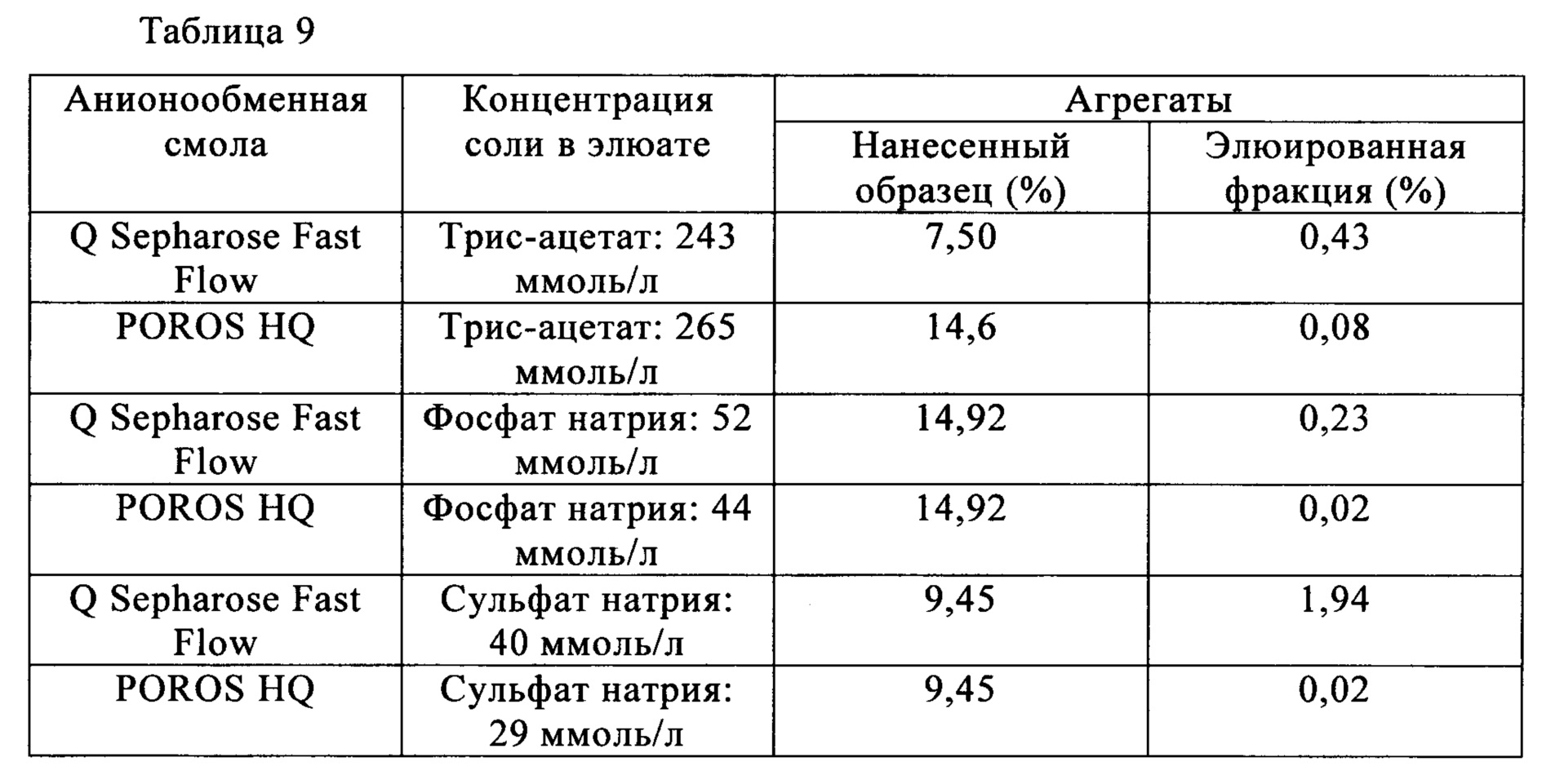
Пример 2-4
Способность очистки от вирусов (клиренс вируса) анионообменной хроматографией при элюировании Mab1 трис-содержащими растворами
При имитации стадии инактивации вируса в процессе очистки в промышленном масштабе, раствор очищенных антител Mab1, после добавления в него 1 моль/л хлористоводородной кислоты, выдерживали при pH 3,6 или менее в течение 30 мин или более. Выдержанные фракции обрабатывали буферным раствором трис в концентрации от 1 моль/л для нейтрализации до pH 7 или более. Затем их выдерживали в течение 20 ч или более и затем использовали для очистки.
Очистку проводили с использованием коммерческой смолы POROS HQ (фирмы Life Technologies) для анионообменной хроматографии. Колонку уравновешивали 20 ммоль/л трис-ацетатным буферным раствором (pH 7,8) и затем наносили нейтрализованную фракцию, в которую добавляли модельный ретровирус MuLV. После промывки колонки 20 ммоль/л трис-ацетатным буферным раствором (pH 7,8) концентрацию соли повышали с использованием 225 ммоль/л-275 ммоль/л трис-ацетатного буферного раствора (pH 7,8) и использовали его для элюирования антител Mab1. Количество вирусных частиц рассчитывали по титру вируса в нанесенной фракции и в элюированной фракции после очистки.
Степень очистки от вирусов (клиренс вируса) после очистки антител Mab1 анионообменной хроматографией представлена в табл. 10. Полученные результаты свидетельствуют о том, что вирусные частицы можно эффективно удалять с использованием анионообменной хроматографии в трис-ацетатном буферном растворе.
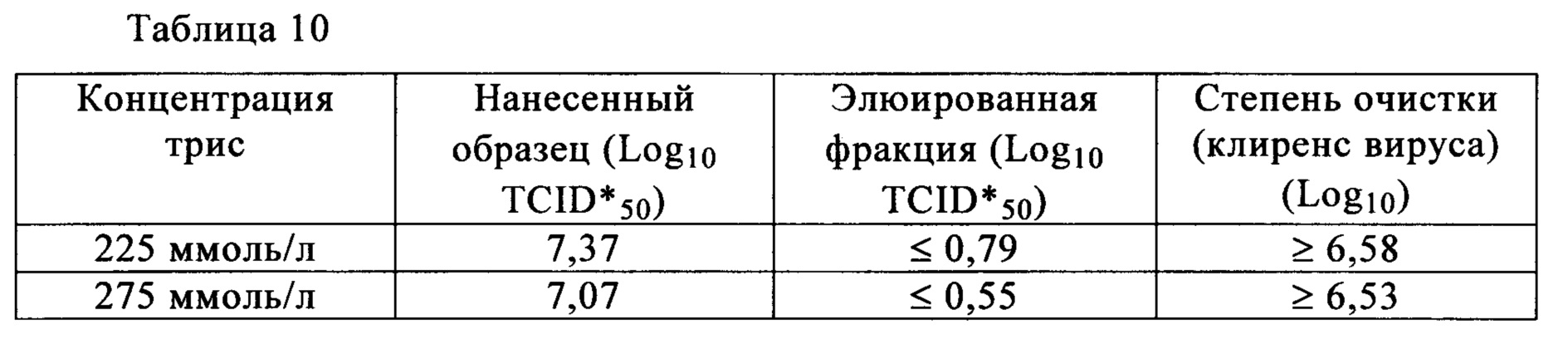
*TCID50 - доза инфекционного агента, инфицирующего 50% клеточной культуры.
Пример 2-5
Удаление агрегатов Маb2 анионообменной хроматографией с использованием трис-содержащего раствора для элюирования
При имитации стадии инактивации вируса в процессе очистки в промышленном масштабе, раствор очищенных антител Маb2, после добавления в него 1 моль/л хлористоводородной кислоты, выдерживали при pH 3,6 или менее в течение 30 мин или более. Выдержанные фракции обрабатывали буферным раствором трис в концентрации 1 моль/л для нейтрализации до pH 7 или более. Затем их выдерживали в течение 20 ч или более и использовали для очистки.
Очистку проводили с использованием коммерческих смол, представленных в табл. 11, таких как смолы для анионообменной хроматографии. Колонку уравновешивали 20 ммоль/л буферным раствором трис-HCl (pH 7,0 или 8,0) и затем наносили нейтрализованную фракцию. После промывки колонки 20 ммоль/л трис-ацетатным буферным раствором (pH 7,0 или 8,0) концентрацию соли повышали с использованием трис-ацетатного буферного раствора в концентрации 300-500 ммоль/л (pH 7,0 или 8,0) и антитела Маb2 элюировали. Количество агрегатов после очистки рассчитывали с использованием эксклюзионной хроматографии по площади пика в процентах.

Количество агрегатов антител Маb2, присутствовавших во фракциях после очистки анионообменной хроматографией, представлено в табл. 12. Полученные результаты свидетельствуют о том, что мономер и агрегаты антител Маb2 разделяются с использованием анионообменной хроматографии.

Пример 2-6
Способность очистки от вирусов анионообменной хроматографией при элюировании Маb2 трис-содержащим буферным раствором
При имитации стадии инактивации вируса в процессе очистки в промышленном масштабе, раствор очищенных антител Маb2, после добавления в него 1 моль/л хлористоводородной кислоты, выдерживали при pH 3,6 или менее в течение 30 мин или более. Выдержанные фракции обрабатывали буферным раствором трис в концентрации 1 моль/л для нейтрализации до pH 7 или более. Затем их выдерживали в течение 20 ч или более и использовали для очистки.
Очистку проводили с использованием коммерческой смолы POROS PI (фирмы Life Technologies) для анионообменной хроматографии. Колонку уравновешивали 20 ммоль/л буферным раствором трис-HCl (pH 8,0) и затем наносили нейтрализованную фракцию, в которую добавляли модельный ретровирус MuLV. После промывки колонки 20 ммоль/л Трис-HCl (pH 8,0) концентрацию соли повышали с использованием 470 ммоль/л буферного раствора трис-HCl (pH 8,0) и антитела Маb2 элюировали. Количество вирусных частиц рассчитывали по титру вируса в нанесенной фракции и в элюированной фракции после очистки.
Степень очистки от вирусов после очистки антител Маb2 анионообменной хроматографией представлен в табл. 13. Полученные результаты свидетельствуют о том, что вирусные частицы можно удалять с помощью анионообменной хроматографии в буферном растворе трис-HCl.
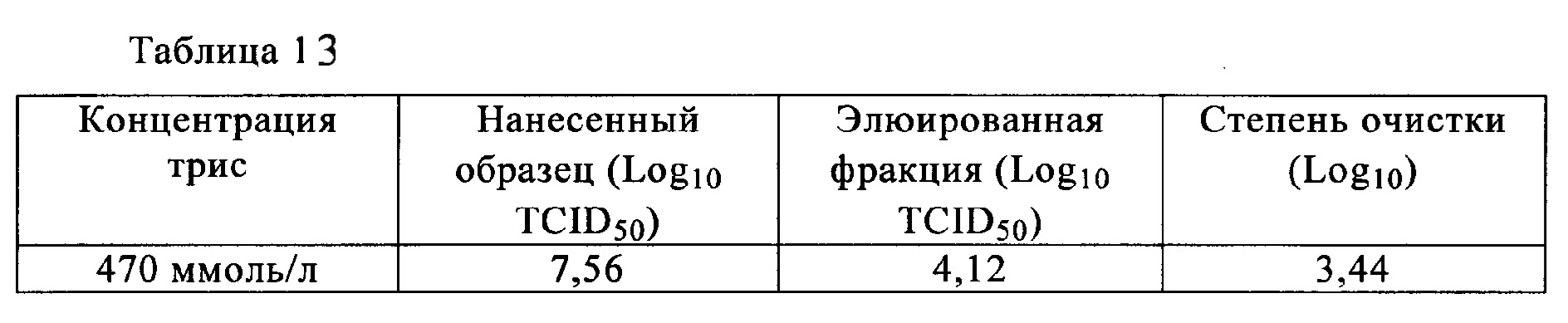
Пример 2-7
Очистка антител Mab1 анионообменной хроматографией и хроматографией на мультимодальных матрицах
Антитела Маb2 экспрессировали с использованием методов, известных специалистам в данной области техники, с помощью стабильно экспрессирующей клеточной линии СНО, затем очищали по методикам, известным специалистам в данной области техники, включая колоночную хроматографию на иммобилизованном белке A, с последующей очисткой анионообменной хроматографией, как описано в примерах 2-3 и 2-4, а затем использовали для очистки в следующем примере.
Элюированные фракции после анионообменной хроматографии доводили до pH 6,5+/-0,3 с использованием уксусной кислоты. Очистку проводили на мультимодальных матрицах (гидрофобная + анионообменная) с использованием коммерческой смолы Capto Adhere (фирмы GE Healthcare). После уравновешивания колонки 250+/-25 ммоль/л трис-ацетатным буферным раствором наносили фракции с доведенным pH. Антитела Mab1 собирали в проточной фракции (выходящей в свободном объеме колонки).
В результате серии таких стадий очистки можно удалять ДНК до концентрации менее 1,0 пг/мг антител Mab1 (ниже предела обнаружения), белки клеток организма-хозяина до концентрации менее 17 нг/мг антител Mab1 (ниже предела обнаружения) и вымывающийся с колонки белок A до концентрации менее 0,4 нг/мг антител Mab1 (ниже предела обнаружения), которые представляют собой примеси, образующиеся в процессе получения антител, а также можно удалять агрегаты Mab1, как показано в примере 2-3. Что касается способности очистки от вирусов кроме высокой эффективности, описанной в примере 2-4, хроматография на мультимодальных матрицах также позволяет отделять модельный ретровирус MuLV с высокой эффективностью (5,42 Log10).
ДНК определяли количественным методом ПЦР. Белки клеток организма-хозяина определяли методом ИФА с использованием антител против белков клеток организма-хозяина. Вымывающийся с колонки белок A определяли методом ИФА с использованием антител против белка А.
Пример 2-8
Очистка антител Маb2 анионообменной хроматографией и гидрофобной хроматографией
Антитела Маb2 экспрессировали с использованием методов, известных специалистам в данной области техники, с использованием стабильно экспрессирующей клеточной линии СНО, затем очищали с высокой степенью очистки по методикам, известным специалистам в данной области техники, включая колоночную хроматографию на иммобилизованном белке A, с последующей очисткой анионообменной хроматографией, как описано в примерах 2-2 и 2-6, а затем использовали для очистки в следующем примере.
В элюированные фракции после анионообменной хроматографии добавляли соль (например, сульфат натрия) до конечной концентрации 250 ммоль/л или более и pH доводили до величины в интервале от 6,8 до 8,0. Очистку проводили с использованием смолы для гидрофобной хроматографии (например, смолы с фенильными группами). После уравновешивания колонки буферным раствором (pH от 6,8 до 8,0) с концентрацией, эквивалентной концентрации добавленной соли, на колонку наносили фракции и антитела Маb2 собирали в проточной фракции.
В результате серии таких стадий очистки можно удалять ДНК до концентрации менее 1,9 пг/мг антител Маb2 (ниже предела обнаружения), белки клеток организма-хозяина до концентрации менее 0,8 нг/мг антител Mab1 (ниже предела обнаружения) и вымывающийся белок A до концентрации менее 0,4 нг/мг антител Mab1 (ниже предела обнаружения), которые представляют собой примеси, образующиеся в процессе получения антител, а также можно удалять агрегаты Маb2, как описано в примере 2-2. Что касается очистки от вирусов кроме высокой эффективности, описанной в примере 2-6, гидрофобная хроматография позволяет также очищать с высокой эффективностью от модельного ретровируса MuLV и модельного парвовируса MVM (5,94 Log10 и 1,55 Log10, соответственно).
ДНК определяли количественным методом ПЦР. Белки клеток организма-хозяина определяли методом ИФА с использованием антител против белков клеток организма-хозяина. Вымывающийся белок А определяли методом ИФА с использованием антител против белка А.
Пример 3
Образование агрегатов в зависимости от различий в величинах pH при выдерживании после нейтрализации и инактивации вируса B данном примере использовали следующее антитело:
Mab1: антитело к рецептору IL-6, описанное в заявке WO 2009/041621, величину ИЭТ которого изменяли до 5,8 за счет модификации аминокислот в последовательности антитела Маb3. Аминокислотная последовательность антитела Mab1: цепь Н / SEQ ID NO: 1 и цепь L / SEQ ID NO: 2.
Описанные выше антитела экспрессировали с использованием методов, известных специалистам в данной области техники, с использованием стабильно экспрессирующей клеточной линии СНО, и очищали по методикам, известным специалистам в данной области техники, включая колоночную хроматографию на иммобилизованном белке A, и затем использовали для оценки образования агрегатов в следующем примере.
При имитации стадии инактивации вируса в процессе очистки в промышленном масштабе, раствор очищенных антител Mab1, после добавления в него 1 моль/л хлористоводородной кислоты, выдерживали при pH 3,8 или менее в течение 30 мин или более. Выдержанные фракции обрабатывали буферным раствором трис в концентрации 2 моль/л для нейтрализации до pH 7,0, что ниже величины ИЭТ антитела, и до pH 7,0, что выше величины ИЭТ антитела. После нейтрализации образцы собирали в течение времени и определяли количество агрегатов. Затем нейтрализованный до pH 5,0 образец выдерживали в течение 22 ч после нейтрализации и в него добавляли 2 моль/л раствор трис для поддержания pH на уровне 7,0, что выше величины ИЭТ антитела. Образцы собирали в течение времени и определяли количество агрегатов. Количество агрегатов определяли эксклюзионной хроматографией по площади пика в процентах.
Эксклюзионную хроматографию использовали для анализа количества агрегатов антител, присутствующих в образце после каждого времени выдерживания. Каждый образец разбавляли до концентрации приблизительно 1,0 г/л с использованием мобильной фазы, описанной ниже, и затем анализировали с использованием колонки G3000SWXL (фирмы Tosoh). В качестве мобильной фазы использовали 50 ммоль/л фосфатный буферный раствор (pH 7,5), содержащий 300 ммоль/л NaCl, и анализ проводили при скорости потока 0,5 мл/мин. Пик, элюирующийся перед пиком мономера, содержал агрегаты, и содержание мономера и агрегатов в процентах рассчитывали по площади пика.
Увеличение количества агрегатов в течение времени при выдерживании антител при pH 7,0, и увеличение количества агрегатов при выдерживании антител при pH 5,0 в течение 22 ч и затем при pH 7,0, показаны, соответственно, в табл. 14 (при выдерживании при pH 7,0) и в табл. 15 (при выдерживании при pH 5,0 в течение 22 ч с последующим повышением pH до 7,0). Полученные результаты свидетельствуют о том, что даже если возрастание количества агрегатов в течение времени выходит на постоянную величину после нейтрализации антител Mab1 до pH 5,0 (ниже ИЭТ антител Mab1), то при повышении pH до 7,0 (выше ИЭТ антител Mab1) с последующим выдерживанием при данном pH, снова наблюдается возрастание количества агрегатов в течение времени с последующим выходом на постоянную величину через определенный период времени.

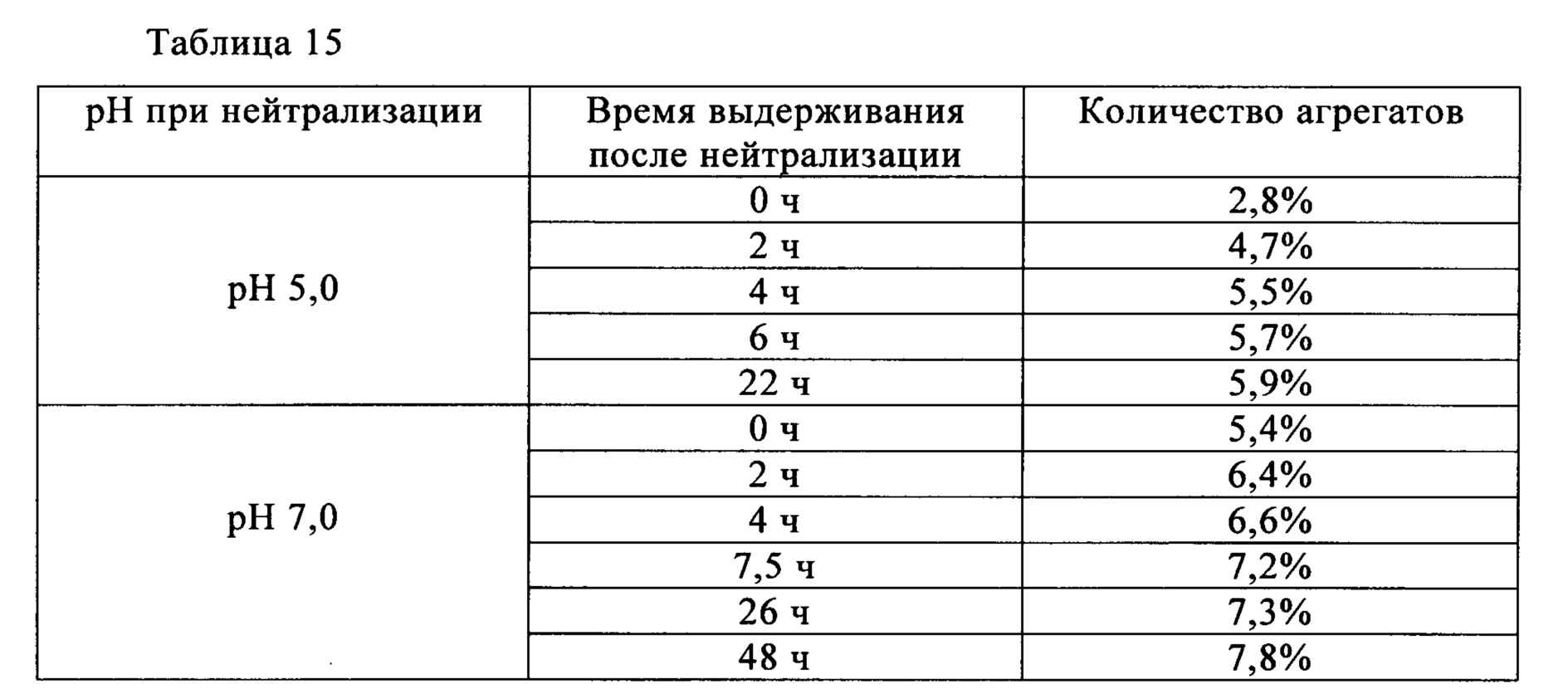
Промышленная применимость
В настоящем изобретении предлагаются способы очистки для эффективного удаления агрегатов антител и примесей из композиции, содержащей прежде всего антитела с низким ИЭТ. В настоящем изобретении предлагается лекарственное средство, содержащее антитела с меньшей тенденцией к образованию агрегатов. Способы очистки по настоящему изобретению являются пригодными для получения биомедицинских продуктов, для которых требуется высокая степень очистки.
Реферат
Группа изобретений относится к биотехнологии. Предложены способ очистки композиции, содержащей антитела с низкой ИЭТ (варианты); композиция, содержащая антитела с ИЭТ от 3,0 до 8,0 и обладающая меньшей тенденцией к образованию агрегатов антител, и способ ее получения, способ получения фармацевтической композиции. Способ очистки композиции предусматривает удаление примесей из композиции путем элюирования антител с ИЭТ от 3,0 до 8,0 из анионообменной смолы в режиме связывание/элюирование с использованием раствора для элюирования с более высокой концентрацией соли либо путем обработки композиции в кислотных условиях с дальнейшей нейтрализацией. Композиция содержит антитела с ИЭТ от 3,0 до 8,0 с содержанием агрегатов антител 3% или менее. Изобретения обеспечивают эффективное удаление примесей, содержащихся в культуральной среде антител. 6 н. и 13 з.п. ф-лы, 15 табл., 10 пр.

Комментарии