Способ очистки белка фактора роста - RU2571926C2
Код документа: RU2571926C2
Чертежи











Описание
Изобретение относится к способу очистки белка фактора роста с применением хроматографии.
Очистка белков из источников природного происхождения является проблемой, поскольку белок, представляющий интерес, часто присутствует только в следовых количествах и ему сопутствуют другие биоматериалы, такие как липиды, белки или даже клеточные фрагменты. Кроме того, белки, представляющие интерес, в основном ассоциированы с биологической функцией, которая часто теряется на стадиях способа их очистки.
Арсенал методов очистки биополимеров, таких как белки, является широким. Помимо методов осаждения известны хроматографические методы с различными типами материалов. Часто материалы модифицированы с использованием химических компонентов, таких как органические ионы, катионы, такие как протонированные амины или частично или полностью алкилированные амины. Такие материалы используются в качестве анионообменных смол. Но катионообменные смолы также могут использоваться для методов очистки в зависимости от физических свойств белка, представляющего интерес, таких как форма, молекулярная масса и, предпочтительно, заряд. Альтернативно или в комбинации применяется аффинная хроматография.
Из предшествующего уровня техники известно, что один недостаток, связанный с традиционно используемыми ионообменными смолами (как например, смолы ионообменной хроматографии SP-, CM-, Q- или DEAE-Sepharose F), заключается в том, что связывание белка со смолой может осуществляться при относительно низкой концентрации соли (проводимости, осмоляльности и т.д.), как правило, в интервале концентраций 0,01-0,15 M соли (NaCl и т.д.). В некоторых применениях существует необходимость возможности применения относительно мягких условий очистки на стадии ионообменной хроматографии по отношению к белкам, а также по отношению к хроматографической смоле (без дополнительного разведения) при некотором повышении ионной силы. Повышенная ионная сила может быть значительным преимуществом для стабильности белка в белковом растворе; особенно в сыром белковом препарате, как в собранных рекомбинантно полученных белковых продуктах, так и в продуктах, выделенных из плазмы, где в растворе присутствуют потенциальные протеазы, которые могут негативно воздействовать на целевой белок. Поскольку протеазы часто работают наилучшим образом в физиологических условиях (как в случае большинства клеточных систем), т.e. при pH приблизительно 7 и при концентрации соли приблизительно 0,15 M.
То протеазы могут ингибироваться путем изменения рабочих условий, например, путем добавления соли и/или путем изменения pH, однако оба этих параметра являются критическими для осуществления стадии стандартной ионной хроматографии и, таким образом, часто невозможны для применения в комбинации с ней. Существует необходимость создания способа очистки, в процессе которого могут применяться условия для минимизации эффектов, оказываемых протеазами.
WO-A2-2008/073620 раскрывает способ получения полипептидов, которые продуцируются в клетках насекомых с использованием бакуловирусных экспрессирующих систем. В одном примере культура клеток насекомых обеспечивается липидной смесью непосредственно перед инфекцией (например, за один час до инфекции). Полипептиды выделяют из культуры клеток насекомых с использованием метода, в котором на ранней стадии способа очистки применяется анионообменная хроматография или хроматография смешанного типа. Эта стадия способа применяется для удаления эндонуклеаз и протеаз с происхождением из клеток насекомых и, таким образом, снижает потерю целевого полипептида в результате ферментативной деградации. В другом примере хроматографию смешанного типа объединяют с аффинной хроматографией с окрашенным лигандом в непрерывном потоке для возможности быстрой обработки жидкой культуры клеток насекомых и для захвата полипептида. Еще в одном примере полипептид выделяют из жидкой культуры клеток насекомых с использованием способа, который объединяет половолоконную фильтрацию, хроматографию смешанного типа и аффинную хроматографию с окрашенным лигандом в автономном процессе с получением раствора полипептида, который по существу свободен от эндонуклеазных и протеолитических активностей. В следующем примере выделенные полипептиды представляют собой гликопептиды, имеющие профиль гликозилирования, специфичный для насекомых, и которые необязательно конъюгированы с модифицирующей группой, такой как полимер (например, ПЭГ), с использованием гликозилтрансферазы и модифицированного нуклеотида.
WO-A2-2009/063069 раскрывает способ очистки пептидов и относится предпочтительно, но без ограничения, к способу удаления эндотоксинов из пептидного раствора, к набору реагентов, включающему реагенты для указанного способа и для очищенного пептида, получаемого с помощью указанного способа.
Dasari Venkata Krishna Rao et al. раскрывают способ очистки с применением способа алгоритма управления, разработанного для повышения выхода rhG-CSF (рекомбинантного человеческого гранулоцитарно-макрофагального колониестимулирующего фактора). В данной работе достигали чистоты ≥99% с общим выходом 2,18 г/л. Анализ продукта во время очистки выявил, что детергенты удаляли 72% LPS (липополисахаридов) и 98% HCP (белков клетки-хозяина) без удаления нуклеиновых кислот. Концентрация цистеина представляла собой ключевой параметр при сборке белка. Оценивали значения высоты слоя и HETP (теоретические тарелки с эквивалентной высотой слоя) в колонке SEC (эксклюзионной хроматографии) и изучали их влияние на разделение. Было обнаружено, что состав во время SEC является решающим для увеличения выхода продукта с сохранением времени и стоимости способа.
Quan Bai et al. исследовали ренатурацию и очистку рекомбинантного человеческого гранулоцитарно-макрофагального колониестимулирующего фактора (rhGM-CSF), экспрессируемого в Escherichia coli, с использованием анионообменной хроматографии (SAX). Соответственно, исследовали эффекты значений pH, соотношений концентраций GSH/GSSG, и концентраций мочевины в подвижной фазе, оказываемые на ренатурацию и очистку rhGM-CSF с помощью SAX. Результаты демонстрируют, что три вышеописанных фактора имеют значительное влияние на эффективность ренатурации и извлечение массы rhGM-CSF. Добавление GSH/GSSG в подвижную фазу может улучшить образование корректных дисульфидных связей в rhGM-CSF с повышением выхода его ренатурации. Кроме того, для извлечения массы rhGM-CSF с помощью SAX, добавляли в подвижную фазу мочевины низкой концентрации для предотвращения агрегации денатурированного белка. При оптимальных условиях rhGM-CSF ренатурировал с одновременной очисткой на колонке SAX в течение 30 с помощью всего одной стадии.
Shelly A. Pizarro сообщает о факторе роста эндотелия сосудов (VEGF165), который является потенциальным митогеном, который индуцирует ангиогенез и проницаемость сосудов in vivo и демонстрирует потенциал в терапевтических применениях для ускорения заживления ран. Способ, описанный в данном сообщении, включает бактериальную экспрессирующую систему, способную продуцировать приблизительно 9 г rhVEGF на литр бульона, и следующий затем способ очистки собранного белка и три стадии хроматографии перед включением в состав лекарственного средства. Использовали способ ферментации периодического действия с подпиткой с высокой плотностью клеток (HCD) для получения rhVEGF в периплазматических тельцах включения. Тельца включения собирали из клеточного лизата и подвергали одностадийной солюбилизации белка и операции сборки с выделением rhVEGF для очистки. Общий выход при извлечении, наблюдаемый в процессе разработки, включающем сборку и хроматографию, составил 30±6%. Примеси клеток-хозяев постоянно выводили до уровня ниже целевого как в лабораторном, так и в крупномасштабном осуществлении способа, демонстрируя устойчивость процесса. Структуру собранного и очищенного rhVEGF подтверждали с помощью масс-спектрометрии. Продукты N-концевого секвенирования и продукты пептидного картирования с использованием трипсинового гидролиза анализировали с использованием множества анализов ВЭЖХ.
Kimberly A. Kaleas раскрыли, что хроматографические смолы смешанного типа стали популярными средствами очистки для трудного исходного сырья, и раскрыли разработку промышленного применения для селективного захвата рекомбинантного человеческого фактора роста эндотелия сосудов (rhVEGF) на Capto MMC из щелочного исходного сырья. Смола Capto MMC содержит лиганд, который обладает потенциалом участия в ионных, гидрофобных взаимодействиях и во взаимодействиях с использованием водородных связей с белками, и он соединен с матрицей в виде агарозных бусин с высокой степенью поперечных связей. VEGF является ключевым фактором роста, вовлеченным в ангиогенез, и имеет терапевтические применения для заживления ран. Он экспрессируется в Escherichia coli в виде телец включения. Твердые вещества собираются из клеточного лизата, и rhVEGF солюбилизируется и собирается при pH 9,8 в присутствии мочевины и восстанавливающих агентов. Уникальные характеристики смешанного режима Capto MMC позволяли захват этого основного белка при условиях минимальной загрузки и доставляли концентрированную смесь для дальнейшего процессирования с выходом >95%, и при этом со снижением содержания белков клеток-хозяев до <1,2%. В данной работе изучали влияние условий загрузки и времени удержания на способность динамического связывания, а также проводили разработку условий элюции для оптимального выполнения очистки. После оценки различных элюирующих буферов было продемонстрировано, что L-аргинин HCl является эффективным элюирующим агентом для десорбции rhVEGF со смолы смешанного типа Capto MMC, так как он успешно разрушал многочисленные взаимодействия между смолой и rhVEGF. В лабораторных условиях получили устойчивую стадию хроматографии, которую успешно осуществили в масштабе коммерческого производства.
Целью изобретения является избежание недостатков способов очистки белка фактора роста, известных из предшествующего уровня техники, путем предоставления нового способа. Согласно изобретению цели достигают с помощью способа очистки белка фактора роста, выбранного из группы, состоящей из колониестимулирующего фактора (CSF), такого как G-CSF (гранулоцитарный колониестимулирующий фактор) или гранулоцитарно-макрофагальный CSF (GM-CSF), интерлейкина 3 (IL-3), фактора роста гепатоцитов, эпидермального фактора роста и фактора роста фибробластов (кислого), в последовательности очистки с применением хроматографии, где
- используется, по меньшей мере, одна хроматография с использованием многомодальной смолы,
- белок фактора роста связывается с многомодальной смолой при pH в интервале 4-6,2 и
- белок фактора роста элюируется с многомодальной смолы при pH >6,3.
В изобретении предлагается способ, в котором преимущественно эффекты протеаз могут быть минимизированы. Благодаря возможности добавления соли и/или изменения pH в образце сырого белка с потенциальным присутствием протеаз, которые могут разрушить целевой белок, и возможности процессирования белкового раствора без каких-либо дополнительных измерений и связывания целевого белка с хроматографической смолой смешанного типа, получают, таким образом, оптимизированную стадию концентрирования и очистки целевого белка в сыром образце, что делает его подходящим для дальнейшей очистки с использованием стадии специфической аффинной хроматографии для белка-мишени с уменьшенным содержанием протеаз и/или ДНК при дальнейшем процессировании. Очень важно избежать деградации целевого белка в процессе очистки при осуществлении комбинации многомодальной хроматографии в качестве стадии захвата в растворе сырого белка.
В одном воплощении, хроматографию на многомодальной смоле комбинируют со стадией хроматографии с использованием аффинного лиганда, выделенного из дрожжей. Хроматографическая стадия, применяющая аффинный лиганд, выделенный из дрожжей, предпочтительно подходит для очистки целевого белка с высоким выходом и с неизмененной молекулярной целостностью (деградация и т.д.).
Белок фактора роста представляет собой колониестимулирующий фактор (CSF), такой как G-CSF (гранулоцитарный колониестимулирующий фактор). Он является членом гемопоэтических регуляторных гликопротеинов, которые вовлечены в рост и дифференцировку гемопоэтических клеток из стволовых клеток. Белки фактора роста представляют собой гранулоцитарно-макрофагальный CSF (GM-CSF), интерлейкин 3 (IL-3), фактор роста гепатоцитов, эпидермальный фактор роста и фактор роста фибробластов (кислый). Все белки факторов роста демонстрируют IP ≤6. В следующем воплощении изобретения многомодальная смола включает компоненты, связанные с матрицей, и компоненты, способные взаимодействовать с белком фактора роста в смеси посредством ионных взаимодействий и взаимодействий других типов, таких как водородные связи и гидрофобные и тиофильные взаимодействия.
В следующем воплощении изобретения аффинный лиганд представляет собой выделенный из дрожжей Fab-фрагмент, направленный против белка фактора роста.
В следующем воплощении изобретения стадия хроматографии с многомодальной смолой процессируется для захвата белка фактора роста из раствора сырого белка, после чего процессируют элюат, полученный в результате хроматографии на многомодальной смоле, затем осуществляют стадию хроматографии с аффинным лигандом, выделенным из дрожжей, и после элюции белка фактора роста из указанной стадии аффинной хроматографии получают чистоту более чем приблизительно 90% по части белков и ДНК.
В другом воплощении изобретения стадия хроматографии с многомодальной смолой и стадия хроматографии с аффинным лигандом, выделенным из дрожжей, комбинируются с другой стадией хроматографической очистки с получением чистоты конечного продукта белка фактора роста более чем 99%.
Еще в одном воплощении изобретения смесь, включающая белок фактора роста, представляет собой раствор.
Еще в одном воплощении изобретения белок фактора роста представляет собой рекомбинантный белок фактора роста.
Еще в одном воплощении изобретения белок фактора роста представляет собой раствор сырого белка, потенциально включающий протеазы, которые могут разрушить продукт.
В другом воплощении белок фактора роста элюируется с помощью изменения pH >6,3.
В следующем воплощении изобретения, элюцию осуществляют с помощью изменения pH или с помощью элюирующего агента, включающего аминокислоту, содержащую основную боковую цепь, и/или высокой ионной силы в элюирующем буфере. Альтернативно или в комбинации элюция также может осуществляться путем изменения pH. Изменение pH осуществляется путем регуляции pH элюирующего буфера с помощью, например, гидроксида натрия или уксусной кислоты до целевого значения pH и затем путем применения буфера к многомодальной смоле, а регуляция ионной силы может осуществляться путем добавления соли в элюирующий буфер перед его применением к многомодальной смоле, например, солей, включенных в ряды Гофмейстера, например, хлорида натрия и хлорида калия.
Согласно изобретению концентрация элюирующего агента предпочтительно находится в интервале от примерно 0,1 M до примерно 2 M.
Согласно другому воплощению изобретения белок фактора роста связывается с многомодальной смолой при pH примерно 6,0, и белок фактора роста элюируется из многомодальной смолы при pH примерно 6,5 или выше, в частности, при pH примерно 7.
Согласно следующему воплощению изобретения используется буферное вещество, включающее цитрат натрия, ацетат натрия, HEPES, причем буферное вещество предпочтительно выбрано из группы, состоящей из цитрата натрия, гистидина, 2-(4-(2-гидроксиэтил)-1-пипераинил)этансульфокислоты (HEPES), 2-(N-морфолино)этансульфокислоты (MES), основания Tris и ацетата натрия, в частности, в интервале pH от примерно 4 до примерно 8.
В способе по изобретению, один неионный детергент может присутствовать в любом из используемых буферов, причем неионный детергент предпочтительно выбран из группы, состоящей из полисорбатов (полисорбат 20, 40, 60, 80) и Pluronic F68.
В следующем воплощении способа по изобретению аминокислота может быть выбрана из группы аминокислот, содержащих основную боковую цепь, включающих аргинин, лизин и гистидин; органические соли могут быть выбраны из группы, включающей KCl и NaCl.
В другом воплощении изобретения стадию промывки осуществляют при pH в интервале от примерно 4 до примерно 6 перед элюцией белка фактора роста из многомодальной смолы, причем эта стадия отличается тем, что промывочный буфер включает промывочные агенты, включающие аминокислоту, содержащую основную боковую цепь, и/или агенты с высокой ионной силой, причем регуляция ионной силы может осуществляться путем добавления соли в состав промывочного буфера перед его применения к многомодальной смоле, например, соли, включенной в ряды Гофмейстера, например, хлорида натрия и хлорида калия.
Согласно изобретению концентрация промывочного агента предпочтительно находится в интервале от примерно 0,1 M до примерно 2 M.
Предпочтительным является применение промывочного буфера для многомодальной смолы для отмывки от загрязнителей (протеаз, ДНК и т.д.) и удержания белка фактора роста перед его высвобождением.
Предпочтительно, концентрация аминокислоты, положительно заряженной при pH 6-8, составляет до 2 M в промывочном буфере при <6,3. Как правило, количество аргинина в промывочном буфере находится в интервале 0,1-1 M, в частности, 0,5 M.
В элюирующем буфере с pH≥6,3 количество аргинина, как правило, находится в интервале 0,1-2 M, в частности, 0,5 M.
В элюирующем буфере с pH≥6,3, хлорид натрия включен в концентрации в интервале 0,1-2,0 M, в частности, в интервале 0,1-1 M.
В промывочном буфере с pH<6,3, хлорид натрия включен в концентрации в интервале 0,1-2,0 M, в частности, в интервале 0,1-1 M.
Количество неионного детергента, как правило, находится в интервале 0,001-1%, в частности, в буферах для многомодальной хроматографии 0,02%.
Многомодальная смола для хроматографии, которая может применяться согласно изобретению, может содержать, по меньшей мере, один из следующих компонентов:
a. положительно заряженный лиганд в виде N-бензил-N-метилэтаноламина,
b. отрицательно заряженный лиганд в виде 2-(бензоиламино)бутановой кислоты,
с. фенилпропиловый лиганд,
d. N-гексиловый лиганд,
e. лиганд в виде 4-меркаптоэтилпиридина,
f. лиганд в виде 3-((3-метил-5-((тетрагидрофуран-2-ил-метил)амино)фенил)амино)бензойной кислоты или их комбинации.
В часности, многомодальная хроматографическая смола для применения согласно настоящему изобретению выбрана из следующих коммерчески доступных смол HEP Hypercel™; PPA Hypercel™; Capto Adhere™; Capto MMC™; МЕР Hypercel™.
В другом воплощении настоящего изобретения, последовательность очистки может дополнительно включать стадию удаления/инактивации патогенов, включающую химическую стадию инактивации, стадию удаления на основе размера, хроматографические стадии или их комбинации, которые основаны на различных физиологических свойствах, направленных на удаление патогенов.
В предпочтительном воплощении способа по настоящему изобретению последовательность очистки дополнительно включает следующие стадии:
1. применение катионной многомодальной смолы, такой как Capto MMC;
2. стадия на основе химической инактивации для оболочечных вирусов, в частности, инактивация с использованием растворителя/детергента, применяющая три-н-бутилфосфат и Triton X-100, как раскрыто в EP-A-131 740;
3. применение аффинной смолы на основе лигандов, экспрессируемых в дрожжах;
4. применение катионообменной смолы, такой как SP Sepharose или Resource S;
5. стадия удаления патогенов фильтрацией со средним размером пор примерно 20 нм, как например у Planova 20N;
6. стадия замены буфера и/или концентрирования, как например ультрафильтрация с использованием приблизительной границы пропускания 1-5 кДа;
7. применение смолы для эксклюзионной хроматографии, такой как Superdex 75.
Краткое описание чертежей
Фигура 1 демонстрирует хроматограмму очистки G-CSF на колонке Capto MMC при pH 4,0 с использованием натрий ацетатного буфера.
Фигура 2 демонстрирует хроматограмму очистки G-CSF на колонке Capto MMC при pH 4,0 с использованием натрий ацетатного буфера.
Фигура 3 демонстрирует хроматограмму очистки G-CSF на колонке Capto MMC при pH 4,0 с использованием натрий ацетатного буфера.
Фигура 4 демонстрирует хроматограмму очистки G-CSF на колонке Capto MMC при pH 4,0 исходного материала с использованием натрий ацетатного буфера.
Фигура 5 демонстрирует хроматограмму очистки G-CSF на колонке Capto MMC при pH 4,0 с использованием натрий цитратного буфера.
Фигура 6 демонстрирует хроматограмму очистки G-CSF на колонке Capto MMC при pH 5,0 с использованием натрий цитратного буфера.
Фигура 7 демонстрирует хроматограмму очистки G-CSF на колонке Capto MMC при pH 5,5 с использованием натрий цитратного буфера.
Фигура 8 демонстрирует хроматограмму очистки G-CSF на колонке Capto MMC при pH 6,0 с использованием натрий цитратного буфера.
Фигура 9 демонстрирует хроматограмму очистки G-CSF на колонке Capto MMC при pH 6,5 с использованием натрий цитратного буфера.
Фигура 10a и 10b демонстрирует окрашивание серебром SDS-PAGE и разделение белков в стартовом материале и в элюате из Capto MMC.
Фигура 11 демонстрирует хроматограмму очистки G-CSF из бесклеточной надосадочной жидкости.
Фигура 12 демонстрирует Кумасси-окрашивание SDS-PAGE элюата после стадии аффинной хроматографии.
Фигура 13 демонстрирует окрашивание серебром SDS-PAGE исходного материала, проточной фракции и элюатов после стадии аффинной хроматографии.
Изобретение дополнительно описано с помощью следующих неограничивающих примеров, которые в качестве примера представляют собой очистку G-CSF.
ПРИМЕРЫ
ОПИСАНИЕ АНАЛИТИЧЕСКИХ МЕТОДОВ
Определение содержания G-CSF с помощью G-CSF-специфичного ELISA
Принцип твердофазного иммуноферментного анализа (ELISA) заключается в количественной оценке белка (антигена) с помощью его специфичного связывания с антителами против данного белка. Количественную оценку G-CSF осуществляли путем использования сэндвич-ELISA на основе G-CSF-специфичного двойного ELISA (Duo Set ELISA) (R&D Systems, Cat No DY214). В качестве калибровочного стандарта применяли выделенный из E. coli рекомбинантный человеческий G-CSF (R&D systems, Cat No. 214-CS-005, 0,015-1 нг/мл). Захватывающее антитело (мышиное антитело, связывающее человеческий G-CSF) связывалось с лунками 96-луночного микропланшета. После захвата G-CSF-антигена и стадии промывки, биотинилированное детектирующее антитело (козье антитело, связывающее человеческий G-CSF) связывалось с G-CSF-антигеном. После второй стадии промывки применяли конъюгированную со стрептавидином пероксидазу хрена (стрептавидин-HRP), которая связывается с биотинилированным детектирующим антителом. Для количественной оценки добавляли субстрат пероксидазы тетраметилбензидин (TMB) в присутствии пероксида водорода, и проявлялся синий цвет. После остановки реакции с помощью серной кислоты проявлялся стабильный желтый цвет. Концентрация желтого цвета пропорциональна количеству связанной пероксидазы и, таким образом, пропорциональна количеству G-CSF-антигена. Концентрацию цвета измеряли фотометрически при 450 нм. Концентрацию G-CSF в неизвестных образцах рассчитывали на основе стандартной кривой рекомбинантного человеческого G-CSF, которая всегда дает коэффициент линейной корреляции (r) >0,99.
Определение содержания G-CSF с помощью ВЭЖХ с обращенной фазой (ОФ)
ОФ-ВЭЖХ включает разделение белков на основе их полярности; удержание белковых молекул управляется с помощью гидрофобных взаимодействий между неполярным компонентом молекул раствора и неполярной стационарной фазой колонки ВЭЖХ. Для определения белков использовали систему ВЭЖХ (Dionex Ultimate 3000), оборудованную УФ-детектором, а также колонкой Jupiter C18, 300A, 5 мкм, 4,6×150 мм (Phenomenex, Cat. № 00F-4053-EO). Колонку, которую прогоняли при 20±5°C, уравновешивали с помощью 0,1% (об./об.) трифторуксусной кислоты (TFA) в воде (подвижная фаза A). Для элюции использовали 0,1% (об./об.) TFA в ацетонитриле (подвижная фаза B) в линейном градиенте (0-5 мин 5% B, 5-12 мин 55% B, 12-17 мин 100% B, 17-22 мин 5% B) со скоростью потока 1,0 мл/мин. Загрузка образца составила 30 мкг на инъекцию в суммарном объеме инъекции максимум 100 мкл. Детектирование проводили с помощью измерения УФ-поглощения при 214 нм. В качестве стандартной кривой использовали Filgrastim CRS из Ph.Eur 2,5-40 мкг (2,5-5-10-20-40 мкг). Стандарт в виде Filgrastim CRS предварительно разводили в воде для лабораторного использования (WFL) до концентрации 0,4 мг/мл. Если необходимо, то осуществляли предварительное разведение образцов в WFL для количества инъекции 30 мкг. Концентрацию G-CSF в неизвестных образцах рассчитывали на основе стандартной кривой для Filgrastim CRS, которая всегда дает коэффициент линейной корреляции (r) >0,99.
Определение чистоты с помощью ВЭЖХ с обращенной фазой (ОФ)
Метод и устройства, используемые для определения чистоты с помощью ОФ-ВЭЖХ, эквивалентны методам определения содержания G-CSF. Чистоту G-CSF-содержащего раствора [%] рассчитывали с помощью определения площади пика G-CSF по отношению к общей площади пиков.
Определение чистоты и распределения молекулярной массы с помощью SDS-PAGE
Электрофорез на SDS-полиакриламидном геле (SDS-PAGE) включает разделение белков на основе их размера. Определение чистоты и анализ распределения молекулярной массы для G-CSF-содержащих образцов осуществляли при восстановительных условиях. Для этой цели использовали градиентные гели Tris-Tricine (10-20%, от Anamed, Cat No. TR12012) и градиентные гели Tris-HCl (10-20%, от Biorad, Cat No. 345-0043). Для градиентных гелей Tris-Tricine применяли полипептидный стандарт молекулярной массы (Polypeptide SDS-PAGE Molecular Weight Standard) от BioRad (Cat No. 161-0326; 1,4-26,6 кДа) в качестве стандарта молекулярной массы; для градиентных гелей Tris-HCl применяли стандарт Precision Plus Protein All Blue от Biorad (Cat No. 161-0373, 10-250 кДа). Белковые фрагменты, разделенные с помощью электрофореза, визуализировали с помощью окрашивания серебром или кумасси. В качестве эталонов G-CSF (контрольные образцы) использовали выделенный из E. coli рекомбинантный человеческий G-CSF (не гликозилированный, R&D systems, Cat No. 214-CS-005), гликозилированный выделенный из CHO коммерческий продукт Granocyte (Chugai). Оценку молекулярной массы и чистоту осуществляли визуально путем оценки проявления стандартных, эталонных (контрольный образец) и анализируемых образцов.
Рекомбинантный G-CSF
Получение G-CSF-содержащей клеточной суспензии и очистка
Клетки
Используемая клеточная линия является производной от человеческой эмбриональной почечной клеточной линии 293 (HEK 293), которую адаптировали для бессывороточного роста. Этот хозяин, HEK 293F, был стабильно трансфицирован экспрессирующей кассетой, несущей кодирующую последовательность кДНК G-CSF. Для кассеты использовали сильный промотор. В общем процесс описан в EP 1739179 (Schroder et al).
Метод культивирования
Клетки культивировали в бессывороточной среде в стандартном оборудовании и согласно основным методам, хорошо известным в данной области, например, со встряхиванием или с перемешиванием культур во флаконах, во флаконах для встряхивания и в биореакторах (одноразовые системы и стандартные смесители), с получением периодических, периодических с подпиткой, перфузионных или непрерывных хемостатных культур (Freshney, R I (2000), Culture of animal cells: a manual of basic technique, 4 ed, Wiley-Liss; Spier, R E ed (2000), Encyclopedia of cell technology, Wiley, New York; Enfors, S-O and Haggstrom, L (2000), Bioprocess technology: fundamentals and applications, Hogskoletryckeriet, Royal Institute of Technology, Stockholm; Vinci, V A and Parekh, S R (2003), Handbook of industrial cell culture: mammalian, microbial, and plant cells, Humana Press, USA). Как правило, перфузию среды используют для повышения количества клеток и титров продукта относительно стандартного уровня периодической культуры. Выход продукта и количество белков клеток-хозяев отличаются в зависимости от способа культивирования:
- титр продукта, как правило, увеличивается вместе с количеством клеток,
- общее содержание белка и ДНК, как правило, увеличивается вместе с количеством клеток,
- общее содержание белка и ДНК также может увеличиваться вместе с продолжительностью культивирования,
- периодические культуры аккумулируют белок и ДНК; ничего не добавляется извне, ничего не удаляется,
перфузионные процессы отмывают клеточные культуры от метаболитов, белков, ДНК и других примесей; фильтры или клеточные центрифуги, как правило, используют для сохранения клеток.
Рекомбинантный продукт высвобождается из клеток или из клеточной суспензии или собирается в надосадочной жидкости клеточной суспензии. Свойства собранных клеток (титр продукта и примеси, как отмечено выше) различаются в зависимости от используемого способа.
Клеточную суспензию использовали в некоторых из описанных ниже примерах G-CSF.
Метод очистки
Рекомбинантный продукт высвобождается из клеток или из клеточной суспензии, или собирается надосадочная жидкость клеточной суспензии. Применяемая очистка включает 4-стадийную очистку. Катионообменную хроматографию (быстропроточная (FF) с SP Sepharose) использовали для стадии захвата G-CSF из надосадочной жидкости клеточной культуры с последующей стадией аффинной хроматографией на основе иммобилизованного металла в виде цинка (IMAC) (Zn-IDA хелатирующая Sepharose (FF)), затем использовали вторую стадию катионообменной хроматографии (Resource S) для доочистки и стадию эксклюзионной хроматографии (Superdex75) в качестве конечной стадии.
Получение G-CSF-содержащей надосадочной жидкости клеточной культуры
Перед стадией захвата определяли концентрацию G-CSF надосадочной жидкости периодических культур [мг/л] с помощью G-CSF-специфичного ELISA с целью подтверждения суммарного количества G-CSF [мг]. Замороженную надосадочную жидкость (-80°C) размораживали на водяной бане, доводя до 20±5°C. После этого надосадочную жидкость центрифугировали при 9000×g в течение 15 минут при 4°C и затем дополнительно фильтровали с использованием порций для фильтров 0,2 мкг. pH отфильтрованной надосадочной жидкости доводили до pH 4,0 с использованием уксусной кислоты.
Стадия захвата (SP Sepharose FF)
Колонку XK 16/20 набивали с помощью 10 мл материала SP Sepharose FF (1 объем колонки (CV) = 10 мл). Смолу SP Sepharose FF получали из GE Healthcare (Cat No. 17-0729-01).
Равновесия достигали с помощью 3 CV уравновешивающего буфера (20 мМ ацетата натрия, 100 мМ хлорида натрия, 0,02% Tween 20, pH 4,0) с последующей загрузкой исходного материала с низкой скоростью потока 2,5 мл/мин. Следующую стадию промывки осуществляли с использованием того же буфера и с той же скоростью потока с использованием 5 CV.
Элюцию осуществляли с помощью элюирующего буфера, содержащего 20 мМ ацетата натрия, 1 M хлорида натрия, 0,02% Tween 20, pH 4,0, с применением линейного градиента элюирующего буфера от 0% до 40% в объеме 8 CV со скоростью потока 2,5 мл/мин, с последующей стадией элюции с использованием 100% элюирующего буфера с помощью 5 CV.
Концентрацию G-CSF суммарного элюата, собранного в результате элюции с линейным градиентом, анализировали с помощью G-CSF-специфичного ELISA.
IMAC-стадия (Zn-IDA хелатирующая Sepharose FF)
Колонку XK 16/20 набивали с помощью 10 мл хелатирующей Sepharose FF, которую заменяли на 2 мл 0,2 M ZnCl2(1 объем колонки (CV) = 10 мл). Смолу в виде хелатирующей Sepharose FF получали из GE Healthcare (Cat No. 17-0575-01). Перед загрузкой pH колонки IMAC (элюат SP Sepharose FF) доводили до pH 8,0 с помощью NaOH).
Равновесия достигали с помощью 3 CV уравновешивающего буфера (20 мМ Tris/HCl, 150 мМ NaCl, pH 8,0) с последующей загрузкой элюат SP Sepharose FF со скоростью потока 2 мл/мин. Следующую стадию промывки осуществляли с использованием того же буфера и с той же скоростью потока с использованием 2 CV.
Элюцию осуществляли с помощью элюирующего буфера, содержащего 20 мМ Tris/HCl, 150 мМ NaCl, pH 4,0, с применением линейного градиента элюирующего буфера от 0% до 100% в объеме 3 CV со скоростью потока 1 мл/мин. Затем применяли остановку градиента с помощью 100% элюирующего буфера с использованием 4 CV.
Концентрацию G-CSF суммарного элюата, собранного в результате элюции с использованием 100% элюирующего буфера, анализировали с помощью G-CSF-специфичного ELISA.
Стадия доочистки (Resource S)
Предварительно набитую колонку Resources (CV = 6 мл) от GE Healthcare (Cat No. 17-1180-01) уравновешивали с помощью 5 CV уравновешивающего буфера (20 мМ ацетат натрия, 0,02% Tween-20, pH 4,0) со скоростью потока 4 мл/мин. Перед очисткой pH элюата IMAC должно быть доведено до 4,0 с помощью уксусной кислоты и элюат должен быть разведен в 5 раз с использованием уравновешивающего буфера.
Стадию промывки осуществляли с помощью 10 CV уравновешивающего буфера со скоростью потока 4 мл/мин.
Элюцию осуществляли с помощью элюирующего буфера, содержащего 20 мМ ацетата натрия, 1 M NaCl, 0,02% Tween-20, pH 4,0, с применением линейного градиента элюирующего буфера от 0% до 100% в объеме 20 CV со скоростью потока 2 мл/мин.
Концентрацию G-CSF суммарного элюата, собранного в результате элюции с использованием линейного градиента 50-85% элюирующего буфера, анализировали с помощью G-CSF-специфичного ELISA.
Стадия эксклюзионной хроматографии (Superdex75)
Для стадии эксклюзионной хроматографии использовали предварительно набитую с помощью Hiload 26/60 Superdex 75 колонку Prep Grade (GE Healthcare Cat No. 17-1044-01, CV = 320 мл). Колонку уравновешивали с помощью 1 CV буфера (20 мМ ацетата натрия, 200 мМ NaCl, 0,02% Tween20, pH 6,5) с последующей загрузкой элюата Resources со скоростью потока 2,5 мл/мин и с максимальным объемом загрузки 4% CV.
Концентрацию G-CSF суммарного элюата анализировали с помощью G-CSF-специфичного ELISA и с помощью ВЭЖХ с обращенной фазой (ОФ-ВЭЖХ). Чистоту конечной фракции очистки анализировали с помощью использования ОФ-ВЭЖХ, эксклюзионной ВЭЖХ и с помощью SDS-PAGE, и чистота, как правило, составляла >95%.
Элюат эксклюзионной хроматографии использовали в некоторых из описанных ниже примерах G-CSF.
Очистка rhG-CSF с использованием смолы Capto MMC в качестве стадии захвата
Пример 1 (Эксперимент 1)
Исходный материал
Очищенный rhG-CSF разводили в уравновешивающем буфере до концентрации ниже суммарной концентрации белка и для достижения более подходящего объема перед загрузкой в колонку Capto MMC. rhG-CSF перед разведением растворяли в 20 мМ ацетата натрия, 0,5 M NaCl, 0,02% Tween 20, pH 4,0.
Хроматографическая смола и колонка
Capto MMC, смолу смешанного типа от GE Healthcare (cat no. 17-5317), использовали в качестве стадии захвата для молекулы rhG-CSF. Capto MMC представляет собой слабую катионную смолу с гидрофобными и тиофильными взаимодействиями и с водородными связями. Колонку Tri-corn 5/150 (GE Healthcare) набивали с помощью смолы Capto MMC с высотой слоя 15 см. Объем колонки (CV) Capto MMC составил 3 мл.
Буферы
Уравновешивающий буфер: 20 мМ ацетат натрия, 0,1 M NaCl, 0,02% полисорбат 80, pH 4.
Элюирующий буфер: 20 мМ цитрат натрия, 0,1 M NaCl, 0,5 M аргинина моногидрохлорид, 0,02% полисорбат 80, pH 7.
План эксперимента
Колонку уравновешивали с помощью уравновешивающего буфера с последующей загрузкой исходного материала со скоростью потока 1 мл/мин. Затем следовала стадия промывки с помощью уравновешивающего буфера и затем проводили элюцию с использованием элюирующего буфера. Образцы отбирали и анализировали на предмет rhG-CSF с помощью метода ВЭЖХ. Как можно видеть из Таблицы 1, в проточной фракции не обнаружено G-CSF. Элюирующий буфер содержал 0,5 M аргинина моногидрохлорид и pH изменялся на 7. Извлечение G-CSF составило 89% и профиль элюции представлял собой более концентрированный пик. Колонку очищали после элюции с помощью раствора 1 M NaOH. Наблюдали очень слабый пик после промывки колонки с помощью 1 M NaOH. Хроматограмма представлена на фигуре 1.
Заключение
Весь загруженный G-CSF связывался с Capto MMC при pH 4,0. Высокий выход (89%) получали в элюированной фракции, которую собирали в три объема колонки. Элюирующий буфер имел pH 7 и содержал 0,5 M аргинина моногидрохлорид.
Подписи к Фигуре 1.
Эксперимент 1; Хроматограмма очистки G-CSF на колонке Capto MMC при pH 4,0 с использованием натрий ацетатного буфера. На фигуре представлены измеренные поглощение при 280 нм (mAU) и проводимость (мС/см). Проводили элюцию с колонки с использованием буфера с pH 7,0, который содержал 0,5 M аргинина моногидрохлорид. С помощью элюции получали двойной пик. Двойной пик собирали в виде одной фракции.
Пример 2 (Эксперимент 2)
Исходный материал
Очищенный rhG-CSF разводили в уравновешивающем буфере до концентрации ниже суммарной концентрации белка и для достижения более подходящего объема перед загрузкой в колонку Capto MMC. rhG-CSF перед разведением растворяли в 20 мМ ацетата натрия, 0,5 M NaCl, 0,02% Tween 20, pH 4.
Хроматографическая смола и колонка
Capto MMC, смолу смешанного типа от GE Healthcare (cat no. 17-5317), использовали в качестве стадии захвата для молекулы rhG-CSF. Capto MMC представляет собой слабую катионную смолу с гидрофобными и тиофильными взаимодействиями и с водородными связями. Колонку Tri-corn 5/150 (GE Healthcare) набивали с помощью смолы Capto MMC с высотой слоя 15 см. Объем колонки (CV) Capto MMC составил 3 мл.
Буферы
Уравновешивающий буфер: 20 мМ ацетат натрия, 0,1 M NaCl, 0,02% полисорбат 80, pH 4
Элюирующий буфер: 20 мМ цитрат натрия, 0,1 M NaCl, 0,02% полисорбат 80, pH 7.
План эксперимента
Колонку уравновешивали с помощью уравновешивающего буфера с последующей загрузкой исходного материала со скоростью потока 1 мл/мин. Затем следовала стадия промывки с помощью уравновешивающего буфера и затем проводили элюцию с использованием элюирующего буфера. Образцы отбирали и анализировали на предмет rhG-CSF с помощью метода ВЭЖХ. Как можно видеть из Таблицы 2, в проточной фракции не обнаружено G-CSF. Элюирующий буфер имел pH 7,0. Более чем 90% rhG-CSF, загруженного в колонку Capto MMC, было обнаружено в элюированной фракции. Пик элюированной фракции был шире, чем в эксперименте 1, где аргинин был включен в элюирующий буфер. Объем элюции был удвоен.
Заключение
Рекомбинантный человеческий G-CSF (rhG-CSF) связывается со смолой Capto MMC при pH 4 и может элюироваться при pH 7 в буферном растворе, содержащем цитрат натрия.
Пример 3 (Эксперимент 3)
Исходный материал
Очищенный rhG-CSF разводили в уравновешивающем буфере до концентрации ниже суммарной концентрации белка и для достижения более подходящего объема перед загрузкой в колонку Capto MMC. rhG-CSF перед разведением растворяли в 20 мМ ацетата натрия, 0,5 M NaCl, 0,02% Tween 20, pH 4,0.
Хроматографическая смола и колонка
Capto MMC, смолу смешанного типа от GE Healthcare (cat no. 17-5317), использовали в качестве стадии захвата для молекулы rhG-CSF. Capto MMC представляет собой слабую катионную смолу с гидрофобными и тиофильными взаимодействиями и с водородными связями. Колонку Tri-corn 5/150 (GE Healthcare) набивали с помощью смолы Capto MMC с высотой слоя 15 см. Объем колонки (CV) Capto MMC составил 3 мл.
Буферы
Уравновешивающий буфер: 20 мМ ацетат натрия, 0,1 M NaCl, 0,02% полисорбат 80, pH 4,0.
Элюирующий буфер: 20 мМ HEPES, 0,3 M NaCl, 0,02% полисорбат 80, pH 7,0.
План эксперимента
Колонку уравновешивали с помощью уравновешивающего буфера с последующей загрузкой исходного материала со скоростью потока 1 мл/мин. Затем следовала стадия промывки с помощью уравновешивающего буфера и затем проводили элюцию с использованием элюирующего буфера. Образцы отбирали и анализировали на предмет rhG-CSF с помощью метода ВЭЖХ. Как можно видеть из Таблицы 3, в проточной фракции не обнаружено G-CSF. Элюирующий буфер имел pH 7,0, и концентрация NaCl была повышена до 0,3 M по сравнению с экспериментом 2. Весь rhG-CSF, загруженный в колонку Capto MMC, был обнаружен в элюированной фракции. Профиль хроматограммы представлен на Фигуре 2. Получали широкий пик элюции, и весь пик собирали в виде одной элюированной фракции.
Заключение
rhG-CSF связывается со смолой Capto MMC при pH 7 и элюируется до 100% при pH 7, когда в элюирующий буфер включают 0,3 M NaCl. Объем элюции был большим, в два раза больше, чем элюирующий буфер с аргинином. Это означает, что 0,3 M NaCl не обладает таким же элюирующим эффектом при элюции G-CSF со смолы Capto MMC, как 0,5 M аргинин.
Подпись к Фигуре 2.
Эксперимент 3; Хроматограмма очистки G-CSF на колонке Capto MMC при pH 4,0 с использованием натрий ацетатного буфера. На фигуре представлены измеренные поглощение при 280 нм (mAU) и проводимость (мС/см). Проводили элюцию с колонки с использованием буфера с pH 7,0, который содержал 0,3 M NaCl. С помощью элюции получали двойной пик. Широкий двойной пик собирали в виде одной фракции.
Пример 4 (Эксперимент 4)
Исходный материал
Очищенный rhG-CSF разводили в уравновешивающем буфере до концентрации ниже суммарной концентрации белка и для достижения более подходящего объема перед загрузкой в колонку Capto MMC. rhG-CSF перед разведением был растворяли в 20 мМ ацетата натрия, 0,5 M NaCl, 0,02% Tween 20, pH 4,0.
Хроматографическая смола и колонка
Capto MMC, смолу смешанного типа от GE Healthcare (cat no. 17-5317), использовали в качестве стадии захвата для молекулы rhG-CSF. Capto MMC представляет собой слабую катионную смолу с гидрофобными и тиофильными взаимодействиями и с водородными связями. Колонку Tri-corn 5/150 (GE Healthcare) набивали с помощью смолы Capto MMC с высотой слоя 15 см. Объем колонки (CV) составил 3 мл.
Буферы
Уравновешивающий буфер: 20 мМ ацетат натрия, 0,1 M NaCl, 0,02% полисорбат 80, pH 4,0.
Элюирующий буфер: 20 мМ цитрат натрия, 0,5 M аргинина моногидрохлорид, 0,02% полисорбат 80, pH 4,0.
План эксперимента
Колонку уравновешивали с помощью уравновешивающего буфера с последующей загрузкой исходного материала со скоростью потока 1 мл/мин. Затем следовала стадия промывки с помощью уравновешивающего буфера и затем проводили элюцию с использованием элюирующего буфера. Образцы отбирали и анализировали на предмет rhG-CSF с помощью метода ВЭЖХ. Как можно видеть из Таблицы 4, в проточной фракции не обнаружено rhG-CSF. Элюирующий буфер заменяли на буфер, содержащий аргинин и не содержащий хлорид натрия, и при pH 4,0. rhG-CSF не обнаружено в элюированной фракции.
Заключение
rhG-CSF не мог элюироваться со смолы Capto MMC только путем добавления к буферу 0,5 M аргинина моногидрохлорида без изменения pH. Может работать в виде стадии промывки.
Пример 5 (Эксперимент 5)
Исходный материал
Очищенный rhG-CSF разводили в уравновешивающем буфере до концентрации ниже суммарной концентрации белка и для достижения более подходящего объема перед загрузкой в колонку Capto MMC. rhG-CSF перед разведением растворяли в 20 мМ ацетата натрия, 0,5 M NaCl, 0,02% Tween 20, pH 4,0.
Хроматографическая смола и колонка
Capto MMC, смолу смешанного типа от GE Healthcare (cat no. 17-5317), использовали в качестве стадии захвата для молекулы rhG-CSF. Capto MMC представляет собой слабую катионную смолу с гидрофобными и тиофильными взаимодействиями и с водородными связями. Колонку Tri-corn 5/150 (GE Healthcare) набивали с помощью смолы Capto MMC с высотой слоя 15 см. Объем колонки (CV) Capto MMC составил 3 мл.
Буферы
Уравновешивающий буфер: 20 мМ ацетат натрия, 0,1 M NaCl, 0,02% полисорбат 80, pH 4,0.
Элюирующий буфер: 20 мМ цитрат натрия, 0,1 M NaCl, 1 M аргинина моногидрохлорид, 0,02% полисорбат 80, pH 4,0.
План эксперимента
Колонку уравновешивали с помощью уравновешивающего буфера с последующей загрузкой исходного материала со скоростью потока 1 мл/мин. Затем следовала стадия промывки с помощью уравновешивающего буфера и затем проводили элюцию с использованием элюирующего буфера. Образцы отбирали и анализировали на предмет rhG-CSF с помощью метода ВЭЖХ. Анализ продемонстрировал, что rhG-CSF связывается со смолой Capto MMC в данных буферных условиях. Как можно видеть из Таблицы 5, в проточной фракции не обнаружено rhG-CSF. Элюирующий буфер заменяли на буфер, содержащий аргинин и не содержащий хлорид натрия, и при pH 4,0, то же самое в уравновешивающем буфере. rhG-CSF не обнаружено в элюированной фракции. Это означает, что более высокая концентрация аргинина (1 M) не оказывает какого-либо эффекта на элюцию rhG-CSF с колонки Capto MMC. Но как видно на фигуре 3, пик получали, когда проводили элюцию с колонки с помощью элюирующего буфера, содержащего 1 M аргинин и при pH 4. Второй большой пик был результатом промывки с помощью 1 М NaOH.
Заключение
rhG-CSF не мог элюироваться со смолы Capto MMC только путем добавления к буферу 1 M аргинина моногидрохлорида без изменения pH. Может работать в виде стадии промывки.
Подпись к Фигуре 3.
Эксперимент 5; Хроматограмма очистки G-CSF на колонке Capto MMC при pH 4,0 с использованием натрий ацетатного буфера. На фигуре представлены измеренные поглощение при 280 нм (mAU) и проводимость (мС/см). Проводили элюцию с колонки с использованием буфера с pH 4,0, который содержал 1 M аргинина моногидрохлорид. С помощью элюции получали двойной пик. Во фракции элюата получали единственный пик. Большой пик получали с помощью промывки с использованием 1 M NaOH.
Пример 6 (Эксперименты 6, 7, 8, 9, 10, 11)
Исходный материал
Очищенный rhG-CSF разводили в уравновешивающем буфере до концентрации ниже суммарной концентрации белка и для достижения более подходящего объема перед загрузкой в колонку Capto MMC. А также до достижения pH, которое требовалось для каждого эксперимента. rhG-CSF перед разведением растворяли в 20 мМ ацетата натрия, 0,2 M NaCl, 0,02% Tween 20, pH 6,5.
Хроматографическая смола и колонка
Capto MMC, смолу смешанного типа от GE Healthcare (cat no. 17-5317), использовали в качестве стадии захвата для молекулы rhG-CSF. Capto MMC представляет собой слабую катионную смолу с гидрофобными и тиофильными взаимодействиями и с водородными связями. Колонку Tri-corn 5/150 (GE Healthcare) набивали с помощью смолы Capto MMC с высотой слоя 15 см. Объем колонки (CV) Capto MMC составил 3 мл.
Эксперимент 6
Буферы
Уравновешивающий буфер: 20 мМ ацетат натрия, 0,1 M NaCl, 0,02% полисорбат 80, pH 4,0.
Промывочный буфер: 20 мМ NaAc, 1 M NaCl, 0,02% полисорбат 80, pH 4,0.
Элюирующий буфер: 20 мМ цитрат натрия, 0,5 M аргинина моногидрохлорид, 0,1 M NaCl, 0,02% полисорбат 80, pH 7,0.
Эксперимент 7
Уравновешивающий буфер: 20 мМ ацетат натрия, 0,1 M NaCl, 0,02% полисорбат 80, pH 5,0.
Элюирующий буфер: 20 мМ цитрат натрия, 0,5 M аргинина моногидрохлорид, 0,1 M NaCl, 0,02% полисорбат 80, pH 7,0.
Эксперимент 8
Уравновешивающий буфер: 20 мМ ацетат натрия, 0,1 M NaCl, 0,02% полисорбат 80, pH 6,0.
Элюирующий буфер: 20 мМ цитрат натрия, 0,5 M аргинина моногидрохлорид, 0,1 M NaCl, 0,02% полисорбат 80, pH 7,0.
Эксперимент 9
Уравновешивающий буфер: 20 мМ ацетат натрия, 0,1 M NaCl, 0,02% полисорбат 80, pH 6,5.
Элюирующий буфер: 20 мМ цитрат натрия, 0,5 M аргинина моногидрохлорид, 0,1 M NaCl, 0,02% полисорбат 80, pH 7,0.
Эксперимент 10
Уравновешивающий буфер: 20 мМ ацетат натрия, 0,1 M NaCl, 0,02% полисорбат 80, pH 5,5.
Элюирующий буфер: 20 мМ цитрат натрия, 0,5 M аргинина моногидрохлорид, 0,1 M NaCl, 0,02% полисорбат 80, pH 7,0.
Эксперимент 11
Уравновешивающий буфер: 20 мМ ацетат натрия, 0,1 M NaCl, 0,02% полисорбат 80, pH 4,0.
Элюирующий буфер: 20 мМ цитрат натрия, 0,5 M аргинина моногидрохлорид, 0,1 M NaCl, 0,02% полисорбат 80, pH 7,0.
План эксперимента
Каждый эксперимент осуществляли, как описано далее. Очищенный rhG-CSF разводили приблизительно 1 к 20 с помощью используемого уравновешивающего буфера. pH исходного материала контролировали, и его значение во всех экспериментах было таким же как в уравновешивающем буфере без регуляции рН. Колонку уравновешивали с помощью уравновешивающего буфера с последующей загрузкой исходного материала со скоростью потока 1 мл/мин. Затем следовала стадия промывки с помощью уравновешивающего буфера и затем проводили элюцию с использованием элюирующего буфера. В эксперименте 6 колонку также промывали перед элюцией с помощью буфера, содержащего 1 M NaCl. Образцы отбирали и анализировали на предмет rhG-CSF с помощью метода ВЭЖХ.
Как видно на фигуре 4 в Эксперименте 6, не получали пика при промывке с помощью 1 M NaCl, что указывало на то, что rhG-CSF не смывался с колонки Capto MMC. Тот же профиль элюции получали, когда G-CSF очищали на колонке Capto MMC независимо от того, использовался ли натрий ацетатный буфер или натрий цитратный буфер при pH 4 (Эксперимент 6 и Эксперимент 11).
Результаты анализа, демонстрирующие на каком уровне rhG-CSF связывается с Capto MMC и какой получают выход, представлены в таблице 6.
Данные из таблицы 6 демонстрируют, что G-CSF связывается со смолой Capto MMC при pH 4-6 без какой-либо потери материала в проточной фракции. Но при pH 6,5 исходного материала, большая часть детектируемого G-CSF была обнаружена в проточной фракции.
Проводили элюцию с колонки Capto MMC с помощью буфера при pH 7, содержащего 0,5 M аргинин. Извлечение G-CSF было высоким, когда исходный материал загружали на колонку при pH 4-6, в то время как при использовании pH 6,5 для исходного материала выход в элюате был низким.
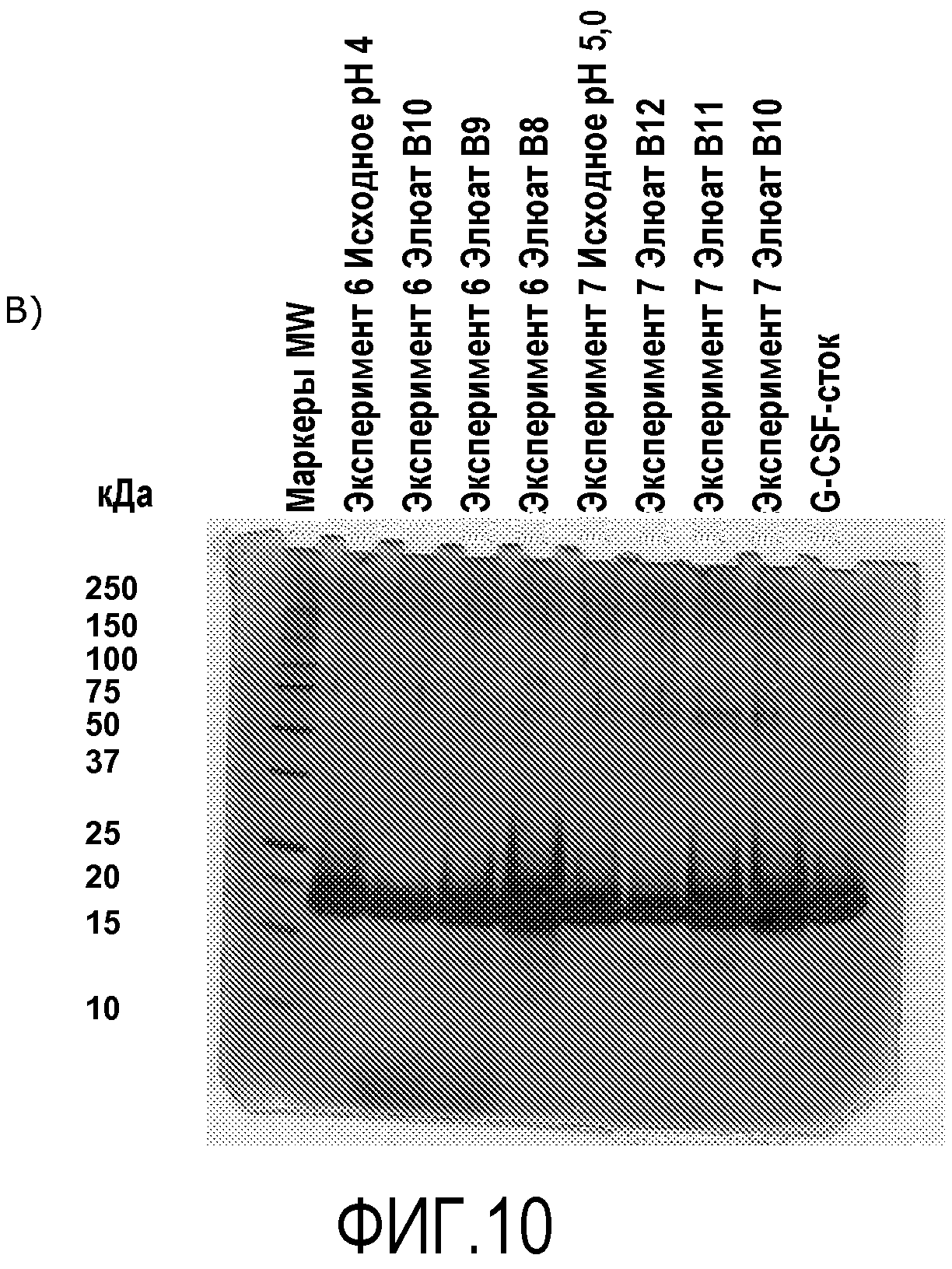
В хроматограммах, представленных ниже (Фигура 4, 5 и 6), показано, что когда rhG-CSF находится в буфере с pH 4 или 5, то он элюируется с колонки Capto MMC в виде двойного пика. Получали единственный пик, когда pH исходного материала составило 5,5, 6 или 6,5 (Фигура 7, 8 и 9). Как представлено с помощью окрашенного серебром SDS-PAGE (Фигура 10A), элюат из Эксперимента 8 (pH 6,0), Эксперимента 9 (pH 6,5) и Эксперимента 10 (pH 5,5) представлял собой единственную полосу. Тогда как элюат из Эксперимента 6 (pH 4,0) и Эксперимента 7 (pH 5,0) демонстрирует большее количество полос на окрашенном серебром SDS-PAGE (Фигура 10B).
Заключение
Результаты этих экспериментов демонстрируют, что rhG-CSF может связываться с Capto MMC при pH 4, 5, 5,5, 6. Связывание rhG-CSF с Capto MMC при pH 6,5 менее сильное, и rhG-CSF обнаруживается в проточной фракции, чего нет в случае, когда pH составляет 4-6.
Профиль элюции лучше, когда используется pH 5,5-6,5, и продукт выглядит лучше на SDS-PAGE, когда используются эти pH для загрузочного материала.
Из-за утечки G-CSF с колонки Capto MMC при использовании pH 6,5, предпочтительно использовать pH загрузочного материала 5,5-6.
Связанный материал элюируется при pH 7 во всех экспериментах, и пик получается более концентрированным, когда в элюирующий буфер включен 0,5 M аргинина моногидрохлорид. Промывку с помощью 1 М NaCl можно осуществлять при pH 4 без какой-либо потери G-CSF.
Подписи для фигур 4-10
Фигура 4.
Эксперимент 6; Хроматограмма очистки G-CSF на колонке Capto MMC при pH 4,0 исходного материала с использованием натрий ацетатного буфера. На фигуре представлены измеренные поглощение при 280 нм (mAU) и проводимость (мС/см). Проводили элюцию с колонки с использованием буфера с pH 7,0, который содержал 0,5 M аргинина моногидрохлорид. С помощью элюции получали двойной пик. Двойной пик собирали в виде одной фракции.
Фигура 5.
Эксперимент 11; Хроматограмма очистки G-CSF на колонке Capto MMC при pH 4,0 с использованием натрий цитратного буфера. На фигуре представлены измеренные поглощение при 280 нм (mAU) и проводимость (мС/см). С колонки проводили элюцию с использованием буфера с pH 7,0, который содержал 0,5 M аргинина моногидрохлорид. С помощью элюции получали двойной пик. Двойной пик собирали в виде одной фракции.
Фигура 6.
Эксперимент 7; Хроматограмма очистки G-CSF на колонке Capto MMC при pH 5,0 с использованием натрий цитратного буфера. На фигуре представлены измеренные поглощение при 280 нм (mAU) и проводимость (мС/см). Проводили элюцию с колонки с использованием буфера с pH 7,0, который содержал 0,5 M аргинина моногидрохлорид. С помощью элюции получали двойной пик. Двойной пик собирали в виде одной фракции.
Фигура 7.
Эксперимент 10; Хроматограмма очистки G-CSF на колонке Capto MMC при pH 5,5 с использованием натрий цитратного буфера. На фигуре представлены измеренные поглощение при 280 нм (mAU) и проводимость (мС/см). Проводили элюцию с колонки с использованием буфера с pH 7,0, который содержал 0,5 M аргинина моногидрохлорид. С помощью элюции получали один немного неоднородный пик.
Фигура 8.
Эксперимент 8; Хроматограмма очистки G-CSF на колонке Capto MMC при pH 6,0 с использованием натрий цитратного буфера. На фигуре представлены измеренные поглощение при 280 нм (mAU) и проводимость (мС/см). Проводили элюцию с колонки с использованием буфера с pH 7,0, который содержал 0,5 M аргинина моногидрохлорид. Получали один сконцентрированный однородный пик.
Фигура 9.
Эксперимент 9; Хроматограмма очистки G-CSF на колонке Capto MMC при pH 6,5 с использованием натрий цитратного буфера. На фигуре представлены измеренные поглощение при 280 нм (mAU) и проводимость (мС/см). Проводили элюцию с колонки с использованием буфера с pH 7,0, который содержал 0,5 M аргинина моногидрохлорид. Получали один сконцентрированный однородный пик.
Фигура 10A и Фигура 10B.
Эксперимент 6, 7, 8, 9, 10; Разделение белков в исходном материале и в элюате после экспериментов с Capto MMC, где в исходном материале использовались различные значения pH. Образцы восстанавливали (обрабатывали SDS) и разделяли на 10%-полиакриламидном геле. Белки визуализировали с помощью окрашивания серебром.
Пример 7 (Эксперимент 12)
Исходный материал
Рекомбинантный человеческий G-CSF продуцировали в клетках HEK 293. Клетки удаляли, и бесклеточная надосадочная жидкость представляла собой исходный материал, загружаемый в колонку Capto MMC.
Хроматографическая смола и колонка
Capto MMC, смолу смешанного типа от GE Healthcare (cat no. 17-5317), использовали в качестве стадии захвата для молекулы rhG-CSF. Capto MMC представляет собой слабую катионную смолу с гидрофобными и тиофильными взаимодействиями и с водородными связями. Колонку XK16 (GE Healthcare) набивали с помощью смолы Capto MMC с высотой слоя 13,5 см. Объем колонки (CV) Capto MMC составил 27 мл.
Буферы
Уравновешивающий буфер: 20 мМ ацетат натрия, 0,1 M NaCl, 0,02% полисорбат 80, pH 6,0.
Элюирующий буфер: 20 мМ цитрат натрия, 0,1 M NaCl, 0,5 M аргинина моногидрохлорид, 0,02% полисорбат 80, pH 7,0.
План эксперимента
pH бесклеточной надосадочной жидкости доводили до 6,0. Колонку уравновешивали с помощью уравновешивающего буфера с последующей загрузкой исходного материала с урегулированным значением рН и со скоростью потока 13,5 мл/мин. Затем следовала стадия промывки с помощью уравновешивающего буфера и затем проводили элюцию с использованием элюирующего буфера. Образцы отбирали и анализировали на предмет rhG-CSF с помощью метода ВЭЖХ. Анализ продемонстрировал, что весь rhG-CSF, загруженный в колонку, связывался со смолой Capto MMC в данных буферных условиях, и G-CSF не обнаруживался в проточной фракции. Элюирующий буфер содержал 20 мМ цитрата натрия, 0,5 M аргинина, 0,1 M NaCl и 0,02% полисорбата 80, и имел pH 7,0. Элюция белков, связанных со смолой Capto MMC, приводила в результате к получению основного пика и небольшого второго пика. Весь G-CSF, загруженный в колонку Capto MMC, обнаруживали в основном пике, и детектировали отсутствие G-CSF во втором небольшом пике (Фигура 11).
Заключение
Рекомбинантный человеческий G-CSF в бесклеточной культуральной среде связывался со смолой Capto MMC при pH 6,0.
G-CSF не обнаруживали в проточной фракции.
Связанный материал элюировали со смолы Capto MMC путем изменения pH до 7 и путем добавления 0,5 M аргинина для концентрирования элюированного пика.
Подпись к Фигуре 11.
Эксперимент 12; Хроматограмма очистки G-CSF из бесклеточной надосадочной жидкости на колонке Capto MMC при pH 6,0 с использованием натрий цитратного буфера. На фигуре представлены измеренные поглощение при 280 нм (mAU) и проводимость (мС/см). Проводили элюцию с колонки с использованием буфера с pH 7,0, который содержал 0,5 M аргинина моногидрохлорид. Получали двойной пик, но G-CSF обнаруживался только в основном пике.
Пример 8
Колонка и смола
Колонку Tricorn 5/50 (GE Healthcare) набивали с помощью Fab-фрагмента, выделенного из дрожжей, на основе аффинного лиганда, связанного с основной смолы Capto MP. Высота слоя приблизительно составила 2 см, с получением объема смолы приблизительно 0,4 мл. Прототип аффинной смолы (G-CSF8) получали из ВАС BV.
Исходный материал
Используемый исходный материал представлял собой G-CSF-содержащую клеточную надосадочную жидкость из клеток HEK293F.
Буферные составы:
Буфер A (Уравновешивающий буфер)
0,3 M NaCl, 0,02 M Na-цитрат, 0,02% Tween 20, pH 6,0, проводимость 32 мС/см при +25°C.
Буфер В (Элюирующий буфер I)
0,3 M NaCl, 0,02 M Na-цитрат, 0,02% Tween 20, pH 3,0, проводимость 32 мС/см при +25°C.
Колонку уравновешивали с помощью уравновешивающего буфера А с последующей загрузкой исходного материала. Затем смолу промывали с помощью уравновешивающего буфера A, и связанный G-CSF затем элюировали с помощью элюирующего буфера В. Анализировали содержание G-CSF в исходном материале и в элюате (Таблица 7).
Фигура 12 демонстрирует окрашивание Кумасси SDS-PAGE элюата после стадии аффинной хроматографии.
Заключение примера 8
Превосходной чистоты и извлечения достигали при использовании буфера с низким pH (pH 3) для элюции G-CSF.
Пример 9
Колонка и смола
Колонку Tricorn 5/50 (GE Healthcare) набивали с помощью Fab-фрагмента, выделенного из дрожжей, на основе аффинного лиганда, связанного с основной смолой Capto MP. Высота слоя приблизительно составила 2 см, с получением объема смолы приблизительно 0,4 мл. Прототип аффинной смолы (G-CSF8) получали из ВАС BV.
Исходный материал
Используемый исходный материал представлял собой G-CSF-содержащую клеточную надосадочную жидкость из клеток HEK293F.
Буферные составы:
Буфер A (Уравновешивающий буфер)
0,3 M NaCl, 0,02 M Na-цитрат, 0,02% Tween 20, pH 6,0, проводимость 32 мС/см при +25°C
Буфер С (Элюирующий буфер II)
1 M NaCl, 0,02 M Na-цитрат, 0,8 M Arg, 0,02% Tween 20, pH 6,0, проводимость 89 мС/см при +25°C.
Уравновешивающий и элюирующий буферы не ограничены установленным pH, концентрациями и типом буфера, солями или детергентами.
Колонку уравновешивали с помощью уравновешивающего буфера А с последующей загрузкой исходного материала. Затем смолу промывали с помощью уравновешивающего буфера A, и связанный G-CSF затем элюировали с помощью элюирующего буфера C. Анализировали содержание G-CSF в исходном материале и в элюате (Таблица 8).
Заключение примера 9
Возможно элюировать G-CSF из аффинной колонки с использованием смеси хлорида натрия и аргинина.
Пример 10
Колонка и смола
Колонку Tricorn 5/50 (GE Healthcare) набивали с помощью Fab-фрагмента, выделенного из дрожжей, на основе аффинного лиганда, связанного с основной смолой Capto MP. Высота слоя приблизительно составила 2 см, с получением объема смолы приблизительно 0,4 мл. Прототип аффинной смолы (G-CSF8) получали из ВАС BV.
Исходный материал
Используемый исходный материал представлял собой G-CSF-содержащую клеточную надосадочную жидкость из клеток HEK293F.
Буферные составы:
Буфер A (Уравновешивающий буфер)
0,3 M NaCl, 0,02 M Na-цитрат, 0,02% Tween 20, pH 6,0, проводимость 32 мС/см при +25°C.
Буфер D (Элюирующий буфер III)
2 M MgCl2, 0,02 M Tris, 0,02% Tween 20, pH 7,5, проводимость 144 мС/см при +25°C.
Уравновешивающий и элюирующий буферы не ограничены установленным pH, концентрациями и типом буфера, солями или детергентами.
Колонку уравновешивали с помощью уравновешивающего буфера А с последующей загрузкой исходного материала. Затем смолу промывали с помощью уравновешивающего буфера A, и связанный G-CSF затем элюировали с помощью элюирующего буфера D. Анализировали содержание G-CSF в исходном материале и в элюате (Таблица 9).
Заключение примера 10
Возможно элюировать G-CSF из аффинной колонки с использованием в качестве элюента 2 M MgCl2.
Пример 11
Колонка и смола
Колонки Tricorn 5/50 (GE Healthcare) набивали с помощью 3 различных Fab-фрагментов, выделенных из дрожжей, на основе прототипов аффинных лигандов, связанных с основной смолой Capto MP. Высота слоя приблизительно составила 2 см, с получением объема смолы приблизительно 0,4 мл. Прототип аффинной смолы (G-CSF2, G-CSF3 и G-CSF6) получали из ВАС BV.
Исходный материал
Используемый исходный материал представлял собой G-CSF-содержащую клеточную надосадочную жидкость из клеток HEK293F.
Буферные составы:
Буфер A (Уравновешивающий буфер)
0,3 M NaCl, 0,02 M Na-цитрат, 0,02% Tween 20, pH 6,0, проводимость 32 мС/см при +25°C.
Буфер B (Элюирующий буфер I)
0,3 M NaCl, 0,02 M Na-цитрат, 0,02% Tween 20, pH 3,0, проводимость 32 мС/см при +25°C.
Колонку уравновешивали с помощью уравновешивающего буфера А с последующей загрузкой исходного материала. Затем смолу промывали с помощью уравновешивающего буфера A, и связанный G-CSF затем элюировали с помощью элюирующего буфера В. Анализировали содержание G-CSF в исходном материале, в проточной фракции и в элюате (Таблица 10).
Фигура 13 демонстрирует окрашивание серебром SDS-PAGE исходного материала, проточной фракции и элюатов после стадии аффинной хроматографии.
Подписи:
Дорожка Образец
1 G-CSF2 на старте; 2 G-CSF2 в проточной фракции; 3 Пустой образец; 4 G-CSF2-элюат; 5. Пустой образец; 6 G-CSF3 в проточной фракции; 7 Пустой образец; 8 G-CSF3-элюат; 9. Пустой образец; 10 G-CSF6 в проточной фракции; 11 Пустой образец; 12 G-CSF6-элюат
Заключение примера 11
Различные прототипы аффинных лигандов обеспечивают различную способность связывания G-CSF, как представлено с помощью детектирования G-CSF в проточной фракции, и различное извлечение в элюированной фракции с использованием буфера с низким pH в качестве элюента. Однако, как представлено на фигуре 13, все аффинные лиганды дают одинаково превосходный профиль чистоты в элюате.
Реферат
Изобретение относится к биотехнологии, а именно к способу очистки G-CSF (гранулоцитарный колониестимулирующий фактор) в последовательности очистки, применяющей хроматографию. Способ включает осуществление по меньшей мере одной хроматографии с использованием многомодальной смолы с отрицательно заряженным лигандом в виде 2-(бензоиламино)бутановой кислоты. G-CSF связывают с многомодальной смолой при pH в интервале 4-6,2. G-CSF элюируют при pH выше 6,3 или элюирующим агентом в элюирующем буфере, где указанный агент включает аминокислоту, имеющую основную боковую цепь и/или высокую ионную силу в элюирующем буфере, выбранную из группы, состоящей из аргинина, лизина и/или гистидина. Концентрация элюирующего агента находится в интервале от примерно 0,1 М до примерно 2,0 М. Предложенное изобретение позволяет получить очищенный G-CSF с высоким выходом. 13 з.п. ф-лы, 14 ил., 10 табл., 11 пр.
Формула
- по меньшей мере одна хроматография осуществляется с использованием многомодальной смолы с отрицательно заряженным лигандом в виде 2-(бензоиламино)бутановой кислоты,
- G-CSF связывается с многомодальной смолой при pH в интервале 4-6,2, и
- G-CSF элюируется при pH выше 6,3,
- или элюирующим агентом в элюирующем буфере, где указанный агент включает аминокислоту, имеющую основную боковую цепь и/или высокую ионную силу в элюирующем буфере, выбранную из группы, состоящей из аргинина, лизина и/или гистидина, и
- где концентрация элюирующего агента находится в интервале от примерно 0,1 М до примерно 2,0 М,
- необязательно в комбинации со стадией хроматографии с аффинным лигандом, выделенным из дрожжей, в частности с Fab-фрагментом, выделенным из дрожжей, направленным против G-CSF.
- применение катионной многомодальной смолы с лигандом в виде 2-(бензоиламино)бутановой кислоты, такой как Capto ММС;
- стадия на основе химической инактивации для оболочечных вирусов, в частности инактивация с использованием растворителя/детергента, применяющая три-н-бутилфосфат и Triton Х-100, как раскрыто в ЕР-А-131 740;
- применение аффинной смолы на основе лиганда, экспрессируемого в дрожжах;
- применение катионообменной смолы, такой как SP Sepharose или Resource S;
- стадия удаления патогенов фильтрацией со средним размером пор примерно 20 нм, как например у Planova 20N;
- стадия замены буфера и/или концентрирования, как, например, ультрафильтрация с использованием приблизительной границы пропускания 1-5 кДа;
- применение смолы для эксклюзионной хроматографии, такой как Superdex 75.
Документы, цитированные в отчёте о поиске
Способ очистки и/или выделения биологически активного гранулоцитарного колониестимулирующего фактора

Комментарии