Способ очистки и/или выделения биологически активного гранулоцитарного колониестимулирующего фактора - RU2358980C2
Код документа: RU2358980C2
Чертежи
Описание
Область изобретения
Изобретение относится к новому способу очистки и/или выделения биологически активного гранулоцитарного колониестимулирующего фактора (G-CSF) посредством аффинной хроматографии с иммобилизованным металлом (IMAC).
G-CSF принадлежит к группе колониестимулирующих факторов, которые регулируют дифференцировку и пролиферацию гемопоэтических предшественных клеток и активацию зрелых нейтрофилов. G-CSF применяют в медицине в области гематологии и онкологии. Два типа G-CSF применяют для лечения: гликозилированную форму (ленограстим), которую получают путем экспрессии в клетках млекопитающих, и негликозилированную форму (филграстим), которую получают путем экспрессии в бактериях Escherichia coli (E. coli).
Предпосылки к созданию изобретения
Негликозилированная форма G-CSF (филграстим) и ее получение описаны в Европейском патенте ЕР 237545 в то время, как гликозилированная форма G-CSF (ленограстим) и ее получение описаны в Европейском патенте ЕР 169566.
Способы очистки и/или выделения G-CSF, которые известны из патентной и научной литературы, содержат различные комбинации ионной хроматографии, хроматофокусирования, гидрофобной хроматографии, гель-хроматографии и некоторых других способов.
В основном, первая стадия способа очистки и/или выделения G-CSF зависит от хозяйского организма для гетерологичной экспрессии G-CSF. В случае экспрессии в E. coli, G-CSF найден в нерастворимых тельцах включений. Поэтому обычные способы заключают в себе дополнительные стадии выделения G-CSF из телец включений, приводящие к получению правильно свернутой (уложенной) биологически активной форме. Указанные стадии обычно представляют собой промывку детергентами или хаотропными веществами, солюбилизацию сильными денатурирующими реагентами (например, хлоргидратом гуанидина (GndHCl), мочевиной) или детергентами с высокой концентрацией (например, N-лауроилсаркозином (саркозилом) или додецилсульфатом натрия (SDS)), частичную очистку солюбилизированного денатурированного белка гель-фильтрацией, ВЭЖХ с обращенной фазой (RP-HPLC) и ренатурацию разбавлением денатурирующего реагента или диализом. В случае экспрессии G-CSF в дрожжах или клетках млекопитающих тельца включений или подобные структуры обнаруживают редко, и в этих случаях осуществление способа очистки и/или выделения начинают прямо после секреции G-CSF. Способы очистки и/или выделения G-CSF описаны в следующих патентных заявках и патентах: Европейских патентах ЕР 169566, ЕР 237545, ЕР 215126, ЕР 243153, патенте США 5055555 и международной публикации WO 0104154. Способы очистки и/или выделения G-CSF также описаны в научной литературе: Lu, H.S. et al. в Protein Expr Purif 4, 465-472 (1993), Kang, S.H. et al. в Biotechnol. Lett. 17, 687-692 (1995), Wingfield, P et al. в Biochem. J. 256, 213-218 (1988), Yamasaki, M. et al. в Biosci. Biotechnol. Biochem. 62, 1528-1534 (1998), Bae, C.S. et al. в Biotechnol. Bioeng. 57, 600-609 (1998).
В случае некоторых других белков для частичной очистки и ренатурации также применяют IMAC. Впервые метод IMAC описан Porath et al. в Nature 258, 598-599 (1975) и основан на связывании белков с иммобилизованными ионами металла, которые образуют хелаты с различными носителями для IMAC. Электронно-донорные группы в аминокислотной последовательности белка ответственны за координированное связывание с носителем, особенно имидазольное кольцо в остатках гистидина. Выделение рекомбинантных белков с аффинными метками к гистидину на N- или С-концах белка с помощью IMAC описано Hochuli, E. et al. в Bio/Technology 1321-1325 (1988), Chaga, G. et al. в Biotechnol. Appl. Biochem. 29 (часть 1), 19-24 (1999) и Jeong, J.K. and Lee S.Y. Protein Expr. Purif., 23: 311-318 (2001). Применение IMAC для исследования небольших топографических различий среди белковых молекул описано Sulkowski в Trends Biotechnol. 3, 1-7 (1985) и Hemdan et al. в Proc. Natl. Acad. Sci. USA 86, 1811-1815 (1989).
Способ очистки посредством IMAC некоторых других белков, которые содержат остатки гистидина, описан в патенте США 5932102.
Способ очистки белков, у которых аминокислоты, расположенные на поверхности молекулы, способны связывать ионы металлов, описан в международной публикации WO 9012803. В данном способе IMAC применяют в качестве дополнительной стадии после частичной очистки белка с помощью некоторых других хроматографических методов. Ни выделение, ни отделение неденатурированных или биологически активных молекул G-CSF от денатурированных или биологически неактивных молекул G-CSF при нативных условиях посредством IMAC не описано.
Сравнительные исследования, посвященные G-CSF, взаимодействию его Ser-17 и (His)6-меченых форм с ионами металлов посредством аффинного распределения по отношению к комплексу специфического красителя-иона металла, описаны в литературе (Zaveckas, M. et al. в J. Chromatogr. A 904, 145-169 (2000)). На основании оценки хроматографического поведения бромелаина и чистого G-CSF на свободной от металла и содержащей Hg(II) колонке с IDA (иминодиацетатом), Gelunaite, L. et al. в J. Chromatogr. A 904, 131-143 (2000), сделали попытку оценить способность Hg(II)-содержащей колонки (сефароза IDA) для IMAC экстрагировать G-CSF при денатурирующих условиях из телец включений, солюбилизированных детергентом.
IMAC с иммобилизованными ионами Zn(II) или Ni(II) также применяют в качестве метода ренатурации интерлейкина, денатурированного GndHCl, G-CSF и колониестимулирующего гранулоцитарно-моноцитарно-макрофагального фактора (GM-CSF) (Rozenaite, V. et al. в Poster abstract, P-104, Cordoba, Spain, 19-22. April (1998)). Денатурированные белки связываются с IMAC-носителем при денатурирующих условиях.
Краткое описание сущности изобретения
Целью изобретения является улучшение способа очистки и/или выделения G-CSF и получение биологически активного G-CSF в высокоочищенной и активной форме, а также фармацевтической композиции, содержащей указанный G-CSF.
Настоящее изобретение касается способа очистки и/или выделения биологически активного G-CSF, представленного в независимом пункте в формуле изобретения. Кроме того, настоящее изобретение относится к способу очистки и/или выделения биологически активного G-CSF, представленного в независимом пункте в формуле изобретения, биологически активного G-CSF, представленного в независимом пункте в формуле изобретения, фармацевтической композиции, представленной в независимом пункте в формуле изобретения, и применению биологически активного G-CSF, представленного в формуле изобретения как независимый пункт. Предпочтительные аспекты представлены в зависимых пунктах формулы изобретения.
Согласно настоящему изобретению неожиданно было найдено, что правильно свернутые и биологически активные молекулы G-CSF могут быть отделены от неправильно свернутых или биологически неактивных молекул G-CSF при нативных условиях путем применения IMAC. Способ очистки и/или выделения биологически активного G-CSF согласно настоящему изобретению включает в себя отделение правильно свернутых и биологически активных молекул G-CSF от неправильно свернутых или биологически неактивных молекул G-CSF и также от большинства хозяйских белков путем применения IMAC при нативных условиях. Согласно указанному способу правильно свернутые и биологически активные молекулы G-CSF специфически связываются с IMAC-носителем в то время, как неправильно свернутые биологически неактивные формы G-CSF и большая часть примесей остаются в элюате. Способ очистки и/или выделения согласно настоящему изобретению также включает в себя отделение биологически активных мономерных форм G-CSF от олигомерных, полимерных и биологически неактивных мономерных форм G-CSF. Биологически активные мономерные формы G-CSF специфически связываются с IMAC-носителем в то время, как олигомерные, полимерные и биологически неактивные мономерные формы G-CSF в основном остаются в элюате.
Способ согласно настоящему изобретению представляет собой эффективную стадию очистки и концентрирования правильно свернутых биологически активных мономерных форм или молекул G-CSF и может быть использована как ключевая стадия в целом способе очистки и/или выделения G-CSF.
Способ очистки и/или выделения согласно настоящему изобретению может быть применен в случаях, когда G-CSF после экспрессии секретируется прямо через пути секреции в среду, или когда G-CSF образуется в виде телец включений в цитоплазме, периплазме или любой другой клеточной органелле. Способ также можно использовать для очистки и/или выделения биологически активного G-CSF прямо из солюбилизированных телец включений и во всех случаях, где G-CSF сначала денатурировали и затем ренатурировали. Способ очистки и/или выделения биологически активного G-CSF согласно настоящему изобретению можно осуществлять при нативных условиях на протяжении всего способа.
Способ очистки и/или выделения биологически активного G-CSF согласно настоящему изобретению приводит к получению биологически активного G-CSF с чистотой выше 95%. Только две дополнительные хроматографические стадии, катионообменную хроматографию и гель-фильтрацию, которые применяют в предпочтительном аспекте настоящего изобретения, можно дополнительно применять для удаления следовых количеств остающихся примесей (доочистка).
Поэтому в целом способ согласно настоящему изобретению приводит к получению биологически активного G-CSF с чистотой выше 99%. Способ годится для получения больших количеств биологически активного G-CSF и годится для промышленного получения биологически активного G-CSF.
Сведений об отделении биологически активных, мономерных, правильно свернутых молекул G-CSF от олигомерных, полимерных или биологически неактивных мономерных форм или неправильно свернутых молекул G-CSF с помощью IMAC при нативных условиях не обнаружено ни в научной, ни в патентной литературе.
В публикациях из предыдущего уровня техники также не обнаружено сведений относительно очистки и/или выделения биологически активного G-CSF из неочищенного раствора или смеси, содержащей биологически активные молекулы G-CSF и примеси, путем связывания правильно свернутых биологически активных мономерных форм G-CSF (т.е. таких молекул, которые уже имеются в растворе или смеси) с носителем для IMAC при нативных условиях. Кроме того, отделение молекул G-CSF соответственно их конформационному состоянию с помощью IMAC не описано.
Все способы очистки и/или выделения G-CSF, описанные на предыдущем уровне техники, включают в себя несколько стадий. Применение только одной хроматографической стадии как для разделения G-CSF соответственно его биологической активности и степени свертывания, так и для отделения от примесей, присутствующих в растворе или смеси, а также в качестве эффективного способа концентрирования G-CSF и получения биологически активного G-CSF с чистотой выше 95%, так что только может потребоваться дополнительная доочистка, в уровне техники не описано.
Подробное описание изобретения и его предпочтительных аспектов
Настоящее изобретение относится к применению IMAC как эффективного хроматографического метода в способе очистки и/или выделения биологически активного G-CSF. Правильно свернутые биологически активные мономерные формы или молекулы G-CSF избирательно связываются с IMAC-носителем при нативных условиях, в то время как неправильно свернутые или агрегированные молекулы G-CSF и большая часть других примесей, в частности, солюбилизированных белков из телец включений после экспрессии из, например, E. coli, в основном не связываются с указанными носителями и смываются, не удерживаясь. Полагают, что эта особенность имеет место вследствие специфического распределения природных остатков гистидина.
Термин "нативные условия", который употребляют в данном тексте, относится к условиям, при которых молекула (G-CSF белок) сохраняет нативную конформацию и биологическую активность.
Термин "денатурирующие условия" относится к условиям, при которых нативная конформация G-CSF белка не сохраняется, биологическая активность изменяется и не сохраняется.
Термин "агрегированные молекулы", который употребляют в данном тексте, относится к молекулам, образующим кластеры молекул, которые удерживаются вместе посредством гидрофобных или некоторых других взаимодействий (например, дисульфидных связей). Указанные молекулы не являются биологически активными.
Термин "элюция", употребляемый в данном тексте, относится к вымыванию или экстрагированию адсорбированного материала из хроматографической колонки.
Термин "элюат", употребляемый в данном тексте, относится к раствору, который получают путем вымывания и экстрагирования из хроматографической колонки.
Термин "тельца включений", употребляемый в данном тексте, относится к нерастворимым компактным агрегатам неправильно свернутых или частично правильно свернутых белков.
Термин "раствор телец включений", употребляемый в данном тексте, относится к раствору, который содержит тельца включений.
Термин "биологически активный G-CSF", употребляемый в данном тексте, относится к G-CSF, который способствует дифференцировке и пролиферации гемопоэтических клеток предшественников и активации зрелых клеток гемопоэтической системы.
Термин "биологически активная форма (или молекула) G-CSF", употребляемый в данном тексте, относится к форме или молекуле G-CSF, которая находится в мономерном и неденатурированном состоянии и которая проявляет указанную выше биологическую активность.
Термин "примесь", употребляемый в данном тексте, относится к веществу, которое отличается от биологически активной молекулы G-CSF, так что биологически активная молекула G-CSF не является чистой. Примесью может быть, по крайней мере, одно вещество из группы, состоящей из биологически неактивных мономерных форм и неправильно свернутых молекул G-CSF, олигомерных и полимерных форм G-CSF, денатурированных форм G-CSF и белков клетки хозяина. Примесью также могут быть другие вещества клетки хозяина, такие как ДНК, (липо)полисахариды и т.д., и добавки, которые применяют при получении и обработке G-CSF.
Чистота, указанная в тексте, относится к чистоте, определенной ВЭЖХ.
Способ очистки и/или выделения биологически активного G-CSF согласно настоящему изобретению, в частности, определяют как способ, состоящий из следующих стадий:
а) нанесение раствора или смеси, которая содержит биологически активную форму G-CSF и примесь, на IMAC-носитель;
b) избирательное связывание биологически активной формы G-CSF с IMAC-носителем, возможно, промывка IMAC-колонки, и
c) элюция биологически активной формы G-CSF из колонки.
Способ согласно настоящему изобретению может быть преимущественно осуществлен при нативных условиях.
Способ очистки и/или выделения биологически активного G-CSF согласно настоящему изобретению может дополнительно включать дальнейшую очистку биологически активного G-CSF и предпочтительно заключает в себе следующие стадии, которые выполняют после очистки и/или выделения биологически активного G-CSF посредством IMAC:
d) катионообменную хроматографию и/или
e) гель-фильтрацию.
Полный способ согласно настоящему изобретению приводит к получению биологически активного G-CSF, подходящего для клинического использования в медицине.
Биологически активный G-CSF, подходящий для клинического использования в медицине, может уже быть получен эффективным и предпочтительным способом очистки и/или выделения, в котором неочищенную смесь, содержащую G-CSF, при нативных условиях подвергают хроматографической стадии(ям), которая состоит только из IMAC и, возможно, по крайней мере, одного из методов очистки, выбранных из ионообменной хроматографии и гель-фильтрации. Способ согласно настоящему изобретению также может быть применен в случае очистки и/или выделения производных G-CSF, таких как метионил-G-CSF (Met-G-CSF), гликозилированный, ферментативно или химически модифицированный (например, пэгилированный) G-CSF, аналоги G-CSF и слитые белки, содержащие G-CSF.
Существенные преимущества способа очистки и/или выделения согласно настоящему изобретению заключаются в том, что:
1) молекулы G-CSF разделяются соответственно их конформационному состоянию и поэтому соответственно их биологической активности;
2) способ делает возможным связывание биологически активных молекул G-CSF с IMAC-носителем при нативных условиях и впоследствии отделение биологически активных молекул G-CSF от биологически неактивных молекул G-CSF при нативных условиях;
3) способ делает возможным связывание правильно свернутых молекул G-CSF с IMAC-носителем при нативных условиях с последующим отделением правильно свернутых молекул G-CSF от неправильно свернутых молекул G-CSF при нативных условиях;
4) способ делает возможным связывание биологически активных мономерных форм G-CSF с IMAC-носителем при нативных условиях и впоследствии отделение биологически активных мономерных форм G-CSF от биологически неактивных мономерных форм G-CSF;
5) способ делает возможным связывание мономерных форм G-CSF с IMAC-носителем и впоследствии отделение мономерных форм G-CSF от олиго- и полимерных форм G-CSF при нативных условиях;
6) способ делает возможным отделение при нативных условиях правильно свернутых мономерных биологически активных молекул G-CSF от других белков и примесей, которые присутствуют в растворе, смеси или среде;
7) благодаря способу согласно настоящему изобретению в значительной степени можно повысить удельную активность очищенного G-CSF, например, до уровня удельной активности, по крайней мере, 1·107 МЕ/мг, более предпочтительно до уровня удельной активности 7-8·107 МЕ/мг, наиболее предпочтительно до уровня удельной активности приблизительно 1·108 МЕ/мг, где удельную активность измеряют методом, основанным на стимуляции клеточной пролиферации, как описано в примере 5;
8) благодаря способу согласно настоящему изобретению можно получать G-CSF с высоким выходом и с чистотой, по крайней мере, 95% или, при осуществлении дальнейшей очистки катионообменной хроматографией и гель-фильтрацией согласно предпочтительному аспекту, даже, по крайней мере, 99%, и поэтому способ является пригодным для промышленного получения биологически активного G-CSF;
9) полный способ очистки и/или выделения биологически активного G-CSF согласно предпочтительному аспекту, который также включает в себя очистку катионообменной хроматографией и гель-фильтрацией, не требует каких-либо дополнительных стадий очистки G-CSF и может преимущественно выполняться при нативных условиях на всем протяжении.
Полный способ очистки и/или выделения биологически активного G-CSF согласно настоящему изобретению наиболее предпочтительно осуществляют при нативных условиях.
Способ согласно настоящему изобретению не представляет собой способ ренатурации неправильно свернутых молекул G-CSF, но является способом, который включает в себя специфическое связывание с IMAC-носителем неденатурированных или правильно свернутых биологически активных мономерных молекул G-CSF, которые уже присутствуют в растворе, смеси или среде, содержащей неочищенный G-CSF.
Отделение мономерных от олиго- и полимерных форм G-CSF происходит таким образом, что биологически активные мономерные формы G-CSF связываются с IMAC-носителем в то время, как олиго- и полимерные формы, которые также могут присутствовать в агрегатной форме, в основном остаются в элюате.
Для отделения мономерной формы G-CSF от олиго- и полимерных форм G-CSF вместо IMAC может быть применена гель-фильтрация. Преимущество IMAC над гель-фильтрацией заключается в ее концентрирующей способности, более высокой связывающей способности и способности отделять правильно свернутые мономерные формы G-CSF от неправильно свернутых мономерных форм G-CSF. Гель-фильтрацией нельзя отделить правильно свернутые мономерные формы G-CSF от неправильно свернутых мономерных форм G-CSF. Таким образом, при использовании IMAC можно добиться наилучших результатов.
Другое преимущество способа очистки и/или выделения биологически активного G-CSF согласно настоящему изобретению над другими способами, известными из предыдущего уровня техники, заключается в том, что (при нативных условиях, которые поддерживают на протяжении всего способа) благодаря способу возможно выделить правильно свернутые молекулы G-CSF из смеси различных белков и также из смеси молекул G-CSF, присутствующих в разных конформационных состояниях. Поэтому прямое выделение G-CSF из (предпочтительно разбавленной) культуральной среды или, в частности, из телец включений при нативных условиях является возможным.
Дополнительными преимуществами способа согласно настоящему изобретению над обычными способами являются также: возможность снизить или исключить применение детергентов, возможность работать в отсутствие денатурирующих реагентов, которые являются либо токсичными, либо неблагоприятными для окружающей среды (например, GndHCl или мочевина), и возможность снизить или исключить применение буферов и других растворов.
Преимущество способа очистки и/или выделения биологически активного G-CSF согласно настоящему изобретению над способами, в которых применяют сильные денатурирующие реагенты, заключается в том, что в данном способе не требуется использование активных восстанавливающих реагентов, подобных дитиотреитолу или бета-меркаптоэтанолу.
В случае секреции G-CSF прямо в среду, способ очистки и/или выделения биологически активного G-CSF согласно настоящему изобретению делает возможным эффективное и непосредственное концентрирование биологически активного G-CSF из разбавленных сред. Биологически активный G-CSF высокой чистоты получают в элюате из IMAC-колонки.
Поскольку эффективного отделения биологически активной молекулы G-CSF от биологически неактивных молекул G-CSF и других примесей можно достичь либо путем выделения биологически активной молекулы G-CSF из телец включений, и/или путем выделения биологически активной молекулы G-CSF прямо из раствора или содержащей ее смеси, то способ очистки и/или выделения G-CSF согласно изобретению представляется более экономичным по сравнению с другими способами.
Таким образом, чистота G-CSF более 95% может быть достигнута при использовании только одной стадии очистки.
Следующая хроматографическая стадия(и) является(ются) особенно подходящей для конечной очистки (доочистки) биологически активного G-CSF после элюирования из IMAC-колонки:
- катионообменная хроматография и/или;
- гель-фильтрация.
Катионообменная хроматография является особенно эффективной для удаления следовых количеств нуклеиновых кислот, липополисахаридов и белков из хозяйских клеток и для удаления ионных изомеров G-CSF и измененных (поврежденных) форм G-CSF с измененными величинами pI. Гель-фильтрация является особенно эффективной для удаления следовых количеств димеров и высших агрегированных форм G-CSF.
Применение дополнительных двух конечных стадий очистки приводит к чистоте биологически активного G-CSF выше 99%.
Преимущества полного способа очистки и/или выделения биологически активного G-CSF согласно предпочтительному аспекту изобретения, который дополнительно включает в себя катионообменную хроматографию и гель-фильтрацию, являются следующими: кроме соответствующих стадий предварительной обработки, таких как солюбилизация и, возможно, последующее удаление солюбилизирующего реагента диализом, ионный обмен, ультрафильтрация, диафильтрация или разбавление или тому подобное, способ может эффективно включать в себя только вышеописанные три хроматографические стадии; между тремя хроматографическими стадиями предпочтительно не существует промежуточных стадий (подобно концентрированию, диализу, осаждению и т.д.), и нативные условия предпочтительно поддерживают на протяжении всего способа очистки и/или выделения.
Промежуточные стадии концентрирования будут вызывать образование димеров и других форм агрегатов, приводящих к снижению выхода. Полный способ очистки и/или выделения может быть переведен на промышленный масштаб и на продукцию биологически активного G-CSF с чистотой, по крайней мере, 99%.
Биологически активный G-CSF, полученный полным способом очистки и/или выделения согласно настоящему изобретению, является подходящим для приготовления фармацевтической композиции, которая содержит терапевтически эффективное количество биологически активного G-CSF, и подходящим для клинического применения.
Возможность сохранения активной формы G-CSF в короткий период способа очистки и выделения вносит вклад не только в увеличение выхода, но также в увеличение чистоты и эффективности биологически активного G-CSF и содержащей его фармацевтической композиции.
Термин "терапевтически эффективное количество", употребляемый в данном тексте, относится к количеству биологически активного G-CSF, которое оказывает терапевтический эффект биологически активного G-CSF.
Подходящие фармацевтически приемлемые вспомогательные вещества включают в себя подходящие разбавители, адъюванты и/или носители, применяемые в терапии с помощью G-CSF.
Биологически активный G-CSF, который был получен способом согласно настоящему изобретению, особенно при использовании дополнительных стадий катионообменной хроматографии и гель-фильтрации, может быть использован для приготовления лекарственных средств, которые предназначены при показаниях, выбранных из группы, состоящей из: нейтропении и связанных с нейтропенией клинических осложнений, уменьшения случаев госпитализации в связи с лихорадочной нейтропенией после химиотерапии, мобилизации гемопоэтических предшественных клеток, как альтернативы к инфузии донорских лейкоцитов, хронической нейтропении, инфекций при нейтропении и инфекций, не связанных с нейтропенией, реципиентов трансплантатов, хронических воспалительных состояний, сепсиса и септического шока, снижения риска заболеваемости, смертности, количества дней госпитализации в связи с инфекцией при нейтропении и с инфекцией, не связанной с нейтропенией, профилактики инфекции и связанных с инфекцией осложнений у больных с инфекцией при нейтропении и у больных с инфекцией, не связанной с нейтропенией, профилактики нозокомиальной инфекции и снижения уровня смертности и частоты нозокомиальных инфекций, энтерального введения новорожденным, усиления иммунной системы новорожденных, улучшения исхода болезни у больных в отделениях интенсивной терапии и больных в критическом состоянии, заживления и обработки ран/кожных язв/ожогов, интенсификации химиотерапии и/или радиотерапии, панцитопении, повышения уровня противовоспалительных цитокинов, сокращения интервалов химиотерапии высокими дозами при употреблении филграстима с целью профилактики, потенциирования противоопухолевых эффектов фотодинамической терапии, профилактики и лечения заболевания, вызванного различными церебральными нарушениями, лечения тромбозного заболевания и его осложнений и восстановления эритропоэза после облучения.
Кроме того, фактор можно применять для лечения всех других заболеваний, для которых G-CSF показан.
Фармацевтическая композиция, содержащая чистый и биологически активный G-CSF, полученный способом согласно настоящему изобретению, также может быть введена больным в терапевтическом количестве, которое является эффективным для лечения вышеупомянутых заболеваний, путем, известным квалифицированным специалистам в данной области.
Далее будут описаны предпочтительные аспекты выполнения IMAC в способе согласно настоящему изобретению.
Способ начинается с нанесения образца и связывания, по крайней мере, биологически активной формы G-CSF белка с IMAC-носителем.
IMAC-носитель представляет собой твердофазный материал и хелатные соединения ионов металлов, связанные с твердофазным материалом. Обычными твердофазными материалами могут быть материалы, используемые подходящим образом, такие как сефароза (Sepharose), фрактогель (Fractogel) и другие гелевые носители. Ионы металлов хелатных соединений, связанных с IMAC-носителем, выбирают подходящим образом из ионов металлов, предпочтительно двухвалентных металлов, особенно ионов переходных металлов. Металл Hg является наименее подходящим, исходя из его токсичности, и его тенденции вымываться из IMAC-колонки. Предпочтительными примерами хелатных соединений ионов металлов, связанных с IMAC-носителем, являются: М(II)-иминодиацетат (IDA), M(II)-нитрилотриуксусная кислота (NTA), M(II)-карбоксиметиласпартат и т.д., где М представляет собой Zn, Cu, Co, Ni и т.д. Особенно эффективными являются Zn(II)-IDA, Ni(II)-IDA и Ni(II)-NTA.
До нагрузки IMAC-колонки тельца включений предпочтительно представлены в виде раствора или в случае периодического способа разделения или способа разделения неплотного слоя в виде суспензии в присутствии детергента или солюбилизирующего реагента с низкими концентрациями. Таким образом, G-CSF может находиться в нативных условиях либо в случае, когда детергенты остаются в растворе или суспензии, либо при их удалении с помощью ионообменников, диализа, осаждения и т.д. Детергент или солюбилизирующий реагент предпочтительно удаляют до нанесения раствора или смеси на IMAC-колонку.
Раствор или суспензию (или смесь) телец включений в присутствии сильных денатурирующих реагентов, таких как 8 М мочевина или 6 М GndHCl, или растворы в присутствии денатурирующих концентраций детергентов (например, 1% саркозил, 2% сакрозил или 1% додецилсульфат натрия) также можно использовать в качестве исходного образца, если наносимый на колонку образец предварительно был подвергнут ренатурации, например, путем разбавления, диализа, ультрафильтрации или удаления денатурирующих реагентов/детергентов.
В случае экспрессии фактора в секретирующих системах, таких как дрожжи, грибы или линии клеток млекопитающих, супернатант или концентрированный супернатант или культуральную среду, смеси которых вначале подвергают обработке, можно наносить на носитель для IMAC при рН в диапазоне от 6,5 до 9,0.
Элюат, выходящий из IMAC-колонки в результате первой элюции, может быть использован в качестве наносимого раствора или смеси для IMAC. рН элюата должен быть доведен, например, путем добавления раствора NaOH или буферного раствора с высоким значением рН, до рН в диапазоне от 6,5 до 9,0. Затем элюат вновь наносят на тот же IMAC-носитель с хелатами, такими как Zn(II)-IDA, Ni(II)-IDA, Ni(II)-NTA, или на другой IMAC-носитель. Также возможна комбинация с другими иммобилизованными ионами металлов (например, Zn(II), Cu(II), Co(II), Ni(II) и т.д.), и она способствует лучшему разделению и удалению специфических белков хозяина.
Независимо от того, как и из чего приготовлен наносимый на колонку раствор, рН наносимого раствора должен находиться в диапазоне от 6,5 до 9,0. Предпочтительный рН наносимого раствора составляет от 7,0 до 8,5, наиболее предпочтительный рН составляет от 7,8 до 8,2.
Различные буферы, которые могут поддерживать рН в диапазоне от 6,5 до 9,0, могут быть использованы для нанесения образца и связывания G-CSF с IMAC-носителем. Подходящими для этих целей буферами являются фосфатный, ацетатный, на основе гидроксиметиламинометана (трис/HCl), трис/ацетатный, цитратный и другие буферы, создающие рН от 6,5 до 9,0. Предпочтительно, используют трис/HCl буфер.
Буфер, особенно трис/HCl буфер, предпочтительно используют при концентрации в диапазоне от 5 до 50 мМ, наиболее предпочтительно в диапазоне от 10 до 40 мМ.
После связывания с носителем способ продолжают путем промывания колонки и элюирования белков из колонки. Элюирование можно выполнять с помощью либо прерывистого ступенчатого градиента или линейного градиента путем снижения рН, либо посредством конкурентной элюции при высоком значении рН (например, имидазолом, гистидином, хлоридом аммония и тому подобным).
Термин "линейный градиент", употребляемый в данном тексте, относится к промыванию хроматографической колонки раствором, состав которого изменяется таким образом, что часть одного буфера (или одного компонента буфера) линейно увеличивается в то время, как часть другого буфера (или другого компонента буфера) линейно уменьшается.
Термин "прерывистый ступенчатый градиент", употребляемый в данном тексте, относится к промыванию хроматографической колонки раствором, который состоит из определенной части одного буфера (или одного компонента буфера) и определенной части другого буфера (или другого компонента буфера), в течение определенного периода времени. Пропорции обоих буферов быстро (внезапно) изменяются, и колонка промывается в течение другого определенного периода времени. Состав раствора (изменение пропорций буфера или пропорций компонентов) не изменяется линейно.
Термин "конкурентная элюция", употребляемый в данном тексте, относится к элюции при рН буфера, применяемого для связывания, где конкурентные молекулы, такие как имидазол, гистидин, хлорид аммония и т.д., в элюционном буфере связываются с металлом, образующим хелаты с матриксом, и, таким образом, вытесняют белковые молекулы.
Предпочтительно, используют прерывистый ступенчатый градиент, приводящий к элюированию при низком значении рН. А именно, высокое значение рН может привести к активации остатков цистеина и образованию димеров. Стабильность G-CSF является высокой при низком значении рН.
Несколько элюционных буферов можно применять для прерывистого ступенчатого или линейного промывания и элюирования, и их можно выбрать из группы, состоящей из: ацетатного, трис/ацетатного, фосфатного, цитратного буфера и других подходящих буферов. Диапазон рН для элюирования может составлять от 3,0 до 5,0, предпочтительно от 3,5 до 4,5. При прерывистом ступенчатом градиенте рН быстро изменяется от порядка величин рН наносимого раствора до порядка величин рН элюционного буфера, например, от 7,0 до 4,0, и изоэлектрическая точка, таким образом, изменяется скачком, что предупреждает осаждение белков.
Таким образом, в элюате получают мономерный, биологически активный, правильно свернутый G-CSF с чистотой выше 95%.
Если желательно, элюат, полученный из IMAC-колонки, может быть нанесен прямо на катионообменную хроматографическую колонку без каких-либо дополнительных промежуточных стадий. Могут применяться различные катионообменные хроматографические носители, и они могут быть выбраны из группы, состоящей из: SP Sepharose FF, SP Sepharose HP, CM Sepharose FF, TSK гель SP-5PW, TSK гель SP-5PW-HR, Toyopearl SP-650M, Toyopearl SP-650S, Toyopearl SP-650C, Toyopearl CM-650M, Toyopearl CM-650S, Macro-Prep High S носитель, Macro-Prep S носитель, Macro-Prep CM носитель и т.д. Предпочтительно, применяют SP Sepharose FF или TSK гель SP-5PW.
Величина рН наносимого на колонку раствора для катионообменной хроматографии находится в диапазоне от 3,0 до 5,8, предпочтительно в диапазоне от 4,0 до 5,0.
Концентрация соли в наносимом на колонку растворе для катионообменной хроматографии должна быть достаточно низкой, чтобы произошло связывание, которое также зависит от рН раствора.
Различные буферы с величинами рН в диапазоне от 3,0 до 5,8 могут быть применены для нанесения и связывания с носителем для катионообменной хроматографии и могут быть выбраны из группы, состоящей из: ацетатного, цитратного, трис/HCl, трис/ацетатного, фосфатного, сукцинатного, малонатного буфера, буфера на основе 2-(N-морфолиноэтансульфоната) (MES) и других буферов. Предпочтительно, применяют ацетатный буфер.
Ацетатный буфер можно использовать при концентрации в диапазоне от 10 до 60 мМ, предпочтительно при концентрации в диапазоне от 10 до 30 мМ.
При катионообменной хроматографии за нанесением на колонку следует промывание колонки и элюирование белков из колонки. Элюирование белков происходит благодаря повышению величины ионной силы после добавления в буферный раствор соли с высокой концентрацией. Можно использовать прерывистый ступенчатый градиент, линейный градиент и подходящую комбинацию ступенчатого и линейного градиента.
Элюирующие буферы, которые могут быть применены для промывания и элюирования, могут быть выбраны из группы, состоящей из: ацетатного, цитратного, трис/HCl, трис/ацетатного, фосфатного, сукцинатного, малонатного буфера, MES буфера и других подходящих буферов с добавлением солей, таких как NaCl или KCl. Ионная сила и концентрация соли, с помощью которых достигается элюирование, зависят от рН буферного раствора. Чем выше рН буфера, тем ниже ионная сила необходима для элюирования белков из колонки.
Таким образом, в элюате получают мономерный, биологически активный, правильно свернутый G-CSF с чистотой выше 98%.
Если желательно, элюат, полученный из IMAC-колонки или, предпочтительно, после следующей катионообменной хроматографической колонки, может быть нанесен прямо на гель-фильтрационную колонку без каких-либо дополнительных промежуточных стадий.
Различные носители для гель-фильтрации могут быть применены и могут быть выбраны из группы, состоящей из: Sephacryl S-200HR, Sephacryl S-100HR, Superose 12, Superose 6, Superdex 75, TSK гель G-2500PW, TSK гель G-3000PW, Bio-Gel P-60, Bio-Gel P-100 и т.д. Предпочтительно, применяют Superdex 75.
Для гель-фильтрации может быть применен широкий диапазон рН, и поэтому в качестве наносимого на колонку раствора подходящим является элюат, полученный из IMAC-колонки и, предпочтительно, из последующей катионообменной хроматографии. Нанесение раствора, связывание белка с носителем для гель-фильтрации и элюирование белка может быть осуществлено с использованием такого же буфера. Различные буферы могут быть применены и могут быть выбраны из группы, состоящей из: цитратного, ацетатного, трис-буфера, фосфатного буфера и других подходящих буферов, которые могут поддерживать рН в диапазоне от 3,5 до 8,0. Предпочтительно, применяют фосфатные буферы с рН от 6,0 до 7,0.
Предпочтительно, фосфатные буферы (для нанесения) могут быть использованы при концентрации в диапазоне от 2 до 100 мМ, предпочтительно при концентрации в диапазоне между 3 и 10 мМ.
Концентрации соли в буфере для гель-фильтрации могут находиться в диапазоне от 30 до 100 мМ, предпочтительно приблизительно 50 мМ.
Таким образом, в элюате получают мономерный, биологически активный, правильно свернутый G-CSF с чистотой выше 99% и биологической активностью 1×108 МЕ/мг.
Следующие примеры даны для иллюстрирования различных аспектов изобретения, и они не стремятся каким-либо образом ограничить настоящее изобретение.
Описание чертежей
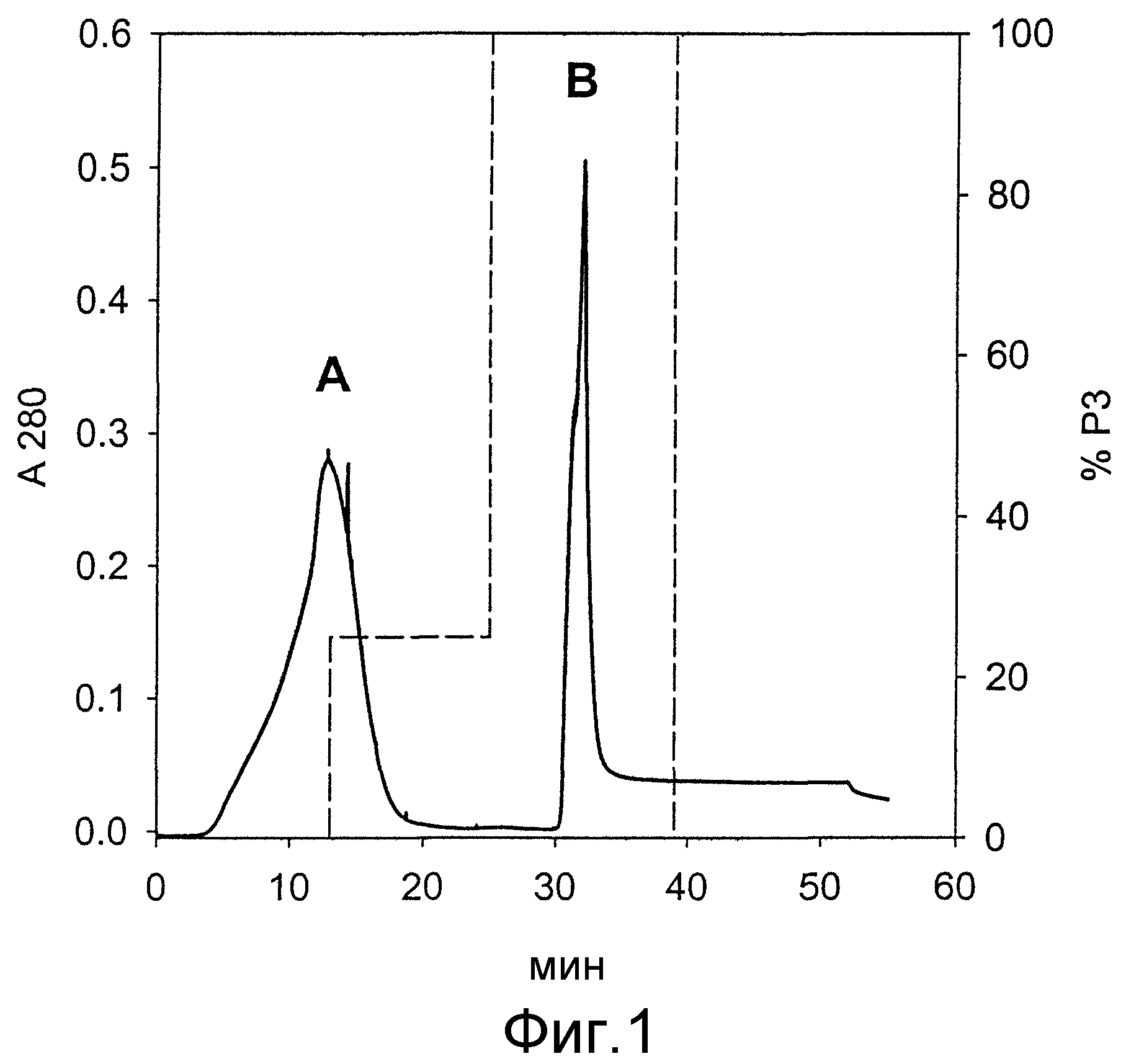
На фиг.1 представлены результаты хроматографического отделения белков от солюбилизированных телец включений при использовании носителя для IMAC: Zn(II)-IDA Chelating Sepharose fast flow (Pharmacia).
Хроматограмма показывает изменение поглощения при 280 нм (А280) (―) и пропорции буфера Р3 (----) в зависимости от времени (мин).
Пик А - E. coli белки и агрегированный G-CSF; пик В - мономерный, правильно свернутый, биологически активный G-CSF и следовые количества белков E. coli.
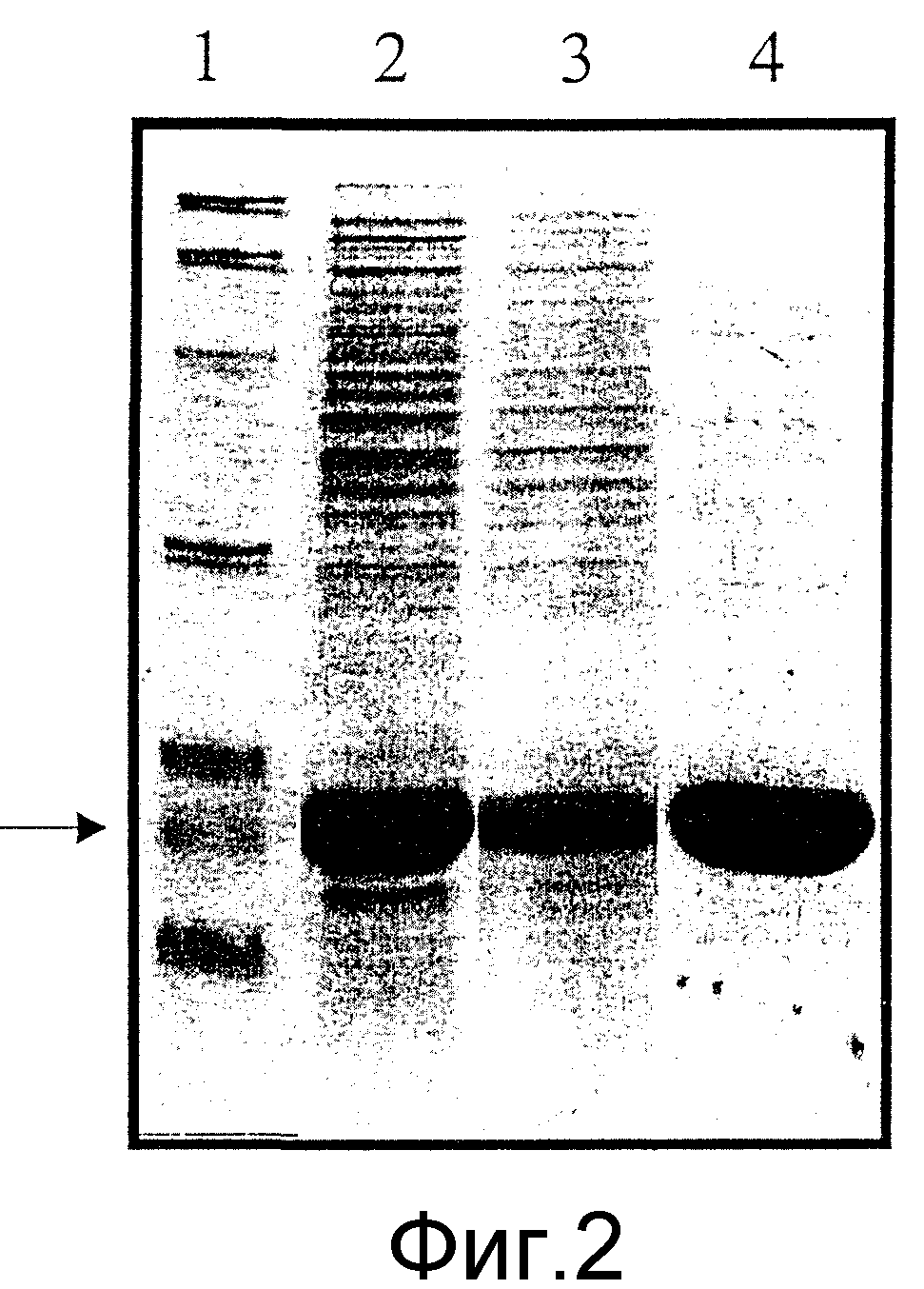
На фиг.2 представлены результаты электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) исходного образца и образцов, представленных в хроматографических пиках после разделения при использовании Zn(II)-IDA Chelating Sepharose fast flow (Pharmacia), согласно фиг.1.
Обозначения:
1. Стандарты молекулярного веса (Bio-Rad) и G-CSF (Neupogen) (помечен стрелкой).
2. Исходный образец до хроматографического разделения.
3. Белки в пике А на фиг.1 (агрегированный G-CSF и белки E. coli).
4. Белки в пике В на фиг.1 (мономерный, правильно свернутый, биологически активный G-CSF и следовые количества белков E. coli).
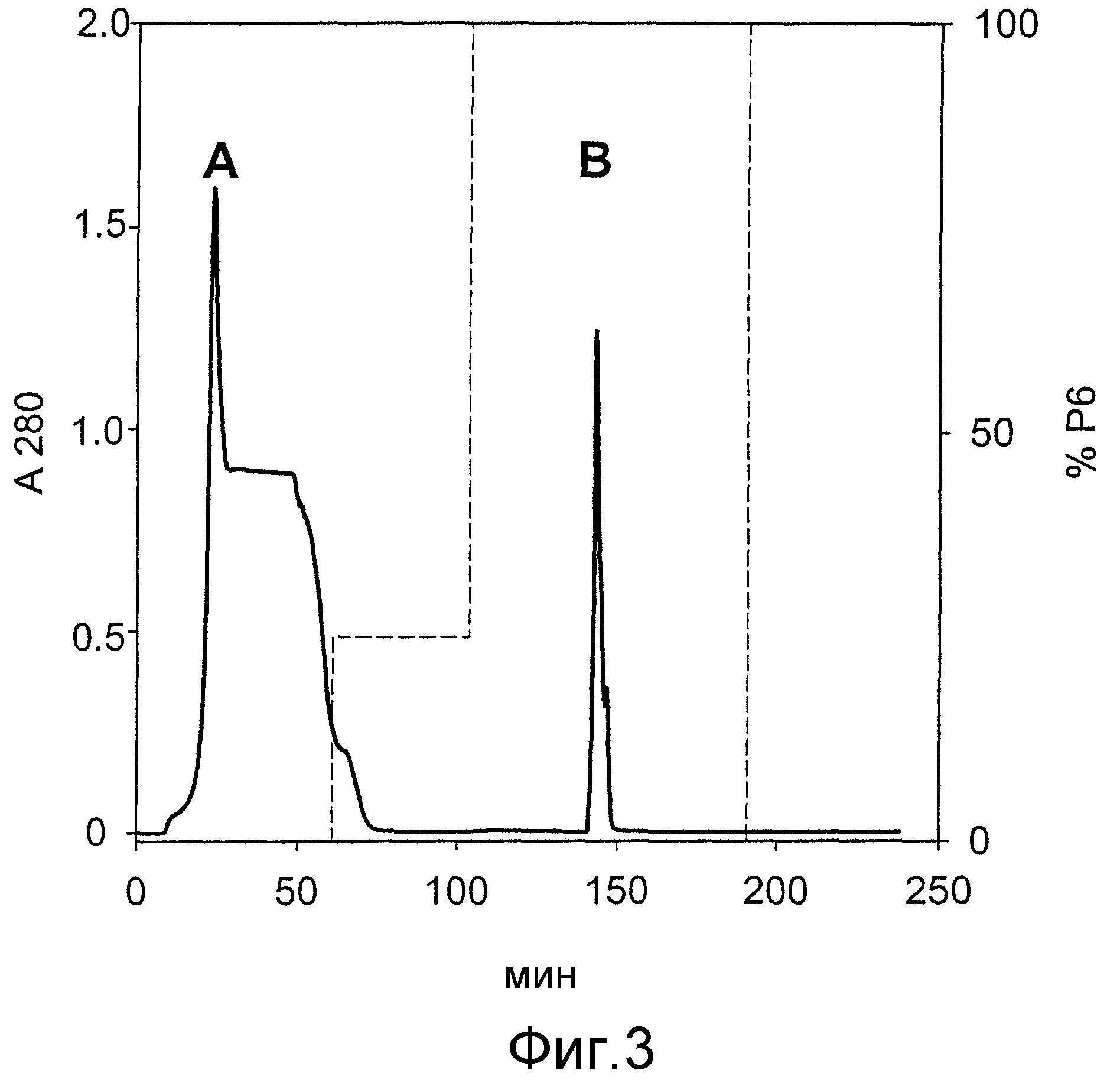
На фиг.3 представлены результаты хроматографического разделения путем использования колонки ХК50/20 для IMAC с носителем Zn(II)-IDA Chelating Sepharose fast flow (Pharmacia).
Хроматограмма показывает изменение поглощения при 280 нм (А280) (―) и пропорции буфера Р6 (----) в зависимости от времени (мин).
Пик А - E. coli белки и агрегированный G-CSF; пик В - мономерный, правильно свернутый, биологически активный G-CSF и следовые количества белков E. coli.
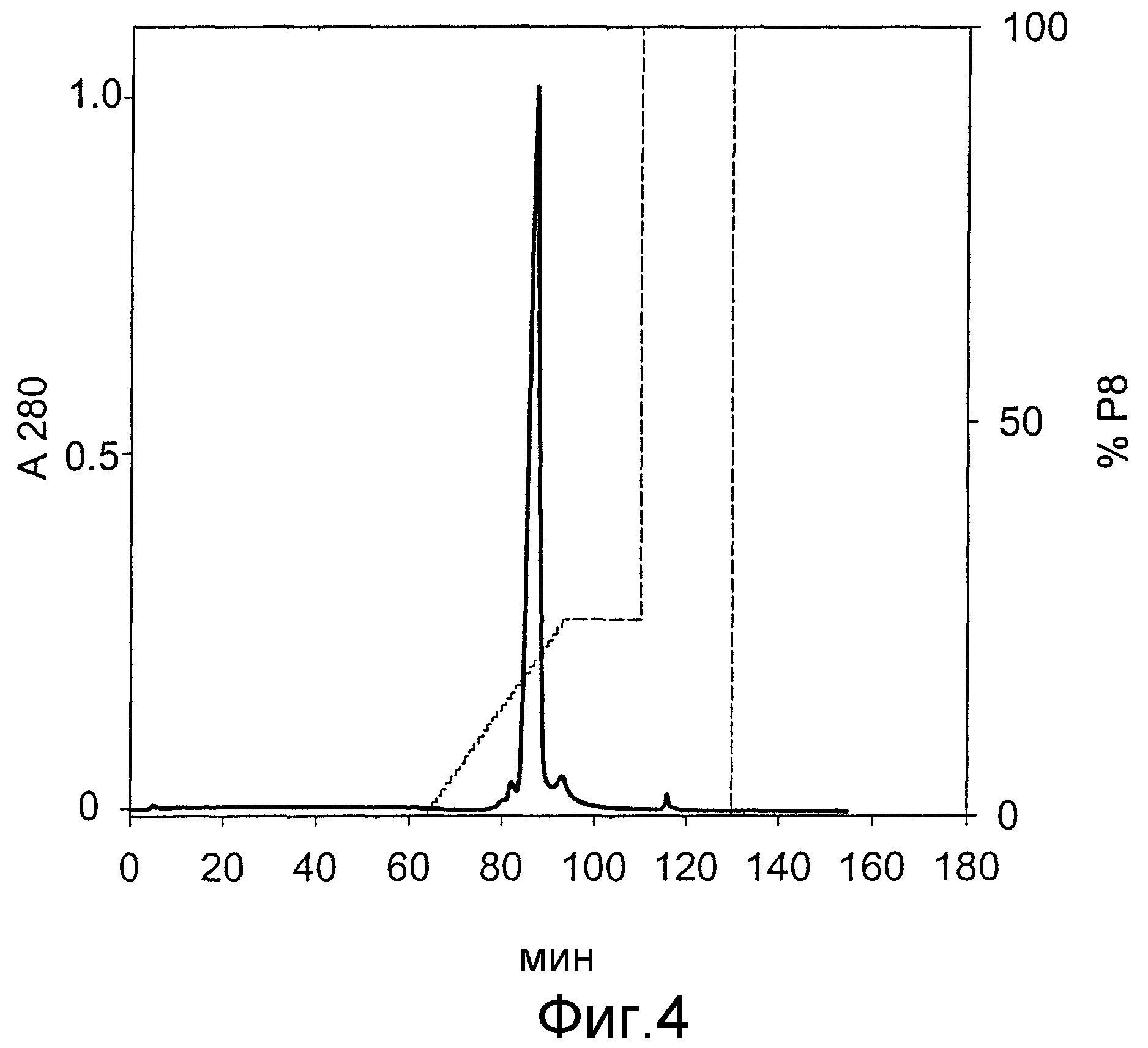
На фиг.4 представлены результаты хроматографического разделения при использовании колонки ХК 16/20, наполненной катионообменным носителем TSK гель SP-5PW (TosoHaas).
Хроматограмма показывает изменение поглощения при 280 нм (А280) (―) и пропорцию буфера Р8 (----) в зависимости от времени (мин).
Главный пик - мономерный, правильно свернутый, биологически активный G-CSF; небольшие пики - изоформы G-CSF и следовые количества белков E. coli.
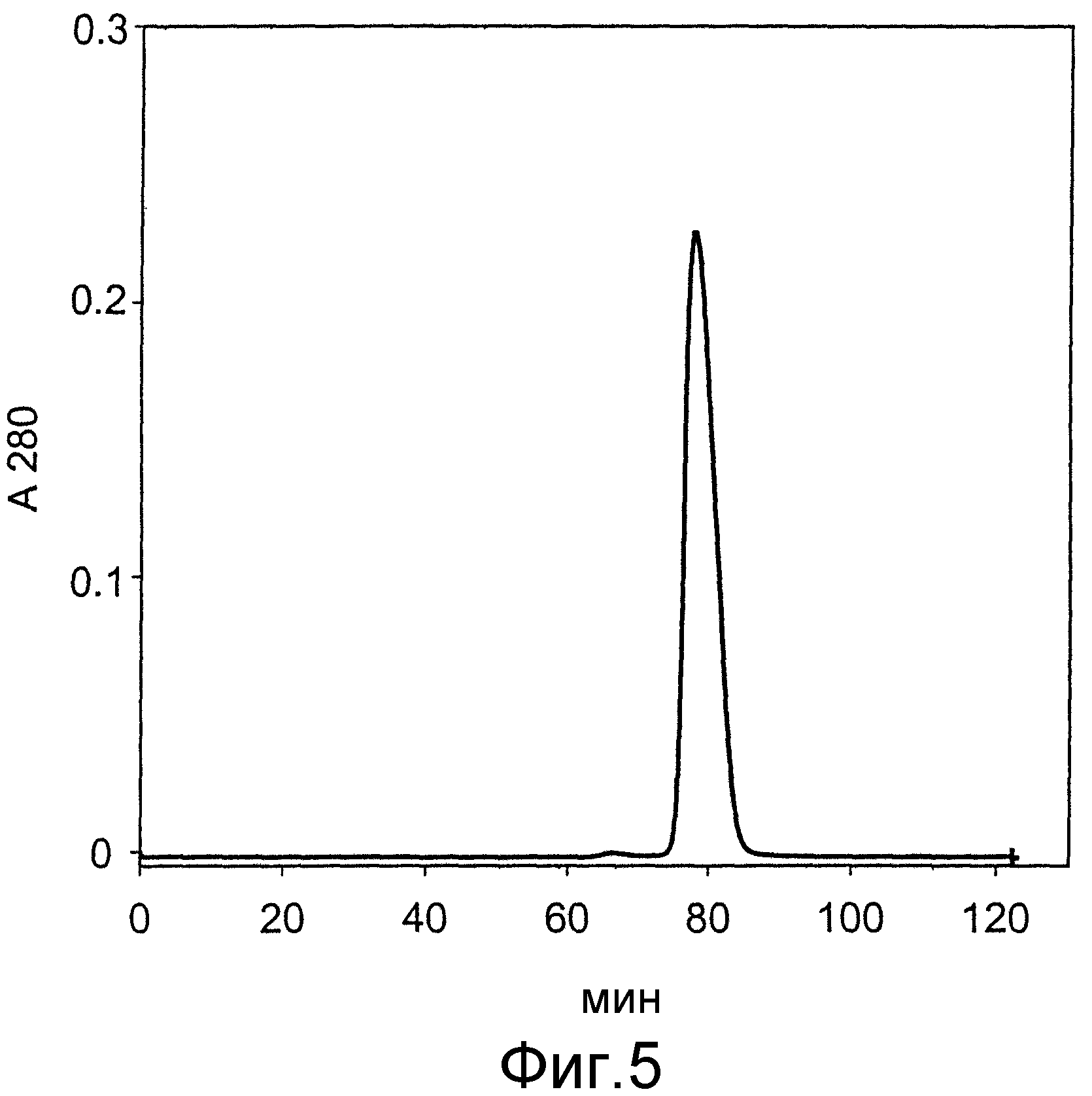
На фиг.5 представлены результаты хроматографического разделения при использовании колонки ХК 26/70, наполненной носителем для гель-фильтрации Superdex™ 75 prep grade (Pharmacia).
Хроматограмма показывает изменение поглощения при 280 нм (А280) в зависимости от времени (мин).
Главный пик - мономерный, правильно свернутый, биологически активный G-CSF.
ПРИМЕРЫ
Пример 1: Очистка и/или выделение биологически активного G-CSF посредством IMAC: Zn-IDA (Chelating Sepharose fast flow)
Хроматографическую колонку (h=10 см, d=10 мм) заполняли носителем Chelating Sepharose fast flow (Pharmacia), с которым были связаны ионы Zn2+, и колонку уравновешивали 5-ю колоночными объемами буфера Р2 при постоянном потоке 2 мл/мин. Тельца включений солюбилизировали в буфере Р1 (0,2% саркозил, 40 мМ трис/HCl, рН 8,0), и саркозил удаляли с помощью ионообменника. В колонку вносили 10 мл раствора (17 мг всех белков), который содержал биологически активный G-CSF, при постоянном потоке 1 мл/мин. Разделение осуществляли путем использования прерывистого ступенчатого градиента буфера Р3 при постоянной скорости потока 2 мл/мин (фиг.1). В первом хроматографическом пике (пик А) были обнаружены белки E. coli и большая часть неправильно свернутого и агрегированного G-CSF. При 100% буфера Р3 (0% буфера Р2) из колонки элюировали в основном чистый мономерный и биологически активный G-CSF (7 мг) с чистотой выше 95% (фиг.2).
Биологическую активность образца из пика А определяли, как описано ниже в примере 5, и она составила 1×106 МЕ/мг белка, определенная биологическая активность образца из пика В составила 0,8-1,0×108 МЕ/мг белков, в то время как биологическая активность стандарта составила 1×108 МЕ/мг белков. Одноступенчатая IMAC исходного раствора телец включений приводит к выделению мономерной формы G-CSF с чистотой выше 95% и биологической активностью, которая сравнима с активностью стандарта.
Пример 2: Очистка и/или выделение биологически активного G-CSF посредством IMAC: Zn-IDA (Fractogel EMD Chelate)
Хроматографическую колонку (h=2 см, d=10 мм) заполняли носителем Fractogel EMD Chelate (Merck), с которым были связаны ионы Zn2+. Колонку промывали водой и уравновешивали пятью колоночными объемами буфера Р2 при постоянной скорости потока 1 мл/мин. Тельца включений солюбилизировали в буфере Р1, и саркозил удаляли с помощью ионообменника. Колонку нагружали 3,3 мл солюбилизированных телец включений общим количеством 4 мг. Разделение осуществляли посредством прерывистого ступенчатого градиента буфера Р3 при постоянной скорости потока 1 мл/мин (градиент: 0% буфера Р3 (100% буфера Р2) 13 мин, 25% буфера Р3 (75% буфера Р2) 12 мин, 100% буфера Р3 (0% буфера Р2) 14 мин, 0% буфера Р3 (100% буфера Р2) 11 мин). При 100% буфера Р3 элюировали мономерный, биологически активный G-CSF (0,7 мг).
Пример 3: Очистка и/или выделение биологически активного G-CSF посредством IMAC: Ni-NTA (Superflow)
Хроматографическую колонку (h=10 см, d=10 мм) заполняли носителем Ni-NTA Superflow (Qiagen) и уравновешивали пятью колоночными объемами буфера Р4 при постоянной скорости потока 2 мл/мин. Тельца включений солюбилизировали в буфере Р1, и саркозил удаляли с помощью ионообменника. Колонку нагружали 10 мл солюбилизированных телец включений (10 мг общих белков) при постоянной скорости потока 1 мл/мин. Разделение осуществляли посредством прерывистого ступенчатого градиента буфера Р5 при постоянной скорости потока 2 мл/мин (такой же градиент, как при разделении на Zn-IDA Chelating Sepharose fast flow, представленном на фиг.1). При 100% буфера Р5 (0% буфера Р4) элюировали мономерный биологически активный G-CSF (3,6 мг) с чистотой выше 95%. В первом хроматографическом пике кроме белков E. coli обнаруживали только неправильно свернутый и агрегированный G-CSF. Мономерные формы G-CSF из второго пика после нескольких хроматографических разделений посредством Ni-NTA Superflow объединяли, и конечную очистку (доочистку) осуществляли катионообменной хроматографией и гель-фильтрацией.
Пример 4: Способ очистки и/или выделения биологически активного G-CSF, включающий дополнительные хроматографические стадии
Способ очистки и/или выделения биологически активного G-CSF начинали с раствора телец включений, который готовили после экспрессии G-CSF в E. coli. Промытые тельца включений в количестве 4,5 г ресуспендировали в 225 мл буфера Р1 и оставляли растворяться при 20°С в течение 18 часов при осторожном (легком) встряхивании, используя линейный встряхиватель. Образец разбавляли водой, чтобы получить двойной объем и ~430 мл раствора телец включений получали с концентрацией белка ~1,4 мг/мл (определенной методом Бредфорда по G-CSF, как стандарту). Белковый раствор, разделенный на два равных объема, наносили на хроматографическую колонку ХК50/20 (Pharmacia), заполненную носителем Chelating Sepharose fast flow (45-165 мкм, Pharmacia) до высоты 10 см (h=10 см, d=5 см, V=200 мл), с которым были связаны ионы Zn2+. Нанесение образца и элюирование осуществляли при постоянной скорости потока 7 мл/мин. Колонку, после нанесения образца, промывали посредством прерывистого ступенчатого градиента (фиг.3): 15 мин буфером Р2, затем 45 мин смесью буферов Р2 и Р6 в объемном отношении 75:25 и 86 мин буфером Р6. Мономерную форму биологически активного G-CSF элюировали при 100% буфера Р6. Все фракции (два разделения), содержащие мономерный биологически активный G-CSF, объединяли и получали 271 мл раствора с концентрацией белка ~0,7 мг/мл. К данному раствору добавляли EDTA до конечной концентрации 2 мМ. Раствор разбавляли в три раза 20 мМ CH3COOH, рН 4,0 и использовали в качестве раствора, подвергаемого катионообменной хроматографии.
Элюат из IMAC-колонки в виде двух аликвот наносили на хроматографическую колонку ХК16/20 (Pharmacia), заполненную хроматографическим носителем SP-5PW (30 мкм; TosoHaas) до высоты 16 см (h=16 см, d=1,6 см, V=32 мл). Нанесение образца и элюирование из колонки осуществляли при постоянной скорости потока 5 мл/мин. После нанесения образца колонку промывали 11 мин буфером Р7 с последующим элюированием посредством линейного градиента буфером Р8 за 30 мин от 0% до 25% буфера Р8 (от 100% до 75% буфера Р7). Колонку вновь промывали в течение 16 мин смесью буферов Р7 и Р8 в объемном отношении 75:25 и затем в течение 22 мин буфером Р8 (фиг.4). Фракции главного хроматографического пика, которые элюировали в линейной части линейного градиента при ~18% буфера Р8 и которые содержали правильно свернутый G-CSF (с чистотой выше 98%), объединяли и непосредственно использовали в качестве растворов для гель-фильтрационной колонки.
Элюат из катионообменной хроматографии (V=46 мл, концентрация белка ~2,4 мг/мл) наносили в виде 5 аликвот на хроматографическую колонку ХК26/70 (Pharmacia), заполненную носителем для гель-фильтрации Superdex 75 (prep grade, 34 мкм) (Pharmacia) до высоты 57 см (h=57 см, d=2,6 см, V=300 мл). Разделение осуществляли в буфере Р9 при постоянной скорости потока 2,5 мл/мин. Пик, который соответствует белковому димеру, четко отделялся от главного пика, который соответствует мономерному белку (фиг.5). Фракции главного хроматографического пика объединяли, буфер сменяли и получали 100 мг чистой мономерной формы G-CSF с чистотой выше 99% и биологической активностью 1×108 МЕ/мг, которая соответствует биологической активности стандарта.
Пример 5: Анализ биологической активности G-CSF in vitro
Биологическую активность G-CSF определяли методом, основанным на стимуляции клеточной пролиферации (NFS-60 клетки), используя для этого известный метод (Hammerling, U. et al. в J. Pharm. Biomed. Anal. 13, 9-20 (1995)), а также международный стандарт G-CSF - человеческий рекомбинантный G-CSF (88/502, произведенный дрожжевыми клетками; NIBSC Potters Bar, Hertfordshire, UK; Mire-Sluis, A.R. et al. v. J. Immunol. Methods 179, 117-126 (1995).
Составы буферов:
Р1: 0,2% саркозил, 40 мМ трис/HCl, рН 8,0.
Р2: 20 мМ трис/HCl, 150 мМ NaCl pH 8,0.
P3: 20 мМ уксусная кислота, 150 мМ NaCl, рН доведен до 4,5 добавлением 1 М NaOH.
Р4: 10 мМ трис/HCl, 200 мМ NaCl, рН 8,0.
Р5: 20 мМ уксусная кислота, 200 мМ NaCl, рН доведен до 4,0 добавлением 1 М NaOH.
Р6: 20 мМ СН3СООН, 150 мМ NaCl, рН 4,0.
Р7: 20 мМ СН3СООН, рН 5,5.
Р8: 20 мМ СН3СООН, 500 мМ NaCl, рН 5,5.
Р9: 5 мМ фосфат Na, 50 мМ NaCl, рН 7,0.
Реферат
Изобретение относится к способу выделения биологически активного гранулоцитарного колониестимулирующего фактора (G-CSF). Выделение осуществляют аффинной хроматографией с иммобилизованным металлом. Способ может быть осуществлен при нативных условиях. Получают биологически активный G-CSF с чистотой выше 95%. Дополнительно применяют две дополнительные хроматографические стадии, катионообменную хроматографию и гель-фильтрацию, для удаления следовых количеств примесей. Способ приводит к получению G-CSF с большим выходом и чистотой выше 99%. Описанный способ является особенно подходящим для промышленного получения G-CSF. 15 з.п. ф-лы, 5 ил.
Формула
приготовление смеси, которая содержит биологически активный G-CSF в присутствии примеси, и
разделение указанной смеси посредством аффинной хроматографии с иммобилизованным металлом (IMAC),
которое включает в себя следующие стадии:
нанесение указанной смеси, которая содержит биологически активный G-CSF в присутствии примеси, на носитель для IMAC,
избирательное связывание биологически активной формы G-CSF с носителем для IMAC и
элюирование биологически активной формы G-CSF из колонки с носителем для IMAC с получением биологически активного G-CSF, где IMAC осуществляют с помощью хелатного соединения иона металла, связанного с носителем для IMAC, где ионом металла не является Hg.
и IMAC осуществляют таким образом, что примесь, в основном, не связывается с носителем для IMAC и элюируется из колонки для IMAC до элюирования биологически активной формы G-CSF.
смеси, среды или раствора, приготовленного после денатурации с последующей ренатурацией;
раствора или суспензии телец включений при нативных условиях;
смеси или раствора, приготовленного из супернатанта после экспрессии в секретирующих системах или из культуральной среды экспрессирующей системы;
и элюата, который получают предыдущим элюированием G-CSF из колонки для IMAC или любой другой хроматографической колонки.

Комментарии