Средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании - RU2433829C2
Код документа: RU2433829C2
Чертежи


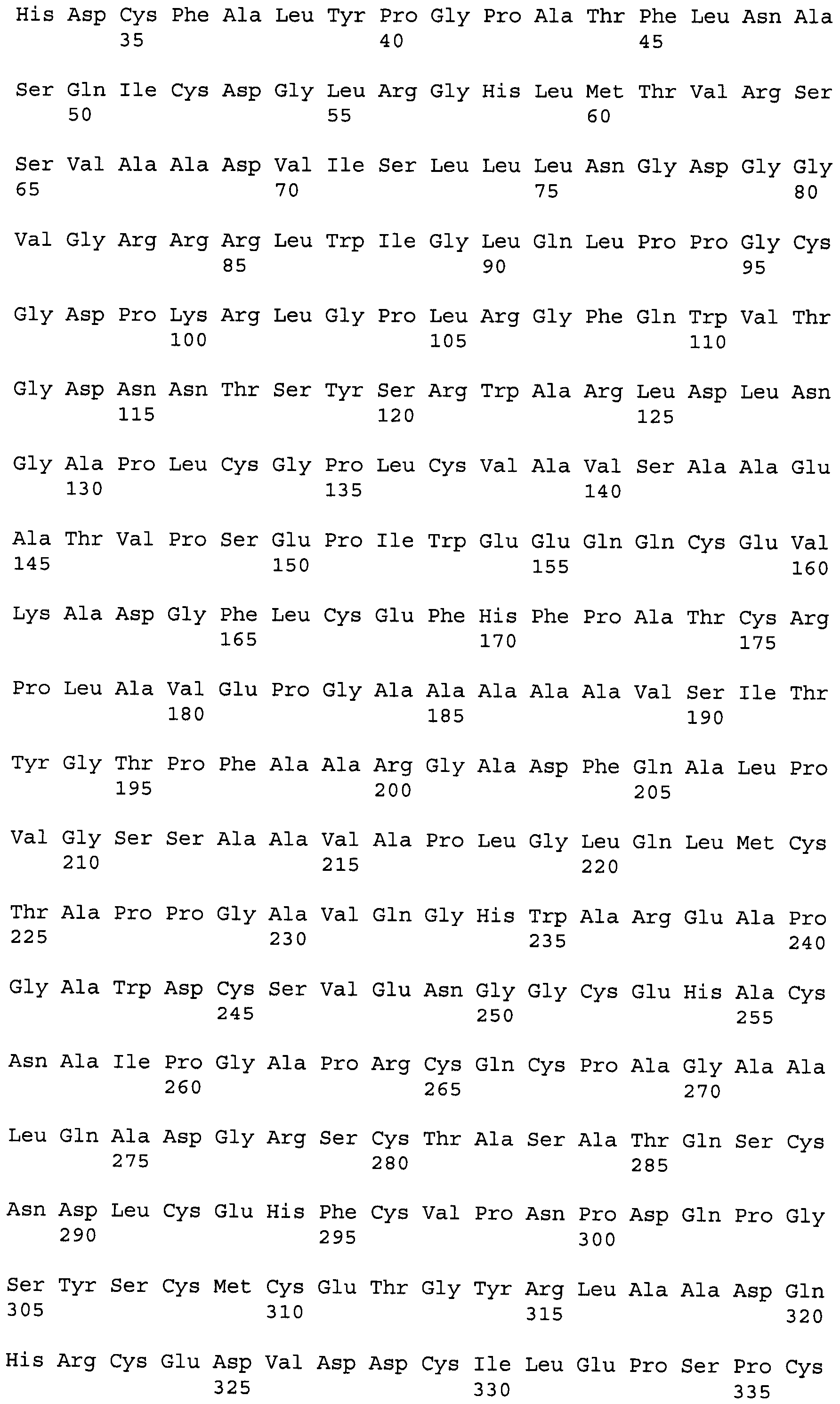

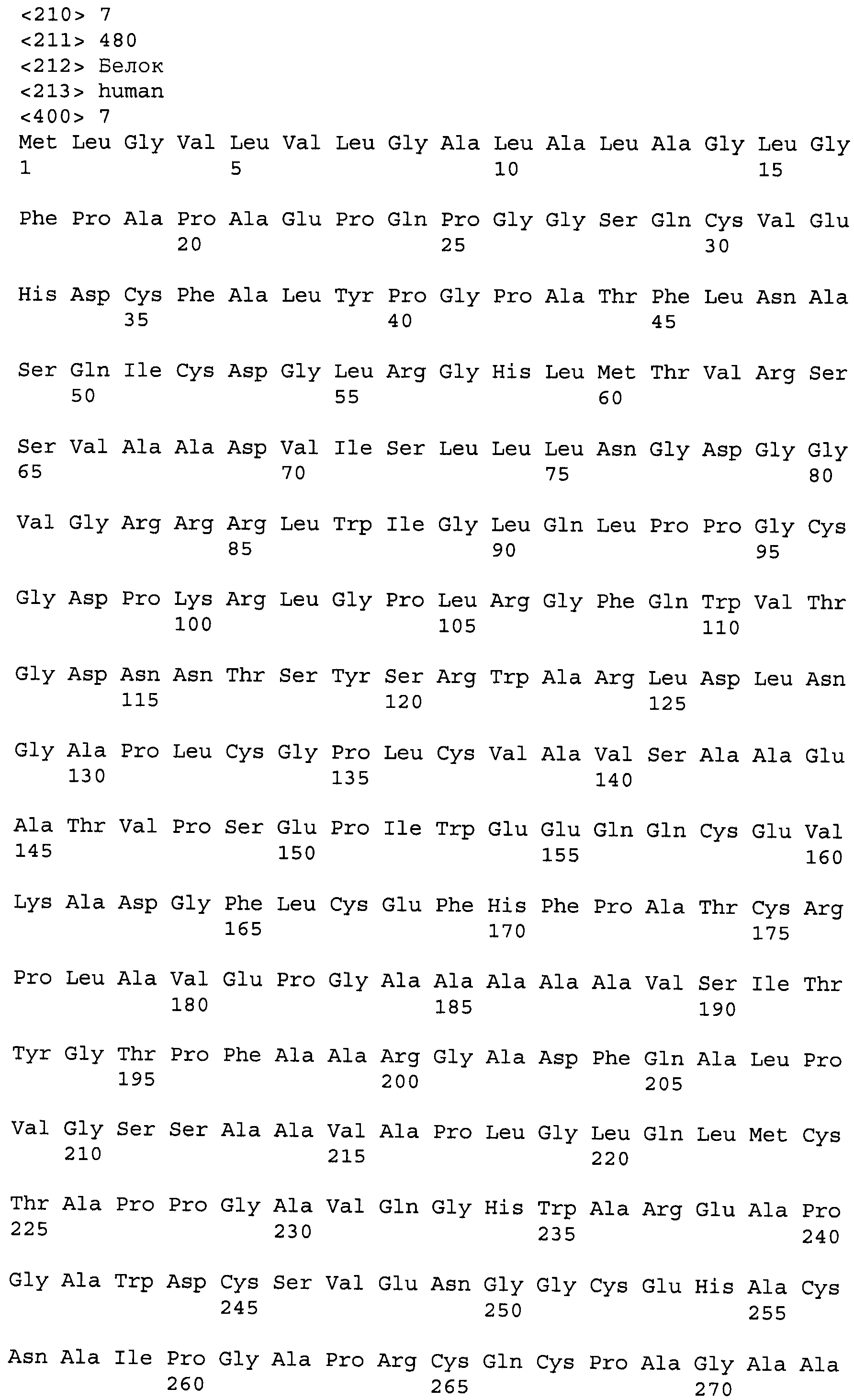







Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к терапевтически эффективному средству для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании, которое в качестве активного ингредиента содержит тромбомодулин. Настоящее изобретение также относится к способу отбора пациентов, страдающих диссеминированным внутрисосудистым свертыванием, которым назначают тромбомодулин.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Диссеминированное внутрисосудистое свертывание (в дальнейшем иногда сокращенно ДВС) представляет собой один из видов болезней свертывания и является заболеванием, при котором образуются большие количества веществ, ускоряющих свертывание крови, как результат повреждения тканей, вызванного различными заболеваниями, так, что деятельность свертывающей системы чрезвычайно усилена, и образуются мелкие тромбы в системе кровеносных сосудов, и они забивают мелкие сосуды, и, в то же время расходуются тромбоциты или факторы свертывания, необходимые для контроля кровотечения, тем самым вызывая аномальное свертывание. В случае ДВС факторы свертывания крови скапливаются в микрососудах почек и легких, вызывая ишемию, и, в результате, во многих случаях имеет место нарушение циркуляции и шок. В связи с этим, может наблюдаться учащенное дыхание, диспноэ, тахикардия, брадикардия, похолодание конечностей, олигурия, судороги и подобное. В некоторых случаях такое шоковое состояние может окончиться внезапной смертью. Одновременно, потребление факторов свертывания и тромбоцитов приводит к кровотечению, в связи с чем может иметь место пурпура на коже, петехии, геммоптоз, гематемезис, гематурия, кровь в кале, носовые кровотечения и подобное. В качестве терапевтического средства при ДВС использовались гепарин, антитромбин (который также называют антитромбин III; в дальнейшем иногда сокращенно AT или AT III), и подобное.
С другой стороны, тромбомодулин известен как вещество, которое специфически связывается с тромбином, таким образом, ингибируя его коагуляционную активность, и одновременно в значительной степени стимулирует способность тромбина активировать белок С. Также известно, что тромбомодулин обладает мощным ингибирующим действием в отношении свертывания крови. Также было известно, что тромбомодулин продлевает время свертывания крови под действием тромбина или что тромбомодулин суппрессирует агрегацию тромбоцитов в результате действия тромбина. Белок C представляет собой зависимый от витамина К белок, который играет важную роль в фибринолитической системе свертывания крови. Белок С активируется под действием тромбина, становясь активированным белком C. Было известно, что активированный белок С дезактивирует активированный фактор V свертывания крови и активированный фактор VIII свертывания крови и что активированный белок С вовлечен в образование активатора плазминогена, обладающего тромболитическим действием (непатентный документ 1). В связи с этим, предполагалось, что тромбомодулин способствует активации белка С под действием тромбина и, следовательно, что он применим в качестве антикоагулянта или тромболитического средства. Также сообщалось в экспериментах на животных, что тромбомодулин является эффективным для лечения или профилактики заболеваний, связанных с повышением свертывания крови (непатентный документ 2).
Обычным способом тромбомодулин был открыт и получен в виде гликопротеина, который экспрессируется на эндотелиальных клетках сосудов у животных различных видов, в том числе у людей, как типичных представителей, и впоследствии был успешно клонирован. Другими словами, ген-предшественник тромбомодулина человека, содержащий сигнальный пептид, был клонирован из библиотеки кДНК легких человека путем генной инженерии, и были проанализированы все генные последовательности тромбомодулина. В результате была выяснена аминокислотная последовательность, состоящая из 575 остатков, содержащих сигнальный пептид (в основном, представлены 18 аминокислотных остатков) (патентный документ 1). Было известно, что зрелый тромбомодулин, от которого отщепился сигнальный пептид, состоит из 5 участков, а именно N-концевого участка (аминокислоты 1-226: это положение определено, когда предполагалось, что сигнальный пептид состоит из 18 аминокислотных остатков, и то же самое верно и для других участков), участка, имеющего шесть EGF-подобных структур (аминокислоты 227-462), области O-гликозилирования (аминокислоты 463-498), трансмембранной области (аминокислоты 499-521), и внутрицитоплазматической области (аминокислоты 522-557), с N-концевой стороны зрелого пептида. Также было известно, что среди шести EGF-подобных структур, 4-я, 5-я, и 6-я части EGF-подобных структур с N-концевой стороны (т.е. минимальные единицы активности) в основном имеют такую же активность, как и полноразмерный тромбомодулин (непатентный документ 3).
В отсутствие поверхностно-активного вещества полноразмерный тромбомодулин почти нерастворим. Следовательно, добавление поверхностно-активного вещества является необходимым для получения препарата тромбомодулина. Напротив, также существует растворимый тромбомодулин, который может полностью растворяться даже в отсутствие поверхностно-активного вещества. Растворимый тромбомодулин может быть получен путем удаления по меньшей мере части трасмембранной области или всей трансмембранной области. Например, было подтверждено, что растворимый тромбомодулин, состоящий только из 3 областей, а именно N-концевой области, области, имеющей шесть EGF-подобных структур, и области O-гликозилирования (то есть растворимый тромбомодулин, имеющий аминокислотную последовательность, состоящую из аминокислот 19-516 SEQ ID NO: 9), может быть получен путем применения рекомбинантных технологий, и что этот рекомбинантный растворимый тромбомодулин имеет такую же активность, что и нативный тромбомодулин (патентный документ 1). Кроме того, существует несколько других сообщений, касающихся растворимых тромбомодулинов (патентные документы 2-9). Также растворимый тромбомодулин, извлеченный из мочи человека, и подобный, был приведен в качестве примера нативных тромбомодулинов (патентные документы 10 и 11).
Как установлено во многих случаях, в результате спонтанных мутаций или мутаций, происходящих при получении тромбомодулинов, полиморфные мутации были обнаружены даже в генах человека. В настоящее время были идентифицированы гены тромбомодулина, в которых аминокислота в положении 473 предшественника тромбомодулина человека, имеющего упомянутую выше аминокислотную последовательность, состоящую из 575 аминокислотных остатков, изменена на Val или Ala. В нуклеотидной последовательности, кодирующей эту аминокислоту, нуклеотид в положении 1418 изменен на T или C (непатентный документ 4). Однако эти два тромбомодулина полностью идентичны по активности и физическим свойствам. Следовательно, можно предположить, что они являются по существу идентичными.
Сообщалось, что тромбомодулин оказывает действие при лечении ДВС (непатентный документ 5). Помимо вышеупомянутых целевых использований ожидается, что тромбомодулин будет использоваться при лечении и профилактике различных заболеваний, таких как острый коронарный синдром (ACS), тромбоз, обструкция периферических сосудов, облитерирующий артериосклероз, васкулит, функциональное нарушение, встречающееся после хирургических операций на сердце, осложнение, вызванное трансплантацией органов, стенокардия, преходящий ишемический приступ, токсикоз беременных, диабет, VOD печени (первичный тромбоз печеночных вен; например, молниеносный гепатит, первичный тромбоз печеночных вен, возникающий после пересадки костного мозга), тромбоз глубоких вен (DVT), сепсис, и респираторный дистресс синдром взрослых (ARDS).
Патентный документ 1: Патентная публикация (Kokai) JP No. 64-6219 A (1989)
Патентный документ 2: Патентная публикация (Kokai) JP No. 2-255699 A (1990)
Патентный документ 3: Патентная публикация (Kokai) JP No. 3-133380 A (1991)
Патентный документ 4: Патентная публикация (Kokai) JP No. 3-259084 A (1991)
Патентный документ 5: Патентная публикация (Kokai) JP No. 4-210700 A (1992)
Патентный документ 6: Патентная публикация (Kokai) JP No. 5-213998 A (1993)
Патентный документ 7: WO92/00325
Патентный документ 8: WO92/03149
Патентный документ 9: WO93/15755
Патентный документ 10: Патентная публикация (Kokai) JP No. 3-86900 A (1991)
Патентный документ 11: Патентная публикация (Kokai) JP No. 3-218399 A (1991)
Непатентный документ 1: Koji Suzuki, Igaku no Ayumi (Progression of Medicines), Vol. 125, p. 901 (1983)
Непатентный документ 2: K. Gomi et al., Blood 75., 1396-1399 (1990)
Непатентный документ 3: M. Zushi et al., J. Biol. Chem., 246, 10351-10353 (1989)
Непатентный документ 4: D. Z. Wen et al., Biochemistry, 26, 4350-4357 (1987)
Непатентный документ 5: S. M. Bates et al., Br. J. of Pharmacol., 144, 1017-1028 (2005)
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Задачи, решаемые изобретением
Задачей настоящего изобретения является получение терапевтически эффективного средства для лечения и/или улучшения состояния при ДВС или способ лечения и/или улучшения состояния при ДВС. Другой задачей настоящего изобретения является разработка способа отбора пациентов, страдающих диссеминированным внутрисосудистым свертыванием, которым показано введение тромбомодулина.
Средства для решения поставленных задач
В качестве средств для лечения и/или улучшения состояния при ДВС в основном применялась антикоагулянтная терапия с использованием антикоагулянта или заместительная терапия с использованием концентрированных тромбоцитов или свежей замороженной плазмы. Основным симптомом ДВС является чрезмерная активация свертывающей системы крови. Таким образом, антикоагулянтная терапия для подавления такой чрезмерной активации широко проводилась параллельно с лечением основного заболевания. При лечении и/или улучшении состояния при ДВС в основном использовался гепарин и/или препараты AT. Считалось, что антикоагулянтное действие гепарина выражается значительным усилением ингибирующей скорости АТ на фактор свертывания (Majerus PW, Tollefsen DM. “Coagulants, thrombolytic agents, and anti-platelet agents” In: edited by Shuji Takaori, Hideomi Fukuda, and Akinori Akaike, Goodman & Gilman's The Pharmacological Basis of Therapeutics (10th ed), Tokyo, Hirokawa Shoten, Co., 2003, pp. 1937-1963). Таким образом, гепарин использовали для пациентов, имеющих относительно высокую активность плазменного АТ, например, активность плазменного АТ приблизительно 80% (Kenji Okajima, “Hanshusei kekkannai gyoko shokogun to tazoki fuzen (Disseminated intravascular coagulation syndrome and multiple organ failure),” Iyaku (Medicine and Drug) Journal Co., Ltd.). Более того, препарат AT является стандартным средством, вводимым пациентам, у которых активность плазменного АТ, например, приблизительно составляет 70% или менее (аннотация к Anthrobin P/Neuart, «Применение и доза»). Способ лечения и/или улучшения состояния при ДВС, под действием усиленной активности плазменного АТ для стимуляции антикоагулянтного действия в основном был одобрен. Кроме того, при необходимости в то же время вместе с таким препаратом АТ может быть использован гепарин.
Следовательно, для лечения и/или улучшения состояния при ДВС предпочтительно, чтобы добавление проводили таким образом, чтобы активность плазменного АТ пациентов, страдающих DIG, удерживалась на уровне, составляющем по меньшей мере 70% или более. Далее, в основном считается, что повышение активности плазменного АТ является важным для лечения и/или улучшения состояния при ДВС. В этих обстоятельствах, авторы настоящего изобретения обнаружили, что, неожиданно, высокая эффективность может быть достигнута у пациентов с низкой активностью плазменного АТ менее 50%, благодаря чему осуществилось настоящее изобретение. То есть, даже занижая, этот препарат является высоко эффективным у пациентов с ДВС, у которых активность плазменного АТ составляет менее 50%. Таким образом, авторы изобретения получили удивительные результаты, которые не могли бы себе представить даже специалисты в этой области.
Препараты AT получают из дорогостоящей крови человека в качестве исходного сырья. Если такие препараты АТ в действительности вводят пациентам, обязательно полностью устранить риск распространения инфекционного заболевания, вызванного применением крови человека в качестве исходного сырья (аннотация к Anthrobin P/Neuart, «Инструкции по применению»). Таким образом, препараты АТ до некоторой степени являются проблематичными. Более того, АТ, используемый как препарат крови, также был проблематичным с точки зрения дороговизны. Однако настоящее изобретение может предоставить предпочтительное средство или средство для лечения и/или улучшения состояния при ДВС, которое решает вышеупомянутые проблемы.
В частности, настоящее изобретение содержит следующие признаки:
[1] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании, содержащее в качестве активного ингредиента тромбомодулин, которое вводят пациентам, страдающим от диссеминированного внутрисосудистого свертывания, у которых активность плазменного антитромбина составляет менее 50%;
[2] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по пункту [1], приведенному выше, в котором тромбомодулин является растворимым тромбомодулином;
[3] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по пункту [1] или [2], приведенному выше, в котором указанный тромбомодулин представляет собой пептид, полученный из трансформированных клеток, полученных путем трансфекции клеток-хозяев ДНК, кодирующей аминокислотную последовательность, приведенную в SEQ ID NO: 1, 3, 5, 7, 9 или 11;
[3-2] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по пункту [1] или [2], приведенному выше, в котором указанный тромбомодулин представляет собой пептид, полученный из трансформированных клеток, полученных путем трансфекции клеток-хозяев ДНК, кодирующей аминокислотную последовательность, приведенную в SEQ ID NO: 1 или 3;
[3-3] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по пункту [1] или [2], приведенному выше, в котором указанный тромбомодулин представляет собой пептид, полученный из трансформированных клеток, полученных путем трансфекции клеток-хозяев ДНК, кодирующей аминокислотную последовательность, приведенную в SEQ ID NO: 5 или 7;
[3-4] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по пункту [1] или [2], приведенному выше, в котором указанный тромбомодулин представляет собой пептид, полученный из трансформированных клеток, полученных путем трансфекции клеток-хозяев ДНК, кодирующей аминокислотную последовательность, приведенную в SEQ ID NO: 9 или 11;
[4] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-2], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1 или 3, пептид, имеющий гомологичную мутантную последовательность указанной последовательности и обладающий активностью тромбомодулина, или их смесь;
[4-2] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-2], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1 или 3, пептид, имеющий гомологичную мутантную последовательность указанной последовательности и обладающий активностью тромбомодулина;
[4-3] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-2], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1 или 3;
[4-4] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-2], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 132 или в положениях с 17 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1 или 3, пептид, имеющий гомологичную мутантную последовательность указанной последовательности и обладающий активностью тромбомодулина, или их смесь;
[4-5] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-2], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 132 или в положениях с 17 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1 или 3, или их смесь;
[4-6] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-2], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 132 или в положениях с 17 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1, или их смесь;
[4-7] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-2], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 132 или в положениях с 17 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 3, или их смесь;
[4-8] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-2], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 132 или в положениях с 17 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1, или их смесь;
[4-9] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-2], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 132 или в положениях с 17 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 3, или их смесь;
[5] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-3], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5 или 7, пептид, имеющий гомологичную мутантную последовательность указанной последовательности и обладающий активностью тромбомодулина, или их смесь;
[5-2] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-3], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5 или 7, пептид, имеющий гомологичную мутантную последовательность указанной последовательности и обладающий активностью тромбомодулина;
[5-3] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-3], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5 или 7;
[5-4] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-3], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 480 или в положениях с 17 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5 или 7, пептид, имеющий гомологичную мутантную последовательность указанной последовательности и обладающий активностью тромбомодулина, или их смесь;
[5-5] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-3], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 480 или в положениях с 17 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5 или 7, или их смесь;
[5-6] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-3], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 480 или в положениях с 17 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5, или их смесь;
[5-7] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-3], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 480 или в положениях с 17 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 7, или их смесь;
[5-8] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-3], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 480 или в положениях с 17 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5, или их смесь;
[5-9] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-3], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 480 или в положениях с 17 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 7, или их смесь;
[6] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 516 аминокислотной последовательности, представленной в SEQ ID NO: 9 или 11, пептид, имеющий аминокислотную последовательность, содержащую замену, делецию или добавление одной или нескольких аминокислот в отношении аминокислотной последовательности указанного пептида и обладающий активностью тромбомодулина, или их смесь;
[6-2] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 516 аминокислотной последовательности, представленной в SEQ ID NO: 9 или 11, или пептид, имеющий аминокислотную последовательность, содержащую замену, делецию или добавление одной или нескольких аминокислот в отношении аминокислотной последовательности указанного пептида и обладающий активностью тромбомодулина;
[6-3] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 516 аминокислотной последовательности, представленной в SEQ ID NO: 9 или 11;
[6-4] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9 или 11, пептид, имеющий аминокислотную последовательность, содержащую замену, делецию или добавление одной или нескольких аминокислот в отношении аминокислотной последовательности указанного пептида и обладающий активностью тромбомодулина, или их смесь;
[6-5] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9 или 11, или их смесь;
[6-6] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9, или их смесь;
[6-7] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 11, или их смесь;
[6-8] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9, или их смесь;
[6-9] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9;
[6-10] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 11, или их смесь;
[6-11] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов [1], [2], и [3-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 11;
[7] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов с [1] по [6-11], приведенных выше, где пациенты, страдающие диссеминированным внутрисосудистым свертыванием, имеют активность плазменного антитромбина 40% или менее.
Следует отметить, что при наличии процитированных номеров пункта, например, упомянутые выше с [1] по [6-11], и в тех случаях, когда такие процитированные номера пункта дополнительно включают пункты с написанными через дефис номерами, например, упомянутый выше [6-2], это означает, что такие пункты с написанными через дефис номерами также цитируются. То же самое справедливо для упомянутых ниже пунктов:
[8] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов с [1] по [7], приведенных выше, которое представляет собой парентеральный препарат;
[9] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов с [1] по [8], приведенных выше, которое представляет собой внутривенный препарат;
[10] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов с [1] по [9], приведенных выше, отличающееся тем, что его вводят в дозе от 0,02 до 0,08 мг/кг в день в течение 4 часов путем непрерывной внутривенной капельной инъекцией;
[11] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов с [1] по [10], приведенных выше, отличающееся тем, что его не назначают в сочетании с антитромбином;
[12] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов с [1] по [11], приведенных выше, где диссеминированное внутрисосудистое свертывание возникает в результате малигнизации гемопоэтических клеток или инфекционного заболевания;
[12-1] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов с [1] по [11], приведенных выше, где диссеминированное внутрисосудистое свертывание происходит в результате малигнизации гемопоэтических клеток;
[12-2] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по любому из пунктов с [1] по [11], приведенных выше, где диссеминированное внутрисосудистое свертывание происходит в результате инфекционного заболевания;
[12-3] средство для снижения вероятности смертельных случаев у пациентов людей, страдающих диссеминированным внутрисосудистым свертыванием, которое в качестве активного ингредиента содержит тромбомодулин и которое назначают пациентам, страдающим диссеминированным внутрисосудистым свертыванием, у которых активность плазменного антитромбина составляет менее 50%;
[12-4] средство по пункту [12-3], приведенному выше, в котором тромбомодулин представляет собой пептид, описанный в одном из пунктов с [1] по [6-11], приведенных выше;
[12-5] средство по пункту [12-3], приведенному выше, которое охарактеризовано в любом из пунктов с [1] по [12-2], приведенных выше;
[13] способ отбора пациентов, страдающих диссеминированным внутрисосудистым свертыванием, которым назначают тромбомодулин, предусматривающий: измерение активности плазменного антитромбина у пациентов, страдающих диссеминированным внутрисосудистым свертыванием; отбор пациентов, страдающих диссеминированным внутрисосудистым свертыванием, у которых активность антитромбина составляет менее 50%; установление, что эти лица являются пациентами, страдающими диссеминированным внутрисосудистым свертыванием, которым назначают тромбомодулин;
[13-2] способ по пункту [13], приведенному выше, для отбора пациентов, страдающих диссеминированным внутрисосудистым свертыванием, которым назначают тромбомодулин, где тромбомодулин представляет собой пептид, описанный в одном из пунктов с [1] по [6-11], приведенных выше;
[13-3] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании, содержащее в качестве активного ингредиента тромбомодулин, которое назначают пациентам, страдающим диссеминированным внутрисосудистым свертыванием после измерения у них активности плазменного антитромбина;
[13-4] средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании, содержащее в качестве активного ингредиента тромбомодулин, которое назначают пациентам, страдающим диссеминированным внутрисосудистым свертыванием, в тех случаях, когда измерена активность их плазменного антитромбина и активность плазменного антитромбина составляет менее 50%;
[14] способ лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании, который предусматривает введение тромбомодулина пациентам, страдающим диссеминированным внутрисосудистым свертыванием, у которых активность плазменного антитромбина составляет менее 50%;
[15] способ по пункту [14], приведенному выше, в котором указанным тромбомодулином является растворимый тромбомодулин;
[16] способ по пункту [14] или [15], приведенному выше, в котором указанный тромбомодулин представляет собой пептид, полученный из трансформированных клеток, полученных путем трансфекции клеток-хозяев ДНК, кодирующей аминокислотную последовательность, приведенную в SEQ ID NO: 1, 3, 5, 7, 9 или 11;
[16-2] способ по пункту [14] или [15], приведенному выше, в котором указанный тромбомодулин представляет собой пептид, полученный из трансформированных клеток, полученных путем трансфекции клеток-хозяев ДНК, кодирующей аминокислотную последовательность, приведенную в SEQ ID NO: 1 или 3;
[16-3] способ по пункту [14] или [15], приведенному выше, в котором указанный тромбомодулин представляет собой пептид, полученный из трансформированных клеток, полученных путем трансфекции клеток-хозяев ДНК, кодирующей аминокислотную последовательность, приведенную в SEQ ID NO: 5 или 7;
[16-4] способ по пункту [14] или [15], приведенному выше, в котором указанный тромбомодулин представляет собой пептид, полученный из трансформированных клеток, полученных путем трансфекции клеток-хозяев ДНК, кодирующей аминокислотную последовательность, приведенную в SEQ ID NO: 9 или 11;
[17] способ по любому из пунктов [14], [15] и [16-2], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1 или 3, пептид, имеющий гомологичную мутантную последовательность указанной последовательности и обладающий активностью тромбомодулина, или их смесь;
[17-2] способ по любому из пунктов с [14], [15] и [16-2], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1 или 3, пептид, имеющий гомологичную мутантную последовательность указанной последовательности и обладающий активностью тромбомодулина;
[17-3] способ по любому из пунктов с [14], [15] и [16-2], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1 или 3;
[17-4] способ по любому из пунктов с [14], [15] и [16-2], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 132 или в положениях с 17 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1 или 3, пептид, имеющий гомологичную мутантную последовательность указанной последовательности и обладающий активностью тромбомодулина, или их смесь;
[17-5] способ по любому из пунктов с [14], [15] и [16-2], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 132 или в положениях с 17 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1 или 3, или их смесь;
[17-6] способ по любому из пунктов с [14], [15] и [16-2], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 132 или в положениях с 17 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1, или их смесь;
[17-7] способ по любому из пунктов с [14], [15] и [16-2], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 132 или в положениях с 17 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 3, или их смесь;
[17-8] способ по любому из пунктов с [14], [15] и [16-2], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 132 или в положениях с 17 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1, или их смесь;
[17-9] способ по любому из пунктов с [14], [15] и [16-2], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 132 или в положениях с 17 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 3, или их смесь;
[18] способ по любому из пунктов с [14], [15] и [16-3], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5 или 7, пептид, имеющий гомологичную мутантную последовательность указанной последовательности и обладающий активностью тромбомодулина, или их смесь;
[18-2] способ по любому из пунктов с [14], [15] и [16-3], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5 или 7, пептид, имеющий гомологичную мутантную последовательность указанной последовательности и обладающий активностью тромбомодулина;
[18-3] способ по любому из пунктов с [14], [15] и [16-3], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5 или 7;
[18-4] способ по любому из пунктов с [14], [15] и [16-3], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 480 или в положениях с 17 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5 или 7, пептид, имеющий гомологичную мутантную последовательность указанной последовательности и обладающий активностью тромбомодулина, или их смесь;
[18-5] способ по любому из пунктов с [14], [15] и [16-3], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 480 или в положениях с 17 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5 или 7, или их смесь;
[18-6] способ по любому из пунктов с [14], [15] и [16-3], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 480 или в положениях с 17 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5, или их смесь;
[18-7] способ по любому из пунктов с [14], [15] и [16-3], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 480 или в положениях с 17 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 7, или их смесь;
[18-8] способ по любому из пунктов с [14], [15] и [16-3], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 480 или в положениях с 17 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5, или их смесь;
[18-9] способ по любому из пунктов с [14], [15] и [16-3], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 480 или в положениях с 17 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5, или их смесь;
[19] способ по любому из пунктов с [14], [15] и [16-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 516 аминокислотной последовательности, представленной в SEQ ID NO: 9 или 11, пептид, имеющий гомологичную мутантную последовательность указанной последовательности и обладающий активностью тромбомодулина, или их смесь;
[19-2] способ по любому из пунктов с [14], [15] и [16-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 516 аминокислотной последовательности, представленной в SEQ ID NO: 9 или 11, пептид, имеющий гомологичную мутантную последовательность указанной последовательности и обладающий активностью тромбомодулина;
[19-3] способ по любому из пунктов с [14], [15] и [16-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 516 аминокислотной последовательности, представленной в SEQ ID NO: 9 или 11;
[19-4] способ по любому из пунктов с [14], [15] и [16-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9 или 11, пептид, имеющий гомологичную мутантную последовательность указанной последовательности и обладающий активностью тромбомодулина, или их смесь;
[19-5] способ по любому из пунктов с [14], [15] и [16-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9 или 11, или их смесь;
[19-6] способ по любому из пунктов с [14], [15] и [16-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9, или их смесь;
[19-7] способ по любому из пунктов с [14], [15] и [16-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, имеющий последовательность, состоящую из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 11, или их смесь;
[19-8] способ по любому из пунктов с [14], [15] и [16-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9, или их смесь;
[19-9] способ по любому из пунктов с [14], [15] и [16-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9;
[19-10] способ по любому из пунктов с [14], [15] и [16-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 11, или их смесь;
[19-11] способ по любому из пунктов с [14], [15] и [16-4], приведенных выше, в котором указанный тромбомодулин представляет собой пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 11;
[20] способ по любому из пунктов с [14] по [19-11], приведенных выше, предусматривающий введение тромбомодулина пациентам, страдающим диссеминированным внутрисосудистым свертыванием, у которых активность плазменного антитромбина составляет 40% или менее;
[21] способ по любому из пунктов с [14] по [20], приведенных выше, в котором тромбомодулин вводят парентерально;
[22] способ по любому из пунктов с [14] по [21], приведенных выше, в котором тромбомодулин вводят внутривенно;
[23] способ по любому из пунктов с [14] по [22], приведенных выше, в котором тромбомодулин вводят в дозе от 0,02 до 0,08 мг/кг в день в течение 4 часов путем непрерывной внутривенной капельной инфузии;
[24] способ по любому из пунктов с [14] по [23], приведенных выше, отличающийся тем, что тромбомодулин вводят без сочетания с антитромбином;
[25] способ по любому из пунктов с [14] по [24], приведенных выше, где диссеминированное внутрисосудистое свертывание происходит в результате малигнизации гемопоэтических клеток или инфекционного заболевания;
[25-1] способ по любому из пунктов с [14] по [24], приведенных выше, где диссеминированное внутрисосудистое свертывание происходит в результате малигнизации гемопоэтических клеток;
[25-2] способ по любому из пунктов с [14] по [24], приведенных выше, где диссеминированное внутрисосудистое свертывание происходит в результате инфекционного заболевания;
[26] способ уменьшения вероятности смертельных случаев у людей пациентов, страдающих диссеминированным внутрисосудистым свертыванием, предусматривающий введение тромбомодулина пациентам, страдающим диссеминированным внутрисосудистым свертыванием, у которых активность плазменного антитромбина составляет менее 50%;
[26-2] способ по пункту [26], приведенному выше, где тромбомодулин представляет собой пептид, описанный в одном из пунктов с [1] по [6-11], приведенных выше;
[26-3] способ по пункту [26], приведенному выше, с характеристиками, описанными в любом из пунктов с [1] по [25-2], приведенных выше;
[27] способ лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании, предусматривающий введение тромбомодулина пациентам, страдающим диссеминированным внутрисосудистым свертыванием после измерения активности их плазменного антитромбина;
[27-2] способ лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании, предусматривающий введение тромбомодулина пациентам, страдающим диссеминированным внутрисосудистым свертыванием, в тех случаях, когда активность их плазменного антитромбина измерена и активность плазменного антитромбина составляет менее 50%.
Технический результат изобретения
Применяя препарат, содержащий тромбомодулин, по настоящему изобретению, можно эффективно лечить и/или облегчать симптомы ДВС у пациентов с активностью плазменного АТ менее 50%, предпочтительно без сочетания с AT.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение будет конкретно описано ниже.
Настоящее изобретение относится к средству для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании (ДВС), содержащему в качестве активного ингредиента тромбомодулин, который вводят пациентам, страдающим диссеминированным внутрисосудистым свертыванием, у которых активность плазменного антитромбина составляет менее 50%.
То есть средство для лечения и/или профилактики диссеминированного внутрисосудистого свертывания по настоящему изобретению представляет собой средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании у пациентов, страдающих диссеминированным внутрисосудистым свертыванием, у которых активность плазменного антитромбина составляет менее 50%.
Более того, настоящее изобретение также относится к средству для снижения вероятности летальных исходов у пациентов людей, страдающих диссеминированным внутрисосудистым свертыванием.
Предпочтительным результатом, полученным благодаря лечению и/или улучшению состояния при ДВС, является «предотвращение летальных исходов у пациентов, связанных с ДВС», например. Кроме того, другим предпочтительным результатом является «предотвращение ухудшения общего состояния пациентов, связанного с ДВС».
ДВС представляет собой заболевание или синдром, при котором огромные количества веществ, ускоряющих свертывание крови, образуются в результате повреждения тканей, вызванного различными заболеваниями, таким образом, функция системы свертывания чрезмерно усилена, и мелкие тромбы образуются в системе кровеносных сосудов (образование микротромбов), и они забивают мелкие сосуды, и в то же время расходуются тромбоциты или факторы свертывания, необходимые для контроля кровотечения, тем самым вызывая аномальное свертывание. В частности, в результате образования фибрина в кровеносном сосуде происходит кровотечение вследствие коагулопатии потребления или органная недостаточность вследствие образования микротромбов. ДВС также называют синдромом диссеминированного внутрисосудистого свертывания или синдромом диффузного внутрисосудистого свертывания.
В том случае, если основным заболеванием является злокачественная опухоль, например, малигнизация гемопоэтических клеток или солидная саркома, когда тканевой фактор, экспрессирующийся в опухолевых клетках, имеет возможность контактировать с кровью, система свертывания крови чрезмерно активируется, вызывая ДВС.
Более того, ДВС также может быть вызвано синдромом системной воспалительной реакции (в дальнейшем иногда сокращенно SIRS), которая происходит в результате тяжелого, инфекционного или неинфекционного, течения болезни.
SIRS является состоянием, вызванным ускоренным образованием воспалительных цитокинов, сопутствующим серьезному повреждению тканей или тяжелому инфекционному заболеванию. Если эта реакция становится чрезмерной, ДВС вызывается активацией нейтрофилов или активацией эндотелиальных клеток сосудов. Другими словами, это состояние является предварительной стадией ДВС (в дальнейшем иногда сокращенно преДВС), и средство для лечения и/или улучшения состояния при ДВС по настоящему изобретению может быть эффективно использовано при преДВС. Таким образом, целевое использование средства для лечения и/или улучшения состояния при ДВС по настоящему изобретению также включает в себя лечение и/или улучшение состояния при преДВС.
ДВС имеет различные типы клинических симптомов, в зависимости от типа основного патогенетического состояния. Помимо наблюдения кровотечения или органных симптомов, предпочтительный способ диагностики заболевания как ДВС включает регистрацию показателя ДВС исходя из нескольких тестируемых величин, как описано ниже, а затем диагностирование заболевания как ДВС, по достижении показателем ДВС определенного уровня. Примеры таких тестируемых показателей включают количество тромбоцитов, концентрацию фибрина/продуктов распада фибриногена (в дальнейшем иногда сокращенно FDP), распадающегося под действием плазмина, концентрацию D-димера, концентрацию фибриногена и протромбиновое время. Более того, также можно диагностировать определенное состояние как преДВС на основе уменьшения тромбоцитов, увеличения концентрации D-димера или FDP, и т.д. (Masao Nakagawa, “Search report regarding use of criteria of disseminated intravascular coagulation (DIC),” Research Study Team of Intractable Disease (Blood Coagulation Abnormality), the Ministry of Health and Welfare, Study report 1999, 1999: 65-72; Katsumi Deguchi, “Tentative plan regarding standards for initiation of early treatment of DIC,” Research Study Team of Intractable Disease (Blood Coagulation Abnormality), the Ministry of Health and Welfare, Study report 1999, 1999: 73-77; и Katsumi Nakagawa & Hajime Tsuji, “Current diagnosis of DIC - Reports on results of inquiry survey” Clinical Blood. 1999, 40: 362-364). Кроме того, также можно диагностировать определенное состояние как преДВС путем измерения концентрации растворимого фибрина в крови или концентрации в крови комплекса тромбин-антитромбин. Конкретные примеры критериев показателей ДВС включают в себя явные критерии ДВС (Taylor FB et al., Thromb Haemost 2001: 86: 1327-1330), критерии острой фазы ДВС (Gando S. et al., Clin Appl Thromb Hemost 2005: 11(1): 71-76) и критерии ДВС Министерства здравоохранения и социального обеспечения (Nobuo Aoki & Jun Hasegawa, “Revision of the chapter 'Auxiliary test results and findings for the diagnosis' in DIC criteria,” Research Study Team of Intractable Disease (Blood Coagulation Abnormality), Ministry of Health and Welfare, Study report 1992, 1988: pp. 37-41).
Способ диагностики заболевания как ДВС конкретно не ограничен при условии, что это упомянутый выше способ диагностики. Предпочтительным является способ диагностики, предусматривающий регистрацию показателей ДВС. Кроме того, с точки зрения терапевтических эффектов, стоимости медицинского ухода и качества жизни пациентов, при необходимости раннего лечения ДВС, существует другой вариант осуществления, в котором предпочтительно проводится диагностика преДВС.
В качестве диагностических способов, предусматривающих регистрацию показателей ДВС, существует другой способ диагностики, предусматривающий регистрацию аналогичных показателей ДВС, а также упомянутый выше способ диагностики.
Тип ДВС, при котором может быть назначено средство для лечения и/или улучшения состояния при ДВС по настоящему изобретению, конкретно не ограничен. Однако средство по настоящему изобретению более предпочтительно применять при ДВС, происходящем в результате малигнизации гемопоэтических клеток, или ДВС, происходящем в результате инфекционного заболевания, и более предпочтительно, при ДВС в результате инфекционного заболевания. Конкретным примером ДВС в результате инфекционного заболевания предпочтительно является ДВС в результате сепсиса. В другом предпочтительном варианте осуществления средство по настоящему изобретению также применяют при ДВС в результате малигнизации гемопоэтических клеток.
Средство для лечения и/или улучшения состояния при ДВС по настоящему изобретению также может быть использовано при сепсисе. Сепсис также может рассматриваться как SIRS, происходящий в результате тяжелого инфекционного клинического течения инфекционного заболевания. Следовательно, сепсис тесно связан с ДВС, вызванным инфекционным заболеванием. Сепсис зачастую протекает с ДВС. Могут быть случаи, в которых средство по настоящему изобретению может быть использовано для пациентов и с сепсисом, и с ДВС. То есть, в настоящем изобретении, это средство может быть использовано для пациентов либо с сепсисом, либо с ДВС, или пациентов как с сепсисом, так и с ДВС, или для пациентов, у которых подозревают наличие сепсиса и/или ДВС.
Сепсис был известен как тяжелое системное инфекционное заболевание, которое возникает вследствие непрерывной или периодической инфильтрации микроорганизмов из очага инфекции в кровь, как результат такого заболевания инфекционное заболевание, злокачественная опухоль, цирроз печени, почечная недостаточность, диабет или патология родов, или лечения повреждения или заболеваний, например, постоянных катетеров, устройств для трансфузии растворов, диализа или трахеостомы. Если симптомы этого заболевания прогрессируют, септический шок индуцирует системный шок, а именно путем резкого падения кровяного давления или недостаточности периферического кровообращения. После этого распространение нарушения на важные органы, такие как легкие, почки, печень, сердце, пищеварительный тракт и центральную нервную систему, приводит к летальному исходу. Более того, как осложнение сепсиса имеет место индуцированный ДВС или респираторный дистресс синдром взрослых (ARDS), характеризующийся интерстициальным отеком легких, кровотечением или острой дыхательной недостаточностью, вызванной нарушением работы легочных капилляров, связанной с активацией нейтрофилов и миграцией и накоплением их в паренхиме легких. Прогноз крайне плохой.
Существует несколько способов диагностики заболевания как сепсис. Такие способы обобщены у Levy M. et al., Crit. Care. Med., 31: 1250-1256. Примеры способов диагностики сепсиса включают в себя способы диагностики заболевания как сепсис докторами и способы, использующие тестируемые величины, и подобные. Примером последних способов является способ диагностики заболевания как сепсис, который предусматривает диагностику заболевания как SIRS, в тех случаях, когда выполнялись два из следующих четырех пунктов ((1) температура тела >38°C или <36°C, (2) частота сердечных сокращений >90/мин, (3) частота дыхания >20/мин или требуется искусственная вентиляция легких, и (4) количество лейкоцитов >12000/мм3 или < 4000/мм3, или количество незрелых лейкоцитов >10%), и затем диагностирование SIRS как сепсис, в тех случаях, когда было показано или предположено, что причиной заболевания является микроорганизм [LaRosa S., домашняя страница Cleveland Clinic]. Способ, аналогичный этому способу описан в Members of the American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference: Crit Care Med, 20, 864-874 (1992)].
Примеры состояний пациентов с сепсисом включают в себя бактериемию, септицемию, синдром системной воспалительной реакции (SIRS), септицемию (которая представляет собой SIRS, при котором было показано или предположено, что причиной заболевания является микроорганизм), тяжелую септицемию, септический шок, некупируемый септический шок и синдром полиорганной дисфункции (в дальнейшем иногда называемый MODS) (Harrison's Principles of Internal Medicine, original article 15th edition, 124: pp. 828-833, Medical Science International). Каждое из упомянутых выше состояний проиллюстрировано как симптом, при котором эффективно используется терапевтическое и/или улучшающее состояние, средство по настоящему изобретению.
В качестве бактериемии приведен пример состояния, при котором наличие бактерий в крови подтверждено положительной гемокультурой.
В качестве септицемии приведен пример состояния, при котором подтверждено наличие в крови токсинов микроорганизмов или других токсинов.
В качестве синдрома системной воспалительной реакции (SIRS) приведен пример предварительной стадии ДВС, как описано выше.
В качестве тяжелого сепсиса приведен пример сепсиса, сопровождаемого одним или несколькими симптомами, выбранными из органной недостаточности и гипотензии, такими как метаболический ацидоз, острая энцефалопатия, олигурия, гипоксемия и диссеминированное внутрисосудистое свертывание.
В качестве септического шока приведен пример состояния, которое включает в себя низкое кровяное давление (кровяное давление 90 мм рт. ст. или менее, или кровяное давление, которое составляет 40 мм рт. ст. или менее обычного кровяного давления), которое не реагирует на реанимационные меры с использованием инфузионного раствора и которое сопровождается органной недостаточностью.
В качестве некупируемого септического шока приведен пример септического шока, который продолжается в течение 1 часа или более и не реагирует на фактор, повышающий кровяное давление, содержащий инфузионный раствор.
В качестве синдрома полиорганной дисфункции (MODS) приведен пример заболевания, которое сопровождается недостаточностью одного или нескольких органов и требует медицинского вмешательства для поддержания гомеостаза.
Средство для лечения и/или улучшения состояния при ДВС по настоящему изобретению может быть эффективно использовано у пациентов с низкой активностью АТ. Термин «пациенты с низкой активностью АТ» используется для обозначения пациентов, у который активность плазменного АТ ниже, чем у здоровых людей (70% или менее). В качестве таких пациентов с низкой активностью АТ приводят примеры пациентов с врожденным дефицитом АТ и пациентов с острой недостаточностью АТ. Пациенты с врожденным дефицитом АТ означают пациентов, у которых активность АТ природно ниже активности у здоровых людей (приблизительно от 35% до 70%). С другой стороны, пациенты с острой недостаточностью АТ означают пациентов, у которых активность АТ снижена до 70% или менее, чем у здоровых людей, после рождения. Конкретные причины снижения активности АТ после рождения включают в себя заболевания печени, такие как хроническая печеночная недостаточность, послеоперационные состояния, шок, тяжелые инфекционные заболевания, заболевания почек, такие как нефротический синдром, заболевания пищеварительной системы, такие как воспалительное заболевание кишечника, снижение активности АТ в результате действия гепарина или подобного, снижение активности АТ вследствие старения, у недоношенных новорожденных, при диабете, болезни Бехчета и нарушении питания. В настоящем изобретении, однако, конкретно не ограничено, является ли заболевание ДВС у пациентов с низкой активностью АТ врожденным, или это заболевание является приобретенным после рождения. Раса таких пациентов конкретно не ограничена. Предпочтительными являются японцы.
Среди других, симптомы ДВС у пациентов с активностью плазменного АТ менее 50% можно эффективно лечить и/или облегчить, используя средство для лечения и/или улучшения состояния при ДВС по настоящему изобретению, содержащее в качестве активного ингредиента тромбомодулин.
Активность AT определяется как активность нейтрализующей свертывающей активности тромбина или активированного фактора X. В основном, активность АТ указывается как относительная величина к активности АТ, полученной из плазмы здорового взрослого человека (в дальнейшем называемой нормальной плазмой). Тип нормальной плазмы конкретно не ограничен при условии, что она представляет собой нормальную плазму, которая традиционно используется специалистами в данной области. Могут быть использованы международные стандартные продукты нормальной плазмы (произведенные NIBSC), которые были утверждены Экспертным комитетом по биологической стандартизации (Expert Committee on Biological Standardization) (в дальнейшем иногда сокращенно ECBS) Всемирной организации здравоохранения (World Health Organization) (WHO), а затем контролировались и распространялись Национальным институтом по биологическим стандартам и контролю (National Institute for Biological Standards and Control) (в дальнейшем иногда сокращенно NIBSC). Более того, в другом предпочтительном примере, также может быть использована коммерчески доступная стандартная плазма, активность АТ которой была скорректирована, с использованием международных стандартных продуктов NIBSC (например, стандартной плазмы Комитета по науке и стандартизации (Scientific and Standardization Committee) (в дальнейшем иногда сокращенно SSC) и Международным обществом по тромбозу и гемостазу (в дальнейшем иногда сокращенно ISTH)). Более того, также может быть использована нормальная плазма, включенная с общей АТ активностью в набор для измерений, или нормальная плазма, предназначенная для такого набора для измерения активности АТ. В качестве такой нормальной плазмы, включенной с общей АТ активностью в набор для измерений, или нормальной плазмы, предназначенной для набора для измерения активности АТ, предпочтительно используют препарат нормальной плазмы “Daiichi” (Daiichi Kagaku Co., Ltd.). В некоторых случаях, активность АТ образца плазмы, измеренная с использованием такой нормальной плазмы, предпочтительно может быть преобразована в активность АТ, полученную с использованием в качестве стандарта, нормальной плазмы, которая является международным стандартным продуктом NIBSC. Более предпочтительно, активность АТ может быть получена путем преобразования ее в активность АТ, полученную с использованием в качестве стандарта препарата нормальной плазмы “Daiichi” (Daiichi Kagaku Co., Ltd.).
В качестве нормальной плазмы предпочтительно используют международный стандартный продукт от NIBSC. В другом варианте осуществления, предпочтительно используют коммерчески доступную стандартную плазму, АТ активность которой скорректирована с использованием международного стандартного продукта от NIBSC. В более предпочтительном варианте осуществления, препарат нормальной плазмы “Daiichi” (Daiichi Kagaku Co., Ltd.) используют в качестве такой нормальной плазмы. Например, когда активность АТ в плазме составляет 50%, это означает, что соотношение активности АТ в плазме к активности АТ в вышеупомянутой плазме составляет 50%.
Для эффективного лечения и/или ослабления симптомов ДВС, активность плазменного АТ пациентов с ДВС конкретно не ограничена при условии, что она меньше 50%. Верхний предел активности плазменного АТ предпочтительно составляет 48% или менее, более предпочтительно 46% или менее, более предпочтительно 44% или менее, особенно предпочтительно 42% или менее, и наиболее предпочтительно 40% или менее. С другой стороны, нижний предел активности плазменного АТ конкретно не ограничен при условии, что он равен или выше предела определения способа измерения. Например, он составляет 0,1% или более, предпочтительно 10% или более, более предпочтительно 15% или более, еще более предпочтительно 20% или более, и особенно предпочтительно 25% или более. Принимая во внимание активность АТ группы пациентов в испытательном примере 1 в разделе примеры, нижний предел активности плазменного АТ наиболее предпочтительно составляет 30% или более.
Более того, настоящее изобретение относится к средству для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании, содержащему в качестве активного ингредиента тромбомодулин, которое назначают пациентам, страдающим диссеминированным внутрисосудистым свертыванием после измерения активности их плазменного антитромбина. Тип средства для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании по настоящему изобретению конкретно не ограничен при условии, что это средство назначают после измерения активности плазменного антитромбина у пациентов. Предпочтительно средство для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании, которое назначают пациентам, страдающим диссеминированным внутрисосудистым свертыванием, в тех случаях, когда измеренная активность антитромбина составляет менее 50%. Таким образом, назначение тромбомодулина пациенту, страдающему диссеминированным внутрисосудистым свертыванием после измерения активности его антитробина, является предпочтительным, чтобы средство имело возможность в достаточной мере проявить свое действие.
Кроме того, также возможно назначать средство для лечения и/или улучшения состояния при ДВС по настоящему изобретению пациентам с низкой активностью АТ, которая была снижена вследствие заболеваний печени, таких как хроническая печеночная недостаточность, послеоперационные состояния, шок, тяжелое инфекционное заболевание, и т.д.
Было известно, что тромбомодулин, используемый в настоящем изобретении, обладает действием по (1) селективному связыванию с тромбином и (2) способствует активации белка С, вызванной тромбином. Кроме того, предпочтительно, чтобы представленный тромбомодулин в основном обладал (3) действием по удлинению времени свертывания под действием тромбина и/или (4) действием для суппрессии агрегации тромбоцитов, вызванной тромбином. Такое действие тромбомодулина можно назвать активностью тромбомодулина.
В качестве такой активности тромбомодулина, тромбомодулин предпочтительно обладает действием в (1) и (2) случаях, приведенных выше, и более предпочтительно обладает всеми действиями приведенных выше случаев с (1) по (4).
В качестве действия по стимуляции активации белка С, вызванной тромбином, уровень активности действия по стимуляции белка С или наличия или отсутствия такого действия легко можно подтвердить применением способов исследования, доходчиво описанных в различных видах известных публикаций, в том числе в патентной публикации (Kokai) JP No. 64-6219 A (1989). Более того, действие по удлинению времени свертывания, вызванного тромбином, или действие по суппрессии агрегации тромбоцитов, вызванной тромбином, также можно подтвердить таким же образом, указанным выше.
Тип тромбомодулина, используемого в настоящем изобретении, конкретно не ограничен при условии, что он обладает тромбомодулирующей активностью. Предпочтительно он представляет собой растворимый тромбомодулин. В качестве предпочтительных примеров растворимости такого растворимого тромбомодулина, он растворяется в воде, например дистиллированной воде, используемой для инъекций (в отсутствие поверхностно-активного вещества, такого как Тритон X-100 или полидоканол, и, как правило, вокруг нейтрального диапазона) в количестве 1 мг/мл или более или 10 мг/мл или более; предпочтительно 15 мг/мл или более или 17 мг/мл или более; более предпочтительно 20 мг/мл или более, 25 мг/мл или более, или 30 мг/мл или более; и особенно предпочтительно 60 мг/мл или более. В некоторых случаях, такой растворимый тромбомодулин растворяется в воде, в количестве 80 мг/мл или более или 100 мг/мл или более. Для того чтобы однозначно определить, был ли растворен в воде растворимый тромбомодулин или нет, после его растворения в воде, воду осматривают невооруженным глазом сразу же при дневном свете в положении освещения приблизительно 1000, например. Если вода выглядит прозрачной и не содержит нерастворимых веществ, до той степени, что их явно видно, это может быть ясным указанием на то, что растворимый тромбомодулин растворился в воде. Это также можно подтвердить путем фильтрования воды и исследования наличия или отсутствия остатка.
Тромбомодулин, используемый в настоящем изобретении, предпочтительно содержит аминокислотную последовательность, состоящую из аминокислот в положениях с 19 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1, которая была известна как центральная часть тромбомодулирующей активности тромбомодулина человека. Аминокислотная последовательность представленного тромбомодулина конкретно не ограничена при условии, что она содержит аминокислотную последовательность, состоящую из аминокислот в положениях с 19 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1. Аминокислотная последовательность, состоящая из аминокислот в положениях с 19 по 132 описанной выше аминокислотной последовательности, показанной в SEQ ID NO: 1, может быть природно или искусственно изменена при условии, что она обладает действием по стимуляции активации белка С, вызванной тромбином, а именно активностью тромбомодулина. Другими словами, аминокислотная последовательность, состоящая из аминокислот в положениях с 19 по 132, может содержать замену, делецию или добавление одной или нескольких аминокислот в отношении аминокислотной последовательности, показанной в SEQ ID NO: 1. Приемлемый уровень изменений конкретно не ограничен при условии, что упомянутая выше аминокислотная последовательность обладает активностью тромбомодулина. Измененная аминокислотная последовательность, состоящая из аминокислот в положениях с 19 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1, гомологична, например, на 50% или более, предпочтительно 70% или более, более предпочтительно 80% или более, еще более предпочтительно 90% или более, особенно предпочтительно 95% или более, и наиболее предпочтительно 98% или более, исходной аминокислотной последовательности. Такая аминокислотная последовательность называется гомологичной мутантной последовательностью. Как описано далее, такую мутантную аминокислотную последовательность легко можно получить общепринятым генно-инженерным способом.
В аминокислотной последовательности, показанной SEQ ID NO: 3, Val, который представляет собой аминокислоту в положении 125 аминокислотной последовательности, представленной в SEQ ID NO: 1, был заменен на Ala. Тромбомодулин, используемый в настоящем изобретении, также предпочтительно содержит аминокислотную последовательность, состоящую из аминокислот в положениях с 19 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 3.
Таким образом, тип тромбомодулина, используемого в настоящем изобретении, конкретно не ограничен при условии, что он имеет по меньшей мере аминокислотную последовательность, состоящую из аминокислот в положениях с 19 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1 или 3, или мутантную последовательность, гомологичную упомянутой выше последовательности, и содержит, по меньшей мере пептидную последовательность, обладающую активностью тромбомодулина. Предпочтительные примеры представленного тромбомодулина включают в себя пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 132 или в положениях с 17 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1 или 3, и пептид, состоящий из мутантной последовательности, гомологичной упомянутой выше последовательности, и обладающий по меньшей мере активностью тромбомодулина. Пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1 или 3, является более предпочтительным. Более того, в другом более предпочтительном варианте осуществления также может применяться пептид, состоящий из мутантной последовательности, гомологичной аминокислотной последовательности, состоящей из аминокислот в положениях с 19 по 132 или в положениях с 17 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1 или 3, и обладающей по меньшей мере активностью тромбомодулина.
В другом варианте осуществления, тромбомодулин, используемый в настоящем изобретении, предпочтительно содержит аминокислотную последовательность, состоящую из аминокислот в положениях с 19 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5. Тип представленного тромбомодулина в этом варианте осуществления конкретно не ограничен при условии, что он содержит такую аминокислотную последовательность, состоящую из аминокислот в положениях с 19 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5. Аминокислотная последовательность, состоящая из аминокислот в положениях с 19 по 480 упомянутой выше аминокислотной последовательности, показанной в SEQ ID NO: 5, может быть гомологично мутирована при условии, что она обладает действием по стимуляции активации белка С, вызванной тромбином, а именно активностью тромбомодулина.
В аминокислотной последовательности, показанной в SEQ ID NO: 7, Val, который представляет собой аминокислоту в положении 473 аминокислотной последовательности, представленной в SEQ ID NO: 5, был заменен на Ala. Тромбомодулин, используемый в настоящем изобретении, также предпочтительно содержит аминокислотную последовательность, состоящую из аминокислот в положениях с 19 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 7.
Таким образом, тип тромбомодулина, используемый в настоящем изобретении, конкретно не ограничен при условии, что он имеет по меньшей мере аминокислотную последовательность, состоящую из аминокислот в положениях с 19 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5 или 7, или мутантную последовательность, гомологичную упомянутой выше последовательности, и содержит по меньшей мере пептидную последовательность, обладающую активностью тромбомодулина. Предпочтительные примеры представленного тромбомодулина включают в себя пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 480 или в положениях с 17 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5 или 7, и пептид, состоящий из мутантной последовательности, гомологичной упомянутой выше последовательности и обладающий по меньшей мере активностью тромбомодулина. Пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5 или 7, является более предпочтительным. Более того, в еще более предпочтительном варианте осуществления также можно применять пептид, состоящий из мутантной последовательности, гомологичной аминокислотной последовательности, состоящей из аминокислот в положениях с 19 по 480 или в положениях с 17 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5 или 7, и обладающий по меньшей мере активностью тромбомодулина.
В дополнительном варианте осуществления, тромбомодулин, используемый в настоящем изобретении, предпочтительно содержит аминокислотную последовательность, состоящую из аминокислот в положениях с 19 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9. Тип представленного тромбомодулина в этом варианте осуществления конкретно не ограничен при условии, что он содержит такую аминокислотную последовательность, состоящую из аминокислот в положениях с 19 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9. Аминокислотная последовательность, состоящая из аминокислот в положениях с 19 по 515 упомянутой выше аминокислотной последовательности, показанной в SEQ ID NO: 9, может быть гомологично мутирована при условии, что она обладает действием по стимуляции активации белка С, вызванной тромбином, а именно активностью тромбомодулина.
В аминокислотной последовательности, показанной в SEQ ID NO: 11, Val, который представляет собой аминокислоту в положении 473 аминокислотной последовательности, представленной в SEQ ID NO: 9, был заменен на Ala. Тромбомодулин, используемый в настоящем изобретении, также предпочтительно содержит аминокислотную последовательность, состоящую из аминокислот в положениях с 19 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 11.
Таким образом, тип тромбомодулина, используемого в настоящем изобретении, конкретно не ограничен при условии, что он имеет, по меньшей мере, аминокислотную последовательность, состоящую из аминокислот в положениях с 19 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9 или 11, или пептидную последовательность, имеющую мутантную последовательность, гомологичную упомянутой выше последовательности, и обладающую по меньшей мере активностью тромбомодулина. Более предпочтительные примеры представленного тромбомодулина включают в себя пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9 или 11, и пептид, состоящий из мутантной последовательности, гомологичной упомянутой выше последовательности, и обладающий по меньшей мере активностью тромбомодулина. Пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9 является особенно предпочтительным. Кроме того, предпочтительным примером также является их смесь. Более того, в другом особенно предпочтительном варианте осуществления, также может использоваться пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 11. Их смесь также является предпочтительным примером тромбомодулина по настоящему изобретению. Дополнительно другим предпочтительным примером представленного тромбомодулина также является пептид, состоящий из гомологичной мутантной последовательности из вышеупомянутых, и обладающий по меньшей мере активностью тромбомодулина.
Пептид, имеющий гомологичную мутантную последовательность, описан выше. Такой пептид, имеющий гомологичную мутантную последовательность, также содержит пептид, который может содержать замену, делецию или добавление одной или более, а именно одной или многих, и предпочтительно нескольких (например, от 1 до 20, предпочтительно от 1 до 10, более предпочтительно от 1 до 5, и особенно предпочтительно от 1 до 3) аминокислот в аминокислотной последовательности целевого пептида. Приемлемый уровень изменения конкретно не ограничен при условии, что этот пептид обладает активностью тромбомодулина. Мутантный пептид демонстрирует гомологию, например, 50% или более, предпочтительно 70% или более, более предпочтительно 80% или более, еще более предпочтительно 90% или более, особенно предпочтительно 95% или более, и наиболее предпочтительно 98% или более, по уровню аминокислотной последовательности с целевым пептидом.
Более того, другие предпочтительные примеры тромбомодулина, используемого в настоящем изобретении, включают в себя пептид, состоящий из последовательности (462 аминокислотных остатка), показанной в SEQ ID NO: 14, пептид, состоящий из последовательности (272 аминокислотных остатка), показанной в SEQ ID NO: 8, и пептид, состоящий из последовательности (236 аминокислотных остатков), показанной в SEQ ID NO: 6, которые описаны в патентной публикации (Kokai) JP No. 64-6219 (1989) A.
Тип тромбомодулина, используемого в настоящем изобретении, конкретно не ограничен при условии, что он имеет по меньшей мере аминокислотную последовательность, состоящую из аминокислот в положениях с 19 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1 или 3. Среди прочих предпочтительным является пептид, имеющий по меньшей мере аминокислотную последовательность, состоящую из аминокислот в положениях с 19 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5 или 7, и более предпочтительным является пептид, имеющий по меньшей мере аминокислотную последовательность, состоящую из аминокислот в положениях с 19 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9 или 11. Более предпочтительным примером пептида, имеющего по меньшей мере аминокислотную последовательность, состоящую из аминокислот в положениях с 19 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9 или 11, является пептид, состоящий из последовательности, состоящей из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9 или 11. Кроме того, смесь, полученная из таких пептидов, из которых каждый состоит из последовательности, состоящей из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9 или 11, также является предпочтительным примером тромбомодулина по настоящему изобретению.
В случае упомянутой выше смеси, соотношение компонентов смеси между пептидом, который начинается с положения 17 аминокислотной последовательности, представленной в SEQ ID NO: 9 или 11, и пептидом, который начинается с положения 19 указанных выше последовательностей, составляет (30: 70) - (50: 50), и предпочтительно (35: 65) - (45: 55).
Более того, соотношение компонентов смеси между пептидом, который заканчивается в положении 515 аминокислотной последовательности, представленной в SEQ ID NO: 9 или 11, и пептидом, который заканчивается в положении 516, составляет (70: 30) - (90: 10), и предпочтительно (75: 25) - (85: 15).
Соотношение таких пептидов в смеси может быть получено общепринятым способом.
Следует отметить, что последовательность, состоящая из аминокислот в положениях с 19 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 1, соответствует последовательности, состоящей из аминокислот в положениях с 367 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 9, и что последовательность, состоящая из аминокислот в положениях с 19 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 5, соответствует последовательности, состоящей из аминокислот в положениях с 19 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 9.
Далее, последовательность, состоящая из аминокислот в положениях с 19 по 132 аминокислотной последовательности, представленной в SEQ ID NO: 3, соответствует последовательности, состоящей из аминокислот в положениях с 367 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 11, и последовательность, состоящая из аминокислот в положениях с 19 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 7, соответствует последовательности, состоящей из аминокислот в положениях с 19 по 480 аминокислотной последовательности, представленной в SEQ ID NO: 11.
Кроме того, каждая из этих последовательностей, состоящая из аминокислот в положениях с 1 по 18 аминокислотных последовательностей, показанных в SEQ ID NO: 1, 3, 5, 7, 9 и 11, являются идентичными друг другу.
Как описано ниже, тромбомодулин, используемый в настоящем изобретении, может быть получен из трансформированных клеток, которые получены путем включения ДНК, кодирующей пептид с аминокислотной последовательностью, показанной в SEQ ID NO: 1, 3, 5, 7, 9, 11 и т.д. (в частности, нуклеотидная последовательность, показанная в SEQ ID NO: 2, 4, 6, 8, 10, 12, и т.д., соответственно), в вектор, а затем трансфекцией клеток-хозяев этим вектором.
Необходимо только, чтобы эти пептиды имели упомянутые выше аминокислотные последовательности. Следовательно, сахарную цепь можно добавлять или не добавлять. Добавление сахарной цепи конкретно не ограничено. Кроме того, в способах генной инженерии, тип такой сахарной цепи, положение, к которому добавляется сахарная цепь, и уровень добавления отличаются в зависимости от типа используемой клетки-хозяина, и они конкретно не ограничены. Положение связывания такой сахарной цепи и ее тип описаны в патентной публикации (Kokai) JP No. 11-341990 (1999) A. В случае тромбомодулина по настоящему изобретению, такая же сахарная цепь может быть добавлена в том же положении, как описано в упомянутой выше публикации. Как описано далее, способ получения тромбомодулина по настоящему изобретению не ограничен генной инженерией. В случае получения тромбомодулина по настоящему изобретению путем генной инженерии, однако, в качестве сигнальной последовательности, которая может быть использована при экспрессии, может быть использована нуклеотидная последовательность, кодирующая аминокислотную последовательность, состоящую из аминокислот в положениях с 1 по 18 упомянутой выше аминокислотной последовательности, показанной в SEQ ID NO: 9, нуклеотидная последовательность, кодирующая аминокислотную последовательность, состоящую из аминокислот в положениях с 1 по 16 упомянутой выше аминокислотной последовательности, показанной в SEQ ID NO: 9, и другие известные сигнальные последовательности, такие как сигнальная последовательность активатора тканевого плазминогена человека (Международная публикация WO88/9811, и патентная публикация (Kokai) JP No. 11-341990 (1999) A).
В тех случаях, когда ДНК последовательность, кодирующую тромбомодулин, вводят в клетки-хозяева, предпочтительно применять способ, который предусматривает включение ДНК последовательности, кодирующей тромбомодулин, в вектор, и более предпочтительно в вектор экспрессии, способный экспрессироваться в клетках животных, а затем введение этого вектора в клетки-хозяева. Такой вектор экспрессии представляет собой молекулу ДНК, которую составляет промоторная последовательность, последовательность для добавления сайта связывания рибосомы с мРНК, ДНК последовательность, кодирующая экспрессируемый белок, сигнал сплайсинга, терминаторная последовательность для транскрипции терминации, последовательность области начала репликации, и другие. Примеры предпочтительного экспрессионного вектора в клетках животных включают в себя: pSV2-X, по сообщению R. C. Mulligan et al. [Proc. Natl. Acad. Sci. U.S.A. 78. 2072 (1981)]; и pBP69T (69-6) по сообщению P. M. Howley et al. [Methods in Emzymology, 101, 387, Academic Press (1983)].
Примеры клеток-хозяев, которые могут быть использованы в получении таких пептидов, включают в себя ооциты китайского хомячка (CHO), клетки COS-1, клетки COS-7, клетки VERO (ATCC CCL-81), клетки BHK, MDCK клетки из почек собак, и AV-12-664 клетки хомяка. Кроме того, примеры таких клеток-хозяев, полученных из клеток человека, включают в себя клетки HeLa, клетки WI38, и клетки человека 293. Из этих клеток наиболее общепринятыми и предпочтительными являются клетки CHO. Наряду с клетками CHO, более предпочтительными являются клетки DHFR-CHO.
В способах генной инженерии или получения белка зачастую используют такие микроорганизмы, как Escherichia coli. Предпочтительно используют систему хозяин-вектор, подходящую для каждого способа. Соответствующая векторная система может быть выбрана в зависимости от упомянутых выше клеток-хозяев. Был клонирован ген тромбомодулина, используемый в технологии генной рекомбинации. Были описаны примеры получения тромбомодулина с помощью таких технологий генной рекомбинации. Кроме того, известен способ очистки тромбомодулина для получения очищенного продукта [патентная публикация (Kokai) JP Nos. 64-6219 (1989) A, 2-255699 (1990) A, 5-213998 (1993) A, 5-310787 (1993) A, и 7-155176 (1995) A; и J. Biol. Chem., 264: 10351-10353 (1989)]. Соответственно, тромбомодулин, используемый в настоящем изобретении, может быть получен способами, описанными в упомянутых выше сообщениях, или эквивалентными им способами. Например, в патентной публикации (Kokai) JP No. 64-6219 (1989) A описывается Escherichia coli K-12 штамм DH5 (ATCC регистрационный № 67283), содержащий плазмиду pSV2TMJ2, содержащую ДНК, кодирующую полноразмерный тромбомодулин. Также может быть использован штамм (Escherichia coli DH5/pSV2TM J2) (FERM BP-5570), где упомянутый выше штамм был повторно депонирован первым National Institute of Bioscience и Human-Technology (теперь National Institute of Advanced Industrial Science and Technology, an Independent Administrative Institution under the Ministry of Economy, Trade and Industry (AIST)). Тромбомодулин по настоящему изобретению может быть получен известным генно-инженерным способом, используя ДНК, кодирующую полноразмерный тромбомодулин, в качестве исходного материала.
Тромбомодулин, используемый в настоящем изобретении, может быть получен общепринятым известным способом, или способом, эквивалентным ему. Например, тромбомодулин по настоящему изобретению может быть получен со ссылкой на упомянутый выше способ по Yamamoto et al. [патентная публикация (Kokai) JP No. 64-6219 A (1989)] или способ, описанный в JP Патентной публикации (Kokai) No. 5-213998 A (1993). Другими словами, ген тромбомодулина, полученный от человека, может подвергаться генной инженерии для преобразования его в ДНК, кодирующую аминокислотную последовательность, показанную в SEQ ID NO: 9, например, и при необходимости она может быть дополнительно модифицирована. Для такой модификации, кодон, кодирующий аминокислоту в положении 473 аминокислотной последовательности, представленной в SEQ ID NO: 9 (в частности, нуклеотид в положении 1418), подвергают сайт-направленному мутагенезу, в соответствии со способом, описанным в Method in Enzymology, 100: 468 (1983), Academic Press, таким образом, чтобы получить ДНК, кодирующую аминокислотную последовательность, например, показанную в SEQ ID NO: 11 (которая главным образом состоит из нуклеотидной последовательности, показанной в SEQ ID NO: 12). С помощью синтетической ДНК, используемой для мутации, которая имеет нуклеотидную последовательность, показанную в SEQ ID NO: 13, нуклеотид T в положении 1418 последовательности SEQ ID NO: 10 может быть преобразован в нуклеотид С таким образом, чтобы получить, например, мутантную ДНК.
Полученную таким образом ДНК вставляют, например, в ооциты китайского хомячка (CHO) для получения трансформированных клеток. Такие клетки затем отбирают соответствующим образом. Отобранные клетки затем культивируют для получения культурального раствора и тромбомодулин может быть получен из этого культурального раствора, путем очистки в соответствии с известным способом. Как указано выше, предпочтительно, чтобы упомянутые выше клетки-хозяева были трансфектированы ДНК (SEQ ID NO: 10), кодирующей аминокислотную последовательность, показанную в SEQ ID NO: 9. Способ получения тромбомодулина, используемого в настоящем изобретении, не ограничен упомянутым выше способом. Например, такой тромбомодулин может быть экстрагирован и очищен также из мочи, крови, других видов жидкостей организма, и т.д. В других случаях, тромбомодулин также может быть экстрагирован и очищен из тканей, продуцирующих тромбомодулин, культурального раствора таких тканей, и т.д. В дальнейшем, при необходимости, тромбомодулин может быть дополнительно подвергнут расщеплению с использованием протеаз.
В тех случаях, когда тромбомодулин по настоящему изобретению получают упомянутым выше способом клеточных культур, могут быть случаи, когда N-концевая аминокислота становится диверсифицированной в результате посттрансляционной модификации белка. Например, аминокислоты в положениях 17, 18, 19 или 22 последовательности SEQ ID NO: 9 в некоторых случаях могут становиться N-концевыми. Кроме того, также могут быть случаи, когда N-концевую аминокислоту модифицируют таким образом, что глутаминовая кислота в положении 22 могла быть преобразована в пироглутаминовую кислоту. Предпочтительно, чтобы аминокислота в положении 17 или 19 стала N-концевой. Более предпочтительно, чтобы аминокислота в положении 19 стала N-концевой. Более того, в другом предпочтительном варианте осуществления, аминокислота в положении 17 может стать N-концевой. В отношении упомянутой выше модификации, диверсификации и т.д. тоже самое распространяется на SEQ ID NO: 11.
Кроме того, в тех случаях, когда тромбомодулин по настоящему изобретению получают с использованием ДНК, имеющей нуклеотидную последовательность, показанную в SEQ ID NO: 10, C-концевая аминокислота может стать диверсифицированной, и в результате в некоторых случаях может быть получен пептид, который короче исходного пептида на один аминокислотный остаток. То есть могут быть случаи, в которых аминокислота в положении 515 становится С-концевой, и она дополнительно амидирована таким образом, чтобы С-концевая аминокислота могла быть модифицирована. В результате, может быть получен пептид с диверсифицированной N-концевой аминокислотой и С-концевой аминокислотой или их смесь. Аминокислота в положении 515 может предпочтительно становиться С-концевой. Более того, в другом предпочтительном варианте осуществления, аминокислота в положении 516 может становиться С-концевой. В отношении упомянутой выше модификации, диверсификации и т.д. то же самое распространяется на ДНК, имеющую нуклеотидную последовательность, показанную в SEQ ID NO: 12.
Тромбомодулин, полученный упомянутым выше способом, может представлять собой пептидную смесь с диверсифицированным N-концом и C-концом. Конкретным примером является смесь пептидов, состоящих из последовательности, состоящей из аминокислот в положениях с 19 по 516, в положениях с 19 по 515, в положениях с 17 по 516, или в положениях с 17 по 515 аминокислотной последовательности, представленной в SEQ ID NO: 9.
Далее, выделение и очистку тромбомодулина из полученного таким образом культурального супернатанта или культурального продукта, можно проводить известным способом [под редакцией Takeichi Horio, Tanpakushitsu/Koso no Kiso Jikken Ho (Basic Experimental Methods for Proteins and Enzymes)]. Например, предпочтительно использовать или адсорбционную хроматографию, или ионообменную хроматографию, в которых используется взаимодействие между хроматографическим носителем, на котором была иммобилизована функциональная группа, имеющая заряд, противоположный заряду тромбомодулина, и тромбомодулин. Другим предпочтительным примером является аффинная хроматография, в которой используется специфическая аффинность к тромбомодулину. Предпочтительные примеры адсорбента, используемого в настоящем изобретении, включают в себя тромбин, который является лигандом тромбомодулина, и антитело к тромбомодулину. В качестве такого антитела, может быть использовано антитело к тромбомодулину, которое имеет соответствующие свойства или распознает соответствующие эпитопы. Например, могут быть использованы антитела, описанные в патентной публикации (Kokoku) JP No. 5-42920 B (1993), патентной публикации (Kokai) JP Nos. 64-45398 A (1989) и 6-205692 A (1994), и т.д. Другие примеры включают в себя гель-проникающую хроматографию и ультрафильтрацию, в которых используется молекулярный размер тромбомодулина. Дополнительно, другие примеры включают в себя гидрофобную хроматографию, в которой используется гидрофобная связь между хроматографическим носителем, на котором была иммобилизована гидрофобная группа, и гидрофобной частью тромбомодулина. Более того, может быть использован гидроксиапатит в качестве носителя в адсорбционной хроматографии. Такая методика описана, например, в патентной публикации (Kokai) JP No. 9-110900 A (1997). Эти средства в зависимости от ситуации могут быть использованы в сочетании. Степень очистки может быть выбрана в зависимости от целевого использования и подобного. Желательно очищать тромбомодулин, пока результаты электрофореза, и предпочтительно SDS-PAGE, не будут получены в виде одной полосы или пока результаты гель-фильтрации ВЭЖХ или ВЭЖХ с обращенной фазой выделенного и очищенного продукта не будут получены в виде одного пика. Само собой разумеется, что когда используют многочисленные типы тромбомодулинов, предпочтительно получить полосу по существу только тромбомодулина. Таким образом, необязательно получать одну полосу.
Конкретным примером способа очистки, применяемого в настоящем изобретении, является способ очистки с использованием активности тромбомодулина в качестве индикатора. Например, применяется способ очистки [Gomi K. et al., Blood, 75: 1396-1399 (1990)], который предусматривает: грубую очистку культурального супернатанта или культурального продукта с помощью ионообменной колонки Q-Sepharose Fast Flow для извлечения фракции, обладающей активностью тромбомодулина; затем ее основную очистку с помощью аффинной колонки, которая представляет собой колонку DIP-тромбин-агароза (диизопропилфосфорилтромбин агарозу) для извлечения фракции, обладающей сильной тромбомодулирующей активностью; затем концентрирование извлеченной фракции; а затем концентрированную фракцию подвергают гель-фильтрации с получением активной фракции тромбомодулина в виде чистого продукта. Примером активности тромбомодулина, используемой в качестве индикатора, является активность стимуляции активации белка С под действием тромбина. Другой предпочтительный способ очистки будет описан ниже.
Выбирают подходящую ионообменную смолу, имеющую хорошие абсорбционные характеристики в отношении тромбомодулина, и затем с использованием этой смолы проводят очистку ионообменной хроматографией. В качестве особенно предпочтительного примера используют Q-Sepharose Fast Flow, которая была уравновешена 0,02 M Tris-HCl буфером (pH 7,4), содержащим 0,18 M NaCl. После соответствующего промывания, полученное в результате вещество элюируют 0,02 M Tris-HCl буфером (pH 7,4), содержащим 0,3 M NaCl, например, таким образом, чтобы получить тромбомодулин в виде грубо очищенного продукта.
Затем, например, вещество, обладающее специфической аффинностью к тромбомодулину, может быть иммобилизовано на смоле, и затем можно проводить аффинную хроматографию. Предпочтительные примеры включают в себя колонку DIP-тромбин-агароза и колонку с моноклональным антителом к тромбомодулину. Например, в случае колонки DIP-тромбин-агароза, колонку предварительно уравновешивали 20 мМ Tris-HCl буфером (pH 7,4), содержащим 100 мМ NaCl и 0,5 мМ хлорид кальция, и затем в нее загружают упомянутый выше грубо очищенный продукт, с последующим соответствующим промыванием. После этого, полученное в результате вещество элюируют 20 мМ Tris-HCl буфером (pH 7,4), содержащим 1,0 M NaCl и 0,5 мМ хлорид кальция, например, таким образом, чтобы получить тромбомодулин в виде очищенного продукта. С другой стороны, в случае колонки с моноклональным антителом к тромбомодулину, например, применяют следующий способ. Моноклональное тело к тромбомодулину, растворенное в 0,1 M NaHCO3 буфере, содержащем 0,5 M NaCl (pH 8,3), приводят в контакт с сефарозой 4 FF (GE Health Care Biosciences), которая предварительно была активирована под действием CNBr, таким образом, чтобы моноклональное антитело к тромбомодулину соединилось с сефарозой 4FF. После этого, колонку, заполненную смолой, в которой моноклональное антитело к тромбомодулину соединилось с сефарозой 4FF, предварительно уравновешивали 20 мМ фосфатным буфером (pH 7,3), содержащим, например, 0,3 M NaCl. После соответствующего промывания, полученное в результате вещество элюируют 100 мМ глицин-HCl буфером, содержащим 0,3 M NaCl (pH 3,0). Элюант можно нейтрализовать подходящим буфером таким образом, чтобы элюант мог быть получен в виде очищенного продукта.
После этого, pH очищенного продукта доводят до pH 3,5, и затем загружают в катионобменник, и предпочтительно на SP-Sepharose FF (GE Health Care Biosciences), которая является сильным катионобменником, которая была уравновешена 100 мМ глицин-HCl буфером (pH 3,5), содержащим 0,3 M NaCl. Катионобменник промывают тем же, приведенным выше, буфером для получения неадсорбировавшейся фракции. Полученную фракцию нейтрализуют подходящим буфером для получения высокоочищенного продукта. Такой продукт предпочтительно концентрируют ультрафильтрацией.
Далее, обмен буфера предпочтительно проводят гель-фильтрацией. Например, высокоочищенный продукт, концентрированный ультрафильтрацией, загружают на колонку Sephacryl S-300 или колонку S-200, уравновешенную 20 мМ фосфатным буфером (pH 7,3), содержащим 50 мМ NaCl, а затем прогоняют и фракционируют, используя 20 мМ фосфатный буфер (pH 7,3), содержащий 50 мМ NaCl. После этого, подтверждают активность стимуляции активации белка С под действием тромбина, и активную фракцию затем извлекают, таким образом, чтобы получить буфер-обменный высокоочищенный продукт. Для усиления безопасности, полученный таким образом очищенный продукт предпочтительно фильтруют, используя подходящий фильтр для удаления вирусов, такой как Planova 15N (Asahi Kasei Medical Co., Ltd.). После этого продукт может быть концентрирован ультрафильтрацией до интересующей концентрации. Наконец, этот продукт предпочтительно фильтруют через фильтр для асептической фильтрации.
Полученный таким образом тромбомодулин может быть переработан в лиофилизированный препарат в соответствии с обычным способом. То есть существует способ, который предусматривает замораживание раствора, содержащего тромбомодулин, и, при необходимости, последующую сушку замороженного продукта сублимацией воды под пониженным давлением.
В настоящем изобретении активность плазменного АТ может представлять собой либо активность АТ в плазме, полученной из артерии, либо активность АТ в плазме, полученной из вены. Предпочтительной является активность АТ в плазме, полученной из вены. Однако также существуют случаи, в которых предпочтительной является активность АТ в плазме, полученной из артерии. В основном, термин «активность плазменного АТ» используется для обозначения активности АТ в плазме, полученной из вены. Тип способа для измерения активности АТ конкретно не ограничен. Например, такую активность АТ можно измерить способом синтетического хромогенного субстрата, получая активность АТ исходя из остаточного количества активированного фактора X.
В частности, образец крови собирают в пробирку для сбора крови, содержащую цитрат натрия. После этого, образец крови быстро центрифугируют для извлечения плазмы. После этого к плазме добавляют гепарин для образования комплекса АТ-гепарин, и затем к комплексу АТ-гепарин добавляют избыточное количество активированного фактора Х. Активированный фактор Х образует комплекс АТ-гепарин-активированный фактор Х, в зависимости от количества комплекса АТ-гепарин в образце, таким образом, чтобы он инактивировался. После завершения реакции образования упомянутого выше комплекса, добавляют раствор субстрата в реакционный раствор, и п-нитроанилин, высвободившийся в результате реакции, затем подвергают колориметрическому анализу, для измерения активности оставшегося активированного фактора X. Активность оставшегося активированного фактора Х отражает активность АТ, содержащегося в образце. Таким образом, активность АТ может быть получена, отдельно, на основе полученной калибровочной кривой. Автоматический анализатор, BM1650 (производимый JEOL Ltd.) может быть использован в колориметрическом анализе п-нитроанилина. Далее, калибровочная кривая может быть получена с использованием стандартных веществ.
Ежедневная доза средства для лечения и/или улучшения состояния при ДВС, содержащего в качестве активного ингредиента тромбомодулин, в соответствии с настоящим изобретением, отличается в зависимости от возраста и массы тела пациентов, степени развития симптомов, пути введения и т.д. В основном, верхний предел количества тромбомодулина предпочтительно составляет 5 мг/кг или менее, более предпочтительно 2 мг/кг или менее, еще более предпочтительно 1 мг/кг или менее, и особенно предпочтительно 0,8 мг/кг или менее. Нижний предел количества тромбомодулина предпочтительно составляет 0,005 мг/кг или более, более предпочтительно 0,01 мг/кг или более, еще более предпочтительно 0,02 мг/кг или более, и особенно предпочтительно 0,05 мг/кг или более.
Это средство применяют однократно или разделено на несколько приемов в день. Относительно интервалов введения, это средство можно вводить каждый день. Однако его также можно предпочтительно вводить один раз от 2 до 14 дней, более предпочтительно один раз от 3 до 10 дней и еще более предпочтительно один раз от 4 до 7 дней.
В частности, в случае внутривенного введения, это средство предпочтительно вводят один раз в день. Однако интервалы введения этим не ограничены. С другой стороны, в случае подкожного введения, это средство предпочтительно вводят один раз в день или один раз в неделю. Также возможно корректировать такие интервалы введения в зависимости от применяемой дозы.
Средство для лечения и/или улучшения состояния при ДВС, содержащее в качестве активного ингредиента тромбомодулин, в соответствии с настоящим изобретением, можно вводить пациентам обычно используемыми способами введения, а именно парентеральными способами, такими как внутривенное введение, внутримышечное введение или подкожное введение. Из них внутримышечное введение и подкожное введение являются особенно предпочтительными тем, что концентрация этого средства в крови поддерживается в течение длительного периода времени, и, следовательно, эти интервалы введения могут быть увеличены. Кроме того, в другом предпочтительном варианте осуществления предпочтительно использовать внутривенное введение. Более того, пероральное введение, интраректальное введение, интраназальное введение, сублингвальное введение и подобные также являются возможными.
В случае внутривенного введения применяют способ введения желаемого количества этого средства за один раз или путем внутривенного капельного введения.
Такой способ введения желаемого количества средства за один раз является предпочтительным, исходя из короткого времени введения. В тех случаях, когда средство вводят за один раз, время, необходимое для введения с помощью инъекционного шприца, как правило, варьирует. Время, необходимое для введения, зависит от количества вводимой жидкости. Однако предпочтительно 2 минуты или менее, более предпочтительно 1 минута или менее, и еще более предпочтительно 30 секунд или менее. Нижний предел времени конкретно не ограничен. Предпочтительно 1 секунда или более, более предпочтительно 5 секунд или более, и еще более предпочтительно 10 секунд или более. Доза, вводимая этим способом, конкретно не ограничена при условии, что она находится в пределах упомянутой выше предпочтительной дозы.
Внутривенное капельное введение является предпочтительным тем, что концентрацию тромбомодулина в крови легко поддерживать на постоянном уровне. Доза, вводимая внутривенно капельно, конкретно не ограничена при условии, что она находится в пределах упомянутой выше предпочтительной дозы. Верхний предел дозы в день предпочтительно составляет 1 мг/кг или менее, более предпочтительно 0,5 мг/кг или менее, еще более предпочтительно 0,1 мг/кг или менее, особенно предпочтительно 0,08 мг/кг или менее, и наиболее предпочтительно 0,06 мг/кг или менее. Нижний предел дозы в день предпочтительно составляет 0,005 мг/кг или более, более предпочтительно 0,01 мг/кг или более, еще более предпочтительно 0,02 мг/кг или более, и особенно предпочтительно 0,04 мг/кг или более.
В случае внутривенного капельного введения, верхний предел времени введения предпочтительно составляет 4 часа или менее, более предпочтительно 3 часа или менее, еще более предпочтительно 2 часа или менее, особенно предпочтительно 1 час или менее, и наиболее предпочтительно 30 минут или менее. Нижний предел времени введения предпочтительно составляет 10 минут или более, более предпочтительно 15 минут или более, и еще более предпочтительно 20 минут или более.
В тех случаях, когда средство по настоящему изобретению перерабатывают в лиофилизированный препарат, этот препарат может быть растворен в воде, например, дистиллированной воде (или воде для инъекций), или физиологическом растворе, когда он используется, и затем его можно вводить пациентам.
В тех случаях, когда жидкий препарат получен из средства по настоящему изобретению, эффективное количество тромбомодулина может быть смешано с носителем, который может быть использован в качестве средства, для получения жидкого препарата. В частности, тромбомодулин в количестве, эффективном для лечения упомянутых выше заболеваний, смешивают с подходящим количеством известного носителя с тем, чтобы получить препарат, подходящий для эффективного введения пациентам. Например, загустители, такие как сахароза, глицерин, метилцеллюлоза или карбоксиметилцеллюлоза, регуляторы рН, например, различные виды неорганических солей, и другие, добавляют в качестве вспомогательных веществ к тромбомодулину для получения жидкого препарата.
[Объяснение перечня последовательностей]
SEQ ID NO: 1 аминокислотная последовательность, кодируемая геном, использованным для получения TME456
SEQ ID NO: 2 нуклеотидная последовательность, кодирующая аминокислотную последовательность, показанную в SEQ ID NO: 1
SEQ ID NO: 3 аминокислотная последовательность, кодируемая геном, использованным для получения TME456M
SEQ ID NO: 4 нуклеотидная последовательность, кодирующая аминокислотную последовательность, показанную в SEQ ID NO: 3
SEQ ID NO: 5 аминокислотная последовательность, кодируемая геном, использованным для получения TMD12
SEQ ID NO: 6 нуклеотидная последовательность, кодирующая аминокислотную последовательность, показанную в SEQ ID NO: 5
SEQ ID NO: 7 аминокислотная последовательность, кодируемая геном, использованным для получения TMD12M
SEQ ID NO: 8 нуклеотидная последовательность, кодирующая аминокислотную последовательность, показанную в SEQ ID NO: 7
SEQ ID NO: 9 аминокислотная последовательность, кодируемая геном, использованным для получения TMD123
SEQ ID NO: 10 нуклеотидная последовательность, кодирующая аминокислотную последовательность, показанную в SEQ ID NO: 9
SEQ ID NO: 11 аминокислотная последовательность, кодируемая геном, использованным для получения TMD123M
SEQ ID NO: 12 нуклеотидная последовательность, кодирующая аминокислотную последовательность, показанную в SEQ ID NO: 11
SEQ ID NO: 13 синтетическая ДНК для мутации, которую используют при проведении сайт-направленного мутагенеза
ПРИМЕРЫ
Настоящее изобретение будет описано подробно в следующих примерах и испытательных примерах. Однако эти примеры не предназначены для ограничения объема настоящего изобретения.
Тромбомодулин по настоящему изобретению, использованный в следующих испытательных примерах, был получен в соответствии с упомянутым выше способом по Yamamoto et al. (этот способ описан в JP патентной публикации (Kokai) No. 64-6219 (1989) A). Примеры получения тромбомодулина по настоящему изобретению будут описаны ниже.
[Пример получения 1]
<Получение тромбомодулина>
Высокоочищенный продукт получали упомянутым выше способом. В частности, ооциты китайского хомячка (CHO) были трансфектированы ДНК (которая, в частности, состоит из нуклеотидной последовательности, показанной в SEQ ID NO: 10), кодирующей аминокислотную последовательность, показанную в SEQ ID NO: 9. После этого, активную фракцию извлекали из культурального раствора трансформированных клеток упомянутым выше обычным способом очистки, используя 20 мМ фосфатный буфер (pH 7,3), содержащий 50 мМ NaCl, для получения высокоочищенного продукта. После этого его подвергают ультрафильтрации, с получением раствора тромбомодулина с концентрацией 11,2 мг/мл (в дальнейшем иногда сокращенно TMD123).
<Получение дополнительного раствора>
480 г аргинин гидрохлорида (производимого фирмой Ajinomoto Co., Inc.) взвешивали, а затем помещали в 10 л сосуд из нержавеющей стали. После этого, туда добавляют 5 л воды для инъекций, так, чтобы вещество там могло раствориться. 1 M раствор гидроксида натрия дополнительно добавляли к этому раствору, чтобы довести значение рН до pH 7,3.
<Получение и добавление раствора средства>
Общее количество упомянутого выше дополнительного раствора помещали в 20 л сосуд из нержавеющей стали, и туда добавляли 2398 мл полученного раствора TMD123 (соответствующего 26,88 г растворимого белка тромбомодулина; добавлено 12% избыточное количество), с последующим смешиванием и перемешиванием. В смешанный раствор дополнительно добавляли воду для инъекций до общего количества 12 л. Полученный раствор непрерывно смешивали и перемешивали. Полученный таким образом раствор средства подвергали фильтрационной стерилизации, используя фильтр, с диаметром пор 0,22 мкм (MCGL10S, производимый фирмой Millipore). После этого 1 мл каждого фильтрата заполняли флакон, и этот флакон затем наполовину закрывали резиновой пробкой.
<Лиофилизация>
Процесс сублимационной сушки проводили в порядке лиофизации → наполнения азотом → закрытия резиновой пробкой → закрытия крышки путем ее завинчивания, в описанных ниже условиях, таким образом, чтобы получить препарат, содержащий TMD123, который содержит 2 мг растворимого тромбомодулина и 40 мг аргинин гидрохлорида в одном флаконе.
<Условия лиофилизации>
Предварительное охлаждение (от комнатной температуры до 15°C за 15 минут) → основное охлаждение (от 15°C до -45°C за 2 часа) → выдерживание (при -45°C в течение 2 часов) → Вакуумная стадия (при -45°C в течение 18 часов) → повышение температуры (с -45°C до 25°C за 20 часов) → выдерживание (при 25°C в течение 15 часов) → повышение температуры (с 25°C до 45°C за 1 час) → выдерживание (при 45°C в течение 5 часов) → комнатная температура (от 45°C до 25°C за 2 часа) → восстановление давления и заполнение азотом (до -100 мм рт. ст.) → полное закрытие пробкой → закрытие крышкой, путем ее завинчивания
[Пример получения 2]
Ооциты китайского хомячка (СНО) трансфектировали ДНК (которая в особенности состоит из нуклеотидной последовательности, показанной в SEQ ID NO: 12), кодирующей аминокислотную последовательность, показанную в SEQ ID NO: 11. После этого раствор тромбомодулина (в дальнейшем иногда сокращенно TMD123M) был получен из культурального раствора трансформированных клеток упомянутым выше обычным способом очистки. После этого лиофилизированный препарат TMD123M был получен тем же способом, который описан выше.
[Пример получения 3]
Ооциты китайского хомячка (СНО) трансфектировали ДНК (которая в особенности состоит из нуклеотидной последовательности, показанной в SEQ ID NO: 2), кодирующей аминокислотную последовательность, показанную в SEQ ID NO: 1. После этого тромбомодулин (в дальнейшем иногда сокращенно TME456) был получен из культурального раствора трансформированных клеток упомянутым выше обычным способом очистки. После этого лиофилизированный препарат TME456 был получен тем же способом, который описан выше.
[Пример получения 4]
Ооциты китайского хомячка (СНО) трансфектировали ДНК (которая в особенности состоит из нуклеотидной последовательности, показанной в SEQ ID NO: 4), кодирующей аминокислотную последовательность, показанную в SEQ ID NO: 3. После этого тромбомодулин (в дальнейшем иногда сокращенно TME456M) был получен из культурального раствора трансформированных клеток упомянутым выше обычным способом очистки. После этого лиофилизированный препарат TME456M был получен тем же способом, который описан выше.
[Пример получения 5]
Ооциты китайского хомячка (СНО) трансфектировали ДНК (которая в особенности состоит из нуклеотидной последовательности, показанной в SEQ ID NO: 6), кодирующей аминокислотную последовательность, показанную в SEQ ID NO: 5. После этого тромбомодулин (в дальнейшем иногда сокращенно TMD12) был получен из культурального раствора трансформированных клеток упомянутым выше обычным способом очистки. После этого лиофилизированный препарат TMD12 был получен тем же способом, который описан выше.
[Пример получения 6]
Ооциты китайского хомячка (СНО) трансфектировали ДНК (которая в особенности состоит из нуклеотидной последовательности, показанной в SEQ ID NO: 8), кодирующей аминокислотную последовательность, показанную в SEQ ID NO: 7. После этого тромбомодулин (в дальнейшем иногда сокращенно TMD12M) был получен из культурального раствора трансформированных клеток упомянутым выше обычным способом очистки. После этого лиофилизированный препарат TMD12M был получен тем же способом, который описан выше.
[Испытательный пример 1]
Средство для лечения и/или улучшения состояния при ДВС по настоящему изобретению полученное описанным ниже способом, вводят пациентам с ДВС, как описано ниже, у которых был диагностирован ДВС на основе диагностических критериев ДВС Министерства здравоохранения и социального обеспечения (Health and Welfare Ministry), у которых симптомы ДВС были индуцированы в результате малигнизации гемопоэтических клеток или инфекционного заболевания. Исследовали коэффициент выживаемости пациентов на 28-й день после начала введения.
Следует отметить, что препараты АТ не вводили во время введения средства для лечения и/или улучшения состояния при ДВС по настоящему изобретению.
<Пример получения композиции 1>
Физиологический раствор добавляли к лиофилизированному препарату TMD123, полученного в соответствии с Примером получения 1, для приготовления 0,5 мг/мл тестируемого раствора.
<Измерение активности АТ>
В день введения средства для лечения и/или улучшения состояния при ДВС по настоящему изобретению, у исследуемого пациента брали 4,5 мл образца крови до введения средства, а затем помещали в пробирку для сбора крови, содержащую 0,5 мл 3,8% цитрата натрия. После этого их перемешивали друг с другом, переворачивая пробирку вверх дном, а затем смесь центрифугировали. Таким образом извлекали плазму, а затем криоконсервировали. В дальнейшем, в плазму добавляли гепарин для получения комплекса АТ-гепарин. Далее к комплексу АТ-гепарин добавляли избыточное количество фактора Xa. После реакции образования комплекса, к нему добавляли раствор субстрата (Testzyme S ATIII (производимый Chromogenix)), и п-нитроанилин, высвобождающийся в результате реакции, затем подвергали колориметрическому анализу путем определения поглощения при 410 нм, для измерения остаточной активности фактора Xa (инструкция по применению приложена с Testzyme S ATIII). Поскольку остаточная активность фактора Xa отражает активность AT, содержащегося в образце, активность АТ получали отдельно, используя полученную калибровочную кривую. При колориметрии п-нитроанилина использовали автоматический анализатор BM1650 (производимый фирмой JEOL Ltd.). Кроме того, в качестве нормальной плазмы для получения такой АТ активности использовали препарат нормальной плазмы “Daiichi” (Daiichi Kagaku Co., Ltd.).
<Доза и способ введения >
Что касается исследуемых пациентов с ДВС, полученный тестируемый раствор, который получили в упомянутом выше примере получения композиции, добавляли в количестве 0,12 мл/кг (соответствующем 0,06 мг/кг) в физиологический раствор до общего количества 100 мл. Полученный таким образом физиологический раствор вводили один раз в день в течение 30 минут внутривенным капельным путем. Такое введение продолжали в течение 6 дней.
<Результаты>
Тестируемый раствор вводили упомянутым выше способом. После этого, результат исследовали на 28-й день после начала введения. В результате, было обнаружено, что коэффициент выживания группы пациентов, с активностью АТ между 50% или более и менее 70% составил 64,3%, тогда как коэффициент выживания группы пациентов с активностью АТ 70% или более составил 80%. С другой стороны, было обнаружено, что коэффициент выживания в группе пациентов с активностью АТ менее 50% составил 92,3%, включая только 1 летальный исход. Таким образом, группа пациентов с активностью АТ менее 50% демонстрировала больший коэффициент выживания, чем в двух приведенных выше группах пациентов. Эти результаты показаны в Таблице.
Более того, среди прочих, у пациентов с активностью АТ 40% или менее (5 случаев) коэффициент выживания составил 100%.
[Испытательный пример 2]
Кроличье антитело к АТ крысы (20 мг/кг) вводили в хвостовую вену каждому самцу крыс Sprague-Dawley (масса тела: от 180 до 240 г), для снижения активности плазменного АТ у крыс до менее 60%. Через час после введения антитела, крыс подвергали анестезии фенобарбиталом, и тканевой фактор (полученный от кролика тромбопластин: 90 мг/кг) непрерывно вводили в хвостовую вену крысы в течение 1 часа. Непосредственно перед введением тканевого фактора, от 0,1 до 10 мг/кг тромбомодулинов в различных примерах получения по настоящему изобретению быстро вводили в хвостовую вену с противоположной стороны. После завершения введения тканевого фактора, из брюшной аорты каждой крысы брали кровь. После этого измеряли число тромбоцитов, величину фибриногена или активность АТ для изучения действия каждого тромбомодулина для лечения и/или улучшения состояния при ДВС, тем самым подтверждая технический результат настоящего изобретения.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Используя средство, содержащее тромбомодулин, по настоящему изобретению, можно эффективно лечить и/или ослаблять симптомы ДВС у пациентов, у которых активность плазменного АТ составляет 50% или менее, предпочтительно без сочетания с AT.
Реферат
Изобретение относится к способам получения терапевтически эффективного средства для лечения и/или улучшения состояния при диссеминированном внутрисосудистом свертывании крови (ДВС), и касается способов лечения и/или улучшения состояния при ДВС у пациентов, активность антитромбина в плазме которых составляет 40% или менее. Сущность изобретения заключается в том, что используется тромбомодулин, полученный трансфекцией клеток-хозяев с помощью ДНК, кодирующей аминокислотную последовательность SEQ ID NO:9 или 11. 9 н. и 1 з.п. ф-лы, 1 табл.
Формула
диссеминированном внутрисосудистом свертывании крови, содержащее в качестве активного ингредиента тромбомодулин, которое вводят пациентам, страдающим таким диссеминированным внутрисосудистым свертыванием крови, у которых активность антитромбина в плазме составляет 40% или менее, где указанный тромбомодулин представляет собой пептид, полученный из клеток-трансформантов, полученных трансфекцией клеток-хозяев с помощью ДНК, кодирующей аминокислотную последовательность, как показано в SEQ ID NO:9 или 11.
Документы, цитированные в отчёте о поиске
Комбинация тромболитически активных белков и антикоагулянтов
Патенты аналоги
Комбинация тромболитически активных белков и антикоагулянтов

Комментарии