Комбинация тромболитически активных белков и антикоагулянтов - RU2166326C2
Код документа: RU2166326C2
Чертежи






Описание
Данное изобретение относится к композициям и способам лечения больных с острым окклюзивным заболеванием сосудов.
Эти способы отличаются тем, что вводится антикоагулянтное средство, которое не является гепарином, путем внутривенной инъекции ударной дозы вместо продолжительного внутривенного вливания в комбинации с тромболитически активным белком, который можно давать путем внутривенного введения ударной дозы и/или внутривенного вливания.
Предпосылки создания изобретения и
прототипы
Сердечно-сосудистые заболевания такие, как инфаркт миокарда, приступ стенокардии, периферическая артериальная окклюзия, легочная эмболия, тромбоз глубоких вен и другие тромбозные
заболевания кровеносных сосудов, являются главными причинами заболеваемости и смертности. Вышеназванные заболевания вызываются образованием тотального или субтотального закупоривающего тромба в
кровеносном сосуде, который мешает поступлению достаточного кровоснабжения в ткани. Тромб состоит из агрегатов клеток крови, таких как тромбоциты, эритроциты и лейкоциты, стабилизированных фибриновой
сеткой.
Современные терапевтические подходы при этих тромбозных сосудистых заболеваниях включают лизис существующего тромба и предупреждение рецидивного тромбообразования, приводящего к повторной окклюзии вновь открытого сосуда. Как было показано, тромболитическая терапия острого инфаркта миокарда заметно улучшает естественное течение острого инфаркта миокарда с примерно 30% снижением смертности (GISSI: Lancet 1986; 1: 871-874; ISIS-2: Lancet 1988; 2: 349-360; AIMS: Lancet 1988; 1: 545-549; Wilcox et al. Lancet 1988: 2: 525-539; ISAM: N.Engl. J.Med. 1986; 314: 1465-1471). Данные недавно завершенного испытания GUSTO (Global Utilization of Streptokinase and Tissue-type plasminogen activator for Occuded coronary arteries - Использование стрептокиназы и тканевого активатора плазминогена для лечения окклюзии коронарных артерий во всем мире) показало, что т-АП с ускоренным действием, назначаемый с внутривенным введением гепарина обеспечивал улучшение выживания по сравнению с ранее используемыми курсами тромболитиков (GUSTO: N.Engl. J.Med. 1993; 329: 673-682). Более важно то, что это исследование подтвердило гипотезу, что более быстрое и полное восстановление коронарного потока через имеющую отношение к инфаркту артерию давало в результате улучшенную работу желудочков и более низкую смертность среди больных с инфарктом миокарда (GUSTO; N.Engl. J.Med. 1993; 329: 1615-1622).
Однако последние данные наводят на мысль, что современная стратегия восстановления кровообращения не реализует максимального потенциала снижения смертности и сохранения вентрикулярной функции (Lincoff and Topol, Circulation 1993; 87; 1792-1805). Лизис тромбов существенно ухудшается у многих больных из-за недостаточно ранней или быстрой реканализации, неполной проходимости с потоком 3 степени при лизисе тромбов или критического остаточного стеноза, отсутствия восстановления тока крови через ткань миокарда, несмотря на эпикардиальную артериальную проходимость, перемежающейся коронарной проходимости, последующей повторной окклюзии или нарушения восстановленной проходимости. Поэтому по ходу дела предпринимались усилия по достижению оптимального восстановления кровотока. Эти усилия направлены большей частью на увеличение скорости и качества лизиса тромбов.
Фармакологические подходы по увеличению скорости и повышению качества лизиса тромбов могут быть основаны на свойствах самого тромболитического средства и вспомогательных средств, т.е. других веществ, вводимых одновременно с тромболитическим средством.
При применении рекомбинантного тканевого активатора плазминогена (рт-А11), как было показано, достигаются более высокие степени (скорости) восстановления проходимости сосудов, дающие в результате низкую смертность, когда вводится общая доза, равная 100 мг; в режиме ускоренного введения, т. е. в течение 90 минут, чем при общепринятом утвержденном 3-часовом режиме (ISIS-3: Lancet 1992; 339; 753-770; GUSTO: N.Engl. J.Med. 1993; 329: 673-682). Как было показано, помимо модификации режима введения рт-А11, очень высокие скорости восстановления кровотока достигаются после двукратного быстрого введения нагрузочной дозы при применении нового тромболитически активного белка, такого как новый рекомбинантный активатор плазминогена ВМ 06.022 (также обозначаемого как рАП), описанного в патенте США N 5223256 и включенного здесь в виде ссылки (Bode et al. Circulation 1993; 88 (suppl. I): 1-292, abstract 1562).
Проблема повторной закупорки, связанной с инфарктом артерии, после успешного восстановления кровотока, как было установлено, ассоциируется с существенными уровнями заболеваемости и смертности (Ohman et al. Circulation 1990; 82: 781-791). Поэтому фармакологическая стратегия нацелена на снижение повторных окклюзий и поддержание проходимости инфарктной артерии. Так как патогенез повторной окклюзии связан большей частью, как было показано, с активацией тромбоцитов и системы свертывания после введения тромболитических средств, предпринимаются попытки фармакологически подавить агрегацию тромбоцитов и коагуляцию. Поэтому обычно рекомендуется применение аспирина, противотромбоцитного средства, и гепарина, противосвертывающего средства, в сочетании с тромболитическими средствами при лечении острого инфаркта миокарда (Popma and Topol, Ann.Int.Med. 1991; 115: 34-44).
Однако эффективность аспирина и гепарина ограничены. Это связано с их механизмом действия. Аспирин подавляет только один метаболический путь активации тромбоцитов (путем подавления циклооксигеназы). Действие гепарина зависит от наличия антитромбина III. Ограниченная эффективность гепарина связана также с присутствием ингибиторов в плазме и его ограниченным доступом к связанному со сгустком тромбину. Поэтому существует большой интерес к новым противотромбоцитным средствам, таким как антагонисты гликопротеиновых IIb/IIIa рецепторов (например, антитела, пептиды или низкомолекулярные химические соединения) и новым антикоагулянтам (пептидные и синтетические прямые ингибиторы тромбина и другие компоненты системы свертывания, такие, как ангибиторы фактора Xa, IXa, VIIa, тканевой фактор и т.д., или имитаторы эндогенных ингибиторов системы свертывания, такие как активированный белок C или тромбомодулин).
Недавно начались клинические испытания по оценке пригодности комбинации т-АП с химерными 7Е3 антителами, которые связываются с гликопротеиновыми IIb/IIa рецепторами (Kleiman et al., J.Am.Coll.Cardiol. 1993; 22: 381-389). Уже проведено несколько клинических испытаний по изучению действия комбинации тромболитического средства с новыми прямыми ингибиторами системы свертывания. Комбинация т-АП с ускоренным действием и гирудина (рекомбинантного белка, который прямо подавляет связанный со сгустком тромбин) давала в результате предотвращение повторной окклюзии и высокие скорости растворения тромбов с восстановлением проходимости III степени (Cannon et al., J.Am.Coll. Cardiol. 1993; 21: 136A and Neuhaus et al., Circulation 1993; 88 (suppl. I): 1-292, abstract 1563). Гирудиноподобный белок гирулог комбинировали с вливанием стрептокиназы; исследование показало, что лизис сгустка происходил более быстро после введения стрептокиназы вместе с гирулогом (Lidon et al., J. Am. Coll. Cardiol. 1993; 21: 419A).
Так как применение т-АП ассоциируется с высокой степенью повторной окклюзии (10-20%) после лизиса тромба, несмотря на применение аспирина или гепарина (Neuhaus et al., J. Am.Coll. Cardiol. 1989; 14: 1566-1569; Cheseboro et al. , Circulation 1987; 76: 142-154; Neuhaus et al., J. Am. Coll. Cardiol. 1988; 12: 581-587; Califf et al. Circulation 1991; 83: 1543-1556; Neuhaus et al. , J. Am. Coll. Cardiol. 1992; 19: 885-891), необходимо введение новых вспомогательных средств, гирудина и гирулога, в виде продолжительного вливания в течение 36, 48 или 96 часов. Этот продолжительный срок вливания означает, что необходимы огромные количества рекомбинантного белка (=гирудина) или синтетического пептида (=гирулога): 532 или 546 мг гирудина или 1008 мг гирулога, что рассчитано путем умножения дозы (мг/кг/ч) на средний вес тела человека (70 кг) и на продолжительность вливания, описанного в вышеупомянутых рефератах. Большие количества белка или синтетического пептида дорогостоящи, что в свою очередь приводит к высокой стоимости лечения, и их введение неблагоприятно с медицинской точки зрения, так как высокая цена антикоагулянтов препятствует их широкому применению. Кроме того, применение вливания увеличивает стоимость, так как метод требует использования механизмов для вливания, контроля эффективности антикоагулянтов и медицинского персонала для регулировки вливания. Эти препятствия ограничивают широту использования и применения гирудина и, тем самым, многие больные не извлекают пользы от их преимуществ.
Объединенные результаты широких испытаний GISSI-2 (Lancet 1990; 336: 65-71) и ISIS-2 (Lancet 1988; 2: 349-360) показали "значительно увеличенное число случаев кровоизлияний в мозг и больших нецеребральных кровотечений в связи с добавлением гепарина к курсу тромболитиков/аспирина", что очень неблагоприятно с медицинской точки зрения (Lincoff and Topol, Circulation 1993; 87: 1792-1805). Так как предыдущий клинический опыт применения гирудина показал, что спонтанные кровоизлияния происходили после введения гирудина, т-АП и аспирина, и что имело место увеличение кровотечения в месте катетеризации (Neuhaus et al. Circulation 1993; 88 (suppl. I): 1-292, abstract 1563), по-видимому не было снижения риска кровотечения при замене вливания гепарина на вливание гирудина. Экспериментальная оценка действия комбинации гирудина с тромболитически активным белком всегда производилась при вливании гирудина. Примерами являются сообщения по применению т-АП плюс гирудина (Haskel et al. Circulation 1991; 83: 1048-1056), стрептокиназы плюс гирудина (Rigel et al. , Circ. Res. 1993; 72: 1091-1102) и ВМ 06.022 плюс гирудина (Martin et al. , Int. J. Hematol. 1992; 56: 143-153). Все эти экспериментальные исследования показали, что вливание гирудина превосходит вливание гепарина по улучшению коронарного кровотока после восстановления кровообращения. Введение гепарина в виде однократной в/в инъекции ударной дозы плюс тромболитическое средство ВМ 06.022 было эффективнее вливания гепарина вместе с ВM 06.022 (Martin et al., J.Am. Coll.Cardiol. 1993; 22: 914-920).
Клинический опыт показал, что повторная окклюзия происходила после успешного восстановления кровотока до выписки больного из госпиталя на 7-21 день после восстановления кровообращения с максимумом случаев в течение первых нескольких дней после лизиса тромба (Ohman et al. Circulation 1990; 82: 781-791). Это наблюдение объясняет, почему сильная антикоагуляция должна быть продолжена в течение нескольких дней после тромболитического лечения.
Фармакокинетический анализ показал, что гирудин имеет короткий период полураспада, равный 10-15 минутам у собак (Biomed. Biochem. Acta 1987; 46: 237-244 и Folia Haematol. 1988; 115: 70-74) и 9-50 минутам у людей (Thromb Haemost. 1984; 52: 160-163).
Экспериментальные, клинические данные и фармакокинетические показатели, обсужденные выше, наводят на мысль, что необходимо применять антикоагулянт путем продолжительного в/в вливания для надежного достижения соответствующих уровней в плазме для антикоагуляции при лечении острых сосудистых заболеваний. Современная клиническая оценка гирудина как нового антикоагулянта в комбинации с тромболитически активными белками следует этой аргументации.
Несмотря на эти указания, все же существует необходимость снизить количество белка, пептида или химического вещества, используемого при тромболитическом лечении, потребность упростить введение и необходимость снижения риска кровотечений путем ограничения активности и антикоагулянтной эффективности лекарства до оптимума. Этот оптимум сочетает желание максимальной продолжительности эффекта улучшения степени коронарного кровотока и минимальной длительности нежелательных побочных эффектов, таких как небольшие и сильные кровотечения и кровоизлияния в мозг.
Краткое изложение изобретения
Данное изобретение представляет фармацевтические композиции и способы лечения больного с тромбозным заболеванием. По этому изобретению
фармацевтически эффективные композиции и способы лечения больного с тромбозным заболеванием отличаются введением путем быстрой (нагрузочной) в/в инъекции вместо продолжительного в/в вливания
сильнодействующего и эффективного антикоагулянтного средства, которое не является гепарином, в сочетании с тромболитически активным белком, который может вводиться путем быстрой (ударной) в/в инъекции
и/или в/в вливания.
Этот метод пригоден благодаря тому, что он снижает необходимое количество антикоагулянта без потери желаемого фармакологического эффекта - усиления восстановления кровотока и предупреждения повторных окклюзий. С тем самым наиболее неожиданно, что при этом снижается риск кровотечений, т.е. при этом методе улучшается безопасность лечения. Более низкая стоимость (возможная благодаря меньшему количеству белка) лечения и улучшенное отношение отрицательного побочного действия/успешности делает возможным широкое использование этого способа, дающего в результате снижение смертности. Кроме того, этот способ упрощает введение нового антикоагулянта, давая больше удобств, но также обеспечивает возможность более частого и более эффективного лечения больных, сохраняя тем самым многие жизни.
Подробное изложение сущности изобретения
Данное изобретение относится к терапевтическим или профилактическим композициям и способам лечения
или предупреждения тромбозных заболеваний. Более конкретно, данное изобретение относится к фармацевтически эффективным композициям и способам лечения или профилактики тромбозных заболеваний,
отличающихся совместным введением антикоагулянтного средства, другого, а не гепарина, даваемого путем в/в быстрой инъекции ударной дозы вместо продолжительного в/в вливания и тромболитически активного
белка, даваемого путем в/в инъекции ударной дозы и/или в/в вливания.
Данное изобретение представляет композиции и способы лечения больных с тромбозными заболеваниями, которые дают преимущества по снижению количества новых антикоагулянтных средств, но с сохранением желаемого фармакологического эффекта, снижению стоимости терапии, повышению удобства введения нового антикоагулянтного лекарственного препарата и, наиболее важно, снижению риска кровотечения. Все эти преимущества будут в значительной степени способствовать более широкому использованию лизиса тромбов, что поможет спасти многие жизни.
Тромбозные заболевания в значении по данному изобретению включают острый инфаркт миокарда, приступ (стенокардии), периферийную артериальную окклюзию, легочную эмболию, тромбоз глубоких вен и другие тромбозные заболевания кровеносных сосудов, при которых существует риск повторной окклюзии или рецидивного образования тромбов после успешного лизиса тромбов.
Преимущества этого изобретения очевидны. Удобное введение негепаринового антикоагулянта будет способствовать более широкому использованию даже на догоспитальной стадии и даст возможность более частого и более эффективного лечения пациентов и, тем самым, сохранения многих жизней. Более важно, что ограничение введения негепаринового антикоагулянта, например, гирудина, только в/в инъекцией ударной дозы вместо первоначальной инъекции ударной дозы плюс продолжительного в/в вливания в течение нескольких часов, приводит к большей безопасности для больного путем снижения риска кровотечения. Сниженный риск кровотечения является следствием более короткой продолжительности подавления системы свертывания, более быстрой нормализации системы свертывания и меньшего влияния на время кровотечения. Как можно видеть из результатов, представленных в рабочем примере, время частично активированных тромбопластин (ВЧАТ), которое является мерой, присущей части системы свертывания, через 2 часа после введения тромболитически активного белка (= 3 часа + 10 минут после в/в инъекции ударной дозы нового антикоагулянтного гирудина) возвращается примерно к уровням до лечения, тогда как ВЧАТ все еще достаточно продолжительно в группе с продолжительным внутривенным вливанием антикоагулянта. Это указывает на ограниченную продолжительность антикоагулянтного эффекта после в/в инъекции ударной дозы, который достаточно длителен для предотвращения повторной окклюзии и достаточно короткий, чтобы исключить кровотечение. Соответственно, время кровотечения, которое характеризует сильное клиническое кровотечение (Gimple et al. Circulation 1989; 80: 581-588), значительно ниже в группе с инъекцией ударной дозы нового антикоагулянта, чем в группе с продолжительным в/в вливанием антикоагуулянта.
Кроме того, как можно видеть в рабочем примере, при ограничении введения нового антикоагулянта только в/в инъекцией ударной дозы вместо в/в введения инъекции ударной дозы плюс продолжительного в/в вливания (ударная доза плюс вливание является предшествующей практикой, прототипом) сохранялся превосходящий эффект предупреждения рецидивирующей окклюзии с помощью применения новых антикоагулянтов, даваемых в виде в/в инъекции ударной дозы плюс вливания по сравнению с эффектом общепринятого вспомогательного лечения аспирином с гепарином, которое все еще ассоциируется с рецидивирующей окклюзией.
Другие антикоагулянты, отличные от гепарина, охватываемые данным изобретением, включают пептидные и синтетические прямые ингибиторы тромбина и ингибиторы других компонентов системы коагуляции, такие как ингибиторы факторов XIIIa, Xa, IXa, VIIa, тканевой фактор, фактор фон Виллебранда (гликопротеин 1b) и т.д., или имитаторы или рекомбинантные формы эндогенных ингибиторов системы коагуляции, например, тромбомодулин или активированный белок C.
Эти антикоагулянты предпочтительно являются белками, пептидами или низкомолекулярными химическими веществами, которые получают с помощью генной инженерии, путем выделения и очистки веществ из природных источников, путем синтеза пептидов, химической модификации или путем обычного химического синтеза.
Предпочтительными антикоагулянтами являются природные формы гирудина (Markwardt, Methods Enzymol 1970; vol. 19: 924-932 и Markwardt, Biomed. Biochem. Acta 1985; 44: 1007-1013), более конкретно, рекомбинантные формы гирудина, такие как дезсульфатогирудин (у которого отсутствует сульфат на тирозиновом остатке 63 природного гирудина, но который имеет ту же самую аминокислотную последовательность, что и природный гирудин) (вариант 1), GGp 39393 (Thromb Haemost 1989; 61: 77-80), или формы, которые отличаются от природного гирудина по аминокислотам 1 и 2, лейцину и треонину, такие как HBW 023 (Markwardt et al., Thromb. Res. 1988; 52: 393-400 и Rothing et aj., Hame-staseologie 1991; 11: 132-136). Дезсульфатогирудин может продуцироваться эукариотическими клетками, например, Saccharo-myces cerevisiae, или бактериальными клетками, например, Escherichia coli. Другие пригодные клеточные линии включают Bacillus Subtilis, почечные клетки хомячат, клетки насекомых и другие. Гирудин и дезсульфатогирудин состоят из единственной полипептидной цепи из 65 аминокислот с тремя дисульфидными мостиками, имеющими молекулярный вес, равный примерно 7000.
Данное изобретение также относится к модифицированным формам гирудина, таким как варианты гирудина с делецией или замещением, и к химерным или химически конъюгированным вариантам, например, ПЭГ-гирудину или фрагментам ПЭГ-гирудина. Данное изобретение также, в частности, относится к гирулогу и гирулогоподобным пептидам (Maraganore et al. Biochemistry 1990; 29: 7095-7101 и Bourdon et al., FEBS letters 1991; 294: 163-166).
Гирулог представляет собой синтетический пептидный тромбиновый ингибитор из 20 аминокислот (D-Phe-Pro-Arg-Pro-[Gly]4, соединенный с остатками 53-64 HV2 варианта гирудина).
Гирудин и гирулог, а также родственные пептидные формы, действуют путем прямого и специфического подавления тромбина. Данное изобретение также относится к синтетическим низкомолекулярным прямым тромбиновым ингибиторам, применяемым в качестве антикоагулянтов, таких как аргатробан (=MD-805 и MCl 9038) (Clarke et al. Circulation 1991; 83: 1510-1518), GYKI-14766 (=LY 294468) (Jackson et al., J. Pharm. Exp. Ther. 1992; 261: 546-552), DuP714 (Knabb et al. , Thromb Haemost. 1992, 67: 56-59) или другие пептиды, такие как бороаргинин (Kettner et al., J. Biol. Chem. 1990; 265: 18297-18298) или SDZ 217766 (Tapparelli and Metternich, Thromb Haemost. 1993; 69: 668, abstract 455). Другие прямые синтетические тромбиновые ингибиторы являются производными 3-амидинофенилаланина (Sturzebecher et al., Tromb. Haemost. 1993; 69: 1316, abstract 27773), или новый тромбиновый ингибитор "RTI" (Tschopp et al. , Thromb. Haemost. 1993, 69: 668, abstract 456) и другие синтетические прямые тромбиновые ингибиторы.
Предпочтительные антикоагулянты также включают природные и особенно рекомбинантные формы селективных плотно связывающих ингибиторов фактора Xa свертывания крови, такие как антистатин (Nutt et al. Arch. Biochem. Biophys. 1991; 285: 37-44) и природные и рекомбинантные формы медленных плотно связывающих ингибиторов, специфичных для фактора Xa, такие как антикоагулянтный пептид клещей (Waxman et al., Science, 1990; 248: 593-596) и другие пептидные ингибиторы фактора Xa. Фактор Xa может также подавляться DX 9065а, активным при пероральном приеме синтетическим антикоагулянтом со строением бензамидинового типа (Kim et al., Thromb Haemost. 1993; 69: 672, abstract 471) и другими синтетическими прямыми ингибиторами фактора Xa. В это изобретение также включены ингибиторы фактора IXa (например, Benedict et al., J. Clin, Invest. 1991; 88: 1760-1765), фактора XIIIa (например, Shebuski et al. Blood 1990; 75: 1455-1459), ингибиторы фактора VIIa (например, Meluch et al. , Thromb Haemost. 1993; 69: 887, abstract 1244), тканевого фактора (например, Ragni et al. Circulation 1993; 88 (suppl. I); 1-615, abstract 3309), гликопротеина 1b или фактора фон Виллебранда (например, Yao et al., Clinical Research 1993; 41: 228A) и другие ингибиторы компонентов системы свертывания. Другие антикоагулянты, применимые в этом изобретении являются имитаторами или рекомбинантными формами эндогенных ингибиторов системы свертывания, такими как рекомбинантный тромбомодулин (например, Gomi et al. Blood 1990; 75: 1396-1399), рекомбинантный ингибитор пути метаболизма тканевого фактора (например, Haskel et al., Circulation 1991; 84: 821-827), рекомбинантный активированный белок C (например, Gruber et al. Circulation 1990; 82: 578-585) и другие имитаторы эндогенных антикоагулянтов.
Антикоагулянты этого изобретения вводятся в дозах от 0,01 до 10 мг/кг в течение от 0,5 до 5 минут в виде внутривенной быстрой (ударной) инъекции перед или сразу после начала введения тромболитически активного белка. Гирудин, гирулог и родственные пептиды предпочтительно вводятся в дозах от 0,3 до 6 мг/кг в течение от 0,5 до 3 минут в виде внутривенной быстрой (ударной) инъекции перед или в течение 5 минут после начала введения тромболитически активного белка. Более конкретно, гирудин, гирулог и родственные пептиды вводятся в дозах, равных от 0,5 до 6 мг/кг в течение 1-2 минут в виде внутривенной быстрой инъекции перед введением тромболитически активного протеина. Пероральное введение вместо внутривенного быстрого введения может производиться в случае лекарственных форм химических веществ с низким молекулярным весом и пептидов в сочетании с системами доставки лекарственных веществ.
Тромболитически активными белками, применимыми в сочетании с антикоагулянтами в данном изобретении, являются средства, известные специалистам, такие как рекомбинантный тканевого типа активатор плазминогена, например, алтеплаз и силтеплаз и другие, такие как анистреплаз, стрептокиназа, урокиназа и про-урокиназа. Данное изобретение также относится к тромболитическим средствам, таким как рекомбинантный активатор плазминогена (рАП), ВМ 06.022, активатор плазминогена летучих мышей-вампиров (например, Mellott et al., Arterioscler Thrombos 2992; 12: 212-221), активатор плазминогена из слюны десмодуса (летучей мыши-вампира), АПСД (например, Witt et al. Blood 1992; 79: 1213-1217) и родственные формы и TNK варианты активатора плазминогена тканевого типа (например, Refino et al., Thromb Haemost. 1993; 69: 841, abstract 1074). Особенно предпочтительным является тромболитически активный белок ВМ 06.022, описанный выше. Этот белок является негликозилированным белком, состоящим из аминокислот 1-3 и 176-527 из человеческого т-АП дикого типа. Дополнительные тромболитически активные белки описаны в USP 4970159; EP-A-0207589; AU 61804/86; EP-A-0231624; EP-A-0289508; JP 63133988; EP-A-0234051; EP-A-0263172; EP-A-0241208; EP-A-0292009; EP-A-297066; EP-A-0302456; EP-A-0379890. Все можно использовать в этом изобретении, как может использоваться Е-6010 (Suzuki et al., J.Cardiovasc. Pharmacol. 1991; 17: 738-746), YM-g66 (Kawasaki et al., Japan J. Pharmacol. 1993; 63: 135-142) и SUN-9216 (Umemura et al., Stroke 1993; 24: 1077-1082). Дополнительные применимые тромболитически активные белки включают LY 210825 (=К2Р из клеток сирийских хомячков; Circulation 1990; 82: 930-940), FE3X и FE1X (=K1K2P из клеток яичников китайского хомячка. Blood 1988; 71: 216-219), FEKI (К2Р из клеток C127 мыши, J.Cardio - vasc. Pharmacol. 1990; 16: 197-209), варианты т-АП (Thromb Haemost. 1989; 62: 542), К2Р и D-K2P (Thromb Haemost 1989; 62: 393), MB-1018 (FK2K2P), Thromb Haemost. 1989; 62: 543), FK2P (FASEB J. 1989; 3: A1031, abstract 4791), IX (Circulation 1988; 78: 11-15, abstract 59), K1K2P (Thromb. Res. 1988; 50: 33-41), FK1K2P (J.Biol. Chem. 1988; 263: 1599-1602).
Дозы и режимы введения тромболитических средств включают те, которые приняты авторитетными специалистами-медиками, например, 100 мг алтеплаза или 1,5 миллиона Ед стрептокиназы. Доза и режим введения может меняться. Особенно предпочтительной является общая доза, равная 15-25 млн. единиц (Мед) рекомбинантного активатора плазминогена ВМ 06.022; главным образом, более предпочтителен режим 10 + 10 Мед ударной инъекции ВМ 06.022. Способом введения для тромболитических средств может быть внутривенная инъекция, разовая ударная или многократные быстрые инъекции или внутривенное вливание, или их комбинация. Особенно предпочтительным является двойное быстрое внутривенное введение ВМ 06.022 или других тромболитически активных белков. Когда используются тромболитически активные белки с более длинным периодом полувыведения, чем у т-АП (сравните WO 92/18157, который включен здесь в виде ссылки), то наиболее предпочтительно вводить эти белки путем двукратной быстрой инъекции. В основном временной интервал между инъекциями тромболитически активного белка может составлять 15-60 минут, более предпочтительно от 20 до 40 минут, наиболее предпочтительно, чтобы временной интервал составлял 30 минут.
Особенно предпочтительна комбинация гирудина в качестве нового, более сильнодействующего и эффективного антикоагулянта, отличного от гепарина, с быстрым внутривенным введением ВМ 06.022 в качестве тромболитически активного белка при описанных выше режимах дозирования. Также предпочтительна комбинация гирулога в качестве нового более сильнодействующего и эффективного антикоагулянта, отличного от гепарина, с быстрым внутривенным введением ВМ 06.022 в качестве тромболитически активного белка при режимах дозирования, описанных выше.
Антикоагулянты этого изобретения вводятся путем быстрой (ударной) внутривенной инъекции перед или вскоре после начала введения тромболитически активного белка. Временной интервал между инъекцией негепаринового антикоагулянта и тромболитичеcки активного белка может составлять от 1 до 30 минут, главным образом, 2-10 минут, и предпочтительно примерно 5 минут. Предпочтительно антикоагулянт вводится перед введением тромболитически активного белка. Если антикоагулянт вводится после начала введения тромболитически активного белка, временной интервал для введения антикоагулянта составляет предпочтительно 2-10 минут и, главным образом, примерно 5 минут после первого введения тромболитически активного белка.
За введением негепаринового антикоагулянта в виде единственной ударной внутривенной инъекции, через 1-2 часа может следовать стандартное лечение гепарином при лечении острого инфаркта миокарда, т.е. внутривенное вливание гепарина и позднее подкожное введение, или может следовать непосредственно подкожное введение гепарина.
Данный подход к введению негепаринового антикоагулянта включает введение антитромбоцитных средств, отличных от аспирина (ацетилсалициловой кислоты = АСК). Антикоагулянт, так же как и антитромбоцитные средства, клинически действует как противотромбозное средство, но отличается по способу своего действия, т.е. действие обоих (подавление коагуляции и подавление тромбоцитов) предотвращает образование тромба и повторную окклюзию. Противотромбоцитные средства, отличные от аспирина, даются в виде однократной внутривенной быстрой инъекции в сочетании с тромболитически активным белком, т.е. перед или в течение 30 минут после введения тромболитически активного белка и с возможным последующим введением аспирина через несколько дней вместо отсроченного или продолжительного введения нового более сильнодействующего и эффективного антитромбоцитного средства.
Новые более сильнодействующие и эффективные антитромбоцитные средства, отличные от гепарина, предпочтительно являются ингибиторами гликопротеиновых рецепторов IIa/IIIa на тромбоцитах, которые опосредуют агрегацию тромбоцитов. Такие ингибиторы тромбоцитных гликопротеиновых рецепторов IIb/IIIa (ГП IIb/IIIa) могут быть антителами, фрагментами антител, антителами человека или фрагментами антител человека к ГП IIb/IIIa рецепторам, пептидами или пептидомиметиками, действующими как антагонисты к ГП IIb/IIIa антагонисту и низкомолекулярными синтетическими новыми химическими веществами, подавляющими антагонисты ГП IIb/IIIa.
Ингибиторы рецепторов ГП IIb/IIIa являются, предпочтительно, моноклональными антителами 7Е3 или химерными антителами 7Е3 (фрагмент) к ГП IIb/IIIa (Tcheng et al. Circulation 1993, 88. (suppl. I): 1-506, abstract 2727), пептидными антагонистами ПГ IIb/IIIa - интегрилином (Tcheng et al. Circulation 1993, 88 (suppl. I): 1-595, abstract 3200) и пептидом МК-852 (Theroux et al. Circulation 1993, 88 (suppl. I): 1-201, abstract 1075), а также непептидным имитатором ГП IIb/IIIa, МК-383 (Peerlinck et al. Circulation 1993; 88: 1512-1517).
Дополнительные антагонисты рецепторов ГП IIb/IIIa включают Ro 43-5054 (J. Pharmacol. Exp. Ther. 1993; 264: 501-508), Ro 44-9883 (Thromb Haemostas 1993, 70: 817-821), BIBU 104 (Thromb Haemostas 1993; 69: 975, abstract 1557) и BIBU 52 (Thromb Haemostas 1993; 69: 1072, abstract 1887), SC 49992 (J.Pharmacol. Exp. Ther. 1993; 267: 1191-1197) и SC 54684 (Thromb Haemostas 1993; 69: 975, abstract 1558), DMP 728 (Circulation 1994; 80: 3-12), GR 144053 (Thromb Haemostas 1993; 69: 1071, abstract 1884), FR 144633 (Thromb Haemostas 1993; 69: 706, abstract 598), SKF-106760 (Nichols et al., представленный на Am. Soc. Pharmacol. Exp. Ther. Meeting, July 30-August 3, 1993, San Francisco, Ca, USA). Некоторые из этих ингибиторов могут даваться в виде однократной пероральной дозы вместо однократного внутривенного быстрого введения.
Данное изобретение включает также другие ингибиторы ГП IIb/IIIa конкретно здесь не упомянутые.
Лечение больного с тромбозным заболеванием комбинацией, композицией или способом по данному изобретению может включать сопутствующее использование дополнительных вспомогательных средств, таких как антитромбоцитные средства, например, аспирин и антикоагулянтные средства, например, гепарин или гепарин с низким молекулярным весом, или другие лекарственные препараты, например, бетаблокаторы, ингибиторы ферментов, превращающих ангиотензин, средства от повреждений при восстановлении кровотока и другие.
Предметом данного изобретения являются также фармакологические композиции, которые содержат тромболитически активный белок в соответствующем контейнере и антикоагулянт в отдельном контейнере для использования в соответствии с вышеупомянутыми режимами введения.
Доза тромболитически активного белка в указанном первом контейнере по существу зависит от терапевтической эффективности указанного белка для лечения пациентов с тромбозными заболеваниями. Например, белок рАП содержится в таком контейнере в количестве, равном 5-30 млн. ед (которое соответствует 8-36 мг белка). Также может быть возможно, что тромболитически активный белок представлен в двух или более отдельных контейнерах, которые дают возможность введения соответствующей дозы тромболитически активного белка в виде двух или более быстрых инъекций. Эти два контейнера могут содержать тромболитически активный белок в одинаковых или разных количествах, в зависимости от желаемого режима введения. В случае рПА каждый из двух контейнеров предпочтительно заключает эффективное количество, равное 10 млн. ед. Другие тромболитически активные белки, которые нужно вводить в высоких дозах, такие как т-АП, применяются в больших количествах, таких как, например, 50-150 мг. В первом контейнере препарат может быть представлен в форме раствора, готового для инъекции, или же в виде лиофилизата, который воспроизводится перед введением в соответствующий раствор, обычно водой для инъекций с получением желаемого инъекционного раствора. Лиофилизат, так же как и воспроизведенный раствор может содержать дополнительно фармацевтический носитель или вспомогательные вещества, которые применяются для получения изотонического раствора или для стабилизации или растворения белка в вышеуказанной фармацевтической композиции.
Фармацевтические упаковочные единицы, изготовленные по данному изобретению, включают соответствующую лекарственную форму для введения, которая содержит тромболитически активный белок, и соответствующую упаковку, которая содержит антикоагулянт. Два активных соединения, предпочтительно, присутствуют в упаковочной единице в двух разных контейнерах, например, в стеклянных ампулах. Однако в зависимости от типа активных соединений, может быть также возможно представить оба соединения в единственной дозированной форме. В случаях, когда негепариновый антикоагулянт должен вводиться в виде двукратных или многократных быстрых инъекций, фармацевтическая упаковка содержит два или более отдельных контейнеров, каждый из которых содержит соответствующее количество негепаринового антикоагулянта для соответствующей быстрой инъекции. Кроме того, фармацевтическая упаковка содержит инструкции, например, в форме упаковочного вкладыша-листовки, написанные для медикаментов, из которых следует, что введение терапевтически активного количества тромболитически активного белка преимущественно происходит в сочетании с быстрым введением антикоагулянта.
Фармацевтические упаковки могут дополнительно содержать отдельный контейнер для введения фармакологически эффективного количества гепарина. Таким образом, такие фармацевтические упаковки содержат в итоге три различных фармацевтических средства: во-первых, тромболитически активный белок, во-вторых, антикоагулянт и, в-третьих, гепарин. Такие упаковки особенно ценны в случаях скорой помощи, когда желательно иметь полный набор фармацевтических препаратов, которые необходимо применить для эффективного лечения тромбоэмболических состояний в соответствии с данным изобретением.
Введение антикоагулянта происходит до, одновременно или после введения тромболитически активного белка. Было обнаружено, что особенно благоприятно, когда тромболитически активный белок вводится в виде двукратных или многократных быстрых инъекций, что сочетается с очень ранней антикоагуляцией, т.е. введением антикоагулянта перед введением тромболитически активного белка. Кроме того, было обнаружено, что особенно благоприятно для предупреждения повторной окклюзии вновь открытых кровеносных сосудов, когда тромболитически активное соединение вводится в виде двукратных или многократных быстрых внутривенных инъекций в сочетании с очень ранней антикоагуляцией. Оказывается, что даже более благоприятно, когда гепарин вводится дополнительно, так что поддерживается достаточно высокая концентрация в сыворотке, особенно в то время, когда вводится тромболитически активный белок.
Подобная информация, относящаяся к способу применения, может быть дана в информационной листовке или в напечатанном виде на упаковке медицинского препарата, который может поставляться вместе с медицинскими препаратами, которые содержат тромболитически активные белки. С другой стороны фармацевтические упаковки, содержащие только соответствующие лекарственные формы для введения тромболитически активных белков могут содержать такую информацию, например, в виде листовок-вкладышей в упаковке, в которых упоминается о комбинированном введении вместе с антикоагулянтами по данному изобретению. И третьей альтернативой было бы создание фармацевтических упаковок, которые содержат тромболитически активный белок, антикоагулянт и соответствующую информацию о комбинированном применении обоих, например, обычную листовку-вкладыш в упаковке. Дополнительно упаковочные листовки-вкладыши могут содержать соответствующие указания по применению тромболитически активного белка, негепаринового антикоагулянта в сочетании с введением гепарина.
Соответствующие указания по применению вышеупомянутых фармацевтических средств существенны для коммерциализации таких фармацевтических упаковок, содержащих или тромболитически активный белок, не-антикоагулянт, или гепарин или их комбинацию. Коммерциализация соответствующих фармацевтических препаратов фармацевтическими компаниями становится возможной только, когда соответствующими органами здравоохранения, такими как FDA (Федеральное управление по контролю лекарственных средств и косметических препаратов) в США или Организации СРМР в Европе, предварительно доводится до конца утверждение таких фармацевтических препаратов и соответствующих режимов введения. Это включает, но не ограничивается ими, клинические испытания в соответствии с полностью утвержденными процедурами под наблюдением указанной фармацевтической компании, которая позднее намеревается коммерциализировать такие фармацевтические средства. Это также включает подачу соответствующей документации о результатах подобных клинических испытаний соответствующим органам здравоохранения для получения санкций на продажу. Санкции во многих случаях ограничиваются определенными протоколами администрации или режимами, которые должны быть включены в печатной форме в сопровождающую информационную листовку, написанную для медикаментов.
В качестве лекарственных форм для тромболитически активных белков или антикоагулянтов предпочтительны галеновые лекарственные формы, например, лиофилизаты или растворы в соответствующих контейнерах, в каких, например, как ампулы. Как правило, эти лекарственные формы содержат обычные фармацевтические вспомогательные вещества, которые годны для приготовления изотонических растворов, и могут также включать дополнительные стабилизирующие и солюбилизирующие средства. Таким же образом можно готовить лекарственные формы антикоагулянтов в виде растворов, готовых к применению, или в виде лиофилизатов, которые растворяют в воде перед использованием.
Другие аспекты этого изобретения будут ясны опытному специалисту, и нет необходимости их повтора здесь.
Должно быть понятно, что описание и примеры являются иллюстративными, но не ограничивают данное изобретение, и другие осуществления в рамках сущности и объема этого изобретения будут сами напрашиваться опытным специалистам.
Пример
Данный пример представляет фармакологические доказательства удивительного и превосходящего
эффекта фармацевтически эффективных композиций и способов лечения острых окклюзивных сосудистых заболеваний, описанных здесь. Модель на животных, используемая в этом примере, имитирует острый инфаркт
миокарда, вызванный острым образованием тромба коронарной артерии и дает возможность оценки риска повторной окклюзии после успешного лизиса тромба и риска кровотечения.
Взрослым гончим собакам каждого пола делали анестезию при помощи внутривенного введения раствора пентобарбитала (35 мг/кг веса тела), интубировали и переводили на искусственное дыхание. В бедренную и бронхиальную вены ставили катетеры для введения лекарства или отбора крови, соответственно. Артериальное давление крови измеряли постоянно по ходу правой бедренной артерии. Грудную клетку вскрывали слева, в пятом межреберном пространстве, и сердце приподнимали в перикардиальной сумке. Выделяли 2-см иссечение левой огибающей коронарной артерии и обрабатывали, как описано ранее (Martin et al., J. Cardiovasc. Pharmacol. 1991; 18: 111-119). Для непрерывного контроля потока крови использовали электромагнитный датчик потока. Давление крови, частоту сердечных сокращений и коронарный поток крови регистрировали непрерывно на полиграфе.
Тромбоз левой огибающей коронарной артерии производили следующим образом: регулируемый винт, пережимавший левую огибающую коронарную артерию, затягивали так, чтобы получить 90%-ное снижение гиперемичного кровотока в ответ на 20-секундную окклюзию коронарной артерии. Постоянный анодный ток в 150 мкА подавали на электрод в коронарной артерии, помещенный в просвет артерии и присоединенный к внутренней поверхности коронарной артерии, и поддерживали до тех пор, пока кровоток в левой огибающей коронарной артерии не снижался до уровня 0 мл/мин и не оставался на нем в течение по крайней мере 3 минут. Электрическая стимуляция производилась в течение по крайней мере 15 минут. Тромбу давали состариться в течение часа до того, как вводили тромболитически активный белок.
Тромболитически активным белком, использованным для лизиса тромба в этом примере, был ВМ 06.022, раскрытый в патенте США N 5223256. Специфическая активность ВМ 06.022, использованного в этом экспериментальном исследовании, составляла, 575000 Ед/мг. Использованным антикоагулянтом был рекомбинантный гирудин, продуцируемый Hansenula polymorpha (вариант BK-HV).
Вспомогательное лечение в группе для сравнения производили аспирином и гепарином. Аспирин давали в виде в/в быстрой инъекции в дозе 20 мг/кг через 45 минут после образования тромба, т.е. за 15 минут до введения тромболитически активного белка. Через 5 минут (т.е. через 50 минут после образования тромба - за 10 минут до введения тромболитически активного белка) вводили гепарин в виде в/в инъекции ударной дозы 120 Мед/кг с последующим немедленно за этим длительным в/в вливанием 80 Мед/кг/час гепарина.
Вспомогательное лечение в испытуемой группе проводили аспирином и гирудином BK-HV. Аспирин давали в виде в/в инъекции ударной дозы 20 мг/кг через 45 минут после образования тромба, т.е. за 15 минут до введения тромболитически активного белка. Через 5 минут после этого (т.е. через 50 минут после образования тромба = за 10 минут перед введением тромболитически активного белка) вводили гирудин BK-HV в виде в/в инъекции ударной дозы 6 мг/кг в течение 1 мин.
Контрольный эксперимент производили с вливанием аспирина и гирудина. Аспирин давали в виде в/в инъекции ударной дозы 20 мг/кг через 45 минут после образования тромба, т.е. за 15 минут до введения тромболитически активного белка. Через 15 минут после этого (т.е. через 50 минут после образования тромба = за 10 минут до введения тромболитически активного белка) вводили гирудин BK-HV в виде в/в инъекции ударной дозы 2 мг/кг с последующим продолжительным вливанием в/в 2 мг/кг/час гирудина BK-HV.
Все собаки получали двукратную инъекцию тромболитически активного белка ВМ 06.022. Первую в/в инъекцию ударной дозы производили через 60 минут после образования тромба. Вторую в/в инъекцию ударной дозы делали через 30 минут после первой, т.е. между двумя инъекциями ударных доз существовал временной интервал, равный 30 минутам. Каждая в/в нагрузочная инъекция производилась в дозе 140 кЕд/кг, т.е. общая доза ВМ 06.022 составляла 280 кЕд/кг.
Период наблюдения в эксперименте составил 3,5 часа после первой в/в инъекции ударной дозы ВМ 06.022. Измеряли средний и фазный коронарный кровоток. Время возобновления кровотока определяли как время от начала тромболитического лечения до момента восстановления коронарного кровотока до 33% контрольного уровня перед окклюзией. Циклические снижения кровотока определяли как число циклов восстановления кровотока с последующей полной повторной окклюзией (нулевой поток). Пробы плазмы получали до введения вспомогательных средств и повторно после начала тромболитического лечения для измерения времени частичной активации тромбопластин (ВЧАТ) по Lerrieu et al. (Rev. Haematol. 1957; 12: 199-210) при помощи тест-набора от Boeringer Mannheim, Маннгейм, Германия. Время кровотечения измеряли с помощью пружинного устройства (Simplate I от Organon Teknika Eppelhiem, Германия) на щечной слизистой оболочке внутренней поверхности губы собак. Надрез делали с помощью устройства Simplate I на слизистой оболочке внутренней части губы собак, и продолжительность кровотечения регистрировали по времени.
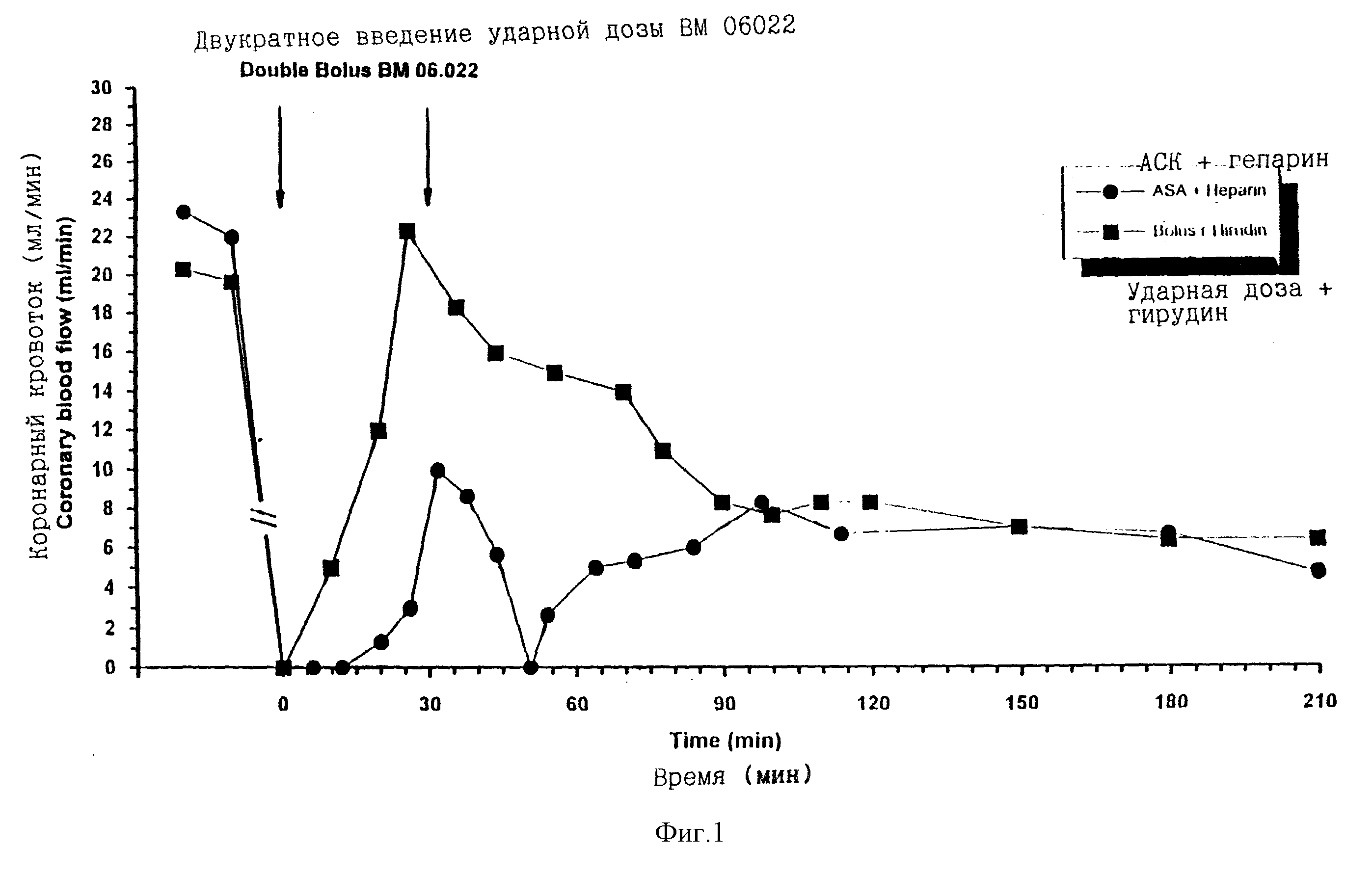
У всех собак в этих представительных экспериментах продемонстрировано восстановление кровообращения. При совместном лечении аспирином с ударным введением гирудина достигалось более быстрое восстановление кровотока, чем при приеме аспирина и вливании гепарина (таблица 1: 15 минут по сравнению с 25 минутами). Время до восстановления кровотока после введения ВМ 06.022 плюс аспирина и введения ударной дозы гирудина было сравнимо со сроком, наблюдаемым в контрольном эксперименте с введением ВМ 06.022 плюс аспирина и вливанием гирудина. Поэтому при введении единственной в/в инъекции ударной дозы гирудина достигалась та же самая степень быстрого восстановления кровотока, что и при вливании гирудина (15 минут и 14 минут, соответственно).
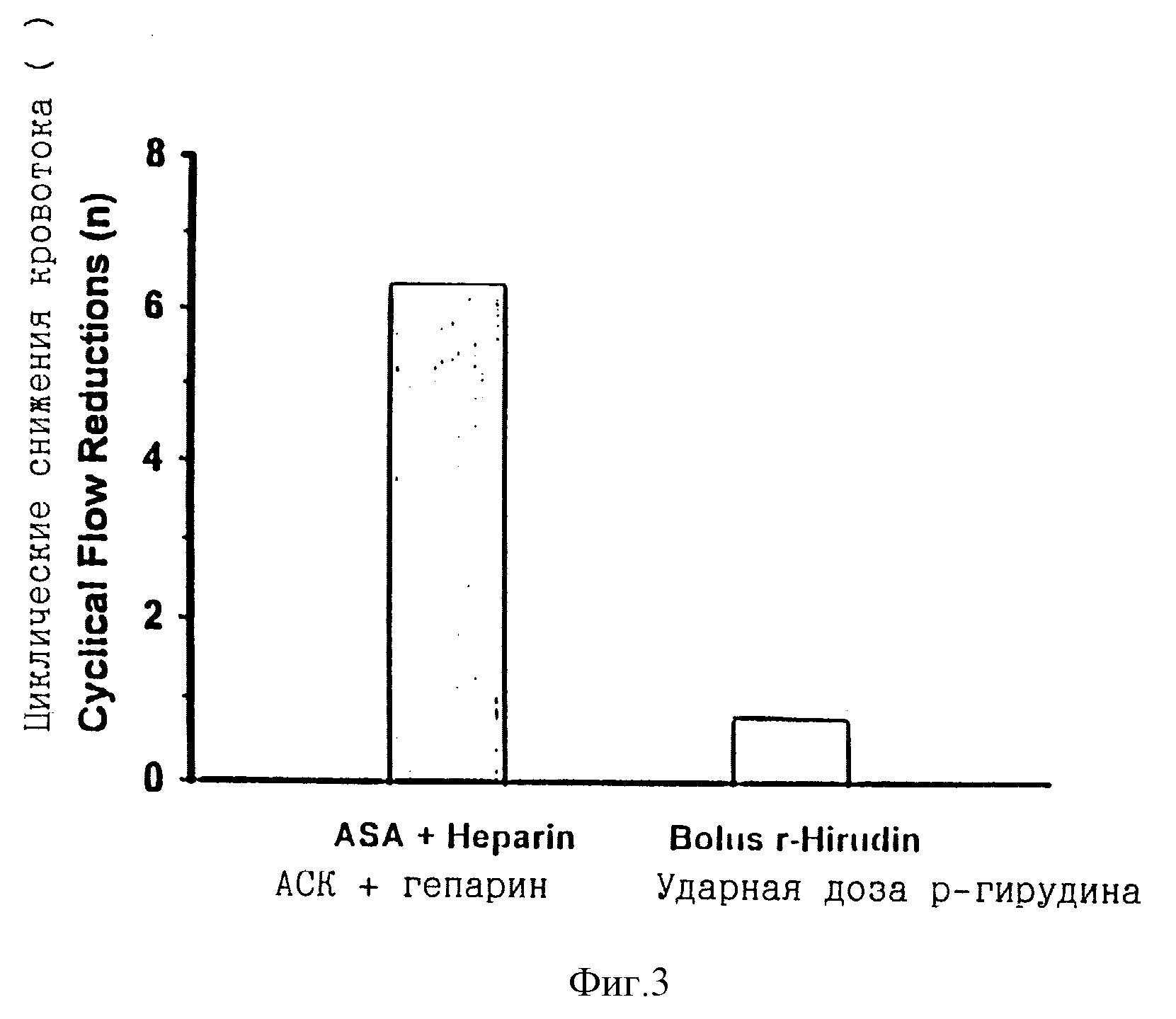
Кроме того, введение аспирина плюс в/в инъекции ударной дозы гирудина, было достаточно, чтобы прочно предотвратить повторную окклюзию, в противоположность с введением аспирина плюс вливанием гепарина, что можно видеть на фигуре 1, иллюстрирующей изменение коронарного кровотока со временем у этих двух групп. Действие аспирина плюс введения ударной дозы гирудина по предупреждению повторной окклюзии было эквивалентно действию аспирина плюс вливания гирудина (фигура 2). Соответственно введение аспирина плюс инъекция ударной дозы гирудина значительно снижали число циклических снижений кровотока по сравнению с введением аспирина плюс вливание гепарина (фигура 3, таблица 1) 6,3 до 0,6 циклических снижений кровотока. Введение ударной дозы гирудина было эквивалентно вливанию гирудина (таблица 1) по уменьшению циклических снижений кровотока.
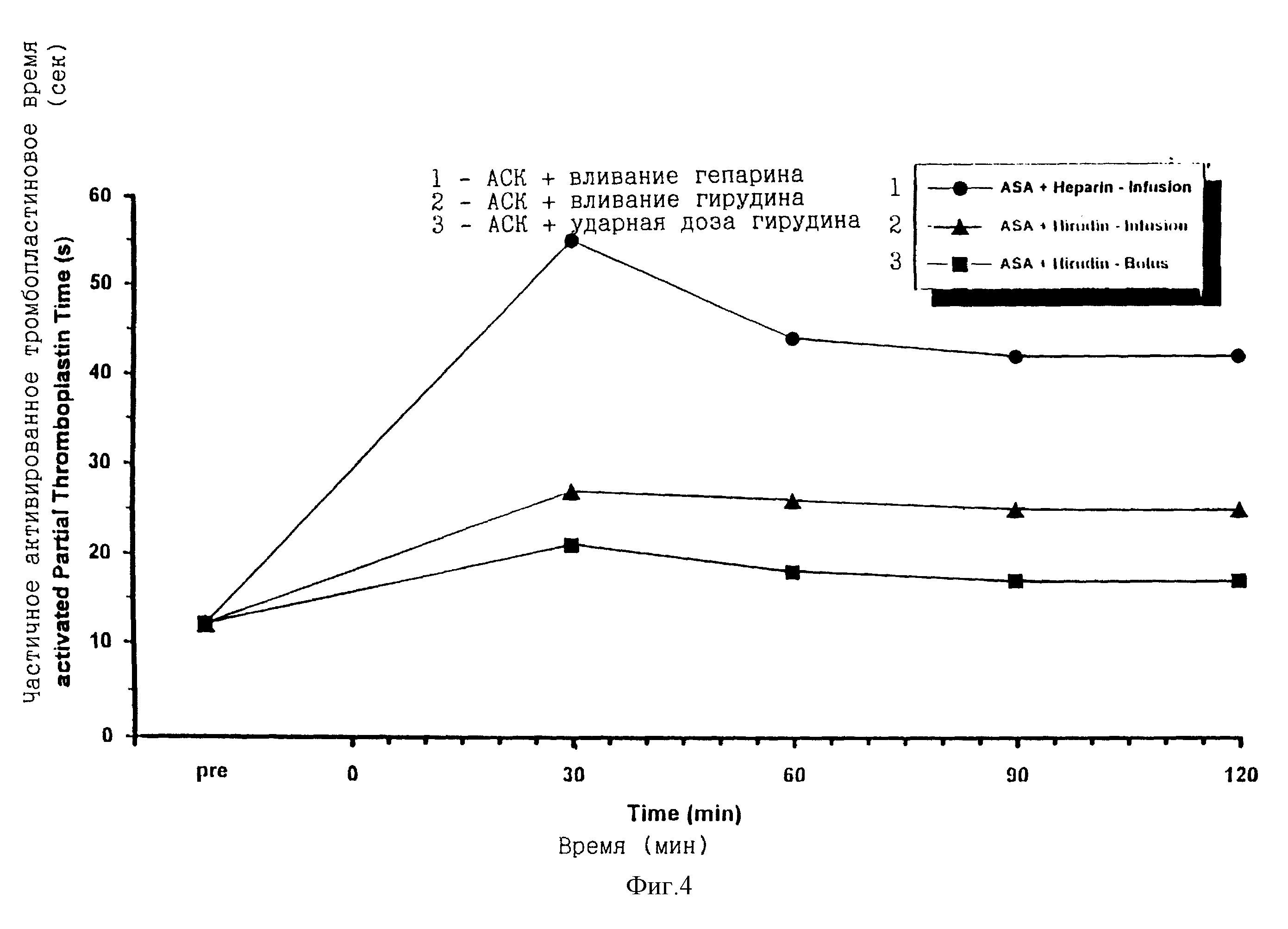
Введение гирудина или как инъекции ударной дозы или в виде вливания вызывало меньшее увеличение времени частично активированных тромбопластин (ВЧАТ), чем вливание гепарина (фигура 4). Когда эффекты введения ударной дозы гирудина на ВЧАТ сравниваются с действием вливания гирудина на ВЧАТ, становится очевидным, что ударное введение гирудина удлиняло ВЧАТ в меньшей степени, чем вливание гирудина (138 против 203% от значения до воздействия через 2 часа), что обнаружено в данных экспериментах (таблица 2). Сравнение эффектов на ВЧАТ после введения ударной дозы гирудина с опубликованными данными по комбинации ВМ 06.022 плюс вливание гирудина (Martin et al. Int. J. Haematol. 1992; 56: 143-153) подтверждает меньшее удлинение ВЧАТ после введения ударной дозы гирудина (таблица 2).
Как сообщалось, 90-минутный срок кровотечения является сильным предвестником (показателем) клинического кровотечения (Gimple et al. Circulation 1989; 80: 581-588). Данные эксперимента к удивлению показали, что время кровотечения после введения ударной дозы гирудина меньше удлинялось по сравнению со значением до введения, чем после вливания гепарина, а также после вливания гирудина (100 против 135 или 133%, соответственно; таблица 3 и фиг. 5). Различие в удлинении времени кровотечения между случаями введения ударной дозы гирудина и вливания гирудина также очевидно при сравнении с опубликованными сообщениями по комбинации ВМ 06.022 и вливания гирудина (Martin et al. Int. J. Haematol. 1992; 56: 143-153; таблица 3).
Результаты экспериментов, обсужденные здесь, и сравнение результатов с опубликованными данными демонстрируют, что с помощью одной в/в инъекции ударной дозы гирудина в сочетании с ВМ 06.022 можно достичь превосходящего эффекта по ускорению восстановления кровотока и предотвращению повторной окклюзии по сравнению с вливанием гепарина, сравнимы с результатами применения длительного вливания гирудина в сочетании с ВМ 06.022. Благоприятно то, что ограничение введения гирудина одним в/в введением ударной дозы вместо продолжительного в/в вливания приводит к большей терапевтической безопасности, что видно по меньшему увеличению и более быстрой нормализации ВЧАТ, а также по меньшему увеличению 90-минутного времени кровотечения. Кроме того, ограничение введения гирудина до одной в/в инъекции ударной дозы в этой постановке эксперимента (220-минутное вливание) помогало сэкономить 35% количество гирудина, необходимого для достижения описанных фармакологических эффектов в сравнении с вливанием гирудина.
Как показано выше, при однократной внутривенной инъекции ударной дозы в течение 1 мин 6 мг/кг гирудина собакам перед введением тромболитически активного белка достигается превосходящий эффект по сравнению с общепринятой антикоагулянтной терапией внутривенным вливанием гепарина по предупреждению повторной окклюзии после успешного лизиса тромба. Ранее показано, что для достижения превосходящего эффекта по отношению к контрольной группе с вливанием гепарина, гирудин вводится в виде сочетанной терапии при экспериментальных исследованиях на собаках с тромбозом коронарной артерии в дозах, равных 6 мг/кг/час (в комбинации с т-АП: Sitko et al. Circulation 1992; 85: 805-815) или в виде первоначального в/в введения ударной дозы 2 мг/кг плюс в/в вливания 2 мг/кг/час (в сочетании со стрептокиназой: Rigel et al., Circ. Res. 1993; 72: 1091-1102). При условии 3,5-часового периода наблюдения при экспериментальных исследованиях на собаках необходимы следующие количества гирудина при расчете на вес тела, равный для собаки 10 кг (см. табл. 4).
Это сравнение четко показывает, что даже во время короткого периода наблюдения, равного 3,5 часам, введение ударной дозы гирудина снижает количество гирудина с коэффициентом 1,5 или 3,5, соответственно. Это сниженное количество гирудина было достаточно для достижения фармакологического эффекта предотвращения повторной окклюзии, который превосходит эффект гепарина, но сравним с эффектом вливания гирудина. При клинических испытаниях с применением гирудина, как описано в обосновании и прототипах, процитированных выше, гирудин вливали в течение 36, 48 или 96 часов, что должно заметно повысить различия между количествами, необходимыми для первоначальной ударной инъекции и количеством, необходимым для длительного вливания.
Необходимо помнить, что абсолютная доза гирудина у людей ниже, чем доза для собак, из-за повышенной чувствительности (примерно с коэффициентом 10) человеческого тромбина к подавлению гирудином. Neuhaus et al. (Circulation 1993; 88 (suppl. I): 1-292, abstract 1563) вводил гирудин в виде первоначальной в/в инъекции ударной дозы, равной 0,6 мг/кг с последующим в/в длительным вливанием 0,15 мг/кг в течение 48 часов. Cannon et al. (J. Am. Coll. Cardiol. 1993; 21: 136A) вводили гирудин в виде первоначальной в/в инъекции ударной дозы 0,6 мг/кг с последующим в/в вливанием ударной дозы 0,2 мг/кг в течение 36 часов. Однако относительные различия между режимами (ударное введение гирудина по сравнению с ударным введением плюс вливанием гирудина) остается постоянным у каждого вида (животных).
Краткое описание рисунков
Фигура 1. Изменение со временем коронарного кровотока у собак с тромбозом коронарной артерии, получающих двукратную инъекцию
ударной дозы, равной 140 и 140 кЕд/кг, ВМ 06.022 с интервалом в 30 минут и сочетанное лечение ацетилсалициловой кислотой (АСК = аспирин; 20 мг/кг, в/в инъекция ударной дозы) и гепарином (120 Мед/кг
в/в, ударная инъекция с последующим продолжительным в/в вливанием 80 Мед/кг/час гепарина) или АСК (20 мг/кг, в/в, ударная инъекция) и единственной в/в инъекцией ударной дозы, равной 6 мг/кг гирудина.
Данные представлены средними значениями с n = 3 для каждой группы.
Фигура 2. Изменение со временем коронарного кровотока у собак с тромбозом коронарной артерии, получающих двукратную инъекцию ударной дозы, равной 140 и 140 кЕд/кг ВМ 06.022 с интервалом в 30 минут и сочетанное лечение ацетилсалициловой кислотой (АСК = аспирин 20 мг/кг, в/в инъекция ударной дозы) и гирудином (2 мг/кг, в/в, ударная доза с последующим длительным вливанием 2 мг/кг/час гирудина) или АСК (20 мг/кг, в/в инъекция ударной дозы) и гирудином (2 мг/кг, в/в инъекция ударной дозы с последующим длительным в/в вливанием 2 мг/кг/час гирудина) или АСК (20 мг/кг, в/в введение ударной дозы) и разовой в/в инъекцией ударной дозы 6 мг/кг гирудина. Данные представлены средними значениями с n = 1 или n = 3, соответственно по группам.
Фигура 3. Число циклических снижений кровотока, как показатель повторной окклюзии после успешного восстановления кровотока у собак с тромбозом коронарной артерии, получающих двукратную в/в инъекцию 140 и 140 кЕд/кг ВМ 06.022 с интервалом в 30 минут и сочетанное лечение ацетилсалициловой кислотой (АСК = аспирин; 20 мг/кг, в/в введение ударной дозы) и гепарином (120 Мед/кг, в/в введение ударной дозы) с последующим длительным в/в вливанием 80 Мед/кг/час) или АСК (20 мг/кг, в/в инъекция ударной дозы) и разовой в/в инъекцией ударной дозы гирудина 6 мг/кг. Данные представлены средними значениями с n = 3 на группу.
Фигура 4. Изменение времени частично активированных тромбопластин (ВЧАТ) как показатель безопасности у собак с тромбозом коронарной артерии, получающих двукратную инъекцию ударной дозы, равной 140 и 140 кЕд/кг ВМ 06.022 с интервалом 30 минут и сочетанное лечение ацетилсалициловой кислотой (АСК = аспирин; 20 мг/кг, в/в инъекция ударной дозы) и гепарином (120 Мед/кг/час в/в инъекцией ударной дозы; с последующим длительным в/в вливанием 80 Мед/кг/час) или ацетилсалициловой кислотой (АСК = аспирин; 20 мг/кг/, в/в инъекцией ударной дозы) и гирудином (20 мг/кг, в/в инъекция ударной дозы с последующим длительным в/в вливанием 2 мг/кг/час гирудина) или АСК (20 мг/кг, в/в инъекция ударной дозы) и разовой инъекцией ударной дозы 6 мг/кг гирудина. Данные представлены средними значениями с n = 3 или n = 1, соответственно по группам.
Фигура 5. Время кровотечения через 90 минут (как % от значения до лечения) как показатель безопасности у собак с тромбозом коронарной артерии, получающих двукратную инъекцию ударной дозы, равной 140 и 140 кЕд/кг ВМ 06.022 с интервалом 30 минут, и сочетанное лечение ацетилсалициловой кислотой (АСК = аспирин; 20 мг/кг в/в инъекция ударной дозы) и гепарином (120 Мед/кг в/в инъекция ударной дозы с последующим продолжительным в/в вливанием 80 Мед/кг/час гепарина или ацетилсалициловой кислотой (АСК = аспирин; 20 мг/кг в/в инъекцией ударной дозы) и гирудином (2 мг/кг в/в инъекция ударной дозы с последующим продолжительным вливанием 2 мг/кг/час гирудина) или АСК (20 мг/кг в/в инъекция ударной дозы) и единственной в/в инъекцией ударной дозы, равной 6 мг/кг, гирудина. Данные представлены средними значениями с n = 3 или n = 1, соответственно, по группам.
Реферат
Изобретение относится к области медицины. Изобретение характеризуется тем, что тромболитически активные белки комбинируются с антикоагулянтами, когда антикоагулянт не является гепарином. Антикоагулянт вводится в форме внутривенной инъекции ударной дозы, тогда как тромболитически активный белок может вводиться путем внутривенной инъекции ударной дозы или путем внутривенного вливания. Изобретение позволяет избежать повторной окклюзии на открытом сосуде, чем снижает течение острого инфаркта миокарда со снижением смертности на 30%. 2 с. и 8 з.п. ф-лы, 4 табл., 5 ил.

Комментарии