Рекомбинантный лектин омелы белой и его применение в качестве адьюванта - RU2664458C2
Код документа: RU2664458C2
Чертежи





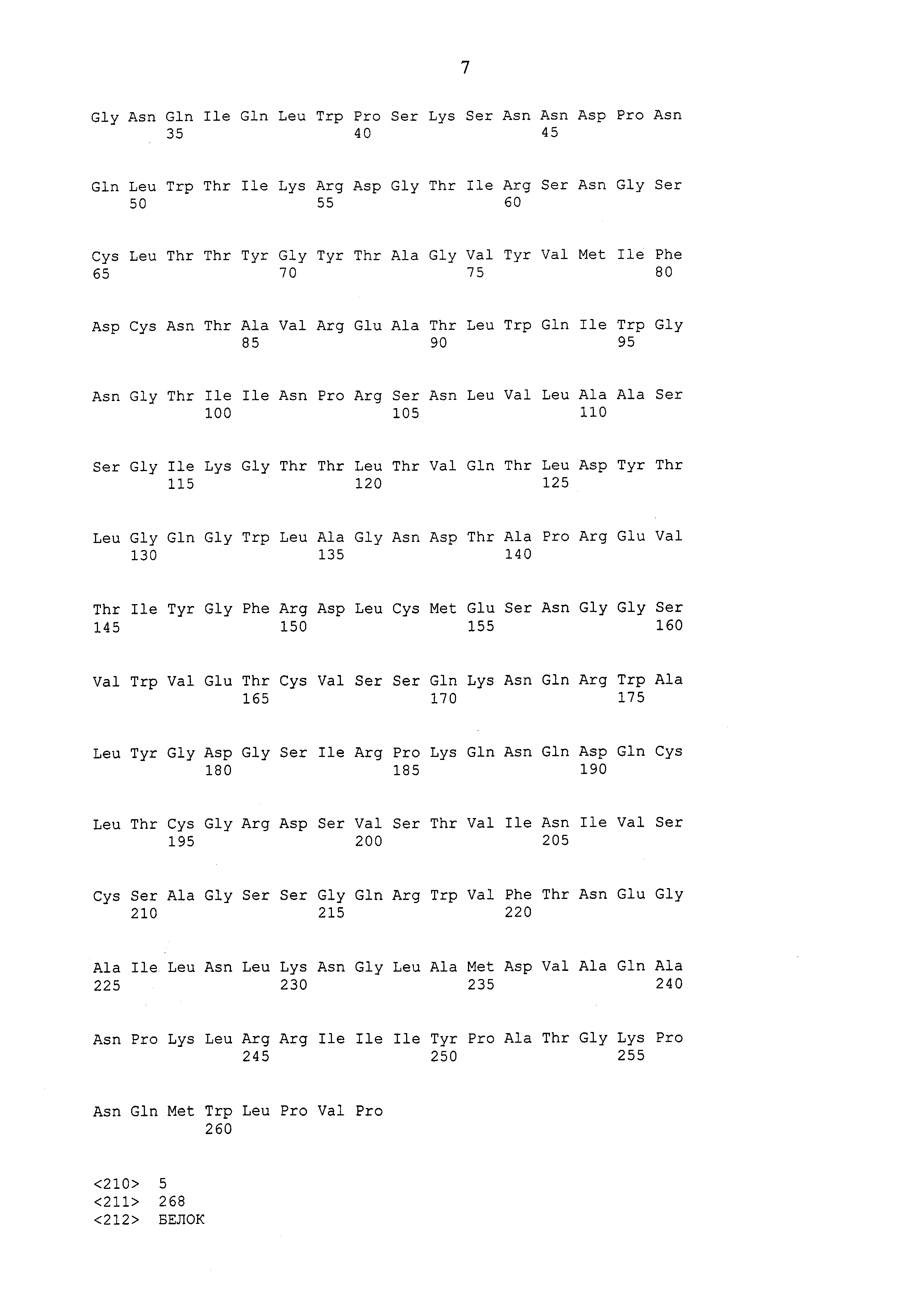











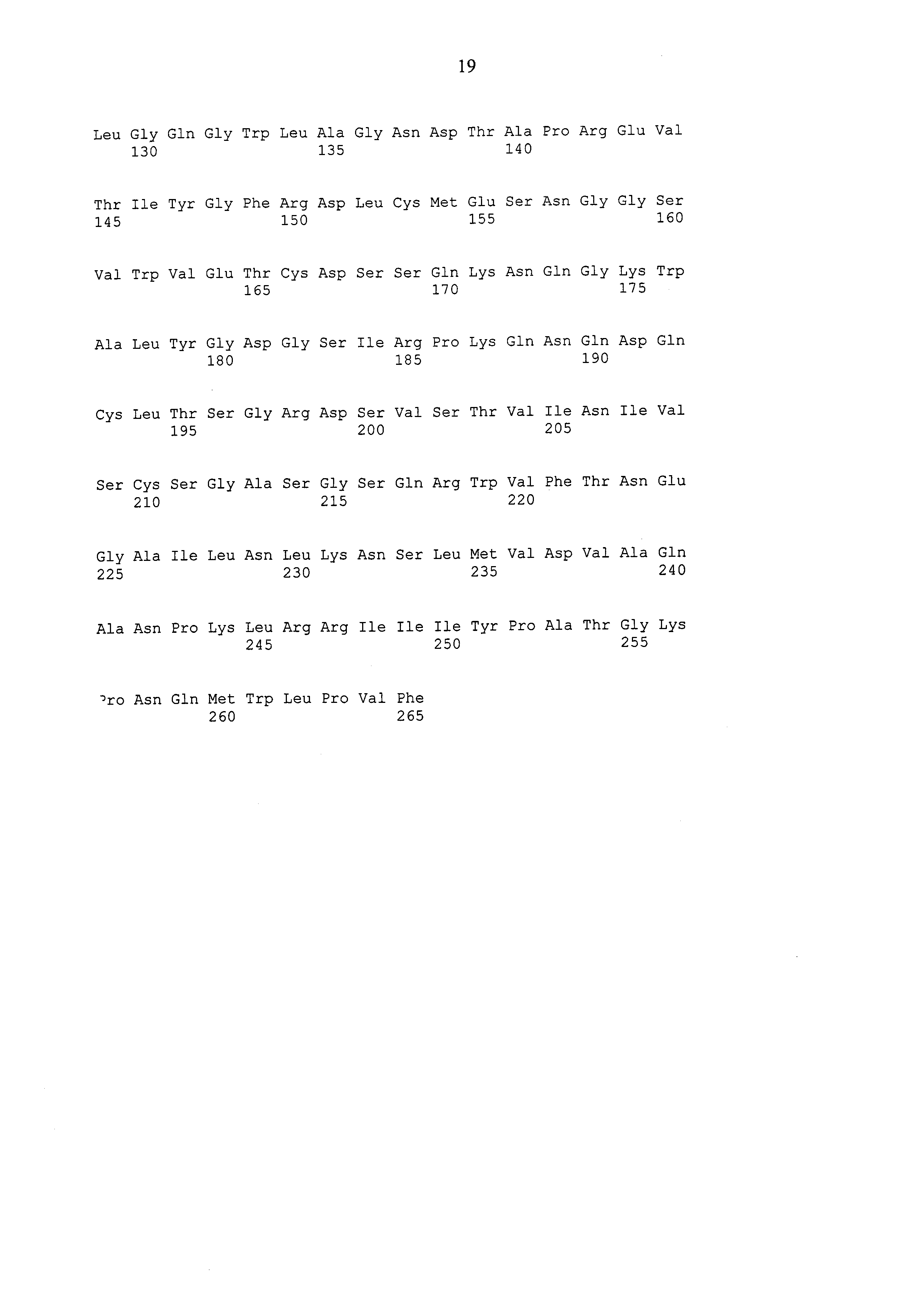


Описание
Изобретение относится к вакцинам, которые содержат антигены и адъювант, и применению адъюванта, при котором адъювант выделен из рекомбинантного лектина омелы белой.
При многих заболеваниях вакцины эффективны только частично, либо неэффективны вообще. Исследования защитного иммунитета и адъювантов, которые вызывают сильные иммунные ответы, могут помочь разработать эффективные вакцины против патогенных микроорганизмов (McKee AS, MacLeod MKL, KapplerJW et al. 2010 BMC Biology;8: 37–46). Вакцинами являются вакцины, полученные из живых, ослабленных (то есть, со сниженной вирулентностью) или инактивированных патогенных агентов, либо инактивированных (обезвреженных) токсинов или анатоксинов патогенных микроорганизмов, или фрагментов поверхностной структуры патогенных микроорганизмов. В настоящее время формально различают три основных типа вакцин: а) ослабленные живые вакцины, которые содержат вирусы или бактерии, подобные действующему возбудителю заболевания, но при этом являющиеся менее патогенными; б) инактивированные вакцины, которые представляют собой температурно-инактивированные или химически инактивированные частицы патогенных микроорганизмов; или в) субъединичные вакцины, состоящие из компонент патогенных микроорганизмов.
В дополнение к антигену, который является объектом адаптивного иммунного ответа, вакцины обычно содержат также патоген-ассоциированные молекулярные паттерны (ПАМПы) или другие вещества, которые усиливают эффект адаптивного ответа. Эти вещества описаны как адъюванты (McKee et al 2010 (выше)).
Известный адъювант, имеющий длительную историю применения в вакцинах для людей, – это соли алюминия (которые также называют квасцами). Протеины (антигены) патогенных микроорганизмов адсорбируются солью алюминия, образуя при этом суспензию, которая вводится внутримышечно.
Гепатит В является инфекционным заболеванием печени, вызываемым вирусом гепатита В, который часто сопровождается острым протеканием (90%) и иногда – хроническим протеканием болезни. Приблизительно 350 миллионов людей хронически инфицированы гепатитом В, что делает его одним из самых распространенных в мире вирусных заболеваний. Хроническое воспаление печени может привести к циррозу печени и гепатоцеллюлярной карциноме. Лечение хронического гепатита В является затруднительным, поэтому наиболее важной мерой предотвращения инфекции и уменьшения количества вирусоносителей является вакцинация.
Ряд вакцин против гепатита В выпускается серийно, среди них – Энджерикс-В (Engerix-B) от GlaxoSmithKline. В этой вакцине в качестве адъюванта используется гидроксид алюминия, а HBsAg (поверхностный антиген вируса гепатита В) вырабатывается в дрожжевых клетках (Saccharomyces cerevisiae или пекарские дрожжи) с применением генной инженерии.
При лечении рака путем вакцинации вакцины могут быть терапевтическими либо профилактическими. Адъюванты применяются с целью усиления действия профилактических или терапевтических вакцин, то есть, чтобы вызвать сильный и стойкий иммунный ответ. В частности, существует потребность в субъединичных вакцинах. Субъединичные вакцины состоят из очищенных антигенов, которые специфически распознаются лимфоцитами. И, хотя они более безопасны, чем вакцины, действующие во всем организме, сами по себе они не способны оптимально активизировать иммунную систему, так как лишены собственных ПАМПов (McKee et al 2010 (выше)). Адъюванты могут влиять на баланс антитело- и клеточно-опосредствованного индуцированного иммунитета. Применение подобных веществ, тем самым, делает возможным уменьшение дозы антигена и количества требуемых инъекций (Salk JE, Laurent AM & Bailey ML 1951 Am J Public Health Nations Health 41: 669-77).
Адъюванты также подразделяются на две категории: системы-носители и “иммуностимуляторы”, то есть, иммуномодуляторы (Pashine A, Valiante NM & Ulmer JB 2005 Nature medicine 11: 63-68, Pichichero ME 2008 Human vaccines 4(4): 262270). Основанные на носителях адъюванты (алюминий) увеличивают взаимодействие между компонентами вакцины и ключевыми клетками иммунной системы.
Иммуномодуляторы напрямую активируют антиген-презентирующие клетки (АПК) и естественный иммунный ответ, используя специфические рецепторы (например, Толл-подобные рецепторы (ТПР)) (Pashine et al. (supra), O’Hagan DT & Valiante NM 2003 Nature reviews 2: 727-735).
Несколько типов адъювантов для вакцин известны начиная с 1970-х, но на сегодня лишь некоторые из них были разрешены для применения к человеку (O’Hagan DT & De Gregorio E 2009 Drug Discov Today 14(11–12): 541–551).
В последнее время новые адъюванты такие, как агонисты Толл-подобных рецепторов (ТПР) и новые, крупнодисперсные системы-носители такие, как вакцины на основе пептидов, предоставляют возможности для современной иммунотерапии.
Тем не менее, все еще необходимы новые адъюванты, которые должны обладать следующими свойствами (Brunner R, Jensen-Jarolim E & Pali-Schöll I 2010 Immunol Lett 128(1): 29-35):
а) укрепление Тх17 (Т-хелперов 17). Адъюванты характеризуются выработкой ИЛ-17 (интерлейкина-17). Они являются важными модуляторами памяти воспалительных и CD4+ Т-клеток.
б) индуцирование стойких клеточных ответов, включающих клетки Т-хелперов (Tx) 1 и цитотоксических T-лимфоцитов (ЦТЛ) в дополнение к антителам (Guy B 2007 Nat Rev Microbiol 5: 505–517).
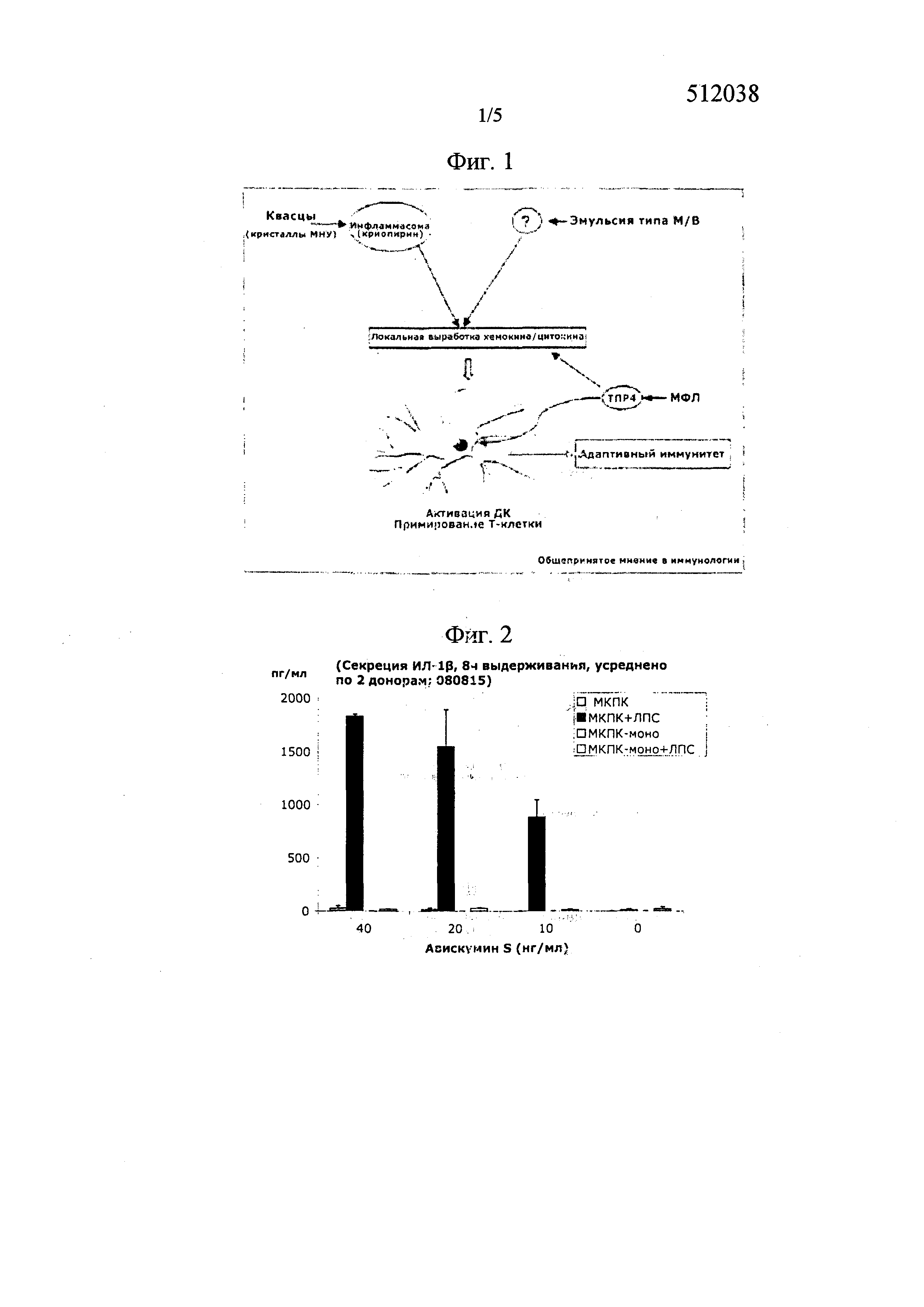
В целом, механизмы действия адъювантов могут быть различными (фиг. 1). Неспецифические адъюванты (например, гидроксид алюминия) усиливают презентацию антигенов через активацию метаболизма инфламмасом, для которого характерна секреция ИЛ-1β (Lamine Mbow M, De Gregorio E, Valianteal NM et al. 2010 Current Opinion in lmmunology 2010, 22: 411-416). В месте инъекции алюминий образует депо, что приводит к высокой локальной концентрации антигена и, таким образом, улучшает поглощение антигенпрезентирующими клетками (АПК) (HogenEsch H 2002 Vaccine 20 (Suppl 3): 34–39). Более того, распознавание антигена может быть ускорено путем прямой стимуляции иммунных клеток (Gupta RK, Rost BE, Relyveld E et al 1995 Pharm Biotechnol 6: 229–248). Эти, так называемые адъюванты В-типа, взаимодействуют с АПК и антигенами неспецифическим образом, и, вследствие этого, их эффект основан на усилении антигенпрезентирующих молекул ГКГ (главного комплекса гистосовместимости).
В противоположность адъювантам В-типа, адъюванты А-типа имеют специфический механизм действия. Большинство недавно разработанных адъювантов А-типа таких, как монофосфорил-липид А (МФЛ), являются специфическими агонистами ТПР. Они действуют в первую очередь на ТПР и действуют опосредованно путем активации АПК и усиления секреции цитокинов таких, как ИЛ-12. Дополнительно, агонисты ТПР могут действовать на ГКГ-рецепторы путем эффективной презентации применяемых антигенов (Guy B 2007 (выше)).
Более того, существует описание адъювантов С-типа. Их действие основано на усилении ГКГ-рецепторов вследствие взаимодействия ко-стимулирующих клеток с АПК. Предпринимаются усилия для того, чтобы найти клиническое применение для адъювантов С-типа. Один из известных примеров – TGN1412 – новое, суперагонистическое анти-CD28 моноклональное антитело, которое стимулирует непосредственно Т-клетки, однако, при одном исследовании из-за цитокиновой бури наблюдались кардиогенный шок и острая легочная недостаточность (Suntharalingam G, Perry MR, Ward S et al. 2006 N Engl J Med 355: 1018-1028).
В прототипе существует острая потребность в новых соответствующих требованиям адъювантах.
Растительные экстракты, выделенные из омелы белой, применялись в терапевтических целях на протяжении столетий. Средства на основе омелы белой применялись, с разной степенью успешности, в частности, в лечении рака (Bocci V 1993 J Biol Regulators and Homeostatic Agents 7(1): 1-6; Gabius H-J, Gabius S, Joshi S S et al. 1993 Planta Med 60: 2-7; Gabius H-J & Gabius S 1994 PZ 139: 9-16; Ganguly C & Das S 1994 Chemotherapy 40: 272-278, Hajto T, Hostanska K, Gabius H_J 1989 Cancer Res 49: 4803-4808, Hajto T, Hostanska K, Frei K et al. 1990 Cancer Res. 50: 3322-3326). Было показано, что терапевтический эффект оказывается, в частности, так называемыми лектинами омелы белой (вискумин, агглютинин Viscum album, VAA). Лектины омелы белой имеют цитотоксическое действие и вызывают неспецифическую иммуномодуляцию, положительные эффекты которой применяются для лечения опухолевых больных. Различные исследования лектинов омелы белой in vitro (Hajto et al., 1990 (выше); Männel D N, Becker H, Gundt A et al. 1991 Cancer Immunol Immunother 33: 177-182; Beuth J, Ko K L, Tunggal L et al. 1993 Drug Res 43: 166-169) и in vivo (Hajto T 1986 Oncology 43 suppl 1: 51-65; Hajto et al., 1989 (supra), Beuth J, Ko H L, Gabius H-J et al. 1991 In Vivo 5: 29-32; Beuth J, Ko H L, Gabius H-J et al. 1992 J Clin Invest 70: 658-661), а также клинические исследования (Beuth et al., 1992 (выше)) показали усиленное выделение воспалительных цитокинов (TNF-alpha (фактор-альфа некроза опухоли), интерлейкин-1 (ИЛ-1), интерлейкин-6 (ИЛ-6)) и активацию клеточных компонентов иммунной системы (Тх-клетки, натуральные клетки-киллеры (NK-клетки)).
На сегодняшний день анализ экстракта омелы белой сводится к идентификации трех лектинов омелы белой (ML-I, ML-II и ML-III), которые имеют различные молекулярный вес и специфику связывания сахаров. Было показано, что иммуностимулирующее действие экстракта омелы белой оказывается ML-I. Лектин ML-I состоит из двух А- и двух В-цепей (MLA и MLB, соответственно), каждая из которых является гликозилированной. А-цепь ответственна за ферментативную инактивацию рибосом (Endo Y, Tsurugi K & Franz H 1988 FEBS Lett 231: 378–380), а В-цепь участвует в связывании углеводов. Обе цепи связаны между собой дисульфидным мостиком. Полученные в результате мономеры лектина омелы белой могут ассоциировать в димеры с образованием нековалентных связей.
Также существует возможность получать биологически активный лектин омелы белой с помощью рекомбинантной технологии. В EP 0751221 описано выделение полипептидов лектина омелы белой в виде структурно гомогенного вещества, при котором, исходя из генетической последовательности лектина омелы белой, воспроизводятся рекомбинантные одиночные цепи (А-цепи, В-цепи) высокой чистоты, которые могут быть реассоциированы in vitro и тем самым образовывать рекомбинантный лектин омелы белой – голопротеин, который преимущественно является протеин-химически, ферментативно и структурно гомогенным, так называемым авискумином (Aviscumine). Согласно EP 0751221, полипептид рекомбинантного лектина омелы белой подходит для терапевтического применения как голопротеин, подцепь и в форме субфрагментов, и рассматривается согласно данному изобретению. Биологически активный лектин омелы белой, который можно получить путем рекомбинантной технологии в E. coli, называют не только авискумином (Aviscumine), но также и “rViscumin” или “rML” (recombinant mistletoe lectin) (Eck J, Langer, M, Möckel, B et al 1999; Eur J Biochem 264: 775-784).
Хотя в EP 0751221 упоминается о возможности применения рекомбинантного лектина омелы белой для лечения инфекционных заболеваний, никакой информации относительно применения рекомбинантного лектина омелы белой в качестве адъюванта в вакцине не предоставляется.
Кроме того, Lavelle et al (Lavelle EC, Grant G, Pusztal A et al. 2002. Immunology 107:268-274) описывают использование выделенных из растений лектинов как адъювантов, которые вводятся мукозно путем ингаляции по 1000 нг. Lavelle также обнаружил, что доза в 1000 нг/мышь оказывает негативный эффект на вес животных и влияет на их выживание, то есть, является токсичной.
Song et al (Song SK, Moldoveanu Z, Nguyen HN et al. 2007 Vaccine 25: 6359-6366) показали возможность применения лектина корейской омелы в качестве адъювантов, применяемых мукозно.
Как бы то ни было, выделенные из растений лектины омелы белой негомогенны (Soler MH, Stoeva S, Schwamborn C et al. 1996 FEBS Letter 399: 153-157, Soler HS, Stoeva S, Voelter W 1998 Biochem Biophys Res Comm 246: 596-601) и разнородны или отличны друг от друга в плане действия (EP 1051495 B1), а также не являются эффективными per se как адъюванты или иммуномодуляторы. В связи с этим, хотя лектин корейской омелы, к примеру, относится к RIP II протеинам (протеинам-инактиваторам рибосом), он имеет существенные отличия в структуре и конформации по сравнению с рекомбинантным лектином омелы белой, который обсуждается здесь (Kang TB, Song SK, Yoon TJ et al. 2007 J Biochem Mol Biol 40(6): 959-965). Недостатком является невозможность точно определить дозировку и то, что выделенные из растений лектины содержат примеси. К тому же, выделенные из растений лектины омелы белой имеют отличия в гликозилировании, что может влиять на их эффективность как адъювантов (в частности, на кинетику и т.д.).
Согласно изобретению лектины рекомбинантной омелы белой преимущественно не имеют такого гликолизирования.
Желательным является увеличение иммуногенности антигенов путем применения адъювантов с целью получить эффективный и улучшенный иммунный ответ у носителя или больного. Также существует большая потребность в безопасных и действенных адъювантах, которые увеличивают эффективность вакцин и просты в применении.
Задача, которую рассматривает данное изобретение, - создание вакцины или адъюванта, с которыми иммунный ответ носителя или больного на антигены мог бы быть усилен.
Эта задача решается созданием вакцины или адъюванта, которые содержат рекомбинантный лектин омелы белой.
Неожиданно было обнаружено что рекомбинантный лектин омелы белой может быть применен как потенциальный адъювант вместе с антигеном.
Таким образом, изобретение относится к адъюванту, содержащему как минимум один рекомбинантный лектин омелы белой (называемый далее адъювантом согласно изобретению).
Также изобретение относится к вакцине, содержащей антиген вместе с адъювантом согласно изобретению (называемой далее вакциной согласно изобретению).
Вследствие этого, изобретение также относится к лекарству или композиции, содержащим вакцину согласно изобретению и, в некоторых случаях, дополнительные вещества и добавки и/или фармацевтически приемлемый носитель или фармацевтически приемлемый растворитель.
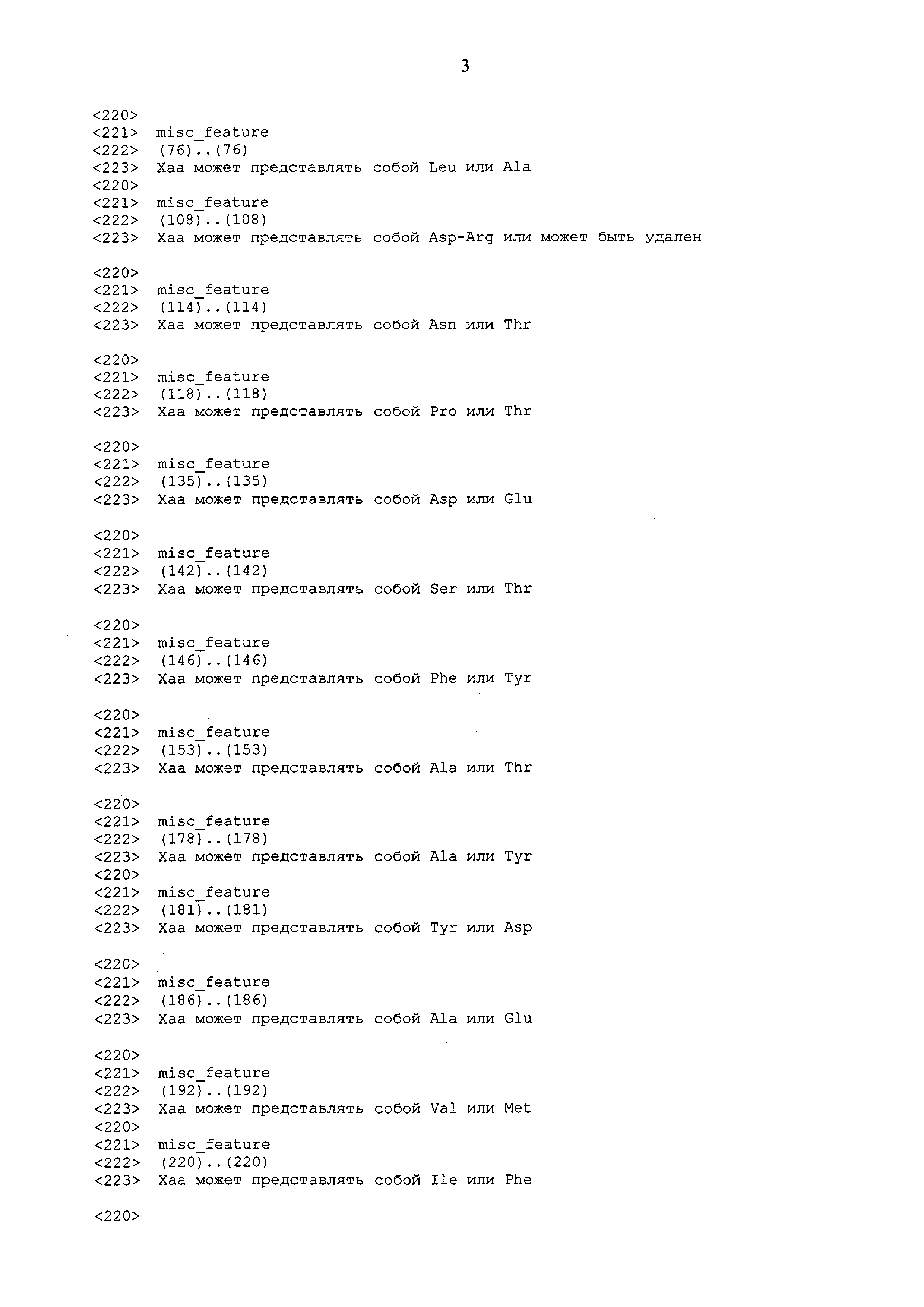
Задача решается путем создания адъюванта или вакцины, которые содержат рекомбинантные лектины омелы белой, а рекомбинантные лектины омелы белой состоят из следующих аминокислотных последовательностей:
Лекарственное средство согласно изобретению предпочтительно содержит А-цепь лектина омелы белой (MLA) и В-цепь лектина омелы белой (MLB), как отдельно так и в комбинации для обоих случаев, а также в форме димеров (см., к примеру, EP 0751221 или EP 1051495).
Полипептид рекомбинантного лектина омелы белой А-цепи лектина омелы белой содержит следующие последовательности: SEQ ID No. 1–3, включая их изоформы или функциональные фрагменты.
Полипептид рекомбинантного лектина омелы белой В-цепи лектина омелы белой содержит следующие последовательности: SEQ ID No. 4–12, включая их изоформы или функциональные фрагменты.
(Полностью именуемые в дальнейшем и выше как “рекомбинантные лектины омелы белой”)
В дальнейшем предпочтение отдается рекомбинантному лектину омелы белой согласно изобретению – гетеродимеру, содержащему последовательности SEQ ID No. 1 и SEQ ID No. 4; см., например, EP 0751221, про так называемый авискумин (см. примеры).
В контексте настоящего изобретения, выражение “функциональный фрагмент” означает фрагменты заявленных полипептидов, которые имеют аналогичную биологическую функцию, что и представленные выше полипептиды, содержащие определенную последовательность аминокислот.
В этом контексте выражение “аналогичная биологическая функция” означает, к примеру, что фрагменты или производные полипептидов вызывают в клетках те же сигналы, что и заявленные полипептиды. Примерами фрагментов служат пептидные домены, обладающие определенными функциями. Выражение “аналогичная биологическая функция” также включает цитотоксичность, иммуностимуляцию (врожденной и адаптивной иммунных систем), стимуляцию выделения цитокина, антигенность, индуцирование экспрессии или активации поверхностных маркеров, индуцирование апоптоза или стимуляцию эндорфина.
В этом случае выражение “биологическая активность рекомбинантного лектина омелы белой” относится к любой биологической активности из спектра совокупности биологических активностей рекомбинантного лектина омелы белой. Функцией такого типа является фармакологический эффект рекомбинантного лектина омелы белой, например, его пригодность в качестве адъюванта в комбинации с антигеном (вакцина).
При исследовании мономеров ML-I обнаружено 25 изоформ, которые обусловлены различными комбинациями А- и В-цепей и различными уровнями гликолизирования цепей.
В отношении данного изобретения также рассматриваются полипептид лектина омелы белой или его фрагмент, содержащие разнообразные последовательности MLA и MLB цепей согласно изобретению, для последовательностей SEQ ID No. 1–12.
Лекарственное средство согласно изобретению предпочтительно содержит как минимум один полипептид рекомбинантного лектина омелы белой, включающий последовательности SEQ ID No. 1–12 либо их функциональный фрагмент, или любую их комбинацию.
К примеру, усиленный иммунный ответ наблюдался при применении вакцины согласно изобретению, содержащей поверхностный антиген гепатита В HBsAg (Hepatitis B surface antigen) и овальбумин в качестве “слабого модельного антигена” (см. примеры). Более того, неожиданно было обнаружено, что активация клеток рекомбинантными лектинами омелы белой происходит путем действенной и исключительно эффективной активации инфламмасом, сравнимым с механизмом действия алюминия (гидроксида алюминия).
В дальнейшем успешном осуществлении изобретения доза рекомбинантных лектинов омелы белой, приходящаяся на пациента (человека или млекопитающего) и, предпочтительно, вводимая подкожно, составляет от 5 до 600 нг/мл, в частности, от 250 до 450 нг/мл, 350 нг/мл или от 5 до 600 нг/пациент, в частности, от 250 до 450 нг/пациент, 350 нг/пациент.
Как показано в примерах, в диапазоне от 5 до 50 нг/животное (или от 50 до 500 нг/мл) или пациента оптимальное выделение интерлейкина-1β (ИЛ-1β) происходит в узком диапазоне дозировок 280–420 нг/пациент (280–420 нг/мл), в частности, после подкожного введения. При более высоких дозах интерлейкин не выделяется; наоборот, более вероятно возникновение цитотоксических эффектов в здоровых тканях. ИЛ-1β является прямым показателем активации инфламмасомы, которая особенно важна в плане пригодности адъюванта.
Особым преимуществом является то, что гомогенные рекомбинантные лектины омелы белой могут, таким образом, вызывать оптимальную активацию инфламмасомы. Благодаря гомогенности рекомбинантного лектина омелы белой становится возможным определение эффективной точной дозировки в узком диапазоне.
Это также приводит к улучшенной переносимости применения и, следовательно, для успешной вакцинации требуется меньшее количество применений. Согласно Lavelle (выше) для успешной вакцинации требуется четыре применения по причине недостаточной активации инфламмасомы. Согласно примеру 2, в качестве целесообразного аналога можно привести достижение успешной вакцинации всего после двух применений.
Рекомбинантные лектины омелы белой должны быть отнесены к такой категории адъювантов как “иммуностимуляторы” (иммуномодуляторы (выше)) благодаря наблюдаемому механизму действия.
АПК активируются следующим образом:
1. Активация фагоцитов (дендритные клетки и моноциты/макрофаги) вследствие фагоцитоза авискумина с последующими
а. Презентацией антигена,
б. Инициацией откликов Т-клеток и
в. Секрецией цитокина,
и
2. Индуцирование апоптоза (например, моноциты/макрофаги) с последующими
а. Активацией соседних фагоцитов путем поглощения мертвых клеток (например, апоптозных телец) апоптоза и
б. Секрецией цитокина.
Более того, показана эффективная активация инфламмасомы в моноцитах с помощью рекомбинантных лектинов омелы белой согласно изобретению путем стимуляции каспазы-1 и секреции ИЛ-1β и ИЛ-18. Совокупность механизмов генерации сильных иммунных ответов, таким образом, характеризует рекомбинантные лектины омелы белой как сильные и уникальные адъюванты.
В частности, рекомбинантные лектины омелы белой согласно изобретению обеспечивают специфическую и существенную активацию инфламмасомы, которая, согласно изобретению, считается необходимой в плане пригодности адъюванта.
Следовательно, изобретение также относится к применению рекомбинантных лектинов омелы белой в качестве адъювантов в вакцинах для усиления иммунного ответа носителя (животного, млекопитающего или человека) на один антиген или более.
Согласно изобретению созданы вакцины, содержащие как минимум один рекомбинантный лектин омелы белой в качестве адъюванта и антиген, например, антиген HBsAg, полученный из дрожжевых клеток и, в некоторых случаях, фармацевтически приемлемый носитель или фармацевтически приемлемый растворитель, и, в некоторых случаях, другие компоненты такие, как хлорид натрия, дигидрат двунатриевого фосфата, первичный кислый фосфат натрия.
Вакцины согласно изобретению преимущественно соединяются с буферным физиологическим раствором и производятся в виде стерильной суспензии для инъекций в ампулах или наполненных шприцах и вызывают иммунологический ответ у носителя (животного, млекопитающего или человека) или донора/пациента. Вакцины согласно изобретению индуцируют образование специфических Т-клеток и образование гуморальных антител к HBsAg.
Вакцины согласно изобретению применяются, например, для активной иммунизации против вируса гепатита В, который у неиммунных людей всех возрастов вызван вирусами всех известных подтипов. Группа людей, подлежащая иммунизации, определяется официальными рекомендациями к вакцинации (Постоянный комитет по вакцинации при институте Роберта Коха).
Для основной иммунизации может быть применена следующая программа вакцинации с использованием вакцины согласно изобретению:
1. Программа вакцинации, предусматривающая вакцинацию на 0, 1 и 6 месяцах, обеспечивает высокую концентрацию антител и, как правило, оптимальную защиту на 7 месяце.
2. Ускоренная программа вакцинации, предусматривающая вакцинацию после 0, 1 и 2 месяцев, делает возможным быстрое наращивание защиты за счет инокуляции. После 12 месяцев следует применять четвертую дозу для обеспечения долговременной защиты.
Эти программы вакцинации, приведенные в качестве примеров, могут корректироваться согласно национальным рекомендациям к вакцинации (Постоянный комитет по вакцинации при институте Роберта Коха).
Вакцины согласно изобретению вводятся преимущественно подкожно или внутримышечно.
Количество одного или более антигенов и рекомбинантного лектина омелы белой в вакцине согласно изобретению, а также применяемые дозы, могут быть определены способами, известными специалисту в данной области медицины. Тип дозировки определяется лечащим врачом в соответствии с клиническими предпосылками. Специалист в данной области знает, что тип дозировки зависит от многих факторов таких, как рост, вес, площадь поверхности тела, возраст, пол или общее состояние здоровья пациента, а также от конкретного применяемого средства, длительности и типа применения, и от других лекарств, которые могут приниматься параллельно.
Предпочтительно, чтобы адъювант рекомбинантного лектина омелы белой в вакцинах согласно изобретению вводился в виде водного или физиологического раствора, а антиген, в зависимости от единиц, обычно находился в порядке величины: от нанограммов, микрограммов и до миллиграммов (см. примеры, приведенные ниже).
Адъювант рекомбинантного лектина омелы белой согласно изобретению может быть использован с любым подходящим антигеном, и, таким образом, создается вакцина согласно изобретению.
Подходящими антигенами являются преимущественно те, которые применяются как потенциальные вакцины, и не могут быть исключительно такими, как, например, HBsAg (выше), антигены против вирусов гриппа H1N1 и других подвидов, пептидные антигены направленные против иммуногенных опухолей, например, PAX пептиды (Rodeberg DA, Nuss RA, Elsawa SF et al. 2006 Int J Cancer 119: 126-132, Yan M, Himoudi N, Pule M et al. 2008 Cancer Res 68(19): 8058-8065), и многие другие.
Стандартная дозировка адъюванта согласно изобретению отвечает концентрации 5 нг и выше.
Вакцины согласно изобретению создаются в удобном виде - как жидкие средства или композиции, которые могут быть приведены к определенному уровню pH (выше).
Выбор подходящих носителей и других добавок зависит от желаемого способа применения и от типа лекарственной формы.
С целью увеличить срок годности вакцин может быть использован фармацевтически приемлемый консервант.
Вакцины согласно изобретению приготавливаются путем смешивания компонент согласно общеустановленным методам или по собственному усмотрению.
Следующие примеры служат для иллюстрации изобретения, но без ограничения изобретения этими примерами.
Примеры
Пример 1: Активация инфламмасомы авискумином
МКПК, изолированные с помощью градиентной очистки фиколлом от человеческой донорской крови, высеивали на титровальных планшетах и выдерживали вместе с авискумином на протяжении от 8 до 24 часов, с или без стимуляции липополисахаридом (ЛПС). ЛПС активирует про-ИЛ-1β и про-ИЛ-18 посредством Толл-подобного рецептора-4 (ТПР4), а без этого последующая активация каспазы-1 приводит к выделению цитокинов одним ЛПС.
В совместной культуре авискумина и ЛПС цитокины ИЛ-1β и ИЛ-18 выделяются путем, зависящим от концентрации. Секреция ИЛ-6 и ФНО-альфа (фактор некроза опухолей) не индуцируется (9-часовой эксперимент). Авискумин и ЛПС, находясь по отдельности в клеточной культуре, не вызывают выделение цитокинов ИЛ-1β. Авискумин, взятый отдельно, способен вызывать выделение ИЛ-18, и этот эффект усиливается ЛПС. В случае, когда МКПК освобождены от моноцитов магнитной сортировкой клеток (анти-CD14 МАКС гранулы, Miltenyi), ни ИЛ-1β ни ИЛ-18 не могут выделяться в оставшихся МКПК при выдерживании с авискумином и ЛПС. Цитокины ИЛ-1β и клетки ИЛ-18, следовательно, выделяются из моноцитов. Индуцирование ИЛ-1β и ИЛ-18 путем выдерживания МКПК вместе с авискумином и ЛПС свидетельствует об активации инфламмасомного комплекса.
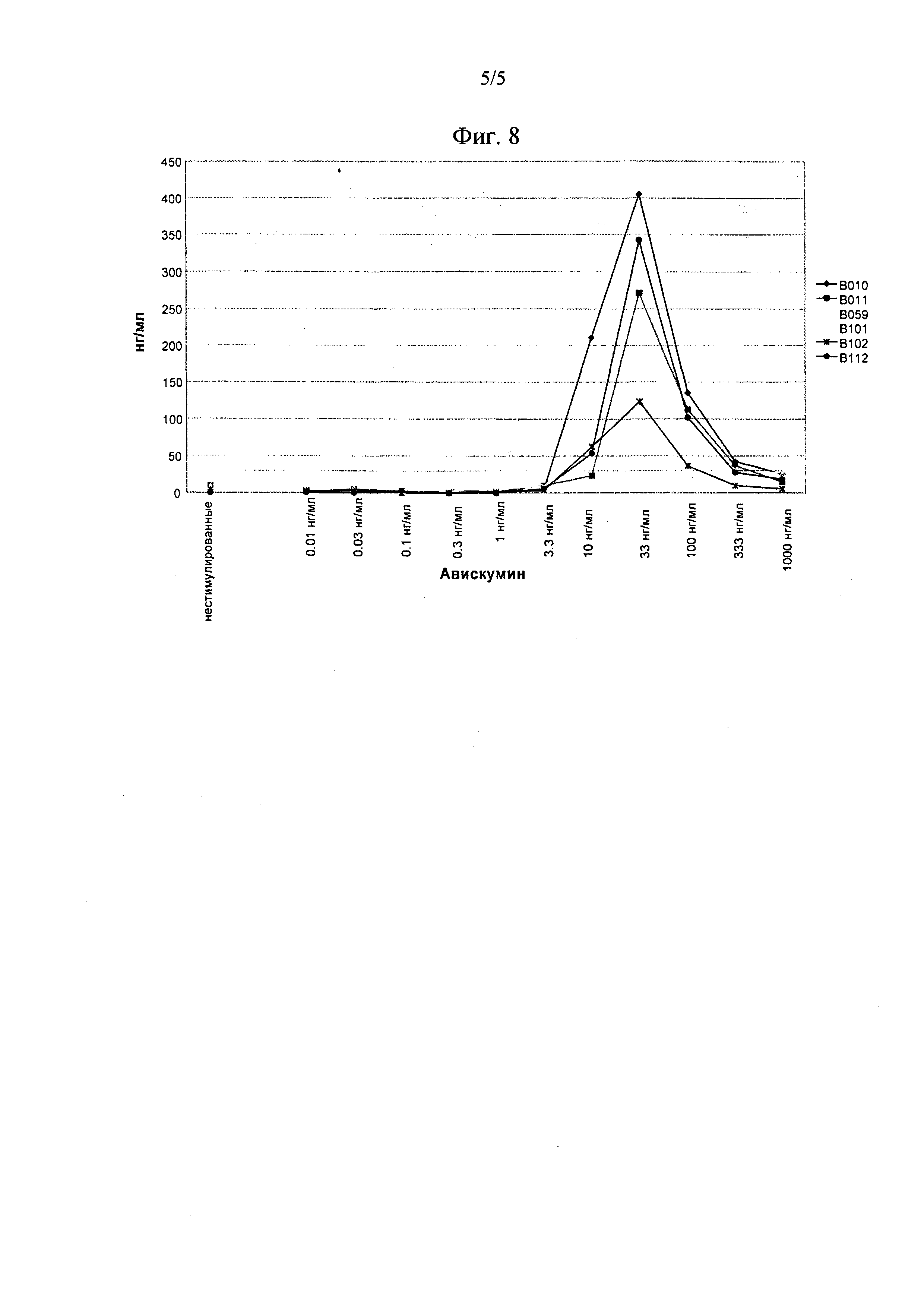
In vitro, оптимальное выделение ИЛ-1β из мононуклеарных клеток периферической крови (МКПК) наблюдали в узком диапазоне концентраций при оптимальной концентрации 33 нг/мл, в зависимости от времени выдерживания с авискумином в отсутствие ЛПС. Этот эффект сопровождается конусовидной зависимостью “концентрация-эффект” (фиг. 8).
а) Иммунизации
Были осуществлены две иммунизации мышей определенной инбредной линии (белые мыши), при которых применяли в совокупности авискумин в качестве адъюванта и поверхностный антиген гепатита В (HBsAg), а также – в дальнейших экспериментах – овальбумин как антиген. Иммунизации осуществляли с интервалом в 3 недели. Композиции антиген-авискумин вводили подкожно на 1 и 21 дни, а иммунизированных животных умерщвляли через 14 дней после последней иммунизации.
С целью определения иммуногенности проводили окрашивание внутриклеточного цитокина антиген-специфических Т-клеток CD8 и CD4 и определение антиген-специфических антител. Подобная постановка эксперимента дает возможность регистрировать усиленный иммунный ответ, вызванный авискумином, на клеточном и гуморальном уровнях.
Пример 2. Иммунизация поверхностным антигеном гепатита В (HBsAg)
Антиген HBsAg является липопротеиновой частицей размером 20 нм. Такая вирусоподобная частица способна вызывать гуморальный иммунный ответ, часто даже в отсутствие адъюванта. Мягкий ответ Т-клеток CD8 на HBsAg может стимулироваться в белых мышах одним только антигеном.
Данная комбинация антигена и мышиного штамма дает возможность проанализировать способность авискумина усиливать мягкие гуморальные и клеточные ответы. В этом случае для позитивного контроля использовали AbISCO®-100 (ISCONOVA, Уппсала, Швеция), так как известно, что данный адъювант усиливает иммунный ответ в этой модели.
Штамм мышей: белые мыши;
2 подкожные иммунизации (1, 21 дни);
5 животных на группу (3 животных для контрольных групп 2 и 3); всего 31 животное.
Свежие композиции вакцины готовили перед каждой иммунизацией. Авискумин растворяли в физрастворе с добавлением 0,01% Твин 80.
Реагенты
В качестве антигена для композиций (объем 100 мкл на дозу/животное) применяли по 5 мкг рекомбинантного HBsAg (Rhein Biotech GmbH, Дюссельдорф, Германия) на животное.
В качестве контрольного теста использовали адъювант AbISCO-100 (Isconova, Уппсала, Швеция) в количестве 12 мкг на дозу. AbISCO-100 является адъювантом, оптимизированным для использования на мышах.
Для повторной стимуляции CD8+ клеток у белых мышей использовали следующие синтетические полипептиды: HBsAg28-39 IPQSLDSWWTSL как (Ld)-рестриктированные, HBsAg-специфические пептиды ГКГ класса I. Малярийные CSP280-289 SYVPSAEQI как (Kd)-рестриктированные, нерелевантные контрольные пептиды ГКГ класса I.
Специфические CD4+ Т-клетки активировали с помощью антигенов HBsAg (применяемых как и в композиции вакцины).
Исследования
а) Определение HBsAg-специфических IFNγ-образующих CD8+ Т-клеток селезенки
На 14 день после второй иммунизации суспензию, состоящую из одиночных клеток селезенки, активировали ex vivo на протяжении 4 часов с помощью соответствующих антиген-специфических пептидов. Брефелдин А добавляли, чтобы поддерживать внутриклеточную выработку цитокинов. Поверхности клеточных мембран окрашивали для CD8, фиксировали и делали проницаемыми для последующего внутриклеточного окрашивания IFN-γ. Окрашенные клетки анализировали с помощью проточного цитометра Beckmann Coulter (FC 500) с применением программного обеспечения CXP. Проанализировали 60000 положительных CD8 клеток. Определили количество CD8+IFN-γ+ Т-клеток на 105 CD8+ Т-клеток.
б) Определение HBsAg-специфических IFNγ-образующих CD4+ Т-клеток селезенки
На 14 день после второй иммунизации суспензию, состоящую из одиночных клеток селезенки, активировали ex vivo на протяжении ночи с помощью 1 мкг/мл рекомбинантного HBsAg. Среду для активации использовали в качестве отрицательного контроля. После обработки брефелдином А на протяжении 4 часов поверхности клеточных мембран окрашивали для CD4, фиксировали и делали проницаемыми для последующего внутриклеточного окрашивания IFN-γ. Клетки анализировали с помощью проточного цитометра Beckmann Coulter (FC 500) с применением программного обеспечения CXP. Проанализировали 60000 положительных клеток CD4. Определили количество CD4+IFN-γ+ Т-клеток на 105 CD4+ Т-клеток.
в) Определение количества специфических поверхностных антител вируса гепатита В в мышиной сыворотке
С целью определения количества антител использовали оборудование IMx AUSAB (ELISA - энзим связанный иммуносорбентный метод исследования) с IMx Reader (Диагностика Эбботта). Тестирование проводили в соответствии с рекомендациями производителя.
г) Определение профиля Т-хелперов (Тх) иммунного ответа
Антиген-специфические титры IgG1 и IgG2b определяли с помощью ELISA, а отношение IgG1/IgG2b использовали для определения Тх профиля.
Статистика
Для проведения статистического анализа разницы между двумя группами использовали t-тест (программное обеспечение GraphPad Prism 5).
Результаты
HBsAg-специфический ответ Т-клеток
После 2 иммунизаций наблюдали усиленный HBsAg-специфический ответ CD8+ Т-клеток в группах, к которым применяли по 50 нг и 5 нг авискумина (см. фиг. 4).
Группа, к которой применяли HBsAg с 0,5 нг авискумина, не продемонстрировала усиленного ответа CD8+ по сравнению с группой, к которой применяли один HBsAg (на который у белых мышей наблюдали определенный ответ CD8+). Как и ожидалось, положительный контроль AbISCO продемонстрировал эффективный ответ CD8+. В буферной и адъювантной контрольных группах теневой фенотип не наблюдали (см. фиг. 4).
HBsAg-специфический ответ CD4 Т-клеток наблюдали в группе, получившей HBsAg + 50 нг авискумина (см. фиг. 5).
Эффективность данного CD4+ ответа сравнима с той, что получили с AbISCO. Более низкие дозы авискумина, равно как и буферный и адъювантный контроль, не вызывали HBsAg-специфического ответа CD4 (см. фиг. 5).
Анти-HBsAg гуморальный ответ
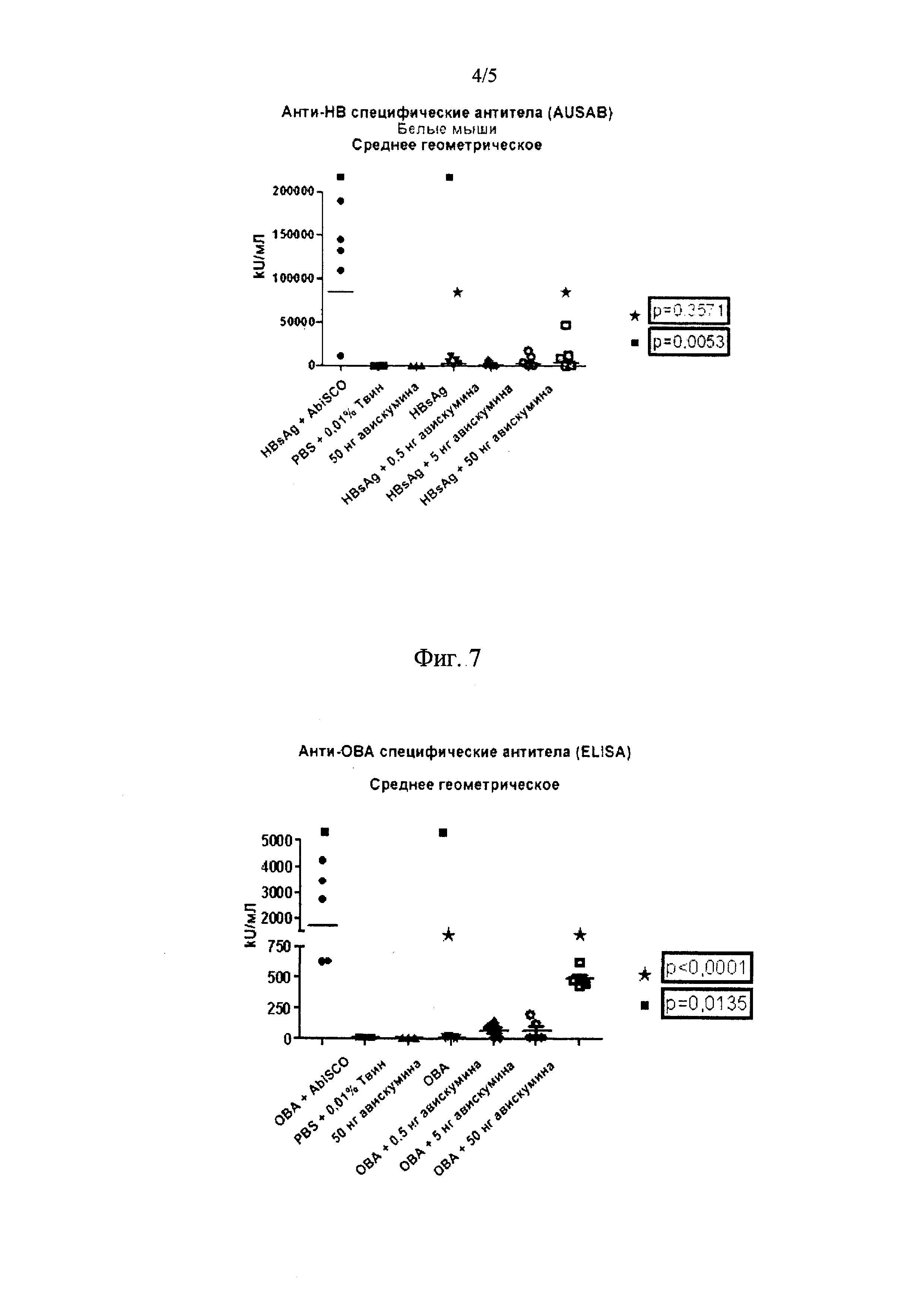
Слабый анти-HB гуморальный ответ наблюдали через 2 недели после второй иммунизации в группе, к которой применяли 50 нг авискумина (см. фиг. 6).
Слабый анти-HB гуморальный ответ наблюдали у мышей даже при повторной иммунизации одним HBsAg.
Как и ожидалось, положительный контроль AbISCO вызывает сильный гуморальный ответ, в то время как буферный и адъювантный контроли являются отрицательными.
Профиль Т-хелперов не определили для животных иммунизированных HBsAg по причине слабых или негативных анти-HB титров.
Пример 3. Иммунизация овальбумином (ОВА)
Овальбумин (ОВА) является растворимым мономерным протеином, который может вызывать выработку анти-ОВА антител только в комбинации с адъювантами. Для позитивного контроля использовали AbISCO®-100 (Isconova, Уппсала, Швеция), так как известно, что данный адъювант увеличивает иммунный отклик в этой модели.
Штамм мышей: C57BL/6 (инбредные черные мыши);
2 подкожные иммунизации (1, 21 дни);
5 животных на группу (3 животных для контрольных групп 9 и 10); всего 31 животное.
Свежие композиции вакцины готовили перед каждой иммунизацией. Авискумин растворяли в физрастворе с добавлением 0,01% Твин 80.
Реагенты
В качестве антигена для композиций (объем 100 мкл на дозу/животное) применяли по 10 мкг обедненного эндотоксинами овальбумина (Hyglos GmbH, Регенсбург, Германия) на животное.
В качестве контрольного теста использовали адъювант AbISCO-100 (Isconova, Уппсала, Швеция) в количестве 12 мкг на дозу. AbISCO-100 является адъювантом, оптимизированным для использования на мышах.
Исследования
а) Определение количества специфических антител ОВА в мышиной сыворотке Alpha Diagnostics International.
Для определения количества анти-ОВА антител у мышей применяли метод ELISA от Alpha Diagnostics International. Тестирование проводили в соответствии с рекомендациями производителя.
б) Определение профиля Т-хелперов (Тх) иммунного ответа
Антиген-специфические титры IgG1 и IgG2b определяли с помощью ELISA, а отношение IgG1/IgG2b использовали для определения Тх профиля.
Статистика
Для проведения статистического анализа разницы между двумя группами использовали t-тест (программное обеспечение GraphPad Prism 5).
Результаты
Анти-ОВА антитела
ОВА-специфический гуморальный ответ наблюдали в группе, к которой применяли 50 нг авискумина (см. фиг. 7). Буферная и адъювантная контрольные группы оказались отрицательными. Контрольная группа AbISCO была положительной (см. фиг. 7).
Определение ОВА-специфических изотипов IgG1 и IgG2b в группах с наибольшим применением авискумина (50 нг) показало, что анти-ОВА антитела подавлялись IgG1. Это служит показателем профиля Тх2 иммунного ответа.
Общие замечания
После первой и второй иммунизации никаких нежелательных явлений у животных не наблюдали.
Вывод
Исследования авискумина с антигенами HBsAg и ОВА показали наличие эффекта от применения адъюванта у мышей после подкожных иммунизаций (на 1 и 21 дни) при более высоких применяемых дозах (5 нг (50 нг/мл) и 50 нг (500 нг/мл)).
Т-клеточный ответ
Ответ CD4+ и CD8+ на HBsAg наблюдали в случае их применения вместе с авискумином (в дозировках 50 нг (500 нг/мл) и 5 нг (50 нг/мл)). В частности, ответу CD4+ Т-клетки в большой мере способствует авискумин.
Так как HBsAg отдельно вызывает определенный ответ CD8+ у белых мышей, как это известно, эффект авискумина как адъюванта усиливает этот исходный уровень.
Эти результаты показывают, что авискумин обладает свойствами адъюванта, в частности в отношении ответа CD4+ Т-хелперов.
Гуморальный иммунный ответ
Анти-HBsAg ответ был отрицательным, исключение составлял случай с одним животным из пяти. Известно, что антитела анти-HBsAg характеризуются медленной кинетикой. В таком случае, животные, у которых не обнаружили антител анти-HBsAg, с течением времени проявили бы положительный эффект. В идеальном варианте антитела определяются через 4 недели после иммунизации. Однако исследования были сфокусированы на ответе Т-клеток и поэтому животные умерщвлялись через 14 дней после иммунизации.
Анти-ОВА гуморальный иммунный ответ наблюдали на момент умерщвления животных, то есть, через 14 дней после иммунизации.
Определение изотипов анти-ОВА антител характеризует профайл Тх2 иммунного ответа. Это согласуется с наблюдаемым индуцированием CD4 Т-клеток.
Обобщающие результаты
Дозы авискумина в 50 нг (500 нг/мл) и 5 нг (50 нг/мл) на животное усиливают специфические ответы CD8 Т-клеток и, в особенности, CD4 Т-клеток на HBsAg, который является сложным липопротеиновым антигеном. Были определены специфические антитела к ОВА, имеющие Тх2 профиль.
Эти данные показывают, что авискумин оказывает эффект адъюванта с усиленным ответом CD4 Т-хелперов.
Дозы авискумина, при которых проявлялся усиленный иммунный ответ на HBsAg, были низкими.
Эффект авискумина как адъюванта, возможно, может быть усиленным изменением дозировок, или бустер-иммунизации, или базовой композиции с целью достижения определенных концентраций антител в каждом случае.
Описание фигур
Фиг. 1 описывает механизм действия неспецифических адъювантов (фигура из Lamine Mbow M et al. 2010 (выше)).
На Фиг. 2 показана секреция ИЛ-1β (пг/мл) из человеческих МКПК авискумином и ЛПС.
На Фиг. 3 показана секреция ИЛ-18 (пг/мл) из человеческих МКПК авискумином и ЛПС.
На Фиг. 4 показаны результаты исследования HBsAg-специфического ответа Т-клеток, при котором измеряли ответ CD8 Т-клеток белых мышей. Повторная стимуляция происходила с участием поверхностного эпитопа ГВ 28-39.
На Фиг. 5 показаны результаты исследования HBsAg-специфического ответа Т-клеток, при котором измеряли ответ CD4 Т-клеток белых мышей. Повторная стимуляция происходила с участием HBsAg.
На Фиг. 6 показаны результаты исследования анти-HBs гуморального иммунного ответа у белых мышей.
На Фиг. 7 показаны результаты исследования анти-ОВА гуморального иммунного ответа у черных мышей штамма C57BL/6.
На Фиг. 8 показана индуцированная авискумином секреция ИЛ-1β (пг/мл) из мононуклеарных клеток периферической крови (МКПК) добровольных доноров после выдерживания на протяжении 24 часов в присутствии ЛПС.
Реферат
Изобретение относится к области биотехнологии, конкретно к вакцинам, которые содержат антигены и адъювант, что может быть использовано в медицине. Рекомбинантным путем получают и отбирают адъювант из группы рекомбинантных лектинов омелы белой, не имеющей гликозилирования, который используют в вакцине, которую в свою очередь используют в качестве лекарственного средства и композиции. Изобретение позволяет получить эффективную вакцину, содержащую один антиген или более и, по меньшей мере, один адъювант. 5 н. и 8 з.п. ф-лы, 8 ил., 2 табл., 3 пр.
Формула
Документы, цитированные в отчёте о поиске
Рекомбинантный лектин омелы белой (rml)

Комментарии