Рекомбинантный лектин омелы белой (rml) - RU2241750C2
Код документа: RU2241750C2
Чертежи









Описание
Настоящее изобретение относится к молекулам нуклеиновых кислот, кодирующим препропротеины, которые после созревания проявляют биологическую активность димера лектина омелы белой, к векторам, содержащим эти молекулы нуклеиновых кислот, к трансформированным этими векторами организмам-хозяевам и к полипептидам или димерам полипептидов, кодируемым этими молекулами нуклеиновых кислот. Полипептиды согласно изобретению или соответственно димеры полипептидов применяются в разнообразных терапевтических целях. Следовательно, изобретение далее относится к иммунотоксинам, а также к лекарственным средствам, содержащим полипептиды или димеры полипептидов согласно изобретению. Изобретение также относится к композициям для диагностики, содержащим молекулы нуклеиновых кислот согласно изобретению, полипептиды или димеры полипептидов согласно изобретению и/или праймеры, которые специфически гибридизуются с молекулами нуклеиновых кислот по изобретению. Кроме того, изобретение относится к средствам защиты растений, содержащим полипептиды и/или димеры полипептидов согласно изобретению.
Экстракты омелы белой на протяжении многих столетий используются в терапевтических целях. С начала этого столетия препараты омелы белой с тем или иным успехом применяют в терапии рака (Bocci, 1993; Gabius и др., 1993; Gabius и Gabius, 1994; Ganguly и Das, 1994). Hajto и др. (1989, 1990) смогли показать терапевтические эффекты при использовании, в частности, так называемых лектинов омелы белой (вискумин, агглютинин Viscum album, VAA). В настоящее время помимо их цитотоксического действия обсуждается, в частности, неспецифическая стимуляция иммунного ответа, положительные эффекты которого используют для сопутствующей терапии и для долечивания больных с опухолями. Увеличение выживаемости таких больных, вероятно, происходит за счет выделения гомологичного эндорфина (Heiny и Beuth, 1994).
Многочисленные исследования in vitro (Hajto и др., 1990; Mannel и др., 1991; Beuth и др., 1993) и in vivo (Hajto, 1986; Hajto и др., 1989; Beuth и др., 1991; Beuth и др., 1992), а также клинические исследования (Beuth и др., 1992) подтверждают увеличенное выделение воспалительных цитокинов (фактор-α некроза опухоли (TNF-α), интерлейкин-1 (IL-1), интерлейкин-6 (IL-6)), а также активацию клеточных компонентов иммунной системы (ТH-клетки, натуральные клетки-киллеры (NK-клетки)).
В качестве активного начала экстракта омелы белой в настоящее время рассматривают протеин лектина омелы белой (ML) массой 60 кДа, который может быть получен биохимическим путем из экстрактов (Franz и др., 1977; Gabius и др., 1992). Протеин ML состоит из двух ковалентно соединенных дисульфидным мостиком субъединиц, чья А-цепь ответственна за ферментативную инактивацию рибосом (Endo и др., 1988), а В-цепь ответственна за связывание углеводов. Биологическая активность согласно известным к настоящему времени данным сводится в основном к лектиновой активности В-цепи (Hajto и др., 1990).
Однако на настоящий момент имеется недостаточно сведений о связи между структурой и активностью лектина омелы белой (ML). Так, например, неясен вклад отдельных цепей и присущей им различной биохимической и ферментативной активности в наблюдаемое действие или терапевтические эффекты ML-1. Анализ связи между структурой и активностью затруднен из-за загрязнения препаратов другими растительными веществами, входящими в состав омелы белой (Stein и Berg, 1994). В литературе описана зависимость активности препаратов экстракта от различных составов экстрактов, что, в свою очередь, зависит от вида дерева, из которого выделен экстракт (например, яблоня, сосна, тополь) (
С целью подробно исследовать терапевтическое действие лектина омелы белой желательно получить его в чистом виде как структурно гомогенное вещество. Далее для специалистов представляет интерес возможность получения ML или его составных частей в больших количествах в чистом виде, чтобы их, например, можно было использовать в качестве активной составной части лекарственных средств при промышленном получении последних. До настоящего времени с помощью известных способов, известных из уровня техники, в принципе не удавалось решить эти проблемы. При выделении из растительного источника при существующем уровне техники всегда получают гетерогенную смесь веществ.
Гетерогенность растительных препаратов лектина омелы белой является среди прочего результатом посттрансляционной обработки ML-1 в изоформы ML-2 и ML-3, так что в препаратах ML в зависимости от методики выделения или продолжительности ферментации обнаруживают разное содержание ML-1, ML-2 и ML-3 (
В основу настоящего изобретения, таким образом, была положена задача получить лектин омелы белой в чистом виде и в таких количествах, которые обеспечивают промышленное использование. Эта задача решается с помощью различных вариантов выполнения, представленных в формуле изобретения изобретения.
Таким образом, изобретение относится к молекуле нуклеиновой кислоты, которая (а) кодирует препропротеин, который после созревания проявляет биологическую функцию, свойственную димеру лектина омелы белой, и характеризуется представленной на фиг.4в нуклеотидной последовательностью; (б) кодирует фрагмент препропротеина согласно пункту (а), причем фрагмент является биологически активной составной частью димера лектина омелы белой; (в) отличается от молекулы нуклеиновой кислоты согласно пунктам (а) или (б) вследствие вырожденности генетического кода или (г) в строгих условиях гибридизуется с молекулой нуклеиновой кислоты согласно пунктам (а), (б) или (в) и кодирует полипептид с указанной в пункте (а) или (б) биологической функцией, соответственно активностью.
Исходя из последовательностей гена лектина омелы белой, сначала могут быть получены рекомбинантные высокочистые отдельные цепи (rMLA, rMLB), которые могут быть реассоциированы in vitro, что тем самым приведет к получению голопротеина rML, являющемуся химически, ферментативно и структурно гомогенным. Реассоциированный рекомбинантный протеин не проявляет изменчивости и микрогетерогенности, прежде всего в отношении первичной структуры и посттрансляционных модификаций (гликозилирования, фосфорилирования), и наиболее пригоден для терапевтических целей как в виде голопротеина, так и в виде части цепи и в виде субфрагментов.
Под понятием "фрагмент" препротеина лектина омелы белой подразумевается каждый фрагмент согласно изобретению (не только естественного происхождения), который является биологически активной составной частью димера лектина омелы белой. Для специалиста в данной области техники очевидно, что под подобной биологически активной составной частью димера лектина омелы белой подразумеваются такие составные части, которые являются составными частями отдельных цепей димера. При этом очевидно также, что отдельные цепи или их фрагменты, которые являются составной частью представленной на фиг.4в последовательности, являются объектом изобретения.
Термин "естественный" в сочетании с выражением "составная часть лектина омелы белой" в контексте настоящего изобретения означает, что таким образом обозначенный фрагмент либо представляет собой цепь димера лектина омелы белой, либо является субфрагментом цепи, который естественным образом присутствует в цепи. Эти фрагменты преимущественно являются биологически активными.
Под термином "биологически активный" согласно изобретению подразумевается, что эти фрагменты обладают по меньшей мере одной биологической функцией, присущей цепям или димеру, как это представлено в данном описании, или любой другой биологической функцией отдельных цепей или димера. Кроме того, под термином "биологически активный" подразумевается также фармакологическая и/или иммунологическая активность.
С помощью рекомбинантных протеинов ML впервые стало возможным дополнительное экспериментальное изучение вклада отдельных доменов или субдоменов. Рекомбинантные протеины ML и рекомбинантные субъединицы/части цепей составляют основу соответствующих определенных препаратов, содержащих одно из этих веществ, в качестве замены препаратам, представляющим собой экстракты, и стандартизированным экстрактам.
Неожиданно было обнаружено, что клонирование гена, кодирующего лектин омелы белой, может быть осуществлено на основе новой стратегии клонирования, после того, как общепринятые стратегии клонирования не привели к успеху.
Известен целый ряд данных о химических свойствах протеина лектина омелы белой ML-1. К ним наряду с молекулярным весом и строением субъединиц относятся, в частности, короткие N-концевые пептиды, аминокислотные последовательности которых независимо описаны Dietrich и др. (1992) и Gabius и др. (1992) [см. также патент Германии 4221836]. Исходя из N-концевых пептидов А- или В-цепи, на основании их аминокислотного состава из-за высокой степени врожденности производных последовательностей нуклеиновых кислот практически невозможно получить синтетические олигонуклеотиды, степень вырожденности которых достаточно низка, чтобы при скрининге геномных библиотек обеспечить идентификацию фрагментов гена ML. Это также относилось и к банку генов кДНК, полученных с помощью поли-(А+)-РНК из Viscum album.
Полимеразная цепная реакция (ПЦР) позволяет осуществлять амплификацию участков ДНК, расположенных между известными участками (Erlich и др., 1988). С помощью смыслового олигонуклеотида для N-конца MLA и антисмыслового олигонуклеотида для N-конца MLB стала возможной амплификация расположенного между ними участка гена ML, не содержащего интрон (фиг.1а). Однако на практике анализ N-концевой последовательности В-цепи показывает, что степень вырожденности (количество возможных комбинаций олигонуклеотидов) при этом все еще слишком высока для успешного проведения этого процесса. Это, в частности, связано с тем, что последовательности N-конца В-цепей непригодны для построения олигонуклеотида, вследствие чего амплификация последовательностей гена ML, исходя из известных участков аминокислотных последовательностей, не практикуется (фиг.1б).
Для клонирования гена ML с помощью измененной стратегии ПЦР исследовали возможность использования для построения амплифицированных олигонуклеотидов дополнительных данных о протеинах, в частности, основанных на родстве лектина омелы белой с классом инактивирующих рибосомы протеинов типа I и типа II (ПИР) (Stirpe и др., 1992). Основываясь на многочисленных структурах, присущих (а) ПИР типа I и А-цепям рицина, а также (б) В-цепям абрина и рицина, было идентифицировано в целом 8 консервативных участков последовательности. Исходя из этих участков последовательностей с учетом кодонов, используемых в родственных видах, был построен 21 олигонуклеотид, и все эти олигонуклетиды использовали в различных комбинациях в более чем 200 экспериментах по амплификации. Однако ни в одном из случаев не были получены специфические продукты амплификации даже несмотря на то, что условия ПЦР, относящиеся к температуре отжига, содержанию Mg2+, а также к параметрам цикла, варьировали в широких пределах.
Ни скрининг геномных банков и банков кДНК, ни применение техники ПЦР не позволили с учетом приведенных выше рассуждении определить последовательности, специфичные для ДНК ML.
Поэтому был начат поиск новых путей использования дополнительных данных о структуре рицина и абрина для построения олигонуклеотидов в результате амплификации.
Поскольку ферментативный механизм, присущий ПИР, в частности, ПИР типа II рицина, подобен механизму ML (Endo и др., 1988а + 19886), нельзя было исключить того, что между ними также имеется структурное подобие в области функционально активных участков первичной и третичной структур. Исходя из кристаллической структуры рицина (Katzin и др., 1991; Rutenberg и Robertus, 1991; Weston и др., 1994), анализ пластичности А-цепи рицина свидетельствовал о малой мобильности Arg180, который находится внутри консервативного участка последовательности. Далее был проведен анализ возможных в данном случае замещений аминокислот на этом участке активного центра на основании стерического расположения основного участка цепи, принимая во внимание взаимодействие с субстратом. Указанные результаты были получены только при оценке всевозможных достраиваний последовательности А-цепи рицина и других последовательностей, относящихся к ПИР типа I.
За счет дополнения результатов сравнения последовательностей сведениями о структуре получили данные о вероятном включении определенных остатков аминокислот в определенные положения. Благодаря этому стало возможным определить ряд теоретических аминокислотных последовательностей для этой области ML и с помощью этого построить соответствующий, чрезвычайно мало вырожденный олигонуклеотид (RMLA2) (фиг.1в).
Другие фрагменты могли быть получены только при комбинации RMLA1 (вырожденный олигонуклеотид, полученный на базе N-концевой аминокислотной последовательности А-цепи ML; ср. фиг.1б) и построенного на основании вышеупомянутых рассуждении при определенных параметрах ПЦР олигонуклеотида "активного сайта" RMLA2, исходя из комплексной геномной ДНК ML, после того, как все относящиеся к этому альтернативные подходы, как описано выше, были безрезультатными.
Дополнительную информацию о последовательности гена получили только с использованием специфического невырожденного олигонуклеотидного праймера, полученного на основании частично определенной последовательности гена MLA в результате клонирования и секвенирования фрагмента "a" (фиг.3), и вырожденных олигонуклеотидов, полученных в результате достраиваний последовательностей ПИР типа I и рицина/абрина при дальнейших ПЦР-амплификациях. Для построения вырожденных олигонуклеотидов для В-цепей использовали достраивания последовательностей В-цепей рицина и абрина, где также были найдены отдельные участки более высокой инвариантности.
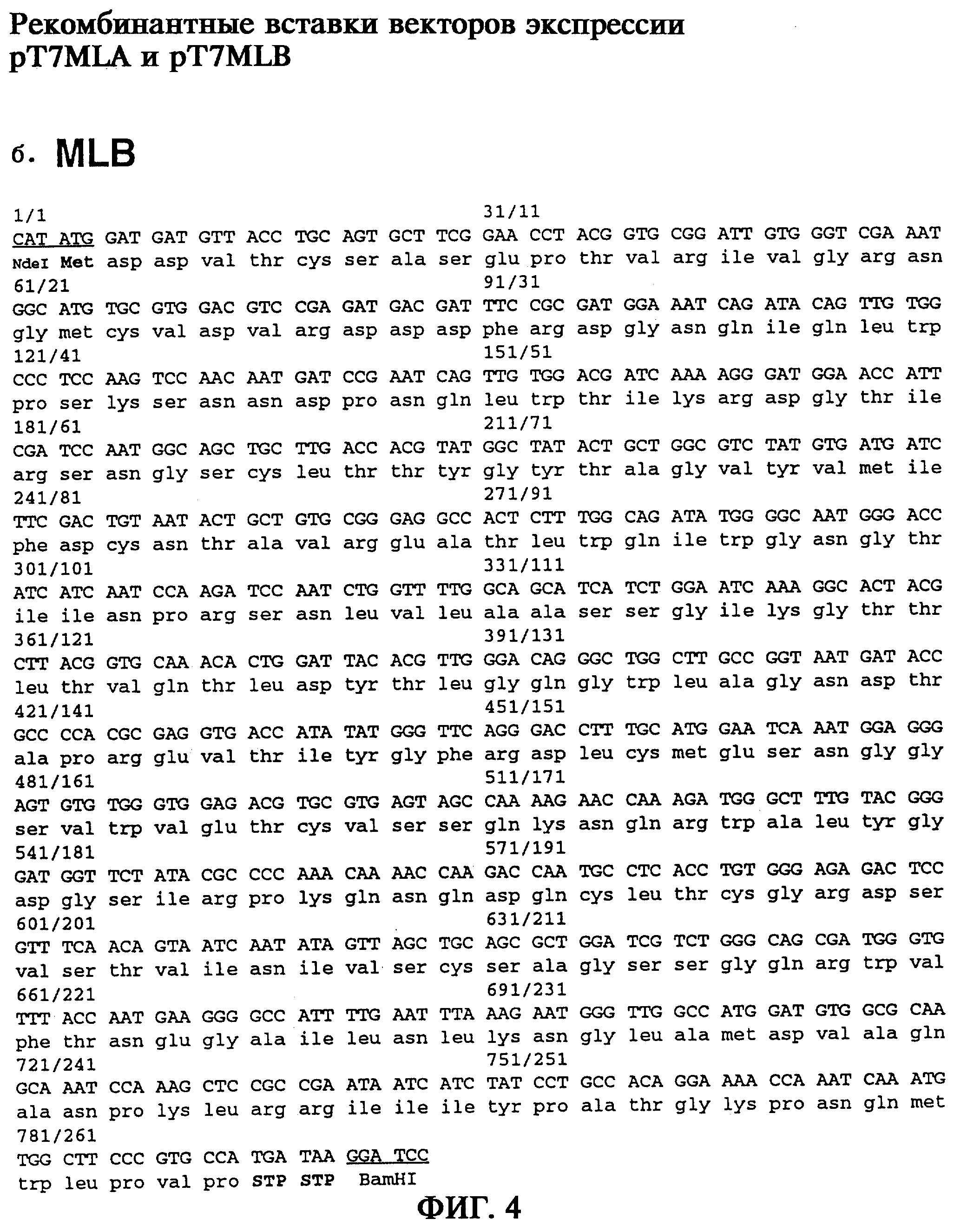
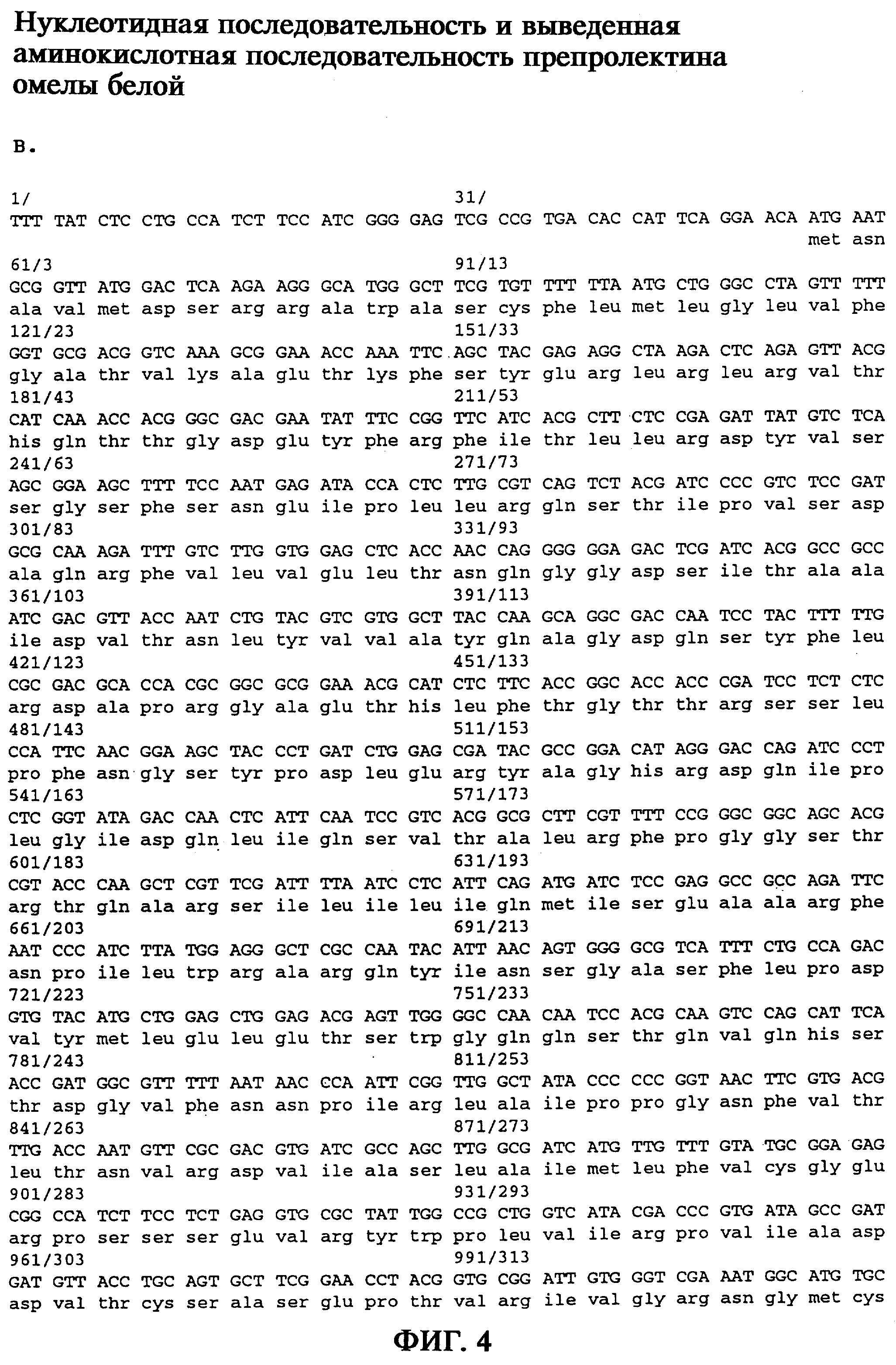
Для получения 5’- и 3’-концов голопротеина путем обратной транскрипции были синтезированы фрагменты В-цепей, а также 5’- и 3’-концевые нетранслируемые участки, исходя из выделенной РНК омелы белой, аналогичной кДНК, и с помощью методики быстрой амплификации мРНК и кДНК с использованием ПЦР (RACE-метод) (Frohman и др., 1988) получали соответствующие участки гена. После получения в каждом случае большого числа перекрывающихся фрагментов гена (фиг.3) затем с помощью специфической ПЦР были получены полные участки генов, кодирующих А-цепи и В-цепи, исходя в каждом случае из комплексной геномной ДНК омелы белой. Последовательности генов rMLA и rMLB с концевыми модификациями представлены на фиг.4а и фиг.4б. На фиг.4в представлены как 5’- и 3’-нетранслируемые участки, так и полная последовательность гена ML, охватывающая участки гена, кодирующие эндопептид и сигнальный пептид.
В предпочтительном варианте осуществления изобретения молекула нуклеиновой кислоты является фрагментом А-цепи лектина омелы белой, которая кодируется представленной на фиг.4а (MLA) нуклеотидной последовательностью.
В другом предпочтительном варианте осуществления изобретения молекула нуклеиновой кислоты является фрагментом В-цепи лектина омелы белой, которая кодируется нуклеотидной последовательностью, представленной на фиг.4б (MLB).
Другой предпочтительный вариант осуществления изобретения относится к молекуле нуклеиновой кислоты, которая является молекулой ДНК.
Согласно изобретению под понятием "молекула ДНК" подразумевают как геномную, так и молекулу кДНК или полусинтетическую молекулу ДНК. Способы получения этих различных молекул ДНК известны специалистам в данной области техники.
В другом предпочтительном варианте осуществления изобретения молекулой нуклеиновой кислоты является молекула РНК.
Далее изобретение относится к молекуле нуклеиновой кислоты, которая является антисмысловой нитью к вышеописанной молекуле нуклеиновой кислоты по изобретению. Такая антисмысловая нить может быть, например, использована для ингибирования транскрипции в случае проведения исследований по экспрессии или регуляции в растении.
Изобретение далее относится к вектору, который содержит по меньшей мере одну молекулу нуклеиновой кислоты по изобретению.
Вектор согласно изобретению может, например, содержать одну единственную молекулу нуклеиновой кислоты согласно изобретению, которая кодирует весь препропротеин лектина омелы белой. Поскольку этот вектор является вектором, экспрессирующим препропротеин, он может быть получен в пригодном для этой цели трансформированном хозяине, а мономерные фрагменты могут соединяться in vivo или in vitro в димер лектина омелы белой. В другом варианте осуществления изобретения предлагаемый вектор является вектором, который предназначен исключительно для воспроизведения нуклеиновой кислоты согласно изобретению.
В предпочтительном варианте осуществления изобретения предлагаемый вектор содержит не только молекулу нуклеиновой кислоты, которая кодирует А-цепь лектина омелы белой или ее фрагмент, но также молекулу нуклеиновой кислоты, кодирующую В-цепь или ее фрагмент. Фрагменты мономеров являются преимущественно биологически активными.
В другом предпочтительном варианте осуществления изобретения вектор по изобретению является вектором экспрессии. Специалистам в данной области техники известно, каким образом можно получить приемлемые векторы экспрессии для различных организмов-хозяев.
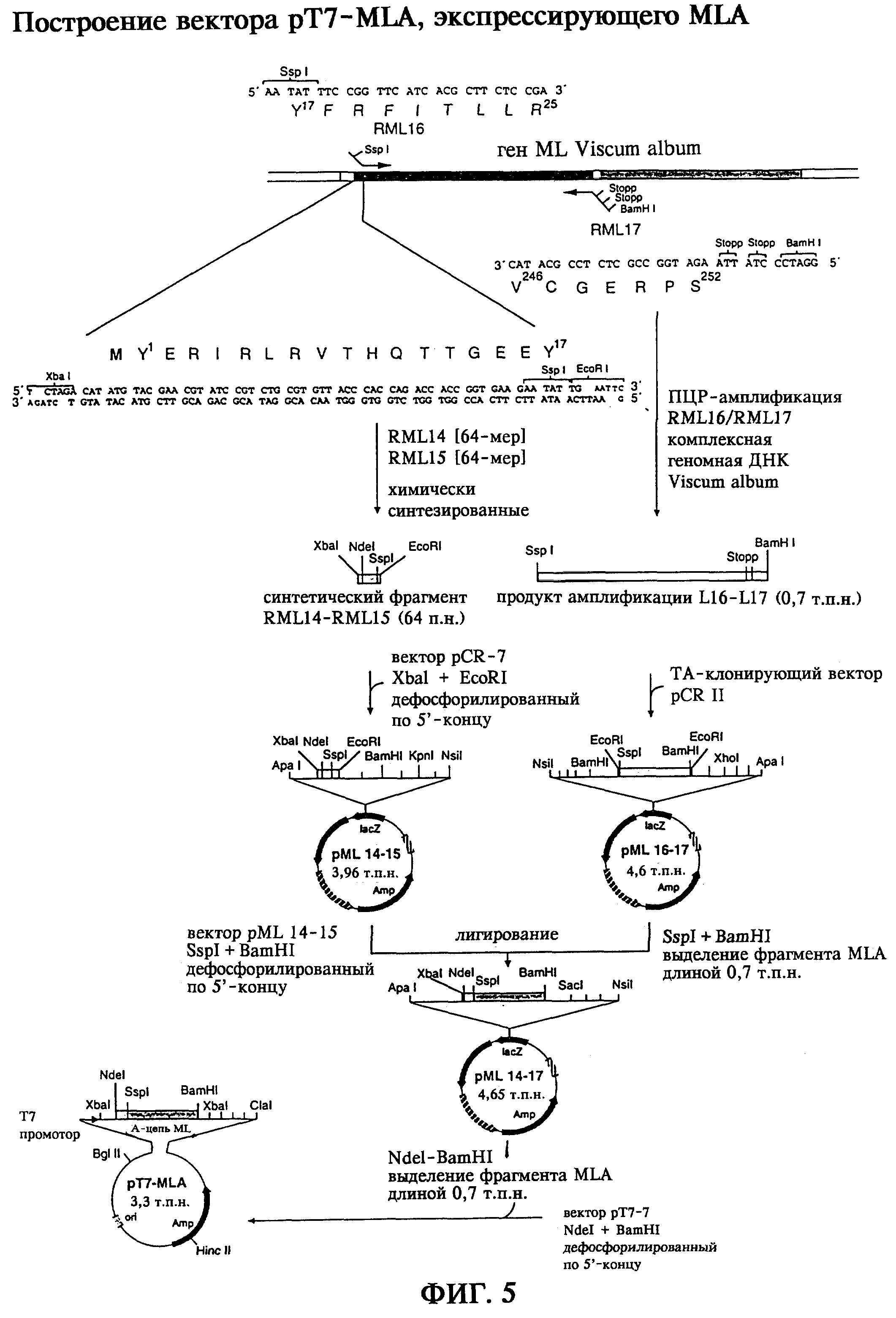
Согласно изобретению для гетерологичной экспрессии исходя из комплексной геномной ДНК омелы белой с помощью специфической ПЦР была получена последовательность, кодирующая А-цепь лектина омелы белой. При этом с помощью некомплементарных участков встроенных олигонуклеотидных праймеров вводили элементы, контролирующие трансляцию, а также последовательности, которые распознаются эндонуклеазами рестрикции, благодаря чему, исходя из рассматриваемого геномного гена препролектина омелы белой, были возможны клонирование и раздельная экспрессия А-цепи лектина омелы белой.
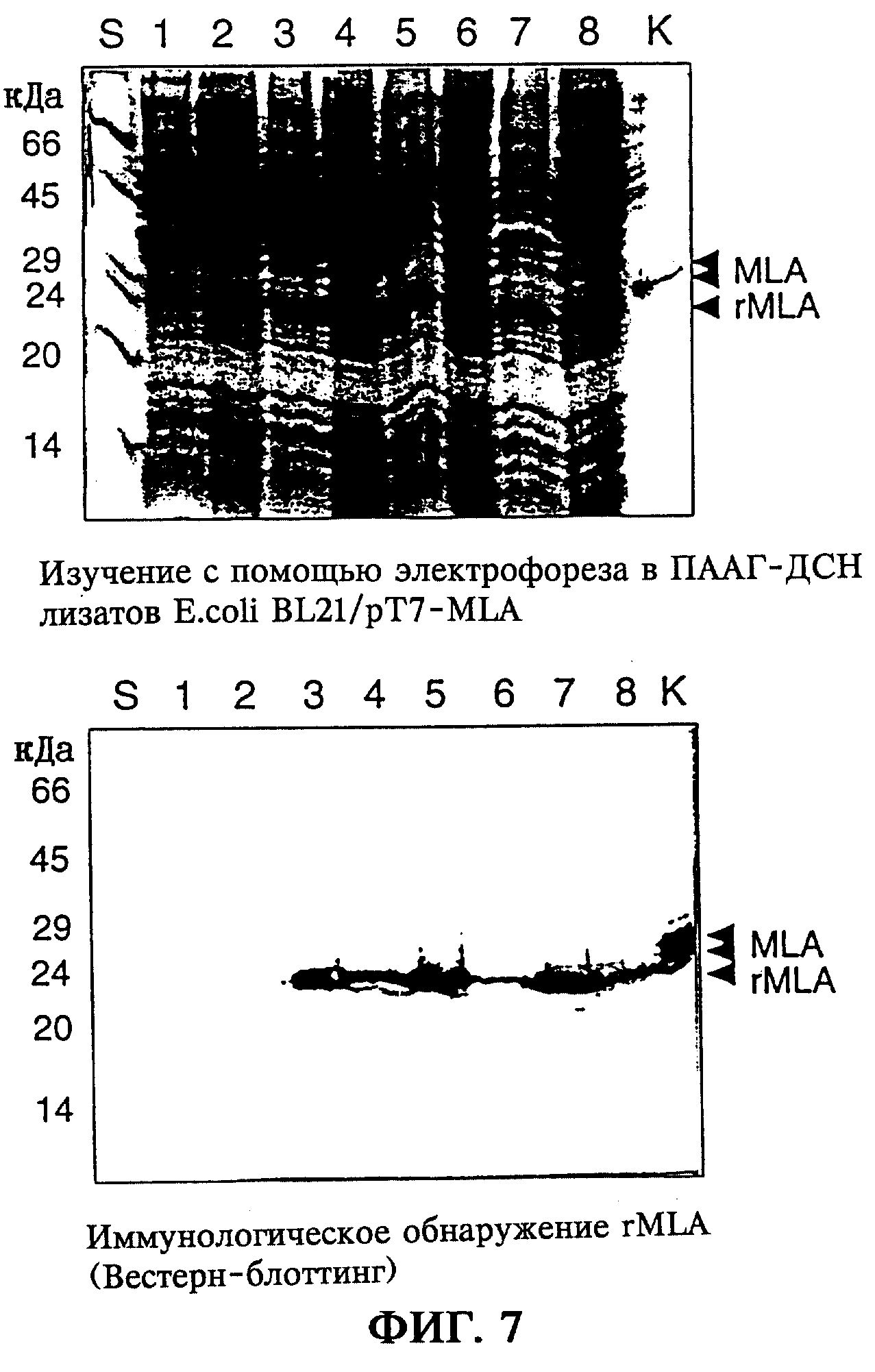
Участок на 5’-конце кодирующей rMLA последовательности, соответствующий аминокислотным остаткам тирозин1-тирозин17 (Dietrich и др., 1992; Gabius и др., 1992), был получен при встраивании перед кодоном, инициирующим трансляцию синтетического фрагмента гена, с помощью гибридизации и клонирования двойных олигонуклеотидов. Была осуществлена оптимизация последовательности гена относительно выбора кодона, как это описано для сильно экспрессирующегося в Escherichia coli гена (Gribskov и др., 1984). На 3’-конце синтетического генного фрагмента rMLA, а также на 5’-конце полученного с помощью ПЦР фрагмента гена rMLA с помощью целенаправленной замены кодона тирозина17 ТАС на ТАТ был введен сайт рестрикции, получаемый при расщеплении рестриктазой Ssp I, который делал возможным соединение обоих генных фрагментов rMLA при получении вектора pML14-17 (фиг.5). Была секвенирована кодирующая rMLA последовательность (фиг.4а). Для экспрессии rMLA в Escherichia coli последовательность гена выделяли из вектора pML14-17 и встраивали в экспрессирующий вектор рТ7-7 (Studier и Moffart, 1986) под контролем промотора Т7-РНК-полимеразы, а также терминатора транскрипции. С помощью полученного в результате экспрессирующего вектора pT7-MLA (фиг.5) трансформировали штамм E.coli BL21. Индукция экспрессии гена сопровождается появлением полосы протеина, соответствующей А-цепи негликозилированного рекомбинантного лектина омелы белой, имеющего относительную молекулярную массу 25 кДа. Обнаружение и идентификацию рекомбинантного продукта экспрессии осуществлял с помощью Вестерн-блоттинга с использованием антитела, специфичного к MLA (фиг.7).
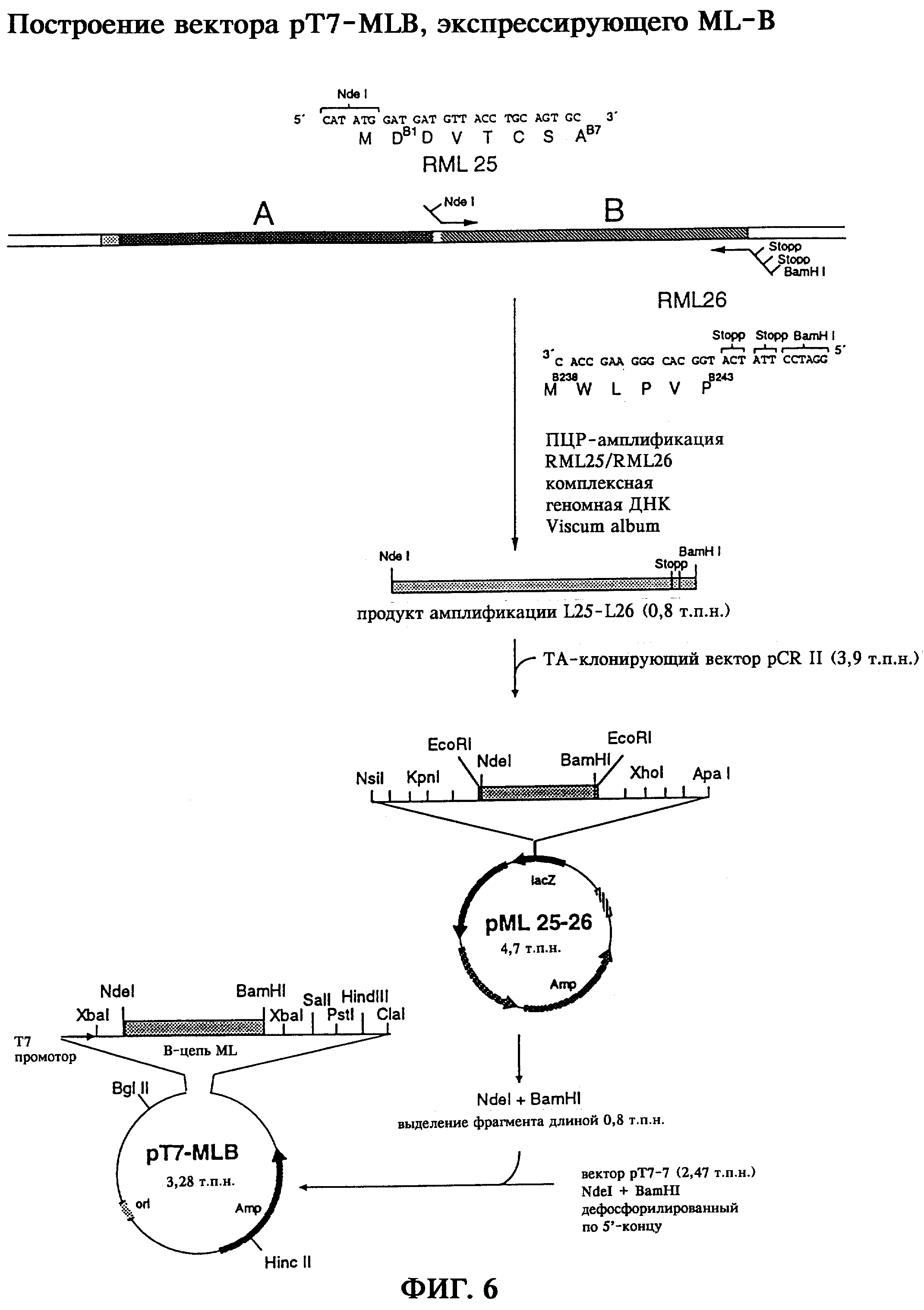
Для гетерологичной экспрессии В-цепи лектина омелы белой полная кодирующая MLB последовательность из комплексной геномной ДНК Viscum album была амплифицирована с помощью специфической ПЦР, причем с помощью некомплементарных участков встроенных олигонуклеотидных праймеров были введены элементы, контролирующие трансляцию, а также последовательность, узнаваемая эндонуклеазой рестрикции (фиг.6). Полученный в результате ПЦР продукт длиной 0,8 т.п.н. после клонирования в ТА-клонирующем векторе pCRII был встроен в вектор экспрессии рТ7-7 под контролем элементов, контролирующих транскрипцию, и с помощью полученного в результате вектора экспрессии pT7-MLB был трансформирован штамм E.coli BL21.
Правильность кодирующей rMLB последовательности была подтверждена при ее секвенировании (фиг.4б). Экспрессию удалось подтвердить с помощью Вестерн-блоттинга при использовании антитела, специфичного к MLB (TB33, Tonevitsky и др., 1995), при этом через 2 часа после индукции экспрессии гена появлялся иммунореактивный протеин с относительной молекулярной массой 31 кДа, соответствующий В-цепи негликозилированного рекомбинантного лектина омелы белой (фиг.7б). Анализ клеточных фракций после соответствующей обработки клеток E.coli показал распределение синтезированной В-цепи rML в растворимой фракции в надосадочной жидкости, а также нерастворимой фракции в "тельцах включения", т.е. в осадке после обрабтки клеток E.coli, причем через 4 часа после индукции доля растворимой или нерастворимой фракции составляла соответственно 50% от общего выхода (фиг.7б).
Далее изобретение относится к организму-хозяину, который трансформирован по меньшей мере одним вектором согласно изобретению.
В зависимости от целей с помощью организма-хозяина согласно изобретению могут быть получены лишь один из обоих мономеров или комбинации обоих мономеров, преимущественно в виде ассоциированного димера. Организм-хозяин по изобретению может быть эукариотической или прокариотической клеткой, трансгенным растением или трансгенным животным.
Преимущественно организм-хозяин по изобретению является клеткой млекопитающего, растительной клеткой, бактерией, клеткой гриба, клеткой дрожжей, клеткой насекомого или трансгенным растением.
В особенно предпочтительном варианте осуществления изобретения организмом-хозяином согласно изобретению является бактерия E.coli, клетка Aspergillus или клетка Spodoptera, предпочтительно клетка Spodoptera frugiperda.
Далее изобретение относится к полипептиду, который кодируется молекулой нуклеиновой кислоты согласно изобретению или вектором согласно изобретению и/или продуцируется организмом-хозяином согласно изобретению.
Полипептид согласно изобретению проявляет преимущественно биологическую активность, свойственную А-цепи или В-цепи лектина омелы белой. В других вариантах осуществления изобретения полипептид согласно изобретению может, однако, проявлять также часть биологической активности или совсем не проявлять биологической активности. Под термином "часть биологической активности" согласно изобретению подразумевают или пониженную активность или/и ряд видов активности из спектра биологической активности. Полипептид согласно изобретению может быть также фрагментом А- или В-цепи, который проявляет одно из названных выше свойств.
Исследование свойств rMLA, rMLB и голопротеина rML
(I) Относительные молекулярные массы и структура
Относительные молекулярные массы определяли с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (ЭПААГ-ДСН) и в присутствии восстанавливающих агентов и последующего окрашивания протеина с помощью серебряного красителя или кумасси бриллиантового синего или иммунологического обнаружения в рамках Вестерн-блоттинга.
Неожиданно при этом было обнаружено, что рекомбинантная негликозилированная А-цепь лектина омелы белой имеет относительную молекулярную массу 25 кДа и, таким образом, существенно отличается от природных А-цепей лектина омелы белой А1 (31 кДа) или А2 (29 кДа). Это различие в относительной молекулярной массе является неожиданным прежде всего потому, что согласно уровню техники исходили из того, что А-цепь не гликозилирована. Рекомбинантная В-цепь лектина омелы белой имеет относительную молекулярную массу 31 кДа и поэтому существенно легче, чем гликозилированная природная В-цепь лектина омелы белой с относительной молекулярной массой 36 кДа (фиг.7).
Присущая природным протеинам ML гетерогенность по причине гликозилирования и/или вариаций последовательностей, которая проявляется в геле в присутствии ДСН в виде широкой полосы, не наблюдается ни в одном из исследуемых случаев для рекомбинантных видов.
Относительные молекулярные массы реассоциированного голопротеина rMLA/rMLB (rML) суммируются до 56 кДа по сравнению с тяжелым природным голопротеином (nML) с относительной молекулярной массой 65-67 кДа.
(II) Изоэлектрическая гомогенность
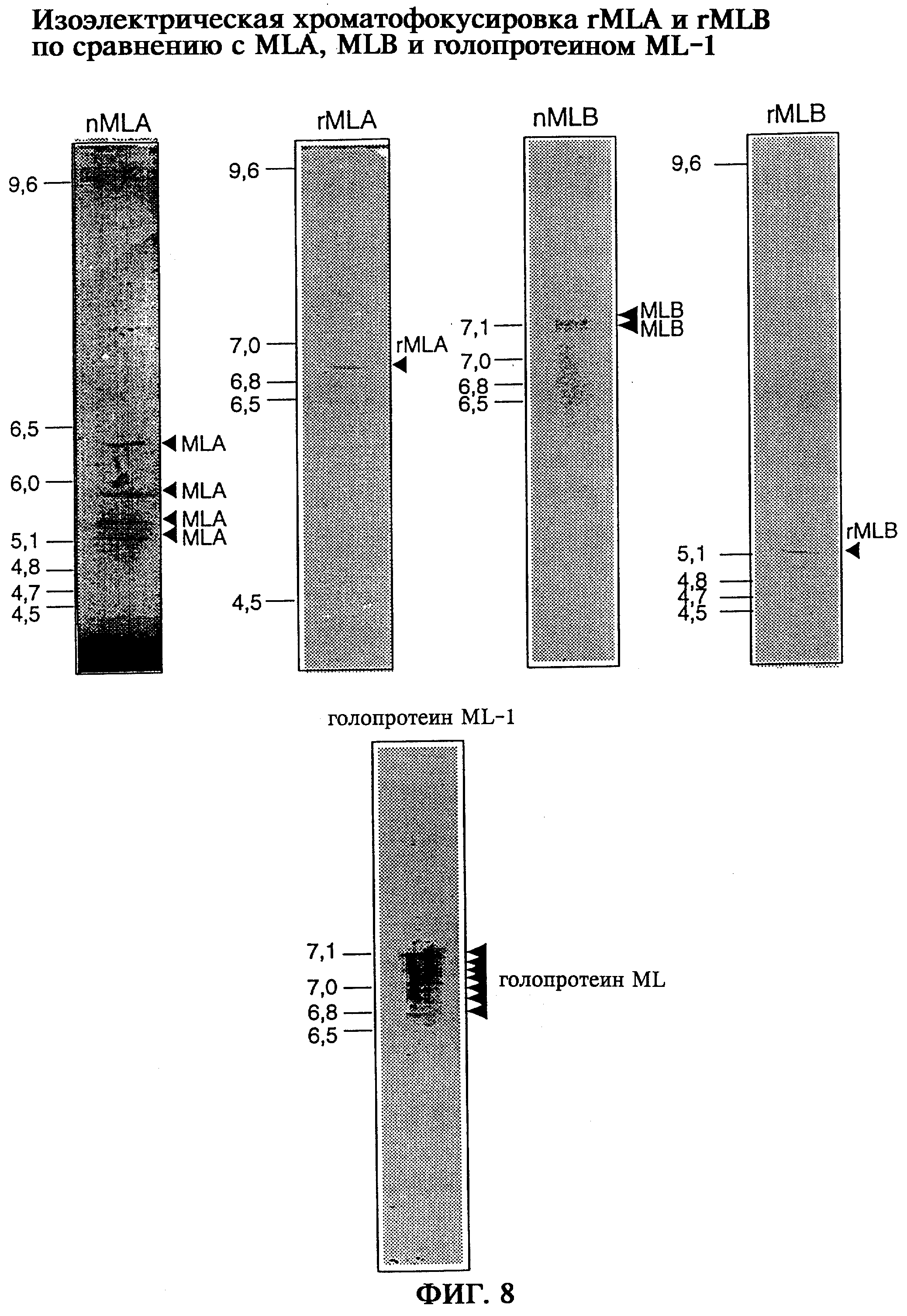
rMLA обнаруживается как изоэлектрически гомогенный протеин с изоэлектрической точкой 6,8 в отличие от высокочистых природных А-цепей лектина омелы белой, которые подразделяются на четыре вида с изоэлектрическими точками 5,2; 5,4; 5,7 и 6,2 (фиг.8).
rMLB обнаруживается как изоэлектрически гомогенный протеин с изоэлектрической точкой 5,1 в отличие от природной В-цепи лектина омелы белой, которая подразделяется по меньшей мере на 2 вида с изоэлектрическими точками 7,1 и 7,3 (фиг.8).
При этом природный голопротеин ML обнаруживает большое число вариантов молекул и комбинаций молекул (фиг.8 внизу), в то же время для рекомбинантных протеинов лектина омелы белой выявляется однородная подвижность при хроматофокусировке с изоэлектрофокусировкой, что свидетельствует о гомогенности rML в отличие от микрогетерогенности природных видов протеинов.
(III) Ферментативная активность rMLA
При включении очищенных с помощью иммуноафинной хроматографии препаратов rMLA в спаренный опыт по транскрипции/трансляции была обнаружена ингибирующая трансляцию активность rMLA (выделенной из растворимой фракции продукта экспрессии) и rMLA (выделенной из нерастворимой фракции в "тельцах включения").
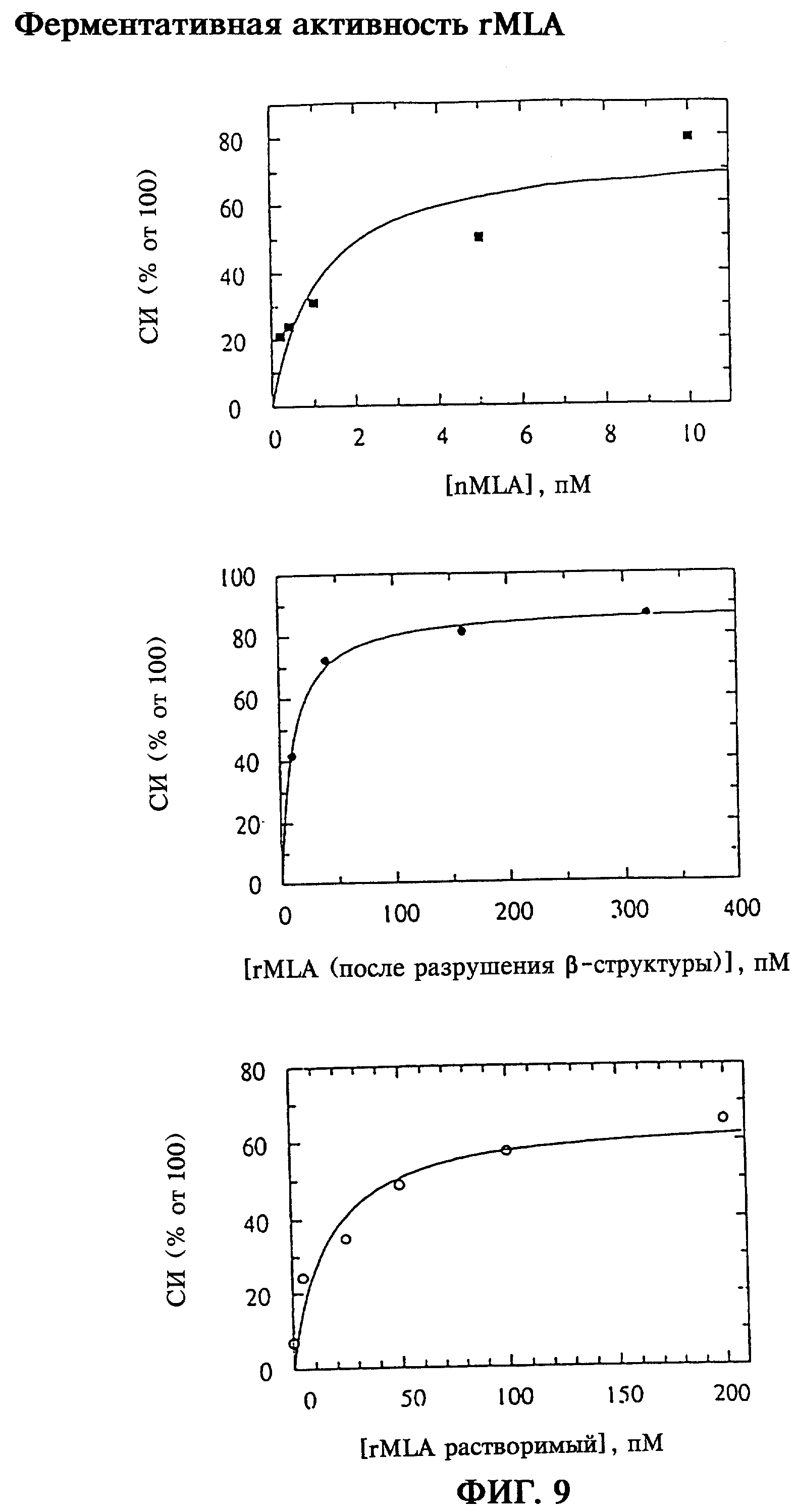
rMLA при сравнении с природной цепью лектина омелы белой проявляет отличающуюся ингибиторную характеристику в отношении зависимости степени ингибирования трансляции от дозы, а также в отношении неингибируемой остаточной активности трансляции в используемом лизате ретикулопитов (фиг.9). Свойство фермента, лежащее в основе токсического действия голопротеинов ML, существенно меньше в рекомбинантных видах.
(IV) Активность rMLB в отношении связывания углеводов
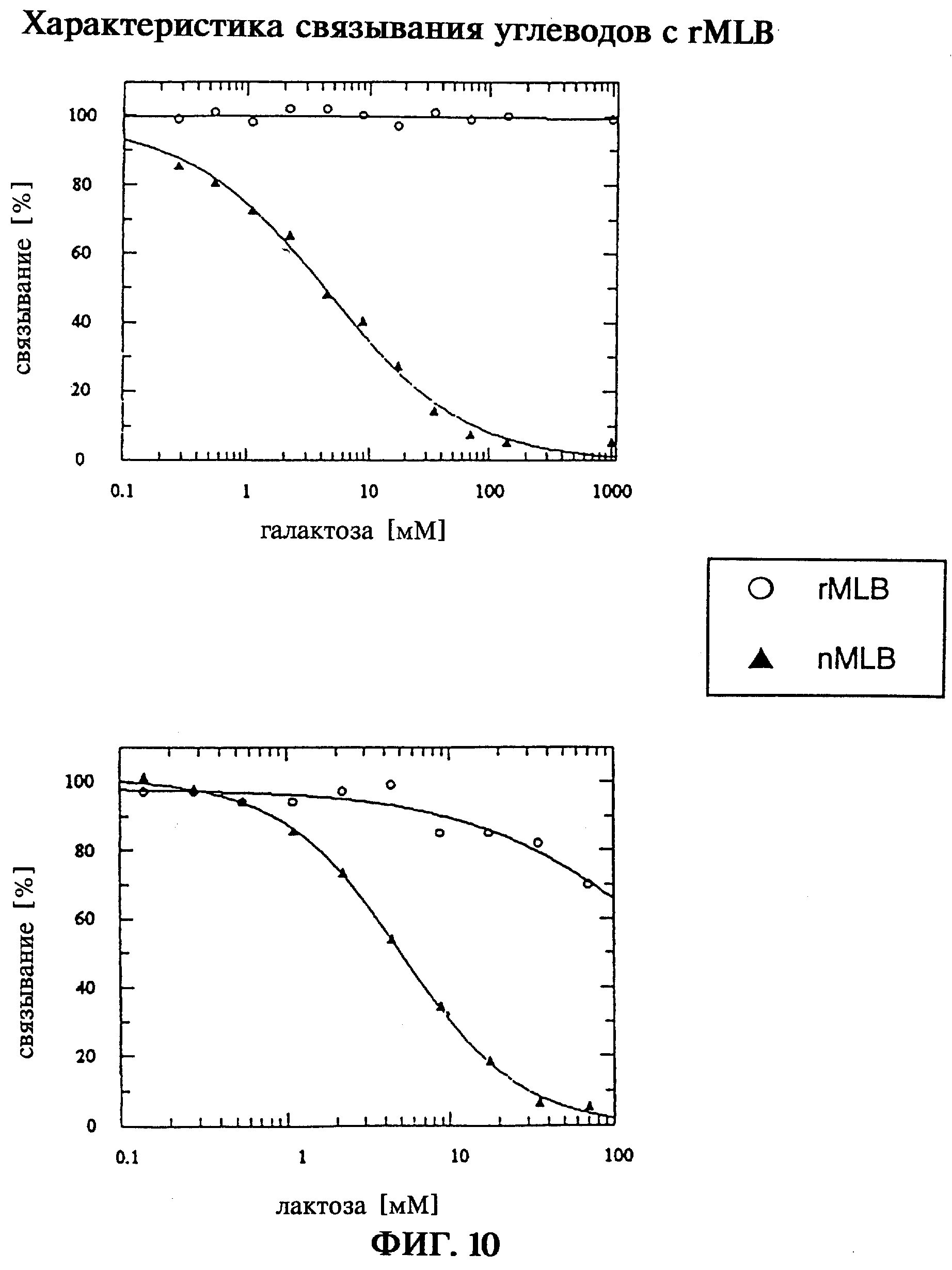
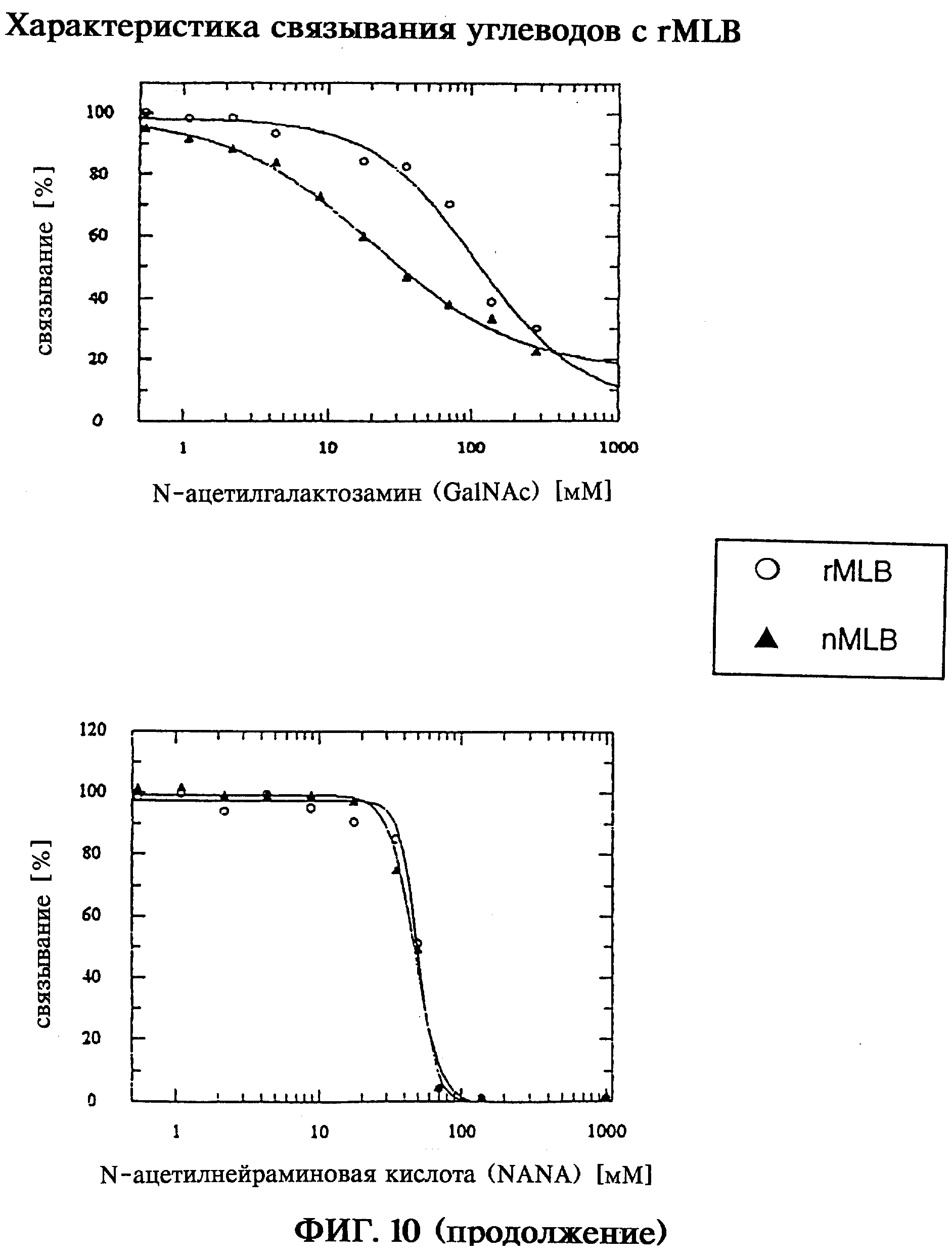
В-цепи rML, которые получают путем ренатурации и реокисления из первичных продуктов экспрессии, а также реассоциированные in vitro rMLA/rMLB, rMLA/MLB и голопротеины MLA/rMLB проявляют активность в отношении связывания углеводов, которая может быть обнаружена при анализе с помощью лектинсвязывающего фермента (ELLA) по связыванию с углеводными асиалофетуиновой или фетуиновой матрицами. Специфичность в отношении углеводов рекомбинантной В-цепи rML может быть определена и количественно оценена в ELLA-системе в условиях конкурентного связывания с галактозой, β-лактозой, N-ацетилгалактозамином (Ga1NAc) и сиаловой кислотой (N-ацетилнейраминовой кислотой, NANA). При ELLA-тесте в конкурентных условиях неожиданно обнаруживают различную специфичность nMLB и rMLB в отношении углеводов. Сродство к связыванию описывают при этом с помощью специфических для системы значений ИК50 для полумаксимального вытеснения протеинов с иммобилизованного асиалофетуинового лиганда галактозой (ИК50 nMLB: 4,5 мМ; ИК50 rMLB: вследствие незначительного взаимодействия определить невозвожно), β-лактозой (ИК50 nMLB: 4,9 мМ; ИК50 rMLB: >70 мМ), N-ацетилгалактозамином (ИК50 nMLB: 20,7 мМ; ИК50 rMLB: 109 мМ) или с иммобилизованного фетуинового лиганда сиаловой кислотой (ИК50 nMLB: 49,8 мМ; ИК50 rMLB: 47,1 мМ).
В то время как природная В-цепь nML, описанная как специфичный к галактозе лектин, как и ожидалось, может конкурировать с галактозой и β-лактозой, полученная в E.coli рекомбинантная В-цепь rML не обнаруживает никакого выявляемого взаимодействия с галактозой и обнаруживает незначительное взаимодействие с β-лактозой. Рекомбинантная rMLB обладает четким сродством к N-ацетилгалактозамину и сиаловой кислоте и при этом неожиданно обнаруживает при сравнении с растительной nMLB четкое смещение углеводной специфичности лектина к специфичности в отношении N-ацетилгалактозамина/сиаловой кислоты. Вследствие этого, принимая во внимание биологическую активность rMLB и rMLB-содержащих голопротеинов, можно использовать более широкий или разнообразный спектр лигандов, рецепторов или целевых клеток по сравнению с растительными протеинами лектина омелы белой.
В предпочтительном варианте полипептид согласно изобретению содержит по меньшей мере одну химическую или ферментативную модификацию.
Эта модификация при необходимости может привести к изменению известной биологической активности полипептида, понизить ее или повысить. Подобная модификация может, например, быть осуществлена после трансляции и выделения полипептида. С другой стороны, подобные модификации могут быть получены при химическом или полусинтетическом получении полипептида согласно изобретению. Эти модификации с помощью известных способов могут быть использованы с той целью, чтобы изменить, предпочтительно улучшить, фармакологическую активность лектина омелы белой.
В другом предпочтительном варианте полипептид согласно изобретению является слитым протеином. Слитый протеин проявляет преимущественно указанную выше определенную биологическую активность.
Этот вариант предлагаемого полипептида преимущественно предназначен для изменения или предпочтительно улучшения фармакологических свойств полипептида лектина омелы белой в отношении его направленного воздействия на клеточном уровне.
Далее изобретение относится к димеру полипептида с биологической активностью лектина омелы белой, причем оба мономера кодируются молекулами нуклеиновых кислот по изобретению.
Под термином "биологическая активность лектина омелы белой" подразумевается любая биологическая активность из спектра всех видов биологической активности, присущих лектину омелы белой. Подобной активностью является, например, фармакологическое действие лектина омелы белой.
В многочисленных линиях опухолевых клеток человека и животного растительный ML-1 вызывал гибель клеток с помощью механизмов апоптоза (Janssen, 1993). ML-1 или только его В-цепь индуцировали выделение цитокинов из периферических одноядерных клеток здоровых людей, служивших донорами крови (Hajto, 1990). У нейтрофильных гранулоцитов больных раком ML-1 индуцировал секрецию супероксидных ионов (Timoshenko, 1993). ML-1 индуцировал экспрессию А-цепи рецептора интерлейкина-2 (CD25) или антигена HLA-DQ у периферических лимфоцитов здоровых людей, служивших донорами крови (Beuth, 1992). После применения ML-1 у мышей было отмечено увеличение числа клеток тимуса, количества цитотоксичных Т-лимфоцитов (Lyt-2+) и Т-клеток-хелперов (L3T4+) в тимусе и число перитонеальных макрофагов, а именно тех, которые переносили маркер активации МАС-3 (Beuth, 1994). Кроме того, было повышено отношение L3N4+/Lyt2+ в тимусе исследуемых животных. В периферической крови мышей после обработки ML-1 в целом была повышена плотность лейкоцитов, лимфоцитов, моноцитов и именно лимфоцитов, которые экспрессируют рецептор интерлейкина-2 в качестве поверхностного маркера активации клетки, а также моноцитов, которые экспрессируют маркер активации МАС-3 (Beuth, 1994). В крови больных раком ML-1 повышал плотность Т-лимфоцитов (CD4+, CD8+), естественных клеток-киллеров и В-лимфоцитов (Beuth, 1992). Далее после применения ML-1 обнаруживали повышение эндогенного опиатного медиатора β-эндорфина в плазме крови больных раком молочной железы (Heiny, 1994). Кроме того, было обнаружено, что ML-1 повышает цитотоксическое действие периферических клеток естественных киллеров против опухолевых клеток К-562 и плотность больших зернистых лимфоцитов (LGL) в периферической крови (Hajto, 1989). Была подтверждена антиметастатическая активность ML-1 в отношении клеток саркомы мышей (Beuth, 1991).
В другом предпочтительном варианте димер полипептида по изобретению обнаруживает такой же спектр биологической активности, что и природный димер лектина омелы белой.
(V) Биологическая активность рекомбинантного лектина омелы белой
Получение голопротеинов rML с использованием независимо синтезированных рекомбинантным путем отдельных цепей осуществляли, исходя из имеющих β-структуру растворимых цепей или денатурированных А- и В-цепей rML в рамках совместного формирования β-структуры, причем rMLB была преимущественно реассоциирована in vitro с молярным избытком rMLA в присутствии окислительно-восстановительной системы с глутатионом и частично в присутствии дисульфидизомеразы. Соответствующий гетеродимеру голопротеин rML выделяли из реассоциированной смеси и очищали с помощью аффинной хроматографии на N-ацетилгалактозамин-агарозе или лактозил-агарозе до получения свободной rMLA и rMLA димеров. При аналогичном подходе получали rMLA/rMLB (rML) и голопротеины гетеродимеров rMLA/nMLB.
Цитотоксическая активность
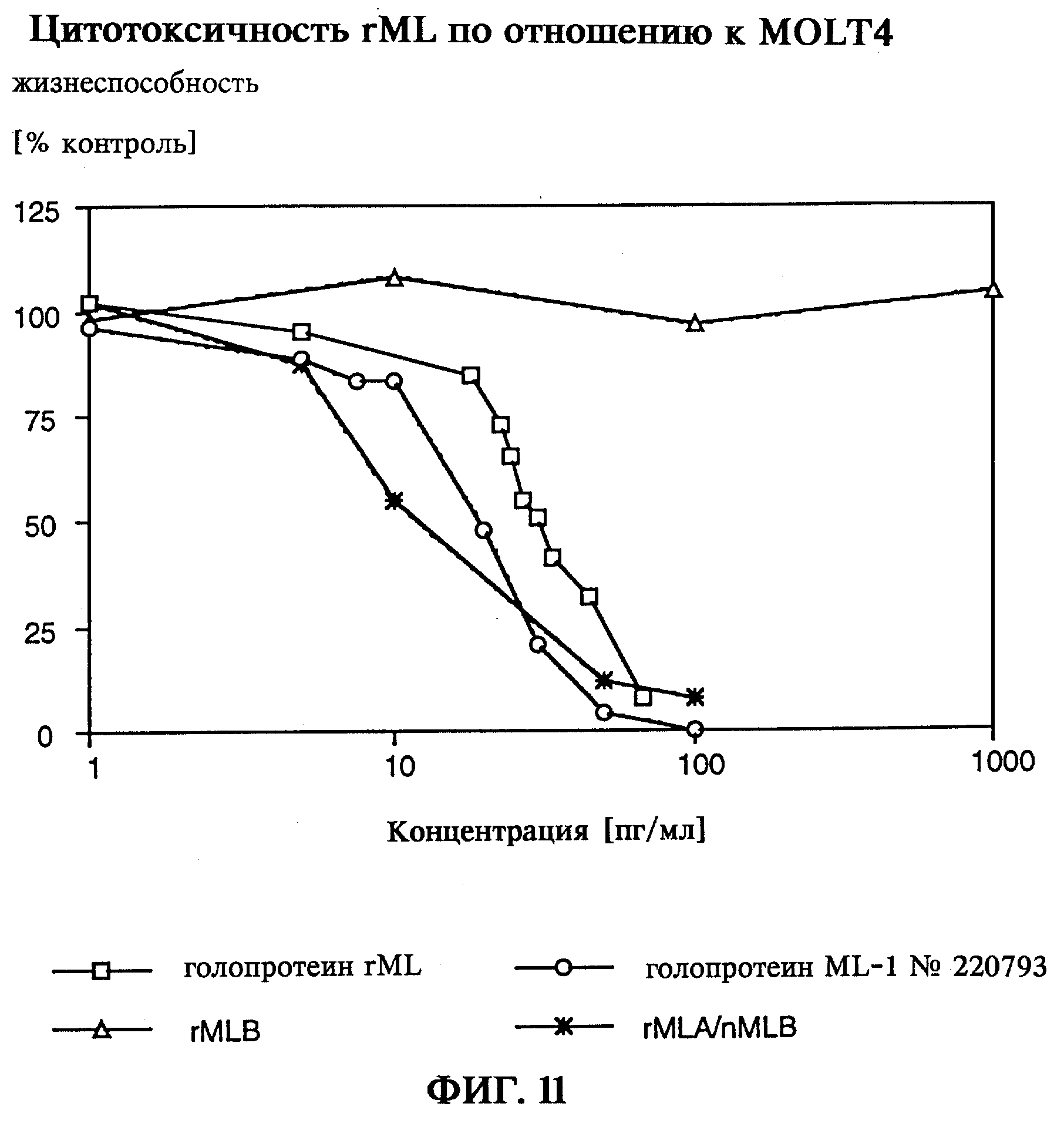
Цитотоксическое действие, как пример биологической активности реассоциированных голопротеинов, было изучено на линии клеток моноцитарного лейкоза (MOLT4). В-цепь (поверхностное связывание), равно как и А-цепь (ферментативная инактивация рибосом) вносят определенный вклад в наблюдаемый цитотоксический эффект. Реассоциированный in vitro голопротеин rMLA/rMLB и реассоциированный in vitro голопротеин rMLA/nMLB сравнивался с "двухзарядным" природным голопротеином nML. Рекомбинантные голопротеины rMLA/rMLB и rMLA/nMLB характеризуются сравнимыми высокими цитотоксическими свойствами со значениями ИК50 около 10-30 пг/мл (фиг.11), что свидетельствует о функциональной целостности и биологической активности реассоциированных in vitro рекомбинантных цепей, входящих в голопротеины rML. Для достижения цитотоксической активности необходимо объдинить функционально активную В-цепь с ферментативно активной А-цепью, поскольку выделенная В-цепь rML сама по себе неожиданно не проявляет цитотоксической активности. Выявляемая до настоящего времени цитотоксическая активность растительных препаратов В-цепей лектина омелы белой, по-видимому, с большой вероятностью была обусловлена остаточным содержанием голопротеина nML. При получении отдельных цепей с помощью технологии рекомбинантных ДНК впервые, таким образом, достигается возможность независимого изучения и применения активности, присущей лектину омелы белой в отношении связывания углеводов и ее ферментативной активности.
Индукция апоптоза
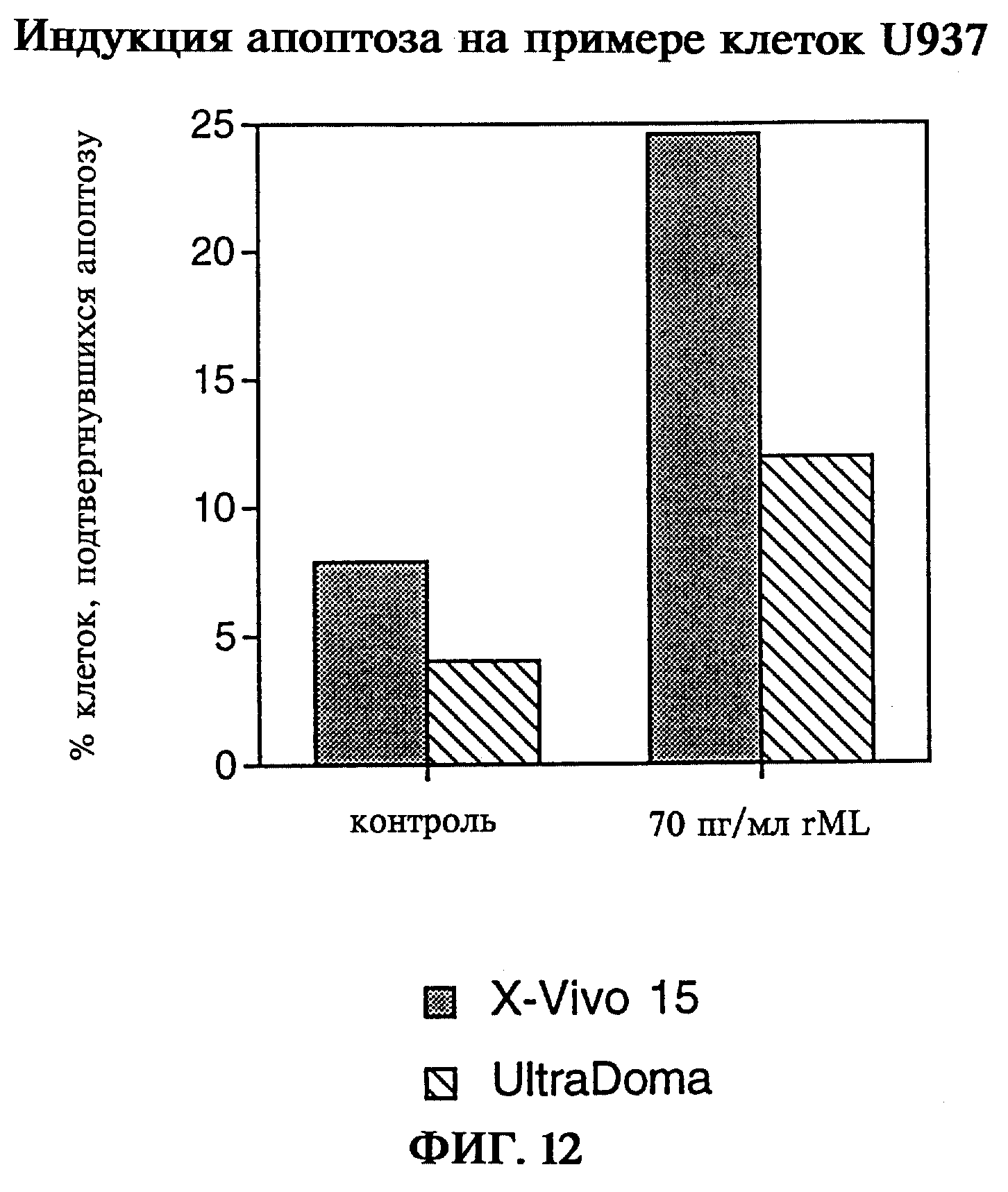
Способность к индукции апоптоза как пример биологической активности лектина омелы белой была обнаружена для рекомбинантного голопротеина rML на линии клеток моноцитов U937. Таким образом, при обработке клеток 70 пг/мл rML через 24 часа смогли обнаружить индукцию апоптоза при действии голопротеина rML (фиг.12). В исследованиях с лектином омелы белой на клетках MOLT-4 и одноядерных клетках периферической крови (РВМС) было показано, что в основе цитотоксической активности лектина омелы белой при использовании низких доз лежит индукция процессов апоптоза. Поскольку в области концентраций, обладающих низкой цитотоксичностью, происходит индукция цитокина (фиг.13, фиг.14), корреляция цитотоксичности с индуцирующей апоптоз активностью вполне понятна. Напротив, в области высоких доз, а также при более длительной инкубации апоптоз перекрывается некротическими эффектами. В связи с тем, что цитотоксичность как следствие апоптоза не была выявлена при обработке чувствительных клеток MOLT-4 рекомбинантной В-цепью, следовательно, биологическая активность, характеризующаяся индукцией аполтоза в области низких доз, может быть объяснена только действием голопротеина.
Иммуностимулирующая активность
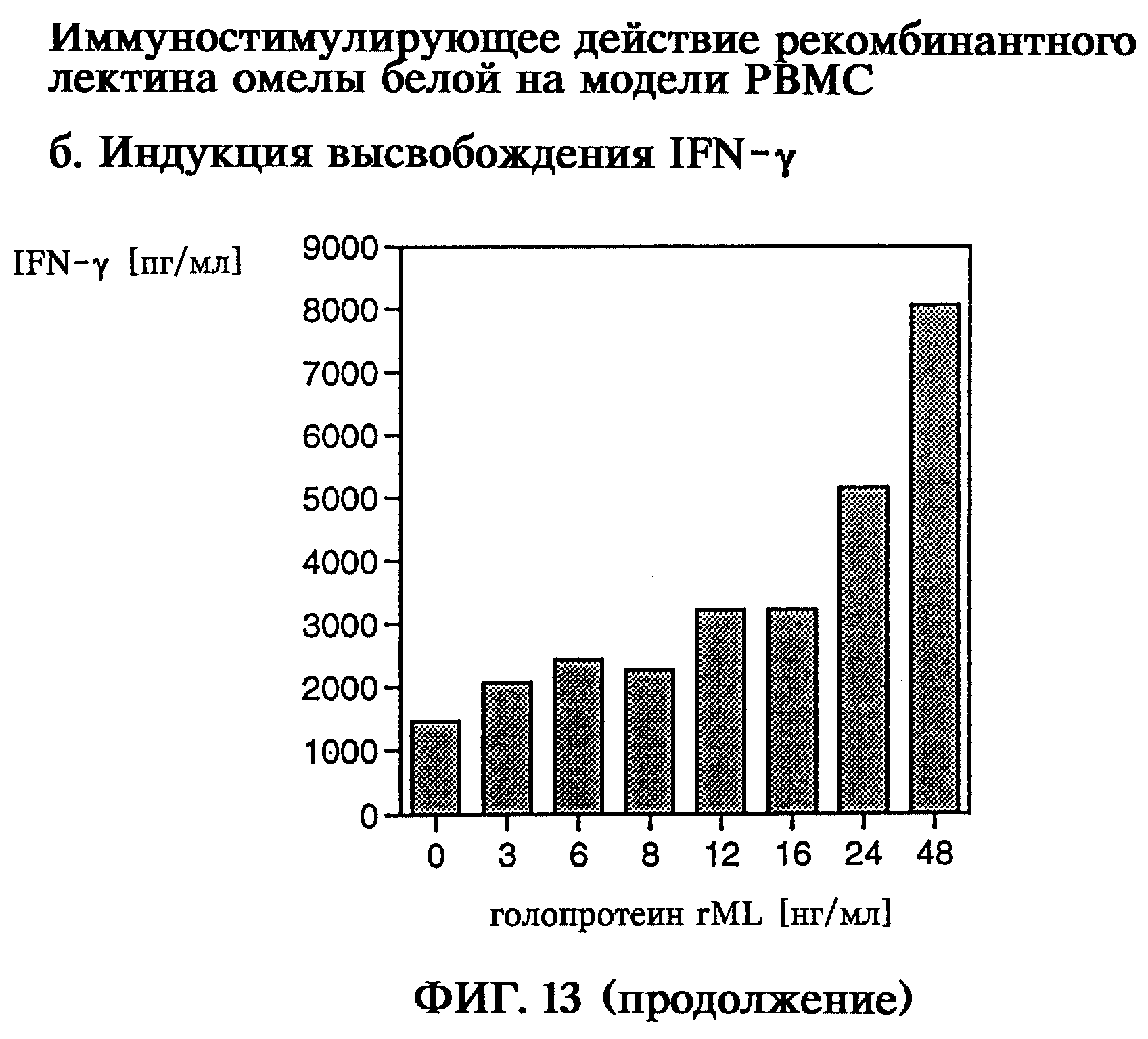
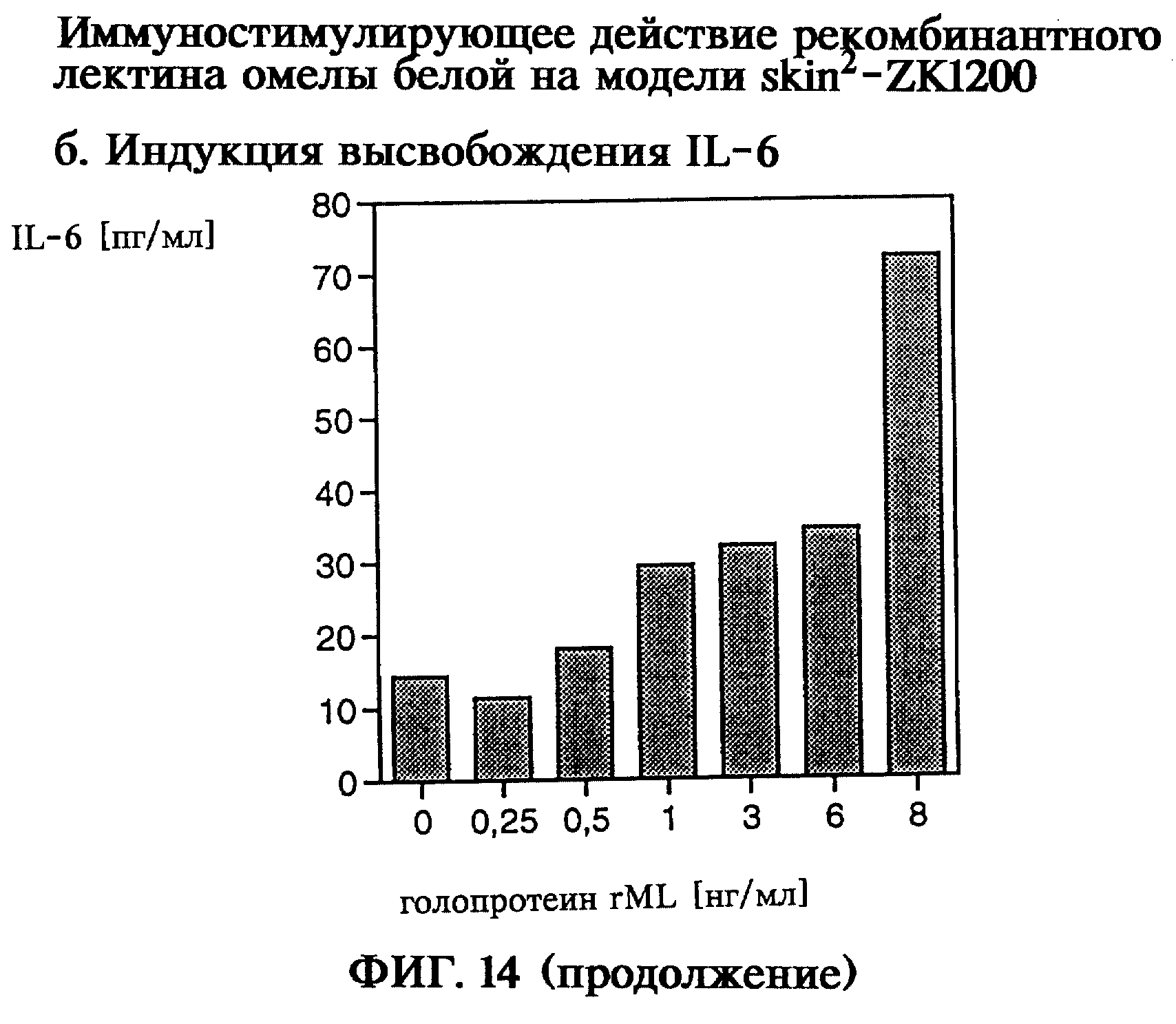
Иммуностимулирующее действие как пример биологической активности рекомбинантного голопротеина лектина омелы белой обнаруживали по индукции выделения фактора-α некроза опухоли (TNF-α) и γ-интерферона (IFN-γ) человеческими одноядерными клетками здоровых доноров крови (модель РВМС), а также по индукции выделения интерлейкина-1α (IL-1α) и интерлейкина-6 (IL-6) сокультурой человеческих первичных кератиноцитов и кожных фибробластов (модель skin2 ZK1200). Таким образом, на модели РВМС с помощью рекомбинантного голопротеина rML в концентрации 3-48 нг/мл продемонстрировано зависящее от дозы выделение TNF-α и IFN-γ, а на модели skin2 при концентрации рекомбинантного голопротеина rML 0,25-8 нг/мл показано зависящее от дозы выделение IL-1α и IL-6.
Все названные цитокины являются важными медиаторами, стимулирующими иммунную систему человека, главные функции которой заключаются в активации прежде всего клеточного иммунного ответа.
Вопреки существующим представлениям, согласно которым иммуностимулирующая активность сводится главным образом к лектиновой активности В-цепи (Hajto и др., 1990), с помощью только одной рекомбинантной В-цепи rML не могли индуцировать вышеупомянутое выделение цитокинов. При использовании низких доз иммуностимулирующая активность могла быть достигнута исключительно за счет функционально активного голопротеина rML. Этот неожиданный результат позволяет заключить, что иммуностимулирующие препараты растительной В-цепи nML содержали следы голопротеина nML и предписываемое В-цепи nML иммуностимулирующее действие объясняется остаточным содержанием nML. Ранее описанные способы получения nMLB не позволяли определить количество голопротеина, в то время как при получении отдельных цепей лектина омелы белой рекомбинантным путем впервые появилась возможность исследования и получения гомогенных препаратов В-цепей лектина омелы белой. Это позволило впервые раздельно изучить и использовать биологическую активность, присущую А- и В-цепи, а также различить биологическую активность, которая свойственна отдельным цепям и функционально активному голопротеину.
(VI) Биологическая активность, присущая рекомбинантной В-цепи лектина омелы белой (rMLB)
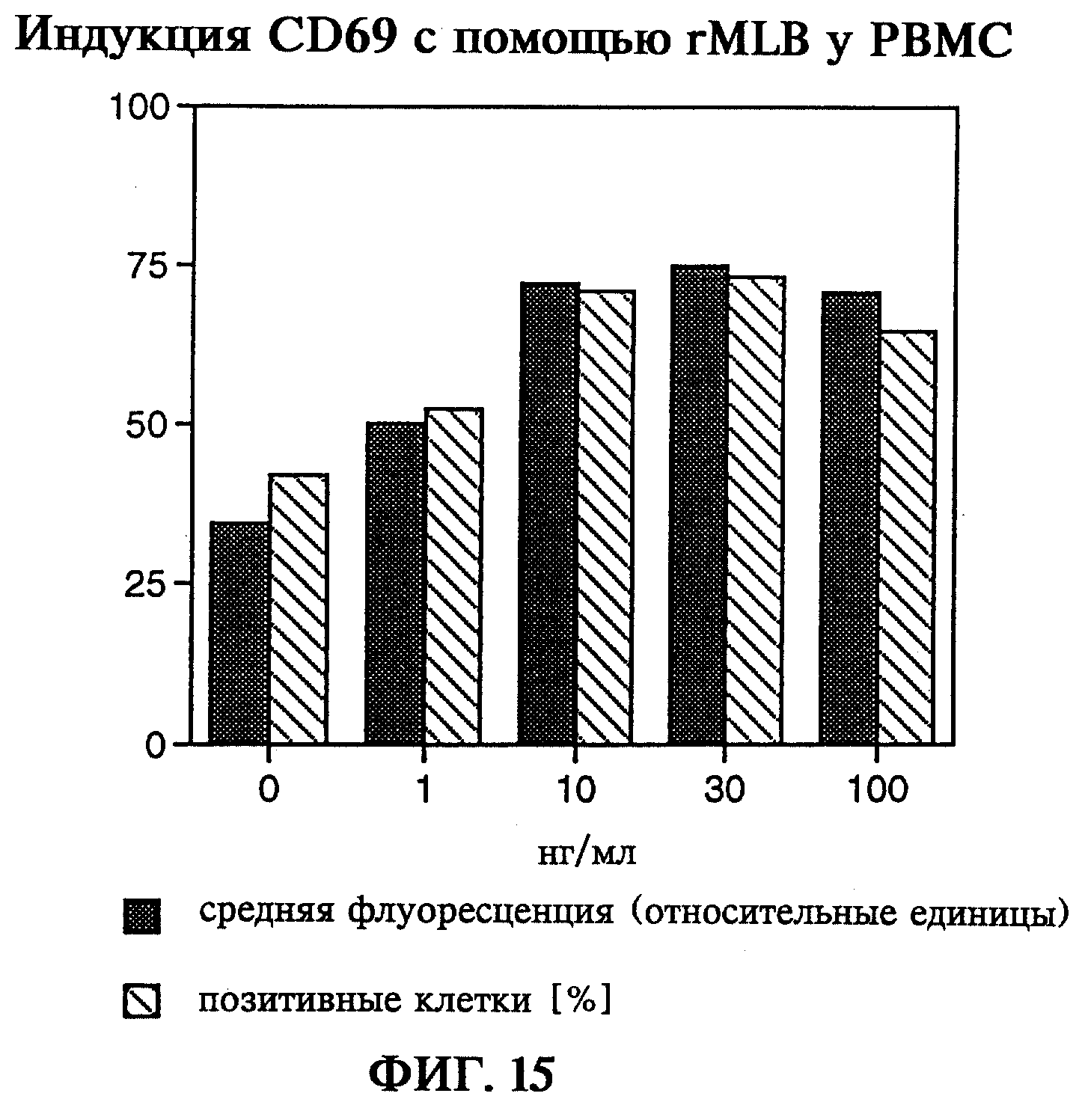
В качестве маркера активации иммунокомпетентных клеток исследовали индукцию протеина клеточной поверхности CD69. CD69 выступает в качестве одного из первых антигенов клеточной поверхности при активации Т-клеток, В-клеток и прежде всего "естественных клеток-киллеров" (NK-клеток). CD69 представляет собой при этом маркер активации вышеназванных иммунокомпетентных клеточных популяций, так как протеин клеточной поверхности не экспрессируется лимфоцитами без их индукции. Кроме того, у индуцируемого поверхностного протеина CD69 была обнаружена функция, обеспечивающая цитолитическую активность NK-клеток и Т-клеток TcRγ/δ (Moretta и др., 1991). С помощью проточной цитометрии (FACS) при использовании моноклонального антитела к CD69 при использовании концентраций 1-100 нг/мл смогли установить активацию одноядерных клеток как по появлению CD69 на клеточной поверхности, так и по доле позитивных к CD69 клеток. При этом выявили колоколообразную кривую зависимости от дозы, что указывает на перекрестное связывание клеточных рецепторов с обоими сайтами связывания лигандов, представляющих собой В-цепи rML. Однако цитотоксическое действие на изучаемые в данном случае РВМС не могло быть обнаружено и при использовании наивысшей концентрации rMLB в 100 нг/мл.
В предпочтительном варианте димер полипептида согласно изобретению представлен в виде по меньшей мере одного из мономеров химически или ферментативно модифицированного полипептида согласно изобретению или одного слитого протеина согласно изобретению.
В результате модификаций можно достичь как оптимального усиления активности, так и путем устранения влияния отдельных свойств на активность (например, на места присоединения углеводов в В-цепи или на гликозидазную активность А-цепи) расширить возможность терапевтического применения, при котором исключаются возможные побочные действия. Полипептиды с измененными свойствами также могут служить инструментом для выявления механизмов активности. Для определенных видов терапии иногда необходимо уменьшение антигенности и иммуногенности полипептидов и/или оптимизация их фармакокинетических свойств, что возможно осуществить путем направленной замены отдельных аминокислот.
Кроме того, изобретение относится к антителам либо их фрагментам или производным, которые специфически связывают полипептиды согласно изобретению и/или димер полипептида. Но при этом они не распознают природный лектин омелы белой или его отдельные цепи. Предпочтительно антитела по изобретению связываются с эпигонами, которые замаскированы за за счет гликозилирования у природных лектинов омелы белой. Антитела могут быть моноклональными, поликлональными или полусинтетическими антителами. Фрагменты могут быть, например, фрагментами Fab’, F(ab)2 или Fv. Производные антител известны из уровня техники. Антитело и его фрагмент, специфически связывающиеся с полипептидом по изобретению, и/или димер полипептида можно получить методом, описанным, например, в книге Harlow и Lane, Antibodies, a Laboratory Manual, CSH Press, Cold Spring Harbor (1988). Моноклональное антитело можно получить, например, способом, впервые описанным в статьях Kohler и Milstein, Nature, 256, 495 (1975), и Galfre, Meth. Enzymol., 73, 3 (1981).
Изобретение далее относится к способу получения полипептида или димера полипептида согласно изобретению, причем организм-хозяин согласно изобретению культивируют в пригодных условиях и выделяют полученный таким образом полипептид или димер полипептида.
Специалистам в данной области техники известны условия, пригодные для культивирования и выделения полипептида из организма-хозяина. Так, например, полипептид или димер полипептида согласно изобретению может быть получен из организма-хозяина с помощью пригодной для этой цели системы эксперессии и выделен из среды. С другой стороны, полипептиды или димеры полипептидов могут оставаться в клетке и быть выделены из нее. Далее представлен другой предпочтительный вариант осуществления способа согласно изобретению.
Для выделения rMLA проводили полное разрушение клеток E.coli, трансформированных с помощью соответствующего вектора экспрессии, и разделение растворимых и нерастворимых составных частей клетки путем центрифугирования. Анализ клеточных фракций показал, что в зависимости от условий экспрессии и продолжительности экспрессии от 5 до 50% рекомбинантной А-цепи лектина омелы белой аккумулируется в растворимой форме или от 50 до 95% аккумулируется в форме нерастворимых протеиновых скоплений ("телец включения").
Наличие растворимых и нерастворимых протеинов, когда возможно разрушение β-структуры или ренатурация протеинов rMLA, предоставляет по меньшей мере два способа выделения rMLA. Агрегированную с "тельцами включения" rMLA после промывки осадка с целью удаления протеинов E.coli (Babbitt и др., 1990) растворяли в денатурирующих условиях и разрушали β-структуру путем 90-кратного разведения в соответвующем буфере (50 мМ трис-HC1, 2 мМ дитиотреитол (ДТТ), 1 мМ этилендиаминтетрауксусная кислота (ЭДТК), рН 8, 0.
После этой процедуры получают, с одной стороны, растворимые, имеющие β-структуру виды протеинов, как показано на фиг.9, а также проявляющие полную ферментативную активность ренатурированные виды rMLA, которые исходно являлись нерастворимыми и денатурированными. Выделение ренатурированной rMLA можно осуществлять по той же методике, которую используют для выделения растворимой rMLA с помощью иммуноаффинной хроматографии при использовании антитела ТА5, специфичного к MLA (Tonevitsky и др., 1995).
Благодаря существованию rMLB как в растворимой форме, как и в форме нерастворимых "телец включения" возможны два способа выделения рекомбинантной В-цепи лектина омелы белой.
Для выделения из цитоплазмы E.coli растворимой В-цепи rML, обладающей сильными восстановительными свойствами, обеспечивающими построение внутреннего дисульфидного мостика, клетки инкубировали в присутствии окислительно-восстановительной системы с использованием восстановленного и окисленного глутатиона, а также в присутствии β-лактозного лиганда для стабилизации функционально активных после формирования β-структуры продуктов. Из смеси для формирования β-структуры селективно в одну стадию выделяли, соответственно очищали функционально активную, связывающую углеводы В-цепь rML с помощью аффинной хроматографии на лактозил-агарозе или N-ацетилгалактозамин-агарозе.
Для выделения rMLB из нерастворимой, представленной в виде "телец включения" фракции продукта экспрессии после соответствующей обработки клеток E.coli, осадок промывали для удаления протеинов E.coli (Babitt и др., 1990) и растворяли в денатурирующих и восстановительных условиях. Ренатурацию осуществляли в присутствии окислительно-восстановительной системы, использующей восстановленный и окисленный глутатион, а также в присутствии β-лактозного лиганда, при этом функционально активную, связывающую углеводы В-цепь rML селективно выделяли из смеси после ренатурации и очищали с помощью аффинной хроматографии на N-ацетилгалактозамин-агарозе или лактозил-агарозе.
Изобретение, кроме того, относится к лекарственному средству, содержащему полипептид согласно изобретению или димер полипептида согласно изобретению и/или приведенный ниже иммунотоксин согласно изобретению при необходимости вместе с фармацевтически приемлемым носителем.
Предлагаемые полипептиды, их ассоциаты или модификации пригодны для разнообразного использования в терапии рака и инфекций в соответствии с известными фармакологическими свойствами, присущими природному лектину омелы белой. Иммуностимулирующее действие используется в терапии опухолей, когда в результате прямого и/или непрямого стимулирования возникает гомологичная иммунная защита, обеспечивающая эффективную борьбу с опухолью и возможными метастазами. То же самое происходит в случае инфекций, прежде всего вирусных заболеваний. Полипептиды по изобретению могут также вводиться в комбинации с другими иммуностимуляторами, например, интерферонами, цитокинами или факторами, стимулирующими образование колонии бактерий, что позволяет достичь синергетического действия, соответственно снизить необходиую дозу комбинируемых компонентов и, таким образом, уменьшить их побочное действие.
В комбинации с цитостатиками или с облучением достигается смягчение или уменьшение побочного действия лейкопении/миелосупрессии, так что с помощью этих общепринятых в настоящее время методов лечения восстанавливается приобретенное ослабление иммунной системы.
Прямое цитотоксическое действие полипептидов с гликозидазной активностью приводит к апоптозу опухолевых клеток и может также использоваться в терапии. Специфичность действия полипептидов может быть достигнута за счет использования иммунотоксинов, когда полипептиды согласно изобретению связывают с соответствующими антителами. Таким образом, изобретение далее относится к иммунотоксинам, которые связаны по меньшей мере с одним полипептидом согласно изобретению или димером полипептида. Например, при использовании способов, применяемых в химии протеинов, можно осуществлять связывание функционально активной А-цепи или голопротеина с антителом или его фрагментом. Такие способы связывания известны в данной области техники, при этом соответствующие конъюгаты объединяются многократно (Vitetta, 1993). Альтернативно можно также экспрессировать соответствующим образом построенные конструкции слитых белков, которые содержат связывающие антиген домены, например, из антител, и дополнительно цитотоксичные фрагменты полипептида согласно изобретению.
Далее образование метастазов можно предотвратить в результате ингибирования связывания опухолевых клеток с другими клетками. Это связывание можно предотвратить с помощью полипептидов согласно изобретению через конкурентное связывание лектина.
Изобретение далее относится к праймеру и/или паре праймеров, который/которая специфически гибридизуется с молекулой нуклеиновой кислоты согласно изобретению или с комплементарной ей нитью.
Кроме того, изобретение относится к диагностическим композициям, которые содержат по меньшей мере:
а) молекулу нуклеиновой кислоты согласно изобретению;
б) праймер и/или пару праймеров, который/которая специфически гибридизуется с молекулой нуклеиновой кислоты согласно изобретению или с комплементарной ей нитью; и/или
в) полипептид согласно изобретению и/или димер полипептида согласно изобретению.
Предлагаемая диагностическая композиция, содержащая в предпочтительном варианте изобретения праймер или пару праймеров, может быть использована для изучения организма на предмет существования гена лектина с целью найти таким способом, например, новые гены лектина, которые кодируют представляющие с фармакологической точки зрения интерес лектины. Содержащаяся в диагностической композиции по изобретению молекула нуклеиновой кислоты также может быть использована, например, в Саузерн-блоттинге или Нозерн-блоттинге для исследования организмов на предмет существования соответствующих генов лектина. Далее по степени гибридизации нитей можно выявлять гены, родственные гену лектина. Димер полипептида может быть, например, использован для получения антител или антисывороток, с помощью которых известными способами в различных организмах могут быть обнаружены, например, соответствующие лектины омелы белой.
Изобретение, кроме того, относится к средству защиты растений, содержащему полипептид согласно изобретению и/или димер полипептида согласно изобретению. Предлагаемые полипептиды, их ассоциаты или модификации могут быть использованы для защиты растений в соответствии с наличием у них рассматриваемых ниже функций, свойственных растительному лектину омелы белой. При этом для защиты растительных кормов учитывается присущая лектину омелы белой функция, основанная на свойствах токсичности, а также функция для противовирусной защиты, основанная на свойстве, сказывающемся на проницаемости и строении мембран. На приложенных к описанию чертежах показано:
на фиг.1 - построение первичных олигонуклеотидов путем амплификации;
на фиг.2 - первичный продукт амплификации ML Viscum album;
на фиг.3 - стратегия клонирования для получения гена ML;
на фиг.4 - вставки для rMLA и rMLB в векторах экспрессии и полная генная последовательность ML;
на фиг.5 - схема построения вектора, экспрессирующего rMLA;
на фиг.6 - схема построения вектора, экспрессирующего rMLB;
на фиг.7 - экспрессия rMLA, rMLB и иммунологическое детектирование;
на фиг.8 - хроматофокусировка с изоэлектрофокусировкой rMLA и rMLB относительно природного ML;
на фиг.9 - ферментативная активность rMLA (ПИР);
на фиг.10 - характеристика в отношении связывания углеводов rMLB;
на фиг.11 - цитотоксичность rML по отношению к MOLT4;
на фиг.12 - индукция апоптоза с помощью rML;
на фиг.13 - иммуностимулирующее действие рекомбинантного лектина омелы белой на модели РВМС;
на фиг.14 - иммуностимулирующее действие рекомбинантного лектина омелы белой на модели skin2;
на фиг.15 - индукция маркера клеточной поверхности CD69 у РВМС.
Ниже изобретение поясняется на примерах.
Пример 1
Построение первичных олигонуклеотидов путем амплификации
Лектин омелы белой (ML) относится к классу инактивирующих рибосомы протеинов (Stirpe и др., 1992), которые представляют собой широко распространенное семейство протеинов в растениях различного таксономического происхождения. ML на основании активности входящих в него субъединиц был отнесен к группе инактивирующих рибосомы протеинов типа II (Endo и др., 1988а).
Однако для определения последовательности гена ML непригодна часто используемая в других случаях смесь, полученная в результате скрининга библиотеки кДНК и геномной библиотеки Viscum album. Так, в библиотеках генов из поли-(А+)-РНК Viscum album несмотря на использование различных зондов ДНК не смогли идентифицировать специфичные для ML клоны. Основываясь на допущении, что последовательность гена ML не содержит интронов, была применена стратегия ПЦР. Поскольку N-концевые аминокислотные последовательности А-цепи ML, а также В-цепи ML были известны (Dietrich и др., 1992; Gabius и др., 1992), оказалась возможной амплификация кодирующего MLA участка при использовании вырожденных олигонуклеотидов, полученных в результате амплификации генов известных пептидов (фиг.1a). В то время как пригодный олигонуклеотид с незначительной степенью вырожденности может быть получен исходя из N-конца А-цепи ML (RMLA1, фиг.1б), построить соответствующие олигонуклеотиды с удовлетворительной специфичностью исходя из N-конца В-цепи ML невозможно (RMLB1, RMLB2, RMLB3, фиг.1б).
Поэтому необходимо было разработать альтернативную стратегию, которая позволила бы при привлечении сведений о родственных протеинах с помощью амплификации получить олигонуклеотиды исходя из еще неизвестных областей последовательности ML. Так, анализ аминокислотной последовательности ПИР типа I и типа II показал некоторое количество консервативных участков с повышенной гомологией последовательности. На фиг.1в показана высокая степень сродства ПИР типа I и типа II на примере активного центра рицина. В литературе описано участие Е177 и R180, которые находятся внутри последовательности MISEAARF, в ферментативном механизме (Kim и др., 1992; Lord и др., 1994). Отсюда было сделано заключение, что по меньшей мере оба этих остатка могут присутствовать в последовательности ML. В результате дальнейших изучений структуры касательно наличия отдельных остатков, при котором особо учитывались остатки, имеющие низкую степень вырожденности используемого кодона, получали с помощью амплификации конструкцию олигонуклеотида RMLA2. Последовательность этого олигонуклеотида представлена на фиг.1в.
Пример 2
Получение фрагментов ДНК. специфичных для гена ML
Высокомолекулярная геномная ДНК была выделена из свежих листьев Viscum album (дерево-хозяин Populus wilsonii) по методу Baur и др. (1993). Для получения специфичных для гена ML фрагментов ДНК с помощью ПЦР в каждую амплифицируемую смесь вводили 100 нг геномной ДНК. Амплификацию проводили в общем объеме в 50 мкл, содержащем буфер для ПЦР (10 мМ трис-НСl, 1,5 мМ MgCl2, 50 мМ КСl, 0,25 мМ дезоксинуклеозидтрифосфата (дНТФ), рН 8,3), 78 пмолей праймера RMLA1 и 50 пмолей (смесь 2) или 100 пмолей (смесь 1) RMLA2. ПЦР проводили с ДНК-полимеразой Taq (1,5 ЕД/смесь) фирмы Boehrmger Mannheim с термоциклизатором фирмы Biometra. Параметры ПЦР: денатурация в течение 1 минуты при 90° С, отжиг в течение 1 минуты при 50°С, элонгация в течение 1 минуты при 72°С в общей сложности при 30 циклах. Продукты амплификации анализировали с помощью электрофореза в 5%-ном полиакриламидном геле и окрашивания этидийбромидом (фиг.2). Полученный в смеси 2 специфический продукт амплификации длиной около 500 пар нуклеотидов (п.н.) элюировали с геля и клонировали в ТА-векторы.
Пример 3
Стратегия клонирования
Происхождение используемых для первичной ПЦР-амплификации олигонуклеотидов приведено в примере 1 (фиг.1а), а получение первичного фрагмента гена ML Viscum album, в дальнейшем обозначенного как а, приведено в примере 2 (фиг.2). Исходя из последовательности клонированного фрагмента гена а и при допущении, что ген ML не имеет интронов, можно получить 5’-олигонуклеотиды со специфичными последовательностями, с помощью которых можно амплифицировать фрагменты b, с, d и е. В то время как 3’-олигонуклеотид для с также был получен исходя из последовательности ДНК фрагмента а, построение вырожденного 3’-праймера для амплификации фрагментов гена b, d, е и g осуществляли с помощью анализа гомологичных участков ПИР типа I (b) и типа II (d, е, g). При этом вновь, исходя из сравнения последовательностей внутри семейства протеинов, делали заключение о наличии отдельных остатков, причем особо учитывали остатки с незначительной степенью вырожденности используемого кодона. В частности, для построения примерно 50 комбинаций олигонуклеотидов, специфичных для ML, были использованы известные последовательности кДНК и производные последовательности протеинов рицина и абрина. На фиг.3 показаны только те фрагменты гена, которые могли быть клонированы в качестве специфических продуктов амплификации и могли быть представлены для дальнейшего анализа. Исходя из других комбинаций олигонуклеотидов не могли быть получены какие-нибудь специфичные для ML продукты амплификации. Получение фрагментов гена f (кодирующего А-цепь ML) и g (кодирующего В-цепь ML) подробно описано в примере 5 и примере 6.
Для анализа 5’- и 3’-концевых участков транслируемых и нетранслируемых областей последовательности гена ML были разработаны условия для быстрой амплификации 5’- и 3’- концов с использованием ПЦР (метод RACE) (Frohmann и др., 1988), которые приводили к получению фрагментов h, i и j. Амплификация фрагмента j с помощью (RACE)-ПЦР является при этом альтернативной для получения фрагментов полного гена MLB. Реакции с помощью RACE проводили при использовании кДНК, которая была получена путем обратной транскрипции полной РНК Viscum album, выделенной из листьев омелы белой (дерево-хозяин Populus wilsonii).
Пример 4
Последовательность ДНК и продукты трансляции rMLA и rMLB
Вставки, содержащиеся в векторах экспрессии pT7-MLA и pT7-MLB, были секвенированы стандартными способами с помощью стратегии "блуждающей затравки" (определение полностью перекрывающихся последовательностей обеих нитей) при использовании различных специфичных для ML олигонуклеотидов (фиг.4а,б). Подчеркнутые участки последовательностей обозначают сайты рестрикции для клонирования в векторах экспрессии рТ7. Оба фрагмента гена модифицируются в соответствии со схемой построения векторов экспрессии, как описано в примере 5 и примере 6.
На фиг.4в приведена полученная на основании указанных фрагментов полная последовательность гена ML. Она охватывает как 5’- и 3’-нетранслируемые участки, так и участки, кодирующие эндопептид и сигнальный пептид.
Пример 5
Построение вектора экспрессии pT7-MLA
Для гетерологичной экспрессии исходя из комплексной геномной ДНК омелы белой с помощью специфической ПЦР была получена последовательность, кодирующая А-цепь лектина омелы белой, и модифицирована по концам. С помощью некомплементарных участков встроенных олигонуклеотидных праймеров присоединяли элементы, контролирующие трансляцию, а также последовательности, узнаваемые эндонуклеазами рестрикции, в результате чего исходя из представленного в геноме гена препролектина омелы белой были возможны клонирование и раздельная экспрессия А-цепи лектина омелы белой.
На фиг.5б представлено получение с помощью ПЦР фрагментов гена, кодирующих MLA. Для амплификации последовательности гена, кодирующей MLA, использовали 200 нг геномной ДНК Viscum album, 1,5 мМ (смесь 1) или 2,5 мМ (смесь 2) MgCl2, 40 пмолей каждого олигонуклеотидного праймера RML16 и RML17 в буфере для ПЦР (10 мМ трис-HCl, 50 мМ КСl, 0,25 мМ каждого из дНТФ, рН 8,3) в общем объеме 50 мкл. ПЦР проводили при использовании полимеразы Taq (1,5 ед./смесь, фирма Boehringer Mannheim) в общей сложности за 30 циклов с температурой 94°С при денатурации в течение 1 минуты, с температурой 52°С при отжиге в течение 1 минуты, с температурой 72°С при элонгации в течение 1,5 минут. Продукты амплификации анализировали электрофорезом в 1%-ном агарозном геле и окраской этидийбромидом (фиг.5б) и элюировали с геля и клонировали в ТА-векторы.
5’-концевой участок кодирующей rMLA последовательности, соответствующий аминокислотным остаткам тирозин1-тирозин17 (Dietrich и др., 1992; Gabius и др., 1992), был получен в результате встраивания кодона, инициирующего трансляцию, в виде синтетического фрагмента гена путем гибридизации и клонирования двух олигонуклеотидов. Таким путем была получена оптимальная в отношении выбора кодонов последовательность гена, которая описана для гена, сильно экспрессирующегося в E.coli (Gribskov и др., 1984). У 3’-конца синтетического фрагмента гена rMLA, а также у 5’-конца полученного с помощью ПЦР фрагмента гена rMLA путем направленного обмена кодона для тирозина17 ТАС на ТАТ вводили сайт рестрикции, узнаваемый рестриктазой Ssp I, что способствовало соединению обоих фрагментов гена rMLA при получении вектора pML14-17 (фиг.5).
Полученная полная последовательность, кодирующая rMLA, была секвенирована (фиг.4а). Для экспрессии rMLA в E.coli выделяли последовательность гена из вектора pML14-17 и встраивали в вектор экспрессии рТ7-7 под контролем промотора Т7-РНК-полимеразы, а также терминатора транскрипции. С помощью полученного в результате вектора pT7-MLA экспрессии (фиг.5) трансформировали штамм E.coli BL21.
Пример 6
Построение экспрессирующего вектора pT7-MLB
Для гетерологичной экспрессии В-цепи лектина омелы белой полная последовательность, кодирующая MLB, была амплифицирована из комплексной геномной ДНК Viscum album путем специфической ПЦР, при этом с помощью некомплементарных участов встроенных олигонуклеотидных праймеров вводили элементы, контролирующие трансляцию, а также последовательности, узнаваемые эндонуклеазами рестрикции.
На фиг.6б представлено получение с помощью ПЦР всего фрагмента гена, кодирующего полную rMLB. Амплификацию фрагмента ДНК, кодирующего rMLB, проводили исходя в каждом случае из 200 нг геномной ДНК Viscum album в смеси для ПЦР с 50 пмолями олигонуклеотидного праймера RML25 и 30 пмолями (смесь 1) или 10 пмолями (смесь 2) олигонуклеотидного праймера RML26 в общем объеме 50 мкл буфера для ПЦР (10 мМ трис-HCl, 50 мМ КСl, 1,5 мМ MgCl2, 0,25 мМ каждого дНТФ, рН 8,3). ПЦР проводили с использованием полимеразы Taq (1,5 ЕД/смесь, фирма Boehringer Mannheim) в 30 циклов, включающих денатурацию в течение 1 мин при 94°С, отжиг при 52°С в течение 1 мин и элонгацию при 72°С в течение 1,5 мин. Продукты, полученные в результате ПЦР, анализировали путем электрофореза в 1%-ном агарозном геле и окрашивания этидийбромидом. В результате получали продукт ПЦР длиной 0,8 т.п.н., который элюировали с геля и клонировали в ТА-векторах. Путем инсерции в вектор экспрессии рТ7-7 втраивали фрагмент гена, кодирующий rMLB, под контролем элементов, контролирующих транскрипцию, и с помощью полученного в результате вектора экспрессии pT7-MLB трансформировали штамм E.coli BL21. Правильность полученной с помощью ПЦР последовательности, кодирующей полную rMLB, была подтверждена секвенированием (фиг.4б).
Пример 7
Экспрессия, иммунологическое выявление, разрушение β-структуры и реассоциация rMLA и rMLB in vitro
(I) Экспрессия rMLA в E.coli
Для экспрессии рекомбинантной А-цепи лектина омелы белой на 1000 мл LBAmp-среды в 2-литровой колбе для встряхивания с дефлекторами высевали 5 мл выращенной в стационарных условиях на LВAmp-среде предварительной культуры E.coli BL21/pT7-MLA и культивировали при встряхивании при 37°С, при этом за ростом наблюдали путем измерения мутности при 578 нм. Экспрессию гена индуцировали по достижении плотности клеток, соответствующей оптической плотности примерно 0,9-1,0 при 578 нм, добавлением 0,5 мМ изопропилтиогалактозида (ИПТГ). Для сбора продукта клетки через 2 часа после индукции осаждали центрифугированием в течение 20 минут при 5000 об./мин и 4°С на центрифуге GS-3 (Sorvall) и декантировали с культуральной среды, при этом из 1 л объема культуры выделяли 3-4 г влажной клеточной массы.
Клетки обрабатывали с помощью ленточного фильтр-пресса Френча (French-пресс) (фирма SLM Instruments), для чего осадок клеток повторно суспендировали в 20 мл буфера для обработки (50 мМ трис-HCl, 100 мМ NaC1, 1 мМ ЭДТК, 5 мМ ДТТ, 1 мМ фенилметилсульфонилфторид (ФМСФ), рН 8,0 и дважды пропускали через French-пресс под давлением 105,45 кг/см2. При последующем центрифугировании в течение 30 минут при 10000 об./мин и 4°С на центрифуге SS-34 (Sorvall) осаждали нерастворимые составные части клеток, а также содержащиеся в них "тельца включения" и отделяли от оставшихся в надосадочной жидкости растворимых протеинов E.coli или растворимых продуктов экспрессии.
Для анализа экспрессии одинаковые объемы обработанных фракций клеток исследовали с помощью электрофореза в 12,5%-ном полиакриламидном геле в присутствии ДСН и окрашивания кумасси бриллиантовым синим, а также с помощью Вестерн-блоттинга при использовании специфичной к MLA антисыворотки ТА5 (фиг.7а). Моноклональные антитела ТА5 (Tonevitsky и др., 1995) были предоставлены автором. Как и другие использованные в данном случае антитела, их получают стандартными способами с применением соответствующего иммуногена (в случае ТА5 это ML-1 или MLA). Для определения экспрессии равные объемы растворимой фракции (след 2, 4, 6, 8), а также нерастворимой фракции с "тельцами включения" (след 1, 3, 5, 7) из обработанной массы E.coli исследовали на содержание rMLA. Для изучения характера протекания экспрессии вводили зонды до начала индукции (след 1+2), через 2 часа (след 3+4), через 4 часа (след 5+6) и через 6 часов (след 7-8) после индукции экспрессии гена. Экспрессию наблюдали уже через 1 час после индукции по появлению иммунореактивного продукта экспрессии в 25 кДа, соответствующего rMLA, максимум экспрессии которого достигается уже через 2 часа после индукции. Распределение rMLA в растворимой или нерастворимой фракции обработанных клеток через каждые 2 часа после индукции составляет примерно 50%, причем более продолжительная экспрессия приводит к возрастающему образованию нерастворимых "телец включения".
(II) Выделение rMLA из нерастворимых "телец включения"
Осадок всех обработанных клеток E.coli для удаления протеинов E.coli дважды промывали порциями по 20 мл СТЭТ-буфера (50 мМ трис-HCl, 8% (масса/объем) сахарозы, 50 мМ ЭДТК, 1,5 об.% тритона Х-100, рН 7,4) согласно Babitt и др. (1990). Оставшийся осадок с "тельцами включения" растворяли в 20 мл буфера для денатурации (6М гидрохлорид гуанидина, 100 мМ ДТТ, 50 мМ трис-HCl, рН 8,0) с последующим инкубированием в течение 16 часов при комнатной температуре и при встряхивании.
Для ренатурации rMLA имеющийся раствор протеинов в буфере для денатурации медленно добавляли по каплям в 90-кратный объем буфера для формирования β-структуры (50 мМ трис-HCl, 2 мМ ДТТ, 1 мМ ЭДТК, рН 8,0) и инкубировали в течение 16 часов при комнатной температуре и при перемешивании. Вновь выпавший в осадок протеин отделяли центрифугированием в течение 30 минут при 6000 об./мин и 4°С на центрифуге GS-3 (Sorvall). Содержащий rMLA супернатант для хранения сливали в 20%-ный (объем/объем) глицерин и хранили при 4°С.
(III) Очистка rMLA с помощью иммуноаффинной хроматографии
Для одностадийной очистки rMLA (растворимая часть продукта экспрессии, соответственно протеина, полученного после разрушения β-структуры) с помощью иммуноаффинной хроматографии 200 мкг моноклонального антитела анти-nMLA-IgG к А-цепи лектина омелы белой (ТА5, Tonevitsky и др., 1995) иммобилизовали на протеин-А-сефарозе CL4B (Sigma, Дайзенхофен) согласно методу Hariow и Spur (1988). После инкубации иммуноаффинной матрицы с rMLA-зондом и промывки матрицы буфером для промывки 1 (1н. NaCl, 10 мМ фосфатный буфер, рН 7,0) в количестве, соответствующем 10 объемам наполнителя колонки, и буфером для промывки 2 (10 мМ фосфатный буфер, рН 7,0), соответствующем 10 объемам наполнителя колонки, специфически связанную rMLA элюировали соответвующим буфером (0,1 М глицин, рН 2,5) для удаления неспецифически связанных протеинов. Элюирование осуществляли для восстановления значения рН с предварительной загрузкой в 1М фосфатный буфер, рН 8,0.
(IV) Экспрессия rMLB в E.coli
Для экспрессии рекомбинантной В-цепи лектина омелы белой на 1000 мл LBAmp-среды в 2-литровой колбе для встряхивания с дефлекторами высевали 5 мл выращенной в стационарных условиях на LВAmp-среде предварительной культуры E.coli BL21/pT7-MLB и культивировали при 37°С и при встряхивании, при этом за ростом наблюдали путем измерения мутности при 578 нм. Экспрессию гена индуцировали по достижении плотности клеток, соответствующей оптической плотности примерно 0,9-1,0 при 578 нм, путем добавления 0,5 мМ ИПТГ. Для сбора через 4 часа после индукции осаждали центрифугированием в течение 20 мин при 5000 об./мин и 4°С на центрифуге GS-3 (Sorvall) и декантировали с культуральной среды.
Обработку клеток осуществляли с помощью French-прессаТМ (фирма SLM Instruments), для чего осадок клеток повторно суспендировали в 20 мл буфера для обработки В (20 мМ фосфатный буфер, 40 мМ NaCl, 1 мМ ЭДТК, 1 мМ ФМСФ, рН 7,2) и дважды пропускали через French-пресс под давлением 105,45 кг/см2. При последующем центрифугировании в течение 30 мин при 10000 об./мин и 4°С на центрифуге SS-34 (Sorvall) осаждали нерастворимые составные части клеток, а также части, содержащие "тельца включения", и отделяли от оставшихся в супернатанте растворимых протеинов E.coli или растворимого продукта экспрессии.
Для подтверждения экспрессии равные объемы фракций обработанных клеток исследовали с помощью электрофореза в 12,5%-ном полиакриламидном геле в присутствии ДСН и окрашивания кумасси бриллиантовым синим, а также с помощью Вестерн-блоттинга при использовании специфичной к MLB антисыворотки ТВЗЗ (фиг.7б). Моноклональные антитела ТВ33 (Tonevitsky и др., 1995) были предоставлены автором. Они были получены при использовании стандартных способов. Соответствующие антитела к ML-1 и MLB также могут быть получены по стандартным методам с ML-1 или MLB в качестве иммуногена. Для подтверждения экспрессии равные объемы растворимой фракции (след 2, 4, 6, 8), а также нерастворимой фракции с "тельцами включения" (след 1, 3, 5, 7) продукта обработки E.coli исследовали на содержание rMLB. Для изучения характера протекания экспрессии вводили зонды до индукции экспрессии (след 1+2), через 2 часа (след 3+4), через 4 часа (след 5+6) и через 6 часов (след 7-8) после индукции экспрессии гена. Вестерн-блоттинг показал появление полосы иммунореактивного протеина (31 кДа), соответствующего rMLB, уже через 1 час после индукции, причем максимум его экспрессии достигался через 4 часа после индукции. В каждом случае через 4 часа после индукции примерно 50% rMLB находилось в растворимой и примерно 50% в нерастворимой фракции, полученных после обработки клеток. Более продолжительная инкубация приведет к большей аккумуляции экспрессирующейся rMLB в форме нерастворимых "телец включения".
(V) Выделение rMLB из нерастворимых "телец включения"
Осадок всех обработанных клеток E.coli для удаления протеинов E.coli дважды промывали порциями по 20 мл СТЭТ-буфера (50 мМ трис-HCl, 8% (масса/объем) сахарозы, 50 мМ ЭДТК, 1,5 об.% тритона Х-100, рН 7,4) согласно методу Babbitt и др. (1990). Оставшийся осадок вместе с содержащимися в нем "тельцами включения" растворяли в 20 мл буфера для денатурации (6М гидрохлорид гуанидина, 100 мМ ДТТ, 50 мМ трис-HCl, рН 8,0) с последующей инкубацией в течение 16 часов при комнатной температуре и при встряхивании.
Для ренатурации rMLB имеющийся раствор протеинов в буфере для денатурации медленно добавляли по каплям в 90-кратный объем буфера для формирования β-структуры (20 мМ фосфатный буфер, 50 мМ КСl, 1 мМ ЭДТК, 100 мМ глюкоза, 10 об.% глицерина, 10 мМ β -лактоза, рН 5,5) и инкубировали в течение 16 часов при комнатной температуре и при перемешивании. Вновь выпавший в осадок протеин отделяли от растворимой фракции rMLB, полученной после формирования β-структуры, центрифугированием в течение 30 минут при 6000 об./мин и 4°С на центрифуге GS-3 (Sorvall).
(VI) Выделение rMLB путем аффинной хроматографии на N-ацетил-галактозамин-агарозе
Для выделения активной, связывающей углеводы rMLB аффинную матрицу с N-ацетилгалактозамин-агарозой (PIERCE, США) уравновешивали буфером для хроматографии (50 мМ фосфатный буфер, 300 мМ NaCl, 1 мМ ЭДТК, 10 об.% глицерина, 0,05 об.% Твин®-20, рН 7,0) в объеме, соответствующем 10 объемам наполнителя колонки. Пробы наносили "порциями" путем инкубации аффинной матрицы с раствором пробы, содержащим rMLB, в течение не менее 2 часов при 4°С. После промывки аффинной матрицы буфером для хроматографии для удаления неспецифически связанных протеинов связанную rMLB элюировали путем конкурентного замещения 0,3 М N-ацетилгалактозамином в буфере для хроматографии при рН 4,0.
(VII) Реассоциация цепей лектина омелы белой для получения голопротеина in vitro
Получение рекомбинантного голопротеина лектина омелы белой (rML) можно осуществлять с использованием как А- и В-цепей, полученных в результате выделения и формирования β-структуры, так и денатурированных, а затем в процессе совместного формирования β-структуры ренатурированных А- и В-цепей лектина омелы белой. Для реассоциации отдельных цепей, полученных в результате выделения и имеющих β-структуру, выделенную В-цепь лектина омелы белой (nMLB или rMLB) инкубировали с молярным избытком rMLA в 20 мМ фосфатном буфере, 50 мМ NaCl, 1 мМ ЭДТК при рН 7,2 в течение 16-48 часов при 4°С. Образованию дисульфидных мостиков между нитями способствует инкубирование в присутствии окислительно-восстановительной системы из 6 мМ глутатиона (отношение восстановленного к окисленному 5:1) или 10 мМ глутатиона (отношение восстановленного к окисленному 2:1) и 1 мкМ протеин-дисульфид-изомеразы (фирмы Boehringer Mannheim).
Для реассоциации исходя из денатурированных отдельных цепей в рамках совместного формирования β-структуры растворяли А-цепь rML в 6М гидрохлориде гуанидина, 2 мМ ДТТ, 50 мМ трис-HCl, рН 8,0, до концентрации 2 мг/мл. Для полного восстановления цистеинового остатка В-цепь rML растворяли в 6М гидрохлориде гуанидина, 100 мМ ДТТ, 50 мМ трис-HCl, рН 8,0, затем после инкубирования в течение 20 минут при комнатной температуре забуферивали 6М гидрохлоридом гуанидина, 50 мМ трис-HCl, рН 8,0, с помощью гель-проникающей хроматографии на PD-10 (фирма Pharmacia, Швеция) и доводили концентрацию до 200 мкг/мл. Реассоциацию осуществляли в результате совместного формирования β-структуры rMLB с молярным избытком rMLA при инкубации в течение 16 часов при 4°С в смеси, полученной путем медленного разведения (1:30) растворов соли гуанидина в буфере для связывания (50 мМ натрийфосфатный буфер, 50 мМ КСl, 1 мМ ЭДТК, 10 об.% глицерина, 100 мМ глюкоза, 20 мМ лактоза, рН 8,0). Для образования дисульфидных мостиков между нитями инкубацию осуществляли в присутствии окислительно-восстановительной системы из 2 мМ глутатиона (отношение восстановленного к окисленному 1:1).
Смеси, полученные в результате связывания, подвергали диализу в противотоке буфера для хранения (50 мМ натрийфосфатный буфер, 300 мМ NaCl, 1 мМ ЭДТК, 10 об.% глицерина, 0,05 об.% Твин®-20, рН 8,0). Определение и идентификацию образованного гетеродимера осуществляли с помощью электрофореза в ПААГ-ДСН в невосстановительных условиях с последующим Вестерн-блоттингом при использовании моноклональных антител, специфичных к А-цепи лектина омелы белой (ТА5) или В-цепи лектина омелы белой (ТВ33). Выделение образовавшегося голопротеина или отделение свободной rMLA или скоплений rMLA проводили с помощью аффинной хроматографии на N-ацетилгалактозамин-сефарозе или лактозил-агарозе, как описано в разделе (VI).
Пример 8
Изоэлектрическая гомогенность rMLA и rMLB
1-2 мкг rMLA, природной MLA, rMLB, природной MLB или голопротеина ML фокусировали вместе с протеином, используемым в качестве стандарта при изоэлектрофокусировке (ИЭФ) (BioRad, США) в ИЭФ-гелях Servalyt PreNets (рН 3-10, 125×125 мм, 150 мкм, фирма Serva, Гейдельберг). Для обнаружения протеины иммобилизировали путем "полусухого электроблоттинга" на мембранах из нитроцеллюлозы (0,2 мкм, Schleicher &
В то время как высокочистая А-цепь лектина омелы белой, а также высокочистая В-цепь лектина омелы белой представлены как изоэлектрически негомогенные протеины с изоэлектрическими точками nMLA 5,2:5,4:5,5:6,2, соответственно nMLB 7,1:7,3, рекомбинантная А-цепь rML с изоэлектрической точкой 6,8, равно как и рекомбинантная В-цепь rML с изоэлектрической точкой 5,1 оказывается гомогенным протеином (фиг.8). При этом в случае природного голопротеина ML обнаруживают большое количество неоднородных молекулярных вариантов (фиг.8, внизу), в то время как одинаковая подвижность рекомбинантных протеинов лектина омелы белой доказывает гомогенность rML по сравнению с микрогетерогенностью растительного лектина омелы белой.
Пример 9
Определение ферментативной активности rMLA, связанной с инактивацией рибосом
Концентрацию протеинов rMLA (после разрушения β-структуры) и rMLA (растворимый), очищенных с помощью иммуноаффинной хроматографии, а также природной А-цепи ML (nMLA) определяли по Bradford (1976) при использовании в качестве стандарта бычьего сывороточного альбумина (БСА).
Для определения и количественной оценки ферментативной pPHK-N-гликозидазной активности MLA была разработана нерадиоактивная тест-система с использованием "связанной TNT системы ретикулоцитов" (Promega, США). С каждой исследуемой смесью предварительно инкубировали одинаковые количества (20 мкл) TNT-системы в течение 15 минут при 30°С. Для количественной оценки ингибирования трансляции к контрольным смесям добавляли 2 мкл соответствующего буфера или к исследуемым смесям добавляли 2 мкл возрастающих разведений MLA (интервал концентраций 350-0 пМ). Из каждой смеси с интервалом в 8 минут отбирали 2 пробы и для остановки реакции замораживали в жидком азоте. В качестве меры трансляционной активности в биолюминесцентном тесте с помощью сцинтилляционного счетчика определяли относительные количества люциферазы (квадратный корень из числа отсчетов в минуту). При этом для каждой смеси определяли разницу измеренных значений квадратного корня из числа отсчетов в минуту для обеих временных проб в качестве меры относительной трансляционной активности, причем активность контрольной смеси без ПИР была принята за 0% степени инактивации (СИ).
При построении графика зависимости относительной степени инактивации трансляции от использованных концентраций rMLA с помощью нелинейной регрессии определяли ту концентрацию протеина, которая приводит к 50%-ному ингибированию трансляционной активности в сравнении с контрольной смесью. Это значение ИК50 представляет собой зависящую от системы величину, которая позволяет определить и количественно оценить ферментативную активность rMLA (растворимого), rMLA (после разрушения β-структуры) по сравнению с nMLA (фиг.9).
На фиг.9 показано определение связанной с инактивацией рибосом ферментативной активности рекомбинантной А-цепи ML, причем ферментативно активный продукт экспрессии получают как путем выделения растворимой части продукта экспрессии (rMLA растворимый), так и путем разрушения β-структуры выделенного из "телец включения" протеина (rMLA после разрушения β-структуры). Для rMLA (растворимый) и rMLA (после разрушения β-структуры) была выялена активность, характеризующаяся значениями ИК50 10,7±1,3 пМ, соответственно 15,6±6,6 пМ. При этом для них была характерна более низкая токсичность по сравнению с природной А-цепью ML (ИК50 1,1±0,7 пМ).
Пример 10
Активность в отношении связывания углеводов В-цепью лектина омелы белой
Определение активности в отношении связывания углеводов рекомбинантной В-цепью лектина омелы белой, а также сравнение активности в отношении связывания углеводов и специфичности рекомбинантной и растительной В-цепи лектина омелы белой осуществляли с помощью анализа лектин-связывающего фермента (ELLA) в присутствии конкурирующих углеводородов. При применении иммобилизованной асиалофетуиновой матрицы В-цепи nML и rML преимущественно связывались с остатками галактозы и N-ацетилгалактозамина, а при применении иммобилизованной фетуиновой матрицы связывались преимущественно с остатками сиаловой кислоты.
Для иммобилизации углеводной матрицы 100 мкл раствора 1,1 мг асиалофетуина (фирма Sigma, Дайзенхофен) или 1,1 мг фетуина (фирма Sigma, Дайзенхофен) в 11 мл забуференного фосфатом физиологического раствора (ЗФР) помещали в лунки планшетов для микротитрования MaxiSorp C96 (фирма Nunc, Висбаден) и инкубировали в течение 16 часов при комнатной температуре. После трехкратной промывки планшетов 150 мкл/лунку ЗФР-Т (10 мМ натрийфосфатный буфер, 130 мМ NaC1, 0,1 об.% Твин®-20, рН 7,2) для блокирования связывания неспецифических положений планшет инкубировали с 200 мкл/лунку ЗФР-Т-1% БСА (10 мМ натрийфосфатный буфер, 130 мМ NaCl, 0,1 об.% Твин®-20, 1% (масса/объем) БСА, рН 7,2) в течение 1 часа при 36°С и затем промывали, как описано выше. Для испытания использовали 100 мкл препаратов, содержащих В-цепи, в концентрации 100-500 нг/мл, предпочтительно 400 нг/мл, при этом концентрацию для опыта устанавливали путем разведении проб в ЗФР-0,05% БСА (10 мМ натрийфосфатный буфер, 130 мМ NaCl, 0,05% (масса/объем) БСА, рН 7,2). Для опытной концентрации и контроля проводили 2-3 повторения. Определение значения для "холостого" опыта проводили с использованием ЗФР-0,05% БСА или соответствующего препаративного буфера. Для определения специфичности связывания инкубацию проб проводили в присутствии свободного конкурирующего сахара. Для вытеснения rMLB, nMLB или голопротеинов ML из соединения на асиалофетуиновой или фетуиновой матрице добавляли галактозу преимущественно в концентрации 0-280 мМ, N-ацетилгалактозамин в концентрации 0-280 мМ, лактозу в концентрации 0-140 мМ или сиаловую кислоту в концентрации 0-140 мМ.
Планшеты после загрузки инкубировали в течение 2 ч при 36°С и затем промывали, как описано выше. В заполненные лунки добавляли 100 мкл/лунку свиной антисыворотки к лектину омелы белой (разведение 1:19800 пула сыворотки) в ЗФР-Т-0,1% БСА-Тх (10 мМ натрийфосфатный буфер, 130 мМ NaCl, 0,1 об.% Твин®-20, 0,1% (масса/объем) БСА, 1 об.% Тритон® Х 100, рН 7,2), инкубировали в течение 2 ч при 36°С и затем промывали, как описано выше. Для обнаружения иммунных комплексов в каждую из заполненных лунок добавляли 100 мкл антисвиного IgG-IgG, конъюгированного с пероксидазой хрена (фирма Sigma, Дайзенхофен), в разведении 1:3500 в ЗФР-1% БСА (10 мМ натрийфосфатный буфер, 130 мМ NaCl, 1% (масса/объем) БСА, рН 7,2) и инкубировали в течение 1 ч при 36°С. Затем лунки 6 раз промывали ЗФР-Т порициями по 150 мкл/лунку. Для проявления добавляли 100 мкл/лунку. раствора субстрата (1 таблетка о-фенилендиамина (Sigma, Дайзенхофен) в 25 мл 65 мМ лимонной кислоты, рН 5,0+10 мкл 30%-ной перекиси водорода) и инкубировали в течение 20 минут при комнатной температуре в темноте. Реакцию останавливали добавлением 100 мкл 1М серной кислоты/лунку. Количественную оценку проводили путем измерения поглощения при 450 нм с длиной волны для эталона 690 нм и значение ИК50 рассчитывали путем описания результатов измерения с помощью приближения в 4-параметрической функции.
На фиг.10 представлена зависимость наблюдаемого в ELLA-системе вытеснения rMLB и nMLB с иммобилизованного асиалофетуинового лиганда с помощью увеличивающихся количеств D-галактозы (фиг.10а), β-лактозы (фиг.106) или N-ацетилгалактозамина (фиг.10в), а также вытеснение с иммобилизованного фетуинового лиганда с помощью увеличивающихся количеств сиаловой кислоты (фиг.10 г). Характеристики связывания nМВ и rMLB описываются значением ИК50, соответствующим полумаксимальному вытеснению.
В то время как при связывании углеводов растительной В-цепью nML в первую очередь конкурируют галактоза (ИК50=4,5 мМ) и β-лактоза (ИК50=4,9 мМ), рекомбинантная В-цепь rML обнаруживает неожиданно четко измененную углеводную специфичность. В отличие от nMLB активность связывания углеводов rMLB не распространяется на галактозу (ИК50 невозможно определить) и только в незначительной степени распространяется на β-лактозу (ИК50>70 мМ). Помимо резко уменьшенного сродства по отношению к галактозе и β-лактозе рекомбинантная В-цепь rML обнаруживает, однако, четкую специфичность к N-ацетилгалактозамину (ИК50 109 мМ). Дальнейшая, описанная для nMLB активность связывания на лигандах с сиаловой кислотой также была обнаружена для рекомбинантной В-цепи ML (фиг.10 г). При этом для растительной В-цепи nML (ИК50 49,8 мМ) и рекомбинантной В-цепи rML (ИК50 47,1 мМ) характерно согласующееся сродство к связыванию.
В отличие от растительной В-цепи nML, в первую очередь специфичной к галактозе/β-лактозе, рекомбинантная В-цепь rML обладает четко отличающейся, смещающейся в сторону связывания N-ацетилгалактозамина/сиаловой кислоты специфичностью к углеводам.
Пример 11
Определение цитотоксичности реассоциированных голопротеинов rML в отношении клеток лимфолейкоза человека in vitro
Чистоту голопротеина лектина омелы белой подтверждали путем количественного определения цитотоксичности по отношению к линии одноядерных (лимфатических) клеток лейкоза человека MOLT-4 (Европейская Коллекция Культур Клеток Животных, каталожный номер 85011413).
Клетки MOLT-4 культивировали в не содержащей сыворотки среде MDC-1 (PAN SYSTEMS, Айденбах) и использовали в тесте с плотностью засева клеток 1,6× 105 клеток MOLT-4/мл при воспроизводимости >98%. Для определения цитотоксичности в каждую лунку 96-луночного планшета для микротитрования вносили 90 мкл суспензии клеток MOLT-4, соответственно 18000 клеток/лунку и смешивали с 10 мкл раствора пробы. Для проведения опыта вводили препараты голопротеина лектина омелы белой (партии №220793 (Madaus) и BRAIN 12/94, которые были выделены стандартными способами из листьев омелы белой или чая омелы на лактозил-сефарозе (Franz и др., 1977), а также реассоциированный in vitro голопротеин rML в концентрациях 1-100 пг/мл, что соответствует 1,6 фМ-1,6 пМ, при этом готовили ряд разведений в клеточной культуральной среде MDC-1. Для каждой концентрации пробы и контроля опыт повторяли 6 раз.
Клетки инкубировали в течение 72 ч при 37°С в атмосфере с 5% СО2 в инкубаторе, насыщенном газом. Количественную оценку цитотоксического эффекта проводили путем определения жизнеспособности клеток с помощью растворимого формазанового красителя по методу WST-1 (Scudiero и др., 1988) при использовании соответствующего реагента, вызывающего клеточную пролиферацию WST-1 (Boehringer Mannheim).
Рекомбинантный голопротеин, как и химерный голопротеин rMLB/nMLA проявляют в отношении MOLT-4 цитотоксическую активность с ИК50 около 10-30 пг/мл, совпадающую с биологической активностью природного протеина. Напротив, rMLB в анализируемой области концентраций (rMLB до 1 нг/мл) не проявляет никакой цитотоксической активности.
Пример 12
Индукция апоптоза на примере линии клеток человеческих моноцитов U937 с помощью рекомбинантного лектина омелы белой (rML)
Обнаружение индукции процессов апоптоза под действием рекомбинантного лектина омелы белой (rMLA/rMLB) проводили в данном случае путем окрашивания ядер клеток флуоресцирующим красителем 4’,6-диамино-2-фенилиндолом (ДАФИ) (Hotz и др., 1992). Типичные апоптотические изменения морфологии ядра могут быть видны при этом через микроскоп и количественно оценены путем подсчета 500-1000 клеток на пробу. Использование не содержащей сыворотки среды имеет определенное значение для чувствительности анализа, поскольку присутствие протеинов сыворотки заметно уменьшает имеющееся в наличии количество лектина (например, в 40 раз в случае 10%-ной околоплодной сыворотки теленка (ОПСТ), Ribereau-Gayon и др., 1995). Время индукции в 24 часа делает условной прямую корреляцию с анализом MOLT, т.к. цитотоксический эффект при анализе на жизнеспособность полностью четко наблюдается только через 72 часа, однако апоптоз является ранним эффектом. При более продолжительном времени инкубирования апоптоз перекрывается вторичным некрозом.
На фиг.12 видно четкое повышение доли подвергшихся апоптозу клеток U937 после обработки рекомбинантным голопротеином ML. При 70 пг/мл число таких клеток повышается в 3 раза через 24 часа для двух различных культур в средах, не содержащих сыворотки. Рекомбинантный лектин омелы белой, равно как и природный протеин обладают (Janssen и др., 1993) способностью индуцировать гибель клетки в результате апоптоза.
Пример 13
Иммуностимулирующее действие рекомбинантного лектина омелы белой на модели РВМС
В случае с цитокинами TNF-α (моноциты, макрофаги) и γ-интерфероне (IFN-γ) (Т-клетки-хелперы) речь идет о центральных медиаторах в комплексной сети иммунной системы человека.
Человеческие одноядерные клетки (РВМС, содержат моноциты и лимфоциты) здоровых доноров крови выделяли с помощью центрифугирования с градиентом плотности на центрифуге FICOLL-PAQUE® в соответствии с указаниями изготовителя (фирма Pharmacia, Швеция). Для индукции выделения tnf-α клетки (4×106 одноядерных клеток/мл) инкубировали в газовом инкубаторе в среде RPMI 1640 с 10 об.% околоплодной сыворотки теленка, 100 ЕД/мл пенициллина, 100 мкг/мл стрептомицина сначала в течение 18 ч только с рекомбинантными протеинами лектина омелы белой, а затем в течение следующих 24 ч с 1 мкг/мл липополисахаридов из Salmonella abortus equi в качестве сопутствующего стимулирующего фактора при 37°С в атмосфере с 5% СО2 при относительной влажности воздуха >95% в U-образных планшетах для микротитрования клеточных культур. Затем в свободных от клеток супернатантах сразу количественно оценивали концентрацию TNF-α с помощью твердофазного иммуноферментного анализа (ELISA) (Genzyme Diagnostics, Рюссельсхайм).
Для индукции выделения IFN-γ клетки инкубировали по описанной выше методике и в указанной выше среде сначала в течение 1 ч только с рекомбинантными протеинами лектина омелы белой, а затем в течение следующих 65 часов с 0,5 мкл/мл фитогемагглютинина-L в качестве сопутствующего стимулирующего фактора. Затем в свободных от клеток супернатантах сразу количественно оценивали в каждом случае концентрацию IFN-γ с помощью ELISA-теста (ENDOGEN INC., Кембридж, США).
Пример 14
Иммуностимулирующее действие рекомбинантного лектина омелы белой на модели skin2-ZK1200
Использованная в качестве биологической пробы модель skin2 состоит из трехмерной содержащей фибробласты дермы и структурированного эпидермиса из неороговевающих кератиноцитов в принадлежащей им естественно выделенной матрице (Joller и др., 1996). Кусочки кожной ткани (11×11 мм2, полученные из человеческих клеток-предшественников; Advanced Tissue Sciences Inc. (ATS), Ла Джолла, США) в каждом случае помещали на плетеную решетку из найлона на агарозу и сразу после загрузки переносили на специальную среду А (ATS, Ла Джолла, США).
IL-1α и IL-6 являются важными цитокинами, стимулирующими иммунную систему человека.
Для индукции высвобождения IL-1α или IL-6 кусочки ткани в модели skin2 инкубировали в каждом случае с испытуемым веществом в 2 мл специальной среды В (ATS, Ла Джолла, США) в течение 24 часов при 37°С в атмосфере с 5% СО2 и при относительной влажности воздуха >95% в 12-луночных микропланшетах для клеточных культур (Corning Glass Works, Корнинг, США). После этого в супернатантах, не содержащих клеток, в каждом случае с помощью ELISA-теста количественно определяли концентрации IL-1α (набор Quintikine для количественного анализа IL-1α человека, R & D Systems Inc., Миннеаполис, США) или IL-6 (ELISA-тест на человеческий интерлейкин-6, Boehringer Mannheim GmbH).
На модели skin2 было показано зависящее от дозы, индуцируемое с помощью 0,25-8 нг rML/мл выделение IL-1α, а также зависящее от дозы, индуцируемое с помощью 0,5-8 нг rML/мл выделение IL-6 (фиг.14). Неожиданно было обнаружено, что с помощью одной рекомбинантной В-цепи rML не удалось индуцировать выделение вышеназванных цитокинов, что противоречит известным к настоящему моменту сведениям, согласно которым иммуностимулирующая активность главным образом относится к лектиновой активности В-цепи (Hajto и др., 1990).
Пример 15
Активация иммунокомпетентных клеток с помощью рекомбинантной В-цепи лектина омелы белой (rMLB)
Активацию иммунокомпетентных клеток изучали посредством индукции протеина клеточной поверхности CD69. Протеин CD69 появляется в качестве одного из первых антигенов клеточной поверхности после активации Т-клеток, В-клеток и прежде всего "естественных клеток-киллеров" (NK-клетки), которые благодаря их способности узнавать и лизировать неопластические клетки приобретают большое значение при естественной противоопухолевой защите. CD69 представляет собой маркер активации вышеназванных иммунокомпетентных популяций клеток, поскольку этот протеин клеточной поверхности не экспрессируется необработанными лимфоцитами. Кроме того, у индуцируемого поверхностного протеина CD69 обнаружилась функция, способствующая цитолитической активности NK-клеток и Т-клеток TcRγ/δ (Мoretta др., 1991).
Для обнаружения поверхностного маркера на одноядерных клетках человека посредством проточной цитометрии (FACS) выделяли РВМС с помощью градиента плотности на гипаке (натриевая соль 3,5-бис[ацетиламино]-2,4,6-трииодбензойной кислоты) (фирма Sigma) аналогично примеру 13. После переноса клеток в среду RPMI 160 с 5% ОПСТ и засева примерно по 250000 клеток/лунку планшета для микротитрования проводили инкубацию в течение 4 часов с 1, 10, 30 и 100 нг испытуемого вещества rMLB. После инкубации в течение 20 минут в бане со льдом с моноклональным антителом к CD69, содержащим флуоресцентную метку, осуществляли промывку в растворе Ханка с 5% ОПСТ. Осажденные меченые клетки помещали в 200 мкл "жидкости оболочки" и флуоресценцию измеряли с помощью прибора FACScan (Becton Dickinson). На соответствующем чертеже представлены средняя флуоресценция в соответствии с количеством CD69 маркеров клеточной поверхности на клетку, а также доля позитивных в отношении CD69 клеток в общей популяции клеток.
В интервале концентраций 1-100 нг/мл была выявлена активация одноядерных клеток как по появлению CD69 на поверхности клетки, так и по доле позитивных в отношении CD69 клеток. При этом наблюдалось колоколообразная кривая зависимости от дозы. При концентрациях rMLB более 100 нг/мл цитотоксическое действие на исследуемые РВМС не было обнаружено.
Источники информации
Babbitt P.C., West B.L., Buechter D.D., Kuntz I.D. и Kenyon G.L. [1990]: Removal of a proteolytic activity associated with aggregates formed from expression of creatine kinase in Escherichia coli leads to improved recovery of active enzyme Bio/Technology 8, 945-949.
Baur A., Buschinger А. и Zimmermann F.K. (1993): Molecular cloning and sequencing of 18S rDNA fragments of six different ant species. Ins. Soc. 40, 325-335.
Beuth J., Ко H.L., Gabius H.-J. и Pulverer G. [1991]: Influence of treatment with the immunomodulatory effective dose of the β-galactoside-specific lectin from Mistletoe on tumor colonization in BALB/c-mice for two experimental model systems. in vivo 5, 29-32.
Beuth J., Ко H.L., Gabius H.-J., Burrichter H., Oette К. и Pulverer G. [1992]: Behavior of lymphocyte subsets and expression of activation markers in response to immunotherapy with galactoside-specific lectin from mistletoe in breast cancer patients. Clin. Investig. 70, 658-661.
Beuth J., Ко H.L., Tunggal L., Steuer M.K., Geisel J., Jeljaszewicz J. и Pulverer G. [1993]: Thymocyte proliferation and maturation in response to galactoside-specific Mistletoe Lectin-1. in vivo 7, 407-410.
Beuth J., Ко H.L., Tunggal L., Geisel J. и Pulverer G. [1993]: Vergleichende Untersuchungen zur immunaktiven Wirkung von Galactosid-spezifischem Mistellektin. Arzneim. Forsch. 43, 166-169.
Bocci V. [1993]: Mistletoe (Viscum album) lectins as cytokine inducers and immunoadjuvant in tumor therapy. J. of Biological Regulators and Homeostatic Agents 7,1-6.
Beuth J., Ко H.L., Tungal L., Buss G., Jeljaszewicz J., Steuer M.K. и Pulverer G. [1994]: Immunaktive Wirkung von Mistellektin-1 in Abhangigkeit von der Dosierung. Arzneim. Forschung 44, 1255-1258.
Bradford M.M. [1976]: A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry 72, 248-254.
Dietrich J.B.,
Eifler R.,
Endo Y., Tsurugi К. и Franz H. [1988a]: The site of action of the A-chain of mistletoe lectin I on eukaryotic ribosomes. The RNA N-glycosidase activity of the protein. FEBS Lett. 231, 378-80.
Endo Y., Tsurugi К. и Lambert J.M. [1988b]: The site of action of six different ribosom-inactivating proteins from plants on eukaryotic ribosomes: the RNA N-glycosidase activity of the proteins. Biochem. Biophys. Res. Commun. 150, 1032-1036.
Erlich H.A., Gelfand D.H. и Saiki R.K. [1988]: Specific DNA amplification. Nature 331, 461.
Franz H., Haustein В., Luther P., Kuropka U. и Kindt A. [1977]: Isolierung und Charakterisierung von Inhaltsstoffen der Mistel (Viscum album L.) I. Affinitдtschromatographie an fixierten Plasmaproteinen. Acta biol. med. germ. 36, 113-117.
Frohman M.A., Dush M.K. и Martin G.R. [1988]: Rapid production of full-length cDNAs from rare transcripts: Amplification using a single gene-specific oligonucleotide primer. Proc. Natl. Acad. Sci. USA 85, 8998-9002.
Gabius H.-J., Walzel H., Joshi S.S., Kruip J., Kojima S., Gerke V., Kratzin H. и Gabius S. [1992]: The immunomodulatory p-galactoside-specific lectin from Mistletoe: Partial sequence analysis, cell and tissue binding, and impact on intracellu-lar biosignalling of monocytic leukemia cells. Anticancer Res. 12, 669-676.
Gabius H.-J., Gabius S., Joshi S.S., Koch В., Schroeder M., Manzke W.M. и Westerhausen M. [1993]: From III-defined extracts to the immunomodulatory lectin: Will there be a reason for oncological application of Mistletoe? Planta Med. 60, 2-7.
Gabius H.-J. и Gabius S. [1994]: Die Misteltherapie auf dem naturwissenschaftlichen
Ganguly С. и Das S. [1994]: Plant Lectins as inhibitors of tumor growth and modulators of host immune response. Chemotherapy 40, 272-278.
Garcia-Olmedo F., Carbonero P., Hernandez-Lucas C., Paz-Ares J., Ponz F., Vicente О. и Sierra J.M. [1983]: Inhibition of eukaryotic cell-free protein synthesis by thionins from Wheat endosperm. Biochim. Biophys. Acta 740, 52-56.
Gribskov M., Devereux J. и Burgess R. [1984]: Nucl. Acids Res. 12, 539-549.
Hajto Т. [1986]: Immunomodulatory effects of Iscador: A Viscum album preparation. Oncology 43 suppl.l, 51-65.
Hajto Т., Hostanska К. и Gabius H.-J. [1989]: Modulatory potency of the β -galactoside-specific lectin from Mistletoe extract (Iscador) on the host defense system in vivo in Rabbits and Patients. Cancer Res. 49, 4803-4808.
Hajto Т., Hostanska К., Frei К., Rordorf С. и Gabius H.-J. [1990]: Increased secretion of Tumor necrosis factor a, Interleukin 1, and Interleukin 6 by Human Mononuclear Cells exposed to β-Galactoside-specific lectin from clinically applied Mistletoe extract. Cancer Res. 50, 3322-3326.
Harlowe E. и Spur D. [1988]: In: Antibodies. A laboratory manual. Cold Spring Harbor Laboratory, Cold Spring Harbor, New York.
Heiny B.-M. и Beuth J. [1994]: Mistletoe extract standardized for the galactoside-specific lectin (ML-1) induces β-endorphin release and immunopotentiation in breast cancer patients. Anticancer Research 14, 1339-1342.
Hotz M., Del Bino G., Lassota P., Traganos F., Darzynkiewicz Z. [1992]: Cytostatic and cytotoxic effects of fostriecin on human promyelocytic HL-60 and lymphocytic MOLT-4 leukemic cells. Cancer Res. 52, 1530-1535.
Janssen 0., Scheffler А. и Kabelitz D. [1993]: In vitro Effects of Mistletoe Extracts and Mistletoe Lectins. Cytotoxicity towards tumor cells due to the induction of programmed cell death (apoptosis). Arzneim. forsch. 43, 1221-1227.
Joller P.W., Menrad J.M., Schwarz Т.,
Katzin B.J., Collins E.J. и Robertus J.D. [1991]: Structure of Ricin A-Chain at 2.5
Kim Y., Misna D., Monzingo A.F., Ready M.P., Frankel А. и Robertus J.D. [1992]: Structure of a Ricin mutant showing rescue of activity by a noncatalytic residue. Biochemistry, 31, 3294-3296.
Lord J.M., Roberts L.M. и Robertus J.D. [1994]: Ricin: structure, mode of action, and some current applications. FASEB J. 8, 201-208.
Minowada J., Ohnuma Т., Moore G.E. [1972]: Rosette-forming human lymphoid cell lines. J. Nat. Cancer Inst. 49, 891-895.
Mendez E., Moreno A., Colilla F., Pelaez F., Limas G.G., Mendez R., Soriano F., Salinas M. и de Наrо С. [1990]: Primary structure and inhibition of protein synthesis in eukaryotic cell-free system of a novel thionin, g-hordothionin, from barley endosperm. Eur. J. Biochem. 194, 533-539.
Moretta А. и др. [1991]: J. Exp. Med. 172, 701-707.
Ribereau-Gayon G., Jung M.-L., Beck J.-P., Anton R. [1995]: Effect of fetal calf serum on the cytotoxic activity of Mistletoe (Viscum album L.) lectins in cell culture. Phytotherapy Res. 9,336-339.
Rutenber E. и Robertus J.D. [1991]: Structure of Ricin B-chain at 2.5
Scudiero P.A. и др. [1988]: Cancer Res. 48, 4827-4823.
Stein G. и Berg P.A. [1994]: Non-lectin component in a fermented extract from Viscum album L. growth on pines induces proliferation of lymphocytes from healthy and allergic individuals in vitro. Eur. J. Clin. Pharmacol. 47, 33-38.
Stirpe F., Barbieri L., Battelli M.G., Soria M. и Lappi D.A. [1992]: Ribosome-inactivating proteins from plants: Present status and future prospects. Bio/Technology 10, 405-412.
Studier F.W. и Moffart B.A. [1986]: Use of Bacteriophage T7 RNA Polymerase to direct selective high-level expression of cloned genes. J. Mol. Biol. 189, 113-130.
Tonevitsky A.G., Rakhmanova V.A., Agapov I.I., Shamshiev A.T., Usacheva E.A., Prokoph’ev S.A., Denisenko O.N., Alekseev Y. и Pfueller U. [1995]: The interactions of anti-MLI monoclonal antibodies with isoforms of the lectin from Viscum album. Immunol. Lett. 44, 31-4.
Vitetta E.S., Thorpe P.E., Uhr J.W. [1993]: Immunotoxins: magic bullets of misguided missiles? Immunol. Today, 14, 252-259.
Weston S.A., Tucker A.D., Thatcher D.R., Derbyshire DJ. и Pauptit R.A. [1994]: X-ray structure of recombinant Ricin A-Chain at 1.8


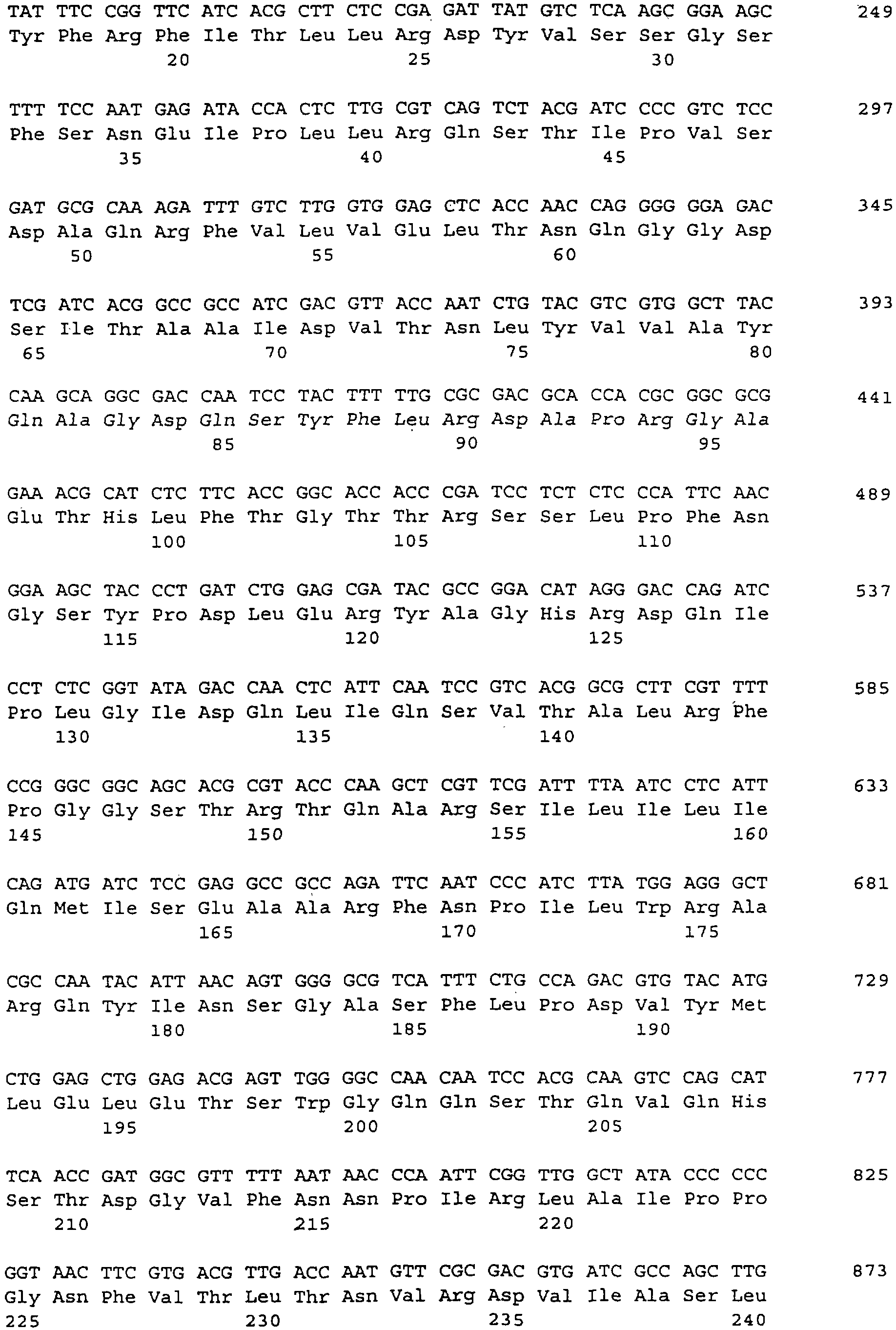


Реферат
Изобретение относится к генетической инженерии и может быть использовано в терапевтических целях, в частности в терапии опухолевых процессов. Использование молекул нуклеиновых кислот, кодирующих полипептиды и димеры полипептидов-лектинов омелы белой, позволяет диагностировать наличие соответствующих генов в организме, а сами полипептиды и их димеры могут быть использованы в составе лекарственных средств, обладающих иммуностимулирующей и цитотоксической активностью. 12 c. и 9 з.п. ф-лы, 15 ил.
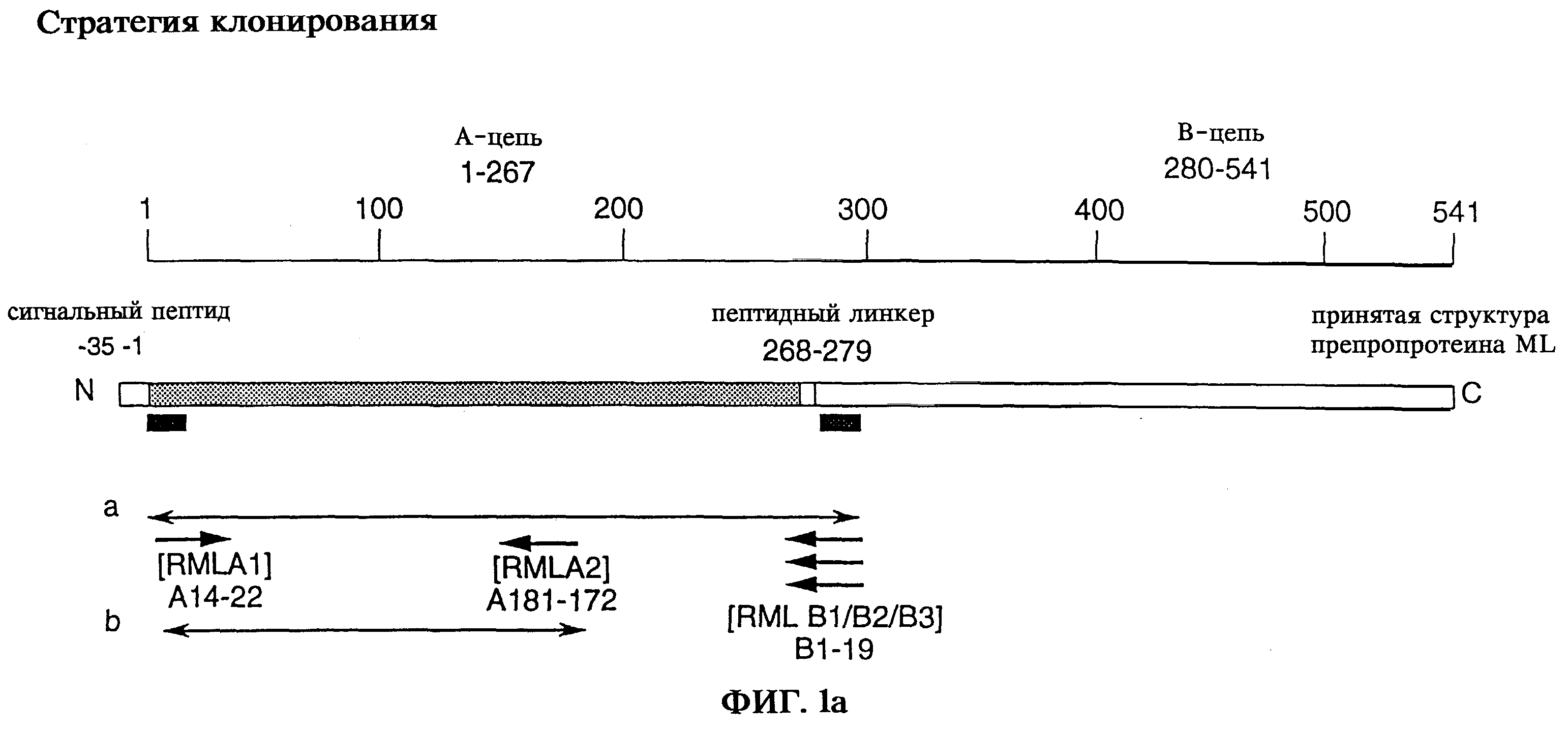

Комментарии