Микроорганизм для продуцирования о-ацетилгомосерина и способ получения о-ацетилгомосерина с использованием этого микроорганизма - RU2676137C2
Код документа: RU2676137C2
Чертежи

















Описание
Область изобретения
Настоящее изобретение относится к микроорганизму, продуцирующему О-ацетилгомосерин с высоким выходом, и способу получения О-ацетилгомосерина с использованием этого микроорганизма.
Предшествующий уровень техники
О-ацетилгомосерин действует как предшественник метионина, который представляет собой тип незаменимой аминокислоты в организме. Метионин используется не только как добавка для кормов и пищевых продуктов, но также как исходный материал для инфузионных растворов и фармацевтических лекарственных средств.
Метионин получают путем химического и биологического синтеза. Недавно был опубликован двухстадийный процесс получения L-метионина из предшественника L-метионина, который был получен путем ферментирования с помощью ферментативного превращения (Международная публикация No. WO 2008/013432).
В двухстадийном процессе используют О-сукцинилгомосерин и О-ацетилгомосерин в качестве предшественников, и очень важно получать О-ацетилгомосерин с высоким выходом с целью экономичного массового производства.
Описание
Техническая задача
В данных обстоятельствах авторы настоящего изобретения приложили усилия для улучшения продукции О-ацетилгомосерина, и в результате они обнаружили белок, способный экспортировать О-ацетилгомосерин, тем самым создав настоящее изобретение.
Техническое решение
Задача настоящего изобретения заключается в том, чтобы предложить микроорганизм, обладающий повышенной продуктивностью по О-ацетилгомосерину.
Другая задача настоящего изобретения заключается в том, чтобы предложить способ эффективной продукции О-ацетилгомосерина с использованием микроорганизма, обладающего повышенной продуктивностью по О-ацетилгомосерину.
Полезные эффекты изобретения
Микроорганизм по настоящему изобретению с повышенной активностью YjeH, то есть белка внутренней мембраны, обладает улучшенной способностью экспортировать О-ацетилгомосерин, и таким образом эффективность продукции О-ацетилгомосерина может быть увеличена. Следовательно, микроорганизм по настоящему изобретению можно широко использовать для продуцирования О-ацетилгомосерина.
Краткое описание графических материалов
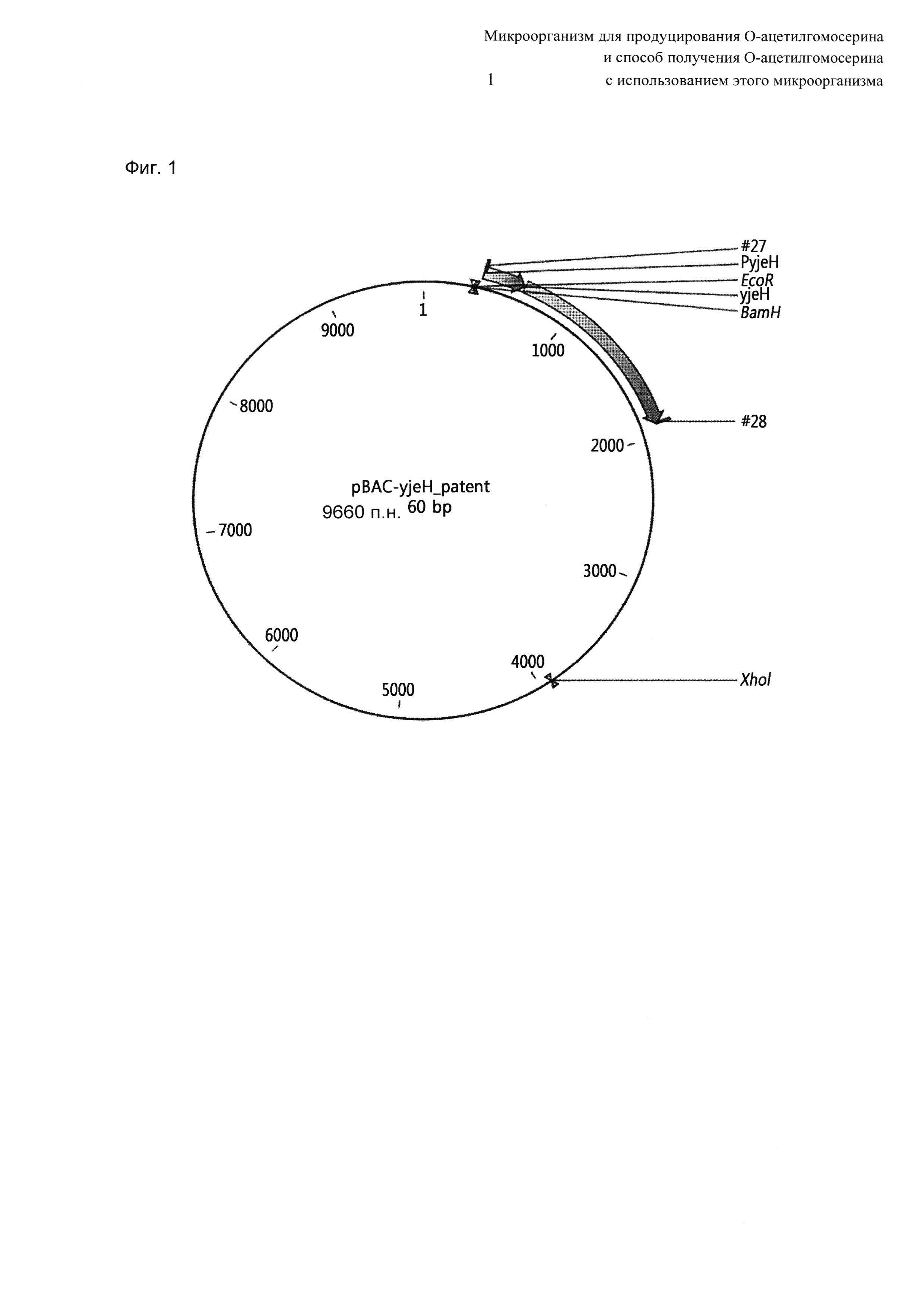
На Фиг. 1 показана карта расщепления вектора yjeH (вектор pBAC-yjeH) по настоящему изобретению.
Наилучшее воплощение изобретения
В одном аспекте настоящего изобретения предложен микроорганизм, обладающий продуктивностью по О-ацетилгомосерину, у которого активность YjeH, то есть белка внутренней мембраны, повышена по сравнению с немодифицированным микроорганизмом.
Как его используют здесь, термин "О-ацетилгомосерин" относится к ацетильному производному L-гомосерина, который представляет собой специфическое промежуточное вещество в пути биосинтеза метионина у микроорганизмов. Известно, что О-ацетилгомосерин образуется путем реакции между гомосерином и ацетил-СоА, катализируемой гомосеринацетилтрансферазой. Он имеет химическую формулу C6H11NO4.
Как его используют здесь, термин "микроорганизм, обладающий продуктивностью по О-ацетилгомосерину" относится к микроорганизму, который при его культивировании в культуральной среде может продуцировать О-ацетилгомосерин внутри биоорганизма и секретировать его в культуральную среду. Продуктивность по О-ацетилгомосерину может быть обеспечена или усилена путем усовершенствования видов. В частности, микроорганизм, обладающий продуктивностью по О-ацетилгомосерину, может представлять собой микроорганизм рода Escherichia, обладающий продуктивностью по О-ацетилгомосерину, и более конкретно Е. coli. Например, микроорганизм может представлять собой Е. coli, обладающую продуктивностью по лизину, треонину, изолейцину или метионину, но не ограничиваясь этим. Как его используют здесь, термин "YjeH", как известно, означает белок, который, являясь членом семейства переносчиков аминокислот
Аминокислота-Полиамин-Органокатион (Amino Acid-Polyamine-Organocation, АРС), присутствует во внутренней мембране. Предполагается, что YjeH действует как переносчик аминокислот, но его точная функция еще не известна. Фактически, авторы настоящего изобретения первыми подтвердили, что YjeH специфически экспортирует О-ацетилгомосерин.
В частности, YjeH может иметь происхождение из микроорганизма рода Escherichia, и более конкретно из Е. coli. В частности, YjeH может представлять собой белок, имеющий аминокислотную последовательность SEQ ID NO: 1, или любую аминокислотную последовательность, имеющую гомологию 70% или больше, в частности 80% или больше или более конкретно 90% или больше с аминокислотной последовательностью SEQ ID NO: 1. Кроме того, очевидно, что любая аминокислотная последовательность, которая имеет такую же аминокислотную последовательность как таковая, изложенная в SEQ ID NO: 1, или любая аминокислотная последовательность, обладающая активностью по экспортированию О-ацетилгомосерина, может попадать в объем настоящего изобретения, хотя последовательность может иметь в себе частичную делецию, модификацию, замену или вставку. Кроме того, на основании вырожденности генетического кода нуклеотидные последовательности, кодирующие одни и те же аминокислоты и их варианты, попадают в объем настоящего изобретения, например, нуклеотидная последовательность, изложенная в SEQ ID NO: 2, но не ограничиваясь ими.
Как его используют здесь, термин "гомология" относится к степени идентичности между двумя различными последовательностями нуклеотидов или аминокислотных остатков в определенном участке сравнения нуклеотидных или аминокислотных последовательностей гена, кодирующего белок, после выравнивания обеих последовательностей по максимальному совпадению. Когда гомология является достаточно высокой, продукты экспрессии соответствующего гена могут иметь одинаковую или похожую активность. Гомологию можно определить с использованием программы сравнения последовательностей, известной в данной области техники, например BLAST (NCBI), CLC Main Workbench (CLC bio), MegAlign™ (DNASTAR Inc.) и так далее.
Как его используют здесь, термин "немодифицированный микроорганизм" относится к микроорганизму, в который не введена модификация, изменяющая активность соответствующего белка, и микроорганизм относится к базовому штамму, в который будет введена модификация, изменяющая активность соответствующего белка, который может представлять собой природный или модифицированный микроорганизм.
Как его используют здесь, термин "повышение" активности белка относится к улучшению активного состояния белков, которыми обладает микроорганизм. Повышение активности белка не ограничено до тех пор, пока активность каждого белка может быть повышена по сравнению с таковой немодифицированного микроорганизма, как в случае с повышением активности белка-мишени. Например, повышение может быть выполнено способами, выбранными из группы, состоящей из: 1) увеличения числа копий полинуклеотида, кодирующего каждый белок, 2) модификации последовательности контроля экспрессии для увеличения экспрессии полинуклеотида, 3) модификации полинуклеотидной последовательности хромосомы для повышения активности каждого белка и 4) их комбинации. В частности, повышение активности белка может быть выполнено способом, выбранным из группы, состоящей из способа введения нуклеотидной последовательности, кодирующей каждый белок, в хромосому, способа введения нуклеотидной последовательности в микроорганизм после его введения в векторную систему, способа введения промотора, проявляющего улучшенную активность, выше по ходу транскрипции от нуклеотидной последовательности, кодирующей каждый белок, или введения каждого белка с модификацией в промоторе, способа модифицирования нуклеотидной последовательности области 5'-UTR (5'-нетранслируемая область) и способа введения варианта нуклеотидной последовательности, кодирующей каждый белок, но способ не ограничен этим.
В конкретном воплощении настоящего изобретения активность YjeH может быть повышена по сравнению с таковой у немодифицированного микроорганизма путем увеличения числа копий или повышения активности данного промотора. В частности, активность YjeH может быть усилена путем введения промотора, проявляющего улучшенную активность, в YjeH, который представляет собой белок внутренней мембраны. В конкретном воплощении настоящего изобретения промотор с улучшенной активностью может включать без ограничения любой промотор, имеющий улучшенную активность по сравнению с таковой собственного промотора yjeH. Примеры такого промотора могут включать без ограничения любой промотор гена, имеющего более высокую активность экспрессии гена по сравнению с таковой собственного промотора yjeH, или модифицированный промотор с активностью, улучшенной благодаря модификации гена в собственном промоторе yjeH, и так далее. В частности, промотор по настоящему изобретению, проявляющий улучшенную активность, может быть выбран из группы, состоящей из промотора icd, промотора pro и промотора cysk. В частности, промотор icd может состоять из нуклеотидной последовательности SEQ ID NO: 51, промотор pro может состоять из нуклеотидной последовательности SEQ ID NO: 52, и промотор cysk может состоять из нуклеотидной последовательности SEQ ID NO: 53, но каждый из этих промоторов может состоять из нуклеотидной последовательности, имеющей гомологию 70% или больше, в частности 80% или больше, и более конкретно 90% или больше, с каждой из вышеизложенных нуклеотидных последовательностей.
В конкретном аспекте настоящего изобретения микроорганизм рода Escherichia, обладающий продуктивностью по О-ацетилгомосерину, может представлять собой микроорганизм, у которого активность цистатионинсинтазы дополнительно понижена или инактивирована. В частности, микроорганизм может представлять собой такой, у которого активность цистатионинсинтазы понижена или инактивирована по сравнению с таковой у немодифицированного микроорганизма, и в частности ген metB, который кодирует цистатионинсинтазу, делетирован, но не ограничиваясь этим. Аминокислотную последовательность metB можно взять из известной базы данных, и любая аминокислотная последовательность, обладающая активностью цистатионинсинтазы, может быть включена без ограничения, например, она может относиться к белку, имеющему аминокислотную последовательность SEQ ID NO: 3. Белок, имеющий аминокислотную последовательность SEQ ID NO: 3, может представлять собой белок, кодируемый нуклеотидной последовательностью SEQ ID NO: 4, но не ограничиваясь этим. Дополнительно, в другом аспекте настоящего изобретения микроорганизм рода Escherichia может представлять собой микроорганизм, у которого активность гомосеринкиназы дополнительно понижена или инактивирована. В частности, микроорганизм может представлять собой такой, у которого активность гомосеринкиназы понижена или инактивирована по сравнению с эндогенной активностью немодифицированного микроорганизма, и в особенности такой, у которого ген thrB, который кодирует гомосеринкиназу, делетирован, но не ограничиваясь этим. Аминокислотную последовательность thrB можно взять из известной базы данных, и любая аминокислотная последовательность, обладающая активностью гомосеринкиназы, может быть включена без ограничения, например, она может относиться к белку, имеющему аминокислотную последовательность SEQ ID NO: 5. Белок, имеющий аминокислотную последовательность SEQ ID NO: 5, может представлять собой белок, кодируемый нуклеотидной последовательностью SEQ ID NO: 6, но не ограничиваясь этим.
В настоящем изобретении "понижение" активности белка может быть выполнено способом, выбранным из группы, состоящей из: 1) делетирования части гена или всего гена, кодирующего каждый белок, 2) модификации последовательности контроля экспрессии для уменьшения экспрессии гена, 3) модификации последовательности гена на хромосоме для понижения активности белка и 4) их комбинации, но не ограничиваясь этим.
В частности, термин "понижение активности белка" относится к уменьшению активности фермента по сравнению с эндогенной активностью фермента, которой обладает микроорганизм штамма в его природном или базовом состоянии. Понижение представляет собой понятие, включающее случай, когда имеет место уменьшение активности фермента у микроорганизма по сравнению с такой, которой изначально обладает сам фермент, вследствие модификации гена, кодирующего фермент, и так далее, случай, когда уровень общей ферментативной активности в клетке ниже, чем таковой у штамма дикого типа вследствие ингибирования экспрессии или ингибирования трансляции гена, кодирующего фермент, или их комбинацию, но не ограничиваясь этим.
Термин "инактивация" относится к случаю, когда ген, кодирующий фермент, у микроорганизма вообще не экспрессируется, и случай, когда ген экспрессируется, но не проявляет активности по сравнению с таковой у штамма дикого типа.
Инактивация фермента может быть достигнута различными способами, известными в данной области техники. Примеры способов могут включать способ замены гена, кодирующего фермент, в хромосоме геном, мутированным для уменьшения активности фермента, включая случай, когда активность фермента устранена; способ введения модификации в последовательность контроля экспрессии гена, кодирующего фермент, на хромосоме; способ замены последовательности контроля экспрессии гена, кодирующего фермент, последовательностью, имеющей слабую активность или не обладающей активностью; способ делетирования всего или части гена, кодирующего фермент, из хромосомы; способ введения антисмыслового олигонуклеотида (например антисмысловой РНК), который комплементарно связывается с транскриптом гена на хромосоме, тем самым ингибируя трансляцию с мРНК в фермент; способ искусственного введения последовательности, комплементарной последовательности SD, выше по ходу транскрипции от последовательности SD гена, кодирующего фермент, образующей вторичную структуру, тем самым делая присоединение рибосомы к ней невозможным; способ включения промотора в 3'-конец открытой рамки считывания (ORF) соответствующей последовательности для индуцирования обратной транскрипции (инженерия обратной транскрипции (RTE)) и так далее, а также их комбинацию, но не ограничиваясь этим.
В частности, способ делетирования всего или части гена, кодирующего фермент, может быть выполнен путем замены полинуклеотида, кодирующего эндогенный белок-мишень, в хромосоме полинуклеотидом или маркерным геном, имеющим частичную делецию в последовательности нуклеиновой кислоты, используя вектор для вставки в хромосому в штамме. В примере воплощения способа делетирования части или всего гена можно использовать способ делетирования гена путем гомологичной рекомбинации, но не ограничиваясь этим.
Как его используют здесь, термин "часть" может варьировать в зависимости от типов полинуклеотидов, и в частности он может относиться к 1-300, более конкретно к 1-100 и еще более конкретно к 1-50, но специально не ограничиваясь этим.
Как его используют здесь, термин "гомологичная рекомбинация" относится к генетической рекомбинации, которая происходит путем кроссинговера в локусе генетической цепи, имеющем взаимную гомологию.
В частности, последовательность регуляции экспрессии можно модифицировать путем индуцирования модификации последовательности контроля экспрессии путем делеции, вставки, неконсервативной или консервативной замены или их комбинации для дальнейшего понижения активности последовательности контроля экспрессии или путем замены на промотор, имеющий намного более низкую активность. Последовательность контроля экспрессии может включать промотор, операторную последовательность, последовательность, кодирующую участок связывания с рибосомой, и последовательности, контролирующие терминацию транскрипции и трансляции, но не ограничиваясь этим.
Более того, генная последовательность в хромосоме может быть модифицирована путем индуцирования модификации в последовательности путем делеции, вставки, неконсервативной или консервативной замены или их комбинации в генной последовательности для дальнейшего понижения активности фермента; или путем замены на генную последовательность, которая была улучшена с тем, чтобы иметь более низкую активность или генную последовательность, которая была улучшена с тем, чтобы не иметь активности, но не ограничиваясь этим.
В конкретном воплощении настоящего изобретения активность каждого белка была понижена путем делеции гена metB, кодирующего цистатионинсинтазу, и/или гена thrB путем гомологичной рекомбинации.
Дополнительно, в конкретном воплощении настоящего изобретения микроорганизм рода Escherichia может представлять собой микроорганизм, у которого дополнительно активность гомосеринацетилтрансферазы повышена по сравнению с таковой у немодифицированного микроорганизма. В частности, микроорганизм может представлять собой такой, у которого активность гомосеринацетилтрансферазы увеличена по сравнению с таковой у немодифицированного микроорганизма, и в частности микроорганизм может представлять собой такой, в который введен модифицированный ген metA, кодирующий гомосеринацетилтрансферазу, обладающую повышенной активностью. Модифицированный ген metA может представлять собой ген, кодирующий гомосеринацетилтрансферазу, у которой 111ая аминокислота гомосеринацетилтрансферазы заменена на глутаминовую кислоту и 112ая аминокислота заменена на гистидин, и в частности, ген, который состоит из нуклеотидной последовательности SEQ ID NO: 8, но не ограничиваясь этим. Продукт модифицированного гена metA может включать без ограничения любую аминокислотную последовательность, с тем чтобы активность гомосеринацетилтрансферазы была повышена по сравнению с таковой у дикого типа, например белок, имеющий аминокислотную последовательность, изложенную в SEQ ID NO: 7. Пример воплощения в отношении получения, использования модифицированного гена metA, штамма с повышенной активностью гомосеринацетилтрансферазы и так далее, раскрыт в патенте Кореи No. 10-1335841, и этот патент Кореи можно считать включенным в настоящее описание во всей полноте посредством ссылки.
Дополнительно, в конкретном аспекте настоящего изобретения микроорганизм рода Escherichia может представлять собой микроорганизм, у которого активность аспартаткиназы (ЕС 2.7.2.4) повышена по сравнению с таковой у немодифицированного микроорганизма. В частности, микроорганизм может представлять собой такой, у которого активность аспартаткиназы повышена по сравнению с таковой эндогенной активностью у микроорганизма, но не ограничиваясь этим.
В конкретном воплощении настоящего изобретения путь биосинтеза был дополнительно усилен с целью достижения максимальной продуктивности по О-ацетилгомосерину. Более конкретно, аспартаткиназу и гомосерин-О-ацетилтрансферазу вводили с помощью плазмиды, и изменение в продуктивности по О-ацетилгомосерину измеряли после дополнительного усиления YjeH в штамме с усиленным путем биосинтеза гомосерина. В результате одновременного усиления как пути биосинтеза, так и yjeH, было подтверждено, что продуктивность по О-ацетилгомосерину была дополнительно улучшена. В частности, было подтверждено, что когда активность YjeH была повышена с помощью промотора cysk, продуктивность YjeH увеличивалась примерно на 93% (от 2,8 г/л до более 5,4 г/л) (Таблица 5).
Дополнительно, в конкретном воплощении настоящего изобретения было изучено, может ли повышение активности YjeH у существующего штамма, обладающего продуктивностью по О-ацетилгомосерину с высоким выходом, дополнительно увеличивать его продуктивность по О-ацетилгомосерину. Более конкретно, количество продукции О-ацетилгомосерина изучали с использованием штамма KCCM11146P (Международная публикация No. WO2012/087039), продуцирующего О-ацетилгомосерин, полученный из штамма, обладающего продуктивностью по треонину вследствие мутации NTG, который представляет собой штамм, имеющий происхождение от штамма дикого типа W3110 после замены промотора эндогенного гена yjeH на промотор с высокой активностью по индукции экспрессии. В результате было подтверждено, что штамм, который уже обладает продуктивностью по О-ацетилгомосерину с высоким выходом, может дополнительно увеличивать активность продукции О-ацетилгомосерина путем повышения активности YjeH примерно на 14% (от 14,2 г/л до более 18,2 г/л) и, в частности, путем повышения активности YjeH с использованием промотора cysk (Таблица 7).
Информация о генах, используемых в настоящем описании, последовательностях белков, кодируемых этими генами, и промоторных последовательностях могут быть получены из известных баз данных, например NCBI GenBank, но не ограничиваясь этим.
Гены, кодирующие каждый из белков и промоторов по настоящему изобретению, включают не только нуклеотидные последовательности, изложенные в каждой из приведенных SEQ ID NO, но также включают без ограничения любую генную последовательность, имеющую гомологию 80% или больше, в частности 90% или больше, более конкретно 95% или больше, еще более конкретно 98% или больше и наиболее конкретно 99% или больше, с этими последовательностями, до тех пор пока генная последовательность кодирует фермент, который проявляет действие по существу такое же, как каждый из ферментов, описанных выше, или соответствующее таковому. Более того, очевидно, что любая нуклеотидная последовательность, имеющая гомологию последовательности как изложено выше, также должна попадать в объем настоящего изобретения, несмотря на то что аминокислотная последовательность может иметь делецию, модификацию, замену или вставку в части последовательности.
Кроме того, очевидно, что любая аминокислота, составляющая каждый из вышеупомянутых белков по настоящему изобретению, также должна попадать в объем настоящего изобретения, несмотря на то что аминокислотная последовательность может иметь делецию, модификацию, замену или вставку в части последовательности, до тех пор, пока аминокислотная последовательность имеет ту же самую последовательность, как изложено в каждой из приведенных SEQ ID NO, или имеет гомологию с ней, в то же время обладая действием по существу таким же, как каждый из белков, или соответствующим таковому.
Действие по единообразному увеличению продуктивности по О-ацетилгомосерину путем повышения активности YjeH было подтверждено на микроорганизмах, имеющих различный генетический фон и различную продуктивность по О-ацетилгомосерину. Это может происходить путем стимуляции продукции определенных промежуточных веществ YjeH в пути биосинтеза. Однако, что касается свойств YjeH, который локализован на внутренней мембране и является членом семейства переносчиков аминокислот, считают, что увеличение продуктивности по О-ацетилгомосерину достигается путем увеличения способности экспортировать О-ацетилгомосерин, который представляет собой конечный продукт и тип аминокислоты, тем самым стимулируя внутриклеточные реакции.
Еще в одном аспекте настоящего изобретения предложен способ получения О-сукцинилгомосерина, включающий культивирование микроорганизма рода Escherichia, продуцирующего О-ацетилгомосерин по настоящему изобретению, и выделение культуральной среды.
Среда, применяемая для культивирования микроорганизма по настоящему изобретению, и другие условия культивирования специально не ограничены, но можно использовать любую среду, традиционно используемую для культивирования микроорганизмов рода Escherichia. В частности, микроорганизм по настоящему изобретению можно культивировать в стандартной среде, содержащей подходящие источники углерода, источники азота, источники фосфора, неорганические соединения, аминокислоты и/или витамины и так далее, в аэробных условиях, в то же время регулируя температуру, рН и так далее.
В настоящем изобретении источники углерода могут включать углеводы (например глюкозу, фруктозу, сахарозу, мальтозу, маннит, сорбит и так далее), спирты (например сахарный спирт, глицерин, пировиноградную кислоту, молочную кислоту, лимонную кислоту и так далее), аминокислоты (например глутаминовую кислоту, метионин, лизин и так далее) и так далее, но не ограничиваясь этим. Дополнительно источники углерода могут включать натуральные органические питательные вещества, такие как гидролизат крахмала, меласса, сырая меласса, рисовые отруби, маниока, меласса сахарного тростника, жидкий кукурузный экстракт и так далее. В частности, можно использовать углеводы, такие как глюкоза и стерилизованная предварительно обработанная меласса (то есть меласса, преобразованная в редуцирующий сахар), и дополнительно можно использовать без ограничения различные источники углерода в подходящем количестве. Эти источники углерода можно использовать по отдельности или в комбинации по меньшей мере из двух типов.
Примеры источников азота могут включать неорганические источники азота (например аммиак, сульфат аммония, хлорид аммония, карбонат аммония, фосфат аммония, нитрат аммония и так далее), аминокислоты (глутаминовую кислоту, метионин, глутамин и так далее) и органические источники азота (например пептон, N-Z-амин, мясной экстракт, дрожжевой экстракт, солодовый экстракт, жидкий кукурузный экстракт, гидролизат казеина, рыбу или продукт ее разложения, обезжиренный соевый жмых или продукт его разложения и так далее). Эти источники азота можно использовать по отдельности или в комбинации по меньшей мере из двух типов, но не ограничиваясь ими.
Примеры источников фосфора могут включать дигидрофосфат калия, гидрофосфат калия и соответствующие натрий-содержащие соли. Примеры неорганических соединений для использования могут включать хлорид натрия, хлорид кальция, хлорид железа, сульфат магния, сульфат железа, сульфат марганца, карбонат кальция и так далее. Дополнительно могут быть включены аминокислоты, витамины и/или соответствующие предшественники. Эти среды или предшественники могут быть добавлены в культуру в процессе периодического культивирования или непрерывного культивирования, но не ограничиваясь этим.
В настоящем изобретении значение рН культуры может быть подведено во время культивирования путем добавления соединения, такого как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота и серная кислота, в культуру соответствующим способом. Во время культивирования также может быть добавлен пеногаситель, такой как полигликолевый сложный эфир жирной кислоты, для предотвращения пенообразования. Дополнительно в культуру может быть введен кислород или газ, содержащий кислород, для поддержания аэробного состояния культуры; или газ азот, водород или диоксид углерода может быть введен без инжекции газа для поддержания анаэробного или микроаэробного состояния культуры.
Температура культуры может обычно находиться в диапазоне от 27°C до 37°C, и более конкретно от 30°C до 35°C, но не ограничиваясь этим. Культивирование можно продолжать до достижения желаемого количества полезных веществ и, в частности, от 10 часов до 100 часов, но не ограничиваясь этим.
Способ получения О-ацетилгомосерина по настоящему изобретению может дополнительно включать способ выделения О-ацетилгомосерина из культивируемого микроорганизма или из культуральной среды.
В частности, выделение О-ацетилгомосерина может быть выполнено способом культивирования микроорганизмов по настоящему изобретению, например, подходящего способа, известного в данной области техники, такого как периодический процесс, непрерывный периодический процесс или процесс с подпиткой.
Выделение может включать процесс очистки.
Выделенный таким образом О-ацетилгомосерин можно использовать для получения метионина путем двухстади иного процесса, разработанного авторами настоящего изобретения (патент Кореи No. 10-0905381), то есть двухстадийного процесса.
Двухстадийный процесс включает процесс получения L-метионина и органических кислот путем ферментативной реакции с использованием фермента, обладающего активностью О-ацетилгомосеринсульфогидролазы, или штамма, содержащего этот фермент, путем использования О-ацетилгомосерина, продуцированного штаммом, продуцирующим предшественник L-метионина, и метилмеркаптана в качестве субстратов.
Еще более конкретно в настоящем изобретении предложен способ получения L-метионина путем ферментативной реакции с использованием фермента, такого как О-ацетилгомосеринсульфогидролаза, путем использования О-ацетилгомосерина, накопленного путем вышеизложенного способа, в качестве субстрата.
В этом двухстадийном процессе, когда О-ацетилгомосерин используют в качестве предшественника L-метионина, в частности можно использовать О-ацетилгомосеринсульфогидролазу, полученную из штамма микроорганизма, принадлежащего роду Leptospira, роду Chromobacterium и роду Hyphomonas и более конкретно из штамма микроорганизма, принадлежащего Leptospira meyeri, Pseudomonas aurogenosa, Hyphomonas neptunium и Chromobacterium violaceum.
Реакция показана ниже.
CH3SH + О-ацетил-L-гомосерин<=>ацетат + метионин
Такой дополнительный процесс получения метионина раскрыт в патенте Кореи No. 10-0905381, и полное описание вышеупомянутого корейского патента может быть включено в настоящее описание посредством ссылки.
Осуществление изобретения
Здесь и далее настоящее изобретение будет описано более подробно со ссылкой на соответствующие Примеры. Однако эти Примеры приведены исключительно для иллюстративных целей и не предназначены никаким образом ограничивать объем настоящего изобретения.
Пример 1: Получение штаммов, обладающих продуктивностью по О-ацетилгомосерину
1-1. Делеция гена metB у Е. coli дикого типа
Для получения штамма, продуцирующего О-ацетилгомосерин, использовали Е. coli, репрезентативный микроорганизм рода Escherichia. Для этой цели Е. coli (K12) W3110 (АТСС27325) дикого типа получали из Американской коллекции типовых культур (АТСС) и использовали. Сначала для блокирования пути продуцирования цистатионина из О-сукцинил-L-гомосерина был делетирован ген metB (SEQ ID NO: 4), кодирующий цистатионинсинтазу.
Более конкретно, использовали способ делеции одностадийной ПЦР с ФРВ-детекцией (флуоресценция в формате реального времени) для делетирования гена metB (Wanner BL., Proc. Natl. Acad. Sci. USA 97: 6640-6645, 2000). Делеционную кассету (deletion cassette) изготавливали путем проведения ПЦР на основе вектора pKD3 (Wanner BL., Proc. Natl. Acad. Sci. USA 97: 6640-6645, 2000) в качестве матрицы с использованием праймеров TKd с SEQ ID NO: 13 и 14. Более конкретно, проводили ПЦР в общей сложности из 30 циклов в следующих условиях: денатурация при 94°C в течение 30 сек, отжиг при 55°C в течение 30 сек и удлинение цепи при 72°C в течение 1 мин.
Полученный таким образом ПЦР-продукт подвергали электрофорезу в 1,0% агарозном геле и ДНК, полученную из полосы 1,2 т.н., очищали. Выделенный фрагмент ДНК вводили в штамм Е. coli (К12) W3110, который уже был трансформирован вектором pKD46 (Wanner BL, Proc. Natl. Acad. Sci. USA 97: 6640-6645, 2000), путем электропорации. Штамм W3110, трансформированный pKD46, культивировали в среде LB, содержащей ампициллин (100 мкг/л) и L-арабинозу (5 мМ), до тех пор, пока культура не достигла ОП600 (оптическая прлотность при 600 нм) равной 0,6 при 30°C и использовали после двукратной промывки стерильной дистиллированной водой и однократной промывки 10% глицерином. Электропорацию проводили при 2500 В. Выделенный штамм высевали на чашку со средой LB, содержащей хлорамфеникол (25 мкг/л), культивировали в течение ночи при 37°C и отбирали устойчивые штаммы.
ПЦР проводили с использованием отобранного таким образом штамма в качестве матрицы наряду с такими же праймерами (SEQ ID NO: 13 и 14) и делецию гена metB подтверждали путем наблюдения присутствия генной полосы 1,2 т.н. в 1,0% агарозном геле. Штамм, в котором делеция гена metB была подтверждена, трансформировали вектором рСР20 (Wanner BL., Proc. Natl. Acad. Sci. USA 97: 6640-6645, 2000) и культивировали в такой же среде LB. Затем проводили ПЦР в таких же условиях с последующим электрофорезом в 1,0% агарозном геле для наблюдения присутствия полосы 1,2 т.н., тем самым подтверждая делецию гена гена metB. Этот штамм после подтверждения делеции трансформировали вектором рСР20 (Wanner BL., Proc. Natl. Acad. Sci. USA 97: 6640-6645, 2000) и культивировали в такой же среде LB. Затем проводили ПЦР в тех же самых условиях с последующим электрофорезом в 1,0% агарозном геле для отбора конечного штамма с делецией гена metB, представленного генной полосой, которая уменьшалась до размера 150 п.н., тем самым подтверждая удаление хлорамфениколового маркера из штамма.
Полученный и отобранный таким образом штамм с делецией гена metB, кодирующего цистатионинсинтазу, получил название "W3-B".
1-2. Делеция гена thrB
Для увеличения объема синтеза О-сукцинилгомосерина штаммом W3-B, полученным в Примере 1-1, у этого штамма был делетирован ген thrB (SEQ ID NO: 6), кодирующий гомосеринкиназу. Для делетирования гена thrB использовали такой же способ делеции одностадийной ПЦР с ФРВ-детекцией, который использовали для делетирования гена metB в Примере 1-1.
Сначала для получения делеционной кассеты thrB проводили ПЦР с использованием вектора pKD4 (Wanner BL, Proc. Natl. Acad. Sci. USA 97: 6640-6645, 2000) в качестве матрицы и тем самым получали делеционную кассету. Более конкретно, ПЦР проводили с использованием праймеров SEQ ID NO: 15 и 16 в течение 30 циклов в следующих условиях: денатурация при 94°C в течение 30 сек, отжиг при 55°C в течение 30 сек и удлинение цепи при 72°C в течение 1 мин.
Полученный таким образом ПЦР-продукт подвергали электрофорезу в 1,0% агарозном геле и ДНК, полученную из полосы 1,6 т.н., очищали. Выделенный фрагмент ДНК вводили в штамм W3-B, который был уже трансформирован вектором pKD46 путем электропорации. Выделенный штамм высевали на чашку со средой LB, содержащей канамицин (50 мкг/л), культивировали в течение ночи при 37°C и отбирали устойчивые штаммы.
ПЦР проводили в тех же условиях с использованием штамма, выбранного путем вышеизложенного процесса, в качестве матрицы вместе с праймерами (SEQ ID NO: 15 и 16) и делецию гена thrB подтверждали путем наблюдения присутствия гена 1,6 т.н. в 1,0% агарозном геле. Подтвержденный штамм снова трансформировали вектором рСР20 и культивировали в среде LB, а затем ПЦР проводили в тех же условиях с последующим электрофорезом в 1,0% агарозном геле для отбора конечного штамма с делецией гена thrB, представленного генной полосой, которая уменьшилась в размерах до 150 п. н., тем самым подтверждая удаление канамицинового маркера из штамма. Полученный таким образом и отобранный штамм с делецией гена thrB, кодирующего гомосеринкиназу, получил название "W3-BT.
Примеры воплощений в отношении штаммов с делецией гена metB и гена thrB и так далее раскрыты в патенте Кореи No. 10-0905381 или международной публикации No. WO 2008/013432, и описание этого патента Кореи или международной патентной публикации могут быть включены в данное описание во всей полноте посредством ссылки.
1-3. Получение штамма с модифицированным геном metA, обладающим активностью гомосеринацетилтрансферазы
Для повышения активности гомосеринацетилтрансферазы у штамма, полученного в Примерах 1-2, была предпринята попытка ввести в этот штамм модифицированный ген metA (SEQ ID NO: 8), который кодирует гомосеринацетилтрансферазу с повышенной активностью.
В этом отношении для получения модифицированного гена metA с повышенной активностью ген metA сначала амплифицировали и получали путем ПЦР с использованием хромосомы штамма W3110 в качестве матрицы вместе с праймерами (SEQ ID NO: 17 и 18). Праймеры (SEQ ID NO: 17 и 18), используемые в ПЦР, были получены так, чтобы включать сайт рестрикции EcoRV и сайт рестрикции HindIII, соответственно, на основе нуклеотидной последовательности хромосомы Е. coli NC_000913, зарегистрированной в NIH GenBank.
Полученный таким образом ПЦР-продукт и плазмиду pCL1920, включающую pcjl, обрабатывали EcoRV и HindIII и клонировали. Е. coli DH5α трансформировали клонированной плазмидой и культивировали на чашке со средой LB, содержащей стрептомицин (50 мкг/л), и трансформированную Е. coli DH5α отбирали и тем самым получали плазмиду. Полученная таким образом плазмида получила название "pCL_Pcj1_metA".
Модифицированный ген metA получали с использованием набора для сайт-направленного мутагенеза (Stratagene, USA) на основе pCL_Pcj1_metA, полученной как изложено выше. Более конкретно, 111ую аминокислоту (Gly) гомосеринацетилтрансферазы заменяли на глутаминовую кислоту (Glu) (G111E). Полученная таким образом плазмида получила название upCL_Pcj1_metA(EL)".
Дополнительно 111ую аминокислоту (Gly) гомосеринацетилтрансферазы заменяли на глутаминовую кислоту (Glu) и дополнительно 112ую аминокислоту (Leu) заменяли на гистидин (His) с использованием праймеров (SEQ ID NO: 21 и 22). Соответственно, плазмида, содержащая ген metA, в котором 111ая аминокислота была заменена с глицина на глутаминовую кислоту и 112ая аминокислота была заменена с лейцина на гистидин, получила название ʺpCL_Pcj1_metA(EH)".
Затем для получения замещающей кассеты (replacement cassette) для замены на модифицированный ген metA после введения его в штамм проводили ПЦР с использованием вектора pKD3 в качестве матрицы вместе с праймерами (SEQ ID NO: 27 и 28) в течение 30 циклов в следующих условиях: денатурация при 94°C в течение 30 сек, отжиг при 55°C в течение 30 сек и удлинение цепи при 72°C в течение 2 мин. Часть metA(EH) замещающей кассеты получали как ПЦР-продукт с использованием pCL-Pcj1-metA(EH) в качестве матрицы вместе с праймерами (SEQ ID NO: 23 и 24) и часть metA дикого типа получали с использованием праймеров (SEQ ID NO: 25 и 26), соответственно. Три ПЦР-продукта использовали для получения замещающей кассеты metA(EH), которая включает хлорамфениколовый маркер, с использованием праймеров (SEQ ID NO: 23 и 26) и модифицированный ген metA вводили в штамм W3-BT, который был уже трансформирован вектором pKD46, полученным в Примере 1-2 путем электропорации. Штамм, в котором введение было подтверждено, снова трансформировали вектором рСР20, культивировали в среде LB, и штамм, у которого хлорамфениколовый маркер был удален и ген metA был заменен на metA(EH), получил название "W3-ВТА".
Примеры воплощений, относящихся к штаммам с повышенной активностью гомосеринацетилтрансферазы, и им подобные раскрыты в патенте Кореи No. 10-1335841 или международной публикации No. WO 2012/087039, и описания патента Кореи или международной патентной публикации могут быть включены сюда во всей своей полноте посредством ссылки.
1-4. Получение штаммов, включающих 2 копии генов ррс, aspC и asd
Для увеличения продуктивности по О-ацетилгомосерину W3-BTA, полученного в Примерах 1-3, была введена существующая стратегия для усиления пути биосинтеза. Были приложены усилия для получения штамма, у которого фосфоенолпируваткарбоксилаза, вовлеченная в биосинтез оксалоацетата из фосфоенолпирувата, аспартатаминотрансфераза, вовлеченная в биосинтез аспартата из оксалоацетата, и аспартат-полуальдегид-дегидрогеназа, вовлеченная в биосинтез гомосерина из дегидрогеназы полуальдегида аспартата (то есть ген ррс, ген aspC и ген asd), были амплифицированы до 2 копий.
Соответственно, ген ррс был амплифицирован до 2 копий с использованием праймеров SEQ ID NO: 29, 30, 31 и 32; ген aspC был амплифицирован до 2 копий с использованием праймеров SEQ ID NO: 33 и 34; и ген asd был амплифицирован до 2 копий с использованием праймеров SEQ ID NO: 35, 36, 37 и 38, соответственно.
Штамм, у которого путь биосинтеза для О-ацетилгомосерина был усилен на основе штамма W3-BTA путем вышеизложенного процесса, получил название "W3-BTA2PCD (= WCJM)".
Примеры воплощений, относящихся к штаммам с повышенной активностью гомосеринацетилтрансферазы, и им подобные раскрыты в патенте Кореи No. 10-0905381 или международной публикации No. WO 2008/013432, и описания этого патента Кореи или международной патентной публикации могут быть включены сюда во всей своей полноте посредством ссылки.
1-5. Эксперимент с культурой в колбе
Для эксперимента по исследованию объема продукции О-ацетилгомосерина штаммом, полученным в Примерах 1-3 и 1-4, была приготовлена культура в колбе Эрленмейера. Штаммы W3110, W3-BTA и WCJM инокулировали в среду LB, культивировали при 33°C в течение ночи. Затем одиночную колонию инокулировали в среду LB (3 мл), культивировали при 33°C в течение 5 часов, снова разводили в 200 раз в колбе Эрленмейера емкостью 250 мл, содержащей 25 мл среды для продукции О-ацетилгомосерина, культивировали при 33°C при скорости 200 об/мин в течение 30 часов, и объем продукции О-ацетилгомосерина подтверждали анализом ВЭЖХ (высокоэффективная жидкостная хроматография). Состав используемой среды суммирован в Таблице 1 ниже.

Штаммы культивировали в вышеописанной среде в течение 30 часов и объем продукции О-ацетилгомосерина подтверждали анализом ВЭЖХ. Результаты показаны в Таблице 2 ниже.

Как могут подтвердить данные из Таблицы 2, штамм дикого типа W3110 вообще не продуцировал О-ацетилгомосерин, однако штамм W3-BTA продуцировал О-ацетилгомосерин в концентрации 0,9 г/л, и штамм WCJM, у которого путь биосинтеза усилен, продуцировал О-ацетилгомосерин в концентрации 1,2 г/л.
Пример 2: Идентификация мембранных белков, увеличивающих продуктивность по О-ацетилгомосерину
Авторы настоящего изобретения применили yjeH (SEQ ID NO: 1), связь которого с экспортированием О-ацетилгомосерина и продуктивностью по О-ацетилгомосерину никогда не была раскрыта.
Ген yjeH штамма был усилен путем клонирования гена yjeH в векторе bac с использованием сайта рестрикции HindIII, присутствующего в векторе bac. Для вектора bac использовали набор CopyControl ВАС Cloning kit (Кат. No. ССВАС1 H-HindIII, Epicentre).
Сначала для получения гена yjeH проводили ПЦР с использованием праймеров (SEQ ID NO: 9 и 10) в общей сложности из 30 циклов в следующих условиях: денатурация при 94°C в течение 30 сек, отжиг при 55°C в течение 30 сек и удлинение цепи при 68°C в течение 1 мин. Полученный в результате ПЦР-продукт подвергали электрофорезу в 1,0% агарозном геле и ДНК, полученную из полосы 1,2 т.н., очищали. Очищенную ДНК обрабатывали HindIII при 37°C в течение ночи, очищали еще один раз и yjeH и вектор ВАС клонировали с использованием лигазы Т4. Е. coil DH5α трансформировали клонированной плазмидой и трансформированную Е. coil DH5α отбирали с чашки со средой LB, содержащей хлорамфеникол 50 мкг/мл. Полученную таким образом плазмиду вводили в штаммы W3-BTA и WCJM, которые продуцируют О-ацетилгомосерин, и выполняли оценку на их продуктивность по О-ацетилгомосерину.
Полученный в результате ПЦР-продукт подвергали электрофорезу в 1,0% агарозном геле и ДНК, полученную из полосы 1,2 т.н., очищали. Очищенную ДНК обрабатывали HindIII при 37°C в течение ночи, очищали еще один раз и yjeH и вектор ВАС клонировали с использованием лигазы Т4. Е. coil DH5α трансформировали клонированной плазмидой и трансформированную Е. coil DH5α отбирали с чашки со средой LB, содержащей хлорамфеникол 50 мкг/мл, и из нее получали плазмиду. Полученную таким образом плазмиду вводили в штаммы W3-BTA и WCJM, которые продуцируют О-ацетилгомосерин, и выполняли оценку на их продуктивность по О-ацетилгомосерину.
Более конкретно, каждый штамм высевали на твердую среду LB и культивировали в инкубаторе при 33°C в течение ночи. Одиночные колонии для каждого штамма, культивированные на твердой среде LB в течение ночи, инокулировали в среду LB (3 мл), культивировали при 33°C в течение 5 часов. Полученную в результате культуру снова разводили в 200 раз в колбе Эрленмейера емкостью 250 мл, содержащей 25 мл среды для продуцирования О-ацетилгомосерина, культивировали при 33°C при скорости 200 об/мин в течение 30 часов, и объем продукции О-ацетилгомосерина подтверждали анализом ВЭЖХ. Результаты суммированы в Таблице 3 ниже.

Как могут подтвердить данные из Таблицы 3, введение плазмиды yjeH в штамм WCJM приводило к более высокому значению ОП по сравнению с таковым контрольного штамма и также к более высокой скорости потребления глюкозы. Штамм WCJM/pBAC-yjeH продуцировал О-ацетилгомосерин в концентрации 2,3 г/л, таким образом подтверждая, что этот штамм может иметь повышенную продуктивность по О-ацетилгомосерину вследствие введения yjeH.
Пример 3: Получение плазмиды с усиленным промотором yjeH и оценка продуктивности по О-ацетилгомосерину
3-1. Получение плазмиды с усиленным промотором yjeH
Был проведен эксперимент по замене эндогенного промотора yjeH на 3 различных промотора, имеющих сильные активности по индукции экспрессии по сравнению с таковыми эндогенного промотора yjeH, на основе плазмиды, полученной в Примере 2.
Более конкретно, векторы PCL с промоторами, обладающими повышенной активностью, получали с использованием промотора pro, cysk или icd. Векторы PCL получали с использованием сайта рестрикции SmaI вектора PCL, и промотор icd (SEQ ID NO: 51) получали путем амплификации ПЦР с использованием праймеров SEQ ID NO: 39 и 40, промотор pro (SEQ ID NO: 52) с использованием праймеров SEQ ID NO: 41 и 42 и промотор cysk (SEQ ID NO: 53) с использованием праймеров SEQ ID NO: 43 и 44. Плазмиды, полученные таким образом, вводили в штамм WCJM, соответственно, и их продуктивности по О-ацетилгомосерину оценивали в колбах.
Более конкретно, каждый штамм высевали на чашку со средой LB и культивировали в инкубаторе при 33°C в течение ночи. Каждый штамм, культивированный в течение ночи на чашке со средой LB, инокулировали в среду для титрования 25 мл и культивировали в инкубаторе при 33°C при скорости 200 об/мин в течение ночи. Результаты показаны в Таблице 4 ниже.

Как могут подтвердить данные из Таблицы 4, штамм с введенной плазмидой pCL-Pcysk-yjeH демонстрировал уменьшение значения ОП по сравнению с таковой с собственным промотором, но этот штамм демонстрировал более высокую скорость потребления глюкозы и самую высокую продукцию О-ацетилгомосерина (4,4 г/л).
3-2. Получение плазмиды для усиления гена и промотора в пути биосинтеза
Для достижения максимальной продуктивности по О-ацетилгомосерину была получена плазмида для усиления пути биосинтеза вплоть до гомосерина. Для клонирования аспартаткиназы, гомосерин-О-ацетилтрансферазы и yjeH в векторе PCL использовали плазмиду pCL-thrA-metX, которая была уже получена.
Более конкретно, для получения гена yjeH проводили ПЦР с использованием праймеров (SEQ ID NO: 11 и 12) в общей сложности из 30 циклов в следующих условиях: денатурация при 94°C в течение 30 сек, отжиг при 55°C в течение 30 сек и удлинение цепи при 68°C в течение 1 мин.
Полученный в результате ПЦР-продукт подвергали электрофорезу в 1,0% агарозном геле и ДНК, полученную из полосы 1,2 т.н., очищали. Очищенную ДНК обрабатывали KpnI при 37°C в течение ночи, очищали еще один раз и yjeH и вектор ВАС клонировали с помощью лигазы Т4. Е. coil DH5α трансформировали клонированной плазмидой и трансформированную Е. coil DH5α отбирали на чашке со средой LB, содержащей стрептомицин 50 мкг/мл, и из нее выделяли плазмиду. Полученную таким образом плазмиду вводили в штамм WCJM, который продуцирует О-ацетилгомосерин, и проводили оценку на продуктивность по О-ацетилгомосерину в колбе. Таким образом были получены все 3 типа плазмид, и они были получены с использованием 3 разных промоторов, полученных в Примере 3-1. Эти 3 разных типа плазмид вводили в штамм WCJM и проводили оценку в колбе таким же образом как в Примере 3-1. Результаты показаны в Таблице 5 ниже.

Как могут подтвердить данные из Таблицы 5, когда путь биосинтеза и yjeH были усилены одновременно, продукция О-ацетилгомосерина дополнительно улучшалась. Порядок увеличения продукции О-ацетилгомосерина был следующим: таким же образом как изложено выше, штамм с введенной плазмидой pC2-Pcysk-yjeH демонстрировал уменьшение величины ОП по сравнению с таковой штамма, у которого применялся собственный промотор, но штамм с введенной плазмидой pC2-Pcysk-yjeH демонстрировал наиболее высокую скорость потребления глюкозы, а также наиболее высокую продукцию О-ацетилгомосерина (5,4 г/л).
Пример 4: Получение штамма с усиленным эндогенным промотором yjeH и оценка продуктивности по О-ацетилгомосерину
4-1. Получение штамма с усиленным эндогенным yjeH и его оценка
Для получения штамма с повышенной активностью эндогенного гена yjeH штамма WCJM, который продуцирует О-ацетилгомосерин, был проведен эксперимент по замене промотора. Штамм WCJM по настоящему изобретению имеет одну копию гена yjeH, и был получен штамм для усиления гена yjeH путем усиления промотора, вместо увеличения числа копий гена yjeH.
Более конкретно, в качестве промотора для замены использовали промоторы icd, cysK и pro (Pied, Pcysk и Ppro), активности которых были подтверждены в Примере 3, и применяли метод делеции одностадийной ПЦР с ФРВ-детекцией, изложенный выше (Wanner BL, Proc. Natl. Acad. Sci. USA 97: 6640-6645, 2000). Инсерционные кассеты получали с использованием вектора pKD4 в качестве матрицы вместе с праймерами SEQ ID NO: 45 и 46 для промотора icd, праймерами SEQ ID NO: 47 и 48 для промотора cysk и праймерами SEQ ID NO: 49 и 50 для промотора pro. ПЦР проводили в общей сложности в течение 30 циклов в следующих условиях: денатурация при 94°C в течение 30 сек, отжиг при 55°C в течение 30 сек и удлинение цепи при 72°C в течение 1 мин.
Полученный таким образом ПЦР-продукт подвергали электрофорезу в 1,0% агарозном геле и ДНК, полученную из полосы 2,5 т.н., очищали. Выделенный фрагмент ДНК вводили в штамм WCJM, который был уже трансформирован вектором pKD46 (Wanner BL., Proc. Natl. Acad. Sci. USA 97: 6640-6645, 2000) путем электропорации. Штамм WCJM, трансформированный pKD46, культивировали с использованием среды LB, содержащей ампициллин 100 мкг/л и L-арабинозу 5 мМ, до достижения культурой значения ОП600 равного 0,6 при 30°C и использовали после двукратной промывки стерильной дистиллированной водой и однократной промывки 10% глицерином. Электропорацию проводили при 2500 В. Полученный штамм высевали на чашку со средой LB, содержащей хлорамфеникол 25 мкг/л, культивировали в течение ночи при 37°C и отбирали устойчивые штаммы.
ПЦР проводили с использованием отобранного таким образом штамма в качестве матрицы вместе с праймерами SEQ ID NO: 45 и 46 для промотора icd, праймерами SEQ ID NO: 47 и 48 для промотора cysk и праймерами SEQ ID NO: 49 и 50 для промотора pro в таких же условиях как изложено выше, и замену эндогенного промотора гена yjeH на каждый из чужеродных промоторов подтверждали наблюдением присутствия генной полосы 2,5 т.н. в 1,0% агарозном геле. Штаммы, в которых была подтверждена замена промотора, трансформировали вектором рСР20 (Wanner BL., Proc. Natl. Acad. Sci. USA 97: 6640-6645, 2000) и культивировали в среде LB. Затем проводили ПЦР в тех же условиях с последующим электрофорезом в 1,0% агарозном геле для получения конечных штаммов с заменой промотора, представленных генной полосой, размер которой уменьшался до 1 т.н., тем самым подтверждая удаление канамицинового маркера из штаммов. Полученные таким образом штаммы получили названия по их соответствующим промоторам: то есть, "WCJM-PIY" для штамма с замененным icd-промотором icd, "WCJM-PCY" для штамма с замененным промотором cysk и ʺWCJM-PCY" для штамма с замененным промотором pro. Продуктивности по О-ацетилгомосерину штаммов, у которых промотор гена yjeH был заменен, измеряли путем выполнения оценки культуры в колбе, и результаты показаны в Таблице 6 ниже.

Как могут подтвердить данные из Таблицы 6, когда экспрессия гена yjeH у штамма WCJM была усилена путем замены эндогенного промотора гена yjeH в хромосоме на промотор, обладающий сильной экспрессионной активностью, продуктивность по О-ацетилгомосерину не изменялась быстро по сравнению с результатами из Примера 3, в котором штамм был трансформирован путем введения плазмиды (5 копий), но было показано, что продуктивность по О-ацетилгомосерину каждого из штаммов повышалась по сравнению с таковой у штамма WCJM, который представляет собой штамм, продуцирующий О-ацетилгомосерин.
4-2. Получение штамма с усиленным промотором гена yjeH в штамме с высоким выходом О-ацетилгомосерина и оценка продуктивности этого штамма по О-ацетилгомосерину
Способ получения штамма, продуцирующего О-ацетилгомосерин, с использованием штамма, имеющего происхождение от W3110 дикого типа, который обладает продуктивностью по треонину благодаря мутации NTG, известен (Международная публикация No. WO 2012/087039). В частности, полученный таким образом штамм, продуцирующий О-ацетилгомосерин с высоким выходом, был депонирован в Корейском центре культур микроорганизмов (KCCM) с номером доступа No. KCCM11468P.
Штамм с номером доступа No. KCCM11146P обладает продуктивностью по О-ацетилгомосерину с высоким выходом, потребляет 40 г/л глюкозы и продуцирует примерно от 15 г/л до 16 г/л во время культивирования в колбе. В этом отношении авторы настоящего изобретения исследовали, можно ли в штаммах, которые уже обладают высокой продуктивностью по О-ацетилгомосерину, дополнительно улучшить продуктивность по О-ацетилгомосерину путем усиления гена yjeH в этих штаммах.
Более конкретно, промотор гена yjeH заменяли на промотор с высокой активностью индукции экспрессии, и это выполняли таким же образом как в Примере 4-1. Полученные таким образом штаммы, у которых промотор гена yjeH штамма KCCM11146P, получили названия "KCCM11146P-PIY" для штамма с замененным промотором icd, "KCCM11146P-PCY" для штамма с замененным промотором cysk и "KCCM11146P-PPY для штамма с замененным промотором pro, соответственно.
Продуктивность по О-ацетилгомосерину штаммов, у которых промотор гена yjeH был заменен, измеряли путем оценки культуры в колбе. Более конкретно, штаммы KCCM11146P, KCCM11146P-PIY, KCCM11146P-PCY и KCCM11146P-PPY инокулировали в среду LB и культивировали при 33°C в течение ночи. Полученные в результате отдельные колонии инокулировали в 3 мл среды LB, культивировали при 33°C в течение 5 часов, разводили в 200 раз в колбе Эрленмейера емкостью 250 мл, содержащей 25 мл среды для продуцирования О-ацетилгомосерина, культивировали при 33°C при скорости 200 об/мин в течение 30 часов, и объем продукции О-ацетилгомосерина анализировали путем ВЭЖХ. Результаты показаны в Таблице 7 ниже.

Как могут подтвердить данные из Таблицы 7, штамм KCCM11146P продуцировал 14,2 г/л О-ацетилгомосерина, тогда как в случаях со штаммами с замененным промотором штамм PCY демонстрировал самую высокую продукцию (18,2 г/л), и штаммы PIY и PPY демонстрировали увеличенную продукцию О-ацетилгомосерина по сравнению с таковой у исходного штамма.
Авторы настоящего изобретения подтвердили, что штамм на основе штамма KCCM11146P, у которого повышена активность гена yjeH, может увеличивать продукцию О-ацетилгомосерина. В результате авторы изобретения назвали этот штамм "СА05-4008" и депонировали этот штамм в Корейском центре культур микроорганизмов (KCCM) в соответствии с Будапештским договором 22 ноября 2013 года с номером доступа No. KCCM11484P.
На основании вышеизложенного специалист в области техники, к которой относится данное изобретение, способен понять, что настоящее изобретение может быть воплощено в других конкретных формах без изменения технической идеи или существенных признаков настоящего изобретения. В этом отношении примеры воплощений, раскрытые здесь, служат исключительно для иллюстративных целей и не предназначены ограничивать объем настоящего изобретения. Наоборот, настоящее изобретение предназначено охватывать не только воплощения, представленные в примерах, но также различные альтернативные, модифицированные, эквивалентные и другие воплощения могут быть включены в пределах сущности и объема настоящего изобретения, как определено в прилагаемой формуле.
Реферат
Группа изобретений относится к биотехнологии. Предложен микроорганизм рода Escherichia, продуцирующий О-ацетилгомосерин, где активность белка, содержащего аминокислотную последовательность SEQ ID NO: 1, повышена по сравнению с немодифицированным микроорганизмом, продуцирующим О-ацетилгомосерин, и где активность цистатионинсинтазы инактивирована по сравнению с немодифицированным микроорганизмом, продуцирующим О-ацетилгомосерин. Предложены также способ получения О-ацетилгомосерина и способ получения L-метионина с использованием указанного микроорганизма. Изобретение обеспечивает улучшенную продукцию О-ацетилгомосерина. 3 н. и 6 з.п. ф-лы, 1 ил., 7 табл., 4 пр.
Формула
Документы, цитированные в отчёте о поиске
Бактерия - продуцент l-аминокислоты и способ получения l-аминокислоты (варианты)

Комментарии