Гены, кодирующие главный капсидный белок l1 вируса папилломы человека, и их применение - RU2494106C2
Код документа: RU2494106C2
Чертежи











Описание
Область изобретения
Настоящее изобретение относится к области биотехнологии, а именно к основному капсидному белку вируса папилломы человека, гену, кодирующему этот белок, а также к способу его получения и использованию.
Предпосылки создания изобретения
Вирус папилломы человека (ВПЧ) - малый вирус без оболочки с кольцевой двухспиральной ДНК, относящийся к подсемейству вирусов полиомы семейства паповавирусов. ВПЧ передается от человека к человеку при интимном контакте, приводя к таким поражениям у инфицированного пациента как бородавки на коже и кондиломы в перианальной области и в области половых органов, которые классифицируются как заболевания, передающиеся половым путем. Согласно результатам исследований, опубликованным Международным агентством по изучению рака в 1995, ВПЧ имеет прямое отношение к появлению рака шейки матки. Таким образом ясно, что ВПЧ является патогеном, вредным для здоровья человека, В связи с этим разработка высокоэффективных и недорогих вакцин против ВПЧ для предотвращения рака шейки матки у женщин, а также заболеваний, передающихся половым путем, вызванных инфицированием ВПЧ, является актуальной задачей.
В настоящее время идентифицировано более 100 подтипов ВПЧ. При использовании чувствительных методов исследования практически у 100% больных раком шейки матки в пораженных тканях обнаруживается ДНК, принадлежащая подтипам ВПЧ высокой степени риска. В зависимости от способности подтипов ВПЧ вызывать злокачественные новообразования в половых путях женщин, ВПЧ подразделяются на подтипы высокой степени риска и низкой степени риска. ВПЧ 6, 11, 34, 40, 42 и аналогичные относятся к подтипам низкой степени риска, которые обнаруживаются обычно при доброкачественных заболеваниях шейки матки, таких как кондиломы и умеренная атипическая гиперплазия цервикального эпителия, в то время как подтипы высокой степени риска - ВПЧ 16, 18, 31, 33, 35, 39, 45, как правило обнаруживаются при тяжелой атипической гиперплазии цервикального эпителия, а также при раке шейки матки. В ряде исследований различных групп населения показано, что инфицирование половых путей вирусами ВПЧ 16 и 18 в большей степени связано с появлением рака шейки матки, чем другие факторы риска. Около 50-60% случаев рака шейки матки вызвано инфицированием ВПЧ 16, около 14% - ВПЧ 18, около 8% - ВПЧ 45 и около 5% - ВПЧ 31. Оставшиеся 23% случаев вызвано другими подтипами ВПЧ.
ВПЧ является глобулярным вирусом без оболочки диаметром около 45-55 нм, имеет капсид, состоящий из 72 модулей (капсомеров) икосаэдрической симметрии. Капсид вириона состоит из главного капсидного белка (L1) и малого капсидного белка (L2). После экспрессии в клетках главные капсидные белки L1 способны к самосборке с образованием капсидных частиц, называемых вирусоподобными частицами (ВЧ).
Для обычной женщины вероятность заражения цервикальных путей хотя бы одним подтипом ВПЧ в течение всей жизни составляет 40%. Таким образом, разработка эффективных вакцин против рака шейки матки, имеющих приемлемую цену, и, прежде всего, вакцин против ВПЧ 16 и ВПЧ 18 имеет большое значение для снижения заболеваемости и смертности женщин от рака шейки матки.
Из уровня техники известны некоторые вакцины, разработанные против ВПЧ. Как правило, они характеризуются низкой эффективностью экспрессии белков ВПЧ, низкой активностью экспрессированного белка, неспособностью белка образовывать вирусоподобные частицы либо нежелательным иммунологическим действием образованных частиц. Следовательно, в данной области существует потребность в вакцинах против ВПЧ с улучшенными свойствами.
Краткое описание изобретения
Объектами данного изобретения является ген, кодирующий главный капсидный белок L1 вируса папилломы человека, а также способ его получения и использование.
Согласно первому аспекту настоящего изобретения, предлагается выделенный ген, кодирующий главный капсидный белок L1 вируса папилломы человека, причем указанный ген содержит кодоны, предпочтительные для дрожжей Pichia.
В другом предпочтительном осуществлении настоящего изобретения указанный ген кодирует главный капсидный белок L1 вируса папилломы человека, включающий цепочку аминокислот, представленную в SEQ ID NO:10 либо в положениях 62-568 SEQ ID NO:10 (т.е., главный капсидный белок L1 вируса папилломы человека подтипа 18). Более предпочтительно, указанный ген содержит последовательность нуклеотидов, выбранную из представленных в SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3; либо содержит последовательность нуклеотидов, выбранную из представленных в SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6.
В другом предпочтительном осуществлении настоящего изобретения указанный ген кодирует главный капсидный белок L1 вируса папилломы человека, включающий цепочку аминокислот, представленную в SEQ ID NO:11 (т.е., главный капсидный белок L1 вируса папилломы человека подтипа 16). Более предпочтительно, указанный ген содержит последовательность нуклеотидов, выбранную из представленных в SEQ ID NO:7, SEQ ID NO:8 и SEQ ID NO:9.
Согласно второму аспекту настоящего изобретения, предлагается вектор экспрессии, содержащий последовательность указанного гена.
Согласно еще одному предпочтительному осуществлению настоящего изобретения, указанный вектор экспрессии представляет собой вектор для экспрессии в клетках дрожжей Pichia.
Согласно третьему аспекту настоящего изобретения, предлагается клетка-хозяин, полученная методом генной инженерии, причем указанная клетка содержит упомянутый экспрессирующий вектор или имеет указанный ген, включенный в ее геном.
Согласно другому предпочтительному осуществлению настоящего изобретения, указанная клетка представляет собой клетку дрожжей Pichia. Более предпочтительно, дрожжи Pichia выбираются из штаммов дрожжей Pichia Х-33, GS115, КМ71 и SMD1168. Наиболее предпочтительно, указанные дрожжи Pichia относятся к штамму дрожжей Pichia Х-33.
Согласно четвертому аспекту настоящего изобретения, предлагается иммуногенная макромолекула (т.е., вирусоподобная частица). Указанная макромолекула диаметром 50-80 нм получается путем самосборки из главного капсидного белка L1 вируса папилломы человека, который был экспрессирован в дрожжах Pichia.
В другом предпочтительном осуществлении настоящего изобретения указанную иммуногенную макромолекулу получают способом, включающим:
(1) культивирование указанной клетки-хозяина, позволяющее экспрессию указанного главного капсидного белка L1 вируса папилломы человека и его самосборку в указанную иммуногенную макромолекулу в указанной клетке-хозяине;
(2) отделение указанной иммуногенной макромолекулы.
Согласно пятому аспекту настоящего изобретения, предлагается способ получения указанной иммуногенной макромолекулы, причем данный способ включает:
(1) культивирование указанной клетки-хозяина, позволяющее экспрессию указанного главного капсидного белка L1 вируса папилломы человека и его самбосорку в указанную иммуногенную макромолекулу в указанной клетке-хозяине;
(2) отделение указанной иммуногенной макромолекулы.
Еще в одном предпочтительном осуществлении настоящего изобретения стадия (2), описанная выше, включает:
(a) разрушение клеток-хозяев, полученных на стадии (1) с образованием супернатанта, содержащего указанную иммуногенную макромолекулу; и
(b) последовательную очистку супернатанта, полученного на стадии (а), методом колоночной хроматографии на колонке с POROS 50 HS и методом колоночной хроматографии на колонке СНТ с образованием указанной иммуногенной макромолекулы.
Еще в одном предпочтительном осуществлении на стадии (b), описанной выше, очистку методом колоночной хроматографии на колонке с POROS 50 HS осуществляют следующим образом: Супернатант, полученный на стадии (а), наносят на предварительно очищенную и приведенную в равновесие колонку с POROS 50 HS, при этом указанная иммуногенная макромолекула связывается с колонкой. После промывки и приведения в равновесие, проводят элюирование линейным градиентом от 100% буфера А до 100% буфера В и собирают фракции, соответствующие хроматографическим пикам с электропроводностью 70-100 мСм/см, при этом указанный буфер А содержит 50±20 мМ MOPS (4-морфолинпропансульфоновая кислота), 0,75±0,3 М NaCl и 0,05±0,02% Твин-80 (pH 6.5±1), а указанный буфер В содержит 50±20 мМ MOPS, 1,5 М NaCl и 0,05±0,02% Твин-80 (pH 6.5±1); или
очистку методом колоночной хроматографии на СНТ осуществляют следующим образом: продукт, очищенный на колонке POROS 50 HS, наносят на предварительно очищенную и приведенную в равновесие колонку с СНТ. После промывки и приведения в равновесие, проводят элюирование линейным градиентом от буфера С до 100% буфера D, и собирают фракции, соответствующие хроматографическим пикам 50-70 мСм/см, причем указанный буфер С содержит 50±20 мМ MOPS, 0,5±0,2 М NaCl, 0,04±0,02 М фосфатный буфер (РВ) и 0,05±0,02% Твин-80 (pH 6.5±1), а указанный буфер D содержит 0,5±0,2М NaCl, 200 мМ РВ и 0,05±0,02% Твин-80 (pH 6.5±1).
Согласно шестому аспекту настоящего изобретения, предлагается иммуногенная композиция, причем упомянутая композиция содержит:
(i) эффективное количество указанной иммуногенной макромолекулы; и
(ii) фармацевтически приемлемый носитель.
В другом предпочтительном осуществлении настоящего изобретения, указанный фармацевтически приемлемый носитель включает по крайней мере один иммуностимулятор или адъювант.
Еще в одном предпочтительном осуществлении настоящего изобретения указанный адъювант является соединением алюминия.
Согласно другому предпочтительному осуществлению настоящего изобретения, указанная композиция представляет собой вакцину.
Согласно седьмому аспекту настоящего изобретения, предлагается применение указанной иммуногенной макромолекулы для профилактики или лечения заболеваний, связанных с инфицированием вирусом папилломы человека.
Согласно восьмому аспекту настоящего изобретения, предлагается способ профилактики или лечения заболеваний, связанных с инфицированием вирусом папилломы человека, причем указанный способ включает введение пациента, нуждающемуся в профилактике или лечении, эффективного количества указанной иммуногенной макромолекулы либо указанной иммуногенной композиции.
В другом предпочтительном осуществлении настоящего изобретения заболевания, связанные с инфицированием вирусом папилломы человека, выбраны из группы злокачественных новообразований (таких как рак шейки матки, рак влагалища, рак ануса или перианальный рак, ротоглоточный рак, рак гайморовой пазухи, рак легких) и интраэпителиальной цервикальной неоплазии.
Прочие аспекты настоящего изобретения будут очевидны для специалиста в данной области в рамках настоящего описания.
Краткое описание рисунков
На фиг.1 схематически показана конструкция вектора pPICZ-18L1.
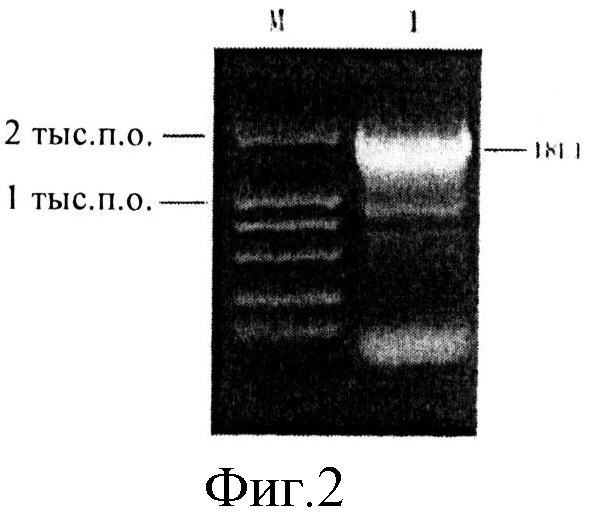
На фиг.2 приведена диаграмма ПЦР-амплификации гена L1 ВПЧ 18.
На фиг.3 приведена схема идентификации вектора pPICZ-18L1, при этом дорожка 1 представляет собой pPICZαB, гидролизованный действием BstBI и KpnI, а дорожка 2 - pPICZ-18L1, гидролизованный действием BstBI и KpnI.
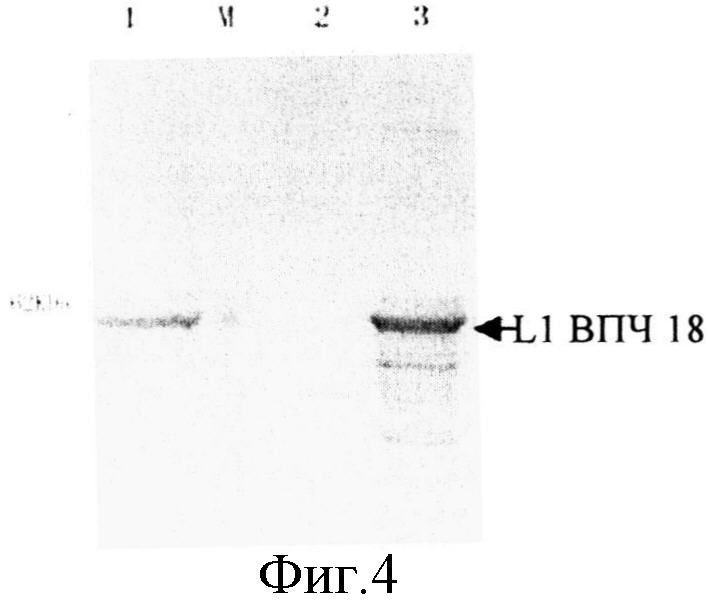
На фиг.4 приведена схема анализа экспрессии L1 ВПЧ 18 методом вестерн-блоттинга, где М - маркер молекулярной массы Rainbow Marker (Fermentas Co., Ltd); 1 - положительный контроль экспрессии; 2 - отрицательный контроль экспрессии, 3 - штамм, экспрессирующий Bn418L1. Стрелкой отмечен экспрессированный L1 ВПЧ 18.
На фиг.5 приведена схема ПЦР-амплификации гена усеченного L1 ВПЧ 18.
На фиг.6 приведена схема идентификации вектора pPICZ-18L1', дорожка 1 представляет собой pPICZαB, гидролизованный действием BstBI и KpnI; а дорожка 2 - pPICZ-18L1', гидролизованный действием BstBI и KpnI.
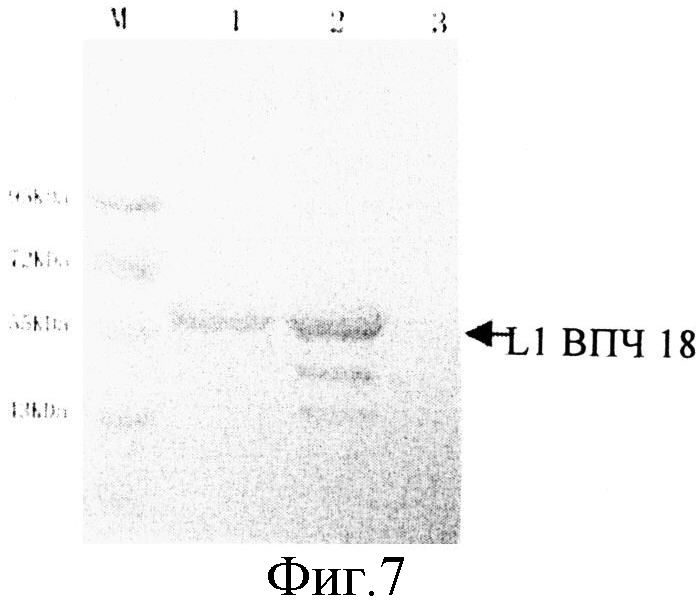
На фиг.7 приведена схема анализа экспрессии усеченного L1 ВПЧ 18 методом вестерн-блоттинга, где М - маркер молекулярной массы Rainbow Marker (Fermentas Co., Ltd); 1 - положительный контроль экспрессии; 2 - штамм, экспрессирующий усеченный Bn418L1; и 3 - отрицательный контроль экспрессии. Стрелкой отмечен экспрессированный усеченный L1 ВПЧ 18.
На фиг.8 приведены результаты электрофореза на ДДС-Na-ПААГ в восстанавливающих условиях хроматографически очищенного образца L1 ВПЧ 18, причем 1 - фракция пика 1, собранная на колонке POROS 50 HS; 2 - фракция пика 2, собранная на колонке POROS 50 HS; 3 - фракция пика 3, собранная на колонке POROS 50 HS; 4 - фракция пика 1, собранная на колонке СНТ; 5 - концентрат образца пика 1 с колонки СНТ; и 6 - положительный контроль.
На фиг.9 приведены результаты иммуноблоттинга очищенного продукта L1 ВПЧ 18, при этом первичным антителом является антитело против L1 ВПЧ 18 от компании Fitzgerald Corp. при разбавлении 1:5000; вторичным антителом является антитело козы против мышиного антигена при разбавлении 1:250; 1 - положительный контроль; 2 и 3 - очищенный белок L1 ВПЧ 18.
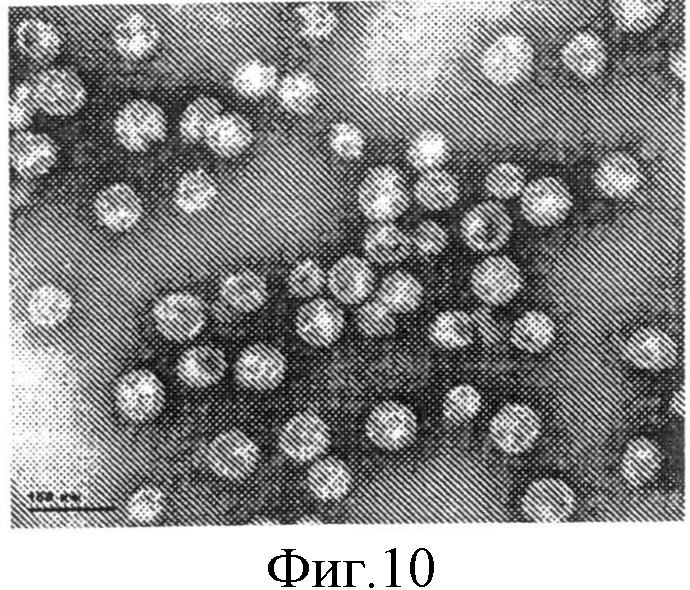
На фиг.10 приведена микрофотография, полученная методом просвечивающей электронной микроскопии (×105000), очищенного образца ВЧ L1 ВПЧ 18.
На фиг.11А приведена схема инфицирования клетки 293 FT псевдотипом вируса ВПЧ 18.
На фиг.11В приведена схема нейтрализации псевдотипа вируса ВПЧ 18 мышиной сывороткой.
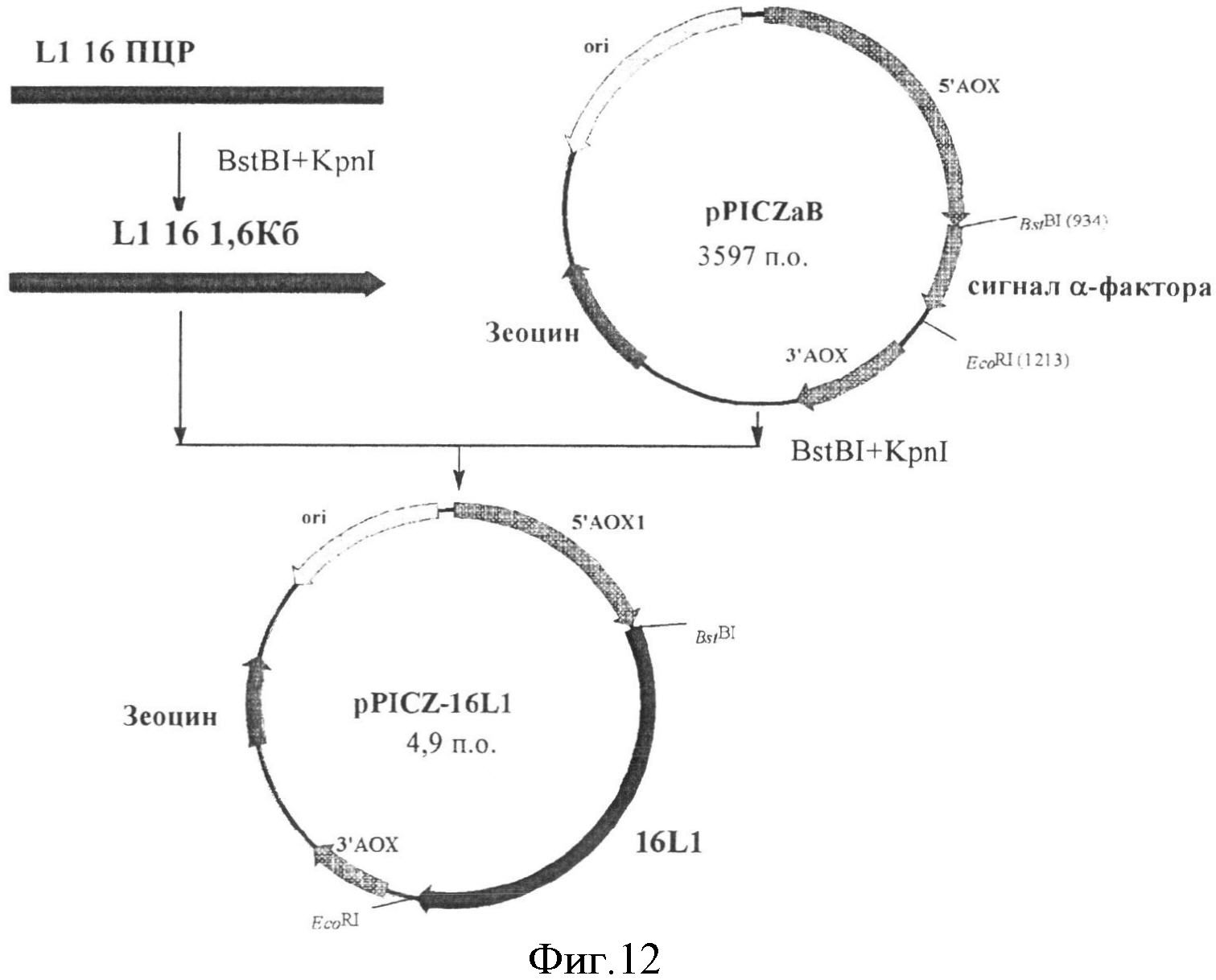
На фиг.12 приведена схема конструкции вектора pPICZ-16 L1.
На фиг.13 приведена схема ПЦР-амплификации гена белка L1 ВПЧ 16.
На фиг.14 приведена схема идентификации вектора pPICZ-16 L1, при этом дорожка 1 представляет собой pPICZαB, гидролизованный действием BstBI и KpnI; а дорожка 2 - pPICZ-16L1, гидролизованный действием BstBI и KpnI.
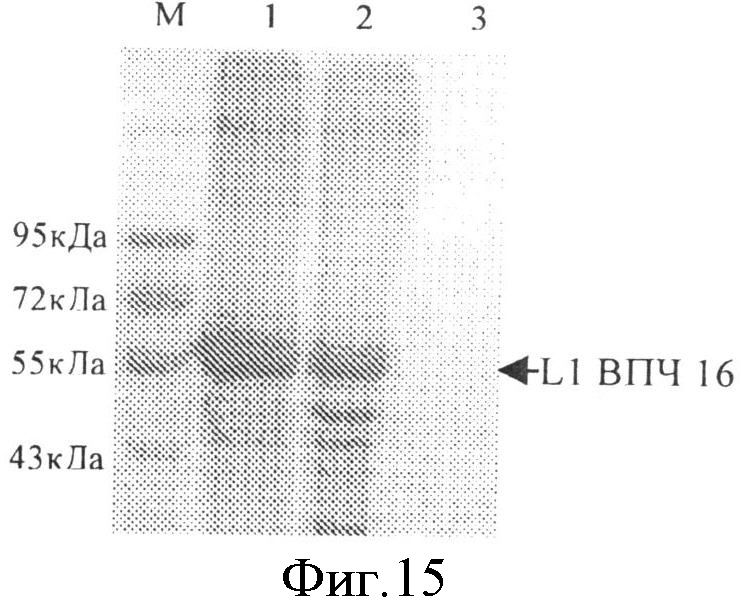
На фиг.15 приведена схема анализа экспрессии L1 ВПЧ 16 методом вестерн-блоттинга, где М - маркер молекулярной массы Rainbow Marker (Fermentas Co., Ltd); 1 - положительный контроль экспрессии; 2 - штамм, экспрессирующий L1 ВПЧ 16, 3 - отрицательный контроль экспрессии. Стрелкой отмечен экспрессированный L1 ВПЧ 16.
На фиг.16 приведены результаты электрофореза на ДДС-Na-ПААГ в восстанавливающих условиях хроматографически очищенного образца L1 ВПЧ 16, причем 1 - фракция пика, собранная на колонке POROS 50 HS; 2 - фракция 1, прошедшая через колонку СНТ; 3 - фракция 2, прошедшая через колонку СНТ; 4 - положительный контроль L1 ВПЧ 16; 5 - пик 1, элюированный с колонки СНТ; 6 - пик 2, элюированный с колонки; 7 - пик 4, элюированный с колонки СНТ; 8 - пик 8, элюированный с колонки СНТ; и 9 - пик 12, элюированный с колонки СНТ.
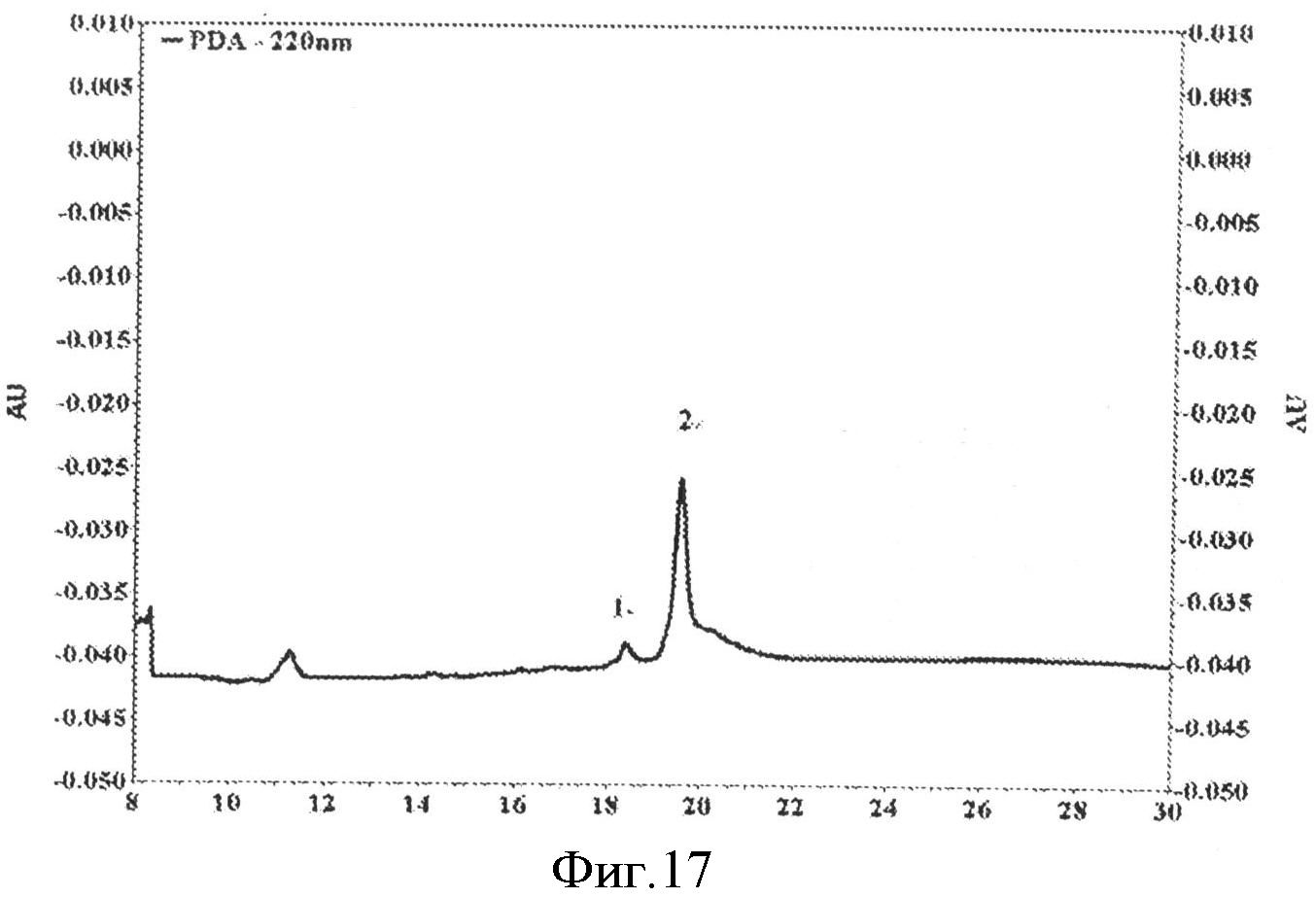
На фиг.17 приведены результаты определения чистоты L1 ВПЧ 16 по данным капиллярного электрофореза.
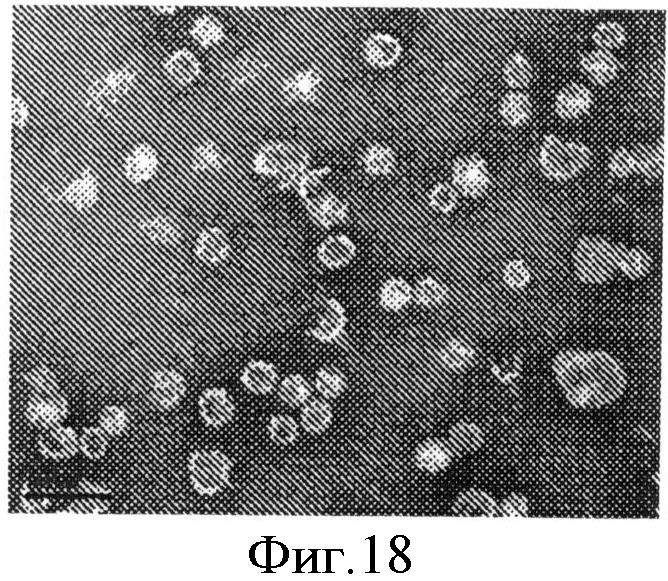
На фиг.18 приведена микрофотография, полученная методом просвечивающей электронной микроскопии (×105000), очищенного образца ВЧ L1 ВПЧ 16.
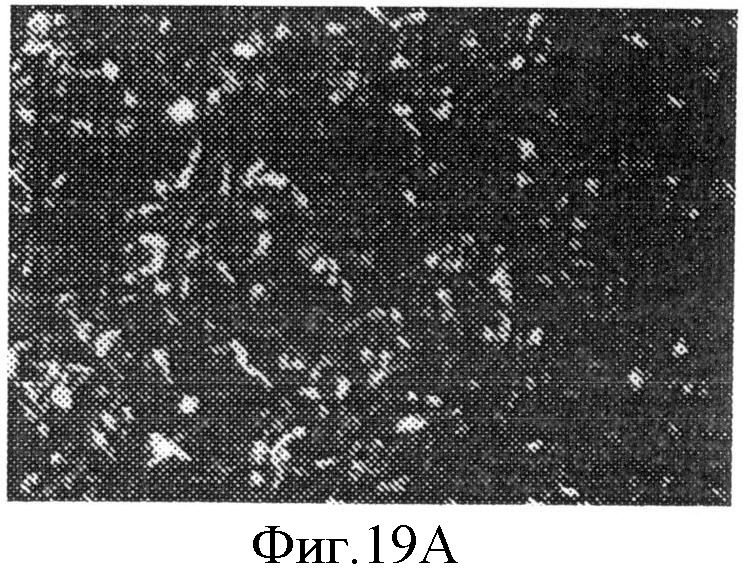
На фиг.19А приведена схема инфицирования клетки 293FT псевдотипом вируса ВПЧ 16.
На фиг.19В приведена схема нейтрализации псевдотипа вируса L1 ВПЧ 18 мышиной сывороткой.
Подробное описание изобретения
В результате интенсивных исследований авторы настоящего изобретения впервые раскрыли кодон-оптимизированный ген, кодирующий главный капсидный белок L1 вируса папилломы человека, который при введении в клетку дрожжей способен эффективно экспрессировать главный капсидный белок L1 вируса папилломы человека, способный к самосборке в вирусоподобные частицы, причем величина экспрессии соответствует требованиям технологического производства. Настоящее изобретение также впервые представляет иммуногенную макромолекулу, образующуюся при экспрессии указанного кодон-оптимизированного гена, кодирующего главный капсидный белок L1 вируса папилломы человека, в клетке дрожжей.
В данном документе упомянутый главный капсидный белок L1 вируса папилломы человека обозначается для краткости белок L1 ВПЧ; упомянутый главный капсидный белок L1 вируса папилломы человека подтипа 18 для краткости обозначается белок L1 ВПЧ 18; а упомянутый главный капсидный белок L1 вируса папилломы человека подтипа 16 для краткости обозначается белок L1 ВПЧ 16. Белок L1 ВПЧ включает в себя белок L1 ВПЧ 18 и белок L1 ВПЧ 16, в также их усеченную форму.
В данном документе термин «иммуногенная макромолекула» относится к полимерной макромолекуле, включающей несколько мономерных главных капсидных белков L1 вируса папилломы человека, которая предпочтительно получена при полимеризации или сборке нескольких главных капсидных белков L1 вируса папилломы человека; указанные главные капсидные белки L1 вируса папилломы человека кодируются кодон-оптимизированным геном, кодирующим главный капсидный белок L1 вируса папилломы человека и экспрессируются в клетках дрожжей (предпочтительно в клетках дрожжей Pichia). Указанная иммуногенная макромолекула имеет гранулярную форму.
В данном документе термины «функционально связаны друг с другом» или «функционально связан с» относятся к ситуации, когда некоторая часть линейной последовательности ДНК может влиять на активность других частей той же самой линейной последовательности ДНК. Например, если промотор управляет транскрипцией кодирующей последовательности, то он функционально связан с кодирующей последовательностью.
В данном документе выражения «содержащий», «имеющий» или «включающий» (или их грамматические варианты) подразумевают «содержащий», «в основном состоящий из…», «преимущественно состоящий из…» и «состоящий из…». Понятия «в основном состоящий из…», «преимущественно состоящий из…» и «состоящий из…» - подчиненные понятия по отношению к «содержащий», «имеющий» или «включающий».
Ген, кодирующий главный капсидный белок L1 вируса папилломы человека
С учетом задачи экспрессии белка L1 ВПЧ с помощью клетки дрожжей авторы настоящего изобретения обнаружили в результате тщательных исследований оптимизированный ген, кодирующий белок L1 ВПЧ, который может эффективно экпрессироваться в клетке дрожжей, в частности, в клетке дрожжей Pichia. Указанный оптимизированный ген кодирует полноразмерный или усеченный белок L1 ВПЧ 18. Либо указанный оптимизированный ген кодирует полноразмерный белок L1 ВПЧ 16.
Специалистам в данной области хорошо известно, что, хотя существует 64 генетических кодона, в большинстве организмов встречается лишь часть этих кодонов. Например, гены клеток дрожжей проявляют иное предпочтение к кодонам, чем человеческие гены. Вследствие вырождения генетических кодонов, каждая аминокислота может кодироваться более чем одним кодоном, причем кодоны для той же самой аминокислоты характеризуются различной распространенностью в генах дикого типа. Существующее предпочтение клеток дрожжей к определенным кодонам может привести к низкой эффективности и низкому уровню экспрессии рекомбинантных белков.
Оптимизация кодонов в соответствии с настоящим изобретением в основном осуществлялась следующим образом. Во-первых, в результате многократных экспериментов в существующий в природе ген, кодирующий L1 ВПЧ, вносили модификации, оптимизируя кодоны для всех аминокислот гена, и многократно проводили опыты по экспрессии гена с оптимизированными последовательностями, с целью выявления нового набора последовательностей ДНК ВПЧ, пригодных для экспрессии в клетке дрожжей. Ген, кодирующий полноразмерный L1 ВПЧ 18, представлен в Genbank, № вхождения ААР20601; ген, кодирующий усеченный L1 ВПЧ 18, представлен в Genbank, № вхождения AAQ92369; и ген, кодирующий полноразмерный L1 ВПЧ 16 представлен в Genbank, № вхождения ААС09292.
Далее, во избежание наличия высокого соотношения GC в транскрибированных мРНК, влияния вторичной структуры мРНК на эффективность трансляции и присутствия общих сайтов рестрикции, авторы настоящего изобретения внесли изменения в некоторые из предпочтительных кодонов, например, кодон аспарагина (Asn) изменяли с ААС на ААТ; кодон лизина (Lys) - с AAG на ААА; кодон аспарагиновой кислоты (Asp) - с GAT на GAC, кодон фенилаланина (Phe) - с ТТТ на ТТС; кодон тирозина (Tyr) - с ТАС на ТАТ и кодон глицина (Gly) - с GGT на GGA, получая таким образом новые последовательности ДНК ВПЧ.
Согласно предпочтительному осуществлению настоящего изобретения, указанный ген кодирует главные капсидные белки L1 вируса папилломы человека, имеющие цепочку аминокислот, представленную в SEQ ID NO:10 либо в положениях 62-568 SEQ ID NO:10 (т.е., L1 ВПЧ 18). Более предпочтительно, указанный ген содержит последовательность нуклеотидов, выбранную из представленных в SEQ ID NO:I, SEQ ID NO:2 и SEQ ID NO:3; или содержит последовательность нуклеотидов, выбранную из представленных в SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6. Еще более предпочтительно, указанный ген содержит последовательность нуклеотидов, представленную в SEQ ID NO:1 или SEQ ID NO:4. Наиболее предпочтительно, указанный ген имеет последовательность нуклеотидов, представленную в SEQ ID NO:1, являющуюся геном усеченного L1 ВПЧ 18, что соответствует усеченному белку L1 ВПЧ 18 с 61 аминокислотной делецией на N-конце. Такой усеченный ген более благоприятен для экспрессии в рекомбинантном векторе без изменения активности белка.
Еще в одном предпочтительном осуществлении настоящего изобретения указанный ген кодирует главные капсидные белки L1 вируса папилломы человека, имеющие цепочку аминокислот, представленную в SEQ ID NO:11 (т.е., L1 ВПЧ16). Более предпочтительно, указанный ген содержит последовательность нуклеотидов, выбранную из представленных в SEQ ID NO:7, SEQ ID NO:8 и SEQ ID NO:9. Наиболее предпочтительно, указанный ген содержит последовательность нуклеотидов, представленную в SEQ ID NO:7.
Кодон-оптимизированный ген, предлагаемый в настоящем изобретении, имеет следующие преимущества: 1) данный оптимизированный ген в большей степени пригоден для эффективной экспрессии целевого белка в дрожжевой клетке-хозяине и удовлетворяет требованиям промышленного производства; 2) при использовании системы экспрессии на основе дрожжей Pichia он обеспечивает низкую стоимость, высокий выход, а также более равномерное и стабильное качество продукта.
В настоящем изобретении также предлагается вектор, включающий упомянутый ген, кодирующий L1 ВПЧ. Упомянутый вектор может содержать помимо этого регуляторные последовательности экспрессии, функционально связанные с последовательностью упомянутого кодирующего гена, которые содействуют экспрессии указанного белка L1 ВПЧ. Можно использовать любой подходящий вектор, прежде всего, из обычно применяемых для клонирования и экспрессии в клетке дрожжей. Более предпочтительно, указанный вектор экспрессии выбирают из наиболее распространенных в настоящее время векторов экспрессии в клетках дрожжей, например, pPICZs pPIC6, pGAPZ и рА0815. Такие векторы экспрессии имеются в открытой продаже.
Далее, к настоящему изобретению относится и рекомбинантная клетка, содержащая указанный ген, который кодирует L1 ВПЧ. Указанная рекомбинантная клетка представляет собой клетку дрожжей, в частности клетку дрожжей Pichia. Более предпочтительно, упомянутая клетка дрожжей Pichia выбирается из штаммов дрожжей Pichia X-33, GS115, KM71 и SMD1168. Указанные штаммы дрожжевых клеток имеются в открытой продаже. Способы введения внешнего гена в клетку дрожжей известны в данной области, например, электротрансформация или трансформация протопластов.
В настоящее изобретение входит также способ получения L1 ВПЧ. Указанный способ предполагает культивирование указанной рекомбинантной клетки, которая включает указанный кодирующий ген. Способ может включать экспрессию кодированного белка L1 ВПЧ в клетках, а также может включать отделение и(или) очистку экспрессированного белка. Белок L1 ВПЧ, полученный как указано выше, может быть очищен до преимущественно однородного состояния, например, дающего одну линию при электрофорезе на ДДС-Na-ПААГ.
Белок L1 ВПЧ, экспрессированный в клетке дрожжей в соответствии с настоящим изобретением, можно использовать для получения иммуногенной макромолекулы, которая может вызвать иммунный ответ in vivo, конкретно, гуморальный иммунный ответ.
В качестве осуществлении настоящего изобретения, авторы изобретения разработали в результате оптимизации несколько последовательностей генов, пригодных для экспрессии белка L1 ВПЧ в клетках дрожжей Pichia, которые затем использовали для полного синтеза полноразмерного гена L1 ВПЧ или его усеченной формы. Ген либо его усеченную форму клонировали в существующий вектор экспрессии на основе дрожжей, который затем служил для конструирования рекомбинантного штамма дрожжей Pichia для экспрессии с помощью гомологичной рекомбинации и тестирования по отношению к высоким концентрациям антибиотиков. Рекомбинантные клетки дрожжей Pichia культивировали в условиях ферментации, а затем обрабатывали метанолом для повышения внутриклеточной экспрессии белка L1 ВПЧ, способного к внутриклеточной конкурентной самосборке с образованием вирусоподобных частиц (ВЧ). Вирусоподобные частицы, очищенные методом колоночной хроматографии супернатанта, полученного из разрушенных клеток, имели чистоту более 90% и проявляли значительное иммуногенное действие при адсорбции на адъюванте - соединении алюминия, что позволяет применять их в качестве вакцины против рака шейки матки у женщин.
Экспрессия и очистка белка
Белок L1 ВПЧ эффективно экспрессируется при культивировании указанной рекомбинантной клетки, содержащей упомянутый ген, кодирующий L1 ВПЧ, причем экспрессированные белки способны к самосборке в конкурентных условиях с образованием иммуногенных макромолекул. Способ экспрессии и очистки включает: (1) культивирование указанной рекомбинантной клетки, обеспечивающее экспрессию упомянутого главного капсидного белка L1 вируса папилломы человека и конкурентную самосборку с образованием иммуногенных молекул в рекомбинантных клетках; (2) разрушение клеток, полученных на стадии (1) с образованием супернатанта, содержащего иммуногенные молекулы; и (3) последовательную очистку супернатанта, полученного на стадии (2) методом колоночной хроматографии на POROS 50 HS и колоночной хроматографии на СНТ с образованием указанных иммуногенных макромолекул.
Предпочтительно, культивирование клеток и экспрессию белка проводят следующим образом. Полученные методом генной инженерии клетки дрожжей согласно настоящему изобретению инокулируют в активирующую среду (YPD, или LB, или SOC) и культивируют при 25-37°C, оставляя на ночь. Затем активированную жидкость инокулируют в питательную среду для культивирования (YPD или LB или SOC) и культивируют при 25-37°C, оставляя на ночь. Ферментацию проводят в солевой основной питательной среде (BSM1 или BSM2 или BSM3), которые добавляют со следовыми количествами солей (РТМ1, РТМ2, РТМ3) при температуре 20-37°C и при начальной величине pH 3-8. После первоначальной стадии пролиферации, занимающей 15-30 часов, концентрацию растворенного кислорода поддерживают на уровне 20-80% за счет регулирования скорости перемешивания, тока воздуха и давления в ферментере. После полного расходования источника углерода, масса сырых дрожжей составляет от 50 до 150 г/л. В этот момент начинают подачу раствора глицерина или глюкозы, поддерживая концентрацию растворенного кислорода на уровне 20-80%. Через некоторое время масса сырых дрожжей достигает от 50 до 500 г/л, после чего подачу прекращают и добавляют метанол для индуцирования, при этом pH поддерживают в интервале от 3 до 8. Концентрация растворенного кислорода находится в интервале от более 20% до 80%, температура - от 20 до 37°C, а pH составляет 3-8. В интервале 2-10 часов отбирают пробы и анализируют методом вестерн-блоттинга. Ферментацию останавливают через 5-90 часов после индуцирования, и ферментационный бульон выгружают из аппарата. Бульон центрифугируют на охлаждаемой центрифуге, после чего клетки отделяют и хранят при минус 20°C. Белок L1 ВПЧ, полученный при индуцированной экспрессии, способен к самосборке в вирусоподобные частицы (ВЧ L1 ВПЧ) внутри клетки дрожжей Pichia.
После экспрессии указанного белка L1 ВПЧ в клетке дрожжей Pichia более чистый белок может быть получен в результате разрушения клеток и очистки, после чего он подвергается самосборке с образованием вирусоподобных частиц. Очистка в целом осуществляется следующим образом. Клетки промывают для удаления захваченных компонентов среды (соли, пигменты и т.д.) с целью снижения их влияния на дальнейшую очистку. Промытые клетки помещают в соответствующий буфер для разрушения клеток, содержащий соли и поверхностно-активные вещества в определенных концентрациях. В качестве солей пригодны, например, NaCl и KCl в концентрациях от прибл. 0,4 до 0,8 моль/л. В качестве поверхностно-активных веществ можно применять, например, Твин-80, Твин-20 и Тритон-Х 100 в концентрации от прибл. 0,005 до 0,05% (масса/объем). К подходящим буферным системам относятся, например, фосфатный буфер, буфер Трис, буфер MOPS и буфер HEPES в концентрации от прибл. 0,02 до 0,2 моль/л. Смешанные клетки можно разрушить, например, в гомогенизаторе высокого давления с рабочим давлением от прибл. 800 до 2000 бар, что обеспечивает степень разрушения выше 90% за 2-4 цикла, либо в шаровом гомогенизаторе с использованием шаров диаметром от 0,2 до 0,4 мм, которые загружаются в количестве прибл. от 70 до 90%, что обеспечивает степень разрушения выше 80% за 1-2 цикла. Для отделения осадка от супернатанта раствор, содержащий разрушенные клетки, центрифугируют на высокоскоростной центрифуге на 6000-10000 об/мин (SORVALL, HITACHI и т.д.) в течение 20-60 мин или разделяют методом проточной микрофильтрации вдоль потока с мембранным модулем от 0,45 до 0,65 мкм (Millipore, PALL и т.д.). Прежде чем проводить дальнейшую очистку, полученный супернатант направляют на анионообменную хроматографию на Q Sepharose Flast Flow (GE) или DEAE SephroseFast Flow (GE) для удаления из супернатанта некоторых примесей, таких как ДНК, РНК и примесных белков. В качестве альтернативы полученный супернатант сразу направляют на дальнейшую очистку. Для дальнейшей очистки образцы супернатанта наносят на хроматографическую фазу, связывающую ВЧ L1 ВПЧ, такую как SP Sepharose FF, Heparin SepharoseCL-6В (GE), Poros 50 HS (Merck) и Fractogel@EMD TMAE-650 (Merck), в результате чего ВЧ белка L1 ВПЧ эффективно с ней связывается. Затем фазу промывают градиентом концентрации соли (например, буферным раствором 0,5-1,0 М NaCl или KCl) для отделения примесей от ВЧ белка L1 ВПЧ. Затем связанные ВЧ L1 ВПЧ элюируют концентрированным раствором солевого буфера (например, буферным раствором, 1,0-2,0 М NaCl или KCl), собирая фракцию предварительно очищенных ВЧ L1 ВПЧ. Полученные таким образом предварительно очищенные ВЧ L1 ВПЧ наносят на хроматографическую фазу для глубокой очистки, например, СНТ (BIO-RAD Тип II), с которой ВЧ белка L1 ВПЧ могут эффективно связываться в определенном интервале концентраций соли (например, в буферном растворе, содержащем 0,3-1,5 М NaCl или KCl). Элюируют градиентом концентрации фосфата (например, при изменении концентрации фосфата от 20 до 400 мМ) для отделения от ВЧ L1 ВПЧ примесей. В качестве альтернативы для более глубокой очистки предварительно очищенных ВЧ L1 ВПЧ можно применять хроматографические фазы такие как Sephacryl S-1000 (GE) и HW-75 (TSK), при этом отделение примесей от ВЧ L1 ВПЧ достигается методом гель-хроматографии. После глубокой очистки элюированные ВЧ L1 ВПЧ собирают в качестве конечной очищенной фракции.
Способ очистки в соответствии с настоящим изобретением позволяет удалить большую часть примесных биомолекул (в том числе ДНК, липиды и белки). Методом электрофореза на ДДС-Na-ПААГ восстанавливающих условиях или капиллярного электрофореза (Beckman Coulter) показано, что образец полученный в результате хроматографической очистки на POROS 50 HS, имеет чистоту от 75% до 80%, а конечный образец ВЧ L1 ВПЧ, очищенный на гидроксиапатитной фазе, имеет чистоту от 90% до 95%. Обнаружение методом вестерн-блоттинга (Bio-RAD) позволило выявить специфическую реакцию окрашивания между полосой целевого белка и моноклональным или поликлональным антителом к ВЧ L1 ВПЧ. Методом динамического светорассеяния (Malvern Instruments Zetasizer Nano ZS) установлено, что размер частиц в очищенном образце варьирует прибл. в интервале 50-80 нм, а исследование методом просвечивающей электронной микроскопии (Philips) показало наличие в образце вирусоподобных частиц (ВЧ) размером прибл. 50-80 нм. Наиболее предпочтительная гидроксиалатитовая фаза в настоящем эксперименте - это керамический гидроксиапатитовый наполнитель с размером частиц в интервале прибл. 20-50 нм и размером пор около 800 Å. Буферные растворы, которые применяются в хроматографии, имеют pH в интервале от 6 до 9, предпочтительным буфером является 50 мМ MOPS.
По сравнению с уровнем техники настоящее изобретение предлагает оптимальное конструирование гена для L1 ВПЧ 18 (полноразмерный ген, или предпочтительно усеченный ген, соответствующий белку L1 ВПЧ 18 с делецией 61 аминокислоты на N-конце) и его клонирование в дрожжи Pichia, что позволяет достичь значительного повышения экспрессии белка L1 ВПЧ 18 по сравнению с другими системами экспрессии (такими как клетки млекопитающих, бакуловирусы, Saccharomyces cerevisiae). После экспрессии полученные в результате очистки вирусоподобные частицы изучали с помощью электронного микроскопа, и было показано, что их размер - 50-80 нм, что близко к размеру частиц ВПЧ дикого типа. Вирусоподобные частицы, образованные из рекомбинантного белка L1 ВПЧ 18, адсорбировали на адъюванте - соединении алюминия - и использовали для иммунизации мышей, что приводило к высоким титрам антител к L1 ВПЧ 18. Опыты по нейтрализации с псевдотипом вируса показали высокую нейтрализующую активность антител (т.е. способность ингибировать попадание псевдотипа вируса в клетки). Кроме того, оптимальным образом сконструированный ген L1 ВПЧ 16 в соответствии с настоящим изобретением после клонирования в дрожжи Pichia позволяет достичь очень высоких уровней экспрессии белка L1 ВПЧ 16.
Иммуногенная макромолекула
В настоящем изобретении также предлагается иммуногенная макромолекула диаметром от 50 до 80 нм, представляющая собой полимолекулярный полимер, в основном полученный в результате самосборки главных капсидных белков L1 вируса папилломы человека, причем указанные главные капсидные белки L1 вируса папилломы человека экспрессированы в дрожжах Pichia.
Иммуногенную макромолекулу согласно настоящему изобретению предпочтительно получают следующим способом: (1) культивирование упомянутой рекомбинантной клетки, позволяющее экспрессию упомянутого главного капсидного белка L1 вируса папилломы человека и его конкурентную самосборку с образованием иммуногенной молекулы в рекомбинантных клетках; (2) разрушение клеток, полученных на стадии (1), с образованием супернатанта, содержащего иммуногенные молекулы; и (3) последовательная очистка супернатанта, полученного на стадии (2), методом колоночной хроматографии на POROS 50 HS и колоночной хроматографии на СНТ с образованием указанных иммуногенных макромолекул.
В настоящем изобретении также предлагается применение указанной иммуногенной макромолекулы для производства композиции для профилактики или лечения заболеваний, связанных с инфицированием вирусом папилломы человека (ВПЧ). Упомянутые заболевания выбираются, без ограничения, из группы злокачественных новообразований (таких как рак шейки матки, рак влагалища, рак ануса или перианальный рак, ротоглоточный рак, рак гайморовой пазухи, рак легких) и интраэпителиальной цервикальной неоплазии.
Композиция
В настоящем изобретении предлагается также иммуногенная композиция (такая как профилактическая или терапевтическая вакцина), содержащая эффективное количество указанных иммуногенных макромолекул в соответствии с настоящим изобретением и фармацевтически приемлемый носитель.
В настоящем изобретении предлагается также способ получения вакцины против вируса папилломы человека, включающий приготовление вирусоподобных частиц рекомбинантного белка L1 вируса папилломы человека описанным выше способом и добавление фармацевтически приемлемого адъюванта для вакцины. Указанный адъювант для вакцины может быть адъювантом - соединением алюминия или другим адъювантом. Вирусоподобные частицы, образованные из очищенного белка вируса папилломы человека (L1 ВПЧ), после адсорбции на адъюванте могут служить в качестве вакцины.
В настоящем документе термин «фармацевтически приемлемый» компонент относится к веществу, пригодному для употребления человеком и(или) млекопитающими без появления неприемлемого вредного побочного действия (например, токсичности), обеспечивающему разумное соотношение пользы и риска. Термин «фармацевтически приемлемый носитель» относится к носителям для введения терапевтических препаратов, включая различные наполнители и разбавители. Данный термин относится к таким носителям для терапевтических препаратов, которые сами по себе не являются основными активными компонентами и не обладают неприемлемой токсичностью после введения. Соответствующие требованиям носители хорошо известны рядовым специалистам в данной области. Полное описание фармацевтически приемлемых носителей можно найти в справочнике Reminton's Pharmaceutical Sciences (Mack Pub. Co., N.J. 1991). К фармацевтически приемлемым носителям для данной композиции относятся жидкости, такие как вода, физиологический раствор, глицерин и сорбит. Далее, указанные носители могут включать вспомогательные компоненты, например, смазывающие вещества, скользящие вещества, увлажняющие средства или эмульгаторы, pH-буферные вещества и стабилизаторы, например, альбумин или аналогичные.
Указанная композиция может служить для получения различных лекарственных форм, пригодных для введения млекопитающим, например, без ограничения, это могут быть инъекции, капсулы, таблетки, эмульсии и суппозитории.
Опыты на животных показали, что иммунизация животных вакциной, полученной на основе иммуногенной макромолекулы в соответствии с настоящим изобретением, приводит к сильному иммунному ответу у животных.
Если иммуногенная макромолекула в соответствии с настоящим изобретением предназначена для применения, ее вводят в организм млекопитающего (например, человека) в безопасном и эффективном количестве, причем упомянутое безопасное и эффективное количество как правило составляет по крайней мере около 1 мкг/кг массы тела и в большинстве случаев не превышает 10 мг/кг массы тела, предпочтительно находится в интервале от прибл. 1 мкг/кг массы тела до прибл. 1 мг/кг массы тела. Конкретная дозировка разумеется зависит от таких факторов как способ введения, общее состояние здоровья пациента и прочие факторы, находящиеся в компетенции лечащего врача.
Настоящее изобретение далее раскрывается с помощью приведенных ниже конкретных примеров, которые предназначены для иллюстрации настоящего изобретения, но не ограничивают область настоящего изобретения. Методики экспериментов, для которых не указаны конкретные условия, как правило соответствуют методикам, приведенным в книге Sambrook et. al., Molecular Cloning: A Laboratory Manual, Нью-Йорк, Cold Spring Harbor Laboratory Press, 1989) либо рекомендованным производителями. Если не указано иначе, доли и процентные содержания являются массовыми.
В примерах настоящего изобретения для синтеза ДНК и для ПЦР-амплификации использовали фермент Pfu, активируемый при нагревании, продукт компании Strataген Co., Ltd.
В примерах настоящего изобретения плазмиду pUC18 приобретали в компании Generay Biotech (Shanghai) Co., Ltd (Шанхай, Китай), а плазмиду pPICZaB - в компании Invitrogen Corp.
В примерах настоящего изобретения поликлональные антитела кролика против L1 ВПЧ18 и белок L1 ВПЧ16 были приобретены в компании Shanghai PrimeGene Bio-tech, LTD (Шанхай, Китай), мышиное моноклональное антитело МАВ885 приобретали в компании CHEMICON Co., Ltd, а меченые пероксидазой хрена IgG козы к мышиным антигенам приобретали в компании Being Dingguo Changsheng Biotechnology Co., Ltd (Пекин, Китай).
В примерах настоящего изобретения мышей линии BALB/c приобретали в Shanghai SLAC laboratory Animal Co., Ltd. (Шанхай, Китай).
В примерах настоящего изобретения буфер для промывки на стадии очистки содержал: 100 мМ РВ, 0,15 М NaCl, pH 7.0; Буфер для разрушения клеток: 200 мМ MOPS, 0,4 М NaCl, 0,05% Твин-80, pH 7.0;
Буфер Е: 50 мМ MOPS, 0,5 М NaCl, 0,05% Твин-80, pH 6.5;
Буфер F: 50 мМ MOPS, 1,5 М NaCl, 0,05% Твин-80, pH 6.5;
Буфер G: 50 мМ MOPS, 0,6M NaCl, 0,05 М РВ, 0,05% Твин-80, pH 6.5;
Буфер Н: 0,6М NaCl, 200 мМ РВ, 0,05% Твин-80, pH 6.5.
Пример 1. Конструирование и синтез кодон-оптимизированного гена L1 ВПЧ 18
1.1. Конструирование кодон-оптимизированного гена белка L1 ВПЧ 18
Настоящее изобретение относится к молекулам ДНК, кодирующим главный капсидный белок L1 вируса папилломы человека подтипа 18 (ВПЧ18), которые были кодон-оптимизированы с помощью кодонов, предпочтительных для дрожжей Pichia. С помощью оптимизации кодонов и модификации оптимизированных кодонов было получено три последовательности ДНК, соответствующие представленным в SEQ ID NO:4, 5 и 6, как более подробно описано ниже.
Во-первых, в результате многократных экспериментов в существующий в природе ген, кодирующий L1 ВПЧ 18, вносили модификации, оптимизируя кодоны для всех аминокислот гена с целью конструирования новой последовательности ДНК ВПЧ, а именно, SEQ ID NO:4.
Далее, во избежание наличия высокого соотношения GC в транскрибированных мРНК, влияния вторичной структуры мРНК на эффективность трансляции и присутствия общих сайтов рестрикции, в оптимизированные кодоны вносили изменения, например, кодон аспарагина (Asn) изменяли с ААС на ААТ; кодон лизина (Lys) - с AAG на ААА; кодон аспарагиновой кислоты (Asp) - с GAT на GAC, кодон фенилаланина (Phe) - с ТТТ на ТТС; кодон тирозина (Tyr) - с ТАС на ТАТ и кодон глицина (Gly) - с GGT на GGA, получая таким образом две новые последовательности ДНК ВПЧ - SEQ ID NO:5, образованную из SEQ ID NO:4 за счет изменения кодонов аспарагина (Asn), лизина (Lys) и аспарагиновой кислоты (Asp); и SEQ ID NO:6, образованную из SEQ ID NO:4 за счет изменения кодонов фенилаланина (Phe), тирозина (Tyr) и глицина (Gly).
1.2. Синтез кодон-оптимизированного гена белка L1 ВПЧ 18
Кодон-оптимизированный ген L1 ВПЧ 18, представленный SEQ ID NO:4, синтезировали и использовали в качестве темплаты для ПЦР-амплификации с праймерами а1 и а2, имеющими приведенные ниже последовательности:
а1: 5'-ATAGAATTCAAGATGTGTTTGTACACTAGAGTTT-3' (SEQ ID NO:12);
а2: 5'-AATGGTACCCTATTACTTTCTAGCTCTAACT-3' (SEQ ID NO:13).
Полученные продукты ПЦР разделяли методом агарозного гель-электрофореза, целевую последовательность выделяли, получая фрагмент размером около 1,7 тысяч пар оснований. Указанный фрагмент секвенировали, причем результат секвенирования соответствовал SEQ ID NO:4 и, как было показано, представлял собой полноразмерный кодон-оптимизированный ген L1 ВПЧ 18. Полученный таким образом ген L1 ВПЧ 18 с помощью сайтов рестрикции EcoRI и KpnI на концах лигировали в плазмиду pUC18 (продукт компании Generay Biotech (Shanghai) Co., Ltd (Шанхай, Китай)). Правильность полученной конструкции проверяли секвенированием, конструкция получила название pUC-18L1.
Кодон-оптимизированные гены белка L1 ВПЧ 18, соответствующие SEQ ID NO:5 и 6, были получены по аналогичной методике.
Для проверки пригодности оптимизированных последовательностей на основе одного из кодон-оптимизированных генов белка L1 ВПЧ 18, полученного в примере 1 (SEQ ID NO:4), конструировали экспрессирующую плазмиду для оценки ее экспрессии, как подробно описано в примере 2.
Пример 2. Конструирование вектора экспрессии гена L1 ВПЧ 18
Оптимизированную последовательность SEQ ID NO:4 клонировали в вектор экспрессии дрожжей Pichia, как показано на фиг.1 и более подробно описано ниже.
2.1. Синтезировали прямой и обратный праймеры, имеющие следующие последовательности, необходимые для амплификации гена для L1 ВПЧ 18:
прямой праймер: 5'-TCCCAATCTTCGAAACGATGTGTTTGTACACTAGAGTTT-3' (SEQ ID NO:14);
обратный праймер: 5'-AATGGTACCCTATTACTTTCTAGCTCTAACT-3' (SEQ ID NO:13);
причем прямой праймер содержит сайт рестрикции BstBI, а обратный праймер содержит сайт рестрикции KpnI, фланкирующий стоп-кодон; указанные сайты рестрикции соответственно показаны подчеркнутыми участками приведенных выше последовательностей праймеров.
2.2. ПЦР-амплификацию проводили с указанными выше праймерами и pUC-18L1, полученным в примере 1, в качестве темплаты. Амплифицированный продукт обнаруживали с помощью электрофореза, результаты которого приведены на фиг.2, из которого видно, что был получен полноразмерный кодон-оптимизированный ген L1 ВПЧ 18. ПЦР-амплифицированный фрагмент расщепляли действием BstBI и KpnI (эндонуклеазы рестрикции), а затем лигировали в pPICZaB (Invitrogen Corp.), который также расщепляли действием BstBI и KpnI. Далее дотированную конструкцию использовали для трансформации компетентных клеток Е.coli штамма Тор 10 (продукт Generay Biotech (Shanghai) Co., Ltd (Шанхай, Китай)), и трансформированные клетки сеяли на LB-агар, содержащий 25 мкг/мл антибиотика зеоцин.
Трансформированные клетки были способны расти в среде LB, содержащей антибиотик зеоцин, так как вектор pPICZaB несет ген, устойчивый к зеоцину. Единичные колонии трансформированных клеток отделяли для получения плазмидной ДНК. Ген L1 ВПЧ 18 и последовательность вектора исследовали методом рестриктазного картирования (см. фиг.3) и анализа последовательности нуклеотидов с целью идентификации правильной конструкции, содержащей ген L1 ВПЧ 18, которая получила название pPICZ-18L1. Так как сигнал к секреции (сигнал α-фактора) отделен от сконструированной плазмиды, внутриклеточная экспрессия приводит к образованию белка L1 ВПЧ 18.
Пример 3. Конструирование штамма, экспрессирующего ген L1 ВПЧ 18, и экспрессия
3.1. Конструирование штамма, экспрессирующего ген L1 ВПЧ 18
Плазмиду pPICZ-18L1 линеаризовали действием фермента эндонуклеазы рестрикции SacI и пустую плазмиду pPICZaB аналогичным образом гидролизовали действием SacI для применения в качестве отрицательного контроля. К ферментативному расщепляющему раствору прибавляли абсолютный этиловый спирт для осаждения ДНК. Линеаризованный фрагмент pPICZ-18L1 растворяли в небольшим количестве бидистиллированной воды и использовали для электропорации штамма Х-33 дрожжей Pichia (Invitrogen Corp.) в следующих условиях: фрагмент ДНК - 5 мкг; напряжение - 1500 В; сопротивление - 25 ом; время электропорации - 5 миллисекунд. После электропорации клетки сеяли на YPDS-агар, содержащий 200 мкг/мл антибиотика зеоцин. Так как вектор pPICZaB несет ген, устойчивый к зеоцину, трансформированные клетки способны расти в среде YPDS, содержащей зеоцин. Единичные колонии трансформированных клеток отделяли, получая штамм дрожжей Pichia, экспрессирующий ген L1 ВПЧ 18.
3.2. Экспрессия штамма дрожжей Pichia, экспрессирующего ген L1 ВПЧ 18
Полученный штамм дрожжей Pichia, экспрессирующий ген L1 ВПЧ 18, помещали на планшеты, содержащие 1000 мкг/мл или 1500 мкг/мл антибиотика зеоцин. Клоны, полученные на планшетах с высокой концентрацией антибиотика, отдельно культивировали в 4 мл жидкой питательной среды YPD в течение суток, после чего проводили индуцирование экспрессии гена в среде BMMY в течение 2 суток. Далее клетки отделяли центрифугированием, и часть клеток разрушали для получения супернатанта для проведения вестерн-блоттинга, результаты которого приведены на фиг.4, из которого видно, что супернатант содержит белок L1 ВПЧ 18.
Хотя в примерах 2 и 3 настоящего изобретения клонирование и экспрессию проводили с последовательностью SEQ ID NO:4, для специалиста в данной области очевидно, что аналогичные результаты можно получить, взяв для клонирования и экспрессии последовательности SEQ ID NO:5 и 6, и таким образом указанные две последовательности также входят в сферу настоящего изобретения. Более того, в свете смысла настоящего изобретения для специалиста несложно сконструировать аналогичные последовательности, а также клонировать и экспрессировать сконструированные последовательности в дрожжах Pichia, получив аналогичные или лучшие результаты и, следовательно, данные последовательности также считаются входящими в сферу настоящего изобретения.
Пример 4. Очистка белка L1 ВПЧ 18
Клетки, полученные в примере 3, разрушали и центрифугировали, и полученный супернатант очищали методом хроматографии для получения белка L1 ВПЧ 18, который при самосборке формирует вирусоподобные частицы, как подробно описано ниже.
Клетки дрожжей Pichias, экспрессирующие ген L1 ВПЧ 18, смешивали с буфером для промывки в отношении 1:3 и энергично встряхивали, затем смесь центрифугировали при 8000 об/мин в течение 5 минут для отделения клеток. Данную операцию повторяли дважды.
Промытые клетки смешивали с буфером для разрушения клеток в отношении 1:5 и энергично встряхивали, клетки в полученной суспензии разрушали под действием высокого давления. Указанную операцию повторяли до разрушения около 90% клеток. Полученный раствор, содержащий разрушенные клетки, центрифугировали на 9000 об/мин при 10°C в течение 30 минут, и супернатант собирали.
Полученный супернатант предварительно очищали на хроматографической колонке с POROS 50 HS (Applied Biosystems Co., Ltd), элюируя фракции линейным градиентом от 100% буфера Е до 100% буфера F. Из очищенных фракций отбирали пробы и восстанавливали до мономерных белков для обнаружения на ДДС-Na-ПААГ и проведения вестерн-блоттинга.
Элюированные фракции, содержащие белок L1 ВПЧ 18, объединяли и подвергали глубокой очистке на хроматографической колонке с СНТ (BIO-RAD Тип II), элюируя линейным градиентом от 100% буфера G до 100% буфера Н. Фракции собирали, из них отбирали пробы и восстанавливали до мономерных белков для обнаружения на ДДС-Na-ПААГ и проведения вестерн-блоттинга. Элюированные фракции, содержащие белок L1 ВПЧ 18, объединяли, получая таким образом конечный очищенный образец со степенью чистоты более 90%.
Пример 5. Получение вакцины L1 ВПЧ 18
Очищенный белок L1 ВПЧ 18, полученный в примере 4, адсорбировали на адъюванте - соединении алюминия - для получения иммуногенной вакцины L1 ВПЧ 18 согласно способу, описанному в книге Chinese Pharmacopoeia (издание 2005 г.).
Пример 6. Определение иммуногенности продукта экспрессии гена L1 ВПЧ 18
Мыши (двадцать четыре) особи линии BALB/c, свободные от патогенной микрофлоры (SPF), возрастом 6-8 недель разбивали на 4 группы, по 6 мышей в каждой группе. Мыши первой группы (группа отрицательного контроля) были иммунизированы путем трех подкожных инъекций 0,1 мл буфера (0,32 М хлорид натрия, 0,35 мМ борат натрия, 0,01% Твин-80, 0,01 М гистидин, pH 6.5), содержащего адъювант - соединение алюминия, соответственно на 0, 7 и 21 сутки, а мыши трех других групп (испытуемые группы) получали аналогичные инъекции 0,1 мл ВЧ, адсорбированных на адъюванте - соединении алюминия, при концентрации соответственно 5 мкг/мл, 0,5 мкг/мл и 0,05 мкг/мл. Образцы крови отбирали через две недели после третьей инъекции. Отобранные образцы оставляли на 2 часа при 37°C, после чего центрифугировали 10 минут при 4000 g. Супернатант - поликлональную мышиную антисыворотку - аспирироватли и хранили при -20°C. Супернатант дополнительно анализировали для определения уровня сероконверсии и титра, как подробно описано ниже.
6.1. Определение уровня сероконверсии
Очищенный белок L1 ВПЧ 18, экспрессированный в дрожжах Pichia, разводили покрывающим раствором до концентрации 1 мкг/мл. Аликвоты разведения (0,1 мл) помещали в лунки планшета для твердофазного ИФА, после чего планшет инкубировали при 4°C, оставляя на ночь. Покрывающий раствор удаляли из лунок, которые затем промывали 0,3 мл буфера PBST. Далее в лунки вносили по 0,3 мл блокирующего раствора (5% сухого обезжиренного молока + PBST) и выдерживали 2 часа при 37°C. В лунки добавляли по 0,1 мл раствора исследуемой сыворотки (сыворотка, полученная после иммунизации мышей белком L1 ВПЧ 18, адсорбированным на адъюванте - соединении алюминия, и сыворотка, полученная после иммунизации мышей только адъювантом - соединением алюминия), полученного разбавлением сыворотки буфером для разведения (2% сухого обезжиренного молока + PBST) в соотношении 1:400 и инкубировали 1 час при 37°С. Далее раствор испытуемой сыворотки удаляли и промывали лунки промывочным буфером, по 0,3 мл. Затем в каждую лунку добавляли 0,1 мл раствора меченого пероксидазой хрена IgG козы к мышиным антигенам, полученного разведением IgG буфером для разведения в соотношении 1:5000, и инкубировали 0,5 часа при 37°C. Далее раствор для твердофазного ИФА удаляли, и промывали лунки промывочным буфером по 0,3 мл на лунку. В каждую лунку добавляли по 0,1 мл буфера DAB для проявления окраски и оставляли в темноте при комнатной температуре на 20 минут. Затем для прекращения реакции в каждую лунку добавляли 0,05 мл 2 М H2SO4 (стоп-раствор) и определяли величину оптической плотности OD450 с помощью ИФА-ридера, показания которого приведены ниже в табл.2.
Пороговая величина представляет собой сумму средней величины OD450 для антител против исследуемой сыворотки, полученной для группы отрицательного контроля (мышиная сыворотка, полученная при иммунизации только адъювантом) и трехкратного стандартного отклонения. Результаты OD450 больше пороговой величины считали положительными, а значения OD450 меньше пороговой величины - отрицательными. Данные по сероконверсии для трех испытуемых групп приведены ниже в табл.3.
6.2. Определение титров сыворотки
Очищенный белок L1 ВПЧ 18 разводили покрывающим раствором до концентрации 1 мкг/мл. Аликвоты разведения (0,1 мл) помещали в лунки планшета для твердофазного ИФА, после чего планшет инкубировали при 4°С оставляя на ночь. Покрывающий раствор удаляли из лунок, которые затем промывали 0,3 мл буфера PBST. Далее в лунки вносили по 0,3 мл блокирующего раствора (5% сухого обезжиренного молока + PBST) и инкубировали 2 часа при 37°C. Проводили серийное разведение испытуемых сывороток (сыворотки, полученные от мышей, иммунизированных белком L1 ВПЧ 18) буфером для разведения (2% сухого обезжиренного молока + PBST) от соотношения 1:500 до 1:32000, а сыворотку отрицательного контроля (сыворотка, полученная от мышей, иммунизированных адъювантом) разводили в соотношении 1:10000, В каждую лунку добавляли аликвоты по 0,1 мл разведенной сыворотки (испытуемая сыворотка или сыворотка отрицательного контроля) и инкубировали 1 час при 37°C. Далее испытуемый раствор сыворотки удаляли и промывали лунки промывочным буфером по 0,3 мл на лунку. Далее в каждую лунку добавляли 0,1 мл раствора меченого пероксидазой хрена IgG козы к мышиным антигенам, полученного разведением IgG буфером для разведения в соотношении 1:5000, и инкубировали 0,5 часа при 37°C. Далее раствор для твердофазного ИФА удаляли, и промывали лунки промывочным буфером по 0,3 мл на лунку. В каждую лунку добавляли 0,1 мл буфера DAB для проявления окраски и оставляли при комнатной температуре на 20 минут. Затем для прекращения реакции в каждую лунку добавляли 0,05 мл 2 М H2SO4 (стоп-раствор) и определяли величину оптической плотности OD450 с помощью ИФА-ридера.
Титры сывороток рассчитывали методом титрования до конечной точки, результаты приведены ниже в табл.4
Таким образом, в примерах 1-6 показано, что ген, кодирующий главный капсидный белок L1 вируса папилломы человека подтипа 18 в соответствии с настоящим изобретением, представляет собой оптимизированный ген L1 ВПЧ 18, преимуществами которого являются более эффективная экспрессия целевого белка в дрожжевой клетке-хозяине и соответствие требованиям технологического производства. Далее, показано, что вакцина L1 ВПЧ 18 в соответствии с настоящим изобретением, полученная при адсорбции на адъюванте ВЧ (вирусоподобых частиц, образованных при самосборке из белка L1 ВПЧ 18), обладает сильным иммуногенным действием по отношению к мышам, на что указывает уровень сероконверсии и титры сывороток. Далее, преимуществами данного способа являются низкая стоимость, высокий выход и более однородное и стабильное качество продукта благодаря использованию системы экспрессии на основе дрожжей Pichia.
Пример 7. Конструирование и синтез кодон-оптимизированного гена усеченного L1 ВПЧ 18
7.1. Конструирование кодон-оптимизированного гена усеченного L1 ВПЧ 18
Настоящее изобретение относится к молекулам ДНК, кодирующим усеченный главный капсидный белок L1 вируса папилломы человека подтипа 18 (ВПЧ18), которые были кодон-оптимизированы с помощью кодонов, предпочтительных для дрожжей Pichia. С помощью оптимизации кодонов, модификации оптимизированных кодонов и удаления 61 аминокислоты с N-конца было получено три последовательности ДНК, соответствующие представленным в SEQ ID NO:1, 2 и 3, как подробно описано ниже. Во-первых, в природный ген, кодирующий L1 ВПЧ 18, вносили модификации как описано выше в примере 1 с целью конструирования новой последовательности ДНК ВПЧ. Далее, во избежание наличия высокого соотношения в транскрибированных мРНК, влияния вторичной структуры мРНК на эффективность трансляции и присутствия общих сайтов рестрикции, в оптимизированные кодоны вносили изменения, например, кодон аспарагина (Asn) был изменен с ААС на ААТ, кодон лизина (Lys) - с AAG на ААА, кодон аспарагиновой кислоты (Asp) - с GAT на GAC, кодон фенилаланина (Phe) -с ТТТ на ТТС, кодон тирозина (Tyr) - с ТАС на ТАТ, а также 61 аминокислота была усечена с N-конца, приводя к трем новым усеченным последовательностям ДНК ВПЧ, причем:
SEQ ID NO:1 - последовательность ДНК без изменения кодонов;
SEQ ID NO:2 - последовательность ДНК, полученная из SEQ ID NO:1 заменой кодонов для аспарагина (Asn), лизина (Lys) и аспарагиновой кислоты (Asp);
SEQ ID NO:3 - последовательность ДНК, полученная из SEQ ID NO:1 заменой кодонов для фенилаланина (Phe), тирозина (Tyr) и глицина (Gly).
7.2. Синтез кодон-оптимизированного гена усеченного L1 ВПЧ 18
Полноразмерный кодон-оптимизированный ген усеченного L1 ВПЧ 18, представленный SEQ ID NO:1, получали практически тем же способом, как описано выше в примере 1. Полученный таким образом ген усеченного L1 ВПЧ 18 дотировали по сайтам рестрикции EcoRI и KpnI на концах в плазмиду pUC18 (продукт Generay Biotech (Shanghai) Co., Ltd (Шанхай, Китай)). Правильность полученной конструкции проверяли секвенированием, конструкция получила название pUC-18L1'.
Кодон-оптимизированные гены усеченного L1 ВПЧ 18, представленные SEQ ID NO:2 и 3, были получены по аналогичной методике.
Для проверки пригодности оптимизированных последовательностей, на основе одного из кодон-оптимизированных генов усеченного L1 ВПЧ 18, полученного в данном примере 7 (SEQ ID NO:1), конструировали экспрессирующую плазмиду для оценки ее экспрессии, как подробно описано в примере 8.
Пример 8. Конструирование вектора экспрессии усеченного гена L1 ВПЧ 18
Оптимизированную последовательность SEQ ID NO:1 клонировали в вектор экспрессии дрожжей Pichia, как более подробно описано ниже.
8.1. Синтезировали прямой и обратный праймеры, имеющие следующие последовательности, необходимые для амплификации гена L1 ВПЧ 18:
прямой праймер: 5'-TCCCAATCTTCGAAACGATGGCTTTGTGGA-3' (SEQ ID NO:15);
обратный праймер: 5'-AATGGTACCCTATTACTTTCTAGCTCTAACT-3' (SEQ ID NO:13).
причем прямой праймер содержит сайт рестрикции BstBI, а обратный праймер содержит сайт рестрикции KpnI, фланкирующий стоп-кодон. Указанные сайты рестрикции соответственно показаны подчеркнутыми участками приведенных выше последовательностей праймеров.
8.2. ПЦР-амплификацию проводили с указанными выше праймерами и с pUC-18L1', полученным в примере 7, в качестве темплаты. Амплифицированный продукт обнаруживали с помощью электрофореза, результаты которого приведены на фиг.5, из которого видно, что был получен полноразмерный кодон-оптимизированный ген усеченного L1 ВПЧ 18. ПЦР-амплифицированный фрагмент гидролизовали действием BstBI и KpnI (эндонуклеазы рестрикции), а затем лигировали в pPICZaB (Invitrogen Corp.), который также гидролизовали действием BstBI и KpnI. Далее дотированную конструкцию использовали для трансформации компетентных клеток Е.coli штамма Тор 10 (продукт Generay Biotech (Shanghai) Co., Ltd (Шанхай, Китай)), и трансформированные клетки сеяли на LB-агар, содержащий 25 мкг/мл антибиотика зеоцин.
Трансформированные клетки были способны расти в среде LB, содержащей зеоцин, так как вектор pPICZaB несет ген, устойчивый к зеоцину. Единичные колонии трансформированных клеток отделяли для получения плазмидной ДНК. Ген L1 ВПЧ 18 и векторную последовательность исследовали методом рестриктазного картирования (см. фиг.6) и анализа последовательности нуклеотидов с целью идентификации правильной конструкции, содержащей усеченный ген L1 ВПЧ 18, которая получила название pPICZ-18L1'. Поскольку сигнал к секреции (сигнал α-фактора) отделен от сконструированной плазмиды, внутриклеточная экспрессия приводит к образованию белка L1 ВПЧ 18.
Пример 9. Конструирование штамма, экспрессирующего усеченный ген L1 ВПЧ 18, и экспрессия
9.1. Конструирование штамма, экспрессирующего усеченный ген L1 ВПЧ 18
Плазмиду pPICZ-18L1' линеаризовали действием фермента эндонуклеазы рестрикции SacI, и пустую плазмиду pPICZaB аналогичным образом гидролизовали действием SacI для применения в качестве отрицательного контроля. К ферментативному расщепляющему раствору прибавляли абсолютный этиловый спирт для осаждения ДНК. Линеаризованный фрагмент pPICZ-18L1' растворяли в небольшом количестве бидистиллированной воды и использовали для электропорации штамма Х-33 дрожжей Pichia (Invitrogen Corp.) при следующих условиях: фрагмент ДНК - 5 мкг; напряжение - 1500 В; сопротивление - 25 ом; время электропорации - 5 миллисекунд. После электропорации клетки высевали на YPDS-агар, содержащий 200 мкг/мл антибиотика зеоцин (продукт Zeocin Co.). Так как вектор pPICZaB несет ген, устойчивый к зеоцину, трансформированные клетки способны расти в среде YPDS, содержащей зеоцин. Единичные колонии трансформированных клеток отделяли, получая штамм дрожжей Pichia, экспрессирующий усеченный ген L1 ВПЧ 18.
9.2. Экспрессия штамма дрожжей Pichia, экспрессирующего усеченный ген L1 ВПЧ 18
Полученный штамм дрожжей Pichia, экспрессирующий усеченный ген L1 ВПЧ 18 помещали на планшеты, содержащие 1000 мкг/мл или 1 500 мкг/мл зеоцина. Клоны, полученные на планшетах с высокой концентрацией антибиотика, отдельно культивировали в 4 мл жидкой питательной среды YPD в течение суток, после чего проводили индуцирование экспрессии гена в среде BMMY в течение 2 суток. Далее клетки отделяли центрифугированием, и часть клеток разрушали для получения супернатанта для проведения вестерн-блоттинга, результаты которого приведены на фиг.7, из которого следует наличие в супернатанте усеченного белка L1 ВПЧ 18.
Хотя в примерах 8 и 9 настоящего изобретения клонирование и экспрессию проводили с последовательностью SEQ ID NO:1, для специалиста в данной области очевидно, что аналогичные результаты можно получить, взяв для клонирования и экспрессии последовательности SEQ ID NO:2 и 3, и таким образом указанные две последовательности также входят в сферу настоящего изобретения. Более того, с учетом характера настоящего изобретения для специалиста несложно сконструировать аналогичные последовательности, а также клонировать и экспрессировать сконструированные последовательности в дрожжах Pichia, получив аналогичные или лучшие результаты и, следовательно, данные последовательности также считаются входящими в сферу настоящего изобретения.
Пример 10. Крупномасштабная экспрессия и обнаружение усеченного белка L1 ВПЧ 18
1. Крупномасштабная экспрессия рекомбинантного усеченного белка L1 ВПЧ 18
Приготовление раствора инокулята: Из рабочего банка клеток брали одну пробирку с рекомбинантным штаммом дрожжей, замороженных в глицерине. После оттаивания 100 мкл дрожжей инокулировали в 5 мл среды YPD и культивировали на 280 об/мин при 30°С в течение 20 часов, в этот период величина OD600 составляла от 1 до 2, и при исследовании под микроскопом не обнаруживалось загрязнения другими микроорганизмами. 1 мл жидкости для активации (удовлетворительное состояние которой было подтверждено при испытании) инокулировали в 500 мл среды YPD и культивировали на 280 об/мин при 30°С в течение 20 часов, в этот период величина OD600 составляла от 2 до 6, и при исследовании под микроскопом не обнаруживалось загрязнения другими микроорганизмами.
Процесс ферментации: солевую основную питательную среду для ферментации готовили на деионизированной воде: BSM1 (K2SO4 - 273 г, MgSO4 - 109 г, CaSO4·2H2O - 17.6 г, H3PO4 - 400,5 мл, KOH - 62 г, глицерин - 600 г, PTM1 - 60 мл, противовспенивающая добавка - 1 мл; деионизированную воду добавляли до объема 15 л). Приготовленную среду, не содержащую антибиотиков, переносили в ферментер объемом 30 л (Bioengineering Co., Ltd) и стерилизовали в ферментере 30 минут при 121°С, после чего охлаждали до 30°С. Предварительно приготовленный раствор инокулята засевали в стерилизованную среду в соотношении 1:15. Ферментацию начинали при температуре 30,0±0,5°С, начальная величина рН составляла 5,00±0,05, начальная скорость перемешивания 300 об/мин, объем аэрации среды 0,5 об.об.м, содержание растворенного кислорода (DO) 100%, с добавлением следовых количеств солей РТМ1 (CuSO4·5H2O - 6,0 г, NaI - 0,008 г, MnSO4 - 3.0 г, NaMoO4 - 0,2 г, Н3ВО3 - 0,02 г, ZnSO4 - 20,0 г, CoCl2 - 0,5 г, FeSO4·7H2O - 65,0 г, биотин - 0,2 г и H2SO4 - 5,0 мл; деионизированную воду добавляли до объема 1 л). Начальная стадия пролиферации продолжалась около 20 часов, в течение которых количество растворенного кислорода поддерживали на уровне не менее 30%. После полного расходования источника углерода уровень растворенного кислорода быстро повышался, при этом масса сырых клеток достигала прибл. 100 г/л. В первые два часа ферментации проводили подпитку раствором глицерина с концентрацией 50 об, % (содержащий 12 мл PTM1 на 1 литр) при расходе 200 мл/ч. Далее подачу продолжали при расходе 300 мл/ч около 8 часов, в течение которых поддерживали уровень растворенного кислорода более 20% за счет регулирования скорости перемешивания, расхода воздуха и давления в ферментере (0,8 бар). Когда масса сырых клеток достигала прибл. 350 г/л, подпитку прекращали, уровень растворенного кислорода соответственно повышался. В то же время устанавливали величину рН 6.00±0,05, и вводили метанол (содержащий 12 мл PTM1 на 1 литр) при начальном расходе 30 мл/ч для индуцирования экспрессии гена. Скорость подачи метанола медленно повышали до достижения заданного расхода 90 мл/ч через 4 часа. В ходе индуцирования количество растворенного кислорода поддерживали на уровне более 20 об.%, температуру - 30°С и рН - 6.00±0,05. Каждые восемь часов отбирали пробу для анализа методом вестерн-блоттинга. Через 48 часов после индуцирования ферментация заканчивалась и ферментационный бульон разгружали.
Сбор клеток: Ферментационный бульон центрифугировали на центрифуге с охлаждением, и отделяли клетки, которые затем взвешивали. Записывали номер партии, дату и массу выделенных клеток, и направляли клетки на очистку или оставляли на хранение при -20°С.
2. Определение
Очищенный (по методу, описанному ниже в примере 11) усеченный белок L1 ВПЧ 18 служил для построения стандартной концентрационной кривой белка. Величину экспрессии гена L1 ВПЧ 18 в дрожжах Pichia в ходе ферментации определяли сэндвич-методом твердофазного ИФА, используя клетки до индуцирования в качестве отрицательного контроля, как подробно описано ниже.
Поликлональное антитело кролика против белка L1 ВПЧ 18 разводили в 2000 раз покрывающим раствором. В каждую лунку планшета для твердофазного ИФА вносили аликвоту (0,1 мл) разведенных поликлональных антител кролика и инкубировали планшет при 4°С, оставляя на ночь. Покрывающий раствор удаляли из лунок, и каждую лунку промывали 0,3 мл буфера PBST. Далее связывание блокировали инкубированием с 0,3 мл блокирующего раствора в течение 2 часов при 37°С.
Очищенный белок L1 ВПЧ 18 градиентно разводили буфером для разведения от концентрации 2 мкг/мл до 0,0625 мкг/мл. Параллельно супернатант, полученный из разрушенного ферментационного бульона, разбавляли в 200 раз. Далее от каждого из растворов белка L1 ВПЧ 18 разных концентраций, полученных серийным разведением, а также от разведенного супернатанта, отбирали аликвоты по 0,1 мл и вносили каждую в отдельную лунку обработанного, как указано выше, планшета для твердофазного ИФА, и инкубировали планшет 1 час при 37°С. После инкубирования аликвоты раствора антигена удаляли из лунок, и промывали лунки 0,3 мл промывочного буфера. Далее мышиное моноклональное антитело МАВ885 (продукт CHEMICON Co., Ltd.) разводили в 1000 раз буфером для разведения, аликвоты разведении (по 0,1 мл) вносили в лунки и инкубировали 1 час при 37°С. После инкубирования раствор моноклональных антител удаляли из лунок и промывали лунки 0,3 мл промывочного буфера. Далее в каждую лунку добавляли 0,1 мл раствора меченого пероксидазой хрена IgG козы к мышиным антигенам, полученного разведением IgG в 5000 раз буфером для разведения, и инкубировали 0,5 часа при 37°С. Далее раствор для твердофазного ИФА удаляли, и промывали лунки промывочным буфером по 0,3 мл.. В каждую лунку добавляли 0,1 мл буфера DAB для проявления окраски и оставляли при комнатной температуре на 20 минут. Затем для прекращения реакции в каждую лунку добавляли 0,05 мл 2 М H2SO4 (стоп- раствор) и определяли величину оптической плотности OD450 с помощью ИФА-ридера.
Величины OD450 для градиентно разведенных растворов белка L1 ВПЧ 18 служили для построения стандартной концентрационной кривой белка. На основе стандартной кривой определяли величину экспрессии усеченного белка L1 ВПЧ 18 в ходе ферментации, как показано ниже в табл.5.
Более конкретно, исходный раствор очищенного целевого белка известной концентрации последовательно разводили, получая серию растворов в заданном интервале концентраций, таких как 2 мкг/мл, 1 мкг/мл, 0,5 мкг/мл, 0,25 мкг/мл и 0,125 мкг/мл, которые служили в качестве стандартных концентраций. Для указанных растворов проводили твердофазный ИФА, получая соответствующие величины OD450, Строили график стандартной линейной регрессии, при этом на оси ординат откладывали концентрации, а на оси абсцисс - величины OD450,
Супернатант, полученный из разрушенного ферментационного бульона, последовательно разводили, т.е. в 50 раз, в 100 раз, в 200 раз и в 400 раз. Для серии разведении измеряли величины OD450, и по графику стандартной линейной регрессии определяли соответствующие концентрации (мкг/мл). Далее рассчитывали концентрацию целевого белка в супернатанте (мкг/мл) умножением найденной концентрации на коэффициент разведения. Так как разрушенный бульон готовили при соотношении сырая масса клеток: буфер для разрушения клеток = 1:5, следовательно величина экспрессии целевого белка в сырых клетках (мкг/г сырых клеток) составляла 5 × концентрация целевого белка в супернатанте (мкг/мл). Концентрацию экспрессированного целевого белка в ферментационном бульоне (мкг/л ферментационного бульона) получали умножением вышеуказанной величины экспрессии целевого белка в сырых клетках на плотность клеток в ферментационном бульоне (г сырых клеток/л ферментационного бульона).
Концентрация целевого белка в супернатанте, полученном из разрушенного ферментационного бульона (мкг/мл) = Коэффициент разведения × Стандартная концентрация целевого белка (мкг/мл) × OD450 (супернатант, полученный из разрушенного ферментационного бульона) / OD450 (стандартная концентрация целевого белка).
Концентрация экспрессированного целевого белка в ферментационном бульоне (мкг/л ферментационного бульона)= 5 × концентрация целевого белка в супернатанте, полученном из разрушенного ферментационного бульона (мкг/мл) × плотность клеток в ферментационном бульоне (г сырых клеток/л ферментационного бульона).
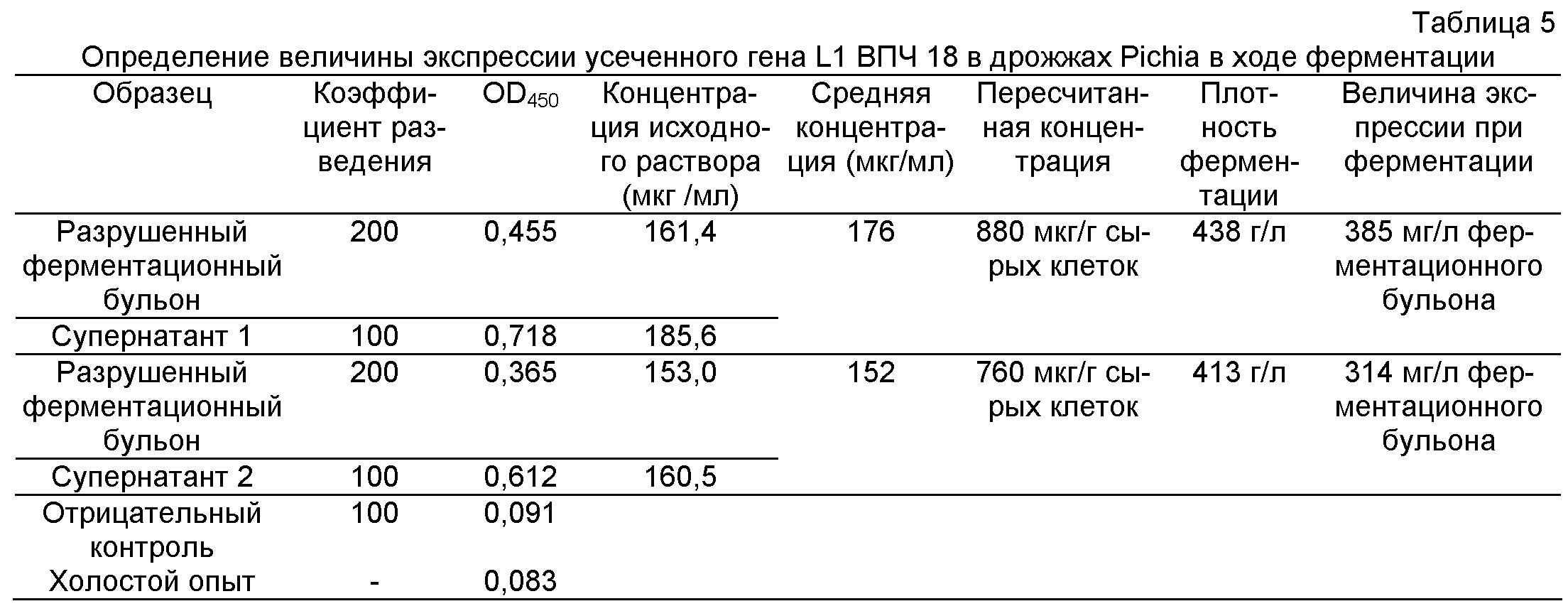
Результаты, приведенные в табл.5, показывают, что оптимизированная последовательность гена белка L1 ВПЧ 18 в соответствии с настоящим изобретением не только может экспрессироваться с получением белка L1 ВПЧ 18 в дрожжах Pichia, но также характеризуется высокой величиной экспрессии, соответствующей требованиям технологического производства.
Пример 11. Очистка усеченного белка L1 ВПЧ 18
Отмывка: Полученные клетки дрожжей Pichias, способные экспрессировать усеченный белок L1 ВПЧ 18, которые хранили при -20°С, размораживали при комнатной температуре. Далее размороженные клетки смешивали с промывочным буфером (100 мМ РВ, рН 7.0, 0,15М NaCl) или с водой в отношении 1:3 (г/мл) для очистки и проводили полную гомогенизацию в буфере или в воде с помощью гомогенизатора (FLUKO). Далее, гомогенизат центрифугировали на высокоскоростной центрифуге (SORVALLRC6PLUS) на 8000 об/мин в течение 5 минут для отделения клеток, после чего Супернатант декантировали. Указанную операцию повторяли дважды, таким образом достигая отмывки клеток.
Разрушение: Отмытые клетки смешивали с буфером для разрушения клеток (100 мМ MOPS, 0,75M NaCl, 0,05% Твин-80, рН 7.0) в отношении 1:5 (г/мл) и проводили полную гомогенизацию с буфером в гомогенизаторе (FLUKO). Клетки, суспендированные в гомогенизате, разрушали в гомогенизаторе высокого давления (ATSAH110B) с рабочим давлением в интервале от 1200 до 1300 бар. Операцию разрушения повторяли четырежды, затем раствор, содержащий разрушенные клетки, выгружали при 4-8°С, при этом доля разрушенных клеток составляла 90%.
Осветление: Раствор, содержащий разрушенные клетки, полученный гомогенизацией при высоком давлении, как описано выше, заливали в центрифужный стакан и центрифугировали на высокой скорости для удаления клеточного дебриса, получая супернатант для дальнейшего разделения методом колоночной хроматографии. Использовали центрифугу SORVALLRC6PLUS, ротор модели: FIBERLITEF10-6x500y, параметры центрифугирования: 9000 об/мин, 30 мин, 10°С.
Предварительная очистка: Хроматографическую фазу POROS 50 HS (Applied Biosystems) загружали в колонку (диаметр 26 мм, высота 10 см, объем 50 мл). Предварительная очистка включала следующие стадии: (1) промывка и дезинфекция: колонку промывали двумя ее объемами 0,5 М раствора NaOH; (2) регенерация и установление равновесия: колонку промывали двумя ее объемами буфера F и устанавливали равновесие с буфером Е; (3) ввод образца: супернатант, полученный центрифугированием раствора, содержащего разрушенные клетки, вводили в колонку; (4) промывка: колонку промывали пятью ее объемами буфера Е до стабилизации нулевой линии; (5) элюированиие: элюировали линейным градиентом от 100% буфера Е до 100% буфера F, общий объем элюирования составлял шесть объемов колонки; и (6) сбор продукта: хроматографические пики с электропроводностью в интервале от 70 до 100 мСм/см собирали и хранили при 4°С.
Глубокая очистка: Хроматографическую фазу СНТ (BIO-RAD, Тип II, 40 мкм) загружали в Хроматографическую колонку (диаметр 26 мм, высота 10 см, объем 50 мл). Глубокая очистка включала следующие стадии: (1) промывка и дезинфекция: колонку промывали двумя ее объемами 0,5 М раствора NaOH; (2) регенерация и установление равновесия: колонку промывали двумя ее объемами буфера H и устанавливали равновесие с буфером G; (3) ввод образца: образец, собранный после предварительной очистки, разбавляли фосфатным буфером до концентрации 30 мМ и затем помещали на колонку; (4) промывка: колонку промывали пятью ее объемами буфера G до стабилизации нулевой линии; (5) элюированиие: элюировали линейным градиентом от 100% буфера G до 100% буфера H; и (6) сбор продукта: собирали элюированные фракции. Фракции, содержащие усеченный белок L1 ВПЧ 18, объединяли, получая конечный очищенный образец. Очищенный образец восстанавливали до мономерных белков для анализа на ДДС-Na-ПААГ (Bio-RAD), показавшего степень чистоты образца более 90% (см. фиг.8).
Анализ методом вестерн-блоттинга (Bio-RAD) показал наличие специфической реакции окрашивания между целевой электрофоретической полосой и моноклональным или поликлональным антителом против белка L1 ВПЧ 18 (см. фиг.9). Детектирование методом динамического светорассеяния (Malvern Instruments Zetasizer Nano ZS) показало размер частиц в очищенном образце в интервале прибл. от 50 до 80 нм, а исследование под электронным микроскопом (просвечивающий электронный микроскоп Philips Tecnai-12Biotwin, Electron Microscope Laboratory, Science and Technology Center, Shanghai University of Traditional Chinese Medicine, Китай) показало наличие в очищенном образце вирусоподобных частиц (ВЧ) размером от 50 до 80 нм (см. фиг.10). В случае полноразмерного белка L1 ВПЧ 18, экспрессированного, как описано выше в настоящем документе, и очищенного по такой же методике, также были получены очищенные ВЧ, которые по данным динамического светорассеяния и электронный микроскопии имели тот же размер частиц, что и усеченный белок L1 ВПЧ 18, а именно от 50 до 80 нм.
Пример 12. Получение вакцины на основе усеченного L1 ВПЧ 18
Очищенный белок L1 ВПЧ 18, полученный в примере 11, адсорбировали на адъюванте - соединении алюминия - с получением иммуногенной вакцины L1 ВПЧ 18, согласно способу, описанному в Chinese Pharmacopoeia (издание 2005 г.).
Пример 13. Определение иммуногенности продукта экспрессии усеченного гена L1 ВПЧ 18
Двадцать четыре мыши линии BALB/c, свободные от патогенной микрофлоры (SPF), возрастом 6-8 недель разбивали на 4 группы, по 6 мышей в каждой группе. Мыши первой группы (группа отрицательного контроля) получали три подкожные инъекции 0,1 мл буфера (0,32 М хлорид натрия, 0,35 мМ борат натрия, 0,01% Твин-80, 0,01 М гистидин, рН 6.5), содержащего адъювант - соединение алюминия, соответственно на 0, 7 и 21 сутки, а мыши трех других групп (испытуемые группы) получали аналогичные инъекции 0,1 мл ВЧ, адсорбированных на адъюванте - соединении алюминия, при концентрации соответственно 5 мкг/мл, 0,5 мкг/мл и 0,05 мкг/мл. Образцы крови отбирали через две недели после третьей иммунизации. Отобранные образцы оставляли на 2 часа при 37°С после чего центрифугировали 10 минут при 4000 g. Супернатант - поликлональную мышиную антисыворотку - аспирироватли и хранили при -20°С. Супернатант дополнительно анализировали для определения уровня сероконверсии и титра, как подробно описано ниже.
13.1. Определение уровня сероконверсии
Очищенный усеченный белок L1 ВПЧ 18, экспрессированный в дрожжах Pichia, разводили покрывающим раствором до концентрации 1 мкг/мл. Аликвоты разведения (0,1 мл) помещали в лунки планшета для твердофазного ИФА, после чего планшет инкубировали при 4°С, оставляя на ночь. Покрывающий раствор удаляли из лунок, которые затем промывали 0,3 мл буфера PBST. Далее в лунки вносили по 0,3 мл блокирующего раствора (5% сухого обезжиренного молока + PBST) и выдерживали 2 часа при 37°С. В лунки добавляли по 0,1 мл раствора исследуемой сыворотки (сыворотка, полученная после иммунизации мышей белком L1 ВПЧ 18, адсорбированным на адъюванте - соединении алюминия, и сыворотка, полученная после иммунизации мышей только адъювантом - соединением алюминия), полученного разведением сыворотки буфером для разведения (2% сухого обезжиренного молока + PBST) в соотношении 1:400, и инкубировали 1 час при 37°С. Далее испытуемый раствор сыворотки удаляли и промывали лунки промывочным буфером, по 0,3 мл. Далее в каждую лунку добавляли 0,1 мл раствора меченого пероксидазой хрена IgG козы к мышиным антигенам, полученного при разведении IgG буфером для разведения в соотношении 1:5000, и инкубировали 0,5 часа при 37°С. Далее раствор для твердофазного ИФА удаляли и промывали лунки промывочным буфером по 0,3 мл на лунку. В каждую лунку добавляли по 0,1 мл буфера DAB для проявления окраски и оставляли в темноте при комнатной температуре на 20 минут. Затем для прекращения реакции в каждую лунку добавляли 0,05 мл 2 М H2SO4 (стоп-раствор) и определяли величину оптической плотности OD450 с помощью ИФА-ридера, показания которого приведены ниже в табл.6.
Пороговая величина представляет собой сумму средней величины OD450 для антител против исследуемой сыворотки, полученной для группы отрицательного контроля (мышиная сыворотка, полученная при иммунизации только адъювантом), и трехкратного стандартного отклонения. Результаты OD450 больше пороговой величины считали положительными, а значения OD450 меньше пороговой величины - отрицательными. Данные по сероконверсии для трех испытуемых групп приведены ниже в табл.7.

13.2. Определение титров сыворотки
Очищенный усеченный белок L1 ВПЧ 18 разводили покрывающим раствором до концентрации 1 мкг/мл. Аликвоты разведения (0,1 мл) помещали в лунки планшета для твердофазного ИФА, после чего планшет инкубировали при 4°С, оставляя на ночь. Покрывающий раствор удаляли из лунок, которые затем промывали 0,3 мл буфера PBST. Далее в лунки вносили по 0,3 мл блокирующего раствора (5% сухого обезжиренного молока + PBST) и инкубировали 2 часа при 37°С. Испытуемую сыворотку (сыворотки, полученные от мышей, иммунизированных белком L1 ВПЧ 18) последовательно разводили в два раза буфером для разведения (2% сухого обезжиренного молока + PBST), получая разбавления от 1:500 до 1:32000, а сыворотку отрицательного контроля (сыворотка, полученная от мышей, иммунизированных адъювантом) разводили в соотношении 1:10000, В каждую лунку добавляли аликвоты по 0,1 мл разведенной сыворотки (испытуемая сыворотка или сыворотка отрицательного контроля) и инкубировали 1 час при 37°С. Далее раствор испытуемой сыворотки удаляли и промывали лунки промывочным буфером, по 0,3 мл. Далее в каждую лунку добавляли 0,1 мл раствора, меченого пероксидазой хрена IgG козы к мышиным антигенам, полученного разведением IgG буфером для разведения в соотношении 1:5000 и инкубировали 0,5 часа при 37°С. Далее раствор для твердофазного ИФА удаляли и промывали лунки промывочным буфером по 0,3 мл на лунку. В каждую лунку добавляли 0,1 мл буфера DAB для проявления окраски и оставляли при комнатной температуре на 20 минут. Затем для прекращения реакции в каждую лунку добавляли 0,05 мл 2 М H2SO4 (стоп- раствор) и определяли величину оптической плотности OD450 с помощью ИФА-ридера. Титры сывороток рассчитывали методом титрования до конечной точки, результаты приведены ниже в табл.8.
Таким образом, в примерах 1-13 показано, что ген, кодирующий главный капсидный белок L1 вируса папилломы человека подтипа 18, в соответствии с настоящим изобретением или ген, кодирующий усеченный главный капсидный белок L1 вируса папилломы человека подтипа 18, в соответствии с настоящим изобретением представляет собой оптимизированный ген L1, преимуществами которого являются более эффективная экспрессия целевого белка в дрожжевой клетке-хозяине и соответствие требованиям технологического производства. Далее, вакцина L1 ВПЧ 18 в соответствии с настоящим изобретением способна к самосборке с образованием структуры ВЧ. Показано, что вакцина обладает сильным иммуногенным действием по отношению к мышам, на что указывает уровень сероконверсии и титры сывороток для очищенных ВЧ, адсорбированных на адъюванте. Далее, преимуществами данного способа являются низкая стоимость, высокий выход и более однородное и стабильное качество продукта благодаря использованию системы экспрессии на основе дрожжей Pichia.
Пример 14. Нейтрализующая активность ВЧ усеченного L1 ВПЧ 18
Иммунизацию мышей проводили по описанной выше схеме и образцы крови брали через две недели после иммунизации. Собранную кровь выдерживали 2 часа при 37°С и центрифугировали на 4000 g в течение 10 минут. Супернатант - поликлональную мышиную антисыворотку - аспирировали и хранили при -20°С.
Клетки 293FT (Invitrogen) первоначально высевали на чашку для культивирования размером 15 см (1,1×107 клеток на чашку). Через 24 часа клетки котрансфецировали плазмидами p18L1h, p18L2h (Buck CB, Pastrana DV, Lowy DR et al. Efficient Intracellular Assembly of Papillomaviral Vectors. J Virol, 2004, 78(2):751-757) и pIRES2-EGFP, несущей ген зеленого флуоресцентного белка (продукт BD Biosciences Clontech) в количестве соответственно 20 мкг, 10 мкг и 10 мкг методом кальцийфосфатной трансфекции. Через 48 часов клетки осматривали, собирали и лизировали. Супернатант клеточного лизата сразу же подвергали очистке или хранили при -80°С.
Очистку проводили центрифугированием супернатанта лизата клеток в центрифужной пробирке на 5 мл (Beckman) методом центрифугирования по градиенту плотности с 30% OptiPrep на 100000 g при 16°С в течение 4 часов (ротор центрифуги MLS-50, высокоскоростная центрифуга Beckman). Фракции, полученные при центрифугировании, собирали, объем каждой фракции составлял около 500 мкл, и анализировали на содержание белка L1 ВПЧ 18 методом вестерн-блоттинга. Фракции, содержащие наиболее высокие концентрации белка L1, объединяли как раствор псевдотипа вируса, от которого брали аликвотные порции. Раствор хранили при -80°С.
Клетки 293FT помещали на 24-луночный культуральный планшет (1,5×105 клеток/лунка). Через 24 часа проводили опыт по нейтрализации по следующей методике. Образцы сывороток серийно разбавляли в 100 раз средой DMEM. Аликвоты по 50 мкл каждого разбавления смешивали с 50 мкл раствора псевдотипа вируса в среде DMEM, и каждую смесь инкубировали 1 час при 4°С. Далее каждую инкубированную смесь наносили на 24-луночный культуральный планшет, на который были предварительно нанесены клетки 293FT и инкубировали 48 часов при 37°С. После инкубирования клетки исследовали на экспрессию зеленого флуоресцентного белка под инвертированным флуоресцентным микроскопом OLUMPUSCKX41F32FL и записывали флуоресцентные изображения, которые показаны на фиг.11a и 11b. На фиг.11a можно было наблюдать флуоресценцию, что означает факт инфицирования клеток 293FT псевдотипом вируса ВПЧ 18. На фиг.11b остается малая доля флуоресценции, что означает факт нейтрализации псевдотипа вируса ВПЧ 18 мышиной сывороткой, снижающий вирусную инфекцию в клетках 293FT. Таким образом ясно, что в организме мышей, получивших иммунизацию рекомбинантной вакциной на основе ВЧ L1 ВПЧ 18, могут генерироваться нейтрализующие антитела, ингибирующие проникновение псевдотипа вируса в клетки.
Согласно настоящему изобретению, нуклеотидная последовательность SEQ ID NO:2 или 3 и нуклеотидная последовательность SEQ ID NO:5 или 6 могут заменить соответственно SEQ ID NO:1 и SEQ ID NO:4 в приведенных примерах получения белка L1 ВПЧ 18 и его усеченной формы согласно настоящему изобретению способами, описанными в приведенных примерах. Помимо этого, вышеуказанные гены можно также клонировать соответствующим методом клонирования в другие существующие векторы экспрессии дрожжей Pichia, такие как pPIC6, pGAPZ или рА0815. Далее полученные рекомбинантные векторы экспрессии могут служить для трансформации других штаммов дрожжей Pichia, таких как штаммы Pichia pastoris GS115, KM71 или SMD1168, приводящей к генно-инженерным штаммам. Обычными методами культивирования и ферментации, а также разделения и очистки (которые не изложены здесь в деталях) из указанных генно-инженерных штаммов можно получить белок L1 ВПЧ 18 (ВЧ L1 ВПЧ 18) или его усеченную форму в соответствии с настоящим изобретением. Полученный таким образом белок L1 ВПЧ 18 или его усеченная форма будут иметь аналогичные иммуногенные свойства, что и белок L1 ВПЧ 18 или его усеченная форма, полученная в приведенных примерах.
Пример 15. Конструирование и синтез кодон-оптимизированного гена L1 ВПЧ 16
15.1. 1.1. Конструирование кодон-оптимизированного гена белка L1 ВПЧ 16
Настоящее изобретение относится к молекулам ДНК, кодирующим главный капсидный белок L1 вируса папилломы человека подтипа 16 (ВПЧ 16), которые были кодон-оптимизированы с помощью кодонов, предпочтительных для дрожжей Pichia. С помощью оптимизации кодонов и модификации оптимизированных кодонов было получено три последовательности ДНК, соответствующие представленным соответственно в SEQ ID NO:7, 8 и 9, как подробно описано ниже.
Во-первых, в результате многократных экспериментов в существующий в природе ген, кодирующий L1 ВПЧ 16 вносили модификации, оптимизируя кодоны для всех аминокислот гена с целью конструирования новой последовательности ДНК ВПЧ, а именно, SEQ ID NO:7.
Далее, во избежание наличия высокого соотношения GC в транскрибированных мРНК, влияния вторичной структуры мРНК на эффективность трансляции и присутствия общих сайтов рестрикции, в оптимизированные кодоны вносили изменения, например, кодон аспарагина (Asn) был изменен с ААС на ААТ, кодон лизина (Lys) - с AAG на ААА, кодон аспарагиновой кислоты (Asp) - с GAT на GAC, кодон фенилаланина (Phe) - с ТТТ на ТТС, кодон тирозина (Tyr) - с ТАС на ТАТ, а кодон глицина (Gly) - с GGT на GGA, получая таким образом две новые последовательности ДНК ВПЧ, причем:
SEQ ID NO:8 - последовательность ДНК, полученная из SEQ ID NO:7 за счет изменения кодонов аспарагина (Asn), лизина (Lys) и аспарагиновой кислоты (Asp); a SEQ ID NO:9 последовательность ДНК, полученная из SEQ ID NO:7 за счет изменения кодонов фенилаланина (Phe), тирозина (Tyr) и глицина (Gly).
15.2. Синтез кодон-оптимизированного гена белка L1 ВПЧ 16
Кодон-оптимизированный ген L1 ВПЧ 16, представленный SEQ ID NO:7, синтезировали и использовали в качестве темплаты для ПЦР-амплификации с праймерами а1 и а2, имеющими приведенные ниже последовательности:
а1: 5'-ATAGAATTCATGTCTTTGTGGTTGCCATC-3' (SEQ ID NO:16);
а2: 5'-ATAGGTACCCTATTACAACTTTCTCTTCTTT-3' (SEQ ID NO:17).
Полученные продукты ПЦР разделяли методом агарозного гель-электрофореза, целевую последовательность выделяли, получая фрагмент размером около 1,5 тысячи пар оснований. Указанный фрагмент секвенировали, причем результат секвенирования соответствовал SEQ ID NO:7, и, как было показано, представлял собой полноразмерный кодон-оптимизированный ген L1 ВПЧ 16. Полученный таким образом ген L1 ВПЧ с помощью сайтов рестрикции EcoRI и KpnI на концах лигировали в плазмиду pUC18 (продукт компании Generay Biotech (Shanghai) Co., Ltd (Шанхай, Китай)). Правильность полученной конструкции проверяли секвенированием, конструкция получила название pUC-16L1.
Кодон-оптимизированные гены белка L1 ВПЧ 16, соответствующие SEQ ID NO:8 и 9, были получены по аналогичной методике.
Для проверки пригодности оптимизированных последовательностей на основе одного из кодон-оптимизированных генов L1 ВПЧ 16, полученного в данном примере 15 (SEQ ID NO:7), конструировали экспрессирующую плазмиду для оценки ее экспрессии следующим образом.
Пример 16. Конструирование вектора экспрессии гена L1 ВПЧ 16
Оптимизированную последовательность SEQ ID NO:7 клонировали в вектор экспрессии дрожжей Pichia, как показано на фиг.12, и ниже изложено более подробно.
16.1. Синтезировали прямой и обратный праймеры, имеющие следующие последовательности, необходимые для амплификации гена L1 ВПЧ 16:
прямой праймер: 5'-ACTAATTATTCGAAACGATGTCTTTGTGG-3' (SEQ ID NO:18);
обратный праймер: 5'-AGCGGTACCCTATTACAACTTTCTCTTCTTTC-3' (SEQ ID NO:19).
причем прямой праймер содержит сайт рестрикции BstBI, а обратный праймер содержит сайт рестрикции KpnI, фланкирующий стоп-кодон. Указанные сайты рестрикции соответственно показаны подчеркнутыми участками приведенных выше последовательностей праймеров.
16.2. ПЦР-амплификацию проводили с указанными выше праймерами и в качестве темплаты - с pUC-16L1, полученным в примере 15. Амплифицированный продукт обнаруживали с помощью электрофореза, результаты которого приведены на фиг.13, из которого видно, что был получен полноразмерный кодон-оптимизированный ген L1 ВПЧ 16. ПЦР-амплифицированный фрагмент гидролизовали действием BstBI и KpnI (эндонуклеазы рестрикции), а затем лигировали в pPICZaB (Invitrogen Corp.), который также гидролизовали действием BstBI и KpnI. Далее лигированную конструкцию использовали для трансформации компетентных клеток Е.coli штамма Тор 10 (продукт Generay Biotech (Shanghai) Co., Ltd (Шанхай, Китай)), и трансформированные клетки сеяли на LB-агар, содержащий 25 мкг/мл антибиотика зеоцин.
Трансформированные клетки были способны расти в среде LB, содержащей зеоцин, так как вектор pPICZaB несет ген, устойчивый к зеоцину. Единичные колонии трансформированных клеток отделяли для получения плазмидной ДНК. Ген L1 ВПЧ 16 и векторную последовательность исследовали методами рестриктазного картирования (см. фиг.14) и анализа последовательности нуклеотидов с целью идентификации правильной конструкции, содержащей ген L1 ВПЧ, которая получила название pPICZ-16Ll. Так как сигнал к секреции (сигнал а-фактора) отделен от сконструированной плазмиды, внутриклеточная экспрессия приводит к образованию белка L1 ВПЧ 16.
Пример 17. Конструирование штамма дрожжей Pichia, экспрессирующего ген L1 ВПЧ 16 и его экспрессия
17.1. Конструирование штамма дрожжей Pichia, экспрессирующего ген L1 ВПЧ 16
Плазмиду pPICZ-16L1 линеаризовали действием фермента эндонуклеазы рестрикции SacI и пустую плазмиду pPICZaB аналогичным образом гидролизовали действием SacI для применения в качестве отрицательного контроля. К ферментативному расщепляющему раствору фермента прибавляли абсолютный этиловый спирт для осаждения ДНК. Линеаризованный фрагмент pPICZ-16L1 растворяли в небольшом количестве бидистиллированной воды и использовали для электропорации штамма Х-33 дрожжей Pichia (Invitrogen Corp.) при следующих условиях: фрагмент ДНК - 5 мкг; напряжение - 1500 В; сопротивление - 25 ом; время электропорации - 5 миллисекунд. После электропорации клетки высевали на YPDS-агар, содержащий 200 мкг/мл зеоцина (продукт Zeocin Co.). Так как вектор pPICZaB несет ген, устойчивый к зеоцину, трансформированные клетки могут расти в среде YPDS, содержащей зеоцин. Единичные колонии трансформированных клеток отделяли, получая штамм дрожжей Pichia, экспрессирующий ген L1 ВПЧ 16.
17.2. Экспрессия штамма дрожжей Pichia, экспрессирующего ген L1 ВПЧ 16
Полученный штамм дрожжей Pichia, экспрессирующий ген L1 ВПЧ 16, помещали на планшеты, содержащие 1000 мкг/мл или 1500 мкг/мл зеоцина. Клоны, полученные на планшетах с высокой концентрацией антибиотика, отдельно культивировали в 4 мл жидкой питательной среды YPD в течение суток, после чего проводили индуцирование экспрессии гена в питательной среде BMMY в течение 2 суток. Далее клетки отделяли центрифугированием, и часть клеток разрушали для получения супернатанта для проведения вестерн-блоттинга, результаты которого приведены на фиг.15, из которого следует наличие в супернатанте белка L1 ВПЧ 16.
Хотя в примерах 16 и 17 настоящего изобретения клонирование и экспрессию проводили с последовательностью SEQ ID NO:7, для специалиста в данной области очевидно, что аналогичные результаты можно получить, взяв для клонирования и экспрессии последовательности SEQ ID NO:8 и 9, и таким образом указанные две последовательности также входят в сферу настоящего изобретения. Более того, с учетом характера настоящего изобретения для специалиста несложно сконструировать аналогичные последовательности, а также клонировать и экспрессировать сконструированные последовательности в дрожжах Pichia, получив аналогичные или лучшие результаты, и, следовательно, данные последовательности также считаются входящими в сферу настоящего изобретения.
Пример 18. Крупномасштабная экспрессия и обнаружение белка L1 ВПЧ 16
1. Крупномасштабная экспрессия рекомбинантного белка L1 ВПЧ 16
Приготовление раствора инокулята: Из рабочего банка клеток брали одну пробирку с рекомбинантным штаммом дрожжей, замороженных в глицерине. После оттаивания 100 мкл дрожжей инокулировали в 5 мл среды YPD и культивировали на 280 об/мин 20 часов при 30°С, в этот период величина OD600 составляла от 1 до 2, и при исследовании под микроскопом не обнаруживалось загрязнения другими микроорганизмами. 1 мл жидкости для активации (удовлетворительное состояние которой было подтверждено при испытании) инокулировали в 500 мл среды YPD и культивировали на 280 об/мин при 30°С в течение 20 часов, в этот период величина OD600 составляла от 2 до 6 и при исследовании под микроскопом не обнаруживалось загрязнения другими микроорганизмами.
Процесс ферментации: солевую основную питательную среду для ферментации готовили на деионизированной воде: BSM1 (K2SO4 - 273 г, MgSO4 - 109 г, CaSO4·2H2O - 17.6 г, H3PO4 - 400,5 мл, KOH - 62 g, глицерин - 600 г, PTM1 - 60 мл, противовспенивающая добавка - 1 мл; деионизированную воду добавляли до объема 15 л). Приготовленную среду, не содержащую антибиотиков, переносили в ферментер объемом 30 л (Bioengineering Co., Ltd) и стерилизовали в ферментере 30 минут при 121°С, после чего охлаждали до 30°С. Предварительно приготовленный раствор инокулята засевали в стерилизованную среду в соотношении 1:15. Ферментацию начинали при температуре 30,0±0,5°С, начальная величина рН составляла 5,00±0,05, начальная скорость перемешивания 300 об/мин, объем среды аэрации 0,5 об.об.м и содержание растворенного кислорода (DO) 100%, с добавлением следовых количеств солей PTM1 (CuSO45H2O - 6.0 г, NaI - 0,008 г, MnSO4 - 3,0 г, NaMoO4 - 0,2 г, Н3ВО3 - 0,02 г, ZnSO4 - 20,0 г, CoCl2- 0,5 г, FeSO4·7H2O - 65,0 г, биотин - 0,2 г и H2SO4 - 5,0 мл; деионизированную воду добавляли до объема 1 л). Начальная стадия пролиферации продолжалась около 20 часов, в течение которых концентрацию растворенного кислорода поддерживали на уровне не менее 30%. После полного расходования источника углерода уровень растворенного кислорода быстро повышался, при этом масса сырых клеток достигала прибл. 100 г/л. В последующие два часа ферментации проводили подпитку, раствором глицерина с концентрацией 50 об.% (содержащим 12 мл PTM1 на 1 литр) при расходе 200 мл/ч. Далее подачу продолжали при расходе 300 мл/ч около 8 часов, в течение которых поддерживали уровень растворенного кислорода более 20% за счет регулирования скорости перемешивания, расхода воздуха и давления в ферментере (<0,8 бар). Когда масса сырых клеток достигала прибл. 350 г/л, подпитку прекращали, уровень растворенного кислорода соответственно повышался. В то же время устанавливали величину рН 6.00±0,05 и вводили метанол (содержащий 12 мл PTM1 на 1 л) при начальном расходе 30 мл/ч для индуцирования экспрессии гена. Скорость подачи метанола медленно повышали до достижения заданного расхода 90 мл/ч через 4 часа. В ходе индуцирования количество растворенного кислорода поддерживали на уровне более 20 об.%, температуру - 30°С и рН - 6.00±0,05. Каждые восемь часов отбирали пробу для анализа методом вестерн-блоттинга. Через 24 часа после индуцирования ферментация заканчивалась и ферментационный бульон разгружали.
Сбор клеток: Ферментационный бульон центрифугировали на центрифуге с охлаждением, и отделяли клетки, которые затем взвешивали. Записывали номер партии, дату и массу выделенных клеток, и направляли клетки на очистку или оставляли на хранение при -20°С.
2. Определение
Очищенный (по методу, описанному ниже в примере 19) белок L1 ВПЧ 16 служил для построения стандартной концентрационной кривой белка. Величину экспрессии гена L1 ВПЧ 16 в дрожжах Pichia в ходе ферментации определяли сэндвич-методом твердофазного ИФА, используя клетки до индуцирования в качестве отрицательного контроля, как подробно описано ниже.
Поликлональное антитело кролика против белка L1 ВПЧ 16 разводили в 2000 раз Покрывающим раствором. В каждую лунку планшета для твердофазного ИФА вносили аликвоту (0,1 мл) разведенных поликлональных антител кролика и инкубировали планшет при 4°С, оставляя на ночь. Покрывающий раствор удаляли из лунок и каждую лунку промывали 0,3 мл буфера PBST. Далее связывание блокировали инкубированием с 0,3 мл блокирующего раствора 2 часа при 37°С.
Очищенный белок L1 ВПЧ 16 градиентно разводили буфером для разведения от концентрации 2 мкг/мл до 0,0625 мкг/мл. Параллельно супернатант, полученный из разрушенного ферментационного бульона, разводили в 200 раз. Далее от каждого из растворов белка L1 ВПЧ 16 разных концентраций, полученных серийным разведением, а также от разведенного супернатанта, отбирали аликвоты по 0,1 мл, вносили каждую в отдельную лунку планшета для твердофазного ИФА, и инкубировали планшет 1 час при 37°С. После инкубирования аликвоты раствора антигена удаляли из лунок и промывали лунки 0,3 мл промывочного буфера. Далее мышиное моноклональное антитело МАВ885 (продукт CHEMICON Co., Ltd) разводили в 1000 раз буфером для разведения, аликвоты разведения (по 0,1 мл) вносили в лунки и инкубировали 1 час при 37°С.. После инкубирования раствор моноклональных антител удаляли из лунок и промывали лунки 0,3 мл промывочного буфера. Далее в каждую лунку добавляли 0,1 мл раствора меченого пероксидазой хрена IgG козы к мышиным антигенам, полученного разведением IgG в 5000 раз буфером для разведения и инкубировали 0,5 часа при 37°С. Далее раствор для твердофазного ИФА удаляли, и промывали лунки промывочным буфером по 0,3 мл.. В каждую лунку добавляли 0,1 мл буфера DAB для проявления окраски и оставляли при комнатной температуре на 20 минут. Затем для прекращения реакции в каждую лунку добавляли 0,05 мл 2 М H2SO4 (стоп-раствор), и определяли величину оптической плотности OD450 с помощью ИФА-ридера.
Величины OD450 для градиентно разведенных растворов белка L1 ВПЧ 16 служили для построения стандартной концентрационной кривой белка. На основе стандартной кривой определяли величину экспрессии белка L1 ВПЧ 16 в ходе ферментации, как показано ниже в табл.9. Более конкретно, исходный раствор очищенного целевого белка известной концентрации последовательно разводили, получая серию растворов в заданном интервале концентраций, таких как 2 мкг/мл, 1 мкг/мл, 0,5 мкг/мл, 0,25 мкг/мл и 0,125 мкг/мл, которые служили в качестве стандартных концентраций. Для указанных растворов проводили твердофазный ИФА, получая соответствующие величины OD450, Строили график стандартной линейной регрессии, при этом на оси ординат откладывали концентрации, а на оси абсцисс - величины OD450,
Супернатант, полученный из разрушенного ферментационного бульона, последовательно разводили, т.е. в 50 раз, в 100 раз, в 200 раз и в 400 раз. Для серии разведении измеряли величины OD450 и по графику стандартной линейной регрессии определяли соответствующие концентрации (мкг/мл). Далее рассчитывали концентрацию целевого белка в супернатанте (мкг/мл) умножением найденной концентрации на коэффициент разведения. Так как разрушенный бульон готовили при соотношении сырая масса клеток: буфер для разрушения клеток = 1:5, следовательно величина экспрессии целевого белка в сырых клетках (мкг/г сырых клеток) составляла 5 × концентрация целевого белка в супернатанте (мкг/мл). Концентрацию экспрессированного целевого белка в ферментационном бульоне (мкг/л ферментационного бульона) получали умножением вышеуказанной величины экспрессии целевого белка в сырых клетках на плотность клеток в ферментационном бульоне (г сырых клеток/л ферментационного бульона).
Концентрация целевого белка в супернатанте, полученном из разрушенного ферментационного бульона (мкг/мл) = Коэффициент разведения × Стандартная концентрация целевого белка (мкг/мл) × OD450 (супернатант, полученный из разрушенного ферментационного бульона) / OD450 (стандартная концентрация целевого белка);
Концентрация экспрессированного целевого белка в ферментационном бульоне (мкг/л ферментационного бульона) = 5 × концентрация целевого белка в супернатанте, полученном из разрушенного ферментационного бульона (мкг/мл) × Плотность клеток в ферментационном бульоне (г сырых клеток/л ферментационного бульона).
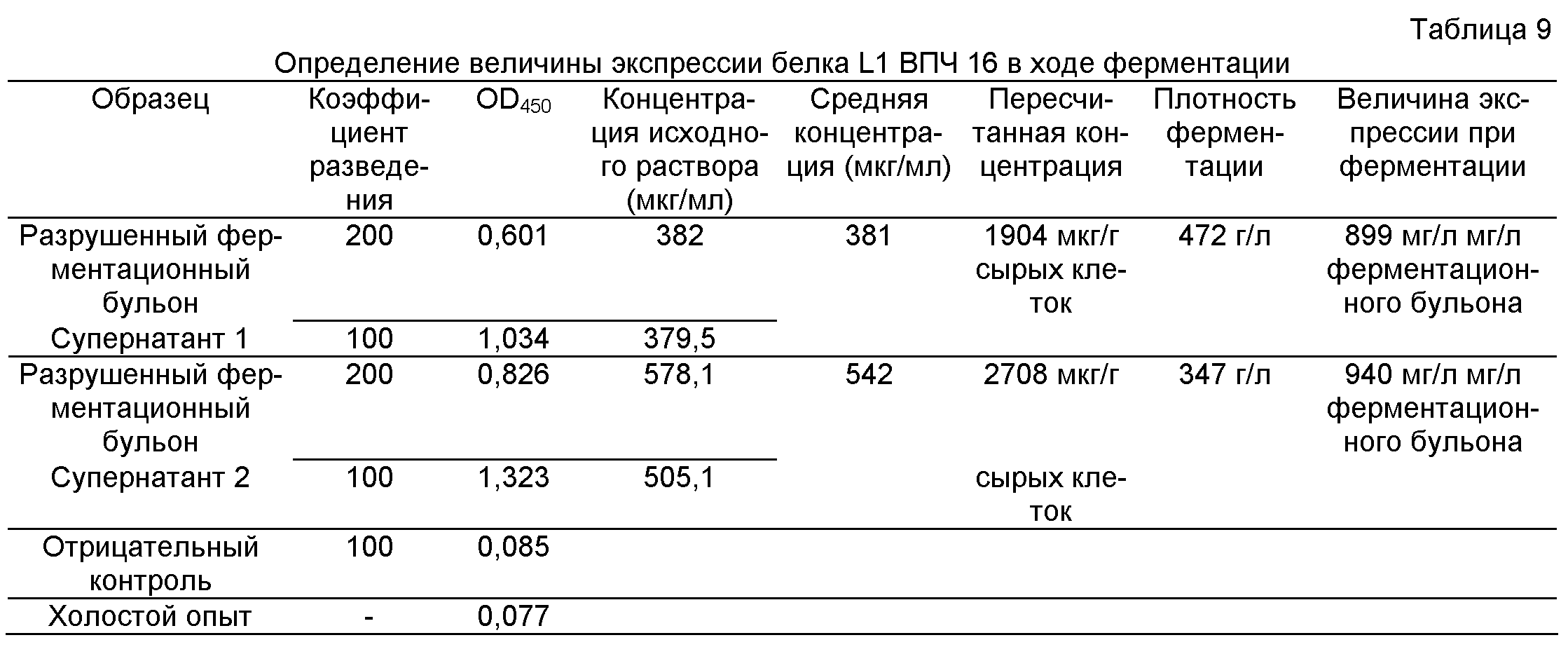
Результаты, приведенные в табл.9, показывают, что оптимизированная последовательность гена белка L1 ВПЧ 16 в соответствии с настоящим изобретением не только может экспрессироваться с получением белка L1 ВПЧ 16 в дрожжах Pichia, но также характеризуется высокой величиной экспрессии, соответствующей требованиям технологического производства.
Пример 19. Очистка белка L1 ВПЧ 16
Отмывка: Полученные клетки дрожжей Pichias, способные экспрессировать белок L1 ВПЧ 16, которые хранили при -20°С, размораживали при комнатной температуре. Далее размороженные клетки смешивали с промывочным буфером (100 мМ РВ, рН 7,0, 0,15 М NaCl) или водой в отношении 1:3 (г/мл) для очистки и проводили полную гомогенизацию в буфере или в воде с помощью гомогенизатора (FLUKO). Далее, гомогенизат центрифугировали на высокоскоростной центрифуге (SORVALLRC6PLUS) на 8000 об/мин в течение 5 минут для отделения клеток, после чего Супернатант декантировали. Указанную операцию повторяли дважды, таким образом достигая отмывки клеток.
Разрушение: Отмытые клетки смешивали с буфером для разрушения клеток (200 мМ MOPS, рН 7.0, 0,4 М NaCl, 0,05% Твин-80) в соотношении 1:5 (г/мл), и проводили полную гомогенизацию с буфером в гомогенизаторе (FLUKO). Клетки, суспендированные в гомогенизате, разрушали в гомогенизаторе высокого давления (ATSAH110B) с рабочим давлением в интервале от 1200 до 1300 бар. Операцию разрушения повторяли четырежды, затем раствор, содержащий разрушенные клетки, выгружали при 4-8°С, при этом доля разрушенных клеток составляла 90%.
Осветление: Раствор, содержащий разрушенные клетки, полученный гомогенизацией при высоком давлении, как описано выше, заливали в центрифужный стакан и центрифугировали на высокой скорости для осаждения клеточного дебриса, получая супернатант для дальнейшего разделения методом колоночной хроматографии. Использовали центрифугу SORVALLRC6PLUS, ротор модели: FIBERLITEF10-6x500y, параметры центрифугирования; 9000 об/мин, 30 мин, 10°С.
Предварительная очистка: Хроматографическую фазу POROS 50 HS (Applied Biosystems) загружали в колонку (диаметр 26 мм, высота 10 см, объем 50 мл). Предварительная очистка включала следующие стадии: (1) промывка и дезинфекция: колонку промывали двумя ее объемами 0,5 М NaOH; (2) регенерация и установление равновесия: колонку промывали двумя ее объемами буфера F и устанавливали равновесие с буфером Е; (3) ввод образца: супернатант, полученный центрифугированием раствора, содержащего разрушенные клетки, вводили в колонку; (4) промывка: колонку промывали пятью ее объемами буфера Е до стабилизации нулевой линии; (5) элюированиие: элюировали линейным градиентом от 100% буфера Е до 100% буфера F; и (6) сбор продукта: элюированные фракции собирали, при этом фракции, содержащие белок L1 ВПЧ 16 (по данным электрофореза на ДДС-Na-ПААГ и вестерн-блоттинга) собирали и направляли на дальнейшую очистку.
Глубокая очистка: Хроматографическую фазу CRT (BIO-RAD, Тип II, 40 мкм) загружали в хроматографическую колонку (диаметр 26 мм, высота 10 см, объем 50 мл). Глубокая очистка включала следующие стадии: (1) промывка и дезинфекция: колонку промывали двумя ее объемами 0,5 М NaOH; (2) регенерация и установление равновесия: колонку промывали двумя ее объемами буфера Н и устанавливали равновесие с буфером G; (3) ввод образца: образец, собранный после предварительной очистки разводили фосфатным буфером до концентрации 20 мМ и затем помещали на колонку; (4) промывка: колонку промывали пятью ее объемами буфера G до стабилизации нулевой линии; (5) элюированиие: элюировали линейным градиентом от 100% буфера G до 100% буфера Н; и (6) сбор продукта: собирали элюированные фракции, и фракции, содержащие белок L1 ВПЧ 16, объединяли, получая конечный очищенный образец. Очищенный образец восстанавливали до мономерных белков, которые зачем анализировали методами электрофореза на ДДС-Na-ПААГ (Bio-RAD) в восстановительных условиях (см. фиг.16) и капиллярного электрофореза (см. фиг.17), согласно которым образец имел чистоту выше 90%. Параметры капиллярного электрофореза L1 ВПЧ 16 приведены ниже.
Анализ методом вестерн-блоттинга (Bio-RAD) показал наличие специфической реакции окрашивания целевой электрофоретической полосой и моноклональным или полуклональным антителом против белка L1 ВПЧ 16. Детектирование методом динамического светорассеяния (Malvern Instruments Zetasizer Nano ZS) показало размер частиц в очищенном образце в интервале прибл. от 50 до 80 нм, а исследование под электронным микроскопом (просвечивающий электронный микроскоп Philips Tecnai-12Biotwin, Electron Microscope Laboratory, Science and Technology Center, Shanghai University of Traditional Chinese Medicine, Китай) показало наличие в очищенном образце вирусоподобных частиц (ВЧ) размером от 50 до 80 нм (см. фиг.18).
Пример 20. Получение вакцины на основе L1 ВПЧ 16
Очищенный белок L1 ВПЧ 16, полученный в примере 19 выше, адсорбировали на адъюванте - соединении алюминия - с получением иммуногенной вакцины L1 ВПЧ 16, согласно способу, описанному в Chinese Pharmacopoeia (издание 2005 г.).
Пример 21. Определение иммуногенности продукта экспрессии гена L1 ВПЧ 16
Двадцать четыре мыши линии BALB/c, свободные от патогенной микрофлоры (SPF), возрастом 6-8 недель разбивали на 4 группы, по 6 мышей в каждой группе. Мыши первой группы (группа отрицательного контроля) получали три подкожные инъекции по 0,1 мл буфера (0,32 М хлорид натрия, 0,35 мМ борат натрия, 0,01% Твин-80, 0,01 М гистидин, рН 6.5) содержащего адъювант - соединение алюминия соответственно на 0, 7 и 21 сутки, а мыши трех других групп (испытуемые группы) получали аналогичные инъекции по 0,1 мл ВЧ, адсорбированных на адъюванте - соединении алюминия, при концентрации соответственно 5 мкг/мл, 0,5 мкг/мл и 0,05 мкг/мл. Образцы крови отбирали через две недели после третьей иммунизации.. Отобранные образцы оставляли на 2 часа при 37°С после чего центрифугировали 10 минут при 4000 g. Супернатант - поликлональную мышиную антисыворотку - аспирироватли и хранили при -20°С. Супернатант дополнительно анализировали для определения уровня сероконверсии и титра, как подробно описано ниже.
21.1. Определение уровня сероконверсии
Очищенные ВЧ L1 ВПЧ 16, экспрессированные дрожжами Pichia, разводили покрывающим раствором до концентрации 1 мкг/мл. Аликвоты разведения (0,1 мл) помещали в лунки планшета для твердофазного ИФА, после чего планшет инкубировали при 4°С, оставляя на ночь. Покрывающий раствор удаляли из лунок, которые затем промывали 0,3 мл буфера PBST. Далее связывание блокировали инкубированием с 0,3 мл блокирующего раствора (5% сухого обезжиренного молока + PBST) 2 часа при 37°С. В лунки добавляли по 0,1 мл раствора исследуемой сыворотки (сыворотка, полученная после иммунизации мышей белком L1 ВПЧ 16, адсорбированным на адъюванте - соединении алюминия, и сыворотка, полученная после иммунизации мышей только адъювантом - соединением алюминия), полученного разведением сыворотки буфером для разведения (2% сухого обезжиренного молока + PBST) в соотношении 1:400, и инкубировали 1 час при 37°С. Далее испытуемый раствор сыворотки удаляли и промывали лунки промывочным буфером, по 0,3 мл. Далее в каждую лунку добавляли 0,1 мл раствора меченого пероксидазой хрена IgG козы к мышиным антигенам, полученного разведением IgG буфером для разведения в соотношении 1:5000, и инкубировали 0,5 часа при 37°С. Далее раствор для твердофазного ИФА удаляли, и промывали лунки промывочным буфером по 0,3 мл на лунку. В каждую лунку добавляли 0,1 мл буфера DAB для проявления окраски и оставляли в темноте при комнатной температуре на 20 минут. Затем для прекращения реакции в каждую лунку добавляли 0,05 мл 2 М H2SO4 (стоп-раствор) и определяли величину оптической плотности OD450 с помощью ИФА-ридера, показания которого приведены ниже в табл.10.
Пороговая величина представляет собой сумму средней величины OD450 Для антител против исследуемой сыворотки, полученной для группы отрицательного контроля (мышиная сыворотка, полученная при иммунизации только адъювантом) и трехкратного стандартного отклонения. Результаты OD450 больше пороговой величины считали положительными, а значения OD450 меньше пороговой величины - отрицательными. Данные по сероконверсии для трех испытуемых групп приведены ниже в табл.11.
21.2. Определение титров сыворотки
Очищенный белок L1 ВПЧ 16 разводили покрывающим раствором до концентрации 1 мкг/мл. Аликвоты разведения (0,1 мл) помещали в лунки планшета для твердофазного ИФА, после чего планшет инкубировали при 4°С, оставляя на ночь. Покрывающий раствор удаляли из лунок, которые затем промывали 0,3 мл буфера PBST. Далее связывание блокировали инкубированием с 0,3 мл блокирующего раствора (5% сухого обезжиренного молока + PBST) 2 часа при 37°С. Испытуемую сыворотку (сыворотки, полученные от мышей, иммунизированных белком L1 ВПЧ 16) последовательно разводили в два раза буфером для разведения (2% сухого обезжиренного молока + PBST), получая разбавления от 1:500 до 1:32000, а сыворотку отрицательного контроля (сыворотка, полученная от мышей, иммунизированных адъювантом) разводили в соотношении 1:10000, В каждую лунку добавляли аликвоты по 0,1 мл разведенной сыворотки (испытуемая сыворотка или сыворотка отрицательного контроля) и инкубировали 1 час при 37°С. Далее раствор испытуемой сыворотки удаляли и промывали лунки промывочным буфером, по 0,3 мл. Далее в каждую лунку добавляли 0,1 мл раствора, меченого пероксидазой хрена IgG козы к мышиным антигенам, полученного разведением IgG буфером для разведения в соотношении 1:5000 и инкубировали 0,5 часа при 37°С. Далее раствор для твердофазного ИФА удаляли, и промывали лунки промывочным буфером по 0,3 мл на лунку. В каждую лунку добавляли 0,1 мл буфера DAB для проявления окраски и оставляли при комнатной температуре на 20 минут. Затем для прекращения реакции в каждую лунку добавляли 0,05 мл 2 М H2SO4 (стоп- раствор) и определяли величину оптической плотности OD450 с помощью ИФА-ридера.
Титры сывороток рассчитывали методом титрования до конечной точки, результаты приведены ниже в табл.12.
Таким образом, в примерах 15-21 показано, что ген, кодирующий главный капсидный белок L1 вируса папилломы человека подтипа 16, в соответствии с настоящим изобретением, представляет собой оптимизированный ген L1 ВПЧ 16, преимуществами которого являются более эффективная экспрессия целевого белка в дрожжевой клетке-хозяине и соответствие требованиям технологического производства. Далее, вакцина L1 ВПЧ 16 в соответствии с настоящим изобретением, полученная на основе очищенных ВЧ (вирусоподобных частиц, образовавшихся при самосборке белка L1 ВПЧ 16), адсорбированных на адъюванте, обладает сильным иммуногенным действием по отношению к мышам, на что указывает уровень сероконверсии и титры сывороток. Далее, преимуществами данного способа являются низкая стоимость, высокий выход и более однородное и стабильное качество продуктов, что достигается благодаря использованию системы экспрессии на основе дрожжей Pichia.
Пример 22. Нейтрализующая активность ВЧ L1 ВПЧ 16
Иммунизацию мышей проводили по описанной выше схеме и образцы крови брали через две недели после иммунизации. Собранную кровь выдерживали 2 часа при 37°С и центрифугировали на 4000 g в течение 10 минут. Супернатант - поликлональную мышиную антисыворотку - аспирировали и хранили при -20°С.
Клетки 293 FT (Invitrogen) первоначально высевали на чашку для культивирования размером 15 см (1,1×107 клетки/чашку). Через 24 часа клетки котрансфецировали плазмидами p16L1h, p16L2h (Buck CB, Pastrana DV, Lowy DR et al. Efficient I Intracellular Assembly of Papillomaviral Vectors. J Virol, 2004, 78(2):751-757) и pIRES2-EGFP, несущей ген зеленого флуоресцентного белка (продукт BD Biosciences Clontech) в количестве соответственно 20 мкг, 10 мкг и 10 мкг методом кальцийфосфатной трансфекции. Через 48 часов клетки осматривали, собирали и лизировали. Супернатант клеточного лизата сразу же подвергали очистке или хранили при -80°С.
Очистку проводили центрифугированием супернатанта лизата клеток в центрифужной пробирке на 5 мл (Beckman) методом центрифугирования по градиенту плотности с 30% OptiPrep на 100000 g при 16°С в течение 4 часов (ротор центрифуги MLS-50, высокоскоростная центрифуга Beckman). Фракции, полученные при центрифугировании, собирали, объем каждой фракции составлял около 500 мкл, и анализировали на содержание белка L1 ВПЧ 16 методом вестерн-блоттинга. Фракции, содержащие наиболее высокие концентрации белка L1, объединяли как раствор псевдотипа вируса, от которого брали аликвотные порции. Раствор хранили при -80°С.
Клетки 293FT помещали на 24-луночный культуральный планшет (1,5×105 клеток/лунка). Через 24 часа проводили опыт по нейтрализации по следующей методике. Образцы сывороток последовательно разводили в 100 раз средой DMEM. Аликвоты по 50 мкл каждого разведения смешивали с 50 мкл раствора псевдотипа вируса в среде DMEM, и каждую смесь инкубировали 1 час при 4°С. Далее каждую инкубированную смесь наносили на 24-луночный культуральный планшет, на который были предварительно нанесены клетки 293FT и инкубировали 48 часов при 37°С. После инкубирования клетки исследовали на экспрессию зеленого флуоресцентного белка под инвертированным флуоресцентным микроскопом OLUMPUSCKX41F32FL, и записывали флуоресцентные изображения, которые показаны на фиг.19. На фиг.19А можно было наблюдать флуоресценцию, что означает факт инфицирования клеток 293FT псевдотипом вируса ВПЧ 16. На фиг.19В остается малая доля флуоресценции, что означает факт нейтрализации псевдотипа вируса ВПЧ 16 мышиной сывороткой, снижающий вирусную инфекцию в клетках 293FT. Таким образом ясно, что в организме мышей, получивших иммунизацию рекомбинантной вакциной на основе ВЧ L1 ВПЧ 16, могут генерироваться нейтрализующие антитела, ингибирующие проникновение псевдотипа вируса в клетки.
Согласно настоящему изобретению, нуклеотидная последовательность SEQ ID NO:8 или SEQ ID NO:9 может заменить SEQ ID NO:7 в приведенных выше примерах получения белка L1 ВПЧ 16 согласно настоящему изобретению способами, описанными в приведенных выше примерах. Помимо этого, вышеуказанные гены можно также клонировать соответствующим методом клонирования в другие существующие векторы экспрессии дрожжей Pichia, такие как pPIC6, pGAPZ или рА0815. Далее полученные рекомбинантные векторы экспрессии могут служить для трансформации других штаммов дрожжей, таких как штаммы Pichia pastoris GS115, KM71 или SMD1168, приводящей к генно-инженерным штаммам. Обычными методами культивирования и ферментации, а также разделения и очистки (которые не изложены здесь в деталях) из указанных генно-инженерных штаммов можно получить белок L1 ВПЧ 16 (ВЧ L1 ВПЧ) в соответствии с настоящим изобретением. Полученный таким образом белок L1 ВПЧ 16 будет иметь аналогичные иммуногенные свойства, что и белок L1 ВПЧ 16, полученный в приведенных примерах.
Все ссылки, упомянутые в данном описании, включены сюда посредством ссылки, так же, как если бы каждая из них отдельно была включена сюда посредством ссылки. Кроме того, следует понимать, что специалист в данной области может, в свете изложенной выше доктрины, вносить различные изменения и модификации в настоящее изобретение, не отходя от духа настоящего изобретения, и полученные при этом эквиваленты также считаются входящими в сферу настоящего изобретения, как она изложена в прилагаемой формуле изобретения.
Реферат
Изобретение относится к области биотехнологии и вирусологии. В настоящем изобретении раскрывается кодон-оптимизированный ген, кодирующий главный капсидный белок L1 вируса папилломы человека, который способен, после трансдукции в клетку дрожжей, к эффективной экспрессии главного капсидного белка L1 вируса папилломы человека. Описана также иммуногенная макромолекула, которая преимущественно образуется при экспрессии указанного кодон-оптимизированного гена, кодирующего главный капсидный белок L1 вируса папилломы человека в клетке дрожжей. Также раскрывается применение указанной иммуногенной макромолекулы и композиции, включающей указанную иммуногенную макромолекулу. Предложенная группа изобретений может быть использована в медицине для вакцинации против вируса папилломы человека. 8 н. и 7 з.п. ф-лы, 21 ил., 11 табл., 22 пр.
Формула
(1) культивирование клетки-хозяина по п.8, позволяющее экспрессию указанного главного капсидного белка L1 вируса папилломы человека и его самосборку в указанную иммуногенную макромолекулу в клетке-хозяине;
(2) отделение указанной иммуногенной макромолекулы.
(1) культивирование клетки-хозяина по п.8, позволяющее экспрессию указанного главного капсидного белка L1 вируса папилломы человека и его самосборку в указанную иммуногенную макромолекулу в клетке-хозяине;
(2) отделение указанной иммуногенной макромолекулы.
(a) разрушение клеток-хозяев, полученных на стадии (1), с получением супернатанта, содержащего указанную иммуногенную макромолекулу; и
(b) последовательную очистку супернатанта, полученного на стадии (а), методом колоночной хроматографии на колонке с POROS 50 HS и методом колоночной хроматографии на CHT с образованием указанных иммуногенных макромолекул.
продукт, очищенный колоночной хроматографией на колонке с POROS 50 HS, вводят в колонку с CHT, предварительно очищенную и приведенную в равновесие, после промывки и приведения к равновесию, колонку элюируют линейным градиентом от буфера С до 100% буфера D, собирая хроматографические пики в интервале 50-70 мСм/см, при этом указанный буфер С содержит 50±20 мМ MOPS, 0,5±0,2 М NaCl, 0,04±0,02 М PB и 0,05±0,02% Твин-80, pH 6.5±1, а указанный буфер D содержит 0,5±0,2 М NaCl, 200 мМ РВ, и 0,05±0,02% Твин-80, pH 6.5±1.
(i) эффективное количество иммуногенной макромолекулы по п.9; и
(ii) фармацевтически приемлемый носитель.
Документы, цитированные в отчёте о поиске
Папилломавирусные вакцины

Комментарии