Стабильный вектор конститутивно высокой экспрессии для получения вакцины против впч и трансформированные этим вектором рекомбинантные молочнокислые бактерии - RU2492240C2
Код документа: RU2492240C2
Чертежи

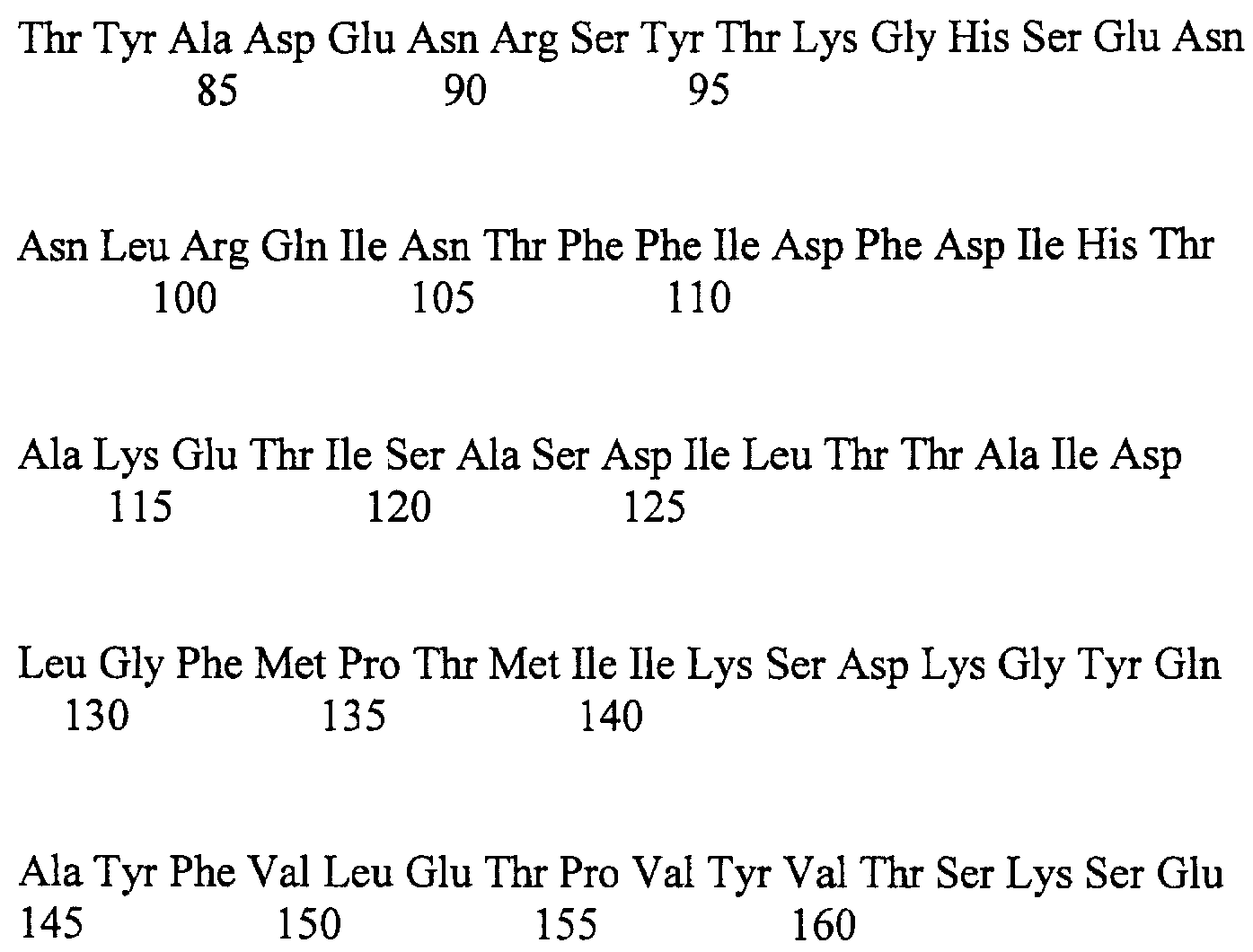


Описание
Область техники
Настоящее изобретение касается вектора поверхностной экспрессии для получения терапевтических вакцин против вируса папилломы человека (ВПЧ), в которых вектор поверхностной экспрессии содержит ген, кодирующий мутантный белок repE, имеющий аминокислотную последовательность SEQ ID NO:1, промотор, комплексный ген поли-гамма-глутаматсинтетазы и ген, который соединен с комплексным геном поли-гамма-глутаматсинтетазы и кодирует антигенный белок вируса папилломы человека, связанный с индукцией опухоли.
Уровень техники
Известно, что производство полезных чужеродных белков с целью экспрессировать большие количества чужеродных белков зависит от числа копий генов, то есть числа плазмид, и силы промоторов, которые используются для контроля транскрипции. Сообщалось, что экспрессия целевых белков может быть увеличена путем изменения числа плазмидных векторов в отдельных бактериях, в дополнение к промоторам высокой экспрессии, которые обычно часто используются (Tomio, M. et al., Appl. Microbiol. Biotechnol., 28: 170, 1988). Также сообщалось, что repE мутации в мини-F плазмиде могут изменять число 25 плазмид в отдельных бактериях (Yasuo, К. et al., J. Biol. Chem., 267:11520, 1992).
По оценкам вирусом папилломы человека (ВПЧ) заражено более 50% взрослого населения во всем мире. В частности сообщалось, что четыре типа ВПЧ, включая ВПЧ 16, 18, 31 и 45, вызывают более чем 80% случаев рака шейки матки (Lowy, D. R. et al., Proc. Nat. Acad. Sci., 91:2436, 1994).
Рак шейки матки у женщин является вторым по распространенности видом рака после рака молочной железы, и по данным ВОЗ (Всемирная организация здравоохранения), каждый год во всем мире выявляются более 500000 новых случаев рака шейки матки, и каждый год во всем мире более чем 300000 пациентов умирает от рака шейки матки. Особенно в развивающихся странах рак шейки матки является одной из ведущих причин смертности среди женщин (Pisani, P. et al., Int. J. Cancer, 55: 891, 1993). В докладе МАИР показано, что число пациентов с хронической инфекцией ВПЧ в развивающихся странах значительно больше, чем в развитых странах и, что наиболее эффективным способом искоренить ВПЧ-инфекцию является применение профилактических вакцин против ВПЧ.
Разработка вакцин, связанных с раком шейки матки, была сосредоточена на двух видах профилактических вакцин и терапевтических вакцин. Целью профилактических вакцин является производство более сильного нейтрализующего антитела на антиген L1/L2 ВПЧ, что, таким образом, предохраняет хозяина от ВПЧ-инфекции и предотвращает дальнейшее развитие заболевания, даже если хозяин уже инфицирован. С другой стороны, терапевтическая вакцина направлена против ВПЧ Е6/Е7 с целью индуцировать специфические клеточные иммунные ответы для разрушения сформировавшихся повреждений или злокачественных опухолей.
Поскольку белок ВПЧ Е6/Е7 является специфическим антигеном рака, связанным с канцерогенезом ВПЧ-инфицированных клеток, были продолжены исследования по использованию белка Е6/Е7 в качестве мишени для иммунотерапии рака шейки матки. Действительно, имеется сообщение, что когда белок ВПЧ Е6/Е7, синтезированный в микробной системе, вводили мышам, которых заражали опухолевыми клетками, образование опухоли подавлялось или задерживалось (Gao, L. et al., J. Gen. Viol., 75:157, 1994, Meneguzzi, G. et al., Virology, 181:62, 1991). Однако в случае использования живых вирусных вакцин могут возникнуть проблемы, связанные с чрезмерной репликацией вируса, как это происходит в других случаях. Таким образом, живые вирусные вакцины используются во многих случаях только для исследовательских целей и имеют недостатки, заключающиеся в том, что для их появления на рынке требуется длительное время, и они нуждаются в значительных клинических испытаниях.
Между тем, также активно ведутся исследования по разработке вакцин, включающих бактериальные векторы, и имеется сообщение, что ВПЧ 16 VLP, синтезируемый в ослабленной Salmonella typhimurium, индуцирует продукцию специфических к антигену антител в слизистой оболочке или во всем теле мышей (Denis, N. et al., Infection and immunity, 65:3328, 1997). В случае вакцин, состоящих из синтетических пептидов, для вакцинации синтезируются только эпитопы, необходимые для индукции иммунного ответа, и эпитопы, вызывающие ответ цитотоксических Т-лимфоцитов (CTL) на ВПЧ 16 Е6/Е7, которые уже известны (Ressing, М.Е. et al., J. Immunol., 154:5934, 1995).
В дополнение к таким попыткам ведутся исследования по использованию трансгенных овощей (полученных из овощей, включая томаты и картофель) в качестве пероральных вакцин или съедобных вакцин для продукции вирусных антигенов в растениях. Типичные примеры таких вакцин включают поверхностные антигенные частицы гепатита В (Thavala, Y.F. and Artzen, С.J., Pro. Natl. Acad. Sci. USA., 92:3358, 1995) и капсидные белки и L1 и L2 вируса папилломы (патент Кореи №регистрации 0366608). Тем не менее, растительные системы имеют проблему, заключающуюся в том, что коммерческое использование их. ограничено из-за малого количества экспрессируемого белка ВПЧ L1 и проблем, связанных с очисткой.
Таким образом, в связи с тем, что население, инфицированное ВПЧ, в основном сосредоточено в развивающихся странах, в срочном порядке необходима разработка способа приготовления антигенов ВПЧ на более экономичной и стабильной основе в целях предупреждения и лечения опухолей слизистой оболочки кожи полости рта или половых органов, вызываемых вирусом папилломы.
Авторы настоящего изобретения ранее разработали вектор для эффективной экспрессии антигенного белка ВПЧ на поверхности трансформированных рекомбинантных микроорганизмов и способ для экспрессии антигенного белка ВПЧ на поверхности микроорганизмов (патент Кореи № регистрации 0609866).
Соответственно, авторы настоящего изобретения предприняли интенсивные усилия по разработке вектора, способного стабильно и конститутивно экспрессировать высокий уровень антигенного белка ВПЧ на поверхности трансформированных рекомбинантных молочнокислых бактерий, и в результате обнаружили, что антигенный белок ВПЧ более стабильно экспрессируется на высоком уровне в рекомбинантных микроорганизмах, трансформированных вектором, содержащим мутантный ген repE, завершив тем самым настоящее изобретение.
Раскрытие изобретения
Главной задачей настоящего изобретения является предоставление вектора, способного стабильно и конститутивно экспрессировать высокий уровень антигенного белка ВПЧ на поверхности трансформированных рекомбинантных молочнокислых бактерий с применением мутантного гена repE.
Другой задачей настоящего изобретения является предоставление рекомбинантных молочнокислых бактерий, трансформированных указанным вектором экспрессии, и способ получения антигенного белка ВПЧ с применением указанных молочнокислых бактерий.
Еще одной задачей настоящего изобретения является предоставление вакцины для лечения рака шейки матки, которая содержит указанные трансформированные рекомбинантные молочнокислые бактерии.
Для достижения вышеуказанных целей настоящее изобретение предоставляет вектор поверхностной экспрессии, содержащий: мутантный ген repE с аминокислотной последовательностью SEQ ID NO:1; промотор; комплексный ген поли-гамма-глутаматсинтетазы и ген, который соединен с комплексным геном поли-гамма-глутаматсинтетазы и кодирует антигенный белок вируса папилломы человека, связанный с индукцией опухоли.
Настоящее изобретение также предоставляет рекомбинантный микроорганизм, трансформированный указанным вектором.
Настоящее изобретение также предоставляет вакцину для лечения рака шейки матки, которая содержит в качестве активного ингредиента рекомбинантный микроорганизм, содержащий антигенный белок ВПЧ, который экспрессируется на его поверхности.
Настоящее изобретение также предоставляет способ получения микроорганизма, содержащего антиген ВПЧ, который экспрессируется на его поверхности, способ, включающие следующие стадии: культивирование рекомбинантного микроорганизма, трансформированного указанным вектором, для экспрессии антигена ВПЧ на поверхности микроорганизма; и сбор рекомбинантного микроорганизма, содержащего антиген ВПЧ, который экспрессируется на его поверхности.
Настоящее изобретение также предоставляет вакцину для лечения рака шейки матки, которая содержит в качестве активного ингредиента микроорганизм, полученный указанным способом и содержащий антиген ВПЧ, который экспрессируется на его поверхности.
Краткое описание фигур
Фигура 1 показывает карту расщепления вектора pKV-Pald-PgsA-амилазы, в который введен мутантный ген repE.
Фигура 2 показывает карту расщепления двух видов экспрессионных векторов, экспрессирующих ген Е7 на поверхности микроорганизмов.
Фигура 3 показывает результаты Вестерн-блот анализа для экспрессии Е7 на поверхности молочнокислых бактерий, трансформированных pKV-Pald-PgsA-E7.
Фигура 4 показывает график введения молочнокислых бактерий мышам, для того чтобы исследовать способность трансформированных рекомбинантных молочнокислых бактерий, экспрессирующих Е7 на своей поверхности, индуцировать иммунный ответ.
Фигура 5 показывает изменения в IgG и IgA при пероральном введении трансформированных рекомбинантных молочнокислых бактерий, экспрессирующих Е7 на своей поверхности.
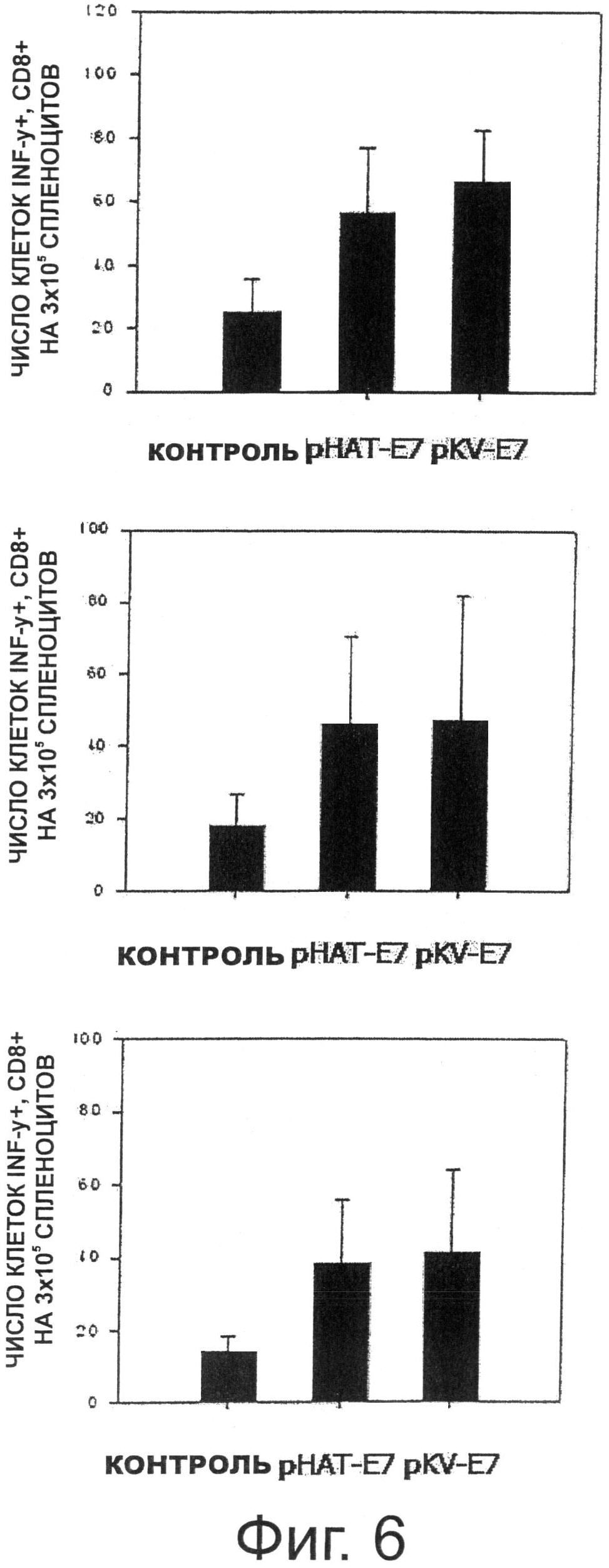
Фигура 6 показывает результаты анализа секреции Е7-специфического IFN-гамма при пероральном введении трансформированных рекомбинантных молочнокислых бактерий, экспрессирующих Е7 на своей поверхности.
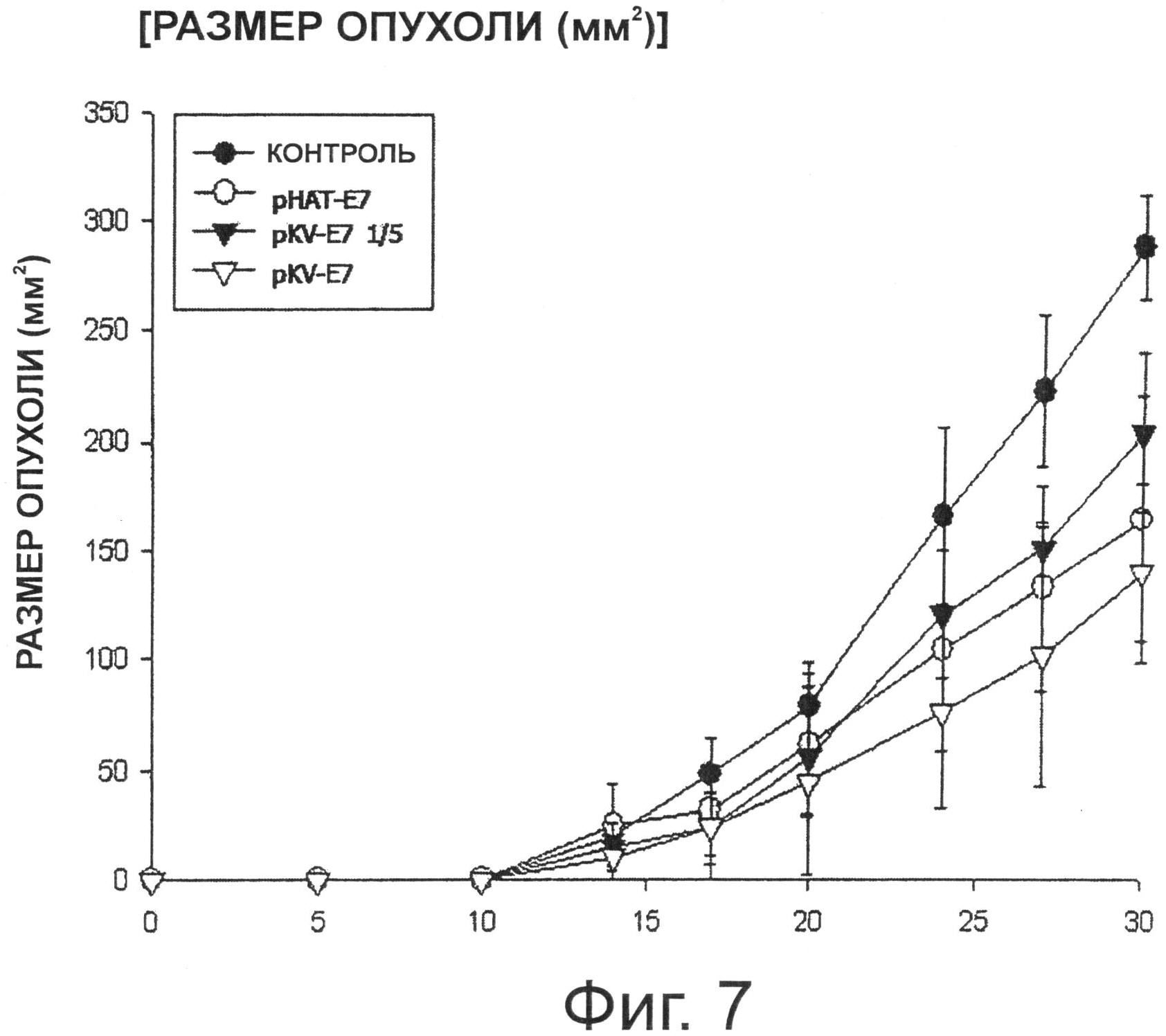
Фигура 7 показывает результаты анализа развития опухоли, проведенного при пероральным введении трансформированных рекомбинантных молочнокислых бактерий, экспрессирующих Е7 на своей поверхности, и определении, увеличивается ли размер опухоли.
Фигура 8 показывает карту расщепления экспрессионного вектора, экспрессирующего ген Е7 (Rb) на поверхности микроорганизмов.
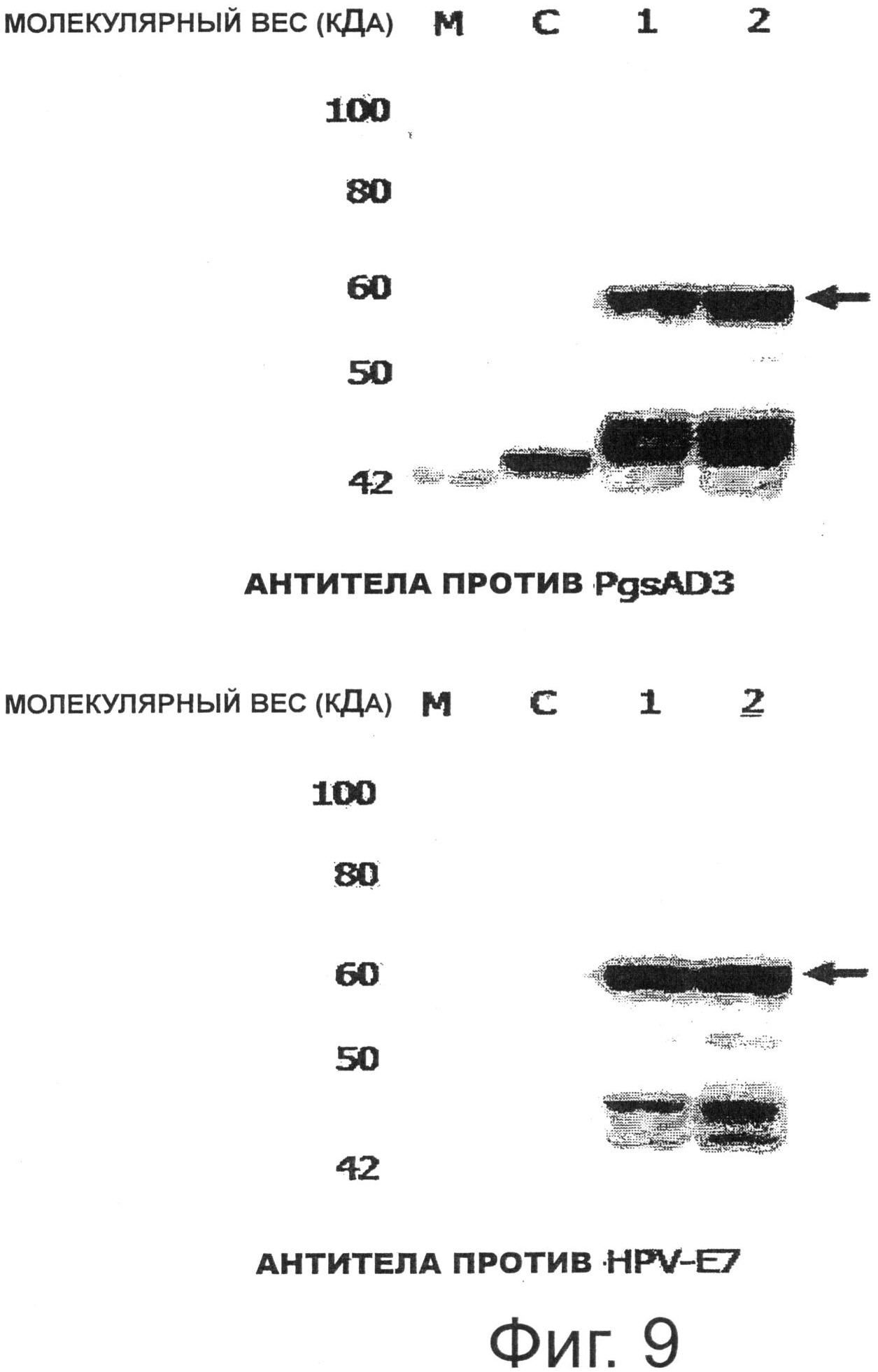
Фигура 9 показывает результаты анализа экспрессии Е7 (Rb) на поверхности рекомбинантных молочнокислых бактерий, трансформированных pKV-Pald-PgsA-E7 (Rb).
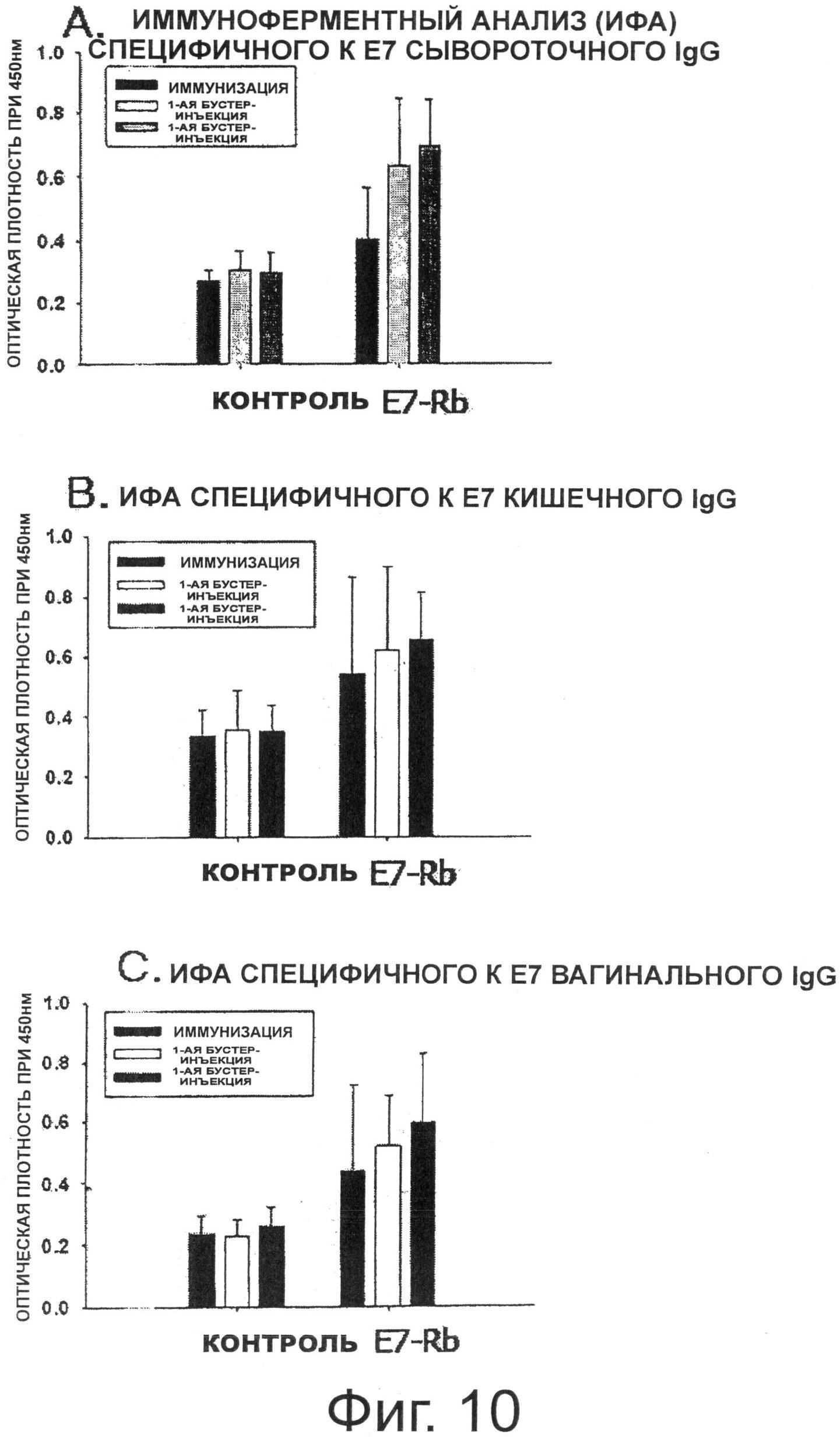
Фигура 10 показывает результаты Е7-специфичного иммуноферментного анализа (ИФАЪ.
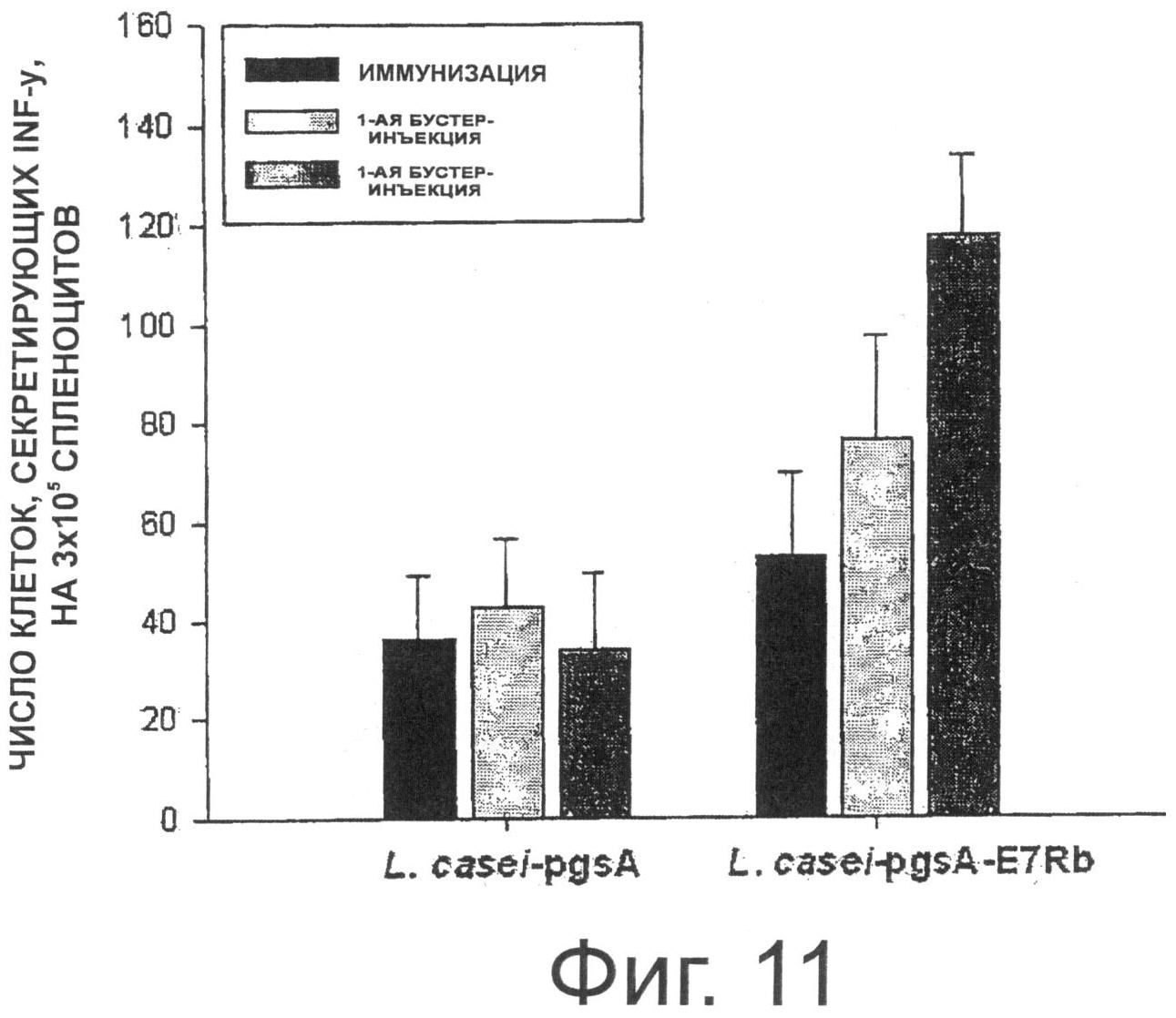
Фигура 11 показывает результаты анализа секреции Е7 (Rb)-специфичного IFN-гамма при пероральном введении трансформированных рекомбинантных молочнокислых бактерий, экспрессирующих Е7 на своей поверхности.
Осуществление изобретения
Первый объект настоящего изобретения касается вектора поверхностной экспрессии, содержащего: мутантный ген repE, кодирующий аминокислотную последовательность SEQ ID NO:1; промотор; комплексный ген поли-гамма-глутаматсинтетазы и ген, который соединен с комплексным геном поли-гамма-глутаматсинтетазы и кодирует антигенный белок вируса папилломы человека, связанный с индукцией опухоли.
В настоящем изобретении мутантный ген repE, кодирующий аминокислотную последовательность SEQ ID NO:1, который можно стабильно поддерживать в трансформированных микроорганизмах, вводили в трансформированные микроорганизмы вместе с промотором альдолазы (Pald), полученным из гена альдолазы Lactobacillus casei. В результате видно, что экспрессия целевого белка в микроорганизмах была увеличена. Для того чтобы подтвердить, что челночный вектор настоящего изобретения стабильно поддерживается в рекомбинантных микроорганизмах и что целевой белок экспрессируется в рекомбинантных микроорганизмах, ген амилазы в качестве целевого гена вводили в рекомбинантные микроорганизмы и анализировали экспрессию амилазы в рекомбинантных микроорганизмах.
Кроме того, для поверхностной экспрессии целевого белка комплексный ген поли-гамма-глутаматсинтетазы, который представляет собой мотив заякоривания на поверхности, расположили так, что он экспрессировался в форме, соединенной с целевым белком. При этом комплексным геном поли-гамма-глутамат синтетазы является предпочтительно pgsBCA и более предпочтительно, pgsA (патент Кореи № регистрации 469800).
В одном воплощении настоящего изобретения ген, кодирующий ВПЧ16 Е7, слили с pgsA таким образом, что белок ВПЧ16 Е7 в качестве целевого белка был слит с С-концом PgsA, получив, таким образом, вектор pKV-Pald-PgsA-E7, способный конститутивно экспрессировать антигенный белок ВПЧ на поверхности молочнокислых бактерий. Также вектор экспрессии вставили в Lactobacillus casei, тем самым приготовив трансформированные рекомбинантные молочнокислые бактерии, экспрессирующие антигенный белок ВПЧ.
В используемом здесь значении термин "целевой белок" или "чужеродный белок" относится к белку, который не может быть обычно найден в трансформированных клетках хозяина, экспрессирующих белок. Например, когда манипуляцию выполняют так, что белок вирусного происхождения или опухолевого происхождения искусственно экспрессируется в молочнокислых бактериях, белок называется чужеродным белком или целевым белком.
В другом аспекте настоящее изобретение также касается рекомбинантных микроорганизмов, трансформированных указанным вектором, рекомбинантного микроорганизма, экспрессирующего антигенный белок ВПЧ на своей поверхности, и вакцины для лечения рака шейки матки, которая содержит в качестве активного ингредиента трансформированный рекомбинантный микроорганизм.
В используемом здесь значении термин "хозяева", или "микроорганизмы" относится к молочнокислым бактериям, которые являются пробиотическими грам-положительными бактериями, и общие критерии, используемые для выбора пробиотических микроорганизмов, включают следующее: (I) микроорганизм, полученный от человека; (II) устойчивость к желчи, кислоте, ферменту и кислороду; (III) способность удерживаться на слизистой оболочке кишечника; (IV) колонизационный потенциал в желудочно-кишечном тракте человека; (V) продукция антимикробных веществ; и (VT) очевидная эффективность и безопасность. На основе таких критериев очевидно, что молочнокислые бактерии являются дружественными и безвредными для человеческого организма. Таким образом, когда трансформанты, которые используют молочнокислые бактерии в качестве хозяев, применяются для человеческого организма с целью доставки гена или белка для профилактики или лечения заболевания, стадия детоксикации бактериальных штаммов не требуется, в отличие от обычного способа получения вакцин, который использует бактериальные штаммы.
В настоящем изобретении молочнокислые бактерии, которые применяются в качестве хозяев, включают Lactobacillus sp.,. Streptococcus sp. и Bifidobacterium sp. Как правило, указанный Lactobacillus sp. включает L. acidophilus, L. casei, L. plantarum, L. ferementum, L. delbrueckii, L. johnsonii LJI, L. reuteri и L. bulgaricus, указанный Streptococcus sp. включает S. thermophilus, и Bifidobacterium sp. включает В. Infantis, В. bijidum, В. longum, В. psuedolongum, В. breve, В. lactis Bb-12 и В. adolescentis. Предпочтительно, в качестве хозяина применяется Lactobacillus sp.
Еще один аспект настоящего изобретения касается способа получения микроорганизма, содержащего антиген ВПЧ, экспрессируемый на его поверхности, причем способ включает следующие стадии: культивирование рекомбинантного микроорганизма, трансформированного указанным вектором для экспрессии антигена ВПЧ на поверхности данного микроорганизма, а также сбор рекомбинантного микроорганизма, содержащего антиген ВПЧ, экспрессируемый на его поверхности.
Культивирование рекомбинантных микроорганизмов в соответствии с настоящим изобретением может быть осуществлено в соответствии с методом, хорошо известным в данной области техники, и условия культивирования, включая температуру и время культивирования и рН среды, могут контролироваться надлежащим образом. Сбор рекомбинантных микробных клеток из культуральной жидкости может быть проведен с применением обычных способов выделения, например, центрифугирования или фильтрации.
Еще один аспект настоящего изобретения касается вакцины для лечения рака шейки матки, которая содержит в качестве активного ингредиента микроорганизм, полученный указанным способом и содержащий антиген ВПЧ, экспрессируемый на его поверхности.
Кроме того, настоящее изобретение касается вакцины для лечения рака шейки матки, которая применяется перорально.
Вакцины являются лекарственными препаратами, которые используют живые организмы в профилактических целях против болезней для стимуляции иммунной системы. Иммунная активация относится к процессу эффективного удаления антигенов за счет выработки антител в организмах, стимуляции Т-лимфоцитов или стимуляции других иммунных клеток (например, макрофагов). Подробный обзор по иммунологии, связанный с такими деталями, легко понятен для специалистов в данной области техники (Barrett J.T., Textbook of Immunology, 1983). Вакцина из трансформированного микроорганизма, экспрессирующего целевой белок в качестве антигена, может быть введена млекопитающим, и, предпочтительно, людям.
Получение вакцины может быть проведено с применением стандартных способов. Доза, пригодная для введения, варьирует в зависимости от антигенности генных продуктов и может составлять количество, при котором вакцина может эффективно индуцировать типичные иммунные ответы. Доза может быть легко определена путем обычных экспериментальных процедур. Типичная начальная доза вакцины составляет 0,001-1 мг антигена/кг массы тела. При необходимости доза может быть увеличена, чтобы обеспечить предпочтительный уровень защиты, или вакцина применяется многократно. Доза может быть определена специалистами в данной области техники и может варьировать в зависимости от способа ее получения, типа введения, возраста пациента, массы тела, пола, тяжести заболевания, диеты, частоты введения, пути введения, скорости выведения и реакции чувствительности.
Наиболее предпочтительным воплощением вектора поверхностной экспрессии настоящего изобретения для получения вакцины против ВПЧ, кодирующего антигенный белок ВПЧ Е7, является вектор поверхностной экспрессии, содержащий: ген, кодирующий мутантный белок repE с аминокислотной последовательностью SEQ ID NO:1; промотор альдолазы, полученный из молочнокислых бактерий; комплексный ген поли-гамма-глутаматсинтетазы, выбранный из группы, состоящей из pgsB, pgsC и pgsA для поверхностной экспрессии; и ген, который кодирует антигенный белок Е7 вируса папилломы человека, связанный с индукцией опухоли и соединен с комплексным геном поли-гамма-глутаматсинтетазы. Рекомбинантные молочнокислые бактерии, трансформированные данным вектором, могут культивироваться для экспрессии на их поверхности антигенного белка ВПЧ Е7 и затем применяться непосредственно в качестве вакцины.
Наиболее предпочтительным воплощением вектора поверхностной экспрессии настоящего изобретения для получения вакцины против ВПЧ, кодирующего антигенный белок ВПЧ Е7 (Rb), является вектор поверхностной экспрессии, содержащий: ген, кодирующий мутантный белок repE с аминокислотной последовательностью SEQ ID NO:1; промотор альдолазы, полученный из молочнокислых бактерий; комплексный ген поли-гамма-глутаматсинтетазы, выбранный из группы, состоящей из pgsB, pgsC и pgsA для поверхностной экспрессии; и ген, который кодирует антигенный белок Е7 (Rb) вируса папилломы человека, связанный с индукцией опухоли, и соединен с комплексным геном поли-гамма-глутаматсинтетазы. Рекомбинантные молочнокислые бактерии, трансформированные данным вектором, могут культивироваться для экспрессии на их поверхности антигенного белка ВПЧ Е7 (Rb) и затем применяться непосредственно в качестве вакцины.
Для того, чтобы вакцина была эффективна в продукции антитела, антигенное вещество должно высвобождаться in vivo, так чтобы механизм продуцирования антител вакцинированных лиц мог начать действовать. Таким образом, микробный носитель генного продукта должен быть предпочтительно введен in vivo для иммунных ответов. В целях стимулирования предпочтительного ответа на антиген, который представлен трансформированными рекомбинантными молочнокислыми бактериями настоящего изобретения, вакцина предпочтительно вводится перорально или непосредственно в шейку матки в виде спрея.
Для перорального введения композиции вакцины объекту, композиция вакцины предпочтительно предоставляется в лиофилизированной форме, например, в форме капсул. Капсула выступает в роли кишечного покрытия, содержащего Eudragate S, Eudragate L, ацетат целлюлозы, фталат целлюлозы или гидроксипролилметилцеллюлозу. Капсулу можно применять как она есть, или можно вводить после того, как ее восстановили в лиофильный материал, такой как суспензия. Восстановление предпочтительно проводят в буфере с уровнем рН, подходящим для выживания трансформированных рекомбинантных микроорганизмов. В целях защиты трансформированного рекомбинантного микроорганизма и вакцины от желудочной кислоты, предпочтительно вводить каждый раз перед введением вакцины препарат бикарбоната натрия. Вакцину можно выборочно приготовить для парентерального введения, интраназального введения или интрамаммарного (внутрь молочной железы) введения.
ПРИМЕРЫ
В дальнейшем настоящее изобретение будет описано более подробно с помощью примеров. Для специалиста в данной области техники будет очевидным, что эти примеры носят только иллюстративный характер и не должны толковаться как ограничения объема настоящего изобретения. Это значит, что следующие шаги будут описаны в качестве иллюстрации и не ограничивают объема настоящего изобретения.
Пример 1: Получение вектора поверхностной экспрессии (pKV-Pald-PgsAL-амилаза), содержащего мутантный ген repE
В данном Примере, в целях стабилизации вектора экспрессии в клетках хозяина, сконструировали вектор поверхностной экспрессии, содержащий мутантный ген repE и демонстрирующих повышенный уровень экспрессии целевого белка.
Во-первых, для дальнейшего повышения экспрессии целевого белка в молочнокислых бактериях получили фрагмент промотора альдолазы, который является промотором, происходящим из Lactobacillus casei. Промотор альдолазы получили методом ПЦР с применением pDT-PgsA-амилазы (раскрыто в корейской патентной публикации №10-2008-0086161) в качестве матрицы и праймеров SEQ ID NO:2 и SEQ ID NO:3.
SEQ ID NO:2: 5'-cgc gca tgc aat ace cac tta ttg cg-3'
SEQ ID NO:3: 5'-cag ttc ttt ttt cat gta gat ate etc c-3' В результате получили фрагмент ДНК размером 421 п.н., содержащий промотор альдолазы, сайт фермента рестрикции SphI на 5'-конце и N-концевой участок pgsA размером 17 п.н. на 3'-конце. Кроме того, фрагмент гена pgsA, который может быть соединен со сконструированным выше фрагментом промотора альдолазы, получили методом ПЦР с применением описанного выше вектора в качестве матрицы и праймеров SEQ ID NO:4 и SEQ ID NO:5.
SEQ ID NO:4: 5'-gga gga tat cta cat gaa aaa aga act g-3'
SEQ ID NO:5: 5'-ggc get ggc ggt cgt ttg g-3'
Полученный фрагмент ДНК представлял собой фрагмент размером 782 п.н., содержащий 13 п.н. 3'-конца промотора альдолазы и содержащий pgsA, который соединяется непосредственно с ним. Участок pgsA этого фрагмента включает сайт фермента рестрикции Pstl.
Два полученных фрагмента лидировали друг с другом и подвергали ПЦР с использованием праймеров на обоих концах, таким образом получив фрагмент ДНК размером 1175 п.н. Фрагмент ДНК расщепляли с помощью SphI и Pstl, таким образом получив фрагмент, содержащий промотор альдолазы и N-концевой участок pgsA.
pBT:pgsA-амилаза (pAT-PslpA-pgsA-амилаза; см. косвенный пример патента Кореи №регистрации 0872042) расщепляли SphI и PstI, для того чтобы удалить участок промотора SlpA7 и N-концевой участок pgsA, таким образом получив основу вектора экспрессии.
Содержащий промотор альдолазы фрагмент ДНК, расщепленный SphI и PstI, лигировали с рВТ:PslpA-амилазой, расщепленной теми же ферментами рестрикции, таким образом конструируя pAT-Pald-PgsA-амилазу. Вектор pAT-Pald-Pgs-амилаза подвергали сайт-направленному мутагенезу для замены кодона TTA, кодирующего 475-ую аминокислоту лейцин гена repE на стоп-кодон TGA, для того чтобы отрезать 21 С-концевую аминокислоту белка repE, таким образом конструируя pKV-Pald-PgsA-амилазу с аминокислотной последовательностью SEQ ID NO:1 (Фиг.1).
Пример 2: Получение вектора поверхностной экспрессии ВПЧ16 Е7 (pKV-Pald-PgsA-ET)
Используя вектор поверхностной экспрессии (pKV-Pald-PgsA-амилаза), приготовленный в Примере 1, ген, кодирующий белок ВПЧ16 Е7, вставляли в С-конец PgsA, таким образом получая вектор pKV-Pald-PgsA-E7, способный экспрессировать целевой белок на поверхности молочнокислых бактерий.
Для этого ген амилазы, слитый с pgsA в векторе pKV-Pald-PgsA-амилаза, полученном в Примере 1, удалили, и ген, кодирующий ВПЧ16 Е7, вставили в вектор. Как показано на Фигуре 1, фрагмент, содержащий ген ВПЧ16 Е7, получили проведением ПЦР с использованием pHAT:PgsA-E7 (Poo и др., Int J. Cancer, 119:.. 1702, 2006) в качестве матрицы и праймеров SEQ ID NO:6 и SEQ ID NO:7.
SEQ ID NO:6: 5'-gcg gga tec cat gga gat аса cct аса ttg c-3'
SEQ ID NO:7: 5'-acg cag aag egg tct gat aa-3'
В результате получили фрагмент размером 386 п.н., содержащий ген ВПЧ16 Е7. Фрагмент содержал сайт фермента рестрикции BamHI на 5'-конце и сайт фермента рестрикции XbaI на 3'-конце. Полученный фрагмент ДНК расщепляли BamHI и XbaI, таким образом получив фрагмент размером 306 п.н.
Вектор pKV-Pald-PgsA-амилаза расщепляли BamHI и XbaI для удаления участка гена амилазы, таким образом получив фрагмент вектора.
Фрагмент ДНК, содержащий ген Е7, расщепленный BamHI и XbaI, лигировали с вектором, расщепленным теми же ферментами рестрикции, таким образом конструируя pKV-Pald-PgsA-E7 (Фиг.2А).
Пример 3: Исследование экспрессии pHAT:PgsA-E7 и pKV-Pald-PgsA-E7 в трансформированных молочнокислых бактериях
В данном примере Lactobacillus casei трансформировали каждым из pHAT: PgsA-Е7 и pKV-Pald-PgsA-E7, сконструированными в Примере 2. Трансформированный рекомбинантный штамм Lactobacillus casei культивировали и исследовали экспрессию белка Е7 в рекомбинантном штамме. Экспрессия белка Е7, слитого с PgsA, была исследована в трансформированном рекомбинантном штамме Lactobacillus casei.
Рекомбинантный штамм Lactobacillus casei, трансформированный каждым из pHAT:PgsAE7 и pKV-Pald-PgsA-E7, стационарно культивировали в среде MRS (Lactobacillus MRS, Becton Dickinson and Company Sparks, США) при 30°С, чтобы вызвать поверхностную экспрессию белка ВПЧ16 Е7, слитого с С-концом гена pgsA поли-гамма-глутаматсинтетазы.
Целые клетки культивированного штамма Lactobacillus casei подвергали SDS-электрофорезу в полиакриламидном геле и Вестерн-блоттингу, используя PgsA-специфическое антитело.
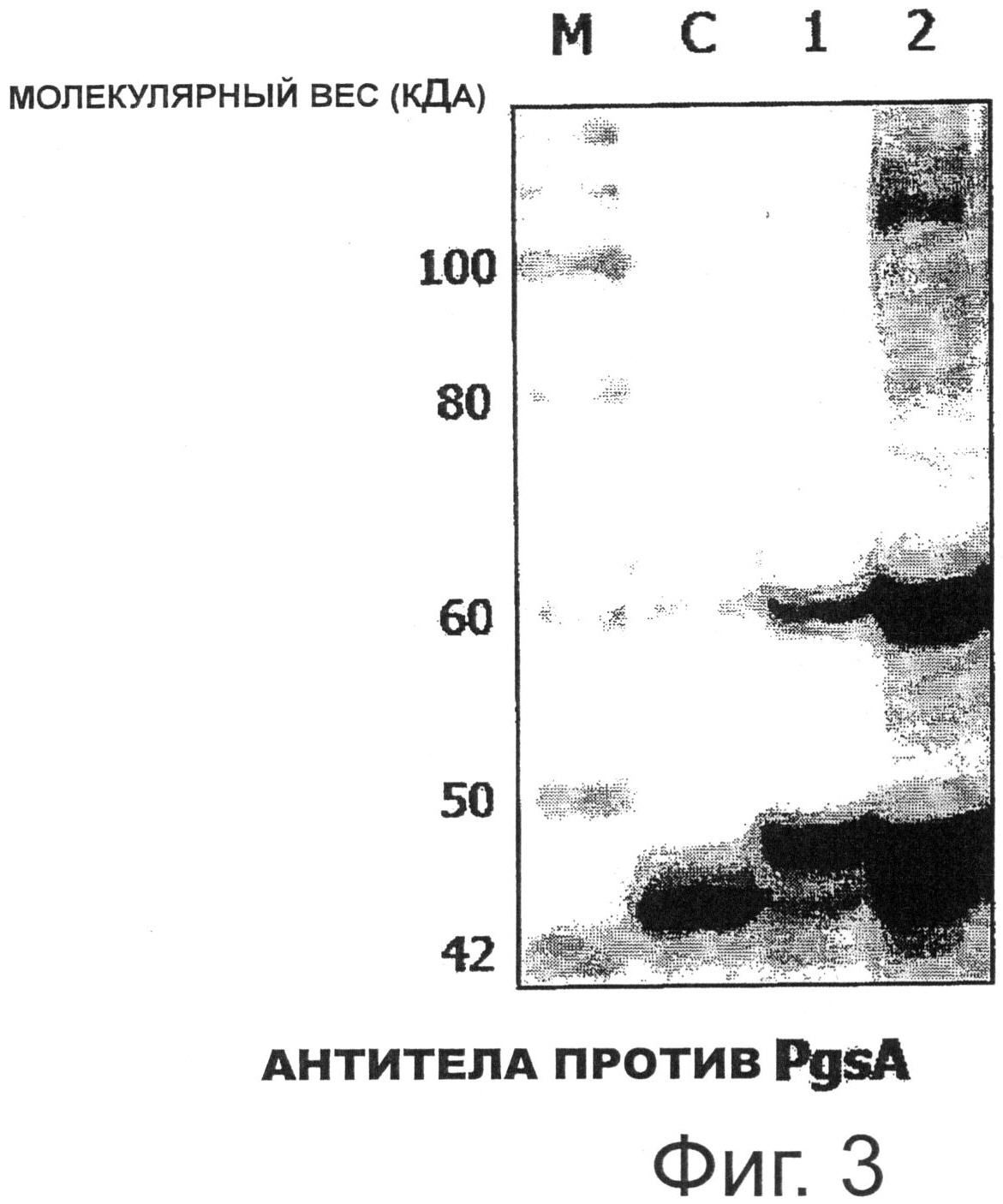
Более конкретно, целые клетки трансформированного рекомбинантного штамма Lactobacillus casei, в которой индуцировали экспрессию гена Е7, денатурировали белком, полученным при той же концентрации клеток, что и при подготовке образца. Образец анализировали SDS-электрофорезом в полиакриламидном геле, и затем белковые фракции переносили на поливинилиденфториддифторидные (PVDF) мембраны (Bio-Rad). PVDF мембраны, на которые были перенесены белковые фракции, блокировали встряхиванием в блокирующем буфере (50 мМ Трис-HCl, 5% обезжиренное молоко, рН 8,0) в течение 1 часа, и затем выдерживали в течение 1 часа с кроличьими поликлональными анти-PgsA первичными антителами, разведенными в 1000 раз в блокирующем буфере. После завершения инкубации мембраны промывали буферным раствором и инкубировали в течение 1 часа с конъюгированными с пероксидазой хрена (HRP) анти-кроличьими вторичными антителами, разведенными в 10000 раз в блокирующем буфере. После завершения инкубации мембраны промывали буферным раствором, и промытые мембраны прокрашивали в течение примерно 1 минуты после добавления субстрата (lumigen PS-3 acridan, H2O2), и специфическое связывание между PgsA-специфическим антителом и гибридным белком наблюдали с помощью CCD-камеры (Фиг.3).
На Фигуре 3 дорожка С представляет трансформированный рекомбинантный штамм Lactobacillus casei, в котором экспрессировали только PgsA (pKV-Pald-PgsA), дорожка 1 представляет экспрессию белка рекомбинантным штаммом Lactobacillus casei, трансформированным pHAT: PgsA-E7, и дорожка 2 представляет экспрессию белка рекомбинантным штаммом Lactobacillus casei, трансформированным pKV-Pald-PgsA-E7. Как показано на Фигуре 3, экспрессию гибридного белка PgsA-E7 размером 54,4 кДа можно было наблюдать на дорожках 1 и 2, используя антитела, специфичные к PgsA, и было отмечено, что экспрессия гибридного белка PgsA-E7 с применением гена pKV-Pald-PgsA-E7 была выше, чем экспрессия гибридного белка PgsA-E7 с применением гена pHAT:PgsA-E7.
В случае структуры, в которой участок PslpA-PgsA-E7 гена pHAT:PgsA-E7, содержащий нормальный repE, заменяли на Pald-PgsA-E7, трансформированные молочнокислые бактерии не могут быть получены по способу получения трансформированных молочнокислых бактерий, описанному выше.
Пример 4: Сравнение способности индуцировать гуморальные иммунные ответы между штаммами Lactobacillus, экспрессируюшими антиген ВПЧ16 Е7 на своей поверхности
Штаммы Lactobacillus casei трансформировали каждым из векторов поверхностной экспрессии, и экспрессию антигена ВРЧ Е7 на поверхности штаммов вызывали таким же способом, как в Примере 2. Затем два вида трансформированных рекомбинантных штаммов Lactobacillus casei сравнивали в отношении способности гибридного белка PgsA-BP416 E7 вызывать гуморальный иммунный ответ. Кроме того, два трансформированных штамма с различным уровнем экспрессии гибридного белка вводили мышам в различных количествах (1, 1/5, и 1/10) и сравнивали в отношении способности индуцировать иммунные ответы.
Штамм Lactobacillus casei трансформировали каждым из векторов, культивировали, собирали и сублимировали, чтобы приготовить порошок. Порошок растворяли в буфере (PBS, рН 7,4), и затем вводили перорально 6-недельным самкам мышей Balb/с.
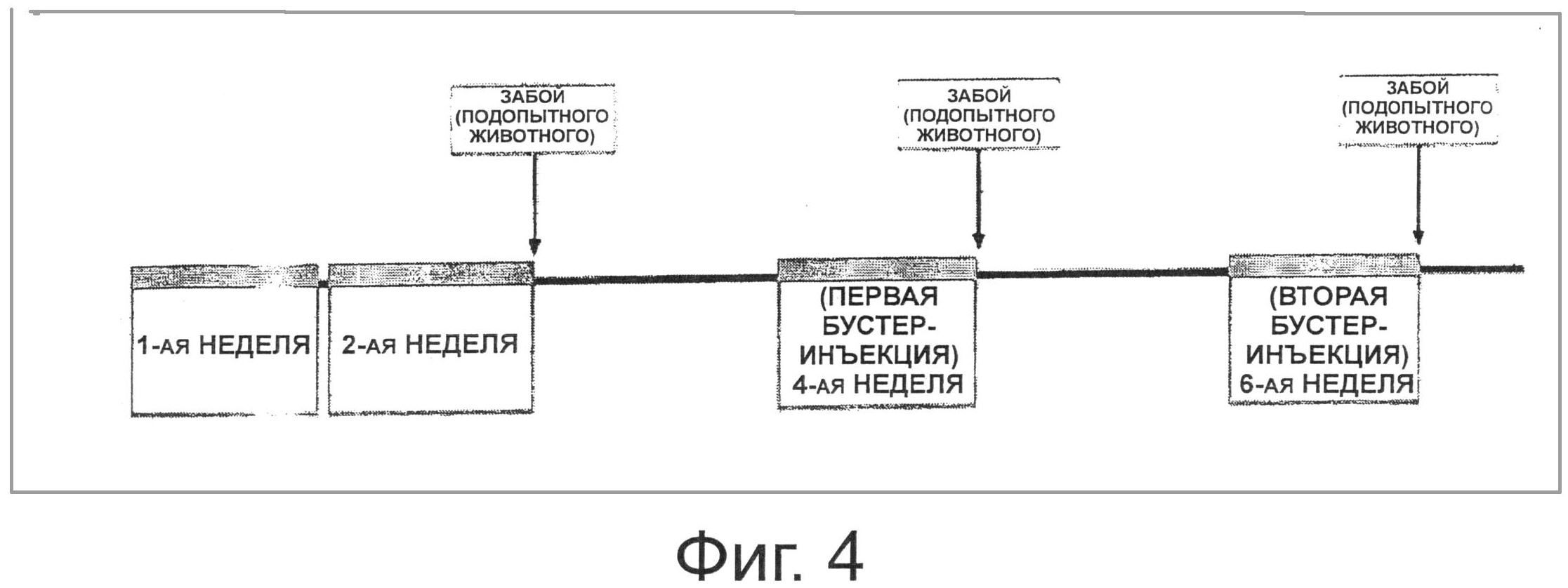
В частности, каждый из лиофилизованных порошков трансформированных рекомбинантных штаммов Lactobacillus casei (pHAT-E7 и pKV-E7), экспрессирующих антиген ВРЧ 16 Е7, и штамма Lactobacillus casei (pAT), не экспрессирующего антиген ВПЧ16 Е7, растворяли в PBS при различных концентрациях (5×109 клеток/200 мкл, 1×109 клеток/200 мкл и 5×108 клеток/200 мкл) и иммунизировали мышей пять раз в неделю в течение 2 недель (дни 0-4 и дни 7-11). Через 1 неделю провели первую бустер-инъекцию путем перорального введения (дни 21-25) и спустя 1 неделю провели вторую бустер-инъекцию путем перорального введения (дни 35-39). Для того чтобы измерить специфичное к ВРЧ16 Е7 антитело IgG в сыворотке крови мыши и специфичное к ВРЧ16 Е7 антитело IgA, секретируемое из слизистой оболочки мыши, кишечный смыв и вагинальный смыв собирали от каждой из мышей на 14-ый день, 28-ой день и 42-ой день (Фиг.4). В частности, кровь получали из глаза мыши, используя микрокапиллярную трубку с гепариновым покрытием, и кишечный смыв и вагинальный смыв собирали в количестве 0,8 мл и 250 мкл, соответственно, используя буфер PBS, содержащий 1 мМ PMSF. Затем каждый из смывов центрифугировали при 13000 об/мин в течение 20 минут и супернатант выделяли и подвергали анализу ИФА.
При анализе ИФА белок ВРЧ16 Е7 растворяли в покрывающем буфере (0,1 М карбоната натрия, 0,02% азида натрия, рН 9,6) в концентрации 500 нг/100 мкл на лунку и затем 100 мкл из разведения добавляли в 96-луночный ИФА-планшет и инкубировали в течение ночи при 4°С. ИФА-планшеты промывали три раза, добавляя к ним PBST (PBS с 0,05% Tween20) в количестве 300 мкл/лунку, и затем ИФА-планшеты блокировали 100 мкл 5% обезжиренного молока при 37°С в течение 1 часа, после чего удаляли блокирующий буфер. Затем планшеты промывали три раза PBST и к планшетам добавляли по 100 мкл смывов разбавленной сыворотки и смывов слизистой оболочки. После добавления образцов планшеты инкубировали при 37°С в течение 2 часов и затем промывали три раза промывочным буфером. Затем конъюгированные с пероксидазой хрена анти-мышиные IgG или IgA антитела разбавляли 1:5000, добавляли в каждую лунку и инкубировали при 37°С в течение 1 часа. Затем каждую лунку промывали промывочным буфером, окрашивали раствором ТМБ и развитие окраски останавливали 2,5 М серной кислоты. Количество антигена, специфичного к ВРЧ16 Е7, анализировали измерением на ИФА-ридере при 450 нм.
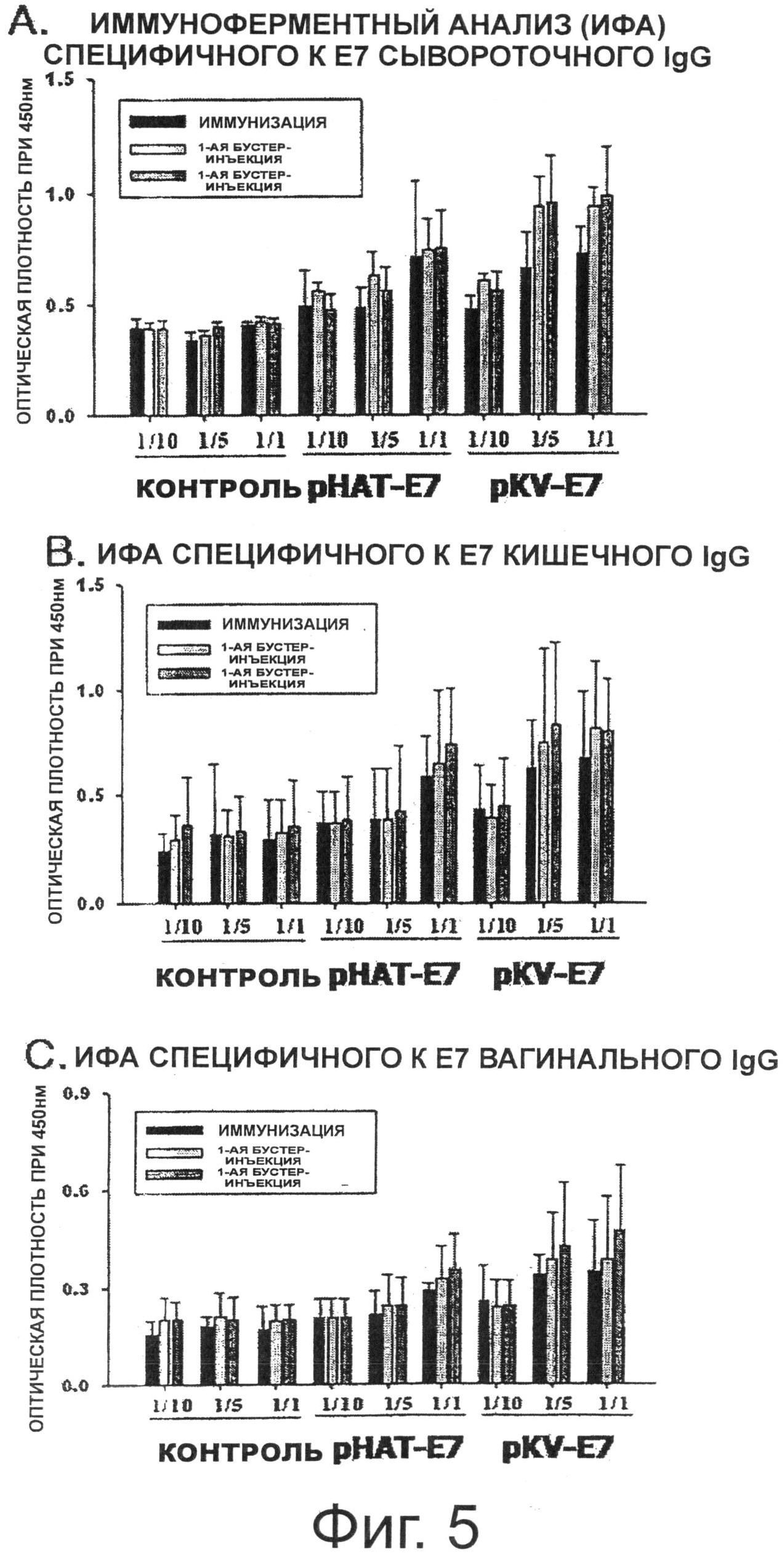
В результате, как показано на Фиг.5А, когда среднее значение оптической плотности (ОП) сывороточного IgG, специфичного к Е7, измеряли через 2 недели иммунизации, группы, которым вводили каждый из рАТ-Е7 и pKV-E7, показали значения ОП выше, чем контрольная группа рАТ. Кроме того, было отмечено, что количество антител, специфичных к Е7, увеличивается в зависимости от количества введенного штамма. Среднее значение ОП сывороточного IgG, специфичного к Е7, после первой бустер-инъекции было увеличено в обеих группах, получавших рАТ и pKV-E7, по сравнению с величиной, измеренной через 2 недели иммунизации, что указывает на ревакцинаторный эффект. Среднее значение ОП сывороточного IgG, специфичного к Е7, после второй бустер-инъекции также указало на ревакцинаторный эффект в двух проверяемых группах. В частности, в случае группы, получавшей pKV-E7, у которой поверхностная экспрессия гибридного белка Е7 была значительно выше, чем у группы, получавшей рАТ-Е7, данная группа, которой вводили pKV-E7 в количестве 1/5, показала ревакцинаторный эффект повышения уровня IgG, аналогичный эффекту в группе, которой вводили рАТ-Е7 в количестве 1/1.
Между тем, для того чтобы измерить иммунные ответы слизистой оболочки, специфичные к Е7 IgA антитела в кишечном и вагинальном смывах измерили ИФА. В результате, как показано на Фиг.5 В и Фиг.5С, среднее значение ОП (то есть, специфичные к Е7 IgA) через 2 недели иммунизации было увеличено в обеих группах, получавших рАТ-Е7 и pKV-E7, по сравнению с контрольной группой рАТ, и уровень специфичного к Е7 антитела был увеличен в зависимости от количества введенного штамма. Среднее значение ОП после первой бустер-инъекции еще более увеличилось, а эффект второй бустер-инъекции был несколько выше, чем эффект первой бустер-инъекции.
В заключение, когда трансформированные рекомбинантные штаммы Lactobacillus casei настоящего изобретения, экспрессирующие ВПЧ16 Е7, вводили перорально мышам, они могли вызывать гуморальные иммунные ответы, специфичные к ВПЧ16 Е7 (индукция сывороточного IgG) и иммунные ответы слизистой оболочки (кишечная/вагинальная индукция IgA). В частности, группа, получавшая pKV-E7, экспрессирующий более высокий уровень Е7, могла более эффективно индуцировать иммунные ответы по сравнению с группой, получавшей рАТ-Е7.
Пример 5: Сравнение способности индуцировать клеточные иммунные реакции между штаммами Lactobacillus, экспрессирующими антиген ВПЧ16 Е7 на своей поверхности
Для того, чтобы исследовать, отличаются ли два вида трансформированных рекомбинантных штаммов Lactobacillus casei (pHAT-E7 и pKV-E7), имеющих различные уровни поверхностной экспрессии антигена ВПЧ16 Е7, по способности индуцировать специфичные к Е7 антигену опосредованные CD8+ Т-клетками иммунные ответы и Т-клеточные иммунные ответы, проводили внутриклеточное окрашивание цитокинов и IFN-γ методом ELISPOT с использованием мышей, которым перорально вводили каждый из штаммов, изучая, таким образом, способность штаммов индуцировать клеточные иммунные ответы.
Для этой цели из мышей, которым перорально вводили каждый из трансформированных рекомбинантных штаммов Lactobacillus casei, экспрессирующих Е7 на своей поверхности, как упоминалось в Примере 4, выделяли спленоциты. Спленоциты суспендировали в 10% среде RPMI-1640, содержащей FBS, и высевали в 24-луночных планшетах с плотностью 5×106 клеток/лунку. Каждую лунку обрабатывали пептидом Е7, содержащим эпитоп МНС класса I (аминокислоты 49-57, AniGen, Корея) и GolgiPlug (BD Biosciences), и клетки культивировали при 37°С в течение 16 часов. Культивируемые клетки окрашивали конъюгированным с фикоэритрином (РЕ) моноклональным крысиным антителом против CD8 мыши при 4°С в течение 40 минут, и IFN-γ в клетках окрашивали ФИТЦ-конъюгированным моноклональным крысиным антителом против IFN-γ мыши, используя набор Cytofix/Cytoperm.
Как описано выше, после того, как мышам перорально вводили каждый из двух рекомбинантных штаммов Lactobacillus casei, проводили окрашивание внутриклеточных цитокинов с целью определения количества специфичных к Е7 IFN-γ-секретирующих CD8+ Т-клеток. В результате, как видно на Фиг.6, число предшественников IFN-γ-секретирующих CD8+Т-25 клеток, специфичных к Е7, увеличивалось при введении трансформированных рекомбинантных штаммов Lactobacillus casei, экспрессирующих Е7. В частности, на начальной стадии, на которой индуцировались иммунные ответы, было видно, что опосредованные клетками иммунные ответы, индуцированные рекомбинантным штаммом Lactobacillus casei pKV-E7, имеющим более высокий уровень поверхностной экспрессии, были немного увеличены по сравнению с иммунными ответами, индуцированными рНАТ-Е7 молочнокислыми бактериями, но опосредованные клетками иммунные ответы, индуцированные рНАТ-Е7 молочнокислыми бактериями, были увеличены до уровня, сходного с уровнем ответа штамма pKV-E7 после бустер-инъекции.
С целью изучения индукции иммунных ответов Е7-специфичных Т-клеток, проводили анализ IFN-γ ELISPOT для оценки общего количества Т-клеток, специфично секретирующих IFN-γ в отношении стимуляции пептидом Е7. Для этой цели за один день до выделения спленоцитов 24-луночный планшет покрывали захватывающим антителом против IFN-γ мыши, и спленоциты, выделенные в день эксперимента, высевали в каждую лунку планшета с плотностью 2×105 клеток/лунку. Каждую лунку с высаженными клетками обрабатывали пептидом Е7 или РНА-М, и клетки культивировали в течение 2 дней. Через 2 дня содержимое планшета удаляли и дважды промывали дистиллированной водой и три раза 0,05% PBS, содержащим Твин-20, после чего в каждую лунку планшета добавляли биотинилированные антитела против INF-γ мыши и инкубировали в течение 2 часов при комнатной температуре. После завершения инкубации содержимоее планшета удаляли, каждую лунку промывали три раза 0,05% PBS, содержащим Твин-20, и затем в каждую лунку планшета добавляли стрептавидин-HRP и инкубировали при комнатной температуре в течение 1 часа. После этого содержимоее планшета удаляли, каждую лунку промывали четыре раза 0,05% PBS, содержащим Твин-20 и два раза PBS. Затем в каждую лунку добавляли субстрат и наблюдали за развитием окраски в каждой лунке в течение 5-60 минут. Реакцию развития окраски останавливали дистиллированной водой, и число пятен в каждой лунке измеряли с помощью ELISPOT-ридера.
В результате, как показано на Фиг.6, у мышей, которым перорально вводили рекомбинантные молочнокислые бактерии, трансформированные рНАТ-Е7 или pKV-E7, количество клеток, специфично секретирующих IFN-γ к пептиду Е7, было увеличено. Кроме того, количество IFN-γ-секретирующих клеток в группе, которой вводили рекомбинантный штамм Lactobacillus casei, трансформированный pKV-E7, было немного больше, чем количество IFN-γ-секретирующих клеток в группе, которой вводили рекомбинантный штамм Lactobacillus casei, трансформированный рНАТ-Е7.
Пример 6: Провокация опухолевыми клетками у мышей, иммунизированных Lactobacillus, экспрессирующим антиген ВПЧ Е7 на своей поверхности
Для того, чтобы подтвердить противоопухолевой эффект двух видов трансформированных рекомбинантных штаммов Lacfobacillus (рНАТ-Е7 и pKV-E7), имеющих различные уровни поверхностной экспрессии антигена ВПЧ16 Е7, и подтвердить противоопухолевый эффект в зависимости от их количества, исследовалась провокация опухолевыми клетками с использованием модели опухолевой клетки ТС-1, экспрессирующей белок Е7.
С этой целью 6-8-недельные самки мышей C57BL/6 были разделены на несколько групп, каждая из которых состояла из 5 животных, и каждый из трансформированных рекомбинантных штаммов Lactobacillus casei, экспрессирующих Е7 на своей поверхности, вводили мышам перорально. Пероральное введение проводили пять раз в неделю, и мышей обрабатывали в соответствии со следующим графиком: 1 неделя перорального приема внутрь, 1 неделя отдыха, затем 1 неделя первой бустер-инъекции, затем 1 неделя отдыха, затем 1 неделя второй бустер-инъекции. После 1 недели перорального введения 2×104 TC-L опухолевых клеток вводили подкожно в левое бедро каждой мыши для индукции опухолей. Размер образовавшейся опухоли измеряли три раза в неделю, используя штангенциркуль.
В результате, как видно на Фиг.7, в группе, которой перорально вводили рекомбинантный штамм Lactobacillus casei, трансформированный рНАТ-Е7 или pKV-E7, размер образовавшейся опухоли был примерно на 50 процентов меньше, чем размер опухоли в контрольной группе. Кроме того, у группы, которой вводили рекомбинантный штамм Lactobacillus casei pKV-E7 в уменьшенном количестве 1/5, размер опухоли был меньше, чем у контрольной группы.
Пример 7: Получение иммунизированных молочнокислых бактерий (pKV-Pald-PgsA-E7 (Rb), экспрессирующих на своей поверхности белок, имеющий аминокислотные мутации, введенные в Е7 ВПЧ типа 16
Если клетки заражены вирусом папилломы, экспрессированный белок Е7 может связываться с белком-супрессором роста ретинобластомы (pRB), что приводит к раку. Для этой цели были введены мутации в последовательность оснований гена Е7 в области связывания pRB. Ген с индуцированной мутацией Е7 (Rb) был слит с концом PgsA с использованием челночного вектора pKV, который стабильно экспрессируется в кишечной палочке и молочнокислых бактериях, тем самым получив вектор pKV-Pald-PgsA-E7 (Rb), способный к экспрессии на поверхности молочнокислых бактерий.
Результаты исследования сайта связывания Rb в белке Е7 вируса папилломы типа 16 показали, что сайт связывания (DL×C×E) белка-супрессора роста ретинобластомы (pRB) состоит из аминокислотных остатков 21-26 гена Е7 ВПЧ16 (Smahel M. et al., Virology, 281:231, 2001). Для того чтобы заменить все 21-ую (D), 24-ую (С) и 26-ую (Е) аминокислоты среди аминокислотных остатков 21-26 на глицин, способность белка Е7 связываться с белком pRB устраняли точечным мутагенезом с использованием праймеров. В частности, проводили ПЦР с использованием вектора pKV-Pald-PgsA-E7, полученного в Примере 2 в качестве матрицы, и каждого из набора праймеров SEQ ID NOS:8 и 9 и набора праймеров SEQ ID NO:10 и 11.
SEQ ID NO:8: 5'-tct gga tcc atg cat gga gat аса cct ac-3'
SEQ ID NO:9: 5'-ttg ccc ata acc gta gag acc agt tgt c-3'
SEQ ID NO:10: 5'-act ggt ctc tac ggt tat ggg caa tta aat g-3'
SEQ ID NO:11: 5'-cat tot aga tca tta tgg ttt ctg aga аса g-3'
В результате с использованием праймеров SEQ ID NO:8 и 9 получили фрагмент ДНК размером 87 п.н., содержащий ген Е7 ВПЧ16 и содержащий сайт фермента рестрикции BamHI на 5' конце. Кроме того, с использованием праймеров SEQ ID NOS:10 и 11 получили фрагмент ДНК размером 249 п.н., содержащий сайт фермента рестрикции XbaI на 3' конце. Два полученных фрагмента ДНК смешивали друг с другом и подвергали 10 циклам ПЦР, состоящих из 30 сек при 95°С, 30 сек при 42°С и 30 сек при 72°С. После этого к продукту ПЦР добавляли праймеры SEQ ID NOS: 8 и 11 и снова проводили ПЦР (30 сек при 95°С, 30 сек при 53°С и 30 сек при 72°С). Полученный фрагмент ДНК размером 312 п.н. содержал сайт фермента рестрикции BamHI на 5' конце и сайт фермента рестрикции XbaI на 3' конце. Фрагмент расщепляли ферментами рестрикции BamHI и XbaI для получения фрагмента мутантного гена Е7 (Rb) размером 306 п.н.. pKV-Pald-PgsA-амилазу расщепляли BamHI и XbaI для удаления участка гена амилазы, таким образом получив участок вектора. Фрагмент ДНК, содержащий мутантный ген Е7 (Rb), расщепленный BamHI и XbaI, лигировали с вектором, расщепленным теми же ферментами рестрикции, таким образом конструируя pKV-Pald-PgsA-E7 (Rb) (Фиг.8).
Конструкцию pKV-Pald-PgsA-E7 (Rb) трансформировали в Lactobacillus casei электропорацией, таким образом получая молочнокислые бактерии, трансформированные данной конструкцией.
Пример 8: Изучение экспрессии pKV-Pald-PgsA-E7 (Rb) в трансформированных молочнокислых бактериях
Для того чтобы изучить, экспрессируется ли гибридный белок PgsA-E7, имеющий мутации в сайте связывания Rb, в рекомбинантных Lactobacillus casei, трансформированных вектором pKV-Pald-PgsA-E7 (Rb), полученным для экспрессии на поверхности молочнокислых бактерий, проводили следующий эксперимент.
Трансформированный рекомбинантный Lactobacillus casei стационарно культивировали в среде MRS (Lactobacillus MRS, Becton Dickinson and Company Sparks, США) при 30°С, микробные клетки собирали и анализировали Вестерн-блоттингом таким же образом, как в Примере 3. В результате было подтверждено, что гибридный белок экспрессировался в данном микробном штамме. В частности, Вестерн-блоттинг проводили с использованием антитела, специфичного к PgsA, и антитела, специфичного к Е7 ВПЧ16 (моноклональное антитело Е7, Invitrogen, США), и, как результат, как показано на Фиг.9, была подтверждена экспрессия мутантного белка Е7 размером примерно 54,7 кДа, слитого с PgsA.
Пример 9: Индукция гуморальных иммунных ответов Lactobacillus, экспрессирующего мутантный антиген ВПЧ16 Е7 (Rb) на своей поверхности
Рекомбинантный штамм Lactobacillus casei, для которого подтвердили экспрессию мутантного белка Е7, слитого с PgsA, вводили перорально мышам, чтобы изучить возможность индукции гуморальных иммунных ответов. Для этой цели Lactobacillus casei трансформировали вектором, культивировали, а затем лиофилизовали, чтобы приготовить порошок. Порошок растворяли в буфере (PBS, рН 7,4) и вводили перорально 6-недельным самкам мышей Balb/c.
Более конкретно, порошок трансформированного рекомбинантного штамма Lactobacillus casei (E7-Rb), экспрессирующего ВПЧ16 Е7 (Rb), и порошок штамма Lactobacillus casei (L525), не экспрессирующего ВПЧ16 Е7 (Rb), растворяли в PBS в концентрации 2-5×109 клеток/200 мкл и затем иммунизировали мышей пять раз в неделю в течение 2 недель (дни 0-4 и дни 7-11). Через 1 неделю проводили первую бустер-инъекцию путем перорального введения (дни 21-25) и спустя 1 неделю проводилили вторую бустер-инъекцию путем перорального введения (дни 35-39). Для того чтобы измерить специфичное к ВРЧ16 Е7 антитело IgG в сыворотке крови мыши и специфичное к ВРЧ16 Е7 антитело IgA, выделяемое из слизистой оболочки мыши, кишечный смыв и вагинальный смыв собирали от каждой из мышей на 14 день, 28 день и 42 день как показано на Фиг.4. Как описано в Примере 4, кровь получали из глаза мыши, используя микрокапиллярную трубку с гепариновым покрытием, и кишечный смыв и вагинальный смыв собирали в количестве 0,8 мл и 250 мкл, соответственно, используя PBS буфер, содержащий 1 мМ PMSF. Каждый из собранных смывов центрифугировали при 13000 об/мин в течение 20 минут, и супернатант выделяли и анализировали ИФА таким же образом, как описано в Примере 4.
В результате, как показано на Фиг.10А, когда через 2 недели иммунизации померяли среднее значение оптической плотности (ОП) сывороточного IgG, специфичного к Е7, группа, которой вводили E7-Rb, показала значение ОП выше, чем значение ОП в группе, которой вводили L525 (отрицательная контрольная группа). Среднее значение ОП сывороточного IgG, специфичного к Е7, после первой бустер-инъекции было увеличено в группе, получавшей E7-Rb, по сравнению с ОП, измеренным через 2 недели иммунизации, что указывает на ревакцинаторный эффект. Среднее значение ОП сывороточного IgG, специфичного к Е7, также указало на ревакцинаторный эффект. Однако группа, которой вводили L525, не показала специального ревакцинаторного эффекта. Кроме того, для того чтобы измерить гуморальные иммунные ответы, индуцированные в слизистой оболочке, специфичное к Е7 антитело IgA в каждом из кишечных и вагинальных смывов измеряли с помощью ИФА. В результате, как показано на Фиг.10В и Фиг.10С, среднее значение ОП (специфичные к Е7 IgA) через 2 недели иммунизации было увеличено в группе, получавшей E7-Rb, по сравнению с группой, которой вводили L525 (отрицательная контрольная группа). Кроме того, среднее значение ОП после первой бустер-инъекции было увеличено по сравнению с измеренным значением через 2 недели иммунизации, и эффект второй бустер-инъекции был увеличен по сравнению с эффектом первой бустер-инъекции.
В заключение, когда рекомбинантный штамм Lactobacillus casei, трансформированный E7-Rb, вводили перорально мышам, это могло индуцировать все специфичные к ВРЧ16 Е7 системные гуморальные иммунные ответы (индукция сывороточного IgG) и гуморальные иммунные ответы слизистой оболочки (кишечная/вагинальная индукция IgA).
Пример 10: Индукция клеточных иммунных ответов Lactobacillus, экспрессирующим мутантный антиген ВПЧ16 Е7 (Rb) на своей поверхности
Для того, чтобы изучить, обладает ли трансформированный рекомбинантный штамм Lactobacillus (E7-Rb), экспрессирующий мутантный антиген ВПЧ16 Е7 (Rb) на своей поверхности, способностью индуцировать специфичные к антигену Е7 (Rb) опосредованные Т-клетками иммунные ответы, проводили IFN-γ ELISPOT с использованием мышей, которым перорально вводили данный штамм, таким образом изучая способность данного штамма вызывать клеточные иммунные ответы. Для этой цели трансформированный рекомбинантный штамм Lactobacillus casei, экспрессирующий мутантный антиген ВПЧ16 Е7 (Rb) на своей поверхности, сконструированный в Примере 7, вводили перорально мышам, после чего из мышей выделяли спленоциты. Выделенные спленоциты суспендировали в среде RPMI-1640, содержащей 10% FBS и высевали в каждую лунку 24-луночного планшета с плотностью 5×10 клеток. Каждую лунку обрабатывали пептидом Е7, содержащим эпитоп МНС класса I (аминокислоты 49-57, AniGen, Корея) и GolgiPlug (BD Biosciences), и клетки культивировали при 37°С в течение 16 часов. Культивируемые клетки окрашивали конъюгированным с фикоэритрином (РЕ) моноклональным крысиным антителом против CD8 мыши при 4°С в течение 40 минут и IFN-y в клетках окрашивали ФИТЦ-конъюгарованным моноклональным крысиным антителом против IFN-γ мыши, используя набор Cytofix/Cytoperm.
Как описано выше, мышам перорально вводили каждый из двух рекомбинантных штаммов Lactobacillus casei и затем проводили окрашивание внутриклеточных цитокинов с целью определения количества специфичных к Е7 (Rb) IFN-γ-секретирующих CD8+ Т-клеток. В результате, как видно на Фиг.6, число предшественников IFN-γ-секретирующих CD8+ Т-25 клеток, специфичных к Е7 (Rb), увеличивалось при введении трансформированных рекомбинантных штаммов Lactobacillus casei, экспрессирующих Е7 (Rb). В частности, на начальной стадии, на которой индуцировались иммунные ответы, было видно, что опосредованные клетками иммунные ответы, индуцированные рекомбинантным штаммом Lactobacillus casei pKV-E7 (Rb), имеющим более высокий уровень поверхностной экспрессии, были немного увеличены по сравнению с иммунными ответами, вызванными молочнокислыми бактериями рНАТ-Е7 (Rb), но опосредованные клетками иммунные ответы, вызванные молочнокислыми бактериями рНАТ-Е7 (Rb), были увеличены до уровня, сходного с уровнем ответа штамма pKV-E7 (Rb) после бустер-инъекции.
С целью изучения индукции иммунных ответов Е7-специфичных Т-клеток, проводили анализ IFN-γ ELISPOT для оценки общего количества Т-клеток, секретирующих IFN-γ специфично к стимуляции пептида Е7.
Для этой цели за один день до выделения спленоцитов 24-луночный планшет покрывали захватывающим антителом против IFN-γ мыши и спленоциты, выделенные в день эксперимента, высевали в каждую лунку планшета с плотностью 2×105клеток/лунку. Каждую лунку с высаженными клетками обрабатывали пептидом Е7 или РНА-М, и клетки культивировали в течение 2 дней. Через 2 дня содержимое планшета удаляли и промывали дважды дистиллированной водой и три раза 0,05% PBS, содержащим Твин-20, после чего в каждую лунку планшета добавляли биотинилированные антитела против INF-γ мыши и инкубировали в течение 2 часов при комнатной температуре. После завершения инкубации содержимое планшета удаляли, каждую лунку промывали три раза 0,05% PBS, содержащим Твин-20, и затем в каждую лунку планшета добавляли стрептавидин-HRP и инкубировали при комнатной температуре в течение 1 часа. После этого содержимое планшета удаляли, каждую лунку промывали четыре раза 0,05% PBS, содержащим Твин-20, и два раза PBS. Затем в каждую лунку добавляли субстрат и наблюдали за развитием окраски в каждой лунке в течение 5-60 минут. Реакцию развития окраски останавливали дистиллированной водой, и число пятен в каждой лунке измеряли с помощью ELISPOT-ридера.
В результате, как показано на Фиг.11, у мышей, которым перорально вводили рекомбинантные молочнокислые бактерии, трансформированные рНАТ-Е7 (Rb) или pKV-Е7 (Rb), количество клеток, секретируемых IFN-y специфично к пептиду Е7, было увеличено. Кроме того, количество IFN-γ-секретирующих клеток в группе, которой вводили рекомбинантный штамм Lactobacillus casei, трансформированный pKV-E7 (Rb), было немного больше, чем количество IFN-γ-секретирующих клеток в группе, которой вводили рекомбинантный штамм Lactobacillus casei, трансформированный рНАТ-Е7 (Rb).
Хотя настоящее изобретение было подробно описано со ссылкой на специфические особенности, для специалиста в данной области будет очевидно, что это описание составлено только для предпочтительного воплощения изибретения и не ограничивает объем настоящего изобретения.
Промышленная применимость
Как описано выше, рекомбинантные молочнокислые бактерии, трансформированные вектором поверхностной экспрессии настоящего изобретения и экспрессирующие антигенный белок вируса папилломы человека (ВПЧ) на своей поверхности, и композиция, содержащая рекомбинантные молочнокислые бактерии в качестве активного ингредиента, могут применяться в качестве вакцины для лечения рака шейки матки. Трансформированный рекомбинантный штамм, конститутивно экспрессирующий высокий уровень антигена ВПЧ, является очень эффективным, поскольку он может размножаться в большом количестве экономичным образом и может применяться в качестве пероральной вакцины или вводиться непосредственно во влагалище.
Реферат
Изобретение относится к области генной инженерии и вакцинологии. Предложен вектор поверхностной экспрессии, конститутивно экспрессирующий высокий уровень антигенного белка вируса папилломы человека (ВПЧ), для получения вакцин против ВПЧ, где вектор содержит ген, кодирующий мутантный белок repE, промотор, комплексный ген поли-гамма-глутаматсинтетазы и ген, который соединен с комплексным геном поли-гамма-глутаматсинтетазы и кодирует антигенный белок вируса папилломы человека, связанный с индукцией опухоли. Кроме того, предложены рекомбинантные молочнокислые бактерии, трансформированные вышеуказанным вектором. Изобретение может быть использовано в качестве вакцины для лечения рака шейки матки. 9 н. и 5 з.п. ф-лы, 11 ил., 10 пр.

Комментарии