Самореплицирующийся рекомбинантный вектор, экспрессирующий регуляторные белки вич, способ его получения, вакцина для иммунизации против вич на основе днк, содержащая указанный вектор, способ лечения или профилактики вич - RU2232815C2
Код документа: RU2232815C2
Чертежи





Описание
Область изобретения
Изобретение направлено на самореплицирующийся рекомбинантный вектор, пригодный для иммунизации против ВИЧ с помощью ДНК. Изобретение также направлено на вакцину, содержащую вышеуказанный вектор, способ получения вектора и клетку-хозяина, содержащую его. Изобретение, кроме того, относится к использованию вышеуказанных векторов для производства вакцины против ВИЧ и к способу лечения или профилактики ВИЧ.
Предпосылки создания изобретения
Взаимодействие позвоночных и поэтому также и людей с патогенными микробами, такими как бактерии, грибки и вирусы, регулируется способностью организма позвоночного осуществлять иммунный ответ против проникшего микроба. Эта реакция основана на способности иммунной системы различать "свое" и "чужое"; в нормальной ситуации иммунный ответ щадит собственные структуры, клетки и антигенные молекулы организма, но разрушает чужеродные антигены, экспрессируемые проникшими микробами. Когда позвоночное, например человек, инфицируется микробами, иммунный ответ помогает избавиться от инфекции путем уничтожения микробов или клеток, инфицированных микробами или путем предотвращения распространения инфекции в результате действия нейтрализующих антител. Во-вторых, что более важно иммунный ответ, однажды вызванный проникшим организмом, обладает врожденным механизмом памяти, и поэтому индивидуум, который однажды перенес инфекцию, вызванную определенным микробом, часто является иммунным и может не заразиться повторно.
Эта иммунологическая память, вызываемая в естественной ситуации инфекцией, является основой для вакцин, которые имитируют естественную инфекцию разными способами Идеальная вакцина вообще не будет вызывать или вызовет только слабые симптомы у вакцинированных индивидуумов, но тем не менее приведет к индукции иммунологической памяти и способности развивать сильный предупредительный иммунный ответ, если вакцина сталкивается с данным микробом.
Разработка вакцины против определенного микроба зависит от механизма, при помощи которого организм при естественной инфекции может уничтожить этот определенный организм и предотвратить последующие инфекции. Существует несколько способов, которыми иммунный ответ может выполнить свою полезную функцию. Во-первых, антитела, синтезируемые и секретируемые В-лимфоцитами, могут связываться с микробом и разрушать их с помощью опосредованного комплементом лизиса. Во-вторых, нейтрализующие антитела могут предотвратить распространение инфекции путем ингибирования связывания микроба с клеткой-мишенью. В-третьих, антитела в сочетании с активацией комплемента могут разрушать инфицированные клетки, и, наконец, специфические цитотоксичные Т-лимфоциты (CTL, ЦТЛ) могут убивать и разрушать клетки, инфицированные микробом Полагают, что все эти механизмы вовлечены в иммунный ответ, вызываемый вирусом иммунодефицита человека (ВИЧ) типа 1 и 2 (ВИЧ-1 и ВИЧ-2). Однако иммунный ответ у ВИЧ-инфицированных индивидуумов обычно характеризуется сильным ответом с образованием антител и менее эффективным или вообще отсутствующим ответом Т-лимфоцитов (Gerstott, J. et al. Scand. J. Immunol. 22(5): 463-470, 1985; Re, M.C. et al. J. Clinical Pathol. 42(5): 282-283, 1989) Это может быть причиной того, почему у индивидуумов, инфицированных ВИЧ, развивается хроническая инфекция, несмотря на сильный, опосредованный антителами иммунный ответ.
Профилактический иммунный ответ на вирусную инфекцию, в целом, может быть опосредован четырьмя типами иммунных ответов, описанными выше, но известно, что наиболее эффективным является ЦТЛ-ответ, способный убивать инфицированные вирусом клетки. Это является причиной, почему, вообще говоря, живые ослабленные вирусные вакцины, как доказано, являются наиболее эффективными. Фактически, первая вакцина, разработанная Дженнером более 200 лет назад, живая вирусная вакцина, которая может предотвращать заражение вирусом натуральной оспы, является примером такого принципа. Когда индивидуум вакцинирован живой ослабленной вирусной вакциной, инфицируются клетки-хозяева и синтезируются вирусные белки. Некоторые из молекул вирусных белков используются для образования вирусных частиц, тогда как другие протеолитически расщепляются на мелкие пептиды, которые связываются с антигенами главного комплекса гистосовместимости (МНС) (у человека - HLA класса I и II) и представляются Т-лимфоцитам на поверхности инфицированных клеток. Впоследствии Т-лимфоциты, несущие соответствующий Т-клеточный рецептор (TCR), будут распознавать чужеродный пептид, связанный с HLA, и либо будут помогать В-клеткам продуцировать антитела (Т-клетки хелперы/индукторы; Тh), либо будут разрушать инфицированную клетку (цитотоксические Т-лимфоциты; CTL).
Несмотря на производившиеся в течение десятилетия попытки, эффективной вакцины против заражения вирусом иммунодефицита человека (ВИЧ) и СПИДа все еще нет. Наиболее ранние попытки концентрировались на получении стерилизующей иммунности с помощью нейтрализующих антител к гликопротеину наружной оболочки ВИЧ, gp120/gp160. Исследования фазы I/II с gp160/gp120 показали, Однако нейтрализацию лабораторных штаммов, но неспособность нейтрализовать полевые изоляты.
В противоположность этому, эксперименты с ослабленным вирусом оказались успешными на модели иммунодефицита обезьян (SIV). SIV, из которого делегированы гены NEF или REV, ведет себя как ослабленный вирус и защищает вакцинированных животных от развития заболевания, но не от заражения провоцирующим вирусом дикого типа. В случае REV-дефективного вируса, единственным значимым иммунологическим коррелятом с защитой был клеточный иммунный (КИ) ответ на регуляторные белки SIV NEF и ТАТ. Важное наблюдение, сделанное в этом эксперименте, состояло в том, что вакцинированные животные могли даже преодолевать инфекцию, вызванную провоцирующим вирусом дикого типа. Недавно сообщалось, что и ВИЧ-инфицированные больные иногда могут преодолевать явную инфекцию. Единственной корреляцией с защитой в этих исследованиях на животных и/или людях представляется клеточный иммунный ответ на ВИЧ.
Этот тип иммунного ответа обычно не получают при иммунизации белками. В случае ВИЧ, живые ослабленные вакцины могут быть эффективными для профилактики инфекции, но они теоретически являются опасными по нескольким причинам. Недавно описанный метод генетической иммунизации (синонимы иммунизация нуклеиновой кислотой, иммунизация с помощью ДНК) имеет несколько преимуществ по сравнению с живыми ослабленными вакцинами, но не имеет их потенциальных вредных побочных эффектов. Вакцина на основе ДНК, в форме эукариотического вектора экспрессии, который несет ген одного или нескольких вирусных белков, трансфицируется в клетку-хозяина. Вирусные белки, синтезируемые в клетке-мишени, затем будут расщепляться протеолитическими ферментами, образующиеся пептиды будут связываться с молекулами MHC/HLA и представляться на поверхности трансфицированных клеток. Это будет причиной ЦТЛ-опосредованной иммунологической памяти, которая, в том случае, если индивидуум впоследствии будет инфицирован вирулентным вирусом дикого типа, будет эффективно убивать инфицированные вирусом клетки сразу же после заражения и таким образом предотвращать инфекцию. Было показано, что прямое внутримышечное или внутрикожное введение кДНК в эукариотической экспрессирующей плазмиде индуцирует иммунный ответ (Wolff et al. Science 246: 1465-1468, 1990). Экспрессия чужеродных антигенов таким способом приводит, главным образом, к иммунным ответам клеток Т-хелперов подкласса 1 (Th1) с сильным ответом цитотоксических Т-лимфоцитов (ЦТЛ) и иногда также с высоким титром антител (Wang, В. Et al. PNAS 90: 4156-4160, 1993; Wang et al. Ann. NY Acad. Sci. 772: 186-197, 1995; Hayness et al. AIDS Res. Hum. Retroviruses 10 (2): 43-45, 1994). Кроме того, при использовании антигенов, являющихся нуклеопротеинами вируса гриппа А, были описаны появление антигенспецифичных ЦТЛ и защита (Ulmer et al. Science 259, 1745-1749, 1993). Более того, защита от инфекции с использованием иммунизации с помощью ДНК была получена в случае микоплазмы у мышей (Barry et al., Nature 377 (6550): 632-635, 1995; Lai et al. DNA Cell Biol. 14(7): 643-651, 1995) и в случае вируса папилломы человека в модельных экспериментах на кроликах (Donnelly et al. J. Inf. Dis. 173(2): 314-320, 1996). Иммунизация с помощью ДНК также использовалась для индукции противоопухолевой иммунности, опосредованной цитотоксическими лимфоцитами (Bohm et al. Cancer Immunol. Immunother. 44(4): 230-238, 1997).
Иммунизация с помощью ДНК имеет несколько преимуществ по сравнению с иммунизацией живыми ослабленными вирусными вакцинами. Поскольку не образуется инфекционного вируса, вирусные гены, введенные в организм-реципиент, остаются только в тех клетках, которые изначально трансфицированы, и не возникает симптомов вирусной инфекции. В случае ВИЧ, основным теоретически возможным вредным эффектом живого ослабленного вируса может быть реверсия посредством мутации в вирулентный вирус дикого типа. Кроме того, при иммунизации с помощью ДНК можно использовать только те вирусные гены, или их части, относительно которых известно, что они эффективно индуцируют профилактический иммунный ответ.
Для эффективного ЦТЛ-ответа важно, чтобы цитотоксические Т-клетки разрушали инфицированные клетки до образования структурных белков и до высвобождения зрелых вирусных частиц. Поэтому предпочтителен иммунный ответ на ранние белки жизненного цикла вируса. Репликация ВИЧ регулируется его собственными регуляторными генами и белками. Геном ВИЧ кодирует три неструктурных регуляторных белка (NEF, TAT, REV), которые необходимы для репликации вируса in vivo. REV - это белок, транспортирующий геномную РНК в цитоплазму, ТАТ регулирует транскрипцию вируса, а NEF обеспечивает репликацию в покоящихся клетках. Эксперименты с SIV показали, что вирусы, у которых один из этих регуляторных генов не функционирует, могут быть неспособными индуцировать заболевание из-за недостаточной репликации вируса. Три этих белка в течение непродолжительного времени и в малых количествах экспрессируются в течение первых ч инфекционного цикла вируса (Ranki et al. Arch. Virol. 139: 365-378, 1994). Только у небольшой части ВИЧ-инфицированных индивидуумов обнаруживаются гуморальный и/или клеточный ответы на эти белки, и этот ответ коррелирует с благоприятным клиническим течением.
ЦТЛ-ответы против NEF, ТАТ и REV широко изучались. NEF-специфичные ответы ЦТЛ и Th (клеток Т-хелперов) коррелируют с благоприятным клиническим прогнозом. При использовании REV-дефектной SIV-вакцины иммунные ответы на NEF и ТАТ были защитными. Были идентифицированы Th- и CTL-эпитопы в белках ТАТ и REV, которые выявляются у ВИЧ-инфицированных индивидуумов и которые коррелируют с клиническим течением (Blazevic et al. J AIDS 6: 881-890, 1993, Blazevic et al. AIDS Res. Hum. Retroviruses 11: 1335-1341, 1995).
При совместном рассмотрении эти результаты показывают, что для профилактики заболевания может быть необходима умеренная репликация вируса (пониженное размножение) в сочетании со специфическими иммунными ответами против регуляторных белков, участвующих в обеспечении репликации вируса.
При иммунизации с помощью ДНК можно использовать несколько эукариотических экспрессирующих векторов, но их эффективность различна. Некоторые параметры, регулирующие эффективность определенного экспрессирующего вектора в отношении индукции иммунного ответа, неизвестны, но явно предпочтительным должен быть высокий уровень экспрессии антигенного белка. Период времени, когда вектор, введенный в клетку, может экспрессировать чужеродный антигенный вирусный белок, также может быть важным. Наконец, экспрессирующие векторы, которые вызывают определенный уровень повреждения клетки, также могут иметь преимущества, поскольку известно, что деструкция ткани будет усиливать иммунный ответ за счет нескольких биологически активных молекул, таких как цитокины, лимфокины и хемокины, секретируемые клеткой, экспрессирующей антигенный белок. По-видимому, это еще одна причина, по которой живой ослабленный вирус, который вызывает определенный уровень деструкции ткани и клетки, столь эффективно индуцирует иммунитет, и поэтому ДНК-вектор, который в этом отношении имитирует живую ослабленную вакцину, может иметь преимущества.
Неспецифические факторы, такие как цитокины и лимфокины, также могут регулировать репликацию вируса и иммунные ответы при ВИЧ-инфекции. Роль баланса клеток-хелперов Th1/Th2, отражающегося в продукции лимфокинов, специфичных для этих двух популяций клеток Т-хелперов, была продемонстрирована Clerici и Shearer (Immunology Today 14(3): 107-111, 1993) и другими авторами. Растворимые факторы, продуцируемые CDS-клетками и способные подавлять продукцию вируса ВИЧ-инфицированными СD4-клетками, недавно были идентифицированы как RANTES, МIР1-α и МIР1-β (Cocchi et al. Science 270(5243): 1811-1815, 1995). Возможно, что цитокины, продукция которых либо повышается, либо понижается при ВИЧ-инфекции, регулируют транскрипцию вируса.
Ранее выполненные исследования по иммунизации с помощью ДНК с использованием гена, кодирующего ВИЧ-регуляторный белок NEF, продемонстрировали пролиферативные ответы Т-клеток (Hinkula et al. Vaccine 15(8): 874-878, 1997 и Hinkula et al. J. Virol. Jul., 71(7): 5528-5539, 1997). Однако положительный эффект ЦТЛ коррелирует с благоприятным клиническим течением.
Поэтому одной из основных задач настоящего изобретения является создание вакцины для иммунизации с помощью ДНК, кодирующей регуляторный белок ВИЧ, вакцины, способной вызывать ЦТЛ-ответ против ВИЧ-инфицированных клеток на ранней фазе инфекционного цикла, до выделения новых зрелых вирусных частиц.
Другая задача изобретения состоит в создании вакцины, которая дополнительно вызывает гуморальный ответ против ВИЧ.
Еще одна задача изобретения состоит в создании вакцины против ВИЧ, которая безопасна при использовании, поскольку не подвергает реципиента воздействию структурных генов или белков ВИЧ.
Еще одна задача изобретения состоит в создании самореплицирующегося вектора, который приводит к длительному и высокому уровню экспрессии регуляторных белков ВИЧ и определенному уровню деструкции клеток, который дополнительно стимулирует иммунный ответ.
Еще одна задача изобретения состоит в создании самореплицирующегося рекомбинантного вектора, экспрессирующего регуляторные белки ВИЧ, причем этот вектор длительно и стабильно персистирует и дает большое число копий в трансфицированных клетках, в том числе в клетках млекопитающих.
Еще одна задача изобретения состоит в создании клетки-хозяина, содержащей вышеуказанный вектор.
Еще одна задача изобретения состоит в создании способа получения вышеуказанного самореплицирующегося вектора.
Настоящее изобретение далее обеспечивает способ лечения или профилактики ВИЧ.
Еще одной задачей изобретения является использование вышеуказанного вектора для получения вакцины против ВИЧ для иммунизации с помощью ДНК.
Сущность изобретения
Задачи настоящего изобретения могут быть решены путем включения гетерологичной последовательности нуклеотидов, кодирующей регуляторный белок ВИЧ NEF, REV или ТАТ или их иммунологически активный фрагмент, в вектор, содержащий Е1 ген или Е2 ген вируса папилломы, минимальный источник репликации вируса папилломы и минихромосомный элемент поддержки вируса папилломы.
Другими словами, изобретение направлено на самореплицирующийся рекомбинантный вектор, содержащий нуклеотидные последовательности вируса папилломы, обязательно состоящие из
(I) гена Е1 и гена Е2 папилломы,
(II) минимального источника репликации вируса папилломы,
(III) минихромосомного элемента поддержки вируса папилломы,
гетерологичной нуклеотидной последовательности, кодирующей ВИЧ-регуляторный белок NEF, REV или ТАТ или его иммунологически активный фрагмент.
Изобретение далее позволяет создать вакцину для иммунизации против ВИЧ с помощью ДНК, включающую вышеуказанный вектор, использование вышеуказанного вектора для производства вакцины против ВИЧ и способ лечения или профилактики ВИЧ, включающий введение нуждающемуся в этом человеку эффективного количества самореплицирующегося вектора и экспрессию NEF, REV или ТАТ белка или его иммунологически активного фрагмента у вышеуказанного человека.
Изобретение, кроме того, обеспечивает способ получения самореплицирующегося рекомбинантного вектора, вышеуказанный способ включает
A) вставку гетерологичной последовательности нуклеотидов, кодирующей регуляторный белок ВИЧ NEF, REV или ТАТ или его иммунологически активный фрагмент, в вектор, содержащий нуклеотидные последовательности вируса папилломы, по существу состоящие из
(1) гена Е1 и гена Е2 папилломы,
(2) минимального источника репликации вируса папилломы,
(3) минихромосомного элемента поддержки вируса папилломы,
и
Б) трансформацию клетки-хозяина образованным самореплицирующимся рекомбинантным вектором,
B) культивирование клеток-хозяев,
(Г) извлечение вышеуказанного вектора.
Изобретение также позволяет создать клетку-хозяина, содержащую вышеуказанный вектор.
Краткое описание графических материалов
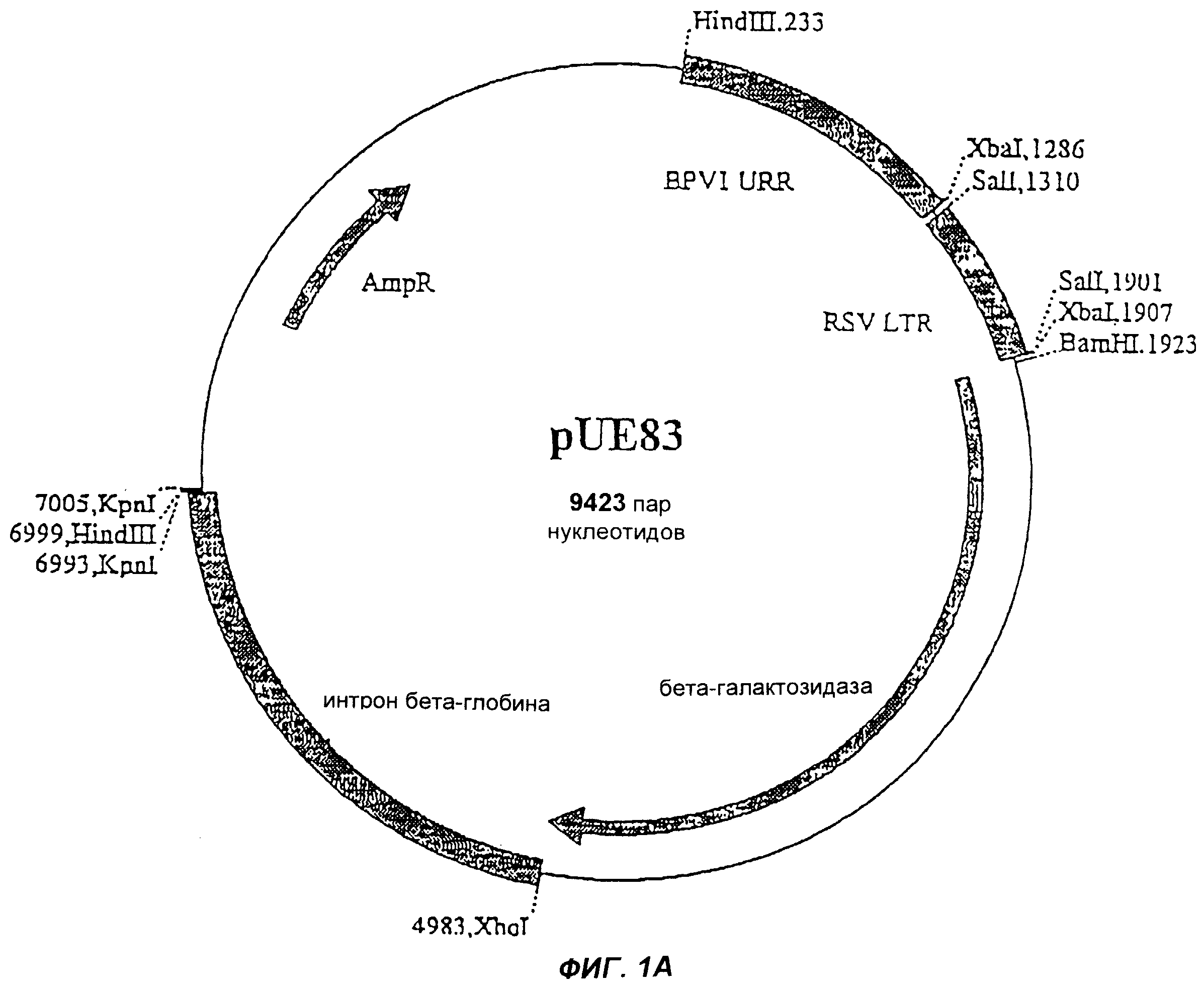
Фиг.1А изображает челночный вектор pUE83.
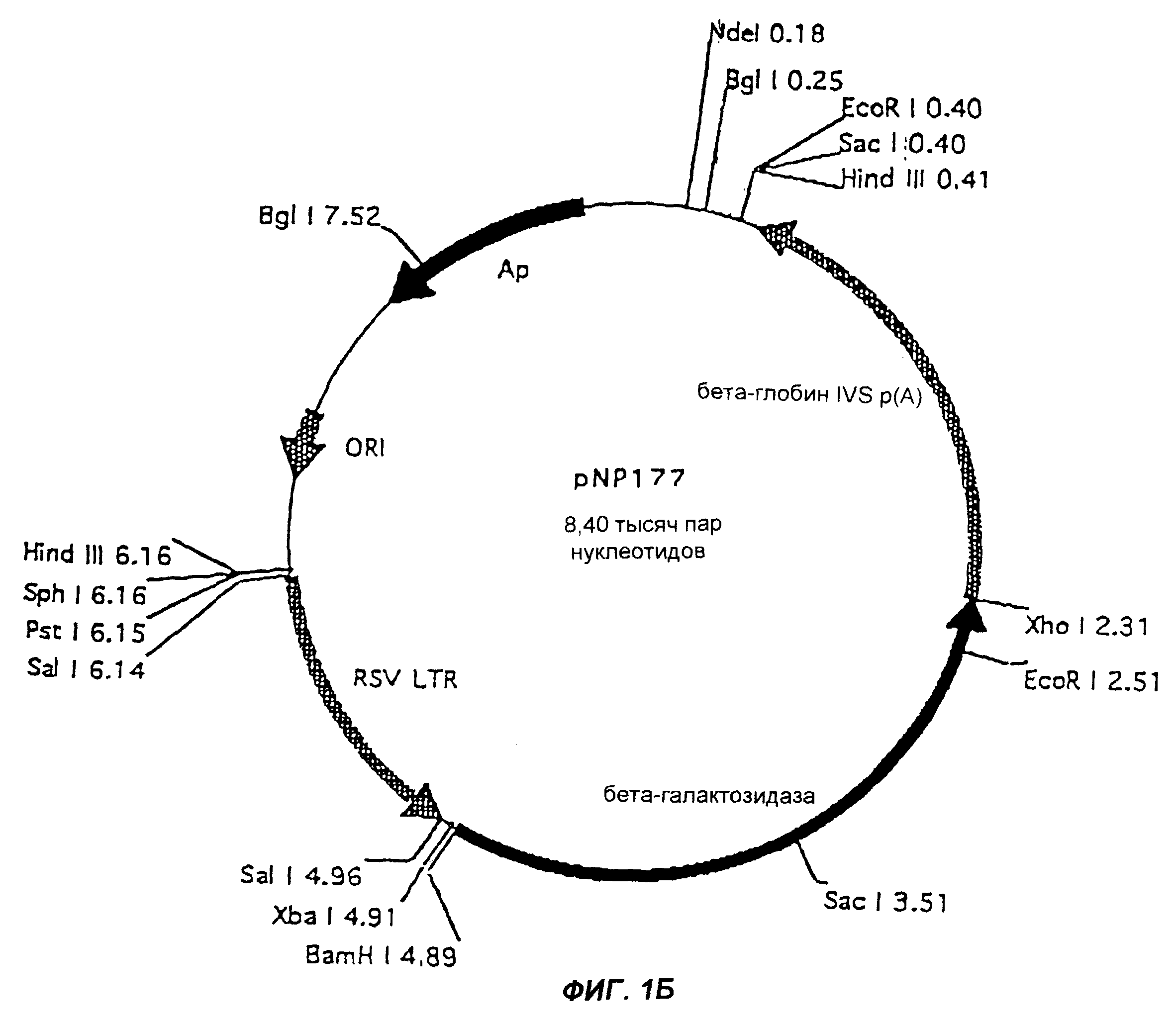
Фиг.1В изображает челночный вектор pNP177.
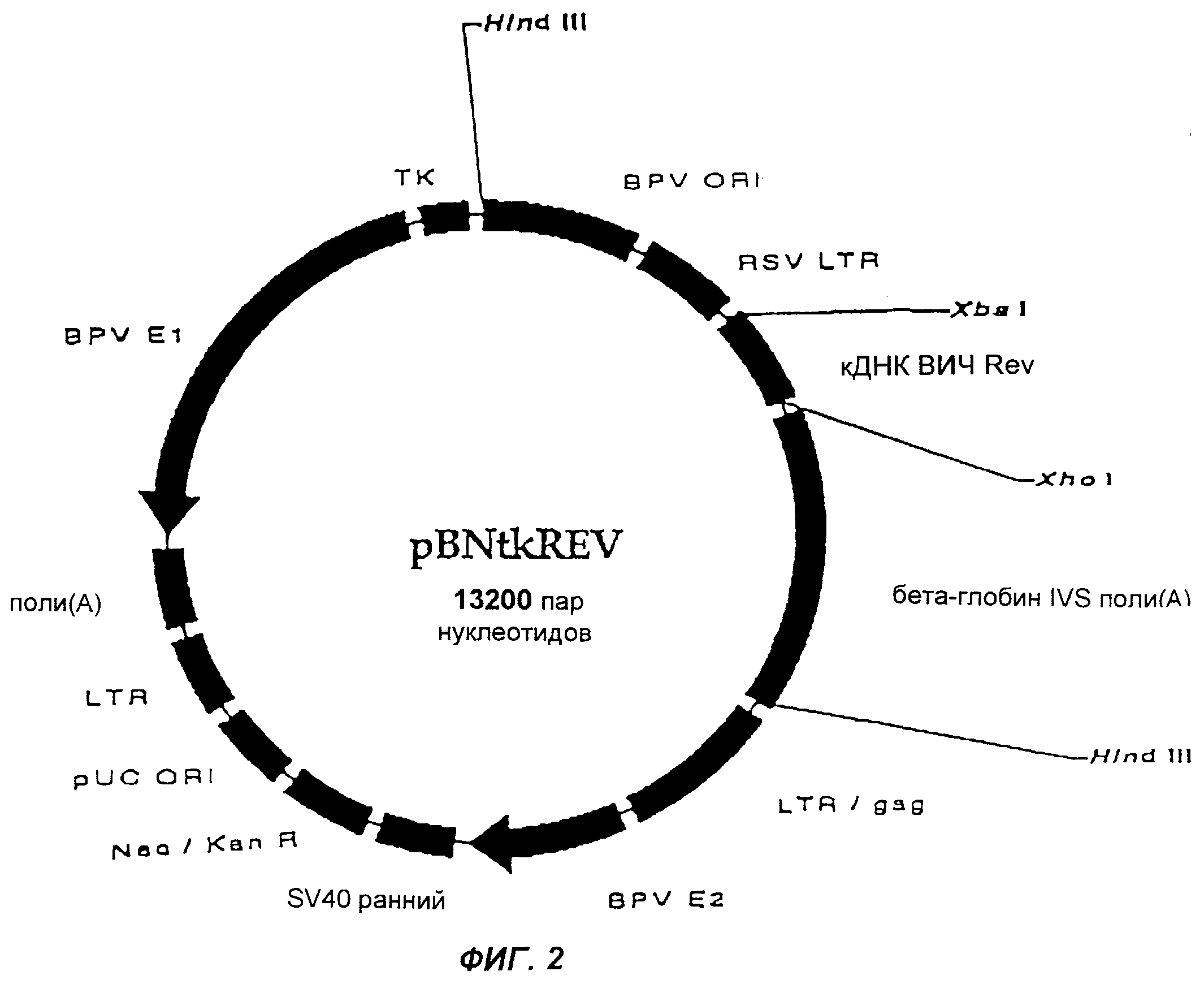
Фиг.2 изображает плазмиду pBNtkREV согласно настоящему изобретению.
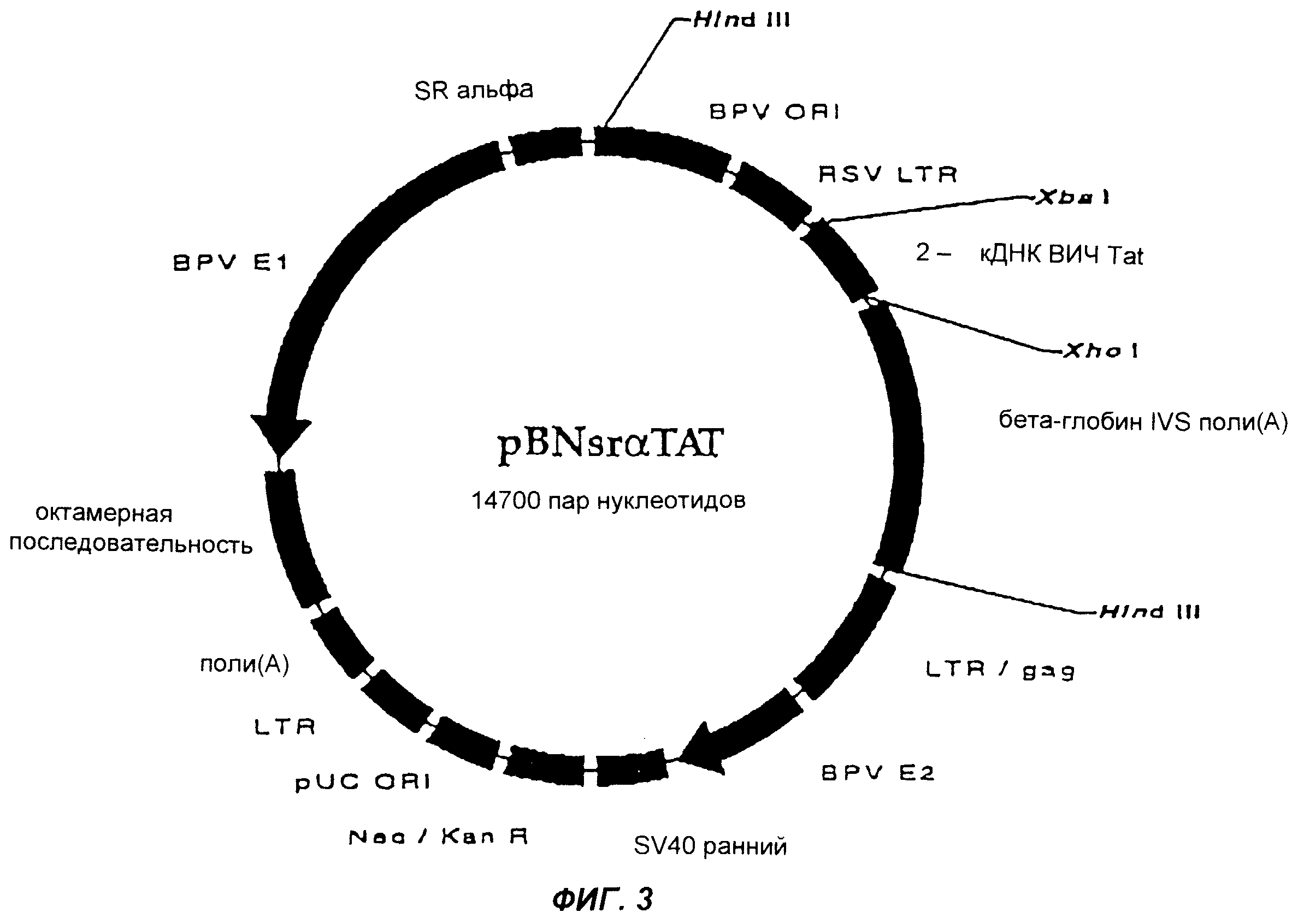
Фиг.3 изображает плазмиду pBNsrαTAT согласно настоящему изобретению.
Фиг.4 изображает плазмиду pBNsrαNEF согласно настоящему изобретению.
Фиг.5 изображает экспрессию NEF в клетках COS-7, трансфицированных pBNsrαNEF. Пробы для вестерн-блоттинга взяты через 72 ч после трансфекции и визуализированы при помощи ECL.
Фиг.6 демонстрирует антитела к NEF в сыворотке мышей, иммунизированных pBNsrαNEF, выявленные при помощи вестерн-блоттинга. Пробы 1-4 были взяты через 2 недели после последней иммунизации, а пробы 5-8 были взяты через 4 недели после последней иммунизации.
Фиг.7 изображает ответы ЦТЛ у мышей, иммунизированных вектором pBNsrαNEF. Фиг.7А изображает ответы ЦТЛ, выраженные в % специфического лизиса клеток-мишеней, у четырех мышей, тестированных через две недели после последней иммунизации. Фиг.7Б изображает уровни через четыре недели после последней иммунизации. Специфический лизис, больший 4%, считается положительным.
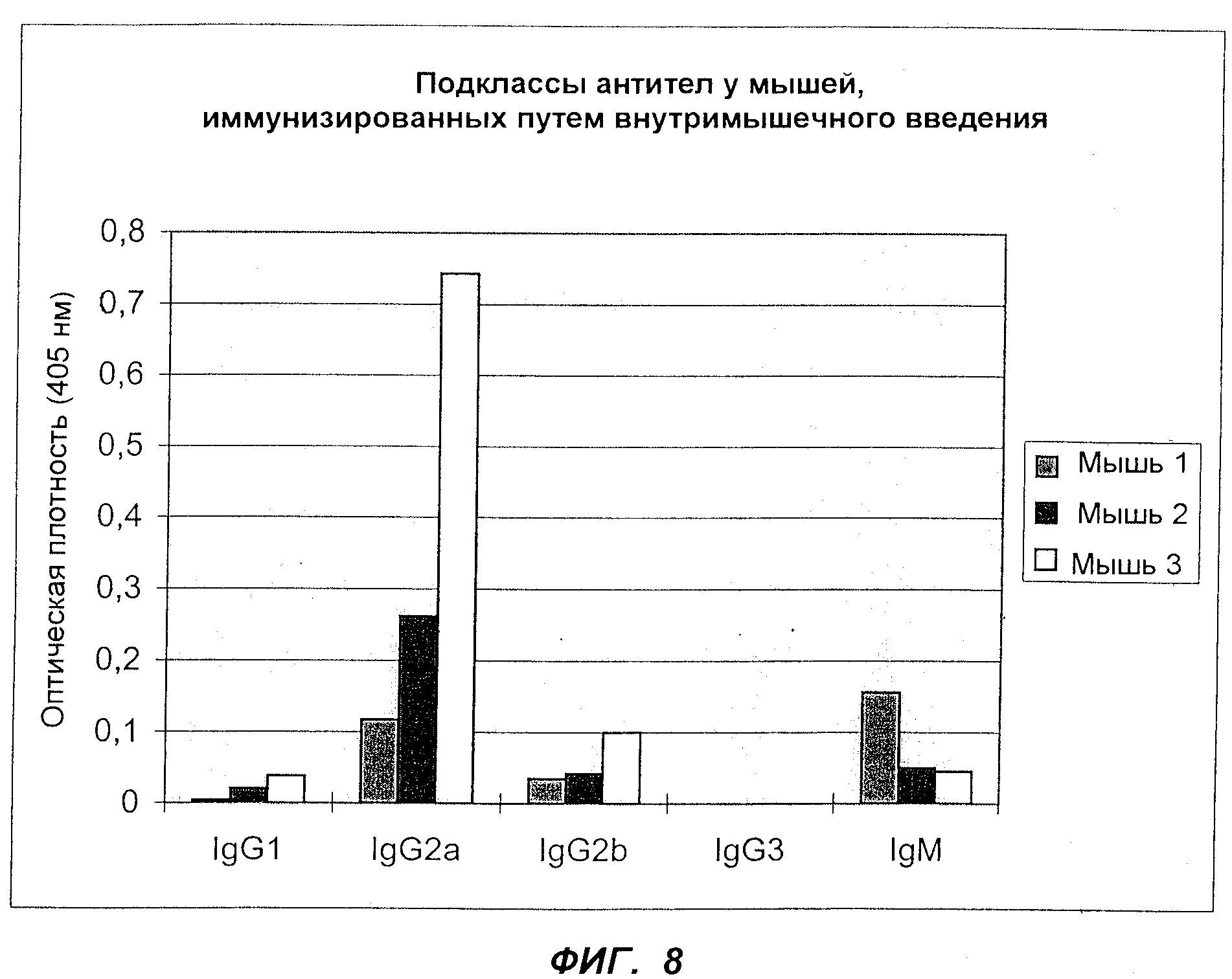
Фиг.8 изображает распределение иммуноглобулинов по подклассам у трех мышей, иммунизированных pBN-NEF.
Подробное описание изобретения
Согласно настоящему изобретению осуществляют вставку гетерологичной последовательности нуклеотидов ВИЧ в вектор, содержащий ген Е1 и ген Е2 вируса папилломы, минимальный источник репликации вируса папилломы (МО) и минихромосомный элемент поддержки вируса папилломы (ММЕ). Этот вектор, включающий Е1/Е2/МО/ММЕ, далее в настоящей работе будет обозначаться рВМ, и он подробно описан в публикации международной заявки WO 97/24451, включенной в настоящее описание посредством ссылки. Вышеуказанная патентная публикация основана на открытии, что репликация ДНК в вирусах папилломы, обеспечиваемая только МО, недостаточна для стабильного длительного персистирования, и необходима дополнительно другая вирусная последовательность ММЕ, и что наилучшие результаты возникают, если вектор дополнительно содержит гены Е1 и Е2 вируса папилломы.
"Вирус папилломы" при использовании здесь означает любого представителя семейства вирусов папилломы. Предпочтительным вирусом папилломы, используемым в изобретении, является вирус папилломы быка (BPV) или вируса папилломы человека (HPV).
"Е1" и "Е2" являются регуляторными белками вирусов папилломы, которые реплицируются посредством МО и которые необходимы для репликации.
"Минимальный источник репликации” (МО) - это минимальная нуклеотидная последовательность вируса папилломы, которая необходима для инициации синтеза ДНК.
"Микрохромосомный элемент поддержки (ММЕ)” относится к области генома вируса папилломы, с которой связываются вирусные белки или белки человека, необходимые для репликации вируса папилломы. ММЕ необходим для стабильной эписомальной поддержки МО вируса папилломы в клетке-хозяине.
Предпочтительно ММЕ содержит множественные сайты связывания активатора транскрипции - белка Е2.
"Самореплицирующийся вектор” при использовании в настоящей заявке означает векторную плазмиду, способную к автономной репликации в эукариотической клетке-хозяине.
"Гетерологичный" означает чужеродный. Например, по отношению к векторам согласно настоящему изобретению гетерологичная последовательность нуклеотидов означает последовательность, не связанную с папилломой.
"Иммунологически активный фрагмент” означает фрагмент, способный вызывать иммунологический ответ у реципиента.
"Нуклеотидные последовательности вируса папилломы, обязательно состоящие из” означает, что вектор содержит нуклеотидные последовательности вируса папилломы, которые необходимы и достаточны для длительной персистентности вектора и его репликации. Это означает, например, что лишние последовательности, такие как все онкогенные кодирующие последовательности папилломы, были делегированы из pBN векторов, использованных в настоящем изобретении.
Кроме генов Е1 и Е2, МО, ММЕ и NEF, REV или ТАТ генов, векторы согласно настоящему изобретению содержат промоторы для кодируемых белков, а также дополнительные регуляторные последовательности, последовательности полиаденилирования и интроны. Предпочтительно векторы также включают источник репликации бактериальной клетки-хозяина и один или несколько генов избирательных маркеров для получения векторной ДНК в бактериальной клетке-хозяине.
Существенной чертой pBN векторов является то, что они неспецифичны для клетки-хозяина. Это обусловлено тем, что экспрессия Е1 и Е2 белков контролируется промоторами, которые являются ненативными, то есть гетерологичными. Вышеуказанные промоторы либо функционируют в широком диапазоне клеток или тканей млекопитающих, либо являются клеточно- или тканеспецифичными.
В векторах согласно настоящему изобретению Е1 ген предпочтительно находится под контролем srα промотора или промотора тимидинкиназы (tk), а Е2 ген предпочтительно находится под контролем промотора LTR gаg. Гены NEF, REV или ТАТ могут находиться под контролем CMV промотора или RSV LTR промотора. Кроме того, вектор может содержать ранний промотор SV40 для индукции экспрессии гена для селекции с помощью антибиотика (неомицина или канамицина).
Источником репликации в клетке-хозяине в векторах согласно настоящему изобретению предпочтительно является pUC ORI, а используемыми селективными маркерами являются, например, канамицин и/или неомицин. Предпочтительно интроном является бета-глобин IVS.
Последовательность из восьми нуклеотидов, обнаруженная в плазмидах на основе ТК-промотора, является некодирующей последовательностью октамерного белка. Она не имеет функционального значения в плазмиде, но была необходима для создания сайтов рестрикции, пригодных для получения конечных плазмид.
Гены NEF, REV или ТАТ для вставки в pBN могут быть получены из нескольких торговых фирм, например, плазмида рКР59, которую можно приобрести в хранилище МНС AIDS Reagent Project. Вышеуказанные гены хорошо известны и были полностью секвенированы (Wain-Hobson, et al. Cell 40: 9-17, 1985). Конечно, можно также произвести вставку последовательности, кодирующей только иммунологически активный фрагмент вышеуказанных белков ВИЧ.
Гены NEF, REV или TAT или их фрагменты вначале вставляют в соответствующий челночный вектор. Эти векторы могут содержать или не содержать МО-области. В примерах проиллюстрированы два челночных вектора: pNp177, который не содержит МО, и pUE83, который содержит МО. Конечно, можно использовать и другие челночные векторы. Как челночные векторы, так и конечные векторы согласно настоящему изобретению предпочтительно мультиплицируют в Eschenchia coli. Примеры конечных pBN-NEF, pBN-REV или pBN-TAT векторов согласно настоящему изобретению приведены на фиг.2, 3 и 4. Векторы согласно настоящему изобретению стабильны и реплицируются с образованием большого числа копий. После трансфекции в эукариотическую клетку-хозяина вектор (плазмида) будет мультиплицироваться и давать 100-1000-кратное число новых плазмид, каждая из которых способна экспрессировать необходимый ВИЧ-белок.
Клетка-хозяин, заявляемая в настоящем изобретении, может быть либо эукариотической клеткой, трансфицированной вектором, или прокариотической клеткой, трансформированной вектором. Эукариотическая клетка предпочтительно является клеткой млекопитающего, а прокариотическая клетка предпочтительно является бактериальной клеткой, особенно Е. coli.
Экспрессия NEF, REV и ТАТ ВИЧ полученными плазмидными векторами согласно настоящему изобретению была проанализирована как на трансфицированных клетках COS-7, так и на мышах, иммунизированных вышеуказанными плазмидами. Высокую экспрессию ВИЧ-белков можно было продемонстрировать на клетках COS-7, иммунизированные мыши также показали выраженные гуморальные и клеточные (CTL) иммунные ответы. Выраженный ЦТЛ-ответ был также продемонстрирован на обезьянах. Эти результаты показывают, что векторы согласно настоящему изобретению потенциально могут использоваться в качестве эффективных вакцин против ВИЧ.
Далее было продемонстрировано, что смесь pBN векторов, кодирующих различные регуляторные белки ВИЧ, увеличивает иммунный ответ с помощью нескольких регуляторных генов. Настоящее изобретение поэтому включает вакцины, содержащие смесь векторов, кодирующих различные регуляторные белки ВИЧ или их иммунологически активные фрагменты, и использование вышеуказанной смеси при производстве вакцины и для лечения или профилактики ВИЧ. Вакцина может содержать смесь векторов, кодирующих все три различных регуляторных белка. Вакцины согласно настоящему изобретению могут также содержать другие гены или фрагменты генов, например, выбранные из группы, состоящей из структурных генов ВИЧ.
Описание примеров осуществления изобретения
Настоящее изобретение далее иллюстрируется нижеследующими примерами. Примеры подробно описывают некоторые примеры осуществления изобретения, но их не следует интерпретировать как ограничивающие изобретение, которое определено прилагаемой формулой изобретения.
Пример 1
Клонирование REV и ТАТ генов ВИЧ-1 в самореплицирующихся плазмидах pBNsr-α и pBNtk
Получение pBNtkREV и pBNsraTAT
Фаза 1:
REV и ТАТ гены ВИЧ-1 из изолированного BRU, называемого также LAI (Wain-Hobson et al. Cell 40: 9-17, 1985), были амплифицированы из векторов pcREV и рсТАТ (Arya et al. Science 229: 69-73, 1985) с использованием Taq ДНК-полимеразы Dynazyme (Finnzymes, Финляндия) и нижеследующих праймеров, которые имеют сайты рестрикции для ферментов Xhol и Хbа1:
Для REV:
5’-TTTTTCTAGAACCATGGCAGGAAGAAGCGGA-3’
5’-TTTTCTCGAGCTATTCTTTAGTTCCCTGG-3’
Для TAT:
5’-TTTTTCTAGAACCATGGAGCCAGTAGATCCT-3’
5’-TTTTCTCGAGCTAATCGAACGGATCTGC-3’
Амплифицированные гены и челночный вектор pUE83 (фиг.3) ферментативно расщепляли при +37°С ферментами Xbal и Xhol (New England Biolabs, США) в течение ночи, чтобы получить совместимые концы. Полученные при расщеплении фрагменты ДНК анализировали на 1,5%-ном агарозном геле и дополнительно очищали с использованием набора Band Prep Kit (Pharmacia Biotech, Швеция). Каждый ген лигировали к вектору по отдельности, используя Т4 ДНК-лигазу (New England Biolabs, США), в ходе инкубации в течение ночи при +16°С. Продукты лигирования трансформировали в компетентные клетки Е. соli из набора One Shot Kit (Invitrogen, Нидерланды), которые наносили на LB-планшеты, содержащие канамицин для селекции. Минипрепараты приготавливали из растущих клонов, и анализ на наличие клонированных генов проводили путем ферментативного расщепления ферментами XhoI и XbaI. Присутствие клонированных генов также подтверждали при помощи полимеразной цепной реакции (ПЦР) из минипрепаратов с использованием вышеуказанных праймеров. Клоны, содержащие нужный ген, массово культивировали, а плазмиды очищали с использованием колонок Megaprep (Qiagen, Германия).
Фаза 2:
Фрагмент ДНК, содержащий BPVori, промотор RSV LTR, REV- или ТАТ-ген и бета-глобин IVS поли(А), выделяли из вектора-челнока путем ферментативного расщепления ферментом Hind III (New England Biolabs, США) и очищали с использованием 1%-ного агарозного геля и набора Band Prep Kit. Лигирование выделенных с помощью Hind III и дефосфорилированных (щелочная фосфатаза, CIP, Promega, США) pBNsrα или pBNtk, трансформацию клеток, подтверждение присутствия клонированного гена и очистку плазмид осуществляли так же, как и в Фазе 1.
Образующиеся в результате плазмиды имеют название pBNtkREV и pBNsrαTAT и представлены на фиг. 2 и 3.
Пример 2
Клонирование ВИЧ-1 NEF в самореплицирующуюся плазмиду pBNsrα
Получение pBNsrαNEF
Фаза 1:
NEF ген ВИЧ-1 был получен из плазмидного вектора pcNEF, который содержал LAI изолят NEF гена, вставленный в рсТАТ вектор, не содержащий ТАТ гена. NEF ген, используемый для дальнейшего клонирования, был получен как фрагмент размером 1,3 тысяч пар нуклеотидов путем ферментативного расщепления при помощи Spe I и Hind III из pcNEF. Чтобы устранить реформирование сайта Hind III при лигировании, после расщепления с помощью Hind III фрагмент обрабатывали ферментом Кленова и смесью dATP, dCTP, dGTF нуклеотидов, после чего осуществляли расщепление с помощью Spe I. Полученные фрагменты разделяли путем электрофореза в 1%-ном агарозном геле параллельно со стандартными маркерами размера. Полосы нужного размера вырезали и выделяли ДНК с использованием набора Sephaglas Bandprep Kit (Pharmacia Biotech) в соответствии с протоколом изготовителя.
Челночный вектор pNP177, изображенный на фиг. 1, первоначально расщепляли с помощью Хhо I, затем обрабатывали ферментом Кленова и смесью dNTP и наконец расщепляли с помощью Хbа I. Вектор также обрабатывали интестинальной щелочной фосфатазой телят (CIF).
Фрагмент, содержащий NEF ген, лигировали с расщепленным вектором pNP177 с использованием Т4 лигазы при +14°С в течение ночи. Набор компетентных Е. coli One Shot Kit (Invitrogen) использовали для трансформации. Позитивные клоны идентифицировали с использованием расщеплений рестрицирующими ферментами и электрофореза. Плазмидную ДНК далее амплифицировали в Е. coli и очищали в больших количествах при помощи колонок Qiagen. Образующуюся в результате плазмиду назвали pNP177cHIVNEF
Фаза 2:
Челночный вектор pNP177 сконструирован так, что он имеет только два сайта для Hind III, между которыми может быть клонирована вставка Поэтому расщепление плазмиды при помощи Hind III дает фрагмент, который может быть клонирован далее. Полученный с помощью Hind III фрагмент pNP177cHIVNEF клонировали в pBNsrα. Вектор расщепляли с помощью Hind III и обрабатывали CIP (интестинальной щелочной фосфатазой телят). Были использованы те же способы выделения полос, лигирования и трансформации, что и в первой фазе, а корректную ориентацию вставки подтвердили рестрикционным анализом. Конечная плазмида получила название pBNsrαNEF, и она показана на фиг.4.
Пример 3
Демонстрация экспрессии ВИЧ-NEF in vitro
3А. Трансфекции
Чтобы проанализировать экспрессию pBN-конструкций из примеров 1 и 2, их при помощи электропорации трансфицировали в клетки COS-7. 10 мг pBNβ-Gal в качестве контроля и 10 мкг pBN-NEF, трансфицированного совместно с 1 мкг pCMVβ-Gal, электропорировали в три миллиона клеток в каждом случае. В качестве переносчика использовали ДНК из спермы лосося. Электропорацию осуществляли при емкости 960 мФ и напряжении 260 В. Производили измерения концентрации белка и активности β-gal с целью контроля эффективности трансфекции и калибровки количества лизатов в анализе путем вестерн-блоттинга.
3Б. Иммуногистохимия и вестерн-блоттинг
Накопленные клетки, трансфицированные pBN-конструкциями, лизировали для использования в вестерн-блоттинге После лизиса пробы белка кипятили в буфере для проб и переносили в 12%-ный ДСН-полиакриламидный гель, затем переносили на нитроцеллюлозный фильтр с диаметром пор 2 мкм, который блокировали 5%-ный раствором молока в TBS. В качестве первичного антитела использовали смесь моноклональных антител мыши к NEF (Ovod V. Et al. AlDS 6 25-34, 1992), разведенных в соотношении 1: 1000 каждое. Вторичным антителом было биотинилированное антитело к белкам мышей в разведении 1: 500.
После трансфекции в COS-клетки векторы вызывали сильную кратковременную экспрессию регуляторного белка ВИЧ, что выявлялось вестерн-блоттингом лизированных клеток через 72 ч. Результаты, полученные с pBNsrαNEF, показаны на фиг.5 При длительном культивировании трансфицированных клеток экспрессия NEF сохранялась в течение периода до 7 недель в клетках, трансфицированных самореплицирующимся pBN вектором.
NEF-трансфицированные клетки также были использованы для приготовления цитоспин-препаратов, их окрашивали гематоксилином, а моноклональные антитела к NEF и затем биотинилированные антитела к белкам мыши были использованы для иммуногистохимии, как описано в работе Ovod et al. (см. выше). Цитоспин-срезы выявили экспрессию, поскольку позитивное окрашивание было видно в большом числе клеток в виде гранул, занимающих цитоплазму клеток. Часть экспрессирующих NEF клеток обнаружила морфологические признаки клеточной деструкции, что свидетельствовало об апоптозе. Уровень экспрессии был высок, хотя условия для клеток становились хуже.
Пример 4
Демонстрация иммуногенности экспрессии ВИЧ-Nef, ВИЧ-Tat или ВИЧ-Rev векторами pBNsrα и pBNtk in vivo
4А. Генная пушка
ДНК преципитировали (осаждали) на частички золота диаметром 1 мкм с использованием спермидина и СаСl2 в соответствии с процедурой, описанной в руководстве по эксплуатации генной пушки Helios Gene Gun (Лаборатории Bio Rad). Были изготовлены картриджи, каждый из которых содержал 0,5 мг золота и 1 мкг ДНК. Количество ДНК контролировали спектрофотометрически в соответствии с инструкциями в руководстве. Инокуляции производили с использованием системы Helios Gene Gun System (Лаборатории Bio-Rad). Давление гелия при разряде с целью доставки ДНК устанавливали равным 300 фунтов на квадратный дюйм (примерно 21 кг/см2). Во время проведенной оптимизации условий бомбардировки авторами настоящего изобретения было обнаружено, что 300 фунтов на квадратный дюйм достаточно для продвижения частиц в дерму.
4Б. Иммунизации
Использовали самок мышей Balb/c в возрасте 6-8 недель. Перед иммунизациями мышей анестезировали и у них удаляли шерсть на брюшке.
Инокуляции кожи на брюшке 8 мышей были выполнены в дни 1, 2, 3, 10, 11 и 12 с использованием генной пушки, описанной выше, в соответствии с инструкциями изготовителя. Каждой мыши вводили в общей сложности 6 мкг pBN-NEF. Четырех мышей из обеих групп безболезненно умерщвляли через две недели после последней иммунизации, а оставшихся четырех мышей - через 4 недели после последней иммунизации. Брали пробы сыворотки для вестерн-блоттинга, а спленоциты накапливали для анализа на ЦТЛ. Все восемь мышей, иммунизированных pBN-NEF вектором, показали ответ антител через 2 недели и через 4 недели (фиг. 6). Интенсивность реакции при вестерн-блоттинге варьировала
4В. Измерение цитотоксической активности Т-клеток у иммунизированных мышей
4В1. Стимуляция клеток-эффекторов
У иммунизированных мышей через две недели (16 мышей) и четыре недели (16 мышей) после иммунизации асептически удаляли селезенки. Их измельчали в буфере Хэнкса, фильтровали через марлю и удаляли эритроциты. Затем клетки суспензировали в концентрации 5×106 /мл в культуральной среде среда RPMI 1640, содержащая 10% фетальной сыворотки телят (FCS, GibcoBRL), 1% глутамина, 100 Ед пенициллина на мл, 100 мкг стрептомицина на мл и 5×10-5М 2-меркаптоэтанола. Реагирующие клетки (5×106) культивировали в колбе для культур клеток объемом 25 мл в 5 мл культуральной среды совместно с 4×106антигенпредставляющих клеток (АПК; см. ниже) в течение пяти дней. В первый день к клеткам добавляли 10 Ед/мл рекомбинантного интерлейкина-2 (rlL-2) (Hiserodt J. Et al. J. Immunol. Jul, 135(1): 53-59, 1985, Lagrandene M. et al. J. Virol. Mar., 71(3): 2303-2309, 1997; tsuji Т. et al. Immunology Jan. 90(1): 1-6, 1997; Vahlsing H.L. et al. Journal of Immunological Methods 175: 11-22, 1994, Varkila К. et al. Acta path. Microbiol. Immunol. Scand. Sect. С 95: 141-148, 1987).
4В2. Антигенпредставляющие клетки
Сингенные клетки мастоцитомы Р815 (H-2d) инфицировали модифицированным вирусом коровьей оспы Ankara (MBA), перестроенным так, чтобы он экспрессировал ген ВИЧ-1 LAI NEF (MBA-HIVNEF). MBA - это сильно ослабленный слабореплицирующийся вирус коровьей оспы, который может служить эффективным вектором для экспрессии гетерологичных генов, обеспечивая исключительно высокий уровень биологической безопасности (Sutter G. Et al. J. Virol. Jul, 68(7): 4109-4116, 1994, Sutter et al. Vaccine 12(11): 1032-1039, 1994; Drexler I. Et al. J. Gen. Virol. 79: 347-352, 1998; Sutter G. et al., Proc. Natl. Acad. Sci. USA 89: 10847-10851, 1992). Заражение МВА-HIVNEF производили при числе заражений (ЧЗ), равном 5, на 24-ячеечных планшетах (1×106 клеток на ячейку). После абсорбции вируса в течение 1 часа при +37°С клетки инкубировали в течение 15 ч при +37°С (Carmichael A. Et al. Journal of Virology 70: 8468-8476, 1996). После заражения клетки дважды промывали фосфатным буферным раствором (PBS), содержащим 10% фетальной сыворотки телят, и суспензировали в этом растворе до концентрации 5×106 клеток/мл. Затем клетки обрабатывали γ-излучением в дозе 5000 рад и промывали культуральной средой перед добавлением отвечающих клеток.
4В3. Анализы на цитотоксичность
Активность ЦТЛ была исследована с помощью анализа на выделение51Сr (Hiserodt J. Et al. J. Immunol. Jul, 135(1): 53-59, 1985; Lagrandene M. et al. J. Virol. Mar, 71(3): 2303-2309, 1997; Varkila К. et al. Acta path. Microbiol. Immunol. Scand. Sect. С 95: 141-148, 1987; van Baalen С. et al. AIDS 7: 781-786, 1993). В кратком изложении, 2×106 клеток Р-815 инфицировали MBA-HIVNEF так же, как описано выше для антигенпредставляющих клеток. После инфицирования клетки один раз промывали культуральной средой, не содержащей сыворотки. Клетки-мишени затем суспензировали в 200 мкл культуральной среды, не содержащей сыворотки, и добавляли 100 мкКи51Cr (Amersham)/1×106 клеток на 1 час при 37°С. Затем клетки-мишени четыре раза промывали в среде и суспензировали до концентрации 5×104/мл. Стимулированные эффекторные клетки один раз промывали культуральной средой, прежде чем добавить к клеткам-мишеням. Клетки-мишени наносили на 96-ячеечный планшет в количестве 100 мкл на ячейку (5×103) и добавляли эффекторные клетки в виде трех образцов объемом 100 мкл при соотношении эффектор: мишень, равном 50, 25 и 12,5. Для спонтанного выделения клетки-мишени наносили на 6 ячеек в 100 мкл культуральной среды, а для максимального выделения - на 6 ячеек с 2,5% Тритона-Х-100. Планшеты быстро поворачивали, инкубировали в течение 4 ч при 37°С, а число распадов в супернатантах подсчитывали с помощью гамма-счетчика. Процент специфического лизиса клеток-мишеней рассчитывали как (выделение51Сr в анализе - спонтанное выделение)/(максимальное выделение - спонтанное выделение)х100. Процент специфического лизиса больший или равный 6% считался положительным.
Пример, демонстрирующий активность ЦТЛ у 6 из 8 мышей, иммунизированных pBNsrαNEF, изображен на фиг.7.
Г. Гуморальный иммунный ответ у иммунизированных мышей
Чтобы проанализировать образование антител к ВИЧ-1 NEF у иммунизированных мышей, сывороточный белок NEF подвергали электрофорезу на PAGE, переносили на нитроцеллюлозные фильтры и реактивность антител определяли, как описано выше.
Краткое содержание результатов
Результаты анализов с трансфекцией и иммунизацией суммированы в табл.1. Иммунный ответ у иммунизированных мышей оценивали путем иммуноблоттинга (вестерн-блоттинг) для гуморального ответа и с помощью анализа на цитотоксические Т-лимфоциты (ЦТЛ) для клеточного иммунитета. Как видно из табл.1, все восемь мышей, иммунизированных экспрессирующим NEF вектором, обнаружили и гуморальный, и клеточный иммунный ответ.

В настоящем исследовании мы продемонстрировали, что иммунизация с помощью ДНК с использованием самореплицирующегося вектора экспрессии, в соответствии с описанием, может вызывать легко выявляемый ЦТЛ-ответ у мышей. Кроме того, был получен гуморальный иммунный ответ. В свете вышеприведенных результатов можно предположить, что плазмиды pBN-NEF, pBN-REV и pBN-TAT могут экспрессировать NEF, REV и TAT in vivo в количестве, достаточном для того, чтобы вызвать как гуморальный, так и клеточный иммунный ответ, необходимый для профилактики и лечения ВИЧ.
Пример 5
Измерение ответа n|Th типа у мышей, иммунизированных путем внутримышечного введения
Гуморальный иммунный ответ, обнаруживаемый у мышей, иммунизированных pBN-конструкциями, экспрессирующими регуляторные белки ВИЧ, был проанализирован на специфичность подкласса иммуноглобулинов. Хорошо известно, что ответ с выделением антител, среди которых доминируют lgG2a подклассы иммуноглобулинов, характерен для Тh1-типа клеточного иммунного ответа, тогда как lgG1, lgG2b и lgG3 характерны для Тh2-клеточного ответа. Более того, известно, что ответы Тh1-типа индуцируют и способствуют клеточным цитотоксическим иммунным ответам (ЦТЛ-ответам), тогда как Тh2-ответ будет индуцировать ответ антител, но менее активные ЦТЛ-ответы.
График иммунизации был следующим.
Четыре мыши Balb/c были иммунизированы шесть раз 24 мкг pBN-Nef из примера 2 в течение двух недель, общее количество ДНК поэтому составило 144 мкг, и сыворотку анализировали на антитела путем вестерн-блоттинга. У трех из четырех мышей были антитела к ВИЧ-1 Nef, и подкласс этих антител определяли с помощью твердофазного иммуноферментного анализа (ELISA) следующим образом.
Антиген пипеткой наносили на чашки Nunc Maxi Sorb для инкубации в течение ночи при +4°С; использовавшимся антигеном был ВИЧ-1 Nef белок (NIH, AIDS Research and Reference Reagent Program) в фосфатном буфере (50 нг/ячейку). Чашки после инкубации в течение ночи блокировали 1%-ным альбумином сыворотки быка (BSA, Sigma) и после этого инкубировали с сывороткой мышей (разведенной в соотношении 1: 100 блокирующим раствором) в течение 4 ч при комнатной температуре. Чашки промывали фосфатным буфером/ 0,1%-ным Твином 20 три раза и после этого фосфатным буфером два раза. В качестве вторичных антител использовали конъюгированные с пероксидазой антитела против антигенов мыши lgG1, lgG2a, lgG2b, lgG3 и IgM (Calbiochem), разведенные в соотношении 1: 1000 блокирующим раствором, и чашки инкубировали в течение 2 ч при комнатной температуре. После стадий промывки, выполненных так, как описано выше, добавляли субстрат ABTS (Sigma) и Н2O2 в цитратном буфере на 10 мин и производили фотометрическое определение на ELISA-регистрирующем устройстве при длине волны 405 нм.
Результаты представлены на фиг.8. Наивысший ответ у трех мышей был обнаружен для lgG2 вторичных антител (абсорбция при длине волны 405 нм 0,117, 0,262, 0,743 соответственно), ответ для антител lgG1 был значительно ниже (А(405) 0,004, 0,020, 0, 038). Это свидетельствовало, что тип ответа у этих мышей после внутримышечной иммунизации в основном является ответом Тh1-типа, приводящим к клеточному иммунному ответу.
Результаты демонстрируют, что практически у всех мышей был сильный ответ lgG2 типа против рекомбинантного NEF, тогда как концентрация антител, представляющих другие подклассы IgG, была очень низкой Результаты далее показали, что pBN NEF конструкции способны вызывать ответ Тh1-типа и вследствие этого сильный клеточный иммунный ответ, способный разрушать ВИЧ-инфицированные клетки на ранней фазе вирусного инфекционного цикла.
Пример 6
Генерация клеточного иммунного ответа у обезьян Масаса fasciculans pBN-конструкциями, экспрессирующими регуляторные белки ВИЧ-1
Эксперименты с мышами ясно показали, что pBN NEF, pBN REV и pBN ТАТ конструкции способны вызывать ЦТЛ-ответ у иммунизированных мышей. Был проведен дополнительный эксперимент с нечеловекообразными обезьянами для подтверждения того, что конструкции могут быть использованы в качестве профилактических вакцин у людей. Важно продемонстрировать, что иммунный ответ может быть также генерирован у нечеловекообразных приматов, которые генетически ближе к людям и которые могут быть инфицированы соответствующим ретровирусом приматов SIV, который близкородственен ВИЧ-1 и ВИЧ-2, инфицирующим людей. Поэтому был проведен эксперимент, в котором обезьян Масаса fascicularis иммунизировали pBN-конструкциями, экспрессирующими регуляторные белки ВИЧ-1 NEF, REV и ТАТ. Эти белки получали, как описано в примерах 1 и 2. Три обезьяны Масаса fascicularis были иммунизированы смесью pBN NEF, pBN REV и pBN TAT. Три обезьяны служили в качестве контроля. График иммунизации был следующим.
Обезьян иммунизировали общим количеством, равным 300 мкг, pBN-NEF, pBN-REV и pBN-TAT (100 мкг каждой конструкции) дважды. Первую иммунизацию производили в дельтовидную мышцу, а вторую (через 2 недели) производили интрадермально Анализы на цитотоксические Т-лимфоциты были выполнены через два месяца после последней иммунизации, как описано в примере 4С3. Результаты оказались следующими.
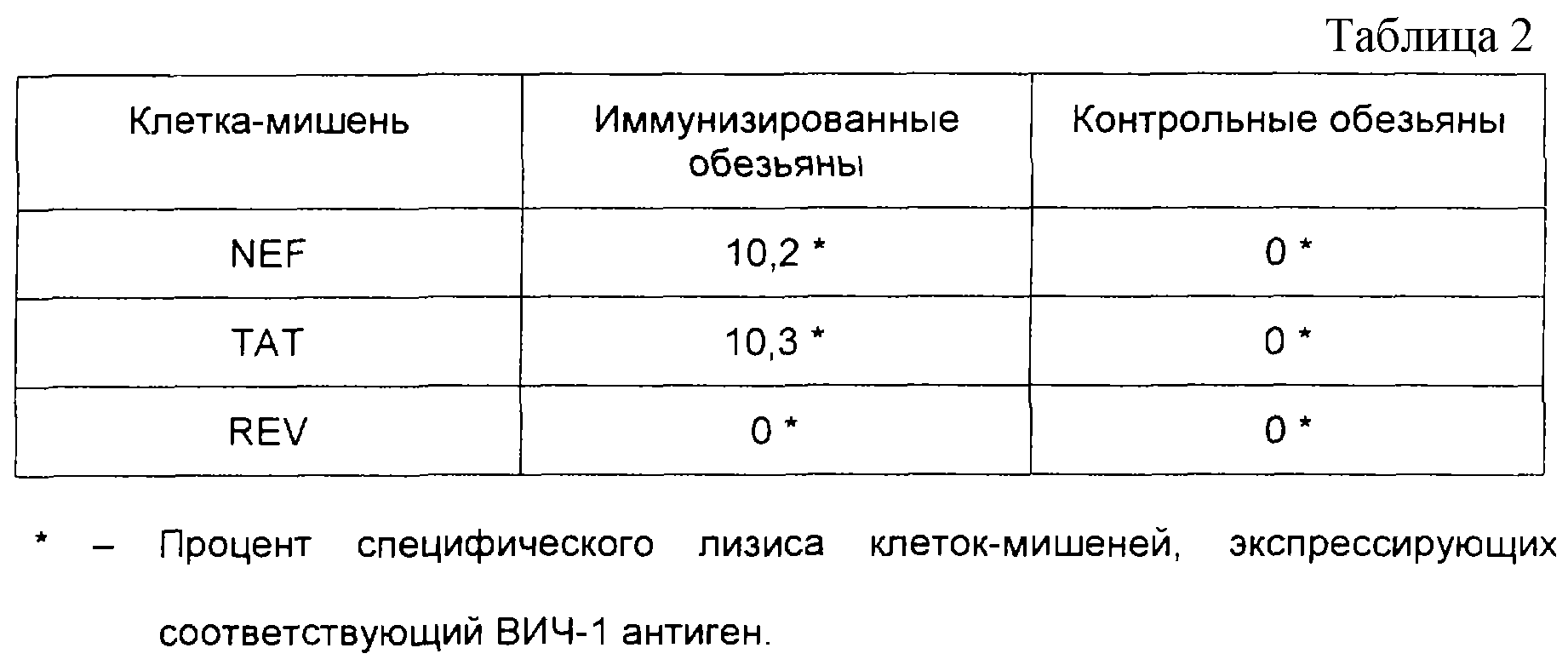
У одной из трех обезьян был выраженный ЦТЛ-ответ против аутологичных В-клеток, экспрессирующих NEF и ТАТ ВИЧ-1. Результаты демонстрируют, что не только мыши, но и приматы могут быть иммунизированы pBN-конструкциями, экспрессирующими регуляторные белки ВИЧ, и иммунизированные животные будут развивать клеточный иммунный ответ, опосредованный Т-клетками, характеризующийся присутствием цитотоксических Т-лимфоцитов, которые способны разрушать ВИЧ-инфицированные клетки на ранней фазе вирусного инфекционного цикла. Более того, результаты показывают, что конструкции могут вводиться одновременно в виде смеси и что присутствие одной конструкции в смеси не интерферирует с иммунным ответом, генерируемым другой конструкцией.
Реферат
Изобретение относится к иммунологии, а точнее к созданию вакцины против ВИЧ на основе ДНК. Предложен самореплицирующийся рекомбинантный вектор, экспрессирующий регуляторные белки ВИЧ ТАТ, NEF, REV, способ его получения, вакцина для иммунизации против ВИЧ на основе ДНК, содержащая указанный вектор, способ лечения или профилактики ВИЧ. Технический результат заключается в создании самореплицирующегося рекомбинантного вектора, экспрессирующего регуляторные белки ВИЧ, а также безопасной вакцины против ВИЧ. 4 н. и 8 з.п. ф-лы, 8 ил., 2 табл.

Комментарии