Пептидомиметические макроциклы - RU2582678C2
Код документа: RU2582678C2
Чертежи















































































































































































































































































































































































































































































































































Описание
Перекрестная ссылка на родственные заявки
Настоящая заявка заявляет приоритет на основании предварительных заявок США № 61/373701, поданной 13 августа 2010 года, № 61/373638, поданной 13 августа 2010 года, и № 61/374163, поданной 16 августа 2010 года, которые включены в данное описание в качестве ссылки во всей полноте.
Уровень техники изобретения
Человеческий белок - фактор транскрипции p53 индуцирует прекращение клеточного цикла и апоптоз в ответ на повреждение ДНК и клеточный стресс и, следовательно, играет важную роль в защите клеток от злокачественной трансформации. E3 убихитин-лигаза HDM2 осуществляет отрицательную регуляцию функции p53 путем непосредственного связывающего взаимодействия, которое нейтрализует трансактивационную активность p53, приводя к экспорту белка p53 из ядра и деградации мишеней p53 по убихитилирующему - протеасомальному пути. Утрата активности p53 в результате делеции, мутации или сверхэкспрессии HDM2 представляет собой наиболее распространенный дефект при раковых заболеваниях человека. Опухоли, экспрессирующие p53 дикого типа, являются чувствительными к фармакологическим средствам, которые стабилизируют активный p53 или повышают его концентрацию. В данном контексте ингибирование активности HDM2 является обоснованным подходом к восстановлению активности p53 и возобновлению способности раковых клеток вступать в апоптоз in vitro и in vivo. Совсем недавно HDMX (HDM4) был идентифицирован как аналогичный отрицательный регулятор p53, причем исследования показали наличие значительной структурной гомологии среди p53-связывающих поверхностей HDM2 и HDMX.
Белок-белковые взаимодействия p53-HDM2 и p53-HDMX опосредуются одним и тем же альфа-спиральным трансактивационным доменом, состоящим из 15 остатков, который вставляется в гидрофобные щели на поверхности HDM2 и HDMX. Три остатка указанного домена p53 (F19, W23 и L26) являются необходимыми для связывания HDM2 и HDMX. Настоящее изобретение предлагает пептидомиметические макроциклы на основе p53, которые модулируют p53 путем ингибирования взаимодействий между p53 и HDM2, p53 и HDMX, или p53 и обоими белками HDM2 и HDMX, и которые можно использовать для лечения заболеваний, включающих в себя, без ограничения, рак и другие гиперпролиферативные болезни.
Сущность изобретения
Ниже описаны пептиды со стабильными поперечными связями, соединенные с фрагментом человеческого p53 ("p53-пептидомиметические макроциклы"). Указанные поперечносшитые пептиды содержат, по меньшей мере, две модифицированные аминокислоты, которые вместе образуют внутримолекулярную поперечную связь, способствующую стабилизации альфа-спиральной вторичной структуры фрагмента p53, что является важным для связывания p53 с HDM2 и для связывания p53 с HDMX. Соответственно, поперечносшитый полипептид, описанный в данном документе, может обладать улучшенной биологической активностью по сравнению с соответствующим полипептидом, не содержащим поперечных связей. Полагают, что p53 пептидомиметические макроциклы препятствуют связыванию p53 с HDM2 и/или p53 с HDMX, высвобождая функциональный p53 и ингибируя его разрушение. Описанные здесь p53 пептидомиметические макроциклы можно использовать в терапии, например, для лечения рака и других нарушений, характеризующихся нежелательно низким уровнем p53, или низкой активностью p53, и/или для лечения рака и других нарушений, характеризующихся нежелательно высоким уровнем HDM2 или HDMX. p53 пептидомиметические макроциклы также можно использовать для лечения любого заболевания, связанного с нарушением регуляции транскрипционного пути p53, приводящим к развитию состояний, связанных с избыточным выживанием клеток и пролиферацией, таких как рак и аутоиммунные заболевания, а также состояний, характеризующихся неадекватным прекращением клеточного цикла и апоптозом, таких как нейродегенерация и иммунодефициты. В некоторых случаях p53 пептидомиметические макроциклы связываются с HDM2 (например, GenBank®, № доступа: 228952; GI:228952) и/или HDMX (который также обозначают HDM4; GenBank®, № доступа: 88702791; GI:88702791).
В одном аспекте настоящее изобретение предлагает пептидомиметический макроцикл, содержащий аминокислотную последовательность, которая, по меньшей мере, примерно на 60%, 80%, 90% или 95% идентична аминокислотной последовательности, выбранной из группы, включающей в себя аминокислотные последовательности, описанные в таблице 1, 2, 3 или 4. Альтернативно аминокислотная последовательность указанного пептидомиметического макроцикла выбрана из группы, включающей в себя аминокислотные последовательности, описанные в таблице 1. Альтернативно аминокислотная последовательность упомянутого пептидомиметического макроцикла выбрана из указанных выше последовательностей и, кроме того, макроцикл не содержит тиоэфир или триазол. В некоторых воплощениях пептидомиметический макроцикл содержит спираль, такую как α-спираль. В других воплощениях пептидомиметический макроцикл содержит α,α-дизамещенную аминокислоту. Пептидомиметический макроцикл настоящего изобретения может содержать поперечный линкер, который соединяет α-положения, по меньшей мере, двух аминокислот. По меньшей мере одна из двух указанных аминокислот может представлять собой α,α-дизамещенную аминокислоту.
В некоторых воплощениях пептидомиметический макроцикл имеет формулу:

Формула I
где:
каждый A, C, D и E независимо обозначает природную или неприродную аминокислоту, а D и E независимо и необязательно содержат кэпирующую группу;
B представляет собой природную или неприродную аминокислоту, аналог аминокислоты,

R1 и R2 независимо обозначают -H, алкил, алкенил, алкинил, арилалкил, циклоалкил, циклоалкилалкил, гетероалкил или гетероциклоалкил, незамещенный или замещенный галогеном;
R3 обозначает водород, алкил, алкенил, алкинил, арилалкил, гетероалкил, циклоалкил, гетероциклоалкил, циклоалкилалкил, циклоарил или гетероциклоарил, необязательно замещенный R5;
L обозначает макроцикл-образующий линкер формулы -L1-L2-;
L1 и L2 независимо обозначают алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, циклоарилен, гетероциклоарилен или [-R4-K-R4-]n, каждый из которых необязательно замещен R5;
каждый R4 обозначает алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, арилен или гетероарилен;
каждый K обозначает O, S, SO, SO2, CO, CO2 или CONR3;
каждый R5 независимо обозначает галоген, алкил, -OR6, -N(R6)2, -SR6, -SOR6, -SO2R6, -CO2R6, флуоресцентный фрагмент, радиоизотоп или терапевтическое средство;
каждый R6 независимо обозначает -H, алкил, алкенил, алкинил, арилалкил, циклоалкилалкил, гетероциклоалкил, флуоресцентный фрагмент, радиоизотоп или терапевтическое средство;
R7 обозначает -H, алкил, алкенил, алкинил, арилалкил, циклоалкил, гетероалкил, циклоалкилалкил, гетероциклоалкил, циклоарил или гетероциклоарил, необязательно замещенный R5, или часть циклической структуры, содержащую остаток D;
R8 обозначает -H, алкил, алкенил, алкинил, арилалкил, циклоалкил, гетероалкил, циклоалкилалкил, гетероциклоалкил, циклоарил или гетероциклоарил, необязательно замещенный R5, или часть циклической структуры, содержащую остаток E;
v и w независимо обозначают целые числа в диапазоне 1-1000;
u обозначает целое число в диапазоне 1-10;
x, y и z независимо обозначают целые числа в диапазоне 0-10; и
n обозначает целое число в диапазоне 1-5.
В разных воплощениях пептидомиметический макроцикл содержит L1 и L2, где L1 и L2 ни по отдельности, ни в сочетании не содержат тиоэфир или триазол.
В других воплощениях пептидомиметический макроцикл может содержать поперечный линкер, соединяющий скелетную аминогруппу первой аминокислоты со второй аминокислотой, входящей в состав пептидомиметического макроцикла. Например, изобретение предлагает пептидомиметические макроциклы формулы (IV) или (IVa):
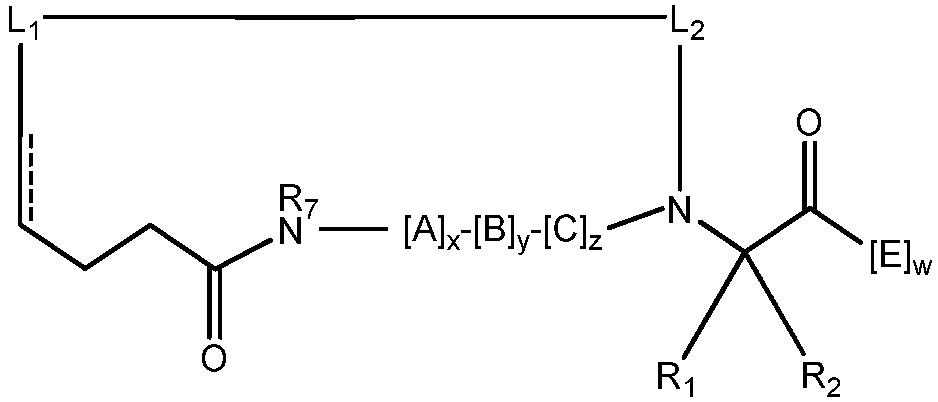
где:
каждый A, C, D и E независимо обозначает природную или неприродную аминокислоту, а D и E независимо и необязательно содержат кэпирующую группу;
B обозначает природную или неприродную аминокислоту, аналог аминокислоты,

R1 и R2 независимо обозначают -H, алкил, алкенил, алкинил, арилалкил, циклоалкил, циклоалкилалкил, гетероалкил или гетероциклоалкил, незамещенный или замещенный галогеном, или часть циклической структуры, содержащей остаток E;
R3 обозначает водород, алкил, алкенил, алкинил, арилалкил, гетероалкил, циклоалкил, гетероциклоалкил, циклоалкилалкил, циклоарил или гетероциклоарил, необязательно замещенный R5;
L1 и L2 независимо обозначают алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, циклоарилен, гетероциклоарилен или [-R4-K-R4-]n, каждый из которых необязательно замещен R5;
каждый R4 обозначает алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, арилен или гетероарилен;
каждый K обозначает O, S, SO, SO2, CO, CO2 или CONR3;
каждый R5 независимо обозначает галоген, алкил, -OR6, -N(R6)2, -SR6, -SOR6, -SO2R6, -CO2R6, флуоресцентный фрагмент, радиоизотоп или терапевтическое средство;
каждый R6 независимо обозначает -H, алкил, алкенил, алкинил, арилалкил, циклоалкилалкил, гетероциклоалкил, флуоресцентный фрагмент, радиоизотоп или терапевтическое средство;
R7 обозначает -H, алкил, алкенил, алкинил, арилалкил, циклоалкил, гетероалкил, циклоалкилалкил, гетероциклоалкил, циклоарил или гетероциклоарил, необязательно замещенный R5;
v и w независимо обозначают целые числа в диапазоне 1-1000;
u обозначает целое число в диапазоне 1-10;
x, y и z независимо обозначают целые числа в диапазоне 0-10; и
n обозначает целое число в диапазоне 1-5.
Кроме того, изобретение предлагает способ лечения рака у субъекта, включающий в себя введение субъекту пептидомиметического макроцикла настоящего изобретения. Изобретение также предлагает способ модуляции активности p53, или HDM2, или HDMX, у субъекта, включающий в себя введение субъекту пептидомиметического макроцикла настоящего изобретения, или способ препятствования взаимодействию p53 с белками HDM2 и/или HDMX у субъекта, включающий в себя введение субъекту такого пептидомиметического макроцикла.
Включение в качестве ссылки
Все публикации, патенты и патентные заявки, упомянутые в данном описании, включены в настоящий документ в качестве ссылки в такой степени, как если бы по поводу каждой отдельной публикации, каждого отдельного патента и каждой отдельной патентной заявки было бы конкретно и индивидуально указано, что они включены в качестве ссылки.
Краткое описание чертежей
Новые признаки настоящего изобретения подробно описаны в прилагающейся формуле изобретения. Облегчить понимание признаков и преимуществ настоящего изобретения помогают приведенные в нижеследующем подробном описании иллюстративные воплощения, основанные на принципах настоящего изобретения, и прилагаемые рисунки:
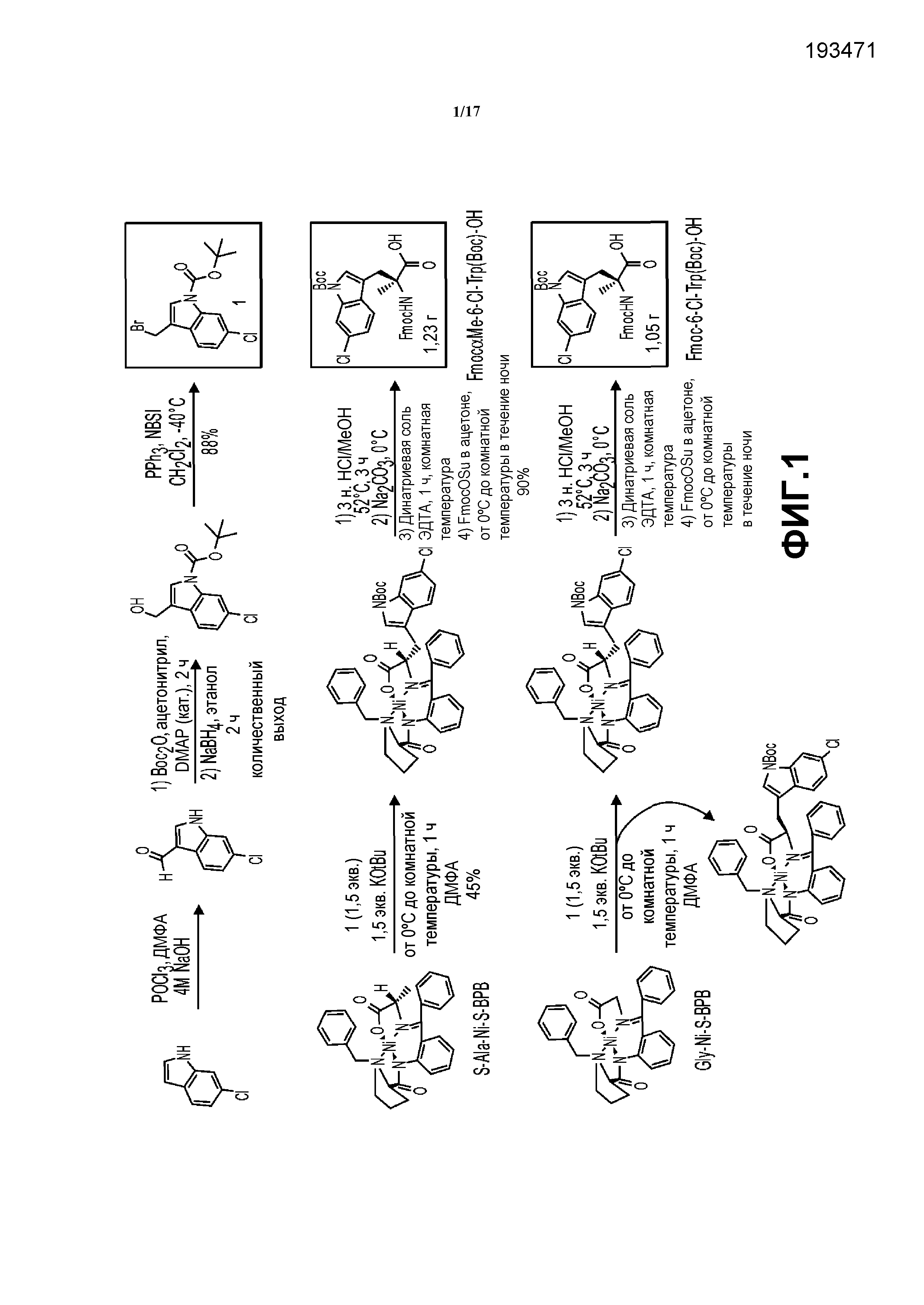
На фиг.1 описан синтез Fmoc-Me-6-хлортриптофана и Fmoc-6-хлортриптофана.
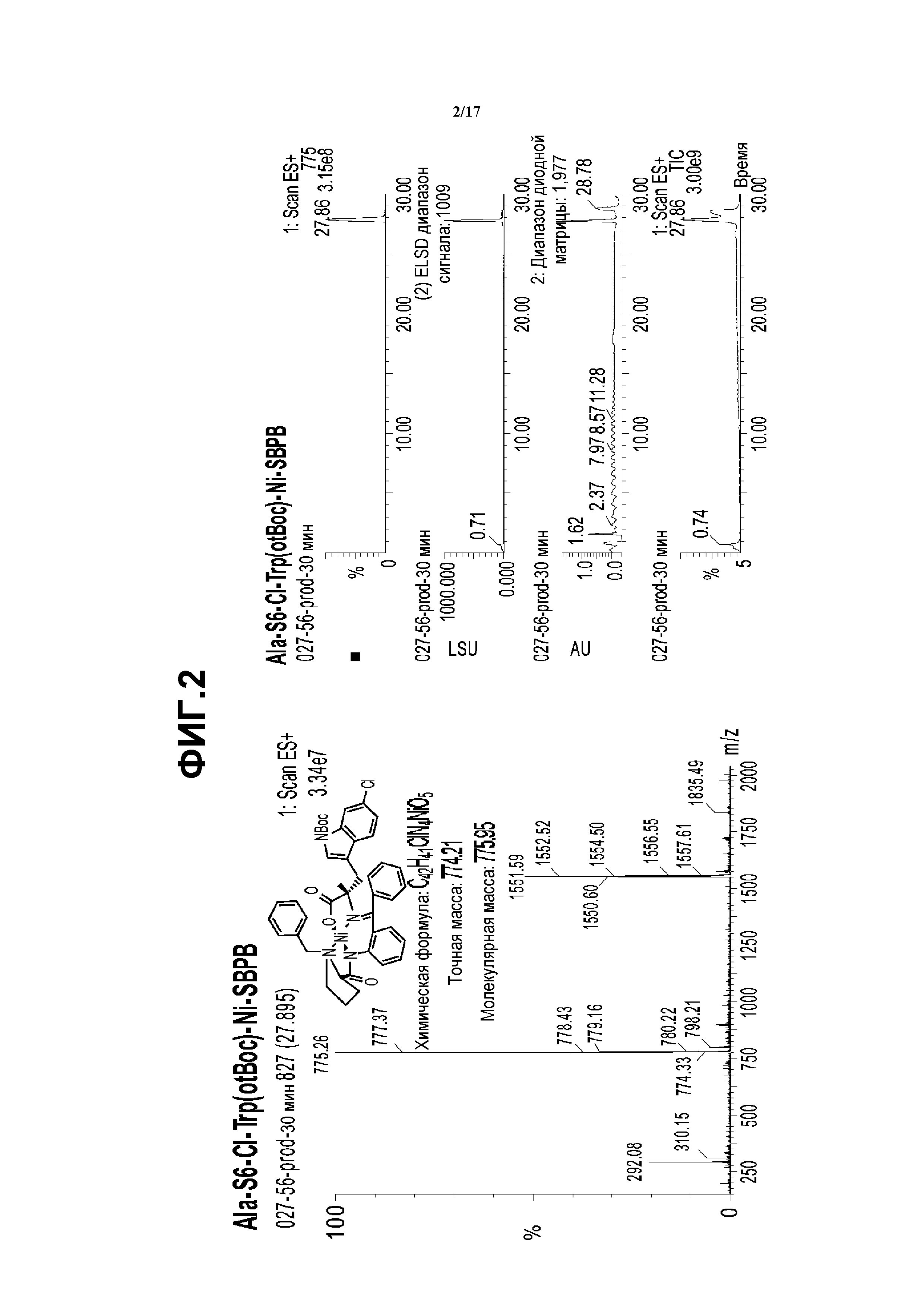
На фиг.2 показаны результаты анализа Me-6-хлор-(Boc)триптофан-Ni-S-BPB методом ЖХ-МС.
На фиг.3 показан1H-ЯМР-спектр Me-6-хлор-(Boc)триптофан-Ni-S-BPB.
На фиг.4 показаны результаты анализа Fmoc-Me-6-хлор-(Boc)триптофана методом ЖХ-МС.
На фиг.5 показан1H-ЯМР-спектр Fmoc-Me-6-хлор-(Boc)триптофана.
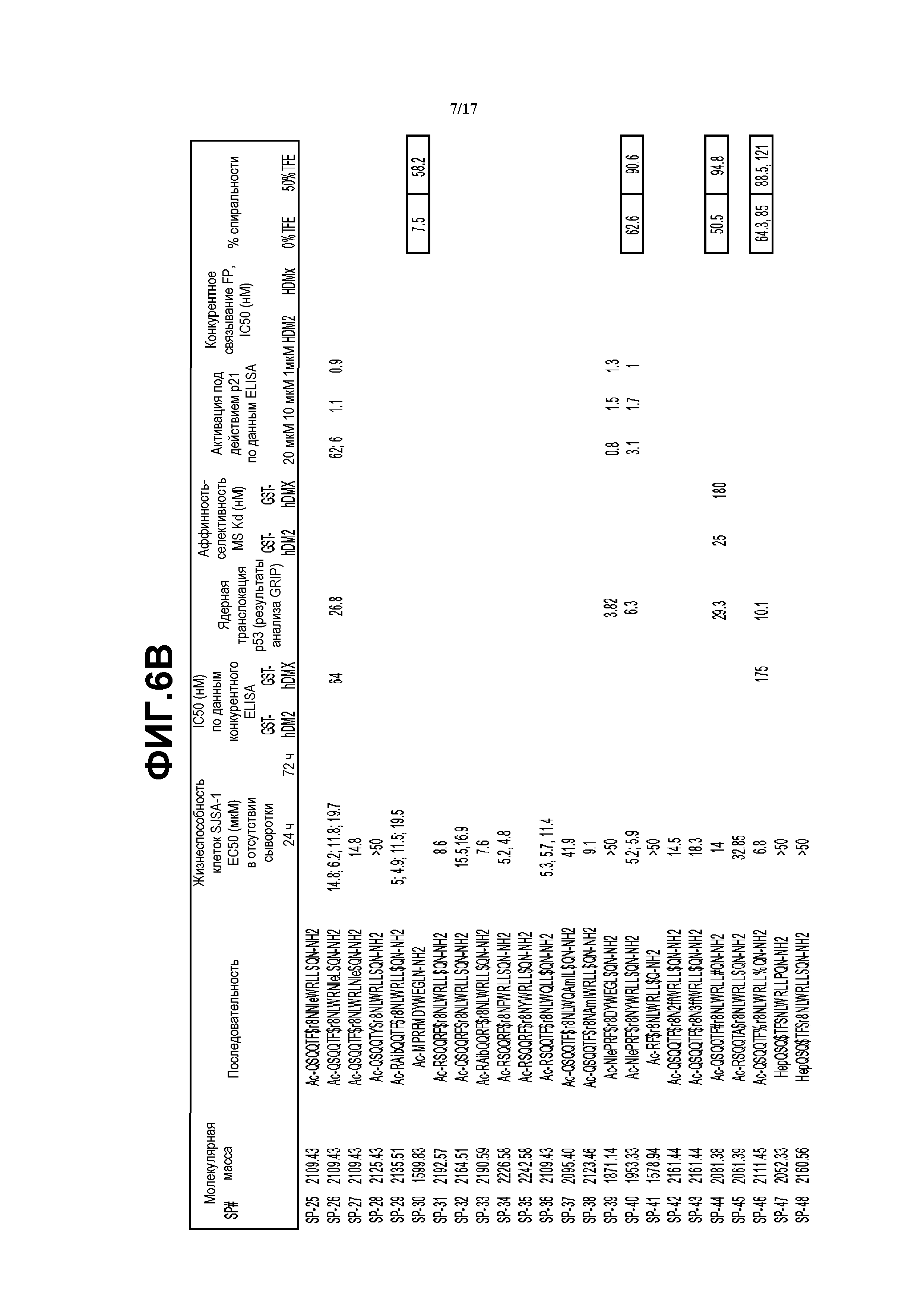
На фиг.6A-F описаны результаты анализа жизнеспособности клеток, конкурентного анализа ELISA, анализа GRIP, определения значений Kd, анализа активации p21, флуоресцентного поляризационного анализа конкурентного связывания и определения циклической спиральности для типичных пептидомиметических макроциклов настоящего изобретения.
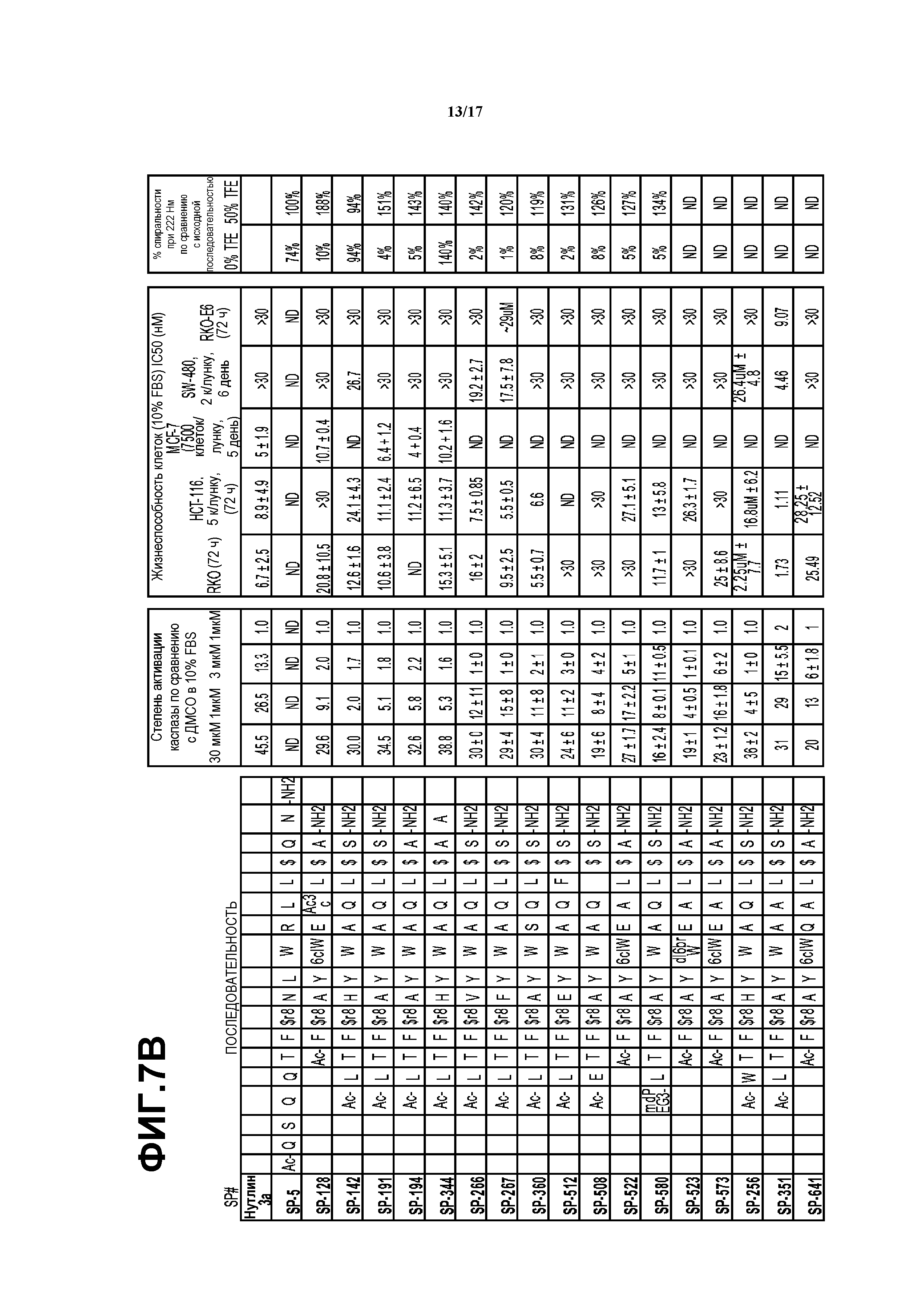
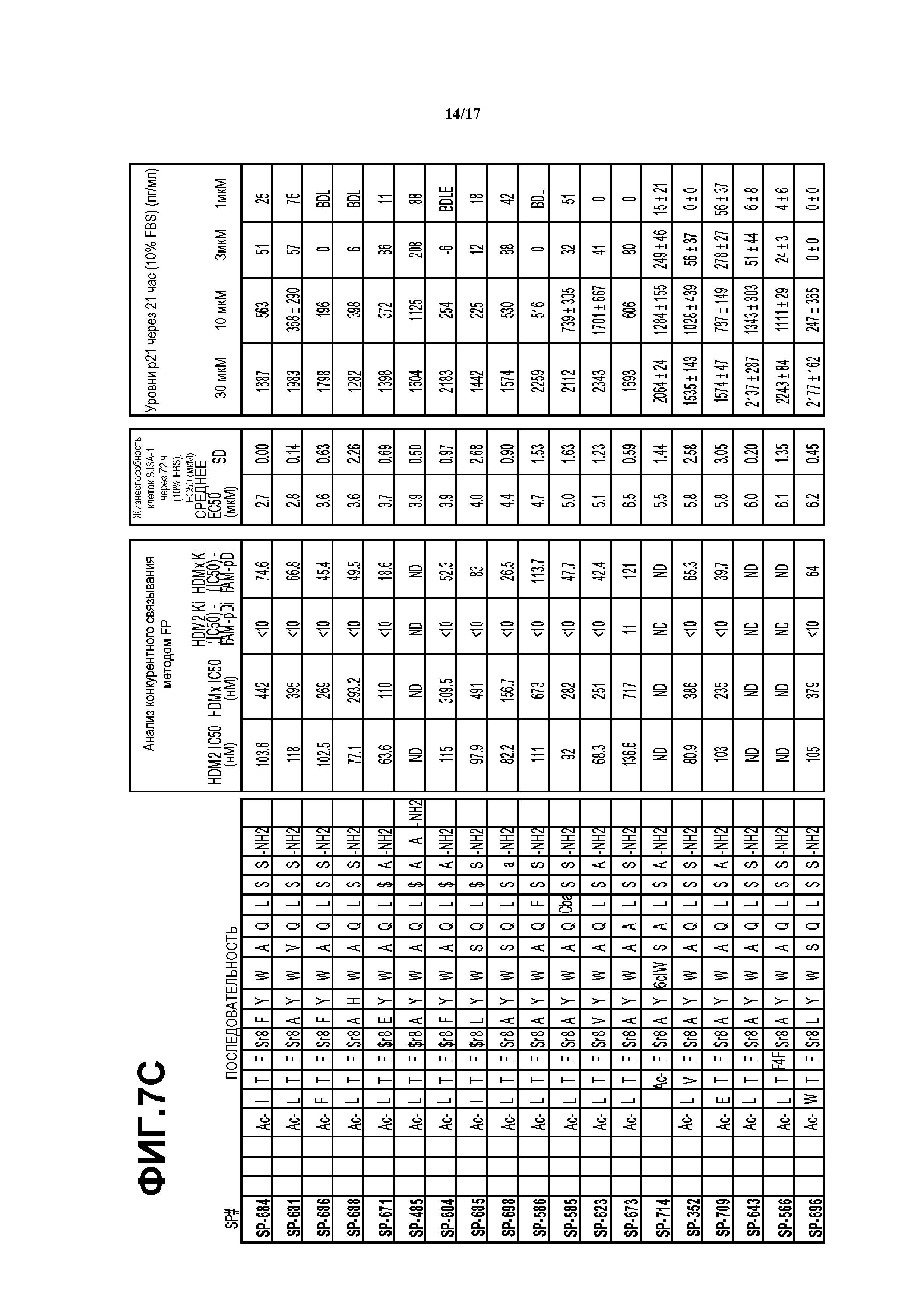
На фиг.7A-D приведены данные для ряда макроциклов.
На фиг.8A-B приведены данные для ряда макроциклов.
Подробное описание изобретения
В настоящем описании термин "макроцикл" относится к молекуле, химическая структура которой содержит кольцо или цикл, образованный по меньшей мере 9 ковалентно связанными атомами.
В настоящем описании термин "пептидомиметический макроцикл" или "поперечносшитый полипептид" относится к соединению, содержащему совокупность аминокислотных остатков, соединенных рядом пептидных связей, и, по меньшей мере, один макроцикл-образующий линкер, который образует макроцикл путем соединения первого природного или неприродного аминокислотного остатка (или его аналога) со вторым природным или неприродным аминокислотным остатком (или его аналогом), входящим в состав той же молекулы. Пептидомиметический макроцикл включает в себя воплощения, в которых макроцикл-образующий линкер соединяет атом углерода первого аминокислотного остатка (или его аналога) с атомом углерода второго аминокислотного остатка (или его аналога). Пептидомиметические макроциклы необязательно содержат одну или несколько непептидных связей, соединяющих два или более аминокислотных остатков и/или аналогов аминокислотных остатков, и необязательно содержат один или несколько неприродных аминокислотных остатков или аналогов аминокислотных остатков помимо образующих макроцикл. Термин "соответствующий полипептид, не содержащий поперечных связей", упоминающийся в контексте пептидомиметического макроцикла, относится к полипептиду такой же длины, что и макроцикл, который содержит природные аминокислоты, эквивалентные аминокислотам последовательности макроцикла дикого типа.
В настоящем описании термин "стабильность" относится к поддержанию определенной вторичной структуры пептидомиметического макроцикла настоящего изобретения в растворе, что определяют методом кругового дихроизма, ЯМР или другим биофизическим методом, или к устойчивости к протеолитической деградации in vitro или in vivo. Неограничивающие примеры вторичных структур, охватываемых настоящим изобретением, включают в себя α-спирали, β-изгибы и β-складки.
В настоящем описании термин "стабильность спиральной структуры" относится к поддержанию спиральной структуры пептидомиметического макроцикла настоящего изобретения, измеряемому методом кругового дихроизма или ЯМР. Например, в некоторых воплощениях по данным кругового дихроизма α-спиральность пептидомиметических макроциклов настоящего изобретения, по меньшей мере, в 1,25, 1,5, 1,75 или 2 раза превышает α-спиральность соответствующего макроцикла, не содержащего поперечных связей.
Термин "α-аминокислота" или просто "аминокислота" относится к молекуле, которая содержит аминогруппу и карбоксильную группу, присоединенные к атому углерода, обозначаемому "α-атом углерода". Подходящие аминокислоты включают в себя, без ограничения, D- и L-изомеры природных аминокислот, а также неприродных аминокислот, полученных путем органического синтеза или других метаболических процессов. Если контекст конкретно не указывает иначе, термин "аминокислота" в настоящем описании охватывает аналоги аминокислот.
Термин "природная аминокислота" относится к любой из двадцати аминокислот, обычно присутствующих в пептидах, синтезированных в природе, и имеющих однобуквенные обозначения A, R, N, C, D, Q, E, G, H, I, L, K, M, F, P, S, T, W, Y и V.
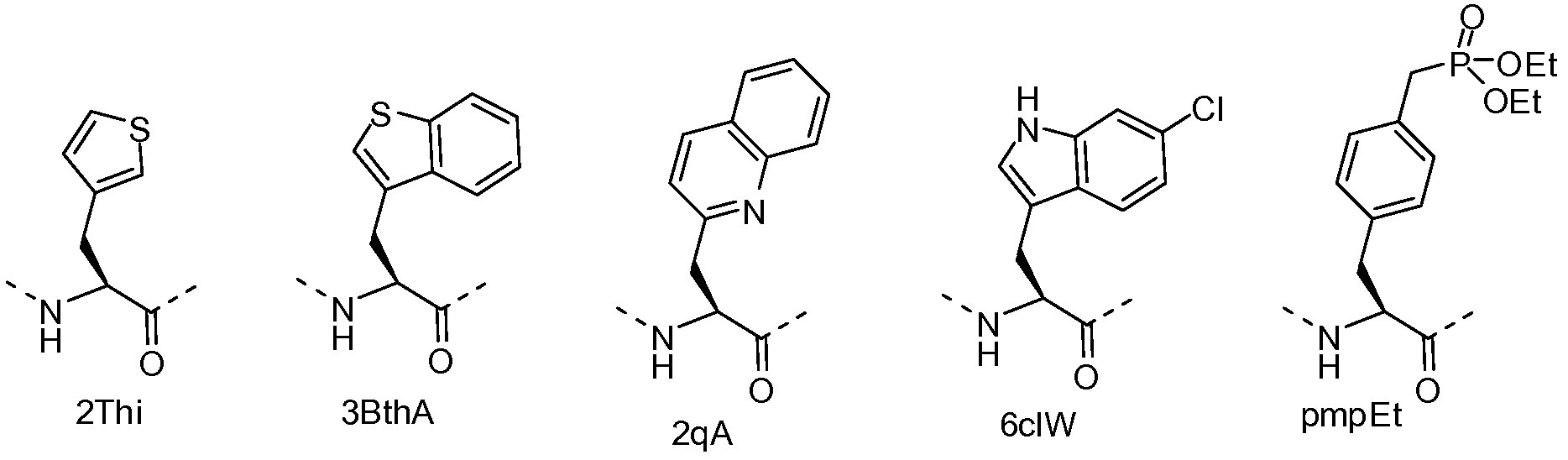
Термин "аналог аминокислоты" или "неприродная аминокислота" относится к молекуле, структурно подобной аминокислоте, которая может замещать аминокислоту при образовании пептидомиметического макроцикла. Аналоги аминокислот включают в себя, без ограничения, соединения, структурно идентичные аминокислотам, в соответствии с приведенным здесь определением, за исключением вставки одной или нескольких дополнительных метиленовых групп между аминогруппой и карбоксильной группой (например, α-амино-β-карбоновые кислоты), или замены аминогруппы или карбоксильной группы подобной реакционноспособной группой (например, замены первичной аминогруппы вторичной или третичной аминогруппой, или замены карбоксильной группы сложноэфирной группой). Неприродные аминокислоты могут содержать следующие структуры:










"Не необходимый" аминокислотный остаток представляет собой остаток последовательности полипептида дикого типа, который можно изменить без утраты или существенного изменения основной биологической или биохимической активности (такой как связывание или активация рецептора) полипептида. "Необходимый" аминокислотный остаток представляет собой остаток последовательности полипептида дикого типа, изменение которого приводит к утрате или существенному изменению основной биологической или биохимической активности полипептида.
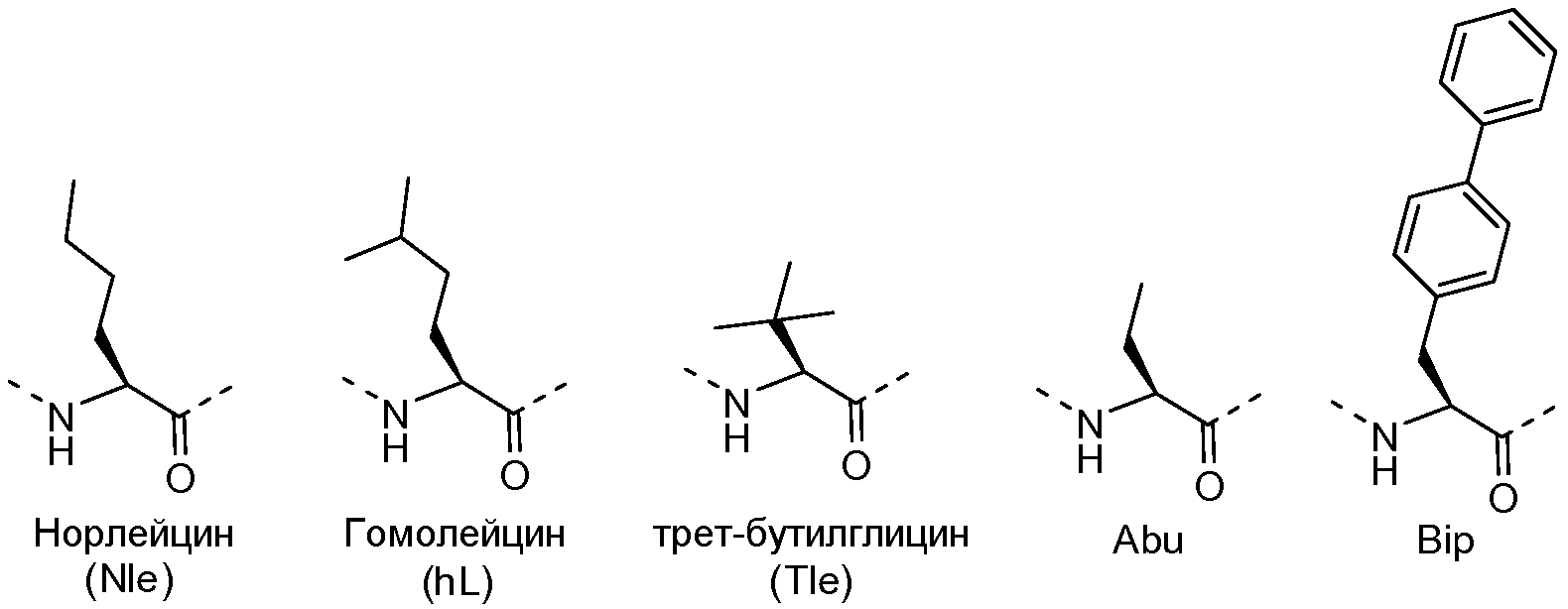
"Консервативная аминокислотная замена" представляет собой замену аминокислотного остатка другим аминокислотным остатком, содержащим подобную боковую цепь. В данной области определены семейства аминокислотных остатков, содержащих подобные боковые цепи. Указанные семейства включают в себя аминокислоты, содержащие основные боковые цепи (например, K, R, H), кислые боковые цепи (например, D, E), незаряженные полярные боковые цепи (например, G, N, Q, S, T, Y, C), неполярные боковые цепи (например, A, V, L, I, P, F, M, W), бета-разветвленные боковые цепи (например, T, V, I) и ароматические боковые цепи (например, Y, F, W, H). Таким образом, определенный теоретически не необходимый аминокислотный остаток, входящий в состав полипептида, например, предпочтительно заменяют другим аминокислотным остатком, относящимся к тому же семейству боковых цепей. Другие примеры приемлемых замен включают в себя замены на основе изостерических факторов (например, замена норлейцина на метионин) или других свойств (например, замена 2-тиенилаланин на фенилаланин).
Термин "кэпирующая группа" относится к химическому фрагменту, находящемуся на карбокси- или аминоконце полипептидной цепи указанного пептидомиметического макроцикла. Кэпирующая группа карбоксиконца включает в себя немодифицированную карбоксильную группу (т.е. -COOH) или карбоксильную группу, содержащую заместитель. Например, карбоксиконец может быть замещен аминогруппой с получением карбоксамида на C-конце. Разные заместители включают в себя, без ограничения, первичные и вторичные аминогруппы, в том числе пэгилированные вторичные аминогруппы. Типичные вторичные аминогруппы для кэпирования С-конца включают в себя:





Кэпирующая группа аминоконца включает в себя немодифицированную аминогруппу (т.е. -NH2) или аминогруппу, содержащую заместитель. Например, аминоконец может быть замещен ацильной группой с получением карбоксамида на N-конце. Разные заместители включают в себя, без ограничения, замещенные ацильные группы, такие как C1-C6 карбонилы, C7-C30 карбонилы и пэгилированные карбаматы. Типичные кэпирующие группы для N-конца включают в себя:



В настоящем описании в объем термина "член", используемого в применении к макроциклам или макроцикл-образующим линкерам, входят атомы, которые образуют или могут образовать макроцикл, но не атомы заместителей или боковых цепей. Так, например, циклодекан, 1,2-дифтордекан и 1,3-диметилциклодекан считаются десятичленными макроциклами, поскольку заместители водород или фтор, или метильные боковые цепи не участвуют в образовании макроцикла.
Символ "

Термин "боковая цепь аминокислоты" относится к фрагменту, присоединенному к α-атому углерода аминокислоты. Например, аминокислотная боковая цепь аланина представляет собой метил, аминокислотная боковая цепь фенилаланина представляет собой фенилметил, аминокислотная боковая цепь цистеина представляет собой тиометил, аминокислотная боковая цепь аспартата представляет собой карбоксиметил, аминокислотная боковая цепь тирозина представляет собой 4-гидроксифенилметил, и т.д. В объем термина также входят другие, неприродные аминокислотные боковые цепи, например, встречающиеся в природе (такие как метаболит аминокислоты) или полученные синтетическими способами (такие как α,α-дизамещенная аминокислота).
Термин "α,α-дизамещенная аминокислота" относится к молекуле или фрагменту, в которых аминогруппа и карбоксильная группа связаны с атомом углерода (α-атомом углерода), к которому присоединены две природные или неприродные аминокислотные боковые цепи.
Термин "полипептид" обозначает молекулу, содержащую две или более природных или неприродных аминокислот, соединенных ковалентной связью (например, амидной связью). Описанные здесь полипептиды включают в себя полноразмерные белки (например, полностью процессированные белки), а также более короткие аминокислотные последовательности (например, фрагменты природных белков или синтетических полипептидов).
В настоящем описании термин "реагент макроциклизации" или "макроцикл-образующий реагент" относится к любому реагенту, который может способствовать получению пептидомиметического макроцикла путем опосредования реакции между двумя реакционноспособными группами. Если реакционнопособные группы представляют собой, например, азид и алкин, реагент макроциклизации включает в себя, без ограничения, Cu-содержащие реагенты, например, реагенты, предоставляющие реакционноспособные соединения Cu(I), такие как CuBr, CuI или CuOTf, а также соли Cu(II), такие как Cu(CO2CH3)2, CuSO4 и CuCl2, которые можно превратить in situ в активный реагент Cu(I) путем добавления восстанавливающего средства, такого как аскорбиновая кислота или аскорбат натрия. Реагенты макроциклизации также могут включать в себя, например, известные в данной области реагенты Ru, такие как Cp*RuCl(PPh3)2, [Cp*RuCl]4 или другие реагенты Ru, которые могут предоставлять реакционноспособные соединения Ru(II). В других случаях реакционноспособные группы представляют собой концевые олефины. В таких воплощениях реагенты макроциклизации или макроцикл-образующие реагенты представляют собой катализаторы метатезиса, включающие в себя, без ограничения, стабилизированные карбеновые комплексы поздних переходных металлов, такие как карбеновые комплексы переходных металлов VIII группы. Например, такие катализаторы содержат в центре пентакоординированные металлы Ru и Os в степени окисления +2 и с числом электронов 16. Другие катализаторы описаны в Grubbs et al., "Ring Closing Metathesis и Related Processes in Organic Synthesis" Acc. Chem. Res. 1995, 28, 446-452, и патенте США № 5811515. В других случаях реакционноспособные группы представляют собой тиольные группы. В таких воплощениях реагент макроциклизации представляет собой, например, линкер, функционализированный двумя тиольными реакционноспособными группами, такими как галоген-содержащие группы.
Термин "галоген" включает в себя атомы фтора, хлора, брома или йода, или их радикалы.
Термин "алкил" относится к линейной или разветвленной углеводородной цепи, содержащей указанное число атомов углерода. Например, C1-C10 обозначает группу, содержащую от 1 до 10 (включительно) атомов углерода. При отсутствии какого-либо численного обозначения "алкил" представляет собой цепь (линейную или разветвленную), содержащую от 1 до 20 (включительно) атомов углерода.
Термин "алкилен" обозначает двухвалентный алкил (т.е. -R-).
Термин "алкенил" относится к линейной или разветвленной углеводородной цепи, содержащей одну или несколько углерод-углеродных двойных связей. Алкенильный фрагмент содержит указанное число атомов углерода. Например, C2-C10 обозначает группу, содержащую от 2 до 10 (включительно) атомов углерода. Термин "низший алкенил" относится к C2-C6 алкенильной цепи. При отсутствии какого-либо численного обозначения "алкенил" представляет собой цепь (линейную или разветвленную), содержащую от 2 до 20 (включительно) атомов углерода.
Термин "алкинил" относится к линейной или разветвленной углеводородной цепи, содержащей одну или несколько углерод-углеродных тройных связей. Алкинильный фрагмент содержит указанное число атомов углерода. Например, C2-C10 обозначает группу, содержащую от 2 до 10 (включительно) атомов углерода. Термин "низший алкинил" относится к C2-C6 алкинильной цепи. При отсутствии какого-либо численного обозначения "алкинил" представляет собой цепь (линейную или разветвленную), содержащую от 2 до 20 (включительно) атомов углерода.
Термин "арил" относится к 6-углеродной моноциклической или 10-углеродной бициклической ароматической системе, где 0, 1, 2, 3 или 4 атома в каждом цикле замещены заместителем. Примеры арильных групп включают в себя фенил, нафтил и т.п. Термин "арилалкил" или термин "аралкил" относится к алкилу, замещенному арилом. Термин "арилалкокси" относится к алкоксильной группе, замещенной арилом.
"Арилалкил" представляет собой арильную группу, определенную выше, в которой один из атомов водорода замещен C1-C5 алкильной группой, определенной выше. Иллюстративные примеры арилалкильной группы включают в себя, без ограничения, 2-метилфенил, 3-метилфенил, 4-метилфенил, 2-этилфенил, 3-этилфенил, 4-этилфенил, 2-пропилфенил, 3-пропилфенил, 4-пропилфенил, 2-бутилфенил, 3-бутилфенил, 4-бутилфенил, 2-пентилфенил, 3-пентилфенил, 4-пентилфенил, 2-изопропилфенил, 3-изопропилфенил, 4-изопропилфенил, 2-изобутилфенил, 3-изобутилфенил, 4-изобутилфенил, 2-втор-бутилфенил, 3-втор-бутилфенил, 4-втор-бутилфенил, 2-трет-бутилфенил, 3-трет-бутилфенил и 4-трет-бутилфенил.
Термин "ариламидо" относится к арильной группе, определенной выше, в которой один из атомов водорода замещен одной или несколькими группами -C(O)NH2. Иллюстративные примеры группы ариламидо включают в себя 2-C(O)NH2-фенил, 3-C(O)NH2-фенил, 4-C(O)NH2-фенил, 2-C(O)NH2-пиридил, 3-C(O)NH2-пиридил и 4-C(O)NH2-пиридил.
Термин "алкилгетероцикл" относится к C1-C5 алкильной группе, определенной выше, в которой один из атомов углерода замещен гетероциклом. Иллюстративные примеры алкилгетероциклической группы включают в себя, без ограничения, -CH2CH2-морфолин, -CH2CH2-пиперидин, -CH2CH2CH2-морфолин и -CH2CH2CH2-имидазол.
"Алкиламидо" относится к C1-C5 алкильной группе, определенной выше, в которой один из атомов углерода замещен группой -C(O)NH2. Иллюстративные примеры алкиламидной группы включают в себя, без ограничения, -CH2-C(O)NH2, -CH2CH2-C(O)NH2, -CH2CH2CH2C(O)NH2, -CH2CH2CH2CH2C(O)NH2, -CH2CH2CH2CH2CH2C(O)NH2, -CH2CH(C(O)NH2)CH3, -CH2CH(C(O)NH2)CH2CH3, -CH(C(O)NH2)CH2CH3, -C(CH3)2CH2C(O)NH2, -CH2-CH2-NH-C(O)-CH3, -CH2-CH2-NH-C(O)-CH3-CH3 и -CH2-CH2-NH-C(O)-CH=CH2.
Термин "алканол" относится к C1-C5 алкильной группе, определенной выше, в которой один из атомов углерода замещен гидроксильной группой. Иллюстративные примеры алканола включают в себя, без ограничения, -CH2OH, -CH2CH2OH, -CH2CH2CH2OH,-CH2CH2CH2CH2OH, -CH2CH2CH2CH2CH2OH, -CH2CH(OH)CH3, -CH2CH(OH)CH2CH3, -CH(OH)CH3 и -C(CH3)2CH2OH.
Термин "алкилкарбокси" относится к C1-C5 алкильной группе, определенной выше, в которой один из атомов углерода замещен группой -COOH. Иллюстративные примеры алкилкарбоксильной группы включают в себя, без ограничения, -CH2COOH, -CH2CH2COOH, -CH2CH2CH2COOH, -CH2CH2CH2CH2COOH, -CH2CH(COOH)CH3, -CH2CH2CH2CH2CH2COOH, -CH2CH(COOH)CH2CH3, -CH(COOH)CH2CH3 и -C(CH3)2CH2COOH.
Термин "циклоалкил" в соответствии с настоящим описанием охватывает насыщенные и частично ненасыщенные циклические углеводородные группы, содержащие от 3 до 12 атомов углерода, предпочтительно от 3 до 8 атомов углерода, и более предпочтительно от 3 до 6 атомов углерода, где циклоалкильная группа также может быть необязательно замещена. Некоторые циклоалкильные группы включают в себя, без ограничения, циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил и циклооктил.
Термин "гетероарил" относится к ароматической 5-8-членной моноциклической, 8-12-членной бициклической, или 11-14-членной трициклической системе, содержащей 1-3 гетероатомов в случае моноциклической системы, 1-6 гетероатомов в случае бициклической системы, или 1-9 гетероатомов в случае трициклической системы, где указанные гетероатомы выбраны из O, N или S (например, гетероарил содержит атомы углерода и 1-3, 1-6 или 1-9 гетероатомов, выбранных из O, N или S, в случае моноциклической, бициклической или трициклической системы, соответственно), где 0, 1, 2, 3 или 4 атома каждого цикла замещены заместителем. Примеры гетероарильных групп включают в себя пиридил, фурил или фуранил, имидазолил, бензимидазолил, пиримидинил, тиофенил или тиенил, хинолинил, индолил, тиазолил и т.п.
Термин "гетероарилалкил" или термин "гетероаралкил" относится к алкилу, замещенному гетероарилом. Термин "гетероарилалкокси" относится к алкокси, замещенному гетероарилом.
Термин "гетероарилалкил" или термин "гетероаралкил" относится к алкилу, замещенному гетероарилом. Термин "гетероарилалкокси" относится к алкокси, замещенному гетероарилом.
Термин "гетероциклил" относится к неароматической 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической системе, содержащей 1-3 гетероатомов в случае моноциклической системы, 1-6 гетероатомов в случае бициклической системы, или 1-9 гетероатомов в случае трициклической системы, где указанные гетероатомы выбраны из O, N или S (например, гетероциклил содержит атомы углерода и 1-3, 1-6 или 1-9 гетероатомов, выбранных из O, N или S, в случае моноциклической, бициклической или трициклической системы, соответственно), где 0, 1, 2 или 3 атома в каждом цикле замещены заместителем. Примеры гетероциклильных групп включают в себя пиперазинил, пирролидинил, диоксанил, морфолинил, тетрагидрофуранил и т.п.
Термин "заместитель" относится к группе, замещающей второй атом или вторую группу, например, атом водорода, в молекуле, соединении или фрагменте. Подходящие заместители включают в себя, без ограничения, такие группы как галоген, гидрокси, меркапто, оксо, нитро, галогеналкил, алкил, алкарил, арил, аралкил, алкокси, тиоалкокси, арилокси, амино, алкоксикарбонил, амидо, карбокси, алкансульфонил, алкилкарбонил и циано.
В некоторых воплощениях соединения настоящего изобретения содержат один или несколько асимметричных центров и, следовательно, могут находиться в виде рацематов и рацемических смесей, отдельных энантиомеров, отдельных диастереомеров и смесей диастереомеров. Если однозначно не указано иначе, все изомерные формы указанных соединений входят в объем настоящего изобретения. В некоторых воплощениях соединения настоящего изобретения также могут присутствовать в виде нескольких таутомерных форм, и в таких случаях изобретение охватывает все таутомерные формы описанных здесь соединений (например, если алкилирование циклической системы приводит к присоединению алкила в нескольких положениях, изобретение охватывает все такие продукты реакции). Если однозначно не указано иначе, все изомерные формы указанных соединений входят в объем настоящего изобретения. Все кристаллические формы описанных здесь соединений также входят в объем настоящего изобретения, если контекст однозначно не указывает иначе.
В настоящем описании термины "увеличивает" и "уменьшает" означают, соответственно, что соединение вызывает статистически значимое (т.е. p<0,1) увеличение или уменьшение, составляющее, по меньшей мере, 5%.
В настоящем описании указание диапазона численных значений переменной означает, что изобретение можно осуществлять при любом значении переменной, попадающим в указанный диапазон. Таким образом, если переменная является по существу дискретной, она может иметь значение, равное любому целому числу, входящему в указанный численный диапазон, включая граничные значения диапазона. Подобным образом, если переменная является по существу непрерывной величиной, она может иметь значение, равное любому действительному числу, входящему в указанный численный диапазон, включая граничные значения диапазона. Например, и без ограничения, если указано, что переменная может иметь значения в диапазоне от 0 до 2, ее значение может быть равно 0, 1 или 2, если переменная является по существу дискретной, или ее значение может быть равно 0,0, 0,1, 0,01, 0,001 или любому другому действительному числу >0 и <2, если переменная является по существу непрерывной.
Если не указано иначе, в настоящем описании слово "или" используется во включающем смысле "и/или", а не в исключающем смысле "либо/либо".
Термин "в среднем" обозначает среднее значение, полученное при выполнении, по меньшей мере, трех независимых повторов для каждой экспериментальной точки.
Термин "биологическая активность" охватывает структурные и функциональные свойства макроцикла настоящего изобретения. К биологической активности относится, например, структурная стабильность, альфа-спиральность, сродство к мишени, устойчивость к протеолитической деградации, способность проникать в клетки, внутриклеточная стабильность, стабильность in vivo или любое сочетание вышеуказанных свойств.
Детали одного или нескольких конкретных воплощений настоящего изобретения описаны в прилагающихся чертежах и в приведенном ниже описании. Другие признаки, цели и преимущества настоящего изобретения станут очевидны из нижеследующих описания, чертежей и формулы изобретения.
В некоторых воплощениях пептидные последовательности получены из белка p53.
Ниже приведен неограничивающий иллюстративный список пептидов p53, подходящих для применения в настоящем изобретении.
В таблице 3, а также в других местах, "Aib" обозначает остаток 2-аминоизомасляной кислоты, а "Ac3c" обозначает остаток аминоциклопропанкарбоновой кислоты.
Пептидомиметические макроциклы
В некоторых воплощениях пептидомиметический макроцикл настоящего изобретения имеет формулу (I):

Формула I
где:
каждый A, C, D и E независимо обозначает природную или неприродную аминокислоту, а D и E независимо и необязательно содержат кэпирующую группу;
B представляет собой природную или неприродную аминокислоту, аналог аминокислоты,

R1 и R2 независимо обозначают -H, алкил, алкенил, алкинил, арилалкил, циклоалкил, циклоалкилалкил, гетероалкил или гетероциклоалкил, незамещенный или замещенный галогеном;
R3 обозначает водород, алкил, алкенил, алкинил, арилалкил, гетероалкил, циклоалкил, гетероциклоалкил, циклоалкилалкил, циклоарил или гетероциклоарил, необязательно замещенный R5;
L обозначает макроцикл-образующий линкер формулы -L1-L2-;
L1 и L2 независимо обозначают алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, циклоарилен, гетероциклоарилен или [-R4-K-R4-]n, каждый из которых необязательно замещен R5;
каждый R4 обозначает алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, арилен или гетероарилен;
каждый K обозначает O, S, SO, SO2, CO, CO2 или CONR3;
каждый R5 независимо обозначает галоген, алкил, -OR6, -N(R6)2, -SR6, -SOR6, -SO2R6, -CO2R6, флуоресцентный фрагмент, радиоизотоп или терапевтическое средство;
каждый R6 независимо обозначает -H, алкил, алкенил, алкинил, арилалкил, циклоалкилалкил, гетероциклоалкил, флуоресцентный фрагмент, радиоизотоп или терапевтическое средство;
R7 обозначает -H, алкил, алкенил, алкинил, арилалкил, циклоалкил, гетероалкил, циклоалкилалкил, гетероциклоалкил, циклоарил или гетероциклоарил, необязательно замещенный R5, или часть циклической структуры, содержащую остаток D;
R8 обозначает -H, алкил, алкенил, алкинил, арилалкил, циклоалкил, гетероалкил, циклоалкилалкил, гетероциклоалкил, циклоарил или гетероциклоарил, необязательно замещенный R5, или часть циклической структуры, содержащую остаток E;
v и w независимо обозначают целые числа в диапазоне 1-1000;
u обозначает целое число в диапазоне 1-10;
x, y и z независимо обозначают целые числа в диапазоне 0-10; и
n обозначает целое число в диапазоне 1-5.
В одном воплощении L1 и L2, по отдельности или вместе, не образуют триазол или тиоэфир.
В одном примере, по меньшей мере, один из R1 и R2 обозначает алкил, незамещенный или замещенный галогеном. В другом примере и R1, и R2 независимо обозначают алкил, незамещенный или замещенный галогеном. В некоторых воплощениях, по меньшей мере, один из R1 и R2 обозначает метил. В других воплощениях R1 и R2 обозначают метил.
В некоторых воплощениях настоящего изобретения сумма x+y+z равна, по меньшей мере, 3. В других воплощениях настоящего изобретения сумма x+y+z равна 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10. Каждый элемент A, B, C, D или E в макроцикле или в предшественнике макроцикла настоящего изобретения выбирают независимо. Например, последовательность, представленная формулой [A]x, где x равен 3, охватывает воплощения, в которых аминокислоты не являются идентичными, например, Gln-Asp-Ala, и воплощения, в которых аминокислоты являются идентичными, например, Gln-Gln-Gln. Это применимо к любому значению x, y или z в указанных диапазонах. Подобным образом, если u больше 1, каждое соединение настоящего изобретения может включать в себя одинаковые или разные пептидомиметические макроциклы. Например, соединение настоящего изобретения может включать в себя пептидомиметические макроциклы, содержащие линкеры разной длины, или имеющие разные химические составы.
В некоторых воплощениях вторичная структура пептидомиметического макроцикла настоящего изобретения представляет собой α-спираль, а R8 обозначает -H, что создает возможность для образования внутриспиральных водородных связей. В некоторых воплощениях, по меньшей мере, один из A, B, C, D или E обозначает α,α-дизамещенную аминокислоту. В одном примере B обозначает α,α-дизамещенную аминокислоту. Например, по меньшей мере, один из A, B, C, D или E обозначает 2-аминоизомасляную кислоту. В других воплощениях, по меньшей мере, один из A, B, C, D или E обозначает

В других воплощениях длину макроцикл-образующего линкера L, измеряемую от первого Cα до второго Cα, выбирают так, чтобы стабилизировать желательную вторичную структуру пептида, такую как α-спираль, образованную остатками пептидомиметического макроцикла, включающими в себя, без обязательного ограничения, остатки, находящиеся между первым Cα и вторым Cα.
В одном воплощении пептидомиметический макроцикл формулы (I) представляет собой:

где каждый R1 и R2 независимо обозначает -H, алкил, алкенил, алкинил, арилалкил, циклоалкил, циклоалкилалкил, гетероалкил или гетероциклоалкил, незамещенный или замещенный галогеном.
В родственных воплощениях пептидомиметический макроцикл формулы (I) представляет собой:


В других воплощениях пептидомиметический макроцикл формулы (I) представляет собой соединение любой из приведенных ниже формул:








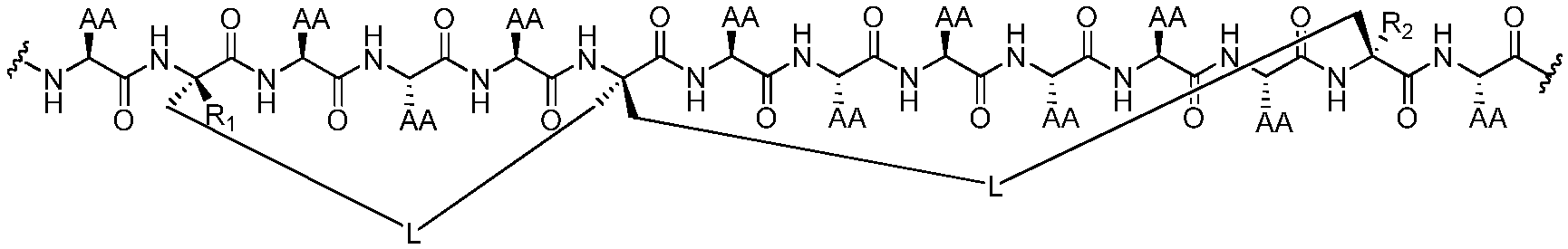

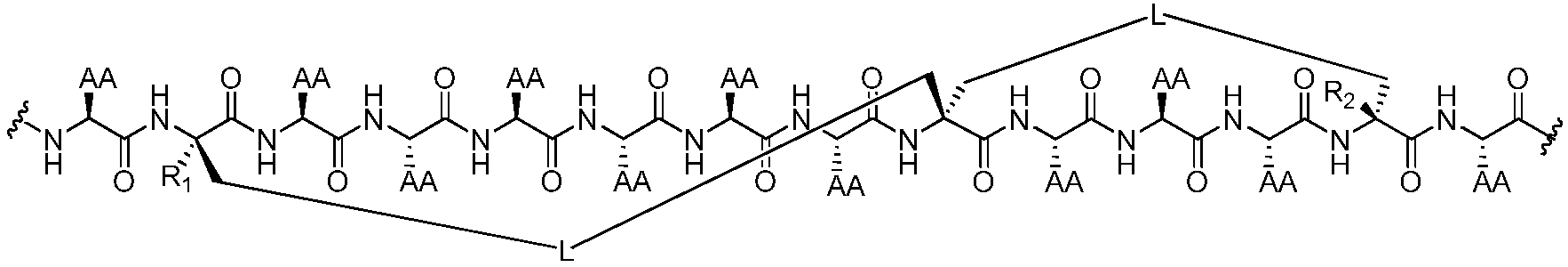

где "AA" обозначает боковую цепь любой природной или неприродной аминокислоты, "

Иллюстративные воплощения макроцикл-образующего линкера L показаны ниже.
В других воплощениях D и/или E в соединении формулы I дополнительно модифицируют, чтобы облегчить их поглощение клетками. В некоторых воплощениях липидирование или ПЭГилирование пептидомиметического макроцикла облегчает поглощение клетками, повышает биодоступность, увеличивает время присутствия в кровотоке, изменяет фармакокинетические параметры, снижает иммуногенность и/или уменьшает требуемую частоту введения.
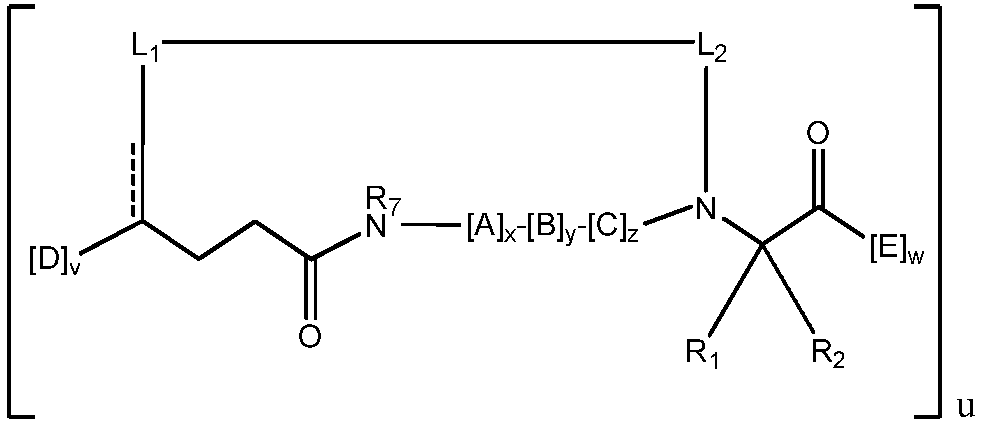
В других воплощениях, по меньшей мере, один из [D] и [E] в соединении формулы I представляет собой фрагмент, содержащий дополнительный макроцикл-образующий линкер, в результате чего пептидомиметический макроцикл содержит, по меньшей мере, два макроцикл-образующих линкера. В конкретном воплощении пептидомиметический макроцикл содержит два макроцикл-образующих линкера. В одном воплощении u равен 2.
Любой из описанных здесь макроцикл-образующих линкеров, входящий в состав пептидомиметического макроцикла настоящего изобретения, можно использовать в сочетании с любой из последовательностей, приведенных в таблицах 1-4, а также с любым из указанных здесь заместителей R.
В некоторых воплощениях пептидомиметический макроцикл содержит, по меньшей мере, один α-спиральный мотив. Например, A, B и/или C в соединении формулы I содержат один или несколько α-спиральных участков. Обычно виток α-спирали состоит из 3-4 аминокислотных остатков. В некоторых воплощениях α-спираль пептидомиметического макроцикла содержит от 1 до 5 витков и, следовательно, от 3 до 20 аминокислотных остатков. В конкретных воплощениях α-спираль содержит 1 виток, 2 витка, 3 витка, 4 витка или 5 витков. В некоторых воплощениях макроцикл-образующий линкер стабилизирует α-спиральный мотив, входящий в состав пептидомиметического макроцикла. Таким образом, в некоторых воплощениях длину макроцикл-образующего линкера L от первого Cα до второго Cα выбирают так, чтобы увеличить стабильность α-спирали. В некоторых воплощениях макроцикл-образующий линкер стягивает от 1 до 5 витков α-спирали. В некоторых воплощениях макроцикл-образующий линкер стягивает примерно 1 виток, 2 витка, 3 витка, 4 витка или 5 витков α-спирали. В некоторых воплощениях длина макроцикл-образующего линкера составляет примерно от 5 A до 9 A на виток α-спирали, или примерно от 6 A до 8 A на виток α-спирали. Если макроцикл-образующий линкер стягивает примерно 1 виток α-спирали, его длина составляет примерно от 5 углерод-углеродных связей до 13 углерод-углеродных связей, примерно от 7 углерод-углеродных связей до 11 углерод-углеродных связей, или примерно 9 углерод-углеродных связей. Если макроцикл-образующий линкер стягивает примерно 2 витка α-спирали, его длина составляет примерно от 8 углерод-углеродных связей до 16 углерод-углеродных связей, примерно от 10 углерод-углеродных связей до 14 углерод-углеродных связей, или примерно 12 углерод-углеродных связей. Если макроцикл-образующий линкер стягивает примерно 3 витка α-спирали, его длина составляет примерно от 14 углерод-углеродных связей до 22 углерод-углеродных связей, примерно от 16 углерод-углеродных связей до 20 углерод-углеродных связей, или примерно 18 углерод-углеродных связей. Если макроцикл-образующий линкер стягивает примерно 4 витка α-спирали, его длина составляет примерно от 20 углерод-углеродных связей до 28 углерод-углеродных связей, примерно от 22 углерод-углеродных связей до 26 углерод-углеродных связей, или примерно 24 углерод-углеродные связи. Если макроцикл-образующий линкер стягивает примерно 5 витков α-спирали, его длина составляет примерно от 26 углерод-углеродных связей до 34 углерод-углеродных связей, примерно от 28 углерод-углеродных связей до 32 углерод-углеродных связей, или примерно 30 углерод-углеродных связей. Если макроцикл-образующий линкер стягивает примерно 1 виток α-спирали, мостик содержит примерно от 4 атомов до 12 атомов, примерно от 6 атомов до 10 атомов, или примерно 8 атомов. Если макроцикл-образующий линкер стягивает примерно 2 витка α-спирали, мостик содержит примерно от 7 атомов до 15 атомов, примерно от 9 атомов до 13 атомов, или примерно 11 атомов. Если макроцикл-образующий линкер стягивает примерно 3 витка α-спирали, мостик содержит примерно от 13 атомов до 21 атомов, примерно от 15 атомов до 19 атомов, или примерно 17 атомов. Если макроцикл-образующий линкер стягивает примерно 4 витка α-спирали, мостик содержит примерно от 19 атомов до 27 атомов, примерно от 21 атома до 25 атомов, или примерно 23 атома. Если макроцикл-образующий линкер стягивает примерно 5 витков α-спирали, мостик содержит примерно от 25 атомов до 33 атомов, примерно от 27 атомов до 31 атома, или примерно 29 атомов. Если макроцикл-образующий линкер стягивает примерно 1 виток α-спирали, полученный макроцикл содержит примерно от 17 членов до 25 членов, примерно от 19 членов до 23 членов, или примерно 21 член. Если макроцикл-образующий линкер стягивает примерно 2 витка α-спирали, полученный макроцикл содержит примерно от 29 членов до 37 членов, примерно от 31 члена до 35 членов, или примерно 33 члена. Если макроцикл-образующий линкер стягивает примерно 3 витка α-спирали, полученный макроцикл содержит примерно от 44 членов до 52 членов, примерно от 46 членов до 50 членов, или примерно 48 членов. Если макроцикл-образующий линкер стягивает примерно 4 витка α-спирали, полученный макроцикл содержит примерно от 59 членов до 67 членов, примерно от 61 члена до 65 членов, или примерно 63 члена. Если макроцикл-образующий линкер стягивает примерно 5 витков α-спирали, полученный макроцикл содержит примерно от 74 членов до 82 членов, примерно от 76 членов до 80 членов, или примерно 78 членов. В других воплощениях изобретение предлагает пептидомиметические макроциклы формулы (IV) или (IVa):


где:
каждый A, C, D и E независимо обозначает природную или неприродную аминокислоту, а концевые D и E независимо и необязательно содержат кэпирующую группу;
B обозначает природную или неприродную аминокислоту, аналог аминокислоты,

R1 и R2 независимо обозначают -H, алкил, алкенил, алкинил, арилалкил, циклоалкил, циклоалкилалкил, гетероалкил или гетероциклоалкил, незамещенный или замещенный галогеном, или часть циклической структуры, содержащей остаток E;
R3 обозначает водород, алкил, алкенил, алкинил, арилалкил, гетероалкил, циклоалкил, гетероциклоалкил, циклоалкилалкил, циклоарил или гетероциклоарил, необязательно замещенный R5;
L обозначает макроцикл-образующий линкер формулы -L1-L2-;
L1 и L2 независимо обозначают алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, циклоарилен, гетероциклоарилен или [-R4-K-R4-]n, каждый из которых необязательно замещен R5;
каждый R4 обозначает алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, арилен или гетероарилен;
каждый K обозначает O, S, SO, SO2, CO, CO2 или CONR3;
каждый R5 независимо обозначает галоген, алкил, -OR6, -N(R6)2, -SR6, -SOR6, -SO2R6, -CO2R6, флуоресцентный фрагмент, радиоизотоп или терапевтическое средство;
каждый R6 независимо обозначает -H, алкил, алкенил, алкинил, арилалкил, циклоалкилалкил, гетероциклоалкил, флуоресцентный фрагмент, радиоизотоп или терапевтическое средство;
R7 обозначает -H, алкил, алкенил, алкинил, арилалкил, циклоалкил, гетероалкил, циклоалкилалкил, гетероциклоалкил, циклоарил или гетероциклоарил, необязательно замещенный R5;
v и w независимо обозначают целые числа в диапазоне 1-1000;
u обозначает целое число в диапазоне 1-10;
x, y и z независимо обозначают целые числа в диапазоне 0-10; и
n обозначает целое число в диапазоне 1-5.
В одном примере L1 и L2, по отдельности или вместе, не образуют триазол или тиоэфир.
В одном примере, по меньшей мере, один из R1 и R2 обозначает алкил, незамещенный или замещенный галогеном. В другом примере и R1 и R2 независимо обозначают алкил, незамещенный или замещенный галогеном. В некоторых воплощениях, по меньшей мере, один из R1 и R2 обозначает метил. В других воплощениях R1 и R2 обозначают метил.
В некоторых воплощениях настоящего изобретения, сумма x+y+z равна, по меньшей мере, 1. В других воплощениях настоящего изобретения сумма x+y+z равна, по меньшей мере, 2. В других воплощениях настоящего изобретения сумма x+y+z равна 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10. Каждый элемент A, B, C, D или E в макроцикле или в предшественнике макроцикла настоящего изобретения выбирают независимо. Например, последовательность, представленная формулой [A]x, где x равен 3, охватывает воплощения, в которых аминокислоты не являются идентичными, например, Gln-Asp-Ala, и воплощения, в которых аминокислоты являются идентичными, например, Gln-Gln-Gln. Это применимо к любому значению x, y или z в указанных диапазонах.
В некоторых воплощениях вторичная структура пептидомиметического макроцикла настоящего изобретения представляет собой α-спираль, а R8 обозначает -H, что создает возможность для образования внутриспиральных водородных связей. В некоторых воплощениях, по меньшей мере, один из A, B, C, D или E обозначает α,α-дизамещенную аминокислоту. В одном примере B обозначает α,α-дизамещенную аминокислоту. Например, по меньшей мере, один из A, B, C, D или E обозначает 2-аминоизомасляную кислоту. В других воплощениях, по меньшей мере, один из A, B, C, D или E обозначает

В других воплощениях длину макроцикл-образующего линкера L, измеряемую от первого Cα до второго Cα, выбирают так, чтобы стабилизировать желательную вторичную структуру пептида, такую как α-спираль, образованную остатками пептидомиметического макроцикла, включающими в себя, без обязательного ограничения, остатки, находящиеся между первым Cα и вторым Cα.
Иллюстративные воплощения макроцикл-образующего линкера L показаны ниже.
Получение пептидомиметических макроциклов
Пептидомиметические макроциклы настоящего изобретения можно получить с помощью любого известного в данной области способа. Например, любой остаток, обозначенный "X" в таблицах 1, 2, 3 или 4, может быть замещен остатком, способным образовывать поперечный линкер со вторым остатком в той же молекуле или с предшественником такого остатка.
В данной области известны разные способы получения пептидомиметических макроциклов. Например, получение пептидомиметических макроциклов формулы I описано в Schafmeister et al., J. Am. Chem. Soc. 122: 5891-5892 (2000); Schafmeister & Verdine, J. Am. Chem. Soc. 122: 5891 (2005); Walensky et al., Science 305: 1466-1470 (2004); в патенте США № 7192713 и в заявке PCT WO 2008/121767. α,α-Дизамещенные аминокислоты и аминокислотные предшественники, раскрытые в указанных ссылках, можно использовать для синтеза полипептидных предшественников пептидомиметических макроциклов. Например, "S5-олефинаминокислота" представляет собой (S)-α-(2'-пентенил)аланин, а "R8 олефинаминокислота" представляет собой (R)-α-(2'-октенил)аланин. После включения таких аминокислот в полипептиды-предшественники концевые олефины подвергают взаимодействию с катализатором метатезиса, получая пептидомиметический макроцикл. В разных воплощениях для синтеза пептидомиметического макроцикла можно использовать следующие аминокислоты:

В других воплощениях пептидомиметические макроциклы настоящего изобретения имеют формулы IV или IVa. Способы получения таких макроциклов описаны, например, в патенте США № 7202332.
Другие способы получения пептидомиметических макроциклов, подходящие для осуществления настоящего изобретения, включают в себя способы, описанные в Mustapa, M. Firouz Mohd et al., J. Org. Chem (2003), 68, pp. 8193-8198; Yang, Bin et al. Bioorg Med. Chem. Lett. (2004), 14, pp. 1403-1406; патенте США № 5364851; патенте США № 5446128; патенте США № 5824483; патенте США № 6713280; и патенте США № 7202332. В таких воплощениях используют аминокислотные предшественники, содержащие дополнительный заместитель R- в альфа-положении. Такие аминокислоты включают в предшественник макроцикла в желательных положениях, которые могут представлять собой положения, где поперечный линкер является замещенным, или, альтернативно, в других местах последовательности предшественника макроцикла. Затем проводят циклизацию предшественника в соответствии с указанным способом.
Анализы
Свойства пептидомиметических макроциклов настоящего изобретения анализируют, например, с помощью описанных ниже способов. В некоторых воплощениях пептидомиметический макроцикл настоящего изобретения обладает улучшенными биологическими свойствами по сравнению с соответствующим полипептидом, не содержащим описанные здесь заместители.
Определение α-спиральности
При растворении полипептидов, содержащих α-спиральные домены, их вторичная структура характеризуется динамическим равновесием между структурами, представляющими собой статистические клубки, и α-спиральными структурами, соотношение которых часто выражают в виде "процента спиральности". Так, например, в растворе альфа-спиральные домены преимущественно находятся в виде статистических клубков и содержание α-спиральных участков обычно составляет менее 25%. С другой стороны, альфа-спиральность пептидомиметических макроциклов с оптимизированными линкерами, например, по меньшей мере, в два раза превышает альфа-спиральность соответствующего полипептида, не содержащего поперечных связей. В некоторых воплощениях альфа-спиральность макроциклов настоящего изобретения составляет более 50%. Чтобы определить спиральность пептидомиметических макроциклов настоящего изобретения, соединения растворяют в водном растворе (например, в 50 мМ растворе фосфата калия при pH 7, или в дистиллированной H2O, до концентрации 25-50 мкМ). Спектры кругового дихроизма (CD) получают на спектрополяриметре (например, Jasco J-710), используя стандартные параметры измерения (например, температура 20ºC; длина волны 190-260 нм; шаговое разрешение 0,5 нм; скорость 20 нм/сек; накопление 10; ответ 1 сек; ширина полосы 1 нм; длина пути 0,1 см). Содержание альфа-спиральных участков в каждом пептиде рассчитывают путем деления средней остаточной эллиптичности (например, [Ф]222obs) на опубликованное значение, полученное для модельного спирального декапептида (Yang et al. (1986), Methods Enzymol. 130:208)).
Определение температуры плавления (т.пл.).
Пептидомиметический макроцикл настоящего изобретения, вторичная структура которого представляет собой α-спираль, имеет, например, более высокую температуру плавления, чем соответствующий полипептид, не содержащий поперечных связей. Как правило, т.пл. пептидомиметических макроциклов настоящего изобретения составляет >60ºC, свидетельствуя о высокой стабильности структуры в водных растворах. Чтобы определить, как влияет образование макроцикла на температуру плавления, пептидомиметические макроциклы или немодифицированные пептиды растворяют в дистиллированной H2O (например, в конечной концентрации 50 мкМ) и определяют т.пл. путем измерения на спектрополяриметре (например, Jasco J-710) изменения эллиптичности в диапазоне температур (например, от 4 до 95ºC), используя стандартные параметры (например, длина волны 222 нм; шаговое разрешение 0,5 нм; скорость 20 нм/сек; накопление 10; ответ 1 сек; ширина полосы, 1 нм; скорость повышения температуры: 1ºC/мин; длина пути 0,1 см).
Анализ устойчивости к протеазам
Амидная связь пептидного скелета чувствительна к гидролизу под действием протеаз, что придает пептидным соединениям склонность к быстрой деградации in vivo. Однако образование пептидной спирали обычно приводит к заглублению амидного скелета и, следовательно, может защитить его от протеолитического расщепления. Чтобы определить изменение скорости деградации по сравнению с полипептидом, не содержащим поперечные связи, пептидомиметические макроциклы настоящего изобретения можно подвергнуть протеолизу под действием трипсина in vitro. Например, пептидомиметический макроцикл и соответствующий полипептид, не содержащий поперечных связей, инкубируют с трипсин-содержащей агарозой, реакции гасят в разные моменты времени центрифугированием и затем проводят анализ методом ВЭЖХ, чтобы количественно определить остаточный субстрат по ультрафиолетовому поглощению при 280 нм. Коротко говоря, пептидомиметический макроцикл и пептидомиметический предшественник (5 мкг) инкубируют с трипсин-содержащей агарозой (Pierce) (S/E приблизительно 125) в течение 0, 10, 20, 90 и 180 минут. Реакции гасят центрифугированием с высокой скоростью в настольной центрифуге; количественное определение оставшегося субстрата в выделенном супернатанте проводят методом ВЭЖХ с детекцией пика при 280 нм. Протеолитическая реакция характеризуется кинетическими параметрами первого порядка и константой скорости, k, которую определяют из графика зависимости ln[S] от времени (k=-1×угол наклона).
Анализ стабильности ex vivo
Период полужизни ex vivo пептидомиметических макроциклов с оптимизированными линкерами, например, по меньшей мере, в два раза превышает период полужизни соответствующего полипептида, не содержащего поперечных связей, и составляет 12 часов или более. Стабильность в сыворотке ex vivo можно анализировать с помощью ряда способов. Например, пептидомиметический макроцикл и соответствующий полипептид, не содержащий поперечных связей, (2 мкг) инкубируют со свежей мышиной, крысиной и/или человеческой сывороткой (2 мл) при 37ºC в течение 0, 1, 2, 4, 8 и 24 часов. Уровень интактного соединения можно определить с помощью следующего способа: Образцы экстрагируют путем переноса 100 мкл сыворотки в центрифужные пробирки объемом 2 мл с последующим добавлением 10 мкл 50% муравьиной кислоты и 500 мкл ацетонитрила, после чего центрифугируют при 14000 об/мин в течение 10 мин при 4±2ºC. Затем супернатанты переносят в новые пробирки объемом 2 мл и упаривают на Turbovap при давлении N2 <10 фунт/дюйм2 и 37ºC. Образцы перерастворяют в 100 мкл смеси 50:50 ацетонитрил:вода и анализируют методом ЖХ-МС/МС.
Анализ связывания in vitro
Для оценки связывания пептидомиметических макроциклов и пептидомиметических предшественников с акцепторными белками, а также сродства такого связывания, можно использовать, например, анализ поляризации флуоресценции (FPA). Метод FPA позволяет измерять ориентацию и мобильность молекул с использованием поляризованного света и флуоресцентной метки. При возбуждении поляризованным светом флуоресцентные метки (например, FITC), присоединенные к молекулам с высокой кажущейся молекулярной массой (например, FITC-меченные пептиды, связанные с большим белком), испускают поляризованную флуоресценцию на повышенном уровне, поскольку они характеризуются более медленной скоростью вращения, чем флуоресцентные метки, присоединенные к молекулам меньшего размера (например, FITC-меченные пептиды, присутствующие в растворе в свободном состоянии).
Например, меченные флуоресцином пептидомиметические макроциклы (25 нМ) инкубируют с акцепторным белком (25-1000 нм) в буфере для связывания (140 мМ NaCl, 50 мМ Tris-HCl, pH 7,4) в течение 30 минут при комнатной температуре. Связывающую активность измеряют, например, методом поляризации флуоресценции на люминесцентном спектрофотометре (например, Perkin-Elmer LS50B). Значения Kd можно определить методом нелинейной регрессии, используя, например, программное обеспечение Graphpad Prism (GraphPad Software, Inc., San Diego, CA). В некоторых случаях Kd пептидомиметического макроцикла настоящего изобретения равна или ниже Kd соответствующего полипептида, не содержащего поперечных связей.
Анализ замещения in vitro с целью характеристики антагонистов пептид-белковых взаимодействий
Связывание и сродство соединений, препятствующих взаимодействию пептида с акцепторным белком, определяют, например, методом поляризации флуоресценции (FPA), используя меченный флуоресцеином пептидомиметический макроцикл, полученный из последовательности пептидомиметического предшественника. Метод FPA позволяет измерять ориентацию и мобильность молекул с использованием поляризованного света и флуоресцентной метки. При возбуждении поляризованным светом флуоресцентные метки (например, FITC), присоединенные к молекулам с высокой кажущейся молекулярной массой (например, FITC-меченные пептиды, связанные с большим белком), испускают поляризованную флуоресценцию на повышенном уровне, поскольку они характеризуются более медленной скоростью вращения, чем флуоресцентные метки, присоединенные к молекулам меньшего размера (например, FITC-меченные пептиды, присутствующие в растворе в свободном состоянии). Соединение, препятствующее взаимодействию меченного флуоресцеином пептидомиметического макроцикла и акцепторного белка, детектируют с помощью анализа конкурентного связывания методом FPA.
Например, предполагаемые соединения-антагонисты (в концентрации от 1 нМ до 1 мМ) и меченный флуоресцеином пептидомиметический макроцикл (25 нМ) инкубируют с акцепторным белком (50 нМ) в буфере для связывания (140 мМ NaCl, 50 мМ Tris-HCl, pH 7,4) в течение 30 минут при комнатной температуре. Связывающую активность антагониста измеряют, например, методом поляризации флуоресценции на люминесцентном спектрофотометре (например, Perkin-Elmer LS50B). Значения Kd можно определить методом нелинейной регрессии, используя, например, программное обеспечение Graphpad Prism (GraphPad Software, Inc., San Diego, CA).
В данном анализе в качестве предполагаемых антагонистов можно использовать молекулы любого класса, такие как маленькие органические молекулы, пептиды, олигонуклеотиды или белки.
Анализ связывания белок-лиганд методом аффинной селекции-масс-спектрометрии
Для анализа связывания тестируемых соединений с белками и сродства такого связывания используют, например, метод аффинной селекции-масс-спектрометрии. Анализ связывания белок-лиганд проводят в соответствии с нижеследующей типичной процедурой, описанной для общесистемного контрольного эксперимента, используя 1 мкМ пептидомиметического макроцикла и 5 мкМ hMDM2. Аликвоту объемом 1 мкл 40 мкМ исходного раствора пептидомиметического макроцикла в ДМСО растворяют в 19 мкл PBS (забуференный фосфатом физиологический раствор: 50 мМ фосфатный буфер, pH 7,5, содержащий 150 мМ NaCl). Полученный раствор перемешивают путем многократного пипетирования и затем осветляют путем центрифугирования при 10000 g в течение 10 мин. К аликвоте полученного супернатанта объемом 4 мкл добавляют 4 мкл 10 мкМ раствора hMDM2 в PBS. В результате каждые 8,0 мкл экспериментального образца содержат 40 пмоль (1,5 мкг) белка при концентрации 5,0 мкМ в PBS, 1 мкМ пептидомиметического макроцикла и 2,5% ДМСО. Полученные таким образом образцы с повторами для каждой концентрационной точки инкубируют 60 мин при комнатной температуре, затем охлаждают до 4ºC и подвергают анализу методом гель-хроматографии-ЖХ-МС, используя для ввода 5,0 мкл. Образцы, содержащие целевой белок, комплексы белок-лиганд и несвязанные соединения, вводят на колонку для SEC (Size Exclusion Chromatography - гель-хроматографии), где комплексы отделяют от несвязанных компонентов путем быстрого проведения SEC. Элюат, полученный с колонки для SEC, анализируют с помощью УФ-детекторов, подтверждая, что рано элюирующаяся белковая фракция, которая выходит в свободном объеме колонки для SEC, не содержит несвязанных компонентов, которые удерживаются на колонке. После того, как пик, содержащий белок и комплексы белок-лиганд, элюируется с первичного УФ-детектора, он поступает в петлю для образца, где отделяется от потока стадии SEC и посредством распределительного механизма переносится в ЖХ-МС. ESI-МС показывает наличие иона пептидомиметического макроцикла (M+3H)3+ с ожидаемым значением m/z, подтверждая присутствие комплекса белок-лиганд.
Титриметрический анализ для определения Kd комплекса белок-лиганд
Чтобы определить связывание тестируемых соединений с белками и сродство такого связывания, проводят, например, титриметрический анализ для определения Kd комплекса белок-лиганд. Титриметрический анализ для определения Kd комплекса белок-лиганд проводят следующим образом: Получают аликвоты серийных разведений исходного раствора титранта - пептидомиметического макроцикла в ДМСО объемом 2 мкл (5, 2,5, …, 0,098 мМ) и затем добавляют 38 мкл PBS. Полученные растворы перемешивают путем многократного пипетирования и затем осветляют путем центрифугирования при 10000 g в течение 10 мин. К аликвотам полученных супернатантов объемом 4,0 мкл добавляют 4,0 мкл 10 мкМ раствора hMDM2 в PBS. В результате каждые 8,0 мкл экспериментального образца содержат 40 пмоль (1,5 мкг) белка при концентрации 5,0 мкМ в PBS, разные концентрации (125, 62,5, …, 0,24 мкМ) титрационного пептида и 2,5% ДМСО. Полученные таким образом образцы с повторами для каждой концентрационной точки инкубируют 30 мин при комнатной температуре, затем охлаждают до 4ºC и подвергают анализу методом SEC-ЖХ-МС, используя для ввода 2,0 мкл. ESI-МС показывает наличие ионов (M+H)1+, (M+2H)2+, (M+3H)3+ и/или (M+Na)1+; экстрагированные ионные хроматограммы подвергают количественному анализу, затем подгоняют к уравнениям, чтобы определить сродство связывания Kd, как описано в "General Technique to Rank Protein-Ligand Binding Affinities and Determine Allosteric vs. Direct Binding Site Competition in Compound Mixtures." Annis, D. A.; Nazef, N.; Chuang, C.C; Scott, M. P.; Nash, H. M. J. Am. Chem. Soc. 2004, 126, 15495-15503; и в "ALIS: An Affinity Selection-Mass Spectrometry System for the Discovery и Characterization of Protein-Ligand Interactions" D. A. Annis, C.-C. Chuang, и N. Nazef. In Mass Spectrometry in Medicinal Chemistry. Edited by Wanner K, Homer G:Wiley-VCH; 2007: 121-184. Mannhold R, Kubinyi H, Folkers G (Series Editors): Methods and Principles in Medicinal Chemistry.
Анализ конкурентного связывания методом аффинной селекции-масс-спектрометрии
Чтобы определить способность тестируемых соединений конкурентно связываться с белками, используют, например, метод аффинной селекции-масс-спектрометрии. Смесь лигандов, содержащую 40 мкМ каждого компонента, получают путем объединения 2 мкл аликвот 400 мкМ исходных растворов каждого из трех соединений с 14 мкл ДМСО. Затем аликвоты объемом 1 мкл полученной смеси, содержащей 40 мкМ каждого компонента объединяют с 1 мкл аликвот серийных разведений исходного раствора титранта пептидомиметического макроцикла в ДМСО (10, 5, 2,5, …, 0,078 мМ). Полученные образцы объемом 2 мкл растворяют в 38 мкл PBS. Полученные растворы перемешивают путем многократного пипетирования и затем осветляют путем центрифугирования при 10000 g в течение 10 мин. К аликвотам полученных супернатантов объемом 4,0 мкл добавляют 4,0 мкл 10 мкМ раствора hMDM2 в PBS. В результате каждые 8,0 мкл экспериментального образца содержат 40 пмоль (1,5 мкг) белка при концентрации 5,0 мкМ в PBS, 0,5 мкМ лиганда, 2,5% ДМСО и разные концентрации (125, 62,5, …, 0,24 мкМ) титранта пептидомиметического макроцикла. Полученные таким образом образцы с повторами для каждой концентрационной точки инкубируют 30 мин при комнатной температуре, затем охлаждают до 4ºC и подвергают анализу методом SEC-ЖХ-МС, используя для ввода 2,0 мкл. Другие подробности описанных и других методов можно найти в "A General Technique to Rank Protein- Ligand Binding Affinities and Determine Allosteric vs. Direct Binding Site Competitionin Compound Mixtures Annis, D. A.; Nazef, N.; Chuang, C. C; Scott, M.P.; Nash, H. M. J. Am. Chem. Soc. 2004, 126, 15495-15503; а также в "ALIS: An Affinity Selection-Mass Spectrometry System for the Discovery and Characterization of Protein-Ligand Interactions" D. A. Annis, C.-C. Chuang, and N. Nazef. In Mass Spectrometry in Medicinal Chemistry. Edited by Wanner K, Hofner G: Wiley-VCH; 2007: 121-184. Mannhold R, Kubinyi H, Folkers G (Series Editors): Methods и Principles in Medicinal Chemistry.
Анализ связывания на интактных клетках
Связывание пептидов или пептидомиметических макроциклов с их природными акцепторами в интактных клетках можно измерить, используя метод иммунопреципитации. Например, интактные клетки инкубируют с соединениями, меченными флуоресцеином (FITC-меченными), в течение 4 ч в отсутствие сыворотки, затем сыворотку заменяют и дополнительно инкубируют в интерале времени от 4 до 18 ч. Затем клетки осаждают центрифугированием и инкубируют в буфере для лизиса (50 мМ трис [pH 7,6], 150 мМ NaCl, 1% CHAPS и смесь ингибиторов протеаз) в течение 10 минут при 4ºC. Экстракты центрифугируют при 14000 об/мин в течение 15 минут, после чего супернатанты собирают и инкубируют, переворачивая, с 10 мкл козьих антител против FITC в течение 2 ч при 4ºC, затем инкубируют еще 2 ч при 4ºC с сефарозой, содержащей белок A/G (50 мкл 50% взвеси гранул). После быстрого центрифугирования осадки промывают буфером для лизиса, содержащим повышенные концентрации соли (например, 150, 300, 500 мМ). Затем гранулы переуравновешивают в 150 мМ NaCl, добавляют SDS-содержащий буфер для образца и кипятят. После центрифугирования супернатанты необязательно подвергают электрофорезу в 4-12% градиенте Bis-Tris гелей и затем переносят на мембраны Immobilon-P. После блокирования блоты необязательно инкубируют с антителом, позволяющим детектировать FITC и, кроме того, с одним или несколькими антителами, позволяющими детектировать белки, способные связываться с пептидомиметическим макроциклом.
Анализ способности проникать в клетки
Пептидомиметический макроцикл, например, лучше проникает в клетки, чем соответствующий макроцикл, не содержащий поперечных связей. Способность проникать в клетки у пептидомиметических макроциклов, содержащих оптимизированные линкеры, например, по меньшей мере, в два раза выше, чем у соответствующего макроцикла, не содержащего поперечных связей, и обычно через 4 часа в клетки проникает 20% или более от количества введенного пептидомиметического макроцикла. Чтобы измерить способность проникать в клетки пептидомиметического макроцикла и соответствующего макроцикла, не содержащего поперечных связей, интактные клетки инкубируют с меченным флуоресцеином пептидомиметическим макроциклом или соответствующим макроциклом, не содержащим поперечных связей, (10 мкМ) в течение 4 ч в бессывороточной среде при 37ºC, дважды промывают средой и инкубируют с трипсином (0,25%) в течение 10 мин при 37ºC. Клетки снова промывают и ресуспендируют в PBS. Флуоресценцию в клетках анализируют, например, с помощью проточного цитометра FACSCalibur или HCS-ридера Cellomics' KineticScan®.
Анализы клеточной эффективности
Эффективность некоторых пептидомиметических макроциклов определяют, например, с помощью анализов выживания клеток, в которых используют ряд образующих опухоль и не образующих опухоль клеточных линий, а также первичные клетки, полученные из человеческих или мышиных клеточных популяций. Жизнеспособность клеток отслеживают, например, на протяжении 24-96 ч инкубации с пептидомиметическими макроциклами (от 0,5 до 50 мкМ), чтобы идентифицировать макроциклы, способные убивать клетки при EC50<10 мкМ. Некоторые стандартные анализы, позволяющие измерять жизнеспособность клеток, являются коммерчески доступными и могут использоваться для определения эффективности пептидомиметических макроциклов. Кроме того, анализы, позволяющие измерять активацию аннексина V и каспазы, можно использовать для определения способности пептидомиметических макроциклов убивать клетки в результате активации апоптотического механизма. Например, можно использовать анализ Cell Titer-glo, который позволяет определять жизнеспособность клеток как функцию внутриклеточной концентрации АТФ.
Анализ стабильности in vivo
Чтобы исследовать стабильность пептидомиметических макроциклов in vivo, например, соединения вводят мышам и/или крысам путем в.в., в.б., п.о. введения, или путем ингаляции, в концентрациях, варьирующих от 0,1 до 50 мг/кг, и через 0 мин, 5 мин, 15 мин, 30 мин, 1 ч, 4 ч, 8 ч и 24 ч после введения берут образцы крови. Затем измеряют уровни интактных соединений в 25 мкл свежей сыворотки с помощью описанного выше метода ЖХ-МС/МС.
Эффективность у животных моделей in vivo
Чтобы определить антионкогенную активность пептидомиметических макроциклов настоящего изобретения in vivo, соединения, например, вводят отдельно (в.б., в.в., п.о., путем ингаляции или назального введения) или в сочетании с субоптимальными дозами соответствующей химиотерапии (например, циклофосфамида, доксорубицина, этопозида). В одном примере 5×106 клеток RS4;11 (полученных из костного мозга пациента с острым лимфобластным лейкозом), стабильно экспрессирующих люциферазу, вводят мышам NOD-SCID в хвостовую вену через 3 ч после тотального облучения организма. Необработанные модели данного лейкоза погибают через три недели. Лейкоз легко отслеживать, например, путем введения мышам D-люциферина (60 мг/кг) с последующей томографией анестезированных животных (например, с помощью системы визуализации in vivo Xenogen, Caliper Life Sciences, Hopkinton, MA). Общую биолюминесценцию организма количественно определяют путем интеграции потока фотонов (фотоны/сек) с помощью программного обеспечения Living Image (Caliper Life Sciences, Hopkinton, MA). Пептидомиметические макроциклы, например, вводят лейкемическим мышам отдельно или в сочетании с субоптимальными дозами подходящих химиотерапевтических средств (через 10 дней после инъекции/на 1 день эксперимента, в диапазоне биолюминесценции 14-16) через хвостовую вену или внутрибрюшинно в дозах, варьирующих от 0,1 мг/кг до 50 мг/кг в течение 7-21 дней. На всем протяжении эксперимента через день мышей необязательно подвергают томографии и ежедневно отслеживают выживание. В конце эксперимента умерших мышей необязательно подвергают некропсии. Другую животную модель получают путем имплантации мышам NOD-SCID DoHH2, клеточной линии человеческой фолликулярной лимфомы, стабильно экспрессирующей люциферазу. С помощью описанных анализов in vivo можно получить предварительные фармакокинетические, фармакодинамические и токсикологические данные.
Клинические испытания
Клинические испытания проводят, чтобы определить, можно ли использовать пептидомиметические макроциклы настоящего изобретения для лечения людей. Например, выбирают пациентов, которые имеют диагностированный рак и нуждаются в лечении, и подразделяют их на экспериментальную группу и одну или несколько контрольных групп, экспериментальной группе вводят пептидомиметический макроцикл настоящего изобретения, а контрольным группам вводят плацебо или известное противораковое средство. Безопасность лечения и эффективность пептидомиметических макроциклов настоящего изобретения можно оценить путем сравнения таких факторов как выживание и качество жизни в разных группах пациентов. В данном примере в группе пациентов, получающих пептидомиметический макроцикл, наблюдается улучшенное длительное выживание по сравнению с контрольной группой пациентов, получающих плацебо.
Фармацевтические композиции и способы введения
Пептидомиметические макроциклы настоящего изобретения также включают в себя фармацевтически приемлемые производные или пролекарственные формы. Термин "фармацевтически приемлемое производное" включает в себя все фармацевтически приемлемые соли, сложные эфиры, соли сложных эфиров, пролекарства или другие производные соединений настоящего изобретения, которые при введении реципиенту способны предоставлять (непосредственно или косвенно) соединение настоящего изобретения. Особенно предпочтительными фармацевтически приемлемыми производными являются такие производные, которые повышают биодоступность соединений настоящего изобретения при введении млекопитающему (например, в результате повышенного поступления в кровь после перорального введения соединения), или которые увеличивают доставку активного соединения в биологический компартмент (такой как мозг или лимфатическая система), соответствующий типу пациента. Некоторые фармацевтически приемлемые производные содержат химическую группу, которая повышает растворимость в воде или активный транспорт через слизистую оболочку желудочно-кишечного тракта.
В некоторых воплощениях пептидомиметические макроциклы настоящего изобретения модифицируют путем ковалентного или нековалентного присоединения соответствующих функциональных групп с целью улучшения отдельных биологических свойств. Такие модификации включают в себя модификации, которые повышают биологическое проникновение в заданный биологический компартмент (такой как кровь, лимфатическая система, центральная нервная система), увеличивают биодоступность при пероральном применении, повышают растворимость, позволяя вводить соединения путем инъекции, изменяют метаболизм и скорость выведения.
Фармацевтически приемлемые соли соединений данного изобретения включают в себя соли фармацевтически приемлемых неорганических и органических кислот и оснований. Примеры солей подходящих кислот включают в себя ацетат, адипат, бензоат, бензолсульфонат, бутират, цитрат, диглюконат, додецилсульфат, формат, фумарат, гликолят, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроидид, лактат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, пальмоат, фосфат, пикрат, пивалат, пропионат, салицилат, сукцинат, сульфат, тартрат, тозилат и ундеканоат. Соли подходящих оснований включают в себя соли щелочных металлов (например, натрия), щелочноземельных металлов (например, магния), аммония и N-(алкил)4+.
Фармацевтически приемлемые носители, подходящие для получения фармацевтических композиций соединений настоящего изобретения, включают в себя как твердые, так и жидкие носители. Твердые препараты включают в себя порошки, таблетки, пилюли, капсулы, крахмальные облатки, суппозитории и диспергируемые гранулы. Твердый носитель может представлять собой одно или несколько веществ, которые также могут действовать как разбавители, ароматизаторы, связующие средства, консерванты, дезинтегрирующие средства для таблеток или капсулирующие средства. Детали способов получения и введения композиций широко описаны в научной и патентной литературе, например, в последнем издании Remington's Pharmaceutical Sciences, Maack Publishing Co, Easton PA.
Носитель, используемый для получения порошков, представляет собой мелкоизмельченное твердое вещество, которое смешивают с мелкоизмельченным активным соединением. При получении таблеток активный компонент смешивают с носителем, обладающим необходимыми связывающими свойствами, в подходящем соотношении и прессуют, придавая желательные форму и размер.
Подходящие твердые наполнители, представляющие собой углеводные или белковые наполнители, включают в себя, без ограничения, сахара, такие как лактоза, сахароза, маннит или сорбит; крахмал из кукурузы, пшеницы, риса, картофеля или других растений; целлюлозу, такую как метилцеллюлоза, гидроксипропилметилцеллюлоза или карбоксиметилцеллюлоза натрия; и камеди, такие как гуммиарабик и трагакант; а также белки, такие как желатин и коллаген. При необходимости добавляют дезинтегрирующие или солюбилизирующие средства, такие как поперечно сшитый поливинилпирролидон, агар, альгиновая кислота или ее соль, такая как альгинат натрия.
Жидкие препараты включают в себя растворы, суспензии и эмульсии, например, водные или водно/пропиленгликолевые растворы. Для парентеральной инъекции можно использовать жидкие препараты, полученные в виде водно-полиэтиленгликолевого раствора.
Фармацевтическая композиция предпочтительно находится в виде стандартной лекарственной формы. Для получения такой формы препарат подразделяют на отдельные дозы, содержащие соответствующие количества активного компонента. Стандартная лекарственная форма может представлять собой упакованный препарат, упаковка которого содержит отдельные количества препарата, такие как пакетированные таблетки, капсулы и порошки во флаконах или в ампулах. Кроме того, стандартная лекарственная форма может представлять собой капсулу, таблетку, облатку или пастилку как таковую, или она может представлять собой подходящее число любой из указанных форм в одной упаковке.
Если композиции настоящего изобретения содержат сочетание пептидомиметического макроцикла и одно или несколько других терапевтических или профилактических средств, и соединение, и другое средство должны присутствовать на дозировочных уровнях, составляющих примерно от 1 до 100%, более предпочтительно примерно от 5 до 95% от дозы, обычно вводимой в режиме монотерапии. В некоторых воплощениях другие средства вводят отдельно от соединений настоящего изобретения, как часть режима многократного приема. Альтернативно указанные средства являются частью одной лекарственной формы и в смеси с соединениями настоящего изобретения входят в состав одной композиции.
Способы применения
В одном аспекте настоящее изобретение предлагает новые пептидомиметические макроциклы, которые можно использовать в анализах конкурентого связывания для идентификации средств, которые связываются с природным лигандом (природными лигандами) белков или пептидов, на основе которых моделируют пептидомиметические макроциклы. Например, в системе p53/HDMX меченные пептидомиметические макроциклы на основе p53 можно использовать в анализе связывания HDMX наряду с маленькими молекулами, которые конкурентно связываются с HDMX. Анализы конкурентного связывания позволяют быстро оценить и детектировать in vitro лекарственные средства-кандидаты, специфичные к системе p53/HDMX. Такие анализы связывания можно проводить с использованием любого из раскрытых здесь пептидомиметических макроциклов и их партнеров по связыванию.
Изобретение дополнительно предлагает антитела против пептидомиметических макроциклов. В некоторых воплощениях указанные антитела специфически связываются как с пептидомиметическим макроциклом, так и с пептидами-предшественниками, такими как p53, родственными пептидомиметическим макроциклам. Такие антитела могут разрушать природные белок-белковые взаимодействия, например, связь между p53 и HDMX.
В других аспектах настоящее изобретение предлагает способы профилактики и лечения субъекта с риском нарушения (или восприимчивого к нарушению), или страдающего от нарушения, характеризующегося аберрантной (например, недостаточной или избыточной) экспрессией или активностью молекул, включающих в себя p53, HDM2 или HDMX.
В другом воплощении нарушение обусловлено, по меньшей мере, отчасти, аномальным уровнем p53, или HDM2, или HDMX, (например, повышенной или пониженной экспрессией), или присутствием p53, или HDM2, или HDMX, обладающих аномальной активностью. Как таковое, уменьшение уровня и/или активности p53, или HDM2, или HDMX, или увеличение уровня и/или активности p53, или HDM2, или HDMX, под действием пептидомиметических макроциклов, полученных из p53, используют, например, для облегчения или уменьшения неблагоприятных симптомов нарушения.
В другом аспекте настоящее изобретение предлагает способы лечения или профилактики заболевания, включающего в себя гиперпролиферативное заболевание и воспалительное нарушение, путем препятствования взаимодействию или связыванию партнеров по связыванию, например, p53 и HDM2, или p53 и HDMX. Указанные способы включают в себя введение эффективного количества соединения настоящего изобретения теплокровному животному, в том числе человеку. В некоторых воплощениях введение соединений настоящего изобретения индуцирует прекращение роста клеток или апоптоз.
В настоящем описании термин "лечение" определяют как применение или введение терапевтического средства пациенту, или применение или введение терапевтического средства в выделенную ткань или клеточную линию, полученную от пациента, имеющего заболевание, симптом заболевания или предрасположенность к заболеванию, с целью лечения, излечения, облегчения, уменьшения, изменения, вылечивания, повышения, улучшения или воздействия на заболевание, симптомы заболевания или предрасположенность к заболеванию.
В некоторых воплощениях пептидомиметические макроциклы настоящего изобретения используют для лечения, профилактики и/или диагностики раковых заболеваний и неопластических состояний. В настоящем описании термины "рак", "гиперпролиферативный" и "неопластический" относятся к клеткам, обладающим способностью к автономному росту, т.е. к аномальному статусу или состоянию, характеризующемуся быстрой пролиферацией клеток. Гиперпролиферативные и неопластические болезненные состояния можно классифицировать как патологические, т.е. характеризующие или составляющие болезненное состояние, или их можно классифицировать как непатологические, т.е. как отклонение от нормального состояния, не связанное с болезненным состоянием. Подразумевается, что термин включает в себя все типы ракового роста или онкогенных процессов, метастатические ткани или клетки, ткани или органы, подвергшиеся злокачественной трансформации, независимо от гистопатологического типа или стадии инвазивности. Метастатические опухоли могут вырастать из первичных опухолей разных типов, включающих в себя, без ограничения, опухоли молочной железы, легкого, печени, толстой кишки и яичника. "Патологические гиперпролиферативные" клетки встречаются при болезненных состояниях, характеризующихся злокачественным ростом опухоли. Примеры непатологических гиперпролиферативных клеток включают в себя пролиферацию клеток, связанную с заживлением раны. Примеры клеточно-пролиферативных и/или дифференцировочных расстройств включают в себя рак, такой как карцинома, саркома или метастаческие нарушения. В некоторых воплощениях пептидомиметические макроциклы представляют собой новые терапевтические средства лечения рака молочной железы, рака яичника, рака толстой кишки, рака легкого, метастаз указанных раковых заболеваний и т.п.
Примеры раковых заболеваний или неопластичских состояний включают в себя, без ограничения, такие заболевания, как фибросаркома, миосаркома, липосаркома, хондросаркома, остеогенная саркома, хордома, ангиосаркома, эндотелиосаркома, лимфангиосаркома, лимфангиоэндотелиосаркома, синовиома, мезотелиома, саркома Юинга, лейомиосаркома, рабдомиосаркома, рак желудка, рак пищевода, рак прямой кишки, рак поджелудочной железы, рак яичника, рак простаты, рак матки, рак головы и шеи, рак кожи, рак мозга, плоскоклеточная карцинома, карцинома сальных желез, папиллярная карцинома, папиллярная аденокарцинома, цистаденокарцинома, медуллярный рак, бронхогенный рак, почечноклеточный рак, гепатома, карцинома желчного протока, хориокарцинома, семинома, эмбриональный рак, опухоль Вилма, рак шейки матки, рак яичка, мелкоклеточная карцинома легкого, немелкоклеточный рак легкого, карцинома мочевого пузыря, карцинома эпителия, глиома, астроцитома, медуллобластома, краниофарингиома, эпендимома, пинеалома, гемангиобластома, акустическая невринома, олигодендроглиома, менингиома, меланома, нейробластома, ретинобластома, лейкоз, лимфома или саркома Капоши.
Примеры пролиферативных нарушений включают в себя неопластические нарушения кроветворных органов. В настоящем описании термин "неопластические нарушения кроветворных органов" включает в себя заболевания, в которых участвуют гиперпластические/неопластические клетки гематопоэтического происхождения, например, образующиеся из миелоидных, лимфоидных или эритроидных линий, или из их предшественников. Предпочтительно эти заболевания развиваются из плохо дифференцированных острых лейкозов, таких как эритробластический лейкоз и острый мегакариобластический лейкоз. Другие примеры миелоидных нарушений включают в себя, без ограничения, острый промиелоидный лейкоз (APML), острый миелогенный лейкоз (AML) и хронический миелогенный лейкоз (CML) (обзор можно найти в Vaickus (1991), Crit Rev.Oncol./Hemotol. 11:267-97); лимфоидные злокачественные заболевания включают в себя, без ограничения, острый лимфобластный лейкоз (ALL), в котором участвуют B-линия ALL и T-линия ALL, хронический лимфолейкоз (CLL), пролимфоцитарный лейкоз (PLL), волосатоклеточный лейкоз (HLL) и макроглобулинемия Вальденстрема (WM). Другие формы злокачественных лимфом включают в себя, без ограничения, неходжкинскую лимфому и ее варианты, лимфомы периферических T-клеток, T-клеточный лейкоз/лимфома взрослых (ATL), Т-клеточная лимфома кожи (CTCL), большой гранулярный лимфоцитарный лейкоз (LGF), болезнь Ходжкина и болезнь Рида-Стернберга.
Примеры клеточных пролиферативных и/или дифференцировочных расстройств молочной железы включают в себя, без ограничения, пролиферативную болезнь молочной железы, такую как, например, эпителиальная гиперплазия, склерозирующий аденоз и папилломы маленьких молочных протоков; опухоли, например, стромальные опухоли, такие как фиброаденома, филлоидная цистосаркома и саркомы, а также эпителиальные опухоли, такие как папилломы больших молочных протоков; карцинома молочной железы, такая как карцинома in situ (неинвазивная), которая включает в себя карциному эпителия протоков in situ (в том числе болезнь Педжета) и дольковую карциному in situ, и инвазивная (инфильтрующая) карцинома, включающая в себя, без ограничения, инвазивную карциному эпителия протоков, инвазивную дольковую карциному, медуллярную карциному, коллоидную (слизеобразующую) карциному, тубулярную карциному и инвазивную папиллярную карциному, а также смешанные злокачественные опухоли. Заболевания мужской молочной железы включают в себя, без ограничения, гинекомастию и карциному.
Примеры клеточных пролиферативных и/или дифференцирующих нарушений легких включают в себя, без ограничения, бронхогенный рак, включающий в себя паранеопластические синдромы, бронхоальвеолярную карциному, нейроэндокринные опухоли, такие как бронхиальный карциноид, смешанные опухоли и метастатические опухоли; патологии плевры, включающие в себя воспалительные плевральные экссудаты, невоспалительные плевральные экссудаты, пневмоторакс и плевральные опухоли, включающие в себя отдельные фиброзные опухоли (фибромы плевры) и злокачественную мезотелиому.
Примеры клеточных пролиферативных и/или дифференцирующих нарушений толстой кишки включают в себя, без ограничения, не неопластические полипы, аденомы, семейные синдромы, колоректальный канцерогенез, колоректальную карциному и карциноидные опухоли.
Примеры клеточных пролиферативных и/или дифференцирующих нарушений печени включают в себя, без ограничения, узловые гиперплазии, аденомы и злокачественные опухоли, такие как первичная карцинома печени и метастатические опухоли.
Примеры клеточных пролиферативных и/или дифференцирующих нарушений яичников включают в себя, без ограничения, опухоли яичников, такие как опухоли целомического эпителия, серозные опухоли, слизеобразующие опухоли, эндометриоидные опухоли, светлоклеточная аденокарцинома, цистаденофиброма, опухоль Бреннера, поверхностные эпителиальные опухоли; герминомы, такие как зрелые (доброкачественные) тератомы, монодермальные тератомы, незрелые злокачественные тератомы, дисгерминома, эндодермальная опухоль, хориокарцинома; опухоли зародышевых тяжей-стомы, такие как гранулезотекаклеточные опухоли, текомафибромы, андробластомы, hill cell tumors и гонадобластома; а также метастатические опухоли, такие как опухоли Крукенберга.
В других или следующих воплощениях описанные здесь пептидомиметические макроциклы используют для лечения, профилактики или диагностики состояний, характеризующихся гибелью сверхактивных клеток или клеточной гибелью вследствие физиологического повреждения и др. Некоторые примеры состояний, характеризующихся преждевременной или нежелательной гибелью клеток, или, альтернативно, нежелательной или избыточной пролиферацией клеток, включают в себя, без ограничения гипоцеллюлярные/гипопластические, ацеллюлярные/апластические или гиперцеллюлярные/гиперпластические остояния. Некоторые примеры включают в себя гематологические расстройства, такие как, без ограничения, анемия Фанкони, апластическая анемия, талассемия, наследственный агранулоцитоз и миелодисплазия.
В других или следующих воплощениях пептидомиметические макроциклы настоящего изобретения, действие которых заключается в уменьшении апоптоза, используют для лечения расстройств, связанных с нежелательным уровнем клеточной гибели. Так, в некоторых воплощениях антиапоптотические пептидомиметические макроциклы настоящего изобретения используют для лечения расстройств, сопровождающихся гибелью клеток, обусловленной вирусной инфекцией, такой как инфекция, ассоциированная с инфекцией вируса иммунодефицита человека (ВИЧ). Широкий ряд нейрологических заболеваний характеризуется постепенной утратой специфических групп нейронов. Одним из примеров является болезнь Альцгеймера (AD). Болезнь Альцгеймера характеризуется утратой нейронов и синапсов в коре головного мозга и в некоторых подкорковых участках. Данная утрата приводит к явной атрофии пораженных участков. В мозгах пациентов, пораженных AD, видны и амилоидные бляшки, и нейрофибриллярные клубки. Болезнь Альцгеймера была идентифицирована как заболевание, связанное с нарушением свертывания белков вследствие накопления в мозге A-бета и tau-белков с аномальной укладкой. Бляшки образуются из β-амилоида. β-амилоид представляет собой фрагмент более крупного белка, называемого белок-предшественник амилоида (APP). APP играет важную роль в росте нейронов, выживании и восстановлении после повреждения. При AD неизвестный процесс вызывает расщепление APP на более мелкие фрагменты в результате ферментативного протеолиза. Один из таких фрагментов представляет собой скопление волоконец β-амилоида, которые образуют комки, откладывающиеся снаружи нейронов в виде плотных образований, называемых старческие бляшки. Бляшки продолжают расти с образованием нерастворимых скрученных волокон в нервных клетках, часто называемых клубками. Следовательно, нарушение взаимодействия β-амилоида с его природным рецептором является важным фактором при лечении AD. В некоторых воплощениях антиапоптотические пептидомиметические макроциклы настоящего изобретения используют для лечения AD и других неврологических расстройств, связанных с клеточным апоптозом. Такие неврологические расстройства включают в себя болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз (ALS), пигментную дегенерацию сетчатки, атрофию остистой мышцы и разные формы дегенерации мозжечка. При данных заболеваниях утрата клеток не приводит к воспалительному ответу, а механизмом гибели клеток является апоптоз.
Кроме того, ряд гематологических заболеваний связан с уменьшением продукции кровяных клеток. Указанные заболевания включают в себя анемию, ассоциированную с хронической болезнью, апластическую анемию, хроническую нейтропению и миелодиспластические синдромы. Нарушения продукции кровяных клеток, такие как миелодиспластический синдром и некоторые формы апластической анемии, связаны с увеличением апоптотической гибели клеток в костном мозге. Причиной указанных нарушений может служить активация генов, инициирующих апоптоз, приобретенный дефицит стромальных клеток или факторов выживания гематопоэтических клеток, или непосредственное влияние токсинов и медиаторов иммунных ответов. Двумя распространенными нарушениями, связанными с клеточной гибелью, являются инфаркт миокарда и инсульт. При обоих нарушениях клетки в центральном участке ишемического повреждения, образующегося при резком уменьшении кровотока, быстро погибают в результате некроза. Однако вне центральной ишемической зоны клетки погибают в течение более продолжительного периода времени и по данным морфологического анализа - в результате апоптоза. В других или следующих воплощениях антиапоптотические пептидомиметические макроциклы настоящего изобретения используют для лечения всех указанных нарушений, связанных с нежелательной гибелью клеток.
Некоторые примеры неврологических нарушений, которые можно лечить с помощью описанных здесь пептидомиметических макроциклов, включают в себя, без ограничения, болезнь Альцгеймера, синдром Дауна, наследственная церебральная геморрагия с амилоидозом голландского типа, реактивный амилоидоз, семейная амилоидная нефропатия с крапивницей и глухотой, синдром Макла-Веллса, идиопатическую миелому; макроглобулинемия-ассоциированную миелому, семейную амилоидную полиневропатию, семейную амилоидную кардиомиопатию, выделенный сердечный амилоид, системный сенильный амилоидоз, диабет зрелого возраста, инсулинома, выделенный атриальный амилоид, медуллярная карцинома щитовидной железы, семейный амилоидоз, наследственная церебральная геморрагия с амилоидозом, семейная амилоидотическая полиневропатия, почесуха, болезнь Крейтцфельда-Якоба, синдром Герстманна-Штраусслера-Шейнкера, губкообразная энцефалопатия крупного рогатого скота, болезнь, опосредуемая прионами, и болезнь Хантингтона.
В другом воплощении описанные здесь пептидомиметические макроциклы используют для лечения, профилактики или диагностики воспалительных расстройств. Существует много типов воспалительных расстройств. Некоторые воспалительные заболевания связаны с иммунной системой, например, аутоиммунные заболевания. Аутоиммунные заболевания возникают в результате повышенного иммунного ответа организма, направленного против веществ и тканей, обычно присутствующих в организме, т.е. против собственных антигенов. Другими словами, при аутоиммунных заболеваниях иммунная система атакует свои собственные клетки. Аутоиммунные заболевания являются основной причиной болезней, опосредуемых иммунной системой. Примером аутоиммунного заболевания является ревматоидный артрит, при котором иммунная система атакует суставы, вызывая воспаление (т.е. артрит) и разрушение. Она также может разрушать некоторые органы, такие как легкие и кожа. Ревматоидный артрит может приводить к значительному снижению функционирования и подвижности. Ревматоидный артрит диагностируют с помощью анализов крови, особенно анализа на ревматоидный фактор. Некоторые примеры аутоиммунных заболеваний, которые можно лечить с помощью описанных здесь пептидомиметических макроциклов, включают в себя, без ограничения, такие заболевания, как острый диссеминированный энцефаломиелит (ADEM), болезнь Аддисона, анкилозирующий спондилит, антифосфолипидный синдром (APS), аутоиммунная гемолитическая анемия, аутоиммунный гепатит, аутоиммунная болезнь внутреннего уха, синдром Бехчета, буллезный пемфигоид, глютеновая энтеропатия, болезнь Шагаса, синдром Черджа-Строса, хроническое обструктивное заболевание легких (COPD), болезнь Крона, дерматомиозит, сахарный диабет типа 1, эндометриоз, синдром Гудпасчера, болезнь Грейвса, синдром Гийена-Барре (GBS), тиреоидит Хашимото, гнойный гидраденит, идиопатическая тромбоцитопеническая пурпура, воспалительная болезнь кишечника (IBD), интерстициальный цистит, красная волчанка, кольцевидная склеродермия, рассеянный склероз, миастения gravis, нарколепсия, нейромиотония, обыкновенная пузырчатка, злокачественная анемия, полимиозит, ревматическая полимиалгия, первичный биллиарный цирроз, псориаз, ревматоидный артрит, шизофрения, склеродермия, синдром Шегрена, темпоральный артериит (также известный как "гигантоклеточный артериит"), синдром Такаясу, васкулит, витилиго и гранулематоз Вегенера.
Некоторые примеры других типов воспалительных расстройств, которые можно лечить с помощью описанных здесь пептидомиметических макроциклов, включают в себя, без ограничения, такие заболевания, как аллергия, в том числе аллергический ринит/синусит, кожные аллергии (крапивница/сыпь, ангионевротический аллергический отек, атопический дерматит), пищевые аллергии, медикаментозные аллергии, аллергии на укусы насекомых и редкие аллергические расстройства, такие как мастоцитоз, астма, артрит, в том числе остеоартрит, ревматоидный артрит и спондилоартропатии, первичный ангиит ЦНС, саркоидоз, отторжение органного трансплантата, фибромиалгия, фиброз, панкреатит и воспаление тазовых органов.
Примеры сердечно-сосудистых нарушений (таких как воспалительные нарушения), которые можно лечить или предотвращать с помощью пептидомиметических макроциклов настоящего изобретения, включают в себя, без ограничения, стеноз клапана аорты, атеросклероз, инфаркт миокарда, инсульт, тромбоз, аневризма, сердечная недостаточность, ишемическая болезнь сердца, стенокардия, внезапная сердечная смерть, гипертоническая болезнь сердца; некоронарная болезнь, такая как артериолосклероз, болезнь малых сосудов, нефропатия, гипертриглицеридемия, гиперхолестеринемия, гиперлипидемия, ксантоматоз, астма, гипертония, эмфизема и хроническая болезнь легких; или сердечно-сосудистое состояние, связанное с процедурами вмешательства ("процедурная травма сосудов"), такое как рестеноз после ангиопластики, установка шунта, стента, синтетических или природных эксцизионных трансплантатов в постоянно пребывающем катетере, клапана или других имплантируемых устройств. Предпочтительные сердечно-сосудистые нарушения включают в себя атеросклероз, инфаркт миокарда, аневризму и инсульт.
Хотя здесь показаны и описаны предпочтительные воплощения настоящего изобретения, для специалистов в данной области очевидно, что такие воплощения приведены только для примера. Специалисты в данной области могут осуществить многочисленные вариации, изменения и замены, не отступая от объема и сущности изобретения. Следует понимать, что для осуществления настоящего изобретения можно использовать разные альтернативы воплощениям настоящего изобретения. Подразумевается, что нижеследующая формула изобретения определяет объем настоящего изобретения, охватывая способы, структуры и их эквиваленты.
ПРИМЕРЫ
Пример 1: Синтез 6-хлортриптофан-Fmoc-аминокислот
Трет-бутил 6-хлор-3-формил-1H-индол-1-карбоксилат, 1. К перемешиваемому раствору в сухом ДМФА (12 мл) добавляют по каплям POCl3 (3,92 мл, 43 ммоль, 1,3 экв.) при 0ºC в атмосфере аргона. Раствор перемешивают при той же температуре 20 мин и затем добавляют по каплям раствор 6-хлориндола (5,0 г, 33 ммоль, 1 экв.) в сухом ДМФА (30 мл). Полученную смесь оставляют нагреваться до комнатной температуры и перемешивают еще 2,5 ч. Добавляют воду (50 мл) и раствор нейтрализуют 4M водным раствором NaOH (pH приблизительно 8). Полученное твердое вещество отфильтровывают, промывают водой и сушат в вакууме. Это вещество непосредственно используют на следующей стадии без дополнительной очистки. К перемешиваемому раствору неочищенного формилиндола (33 ммоль, 1 экв.) в ТГФ (150 мл) добавляют избыток Boc2O (7,91 г, 36,3 ммоль, 1,1 экв.) и DMAP (0,4 г, 3,3 ммоль, 0,1 экв.) при комнатной температуре в атмосфере N2. Полученную смесь перемешивают при комнатной температуре 1,5 ч и растворитель упаривают при пониженном давлении. Остаток помещают в EtOAc, промывают 1 н. HCl, сушат и концентрируют, получая формилиндол 1 (9 г, 98% с 2 стадий) в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 1,70 (с, Boc, 9H), 7,35 (дд, 1H), 8,21 (м, 3H), 10,07 (с, 1H).
Трет-бутил 6-хлор-3-(гидроксиметил)-1H-индол-1-карбоксилат, 2. К раствору соединения 1 (8,86 г, 32 ммоль, 1 экв.) в этаноле (150 мл) добавляют NaBH4 (2,4 г, 63 ммоль, 2 экв.). Реакционную смесь перемешивают в течение 3 ч при комнатной температуре. Затем реакционную смесь концентрируют и остаток выливают в смесь диэтилового эфира и воды. Органический слой отделяют, сушат над сульфатом магния и концентрируют, получая белое твердое вещество (8,7 г, 98%). Это вещество непосредственно используют на следующей стадии без дополнительной очистки.
1H-ЯМР (CDCl3) δ: 1,65 (с, Boc, 9H), 4,80 (с, 2H, CH2), 7,21 (дд, 1H), 7,53 (м, 2H), 8,16 (шир.с, 1H).
Трет-бутил 3-(бромметил)-6-хлор-1H-индол-1-карбоксилат, 3. К раствору соединения 2 (4,1 г, 14,6 ммоль, 1 экв.) в дихлорметане (50 мл) в атмосфере аргона добавляют раствор трифенилфосфина (4,59 г, 17,5 ммоль, 1,2 экв.) в дихлорметане (50 мл) при -40ºC. Реакционный раствор перемешивают еще 30 мин при 40ºC. Затем добавляют NBS (3,38 г, 19 ммоль, 1,3 экв.). Полученную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение ночи. Дихлорметан упаривают, добавляют четыреххлористый углерод (100 мл), после чего смесь перемешивают в течение 1 ч и фильтруют. Фильтрат концентрируют, загружают на слой оксида кремния и быстро элюируют 25% раствором EtOAc в гексанах. Полученный раствор концентрируют, получая белую пену (3,84 г, 77%).
1H-ЯМР (CDCl3) δ: 1,66 (с, Boc, 9H), 4,63 (с, 2H, CH2), 7,28 (дд, 1H), 7,57 (д, 1H), 7,64 (шир.с, 1H), 8,18 (шир.с, 1H).
αMe-6Cl-Trp(Boc)-Ni-S-BPB, 4. К S-Ala-Ni-S-BPB (2,66 г, 5,2 ммоль, 1 экв.) и KO-tBu (0,87 г, 7,8 ммоль, 1,5 экв.) добавляют 50 мл ДМФА в атмосфере аргона. Через шприц добавляют бромид-содержащее производное 3 (2,68 г, 7,8 ммоль, 1,5 экв.) в растворе ДМФА (5,0 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение 1 ч. Затем раствор гасят 5% водным раствором уксусной кислоты и разбавляют водой. Целевой продукт экстрагируют в дихлорметан, сушат и концентрируют. Маслянистый продукт 4 очищают флэш-хроматографией (твердая загрузка) на нормальной фазе, используя в качестве элюентов EtOAc и гексаны, и получают красное твердое вещество (1,78 г, выход 45%). αMe-6Cl-Trp(Boc)-Ni-S-BPB, 4: M+H рассчитано 775,21, M+H получено 775,26.
1H-ЯМР (CDCl3) δ: 1,23 (с, 3H, αMe), 1,56 (м, 11H, Boc+CH2), 1,82-2,20 (м, 4H, 2CH2), 3,03 (м, 1H, CHα), 3,24 (м, 2H, CH2), 3,57 и 4,29 (AB система, 2H, CH2 (бензил), J=12,8 Гц), 6,62 (д, 2H), 6,98 (д, 1H), 7,14 (м, 2H), 7,23 (м, 1H), 7,32-7,36 (м, 5H), 7,50 (м, 2H), 7,67 (шир.с, 1H), 7,98 (д, 2H), 8,27 (м, 2H).
Fmoc-αMe-6Cl-Trp(Boc)-OH, 6. К раствору 3 н. HCl/MeOH (1/3, 15 мл) при 50ºC по каплям добавляют раствор соединения 4 (1,75 г, 2,3 ммоль, 1 экв.) в MeOH (5 мл). Перемешиваемое вещество исчезает в течение 3-4 ч. Затем кислый раствор охлаждают до 0ºC на ледяной бане и гасят водным раствором Na2CO3 (1,21 г, 11,5 ммоль, 5 экв.). Метанол удаляют и к суспензии добавляют еще 8 эквивалентов Na2CO3 (1,95 г, 18,4 ммоль). Затем для удаления никеля добавляют дигидрат динатриевой соли ЭДТА (1,68 г, 4,5 ммоль, 2 экв.) и суспензию перемешивают в течение 2 ч. Добавляют раствор Fmoc-OSu (0,84 г, 2,5 ммоль, 1,1 экв.) в ацетоне (50 мл) и реакционную смесь перемешивают в течение ночи. Затем реакционную смесь разбавляют диэтиловым эфиром и 1 н. HCl. Органический слой сушат над сульфатом магния и концентрируют в вакууме. Целевой продукт 6 очищают на нормальной фазе, используя в качестве элюентов ацетон и дихлорметан, и получают белую пену (0,9 г, выход 70%). Fmoc-αMe-6Cl-Trp(Boc)-OH, 6: M+H рассчитано 575,19, M+H получено 575,37.
1H-ЯМР (CDCl3) δ: 1,59 (с, 9H, Boc), 1,68 (с, 3H, Me), 3,48 (шир.с, 2H, CH2), 4,22 (м, 1H, CH), 4,39 (шир.с, 2H, CH2), 5,47 (с, 1H, NH), 7,10 (м, 1H), 7,18 (м, 2H), 7,27 (м, 2H), 7,39 (м, 2H), 7,50 (м, 2H), 7,75 (д, 2H), 8,12 (шир.с, 1H).
6Cl-Trp(Boc)-Ni-S-BPB, 5. К Gly-Ni-S-BPB (4,6 г, 9,2 ммоль, 1 экв.) и KO-tBu (1,14 г, 10,1 ммоль, 1,1 экв.) добавляют 95 мл ДМФА в атмосфере аргона. Через шприц добавляют бромид-содержащее производное 3 (3,5 г, 4,6 ммоль, 1,1 экв.) в растворе ДМФА (10 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение 1 ч. Затем раствор гасят 5% водным раствором уксусной кислоты и разбавляют водой. Целевой продукт экстрагируют в дихлорметан, сушат и концентрируют. Маслянистый продукт 5 очищают флэш-хроматографией (твердая загрузка) на нормальной фазе, используя в качестве элюентов EtOAc и гексаны, и получают красное твердое вещество (5 г, выход 71%). 6Cl-Trp(Boc)-Ni-S-BPB, 5: M+H рассчитано 761,20, M+H получено 761,34.
1H-ЯМР (CDCl3) δ: 1,58 (м, 11H, Boc+CH2), 1,84 (м, 1H), 1,96 (м, 1H), 2,24 (м, 2H, CH2), 3,00 (м, 1H, CHα), 3,22 (м, 2H, CH2), 3,45 и 4,25 (AB система, 2H, CH2 (бензил), J=12,8 Гц), 4,27 (м, 1H, CHα), 6,65 (д, 2H), 6,88 (д, 1H), 7,07 (м, 2H), 7,14 (м, 2H), 7,28 (м, 3H), 7,35-7,39 (м, 2H), 7,52 (м, 2H), 7,96 (д, 2H), 8,28 (м, 2H).
Fmoc-6Cl-Trp(Boc)-OH, 7. К раствору 3 н. HCl/MeOH (1/3, 44 мл) при 50ºC по каплям добавляют раствор соединения 5 (5 г, 6,6 ммоль, 1 экв.) в MeOH (10 мл). Исходное вещество исчезает в течение 3-4 ч. Затем кислый раствор охлаждают до 0ºC на ледяной бане и гасят водным раствором Na2CO3 (3,48 г, 33 ммоль, 5 экв.). Метанол удаляют и к суспензии добавляют еще 8 эквивалентов Na2CO3 (5,57 г, 52 ммоль). Затем для удаления никеля добавляют дигидрат динатриевой соли ЭДТА (4,89 г, 13,1 ммоль, 2 экв.) и суспензию перемешивают в течение 2 ч. Добавляют раствор Fmoc-OSu (2,21 г, 6,55 ммоль, 1,1 экв.) в ацетоне (100 мл) и реакционную смесь перемешивают в течение ночи. Затем реакционную смесь разбавляют диэтиловым эфиром и 1 н. HCl. Органический слой сушат над сульфатом магния и концентрируют в вакууме. Целевой продукт 7 очищают на нормальной фазе, используя в качестве элюентов ацетон и дихлорметан, и получают белую пену (2,6 г, выход 69%). Fmoc-6Cl-Trp(Boc)-OH, 7: M+H рассчитано 561,17, M+H получено 561,37.
1H-ЯМР (CDCl3) 1,63 (с, 9H, Boc), 3,26 (м, 2H, CH2), 4,19 (м, 1H, CH), 4,39 (м, 2H, CH2), 4,76 (м, 1H), 5,35 (д, 1H, NH), 7,18 (м, 2H), 7,28 (м, 2H), 7,39 (м, 3H), 7,50 (м, 2H), 7,75 (д, 2H), 8,14 (шир.с, 1H).
Пример 2: Пептидомиметические макроциклы настоящего изобретения
Пептидомиметические макроциклы синтезируют, очищают и анализируют с помощью описанных выше и ниже способов (Schafmeister et al., J. Am. Chem. Soc. 122: 5891-5892 (2000); Schafmeister & Verdine, J. Am. Chem. Soc. 122: 5891 (2005); Walensky et al., Science 305: 1466-1470 (2004); и патент США № 7192713). Пептидомиметические макроциклы конструируют путем замены двух или более природных аминокислот соответствующими синтетическими аминокислотами. Замены осуществляют в положениях i и i+4, i и i+7. Пептидный синтез проводят либо вручную, либо на автоматизированном пептидном синтезаторе (Applied Biosystems, модель 433 A), используя твердую фазу, амидную AM смолу Ринка (Novabiochem) и Fmoc-химию для защиты основной цепи. Для присоединения природных Fmoc-защищенных аминокислот (Novabiochem) используют 10 эквивалентов аминокислот и конденсирующие реагенты HBTU/HOBt (Novabiochem)/DIEA в молярном соотношении 1:1:2. Неприродные аминокислоты (4 экв.) присоединяют, используя HATU (Applied Biosystems)/HOBt/DIEA в молярном соотношении 1:1:2. N-концы синтетических пептидов ацетилируют, а C-концы амидируют.
Очистку поперечносшитых соединений проводят методом высокоэффективной жидкостной хроматографии (ВЭЖХ) (Varian ProStar) на колонке с обращенной фазой C18 (Varian), получая чистые соединения. Химический состав чистых соединений подтверждают методом масс-спектрометрии ЖХ/МС (Micromass LCT, соединенный с системой ВЭЖХ Agilent 1100) и аминокислотного анализа (Applied Biosystems, модель 420A).
В таблице 4 приведен список полученных пептидомиметических макроциклов настоящего изобретения.
В последовательностях, приведенных выше и в других местах, используют нижеследующие сокращения: "Nle" обозначает норлейцин, "Aib" обозначает 2-аминоизомасляную кислоту, "Ac" обозначает ацетил и "Pr" обозначает пропионил. Аминокислоты, обозначаемые "$", представляют собой альфа-Me S5-пентенил-аланин-олефин-аминокислоты, соединенные углеродным i - i+4 поперечным линкером, содержащим одну двойную связь. Аминокислоты, обозначаемые "$r5", представляют собой альфа-Me R5-пентенил-аланин-олефин-аминокислоты, соединенные углеродным i - i+4 поперечным линкером, содержащим одну двойную связь. Аминокислоты, обозначаемые "$s8", представляют собой альфа-Me S8-октенил-аланин-олефин-аминокислоты, соединенные углеродным i - i+7 поперечным линкером, содержащим одну двойную связь. Аминокислоты, обозначаемые "$r8", представляют собой альфа-Me R8-октенил-аланин-олефин-аминокислоты, соединенные углеродным i - i+7 поперечным линкером, содержащим одну двойную связь. "Ahx" обозначает аминоциклогексильный линкер. Поперечные линкеры представляют собой углеродные поперечные линкеры, содержащие восемь или одиннадцать атомов углерода между альфа-атомами углерода аминокислот. Аминокислоты, обозначаемые "$/", представляют собой альфа-Me S5-пентенил-аланин-олефин-аминокислоты, которые не соединяются поперечными линкерами. Аминокислоты, обозначаемые "$/r5", представляют собой альфа-Me R5-пентенил-аланин-олефин-аминокислоты, которые не соединяются поперечным линкером. Аминокислоты, обозначаемые "$/s8", представляют собой альфа-MeS8-октенил-аланин-олефин-аминокислоты, которые не соединяются поперечным линкером. Аминокислоты, обозначаемые "$/r8", представляют собой альфа-Me R8-октенил-аланин-олефин-аминокислоты, которые не соединяются поперечным линкером. Аминокислоты, обозначаемые "Amw", представляют собой альфа-Me-триптофанаминокислоты. Аминокислоты, обозначаемые "Aml", представляют собой альфа-Me-лейцинаминокислоты. Аминокислоты, обозначаемые "2ff", представляют собой 2-фтор-фенилаланинаминокислоты. Аминокислоты, обозначаемые "3ff", представляют собой 3-фтор-фенилаланинаминокислоты. Аминокислоты, обозначаемые "St", представляют собой аминокислоты, содержащие две боковые цепи пентенил-аланин-олефин, каждая из которых соединена поперечной связью с другой аминокислотой, как указано. Аминокислоты, обозначаемые "St//", представляют собой аминокислоты, содержащие две пентенил-аланинолефиновые боковые цепи, которые не участвуют в образовании поперечных связей. Аминокислоты, обозначаемые "%St", представляют собой аминокислоты, содержащие две пентенил-аланинолефиновые боковые цепи, каждая из которых соединена поперечной связью с другой аминокислотой, как указано, посредством полность насыщенных углеводородных мостиков.
Например, соединения, обозначенные SP-72, Sp-56 и SP-138, имеют следующие структуры:
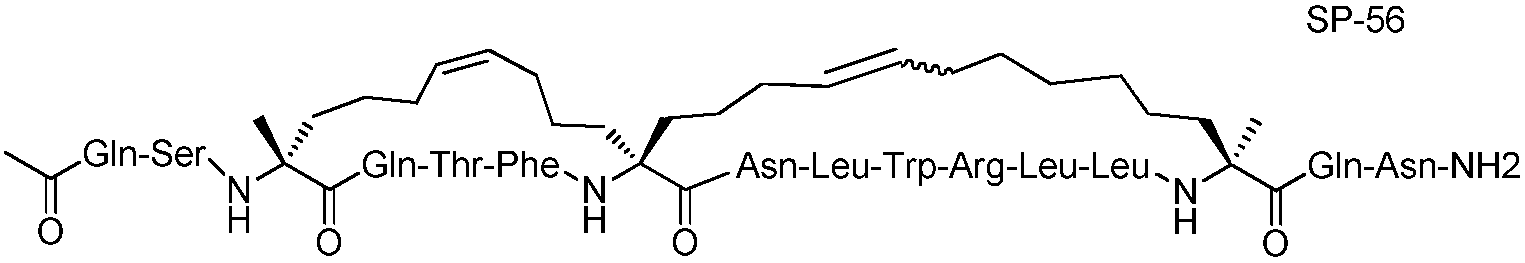
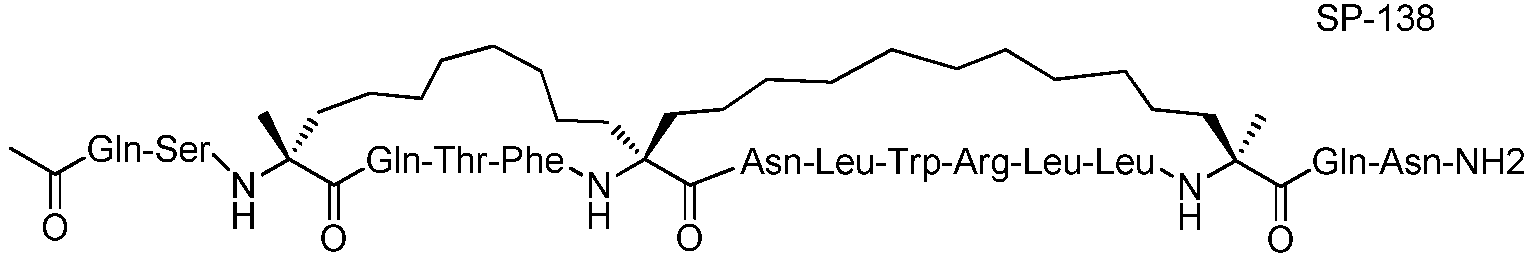
Например, другие соединения имеют следующие структуры:




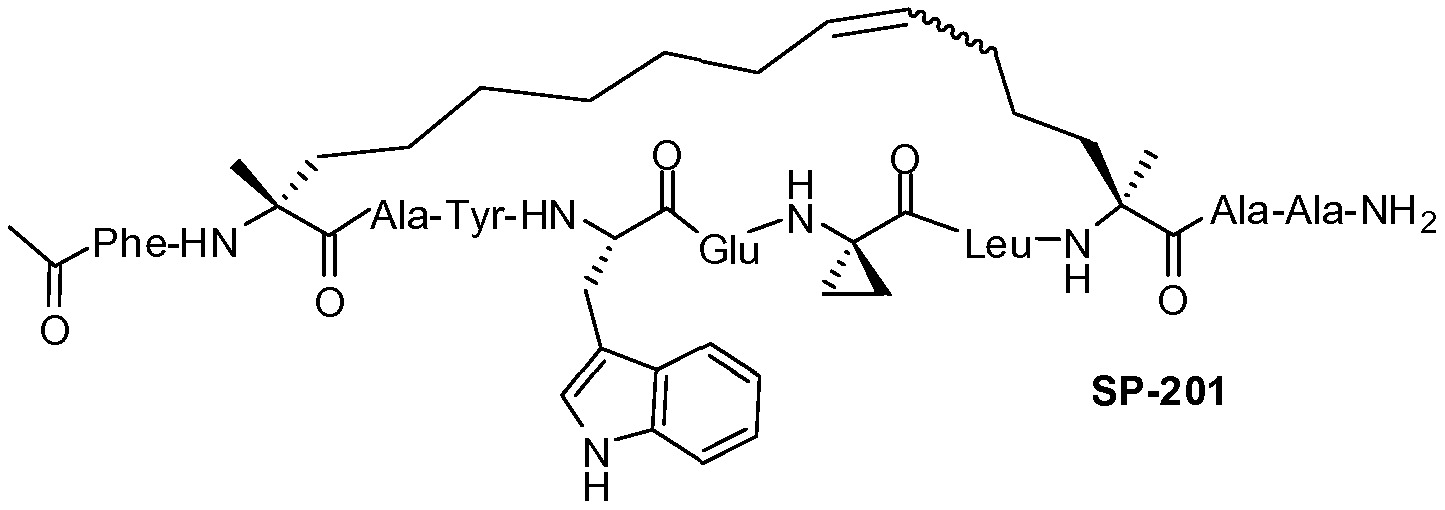

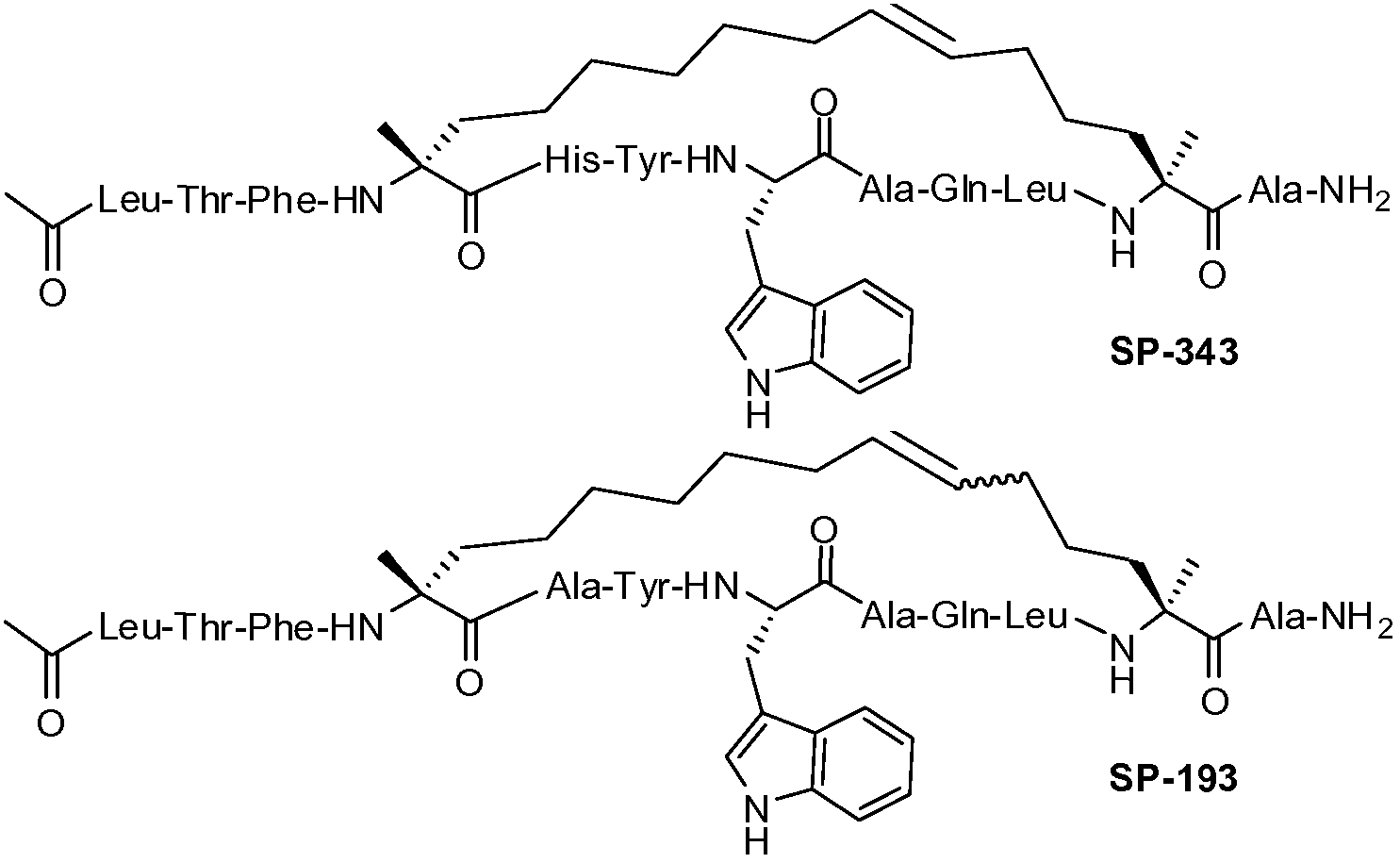



Пример 3: Анализ конкурентного связывания методом ELISA (HDM2 и HDMX)
Лунки 96-луночных планшетов Immulon покрывают белком p53-His6 (30 нМ/лунку) в течение ночи при комнатной температуре. В день эксперимента планшеты промывают 1×PBS-твин 20 (0,05%), используя автоматизированную машину для мойки планшетов ELISA, блокируют блокирующим реагентом ELISA Micro well Blocking в течение 30 минут при комнатной температуре; избыток блокирующего реагента удаляют путем промывания планшетов 1×PBS-твин 20 (0,05%). Рабочие растворы пептидов с концентрацией 500 мкМ получают путем разведения исходных 10 мМ растворов в ДМСО стерильной водой, для дальнейших разведений используют 0,5% ДМСО, поддерживая одинаковую концентрацию ДМСО во всех образцах. Пептиды добавляют в лунки в концентрации, в два раза превышающей желательную, в объеме 50 мкл, и затем добавляют разбавленный раствор белка GST-HDM2 или GST-HMDX (конечная концентрация: 10 нМ). Образцы инкубируют при комнатной температуре в течение 2 ч, после чего планшеты промывают PBS-твин 20 (0,05%) и добавляют 100 мкл HRP-конъюгированного антитела против GST [Hypromatrix, INC], разбавленного до концентрации 0,5 мкг/мл HRP-стабилизирующим буфером. После инкубации с детекционным антителом в течение 30 мин планшеты промывают и инкубируют со 100 мкл/лунку раствора субстрата TMB-E в течение не более 30 минут; реакции останавливают с помощью 1M HCl и измеряют поглощение при 450 нМ на ридере для микропланшетов. Результаты анализируют с помощью программного обеспечения Graph Pad PRISM.
Пример 4: Анализ жизнеспособности клеток SJSA-1
Клетки SJSA1 высевают в 96-луночные планшеты с плотностью 5000 клеток/100 мкл/лунку за день до анализа. В день исследования клетки промывают один раз средой Opti-MEM и добавляют 90 мкл среды Opti-MEM. Рабочие растворы пептидов с концентрацией 500 мкМ получают путем разведения исходных 10 мМ растворов в ДМСО стерильной водой, для дальнейших разведений используют 0,5% ДМСО, поддерживая одинаковую концентрацию ДМСО во всех образцах. Диапазон конечной концентрации пептидов составляет 50, 25, 12,5, 6,25, 3,1, 1,56, 0,8 и 0 мкМ в конечном объеме 100 мкл на лунку. Наивысшую конечную концентрацию ДМСО, которая составляет 0,5%, используют в качестве отрицательного контроля. В качестве положительного контроля используют (-)-нутлин-3 (10 мМ) Cayman Chemicals Cell-Based Assay. Нутлин разводят по той же схеме, что и пептиды: чтобы достичь желательных конечных концентраций, в соответствующие лунки добавляют 10 мкл растворов с концентрацией, в 10 раз превосходящей желательную. Затем клетки инкубируют с пептидами в течение 20-24 ч при 37ºC во влажной атмосфере, содержащей 5% CO2. После инкубации измеряют жизнеспособность клеток, используя реагенты Promega Cell Titer-Glo, в соответствии с инструкциями производителя.
Пример 5: Анализ повышающей регуляции SJSA-1 под действием p21
Клетки SJSA1 высевают в 6-луночные планшеты с плотностью 0,8 миллионов клеток/2 мл/лунку за день до анализа. В день исследования клетки промывают один раз средой Opti-MEM и добавляют 1350 мкл среды Opti-MEM. Рабочие растворы пептидов с концентрацией 500 мкМ получают путем разведения исходных 10 мМ растворов в ДМСО стерильной водой, для дальнейших разведений используют 0,5% ДМСО, поддерживая одинаковую концентрацию ДМСО во всех образцах. Наивысшую конечную концентрацию ДМСО, которая составляет 0,5%, используют в качестве отрицательного контроля. В качестве положительного контроля используют (-)-нутлин-3 (10 мМ) Cayman Chemicals Cell-Based Assay. Нутлин разводят по той же схеме, что и пептиды: чтобы достичь желательных конечных концентраций, в соответствующие лунки добавляют 150 мкл растворов с концентрацией, в 10 раз превосходящей желательную. Затем клетки инкубируют с пептидами в течение 18-20 ч при 37ºC во влажной атмосфере, содержащей 5% CO2. После инкубации клетки собирают, промывают 1×PBS (не содержащим Ca++/Mg++) и лизируют в 1× буфере для лизиса клеток (10× буфер Cell Signaling technologies, разбавленный до 1× и дополненный ингибиторами протеаз и ингибиторами фосфатаз) на льду в течение 30 мин. Лизаты центрифугируют со скоростью 13000 об/мин в микроцентрифуге при 40ºC в течение 8 мин; прозрачные супернатанты собирают и хранят при -80ºC до последующего применения. Общее содержание белка в лизатах измеряют с помощью набора для определения белка BCA, используя стандартные растворы БСА от Thermofisher. 25 мкг общего белка используют для детекции p21 методом ELISA. Каждый образец в планшете ELISA анализируют с тройными повторами. Анализ ELISA проводят в соответствии с инструкциями производителя. Каждая лунка содержит 25 мкг общего белка и имеет три повтора. Результаты анализируют с помощью программного обеспечения Graph Pad PRISM.
Пример 6: Анализ p53 методом GRIP
Анализ перераспределения Thermo Scientific* BioImage p53-Hdm2 позволяет регистрировать взаимодействие белка с Hdm2 и внутриклеточное перемещение GFP-меченного p53 в ответ на лекарственные соединения или другие стимулы. Рекомбинантные клетки CHO-hIR стабильно экспрессируют p53(1-312), соединенный с C-концом усиленного зеленого флуоресцентного белка (EGFP), и PDE4A4-Hdm2(1-124), гибридный белок, содержащий PDE4A4 и Hdm2(1-124). Они представляют собой готовую к применению аналитическую систему, которую можно использовать для измерения влияния экспериментальных состояний на взаимодействие p53 и Hdm2. Визуализацию и анализ проводят на платформе HCS.
Клетки CHO-hIR регулярно поддерживают в среде Ham's F12, содержащей 1% пенициллина-стрептомицина, 0,5 мг/мл генетицина, 1 мг/мл зеоцина и 10% FBS. Клетки высевают в 96-луночные планшеты с плотностью 7000 клеток/100 мкл/лунку за 18-24 часа до начала анализа с использованием культуральной среды. На следующий день среду заменяют на свежую и к клеткам добавляют PD177 с конечной концентрацией 3 мкМ, чтобы активировать образование очагов. Контрольные лунки не содержат раствор PD-177. Через 24 ч после стимуляции PD177 клетки промывают один раз средой Opti-MEM и добавляют 50 мкл среды Opti-MEM, содержащей PD-177 (6 мкМ). Рабочие растворы пептидов с концентрацией 500 мкМ получают путем разведения исходных 10 мМ растворов в ДМСО стерильной водой, для дальнейших разведений используют 0,5% ДМСО, поддерживая одинаковую концентрацию ДМСО во всех образцах. Наивысшую конечную концентрацию ДМСО, которая составляет 0,5%, используют в качестве отрицательного контроля. В качестве положительного контроля используют (-)-нутлин-3 (10 мМ) Cayman Chemicals Cell-Based Assay. Нутлин разводят по той же схеме, что и пептиды. Чтобы достичь желательных конечных концентраций, в соответствующие лунки добавляют 50 мкл растворов с концентрацией, в 2 раза превосходящей желательную. Затем клетки инкубируют с пептидами в течение 6 ч при 37ºC во влажной атмосфере, содержащей 5% CO2. После инкубации среду осторожно отсасывают и клетки фиксируют путем добавления 150 мкл фиксирующего раствора на лунку в течение 20 минут при комнатной температуре. Фиксированные клетки промывают 4 раза, каждый раз используя 200 мкл PBS на лунку. В конце последнего промывания добавляют 100 мкл 1 мкМ окрашивающего раствора Hoechst. Герметично закрытые планшеты инкубируют в течение, по меньшей мере, 30 мин в темноте, промывают PBS, чтобы удалить избыток окрашивающего реагента, и в каждую лунку добавляют PBS. Планшеты можно хранить при 4ºC в темноте до 3 дней. Перемещение p53/HDM2 визуализируют с помощью модуля молекулярного перемещения прибора Cellomics Arrayscan, используя 10× объектив, набор фильтров XF-100 для Hoechst и GFP. Выходным параметром является Mean-CircRTNGAveIntenRatio (отношение средних значений интенсивности флуоресценции в ядре и цитоплазме (с полным усреднением)). Минимально число клеток на лунку, которое можно использовать для анализа визуализации, составляет 500.
Пример 7: Анализ прямого связывания hDM2 методом поляризации флуоресценции (FP)
Анализ проводят в соответствии с нижеследующей общей схемой:
1. hDM2 (собственного получения, 41 кДа) разбавляют буфером для FP (буфер с высоким содержанием солей: 200 мМ Nacl, 5мМ CHAPS, pH 7,5) с получением исходного рабочего раствора с концентрацией 10 мкМ.
2. Добавляют 30 мкл 10 мкМ исходного раствора белка в лунки A1 и B1 96-луночного черного микропланшета HE (Molecular Devices).
3. В 30 мкл буфера для FP наносят на колонку A2-A12, B2-B12, C1-C12 и D1-D12.
4. Осуществляют 2- или 3-кратные серийные разведения исходных растворов белка A1, B1 с получением растворов A2, B2; A2, B2 разводят с получением A3, B3; … с достижением после последнего разведения концентрации, равной однозначному числу в нМ-диапазоне.
5. 1 мМ раствор (в 100% ДМСО) FAM-меченного линейного пептида разводят ДМСО до 100 мкМ (разведение 1:10). 100 мкМ растворы разводят до 10 мкМ водой (разведение 1:10) и затем 10 мкМ растворы разводят буфером для FP до 40 нМ (разведение 1:250). Так получают рабочий раствор, концентрация которого в лунке составляет 10 нМ (разведение 1:4). Разведенный раствор FAM-меченного пептида держат в темноте до использования.
6. В каждую лунку добавляют 10 мкл 10 нМ раствора FAM-меченного пептида, инкубируют и прочитывают в разные моменты времени. Kd комплекса с 5-FAM-BaLTFEHYWAQLTS-NH2 составляет приблизительно 13,38 нМ.
Пример 8: Конкурентный анализ hDM2 методом поляризации флуоресценции
Анализ проводят в соответствии с нижеследующей общей схемой:
1. hDM2 (собственного получения, 41 кДа) разбавляют буфером для FP (буфер с высоким содержанием солей: 200 мМ Nacl, 5 мМ CHAPS, pH 7,5) с получением исходного рабочего раствора с концентрацией 84 нМ (2×).
2. Добавляют 20 мкл 84 нМ (2×) исходного раствора белка в каждую лунку 96-луночного черного микропланшета HE (Molecular Devices).
3. 1 мМ раствор (в 100% ДМСО) FAM-меченного линейного пептида разводят ДМСО до 100 мкМ (разведение 1:10). 100 мкМ растворы разводят до 10 мкМ водой (разведение 1:10) и затем 10 мкМ растворы разводят буфером для FP до 40 нМ (разведение 1:250). Так получают рабочий раствор, концентрация которого в лунке составляет 10 нМ (разведение 1:4). Разведенный раствор FAM-меченного пептида держат в темноте до использования.
4. Планшет, содержащий немеченый пептид в разных концентрациях, получают, используя буфер для FP и начиная с концентрации пептида 1 мкМ (конечная) с последующими 5-кратными серийными разведениями для 6 точек с помощью нижеследующей схемы разведения. 10 мМ раствор (в 100% ДМСО) разводят ДМСО до 5 мМ (разведение 1:2). 5 мМ раствор разводят H2O до 500 мкМ (разведение 1:10) и затем 500 мкМ раствор разводят буфером для FP до 20 мкМ (разведение 1:25). Получают 5-кратные серийные разведения от 4 мкМ (4×) для 6 точек.
5. 10 мкл серийных разведений немеченых пептидов переносят в каждую лунку и добавляют 20 мкл 84 нМ раствора белка.
6. В каждую лунку добавляют 10 мкл 10 нМ раствора FAM-меченного пептида, инкубируют в течение 3 часов и прочитывают. Результаты примеров 7 и 8 приведены на фиг.7A-D в виде данных по HDM2.
Пример 9: Анализ прямого связывания hDMX методом поляризации флуоресценции (FP)
Анализ проводят в соответствии с нижеследующей общей схемой:
1. hDMX (собственного получения, 40 кДа) разбавляют буфером для FP (буфер с высоким содержанием солей: 200 мМ NaCl, 5 мМ CHAPS, pH 7,5) с получением исходного рабочего раствора с концентрацией 10 мкМ.
2. Добавляют 30 мкл 10 мкМ исходного раствора белка в лунки A1 и B1 96-луночного черного микропланшета HE (Molecular Devices).
3. В 30 мкл буфера для FP наносят на колонку A2-A12, B2-B12, C1-C12 и D1-D12.
4. Осуществляют 2- или 3-кратные серийные разведения исходных растворов белка A1, B1 с получением растворов A2, B2; A2, B2 разводят с получением A3, B3; … с достижением после последнего разведения концентрации, равной однозначному числу в нМ-диапазоне.
5. 1 мМ раствор (в 100% ДМСО) FAM-меченного линейного пептида разводят ДМСО до 100 мкМ (разведение 1:10). 100 мкМ растворы разводят до 10 мкМ водой (разведение 1:10) и затем 10 мкМ растворы разводят буфером для FP до 40 нМ (разведение 1:250). Так получают рабочий раствор, концентрация которого в лунке составляет 10 нМ (разведение 1:4). Разведенный раствор FAM-меченного пептида держат в темноте до использования.
6. В каждую лунку добавляют 10 мкл 10 нМ раствора FAM-меченного пептида, инкубируют и прочитывают в разные моменты времени.
Kd комплекса с 5-FAM-BaLTFEHYWAQLTS-NH2 составляет приблизительно 51 нМ.
Пример 10: Конкурентный анализ hDMX методом поляризации флуоресценции
Анализ проводят в соответствии с нижеследующей общей схемой:
1. hDM2 (собственного получения, 40 кДа) разбавляют буфером для FP (буфер с высоким содержанием солей: 200 мМ NaCl, 5 мМ CHAPS, pH 7,5) с получением исходного рабочего раствора с концентрацией 300 нМ (2×).
2. Добавляют 20 мкл 300 нМ (2×) исходного раствора белка в каждую лунку 96-луночного черного микропланшета HE (Molecular Devices).
3. 1 мМ раствор (в 100% ДМСО) FAM-меченного линейного пептида разводят ДМСО до 100 мкМ (разведение 1:10). 100 мкМ растворы разводят до 10 мкМ водой (разведение 1:10) и затем 10 мкМ растворы разводят буфером для FP до 40 нМ (разведение 1:250). Так получают рабочий раствор, концентрация которого в лунке составляет 10 нМ (разведение 1:4). Разведенный раствор FAM-меченного пептида держат в темноте до использования.
4. Планшет, содержащий немеченый пептид в разных концентрациях, получают, используя буфер для FP и начиная с концентрации пептида 5 мкМ (конечная) с последующими 5-кратными серийными разведениями для 6 точек с помощью нижеследующей схемы разведения.
5. 10 мМ раствор (в 100% ДМСО) разводят ДМСО до 5 мМ (разведение 1:2). 5 мМ раствор разводят H2O до 500 мкМ (разведение 1:10) и затем 500 мкМ раствор разводят буфером для FP до 20 мкМ (разведение 1:25). Получают 5-кратные серийные разведения от 20 мкМ (4×) для 6 точек.
6. 10 мкл серийных разведений немеченых пептидов переносят в каждую лунку и добавляют 20 мкл 300 нМ раствора белка.
7. В каждую лунку добавляют 10 мкл 10 нМ (4×) раствора FAM-меченного пептида, инкубируют в течение 3 часов и прочитывают. Результаты примеров 9 и 10 приведены на фиг.7A-D в виде данных по HDMX.
Пример 11: Анализ жизнеспособности клеток
Анализ проводят в соответствии с нижеследующей общей схемой:
Высевание клеток: Клетки трипсинизируют, считают и высевают с заранее определенной плотностью в 96-луночные планшеты за день до анализа. Для каждой анализируемой клеточной линии используют следующие значения плотности:
SJSA-1: 7500 клеток/лунку
RKO: 5000 клеток/лунку
RKO-E6: 5000 клеток/лунку
HCT-116: 5000 клеток/лунку
SW-480: 2000 клеток/лунку
MCF-7: 5000 клеток/лунку
В день анализа среду при комнатной температуре заменяют на свежую, содержащую 11% FBS (среда для анализа). В каждую лунку добавляют 180 мкл среды для анализа. В контрольные лунки, не содержащие клетки, добавляют 200 мкл среды.
Разведение раствора пептида: все разведения и добавление полученных растворов к клеткам проводят при комнатной температуре.
Получают 10 мМ исходные растворы пептидов в ДМСО. Используя ДМСО в качестве разбавителя проводят серийные разведения исходного раствора по схеме 1:3 с получением 10, 3,3, 1,1, 0,33, 0,11, 0,03, 0,01 мМ растворов. Серийно разведенные растворы пептидов в ДМСО разводят в 33,3 раза стерильной водой. В результате получают ряд 10× рабочих растворов. Также готовят смесь ДМСО/стерильная вода (3% ДМСО) для контрольных лунок.
В результате получают рабочие растворы с концентрациями в мкМ диапазоне, которые составляют 300, 100, 30, 10, 3, 1, 0,3 и 0 мкМ. Содержимое лунок на каждой стадии разведения тщательно перемешивают, используя многоканальную систему.
Ряд H содержит контроли. В H1-H3 добавляют 20 мкл среды для анализа. В H4-H9 добавляют 20 мкл 3% раствора ДМСО в воде. H10-H12 содержат только среду и не содержат клетки.
Положительный контроль: В качестве положительного контроля используют низкомолекулярный ингибитор HDM2, нутлин-3a (10 мМ). Растворы нутлина разводят по той же схеме, что и пептиды.
Добавление рабочих растворов к клеткам:
В соответствующие лунки добавляют 20 мкл растворов с концентрацией, в 10 раз превосходящей желательную, чтобы достичь нужной конечной концентрации в общем объеме 200 мкл/лунку. (20 мкл 300 мкМ раствора пептида +180 мкл суспензии клеток в среде = конечная концентрация 30 мкМ в 200 мкл/лунку). Осторожно перемешивают несколько раз с помощью пипетки. Таким образом, диапазон используемых конечных концентраций включает в себя 30, 10, 3, 1, 0,3, 0,1, 0,03 и 0 мкМ (для активных пептидов используют дополнительные разведения).
Контрольные лунки включают в себя лунки, которые не содержат пептиды, но содержат такие же концентрации ДМСО, как и лунки, содержащие пептиды, или лунки, не содержащие клетки.
Инкубируют в течение 72 часов при 37ºC во влажной атмосфере, содержащей 5% CO2.
Жизнеспособность клеток определяют с помощью реагента MTT от Promega. Жизнеспособность клеток SJSA-1, RKO, RKO-E6, HCT-116 определяют на 3 день, клеток MCF-7 на 5 день, а клеток SW-480 на 6 день. После инкубации в течение указанного времени планшеты оставляют остывать до комнатной температуры. Из каждой лунки удаляют 80 мкл среды для анализа. В каждую лунку добавляют 15 мкл оттаявшего реагента MTT.
Планшет инкубируют в течение 2 ч при 37ºC во влажной атмосфере, содержащей 5% CO2, и добавляют 100 мкл солюбилизирующего реагента в соответствии с инструкциями производителя. Инкубируют при встряхивании в течение 1 ч при комнатной температуре, после чего с помощью многопланшетного ридера Synergy Biotek определяют поглощение при 570 нМ.
Жизнеспособность клеток анализируют против контролей ДМСО, используя аналитические инструменты GraphPad PRISM.
Реагенты:
Среда для культивирования клеток Invitrogen.
i. 96-луночные обработанные прозрачные планшеты для культивирования клеток Falcon (Nunc 353072)
ДМСО (Sigma D 2650)
RPMI 1640 (Invitrogen 72400)
MTT (Promega G4000)
Инструменты: Многопланшетный ридер для измерения поглощения (Synergy 2)
Результаты примера 11 приведены на фиг.7A-D как EC50 SJSA-1.
Пример 12. Анализ P21 методом ELISA
Анализ проводят в соответствии с нижеследующей общей схемой:
Высевание клеток:
Клетки SJSA-1 трипсинизируют, считают и высевают с плотностью 7500 клеток/100 мкл/лунку в 96-луночные планшеты за день до анализа.
В день анализа среду при комнатной температуре заменяют на свежую RPMI, содержащую 11% FBS (среда для анализа). В каждую лунку добавляют 90 мкл среды для анализа. В контрольные лунки, не содержащие клетки, добавляют 200 мкл среды.
Разведение раствора пептида:
Получают 10 мМ исходные растворы пептидов в ДМСО. Используя ДМСО в качестве разбавителя проводят серийные разведения исходного раствора по схеме 1:3 с получением 10, 3,3, 1,1, 0,33, 0,11, 0,03, 0,01 мМ растворов. Серийно разведенные растворы пептидов в ДМСО разводят в 33,3 раза стерильной водой. В результате получают ряд 10× рабочих растворов. Также готовят смесь ДМСО/стерильная вода (3% ДМСО) для контрольных лунок.
В результате получают рабочие растворы с концентрациями в мкМ диапазоне, которые составляют 300, 100, 30, 10, 3, 1, 0,3 и 0 мкМ. Содержимое лунок на каждой стадии разведения тщательно перемешивают, используя многоканальную систему.
Ряд H содержит контроли. В H1-H3 добавляют 10 мкл среды для анализа. В H4-H9 добавляют 10 мкл 3% раствора ДМСО в воде. H10-H12 содержат только среду и не содержат клетки.
Положительный контроль: В качестве положительного контроля используют низкомолекулярный ингибитор HDM2, нутлин-3a (10 мМ). Растворы нутлина разводят по той же схеме, что и пептиды.
Добавление рабочих растворов к клеткам:
В соответствующие лунки добавляют 10 мкл растворов с концентрацией, в 10 раз превосходящей желательную, чтобы достичь нужной конечной концентрации в общем объеме 100 мкл/лунку. (10 мкл 300 мкМ раствора пептида +90 мкл суспензии клеток в среде = конечная концентрация 30 мкМ в 100 мкл/лунку). Таким образом, диапазон используемых конечных концентраций включает в себя 30, 10, 3, 1, 0,3, 0,1, 0,03 и 0 мкМ.
Контрольные лунки включают в себя лунки, которые не содержат пептиды, но содержат такие же концентрации ДМСО, как и лунки, содержащие пептиды, или лунки, не содержащие клетки.
Через 20 ч после инкубации среду отсасывают; клетки промывают 1×PBS (не содержащим Ca++/Mg++) и лизируют в 60 мкл 1× буфера для лизиса клеток (10ъ буфер Cell Signaling technologies разбавляют до 1× и добавляют ингибиторы протеазы и ингибиторы фомфатазы) на льду в течение 30 мин.
Планшеты центрифугируют со скоростью 5000 об/мин при 4ºC в течение 8 мин; прозрачные супернатанты собирают, замораживают при -80ºC и хранят до последующего применения.
Определение белка:
Общее содержание белка в лизатах измеряют с помощью набора для определения белка BCA, используя стандартные растворы БСА Thermofisher. Предположительно в каждой лунке содержится примерно 6-7 мкг белка.
Для проведения анализа p21 методом ELISA используют 50 мкл лизата на лунку.
Анализ человеческого общего p21 методом ELISA:
Анализ ELISA проводят в соответствии с инструкциями производителя. Используют 50 мкл лизата на лунку, причем каждую лунку готовят с тройными повторами.
Реагенты:
(-)-Нутлин-3 для клеточных анализов (10 мМ): Cayman Chemicals, № по каталогу 600034
OptiMEM, Invitrogen, № по каталогу 51985
Буфер для лизиса Cell Signaling (10×), Cell signaling technology, № по каталогу 9803
Таблетки смеси ингибиторов протеаз (мини), Roche Chemicals, № по каталогу 04693124001
Таблетки смеси ингибиторов фосфатаз, Roche Chemicals, № по каталогу 04906837001
Набор для определения человеческого общего p21 методом ELISA, R&D Systems, DYC 1047-5
Стоп-раствор (1M HCl), Cell Signaling Technologies, № по каталогу 7002
Инструменты: микроцентрифуга-Эппендорф 5415D и многопланшетный ридер для измерения поглощения (Synergy 2).
Результаты примера 12 приведены на фиг.7A-D как данные для p21.
Пример 13: Детекция каспазы 3
Анализ проводят в соответствии с нижеследующей общей схемой:
Высевание клеток:
Клетки SJSA-1 трипсинизируют, считают и высевают с плотностью 7500 клеток/100 мкл/лунку в 96-луночные планшеты за день до анализа. В день анализа среду при комнатной температуре заменяют на свежую RPMI, содержащую 11% FBS (среда для анализа). В каждую лунку добавляют 180 мкл среды для анализа. В контрольные лунки, не содержащие клетки, добавляют 200 мкл среды.
Разведение раствора пептида:
Получают 10 мМ исходные растворы пептидов в ДМСО. Используя ДМСО в качестве разбавителя проводят серийные разведения исходного раствора по схеме 1:3 с получением 10, 3,3, 1,1, 0,33, 0,11, 0,03, 0,01 мМ растворов. Серийно разведенные растворы пептидов в ДМСО разводят в 33,3 раза стерильной водой. В результате получают ряд 10× рабочих растворов. Также готовят смесь ДМСО/стерильная вода (3% ДМСО) для контрольных лунок.
В результате получают рабочие растворы с концентрациями в мкМ диапазоне, которые составляют 300, 100, 30, 10, 3, 1, 0,3 и 0 мкМ. Содержимое лунок на каждой стадии разведения тщательно перемешивают, используя многоканальную систему. В соответствующие лунки добавляют 20 мкл 10× рабочие растворы.
Ряд H содержит контроли. В H1-H3 добавляют 20 мкл среды для анализа. В H4-H9 добавляют 20 мкл 3% раствора ДМСО в воде. H10-H12 содержат только среду и не содержат клетки.
Положительный контроль: В качестве положительного контроля используют низкомолекулярный ингибитор HDM2, нутлин-3a (10 мМ). Растворы нутлина разводят по той же схеме, что и пептиды.
Добавление рабочих растворов к клеткам:
В соответствующие лунки добавляют 10 мкл растворов с концентрацией, в 10 раз превосходящей желательную, чтобы достичь нужной конечной концентрации в общем объеме 100 мкл/лунку. (10 мкл 300 мкМ раствора пептида +90 мкл суспензии клеток в среде = конечная концентрация 30 мкМ в 100 мкл/лунку). Таким образом, диапазон используемых конечных концентраций включает в себя 30, 10, 3, 1, 0,3, 0,1, 0,03 и 0 мкМ.
Контрольные лунки включают в себя лунки, которые не содержат пептиды, но содержат такие же концентрации ДМСО, как и лунки, содержащие пептиды, или лунки, не содержащие клетки.
Через 48 ч после инкубации отсасывают 80 мкл среды из каждой лунки; добавляют 100 мкл реагента для анализа Caspase3/7Glo (аналитическая система Caspase 3/7glo, Promega, G8092) на лунку, инкубируют при осторожном встряхивании в течение 1 ч при комнатной температуре.
Люминесценцию определяют с помощью многопланшетного ридера Synergy Biotek.
Результаты анализируют в виде активации каспазы 3 над ДМСО-обработанными клетками.
Результаты примера 13 приведены на фиг.7A-D в виде данных по p21.
Реферат
Изобретение относится к новым пептидомиметическим макроциклам и способам применения таких макроциклов для модуляции активности p53 и/или HDM2, HDMX. 4 н. и 29 з.п. ф-лы, 8 ил., 4 табл., 13 пр.
Формула
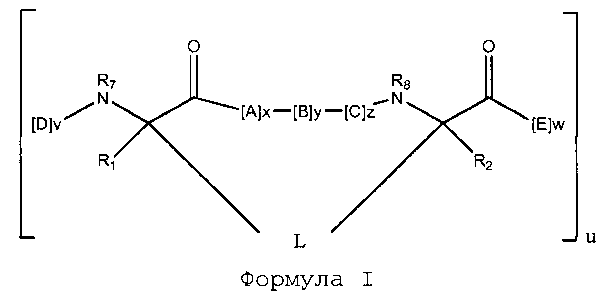
где:
каждый А, С, D и Е независимо обозначает природную или неприродную аминокислоту, a D и Е независимо и необязательно содержат кэпирующую группу;
В представляет собой природную или неприродную аминокислоту, аналог аминокислоты или

R1 и R2 независимо обозначают -Н, алкил, алкенил, алкинил, арилалкил, циклоалкил, циклоалкилалкил, гетероалкил или гетероциклоалкил, незамещенный или замещенный галогеном;
R3 обозначает водород, алкил, алкенил, алкинил, арилалкил, гетероалкил, циклоалкил, гетероциклоалкил, циклоалкилалкил, циклоарил или гетероциклоарил, необязательно замещенный R5;
L обозначает макроцикл-образующий линкер формулы -L1-L2-;
L1 и L2 независимо обозначают алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, циклоарилен, гетероциклоарилен или [-R4-K-R4-]n, каждый из которых необязательно замещен R5;
каждый R4 обозначает алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, арилен или гетероарилен;
каждый К обозначает О, S, SO, SO2, СО, CO2 или CONR3;
каждый R5 независимо обозначает галоген, алкил, -OR6, N(R6)2, -SR6, -SOR6, -SO2R6, -CO2R6, флуоресцентный фрагмент, радиоизотоп или терапевтическое средство;
каждый R6 независимо обозначает -Н, алкил, алкенил, алкинил, арилалкил, циклоалкилалкил, гетероциклоалкил, флуоресцентный фрагмент, радиоизотоп или терапевтическое средство;
R7 обозначает -Н, алкил, алкенил, алкинил, арилалкил, циклоалкил, гетероалкил, циклоалкилалкил, гетероциклоалкил, циклоарил или гетероциклоарил, необязательно замещенный R5, или часть циклической структуры, содержащую остаток D;
R8 обозначает -Н, алкил, алкенил, алкинил, арилалкил, циклоалкил, гетероалкил, циклоалкилалкил, гетероциклоалкил, циклоарил или гетероциклоарил, необязательно замещенный R5, или часть циклической структуры, содержащую остаток Е;
v и w независимо обозначают целые числа в диапазоне 1-1000;
u обозначает целое число в диапазоне 1-10;
x, y и z независимо обозначают целые числа в диапазоне 0-10; и
n обозначает целое число в диапазоне 1-5.


где:
каждый А, С, D и Е независимо обозначает природную или неприродную аминокислоту, a D и Е независимо и необязательно содержат кэпирующую группу;
В обозначает природную или неприродную аминокислоту, аналог аминокислоты или

R1 и R2 независимо обозначают -Н, алкил, алкенил, алкинил, арилалкил, циклоалкил, циклоалкилалкил, гетероалкил или гетероциклоалкил, незамещенный или замещенный галогеном, или часть циклической структуры, содержащей остаток Е;
R3 обозначает водород, алкил, алкенил, алкинил, арилалкил, гетероалкил, циклоалкил, гетероциклоалкил, циклоалкилалкил, циклоарил или гетероциклоарил, необязательно замещенный R5;
L1 и L2 независимо обозначают алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, циклоарилен, гетероциклоарилен или [-R4-K-R4-]n, каждый из которых необязательно замещен R5;
каждый R4 обозначает алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, арилен или гетероарилен;
каждый К обозначает О, S, SO, SO2, СО, CO2 или CONR3;
каждый R5 независимо обозначает галоген, алкил, -OR6, N(R6)2, -SR6, -SOR6, -SO2R6, -CO2R6, флуоресцентный фрагмент, радиоизотоп или терапевтическое средство;
каждый R6 независимо обозначает -Н, алкил, алкенил, алкинил, арилалкил, циклоалкилалкил, гетероциклоалкил, флуоресцентный фрагмент, радиоизотоп или терапевтическое средство;
R7 обозначает -Н, алкил, алкенил, алкинил, арилалкил, циклоалкил, гетероалкил, циклоалкилалкил, гетероциклоалкил, циклоарил или гетероциклоарил, необязательно замещенный R5;
v и w независимо обозначают целые числа в диапазоне 1-1000;
u обозначает целое число в диапазоне 1-10;
x, y и z независимо обозначают целые числа в диапазоне 0-10; и
n обозначает целое число в диапазоне 1-5.

где:
каждый А, С, D и Е независимо обозначает природную или неприродную аминокислоту, a D и Е независимо и необязательно содержат кэпирующую группу;
В представляет собой природную или неприродную аминокислоту, аналог аминокислоты или

R1 и R2 независимо обозначают -Н, алкил, алкенил, алкинил, арилалкил, циклоалкил, циклоалкилалкил, гетероалкил или гетероциклоалкил, незамещенный или замещенный галогеном;
R3 обозначает водород, алкил, алкенил, алкинил, арилалкил, гетероалкил, циклоалкил, гетероциклоалкил, циклоалкилалкил, циклоарил или гетероциклоарил, необязательно замещенный R5;
L обозначает макроцикл - образующий линкер формулы -L1-L2-;
L1 и L2 независимо обозначают алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, циклоарилен, гетероциклоарилен или [-R4-K-R4-]n, каждый из которых необязательно замещен R5;
каждый R4 обозначает алкилен, алкенилен, алкинилен, гетероалкилен, циклоалкилен, гетероциклоалкилен, арилен или гетероарилен;
каждый К обозначает О, S, SO, SO2, СО, CO2 или CONR3;
каждый R5 независимо обозначает галоген, алкил, -OR6, N(R6)2, -SR6, -SOR6, -SO2R6, -CO2R6, флуоресцентный фрагмент, радиоизотоп или терапевтическое средство;
каждый R6 независимо обозначает -Н, алкил, алкенил, алкинил, арилалкил, циклоалкилалкил, гетероциклоалкил, флуоресцентный фрагмент, радиоизотоп или терапевтическое средство;
R7 обозначает -Н, алкил, алкенил, алкинил, арилалкил, циклоалкил, гетероалкил, циклоалкилалкил, гетероциклоалкил, циклоарил или гетероциклоарил, необязательно замещенный R5, или часть циклической структуры, содержащую остаток D;
R8 обозначает -Н, алкил, алкенил, алкинил, арилалкил, циклоалкил, гетероалкил, циклоалкилалкил, гетероциклоалкил, циклоарил или гетероциклоарил, необязательно замещенный R5, или часть циклической структуры, содержащую остаток Е;
v и w независимо обозначают целые числа в диапазоне 1-1000;
u обозначает целое число в диапазоне 1-10;
x, y и z независимо обозначают целые числа в диапазоне 0-10; и
n обозначает целое число в диапазоне 1-5.
Документы, цитированные в отчёте о поиске
Способ и композиции, содержащие dna-поражающие агенты и р53







Комментарии