Способ и композиции, содержащие dna-поражающие агенты и р53 - RU2146149C1
Код документа: RU2146149C1
Чертежи
























Описание
Изобретение относится, в основном, к области новых направлений в усовершенствовании методов химиотерапевтического вмешательства. Кроме того, настоящее изобретение предлагает новые способы и композиции, которые объединяют потенциальные возможности DNA-поражающих агентов с комбинированной доставкой гена-суппрессора новообразований. Объединение DNA-поражающих факторов с ксеногенной экспрессией гена-суппрессора новообразований ведет к ощутимой синергии, подавляющей активность отдельных индивидуальных компонентов.
Описание уровня техники
Современные методы лечения рака,
включающие радиационную терапию, хирургию и химическую терапию, характеризуются ограниченной эффективностью. Только рак легких убивает в Соединенных Штатах более 140000 человек ежегодно. Недавно для
установленной возрастной группы смертность от рака легких превысила смертность от рака груди у женщин. Хотя введение в жизнь программы борьбы с курением снизило уровень распространения заболеваний от
курения, уровень смертности от рака легких останется высоким даже в 21-м веке. Развитие новых терапевтических методов лечения рака легких будет зависеть от проникновения в механизм биологии рака
легких на молекулярном уровне.
В настоящее время установлено, что разновидности рака вызываются, по крайней мере частично, генетическими отклонениями, которые проявляются или в повышенной экспрессии одного или более генов, или в экспрессии отклоненного от нормы или мутантного гена или генов. Например, во многих случаях, как известно, экспрессия онкогенов вызывает развитие рака. "Онкогены" - это генетически измененные гены, чей мутированный продукт экспрессии каким-то образом нарушает нормальное функционирование клетки или управление этим процессом. (Spendidos et al., 1989).
Большинство из изученных на настоящий момент онкогенов получили определение "активированных" в результате мутации, часто точечной мутации, в кодирующей области нормального клеточного гена, то есть "прото-онкогена", результатом чего является замещение аминокислоты в протеиновом продукте, экспрессия которого претерпела изменение. Этот продукт с видоизмененной экспрессией проявляет отклоненные от нормы биологические функции, которые оказывают влияние на протекание процесса образования опухолей (Travali et al., 1990). Не проявляющие себя мутации могут развиваться при различных обстоятельствах, например в результате химического мутагенеза или ионизирующей радиации. Целый ряд онкогенов или онкогенных семейств, включая ras, myc, neu, raf, erb, src, fims, jun, abl, в настоящее время уже идентифицированы и в различной степени описаны (Travali et al., 1990, Bishop, 1987).
Как установлено, при нормальном росте клетки, прото-онкогены, стимулирующие рост, сбалансированы генами-супрессорами, сдерживающими рост новообразований. Некоторые факторы могут внести дисбаланс во взаимодействие этих двух сил, ведущий к состоянию, предполагающему образование опухолей. Одним из таких факторов является мутация в генах-супрессорах новообразований (Weinberg, 1991).
Одним из важных генов-супрессоров новообразований является ген, кодирующий клеточный протеин, p53, который представляет собой ядерный фосфопротеин kD 53 (замещенный в цикле фосфопротеин kD 53), который управляет клеточной пролифератией (процессом разрастания клеток). Мутации, происходящие с геном p53, и потеря аллельного гена на хромосоме 17p, где этот ген размещен, являются одними из наиболее распространенных видоизменений, идентифицированных в злокачественных новообразованиях человека. Протеин p53 обладает высокой степенью сохранности в процессе эволюции и проявляется в наиболее нормальных тканях. Было продемонстрировано, как природный p53 (в некоторых источниках p53 "дикого типа") должен быть вовлечен в управление клеточным циклом (Mercer, 1992), в процесс транскрипционного регулирования (Fields et al., Mietz et al., 1992), в репликации DNA (Wilcock and Lane, 1991, and Bargonetti et al. , 1991) и в возбуждение апоптоза (Yonish - Rouach et al., 1991, Shaw et al., 1992).
Известны различные мутантные аллельные гены p53, в которых единственное базовое замещение ведет к синтезу протеинов, которые имеют совершенно другие характеристики, определяющие закономерности роста, что, в конечном счете, ведет к злокачественным новообразованиям (Hollstein et al., 1991). Действительно, было установлено, что ген p53 является наиболее часто мутированным геном при раке у человека (Hollstein et al., 1991) и, в частности, ассоциируется с теми разновидностями рака, возникновение которых связано с сигаретным дымом (Hollstein et al., Zakut - Houri et al., 1985). Чрезмерная экспрессия p53 в опухолях груди также была документально подтверждена (Casey et al., 1991).
Одним из аспектов, привлекающих наибольшее внимание генной терапии рака, является использование генов - супрессоров, таких как p53, для лечения опухолей. Было установлено, что трансфекция (заражение клеток чужеродной нуклеиновой кислотой, например вирусной) природного гена p53 в определенного типа опухолевых клетках рака груди и легких может восстановить управление процессом подавления роста в клеточных линиях (Casey et al., 1991, Takahasi et al. , 1992). Хотя трансфекция DNA не является жизнеспособным средством введения DNA в клетки пациентов, эти результаты служат демонстрацией того, что внедрение природного гена p53 в раковые клетки, содержащие мутированный p53, может стать эффективным методом лечения, если будут разработаны усовершенствованные способы внедрения гена p53.
В настоящее время ведется изучение проблемы и создаются системы внедрения гена, которые могут быть применены в генной терапии для подавления роста опухоли. Средства на основе вируса для трансфекции гена вызывают особый интерес, благодаря способности вирусов инфицировать действительно живые клетки. Налицо способ, в котором перемещается сам вирусный генетический материал. В этой связи уже были отмечены некоторые успешные решения, например воспроизведение ретровирусных векторов, разработанных для доставки целого многообразия генов. Однако существуют серьезные проблемы, связанные с использованием ретровирусных векторов в генной терапии. Поскольку их эффективность зависит от наличия ретровирусных рецепторов на клетках-мишенях, их трудно сконцентрировать и обеззаразить, и кроме того, они могут эффективно внедряться только в размножающиеся клетки (репликационные клетки).
Основную проблему клинической онкологии составляет устойчивость клетки злокачественного новообразования к воздействию химиотерапевтического лекарственного средства. Почти 80% случаев рака легких составляет рак легких с вовлечением значительного количества клеток (NSCLC). Однако больные этой формой рака, в основном, невосприимчивы к химиотерапевтическим методам лечения (Doyle, 1993). Одной из задач современных исследований в области лечения злокачественных новообразований является поиск путей улучшения действенности терапевтических методов лечения рака, основанных на перемещении гена, путем изучения механизма взаимодействия между продуктом гена и химиотерапевтическими лекарственными средствами. Ген герпес-симплекс-тимидин-киназы (HS-tk), будучи внедренным в опухоль мозга с помощью ретровирусной векторной системы, успешно вызывал восприимчивость к gancilclovir антивирусного агента (Culver et al. , 1992). Продукт гена HS-tK представляет собой экзогенный вирусный энзим, и поскольку экспрессия протеина wt-p53 проявляется в нормальных тканях, возникает предположение, что модуляция устойчивости к воздействию химиотерапевтических средств, вызванная альтерацией в экспрессии wt-p53, возможно, явится альтернативным подходом, использующим путь, который опосредствованно определен эндогенной генетической программой.
Аденовирусная система имеет потенциальные преимущества при перемещении гена in vivo, например легкость получения высокого значения титра-вируса, высокая степень инфекционной активности и невосприимчивость для многих типов клеток. Однако стабильность и продолжительность существования экспрессии внедренного гена все еще остаются проблематичными. Рост уровней p53 в клетках, которые отличаются чувствительностью к химиотерапевтическим лекарственным средствам, может наблюдаться в пределах 6 часов после воздействия DNA-поражающих стимуляторов (Fritche et al., 1993, Zhan et al., 1993), хотя повышенная активность, вызванная действием DNA, может быть возвращена в первоначальное состояние в течение четырех часов, если стимулятор удаляют (Tishler et al., 1993). Отсюда высокий уровень экспрессии p53 может поддерживаться даже после прекращения воздействия на организм лекарственного средства. Обеспечение экспрессии протеина wt-p53 с помощью Ad-p53 достигает кульминации на третий день после инфицирования (14 - складкой больше, чем эндогенный "дикого типа") и снижается до низкого уровня к девятому дню (Zhang et al. , 1993). Это наводит на мысль, что переменно высокого уровня экспрессии wt-p53 достаточно, чтобы инициировать цитотоксическую программу в раковой клетке.
p53 играет важную роль в определении чувствительности клеток рака легких человека к химиотерапевтическим лекарственным средствам. Многообразие протоколов лечения (историй болезни), включающих хирургическое вмешательство, химиотерапию и радиотерапию, было изучено в связи с лечением разновидности рака легких человека NSCLS, однако коэффициент выживаемости в течение продолжительного срока остается неудовлетворительным. В чем возникает потребность, так это в комбинированном терапевтическом методе, которым мог бы использоваться самостоятельно или в качестве вспомогательного лечения для предотвращения местного рецидива, следующего за предварительной резекцией, или который заключается в методе лечения, состоящем во введении инъекций в поврежденное место, которое первоначально было невосприимчивым к воздействию лекарственного средства и в котором имеются метастазы, или при местном рецидиве рака легких. Композиции и способы требуют дальнейших исследований, разработки и совершенствования способов клинической применимости новых средств для лечения рака. Кроме того, эти способы и композиции должны подтвердить свое право на использование in vivo.
Сущность изобретения
Изобретение направлено на решение задачи улучшения терапевтических средств и способов использования их в процессе уничтожения
клеток путем объединения воздействий гена-супрессора злокачественных новообразований или протеина и DNA-поражающего агента или фактора. Настоящее изобретение также предлагает композиции и способы,
включающие такие, которые используют вирусное перемещение гена-посредника, с целью обеспечения экспрессии природного гена-супрессора злокачественного новообразования, например p53, в клетках-мишенях и
направить агент или фактор, который вызывает повреждение DNA. Изобретатели неожиданно обнаружили, что, используя композиции, раскрытые в данном изобретении, они получили возможность вызвать
запрограммированное уничтожение клетки, явление, известное под названием "апоптоз", в значительном количестве клеток мишеней.
Используя настоящее изобретение, авторы продемонстрировали замечательный эффект, заключающийся в контроле роста клетки ракового новообразования. Формирование и рост опухолевой клетки также известны под названием "трансфекция", которое описывает образование и пролифератию клеток, которые потеряли способность контролировать процесс клеточного деления, т.е. превратились в раковые клетки. Совершенно очевидно, что целый ряд различных типов трансформированных клеток можно считать потенциальными объектами использования способов и композиций по данному изобретению, например, саркомы, меланомы, лимфомы, широкий спектр твердых опухолей и т.п. Хотя любая ткань, в которой наблюдается рост злокачественной клетки, может служить объектом использования изобретения, предпочтительную область использования составляют ткани легких и груди. Изобретатели обнаружили, что вектор, осуществляющий перенос рекомбинанта, вызывающего экспрессию p53,оказался в состоянии значительно снизить степень роста клеток в том случае, если он используется в сочетании с поражающим DNA агентом.
Изобретение предлагает в определенных примерах осуществления способы и композиции для уничтожения клетки или клеток, например раковых клеток или клетки, путем обеспечения контакта или облучения клетки или популяции клеток протеином p53 или геном и одним или более поражающими DNA агентами, общее количество которых оказывается достаточно эффективным, чтобы убить данную клетку (клетки). Перечень клеток, которые могут быть уничтожены в результате использования настоящего изобретения, включает например, нежелательные, но доброкачественные опухолевые клетки, такие как клетки гиперплазии, доброкачественной опухоли простаты, клетки щитовидной железы, отличающиеся повышенной активностью, клетки, относящиеся к аутоиммунным заболеваниям, например клетки B, которые производят антитела, присутствующие в артритах, волчанке, миастения гравис, плоскоклеточной метаплазии, дисплазии и т.п. Хотя изобретение применимо при уничтожении, в основном, всех нежелательных клеток, специфическая задача, которую оно решает, - это уничтожение злокачественных клеток. Термин "злокачественные клетки "относится к клеткам, которые потеряли способность к управлению циклом деления клетки, что ведет к появлению "трансформированного" или "ракового" фенотипа.
Для того, чтобы убить клетки, такие как злокачественные или метастазные, используя способы и композиции по настоящему изобретению, следует обеспечить контакт клетки-мишени с протеином p53 или геном и, по крайней мере, одним поражающим DNA агентом, общее количество которых достаточно эффективно, чтобы уничтожить данную клетку-мишень. Этот процесс может включать обеспечение контакта с протеином p53 или геном и поражающим(и) DNA агентом(ами) или фактором(ами) одновременно. Это может быть достигнуто путем обеспечения контакта клетки с одной единственной композицией или фармакологической единицей, которая включает оба компонента, или путем обеспечения контакта клетки с двумя отдельными композициями или фармакологическими единицами в одно и то же время, при условии, что одна композиция включает протеин p53 или ген, а другая включает поражающий DNA агент.
Совершенно очевидно, что клетка-мишень может быть первоначально облучена поражающим (и) DNA агентом(ами), а затем приведена в контакт с протеином p53 или геном, или наоборот. Однако, для вариантов осуществления изобретения, где поражающий DNA фактор и p53 используют для воздействия на клетку раздельно, следует четко уяснить, что между каждым из вводов указанных компонентов не должно быть значительного промежутка времени, чтобы поражающий DNA агент и p53 оставались бы в состоянии в полной мере объединенными усилиями оказать положительное воздействие на клетку. Установлено, что в таких случаях контакт с обоими компонентами следует осуществлять с промежутками в пределах 12-24 часов, а более предпочтительно, с промежутками в пределах 6-12 часов, при этом наиболее предпочтительным временем задержки (опаздывания) следует считать около 12 часов.
Термины "приведенные в контакт" или "подверженные воздействию", в применении к клетке, используются в настоящем описании для того, чтобы охарактеризовать процесс, с помощью которого ген-супрессор злокачественной опухоли или протеин, например p53, и поражающий DNA агент или фактор доставляется к клетке-мишени или приводится в непосредственное соприкосновение с данной клеткой-мишенью. Чтобы обеспечить умерщвление клетки, оба компонента доставляются в клетку в общем количестве, достаточном для обеспечения процесса уничтожения этой клетки, т.е. запрограммированной гибели клетки, или апоптоза. Термины "умерщвление", "запрограммированная гибель клетки" и "апоптоз" в настоящем контексте взаимозаменяемы и используются для описания серии внутриклеточных превращений, которые ведут к уничтожению клетки-мишени. Процесс уничтожения клетки-мишени приводит в активное состояние внутриклеточные протеазы и нуклеазы, что обеспечивает ядерную инволюцию клетки и фрагментацию ядерной DNA. Понимание точных механизмов внутриклеточного молекулярного взаимодействия, направленных на осуществление умерщвления клетки, не обязательно при использовании настоящего изобретения.
Поражающие DNA факторы или агенты в настоящем контексте определяются как любые химические соединения или методы лечения, которые вызывают повреждение DNA в применении к клетке. Такие агенты и факторы включают излучение или волны, которые стимулируют повреждение DNA, например γ- излучение, X-излучение, ультрафиолетовое (UV) излучение, микроволны, электронные эмиссии и т.п. Многообразие химических соединений, присутствующее в описании в виде термина "химиотерапевтические" агенты, действуют как средства, вызывающие поражение DNA, при этом все они могут быть использованы в комбинированных методах лечения, раскрытых в настоящем изобретении. Перечень предназначенных к использованию химиотерапевтических агентов включает, например: адриамицин, 5-флуороурацил (5FU), этопозид (VP-16), камптотецин, актиномицин-D, митомицин C, цисплатин (CDDP) и даже пероксид водорода. Настоящее изобретение также очерчивает круг использования комбинаций из одного или нескольких поражающих DNA агентов, которые основаны на принципе излучения, или представляют собой активные соединения, например использование радиоактивного излучения совместно с цисплатином или использование цисплатина с этопозидом. В отдельных случаях использование цисплатина в сочетании с протеином p53 или геном значительно предпочтительнее, по сравнению с упомянутым соединением.
Может быть использован любой способ обеспечения контакта клетки с протеином p53 в течение периода времени, пока этот способ обеспечивает высокие уровни инфицирования протеина p53 внутри клетки. Он включает как прямую доставку протеина p53, так и доставку гена или DNA-сегмента, который кодирует p53, при этом данный ген должен будет возбудить экспрессию и образование p53 внутри клетки. При таком способе доставки протеина наблюдается недостаток, который заключается в деградации протеина и низкой поглотительной способности клетки. Сделано заключение, что способ использования рекомбинантного вектора, вызывающего экспрессию протеина p53, обладает значительными преимуществами.
Может быть разработано широкое многообразие рекомбинантных плазмидов и векторов, способных вызвать экспрессию протеина p53 и, будучи таким образом использованными, доставить p53 в клетку. Например, известно использование "голой" DNA и плазмидов p53 для непосредственной доставки генетического материала в клетку (Wolfe et al., 1990), соединения p53 - кодирующей DNA, находящиеся в ловушке у липосом (Ledley et al., 1987) или у протолипосом, которые содержат протеины рецептора в вирусной оболочке (Nicolau et al., 1983); и p53-кодирующие DNA, присоединенные к комплексу-переносчику полилизингликопротеина. Изучалось также использование вирусов-рекомбинантов, разработанных для обеспечения проявления экспрессии p53.
Целый набор вирусных векторов, например ретровирусные векторы, вирус простого пузырькового герпеса (герпес-симплекс-вирус) (патент США N 5288641, включенный в перечень ссылок), вирусы цитомегалии и т.п. могут быть использованы, как описано Миллером (Miller, 1992); могут быть использованы рекомбинантные аденоассоциированные вирусы (векторы AAV), описанные в патенте США N 5139941 и включенные в перечень ссылок, а также, в частности, векторы аденовирусов-рекомбинантов. Технологии приготовления репликационно-дефектных инфицирующих вирусов хорошо известны из уровня техники, а их примеры описаны в работах авторами: Ghosh-Choudhury & Graham (1987); McGrory et al., (1988); и Gluzman et al. (1982), каждая из которых приведена в перечне ссылок.
Для того чтобы умертвить клетку в соответствии с настоящим изобретением, следует обеспечить контакт клетки с протеином p53 или геном и с поражающим DNA агентом при их объединенном количестве, достаточно эффективном для того, чтобы умертвить данную клетку. Термин "при объединенном их количестве, достаточно эффективном для того, чтобы умертвить данную клетку" означает, что количества p53 и поражающих DNA агентов должны быть достаточными настолько, что, в том случае, если они будут объединены внутри клетки, это вызовет апоптоз данной клетки. Хотя данного замечания и не требуется для каждого из примеров осуществления изобретения, в качестве объединенного эффективного количества p53 и поражающего DNA агента, предпочтительно может быть принято такое количество, которое инициирует умерщвление значительно большего количества клеток, чем использование каждого элемента в отдельности. Наиболее предпочтительным может считаться такое эффективное объединенное количество, которое будет составлять величину, инициирующую синергическое умерщвление клетки в сравнении с результатами, которые наблюдаются при использовании каждого из элементов в отдельности.
Определенное количество параметров in vitro может быть использовано для определения результата, который достигается в результате применения композиций и способов, предлагаемых настоящим изобретением. Эти параметры включают, например, подсчет результирующего количества клеток до и после воздействия композициями, описанными в настоящем изобретении, а также измерением размеров многоклеточных опухолевых сфероидов, сформированных таким же образом, каким формируются их колонии в культуре ткани. In vitro процесс умерщвления клетки, в частности, показан в примере 7 осуществления способа настоящего описания. Дополнительно можно измерить параметры, которые характерны для клетки, подвергающейся запрограммированному умерщвлению, например фрагментации клеточной геномной DNA на фрагменты с размерами нуклеосомы, которые, в основном, идентифицировались путем выделения фрагментов при электрофорезе геля агарозы, окраски DNA и сравнения DNA с размерной цепочкой DNA. Фрагменты с размером нуклеосомы идентифицируются как возрастающие ступеньки (по типу спущенной петли) или цепочки мономеров или полимеров, имеющих основной блок приблизительно из 200 пар.
По аналогии, термин "терапевтически эффективное количество" означает объединенное количество протеина p53 или гена поражающего DNA агента, которое при введении в организм животного в состоянии умертвить клетки внутри организма животного. Это, в частности, подтверждается умерщвлением раковых клеток, например, клеток рака легких, груди или клеток рака толстой кишки в организме животного или человека, пораженного злокачественной опухолью. Термин "терапевтически эффективные соединения " означает, в основном, таким образом объединенные количества p53 и поражающих DNA агентов, действие которых направлено на умерщвление большего количества клеток, чем каждый из элементов в отдельности, и, предпочтительно, такие объединенные количества, которые обеспечивают синергическое снижение генетического груза в опухолевом новообразовании.
Изучение in vivo и ex vivo определенных параметров умерщвления клетки являются также эффективными средствами, с помощью которых доказывается эффективность композиций и способов по настоящему изобретению. Например, наблюдения воздействуют на подавление онкогенности, измеренной с помощью экспрессии TdT замороженных высечек тканей или путем использования методов окрашивания и антигенов клетки-мишени, что не является новостью для паталогоанатомов. Естественно, другие способы определения массы опухоли, ее роста и жизнеспособности также могут быть использованы для установления факта умерщвления клеток - мишеней. В частности, можно определить такое поведение в живом организме различных моделей раковых систем, включая те, в которых раковые клетки человека локализованы в пределах организма животного. Известно, что модели рака животного, в отличие от модели AIDS, имеют большое сходство (прогнозируемы) с режимами лечения, разрабатываемыми для человеческого организма (Roth et al., редакторы, 1989). Существует один экземпляр образца прогнозируемой модели животного, в которой подкожно выращивали клетки рака легких человека, разновидность которого отличается малым размером клетки (клетки H358). Используя данную систему, изобретатели показали, что аденовирус, несущий p53, введенный в виде капель внутрь пораженной опухолью области совместно с введением химиотерапевтического агента приводит к совершенно неожиданному эффективному уменьшению клеток опухоли.
Одним из предпочтительных способов доставки протеина p53 в клетку является обеспечение контакта клетки с вирионом аденовируса-рекомбинанта или с частицей, которая включает вектор аденовируса-рекомбинанта, состоящий из области экспрессии p53, расположенной под контролем промотора, способного направлять экспрессию p53 в данном типе клетки.
Область экспрессии p53 в векторе может содержать последовательность геномов, но для упрощения можно предположить, что более предпочтительно использование последовательности cDNA p53, так как это легко доступно для анализа уровня техники в данной области и проще в управлении процессом. В дополнение к экспрессии p53 и зоне промотора вектор должен также включать сигнал полиаденилации (polyadenilation), например ранний ген SV40 или ген протамина, или что-либо подобное.
В предпочтительных вариантах изобретения предполагается, что может возникнуть необходимость в расположении зоны экспрессии p53 под контролем сильного, существенного (структурного) промотора, например промотора цитомегаловируса (CMV), вирусного промотора LTR, RSV или SV40 или промотора, ассоциированного с генами, которые проявляют экспрессию на высоких уровнях в клетках млекопитающих (молочной железы), например промоторы фактора-1 элонгации или актина. Все эти варианты имеют право на существование в связи с использованием изобретения. В настоящее время наиболее предпочтительным промотором считается промотор IE вируса цитомегалии (CMV).
Ген p53 или cDNA может быть введен в аденовирус-рекомбинант, в соответствии с настоящим изобретением, простым включением или добавлением кодирующей последовательности p53 в вирусный геном. Однако в качестве предпочтительных аденовирусов следует рассматривать дефектные вирусы репликаций, в которых вирусный ген, существенный для репликаций и/или "упаковки", был удален из аденовирусной векторной структуры, давая возможность зоне экспрессии p53 переместиться на свое место. Любой ген, то ли существенный, например E1A, E2, E4, то ли несущественный, например E3, для репликаций, может быть удален и замещен p53. В частности, предпочтительными являются те векторы и вирионы, в которых области E1A и E1B векторов аденовируса удалены, а зона экспрессии p53 внедрена на их место, что показано в качестве примера на структуре генома на фиг. 1.
Технологические процессы приготовления репликационных дефектных аденовирусов хорошо известны из уровня техники, что подтверждается приведенными в данном описании аналогами Ghoss-Choudhury и Graham (1987); McGrory et al. (1988); и Gluzman et al., (1982), перечисленными в ссылках на использованную литературу. Кроме того, хорошо известно, что могут быть использованы различные клеточные линии, с целью воспроизведения аденовирусов-рекомбинантов, при этом их воспроизведение может продолжаться до тех пор, пока существует возможность дополнения дефекта репликаций, если таковой присутствует. Предпочтительной клеточной линией является клеточная линия 293 человека, но существуют также и другие клеточные линии, приемлемые для репликаций, например, могут быть использованы в предпочтительном случае экспрессии E1A и E1B. Причем клетки могут воспроизводиться как на пластмассовых чашках, так и в культуре суспензии, чтобы получить запасы культуры вирусов.
Изобретение не ограничивается вирусами с недостающим звеном E1 и клетками с экспрессией E1. Действительно, в связи с настоящим изобретением, могут быть использованы другие дополняемые комбинации вирусов и клеток - хозяев. Могут быть использованы клетки с экспрессией E2 и вирус, теряющий функциональное звено E2 точно так же, как и клетки с экспрессией E4 и вирус, теряющий функциональное звено E4 и т.д. В том случае, если несущественный для репликации ген удаляется или замещается, каковым, например, является ген E3, такой дефект нет надобности отдельно укомплектовывать с помощью клетки-хозяина.
Для успешного использования изобретения единственным требованием является создание векторов аденовирусов, которые способны возбуждать экспрессию p53. Природа же исходного аденовируса решающего значения для использования изобретения не имеет. Может быть использован любой аденовирус из 42 известных различных серотипов или подгрупп A-F. Аденовирус типа 5 подгруппы C является предпочтительным стартовым материалом для получения цельного репликационно-дефектного вектора аденовируса для использования в методике, предлагаемой настоящим изобретением. Аденовирус типа 5 выбран потому, что, в связи с этим аденовирусом человека, накоплен значительный объем биохимической и генетической информации, и, кроме того, он традиционно применяется для большинства структур, использующих аденовирус в качестве вектора.
Способы и композиции, в связи с настоящим изобретением, одинаково пригодны для умерщвления клетки или клеток как in vivo, так и in vitro. В том случае, когда клетки, предназначенные для умерщвления, сосредотачиваются внутри организма животного, например раковые клетки рака легкого, груди или прямой кишки, или другие клетки, несущие мутированный p53, в данном случае протеин p53 или ген, а также поражающий DNA агент должны вводиться в организм животного в фармакологически приемлемом виде. Термин "фармакологически приемлемый вид" в настоящем контексте относится как к форме любой из композиций, которая может быть введена в организм животного, так и к методу обеспечения контакта живого организма с радиационным излучением, т.е. к способу, с помощью которого облучается какая-либо зона тела животного, например путем γ- излучения, X-лучей, ультрафиолетового (UV) излучения, микроволн, электронных эмиссий и т.п. Использование поражающей DNA радиации и волн известно всем, кто имеет опыт работы в области лучевой терапии.
Настоящее изобретение также предлагает способы лечения рака, которые, в основном, включают введение в организм животного или человека, больного раком, терапевтически эффективной комбинации протеина p53 или гена и поражающего DNA агента. Это может быть достигнуто, благодаря использованию рекомбинантного вируса, в частности аденовируса, который несет вектор, способный вызвать экспрессию p53 в клетках опухолевых новообразований. Композиция, несущая ген p53, в основном, должна быть введена в организм животного часто при обеспечении тесного контакта с опухолью, в виде фармацевтически приемлемой композиции. Предпочтительным способом является непосредственное впрыскивание терапевтически эффективного количества гена p53, такого, который размещается в пределах границ рекомбинантного вируса, в то место в организме, которое поражено опухолью. Однако имеют право на существование и другие парентеральные способы введения, например внутривенно, через кожу, эндоскопически или с помощью подкожного впрыскивания.
При лечении рака, в соответствии с настоящим изобретением, можно обеспечить контакт клеток опухоли с поражающим DNA агентом, в дополнение к воздействию протеина p53 или гена. Этот способ может осуществляться путем облучения места сосредоточения опухолевых тканей поражающей DNA радиацией, например рентгеновскими лучами, ультрафиолетовым световым излучением, γ- лучами или даже микроволнами. Кроме того, опухолевые клетки могут быть приведены в контакт с поражающим DNA агентом путем введения в организм животного фармацевтически эффективного количества фармацевтического средства, содержащего поражающее DNA соединение, например адриамицин, 5-флуороурацил, этопозид, камптотецин, актиномицин-D, митомицин C, а еще лучше - цисплатин. Поражающий DNA агент может быть приготовлен и использован в виде сложной терапевтической композиции или фармакологического набора, полученного объединения поражающего DNA агента с протеином p53, геном или генной системой доставки, как было описано выше.
Поразительный положительный эффект, возникающий при использовании настоящего изобретения, раскрывается в том, что использование вируса Ad5CMV-p53 в сочетании с цисплатином показало замечательные результаты в исследованиях, использующих модель безволосой мыши. Комбинированный режим вирус-поражающей DNA терапии значительно снизил онкогенность клеток H358, клеток, которые нормально производят значительные опухолевые массы. Онкогенность раковых клеток рака легких была подавлена, благодаря лечению с помощью Ad5CMV-p53,но не благодаря лечению контрольным вирусом, вызывающим экспрессию люциферазы. Это указывает на то, что протеин p53 в сочетании с поражающим DNA агентом имеет большую терапевтическую эффективность.
Специалистам, компетентным в данной области знаний, известны методы доставки химиотерапевтических средств, включая структуры экспрессии DNA, в эвкариотические клетки. В свете настоящего изобретения опытный специалист будет в состоянии доставить как поражающие DNA агенты, так и протеины p53 или гены к клеткам, используя для этого многообразие эффективных средств.
Для доставки DNA in vivo изобретатели предполагают использование различных генных систем доставки, например вирусную и с промежуточным звеном липосомы трансфекцию. В контексте описания настоящего изобретения термин "трансфекция" используется для описания адресной доставки DNA в эвкариотические клетки путем использования таких систем доставки, как например, аденовирусные, AAV, ретровирусные или системы доставки гена с помощью плазмидов. Специфичность вирусной доставки может быть выбрана для предпочтительного непосредственного переноса гена в отдельную специфичную клетку-мишень. При этом используются вирусы, которые способны инфицировать эти отдельные специфичные виды клеток. Естественно, различные особенности разновидностей вирусов определяют специфику выбора подходящего вируса для переноса гена по принципу того, как и ген-супрессор злокачественного новообразования должен проявить свою способность к умерщвлению злокачественной клетки указанного типа.
Было обнаружено, что применить поражающий DNA химиотерапевтический агент можно, используя целое многообразие средств, например, с помощью использования парентеральных способов доставки, таких как внутривенные и подкожные инъекции и т.п. Такие способы известны специалистам в области введения в организм лекарственных средств и будут описаны в разделе, относящемуся к фармацевтическим препаратам и способам лечения.
Для доставки гена in vitro могут быть использованы различные способы, например применение фосфата кальция или трансфекция с промежуточным звеном из декстрин-сульфата, электрофорез; позиционирование (целеуказание) с помощью стеклянного микроснаряда и т.п. Эти методы хорошо известны из уровня техники, а точный состав средств и методика их использования дается в описании к данному изобретению.
Другие варианты осуществления изобретения относятся к композициям, включающим фармацевтические средства, состоящие из протеина p53 или гена в сочетании с поражающим DNA агентом, например цисплатином. В таких композициях p53 может быть представлен в виде сегмента DNA рекомбинантного вектора или рекомбинантного вируса, который способен вызывать экспрессию протеина p53 в клетке животного. Данные композиции, включая и такие, которые содержат систему-вируса-рекомбинанта, предназначенную для доставки гена, например аденовирусную частицу, могут быть приготовлены для введения in vitro путем диспергирования в фармакологически приемлемом растворе или буферной смеси. Предпочтительные, фармакологически допустимые растворы включают нейтральные физиологические растворы, защищенные фосфатом, лактатом, тризом (Tris) и т. п.
Безусловно, у всех, кто использует вирусную систему доставки, существует стремление очистить вирион до такой степени, чтобы существенно освободить его от нежелательных загрязнений, таких, например, как дефектные, создающие помехи аденовирусные частицы или эндотоксины и другие пирогены, чтобы этот вирион не вызывал побочных реакций в организме животного или человека, получающего векторную структуру. Предпочтительными средствами очистки вектора является создание условий для использования градиентов плавучей плотности, например, центрифугирование хлорида цезия в градиенте плотности.
Предпочтительными фармацевтическими средствами по изобретению являются такие, которые включают, в пределах фармакологически приемлемого раствора или буферной смеси, протеин p53, или предпочтительнее ген p53, в сочетании с химиотерапевтическим поражающим DNA агентом. Примерами химиотерапевтических агентов могут служить адриамицин, флуороурацил-5, комптоцин, актиномицин-D, пероксид водорода, митомицин C, цисплатин (CDDP) и этопозид (VP-16), при этом особенно предпочтительным является использование цисплатина.
Последующие варианты осуществления настоящего изобретения относятся к наборам, предназначенным для умерщвления клеток, а именно раковых клеток, которые могут быть определены как терапевтические наборы для лечения рака. Такие наборы, по настоящему изобретению, должны, в основном, содержать размещенную в соответствующей контейнерной оболочке (капсуле) фармацевтическое средство рекомбинантного вектора, которое способно вызвать экспрессию протеина p53 в клетке животного, и фармацевтическое средство поражающего DNA агента. Рекомбинантные векторы и поражающие DNA агенты могут присутствовать в одной и той же капсуле или эти компоненты могут вводиться в отдельных различных капсулах. В предпочтительном варианте в качестве рекомбинантного вектора используется вектор аденовируса-рекомбинанта, вызывающий экспрессию p53, при этом данный вектор присутствует в пределах аденовирусной частицы, а в качестве поражающего DNA агента используют цисплатин.
Компоненты набора, предпочтительно, вводятся в виде жидких растворов или сухого порошка. В том случае, когда компоненты вводят в виде жидкого раствора, в качестве жидкого раствора используют водный раствор, причем особенно предпочтительным является стерильный водный раствор. В том случае, когда реагенты или компоненты вводятся в виде сухого порошка, порошок может менять свое состояние путем добавления подходящего растворителя. Вполне очевидно, что растворитель может присутствовать в другом контейнерном средстве.
Краткое описание чертежей
Частью настоящего описания являются чертежи, которые включены для дополнительного раскрытия определенных аспектов изобретения. Изобретение может быть лучше понято при обращении к одному или
целому ряду приведенных чертежей в сочетании с подробным описанием отдельных вариантов осуществления изобретения.
Фиг. 1. Дана схема образования аденовируса-рекомбинанта p53. Кассета экспрессии p53 была введена между Xba- и Cla участками pXCJL. 1. Вектор экспрессии p53 (pEC53) и рекомбинантный плазмид (pJM17) были подвергнуты котрансфекции в клетках 293. Зараженные клетки выдерживались в среде до тех пор, пока не проявлялся цитопатогенный эффект. Идентификация вновь образованных аденовирусов-рекомбинантов p53 (Ad5CMV - p53) производилась на пробах цепной реакции полимеризации (PCR) DNA с использованием матриц DNA, приготовленных из надосадочной жидкости, обработанной протеиназой K и экстрактом фенола.
На фиг. 2A показана карта, применяемая для структурных исследований DNA Ad5CMV-p53. Карта DNA генома AdCMV-p53 с местами расположения кассет экспрессии p53, первичных материалов цепной реакции полимеризации (PCR) и ограничивающих участков. Размер генома около 35,4 kb, разделенные на 100 ячеек карты (1 m.u. (ячейка карты = 0,35 kb). Кассета экспрессии заняла место зоны E1 (1,3-9,2 m.u.) генома Ad5. Первичный элемент 1 сосредоточен в первом интроне, расположенном вниз по траектории движения промотора главного гена 1E цитомегаловируса (CMV) человека. Первичный элемент 2 сосредоточен в зоне раннего сигнала полиаденилации SV40. Оба эти элемента, расположенные в 15-20 bp от ввода CDNA p53 на двух концах, определяют продукт 1,40 kb цепной реакции полимеризации (PCR). Первичные элементы 3 и 4 сосредоточены в 11 ячейке карты (m.u.) и 13,4 ячейке карты (m.u.) генома Ad5, соответственно, и определяют специфический продукт 0,86 kb цепной реакции полимеризации (PCR) генома-вируса.
На фиг. 2B показаны пробы геля агарозы продукта цепной реакции полимеризации (PCR). Две пары первичных элементов (параметров), которые определяют фрагменты DNA 1,4 kb (p53) и 0,86 kb (Ad5), были использованы в каждой реакции. В каждой реакции были использованы матрицы DNA: плазмид pEC53 (1-я полоса), DNA Ad5/RCV/GL2 () 1-я полоса, никаких DNA (3-я полоса) и DNA Ad5CMV-p53 (4-я полоса). Полоса с обозначением (M) соответствует генам-маркерам молекулярного веса.
На фиг. 2C показано картирование ограничения DNA Ad5CMV-p53. Образцы DNA, очищенной от CsCl-градиента Ad5CMV-p53, были классифицированы по признаку отсутствия энзима (U), Hind III (H) (задний, задняя нога туши). Bam HI (B), Eco RI (E) и Cla I (C), соответственно, и проанализированы на 1% геле агарозы. Дорожка с обозначением (M) соответствует генам-маркерам молекулярного веса.
На фиг. 3A, 3B, 3C и 3D показаны результаты наблюдения цитопатогенных эффектов на клетках 293, полученных с помощью аденовируса-рекомбинанта.
На фиг. 3A, 3B, 3C и 3D даны серии фазовых контрастных изображений (х 400) клеток 293.
На фиг. 3A, 3B, 3C и 3D даны четыре фотографии одной фигуры, показанной на странице. Фиг. 3 A - перед трансфекцией, фиг. 3B - отрицательный контрольный результат на 12-й день после трансфекции, фиг. 3C - появление цитопатогенного эффекта (CPE) на 12-й день после трансфекции, фиг. 3D - полное проявление цитопатогенного эффекта (CPE) на 14-й день после трансфекции.
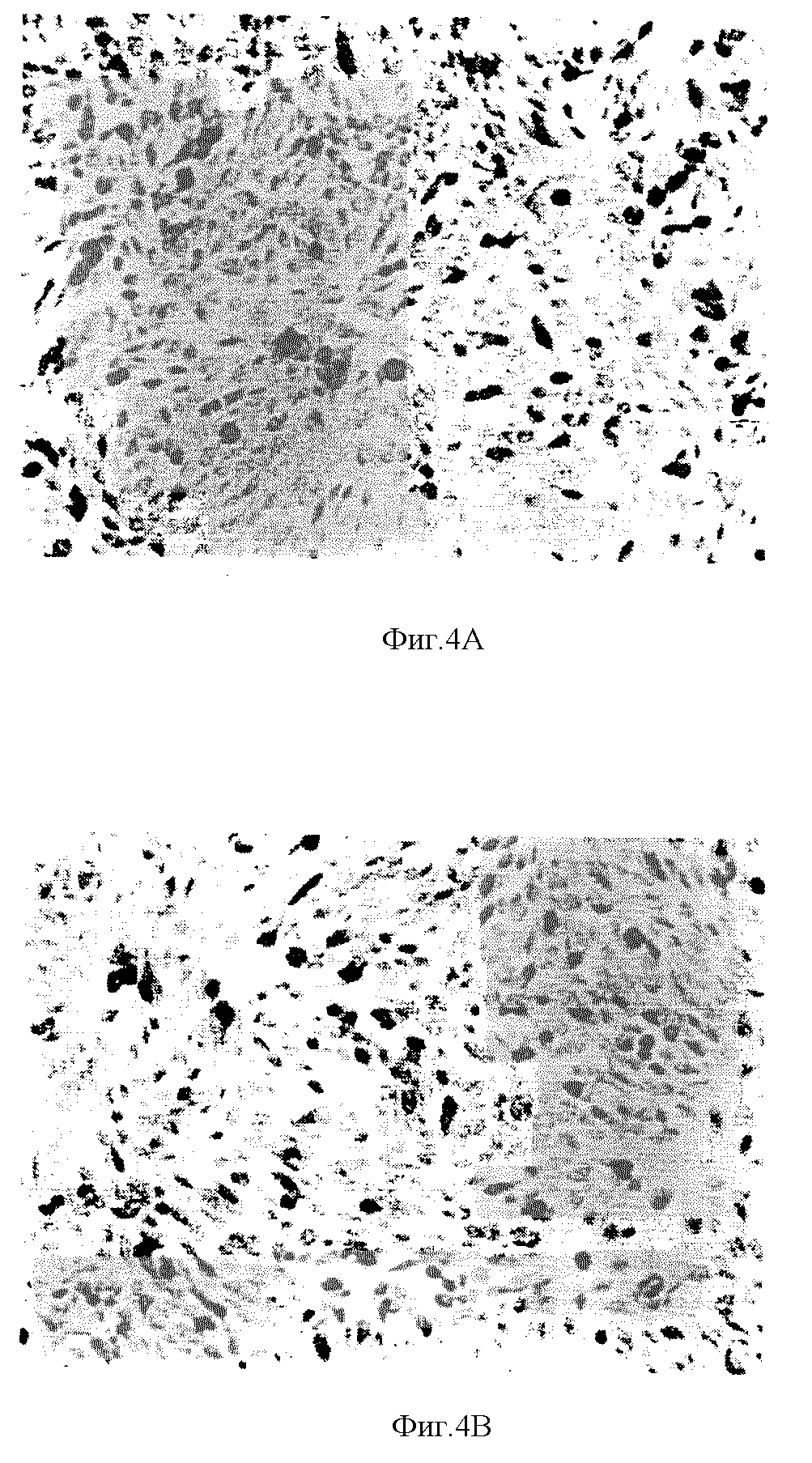
На фиг. 4A, 4B, 4C и 4D дана иммунология клеток, инфицированных аденовирусами-рекомбинантами.
На фиг. 4A, 4B, 4C и 4D показаны серии иммунологических изображений клеток H358.
На фиг. 4A, 4B, 4C и 4D даны 4 фотографии фигуры, представленной на одной странице.
Проявление способности к инфицированию в клетках H358. Клетки H358 были инфицированы Ad5CMV-p53 или Ad5/RCV/GL2 в 50 PFU/клетка в течение 24 часов. Питательная среда была использована, единственно, в качестве смоделированной инфекции. Инфицированные клетки были проанализированы с помощью иммуноокрашивания. На фиг. 4A представлены результаты испытаний смоделированной инфекции с помощью антитела anti-p53. Ha фиг. 4B показаны клетки, инфицированные контрольным Ad5/RSV/GL2 и испытанные с помощью антитела anti-p53. Ha фиг. 4C даны инфицированные клетки Ad5CMV-p53, испытанные с помощью несвязанного антитела (MOPC21). На фиг. 4D показана клеточная инфекция Ad5CMV, испытанная антителом anti-p53. В качестве антитела anti-p53 был использован Pab 1801, а для окрашивания применяли авидино-биотиновый метод.
На фиг. 5A показано сравнение относительного уровня экспрессии экзогенного p53 в клетках H358 с помощью геля SDS-PAGE, окрашенного в голубой цвет (Coomassie - blue). Образцы клеток H358, которые были инфицированы Ad5CMV-p53 или Ad5/RSV/GL2 в 30 PFU/клетка, препарировались в течение 24 и 72 часов после инфицирования. Испытывались образцы пробы SDS-PAGE, окрашенной в голубой цвет (Coomassie blue), с целью определения относительного содержания протеина. Полосы 1 и 4 содержат образцы клеток, инфицированных Ad5/RSV/GL2. Полосы 2 и 3 содержат образцы клеток, инфицированных двумя индивидуальными группами Ad5CMV-p53 через 24 часа после инфицирования. Полосы 5 и 6 - это образцы Ad5CMV-p53 - инфицированной клетки, собранные через 72 часа после инфицирования. Полоса 7 - это образец H358 с моделированным инфицированием через 72 часа после инфицирования. Полоса M - это предварительно окрашенные гены-маркеры молекулярного веса в kDu (CIBCO - BRL).
На фиг. 5B дан блотированный Western анализ геля, размещенного на полосе, идентичной той, которая принадлежит SDS-PAGE на фиг. 5A. Относительные уровни экспрессии p53 были исследованы Western блотированием с использованием anti-p53. Первичные антитела были моноклональными антителами против протеина p53 (Pab 1801, Oncogene Science Inc.) и β- актина (Amersham Inc.) HRP-конъюгированное вторичное антитело и ECL-проявитель были получены из вирус-инфицированных клеток H358, прошедших Western блотирование (Amersham Inc. ). Отпечаток, полученный Western блотированием, на фиг. 5B, имеет эквивалентную методику восстановления и лечения, что и у тех, которые представлены на фиг. 5A.
На фиг. 6 показано время протекания экспрессии p53, определенное Western блотированием. Множественные чашки клеток H358 были инфицированы Ad5CMV при 10 PFU/клетка. Клеточные лизаты были приготовлены в установленные моменты времени после инфицирования. Western блотирование было испытано с помощью антител анти-p53 и антиактина одновременно. Полосы с отметкой 'C' представляют отрицательные результаты. Гистограмма показывает относительные количества p53, определенные с помощью денситометра.
На фиг. 7A показана кривая роста вирус-инфицированных клеток рака легких у человека в клеточных линиях H358. Клетки были засеяны в количестве 105 клеток на чашку (60 мм), при этом в процессе участвовали 6 чашек на одну клеточную линию. Через 24 часа клетки были инфицированы Ad5CMV-p53 или Ad5/RSV/GL2 при 10 m.o.i. (множественность инфицирования, т.е. PFU/клетка). После инфицирования клетки подсчитывались ежедневно в течение 6 дней. Кривые роста представляют данные, полученные при наблюдении четырех отдельных исследований.
На фиг. 7B показана кривая роста вирус-инфицированных клеток рака легких у человека в клеточных линиях H322. Клетки были засеяны в количестве 105 клеток на чашку (60 мм), при этом в процессе участвовали 6 чашек на одну клеточную линию. Через 24 часа клетки были инфицированы Ad5CMV-p53 или Ad5/RSV/GL2 при 10 m.o.i. (множественность инфицирования, т.е. PFU/клетка). После инфицирования клетки подсчитывались ежедневно в течение 6 дней. Кривые роста представляют данные, полученные при наблюдении четырех отдельных исследований.
На фиг. 7C показана кривая роста вирус-инфицированных клеток рака легких у человека в клеточных линиях H460. Клетки были засеяны в количестве 105 клеток на чашку (60 мм), при этом в процессе участвовали 6 чашек на одну клеточную линию. Через 24 часа клетки были инфицированы Ad5CMV-p53 или Ad5/RSV/GL2 при 10 m.о.i. (множественность инфицирования, т.е. PFU/клетка). После инфицирования клетки подсчитывались ежедневно в течение 6 дней. Кривые роста представляют данные, полученные при наблюдении четырех отдельных исследований.
На фиг. 8 показана схема последовательности операций при исследовании Ad5CMV-p53 в ортотопической модели рака легких. Дозировка и методика лечения безволосых мышей, зараженных клетками H226Br и вирусами, представлены в указанной схеме.
На фиг. 9A, 9B, 9C и 9D показаны образцы средостений, легких мышей, прошедших лечение, и контрольных мышей. Фиг. 9A, 9B, 9C и 9D - это фотографии одной фигуры. Особь была принесена в жертву в конце 6-недельного периода, наступившего после прекращения лечения. Ткани легкого и средостения были иссечены для изучения опухолевого формообразования.
На фиг. 9A показан образец медиастинального блока от нормальной безволосой мыши.
На фиг. 9B дан образец медиастинального блока из мыши, которая была подвергнута лечению с помощью переносчика фосфатно-солевого буферного раствора (PBS).
На фиг. 9C показан образец медиастинального блока от мыши, прошедшей курс лечения Ad5CMV-p53.
На фиг. 9D представлен образец медиастинального блока, взятого от мыши, прошедшей курс лечения Ad5/RSV/GL2, Стрелки указывают на опухолевые массы.
На фиг. 10A показано непрерывное воздействие CDDP на степень роста родительских Ad-Luc-инфицированных и Ad-p53-инфициpoвaнныx клеток H358. Клетки H358 (1,5•105 клеток/лунка) были высеяны в двух экземплярах на чашке с 24 лунками. Через 24 часа в 100 μl среды был добавлен Ad-Luc-вирусный штамм (запас биомассы) (108 PFU/мл) или Ad-p53-вирусный штамм (108 PFU/мл). Через дополнительные 24 часа инкубационного периода среда, содержащая вирус, была заменена свежей средой, которая содержала 10 μг/мл CDDP.
На фиг. 10B показано воздействие CDDP в течение 24 часов на рост родительских Ad-Luc-инфицированных и Ad-p53-инфицированных клеток H358. Клетки были подвержены воздействию CDDP непрерывно (фиг. 10A) или в течение 24 часов (фиг. 10B), после чего следовало восстановление в свободной от лекарственного средства среде. Клетки, которые оставались в виде приложенного монослоя, были испытаны на жизнеспособность в течение более пяти дней путем определения степени поглощения голубизны трипана. Показано значение ±SE. На пятый день клеточное число для Ad-p53:CDDP-группы значительно отличалось от всех остальных групп как для A, так и для B (p< 0,05 определено с помощью исследований 'Student'st-test' (студенческого t-испытания).
На фиг. 10C показано воздействие различных концентраций CDDP на жизнеспособность Ad-53-инфицированных клеток H358. После 24-часового воздействия вируса Ad-Luc или Ad-p53 на клетки, они были обработаны 0, 10, или 100 μг/мл CDDP в течение 24 часов, после чего была определена их жизнеспособность.
На фиг. 11A показано нуклеосомальное разрушение DNA в клетках H358, инфицированных Ad-p53, которые подвергаются воздействию CDDP. Клетки были инфицированы и обработаны CDDP в течение 24 часов по методике, которая была описана в комментариях к фиг. 10.
На фиг. 11B, 11C, 11D, 11E, 11F, 11G показаны клетки H358, которые были выращены на
предметных стеклах, инфицированы Ad-p53 в течение 24 часов, обработаны в течение дополнительных 24 часов с помощью CDDP и зафиксированы для маркировки по месту фрагментов DNA. Даны изображения
родительских клеток H358 (B) без или (C) с CDDP; Ad-Luc-инфицированные клетки (D) без или (E) с CDDP; и Ad-p53-инфицированные клетки (F) без или (G) с CDDP. Размерная стрелка показывает пример
окрашенных в темный цвет фрагментов ядра. Bar = 100 μм.
На фиг. 12A показан эффект воздействия сочетания Ad-p53-инфeкции с обработкой CDDP на сфероиды злокачественной опухолевой клетки
H358. Среды многоклеточной опухоли с клетками H358 были приготовлены по методике, описанной ранее (Takahashi et al., 1989). В нулевой день сфероиды диаметром от 150 до 200 μм были помещены в 24
лунки агаровой накладки, покрывающей пластину, и подвержены воздействию Ad-p53 или Ad-Luc в течение 24 часов. В первый день среда, содержащая 10 μг/мл CDDP была добавлена после удаления
вируссодержащей среды. Во второй день после 24-часового инкубационного периода агаровая накладка была замещена 1 мл свежей среды, свободной от лекарственного средства. Перпендикулярные диаметры были
измерены с использованием Г-образного (инвертированного) микроскопа. Относительное изменение объема было подсчитано по формуле: a2•b/a12•b1, где a и b - наименьший и наибольший диаметры сфероида, а a1 и b1 - диаметры первого дня. Только относительный объем Ad-p53/CDDP сфероидов значительно меньше (p<0,
05, значение, полученное в результате испытания "Student's t-test" (студенческого t-испытания), чем у контрольной группы (Ctl).
На фиг. 12B, 12C, 12D, 12E показано маркирование по
месту dUTP с TdT-определением апоптоза. Сфероиды H358 были зафиксированы на третий день и окрашены по методике, описанной в материалах и способах примера 7. Контрольный необработанный сфероид (B);
сфероид (C), обработанный CDDP; сфероид (D), инфицированный Ad-p53, и сфероид (E), инфицированный Ad-p53 и обработанный CDDP. Bar = 100 μм.
На фиг. 13A показана схема апоптоза с
помощью CDDP после инфицирования in vivo посредством Ad-p53 по результатам измерений изменений, возникающих в объемах меняющейся опухоли. Клетки H358 (5•106) в 0,1 мл
сбалансированного солевого раствора Hank были введены подкожно в правый блок BALB/c - женских особей nu/nu мышей. Через тридцать дней 200 самой среды, содержащей Ad-Luc (108 PFV/мл) или
Ad-p53 (108 PFV/мл), было введено внутрь опухоли диаметром от 5 до 6 мм. Были выполнены внутриопухолевая инъекция (100 μл) и околоопухолевая инъекция в двух противоположных областях
( 50 μл каждая). CDDP (3 мг/кг) или контрольный физиологический солевой раствор был введен интерперитонеально. Опухоли были измерены по двум перпендикулярным диаметрам без получения информации
о лечебных группах, а объем опухоли был рассчитан путем получения сферической формы со средним диаметром опухоли, рассчитанным как корень квадратный произведения диаметров поперечных сечений. Было
использовано по пять мышей для каждой лечебной группы, при этом проявляется значение ±SE. Данные были проанализированы с использованием Student's t-test. Стрелка указывает на день лечения. Даны
независимые показания p<0,05 в пятый день опыта 1; p<0,05 в седьмой день опыта 2 (B-E).
На фиг. 13B, 13C, 13D, 13E показаны гистологические исследования, использующие биотин-dUTP-технологию маркирования с TdT-промежуточным звеном. Опухоли были проанализированы через пять дней после начала лечения и сразу же помещены в О. С.Т. (подготовлен гистологический материал. Замороженные ткани были иссечены в криостате толщиной 5). Иссечения были обработаны 1 μг/мл протеиназы и окрашены по методике, описанной в комментариях к фиг. 12. Представлены изображения опухоли H358, обработанные: (B) только CDDP; (C) только Ad-p53; (D, E) Ad-p53 в сочетании с CDDP. Bars = 5 мм. Животные содержались с соблюдением требований UT MD (UT MD Anderson Institutional Animal Care and Use Committee) - организации, осуществляющей надзор за содержанием и уходом за животными.
Детальное описание предпочтительных вариантов осуществления изобретения
A.
Явления, происходящие на молекулярном уровне при развитии рака легких.
Исследования, проведенные авторами настоящего изобретения, идентифицировали принципиально важные явления на молекулярном уровне, ведущие к появлению и прогрессированию рака. Это дало возможность изобретателям разработать новые методы восстановления известных нормальных функций протеина до такой степени, когда фенотип, вызывающий раковые новообразования, может быть подавлен in vivo.
Наиболее распространенные гистологии рака легких (80%) объединены под названием "рак легких с вовлечением значительного количества клеток (NSCLC)" и включают сквамозный рак, аденокарциному и неидентифицированную форму рака с обширным вовлечением пораженных клеток. Накоплен большой банк данных, касающихся молекулярной биологии рака легких, которые основаны на изучении не так часто встречающейся формы рака легких с вовлечением небольшого числа клеток (SCLC). SCLC может быть отличен от NSCLC по нейроэндокринным признакам клеток; SCLC очень чувствителен к химиотерапии, но быстро возобновляется после прохождения пациентом курса лечения. NSCLC также может служить моделью для других форм эпителиального рака, вызванного канцерогенными веществами. Научные достижения, полученные в результате создания настоящего изобретения, могут быть использованы для лечения других форм эпителиального рака.
Накоплен богатый опыт, подтверждающий тот факт, что процессу злокачественных трансформаций предшествует генетическая парадигма. Основные патологические изменения, происходящие в раковых клетках, касаются доминантных онкогенов и генов-супрессоров новообразований. Доминантные онкогены имеют альтернативы в классе генов, названные протоонкогенами, которые участвуют в принципиально важных функциях нормальных клеток, включая сигнальную трансдукцию и транскрипцию. Первостепенной важности модификации в доминантных онкогенах, которые обеспечивают возможность трансформации, включают точечные мутации, трансформации, реклассификации и амплификации (расширения, усиления). Гены-супрессоры новообразований необходимы для осуществления гомозигозной утраты функций за счет мутации и удаления или комбинирования последних, с целью получения трансформаций. Некоторые гены-супрессоры новообразований предназначены для осуществления процессов управления разрастанием клеток путем регулирования трансплантации. Модификация экспрессий доминантных онкогенов и генов-супрессоров, по всей вероятности, влияет на определенные характеристики клеток, которые способствуют возникновению злокачественного фенотипа.
Несмотря на увеличение накопленных знаний о механизмах, происходящих в процессе трансформаций, испытывающих опосредствованное влияние онкогенов, недостаточное развитие получили терапевтические методы лечения, действие которых должно быть направлено специально на онкогены и их продукты, служащие мишенью для воздействия на них при лечебном процессе. Первоначально исследования в этой области были сосредоточены на доминантных онкогенах, поскольку они первыми требовали описания. Исследования процесса переноса DNA - промежуточного гена продемонстрировали механизм приобретения злокачественного фенотипа нормальными клетками, в результате переноса DNA от злокачественных опухолей человека.
B. p53 и мутанты p53 в раковых новообразованиях.
p53 известен как ген-супрессор опухолевых новообразований (Montenarh, 1992). Высокие уровни его были обнаружены во многих клетках, трансформированных химическим онкогенезом, ультрафиолетовой радиацией и различными вирусами, включающими SV40. Ген p53 представляет собой часто встречающуюся мишень мутирующей инактивации в большом разнообразии опухолевых новообразований человека, и уже документально подтверждено, что он является наиболее часто встречающимся мутированным геном в традиционных раковых новообразованиях (Mercer, 1992). Он мутируется более чем в 50% рака легких с довольно обширным вовлечением клеток (NSCLC) (Hollestein et al., 1991) и в большом количестве других новообразований.
Ген p53 кодирует фосфопротеин аминовой кислоты - 375, который может формировать комплексы с протеинами-хозяевами, например обширный T-антиген и E1B. Протеин обнаружен в нормальных клетках и тканях, но в концентрациях, которые незначительны, в сравнении с трансформированными клетками или тканями опухолевых новообразований. Интересен тот факт, что природный p53, как было установлено, играет важную роль в процессе регулирования роста клеток и их делении. Чрезмерная экспрессия природного p53, как выяснилось, в некоторых случаях подавляет пролифератию в клеточных линиях опухолевых новообразований человека. Так, p53 может действовать как негативный регулятор клеточного роста (Weinberg, 1991) и может непосредственно подавлять бесконтрольный рост клеток или выполнять эту функцию опосредованно, активизируя гены, которые подавляют этот рост. Отсутствие природного p53 или лишение его активности может способствовать возникновению процесса трансформации.
Однако некоторые исследования указывают на то, что присутствие мутантного гена p53 может оказаться необходимым для полной экспрессии трансформирующего потенциала гена. Хотя признано, что природный ген p53 является чрезвычайно важным регулятором роста для многих типов клеток, играют роль также его генетические и биохимические признаки. Мис-сенс мутации являются обычными для гена p53 и существенными для трансформирующей способности онкогена. Единственное генетическое изменение, подсказанное точечными мутациями, может создать концерогенный p53. Однако известно, что, в отличие от других онкогенов, точечные мутации p53 встречаются, по крайней мере, в 30 отдельных кодонах, часто создавая доминантные аллельные гены, которые способствуют образованию смещений в фенотипе клетки без репозиции до гемозиготы. Кроме того, многие из этих доминантных негативных аллельных генов иногда переносятся в организме и передаются в линию зарождения инфекции. Различные мутантные аллельные гены могут переходить из минимально дисфункционального состояния в состояние чрезвычайно проникающих, доминантных негативных аллельных генов (Weinberg, 1991).
Casey и его коллеги показали, что трансформация DNA, кодирующая природный p53 в двух клеточных линиях рака груди человека, восстанавливает функцию управления подавлением роста в таких клетках (Casey et al., 1991). Подобный эффект был также продемонстрирован на трансфекции природного, но не мутантного, p53 в клеточных линиях рака легких человека (Takahasi et al., 1992). P53 проявляет доминантные признаки по сравнению с мутантным геном и может произвести отбор против пролифератии после трансфекции в клетке с мутантными генами. Нормальная экспрессия подверженного трансфекции гена p53 не воздействует на рост клеток с эндогенным p53. Таким образом, такие структуры могут восприниматься нормальными клетками без побочных эффектов.
Исходя из изложенного, можно заключить о возникновении возможности лечения рака, имеющего отношение к p53, природным p53 путем уменьшения количества раковых клеток. Однако исследования, приведенные выше, далеки от практического применения, хотя бы потому, что трансфекция DNA не может быть использована для внедрения DNA в раковые клетки в организме больного.
C. Методы генной терапии
Разработано несколько экспериментальных методов применения генной терапии, но они все имеют значительные
недостатки (Mulligan, 1993). Как указывалось выше, существует целый ряд основных методов трансфекции, в которых DNA, содержащая интересующий нас ген, вводится в клетки не биологическим путем, а,
например, путем физического или химического проникновения через клеточную оболочку. Естественно, такие методы ограничены клетками, которые могут быть временно извлечены из организма и в состоянии
перенести цитотоксичность лечения, т.е. лимфоциты. Липосомы, или протеиновые конъюгаты, образованные определенными липидами, амфофильными пептидами, могут быть использованы для трансфекции, но
эффективность интегрирования гена остается все еще низкой, порядка одного случая интеграции на 1000 - 1000000 клеток, а экспрессия зараженного гена часто ограничивается днями в разрастающихся клетках
и неделями в неразрастающихся клетках. Поэтому совершенно очевидно, что метод трансфекции не может считаться подходящим для лечения рака.
Второй метод основывается на естественной способности вирусов проникать в клетки, внедряя в них свой собственный генетический материал. Ретровирусы имеют преимущество в качестве векторов для переноса генов, благодаря своей способности внедрять свои гены в геном-хозяин, перенося большое количество чужеродного генетического материала, инфицируя широкий спектр специфических групп клеток, которые выстраиваются в специфические клеточные линии. Однако существуют три основные проблемы, препятствующие практическому использованию ретровирусных векторов. Первое - ретровирусное инфицирование зависит от доступности вирусных рецепторов на поверхности мишени. Второе - ретровирусы эффективно интегрируют только в репликационные клетки. Наконец, последнее - ретровирусы трудно сконцентрировать и обеззаразить.
D.
Аденовирусные структуры, предназначенные для использования в генной терапии
Аденовирусы человека - это опухолевые вирусы двунитевой DNA с размерами генома около 36 kb (TOOZA, 1981).
Аденовирусы были широко изучены и описаны в качестве модельной системы для эквариотической генной экспрессии, что заставляет воспринимать их как привлекательную систему для использования аденовирусов
в качестве системы для переноса генов. Такую группу вирусов легко выращивать и использовать, при этом они проявляют широкий круг хозяев in vitro и in vivo. В литически инфицированных клетках
аденовирусы способны отсечь синтез протеина - хозяина, направляя клеточные механизмы на синтез большого количества вирусных протеинов и получение обильного количества вирусов.
Зона E1 генома включает E1A и E1B, которые кодируют протеины, ответственные за регулирование транскрипции вирусного генома и некоторых клеточных генов. Экспрессия E2, включающая E2A и E2B, обеспечивает синтез вирусных репликационных функций, например DNA-связанного протеина, DNA-полимеразы и окончательного протеина, что создает почву для репликации. Продукты гена E3 предупреждают цитолиз, вызываемый цитотоксичными T-клетками, и фактор некроза опухоли и играют важную роль для вирусного воспроизведения. Функции, ассоциированные с протеинами E4, включают репликацию DNA, экспрессию последнего гена и отсечение клетки-хозяина. Продукты последнего гена включают большинство протеинов капсида вириона, при этом они проявляются только после того, как большая часть производства единственного главного транскрипта из основного последнего промотора будет выполнена. Последний основной промотор (MLP) проявляет высокую эффективность в процессе последней фазы инициирования (Stradford Perricaudet and Perricaudet, 1991a).
Поскольку только небольшая часть вирусного генома требуется in cis (Tooza, 1981), аденовирусопроизводные векторы предлагают отличный потенциал для замещения обширных фрагментов DNA при использовании связи с такими клеточными линиями, как для клеток 293. Ad5-трансформированная клеточная линия мезонефроса (первичной почки) (Graham et al., 1977) была создана для обеспечения основных вирусных протеинов in trans. Изобретатели, таким образом, показали, что данные характеристики аденовирусов продемонстрировали хорошие предпосылки для их использования, с целью прицельного попадания в раковые клетки in vitro (Grunhaus & Horwitz, 1992).
Особые преимущества аденовирусной системы для переноса инородных протеинов в клетку включают:
(i) способность к замещению относительно больших фрагментов вирусной DNA с помощью чужеродной DNA;
(ii) структурную стабильность аденовирусов-рекомбинантов;
(iii) безопасность
аденовирусного назначения для человека;
(iv) отсутствие каких бы то ни было известных ассоциаций аденовирусной инфекции с раком или злокачественными образованиями;
(v) способность к
получению высоких титров при использовании вируса рекомбинанта при лечении;
(vi) высокую эффективность аденовируса.
Еще одним преимуществом аденовирусных векторов, по сравнению с ретровирусами, являются высокие уровни экспрессии гена. Кроме того, репликация аденовируса не зависит от репликации гена-хозяина, что выгодно отличает его применение от применения ретровируса. Поскольку аденовирусные трансформирующие гены в зоне E1 могут быть свободно удалены и при этом обеспечивать существование векторов эффективной экспрессии, существует мнение, что онкогенный риск от аденовирусных векторов сводится к минимуму и не принимается в расчет (Grunhaus & Horwitz, 1992).
В основном, аденовирусные системы переноса генов основываются на рекомбинантном сконструированном аденовирусе, который представляет собой репликацию, не укомплектованную за счет отсутствия части ее генома, например E1, но при этом сохраняющую еще способность к инфицированию. Относительно большое количество чужеродных протеинов может быть проявлено, если в аденовирусном геноме осуществить дополнительные удаления. Например, аденовирусы, не укомплектованные в обеих зонах E1 и E3, способны переносить до 10 kb чужеродной DNA и могут быть выращены до высоких титров в клетках 293 (Strattford - Perricaudet & Perricaudet, 1991a). Кроме того, была отмечена также удивительно продолжительная экспрессия трансгенов, сопровождающая аденовирусное инфицирование.
Способ переноса гена с помощью аденовируса недавно был изучен в качестве средства переноса гена-посредника в эвкариотические клетки живых организмов. Например, при лечении мышей с редким рецессивным генетическим расстройством - орнитозным транскабамилаза-дефицитом (Ornithine transcarbumylase (OTC) - было обнаружено, что аденовирусные структуры могут быть использованы для снабжения нормальными (OTC)-энзимами. К сожалению, экспрессия нормальных уровней (OTC) была достигнута только в 4-х из 17-и примерах (Strattford - Perricaudet et al., 1991b). Поэтому дефект был только частично исправлен у большинства мышей, что не привело ни к физиологическим, ни к фенотипическим изменениям, а значит, такие результаты оставляют мало надежды на возможность использования аденовирусных векторов в терапии рака.
Попытки использовать аденовирус при переносе гена для регулятора трансмембранной проводимости при фиброзно-кистозной дегенерации (CFTR) в легочный эпителий хлопковых крыс также имели только частичный успех без возможности получения биологической активности перенесенных генов в эпителии животных (Resenfeld et al., 1992). И опять-таки эти исследования продемонстрировали перенос гена и экспрессию протеина CFTR в клетках легочных дыхательных путей (воздуховодов), но не подтвердили никакого физиологического эффекта. В 1991 г. научная статья авторов Resenfeld et al. показала легочную экспрессию -α1- антитрипсин - протеина, которая опять-таки не дала физиологического эффекта. Авторы этой статьи пришли к выводу, что уровни экспрессии, которую они наблюдали, составляют всего 2 процента от того уровня, который требуется для защиты легкого человека, т.е. эти уровни намного ниже тех, которые способны дать физиологический эффект.
Ген для человеческого α1-антитрипсина был введен в печень нормальных крыс путем интрапортальной инъекции, где наблюдалась его экспрессия, результатом чего было обнаружение секреции введенного человеческого протеина в плазме этих крыс (Jaffe et al., 1992).
Однако полученные уровни не были достаточно высоки, чтобы оказать какое-либо терапевтическое воздействие.
Итак, данные результаты не подтверждают того, что аденовирус в достаточной степени способен направить экспрессию достаточного протеина в рекомбинантных клетках на получение релевантного физиологического эффекта, и поэтому они не высказывают предположения об использовании потенциальных возможностей аденовирусной системы для лечения рака. Кроме того, в существовавшем до настоящего времени уровне техники бытовало мнение, что p53 не может быть инкорпорирован в упакованную клетку, такую, которую они использовали для получения аденовируса, так как она могла быть токсичной. То, что E1B аденовируса присоединяется к p53, было воспринято как еще одна причина того, что технология аденовируса и p53 не могут сочетаться.
E. Структуры аденовируса p53 и подавление опухолевых новообразований
Настоящее изобретение предлагает генную
терапию рака с новым и более эффективным вектором подавления опухолевых новообразований. Данный рекомбинантный вирус использует преимущества аденовирусных векторов, такие как высокие титры, широкий
диапазон поражения, эффективная трансдукция и неспособность интегрировать в клетки-мишени. В одном из примеров осуществления изобретения получают репликационно-дефектный, не требующий помощника
независимый аденовирус, который способствует проявлению экспрессии природного p53 (Ad5CMV-p53) под управлением человеческого цитомегаловирусного промотора.
Контрольные функции на векторах экспрессии часто обеспечиваются вирусами, когда хотят достичь экспрессии в клетках млекопитающих. Например, обычно используемые промоторы являются производными от полиомы, аденовируса 2 и вакуолизирующего обезьяньего вируса 40 (SV40). Ранние и поздние промоторы вируса SV40 являются особенно часто применяемыми, так как они оба легко получаются из вируса в виде фрагмента, который содержит SV40-вирусный источник репликации. Меньшие или большие SV40-фрагменты могут быть также использованы при условии, что включено приблизительно 250 bp последовательности, простирающейся от участка Hind III по направлению к участку Bg II, сосредоточенному в вирусном источнике репликации. Кроме того, возникает также возможность, и часто желаемая, использования промотора или контрольных последовательностей, нормально ассоциированных с включенной генной последовательностью, при условии, что такие контрольные последовательности совместимы с системами клетки-хозяина.
Источник репликации может быть обеспечен структурой вектора, чтобы включить экзогенный источник, такой, например, который может быть производным от SV40 или других (например, полиомы, адено, VSV, BPV) вирусных источников, или может быть снабжен механизмом хромосомной репликации клетки-хозяина. Если вектор интегрируется в хромосому клетки-хозяина, этого бывает достаточно.
Структура и воспроизведение предпочтительного аденовируса p53 представлены в виде графической схемы на фиг. 1. В связи с этим был разработан улучшенный протокол для воспроизведения и идентификации аденовируса-рекомбинанта (будет описано ниже). После идентификации аденовирус-рекомбинант p53 был структурно подтвержден анализами цепной реакции полимеризации (PCR), как показано на фиг. 2. После изоляции и подтверждения структуры аденовирус p53 был использован для инфицирования клеточной линии H358 рака легких человека, которая имела гомозигозное удаление гена p53. Отпечатки (реплики) Westrn показали, что экзогенный протеин p53 проявил экспрессию на высоком уровне (фиг. 4 и фиг. 5), а пик его экспрессии пришелся на 3-й день после инфицирования (фиг. 6).
Было также показано в клеточной линии H322 точечной мутации p53, что мутант p53 был отрегулирован с понижением уровней экспрессией экзогенного p53. В качестве экспериментального контрольного элемента был использован вирион Ad5/RSV/GL2, который имел структуру, похожую на структуру Ad5CMV-p53. Этот вирус содержал с DNA-люциферазу, произведенную LTR-промотором вируса Rous-саркомы в кассете экспрессии вириона. Ни экспрессии p53, ни изменения в экспрессии актина не было обнаружено в клетках, инфицированных Ad5/RSV/GL2 вириона. Рост клеток H358, инфицированных Ad5CMV-p53, был в большей степени подавлен, по сравнению с неинфицированными клетками, или клетками, инфицированными контрольным вирионом (фиг. 7A). Рост клеток H322 был также в большой степени подавлен вирионом p53 (фиг. 7B), в то время как рост клеток H460 раковых опухолей человека, содержащих природный p53, испытывал меньшее влияние (фиг. 7C).
Ad5CMV-p53 оказал сильное подавляющее воздействие на рост клетки рака легких in vitro. Подавление роста не было столь очевидно, когда клетки были инфицированы Ad5CMV-p53 при MOI (множественности инфицирования) ниже, чем 1 PFU/клетка, а при MOI выше, чем 100 PFU/клетка цитотоксичность наблюдалась даже у контрольного вируса Ad5/RSV/GL2. В наших исследованиях оптимальной дозой для изучения возрастного состава популяции было значение 10 - 50 PFU/клетка. В диапазоне этой дозы подавление роста клетки было показательно для протеина p53 с проявленной экспрессией p53.
Испытания, проведенные на безволосых мышах, продемонстрировали, что способность к образованию опухолей в клетках H358, пролеченных Ad5CMV-p53, была значительно снижена. В экспериментальной модели с мышами ортотопического рака легких человека онкогенные клетки H226Br с точечной мутацией были введены внутритрахеально за три дня до начала лечения вирусом. Внутритрахеальная инстилляция Ad5CMV-p53 предупреждала формирование опухолей в данных модельных системах, предполагающих, что модифицированный аденовирус является эффективным вектором для промежуточного переноса и экспрессии генов супрессоров опухоли на уровне раковых клеток человека и что вирус Ad5CMV-p53 впоследствии может быть усовершенствован до получения терапевтического средства, с целью использования его в генной терапии рака.
Ad5CMV-p53 является посредником при получении высокого уровня экспрессии гена p53 в клетках рака легких человека, что продемонстрировано Western-блотированными анализами. Экзогенный протеин p53 был почти в 14 раз обильнее, чем эндогенный природный p53 в клетках H460, и почти в два - четыре раза обильнее, чем β- активный внутренний контроль в клетках H358. Высокий уровень экспрессии может быть объяснен присутствием: высокоэффективного переносчика гена, сильного промотора цитомегаловируса (CMV), приводящего в движение p53-CDNA, и аденовирусного E1-усилителя, активизирующего транскрипцию CDNA-p53. Продолжительность экспрессии p53 после инфицирования составила более 15 дней в клетках H358. Однако наблюдалось быстрое затухание экспрессии по истечении 5 дней после инфицирования. Анализы цепной реакции полимеризации на образцах DNA на инфицированных клетках H358 показали снижение уровня вирусной DNA с уменьшенным уровнем протеина, указывающим на потерю вирусной DNA в процессе непрерывного роста раковых клеток in vitro.
Понижение экспрессии p53 также может явиться результатом клеточной аттенуации промотора цитомегаловируса, который контролирует степень экспрессии p53, поскольку явление отсечения промотора цитомегаловируса - промежуточной клетки-хозяина уже известно (Dai et al., 1992). Аденовирусные векторы представляют собой неинтегрированные векторы-переносчики генов, и поэтому длительность экспрессии гена зависит от целого ряда факторов, включающих клетки-хозяева, перенесенные гены и соответствующие промоторы. Кристалл и соисполнители показывали низкий уровень экспрессии гена-регулятора трансмембранной проводимости в фиброзно-кистозных дегенерациях в клетках эпителия хлопковой крысы, что обнаруживало себя через 6 недель после инфицирования (Rosenfeld et al., 1992). Лаборатория Perricaudet продемонстрировала минимальную экспрессию гена-минидистрофина в mdx мышце мыши, которая длилась более трех месяцев после инфицирования. Скоротечные экспрессии высокого уровня природного протеина p53, наблюдавшиеся в настоящем исследовании, могут иметь обнадеживающие результаты, вызывающие снижение возможных побочных влияний на нормальные клетки, сопровождающие in vivo лечение с помощью Ad5CMV-p53.
Раскрытые в данном описании результаты указывают на то, что аденовирус-рекомбинант p53 обладает свойствами подавления опухолей, при этом он осуществляет эти действия за счет восстановления функции протеина p53 в раковых клетках. Эти результаты дают возможность заявить об использовании вириона Ad5CMV-p53 в качестве терапевтического средства для лечения рака.
F. Поражающие DNA агенты
В связи с настоящим изобретением может быть использовано широкое многообразие поражающих DNA агентов, например агентов, которые структурируют
DNA (образуют поперечные связи), агенты, которые внедряются в DNA, и агенты, которые ведут к хромосомным имитотическим искажениям путем создания условий для синтеза нуклеиновой кислоты.
Агенты, которые непосредственно структурируют (образуя поперечные связи) нуклеиновые кислоты, в частности DNA, предназначены в данной ситуации для поражения DNA, что ведет к образованию синергического антибластомного (противоопухолевого) соединения. Могут быть использованы цисплатин и другие алкилирующие DNA агенты. Цисплатин широко используется для лечения рака. Эффективные дозы использовались в клинических назначениях 20 мг/м2 в течение каждых трех недель для проведения полного курса лечения, состоящего из трех циклов. Цисплатин не усваивается орально, поэтому должен вводиться внутривенно, подкожно, непосредственно в опухолевую ткань или интерперитонеально.
Агенты, которые поражают DNA, также включают компоненты, которые интерферируют с DNA-репликацией, митозисом и хромосомной сегрегацией. Примерами таких соединений могут служить адриамицин, известный также под названием дексорубицина, этопозид, верапамил, подофиллотоксин и т.п. Нашедшие широкое применение в клинических назначениях для лечения злокачественных новообразований, эти соединения вводятся с помощью инъекции ударной дозы вещества внутривенно с использованием доз 25 - 75 мг/м2 с интервалами на 21 день для адриамицина, до 35-50 мг/м2 для этопозида внутривенно или удвоенную внутривенную дозу - орально.
Агенты, которые разрушают синтез и точность предшественников нуклеиновых кислот и подгруппы, также ведут к разрушению DNA. Был получен целый ряд предшественников нуклеиновой кислоты. В частности, заслуживают внимания агенты, которые были подвержены экстенсивному тестированию и которые вполне поддаются оценке. В частности, полезными могут оказаться такие агенты, как 5-флуороурацил (5-FU), которые предпочтительно используются неопластическими тканями, что делает этого агента особенно полезным при переносе клетки опухолевых новообразований. Несмотря на чрезвычайную токсичность, 5-FU, может быть использован для широкого диапазона "проводников" (переносчиков), включая локальных; обычно используется внутривенное введение доз от 3 до 15 мг/кг/день.
Существуют другие факторы, вызывающие
поражение DNA, которые широко используются и которые хорошо известны как γ- лучи, X-лучи и/или управляемая доставка радиоизотопов в клетки опухоли. Могут применяться другие виды поражающих DNA
факторов, например микроволновое и ультрафиолетовое излучение. Наиболее вероятно предположить, что все эти
факторы оказывают обширное поражающее воздействие на большой круг предвестников DNA,
на репликацию, репарацию DNA, а также на объединение и поддержание жизнеспособности хромосомы. Дозировка уровней для X-лучей рассчитывалась от дневных доз величиной от 50 до 200 рентген в течение
продолжительного периода времени (от трех до четырех недель) до одной единственной дозы величиной от 2000 до 6000 рентген. Дозировка для радиоизотопов изменяется в очень широких пределах и зависит от
половинного срока жизни изотопа, силы и типа излучаемой радиации, а также от степени поглощаемости клетками со злокачественным новообразованием.
См. "Remington's Pharmaceutical Sciences", 15-е издание, глава 33, стр. 624-652. Допускаются некоторые варианты в дозировке, в зависимости от условий, связанных с особенностями пациентов. Лицо, ответственное за введение лекарства, в любом случае индивидуально определяет соответствующую дозу для отдельного больного. Кроме того, лекарство, предназначенное для приема больным, должно быть стерильным, защищенным от пирогенности, отвечать требованиям безопасности и обеззаражено в соответствии с требованиями стандартов FDA Office of Biologics.
G. Лечение с применением p53 и цисплатина
Для определения
эффективности комбинированных терапевтических методов, включающих перемещение гена и воздействие химиотерапевтических средств для лечения рака человека, изобретатели исследовали вопрос, может ли
возбудить апоптоз in vivo непрерывное ведение Ad-p53 и CDDP. В последующие три дня после прямого внутриопухолевого введения Ad-p53 или интерперитонеального введения CDDP опухолевые клетки H358,
имплантированные подкожно в организм nu/nu (безволосых мышей), показали действительно обнадеживающие результаты замедления роста. Если Ad-p53 и CDDP были введены одновременно, опухоли регрессировали
частично, а размер исследуемой опухоли оставался статистически значительно меньшим, чем те, которые участвовали в каких-либо других лечебных группах. Рост эффекта поглощения становился еще более
ощутимым после двух циклов лечения (фиг. 13A). Гистологические исследования обнаруживали массированное разрушение раковых клеток в той зоне, куда был введен Ad-p53 в организме мыши, подверженной
лечению CDDP. Окрашивание по месту продемонстрировало большое количество умерщвленных клеток вокруг межклеточных пространств (фиг. 13B-E). По контрасту, опухоли, обработанные только CDDP или только
Ad-p53, не показали ни зон насыщенности, ни зон апоптоза.
Настоящее изобретение демонстрирует новое направление в генной терапии человека в сочетании с традиционной химиотерапией, использующей структурирующий DNA агент. Сопротивляемость опухолевой клетки химиотерапевтическим лекарственным средствам составляет основную проблему клинической онкологии. Разновидность рака NSCLC составляет, по крайней мере, 80% случаев рака легких; пациенты с NSCLC, однако, в основном, невосприимчивы к химиотерапевтическим лекарственным средствам (Doyle, 1993). Одной из задач современных исследований в области онкологии является поиск путей улучшения методик терапевтического лечения рака, в основе которых лежит принцип перемещения гена, в результате изучения механизмов взаимодействия между генным продуктом и химиотерапевтическим лекарственным средством. Ген герпес-симплекс-тимидин-киназа (HS-tK), будучи перенесенным ретровирусной векторной системой в ткань опухоли мозга, успешно проявил чувствительность к антивирусному агенту gancilclovir (Culver et al., 1992). Продукт гена HS-tK представляет собой экзогенный вирусный энзим, и поскольку экспрессия протеина wt-p53 проявляется в нормальных тканях, возникает предположение, что модуляция устойчивости к воздействию химиотерапевтических средств, вызванная альтерацией в экспрессии wt-p53, возможно явится альтернативным подходом, использующим путь, который опосредствованно определен эндогенной генетической программой.
Аденовирусная система имеет потенциальные преимущества при перемещении гена in vivo, например легкость получения высокого значения титра вируса, высокая степень инфекционной активности и невосприимчивость для многих типов клеток. Однако стабильность и продолжительность существования экспрессии внедренного гена все еще остаются проблематичными. Рост уровней p53 в клетках, которые отличаются чувствительностью к химиотерапевтическим лекарственным средствам, может наблюдаться в пределах 6 часов после воздействия DNA-поражающих стимуляторов (Fritche et al. , 1993, Zhan et al., 1993), хотя повышенная активность, вызванная действием DNA, может быть возвращена в первоначальное состояние в течение четырех часов, если стимулятор удаляют (Tishler et al., 1993). Отсюда высокий уровень экспрессии p53 может поддерживаться даже после прекращения воздействия на организм лекарственного средства. Обеспечение экспрессии протеина wt-p53 с помощью Ad-p53 достигает кульминации на третий день после инфицирования (14 - складкой больше, чем эндогенный "дикого типа") и снижается до низкого уровня к девятому дню (Zhang et al. , 1993). Это наводит на мысль, что переменно высокого уровня экспрессии wt-p53 достаточно, чтобы инициировать цитотоксическую программу в раковой клетке.
H. Пациенты и протоколы лечения (истории болезней)
Изобретатели предполагают, что региональная доставка аденовирусных p53 генных структур, например неоперабельной закупоривающей
эндобронхиальной формы рака, окажется эффективным способом доставки терапевтически эффективного гена, способного противостоять клинике заболевания. Переносчик гена p53 должен действовать в сочетании с
агентами или факторами, которые ведут к разрушению DNA. Этот объединенный подход представляет собой значительное улучшение в современной терапии рака, например, изменяется отношение к цисплатину,
который в существующих методиках один направляет усилия на умерщвление или удаление последней раковой клетки с помощью эффективного разрушения DNA. Но поскольку "спячка" опухолевой клетки является
установленным фактом, это делает возможность такого умерщвления в высшей степени маловероятным.
Существует мнение, что поглощение аденовирусных структур клетками NSCL должно снизить степень разрастания этих клеток, однако существующие образцы показывают, что объединенное использование поражающих DNA агентов или факторов совместно с аденовирусом ведет к глубокому подавлению роста клетки и размеров опухоли, чего не обнаруживает ни один из компонентов в отдельности. Композиции и способы, раскрытые в данном описании, в большой степени предопределяют повышение на протяжении времени вероятности того, что больное легкое может оставаться в расширенном состоянии, предотвращая возобновление роста и деление клеток опухоли, что может продлить жизнь больного.
Больные с рецидивом неоперабельной эндобронхиальной опухоли, которая частично или полностью закрывает дыхательные пути и которая безуспешно подвергалась или не может быть подвергнута наружной радиотерапии, были выбраны для протокола лечения предлагаемым комбинированным способом. Существующие терапевтические способы лечения в таких условиях предлагают только кратковременное облегчение. Большинство пациентов получили рецидивы, несмотря на наружную лучевую радиотерапию. Существует возможность введения брахитерапевтического катетера и назначения дополнительной радиотерапии, внутривенного введения поражающих DNA агентов. Больные, получившие такое лечение, могли прожить, в среднем, 6 месяцев. Больные, для которых брахитерапевтическое лечение оказалось неэффективным, также были отобраны для получения генной терапии. Опухоль может быть удалена из дыхательных проходов с помощью лазера или биопсийных щипцов. Это может быть выполнено в сочетании с вводом аденовирусных структур, уменьшая таким образом объем, который должен быть введен. Назначение вирусных структур не должно препятствовать назначению пациентам других паллиативных средств, если опухоль прогрессирует.
I. Другие средства переноса гена
Успешное применение генной терапии зависит, в основном, от интеграции гена, способного корректировать генетические нарушения в
геноме-хозяине, где он мог бы сосуществовать и воспроизводиться в DNA-хозяине, а также проявлять свою экспрессию на уровне, способном компенсировать недостающие компоненты дефектного гена. Идеально,
болезнь должна бы излечиваться после проведения одного или нескольких курсов лечения без серьезных побочных явлений. На настоящий момент было разработано и предложено несколько подходов генной терапии,
которые могут быть применены с использованием настоящего изобретения.
Первый подход заключается в трансфекции DNA, содержащей нужный ген, в клетки, например, путем проникновения через клеточную мембрану химическим или физическим путем. Этот подход применим, в основном, по отношению к клеткам, которые могут быть временно удалены из организма и которые в состоянии выносить цитотоксичность лечения (а именно, лимфоциты). Липосомы, или протеиновые конъюгаты, образованные определенными липидами и амфофильными пептидами, могут быть использованы для трансфекции in vivo (Stewart et al., 1992; Torchilin et al., 1992; Zhu et al., 1993), однако действительная эффективность интеграции гена очень низка. Установлено, что нужный ген интегрирует в геном только одной клетки в 1,000 до 100,000. При отсутствии интеграции экспрессия привнесенного гена ограничивается несколькими днями в разрастающихся клетках или несколькими неделями в неразрастающихся клетках, из-за неинтегрированных DNA.
Второй подход основан на природной способности вирусов проникать в клетки, привнося в них свой собственный генетический материал.
Ретровирусы проявили себя в качестве векторов, переносящих гены, благодаря их способности интегрировать свои гены в геном-хозяин, перенося большое количество чужеродного генетического материала и инфицируя широкий спектр видов и типов клеток, образующих специфические клеточные линии (Miller, 1992).
В основе третьего метода лежит использование других вирусов, таких, например, как аденовирусы, герпес-симплекс-вирусы (HSV), вирус цитомегалии (CMV) и аденоассоцированный вирус (AAV), которые разработаны для выполнения роли векторов, переносящих гены. Хотя некоторые вирусы, способные воспринимать чужеродный генетический материал, ограничены в числе нуклеотидов, они могут аккомодировать, и в границах клеток, которые они инфицируют, на данных вирусах был успешно продемонстрирован эффект экспрессии гена. Однако аденовирусы не интегрируют свой генетический материал в геном-хозяин и поэтому не требуют репликации хозяина для возникновения экспрессии гена, что делает их идеально подходящими для возбуждения быстрой и эффективной гетерогенной экспрессии гена.
Хотя изобретение было описано с определенной степенью частных проявлений, совершенно очевидно, что многие альтернативные решения, модификации и варианты могут возникать у специалистов при изучении данного описания, раскрывающего сущность изобретения. Важно, чтобы все эти альтернативные решения, модификации и варианты находились в пределах круга признаков, очерченных пунктами формулы изобретения.
Включены следующие примеры, демонстрирующие предпочтительные варианты осуществления изобретения. Специалисты в данной области должны принять к сведению, что технологические приемы показаны в примерах, которые соответствуют способам, раскрытым изобретением, чтобы дать представление об их осуществлении в соответствии с изобретением и, таким образом, показать осуществимость изобретения в его предпочтительных вариантах. Однако, исходя из принципов раскрытия данного изобретения, специалисты должны отдавать себе отчет в том, что на практике способы по данному изобретению могут быть осуществлены с использованием эквивалентной замены некоторых признаков с достижением аналогичного результата, оставаясь при этом в рамках сущности изобретения, выраженной в изложении его формулы.
Пример 1. Структура вектора экспрессии p53.
Настоящий пример описывает структуру вектора экспрессии p53. Данный вектор сконструирован и используется для замещения зоны E1 (1,3 - 9,2 m.u.) генома Ad5 аденовирусного штамма и получения структуры аденовирусного вириона, описанного в примере 2.
Кассета экспрессии p53, показанная на фиг. 1, содержащая промотор цитомегаловируса (CMV) человека (Boshart et al., 1985), p53 cDNA и ранний сигнал полиаденилации SV40, была установлена между участками Xba I & ClaI pXCJLI (описано: Dr. Frank L. Graham, Mc Master University, Canada).
Размер генома составляет около 35,4 kb, разделенные на 100 карточных ячеек (1 m.u. (карточная ячейка) = 0,35 kb). Кассета экспрессии p53 заместила зону E1 (1,3 - 9,2 m.u.) генома Ad5.
Первичный элемент 1 имеет последовательность 5'-GGCCCACCCCCTTGGCTTC-3' (SEQ ID N 1) и сосредоточен в первом интроне вниз по движению промотора главного гена 1E цитомегаловируса человека (Boshart et al., 1985). Первичный элемент 2 имеет последовательность 5'-TTGTAACCATTATAAGCTGC-3' (SEQ ID N 2) и сосредоточен в раннем сигнале полиаденилации SV40. Оба первичных элемента, 15-20 bp от включения cDNA p53 на обоих концах определяют продукт цепной реакции пролимеризации 1,40 kb. Первичный элемент 3 имеет последовательность 5'-TCGTTTCTCAGCAGCTGTTG-3' (SEQ ID N 3) и первичный элемент 4 имеет последовательность 5'-CATCTGAACTCAAAGCGTGG-3 (SEQ ID N 4) и расположены в 11 m.u. и 13,4 m. u. генома Ad5, соответственно, которые определяют продукт 0,86 kb-вирусно-геном-специфической цепной реакции полимеризации.
Пример 2. Образование и воспроизведение аденовируса-рекомбинанта p53.
Данный пример описывает способ, применяемый для образования помощник-независимого рекомбинантного аденовируса, проявляющего экспрессию p53. Молекулярный алгоритм, примененный для получения аденовируса-рекомбинанта, основан на том факте, что, благодаря лимиту упаковки (дозировки) аденовируса, pJM17 не может формировать вирус самостоятельно. Поэтому гомологические рекомбинации между векторным плазмидом экспрессии p53 и pJM17 в инфицированной клетке позволит получить результат в виде жизнеспособного вируса, который может быть упакован только в клетках, в которых созданы условия для экспрессии протеинов. В данном примере клетки 293 используются в качестве клеток-хозяев для воспроизведения вирусов, которые содержат замещения кассет экспрессии гетерологической DNA в зонах E1 и E3. Этот процесс требует котрансфекции DNA в клетках 293. Трансфекция широко определяет эффективность вирусного воспроизведения.
Способ, использованный для трансфекции DNA в клетках 293 до создания настоящего изобретения, обычно включал использование фосфата кальция/копреципитации DNA (Graham & van der Eb, 1973). Однако этот способ совместно с розеткообразованием относительно трудно осуществим и обычно заканчивается малой эффективностью воспроизведения вирусов. Как показано на этом примере, трансфекция и последующая идентификация инфицированных клеток были значительно усовершенствованы, благодаря использованию способа трансфекции с промежуточным перемещающим звеном липосомы, при идентификации зараженных клеток с помощью цитопатогенного эффекта (CPE).
Клеточные линии 293 выдерживались в несколько измененной питательной среде Dulbecco с 10% инактивированной с помощью нагревания лошадиной сывороткой. Вектор экспрессии p53 и плазмид pJM17 (Mc Grory et al., 1988) для гемологической рекомбинации были подвергнуты котрансфекции в клетках 293 с помощью метода трансфекции с промежуточным звеном DOTAP, согласно протоколу исполнения (Boehringer Mannheim Biochemicals, 1992). Схематически это изображено на фиг. 1.
Клетки 293 (проход 30, 60% - пересечение) были заражены за 24 часа до трансфекции или в 60-миллиметровых чашках, или в 24-луночных чашках Петри, Клетки в каждой лунке были подвержены трансфекции с помощью 30 μл DOTAP. 2 μг вектора экспрессии p53 и 3 μг плазмида pJM17. После трансфекции клетки получали питание в виде среды MEM каждые 2-3 дня до тех пор, пока не появлялся цитопатогенный эффект.
Пример 3. Подтверждение идентичности аденовируса-рекомбинанта.
Данный пример иллюстрирует новый способ исследования цепной реакции полимеризации (PCR) для подтверждения идентичности рекомбинантных вирионов, сопровождающих процесс котрансфекции соответствующей клеточной линии.
Слои надосадочной жидкости клеточной культуры (от 50 до 370 μл ) были собраны из участвовавших в исследованиях чашек Петри, обработаны протеиназой K ( 50 μг/μл с 0,5% SDS и 20 mM EDTA) при 56oC в течение 1 часа с помощью фенолхлороформа, а нуклеиновые кислоты были выведены в осадок с помощью этанола. Осадок DNA был повторно суспендирован в 20 μл dH2O и использован в качестве матрицы для усиления цепной реакции полимеризации (PCR). Относительные локализации первичных элементов цепной реакции полимеризации (PCR) и их последовательности показаны на фиг. 1 и обозначены: SEQ ID N 1, 2, 3 и 4, соответственно. Первичные элементы специфических включений DNA определяют продукт 1,4 kb цепной реакции полимеризации (PCR), а вирусные геном-специфические первичные элементы определяют продукт 0,86 kb цепной реакции полимеризации (PCR). Цепные реакции полимеризации проводились в объеме 50 μл, содержащем 4 mM MgCl2, 50 mM KCl, 1,1% тритона X-100, 200 μM каждой из dNTP, 10 mM Tris-CI (pH 9,0), 2 μM каждого первичного элемента и 1,0 единица Tag-полимеразы (Promega). Реакции проводились при 94oC в течение 0,5 мин, 56oC в течение 0,5 мин., 72oC в течение 1 мин на протяжении 30 циклов.
Чтобы упростить процесс идентификации вновь воспроизведенного рекомбинантного вируса, был разработан способ осуществления непосредственно цепной реакции полимеризации (PCR) на образцах DNA, взятых из надосадочной жидкости клеточной культуры. Слои (50 или 370 μл ) надосадочной жидкости клеточной среды с цитопатогенным эффектом были обработаны протеиназой K и фенол/хлороформ/экстрактом. После этанолового осаждения образцы DNA были проанализированы с использованием цепной реакции полимеризации (PCR), в которой принимали участие две пары первичных элементов, с целью усиления специфических последовательностей включений и вирусногеном-специфических последовательностей. Мишени первичных элементов цепной реакции полимеризации и их последовательности показаны на фиг. 1. Первичные элементы 1, 2, 3 и 4 представлены с помощью SEQ ID N 1, 2, 3, 4, соответственно.
В результате включение cDNA 1,4 kb и фрагмент вирусного генома 0,86 kb были усилены из вектора экспрессии (положительный результат) и образцов DNA положительной клеточной культуры (фиг. 2B,
полоса 1 и 4, соответственно). Только фрагмент 0,86 kb был усилен из образца DNA вируса Ad5/RSV/GL2 (отрицательный результат, полоса 2). Никаких усиленных полос, пучков волокон не было обнаружено при
цепных реакциях полимеризации (PCR), которые использовали необработанный положительный надосадочный слой клеточной культуры (3-я полоса)
Эти результаты указывают на то, что аденовирусы,
секретированные в клеточной культурной среде, могут быть определены цепной реакцией полимеризации (PCR), используя всего лишь 50 μл надосадочной жидкости среды клеточной культуры для
приготовления матриц DNA. Полученные результаты должны позволить разработать количественный метод при использовании данного способа, с целью определения аденовирусных титров, что обычно получают с
помощью метода розеток.
Природная последовательность cDNA p53 в вирусе Ad5CMV-p53 была подтверждена посредством дидеокси DNA-последовательности на CsCl-gradient - очищенной вирусной DNA. Контрольный вирус Ad5/RSV/GL2, полученный подобным способом, имеет структуру, подобную Ad5CMV-p53, за исключением вирусного промотора Rous-саркомы и cDNA люциферазы, которые были использованы в его кассете экспрессии. Аденовирус-рекомбинант, который несет ген E.coli β- галактозидазы (LacZ), Ad5CMV-LacZ, имеет структуру, подобную Ad5CMV-p53, и был получен на основании исследований Dr. Frank L Graham (см. Graham et al., 1991).
Вирусная биомасса, титр и инфицирование. Индивидуальные клоны Ad5CMV-p53, Ad5/RSV/Gl2 и Ad5CMV-LacZ-вирусов были получены путем обеззараживания бляшек (розеток) по методу Graham & Prevec (1991). Одиночные вирусные клоны были воспроизведены в клетках 293. Культурная среда клеток 293, обнаруживающая законченный цитопатогенный эффект, была собрана и центрифугирована при 1000 • g в течение 10 мин. Собранные надосадочные массы были расслоены и размещены для хранения при температуре -20oC в качестве штамма (биомассы). Вирусные титры были определены в результате реакции розеткообразования (Graham and Prevec, 1991). Инфицирование клеточных линий было произведено путем добавления вирусных растворов (0,5 мл на 60-миллиметровую чашку) к клеточным монослоям и создания условий инкубационного периода при комнатной температуре в течение 30 минут с кратковременными встряхиваниями через каждые 5 минут. Этот процесс сопровождался добавлением культурной среды и возвращением инфицированных клеток в инкубатор при 37oC.
Эффективность передачи гена аденовируса-рекомбинанта также была исследована на примере использования Ad5CMV-LacZ в целом ряде клеточных линий, например H226Br, H322, HeLa, HepG2, LM2 и Vero. С помощью окраски X-геля все клеточные линии были окрашены. 97-100% - в голубой цвет - после инфицирования Ad5CMV-LacZ при MOI 30 PFU/клетка.
Пример 4. Экспрессия гена p53, направляемая Ad5CMV, в клетках рака легкого человека.
Этот пример раскрывает способ использования аденовируса-рекомбинанта p53, с целью инфицирования клеток рака легких человека с помощью гомозигозного удаления гена p53. Результаты показывают, что рост этих клеток и экспрессия мутанта p53 были подавлены, обнаруживая потенциал вириона Ad5CMV-p53, проявляющего признаки агента, способного контролировать состояние метастатических клеток.
Монослои инфицированной клетки были подвергнуты иммуногистохимической обработке, которая заключалась в том, что эти слои были зафиксированы 3,8-процентным формалином и обработаны 3-процентным H2O2 в метаноле в течение 5 минут. Иммуногистохимические анализы были осуществлены с использованием набора Vectastain Elite (Vector, Burlingame, CA). В качестве первичного антитела использовали антитело PAb 1801 anti-p53 (Oncogene Science, Manhasset, N 4); MOPC-21 (Organon Tekhica Corp., West Chester, PA) использовался в качестве отрицательной контрольной группы. В качестве второго антитела использовали avidin-labeled anti-mouse IgG (авидин-меченый антимышиный иммуноглобулин G) (вектор). Biotinylated horseradish peroxidase ABC complex reagent (комплексный ABC реактив блотированной периксидазы хрена) был использован в качестве определителя антиген-антитело-комлекса. Наконец, клетки после обесцвечивания препарата были докрашены Harris-гематоксилином (Sigma) и установлены с помощью уплотняющего материала - Цитосила-60 (Stephens Scientific, Riverdale, NJ).
Иммуногистохимические анализы инфицированных клеточных линий были произведены с целью исследования экспрессии in situ экспрессии p53, возбужденной промотором цитомегаловируса (CMV) вируса Ad5CMV-p53. В клеточной линии H358, которая имела гомозигозное удаление p53, ген p53 был перенесен с эффективностью 97-100%, как показали иммуногистохимические анализы, когда клетки были инфицированы Ad5CMV-p53 при множественности инфицирования - 30-50 розетки-формирующих единиц (PFU/клетка) (фиг. 4).
Высокая эффективность переноса аденовируса-рекомбинанта была подтверждена Ad5CMV-LacZ, вирусом, который несет ген LacZ, трансформированный промотором 1E CMV (цитомегаловируса) человека. При множественности инфицирования человека 30-50 PFU/клетка все клетки подвергались исследованию, включая HeLa, НерG2, LM2, и клеточные линии рака NSCLC человека показали 97-100% позитивный результат для b-галактозидаза-активности, с помощью X-гелевого окрашивания. Эти результаты указывают на то, что аденовирусные векторы представляют собой эффективное средство для доставки гена в раковые клетки человека.
Western-блотирующие анализы были осуществлены на всех клеточных лизатах, приготовленных путем растворения клеток монослоев в чашках, с помощью буферного образца SDS-PAGE (0,5 мл на 60-миллиметровую чашку) после промывания клеток фосфатно-солевым буферным раствором (PBS). Для анализов SDS-PAGE линии были загружены лизатами эквивалентно 5•104 клеткам (10-15 мл). Протеины были перенесены к Hybond TM-ECL-мембране (Amerrsham, Arlington Heights, IL). Мембраны были заблокированы 0,5% сухим молоком в фосфатно-солевом буферном растворе и проведены исследования с помощью первичных антител: мышиного античеловеческого p53 моноклонального антитела PAb 1801 и мышиного античеловеческого - активного моноклонального антитела (Amersham), промыты и исследованы с помощью вторичного антитела, а именно кроличьего антимышиного гамма-глобулина G, связанного пероксидазой хрена (horseradish peroxidase-conjuated rabbit antimouse IgG) (Pierce Chemical Co. Rocliford, lL). Мембраны были разработаны в соответствии с усиленным хемилюминесцентным протоколом. Относительные количества экзогенного p53 с выраженной экспрессией были определены денситомером (Molecular Dynamics Inc., Sunnyvale, CA).
Western-блоты показали, что экзогенный протеин p53 проявил свою экспрессию на высоких уровнях (фиг. 5A, полосы 2, 3 и 5, 6). Пик протеина наблюдался на 3-й день после инфицирования (фиг. 6, внедрения от 0,5 дня до 3-х дней). В качестве контрольного элемента был разработан вирион, структура которого напоминает рекомбинант Ad5CMV-p53 по примеру 1. Вирион содержит cDNA-люциферазу, приведенную в активное состояние промотором LTR вируса Rous-саркомы в кассете экспрессии вириона. Ни экспрессии p53, ни изменения в экспрессии актина не было обнаружено в клетках, инфицированных вирионом Ad5/RSV/GL2.
Аденовирус-рекомбинант был использован для
инфицирования трех линий рака легких NSCLC:
- клеточной линии H358, которая имеет гомозигозное удаление гена p53,
- клеточной линии H322, которая имеет точечную мутацию гена p53 в
кодоне 248 (от G до T), и
- клеточной линии H460, которая имеет природный ген p53.
Степень роста клеток NSCLC человека была определена, исходя из инокуляции H322 и H460 (1•105) или H358 (2•105) в 60-миллиметровых чашках за 24 часа до вирусного инфицирования. Клетки были инфицированы вирусом при множественности инфицирования 10 PFU/клетка. Культурная среда была использована для контроля смоделированной инфекции. Матричные культуры каждой клеточной линии с различными видами обработки подсчитывались ежедневно с 1-го по 6-й день после инфицирования.
Рост клеток H358, инфицированных Ad5CMV-p53, был значительно подавлен, по сравнению с неинфицированными клетками или с клетками, инфицированными контрольным вирионом (фиг. 7A). Рост клеток H322 был также в большой степени подавлен вирионом p53 (фиг. 7B), тогда как клетки H460 рака легких человека, содержащие природный p53, были подвергнуты воздействию в меньшей степени (фиг. 7C). Рост клеток H358, инфицированных вирусом Ad5CMV-p53, был подавлен на 79%, в то время как неинфицированные клетки или клетки, инфицированные контрольным вирусом, подавлены не были. Рост клеточной линии H322, которая имела точечную мутацию, был подавлен на 72% посредством Ad5CMV-p53, тогда как рост клеточной линии H460, содержащей природный p53, был подавлен меньше (подавление роста составило 28%). Результаты указывают на то, что аденовирус-рекомбинант обладает свойствами подавления роста злокачественных новообразований, благодаря восстановлению функций протеина p53 в клетках опухолевых новообразований.
Пример 5. Использование Ad5CMV-p53 при лечении клеток с p53-дефицитом.
Настоящий пример касается использования аденовируса-рекомбинанта p53 при восстановлении функции подавления роста опухолевых клеток in vitro и осуществления таким образом лечения заболеваний, связанных со злокачественным или метастатическим ростом клеток. Он описывает некоторые из способов по данному изобретению, которые предполагается использовать при лечении рака с помощью аденовирусной генной терапии.
Клетки H358 были инфицированы Ad55CMV-p53 и Ad5/RSV/GL2 при множественности инфицирования (m.o.i.) 10 PFU/клетка. Одинаковое количество клеток было обработано средой, смоделированной в качестве инфекции. Через 24 часа после инфицирования обработанные клетки были собраны и дважды промыты фосфатно-солевым буферным раствором (PBS). Для каждого из видов обработки три миллиона (3•106) клеток в объеме 0, 1 мл были подкожно введены каждой из безволосых мышей (Harlan Co. Houston TX). Для каждого из видов обработки было использовано по 5 особей. Мыши были облучены (300 cGy,60Co) перед инъекцией и обследовались еженедельно после инъекции. Опухолевые новообразования были обнаружены в конце шестинедельного периода, а объем опухоли был определен на основе использования модели сферы со средним диаметром опухоли, полученным в виде корня квадратного из величины произведения диаметров поперечного сечения.
Чтобы определить эффект подавления онкогенности с помощью Ad5CMV-p53, безволосые мыши были инфицированы подкожно клетками H358 (клетка рака типа NSCLC человека), чтобы вызвать злокачественные новообразования. Каждая мышь получила одну инъекцию клеток, которые были инфицированы Ad5CMV-p53 или Ad5/RSV/GL2 при 10 PFU/клетка в течение 24 часов. Клетки H358, обработанные только средой, были использованы в качестве контрольных с ложным инфицированием. Опухоли, которые первоначально прощупывались, на 14-й день после инъекции были индуцированы только смоделированными или контрольными вирус-инфицированными клетками, как показано в табл. 1.
Как показано в табл. 1, у мышей, которые получили клетки, обработанные Ad5CMV-p53, опухолевые новообразования не развивались. Опухоли в конце 6-недельного периода имели 4-5 мм в диаметре. Это исследование начиналось с 5-ю особями на группу. Одна мышь в каждой из групп исследований с Ad5CMV-p53 или Ad5/RSV/GL2 не участвовала и не смогла завершить цикл исследований. Ранние смерти наступили, предположительно, от нозокомиальной инфекции.
Пример 6. Ad5CMV-p53 в лечении рака легких.
Настоящий пример касается использования аденовируса рекомбинанта p53 для восстановления функции подавления роста клеток новообразований in vivo и лечения таким образом злокачественных опухолей у животных. На данном примере наблюдаются несколько путей осуществления изобретения, с целью его использования для лечения рака методом генной терапии, использующей аденовирус в качестве промежуточного звена - посредника.
Эффективность Ad5CMV-p53 для подавления онкогенности была повторно доказана на мышиной модели ортотопического рака легких человека. Поскольку клетки H358 и H322 в данной модели не вызывают опухолевых новообразований, в исследовании использовалась клеточная линия H226Br. Эта клеточная линия имела происхождение от сквамозного рака легких и метастазировала от легкого до мозга. H226Br имеет точечную мутацию (от ATC до GTC) в экзоне 7, кодона 254, гена p53 и является онкогенной в организме мыши.
Процедура тестирования в мышиной модели ортотопического рака легких человека ранее уже была описана (Gorges et al., 1993). В двух словах, безволосые мыши были предварительно облучены (300 c Gy 60 Co), после этого привиты внутритрахеальной инсталляцией клеток H226Br. Каждая мышь получила 2• 106 клеток в объеме 0,1 мл PBS (фосфатно-солевого буферного раствора). Через три дня после прививки 10 мышей на группу обрабатывались 0,1 мл вируса или среды-носителя (PBS) путем внутритрахеальной инстилляции 1 раз в день в течение двух дней. Использовалась дозировка вируса Ad5CMV-p53 или Ad5/RSV/GL2 - 5•107 на одну особь. Мыши были умерщвлены в конце 6-недельного периода. Опухолевые новообразования были изучены следующим образом. Ткани легкого и средостения были иссечены и определены размеры опухоли. Новообразования были подтверждены гистологическими анализами иссечения опухолевой массы.
Облученные безволосые мыши были привиты клетками H226Br - 2•106 на одну особь путем внутритрахеальной инстилляции. Через три дня после прививки каждая из мышей (8-10 мышей на группу) прививалась 0,1 мл или Ad5CMV-p5, или Ad5/RSV/GL2, или носителем (PBS) (фосфатно-солевым буферным раствором) путем внутритрахеальной инстилляции один раз в день в течение двух дней. Дозировка вируса составляла 5•107 (PFU)/на мышь. Опухолевые новообразования были исследованы в конце 6-недельного периода путем иссечения тканей легкого и средостения и определены размеры опухолей. Схема процедуры исследования показана на фиг. 7 с представлением образцов иссечения на фиг. 8. Обнаруженные опухоли были подтверждены гистологическими анализами. Данные измерений опухолей представлены в табл. 2.
Только 25% мышей, обработанных Ad5CMV-p53, получили сформировавшиеся опухоли, тогда как в группе мышей, обработанных носителем или Ad5/RSV/GL2 (контрольная группа) опухоли получили 70 - 80% инфицированных мышей. Средний размер опухоли для группы Ad5CMV-p53 был значительно меньше, чем для контрольных групп. Эти результаты указывают на то, что Ad5CMV-p53 может предохранить H226Br от формирования опухолевых новообразований в мышиной модели ортотопического рака легких человека.
Пример 7. Синергизм между p53 поражающим DNA действием.
Биохимической характеристикой запрограммированного умерщвления (апоптоза) является появление характерного изображения фрагментов DNA, полученных в результате дробления ядерной DNA. Последние исследования продемонстрировали, что возникновение апоптоза в результате воздействия химиотерапевтических лекарственных средств и ионизирующей радиации может иметь отношение к статусу гена p53 и к тому факту, что поражающие DNA стимуляторы способны повысить внутриклеточные уровни протеина p53 в клетках, что имеет место в процессе апоптоза (Lowe et al., 1993; Clarke et al., 1993; Fritsche et al., 1993; Harper et al., 1993; El-Deiry et al., 1993). Подавление цикла клетки в фазе G1 за счет роста уровней природного протеина wt-p53 обеспечивает увеличение промежутка времени для DNA-восстановления; если оптимальное восстановление невозможно, p53 может инициировать программу умерщвления клетки. Таким образом, p53 может способствовать возникновению апоптической гибели клетки, вызванной химиотерапевтическими агентами.
Инактивация гена p53 за счет миссенс-мутации или дилеции является наиболее распространенной генетической альтерацией при раковых заболеваниях человека (Levine et al., 1991; Hollstein et al., 1991). Утрата p53 функции явилась результатом усиления устойчивости клетки к воздействию многообразия химиотерапевтических агентов (Lowe et al., 1993). Исследования изобретателей показали, что при NSCLC-разновидности рака легких человека клетки H358, в которых стираются оба аллельных гена p53, были устойчивы к воздействию химиотерапевтических лекарственных средств, тогда как клеточная линия WTH 226b, имеющая эндогенный wt-p53, продемонстрировала апоптическую гибель уже через 16 часов после лечения цисплатином (CDDP) и этопозидом (VP-16) (T.Fujiwara, E. Grimm, T.Mukhopadhyay, J.A.Roth, дата не публикуется). Поэтому изобретатели поставили задачу определить, способно ли введение гена wt-p53 в клетку H358, с помощью аденовирусного вектора, повысить чувствительность клетки к агентам CDDP, образующим поперечные связи с DNA, in vivo и in vitro.
Материалы и способы
Клетки H358 были поставлены A.Gazdar & J.Minna (Takahashi et al., 1989).
Аденовирусные векторы
Структура и способ идентификации вектора
аденовируса-рекомбинанта, содержащего cDNA, кодирующую человеческий wt-p53 (Ad-p53) или люциферазу (Ad-Luc), были описаны ранее (Zhang et al., 1993). Вкратце охарактеризуем способ получения. Кассета
экспрессии p53, содержащая промотор человеческого вируса цитомегалии wt-p53 cDNA и ранний сигнал полиаденилации SV40, была вставлена в промежуток между Xba1 и Cla1 положениями pXCJL1. Челночный вектор
p53 и рекомбинантный плазмид pJM17 были перенесены в клетки 293 (Ad5-трансформированная клеточная линия, взятая из почки человеческого эмбриона) с помощью способа, включающего использование липосомы в
качестве промежуточного звена. Культура надосадочных клеток 293, демонстрирующая полный цитопатический эффект, была собрана и использована в последующем в качестве инфицирующего средства. Контрольный
вирус Ad-Luc был получен таким же способом. Вирусы Ad-p53 и Ad-Luc были внедрены в клетки 293. Присутствие вируса, ответственного за репликацию, было исключено в результате опытов на клетках Hela.
Вирусные титры были определены в результате реакции розеткообразования (Graham et al., 1991).
Обнаружение нуклеосомального разрушения DNA
DNA была изолирована от родительской,
Ad-Luc-инфицированной и Ad-p53-инфицированной клеток, которые подвергались или не подвергались обработке CDDP, путем выдерживания клеток при 55oC в течение 6 часов в лизисном буферном
растворе (50 мМ Триз-HCl, pH 8,0; 100 мМ EDTA, 100 мМ NaCl; 1% SDS и 50 μл/мл протеиназы K). DNA была экстрагирована дважды с одинаковыми объемами фенола и один раз с хлороформным изоамиловым
спиртом (24:1), после чего осаждена в этиноле. Образцы были подвержены обработке электрофорезом на 1,5%-ном геле агарозы, а затем проявлены путем окрашивания бромидом этильного соединения (ethidium
bromide).
Пометка и маркировка dUTP с промежуточным звеном TdT были осуществлены в соответствии с процессом, описанным ранее (Gavrielli et al., 1992). Мономолекулярные клетки были обработаны 0,01% NP-40. Предметные стекла были погружены в буферный раствор TdT (30 мМ Триз-HCl, pH 7,2; 140 мМ кокадилата натрия; 1 мМ хлорида кобальта) и помещены в инкубатор с обработанным dUTP витамином H (биотином) (Boehringer Mannheim, Indianapolis, IN) и TdT при 37oC на 45 минут. Предметные стекла были покрыты 2%-ным бычьим сывороточным альбумином на 10 мин и помещены в инкубатор с авидино-биотиновым комплексом (Vectastain Elite Kit; Vector Laboratories, Burlingame, CA) на 30 минут. Колорометрическое определение было выполнено с использованием диамино-бензидина.
Результаты
Клетки H358 были преобразованы in vitro с помощью cDNA человеческого wt-p53 путем воздействия на них Ad-p53. Анализы Western-блотирования показали высокий уровень
экспрессии протеина wt-p53 сразу через 24 часа после инфицирования Ad-p53. Однако wt-p53 не был обнаружен ни в родительских клетках (необработанных), ни в контрольных клетках, инфицированных Ad-Luc
(данные не показаны). Сопутствующая исследованиям иммуногистологическая экспертиза продемонстрировала обнаруживаемый протеин wt-53 более чем в 80% инфицированных клеток, доказывая, что перенос и
проявление экспрессии p53 с помощью Ad-p53 в высокой степени эффективны (данные не показаны).
Непрерывная обработка клеток H358, инфицированных Ad-p53, с помощью CDDP быстро снижала их жизнеспособность, в то время как гибель значительного количества родительских клеток и клеток, инфицированных Ad-Luc, наступала после 72 часов обработки с помощью CDDP (фиг. 10A). Потеря жизнеспособности очень возрастала в клетках, преобразованных с помощью Ad-p53. Более того, снижение жизнеспособности можно было также наблюдать даже тогда, когда клетки находились в среде, свободной от лекарственных средств, после 24-часового на них воздействия, подтверждая тот факт, что летальное поражающее воздействие продолжалось в течение 24 часов (фиг. 10B). Чувствительность клеток H358, преобразованных wt-p53, к воздействию CDDP зависела от дозировки (фиг. 10C).
Интернуклеосомальная лесенка (по типу спустившейся петли) DNA, указывающая на разрушение DNA, была видна в клетках, обнаруживающих проявление экспрессии wt-p53 после 24 часов воздействия CDDP, однако родительские и Ad-Luc-инфицированные клетки разрушения DNA не показали (фиг. 11A). Концевые метки ника (разрыва одной внутренней фосфодиэфирной связи в двунитевой DNA) биотин-трифосфат (средняя соль ортофосфорной кислоты) (dUTP)-2'-деоксиридина-5' с промежуточным звеном концевой диоксинуклеотидил-трансферазы (TdT), которая (метка) указывает на разрушение DNA in situ в результате апоптоза, выявила много апоптических клеток среди Ad-p53-инфицированных клеток, обработанных CDDP, в течение 24 часов, как показано на фиг. G, которая демонстрирует окрашенные в темный цвет ядра и ядерные фрагменты, что отсутствует на фиг. 11B-F.
Известны способы введения wt-p53 с целью инициирования апоптоза в некоторых видах опухолевых клеточных линий со стертым или мутированным p53 (Yonish-Rouach et al., 1991; Shaw et al., 1992; Ramqwist et al., 1993). Однако чрезмерная экспрессия wt-p53 сама по себе не может привести к разрушению DNA в p53-отрицательной клеточной линии H358 (фиг. 11), хотя их рост и подавляется Ad-p53 (фиг. 10). Это совместимо с предыдущими наблюдениями изобретателей, показывающими, что стабильные клоны H358 могут быть получены после переноса wt-p53 с промежуточным звеном ретровируса, и что эти клоны растут гораздо медленнее, чем родительские клетки (Cai et al., 1993).
Потенциальная терапевтическая эффективность комбинаций Ad-p53 с CDDP была обнаружена в сроки относительного изменения в объеме сфероидов H358. Модель сфероида многоклеточной опухоли показывает in vitro гистологическую структуру, похожую на ту, которую имеет опухоль на первоначальной стадии и на стадии микрометастазы. Лечение с помощью CDDP вызывало уменьшение относительного объема в количестве сферидов, инфицированных Ad-p53, но не оказывало ощутимого влияния на родительские или Ad-Luc-инфицированные сфероиды (фиг. 12A). In situ маркировка dUTP с промежуточным звеном TdT показала множество клеток, находящихся в состоянии апоптоза на поверхности Ad-p53-инфицированных сферидов, в то время как апоптические клетки отсутствовали на сфероидах, не инфицированных Ad-p53 (фиг. 12B-E). Изобретатели и ранее сообщали о том, что экспрессия wt-p53 с промежуточным звеном ретровируса подавляла рост сфероидов H322a, благодаря трансформированию фактора роста (TGF- α ) (Fujiwara et al., 1993). Однако ретровирусный вектор не может инфицировать сфероиды H358, так как клетки этих сфероидов быстро не разрастаются в ответ на экзогенный TGF- α. Обнаружение того факта, что воздействие CDDP уменьшает размеры сфероидов H358, инфицированных Ad-p53, благодаря инициированию апоптоза, наводит на мысль, что Ad-p53 инфицирует неразрушающиеся клетки и что CDDP инициирует процесс апоптоза в бессимптомных (скрытых) клетках.
Пример 8. Использование p53 и поражающих DNA агентов в лечебных схемах.
Естественно, что модели лечения, разработанные для животных, должны применяться как часть исследований, предшествующих клиническим назначениям, как показано на примерах 5, 6, 7. Поэтому больные, которым было установлено показание на лечение с помощью переноса гена посредством аденовируса, могут быть исследованы на присутствие антител, действие которых направлено против аденовируса. При наличии антител и при установившейся аллергической реакции больного на какие-либо фармакологические или естественные средства, может быть назначено применение опытных доз порядка от 103 до 106 аденовируса-рекомбинанта под пристальным клиническим наблюдением.
Для назначения человеку при лечении рака с использованием Ad5CMV-p53 аденовирус-рекомбинант, проявляющий экспрессию p53 под контролем соответствующих промоторов/усиливающих элементов, например промотора CMV (цитомегаловируса), должен быть приготовлен и обеззаражен, в соответствии с методикой, одобренной организацией по надзору за продуктами питания и лекарственными средствами (FDA). Такая методика включает, но не ограничивается, центрифугирование в градиенте плотности хлорида цезия с последующими испытаниями на эффективность и чистоту.
Сложилось мнение, что существует два способа лечения с помощью аденовируса p53, непосредственное или локальное назначение или более общее лечение. Данные методы дают результаты только при лечении многообразия злокачественных опухолей, которые известны как имеющие отношение к p53-мутациям. Что касается общего лечения, то, как было доказано на опытах, достаточно обыкновенной внутривенной инъекции, чтобы инфицировать введенным вирусом ткани, расположенные на расстоянии от места введения лекарства (Stratford-Perricaudet et al., 1991b). Таким образом, вирусное инфицирование с помощью внутривенной инъекции можно рассматривать как способ, удобный для лечения всех злокачественных опухолей, имеющих отношение к p53. Вирус может быть назначен больным как внутривенно в виде любого фармакологически допустимого раствора, так и в виде инфузий в течение какого-то промежутка времени. Откровенно говоря, существует глубокое убеждение в том, что для получения ожидаемого эффекта количество назначенных действующих вирусных частиц должно быть порядка от 1•1010 до 5•1012.
Кроме того, там где речь идет о раке легких, при желании, может быть использован метод более прямого физического воздействия аденовируса-рекомбинанта на клетки-мишени, аналогичный внутритрахеальному назначению регулятора трансмембранной проводимости при фибрознокистозной дегенерации (Rosenfeld et al., 1992). Результатом такого метода может быть доставка аденовируса-рекомбинанта p53 поближе к тому месту, где концентрируются клетки мишени.
Методы
Маркировка in situ dUTP с промежуточным звеном TdT для определения апоптоза. Сфероиды H358 были зафиксированы на третий
день и окрашены, как описано в примере 7. Маркированные пробы TdT приводились в контакт с предметным стеклом, погруженным в буферный раствор TdT и выдерживались в инкубаторе с dUTP и TdT,
обработанными биотином, при 37oC в течение 45 минут. Предметные стекла покрывались 2%-ным бычьим сывороточным альбумином на 10 минут и помещались в инкубатор (выращивались) с
авидин-биотиновым раствором на 30 минут. Колорометрическое определение проводилось с использованием диамино-бензидина.
Инициирование апоптоза с помощью CDDP после Ad-p53 инфицирования in vivo.
Клетки H358 (5•106) в 0,1 мл сбалансированного солевого раствора Hank вводились в правый бок BALB/c женской особи nu/nu безволосых мышей. Через тридцать дней 200 μл однородной среды или среда, содержащая Ad-Luc (108 PFU/мл) или Ad-p53 (108 PFU/мл), была введена в раковую опухоль диаметром от 5 до 6 мм. Внутриопухолевая инъекция (100 μл) и околоопухолевая инъекция в двух противоположных зонах ( 50 μл каждая). CDDP (3 мг/кг) или контрольный физиологический раствор были введены интерперитонеально. Объем опухоли (A) меняется. Опухоли были измерены циркулем по двум перпендикулярным диаметрам без учета отношения к лечебной группе, а объем опухоли был рассчитан по модели со сферической формой со средним диаметром опухоли, рассчитанным как корень квадратный из произведения диаметров поперечных сечений. Пять особей мышей были использованы для формирования каждой лечебной группы, и показано среднее значение ±SF. Данные были проанализированы с использованием Student's t-test. Стрелка указывает на день лечения. Представлены два независимых обозначения: p<0,05 на 5-ый день в опыте 1; p<0,05 на 7-й день в опыте 2. Гистологическое исследование было проведено с использованием технологии маркировки биотином-dUTP с промежуточным звеном TdT. Опухоли снимались через 5 дней от начала лечения и сразу же помещались в состав O.C.T. Образцы толщиной 5 μм иссекались в замороженных тканях в криостате. Иссечения обрабатывались 1 μг/μл протеиназы K и окрашивались по методике, описанной выше. Животные содержались в соответствии с требованиями UT M.D. Anderson Institutional Animal Care & Use Committee.
Результаты
Чтобы продемонстрировать in vivo эффективность методов и композиций, а именно эффективность объединения терапии, основанной на переносе гена, с химиотерапией при лечении рака человека, изобретатели
исследовали вопрос, может ли быть вызван апоптоз in vivo при последовательном введении Ad-p53 и CDDP. Через три дня после прямого внутриопухолевого введения Ad-p53 или интерперитонеального введения
CDDP опухолевые клетки были имплантированы подкожно в организм nu/nu мышей и результаты показали скромные результаты замедления роста. Однако в тех случаях, когда Ad-p53 и CDDP были введены
одновременно, раковые опухоли частично регрессировали, а размеры опухоли оставались статистически значительно меньше, чем размеры для любых других лечебных групп. Эффект подавления роста был даже
более ощутим после двух лечебных циклов (фиг. 13A). Гистологические исследования выявили массированное разрушение раковых клеток в зоне организма мыши, пролеченной CDDP, куда был введен Ad-p53.
Окрашивание in situ продемонстрировало много погибших клеток вокруг межклеточных пространств (фиг. 13A-E). По контрасту с изложенным, раковые клетки, обработанные только CDDP или только Ad-p53, не
показали ни апоптических зон, ни зон межклеточных пространств, окруженных погибшими клетками.
Более подробно предпочтительные протоколы лечения могут быть разработаны в соответствии со следующим алгоритмом. Вначале больной может быть подвергнут бронхоскопии для выяснения степени поражения. Методом эндоскопии должна быть извлечена как можно большая часть опухоли. Предварительная бронхоскопия должна проводиться под местным или общим наркозом. Трансбронхиальная аспирационная игла (21 g) Stifcortm (с жестким сердечником) должна быть проведена в биопсийный канал бронхоскопа. К сохранившимся участкам опухоли затем может быть подведен малый объем аденовируса p53 в количестве 10 мл или меньше.
В любом случае, если даже примененного аденовируса окажется недостаточно для возникновения репликационного эффекта, сам по себе вирус на организм человека никакого пагубного воздействия не окажет. Тем не менее больные во время лечения должны находиться в стационаре, по меньшей мере, в течение 48 часов для наблюдения за возможным возникновением острой или отдаленной во времени побочной реакции. Хотя вопросу эффективного и безопасного применения аденовируса с дефицитом репликации в качестве носителя при переносе гена в человеческом организме было уделено внимание в прошлом (Rosenfeld et al., 1992, Jaffe et al., 1992), дозировка аденовируса, назначаемая для ввода в организм, должна серьезно исследоваться, с целью дальнейшего уменьшения возможностей возникновения побочных эффектов.
Существуют различные критерии, которые следует принимать во внимание при оценках существования необходимости в ответной реакции и существования токсичности. Для решения вопроса определения токсичности, прежде чем приступить к курсу терапевтического лечения, следует сфотографировать ложе опухоли, измерить ее наибольший диаметр и перпендикуляр. Размер опухоли определяется как произведение диаметров. Имея эти данные, можно рассчитать степень рецидива опухоли.
Время до прогрессирования в развитии болезни может быть также измерено, начиная от первого обследования с обнаружением уменьшения опухолевой массы до появления очевидных признаков прогрессирования. Прогрессирование в развитии болезни определяется как увеличение на ≥ 25% суммы произведений диаметров измеренных новообразований. Больной должен пройти, по крайней мере, два курса терапевтического лечения, прежде чем появятся показания на прогрессирование болезни. Наблюдения над больными должны оцениваться с момента занесения в протокол (историю болезни).
Последующие исследования должны включать все действия (назначения) терапевтического лечения рака, включая определение клинических анализов и взятие биопсий для стандартных и молекулярных биологических анализов, в которых может быть исследована структура экспрессии различных генов p53. Эти анализы могут также представить данные о количестве клеток, которые восприняли перенесенный ген, а также об относительной эффективности просмотра in vivo. Основываясь на полученных данных, могут быть внесены нужные корректировки в ход лечения. Эти корректировки могут включать структуры аденовируса, которые используют различные промоторы, или изменения в количестве PFU (множественности инфицирования), введенных с целью обеспечения уверенности в том, что инфицированы все или большинство клеток опухолей без нефизиологической чрезмерной экспрессии рекомбинантных генов.
Установлено, что экспрессия экзогенных генов, перенесенных in vivo аденовирусами, может существовать в течение продолжительного времени. Терапевтически эффективная, продолжительная во времени экспрессия экзогенных генов, переносимых вирусами, должна быть направлена на больного организмом (природой) самого больного. Гены-маркеры ограничены в своем влиянии определением терапевтически релевантной продолжительности экспрессии гена, так как уровни экспрессии, необходимые для исправления любого конкретного генетического нарушения, значительно отличаются от уровня, требуемого для комплексного лечения другого заболевания.
Хотя композиции и способы по данному изобретению были описаны, ссылаясь на предпочтительные примеры осуществления, специалистам, имеющим опыт в данной области знаний, совершенно очевидно, что возможны варианты в композициях и способах, а также в приемах или в последовательности приемов способов, описанных выше, без отступления от сущности, изложенной в формуле изобретения. Более конкретно, из данного описания изобретения вытекает, что определенные агенты, которые могут иметь как химическую, так и физиологическую природу, заменяются агентами, описанными в данном изобретении и проявляющими идентичный или похожий эффект. Все подобные замещения должны быть в рамках признаков формулы изобретения. Все защищенные формулой изобретения композиции и способы могут быть осуществлены без дополнительных экспериментальных исследований.
Перечень последовательностей
1. Общая информация:
(i) Заявитель:
A. Имя: "БО ОВ РИДЖЕНТ, ДЗЕ ЮНИВЕРСИТИ ОВ
ТЕКЗАС СИСТЕМ"
B. Стрит (Адрес): 201 Вест Севенс (7-я) Стрит
C. Сити (Город) Остин
D. Стейт (Штат) Техас
E. Кантри (Страна) США
F. Почтовый индекс: (ЗИП)
78701
G. Телефон: (512) 499-4462
H. ТЕЛЕФАКС: (512) 499-4523
(ii) Изобретатели: Рот, Джек А., Фуживара, Тошийоши, Гримм, Элизабет Эй, Мухопадиаи, Тапаз Занг, Вей - Вей и
Оуэн-Скоб, Лори Б.
(iii) Название изобретения:
Способы и композиции, содержащие поражающие DNA агенты и p53
(iv) количество последовательностей: 4
(v)
Соответствующий адрес:
(A) Адресат: Арнольд, Вайт & Деки
(B) Адрес: А/Я 4433
(C) Город: Хьюстон
(D) Штат: Техас
(E) Страна: США
(F)
Почтовый индекс: 77210
(vi) Форма, читаемая на компьютере:
A Тип носителя: Дискета/ASCII
B Компьютер: IBM. PC-совместимый
C Операционная система: PC-DOS/MS-DOS
D Программное обеспечение: WORDPERFECT 5.1
Данные о заявке находящейся на рассмотрении:
A Номер заявки: неизвестен
B Дата подачи: в соответствии с вытекающими
обстоятельствами
C Классификация: неизвестна
(viii) Ранее поданная заявка:
A Номер заявки: USSEN 08/233,002
B Дата подачи: 25 апреля 1994 г.
C
Классификация: неизвестна
(ix) Информация о патентном поверенном/агенте
A Имя: Хайлендер, Стивен Л.
B Регистрационный номер: 37,642
C Ссылка на документ об
уплате пошлины: UTFC403PCE
(x) Информация о каналах связи:
A Телефон: (512) 418-3000
B Телефакс: (713) 789-2679
C Телекс: 79-0924
(2) Информация о
последовательности SEQ ID N 1
(i) Характеристики последовательности:
A. Длина: 20 базовых пар (основных пар)
B. Тип: Нуклеиновая кислота
C. Цепь ДНК: Одиночная
D. Топология: Линейная
(ii) Описание последовательности: SEQ ID N 1:
GGCCCACCC CCTTGGCTTC 20
(2) Информация для последовательности SEQ ID N 2:
(iii)
Характеристики последовательности:
A. Длина: 20 базовых пар (основных пар)
B. Тип: Нуклеиновая кислота
C. Цепь ДНК: Одиночная
D. Топология: Линейная
(iv)
Описание последовательности: SEQ ID N 2:
TTGTAACCAT TATAAGCTGC 20
(2) Информация для последовательности SEQ ID N 3:
(v) Характеристики последовательности:
A. Длина:
20 базовых пар (основных пар)
B. Тип: Нуклеиновая кислота
C. Цепь ДНК: Одиночная
D. Топология: Линейная
(vi) Описание последовательности: SEQ ID N 3:
TCGTTTCTCA GCAGCTGTTG 20
(2) Информация для последовательности SEQ ID N 4:
(vii) Характеристики последовательности:
A. Длина: 20 базовых пар (основных пар)
B. Тип:
Нуклеиновая кислота
C. Цепь ДНК: Одиночная
D. Топология: Линейная
(viii) Описание последовательности: SEQ ID N 4:
CATCTGAACT CAAAGCGTGG 20ы
Реферат
Изобретение относится к медицине, в частности к использованию генов-супрессоров злокачественных опухолей в сочетании с поражающим DNA агентом или фактором, с целью умерщвления клеток, в частности клеток злокачественных новообразований. Ген-супрессор злокачественной опухоли, р53, был доставлен in vivo переносчиком гена с промежуточным звеном аденовируса-рекомбинанта, в сочетании с химиотерапевтическим агентом. Пролеченные клетки проявляли состояние апоптоза при специфической DNA-фрагментации. Непосредственная подкожная инъекция р53 - аденовирусного состава в злокачественные опухоли с последующим интерперитонеальным введением поражающего DNA агента, цисплатина, вызывало массированное апоптическое разрушение опухолей. Изобретение также предлагает способ, объединяющий перемещение гена, благодаря использованию репликационно-дефектного аденовируса р53 "дикого" типа (природного аденовируса р53) в сочетании с лекарственными средствами, поражающими DNA, для лечения злокачественной опухоли. Техническим результатом изобретения является расширение арсенала средств для борьбы со злокачественными новообразованиями. 4 с. и 111 з.п.ф-лы, 13 ил., 2 табл.


Комментарии