Липопротеиновые комплексы и их получение и применения - RU2627173C2
Код документа: RU2627173C2
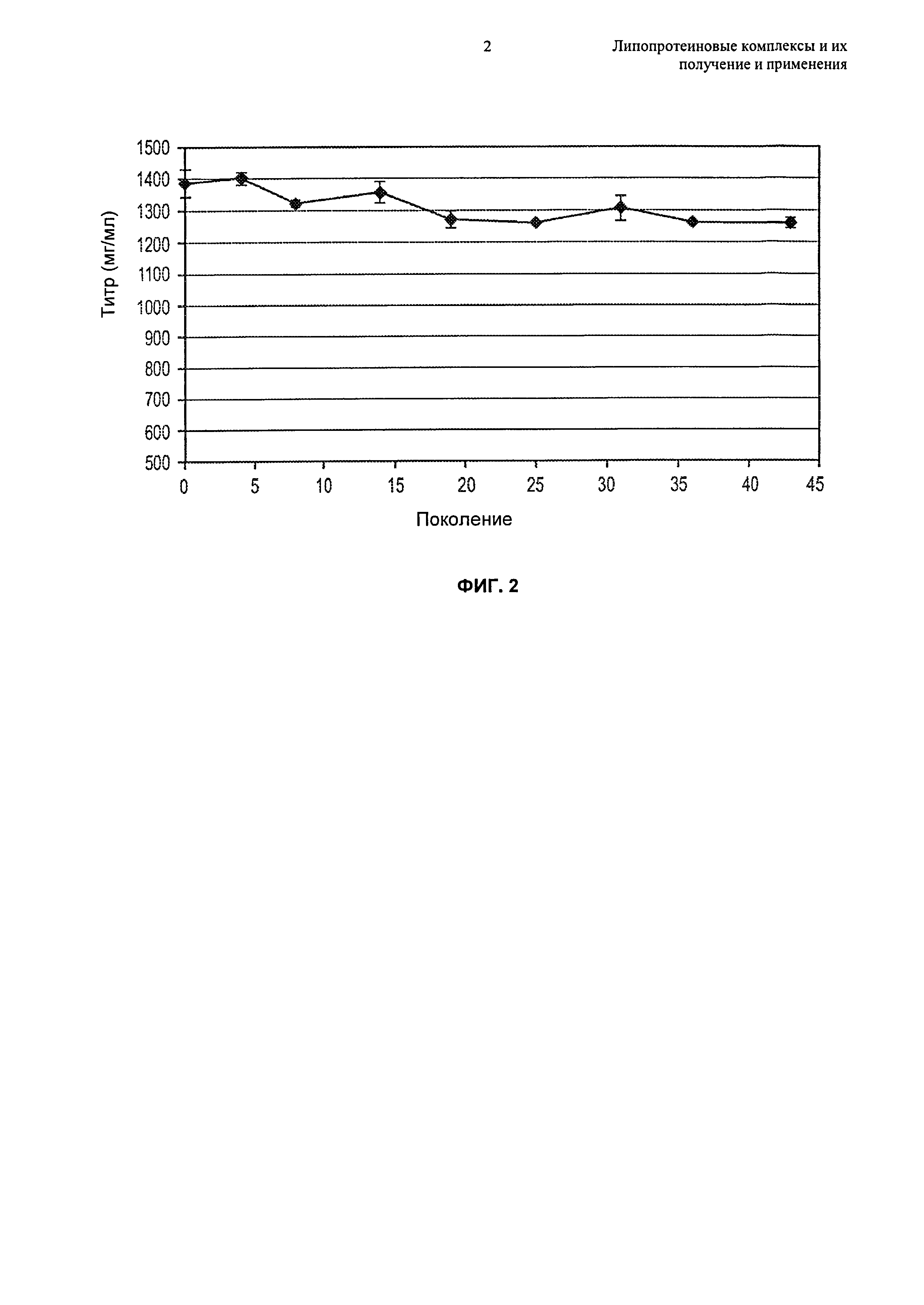
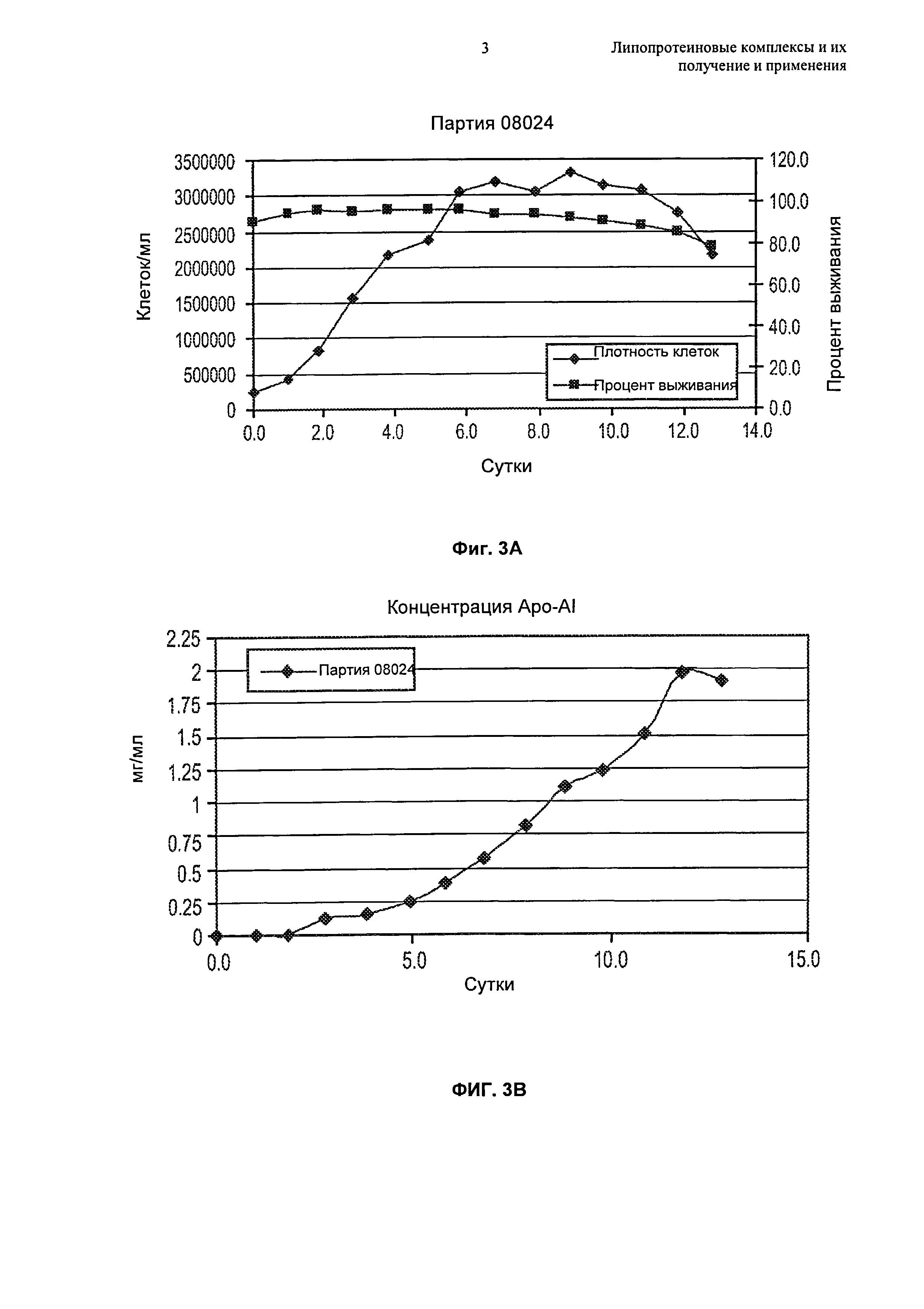
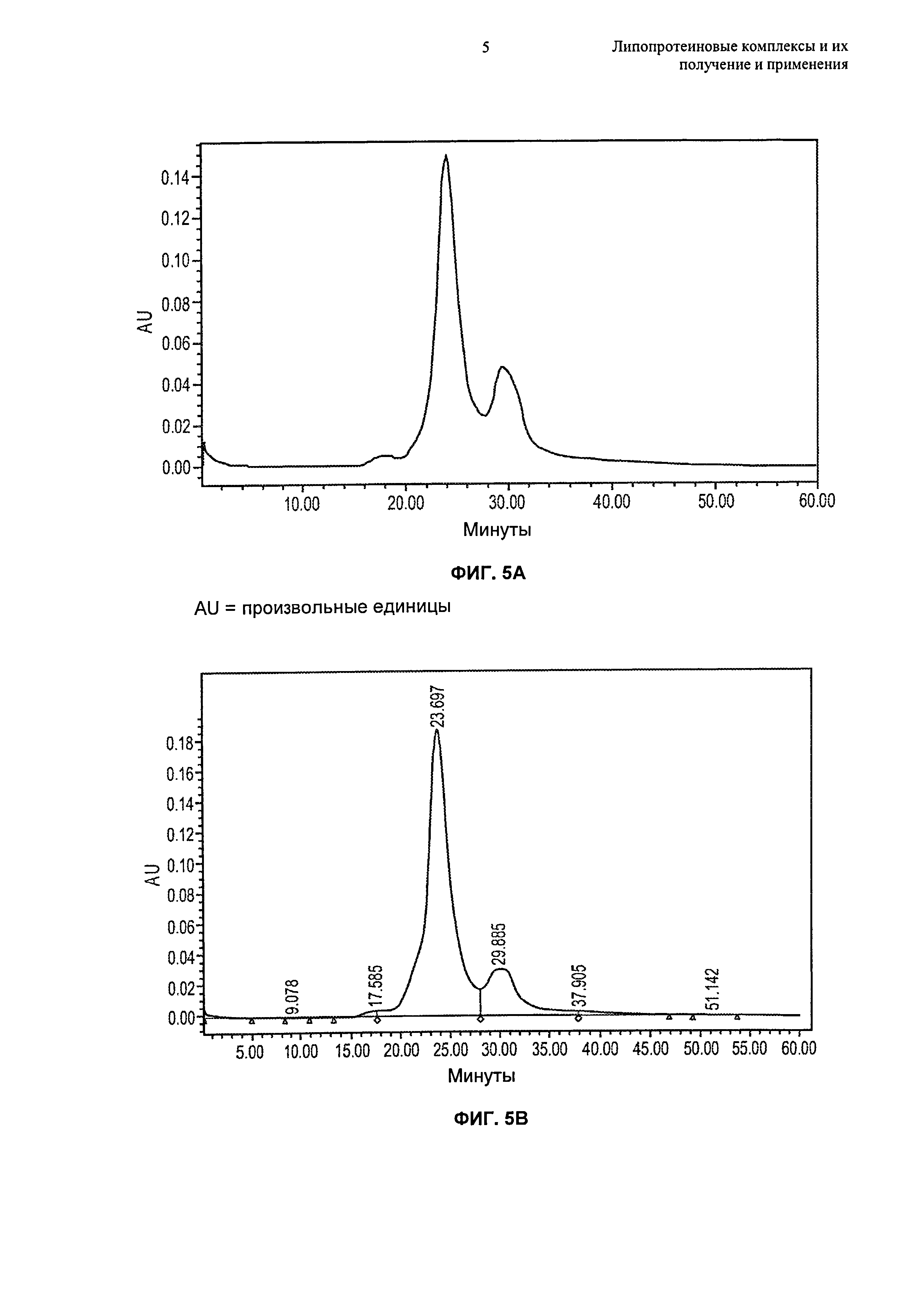
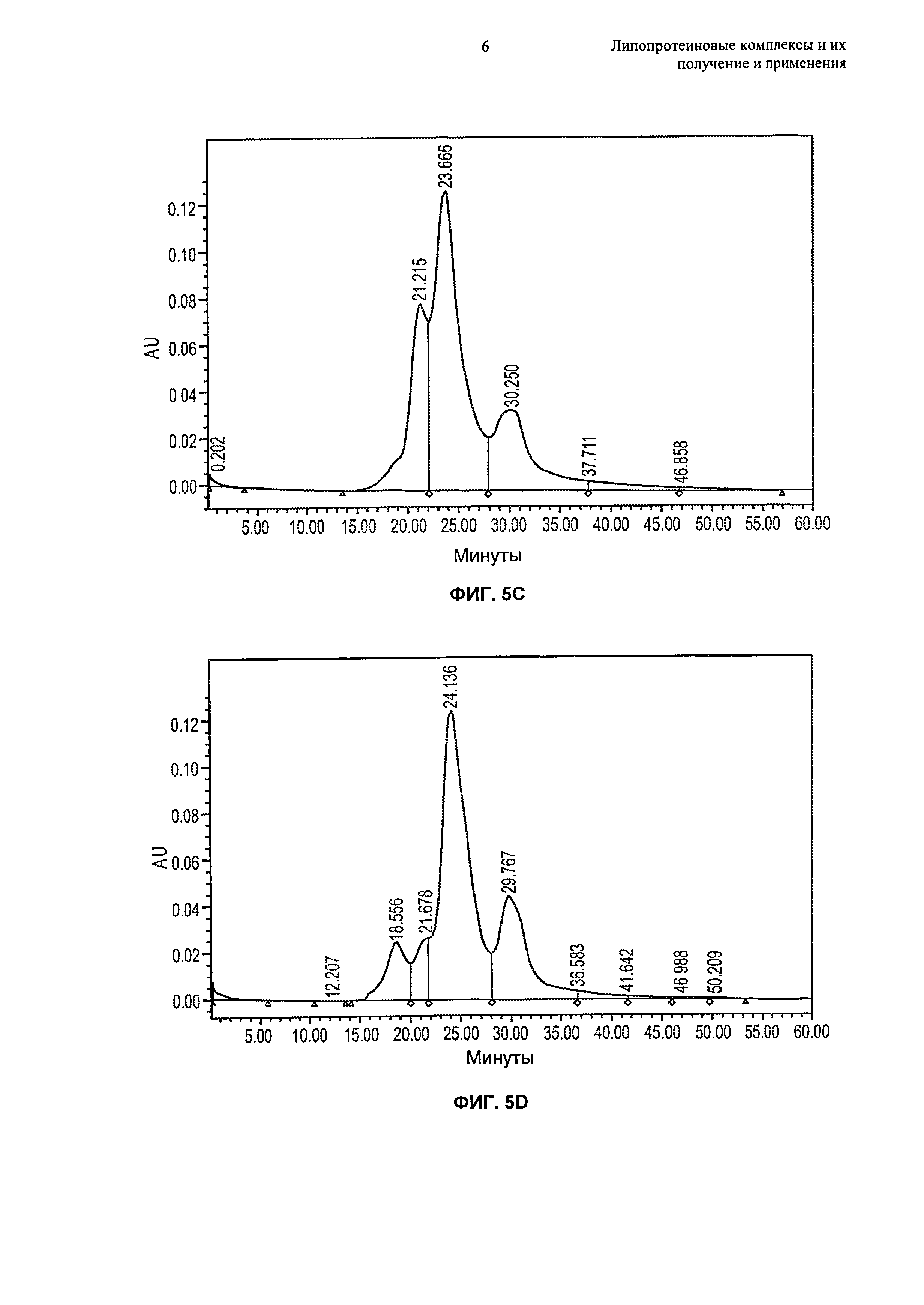
Чертежи





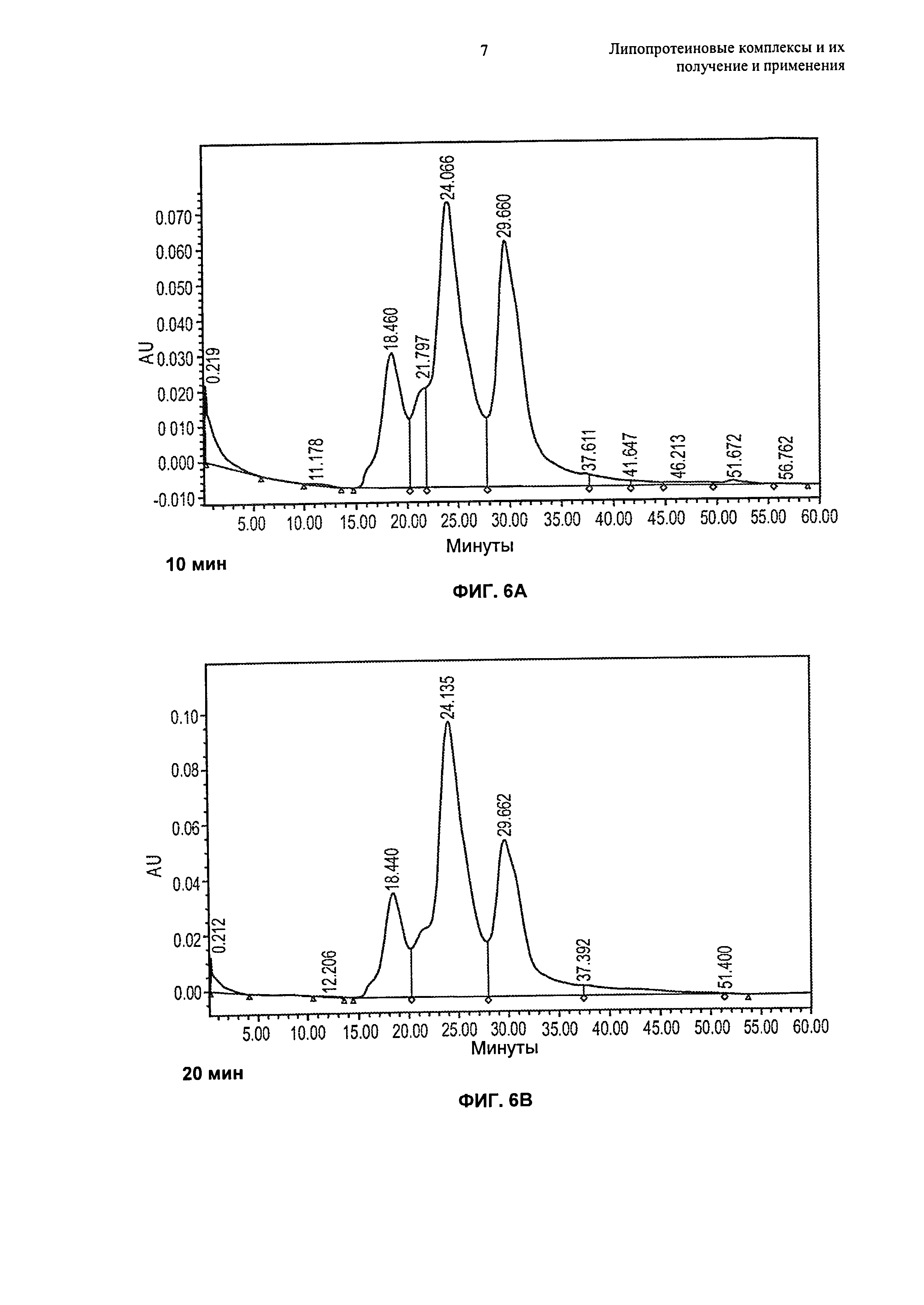
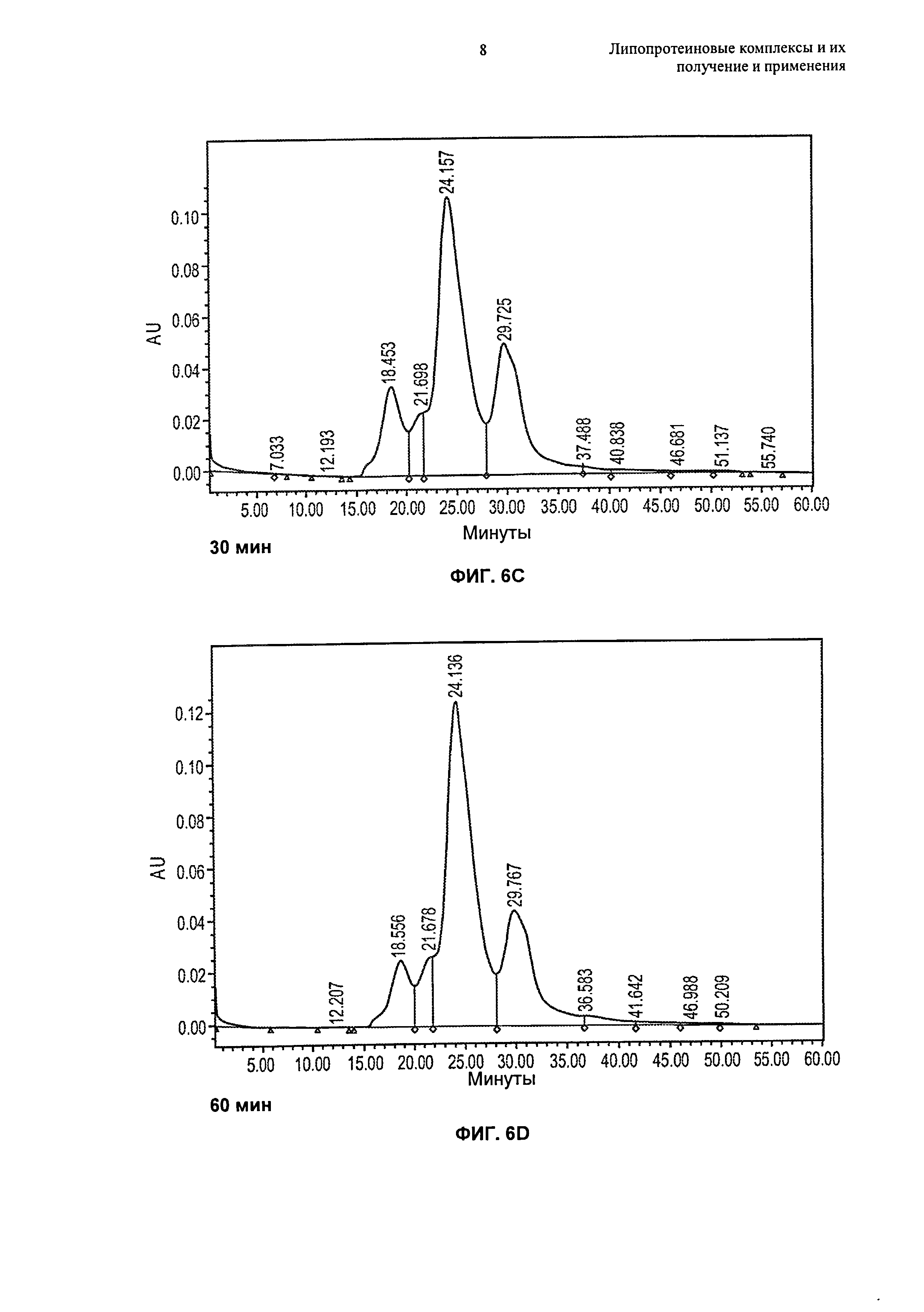
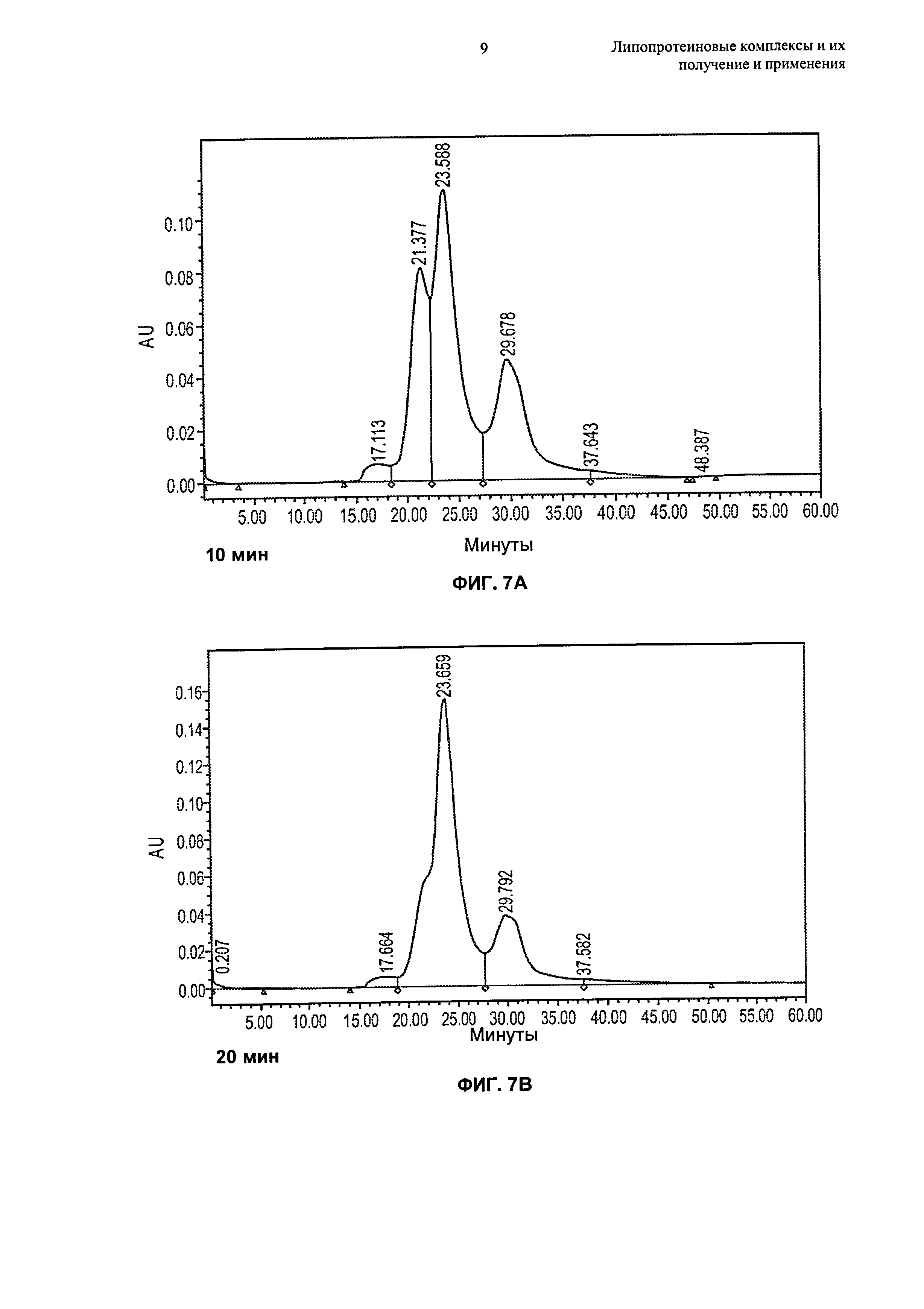
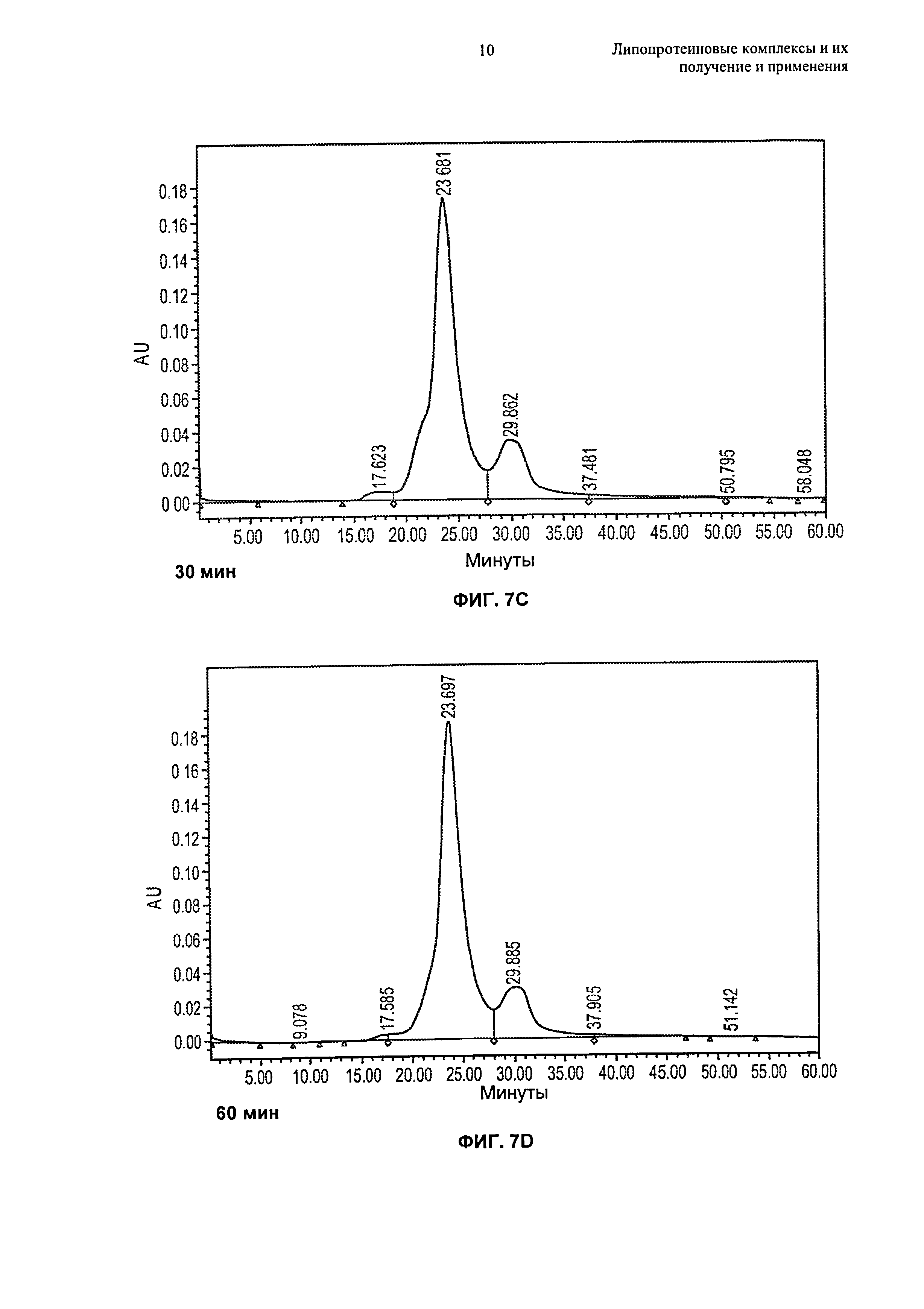
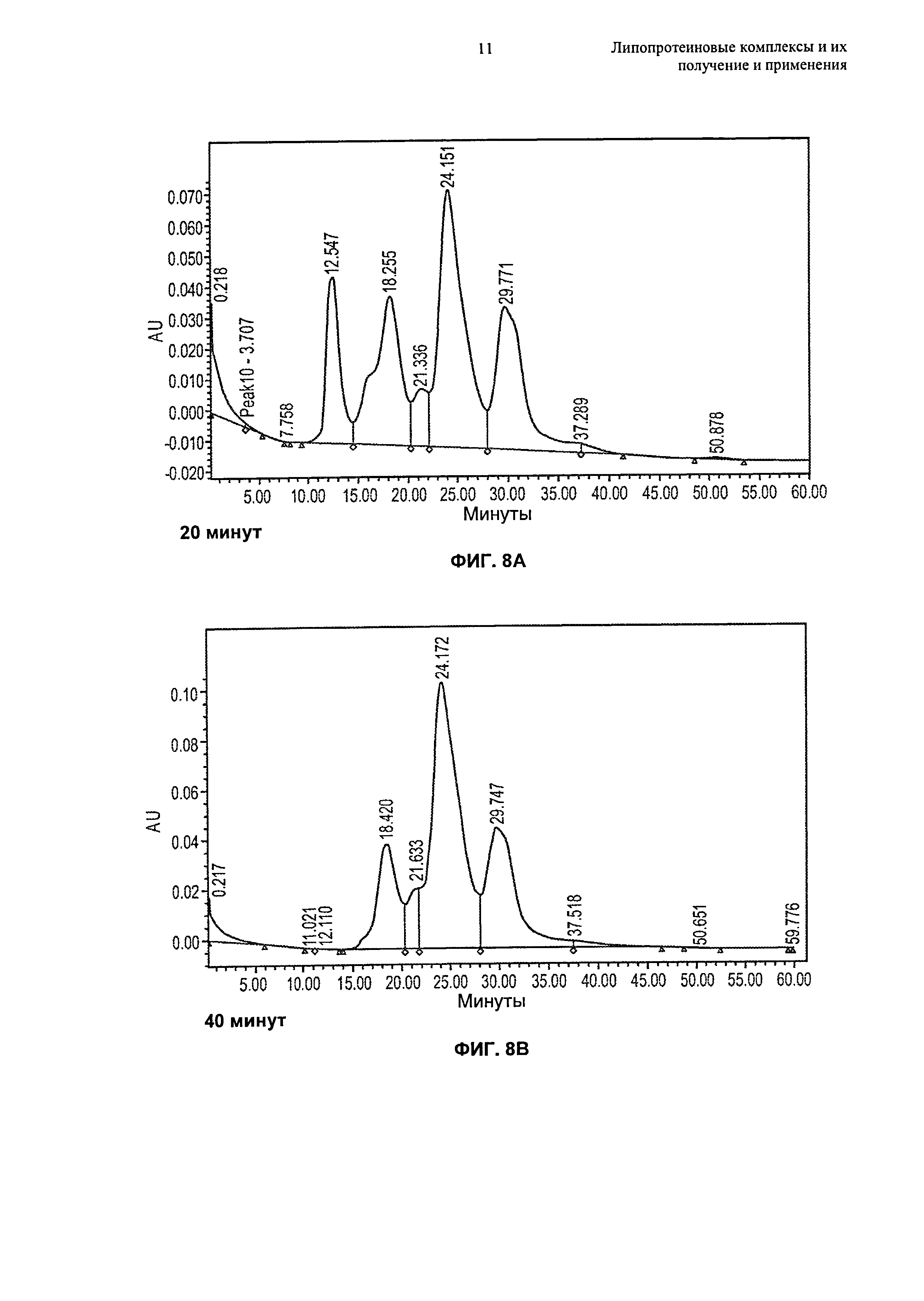
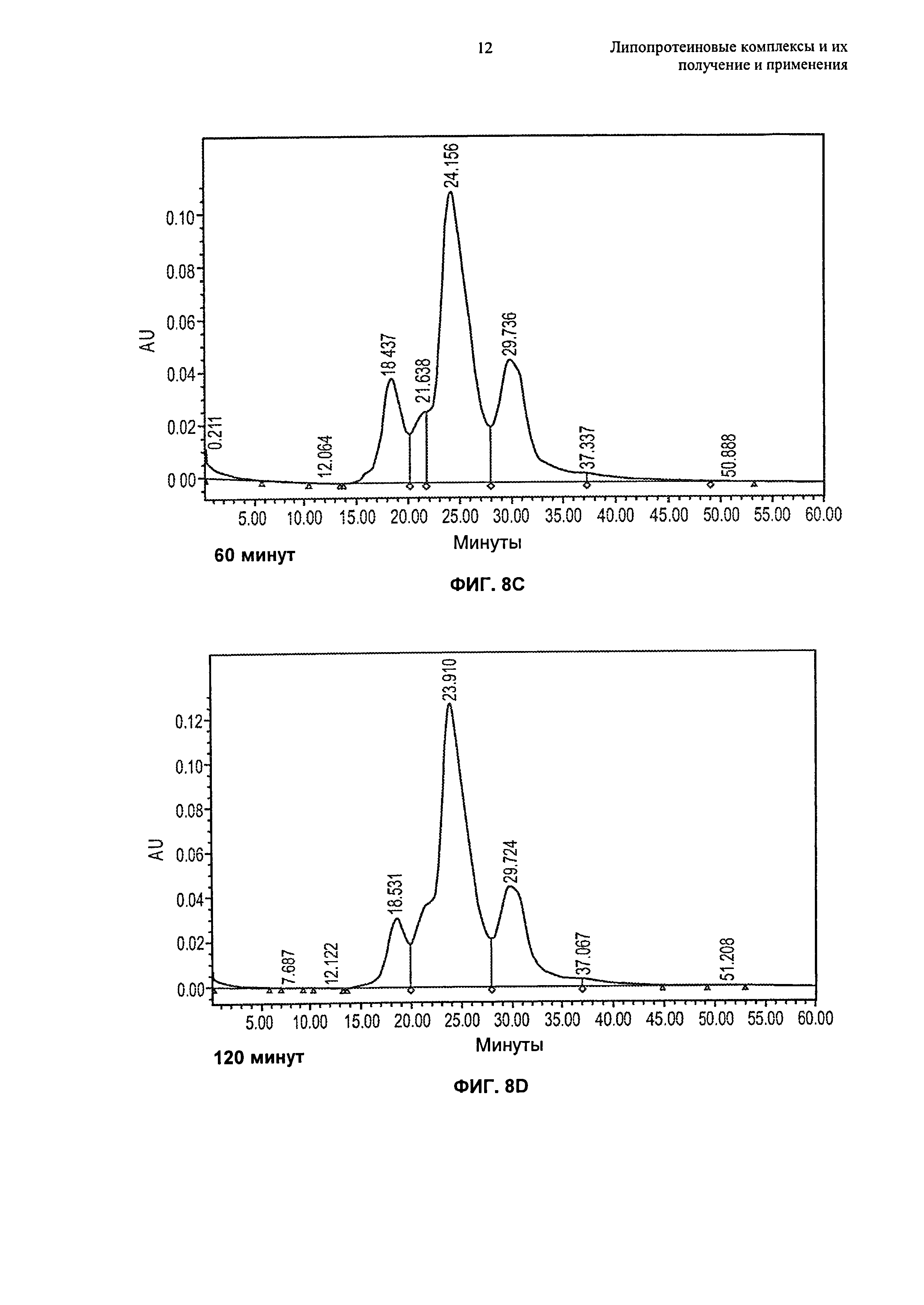

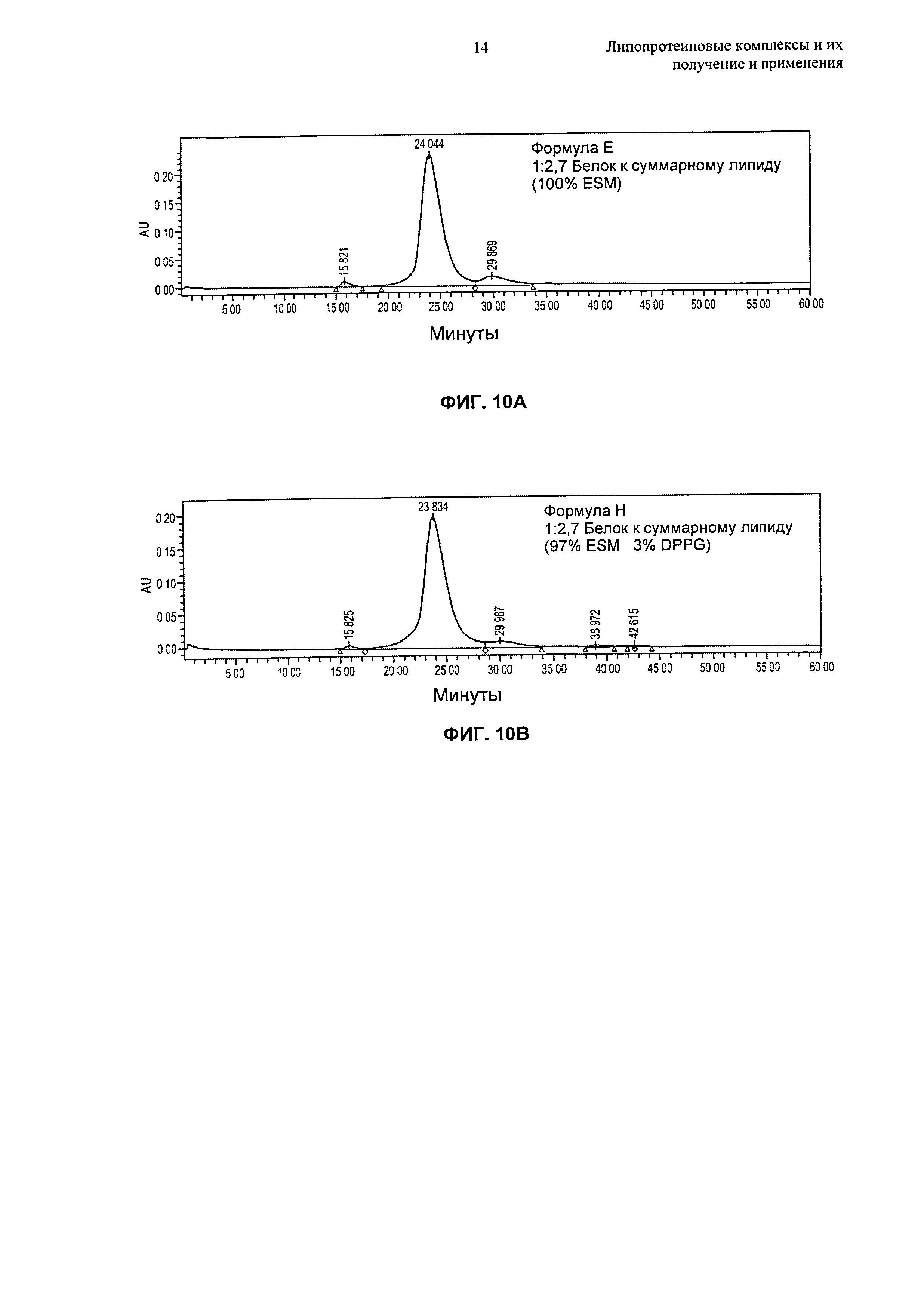
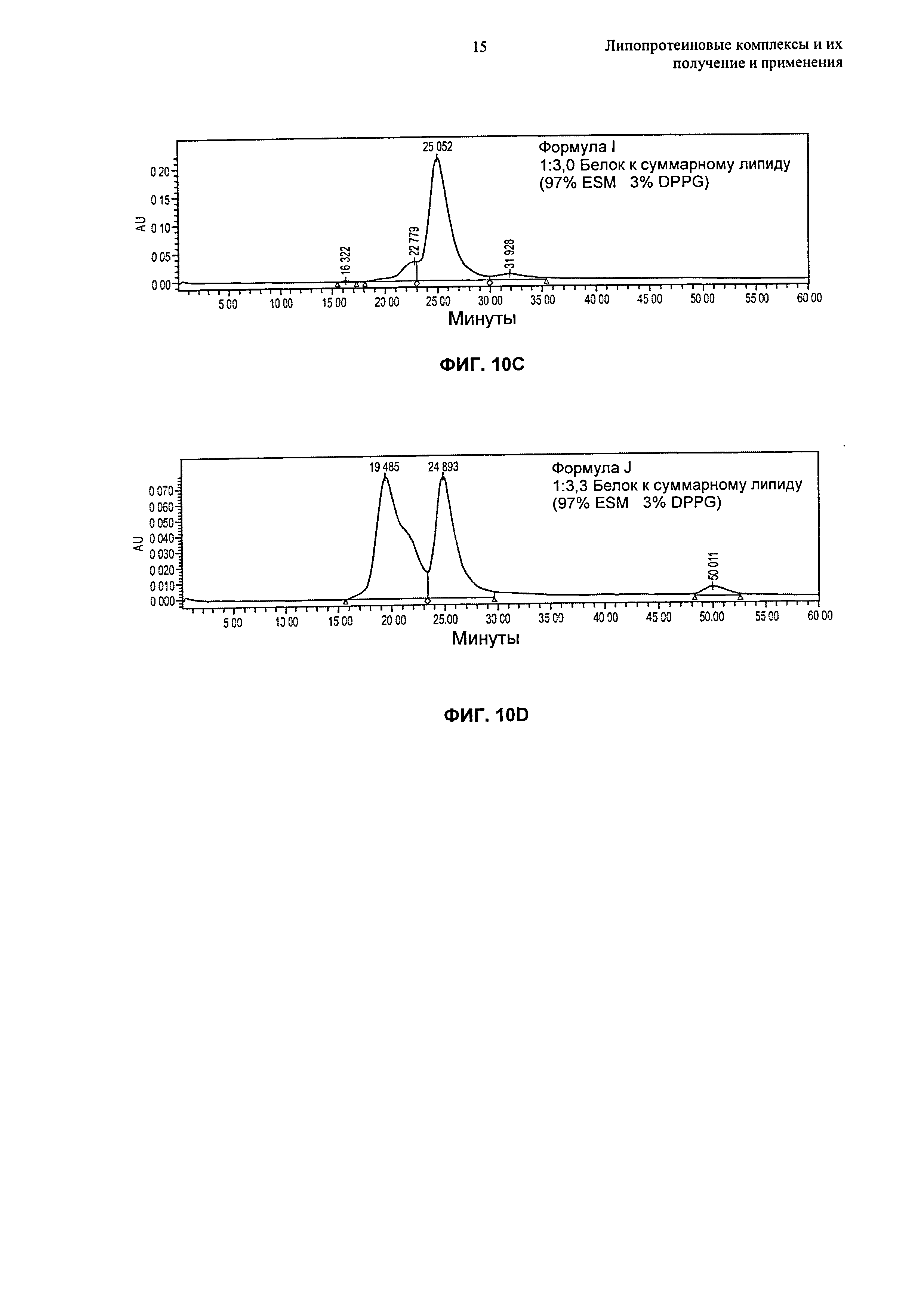
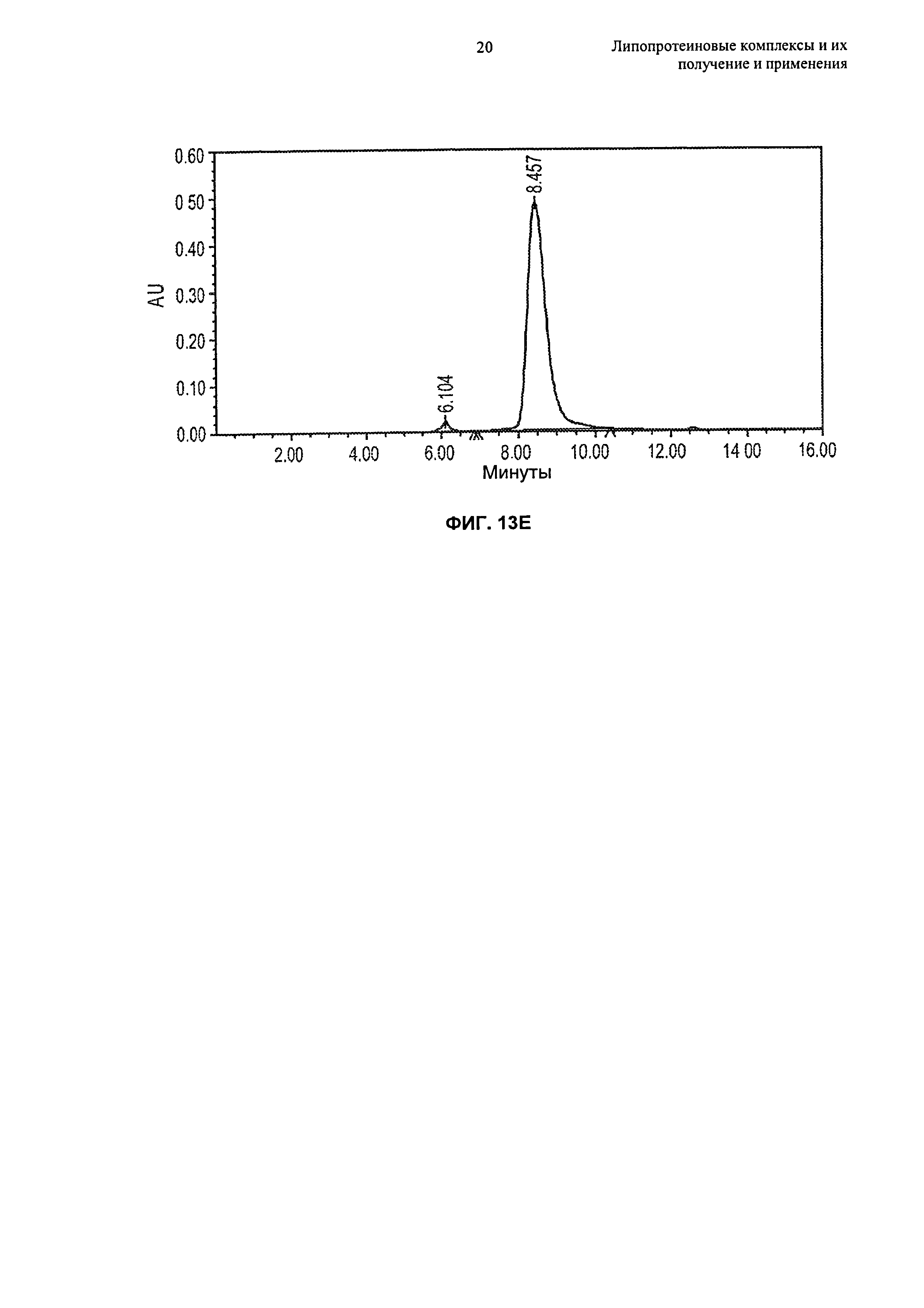
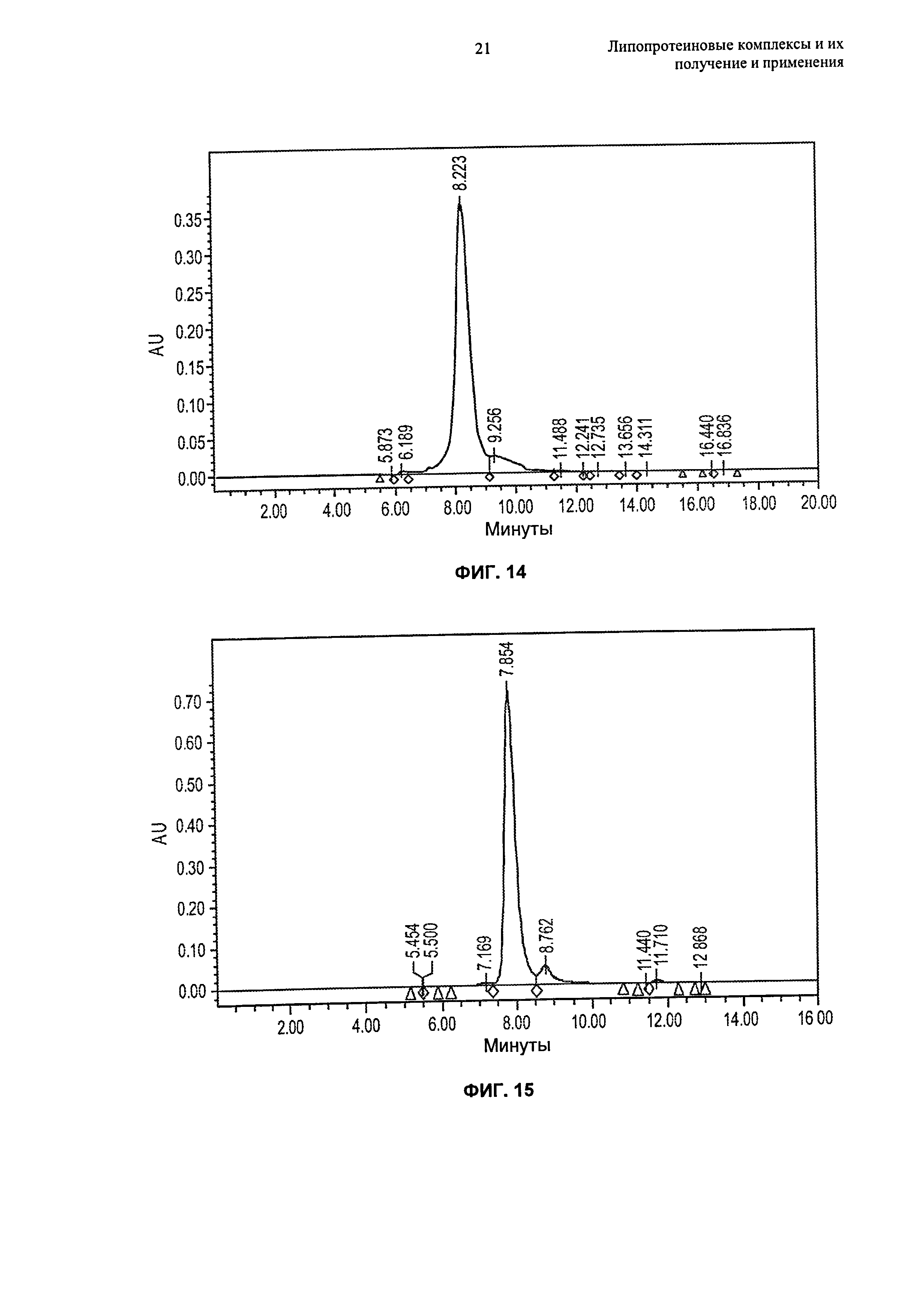
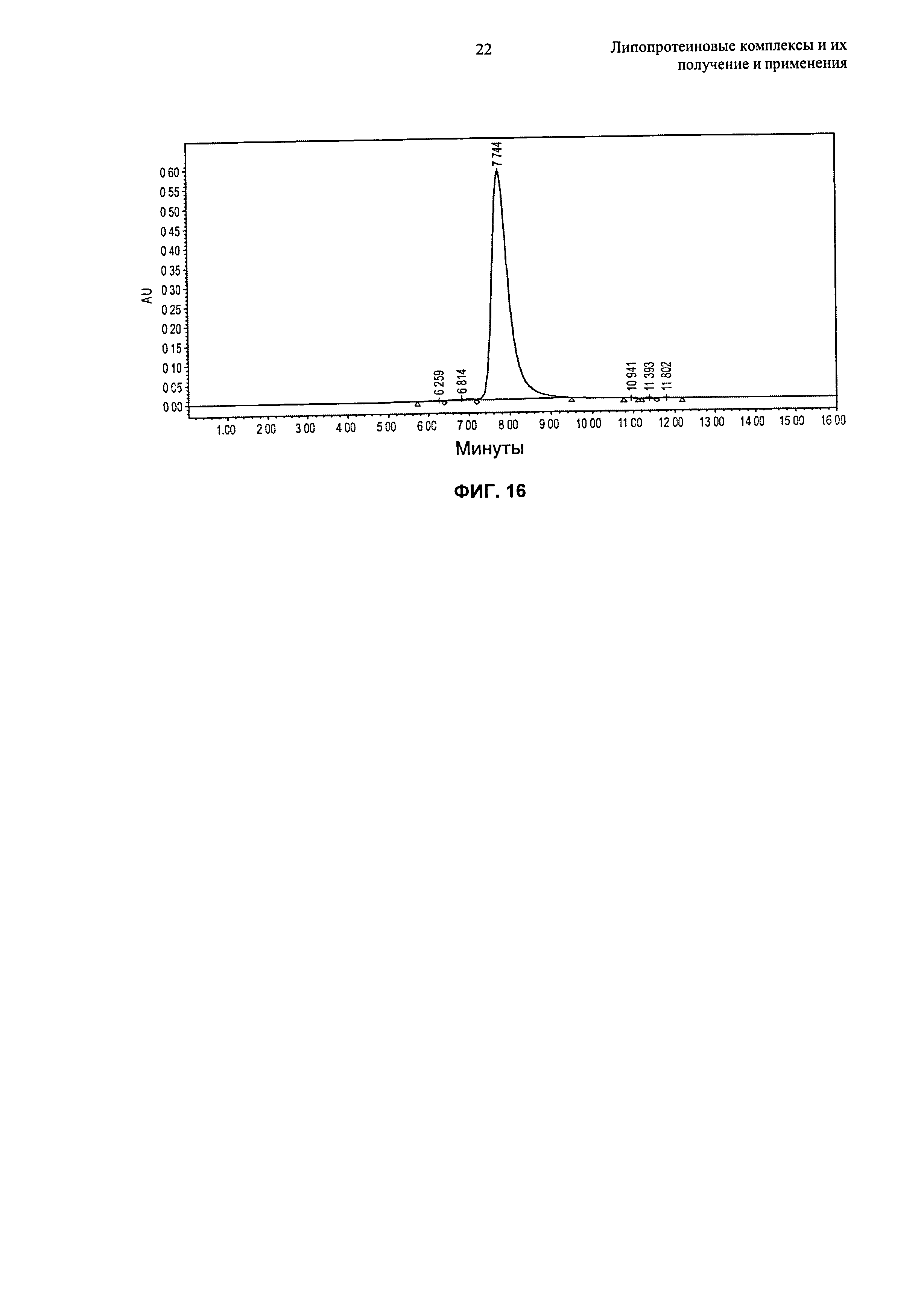
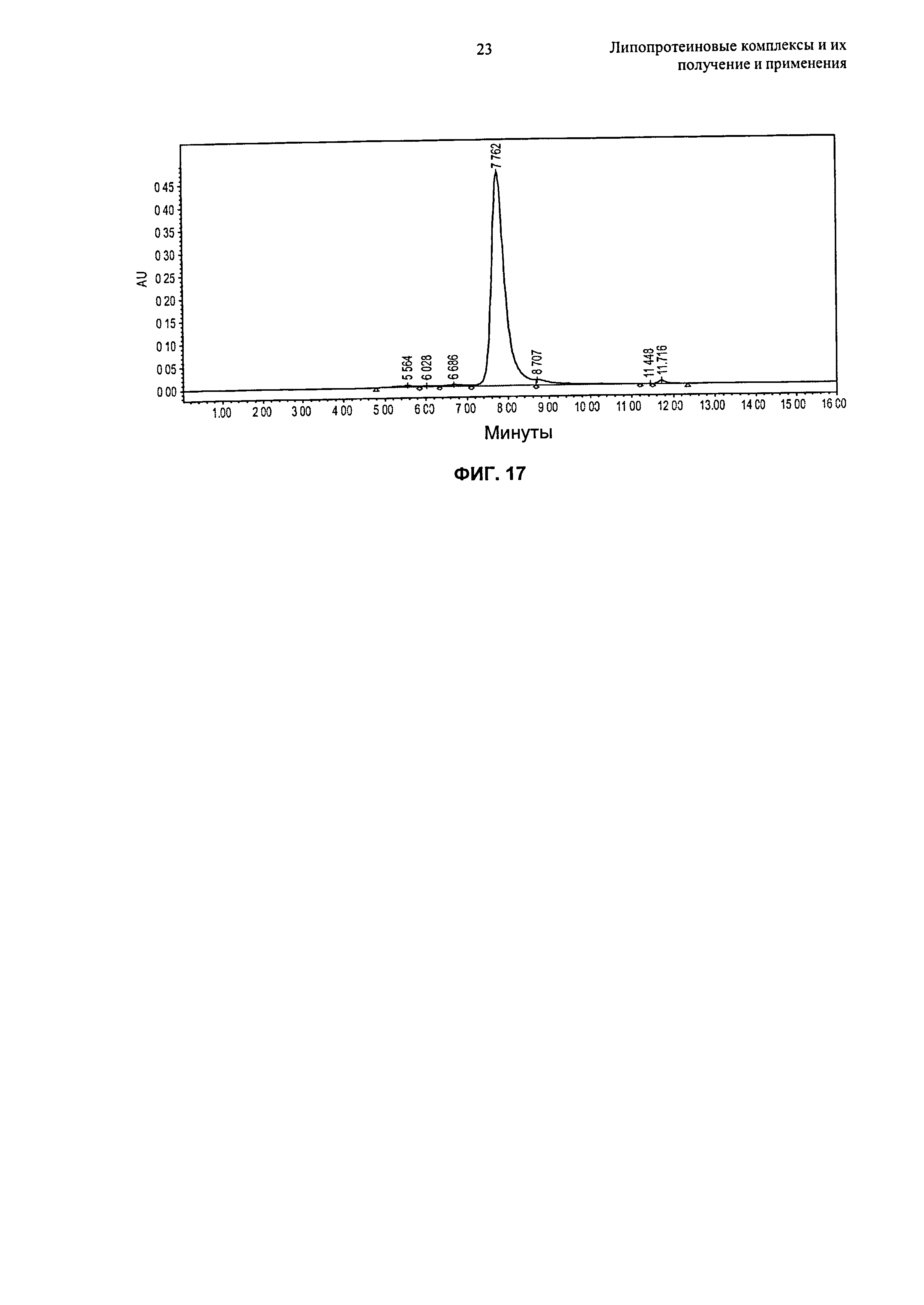

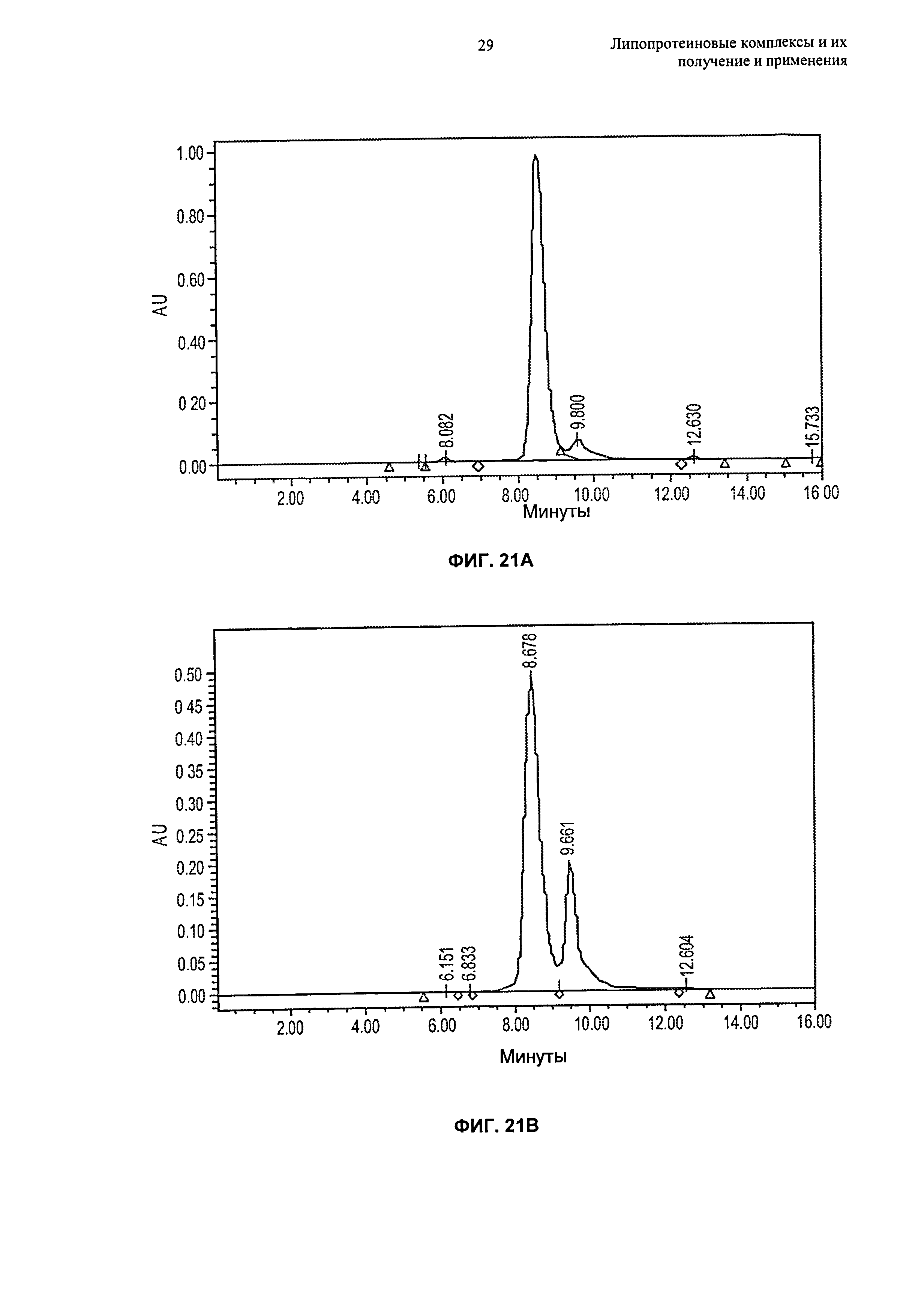
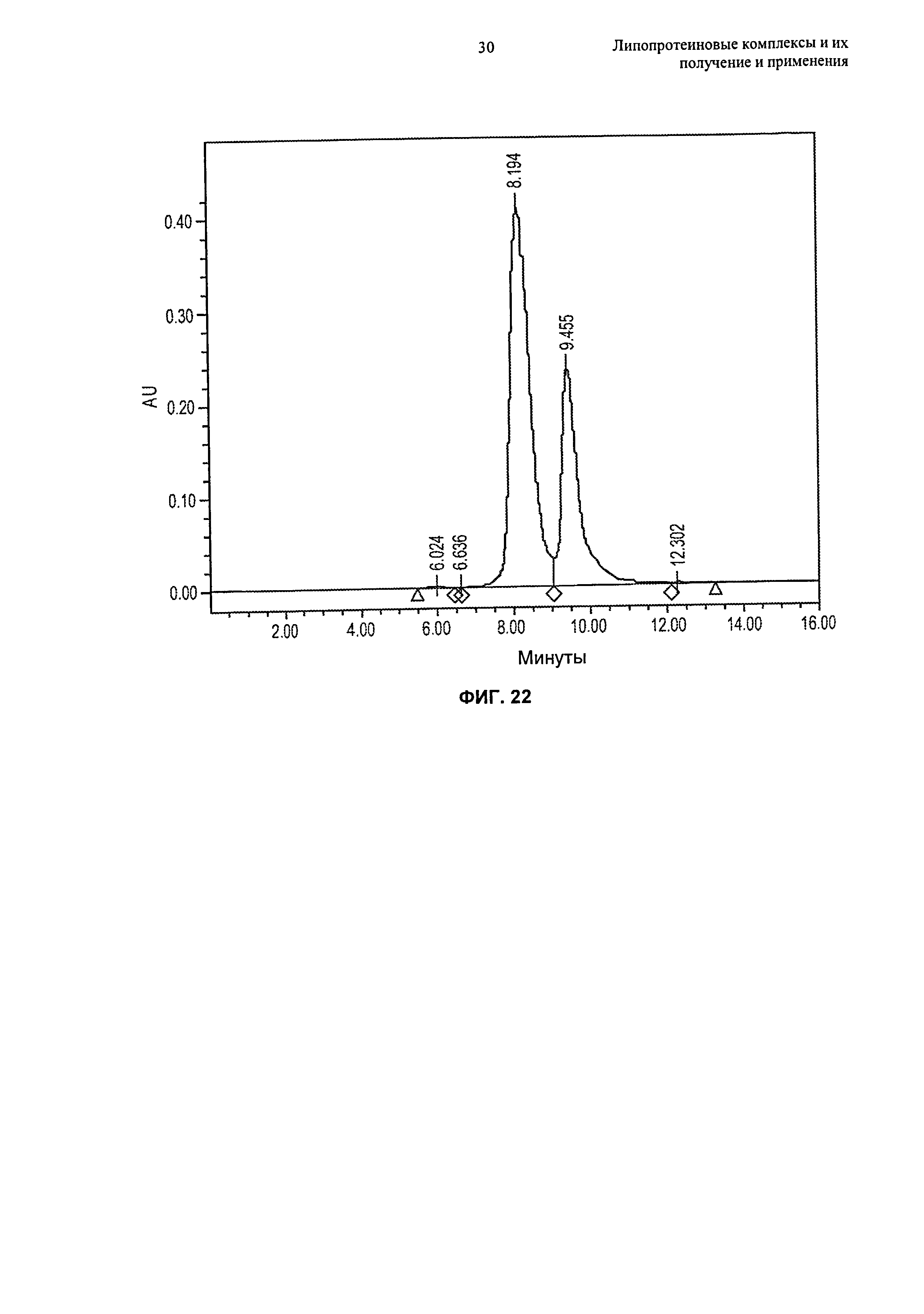
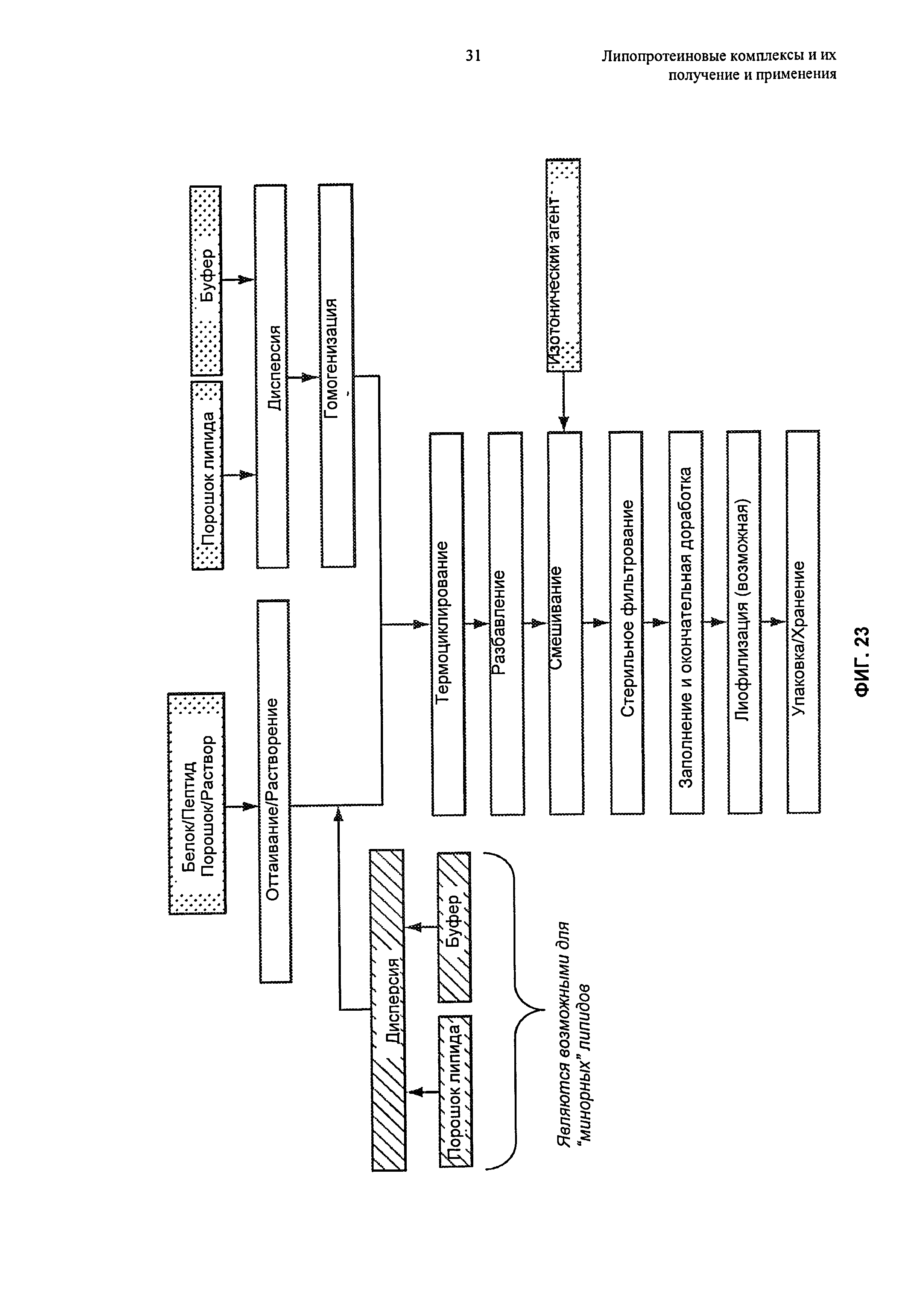
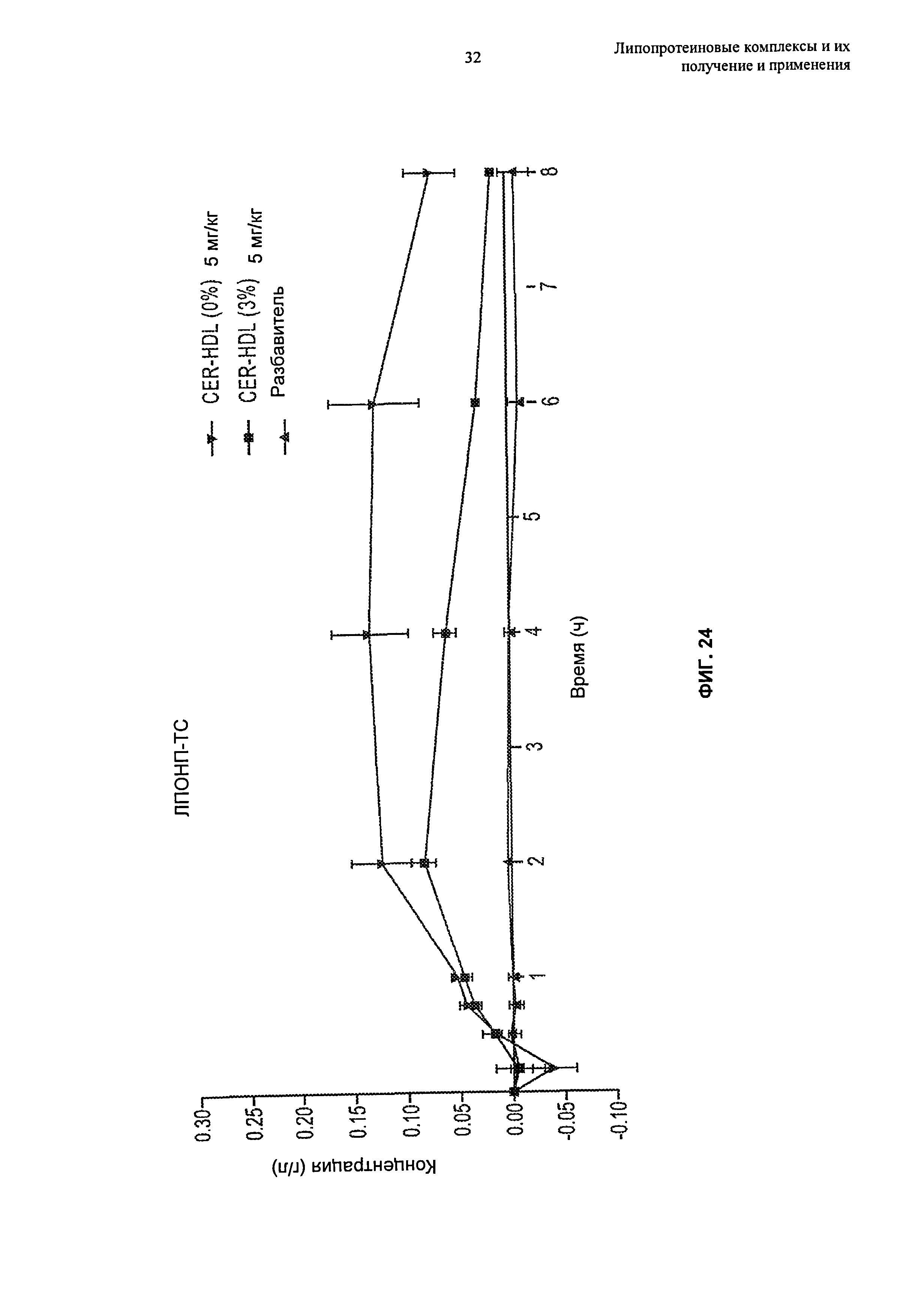
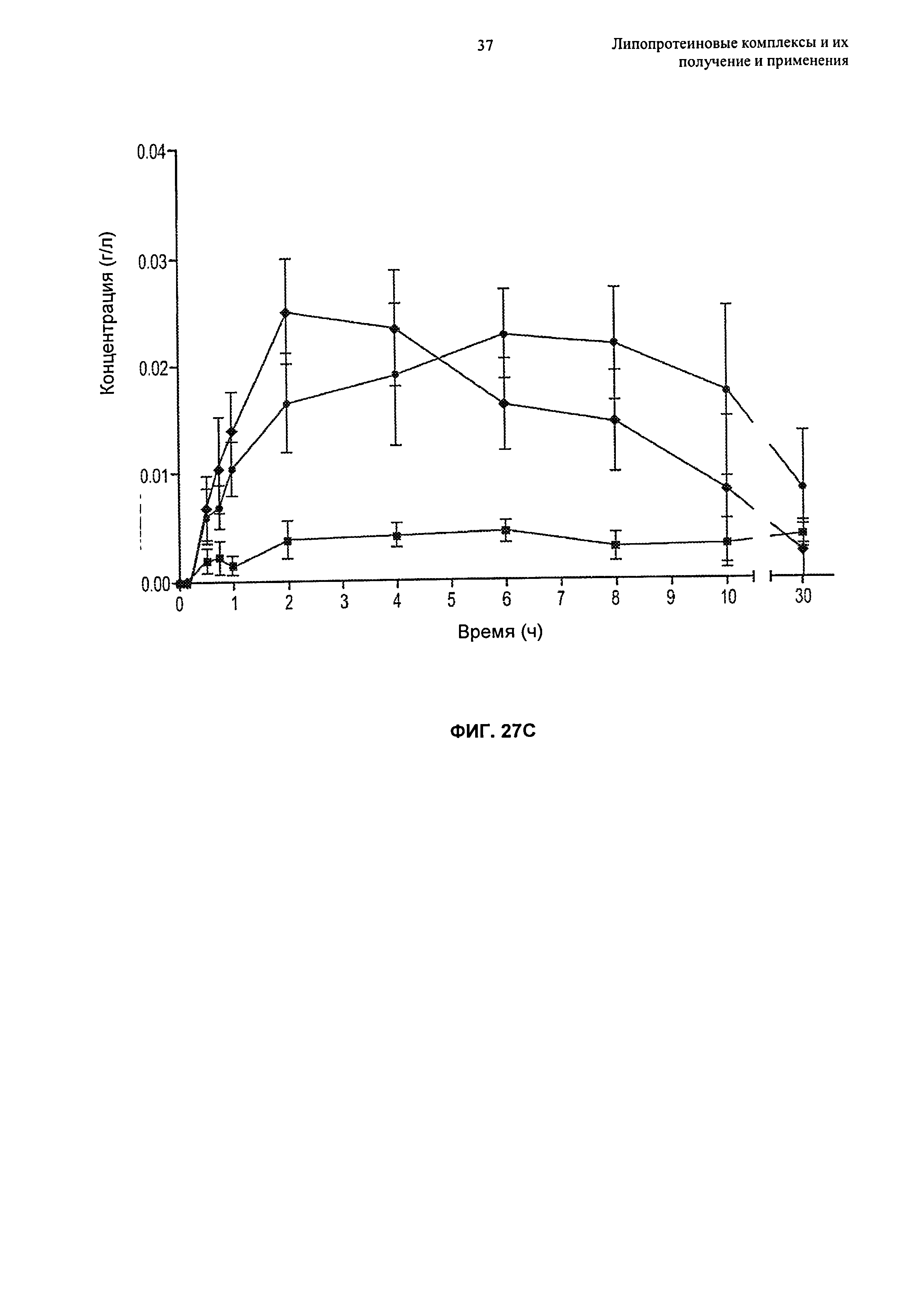
Описание
1. ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет согласно 35 U.S.С. §119 (е) в отношении предварительной заявки № 61/440371, поданной 7 февраля 2011, предварительной заявки № 61/452630, поданной 14 марта 2011, и предварительной заявки № 61/487263, поданной 17 мая 2011, где содержания всех этих документов полностью включены в настоящее описание посредством ссылки.
2. ОБЛАСТЬ ТЕХНИКИ
В настоящем изобретении предложены липопротеиновые комплексы, фармацевтические композиции, содержащие эти комплексы, способы получения и очистки аполипопротеинов для таких комплексов, способы получения этих комплексов и способы применения этих комплексов для лечения или предупреждения сердечно-сосудистых заболеваний, расстройств и/или состояний, связанных с ними.
3. ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
3.1. Обзор
Циркулирующий в крови холестерин переносится липопротеинами плазмы, представляющими собой комплексные частицы, состоящие из липида и белка, которые осуществляют транспорт липидов в крови. Четыре основных класса липопротеиновых частиц циркулируют в плазме и вовлечены в систему транспорта жиров: хиломикроны, липопротеин очень низкой плотности (ЛПОНП), липопротеин низкой плотности (ЛПНП) и липопротеин высокой плотности (ЛПВП). Хиломикроны составляют короткоживущий продукт всасывания жиров в кишечнике. ЛПОНП и, в частности, ЛПНП ответственны за доставку холестерина из печени (где он синтезируется или получен из пищевых источников) во внепеченочные ткани, включая стенки кровеносных сосудов. ЛПВП, напротив, опосредуют обратный транспорт холестерина (RCT), удаление холестериновых липидов, в частности, из внепеченочных тканей в печень, где он запасается, претерпевает катаболизм, подвергается элиминации или рециркуляции. ЛПВП также играют благоприятную роль при воспалении, транспорте окисленных липидов и интерлейкина, что может, в свою очередь, уменьшать воспаление в стенках кровеносных сосудов.
Липопротеиновые частицы имеют гидрофобное ядро, состоящее из холестерина (обычно в форме сложного эфира холестерина) и триглицеридов. Это ядро окружено поверхностной оболочкой, включающей фосфолипиды, неэтерифицированный холестерин и аполипопротеины. Аполипопротеины опосредуют транспорт липидов, и некоторые из них могут взаимодействовать с ферментами, вовлеченными в метаболизм липидов. Идентифицировано по меньшей мере десять аполипопротеинов, включающих: АроА-I, АроА-II, АроА-IV, ApoA-V, ApoB, ApoC-I, ApoC-II, ApoC-III, ApoD, ApoE, ApoJ и АроН. Также обнаружено, что с липопротеинами связаны некоторые белки, такие как LCAT (лецитин:холестерин ацилтрансфераза), СЕТР (транспортный белок холестериновых эфиров), PLTP (транспортный белок фосфолипидов) и PON (параоксоназа).
Сердечно-сосудистые заболевания, такие как коронарная болезнь сердца, болезнь коронарных артерий и атеросклероз, в подавляющем большинстве случаев связаны с повышенными уровнями сывороточного холестерина. Например, атеросклероз представляет собой медленно прогрессирующее заболевание, характеризующееся аккумуляцией холестерина внутри стенок артерий. Убедительные доказательства подтверждают теорию, что липиды, депонируемые в атеросклеротических повреждениях, имеют происхождение главным образом от ЛПНП плазмы; поэтому ЛПНП стали общеизвестны как "плохой" холестерин. Напротив, уровни сывороточных ЛПВП имеют обратную корреляцию с коронарной болезнью сердца. Действительно, высокие уровни ЛПВП рассматривают как отрицательный фактор риска. Выдвинута гипотеза, что высокие уровни ЛПВП плазмы не только обладают защитным действием против болезни коронарных артерий, но могут действительно индуцировать регрессию атеросклеротической бляшки (см., например, Badimon et al., 1992, Circulation 86 (Suppl. III):86-94; Dansky and Fisher, 1999, Circulation 100:1762-63; Tangirala et al., 1999, Circulation 100(17):1816-22; Fan et al., 1999, Atherosclerosis 147(1):139-45; Deckert et al., 1999, Circulation 100(11):1230-35; Boisvert et al., 1999, Arterioscler. Thromb. Vase. Biol.l9(3):525-30; Benoit et al., 1999, Circulation 99(1):105-10; Holvoet et al., 1998, J. Clin. Invest. 102(2):379-85; Duverger et al., 1996, Circulation 94(4):713-17; Miyazaki et al., 1995, Arterioscler. Thromb. Vase. Biol. 15(11):1882-88; Mezdour et al., Atherosclerosis 113(2):237-46; Liu et al., 1994, J. Lipid Res. 35(12):2263-67; Plump et al., 1994, Proc. Nat. Acad. Sci. USA 91(20):9607-11; Paszty et al., 1994, J. Clin. Invest. 94(2):899-903; She et al, 1992, Chin. Med. J. (Engl). 105(5):369-73; Rubin et al., 1991, Nature 353(6341):265-67; She et al., 1990, Ann. NY Acad. Sci. 598:339-51; Ran, 1989, Chung Hua Ping Li Hsueh Tsa Chih (also translated as: Zhonghua Bing Li Xue Za Zhi) 18(4):257-61; Quezado et al., 1995, J. Pharmacol. Exp. Ther. 272(2):604-I 1; Duverger et al., 1996, Arterioscler. Thromb. Vase. Biol. 16(12):1424-29; Kopfler et al., 1994, Circulation; 90(3):1319-27; Miller et al., 1985, Nature 314(6006):109-11; На et al., 1992, Biochim. Biophys. Acta 1125(2):223-29; Beitz et al., 1992, Prostaglandins Leukot. Essent. Fatty Acids 47(2):149-52). Вследствие этого ЛПВП стали общеизвестны как "хороший" холестерин (см., например, Zhang, et al., 2003 Circulation 108:661-663).
"Защитная" роль ЛПВП подтверждена в ряде исследований (например, Miller et al., 1977, Lancet 1 (8019):965-68; Whayne et al., 1981, Atherosclerosis 39:411-19). В этих исследованиях оказалось, что ЛПНП связаны с повышенным риском сердечно-сосудистых заболеваний, тогда как высокие уровни ЛПВП, по-видимому, создают защиту от сердечно-сосудистых заболеваний. В исследованиях in vivo дополнительно продемонстрирована защитная роль ЛПВП, причем показано, что инфузии ЛПВП кроликам могут затруднять развитие индуцированных холестерином повреждений артерий (Badimon et al., 1989. Lab. Invest. 60:455-61) и/или индуцировать их регрессию (Badimon et al., 1990. J. Clin. Invest. 85:1234-41).
3.2. Обратный транспорт холестерина, ЛПВП и аполипопротеин A-I
Биохимический путь обратного транспорта холестерина (RCT) функционирует для удаления холестерина из большинства внепеченочных тканей и принципиально важен для поддержания структуры и функции большинства клеток в организме. Путь RCT состоит, в основном, из трех следующих стадий: (а) эффлюкс холестерина, то есть первоначальное удаление холестерина из различных пулов периферических клеток; (b) этерификация холестерина под действием лецитин:холестерин ацилтрансферазы (LCAT), предотвращающая обратное поступление выведенного холестерина в клетки; и (с) захват ЛПВП-холестерина и холестериновых эфиров клетками печени для гидролиза с последующей рециркуляцией, запасанием, выделением с желчью или катаболизмом до желчных кислот.
LCAT, представляющая собой ключевой фермент в пути RCT, продуцируется печенью и циркулирует в плазме в связи с фракцией ЛПВП. LCAT преобразует холестерин клеточного происхождения в холестериновые эфиры, которые изолируются в ЛПВП, предназначенных для удаления (см. Jonas 2000, Biochim. Biophys. Acta 1529(I-3):245-56). Транспортный белок холестериновых эфиров (СЕТР) и транспортный белок фосфолипидов (PLTP) вносят вклад в дальнейшее ремоделирование циркулирующей совокупности ЛПВП. Белок СЕТР перемещает холестериновые эфиры, образуемые LCAT, на другие липопротеины, в частности, АроВ-содержащие липопротеины, такие как ЛПОНП и ЛПНП. PLTP поставляет лецитин в ЛПВП. Триглицериды ЛПВП катаболизируются внеклеточной печеночной триглицеридлипазой, и холестерин липопротеинов удаляется печенью посредством нескольких механизмов.
Функциональные характеристики частиц ЛПВП определяются, в основном, их основными аполипопротеиновыми компонентами, такими как АроА-I и АроА-II. Также наблюдали, что с ЛПВП связаны минорные количества АроС-I, АроС-II, ApoC-III, ApoD, ApoA-IV, ApoE и ApoJ. ЛПВП существуют в широком разнообразии различных размеров и различных смесей вышеупомянутых компонентов в зависимости от состояния ремоделирования в процессе метаболического каскада или биохимического пути RCT.
Каждая частица ЛПВП обычно включает по меньшей мере одну молекулу, и обычно от двух до 4 молекул АроА-I. Частицы ЛПВП могут также включать только ApoE (частицы гамма-LpE), которые также известны как ответственные за эффлюкс холестерина, как описано Prof Gerd Assmann (см., например, von Eckardstein et al., 1994, Curr Opin Lipidol. 5(6):404-16). ApoA-I синтезируется печенью и тонком кишечником в виде препроаполипопротеина А-I, который секретируется в виде проаполипопротеина A-I (proApoA-I) и быстро расщепляется с образованием плазматической формы ApoA-I, одной полипептидной цепи, состоящей из 243 аминокислот (Brewer et al., 1978, Biochem. Biophys. Res. Commun. 80:623-30). Препро-АроА-I, который экспериментально инъецируют непосредственно в кровоток, также расщепляется до плазматической формы АроА-I (Klon et al., 2000, Biophys. J. 79(3):1679-85; Segrest et al., 2000, Curr. Opin. Lipidol. 11(2):105-15; Segrest et al., 1999, J. Biol. Chem. 274 (45):31755-58).
ApoA-I включает от 6 до 8 различных 22-аминокислотных альфа-спиралей или функциональных повторов, разделенных линкерной группировкой, часто представляющей собой пролин. Повторяющиеся звенья находятся в амфипатической спиральной конформации (Segrest et al., 1974, FEBS Lett. 38:247-53) и придают ApoA-I основные биологические активности, то есть связывание липидов и активацию лецитин:холестерин ацилтрансферазы (LCAT).
ApoA-I образует три типа стабильных комплексов с липидами: небольшие, бедные липидами комплексы, называемые пре-бета-1 ЛПВП; сплюснутые дисковидные частицы, содержащие полярные липиды (фосфолипид и холестерин), называемые пре-бета-2 ЛПВП; и сферические частицы, содержащие как полярные, так и неполярные липиды, называемые сферическими или зрелыми ЛПВП (ЛПВП3 и ЛПВП2). Большинство ЛПВП в циркулирующей совокупности содержит как ApoA-I, так и АроА-II ("фракция AI/AII-ЛПВП"). Тем не менее, фракция ЛПВП, содержащая только ApoA-I ("фракция AI-ЛПВП") оказалась более эффективной в RCT. Некоторые эпидемиологические исследования подтверждают гипотезу о том, что фракция АроА-I-ЛПВП является антиатерогенной (Parra et al., 1992, Arterioscler. Thromb. 12:701-07; Decossin et al., 1997, Eur. J. Clin. Invest. 27:299-307).
Частицы ЛПВП составляют несколько совокупностей частиц, имеющих различные размеры, липидную композицию и композицию аполипопротеинов. Их можно разделить в соответствии с их свойствами, включающими их гидратированную плотность, композицию аполипопротеинов и характеристики заряда. Например, фракция пре-бета-ЛПВП характеризуется более низким поверхностным зарядом, чем зрелые частицы альфа-ЛПВП. В связи с различием их заряда пре-бета-ЛПВП и зрелые альфа-ЛПВП обладают различными электрофоретическими подвижностями в агарозном геле (David et al., 1994, J. Biol. Chem. 269(12):8959-8965).
Метаболизм пре-бета-ЛПВП и зрелых альфа-ЛПВП также различается. Пре-бета-ЛПВП имеют два пути метаболизма: либо удаление из плазмы и катаболизм почками, либо ремоделирование до ЛПВП среднего размера, которые преимущественно разлагаются печенью (Lee et al., 2004, J. Lipid Res. 45(4):716-728).
Хотя механизм транспорта холестерина из клеточной поверхности (то есть эффлюкса холестерина) неизвестен, считают, что бедный липидами комплекс, пре-бета-1 ЛПВП, является предпочтительным акцептором холестерина, переносимого из периферической ткани, вовлеченного в RCT (см. Davidson et al., J. Biol. Chem. 269:22975-82; Bielicki et al., 1992, J. Lipid Res. 33:1699-1709; Rothblat et al., 1992, J. Lipid Res. 33:1091-97; и Kawano et al., 1993, Biochemistry 32:5025-28; Kawano et al., 1997, Biochemistry 36:9816-25). Во время этого процесса рекрутмента холестерина из клеточной поверхности пре-бета-1 ЛПВП быстро преобразуются в пре-бета-2 ЛПВП. PLTP может увеличить скорость образования диска пре-бета-2 ЛПВП, но данные, указывающие на роль PLTP в RCT, отсутствуют. LCAT взаимодействует преимущественно с дисковидными, мелкими (пре-бета) и сферическими (то есть зрелыми) ЛПВП, перенося 2-ацильную группу лецитина или других фосфодипидов на свободный гидроксильный остаток холестерина с образованием холестериновых эфиров (удерживаемых в ЛПВП) и лизолецитина. Для этой реакции LCAT требуется АроА-I в качестве активатора; то есть АроА-I является природным кофактором LCAT. Преобразование холестерина, изолированного в ЛПВП, в его сложный эфир предотвращает обратное поступление холестерина в клетку, и конечным результатом является удаление холестерина из клетки.
Холестериновые эфиры в зрелых частицах ЛПВП во фракции частиц ApoAI-ЛПВП (то есть содержащих АроА-I и не содержащих АроА-II) удаляются печенью и претерпевают процессинг в желчи более эффективно, чем частицы, имеющие происхождение от ЛПВП, содержащих и АроА-I, и АроА-II (фракции AI/AII-ЛПВП). Это может быть отчасти связано с более эффективным связыванием ApoAI-ЛПВП с мембраной гепатоцита. Выдвинута гипотеза о существовании рецептора ЛПВП, и фагоцитарный рецептор класса В типа I (SR-BI) идентифицирован как рецептор ЛПВП (Acton et al., Science 271:518-20; Xu et al., 1997, Lipid Res. 38:1289-98). SR-BI более обильно экспрессируется в стероидогенных тканях (например, в надпочечниках) и в печени (Landschulz et al., 1996, J. Clin. Invest. 98:984-95; Rigotti et at., 1996, J. Biol. Chem. 271:33545-49). Обзор рецепторов ЛПВП см. в Broutin et al., 1988, Anal. Biol. Chem. 46:16-23.
Первоначальное липидирование АТФ-связывающего кассетного переносчика AI, по-видимому, является критическим для образования плазматических частиц ЛПВП и для способности частиц пре-бета-ЛПВП к осуществлению эффлюкса холестерина (Lee and Parks, 2005, Curr. Opin. Lipidol. 16(1):19-25). Согласно этим авторам, это первоначальное липидирование обеспечивает более эффективное функционирование пре-бета-ЛПВП в качестве акцептора холестерина и предотвращает быструю ассоциацию АроА-I с предсуществующими плазматическими частицами ЛПВП, что приводит в результате к большей доступности частиц пре-бета-ЛПВП для эффлюкса холестерина.
СЕТР может также играть роль в RCT. Изменения в активности СЕТР или его акцепторах, ЛПОНП и ЛПНП, играет роль в "ремоделировании" совокупности ЛПВП. Например, в отсутствие СЕТР, ЛПВП становятся расширенными частицами, которые не претерпевают клиренс. (Обзор RCT и ЛПВП см. в статьях Fielding and Fielding, 1995, J. Lipid Res. 36:211-28; Barrans et al., 1996, Biochem. Biophys. Acta 1300:73-85; Hirano et al., 1997, Arterioscler. Thromb. Vase. Biol. 17(6):1053- 59).
ЛПВП также играют роль в обратном транспорте других липидов и неполярных молекул, а также в детоксикации, то есть в транспорте липидов из клеток, органов и тканей в печень для катаболизма и выведения. Такие липиды включают сфингомиелин (SM), окисленные липиды и лизофосфатидилхолин. Например, авторами Robins и Fasulo (1997, J. Clin. Invest. 99:380-84) показано, что ЛПВП стимулируют транспорт растительного стерина печенью в секреции желчи.
Основной компонент ЛПВП, АроА-I, может связываться с SM in vitro. При восстановлении in vitro комплекса АроА-I с SM головного мозга коров (BBSM) максимальная скорость восстановления наблюдается при температуре 28°С, приближенной к температуре фазового перехода для BBSM (Swaney, 1983, J. Biol. Chem. 258(2), 1254-59). При соотношениях BBSM:ApoA-I, составляющих 7,5:1 или менее (масс./масс.), образуется единая гомогенная восстановленная частица ЛПВП, содержащая три молекулы АроА-I на частицу и имеющая молярное отношение BBSM:ApoA-I, составляющее 360:1. Эта частица под электронным микроскопом выглядит как дисковидный комплекс, подобный комплексу, наблюдаемому при рекомбинации ApoA-I с фосфатидилхолином при повышенных соотношениях фосфолипид/белок. При соотношениях BBSM:ApoA-I, составляющих 15:1 (масс./масс.), тем не менее, образуются дисковидные комплексы большего диаметра, имеющие более высокое молярное отношение фосфолипид:белок (535:1). Эти комплексы имеют значительно больший размер, более стабильны и более устойчивы к денатурации, чем комплексы ApoA-I, образованные с фосфатидилхолином.
Содержание сфингомиелина (SM) повышено в ранних акцепторах холестерина (пре-бета-ЛПВП и гамма-мигрирующем АроЕ-содержащем липопротеине), что позволяет предположить, что SM может усиливать способность этих частиц к стимуляции эффлюкса холестерина (Dass and Jessup, 2000, J. Pharm. Pharmacol. 52:731-61; Huang et al., 1994, Proc. Natl. Acad. Sci. USA 91:1834-38; Fielding and Fielding 1995, J. Lipid Res. 36:211-28).
3.3 Защитный механизм ЛПВП и ApoA-I
Исследования защитного механизма(ов) ЛПВП сосредоточены на аполипопротеине A-I (ApoA-I), являющемся основным компонентом ЛПВП. Высокие уровни ApoA-I в плазме связаны с отсутствием или уменьшением повреждений коронарных сосудов (Maciejko et al., 1983, N. Engl. J. Med. 309:385-89; Sedlis et al., 1986, Circulation 73:978-84).
Инфузия ApoA-I или ЛПВП подопытным животным вызывает значительные биохимические изменения, а также снижает степень и тяжесть атеросклеротических повреждений. После первоначального сообщения авторов Maciejko and Мао (1982, Arteriosclerosis 2:407a), Badimon et al., (1989, Lab. Invest. 60:455-61; 1989, J. Clin. Invest. 85:1234-41), обнаруживших, что эти частицы могут значительно снижать степень атеросклеротических повреждений (снижение на 45%) и содержание холестеринового эфира (снижение на 58,5%) у кроликов, которых кормили холестерином, посредством инфузии ЛПВП (d=1,063-1,325 г/мл). Эти авторы также обнаружили, что ЛПВП приводят к регрессии установленных повреждений, от заживления до 50% регрессии. Авторами Esper et al. (1987, Arteriosclerosis 7:523a) показано, что инфузии ЛПВП могут заметно изменить композицию плазматических липопротеинов кроликов линии Watanabe с наследственной гиперхолестеринемией, у которых развиваются ранние артериальные повреждения. У этих кроликов в результате инфузий ЛПВП соотношение между защитными ЛПВП и атерогенными ЛПНП может увеличиться более чем вдвое.
Потенциал ЛПВП по предупреждению артериального заболевания в моделях на животных дополнительно оценен в результате наблюдения того, что АроА-I может осуществлять фибринолитическую активность in vitro (Saku et al., 1985, Thromb. Res. 39:1-8). Автором Ronneberger (1987, Xth Int. Congr. Pharmacol., Sydney, 990) показано, что ApoA-I может повышать фибринолиз у собак породы бигль и у яванских макаков. Подобная активность может быть отмечена in vitro на плазме человека. Ronneberger смог подтвердить уменьшение липидных отложений и образования артериальных бляшек у животных, обработанных ApoA-I.
Исследования in vitro показывают, что комплексы ApoA-I и лецитина могут стимулировать эффлюкс свободного холестерина из культивируемых артериальных гладкомышечных клеток (Stein et al., 1975, Biochem. Biophys. Acta, 380:106-18). За счет данного механизма ЛПВП может также снижать пролиферацию этих клеток (Yoshida et al., 1984, Exp. Mol Pathol. 41:258-66).
Также показано, что инфузионная терапия ЛПВП, содержащими ApoA-I или пептидные миметики ApoA-I регулирует плазматические уровни ЛПВП посредством переносчика АВС1, что приводит к эффективности при лечении сердечно-сосудистых заболеваний (см., например, Brewer et al., 2004, Arterioscler. Thromb. Vase. Biol. 24:1755-1760).
Выделено два природных полиморфизма ApoA-I человека, в которых остаток аргинина заменен цистеином. В аполипопротеине A-IMilano (АроА-IM) данная замена происходит в остатке 173, тогда как в аполипопротеине A-IParis (ApoA-IP) данная замена происходит в остатке 151 (Franceschini et al., 1980, J. Clin. Invest. 66:892-900; Weisgraber et al., 1983, J. Biol. Chem. 258:2508-13; Bruckert et al., 1997, Atherosclerosis 128:121-28; Daum et al., 1999, J. Mol. Med. 77:614-22; Klon et al., 2000, Biophys. J. 79(3):1679-85). Кроме того, выделен еще один природный полиморфизм ApoA-I человека, в котором лецитин заменен аргинином в остатке 144. Данный полиморфизм назван Apolipoprotein A-IZaragoza (ApoA-IZ) и связан с тяжелой гипоальфа-липопротеинемией и повышенным эффектом обратного транспорта холестерина липопротеинов высокой плотности (ЛПВП) (Recalde et al., 2001, Atherosclerosis 154(3):613-623; Fiddyment et al., 2011, Protein Expr. Purif. 80(1):110-116).
Восстановленные частицы ЛПВП, включающие гомодимеры либо АроА-IM, либо ApoA-Ip, связанных дисульфидными связями, подобны восстановленным частицам ЛПВП, включающим АроА-I дикого типа, по их способности к клиренсу эмульсий димиристоилфосфатидилхолина (DMPC) и по их способности к стимуляции эффлюкса холестерина (Calabresi et al., 1997b, Biochemistry 36:12428-33; Franceschini et al., 1999, Arterioscler. Thromb. Vase. Biol. 19:1257-62; Daum et al., 1999, J. Mol. Med. 77:614-22). При обеих мутациях гетерозиготные индивидуумы обладают пониженными уровнями ЛПВП, но, что парадоксально, обладают повышенным риском атеросклероза (Franceschini et al., 1980, J. Clin. Invest. 66:892-900; Weisgraber et al., 1983, J. Biol. Chem. 258:2508-13; Bruckert et al., 1997, Atherosclerosis 128:121-28). Восстановленные частицы ЛПВП, включающие любой из вариантов, способны к активации LCAT, хотя с пониженной эффективностью по сравнению с частицами ЛПВП, включающими АроА-I дикого типа (Calabresi et al., 1997, Biochem. Biophys. Res. Commun. 232:345-49; Daum et al., 1999, J. Mol. Med. 77:614-22).
Мутация АроА-IM передается как аутосомно-доминантный признак; идентифицировано восемь поколений носителей внутри семьи (Gualandri et al., 1984, Am. J. Hum. Genet. 37:1083-97). Состояние индивидуума-носителя АроА-IM характеризуется заметным снижением уровня ЛПВП-холестерина. Несмотря на это, у индивидуумов-носителей явным образом не показан какой-либо повышенный риск артериального заболевания. Действительно, в результате исследования родословных оказалось, что эти субъекты могут быть "защищены" от атеросклероза (Sirtori et al., 2001, Circulation, 103:1949-1954; Roma et al., 1993, J. Clin. Invest. 91(4):1445-520).
По-видимому, возможный механизм защитного эффекта АроА-IM у носителей мутации связан с модификацией в структуре мутантного АроА-IM с утратой одной альфа-спирали и повышенной доступностью гидрофобных остатков (Franceschini et al., 1985, J. Biol. Chem. 260:1632-35). Утрата плотно уложенной структуры множественных альфа-спиралей приводит к повышенной гибкости молекулы, которая легче связывается с липидами по сравнению с нормальным АроА-I. Кроме того, липопротеиновые комплексы в большей степени склонны к денатурации, что, таким образом, позволяет предположить, что в случае мутанта доставка липидов также улучшается.
Авторами Bielicki et al. (1997, Arterioscler. Thromb. Vase. Biol. 17(9):1637-43) показано, что АроА-IM обладает ограниченной способностью рекрутировать мембранный холестерин по сравнению с АроА-I дикого типа. Кроме того, вновь образованные ЛПВП в результате связывания с АроА-IM с мембранными липидами преимущественно представляли собой частицы, имеющие размер 7,4 нм, вероятнее, чем комплексы большего размера от 9 до 11 нм, образованные АроА-I дикого типа. Эти наблюдения указывают на то, что замена Arg173->Cys173 в первичной последовательности АроА-I препятствовала нормальному процессу рекрутмента клеточного холестерина и сборки вновь образованных ЛПВП. Эта мутация явным образом связана с пониженной эффективностью удаления холестерина из клеток. Следовательно, его антиатерогенные свойства могут быть не связаны с RCT.
Наиболее резким структурным изменением, свойственным замене Arg173->Cys173 является димеризация АроА-IM (Bielicki et al., 1997, Arterioscler. Thromb. Vase. Biol. 17(9):1637-43). АроА-IM могут образовать гомодимеры друг с другом и гетеродимеры с АроА-II. Исследования фракций крови, содержащих смесь аполипопротеинов, показывают, что присутствие димеров и комплексов в кровообращении может быть ответственным за повышенный период полувыведения аполипопротеинов. Такой повышенный период полувыведения наблюдали в клинических исследованиях носителей этой мутации (Gregg et al., 1988, NATO ARW on Human Apolipoprotein Mutants: From Gene Structure to Phenotypic Expression, Limone S G). В других исследованиях показано, что димеры АроА-IM (ApoA-IM/ApoA-Im) действуют как фактор ингибирования при взаимном преобразовании частиц ЛПВП in vitro (Franceschini et al., 1990, J. Biol. Chem. 265:12224-31).
3.4 Современные терапии дислипидемии и родственных расстройств
Дислипидемические расстройства представляют собой заболевания, связанные с повышенными уровнями холестерина и триглицеридов в сыворотке и сниженными отношениями ЛПВПЛПНП в сыворотке, и включают гиперлипидемию, в частности, гиперхолестеринемию, коронарную болезнь сердца, болезнь коронарных артерий, васкулярные и периваскулярные заболевания и сердечно-сосудистые заболевания, такие как атеросклероз. Эти расстройства также включают синдромы, обусловленные атеросклерозом, такие как преходящая ишемическая атака или перемежающаяся хромота, вызванные артериальной недостаточностью. В настоящее время доступен ряд терапий для снижения повышенных уровней холестерина и триглицеридов в сыворотке, обусловленных дислипидемическими расстройствами. Тем не менее, каждая из них имеет свои недостатки и ограничения в отношении эффективности, побочных эффектов и качества жизни пациентов.
Смолы, связывающие желчные кислоты, представляют собой класс лекарственных средств, препятствующих рециркуляции желчных кислот из кишечника в печень; например, холестирамин (Questran Light®, Bristol-Myers Squibb), колестипол гидрохлорид (Colestid®, The Upjohn Company) и колесевелам гидрохлорид (Welchol®, Daiichi-Sankyo Company). При пероральном приеме эти положительно заряженные смолы связываются с отрицательно заряженными желчными кислотами в кишечнике. Поскольку эти смолы не могут всасываться из кишечника, они выводятся, унося с собой желчные кислоты. Тем не менее, применение таких смол в лучшем случае снижает сывороточные уровни холестерина лишь приблизительно на 20% и сопровождается желудочно-кишечными побочными эффектами, включая констипацию и дефицит некоторых витаминов. Кроме того, поскольку эти смолы связывают другие лекарственные средства, другие пероральные лекарственные средства необходимо принимать по меньшей мере за час или спустя от четырех до шести часов после приема смолы; таким образом, это осложняет схемы лечения пациентов с сердечными заболеваниями.
Статины представляют собой агенты, снижающие уровни холестерина, которые блокируют синтез холестерина посредством ингибирования HMGCoA редуктазы, являющейся ключевым ферментом, вовлеченным в путь биосинтеза холестерина. Статины, например, ловастатин (Mevacor®), симвастатин (Zocor®), правастатин (Pravachol®), флувастатин (Lescol®) и аторвастатин (Lipitor®), иногда применяют в комбинации со смолами, связывающими желчные кислоты. Статины значительно снижают сывороточные уровни холестерина-ЛПНП и замедляют прогрессирование коронарного атеросклероза. Тем не менее, сывороточные уровни холестерина-ЛПВП только умеренно повышаются. В механизм снижения уровней ЛПНП могут быть вовлечены как снижение концентрации ЛПОНП, так и индукция клеточной экспрессии ЛПНП-рецептора, приводя к сниженному продуцированию и/или повышенному катаболизму ЛПНП. Применение этих лекарственных средств сопровождается побочными эффектами, включающими дисфункцию печени и почек (The Physicians Desk Reference, 56th Ed., 2002, Medical Economics).
Ниацин (никотиновая кислота) представляет собой водорастворимый комплекс витамина В, применяемый в качестве пищевой добавки и гиполипидемического агента. Ниацин уменьшает продуцирование ЛПОНП и эффективен при снижении ЛПНП. В некоторых случаях его применяют в комбинации со смолами, связывающими желчные кислоты. Ниацин может повысить содержание ЛПВП при применении в адеквантых дозах, тем не менее, его польза ограничена серьезными побочными эффектами при применении в таких высоких дозах. Niaspan® представляет собой форму ниацина пролонгированного высвобождения, которая дает меньше побочных эффектов, чем чистый ниацин. Ниацин/ловастатин (Nicostatin®) представляет собой препарат, содержащий как ниацин, так и ловастатин, который объединяет полезные эффекты каждого из этих лекарственных средств.
Фибраты представляют собой класс лекарственных средств, которые снижают уровни липидов, применяемых для лечения различных форм гиперлипидемии (то есть повышенных сывороточных уровней триглицеридов), которые могут также сопровождаться гиперхолестеринемией. Фибраты, по-видмому, снижают фракцию ЛПОНП и умеренно снижают ЛПВП, Тем не менее, эффект этих лекарственных средств в отношении сывороточного холестерина варьирует. В США фибраты, такие как клофибрат (Atromid-S®), фенофибрат (Tricor®) и безафибрат (Bezalip®), одобрены для применения в качестве антилипидемических лекарственных средств, но не получили подтверждения в качестве агентов против гиперхолестеринемии. Например, клофибрат представляет собой антилипидемический агент, действующий (посредством неизвестного механизма) как снижающий сывороточные уровни триглицеридов посредством снижения фракции ЛПОНП. Хотя холестерин может снижаться в некоторых подгруппах пациентов, биохимический ответ на это лекарственное средство варьирует, и не всегда возможно предсказать, какие пациенты получат благоприятные результаты. Atromid-S® не показан как эффективный для предупреждения коронарной болезни сердца. Химически и фармацевтически родственное лекарственное средства, гемфиброзил (Lopid®) представляет собой агент, регулирующий липиды, который умеренно снижает уровни триглицеридов и холестерина-ЛПОНП в сыворотке, а также умеренно повышает субфракции холестерина-ЛПВП холестерин-ЛПВП2 и -ЛПВП3, а также как АроА-I, так и А-II (то есть фракцию AI/АМТ-ЛПВП). Тем не менее, липидный ответ является гетерогенным, в частности, среди различных групп пациентов. Кроме того, хотя у пациентов-мужчин в возрасте от 40 до 55 лет, не имеющих анамнеза или симптомов существующей коронарной болезни сердца, наблюдали предупреждение коронарной болезни сердца, неясно, до какой степени эти наблюдения могут быть экстраполированы на другие группы пациентов (например, женщин, мужчин старшего или более молодого возраста). Действительно, у пациентов с установленной коронарной болезнью сердца эффективности не наблюдали. Применение фибратов сопровождается серьезными побочными эффектами, включающими токсичность, например, злокачественные опухоли (в частности, рак желудочно-кишечного тракта), заболевание мочевого пузыря и повышенную смертность, не связанную с коронарной болезнью сердца.
Заместительная терапия пероральными эстрогенами может быть рассмотрена в случае умеренной гиперхолестеринемии у женщин в период постменопаузы. Тем не менее, повышение уровней ЛПВП может сопровождаться повышением уровней триглицеридов. Конечно, лечение эстрогенами ограничено определенной группой пациентов (женщинами в период постменопаузы) и сопровождается серьезными побочными эффектами, включающими индукцию злокачественных новообразований, заболевание мочевого пузыря, тромбоэмболическое заболевание, аденому печени, повышенное кровяное давление, нарушение толерантности к глюкозе и гиперкальцемию.
Другие средства, полезные для лечения гиперлипидемии, включают эзетиниб (zetia®; Merck), который блокирует или ингибирует всасывание холестерина. Тем не менее, показано, что ингибиторы эзетиниба проявляют некоторые токсичности.
Как ЛПВП, так и рекомбинантные формы АроА-I в комплексе с фосфолипидами могут служить в качестве поглотителей/акцепторов для неполярных или амфипатических молекул, например, холестерина и его производных (оксистеринов, окисленных стеринов, растительных стеринов и т.д.), холестериновых эфиров, фосфолипидов и их производных (окисленных фосфолипидов), триглицеридов, продуктов окисления и липополисахаридов (ЛПС) (см., например, Casas et al., 1995, J. Surg. Res. Nov 59(5):544-52). ЛПВП могут также служить в качестве акцептора для TNF-альфа и других лимфокинов. ЛПВП могут также служить в качестве носителя для сывороточных параоксоназ человека, например, PON-1, -2, -3. Параоксоназа, представляющая собой эстеразу, ассоциированную с ЛПВП, важна для защиты клеточных компонентов от окисления. Окисление ЛПНП, происходящее во время окислительного стресса, по-видимому, прямо связано с атеросклерозом (Aviram, 2000, Free Radic. Res. 33 Suppl:S85-97). Параоксоназа, по-видимому, играет роль в склонности к атеросклерозу и сердечно-сосудистому заболеванию (Aviram, 1999, Mol. Med. Today 5(9):381-86). Сывороточная Параоксоназа человека (PON-1) связана с липопротеинами высокой плотности (ЛПВП). Ее активность обратно связана с атеросклерозом. PON-1 гидролизует фосфорорганические соединения и может защищать от атеросклероза посредством ингибирования окисления ЛПВП и липопротеинов низкой плотности (ЛПНП) (Aviram, 1999, Mol. Med. Today 5(9):381-86). Экспериментальные исследования позволяют предположить, что эта защита обусловлена способностью PON-1 гидролизовать определенные липидные пероксиды в окисленных липопротеинах. Вмешательства, сохраняющие или усиливающие активность PON-1, могут помочь замедлить возникновение атеросклероза и коронарной болезни сердца.
Кроме того, ЛПВП играет роль в качестве антитромботического агента и редуцирующего агента фибриногена, а также в качестве средства при геморрагическом шоке (Cockerill et al., WO 01/13939, опубликованная 1 марта 2001). Показано, что ЛПВП, и, в частности, АроА-I способствует обмену липополисахарида, продуцируемого в результате сепсиса, до липидных частиц, включающих АроА-I, приводя в результате к функциональной нейтрализации липополисахарида (Wright et al., WO 9534289, опубликованная 21 декабря 1995; Wright et al., патент US №5928624, опубликованный 27 июля 1999; Wright et al., патент US №5932536, опубликованный 3 августа 1999).
Существует ряд способов, доступных для получения липопротеиновых комплексов in vitro. В патентах US №№6287590 и 6455088 раскрыт способ, включающий совместную лиофилизацию аполипопротеина и липидных растворов в органическом растворителе (или в смеси растворителей) и образование заряженных липопротеиновых комплексов во время гидратации лиофилизированного порошка. Липопротеиновые комплексы могут быть также образованы способом детергентного диализа; например, смесь липида, липопротеина и детергента, такого как холат, подвергают диализу и восстанавливают с образованием комплекса (см., например, Jonas et al., 1986, Methods Enzymol. 128:553-82). В Примере 1 публикации US 2004/0067873 раскрыт способ холатной дисперсии, при котором липидную дисперсию объединяют с холатом в условиях образования мицелл, и эти мицеллы, в свою очередь, инкубируют с раствором аполипопротеина с образованием комплекса. Наконец, холат, который является токсичным, необходимо удалить, например, с помощью диализа, ультрафильтрации или адсорбции/абсорбции на аффинных гранулах или на аффинной смоле. В патенте US №6306433 раскрыто образование липопротеинового комплекса, при котором жидкую смесь белка и липида подвергают воздействию гомогенизации высокого давления. Тем не менее, белки, чувствительные к высоким сдвигающим усилиям, могут утрачивать активность под действием гомогенизации высокого давления.
Таким образом, доступные в настоящее время способы получения приводят в результате к потерям исходных веществ, например, разрушению белка, и/или требуют очистки полученного в результате продукта, например, удаления токсичного агента, и, следовательно, являются неэффективными и дорогостоящими. Кроме того, препараты липопротеиновых комплексов могут быть гетерогенными, содержать смесь комплексов, варьирующих по размеру и по композиции. См., например, патент US №5876968. Соответственно, существует необходимость в разработке новых способов получения липопротеиновых комплексов, которые являются эффективными и образуют комплексы, имеющие большую гомогенность, предпочтительно имеющие высокую степень чистоты. Такие способы могли бы дать возможность более экономичного получения в широком масштабе, образуя при этом более однородный фармацевтически приемлемый препарат при меньших рисках побочных эффектов вследствие загрязнений.
Кроме того, терапевтическое применение АроА-I, АроА-IM, ApoA-IP и других вариантов, а также восстановленных ЛПВП, тем не менее, в настоящее время ограничено большим количеством аполипопротеина, требующимся для терапевтического введения, и затратами на получение белка с учетом низкого общего выхода продукции и встречаемости разрушения белка в культурах для рекомбинантной экспрессии белков. (См., например, Mallory et al., 1987, J. Biol. Chem. 262(9):4241-4247; Schmidt et al., 1997, Protein Expression & Purification 10:226-236). В результате ранних клинических исследований предположили, что диапазон дозы составляет от 1,5 до 4 г белка на инфузию для лечения сердечно-сосудистых заболеваний. Число инфузий, необходимое для полного курса лечения, неизвестно. (См., например, Eriksson et al., 1999, Circulation 100(6):594-98; Carlson, 1995, Nutr. Metab. Cardiovasc. Dis. 5:85-91; Nanjee et al., 2000, Arterioscler. Thromb. Vase. Biol. 20(9):2148-55; Nanjee et al., 1999, Arterioscler. Thromb. Vase. Biol. 19(4):979-89; Nanjee et al., 1996, Arterioscler. Thromb. Vase. Biol. 16(9): 1203-14).
Рекомбинантный ApoA-I человека экспрессирован в гетерологичных хозяевах, тем не менее, выход зрелого белка является недостаточным для широкомасштабных клинических применений, в частности, в сочетании с методами очистки, которые дополнительно снижают выходы и приводят в результате к продукту с примесями.
Авторами Weinberg et al., 1988, J. Lipid Research 29:819-824, описано разделение аполипопротеинов A-I, A-II и A-IV и их изоформ, очищенных из плазмы человека, с помощью высокоэффективной жидкостной хроматографии с обращенной фазой.
В документе WO 2009/025754 описано разделение и очистка белков альфа-1-антитрипсина и ApoA-I из плазмы человека.
Авторами Hunter et al., 2009, Biotechnol. Prog. 25(2):446-453, описана широкомасштабная очистка варианта АроА-I Milano, рекомбинантно экспрессируемого в Е.coli.
Авторами Caparon et al., 2009, Biotechnol. And Bioeng. 105(2):239-249, описана экспрессия и очистка ApoA-I Milano из клеток-хозяев E.Coli, в которых генно-инженерными методами было делетировано два клеточных белка, чтобы снизить уровни этих белков в очищенном продукте, представляющем собой аполипопротеин.
В патенте US №6090921 описана очистка ApoA-I или аполипопротеина Е (АроЕ) из фракции плазмы человека, содержащей ApoA-I и АроЕ, с использованием анионообменной хроматографии.
Авторами Brewer et al., 1986, Meth. Enzymol. 128:223-246, описано выделение и характеризация аполипопротеинов из крови человека с использованием хроматографических методов.
Авторами Weisweiler et al., 1987, Clinica Chimica Acta 169:249-254, описано выделение ApoA-I и ApoA-II из ЛПВП человека с использованием жидкостной экспресс-хроматографии белков.
Авторами deSilva et al., 1990, J. Biol. Chem. 265(24):14292-14297, описана очистка аполипопротеина J с помощью иммуноаффинной хроматографии и высокоэффективной жидкостной хроматографии с обращенной фазой.
Липопротеины и липопротеиновые комплексы в настоящее время разрабатывают для клинического применения в клинических исследованиях с использованием различных агентов на основе липопротеинов, устанавливающих пригодность терапии липопротеинами (Tardif, 2010, Journal of Clinical Lipidology 4:399-404). В одном из исследований оценивали аутологичные делипидизированные ЛПВП (Waksman et al., 2010, J Am. Coll. Cardiol. 55:2727-2735). В другом исследовании оценивали ЕТС-216, представляющий собой комплекс рекомбинантного АроА-IM и пальмитоил-олеоил-РС (РОРС) (Nissen et al., 2003, JAMA 290:2292-2300). CSL-111 представляет собой восстановленный ApoA-I человека, очищенный из плазмы, в комплексе с фосфатидилхолином сои (SBPC) (Tardif et al., 2007, JAMA 297:1675-1682). Современные диагностические лекарственные средства показали эффективность при уменьшении атеросклеротической бляшки, но этот эффект сопровождался вторичными эффектами, такими как повышение трансаминаз или образование антител к АроА-I (Nanjee et al., 1999, Arterioscler. Vase. Throm. Biol. 19:979-89; Nissen et al., 2003, JAMA 290:2292-2300; Spieker et al., 2002, Circulation 105:1399-1402; Nieuwdorp et al., 2004, Diabetologia 51:1081-4; Drew et al., 2009, Circulation 119, 2103-11; Shaw et al., 2008, Circ. Res. 103:1084-91; Tardiff et al., 2007, JAMA 297:1675-1682; Waksman, 2008, Circulation 118:S 371; Cho, патент US №7273849 B2, опубликованный 25 сентября 2007). Например, в клиническом испытании ERASE (Tardiff et al., 2007, JAMA 297:1675-1682) применяли две дозы CSL-111: составляющие 40 мг/кг и 80 мг/кг, АроА-I. В группе, получающей дозу 80 мг/кг, исследование пришлось прекратить вследствие печеночной токсичности (как показано с помощью серьезной оценки трансаминаз). Даже в группе, получающей дозу 40 мг/кг, у нескольких пациентов наблюдали повышение трансаминазы.
Следовательно, существует необходимость в более безопасных лекарственных средствах, более эффективных при снижении сывороточного холестерина, повышении сывороточных уровней ЛПВП, предупреждении и/или лечения дислипидемии и/или заболеваний, состояний и/или расстройств, обусловленных дислипидемией. В данной области техники существует необходимость в препаратах липопротеинов, не связанных с печеночной токсичностью, и предпочтительно вызывающих только минимальное (или не вызывающих) повышения триглицеридов, ЛПНП-триглицеридов или ЛПОНП-триглицеридов, а также в хорошо налаженных способах получения, которые можно применять для надежного получения этих препаратов липопротеинов в промышленном масштабе.
4. КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложены липопротеиновые комплексы, включающие белковую фракцию (например, фракцию аполипопротеина) и липидную фракцию, и их совокупности, особенно подходящие для лечения и/или предупреждения дислипидемии, а также заболеваний, расстройств и/или состояний, обусловленных дислипидемией. Обнаружено, что совокупности комплексов с более высокой чистотой и/или гомогенностью и/или содержащие определенные соотношения липидов и белков, как описано в настоящем изобретении, обладают повышенной способностью к мобилизации холестерина в сочетании со сниженным риском побочных эффектов.
Липопротеиновые комплексы включают белковую фракцию (например, фракцию аполипопротеина) и липидную фракцию (например, фракцию фосфолипида). Белковая фракция включает один или более чем один липидсвязывающий белок, такой как аполипопротеины, пептиды или пептидные аналоги аполипопротеина или миметики, способные к мобилизации холестерина при нахождении в липопротеиновом комплексе. Неограничивающие примеры таких аполипопротеинов и пептидов аполипопротеина включают препроаполипопротеины, препроАроА I, проАроА-I, АроА-I, препроАроА-II, проАроА-II, АроА-II, препроApoA-IV, проApoA-IV, ApoA-IV, ApoA-V, препроАроЕ, проАроЕ, АроЕ, препроАроА-IM, proApoA-IM, АроА-IM, препроApoA-IP, проApoA-IP, ApoA-IZ, препроApoA-IZ, проАроА-IZ и ApoA-IZ.
Аполипопротеин(ы) могут находиться в форме мономеров, димеров или тримеров, либо их смесей.
В конкретном воплощении фракция аполипопротеина состоит по существу из АроА-I, наиболее предпочтительно из одной изоформы. АроА-I в липопротеиновых комплексах могут обладать по меньшей мере 90% или по меньшей мере 95% идентичностью последовательности с белком, соответствующим аминокислотам 25-267 SEQ ID NO:1. Возможно, ApoA-I дополнительно включает аспарагиновую кислоту в положении, соответствующем аминокислоте 25 полноразмерного АроА-I SEQ ID NO:1 (и положению 1 зрелого белка).
Предпочтительно по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% ApoA-I претерпевает правильный процессинг, представляет собой зрелый белок (то есть без сигнальных и пропептидных последовательностей) и не является окисленным, деамидированным и/или укороченным.
В настоящем изобретении также предложены клетки-хозяева млекопитающих, сконструированные для экспрессии ApoA-I, клеточные культуры, содержащие ApoA-I, и способы получения зрелого биологически активного ApoA-I. Обнаружено, что возможно сконструировать клетки-хозяева млекопитающих для экспрессии больших количеств зрелого белка ApoA-I, который по существу не содержит ни незрелый белок ApoA-I (проАроА-I), ни укороченные формы ApoA-I, образованные в результате расщепления протеазами. Эти результаты являются неожиданными.
Во-первых, можно было ожидать, что механизм клетки-хозяина для процессинга белка перегружен гиперэкспрессией гетерологичного белка, такого как АроА-I, что приводит к продуцированию непроцессированного, незрелого белка. Во-вторых, АроА-I, секретируемый в культуральную среду, подвергается расщеплению протеазами, и, кроме того. в культуральной среде наблюдают только низкие уровни укороченного АроА-I. Клетки-хозяева млекопитающих, клеточная культура и способы продуцирования АроА-I особенно подходят для получения зрелого белка, полезного в терапевтических применениях, в коммерчески релевантных количествах.
Как предложено в данном изобретении, клетка-хозяин млекопитающего сконструирована для экспрессии белка, предпочтительно включающего аминокислотную последовательность (или состоящего из нее), обладающую по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичностью положениям 25-267 SEQ ID NO:1. Белок предпочтительно включает остаток аспарагиновой кислоты в положении, соответствующем положению 25 SEQ ID NO:1. Клетка-хозяин млекопитающего может, кроме того, возможно секретировать такой белок. В некоторых случаях белок, экспрессируемый и/или секретируемый клеткой-хозяином млекопитающего, может дополнительно включать 18-аминокислотную сигнальную последовательность (MKAAVLTLAVLFLTGSQA, SEQ ID NO:2) и/или 6-аминокислотную пропептидную последовательность (RHFWQQ, SEQ ID NO:3). В некоторых случаях клетка-хозяин сконструирована для экспрессии белка, включающего аминокислотную последовательность, обладающую по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичностью SEQ ID NO:1.
Клетка-хозяин может иметь происхождение от любой линии клеток млекопитающих, включающей, но не ограниченной ими, клетки яичника китайского хомячка (например, СНО-K1 или CHO-S), VERO, BHK, BHK 570, HeLa, COS-1, COS-7, MDCK, 293, 3Т3, РС12 и W138, или от клетки или клеточной линии миеломы (например, от клетки или клеточной линии миеломы мыши).
Клетка-хозяин млекопитающего может дополнительно содержать множественные копии нуклеиновой кислоты, кодирующей белок АроА-I, например, белок, включающий положения 25-267 SEQ ID NO:1 или состоящий из них. Например, клетка-хозяин млекопитающего может содержать по меньшей мере приблизительно 5, 6, 7, 8 или большее число копий, и вплоть до приблизительно 10, 11, 12, 13 или 14 копий нуклеиновой кислоты. Нуклеиновая кислота может быть, кроме того, функционально связана с промотором, способным к экспрессии белка на высоком уровне в клетке-хозяине млекопитающего, таким как, например, промотор цитомегаловируса обезьян или более конкретно немедленно-ранний промотор цитомегаловируса обезьян.
Клетки-хозяева млекопитающих предпочтительно способны к продуцированию по меньшей мере приблизительно 0,5, 1, 2 или 3 г/л ApoA-I в культуре и/или вплоть до приблизительно 20 г/л ApoA-I в культуре, например, вплоть до 4, 5, 6, 7, 8, 9, 10, 12 или 15 г/л ApoA-I в культуре. Культура может иметь любой масштаб в диапазоне, составляющем от примерно 150 мл до примерно 500 л, 1000 л, 2000 л, 5000 л, 10000 л, 25000 л или 50000 л или более. В различных воплощениях объем культуры может находиться в диапазоне, составляющем от 10 л до 50 л, от 50 л до 100 л, от 100 л до 150 л, от 150 л до 200 л, от 200 л до 300 л, от 300 л до 500 л, от 500 л до 1000 л, от 1000 л до 1500 л, от 1500 л до 2000 л, от 2000 л до 3000 л, от 3000 л до 5000 л, от 5000 л до 7500 л, от 7500 л до 10000 л, от 10000 л до 20000 л, от 20000 л до 40000 л, от 30000 л до 50000 л. В некоторых случаях культура представляет собой широкомасштабную культуру, такую как 15 л, 20 л, 25 л, 30 л, 50 л, 100 л, 200 л, 300 л, 500 л, 1000 л, 5000 л, 10000 л, 15000 л, 20000 л, 25000 л, вплоть до 50000 л или более.
Клетки-хозяева млекопитающих по настоящему изобретению можно выращивать в культуре. Таким образом, в настоящем изобретении дополнительно предложена культура клеток млекопитающих, содержащая множество клеток-хозяев млекопитающих, как описано выше или в Разделе 6.1.2 ниже. Культура клеток может включать один или более чем один из следующих признаков: (а) культура (которая возможно представляет собой широкомасштабную периодическую культуру, объем которой составляет по меньшей мере 10 литров, по меньшей мере 20 литров, по меньшей мере 30 литров, по меньшей мере 50 литров, по меньшей мере 100 литров, 300 л, 500 л, 1000 л, 5000 л, 10000 л, 15000 л, 20000 л, 25000 л, вплоть до 50000 л, или непрерывную культуру, объем которой составляет по меньшей мере 10 литров, по меньшей мере 20 литров, по меньшей мере 30 литров, по меньшей мере 50 литров, по меньшей мере 100 литров, 300 л, 500 л, 1000 л, 5000 л или вплоть до 10000 л) содержит по меньшей мере примерно 0,5, 1,0, 1,5, 2,0, 2,5, 3,0, 4,0 г/л или большее количество зрелого белка ApoA-I, включающего аминокислотную последовательность, соответствующую аминокислотам 25-267 SEQ ID NO:1, или состоящего из нее; (b) по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% белка в культуральное среде составляет белок ApoA-I, не включающий сигнальную последовательность; (c) по меньшей мере 15%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% белка в культуральной среде составляет зрелый белок ApoA-I, не включающий сигнальную последовательность и пропептидную последовательность; и (d) по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% зрелого белка ApoA-I составляет не укороченный, не окисленный или не деамидированный белок.
В настоящем изобретении также предложены способы получения зрелого биологически активного белка ApoA-I. В целом эти способы включают культивирование любой из клеток-хозяев млекопитающих, описанных выше или в Разделе 6.1.2, в условиях, в которых ApoA-I экспрессируется и секретируется. Этот способ может дополнительно включать стадию выделения из супернатанта культивированной клетки-хозяина млекопитающего, и, возможно, очистки, зрелого, биологически активного белка ApoA-I (например, способы, описанные в Разделах 6.1.3 и 6.1.4 ниже).
ApoA-I, который получен или может быть получен способами, описанными выше, может быть дополнительно включен в комплексы с липидом с образованием липопротеинового комплекса, как описано в настоящем изобретении, и/или включен в фармацевтические композиции в терапевтически эффективных количествах. Фармацевтические композиции предпочтительно представляют собой растворы, забуференные фосфатом, также содержащие сахарозу и/или маннит в качестве эксципиентов.
Кроме того, обнаружено, что в результате очистки АроА-I с использования новой комбинации стадий хроматографии и фильтрования могут быть получены большие количества чистого АроА-I, который содержит уровни белков клетки-хозяина, ДНК клетки-хозяина, эндотоксинов и укороченных форм белка, являющиеся достаточно низкими для того, чтобы придавать одно или более чем одно свойство, включающее сниженный риск побочных эффектов и низкую токсичность или отсутствие токсичности, что делает этот белок особенно подходящим для терапевтических применений. Предпочтительно АроА-I, очищенный способом, описанным в настоящем изобретении, продуцируется рекомбинантным путем в клетках млекопитающих и секретируется в ростовую среду. Соответственно, настоящее изобретение относится к способу очистки АроА-I, включающему следующие стадии: (а) приведение в контакт раствора, содержащего АроА-I, с анионообменной матрицей в таких условиях, что АроА-I не связывается с этой матрицей; (b) фильтрование раствора, содержащего АроА-I, полученного на стадии (а), через мембрану, имеющую размер пор, достаточный для удаления вирусов или вирусных частицы; (с) пропускание фильтрата, полученного на стадии (b), через первую хроматографическую колонку с обращенной фазой в таких условиях, что АроА-I связывается с матрицей; (а) элюирование первого "обращенно-фазного" элюата, содержащего АроА-I, из первой матрицы хроматографии с обращенной фазой с использованием градиента возрастающих концентраций органического растворителя; (е) пропускание первого "обращенно-фазного" элюата АроА-I со стадии (d) через вторую хроматографическую колонку с обращенной фазой в таких условиях, что АроА-I связывается с матрицей; и (f) элюирование второго "обращенно-фазного" элюата, содержащего АроА-I, из второй матрицы хроматографии с обращенной фазой с использованием градиента возрастающих концентраций органического растворителя. Порядок, в котором выполняют эти стадии, не является критическим, например, в иллюстративном воплощении стадию фильтрования через мембрану для удаления вирусов или вирусных частиц выполняют после вышеописанной стадии (f) вероятнее, чем после стадии (a).
В данном изобретении также предложен по существу чистый продукт АроА-I, который получен или может быть получен способами очистки, описанными в настоящем изобретении, в котором концентрация АроА-I составляет по меньшей мере 10 г/л. Этот по существу чистый продукт АроА-I, полученный способами очистки, описанными в настоящем изобретении, предпочтительно содержит менее примерно 10 пг ДНК клетки-хозяина на мг АроА-I, менее примерно 100 нг белков клетки-хозяина на мг АроА-I и/или менее 0,1 EU эндотоксина на мг АроА-I. Продукт АроА-I может быть по меньшей мере на 95% чистым, по меньшей мере на 96% чистым, по меньшей мере на 97% чистым, по меньшей мере на 98% чистым или по меньшей мере на 99% чистым.
Кроме того, по существу чистый продукт АроА-I может быть включен в любую из фармацевтических композиций и/или в любой из липопротеиновых комплексов, описанных в настоящем изобретении, который содержит АроА-I.
Липидная фракция обычно включает один или более чем один фосфолипид, который может быть нейтральным, отрицательно заряженным, положительно заряженным или представлять собой их комбинацию. Цепи жирных кислот на фосфолипидах предпочтительно состоят из числа атомов углерода в длину, составляющего от 12 до 26 или от 16 до 26, и могут варьировать по степени насыщенности от насыщенных до мононенасыщенных. Иллюстративные фосфолипиды включают фосфолипиды с небольшой алкильной цепью, фосфатидилхолин куриного яйца, фосфатидилхолин сои, дипальмитоилфосфатидилхолин, димиристоилфосфатидилхолин, дистеароилфосфатидилхолин, 1-миристоил-2-пальмитоилфосфатидилхолин, 1-пальмитоил-2-миристоилфосфатидилхолин, 1-пальмитоил-2-стеароилфосфатидилхолин, 1-стеароил-2-пальмитоилфосфатидилхолин, диолеоилфосфатидилхолин диолеофосфатидилэтаноламин, дилауроилфосфатидилглицерин фосфатидилхолин, фосфатидилсерин, фосфатидилэтаноламин, фосфатидилинозит, фосфатидилглицерины, дифосфатидилглицерины, такие как димиристоилфосфатидилглицерин, дипальмитоилфосфатидилглицерин, дистеароилфосфатидилглицерин, диолеоилфосфатидилглицерин, димиристоилфосфатидную кислоту, дипальмитоилфосфатидную кислоту, димиристоилфосфатидилэтаноламин, дипальмитоилфосфатидилэтаноламин, димиристоилфосфатидилсерин, дипальмитоилфосфатидилсерин, фосфатидилсерин головного мозга, сфингомиелин головного мозга, сфингомиелин куриного яйца, сфингомиелин молока, пальмитоилсфингомиелин, фитосфингомиелин, дипальмитоилсфингомиелин, дистеароилсфингомиелин, соль дипальмитоилфосфатидилглицерина, фосфатидную кислоту, галактоцереброзид, ганглиозиды, цереброзиды, дилаурилфосфатидилхолин, (1,3)-D-маннозил-(1,3)диглицерид, аминофенилгликозид, 3-холестерил-6'-(гликозилтио)гексиловый эфир-гликолипиды, а также холестерин и его производные. Фосфолипидные фракции, включающие SM и пальмитоилсфингомиелин, возможно могут включать небольшие количества любого типа липида, включая, но не ограниченного ими, лизофосфолипиды, сфингомиелины, отличные от пальмитоилсфингомиелина, галактоцереброзид, ганглиозиды, цереброзиды, глицериды, триглицериды, а также холестерин и его производные.
Наиболее предпочтительно, липидная фракция содержит по меньшей мере один нейтральный фосфолипид и, возможно, один или более чем один отрицательно заряженный фосфолипид. В липопротеиновых комплексах, включающих как нейтральные, так и отрицательно заряженные фосфолипиды, эти нейтральные и отрицательно заряженные фосфолипиды могут иметь цепи жирных кислот с одинаковым или разным числом атомов углерода и с одинаковой или разной степенью ненасыщенности. В некоторых случаях нейтральные и отрицательно заряженные фосфолипиды имеют одинаковый ацильный "хвост", например, С16:0 или пальмитоильную ацильную цепь.
Когда липидный компонент комплекса включает нейтральные и отрицательно заряженные фосфолипиды, массовое отношение (масс.:масс.) нейтральных и отрицательно заряженных фосфолипидов предпочтительно составляет отношение масс:масс, находящееся в интервале от примерно 99:1 до примерно 90:10, более предпочтительно от примерно 99:1 до примерно 95:5, и наиболее предпочтительно от примерно 98:2 до примерно 96:4. В одном воплощении нейтральный(е) фосфолипид(ы) и отрицательно заряженный(е) фосфолипид(ы) присутствуют в массовом отношении (масс:масс) нейтрального фосфолипида(ов) и отрицательно заряженного фосфолипида(ов), составляющем примерно 97:3.
Нейтральный фосфолипид может быть природным или синтетическим. Предпочтительно фосфолипид представляет собой сфингомиелин ("SM"), такой как пальмитоилсфингомиелин, фитосфингомиелин, дифитосфингомиелин, фосфосфинголипид или гликосфинголипид, возможно, включающий насыщенные или ненасыщенные жирные кислоты, длина цепи которых составляет от 16 до 26 атомов углерода. SM может иметь происхождение из любого источника. Например, SM может быть получен из молока, куриного яйца, головного мозга, либо получен синтетическим путем.
В конкретном воплощении SM получен из куриного яйца ("SM куриного яйца"). В другом конкретном воплощении SM представляет собой пальмитоилсфингомиелин.
Любой фосфолипид, который несет по меньшей мере частичный отрицательный заряд при физиологическом значении рН, можно использовать в качестве отрицательно заряженного фосфолипида. Неограничивающие примеры включают отрицательно заряженные формы, например, соли, фосфатидилинозита, фосфатидилсерина, фосфатидилглицерина и фосфатидной кислоты. В конкретном воплощении отрицательно заряженный фосфолипид представляет собой 1,2-дипальмитоил-sn-глицеро-3-[фосфо-рац-(1-глицерин)] или DPPG, фосфатидилглицерин. Предпочтительные соли включают соли калия и натрия.
Фосфолипиды, используемые для получения комплексов по изобретению, предпочтительно являются по меньшей мере на 95% чистыми, и более предпочтительно по меньшей мере на 99% чистыми, и/или имеют уровни окисления, составляющие ниже 4 мЭкв О/кг, более предпочтительно ниже 3 мЭкв О/кг (Например, ниже 2 мЭкв О/кг). Основным исходным продуктов взаимодействия кислорода и жирных кислот является гидропероксид. Используя йодометрический метод, можно измерить уровни окисления путем оценки присутствия пероксида в образце.
Липопротеиновые комплексы по настоящему изобретению предпочтительно имеют отношения аполипопротеина к липиду, которые приводят в результате к более полному и гомогенному образованию комплекса, как показано ниже в примерах. Липопротеиновые комплексы характеризуются молярным отношением фракции аполипопротеина к фракции липида, находящимся в интервале от 1:80 до 1:120, от 1:100 до 1:115 или от 1:105 до 1:110, где аполипопротеин выражен в эквивалентах АроА-I. В конкретном воплощении молярное отношение фракции аполипопротеина к фракции липида составляет от 1:80 до 1:90 (например, 1:82, 1:85 или 1:87), от 1:90 до 1:100 (например, 1:95 или 1:98), от 1:100 до 1:110 (например, 1:105 или 1:108).
В конкретных воплощениях, как правило, в тех, в которых используют SM куриного яйца в качестве нейтрального липида, массовое отношение фракции аполипопротеина к фракции липида находится в интервале от примерно 1:2,7 до примерно 1:3 (например, 1:2,7).
Липопротеиновые комплексы по настоящему изобретению можно также использовать в качестве носителей для доставки гидрофобных, липофильных или неполярных активных агентов. Для таких применений один или более чем один гидрофобный, липофильный или неполярный активный агент можно дополнительно включать в липидную фракцию или загружать в липопротеиновый комплекс, где эти активные агенты включают, но не ограничены ими, жирные кислоты, лекарственные средства, нуклеиновые кислоты, витамины и/или питательные вещества. Конкретные примеры активных агентов описаны в Разделе 6.2.
В настоящем изобретении также предложены совокупности липопротеиновых комплексов.
Обычно:
- Эти совокупности содержат множество липопротеиновых комплексов, каждый из которых включает белковую фракцию и липидную фракцию;
- Белковые фракции содержат липопротеин или аналог липопротеина, как описано выше, а также в Разделе 6.1 или в Разделе 6.5.3; наиболее предпочтительно белковая фракция содержит липопротеин (например, белок АроА-I), который получен или может быть получен способами, описанными в Разделе 6.1.2, и/или очищен способами, описанными в Разделе 6.1.4, либо по существу состоит из этого липопротеина;
- Липидные фракции содержат липид, как описано выше, а также в Разделе 6.2 или в Разделе 6.5.2;
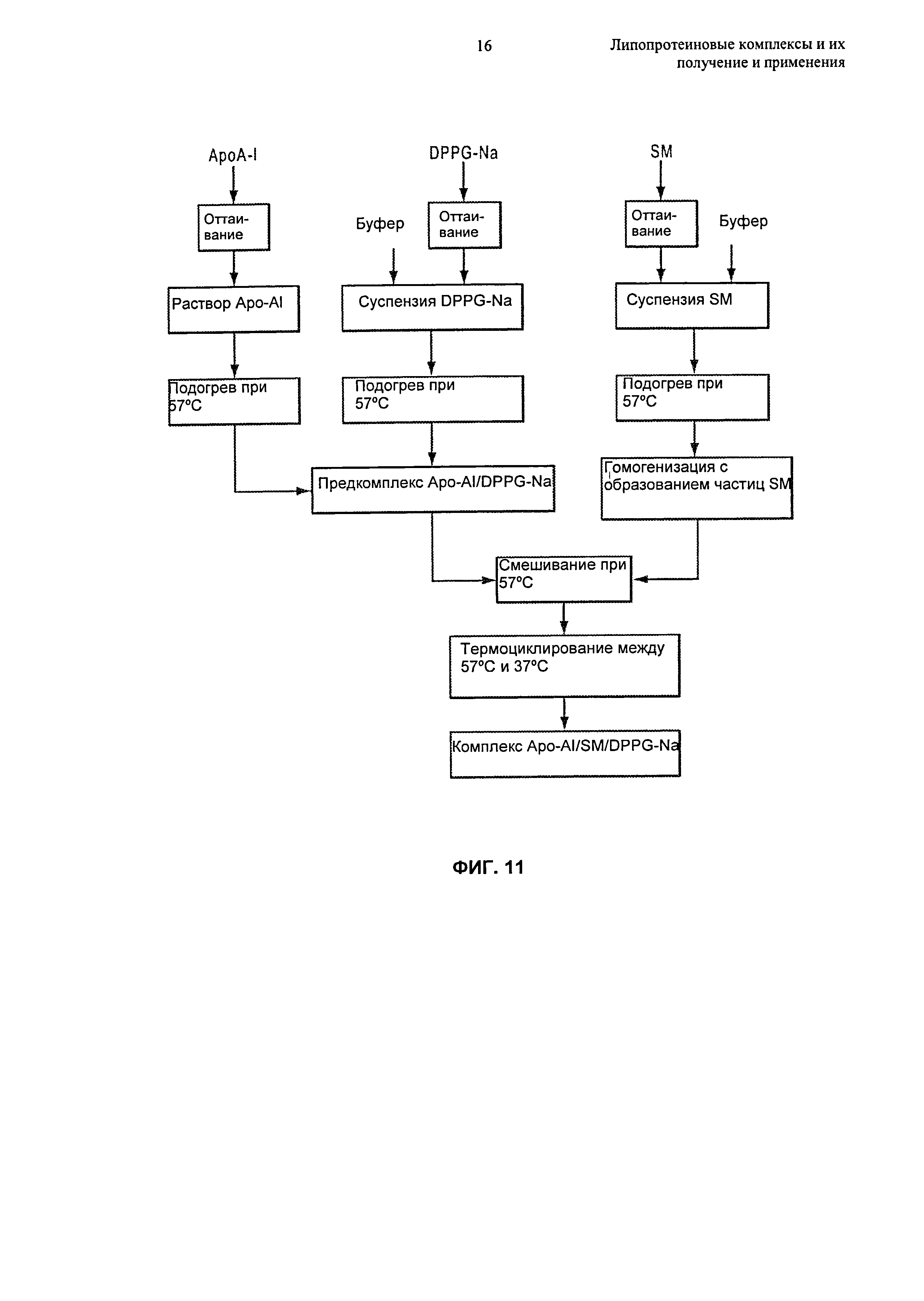
- Липопротеиновые комплексы предпочтительно получены способами термоциклирования, описанными в Разделе 6.5.4.
Авторы изобретения обнаружили несколько признаков, которые, как считают, вносят вклад, по отдельности или в комбинации, в профиль эффективности и безопасности совокупностей липопротеиновых комплексов. Эти признаки включают:
- гомогенность по размеру комплексов в совокупности, в основном, находящемуся в интервале от 4 нм до 15 нм (например, от 5 нм до 12 нм, от 6 нм до 15 нм или от 8 нм до 10 нм);
- чистоту аполипопротеина, используемого для получения комплекса (например, отсутствие окисленных, деамидированных, укороченных и/или незрелых форм аполипопротеина и/или отсутствие эндотоксина, и/или отсутствие белков, отличающихся от аполипопротеина(ов) (таких как белки клетки-хозяина), и/или ДНК клетки-хозяина, которая часто присутствует при рекомбинантном продуцировании);
- чистоту сами комплексов в совокупности (характеризующихся отсутствием загрязняющих веществ, таких как растворители или детергенты, используемые для получения комплексов; отсутствие окисленных липидов; отсутствие деамидированных, окисленных или укороченных белков; и/или сниженные количества или отсутствие не связанного в комплекс аполипопротеина и/или липида).
Считают, что из этих признаков гомогенность комплексов и преобладание зрелого, немодифицированного аполипопротеина в комплексах повышают эффективность. Чистота аполипопротеинов, липидов и комплексов снижает риск побочных эффектов, таких как повреждение печени, отражающееся в повышении уровня ферментов печени (например, трансаминаз). Кроме того, авторы изобретения сделали возможным получение совокупности липопротеиновых комплексов способами, приводящими в результате к включению в комплексы большей части аполипопротеина, и снижение количества не связанного в комплекс аполипопротеина также является полезным тем, что снижает риск иммуногенного ответа у субъекта, который мог бы быть вызван введением гетерологичного белка.
Соответственно, в настоящем изобретении предложены совокупности липопротеиновых комплексов, которые характеризуются одним или более чем одним, или даже всеми из следующих признаков:
(а) по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% масс./масс. липопротеина, обычно АроА-I, в данной совокупности находится в зрелой форме;
(b) не более 25%, не более 20%, не более 15%, не более 10% или не более 5% масс./масс. липопротеина, обычно АроА-I, в данной совокупности находится в незрелой форме;
(c) совокупность содержит не более 100 пикограммов, не более 50 пикограммов, не более 25 пикограммов, не более 10 пикограммов или не более 5 пикограммов ДНК клетки-хозяина на миллиграмм липопротеина, обычно АроА-I;
(d) совокупность содержит не более 500 нанограммов, не более 200 нанограммов, не более 100 нанограммов, не более 50 нанограммов или не более 20 нанограммов белка клетки-хозяина на миллиграмм липопротеина, обычно АроА-I;
(e) не более 25%, не более 20%, не более 15%, не более 10% или не более 5% масс./масс. липопротеина, обычно АроА-I, в совокупности находится в укороченной форме;
(f) липопротеиновый компонент включает зрелый белок АроА-I или состоит из него, и не более 20%, не более 15%, не более 10%, не более 5%, не более 3%, не более 2% или не более 1% каждого остатка метионина 112 и метионина 148 в данном АроА-I в данной совокупности окислен;
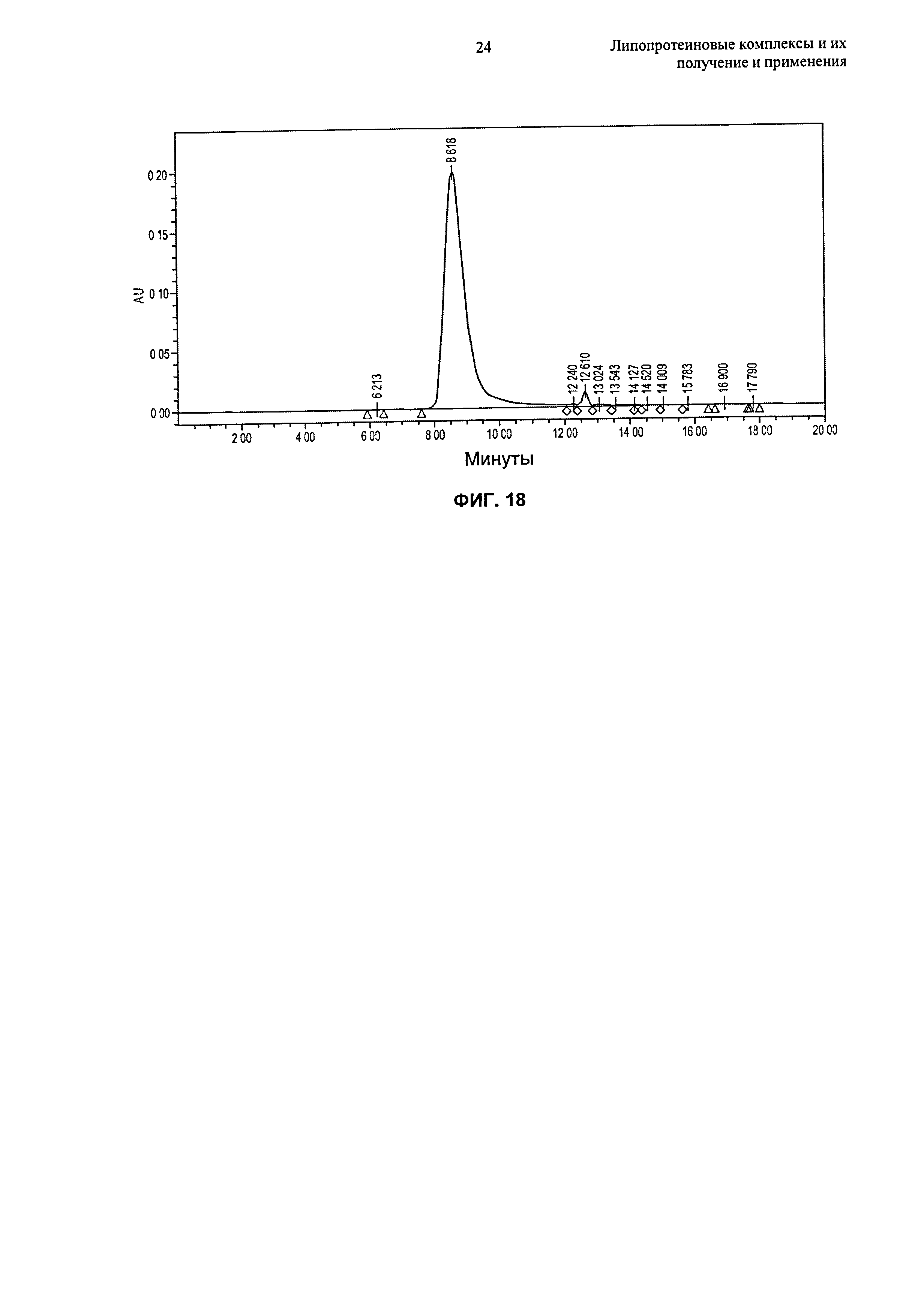
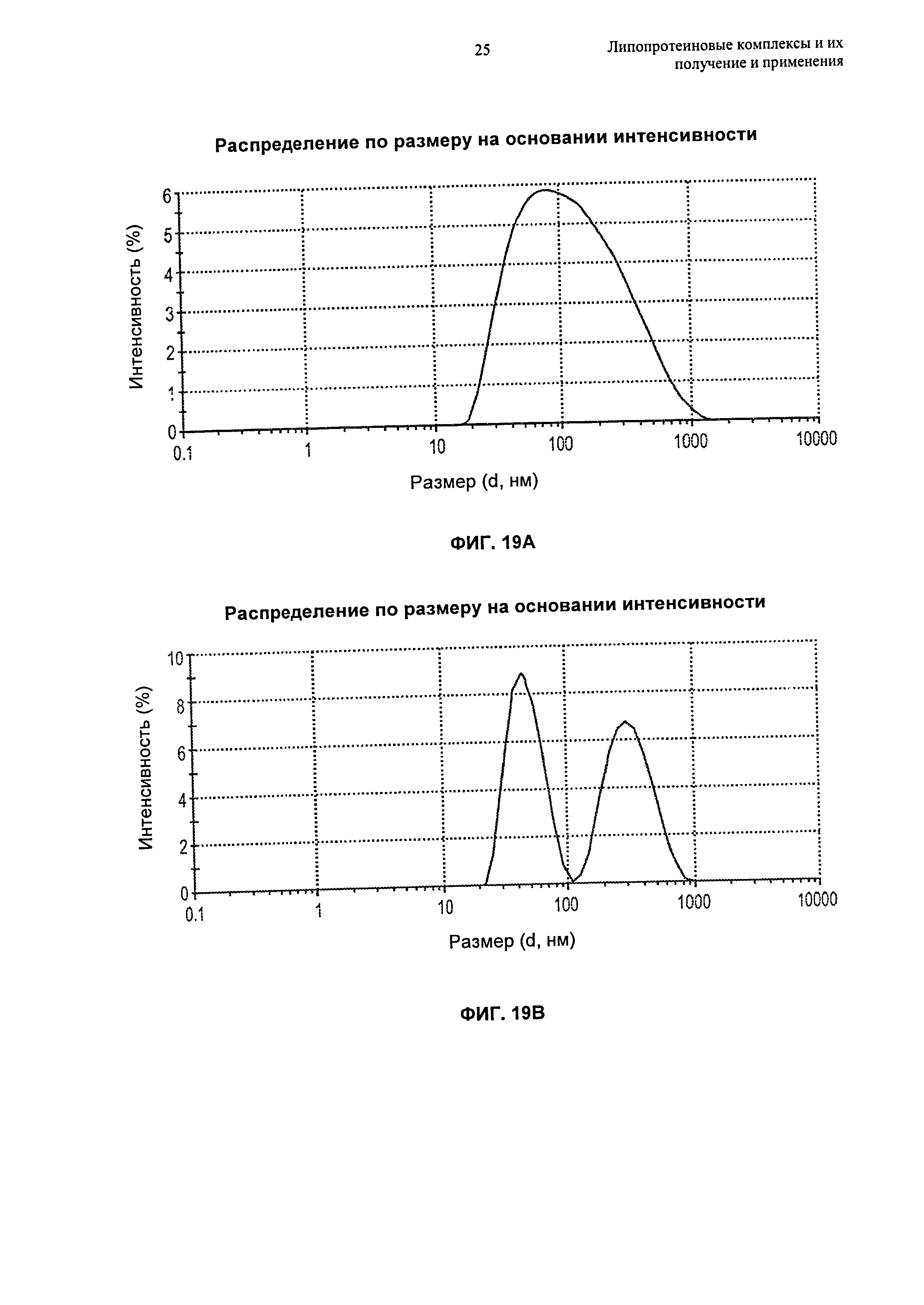
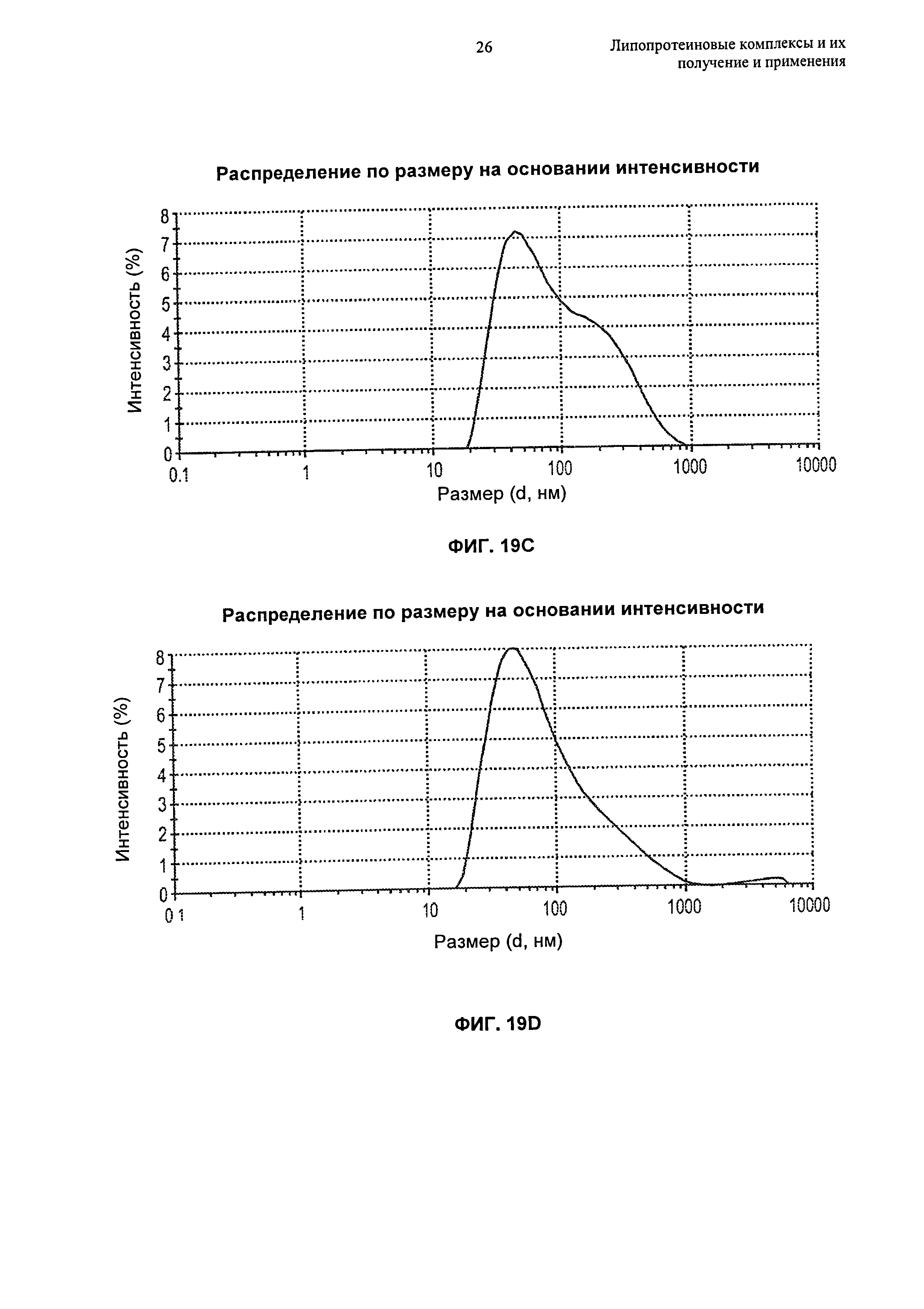
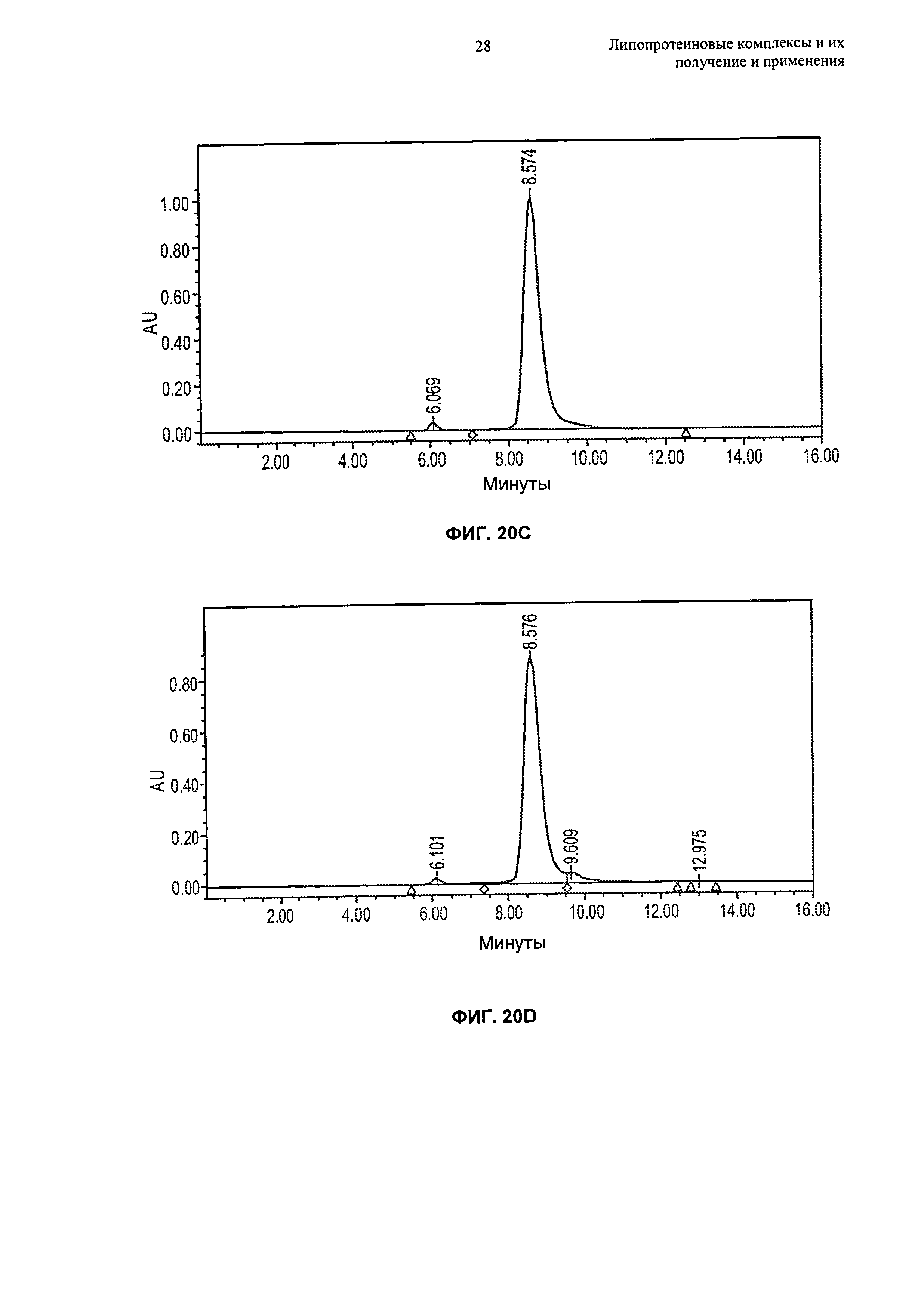
(g) по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% липопротеиновых комплексов находится в форме частиц, имеющих размер от 4 нм до 15 нм, например, размер от 6 нм до 15 нм или размер от 8 до 12 нм, еще более предпочтительно размер от 5 нм до 12 нм, как измерено гель-проникающей хроматографией ("ГПХ") или динамическим светорассеянием ("ДСР");
(i) совокупность содержит не более 1 EU, не более 0,5 EU, не более 0,3 EU или не более 0,1 EU эндотоксина на миллиграмм липопротеина, обычно АроА-I;
(j) не более 15%, не более 10%, не более 5%, не более 4%, не более 3%, не более 2% или не более 1% аминокислот в липопротеине, обычно АроА-I, в данной совокупности деамидировано;
(k) не более 15%, не более 10%, не более 5%, не более 2% или 0% масс./масс. липида в липидной фракции в данных комплексах составляет холестерин;
(l) совокупность содержит не более 200 млн-1, 100 млн-1, 50 млн-1неводного растворителя;
(m) совокупность не содержит какой-либо детергент (например, холат);
(n) совокупность может быть по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% гомогенной, как измерено на основании процентного содержания совокупности в одном пике гельпроникающей хроматографии;
(о) совокупность находится в композиции, в которой по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 97% белка находится в виде комплекса;
(p) не более 5%, не более 4%, не более 3%, не более 2% или не более 1% липида в данной совокупности является окисленным; и
(q) не более 15%, не более 10%, не более 5%, не более 4%, не более 3%, не более 2% или не более 1% остатков метионина и/или триптофана в данной совокупности является окисленным.
В конкретных воплощениях совокупность обладает признаками, выбранными из следующих групп:
Группа I: описанные выше признаки (а), (b) и (е);
Группа II: описанные выше признаки (с), (d) и (i);
Группа III: описанные выше признаки (f), (j), (е), (p) и (q);
Группа IV: описанные выше признаки (g), (n) и (o);
Группа V: описанные выше признаки (l) и (m); и
Группа VI: описанный выше признак (k).
В некоторых аспектах совокупность характеризуется одним или двумя признаками, независимо выбранными из каждой из группы I и группы IV; возможно, совокупность характеризуется тремя признаками, независимо выбранными из каждой из группы I и группы IV. Совокупность может дополнительно характеризоваться одним, двумя или тремя признаками, независимо выбранными из каждой из группы II и/или группы III. Совокупность может, кроме того, дополнительно характеризоваться одним или двумя признаками, независимо выбранными из группы V и/или одним признаком, независимо выбранным из группы VI.
Некоторые липидные и белковые компоненты могут образовать множество различных, но гомогенных липопротеиновых комплексов. Соответственно, в настоящем изобретении также предложены композиции, содержащие две, три или четыре совокупности липопротеиновых комплексов, содержащие различные количества молекул аполипопротеина (например, две, три или четыре молекулы АроА-I или эквивалентов АроА-I). В иллюстративном воплощении композиция содержит две совокупности липопротеиновых комплексов: первую совокупность, включающую липопротеиновые комплексы, имеющие 2 молекулы АроА-I или эквивалента АроА-I на липопротеиновый комплекс, вторую совокупность, включающую липопротеиновые комплексы, имеющие 3 или 4 молекулы АроА-I или эквивалента АроА-I на липопротеиновый комплекс, и возможно третью совокупность, включающую липопротеиновые комплексы, имеющие 4 или 3 молекулы АроА-I или эквивалента АроА-I на липопротеиновый комплекс, соответственно.
Композиции, содержащие две или более чем две совокупности липопротеиновых комплексов, предпочтительно имеют низкие уровни не связанного в комплекс липопротеина и/или липида. Соответственно, предпочтительно не более 15%, не более 12%, не более 10%, не более 9%, не более 8%, не более 7%, не более 6%, не более 5%, не более 4%, не более 3%, не более 2% или не более 1% липида в композиции находится в не связанной в комплекс форме, и/или не более 15%, не более 12%, не более 10%, не более 9%, не более 8%, не более 7%, не более 6%, не более 5%, не более 4%, не более 3%, не более 2% или не более 1% липопротеина в композиции находится в не связанной в комплекс форме.
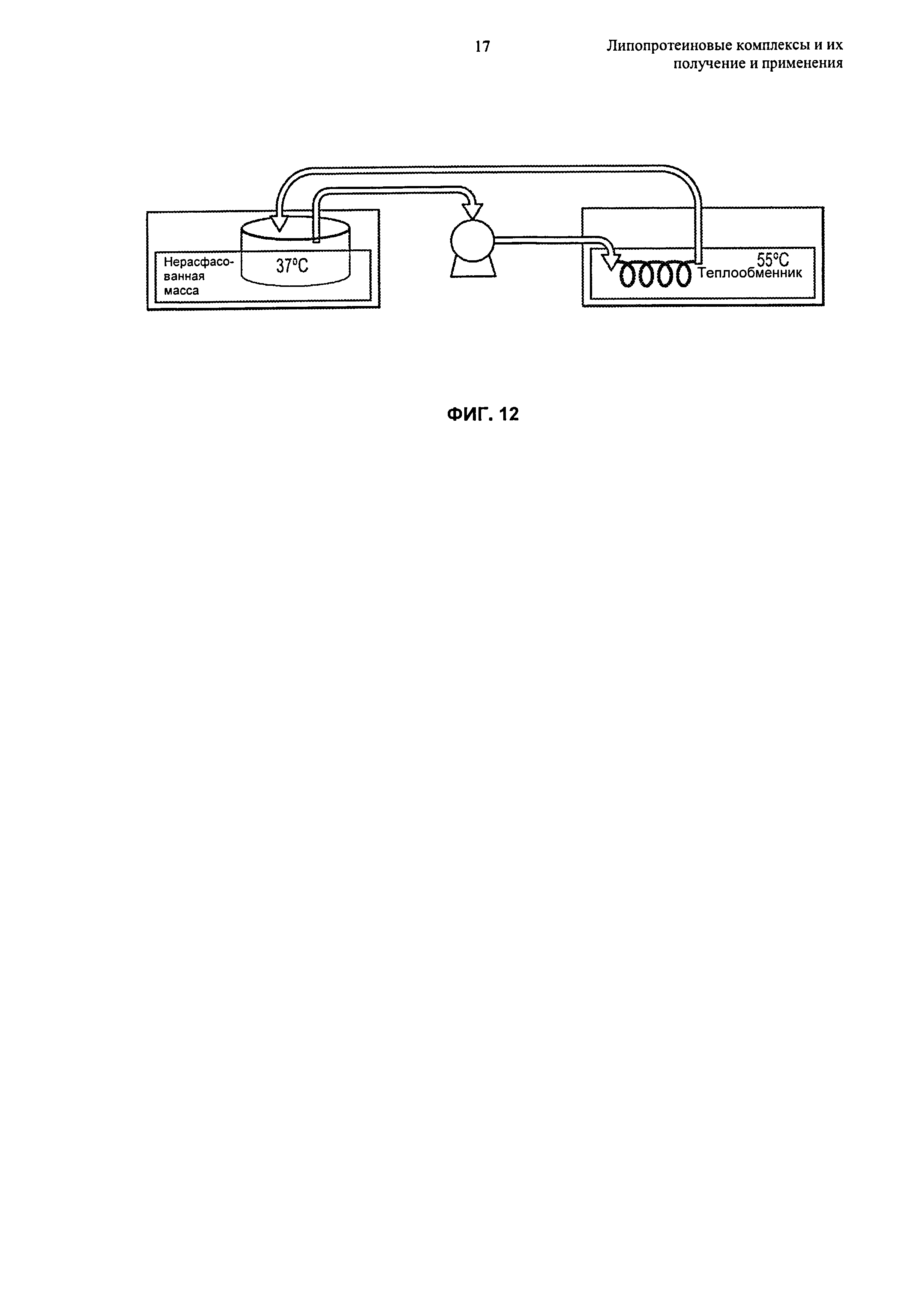
В изобретении предложены способы получения липопротеиновых комплексов. Эти способы основаны, inter alia, на обнаружении того, что, подвергая суспензию, содержащую не связанные в комплекс липиды и липидсвязывающие белки или пептиды, условиям термоциклирования, получают в результате образование липопротеиновых комплексов, причем эти результаты обладают преимуществами относительно других способов, при которых липопротеиновые комплексы получают путем инкубации компонентов при фиксированной температуре.
В настоящем изобретении предложены способы термоциклирования для получения липопротеиновых комплексов, как описано в Разделах 6.5.1-6.5.4. Эти способы обычно включают воздействие на суспензию, содержащую липидные частицы ("липидный компонент") и липидсвязывающие белки или пептиды ("белковый компонент"), множества температурных циклов до тех пор, пока большая часть белкового компонента не окажется включенной в липопротеиновые комплексы. Эти способы в целом включают цитирование суспензии между температурой, находящейся в первом, более высоком температурном диапазоне, и температурой, находящейся во втором, более низком температурном диапазоне, до образования липопротеиновых комплексов. Высокие и низкие температурные диапазоны процесса термоциклирования основаны на температурах фазового перехода липидных и белковых компонентов липопротеиновых комплексов. Альтернативно, если липидный компонент не проявляет определенный или дискретный фазовый переход, что может происходить при использовании фосфолипидов, имеющих ненасыщенные цепи жирных кислот, или смеси фосфолипидов, высокий и низкий температурные диапазоны термоциклирования различаются по меньшей мере примерно на 20°С, вплоть до примерно 40°С или даже более. Например, в некоторых воплощениях высокий и низкий температурные диапазоны различаются на 20°С-30°С, 20°С-40°С, 20°С-50°С, 30°С-40°С, 30°С-50°С, 25°С-45°С, 35°С-55°С.
Для липида фазовый переход включает изменение от плотно упакованной упорядоченной структуры, известной как состояние геля, до слабо упакованной, менее упорядоченной структуры, известной как жидкое состояние. В данной области техники липопротеиновые комплексы обычно образуют путем инкубирования липидных частиц и аполипопротеинов при температурах, находящихся вблизи температуры фазового перехода определенного используемого липида или смеси липидов. Температура фазового перехода липидного компонента (которую можно определить с помощью калориметрии) +/-12°С, более предпочтительно +/-10°С, представляет собой "низкий" температурный диапазон в способах по изобретению. В определенных воплощениях этот низкий температурный диапазон составляет +/-3°С, +/-5°С или +/-8°С от температуры фазового перехода липидного компонента. В одном конкретном воплощении низкий температурный диапазон включает значения, составляющие от не менее 5°С или не менее 10°С ниже до 5°С выше температуры фазового перехода липидного компонента.
Для белка температура фазового перехода включает изменение от третичной структуры до вторичной структуры. Температура фазового перехода белкового компонента +/-12°С, более предпочтительно +/-10°С, представляет собой "высокий" температурный диапазон в способах по изобретению. В конкретных воплощениях этот низкий температурный диапазон составляет +/-3°С, +/-5°С или +/-8°С от температуры фазового перехода белкового компонента. В одном конкретном воплощении высокий температурный диапазон включает значения, составляющие от 10°С ниже до не более чем 5°С, не более чем 10°С или не более чем 15°С выше температуры фазового перехода белкового компонента.
Липидный компонент исходной суспензии, то есть суспензии, еще не подвергнутой термоциклированию, предпочтительно включает частицы липидов, например, преимущественно состоит из липидов, не связанных в комплекс с липидсвязывающими белками. Состав липидного компонента в целом является таким, как описано ниже в Разделе 6.5.2.
Белковый компонент исходной суспензии предпочтительно содержит липидсвязывающие пептиды и/или белки, которые не связаны в комплекс с липидами или объединены с липидами в отношении белка/пептида к липиду, значение которого по меньшей мере в 5 раз выше (например, по меньшей мере в 5 раз, по меньшей мере в 10 раз или по меньшей мере в 20 раз выше), чем значение отношения белка/пептида к липиду в желаемом комплексе. Состав белкового компонента в целом является таким, как описано ниже в Разделе 6.1 и в Разделе 6.5.3.
Белковый компонент предпочтительно получают согласно способам, описанным в Разделе 6.1.2, и/или очищают согласно способам, описанным в Разделе 6.1.3 или 6.1.4.
В способах по изобретению суспензию, содержащую белковый компонент и липидный компонент, обычно подвергают термоциклированию между высоким температурным диапазоном и низким температурным диапазоном, предпочтительно начиная при температуре, находящейся в высоком температурном диапазоне, до образования липопротеиновых комплексов. При использовании подходящих количеств липидного и белкового компонентов (например, как описано в публикации патента US №2006-0217312 A1, содержание которого полностью включено в настоящее описание посредством ссылки), может быть достигнуто почти полное комплексообразование липидного и белкового компонентов после нескольких циклов. Дополнительные подробности, касающиеся стехиометрии белка и липида, подходящей для способов термоциклирования, описаны в Разделе 6.5.4.
Комплексы, полученные этими способами, обычно представляют собой надмолекулярные ансамбли, имеющие форму мицелл, везикул, сферических или дисковидных частиц, в которых белковый компонент физически связан с липидным компонентом в определенном стехиометрическом диапазоне, имеющих однородное распределение по размеру. Преимущественный результат настоящих способов состоит по существу в полном комплексообразовании липидов и/или белков в исходной суспензии, с получением в результате композиции, которая по существу не содержит свободные липиды и/или свободный белок, что наблюдали с помощью способов разделения, например, путем хроматографии. Таким образом, способы по изобретению могут быть выполнены в отсутствие стадии очистки.
Липидный компонент в исходной суспензии обычно находится в форме частиц. Предпочтительно, чтобы размер этих частиц преимущественно составлял по меньшей мере 45 нм, по меньшей мере 50 нм, по меньшей мере 55 нм или по меньшей мере 60 нм в диапазоне размера, составляющем вплоть до 65 нм, вплоть до 70 нм, вплоть до 75 нм, вплоть до 80 нм, вплоть до 100 нм, вплоть до 120 нм, вплоть до 150 нм, вплоть до 200 нм, вплоть до 250 нм, вплоть до 300 нм, вплоть до 500 нм, например, в диапазоне размера, составляющем от 45 нм до 100 нм или от 45 до 250 нм, более предпочтительно в диапазоне размера, составляющем от 50 нм до 90 нм, и наиболее предпочтительно в диапазоне размера, составляющем от 55 нм до 75 нм. В предпочтительном воплощении липидные частицы преимущественно состоят из сфингомиелина куриного яйца и имеют размер, составляющий от 55 до 75 нм. В другом предпочтительном воплощении липидные частицы преимущественно состоят из одного или более чем одного синтетического сфингомиелина (например, пальмитоилсфингомиелина или фитосфингомиелина) и имеют размер, составляющий от 175 нм до 250 нм. Еще в одном другом предпочтительном воплощении липидные частицы преимущественно состоят из одного или более чем одного синтетического липида (например, пальмитоилсфингомиелина или фитосфингомиелина) и имеют размер, составляющий от 250 нм до 1000 нм. Еще в одном другом предпочтительном воплощении липидные частицы преимущественно состоят из одного или более чем одного синтетического липида (например, пальмитоилсфингомиелина или фитосфингомиелина) и имеют размер, составляющий от 1000 нм до 4000 нм. Размеры, относящиеся к данному изобретению, представляют собой средние размеры зета (Z), определенные с помощью динамического светорассеяния. При гомогенизации высокого давления, например, микрофлюидизации, преимущественно образуются липидные частицы подходящих размеров. Другие способы образования этих частиц описаны ниже в Разделе 6.5.2, и эти способы можно использовать в качестве альтернативы гомогенизации. Если такими способами образуются частицы, размер которых находится вне предпочтительных диапазонов, эти частицы можно подвергать фильтрованию по размеру, чтобы получить частицы подходящего размера.
Способы получения липопротеиновых комплексов, описанные в настоящем изобретении, преимущественно образуют комплексы, имеющие однородное распределение по размеру, что позволяет избежать необходимости во фракционировании по размеру. Кроме того, способы по изобретению приводят в результате по существу к полному включению (например, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99%) исходного белка в липопротеиновые частицы. Соответственно, в изобретении предложена композиция, содержащая липопротеиновые комплексы, в которой по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% липидсвязывающего белка в композиции связано в комплекс с липидом, как определено, например, с использованием гельпроникающей хроматографии. В конкретных воплощениях в изобретении предложена композиция, содержащая липопротеиновые комплексы, имеющие средний размер зета, составляющий от 4 нм до 20 нм, например, средний размер зета, составляющий от 4 нм до 20 нм, средний размер зета, составляющий от 4 нм до 15 нм, средний размер зета, составляющий от 4 нм до 12 нм, средний размер зета, составляющий от 5 нм до 15 нм, средний размер зета, составляющий от 5 нм до 12 нм, средний размер зета, составляющий от 5 нм до 10 нм, средний размер зета, составляющий от 5 нм до 20 нм, средний размер зета, составляющий от 6 нм до 15 нм, или средний размер зета, составляющий от 8 нм до 12 нм, и в которой по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% липидсвязывающего белка в композиции связано в комплекс с липидом, как определено, например, с использованием гельпроникающей хроматографии.
Результатом воздействия на липидные частицы термоциклирования с липопротеином согласно способам, описанным в настоящем изобретении, обычно является совокупность липопротеиновых частиц, имеющих размер, составляющий от 4 нм до 15 нм, например, совокупность липопротеиновых частиц, имеющих размер, составляющий от 6 нм до 15 нм, от 5 нм до 12 нм или от 8 нм до 12 нм. Размер липидных частиц, подвергаемых термоциклированию, может находиться в диапазоне от 50 нм до 250 нм. В предпочтительном воплощении липидные частицы преимущественно состоят из сфингомиелина куриного яйца и имеют размер, составляющий от 55 до 75 нм. В другом предпочтительном воплощении липидные частицы преимущественно состоят из одного или более чем одного синтетического сфингомиелина (например, фитосфингомиелина) и имеют размер, составляющий от 175 нм до 250 нм.
Одну или более чем одну стадию в способах получения липопротеиновых комплексов можно осуществлять в атмосфере инертного газа. Это действие может уменьшить или предотвратить окисление аполипопротеинов и/или липидов, в результате чего снижается риск побочных эффектов, таких как повреждение печени. Подходящие инертные газы включают азот, гелий и аргон.
Липопротеиновые комплексы, которые получены или могут быть получены описанными выше способами, особенно подходят для терапевтических применений, поскольку после образования комплексов нет необходимости в стадии дополнительной очистки.
В настоящем изобретении также предложены совокупности липопротеиновых комплексов, и фармацевтические композиции, которые содержат липопротеиновые комплексы или их совокупности, как описано в настоящем изобретении, и могут возможно включать один или более чем один фармацевтически приемлемый носитель, эксципиент и/или разбавитель. В некоторых воплощениях фармацевтические композиции упакованы в количествах, составляющих стандартную дозу, подходящую для введения. Например, в некоторых воплощениях композиции включают количества, составляющие стандартную дозу, высушенных (например, лиофилизированных) липопротеиновые комплексов, упакованных в герметично закрытые флаконы. Такие композиции подходят для восстановления водой, физиологическим раствором (таким как солевой раствор) или буфером и введения посредством инъекции. Такие композиции могут возможно включать одно или более чем одно средство против спекания и/или средство, препятствующее агглютинации, чтобы облегчить восстановление заряженных комплексов, или один или более чем один буферный агент, изотонический агент (например, сахарозу и/или маннит), сахар или соль (например, хлорид натрия), предназначенные для регуляции рН, осмоляльности и/или содержания соли в восстановленной суспензии. Совокупности липопротеиновых комплексов и/или фармацевтические композиции, описанные выше, могут быть получены в условиях, сводящих к минимуму окисление, в результате чего снижается риск побочных эффектов, таких как повреждение печени, вызванных продуктами окисления. Например, фармацевтические композиции можно готовить в атмосфере инертного газа, такого как азот, гелий или аргон.
Для коммерческих применений полезно получать крупномасштабные препараты липопротеиновых комплексов и фармацевтических композиций. Соответственно, в настоящем изобретении также предложен препарат, имеющий объем, составляющий по меньшей мере 1 л, 2 л, 5 л или 10 л, и вплоть до 15 л, 20 л, 30 л, 50 л или более (например, препарат, объем которого составляет от 5 л до 30 л, от 10 л до 15 л или от 30 л до 50 л), содержащий липопротеиновые комплексы в количестве, достаточном для достижения концентрации липидсвязывающего белка, составляющей по меньшей мере примерно 3 мг/мл, по меньшей мере примерно 4 мг/мл или по меньшей мере примерно 5 мг/мл, и вплоть до примерно 10 мг/мл, примерно 15 мг/мл или примерно 20 мг/мл, предпочтительно в интервале, составляющем от примерно 8 мг/мл до примерно 12 мг/мл, наиболее предпочтительно примерно 8 мг/мл. В конкретном воплощении препарат имеет объем, составляющий от 15 л до 25 л, и содержит от примерно 100 г до примерно 250 г АроА-I. В другом конкретном воплощении препарат имеет объем, составляющий от 30 л до 50 л, и содержит от примерно 240 г до примерно 780 г АроА-I.
Липопротеиновые комплексы, описанные в настоящем изобретении, полезны для лечения дислипидемических расстройств у животных, наиболее предпочтительно у людей. Такие состояния включают, но не ограничены ими, гиперлипидемию, и, в частности, гиперхолестеринемию (включая гетерозиготную и гомозиготную семейную гиперхолестеринемию), и сердечнососудистое заболевание, такое как атеросклероз (включая лечение и предупреждение атеросклероза) и огромное число клинических проявлений атеросклероза, таких как, например, удар, ишемический удар, транзиторная ишемическая атака, инфаркт миокарда, острый коронарный синдром, стенокардия, перемежающаяся хромота, критическая ишемия конечностей, стеноз клапана и склероз атриального клапана; рестеноз (например, предупреждение или лечение атеросклеротических бляшек, которые развиваются вследствие медицинских процедур, таких как баллонная ангиопластика); и другие расстройства, такие как эндотоксемия, часто приводящие в результате к септическому шоку.
Обнаружено, что липопротеиновые комплексы и композиции, как описано в настоящем изобретении, осуществляют эффлюкс холестерина и/или способствуют ему при введении в более низких дозах, чем применяемые для других липопротеиновых комплексов, к настоящему времени находящихся в исследованиях (см., например, Spieker et al., 2002, Circulation 105:1399-1402 (применение дозы 80 мг/кг); Nissen et al., 2003, JAMA 290:2292-2300 (применение доз 15 мг/кг или 40 мг/кг); Tardif et al., 2007 JAMA 297:1675-1682 (применение доз от 40 мг/кг до 80 мг/кг)) с применением доз, находящихся в диапазоне, составляющем от 15 мг/кг до 80 мг/кг. Кроме того, обнаружено, что липопротеиновые комплексы, как описано в настоящем изобретении, обладают сниженными побочными эффектами. Как показано в приведенных ниже примерах, обнаружено, что липопротеиновые комплексы по изобретению эффективно мобилизуют холестерин в настолько низких дозах, как 2 мг/кг, и, в отличие от липопротеиновых комплексов, вводимых ранее пациентам-людям, значительно не повышают уровни триглицеридов, ЛПОНП и ферментов печени, таких как трансаминазы (см. Nanjee et al., 1999, Arterioscler. Vase. Throm. Biol. 19:979-89). Кроме того, сниженные побочные эффекты наблюдали даже при повышении доз вплоть до примерно 15 мг/кг (отсутствие повышения триглицеридов) или даже при столь высоких дозах, как 45 мг/кг (отсутствие повышения трансаминазы) у нормальных субъектов с нормальной функцией печени и/или почек. Следовательно, способность к введению комплексов по настоящему изобретению без побочных эффектов предпочтительно оценивают у индивидуума с нормальной функцией печени, нормальной функцией почек или нормальной функцией обоих органов.
Не связываясь теорией, авторы изобретения связывают преимущества липопротеиновых комплексов по изобретению с более однородным распределением комплексов по размеру и со сниженными количествами поврежденного белка и/или липида (например, окисленного белка, деамидированного белка и окисленного липида) по сравнению с терапевтическими средствами из уровня техники. Кроме того, считают, что отрицательно заряженные фосфолипиды, включенные в липидную фракцию, придают комплексам и композициям, описанным в настоящем изобретении, улучшенные терапевтические свойства по сравнению с традиционными липопротеиновыми комплексами. Одним из ключевых различий между малыми дисковидными частицами пре-бета-ЛПВП, которые разлагаются в почках, и большими дисковидными и/или сферическими частицами ЛПВП, распознаваемыми печенью, где содержащийся в них холестерин либо запасается, либо подвергается рециркуляции, либо претерпевает метаболизм (в виде желчных кислот), либо выводится (в желчи), является заряд частиц. Малые дисковидные частицы пре-бета-ЛПВП имеют более низкий отрицательный поверхностный заряд, чем большие дисковидные и/или сферические частицы ЛПВП, которые заряжены отрицательно. Считают, что более высокий отрицательный заряд является одним из факторов, запускающих распознавание частиц печенью, и, следовательно, позволяющих избежать катаболизма частиц в почках. Кроме того, показано, что почки с трудом абсорбируют заряженные частицы (см. Hacker et al., 2009, Pharmacology: Principles and Practice. 183). Следовательно, считают, что, отчасти благодаря присутствию заряженного фосфолипида(ов), отрицательно заряженные липопротеиновые комплексы и композиции, описанные в настоящем изобретении, остаются в кровообращении дольше, чем традиционные липопротеиновые комплексы, или что заряд влияет на период полувыведения липопротеинов в зависимости от заряда. Ожидают, что более длительное время нахождения (пребывания) их в кровотоке в сочетании со снижением скорости и/или степени, до которой эти комплексы претерпевают агрегацию и слияние с существующими ЛПВП в результате их отрицательного заряда, способствует мобилизации холестерина (давая этим комплексам более длительное время для аккумуляции холестерина) и этерификации холестерина (путем предоставления более длительного времени для LCAT, чтобы катализировать реакцию этерификации). Заряд может также повышать скорость захвата и/или удаления холестерина, в результате чего способствует удалению холестерина в больших количествах. Вследствие этого ожидают, что отрицательно заряженные липопротеиновые комплексы и композиции, описанные в настоящем изобретении, обеспечивают терапевтическое преимущество по сравнению с традиционными терапиями липопротеинами, поскольку нужно вводить меньшее количество комплекса и/или композиции, а также менее часто и при сниженных побочных эффектах.
Соответственно, способы, предложенные в данном изобретении, в целом включают введение субъекту терапевтически эффективного количества липопротеинового комплекса, совокупности липопротеиновых комплексов или фармацевтической композиции, как описано в настоящем изобретении, для лечения или предупреждения дислипидемического расстройства. Липопротеиновый комплекс можно вводить в дозе, находящейся в диапазоне от примерно 0,25 мг/кг эквивалентов АроА-I до примерно 45 мг/кг, например, в дозе, составляющей от примерно 0,5 мг/кг до примерно 30 мг/кг или от примерно 1 мг/кг эквивалентов АроА-I вплоть до примерно 15 мг/кг эквивалентов АроА-I на инъекцию. Эта доза может быть дополнительно отрегулирована для индивидуума, подлежащего лечению, путем подбора дозы, которая сводит к минимуму повышение уровней триглицеридов, холестерина-ЛПОНП и/или триглицерида-ЛПОНП. В конкретных воплощениях доза составляет примерно 3 мг/кг, примерно 6 мг/кг или примерно 12 мг/кг.
Эти способы дополнительно включают введение липопротеинового комплекса через интервал, составляющий от 5 до 14 суток или от 6 до 12 суток, например, через интервал, составляющий от одной до двух недель. Эти способы могут дополнительно включать введение липопротеинового комплекса 4, 5, 6, 7, 8, 9, 10, 11, 12 или вплоть до 52 раз через любой из интервалов, описанных выше, и предпочтительно через интервал, составляющий одну неделю. Например, в одном воплощении липопротеиновый комплекс вводят шесть раз через интервал, составляющий одну неделю, между каждыми введениями. Для лечения хронических состояний можно осуществлять более 52 введений. Возможно, этим способам может предшествовать первоначальная фаза индукции, где липопротеиновый комплекс вводят чаще.
Комплексы и/или их фармацевтические композиции можно вводить парентерально, например, внутривенно. Внутривенное введение можно выполнять в виде инфузии в течение периода времени, находящегося в диапазоне от примерно 1 до примерно 24 часов или примерно от 1 до 4 часов, примерно от 0,5 до 2 часов или примерно 1 час.
В приведенных ниже примерах показано небольшое повышение уровней триглицеридов после введения доз, составляющих 30 мг/кг и 45 мг/кг, которое объясняется повышением уровня ЛПОНП и ЛПНП в результате высокой степени мобилизации холестерина. Эти параметры можно контролировать в процессе лечения, поскольку их можно измерить обычным способом в клинических лабораториях с помощью стандартных панелей липидов. На основании приведенных ниже примеров, может быть достигнут выбор дозы, который сводит к минимуму повышение уровней триглицеридов и холестерина-ЛПОНП и триглицерида-ЛПОНП в зависимости от реакции пациента на лекарственное средство, что обеспечивает возможность для персонализированной медицины.
Комплексы и/или композиции можно вводить отдельно (в виде монотерапии), либо альтернативно их можно вводить с дополнением другими терапевтическими средствами, полезными для лечения и/или предупреждения дислипидемии и/или обусловленных ею состояний, заболеваний и/или расстройств. Неограничивающие примеры терапевтических агентов, дополнительно с которыми можно вводить отрицательно заряженные липопротеиновые комплексы и композиции, описанные в настоящем изобретении, включают смолы, связывающие желчные кислоты, ингибиторы HMG СоА-редуктазы (статины), ниацин, смолы, ингибиторы всасывания холестерина, ингибиторы агрегации тромбоцитов, фибраты, антикоагулянты, ингибиторы СЕТР (например, анацетрапиб и далцетрапиб) и/или антитела или лиганды PCSKG.
5. КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
ФИГ.1: Аминокислотная последовательность препро-Аполипопротеина A-I человека (SEQ ID NO:1; GenBank, № доступа ААВ59514.1). Аминокислоты 1-18, выделенные полужирным шрифтом, соответствуют сигнальной последовательности АроА-I, а аминокислоты 19-24 соответствуют пропептидной последовательности, подчеркнуты. И сигнальная последовательность, и пропептид расщепляются в клетках с образованием полноразмерного зрелого белка АроА-I (аминокислоты 25-267).
ФИГ.2: Титры АроА-I в 12-суточных периодических культурах с подпиткой рекомбинантных клеток S-CHO, экспрессирующих АроА-I. Клетки непрерывно культивировали путем серийных пересевов от поколения 0 до поколения 43. Мониторинг продуцирования АроА-I проводили в поколениях 4, 8, 14, 19, 25, 21, 36 и 43 с помощью ВЭЖХ с обращенной фазой. Количество АроА-I в культуральной среде варьировало от 1259 мг/л до 1400 мг/л.
ФИГ.3А-3В: На ФИГ.3А показана плотность жизнеспособных клеток в 200 л 13-суточной культуры рекомбинантных клеток S-CHO, экспрессирующих АроА-I. Плотность жизнеспособных клеток достигала пика на сутки 9 при значении 33,20×105 клеток/мл, жизнеспособность которых составляла 92,5%. На ФИГ.3B показана концентрация АроА-I в культуральной среде 13-суточной культуры. Концентрация АроА-I в культуральной среде достигала пика на сутки 12 при значении около 2 мг/мл.
ФИГ.4: Полиакриламидный SDS-гель АроА-I, очищенного способами, описанными в настоящем изобретении.
На дорожке слева показаны маркеры молекулярной массы. На дорожке справа показан очищенный АроА-I, имеющий молекулярную массу, составляющую приблизительно 28 кДа.
ФИГ.5A-5D: Хроматограммы ВЭЖХ комплексов ApoA-I/SM при массовых отношениях белок:липид, составляющих 1:2,5 (формула А; ФИГ.5А), 1:2,7 (формула В; ФИГ.5В), 1:3,1 (формула С; ФИГ.5С), и комплексов проАроА-I/SM/DPPC при массовых отношениях белок:липид, составляющих 1:2,7 (формула D; ФИГ.5D).
ФИГ.6A-6D: Хроматограммы ВЭЖХ липопротеиновых комплексов, имеющих формулу D, через 10, 20, 30 и 60 минут соответственно.
ФИГ.7A-7D: Хроматограммы ВЭЖХ липопротеиновых комплексов, имеющих формулу В, через 10, 20, 30 и 50 минут соответственно.
ФИГ.8A-8D: Хроматограммы ВЭЖХ липопротеиновых комплексов, имеющих формулу F, через 20, 40, 60 и 120 минут соответственно.
ФИГ.9: Схема образования комплекса пре-бета-ЛПВП по времени, иллюстрирующая образование липопротеиновых комплексов при отношении масс./масс. липопротеин:суммарный фосфолипид, составляющем 1:2,7, включающих проАроА-I и SM (формула В), проАроА-I, SM, DPPC и DPPG при отношении масс./масс. SM:DPPC:DPPG, составляющем 48:48:4 (формула F), и проАроА-I, SM, DPPC и DPPG при отношении масс./масс. SM:DPPC:DPPG, составляющем 73:23:4 (формула G).
ФИГ.10A-10D: Хроматограммы ВЭЖХ для формул Е, Н, I и J соответственно.
ФИГ.11: Схематическая диаграмма иллюстративного способа получения липопротеиновых комплексов.
ФИГ.12: Иллюстративный прибор для термоциклирования, используемый для пробегов термоциклирования в непромышленном масштабе.
ФИГ.13А-13Е: Гельпроникающая хроматография комплексов SM/DPPG/белок АроА-I при возрастающем числе температурных циклов. Компоненты подвергали термоциклированию при температуре, составляющей 57°С и 37°С в течение 5 минут при каждой температуре, в течение суммарно 30 минут (ФИГ.13А), 60 минут (ФИГ.13В), 120 минут (ФИГ.13С), 180 минут (ФИГ.13D) или 210 минут (ФИГ.13Е).
ФИГ.14: Гельпроникающая хроматограмма комплексов SM/ApoA-I.
ФИГ.15: Гельпроникающая хроматограмма комплексов N-пальмитоил-4-гидроксисфинганин-1-фосфохолин (форма растительного SM или фитосфингомиелин)/DPPG/АроА-I.
ФИГ.16: Гельпроникающая хроматограмма комплексов синтетический пальмитоил-SM/DPPG/ApoA-I.
ФИГ.17: Гельпроникающая хроматограмма комплексов фитосфингомиелин/DPPG/ApoA-I.
ФИГ.18: Гельпроникающая хроматограмма комплексов SM/DPPC/DPPG/пептид АроА-I.
ФИГ.19A-19D: Характеризация липидных частиц с помощью системы динамического светорассеяния с использованием прибора Malvern Instruments Zetasizer (Malvern Instruments Inc.). На ФИГ.19А средний размер Z составляет 84,49 нм ("частицы 84 нм"); на ФИГ.19В средний размер Z составляет 76,76 нм ("частицы 77 нм"); на ФИГ.19С средний размер Z составляет 66,21 нм ("частицы 66 нм"); и на ФИГ.19D средний размер Z составляет 59,50 нм (" частицы 60 нм").
ФИГ.20A-20D: Гельпроникающие хроматограммы комплексов после пяти температурных циклов с липидными частицами 84 нм (ФИГ.20А), 77 нм (ФИГ.20В), 66 нм (ФИГ.20С) и 60 нм (ФИГ.20D).
ФИГ.21А-21В: Гельпроникающие хроматограммы комплексов после шести температурных циклов, начиная с липидных частиц, имеющих размер 450 нм (ФИГ.21А) и 40 нм (ФИГ.21В).
ФИГ.22: Гельпроникающая хроматограмма комплексов после шести температурных циклов, начиная с липидных частиц, имеющих размер 65 нм, где первый цикл инициирован при "низкой температуре", составляющей 37°С.
ФИГ.23: Схематическая диаграмма иллюстративного воплощения для получения фармацевтических композиций, содержащих липопротеиновые комплексы, при котором липопротеиновые комплексы, полученные способами по изобретению, включают в препарат коммерчески полезных фармацевтических композиций.
ФИГ.24: Повышение уровней суммарного холестерина-ЛПОНП в плазме после инфузии липопротеинового комплекса в соответствии с формулой B и с формулой Н. Липопротеиновые комплексы в соответствии с формулой Н (■) и с формулой В (▼) вводили путем инфузии кроликам натощак в дозах, составляющих 5 мг/кг. Чтобы определить повышение уровней суммарного холестерина-ЛПОНП в плазме, вычитали базовые значения, находящиеся в интервале от 0,03 до 0,3 г/л для трех групп.
ФИГ.25: Повышение уровней триглицеридов в плазме после инфузии липопротеинового комплекса в соответствии с формулой Вис формулой Н. Липопротеиновые комплексы в соответствии с формулой Н (■) и с формулой В (▲) вводили путем инфузии кроликам натощак в дозах, составляющих 5 мг/кг. Чтобы определить повышение уровней триглицеридов в плазме, вычитали базовые значения, находящиеся в интервале от 0,31 до 0,71 г/л для трех групп.
ФИГ.26A-26D: Повышение уровней суммарного холестерина (ФИГ.26А), триглицеридов (ФИГ.26В), фосфолипидов (ФИГ.26С) и АроА-I (ФИГ.26D) в плазме после инфузии кроликам 5 мг/кг или 20 мг/кг и 20 мг/кг комплексов АроА-I/SM куриного яйца (●,▲) или комплексов АроА-I/синтетический SM (♦,▼) по сравнению с разбавителем (■). Базовые значения для различных измеряемых липидов находились в следующих интервалах: от 0,28 до 0,4 г/л для плазматического холестерина, от 0,23 до 0,29 г/л для плазматических триглицеридов и от 0,45 до 0,61 г/л для плазматических фосфолипидов.
ФИГ.27А-27С: Повышение уровней суммарного холестерина-ЛПВП (ФИГ.27А), суммарного холестерина-ЛПНП (ФИГ.27В) и суммарного холестерина-ЛПОНП (ФИГ.27С) после инфузии кроликам 5 мг/кг 5 мг/кг комплексов АроА-I/SM куриного яйца (●) и комплексов АроА-I/синтетический SM (♦) по сравнению с разбавителем (■). Базовые значения находились в следующих интервалах: от 0,20 до 0,31 г/л для плазматического суммарного холестерина-ЛПВП, от 0,06 до 0,09 г/л для плазматического суммарного холестерина-ЛПНП и от 0,007 до 0,011 г/л для плазматического суммарного холестерина-ЛПОНП.
6. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложены Липопротеиновые комплексы и их совокупности вместе со способами получения липопротеиновых комплексов. Комплексы, совокупности и их композиции (например, фармацевтические композиции) среди прочего полезны для лечения и/или профилактики дислипидемии и/или заболеваний, расстройств и/или состояний, обусловленных дислипидемией. Как обсуждалось в разделе Краткое изложение сущности изобретения, липопротеиновые комплексы включают две основные фракции, фракцию аполипопротеина и фосфолипидную фракцию, предпочтительно в определенных массовых или молярных отношениях, и предпочтительно включающих определенное количество нейтрального фосфолипида и возможно одного или более чем одного отрицательно заряженного фосфолипида.
6.1. Белковая фракция
В настоящем изобретении предложены липопротеиновые комплексы, включающие белковую фракцию. В настоящем изобретении дополнительно предложены способы получения липопротеиновых комплексов. Белковый компонент липопротеиновых комплексов не является критическим для успешного осуществления настоящих способов. В комплексы можно включать практически любой липидсвязывающий белок, такой как аполипопротеин и/или его производное или аналог, обеспечивающий терапевтическую и/или профилактическую пользу. Кроме того, в липопротеиновые комплексы можно включать любой альфа-спиральный пептид или пептидный аналог, или молекулу любого другого типа, "имитирующую" активность аполипопротеина (такого как, например, АроА-I), при которой он может активировать LCAT или образовывать дисковидные частицы при ассоциации с липидами, и эти пептиды охвачены термином "липидсвязывающий белок".
6.1.1. Липидсвязывающие белки
В настоящем изобретении дополнительно предложены способы очистки рекомбинантно продуцированного белка, например, используемого при получении липопротеиновых комплексов. Рекомбинантно продуцируемый белок наиболее целесообразно представляет собой аполипопротеин. Подходящие белки включают аполипопротеины АроА-I, ApoA-II, ApoA-IV, ApoA-V и АроЕ; предпочтительно в форме зрелого белка. Липидсвязывающие белки также включают активные полиморфные формы, изоформы, варианты и мутанты, а также укороченные формы вышеуказанных аполипопротеинов, наиболее распространенными из которых являются аполипопротеин А-IMilano (АроА-IM), Аполипопротеин A-IParis (ApoA-IP) и Аполипопротеин A-IZaragoza (ApoA-IZ). Известные также мутанты аполипопротеинов, содержащие остатки цистеина, и эти мутанты можно также использовать (см., например, публикацию US №2003/0181372). Аполипопротеины могут находиться в форме мономеров или димеров, которые могут представлять собой гомодимеры или гетеродимеры. Например, можно использовать гомо- и гетеродимеры (где это целесообразно) ApoA-I (Duverger et al., 1996, Arterioscler. Thromb. Vase. Biol. 16(12):1424-29), АроА-IM (Franceschini et al., 1985, J. Biol. Chem. 260:1632-35), ApoA-IP (Daum et al., 1999, J. Mol. Med. 77:614-22), ApoA-II (Shelness et al., 1985, J. Biol. Chem. 260(14):8637-46; Shelness et al., 1984, J. Biol. Chem. 259(15):9929-35), ApoA-IV (Duverger et al., 1991, Euro. J. Biochem. 201(2):373-83), ApoE (McLean etal., 1983, J. Biol. Chem. 258(14):8993-9000), ApoJ и АроН. Аполипопротеины могут включать остатки, соответствующие элементам, которые облегчают их выделение, такие как His-метки, или другие элементы, предназначенные для других целей, при условии, что аполипопротеины сохраняют некоторую биологическую активность при включении в комплексы.
Такие аполипопротеины можно очистить из животных источников (и, в частности, из человеческих источников) или продуцировать рекомбинантным путем, как хорошо известно в данной области техники, см., например, Chung et al., 1980, J. Lipid Res. 21(3):284-91; Cheung et al., 1987, J. Lipid Res. 28(8):913-29. См. также патенты US №№5059528, 5128318, 6617134; публикации US №№20002/0156007, 2004/0067873, 2004/0077541 и 2004/0266660; и публикации РСТ №№ WO/2008/104890 и WO/2007/023476. Также возможны другие способы очистки, например, как описано в Разделах 6.1.3 и 6.1.4 ниже.
Неограничивающие примеры пептидов и пептидных аналогов, соответствующих аполипопротеинам, а также агонистов, которые имитируют активность ApoA-I, АроА-IM, ApoA-II, ApoA-IV и ApoE, подходящих для применения в качестве аполипопротеинов в комплексах и композициях, описанных в настоящем изобретении, описаны в патентах US №№6004925, 6037323 и 6046166 (заявители Dasseux et al.), в патенте US №5840688 (заявитель Tso), в публикациях US №№2004/0266671, 2004/0254120, 2003/0171277 и 2003/0045460 (заявитель Fogelman), в публикации US №2003/0087819 (заявитель Bielicki) и в публикации РСТ № WO/2010/093918 (заявители Dasseux et al.), описания которых полностью включены в настоящее изобретение посредством ссылки. Эти пептиды и пептидные аналоги могут состоять из L-аминокислот или D-аминокислот, либо из смеси L- и D-аминокислот. Они могут также включать одну или более чем одну непептидную или неамидную связь, например, как в одном или более чем одном хорошо известном изостерном пептиде/амиде. Такие аполипропротеины, представляющие собой "пептиды и/или пептидные миметики", могут быть синтезированы или получены с использованием любого метода пептидного синтеза, известного в данной области техники, включая, например, методы, описанные в патентах US №№6004925, 6037323 и 6046166.
Комплексы могут включать один тип липидсвязывающего белка или смеси двух или более чем двух различных липидсвязывающих белков, которые могут иметь происхождение от одинаковых или разных соединений. Хотя это необязательно, липопротеиновые комплексы предпочтительно включают липидсвязывающие белки, имеющие происхождение от аминокислотной последовательности вида животного, подлежащего лечению, или соответствующие этой аминокислотной последовательности, чтобы избежать иммунного ответа на терапию. Таким образом, для лечения пациентов-людей в комплексах по изобретению предпочтительно используют липидсвязывающие белки, имеющие человеческое происхождение. Использование пептидных миметиков аполипопротеинов может также снизить иммунный ответ или позволяет избежать его.
В определенных предпочтительных воплощениях липидсвязывающий белок представляет собой белок, имеющий аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью последовательности зрелому белку АроА-I человека, например, белку, имеющему аминокислотную последовательность, соответствующую положениям 25-267 SEQ ID NO:1.
В определенных воплощениях зрелый белок АроА-I человека имеет аминокислотную последовательность, обладающую по меньшей мере по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности положениям 25-267 of SEQ ID NO:1. В некоторых воплощениях зрелый белок АроА-I человека имеет аминокислотную последовательность, включающую аспарагиновую кислоту в положении 1 (то есть в положении, соответствующем положению 25 SEQ ID NO:1). В конкретном воплощении зрелый белок АроА-I человека имеет аминокислотную последовательность, соответствующую положениям 25-267 SEQ ID NO:1. В предпочтительном воплощении белок АроА-I Рекомбинантно продуцируется в клетках-хозяевах млекопитающих, наиболее предпочтительно в клетках яичника китайского хомячка ("СНО"), как описано в следующем подразделе.
6.1.2. Рекомбинантная экспрессия аполипопротеинов
В настоящем изобретении предложены способы рекомбинантной экспрессии для продуцирования липидсвязывающих белков, таких как АроА-I, и соответствующие нуклеиновые кислоты, клетки-хозяева млекопитающих, клеточных культур. Полученный в результате рекомбинантный липидсвязывающий белок может быть очищен и/или включен в липопротеиновые комплексы, как описано в настоящем изобретении.
Как правило, для рекомбинантного продуцирования полинуклеотидную последовательность, кодирующую липидсвязывающий белок или пептид, встраивают в соответствующий носитель экспрессии, то есть вектор, содержащий необходимые элементы для транскрипции и трансляции встроенной кодирующей последовательности, или в случае РНК-вирусного вектора необходимые элементы для репликации и трансляции. Экспрессионный вектор может иметь происхождение от вирусов, например, аденовируса, аденоассоциированного вируса, вируса герпеса, ретровируса или лентивируса. Затем этим носителем экспрессии трансфицируют подходящую клетку-мишень, которая будет экспрессировать белок или пептид. Подходящие клетки-хозяева включают, но не ограничены ими, различные виды бактерий, системы клеток-хозяев млекопитающих или насекомых, включающих бакуловирусные системы (см., например, Luckow et at., Bio/Technology, 6, 47 (1988)), и устойчивые клеточные линии, такие как 293, COS-7, C127, 3Т3, СНО, HeLa, BHK и т.д. В зависимости от используемой экспрессионной системы экспрессированный пептид затем выделяют методами, хорошо известными в данной области техники. Способы продуцирования рекомбинантных белков и пептидов хорошо известны в данной области техники (см., например, Sambrook et al., 1989, Molecular Cloning A Laboratory Manual, Cold Spring Harbor Laboratory, N.Y.; и Ausubel et al., 1989, Current Protocols in Molecular Biology, Greene Publishing Associates and Wiley Interscience, N.Y., где каждый из этих документов полностью включен в настоящее изобретение посредством ссылки).
В том случае, когда липидсвязывающим белком является АроА-I, белок АроА-I экспрессируется с рекомбинантной нуклеотидной последовательности, кодирующей АроА-I. В некоторых воплощениях нуклеотидная последовательность, кодирующая АроА-I, представляет собой последовательность человека. Неограничивающие примеры нуклеотидных последовательностей АроА-I человека описаны в патентах US №№ 5876968; 5643757 и 5990081, а также WO 96/37608; описания всех этих документов полностью включены в настоящее изобретение посредством ссылки. В определенных воплощениях нуклеотидная последовательность кодирует аминокислотную последовательность зрелого белка АроА-I, предпочтительно функционально связанную с сигнальной последовательностью (например, аминокислоты 1-18 SEQ ID NO:1), для секреции ApoA-I из клетки-хозяина, и/или последовательность пробелка (например, аминокислоты 19-25 SEQ ID NO:1). Другие сигнальные последовательности, подходящие для направленной секреции ApoA-I, могут быть либо гетерологичными по отношению к ApoA-I, например, последовательность сигнального пептида альбумина человека или сигнального пептида IL-2 человека, либо гомологичными по отношению к АроА-I.
Предпочтительно нуклеотидная последовательность кодирует зрелый полипептид ApoA-I, например, полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична аминокислотной последовательности, соответствующей положениям 25-267 SEQ ID NO:1, возможно, где аминокислотная последовательность включает аспарагиновую кислоту в положении 25. В предпочтительном воплощении нуклеотидная последовательность кодирует полипептид, имеющий аминокислотную последовательность SEQ ID NO:1. Нуклеотидная последовательность может также кодировать полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична аминокислотной последовательности белка АроА-I человека, представленной в одной из последовательностей GenBank, номера доступа NP 000030, ААВ59514, Р02647, САА30377, ААА51746 или ААН05380.1, возможно включающей аспарагиновую кислоту в положении, соответствующем первой аминокислоте зрелого белка АроА-I человека.
Полинуклеотиды, кодирующие АроА-I, могут быть оптимизированы по кодонам для экспрессии в рекомбинантных клетках-хозяевах. Предпочтительными клетками-хозяевами являются клетки-хозяева млекопитающих, включающие, но не ограниченные ими, клетки яичника китайского хомячка (например, СНО-K1; АТСС No. CCL 61; CHO-S (GIBCO Life Technologies Inc., Rockville, MD, № по каталогу 11619012)), клетки VERO, BHK (АТСС No. CRL 1632), BHK 570 (АТСС No. CRL 10314), клетки HeLa, COS-1 (АТСС No. CRL 1650), COS-7 (АТСС No. CRL 1651), клетки MDCK, клетки 293 (АТСС No. CRL 1573; Graham et al., J. Gen. Virol. 36:59-72, 1977), клетки 3Т3, клетки миеломы (в частности, мыши), клетки РС12 и клетки W138. В определенных воплощениях клетки млекопитающих, такие как клетки CHO-S (Invitrogen™, Carlsbad CA), приспособлены к росту в среде без сыворотки. Дополнительные линии клеток известны в данной области техники и доступны из государственных депозитов, таких как Американская коллекция типовых клеточных культур, Manassas, Va.
Для рекоминантной экспрессии АроА-I, полинуклеотиды, кодирующие АроА-I, функционально связаны с одной или более чем одной регуляторной последовательностью, например, промотором или терминатором, которые регулируют экспрессию АроА-I в представляющей интерес клетке-хозяине. Эта регуляторная последовательность(и) может(гут) быть нативной или чужеродной по отношению к кодирующей посредовательности АроА-I, а также нативной или чужеродной по отношению к клетке-хозяину, в которой экспрессируется АроА-I. Регуляторные последовательности включают, но не ограничены ими, промоторы, сайты связывания рибосомы, лидерные последовательности, последовательности полиаденилирования, пропептидные последовательности, последовательности сигнального пептида и терминаторы транскрипции. В некоторых воплощениях регуляторные последовательности включают промотор, сайт связывания рибосомы и транскрипционные и трансляционные сигналы терминации. Регуляторные последовательности могут также включать один или более чем один линкер с целью введения специфичных сайтов рестрикции, способствующих лигированию регуляторных последовательностей с кодирующим участком нуклеотидной последовательности, кодирующей АроА-I.
Промоторы, направляющие рекомбинантную экспрессию АроА-I, могут представлять собой конститутивные промоторы, регулируемые промоторы или индуцибельные промоторы. Подходящие промоторные последовательности могут быть получены из генов, кодирующих внутриклеточные или внеклеточные полипептиды, которые являются либо эндогенными, либо гетерологичными для клетки-хозяина. Способы выделения, идентификации промоторов и манипуляций с промоторами, обладающими различной силой, доступны или легко адаптируются из данной области техники. См, например, статью Nevoigt et al. (2006) Appl. Environ. Microbiol. 72:5266-5273, описание которой полностью включено в настоящее изобретение посредством ссылки.
Одна или более чем одна из регуляторных последовательностей может иметь происхождение из вирусных источников. Например, в некоторых аспектах промоторы имеют происхождение от основного позднего промотора вируса полиомы или аденовируса. В других аспектах промотор имеет происхождение от обезьяньего вируса 40 (SV40), который может быть также получен в виде фрагмента, также включающего точку начала репликации SV40 (Fiers et al., 1978, Nature, 273:113-120), или от цитомегаловируса, например, немедленно-раннего промотора цитомегаловируса обезьян. (См. патенты US №№4956288). Другие подходящие промоторы включают промоторы из генов металлотионеина (см. патенты US №№4579821 и 4601978).
В данном изобретении также предложены рекомбинантные экспрессионные векторы ApoA-I. Рекомбинантный экспрессионный вектор может представлять собой любой вектор, например, плазмиду или вирус, с которым можно манипулировать методами рекомбинантных ДНК, чтобы способствовать экспрессии гетерологичного ApoA-I в рекомбинантной клетке-хозяине. Экспрессионный вектор может быть интегрирован в хромосому рекомбинантной клетки-хозяина и включает один или более чем один гетерологичный ген, функционально связанный с одной или более чем одной регуляторной последовательностью, полезной для продуцирования АроА-I. В других воплощениях экспрессионный вектор представляет собой экстрахромосомную репликативную молекулу ДНК, например, линейную или замкнутую кольцевую плазмиду, которая обнаруживается либо при низком числе копий (например, от примерно 1 до примерно 10 копий на геномный эквивалент), либо при высоком числе копий (например, более чем примерно 10 на геномный эквивалент). В различных воплощениях экспрессионный вектор включает селективный маркер, например, ген, придающий устойчивость к антибиотикам (например, устойчивость к ампициллину, канамицину, хлорамфениколу или тетрациклину) рекомбинантному организму-хозяину, содержащему этот вектор. В конкретных аспектах конструкции ДНК, векторы и полинуклеотиды подходят для экспрессии АроА-I в клетках млекопитающих. Векторы для экспрессии АроА-I в клетках млекопитающих могут включать точку начала репликации, промотор и любые необходимые сайты связывания рибосомы, сайты сплайсинга РНК, сайт полиаденилирования и последовательности терминации транскрипции, совместимые с системами клетки-хозяина. В некоторых аспектах точка начала репликации является гетерологичной по отношению к клетке-хозяину, например, имеет вирусное происхождение (например, от вируса SV40, полиомы, аденовируса, VSV (вируса везикулярного стоматита), BPV (вируса папилломы крупного рогатого скота)). В других аспектах точка начала репликации обеспечена механизмом хромосомной репликации клетки-хозяина.
Способы, реагенты и средства для введения чужеродной ДНК в клетки-хозяева млекопитающих известны в данной области техники и включают, но не ограничены ими, трансфекцию, опосредованную фосфатом кальция (Wigler et al., 1978, Cell 14:725; Corsaro et al., 1981, Somatic Cell Genetics 7:603; Graham et al., 1973, Virology 52:456), электропорацию (Neumann et al., 1982, EMBO J. 1:841-5), трансфекцию, опосредованную ДЭАЭ-декстраном (Ausubel et al. (eds.), Short Protocols in Molecular Biology, 3rd Edition (John Wiley & Sons 1995)) и трансфекцию, опосредованную липосомами (Hawley-Nelson et al., 1993, Focus 15:73; Ciccarone etal., 1993, Focus 15:80).
Для продуцирования с высоким выходом предпочтительна стабильная экспрессия АроА-I. Например, после введения чужеродной ДНК в клетки-хозяева, этим клеткам-хозяевам можно дать возможность расти в течение 1-2 суток в обогащенной среде, а затем перевести их на селективную среду. Клетки-хозяева можно трансформировать вектором, включающим нуклеотидную последовательность, содержащую кодирующую последовательность АроА-I, регулируемую подходящими регуляторными элементами экспрессии, и селективный маркер, что более вероятно, чем использование экспрессионных векторов, содержащих точки начала репликации вирусов. Селективный маркер в векторе придает устойчивость к отбору и дает возможность для стабильной интеграции этого вектора в хромосомы клеток, а также дает возможность расти с образованием фокусов, которые, в свою очередь, можно клонировать и размножать с получением клеточных линий. Можно использовать ряд селективных систем, включающих, но не ограниченных ими, гены тимидинкиназы вируса простого герпеса (Wigler et al., 1977, Cell 11:223), гипоксантин-гуанинфосфорибозилтрансферазы (Szybalska & Szybalski, 1962, Proc. Natl. Acad. Sci. USA 48:2026) и аденинфосфорибозилтрансферазы (Lowy et al., 1980, Cell 22:817), которые можно использовать в клетках tk-, hgprt- или aprt- соответственно. В качестве основы для отбора можно также использовать устойчивость к антиметаболитам путем использования, например, гена dhfr, который придает устойчивость к метотрексату (Wigler et al., 1980, Natl. Acad. Sci. USA 77:3567; O'Hare et al., 1981, Proc. Natl. Acad. Sci. USA 78:1527); gpt, который придает устойчивость к микофеноловой кислоте (Mulligan & Berg, 1981, Proc. Natl. Acad. Sci. USA 78:2072); neo, который придает устойчивость к аминогликозиду G-418 (Colberre-Garapin et al., 1981, J. Mol. Biol. 150:1); и/или hyg, который придает устойчивость кгигромицину (Santerre et al., 1984, Gene 30:147).
Стабильная экспрессия при высоком выходе может быть также достигнута с использованием ретровирусных векторов, которые интегрируют в геном клетки-хозяина (см., например, публикации патентов US №№2008/0286779 и 2004/0235173). Альтернативно стабильная экспрессия АроА-I при высоком выходе может быть достигнута с помощью методов активации генов, включающих активацию экспрессии и амплификацию эндогенного гена АроА-I в геномной ДНК выбранной клетки млекопитающего, например, как описано в WO 1994/012650. Увеличение числа копий гена АроА-I (содержащегокодирующую последовательность АроА-I и один или более чем один регуляторный элемент) может способствовать высокому выходу экспрессии АроА-I. Предпочтительно клетка-хозяин млекопитающего, в которой экспрессируется АроА-I, обладает высоким показателем копийности гена АроА-I, составляющим по меньшей мере 2, по меньшей мере 3, по меньшей мере 4 или по меньшей мере 5. В конкретных воплощениях клетка-хозяин млекопитающего, в которой экспрессируется АроА-I, обладает показателем копийности гена АроА-I, составляющим по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9 или по меньшей мере 10.
В определенных воплощениях клетки млекопитающих приспособлены к продуцированию АроА-I в количествах, составляющих по меньшей мере 0,5 г/л, по меньшей мере 1 г/л, по меньшей мере 1,5 г/л, по меньшей мере 2 г/л, по меньшей мере 2,5 г/л, по меньшей мере 3 г/л, по меньшей мере 3,5 г/л и возможно вплоть до 4 г/л, вплоть до 4,5 г/л, вплоть до 5 г/л, вплоть до 5,5 г/л или вплоть до 6 г/л. Клетки-хозяева млекопитающих предпочтительно способны продуцировать по меньшей мере примерно 0,5, 1, 2 или 3 г/л ApoA-I в культуре и/или вплоть до примерно 20 г/л ApoA-I в культуре, например, вплоть до 4, 5, 6, 7, 8, 9,12 или 15 г/л ApoA-I в культуре.
В определенных воплощениях клетки млекопитающих приспособлены к росту в среде без сыворотки. В этих воплощениях ApoA-I секретируется из клеток. В других воплощениях ApoA-I не секретируется из клеток.
Клетки-хозяева млекопитающих, предложенные в данном изобретении, можно использовать для продуцирования ApoA-I. Как правило, способы включают культивирование клетки-хозяина млекопитающего, как описано в настоящем изобретении, в условиях, в которых экспрессируется ApoA-I. Кроме того, эти способы могут включать выделение и, возможно, очистку зрелого белка ApoA-I из супернатанта культуры клеток млекопитающих.
Условия культивирования, включающие среду для культивирования, температуру, рН, могут быть приспособлены к культивируемой клетке-хозяину млекопитающего и к выбранному режиму культуры (встряхиваемая колба, биореактор, роллерный флакон и т.д.). Клетки млекопитающих можно выращивать в крупномасштабной периодической культуре, в непрерывной или полунепрерывной культуре.
В данном изобретении также предложена культура клеток млекопитающих, содержащая множество клеток-хозяев млекопитающих, продуцирующих АроА-I, как описано в настоящем изобретении. В некоторых воплощениях культура клеток млекопитающих содержит по меньшей мере 0,5 г/л, по меньшей мере 1 г/л, по меньшей мере 1,5 г/л, по меньшей мере 2 г/л, по меньшей мере 2,5 г/л, по меньшей мере 3 г/л, по меньшей мере 3,5 г/л и возможно вплоть до 4 г/л, вплоть до 4,5 г/л, вплоть до 5 г/л, вплоть до 5,5 г/л или вплоть до 6 г/л АроА-I. Культура может иметь любой масштаб, находящийся в диапазоне от примерно 150 мл до примерно 500 мл, 1 л, 10 л, 15 л, 50 л, 100 л, 200 л, 250 л, 300 л, 350 л, 400 л, 500 л, 750 л, 1000 л, 1500 л, 2000 л, 2500 л, 3000 л, 5000 л, 7500 л, 10000 л, 15000 л, 20000 л, 25000 л, 50000 л или более. В некоторых случаях культура представляет собой крупномасштабную культуру, объем которой составляет, например, 15 л, 20 л, 25 л, 30 л, 50 л, 100 л, 200 л, 300 л, 500 л, 1000 л, 5000 л, 10000 л, 15000 л, 20000 л, 25000 л, вплоть до 50000 л или более.
6.1.3. Очистка аполипопротеинов
Настоящее изобретение относится к способам получения высокоочищенного аполипопротеина, полезного при получении липопротеиновых комплексов и их композиций, как описано в настоящем изобретении. Эти способы можно применять к любому аполипопротеину, включая, но не ограничиваясь, АроА-I, -II, -III или - IV; АроВ48 и АроВЮО; АроС-I, -II, -III или -IV; ApoD; ApoE, ApoH; ApoJ. Более конкретно, настоящее изобретение относится к способам получения высокоочищенного АроА-I. В некоторых воплощениях АроА-I представляет собой белок человека, имеющий последовательность, выбранную из последовательностей, включающих, но не ограниченных ими, последовательности, представленные в Genbank, №№ доступа NP 000030. ААВ59514, Р02647, САА30377, ААА51746 и ААН05380.1. В определенных воплощениях АроА-I представляет собой белок человека, описанный выше в Разделе 6.1.2. В других воплощениях способы по настоящему изобретению можно применять для очистки АроА-I, имеющего происхождение от животных, отличающихся от человека (см., например, публикацию US №2004/0077541), например, крупного рогатого скота, лошадей, овец, обезьян, бабуинов, коз, кроликов, собак, ежей, барсуков, мышей, крыс, кошек, морских свинок, хомяков, уток, кур, лосося и угря (Brouillette et al., 2001, Biochim. Biophys. Acta. 1531:4-46; Yu et al., 1991, Cell Struct. Fund 16(4):347-55; Chen and Albers, 1983, Biochim Biophys Acta. 753(I):40-6; Luo et al., 1989, J Lipid Res. 30(11):1735-46; Blaton et al., 1977, Biochemistry 16:2157-63; Sparrow et al., J Lipid Res. 36(3):485-95; Beaubatie et al., 1986, J. Lipid Res. 27:140-49; Januzzi et al., 1992, Genomics 14(4):1081-8; Goulinet and Chapman, 1993, J. Lipid Res. 34(6):943-59; Collet et al., 1997, J Lipid Res. 38(4):634-44; и Frank and Marcel, 2000, J. Lipid Res. 41(6):853-72).
Примеры белков ApoA-I, которые могут быть очищены способами, описанными в настоящем изобретении, включают, но не ограничены ими, форму препроаполипопротеина ApoA-I, про-форму и зрелые формы ApoA-I, а также активные полиморфные формы, изоформы, варианты и мутанты, в также укороченные формы, например АроА-IM, АроА-IZ и ApoA-IP. АроА-IM представляет собой молекулярный вариант R173C ApoA-I (см., например, Parolini et al., 2003, J Biol Chem. 278(7):4740-6; Calabresi et al., 1999, Biochemistry 38:16307-14; and Calabresi et al., 1997, Biochemistry 36:12428-33). ApoA-IP представляет собой молекулярный вариант R151C ApoA-I (см., например, Daum et al., 1999, J Mol Med. 77(8):614-22). ApoA-IZ представляет собой молекулярный вариант L144R ApoA-I (см. Recalde et al., 2001, Atherosclerosis 154(3):613-623; Fiddyment et al., 2011, Protein Expr. Purif. 80(1):110-116). Мутанты аполипопротеина A-I, содержащие остатки цистеина также известны, и могут быть также очищены способами, описанными в настоящем изобретении (см., например, публикацию US №2003/0181372). ApoA-I, применяемый в способах, описанных в настоящем изобретении, может находиться в форме мономеров, гомодимеров или гетеродимеров. Например, могут быть получены гомо- и гетеродимеры про- и зрелого ApoA-I, включающие среди прочего ApoA-I (Duverger et al., 1996, Arterioscler Thromb Vase Biol. 16(12):1424-29), АроА-IM (Franceschini et al., 1985, J Biol Chem. 260:1632-35) и ApoA-IP (Daum et al., 1999, J Mol Med. 77:614-22).
Способы очистки, описанные в настоящем изобретении, могут быть осуществлены в любом масштабе, удобном для практикующего специалиста в данной области техники.
В некоторых аспектах белок ApoA-I, который можно очистить способами, описанными в настоящем изобретении, имеет аминокислотную последовательность, по меньшей мере на 75% идентичную, по меньшей мере на 80% идентичную, по меньшей мере на 85% идентичную, по меньшей мере на 90% идентичную, по меньшей мере на 91% идентичную, по меньшей мере на 92% идентичную, по меньшей мере на 93% идентичную, по меньшей мере на 94% идентичную, по меньшей мере на 95% идентичную, по меньшей мере на 96% идентичную, по меньшей мере на 97% идентичную, по меньшей мере на 98% идентичную, по меньшей мере на 99% идентичную или по меньшей мере на 100% идентичную аминокислотам 25-267 SEQ ID NO:1.
Аполипопротеин может иметь происхождение из любого источника, включая плазму крови, или в результате рекомбинантной экспрессии в прокариотических или эукариотических клетках. В конкретных воплощениях аполипопротеин представляет собой АроА-I, например, АроА-I человека. В некоторых аспектах АроА-I экспрессируется в цитоплазме или периплазме прокариотических или эукариотических клеток-хозяев. В этих воплощениях для высвобождения АроА-I в супернатант клетки разрушают, после чего очищают АроА-I. Способы разрушения клеток хорошо известны в данной области техники. Иллюстративные способы разрушения клеток включают, но не ограничены ими, ферментативные способы, обработку ультразвуком, способы с использованием детергентов и механические способы. В определенных предпочтительных аспектах АроА-I экспрессируется в клетках млекопитающих, предпочтительно в клетках СНО, и секретируется в ростовую среду. В этих воплощениях АроА-I очищают из осветленной бесклеточной среды. Понятно, что, хотя способы очистки подробно описаны в настоящем изобретении в связи с АроА-I человека, специалисты в данной области техники смогут приспособить эти условия очистки к другим аполипопротеинам, а также к АроА-I, имеющему происхождение не от человека, к полиморфным формам, изоформам, вариантам, мутантам и укороченным формам АроА-I или других аполипопротеинов в зависимости от конкретных характеристик белка, которые могут быть легко определены специалистами в данной области техники (например, молекулярная масса, изоэлектрическая точка, радиус Стокса, гидрофобность, мультимерное состояние и т.д).
Если АроА-I получают из плазмы крови, его можно выделить из плазмы крови любым известным способом, включая, но не ограничиваясь, способы низкотемпературного фракционирования, такие как описаны авторами Conn et al., 1946, J. Am. Chem. Soc. 68:459-475 ("способ Коэна") или Oncley et al., 1949, J. Am. Chem. Soc. 71:541-550 ("способ Коэна-Оксли"). Другие способы выделения аполипопротеина из плазмы крови включают вариации способов Коэна и Коэна-Оксли, такие как способ Кистлера-Нитшманна (см. Nitschmann et al., 1954, Helv. Chim. Acta 37:866-873; Kistler et al., 1962, Vox Sang. 7:414-424).
В этих воплощениях аполипопротеин получают путем осаждения из плазмы холодным спиртом, например, этанолом. Другие спирты, применяемые при низкотемпературном фракционировании плазмы, включают C1-C6 прямоцепочечные или разветвленные спирты, такие как метанол, н-пропанол, изопропанол, н-бутанол, втор-бутанол, изобутанол и трет-бутанол. В различных воплощениях для осаждения аполипопротеина из плазмы можно использовать другие агенты, отличающиеся от спиртов, которые снижают растворимость белка. Такие агенты включают, но не ограничены ими, простые эфиры, сульфат аммония, 7-этоксиакридин-3,9-диамин (риванол) и полиэтиленгликоли. Осажденные белки можно отделить от супернатанта любым способом, известным в данной области техники, включая, но не ограничиваясь, седиментацию, центрифугирование и фильтрование.
АроА-I можно выделить из любой фракции плазмы крови, содержащей белок. В некоторых воплощениях АроА-I выделяют из сывороточной фракции плазмы человека, в которой количество фибриногена уменьшено путем осаждения примерно 8% (масс./масс.) этанолом. В других воплощениях аполипопротеин выделяют из сывороточной фракции плазмы человека, в которой снижены концентрации других сывороточных белков (например, β-глобулинов и γ-гамма-глобулинов) путем осаждения примерно 25% (масс./масс.) этанолом. В других воплощениях аполипопротеин выделяют в виде осадка из сыворотки человека, полученного в результате повышения концентрации этанола до примерно 38% - примерно 42% (масс./масс.). В конкретном воплощении аполипопротеин выделяют в виде осадка из сыворотки человека, полученного в результате повышения концентрации этанола до примерно 40% (масс./масс.) (фракция IV Коэна). Осажденный белок АроА-I можно выделить из сывороточных фракций любым способом, известным в данной области техники, включающим, но не ограниченным ими, центрифугирование и фильтрование.
В некоторых воплощениях температура фракций плазмы, из которых выделяют аполипопротеин, является достаточно низкой, чтобы предотвратить денатурацию белка. В этих воплощениях температура фракций АроА-I находится в диапазоне от примерно -10°С до примерно 0°С, например, от примерно - 8°С до примерно -2°С. В различных воплощениях рН фракций плазмы, из которых выделяют аполипопротеин, находится в диапазоне, предотвращающем денатурацию белка. В этих воплощениях рН фракций, содержащих АроА-I, находится в диапазоне от примерно 5 до примерно 7, например, от примерно 5,5 до примерно 6,5.
6.1.4. Усовершенствованные способы очистки липопротеина
Авторы настоящего изобретения также открыли усовершенствованный способ очистки, описанный ниже и проиллюстрированный в Примерах, при котором получают липопротеины, являющиеся зрелыми, интактными и по существу свободными от загрязняющих веществ. Способы очистки, описанные в настоящем изобретении, могут быть осуществлены в любом масштабе, удобном для практикующего специалиста в данной области техники.
Эти способы можно применять к любому аполипопротеину, включая, но не ограничиваясь, АроА-I, -II, -III или - IV; АроВ48 и АроВ100; АроС-I, -II, -III или -IV; ApoD; ApoE, ApoH; ApoJ. Более конкретно настоящее изобретение относится к способам получения высокоочищенного АроА-I. В некоторых воплощениях АроА-I представляет собой белок человека, имеющий последовательность, выбранную из последовательностей, включающих, но не ограниченных ими, последовательности, представленные в Genbank, № доступа NP 000030, ААВ59514, Р02647, САА30377, ААА51746 и ААН05380.1. В определенных воплощениях В определенных воплощениях АроА-I представляет собой белок человека, описанный выше в Разделе 6.1.2. В других воплощениях способы по настоящему изобретению можно применять для очистки АроА-I, имеющего происхождение от животных, отличающихся от человека (см., например, публикацию US №2004/0077541), например, крупного рогатого скота, лошадей, овец, обезьян, бабуинов, коз, кроликов, собак, ежей, барсуков, мышей, крыс, кошек, морских свинок, хомяков, уток, кур, лосося и угря (Brouillette et at., 2001, Biochim Biophys Acta. 1531:4-46; Yu et al., 1991, Cell Struct Funct. 16(4):347-55; Chen and Albers, 1983, Biochim Biophys Acta. 753(I):40-6; Luo et al., 1989, J Lipid Res. 30(11):1735-46; Blaton et al., 1977, Biochemistry 16:2157-63; Sparrow et al., 1995, J Lipid Res. 36(3):485-95; Beaubatie et al., 1986, J Lipid Res. 27:140-49; Januzzi et al., 1992, Genomics 14(4):1081-8; Goulinet and Chapman, 1993, J Lipid Res. 34(6):943-59; Collet et al., J Lipid Res. 38(4):634-44; и Frank and Marcel, 2000, J Lipid Res. 41(6):853-72).
Примеры белков ApoA-I, которые могут быть очищены способами, описанными в настоящем изобретении, включают, но не ограничены ими, форму препроаполипопротеина ApoA-I, про-форму и зрелые формы ApoA-I, a также активные полиморфные формы, изоформы, варианты и мутанты, в также укороченные формы, например АроА-IM, ApoA-IZ и ApoA-IP. Мутанты аполипопротеина A-I, содержащие остатки цистеина также известны, и могут быть также очищены способами, описанными в настоящем изобретении (см., например, публикацию US №2003/0181372). ApoA-I, применяемый в способах, описанных в настоящем изобретении, может находиться в форме мономеров, гомодимеров или гетеродимеров. Например, могут быть получены гомо- и гетеродимеры про- и зрелого ApoA-I, включающие среди прочего ApoA-I (Duverger et al., 1996, Arterioscler Thromb Vase Biol. 16(12):1424-29), АроА-IM (Franceschini et al., 1985, J Biol Chem. 260:1632-35) и ApoA-IP (Daum et al., 1999, J Mol Med. 77:614-22).
В некоторых аспектах белок ApoA-I, который можно очистить способами, описанными в настоящем изобретении, имеет аминокислотную последовательность, по меньшей мере на 75% идентичную, по меньшей мере на 80% идентичную, по меньшей мере на 85% идентичную, по меньшей мере на 90% идентичную, по меньшей мере на 91% идентичную, по меньшей мере на 92% идентичную, по меньшей мере на 93% идентичную, по меньшей мере на 94% идентичную, по меньшей мере на 95% идентичную, по меньшей мере на 96% идентичную, по меньшей мере на 97% идентичную, по меньшей мере на 98% идентичную, по меньшей мере на 99% идентичную или по меньшей мере на 100% идентичную аминокислотам 25-267 SEQ ID NO:1.
Аполипопротеин может иметь происхождение из любого источника, включая плазму крови, или в результате рекомбинантной экспрессии в прокариотических или эукариотических клетках. В конкретных воплощениях аполипопротеин представляет собой АроА-I, например, АроА-I человека. В некоторых аспектах АроА-I экспрессируется в цитоплазме или периплазме прокариотических или эукариотических клеток-хозяев. В этих воплощениях для высвобождения АроА-I в супернатант клетки разрушают, после чего очищают АроА-I. Способы разрушения клеток хорошо известны в данной области техники. Иллюстративные способы разрушения клеток включают, но не ограничены ими, ферментативные способы, обработку ультразвуком, способы с использованием детергентов и механические способы. В определенных предпочтительных аспектах АроА-I экспрессируется в клетках млекопитающих, предпочтительно в клетках СНО, и секретируется в ростовую среду. В этих воплощениях АроА-I очищают из осветленной бесклеточной среды. Понятно, что, хотя способы очистки подробно описаны в настоящем изобретении в связи с АроА-I человека, специалисты в данной области техники смогут приспособить эти условия очистки к другим аполипопротеинам, а также к АроА-I, имеющему происхождение не от человека, к полиморфным формам, изоформам, вариантам, мутантам и укороченным формам АроА-I или других аполипопротеинов в зависимости от конкретных характеристик белка, которые могут быть легко определены специалистами в данной области техники (например, молекулярная масса, изоэлектрическая точка, радиус Стокса, гидрофобность, мультимерное состояние и т.д).
Как правило, способы очистки включают следующие стадии: (а) приведение в контакт раствора, содержащего АроА-I, с анионообменной матрицей в таких условиях, что АроА-I не связывается с матрицей; (b) фильтрование раствора, содержащего АроА-I, полученного на стадии (а), через мембрану, имеющую достаточный размер пор, чтобы удалить вирусы или вирусные частицы; (с) пропускание фильтрата, полученного на стадии (b), через первую хроматографическую колонку с обращенной фазой в таких условиях, что АроА-I связывается с матрицей; (а) элюирование первого "обращенно-фазного" элюата, содержащего АроА-I, из первой матрицы хроматографии с обращенной фазой, используя градиент возрастающих концентраций органического растворителя; (е) пропускание первого "обращенно-фазного" элюата АроА-I со стадии (d) через вторую хроматографическую колонку с обращенной фазой в таких условиях, что АроА-I связывается с матрицей; и (f) элюирование второго "обращенно-фазного" элюата, содержащего АроА-I, из второй матрицы хроматографии с обращенной фазой, используя градиент возрастающих концентраций органического растворителя. Порядок, в котором выполняют эти стадии, не является критическим. Как очевидно специалистам в данной области техники, возможен ряд взаимных перестановок в порядке стадий, где некоторые из них описаны ниже.
В определенных аспектах раствор, содержащий АроА-I, уравновешивают перед приведением в контакт с анионообменной матрицей на стадии (а). Уравновешивание проводят для доведения значения рН раствора белка таким образом, чтобы оно находилось в диапазоне, в котором АроА-I не связывается с анионообменной матрицей на стадии (а) (то есть белок не имеет суммарного отрицательного заряда, и стадию (а) проводят в отрицательном режиме). В этих аспектах значение рН раствора, содержащего АроА-I, составляет от примерно 5 до примерно 7, предпочтительно от примерно 5,0 до примерно 5,6. В конкретных аспектах рН составляет от примерно 5,1 до примерно 5,5. В других дополнительных аспектах рН составляет примерно 5,3. Регулирование рН можно выполнять путем добавления подходящей кислоты (например, соляной кислоты) или подходящего основания (например, гидроксида натрия) до получения значения рН, находящегося в желаемом диапазоне. В некоторых воплощениях раствор, содержащий АроА-I, перед стадией уравновешивания фильтруют, чтобы удалить клетки и клеточный дебрис. В других воплощениях, когда стадия уравновешивания отсутствует, раствор, содержащий АроА-I, возможно фильтруют перед стадией (а), чтобы удалить клетки и клеточный дебрис.
В некоторых воплощениях стадию (а) приведения в контакт раствора, содержащего АроА-I, с анионообменной матрицей выполняют путем пропускания раствора белка через хроматографическую колонку. В этих воплощениях колонку набивают таким образом, чтобы высота слоя составляла от примерно 10 см до примерно 50 см, предпочтительно от примерно 10 см до примерно 30 см и более предпочтительно, чтобы высота слоя составляла примерно 20 см. В некоторых аспектах, на колонку наносят раствор белка, содержащий от примерно 10 г до примерно 50 г, например, от примерно 10 г до примерно 30 г, например, от примерно 25 г до примерно 35 г АроА-I на литр. В конкретных воплощениях, на колонку наносят раствор белка, содержащий вплоть до примерно 32 г АроА-I на литр. В других воплощениях стадию (а) выполняют в периодическом режиме, то есть путем добавления анионообменной матрицы к раствору белка в колбе, смешивания в течение периода времени, достаточного для связывания загрязняющих веществ с матрицей, а затем отделения материала матрицы от раствора белка, например, путем фильтрования или центрифугирования. В определенных воплощениях раствор белка фильтруют, чтобы удалить частицы из раствора, перед приведением его в контакт с анионообменной матрицей.
Анионообменные матрицы, применяемые на стадии (а) способов, описанных в настоящем изобретении, могут представлять собой любую анионообменную матрицу, известную в данной области техники. Подходящие анионообменные матрицы включают, но не ограничены ими, Q-сефарозу FF, Q-Spherosil, ДЭАЭ-сефарозу FF, Q-целлюлозу, ДЭАЭ-целлюлозу и Q-Spherodex. В конкретном воплощении анионообменная матрица представляет собой Q-сефарозу FF (GE Healthcare). В определенных аспектах перед приведением в контакт раствора белка на стадии (а) с анионообменной матрицей, эту матрицу уравновешивают в буфере, имеющем значение рН, находящееся в предпочтительных диапазонах, обсужденных выше, чтобы АроА-I не связывался с матрицей. Буферы, полезные для уравновешивания анионообменных матриц перед стадией (а) и для выполнения стадии (а), известны специалистам в данной области техники. В конкретных воплощениях буфер представляет собой TAMP A (20 мМ фосфат натрия, рН 5,3).
В различных воплощениях стадию (а) используют, чтобы очистить АроА-I от следующих веществ: белков, отличающихся от АроА-I ^например, от белков клетки-хозяина), ДНК клетки-хозяина и эндотоксина, которые связываются с анионообменной матрицей, и, таким образом, отделяются от АроА-I, который не связывается с матрицей в условиях рН и содержания соли, описанных выше. В некоторых аспектах на анионообменной стадии выделяют по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85% или по меньшей мере 90%, или большее количество АроА-I, содержащегося в исходном растворе.
В различных воплощениях способы очистки включают стадию (b), на которой раствор АроА-I со стадии (а) фильтруют с использованием фильтра, имеющего размер пор, достаточный для улавливания вирусов и вирусных частиц. Возможно, стадию (b) фильтрования через мембрану для удаления вирусов или вирусных частиц выполняют после описанной выше стадии (f) вероятнее, чем после стадии (а). В некоторых аспектах рН элюата с анионообменной матрицы доводят перед стадией (b) фильтрования вирусов путем добавления гидроксида натрия или другого подходящего основания. Раствор, содержащий АроА-I, со стадии (а) доводят до значения рН, составляющего от примерно 7,8 до примерно 8,2. В конкретном аспекте раствор, содержащий АроА-I, доводят до значения рН, составляющего примерно 8,0. Фильтр, применяемый на стадии (b), может представлять собой любой фильтр, имеющий соответствующий размер пор для улавливания вирусов, например, размер пор, составляющий от примерно 15 нм до примерно 75 нм. В конкретных воплощениях размер пор фильтра составляет примерно 20 нм (например, Planova 20N, Asahi Kasei Medical). Специалистам в данной области техники понятно, что скорость тока раствора белка через вирусный фильтр определяется свойствами раствора ("например, его вязкостью, концентрацией частиц и т.д.). Характерная скорость тока для фильтрования вирусов составляет примерно 12,5 л/ч/м2, тем не менее, скорость тока можно регулировать выше или ниже, чтобы поддерживать давление фильтра, составляющее 1 бар (100 кПа) или менее. Фильтрат со стадии (b) содержит АроА-I. В определенных аспектах выход АроА-I со стадии фильтрования вирусов составляет по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% или более от количества АроА-I в анионообменном элюате со стадии (а).
В конкретных воплощениях, способы очистки, описанные в настоящем изобретении, включают стадию (с) после стадии (b), на которой фильтрат со стадии (b) пропускают через первую хроматографическую колонку с обращенной фазой в таких условиях буфера и содержания соли, которые дают возможность связывания аполипопротеина А-I с матрицей. В этих воплощениях АроА-I очищают от ДНК клетки-хозяина, белков клетки-хозяина, эндотоксина и укороченных форм, используя градиент возрастающих концентраций органического растворителя. Хроматографию с обращенной фазой можно проводить, используя широкий ряд вариантов матриц, известных в данной области техники, включающих, но не ограниченных ими, среду на основе силикагеля, полистирола или сшитой агарозы, на которую привиты C4-C18 гидрофобные лиганды. Имеющиеся в продаже гидрофобные матрицы, полезные в способах, описанных в настоящем изобретении, включают, но не ограничены ими, бутилсефарозу-FF, октилсефарозу-FF, Dianon HP20ss, C18 Hypersil и Source 30 RPC. В конкретных воплощениях матрица, используемая на стадии (с), представляет собой Source 30 RPC (GE Healthcare). В некоторых аспектах хроматографическая колонка с обращенной фазой имеет высоту слоя, составляющую от примерно 10 см до примерно 50 см, например, от примерно 10 см до примерно 30 см. В конкретном аспекте хроматографическая колонка с обращенной фазой имеет высоту слоя, составляющую примерно 25 см.
В некоторых воплощениях фильтрат АроА-I со стадии (b) фильтрования вирусов наносят на колонку с обращенной фазой при концентрации, составляющей от примерно 1 до примерно 20 г ApoA-I, например, при концентрации, составляющей от примерно 1,5 г до примерно 5 г ApoA-I, и более предпочтительно при концентрации, составляющей от примерно 2,5 г до примерно 3,5 г АроА-I на литр. В конкретном аспекте фильтрат ApoA-I со стадии (b) наносят на колонку с обращенной фазой при концентрации, составляющей примерно 3,4 г ApoA-I на литр. Буферные условия, которые можно применять, чтобы уравновешивать колонку с обращенной фазой перед нанесением ApoA-I, и чтобы гарантировать, что белок свяжется с колонкой после нанесения, могут быть легко определены специалистами в данной области техники. Предпочтительно буфер для уравновешивания колонки представляет собой сильный буфер, который может снизить рН колонки до примерно 9,5. В определенных воплощениях буфер для уравновешивания представляет собой буфер TAMP D (20 мМ карбонат аммония). Предпочтительно после уравновешивания фильтрат, содержащий ApoA-I, со стадии (b) (при значении рН, составляющем примерно 8,0) наносят на колонку при скорости тока, составляющей от примерно 0,5 см до примерно 5,0 см в минуту, например, от примерно 2,0 см до примерно 4,0 см в минуту. В конкретном воплощении, фильтрат, содержащий ApoA-I, наносят на колонку при скорости тока, составляющей примерно 2,8 см в минуту.
После того, как АроА-I связывается с обращенно-фазной матрицей на стадии (с), этот белок элюируют на стадии (d) путем воздействия градиентом возрастающих концентраций органического растворителя в буфере, например, от примерно 35% до примерно 50% ацетонитрила в буфере TAMP D. В некоторых аспектах для элюирования АроА-I из колонки можно использовать линейный градиент, составляющий от примерно 35% до примерно 50% ацетонитрила, за период времени, составляющий от примерно 60 до примерно 90 минут, например, примерно 70 минут или более, предпочтительно примерно 80 минут. В определенных аспектах за линейным градиентом следует примерно 10 минут изократического элюирования 50% ацетонитрилом. Точные условия элюирования АроА-I из колонки с обращенной фазой могут быть легко определены специалистами в данной области техники. В различных воплощениях в колоночном элюате на стадии (d) находится примерно 60%, например, примерно 65%, примерно 70%, примерно 75% или примерно 80% или более от количества АроА-I при нанесении на колонку.
В определенных аспектах способы очистки, описанные в настоящем изобретении, дополнительно включают после стадии (d) стадию (е), состоящую в пропускании "обращенно-фазного" элюата хроматографии, содержащего аполипопротеин А-I, со стадии (d) через вторую хроматографическую колонку с обращенной фазой, чтобы дополнительно удалить ДНК, белки клетки-хозяина и укороченные формы АроА-I из полноразмерного белка. Предпочтительно, "обращенно-фазный" элюат со стадии (d) наносят на вторую колонку с обращенной фазой в условиях, дающих возможность связывания аполиполипопротеина А-I с матрицей. Матрица для хроматографии с обращенной фазой, используемая на стадии (е), может представлять собой матрицу такого же типа, которую используют на стадии (d), или другого типа. В конкретных воплощениях, "обращенно-фазная" матрица, используемая на стадии (е), представляет собой матрицу, состоящую из силикагеля С18, такую как матрица Daisogel SP-300-BIO С18 (300 Å, 10 мкм; Daiso Co., Ltd.). Буферные условия, которые можно использовать для уравновешивания колонки с обращенной фазой перед нанесением АроА-I, и чтобы гарантировать, что белок свяжется с колонкой после нанесения, могут быть легко определены специалистами в данной области техники. Предпочтительно, буфер для уравновешивания колонки представляет собой сильный буфер, который может снизить рН колонки до примерно 9,5. В некоторых воплощениях, буфер для уравновешивания представляет собой буфер TAMP E (100 мМ карбонат аммония). В различных воплощениях колонка с обращенной фазой, используемая на стадии (е) способов очистки, описанных в настоящем изобретении, имеет высоту слоя, составляющую от примерно 10 см до примерно 50 см, например, от примерно 10 см до примерно 30 см. В конкретных воплощениях колонка с обращенной фазой, применяемая на стадии (е имеет высоту слоя, составляющую примерно 25 см.
В различных воплощенияю элюат, содержащий ApoA-I, со стадии (d) наносят на колонку С18 с обращенной фазой в концентрации, составляющей от примерно 0,5 г до примерно 30 г ApoA-I, например, в концентрации, составляющей от примерно 1 г до примерно 10 г ApoA-I, и более предпочтительно в концентрации, составляющей от примерно 4 г до примерно 5 г ApoA-I на литр. В некоторых воплощениях, элюат, содержащий ApoA-I, со стадии (d) наносят на колонку С18 в концентрации, составляющей примерно 4,7 г ApoA-I на литр. Предпочтительно после уравновешивания элюат, содержащий ApoA-I, со стадии (d) наносят на колонку при скорости тока, составляющей от примерно 0,5 см до примерно 5,0 см в минуту, например, от примерно 1,0 см до примерно 3,0 см в минуту. В конкретном воплощении элюат, содержащий АроА-I, наносят на колонку при скорости тока, составляющей примерно 2,1 см в минуту.
После того, как ApoA-I связался с обращенно-фазной матрицей на стадии (е), этот белок элюируют на стадии (f), используя градиент возрастающих концентраций органического растворителя в буфере, например, от примерно 40% до примерно 50% ацетонитрила в буфере ТАМР Е. В некоторых аспектах для элюирования ApoA-I из колонки можно использовать линейный градиент, составляющий от примерно 40% до примерно 50% ацетонитрила, за период времени, составляющий от примерно 40 до примерно 80 минут, например, примерно 50 минут, примерно 60 минут или примерно 70 минут. В конкретных воплощениях для элюирования ApoA-I из обращенно-фазной матрицы используют линейный градиент, составляющий от примерно 40% до примерно 50% ацетонитрила в буфере TAMP E за период времени, составляющий примерно 60 минут. В определенных аспектах за линейным градиентом следует примерно 15 минут изократического элюирования 50% ацетонитрилом. Точные условия элюирования АроА-I из колонки с обращенной фазой могут быть легко определены специалистами в данной области техники. В различных воплощениях, в колоночном элюате колонки на стадии (f) выделяют примерно 60%, например, примерно 65%, примерно 70%, примерно 75% или примерно 80% или более количества АроА-I, нанесенного на колонку.
В определенных воплощениях органический растворитель удаляют из элюата, содержащего АроА-I, на стадии (f) способов, описанных в настоящем изобретении. Удаление растворителя может быть выполнено любым способом, известным в данной области техники, включающим, но не ограниченным ими, концентрирование элюата, содержащего АроА-I, полученного на стадии (f), и диафильтрацию концентрата в водный буфер. В некоторых воплощениях, элюат со стадии (f) концентрируют примерно в 2 раза, примерно в 2,5 раза, примерно в 3 раза, примерно в 3,5 раза, примерно в 4 раза, примерно в 4,5 раза или примерно в 5 раз по сравнению с объемом элюата из колонки с обращенной фазой на стадии (f). В конкретном воплощении, элюат концентрируют примерно в 2,5 раза, а затем подвергают диафильтрации против приблизительно 10, 15 или 20, предпочтительно 15 объемов подходящего водного буфера. Подходящие водные буферы известны в данной области техники. Особенно предпочтительный буфер представляет собой буфер ТАМР С (3 мМ фосфат натрия, рН 8,0).
В некоторых воплощениях порядок хроматографических колонок является обратным.
Возможно, после концентрирования и обмена буфера, водный раствор АроА-I дополнительно очищают анионообменной хроматографией в отрицательном режиме (то есть в условиях, при которых АроА-I не связывается с анионообменной матрицей), чтобы удалить остаточную ДНК и другие отрицательно заряженные загрязняющие вещества, такие как белки клетки-хозяина. (Step (g)). В некоторых воплощениях анионообменную стадию проводят в периодическом режиме. В других воплощениях анионообменную стадию проводят путем колоночной хроматографии. Подходящие анионообменные матрицы, используемые в периодическом режиме или при колоночной хроматографии, включают, но не ограничены ими, Q сефарозу-FF или любую из анионообменных матриц, обсужденных выше для использования на стадии (а). В конкретных аспектах анионообменную стадию проводят путем пропускания раствора АроА-I через анионообменную мембрану, например, мембрану, имеющую большую площадь поверхности и сильный катионный заряд, например, Sartobind Q или Mustang Q. Предпочтительно, анионообменную стадию проводят, используя анионообменную мембрану Mustang Q (Pall Life Sciences). В определенных аспектах перед анионообменной стадией рН водного раствора АроА-I снижают до примерно 5,5, до примерно 6,0 или до примерно 6,5, используя любую подходящую кислоту. В конкретных аспектах водного раствора АроА-I снижают до примерно 6,0, используя разбавленную фосфорную кислоту. В предпочтительных воплощениях раствор АроА-I пропускают через картридж Mustang Q со скоростью, составляющей приблизительно 12,5 л/м2/ч.
В некоторых воплощениях фильтрат анионообменной мембраны концентрируют и, возможно, подвергают диафильтрации для обмена растворителя на растворитель, подходящий для хранения или для дальнейшей обработки АроА-I, например, для комплексообразования с липидами, как описано ниже в Разделе 6.5.1, и/или для включения в фармацевтические композиции, как описано ниже в Разделе 6.6. Подходящие буферы для хранения или для дальнейшей обработки АроА-I могут быть легко определены специалистами в данной области техники. В конкретных воплощениях очищенный АроА-I подвергают обмену на буфер ТАМР С. На этой стадии можно использовать любую мембрану для ультрафильтрации при условии, что мембрана имеет порог отсечения молекулярной массы ниже молекулярной массы полноразмерного зрелого АроА-I, так что она дает возможность пропускания буфера, но не белка. В конкретных воплощениях используют полиэфирсульфоновую мембрану (например, серии Filtron Omega), имеющую номинальный порог отсечения молекулярной массы, составляющий 10000. Предпочтительно концентрация АроА-I в растворе после ультрафильтрации составляет по меньшей мере 10 г/л, по меньшей мере 12 г/л, по меньшей мере 15 г/л, по меньшей мере 20 г/л, по меньшей мере 25 г/л, по меньшей мере 30 г/л, по меньшей мере 35 г/л, по меньшей мере 40 г/л, по меньшей мере 45 г/л или по меньшей мере 50 г/л.
6.1.5. Препараты аполипопротеина
В настоящем изобретении также предложены по существу чистые полноразмерные аполипопротеины. Как используют в настоящем описании, термин "по существу чистый" относится к белку, который является чистым по меньшей мере на 95%. В определенных воплощениях по существу чистый белок является чистым по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, по меньшей мере на 99,5%, по меньшей мере на 99,9% или на 100%. В определенных аспектах по существу чистый препарат аполипопротеина, полученный способами очистки, описанными в настоящем изобретении, представляет собой бесцветный раствор от прозрачного до слегка мутноватого, не содержащий видимых частиц при визуальном осмотре с использованием источника света против белого фона. В различных воплощениях по существу чистый аполипопротеин, который получен или может быть получен способами, описанными в разделе 6.1.4 выше, содержит низкие или необнаружимые количества одного или более чем одного из следующих веществ: ДНК клетки-хозяина, белков, отличающихся от аполипопротеина (например, белков клетки-хозяина), эндотоксина, остаточного растворителя, а также имеет низкую биологическую нагрузку (то есть низкое число микроорганизмов на образце или в образце), как более подробно описано ниже. Чистоту препарата аполипопротеина можно определить любым способом, известным в данной области техники, включающим, но не ограниченным ими, N-концевое секвенирование по Эдману, МАЛДИ-МС (масс-спектроскопию с помощью матрично-ассоциированной лазерной десорбции/ионизации), гель-электрофорез, ВЭЖХ и/или иммунологический анализ.
В различных воплощениях по существу чистый препарат аполипопротеина, полученный способами, описанными в настоящем изобретении, представляет собой полноразмерный зрелый АроА-I человека, имеющий массу, составляющую примерно 28,1 килодальтон. Массу АроА-I в препарате можно определить любым способом, известным в данной области техники, включающим, но не ограниченным им, МАЛДИ-МС. В различных воплощениях по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% белка АроА-I в препарате составляет зрелый полноразмерный АроА-I (например, АроА-I, включающий аминокислоты 25-267 SEQ ID NO:1). В определенных аспектах по существу чистый препарат АроА-I содержит примерно 15% или менее, примерно 10% или менее, примерно 5% или менее, примерно 4% или менее, примерно 3% или менее, примерно 2% или менее или примерно 1% или менее масс./масс. изоформ АроА-I с N-концевым удлинением (например, про-АроА-I). Как понятно специалистам в данной области техники, любой АроА-I с N-концевым удлинением в препарате быстро преобразуется в зрелый АроА-I в крови после введения. В различных воплощениях препарат АроА-I содержит примерно 25% или менее, примерно 20% или менее, примерно 15% или менее, примерно 10% или менее, примерно 5% или менее, примерно 4% или менее, примерно 3% или менее, примерно 2% или менее, примерно 1% или менее, примерно 0,75% или менее, примерно 0,5% или менее, примерно 0,25% или менее или примерно 0,1% или менее масс./масс. укороченных форм АроА-I. Количество укороченного или удлиненного АроА-I можно определить, например, с помощью N-концевого секвенирования по Эдману и/или МАЛДИ-МС и/или путем пробега и сканирования на гель-электрфорезе в ДСН-ПААГ (полиакриламидном геле с додецилсульфатом натрия), чтобы определить отношение интенсивности зоны полосы очищенного АроА-I к суммарной интенсивности всех полос, если они присутствуют. В различных воплощениях препарат АроА-I содержит примерно 20% или менее, примерно 10% или менее, примерно 5% или менее, примерно 4% или менее, примерно 3% или менее, примерно 2% или менее, примерно 1% или менее, примерно 0,75% или менее, примерно 0,5% или менее, примерно 0,25% или менее или примерно 0,1% или менее масс./масс. окисленных форм АроА-I, в частности, АроА-I, окисленного в положении Met112 и/или Met148.
В некоторых воплощениях по существу чистый аполипопротеин, полученный способами, описанными в настоящем изобретении, содержит белки клетки-хозяина в количестве, составляющем менее примерно 100 млн-1 (например, нг/мг), например, менее примерно 75 млн-1, менее примерно 50 млн-1, менее примерно 40 млн-1, менее примерно 30 млн-1, менее примерно 20 млн-1или менее примерно 10 млн-1. В конкретных воплощениях по существу чистый препарат аполипопротеина содержит менее примерно 20 млн-1 белков клетки-хозяина. Более предпочтительно, препарат аполипопротеина содержит менее примерно 10 млн-1 белков клетки-хозяина. Присутствие и количество белков клетки-хозяина в образце аполипопротеина можно определить любым способом, известным в данной области техники. Когда аполипопротеин продуцируется рекомбинантным путем, например, в клетках млекопитающих, для обнаружения и определения количественных уровней белков клетки-хозяина можно использовать имеющиеся в продаже наборы для ELISA (например, набор F015 от фирмы Cygnus Technologies).
В некоторых аспектах по существу чистый препарат аполипопротеина, очищенный, как описано в настоящем изобретении, содержит ДНК клетки-хозяина в количестве, составляющем менее примерно 50 пг/мг аполипопротеина, например, менее примерно 40 пг/мг, менее примерно 30 пг/мг, менее примерно 20 пг/мг, менее примерно 10 пг/мг или менее примерно 5 пг/мг аполипопротеина. В предпочтительных воплощениях по существу чистый препарат аполипопротеина содержит менее примерно 10 пг белков клетки-хозяина на мг аполипопротеина. Присутствие и количество ДНК клетки-хозяина в образце аполипопротеина можно определить любым способом, известным в данной области техники, включающим ПЦР (полимеразную цепную реакцию) в реальном времени или обнаружение комплексов с белком, связывающим однонитевую ДНК, используя антитело против SSB (Glycotype Biotechnology), предпочтительно с помощью количественной ПЦР.
В определенных воплощениях по существу чистый препарат аполипопротеина, полученный способами, описанными в настоящем изобретении, содержит эндотоксин в количестве, составляющем менее примерно 0,5 EU на мг аполипопротеина, например, менее примерно 0,4 EU на мг, менее примерно 0,3 EU на мг, менее примерно 0,2 EU на мг или менее примерно 0,1 EU на мг аполипопротеина. Предпочтительно по существу чистый препарат аполипопротеина, описанный в настоящем изобретении, содержит менее примерно 0,1 EU эндотоксина на мг аполипопротеина. Обнаружение и количественное определение эндотоксина может быть достигнуто любым способом, известным в данной области техники, например, используя количественный тест на эндотоксины грамотрицательных бактерий с лизатом амебоцитов Limulus (LAL) (Cambrex; чувствительность 0,125 EU/мл).
По существу чистый препарат аполипопротеина, описанный в настоящем изобретении, обладает низкой биологической нагрузкой. Термин "биологическая нагрузка" относится к уровню аэробных бактерий, анаэробных бактерий, дрожжей и плесневых грибов в препарате. В различных воплощениях биологическая нагрузка по существу чистого препарата аполипопротеина, очищенного, как описано в настоящем изобретении, составляет менее примерно 1 КОЕ (колониеобразующих единиц) на мл. Тестирование биологической нагрузки может быть выполнено согласно любому известному способу, например, согласно единому методу Европейской Фармакопеи, глава 2.6.12.В, 2.6.1 и USB Глава 61.
По существу чистый препарат аполипопротеина, описанный в настоящем изобретении, содержит низкие количества остаточных растворителей. В конкретных воплощениях остаточный растворитель присутствует в количестве, составляющем менее примерно 50 млн-1, менее примерно 45 млн-1, менее примерно 40 млн-1, менее примерно 35 млн-1, менее примерно 30 млн-1, менее примерно 25 млн-1, менее примерно 20 млн-1, менее примерно 15 млн-1 или менее примерно 10 млн-1 на 10 мг/л аполипопротеина. Предпочтительно остаточный растворитель присутствует в количестве, составляющем менее примерно 41 млн-1 на 10 мг/л аполипопротеина. Количество остаточного растворителя можно оценить любым способом, известным в данной области техники, включающим, но не ограниченным ими, ЖХ-МС (жидкостную хроматографию с масс-спектрометрией) и ВЭЖХ (высокоэффективную жидкостную хроматографию).
Предпочтительно аполипопротеин представляет собой АроА-I (например, АроА-I, включающий аминокислоты 25-267 SEQ ID NO:1). В некоторых воплощениях зрелый белок АроА-I человека имеет аминокислотную последовательность, включающую аспарагиновую кислоту в положении 1 (то есть в положении, соответствующем положению 25 SEQ ID NO:1).
6.2. Липидная фракция
Липопротеиновые комплексы и композиции по настоящему изобретению включают липидную фракцию. Эта липидная фракция включает один или более один липид. В различных воплощениях один или более один липид может представлять собой насыщенный и/или ненасыщенный и природный или синтетический липид. Липидная фракция предпочтительно включает по меньшей мере один фосфолипид.
Подходящие липиды, которые могут присутствовать в липидной фракции, включают, но не ограничены ими, фосфолипиды, имеющие небольшую алкильную цепь, фосфатидилхолин куриного яйца, фосфатидилхолин сои, дипальмитоилфосфатидилхолин, димиристоилфосфатидилхолин, дистеароилфосфатидилхолин, 1-миристоил-2-пальмитоилфосфатидилхолин, 1-пальмитоил-2-миристоилфосфатидилхолин, 1-пальмитоил-2-стеароилфосфатидилхолин, 1-стеароил-2-пальмитоилфосфатидилхолин, диолеоилфосфатидилхолин, диолеофосфатидилэтаноламин, дилауроилфосфатидилглицерин фосфатидилхолин, фосфатидилсерин, фосфатидилэтаноламин, фосфатидилинозит, фосфатидилглицерины, дифосфатидилглицерины, такие как димиристоилфосфатидилглицерин, дипальмитоилфосфатидилглицерин, дистеароилфосфатидилглицерин, диолеоилфосфатидилглицерин, димиристоилфосфатидную кислоту, дипальмитоилфосфатидную кислоту, димиристоилфосфатидилэтаноламин, дипальмитоилфосфатидилэтаноламин, димиристоилфосфатидилсерин, дипальмитоилфосфатидилсерин, фосфатидилсерин головного мозга, сфингомиелин головного мозга, пальмитоилсфингомиелин, дипальмитоилсфингомиелин, сфингомиелин куриного яйца, сфингомиелин молока, фитосфингомиелин, дистеароилсфингомиелин, соль дипальмитоилфосфатидилглицерина, фосфатидную кислоту, галактоцереброзид, ганглиозиды, цереброзиды, дилаурилфосфатидилхолин, (1,3)-D-маннозил-(1,3)диглицерид, аминофенилгликозид, 3-холестерил-6'-(гликозилтио)гексиловый эфир-гликолипиды и холестерин и его производные. Синтетические липиды, такие как синтетический пальмитоилсфингомиелин или N-пальмитоил-4-гидроксисфинганин-1-фосфохолин (форма фитосфингомиелина), можно использовать, чтобы свести к минимуму окисление липидов. Фосфолипидные фракции, включающие пальмитоилсфингомиелин, могут возможно включать небольшие количества липида любого типа, включающего, но не ограниченного ими, лизофосфолипиды, сфингомиелины, отличающиеся от пальмитоилсфингомиелина, галактоцереброзид, ганглиозиды, цереброзиды, глицериды, триглицериды и холестерин и его производные.
В предпочтительных воплощениях, липидная фракция включает два типа фосфолипидов: сфингомиелин (SM) и отрицательно заряженный фосфолипид. SM представляет собой "нейтральный" фосфолипид, поскольку имеет суммарный заряд, равный примерно нулю при физиологическом рН. Идентичность применяемого SM не является критичной для успеха. Таким образом, как используют в настоящем описании, выражение "SM" включает сфингомиелины, имеющие происхождение или полученные из природных источников, а также аналоги и производные природных SM, не поддающиеся воздействию гидролиза LCAT, как встречающийся в природе SM. SM представляет собой фосфолипид, очень сходный по структуре с лецитином, но, в отличие от лецитина, он не имеет глицеринового каркаса, и, следовательно, не имеет сложноэфирных связей, присоединяющих ацильные цепи. Вероятнее, SM имеет церамидный каркас с амидными связями, присоединяющими ацильные цепи. SM не является субстратом для LCAT и, как правило, не подвергается гидролизу этим ферментом. Тем не менее, он может действовать как ингибитор LCAT или может снижать активность LCAT посредством разбавления концентрации субстрата, представляющего собой фосфолипид. Поскольку SM не претерпевает гидролиз, он дольше пребывает в кровообращении. Ожидают, что данный признак даст возможность отрицательно заряженным липопротеиновым комплексам, описанным в настоящем изобретении, иметь большую продолжительность фармакологического эффекта (мобилизации холестерина) и собирать большее количество липидов, в частности, холестерина, чем аполипопротеиновые комплексы, не включающие SM. Этот эффект может привести в результате к необходимости в менее частых или меньших дозах для лечения, чем требуется для липопротеиновых комплексов, не включающих SM.
SM может быть получен практически из любого источника. Например, SM может быть получен из молока, куриного яйца или головного мозга. Можно также применять аналоги или производные SM. Неограничивающие примеры аналогов и производных SM включают, но не ограничены ими, пальмитоилсфингомиелин, N-пальмитоил-4-гидроксисфинганин-1-фосфохолин (форму фитосфингомиелина), пальмитоилсфингомиелин, стеароилсфингомиелин, D-эритро-N-16:0-сфингомиелин и его дигидро-изомер, D-эритро-N-16:0-дигидро-сфингомиелин. Синтетический SM, такой как синтетический пальмитоилсфингомиелин или N-пальмитоил-4-гидроксисфинганин-1-фосфохолин (фитосфингомиелин), можно применять с целью получения более гомогенных комплексов с меньшим количеством загрязняющих веществ и/или продуктов окисления, чем сфинголипиды животного происхождения.
Иллюстративные примеры сфингомиелинов, представляющих собой пальмитоилсфингомиелин и фитосфингомиелин, показаны ниже:
Пальмитоил SM
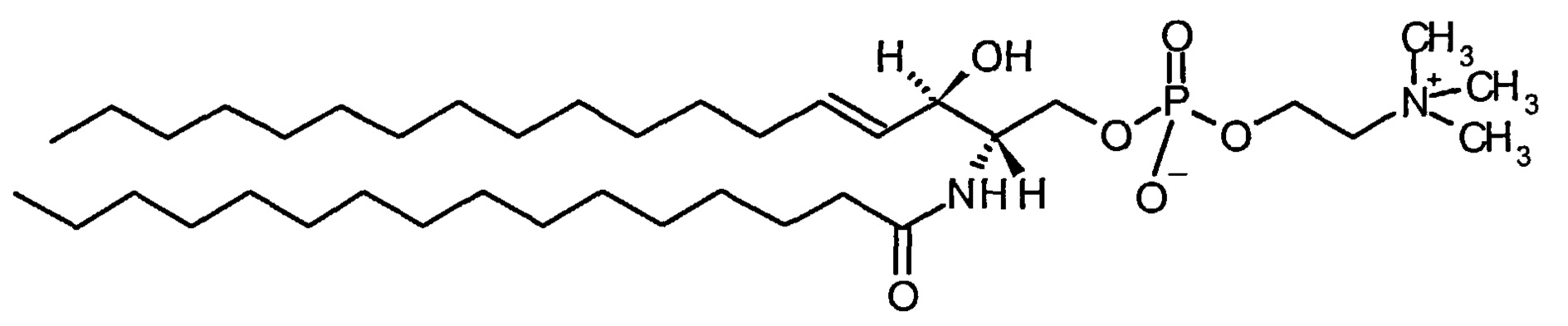
Фито-SM
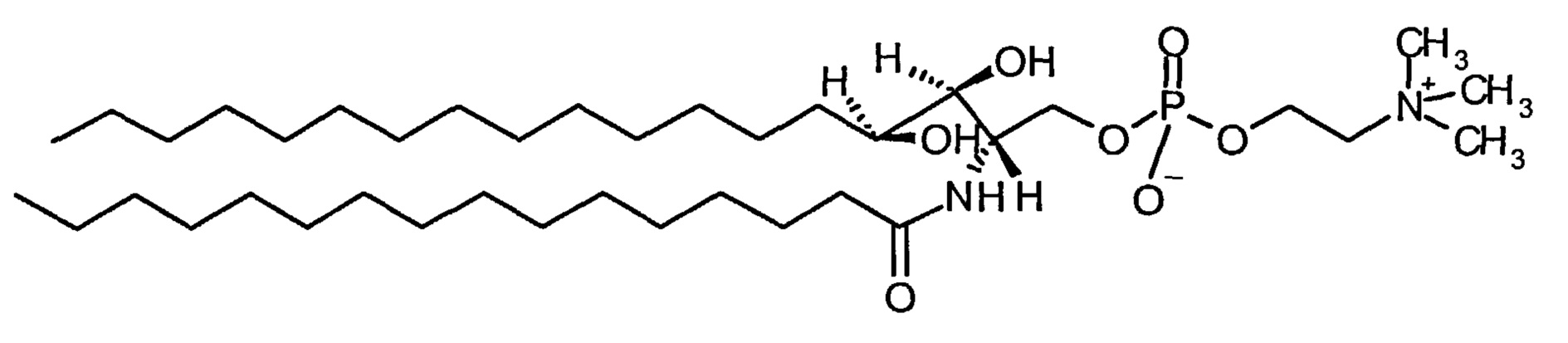
Сфингомиелины, выделенные из природных источников, могут быть искусственно обогащены в одной конкретной насыщенной или ненасыщенной ацильной цепи. Например, сфингомиелин молока (Avanti Phospholipid, Alabaster, Ala.) характеризуется длинными насыщенными ацильными цепями (то есть ацильными цепями, имеющими 20 или более атомов углерода). В отличие от него, сфингомиелин куриного яйца характеризуется короткими насыщенными ацильными цепями (то есть ацильными цепями, имеющими менее 20 атомов углерода). Например, если только примерно 20% сфингомиелина молока содержит ацильные цепи С16:0 (16 атомов углерода, насыщенные), примерно 80% сфингомиелина куриного яйца содержит ацильные цепи С16:0. Используя экстракцию растворителем, композицию сфингомиелина молока можно обогатить с получением композиции ацильных цепей, сравнимой с композицией сфингомиелина куриного яйца, или наоборот.
SM может быть полусинтетическим, таким образом, он включает определенные ацильные цепи. Например, сфингомиелин молока можно сначала очистить от молока, затем одну конкретную ацильную цепь, например, ацильную цепь С16:0, можно отщепить и заменить другой ацильной цепью. SM можно также полностью синтезировать, например, путем крупномасштабного синтеза. См., например, Dong et al., патент US №5220043, под заголовком Synthesis of D-erythro-sphingomyelins, опубликованный 15 июня 1993; Weis, 1999, Chem. Phys. Lipids 102 (I-2):3-12.
Длины и уровни насыщенности ацильных цепей, включенных в полусинтетический или синтетический SM, можно селективно варьировать. Ацильные цепи могут быть насыщенными или ненасыщенными, и могут содержать от примерно 6 до примерно 24 атомов углерода. Каждая цепь может содержать одно и то же число атомов углерода, либо альтернативно каждая цепь может содержать разное число атомов углерода. В некоторых воплощениях полусинтетический или синтетический SM включает смешанные ацильные цепи, так что одна цепь является насыщенной, а одна цепь является ненасыщенной. В таких SM, имеющих смешанные ацильные цепи, длины цепей могут быть одинаковыми или разными. В других воплощениях ацильные цепи полусинтетических или синтетических SM либо обе являются насыщенными, либо обе являются ненасыщенными. Опять же, эти цепи могут содержать одинаковое или разное число атомов углерода. В некоторых воплощениях обе ацильные цепи, включенные в полусинтетический или синтетический SM, идентичны. В конкретном воплощении эти цепи соответствуют ацильным цепям встречающейся в природе жирной кислоты, такой как, например, олеиновой, пальмитиновой или стеариновой кислоты. В другом воплощении применяют SM, имеющий насыщенные или ненасыщенные функционализированные цепи. В другом конкретном воплощении обе ацильные цепи являются насыщенными и содержат от 6 до 24 атомов углерода. Неограничивающие примеры ацильных цепей, присутствующих в распространенных жирных кислотах, которые можно включать в полусинтетические и синтетические SM, представлены в таблице 1, ниже:
В предпочтительных воплощениях SM представляет собой пальмитоил SM, такой как синтетический пальмитоил SM, имеющий ацильные цепи С16:0, или SM куриного яйца, включающий в качестве основного компонента пальмитоил SM.
В конкретном воплощении применяют функционализированный SM, такой какфитосфингомиелин.
Липидная фракция предпочтительно включает отрицательно заряженный фосфолипид. Как используют в настоящем описании, "отрицательно заряженные фосфолипиды" представляют собой фосфолипиды, имеющие суммарный отрицательный заряд при физиологическом значении рН. Отрицательно заряженный фосфолипид может включать один тип отрицательно заряженного фосфолипида или смесь двух или более двух различных отрицательно заряженных фосфолипидов. В некоторых воплощениях заряженные фосфолипиды представляют собой отрицательно заряженные глицерофосфолипиды. Идентичность (идентичности) заряженного фосфолипида(ов) не является принципиально важной для успеха. Конкретные примеры подходящих отрицательно заряженных фосфолипидов включают, но не ограничены ими, 1,2-дипальмитоил-sn-глицеро-3-[фосфо-рац-(1-глицерин)], фосфатидилглицерин, фосфатидилинозит, фосфатидилсерин и фосфатидную кислоту. В некоторых воплощениях отрицательно заряженный фосфолипид включает один или более один из следующих фосфолипидов: фосфатидилинозита, фосфатидилсерина, фосфатидилглицерина и/или фосфатидной кислоты. В конкретном воплощении отрицательно заряженный фосфолипид состоит из 1,2-дипальмитоил-sn-глицеро-3-[фосфо-рац-(1-глицерин)], или DPPG.
Подобно SM, отрицательно заряженные фосфолипиды могут быть получены из природных источников или получены путем химического синтеза. В воплощениях, в которых используют синтетические отрицательно заряженные фосфолипиды, идентичности ацильных цепей можно селективно варьировать, как обсуждалось выше в связи с SM. В некоторых воплощениях, отрицательно заряженных липопротеиновых комплексов, описанных в настоящем изобретении, обе ацильные цепи на отрицательно заряженных фосфолипидах идентичны. В некоторых воплощениях, все ацильные цепи на SM и отрицательно заряженных фосфолипидах идентичны. В конкретном воплощении, все отрицательно заряженные фосфолипиды и/или SM имеют ацильные цепи 06:0 или 06:1. В конкретном воплощении, группировка жирной кислоты SM преимущественно представляет собой 06:1 пальмитоил. В одном конкретном воплощении, отрицательно заряженные фосфолипиды и/или SM имеют ацильные цепи, соответствующие ацильной цепи пальмитиновой кислоты.
Применяемые фосфолипиды предпочтительно являются чистыми по меньшей мере на 95% и/или имеют сниженные уровни окислительных агентов. Липиды, полученные из природных источников, предпочтительно имеют меньше группировок полиненасыщенных жирных кислот и/или группировок жирных кислот, не склонных к окислению. Уровень окисления в образце можно определить, используя йодометрический метод, в результате чего получают пероксидное число, выраженное в числе миллиэквивалентов изолированных атомов йода на кг образца, сокращенное как мэкв О/кг. См., например, Gray, J.I., Measurement of Lipid Oxidation: A Review, Journal of the American Oil Chemists Society, Vol. 55, p.539-545 (1978); Heaton, F.W. and UriN., Improved Iodometric Methods for the Determination of Lipid Peroxides, Journal of the Science of Food and Agriculture, vol 9. p.781-786 (1958). Предпочтительно уровень окисления или пероксидный уровень является низким, например, составляет менее 5 мэкв О/кг, менее 4 мэкв О/кг, менее 3 мэкв О/кг или менее 2 мэкв О/кг.
Липидные фракции, включающие SM и пальмитоилсфингомиелин, могут возможно включать небольшие количества дополнительных липидов. Можно применять практически любой тип липидов, включая, но не ограничиваясь ими, лизофосфолипиды, галактоцереброзид, ганглиозиды, цереброзиды, глицериды, триглицериды и холестерин и его производные.
Такие возможные липиды в случае их включения обычно составляют менее примерно 15% масс./масс. липидной фракции, хотя в некоторых случаях можно включать большее количество возможных липидов. В некоторых воплощениях эти возможные липиды составляют менее примерно 10% масс./масс., менее примерно 5% масс./масс. или менее примерно 2% масс./масс. В некоторых воплощениях в липидную фракцию не включают возможные липиды.
В конкретном воплощении, фракция фосфолипидов содержит SM куриного яйца или пальмитоил-SM или фитосфингомиелин и DPPG в массовом соотношении (SM: отрицательно заряженный фосфолипид), находящемся в диапазоне от 90:10 до 99:1, более предпочтительно в диапазоне от 95:5 до 98:2. В одном воплощении это массовое соотношение составляет 97:3.
Липопротеиновые комплексы по настоящему изобретению можно также применять в качестве носителей для доставки гидрофобных, липофильных или неполярных активных агентов для разнообразных терапевтических или диагностических применений. Для таких применений в липидную фракцию можно дополнительно включать один или более чем один гидрофобный, липофильный или неполярный активный агент, включающий, но не ограниченный ими, жирные кислоты, лекарственные средства, нуклеиновые кислоты, витамины и/или питательные вещества. Подходящие гидрофобные, липофильные или неполярные активные агенты не ограничены терапевтической категорией и могут представлять собой, например, обезболивающие средства, противовоспалительные агенты, антигельминтные средства, противоаритмические средства, антибактериальные агенты, противовирусные агенты, антикоагулянты, антидепрессанты, противодиабетические средства, противоэпилептические средства, противогрибковые агенты, средства против подагры, гипотензивные средства, противомалярийные средства, средства против мигрени, антимускариновые агенты, противоопухолевые агенты, средства, улучшающие эректильную дисфункцию, иммуносупрессанты, противопротозойные средства, антитиреоидные средства, анксиолитические средства, седативные средства, снотворные средства, нейролептики, β-блокаторы, сердечные инотропные агенты, кортикостероиды, диуретики, противопаркинсонические средства, желудочно-кишечные средства, антагонисты рецептора гистамина, кератолитики, средства, регулирующие липиды, средства против стенокардии, ингибиторы сох-2, ингибиторы лейкотриенов, макролиды, мышечные релаксанты, питательные вещества, нуклеиновые кислоты (например, малые интерферирующие РНК), опиоидные анальгетики, ингибиторы протеаз, половые гормоны, стимуляторы, средства против остеопороза, средства против ожирения, средства, усиливающие познавательную способность, средства против недержания мочи, питательные масла, средства против доброкачественной гипертрофии простаты, эссенциальные жирные кислоты, неэссенциальные жирные кислоты, а также смеси этих средств.
Конкретными неограничивающими примерами подходящих гидрофобных, липофильных или неполярных активных агентов являются следующие соединения: ацитретин, альбендазол, альбутерол, аминоглутетимид, амиодарон, амлодипин, амфетамин, амфотерицин В, аторвастатин, атовахион, азитромицин, баклофен, беклометазон, бенезеприл, бензонатат, бетаметазон, бикалутинид, будесонид, бупропион, бусульфан, бутенафин, кальцифедиол, кальципотриен, кальцитриол, камптотецин, кандесартан, капсаицин, карбамезепин, каротины, целекоксиб, церивастатин, цетиризин, хлорфенирамин, холекальциферол, цилостазол, циметидин, циннаризин, ципрофлоксацин, цизаприд, кларитромицин, клемастин, кломифен, кломипрамин, клопидогрел, кодеин, коэнзим Q10, циклобензаприн, циклоспорин, даназол, дантролен, дексхлорфенирамин, диклофенак, дикумарол, дигоксин, дегидроэпиандростерон, дигидроэрготамин, дигидротахистерол, диритромицин, донезеприл, эфавиренз, эпосартан, эргокальциферол, эрготамин, источники эссенциальных жирных кислот, этодолак, этопозид, фамотидин, фенофибрат, фентанил, фексофенадин, финастерид, флуконазол, флурбипрофен, флувастатин, фосфенитоин, фроватриптан, фуразолидон, габапентин, гемфиброзил, глибенкламид, глипизид, глибурид, глимепирид, гризеофульвин, галофантрин, ибупрофен, ирбесартан, иринотекан, изосорбид динитрат, изотретиноин, итраконазол, ивермектин, кетоконазол, кеторолак, ламотригин, лансопразол, лефлуномид, лизиноприл, лоперамид, лоратадин, ловастатин, L-тироксин, лютеин, ликопин, медроксипрогестерон, мифепристон, мефлохин, мегестрол ацетат, метадон, метоксален, метронидазол, миконазол, мидазолам, миглитол, миноксидил, митоксантрон, монтелукаст, набуметон, налбуфин, наратриптан, нелфинавир, нифедипин, нисолдипин, нилутанид, нитрофурантоин, низатидин, омепразол, опревелкин, эстрадиол, оксапрозин, паклитаксел, паракальцитол, пароксетин, пентазоцин, пиоглитазон, пизофетин, правастатин, преднизолон, пробукол, прогестерон, псевдоэфедрин, пиридостигмин, рабепразол, ралоксифен, рофекоксиб, репаглинид, рифабутин, рифапентин, римексолон, рифановир, ризатриптан, розиглитазон, саквинавир, сертралин, сибутрамин, силденафил цитрат, симвастатин, сиролимус, спиронолактон, суматриптан, такрин, такролимус, тамоксифен, тамсулозин, таргретин, тазаротен, телмисартан, тенипозид, тербинафин, теразозин, терагидроканнабинол, тиагабин, тиклопидин, тирофибран, тизанидин, топирамат, топотекан, торемифен, трамадол, третиноин, троглитазон, тровафлоксацин, убидекаренон, валсартан, венлафаксин, вертепорфин, вигабатрин, витамин А, витамин D, витамин Е, витамин K, зафирлукаст, зилеутон, золмитриптан, золпидем и зопиклон. Можно также применять соли, изомеры и производные перечисленных выше агентов, а также их смеси.
6.3. Липопротеиновые комплексы
В настоящем изобретении предложены липопротеиновые комплексы, включающие белковую фракцию и липидную фракцию, композиция которых описана выше в Разделах 6.1 и 6.2., соответственно.
Как правило, белковая фракция включает один или более один липидсвязывающий белок, такой как аполипопротеин и/или его производное или аналог, обеспечивающий терапевтическую и/или профилактическую пользу. Комплексы могут включать один тип липидсвязывающего белка или смеси двух или более двух различных липидсвязывающих белков, которые могут иметь происхождение от одного и того же или от различных видов. Подходящие липидсвязывающие белки описаны выше в Разделе 6.1. Хотя это необязательно, липопротеиновые комплексы предпочтительно включают липидсвязывающие белки, имеющие происхождение от видов животных, подлежащих лечению, или имеют аминокислотную последовательность этих видов, чтобы избежать индукции иммунного ответа на терапию. Таким образом, для лечения пациентов-людей в комплексах по изобретению предпочтительно применяют белки, имеющие человеческое происхождение. Применение пептидомиметиков аполипопротеинов может также снизить иммунный ответ или позволяет избежать его.
Считают, что применение аполипопротеина, имеющего высокую степень чистоты (например, зрелого и неукороченного, неокисленного, недеамидированного, не загрязненного эндотоксином и/или не загрязненного другими белками или нуклеиновыми кислотами) повышает терапевтическую эффективность и/или повышает безопасность липопротеинового комплекса. Соответственно, белковая фракция может включать по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% зрелого полноразмерного белка АроА-I, возможно, включающего не более 25%, не более 20%, не более 15%, не более 10%, не более 5% или примерно 0% окисленного метионина-112 или метионина-148, и/или не более 15%, не более 10%, не более 5% или примерно 0% деаминированных аминокислот. Аполипопротеин можно очистить согласно любому из способов, описанных в настоящем изобретении. Предпочтительно аполипопротеин может быть получен, как описано в Разделе 6.1.4.
В конкретном воплощении, белковая фракция включает АроА-I, например, по существу чистый, зрелый полноразмерный АроА-I, как описано выше в Разделе 6.1.5, или по существу состоит из него.
Липидная фракция включает один или более чем один липид, который может представлять собой насыщенные, ненасыщенные, природные и синтетические липиды и/или фосфолипиды. Подходящие липиды включают, но не ограничены ими, фосфолипиды, имеющие небольшую алкильную цепь, фосфатидилхолин куриного яйца, фосфатидилхолин сои, дипальмитоилфосфатидилхолин, димиристоилфосфатидилхолин, дистеароилфосфатидилхолин, 1-миристоил-2-пальмитоилфосфатидилхолин, 1-пальмитоил-2-миристоилфосфатидилхолин, 1-пальмитоил-2-стеароилфосфатидилхолин, 1-стеароил-2-пальмитоилфосфатидилхолин, диолеоилфосфатидилхолин, диолеофосфатидилэтаноламин, дилауроилфосфатидилглицерин, фосфатидилхолин, фосфатидилсерин, фосфатидилэтаноламин, фосфатидилинозит, фосфатидилглицерины, дифосфатидилглицерины, такие как димиристоилфосфатидилглицерин, дипальмитоилфосфатидилглицерин, дистеароилфосфатидилглицерин, диолеоилфосфатидилглицерин, димиристоилфосфатидную кислоту, дипальмитоилфосфатидную кислоту, димиристоилфосфатидилэтаноламин, дипальмитоилфосфатидилэтаноламин, димиристоилфосфатидилсерин, дипальмитоилфосфатидилсерин, фосфатидилсерин головного мозга, сфингомиелин головного мозга, сфингомиелин куриного яйца, сфингомиелин молока, фитосфингомиелин, пальмитоилсфингомиелин, дипальмитоилсфингомиелин, дистеароилсфингомиелин, соль дипальмитоилфосфатидилглицерина, фосфатидную кислоту, галактоцереброзид, ганглиозиды, цереброзиды, дилаурилфосфатидилхолин, (1,3)-D-маннозил-(1,3)дигдицерид, аминофенилгликозид, 3-холестерил-6'-(гликозилтио)гексиловый эфир-гликолипиды и холестерин и его производные. Фосфолипидные фракции, включающие SM и пальмитоилсфингомиелин, могут возможно включать небольшие количества любого типа липида, включающего, но не ограниченного ими, лизофосфолипиды, сфингомиелины, отличающиеся от пальмитоилсфингомиелина, галактоцереброзид, ганглиозиды, цереброзиды, глицериды, триглицериды и холестерин и его производные. Предпочтительными являются синтетические липиды, такие как синтетический пальмитоилсфингомиелин или N-пальмитоил-4-гидроксисфинганин-1-фосфохолин (фитосфингомиелин). Дополнительные липиды описаны выше в Разделе 6.2. Предпочтительно, липопротеиновые комплексы включают сфингомиелин.
Возможно, липопротеиновые комплексы по настоящему изобретению можно нагружать гидрофобными, липофильными или неполярными активными агентами, включающими, но не ограниченными ими, жирные кислоты, лекарственные средства, нуклеиновые кислоты, витамины и/или питательные вещества, для разнообразных терапевтических или диагностических применений. Подходящие агенты описаны выше в Разделе 6.2.
Липопротеиновые комплексы могут быть получены с использованием любого из способов, описанных в настоящем изобретении. Предпочтительно комплексы получают, как описано в Разделах 6.5.1-6.5.4.
Молярное соотношение липидной фракции и белковой фракции отрицательно заряженных липопротеиновых комплексов, описанных в настоящем изобретении, может варьировать и зависит среди прочих факторов от идентичности (идентичностей) аполипопротеина, включенного в белковую фракцию, идентичностей и количества заряженных фосфолипидов, включенных в липидную фракцию, и от желаемого размера заряженного липопротеинового комплекса. Поскольку считают, что биологическая активность аполипопротеинов, таких как АроА-I, опосредована амфипатическими спиралями, составляющими аполипопротеин, удобно выражать аполипопротеиновую фракцию молярного отношения липид:аполипопротеин, используя эквиваленты белка АроА-I. Общепризнано, что АроА-I содержит 6-10 амфипатических спиралей в зависимости от способа, используемого для подсчета спиралей. Другие аполипопротеины можно выражать в отношении эквивалентов АроА-I, основываясь на числе амфипатических спиралей, которое они содержат. Например, АроА-IM, который в характерном случае существует в виде димера, связанного дисульфидной связью, можно выражать в виде 2 эквивалентов АроА-I, поскольку каждая молекула АроА-IM содержит двойное количество амфипатических спиралей по отношению к молекуле АроА-I. Напротив, пептид аполипопротеина, содержащий единственную амфипатическую спираль, можно выражать в виде 1/10-1/6 эквивалента АроА-I, поскольку каждая молекула содержит 1/10-1/6 количества амфипатических спиралей по отношению к молекуле АроА-I. Как правило, молярное отношение липид:эквивалент АроА-I липопротеиновых комплексов (определенное в настоящем изобретении как "Ri") находится в диапазоне от примерно 105:1 до 110:1. В некоторых воплощениях Ri составляет примерно 108:1. Отношения по массе могут быть получены, используя значение MW (молекулярной массы), составляющее приблизительно 650-800, для фосфолипидов.
В некоторых воплощениях молярное отношение липид:эквивалент АроА-I ("RSM") находится в диапазоне от примерно 80:1 до примерно 110:1, например, от примерно 80:1 до примерно 100:1. В конкретном примере RSM для липопротеиновых комплексов может составлять примерно 82:1.
Различные молекулы аполипопротеина и/или фосфолипидов, включенные в отрицательно заряженные липопротеиновые комплексы, могут быть меченными каким-либо известным в данной области техники обнаружимым маркером, включающим стабильные изотопы (например,13С,15N,2H и т.д.); радиоактивные изотопы (например,14С,3H,125I и т.д.); флуорофоры; хемилюминесцентные вещества или ферментативные маркеры.
В предпочтительных воплощениях липопротеиновые комплексы представляют собой отрицательно заряженные липопротеиновые комплексы, включающие белковую фракцию, предпочтительно включающую зрелый полноразмерный АроА-I, и липидную фракцию, включающую нейтральный фосфолипид, сфингомиелин (SM), и отрицательно заряженный фосфолипид.
Обнаружено, что композиция и относительные количества SM и отрицательно заряженного фосфолипида, включенные в липидную фракцию липопротеиновых комплексов, влияют на гомогенность и стабильность композиций, содержащих эти комплексы. Как проиллюстрировано в разделе Примеры, композиции, содержащие комплексы, в которых липидная фракция состоит из SM и отрицательно заряженного фосфолипида, обладают большей гомогенностью и большей стабильностью, чем аналогичные композиции, в которых липидная фракция включает DPPC в дополнение к SM.
Таким образом, комплексы по настоящему изобретению, содержащие SM и отрицательно заряженный липид, предпочтительно получают в отсутствие лецитина, чтобы улучшить их гомогенность и стабильность. Как только получены гомогенные комплексы, включающие SM и отрицательно заряженные липиды, можно включать дополнительные липиды, такие как лецитин.
Возможные липиды при их включении обычно составляют менее примерно 15% липидной фракции, хотя в некоторых случаях может быть включено большее количество возможных липидов. В некоторых воплощениях возможные липиды составляют менее примерно 10%, менее примерно 5% или менее примерно 2% масс./масс. В некоторых воплощениях липидная фракция отрицательно заряженных липопротеиновых комплексов не включает возможные липиды.
В конкретном воплощении фосфолипидная фракция содержит SM куриного яйца или пальмитоил-SM или фито-SM и DPPG в массовом отношении (SM : отрицательно заряженный фосфолипид) в диапазоне от 90:10 до 99:1, более предпочтительно в диапазоне от 95:5 до 98:2, например, 97:3.
Некоторые аполипопротеины претерпевают обмен in vivo из одного липопротеинового комплекса в другой (это верно для аполипопротеина АроА-I). В ходе такого обмена аполипопротеин в характерном случае переносит с собой одну или более одну молекулу фосфолипида. Благодаря этому свойству ожидают, что отрицательно заряженные липопротеиновые комплексы, описанные в настоящем изобретении, будут "сеять" отрицательно заряженные фосфолипиды на эндогенные ЛПВП, в результате чего они переходят в альфа-частицы, более устойчивые к удалению почками. Таким образом, ожидают, что введение отрицательно заряженных липопротеиновых комплексов и композиций, описанных в настоящем изобретении, повысит сывороточные уровни ЛПВП и/или изменит период полувыведения эндогенных ЛПВП, а также метаболизм эндогенных ЛПВП. Ожидают, что это приведет в результате к изменению метаболизма холестерина и обратного транспорта липидов.
Как проиллюстрировано в разделе Примеры, композиции, содержащие комплексы, в которых массовое отношение АроА-I: SM и фосфолипид DPPG составляет примерно 1:2,7, обладали большей гомогенностью и большей стабильностью, чем аналогичные композиции, имеющие другие массовые отношения. Соответственно, в настоящем изобретении предложены композиции липопротеинов, в которых массовое отношение белок : липид оптимизировано для образования гомогенной совокупности комплексов. Данное массовое отношение находится в диапазоне от 1:2,6 до 1:3, и оптимально составляет 1:2,7 для комплексов, включающих ApoA-I, SM и DPPG, и для комплексов, включающих компоненты, имеющие подобную молекулярную массу. В конкретных воплощениях отношение белковой фракции ApoA-I к липидной фракции в характерном случае находится в диапазоне от примерно 1:2,7 до примерно 1:3, причем предпочтительно отношение, составляющее 1:2,7. Это соответствует молярным отношениям белка ApoA-I к фосфолипиду, находящимся в диапазоне от приблизительно 1:90 до 1:140. Соответственно, в настоящем изобретении предложены комплексы, в которых молярное отношение белка к липиду составляет от примерно 1:90 до примерно 1:120, от примерно 1:100 до примерно 1:140 или от примерно 1:95 до примерно 1:125. В частности, при данном оптимизированном отношении фракции белка ApoA-I и липидной фракции, включающей SM и DPPG, образуются по существу гомогенные комплексы, имеющие такие же характеристики размера и заряда, как природные ЛПВП, как оценивают с помощью колоночной хроматографии и гель-электрофореза, соответственно.
Размер отрицательно заряженного липопротеинового комплекса можно контролировать путем регулирования показателя Ri. To есть, чем меньше Ri, тем меньший размер имеет диск. Например, крупные дисковидные частицы в характерном случае имеют значение Ri, находящееся в диапазоне от примерно 200:1 до 100:1, тогда как мелкие дисковидные частицы в характерном случае имеют значение Ri, находящееся в диапазоне от примерно 100:1 до 30:1.
В некоторых конкретных воплощениях отрицательно заряженные липопротеиновые комплексы представляют собой крупные дисковидные частицы, содержащие 2-4 эквивалента ApoA-I (например, 2-4 молекулы ApoA-I, 1-2 молекулы димера АроА-IM или 12-40 молекул односпирального пептида), одну молекулу отрицательно заряженного фосфолипида и 400 молекул SM. В других конкретных воплощениях отрицательно заряженные липопротеиновые комплексы представляют собой мелкие дисковидные частицы, содержащие 2-4 эквивалента ApoA-I; 1-10, более предпочтительно 3-6 молекул отрицательно заряженного фосфолипида; и 90-225 молекул, более предпочтительно 100-210 молекул SM.
6.3.1. Измерение комплексов и размера частицы
Композицию липопротеиновых комплексов, а также их размер и размер липидных частиц, применяемых при получении липопротеиновых комплексов, можно определить, используя ряд методов, известных в данной области техники.
Концентрацию белка и липида липопротеиновых комплексов в растворе можно измерить любым способом, известным в данной области техники, включающим, но не ограниченным ими, количественные анализы белков и фосфолипидов, хроматографические методы, такие как ВЭЖХ, гель-фильтрация, ГХ (гель-хроматография), сопряженная с различными детекторами, включая масс-спектрометрию, ультрафиолетовый или цифровой диодный детектор, флуоресцентные методы, упругое рассеяние света и другие. Целостность липидов и белков можно также определить с помощью тех же хроматографических методов, а также с помощью пептидного картирования, гель-электрофореза в полиакриламидном геле с додецилсульфатом натрия (ДСН-ПААГ), N- и C-концевого секвенирования АроА-I и стандартных количественных анализов для определения окисления липидов.
Липопротеиновый комплекс, а также липидные частицы, используемые при получении липопротеиновых комплексов, могут изменяться по размеру, как описано в настоящем изобретении. Размер липидной частицы и/или размер комплекса липида и белка можно определить, используя способы, известные в данной области техники. Иллюстративные способы включают динамическое светорассеяние и гельпроникающую хроматографию.
Динамическое светорассеяние (ДСР), также известное как фотонно-корреляционная спектроскопия, измеряет сдвиг длины волны светового пучка, ударяющегося в частицу, движущуюся в растворе посредством Броуновского движения. В частности, движущиеся частицы рассеивают свет при облучении лазером, и полученные в результате колебания интенсивности рассеянного света можно использовать для вычисления распределение по размеру сферических частиц в растворе. См. Zetasizer Nano Series User Manual, MAN0317 Issue 2.1 (July 2004). ДСР определяет распределение интенсивности и средний размер частиц в растворе, на основании чего можно вычислить объем частицы и распределение их числа и среднего размера. Метод ДСР можно использовать для определения как размера липидных частиц, применяемых для получения липопротеиновых комплексов, так и размера самих липопротеиновых комплексов. Подходящим прибором для измерения ДСР является прибор Zetasizer Nano фирмы Malvern Instruments.
Гельпроникающую хроматографию (ГПХ) можно также использовать для определения размера комплексов, содержащих белок. Гельпроникающая хроматография разделяет компоненты в смеси на основе молекулярного размера. Размер комплекса липид-белок можно определить путем сравнения кривой элюирования комплекса с известными стандартами или сравнительными образцами, обычно путем сравнения с калибровочной кривой. Сравнительные образцы имеются в продаже и могут включать как белковые, так и небелковые стандарты, такие как альбумин, ферритин и витамин В12. Current Protocols in Molecular Biology (1998), Section IV, 10.9.1-10.9.2.
Липидные частицы, полезные при получении липопротеиновых комплексов по изобретению, могут иметь размер, составляющий по меньшей мере 45 нм, по меньшей мере 50 нм, по меньшей мере 55 нм, по меньшей мере 60 нм, на основании измерения с помощью ДСР (например, используя измерение на основе интенсивности). Кроме того, размер липидной частицы может составлять вплоть до 65 нм, вплоть до 70 нм, вплоть до 80 нм, вплоть до 90 нм, вплоть до 100 нм, вплоть до 120 нм, вплоть до 150 нм, вплоть до 200 нм, вплоть до 250 нм, вплоть до 300 нм или вплоть до 500 нм на основании измерения с помощью ДСР.
Липопротеиновые комплексы по изобретению могут находиться в диапазоне по размеру от 4 нм до 15 нм, от 6 нм до 15 нм, от 4 нм до 12 нм, от 5 нм до 12 нм, от 6 нм до 12 нм, от 8 нм до 12 нм или от 8 нм до 10 нм на основании измерения методами, описанными в настоящем изобретении.
6.4. Совокупности липопротеиновых комплексов
В настоящем изобретении дополнительно предложены совокупности липопротеиновых комплексов, описанные в настоящем изобретении. Эти совокупности включают множество липопротеиновых комплексов, как описано в настоящем изобретении, каждый из которых включает белковую фракцию и липидную фракцию, например, как описано выше в Разделе 6.3. Авторы изобретения обнаружили несколько признаков, которые считают вносящими вклад, по отдельности или в комбинации, в профиль эффективности и безопасности совокупностей липопротеиновых комплексов. Совокупности липопротеиновых комплексов могут включать любое число этих признаков, описанных в настоящем изобретении, по отдельности или в комбинации.
Во-первых, считают, что гомогенность липопротеиновых комплексов в совокупности, то есть преобладание одного или более одного дискретного липопротеинового комплекса (комплексов) в совокупности, на что указывает один или более один дискретный пик липопротеиновых комплексов в совокупности, и преобладание в липопротеиновых комплексах зрелого, немодифицированного аполипопротеина, повышает их эффективность. Соответственно, совокупность липопротеиновых комплексов может включать белковую фракцию, включающую аполипопротеин, например, АроА-I, или по существу состоящую из него, и липидную фракцию, причем эта совокупность является гомогенной по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% на основании измерения процентного содержания этой совокупности в одном пике при гельпроникающей хроматографии.
В некоторых воплощениях размер липопротеинового комплекса в совокупности может находиться в диапазоне от 4 нм до 15 нм, например, от 5 нм до 12 нм, от 6 нм до 15 нм или от 8 нм до 10 нм.
Аполипопротеин, например, АроА-I, в совокупности может представлять собой зрелый, предпочтительно полноразмерный (не укороченный) АроА-I, и совокупность может содержать по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% масс./масс. зрелого, предпочтительно полноразмерного (не укороченного) АроА-I. В некоторых воплощениях совокупность включает не более 25%, не более 20%, не более 15%, не более 10% или не более 5% масс./масс. незрелого или не полностью процессированного АроА-I и/или не более 20%, не более 15%, не более 10% или не более 5% масс./масс. укороченного АроА-I.
Во-вторых, считают, что чистота аполипопротеина и липидов в комплексах и относительное отсутствие загрязняющих веществ в липопротеиновых комплексах, также относящееся к чистоте липопротеиновых комплексов, снижает риск побочных эффектов, таких как повреждение печени, отражающееся повышениями уровней ферментов печени (например, трансаминазы). Чистоту аполипопротеина можно измерить на основании относительного отсутствия окисления и/или деамидирования. Соответственно, в определенных воплощениях совокупности липопротеиновых комплексов могут иметь сниженные количества окисленного аполипопротеина, например, не более 20%, не более 15%, не более 10%, не более 5%, не более 4%, не более 3%, не более 2%, не более 1% окисленного метионина, в частности, метионина-112 или метионина-148, или не более 15%, не более 10%, не более 5%, не более 4%, не более 3%, не более 2% или не более 1% окисленного триптофана. Совокупности липопротеиновых комплексов могут также иметь сниженное процентное содержание деамидированных аминокислот, например, не более 15%, не более 10%, не более 5%, не более 4%, не более 3%, не более 2% или не более 1% деамидированных аминокислот.
Желательно также контролировать чистоту липидов в липопротеиновом комплексе. Соответственно, в некоторых воплощениях окислено не более 5%, не более 4%, не более 3%, не более 2% или не более 1% липида в данной совокупности.
Другой мерой чистоты комплексов и их совокупностей является снижение количества или отсутствие загрязняющих веществ, что является результатом способа получения или очистки аполипопротеина или способов получения самих липопротеиновых комплексов. Соответственно, в случаях, где аполипопротеин очищают из клеток-хозяев, например, из клеток-хозяев млекопитающих, совокупности липопротеиновых комплексов предпочтительно не содержат ДНК или белки клетки-хозяина. В конкретных воплощениях совокупность содержит не более 500 нанограммов, не более 200 нанограммов, не более 100 нанограммов, не более 50 нанограммов или не более 20 нанограммов белка клетки-хозяина на миллиграмм липопротеина и/или не более 100 пикограммов, не более 50 пикограммов, не более 25 пикограммов, не более 10 пикограммов или не более 5 пикограммов ДНК клетки-хозяина на миллиграмм липопротеина, в характерном случае АроА-I.
Другими загрязняющими веществами, которые могут встречаться и которых следует избегать, являются следующие вещества: эндотоксин, который может присутствовать среди прочего в клеточных культурах и в образцах плазмы, в также растворители и детергенты, которые могут присутствовать в зависимости от способа, применяемого для получения и/или очистки липопротеинового комплекса. Совокупности липопротеиновых комплексов могут содержать максимум примерно 1 EU, примерно 0,5 ED, примерно 0,3 EU или примерно 0,1 EU эндотоксина на миллиграмм липопротеина, например АроА-I. Совокупности липопротеиновых комплексов могут быть также ограничены содержанием не более 200 млн-1, 250 млн-1, 100 млн-1 неводного растворителя. В конкретных воплощениях совокупность не содержит никакого детергента, например, холата.
Дополнительно, используя способы, описанные в данном изобретении, возможно включать в комплексы большую часть исходного вещества, представляющего собой аполипопротеин, ограничивая количество не связанного в комплекс аполипопротеина, присутствующего в совокупности. Преимущество снижения количества не связанного в комплекс аполипопротеина состоит в том, что в результате снижается риск иммуногенного ответа вследствие воздействия гетерологичного белка. Совокупность липопротеиновых комплексов может иметь композицию, в которой по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% белка находится в липопротеиновом комплексе, то есть в связанной в комплекс форме. Возможно, совокупность липопротеиновых комплексов может иметь композицию, в которой по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% липида находится в липопротеиновом комплексе.
Возможно, совокупность может включать комплексы, в которых липидная фракция включает не более 15%, не более 10%, не более 5%, не более 4%, не более 3%, не более 2%, не более 1% или 0% холестерина от массы липида.
Определенные липидные и белковые компоненты могут образовать множество различных, но гомогенных липопротеиновых комплексов. Соответственно, в настоящем изобретении также предложены композиции, содержащие две, три или четыре совокупности липопротеиновых комплексов, включающих различные количества молекул аполипопротеина (например, две, три или четыре молекулы АроА-I или эквивалентов АроА-I). В иллюстративном воплощении композиция содержит две совокупности липопротеиновых комплексов, причем первая совокупность включает липопротеиновые комплексы, имеющие 2 молекулы АроА-I или эквивалента АроА-I на липопротеиновый комплекс, вторая совокупность включает липопротеиновые комплексы, имеющие 3 или 4 молекулы АроА-I или эквивалента АроА-I на липопротеиновый комплекс, и, возможно, третья совокупность включает липопротеиновые комплексы, имеющие 4 или 3 молекулы АроА-I или эквивалента АроА-I на липопротеиновый комплекс, соответственно.
Композиции, содержащие две или более две совокупности липопротеиновых комплексов, предпочтительно имеют низкие уровни не связанного в комплекс липопротеина и/или липида. Кроме того, предпочтительно не более 15%, не более 12%, не более 10%, не более 9%, не более 8%, не более 7%, не более 6%, не более 5%, не более 4%, не более 3%, не более 2% или не более 1% липида в композиции находится в не связанной в комплекс форме, и/или не более 15%, не более 12%, не более 10%, не более 9%, не более 8%, не более 7%, не более 6%, не более 5%, не более 4%, не более 3%, не более 2% или не более 1% липопротеина в композиции находится в не связанной в комплекс форме.
В настоящем изобретении также предложены крупномасштабные препараты липопротеиновых комплексов или их совокупностей, особенно полезные для промышленных применений, например, крупномасштабное производство липопротеиновых комплексов для терапевтических целей. Препараты, рассмотренные в данном изобретении, содержат совокупность липопротеиновых комплексов, например, отрицательно заряженных липопротеиновых комплексов, как описано в настоящем изобретении.
Предложенные препараты имеют объемы, количества и конечную концентрацию липопротеиновых комплексов, подходящие для приготовления композиций, например, фармацевтических композиций и лекарственных форм, в промышленном масштабе. Характерные объемы препарата находятся в диапазоне от примерно 5 л до примерно 50 л или более, например, от примерно 10 л до примерно 40 л, от примерно 15 л до примерно 35 л, от примерно 15 л до примерно 30 л, от примерно 20 л до примерно 40 л, от примерно 20 л до примерно 30 л, от примерно 25 л до примерно 45 л, от примерно 25 л до примерно 35 л. Препараты могут иметь объем, составляющий примерно 5 л, примерно 6 л, примерно 7 л, примерно 8 л, примерно 9 л, примерно 10 л, примерно 11л, примерно 12 л, примерно 13 л, примерно 14 л, примерно 15 л, примерно 16 л, примерно 17 л, примерно 18 л, примерно 19 л, примерно 20 л, примерно 25 л, примерно 30 л, примерно 35 л, примерно 40 л, примерно 45 л или примерно 50 л. В предпочтительном воплощении препарат имеет объем, составляющий примерно 20 л.
Препараты, кроме того, содержат липопротеиновые комплексы или их совокупность в количествах, достаточных для достижения концентрации аполипопротеина, находящейся в диапазоне от примерно 5 мг/мл вплоть до до примерно 15 мг/мл, от 5 мг/мл до примерно 10 мг/мл, от примерно 10 мг/мл до примерно 15 мг/мл или от примерно 8 мг/мл до примерно 12 мг/мл аполипопротеина. В зависимости от объема препарата количества могут находиться в диапазоне от примерно 25 г вплоть до примерно 350 г, выраженные в виде количества аполипопротеина, например, АроА-I, в препарате. В конкретном воплощении препарат содержит примерно 8 мг/мл АроА-I.
В конкретном воплощении препарат имеет объем, составляющий от 15 л до 25 л, и содержит от примерно 100 г до примерно 250 г АроА-I. В другом конкретном воплощении препарат имеет объем, составляющий от 30 л до 50 л, и содержит от примерно 240 г до примерно 780 г АроА-I.
6.5. Способы получения липопротеиновых комплексов
6.5.1. Способы получения липопротеиновых комплексов, основанные на термоциклировании
Обнаружено, что способы, при которых используют термоциклирование белковых и липидных компонентов, как описано в настоящем изобретении, можно применять для получения липопротеиновых комплексов, что обеспечивает преимущества по сравнению с другими методологиями. В способах термоциклирования, предложенных в настоящем изобретении, белковый компонент и липидный компонент, которые подвергают термоциклированию до тех пор, пока большая часть белкового компонента (например, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90%) не образует комплекс с липидным компонентом с получением липопротеинового комплекса. Как очевидно специалистам в данной области техники, преимущества настоящих способов перед другими способами получения липопротеиновых комплексов включают высокую эффективность комплексообразования, приводящего в результате к получению по существу гомогенного и чистого конечного продукта, содержащего малое количество или не содержащего побочных продуктов (например, не связанного в комплекс белка) или технологических примесей (например, детергентов или сурфактантов, разрушенных белков, окисленных компонентов), присутствующих в конечном продукте, что позволяет избежать необходимости в дорогостоящих и нерациональных стадиях очистки. Следовательно, данные способы эффективны и приводят в результате к небольшим или нулевым потерям исходных материалов. Кроме того, данные способы легко масштабировать, и их осуществляют на недорогостоящем оборудовании. Возможность осуществления этих способов без промышленных растворителей также делает их благоприятными для окружающей среды.
Предпочтительно, чтобы свести к минимуму окисление белкового и липидного компонентов, одну, более одну стадию или все стадии образования комплекса (включая гомогенизацию липидного компонента) проводят под слоем инертного газа (например, азота, аргона или гелия).
6.5.2. Липидный компонент
В способах термоциклирования по изобретению можно использовать разнообразные липиды, отдельно или в комбинации, включая насыщенные, ненасыщенные, природные и синтетические липиды и/или фосфолипиды, как описано выше в Разделе 6.2.
Липиды могут быть приготовлены для термоциклирования с белковым компонентом с использованием любого способа, при котором образуются липидные частицы, такие как многослойные везикулы (MLV), мелкие однослойные везикулы (SUV), крупные однослойные везикулы (LUV), мицеллы, дисперсии и тому подобное.
Известен ряд технологий для получения липидных частиц. Липидные частицы получают, используя различные протоколы, с образованием различных типов везикул. Предпочтительно, чтобы частицы, используемые в способах термоциклирования по изобретению, преимущественно имели размер в диапазоне 45-80 нм, наиболее предпочтительно в диапазоне от 55 нм до 75 нм.
Гомогенизация высокого давления, например, микрофлюидизация, преимущественно образует частицы подходящих размеров. Давление гомогенизации предпочтительно составляет по меньшей мере 1000 бар (1×105кПА), по меньшей мере 1200 бар (12×104 кПА), по меньшей мере 1400 бар (14×104 кПА), по меньшей мере 1600 бар (16×104 кПА), по меньшей мере 1800 бар (18×104 кПА), и наиболее предпочтительно по меньшей мере 2000 бар (20×104 кПА), например, по меньшей мере 2200 бар (22×104 кПА), по меньшей мере 2400 бар (24×104 кПА), по меньшей мере 2600 бар (26×104 кПА), по меньшей мере 2800 бар (28×104 кПА), по меньшей мере 3000 бар (30×104 кПА), по меньшей мере 3200 бар (32×104 кПА), по меньшей мере 3400 бар (34×104кПА), по меньшей мере 3600 бар (36×104 кПА), по меньшей мере 3800 бар (38×104 кПА) или по меньшей мере 4000 бар (40×104 кПА). В конкретных воплощениях давление гомогенизации находится в диапазоне между любой парой приведенных выше значений, например, от 1600 до 3200 бар (от 16 до 32×104 кПА); от 1800 до 2800 бар (от 18 до 28×104 кПА); от 1900 до 2500 бар (от 19 до 25×104 кПА); от 2000 до 2500 бар (от 20 до 25×104 кПА); от 2000 до 3000 бар (от 20 до 30×104 кПА); от 2400 до 3800 бар (от 24 до 38×104 кПА); от 2800 до 3400 бар (от 28 до 34×104 кПА); и т.д., и т.п. Один бар равен 100 кПа, 1000000 дин на квадратный сантиметр (бария), 0,987 атм (атмосфер), 14,5038 psi (фунтов на квадратный дюйм), 29,53 ммHg и 750,06 Торр.
При одном подходящем способе гомогенизации, эмульсию липидов переносят в питающий сосуд микрофлюидайзера модели HOY (Microfluidics Inc, Newton, Mass.). Это устройство погружают в баню для поддержания рабочей температуры (например, 55°С, 58°С, 62°С и т.д.) в процессе гомогенизации и продувают инертным газом, таким как аргон, перед использованием. После фиксации устройства эмульсию пропускают через гомогенизатор при постоянной рециркуляции в течение 5-20 минут при градиенте давления через интерактивную насадку. Гомогенизация липидного компонента в отсутствие белкового компонента позволяет избежать разрушения белкового компонента высоким сдвигом, используемым в методах гомогенизации.
Удобным образом можно использовать другие способы при условии, что могут быть получены частицы подходящего размера. Например, гидратация липидов водным раствором может привести в результате к дисперсии липидов и спонтанному образованию многослойных везикул ("MLV"). MLV представляет собой частицу с множественными липидными бислоями, окружающими центральное водное ядро. Частицы данного типа имеют больший размер, чем мелкие однослойные частицы (SUV), и их диаметр может составлять 350-400 нм. MLV могут быть получены путем солюбилизации липидов в хлороформе в круглодонной колбе и выпаривания хлороформа до тех пор, пока липид не образует тонкий слой на стенке колбы. Добавляют водный раствор и дают возможность для повторной гидратации липидного слоя. Везикулы образуются при вращении или встряхивании колбы. Deamer et al., 1983, в Liposomes (Ostro, Ed.), Marcel Dekker, Inc. New York (цит. Bangham et al., 1965, J. Mol. Biol. 13:238). Данный способ можно также использовать для образования однослойных везикул. Johnson et al., 1971, Biochim. Biophys. Acta 233:820.
Мелкая однослойная везикула (SUV) представляет собой частицу с одним липидным бислоем, в котором заключено водное ядро. В зависимости от способа, используемого для получения SUV, они могут иметь размер в диапазоне 25-110 нм в диаметре. Первые SUV были получены путем высушивания препарата фосфолипида в хлороформе в атмосфере азота, добавления водного слоя до получения концентрации липида в миллимолярном диапазоне и обработки раствора ультразвуком при 45°С до прозрачности. Deamer et al., 1983, в кн. Liposomes (Ostro, Ed.), Marcel Dekker, Inc. New York. В результате такой обработки SUV получают частицы, имеющие диаметр в диапазоне 25-50 нм.
Другой способ получения SUV состоит в быстром впрыскивании раствора этанол/липид в водный раствор для инкапсуляции. Deamer et al., 1983, в Liposomes (Ostro, Ed.), Marcel Dekker, Inc. New York (цит. Batzri et al., 1973, Biochim. Biophys. Acta 298:1015). SUV, полученные таким способом, имеют размер, находящийся в диапазоне 30-110 нм в диаметре.
SUV могут быть также получены путем пропускания многослойных везикул через френч-пресс четыре раза при 20000 psi (137,9×103 кПА) Полученные SUV имеют размер, находящийся в диапазоне 30-50 нм в диаметре. Deamer et al., 1983, в кн. Liposomes (Ostro, Ed.), Marcel Dekker, Inc. New York (цит. Barenholz et al., 1979, FEBS Letters 99:210).
Многослойные и однослойные фосфолипидные везикулы могут быть также образованы путем экструзии водных препаратов фосфолипидов при высоком давлении через мембраны с мелкими порами (Hope et al., 1996, Chemistry and Physics of Lipids, 40:89-107)
Крупные однослойные везикулы подобны SUV в том, что они имеют один липидный бислой, окружающий центральное водное ядро, но LUV имеют значительно больший размер, чем SUV. В зависимости от их составных частей и способов, используемых для их получения, LUV могут иметь размер, находящийся в диапазоне 50-1000 нм в диаметре. Deamer et al., 1983, в Liposomes (Ostro, Ed.), Marcel Dekker, Inc. New York. LUV обычно получают, используя один из трех способов: разведения детергентом, выпаривания с обращенной фазой и инфузии.
При методе разведения детергентом для образования мицелл из препарата липида используют растворы таких детергентов, как холат, дезоксихолат, октилглюкозид, гептилглюкозид и Тритон Х-100. Затем раствор подвергают диализу для удаления детергента. Deamer et al., 1983, в Liposomes (Ostro, Ed.), Marcel Dekker, Inc. New York.
При методе выпаривания с обращенной фазой липид солюбилизируют в водно-неполярных растворах, образуя инвертированные мицеллы. Неполярный растворитель выпаривают, и мицеллы агрегируют с образованием LUV. При данном способе обычно требуются большие количества липида.
При способе инфузии липид, солюбилизированный в неполярном растворе, впрыскивают в водный раствор для инкапсуляции. По мере выпаривания неполярного растворителя липиды собираются на границе раздела между газом и водой. Липидные слои образуют LUV и олиголамеллярные частицы по мере барботирования газа через водный раствор. Частицы разделяют по размеру путем фильтрования. Deamer et al., 1983, в Liposomes (Ostro, Ed.), Marcel Dekker, Inc. New York (цит. Deamer et al., 1976, Biochim. Biophys. Acta 443:629 and Schieren et al., 1978, Biochim. Biophys. Acta 542:137).
Аликвоту полученного в результате липидного препарата можно охарактеризовать, чтобы подтвердить, что липидные частицы подходят для применения в качестве липидного компонента в способах термоциклирования, описанных в настоящем изобретении. Характеризацию липидного препарата можно выполнять, используя любой способ, известный в данной области техники, включающий, но не ограниченный ими, фильтрование по размеру, гель-фильтрацию, колоночную фильтрацию, гельпроникающую хроматографию и не денатурирующий гель-электрофорез.
6.5.3. Белковый компонент
Белковый компонент липопротеиновых комплексов не является принципиально важным для успеха в настоящих способах термоциклирования. В комплексы можно включать практически любой липидсвязывающий белок, такой как аполипопротеин и/или его производное или аналог, обеспечивающий терапевтическую и/или профилактическую пользу. Кроме того, в липопротеиновые комплексы можно включать любой альфа-спиральный пептид или аналог пептида, или молекулы любого другого типа, которые "имитируют" активность аполипопротеина (такого как, например, АроА-I) таким образом, что могут активировать LCAT или образовывать дисковидные частицы при ассоциации с липидами, и, следовательно, включены в определение "липидсвязывающий белок". Липидсвязывающие белки, которые можно использовать в способах термоциклирования, включают белки, описанные в Разделе 6.1 выше. Липидсвязывающие белки могут продуцироваться рекомбинантным путем, как описано в Разделе 6.1.2 выше. Липидсвязывающие белки можно очистить любым из способов, описанных в настоящем изобретении, включая способы, описаны в Разделе 6.1.3 или в Разделе 6.1.4 выше.
Белковый компонент можно очистить из животных источников (в частности, из человеческих источников), синтезировать химическим путем или продуцировать рекомбинантным путем, как хорошо известно в данной области техники, см., например, Chung et al., 1980, J. Lipid Res. 21(3):284-91; Cheung et al., 1987, J. Lipid Res. 28(8):913-29. См. также патенты US №№5059528, 5128318, 6617134; публикации US №№20002/0156007, 2004/0067873, 2004/0077541 и 2004/0266660; и публикации РСТ №№ WO/2008/104890 и WO/2007/023476.
Белковый компонент может включать липиды при отношении белка/пептида к липиду по меньшей мере в 5 раз выше (например, по меньшей мере в 5 раз, по меньшей мере в 10 раз или по меньшей мере в 20 раз выше), чем отношение белка/пептида к липиду в желаемом комплексе. Например, чтобы получить липопротеиновый комплекс, в котором желаемое отношение белка к липиду составляет 1:200 на молярной основе, белок в белковом компоненте можно объединять с липидом, который обычно представляет собой лишь небольшую фракцию липида в конечном комплексе, например, в соотношении, составляющем от 1:10 до 1:20. без привязки к какому-либо механизму данное "предварительное" комплексообразование белка с малым количеством липида полезно в том случае, когда желаемый комплекс включает более один тип липида, что дает возможность для более равномерного распределения липида, присутствующего в небольших количествах в липопротеиновом комплексе, полученном путем термоциклирования (например, 10% или менее от массы суммарного липида, 5% или менее от массы суммарного липида, 3% или менее от массы суммарного липида, 2% или менее от массы суммарного липида или 1% или менее от массы суммарного липида в желаемом липопротеиновом комплексе).
6.5.4. Образование липопротеиновых комплексов путем термоциклирования
Эти способы обычно включают термоциклирование суспензии, содержащей липидные частицы и липидсвязывающие белки, между "высоким" температурным диапазоном и "низким" температурным диапазоном до тех пор, пока не образуются липопротеиновые комплексы.
Суспензия, подлежащая термоциклированию, содержит липидный компонент и белковый компонент, которые приводят в контакт, предпочтительно при температуре, находящейся в высоком температурном диапазоне, с образованием "исходной" суспензии, которую затем подвергают термоциклированию.
Оптимальное соотношение липидов и белков в исходной суспензии определяют на основании желаемой стехиометрии компонентов в конечных липопротеиновых комплексах, которые нужно получить. Как понятно специалистам в данной области техники, молярное отношение липидной фракции к белковой фракции зависит среди прочих факторов от идентичности (идентичностей) белков и/или пептидов в белковом компоненте, идентичностей и количеств липидов в липидной фракции и от желаемого размера липопротеинового комплекса. Подходящие отношения липида к белку в липопротеиновых комплексах можно определить, используя любой из многочисленных функциональных анализов, известные в данной области техники, включающих, но не ограниченных ими, анализ электрофоретической подвижности в геле, эксклюзионную хроматографию, взаимодействие с рецепторами ЛПВП, распознавание АТФ-связывающего кассетного переносчика (АВСА1), захват печенью и фармакокинетику/фармакодинамику. Например, анализы электрофоретической подвижности в геле можно использовать, чтобы определить оптимальное отношение липидного компонента к белковому компоненту в комплексах. В случае, когда комплексы, полученные способами по изобретению, являются заряженными в результате включения фосфолипидов в липидный компонент, эти комплексы могут быть сконструированы таким образом, что проявляют электрофоретическую подвижность, подобную природным частицам пре-бета-ЛПВП или альфа-ЛПВП. Таким образом, в некоторых воплощениях природные частицы пре-бета-ЛПВП или альфа-ЛПВП можно использовать в качестве стандарта для определения подвижности комплексов.
В предпочтительном воплощении конечный комплекс включает по меньшей мере один аполипопротеин или миметик аполипопротеина (наиболее предпочтительно зрелый ApoA-I человека или пептид АроА-I соответственно), по меньшей мере один нейтральный липид и по меньшей мере один отрицательно заряженный липид, как описано в документе РСТ WO2006/100567, содержание которого включено в настоящее описание посредством ссылки.
Поскольку считают, что биологическая активность аполипопротеинов, таких как ApoA-I, опосредована амфипатическими спиралями, составляющими аполипопротеин, удобно выражать аполипопротеиновую фракцию молярного отношения липид:аполипопротеин, используя эквиваленты белка ApoA-I. Общепризнано, что ApoA-I содержит 6-10 амфипатических спиралей в зависимости от способа, используемого для подсчета спиралей. Другие аполипопротеины можно выражать в отношении эквивалентов АроА-I, основываясь на числе амфипатических спиралей, которое они содержат. Например, АроА-IM, который в характерном случае существует в виде димера, связанного дисульфидной связью, можно выражать в виде 2 эквивалентов АроА-I, поскольку каждая молекула АроА-IM содержит двойное количество амфипатических спиралей по отношению к молекуле АроА-I. Напротив, пептид аполипопротеина, содержащий единственную амфипатическую спираль, можно выражать в виде 1/10-1/6 эквивалента АроА-I, поскольку каждая молекула содержит 1/10-1/6 количества амфипатических спиралей по отношению к молекуле АроА-I.
Как правило, молярное отношение липид:эквивалент АроА-I липопротеиновых комплексов (определенное в настоящем изобретении как "Ri") находится в диапазоне от примерно 2:1 до 200:1. В некоторых воплощениях Ri составляет примерно от 50:1 до 150:1 или от 75:1 до 125:1, от 10:1 до 175:1. Отношения по массе могут быть получены, используя значение MW (молекулярной массы), составляющее приблизительно 650-800, для фосфолипидов.
В определенных воплощениях молярное отношение компонентов составляет 2-6 (отрицательно заряженный липид, например, DPPG) : 90-120 (нейтральный липид, например, SM) : 1 (эквиваленты АроА-I). В конкретном воплощении, описанном в Примере 1, комплекс включает DPPG, SM и АроА-I в молярном отношении липида к белку, составляющем приблизительно 108:1, причем DPPG составляет 3% (+/-1%) суммарного липида по массе, и SM составляет 97% (+/-5%) липида по массе.
Концентрация липидного и белкового компонентов в исходной суспензии перед инициацией термоциклирования может находиться в диапазоне от 1 до 30 мг/мл концентрации эквивалентов АроА-I и от 1 до 100 мг/мл концентрации липидов. В конкретных воплощениях концентрация белкового компонента выбрана из следующих концентраций: 1-30 мг/мл, 2-20 мг/мл, от 5 до 20 мг/мл, от 2 до 10 мг/мл, от 5 до 15 мг/мл, от 5 до 20 мг/мли от 10 до 20 мг/мл, а концентрация липидного компонента независимо выбрана из следующих концентраций: от 10 до 100 мг/мл, от 10 до 75 мг/мл, от 25 до 50 мг/мл, от 10 до 75 мг/мл, от 25 до 100 мг/мл, от 25 до 75 мг/мл и от 1 до 75 мг/мл.
Высокий и низкий температурный диапазоны процесса термоциклирования основаны на температурах фазового перехода липидного и белкового компонентов липопротеиновых комплексов. Альтернативно в случаях, когда липидный компонент не проявляет определенный или дискретный фазовый переход, что может встречаться при использовании фосфолипидов, имеющих ненасыщенные цепи жирных кислот, или смеси фосфолипидов, высокий и низкий температурные диапазоны термоциклирования различаются по меньшей мере примерно на 20°С, вплоть до примерно 40°С или даже более. Например, в некоторых воплощениях низкий и высокий температурные диапазоны различаются на 20°С-30°С, 20°С-40°С, 20°С-50°С, 30°С-40°С, 30°С-50°С, 25°С-45°С, 35°С-55°С.
Для липида фазовый переход включает изменение от плотно упакованной упорядоченной структуры, известной как состояние геля, до слабо упакованной, менее упорядоченной структуры, известной как жидкое состояние. В данной области техники липопротеиновые комплексы обычно образуются путем инкубации липидных частиц и аполипопротеинов при температурах, находящихся вблизи температуры фазового перехода определенного используемого липида или смеси липидов. Температура фазового перехода липидного компонента (которую можно определить с помощью калориметрии) +/-5°С-10°С представляет собой "низкий" температурный диапазон в способах по изобретению.
Для белка температура фазового перехода включает изменение от складчатой трехмерной структуры до двухмерной структуры. Для липида фазовый переход включает изменение от плотно упакованной упорядоченной структуры, известной как состояние геля, до слабо упакованной, менее упорядоченной структуры, известной как жидкое состояние. В данной области техники липопротеиновые комплексы в характерном случае образуют путем инкубации липидных частиц и аполипопротеинов при температурах, находящихся вблизи температуры фазового перехода определенного используемого липида или смеси липидов.
Температура фазового перехода липидного компонента (которую можно определить с помощью калориметрии) +/-12°С, более предпочтительно +/-10°С, представляет собой "низкий" температурный диапазон в способах по изобретению. В определенных воплощениях этот низкий температурный диапазон составляет +/-3°С, +/-5°С или +/-8°С от температуры фазового перехода липидного компонента. В одном конкретном воплощении низкий температурный диапазон включает значения, составляющие от не менее 5°С или не менее 10°С ниже до 5°С выше температуры фазового перехода липидного компонента.
Для белка температура фазового перехода включает изменение от третичной структуры до вторичной структуры. Температура фазового перехода белкового компонента +/-12°С, более предпочтительно +/-10°С, представляет собой "высокий" температурный диапазон в способах по изобретению. В конкретных воплощениях этот высокий температурный диапазон составляет +/-3°С, +/-5°С или +/-8°С от температуры фазового перехода белкового компонента. В одном конкретном воплощении высокий температурный диапазон включает значения, составляющие от 10°С ниже до не более 5°С, не более 10°С или не более 15°С выше температуры фазового перехода белкового компонента.
Исходную суспензию подвергают термоциклированию между высокой температурой и низкой температурой, предпочтительно начиная при высокой температуре, до тех пор, пока по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% белка в исходной суспензии не будет включено в липопротеиновые комплексы. При использовании подходящих стехиометрических количеств липидного и белкового компонентов, по существу полное комплексообразование липидного и белкового компонентов может быть достигнуто после нескольких циклов. Число циклов будет зависеть от белкового и липидного компонентов, от продолжительности циклов, но обычно для по существу полного комплексообразования необходимо 5 или более циклов, 10 или более циклов или 15 или более циклов (как при высоких, так и при низких температурах). Продолжительность этих циклов обычно находится в диапазоне от 2 минут до 60 минут. В конкретных воплощениях продолжительность циклов находится в диапазоне от 5 до 30 минут, от 10 до 20 минут, от 5 до 20 минут, от 2 до 45 минут или от 5 до 45 минут при каждой температуре.
Комплексы, полученные данными способами, обычно представляют собой надмолекулярные ансамбли, имеющие форму мицелл, везикул, сферических или дисковидных частиц, в которых белковый компонент физически связан с фосфолипидами при определенном стехиометрическом диапазоне между фосфолипидом и белком, и при гомогенном распределении по размеру. Результатом настоящих способов преимущественно является по существу полное комплексообразование липидов и/или белков в исходной суспензии, с получением в результате композиции, по существу не содержащей свободные липиды и/или свободный белок, что наблюдали посредством методов разделения, например, хроматографии. Таким образом, способы по изобретению могут быть выполнены в отсутствие стадии очистки.
Способами по изобретению преимущественно получают комплексы, являющиеся гомогенными по распределению по размеру, что позволяет избежать необходимости во фракционировании по размеру.
В некоторых воплощениях изобретения липопротеиновые комплексы содержат липид более одного типа, включающий один или более один липид в относительно малых количествах (например, менее 10%, менее 5%, менее 3% или менее 1% липидного компонента). Для оптимизации диспергирования липиды, используемые в малых количествах, можно предварительно смешивать с белковым компонентом, а не включать в липидные частицы в липидном компоненте.
Аликвоту полученных в результате липопротеиновых комплексов можно охарактеризовать для подтверждения, что комплексы обладают желаемыми характеристиками, например, по существу полным (например, более 90%, более 95%, более 97% или более 98%) включением белкового компонента в липидный компонент. Характеризация комплексов может быть выполнена любым способом, известным в данной области техники, включающим, но не ограниченным ими, фильтрование по размеру, гель-фильтрацию, колоночную фильтрацию, гельпроникающую хроматографию и неденатурирующий гель-электрофорез.
Гомогенность и/или стабильность липопротеиновых комплексов или композиции, как описано в настоящем изобретении, можно измерить любым способом, известным в данной области техники, включающим, но не ограниченным ими, хроматографические способы, например, гель-фильтрационную хроматографию. Например, в некоторых воплощениях один пик или ограниченное число пиков может быть связано со стабильным комплексом. Стабильность комплексов можно определить с помощью мониторинга появления новых пиков со временем. Появление новых пиков является признаком перегруппировки среди комплексов вследствие нестабильности частиц.
Предпочтительно, чтобы свести к минимуму окисление белкового и липидного компонентов, термоциклирование проводят под слоем инертного газа (например, азота, аргона или гелия).
6.5.5. Другие способы получения липопротеиновых комплексов
Липопротеиновые комплексы, описанные в настоящем изобретении, включая отрицательно заряженные липопротеиновые комплексы, могут быть получены в разнообразных формах, включающих, но не ограниченных ими, везикулы, липосомы, протеолипосомы, мицеллы и дисковидные частицы. Кроме описанных выше способов термоциклирования, для получения липопротеиновых комплексов можно применять разнообразные способы, известные специалистам в данной области техники. Можно использовать различные методы получения липосом или протеолипосом. Например, аполипопротеин можно совместно обрабатывать ультразвуком (используя ультразвуковую баню или ультразвуковой зонд) с подходящими фосфолипидами с образованием комплексов. Альтернативно аполипопротеин, например, АроА-I, можно объединять с предварительно сформированными липидными частицами, что приводит в результате к спонтанному образованию липопротеиновых комплексов. Липопротеиновые комплексы могут быть также образованы способом детергентного диализа; например, смесь аполипопротеина, заряженного фосфолипида(ов) и SM и детергента, например, холата, подвергают диализу для удаления детергента и восстанавливают с образованием отрицательно заряженных липопротеиновых комплексов (см., например, Jonas et al., 1986, Methods in Enzymol. 128:553-82), либо с использованием экструдера, либо путем гомогенизации.
В некоторых воплощениях комплексы получают путем гомогенизации, используя высокое давление (например, примерно 32000 psi (2,2×105 кПа) в течение примерно 40, примерно 50 или примерно 60 минут. В конкретном воплощении комплекс, включающий ApoA-I, SN и DPPG, получают, как описано ниже. ApoA-I растворяют в фосфатном буфере и инкубируют при 50°C с дисперсией DPPG в фосфатном буфере, полученной с использованием мешалки с высокими сдвиговыми усилиями. Затем смесь ApoA-I/DPPG объединяют с дисперсией SM и гомогенизируют при давлениях, составляющих выше 30000 psi (2,07×105 кПа), при 30-50°С до тех пор, пока образование комплекса не будет по существу полным, осуществляя мониторинг с помощью динамического светорассеяния или гельпроникающей хроматографии.
В некоторых воплощениях липопротеиновые комплексы могут быть получены способом холатной дисперсии, описанным в Примере 1 публикации US 2004/0067873, описание которой включено в настоящее описание посредством ссылки. Кратко, сухой липид гидратируют в буфере NaHCO3, затем перемешивают на вортексе и обрабатывают ультразвуком до тех пор, пока весь липид не диспергируется. Добавляют раствор холата, смесь инкубируют в течение 30 минут при периодическом перемешивании на вортексе и обработке ультразвуком до тех пор, пока она не станет прозрачной, что указывает на образование мицелл липида и холата. Добавляют проАроА-I в буфере NaHCO3, и раствор инкубируют в течение 1 часа при температуре, составляющей приблизительно 37°С-50°С.
Холат можно удалить способами, хорошо известными в данной области техники. Например, холат можно удалить путем диализа, ультрафильтрации, либо путем удаления молекул холата с помощью адсорбции/абсорбции на аффинных гранулах или смоле. В одном воплощении к препарату отрицательно заряженных липопротеиновых комплексов и холата добавляют аффинные гранулы, например, BIO-BEADS® (Bio-Rad Laboratories) для адсорбции холата. В другом воплощении препарат, например, мицеллярный препарат липопротеиновых комплексов и холата, пропускают через колонку, набитую аффинными гранулами.
В конкретном воплощении холат удаляют из препарата липопротеиновых комплексов путем нанесения препарата на гранулы BIO-BEADS®, находящиеся внутри шприца. Затем шприц герметично закрывают защитной пленкой и инкубируют при качании при 4°С в течение ночи. Перед применением холат удаляют путем впрыскивания раствора через BIO-BEADS®; при этом он адсорбируется гранулами.
Ожидают, что липопротеиновые комплексы, такие как отрицательно заряженные липопротеиновые комплексы, описанные в настоящем изобретении, имеют повышенный период полувыведения в кровообращении, когда эти комплексы имеют размер и плотность, соответствующие ЛПВП, в частности, ЛПВП в совокупностьх пре-бета-1 или пре-бета-2 ЛПВП. Стабильные препараты, имеющие длительный срок годности, могут быть получены путем лиофилизации. В некоторых воплощениях для получения комплексов АроА-I-липид применяют способы совместной лиофилизации, общеизвестные в данной области техники. Кратко, стадии совместной лиофилизации включают либо солюбилизацию смеси АроА-I и липида в органическом растворителе или в смеси растворителей, либо солюбилизацию АроА-I и липида по отдельности и смешивание их вместе. Желаемые характеристики растворителей или смесей растворителей включают следующие характеристики: (1) средняя относительная полярность, чтобы обладать способностью растворить гидрофобные липиды и амфипатический белок, (2) растворители класса 2 или класса 3 согласно руководству по растворителям FDA (Federal Register, volume 62, No. 247), чтобы избежать потенциальной токсичности, связанной с остаточным органическим растворителем, (3) низкая температура кипения, чтобы гарантировать легкость удаления растворителя в процессе лиофилизации, (4) высокая точка плавления, чтобы обеспечить более быстрое замораживание, более высокие температуры конденсации и меньший износ элементов лиофилизатора. В некоторых воплощениях используют ледяную уксусную кислоту. Можно также использовать комбинации метанола, ледяной уксусной кислоты, ксилола или циклогексана.
Затем раствор АроА-I-липида лиофилизируют с получением гомогенного порошка. Условия лиофилизации могут быть оптимизированы, чтобы получить быстрое выпаривание растворителя при минимальном количестве остаточного растворителя в лиофилизированном порошке аполипопротеина-липида. Выбор условий лиофилизации может определить специалист в данной области техники в зависимости от природы растворителя, типа и размеров резервуара, раствора для хранения, объема заполнения и характеристик используемого лиофилизатора.
Лиофилизированные липопротеиновые комплексы можно использовать для приготовления крупных партий без упаковки для дальнейшего изготовления в виде фармацевтических препаратов или для приготовления индивидуальных аликвот или стандартных доз, которые можно восстанавливать с получением раствора или суспензии липопротеиновых комплексов. Для восстановления лиофилизированный порошок повторно гидратируют водным раствором до подходящего объема (например, 5 мг полипептида/мл, что удобно для внутривенной инъекции). В некоторых воплощениях лиофилизированный порошок повторно гидратируют фосфатно-солевым буферным раствором или физиологическим солевым раствором. Смесь можно встряхивать или перемешивать на вортексе, чтобы способствовать повторной гидратации. Стадию восстановления можно выполнять при температуре, равной или более высокой, чем температура фазового перехода липидного компонента в комплексах.
Комплексы АроА-I-липид образуются спонтанно после гидратации лиофилизированного порошка аполипопротеина-липида водной средой, имеющей соответствующее значение рН и осмоляльности. В некоторых воплощениях среда для гидратации содержит стабилизаторы, выбранные, но не ограниченные ими, из сахарозы, трегалозы и глицерина. В некоторых воплощениях раствор несколько раз нагревают до температуры выше температуры фазового перехода липидов в целях образования комплексов. Отношение липида к белку может составлять от 1:1 до 200:1 (моль/моль) и предпочтительно составляет от 3:1 до 2:1 липид:белок (масс./масс.), более предпочтительно от 2,7:1 до 2,1:1 липид:белок (масс./масс.), например, 2,7:1 липид:белок (масс./масс.). Порошок гидратируют с получением конечного комплекса, концентрация которого составляет 5-30 мг/мл, выраженная в эквивалентах белка.
В различных воплощениях порошок АроА-I может быть получен путем лиофилизации раствора полипептида в водном растворе NH4HCO3. Затем образуют гомогенный раствор АроА-I и липида (Например, сфингомиелина) путем растворения порошка липида и порошка АроА-I в ледяной уксусной кислоте. Затем раствор лиофилизируют, и комплексы, подобные ЛПВП, аполипопротеин-липид образуются в результате гидратации полученного в результате порошка в водной среде.
В некоторых воплощениях комплексы АроА-I-липид образуют путем совместной лиофилизации растворов или суспензий фосфолипида и белка. Гомогенный раствор АроА-I и липида (например, фосфолипида) в органическом растворителе или в смеси органических растворителей лиофилизируют, а затем комплексы АроА-I-липид образуются спонтанно в результате гидратации лиофилизированного порошка в водном буфере. Примеры органических растворителей и смесей растворителей, используемых в данном способе, включают, но не ограничены ими, уксусную кислоту, смесь уксусная кислота/ксилол, смесь уксусная кислота/циклогексан и смесь метанол/ксилол.
Аликвоту полученных в результате восстановленных препаратов можно охарактеризовать, чтобы подтвердить, что комплексы имеют желаемое распределение по размеру; например, распределение по размеру ЛПВП. Иллюстративным способом характеризации размера является гель-фильтрационная хроматография. В качестве стандартов для калибровки колонки можно использовать серию белков, имеющих известную молекулярную массу и диаметр Стокса, в также ЛПВП человека.
В других воплощениях комплексы рекомбинантный АроА-I-липид получают путем комплексообразования АроА-I с липидами, раскрытыми в патентной публикации US №2006/0217312 и в международной публикации WO 2006/100567 (PCT/IB2006/000635), описания которых включены в настоящее описание посредством ссылки.
В патентах US №№6004925, 6037323, 6046166 и 6287590 (полностью включенных в настоящее описание посредством ссылки) раскрыт простой способ получения отрицательно заряженных липопротеиновых комплексов, обладающих характеристиками, подобными ЛПВП. Данный способ, включающий совместную лиофилизацию растворов аполипопротеина и липида в органическом растворителе (или в смесях растворителей) и образование отрицательно заряженных липопротеиновых комплексов в процессе гидратации лиофилизированного порошка, обладает следующими преимуществами: (1) для этого способа требуется очень малое количество стадий; (2) при этом способе используют недорогостоящий растворитель(и); (3) для образования предполагаемых комплексов используется большая часть или все включенные ингредиенты, что, таким образом, позволяет избежать потерь исходного материала, что является обычным для других способов; (4) в результате образуются лиофилизированные комплексы, которые являются очень стабильными в процессе хранения, так что эти комплексы можно восстанавливать непосредственно перед применением; (5) обычно нет необходимости дополнительно очищать полученные в результате комплексы после образования и перед применением; (6) исключены токсичные соединения, включая детергенты, например, холат; и (7) способ получения можно легко масштабировать, и он подходит для производства с соблюдением НОП (норм оптимального производства) (то есть в окружающей среде, свободной от эндотоксинов).
Другие подходящие способы описаны в опубликованной заявке на патент US №2006/0217312 и в международной публикации WO2006/100567 (РСТ/IB2006/000635); описание каждого из документов включено в настоящее описание посредством ссылки.
Предпочтительно, чтобы свести к минимуму окисление белкового и липидного компонентов, одну, более одну или все стадии образования комплекса проводят под слоем инертного газа (например, азота, аргона или гелия).
Концентрацию белка и липида частиц аполипопротеин-липид в растворе можно измерить любым способом, известным в данной области техники, включающим, но не ограниченным ими, количественные анализы белков и фосфолипидов, хроматографические методы, такие как ВЭЖХ, гель-фильтрация, ГХ (гель-хроматография), сопряженная с различными детекторами, включая масс-спектрометрию, ультрафиолетовый или цифровой диодный детектор, флуоресцентные методы, упругое рассеяние света и другие. Целостность липидов и белков можно также определить с помощью тех же хроматографических методов, а также с помощью пептидного картирования, гель-электрофореза в ДСН-ПААГ, N- и C-концевого секвенирования АроА-I и стандартных количественных анализов для определения окисления липидов.
6.6. Фармацевтические композиции
Фармацевтические композиции, рассматриваемые в изобретении, содержат отрицательно заряженные липопротеиновые комплексы в качестве активного ингредиента в фармацевтически приемлемом носителе, подходящем для введения и доставки in vivo. Поскольку пептиды могут включать кислые и/или основные концы и/или боковые цепи, пептидомиметики аполипопротеинов можно включать в композиции либо в форме свободных кислот или оснований, либо в форме фармацевтически приемлемых солей. Можно также применять модифицированные белки, такие как амидированные, ацилированные, ацетилированные или пегилированные белки. Возможно фармацевтические композиции могут содержать липопротеиновые комплексы, нагруженные одним или более одним гидрофобным, липофильным или неполярным активным агентом, как описано выше в Разделах 6.2 и 6.3.
Инъекционные композиции включают стерильные суспензии, растворы или эмульсии активного ингредиента в водных или масляных растворителях. В композиции можно также включать агенты для приготовления препаратов, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. В некоторых воплощениях инъекционная композиция содержит отрицательно заряженные липопротеиновые комплексы в фосфатно-солевом буферном растворе (10 мМ фосфат натрия, 80 мг/мл сахарозы, рН 8,2). Композиции для инъекций могут быть представлены в форме стандартной дозы, например, в ампулах или в контейнерах, содержащих многократные дозы, и могут содержать добавленные консерванты. Для инфузии композицию можно поставлять в инфузионном мешке, изготовленном из материала, совместимого с отрицательно заряженными липопротеиновыми комплексами, такого как сополимер этилена и винилацетата или любой другой совместимый материал, известный в данной области техники.
Подходящие лекарственные формы содержат отрицательно заряженные липопротеиновые комплексы, имеющие конечную концентрацию, составляющую от примерно 5 мг/мл до примерно 15 мг/мл липопротеина. В конкретном воплощении стандартная лекарственная форма содержит отрицательно заряженные липопротеиновые комплексы, имеющие конечную концентрацию, составляющую от примерно 8 мг/мл до примерно 10 мг/мл аполипопротеина А-I, предпочтительно примерно 8 мг/мл.
Предпочтительно, чтобы свести к минимуму окисление белкового и липидного компонентов, фармацевтические композиции готовят и/или заполняют под слоем инертного газа (например, азота, аргона или гелия).
6.7. Способы лечения
Липопротеиновые комплексы, например, отрицательно заряженные липопротеиновые комплексы, и композиции, описанные в настоящем изобретении, можно применять практически для любой цели, где липопротеиновые комплексы показаны как полезные. Липопротеиновые комплексы, такие как отрицательно заряженные липопротеиновые комплексы, эффективны при мобилизации холестерина, даже при введении в значительно более низких дозах, чем количества аполипопротеина (от 20 мг/кг до 100 мг/кг на введение каждые 2-5 суток, от 1,4 г до 8 г на человека средних размеров), требуемые режимами лечения, доступными в настоящее время.
Следовательно, комплексы и композиции по настоящему изобретению особенно полезны для лечения или предупреждения сердечно-сосудистых заболеваний, расстройств и/или сопутствующих состояний. Способы лечения или предупреждения сердечно-сосудистого заболевания, расстройства и/или сопутствующего состояния у субъекта, как правило, включают введение субъекту низкой (менее 15 мг/кг) дозы или количества липопротеинового комплекса или композиции, как описано в настоящем изобретении, в соответствии с режимом, эффективным для лечения или предупреждения конкретного показания.
Липопротеиновые комплексы вводят в количестве, достаточном или эффективном для получения терапевтической пользы. В контексте лечения сердечно-сосудистого заболевания, расстройства и/или сопутствующего состояния терапевтическая польза может быть получена, если происходит одно или более одно из следующих событий: повышение мобилизации холестерина по сравнению с базовым уровнем, уменьшение объема атеросклеротической бляшки, повышение доли свободного холестерина липопротеинов высокой плотности (ЛПВП) по сравнению с базовым уровнем без повышения средней концентрации триглицеридов в плазме или повышение уровней трансаминазы печени (или аланинаминотрансферазы) выше нормального диапазона. Для существования терапевтической пользы полное излечение необязательно, хотя и желательно.
В некоторых воплощениях липопротеиновый комплекс вводят в дозе, составляющей от примерно 2 мг/кг эквивалентов АроА-I до примерно 12 мг/кг эквивалентов АроА-I на инъекцию. В некоторых воплощениях липопротеиновый комплекс вводят в дозе, составляющей примерно 3 мг/кг эквивалентов АроА-I. В некоторых воплощениях липопротеиновый комплекс вводят в дозе, составляющей примерно 6 мг/кг эквивалентов АроА-I. В некоторых воплощениях липопротеиновый комплекс вводят в дозе, составляющей примерно 12 мг/кг эквивалентов АроА-I.
Субъектами, подлежащими лечению, являются индивидуумы, страдающие или нуждающиеся в предупреждении сердечно-сосудистого заболевания, расстройства и/или сопутствующего состояния. Неограничивающие примеры таких сердечно-сосудистых заболеваний, расстройств и/или сопутствующих состояний, которые можно лечить или предупреждать с помощью липопротеиновых комплексов и композиций, описанных в настоящем изобретении, включают заболевание периферических сосудов, рестеноз, атеросклероз и огромное число клинических проявлений атеросклероза, таких как, например, удар, ишемический удар, транзиторная ишемическая атака, инфаркт миокарда, острый коронарный синдром, стенокардия, перемежающаяся хромота, критическая ишемия конечностей, стеноз клапана и склероз атриального клапана. Субъекты могут представлять собой индивидуумов, страдающих первичным заболеванием острым коронарным синдромом, например, инфарктом миокарда (с подъемом или без подъема ST-сегмента), или нестабильной стенокардией. Субъект, подлежащий лечению, может представлять собой любое животное, например, млекопитающее, в частности, человека.
В одном воплощении, способы включают способ лечения или предупреждения сердечно-сосудистого заболевания, включающий введение субъекту заряженного липопротеинового комплекса или композиции, как описано в настоящем изобретении, в количестве, при котором у пациента не изменяется базовый уровень АроА-I после введения.
В других воплощениях способы включают способ лечения или предупреждения сердечно-сосудистого заболевания, включающий введение субъекту липопротеинового комплекса (например, заряженного комплекса) или композиции, как описано в настоящем изобретении, в количестве, эффективном для достижения сывороточного уровня свободного или связанного в комплекс аполипопротеина, превышающего базовый (исходный) уровень перед введением примерно на 5 мг/дл-100 мг/дл, в течение приблизительно до двух часов после введения, и/или примерно на 5 мг/дл-20 мг/дл в течение приблизительно до 24 часов после введения.
В другом воплощении, способы включают способ лечения или предупреждения сердечно-сосудистого заболевания, включающий введение субъекту липопротеинового комплекса (например, заряженного комплекса) или композиции, как описано в настоящем изобретении, в количестве, эффективном для достижения циркулирующих концентраций фракции холестерина-ЛПВП в плазме в течение по меньшей мере одних суток после введения, по меньшей мере примерно на 10% превышающих исходную концентрацию фракции холестерина-ЛПВП перед введением.
В другом воплощении, способы включают способ лечения или предупреждения сердечно-сосудистого заболевания, включающий введение субъекту липопротеинового комплекса (например, заряженного комплекса) или композиции, как описано в настоящем изобретении, в количестве, эффективном для достижения циркулирующих концентраций фракции холестерина-ЛПВП в плазме, составляющих от 30 до 300 мг/дл, за период, составляющий от 5 минут до 1 суток после введения.
В другом воплощении, способы включают способ лечения или предупреждения сердечно-сосудистого заболевания, включающий введение субъекту липопротеинового комплекса (например, заряженного комплекса) или композиции, как описано в настоящем изобретении, в количестве, эффективном для достижения циркулирующей концентрации холестериновых эфиров в плазме, составляющей от 30 до 300 мг/дл, за период, составляющий от 5 минут до 1 суток после введения.
В другом воплощении, способы включают способ лечения или предупреждения сердечно-сосудистого заболевания, включающий введение субъекту липопротеинового комплекса (например, заряженного комплекса) или композиции, как описано в настоящем изобретении, в количестве, эффективном для достижения повышения выведения холестерина с фекалиями в течение по меньшей мере одних суток после введения, по меньшей мере примерно на 10% превышающего базовый (исходный) уровень перед введением.
Липопротеиновые комплексы, включая отрицательно заряженные липопротеиновые комплексы, или композиции, описанные в настоящем изобретении, можно применять отдельно или в виде комбинированной терапии с другими лекарственными средствами, применяемыми для лечения или предупреждения вышеописанных состояний. Такие терапии включают, но не ограничены ими, одновременное или последовательное введение включенных лекарственных средств. Например, при лечении гиперхолестеринемии, например, семейной гиперхолестеринемии (гомозиготной или гетерозиготной) или атеросклероза препараты заряженного липопротеина можно вводить с одним или более одним из применяемых в настоящее время терапевтических средств, снижающих холестерин; например, секвестрантов желчных кислот, ниацина, статинов, ингибиторов всасывания холестерина и/или фибратов. При таком комбинированном режиме можно получить особенно полезные терапевтические эффекты, поскольку каждое лекарственное средство действует на различные мишени в синтезе и транспорте холестерина, то есть секвестранты желчных кислот действуют на рециркуляцию холестерина, хиломикроны и совокупность ЛПНП; ниацин, прежде всего, действует на совокупность ЛПОНП и ЛПНП; статины ингибируют синтез холестерина, уменьшают совокупность ЛПНП (и, вероятно, повышают экспрессию рецептора ЛПНП); тогда как липопротеиновые комплексы, включая отрицательно заряженные липопротеиновые комплексы, описанные в настоящем изобретении, действуют на RCT, повышают ЛПВП и стимулируют эффлюкс холестерина.
В другом воплощении, липопротеиновые комплексы, включая отрицательно заряженные липопротеиновые комплексы, или композиции, описанные в настоящем изобретении, можно применять в сочетании с фибратами для лечения или предупреждения коронарной болезни сердца; болезни коронарных артерий; сердечно-сосудистого заболевания, рестеноза, васкулярных или периваскулярных заболеваний; атеросклероза (включая лечение и предупреждение атеросклероза). Иллюстративные препараты и режимы лечения описаны ниже.
Липопротеиновые комплексы, включая отрицательно заряженные липопротеиновые комплексы, или композиции, описанные в настоящем изобретении, можно вводить в дозах, повышающих фракцию мелких ЛПВП, например, фракцию пре-бета, пре-гамма и пре-бета-подобных ЛПВП, фракцию альфа-ЛПВП, фракцию ЛПВП3 и/или ЛПВП2. В некоторых воплощениях дозировки эффективны для достижения уменьшения атеросклеротических бляшек, измеренного, например, методами визуализации, такими как магнитно-резонансная визуализация (МРВ) или внутрисосудистое ультразвуковое исследование (IVUS). Параметры для обследования с использованием IVUS включают, но не ограничены ими, изменение процента объема атеромы по сравнению с базовым уровнем и изменение общего объема атеромы. Параметры для обследования с использованием МРВ включают, но не ограничены ими, те же параметры, что и для IVUS, а также композицию липидов и кальцификацию бляшки.
Регрессию бляшки можно измерить, используя пациента в качестве собственного контроля (время ноль против времени t по окончании последней инфузии, либо в течение недель после последней инфузии, либо в течение 3 месяцев, 6 месяцев или 1 года после начала терапии).
Введение может быть лучше всего выполнено парентеральными путями введения, включая внутривенные (IV), внутримышечные (IM), внутрикожные, подкожные (SC) и интраперитонеальные (IP) инъекции. В определенных воплощениях введение осуществляют с помощью перфузора, инфильтратора или катетера. В некоторых воплощениях, липопротеиновые комплексы, например, отрицательно заряженные липопротеиновые комплексы, вводят путем инъекции, путем подкожно имплантируемого насоса или с помощью депо-препарата в количествах, при которых достигается циркулирующая концентрация в сыворотке, равная концентрации, полученной при парентеральном введении. Комплексы могут быть также абсорбированы, например, в стенте или другом устройстве.
Введение может быть достигнуто посредством ряда различных режимов лечения. Например, несколько внутривенных инъекций можно вводить периодически в течение одних суток при кумулятивном общем объеме инъекций, не достигающем суточной токсичной дозы. Эти способы включают введение липопротеинового комплекса через интервал, составляющий 6, 7, 8, 9, 10, 11 или 12 суток. В некоторых воплощениях липопротеиновый комплекс вводят через интервал, составляющий одну неделю.
Способы могут дополнительно включать введение липопротеинового комплекса 4, 5, 6, 7, 8, 9, 10, 11 или 12 раз через любой из интервалов, описанных выше. Например, в одном воплощении липопротеиновый комплекс вводят шесть раз с интервалом в одну неделю между каждым введением. В некоторых воплощениях введение может быть выполнено в виде серии инъекций, а затем прекращено на период, составляющий от 6 месяцев до 1 года, а затем начинают другую серию. Затем можно вводить поддерживающие серии инъекций каждый год или каждые 3-5 лет. Серии инъекций можно выполнять в течение суток (перфузию для поддержания определенного уровня комплексов), нескольких суток (например, четыре инъекции за период, составляющий восемь суток) или нескольких недель (например, четыре инъекции за период, составляющий четыре недели), а затем начать повторно спустя период, составляющий от шести месяцев до года. При хронических состояниях введение можно выполнять на постоянной основе. Способам может возможно предшествовать фаза индукции, при которой липопротеиновые комплексы вводят чаще.
В качестве еще одной альтернативы, можно вводить ступенчато возрастающую дозу, начиная примерно с 1-5 доз, составляющих от 50 до 200 мг на введение, после чего следуют повторяющиеся дозы, составляющие от 200 мг до 1 г на введение. В зависимости от потребностей пациента введение можно осуществлять путем медленной инфузии продолжительностью более одного часа, путем быстрой инфузии в течение одного часа или менее, либо путем однократной болюсной инъекции.
Токсичность и терапевтическую эффективность различных липопротеиновых комплексов можно определить, используя стандартные фармацевтические методы на клеточной культуре или подопытных животных для определения LD50 (дозы, летальной для 50% совокупности) и ED50 (дозы, терапевтически эффективной в 50% совокупности). Отношение дозы между токсическим и терапевтическим эффектами представляет собой терапевтический индекс, который может быть выражен в виде отношения LD50/ED50. Предпочтительны липопротеиновые комплексы, такие как отрицательно заряженные липопротеиновые комплексы, которые проявляют высокие терапевтические индексы. Неограничивающие примеры параметров, за которыми можно следить, включают функциональные трансаминазы печени (не более 2-кратные нормальные базовые уровни). Это является показателем того, что в печень поступает слишком много холестерина, и такое количество не может ассимилироваться. Можно также проводить мониторинг действия на эритроциты, поскольку в результате мобилизации холестерина из эритроцитов они становятся хрупкими, и изменяется их форма.
Пациентов можно лечить в течение периода, составляющего от нескольких суток до нескольких недель, до медицинского заключения (например, превентивное лечение), либо во время или после медицинского заключения. Введение можно проводить последовательно или одновременно с другой инвазивной терапией, например, ангиопластикой, абляцией каротидной артерии, операцией коронарной атерэктомии или трансплантацией органа (например, сердца, почки, печени и т.д.).
В определенных воплощениях отрицательно заряженный липопротеиновые комплексы вводят пациенту, у которого синтез холестерина контролируют посредством статина или ингибитора синтеза холестерина. В других воплощениях отрицательно заряженные липопротеиновые комплексы вводят пациенту, получающему терапию связывающей смолой, например, полусинтетической смолой, такой как холестирамин, или волокном, например, растительным волокном, для улавливания желчных солей и холестерина, для увеличения выведения желчной кислоты и для снижения концентраций холестерина в крови.
6.8. Другие применения
Липопротеиновые комплексы, например, отрицательно заряженные липопротеиновые комплексы, и композиции, описанные в настоящем изобретении, можно применять в количественных анализах in vitro для измерения сывороточных ЛПВП, например, для диагностических целей. Поскольку АроА-I, АроА-II и пептиды Аро ассоциируются с компонентом ЛПВП сыворотки, отрицательно заряженные липопротеиновые комплексы можно применять в качестве "маркеров" для совокупности ЛПВП и совокупностей пре-бета-1 и пре-бета-2 ЛПВП. Кроме того, отрицательно заряженные липопротеиновые комплексы можно применять в качестве маркеров для субсовокупности ЛПВП, эффективной при RCT. С этой целью отрицательно заряженные липопротеиновые комплексы можно добавлять к образцу сыворотки пациента или смешивать с ним; после соответствующего периода инкубации компонент ЛПВП можно анализировать путем определения включенных отрицательно заряженных липопротеиновых комплексов. Это можно осуществить, используя меченые отрицательно заряженные липопротеиновые комплексы (например, радиоактивными метками, флуоресцентными метками, ферментативными метками, красителями и т.д.), или с помощью иммунологических анализов, используя антитела (или фрагменты антител), специфичные к отрицательно заряженным липопротеиновым комплексам.
Альтернативно, меченые отрицательно заряженные липопротеиновые комплексы можно применять в методах визуализации (например, КГ (компьютерно-томографических) сканированиях, МРВ сканированиях) для визуализации системы кровообращения, либо для мониторинга RCT, либо для визуализации аккумуляции ЛПВП в жировых прожилках, атеросклеротических повреждениях и тому подобном, где ЛПВП должны быть активными при эффлюксе холестерина.
Примеры и данные, связанные с получением и характеризацией определенных комплексов проАроА-I-липид, описаны в патентной публикации US №2004/0067873, описание которой полностью включено в настоящее описание посредством ссылки.
Данные, полученные в модельной системе на животных с использованием определенных комплексов проАроА-I-липид, описаны в патентной публикации US №2004/0067873, описание которой полностью включено в настоящее описание посредством ссылки.
7. ПРИМЕР 1: РАЗРАБОТКА ЭКСПРЕССИОННОЙ СИСТЕМЫ APOA-I
7.1. Клонирование и экспрессия АроА-I человека в клетках яичника китайского хомячка (СНО)
7.1.1. Получение экспрессионного вектора АроА-I
Последовательность гена препроАроА-I была получена из Национального центра биотехнологической информации (NCBI) (P02647), и к ней были присоединены фланкирующие последовательности для удобства клонирования и улучшенной экспрессии. ДНК, кодирующую препроАроА-I, с фланкирующими последовательностями синтезировали и клонировали в векторе Bluescript KS+. 5'-фланкирующая последовательность содержала оптимизированную последовательность трансляции Козака. Вставку препроАроА-I вырезали из вектора Bluescript KS+ ферментами рестрикции Hind III и Bgl II. Этот фрагмент очищали из геля и лигировали в ретровирусном экспрессионном векторе, несущем следующие генетические элементы: промотор цитомегаловируса человека, слитый с 5' LTR (длинным концевым повтором) вируса лейкемии мыши Молони, упаковочную последовательность MoMuLV/SV, немедленно-ранний промотор цитомегаловируса обезьян, множественный сайт клонирования, 3' LTR от MoMuLV, а также точку начала репликации и ген бета-лактамазы бактерий. Клоны полученной в результате конструкции секвенировали на протяженности гена и фланкирующих участков. Конечный клон (клон №17) был отобран на основании соответствия предсказанной последовательности ДНК. Затем ретровектор был подготовлен к трансдукции с использованием клеток 293GP путем совместной трансфекции с экспрессионной плазмидой для гликопротеина оболочки вируса везикулярного стоматита. Супернатант, выделенный из котрансфицированных клеток и концентрированный, использовали для стадии трансдукции клеток CHO-S, описанной ниже в Разделе 7.1.2.
7.1.2. Получение линии клеток млекопитающих для экспрессии АроА-I
Клетки яичника китайского хомячка, приспособленные к росту в среде без сыворотки (CHO-S), подвергали трем раундам трансдукции (1Х, 2Х и 3Х), используя ретровирусный вектор, описанный выше в Разделе 7.1.1. Объединенную совокупность размножали для криоконсервации после каждой трансдукции, и образец клеток подвергали анализу на копийность гена. Индекс копийности гена приведен ниже в таблице 2. 3Х трансдуцированную линию клеток анализировали на продуктивность в 16-суточном тесте периодической культуры с подпиткой в двух повторах в колбах объемом 125 мл. Результаты представлены в таблице 3.
7.1.3. Стабильность линии клеток, экспрессирующей АроА-I
Исследование по характеризации, не соответствующее GMP, было проведено на клетках CHO-S-ApoA-I-R (3Х), клон 17, основной банк клеток, продуцирующих АроА-I, в целях оценки их стабильности в отношении жизнеспособности, скорости роста, сохранения вставок гена и секреции соответствующего продукта во время долгосрочного культивирования.
Линию клеток оттаивали из основного банка клеток и культивировали во встряхиваемых колбах объемом 125 мл, используя среду PF CHO LS (HyClone, Logan UT). Клетки непрерывно культивировали путем серийного пассажа от поколения 0 до поколения 43. В поколениях 4, 8, 14, 19, 25, 31, 36 и 43 образцы клеток замораживали. По окончании культивирования образцы клеток от всех поколений оттаивали и использовали для проведения конечных анализов культивирования, чтобы сравнить продуцирование белка АроА-I линии клеток в различных поколениях в одном и том же эксперименте. Супернатант каждого из образцов тестировали на сутки 12, используя анализ ВЭЖХ с обращенной фазой, чтобы определить уровень продуцирования АроА-I. Было обнаружено, что концентрация АроА-I варьирует от 1259 мг/л до 1400 мг/л для различных образцов (ФИГ.2).
Чтобы сравнить стабильность вставок гена, образцы клеток CHO в поколениях 0, 4, 14, 36 и 43 использовали для выделения ДНК. Число генетических вставок для каждого образца определяли, используя ПЦР в реальном времени на геномной ДНК. Как показано в таблице 3, индексы копийности на основании ПЦР значительно не отличались от индексов, полученных на основании перекрывающихся стандартных отклонений между поколением 0 и поколением 43. Было обнаружено, что значения продуцирования АроА-I и индексы копийности гена клеточной линии из основного банка клеток стабильны на протяжении 43 протестированных поколений.
7.2. Выращивание клеток и сбор АроА-I
7.2.1. Масштабирование продуцирования до инокулума и биореактора на 200 л
Пробирку клеток CHO-S, стабильно трансфицированных геном АроА-I человека, из основного банка клеток оттаивали в водяной бане при 37°С и добавляли в одну встряхиваемую колбу (250 мл) (Thermo Fisher Scientific), содержащую 35 мл среды для культуры клеток HyQ PF-CHO LS. Исходный счет клеток, определенный с использованием гемоцитометра, составлял 2,48×105клеток/мл, и жизнеспособность составляла 93,8%. Затем культуру помещали на орбитальный встряхиватель (90 об/мин), находящийся внутри термостата, поддерживаемого при 37°С, в увлажненной атмосфере 5% CO2. Целевые плотности инокуляции стадий субкультивирования составляли приблизительно 1,6×105 клеток/мл. На сутки 4 счет клеток и процент жизнеспособности в колбе составлял 15,01×105 клеток/мл при жизнеспособности, составляющей 93,9%. Колбу объемом 250 субкультивировали до колбы объемом 1 л. На сутки 3 средний счет жизнеспособных клеток из колбы объемом 1 л составлял 13,56×105 клеток/мл при жизнеспособности, составляющей 95,3%. Колбу объемом 1 л субкультивировали до системы биореактора Wave Bioreactor System 20EH, включающей одноразовый биореактор фирмы WAVE Biotech объемом 10л (GE Healthcare Bioscience Bioprocess Corp. Somerset, NJ) при исходном объеме культуры и исходной целевой плотности клеток, составляющих 1000 мл и 1,75×105 клеток/мл соответственно. Рабочие установки биореактора Wave Bioreactor составляли: температура инкубации 37°С, скорость качания 15,0 имп/мин, угол наклона качания 10,9° и концентрация CO2 в аэрационном газе 5,0% при скорости потока газа 0,25 л/минута. После 3 суток культивирования плотность жизнеспособных клеток в одноразовом биореакторе составляла 10,73×105клеток/мл, и добавляли свежую среду HyQ PF-CHO LS, доводя объем культуры до 5000 мл. После дополнительных трех суток плотность жизнеспособных клеток составляла 13,25×105 клеток/мл, и весь объем культуры из одноразового биореактора переносили в биореактор объемом 30 л. Рабочие установки в биореакторе объемом 30 л для температуры, рН, растворенного кислорода, давления и скорости перемешивания составляли: 37°С, рН 7,0, насыщение воздухом 40%, давление 1 psig (манометрическое давление в фунтах на квадратный дюйм; 6,9 кПа) и скорость перемешивания 50 об/мин соответственно.
Плотность жизнеспособных клеток в биореакторе объемом 30 л составляла 10,80×105 клеток/мл на третьи сутки культивирования, что было достаточно для инокуляции биореактора объемом 200 л при исходной целевой плотности, составляющей 2,40×105 клеток/мл. Все содержимое объемом 30 л переносили, и масса после инокуляции, плотность и жизнеспособность клеток составляли соответственно 134,5 кг, 2,37×105 клеток/мл и 90,9%. Рабочие установки в биореакторе объемом 200 л для температуры, рН, растворенного кислорода, давления и скорости перемешивания составляли: 37°С, рН 7,0, насыщение воздухом 40%, давление 1 psig (6,9 кПа) и скорость перемешивания 35 об/мин соответственно. На сутки 3 плотность клеток составляла 15,71×105клеток/мл, что было достаточно для добавления в биореактор 60 л (об/об) полной среды (AGT CD СНО 5Х, Invitrogen) и 200 мМ раствора L-глутамина (конечная концентрация 10 мМ). На сутки 8 и 12 уровень глюкозы падал ниже 5 г/л, что запускало добавление 3 г/л раствора глюкозы (20%). Плотность жизнеспособных клеток достигала пика на сутки 9 при плотности, составляющей 33,20×105 клеток/мл, при жизнеспособности, составляющей 92,5%. Содержимое биореактора собирали на сутки 13 при жизнеспособности клеток, составляющей 78,5%. Значения счета и жизнеспособности клеток в культуре на протяжении всего периода культивирования приведены на ФИГ.3А, и концентрация АроА-I в культуральной среде на протяжении всего периода культивирования приведена на ФИГ.3В.
7.2.2. Сбор, отделение клеток и хранение клеток
Среду из биореактора собирали путем пропускания содержимого биореактора через двойные фильтры Cuno (Rutherford, NJ, USA) 60M02 Maximizer, а затем через фильтр Millipore 0,22 мкм Opticap (Billercia, MA, USA) в мешок объемом 200 л. Затем осветленную среду хранили при 2-8°С до операции распределения. Осветленную среду фильтровали через фильтр Millipore 0,22 мкм (Billerica, MA, USA) и распределяли в стерильные бутылки объемом 2 л PETG (ThermoFisher, Marietta, ОН, USA), а затем замораживали при -20°С до разрешения на отгрузку.
8. ПРИМЕР 2: РАЗРАБОТКА СИСТЕМЫ ОЧИСТКИ АРОА-I
8.1. Материалы и методы
Экспрессия, первичное разделение и кондиционирование. Осветленную среду для выращивания клеток, содержащую АроА-I, полученную, как описано в Примере 1 (приблизительно 1,8 л), оттаивали путем хранения при температуре окружающей среды. Оттаявшую среду кондиционировали для анионообменной хроматографии путем снижения рН до 5,3±0,2 с использованием 1 М HCl.
Очистка Аро A-I. Анионообменную колонку, набитую Q-сефарозой FF (GE Healthcare) до высоты слоя, составляющей 20 см, уравновешивали буфером TAMP A (20 мМ фосфат натрия, рН 5,3). Уравновешивание колонки считали завершенным, когда рН элюата колонки составлял приблизительно 5,5. Кондиционированный фильтрат наносили на колонку при концентрации 25-35 г АроА-I/л анионообменной смолы, при скорости тока, составляющей 3,7 см/мин. АроА-I промывали через колонку непрерывным потоком буфера ТАМР А, который собирали.
рН непрерывного потока, содержащего АроА-I, с анионообменной колонки доводили до 8,0±0,2 с использованием 1 М NaOH. Затем раствор фильтровали через фильтр 0,2 мкм Planova 20N (Asahi Kasei Medical) со скоростью тока, составляющей примерно 12,5 л/ч/м2, чтобы удалить вирусы и вирусные частицы.
Хроматографическую колонку с обращенной фазой Source 30 с высотой слоя, составляющей 25 см, промывали буфером TAMP D (20 мМ карбонат аммония, рН 9,5) до уравновешивания, когда элюат колонки достигал рН 9,5. Фильтрат, содержащий АроА-I, со стадии фильтрования вируса наносили на колонку со скоростью тока, составляющей 2,8 см/мин. АроА-I в образце адсорбировали на матриксе и элюировали градиентом 35-50% ацетонитрила в буфере TAMP D.
Колонку силикагеля С18 с обращенной фазой (300 Å 10 мкм), набитую до высоты слоя, составляющей 25 см, промывали в буфере ТАМР Е (100 мМ карбонат аммония, рН 9,5) до уравновешивания, когда элюат колонки достигал рН 9,5. Затем на колонку С18 наносили 4,7 г АроА-I/л матрикса. АроА-I, адсорбированный на матриксе колонки, элюировали при градиенте 40-50% ацетонитрила в буфере ТАМР Е.
Ацетонитрил удаляли из фракций, содержащих АроА-I, элюированных с колонки С18, путем объединения и концентрирования фракций приблизительно в 2,5 раза с последующей диафильтрацией концентрата против 15 объемов буфера ТАМР С (3 мМ фосфат натрия, рН 8). рН раствора АроА-I после диафильтрации снижали до примерно 6,0, используя разбавленную фосфорную кислоту, а затем пропускали через анионообменную мембрану Mustang Q (Pall Life Sciences), чтобы удалить ДНК и белки клетки-хозяина. Фильтрат Mustang Q подвергали диафильтрации против 5 объемов буфера ТАМР С.
Затем фильтрат после диафильтрации подвергали конечной ультрафильтрации, используя полиэфирсульфоновую мембрану (Filtron Omega series) с порогом отсечения молекулярной массы, составляющим 10000 Дальтон, и, таким образом, эта мембрана удерживает АроА-I, имеющий молекулярную массу 28000 Дальтон. Раствор белка содержал 7,8-17 г/л чистого АроА-I, как определено путем сканирования геля после ДСН-ПААГ электрофореза и измерения отношения интенсивности зоны полосы очищенного АроА-I и общей интенсивности всех полос.
8.2. Результаты
Характеризация АроА-I. Чистоту препарата АроА-I оценивали с помощью электрофореза в ДСН-ПААГ как составляющую более 99% чистоты при низких уровнях ДНК и белков клетки-хозяина и при отсутствии обнаружимого количества укороченного АроА-I. См. ФИГ.4.
9. ПРИМЕР 3: ОПТИМИЗАЦИЯ КОМПОНЕНТОВ ЛИПОПРОТЕИНОВОГО КОМПЛЕКСА
9.1. Получение компонентов, представляющих собой аполипопротеин и фосфолипид
Про-Аро A-I: Белок про-АроА-I поставляется фирмой Unite de Biotechnologie, Institut Meurice, Hte Ecole Lucia De Brouckere, 1 Avenue Emile Gryzon, B-1070 Anderlecht, Belgium в лиофилизированных отдельных флаконах объемом 100 мл, содержащих приблизительно 90 мг белка. Номер партии был 20060202. Белок держали приблизительно при 4°С до использования. Перед лиофилизацией содержание про-АроА-I составляло 3,225 мг/мл при содержании мочевины, составляющем примерно 0,011 мг/мл. Раствор про-АроА-I готовили путем растворения приблизительно 630 мг про-АроА-I в 25,6 мл смеси уксусной кислоты/5% воды. Конечная концентрация раствора составляла 25 мг/мл.
АроА-I: АроА-I был получен, как описано в Примере 1 выше.
Сфингомиелин: Сфингомиелин из куриного яйца (Coatsome® NM-10) поставляется фирмой NOF Corporation, 1-56, Oohama-Cho, Amagasaki-Shi, 660-0095, Japan. Номер партии был 0502ES1. Сфингомиелин держали приблизительно при -20°С до использования. Чистота сфингомиелина составляла 99,1%. Раствор сфингомиелина готовили путем растворения 799,4 мг очищенного сфингомиелина в 16 мл смеси уксусной кислоты/5% воды с получением конечной концентрации, составляющей 50 мг/мл.
Фосфатидилглицерин: 1,2-дипальмитоил-sn-глицеро-3-фосфатидилглицерин в виде натриевой соли (DPPG-Na, Coatsome® MG-6060LS) поставляется фирмой NOF Corporation, 1-56, Oohama-Cho, Amagasaki-Shi, 660-0095, Japan. Номер партии был 0309651 L. DPPG-Na держали приблизительно при -20°С до использования. Чистота DPPG-Na составляла 99,2%. Раствор DPPG-Na готовили путем растворения 49,1 мг DPPG-Na в 1 мл смеси уксусной кислоты/5% воды с получением конечной концентрации, составляющей 50 мг/мл.
Фосфатидилхолин: Дипальмитоилфосфатидилхолин (DPPC) был получен из коммерческого источника.
9.2. Получение липопротеиновых комплексов
Были получены следующие липопротеиновые комплексы:
(а) Нейтральные липопротеиновые комплексы:
a) Формула А: про-АроА-I и SM в массовом соотношении белок:фосфолипид, составляющем 1:2,5;
b) Формула В: про-АроА-I и SM в массовом соотношении белок:фосфолипид, составляющем 1:2,1;
c) Формула С: про-АроА-I и SM в массовом соотношении белок:фосфолипид, составляющем 1:3,1;;
d) Формула D: про-АроА-I, SM и DPPC в соотношении масс./масс. липопротеин:суммарный фосфолипид, составляющем 1:2,7, при соотношении масс./масс. SM:DPPC, составляющем 50:50;
е) Формула Е: АроА-I и SM в массовом соотношении белок:фосфолипид, составляющем 1:2,7.
(b) Отрицательно заряженные липопротеиновые комплексы:
a) Формула F: про-АроА-I, SM, DPPC и DPPG в соотношении масс./масс. липопротеин:суммарный фосфолипид, составляющем 1:2,7, при соотношении масс./масс. SM:DPPC:DPPG, составляющем 48:48:4;
b) Формула G: про-ApoA-I, SM, DPPC и DPPG в соотношении масс./масс. липопротеин:суммарный фосфолипид, составляющем 1:2,7, при соотношении масс./масс. SM:DPPC:DPPG, составляющем 73:23:4;
c) Формула Н: ApoAI, SM и DPPG в соотношении масс./масс. липопротеин:суммарный фосфолипид, составляющем 1:2,7, при соотношении масс./масс. SM:DPPG, составляющем 97:3;
d) Формула I: ApoAI, SM и DPPG в соотношении масс./масс. липопротеин:суммарный фосфолипид, составляющем 1:3,0, при соотношении масс./масс. SM:DPPG, составляющем 97:3;
e) Формула J: ApoAI, SM и DPPG в соотношении масс./масс. липопротеин:суммарный фосфолипид, составляющем 1:3,3, при соотношении масс./масс. SM:DPPG, составляющем 97:3.
9.3. Скорость образования и гомогенность липопротеиновых комплексов
Образование липопротеиновых комплексов Формул A-J тестировали путем впрыскивания образца в систему ВЭЖХ для проверки размера и распределения липопротеиновых комплексов. Комплексы были получены путем совместной гомогенизации, и образцы отбирали в указанное время.
На ФИГ.5 показаны иллюстративные хроматограммы ВЭЖХ для нейтральных липопротеиновых комплексов в соответствии с Формулами А-С, содержащих различные соотношения масс./масс. липопротеин:SM, и с Формулой D, содержащих липопротеин и нейтральные фосфолипиды в соотношении 1:2,7, где нейтральный фосфолипид представляет собой смесь 50:50 SM:DPPC. Соотношение масс./масс. липопротеин:SM, составляющее 1:2,7, было оптимальным.
Формула D, содержащая смесь SM и DPPC, проявляла слабое образование комплекса.
Добавление фосфатидилхолина в качестве второго нейтрального фосфолипида привело в результате к медленному и неполному образованию комплекса. На ФИГ.6 показаны хроматограммы ВЭЖХ липопротеиновых комплексов Формулы D через 10, 20, 30 и 60 минут. Напротив, как показано на ФИГ.7, Формула В быстро образовывала комплексы.
Добавление отрицательно заряженного фосфолипида DPPG к SM и DPPC привело к даже меньшему образованию комплекса, как показано на хроматограммах ВЭЖХ липопротеиновых комплексов Формулы F через 20, 40, 60 и 120 минут, представленных на ФИГ.8.
Как показано на ФИГ.9, липопротеиновые комплексы, включающие только SM в качестве фосфолипида, при массовом отношении белка к липиду, составляющем 1:2,7, образуют больше комплексов пре-В ЛПВП, и эти комплексы образуются быстрее, чем липопротеиновые комплексы, имеющие такое же массовое отношение белка к липиду, но включающие DPPC и/или DPPG. Следовательно, липопротеиновые комплексы, включающие только SM в качестве нейтрального липида, образуют более гомогенные липопротеиновые комплексы с большей скоростью, чем комплексы, включающие DPPC в дополнение к SM, с добавлением или без добавления DPPG.
Наконец, отрицательно заряженные липопротеиновые комплексы, содержащие массовое отношение аполипопротеин: фосфолипид, составляющее от 1:2,7 до 1:3, в которых фосфолипидная фракция содержит SM и DPPG в массовом соотношении 97 к 3, проявляли оптимальную гомогенность и не проявляли пик свободного липида по сравнению с комплексами, содержащими массовое соотношение аполипопротеин: фосфолипид, составляющее 1:3,3, и с незаряженными липопротеиновыми комплексами. См. ФИГ.10, на которой показаны хроматограммы для Формул Е, I и J. Липопротеиновые комплексы в соответствии с Формулами В и Н были выбраны для дальнейшего исследования на животных (Пример 6), и на основании результатов исследований на животных липопротеиновые комплексы Формулы Н были выбраны для клинической оценки у пациентов-людей (Примеры 6 и 8).
10. ПРИМЕР 4: ОБРАЗОВАНИЕ ЛИПОПРОТЕИНОВЫХ КОМПЛЕКСОВ С ИСПОЛЬЗОВАНИЕМ СПОСОБОВ НА ОСНОВЕ ТЕРМОЦИКЛИРОВАНИЯ
10.1. Общее описание процедуры получения комплексов АроА-I/DPPG/Сфингомиелин
Замороженный раствор АроА-I в фосфатном буфере (рН 7-9), имеющий концентрацию белка, составляющую от 1 до 30 мг/мл, обычно от 5 до 20 мг/мл, готовят путем оттаивания в течение приблизительно 24-96 ч при 2-8°С и взвешивают. К раствору АроА-I добавляют одноосновный фосфат натрия и двухосновный фосфат натрия до получения конечной концентрации пептида, составляющей 10 мМ, в буфере при рН 7,4.
Раствор DPPG готовят путем нагревания фосфатного буфера (10 мМ фосфат натрия, рН 8,0) до целевой температуры 50°С. Порошок DPPG (NOF Corporation) оттаивают при температуре окружающей среды в течение по меньшей мере 1,5 ч, а затем взвешивают и добавляют в контейнер буфера. Затем DPPG диспергируют при температуре, составляющей 50°С, используя высокоэффективное диспергирующее устройство ULTRA-TURRAX® (IKA® Works, Inc.). После диспергирования суспензию DPPG и раствор АроА-I нагревают до 57°С. Эти компоненты объединяют и нагревают при 57°С в течение 30 минут в атмосфере азота. Этот раствор предварительного комплекса охлаждают до комнатной температуры.
Порошок сфингомиелина (SM) (NOF Corporation) оттаивают при температуре окружающей среды, затем взвешивают в стеклянной емкости. Фосфатный буфер (10 мМ фосфат натрия, рН 8,0) нагревают до 50°С, объединяют с порошком SM с получением концентрации SM, составляющей 220 мг/мл. Порошок SM диспергируют до суспензии, используя ULTRA-TURRAX®, и дисперсию охлаждают до 4°С, а затем пропускают через гомогенизатор. Мониторинг частиц SM проводят путем динамического светорассеяния (ДСР) до среднего размера зета (Z), составляющего от 55 до 70 нм (используя измерение интенсивности). Это может быть достигнуто, например, при использовании гомогенизатора Nano DeBee при 32000 +/- 3000 бар (32×105±3×105 кПа) при температуре на входе 10-18°С и температуре на выходе, предпочтительно составляющей 30-40°С (и не превышающей 59°С) с получением в результате частицы, имеющей средний размер Z, составляющий 58 нм.
Для комплексообразования смесь ApoA-I/DPPG и дисперсии SM нагревают по отдельности до 57°С. Подогретую дисперсию SM добавляют к смеси АроА-I/DPPG, имеющей установку исходной температуры 57°С. После перемешивания для объединения этот раствор охлаждают до 37°С, а затем проводят через серию температурных циклов (от 57°С до 37°С) с целью образования комплексов ApoA-I/DPPG/SM. Этот процесс нагревания-охлаждения продолжают при времени контакта между температурами, составляющем от 5 минут до 30 минут. Циклы нагревания-охлаждения повторяют до тех пор, пока большая часть белкового компонента не включается в липопротеиновые комплексы. Мониторинг размера и распределения комплексов в процессе термоциклирования проводят с помощью гельпроникающей хроматографии (ГПХ).
Комплексы ApoA-I/DPPG/SM были получены в соответствии с описанным выше методом (и проиллюстрированы на ФИГ.11). Белок АроА-I имел аминокислотную последовательность, соответствующую положениям 25-267 последовательности, изображенной на ФИГ.1. Комплексы содержат сфингомиелин (SM) и 1,2-дигексадеканоил-sn-глицеро-3-фосфо-(1'-рац-глицерин) (дипальмитоилфосфатидилглицерин или DPPG) в массовом соотношении 97:3. Отношение белка АроА-I к суммарным липидам составляет 1:2,7 масс./масс., что эквивалентно молярному отношению 1:108. Объединенные липидный и белковый компоненты подвергали термоциклированию между 57°С и 37°С в течение 5 минут при каждой температуре, используя теплообменник, устроенный, как изображено на ФИГ.5, который включает слева водяную баню Lauda Ecoline Star edition Type 26LE (в которой образец подвергают термоциклированию) и справа кожухотрубный теплообменник (модель EF-C50-HE), который имеет объем удерживания 18 мл, соединенные перистальтическим насосом.
180 мг DPPG добавляли к 2,82 граммам 10 мМ фосфатного буфера, рН 8,0. Суспензию диспергировали с помощью диспергирующего устройства ULTRA-TURRAX® в течение 10 минут при 50°С. 22 грамма порошка SM объединяли с 78 граммами 10 мМ фосфатного буфера рН 8,0. Суспензию диспергировали с помощью диспергирующего устройства ULTRA-TURRAX® в течение 20-40 минут при 50°С. SM гомогенизировали, используя NanoBEE, установленный на средний размер частиц, составляющий 60 нм. DPPG, SM и белок доводили до 57°С. 18 мг (0,3 мл) DPPG добавляли к 214 мг белка АроА-I в 10 мМ фосфатном буфере рН 7,4 при 57°С. После 30 минут при 57°С добавляли 559 мг частиц SM (2,54 мл). Затем этот раствор подвергали термоциклированию с образованием комплекса.
Гельпроникающая хроматография, показывающая образование комплекса ApoA-I/DPPG/SM после термоциклирования в течение 30 минут, 60 минут, 120 минут, 180 минут и 210 минут, представлена на ФИГ.13А-13Е соответственно. Более компактный комплекс образуется при увеличении времени цикла, на что указывает возрастающая острота основного пика ГПХ. Пик, соответствующий незакомплексованному белку, со временем исчезает.
10.2. Образование комплексов АроА-I/Сфингомиелин
Комплексы ApoA-1/SM были получены в соответствии с описанным выше методом, но без предварительного комплексообразования АроА-I с DPPG. Белковый компонент представлял собой 5 мл АроА-I, имеющего концентрацию 8,9 мг/мл, и липидный компонент представлял собой 0,5 мл сфингомиелина куриного яйца (220 мг/мл), который ресуспендировали в 10 мМ фосфатном буфере рН 8,0 и гомогенизировали с образованием липидных частиц, имеющих размер 60 нм. Белковый и липидный компоненты смешивали при 50°С в соотношении 1:2,5 масс./масс.. Полученную в результате суспензию подвергали термоциклированию в течение 18 часов (108 циклов и времени цикла 10 минут), используя прибор для термоциклирования, как изображено на ФИГ.5. Гельпроникающая хроматография показывает, что образовавшийся комплекс белок/липид является по существу гомогенным (см. хроматограмму ГПХ на ФИГ.14).
10.3. Образование комплексов АроА-I/DPPG/N-пальмитоил-4-гидроксисфинганин-1-фосфохолин (фитосфингомиелин)
Комплексы ApoA-I/DPPG/фитосфингомиелин были получены в соответствии с описанным выше методом. Частицы фитосфингомиелина гомогенизировали до размера, составляющего примерно 183 нм (измеренного с помощью ДСР) и добавляли к 7,8 г/л смеси белок:DPPG до достижения конечного отношения белка к липиду (SM и DPPG), составляющего 1:2,7. Суспензию, содержащую N-пальмитоил-4-гидроксисфинганин-1-фосфохолин (фитосфингомиелин) и компонент белок:DPPG, подвергали термоциклированию в течение шести циклов по 10 минут при 37°С и 10 минут при 57°С, всего в течение двух часов. Гельпроникающая хроматография показывает, что образовавшийся комплекс белок/липид является по существу гомогенным (см. хроматограмму ГПХ на ФИГ.15).
10.4. Образование комплексов ApoA-I/DPPG/синтетический пальмитоилсфингомиелин
Комплексы ApoA-I/DPPG/синтетический пальмитоилсфингомиелин были получены, как описано ниже. 8,8 мл раствора синтетического пальмитоилсфингомиелина (220 мг/мл) в 10 мМ фосфатном буфере рН 7,4 перемешивали до достижения размера частиц, составляющего 3300 нм. АроА-I (945 мг при 14 мг/мл) объединяли с 0,03% DPPG (60 мг/мл) по массе и нагревали при 50°С в течение 30 минут. Мицеллы синтетического пальмитоилсфингомиелина объединяли с комплексом белок/DPPG при массовом отношении аполипопротеин:фосфолипид, составляющем 1:2,1. Затем суспензию белка и липида подвергали термоциклированию при чередующихся циклах охлаждения-нагревания при 37°С и 57°С каждые десять минут в течение всего 240 минут или до достижения соответствующего распределения размера частиц. Мониторинг размера и распределения комплексов в процессе термоциклирования проводили с помощью ГПХ. После комплексообразования концентрацию доводили до 8,0 мг АроА-I/мл, затем к комплексу добавляли сахарозу (40 мг/мл) и маннит (20 мг/мл) для изотоничности. Липопротеиновые комплексы анализировали с помощью ГПХ и обнаружили, что они являются по существу гомогенными (см. хроматограмму ГПХ на ФИГ.16).
10.5. Образование комплексов ApoA-I/DPPG/фитосфингомиелин
Комплексы ApoA-I/DPPG/фитосфингомиелин были получены, как описано ниже. 2,0 мл раствора фитосфингомиелина (220 мг/мл) в 10 мМ фосфатном буфере рН 7,4 диспергировали в ULTRA-TURRAX® в течение 40 минут при 50°С до достижения размера частиц, составляющего 990 нм. АроА-I (15,6 мг при концентрации, составляющей 7,8 мг/мл) объединяли с 0,03% DPPG (60 мг/мл) по массе и нагревали при 50°С в течение 30 минут. Раствор фитосфингомиелина объединяли со смесью белок/DPPG при массовом отношении аполипопротеин:фосфолипид, составляющем 1:2,7. Затем суспензию белка и липида подвергали термоциклированию при чередующихся циклах охлаждения-нагревания при 37°С и 57°С каждые десять минут в течение всего 240 минут или до достижения соответствующего распределения размера частиц. Совокупность липопротеиновых комплексов измеряли с помощью ГПХ и обнаружили, что она является гомогенной примерно на 92,6% (см. хроматограмму ГПХ на ФИГ.17).
10.6. Образование комплексов с пептидом АроА-I
Комплексы пептида АроА-I, DPPG и сфингомиелина были получены, как описано выше (см. Раздел 10.1), с использованием раствора пептида АроА-I (Н-Lys-Leu-Lys-Gln-Lys5-Leu-Ala-Glu-Leu-Leu10-Glu-Asn-Leu-Leu-Glu15-Arg-Phe-Leu-Asp-Leu20-Val-Inp22-OH; SEQ ID NO:4). Фосфолипидный компонент состоит из сфингомиелина (SM) куриного яйца, 1,2-дипальмитоил-sn-глицеро-3-фосфохолина (дипальмитоилфосфатидилхолина, DPPC) и 1,2-дипальмитоил-sn-глицеро-3-[фосфо-рац-(1-глицерин)] (дипальмитоилфосфатидилглицерина, DPPG) в массовом соотношении 48,5:48,5:3. Отношение пептида к суммарным фосфолипидам комплекса составляет 1:2,5 (масс./масс.). Комплекс лекарственного средства представляет собой раствор комплекса CER-522 в фосфатно-солевом буферном растворе (12 мМ фосфат натрия, 130 мМ хлорид натрия, рН 8,2). Комплекс образовали, подвергая исходный раствор термоциклированию между 50°С и 37°С в течение двух часов, скорость тока 1 мл/мин.
Гельпроникающая хроматография показывает, что образовавшийся комплекс белок/липид является по существу гомогенным, причем подавляющее большинство белка включено в липопротеиновые комплексы (см. хроматограмму ГПХ на ФИГ.18).
10.7. Влияние размера липидной частицы и числа температурных циклов на образование комплекса
Исследовали влияние размера липидной частицы и числа температурных циклов на размер частицы. Препараты исходных липидных частиц, имеющих четыре различных размера (средний размер зета 85 нм, 77 нм, 66 нм и 60 нм) (ФИГ.19A-19D соответственно) были получены путем пропускания растворов SM через NanoBEE с одним проходом. Каждый проход анализировали на среднее значение зета. Размер липидной частицы уменьшали с каждым проходом, и собирали липидные частицы, когда был достигнут желаемый размер. Липидные частицы, имеющие четыре различных размера, тестировали в способе образования комплексов, описанном в Разделе 10.1, в течение от пяти до семи циклов по 3 минуты при 37°С и по 10 минут при 57°С.
При смешивании липидного компонента с белковым компонентом полученная в результате суспензия является мутной. Мутность уменьшается, и раствор становится более прозрачным по мере образования комплексов.
После пяти циклов суспензия комплексов, полученных из липидных частиц, имеющих размер 60 нм, была самой прозрачной. Хроматограммы ГПХ (ФИГ.20A-20D) показывают полное или почти полное комплексообразование во всех образцах, о чем свидетельствует гомогенность основного пика. Когда начинали с липидных частиц, имеющих размер 66 нм, в полученной в результате суспензии липопротеиновых комплексов отсутствовал незакомплексованный белок, обнаружимый с помощью ГПХ, что указывает на то, что весь белок был включен в комплексы с липидом после пяти циклов, и чистота полученных в результате комплексов составляла 98%. После семи циклов все четыре суспензии становились более прозрачными, что показывает даже большую степень комплексообразования. Суспензия, полученная из липидных частиц, имеющих размер 60 нм, оказалась самой чистой.
В отдельном исследовании частицы SM размером 450 нм и 40 нм подвергали комплексообразованию с ApoA-I и DPPG, используя способ, описанный в Разделе 10.1. Большая часть, но не весь ApoA-I был включен в липопротеиновые комплексы при использовании в качестве липидного компонента частиц SM размером 450 нм, как показано на хроматограмме ГПХ на ФИГ.21А (пик через 9,8 минут). Значительно меньшая фракция ApoA-I была включена в липопротеиновые комплексы при использовании в качестве липидного компонента частиц SM размером 40 нм, как показано на хроматограмме ГПХ на ФИГ.21В (пик через 9,551 минуту).
10.8. Влияние исходной температуры на образование комплекса
Исследовали влияние исходной температуры термоциклирования на образование комплекса. Комплексы ApoA-I/DPPG/SM были получены, как описано в Разделе 10.1, за исключением того, что липидный компонент и белковый компонент подогревали до 37°С и объединяли при этой же температуре вместо 57°С. Хроматограмма ГПХ полученного в результате комплекса показана на ФИГ.22. Значительно меньше белкового компонента было включено в липопротеиновые комплексы, чем при инициации термоциклирования при 57°С, о чем свидетельствует относительно большой пик белка (элюированный через 9,455 минут на ФИГ.22).
10.9. Промышленное получение липопротеиновых комплексов с использованием способов термоциклирования
Для крупномасштабного промышленного производства способы по изобретению можно масштабировать и возможно объединять со стадией изготовления в виде препарата. Промышленное воплощение изображено на ФИГ.23. В данном воплощении после стадий термоциклирования липопротеиновый комплекс разводят, смешивают с одним или более одним изотоническим агентом (например, с сахарозой и/или маннитом), фильтруют и делят на аликвоты во флаконах. Содержимое флаконов можно лиофилизировать, чтобы продлить срок годности полученного в результате препарата.
Комплексы ApoA-I/DPPG/SM, описанные в Разделе 10.1, были получены в 20-литровом масштабе, используя DaBEE2000. Эти комплексы разводили фосфатным буфером (рН 7-8) и смешивали с сахарозой и маннитом с получением конечного препарата, содержащего 10 мМ фосфатный буфер рН 7,4, 8 мг/мл ApoA-I, 4% (масс./масс.) сахарозы и 2% (масс./масс.) маннита.
10.10. Сравнение липопротеиновых комплексов, полученных с помощью термоциклирования, с совместной гомогенизацией
Комплексы ApoA-I/DPPG/SM, полученные способами термоциклирования, описанными в данном изобретении, сравнивали с комплексами, полученными с помощью совместной гомогенизации липидного и белкового компонентов. Чистота комплексов, полученных с помощью термоциклирования, была улучшена до 97% по сравнению с совместной гомогенизацией при измерении гельпроникающей хроматографией. При использовании электрофореза в ДСН-ПААГ комплекс, полученный термоциклированием, имел повышенную чистоту основной полосы, составляющую 98%, при меньшем количестве присутствующих полос укороченного белка по сравнению с комплексами совместной гомогенизации.
Окисление ApoA-I также уменьшается за счет способа термоциклирования по сравнению с совместной гомогенизацией. ОФ-ВЭЖХ (С18) показывает два пика окисления при RT (времени удерживания) 0,93 и 0,99 в совместно гомогенизированных комплексах, которые отсутствуют при способе термоциклирования. Пептидная карта также показывает уменьшение окисления метионина АроА-I в положениях Met 112 и Met 148 в комплексах, полученных с помощью термоциклирования, по сравнению с комплексами, полученными путем совместной гомогенизации.
Краткое изложение данных приведено в таблице 5 ниже.
10.11. Применение инертного газа в способах получения
АроА-I является чувствительным белком, склонным к химической нестабильности (например, к окислению). Чтобы повысить стабильность АроА-I в фармацевтических композициях, содержащих ApoA-I/SM/DPPC, эти фармацевтические композиции готовили (включая стадии термоциклирования, заполнения и окончательной обработки) в атмосфере инертного газа азота. Ниже приведены результаты исследований, в которых сравнивали комплексы ApoA-I/SM/DPPC, полученные путем совместной гомогенизации, и комплексы ApoA-I/SM/DPPC, полученные путем термоциклирования, в атмосфере азота.
11. ПРИМЕР 5: ИССЛЕДОВАНИЯ ЭФФЛЮКСА ХОЛЕСТЕРИНА IN VITRO
Биологическую активность комплексов ApoA-I-липид исследовали в клетках гепатомы крысы Fu5AH, измеряя АВСА1-опосредованный эффлюкс холестерина.
Клетки гепатомы крысы Fu5AH имели высокую экспрессию фагоцитарного рецептора класса В типа I (SRB1), который стимулирует двунаправленный поток холестерина и зрелых ЛПВП между клетками. Данная модель обеспечивает специфичный анализ активности ЛПВП-опосредованного эффлюкса холестерина. Анализ проводили, используя способ, описанный Mweva et al., 2006, "Comparison of different cellular models measuring in vitro the whole human serum cholesterol efflux capacity," Eur. J. Clin. Invest. 36, 552-559. Клетки Fu5AH метили3H-холестерином на 24 часа. Акцепторную среду для эффлюкса готовили для каждого тестируемого образца (АроА-I/DPPG/пальмитоил SM, ApoA-I/DPPG/SM куриного яйца или АроА-I/DPPG/фитоSM при концентрациях, составляющих 30, 20 и 10 мкг/мл, разведенные средой MEM (модифицированной средой Игла), забуференной 25 мМ ГЭПЭС) и для контрольных образцов (АроА-I, очищенный из плазмы человека (20 мкг/мл), ЛПВПЗ, 2% сыворотка человека, только среда). Акцепторную среду, содержащую тестируемые или контрольные образцы, добавляли к клеткам на 4 часа, и холестерин измеряли в эффлюксной среде и в монослоях клеток, чтобы определить процент холестерина, выделившегося из клеток Fu5AH. Биологическую активность тестируемых образцов вычисляли и выражали в виде процента эффлюкса холестерина относительно сравнительного стандарта Формулы Н, описанной выше, при такой же концентрации, как для липопротеинового комплекса в тестируемом образце, который служил в качестве положительного контроля эксперимента. Результаты приведены ниже в таблице 7, и показывают, что тестируемые липопротеиновые комплексы обладают значительной биологической активностью, измеренной в анализе эффлюкса холестерина.
12. ПРИМЕР 6: ФАРМАКОДИНАМИЧЕСКОЕ ИССЛЕДОВАНИЕ ВВЕДЕНИЯ ОДНОКРАТНОЙ НИЗКОЙ ДОЗЫ КОМПЛЕКСОВ ФОРМУЛЫ В И ФОРМУЛЫ Н КРОЛИКАМ
Нормальные кролики получали однократную инъекцию: (а) дозы 5 мг/кг препарата Формулы В (нейтральные липопротеиновые комплексы, содержащие АроА-I и SM в массовом отношении аполипопротеин: фосфолипид 1:2,7); (b) дозы 5 мг/кг препарата Формулы Н (отрицательно заряженные липопротеиновые комплексы, содержащие АроА-I, SM и DPPG в массовом отношении аполипопротеин: фосфолипид 1:2,7 и в массовом отношении SM:DPPG 97:3); или (с) контрольного препарата, содержащего разбавитель для препаратов липопротеинового комплекса. Четыре кролика были протестированы каждым из препаратов: Формулы В, Формулы Н и контроля.
Уровни суммарного холестерина-ЛПОНП и триглицеридов в плазме по времени представлены на ФИГ.24 и 25. Уровни суммарного холестерина-ЛПОНП в плазме повысились меньше и вернулись к базовому уровню быстрее у животных, обработанных препаратом Формулы Н (комплексы АроА-I/DPPG/SM) (b), чем соответствующие уровни у животных, обработанных препаратом Формулы В (липопротеиновые комплексы АроА-I и SM). Подобный эффект наблюдали для уровней триглицеридов. В данном исследовании показано, что транзиторное повышение этих уровней имело более короткую продолжительность при обработке комплексами ApoA-I/DPPG/SM, чем при обработке нейтральными липопротеиновыми комплексами. Данный результат согласуется с результатом исследования фазы I липопротеиновых комплексов Формулы Н у субъектов-людей (как описано в Примере 8 ниже).
13. ПРИМЕР 7: СРАВНИТЕЛЬНЫЕ ФАРМАКОДИНАМИЧЕСКИЕ ИССЛЕДОВАНИЯ SM КУРИНОГО ЯЙЦА И СИНТЕТИЧЕСКОГО ПАЛЬМИТОИЛ-SM
Исследовали фармакодинамический эффект липопротеиновых комплексов аполипопротеина A-I (ApoA-I)/SM куриного яйца и АроА-I/синтетический пальмитоил-SM, введенных внутривенно кроликам. После инъекции липопротеиновых комплексов измеряли изменения уровней липидов и липопротеинов в плазме.
Липопротеиновые комплексы ApoA-I/SM куриного яйца или АроА-I/синтетический пальмитоил-SM вводили кроликам в дозах, составляющих 5 мг/кг или 20 мг/кг, путем внутривенной инфузии в ушную вену со скоростью, составляющей 1 мл/мин. Исследовали 4 животных на группу. Образцы плазмы брали перед дозированием, сразу после окончания инфузии и через 30 мин, 45 мин, 1 ч, 2 ч, 4 ч, 6 ч, 8 ч, 10 ч и 30 ч после инициации инфузии. Затем образцы плазмы анализировали, используя коммерческие ферментативные наборы, на общий холестерин, неэтерифицированный холестерин, фосфолипиды и общие триглицериды. ApoAI анализировали в образцах плазмы, используя коммерческие наборы для ELISA. Образцы плазмы анализировали ГПХ, чтобы определить кривые общего и неэтерифицированного холестерина. Для обработок дозой 5 мг/кг результаты определяли количественно на основании процента общей площади под кривой хроматограммы.
На ФИГ.26А-26D показаны уровни холестерина, триглицеридов, фосфолипидов и АроА-I в плазме по времени у кроликов, которым инфузировали 5 мг/кг и 20 мг/кг комплексов ApoA-I/SM куриного яйца или АроА-I/синтетический пальмитоил-SM. При обеих введенных дозах наблюдали быструю и значительную мобилизацию холестерина в течение 30 минут после инициации инфузии: мобилизация холестерина достигала пика через 30 минут после введения для дозы 5 мг/кг, и значительное повышение мобилизации холестерина наблюдали при дозе 20 мг/кг. При каждой тестируемой дозе оба препарата имели сходные кривые для триглицеридов плазмы, фосфолипидов плазмы и рекомбинантного АроА-I человека плазмы.
На ФИГ.27А-27С показаны уровни суммарного холестерина-ЛПВП в плазме, уровни суммарного холестерина-ЛПНП в плазме и уровни суммарного холестерина-ЛПОНП в плазме. Повышение суммарного холестерина-ЛПВП для комплексов ApoA-I/SM куриного яйца и АроА-I/синтетический SM было аналогичным (ФИГ.27А). Наблюдали небольшие вариации в уровнях ЛПНП-С и ЛПОНП-С плазмы, и изменение этих уровней в результате инъекции липопротеиновых комплексов любого из препаратов было несущественным (ФИГ.27В-27С).
Результаты этого исследования показывают, что липопротеиновые комплексы ApoA-I/SM куриного яйца и АроА-I/синтетический SM вызывают аналогичные ответы in vivo.
14. ПРИМЕР 8: ИССЛЕДОВАНИЕ ФАЗЫ I КОМПЛЕКСОВ АРОА-I/DPPG/SM У ЗДОРОВЫХ СУБЪЕКТОВ С ДИСЛИПИДЕМИЕЙ
14.1. Материалы и методы
Клиническое испытание фазы I проводили с липопротеиновыми комплексами Формулы Н в виде рандомизированного, двойного слепого, плацебо-контролируемого, перекрестного исследования однократных возрастающих доз у здоровых волонтеров, имеющих соотношение ЛПНП/ЛПВП выше 3,0. задачи данной фазы I исследования состояли в том, чтобы оценить безопасность, переносимость, фармакокинетику и фармакодинамику отрицательно заряженного липопротеинового комплекса при введении в виде однократной дозы. Исследовали возрастающие дозы, составляющие 0,25, 0,75, 2,0, 5,0, 10,0, 15,0, 30,0 и 45,0 мг/кг. Субъекты получали инфузию стерильного раствора, содержащего липопротеиновые комплексы АроА-I (полученного, как описано в Примере 1), SM и DPPG (в массовом отношении белок:липид, составляющем 1:2,7, и при композиции липидов, включающей 97% SM/3% DPPG (масс./масс.)), полученные путем совместной гомогенизации белкового и липидного компонентов. Стерильный раствор представлял собой 10 мМ фосфатный буферный раствор рН 8,0, содержащий маннит и сахарозу (4% (масс./масс.) сахарозы, 2% (масс./масс.) маннита) в дополнение к липопротеиновым комплексам.
14.2. Результаты
Ниже суммированы клинические картины данного исследования фазы I.
Общий холестерин: Средние концентрации общего холестерина в плазме в каждый момент времени представлены в таблице 8 ниже:
ЛПОНП, ЛПНП и ЛПВП в общем холестерине: Средние значения для ЛПОНП, ЛПНП и ЛПВП в общем холестерине на момент времени и дозу суммированы в таблицах 9-11 ниже:
Неэтерифицированный (свободный) холестерин: Средние концентрации свободного (неэтерифицированного) холестерина в плазме в каждый момент времени представлены в таблице 12 ниже:
ЛПОНП, ЛПНП и ЛПВП в свободном холестерине: Средние значения для ЛПОНП, ЛПНП и ЛПВП в свободном холестерине суммированы по моменту времени и дозе в таблицах 13-15 ниже:
Триглицериды: Средние концентрации триглицеридов в плазме в каждый момент времени представлены в таблице 16 ниже:
АроА-I: Изменение базового уровня АроА-I субъектов в мг/дл по времени представлено в таблице 17 ниже. Максимальные изменения АроА-I в плазме выделены полужирным шрифтом для каждой дозы.
Трансаминаза: Средние значения для аланинаминотрансферазы печени, или трансаминазы, уровни которой коррелируют с токсичностью, представлены в таблице 18 ниже. Нормальный диапазон для аланинаминотрансферазы составляет от 9 до 60 МЕ/л.
Побочные эффекты: Всего 7 (22%) субъектов имели побочные эффекты. Ни один из субъектов не имел побочных эффектов, которые исследователи рассматривали как по меньшей мере возможно связанные с исследуемым лекарственным средством. По-видимому, не существует каких-либо дозозависимых тенденций в появлении побочных эффектов. Ни у одного из субъектов не было серьезных побочных эффектов, и ни один из субъектов не был извлечен из исследования в связи с побочными эффектами. В таблице 19 ниже приведено суммирование побочных эффектов по системам организма:
14.3. Выводы
По результатам данного исследования фазы I, в котором вводили препарат в виде стерильного раствора, содержащий отрицательно заряженный липопротеиновый комплекс Формулы Н в однократных IV дозах, составляющих 0,25, 0,75, 2,0, 5,0, 10,0, 15,0, 30,0 и 45,0 мг/кг, сделаны следующие выводы.
Препарат хорошо переносился при всех дозах всеми субъектами, причем профиль побочных эффектов был подобен наблюдаемому при плацебо. Оказалось, что комплекс не оказывает влияния на клинические параметры химии, гематологии или свертывания крови, отличающегося от плацебо. Побочные эффекты в отношении ЭКГ не наблюдали. Антитела к АроА-I не были обнаружены после введения однократной дозы.
Концентрации АроА-I и сфингомиелина повышались при дозировании: уровни АроА-I возвращались к базовому уровню через 24 часа после дозирования для доз, составляющих вплоть до 10 мг/кг, и через 72 часа после дозирования для доз, превышающих 10 мг/кг. Уровни сфингомиелина возвращались к базовому уровню через 24 часа после дозирования для доз, составляющих вплоть до 5 мг/кг, через 72 часа после дозирования для доз, составляющих от 10 до 30 мг/кг, и через 7 суток после дозирования для субъектов, получавших дозу 45 мг/кг.
Мобилизация холестерина возрастала с повышением доз: мобилизацию свободного холестерина во фракции ЛПВП наблюдали при столь низких дозах, как 2,0 мг/кг (среднее повышение на 23% выше базового уровня), и она возрастала при повышении дозы. Уровни триглицеридов транзиторно повышались выше уровней, наблюдаемых при плацебо, при дозах, составляющих 15 мг/кг и выше.
Кроме того, введение комплекса не повышало значительно уровни трансаминазы, и во всех случаях эти уровни оставались внутри нормального диапазона. Эти данные противоречат данным для CSL-111, представляющего собой рекомбинантный очищенный АроА-I из плазмы человека в комплексе с фосфатидилхолином сои, для которого у некоторых пациентов наблюдали повышение уровней аланинаминотрансферазы вплоть до более в 100 раз выше нормального предела при введении в дозе, составляющей 80 мг/кг массы тела пациента. Tardif et al., 2007, JAMA 297:1675-1682.
Следовательно, комплексы по изобретению можно вводить в более низких дозах, чем дозы, описанные для других препаратов, имитирующих ЛПВП, и, тем не менее, достигать клинически значимых улучшений параметров липидов при отсутствии побочных эффектов.
15. ПРИМЕР 9: КЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ ФАЗЫ II КОМПЛЕКСОВ APOA-I/SM/DPPG ПРИ ЛЕЧЕНИИ СУБЪЕКТОВ, СТРАДАЮЩИХ ОСТРЫМ КОРОНАРНЫМ СИНДРОМОМ
Чтобы дополнительно подтвердить терапевтическую пользу низких доз отрицательно заряженных липопротеиновых комплексов Формулы Н (АроА-I, сфингомиелин куриного яйца (SM куриного яйца) и DPPG в массовом отношении аполипопротеин:фосфолипид, составляющем 1:2,7, и при массовом отношении SM куриного яйца к DPPG, составляющем 97:3) при лечении сердечно-сосудистых заболеваний, проводят клиническое испытание. АроА-I получают путем экспрессии в клетках СНО, как описано выше в Примере 1, и комплексы образуют способами термоциклирования Примера 4.
Субъекты, у которых представлены симптомы ОКС, соответствуют установленным критериям скрининга для данного исследования. В момент базового зондирования субъектам необходимо иметь адекватную оценку внутрисосудистого ультразвукового исследования (IVUS) одной "целевой" артерии для IVUS, которая не подвергнута воздействию предшествующего или настоящего чрескожного коронарного вмешательства (PCI), и проксимальные 4 см этой целевой артерии должны иметь диаметр стеноза, составляющий от 0 до 50% на основании визуальной ангиографической оценки, эталонный диаметр более 2,5 мм, и не иметь закупоривающих дефектов, позволяющих предположить тромб. Как только центральной лабораторией IVUS проведена базовая оценка IVUS на общее качество, наличие подходящего сосуда-мишени и отсутствие технических факторов, которые могут препятствовать точному считыванию изображений IVUS, субъекта рандомизируют для получения внутривенной инфузии, проводимой в течение одного часа, плацебо или одной из трех доз комплексов (3, 6 или 12 мг/кг). Рандомизированные субъекты возвращаются через недельные интервалы (то есть каждые 7-11 суток) для проведения пяти дополнительных инфузии. Данные лабораторных исследований по окончании лечения берут через неделю (от 5 до 9 суток) после последней инфузии. Обследование с помощью IVUS проводят приблизительно через 3 недели (от 14 до 35 суток) после последней инфузии. Контрольное посещение проводят приблизительно через 6 месяцев (+/- 2 недели) после последней инфузии для сбора образцов на тестирование антител против ApoAI и для мониторинга ожидаемых результатов в отношении серьезного неблагоприятного кардиального события (MACE; major adverse cardiac event).
Основным ожидаемым результатом является номинальное изменение общего объема бляшки в 30 мм сегменте целевой коронарной артерии, оцениваемое с помощью трехмерного IVUS. Другие меры эффективности включают процент изменения объема бляшки и процент изменения объема атеромы в целевом 30 мм сегменте, изменение общего объема кровеносного сосуда в целевом 30 мм сегменте, а также изменения в объемах бляшек, просвета и общего объема кровеносного сосуда от базового уровня до контрольного посещения в анатомически сравнимых 5 мм сегментах, сфокусированных на сайтах с наименьшим объемом бляшки на базовом уровне и с наибольшим объемом бляшки на базовом уровне на трехмерном IVUS. Процент изменения объема бляшки вычисляют как номинальное изменение, деленное на базовое значение, умноженное на 100. Процент объема (обструктивной) атеромы вычисляют путем деления объема бляшки на объем эластичной наружной мембраны (ЕЕМ), а затем умножения на 100.
16. КОНКРЕТНЫЕ ВОПЛОЩЕНИЯ, ЦИТИРОВАНИЕ ССЫЛОК
Различные аспекты настоящего изобретения описаны в воплощениях, изложенных ниже в следующих пронумерованных параграфах.
1. Липопротеиновый комплекс, включающий аполипопротеиновую фракцию и липидную фракцию, где липидная фракция состоит по существу из 95-99% масс./масс. нейтрального фосфолипида и 1-5% масс./масс. отрицательно заряженного фосфолипида, причем отношение фракции аполипопротеина к фракции фосфолипида находится в диапазоне от примерно 1:2,7 до примерно 1:3 по массе.
2. Липопротеиновый комплекс согласно воплощению 1, в котором аполипопротеин выбран из препроаполипопротеина, препроАроА-I, про-АроА-I, АроА-I, препроАроА-II, про-АроА-II, АроА-II, препроApoA-IV, про-ApoA-IV, АроА-IV, ApoA-V, препроАроЕ, про-АроЕ, АроЕ, препроАроА IMilano, про-АроА-IMilano, ApoA-IMilano, препроАроА-IParis, про-ApoA-IParis и ApoA-IParis, а также их смесей.
3. Липопротеиновый комплекс согласно воплощению 2, в котором аполипопротеин по существу состоит из АроА-I, имеющего по меньшей мере 90% или по меньшей мере 95% идентичность последовательности белка, соответствующего аминокислотам 25-267 SEQ ID NO:1.
4. Липопротеиновый комплекс согласно воплощению 3, в котором аполипопротеин включает мономер, димер и/или тетрамер.
5. Липопротеиновый комплекс согласно любому из воплощений 1-4, в котором аполипопротеин включает пептидомиметик АроА-I.
6. Липопротеиновый комплекс согласно любому из воплощений 1-5, в котором отношение аполипопротеиновой фракции к фосфолипидной фракции составляет 1:2,7 по массе.
7. Липопротеиновый комплекс согласно любому из воплощений 1-6, в котором молярное отношение липид:аполипопротеин находится в диапазоне от примерно 1:105 до примерно 110, где количество аполипопротеина выражено в эквивалентах АроА-I.
8. Липопротеиновый комплекс согласно воплощению 7, в котором молярное отношение липид:аполипопротеин составляет 1:108.
9. Липопротеиновый комплекс согласно любому из воплощений 1-8, в котором нейтральный липид представляет собой природный сфингомиелин или синтетический сфингомиелин.
10. Липопротеиновый комплекс согласно воплощению 9, в котором сфингомиелин представляет собой сфингомиелин куриного яйца.
11. Липопротеиновый комплекс согласно воплощению 9, полученный из сфингомиелина, чистота которого составляет по меньшей мере 95%.
12. Липопротеиновый комплекс согласно любому из воплощений 1-11, где указанная липидная фракция состоит по существу из 96-98% масс./масс. нейтрального фосфолипида и 2-4% масс./масс. отрицательно заряженного фосфолипида.
13. Липопротеиновый комплекс согласно воплощению 12, в котором липидная фракция состоит по существу из 97% масс./масс. нейтрального фосфолипида и 3% масс./масс. отрицательно заряженного фосфолипида.
14. Липопротеиновый комплекс согласно воплощению 13, в котором отрицательно заряженный фосфолипид включает фосфатидилглицерин.
15. Липопротеиновый комплекс согласно воплощению 14, в котором отрицательно заряженный фосфолипид включает соль 1,2-дипальмитоил-sn-глицеро-3-[фосфо-рац-(1-глицерин)] (DPPG) или состоит из нее.
16. Липопротеиновый комплекс согласно воплощению 15, в котором соль представляет собой соль натрия или калия.
17. Липопротеиновый комплекс согласно любому из воплощений 1-16, в котором каждая из ацильных цепей нейтральных и/или отрицательно заряженных фосфолипидов независимо друг от друга выбрана из насыщенного или мононенасыщенного углеводорода, содержащего 12-26, 14-26 или 16-26 атомов углерода.
18. Липопротеиновый комплекс согласно воплощению 17, в котором все ацильные цепи нейтрального и/или отрицательно заряженного фосфолипида являются одинаковыми.
19. Липопротеиновый комплекс согласно воплощению 17, в котором все ацильные цепи нейтрального и/или отрицательно заряженного фосфолипида являются разными.
20. Липопротеиновый комплекс согласно воплощению 17, в котором ацильные цепи нейтрального и/или отрицательно заряженного фосфолипида содержат одинаковое число атомов углерода.
21. Липопротеиновый комплекс согласно воплощению 17, в котором ацильные цепи нейтрального и/или отрицательно заряженного фосфолипида имеют разные степени насыщенности.
22. Липопротеиновый комплекс согласно воплощению 17, в котором ацильные цепи нейтрального и/или отрицательно заряженного фосфолипида содержат 16 атомов углерода.
23. Совокупность липопротеиновых комплексов согласно любому из воплощений 1-22.
24. Совокупность липопротеиновых комплексов, каждый из которых включает липидную фракцию и аполипопротеиновую фракцию, состоящую по существу из аполипопротеина A-I ("ApoA-I"), причем совокупность отличается одной, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью или всеми десятью из следующих характеристик:
(a) по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% по массе ApoA-I в указанной совокупности находится в зрелой форме;
(b) не более 20%, не более 15%, не более 10% или не более 5% по массе ApoA-I в указанной совокупности находится в незрелой форме;
(c) совокупность содержит не более 100 пикограммов, не более 50 пикограммов, не более 25 пикограммов, не более 10 пикограммов или не более 5 пикограммов ДНК клетки-хозяина на миллиграмм ApoA-I;
(d) совокупность содержит не более 500 нанограммов, не более 200 нанограммов, не более 100 нанограммов, не более 50 нанограммов или не более 20 нанограммов белка клетки-хозяина на миллиграмм ApoA-I;
(e) не более 20%, не более 15%, не более 10% или не более 5% по массе ApoA-I в совокупности находится в укороченной форме;
(f) не более 20%, не более 15%, не более 10%, не более 5%, не более 3%, не более 2% или не более 1% каждого из метионина 112 и метионина 148 в ApoA-I в данной совокупности окислено;
(g) по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 90% липопротеиновых комплексов находится в форме частиц, имеющих размер от 4 нм до 15 нм или от 6 нм до 15 нм, как измерено гельпроникающей хроматографией ("ГПХ") или динамическим светорассеянием ("ДСР");
(h) совокупность содержит не более 1 EU (эндотоксиновая единица), не более 0,5 EU, не более 0,3 EU или не более 0,1 EU эндотоксина на миллиграмм ApoA-I; и
(i) не более 10%, не более 5%, не более 4%, не более 3%, не более 2% или не более 1% аминокислот в ApoA-I в указанной совокупности деамидировано.
25. Совокупность согласно воплощению 24, в которой не более 15% или не более 10%, не более 5% или не более 2% масс./масс. липида в липидной фракции указанных комплексов составляет холестерин.
26. Совокупность согласно воплощению 25, которая не содержит холестерин.
27. Совокупность согласно любому из воплощений 24-26, в которой по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% белка составляет зрелый белок АроА-I.
28. Совокупность согласно воплощению 27, в которой менее 15%, менее 10% или менее 10% белка составляют окисленные, деамидированные и/или укороченные молекулы.
29. Совокупность согласно любому из воплощений 24-28, в которой липопротеиновые комплексы являются по меньшей мере на 90%, по меньшей мере на 92,5%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97% или по меньшей мере на 98% чистыми.
30. Совокупность согласно любому из воплощений 24-29, в которой липопротеиновые комплексы являются по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% гомогенными, что отражает единственный пик при гельпроникающей хроматографии.
31. Совокупность согласно воплощению 30, в которой по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% липопротеиновых комплексов имеет размер, находящийся в диапазоне от 4 нм до 12 нм, от 6 нм до 12 нм или от 8 нм до 12 нм, измеренный с помощью ГПХ или ДСР.
32. Совокупность согласно любому из воплощений 24-31, в которой по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% белка находится в комплексах.
33. Совокупность согласно любому из воплощений 24-32, не содержащая холат.
34. Совокупность согласно любому из воплощений 24-33, не содержащая какой-либо детергент.
35. Совокупность согласно любому из воплощений 24-34, содержащая менее 200 млн-1, менее 100 млн-1 или менее 50 млн-1 неводного растворителя.
36. Совокупность согласно любому из воплощений 24-35, в которой АроА-I представляет собой белок АроА-I человека.
37. Совокупность согласно любому из воплощений 24-36, в которой АроА-I представляет собой рекомбинантный АроА-I.
38. Совокупность согласно любому из воплощений 24-37, в которой АроА-I имеет аминокислотную последовательность, обладающую по меньшей мере 90% или по меньшей мере 95% идентичностью последовательности белка, соответствующего аминокислотам 25-267 SEQ ID NO:1.
39. Совокупность согласно любому из воплощений 24-38, в которой липидная фракция состоит по существу из 95-99% масс./масс. нейтрального фосфолипида и 1-5% масс./масс. отрицательно заряженного фосфолипида.
40. Совокупность согласно воплощению 39, в которой липидная фракция состоит по существу из 96-98% масс./масс. нейтрального фосфолипида и 2-4% масс./масс. отрицательно заряженного фосфолипида.
41. Совокупность согласно любому из воплощений 24-40, в которой липидная фракция состоит по существу из 97% масс./масс. нейтрального фосфолипида и 3% масс./масс. отрицательно заряженного фосфолипида.
42. Совокупность согласно воплощению 41, в которой нейтральный липид представляет собой природный сфингомиелин или синтетический сфингомиелин, причем этот липид возможно имеет пероксидное число, составляющее менее 5 мэкв О/кг, менее 4 мэкв О/кг, менее 3 мэкв О/кг или менее 2 мэкв О/кг.
43. Совокупность согласно воплощению 42, в которой сфингомиелин представляет собой сфингомиелин куриного яйца.
44. Совокупность согласно воплощению 42, полученная из сфингомиелина, чистота которого составляет по меньшей мере 95%.
45. Совокупность согласно любому из воплощений 41-44, в которой отрицательно заряженный фосфолипид включает фосфатидилглицерин.
46. Совокупность согласно воплощению 45, в которой отрицательно заряженный фосфолипид включает соль 1,2-дипальмитоил-sn-глицеро-3-[фосфо-рац-(1-глицерин)] (DPPG) или состоит из нее.
47. Совокупность согласно воплощению 46, в которой соль представляет собой соль натрия или калия.
48. Совокупность согласно любому из воплощений 24-47, в которой каждая из ацильных цепей нейтральных и/или отрицательно заряженных фосфолипидов независимо друг от друга выбрана из насыщенного или мононенасыщенного углеводорода, содержащего 12-26, 14-26 или 16-26 атомов углерода.
49. Совокупность согласно воплощению 48, в которой все ацильные цепи нейтрального и/или отрицательно заряженного фосфолипида являются одинаковыми.
50. Совокупность согласно воплощению 48, в которой все ацильные цепи нейтрального и/или отрицательно заряженного фосфолипида являются разными.
51. Совокупность согласно воплощению 48, в которой ацильные цепи нейтрального и/или отрицательно заряженного фосфолипида содержат одинаковое число атомов углерода.
52. Совокупность согласно воплощению 48, в которой ацильные цепи нейтрального и/или отрицательно заряженного фосфолипида имеют разные степени ненасыщенности.
53. Совокупность согласно воплощению 48, в которой ацильные цепи нейтрального и/или отрицательно заряженного фосфолипида содержат 16 атомов углерода.
54. Совокупность согласно любому из воплощений 24-41, имеющая молярное отношение фракция аполипопротеина:липидная фракция, находящееся в диапазоне от 1:80 до 1:120, от 1:85 до 1:110 или от 1:100 до 1:115, где количество аполипопротеина выражено в эквивалентах АроА-I.
55. Совокупность согласно воплощению 54, имеющая молярное отношение фракция аполипопротеина:липидная фракция, находящееся в диапазоне от 1:80 до 1:90, от 1:90 до 1:100, от 1:100 до 1:110 или от 1:105 до 1:110, где количество аполипопротеина выражено в эквивалентах АроА-I.
56. Совокупность согласно любому из воплощений 24-55, имеющая отношение фракции аполипопротеина к фракции фосфолипида, находящееся в диапазоне от 1:2 до примерно 1:3 по массе.
57. Совокупность согласно любому из воплощений 24-40, в которой отношение фракции аполипопротеина к фракции фосфолипида находится в диапазоне от 1:2,1 до 1:2,7 по массе.
58. Совокупность согласно воплощению 57, в которой отношение фракции аполипопротеина к фракции фосфолипида составляет 1:2,7 по массе.
59. Фармацевтическая композиция, содержащая липопротеиновый комплекс согласно любому из воплощений 1-22, или совокупность липопротеиновых комплексов согласно любому из воплощений 23-58, или по существу состоящая из них и один или более один фармацевтически приемлемый носитель, разбавитель и/или эксципиент.
60. Клетка-хозяин млекопитающего, сконструированная генно-инженерным путем для экспрессии белка АроА-I, где белок АроА-I включает аминокислотную последовательность, обладающую по меньшей мере 95% идентичностью положениям 25-267 SEQ ID NO:1.
61. Клетка-хозяин млекопитающего согласно воплощению 60, где белок секретируется в среду при культивировании этой клетки-хозяина.
62. Клетка-хозяин млекопитающего согласно воплощению 60 или согласно воплощению 61, где белок дополнительно включает сигнальную последовательность MKAAVLTLAVLFLTGSQA.
63. Клетка-хозяин млекопитающего согласно любому из воплощений 60-62, где белок дополнительно включает пропептидную последовательность RHFWQQ.
64. Клетка-хозяин млекопитающего согласно любому из воплощений 60-63, представляющая собой клетку яичника китайского хомячка (СНО), CHO-S, СНО-K1, VERO, BHK, BHK 570, HeLa, COS-1, COS-7, MDCK, 293, 3Т3, клетку миеломы, РС12 и W138.
65. Клетка-хозяин млекопитающего согласно воплощению 64, представляющая собой клетку СНО.
66. Клетка-хозяин млекопитающего согласно воплощению 65, представляющая собой клетку CHO-S или клетку СНО-K1.
67. Клетка-хозяин млекопитающего согласно любому из воплощений 60-66, способная к продуцированию по меньшей мере 0,5, 1, 2, 3 или 4 г/л белка АроА-I в культуре.
68. Клетка-хозяин млекопитающего согласно воплощению 67, способная к продуцированию вплоть до 4, 5, 6, 7, 8, 9, 10, 12, 15 или 20 г/л белка ApoA-I в культуре.
69. Клетка-хозяин млекопитающего согласно воплощению 67 или согласно воплощению 68, где культура представляет собой крупномасштабную культуру.
70. Клетка-хозяин млекопитающего согласно воплощению 69, где крупномасштабная культура имеет объем по меньшей мере 15 литров, по меньшей мере 20 литров, по меньшей мере 25 литров или по меньшей мере 30 литров.
71. Клетка-хозяин млекопитающего согласно воплощению 70, где крупномасштабная культура имеет объем примерно 50 литров, примерно 100 литров, примерно 200 литров или примерно 300 литров.
72. Клетка-хозяин млекопитающего согласно любому из воплощений 60-71, содержащая по меньшей мере примерно 5 копий нуклеотидной последовательности, кодирующей белок ApoA-I.
73. Клетка-хозяин млекопитающего согласно воплощению 72, в которой каждая нуклеотидная последовательность функционально связана с промотором.
74. Клетка-хозяин млекопитающего согласно воплощению 73, где промотор представляет собой промотор цитомегаловируса.
75. Клетка-хозяин млекопитающего согласно воплощению 74, где промотор представляет собой немедленно-ранний промотор цитомегаловируса обезьян.
76. Клетка-хозяин млекопитающего согласно любому из воплощений 60-75, которая секретирует зрелый белок ApoA-I, включающий аминокислотную последовательность, соответствующую аминокислотам 25-267 SEQ ID NO:1, или состоящий из этой последовательности.
77. Культура клеток млекопитающего, включающая множество клеток-хозяев млекопитающего согласно любому из воплощений 60-76.
78. Культура клеток млекопитающего согласно воплощению 77, содержащая по меньшей мере примерно 0,5 г/л зрелого белка ApoA-I, включающего аминокислотную последовательность, соответствующую аминокислотам 25-267 SEQ ID NO:1, или состоящего из этой последовательности.
79. Культура клеток млекопитающего согласно воплощению 78, в которой по меньшей мере 80%, по меньшей мере 85% или по меньшей мере 90% зрелого белка АроА-I не включает сигнальную последовательность.
80. Культура клеток млекопитающего согласно воплощению 78, в которой по меньшей мере 80%, по меньшей мере 85% или по меньшей мере 90% зрелого белка АроА-I не включает сигнальную последовательность и пропептидную последовательность.
81. Культура клеток млекопитающего согласно любому из воплощений 78-80, в которой по меньшей мере 80%, по меньшей мере 85% или по меньшей мере 90% зрелого белка АроА-I не является укороченным, окисленным или деамидированным.
82. Способ получения зрелого, биологически активного белка АроА-I, включающий культивирование клетки-хозяина млекопитающего согласно любому из воплощений 60-76 в условиях, при которых экспрессируется и секретируется белок АроА-I.
83. Способ согласно воплощению 82, дополнительно включающий выделение из супернатанта культивируемой клетки-хозяина млекопитающего зрелого биологически активного белка АроА-I.
84. Способ согласно воплощению 82 или воплощению 83, дополнительно включающий очистку белка АроА-I.
85. Фармацевтическая композиция, содержащая терапевтически эффективное количество белка АроА-I, который получен или может быть получен способом согласно воплощению 84.
86. Фармацевтическая композиция согласно воплощению 85, в которой белок АроА-I находится в комплексе с липидом.
87. Способ минимизации продуктов окисления в фармацевтической композиции АроА-I, включающий получение фармацевтической композиции в атмосфере инертного газа.
88. Способ согласно воплощению 87, при котором инертный газ представляет собой азот, гелий или аргон.
89. Способ согласно воплощению 87 или согласно воплощению 88, при котором фармацевтическая композиция представляет собой фармацевтическую композицию липопротеинового комплекса, включающего АроА-I.
90. Способ получения липопротеиновых комплексов, включающий следующие стадии:
(a) охлаждение исходной суспензии, содержащей липидный компонент и белковый компонент, от температуры, находящейся в первом температурном диапазоне, до температуры, находящейся во втором температурном диапазоне,
где липидный компонент состоит по существу из частиц липидов, а белковый компонент состоит по существу из липидсвязывающих пептидов и/или липидсвязывающих белков;
(b) нагревание охлажденной суспензии со стадии (а) от температуры, находящейся во втором температурном диапазоне, до температуры, находящейся в первом температурном диапазоне;
(c) охлаждение нагретой суспензии стадии со (b) от температуры, находящейся в первом температурном диапазоне, до температуры, находящейся во втором температурном диапазоне; и
(d) повторение стадий (b) и (c) по меньшей мере один раз, с получением в результате липопротеиновых комплексов.
91. Способ согласно воплощению 90, при котором стадия (с) включает повторение стадий (а) и (b) до тех пор, пока по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% липидного компонента и/или белкового компонента не будет находиться в форме комплекса.
92. Способ согласно воплощению 90 или согласно воплощению 91, при котором стадия (с) включает повторение стадий (а) и (b) до получения липопротеиновых комплексов, обладающих по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% гомогенностью.
93. Способ согласно любому из воплощений 90-92, при котором стадия (d) включает повторение стадий (b) и (с) по меньшей мере три, по меньшей мере четыре или по меньшей мере пять раз.
94. Способ согласно любому из воплощений 90-93, при котором стадия (d) включает повторение стадий (b) и (с) вплоть до шести, вплоть до восьми или вплоть до десяти раз.
95. Способ согласно любому из воплощений 90-94, при котором после стадии (а) суспензию поддерживают во втором температурном диапазоне в течение по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4 или по меньшей мере 5 минут перед указанной стадией нагревания (b).
96. Способ согласно любому из воплощений 90-95, при котором после стадии (а) суспензию поддерживают во втором температурном диапазоне в течение вплоть до 6, вплоть до 8, вплоть до 10, вплоть до 20 минут, вплоть до 30 минут или вплоть до 1 часа перед указанной стадией нагревания (b).
97. Способ согласно любому из воплощений 90-96, при котором после стадии (b) суспензию поддерживают в первом температурном диапазоне в течение по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4 или по меньшей мере 5 минут перед указанной стадией охлаждения (с).
98. Способ согласно любому из воплощений 90-97, при котором после стадии (b) суспензию поддерживают в первом температурном диапазоне в течение вплоть до 6, вплоть до 8, вплоть до 10, вплоть до 20 минут, вплоть до 30 минут или вплоть до 1 часа перед указанной стадией охлаждения (с).
99. Способ согласно любому из воплощений 90-98, при котором полученные в результате липопротеиновые комплексы не подвергают центрифугированию.
100. Способ согласно любому из воплощений 90-99, при котором липидный компонент и белковый компонент составляют большую часть липидов и белков или пептидов соответственно в указанной исходной суспензии со стадии (а).
101. Способ согласно любому из воплощений 90-100, при котором липидный компонент составляет по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90% липидов в указанной исходной суспензии со стадии (а).
102. Способ согласно любому из воплощений 90-101, при котором белковый компонент составляет по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90% белков и пептидов в указанной исходной суспензии со стадии (а).
103. Способ согласно любому из воплощений 90-102, при котором вплоть до 5%, вплоть до 10%, вплоть до 15% или вплоть до 20% липидов в суспензии предварительно образуют комплекс с белковым компонентом в исходной суспензии со стадии (а).
104. Способ согласно любому из воплощений 90-103, при котором первый температурный диапазон составляют температуры, не менее на 10 градусов ниже и не более 15, не более 10 или не более 5 градусов выше температуры фазового перехода белкового компонента.
105. Способ согласно любому из воплощений 90-104, при котором второй температурный диапазон составляют температуры, не менее на 5 или не менее на 10 градусов ниже и не более 5 градусов выше температуры фазового перехода липидного компонента.
106. Способ согласно любому из воплощений 90-105, при котором первый температурный диапазон включает интервалы, составляющие не более 1°С, 2°С, 3°С, 4°С, 5°С, 7°С или 10°С.
107. Способ согласно любому из воплощений 90-106, при котором второй температурный диапазон включает интервалы, составляющие не более 1°С, 2°С, 3°С, 4°С, 5°С, 7°С или 10°С.
108. Способ согласно любому из воплощений 90-107, дополнительно включающий стадию образования указанной исходной суспензии.
109. Способ согласно воплощению 108, при котором образование указанной исходной суспензии включает стадию объединения суспензии липидных частиц и раствора указанных липидсвязывающих пептидов и/или липидсвязывающих белков, причем и то, и другое предварительно нагревают до температуры, находящейся в первом температурном диапазоне.
110. Способ согласно воплощению 108, при котором образование указанной суспензии включает стадию смешивания совокупности липидных частиц и указанных липидсвязывающих пептидов и/или липидсвязывающих белков, предварительно связанных в комплекс с липидом, где каждый компонент предварительно нагревают при температуре, находящейся в первом диапазоне.
111. Способ согласно воплощению 110, при котором липид, предварительно связанный в комплекс с липидсвязывающими пептидами и/или липидсвязывающими белками, составляет не более 5%, не более 10%, не более 15% или не более 20% суммарного липида в исходной суспензии.
112. Способ согласно любому из воплощений 109-111, при котором раствор липидов представляет собой раствор гомогенизированных липидов.
113. Способ согласно воплощению 112, дополнительно включающий стадию образования раствора гомогенизированных липидов с использованием гомогенизации высокого давления перед указанной стадией объединения.
114. Способ согласно воплощению 113, при котором гомогенизацию высокого давления выполняют при давлении, составляющем более 1500 бар (150×103 кПа), более 1800 бар (180×103 кПа) или более 2000 бар (200×103 кПа).
115. Способ согласно воплощению 114, при котором гомогенизацию высокого давления выполняют при давлении, составляющем от 1900 до 2500 бар (от 190 до 250×103 кПа).
116. Способ согласно любому из воплощений 90-115, при котором липидный компонент состоит по существу из липидных частиц, где указанные липидные частицы имеют размер, составляющий:
(1) по меньшей мере 45 нм, по меньшей мере 50 нм, по меньшей мере 55 нм или по меньшей мере 60 нм, как измерено ДСР; и
(2) вплоть до 65 нм, вплоть до 70 нм, вплоть до 75 нм, вплоть до 80 нм, вплоть до 100 нм, вплоть до 120 нм, вплоть до 150 нм, вплоть до 200 нм, вплоть до 250 нм, вплоть до 300 нм, вплоть до 500 нм, как измерено ДСР.
117. Способ согласно воплощению 116, при котором липидные частицы имеют размер, составляющий вплоть до 65 нм, 70 нм, вплоть до 75 нм или вплоть до 80 нм, как измерено ДСР.
118. Способ согласно воплощению 116, при котором указанные липидные частицы имеют размер, составляющий вплоть до 100 нм, вплоть до 120 нм, вплоть до 150 нм, вплоть до 200 нм, вплоть до 250 нм, вплоть до 300 нм, вплоть до 500 нм, как измерено ДСР.
119. Способ согласно любому из воплощений 90-116, при котором стадии (b) и (с) повторяют до получения липопротеиновых комплексов, имеющих размер, составляющий от 4 нм до 15 нм, от 5 нм до 15 нм, от 6 нм до 15 нм или от 8 нмдо 15 нм.
120. Способ согласно любому из воплощений 90-116, при котором стадии (b) и (с) повторяют до получения липопротеиновых комплексов, имеющих размер от 5 нм до 12 нм, от 6 нм до 12 нм или от 8 нм до 12 нм.
121. Способ согласно любому из воплощений 90-120, при котором одну, более чем одну или все стадии проводят в атмосфере инертного газа.
122. Способ согласно воплощению 121, при котором инертный газ представляет собой азот.
123. Способ согласно любому из воплощений 90-122, при котором указанный белковый компонент включает липидсвязывающие белки или состоит из них.
124. Способ согласно воплощению 123, при котором указанные липидсвязывающие белки представляют собой ApoA-I, ApoA-II, ApoA-IV, ApoC-I, ApoC-II, ApoC-III, ApoE или их смеси.
125. Способ согласно любому из воплощений 90-122, при котором указанный белковый компонент включает липидсвязывающие пептиды или состоит из них.
126. Способ согласно воплощению 125, при котором указанные липидсвязывающие пептиды представляют собой аналоги ApoA-I, ApoA-II, ApoA-IV, ApoC-I, ApoC-II, ApoC-III, ApoE или их смеси.
127. Способ согласно любому из воплощений 90-126, при котором указанный липидный компонент включает природные липиды, синтетические липиды или их смесь, или состоит из них.
128. Способ согласно воплощению 127, при котором указанный липидный компонент включает эфиры фосфолипидов, короткоцепочечные фосфолипиды, холестерин, производные холестерина, фосфатидилхолины, фосфатидилэтаноламины, фосфатидилсерины, фосфатидилинозиты, сфинголипиды, фосфатидилглицерины, ганглиозиды и/или цереброзиды, или состоит из них.
129. Способ согласно воплощению 128, при котором липидный компонент включает фосфатидилхолин куриного яйца, фосфатидилхолин сои, дипальмитоилфосфатидилхолин, димиристоилфосфатидилхолин, дистеароилфосфатидилхолин, 1-миристоил-2-пальмитоилфосфатидилхолин, 1-пальмитоил-2-миристоилфосфатидилхолин, 1-пальмитоил-2-стеароилфосфатидилхолин, 1-стеароил-2-пальмитоилфосфатидилхолин, диолеоилфосфатидилхолин, диолеофосфатидилэтаноламин, дилауроилфосфатидилглицерин, дифосфатидилглицерин, димиристоилфосфатидилглицерин, дипальмитоилфосфатидилглицерин, дистеароилфосфатидилглицерин, диолеоилфосфатидилглицерин, димиристоилфосфатидную кислоту, дипальмитоилфосфатидную кислоту, димиристоилфосфатидилэтаноламин, дипальмитоилфосфатидилэтаноламин, димиристоилфосфатидилсерин, дипальмитоилфосфатидилсерин, сфингомиелин, дипальмитоилсфингомиелин, дистеароилсфингомиелин, соль дипальмитоилфосфатидилглицерина, фосфатидную кислоту, галактоцереброзид, дилаурилфосфатидилхолин, (1,3)-D-маннозил(1,3)диглицерид, аминофенилгликозид и/или 3-холестерин-6'-(гликозилтио)гексиловый эфир-гликолипиды, или состоит из них.
130. Способ согласно любому из воплощений 90-126, при котором указанный липидный компонент включает нейтральные липиды.
131. Способ согласно воплощению 130, при котором указанный липидный компонент преимущественно составляют нейтральные липиды.
132. Способ согласно воплощению 130 или согласно воплощению 131, при котором указанные нейтральные липиды включают сфингомиелины.
133. Способ согласно воплощению 132, при котором указанные нейтральные липиды преимущественно составляют сфингомиелины.
134. Способ согласно воплощению 132 или согласно воплощению 133, при котором сфингомиелины включают D-эритрозо-сфингомиелин и/или D-эритрозодигидросфингомиелин, или состоят из этих липидов.
135. Способ согласно любому из воплощений 130-135, при котором указанная исходная суспензия дополнительно содержит отрицательно заряженные фосфолипиды.
136. Способ согласно воплощению 135, при котором указанные отрицательно заряженные фосфолипиды включают фосфатидилглицерины или состоят из них.
137. Способ согласно воплощению 136, при котором указанные фосфатидилглицерины имеют ацильные цепи С16:0.
138. Способ согласно воплощению 136 или согласно воплощению 137, где указанные фосфатидилглицерины включают соль 1,2-дигексадеканоил-sn-глицеро-3-фосфо-(1'-рац-глицерин) или состоят из нее.
139. Способ согласно воплощению 138, где соль представляет собой соль натрия.
140. Способ согласно любому из воплощений 90-139, где молярное отношение липид:белок в исходной суспензии составляет от примерно 2:1 до примерно 200:1.
141. Способ согласно воплощению 140, где молярное отношение липид:белок в указанной исходной суспензии составляет от примерно 10:1 до примерно 125:1.
142. Способ согласно воплощению 140, при котором молярное отношение липид:белок в указанной исходной суспензии составляет от примерно 10:1 до примерно 150:1.
143. Способ согласно воплощению 140, при котором молярное отношение липид:белок в указанной исходной суспензии составляет от примерно 75:1 до 125:1.
144. Способ согласно любому из воплощений 90-143, при котором исходная суспензия содержит отрицательно заряженный липид, нейтральный липид и липидсвязывающие пептиды в молярном отношении в диапазоне 2-6 (отрицательно заряженный липид):90-120 (нейтральный липид):1 (липидсвязывающий пептид, липидсвязывающий белок или их смеси).
145. Способ согласно любому из воплощений 90-144, где указанный первый температурный диапазон составляет от 55°С до 60°С.
146. Способ согласно любому из воплощений 90-145, где указанный второй температурный диапазон составляет от 35°С до 40°С.
147. Способ согласно любому из воплощений 90-146, дополнительно включающий стадию лиофилизации полученных в результате липопротеиновых комплексов.
148. Способ согласно воплощению 147, дополнительно включающий стадию добавления изотонического агента перед лиофилизацией.
149. Фармацевтическая композиция, содержащая совокупность липопротеиновых комплексов, где указанные липопротеиновые комплексы имеют:
(a) размер от 4 нм до 15 нм, или от 6 нм до 15 нм, или от 5 до 12 нм, или от 8 до 10 нм, как измерено ГПХ или ДСР; и
(b) гомогенность, составляющую по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99%, что отражает единственный пик при гельпроникающей хроматографии.
150. Способ изготовления фармацевтической композиции, включающий:
(a) получение совокупности липопротеиновых комплексов в соответствии со способом согласно любому из воплощений 90-146; и
(b) объединение указанной совокупности липопротеиновых комплексов с одним или более одним фармацевтически приемлемым эксципиентом.
151. Способ согласно воплощению 150, при котором фармацевтическую композицию готовят в атмосфере инертного газа.
152. Способ согласно воплощению 151, где инертный газ представляет собой азот, гелий или аргон.
153. Способ согласно любому из воплощений 150-152, дополнительно включающий стадию лиофилизации фармацевтической композиции.
154. Способ согласно любому из воплощений 150-152, дополнительно включающий стадию деления фармацевтической композиции на аликвоты в виде отдельных стандартных доз.
155. Способ согласно воплощению 154, дополнительно включающий стадию лиофилизации отдельных стандартных доз.
156. Способ изготовления фармацевтической композиции, включающий восстановление лиофилизированного препарата липопротеиновых комплексов, полученного в соответствии со способом согласно воплощению 147, либо способом согласно воплощению 153 или согласно воплощению 155.
157. Способ согласно воплощению 156, дополнительно включающий объединение восстановленных липопротеиновых комплексов с одним или более одним фармацевтически приемлемым эксципиентом.
158. Способ согласно воплощению 156 или согласно воплощению 157, дополнительно включающий стадию деления фармацевтической композиции на аликвоты в виде отдельных стандартных доз.
159. Жидкая фармацевтическая композиция, изготовленная способом согласно воплощению 150 или согласно воплощению 156.
160. Лиофилизированная фармацевтическая композиция, изготовленная способом согласно воплощению 153.
161. Жидкая стандартная лекарственная форма, изготовленная способом согласно воплощению 158.
162. Жидкая стандартная лекарственная форма, содержащая терапевтически эффективное количество фармацевтической композиции согласно воплощению 149.
163. Сухая стандартная лекарственная форма, изготовленная способом согласно воплощению 155.
164. Способ лечения дислипидемического расстройства, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества:
(a) липопротеинового комплекса согласно любому из воплощений 1-22;
(b) совокупности липопротеиновых комплексов согласно любому из воплощений 23-58;
(c) фармацевтической композиции согласно любому из воплощений 59, 149 и 159;
(d) терапевтически эффективного количества липопротеиновых комплексов, полученных способом согласно любому из воплощений 90-148;
(e) стандартной лекарственной формы согласно воплощению 161 или воплощению 162;
(f) липопротеинового комплекса, однократное введение которого здоровому волонтеру в количестве вплоть до 45 мг/кг не приводит к повышению уровня ферментов печени;
(g) липопротеинового комплекса, двух-, трех-, четырех-, пяти- или шестикратное введение которого субъекту-человеку не приводит к повышению уровня ферментов печени;
(h) липопротеинового комплекса, однократное введение которого субъекту-человеку в дозе, составляющей от 1 мг/кг до 20 мг/кг, не приводит к повышению уровня ферментов печени;
(i) липопротеинового комплекса, двух-, трех-, четырех-, пяти- или шестикратное введение которого субъекту-человеку в дозе, составляющей от 1 мг/кг до 20 мг/кг при каждом введении, не приводит к повышению уровня ферментов печени;
(j) липопротеинового комплекса, однократное введение которого здоровому волонтеру в количестве вплоть до 20 мг/кг не приводит к более чем двукратному повышению уровня триглицеридов;
(k) липопротеинового комплекса, двух-, трех-, четырех-, пяти- или шестикратное введение которого субъекту-человеку не приводит к более чем двукратному повышению уровня триглицеридов;
(l) липопротеинового комплекса, однократное введение которого субъекту-человеку в дозе, составляющей от 1 мг/кг до 20 мг/кг, не приводит к более чем двукратному повышению уровня триглицеридов; или
(m) липопротеинового комплекса, двух-, трех-, четырех-, пяти- или шестикратное введение которого субъекту-человеку в дозе, составляющей от 1 мг/кг до 20 мг/кг при каждом введении, не приводит к более чем двукратному повышению уровня триглицеридов.
165. Способ согласно воплощению 164, дополнительно включающий повторение указанного введения.
166. Способ согласно воплощению 165, при котором введение повторяют с интервалом, составляющим от 6 суток до 12 суток.
167. Способ согласно воплощению 166, при котором введение выполняют еженедельно.
168. Способ согласно любому из воплощений 165-167, при котором введение выполняют на протяжении периода, составляющего один месяц, пять недель, шесть недель, два месяца, три месяца, шесть месяцев, один год, 2 года, 3 года или дольше.
169. Способ согласно любому из воплощений 165-167, при котором введение выполняют один раз, два раза, три раза, четыре раза, пять раз, шесть раз, семь раз, восемь раз, девять раз, десять раз, одиннадцать раз или двенадцать раз.
170. Способ согласно любому из воплощений 164-169, при котором введение выполняют внутривенно.
171. Способ согласно воплощению 170, при котором введение выполняют путем инфузии.
172. Способ согласно воплощению 171, при котором инфузию выполняют в течение периода от одного до четырех часов.
173. Способ согласно воплощению 171, при котором инфузию выполняют в течение периода вплоть до 24 часов.
174. Способ согласно любому из воплощений 170-173, при котором количество липопротеинового комплекса находится в диапазоне от примерно 0,25 мг/кг эквивалентов АроА-I до примерно 30 мг/кг эквивалентов АроА-I на введение.
175. Способ согласно воплощению 174, при котором количество липопротеинового комплекса находится в диапазоне от примерно 1 мг/кг эквивалентов АроА-I до примерно 15 мг/кг эквивалентов АроА-I на введение.
176. Способ согласно воплощению 175, при котором количество липопротеинового комплекса находится в диапазоне от примерно 2 мг/кг эквивалентов АроА-I до примерно 12 мг/кг эквивалентов АроА-I на введение.
177. Способ согласно воплощению 176, при котором количество липопротеинового комплекса составляет примерно 3 мг/кг эквивалентов АроА-I на введение.
178. Способ согласно воплощению 176, при котором количество липопротеинового комплекса составляет примерно 6 мг/кг эквивалентов АроА-I на введение.
179. Способ согласно воплощению 176, при котором количество липопротеинового комплекса составляет примерно 12 мг/кг эквивалентов АроА-I на введение.
180. Способ лечения дислипидемического расстройства, включающий:
(а) введение субъекту начальной дозы, составляющей от 1 мг/кг до 12 мг/кг:
(1) липопротеинового комплекса согласно любому из воплощений 1-22;
(2) совокупности липопротеиновых комплексов согласно любому из воплощений 23-58;
(3) фармацевтической композиции согласно любому из воплощений 59, 149 и 159;
(4) терапевтически эффективного количества липопротеиновых комплексов, полученных способом согласно любому из воплощений 90-148;
(5) стандартной лекарственной формы согласно воплощению 161 или воплощению 162;
(6) липопротеинового комплекса, однократное введение которого здоровому волонтеру в количестве вплоть до 45 мг/кг не приводит к повышению уровня ферментов печени;
(7) липопротеинового комплекса, двух-, трех-, четырех-, пяти- или шестикратное введение которого субъекту-человеку не приводит к повышению уровня ферментов печени;
(8) липопротеинового комплекса, однократное введение которого субъекту-человеку в дозе, составляющей от 1 мг/кг до 20 мг/кг, не приводит к повышению уровня ферментов печени;
(9) липопротеинового комплекса, двух-, трех-, четырех-, пяти- или шестикратное введение которого субъекту-человеку в дозе, составляющей от 1 мг/кг до 20 мг/кг при каждом введении, не приводит к повышению уровня ферментов печени;
(10) липопротеинового комплекса, однократное введение которого здоровому волонтеру в количестве вплоть до 20 мг/кг не приводит к более чем двукратному повышению уровня триглицеридов;
(11) липопротеинового комплекса, двух-, трех-, четырех-, пяти- или шестикратное введение которого субъекту-человеку не приводит к более чем двукратному повышению уровня триглицеридов;
(12) липопротеинового комплекса, однократное введение которого субъекту-человеку в дозе, составляющей от 1 мг/кг до 20 мг/кг, не приводит к более чем двукратному повышению уровня триглицеридов; или
(13) липопротеинового комплекса, двух-, трех-, четырех-, пяти- или шестикратное введение которого субъекту-человеку в дозе, составляющей от 1 мг/кг до 20 мг/кг при каждом введении, не приводит к более чем двукратному повышению уровня триглицеридов;
(b) определение, повышен ли у субъекта уровень триглицеридов, холестерина-ЛПОНП и/или триглицерида-ЛПОНП, более в два раза через 4, 8, 12, 24, 48, 72, 168, 336 или 504 часа после введения; и
(с) если у субъекта уровень триглицеридов, холестерина-ЛПОНП и/или триглицерида-ЛПОНП повышен более в два раза по сравнению с уровнями до дозирования, введение повторяют, но в более низкой дозе, а если у субъекта уровень триглицеридов, холестерина-ЛПОНП и/или триглицерида-ЛПОНП не повышен более в два раза по сравнению с уровнями до дозирования, введение повторяют в эквивалентной или более высокой дозе.
181. Способ согласно любому из воплощений 165-180, при котором субъект страдает гиперлипидемией или сердечно-сосудистым заболеванием или склонен к этим заболеваниям.
182. Способ согласно воплощению 181, при котором субъект страдает гиперлипидемией или склонен к ней, и гиперлипидемия представляет собой гиперхолестеринемию.
183. Способ согласно воплощению 181, при котором субъект страдает сердечно-сосудистым заболеванием или склонен к нему, и сердечнососудистое заболевание представляет собой атеросклероз, удар, инфаркт миокарда, острый коронарный синдром, стенокардию, перемежающуюся хромоту, критическую ишемию конечностей, склероз атриального клапана или рестеноз.
184. Способ согласно любому из воплощений 165-183, дополнительно включающий вспомогательное введение смолы-секвестранта желчных кислот, ниацина, противовоспалительного агента, статина, фибрата, ингибитора СЕТР, ингибитора агрегации тромбоцитов, антикоагулянта, агониста PCSK9 и/или ингибитора всасывания холестерина.
185. Способ согласно воплощению 181, дополнительно включающий введение статина, выбранного из аторвастатина, розувастатина, правастатина или ловастатина.
186. Способ согласно воплощению 181, дополнительно включающий введение фибрата, представляющего собой фенофибрат.
187. Способ согласно воплощению 181, дополнительно включающий введение ингибитора всасывания холестерина, представляющего собой зетию.
188. Способ согласно воплощению 181, дополнительно включающий введение ингибитора СЕТР, выбранного из анацетрапиба и далцетрапиба.
189. Способ согласно воплощению 181, дополнительно включающий введение антительного агониста PCSK9 или лигандного агониста PCSK9.
190. Способ согласно воплощению 181, дополнительно включающий введение ингибитора всасывания холестерина, представляющего собой клопидогрел бисульфат.
191. Способ согласно воплощению 181, дополнительно включающий введение антикоагулянта, представляющего собой варфарин.
192. Способ согласно воплощению 181, дополнительно включающий введение противовоспалительного агента, представляющего собой аспирин.
193. Композиция, содержащая одну, две или три гомогенные совокупности липопротеиновых комплексов.
194. Композиция согласно воплощению 193, в которой липопротеиновые комплексы по меньшей мере в одной из гомогенных совокупностей обладают характеристиками комплекса согласно любому из воплощений 1-22.
195. Композиция согласно воплощению 193 или согласно воплощению 194, в которой по меньшей мере одна, две или три из совокупностей обладают характеристиками совокупности согласно любому из воплощений 23-58.
Все цитируемые ссылки полностью включены в настоящее описание посредством ссылки для всех целей до такой же степени, как если бы отдельная публикация, патент или заявка на патент была бы конкретно и индивидуально указана как полностью включенная в настоящее описание посредством ссылки для всех целей.
Многие модификации и изменения данного изобретения могут быть произведены без отклонения от его сущности и объема, что очевидно специалистам в данной области техники. Конкретные описанные согласно воплощению предложены только в качестве примера, и изобретение должно быть ограничено только прилагаемой формулой изобретения параллельно с полным объемом эквивалентов, в котором такая формула правомочна.
Реферат
Изобретения касаются способа получения липопротеинового комплекса, использования совокупности полученных липопротеиновых комплексов в получении фармацевтической композиции и применении для лечения и/или предупреждения дислипидемических расстройств. Представленный способ включает: (a) охлаждение исходной суспензии, содержащей липидный компонент и белковый компонент, от температуры, находящейся в первом температурном диапазоне, до температуры, находящейся во втором температурном диапазоне; (b) нагревание охлажденной суспензии со стадии (a) от температуры, находящейся во втором температурном диапазоне, до температуры, находящейся в первом температурном диапазоне; (c) охлаждение указанной нагретой суспензии со стадии (b) от температуры, находящейся в первом температурном диапазоне, до температуры, находящейся во втором температурном диапазоне; и (d) повторение стадий (b) и (c) по меньшей мере один раз, с получением в результате липопротеиновых комплексов. Представленные изобретения могут быть использованы для получения однородных фармацевтически приемлемых препаратов с меньшим риском проявления при их использовании побочных эффектов вследствие загрязнений. 6 н. и 45 з.п. ф-лы, 59 ил., 19 табл., 9 пр.
Формула
Документы, цитированные в отчёте о поиске
Конъюгаты для введения биологически активных соединений

Комментарии