Конъюгаты для введения биологически активных соединений - RU2567667C2
Код документа: RU2567667C2
Чертежи












Описание
Область техники изобретения
Изобретение относится к способам для стабилизации и адресной доставки соединений, представляющих терапевтический интерес, конкретным образом к тканям-мишеням. Изобретение, в частности, основано на способности аполипопротеина A нацеливать соединения, представляющие терапевтический интерес, на все те ткани, которые имеют на своей поверхности высокоаффинные участки связывания указанного белка.
Предпосылки изобретения
Развитие новых форм терапии c использованием макромолекул в качестве активных ингредиентов создало потребность в разработке эффективных способов стабилизации и адресной доставки этих молекул к соответствующим клеточным мишеням. Примеры терапии, которая требует конкретной адресной доставки к ткани-мишени, включают использование специфических факторов роста или использование генов, которые применяются для замещения утерянных или дефектных генов в ткани-мишени. Тканеспецифические системы, которые не основаны на вирусных векторах, часто страдают проблемой низкой или отсутствующей клеточной специфичности.
Описаны различные системы для адресной доставки терапевтических соединений к клеткам печени на основе липидных везикул, которые содержат внутри терапевтическое соединение, и чья адресная доставка обусловлена присутствием на поверхности везикул молекул, имеющих сродство к мембранам клеток печени.
Например, WO07130873 описывает способы адресной доставки микровезикул к клеткам печени за счет инкорпорации в поверхность указанных капсул соединения, которое специфически распознается сиаловыми гликопротеинами, гиалуроновой кислотой, N-ацетилгалактозамином или рецепторами маннозы, присутствующими на клетках печени. WO02086091 описывает способы адресной доставки нановезикул к клеткам печени за счет инкорпорации внутрь указанных везикул оболочечного белка гепатита В. WO200473684 описывает способ для адресной доставки частично гидрофобных соединений к клеткам печени, на основе дискообразных фосфолипидных частиц, содержащих ApoA-I на своей поверхности. Lou et al (World J. Gastroenterol., 2005, 1 1:954-959) описали способ для адресной доставки липофильного противоопухолевого соединения к клеткам печеночноклеточной карциномы с использованием в качестве специфического носителя липопротеина высокой плотности (ЛПВП), основываясь на способности ЛПВП вмещать гидрофобные соединения, такие как холестерин.
Наконец, Kim et al. (Molecular Therapy, 2007, 15:1145-1152) описывают способ для адресной доставки интерферирующей РНК к клеткам печени на основе липосом, которые включают в себя интерферирующую РНК и содержат ApoA-I на своей поверхности. Однако эти способы имеют тот недостаток, что они позволяют переносить только гидрофобные соединения, поскольку указанные соединения размещаются внутри везикул или искусственных мембран в контакте с гидрофобной фракцией фосфолипидов.
Альтернативно, возможна доставка гидрофильных соединений в печень за счет использования конъюгатов указанных соединений с веществами, которые специфически захватываются печенью. Например, Kramer et al (J.Biol.Chem., 1992,267:18598-18604) описали способы для адресной доставки терапевтических соединений (цитостатика хлорамбуцила и ингибитора пролил-4 гидроксилaзы I-нитро-2-оксa-1,3-диазол-β-Ala-Phe-5-оксапролин-Gly) к клеткам печени посредством конъюгации указанных соединений с желчными кислотами. Однако такой тип конъюгации позволяет осуществлять доставку только в печень, что исключает его использование для введения соединений к другим тканям, представляющим терапевтический интерес.
WO04082720 описывает способы для адресной доставки терапевтических соединений к клеткам печени за счет инкорпорации указанных соединений в псевдовирусные частицы, сформированные оболочечным белком гепатита В. Однако, эти носители имеют проблему, связанную с укороченным периодом полувыведения из плазмы, что требует постоянного введения или введения в высоких дозах для достижения устойчивых терапевтических уровней в плазме. Кроме того, вирусные белки, из которых сформированы псевдовирусные частицы, вызывают гуморальный иммунный ответ.
WO8702061A описывает способы для адресной доставки соединений к тканям, экспресирующим рецептор ЛПНП, за счет использования слитых белков, образованных участком аполипопротеина В или Е, который связывается с рецептором, и активным компонентом.
Проблема короткого времени полужизни интерферона была рассмотрена в WO07021494, который описывает слитые белки, образованные альбумином и интерфероном. Время полужизни таких белков в плазме достигает приблизительно 14 дней.
Таким образом, существует потребность в удобных носителях для специфической адресной доставки терапевтических соединений к клеткам печени, которые позволяют достигать длительного времени полужизни конъюгатов в плазме.
Сущность изобретения
В первом аспекте, изобретение относится к конъюгату, который содержит
(i) молекулу Apo A или ее функционально эквивалентный вариант и
(ii) соединение, представляющее терапевтический интерес,
где компоненты (i) и (ii) ковалентно связаны.
Во втором аспекте, изобретение относится к полинуклеотиду или генной конструкции, содержащей полинуклеотид, кодирующий конъюгат по изобретению, где соединение, представляющее терапевтический интерес (ii), является полипептидом, который формирует единую цепь с компонентом (i).
В целом ряде аспектов, изобретение относится к вектору, содержащему полинуклеотид или генную конструкцию по изобретению, и к клетке-хозяину, содержащей полинуклеотид, генную конструкцию или вектор по изобретению, или нанолипочастицу, содержащую конъюгат по изобретению.
В другом аспекте изобретение относится к конъюгату, полинуклеотиду, генной конструкции, вектору, клетке-хозяину или нанолипочастице по изобретению для применения в медицине.
В другом аспекте изобретение относится к конъюгату, полинуклеотиду, генной конструкции, вектору, клетке-хозяину или нанолипочастице по изобретению для лечения заболеваний печени или заболеваний, связанных с иммунной системой.
В другом аспекте изобретение относится к композиции, которая содержит:
(a) первый компонент, выбранный из группы, состоящей из конъюгата, полинуклеотида, генной конструкции, вектора, клетки-хозяина, нанолипочастицы или фармацевтического препарата по изобретению, где компонент (ii) является ингибиторным пептидом TGF-β1, и
(b) второй компонент, выбранный из группы, состоящей из иммуностимулирующего цитокина, полинуклеотида, кодирующего указанный цитокин, вектора, содержащего указанный полинуклеотид, ингибиторного пептида TGF-β1, цитотоксического средства или их сочетания.
В другом аспекте изобретение относится к комбинации по изобретению для применения в медицине и, в частности, при лечении рака.
Краткое описание чертежей
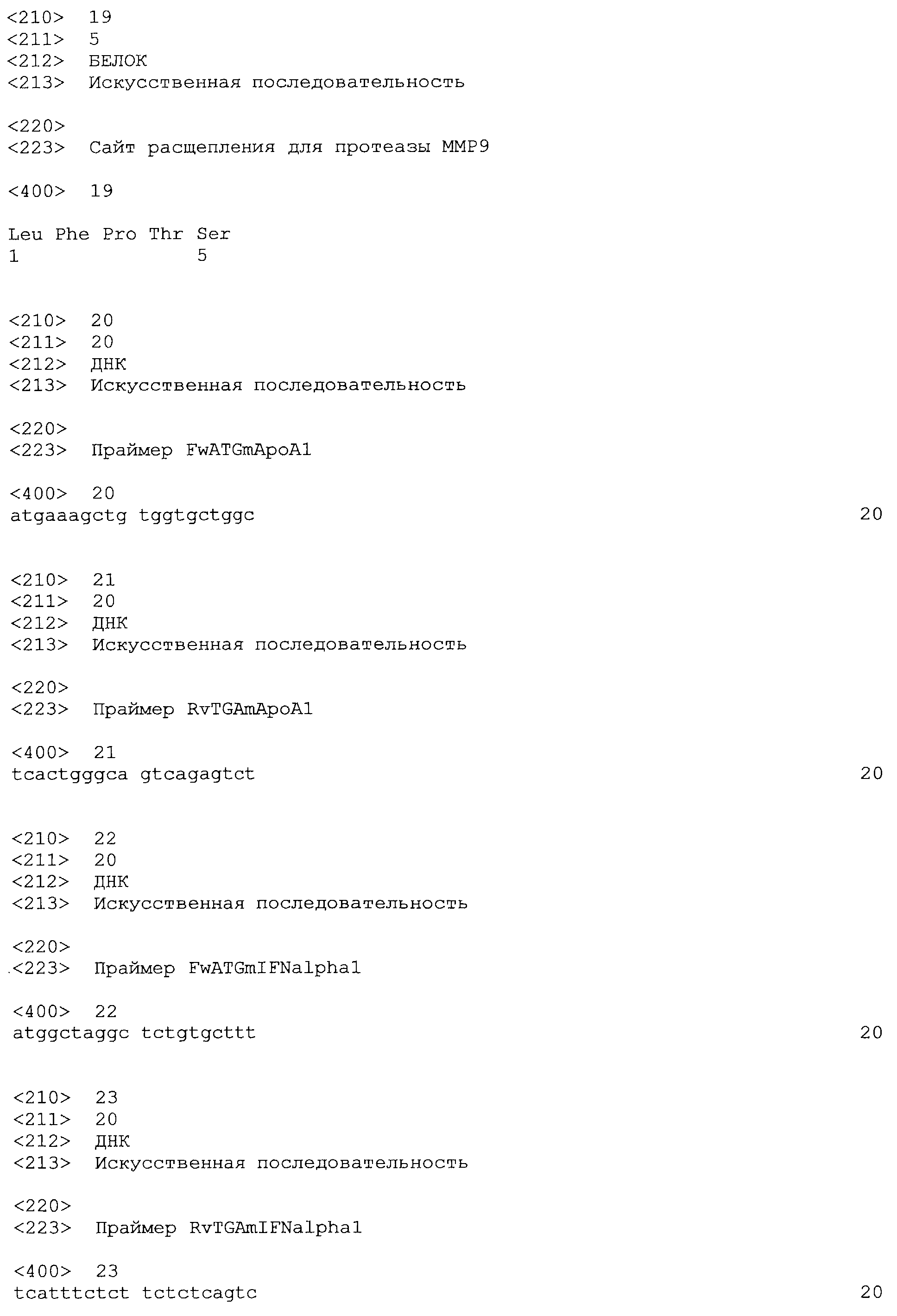
Фигура 1. Кинетика экспрессии IFNα. Мышам BALB/c делали гидродинамическую инъекцию с плазмидами, экспресирующими ApoA1 (Apo), IFNα (IFN), Apo-IFN (AF) или IFN-Apo (IA). Через 6 часов и на 1, 3, 6 и 9 дни делали забор крови и анализировали сывороточные уровни IFNα методом ELISA. Представлены среднее и стандартная ошибка среднего для типичного эксперимента с четырьмя животными в группе. Результаты анализировали дисперсионным анализом для многократных измерений с последующим тестом Бонферрони. Наблюдали достоверные различия между уровнями IFNα, индуцированными плазмидами AF и IA, и уровнями, индуцированными плазмидным IFN, на 1 и 3 дни (p<0,001).
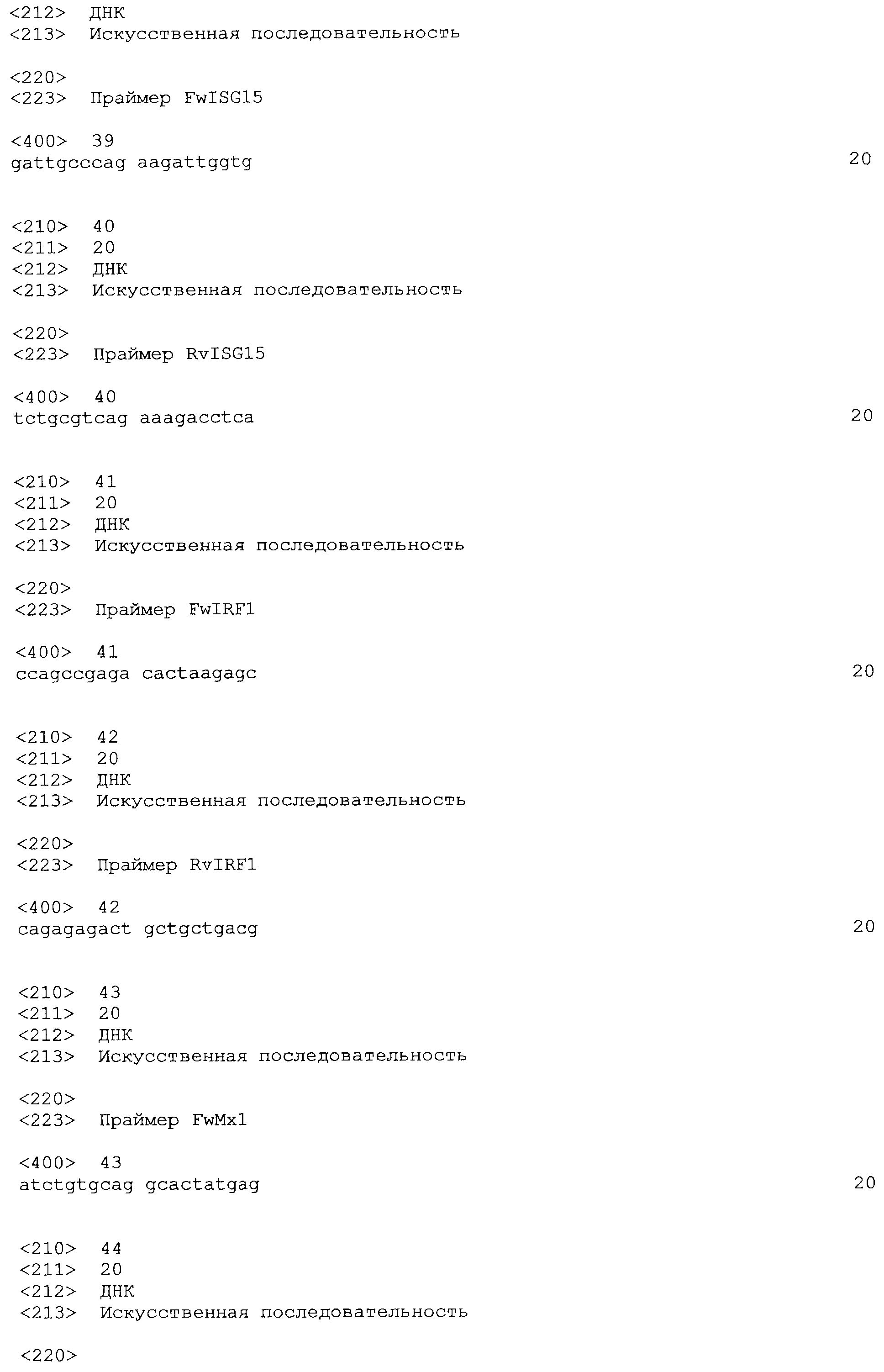
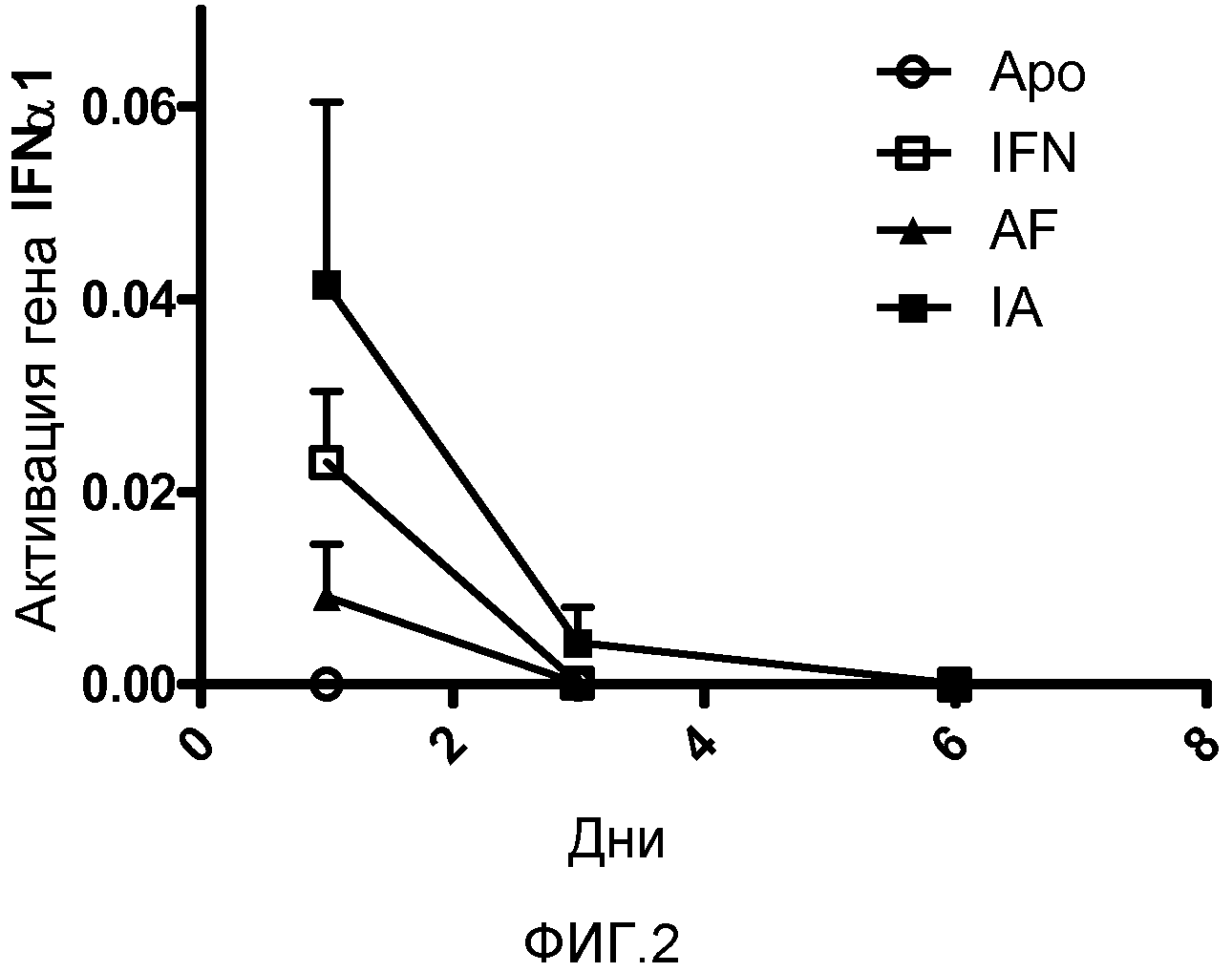
Фигура 2. Количественная ОТ-ПЦР печеночной мРНК IFNα1. Делали гидродинамические инъекции, используя трех мышей BALB/c для каждой плазмиды и дня исследования. На 1, 3 и 6 дни животных забивали и выделяли печень. Выделяли печеночную мРНК и проводили количественную ОТ-ПЦР для гена IFNα1. Показаны среднее и стандартная ошибка среднего для типичного эксперимента. Результаты анализировали дисперсионным анализом для многократных измерений с последующим тестом Бонферрони. Не было достоверных различий между уровнями мРНК, индуцированными плазмидами IFNα1, AF и IA.
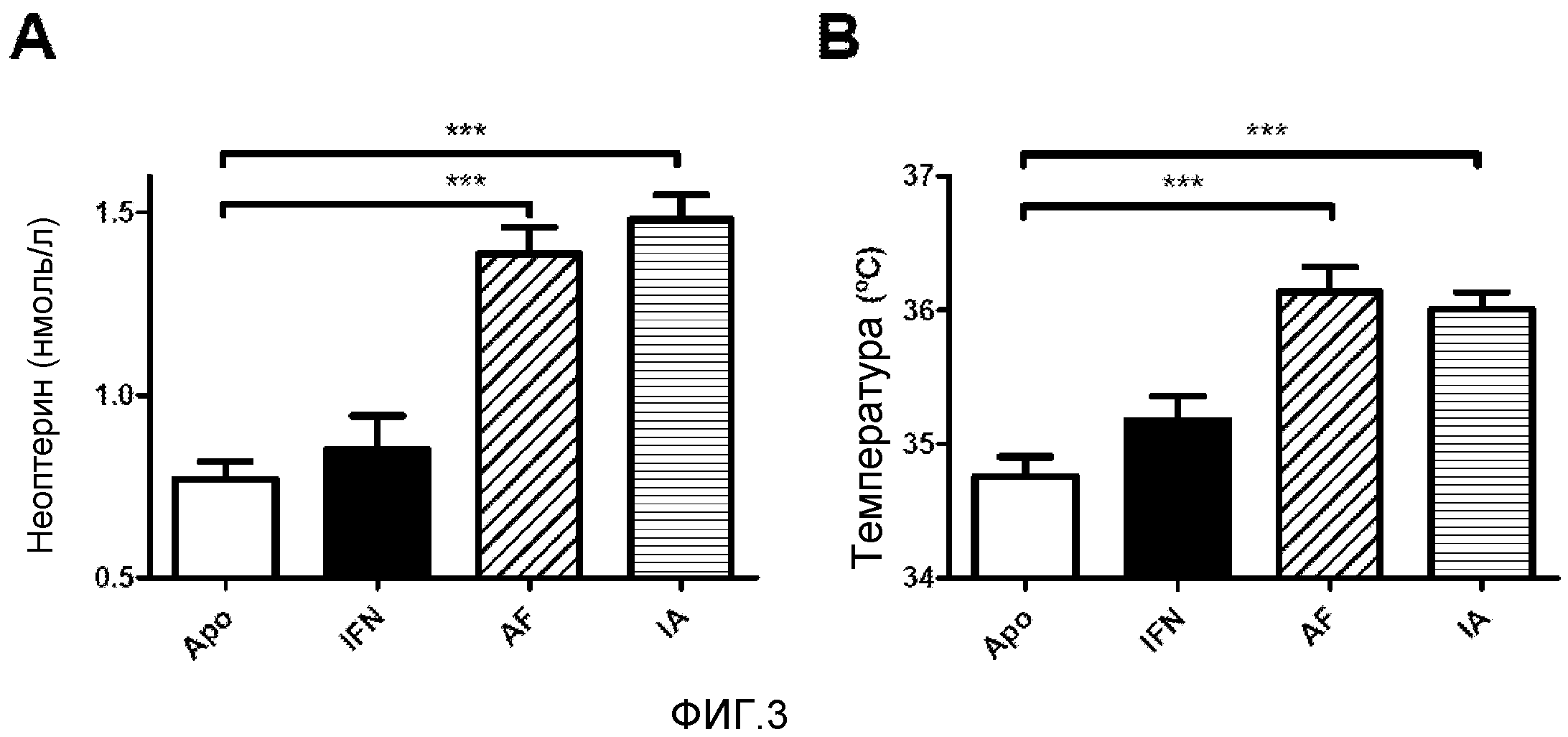
Фигура 3. Температура тела и уровни неоптерина в сыворотке. Мышам BALB/c вводили плазмиды, кодирующие конструкции с IFNα. На 3 день делали забор крови и измеряли уровни неоптерина (A) в сыворотке методом твердофазного иммуноферментного анализа. Одновременно измеряли температуру тела (B). Показаны среднее и стандартная ошибка среднего для двух независимых экспериментов (N=6 мышей). Данные анализировали с помощью дисперсионного анализа с последующим тестом Даннетта, сравнивая группы с IFNα с контрольной группой с ApoAI. *** p<0,0001.
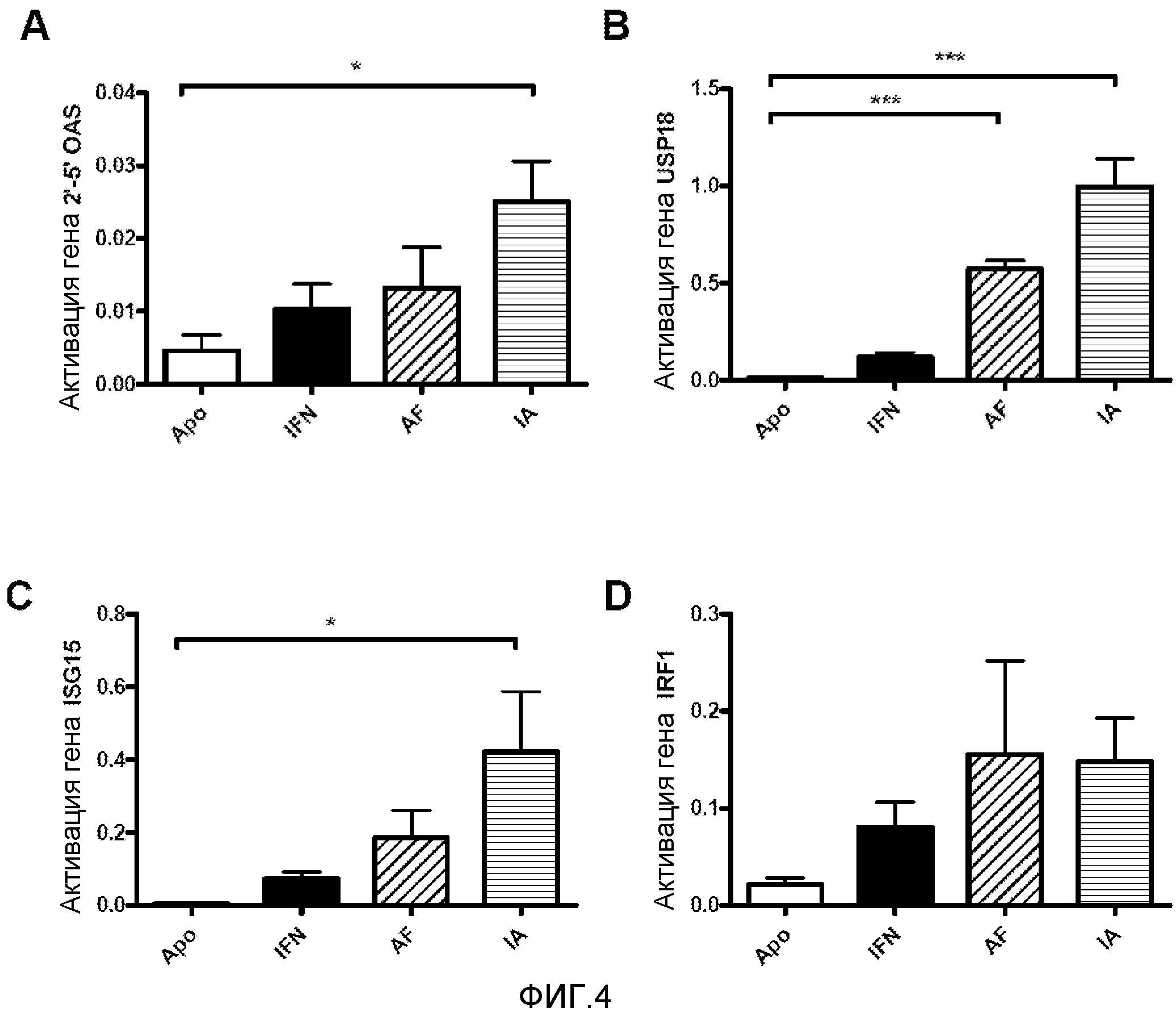
Фигура 4. Количественная ОТ-ПЦР печеночной мРНК генов, индуцируемых IFNα1. Мышам BALB/c делали гидродинамическую инъекцию с плазмидами, экспрессирующими конструкции с IFNα1. На 3 день животных забивали и выделяли печень. Выделяли печеночную мРНК и проводили количественную ОТ-ПЦР для генов 2'-5'OAS (A), USP18 (B), ISG15 (C) и IRF1 (D). Показаны среднее и стандартная ошибка среднего для двух независимых экспериментов (N=6 мышей). Данные анализировали с помощью дисперсионного анализа с последующим тестом Даннетта, сравнивая группы с IFNα с контрольной группой с ApoAI. * р<0,05, *** p<0,0001.
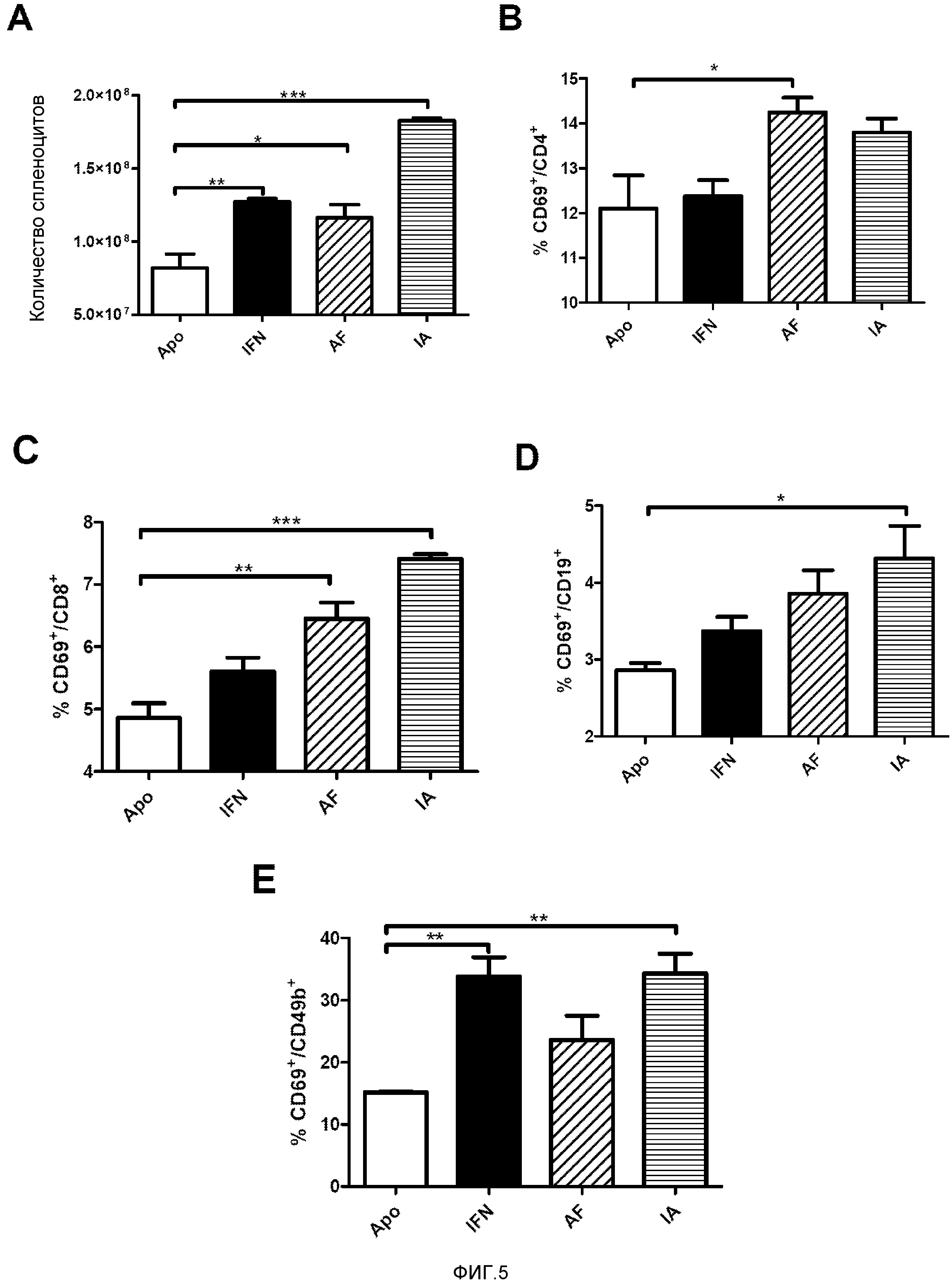
Фигура 5. Увеличение количества и активации спленоцитов. Мышам BALB/c гидродинамическим путем вводили различные конструкции с IFNα, шесть дней спустя мышей забивали и выделяли селезенки. Анализировали число спленоцитов (A) и экспрессию маркера ранней активации CD69 на CD4+ T-клетках (B), CD8+ T-клетках (C), B-клетках (D) и NK клетках (E). Показаны среднее и стандартная ошибка среднего для типичного эксперимента с 7 животными в группе. Данные анализировали с помощью дисперсионного анализа с последующим тестом Даннетта, сравнивая группы с IFNα с контрольной группой с ApoAI. * p<0,05, ** p<0,001, *** p<0,0001.
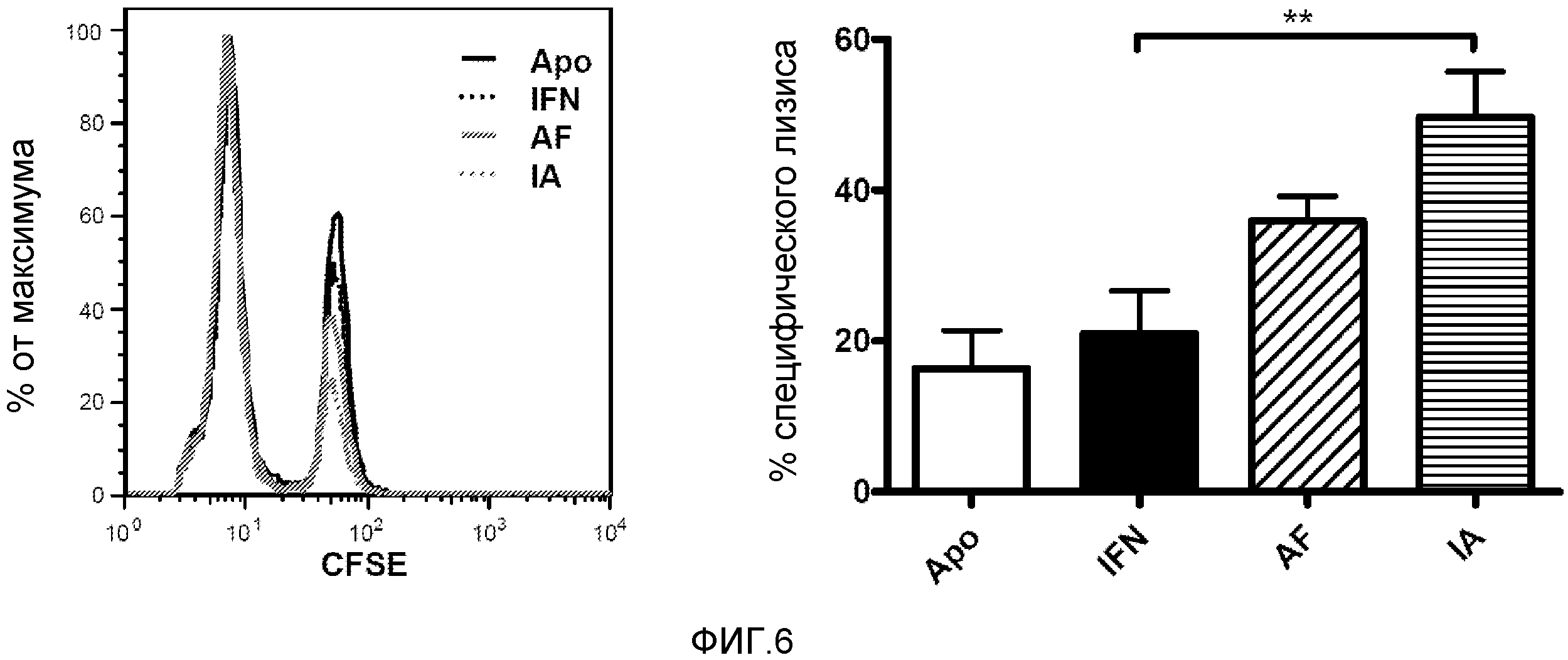
Фигура 6. Увеличение специфического лизиса, индуцированного генетической вакцинацией в присутствии конструкций, экспрессирующих IFNα. Мышей BALB/c иммунизировали посредством гидродинамической инъекции плазмидой, экспрессирующей β-галактозидазу, и плазмидами, экспрессирующими различные конструкции с IFNα. Плазмиды вводили совместно с адъювантом. Через 7 дней вводили внутривенно клетки-мишени с высокой концентрацией CFSE, нагруженные цитотоксическим пептидом, и контрольные клетки с низкой концентрацией CFSE. Через 24 часа животных забивали и анализировали соотношение клеток-мишеней и контрольных клеток для расчета процента специфического лизиса. Показана гистограмма, отражающая каждую группу, (A) среднее и стандартная ошибка среднего для типичного эксперимента с тремя животными в группе (B). Данные анализировали с помощью дисперсионного анализа с последующим тестом Даннетта, сравнивая группы Apo-IFN и IFN-Apo с группой IFNα. ** p<0,001.
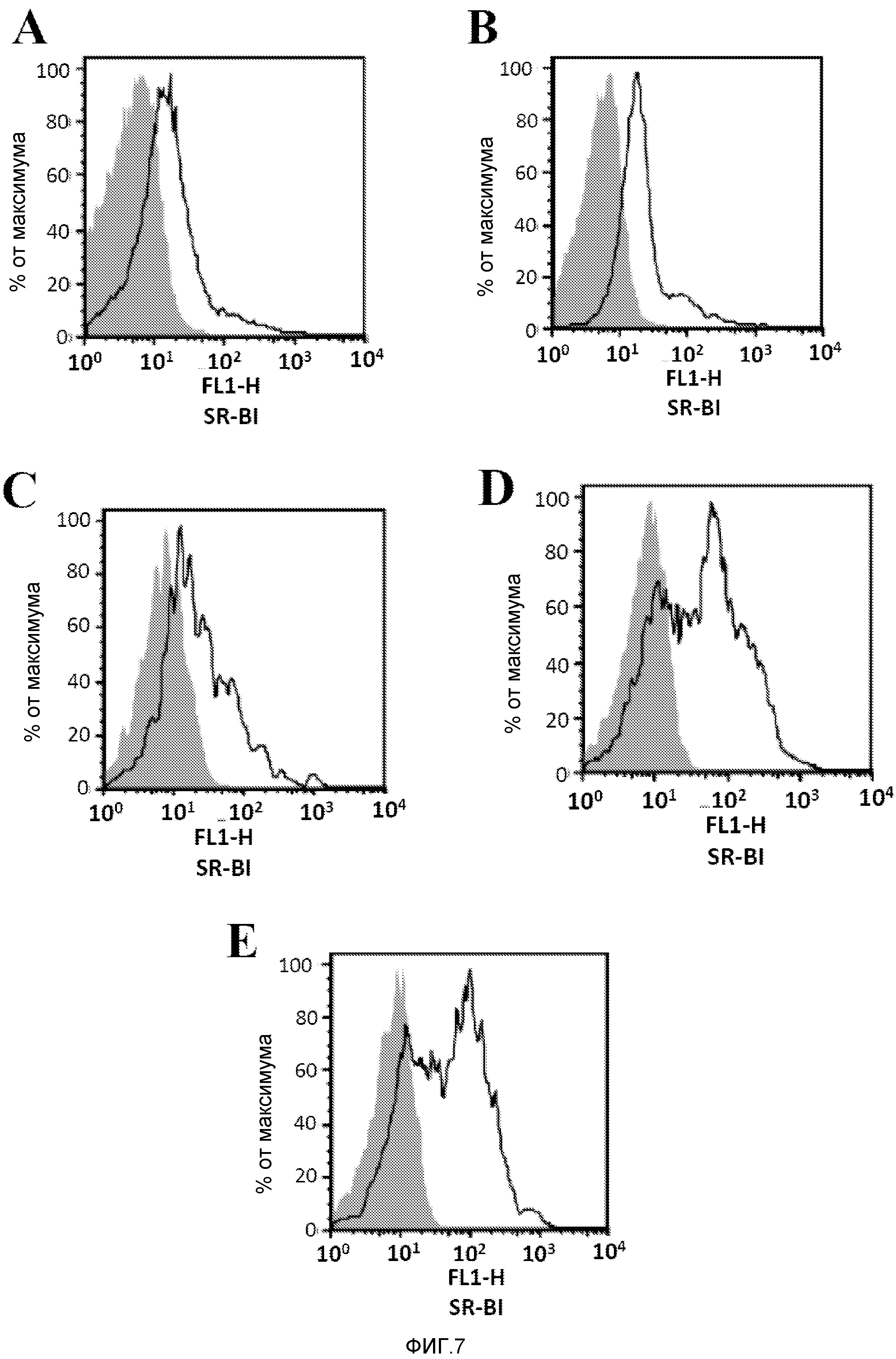
Фигура 7. Экспрессия SR-BI в различных популяциях клеток иммунной системы. Выделяли спленоциты из селезенки мышей BALB/c и метили анти-SR-BI антителами и антителами для распознавания CD4+ Т-клеток (анти-CD4) (A), CD8+ лимфоцитов (анти-CD8) (B), NK клеток (анти-CD49b) (C), моноцитов/макрофагов (анти-CD11b) (D) или дендритных клеток (анти-CD11c) (E).
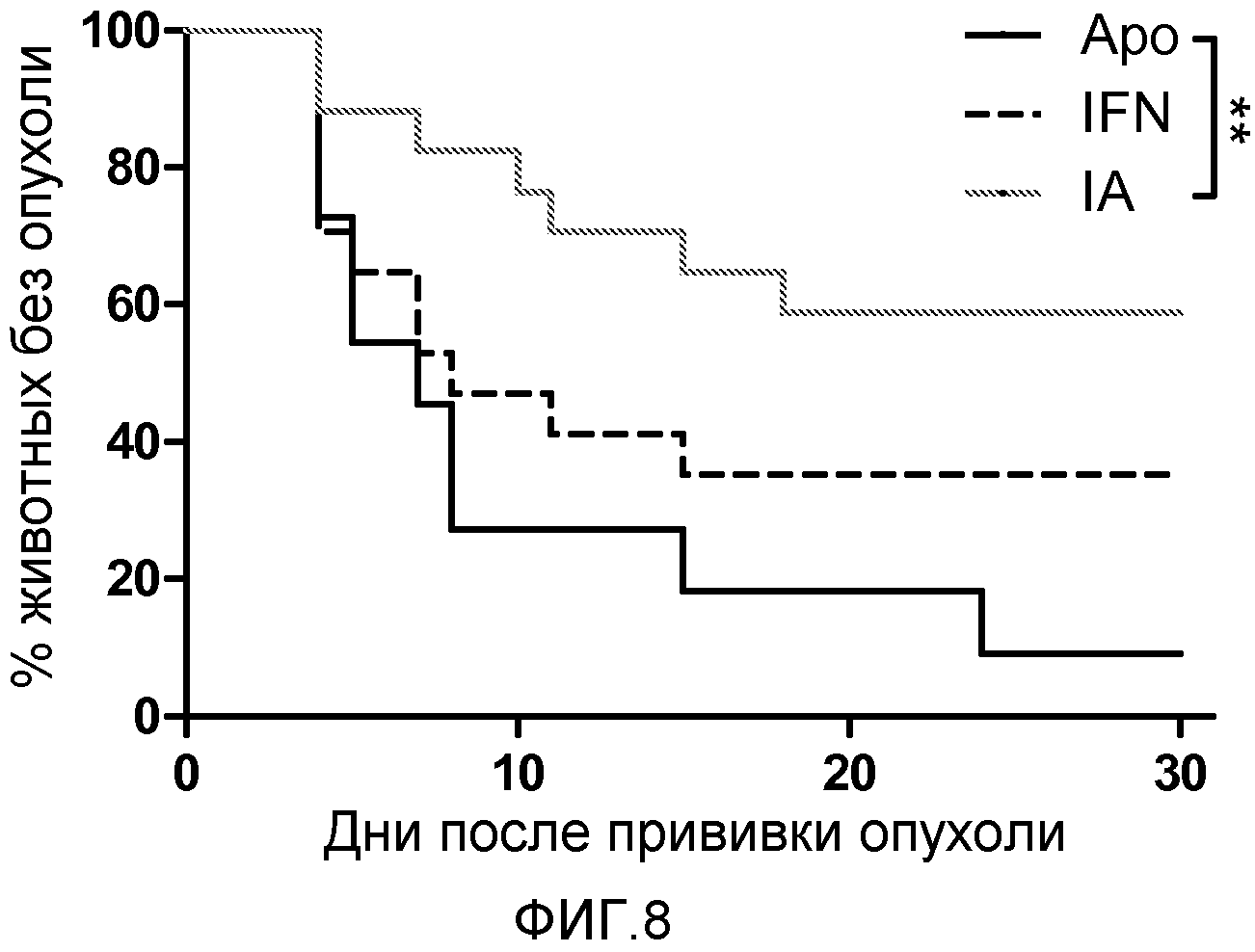
Фигура 8. Действие адъювантного эффекта на модели противоопухолевой вакцинации. Каждая обрабатываемая группа, состоящая из 11-17 мышей BALB/c, получала гидродинамическую инъекцию плазмид, экспрессирующих ApoAI (Apo), IFNα (IFN) или IFN-Apo (IA). Через 24 часа мышей вакцинировали цитотоксическим пептидом AH1 в неполном адъюванте Фрейнда. Девять дней спустя, подкожно прививали 5×106 клеток CT26 и с течением времени наблюдали появление опухоли. Показан процент мышей, у которых не развилась опухоль с течением времени. Экспериментальные группы сравнивали с контрольной группой по среднему значению с помощью логарифмического рангового критерия. ** p<0,01.
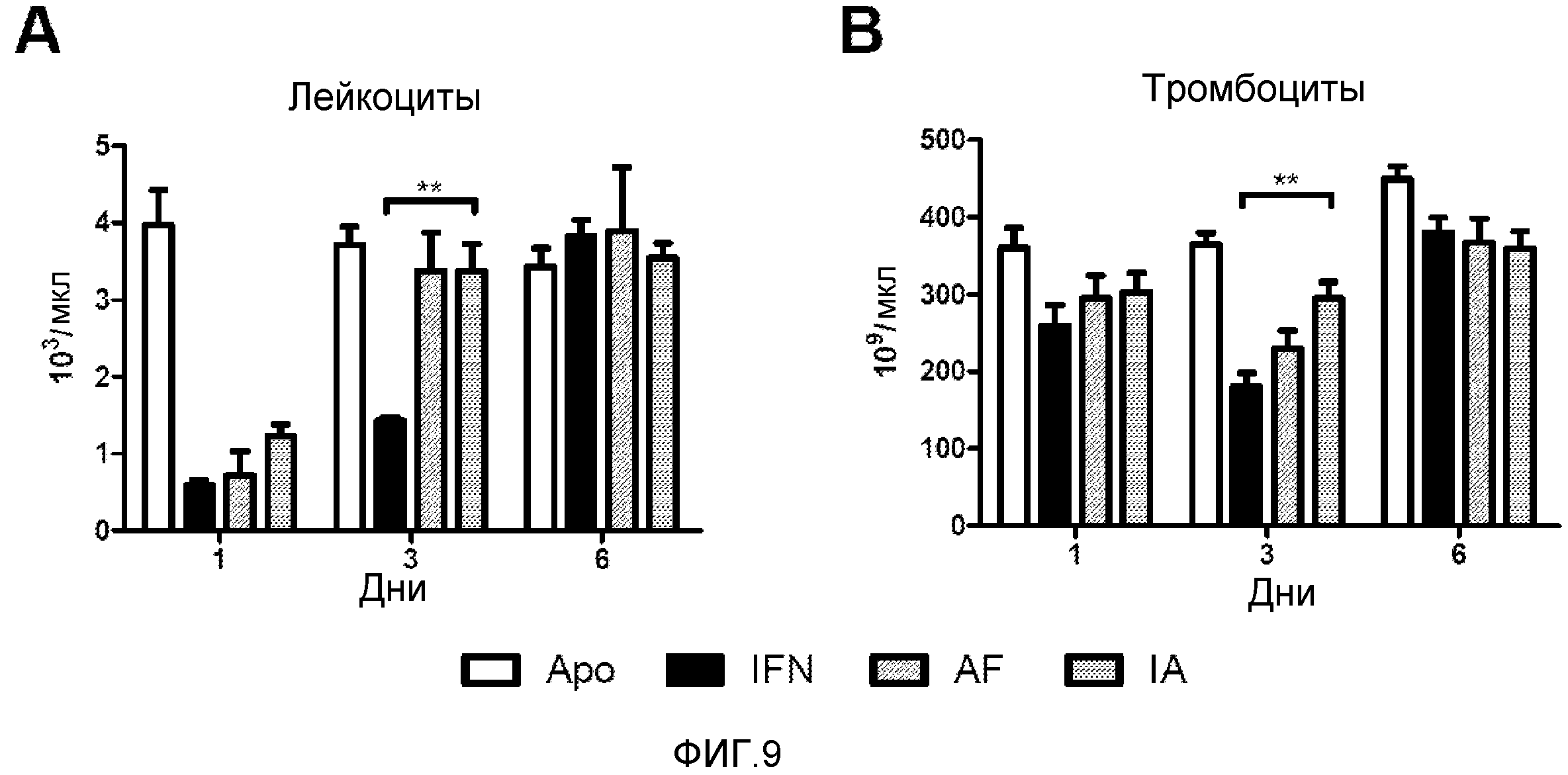
Фигура 9. Кинетика циркулирующих лейкоцитов и тромбоцитов. Мышам BALB/c вводили плазмиды, кодирующие конструкции с IFNα. Делали забор крови у одной группы на 1 день, у другой группы на 3 день и у последней группы на 6 день после гидродинамической инъекции. Производили подсчет лейкоцитов (A) и тромбоцитов (B) при помощи Z1 Coulter Particle Counter согласно инструкциям производителя. Показаны среднее и стандартная ошибка среднего для двух независимых экспериментов (N=4 мыши/день и в группе). Данные анализировали с помощью дисперсионного анализа с последующим тестом Даннетта, сравнивая группы с IFN-Apo и группу с IFN. ** p<0,01.
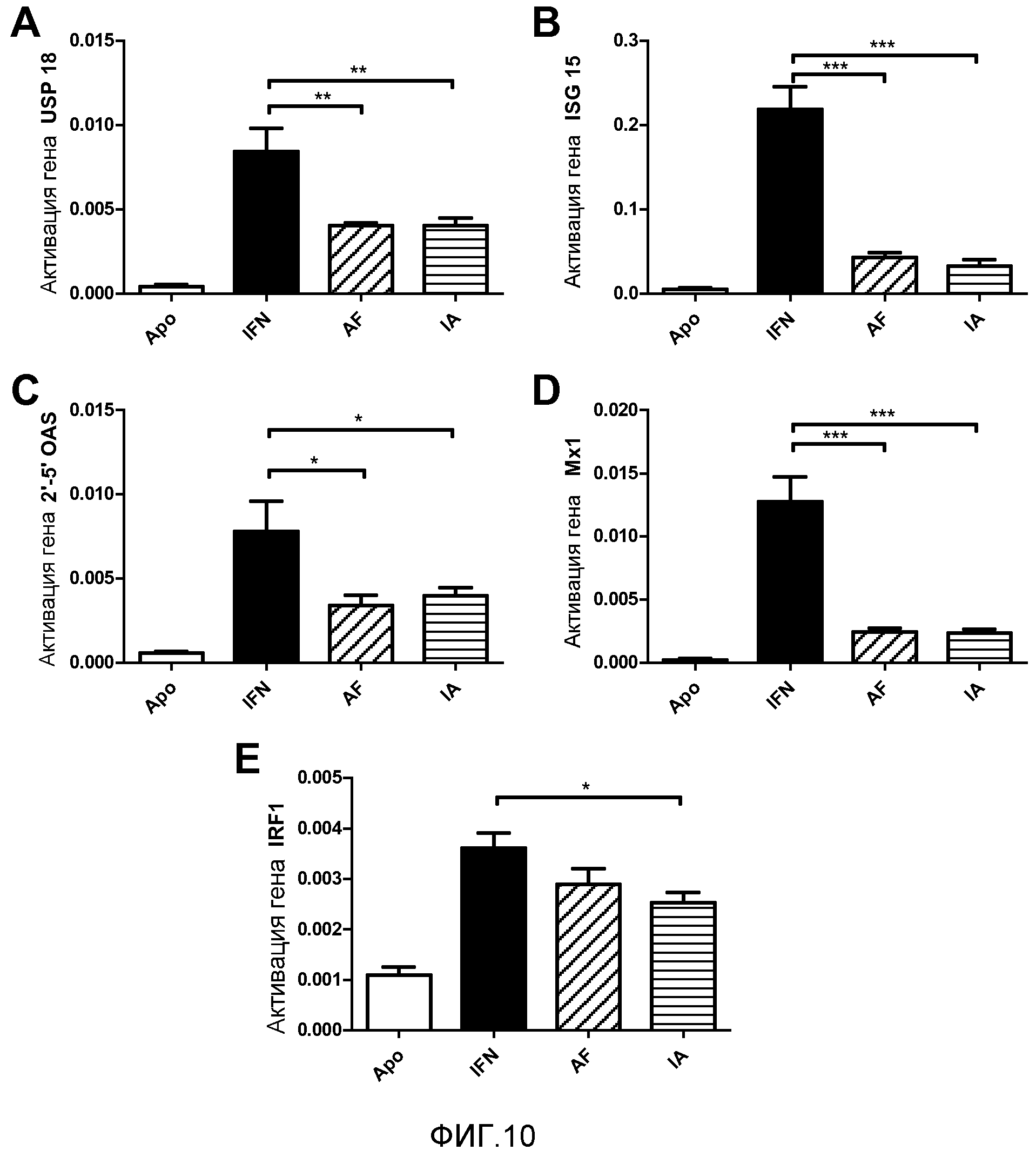
Фигура 10. Количественная ОТ-ПЦР мРНК генов, индуцируемых IFNα, в головном мозге. Мышам BALB/c делали гидродинамическую инъекцию с плазмидами, экспрессирующими конструкции с IFNα. На 1 день животных забивали и выделяли головной мозг. Выделяли мРНК головного мозга и проводили количественную ОТ-ПЦР для генов USP18 (A), ISG15 (B), 2'-5'OAS (C), Mx1 (D) и IRF1 (D). Представлены среднее и стандартная ошибка среднего для двух независимых экспериментов (N=5 мышей/группа). Данные анализировали с помощью дисперсионного анализа с последующим тестом Даннетта, сравнивая группы с IFN-Apo с группой с IFN. *p<0,05, **p<0,01, ***p<0,001. Это один эксперимент, который представляет собой два.
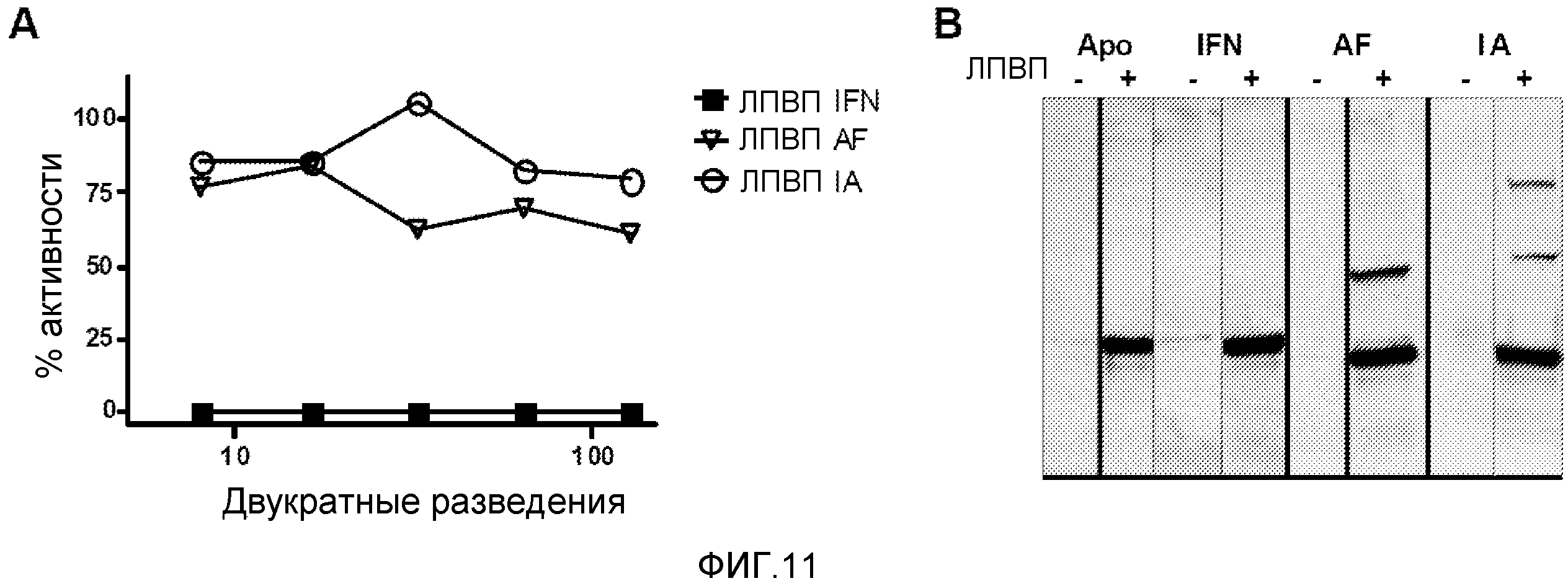
Фигура 11. Инкорпорация слитых белков в циркулирующие липопротеины высокой плотности (ЛПВП). Мышам BALB/c вводили плазмиды, кодирующие конструкции с IFNα. Через 24 часа делали забор крови и выделяли сыворотку, из которой экстрагировали ЛПВП методом дифференциального центрифугирования в градиенте NaBr. Присутствие IFNα в ЛПВП различных групп анализировали посредством интерферонового биотеста, анализа защиты против цитопатического эффекта (A). Для того чтобы определить наличие аполипопротеина A1, проводили вестерн-блоттинг с образцами сыворотки без ЛПВП (ЛПВП-) и фракцией, содержащей ЛПВП (ЛПВП+) (B).
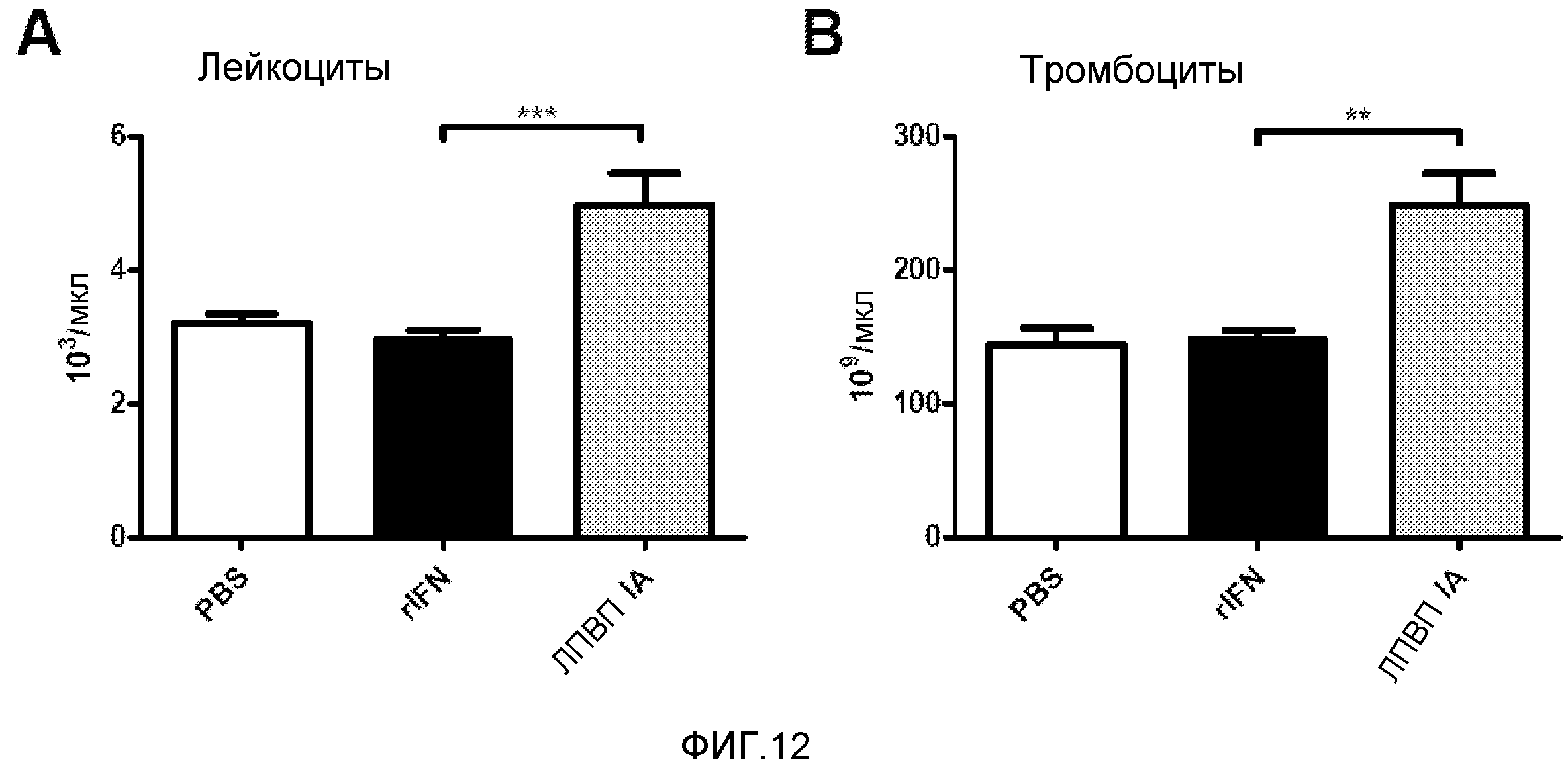
Фигура 12. Гематологические эффекты введения ЛПВП, содержащих IFN-Apo. Мышам BALB/c вводили эквивалент 10000 IU IFN в виде ЛПВП, содержащих IFN-Apo, 10000 IU рекомбинантного IFN или PBS. Через 3 дня производили подсчет лейкоцитов (A) и тромбоцитов (B) с использованием Z1 Coulter Particle Counter согласно инструкциям производителя. Представлены среднее и стандартная ошибка среднего для двух независимых экспериментов (N=4-6 мышей/группа). Данные анализировали с помощью дисперсионного анализа с последующим тестом Даннетта, сравнивая группы с IFN-Apo с группой с IFN. ** p<0,01, *** p<0,001.
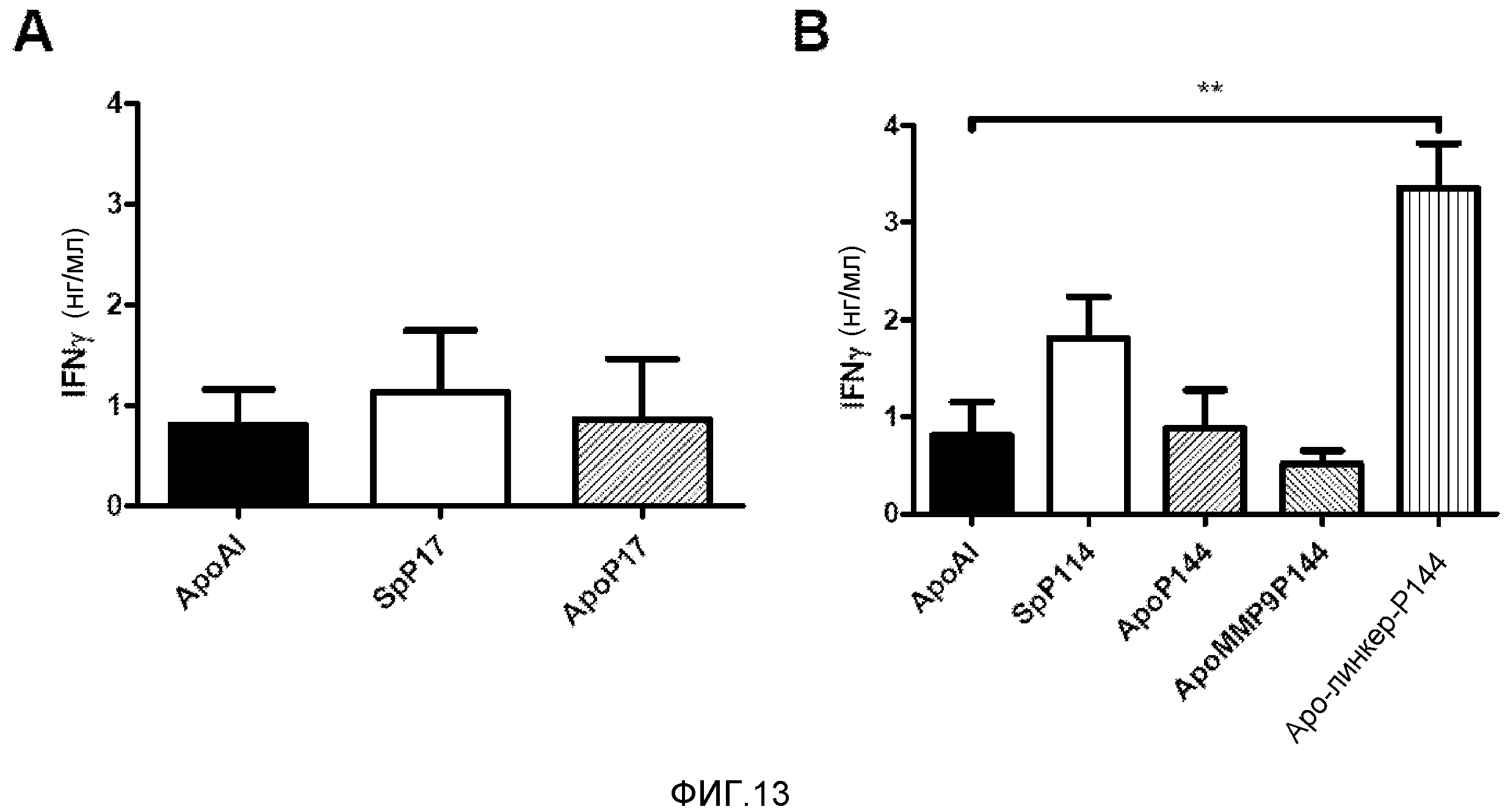
Фигура 13. Увеличение индукции IFNγ, вызванной IL12. Посредством гидродинамической инъекции вводили плазмиду, экспрессирующую IL12 под контролем промотора, индуцируемого доксициклином, и другую плазмиду, экспрессирующую контрольную конструкцию или одну из конструкций с ингибитором TGFβ p17 (A) или с ингибитором TGFβ p144 (B.) Через четыре дня, концентрации IFNγ в сыворотке оценивали методом твердофазного иммуноферментного анализа. Представлены среднее и стандартная ошибка среднего для типичного эксперимента с тремя животными в группе. Данные анализировали с помощью дисперсионного анализа с последующим тестом Даннетта, сравнивая экспериментальные группы с контрольной группой. ** p<0,001.
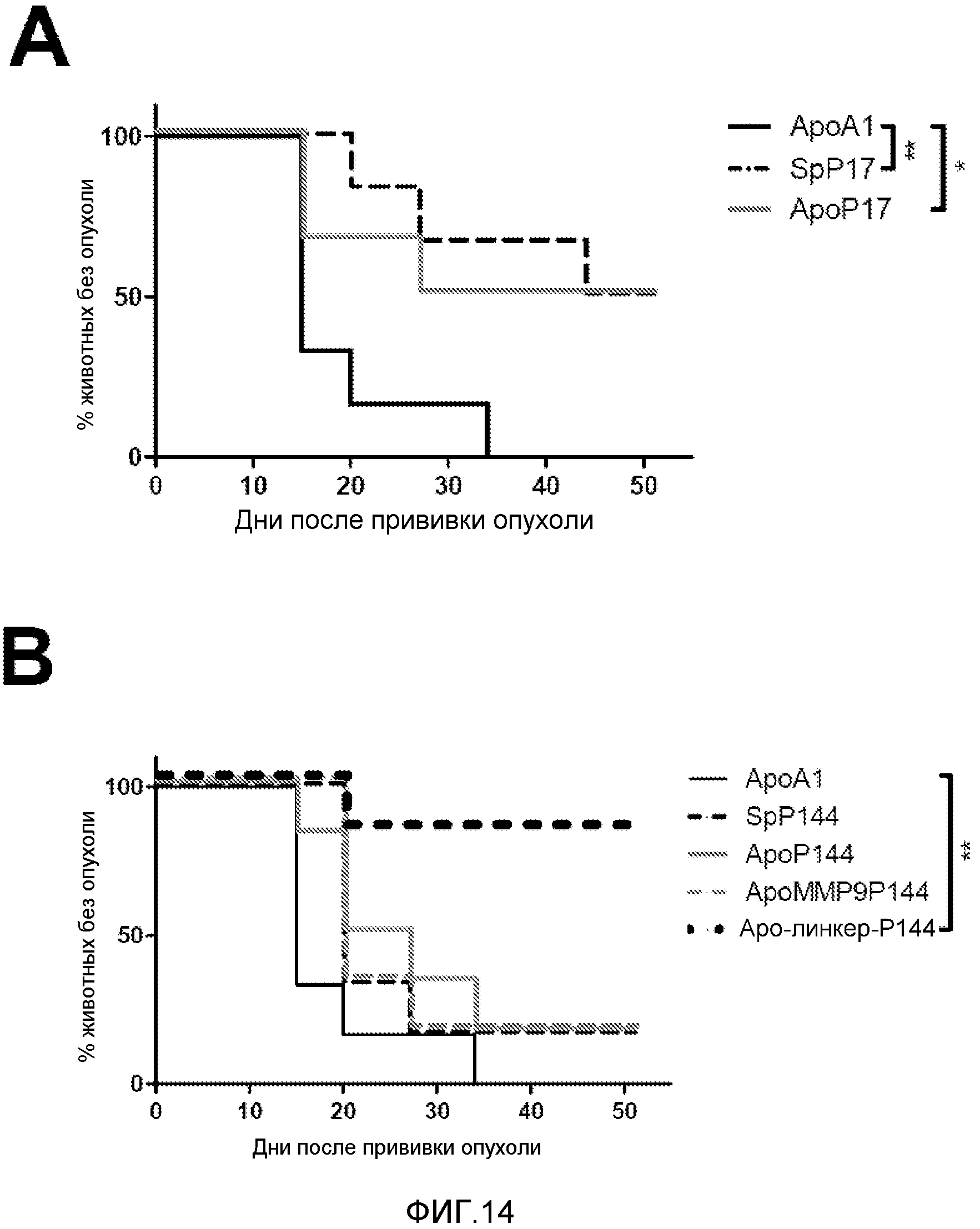
Фигура 14. Защита от развития опухолей CT26. Мышей BALB/c вакцинировали цитотоксическим пептидом AH1 в неполном адъюванте Фрейнда. Через 7 дней делали гидродинамическую инъекцию с конструкциями, экспрессирующими ингибиторы TGFβ или с ApoA-I в качестве контроля. Еще через 7 дней прививали подкожно 5×105 CT26 клеток и наблюдали со временем появление опухоли. Представлен процент мышей, у которых с течением времени не развилась опухоль. Экспериментальные группы сравнивали с контрольной группой по средним с помощью логарифмического рангового критерия. * p<0,05, ** p<0,001.
Фигура 15. Инкорпорация слитых белков Apo-линкер-P144 в циркулирующие липопротеины высокой плотности (ЛПВП). Мышам BALB/c вводили плазмиды, кодирующие конструкции с Apo или Apo-линкер-P144. Через 24 часа производили забор крови и выделяли сыворотку, из которой экстрагировали ЛПВП методом дифференциального центрифугирования в градиенте NaBr. Для того чтобы определить наличие аполипопротеина AI проводили Вестерн-блоттинг с фракциями, содержащими ЛПВП.
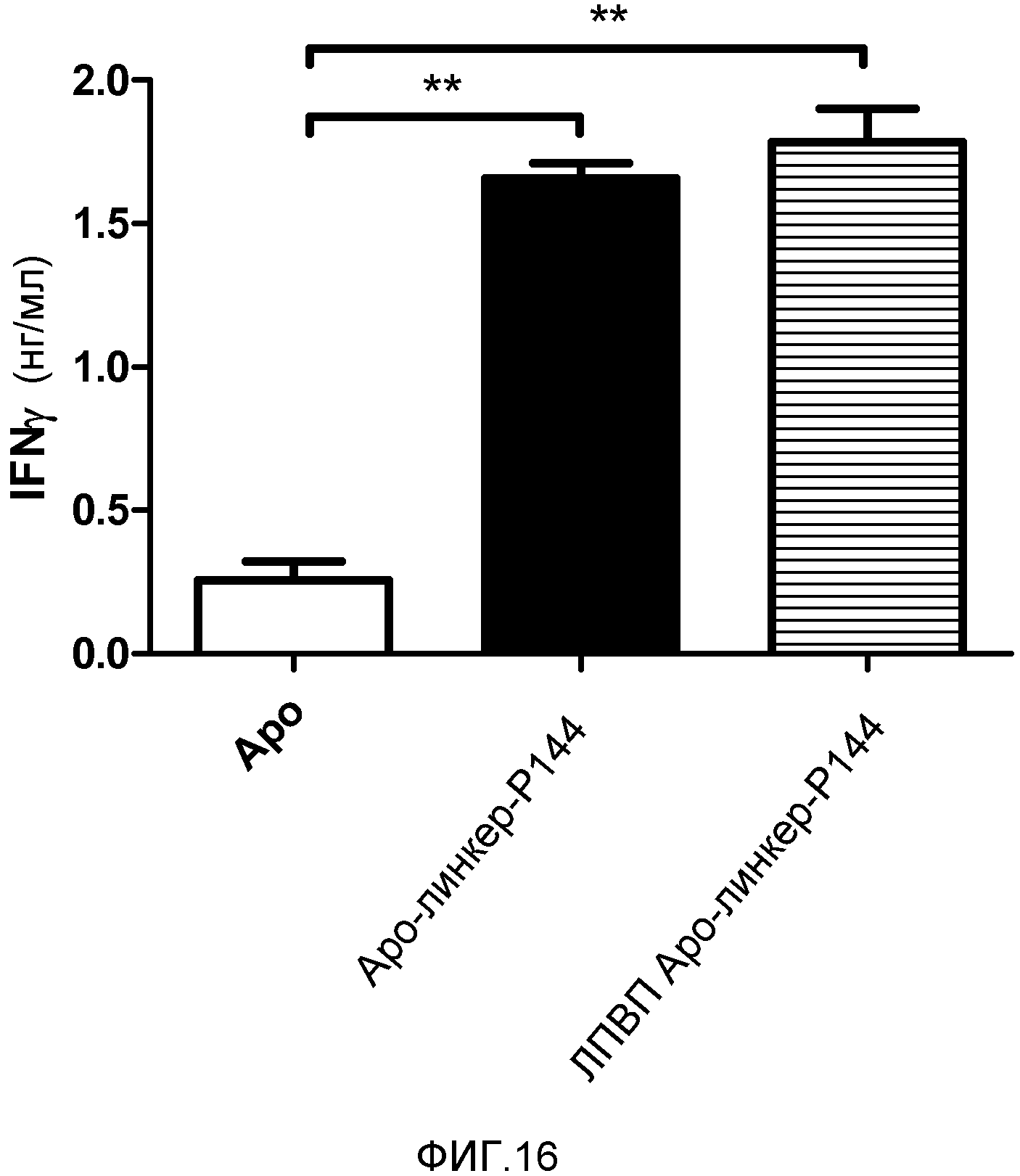
Фигура 16. Повышение индукции IFNγ, вызванной IL12, после введения ЛПВП, содержащих Apo-линкер-P144. Посредством гидродинамической инъекции вводили плазмиду, экспрессирующую IL12 под контролем промотора, индуцируемого доксициклином, и другую плазмиду, экспрессирующую контрольную конструкцию (Apo) или Apo-линкер-P144. Последней группе вводили плазмиду IL12 и делали интраперитонеальную инъекцию ЛПВП, содержащих Apo-линкер-P144 (14 мкг/мышь). Через четыре дня измеряли концентрации IFNγ в сыворотке методом твердофазного иммуноферментного анализа. Представлены среднее и стандартная ошибка среднего для типичного эксперимента с тремя животными в группе. Данные анализировали с помощью однофакторного дисперсионного анализа с последующим тестом Даннетта для сравнения экспериментальных групп с контрольной группой. ** P<0,01.
Подробное описание изобретения
1. Конъюгат по изобретению
Авторы по настоящему изобретению обнаружили, что конъюгаты, сформированные белком Apo A или его функционально эквивалентным вариантом и молекулой, представляющей терапевтический интерес, после их введения пациентам демонстрируют более длительное время полужизни в сыворотке, чем наблюдаемое у пациентов, которым вводили молекулу, представляющую терапевтический интерес, без конъюгата. Дополнительно, конъюгаты Apo A и молекулы, представляющей терапевтический интерес, доставляются точно в печень пациента, что значительно способствует лечению заболеваний печени и снижению побочных эффектов, возникающих за счет действия терапевтической молекулы на другие ткани.
Таким образом, в первом аспекте, изобретение относится к конъюгату, который содержит
(i) молекулу Apo A или ее функционально эквивалентный вариант и
(ii) соединение, представляющее терапевтический интерес,
где компоненты (i) и (ii) ковалентно связаны.
Без намерения быть связанными с какой-либо теорией, считают, что сродство конъюгатов к ткани печени обусловлено тем фактом, что указанная ткань имеет специфические рецепторы для белков Apo A, естественной функцией которых является захват ЛПВП, имеющих ApoA-I на своей поверхности. С другой стороны, более длительное время полужизни конъюгатов, видимо, связано с долгим временем полужизни молекул Apo A в организме (приблизительно 35 часов у людей или 10 часов у мышей в случае Apo AI). Кроме того, существуют другие клетки, экспрессирующие специфические рецепторы для ApoA-I на своей поверхности, которые дают возможность осуществлять доставку к другим тканям.
1.1 Молекула Apo A
В контексте настоящего изобретения под термином "белок Apo A" подразумевают любой член семейства Apo A, формирующий часть липопротеинов высокой плотности (ЛПВП) и способный специфически взаимодействовать с рецепторами на поверхности клеток печени, таким образом, обеспечивая свою способность переносить молекулы, прелставляющие интерес и спаренные с указанным белком Apo A, к данному органу.
Предпочтительно, молекулы Apo A, которые можно применять по настоящему изобретению, выбраны из группы, состоящей из ApoA-I, ApoA-II, ApoA-III, ApoA-IV и ApoA-V или их функциональных эквивалентных вариантов.
В предпочтительном варианте осуществления белок Apo A, использованный в настоящем изобретении, является белком ApoA-I. В контексте настоящего изобретения под ApoA-I подразумевают зрелую форму белка пре-проApoA-I, формирующую часть липопротеинов высокой плотности (ЛПВП). ApoAI синтезируется в виде предшественника (пре-проApoA-I), содержащего сигнальную последовательность для секреции, которая элиминируется, приводя к образованию предшественника. Сигнальная последовательность состоит из 18 аминокислот, пропептид из 6 аминокислот и зрелая форма белка из 243 аминокислот. Предпочтительно применение зрелой формы белка, у которой отсутствует сигнальный пептид и которая процессируется. В предпочтительном варианте осуществления белок ApoA-I человеческого происхождения и его аминокислотная последовательность показана в SEQ ID NO:1 (access number P02647 UniProt). В другом предпочтительном варианте осуществления белок ApoA-I мышиного или крысиного происхождения, в частности, от мыши, и его аминокислотная последовательность представлена в SEQ ID NO:2 (access number Q00623 UniProt). В другом предпочтительном варианте осуществления белок ApoA-I мышиного или крысиного происхождения, в частности, от крысы, и его аминокислотная последовательность представлена в SEQ ID NO:3 (access number P04639 UniProt).
Под функционально эквивалентным вариантом ApoA-I понимают все те полипептиды, которые образуются в результате вставки, замены или делеции одной или более аминокислот упомянутой ранее человеческой, мышиной или крысиной последовательности ApoA-I и по существу сохраняющие нетронутой способность взаимодействовать с так называемым "скэвенджер-рецептором класса B типа I” (SR-BI), который формирует рецептор ЛПВП, присутствующий на клетках печени. Способность взаимодействовать с рецептором ЛПВП определяется главным образом как описано Monaco et al. (EMBO J., 1987, 6:3253-3260) или посредством исследований связывания ApoA-I с мембраной гепатоцитов или посредством определения способности ApoA-I или варианта ингибировать связывание ЛПВП с рецепторами на мембранах гепатоцитов. Предпочтительно, константа диссоциации связывания варианта ApoA-I с мембранами гепатоцитов, по меньшей мере, 10-8 M, 10-7 M, 10-6 M, 10-5 M или 10-4 M.
Варианты ApoA-I, предусмотренные в контексте настоящего изобретения, включают пеполипептиды, показывающие, по меньшей мере, 60%, 65%, 70%, 72%, 74%, 76%, 78%, 80%, 90% или 95% сходства или идентичности с полипептидами ApoA-I. Степень идентичности между двумя полипептидами определяют с использованием компьютерных алгоритмов и способов, которые хорошо известны специалистам в данной области. Идентичность между двумя аминокислотными последовательностями предпочтительно определять с использованием алгоритма BLASTP (BLAST Manual, Altschul, S. et al., NCBI NLM NIH Bethesda, Md. 20894, Altschul S., et al., J., 1990, Mol. Biol.215:403-410).
Варианты ApoA-I, применяемые в контексте изобретения, предпочтительно имеют длительное время полужизни в сыворотке по отношению к нативному ApoA-I, что позволяет достичь более высоких уровней ApoA-I в сыворотке, чем наблюдаемые с ApoA-I. Способы для определения времени полужизни белка в сыворотке, в частности ApoA-I, известны в данной области и включают, среди прочих, использование способов, основанных на метаболическом мечении с помощью меченых белков, описанных Eisenberg, S. et al. (J.Lipid Res 1973, 14:446-458), by Blum et al. (J. Clin. Invest, 1977, 60:795-807) и Graversen et al. (J Cardiovasc Pharmacol., 2008, 51:170-177). Примером указанных вариантов, которые демонстрируют более длительное время полужизни, является, например, вариант под названием Milano (который содержит мутацию R173C).
1.2 Соединения, представляющие терапевтический интерес
В контексте настоящего изобретения "соединения, представляющие терапевтический интерес" следует понимать как любое соединение, которое способно предупреждать или устранять симптомы заболевания. Изобретение изначально предусматривает использование любого терапевтического соединения, которое предрасположено к ковалентной модификации без существенной потери своей биологической активности, так что оно может быть конъюгировано с ApoA-I или его функционально эквивалентным вариантом. Таким образом, изобретение предусматривает применение маленьких органических молекул, пептидов, пептидомиметиков, пептоидов, белков, полипептидов, гликопротеинов, олигосахаров, нуклеиновых кислот и т.п. в качестве терапевтически эффективного компонента.
Например, соединения, которые могут быть конъюгированы с ApoA-I или его функционально эквивалентным вариантом, включают антибиотики, холинэстеразные средства, атропин, скополамин, симпатомиметические перпараты, гипнотики, седативные препараты, антиконвульсанты, опиоиды, анальгетики, противовоспалительные лекарственные средства, гистамины, производные липидов, антиастматические лекарственные средства, жаропонижающие-анальгетические лекарственные средства, ксантины, осмотические диуретики, соединения ртути, тиазиды и сульфонамиды, ингибиторы карбоангидразы, органические нитраты, противогипертонические средства, сердечные гликозиды, антиаритмические препараты, окситоцин, простагландины, алкалоиды, вещества, снижающие родовую деятельность, противоглистные препараты, противопротозойные препараты, антималярийные препараты, амебициды, сульфонамиды, пенициллины, триметропин, цефалоспорины, сульфометоксазол, противогрибковые препараты, фторхинолоны, противовирусные препараты, антибиотики, аминогликозиды, тетрациклины, хлорамфеникол, эритромицин, алкилирующие средства, гормоны, антиметаболиты, антибиотики, радиоактивные изотопы, азатиоприн, хлорамбуцил, циклофосфамид, метотрексат, противосвертывающие препараты, тромболитики, антиагрегантные препараты, гормоны аденогипофиза, гормоны щитовидной железы и противотиреоидные гормоны, эстроген и прогестерон, андрогены, адренокортикотропин, инсулин, паратиреоидный гормон, стероидные производные витамина D, витамины (водорастворимые витамины, такие как комплекс витаминов группы В и аскорбиновая кислота, или жирорастворимые витамины, такие как витамины A, D, K или E), антигистаминные препараты, противоопухолевые лекарственные средства, противовирусные, противогрибковые соединения. Предпочтительно использовать соединения, которые применяют для лечения заболеваний, поражающих печень, или заболеваний печеночного генеза.
В предпочтительном варианте осуществления компонент (ii) конъюгатов по изобретению содержит полипептидную цепь. В предпочтительном варианте осуществления полипептид ApoA-I и полипептид, образующий компонент (ii), формируют единую полипептидную цепь. Настоящее изобретение предусматривает две взаимные ориентации обоих полипептидов. Таким образом, в предпочтительном варианте осуществления C-конец компонента (i) связан с N-концом компонента (ii). В другом предпочтительном варианте осуществления N-конец компонента (i) связан с C-концом компонента (ii). Предпочтительно, когда конъюгаты ApoA-I формируются единой полипептидной цепью, они не формируются посредством
(i) белка A S.aureus, связанного через его C-конец с N-концом белка ApoA-I.
(ii) ApoA-I белка, связанного через его C-конец с N-концом вазоинтестинального пептида (VIP-I)
(iii) компонента (ii), который является тяжелой цепью иммуноглобулина или фрагментом плазминогена.
(iv) домена тримеризации тетранектина (TTSE), связанного через его C-конец с N-концом белка ApoA-I.
Полипептиды, которые могут быть доставлены в печень с использованием конъюгатов по изобретению, включают эритропоэтин (EPO), лептины, адренокортикотропин-высвобождающий гормон (CRH), соматолиберин (GHRH), гонадотропин-высвобождающий гормон (GnRH), тиреотропин-высвобождающий гормон (TRH), пролактин-высвобождающий гормон (PRH), мелатонин-высвобождающий гормон (MRH), пролактин-ингибирующий гормон (PIH), соматостатин, адренокортикотропный гормон (ACTH), соматотропный гормон или гормон роста (GH), лютеинизирующий гормон (LH), фолликулостимулирующий гормон (FSH), тиреотропин (TSH или тиреотропный гормон), пролактин, окситоцин, антидиуретический гормон (ADH или вазопрессин), мелатонин, мюллерова ингибирующая субстанция, кальцитонин, паратиреоидный гормон, гастрин, холецистокинин (CCK), Arg-вазопрессин, тиреоидные гормоны, азоксиметан, трийодтиронин, LIF, амфирегулин, растворимый тромбомодулин, SCF, остеогенный белок 1, BMP, FGM, MGSA, херегулин, меланотропин, секретин, инсулиноподобный фактор роста-I (IGF-I), инсулиноподобный фактор роста-II (IGF-II), предсердный натрийуретический пептид (ANP), хорионический гонадотропин человека (hCG), инсулин, глюкагон, соматостатин, панкреатический полипептид (PP), лептин, нейропептид Y, ренин, ангиотензин I, ангиотензин II, фактор VIII, фактор IX, тканевой фактор, фактор VII, фактор X, тромбин, фактор V, фактор XI, фактор XIII, интерлейкин 1 (IL-1), интерлейкин 2 (IL-2), интерлейкин 3 ( IL-3), интерлейкин 4 (IL-4), интерлейкин 5 (IL-5), интерлейкин 6 (IL-6), интерлейкин 7 (IL-7), интерлейкин 8 (IL-8), интерлейкин 9 (IL-9), интерлейкин 10 (IL-10), интерлейкин 11 (IL-11), интерлейкин 12 (IL-12), интерлейкин 13 (IL-13), интерлейкин 14 (IL-14), интерлейкин 15 (IL-15) интерлейкин 16 (IL-16), интерлейкин 24 (IL-24), фактор некроза опухоли альфа (TNF-α), интерферон альфа, бета, гамма, CD3, CD134, CD137, ICAM-I, LFA-1, LFA-3, хемокины, включая RANTES 1α, MIP-1α, MIP-1β, фактор роста нервов (NGF), белок WT1, который кодируется геном-супрессором опухоли Вилмса, тромбоцитарный фактор роста (PDGF), трансформирующий фактор роста бета (TGF-бета), костные морфогенетические белки (BMP), факторы роста фибробластов (FGF и KGF), эпидермальный фактор роста (EGF и родственные), фактор роста эндотелия сосудов (VEGF) колониестимулирующий фактор гранулоцитов (GM-CSF), глиальный фактор роста, фактор роста кератиноцитов, фактор роста эндотелия сосудов, глиальный нейротрофический фактор (GDNF), альфа-1 антитрипсин, фактор некроза опухоли, гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), кардиотропин 1 (CT-1), онкостатин M (OSM), серпин (A1, A2, A3, A4, A5, A6, A7, A8, A9, A10, A11, A12, A13, B1, B2, B3, B4, B5, B6, B7, B8, B9, B10, B11, B12, B13, C1, D1, E1, E2, F1, F2, G1, H1, I1 и I2), циклоспорин, фибриноген, EDA домен фибронектина, лактоферрин, тканевой активатор плазминогена (tPA), химотрипсин, иммуноглобулины, гирудин, супероксиддисмутаза, имиглюцераза, β-глюкоцереброзидаза, альглюкозидаза-α, α-L-идуронидаза, идуронат-2-сульфатаза, галсульфаза, α-галактозидаза А человека, ингибитор протеиназы α-1, лактазы, ферменты поджелудочной железы (липаза, амилаза, протеаза), аденозиндеаминаза, иммуноглобулины, альбумин, токсины ботулизма типа A и B, коллагеназа, дезоксирибонуклеаза I человека, гиалуронидаза, папаин, L-аспарагиназа, лепирудин, стрептокиназа, порфобилиногендеаминаза (PBGD), пептидные ингибиторы клеточного трансформирующего фактора бета (TGF-β), ингибиторы IL10, ингибиторы FoxP3, ингибиторы TNFα, ингибиторы VEGF, ингибиторы PD-1I и ингибиторы CD152.
В предпочтительном варианте осуществления компонент (ii) конъюгата по изобретению является интерфероном (IFN). Интерфероны классифицируются как интерферон типа I, типа II и типа III. Интерфероны типа I представляют собой семейство полипептидов с цитокиновой активностью, которые изначально были открыты в результате их ингибирующей активности при вирусной инфекции на клеточных линиях in vitro (Pestka, S., Krause, CD. And Walter, MR 2004. Immunol Rev. 202:8-32) и которые характеризуются тем, что связываются с так называемым рецептором IFN-α (IFNAR). В зависимости от гомологии их последовательностей, интерфероны типа I классифицируют как интерферон-α (IFN-α), интерферон-β (IFN-β) и интерферон-ω (IFN-ω). IFN-α и IFN-β делят один димерный рецептор, который экспресируется на поверхности большинства ядросодержащих клеток. Функция этих цитокинов очень важна для иммунного ответа против различных типов вирусных инфекций, с учетом того, что они запускают механизмы гибели инфицированных клеток посредством апоптоза и ингибирование вирусной репликации, в то же самое время они способствуют презентации антигена. Недавно было экспериментально зафиксировано, что они также выполняют свои функции посредством прямой активации деятельности T, B и NK клеток, а также дендритных клеток при иммунном ответе (Le Bon A. et al., 2003. Nat Immunol. 4: 1009-1015; Le Bon A. et al., 2006. J. Immunol. 176:4682-4689; Le Bon A. et al., 2006. J Immunol. 176:2074-8). Интерфероны типа II характеризуются связыванием с рецептором интерферона гамма (IFNGR) и включают IFN-γ в качестве единственного члена. Интерфероны типа III передают свой сигнал через комплекс, сформированный рецептором 2 IL-10 (IL10R2) и рецептором IFN лямбда 1 (IFNLR1), и включают в себя три интерферона лямбда, именуемых IFN- λ1, IFN-λ2 и IFN-λ3.
В предпочтительном варианте осуществления компонент (ii) является интерфероном типа I, таким как IFN-α, IFN-β, IFN-δ, IFN-ε, IFN-k, IFN-τ и IFN-ω. В конкретном варианте осуществления, по меньшей мере, один интерферон типа I, включенный в композицию по изобретению, выбран из группы, состоящей из интерферона-альфа (IFN-α) и интерферона-бета (IFN-β). Когда интерферон типа I представляет собой IFN-α, последний может соответствовать любому интерферону, который кодируется любым геном семейства человеческих генов IFN-α. В конкретном варианте осуществления, по меньшей мере, один интерферон типа I является IFN-α, выбранным из группы, состоящей из IFN-α2a, IFN-α2b, IFN-α4, IFN-α5, IFN-α8 и их сочетаний, включая их комбинации с остальными веществами в фармацевтических составах. В более конкретном варианте осуществления, интерферон является IFN-α1, предпочтительно человеческого происхождения. В предпочтительном варианте осуществления интерферон является IFN-α5.
Список видов интерферона типа I, в частности IFN-α и IFN-β, которые можно использовать по изобретению, можно найти у Bekisz et al. (Growth Factors, 2004, 22: 243-251) и Petska et al. (Immunological Reviews, 2004, 202: 8-32). Дополнительно, изобретение относится к применению комбинаций конъюгатов, содержащих более чем один тип интерферона, таких как, например, IFN-αn1 (производное лимфобластов) или IFN-α3 (комбинация интерферонов, произведенных лимфоцитами человека, после стимуляции вирусом Сендаи (или другим вирусом) или частицами вируса).
Происхождение применяемого интерферона типа I не является критическим аспектом изобретения. Он может быть природного происхождения, экстрагированный и очищенный из биологических жидкостей или тканей, или произведенный посредством обычной рекомбинантной генетической инженерии и методов, таких как описанные в Sambrook и Russel (“Molecular Cloning: Laboratory Manual" by J. Sambrook, Russel DW Eds. 2001, third edition, Cold Spring Harbor, New York), с помощью синтеза или при помощи любого другого общепринятого способа, описанного в данной области.
В конкретном варианте осуществления изобретения, по меньшей мере, один интерферон типа I, включенный в композицию по изобретению, находится в пегилированной форме. Некоторые примеры приготовления пегилированных форм интерферона можно найти в US5762923 и US5766582. Дополнительно, также возможно использовать некоторые из форм интерферона, которые уже являются коммерчески доступными в пегилированной или непегилированной форме. Они включают, без каких-либо ограничений, Roferon-A (рекомбинантный IFN-α2a человека) и PEGASYS (пегилированный IFN-α) от Hoffmann La Roche Inc., INTRON-A (рекомбинантный IFN-α2b человека) и PEG-INTRON (пегилированный IFN-α2b) от Schering Corp., Alferon-N (IFN-α3n, комбинация интерферонов природного происхождения) от Interferon Sciences, или IFNERGEN (IFN-αcon1) от InterMune Pharmaceuticals Inc., последовательность которого представляет собой консенсусную последовательность, не полностью соответствующую природной последовательности. Также включены составы IFN-β, такие как, например AVONEX (IFN-β1a) от Biogen Idee, Rebif (IFN-β1a) от EMD Serano, Inc. и Betaseron (IFN-β1b) от Bayer Health Care.
В предпочтительном варианте осуществления конъюгат по изобретению образован ApoA-I, слитым своим C-концом посредством гибкого линкера с N-концом молекулы интерферона α1. В другом предпочтительном варианте осуществления конъюгат по изобретению образован молекулой интерферона α1, слитой своим C-концом посредством гибкого линкера с N-концом молекулы ApoA-I.
В другом предпочтительном варианте осуществления компонент (ii) является ингибитором TGF-бета. Ингибиторы TGF-бета, которые могут образовывать часть конъюгатов по изобретению, включают пептидные ингибиторы, выбранные из последовательностей рецептора TGF-бета 1, которые связываются с рецептор-связывающим сайтом в TGF-β1, таким образом, блокируя связывание с рецептором. Такие типы пептидов описаны в WO200031135, содержание которого в полном объеме включено в качестве ссылки. В предпочтительном варианте осуществления ингибиторный пептид TGF-β1 является производным TGF-β1 рецептора типа III. В более предпочтительном варианте осуществления ингибиторный пептид является пептидом p144 с последовательностью TSLDASIIWAMMQN (SEQ ID NO:4).
Изобретение также относится к применению пептидов, ингибирующих взаимодействие между TGFβ1 и рецептором TGFβ1 и передачу сигнала, происходящую в ответ на указанное взаимодействие, выявленные по генетической библиотеке фагового дисплея, как описано в WO200519244, содержание которого в полном объеме включено в качестве ссылки. В предпочтительном варианте осуществления ингибиторный пептид является пептидом p17 с последовательностью KRIWFIPRSSWYERA (SEQ ID NO:5), а также его усеченными вариантами, которые по существу сохраняют способность ингибировать взаимодействие между TGFβ1 и его рецептором, и которые описаны в WO2007048857, содержание которого в полном объеме включено в настоящее изобретение.
1.3. Линкерный элемент между компонентом ApoA и терапевтически активным соединением
Конъюгаты по изобретению, включающие белок Apo A и второй компонент пептидной природы, могут содержать связь, напрямую соединяющую белок Apo A и указанный второй компонент, или, альтернативно, могут содержать дополнительную аминокислотную последовательность, которая выступает в качестве линкера между белком Apo A и указанным вторым компонентом пептидной природы. По изобретению, указанная неприродная промежуточная аминокислотная последовательность действует в качестве шарнирной области между доменами, позволяя им двигаться независимо друг от друга, в то время как они сохраняют трехмерную форму отдельных доменов. В этом смысле, предпочтительная неприродная аминокислотная последовательность по изобретению будет шарнирной областью, которая характеризуется структурной пластичностью, позволяя данное движение. В конкретном варианте осуществления указанная неприродная промежуточная аминокислотная последовательность является неприродным гибким линкером. В предпочтительном варианте осуществления указанный гибкий линкер представляет собой гибкий линкерный пептид с длиной 20 или менее аминокислот. В более предпочтительном варианте осуществления линкерный пептид содержит 2 или более аминокислоты, выбранных из группы, состоящей из глицина, серина, аланина и треонина. В предпочтительном варианте осуществления изобретения, указанный гибкий линкер представляет собой полиглициновый линкер. Возможные примеры последовательностей линкера/спейсера включают SGGTSGSTSGTGST (SEQ ID NO:6), AGSSTGSSTGPGSTT (SEQ ID NO:7) или GGSGGAP (SEQ ID NO:8). Эти последовательности были использованы для связывания разработанных скрученных спиралей с другими белковыми доменами (Muller, K.M., Arndt, K.M. и Alber, T., Meth. Enzymology, 2000, 328: 261-281). Предпочтительно, указанный линкер включает в себя или состоит из аминокислотной последовательности GGGVEGGG (SEQ ID NO:9).
Действие линкерной области заключается в обеспечении пространства между Apo A и компонентом (ii). Следовательно, можно быть уверенным в том, что на вторичную структуру Apo A не влияет присутствие компонента (ii) и наоборот. Предпочтительно, спейсер имеет пептидную природу. Предпочтительно, линкерный пептид содержит, по меньшей мере, две аминокислоты, по меньшей мере, три аминокислоты, по меньшей мере, пять аминокислот, по меньшей мере, десять аминокислот, по меньшей мере, 15 аминокислот, по меньшей мере, 20 аминокислот, по меньшей мере, 30 аминокислот, по меньшей мере, 40 аминокислот, по меньшей мере, 50 аминокислот, по меньшей мере, 60 аминокислот, по меньшей мере, 70 аминокислот, по меньшей мере, 80 аминокислот, по меньшей мере, 90 аминокислот или приблизительно 100 аминокислот.
Линкер может быть присоединен к компонентам, фланкирующим два компонента конъюгатов по изобретению, посредством ковалентных связей, и предпочтительно спейсер является практически не иммуногенным и/или не включает никаких цистеиновых остатков. Аналогично, трехмерная структура спейсера является предпочтительно линейной или по существу линейной.
Предпочтительные примеры спейсерных или линкерных пептидов включают те пептиды, которые могут быть использованы для связывания белков без существенного ухудшения функций связанных белков или, по меньшей мере, без существенного ухудшения функции одного из связанных белков. Более предпочтительно, спейсеры или линкеры, использованные для связывания белков, содержат структуры со скрученными спиралями.
Линкер может включать остатки 53-56 тетранектина, формируя бета-складку в тетранектине, и остатки 57-59, формируя виток в тетранектине (Nielsen, B.B. et al, FEBS Lett. 412: 388-396, 1997). Последовательность сегмента представляет собой GTKVHMK (SEQ ID NO:10). Преимущество этого линкера в том, что он присутствует в нативном тетранектине и связывает домен тримеризации с цистеин-богатым доменом и, таким образом, в общем, подходит для связывания домена тримеризации с другим доменом. Более того, полученная конструкция, по-видимому, не будет более иммуногенной, чем конструкция без линкера.
Альтернативно, в качестве линкера может быть выбрана субпоследовательность из соединительной нити 3 фибронектина человека, соответствующая аминокислотам 1992-2102 (SWISSPROT numbering, entry P02751). Предпочтительно использовать последовательность PGTSGQQPSVGQQ (SEQ ID NO:11), соответствующую аминокислотам 2037-2049, внутри которой наиболее предпочтительным является фрагмент субпоследовательности GTSGQ (SEQ ID NO: 52), соответствующий аминокислотам 2038-2042. Преимущество этой конструкции в том, что она не очень устойчива к протеолитическому расщеплению и не слишком иммуногенна, поскольку фибронектин присутствует в высоких концентрациях в плазме.
Альтернативно, подходящий пептидный линкер может основываться на последовательности из 10 аминокислотных остатков верхней шарнирной области мышиного IgG3. Этот пептид (PKPSTPPGSS, SEQ ID NO:12) используют для создания антител, димеризованных посредством скрученной спирали (Pack P. и Pluckthun, A., 1992, Biochemistry 31:1579-1584), и его можно применять в качестве спейсерного пептида по настоящему изобретению. Даже более предпочтительной может быть соответствующая последовательность из верхней шарнирной области IgG3 человека. Последовательности IgG3 человека не будут иммуногенны для людей.
В предпочтительном варианте осуществления линкерный пептид выбран из группы пептидов с последовательностью APAETKAEPMT (SEQ ID NO:13) и пептида с последовательностью GAP.
Альтернативно, два компонента конъюгатов по изобретению могут быть соединены пептидом с последовательностью, которая содержит сайт расщепления для протеазы, и, следовательно, позволяет отделить ApoA-I от компонента (ii). Сайты расщепления для протеаз, подходящие для вставки в полипептиды по изобретению, включают энтерокиназный (сайт расщепления DDDDK SEQ ID NO:14), фактора Xa (сайт расщепления IEDGR, SEQ ID NO:15), тромбиновый (сайт расщепления LVPRGS, SEQ ID NO:16), протеазы TEV (сайт расщепления ENLYFQG, SEQ ID NO:17), протеазы PreScission (сайт расщепления LEVLFQGP, SEQ ID NO:18), интеиновый и т.п. В предпочтительном варианте осуществления сайт расщепления является сайтом расщепления для протеазы, экспрессирующейся в опухолевых тканях, в воспаленных тканях или в печени, так что разделение Apo A и компонента (ii) происходит, как только конъюгат попадает в печень. В предпочтительном варианте осуществления, линкер содержит участок распознавания для матриксной металлопротеиназы-9 (сайт расщепления LFPTS, SEQ ID NO:19).
2. Способы получения конъюгатов по изобретению
Конъюгаты по изобретению можно получать с использованием любого способа, известного специалистам в данной области. Таким образом, возможно получение белка ApoA или варианта указанного белка любым стандартным способом. Например, белок ApoA-I можно выделять из образцов сыворотки человека или лабораторных животных (WO9807751, WO9811140, Jackson et al., 1976, Biochim Biophys Acta 420:342-349, Borresen, A.L. и Kindt, T.J., 1978, J. Immunogenetics. 5:5-12 и Forgez, P, и Chapman, M.J., 1982, J. Biochem. Biophys. Methods, 6:283-96). Альтернативно, белок ApoA-I белок можно получать из кДНК, посредством экспрессии в гетерологичном организме, например, в таком как E.coli, S.cerevisiae, P.pastoris, клетки насекомых, с иcпользованием способов, известных в данной области, таких как описанные в WO07023476, WO9525786, WO8702062, Feng et al. (Protein. Expr. Purif., 2006, 46:337-42), Pyle et al, 1996 Biochemistry. 35:12046-52), Brissette et al, (Protein Expr. Purif. 1991, 2:296-303) и Bonen, D.K. (J. Biol. Chem 1997, 272:5659-67).
Как только имеется достаточное количество очищенного белка ApoA, его нужно конъюгировать с соединением, представляющим терапевтический интерес. Конъюгацию терапевтически активного компонента (ii) с молекулой Apo A можно проводить различными путями. Одной возможностью является прямая конъюгация функциональной группы с терапевтически активным компонентом в положении, которое не нарушает активность указанного компонента. Под функциональными группами в настоящем изобретении понимают группу специфических атомов в молекуле, которые отвечают за характеристическую химическую рекцию данной молекулы. Примеры функциональных групп включают в качестве неограничивающих примеров гидрокси, альдегид, алкил, алкенил, алкинил, амид, карбоксамид, первичные, вторичные, третичные и четвертичные амины, аминокси, азид, азо (диимид), бензил, карбонат, сложный эфир, простой эфир, глиоксил, галогеналкил, галогенформил, имин, имид, кетон, малеимид, изоцианид, изоцианат, карбонил, нитрат, нитрит, нитро, нитрозo, пероксид, фенил, фосфин, фосфат, фосфоно, пиридил, сульфид, сульфонил, сульфинил, тиоэфир, тиол и окисленные 3,4-дигидроксифенилаланиновые группы (DOPA). Примерами указанных групп являются малеимидная или глиоксиловая группы, которые специфически реагируют с тиоловыми группами в молекуле Apo A и окисленными 3,4-дигидроксифенилаланиновыми (DOPA) группами, которые реагируют с первичными аминовыми группами в молекуле Apo A.
Другой возможностью является конъюгация терапевтически активного компонента (ii) с молекулой Apo A с использованием гомо- и гетеробифункциональных групп. Бифункциональную группу можно конъюгировать сначала с терапевтически активным соединением и потом конъюгировать с белком Apo A или, альтернативно, возможно конъюгировать бифункциональную группу с белком Apo A, и затем конъюгировать ее с терапевтически активным соединением. Примеры, иллюстрирующие такие типы конъюгатов, включают конъюгаты, известные как кетон-оксимы (описанные в US20050255042), в которых первый компонент конъюгата содержит аминоксигруппу, связанную с кетоновой группой, присутствующей в гетеробифункциональной группе, которая, в свою, очередь, связана с аминогруппой во втором компоненте конъюгата.
В других вариантах осуществления агент, который используют для конъюгации компонентов (i) и (ii) конъюгатов по изобретению, можно подвергнуть фотолитической, химической, термальной или ферментативной обработке. В частности, интересно использовать связывающие агенты, которые можно гидролизовать ферментами, находящимися в клетке-мишени, так что терапевтически активное соединение высвобождалось бы только внутри клетки. Примеры связывающих агентов, которые можно подвергнуть обработке внутриклеточно, описаны в WO04054622, WO06107617, WO07046893 и WO07112193.
В предпочтительном варианте осуществления компонент (ii) конъюгата по изобретению является соединением пептидной природы, включая как олигопептиды, так и пептиды. Способы химической модификации полипептидной цепи хорошо известны специалистам в данной области и включают способы, основанные на конъюгации с использованием тиоловых групп, присутствующих в молекулах цистеина, способы, основанные на конъюгации с использованием первичных аминогрупп, присутствующих в молекулах лизина (US6809186), способы, основанные на конъюгации с использованием N- и C-концевых частей. Реагенты, подходящие для модификации полипептидов, которые позволяют им спариваться с другими соединениями, включают: глутаральдегид (позволяет соединениям связываться с N-концом полипептида), карбодиимид (позволяет связать соединение с C-концом полипептида), сложные эфиры сукцинимида (например, MBS, SMCC), которые позволяют активировать N-конец и цистеиновые части, бензидин (BDB), который позволяет активировать тирозиновые участки, периодат, который позволяет активировать углеводородные части гликозилированных белков.
В конкретном случае, когда компонент ApoA и соединение, представляющее терапевтический интерес, образуют единую пептидную цепь, возможно экспрессировать конъюгат одномоментно при помощи генетической конструкции по изобретению, кодирующей указанный конъюгат, для чего указанная конструкция вместе с контрольными элементами транскрипции, и по желанию, трансляции, внедряется в вектор, подходящий для ее экспрессии в гетерологичном организме. Контрольные элементы транскрипции и, при желании, трансляции, присутствующие в экспрессирующей кассете по изобретению, включают промоторы, которые направляют транскрипцию нуклеотидной последовательности, с которой они оперативно связаны, и другие последовательности, необходимые или подходящие для транскрипции и ее удобной регуляции по времени и месту, например, сигналы начала и окончания, сайты расщепления, сигнал полиаденилирования, участок начала репликации, энхансеры транскрипции, сайленсеры транскрипции и т.д. Указанные элементы, а также векторы, которые используют для создания экспрессирующих кассет и рекомбинантные векторы по изобретению, как правило, выбирают в зависимости от клеток-хозяев, которые будут использованы.
3. Полинуклеотиды, генные конструкции, векторы, клетки-хозяева по изобретению.
В другом аспекте изобретение относится к полинуклеотиду, кодирующему полипептид по изобретению. Специалистам в данной области ясно, что полинуклеотиды по изобретению будут кодировать только те конъюгаты, в которых компонент (ii) имеет пептидную природу и в которых полипептид Apo A формирует единую пептидную цепь, независимо от взаимной ориентации, и вне зависимости от того, соединены оба компонента напрямую или разделены спейсерной областью.
В другом аспекте изобретение относится к генетической конструкции, которая содержит полинуклеотид по изобретению. Предпочтительно, конструкция содержит полинуклеотид по изобретению, помещенный под оперативный контроль последовательностей, которые регулируют экспрессию полинуклеотида по изобретению. Специалистам в данной области ясно, что полинуклеотиды по изобретению должны попасть в ядро в ткани-мишени, и там транскрибироваться и транслироваться для образования биологически активного слитого белка. По этой причине, когда вводимый активный ингредиент является полинуклеотидом, он предпочтительно должен кодировать форму предшественника пре-проApoA1 или форму предшественника варианта ApoA1, так что после экспрессии он секретируется с помощью сигнальной последовательности и подвергается обработке для образования зрелого ApoA1.
В случае если конъюгат, который должен экспрессироваться, образован Apo A, слитым своим С-концом с молекулой интерферона, предпочтительно, чтобы полинуклеотид, который кодирует конъюгат, предварялся последовательностью, кодирующей сигнальную последовательность ApoA1. В случае если конъюгат, который должен экспрессироваться, образован молекулой интерферона, слитой своим С-концом с N-концом молекулы ApoA1, предпочтительно, чтобы полинуклеотид, который кодирует конъюгат, предварялся последовательностью, кодирующей сигнальную последовательность интерферона α1.
В принципе, любой промотор можно использовать для генетических конструкций по настоящему изобретению при условии, что указанный промотор совместим с клетками, в которых будет экспрессироваться полинуклеотид. Таким образом, подходящие промоторы для осуществления настоящего изобретения включают в качестве неограничивающих примеров, конститутивные промоторы, такие как производные геномов эукариотических вирусов, таких как вирус полиомы, аденовирус, SV40, CMV, вирус саркомы обезьян, вирус гепатита B, промотор гена металлотионеина, промотор гена тимидинкиназы вируса простого герпеса, LTR области ретровирусов, промотор гена иммуноглобулина, промотор гена актина, промотор гена EF-1 альфа, а также индуцибельные промоторы, при которых экспрессия белка зависит от добавления молекулы или экзогенного сигнала, такие как тетрациклиновая система, система NFκB/УФ свет, система Cre/Lox и промотор генов теплового шока, промоторы, которые регулируются РНК-полимеразой II, описанные в WO/2006/135436, и тканеспецифические промоторы. В предпочтительном варианте осуществления генные конструкции по изобретению содержат усиливающие экспрессию участки, присутствующие в промоторных областях генов, которые экспрессируются, главным образом, в печени, таких как гены сывороточного альбумина человека, гены протромбина, гены альфа-1-микроглобулина или гены альдолазы. Эти участки содержатся либо в виде единичной копии или нескольких копий, и либо сами по себе, либо в комбинации с другими элементами, специфически экспрессирующимися в печени, такими как промоторы цитомегаловируса, альфа-1-антитрипсина и альбумина.
Другие примеры тканеспецифических промоторов включают промотор гена альбумина (Miyatake et al., 1997, J. Virol, 71:5124-32), промотор сердцевины вируса гепатита (Sandig et al., 1996, Gene Ther., 3:1002-9), промотор гена альфа-фетопротеина (Arbuthnot et al., 1996, Hum.GeneTher., 7:1503-14), и промотор глобулинсвязывающего белка, который связывается с тироксином (Wang, L., et al., 1997, Proc Natl. Acad. Sci. USA 94:11563-11566).
Полинуклеотиды по изобретению или генные конструкции, образующие их, могут являться частью вектора. Таким образом, в другом аспекте изобретение относится к вектору, который содержит полинуклеотид или генную конструкцию по изобретению. Специалистам в данной области будет ясно, что нет никаких ограничений по типу вектора, который можно использовать, потому что указанный вектор может быть клонирующим вектором, подходящим для распространения и для получения полинуклеотидов, или подходящих генных конструкций, или экспрессирующими векторами в различных гетерологичных организмах, подходящих для выделения конъюгата. Таким образом, подходящие векторы по настоящему изобретению включают прокариотические экспрессирующие векторы, такие как pUC18, pUC19, Bluescript и их производные, mp18, mp19, pBR322, pMB9, CoIE1, pCR1, RP4, фаги и шаттл-векторы, такие как pSA3 и pAT28, дрожжевые экспрессирующие векторы, такие как векторы типа двухмикронных плазмид, интегрирующие плазмиды, векторы YEP, центромерные плазмиды и т.п, экспрессирующие векторы для клеток насекомых, такие как серии PAC и pVL, растительные экспрессирующие векторы, такие как векторы серий pIBI, pEarleyGate, pAVA, pCAMBIA, pGSA, pGWB, pMDC, pMY, pORE и т.п., экспрессирующие векторы клеток высших эукариот, основанные на вирусных векторах (аденовирусы, вирусы связанные с аденовирусами, а также ретровирусы и лентивирусы), а также невирусные векторы, такие как pSilencer 4.1-CMV (Ambion), pcDNA3, pcDNA3.1/hyg pHCMV/Zeo, pCR3.1, pEF1/His, pIND/GS, pRc/HCMV2, pSV40/Zeo2, pTRACER-HCMV, pUB6/V5-His, pVAX1, pZeoSV2, pCI, pSVL и pKSV-10, pBPV-1, pML2d и pTDT1.
Вектор по изобретению можно использовать для трансформации, трансфекции или инфицирования клеток, которые можно трансформировать, трансфецировать или инфицировать указанным вектором. Указанные клетки могут быть прокариотическими или эукариотическими. Например, вектор, в который вставляют последовательность ДНК, может быть плазмидой или вектором, который при введении в клетку-хозяина, интегрируется в геном указанной клетки и реплицируется вместе с хромосомой (или хромосомами), в которую он интегрировался. Указанный вектор можно получать обычными способами, которые известны специалистам в данной области (Sambrook et al., 2001, выше).
Таким образом, в другом аспекте изобретение относится к клетке, которая содержит полинуклеотид, генную конструкцию или вектор по изобретению, для чего указанную клетку удалось трансформировать, трансфецировать или инфицировать конструкцией или вектором по изобретению. Трансформированные, трансфецированные или инфицированные клетки можно получать обычными способами, известными специалистам в данной области (Sambrook et al., 2001, выше). В конкретном варианте осуществления указанная клетка-хозяин является животной клеткой, которая трансфецирована или инфицирована подходящим вектором.
Клетки-хозяева, подходящие для экспрессии конъюгатов по изобретению, включают в качестве неограничивающих примеров клетки млекопитающих, растений, насекомых, грибов и бактерий. Бактериальные клетки включают в качестве неограничивающих примеров клетки грамположительных бактерий, такие как клетки видов семейств Bacillus, Streptomyces и Staphylococcus и клетки грамотрицательных бактерий, такие как клетки семейств Escherichia и Pseudomonas. Клетки грибов предпочтительно включают дрожжевые клетки, такие как Saccharomyces, Pichia pastoris и Hansenula polymorpha. Клетки насекомых включают в качестве неограничивающих примеров, клетки Drosophila и клетки Sf9. Растительные клетки включают, среди прочих, клетки сельскохозяйственных растений, таких как хлебные злаки, клетки лекарственных растений, декоративных или луковичных растений. Клетки млекопитающих, подходящие по настоящему изобретению, включают линии эпителиальных клеток (свиньи и т.д.), клеточные линии остеосаркомы (человека и т.д.), клеточные линии нейробластомы (человека и т.д.), эпителиальной карциномы (человека и т.д.), глиальные клетки (мышиные и т.д.), линии клеток печени (мартышки и т.д.), клетки CHO (китайского хомяка), клетки COS, клетки BHK, клетки HeLa, 911, AT1080, A549, 293 или PER.C6, клетки NTERA-2 ECC человека, клетки D3 клеточной линии mESC, эмбриональные стволовые клетки человека, такие как HS293 и BGVO1, SHEF1, SHEF2 и HS181, клетки NIH3T3, 293T, REH и MCF-7 и клетки hMSC.
В другом аспекте изобретение относится к нанолипочастице, которая содержит конъюгат по изобретению.
Использованный в настоящем документе термин "нанолипочастица" является эквивалентом термина "липопротеин" или "липопротеиновая частица" и может быть использован взаимозаменяемо. Под нанолипочастицей в настоящем документе подразумевают любую водорастворимую частицу, сформированную ядром из неполярных липидов (таких как эфиры хлестерина и триглицериды), которое покрыто внешней полярной оболочкой из аполипопротеинов, фосфолипидов и свободного холестерина.
Нанолипочастицы или липопротеины классифицируют в зависимости от их плотности на хиломикроны, липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛПП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП). Особенности различных липопротеинов представлены в Таблице 1.
В конкретном варианте осуществления нанолипочастицы по изобретению представляют собой ЛПВП, состав которых приведен в Таблице 1, и где белковая фракция образована Apo A, Apo C, Apo D и Apo E.
Наночастицы по изобретению можно получить способами, которые известны специалистам в данной области. Например, нанолипочастицы можно получить in vitro путем добавления холестерина и фосфатидилхолина к конъюгату по изобретению, как описано Lerch et al (Vox Sang, 1996, 71:155-164) или in vivo с использованием трансгенных животных, которые экспрессируют в печени конъюгат по изобретению с последующей секрецией наночастиц в сыворотку, из которой они могут быть выделены.
4. Медицинское применение конъюгатов по изобретению
Конъюгаты по изобретению можно использовать для стабилизации и доставки в печень соединений, представляющих терапевтический интерес. Таким образом, в другом аспекте изобретение относится к фармацевтическому препарату, который содержит терапевтически эффективное количество конъюгата, полинуклеотида, генной конструкции, вектора, или клеток-хозяев или нанолипочастиц по изобретению, и фармацевтически приемлемый носитель или эксципиент.
В другом аспекте изобретение относится к полипептиду по изобретению, полинуклеотиду по изобретению, генной конструкции по изобретению, вектору по изобретению, нанолипочастице по изобретению или фармацевтической композиции для применения в медицине.
Для применения в медицине, конъюгаты по изобретению можно создать в форме пролекарства, соли, сольвата или клатрата, или отдельно или в сочетании с дополнительными активными средствами. Комбинации соединений по настоящему изобретению можно соединять вместе с носителем, приемлемым с фармацевтической точки зрения. Предпочтительные эксципиенты для применения в настоящем изобретении включают сахара, крахмалы, целлюлозу, камеди и белки. В конкретном варианте осуществления фармацевтическая композиция по изобретению составлена в виде твердой лекарственной формы (например, таблетки, капсулы, таблетки, покрытые оболочкой, гранулы, суппозитории, кристаллические или аморфные стерильные твердые формы, которые можно восстановить для получения жидких форм и т.д.), жидкой лекарственной формы (например, растворы, суспензии, эмульсии, эликсиры, лосьоны, мази и т.д.) или полутвердой лекарственной формы (гели, мази, кремы и т.п.). Фармацевтические композиции по изобретению можно вводить любым путем, включая, в качестве неограничивающих примеров, оральный, внутривенный, внутримышечный, внутриартериальный, интрамедуллярный, внутриоболочечный, внутрижелудочковый, трансдермальный, подкожный, интраперитонеальный, интраназальный, энтеральный, наружный, сублингвальный или ректальный пути введения. Обзор различных форм введения активных ингредиентов, применяемых эксципиентов и процессов для их производства можно найти в Tratado de Farmacia Galenica, C. Fauli i Trillo, Luzan 5, S. A. Ediciones, 1993 и в Remington's Pharmaceutical Sciences (A.R. Gennaro, Ed.), 20th edition, Williams & Wilkins PA, USA (2000). Примеры фармацевтически приемлемых носителей известны в данной области и включают растворы фосфатно-солевого буфера, воду, эмульсии, такие как эмульсия вида масло/вода, различные типы увлажнителей, стерильные растворы, и т.д. Композиции, которые содержат указанные носители, можно составить стандартными способами, известными в данной области.
В случае, когда вводят нуклеиновые кислоты (полинуклеотиды по изобретению, векторы или генные конструкции), изобретение относится к фармацевтическим композициям, специально приготовленным для введения указанных нуклеиновых кислот. Фармацевтические композиции могут содержать указанные нуклеиновые кислоты в чистом виде, т.е. в отсутствие соединений, которые защищают нуклеиновые кислоты от деградации нуклеазами в организме, что дает преимущество в виде устранения токсичности, связанной с реагентами, которые применяются при трансфекции. Удобные пути для введения соединений в чистом виде включают внутрисосудистый, внутриопухолевый, внутричерепной, интраперитонеальный, внутриселезеночный, внутримышечный, субретинальный, подкожный, введение в слизистую, наружный и оральный пути введения (Templeton, 2002, DNA Cell Biol, 21:857-867). Альтернативно, нуклеиновые кислоты можно вводить в качестве части липосом, конъюгированные с холестерином или конъюгированные с соединениями, которые обеспечивают перенос через мембраны клеток, такими как пептид Tat (производное белка TAT ВИЧ-1), третья спираль гомеодомена белка Antennapedia D.melanogaster, белок VP22 вируса простого герпеса, олигомеры аргинина и пептиды, описанные в WO07009090 (Lindgren, A. et al., 2000, Trends Pharmacol. Sci, 21:99-103, Schwarze, S.R. et al., 2000, Trends Phaрnacol. Sci, 21:45-48, Lundberg, M et al., 2003, Mol. Therapy 8:143-150 и Snyder, E.L. и Dowdy, S.F., 2004, Pharm. Res. 21:389-393). Альтернативно, полинуклеотид можно вводить в виде составной части плазмидного или вирусного вектора, предпочтительно, векторов на основе аденовирусов, в аденоассоциированных вирусах или ретровирусах, таких как вирусы на основе вируса мышиного (MLV) или лентивируса (HIV, FIV, EIAV).
В другом варианте осуществления композиции и полинуклеотиды по изобретению вводят посредством так называемого “гидродинамического введения" как описано Liu, F., et al. (Gene Ther, 1999, 6:1258-66). Согласно указанному способу, соединения вводят в организм внутрисосудистым путем с большой скоростью и объемом, что приводит к высоким уровням трансфекции с более диффузным распределением. Показано, что эффективность внутриклеточного доступа напрямую зависит от объема вводимой жидкости и скорости инъецирования (Liu et al., 1999, Science, 305:1437-1441). У мышей введение оптимизировано как 1 мл/10 г массы тела в период 3-5 секунд (Hodges et al., 2003, Exp.Opin.Biol.Ther, 3:91-918). Точный механизм, дающий возможность трансфецировать клетки полинуклеотидами in vivo после их гидродинамического введения, полностью не известен. В случае мышей, полагают, что введение через хвостовую вену удается только при скорости, превышающей сердечную скорость, что приводит к накоплению вводимой жидкости в верхней полой вене. Эта жидкость по существу достигает сосудов в органах, и, по существу, через поры в указанных сосудах попадает во внесосудистое пространство. Таким образом, полинуклеотид контактирует с клетками в органе-мишени, прежде чем он успевает смешаться с кровью, и, таким образом, снижается вероятность его деградации нуклеазами.
Композиции по изобретению можно вводить в дозах менее чем 10 мг на килограмм массы тела, предпочтительно менее чем 5, 2, 1, 0,5, 0,1, 0,05, 0,01, 0,005, 0,001, 0,0005, 0,0001, 0,00005 или 0,00001 мг на кг массы тела, и менее чем 200 нмоль РНК-агента, т.е. приблизительно 4,4 × 1016 копий на кг массы тела или менее чем 1500, 750, 300, 150, 75, 15, 7,5, 1,5, 0,75, 0,15 или 0,075 нмоль на кг массы тела. Разовую дозу можно вводить посредством инъекции, ингаляции, или местного введения. Бифункциональные полинуклеотиды и композиции по изобретению можно вводить прямо в орган, в котором экспрессируется мРНК-мишень, в этом случае вводят дозы в диапазоне от 0,00001 мг до 3 мг на орган, или предпочтительно от 0,0001 и 0,001 мг на орган, приблизительно 0,03 и 3,0 мг на орган, приблизительно от 0,1 до 3,0 мг на орган, или от 0,3 и 3,0 мг на орган.
Доза зависит от тяжести состояния, которое лечат, и ответа на лечение, и может варьировать в промежутке от нескольких дней до нескольких месяцев или до тех пор, пока не будет отмечено, что состояние перешло в стадию ремиссии. Оптимальную дозировку можно определить, проводя периодические измерения концентрации средства в организме пациента. Оптимальную дозу можно определить по величинам EC50, полученным с помощью предварительных тестов in vitro или in vivo на животных моделях. Разовую дозу можно вводить один раз в день или реже чем один раз в день, предпочтительно, менее чем один раз каждые 2, 4, 8 или 30 дней. Альтернативно, возможно вводить начальную дозу, за которой следуют одна или несколько поддерживающих доз, обычно меньшего количества, чем начальная доза. Поддерживающая схема лечения может включать лечение пациента дозами в диапазоне от 0,01 мг и 1,4 мг/кг массы тела в сутки, например 10, 1, 0,1, 0,01, 0,001 или 0,00001 мг на кг массы тела в сутки. Поддерживающую дозу вводят предпочтительно не более одного раза каждые 5, 10 или 30 дней. Лечение должно быть продолжено в течение периода времени, который будет варьировать в зависимости от заболевания, которым страдает пациент, тяжести заболевания и состояния пациента. После лечения, необходимо следить за изменением состояния пациента для того чтобы определить, следует ли увеличить дозу в случае, когда заболевание не отвечает на лечение, или понизить дозу, если наблюдается улучшение заболевания или отмечены нежелательные побочные эффекты.
Суточную дозу можно вводить в виде единичной дозы или двух и более доз в зависимости от конкретных обстоятельств. Если желательно повторное или частое введение, рекомендуется имплантация источника введения, такого как помпа, временный катетер (внутривенный, интраперитонеальный, внутрижелудочковый или внутрикапсульный) или резервуар.
Конъюгаты по изобретению, кодирующие их полинуклеотиды, генные конструкции и векторы, содержащие указанные полинуклеотиды, и нанолипочастицы по изобретению можно применять в способах терапевтического лечения, которые дают возможность указанным конъюгатам доставить к ткани-мишени соединение, представляющее терапевтический интерес. Специалисту в данной области будет ясно, что заболевания, которые можно лечить с помощью соединений по изобретению, будут зависеть от (i) активного компонента, который связан с Apo A, и (ii) ткани, к которой нужно доставить указанные конъюгаты. Таблица 2 описывает, в качестве неограничивающих примеров, возможные заболевания, которые можно лечить указанными конъюгатами, и активный ингредиент, который мог бы быть включен в конъюгат:
Конъюгаты по изобретению обладают способностью быть направленными к тем органам или тканям, в которых есть экспрессия поверхностных молекул с достаточным сродством к ApoA и способностью интернализироваться после связывания с указанным полипептидом. Такие поверхностные молекулы включают SR-B1 (скэвенджер рецептор B тип 1), SR-A1 (скэвенджер рецептор A тип 1), SR-A2 (скэвенджер рецептор A тип 2) и SR-C (скэвенджер рецептор C). Таким образом, терапевтически активные соединения могут быть доставлены к указанным органам-мишеням или тканям-мишеням. Такие органы включают не только печень, но также все клетки, экспрессирующие на своей поверхности достаточное количество рецептора SR-B1. Таким образом, пример 7 по настоящему изобретению иллюстрирует присутствие рецептора SR-B1 в различных популяциях клеток иммунной системы и, в частности у CD4+ T-клеток, CD8+ T-клеток, у NK клеток, дендритных клеток и моноцитов/макрофагов. Таким образом, изобретение относится также к применению конъюгатов по изобретению для лечения заболеваний, связанных с иммунной системой. Кроме того, известна экспрессия рецептора SR-BI в остеокластах (Brodeur et al., 2008, J. Bone Miner Res 23:326-37) в эндотелиальных клетках (Yeh et al., 2002, Atherosclerosis, 161:95-103), кишечном эпителии (Cai, S.F. et al., 2001, J. Lipid Res. 42:902-909), в эпителии желчных протоков (Miquel et al., Gut, 2003, 52:1017-1024), жировой ткани (Acton et al., 1994, J.Biol.Chem., 269:21003-21009) и легких (Acton et al., 1994, J.Biol.Chem., 269:21003-21009).
Вследствие этого конъюгаты по настоящему изобретению подходят для доставки соединений, представляющих терапевтический интерес, к указанным ранее отделам. Таким образом, с учетом органа-мишени, конъюгаты по изобретению можно использовать для лечения заболеваний печени, таких как внутрипеченочный холестаз, жировая дистрофия печени (алкогольная жировая дистрофия печени, синдром Рейе), тромбоз печеночной вены, гепатолентикулярная дегенерация, гепатомегалия, гепатопульмонарный синдром, гепаторенальный синдром, портальная гипертензия, абсцесс печени, цирроз (алкогольный, билиарный и экспериментальный), алкогольные заболевания печени (жировая дистрофия печени, гепатит, цирроз), паразитарные заболевания (эхинококкоз, фасциолез, амебный абсцесс печени), желтуха (гемолитическая, гепатоцеллюлярная, холестатическая), гепатиты (алкогольный гепатит, хронический гепатит, аутоиммунный гепатит, гепатит B, гепатит C, гепатит D, лекарственно-индуцированные гепатиты, токсический гепатит, вирусные гепатиты (гепатиты A, B, C, D и E), болезнь Вильсона заболевание, гранулематозный гепатоз, вторичный билиарный цирроз, первичный биллиарный цирроз, гепатическая энцефалопатия, портальная гипертензия, гепатоцеллюлярная аденома, гемангиома, камни желчного пузыря, неоплазии печени (ангиомиолипома, кальцифицированные метастазы печени, кистозные метастазы печени, фиброламеллярная гепатокарцинома, очаговая узловая гиперплазия, гепатоаденома, гепатобилиарная цистаденома, гепатобластома, печеночноклеточная карцинома, гепатома, рак печени, гемангиоэндотелиома печени, регенеративная узловая гиперплазия, доброкачественные опухоли печени, кисты печени (простые кисты, поликистоз, гепатобилиарная цистаденома, мезенхимальные опухоли печени [мезенхимальная гамартома, гемангиоэндотелиома новорожденных, гемангиома, печеночная пурпура, липомы, воспалительная псевдоопухоль], эпителиальные опухоли желчного протока, гамартома желчного протока, аденома желчного протока, злокачественные опухоли печени [гепатоцеллюлярная, гепатобластома, печеночноклеточная карцинома, холангиоцеллюлярный рак, холангиокарцинома, цистаденокарцинома, опухоли капилляров, ангиосаркома, саркома Капоши, гемангиоэндотелиома, эмбриональная саркома, фибросаркома, лейомиосаркома, рабдомиосаркома, карциносаркома, тератома, плоскоклеточная карцинома, первичная лимфома]), эритрогепатическая порфирия, порфирия печени (острая перемежающаяся порфирия, гемохроматоз), синдром Зельвегера.
Конъюгаты по изобретению можно использовать для лечения заболеваний иммунной системы, таких как:
- аутоиммунные заболевания: болезнь Аддисона, аутоиммунная гемолитическая анемия, заболевание, связанное с образованием антител к базальной мембране клубочков, антифосфолипидный синдром, ревматоидный артрит, аутоиммунные заболевания нервной системы, герпесоподобные дерматиты, сахарный диабет типа 1, семейная средиземноморская лихорадка, IGA гломерулонефрит, мембранный гломерулонефрит, синдром Гудпастчера, заболевание Грейвза, аутоиммунный гепатит, миастенический синдром Ламберта-Итона, красная волчанка, симпатическая офтальмия, пузырчатка, аутоиммунная полиэндокринопатия, идиопатическая тромбоцитопеническая пурпура, болезнь Рейтера и аутоиммунный тиреоидит),
- заболевания, связанные с несовместимостью групп крови: гемолитическая болезнь новорожденных, Rh-изоиммунизация,
- мембранопролиферативный гломерулонефрит,
- реакция «трансплантат против хозяина»,
- гиперчувствительность: гиперчувствительность к лекарственным средствам, болезни, вызываемые загрязнением окружающей среды, гиперчувствительность замедленного типа (ингибирование клеточной миграции, острый диссименированный энцефаломиелит), гиперчувствительность немедленного типа (анафилаксия, аллергические конъюктивиты, атопические дерматиты), заболевания, связанные с накоплением иммунных комплексов (васкулиты, связанные с гиперчувствительностью, реакция Арто, сывороточная болезнь), гиперчувствительность к латексу, синдром Висслера.
- синдромы иммунодефицита, такие как дисгаммаглобулинемия, инфекции ВИЧ-1, инфекции HTLV-1 и HTLV-2, эндемическая лимфома Беркетта, лимфопения, нарушения функции фагоцитоза, такие как синдром Чедиака-Хигаши, хронический грануломатоз, синдром Джоба, агаммаглобулинемия, атаксия телеангиэктазия, общий вариабельный синдром иммунодефицита, синдром ДиДжорджи, синдром дефицита адгезии лейкоцитов, синдром Вискотта-Олдрича,
- тромбоцитопеническая пурпура,
- иммунопролиферативные нарушения: гиперглобулинемия (синдром Шнитцлера), лимфопролиферативные нарушения (гранулема, болезнь тяжелых цепей, волосатоклеточный лейкоз, лимфоцитарный лейкоз, миелолейкоз, лимфангиома, лимфома, саркоидоз, агаммаглобулинемия, гигантская гиперплазия лимфатического узла, иммунобластная лимфоаденопатия, инфекционный мононуклеоз, лимфоматоидный гранулематоз, болезнь Марека, синдром Сезари, синдром распада опухоли, макроглобулинeмия Вальденстрема, иммунопролиферативное заболевание тонкого кишечника, плазмоцитарный лейкоз, парапротеинемии и тромбоцитопеническая пурпура), парапротеинемии.
Конъюгаты по изобретению можно использовать для лечения заболеваний эндотелия капилляров, таких как артериосклероз, облитерирующая артериопатия, болезнь Рейно, обусловленная заболеваниями соединительной ткани, простая гипертензия и вторичная легочная гипертензия, диабетическая микроангиопатия, болезнь Бюргера, склеродермия, васкулиты и все заболевания, которые характеризуются повреждением эндотелия с последующей ишемией.
Конъюгаты по изобретению можно использовать для лечения заболевания костей, таких как дисплазии, для которых характерен нарушенный рост кости. Типичными примерами таких состояний являются ахондроплазия, ключично-черепной дизостоз, энхондроматоз, фиброзная дисплазия, заболевание Гаучера, гипофосматемические рахиты, синдром Марфана, наследственные множественные экзостозы, нейфрофиброматоз, несовершенный остеогенез, остеопетроз, остеопойкилоз, склеротические бляшки, переломы, заболевания периодонта, псевдоартроз, гнойный остеомиелит, состояния, приводящие к остеопении, такие как анемические состояния, остеопения, вызванная стероидами и гепарином, заболевания костного мозга, цинга, нарушения питания, дефицит кальция, идиопатический остеопороз, врожденная остеопения, алкоголизм, болезнь Кушинга, акромегалия, гипогонадизм, местный преходящий остеопороз и остеомаляция.
Конъюгаты по изобретению можно использовать для лечения заболеваний кишечного эпителия, таких как синдром нарушенного всасывания, болезнь Крона, дивертикулярная болезнь кишечника, паралич кишечника и кишечная непроходимость.
Конъюгаты по изобретению можно использовать для лечения респираторных заболеваний, таких как носовой вестибулит, неаллергический ринит (например, острый ринит, хронический ринит, вазомоторный ринит), носовые полипы, синусит, ювенильный ангиофиброматоз, рак носа и ювенильные папилломы, полипы голосовых связок, узелки, контактные язвы, паралич голосовых связок, ларингоцеле, фарингит, тонзиллит, тонзиллярный целлюлит, парафарингеальные абсцессы, ларингит, ларингоцеле, рак глотки (например, рак носоглотки, рак миндалин, рак гортани), рак легких (плоскоклеточная карцинома, мелкоклеточная карцинома, крупноклеточная карцинома, аденокарцинома), аллергические расстройства (эозинофильная пневмония, аллергический альвеолит, аллергическая интерстициальная пневмония, аллергический бронхолегочный аспергиллез, астма, грануломатоз Вегенера, синдром Гудпасчера, пневмония (например, бактериальная пневмония (например, вызванная Streptococcus pneumoniae, Staphylococcus aureus, и грамотрицательными бактериями, такими как Klebsiella и Pseudomonas spp, вызванная Mycoplasma pneumoniae, Haemophilus influenzae, Legionella pneumophil и Chlamydia psittaci и вирусная пневмония (например, грипп или ветряная оспа), бронхиолит, полиомиелит, ларинготрахеобронхит (также называемый синдромом крупа), респираторная инфекция, обусловленная синцитиальными вирусами, эпидемический паротит, инфекционная эритема, младенческая розеола, краснуха, грибковая пневмония (например, гистоплазмоз, кокцидиомикоз, бластомикоз и грибковые инфекции у пациентов с иммунной недостаточностью, такие как криптококкоз, вызванные Cryptococcus neoformans; аспергиллез, вызванный Aspergillus spp.; кандидоз, вызванный Candida, и мукормикоз), инфекции, обусловленные Pneumocystis carinii, атипичные пневмонии (например, вызванные Mycoplasma и Chlamydia spp.), пневмония, вызванная условно-патогенными микроорганизмами, пневмония, вызванная внутрибольничной инфекцией, химическая пневмония и аспирационная пневмония, плевральные нарушения (например, плеврит, выпот в плевральной полости и пневмоторакс (например, простой спонтанный пневмоторакс, сочетанный спонтанный пневмоторакс, напряженный пневмоторакс), обструктивные заболевания респираторного тракта (например, астма, хроническая обструктивная болезнь легких, эмфизема, хронический или острый бронхит), профессиональные заболевания легких (например, силикоз, антракоз, асбестоз, бериллиоз, профессиональная астма, биссиноз и доброкачественный пневмокониоз), инфильтративные заболевания легких, такие как фиброз легкого, фиброзирующий альвеолит, идиопатический фиброз легких, десквамативная интерстициальная пневмония, лимфоидная интерстициальная пневмония, гистиоцитоз X (например, болезнь Леттерера-Сиве, болезнь Хэнд-Шуллер-Кристиана, эозинофильная гранулема), идиопатический гемосидероз легких, саркоидоз и легочный альвеолярный протеиноз, острый респираторный дистресс-синдром, водянка, легочная эмболия, бронхит (например, вирусный, бактериальный бронхит), бронхоэктазы, ателектаз, абсцессы легкого и муковисцидоз.
В предпочтительном варианте осуществления изобретение предусматривает, что терапевтически активный компонент представляет собой интерферон. В этом случае, конъюгаты или полинуклеотиды, кодирующие их, можно применять для лечения заболеваний печени, отвечающих на лечение интерфероном, таких как хронический гепатит C, хронический гепатит B, гепатокарцинома, цирроз, фиброз.
С другой стороны, принимая во внимание присутствие рецепторов SR-B1 на клетках иммунной системы, конъюгаты по изобретению можно использовать для адресной доставки терапевтически активных соединений к таким клеткам. Таким образом, в предпочтительном варианте осуществления, конъюгаты по изобретению, содержащие в качестве терапевтически активного соединения интерферон, можно использовать в качестве адъюванта для усиления иммунного ответа на вакцину. Вакцина может быть вакциной, направленной против организма, способного вызывать инфекционное заболевание, вакциной, направленной против опухоли или вакциной, направленной против аллергена. Вакцины могут содержать компонент возбудителя инфекции, опухоли, или аллергена (пептид, полипептид, гликопептид, мультиэпитопный пептид, фрагмент и т.д.), или могут быть генетической вакциной, которая образована нуклеиновой кислотой, кодирующей полипептид указанного организма, опухоли или аллергена.
В другом варианте осуществления конъюгаты по изобретению содержат пептидный ингибитор TGF-β1. Такие конъюгаты можно использовать при лечении заболеваний или патологических расстройств, связанных с избытком или нерегулируемой экспрессией TGF-β1, таких как (i) фиброз, связанный с потерей функции органа или ткани, например, легочный фиброз, фиброз печени (цирроз), фиброз сердца, фиброз почек, фиброз роговицы и т.д., и (ii) хирургические и эстетические осложнения, например, фиброз, связанный с кожной или перитонеальной хирургией, фиброз, связанный с ожогами, костно-суставной фиброз, келоидные рубцы и т.д.
Авторы по настоящему изобретению продемонстрировали, что введение конъюгатов по изобретению, содержащих ингибиторный пептид TGF-β1 в сочетании с IL-12, приводит к стимуляции индукции IFN-гамма, вызванной IL-12. Учитывая, что IFN-γ является известным противоопухолевым средством, открытие авторов изобретения открывает дорогу для новой противоопухолевой терапии на основе комбинации иммуностимулирующего цитокина и конъюгата по изобретению, содержащего пептидный ингибитор TGF-β1.
Таким образом, в другом аспекте изобретение относится к композиции, которая включает
(a) первый компонент, выбранный из группы, включающей конъюгат, полинуклеотид, генную конструкцию, вектор, клетку-хозяина, нанолипочастицу и фармацевтический препарат по изобретению, где компонент (ii) представляет собой пептидный ингибитор TGF-β1, и
(B) второй компонент, выбранный из группы, включающей иммуностимулирующий цитокин, полинуклеотид, кодирующий указанный цитокин, вектор, содержащий указанный полинуклеотид, ингибиторный пептид TGF-β1, цитотоксическое средство и их сочетания.
Иммуностимулирующие цитокины, которые можно вводить в сочетании с конъюгатами Apo A, включают в качестве неограничивающих примеров, ингибиторные пептиды TGF-β1, IL-12, IL-2, IL-15, IL-18, IL-24, GM-CSF, TNF-α, лиганд CD40, IFN-α, IFN-β, IFN-γ. В предпочтительном варианте осуществления стимулирующий цитокин является IL-12.
Ингибиторные пептиды TGF-β1, которые могут образовывать компонент (b) композиции по изобретению, являются по сути теми же, которые образуют часть конъюгата по изобретению, как описано выше. Таким образом, ингибиторными пептидами TGF-β1 могут быть, в частности, пептид p144 (SEQ ID NO:4) или пептид p17 (SEQ ID NO:5). Пептиды, образующие часть конъюгата (компонент (a)) и образующие второй компонент по изобретению, могут быть одинаковыми или различными.
«Цитотоксическое средство» в настоящем документе представляет собой соединение, способное селективно или не селективно убивать клетки или замедлять их рост. Примеры включают паклитаксел, цитохалазин B, грамицидин D, бромистый этидий, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дигидротестостерон, глюкокортикоиды, лидокаин, пропранолол, пуромицин, эрубицин, циклофосфамид и его аналоги и гомологи, антиметаболиты (метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацил, дакарбазин), алкилирующие средства (мехлоретамин, тиотепа, хлорамбуцил, мелфалан, кармустин (BCNU) и ломустин (CCNU)), бусульфан, дибромоманнитол, стрептозотоцин, митомицин C, цисдихлордиамин платины (II) (DDP) цисплатин), антрациклины (даунорубицин и доксорубицин), антибиотики (дактиномицин) и блеомицин.
В другом аспекте, композиции по изобретению можно применять для лечения различных типов опухолей, включающих в качестве неограничивающих примеров, рак крови (например, лейкоз или лимфома), неврологические опухоли (например, астроцитомы или глиобластомы), меланому, рак молочной железы, рак легких, рак головы и шеи, желудочно-кишечные опухоли (например, рак желудка, поджелудочной железы или прямой кишки), рак печени (например, печеночноклеточная карцинома), почечноклеточный рак, опухоли мочеполовой системы (например, рак яичников, рак влагалища, рак шейки матки, рак мочевого пузыря, рак яичек, рак предстательной железы), опухоли кости и васкулярные опухоли.
Таким образом, в другом аспекте, изобретение относится к композиции по изобретению для лечения рака. В другом аспекте изобретение относится к способу лечения рака, который включает введение нуждающемуся в этом пациенту композиции по изобретению. В другом аспекте изобретение относится к применению композиции по изобретению для приготовления медикамента для лечения рака.
Применяемые терапевтически эффективные количества компонентов композиции по изобретению, как описано в настоящем документе, зависят, например, от целей терапии, пути введения и состояния пациента. Таким образом, предпочтительно, чтобы терапевт титровал дозировку и изменял путь введения при необходимости для получения оптимального терапевтического эффекта. Обычная ежедневная доза может варьировать от 0,01 мг/кг до 250 мг/кг или более, ежедневно, каждые 2 дня, каждые 3 дня, каждые 4 дня, каждые 5 дней, каждые 6 дней или еженедельно.
Введение композиции можно производить различными способами. Например, компоненты (a) и (b) композиции можно вводить последовательно, раздельно и/или одновременно. В одном из вариантов осуществления компоненты (a) и (b) композиции вводят одновременно (необязательно многократно). В одном из вариантов осуществления отдельные препараты вводят последовательно (необязательно многократно). В одном из вариантов осуществления отдельные препараты вводят раздельно (необязательно многократно). Специалистам в данной области ясно, что когда компоненты (a) и (b) вводят последовательно или сериями, можно вводить компонент (a), а затем компонент (b), или компонент (b), а затем компонент (a). В другом варианте осуществления раздельные составы компонентов (a) и (b) можно вводить с применением альтернативных схем дозировки. Если введение раздельных составов компонентов (a) и (b) композиции по изобретению производится последовательно или раздельно, то интервал до введения второго компонента не должен быть слишком большим, чтобы сохранялся эффект комбинированного лечения.
Изобретение поясняется ниже на основе следующих примеров, которые предусмотрены как неограничивающая иллюстрация объема изобретения.
ПРИМЕРЫ
ПРИМЕР 1
МАТЕРИАЛЫ И СПОСОБЫ
1. Создание экспрессирующих векторов:
1.1. Выделение РНК:
Общую РНК из печени мышей или из мозга обработанных мышей выделяли из индивидуальных образцов с использованием реагента TRI (Sigma, Madrid, Spain). Концентрацию и чистоту образцов определяли по поглощению при 260 и 280 нм с поправкой на фон при 320 нм в спектрофотометре (Biophotometer, Eppendorf).
1.2.Синтез общей кДНК с помощью ОТ-ПЦР:
Общую РНК (3 мкг) обрабатывали DNAse I и проводили обратную транскрипцию в кДНК с помощью M-MLV RT в присутствии RNase OUT (все реагенты от Invitrogen, Carlsbad, CA). Получили 25 мкл общей кДНК печени. Реакцию инкубировали 1 ч при 37°C, денатурировали 1 мин при 95°C и охлаждали до 4°C. Образцы сразу же использовали для ПЦР или хранили при -20°C.
1.3. Получение и клонирование кДНК мышиного аполипопротеина A1 (mApoA1):
Были разработаны прямой праймер 5'-ATGAAAGCTGTGGTGCTGGC-3' (FwATGmApoA1) (SEQ ID NO:20) и обратный праймер 5'-TCACTGGGCAGTCAGAGTCT-3' (RVTGAmApoA1) (SEQ ID NO:21). кДНК mApoA1 (всего 795 нуклеотидов, 72 нуклеотида кодируют сигнальный пептид и 723 нуклеотида кодируют нативный белок) амплифицировали, проводя ПЦР на общей кДНК печени с использованием BioTaq DNA polymerase (Bioline, London, United Kingdom): 5 мин при 94°C, 30 циклов, состоящих из 40 сек при 94°C, 40 сек при 55°C и 40 сек при 72°C, с последующими 7 мин при 72°C в термоциклере 2720 Thermal cycler (Applied Biosystems, Foster City, USA). Продукт ПЦР разгоняли в 1% агарозном геле из Agarose D-1 low EEO (Pronadisa, Madrid, Spain) и выделяли из фрагмента геля при помощи QIAquick Gel Extraction Kit (Qiagen, Valencia, CA). Выделенную кДНК mApoA1 клонировали в экспрессирующий вектор pcDNA™3.1/V5-His TOPO® TA (Invitrogen, Carlsbad, CA), согласно инструкциям производителя, полученный вектор называли pCMV-mApoA1. В заключение полученную последовательность подтверждали секвенированием.
1.4. Получение и клонирование кДНК мышиного интерферона альфа 1 (mIFNα1):
Были разработаны прямой праймер 5'-ATGGCTAGGCTCTGTGCTTT-3' (FwATGmIFNα1) (SEQ ID NO:22) и обратный праймер 5'-TCATTTCTCTTCTCTCAGTC-3' (RvTGAmIFNα1) (SEQ ID NO:23). кДНК mIFNα1 (всего 570 нуклеотидов, 69 нуклеотидов кодируют сигнальный пептид, и 501 нуклеотид кодирует нативный белок) амплифицировали, проводя ПЦР на общей кДНК печени с использованием BioTaq DNA polymerase (Bioline, London, United Kingdom). Условия амплификации: 5 мин при 94°C, 30 циклов, состоящих из 40 сек при 94°C, 40 сек при 55°C и 40 сек при 72°C, с последующими 7 мин при 72°C в термоциклере 2720 Thermal cycler (Applied Biosystems Foster City, USA). Продукт ПЦР разгоняли в 1% агарозном геле из Agarose D-1 low EEO (Pronadisa, Madrid, Spain) и выделяли из фрагмента геля при помощи QIAquick Gel Extraction Kit (Qiagen, Valencia, CA). Очищенную кДНК MIFNα1 клонировали в экспрессирующий вектор pcDNA™3.1/V5-His TOPO® TA (Invitrogen, Carlsbad, CA), согласно инструкциям производителя, полученный вектор называли pCMV-mIFNα1. В заключение полученную последовательность подтверждали секвенированием.
1.5. Разработка слияния генов:
1.5.1 C-концевое слияние гена mIFNα1 с геном mApoA1: Apo-IFN
Был разработан обратный праймер 5'-GGCGCGCCCTGGGCAGTCAGAGTCTCGC-3' (RvAscImApoA1) (SEQ ID NO:24), в который была включена последовательность из 9 нуклеотидов (GGCGCGCCC) для создания сайта рестрикции для фермента AscI на 3'-конце гена ApoA1 и разрушения стоп-кодона. Эта добавленная рестрикционная последовательность будет транслироваться в короткий связывающий пептид GAP, который обеспечит некоторую мобильность белковым составляющим. Был разработан прямой праймер 5'-GGCGCGCCCTGTGACCTGCCTCAGACTCA-3' (FwAscImIFNα1) (SEQ ID NO:25), включающий рестрикционную последовательность для AscI на 5'-конце последовательности, кодирующей зрелый белок mIFNα1 (т.е., удаление последовательности сигнального пептида). Проводили амплификацию посредством ПЦР с pCMV-mApoA1, в качестве матрицы, и праймерами RvAscImApoA1 и FwATGmApoA1 с ферментом BioTaq ДНК polymerase (Bioline, London, UK), 5 мин при 94°C, 30 циклов, состоящих из 40 сек при 94°C, 40 сек при 57°C и 40 сек при 72°C, с последующими 7 мин при 72°C в термоциклере 2720 Thermal cycler (Applied Biosystems Foster City, USA). Продукт ПЦР (804 нуклеотиды) разгоняли в 1% агарозном геле из Agarose D-1 low EEO (Pronadisa, Madrid, Spain) и выделяли из фрагмента геля при помощи QIAquick Gel Extraction Kit (Qiagen, Valencia, CA). Очищенную ДНК mApoA1-AscI клонировали в экспрессирующий вектор pcDNA™3.1/V5-His TOPO® TA (Invitrogen, Carlsbad, CA), согласно инструкциям производителя, полученный вектор называли pCMV-mApoA1-AscI. В заключение полученную последовательность подтверждали секвенированием.
Параллельно проводили амплификацию методом ПЦР с использованием в качестве матрицы pCMV-mIFNα1 и праймерами FwAscImIFNα1 и RvTGAmIFNα1. Использовали BioTaq DNA Polymerase (Bioline, London, UK) и следующие условия амплификации: 5 мин при 94°C, 30 циклов, состоящих из 40 секунд при 94°C, 40 секунд при 57°C и 40 секунд при 72°C, с последующими 7 мин при 72°C в 2720 Thermal cycler (Applied Biosystems Foster City, USA). Продукт ПЦР (510 нуклеотидов) разгоняли в 1% агарозном геле из Agarose D-1 low EEO (Pronadisa, Madrid, Spain) и выделяли из фрагмента геля при помощи QIAquick Gel Extraction Kit (Qiagen, Valencia, CA). Очищенная ДНК AscI-mIFNα1 была клонирована в экспрессирующий вектор pcDNA™3.1/V5-His TOPO® TA (Invitrogen, Carlsbad, CA), согласно инструкциям производителя, полученный вектор называли pCMV-AscI-mIFNα1. В заключение полученную последовательность подтверждали секвенированием.
Для проведения слияния генов плазмиды pCMV-mApoA1-AscI и pCMV-AscI-mIFNα1 независимо расщепляли ферментами AscI/PmeI в 1×BSA и Буфере 4 (New England Biolabs) при 37°C в течение 1,5 часов, используя сайт рестрикции PmeI, присутствующий в основе pcDNA 3.1V5-His TOPO® TA. Обе рестрикции разгоняли в 1% агарозном геле и выделяли из геля полосы, соответствующие разомкнутому вектору pCMV-mApoA1-AscI и вставке pCMV-AscI-mIFNα1. Продукты лигировали в соотношении 1:3 (вектор:вставка) с использованием T4 DNA ligase High Concentration и 2X Rapid Ligation Buffer в качестве буфера (Promega Madison, WI, USA), инкубируя смесь в течение 10 мин при комнатной температуре. Затем трансформировали бактерии Top10 (Invitrogen, Carlsbad, CA). Проводили селекцию трансформированных бактерий по росту на чашках Петри со средой LB с ампициллином, поскольку вектор содержит ген устойчивости к этому антибиотику. Плазмидную ДНК выделяли из позитивных бактерий с использованием метода MiniPrep (Qiagen, Germany), затем расщепляли 2 мкг указанной плазмиды ферментами AscI/PmeI (New England Biolabs) и продукты рестрикции разделяли посредством электрофореза в 1% агарозном геле для подтверждения наличия вставки. Полученная плазмида (6825 нуклеотидов) в дальнейшем в этом документе будет называться pCMV-Apo-IFN (pCMV-AF).
1.5.2 N-концевое слияние гена mIFNα1 с геном mApoA1: IFN-Apo
Был разработан обратный праймер 5'-GGGCGCGCCTTTCTCTTCTCTCAGTCTTC-3' (RvAscImIFNα1) (SEQ ID NO:26), который включает в себя 9-нуклеотидную последовательность (GGCGCGCCC) для создания сайта рестрикции для фермента AscI на 3'-конце гена mIFNα1 и разрушения стоп-кодона. Был разработан прямой праймер 5'-CCAGGCGCGCCGGATGAACCCCAGTCCCAATG-3' (FwAscImApoA1) (SEQ ID NO:27), который включает рестрикционную последовательность для AscI на 5'-конце последовательности, кодирующей зрелый белок mApoA1 (т.е., элиминирование последовательности сигнального пептида). Этот праймер включает 3 нуклеотида на 5' для рестрикции AscI.
Проводили амплификацию методом ПЦР с pCMV-mApoA1 в качестве матрицы и праймерами FwAscImApoA1 и RvTGAmApoA1, с ферментом BioTaq DNA Polymerase (Bioline, London, UK) и следующими условиями амплификации: 5 мин при 94°C, 30 циклов, состоящих из 40 секунд при 94°C, 40 секунд при 57°C и 40 секунд при 72°C, с последующими 7 мин при 72°C в 2720 Thermal cycler (Applied Biosystems Foster City, USA). Продукт ПЦР (732 нуклеотида) разгоняли в 1% агарозном геле из Agarose D-1 low EEO (Pronadisa, Madrid, Spain) и выделяли из фрагмента геля при помощи QIAquick Gel Extraction Kit (Qiagen, Valencia, CA). Очищенную ДНК AscI-mApoA1 клонировали в экспрессирующий вектор pcDNA™3.1/V5-His TOPO® TA (Invitrogen, Carlsbad, CA), согласно инструкциям производителя, полученный вектор называли pCMV-AscI-mApoA1. В заключение полученную последовательность подтверждали секвенированием.
Параллельно проводили амплификацию методом ПЦР с pCMV-mIFNα1 в качестве матрицы и праймерами FwATGmIFNα1 и RvAscImIFNα1 с ферментом BioTaq DNA Polymerase (Bioline, London, UK) и следующими условиями амплификации: 5 мин при 94°C, 30 циклов, состоящих из 40 секунд при 94°C, 40 секунд при 57°C и 40 секунд при 72°C, с последующими 7 мин при 72°C в 2720 Thermal cycler (Applied Biosystems Foster City, USA). Продукт ПЦР (576 нуклеотидов) разгоняли в 1% агарозном геле из Agarose D-1 low EEO (Pronadisa, Madrid, Spain) и выделяли из фрагмента геля при помощи QIAquick Gel Extraction Kit (Qiagen, Valencia, CA). Очищенная ДНК mIFNα1-AscI была клонирована в экспрессирующий вектор pcDNA™3.1/V5-His TOPO® TA (Invitrogen, Carlsbad, CA), согласно инструкциям производителя, полученный вектор называли pCMV-mIFNα1-AscI. В заключение полученную последовательность подтверждали секвенированием.
Для проведения слияния генов плазмиды pCMV-AscI-mApoA1 и pCMV-mIFNα1-AscI независимо расщепляли ферментами AscI/PmeI в 1×BSA и Буфере 4 (New England Biolabs) при 37°C в течение 1,5 часов, используя сайт рестрикции PmeI, присутствующий в основе pcDNA 3.1V5-His TOPO ® TA. Обе рестрикции разгоняли в 1% агарозном геле и выделяли из геля полосы, соответствующие разомкнутому вектору pCMV-mIFNα1-AscI и вставке pCMV-AscI-mApoA1. Продукты лигировали в соотношении 1:3 (вектор:вставка) с использованием T4 DNA ligase High Concentration и 2X Rapid Ligation Buffer в качестве буфера (Promega Madison, WI, USA), инкубируя смесь в течение 10 мин при комнатной температуре. Затем трансформировали бактерии Top10 (Invitrogen, Carlsbad, CA). Проводили селекцию трансформированных бактерий по росту на чашках Петри со средой LB с ампициллином, поскольку вектор содержит ген устойчивости к этому антибиотику. Плазмидную ДНК выделяли из позитивных бактерий с использованием метода MiniPrep (Qiagen, Germany), затем расщепляли 2 мкг указанной плазмиды ферментами AscI/PmeI (New England Biolabs) и продукты рестрикции разделяли посредством электрофореза в 1% агарозном геле для подтверждения наличия вставки. Полученная плазмида (6825 нуклеотидов) в дальнейшем в этом документе будет называться pCMV-IFN-Apo (pCMV-IA).
1.5.3 C-концевое слияние пептида p17 с геном mApoA1:
Был разработан праймер 5'-TCACGCACGCTCATACCAAGAACTCCTAGGAATAAACCAAATACGCTTGGGCGCGCCCTGGGC-3' (RvmApoA1p17) (SEQ ID NO:28). Проводили амплификацию c Easy-A High Fidelity ПЦР cloning enzyme (Stratagene, La Jolla, CA), используя pCMV-mApoAl-AscI в качестве матрицы и праймеры FwATGmApoA1 и RvmApoA1p17. Использовали следующие условия: 1 мин при 95°C, 30 циклов, состоящих из 40 секунд при 95°C, 40 секунд при 60°C и 1 мин при 72°C, затем 7 мин при 72°C в 2720 Thermal cycler (Applied Biosystems Foster City, USA). Продукт ПЦР (576 нуклеотидов) разгоняли в 1% агарозном геле из Agarose D-1 low EEO (Pronadisa, Madrid, Spain) и выделяли из фрагмента геля при помощи QIAquick Gel Extraction Kit (Qiagen, Valencia, CA). Очищенная ДНК mApoAl-AscI-pl7 была клонирована в экспрессирующий вектор pcDNA™3.1/V5-His TOPO® TA (Invitrogen, Carlsbad, CA), согласно инструкциям производителя, полученный вектор называли pCMV-mApoA1-AscI-p17. В заключение полученную последовательность подтверждали секвенированием.
1.5.4 C-концевое слияние пептида p144 с геном mApoA1:
Был разработан праймер 5'-TCAATTCTGCATCATGGCCCAGATTATCGAGGCGTCCAGCGAGGTGGGCGCGCCCTGGGC-3' (RvmApoA1p144) (SEQ ID NO:29). Проводили амплификацию c Easy-A High Fidelity ПЦР cloning enzyme (Stratagene, La Jolla, CA), используя pCMV-mApoA1-AscI в качестве матрицы и праймеры FwATGmApoA1 и RvmApoA1p144. Использовали следующие условия: 1 мин при 95°C, 30 циклов, состоящих из 40 секунд при 95°C, 40 секунд при 65°C и 1 мин при 72°C, затем 7 мин при 72°C в 2720 Thermal cycler (Applied Biosystems Foster City, USA). Продукт ПЦР разгоняли в 1% агарозном геле из Agarose D-1 low EEO (Pronadisa, Madrid, Spain) и выделяли из фрагмента геля при помощи QIAquick Gel Extraction Kit (Qiagen, Valencia, CA). Очищенная ДНК mApoA1-AscI-p144 была клонирована в экспрессирующий вектор pcDNA™3.1/V5-His TOPO® TA (Invitrogen, Carlsbad, CA), согласно инструкциям производителя, полученный вектор называли pCMV-mApoA1-AscI-p144. В заключение полученную последовательность подтверждали секвенированием.
1.5.5 Клонирование генетической последовательности сигнального пептида mApoA1:
Для создания плазмиды, которая будет служить контролем в экспериментах по слиянию mApoA1 и пептидов, проводили слияние генетической последовательности сигнального пептида mApoA1 (SpmApoA1) с последовательностями пептидов p17 и pl44 (без добавления последовательности для AscI), обеспечивая, таким образом, такую же секрецию пептидов, как и mApoA1-пептидов. Был разработан праймер 5'-TTGCTGCCATACGTGCCAAG-3' (RvSPmApoA1) (SEQ ID NO:30), который вместе с праймером FwATGmApoA1 использовали для амплификации SpmApoA1, применяя в качестве матрицы pCMV-mApoA1. Продукт ПЦР (72 нуклеотида) разгоняли в 1% агарозном геле из Agarose D-1 low EEO (Pronadisa, Madrid, Spain) и выделяли из фрагмента геля при помощи QIAquick Gel Extraction Kit (Qiagen, Valencia, CA). Очищенная ДНК SpmApoA1 была клонирована в экспрессирующий вектор pcDNA™3.1/V5-His TOPO® TA (Invitrogen, Carlsbad, CA), согласно инструкциям производителя, полученный вектор называли pCMV-SpmApoA1. В заключение полученную последовательность подтверждали секвенированием.
1.5.6 C-концевое слияние пептида p17 с последовательностью сигнального пептида гена mApoA1:
Был разработан праймер 5'-TCACGCACGCTCATACCAAGAACTCCTAGGAATAAACCAAATACGCTTTTGCTGCCAGAAATGCCG-3' (RvSPmApoA1p17) (SEQ ID NO:31), который вместе с праймером FwATGmApoA1 использовали для амплификации SPmApoA1-p17, применяя в качестве матрицы pCMV-mApoA1. Продукт ПЦР (120 нуклеотидов) разгоняли в 1% агарозном геле из Agarose D-1 low EEO (Pronadisa, Madrid, Spain) и выделяли из фрагмента геля при помощи QIAquick Gel Extraction Kit (Qiagen, Valencia, CA). Очищенная ДНК SPmApoA1-p17 была клонирована в экспрессирующий вектор pcDNA™3.1/V5-His TOPO® TA (Invitrogen, Carlsbad, CA), согласно инструкциям производителя, полученный вектор называли pCMV-SPmApoA1-p17. В заключение полученную последовательность подтверждали секвенированием.
1.5.7 C-концевое слияние пептида p144 с последовательностью сигнального пептида гена mApoA1:
Был разработан праймер 5'-TCATTCTGCATCATGGCCCAGATTATCGAGGCGTCCAGCGAGGTTTGCTGCCAGAAATGCCG-3' (RvSPmApoA1p144) (SEQ ID NO:32), который вместе с праймером FwATGmApoA1 использовали для амплификации SPmApoA1-p144, применяя в качестве матрицы pCMV-mApoA1. Продукт ПЦР (117 нуклеотидов) разгоняли в 1% агарозном геле из Agarose D-1 low EEO (Pronadisa, Madrid, Spain) и выделяли из фрагмента геля при помощи QIAquick Gel Extraction Kit (Qiagen, Valencia, CA). Очищенная ДНК SPmApoA1-p144 была клонирована в экспрессирующий вектор pcDNA™3.1/V5-His TOPO® TA (Invitrogen, Carlsbad, CA), согласно инструкциям производителя, полученный вектор называли pCMV-SPmApoA1-p144. В заключение полученную последовательность подтверждали секвенированием.
1.5.8 Вставка последовательности MMP9 в pCMV-mApoA1-AscI-p144:
С целью создания слитого белка данного гена с возможностью высвобождать пептид p144 за счет расщепления, в базе данных MEROPS (http://merops.sanger.ac.uk/) изучали протеазы, способные расщеплять аминокислотную последовательность слитого белка с высвобождением целого p144. В качестве кандидата поиск дал металлопротеиназу 9 (MMP9), которая расщепляет, оставляя аминокислоту S в последовательности p144. Применение этой протеазы дополнительно наделяет конструкцию свойством высовобождать данный ингибитор TGF-β в участках, где необходимо ингибирование (локальное, а не системное ингибирование), поскольку было описано его присутствие в карциномах. Последовательность ДНК CTTTTCCCGACGTCT [SEQ ID NO:51] (аминокислоты LFPTS [SEQ ID NO:19]) будет транслироваться в указанный сайт расщепления: LFPT-S TSLDASIIWAMMQN [SEQ ID NO:4].
Были разработаны праймеры 5'-CCAGGCGCGCCGCTTTTCCCGACGTCTACCTCGCTGGACGCCTC-3' (FwMMp9AscIp144) (SEQ ID NO:33) и 5'-TCAATTCTGCATGGCCCATCA-3' (RvMMp9AscIp144) (SEQ ID NO: 34). Проводили амплификацию c Easy-A High Fidelity ПЦР cloning enzyme (Stratagene, La Jolla, CA), используя pCMV-SPmApoA1-p144 в качестве матрицы. ПЦР проводили при следующих условиях: 2 мин при 94°C, 30 циклов, состоящих из 40 секунд при 94°C, 45 секунд при 54°C и 40 секунд при 72°C, с последующими 7 мин при 72°C в 2720 Thermal cycler (Applied Biosystems Foster City, USA). Продукт ПЦР разгоняли в 1% агарозном геле из Agarose D-1 low EEO (Pronadisa, Madrid, Spain) и выделяли из фрагмента геля (70 нуклеотидов) при помощи PerfectPrep DNA Cleanup (Eppendorf, Germany). Очищенную ДНК AscI-MMP9-p144 клонировали в экспрессирующий вектор pcDNA™3.1/V5-His TOPO® TA (Invitrogen, Carlsbad, CA), согласно инструкциям производителя, полученный вектор называли pCMV-AscI-MMP9-p144. В заключение полученную последовательность подтверждали секвенированием.
Для проведения слияния генов плазмиды pCMV-mApoA1-AscI-p144 и pCMV-AscI-MMP9-p144 независимо расщепляли ферментами AscI/PmeI в 1×BSA и Буфере 4 (New England Biolabs) при 37°C в течение 1,5 часов, используя сайт рестрикции PmeI, присутствующий в основе pcDNA 3.1V5-His TOPO® TA. Обе рестрикции разгоняли в 1% агарозном геле и выделяли из геля полосы, соответствующие разомкнутому вектору pCMV-mApoA1-AscI-p144 и вставке pCMV-AscI-MMP9-p144. Продукты лигировали в соотношении 1:3 (вектор:вставка) с использованием T4 DNA ligase High Concentration и 2X Rapid Ligation Buffer в качестве буфера (Promega Madison, WI, USA), инкубируя смесь в течение 10 мин при комнатной температуре. Затем трансформировали бактерии Top10 (Invitrogen, Carlsbad, CA). Проводили селекцию трансформированных бактерий по росту на чашках Петри со средой LB с ампициллином, поскольку вектор содержит ген устойчивости к этому антибиотику. Плазмидную ДНК выделяли из позитивных бактерий с использованием метода MiniPrep (Qiagen, Germany), затем расщепляли 2 мкг указанной плазмиды ферментами AscI/PmeI (New England Biolabs), и продукты рестрикции разделяли посредством электрофореза в 1% агарозном геле для подтверждения наличия вставки. Полученная плазмида (6324 нуклеотида) в дальнейшем в этом документе будет называться pCMV-mApoA1-AscI-MMP9-p144.
1.5.9 Вставка линкерной последовательности в pCMV-p144-mApoA1:
С целью создания слитого белка данного гена с возможностью движений между белком и пептидом p144, была введена последовательность ДНК (GCACCAGCAGAAACAAAAGCAGAACCAATGAC, SEQ ID NO:53), кодирующая гибкий линкер, чья последовательность транслируется в аминокислоты APAETKAEPMT (SEQ ID NO:13), который принимает CCCCCCCCCCC структуру (спираль), и существует в качестве связывающего пептида в нативной пируватферредоксиноксидоредуктазе (1b0pA_2).
Плазмиду pCMV-mApoA1-Asd-p144 расщепляли AscI (Буфер 4, New England Biolabs), ДНК очищали PerfectPrep DNA Cleanup (Eppendorf, Germany) и затем расщепляли NotI (Буфер 3 и BSA, New England Biolabs), в связи с несовместимостью буферов для рестрикции. Разгоняли в 1% агарозном геле, открытый вектор очищали с использованием PerfectPrep DNA Cleanup (Eppendorf, Germany). Продукты лигировали в соотношении 1:3 (вектор:вставка) с использованием T4 DNA ligase High Concentration и 2X Rapid Ligation Buffer в качестве буфера (Promega Madison, WI, USA), инкубируя смесь в течение 10 мин при комнатной температуре. Затем трансформировали бактерии Top10 (Invitrogen, Carlsbad, CA). Проводили селекцию трансформированных бактерий по росту на чашках Петри со средой LB с ампициллином, поскольку вектор содержит ген устойчивости к этому антибиотику. Полученная плазмида (6373 нуклеотида) в дальнейшем в этом документе будет называться pCMV-mApoA1-AscI-LINKER-p144. В заключение полученную последовательность подтверждали секвенированием.
2.Эксперименты:
2.1 Животные:
Эксперименты проводили на самках иммунокомпетентных мышей BALB/c и C57BL/6 в возрасте 5-7 недель (Harlan, Barcelona, Spain). С животными обращались согласно указаниям и этическим правилам Centro de Investigasion Medica Aplicada (CIMA, Pamplona, Spain), при специальных условиях отсутствия внешних патогенов.
2.2 Обращение с животными и модели опухолей:
Каждую плазмидную ДНК (20 мкг) ресуспендировали в 1,8 мл 0,9% физиологического раствора (Braun) и вводили в хвостовую вену посредством гидродинамической инъекции (Liu et al., 1999, Gene Ther., 6: 1258-1266), используя иглы 27,5G и шприцы на 2,5 мл (Becton-Dickinson, Spain). Образцы крови получали ретроорбитальным путем после анестезии ингаляцией изофлурана (Forane, Abbott). Выделяли сыворотку путем двух последовательных центрифугирований при 9,1×G в течение 5 минут и хранили при -20°C. Парентеральную анестезию проводили с помощью интраперитонеальной инъекции смеси (9:1) кетамина (Imalgene) и ксилазина (Rompun) в количестве 200 мкл/мышь. Температуры измеряли, прикладывая к животу термометр ThermoKlinik (Artsana, Grandate, Italy).
2.2.1 Анализ крови
Кровь мышей собирали в пробирки с гепарином в конечной концентрации 0,5% (Mayne). Для определения: i) общего количества лейкоцитов, цельную кровь разводили 1:1000 в пробирках с 20 мл раствора Isotonic II Diluent, за 2 минуты до измерения добавляли 3 капли Zap-Oglobin II Lytic Reagent, ii) общего количества эритроцитов, цельную кровь разводили 1:50000 в пробирках с 10 мл раствора Isotonic II Diluent, iii) тромбоцитов, цельную кровь разводили 1:25 в пробирке с 500 мкл Isotonic II Diluent, центрифугировали 1,5 мин при 600g при 4°C, супернатант переносили, разводя 1:400 в пробирку с 20 мл Isotonic II Diluent, образцы анализировали в Z1 Coulter Particle Counter с настройками, рекомендованными для каждого случая производителем (все материалы и реагенты от Beckman Coulter).
2.2.2 Модели вакцинации против CT26:
Для анализа противоопухолевой эффективности переноса генов, проводили вакцинирование по двум протоколам:
А) Проводили вакцинирование пептидом AH-1 (50 мкг/мышь) с аминокислотной последовательностью SPSYVYHQF (SEQ ID NO:54) (ProImmun Ltd., Oxford, United Kingdom), растворенного (100 мкл/мышь) в 0,9% физиологическом растворе и (100 мкл/мышь) в неполном адъюванте Фрейнда (IFA, Sigma, Madrid, Spain). Смесь обрабатывали ультразвуком в Branson Sonifier 250. Каждое животное вакцинировали 200 мкл смеси, используя иглу 25G и шприц на 1 мл (Becton-Dickinson, Spain), которым вводили мышам 100 мкл в левую подвздошную область и 50 мкл в подошву. Через 7 дней вводили различные конструкции посредством гидродинамической инъекции (Liu et al, 1999, Gene Ther., 6:1258-1266). Через 7 дней после гидродинамической инъекции, прививали опухоли путем подкожной инъекции инсулиновыми шприцами в правую подвздошную область сингенных мышей BALB/c (Becton-Dickinson, Spain) 5×105 клеток колоректальной аденокарциномы CT26, ресуспендированных в 200 мкл HBSS (Gibco-BRL, Paisley, UK).
B) генные конструкции вводили посредством гидродинамической инъекции. Через день после гидродинамической инъекции проводили вакцинацию пептидом AH-1, как описано выше. Через 9 дней делали прививку 5×106 клеток колоректальной аденокарциномы (CT26) посредством подкожной инъекции. Наблюдение за размером опухоли проводили с помощью точного цифрового измерительного прибора.
2.3 Подробное описание использованных клеточных линий:
Клеточные линии CT26 получали из колоректальной аденокарциномы мышей BALB/c, индуцированной канцерогеном N-нитрозo-N-метил-уретаном, культивировали в полной среде RPMI-1640 (Gibco-BRL, Paisley, UK), дополненной 10% эмбриональной телячьей сывороткой 10% (FCS), инактивированной при 56°C, 2 мМ глутамином, 100 U/мл стрептомицином, 100 мг/мл пенициллином, 1% 5×10-3β-меркаптоэтанолом. Клеточные линии MC38 (клетки мышиной аденокарциномы), L929 (клетки-производные мышиных фибробластов) и 293 (клетки почки человеческого эмбриона, стабильно трансфецированные областью Е1, принадлежащей аденовирусу человека, тип 5, ECACC No. 85120602) выращивали в полной среде DMEM (дополненной 10% эмбриональной телячьей сывороткой (FCS) инактивированной при 56°C, 2 мМ глутамином, 100 U/мл стрептомицином, 100 мг/мл пенициллином).
Описанные клетки культивировали во влажных инкубационных камерах при 37°C в среде с 5% CO2. Культуральные флаконы и планшеты приобретены у Greiner Bio-one (Essen, Germany).
2.4 Определение mIFNα1, IFNγ и неоптерина:
Уровни MIFNαl измеряли методом ELISA в плоских 96-луночных планшетах NUNC Maxisorp. Анти-mIFNα1 нейтрализующие Ab антитела (RMMA-1, PBL) разводили 1/1000 в 1x PBS, разносили на планшет по 100 мкл/лунку и оставляли инкубироваться на ночь при 4°C во влажной среде. После пяти промываний 1× PBS-0,1% Tween-20 (pH 7,2-7,4) планшет блокировали раствором 1× PBS 1% BSA 300 мкл/лунку в течение 1 ч при комнатной температуре. Образцы сыворотки разводили 1/100 в растворе 1× PBS 1% BSA и инкубировали 1 ч при комнатной температуре. После пяти промываний 1× PBS-0,1% Tween-20, инкубировали 1 ч со 100 мкл/лунку поликлональных анти-IFNα антител кролика (PBL), разведенных 1/1000 в растворе 1× PBS 1% BSA. После пяти промываний 1× PBS-0,1% Tween-20 добавляли 100 мкл/лунку HRP-конъюгированного ослиного α-кроличьего IgG (Southern Biotech, Birmingham, CA, USA), разведенного 1/4000 в растворе 1× PBS 1% BSA, 1 ч при комнатной температуре. После пяти промываний 1× PBS-0,1% Tween-20, добавляли 100 мкл/лунку субстратного раствора BD OptEIA (BD), после 15 мин в темноте при комнатной температуре добавляли 50 мкл 2N H2SO4. Наконец, измеряли поглощение при 450 нм и корректировали при 540 нм.
Уровни IFNγ в сыворотке измеряли с помощью IFN-γ ELISA Set (BD Biosciences, San Diego, CA). Уровни неоптерина в сыворотке измеряли с помощью Neopterin ELISA (IBL, Hamburg), согласно инструкциям производителя.
2.5 Количественная ПЦР:
2 мкл кДНК инкубировали со специфическими праймерами из Таблицы 1, используя iQ SYBR Green Supermix (Bio-Rad, Hercules, CA). Актин мыши использовали для стандартизации экспрессии генов, потому что ни mIFNα1, ни mApoA1 не влияют на его экспрессию. Уровни мРНК выражены через формулу 2ΔCt, где ΔCt отражает различие в пороговом цикле между актином и генами-мишенями.
2.6 Цитолиз in vivo
Самок мышей BALB/c (N=3/группе) в день 0 иммунизировали посредством гидродинамической инъекции, как описано выше, 20 мкг pCMV-LacZ и 20 мкг каждой изучаемой конструкции: i) pCMV-mApoA1 ii) pCMV-IFNα1 iii) pCMV-mApo-IFN iv) pCMV-mIFN-ApoA1, растворенными в 0,9% физиологическом растворе (Braun). На 7 день выделяли спленоциты из селезенок неиммунизированных мышей BALB/c и лизировали эритроциты раствором ACK (Cambrex, Walkersville, MD). Полученные спленоциты делили на две группы и одну из них инкубировали в течение 30 минут при 37°C в среде RPMI 1640 с 9 мкг пептида TPHPARIGL (цитотоксический эпитоп, производное β-галактозидазы, ProImmun Ltd., Oxford, United Kingdom). Вторую группу обрабатывали так же, но без пептида. Спленоциты, нагруженные пептидом, метили 2,5 мкМ CFSE (CFSEhigh) (Molecular Probes, Eugene, OR). Контрольные спленоциты метили 0,25 мкМ CFSE (CFSElow). В заключение обе популяции смешивали в соотношении 1:1 и 107 клеток инъецировали внутривенно наивным мышам или иммунизированным мышам. Через 24 часа животных умерщвляли. Выделенные селезенки измельчали и анализировали соотношение клеток CFSEhigh и клеток CFSElow методом проточной цитометрии с использованием FACSalibur (Becton Dickinson, Mountain View, Calif, USA). Процент специфического лизиса рассчитывали по следующей формуле:
2.7 Измерение экспрессии SRB1:
Выделяли спленоциты из селезенок мышей C57BL/6. Выделенные и измельченные селезенки делили на 8 групп, из которых 4 группы инкубировали в течение 10 минут с кроличьими анти-SRB1 поликлональными антителами (Novus Biologicals Littleton, CO) и с антителами от BD Pharmigen: i) R-PE-конъюгированное крысиное моноклональное антитело против CD4 (L3T4) мыши для выявления популяции CD4+ клеток и APC-конъюгированное крысиное моноклональное антитело против CD8a (Ly-2) мыши для определения популяции CD8+ клеток. ii) APC-конъюгированное мышиное моноклональное антитело против NK-1.1 (NKR-P1B и NKR-P1C) мыши для определения популяции NK клеток. iii) APC-крысиное антитело против CD11b мыши для определения клеточной популяции моноцитов. iv) APC-CD11c для определения популяции дендритных клеток. Остальные четыре группы использовали в качестве контроля, инкубируя их в течение 10 минут с соответствуюцими антителами, без анти-SRB1. Меченые спленоциты промывали в PBS и 5% эмбриональной телячьей сыворотке и инкубировали 10 мин с FITC-конъюгированными ослиными антителами против IgG кролика (Jackson ImmunoResearch, West Grove, PA). Помеченные таким образом образцы исследовали с помощью проточной цитометрии с использованием FACSalibur (Becton Dickinson, Mountain View, Calif., USA).
2.8 Выделение ЛПВП методом дифференциального центрифугирования в градиенте бромида натрия:
Через 24 часа после гидродинамической инъекции с плазмидами mApoA1, IFNα1, Apo-IFN, IFN-Apo или ApoA1-linker-P144 делали забор крови у мышей в пробирки с 0,5% гепарином (Mayne) (конечная концентрация) и сразу же выделяли плазму посредством центрифугирования (5000g, 20 минут).
Растворы бромида натрия (NaBr) различной плотности готовили в финальном объеме 25 мл в дистиллированной воде. Добавляли ЭДТА до конечной концентрации 0,05% (масса/объем). Добавляли NaBr (Fluka) для получения растворов: 0,225 г (ρ=1,006 г/мл), 1,431 г (ρ=1,04 г/мл), 7,085 г (ρ=1,21 г/мл) и 13,573 г (ρ=1,4 г/мл). Поскольку NaBr является высокогигроскопичной солью, плотность проверяли, и в случае необходимости корректировали добавлением дистиллированной воды.
Способ последовательного разделения липопротеинов при помощи флотации после ультрацентрифугирования проводили по протоколу, описанному Rodriguez-Sureda et al (Analytical Biochemistry 303, 73-77 (2002)) с небольшими модификациями в ультрацентрифуге Optima MAX с ротором TLA 100.4 (Beckman Coulter) c 2-4 мл плазмы мыши (унифицировали в зависимости от образцов) при следующих плотностях: ЛПОНП<1,006 г/мл, ЛПНП 1,006-1,04 г/мл и ЛПВП 1,04-1,21 г/мл. i) Выделение ЛПОНП: 400 мкл мышиной плазмы переносили в поликарбонатные пробирки на 3 мл и добавляли 1100 мкл раствора NaBr (ρ=1,006 г/мл). Образцы центрифугировали в течение 2 часов при 4°C и 336000g. Приблизительно 650 мкл супернатанта собирали пипеткой и хранили при -20°C. ii) Выделение ЛПНП: Оставшийся объем осадка приводили к плотности 1,04, добавляя объем раствора NaBr (ρ=1,4 г/мл), рассчитанный по формуле:
ρ=m/V
V1.4NaBr=Vbf(d-dbf)/1,4-d
V1.4NaBr=объем раствора 1,4 для добавления
Vbf=объем осадка
dbf=плотность осадка
Объем доводили до 1,5 мл раствором NaBr с плотностью ρ=1,04 г/мл и центрифугировали образцы 2,5 часа при 4°C и 336000g. 300-400 мкл супернатанта собирали пипеткой и хранили при-20°C. iii) Выделение ЛПВП: приблизительно 800 мкл осадка переносили в новую пробирку, приводили значение плотности к 1,21 г/мл, как было описано выше, и доводили объем до 1,5 мл раствором NaBr с плотностью ρ=1,21 г/мл. Образцы центрифугировали в течение 3,5 часов при 4°C, 336000g, собирали фракцию супернатанта объемом примерно 400 мкл, соответствующую ЛПВП, и осадочную фракцию, соответствующую плазме без липопротеинов (LDP), и хранили при -20°C.
2.9 Электрофорез и иммуноблоттинг против mAPOA1:
25 мкл фракции ЛПВП или LDP для каждого из образцов разделяли в 4-20% Tris-hepes PAGE LongLife iGels градиентных гелях (Nusep), переносили на нитроцеллюлозную мембрану (Whatman). Белок выявляли с помощью козлиных поликлональных антител против mApoA1, разведение 1:200 (Goat polyclonal anti-Apolipoprotein A1, SantaCruz Biotechnology), и антител против козлиного IgG, разведение 1:20000 (Anti-goat IgG (whole molecule) HRP - conjugated, Sigma-Aldrich). Мембраны проявляли с помощью ECL Plus Western Blotting Detection Reagent (Amersham).
2.10 Анализ биологической активности IFN: цитопатический эффект (CPE):
Единицы активности IFN из фракций ЛПВП, выделенных из плазмы мышей и содержащих Apo-IFN и IFN-Apo, рассчитывали с помощью анализа биологической активности, измеряя способность IFN защищать клетки против цитопатической активности литического вируса энцефаломиокардита (EMCV) в широком диапазоне концентраций IFN на планшете, полученных посредством серийного разведения образцов. Что касается данного разведения, клетки L929 высевали на 96-луночные планшеты для культивирования клеток Cellstar (Greiner bio-one) с плотностью 3×105 клеток/лунку и инкубировали в течении ночи при 37°C и 5% CO2 для получения монослоя клеток, прикрепленных к субстрату. Затем добавляли такое же количество EMCV в лунки и инкубировали 24 часа до появления лиза необработанных клеток, которые использовались в качестве контроля. На данном этапе, жизнеспособные клетки, защищенные действием IFN, измеряют люминометрией с проявляющим раствором ViaLight Plus Kit (Lonza) согласно инструкциям производителя. Показания прибора наносят на график для создания кривой зависимости «доза-эффект» (Prism 5, GraphPad Software, Inc.), по которой можно рассчитать активность препаратов IFN в пересчете на единицы антивирусной активности относительно стандарта рекомбинантного белка rIFNα (PBL), применяемого в каждом анализе.
2.11 Эксперименты с rIFN и изолированными фракциями ЛПВП IFN-Apo:
10000 IU мышиного rIFN альфа (мышиное производное CHO-клеток, Biotechnol Hycult) или 10000 IU ЛПВП IFN-Apo, отмеренные посредством теста на биологическую активность, инъецировали мышам ретроорбитально.
2.12 Статистический анализ данных:
Статистический анализ данных проводили с использованием программы Prism 5 (GraphPad Software, Inc.). Данные по образованию опухоли были представлены в виде кривой Каплана-Мейера и проанализированы с помощью логарифмического рангового критерия. Данные, полученные в разные временные точки, анализировали дисперсионным анализом для многократных измерений с последующим тестом Бонферрони. Остальные параметры анализировали с помощью дисперсионного анализа с последующим апостериорным анализом Даннетта для множественных сравнений. Достоверными считали величины p<0,05.
ПРИМЕР 2
Гидродинамическое введение химерных конструкций ApoA1-IFNα повышает уровни IFN в сыворотке
Для сравнения сывороточных уровней мышиного IFNα, группам из четырех мышей посредством гидродинамической инъекции вводили плазмиды, экспрессирующие аполипопротеин А1 (ApoA1), мышиный интерферон альфа 1 (IFNα1), Apo-IFN (слитые ApoA1 и IFNα1) или IFN-Apo (слитые IFNα1 и ApoA1). Через 6 часов и на 1, 3, 6 и 9 дни получали сыворотку, которую анализировали посредством твердофазного иммуноферментного анализа по типу «сэндвича». Сыворотка мышей, которые получили контрольную плазмиду, экспрессирующую ApoA1 не содержала выявляемых уровней IFNα, указывая на то, что гидродинамическое введение само по себе или экспрессия ApoA1 не индуцируют экспрессию эндогенного IFNα (Фигура 1). Мыши, которых инъецировали плазмидами, экспрессирующими IFNα1, имели высокие уровни IFNα через 6 часов, которые быстро снижались (Фигура 1). Мыши, которые получили плазмиды, кодирующие Apo-IFN или IFN-Apo, имели более высокие уровни интерферона на первый день. Кроме того, высокие уровни IFNα могут быть обнаружены на третий день, в отличие от мышей, инъецированных плазмидой IFNα1 (Фигура 1). Таким образом, конструкции, экспрессирующие слитые белки ApoA1 и IFNα, имеют более высокие и более устойчивые уровни IFNα в сыворотке.
ПРИМЕР 3
Кинетика матричной РНК не изменяется в химерных конструкциях ApoA1-IFNα
Различие в сывороточных уровнях IFNα можно объяснить увеличением времени полужизни слитых белков в плазме по сравнению с IFNα или увеличением экспрессии этих белков. Чтобы различить эти две альтернативы, была проанализирована кинетика матричной РНК (мРНК) данных конструкций. Для этого, на 0, 1, 3 и 6 дни собирали печени мышей, получавших гидродинамическую инъекцию с плазмидами, экспрессирующими ApoA1, IFNα1, Apo-IFN и IFN-Apo. Из этих образцов выделяли РНК и проводили количественную ОТ-ПЦР. Как можно видеть на Фигуре 2, уровни мРНК были обнаружены на 1 день в образцах IFNα1, Apo-IFN и IFN-Apo, но не в образцах ApoA1. Не было достоверных различий в уровнях мРНК между группами с любой конструкцией с IFNα. На 3 и 6 дни уровни мРНК IFNα1 не выявлялись ни в каких образцах. Таким образом, кинетика мРНК является сходной во всех группах с конструкциями, содержащими IFNα1, и гипотезу об увеличении экспрессии в химерных конструкциях ApoA1-IFNα1 можно отбросить.
ПРИМЕР 4
Мыши с введенными химерными конструкциями ApoA1-IFNα имеют более высокие уровни неоптерина в сыворотке и более высокую температуру тела
Для подтверждения i) того, что химерные белки сохраняют биологическую активность IFNα и ii) что более устойчивые уровни коррелированы с более высокой биологической активностью, исследовали два параметра, которые возрастают после введения IFNα. Эти параметры исследовали в течение трех деней после введения плазмид, в это время, IFNα, который вырабатывается конструкцией с IFNα1, больше не определяется, но определяется тот IFNα, который вырабатывается химерными конструкциями. Во-первых, анализировали сывороточные уровни неоптерина. Неоптерин представляет собой продукт катаболизма ГТФ, который синтезируется макрофагами, стимулированными интерферонами I и II типов. Три плазмиды, содержащие последовательность IFNα, повышали уровень неоптерина в сыворотке, но только химерные конструкции повышали его значительно (фиг.3A). Во-вторых, мышам, которым делали инъекции, измеряли температуру тела в брюшной области. Наблюдали высокие уровни для трех конструкций, уровни, наблюдаемые для химерных конструкций, подчеркнуты отдельно (фиг.3B). Таким образом, химерные белки способны увеличивать два биологических параметра, индуцируемых интерфероном, демонстрируя, что они сохраняют биологическую активность, и эта активность коррелирует с уровнями IFNα в сыворотке на 3 день.
ПРИМЕР 5
Химерные конструкции ApoA1-IFNα повышают уровни экспрессии интерферон-стимулированных генов в печени
Активность интерферонов I типа опосредуется белками, которые кодируются интерферон-стимулированными генами (ISG). После того как IFNα свяжется с их мембранным рецептором, запускается сигнальный каскад, который приводит к активации транскрипции ISG. Для того чтобы проверить, индуцируют ли также химерные конструкции эти гены, исследовали уровни мРНК четырех из этих генов на 3 день после гидродинамического введения. Исследовали гены IRF1, 2'-5' OAS, USP18, ISG15, Mх1. Как можно видеть на фигуре 4, химерные конструкции повышали уровни мРНК исследуемых ISG. Можно также наблюдать увеличение, индуцируемое плазмидами, которые экспрессируют IFNα, несмотря на тот факт, что на 3 день IFNα больше не обнаруживался в сыворотке.
ПРИМЕР 6
Конструкции с IFNα увеличивают число спленоцитов и их активацию
Для изучения иммуностимулирующей активности конструкций, сначала исследовали число и активность клеток селезенки. Для этого, с помощью гидродинамической инъекции вводили плазмиды и через 6 дней, измельчали селезенки, считали общее количество клеток, и после того, как спленоциты были помечены антителами для выявления основных популяций лимфоцитов и активационным маркером (CD69), их анализировали с помощью проточной цитометрии. Введение конструкций с IFNα значительно увеличило число спленоцитов. Конструкция, кодирующая IFN-Apo, значительно выделяется в данном тесте (Фигура 5A). Для того чтобы пометить различные популяции спленоцитов использовали анти-CD4 антитела в качестве маркера CD4+ T-клеток, анти-CD8 в качестве маркера CD8+ T-клеток, анти-CD 19, в качестве маркера B-клеток и анти-CD49b, в качестве маркера NK клеток. Что касается CD4+ Т-клеток, химерные конструкции увеличили процент активированных CD4+ клеток, в отличие от IFNα (фигура 5B). Однако, IFNα повысил процентное содержание CD8+ клеток, хотя и незначительным образом. Увеличение было более значительным и достоверным для Apo-IFN, и особенно высоким для IFN-Apo (фигура 5C). Процент активированных B-клеток изменился по тому же профилю, что и CD8+. В этом случае, только IFN-Apo привел к достоверному увеличению (фигура 5D). Наконец, NK клетки показали высокую активацию плазмидой IFNα, этот параметр не был перекрыт химерными конструкциями (фигура 5E). Эти данные подтверждают, что IFN-Apo может иметь мощный адъювантный эффект.
ПРИМЕР 7
IFN-Apo увеличивает специфический лизис, индуцированный цитотоксическими лимфоцитами
Для подтверждения адъювантного эффекта IFN-Apo исследовали увеличение цитотоксической активности, индуцированное ДНК-вакциной, в присутствии различных конструкций. В качестве модели антигена выбрали ген LacZ, кодирующий иммуногенный белок β-галактозидазу. Плазмиду, кодирующую этот белок, вводили совместно с плазмидами, кодирующими ApoА1, IFNα1, Apo-IFN или IFN-Аpo. Через 7 дней после генетической вакцинации вводили внутривенно спленоциты, меченные 2,5 мкМ CFSE и нагруженные цитотоксическим эпитопом H2Kd TPHPARIGL, производным белка в-галактозидазы. Спленоциты с 0,25 мкМ CFSE без пептида вводили в качестве внутреннего контроля. Через 24 часа с помощью проточной цитометрии количественно оценивали специфический лизис спленоцитов, нагруженных цитотоксическим эпитопом. На фигуре 6, более высокий лизис наблюдали для ApoA1 по сравнению с IFNα, за которым следуют Apo-IFN и IFN-Apo, конструкция, для которой были получены самые высокие величины специфического лизиса. Эти результаты коррелируют с результатами процентного количества активации CD8+ T-клеток и позволяют сделать вывод, что IFN-Apo является конструкцией с наибольшим адъювантным эффектом на модели генетической вакцинации.
ПРИМЕР 8
Экспрессия SR-BI
Увеличение адъювантной активности может быть обусловлено увеличением стабильности IFNα или тем фактом, что фракция ApoA1 в IFN-Apo допускает более активное взаимодействие IFNα с клетками иммунной системы. Для проверки последней гипотезы, исследовали наличие основного рецептора для ApoA1, SR-B1, на различных популяциях клеток иммунной системы. У наивных мышей выделяли спленоциты и метили анти-SR-B1 антителами и антителами для определения популяции. Использовали следующие антитела: анти-CD4 в качестве маркера CD4+ T-клеток, анти-CD8 в качестве маркера CD8+ T-клеток, анти-CD 19, в качестве маркера B-клеток и анти-CD49b, в качестве маркера NK клеток, анти-CD11b в качестве маркера моноцитов/макрофагов и анти-CD11c, в качестве маркера дендритных клеток. Рецептор SR-B1 рецептор был выявлен во всех анализируемых популяциях. В эффекторных клетках иммунной системы (CD4+ Т-клетках, CD8+ Т-клетках и NK клетках) процентное содержание клеток, экспрессирующих этот рецептор, варьировало между 15% и 28%. Это процентное содержание вырастало до более чем 50% для клеток с антигенпрезентирующими свойствами, таких как моноциты и дендритные клетки (фигура 7). Этот результат подтверждает, что одним из возможных механизмов для увеличения адъювантной способности может быть повышенное созревание антигенпредставляющих клеток.
ПРИМЕР 9
IFN-Apo улучшает эффективность противоопухолевого протокола вакцинирования
После демонстрации того, что IFN-Apo имеет более высокую адъювантную активность, чем IFN, оценивали, приводит ли этот эффект к более высокой противоопухолевой эффективности в протоколе вакцинирования. Для этого, мышам BALB/c делали гидродинамическую инъекцию с плазмидами Apo, IFN или IFN-Apo и на следующий день вакцинировали их цитотоксическим пептидом AH-1 в неполном адъюванте Фрейнда. Этот пептид вырабатывается линией опухолевых клеток CT26, которые прививали различным экспериментальным группам через 9 дней после вакцинации. У большинства мышей из контрольной группы, которые получали вакцинацию плюс гидродинамическую инъекцию с плазмидой Apo, развилась подкожная опухоль в месте прививки опухолевых клеток CT26. Мыши, которые получали IFN в дополнение к вакцинации, не отличались значительно от контрольной группы. Однако, приблизительно 60% мышей, которые получили вакцинацию и плазмиду IFN-Apo, были способны к отторжению опухолевых клеток, и у них не было выявлено опухолей на протяжении 30 дней эксперимента (Фигура 8). Таким образом, наибольший адъювантный эффект IFN-Apo приводит к увеличению эффективности протокола вакцинации.
ПРИМЕР 10
IFN-Apo показывает более низкую гематологическую токсичность, чем IFN.
Одним из недостатков IFN является его существенная гематологическая токсичность, которая может привести к временному прекращению лечения у определенных пациентов, у которых развивается сильная лейкопения и/или тромбоцитопения. Поэтому анализировали изменения во времени лейкоцитов и тромбоцитов в крови после гидродинамического введения различных конструкций. На Фигуре 9A видно, что все конструкции, имеющие интерферон, демонстрируют низкие уровни лейкоцитов в крови на 1 день после гидродинамического введения плазмид. Этот ранний эффект может быть связан с блокированием выхода лейкоцитов из вторичных лимфоидных органов, которое описано для IFN (Shiow LR et al. Nature. 440 (7083):540-4 (2006)). Однако, на 3 день, когда может быть виден токсический эффект, связанный с антипролиферативными свойствами IFN, низкие уровни демонстрировали только мыши, получившие IFN. У мышей, получивших IFN-Apo, лейкоциты крови восстановили свои нормальные уровни. Что касается тромбоцитов (фиг.9B), то наблюдали снижение на 3 день у животных, получивших IFN. Это снижение было значительно меньше у мышей, получивших IFN-Apo. Таким образом, IFN-Apo уменьшает снижение, как лейкоцитов, так и тромбоцитов, вызванное IFN.
ПРИМЕР 11
IFN-Apo активирует интерферон-стимулированные гены в головном мозге меньше, чем IFN.
Другим из основных побочных эффектов IFN, ограничивающим его применение у определенных больных, являются нервно-психические расстройства. Для изучения действия слитых молекул по изобретению на центральную нервную систему, мышам BALB/c делали инъекцию плазмид, кодирующих различные конструкции, через 24 часа мышей забивали и выделяли головной мозг. Повышение активности интерферон-стимулированных генов (ISG) в различных группах (фигура 10) анализировали методом количественной ОТ-ПЦР. Хотя уровни слитых белков в плазме были выше, чем уровни IFN (фигура 11), активация ISG была значительно больше при IFN, чем в присуствии молекул IFN-Apo. Эти данные указывают на то, что слияние молекулы Apo с IFN изменяет прохождение через гематоэнцефалический барьер (ГЭБ). 0,02%-0,18% плазменного интерферона-альфа пересекает ГЭБ за счет пассивной диффузии (Greig, NH, et al. J Pharmacol Exp There, 245 (2): 574-80 (1988); Greischel, A., et al. Arzneimittelforschung, 38 (10): 1539-1943 (1988), Smith, RA, et al. Clin Pharmacol Ther. 37 (1): 85-8. (1985)). Таким образом, концентрация в головном мозге будет пропорциональна концентрации в плазме. Напротив, прохождение ЛПВП через ГЭБ осуществляется путем активного транспорта, опосредованного SR-BI, поддерживаются высококонтролируемые низкие уровни (Karasinska, JM, et al. J Neurosci. 29 (11): 3579-89 (2009)). Наши результаты подтверждают, что связывание биологически активных соединений с аполипопротеином A1 заставляет такие химерные молекулы следовать через ГЭБ по механизму транспорта для ЛПВП.
ПРИМЕР 12
Слитые белки IFN-Apo циркулируют, инкорпорированные в липопротеины высокой плотности (ЛПВП).
Приблизительно 97% аполипопротеина А1 присутствует в крови, циркулируя в составе макромолекулярного липопротеинового комплекса, который называется липопротеины высокой плотности. Для того чтобы исследовать, способен ли слитый белок инкорпорироваться в ЛПВП, делали гидродинамическую инъекцию плазмид, кодирующих молекулы IFN и IFN-Apo, и через 24 часа выделяли ЛПВП из сыворотки методом дифференциального центрифугирования в градиенте NaBr. С этими фракциями проводили анализ биологической активности IFN, т.е. тест защиты от цитопатического действия вируса, в котором клетки, предварительно инкубированные с образцами с IFN в серийных разведениях, сравниваются при наличии цитопатического вируса. Если образцы содержат интерферон, вирус не способен лизировать обработанные клетки. ЛПВП, полученные от мышей, которым вводили плазмиду, кодирующую IFN, были не способны защитить клетки от цитопатического действия вируса, энцефаломиелита, что указывает на то, что IFN не циркулирует в составе ЛПВП. Напротив, две молекулы IFN-Apo были действительно обнаружены в ЛПВП посредством данной техники (фигура 11A). Затем проводили вестерн-блоттинг для выявления аполипопротеина в сыворотке, свободной от фракций ЛПВП (ЛПВП-), и во фракции ЛПВП (ЛПВП+) в каждой экспериментальной группе. Аполипопротеин A1 не был обнаружен ни в одной фракции, лишенной ЛПВП, что указывает на правильное выделение ЛПВП. Как в группе, которая получила плазмиду с Apo, так и в группе, которая получила плазмиду с IFN, была выявлена только одна полоса во фракции ЛПВП, соответствующая размеру эндогенного аполипопротеина A1. Напротив, полоса большего размера была выявлена в группе с молекулой Apo-IFN, что соответствует слитой молекуле. В случае молекулы IFN-Apo, были выявлены две полосы в дополнение к эндогенному ApoAI, что указывает на формирование димеров в части химерных белков (фигура 11B). Это явление может быть связано с тем, что С-конец в данной конструкции свободен и может взаимодействовать с другими молекулами ApoAI. Эти данные указывают на то, что слитые молекулы способны инкорпорироваться в липопротеины высокой плотности. Следовательно, биораспределение этих молекул будет регулироваться правилами, которые управляют биораспределением ЛПВП, что может объяснить, по меньшей мере, частично, резкие изменения, наблюдаемые для некоторых видов активности IFN.
ПРИМЕР 13
Повторное введение ЛПВП, которые содержат IFN-Apo, сохраняет свойства, наблюдаемые после гидродинамического введения
Возможность очищения ЛПВП, содержащих IFN-Apo, из сыворотки мышей, которым вводили плазмиду, кодирующую IFN-Apo, обеспечивает физиологическими нанолипочастицами IFN-Apo для изучения их свойств in vitro и in vivo. ЛПВП с IFN-Apo очищали и вводили мышам в количестве, эквивалентном 10000 ME IFN на мышь. На 3 день исследовали количество лейкоцитов и тромбоцитов в крови. Введенная доза рекомбинантного IFN была не способна привести к снижению этих параметров. Но мыши, которые получили ЛПВП с IFN-Apo, демонстрировали значительно более высокие уровни (фигура 12A). Этот феномен может быть связан с тем фактом, что IFN-Apo стимулирует пролиферацию латентных гематопоэтических клеток более эффективно, чем IFN (Essers MA, et al. Nature. Feb 11 (2009)). На 1 день у этих мышей выявляли понижение, индуцированное IFN. И снова существует значительное различие между мышами, которые получили рекомбинантный IFN, и мышами, которые получили эквивалентную дозу в виде ЛПВП с IFN-Apo; воспроизводятся результаты, которые наблюдали после гидродинамического введения.
ПРИМЕР 14
Конструкция ApoA1-линкер-P144 усиливает индукцию IFNγ, вызванную IL12
Интерлейкин 12 (IL12) представляет собой иммуностимулирующий цитокин с мощной противоопухолевой активностью. Его активность, главным образом, опосредуется IFNγ. Выработка этого медиатора регулируется TGFβ, и, следовательно, блокада TGFβ посредством ингибиторных пептидов p17 или p144 может увеличить индукцию IFNγ и, таким образом, противоопухолевую активность IL12. Гидродинамической инъекцией вводили плазмиду, кодирующую мышиный IL12 и плазмиды, кодирующие различные конструкции, для того, чтобы исследовать, могут ли химерные конструкции, которые образованы ApoA1 и ингибиторными пептидами TGFβ, связанными между собой посредством различных пептидных последовательностей, повышать индукцию IFNγ, опосредованную IL12. В качестве контроля использовали ApoA1. Были созданы две конструкции с p17: i) spP17, которая содержит последовательность, кодирующую пептид pl7 c последовательностью сигнального пептида ApoA1 впереди, чтобы добиться высвобождения пептида p17 во внеклеточное пространство ii) ApoA1-P17, которая содержит ген, кодирующий ApoA1, за которым следуют три связующих аминокислоты (GAP) и последовательность, кодирующая p17. Заменяя последовательность, кодирующую p17, на последовательность p144, создали конструкции с p144, spP144 и ApoA1-P144. Более того, были созданы две другие конструкции: i) ApoA1-MMP9-P144, которая в качестве связывающего пептида содержит мишень для металлопротеиназы 9 (MMP9). ii) ApoA1-линкер-P144, которая в качестве связывающего пептида содержит последовательность с растянутой конформацией.
Через четыре дня после гидродинамической инъекции исследовали уровни сывороточного IFNγ методом твердофазного иммуноферментного анализа. Инъекция плазмид, кодирующих IL12 и ApoA1, привела к появлению обнаруживаемых уровней IFNγ. Инъекция конструкций с p17 не повысила эти уровни (фигура 13A). Однако, введение конструкции, производящей p144, значительно повысило уровни IFNγ (фигура 13B). Конструкция ApoA1-линкер-P144 вызвала наибольшие уровни, значительно выше тех, что были индуцированы одним лишь p144 (фигура 13B). Достаточно любопытно, что конструкции ApoA1-P144 и ApoA1-MMP9-P144 не увеличили индукцию IFNγ, что указывает на то, что последовательность связывающего пептида может значительно влиять на активность химерной конструкции. Конструкция ApoA1-MMP9-P144 является примером латентного ингибитора, активного только в присутствии MMP9, которая разрезая последовательность, связанную с ApoA1, будет высвобождать активный пептид p144 в том месте, где экспрессируется MMP9. Эта протеаза экспрессируется во многих типах опухолей, включая гепатокарциномы, а также миелоидными супрессорными клетками. Следовательно, эта конструкция будет приводить к высвобождению p144 в том участке, в котором он и должен главным образом действовать, ограничивая побочные эффекты от системного ингибирования TGFβ.
ПРИМЕР 15
Конструкции, экспрессирующие p17 и ApoA1-линкер-P144, увеличивают процентное содержание вакцинированных мышей без опухоли
Для подтверждения биологической активности конструкций с ингибиторными пептидами TGFβ на независимой экпериментальной модели, мышей BALB/c вакцинировали цитотоксическим эпитопом H2Kd AH1 (SPSYVYHQF, SEQ ID NO:54) в неполном адъюванте Фрейнда. Через 7 дней вводили различные конструкции посредством гидродинамической инъекции. Еще через семь дней прививали подкожно 5 × 105 клеток CT26. С течением времени анализировали процентное содержание животных без опухоли. В группе, которая получила вакцину и контрольную конструкцию, экспрессирующую ApoA1, у всех мышей развилась подкожная опухоль в месте прививки клеток CT26. Однако, более чем у 50% мышей, которые получили одну из двух конструкций, экспрессирующих p17, к концу эксперимента опухоль отсутствовала (Фигура 14А). Что касается конструкций с p144, конструкция, экспрессирующая пептид p144, конструкция AсoA1 и конструкция ApoA1-линкер-P144 имели довольно ограниченный эффект, и менее чем 20% мышей были без опухоли к концу эксперимента. Неожиданно, конструкция ApoA1-линкер-P144 оказалась способна предотвратить появление опухоли более чем у 85% мышей.
ПРИМЕР 16
Белок ApoA1-линкер-P144 циркулирует, инкорпорированный в липопротеины высокой плотности
Для изучения того, формирует ли белок ApoA1-линкер-P144 комплексы с ЛПВП, фракцию, содержащую ЛПВП, выделяли из сыворотки мыши, которой гидродинамическим путем вводили плазмиду, кодирующую ApoA1-линкер-P144. Для этого сыворотку подвергали дифференциальному центрифугированию в градиенте NaBr. Как только ЛПВП были выделены, проводили Вестерн-блоттинг для выявления аполипопротеина А1. В дополнение к основной полосе, соответствующей эндогенному аполипопротеину А1, выше была выявлена полоса, соответствующая молекуле ApoA1-линкер-P144 (Фигура 15). Таким образом, аполипопротеин А1, слитый с терпапевтическими пептидами, способен инкорпорироваться и циркулировать в форме физиологической нанолипочастицы.
ПРИМЕР 17
ЛПВП, которые содержат ApoA1-линкер-P144, повышают IFNγ, индуцированный IL-12.
Очистка ЛПВП, которые содержат ApoA1-линкер-P144, позволила получить физиологические нанолипочастицы, способные ингибировать активность TGFβ. Для демонстрации их активности in vivo, очищенные ЛПВП от животного, экспрессирующего ApoA1-линкер-P144, прививали мышам, которым одновременно делали гидродинамическую инъекцию плазмиды, экспрессирующей интерлейкин 12 в ответ на доксициклин. В качестве положительного контроля вводили плазмиду ApoA1-линкер-P144. Уровни IFNγ, наблюдаемые после введения ЛПВП, были сходны с теми, которые наблюдали после гидродинамической инъекции (Фигура 16). В обоих случаях, они были значительно выше наблюдаемых после индукции плазмидой IL-12 без ингибитора TGFβ. Следовательно, пептид P144, присутствующий в ЛПВП способен блокировать TGFβ in vivo, допуская более значительную индукцию IFNγ. Таким образом, инкорпорация пептидов в ЛПВП посредством их слияния с аполипопротеином А1 представляется привлекательной стратегией для разработки новых терапевтических пептидов.
Реферат
Изобретение относится к области биотехнологии, конкретно к конъюгатам Apo A с терапевтическими полипептидами, и может быть использовано в медицине. Получают конъюгат, содержащий молекулу Apo A-I или ее функционально-эквивалентный вариант, такой как Apo А-IV или Аро A-V, ковалентно связанную с представляющим терапевтический интерес полипептидом, выбранным из интерферона, ингибитора TGF-бета Р144 или Р17, IL-15, кардиотрофина-1, порфобилиногендеаминазы, инсулина и фактора VII. Полученный конъюгат позволяет продлить время полужизни вводимого индивиду терапевтического полипептида, а также доставить его к тем тканям, которые имеют сайты специфического связывания для молекулы Apo A. 8 н. и 24 з.п. ф-лы, 16 ил., 1 табл., 15 пр.
Формула
(i) молекулу Apo A-I или ее функционально-эквивалентный вариант, в котором указанный функционально-эквивалентный вариант представляет собой Apo А-IV и Аро A-V, и
(ii) представляющий терапевтический интерес полипептид, где указанный полипептид выбран из группы, состоящей из интерферона, ингибитора TGF-бета, выбранного из группы SEQ ID NO: 4 (Р144) и SEQ ID NO: 5 (Р17), IL-15, кардиотрофина-1, порфобилиногендеаминазы, инсулина и фактора VII,
где компоненты (i) и (ii) ковалентно связаны, где компоненты (i) и (ii) образуют единую полипептидную цепь и компоненты (i) и (ii) связаны непосредственно или с помощью пептидного линкера.
(a) первый компонент, выбранный из группы конъюгата по любому из пп. 1-9, полинуклеотида по п. 13, генной конструкции по п. 14, вектора по п. 19, клетки-хозяина по п. 23, нанолипочастицы по п. 27 или 28 и
(b) второй компонент, выбранный из группы иммуностимулирующего цитокина, полинуклеотида, кодирующего указанный цитокин, вектора, содержащего указанный полинуклеотид, цитотоксического агента или их сочетания.

Комментарии