Платформы доставки антигенов - RU2597974C2
Код документа: RU2597974C2
Чертежи














































































































































































































































































































































































































Описание
РОДСТВЕННАЯ ЗАЯВКА
[01] По настоящей заявке испрашивается приоритет предварительной патентной заявки США, No. 61/391960, поданной 11 октября 2010 г., полное объяснение содержания которой приведено в настоящем документе в качестве ссылки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[02] Вирусы герпеса широко распространены и вызывают у человека широкий ряд заболеваний, которые в худших случаях могут приводить к значительной заболеваемости и смертности, в первую очередь, у индивидуумов с иммунной недостаточностью (например, реципиентов трансплантатов и ВИЧ-инфицированных индивидуумов). Люди являются чувствительными к инфекции по меньшей мере восемью вирусами герпеса. Вирус простого герпеса-1 (HSV-1, HHV-1), вирус простого герпеса-2 (HSV-2, HHV-2) и вирус ветряной оспы (VZV, HHV-3) являются вирусами альфа-подсемейства, цитомегаловирус (CMV, HHV-5) и розеоловирус (HHV-6 и HHV-7) являются вирусами бета-подсемейства, вирус Эпштейна-Барра (EBV, HHV-4) и ассоциированный с саркомой Капоши вирус герпеса (KSHV, HHV-8) являются вирусами гамма-подсемейства, инфицирующими человека.
[03] Инфекция CMV приводит к значительной заболеваемости и смертности у индивидуумов с иммунной недостаточностью (например, реципиентов трансплантатов и ВИЧ-инфицированных индивидуумов), и врожденная инфекция может приводить к разрушительным дефектам в неврологическом развитии новорожденных. Гликопротеины gB, gH, gL, gM и gN оболочки CMV являются привлекательными кандидатами для вакцины, поскольку они экспрессированы на поверхности вируса и могут вызывать защитные нейтрализующие вирус гуморальные иммунные ответы. Несколько стратегий вакцин против CMV были нацелены на главный поверхностный гликопротеин B (gB), который может индуцировать доминантный ответ антител. (Go and Pollard, JID 197: 1631-1633 (2008)). Гликопротеин gB CMV может индуцировать ответ нейтрализующих антител, и большая фракция антител, нейтрализующих инфекцию фибробластов, в сыворотке от CMV-положительных пациентов направлена против gB (Britt 1990). Подобным образом, опубликовано, что gH и gM/gN являются мишенями для иммунного ответа на природную инфекцию (Urban et al (1996) J. Gen. Virol. 77(Pt. 7): 1537-47; Mach et al (2000) J. Virol. 74(24): 11881-92).
[04] Комплексы белков CMV также являются привлекательными кандидатами для вакцины, поскольку они, по-видимому, вовлечены в важные процессы в жизненном цикле вируса. Например, комплекс gH/gL/gO, по-видимому, играет значительные роли в проникновении как в фибробласты, так и в эпителиальные/эндотелиальные клетки. Наиболее распространенная модель предполагает, что комплекс gH/gL/gO опосредует инфекцию фибробластов. hCMV gO-нуль-мутанты образуют небольшие бляшки на фибробластах и очень низкий титр вируса, что указывает на роль в проникновении (Dunn (2003), Proc. Natl. Acad. Sci. USA 100:14223-28; Hobom (2000) J. Virol. 74:7720-29). Недавние исследования позволяют предполагать, что gO не включается в вирионы с gH/gL, но может действовать как молекулярный шаперон, увеличивая экспорт gH/gL из ER к аппарату Гольджи и включение в вирионы (Ryckman (2009) J. Virol 82:60-70). В ходе экспериментов с вытеснением метки показано, что небольшие количества gO остаются связанными с gH/gL в течение длительных периодов времени, но большинство gO диссоциирует и/или деградирует из комплекса gH/gL/gO, поскольку он не обнаружен во внеклеточных вирионах или секретированным из клеток. Когда gO делетировали из клинического штамма CMV (TR), эти вирусные частицы обладали значительно сниженными количествами gH/gL, включенных в вирион. Кроме того, gO, делетированный из вируса TR, также ингибировал проникновение в эпителиальные и эндотелиальные клетки, что позволяет предполагать, что gH/gL также необходимы для проникновения в эпителиальные/эндотелиальные клетки (Wille (2010) J. Virol. 84(5):2585-96).
[05] gH/gL CMV могут также ассоциировать с UL128, UL130 и UL131A (обозначенным в настоящем документе как UL131) и формировать пентамерный комплекс, который необходим для проникновения в несколько типов клеток, включая эпителиальные клетки, эндотелиальные клетки и дендритные клетки (Hahn et al (2004) J. Virol. 78(18): 10023-33; Wang and Shenk (2005) Proc. Natl. Acad. Sci USA 102(50): 18153-8; Gerna et al (2005). J. Gen. Virol. 84(Pt 6): 1431-6; Ryckman et al (2008) J. Virol. 82:60-70). В отличие от этого, этот комплекс не является необходимым для инфекции фибробластов. Лабораторные изоляты hCMV несут мутации в локусе UL128-UL131, и мутации возникают в клинических изолятах после только небольшого количества пассажей на культивируемых фибробластах (Akter et al (2003) J. Gen. Virol. 84(Pt 5): 1117-22). В ходе природной инфекции пентамерный комплекс вызывает образование антител, нейтрализующих инфекцию эпителиальных клеток, эндотелиальных клеток (и, по-видимому, любого другого типа клеток, где пентамерный комплекс опосредует проникновение вируса) с очень высокой активностью (Macagno et al (2010) J. Virol. 84(2): 1005-13). Также, по-видимому, антитела к этому комплексу вносят значительный вклад в способность сыворотки человека нейтрализовывать инфекцию эпителиальных клеток (Genini et al (2011) J. Clin. Virol. 52(2): 113-8).
[06] В US 5767250 описаны способы получения конкретных комплексов белков CMV, содержащих gH и gL. Комплексы получают введением конструкции ДНК, кодирующей gH, и конструкции ДНК, кодирующей gL, в клетку, так что gH и gL экспрессируются совместно.
[07] В WO 2004/076645 описаны рекомбинантные молекулы ДНК, кодирующие белки CMV. Согласно этому документу, комбинации отдельных молекул ДНК, кодирующих различные белки CMV, можно вводить в клетки, чтобы вызывать совместную экспрессию кодируемых белков CMV. Когда gM и gN совместно экспрессировали таким образом, они формировали комплекс с дисульфидными связями. У кроликов, иммунизированных конструкциями ДНК, образующими комплекс gM/gN, или конструкцией ДНК, кодирующей gB, получали эквивалентные ответы нейтрализующих антител.
[08] Существует необходимость в нуклеиновых кислотах, кодирующих два или более белка вируса герпеса, в способах экспрессии двух или более белков вируса герпеса в одной и той же клетке, и в способах иммунизации, приводящих к лучшим иммунным ответам.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[09] Изобретение относится к платформам для совместной доставки к клеткам двух или более белков вируса герпеса, таких как белки цитомегаловируса (CMV), в частности, белков, формирующих комплексы in vivo. В одном аспекте изобретение относится к молекулам рекомбинантной полицистронной нуклеиновой кислоты, содержащим первую последовательность, кодирующую первый белок вируса герпеса (например, CMV) или его фрагмент, и вторую последовательность, кодирующую второй белок вируса герпеса (например, CMV) или его фрагмент.
[10] Например, изобретение относится к самореплицирующейся молекуле РНК, содержащей полинуклеотид, который содержит a) первую нуклеотидную последовательность, кодирующую первый белок или его фрагмент из вируса герпеса; и b) вторую нуклеотидную последовательность, кодирующую второй белок или его фрагмент из вируса герпеса. Первая нуклеотидная последовательность и вторая нуклеотидная последовательность являются функционально связанными с одним или несколькими контрольными элементами, так что когда самореплицирующуюся молекулу РНК вводят в подходящую клетку, первый и второй белки вируса герпеса или их фрагменты продуцируются в количестве, достаточном для формирования в клетке комплекса, содержащего первый и второй белки или фрагменты. Предпочтительно, первый белок и второй белок не являются одним и тем же белком или фрагментами одного и того же белка, первый белок не является фрагментом второго белка, и второй белок не является фрагментом первого белка. Первая нуклеотидная последовательность может являться функционально связанной с первым контрольным элементом, и вторая нуклеотидная последовательность может являться функционально связанной со вторым контрольным элементом.
[11] Самореплицирующаяся молекула РНК может дополнительно содержать третью нуклеотидную последовательность, кодирующую третий белок или его фрагмент из указанного вируса герпеса, необязательно, четвертую нуклеотидную последовательность, кодирующую четвертый белок или его фрагмент из указанного вируса герпеса; и необязательно пятую нуклеотидную последовательность, кодирующую пятый белок или его фрагмент из указанного вируса герпеса. Когда присутствуют последовательности, кодирующие дополнительные белки или фрагменты из вируса герпеса, (т.е. третья, четвертая и пятая нуклеотидные последовательности), они являются функционально связанными с одним или более контрольными элементами. В одном из примеров пентацистронной конструкции первая нуклеотидная последовательность является функционально связанной с первым контрольным элементом, вторая нуклеотидная последовательность является функционально связанной со вторым контрольным элементом, третья нуклеотидная последовательность является функционально связанной с третьим контрольным элементом, четвертая нуклеотидная последовательность является функционально связанной с четвертым контрольным элементом, и пятая нуклеотидная последовательность является функционально связанной с пятым контрольным элементом. Контрольные элементы, присутствующие в конструкции (например, первый, второй, третий, четвертый и пятый контрольные элементы) могут являться независимо выбранными из группы, состоящей из субгеномного промотора, IRES и участка 2A вируса (например, FMDV).
[12] Вирус герпеса может представлять собой HSV-1, HSV-2, VZV, EBV типа 1, EBV типа 2, CMV, HHV-6 типа A, HHV-6 типа B, HHV-7 и HHV-8. В некоторых вариантах осуществления молекула рекомбинантной полицистронной нуклеиновой кислоты (например, самореплицирующаяся РНК) кодирует gH или его фрагмент и gL или его фрагмент из любого из этих вирусов герпеса. В более конкретных вариантах осуществления вирус герпеса представляет собой CMV или VZV.
[13] Когда молекула рекомбинантной полицистронной нуклеиновой кислоты (например, самореплицирующаяся РНК) кодирует два или более белка VZV, белки могут являться выбранными из группы, состоящей из gB, gE, gH, gI, gL и их фрагмента (например, по меньшей мере из 10 аминокислот). В некоторых вариантах осуществления молекула рекомбинантной полицистронной нуклеиновой кислоты (например, самореплицирующаяся РНК) кодирует VZV gH или его фрагмент и VZV gL или его фрагмент.
[14] В конкретном примере изобретение относится к самореплицирующейся молекуле РНК, содержащей полинуклеотид, который содержит a) первую последовательность, кодирующую первый белок цитомегаловируса (CMV) или его фрагмент; и b) вторую последовательность, кодирующую второй белок CMV или его фрагмент. Первая последовательность и вторая последовательность являются функционально связанными с одним или более контрольными элементами, так что когда самореплицирующуюся молекулу РНК вводят в подходящую клетку, первый и второй белки CMV продуцируются в количестве, достаточном для формирования в клетке комплекса, содержащего первый и второй белки CMV или их фрагменты.
[15] Первый белок CMV и второй белок CMV являются независимо выбранными из группы, состоящей из gB, gH, gL; gO; gM, gN; UL128, UL130, UL131 и фрагмента любого из вышеуказанных. Предпочтительно, первый белок CMV и второй белок CMV не являются одним и тем же белком или фрагментами одного и того же белка, первый белок CMV не является фрагментом второго белка CMV, и второй белок CMV не является фрагментом первого белка CMV. Если желательно, самореплицирующаяся молекула РНК может дополнительно содержать третью последовательность, кодирующую третий белок CMV, где третья последовательность является функционально связанной с контрольным элементом. Сходным образом, можно включать дополнительные последовательности, кодирующие дополнительные белки CMV (например, четвертую последовательность, кодирующую четвертый белок CMV, пятую последовательность, кодирующую пятый белок CMV). Контрольные элементы могут являться независимо выбранными из группы, состоящей из субгеномного промотора и IRES, и участка 2A вируса.
[16] В некоторых вариантах осуществления самореплицирующаяся молекула нуклеиновой кислоты кодирует белки gH и gL CMV. В других вариантах осуществления самореплицирующаяся молекула РНК кодирует белки gH, gL и gO CMV. В других вариантах осуществления самореплицирующаяся молекула РНК кодирует белки gH, gL, UL128, UL130 и UL131 CMV.
[17] Самореплицирующиеся молекулы РНК могут представлять собой репликон альфавируса. В таких случаях репликон альфавируса можно доставлять в форме частицы репликона альфавируса (VRP). Самореплицирующаяся молекула РНК может также присутствовать в форме «голой» молекулы РНК.
[18] Изобретение также относится к молекуле рекомбинантной ДНК, кодирующей самореплицирующуюся молекулу РНК, как описано в настоящем документе. В некоторых вариантах осуществления рекомбинантная молекула ДНК представляет собой плазмиду. В некоторых вариантах осуществления рекомбинантная молекула ДНК включает промотор млекопитающих, управляющий транскрипцией кодированной самореплицирующейся молекулы РНК.
[19] Изобретение также относится к композиции, содержащей самореплицирующуюся молекулу РНК, как описано в настоящем документе, и фармацевтически приемлемый носитель. Самореплицирующаяся молекула РНК может являться «голой». В некоторых вариантах осуществления композиция содержит самореплицирующуюся молекулу РНК, кодирующую белки gH и gL CMV. В других вариантах осуществления композиция дополнительно содержит самореплицирующуюся молекулу РНК, кодирующую белок gB CMV. Композиция может также содержать систему доставки РНК, такую как липосома, полимерная наночастица, катионная наноэмульсия масло-в-воде или их комбинации. Например, самореплицирующаяся молекула РНК может являться инкапсулированной в липосому.
[20] В конкретных вариантах осуществления композиция содержит VRP, содержащую репликон альфавируса, кодирующий два или более белков CMV. В некоторых вариантах осуществления VRP содержит репликон, кодирующий gH и gL CMV. Если желательно, композиция может дополнительно содержать вторую VRP, содержащую репликон, кодирующий gB CMV. Композиция может также содержать адъювант.
[21] Изобретение также относится к способам формирования комплекса белков CMV. В некоторых вариантах осуществления самореплицирующуюся РНК, кодирующую два или более белка CMV, доставляют в клетку, где клетку поддерживают в условиях, подходящих для экспрессии белков CMV, где формируется комплекс белков CMV. В других вариантах осуществления VRP, содержащую самореплицирующуюся РНК, кодирующую два или более белков CMV, доставляют в клетку, где клетку поддерживают в условиях, подходящих для экспрессии белков CMV, где формируется комплекс белков CMV. Способ можно использовать для формирования комплекса белков CMV в клетке in vivo.
[22] Изобретение также относится к способу индукции иммунного ответа у индивидуума. В некоторых вариантах осуществления самореплицирующуюся РНК, кодирующую два или более белка CMV, вводят индивидууму. Самореплицирующуюся молекулу РНК можно вводить в форме композиции, содержащей систему доставки РНК, такую как липосома. В других вариантах осуществления VRP, содержащую самореплицирующуюся РНК, кодирующую два или более белка CMV, вводят индивидууму. В предпочтительных вариантах осуществления самореплицирующаяся молекула РНК кодирует белки gH и gL CMV. Предпочтительно, индуцированный иммунный ответ включает в себя продукцию нейтрализующих антител против CMV. Более предпочтительно, нейтрализующие антитела являются независимыми от комплемента.
[23] Изобретение также относится к способу ингибирования проникновения CMV в клетку, включающему в себя контакт клетки с самореплицирующейся молекулой РНК, кодирующей два или более белка CMV, таких как gH и gL. Клетка может являться выбранной из группы, состоящей из эпителиальной клетки, эндотелиальной клетки, фибробласта и их сочетаний. В некоторых вариантах осуществления клетку приводят в контакт с VRP, содержащей самореплицирующуюся РНК, кодирующую два или более белка CMV.
[24] Изобретение также относится к применению самореплицирующейся молекулы РНК, кодирующей два или более белка CMV (например, VRP, композиция, содержащая самореплицирующуюся молекулу РНК и липосому), формирующих комплекс белков CMV в клетке, для индукции иммунного ответа или для ингибирования проникновения CMV в клетку.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
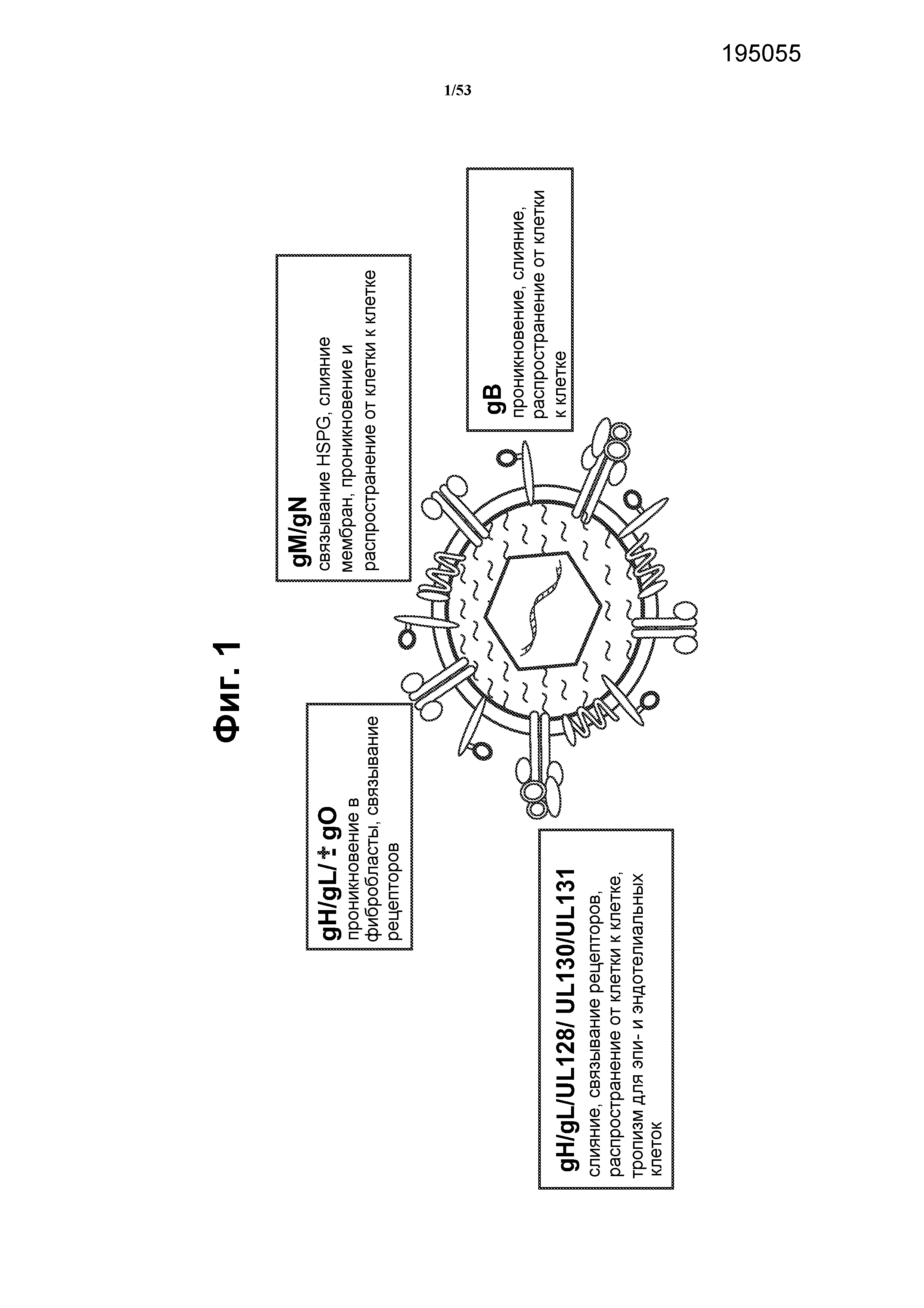
[25] Фиг. 1 представляет собой схему CMV, указывающую известные комплексы гликопротеинов, вовлеченные в проникновение CMV в клетки-мишени. Гликопротеины оболочки представляют собой привлекательные кандидаты для вакцин, поскольку они экспрессируются на вирусной поверхности и могут вызывать защитные и долговременные нейтрализующие вирус гуморальные иммунные ответы. Структурные гликопротеины, опосредующие эти процессы, можно разделить на два класса: гликопротеины, которые являются консервативными в семействе вируса герпеса, и гликопротеины, которые не являются консервативными. Среди тех, которые являются консервативными, присутствуют gB, gH, gL, gM и gN. Многие из этих гликопротеинов формируют комплексы друг с другом (gH/gL/±gO; gH/gL/UL128/UL130/UL131; gM/gN) для облегчения локализации на вирусной поверхности и для осуществления их функций в присоединении вируса, проникновении вируса и слиянии клеток.
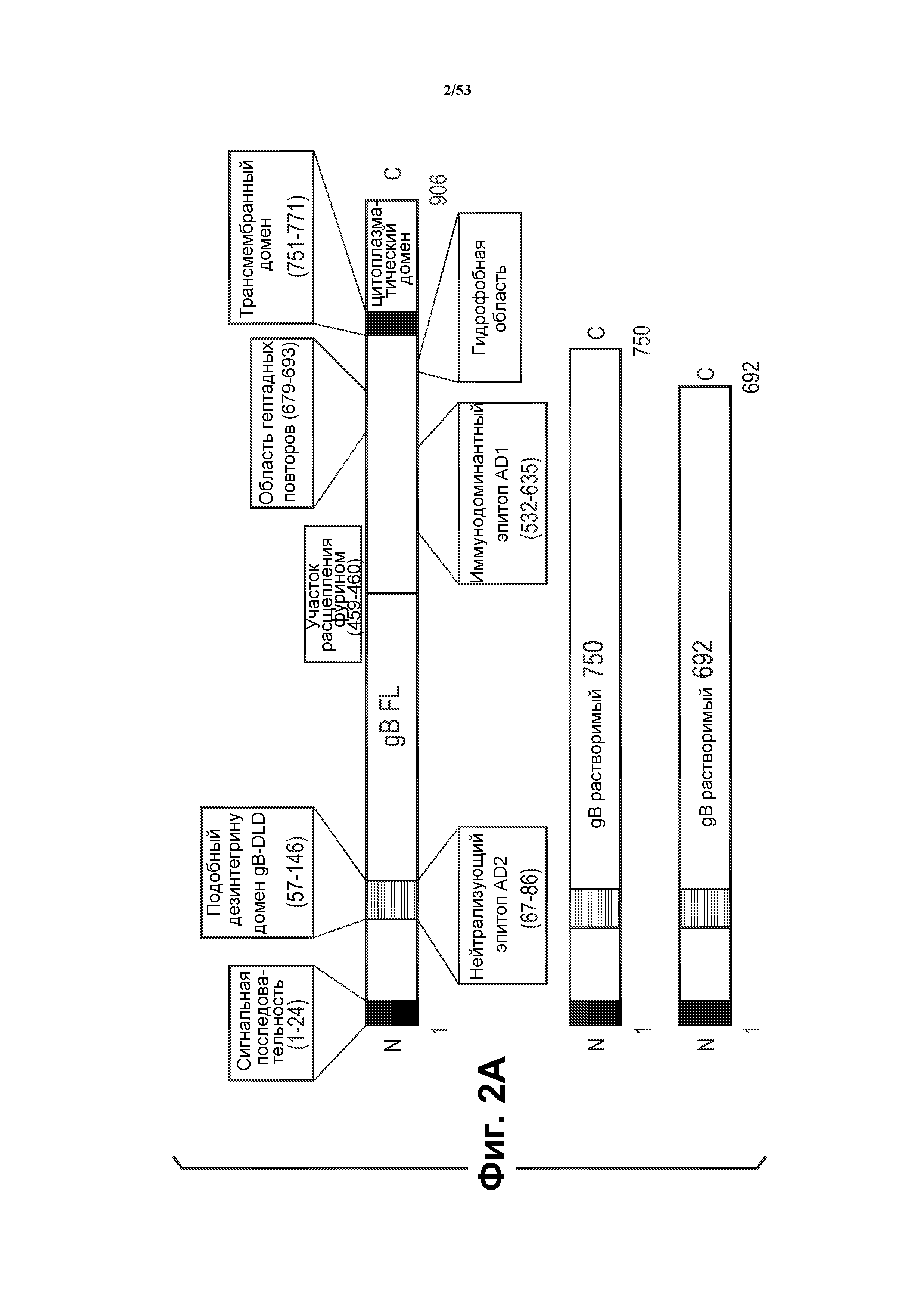
[26] Фиг. 2A-2F представляют собой схемы конструкций CMV. Фиг. 2A, схемы конструкций gB («gB FL», полноразмерный gB; растворимые gB «gB sol 750» и «gB sol 692»), описанные в примере 1. Сконструированы два различных растворимых варианта gB; в gB sol 750 отсутствует трансмембранный домен и цитоплазматический домен, в gB sol 692 также отсутствует гидрофобная область, и он является сходным с gB sol, описанным в Reap et al. (2007) Clin. Vacc. Immunol. 14:748-55. Фиг. 2B, схема векторов с репликоном gB, использованных для получения частиц для репликации вируса (VRP). Фиг. 2C, схемы конструкций gH («gH FL», полноразмерный gH; растворимый gH «gH sol»), описанных в примере 1. Сконструирован один растворимый вариант gH с отсутствующим трансмембранным доменом. Фиг. 2D, схема векторов с репликоном gH, использованных для получения VRP. Фиг. 2E, схема конструкции gL, описанной в примере 1. Фиг. 2F, схема вектора с репликоном gL, использованного для получения VRP. На фиг. 2B, 2D и 2F, «NSP1», «NSP2», «NSP3» и «NSP4» представляют собой неструктурные белки альфавируса 1-4, соответственно, необходимые для репликации вируса.
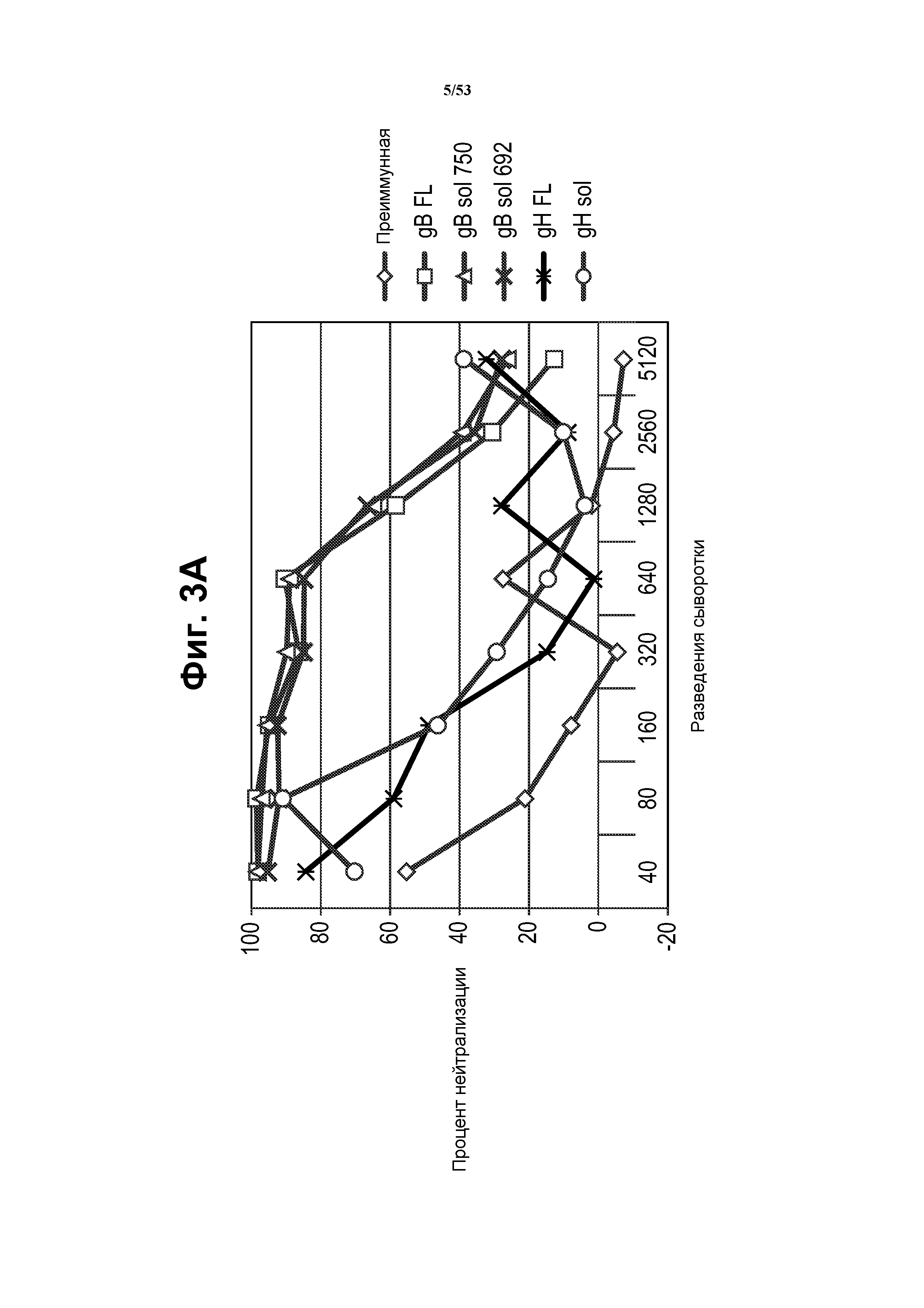
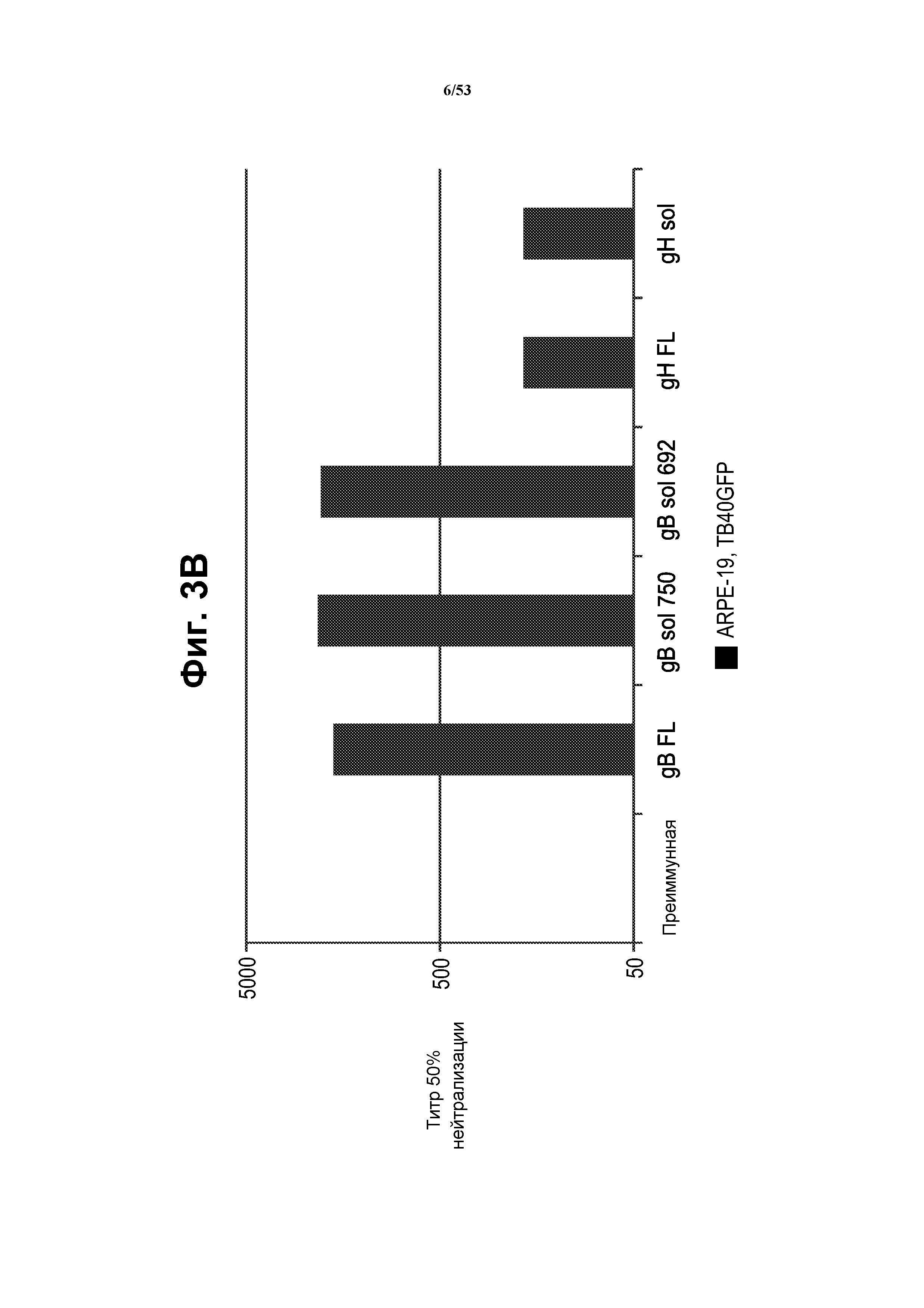
[27] На фиг. 3A и 3B показано, что у мышей, иммунизированных VRP gB (FL, sol 750, sol 692) или gH (FL, sol), индуцированы ответы антител, которые являлись нейтрализующими в присутствии комплемента морской свинки. Анализ нейтрализации проводили посредством предварительной инкубации штамма TB40UL32E-GFP вируса CMV (кодирующего усиленный зеленый флуоресцентный белок-GFP, Sampaio et al (2005) J. Virol. 79(5):2754-67), с сывороткой мыши и комплементом морской свинки перед инфекцией эпителиальных клеток ARPE-19. Через пять суток после инфекции определяли количество положительных по GFP клеток. Фиг. 3A, кривые разведений сыворотки для всех сывороток, проанализированных в клетках ARPE-19 в присутствии комплемента. Фиг. 3B, титры 50% нейтрализации для образцов сыворотки. Для вируса, инкубированного с преиммунной сывороткой, получили низкую нейтрализацию при низких разведениях (1:40-1:80). Сыворотка против gB (FL, sol 750, sol 692) обладала очень сильной нейтрализующей активностью с титрами 50% нейтрализации между 1:1800-1:2100. Для всех иммунизированных gB мышей получили сходный профиль нейтрализации. Сыворотка против gH (FL, sol) обладала нейтрализующей активностью с титрами 50% нейтрализации приблизительно 1:160. См. пример 1.
[28] Фиг. 4A представляет собой схематическую иллюстрацию моноцистронных репликонов, кодирующих зеленый флуоресцентный белок (GFP) или красный флуоресцентный белок (mCherry), и бицистронного репликона, кодирующего GFP и mCherry. «NSP1», «NSP2», «NSP3» и «NSP4» представляют собой неструктурные белки альфавируса 1-4, соответственно. Система полицистронного репликона альфавируса разработана посредством выполнения модификаций существующей системы репликона альфавируса для размещения множества субгеномных промоторов, управляющих интересующими генами.
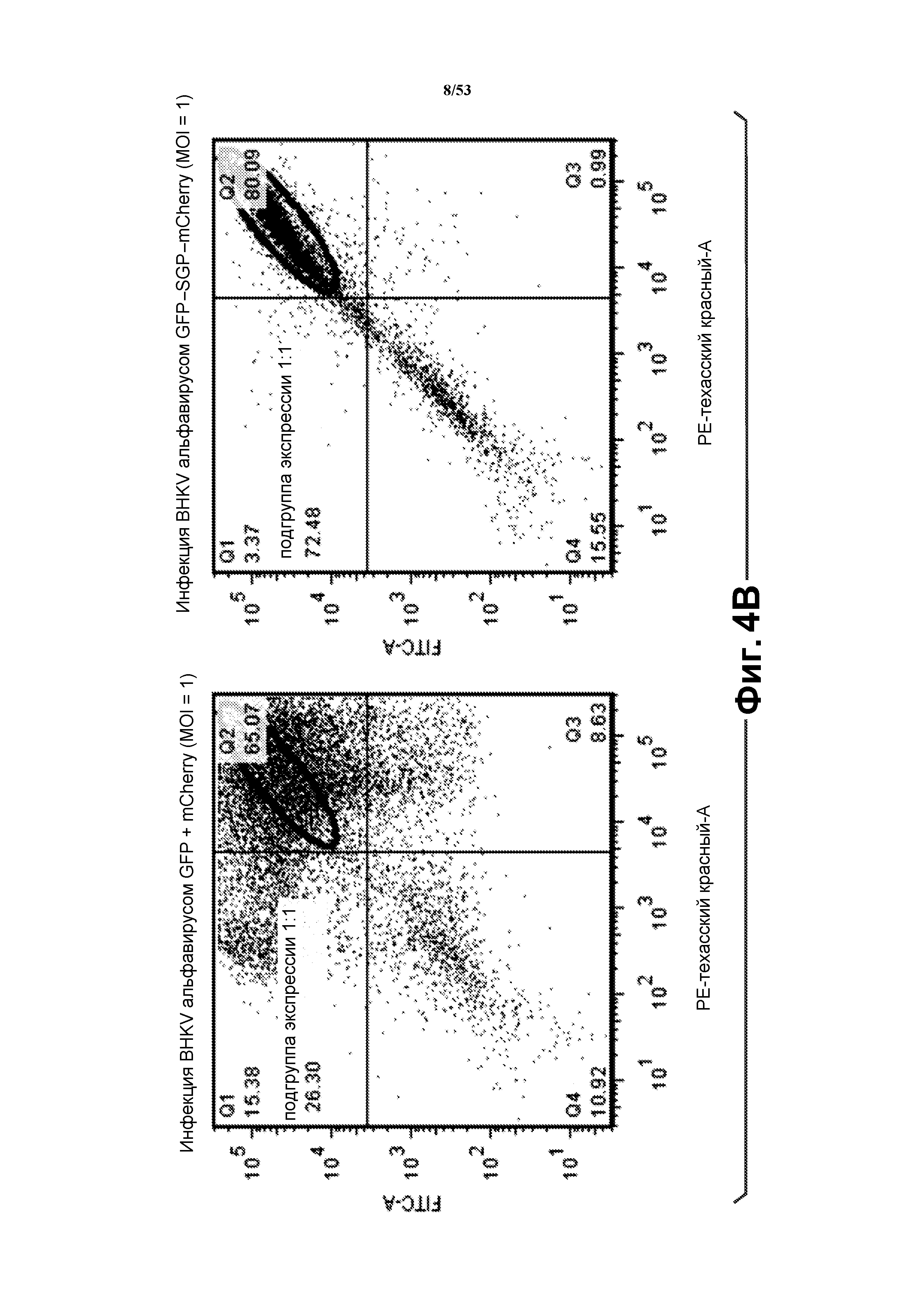
[29] Фиг. 4B представляет собой графики флуоресценции, показывающие анализ FACS клеток BHKV, инфицированных VRP, содержащими моно- и бицистронные РНК. Для полицистронных VRP альфавируса получили больше клеток, экспрессирующих оба интересующих гена в приблизительно равных количествах (GFP и mCherry; 72,48%), чем при совместной инфекции GFP VRP + mCherry VRP (26,30%). См. пример 2.
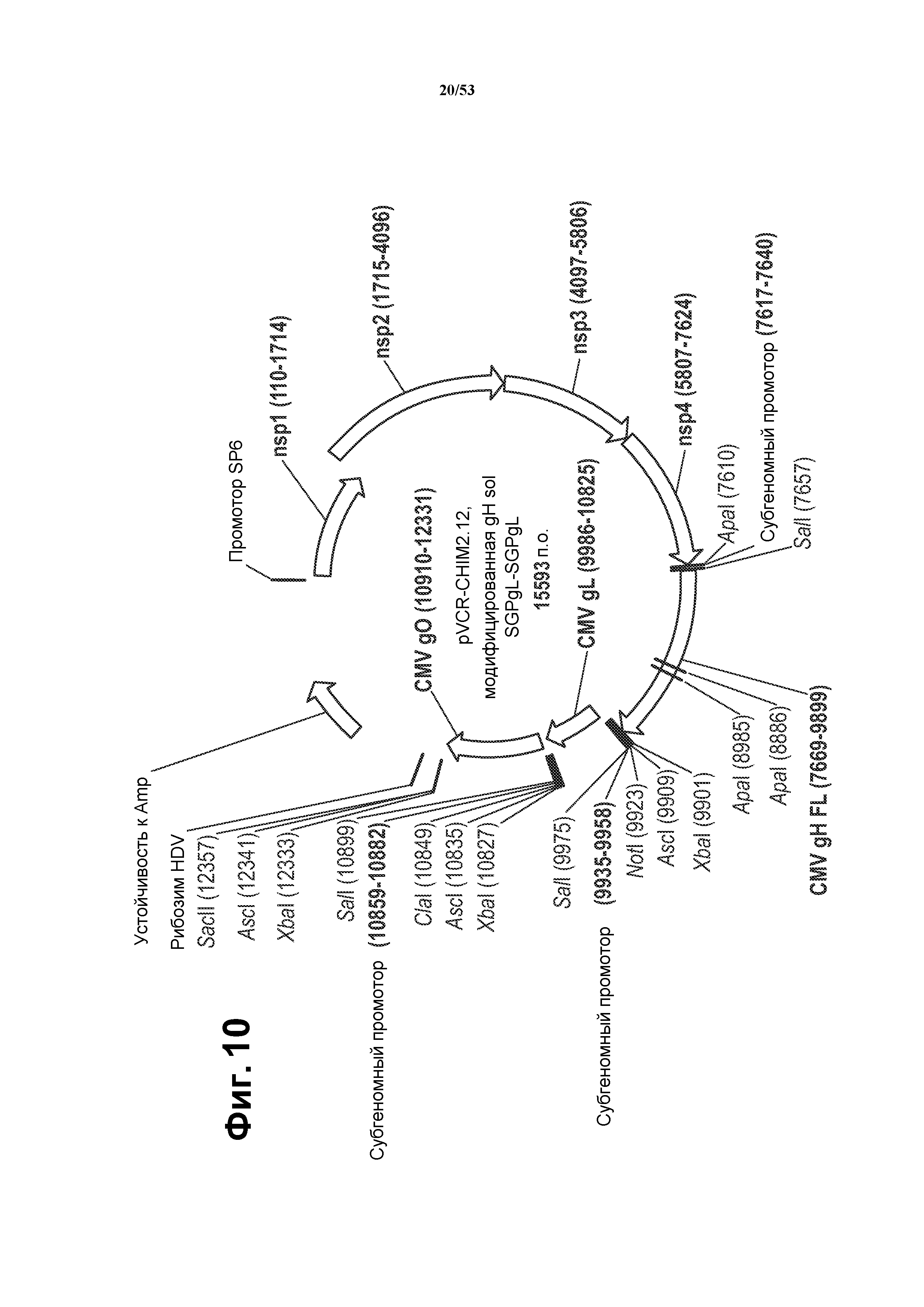
[30] Фиг. 5A представляет собой схематическую иллюстрацию конструкции полицистронного репликона альфавируса, кодирующего gH/gL и gH/gL/gO.
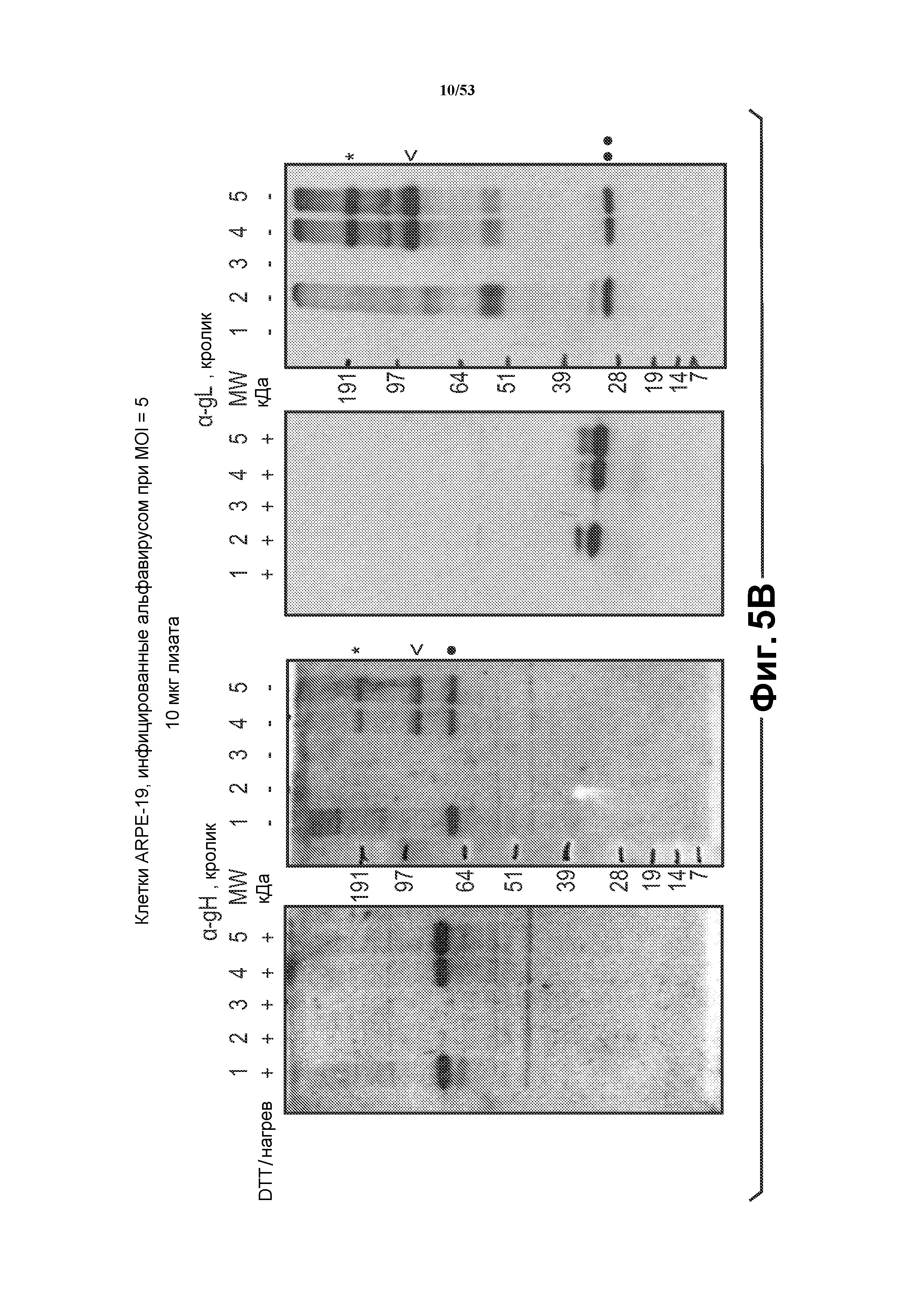
[31] На фиг. 5B показано, что gH/gL формируют комплекс in vitro. VRP, содержащие репликоны, кодирующие gH, gL, gO, gH/gL или gH/gL/gO, получали в клетках BHKV. Полученные VRP использовали для инфекции клеток ARPE-19, чтобы продемонстрировать формирование комплекса in vitro. Инфицированные альфавирусом клетки ARPE-19 собирали и анализировали по присутствию gH и gL. Клетки ARPE-19, инфицированные VRP, кодирующими gH/gL, продуцировали комплексы gH/gL с дисульфидными связями (см. в отсутствие DTT, нагрева). gO не изменял ассоциацию gH/gL до поддающейся детекции степени. На блоте слева показана экспрессия белка gH. На блоте справа показана экспрессия белка gL. Маркеры молекулярной массы показаны между блотами. ● = мономерный gH, ●● = мономерный gL, < = гетеродимер (gH + gL), * = димер из гетеродимеров.
[32] На фиг. 5C показана иммунопреципитация комплексов gH и gH/gL из клеток BHKV, инфицированных VRP. Иммунопреципитацию проводили с использованием антител IgG мыши в качестве контроля (дорожки 2, 4, 7 и 10) или антител мыши против gH (Genway) для иммунопреципитации gH (дорожки 3, 5, 8 и 11). Вестерн-блоттинги проводили с использованием слитых вместе антитела кролика против gL и антитела кролика против gH. На дорожках 1, 6 и 9 показан белок gH (верхняя полоса ~75 кДа) и белок gL (нижняя полоса ~ 30 кДа) для контроля. Дорожки 2 и 3 представляют собой лизаты после инфекции gH-VRP. На дорожке 2 показано, что контрольное антитело не иммунопреципитировало gH. На дорожке 3 показан gH, иммунопреципитированный антителом против gH. Дорожки 4 и 5 получены из лизатов после инфекции только gL-VRP. Не присутствовало иммунопреципитации белка gH. Дорожки 7 и 8 получены из лизатов после инфекции бицистронной gH/gL-VRP. На дорожке 8 показано, что gL являлся иммунопреципитированным с использованием антитела против gH. (См. звездочку). Дорожки 10 и 11 получены из лизатов после инфекции трицистронной gH/gL/gO-VRP. На дорожке 11 показано, что gL являлся иммунопреципитированным с использованием антитела против gH. (См. звездочку). Показаны также маркеры молекулярной массы (MW). См. пример 3.
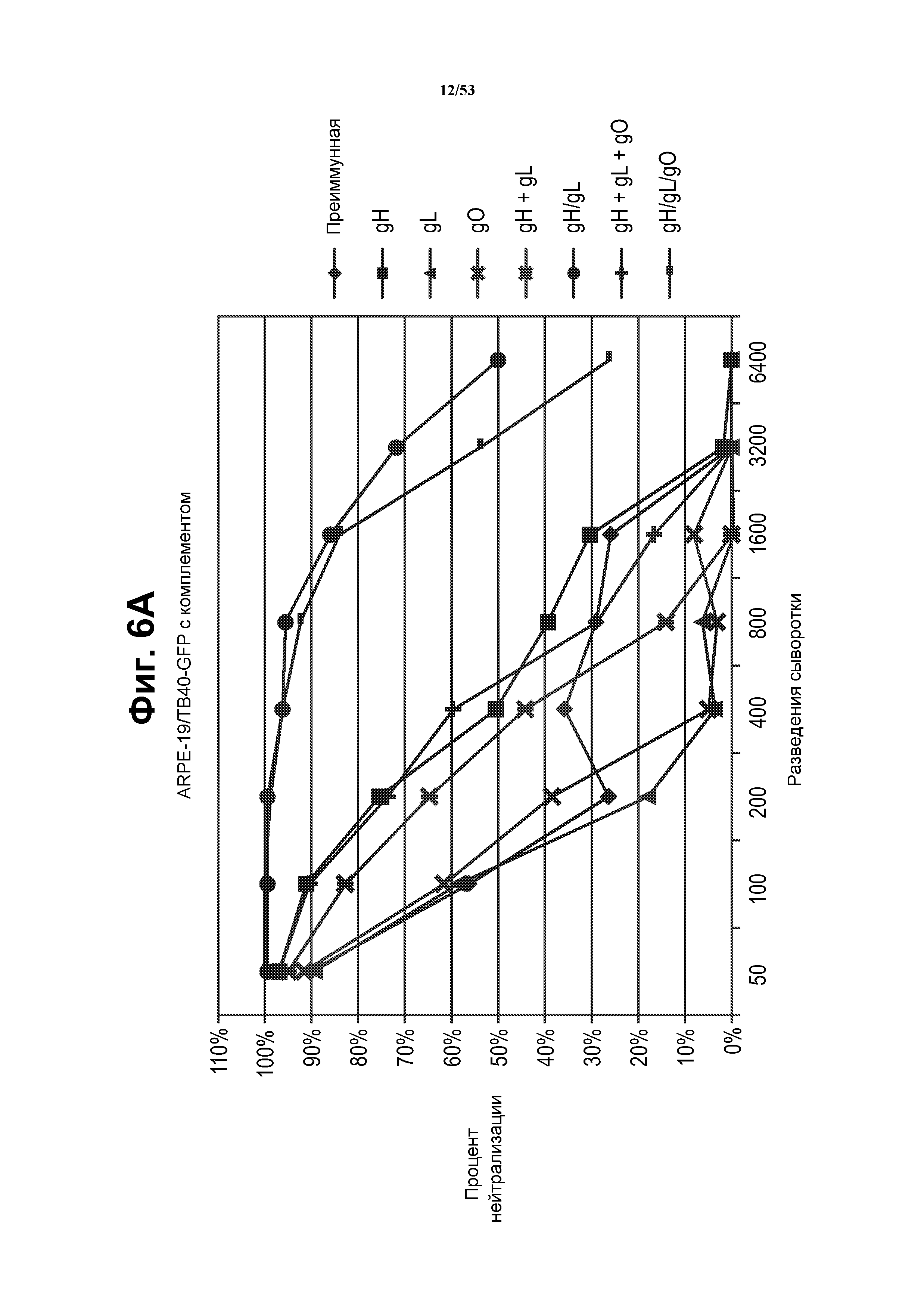
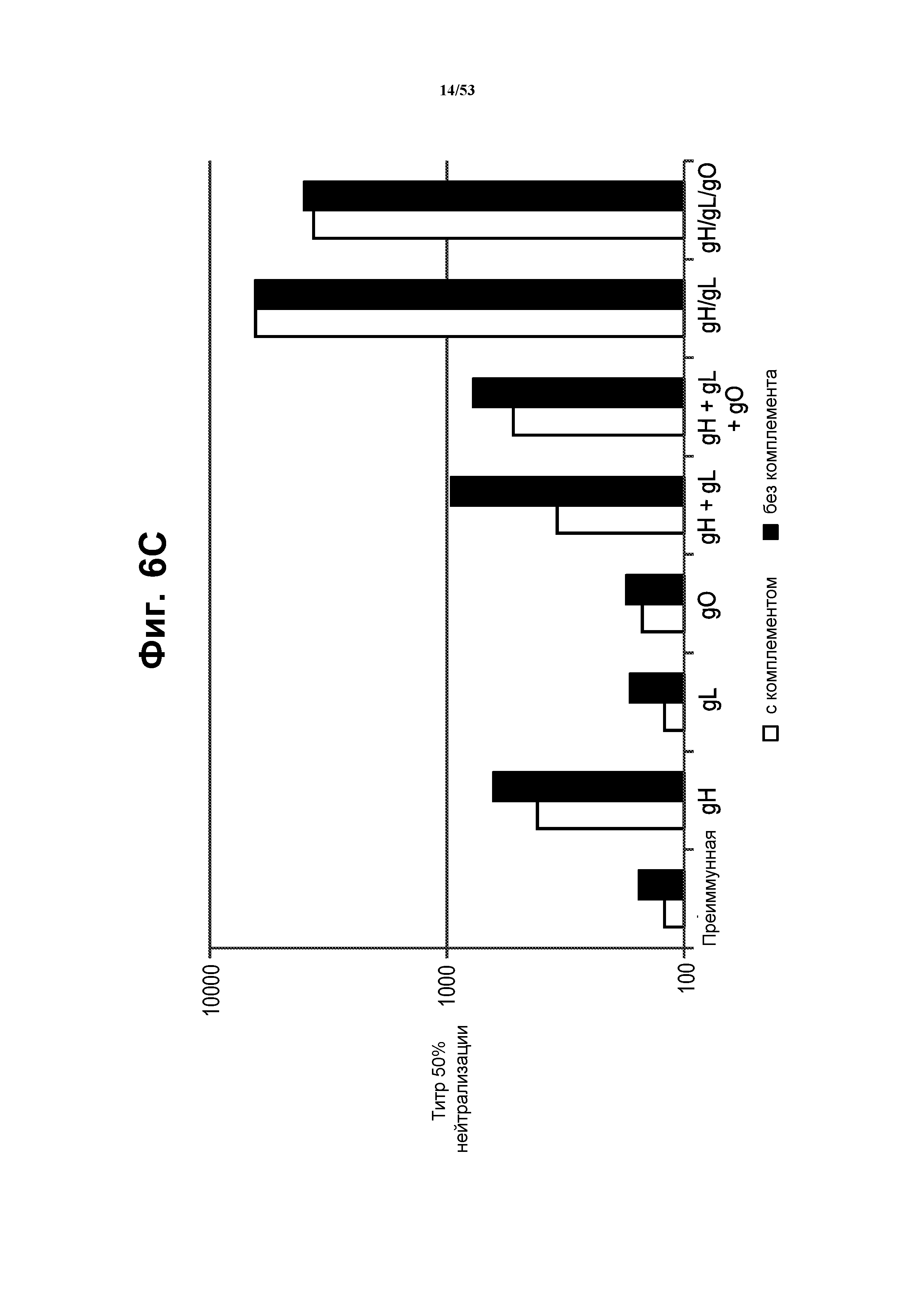
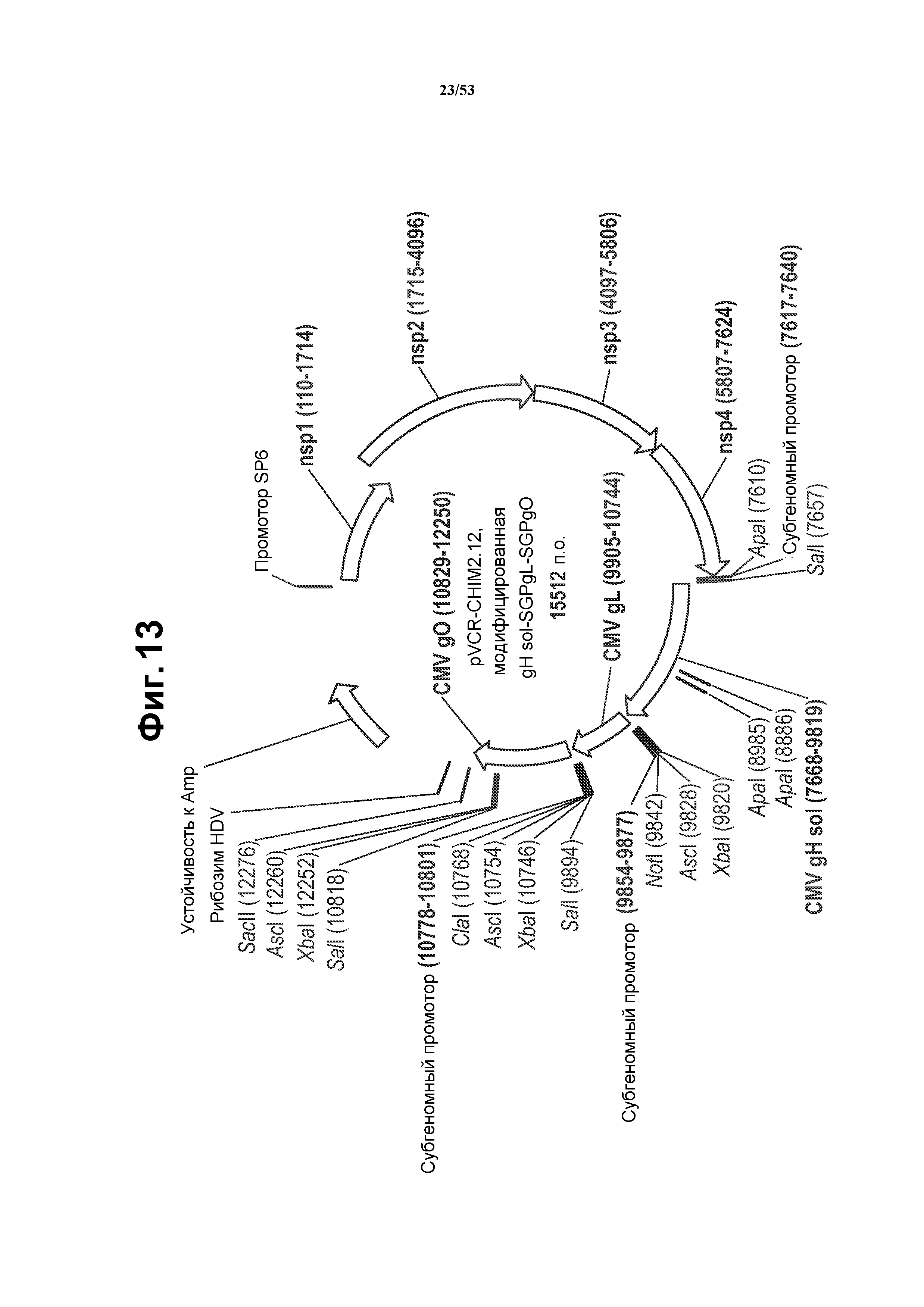
[33] На фиг. 6 показано, что VRP, которые приводят к формированию комплекса gH/gL in vitro, индуцируют сильный иммунный ответ на CMV, который качественно и количественно превосходит ответ на VRP gB. На фиг. 6A и фиг. 6B показаны кривые разведений сыворотки для мышей, иммунизированных VRP gH, gL, gO, gH+gL, gH+gL+gO, gH/gL и gH/gL/gO, при нейтрализации инфекции TB40-UL32-EGFP клеток ARPE-19 в присутствии (фиг. 6A) или в отсутствие (фиг. 6B) комплемента. Различные разведения сыворотки преинкубировали с TB40UL32E-GFP в присутствии или в отсутствие комплемента морской свинки и затем добавляли к эпителиальным клеткам ARPE-19. После 5 суток инфекции вирусом GFP-положительные клетки подсчитывали. Фиг. 6C представляет собой график, показывающий титры 50% нейтрализации, полученные в присутствии и в отсутствие комплемента. «3wp3», три недели после третьей иммунизации. VRP, экспрессирующие отдельные белки CMV (VRP gH, gL, gO или совместно введенные VRP gH, gL и gO), не усиливали нейтрализующую активность выше активности одного gH. В отличие от этого, для сыворотки от мышей, иммунизированных бицистронными VRP gH/gL или трицистронными VRP gH/gL/gO, показали сильные нейтрализующие ответы. Более того, сильные нейтрализующие ответы являлись сходными в присутствии и в отсутствие комплемента морской свинки, показывая, что полицистронные VRP успешно индуцировали независимый от комплемента иммунный ответ. См. пример 4.
[34] На фиг. 7 показано, что VRP, которые влияют на формирование комплекса gH/gL in vitro, индуцировали антитела, которые активно нейтрализовали инфекцию клеток фибробластов MRC-5. На фиг. 7A показаны кривые разведений сыворотки для мышей, иммунизированных VRP gH, gL, gO, gH+gL, gH+gL+gO, gH/gL и gH/gL/gO, для клеток MRC-5 в отсутствие комплемента. Различные разведения сыворотки преинкубировали с TB40GFP в присутствии или в отсутствие комплемента морской свинки и затем добавляли к клеткам фибробластам MRC-5. После 5 суток инфекции вирусом GFP-положительные клетки подсчитывали. Фиг. 7B представляет собой график, показывающий титры 50% нейтрализации, полученные в модели клеток фибробластов MRC-5 в отсутствие комплемента. «3wp3», три недели после третьей иммунизации. VRP, экспрессирующие отдельные белки CMV (VRP gH, gL, gO или совместно введенные VRP gH, gL и gO), не усиливали нейтрализующую активность выше активности одного gH. В отличие от этого, для сыворотки от мышей, иммунизированных бицистронными VRP gH/gL или трицистронными VRP gH/gL/gO, показали необычайно сильные нейтрализующие ответы. См. пример 4.
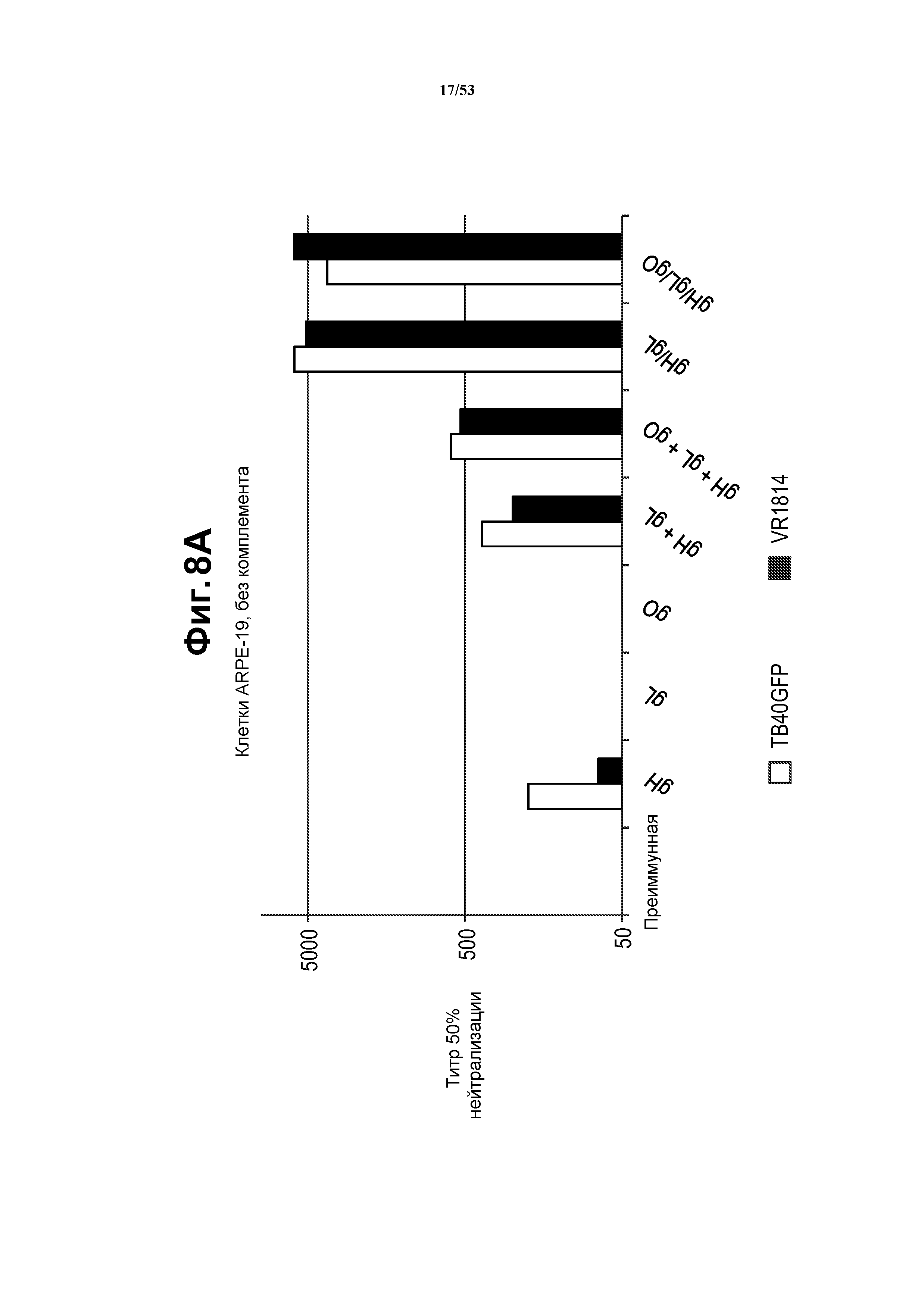
[35] Фиг. 8A и 8B представляют собой графики, показывающие, что нейтрализующие антитела, индуцированные посредством доставки полицистронных VRP, являлись перекрестно нейтрализующими антителами. Сыворотки от мышей, иммунизированных VRP gH/gL и gH/gL/gO, являлись способными нейтрализовывать клинические штаммы CMV TB40UL32E-GFP и VR1814 как в эпителиальных клетках ARPE-19 (фиг. 8A), так и в клетках фибробластах MRC-5 (фиг. 8B) в отсутствие комплемента морской свинки в анализе нейтрализации IE-1.
[36] Фиг. 9 представляет собой график, показывающий, что нейтрализующие антитела, вызванные в ответ на gH FL/gL, являются независимыми от комплемента и сходными по титру с природным иммунитетом. Мышей иммунизировали VRP gB FL или VRP gH FL/gL при 1×106 ИЕ, 3 раза, с интервалом 3 недели до последнего забора крови. Сыворотку анализировали по способности нейтрализовывать инфекцию TB40UL32E-EGFP CMV клеток ARPE-19 в присутствии и в отсутствие комплемента морской свинки в анализе нейтрализации. В отличие от антител, вызванных в ответ на gB, антитела, вызванные в ответ на gH FL/gL, являются независимыми от комплемента. Более того, антитела против gH FL/gL у этих вакцинированных мышей, являлись сходными по титру с антителами, обнаруженными у естественным образом инфицированных субъектов-людей.
[37] На фиг. 10 показана карта плазмиды для pVCR, модифицированной gH-SGPgL-SGPgO.
[38] На фиг. 11 показана карта плазмиды для pVCR, модифицированной gH-SGPgL.
[39] На фиг. 12 показана карта плазмиды для pVCR, модифицированной gH sol-SGPgL.
[40] На фиг. 13 показана карта плазмиды для pVCR, модифицированной gH sol-SGPgL-SGPgO.
[41] На фиг. 14A-14G показана нуклеотидная последовательность (SEQ ID NO:___) плазмиды, кодирующей самореплицирующуюся молекулу РНК A160, кодирующую поверхностный гликопротеин H (gH) CMV и поверхностный гликопротеин L (gL) CMV. Нуклеотидные последовательности, кодирующие gH и gL, подчеркнуты.
[42] На фиг. 15A-15H показана нуклеотидная последовательность (SEQ ID NO:___) плазмиды, кодирующей самореплицирующуюся молекулу РНК A322, кодирующую растворимую форму поверхностного гликопротеина H (gHsol) CMV и поверхностного гликопротеина L (gL) CMV. Нуклеотидные последовательности, кодирующие gHsol и gL, подчеркнуты.
[43] На фиг. 16A-16H показана нуклеотидная последовательность (SEQ ID NO:___) плазмиды, кодирующей самореплицирующуюся молекулу РНК A323, кодирующую поверхностный гликопротеин B (gB) CMV. Нуклеотидная последовательность, кодирующая gB, подчеркнута.
[44] Фиг. 17A и 17B представляют собой гистограммы, показывающие титры 50% нейтрализации сывороток от мышей, которых иммунизировали VRP или самореплицирующейся РНК. На фиг. 17A показаны титры 50% нейтрализации против CMV человека штамма TB40UL32E-EGFP («TB40») на клетках ARPE-19, и на фиг. 17B показаны титры 50% нейтрализации против CMV человека штамма 8819 на клетках ARPE-19.
[45] Фиг. 18 представляет собой схему пентацистронных РНК репликонов A526, A527, A554, A555 и A556, кодирующих пять белков CMV. Субгеномные промоторы показаны стрелками, другие контрольные элементы подписаны.
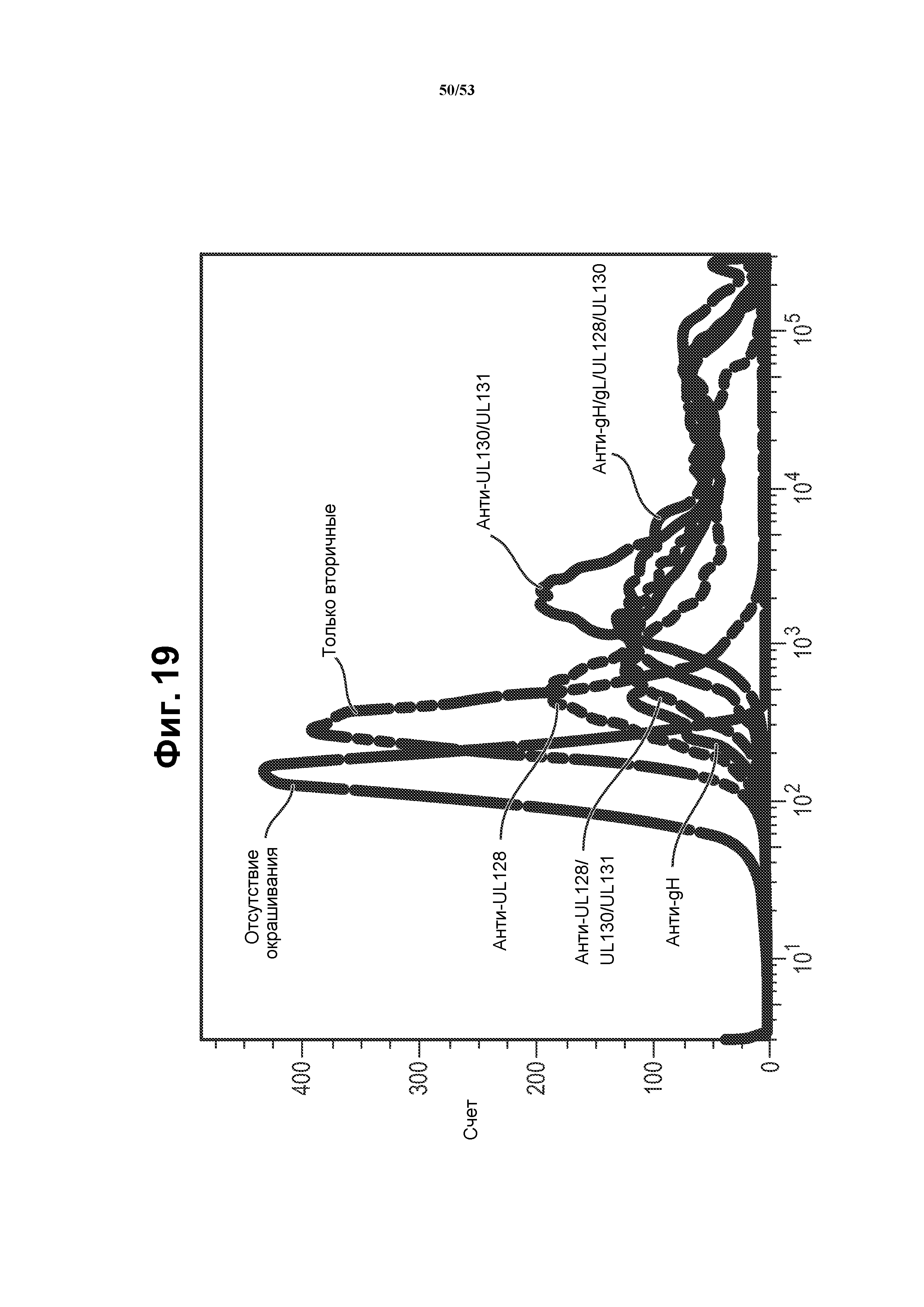
[46] Фиг. 19 представляет собой гистограмму флуоресценции, показывающую, что клетки BHKV, трансфицированные РНК репликоном A527, экспрессируют пентамерный комплекс gH/gL/UL128/UL130/UL131. Окрашивание клеток проводили с использованием антител, которые связывают конформационный эпитоп, присутствующий в пентамерном комплексе (Macagno (2010) J. Virol. 84(2): 1005-13).
[47] Фиг. 20 представляет собой схему и график. На схеме показаны бицистронные РНК репликоны, A160 и A531-A537, кодирующие gH и gL CMV. На графике показана нейтрализующая активность иммунной сыворотки от мышей, иммунизированных VRP, содержащими репликоны.
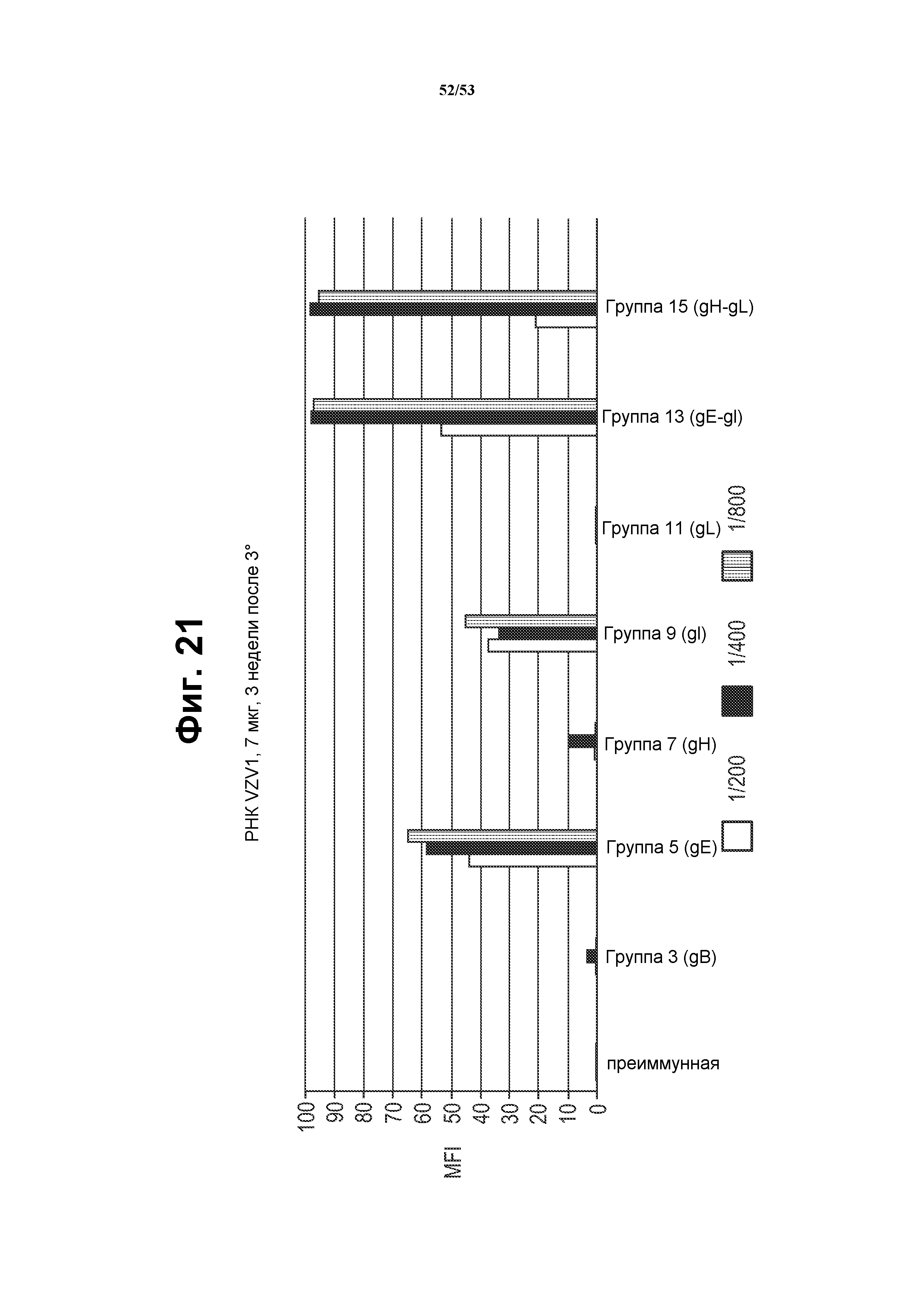
[48] Фиг. 21 представляет собой график, показывающий ответ антител против белка VZV в иммунной сыворотке от мышей, иммунизированных моноцистронными РНК репликонами, кодирующими белки VZV, или бицистронными РНК репликонами, кодирующими VZV gE и gI, или gH и gL. Мышей иммунизировали 7 мкг РНК, составленной с CNE (см. пример 7).
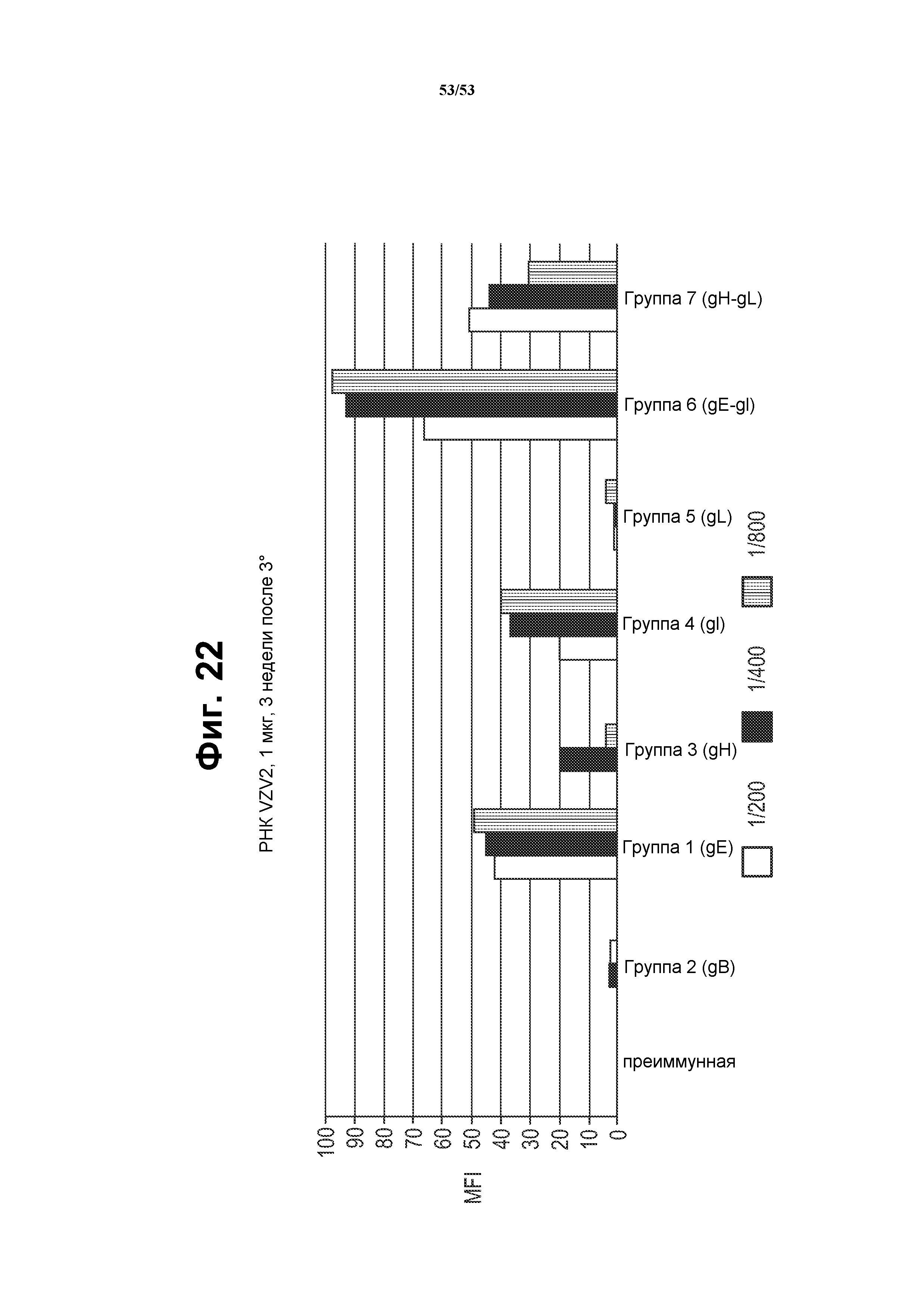
[49] Фиг. 22 представляет собой график, показывающий ответ антител против белка VZV в иммунной сыворотке от мышей, иммунизированных моноцистронными РНК репликонами, кодирующими белки VZV, или бицистронными РНК репликонами, кодирующими VZV gE и gI, или gH и gL. Мышей иммунизировали 1 мкг РНК, составленной с CNE (см. пример 7).
ПОДРОБНОЕ ОПИСАНИЕ
[50] Изобретение относится к платформам для совместной доставки белков вируса герпеса, таких как белки цитомегаловируса (CMV), к клеткам, в частности белков, формирующих комплексы in vivo. В некоторых вариантах осуществления эти белки и сформированные ими комплексы могут вызывать образование сильных нейтрализующих антител. Иммунный ответ, вызываемый совместной доставкой белков вируса герпеса (например, CMV), в частности, белков, формирующих комплексы in vivo (например, gH/gL), может превосходить иммунный ответ, полученный с использованием других способов. Например, молекула РНК (например, репликон), кодирующая как gH, так и gL CMV, может индуцировать лучшие нейтрализующие титры и/или защитный иммунитет по сравнению с молекулой РНК, кодирующей gB, молекулой РНК, кодирующей gH, молекулой РНК, кодирующей gL, или даже смесью молекул РНК, по отдельности кодирующих gH или gL. Кроме того, репликон, кодирующий gH/gL/UL128/UL130/UL131, может обеспечивать ответы, превосходящие ответы на репликон, кодирующий только gH/gL.
[51] В общем аспекте изобретение относится к платформам для доставки двух или более белков вируса герпеса (например, CMV) к клеткам. Платформы включают в себя молекулы рекомбинантной полицистронной нуклеиновой кислоты, содержащие первую последовательность, кодирующую первый белок вируса герпеса (например, CMV) или его фрагмент, и вторую последовательность, кодирующую второй белок вируса герпеса (например, CMV) или его фрагмент. Если желательно, одна или более дополнительных последовательностей, кодирующих дополнительные белки, например, третий белок вируса герпеса (например, CMV) или его фрагмент, четвертый белок вирус герпеса (например, CMV) или его фрагмент, пятый белок вируса герпеса (например, CMV) или его фрагмент и т.д., может присутствовать в молекуле рекомбинантной полицистронной нуклеиновой кислоты. Последовательности, кодирующие белки вируса герпеса (например, CMV) или их фрагменты являются функционально связанными с одним или несколькими подходящими контрольными элементами, так что белки вируса герпеса (например, CMV) или их фрагменты продуцируются клеткой, содержащей рекомбинантную полицистронную нуклеиновую кислоту.
[52] В полицистронных нуклеиновых кислотах, описанных в настоящем документе, кодированные первый и второй белки вируса герпеса или их фрагменты, и кодированные третий, четвертый и пятый белки вируса герпеса или их фрагменты, если присутствуют, обычно и предпочтительно происходят из одного и того же вируса герпеса. В конкретных примерах все белки вируса герпеса или их фрагменты, кодированные полицистронным вектором, представляют собой белки CMV или белки VZV.
[53] Молекулы рекомбинантной полицистронной нуклеиновой кислоты, описанные в настоящем документе, обеспечивают преимущество доставки последовательностей, кодирующих два или более белков вируса герпеса (например, CMV), в клетку, и управление экспрессией белков вируса герпеса (например, CMV) на достаточных уровнях, чтобы приводить к формированию белкового комплекса, содержащего два или более белков вируса герпеса (например, CMV) in vivo. С использованием этого способа два или более кодированных белков вируса герпеса (например, CMV) можно экспрессировать на достаточных внутриклеточных уровнях для формирования комплексов белков вируса герпеса (например, CMV) (например, gH/gL). Например, кодированные белки вируса герпеса (например, CMV) или их фрагменты можно экспрессировать по существу на одинаковом уровне или, если желательно, на различных уровнях посредством выбора подходящих последовательностей для контроля экспрессии (например, промоторов, IRES, участка 2A и т.д.). Это значительно более эффективный способ получения комплексов белков in vivo, чем совместная доставка двух или более индивидуальных молекул ДНК, кодирующих различные вирусы герпеса (например, CMV), в одну и ту же клетку, что может являться неэффективным и высоко изменчивым. См., например, WO 2004/076645.
[54] Молекула рекомбинантной полицистронной нуклеиновой кислоты может быть основана на любой желательной нуклеиновой кислоте, такой как ДНК (например, плазмидная или вирусная ДНК) или РНК. Любую подходящую ДНК или РНК можно использовать в качестве нуклеиновой кислоты - вектора, несущего открытые рамки считывания, кодирующие белки вируса герпеса (например, CMV) или их фрагменты. Подходящие векторы на основе нуклеиновых кислот обладают способностью нести более одного гена белка и управлять их экспрессией. Такие векторы на основе нуклеиновых кислот известны в данной области и включают в себя, например, плазмиды, ДНК, полученные из ДНК вирусов, таких как векторы из вируса осповакцины (например, NYVAC, см. US 5494807), и векторы из поксвируса (например, вектор канарипокс ALVAC, Sanofi Pasteur), и РНК, полученные из подходящих РНК-вирусов, таких как альфавирус. Если желательно, молекула рекомбинантной полицистронной нуклеиновой кислоты может являться модифицированной, например, содержать модифицированные нуклеиновые основания и/или связи, как описано далее в настоящем документе. Предпочтительно молекула полицистронной нуклеиновой кислоты представляет собой молекулу РНК.
[55] В некоторых аспектах молекула рекомбинантной полицистронной нуклеиновой кислоты представляет собой молекулу ДНК, такую как плазмидная ДНК. Такие молекулеры ДНК могут, например, кодировать полицистронный репликон и содержать промотор млекопитающих, управляющий транскрипцией репликона. Молекулы рекомбинантной полицистронной нуклеиновой кислоты этого типа можно вводить млекопитающему и затем транскрибировать in situ для получения полицистронного репликона, экспрессирующего белки вируса герпеса.
[56] В некоторых аспектах изобретение относится к молекуле полицистронной нуклеиновой кислоты, содержащей последовательность, кодирующую gH вируса герпеса или его фрагмент и gL вируса герпеса или его фрагмент. Белки gH и gL, или их фрагменты, могут происходить из любого желательного вируса герпеса, такого как HSV-1, HSV-2, VZV, EBV типа 1, EBV типа 2, CMV, HHV-6 типа A, HHV-6 типа B, HHV-7, KSHV и т.п. Предпочтительно, вирус герпеса представляет собой VZV, HSV-2, HSV-1, EBV (типа 1 или типа 2) или CMV. Более предпочтительно, вирус герпеса представляет собой VZV, HSV-2 или CMV. Даже более предпочтительно, вирус герпеса представляет собой CMV. Последовательности белков gH и gL и нуклеиновых кислот, кодирующих белки из этих вирусов, хорошо известны в данной области. Иллюстративные последовательности показаны в таблице 1. Молекула полицистронной нуклеиновой кислоты может содержать первую последовательность, кодирующую белок gH, описанный в таблице 1, или его фрагмент, или последовательность, по меньшей мере приблизительно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную с ней. Молекула полицистронной нуклеиновой кислоты может содержать также вторую последовательность, кодирующую белок gL, описанный в таблице 1, или его фрагмент, или последовательность, по меньшей мере приблизительно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичную с ней.
[57] В этом описании изобретения для облегчения ясного описания нуклеиновых кислот конкретные компоненты последовательности обозначены как «первая последовательность», «вторая последовательность» и т.д. Следует понимать, что первая и вторая последовательности могут появляться в любом желательном порядке или ориентации, и что слова «первый», «второй» и т.д. не подразумевают какого-либо конкретного порядка или ориентации. Подобным образом, комплексы белков обозначают перечислением белков, присутствующих в комплексе, например, gH/gL. Это предназначено для описания комплекса посредством белков, присутствующих в комплексе, и не указывает относительные количества белков или порядка или ориентации последовательностей, кодирующих белки в рекомбинантной нуклеиновой кислоте.
[58] Конкретные предпочтительные варианты осуществления, такие как альфавирус VRP и самореплицирующаяся РНК, содержащие последовательности, кодирующие белки CMV, дополнительно описаны в настоящем документе. Подразумевают, что последовательности, кодирующие белки CMV в таких предпочтительных вариантах осуществления, можно заменять последовательностями, кодирующими такие белки, как gH и gL из других вирусов герпеса.
Платформы альфавируса VRP
[59] В некоторых вариантах осуществления белки CMV доставляют к клеткам с использованием частиц репликона альфавируса (VRP), в которых применяют полицистронные репликоны (или векторы), как описано ниже. Как применяют в настоящем документе, «полицистронный» включает в себя бицистронные векторы, так же как векторы, содержащие три или более цистронов. Цистроны в полицистронном векторе могут кодировать белки CMV из одного и того же штамма CMV или из различных штаммов CMV. Цистроны могут быть ориентированы в любом порядке 5' - 3'. Любую нуклеотидную последовательность, кодирующую белок CMV, можно использовать для получения белка. Иллюстративные последовательности, пригодные для получения полицистронных нуклеиновых кислот, кодирующих два или более белков CMV или их фрагментов, описаны в настоящем документе.
[60] Как применяют в настоящем документе, термин «альфавирус» обладает своим общепринятым в данной области значением и включает в себя различные виды, такие как вирус венесуэльского энцефалита лошадей (VEE; например, Trinidad donkey, TC83CR и т.д.), вирус леса Семлики (SFV), вирус Синдбис, вирус реки Росс, вирус западного энцефалита лошадей, вирус восточного энцефалита лошадей, вирус Чикунгунья, вирус S.A. AR86, вирус Эверглейдс, вирус Мукамбо, вирус леса Барма, вирус Миддельбург, вирус Пиксуна, вирус О'Ньонг-Ньонг, вирус Гета, вирус Сагияма, вирус Бебару, вирус Маяро, вирус Уна, вирус Аура, вирус Ватароа, вирус Банбанки, вирус Кызылагач, вирус Хайленд J, вирус Форт Морган, вирус Ндуму и вирус Багги Крик. Термин альфавирус может включать в себя также химерные альфавирусы (например, как описано Perri et al, (2003) J. Virol. 77(19): 10394-403), содержащие геномные последовательности из более чем одного альфавируса.
[61] «Частица репликона альфавируса» (VRP) или «частица репликона» представляет собой репликон альфавируса, упакованный в структурные белки альфавируса.
[62] «Репликон альфавируса» (или «репликон») представляет собой молекулу РНК, которая может управлять своей собственной амплификацией in vivo в клетке-мишени. Репликон кодирует полимеразу(полимеразы), катализирующие амплификацию РНК (nsP1, nsP2, nsP3, nsP4) и содержит цис-последовательности РНК, необходимые для репликации, узнаваемые и используемые кодируемыми полимеразой(полимеразами). Репликон альфавируса, как правило, содержит элементы в следующем порядке: 5'-вирусные последовательности, необходимые в цис-положении для репликации, последовательности, кодирующие биологически активные неструктурные белки альфавируса (nsP1, nsP2, nsP3, nsP4), 3'-вирусные последовательности, необходимые в цис-положении для репликации, и участок полиаденилирования. Репликон альфавируса может содержать также один или более вирусных субгеномных промоторов «области соединения», управляющих экспрессией гетерологичных нуклеотидных последовательностей, которые можно, в конкретных вариантах осуществления, модифицировать, чтобы увеличивать или уменьшать вирусную транскрипцию субгеномного фрагмента и гетерологичной последовательности(ей), подлежащих экспрессии. Можно использовать другие контрольные элементы, как описано ниже.
[63] Репликоны альфавируса, кодирующие белки CMV, используют для получения VRP. Такие репликоны альфавируса содержат последовательности, кодирующие по меньшей мере два белка CMV или их фрагменты. Эти последовательности являются функционально связанными с одним или несколькими подходящими контрольными элементами, такими как субгеномный промотор, IRES (например, EMCV, EV71), и вирусный участок 2A, которые могут являться одинаковыми или различными. Доставка компонентов этих комплексов с использованием полицистронных векторов, описанных в настоящем документе, представляет собой эффективный способ предоставления последовательностей нуклеиновой кислоты, кодирующих два или более белков CMV в желаемых относительных количествах; в то время как если множество конструкций альфавируса используют для доставки индивидуальных белков CMV для формирования комплекса, необходима эффективная совместная доставка VRP.
[64] Любую комбинацию подходящих контрольных элементов можно использовать в любом порядке. В одном из примеров один субгеномный промотор является функционально связанным с двумя последовательностями, кодирующими два различных белка CMV, и IRES расположен между двумя кодирующими последовательностями. В другом примере две последовательности, кодирующие два различных белка CMV, являются функционально связанными с раздельными промоторами. В другом примере две последовательности, кодирующие два различных белка CMV, являются функционально связанными с одним промотором. Две последовательности, кодирующие два различных белка CMV, являются связанными друг с другом через нуклеотидную последовательность, кодирующую вирусный участок 2A, и, таким образом, кодируют одну аминокислотную цепь, содержащую аминокислотные последовательности обоих белков CMV. Вирусный участок 2A в этом контексте используют для получения двух белков CMV из кодируемого полибелка.
Субгеномные промоторы
[65] Субгеномные промоторы, известные также как промоторы области соединения, можно использовать для регуляции экспрессии белка. Альфавирусные субгеномные промоторы регулируют экспрессию альфавирусных структурных белков. См. Strauss and Strauss, « The alphaviruses: gene expression, replication, and evolution», Microbiol Rev. 1994 Sep;58(3):491-562. Полицистронный полинуклеотид может содержать субгеномный промотор из любого альфавируса. Когда два или более субгеномных промотора присутствуют в полицистронном полинуклеотиде, промоторы могут являться одинаковыми или различными. Например, субгеномный промотор может иметь последовательность CTCTCTACGGCTAACCTGAATGGA (SEQ ID NO:___). В конкретных вариантах осуществления субгеномные промоторы можно модифицировать, чтобы увеличить или уменьшить вирусную транскрипцию белков. См. патент США № 6592874.
Внутренний участок связывания рибосомы (IRES)
[66] В некоторых вариантах осуществления один или более контрольных элементов представляют собой внутренний участок связывания рибосомы (IRES). IRES позволяет получение множества белков с одного транскрипта мРНК, поскольку рибосомы связываются с каждым IRES и инициируют трансляцию в отсутствие 5'-кэпа, который в норме является необходимым для инициации трансляции белка в эукариотических клетках. Например, IRES может представлять собой IRES EV71 или EMCV.
Вирусный участок 2A
[67] Белок 2A FMDV представляет собой короткий пептид, служащий для отделения структурных белков FMDV от не структурного белка (FMDV 2B). В ранних работах по этому пептиду предполагали, что он действует как автокаталитическая протеаза, но в другой работе (например, Donnelly et al, (2001), J.Gen.Virol. 82, 1013-1025) предполагают, что эта короткая последовательность и следующая отдельная аминокислота 2B FMDV (Gly) действует как стоп-старт трансляции. Вне зависимости от точного образа действия, последовательность можно вставлять между двумя полипептидами и достигать эффекта получения множества отдельных полипептидов с одной открытой рамки считывания. В контексте этого изобретения, последовательности 2A FMDV можно вставлять между последовательностями, кодирующими по меньшей мере два белка CMV, позволяя их синтез в форме части одной открытой рамки считывания. Например, открытая рамка считывания может кодировать белок gH и белок gL, разделенные последовательностью, кодирующей вирусный участок 2A. Транскрибируется одна мРНК, затем, в ходе стадии трансляции, пептиды gH и gL продуцируются по отдельности благодаря активности вирусного участка 2A. Можно использовать любую подходящую вирусную последовательность 2A. Часто вирусный участок 2A содержит консенсусную последовательность Asp-Val/Ile-Glu-X-Asn-Pro-Gly-Pro, где X представляет собой любую аминокислоту (SEQ ID NO:___). Например, последовательность пептида 2A вируса ящура представляет собой DVESNPGP (SEQ ID NO:___). См. Trichas et al, «Use of the viral 2A peptide for bicistronic expression in transgenic mice», BMC Biol. 2008 Sep 15;6:40, и Halpin et al, «Self-processing 2A-polyproteins -- a system for co-ordinate expression of multiple proteins in transgenic plants», Plant J. 1999 Feb;17(4):453-9.
[68] В некоторых вариантах осуществления репликон альфавируса представляет собой химерный репликон, такой как химерный репликон VEE-Синдбис (VCR) или репликон VEE штамма TC83 (TC83R) или химерный репликон TC83-Синдбис (TC83CR). В некоторых вариантах осуществления VCR содержит сигнал упаковки и 3'-UTR из репликона Синдбис вместо последовательностей в nsP3 и на 3'-конце репликона VEE; см. Perri et al, J. Virol. 77, 10394-403, 2003. В некоторых вариантах осуществления TC83CR содержит сигнал упаковки и 3'-UTR из репликона Синдбис вместо последовательностей в nsP3 и на 3'-конце репликона VEE штамма TC83.
Получение VRP
[69] Способы получения VRP хорошо известны в данной области. В некоторых вариантах осуществления альфавирус собирают в VRP с использованием упаковывающей клетки. «Упаковывающая альфавирус клетка» (или «упаковывающая клетка») представляет собой клетку, которая содержит одну или более экспрессирующих кассет структурных белков альфавируса и которая продуцирует частицы рекомбинантного альфавируса после введения репликона альфавируса, эукариотической слоистой векторной системы инициации (например, патент США 5814482) или частицы рекомбинантного альфавируса. Одна или более различных кассет структурных белков альфавируса служат «помощниками» посредством предоставления структурных белков альфавируса. «Кассета структурного белка альфавируса» представляет собой экспрессирующую кассету, которая кодирует один или более структурных белков альфавируса и содержит по меньшей мере одну и вплоть до пяти копий (т.е. 1, 2, 3, 4 или 5) последовательностей узнавания репликазы альфавируса. Экспрессирующие кассеты структурных белков, как правило, содержат, от 5' к 3', 5'-последовательность, инициирующую транскрипцию РНК альфавируса, необязательный промотор субгеномной области альфавируса, нуклеотидную последовательность, кодирующую структурный белок альфавируса, 3'-нетранслируемую область (которая также управляет транскрипцией РНК), и участок полиА. См., например, WO 2010/019437.
[70] В предпочтительных вариантах осуществления две различные кассеты структурных белков альфавируса («разделенные» дефектные помощники) используют в упаковывающей клетке для минимизации событий рекомбинации, которые могут образовать компетентный по репликации вирус. В некоторых вариантах осуществления кассета структурных белков альфавируса кодирует белок капсида (C), но не какой-либо из гликопротеинов (E2 и E1). В некоторых вариантах осуществления кассета структурных белков альфавируса кодирует белок капсида и любой из гликопротеинов E1 или E2 (но не оба). В некоторых вариантах осуществления кассета структурных белков альфавируса кодирует гликопротеины E2 и E1, но не белок капсида. В некоторых вариантах осуществления кассета структурных белков альфавируса кодирует гликопротеин E1 или E2 (но не оба) и не белок капсида.
[71] В некоторых вариантах осуществления VRP получают одновременным введением репликонов и РНК-помощников в клетки из различных источников. В этих условиях, например, клетки BHKV (1×107) подвергают электропорации, например, при 220 вольтах, 1000 мкФ, 2 импульсах вручную, 10 мкг РНК репликона: 6 мкг РНК дефектного помощника Cap: 10 мкг РНК дефектного помощника Gly, содержащий альфавирус супернатант собирают через ~24 часов. Репликоны и/или помощники можно вводить также в формах ДНК, которые образуют подходящие РНК внутри трансфицированных клеток.
[72] Упаковывающая клетка может представлять собой клетку млекопитающих или не относящуюся к млекопитающим клетку, такую как клетку насекомых (например, SF9) или птиц (например, первичный фибробласт курицы или утки или линия клеток фибробластов). См. патент США 7445924. Источники клеток птиц включают в себя, но без ограничения, птичьи эмбриональные стволовые клетки, такие как EB66® (VIVALIS); клетки курицы, включая эмбриональные стволовые клетки курицы, такие как клетки EBx®, эмбриональные фибробласты курицы, и эмбриональные зародышевые клетки курицы; клетки утки, такие как линии клеток AGE1.CR и AGEl.CR.pIX (ProBioGen), описанные, например, в Vaccine 27:4975-4982 (2009) и WO2005/042728); и клетки гуся. В некоторых вариантах осуществления упаковывающая клетка представляет собой первичный фибробласт утки или линию клеток сетчатки глаза утки, такую как AGE.CR (PROBIOGEN).
[73] Источники клеток млекопитающих для одновременного введения нуклеиновых кислот и/или упаковывающих клеток включают в себя, но без ограничения, клетки человека или не относящегося к человеку примата, включая клетки PerC6 (PER.C6) (CRUCELL N.V.), описанные, например, в WO 01/38362 и WO 02/40665, так же как депонированные под номером депонирования ECACC 96022940); MRC-5 (ATCC CCL-171); WI-38 (ATCC CCL-75); зародышевые клетки легкого макака-резуса (ATCC CL-160); эмбриональные клетки почки человека (например, клетки 293, как правило, трансформированные фрагментированной ДНК аденовируса типа 5); клетки VERO из почек обезьяны); клетки лошади, коровы (например, клетки MDBK), овцы, собаки (например, клетки MDCK из почки собаки, ATCC CCL34 MDCK (NBL2) или MDCK 33016, номер депонирования DSM ACC 2219, как описано в WO 97/37001); кошки и грызунов (например, клетки хомяка, такие как клетки BHK21-F, HKCC, или клетки яичника китайского хомяка (CHO)), и их можно получать из широкого множества стадий развития, включая, например, взрослого, новорожденного, плод и эмбрион.
[74] В некоторых вариантах осуществления упаковывающая клетка является стабильно трансформированной одной или несколькими экспрессирующей кассетой(кассетами) структурных белков. Экспрессирующие кассеты структурных белков можно вводить в клетки с использованием общепринятых способов рекомбинантной ДНК, включая опосредованный трансферрином-поликатионом перенос ДНК, трансфекцию голыми или инкапсулированными нуклеиновыми кислотами, опосредованное липосомами слияние клеток, внутриклеточный транспорт покрытых ДНК латексных бусин, слияние протопластов, вирусную инфекцию, электропорацию, способы «генной пушки» и опосредованную DEAE или фосфатом кальция трансфекцию. Экспрессирующие кассеты структурных белков, как правило, вводят в клетку-хозяина в форме молекул ДНК, но их можно вводить также в форме транскрибированной in vitro РНК. Каждую экспрессирующую кассету можно вводить отдельно или по существу одновременно.
[75] В некоторых вариантах осуществления стабильные упаковывающие альфавирус линии клеток используют для получения частиц рекомбинантного альфавируса. Существуют пермиссивные для альфавируса клетки, содержащие кассеты ДНК, экспрессирующие РНК дефектного помощника, стабильно интегрированные в их геномы. См. Polo et al, Proc. Natl. Acad. Sci. USA 96, 4598-603, 1999. РНК помощников являются конститутивно экспрессированными, но структурные белки альфавируса не являются, поскольку гены находятся под контролем субгеномного промотора альфавируса (Polo et al., 1999). После введения репликона альфавируса в геном упаковывающей клетки посредством трансфекции или инфекции VRP, ферменты репликазы образуются и запускают экспрессию генов капсида и гликопротеинов на РНК помощников, и образуются результирующие VRP. Введение репликона можно осуществлять множеством способов, включая как трансфекцию, так и инфекцию исходным материалом для посева частиц репликона альфавирусов. Затем упаковывающую клетку инкубируют в условиях и в течение времени, подходящих для получения упакованных частиц репликона альфавирусов в культуральном супернатанте.
[76] Таким образом, упаковывающие клетки позволяют VRP действовать как саморазмножающиеся вирусы. Этот способ позволяет получать VRP почти таким же способом, и с использованием такого же оборудования, какие используют для живых ослабленных вакцин или других вирусных векторов, для которых доступны продуцирующие линии клеток, например, некомпетентных по репликации аденовирусных векторов, выращенных на клетках, экспрессирующих гены E1A и E1B аденовируса.
[77] В некоторых вариантах осуществления используют двухступенчатый процесс: первая стадия включает в себя получение исходного материала для посева частиц репликона альфавируса посредством трансфекции упаковывающей клетки РНК репликоном или репликоном на основе плазмидной ДНК. Намного большее количество исходного материала частиц репликона получают затем на второй стадии, посредством инфекции свежей культуры упаковывающих клеток материалом для посева частиц. Эту инфекцию можно проводить с использованием различной множественности инфекции (MOI), включая MOI=0,00001, 0,00005, 0,0001, 0,0005, 0,001, 0,005, 0,01, 0,05, 0,1, 0,5, 1,0, 3, 5, 10 или 20. В некоторых вариантах осуществления инфекцию осуществляют при низкой MOI (например, менее 1). С течением времени частицы репликона можно собирать из упаковывающих клеток, инфицированных материалом для посева. В некоторых вариантах осуществления частицы репликона можно затем пассировать в культурах наивных упаковывающих клеток еще больших объемов посредством повторяющейся инфекции с низкой множественностью, получая препараты в коммерческом масштабе с таким же высоким титром.
Платформы самореплицирующейся РНК
[78] Два или более белков CMV можно получать посредством экспрессии рекомбинантных нуклеиновых кислот, кодирующих белки, в клетках субъекта. Предпочтительно, молекулы рекомбинантной нуклеиновой кислоты кодируют два или более белков CMV, например, являются полицистронными. Как определено выше, «полицистронный» включает в себя бицистронный. Предпочтительные нуклеиновые кислоты, которые можно вводить субъекту, чтобы вызвать продукцию белков CMV, представляют собой самореплицирующиеся молекулы РНК. Самореплицирующиеся молекулы РНК по изобретению основаны на геномной РНК РНК-вирусов, но лишены генов, кодирующих один или более структурных белков. Молекулы самореплицирующейся РНК поддаются трансляции для получения неструктурных белков РНК-вируса и белков CMV, кодируемых самореплицирующейся РНК.
[79] Самореплицирующаяся РНК, как правило, содержит по меньшей мере один или более генов, выбранных из группы, состоящей из вирусных репликаз, вирусных протеаз, вирусных хеликаз и других неструктурных вирусных белков, и также содержит 5'- и 3'-концевые цис-активные последовательности репликации, и гетерологичные последовательности, кодирующие два или более желаемых белков CMV. Субгеномный промотор, управляющий экспрессией гетерологичной последовательности(ей), можно включать в самореплицирующуюся РНК. Если желательно, гетерологичная последовательность может являться слитой в рамке с другими кодирующими областями в самореплицирующейся РНК и/или может находиться под контролем внутреннего участка связывания рибосомы (IRES).
[80] Самореплицирующиеся молекулы РНК по изобретению можно разрабатывать так, чтобы самореплицирующаяся молекула РНК не могла индуцировать продукцию инфекционных вирусных частиц. Этого можно достигать, например, исключением одного или нескольких вирусных генов, кодирующих структурные белки, которые являются необходимыми для продукции вирусных частиц, из самореплицирующейся РНК. Например, когда самореплицирующаяся молекула РНК основана на альфавирусе, таком как вирус Синдбис (SIN), вирус леса Семлики и вирус венесуэльского энцефалита лошадей (VEE), можно исключать один или более генов, кодирующих вирусные структурные белки, такие как гликопротеины капсида и/или оболочки. Если желательно, самореплицирующиеся молекулы РНК по изобретению можно разрабатывать для индукции продукции инфекционных вирусных частиц, которые являются ослабленными или вирулентными, или для получения вирусных частиц, способных к одному циклу последующей инфекции.
[81] Самореплицирующаяся молекула РНК может, при доставке в клетку позвоночных даже без каких-либо белков, приводить к продукции множества дочерних РНК посредством транскрипции с нее самой (или с антисмысловой копии ее самой). Самореплицирующуюся РНК можно транслировать непосредственно после доставки в клетку, и эту трансляцию обеспечивает РНК-зависимая РНК-полимераза, которая затем образует транскрипты с доставляемой РНК. Таким образом, доставляемая РНК приводит к продукции множества дочерних РНК. Эти транскрипты являются антисмысловыми по отношению к доставленной РНК и могут быть транслированы сами по себе для обеспечения экспрессии in situ кодированного белка CMV, или могут быть транскрибированы для получения дополнительных транскриптов, таких же смысловых, как доставленная РНК, которые транслируют для обеспечения экспрессии in situ кодированных белка(белков) CMV.
[82] Одной из пригодных систем для достижения саморепликации является использование РНК репликона на основе альфавируса, такого как репликон альфавируса, как описано в настоящем документе. Эти репликоны +цепи транслируют после доставки в клетку для получения репликазы (или репликазы-транскриптазы). Репликаза транслируется как полибелок, который авторасщепляется с образованием репликативного комплекса, который образует геномные копии -цепи с +цепи доставленной РНК. Эти транскрипты -цепи сами могут быть транскрибированы для получения дополнительных копий +цепи исходной РНК, а также для образования одного или нескольких субгеномных транскриптов, кодирующих два или более белков CMV. Трансляция субгеномного транскрипта, таким образом, приводит к экспрессии in situ белка(белков) CMV инфицированной клеткой. В пригодных репликонах альфавируса можно использовать репликазу из вируса Синдбис, вируса леса Семлики, вируса восточного энцефалита лошадей, вируса венесуэльского энцефалита лошадей и т.д.
[83] Предпочтительная самореплицирующаяся молекула РНК, таким образом, кодирует (i) РНК-зависимую РНК-полимеразу, которая может транскрибировать РНК с самореплицирующейся молекулы РНК, и (ii) два или более белков CMV или их фрагментов. Полимераза может представлять собой репликазу альфавируса, например, содержащую белок nsP4 альфавируса. Белок nsP4 является ключевым каталитическим компонентном репликазы.
[84] В то время как природные геномы альфавирусов кодируют структурные белки вириона в дополнение к неструктурному полибелку репликазе, является предпочтительным, чтобы самореплицирующаяся молекула РНК на основе альфавируса по изобретению не кодировала все структурные белки альфавируса. Таким образом, самореплицирующаяся РНК может приводить к продукции копий своей геномной РНК в клетке, но не к продукции содержащих РНК вирионов альфавируса. Неспособность продуцировать эти вирионы означает, что, в отличие от альфавируса дикого типа, самореплицирующаяся молекула РНК неспособна к самоподдержанию в инфекционной форме. Структурные белки альфавируса, которые являются необходимыми для поддержания вирусов дикого типа, отсутствуют в самореплицирующихся РНК по изобретению, и их место занимает ген(гены), кодирующие желательный продукт гена (белок CMV или его фрагмент), так что субгеномный транскрипт кодирует продукт желаемого гена вместо структурных белков вириона альфавируса.
[85] Таким образом, самореплицирующаяся молекула РНК, пригодная по изобретению, обладает двумя последовательностями, кодирующими различные белки CMV или их фрагменты. Последовательности, кодирующие белки CMV или их фрагменты, могут находиться в любой желательной ориентации и могут являться функционально связанными с одним и тем же или с отдельными промоторами. Если желательно, последовательности, кодирующие белки CMV или их фрагменты, могут являться частью одной открытой рамки считывания. В некоторых вариантах осуществления РНК может обладать одной или несколькими дополнительными (нижележащими) последовательностями или открытыми рамками считывания, например, кодирующими другие дополнительные белки CMV или их фрагменты. Самореплицирующаяся молекула РНК может обладать 5'-последовательностью, совместимой с кодированной репликазой.
[86] В одном аспекте самореплицирующаяся молекула РНК получена из альфавируса или основана на альфавирусе, например, репликон альфавируса, как определено в настоящем документе. В других аспектах самореплицирующаяся молекула РНК получена из вируса или основана на вирусе, отличном от альфавируса, предпочтительно, на РНК-вирусах с положительной цепью, и более предпочтительно, на пикорнавирусе, флавивирусе, рубивирусе, пестивирусе, гепацивирусе, калицивирусе или коронавирусе. Пригодные альфавирусные последовательности дикого типа хорошо известны и доступны из депозитариев последовательностей, таких как Американская коллекция типовых культур, Rockville, Md. Репрезентативные примеры пригодных альфавирусов включают в себя Аура (ATCC VR-368), вирус Бебару (ATCC VR-600, ATCC VR-1240), Кабассу (ATCC VR-922), вирус Чикунгунья (ATCC VR-64, ATCC VR-1241), вирус восточного энцефаломиелита лошадей (ATCC VR-65, ATCC VR-1242), Форт Морган (ATCC VR-924), вирус Гета (ATCC VR-369, ATCC VR-1243), Кызылагач (ATCC VR-927), вирус Маяро (ATCC VR-66; ATCC VR-1277), Миддельбург (ATCC VR-370), вирус Мукамбо (ATCC VR-580, ATCC VR-1244), Ндуму (ATCC VR-371), вирус Пиксуна (ATCC VR-372, ATCC VR-1245), вирус реки Росс (ATCC VR-373, ATCC VR-1246), леса Семлики (ATCC VR-67, ATCC VR-1247), вирус Синдбис (ATCC VR-68, ATCC VR-1248), Тонате (ATCC VR-925), Тринити (ATCC VR-469), Уна (ATCC VR-374), вирус венесуэльского энцефаломиелита лошадей (ATCC VR-69, ATCC VR-923, ATCC VR-1250, ATCC VR-1249, ATCC VR-532), вирус западного энцефаломиелита лошадей (ATCC VR-70, ATCC VR-1251, ATCC VR-622, ATCC VR-1252), Ватароа (ATCC VR-926) и Y-62-33 (ATCC VR-375).
[87] Самореплицирующиеся молекулы РНК по изобретению могут содержать один или более модифицированных нуклеотидов и, таким образом, обладать улучшенной стабильностью и являться устойчивыми к деградации и выведению in vivo, и обладать другими преимуществами. Без намерения быть связанными какой-либо конкретной теорией, считают, что самореплицирующиеся молекулы РНК, содержащие модифицированные нуклеотиды, прекращают или уменьшают стимуляцию эндосомальных и цитоплазматических иммунных рецепторов, когда самореплицирующуюся РНК доставляют в клетку. Это позволяет происходить саморепликации, амплификации и экспрессии белка. Это уменьшает также опасения относительно безопасности по сравнению с самореплицирующейся РНК, не содержащей модифицированных нуклеотидов, поскольку самореплицирующаяся РНК, содержащая модифицированные нуклеотиды, снижает активацию врожденной иммунной системы и последующие нежелательные последствия (например, воспаление в участке инъекции, раздражение в участке инъекции, боль и т.п.). Считают также, что молекулы РНК, полученные в результате саморепликации, распознаются как чужеродные нуклеиновые кислоты цитоплазматическими иммунными рецепторами. Таким образом, самореплицирующиеся молекулы РНК, содержащие модифицированные нуклеотиды, обеспечивают эффективную амплификацию РНК в клетке-хозяине и экспрессию белков CMV, так же как эффекты адъюванта.
[88] Последовательность РНК можно модифицировать по отношению к использованию кодонов, например, для увеличения эффективности трансляции и времени полужизни РНК. Поли A-хвост (например, приблизительно 30 или более остатков аденозина) можно присоединять к 3'-концу РНК для увеличения времени ее полужизни. 5'-конец РНК можно кэпировать модифицированным рибонуклеотидом со структурой m7G(5')ppp(5')N (структура кэпа 0) или его производным, которые можно включать в ходе синтеза РНК или можно конструировать ферментативно после транскрипции РНК (например, с использованием кэпирующего фермента вируса осповакцины (VCE), состоящего из трифосфатазы мРНК, гуанилил-трансферазы и гуанин-7-метилтрансферазы, который катализирует конструирование N7-монометилированных структур кэпа 0). Структура кэпа 0 может придавать стабильность и эффективность трансляции молекуле РНК. 5'-кэп молекул РНК можно дополнительно модифицировать 2'-O-метилтрансферазой, что приводит к образованию структуры кэпа 1 (m7Gppp[m2'-Ο]N), которая может дополнительно увеличивать эффективность трансляции. Структура кэпа 1 может также увеличивать активность in vivo.
[89] Как применяют в настоящем документе, «модифицированный нуклеотид» относится к нуклеотиду, содержащему одну или более химических модификаций (например, замен) в или на азотном основании нуклеозида (например, цитозине (C), тимине (T) или урациле (U), аденине (A) или гуанине (G)). Если желательно, самореплицирующаяся молекула РНК может содержать химические модификации в или на группе сахара нуклеозида (например, рибозе, дезоксирибозе, модифицированной рибозе, модифицированной дезоксирибозе, шестичленном аналоге сахара, или аналоге сахара с открытой цепью), или фосфате.
[90] Самореплицирующиеся молекулы РНК могут содержать по меньшей мере один модифицированный нуклеотид, который, предпочтительно, не является частью 5'-кэпа (например, в дополнение к модификации, которая является частью 5'-кэпа). Соответственно, самореплицирующаяся молекула РНК может содержать модифицированный нуклеотид в одном положении, может содержать конкретный модифицированный нуклеотид (например, псевдоуридин, N6-метиладенозин, 5-метилцитидин, 5-метилуридин) в двух или более положениях, или может содержать два, три, четыре, пять, шесть, семь, восемь, девять, десять или более модифицированных нуклеотидов (например, каждый в одном или более положениях). Предпочтительно, самореплицирующиеся молекулы РНК содержат модифицированные нуклеотиды, содержащие модификацию на или в азотном основании, но не содержащие модифицированные группы сахара или фосфата.
[91] В некоторых примерах между 0,001% и 99% или 100% нуклеотидов в самореплицирующейся молекуле РНК представляют собой модифицированные нуклеотиды. Например, 0,001%-25%, 0,01%-25%, 0,1%-25%, или 1%-25% нуклеотидов в самореплицирующейся молекуле РНК представляют собой модифицированные нуклеотиды.
[92] В других примерах между 0,001% и 99% или 100% конкретного немодифицированного нуклеотида в самореплицирующейся молекуле РНК заменено модифицированным нуклеотидом. Например, приблизительно 1% нуклеотидов в самореплицирующейся молекуле РНК, содержащей уридин, могут являться модифицированными, например, заменой уридина на псевдоуридин. В других примерах желательное количество (процент) из двух, трех или четырех конкретных нуклеотидов (нуклеотидов, содержащих уридин, цитидин, гуанозин или аденин) в самореплицирующейся молекуле РНК представляют собой модифицированные нуклеотиды. Например, 0,001%-25%, 0,01%-25%, 0,1%-25% или 1%-25% конкретного нуклеотида в самореплицирующейся молекуле РНК представляют собой модифицированные нуклеотиды. В других примерах, 0,001%-20%, 0,001%-15%, 0,001%-10%, 0,01%-20%, 0,01%-15%, 0,1%-25%, 0,01%-10%, 1%-20%, 1%-15%, 1%-10% или приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20% конкретного нуклеотида в самореплицирующейся молекуле РНК представляют собой модифицированные нуклеотиды.
[93] Является предпочтительным, чтобы менее 100% нуклеотидов в самореплицирующейся молекуле РНК представляли собой модифицированные нуклеотиды. Является предпочтительным также, чтобы менее 100% конкретного нуклеотида в самореплицирующейся молекуле РНК представляли собой модифицированные нуклеотиды. Таким образом, предпочтительные самореплицирующиеся молекулы РНК содержат по меньшей мере некоторые немодифицированные нуклеотиды.
[94] Существует более 96 природных модификаций нуклеозидов, обнаруженных в РНК млекопитающих. См., например, Limbach et al., Nucleic Acids Research, 22(12):2183-2196 (1994). Получение нуклеотидов и модифицированных нуклеотидов и нуклеозидов хорошо известно в данной области, например, из патентов США номера 4373071, 4458066, 4500707, 4668777, 4973679, 5047524, 5132418, 5153319, 5262530, 5700642, полное содержание всех из которых приведено в настоящем документе в качестве ссылки, и многие модифицированные нуклеозиды и модифицированные нуклеотиды являются коммерчески доступными.
[95] Модифицированные нуклеиновые основания, которые можно включать в модифицированные нуклеозиды и нуклеотиды, и которые могут присутствовать в молекулах РНК, включают в себя: m5C (5-метилцитидин), m5U (5-метилуридин), m6A (N6-метиладенозин), s2U (2-тиоуридин), Um (2'-O-метилуридин), m1A (1-метиладенозин); m2A (2-метиладенозин); Am (2-1-O-метиладенозин); ms2m6A (2-метилтио-N6-метиладенозин); i6A (N6-изопентениладенозин); ms2i6A (2-метилтио-N6-изопентениладенозин); io6A (N6-(цис-гидроксиизопентенил)аденозин); ms2io6A (2-метилтио-N6-(цис-гидроксиизопентенил)аденозин); g6A (N6-глицинилкарбамоиладенозин); t6A (N6-треонилкарбамоиладенозин); ms2t6A (2-метилтио-N6-треонилкарбамоиладенозин); m6t6A (N6-метил-N6-треонилкарбамоиладенозин); hn6A (N6-гидроксинорвалилкарбамоиладенозин); ms2hn6A (2-метилтио-N6-гидроксинорвалилкарбамоиладенозин); Ar(p) (2'-O-рибозиладенозин(фосфат)); I (инозин); mlI (1-метилинозин); m'Im (1,2'-O-диметилинозин); m3C (3-метилцитидин); Cm (2T-O-метилцитидин); s2C (2-тиоцитидин); ac4C (N4-ацетилцитидин); f5C (5-фоннилцитидин); m5Cm (5,2-O-диметилцитидин); ac4Cm (N4-ацетил-2TO-метилцитидин); k2C (лизидин); m1G (1-метилгуанозин); m2G (N2-метилгуанозин); m7G (7-метилгуанозин); Gm (2'-O-метилгуанозин); m22G (N2,N2-диметилгуанозин); m2Gm (N2,2'-O-диметилгуанозин); m22Gm (N2,N2,2'-O-триметилгуанозин); Gr(p) (2'-O-рибозилгуанозин(фосфат)); yW (вибутозин); o2yW (пероксивибутозин); OHyW (гидроксивибутозин); OHyW* (не полностью модифицированный гидроксивибутозин); imG (виозин); mimG (метилгуанозин); Q (квеуозин); oQ (эпоксиквеуозин); galQ (галактозилквеуозин); manQ (маннозилквеуозин); preQo (7-циано-7-деазагуанозин); preQi (7-аминометил-7-деазагуанозин); G* (археозин); D (дигидроуридин); m5Um (5,2'-O-диметилуридин); s4U (4-тиоуридин); m5s2U (5-метил-2-тиоуридин); s2Um (2-тио-2'-O-метилуридин); acp3U (3-(3-амино-3-карбоксипропил)уридин); ho5U (5-гидроксиуридин); mo5U (5-метоксиуридин); cmo5U (уридин-5-оксиуксусная кислота); mcmo5U (метиловый сложный эфир уридин-5-оксиуксусной кислоты); chm5U (5-(карбоксигидроксиметил)уридин)); mchm5U (метиловый сложный эфир 5-(карбоксигидроксиметил)уридина); mcm5U (5-метоксикарбонилметилуридин); mcm5Um (S-метоксикарбонилметил-2-O-метилуридин); mcm5s2U (5-метоксикарбонилметил-2-тиоуридин); nm5s2U (5-аминометил-2-тиоуридин); mnm5U (5-метиламинометилуридин); mnm5s2U (5-метиламинометил-2-тиоуридин); mnm5se2U (5-метиламинометил-2-селеноуридин); ncm5U (5-карбамоилметилуридин); ncm5Um (5-карбамоилметил-2'-O-метилуридин); cmnm5U (5-карбоксиметиламинометилуридин); cnmm5Um (5-карбоксиметиламинометил-2-L-O-метилуридин); cmnm5s2U (5-карбоксиметиламинометил-2-тиоуридин); m62A (N6,N6-диметиладенозин); Tm (2'-O-метилинозин); m4C (N4-метилцитидин); m4Cm (N4,2-O-диметилцитидин); hm5C (5-гидроксиметилцитидин); m3U (3-метилуридин); cm5U (5-карбоксиметилуридин); m6Am (N6,T-O-диметиладенозин); rn62Am (N6,N6,O-2-триметиладенозин); m2'7G (N2,7-диметилгуанозин); m2'2'7G (N2,N2,7-триметилгуанозин); m3Um (3,2T-O-диметилуридин); m5D (5-метилдигидроуридин); f5Cm (5-формил-2'-O-метилцитидин); mlGm (1,2'-O-диметилгуанозин); m'Am (1,2-O-диметиладенозин)иринометилуридин); tm5s2U (S-тауринометил-2-тиоуридин)); imG-14 (4-диметилгуанозин); imG2 (изогуанозин); ac6A (N6-ацетиладенозин), гипоксантин, инозин, 8-оксоаденин, его 7-замещенные производные, дигидроурацил, псевдоурацил, 2-тиоурацил, 4-тиоурацил, 5-аминоурацил, 5-(C1-C6)-алкилурацил, 5-метилурацил, 5-(C2-C6)-алкенилурацил, 5-(C2-C6)-алкинилурацил, 5-(гидроксиметил)урацил, 5-хлорурацил, 5-фторурацил, 5-бромурацил, 5-гидроксицитозин, 5-(C1-C6)-алкилцитозин, 5-метилцитозин, 5-(C2-C6)-алкенилцитозин, 5-(C2-C6)-алкинилцитозин, 5-хлорцитозин, 5-фторцитозин, 5-бромцитозин, N2-диметилгуанин, 7-деазагуанин, 8-азагуанин, 7-деаза-7-замещенный гуанин, 7-деаза-7-(C2-C6)алкинилгуанин, 7-деаза-8-замещенный гуанин, 8-гидроксигуанин, 6-тиогуанин, 8-оксогуанин, 2-аминопурин, 2-амино-6-хлорпурин, 2,4-диаминопурин, 2,6-диаминопурин, 8-азапурин, замещенный 7-деазапурин, 7-деаза-7-замещенный пурин, 7-деаза-8-замещенный пурин, водород (лишенный азотистого основания остаток), m5C, m5U, m6A, s2U, W или 2'-O-метил-U. Любой из них или любую комбинацию этих модифицированных нуклеиновых оснований можно включать в самореплицирующуюся РНК по изобретению. Многие из этих модифицированных нуклеиновых оснований и соответствующих им рибонуклеозидов являются доступными из коммерческих источников.
[96] Если желательно, самореплицирующаяся молекула РНК может содержать фосфорамидатные, фосфоротиоатные и/или метилфосфонатные связи.
[97] Самореплицирующиеся молекулы РНК, содержащие по меньшей мере один модифицированный нуклеотид, можно получать с использованием любого пригодного способа. Несколько пригодных способов известны в данной области для получения молекул РНК, содержащих модифицированные нуклеотиды. Например, самореплицирующуюся молекулу РНК, содержащую модифицированные нуклеотиды, можно получать транскрипцией (например, транскрипцией in vitro) ДНК, кодирующей самореплицирующуюся молекулу РНК, с использованием пригодной ДНК-зависимой РНК-полимеразы, такой как РНК-полимераза фага T7, РНК-полимераза фага SP6, РНК-полимераза фага T3 и т.п., или мутантов этих полимераз, позволяющих эффективное включение модифицированных нуклеотидов в молекулы РНК. Реакционная смесь для транскрипции может содержать нуклеотиды и модифицированные нуклеотиды, и другие компоненты, поддерживающие активность выбранной полимеразы, такие как пригодный буфер и пригодные соли. Включение аналогов нуклеотидов в самореплицирующуюся РНК можно разрабатывать, например, для изменения стабильности таких молекул РНК, для увеличения устойчивости против РНКаз, для обеспечения репликации после введения в подходящие клетки-хозяева («инфекционность» РНК), и/или для индукции или уменьшения врожденного и приобретенного иммунных ответов.
[98] Пригодные способы синтеза можно использовать по отдельности или в комбинации с одним или несколькими другими способами (например, способ рекомбинантной ДНК или РНК) для получения самореплицирующейся молекулы РНК, содержащей один или более модифицированных нуклеотидов. Пригодные способы синтеза de novo хорошо известны в данной области и их можно адаптировать для конкретных применений. Иллюстративные способы включают в себя, например, химический синтез с использованием пригодных защитных групп, таких как CEM (Masuda et al., (2007) Nucleic Acids Symposium Series 57:3-4), β-цианоэтил-фосфорамидитного способа (Beaucage S L et al. (1981) Tetrahedron Lett 22: 1859); нуклеозид-H-фосфонатный способ (Garegg P et al. (1986) Tetrahedron Lett 27:4051-4; Froehler B C et al. (1986) Nucl Acid Res 14:5399-407; Garegg P et al. (1986) Tetrahedron Lett 27:4055-8; Gaffney B L et al. (1988) Tetrahedron Lett 29:2619-22). Эти химические способы можно осуществлять или адаптировать для использования с автоматическими синтезаторами нуклеиновых кислот, являющимися коммерчески доступными. Дополнительные пригодные способы синтеза описаны в Uhlmann et al. (1990) Chem Rev 90:544-84, и Goodchild J (1990) Bioconjugate Chem 1 : 165. Синтез нуклеиновых кислот можно проводить также с использованием пригодных рекомбинантных способов, которые являются хорошо известными и общепринятыми в данной области, включая клонирование, процессинг и/или экспрессию полинуклеотидов и продуктов генов, кодированных такими полинуклеотидами. Перетасовка ДНК посредством случайной фрагментации и повторной сборки фрагментов генов посредством ПЦР, и синтетические полинуклеотиды являются примерами известных способов, которые можно использовать для дизайна и конструирования полинуклеотидных последовательностей. Сайт-направленный мутагенез можно использовать для изменения нуклеиновых кислот и кодированных белков, например, для вставки новых участков рестрикции, изменения характера гликозилирования, изменения кодонного предпочтения, получения вариантов сплайсинга, введения мутаций и т.п. Пригодные способы транскрипции, трансляции и экспрессии последовательностей нуклеиновых кислот являются известными и общепринятыми в данной области. (См. в общем, Current Protocols in Molecular Biology, Vol. 2, Ed. Ausubel, et al., Greene Publish. Assoc. & Wiley Interscience, Ch. 13, 1988; Glover, DNA Cloning, Vol. II, IRL Press, Wash., D.C., Ch. 3, 1986; Bitter, et al., in Methods in Enzymology 153:516-544 (1987); The Molecular Biology of the Yeast Saccharomyces, Eds. Strathern et al., Cold Spring Harbor Press, Vols. I and II, 1982; и Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press, 1989.)
[99] Присутствие и/или количество одного или нескольких модифицированных нуклеотидов в самореплицирующейся молекуле РНК можно определять с использованием любого пригодного способа. Например, самореплицирующуюся молекулу РНК можно расщеплять до монофосфатов (например, с использованием нуклеазы P1) и дефосфорилировать (например, с использованием пригодной фосфатазы, такой как CIAP), и полученные нуклеозиды анализировать обращенно-фазовой ВЭЖХ (например, с использованием колонки YMC Pack ODS-AQ (5 микрон, 4,6 × 250 мм) и элюировать с использованием градиента, 30% B (0-5 мин) до 100% B (5-13 мин) и при 100% B (13-40) мин, скорость потока (0,7 мл/мин), УФ-детекция (длина волны: 260 нм), температура колонки (30°C). Буфер A (20 мМ уксусная кислота - ацетат аммония pH 3,5), буфер B (20 мМ уксусная кислота - ацетат аммония pH 3,5/метанол [90/10])).
[100] Самореплицирующаяся РНК может быть ассоциирована с системой доставки. Самореплицирующуюся РНК можно вводить с адъювантом или без.
[101] Системы доставки РНК
[102] Самореплицирующиеся РНК, описанные в настоящем документе, являются пригодными для доставки множеством способов, таких как доставка голой РНК или в комбинации с липидами, полимерами или другими соединениями, облегчающими проникновение в клетку. Самореплицирующиеся молекулы РНК можно вводить в клетки-мишени или субъектам с использованием любого пригодного способа, например, посредством прямой инъекции, микроинъекции, электропорации, липофекции, биолистики и т.п. Самореплицирующуюся молекулу РНК можно также вводить в клетки посредством опосредованного рецептором эндоцитоза. См., например, патент США № 6090619; Wu and Wu, J. Biol. Chem., 263: 14621 (1988); и Curiel et al, Proc. Natl. Acad. Sci. USA, 88:8850 (1991). Например, в патенте США № 6083741 описано введение экзогенной нуклеиновой кислоты в клетки млекопитающих посредством ассоциации нуклеиновой кислоты с поликатионной группой (например, поли-L-лизином, обладающим 3-100 остатками лизина), которая сама присоединена к связывающей рецептор интегрина группе (например, циклический пептид, обладающий последовательностью Arg-Gly-Asp (SEQ ID NO:___).
[103] Самореплицирующиеся молекулы РНК можно доставлять в клетки посредством амфифильных веществ. См., например, патент США № 6071890. Как правило, молекула нуклеиновой кислоты может формировать комплекс с катионным амфифильным веществом. Клетки млекопитающих после контакта с комплексом могут легко поглощать его.
[104] Самореплицирующуюся РНК можно доставлять в форме голой РНК (например, просто в форме водного раствора РНК), но для усиления проникновения в клетки, а также последующих межклеточных эффектов, самореплицирующуюся РНК предпочтительно вводят в комбинации с системой доставки, такой как система доставки частиц или эмульсии. Большое количество систем доставки хорошо известно специалистам в данной области. Такие системы доставки включают в себя, например, основанную на липосомах доставку (Debs and Zhu (1993) WO 93/24640; Mannino and Gould-Fogerite (1988) BioTechniques 6(7): 682-691; Rose US Patent No. 5279833; Brigham (1991) WO 91/06309; и Feigner et al. (1987) Proc. Natl. Acad. Sci. USA 84: 7413-7414), так же как использование вирусных векторов (например, аденовирусных (см., например, Berns et al. (1995) Ann. NY Acad. Sci. 772: 95-104; Ali et al. (1994) Gene Ther. 1: 367-384; и обзор в Haddada et al. (1995) Curr. Top. Microbiol. Immunol. 199 (Pt 3): 297-306), папилломавирусных, ретровирусных (см., например, Buchscher et al. (1992) J. Virol. 66(5) 2731-2739; Johann et al. (1992) J. Virol. 66 (5): 1635-1640 (1992); Sommerfelt et al, (1990) Virol. 176:58-59; Wilson et al. (1989) J. Virol. 63:2374-2378; Miller et al, J. Virol. 65:2220-2224 (1991); Wong-Staal et al, PCT/US94/05700, и Rosenburg and Fauci (1993) in Fundamental Immunology, Third Edition Paul (ed) Raven Press, Ltd., New York и ссылки в этом документе, и Yu et al, Gene Therapy (1994) выше.), и аденоассоциированных вирусных векторов (см., West et al. (1987) Virology 160:38-47; Carter et al. (1989) US Patent No. 4797368; Carter et al. WO 93/24641 (1993); Kotin (1994) Human Gene Therapy 5:793-801; Muzyczka (1994) J. Clin. Invst. 94: 1351 и обзор векторов AAV Samulski (выше); см. также, Lebkowski, US Patent No. 5173414; Tratschin et al. (1985) Mol. Cell. Biol. 5(11):3251-3260; Tratschin, et al. (1984) Mol. Cell. Biol, 4:2072-2081; Hermonat and Muzyczka (1984) Proc. Natl. Acad. Sci. USA, 81 :6466-6470; McLaughlin et al. (1988) и Samulski et al. (1989) J. Virol, 63:03822-3828), и т.п.
[105] Три особенно пригодные системы доставки представляют собой (i) липосомы, (ii) микрочастицы нетоксичных и биоразлагаемых полимеров, и (iii) катионные субмикронные эмульсии типа масло-в-воде.
Липосомы
[106] Различные амфифильные липиды могут формировать бислои в водном окружении для инкапсуляции содержащей РНК водной сердцевины, такие как липосомы. Эти липиды могут обладать анионной, катионной или цвиттерионной гидрофильной концевой группой. Получение липосом из анионных фосфолипидов берет начало в 1960-х годах, и катионные формирующие липосомы липиды изучали с 1990-х годов. Некоторые фосфолипиды являются анионными, в то время как другие являются цвиттерионными. Пригодные классы фосфолипидов включают в себя, но без ограничения, фосфатидилэтаноламины, фосфатидилхолины, фосфатидилсерины и фосфатидилглицерины, и некоторые пригодные фосфолипиды перечислены в таблице 2. Пригодные катионные липиды включают в себя, но без ограничения, диолеоилтриметиламмонийпропан (DOTAP), 1,2-дистеарилокси-N,N-диметил-3-аминопропан (DSDMA), 1,2-диолеилокси-N,N-диметил-3-аминопропан (DODMA), 1,2-дилинолеилокси-N,N-диметил-3-аминопропан (DLinDMA), 1,2-дилиноленилокси-N,N-диметил-3- аминопропан (DLenDMA). Цвиттерионные липиды включают в себя, но без ограничения, ацильные цвиттерионные липиды и эфирные цвиттерионные липиды. Примерами пригодных цвиттерионных липидов являются DPPC, DOPC и додецилфосфохолин. Липиды могут являться насыщенными или ненасыщенными.
[107] Липосомы можно формировать из одного липида или из смеси липидов. Смесь может содержать (i) смесь анионных липидов (ii) смесь катионных липидов (iii) смесь цвиттерионных липидов (iv) смесь анионных липидов и катионных липидов (v) смесь анионных липидов и цвиттерионных липидов (vi) смесь цвиттерионных липидов и катионных липидов или (vii) смесь анионных липидов, катионных липидов и цвиттерионных липидов. Подобным образом, смесь может содержать как насыщенные, так и ненасыщенные липиды. Например, смесь может содержать DSPC (цвиттерионный, насыщенный), DlinDMA (катионный, ненасыщенный), и/или DMPG (анионный, насыщенный). Когда используют смесь липидов, не все липидные компоненты в смеси обязательно должны быть амфифильными, например, один или более амфифильных липидов можно смешивать с холестерином.
[108] Гидрофильная часть липида может являться пегилированной (т.е. модифицированной ковалентным присоединением полиэтиленгликоля). Эта модификация может увеличивать стабильность и предотвращать неспецифическую адсорбцию липосом. Например, липиды можно конъюгировать с PEG с использованием таких способов, как описанные в Heyes et al. (2005) J Controlled Release 107:276-87.
[109] Смесь DSPC, DlinDMA, PEG-DMPG и холестерина можно использовать для формирования липосом. Отдельный аспект изобретения относится к липосоме, содержащей DSPC, DlinDMA, PEG-DMG и холестерин. Эта липосома предпочтительно инкапсулирует РНК, такую как самореплицирующаяся РНК, например, кодирующая иммуноген.
[110] Липосомы обычно разделяют на три группы: многослойные везикулы (MLV); мелкие однослойные везикулы (SUV); и крупные однослойные везикулы (LUV). MLV обладают множеством бислоев в каждой везикуле, формирующих несколько отдельных водных компартментов. SUV и LUV обладают отдельным бислоем, инкапсулирующим водную сердцевину; SUV, как правило, обладают диаметром <50 нм, и LUV обладают диаметром >50 нм. Липосомы, пригодные по изобретению, в идеале представляют собой LUV с диаметром в диапазоне 50-220 нм. В случае композиции, содержащей популяцию LUV с различными диаметрами: (i) по меньшей мере 80% по количеству должны обладать диаметрами в диапазоне 20-220 нм, (ii) средний диаметр (Zav, по интенсивности) популяции в идеале лежит в диапазоне 40-200 нм, и/или (iii) диаметры должны обладать индексом полидисперсности <0,2.
[111] Способы получения пригодных липосом хорошо известны в данной области, например, см. Liposomes: Methods and Protocols, Volume 1: Pharmaceutical Nanocarriers: Methods and Protocols, (ed. Weissig). Humana Press, 2009. ISBN 160327359X; Liposome Technology, volumes I, II & III. (ed. Gregoriadis). Informa Healthcare, 2006; и Functional Polymer Colloids and Microparticles volume 4 (Microspheres, microcapsules & liposomes), (eds. Arshady & Guyot). Citus Books, 2002. Один из пригодных способов включает в себя смешивание (i) этанольного раствора липидов, (ii) водного раствора нуклеиновой кислоты и (iii) буфера, с последующим смешиванием, уравновешиванием, разведением и очисткой (Heyes et al. (2005) J Controlled Release 107:276-87.).
[112] РНК предпочтительно является инкапсулированной внутри липосом, и, таким образом, липосома формирует внешний слой вокруг водной содержащей РНК сердцевины. Обнаружено, что эта инкапсуляция защищает РНК от расщепления РНКазой. Липосомы могут включать в себя некоторое количество внешней РНК (например, на поверхности липосом), но предпочтительно, по меньшей мере половина РНК (и в идеале по существу вся она) является инкапсулированной.
Полимерные микрочастицы
[113] Различные полимеры могут формировать микрочастицы для инкапсуляции или адсорбции РНК. Использование по существу нетоксичного полимера означает, что реципиенту можно безопасно вводить частицы, и использование биоразлагаемого полимера означает, что частицы могут подвергаться метаболизму после доставки, чтобы избегать долговременной персистенции. Пригодные полимеры также поддаются стерилизации, чтобы способствовать получению составов фармацевтической степени очистки.
[114] Пригодные нетоксичные и биоразлагаемые полимеры включают в себя, но без ограничения, поли(α-гидроксикислоты), полигидроксимасляные кислоты, полилактоны (включая поликапролактоны), полидиоксаноны, поливалеролактон, полиортоэфиры, полиангидриды, полицианоакрилаты, происходящие из тирозина поликарбонаты, поливинилпирролидиноны или полиэфирамиды и их комбинации.
[115] В некоторых вариантах осуществления микрочастицы сформированы из поли(α-гидроксикислот), таких как поли(лактиды) («PLA»), сополимеров лактида и гликолида, таких как сополимер D,L-лактида и гликолида («PLG»), и сополимеры D,L-лактида и капролактона. Пригодные полимеры PLG включают в себя полимеры, обладающие молярным соотношением лактид/гликолид в диапазоне, например, от 20:80 до 80:20 например, 25:75, 40:60, 45:55, 55:45, 60:40, 75:25. Пригодные полимеры PLG включают в себя полимеры, обладающие молекулярной массой между, например, 5000-200000 Да, например, между 10000-100000, 20000-70000, 40000-50000 Да.
[116] Микрочастицы в идеале обладают диаметром в диапазоне от 0,02 мкм до 8 мкм. Для композиции, содержащей популяцию микрочастиц с различными диаметрами, по меньшей мере 80% по количеству должны обладать диаметром в диапазоне 0,03-7 мкм.
[117] Способы получения пригодных микрочастиц хорошо известны в данной области, например, см. Functional Polymer Colloids and Microparticles volume 4 (Microspheres, microcapsules & liposomes), (eds. Arshady & Guyot). Citus Books, 2002; Polymers in Drug Delivery, (eds. Uchegbu & Schatzlein). CRC Press, 2006. (in particular chapter 7) и Microparticulate Systems for the Delivery of Proteins and Vaccines. (eds. Cohen & Bernstein). CRC Press, 1996. Для облегчения адсорбции РНК микрочастица может включать катионное поверхностно-активное вещество и/или липид, например, как описано в O'Hagan et al. (2001) J Virology 15: 9037-9043; и Singh et al. (2003) Pharmaceutical Research 20: 247-251. Альтернативный способ получения полимерных микрочастиц представляет собой формовку и отверждение, например, как описано в WO2009/132206.
[118] Микрочастицы по изобретению могут обладать дзета-потенциалом между 40-100 мВ. РНК можно адсорбировать на микрочастицах, и адсорбцию облегчают включением катионных материалов (например, катионных липидов) в микрочастицу.
Катионные эмульсии масло-в-воде
[119] Эмульсии типа масло-в-воде известны в качестве адъювантов для вакцин против гриппа, например, адъювант MF59™ в продукте FLUAD™, и адъювант AS03 в продукте PREPANDRIX™. Доставку РНК можно осуществлять с использованием эмульсии масло-в-воде, при условии, что эмульсия включает одну или более катионных молекул. Например, катионный липид можно включать в эмульсию для получения положительно заряженной поверхности капель, к которой можно присоединять отрицательно заряженную РНК.
[120] Эмульсия содержит одно или более масел. Пригодные масло(масла) включают в себя масло, например, из животного (такого как рыба) или растительного источника. Масло в идеале является биоразлагаемым (подверженным метаболизму) и биосовместимым. Источники растительных масел включают в себя орехи, семена и злаки. Арахисовое масло, соевое масло, кокосовое масло и оливковое масло, наиболее широко доступные, представляют собой примеры ореховых масел. Можно использовать масло жожоба, например, полученное из боба жожоба. Масла из семян включают в себя сафлоровое масло, хлопковое масло, масло семян подсолнечника, масло семян кунжута и т.п. В группе злаков кукурузное масло является наиболее легко доступным, однако можно использовать также масло других зерен хлебных злаков, таких как пшеница, овес, рожь, рис, теф, тритикале и т.п. Сложные эфиры жирных кислот глицерина и 1,2-пропандиола с 6-10 атомами углерода, в то время как не встречается в природе в маслах из семян, могут быть получены гидролизом, разделением и этерификацией пригодных материалов, начиная от ореховых масел и масел из семян. Жиры и масла из молока млекопитающих подвергаются метаболизму и поэтому их можно использовать. Способы разделения, очистки, сапонификации и другие способы, необходимые для получения чистых масел из животных источников, хорошо известны в данной области.
[121] Большинство видов рыбы содержат подверженные метаболизму масла, которые можно легко выделять. Например, жир печени трески, жиры печени акулы и китовый жир, такой как спермацет, являются примерами нескольких рыбьих жиров, которые можно использовать в настоящем документе. Ряд масел с разветвленной цепью можно синтезировать биохимически в форме 5-углеродных изопреновых групп, и их в общей форме обозначают как терпеноиды. Можно использовать также сквалан, насыщенный аналог сквалена. Рыбьи жиры, включая сквален и сквалан, являются легко доступными из коммерческих источников, или их можно получать способами, известными в данной области.
[122] Другими пригодными маслами являются токоферолы, в частности, в комбинации со скваленом. Когда масляная фаза эмульсии включает в себя токоферол, можно использовать любой из α, β, γ, δ, ε или ξ токоферолов, однако α-токоферолы являются предпочтительными. Можно использовать как D-α-токоферол, так и DL-α-токоферол. Предпочтительным α-токоферолом является DL-α-токоферол. Можно использовать комбинацию масел, содержащую сквален и токоферол (например, DL-α-токоферол).
[123] Предпочтительные эмульсии содержат сквален, жир печени акулы, который представляет собой разветвленный, ненасыщенный терпеноид (C30H50; [(CH3)2C[=CHCH2CH2C(CH3)]2=CHCH2-]2; 2,6,10,15,19,23-гексаметил-2,6,10,14,18,22-тетракозагексен; CAS RN 7683-64-9).
[124] Масло в эмульсии может содержать комбинацию масел, например, сквален и по меньшей мере одно дополнительное масло.
[125] Водный компонент эмульсии может представлять собой чистую воду (например, w.f.i.) или может включать дополнительные компоненты, например, растворенные вещества. Например, он может включать соли для формирования буфера, например, соли цитраты или фосфаты, такие как соли натрия. Типичные буферы включают в себя: фосфатный буфер; трис-буфер; боратный буфер; сукцинатный буфер; гистидиновый буфер или цитратный буфер. Забуференная водная фаза является предпочтительной, и буферы, как правило, включают в диапазоне 5-20 мМ.
[126] Эмульсия также включает катионный липид. Предпочтительно, этот липид представляет собой поверхностно-активное вещество, так что он может облегчать формирование и стабилизацию эмульсии. Пригодные катионные липиды, как правило, содержат атом азота, который является положительно заряженным в физиологических условиях, например, как третичный или четвертичный амин. Этот азот может находиться в гидрофильной концевой группе амфифильного поверхностно-активного вещества. Пригодные катионные липиды включают в себя, но без ограничения: 1,2-диолеоилокси-3-(триметиламмоний)пропан (DOTAP), 3'-[N-(N',N'-диметиламиноэтан)карбамоил]холестерин (DC холестерин), диметилдиоктадециламмоний (DDA, например, бромид), 1,2-димиристоил-3-триметиламмонийпропан (DMTAP), дипальмитоил(C16:0)триметиламмонийпропан (DPTAP), дистеароилтриметиламмонийпропан (DSTAP). Другими пригодными катионными липидами являются: хлорид бензалкония (BAK), хлорид бензэтония, цетрамид (который содержит бромид тетрадецилтриметиламмония и, возможно, небольшие количества бромида дедецилтриметиламмония и бромида гексадецилтриметиламмония), хлорид цетилпиридиния (CPC), цетилтриметиламмонийхлорид (CTAC), Ν,Ν',Ν'-полиоксиэтилен (10)-N-талловый-1,3-диаминопропан, бромид додецилтриметиламмония, бромид гексадецилтриметиламмония, смешанный бромид алкилтриметиламмония, хлорид бензилдиметилдодециламмония, хлорид бензилдиметилгексадециламмония, метоксид бензилтриметиламмония, бромид цетилдиметилэтиламмония, бромид диметилдиоктадециламмония (DDAB), хлорид метилбензэтония, хлорид декаметония, метиловый смешанный хлорид триалкиламмония, хлорид метилтриоктиламмония), хлорид N,N-диметил-N-[2(2-метил-4-(1,1,3,3-тетраметилбутил)фенокси]этокси)этил]-бензолметанаминия (DEBDA), соли диалкилдиметиламмония, хлорид [1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония, 1,2-диацил-3-(триметиламмонио)пропан (ацильная группа = димиристоил, дипальмитоил, дистеароил, диолеоил), 1,2-диацил-3-(диметиламмонио)пропан (ацильная группа = димиристоил, дипальмитоил, дистеароил, диолеоил), 1,2-диолеоил-3-(4'-триметиламмонио)бутаноил-sn-глицерин, холиновый сложный эфир 1,2-диолеоил 3-сукцинил-sn-глицерина, холестерил(4'-триметиламмонио)бутаноат), соли N-алкилпиридиния (например, бромид цетилпиридиния и хлорид цетилпиридиния), соли N-алкилпиперидиния, дикатионные болаформные электролиты (C12Me6; C12BU6), диалкилглицетилфосфорилхолин, лизолецитин, L-α-диолеоилфосфатидилэтаноламин, холиновый сложный эфир гемисукцината холестерина, липополиамины, включая, но без ограничения, диоктадециламидоглицилспермин (DOGS), дипальмитоилфосфатидилэтаноламидоспермин (DPPES), липополи-L (или D)-лизин (LPLL, LPDL), поли-L (или D)-лизин, конъюгированный с N-глутарилфосфатидилэтаноламином, сложный эфир дидодецилглутамата с подвешенной аминогруппой (C^GluPhCnN), сложный эфир дитетрадецилглутамата с подвешенной аминогруппой (C14GluCnN+), катионные производные холестерина, включая, но без ограничения, соль холестерил-3-β-оксисукцинамидоэтилентриметиламмония, холестерил-3-β-оксисукцинамидоэтилендиметиламин, соль холестерил-3-β- карбоксиамидоэтилентриметиламмония и холестерил-3-β-карбоксиамидоэтилендиметиламин. Другие пригодные катионные липиды описаны в US 2008/0085870 и US 2008/0057080, содержание которых приведено в настоящем документе в качестве ссылки. Катионный липид является предпочтительно биоразлагаемым (подверженным метаболизму) и биосовместимым.
[127] В дополнение к маслу и катионному липиду, эмульсия может содержать неионное поверхностно-активное вещество и/или цвиттерионное поверхностно-активное вещество. Такие поверхностно-активные вещества включают в себя, но без ограничения: поверхностно-активное вещества сложные эфиры полиоксиэтиленсорбитана (с общим обозначением Твин), особенно полисорбат 20 и полисорбат 80; сополимеры этиленоксида (EO), пропиленоксида (PO), и/или бутиленоксида (BO), продаваемые под торговым наименованием DOWFAX™, такие как линейные блок-сополимеры EO/PO; октоксинолы, у которых можно менять количество повторяющихся этокси- (окси-1,2-этандиил)- групп, где особенный интерес представляет октоксинол-9 (Тритон X-100, или трет-октилфеноксиполиэтоксиэтанол); (октилфенокси)полиэтоксиэтанол (IGEPAL CA-630/NP-40); фосфолипиды, такие как фосфатидилхолин (лецитин); полиоксиэтиленовые жирные эфиры, производные лаурилового, цетилового, стеарилового и олеилового спиртов (известные как поверхностно-активные вещества Brij), такие как монолауриловый эфир триэтиленгликоля (Brij 30); полиоксиэтилен-9-лауриловый эфир; и сложные эфиры сорбитана (общеизвестные как Span), такие как триолеат сорбитана (Span 85) и монолаурат сорбитана. Предпочтительные поверхностно-активные вещества для включения в эмульсию представляют собой полисорбат 80 (Твин 80; моноолеат полиоксиэтиленсорбитана), Span 85 (триолеат сорбитана), лецитин и Тритон X-100.
[128] Смеси этих поверхностно-активных веществ можно включать в эмульсию, например, смеси Твин 80/Span 85 или смеси Твин 80/Тритон-X100. Пригодна также комбинация сложного эфира полиоксиэтиленсорбитана, такого как моноолеат полиоксиэтиленсорбитана (Твин 80) и октоксинола, такого как трет-октилфеноксиполиэтоксиэтанол (Тритон X-100). Другое применимое сочетание содержит лаурет 9 плюс сложный эфир полиоксиэтиленсорбитана и/или октоксинол. Пригодные смеси могут содержать поверхностно-активное вещество со значением HLB в диапазоне 10-20 (например, полисорбат 80, с HLB 15,0) и поверхностно-активное вещество со значением HLB в диапазоне 1-10 (например, триолеат сорбитана, с HLB 1,8).
[129] Предпочтительные количества масла (% по объему) в конечной эмульсии составляют 2-20%, например, 5-15%, 6-14%, 7-13%, 8-12%. Содержание сквалена приблизительно 4-6% или приблизительно 9-11% является особенно пригодным.
[130] Предпочтительные количества поверхностно-активных веществ (% по массе) в конечной эмульсии составляют между 0,001% и 8%. Например: сложные эфиры полиоксиэтиленсорбитана (такие как полисорбат 80) 0,2-4%, в частности, между 0,4-0,6%, между 0,45-0,55%, приблизительно 0,5% или между 1,5-2%, между 1,8-2,2%, между 1,9-2,1%, приблизительно 2%, или 0,85-0,95%, или приблизительно 1%; сложные эфиры сорбитана (такие как триолеат сорбитана) 0,02-2%, в частности, приблизительно 0,5% или приблизительно 1%; октил- или нонилфеноксиполиоксиэтанолы (такие как Тритон X-100) 0,001-0,1%, в частности, 0,005-0,02%; простые эфиры полиоксиэтилена (такие как лаурет 9) 0,1-8%, предпочтительно 0,1-10% и, в частности, 0,1-1% или приблизительно 0,5%.
[131] Абсолютные количества масла и поверхностно-активного вещества и их соотношение могут меняться в широких пределах, в то же время еще образуя эмульсию. Специалист в данной области может легко менять относительные пропорции компонентов для получения желаемой эмульсии, однако массовое соотношение между 4:1 и 5:1 для масла и поверхностно-активного вещества является типичным (избыток масла).
[132] Важным параметром для обеспечения иммуностимулирующей активности эмульсии, в частности, в крупных животных, является размер капель масла (диаметр). Наиболее эффективные эмульсии обладают размером капель в субмикронном диапазоне. Пригодным образом, размер капель может лежать в диапазоне 50-750 нм. Наиболее пригодный средний размер капель составляет менее 250 нм, например, менее 200 нм, менее 150 нм. Средний размер капель является пригодным в диапазоне 80-180 нм. В идеале, по меньшей мере 80% (по количеству) масляных капель эмульсии имеет менее 250 нм в диаметре и, предпочтительно, по меньшей мере 90%. Аппаратура для определения среднего размера частиц в эмульсии и распределения по размерам является коммерчески доступной. В ней, как правило, используют способы динамического светорассеяния и/или оптического измерения отдельных частиц, например, серии аппаратов Accusizer™ и Nicomp™, доступные из Particle Sizing Systems (Santa Barbara, USA), или аппараты Zetasizer™ из Malvern Instruments (UK) или аппараты анализаторы распределения частиц по размерам из Horiba (Kyoto, Japan).
[133] В идеале, распределение капель по размеру (по количеству) обладает только одним максимумом, т.е. существует отдельная популяция капель с распределением около среднего (моды), вместо обладания двумя максимумами. Предпочтительные эмульсии обладают полидисперсностью <0,4, например 0,3, 0,2 или менее.
[134] Пригодные эмульсии с субмикронными каплями и узким распределением по размеру можно получать с использованием микрофлюидизации. Этим способом уменьшают средний размер масляных капель посредством продвижения потоков вводимых компонентов через геометрически фиксированные каналы при высоком давлении и высокой скорости. Эти потоки контактируют со стенками каналов, со стенками камеры и друг с другом. Результирующие силы сдвига, удара и кавитации вызывают уменьшение размера капель. Можно проводить повторяющиеся стадии микрофлюидизации, до достижения эмульсии с желаемым средним размером и распределением частиц.
[135] В качестве альтернативы микрофлюидизации, можно использовать термические способы, чтобы вызвать обращение фаз. Этими способами также можно получать субмикронную эмульсию с узким распределением частиц по размерам.
[136] Предпочтительные эмульсии можно стерилизовать фильтрованием, т.е. их капли могут проходить через фильтр 220 нм. Вместе с обеспечением стерилизации, этим способом удаляют также все большие капли из эмульсии.
[137] В конкретных вариантах осуществления катионный липид в эмульсии представляет собой DOTAP. Катионная эмульсия масло-в-воде может содержать от приблизительно 0,5 мг/мл до приблизительно 25 мг/мл DOTAP. Например, катионная эмульсия масло-в-воде может содержать DOTAP при от приблизительно 0,5 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,6 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,7 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,9 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,0 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,1 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,2 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,3 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,4 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,5 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,6 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,7 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 24 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 22 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 20 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 18 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 15 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 12 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 10 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 2 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,9 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,8 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,6 мг/мл, от приблизительно 0,6 мг/мл до приблизительно 1,6 мг/мл, от приблизительно 0,7 мг/мл до приблизительно 1,6 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 1,6 мг/мл, приблизительно 0,5 мг/мл, приблизительно 0,6 мг/мл, приблизительно 0,7 мг/мл, приблизительно 0,8 мг/мл, приблизительно 0,9 мг/мл, приблизительно 1,0 мг/мл, приблизительно 1,1 мг/мл, приблизительно 1,2 мг/мл, приблизительно 1,3 мг/мл, приблизительно 1,4 мг/мл, приблизительно 1,5 мг/мл, приблизительно 1,6 мг/мл, приблизительно 12 мг/мл, приблизительно 18 мг/мл, приблизительно 20 мг/мл, приблизительно 21,8 мг/мл, приблизительно 24 мг/мл и т.д. В иллюстративном варианте осуществления катионная эмульсия масло-в-воде содержит от приблизительно 0,8 мг/мл до приблизительно 1,6 мг/мл DOTAP, например, 0,8 мг/мл, 1,2 мг/мл, 1,4 мг/мл или 1,6 мг/мл.
[138] В конкретных вариантах осуществления катионный липид представляет собой DC холестерин. Катионная эмульсия масло-в-воде может содержать DC холестерин при от приблизительно 0,1 мг/мл до приблизительно 5 мг/мл DC холестерина. Например, катионная эмульсия масло-в-воде может содержать DC холестерин от приблизительно 0,1 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,2 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,3 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,4 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,62 мг/мл до приблизительно 5 мг/мл, от приблизительно 1 мг/мл до приблизительно 5 мг/мл, от приблизительно 1,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 2 мг/мл до приблизительно 5 мг/мл, от приблизительно 2,46 мг/мл до приблизительно 5 мг/мл, от приблизительно 3 мг/мл до приблизительно 5 мг/мл, от приблизительно 3,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 4 мг/мл до приблизительно 5 мг/мл, от приблизительно 4,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 4,92 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 4,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 4 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 3,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 3 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 2,46 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 2 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 1,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 1 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 0,62 мг/мл, приблизительно 0,15 мг/мл, приблизительно 0,3 мг/мл, приблизительно 0,6 мг/мл, приблизительно 0,62 мг/мл, приблизительно 0,9 мг/мл, приблизительно 1,2 мг/мл, приблизительно 2,46 мг/мл, приблизительно 4,92 мг/мл и т.д. В иллюстративном варианте осуществления катионная эмульсия масло-в-воде содержит от приблизительно 0,62 мг/мл до приблизительно 4,92 мг/мл DC холестерина, например, 2,46 мг/мл.
[139] В конкретных вариантах осуществления катионный липид представляет собой DDA. Катионная эмульсия масло-в-воде может содержать от приблизительно 0,1 мг/мл до приблизительно 5 мг/мл DDA. Например, катионная эмульсия масло-в-воде может содержать DDA при от приблизительно 0,1 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 4,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 4 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 3,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 3 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 2,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 2 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 1,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 1,45 мг/мл, от приблизительно 0,2 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,3 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,4 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,6 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,73 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,9 мг/мл до приблизительно 5 мг/мл, от приблизительно 1,0 мг/мл до приблизительно 5 мг/мл, от приблизительно 1,2 мг/мл до приблизительно 5 мг/мл, от приблизительно 1,45 мг/мл до приблизительно 5 мг/мл, от приблизительно 2 мг/мл до приблизительно 5 мг/мл, от приблизительно 2,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 3 мг/мл до приблизительно 5 мг/мл, от приблизительно 3,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 4 мг/мл до приблизительно 5 мг/мл, от приблизительно 4,5 мг/мл до приблизительно 5 мг/мл, приблизительно 1,2 мг/мл, приблизительно 1,45 мг/мл и т.д. Альтернативно, катионная эмульсия масло-в-воде может содержать DDA при приблизительно 20 мг/мл, приблизительно 21 мг/мл, приблизительно 21,5 мг/мл, приблизительно 21,6 мг/мл, приблизительно 25 мг/мл. В иллюстративном варианте осуществления катионная эмульсия масло-в-воде содержит от приблизительно 0,73 мг/мл до приблизительно 1,45 мг/мл DDA, например, 1,45 мг/мл.
[140] Катетеры или подобные устройства можно использовать для доставки самореплицирующихся молекул РНК по изобретению, в форме голой РНК или в комбинации с системой доставки, в орган- или ткань-мишень. Пригодные катетеры описаны, например, в патентах США № 4186745; 5397307; 5547472; 5674192 и 6129705, содержание всех из которых приведено в настоящем документе в качестве ссылки.
[141] Настоящее изобретение относится к использованию пригодных систем доставки, таких как липосомы, полимерные микрочастицы или микрочастицы субмикронной эмульсии с инкапсулированной или адсорбированной самореплицирующейся РНК, для доставки самореплицирующейся молекулы РНК, которая кодирует два или более белков CMV, например, чтобы вызывать иммунный ответ самостоятельно или в комбинации с другой макромолекулой. Изобретение относится к липосомам, микрочастицам и субмикронным эмульсиям с адсорбированными и/или инкапсулированными самореплицирующимися молекулами РНК, и их комбинациям.
[142] Самореплицирующиеся молекулы РНК, ассоциированные с липосомами и микрочастицами субмикроной эмульсии, можно эффективно доставлять в клетку-хозяина, и они могут вызывать иммунный ответ на белок, кодируемый самореплицирующейся РНК.
[143] Полицистронные самореплицирующиеся молекулы РНК, кодирующие белки CMV, и VRP, полученные с использованием полицистронных репликонов альфавируса, можно использовать для формирования комплексов белков CMV в клетке. Комплексы включают в себя, но без ограничения, gB/gH/gL; gH/gL; gH/gL/gO; gM/gN; gH/gL/UL128/UL130/UL131 и UL128/UL130/UL131.
[144] В некоторых вариантах осуществления комбинации VRP доставляют в клетку. Комбинации включают в себя, но без ограничения:
1. VRP gH/gL и другая VRP;
2. VRP gH/gL и VRP gB;
3. VRP gH/gL/gO и VRP gB;
4. VRP gB и VRP gH/gL/UL128/UL130/UL131;
5. VRP gB и VRP UL128/UL130/UL131;
6. VRP gB и VRP gM/gN;
7. VRP gB, VRP gH/gL и VRP UL128/UL130/UL131;
8. VRP gB, VRP gH/gL/gO и VRP UL128/UL130/UL131;
9. VRP gB, VRP gM/gN, VRP gH/gL и VRP UL128/UL130/UL131;
10. VRP gB, VRP gM/gN, VRP gH/gL/gO и VRP UL128/UL130/UL131;
11. VRP gH/gL и VRP UL128/UL130/UL131; и
[145] В некоторых вариантах осуществления комбинации самореплицирующихся молекул РНК доставляют в клетку. Комбинации включают в себя, но без ограничения:
1. самореплицирующаяся молекула РНК, кодирующая gH/gL и самореплицирующаяся молекула РНК, кодирующая другой белок;
2. самореплицирующаяся молекула РНК, кодирующая gH и gL, и самореплицирующаяся молекула РНК, кодирующая gB;
3. самореплицирующаяся молекула РНК, кодирующая gH, gL и gO, и самореплицирующаяся молекула РНК, кодирующая gB;
4. самореплицирующаяся молекула РНК, кодирующая gB, и самореплицирующаяся молекула РНК, кодирующая gH, gL, UL128, UL130 и UL131;
5. самореплицирующаяся молекула РНК, кодирующая gB, и самореплицирующаяся молекула РНК, кодирующая UL128, UL130 и UL131;
6. самореплицирующаяся молекула РНК, кодирующая gB, и самореплицирующаяся молекула РНК, кодирующая gM и gN;
7. самореплицирующаяся молекула РНК, кодирующая gB, самореплицирующаяся молекула РНК, кодирующая gH и gL, и самореплицирующаяся молекула РНК, кодирующая UL128, UL130 и UL131;
8. самореплицирующаяся молекула РНК, кодирующая gB, самореплицирующаяся молекула РНК, кодирующая gH, gL и gO, и самореплицирующаяся молекула РНК, кодирующая UL128, UL130 и UL131;
9. самореплицирующаяся молекула РНК, кодирующая gB, самореплицирующаяся молекула РНК, кодирующая gM и gN, самореплицирующаяся молекула РНК, кодирующая gH и gL, и самореплицирующаяся молекула РНК, кодирующая UL128, UL130 и UL131;
10. самореплицирующаяся молекула РНК, кодирующая gB, самореплицирующаяся молекула РНК, кодирующая gM и gN, самореплицирующаяся молекула РНК, кодирующая gH, gL и gO, и самореплицирующаяся молекула РНК, кодирующая UL128, UL130 и UL131;
11. самореплицирующаяся молекула РНК, кодирующая gH и gL, и самореплицирующаяся молекула, РНК кодирующая UL128, UL130 и UL131; и
Белки CMV
[146] Пригодные белки CMV включают в себя gB, gH, gL, gO и могут происходить из любого штамма CMV. Другие пригодные белки CMV включают в себя UL128, UL130 и UL131, и могут происходить из любого штамма CMV. Например, белки CMV могут происходить из штаммов CMV Merlin, AD169, VR1814, Towne, Toledo, TR, PH, TB40 или Fix. Иллюстративные белки CMV и их фрагменты описаны в настоящем документе. Эти белки и фрагменты могут быть кодированы любой подходящей нуклеотидной последовательностью, включая последовательности, которые являются оптимизированными или дезоптимизированными по кодонам для экспрессии в желаемом хозяине, таком как клетка человека. Иллюстративные последовательности белков CMV и нуклеиновых кислот, кодирующих белки, представлены в таблице 2.
[147]
Белки gB CMV
[148] Белок gB может являться полноразмерным или можно исключать одну или более областей белка. Альтернативно, можно использовать фрагменты белка gB. Аминокислоты gB пронумерованы в соответствии с аминокислотной последовательностью полноразмерного gB (CMV gB FL), показанной на SEQ ID NO:___, которая обладает длиной 907 аминокислот. Пригодные области белка gB, которые можно исключать из полноразмерного белка или включать в качестве фрагментов, включают в себя: сигнальную последовательность (аминокислоты 1-24), подобный дезинтегрину домен gB-DLD (аминокислоты 57-146), участок расщепления фурином (аминокислоты 459-460), область гептадных повторов (679-693), трансмембранный домен (аминокислоты 751-771), и цитоплазматический домен от аминокислот 771 до 906. В некоторых вариантах осуществления белок gB включает аминокислоты 67-86 (нейтрализующий эпитоп AD2) и/или аминокислоты 532-635 (иммунодоминантный эпитоп AD1). Конкретные примеры фрагментов gB включают в себя «gB sol 692», содержащий первые 692 аминокислоты gB, и «gB sol 750», содержащий первые 750 аминокислот gB. Может присутствовать или отсутствовать сигнальная последовательность, аминокислоты 1-24, из gB sol 692 и gB sol 750, как желательно. Необязательно, белок gB может представлять собой фрагмент gB из 10 аминокислот или длиннее. Например, количество аминокислот в фрагменте может включать 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 525, 550, 575, 600, 625, 650, 675, 700, 725, 750, 775, 800, 825, 850 или 875 аминокислот. Фрагмент gB может начинаться на любом из остатков номер: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 435, 436, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 468, 469, 470, 471, 472, 473, 474, 475, 476, 477, 478, 479, 480, 481, 482, 483, 484, 485, 486, 487, 488, 489, 490, 491, 492, 493, 494, 495, 496, 497, 498, 499, 500, 501, 502, 503, 504, 505, 506, 507, 508, 509, 510, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 535, 536, 537, 538, 539, 540, 541, 542, 543, 544, 545, 546, 547, 548, 549, 550, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 566, 567, 568, 569, 570, 571, 572, 573, 574, 575, 576, 577, 578, 579, 580, 581, 582, 583, 584, 585, 586, 587, 588, 589, 590, 591, 592, 593, 594, 595, 596, 597, 598, 599, 600, 601, 602, 603, 604, 605, 606, 607, 608, 609, 610, 611, 612, 613, 614, 615, 616, 617, 618, 619, 620, 621, 622, 623, 624, 625, 626, 627, 628, 629, 630, 631, 632, 633, 634, 635, 636, 637, 638, 639, 640, 641, 642, 643, 644, 645, 646, 647, 648, 649, 650, 651, 652, 653, 654, 655, 656, 657, 658, 659, 660, 661, 662, 663, 664, 665, 666, 667, 668, 669, 670, 671, 672, 673, 674, 675, 676, 677, 678, 679, 680, 681, 682, 683, 684, 685, 686, 687, 688, 689, 690, 691, 692, 693, 694, 695, 696, 697, 698, 699, 700, 701, 702, 703, 704, 705, 706, 707, 708, 709, 710, 711, 712, 713, 714, 715, 716, 717, 718, 719, 720, 721, 722, 723, 724, 725, 726, 727, 728, 729, 730, 731, 732, 733, 734, 735, 736, 737, 738, 739, 740, 741, 742, 743, 744, 745, 746, 747, 748, 749, 750, 751, 752, 753, 754, 755, 756, 757, 758, 759, 760, 761, 762, 763, 764, 765, 766, 767, 768, 769, 770, 771, 772, 773, 774, 775, 776, 777, 778, 779, 780, 781, 782, 783, 784, 785, 786, 787, 788, 789, 790, 791, 792, 793, 794, 795, 796, 797, 798, 799, 800, 801, 802, 803, 804, 805, 806, 807, 808, 809, 810, 811, 812, 813, 814, 815, 816, 817, 818, 819, 820, 821, 822, 823, 824, 825, 826, 827, 828, 829, 830, 831, 832, 833, 834, 835, 836, 837, 838, 839, 840, 841, 842, 843, 844, 845, 846, 847, 848, 849, 850, 851, 852, 853, 854, 855, 856, 857, 858, 859, 860, 861, 862, 863, 864, 865, 866, 867, 868, 869, 870, 871, 872, 873, 874, 875, 876, 877, 878, 879, 880, 881, 882, 883, 884, 885, 886, 887, 888, 889, 890, 891, 892, 893, 894, 895, 896 или 897.
[149] Необязательно, фрагмент gB может продолжаться далее на N-конце на 5, 10, 20 или 30 аминокислот от начального остатка фрагмента. Необязательно, фрагмент gB может продолжаться далее на C-конце на 5, 10, 20 или 30 аминокислот от последнего остатка фрагмента.
Белки gH CMV
[150] В некоторых вариантах осуществления белок gH представляет собой полноразмерный белок gH (например, CMV gH FL, SEQ ID NO:___, который представляет собой белок из 743 аминокислот). gH обладает трансмембранным доменом и цитоплазматическим доменом, начиная от положения 716 до положения 743. Удаление аминокислот от 717 до 743 приводит к растворимому gH (например, CMV gH sol, SEQ ID NO:___). В некоторых вариантах осуществления белок gH может представлять собой фрагмент gH из 10 аминокислот или длиннее. Например, количество аминокислот в фрагменте может включать 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 525, 550, 575, 600, 625, 650, 675, 700 или 725 аминокислот. Необязательно, белок gH может представлять собой фрагмент gH из 10 аминокислот или длиннее. Например, количество аминокислот в фрагменте может включать 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 525, 550, 575, 600, 625, 650, 675, 700 или 725 аминокислот. Фрагмент gH может начинаться с любого из остатков номер: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 435, 436, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 468, 469, 470, 471, 472, 473, 474, 475, 476, 477, 478, 479, 480, 481, 482, 483, 484, 485, 486, 487, 488, 489, 490, 491, 492, 493, 494, 495, 496, 497, 498, 499, 500, 501, 502, 503, 504, 505, 506, 507, 508, 509, 510, 511, 512, 513, 514, 515, 516, 517, 518, 519, 520, 521, 522, 523, 524, 525, 526, 527, 528, 529, 530, 531, 532, 533, 534, 535, 536, 537, 538, 539, 540, 541, 542, 543, 544, 545, 546, 547, 548, 549, 550, 551, 552, 553, 554, 555, 556, 557, 558, 559, 560, 561, 562, 563, 564, 565, 566, 567, 568, 569, 570, 571, 572, 573, 574, 575, 576, 577, 578, 579, 580, 581, 582, 583, 584, 585, 586, 587, 588, 589, 590, 591, 592, 593, 594, 595, 596, 597, 598, 599, 600, 601, 602, 603, 604, 605, 606, 607, 608, 609, 610, 611, 612, 613, 614, 615, 616, 617, 618, 619, 620, 621, 622, 623, 624, 625, 626, 627, 628, 629, 630, 631, 632, 633, 634, 635, 636, 637, 638, 639, 640, 641, 642, 643, 644, 645, 646, 647, 648, 649, 650, 651, 652, 653, 654, 655, 656, 657, 658, 659, 660, 661, 662, 663, 664, 665, 666, 667, 668, 669, 670, 671, 672, 673, 674, 675, 676, 677, 678, 679, 680, 681, 682, 683, 684, 685, 686, 687, 688, 689, 690, 691, 692, 693, 694, 695, 696, 697, 698, 699, 700, 701, 702, 703, 704, 705, 706, 707, 708, 709, 710, 711, 712, 713, 714, 715, 716, 717, 718, 719, 720, 721, 722, 723, 724, 725, 726, 727, 728, 729, 730, 731 или 732.
[151] Остатки gH пронумерованы в соответствии с аминокислотной последовательностью полноразмерного gH (CMV gH FL), показанной на SEQ ID NO:___. Необязательно, фрагмент gH может продолжаться далее на N-конце на 5, 10, 20 или 30 аминокислот от начального остатка фрагмента. Необязательно, фрагмент gH может продолжаться далее на C-конце на 5, 10, 20 или 30 аминокислот от последнего остатка фрагмента.
Белки gL CMV
[152] В некоторых вариантах осуществления белок gL представляет собой полноразмерный белок gL (например, gL FL CMV, SEQ ID NO:___, который представляет собой белок из 278 аминокислот). В некоторых вариантах осуществления можно использовать фрагмент gL. Например, количество аминокислот в фрагменте может включать 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, 100, 125, 150, 175, 200, 225 или 250 аминокислот. Фрагмент gL может начинаться на любом из остатков номер: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267 или 268.
[153] Остатки gL пронумерованы в соответствии с аминокислотной последовательностью полноразмерного gL (gL FL CMV), показанной на SEQ ID NO:___. Необязательно, фрагмент gL может продолжаться далее на N-конце на 5, 10, 20 или 30 аминокислот от начального остатка фрагмента. Необязательно, фрагмент gL может продолжаться далее на C-конце на 5, 10, 20 или 30 аминокислот от последнего остатка фрагмента.
Белки gO CMV
[154] В некоторых вариантах осуществления белок gO представляет собой полноразмерный белок gO (например, gO FL CMV, SEQ ID NO:___, который представляет собой белок из 472 аминокислот). В некоторых вариантах осуществления белок gO может представлять собой фрагмент gO из 10 аминокислот или длиннее. Например, количество аминокислот в фрагменте может включать 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425 или 450 аминокислот. Фрагмент gO может начинаться на любом из остатков номер: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 435, 436, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461 или 462.
[155] Остатки gO пронумерованы в соответствии с аминокислотной последовательностью полноразмерного gO (CMV gO FL), показанной на SEQ ID NO:___. Необязательно, фрагмент gO может продолжаться далее на N-конце на 5, 10, 20 или 30 аминокислот от начального остатка фрагмента. Необязательно, фрагмент gO может продолжаться далее на C-конце на 5, 10, 20 или 30 аминокислот от последнего остатка фрагмента.
Белки gM CMV
[156] В некоторых вариантах осуществления белок gM представляет собой полноразмерный белок gM (например, gM FL CMV, SEQ ID NO:___, который представляет собой белок из 371 аминокислот). В некоторых вариантах осуществления белок gM может представлять собой фрагмент gM из 10 аминокислот или длиннее. Например, количество аминокислот в фрагменте может составлять 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325 или 350 аминокислот. Фрагмент gM может начинаться на любом из остатков номер: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360 или 361.
[157] Остатки gM пронумерованы в соответствии с аминокислотной последовательностью полноразмерного gM (CMV gM FL), показанной на SEQ ID NO:___. Необязательно, фрагмент gM может продолжаться далее на N-конце на 5, 10, 20 или 30 аминокислот от начального остатка фрагмента. Необязательно, фрагмент gM может продолжаться далее на C-конце на 5, 10, 20 или 30 аминокислот от последнего остатка фрагмента.
Белки gN CMV
[158] В некоторых вариантах осуществления белок gN представляет собой полноразмерный белок gN (например, gN FL CMV, SEQ ID NO:___, который представляет собой белок из 135 аминокислот). В некоторых вариантах осуществления белок gN может представлять собой фрагмент gN из 10 аминокислот или длиннее. Например, количество аминокислот в фрагменте может включать 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, 100 или 125 аминокислот. Фрагмент gN может начинаться на любом из остатков номер: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124 или 125.
[159] Остатки gN пронумерованы в соответствии с аминокислотной последовательностью полноразмерного gN (gN FL CMV), показанной на SEQ ID NO:___. Необязательно, фрагмент gN может продолжаться далее на N-конце на 5, 10, 20 или 30 аминокислот от начального остатка фрагмента. Необязательно, фрагмент gN может продолжаться далее на C-конце на 5, 10, 20 или 30 аминокислот от последнего остатка фрагмента.
Белки UL128 CMV
[160] В некоторых вариантах осуществления белок UL128 представляет собой полноразмерный белок UL128 (CMV UL128 FL, SEQ ID NO:___, например, который представляет собой белок из 171 аминокислот). В некоторых вариантах осуществления белок UL128 может представлять собой фрагмент UL128 из 10 аминокислот или длиннее. Например, количество аминокислот в фрагменте может составлять 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, 100, 125 или 150 аминокислот. Фрагмент UL128 может начинаться на любом из остатков номер: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160 или 161.
[161] Остатки UL128 пронумерованы в соответствии с аминокислотной последовательностью полноразмерного UL128 (CMV UL128 FL), показанной на SEQ ID NO:___. Необязательно, фрагмент UL128 может продолжаться далее на N-конце на 5, 10, 20 или 30 аминокислот от начального остатка фрагмента. Необязательно, фрагмент UL128 может продолжаться далее на C-конце на 5, 10, 20, или 30 аминокислот от последнего остатка фрагмента.
Белки UL130 CMV
[162] В некоторых вариантах осуществления белок UL130 представляет собой полноразмерный белок UL130 (например, UL130 FL CMV, SEQ ID NO:___, который представляет собой белок из 214 аминокислот). В некоторых вариантах осуществления белок UL130 может представлять собой фрагмент UL130 из 10 аминокислот или длиннее. Например, количество аминокислот в фрагменте может включать 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, 100, 125, 150, 175 или 200 аминокислот. Фрагмент UL130 может начинаться на любом из остатков номер: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203 или 204.
[163] Остатки UL130 пронумерованы в соответствии с аминокислотной последовательностью полноразмерного UL130 (UL130 FL CMV), показанной на SEQ ID NO:___. Необязательно, фрагмент UL130 может продолжаться далее на N-конце на 5, 10, 20 или 30 аминокислот от начального остатка фрагмента. Необязательно, фрагмент UL130 может продолжаться далее на C-конце на 5, 10, 20 или 30 аминокислот от последнего остатка фрагмента.
Белки UL131 CMV
[164] В некоторых вариантах осуществления белок UL131 представляет собой полноразмерный белок UL131 (например, UL131 CMV, SEQ ID NO:___, который представляет собой белок из 129 аминокислот). В некоторых вариантах осуществления белок UL131 может представлять собой фрагмент UL131 из 10 аминокислот или длиннее. Например, количество аминокислот в фрагменте может включать 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, 100, 125, 150, 175 или 200 аминокислот. Фрагмент UL131 может начинаться на любом из остатков номер: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119.
[165] Остатки UL131 пронумерованы в соответствии с аминокислотной последовательностью полноразмерного UL131 (UL131 FL CMV), показанной на SEQ ID NO:___. Необязательно, фрагмент UL131 может продолжаться далее на N-конце на 5, 10, 20 или 30 аминокислот от начального остатка фрагмента. Необязательно, фрагмент UL131 может продолжаться далее на C-конце на 5, 10, 20, или 30 аминокислот от последнего остатка фрагмента.
[166] Как указано выше, изобретение относится к молекулам рекомбинантной полицистронной нуклеиновой кислоты, содержащим первую последовательность, кодирующую первый белок вируса герпеса или его фрагмент, и вторую последовательность, кодирующую второй белок вируса герпеса или его фрагмент. Соответственно, вышеизложенное описание конкретных предпочтительных вариантов осуществления, таких как альфавирус VRP и самореплицирующиеся РНК, содержащие последовательности, кодирующие два или более белка CMV или их фрагменты, иллюстрируют изобретение, но не ограничивают объем изобретения. Следует понимать, что последовательности, кодирующие белки CMV, в таких предпочтительных вариантах осуществления можно заменять последовательностями, кодирующими такие белки, как gH и gL, или их фрагменты длиной 10 аминокислот или длиннее, из других вирусов герпеса, таких как HHV-1, HHV-2, HHV-3, HHV-4, HHV-6, HHV-7 и HHV-8. Например, пригодные белки VZV (HHV-3) включают в себя gB, gE, gH, gI и gL и их фрагменты длиной 10 аминокислот или длиннее и могут происходить из любого штамма VZV. Например, белки VZV или их фрагменты могут происходить из штаммов VZV pOka, Dumas, HJO, CA123 или DR. Эти иллюстративные белки VZV и их фрагменты могут быть кодированы любой пригодной нуклеотидной последовательностью, включая последовательности, которые являются оптимизированными или дезоптимизированными по кодонам для экспрессии в желаемом хозяине, таком как клетка человека. Иллюстративные последовательности белков VZV представлены в настоящем документе.
[167] Например, в одном варианте осуществления молекула полицистронной нуклеиновой кислоты содержит первую последовательность, кодирующую белок gH VZV или его фрагмент, и вторую последовательность, кодирующую белок gL VZV или его фрагмент.
[168] В некоторых вариантах осуществления каждая из последовательностей, кодирующих белок вируса герпеса или его фрагмент, которые присутствуют в молекуле полицистронной нуклеиновой кислоты, является функционально связанной с ее собственными контрольными элементами. Например, каждая из последовательностей, кодирующих белок вируса герпеса или его фрагмент, является функционально связанной с ее собственным субгеномным промотором. Таким образом, молекула полицистронной нуклеиновой кислоты, такая как репликон альфавируса, может содержать два, три, четыре или пять субгеномных промоторов, каждый из которых контролирует экспрессию белка вируса герпеса или его фрагмента. Когда этот тип молекулы полицистронной нуклеиновой кислоты представляет собой самореплицирующуюся РНК, такую как репликон альфавируса, она может являться упакованной в форме VRP, или ассоциированной или составленной с системой доставки РНК.
СПОСОБЫ И ПРИМЕНЕНИЯ
[169] В некоторых вариантах осуществления самореплицирующиеся молекулы РНК или VRP вводят индивидууму для стимуляции иммунного ответа. В таких вариантах осуществления самореплицирующиеся молекулы РНК или VRP, как правило, присутствуют в композиции, которая может содержать фармацевтически приемлемый носитель и, необязательно, адъювант. См., например, U.S. 6299884; U.S. 7641911; U.S. 7306805 и US 2007/0207090.
[170] Иммунный ответ может включать в себя гуморальный иммунный ответ, опосредованный клетками иммунный ответ, или оба. В некоторых вариантах осуществления иммунный ответ индуцируют против каждого доставленного белка CMV. Опосредованный клетками иммунный ответ может включать в себя ответ T-клеток-помощников (Th), ответ CD8+ цитотоксических T-клеток (CTL), или оба. В некоторых вариантах осуществления иммунный ответ включает в себя гуморальный иммунный ответ, и антитела представляют собой нейтрализующие антитела. Нейтрализующие антитела блокируют вирусную инфекцию клеток. CMV инфицирует эпителиальные клетки, а также клетки фибробласты. В некоторых вариантах осуществления иммунный ответ снижает или предотвращает инфекцию обоих типов клеток. Ответы нейтрализующих антител могут являться зависимыми от комплемента или независимыми от комплемента. В некоторых вариантах осуществления ответ нейтрализующих антител является независимым от комплемента. В некоторых вариантах осуществления ответ нейтрализующих антител является перекрестно нейтрализующим; т.е. антитело, полученное против введенной композиции, нейтрализует вирус CMV штамма, отличного от штамма, использованного в композиции.
[171] Пригодным в данной области измерением активности антитела является «титр 50% нейтрализации». Для определения титра 50% нейтрализации сыворотку от иммунизированных животных разводят, чтобы оценить, насколько разведенной может быть сыворотка, чтобы еще сохранять способность блокировать проникновение 50% вирусов в клетки. Например, титр 700 означает, что сыворотка сохраняет способность нейтрализовать 50% вируса после разведения в 700 раз. Таким образом, более высокие титры обозначают более сильный ответ нейтрализующих антител. В некоторых вариантах осуществления этот титр лежит в диапазоне, обладающем нижним пределом приблизительно 200, приблизительно 400, приблизительно 600, приблизительно 800, приблизительно 1000, приблизительно 1500, приблизительно 2000, приблизительно 2500, приблизительно 3000, приблизительно 3500, приблизительно 4000, приблизительно 4500, приблизительно 5000, приблизительно 5500, приблизительно 6000, приблизительно 6500 или приблизительно 7000. Диапазон титра 50% нейтрализации может обладать верхним пределом приблизительно 400, приблизительно 600, приблизительно 800, приблизительно 1000, приблизительно 1500, приблизительно 2000, приблизительно 2500, приблизительно 3000, приблизительно 3500, приблизительно 4000, приблизительно 4500, приблизительно 5000, приблизительно 5500, приблизительно 6000, приблизительно 6500, приблизительно 7000, приблизительно 8000, приблизительно 9000, приблизительно 10000, приблизительно 11000, приблизительно 12000, приблизительно 13000, приблизительно 14000, приблизительно 15000, приблизительно 16000, приблизительно 17000, приблизительно 18000, приблизительно 19000, приблизительно 20000, приблизительно 21000, приблизительно 22000, приблизительно 23000, приблизительно 24000, приблизительно 25000, приблизительно 26000, приблизительно 27000, приблизительно 28000, приблизительно 29000 или приблизительно 30000. Например, титр 50% нейтрализации может составлять от приблизительно 3000 до приблизительно 6500. «Приблизительно» означает плюс или минус 10% от указанного значения. Титр нейтрализации можно измерять, как описано в конкретных примерах ниже.
[172] Иммунный ответ можно стимулировать посредством введения VRP или самореплицирующейся РНК индивидууму, как правило, млекопитающему, включая человека. В некоторых вариантах осуществления индуцированный иммунный ответ является защитным иммунным ответом, т.е. ответ снижает риск или тяжесть инфекции CMV. Стимуляция защитного иммунного ответа является особенно желательной в некоторых популяциях, особенно подверженных риску инфекции CMV и заболевания. Например, подверженные риску популяции включают в себя пациентов с трансплантатами паренхиматозных органов (SOT), пациентов с трансплантатами костного мозга и пациентов с трансплантатами гематопоэтических стволовых клеток (HSCT). VRP можно вводить донору трансплантата до трансплантации или реципиенту трансплантата до и/или после трансплантации. Поскольку вертикальная передача от матери к ребенку является основным источником инфекции грудных детей, введение VRP или самореплицирующейся РНК женщине, которая может забеременеть, является особенно пригодным.
[173] Можно использовать любой подходящий способ введения. Например, композицию можно вводить внутримышечно, внутрибрюшинно, подкожно или чрескожно. В некоторых вариантах осуществления ее можно вводить способом введения через слизистые оболочки, например, в ротовую полость, интраназально, интравагинально и в прямую кишку. Композиции можно вводить в соответствии с любым подходящим расписанием.
[174] Полное содержание всех патентов, патентных заявок и процитированных в этом описании ссылок, включая нуклеотидные и аминокислотные последовательности, приведенные в качестве ссылки по номеру доступа, приведено в настоящем описании. Приведенное выше описание представляет собой описание в общей форме. Более полное понимание можно получить со ссылкой на следующие конкретные примеры, которые представлены только с целью иллюстрации.
ПРИМЕР 1
Доставка индивидуальных антигенов CMV с использованием платформы VRP
[175] Каждый из гликопротеинов gB и gH CMV индуцирует нейтрализующие ответы, и gB является доминантным антигеном среди антител в сыворотке человека, нейтрализующих инфекцию фибробластов (Britt et al. (1990) J. Virol. 64(3): 1079-85). Следующие эксперименты показывают у мышей нейтрализующий ответ против этих антигенов, доставленных с использованием платформы VRP.
[176] Каждый из антигенов CMV клонировали в вектор pcDNA-6His (Invitrogen) и тестировали по экспрессии белка перед клонированием в вектор с репликоном альфавируса, pVCR 2.1 SalI/XbaI, происходящий из плазмиды, описанной Perri et al. (J. Virol 77(19)10394-10403 (2003)), получая конструкции, показанные на фигуре 2. pVCR 2.1 SalI/XbaI представляет собой самореплицирующийся РНК-вектор, который, при электропорации с дефектным капсидом помощника и РНК гликопротеина, формирует инфекционную частицу альфавируса.
[177] Векторы pVCR использовали для получения РНК, которую вводили электропорацией в клетки почки детеныша хомяка (BHKV) в присутствии дефектного капсида помощника и РНК гликопротеинов, полученную из вируса венесуэльского энцефалита лошадей (VEE). После электропорации супернатант, содержащий секретированные частицы альфавирусного вектора (VRP) собирали, очищали, титровали и использовали для исследований иммунизации мышей. Мышей иммунизировали 1×106 инфекционных единиц (ИЕ)/мышь в серии из двух иммунизаций, с интервалами три недели. Последний забор крови проводили через три недели после второй иммунизации.
Моноцистронные VRP gB, gH и gL
[178] Сконструированы два различных варианта растворимого gB: в «gB sol 750» отсутствует трансмембранный домен и цитоплазматический домен; и в «gB sol 692» также отсутствует гидрофобная область (фиг. 2A), и он является сходным с конструкцией Reap et al. Сконструирован также растворимый gH с отсутствующим трансмембранным доменом и цитоплазматическим доменом («gH sol 716») (фиг. 2C). Сыворотку от иммунизированных мышей скринировали в нескольких анализах. Иммуноблотинг (данные не представлены) и иммунофлуоресцентные анализы использовали для подтверждения специфических ответов антител на антигены. Анализы нейтрализации использовали, чтобы показать, что вызванные ответы антител являлись способными нейтрализовать инфекцию CMV.
[179] Сыворотку от иммунизированных мышей исследовали посредством иммунофлуоресценции по узнаванию gB в клетках 293T, трансфицированных конструкциями, экспрессирующими gB-6His. Клетки исследовали с использованием в качестве зондов антител против His («анти-6His»), моноклонального антитела против gB («анти-gB 27-156»), или собранных слитых вместе сывороток мышей. Преиммунная сыворотка являлась отрицательной во всех случаях. В клетках, трансфицированных конструкциями, экспрессирующими gB FL-6His, фиксированных и пермеабилизированных, окрашивание анти-6His выявило профиль экспрессии с поверхностной экспрессией с точечной цитоплазматической экспрессией, наиболее вероятно, соответствующий эндоцитозному/экзоцитозному пути миграции. Как для анти-gB 27-156, так и для слитых вместе мышиных сывороток, показан сходный профиль экспрессии. Для сывороток от мышей, иммунизированных каждой из VRP gB FL, VRP gB sol 750 и VRP gB sol 692, показан одинаковый профиль экспрессии.
[180] Мыши, иммунизированные VRP gH FL и VRP gH sol 716, продуцировали антитела, специфические для gH. Иммунофлуоресцентный анализ клеток 293T, трансфицированных конструкциями, экспрессирующими gH FL-6His, детектировал сильное узнавание gH анти-6His, анти-gH и слитыми вместе мышиными сыворотками. Для сывороток, собранных от мышей, иммунизированных VRP gL, получали специфический ответ антител, как определяли анализом иммуноблотинга и иммунофлуоресценции. VRP gL не могли вызывать нейтрализующий ответ.
[181] Сыворотку от мышей, иммунизированных VRP gB или VRP gH, анализировали по присутствию нейтрализующих антител с использованием анализа нейтрализации CMV. Сыворотку в различных разведениях преинкубировали с вирусом CMV TB40UL32EGFP («TB40-GFP», клиническим изолятом, модифицированным для экспрессии GFP, и затем добавляли к эпителиальным клеткам ARPE-19 и инкубировали в течение 5 суток. Через 5 суток после инфекции GFP-положительные клетки подсчитывали. В этом анализе клетки, инкубированные с сывороткой, содержащей нейтрализующие антитела, имели меньше GFP-положительных клеток по сравнению с клетками, инкубированными с одним вирусом или с вирусом, инкубированными с преиммунной сывороткой. Сыворотки от мышей, иммунизированных VRP gB, VRP gB FL, VRP gB sol 750 или VRP gB sol 692, обладали сильной нейтрализующей активностью в присутствии комплемента морской свинки (титр 50% нейтрализации при разведении сыворотки 1:1280-1:2560; фиг. 3). Сыворотки от мышей, иммунизированных VRP gH FL или VRP gH sol, обладали некоторой нейтрализующей активностью, которая являлась независимой от комплемента морской свинки (фиг. 3).
ПРИМЕР 2
Конструирование полицистронных альфавирусных векторов
[182] CMV образует несколько мультибелковых комплексов в ходе инфекции. Чтобы определить, можно ли использовать один репликон, экспрессирующий все компоненты желаемого комплекса, для получения комплекса CMV у субъекта, или возможна ли совместная доставка компонентов комплекса из множества репликонов векторов, авторы настоящего изобретения разработали платформу, позволяющую контролируемую экспрессию множества белков CMV.
[183] Альфавирусный вектор (pVCR 2.1 SalI/XbaI) модифицировали, чтобы позволять сборку множества субгеномных промоторов (SGP) и представляющих интерес генов (GOI). Участок ApaI pVCR 2.1 SalI/XbaI на 11026-31 п.о. заменили с GGGCCC (SEQ ID NO:_) на GGCGCC (SEQ ID NO:_). Участки рестрикции ClaI и PmlI добавили в области непосредственно ниже первого субгеномного промотора и участков для вставки SalI-XbaI. Последовательность на 7727-7754 п.о. заменили с ctcgatgtacttccgaggaactgatgtg (SEQ ID NO:___) на ATCGATGTACTTCCGAGGAACTCACGTG (SEQ ID NO:___).
[184] Разработали челночную векторную систему, чтобы позволять вставку GOI непосредственно ниже SGP с использованием участков SalI-XbaI. pcDNA 3.1(-)C модифицировали следующим образом. Три участка SalI делетировали: положения 1046-1051 п.о., 3332-3337 п.о. и 5519-21, 1-3 п.о. от GTCGAC (SEQ ID NO:_) до GTCTAC (SEQ ID NO:_). pcDNA 3.1(-)C модифицировали для мутации участка XbaI в положении 916-921 п.о. с TCTAGA (SEQ ID NO:_) на TCAAGA (SEQ ID NO:_). pcDNA 3.1(-)C модифицировали для добавления участка ClaI и участка SacII в положениях 942-947 (ClaI) и 950-955 (SacII) п.о. с ctggatatctgcag (SEQ ID NO:___) на ATCGATATCCGCGG (SEQ ID NO:___).
[185] После добавления участков рестрикции и верификации результирующей последовательности, область от п.о. 7611-7689 (ctataactctctacggctaacctgaatggactacgacatagtctagtcgaccaagcctctagacggcgcgcccaccca) (SEQ ID NO:___) амплифицировали из модифицированного альфавирусного вектора pVCR 2.1 с использованием следующих праймеров
[186] Прямой SGP S-X Not F:
5'ATAAGAATGCGGCCGCCTATAACTCTCTACGGCTAACC3' (SEQ ID NO:___)
Обратный SGP S-X Cla R: 5'CCATCGATTGGGTGGGCGCGCCGTCTAG3' (SEQ ID NO:___) или
Прямой SGP S-X Cla F: 5'CCATCGATCTATAACTCTCTACGGCTAACC3' (SEQ ID NO:___) и
Обратный SGP S-X Sac R: 5'TCCCCGCGGTGGGTGGGCGCGCCGTCTAG3' (S SEQ ID NO:___).
[187] Амплифицированные области добавляли в модифицированный вектор pcDNA 3.1(-)C для получения челночных векторов (pcDNA SV) между соответствующими участками (NotI-ClaI или ClaI-SacII). Вставка NotI-SGP Sal-Xba-ClaI образует pcDNA SV кассета 2, вставка ClaI-SGP Sal-Xba-SacII образует pcDNA SV кассета 3. Эти кассеты SV секвенировали. pcDNA SV кассета 2 содержит дополнительные 12 п.о. между участком XbaI и участком ClaI (CCACTGTGATCG) (SEQ ID NO:___), поскольку участок ClaI не разрезали в векторе pcDNA SV кассета 2. Таким образом добавляли участок PmlI. В случае pcDNA SV кассеты 2, участок PmlI вставляли на п.о. 1012 (CACGTG) (SEQ ID NO:_). В случае кассеты 3, участок PmlI, добавленный на п.о. 935-940 (ACTGTG (SEQ ID NO:_) заменяли на CACGTG (SEQ ID NO:___).
[188] Для каждого полицистронного вектора первый ген вставляли непосредственно в модифицированный вектор pVCR 2.1 с использованием участков SalI-XbaI. Второй ген лигировали в pcDNA SV кассету 2 с использованием SalI-XbaI и вырезали с использованием NotI-PmlI, NotI-SacII или амплифицировали с помощью ПЦР с использованием праймеров для NotI-ClaI и расщепляли с использованием NotI и ClaI. Полученную вставку SGP-SalI-GOI-Xba лигировали в модифицированный вектор pVCR 2.1 с использованием участков NotI-PmlI, NotI-SacII или NotI-ClaI. Вставку NotI-ClaI использовали, только когда желаемый ген в конструкции содержал участок PmlI.
[189] В некоторых случаях третий ген лигировали в pcDNA SV кассета 3 с использованием SalI-XbaI и вырезали с использованием PmlI-SacII или амплифицировали с помощью ПЦР с использованием праймеров для ClaI-SacII и расщепляли с использованием ClaI и SacII. Полученную вставку SGP-SalI-GOI-XbaI лигировали в модифицированный pVCR 2.1 с использованием PmlI-SacII или ClaI-SacII.
[190] Расщепление SalI-XbaI использовали для подтверждения конструкции ДНК полицистронного вектора. После расщепления с помощью SalI-XbaI проводили электрофорез в агарозном геле для подтверждения присутствия GOI. Затем ДНК полицистронного вектора линеаризовали с помощью PmeI в течение ночи, очищали с использованием набора для очистки продуктов ПЦР Qiagen, и использовали в качестве матрицы для получения РНК с использованием набора Ambion mMessage mMachine. Качество РНК проверяли посредством разделения аликвоты образца в агарозном геле для РНК.
Экспрессия с полицистронного вектора
[191] Флуоресцентные белки GFP (зеленый флуоресцентный белок) и mCherry (красный флуоресцентный белок) использовали в качестве GOI для оценки способности полицистронного вектора экспрессировать два белка. Авторы настоящего изобретения получили бицистронный вектор, в котором GFP можно экспрессировать с использованием первого субгеномного промотора, и mCherry можно экспрессировать со второго субгеномного промотора (фиг. 4A). Полинуклеотиды, содержащие кодирующие последовательности для этих белков, вставляли с использованием участков SalI-XbaI. Первый полинуклеотид (GFP) вставляли непосредственно в модифицированный вектор с репликоном альфавируса. Второй полинуклеотид (mCherry) вставляли сначала в челночный вектор, содержащий субгеномный промотор непосредственно выше кодирующей последовательности. Фрагмент, содержащий как второй субгеномный промотор, так и второй полинуклеотид, выделяли и лигировали в модифицированный вектор с репликоном альфавируса, содержащий первый полинуклеотид, получая репликон альфавируса с множеством субгеномных промоторов.
[192] VRP получали в клетках BHKV посредством электропорации репликонов РНК с РНК дефектных помощников для Cap и Gly. VRP собирали через 24 часа после электропорации и использовали для инфекции клеток BHKV с множественностью инфекции (MOI) 20 инфекционных единиц (ИЕ) на клетку.
[193] В эксперименте тестировали четыре набора VRP: одну VRP, экспрессирующую только GFP; одну VRP, экспрессирующую mCherry; одну VRP, экспрессирующую только GFP, и одну VRP, экспрессирующую только mCherry, обе при MOI 20 ИЕ/клетку; и одну VRP, содержащую бицистронный вектор GFP(1)-SGPmCherry(2). Инфицированные VRP клетки BHKV исследовали через 24 часа после инфекции для определения процента совместной локализации. Почти все клетки являлись положительными по GFP или mCherry при отдельной детекции. Клетки, инфицированные двумя отдельными VRP, выглядели зелеными или красными. Очень немногие клетки были желтыми, что указывает на то, что немногие клетки экспрессировали GFP и mCherry на равных уровнях и что присутствовал низкий уровень совместной инфекции. Эти данные подтверждали с использованием анализа FACS (фиг. 4B).
[194] В отличие от этого, клетки, инфицированные альфавирусом, содержащим бицистронный вектор GFP(l)- SGPmCherry(2), все являлись желтыми, что указывает на приблизительно равную экспрессию GFP и mCherry. Это исследование показывает, что множество белков можно успешно экспрессировать с одного вектора с полицистронным репликоном альфавируса.
ПРИМЕР 3
Получение комплексов CMV
[195] Этот пример показывает, что комплекс белков CMV можно формировать в клетке после доставки компонентов комплекса в векторе с полицистронным репликоном альфавируса.
Комплексы gH/gL и gH/gL/gO
[196] Полицистронные репликоны альфавируса gH/gL и gH/gL/gO конструировали, как описано выше (схематически показано на фиг. 5A). VRP, содержащие репликоны, кодирующие gH, gL, gO, gH/gL и gH/gL/gO, получали в клетках BHKV, как описано выше, и использовали для инфекции клеток BHKV, чтобы показать формирование комплекса in vitro. Инфицированные VRP клетки ARPE-19 продуцировали комплексы gH/gL с дисульфидными связями. gO не изменял ассоциацию gH/gL до поддающейся детекции степени (фиг. 5B).
[197] Исследования иммунофлуоресценции проводили для оценки локализации gH и gL, доставляемых по отдельности, и при доставке с использованием полицистронного альфавируса для наблюдения за релокализацией белков при совместной экспрессии. Локализация gH, по-видимому, не изменялась в присутствии или в отсутствие gL, или gL/gO. Локализация gL изменялась в присутствии gH и gH/gO.
[198] Наконец, ассоциацию gH/gL проверяли иммунопреципитацией. Коммерческое антитело против gH (Genway) использовали для исследования ассоциации gH и gL. Во всех случаях антитело против gH эффективно иммунопреципитировало gH (фиг. 5C). Когда gH не присутствовал, gL не являлся иммунопреципитированным. Когда gL экспрессировали в присутствии gH или gH/gO, существовала ассоциация gL с gH (фиг. 5C).
[199] Релокализация gL в присутствии gH и ассоциация gH/gL (с или без gO) указывает на то, что все компоненты полицистронных репликонов альфавируса были экспрессированы и ассоциированы с формированием комплекса.
ПРИМЕР 4
VRP, которые приводят к формированию комплекса gH/gL in vitro, индуцируют сильный иммунный ответ на CMV, который качественно и количественно превосходит иммунный ответ, вызванный на VRP gB.
[200] Этот пример показывает индукцию сильных иммунных ответов на комплексы, сформированные посредством доставки полицистронных VRP gH/gL или VRP gH/gL/gO, по сравнению с иммунными ответами, полученными с использованием доставки VRP с отдельными компонентами или VRP с отдельными компонентами, введенными в комбинации, или с ответами, вызванными VRP gB.
[201] Мышей инфицировали трижды VRP, вводимыми с интервалами 3 недели (106 ИЕ на мышь; 5 мышей BalbC/группу). Сыворотки, собранные после иммунизаций одиночными и полицистронными VRP, скринировали на нейтрализующие антитела с использованием анализа нейтрализации CMV, как описано выше. Титр нейтрализации измеряли следующим образом. Различные разведения сыворотки преинкубировали с TB40-UL32-EGFP в присутствии или в отсутствие комплемента морской свинки и затем добавляли к эпителиальным клеткам ARPE-19 или клеткам фибробластам MRC-5 и инкубировали в течение 5 суток. После 5 суток инфекции вирусом, GFP-положительные клетки подсчитывали. Результаты для клеток ARPE-19 показаны на фиг. 6A, фиг. 6B и фиг. 6C. Результаты для клеток MRC-5 показаны на фиг. 7A и фиг. 7B.
[202] Сыворотки от мышей, иммунизированных VRP gH FL, обладали низкой независимой от комплемента нейтрализующей активностью (фиг. 6A и фиг. 6B). Не обнаружено нейтрализующей активности с использованием сывороток от мышей, иммунизированных только gL или gO в присутствии или в отсутствие комплемента морской свинки. (фиг. 6C) Для слитых вместе сывороток от иммунизации несколькими белками CMV gB (gB FL, gB sol 750 и gB sol 692) показана сильная нейтрализующая активность в присутствии комплемента морской свинки, с титром 50% нейтрализации при разведении сывороток 1:1280. Однако не присутствовало нейтрализующей активности в отсутствие комплемента морской свинки в клетках ARPE-19 для слитых вместе сывороток против gB. VRP, экспрессирующие отдельные белки CMV (gH- или gL-VRP или совместно введенные gH-, gL- и gO-VRP при 106 ИЕ/мышь/VRP) не усиливали нейтрализующую активность выше активности одного gH.
[203] В отличие от этого, сыворотки от мышей, иммунизированных бицистронными VRP gH/gL или трицистронными VRP gH/gL/gO (1×106 ИЕ/мышь), показали сильные нейтрализующие ответы. Более того, ответы являлись сходными в присутствии и в отсутствие комплемента морской свинки, показывая, что полицистронные VRP успешно индуцировали независимый от комплемента иммунный ответ (фиг. 6C). Титр 50% нейтрализации составлял 1:3500-6400+ разведение сывороток в клетках ARPE-19 с вирусом CMV TB40-GFP. Этот титр представлял собой титр, приблизительно в 3-4 раза превышающий титр 50% зависимой от комплемента нейтрализации для слитых вместе сывороток против gB.
[204] Результаты в клетках фибробластах MRC-5 являлись сходными с результатами в клетках ARPE-19 (фиг. 7A и 7B). Сыворотки от мышей, иммунизированных бицистронными VRP gH/gL или трицистронными VRP gH/gL/gO, показали сильную нейтрализующую активность по сравнению с сыворотками от мышей, иммунизированных VRP, кодирующими только gH, только gL или только gO, и с сыворотками от мышей, иммунизированных посредством совместного введения VRP gH и VRP gL, или совместного введения VRP gH, VRP gL и VRP gO. Эти результаты показывают, что введение полицистронных VRP индуцировало иммунный ответ, обеспечивающий хорошую независимую от комплемента нейтрализацию инфекции CMV клеток фибробластов. Для оценки широты и силы иммунных сывороток gH/gL против различных штаммов CMV, авторы настоящего изобретения сравнивали способность сывороток блокировать инфекцию фибробластов и эпителиальных клеток для шести различных штаммов CMV. На фигуре 8 показано, что сыворотки против gH/gL сильно нейтрализуют инфекцию обоих типов клеток широким диапазоном штаммов.
[205] Эти данные показывают также сильную нейтрализующую активность для сывороток от мышей, иммунизированных полицистронными VRP, но не смешанными пулами VRP, экспрессирующими только один белок. Это показывает, что полицистронные репликоны, кодирующие компоненты белкового комплекса на одном репликоне, приводят к эффективной продукции комплекса in situ. Более того, поскольку белки штамма Merlin CMV использовали для стимуляции этих ответов, данные in vitro, полученные с использованием штамма TB40 вируса CMV, показывают, что нейтрализующие антитела, индуцированные посредством доставки полицистронных VRP, представляют собой перекрестно нейтрализующие антитела.
ПРИМЕР 5
Синтез РНК
[206] Плазмидная ДНК, кодирующая репликоны альфавируса (см. фиг. 14-16), служили матрицами для синтеза РНК in vitro. Репликоны альфавируса содержали генетические элементы, необходимые для репликации РНК, но в них отсутствовали генетические элементы, кодирующие продукты генов, необходимые для сборки частиц; структурные гены генома альфавируса заменены последовательностями, кодирующими гетерологичный белок. После доставки репликонов в эукариотические клетки, положительная цепь РНК транслируется с образованием четырех неструктурных белков, которые вместе реплицируют геномную РНК и транскрибируют многочисленные субгеномные мРНК, кодирующие продукт гетерологичного гена или представляющего интерес гена (GOI). Из-за отсутствия экспрессии структурных белков альфавируса, репликоны являются неспособными индуцировать образование инфекционных частиц. Промотор бактериофага (T7 или SP6) выше кДНК альфавируса облегчает синтез репликона РНК in vitro, и рибозим вируса гепатита дельта (HDV) непосредственно ниже поли(A)-хвоста образует правильный 3'-конец посредством его саморасщепляющей активности.
[207] Чтобы позволять формирование антигенного белкового комплекса, экспрессия отдельных компонентов указанного комплекса в одной и той же клетке обладает первостепенной важностью. Теоретически этого можно достигать совместной трансфекцией клеток генами, кодирующими отдельные компоненты. Однако в случае невирусной доставки или доставки в VRP РНК репликона альфавируса, этот способ затруднен неэффективной совместной доставкой множества РНК в одну и ту же клетку или, альтернативно, неэффективным запуском множества самореплицирующихся РНК в одной клетке. Потенциально более эффективным способом облегчения совместной экспрессии компонентов белкового комплекса является доставка соответствующих генов в форме части одной и той же самореплицирующейся молекулы РНК. С этой целью авторы настоящего изобретения разработали конструкции репликонов альфавируса, кодирующих множество интересующих генов. Каждому GOI предшествует его собственный субгеномный промотор, узнаваемый транскрипционным аппаратом альфавируса. Таким образом, множество видов субгеномных матричных РНК синтезируют в одной клетке, позволяя сборку многокомпонентных белковых комплексов.
[208] После линеаризации плазмидной ДНК ниже HDV рибозима подходящей рестрикционной эндонуклеазой, транскрипты обрезанной ДНК синтезировали in vitro с использованием происходящей из бактериофага T7 ДНК-зависимой РНК-полимеразы. Транскрипции проводили в течение 2 часов при 37°C в присутствии 7,5 мМ каждого из нуклеозидтрифосфатов (ATP, CTP, GTP и UTP), следуя инструкциям, предоставленным производителем (Ambion, Austin, TX). После транскрипции ДНК-матрицу расщепляли ДНКазой TURBO (Ambion, Austin, TX). РНК репликона преципитировали LiCl и разводили в свободной от нуклеазы воде. Некэпированную РНК кэпировали после транскрипции с помощью кэпирующего фермента осповакцины (VCE) с использованием кэпирующей системы ScriptCap m7G (Epicentre Biotechnologies, Madison, WI), как указано в инструкции пользователя. Кэпированную после транскрипции РНК преципитировали LiCl и разводили в свободной от нуклеазы воде. Концентрацию образцов РНК определяли измерением оптической плотности при 260 нм. Целостность in vitro транскриптов подтверждали электрофорезом в денатурирующем агарозном геле.
Составление липидных наночастиц (LNP)
[209] 1,2-дилинолеилокси-N,N-диметил-3-аминопропан (DlinDMA) синтезировали с использованием ранее опубликованного способа [Heyes, J., Palmer, L., Bremner, K., MacLachlan, I. Cationic lipid saturation influences intracellular delivery of encapsulated nucleic acids. Journal of Controlled Release, 107: 276-287 (2005)]. 1,2-диастеароил-sn-глицеро-3-фосфохолин (DSPC) закупали из Genzyme. Холестерин получали от Sigma-Aldrich (St. Lois, MO). 1,2-димиристоил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-2000] (соль аммония) (PEG DMG 2000) получали из Avanti Polar Lipids.
[210] LNP (RV01(14)) составляли с использованием следующего способа. Партия 150 мкг (полые волокна PES и no mustang): получали свежие исходные растворы липидов в этаноле. 37 мг DlinDMA, 11,8 мг DSPC, 27,8 мг холестерина и 8,07 мг PEG DMG 2000 взвешивали и растворяли в 7,55 мл этанола. Свежеприготовленный исходный раствор липидов осторожно вращали при 37°C в течение приблизительно 15 мин для формирования гомогенной смеси. Затем 453 мкл исходного раствора добавляли к 1,547 мл этанола для получения 2 мл рабочего раствора липидов. Это количество липидов использовали для формирования LNP с 150 мкг РНК с соотношением 8:1 N:P (азот к фосфату). Подверженный протонированию азот на DlinDMA (катионный липид) и фосфаты на РНК использовали для этого расчета. Принимали, что каждый мкг самореплицирующейся молекулы РНК содержит 3 нмоль анионного фосфата, принимали, что каждый мкг DlinDMA содержит 1,6 нмоль катионного азота. Получали также 2 мл рабочего раствора РНК из исходного раствора ~ 1 мкг/мкл, в 100 мМ цитратном буфере (pH 6) (Teknova). Три 20 мл стеклянных флакона (с якорями магнитной мешалки) ополаскивали раствором RNase Away (Molecular BioProducts) и промывали большим количеством воды MilliQ перед использованием для удаления загрязнения флаконов РНКазами. Один из флаконов использовали для рабочего раствора РНК, а другие для сбора липидов и смесей РНК (как описано далее). Рабочие растворы липидов и РНК нагревали при 37°C в течение 10 мин перед загрузкой в 3 см3 шприцы с замком Люера (BD Medical). 2 мл цитратного буфера (pH 6) загружали в другой 3 см3 шприц. Шприцы, содержащие РНК и липиды, соединяли с T-образной мешалкой (PEEK™ соединение с ID 500 мкм) с использованием трубок из FEP ([фторированный этилен-пропилен] 2 мм ID × 3 мм OD, Idex Health Science, Oak Harbor, WA). Выход из T-образной мешалки также представлял собой трубки из FEP (2 мм ID × 3 мм). Третий шприц, содержащий цитратный буфер, соединяли с отдельным участком трубки (2 мм ID × 3 мм OD). Затем все шприцы приводили к скорости потока 7 мл/мин с использованием шприцевого насоса (от kdScientific, модель no. KDS-220). Выходы трубок располагали для сбора смесей в 20 мл стеклянный флакон (при перемешивании). Якорь магнитной мешалки вынимали и этанольному/водному раствору позволяли уравновешиваться до комнатной температуры в течение 1 час. Затем смесь загружали в 5 см3 шприц (BD Medical), оборудованный участком трубки из FEP (2 мм ID × 3 мм OD), и в другой 5 см3 шприц с равной длиной трубки из FEP, загружали равный объем 100 мМ цитратного буфера (pH 6). Два шприца приводили к скорости потока 7 мл/мин с использованием шприцевого насоса, и конечную смесь собирали в 20 мл стеклянный флакон (при перемешивании). Затем LNP концентрировали до 2 мл и диализовали против 10-15 объемов 1X PBS (от Teknova) с использованием системы проточной фильтрации вдоль потока (TFF) перед выделением конечного продукта. Систему TFF и фильтрационные мембраны из полых волокон закупали от Spectrum Labs и использовали в соответствии с руководством производителя. Использовали фильтрационные мембраны из полых волокон полиэфирсульфона (PES) (номер изделия P-C1-100E-100-01N) с отсекающим размером пор 100 кДа и площадью поверхности 20 см2. Для экспериментов in vitro и in vivo составы разводили до необходимой концентрации РНК 1X PBS (от Teknova).
Размер частиц
[211] Размер частиц измеряли с использованием Zetasizer Nano ZS (Malvern Instruments, Worcestershire, UK) в соответствии с инструкциями производителя. Размеры частиц указаны как Z среднее с индексом полидисперсности (pdi). Липосомы разводили в 1X PBS перед измерением.
Эффективность инкапсуляции и концентрация РНК
[212] Процент инкапсулированной РНК и концентрацию РНК определяли посредством набора реагентов Quant-iT RiboGreen RNA (Invitrogen). При анализе следовали инструкциям производителя. Стандарт рибосомальной РНК, представленный в наборе, использовали для получения стандартной кривой. LNP, полученные способом 1 или способами 2-5, разводили в десять раз или в сто раз, соответственно, в 1X TE буфере (из набора), перед добавлением красителя. Отдельно, LNP разводили в десять или в 100 раз в 1X TE буфере, содержащем 0,5% Тритон X (Sigma-Aldrich), перед добавлением красителя. Затем равное количество красителя добавляли к каждому раствору и затем ~180 мкл каждого раствора после добавления красителя наносили в двух повторах в 96-луночный культуральный планшет (полученный из VWR, каталожный # 353072). Флуоресценцию (Ex 485 нм, Em 528 нм) считывали в считывателе для микропланшетов (от BioTek Instruments, Inc.).
[213] Тритон X использовали для разрушения LNP, обеспечивая считывание флуоресценции, соответствующей общему количеству РНК, и образец без Тритона Х обеспечивал флуоресценцию, соответствующую неинкапсулированной РНК. % инкапсуляции РНК определяли следующим образом: (%) инкапсуляции РНК в LNP = [(Ft-Fi)/Ft]×100, где Ft представляет собой интенсивность флуоресценции LNP с добавлением Тритона X, и Fi представляет собой интенсивность флуоресценции раствора LNP без добавления детергента. Эти значения (Ft и Fi) получали после вычитания нулевой интенсивности флуоресценции (1X TE буфера). Концентрацию инкапсулированной РНК получали посредством сравнения Ft-Fi с полученной стандартной кривой. Все составы LNP дозировали in vivo на основании инкапсулированной дозы.
Частицы репликона вируса (VRP)
[214] Для сравнения РНК-вакцин с традиционными способами РНК-векторов для достижения экспрессии in vivo репортерных генов или антигенов, авторы настоящего изобретения использовали частицы репликона вируса (VRP), полученные в клетках BHK способами, описанными Perri et al. (J. Virol 77(19): 10394-10403 (2003)), кодирующие для экспрессии такие же антигены, как соответствующие конструкции РНК. В этой системе антиген, состоящий из химерных репликонов альфавируса (VCR), происходящих из генома вируса венесуэльского энцефалита лошадей (VEEV), конструировали так, чтобы он содержал 3'-концевые последовательности (3' UTR) вируса Синдбис и сигнал упаковки (PS) вируса Синдбис (см. фиг. 2 из Perri et al). Репликоны упаковывали в VRP посредством их совместной электропорации в клетки почки детеныша хомяка (BHK) вместе с РНК дефектных помощников, кодирующих гены капсида и гликопротеинов вируса Синдбис (см. фиг. 2 из Perri et al). Затем VRP собирали и частично очищали ультрацентрифугированием на сахарозной подушке и концентрировали в концентраторе Amicon. Полученный исходный раствор VRP титровали общепринятыми способами и инокулировали животным в культуральной жидкости или других изотонических буферах. Химерная частица репликона альфавируса, полученная из вирусов венесуэльского энцефалита лошадей и Синдбис, является активным вектором для доставки вакцины на основе генов. J. Virol 77, 10394-10403.
Исследования иммуногенности мышей
[215] Группы из 10 самок мышей BALB/c в возрасте 8-10 недель и с массой приблизительно 20 г иммунизировали 1×106 ИЕ (VRP) или 1,0 мкг (РНК) на сутки 0, 21 и 42 с заборами крови через 3 недели после 2й и 3 недели после 3й вакцинаций. Всех животных инъецировали в квадрицепсы в две задние конечности, где в каждую вводили равный объем (50 мкл на участок).
Микроанализ нейтрализации
[216] Образцы сыворотки тестировали на присутствие нейтрализующих антител посредством теста нейтрализации со снижением инфекции. Двукратные серийные разведения HI-сыворотки (в DMEM с 10% HI FBS) добавляли к равному объему CMV (штамм TB40 или клинический изолят 8819), предварительно оттитрованным для получения приблизительно 200 ИЕ/50 мкл. Использовали также штаммы VR1814, Towne, AD169 и клинический изолят 8822. Смеси сыворотка/вирус инкубировали в течение 2 часов при 37°C и 5% CO2, чтобы позволить произойти нейтрализации вируса, и затем 50 мкл этой смеси (содержащей приблизительно 200 ИЕ) инокулировали в двух повторах в лунки с клетками ARPE-19 в 96-луночные планшеты с половинным объемом лунок. Планшеты инкубировали в течение 40-44 часов. Если не указано иначе, количество положительных по инфекции фокусов определяли иммуноокрашиванием с помощью конъюгированного с AlexaFluor 488 моноклонального антитела IE1 против CMV с последующим автоматическим подсчетом. Титр нейтрализации определяли как обратную величину разведения сыворотки, приводящего к 50% уменьшению количества положительных по вирусу фокусов на лунку, по сравнению с контрольными (без сыворотки).
Иммуногенность VRP и составленной с LNP РНК gH/gL
[217] Репликон A323, экспрессирующий поверхностный гликопротеин B (gB) CMV, репликон A160, экспрессирующий мембранный комплекс из полноразмерных гликопротеинов H и L (gH/gL), и репликон A322, экспрессирующий мембранный комплекс из растворимой формы гликопротеинов H и L (gHsol/gL), использовали для этого эксперимента. Мышам BALB/c, 10 животных на группу, проводили билатеральные внутримышечные вакцинации (50 мкл на конечность) на сутки 0, 21 и 42 с использованием VRP, экспрессирующих gB (1×106 ИЕ), VRP, экспрессирующих gH/gL (1×106 ИЕ), VRP, экспрессирующих gHsol/gL (1×106 ИЕ), и PBS в качестве контроля. В трех тестируемых группах вводили самореплицирующуюся РНК (A160, A322 или A323) в составе LNP (RV01(14). Сыворотку собирали для иммунологического анализа на сутки 39 (3wp2) и 63 (3wp3).
Результаты
[218] Размер и процент инкапсулированной РНК в составах RV01(14), полученных для эксперимента, показаны в таблице 3.
[219] Титры 50% нейтрализации для сывороток из последнего забора крови (сутки 63, три недели после последней вакцинации) показаны в таблице 4.
[220] РНК, экспрессирующая либо полноразмерную, либо предположительно растворимую форму комплекса gH/gL HCMV, вызывает образование высоких титров нейтрализующих антител, как определяли анализом эпителиальных клеток с использованием двух различных штаммов HCMV. Средние титры, вызванные РНК gH/gL, являются по меньшей мере такими же высокими, как средний титр для соответствующих VRP gH/gL (см. фиг. 17).
ПРИМЕР 6
Бицистронные и пентацистронные нуклеиновые кислоты, кодирующие белки CMV
[221] Получали бицистронные и пентацистронные репликоны альфавируса, экспрессирующие комплексы гликопротеинов из цитомегаловируса человека (HCMV), и они схематически показаны на фиг. 18 и 20. Репликоны альфавируса основаны на вирусе венесуэльского энцефалита лошадей (VEE). Репликоны упаковывали в частицы репликона вируса (VRP), инкапсулировали в липидные наночастицы (LNP), или составляли с катионной наноэмульсией (CNE). Экспрессию кодированных белков и белковых комплексов HCMV с каждого из репликонов подтверждали иммуноблотингом, коиммунопреципитацией и проточной цитометрией. Проточную цитометрию использовали для подтверждения экспрессии пентамерного комплекса gH/gL/UL128/UL130/UL131 с пентамерных репликонов, кодирующих белковые компоненты комплекса, с использованием моноклональных антител человека, специфических для конформационных эпитопов, присутствующих в пентамерном комплексе (Macagno et al (2010), J. Virol. 84(2): 1005-13). На фиг. 19 показано, что эти антитела связываются с клетками BHKV, трансфицированными РНК репликона, экспрессирующего пентамерный комплекс gH/gL/UL128/UL130/UL131 HCMV (A527). Сходные результаты получали, когда клетки инфицировали VRP, полученными из такой же конструкции репликона. Это показывает, что репликоны, сконструированные для экспрессии пентамерного комплекса, действительно экспрессируют желательный антиген, а не потенциальный побочный продукт gH/gL.
[222] VRP, РНК, инкапсулированную в LNP, и РНК, составленную с CNE, использовали для иммунизации мышей Balb/c посредством внутримышечных инъекций в задние квадрицепсы. Мышей иммунизировали три раза, с интервалами три недели, и образцы сыворотки собирали перед каждой иммунизацией, так же как через три недели после третьей и последней иммунизации. Сыворотки оценивали в микроанализах нейтрализации для измерения силы ответа нейтрализующих антител, вызванного вакцинациями. Титры выражали как титр 50% нейтрализации.
[223] Оценивали иммуногенность ряда различных конфигураций бицистронной экспрессирующей кассеты для растворимого комплекса gH/gL HCMV в VRP. На фиг. 20 показано, что VRP, экспрессирующие заякоренный в мембране полноразмерный комплекс gH/gL, вызывал образование сильных нейтрализующих антител с немного более высокими титрами, чем растворимый комплекс (gHsol/gL), экспрессированный со сходной бицистронной экспрессирующей кассеты. Изменение порядка генов, кодирующих gHsol и gL, или замена одного из субгеномных промоторов на IRES или участок 2A FMDV по существу не улучшала иммуногенность.
[224] Широту и силу активности нейтрализации HCMV в сыворотках от мышей, иммунизированных VRP VEE/SIN, экспрессирующими gH/gL, оценивали с использованием сыворотки для блокирования инфекции фибробластов и эпителиальных клеток различными штаммами HCMV. В таблице 5 показано, что иммунные сыворотки против gH/gL вызывали широкую и сильную нейтрализацию против шести различных штаммов HCMV в обоих типах клеток в отсутствие комплемента. Добавление комплемента оказывало слабый отрицательный эффект на нейтрализующую активность сывороток.
[225] Оценивали иммуногенность инкапсулированных в LNP РНК, кодирующих пентамерный комплекс (A526 и A527), по сравнению с инкапсулированной в LNP РНК (A160) и VRP (pVCR, модифицированной gH-SGPgL), экспрессирующими gH/gL. В таблице 6 показано, что репликоны, экспрессирующие пентамерный комплекс, вызывали образование более активных нейтрализующих антител, чем репликоны, экспрессирующие gH/gL.
[226] Пентацистронный РНК репликон на основе VEE, который вызывал образование наивысших титров нейтрализующих антител (A527), упаковывали в форме VRP, и иммуногенность VRP сравнивали с VRP, экспрессирующими gH/gL, и с инкапсулированными в LNP репликонами, экспрессирующими gH/gL и пентамерный комплекс. В таблице 7 показано, что VRP, экспрессирующие пентамерный комплекс, вызывали образование более высоких титров нейтрализующих антител, чем VRP, экспрессирующие gH/gL. Более того, 106 инфекционных единиц VRP являются по меньшей мере настолько же активными, как 1 мкг инкапсулированной в LNP РНК, когда VRP и РНК кодируют одинаковые белковые комплексы.
[227]
[228] Широту и силу активности нейтрализации HCMV в сыворотках от мышей, иммунизированных основанной на VEE РНК, кодирующей пентамерный комплекс (A527), оценивали с использованием сыворотки для блокирования инфекции фибробластов и эпителиальных клеток различными штаммами HCMV. В таблице 8 показано, что иммунные сыворотки против gH/gL/UL128/UL130/UL131 вызывали широкую и сильную нейтрализацию инфекции эпителиальных клеток. Этот эффект являлся независимым от комплемента. В отличие от этого, сыворотки оказывали сниженный или не поддающийся детекции эффект на инфекцию фибробластов. Эти результаты являются такими, как ожидали для иммунных сывороток, содержащих в основном антитела, специфические для пентамерного комплекса gH/gL/UL128/UL130/UL131, поскольку пентамерный комплекс не является необходимым для инфекции фибробластов и, следовательно, антитела против UL128, UL130 и UL131 не блокируют инфекцию фибробластов (Adler et al (2006), J. Gen. Virol. 87(Pt.9):2451-60; Wang and Shenk (2005), Proc. Natl. Acad. Sci. USA 102(50): 18153-8). Таким образом, эти данные показывают, что пентамерные репликоны, кодирующие пентамерный комплекс gH/gL/UL128/UL130/UL131, вызывают образование специфических антител против комплекса in vivo.
[229] Чтобы выяснить, могут ли бицистронные и пентацистронные репликоны, экспрессирующие gH/gL и пентамерные комплексы, вызывать образование нейтрализующих антител в различных составах, хлопковых хомяков иммунизировали бицистронными или пентацистронными репликонами, смешанными с катионной наноэмульсией (CNE). В таблице 9 показано, что репликоны в CNE вызывали образование сравнимых титров нейтрализующих антител к одним и тем же репликонам, инкапсулированным в LNP.
Пример 7. Репликоны, кодирующие белки VZV
[230] Нуклеиновые кислоты, кодирующие белки VZV, клонировали в вектор с репликоном VEE для получения моноцистронных репликонов, кодирующих gB, gH, gL, gE и gI, и для получения бицистронных репликонов, кодирующих gH/gL или gE/gI. В бицистронных репликонах экспрессией каждой открытой рамки считывания управлял отдельный субгеномный промотор.
[231] Для получения РНК репликона плазмиду, кодирующую репликон, линеаризовали расщеплением с помощью PmeI, и линеаризованную плазмиду экстрагировали фенолом/хлороформом/изоамиловым спиртом, преципитировали в ацетате натрия/этаноле и ресуспендировали в 20 мкл свободной от РНКазы воды.
[232] РНК получали посредством транскрипции in vitro 1 мкг линеаризованной ДНК с использованием набора MEGAscript T7 (AMBION# AM1333). Составляли 20 мкл реакционной смеси согласно инструкции производителя без аналога кэпа и инкубировали в течение 2 часов при 32°C. Добавляли ДНКазу TURBO (1 мкл) и смесь инкубировали в течение 30 мин при 32°C. Добавляли свободную от РНКазы воду (30 мкл) и раствор ацетата аммония (30 мкл). Раствор смешивали и охлаждали в течение по меньшей мере 30 мин при -20°C. Затем раствор центрифугировали при максимальной скорости в течение 25 мин при 4°C. Супернатант удаляли, и осадок промывали 70% этанолом, и снова центрифугировали при максимальной скорости в течение 10 мин при 4°C. Осадок высушивали на воздухе и ресуспендировали в 50 мкл свободной от РНКазы воды. Концентрацию РНК измеряли, и количество проверяли в денатурирующем геле.
[233] РНК кэпировали с использованием кэпирующей системы ScriptCap m7G (Epicentre #SCCE0625). Реакционную смесь отмеряли посредством объединения РНК и свободной от РНКазы воды. Затем РНК денатурировали в течение 5-10 мин при 65°C. Денатурированную РНК быстро переносили на лед, и следующие реагенты добавляли в следующем порядке: буфер для кэпирования ScriptCap, 10 мМ GTP, 2 мМ свежеприготовленный SAM, ингибитор РНКазы ScriptGuard и кэпирующий фермент ScriptCap. Смесь инкубировали в течение 60 мин при 37°C. Реакцию останавливали, добавляя свободную от РНКазы воду и 7,5 M LiCl, хорошо смешивая и сохраняя смесь в течение по меньшей мере 30 мин при -20°C. Затем смесь центрифугировали при максимальной скорости в течение 25 мин при 4°C, осадок промывали 70% этанолом, снова центрифугировали при максимальной скорости в течение 10 мин при 4°C и осадок высушивали на воздухе. Осадок ресуспендировали в свободной от РНКазы воде. Концентрацию РНК измеряли и качество проверяли в денатурирующем геле.
Трансфекция РНК
[234] Клетки (клетки BHK-V), рассеянные в 6-луночные планшеты, доводили до 90-95% конфлюэнтности на время трансфекции. Для каждой трансфекции 3 мкг РНК разводили в 50 мл среды OPTIMEM в первой пробирке. Липофектамин 2000 добавляли во вторую пробирку, содержащую 50 мл среды OPTIMEM. Первую и вторую пробирки объединяли и сохраняли в течение 20 мин при комнатной температуре. Культуральную среду в 6-луночных планшетах заменяли на свежую среду, и комплекс РНК-липофектамин помещали на клетки, и перемешивали посредством осторожного вращения планшета. Планшеты инкубировали в течение 24 часов при 37°C в CO2-инкубаторе.
[235] Экспрессию белков VZV в трансфицированных клетках оценивали посредством Вестерн-блоттинга и иммунофлуоресенции. Для Вестерн-блоттинга лизаты трансфицированных клеток разделяли электрофорезом (5 мкг общего белка/дорожку) и подвергали блоттингу. Очищенную суспензию вируса (7 мкг общего белка/дорожку), происходящего из штамма вакцины OKA/Merck, использовали в качестве положительного контроля. Блоты анализировали с использованием в качестве зондов коммерчески доступных антител (разведение 1:1000), связывающих белки VZV.
[236] Для иммунофлуоресценции трансфицированные клетки собирали и рассевали в 96-луночный планшет, и внутриклеточное окрашивание проводили с использованием коммерчески доступных mAb мыши (диапазон разведения 1:100-1:400). Осадки клеток фиксировали и пермеабилизировали растворами Citofix-Citoperm. Использовали вторичный реагент, меченные Alexa488 антитела козы против антител мыши F(ab')2 (конечное разведение 1:400).
[237] Экспрессию белков VZV gE и gI детектировали в клетках, трансфицированных моноцистронными конструкциями (gE или gI), и экспрессию как gE, так и gI, детектировали в клетках, трансфицированных бицистронной конструкцией gE/gI, Вестерн-блоттингом с использованием коммерчески доступных антител мыши, 13B1 для gE и 8C4 для gI. Экспрессию белка gB VZV детектировали в клетках, трансфицированных моноцистронной конструкцией, кодирующей gB, посредством иммунофлуоресценции с использованием коммерчески доступного антитела 10G6. Экспрессию белкового комплекса gH/gL VZV детектировали посредством иммунофлуоресценции в клетках, трансфицированных моноцистронным gH и моноцистронным gL или бицистронной конструкцией gH/gL. Комплекс gH/gL детектировали с использованием коммерчески доступного антитела SG3.
[238] Исследования иммуногенности у мышей
[239] Группы из 8 самок BALB/c в возрасте 6-8 недель и массой приблизительно 20 г иммунизировали внутримышечно 7,0 или 1,0 мкг РНК репликона, составленного с CNE или LNP (RV01) на сутки 0, 21 и 42. Образцы крови отбирали у иммунизированных животных через 3 недели после 2-й иммунизации и через 3 недели после 3-й иммунизации. Группы показаны в таблице 10.
Иммунный ответ на антигены VZV
[240] Образцы сыворотки тестировали на присутствие антител против gB, посредством внутриклеточного окрашивания трансфицированных репликоном VZV клеток MRC-5. Клетки MRC-5 поддерживали в модифицированной по способу Дульбекко среде Игла с 10% эмбриональной бычьей сывороткой. Инокулят VZV штамма Oka (полученного из ATCC), использовали для инфекции культуры клеток MRC-5, и инфицированные цельные клетки использовали для последующего пассирования вируса. Соотношение между инфицированными и неинфицированными клетками составляло 1:10. Через 30 час после инфекции клетки диспергировали в трипсине для рассева в 96-луночном планшете для проведения внутриклеточного окрашивания пулами сыворотки мышей (диапазон разведения 1:200 - 1:800), полученными после иммунизации. Коммерческие mAb использовали в качестве контроля для количественной оценки уровня инфекции. Осадки клеток фиксировали и пермеабилизировали растворами Citofix-Citoperm. Использовали вторичный реагент, меченные Alexa488 антитела козы против антител мыши F(ab')2 (конечное разведение 1:400).
[241] Коммерческие антитела против gB (10G6), gH (SG3) и gE (13B1 (SBA) и 8612 (Millipore)) использовали в качестве положительного контроля, и с каждым проводили внутриклеточное окрашивание инфицированных клеток MRC-5. Иммунные сыворотки, полученные через 3 недели после третьей иммунизации либо 1, либо 7 мкг РНК, составленной с CNE или LNP, разводили 1/200, 1/400 и 1/800 и использовали для внутриклеточного окрашивания инфицированных клеток MRC-5. Результаты показаны на фиг. 21 (Исследование 1, группы 1, 5, 7, 9, 11, 13 и 15, состав CNE) и фиг. 22 (Исследование 2, группы 1-7, состав LNP).
Анализ нейтрализации
[242] Для сыворотки от каждой иммунизированной мыши проводили серийное разведение с шагом увеличения в два раза, начиная с 1:20, в общепринятой культуральной среде, и добавляли к равному объему суспензии VZV в присутствии комплемента морской свинки. После инкубации в течение 1 часа при 37°C добавляли линию эпителиальных клеток человека A549. Инфицированные клетки можно измерять после одной недели культивирования посредством подсчета образованных бляшек под микроскопом. По числу бляшек рассчитывали % ингибирования для каждого разведения сыворотки. График для каждого образца сыворотки получали посредством нанесения на график значения % ингибирования против кратности разведения на логарифмической шкале. Затем проводили линию аппроксимации взаимосвязи между кратностью разведения и % ингибирования. Затем титр 50% нейтрализации определяли как кратность разведения, где линия пересекала значение 50% ингибирования.
[243] В таблице 11 показано, что сыворотки, полученные от мышей, иммунизированных моноцистронным gE, бицистронным gE/gI и бицистронным gH/gL, содержали большие титры нейтрализующих антител.



Реферат
Изобретение относится к области биотехнологии и вирусологии. Описана самореплицирующаяся молекула РНК. Молекула содержит первую нуклеотидную последовательность, кодирующую первый белок вируса герпеса, и вторую нуклеотидную последовательность, кодирующую второй белок вируса герпеса. Молекула предназначена для получения комплексов белков в клетке. Также описаны частица репликона альфавируса, содержащая такую молекулу РНК, композиция, содержащая такой альфавирус, и способы индукции иммунного ответа у индивидуума, с использованием таких молекул РНК, альфавируса и композиции. Изобретение может быть использовано в медицине. 10 н. и 21 з.п. ф-лы, 57 ил., 11 табл., 7 пр.
Формула
a. первую нуклеотидную последовательность, кодирующую первый белок или его фрагмент из вируса герпеса или его фрагмента; и
b. вторую нуклеотидную последовательность, кодирующую второй белок или его фрагмент из указанного вируса герпеса или его фрагмента;
где первая нуклеотидная последовательность и вторая нуклеотидная последовательность являются функционально связанными с одним или более контрольными элементами, так что когда самореплицирующуюся молекулу РНК вводят в подходящую клетку, первый и второй белки вируса герпеса или их фрагменты продуцируются в количестве, достаточном для формирования в клетке комплекса, содержащего первый и второй белки или фрагменты, при условии, что первый белок и второй белок не являются одним и тем же белком или фрагментами одного и того же белка, первый белок не является фрагментом второго белка и второй белок не является фрагментом первого белка.
первый белок или фрагмент представляет собой gH или его фрагмент и второй белок или фрагмент представляет собой gL или его фрагмент; или
первый белок или фрагмент представляет собой gM или его фрагмент и второй белок или фрагмент представляет собой gN или его фрагмент.
Документы, цитированные в отчёте о поиске
Условно реплицирующийся ретровирусный вектор (варианты), способ его получения и использования (варианты), выделенная и очищенная молекула нуклеиновой кислоты

Комментарии