Условно реплицирующийся ретровирусный вектор (варианты), способ его получения и использования (варианты), выделенная и очищенная молекула нуклеиновой кислоты - RU2270250C2
Код документа: RU2270250C2
Чертежи







Описание
По данной заявке испрашивается приоритет в соответствии с заявкой No08/563459, поданной 28 ноября 1995, которая конвертирована во временную патентную заявку и во всей полноте включена в настоящее описание в виде ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к кондиционно реплицирующемуся вирусному вектору, способам получения, модификации, размножения и селективной упаковки такого вектора, выделенным молекулам специфических нуклеотидных и аминокислотных последовательностей, относящихся к таким векторам, фармацевтической композиции и клетке-хозяину, содержащей такой вектор, а также к способам применения указанного вектора и клетки-хозяина.
Уровень техники
Открытие того факта, что вирус иммунодефицита человека (ВИЧ) вызывает синдром приобретенного иммунодефицита (СПИД), способствовало развитию многочисленных исследований механизмов инфекционного цикла вирусов и вирусного патогененза. Изучение этих механизмов представляет исследователям все увеличивающееся число мишеней для разработки антивирусных агентов, эффективных не только в отношении ВИЧ, но и других вирусов. Эти антивирусные агенты, особенно направленные против ВИЧ, могут быть разделены на группы в зависимости от способа их действия. Такие группы включают ингибиторы обратной транскриптазы, конкуренты проникновения вируса в клетки, вакцины и ингибиторы протеазы, а также недавно образованную группу, обозначаемую здесь, как "генетически антивирусные агенты".
В целом каждый тип антивирусного агента имеет свои собственные преимущества и ограничения и должен оцениваться с точки зрения определенной терапевтической ситуации. Антивирусные агенты, такие как зидовудин (3'-азидо-3'-дезокситимидин, известный также как АЗТ), ингибиторы протеазы и т.д. могут быть относительно легко доставлены в клетки организма пациента и широко изучены. Будучи направленными на один специфический фактор инфекционного вирусного цикла, такие агенты обнаруживают относительную неэффективность в отношении ВИЧ. Это в основном обусловлено тем фактом, что штаммы ВИЧ быстро изменяются и становятся резистентными к агентам, воздействующим на один локус (Richman, AIDS Res. and Hum. Retrovir., 8, 1065-1071 (1992)).
Соответственно проблемы генетических вариаций и быстрых мутаций в геномах ВИЧ создают необходимость разработки новых антивирусных стратегий для лечения ВИЧ-инфекций. Среди этих направлений генетические антивирусные агенты являются наиболее перспективными, поскольку они "работают" в клетках на многих уровнях.
Генетические антивирусные агенты отличаются от других терапевтических агентов тем, что они переносятся как молекулярные элементы в клетку-мишень и защищают от вирусной инфекции (Baltimore, Natura, 325, 395-396 (1988); Dropulic' et al., Hum. Gene Ther., 5, 927-939 (1994)). Генетические антивирусные агенты могут быть представлены любой генетической последовательностью и включают, но не ограничиваются антисмысловыми молекулами, "ловушками" РНК, трансдоминантными мутантами, интерферонами, токсинами, иммуногенами и рибозимами. В частности, рибозимы являются антивирусными агентами, которые расщепляют РНК-мишени, в том числе РНК ВИЧ, последовательность-специфическим образом. Специфичность обусловленного рибозимом расщепления РНК-мишени предполагает возможность применения рибозимов как терапевтических ингибиторов репликации вирусов, включая ВИЧ. Различные типы рибозимов, такие как рибозимы в форме молотка и шпильки, были использованы в различных подходах для борьбы с ВИЧ (см., например, Патенты США № 5144019, 5180818 и 5272262 и патентные заявки PCT № WO 94/01549 и WO 93/23569). Оба рибозима - конфигурации молотка и шпильки - могут быть сконструированы для расщепления любой РНК-мишени, которая содержит последовательность GUC (Haseloff et al., Nature, 334, 585-591 (1988); Uhlenbeck, Nature, 334,585 (1987); Hampel et al., Nuc. Acids Res., 18, 299-304 (1990) и Symons, Ann Rev. Biochem., 61, 641-671 (1992)). В целом, рибозимы в форме молотка имеют два типа функциональных доменов, консервативный каталитический домен, фланкированный двумя гибридизационными доменами. Гибридизационные домены связывают последовательности, окружающие последовательность GUC, а каталитический домен расщепляет РНК-мишень с 3'-конца от последовательности GUC (Uhlenbeck(1987), supra; Haseloff et al. (1988), supra и Symons (1992), supra).
Многочисленные исследования подтвердили, что рибозимы могут быть, по меньшей мере, частично эффективными при ингибировании размножения ВИЧ в клетках тканевой культуры (см., например, Sarver et al., Science, 247, 1222-1225 (1990); Sarver et al., NIH Res., 5, 63-67 (1993a); Dropulic' et al., J. Virol., 66, 1432-1441 (1992), Dropulic' et al., Methods: Comp. Meth. Enzymol., 5, 43-49 (1993); Ojwang et al., PNAS, 89, 10802-10806 (1992); Yu et al., PNAS, 90, 6340-6344 (1993) и Weerasinghe et al., J. Virol., 65, 5531-5534 (1991). В частности, Sarver et al. ((1990), supra) продемонстрировали, что рибозимы в форме молотка, полученные с целью расщепления транскрибированного участка гена gag ВИЧ, т.е. анти-gag рибозимы, способны специфически расщеплять РНК gag ВИЧ in vitro. Более того, когда клеточные линии, экспрессирующие анти-gag рибозимы, были инфицированы ВИЧ-1, наблюдалось ингибирование репликации ВИЧ в 50 до 100 раз. Аналогично, Weerasinghe et al. ((1901), supra) показали, что ретровирусные векторы, кодирующие рибозимы, сконструированные для расщепления последовательности U5 РНК ВИЧ-1, обусловливают резистентность к ВИЧ трансдуцированных клеток при последующем заражении ВИЧ. Хотя различные клоны трансдуцированных клеток продемонстрировали различные уровни резистентности к заражению, что было определено с помощью промоторной системы, используемой для направления экспрессии рибозима, большинство из экспрессирующих рибозим клеточных линий "не выдержали" экспрессии ВИЧ через определенное время культивирования.
Показано, что трансдукция клеток тканевой культуры провирусом, в ген nef которого (не являющийся основным для репликации вируса в культуре ткани) был интродуцирован рибозим с гибридизационными доменами, специфичными к участку U5 ВИЧ, ингибирует репликацию вируса в трансдуцированных клетках в 100 эффективнее по сравнению с клетками, трансдуцированными провирусами дикого типа (см., например, Dropulic' et al. (1992) и (1993), supra). Аналогичным образом показано, что рибозимы в форме шпильки ингибируют репликацию ВИЧ в Т-клетках, трансдуцированных векторами, содержащими рибозимы-шпильки U5, и зараженных ВИЧ (Ojwang et al. (1992), supra). Другие исследования показали, что векторы, содержащие рибозимы, экспрессированные с помощью промотора тРНК, также ингибируют некоторые штаммы ВИЧ (Yu et al. (1993), supra).
Доставка рибозимов или других генетических антивирусных агентов к клеточным мишеням ВИЧ (например, к CD4+ Т-клеткам и моноцитарным макрофагам) была основным препятствием эффективной генетической терапии СПИДа. Существующие подходы к обеспечению "нацеливания" на клетки гемопоэтической системы (т.е. первичные мишени инфекционного ВИЧ) предусматривают интродукцию терапевтически активных генов в мультипотентные стволовые клетки-предшественники, которые дифференцируются и дают зрелые Т-клетки или, альтернативно, зрелые СD4+ Т-лимфоциты. Однако обеспечение "нацеливания" на стволовые клетки проблематично, поскольку указанные клетки трудно культивировать и трансдуцировать in vitro. Направленность на циркулирующие в крови Т-лимфоциты также является проблематичной, поскольку они так широко диссеменированы в организме, что все клетки-мишени трудно достижимы при использовании имеющихся векторных систем доставки. Более того, макрофаги следует рассматривать как клеточную мишень, поскольку они являются основным резервом для передачи вирусов в другие органы. Однако, поскольку макрофаги представляют собой терминально дифференцированные клетки и вследствие этого не подвергаются клеточному делению, их трудно трансдуцировать с помощью обычно используемых векторов.
Соответственно преобладающий современный подход к лечению ВИЧ предусматривает использование репликационно-дефектных вирусных векторов и упаковывающих (т.е. "хелперных" (вспомогательных)) клеточных линий (см., например, Buchschacher, JAMA, 269 (22), 2880-2886 (1993); Anderson, Science, 256, 808-813 (1992); Miller, Nature, 357, 455-460 (1992); Mulligan, Science, 260, 926-931 (1993); Friedmann, Science, 244, 1275-1281 (1989) и Cournoyer et al., Ann Rev. Immunol., 11, 297-329 (1993)) для интродукции в клетки, чувствительные к вирусной инфекции (такой как ВИЧ-инфекция) чужеродного гена, который специфически интерферирует с репликацией вируса или вызывает гибель инфицированной клетки (обзор Buchschacher (1993), supra). Такие репликационно-дефектные вирусные векторы содержат кроме чужеродного гена, представляющего интерес, цис-действующие последовательности, необходимые для репликации вируса, но не последовательности, которые кодируют основные вирусные белки. Следовательно, такой вектор не способен к осуществлению полного цикла вирусной репликации, и для его размножения используют линию хелперных клеток, которая содержит в составе генома и конститутивно экспрессирует вирусные гены в своем геноме. После интродукции репликационно-дефектного вирусного вектора в линию хелперных клеток вектор получает trans-образом белки, необходимые для образования вирусных частиц, и формируются векторные вирусные частицы, способные инфицировать клетки-мишени и экспрессировать в них ген, который интерферирует с репликацией вируса или вызывает гибель инфицированных вирусом клеток.
Такие репликационно-дефектные ретровирусные векторы включают аденовирусы и адено-ассоциированные вирусы, а также те ретровирусные векторы, которые используют в клинических исследованиях генотерапии ВИЧ, в частности мышиный амфотропный ретровирусный вектор, известный как вирус мышиного лейкоза мышей Молони (MuLV). Эти дефектные вирусные векторы были использованы для трансдукции CD4+ клеток генетическими антивирусными агентами, такими как анти-Вич рибозимы, с разной степенью успеха (Sarver et al. (1990), supra; Weerasinghe et al. (1991), supra; Dropulic' et al. (1993), supra; Ojwang et al. (1992), supra и Yu et al. (1993), supra). Однако указанные векторы по своей природе имеют ограниченное применение в генотерапии ВИЧ. Например, высокая частота трансдукции является особенно важной при лечении ВИЧ, где вектор должен трансдуцировать либо редкие гемопоэтические CD34+стволовые клетки-предшественники, либо широко распространенные в организме CD4+ Т-клетки-мишени, большинство из которых во время клинической "латентной" стадии болезни являются уже инфицированными ВИЧ. Однако трудно получить векторы MuLV в высоких титрах, что приводит к малоэффективной трансдукции. Более того, в CD34+ стволовых клетках-предшественниках не получена длительная экспрессия трансдуцированной ДНК, особенно после дифференцировки в зрелые Т-лимфоциты. Кроме того, для использования дефектных вирусных векторов требуются стратегии переноса генов ex vivo (см., например, Патент США №5399346), которые могут быть дорогими и недоступными для основной части населения.
Указанные недостатки, связанные с использованием имеющихся в настоящее время векторов для генетической терапии СПИДа, обусловили разработки новых вирусных векторов. Одним из таких векторов является сам ВИЧ. ВИЧ-векторы были использованы для изучения инфекционности (Page et al., J. Virol., 64, 5270-5276 (1990)) и для интродукции генов (таких как суицидные гены) в CD4+ клетки, в особенности в ВИЧ-инфицированные CD4+ клетки (см., например, Buchschacher et al., Hum. Gener. Ther., 3, 391-397 (1992); Richardson et al., J. Virol., 67, 3997-4005 (1993); Carroll et al., J. Virol, 68, 6047-6051 (1994) и Parolin et al., J. Virol., 68, 3888-3895 (1994)). Стратегией этих исследований является использование ВИЧ-векторов для интродукции генов в CD4+ Т-клетки и моноциты.
В настоящее время, однако, данные векторы являются чрезвычайно сложными. Более того, использование векторов сопровождается риском генерации ВИЧ дикого типа при внутриклеточной рекомбинации. Котрансфекция/коинфицирование дефектных векторных последовательностей и хелперного вируса, как было показано, приводит к рекомбинации между гомологичными участками вирусных геномов (Inoue et al., PNAS, 88, 2278-282 (1991)). Наблюдаемая in vitro комплементация указывает на то, что в подобном репликационно-дефектном ВИЧ-векторе in vivo могла бы происходить рекомбинация, усиливая таким образом уже существующую ВИЧ-инфекцию. Тот факт, что ретровирусы упаковывают два генома РНК в один вирион, привел исследователей к предположению, что ретровирусы содержат две вирусные РНК для того, чтобы обходить любые генетические дефекты, вызываемые комплементацией и/или рекомбинацией (Inoue et al. (1991), supra).
В дополнение к риску внутриклеточной рекомбинации, в результате которой образуется ВИЧ дикого типа, ВИЧ-векторы обнаруживают ассоциированный риск мутации in vivo, который повышает патогенность вирусного вектора. Это привело Sarver et al. (AIDS Res. and Hum. Retrovir., 9, 483-487 (1993b)) к предположению относительно разработки рекомбинантных ВИЧ-векторов второго поколения, которые являются репликационно-компетентными, но непатогенными. Такие векторы в сравнении с широко используемыми нереплицирующимися векторами (т.е. по репликации дефектными векторами) продолжают реплицироваться в организме пациента, обеспечивая таким образом постоянную конкуренцию с ВИЧ дикого типа. Однако авторы изобретения не располагают указанными векторами.
В идеале наилучшая возможность лечения инфицированного индивидуума существует во время инокуляции, даже перед тем, как вирус инфицирует хозяина. Однако это трудно осуществимо, поскольку многие индивидуумы до клинической латентной фазы заболевания не предполагают, что они инфицированы ВИЧ. Таким образом, стадией, на которой антивирусное лечение наиболее необходимо, является клиническая латентная фаза заболевания. Терапия на этой стадии требует, чтобы атака большого числа уже инфицированных CD4+-лимфоцитов, которые содержат вирусные геномы, была отражена. Это не столь просто, что подтверждается тем фактом, что на данный момент СПИД остается неизлечимым и слабо поддается воздействию современных способов терапии. Эффективная вакцина пока не разработана и, хотя было показано, что ингибиторы обратной транскриптазы и протеазы препятствуют репликации ВИЧ в тканевой культуре, генерация вирусной резистентности in vivo не привела к появлению успешных терапевтических подходов. Таким образом, генотерапия ВИЧ может не иметь большого значения для подавляющего большинства ВИЧ-инфицированных индивидуумов, число которых по прогнозам превысит 40 миллионов к 2000 году.
В свете изложенного выше все более важной становится генерация длительных и устойчивых иммунологических ответов в отношении определенных патогенов, особенно вирусов, в частности, в контексте СПИДа и рака. Получены живые аттенуированные (LA) вакцины с использованием репликационно-компетентных, но непатогенных вирусов (Daniel et al., Science, 258, 1938-1941 (1992) и Desrosiers, AIDS Res. & Human Retrovir., 10, 331-332 (1994)). Однако такие непатогенные вирусы, отличающиеся от соответствующих вирусов дикого типа делецией в одном или более генов, либо (1) не могут вызывать защитный иммунный ответ, потому что отсутствует персистенция антигена (поскольку LA-вирус не является эффективно реплицирующимся), либо (2) LA-вирус реплицируется, но имеет другой патогенный потенциал, что подтверждается способностью LA-вируса вызывать заболевание у молодых модельных животных (Baba et al., Science, 267, 1823-1825(1995)).
По вышеупомянутым причинам сохраняется необходимость разработки альтернативных профилактических и терапевтических способов лечения вирусной инфекции, особенно СПИДа и раковых заболеваний. Настоящее изобретение обеспечивает такие альтернативные способы посредством кондиционно реплицирующегося вектора. Изобретение также относится к дополнительным способам, в которых может быть использован такой вектор. Указанные и другие объекты и преимущества настоящего изобретения, а также дополнительные отличительные признаки изобретения будут очевидны из приведенного ниже описания изобретения.
Сущность изобретения
Настоящее изобретение относится к кондиционно реплицирующемуся вирусному вектору, который характеризуется способностью реплицироваться только в клетке-хозяине, пермиссивной для репликации вектора.
Согласно другому варианту осуществления изобретения кондиционно реплицирующийся вирусный вектор содержит, по меньшей мере, одну последовательность нуклеиновой кислоты, наличие, транскрипция или трансляция которой обеспечивает вектору в репликационно-пермиссивной клетке-хозяине селективное преимущество перед штаммом вируса дикого типа, соответствующего вирусу, из которого получен вектор.
Согласно другому варианту осуществления изобретения кондиционно реплицирующийся вирусный вектор, который предпочтительно является ретровирусом, содержит, по меньшей мере, одну последовательность нуклеиновой кислоты, наличие, транскрипция или трансляция которой обеспечивает клетке-хозяину, которая инфицирована вектором, селективное преимущество перед клеткой, инфицированной штаммом вируса дикого типа, соответствующим вирусу, из которого получен вектор.
В настоящем изобретении заявлена также фармацевтическая композиция, содержащая кондиционно реплицирующийся вирусный вектор и фармацевтически приемлемый носитель. Заявлена и клетка-хозяин, содержащая кондиционно реплицирующийся вирусный вектор. Другим объектом изобретения является вектор, который в случае ДНК-вектора содержит нуклеотидную последовательность, выбранную из группы, включающей SEQ ID No 2, 3, 4, 5, 6, 14, в которых, по меньшей мере, один из нуклеотидов (N) является мутантным, 15 и 16, и в случае РНК-вектора содержит нуклеотидную последовательность, кодируемую нуклеотидной последовательностью, выбранной из группы, включающей SEQ ID No 2, 3, 4, 5, 6, 14, в которых, по меньшей мере, один из N является мутантным, 15 и 16, а также выделенные и указанные очищенные молекулы нуклеиновой кислоты. Заявлены также способ конструирования вектора с рибозимом, способы модификации вектора и способ размножения и селективной упаковки кондиционно реплицирующегося вектора без использования упаковывающей клеточной линии.
Еще одним объектом настоящего изобретения является способ терапевтической и профилактической обработки клетки-хозяина при вирусной инфекции. Такие способы могут предусматривать соответствующее дополнительное использование хелперного экспрессирующего вектора, цитотоксического лекарственного вещества, белков/факторов или ингибитора протеазы/обратной транскриптазы соответствующим образом. Способ может быть использован, например, для ингибирования репликации вируса, лечения рака, переноса генов in vivo или для экспрессии гена, представляющего интерес, в клетке-хозяине.
Еще одним объектом настоящего изобретения является способ применения клетки-хозяина, содержащей кондиционно реплицирующийся вектор, для детекции взаимодействия между лекарственным веществом/фактором и белком. Такой способ обеспечивает возможность характеризации белка и скрининга активности лекарственных веществ/факторов в отношении данного белка.
Перечень фигур чертежей
На Фигурах 1А-1Е представлены схематические изображения структуры вирусного генома, присутствующего в ВИЧ дикого типа (Фиг.1А), crВИЧ-1.1 (Фиг.1В), crВИЧ-1.11 (Фиг.1C), crВИЧ-1.12 (Фиг.1D) и crВИЧ-1.111 (Фиг.1Е).
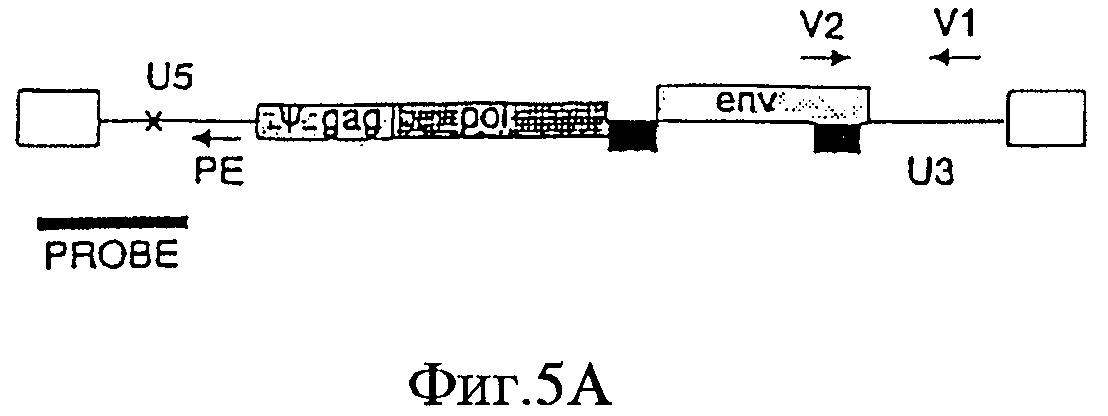
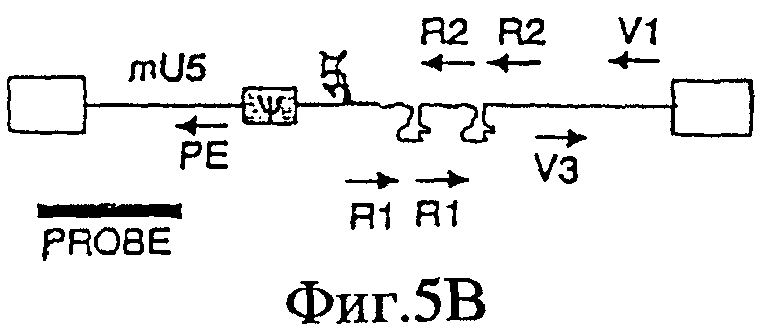
Обозначения: cr - кондиционно реплицирующийся; U5 - U5-кодирующая последовательность; Rz - рибозим; φ - сигнал упаковки; gag, pol и env - кодирующие последовательности белков, которые образуют вирусное ядро, обратную транскриптазу и оболочку вируса соответственно; tat, rev, rre и nef - дополнительные вирусные гены; незакрашенные прямоугольники - вирусные длинные концевые повторы. Крестами в кодирующем участке U5 дикого типа обозначены примерные локусы, в которых рибозимы в соответствии с заявленным изобретением расщепляют РНК U5 дикого типа, но не модифицированную PHK U5 crВИЧ (т.е. "mU5").
На Фигуре 2 показаны последовательности ДНК U5 РНК ВИЧ дикого типа (SEQ ID No1) (А) и модифицированной РНК U5 crВИЧ (SEQ ID No2) (В). Цифрами обозначено число оснований, расположенных ниже области начала транскрипции.
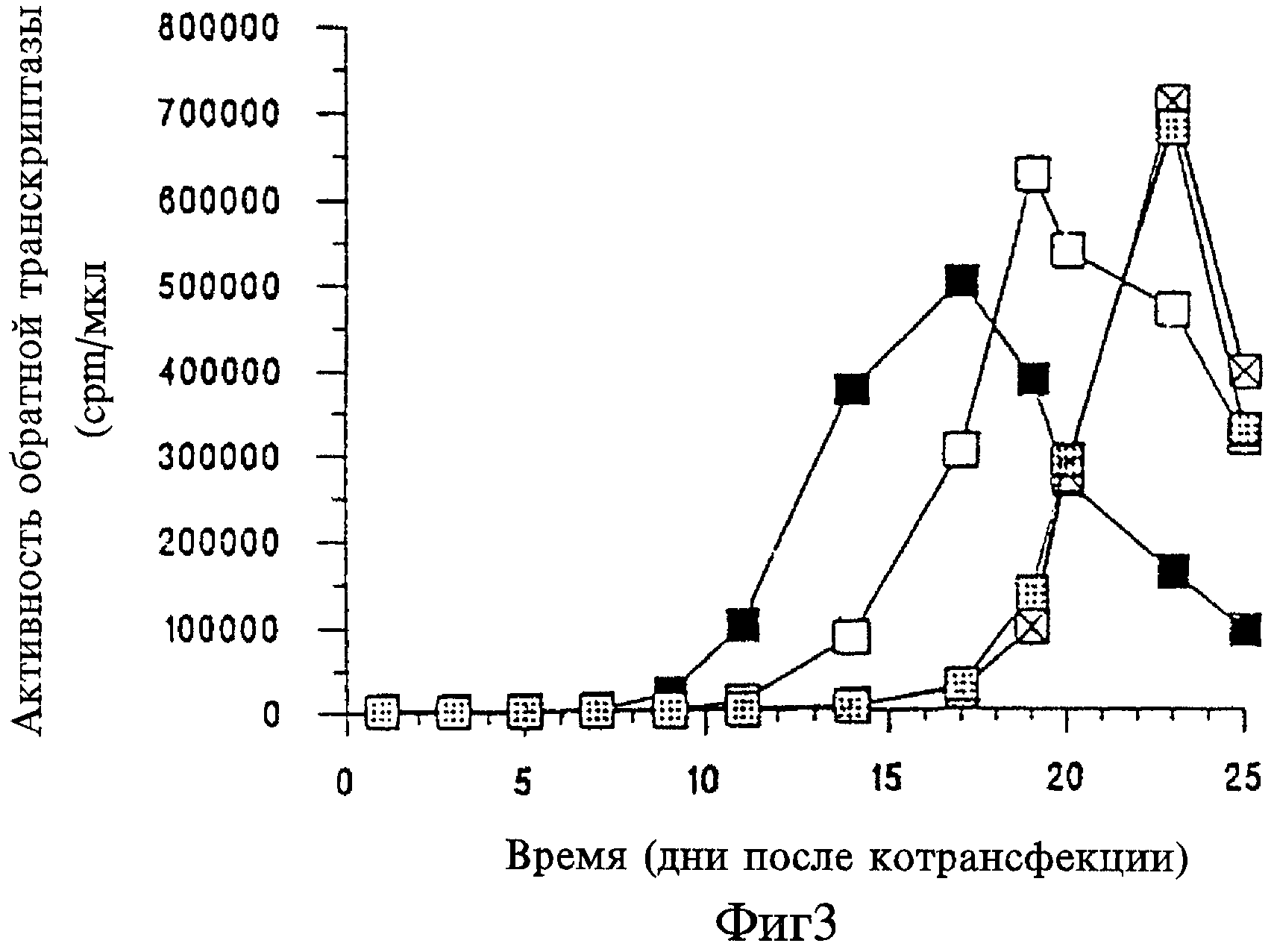
На Фигуре 3 представлен график зависимости активности обратной транскриптазы (cpm/мкл) от времени (дни после котрансфекции) для вызываемого crВИЧ ингибирования репликации ВИЧ дикого типа в клетках Jurkat, котрансфицированных ВИЧ дикого типа и crВИЧ-1.1 (незакрашенные прямоугольники), ВИЧ дикого типа и crВИЧ-1.11 (незакрашенные перечеркнутые прямоугольники), ВИЧ дикого типа и crВИЧ-1.12 (незакрашенные заштрихованные прямоугольники) и ВИЧ дикого типа и контрольной плазмидой pGEM-3Z (черные прямоугольники).
На Фигуре 4 представлен график зависимости активности обратной транскриптазы (cpm/мкл) от времени (дни после котрансфекции) для вызываемого crВИЧ ингибирования репликации ВИЧ дикого типа в клетках Jurkat, котрансфицированных ВИЧ дикого типа и crВИЧ-1.1 (незакрашенные прямоугольники), ВИЧ дикого типа и crВИЧ-1.11 (незакрашенные перечеркнутые прямоугольники), ВИЧ дикого типа и crВИЧ-1.12 (незакрашенные заштрихованные прямоугольники) и ВИЧ дикого типа и контрольной плазмидой pGEM-3Z (черные прямоугольники).
На Фигурах 5А-5С приведены схематические изображения праймеров и зондов, используемых для детекции транскриптов РНК U5 ВИЧ дикого типа (Фиг.5А), crВИЧ-1.1 (Фиг.5В) и crВИЧ-1.111 (Фиг.5С). Обозначения: U5 - U5-кодирующая последовательность; φ - сигнал упаковки; gag, pol и env - кодирующие последовательности белков, которые образуют ядро вируса, обратную транскриптазу и оболочку вируса соответственно; незакрашенные прямоугольники - вирусные длинные концевые повторы; черные прямоугольники - последовательности, кодирующие tat и rev, и РЕ, V1, V2, V3, R1 и R2 - праймеры, используемые для реплицирующихся вирусов дикого типа и/или кондиционно реплицирующихся вирусов. Крестом в кодирующем участке U5 дикого типа отмечен примерный локус, в котором рибозимы в соответствии с заявленным изобретением расщепляют РНК U5 дикого типа, но не модифицированную РНК U5 crВИЧ (т.е. "mU5").
Сведения, подтверждающие возможность осуществления изобретения
Настоящее изобретение относится к способу ингибирования репликации штамма вируса дикого типа. Способ предусматривает обеспечение контактирования хозяина, который способен подвергаться инфицированию таким штаммом вируса дикого типа и предпочтительно действительно инфицирован таким штаммом вируса дикого типа, с вектором, размножающимся только в хозяине, который является пермиссивным в отношении репликации вектора (т.е. непатогенным кондиционно реплицирующимся (cr) вектором).
Как здесь далее описано, основной целью способа является генерирование конкурентной инфекции в организме хозяина с помощью такого непатогенного кондиционно реплицирующегося вектора. В целом, кондиционно реплицирующийся вектор по изобретению содержит, по меньшей мере, одну последовательность нуклеиновой кислоты, которая обусловливает селективное преимущество для репликации и распространения кондиционно реплицирующегося вектора по сравнению с вирусом дикого типа, и/или, по меньшей мере, одну последовательность нуклеиновой кислоты, которая обусловливает селективное преимущество для размножения вирусных частиц в клетке-хозяине, содержащей кондиционно реплицирующийся вектор по сравнению с клеткой-хозяином, содержащей вирус дикого типа.
Согласно предпочтительному варианту осуществления изобретения вектор содержит последовательность ВИЧ и используется для лечения ВИЧ-инфекции. Таким образом, вектор или клетка-хозяин, несущая вектор, содержат, по меньшей мере, одну последовательность нуклеиновой кислоты, которая (1) обеспечивает геному crВИЧ селективное преимущество перед геномом ВИЧ дикого типа с точки зрения упаковки потомства вирионов (т.е. в клетках, где находятся оба вириона) и/или (2) обеспечивает клетке-хозяину, продуцирующей кондиционно реплицирующийся вектор (вирус) селективное преимущество с точки зрения образования вирионов crВИЧ по сравнению с клеткой-хозяином, продуцирующей вирус дикого типа. Один способ (которым изобретение не ограничивается) предусматривает обеспечение геномов crВИЧ селективным преимуществом с точки зрения упаковки посредством введения в них одного или более рибозимов, способных расщеплять геном ВИЧ дикого типа.
Вирус Дикого Типа
Согласно изобретению "вирус" представляет собой инфекционный агент, который состоит из белка и нуклеиновой кислоты и использует генетические механизмы клетки-хозяина для образования вирусных продуктов, кодируемых вирусной нуклеиновой кислотой. "Нуклеиновая кислота" означает полимер ДНК или РНК, который является одно- или двунитевым, линейным или кольцевым и (необязательно) содержит синтетические, неприродные или модифицированные нуклеотиды, которые способны включаться в полимеры ДНК или РНК. Полинуклеотид ДНК предпочтительно состоит из последовательностей геномных или кДНК.
"Штамм вируса дикого типа" представляет собой штамм, который не содержит никаких генерированных человеком мутаций, т.е. любой вирус, который может быть выделен из природных источников. Альтернативно, штамм дикого типа является любым вирусом, который культивируют в лабораторных условиях, но который при отсутствии любого другого вируса способен к образованию геномов или вирионов потомства, подобных природным. Например, молекулярный клон ВИЧ pNL 4-3, описанный в следующих Примерах, является штаммом дикого типа, который получен в соответствии с the AIDS Reserch and Reference Reagent Program Catalog Национального института здравоохранения (см. также Adachi et al., J. Virol., 59, 284-291 (1986)).
В целом способ, описанный в настоящей заявке, предпочтительно используют для лечения вирусных заболеваний, которые развиваются в результате вирусной инфекции. Желательно, чтобы вирус (а также вектор, как обсуждается ниже) являлся РНК-вирусом, но он может быть и ДНК-вирусом. РНК-вирусы - это разнообразная группа вирусов, которая инфицирует прокариот (например, бактериофаги), а также многочисленных эукариот, включая млекопитающих, в частности человека. Геном большинства РНК-вирусов представлен однонитевой РНК, хотя, по меньшей мере, у одного семейства генетический материал представлен двунитевой РНК. РНК-вирусы подразделяются на три основные группы: вирусы с положительной цепью (т.е. переносимый вирусом геном, транслируется с образованием белка, и депротеинизированной нуклеиновой кислоты вируса достаточно для начала инфекции), вирусы с отрицательной цепью (т.е. переносимый вирусом геном, является комплементарным смысловому и должен транскрибироваться вирион-ассоциированными ферментами для того, чтобы могла произойти трансляция), а также двунитевые РНК-вирусы. Способ по настоящему изобретению предпочтительно используют в отношении вирусов с положительной цепью, вирусов с отрицательной цепью и двунитевых РНК-вирусов.
Как указывается в настоящем описании, РНК-вирус относится к Синдбис-подобным вирусам (например, Togaviridae, Bromovirus, Cucumovirus, Tobamovirus, Ilarvirus, Tobravirus и Potexvirus), пикорнавирус-подобным вирусам (например, Picornaviridae, Caliciviridae, Comovirus, Nepovirus и Potyvirus), вирусам с отрицательной цепью (например, Paramyxoviridae, Rhabdoviridae, Orthomyxoviridae, Bunyaviridae и Arenaviridae), двунитевым вирусам (например, Reoviridae и Birnaviridae), флавивирус-подобным вирусам (например, Flaviviridae и Pestivirus), ретровирус-подобным вирусам (например, Retroviridae), Coronaviridae и другим группам вирусов, включающим, но не ограничивающимся Nodaviridae.
Предпочтительным РНК-вирусом по изобретению является вирус семейства Flaviviridae, предпочтительно вирус рода Filovirus и особенно вирус Марбурга или Эбола. Предпочтительно, чтобы вирус семейства Flaviviridae представлял собой вирус рода Flavivirus, например вирус желтой лихорадки, вирус Западного Нила, вирус энцефалита Сан-Луи, вирус японского энцефалита, вирус энцефалита долины Мюррей, вирус Рокио, вирус клещевого энцефалита и т.д.
Кроме того, предпочтительным является вирус семейства Picornaviridae, в особенности вирус гепатита A (HAV), вирус гепатита В (HBV) или вирус гепатита ни-А ни-В.
Другим предпочтительным РНК-вирусом является вирус семейства Retroviridae (т.е. ретровирус), в частности вирус рода или подсемейства Oncovirinae, Spumavirinae, Spumavirus, Lentivirinae и Lentivirus. Желательно, чтобы РНК-вирус подсемейства Oncovirinae представлял собой Т-лимфотропный (в отношении Т-клеток человека) вирус типа 1 или 2 (т.е. HTLV-1 или HTLV-2) или вирус бычьего лейкоза (BLV), вирус лейкосаркомы птиц (например, вирус саркомы Роуз (RSV), вирус миелобластоза птиц (AMV), вирус эритробластоза птиц (AEV) и Раус-ассоциированный вирус (RAV; RAV-0 до RAV-50), вирус млекопитающих С-типа (например, вирус лейкоза мышей Молони (MuLV), вирус саркомы Харвей мышей (HaMSV), вирус лейкоза мышей Абелсона (A-MuLV), AKR-MuLV, вирус лейкоза кошек (FeLV), вирус саркомы обезьян, вирус ретикулоэндотелиоза (REV), вирус некроза селезенки (SNV), вирус В-типа (например, вирус опухоли молочной железы мышей (MMTV)) и вирус D-типа (например, обезьяний вирус Мейсон-Пфайзер (MPMV) и вирусы "SAIDS"). РНК-вирусы подсемейства Lentivirus предпочтительно являются вирусами иммунодефицита человека типов 1 и 2 (т.е. ВИЧ-1 или ВИЧ-2, при этом ВИЧ-1 раньше называли с лимфаденопатией вирусом 3 (HTLV-III) и вирусом, ассоциированным с синдромом приобретенного иммунодефицита (СПИД) (ARV)), или другим вирусом, близким ВИЧ-1 или ВИЧ-2, который был идентифицирован и ассоциирован со СПИДом или СПИД-подобным заболеванием. Акроним "ВИЧ" или термины "вирус СПИДа" или "вирус иммунодефицита человека" употребляются здесь по отношению к вирусам ВИЧ и ВИЧ-подобным и ВИЧ-ассоциированным вирусам. Более того, РНК-вирус подсемейства Lentivirus предпочтительно представляет собой вирус Висны/Маэди (например, инфицирующий овец), вирус иммунодефицита кошек (FIV), бычий лентивирус, вирус иммунодефицита обезьян (SIV), вирус инфекционной анемии лошадей (EIAV) и вирус артрита-энцефалита коз (CAEV).
Вирус по изобретению предпочтительно является ДНК-вирусом. Предпочтительно ДНК-вирус представляет собой вирус Эпштейн-Барра, аденовирус, вирус простого герпеса, вирус папилломы, вирус вакцины и т.п.
Многие из указанных вирусов классифицируются как патогены "Уровня Биобезопасности 4" (т.е. 4-ой группы риска" по классификации Всемирной организации здравоохранения (ВОЗ)), которые требуют определенного обеспечения оборудованием при всех лабораторных исследованиях, осуществляемых с ними. Однако обычный квалифицированный специалист знаком с мерами предосторожности, обеспечивающими безопасность, необходимую для работы с данными вирусами, и способен их выполнить.
"Клетка-хозяин" может быть любой клеткой и предпочтительно является эукариотической клеткой. Желательно, чтобы клетка-хозяин являлась лимфоцитом (например, Т-лимфоцитом) или макрофагом (например, моноцитарным макрофагом) или предшественником любой из указанных клеток, например гемопоэтической стволовой клеткой. Предпочтительно, чтобы клетки экспрессировали на клеточной поверхности CD4+ гликопротеин, т.е. являлись CD4+-клетками. Желательно, однако, чтобы CD4+ Т-лимфоцит, который инфицирован вирусом СПИДа, еще не был активированным (т.е. предпочтительно, чтобы экспрессия гена net еще не началась и даже более предпочтительно отсутствие регуляции по типу обратной связи экспрессии гена CD4, как будет обсуждаться ниже). Более того, предпочтительно, чтобы клетка-хозяин представляла собой клетку, у которой отсутствует маркер CD4, но которая еще способна инфицироваться вирусом, заявленным в соответствии с настоящим изобретением. Такая клетка может быть (без ограничений указанным) астроцитом, фибробластом кожи, клеткой кишечного эпителия и т.д. Предпочтительно клетка-хозяин является эукариотической клеткой многоклеточного организма (например, в противоположность одноклеточным дрожжам) и более предпочтительно клеткой млекопитающего, например человека. Клетка может быть представлена отдельной клеткой или частью более крупной клеточной популяции. Такая "более крупная популяция клеток" может включать, например, культуру клеток (смешанную или чистую), ткань (например, эпителиальную или иную ткань), орган (например, сердце, легкое, печень, желчный пузырь, мочевой пузырь, глаз и другие органы), систему органов (например, кровеносную систему, мочеиспускательную систему, нервную систему, систему наружных покровов или другую систему) или организм (например, птицу, млекопитающее и т.п.). Предпочтительно органы/ткани/клетки-мишени относятся к кровеносной системе (например, включают, но не ограничиваются сердцем, кровеносными сосудами и кровью), дыхательной системе (например, носу, глотке, гортани, трахеи, бронхам, бронхиолам, легким и т.п.), желудочно-кишечной системе (например, рту, глотке, пищеводу, желудку, кишечнику, слюнным железам, поджелудочной железе, печени, желчному пузырю и т.д.), мочеиспускательной системе (например, почкам, мочеточникам, мочевому пузырю, уретре и т.д.), нервной системе (например, включают, но не ограничиваются, головным мозгом, спинным мозгом и специальными органами чувств, такими как глаз) и системе наружных покровов (например, коже). Более предпочтительно, если клетки-мишени выбраны из группы, состоящей из клеток сердца, кровеносных сосудов, легкого, печени, желчного пузыря и глаза.
Вектор
"Вектор" представляет собой молекулу нуклеиновой кислоты (в обычном случае ДНК или РНК), которая служит для переноса последовательности "нуклеиновой кислоты-пассажира" (т.е. ДНК или РНК) в клетку-хозяин. Три обычных типа векторов включают плазмиды, фаги и вирусы. Предпочтительным вектором является вирус.
Желательно, чтобы вектор не являлся штаммом вируса дикого типа, поскольку он содержит генерированные человеком мутации. Таким образом, вектор обычно получают на основе штамма вируса дикого типа с помощью генетических манипуляций (т.е. посредством делеции), и он представляет собой кондиционно реплицирующийся вирус, как далее будет описано. Оптимально, вирусный вектор представляет собой штамм вируса, того же типа, что и вирус дикого типа, вызывающий инфекцию, которая подлежит лечению, и предпочтительно является одним из вышеупомянутых вирусов дикого типа. В соответствии с указанным предпочтительно получение вектора на основе РНК-вируса, более предпочтительно получение вектора на основе ретровируса и оптимально получение вектора на основе вируса иммунодефицита человека. Такой вектор, выделенный из вируса иммунодефицита человека, здесь обозначают общим термином "crВИЧ"-вектор.
Предпочтительно вектор представляет собой "химерный вектор", например комбинацию вирусного вектора с другими последовательностями, например комбинацию последовательностей ВИЧ с другим вирусом (который предпочтительно получен на основе штамма вируса дикого типа и представляет собой кондиционно реплицирующийся вектор). В частности, последовательности ВИЧ предпочтительно могут быть связаны с последовательностями модифицированного (т.е. недикого типа) штамма аденовируса, адено-ассоциированного вируса, вектора на основе вируса Синдбис или амфотропного мышиного ретровирусного вектора.
Как указывается здесь, вектор может содержать либо ДНК, либо РНК. Например, либо ДНК-, либо РНК-вирус может быть использован для получения вектора. Аналогично, копия кДНК может быть получен на основе геномной РНК вируса. Альтернативно, фрагмент кДНК (или вирусной геномной ДНК) может быть транскрибирован in vitro с образованием РНК. Эти методики хорошо известны специалистам, а также описаны в нижеследующих Примерах.
"Кондиционно реплицирующийся вирус" представляет собой репликационно-дефектный вирус, который дефектен только в определенных условиях. В частности, вирус может завершать свой репликационный цикл в пермиссивной клетке-хозяине и не может завершать репликационный цикл в рестриктивной клетке-хозяине. "Пермиссивная клетка-хозяин" является клеткой-хозяином, инфицированной штаммом вируса дикого типа. Такая инфекция может происходить либо до, либо после инфицирования кондиционно реплицирующимся вирусом, заявленным в соответствии с настоящим изобретением. Альтернативно, "пермиссивная клетка-хозяин" является клеткой, которая кодирует генные продукты вируса дикого типа, необходимые для репликации вируса. Таким образом, кондиционно реплицирующийся вектор, заявленный в соответствии с настоящим изобретением, является вирусом (предпочтительно вирусом того же типа, что и вирус, вызывающий инфекцию, которая подлежит лечению), реплицирующийся только при комплементации со штаммом вируса дикого типа или в том случае, когда вирус дикого типа инфицирует клетки, содержащие геномы кондиционно реплицирующихся векторов.
В предпочтительном варианте осуществления изобретения вектор представляет собой РНК-вирус (например, кондиционно реплицирующийся вирус ВИЧ), который интродуцируется в форме ДНК. Этот предпочтительный вариант характеризует стратегию с использованием реплицирующегося ВИЧ-1 (crВИЧ)-вектора, которая обеспечивает получение геномов непатогенного crВИЧ-вектора с селективным преимуществом по сравнению с патогенными геномами ВИЧ дикого типа. В частности, в клетках, содержащих оба генома ВИЧ дикого типа и crВИЧ, РНК crВИЧ имеют селективное преимущество с точки зрения упаковки в вирионы, поскольку они содержат, например, рибозимы, которые расщепляют РНК дикого типа, но не расщепляют РНК crВИЧ. Такие непатогенные crВИЧ способны распространяться в неинфицированных клетках, чувствительных к ВИЧ-инфекции (например, в CD4+ клетках), в присутствии хелперного вируса дикого типа. Таким образом, селективная упаковка и распространение crВИЧ интерферирует с репликацией ВИЧ дикого типа.
В частности, геномы crВИЧ интродуцируют в инфицированные клетки или неинфицированные клетки. Инфицированные клетки обеспечивают геном crВИЧ белками, необходимыми для инкапсидации и образования вирионов потомства. Геном crВИЧ интродуцируют в неинфицированные клетки, предпочтительно либо прямой трансдукцией (например, это может быть выполнено трансдукцией ДНК crВИЧ с помощью липосом или с использованием химерного вирусного вектора), либо инфекцией частиц crВИЧ в результате трансфекции клеток, инфицированных ВИЧ дикого типа. Неинфицированные клетки сами по себе не образуют частицы crВИЧ. Однако они могут стать супернифицированными вирусом дикого типа, который экспрессирует белки, необходимые для дальнейшего образования частиц crВИЧ. В этом смысле кондиционно реплицирующийся вирус, заявленный в соответствии с настоящим изобретением, функционирует и по типу "вирусного доставляющего вектора", обеспечивающего средства, с помощью которых могут происходить многочисленные циклы инфекции crВИЧ (т.е. в присутствии конкурентной инфекции ВИЧ дикого типа). Такой вектор, который является источником вируса для более чем одного цикла репликации вируса, резко отличается от других используемых в настоящее время векторов, например, таких, которые используют с упаковывающими клеточными линиями и которые обеспечивают только один цикл репликации.
Если желательно (например, для облегчения использование вектора in vitro), генные продукты вируса дикого типа могут быть также введены в клетку, инфицированную кондиционно реплицирующимся вектором. Продукты генов вируса дикого типа могут быть введены не только совместной инфекцией со штаммом вируса дикого типа (или кДНК или провирусом РНК-вируса), но и "в форме" генов, субклонированных в экспрессирующий вектор, например хелперный (вспомогательный) экспрессирующий вектор ("хелпер"), который способен обеспечивать в клетке-хозяине транскрипцию или трансляцию последовательностей (регуляторных или структурных) или, альтернативно, продукты генов могут быть введены экзогенно, т.е. добавлением белковых продуктов к клетке. Что касается "хелпера", то его экспрессия может быть клеточно-специфической или неклеточно-специфической, и он может быть интродуцирован в клетку-хозяин совместно с кондиционно реплицирующимся вирусным вектором, как описано здесь, и поэтому обеспечивает непрерывную репликацию кондиционного реплицирующегося вирусного вектора.
Как указано в настоящем описании, "комплементация" означает негенетическое взаимодействие в клетках генных продуктов вирусов, полученных из различных источников. В частности, при смешанной инфекции комплементация обеспечивает повышение выхода вируса с одним или обоими родительскими геномами, в то время как генотипы родительских геномов остаются неизмененными. Комплементация может быть неаллельной (т.е. интергенной, когда мутанты с дефектами различных функций помогают друг другу в репликации вируса, обеспечивая функцию, которая является дефектный у другого вируса) или аллельной (т.е. интрагенной, когда два родителя имеют дефекты в различных доменах мультимерного белка).
Желательно, чтобы клеток, которые могут быть трансфицированы (трансдуцированы) ДНК crВИЧ (с помощью липосом или с использованием аденовирусного вектора или амфотропного ретровирусного вектора), были либо ВИЧ-инфицированными, либо неинфицированными клетками. ВИЧ-инфицированные клетки могут быть активированными или неактивированными. Если они активированы, то будут немедленно транскрибировать РНК ВИЧ дикого типа или РНК crВИЧ, что приводит к селективной упаковке РНК crВИЧ в вирионы потомства. Если ВИЧ-инфицированные клетки неактивированы, ДНК crВИЧ будет оставаться в них до их активации (например, посредством стимуляции митогенами, антигенами и т.д.), приводя опять же к селективной упаковке РНК crВИЧ в вирионы потомства. Как активированные, так и неактивированные неинфицированные клетки, которые трансфицированы ДНК crВИЧ, не образуют вирионы до тех пор, пока они не станут суперинфицированными ВИЧ дикого типа и активированными стимуляцией, что также приводит к селективной упаковке РНКcrВИЧ в вирионы потомства.
Суперинфекция клеток, содержащих геномы crВИЧ (например, в результате трансфекции или инфекции), имеет место, поскольку геномы crВИЧ не кодируют вирусные белки, которые блокируют суперинфекцию (такие как env и nef). Полученные вирионы crВИЧ могут заражать неинфицированные клетки, потому что вирусные частицы содержат молекулу обратной транскриптазы, которую имеют все частицы ВИЧ, и способны образовывать ДНК-провирус на основе геномной РНК. Этот процесс называют обратной транскрипцией. Когда вирионы crВИЧ заражают неинфицированные клетки, они могут осуществить обратную транскрипцию и образовать провирус на основе геномной РНК. Таким образом, указанные клетки являются эквивалентными тем неинфицированным клеткам, которые непосредственно трансдуцируют ДНК crВИЧ. Они не могут образовывать частицы crВИЧ до тех пор, пока клетки не будут суперинфицированы ВИЧ дикого типа и не станут активированными, и тогда снова возможна селективная упаковка РНКcrВИЧ в вирионы потомства. Вероятно, что частицы crВИЧ могут инфицировать и некоторые клетки, которые уже инфицированы ВИЧ (см. например, Yunoki et al., Arch. Viriol., 116, 143-158 (1991); Winslow et al., Virol., 196, 849-854 (1993); Chen et al., Nuc. Acids Res., 20, 4581-4589 (1992) и Kim et al., AIDS Res. & Hum. Retrovir., 9, 875-882 (1993)). Однако, чтобы это произошло, указанные ВИЧ-инфицированные клетки не должны экспрессировать белки, которые регулируют по типу обратной связи экспрессию CD4, поскольку это будет препятствовать вирионам crВИЧ инфицировать указанные клетки. Активированные ВИЧ-инфицированные клетки в основном регулируют экспрессию CD4 по типу обратной связи. В соответствии с указанным, ВИЧ-инфицированные клетки, которые не являются активированными, потенциально чувствительны к суперинфекции crВИЧ и вследствие этого могли бы служить другим источником образования частиц crВИЧ.
Предпочтительный вектор crВИЧ, заявленный в соответствии с настоящим изобретением, содержит последовательности, необходимые для транскрипции РНК, связывания тРНК-праймера, димеризаци и упаковки и либо не содержит последовательности, кодирующие белки, которые блокируют суперинфекцию ВИЧ дикого типа, либо содержит такие последовательности, но они или не транскрибируются, или не транслируются с образованием активного белка, так что их экспрессия считается "молчащей". Даже более предпочтительно, если в векторе отсутствует участок или последовательности, кодирующие область типа gag-кодирующей последовательности до и включая ген nef ВИЧ дикого. Оптимально, однако, когда вектор содержит rev-отвечающий элемент (RRE), который клонирован в область делеции или другой подходящий участок вектора. Такой предпочтительный ВИЧ-вектор из-за "отсутствия участка или последовательностей, кодирующих участок" представляет вектор, который может быть введен в форме РНК или, альтернативно, в форме ДНК, как было описано ранее.
Конструирование векторов хорошо известно специалистам. Например, как описывают в Примере 1, РНК-вирус, такой как ВИЧ, в форме ДНК расщепляют с помощью рестриктаз для вырезания ВИЧ-кодирующих последовательностей из gag-кодирующего участка до участка U3, следующего за геном nef. Клонирующую кассету, содержащую полилинкер с многочисленными сайтами рестрикции, вводят в участок делеции перед лигированием для получения удобных сайтов рестрикции для клонирования в вектор. Фрагмент ДНК, содержащий RRE, по одному из этих сайтов. Полученный вектор образует усеченный транскрипт gag и не образует белок Gag дикого типа или любые другие белки ВИЧ дикого типа. Более того, не является необходимым, чтобы вектор экспрессировал даже усеченный белок gag, поскольку последовательность инициации трансляции gag может быть мутантной и препятствовать его трансляции.
Используя такой же подход, последовательности crВИЧ могут быть связаны с другими последовательностями, например, вируса или другого вектора, для получения химерного вектора. В частности, последовательности crВИЧ могут быть лигированы с последовательностями вируса Синдибис, AAV, аденовируса или амфотропного ретровируса, но немногие из указанных вирусов могут быть использованы для доставки последовательностей crВИЧ. Такой химерный вектор может быть интродуцирован в клетку либо с использованием механизма связывания вирусов клеточной мембраны (например, рецептор-опосредованный эндоцитоз для аденовируса) или другие средства, например липосомы.
Предпочтительным в соответствии с заявленным изобретением является вектор (т.е. кондиционно реплицирующийся вирус, который преимущественно представляет собой crВИЧ-вектор), содержащий, по крайней мере, одну последовательность нуклеиновой кислоты, наличие, транскрипция и трансляция которой обеспечивают селективное преимущество. Известны два типа таких последовательностей нуклеиновой кислоты, предназначенных для включения в вектор: (1) последовательность нуклеиновой кислоты, наличие которой оптимальным образом обеспечивает селективное преимущество для репликации и распространения вирусного вектора, содержащего такую последовательность, перед штаммом вируса дикого типа (т.е. предпочтительно перед штаммом вируса дикого типа, на основе которого был получен вектор и который не содержит данной последовательности), и (2) последовательность нуклеиновой кислоты, содержание которой оптимальным образом обеспечивает селективное преимущество клеток, инфицированным вектором, содержащим данную последовательность, перед клетками, инфицированными штаммом вируса дикого типа (т.е. предпочтительно штаммом дикого типа, на основе которого получен вектор, и также, например, хелперным экпрессирующим вектором, который способствует репликации вектора и/или его активности в неинфицированной клетке-хозяине), и который не содержит данной последовательности, например, посредством стимуляции выживания клеток, стимуляции образования вирионов вектора crВИЧ в продуцирующих crВИЧ-вектор клетках, индукции апоптоза, облегчения образования белка или усиления иммунологической функции или "нацеливания", так что может быть достигнут желаемый профилактический, терапевтический или биологический эффект. Каждая из этих последовательностей или множество указанных последовательностей, т.е. последовательность, которая отдельно или в сочетании с другим фактором(ами) способствует размножению вектора и/или стимулирует определенную функцию клетки-хозяина, обеспечивая благоприятный профилактический, терапевтический и/или биологический эффект, может быть введена в вектор либо при отсутствии, либо в присутствии другой последовательности, т.е. вектор может содержать "по меньшей мере, одну последовательность нуклеиновой кислоты" и "по меньшей мере, одну дополнительную последовательность нуклеиновой кислоты".
Термин "нуклеиновая кислота" обсуждался ранее. "Последовательность нуклеиновой кислоты", в частности, содержит любой ген или кодирующую последовательность (т.е. ДНК или РНК) потенциально любого размера (при ограничении возможностями упаковки, обусловленными вектором), наличие которых обеспечивает селективное преимущество, как описано здесь ниже. "Ген" представляет собой любую последовательность нуклеиновой кислоты, кодирующую белок или молекулу мРНК (независимо от того, транскрибируется и/или транслируется последовательность). Поскольку ген содержит кодирующие последовательности, а также некодирующие последовательности (например, регуляторные последовательности), то "кодирующая последовательность" не включает никакие некодирующие ДНК.
1. Последовательность нуклеиновой кислоты, наличие которой обеспечивает в клетке-хозяине селективное преимущество вектору, содержащему такую последовательность, перед штаммом вируса дикого типа.
Последовательность нуклеиновой кислоты, которая обеспечивает селективное преимущество в клетке-хозяине вектору, содержащему такую последовательность, перед штаммом вируса дикого типа, предпочтительно является любой последовательностью, которая позволяет векторным вирусным частицам селективно продуцироваться или упаковываться по сравнению с вирусными частицами, происходящими из вируса дикого типа. Такие последовательности включают, но не ограничиваются последовательностью, которая приводит к увеличению числа образующихся внутриклеточно векторных геномов по сравнению с геномами дикого типа, и антивирусную последовательность нуклеиновой кислоты.
Первая категория последовательностей нуклеиновой кислоты, которые обеспечивают селективное преимущество в клетке-хозяине вектору, содержащему такую последовательность, по сравнению со штаммом вируса дикого типа, представлена такими последовательностями, как промотор. "Промотор" представляет собой последовательность, которая направляет связывание РНК-полимеразы и таким образом обеспечивает синтез РНК и может содержать один или более энхансеров. "Энхансеры" представляет собой цис-активирующие элементы, которые стимулируют или ингибируют транскрипцию близлежащих генов. Энхансер, который ингибирует транскрипцию, также называют "глушителем". Энхансеры отличаются от ДНК-связывающих сайтов последовательность-специфичных ДНК-связывающих белков, обнаруженных только в промоторе (которые также называют "промоторными элементами") тем, что энхансеры могут действовать в любой ориентации и на расстоянии до нескольких килобаз (т.п.о.), даже находясь в положении ниже по отношению к транскрибируемому участку.
Соответственно предпочтительно, когда промотор (например, длинный концевой повтор (LTR) кондиционно реплицирующегося ВИЧ-вектора модифицирован таким образом, что вектор становится более чувствительным к определенным цитокинам, чем штамм ВИЧ дикого типа. Например, известен модифицированный промотор ВИЧ, который обладает повышенной транскрипционной активностью в присутствии интерлейкина-2. Встраивание указанного промотора в вектор и интродукция вектора в клетки, инфицированные ВИЧ дикого типа, предпочтительно усиливает образование и упаковку вирионов потомства, происходящих из вектора, по сравнению с ВИЧ дикого типа. Другие цитокины и/или хемокины (например, фактор некроза опухоли α, RANTES и т.д.) могут быть использованы подобным образом для стимуляции селективной упаковки вирионов, кодируемых вектором.
Вторая категория последовательностей нуклеиновой кислоты, которые обеспечивают селективное преимущество вектору, содержащему такую последовательность, по сравнению с штаммом вируса дикого типа, представлена такими предпочтительными последовательностями нуклеиновой кислоты, как антивирусные последовательности. "Антивирусные агенты" классифицируются по способу их действия и включают, например, ингибиторы обратной транскриптазы, конкуренты проникновения вируса в клетки, вакцины, ингибиторы протеазы и генетические антивирусные агенты. "Генетические антивирусные агенты" представляет собой молекулы ДНК или РНК, которые переносятся в клетки и воздействуют на соответствующие внутриклеточные мишени либо непосредственным образом (как интродуцированные внутриклеточно) либо после преобразования в РНК или белок (см. обзор Dropulec' et al. (1994), supra). Генетическая антивирусная последовательность также является предпочтительной последовательностью нуклеиновой кислоты. Генетические антивирусные агенты включают (но не ограничиваются указанным) антисмысловые молекулы, ловушки РНК, трансдоминантные мутанты, токсины, иммуногены и рибозимы. Желательно, чтобы генетический антивирусный агент представлял собой антисмысловую молекулу, иммуноген или рибозим. Соответственно предпочтительной последовательностью нуклеиновой кислоты, которая обеспечивает селективное преимущество вектора перед штаммом вируса дикого типа, является последовательность генетического антивирусного агента, выбранного из группы, включающей антисмысловую молекулу, иммуноген и рибозим.
"Антисмысловая молекула" - это молекула, которая является зеркальным отображением короткого фрагмента гена, экспрессию которого необходимо блокировать. Антисмысловая молекула, направленная против ВИЧ, гибридизуется с РНК ВИЧ дикого типа, вызывая его предпочтительную деградацию клеточными нуклеазами. Антисмысловые молекулы предпочтительно являются ДНК-олигонуклеотидами и желательно, чтобы они имели примерно от 20 до 200 пар оснований в длину, предпочтительно из примерно 20 до 50 пар оснований в длину и оптимально менее чем 25 пар оснований в длину. Антисмысловая молекула может экспрессироваться с РНК crВИЧ и предпочтительно связывает геномную РНК вируса дикого типа, таким образом обеспечивая селективное преимущество crВИЧ при упаковке в вирионы потомства.
"Иммуноген" представляет собой одноцепочное антитело (scAb), направленное на вирусный структурный белок. Иммуноген переносится как нуклеиновая кислота и экспрессируется внутриклеточно. Иммуноген может также быть и антигеном, поверхностным белком (включая класс рестриктированные белки) или антителом, которое способсвует селекции вектора и/или клетки-хозяина. В предпочтительном векторе последовательность нуклеиновой кислоты представляет собой последовательность scAb, которая связывает белок Rev ВИЧ дикого типа. Это преимущественно препятствует созреванию белка Rev и в результате чего он удерживается в эндоплазматической сети. В частности, белки Rev экспортируют не подвергнутую сплайсингу РНК ВИЧ в цитоплазму посредством связывания с RRE с последующей олигомеризацией вокруг РНК ВИЧ. РНК ВИЧ, которые образуют комплексы с Rev, переносятся в цитоплазму в обход механизма клеточного сплайсинга. Таким образом, если Rev дикого типа не связывает RRE дикого типа, то РНК ВИЧ дикого типа не переносятся в цитоплазму и не инкапсидируются в вирионы потомства.
Оптимально, чтобы вектор, содержащий последовательность нуклеиновой кислоты scAb, включал также и модифицированную последовательность RRE и кодировал мутантный белок Rev, который узнает модифицированный RRE, RRE, но не дикого типа. Соответственно в клетках, содержащих ВИЧ дикого типа и вектор, включающий последовательность нуклеиновой кислоты scAb, вектор предпочтительно упаковывается в вирионы. Подобную стратегию преимущественно используют, когда белки матрикса или нуклеокапсида ВИЧ дикого типа (или любой белок, участвующий во взаимодействиях белок/РНК, которые влияют на инкапсидацию вирусной РНК) являются мишенями scAb.
"Рибозим" представляет собой антисмысловую молекулу с каталитической активностью, т.е. вместо связывания РНК и ингибирования трансляции рибозимы связывают РНК и вызывают сайт-специфическое расщепление связанной молекулы РНК. В основном известны четыре группы рибозимов: интропная последовательность Tetrahymena группы I, РНКаза Р и рибозимы в форме головки молотка и шпильки. Однако дополнительные каталитические структуры существуют и в составе других молекул РНК, например в РНК Δ-вируса гепатита и рибосомных РНК в грибных митохондриях.
Предпочтительным рибозимом является рибозим, в котором каталитический домен расщепляет 3'-нуклеотидную последовательность NUH, где N может быть любым нуклеотидом (т.е. G, A, U или С), а Н может быть либо А, С, либо U. Однако, поскольку последовательностью, наиболее эффективно расщепляемой такими рибозимами, является сайт GUC, предпочтительно, чтобы последовательность NUH содержала сайт GUC.
Желательно, чтобы такой рибозим расщеплял участок вируса штамма дикого типа или его транскриптов, но не расщеплял участок вектора или его транскриптов. Рибозим расщепляет вирус или его транкрипты в том смысле, что такой вирус или вектор может содержать РНК или ДНК, как описано ранее. Расщепление "участка" означает расщепление участка-мишени, т.е. предпочтительно участка вируса, который необходим для размножения вируса. Желательно, если вектор модифицирован таким образом, что этот определенный участок-мишень (если он вообще присутствует в векторе) не расщепляется рибозимом. Необязательно рибозим может расщеплять вектор, пока расщепление не затрагивает участка, необходимого для размножения вирусных частиц, например частиц crВИЧ.
Оптимально, если рибозим кодируется последовательностью, выбранной из группы, включающей SEQ ID №3 (т.е. CACACAACACTGATGAGGCCGAAAGGCCGAAACGGGCACA) и SEQ ID №4 (ATCTCTAGTCTGATGAGGCCGAAAGGCCGAAACCAGAGTC). В то время как SEQ ID №3 представляет собой рибозим, который направлен на сайт +115 (число оснований после области начала транскрипции) участка U5 ВИЧ дикого типа, SEQ ID №4 представляет собой рибозим, который направлен на сайт +133 участка U5 ВИЧ дикого типа.
Такой рибозим способен расщеплять геном ВИЧ дикого типа (или его транскрипты), но не геном вектора (или его транскрипты), ввиду того, что последовательности U5 вектора модифицированы in vitro сайт-направленным мутагенезом, как известно из уровня техники и описано в Примере 1. В частности, последовательности вектора предпочтительно модифицированы таким образом, что вектор содержит последовательность, выбранную из группы, включающей SEQ ID №2 (GTGTGCCCACCTGTTGTGTGACTCTGGCAGCTAGAGAAC), SEQ ID №5 (GTGTGCCCGCCTGTTGTGTGACTCTGGTAACTAGAGATC), SEQ ID №6 (GTGTGCCCGTCTGTTGTGTGACTCTGGCAACTAGAGATC), SEQ ID №14, в которой, по меньшей мере, один из N является мутантным, SEQ ID №15 и SEQ ID №16. В форме РНК вектор предпочтительно содержит последовательность, кодируемую последовательностью, выбранной из группы, включающей SEQ ID №2, SEQ ID № 5, SEQ ID №6, SEQ ID №14, в которой, по меньшей мере, один из N является мутантным, SEQ ID №15 и SEQ ID №16. В противоположность этому ВИЧ дикого типа содержит последовательность U5, кодируемую последовательностью SEQ ID №1 (GTGTGCCCGTCTGTTGTGTGACTCTGGTAACTAGAGATC). Модификации in toto и сравнение с последовательностью U5 дикого типа (в форме ДНК) приведены на Фигуре 2.
Более того, могут быть использованы другие рибозимы, направленные на другие участки генома вируса, в частности ВИЧ, как отдельно, так и в сочетании друг с другом. Например, рибозим может расщеплять другие последовательности РНК, необходимые для репликации вируса, например последовательности транскриптазы, протеазы или белка трансактиватора, Rev или другие необходимые последовательности, как было описано ранее. Предпочтительно, чтобы вектор содержал многочисленные рибозимы, например, направленные на различные сайты. В таких случаях аналогичные последовательности в составе вектора модифицируют сайт-направленным мутагенезом или какими-либо другими средствами, известными из уровня техники для получения производного вектора, которое устойчиво к такому расщеплению рибозимом.
Когда вектор сконструирован на основе вируса иммунодефицита человека, предпочтительно чтобы в векторе отсутствовали ген tat и его 5'-сплайсинговый сайт и вместо них содержалась кассета из трех анти-Tat рибозимов, в которой каталитический домен каждого рибозима расщепляет различные сайты молекулы нуклеиновой кислоты вируса иммунодефицита человека дикого типа, в частности различные в tat-сайты. Предпочтительно, чтобы каталитический домен каждого рибозима расщеплял нуклеотидную последовательность участка молекулы нуклеиновой кислоты вируса иммунодефицита человека дикого типа, для которого отсутствует рибозим-чувствительный аналогичный участок в самом векторе.
2. Последовательность нуклеиновой кислоты, наличие которой обеспечивает селективное преимущество клеткам, инфицированным вектором, содержащим такую последовательность, по сравнению с клетками, инфицированными штаммом вируса дикого типа.
Последовательность нуклеиновой кислоты, которая обеспечивает селективное преимущество клетке, содержащей вектор, включающий такую последовательность, перед клеткой, содержащей штамм вируса дикого типа (не имеющий указанной последовательности), предпочтительно является любой последовательностью, которая способствует выживанию клетки, содержащей вектор, и размножению вирусных частиц (т.е. вирусных частиц crВИЧ) по сравнению с клеткой, содержащей вирус дикого типа. Такие последовательности включают (но не ограничиваются указанными) любые последовательности, которые не позволяют клетке или вектору, содержащемуся в клетке, избежать разрушения, последовательности, способствующие выживанию клетки, последовательности, которые индуцируют апоптоз, последовательности, которые облегчают образование белка, или последовательности, стимулирующие функцию иммунитета или нацеленность.
Например, предпочтительно такая последовательность нуклеиновой кислоты, содержащаяся в векторе, кодирует гены множественной лекарственной устойчивости (см., например, Ueda et al., Biochem. Biophys. Res. Coomun., 141, 956-962 (1986); Ueda et al., J. Biol. Chem., 262, 505-508 (1987) и Ueda et al., PNAS, 84, 3004-3008 (1987)). В присутствии добавленного цитотоксического лекарственного средства (например, как осуществляется при химиотерапии рака) это обеспечивает выживание клетки, содержащей вектор, тогда как клетка, содержащая вирус дикого типа, такой как ВИЧ, не выживает. Такие цитотоксические лекарственные средства включают (но не ограничиваются указанными) актиномицин D, винбластин сульфат, винкристин сульфат, дауномицин, адриамицин, VP-16 и AMSA.
Альтернативно, такая последовательность нуклеиновой кислоты желательно содержит последовательность, выбранную из группы, включающей последовательности (или кодирующей последовательности) мутантной (т.е. мутанта) протеазы и последовательности (или последовательности, которая кодирует) мутантной (т.е. мутанта) обратной транскриптазы. Предпочтительно мутантная обратная транскриптаза получена генно-инженерным способом так, что она устойчива к нуклеозидным и ненуклеозидным ингибиторам обратной транскриптазы, а мутантная протеаза получена генно-инженерным способом так, что она устойчива к обычно используемым ингибиторам протеазы.
Введение указанных ингибиторов протеазы и обратной транскриптазы хозяину в комплексе с вектором используют для селекции клеток, продуцирующих вектор, в противоположность клеткам, продуцирующим вирус дикого типа. Аналогично, этот подход модифицирован для применения с любым лекарственным веществом, которое ингибирует репликацию вируса, так что вирус способен мутировать, чтобы избежать ингибирования. Соответственно для лечения ВИЧ селективная последовательность нуклеиновой кислоты, инкорпорированная в вектор, предпочтительно содержит мутантные последовательности ВИЧ. Оптимально, однако, если эти последовательности не препятствуют суперинфекции ВИЧ дикого типа.
Предпочтительно вектор представляет собой один из представленных выше и, в частности, предпочтительные crВИЧ-векторы представлены на Фигурах 1В-1Е, а именно crВИЧ-1.1, crВИЧ-1.11, crВИЧ-1.12 и crВИЧ-1.111 соответственно (Dropulic' et al., PNAS, 93, 11103-11108 (1996)). Кроме того, предпочтительно использование вектора, описанного в Примере 11, т.е. cr2ВИЧ.
В векторе cr2ВИЧ предпочтительно отсутствует ген tat и его сплайсинговый сайт по сравнению с геномом вируса иммунодефицита человека дикого типа. Вместо гена tat и его сплайсингового сайта вектор cr2 ВИЧ содержит кассету трех анти-Tat рибозимов, причем каталитический домен каждого рибозима кассеты расщепляет различные сайты молекулы нуклеиновой кислоты ВИЧ дикого типа. Предпочтительно каталитический домен каждого рибозима кассеты расщепляет различные сайты в гене tat ВИЧ дикого типа. Более предпочтительно, каталитический домен каждого рибозима расщепляет нуклеотидную последовательность участка молекулы нуклеиновой кислоты ВИЧ дикого типа, причем аналогичный рибозим-чувствительный участок в самом векторе отсутствует.
Оптимально вектор является совместимым с клеткой, в которую он интродуцирован, например способен осуществлять в клетке экспрессию кодируемых вектором последовательностей нуклеиновых кислот. Желательно, если вектор содержит ориджин репликации, активный в клетке. Когда последовательность нуклеиновой кислоты переносят в форме ДНК-кодирующей последовательности (например, в противоположность полноразмерному гену, содержащему свой собственный промотор), то оптимально, чтобы вектор содержал и промотор, который способен направлять экспрессию кодирующей последовательности и оперативно связан с кодирующей последовательностью. Кодирующая последовательность "оперативно связана с промотором" (например, кодирующая последовательность и промотор вместе образуют нативный или рекомбинантный ген), когда промотор способен направлять транскрипцию кодирующей последовательности.
В рекомбинантном векторе, заявленном в соответствии с настоящим изобретением, предпочтительно, чтобы все элементы, ответственные за надлежащую транскрипцию (например, сигналы инициации и терминации), сигналы трансляции (например, рибосомного входа или сайта связывания и т.д.) и сигналы процессинга (например, сплайсинговые сайты донора и акцептора и при необходимости сигналы полиаденилирования) должным образом входили в состав вектора, так что любой ген или кодирующая последовательность транскрибируется надлежащим образом (и/или транслируется, если это желательно) в клетках, в которые интродуцирован вектор. Манипуляции такими сигналами для получения надлежащей экспрессии в клетках-хозяевах хорошо известны и проверены специалистами.
Предпочтительно, чтобы вектор содержал также некоторые элементы, с помощью которых вектор или содержащую его субклонированную последовательность идентифицируют или селективно отбирают. Идентификацию и/или селекцию вектора выполняют, используя ряд подходов, известных специалистам. Например, векторы, содержащие определенные гены или кодирующие последовательности, предпочтительно идентифицируют методом гибридизации, по наличию или отсутствию функциональной активности так называемых "маркерных генов", входящих в состав вектора, и/или по экспрессии определенных последовательностей. В первом случае наличие определенной последовательности в векторе определяют гибридизацией (например, ДНК-ДНК гибридизацией), используя зонды, содержащие последовательности, гомологичные соответствующей последовательности. Во втором случае систему "рекомбинантный вектор/хозяин" идентифицируют и селективно отбирают по наличию или отсутствию функциональной активности определенных маркерных генов, такой как устойчивость к антибиотикам, активность тимидинкиназы и т.д., обусловленной ответственными за эти функции генами, присутствующими в векторе. В третьем случае векторы идентифицируют, анализируя продукт определенного гена, входящего в состав вектора. Такие исследования основаны на физических, иммунологических и функциональных признаках продукта гена.
Соответственно настоящее изобретение также относится к вектору, который в случае ДНК-вектора содержит нуклеотидную последовательность, выбранную из группы, включающей SEQ ID № 2, 3, 4, 5, 6, 14, в которых, по меньшей мере, один из N является мутантным, 15 и 16, и в случае РНК-вектора содержит нуклеотидную последовательность, кодируемую нуклеотидной последовательностью, выбранной из группы, включающей SEQ ID № 2, 3, 4, 5, 6, 14, в которых, по меньшей мере, один из N является мутантным, 15 и 16.
Настоящее изобретение также относится к способу получения вектора, который получен на основе вируса иммунодефицита человека дикого типа и который способен реплицироваться только в клетке-хозяине, являющейся пермиссивной для репликации указанного вектора с рибозимом. Рибозим, который включен в вектор и кодируется им, расщепляет нуклеиновую кислоту вируса иммунодефицита человека (но не самого вектора) и соответствующие транскрипты при их наличии. Способ предусматривает получение вектора на основе вируса иммунодефицита человека дикого типа, который способен реплицироваться только в клетке-хозяине, являющейся пермиссивной для репликации указанного вектора, и встраивание в вектор последовательности нуклеиновой кислоты, которая содержит или кодирует рибозим, каталитический домен которого расщепляет нуклеиновую кислоту вируса иммунодефицита человека дикого типа (но не самого вектора) и соответствующие транскрипты при их наличии. При осуществлении способа нуклеотидная последовательность, содержащая или кодирующая последовательность U5 вируса иммунодефицита человека дикого типа, может быть удалена из вектора и замещена нуклеотидной последовательностью, выбранной из группы, включающей SEQ ID № 2, 5, 6, 14, в которых, по меньшей мере, один из N является мутантным, 15 и 16, если вектор является ДНК-вектором, и нуклеотидной последовательностью, кодируемой нуклеотидной последовательностью, выбранной из группы, включающей SEQ ID № 2, 5, 6, 14, в которых, по меньшей мере, один из N является мутантным, 15 и 16, если вектор является РНК-вектором. Предпочтительно, чтобы вектор реплицировался в клетке-хозяине, пермиссивной для репликации указанного вектора более, чем один раз.
Настоящее изобретение также относится к способу модификации вектора. Способ предусматривает получение вектора и интродукцию в вектор нуклеотидной последовательности, выбранной из группы, включающей ДНК SEQ ID № 2, 3, 4, 5, 6, 14, в которых, по меньшей мере, один из N является мутантным, 15 и 16, если вектор является ДНК-вектором, и нуклеотидной последовательности, кодируемой нуклеотидной последовательностью, выбранной из группы, включающей SEQ ID №2, 3, 4, 5, 6, 14, в которых, по меньшей мере, один из N является мутантным, 15 и 16, если вектор является РНК-вектором.
Далее настоящее изобретение относится к способу размножения и селективной упаковки кондиционно реплицирующегося вектора без использования упаковывающей клеточной линии. Способ предусматривает контактирование кондиционно реплицирующего вектора с клеткой, способной инфицироваться другим вектором, который является вектором того же типа, что и кондиционно реплицирующийся вектор, который отличается от кондиционно реплицирующегося вектора тем, что является вектором дикого типа с точки зрения репликационной компетентности; последующее контактирование клетки с другим вектором и затем культивирование клетки в условиях, приводящих к размножению кондиционно реплицирующегося вектора.
Изобретение также относится к выделенной и очищенной молекуле нуклеиновой кислоты, выбранной из группы, включающей молекулы ДНК, с нуклеотидными последовательностями, выбранными из группы, включающей SEQ ID № 2, 5, 6, 14, в которых, по меньшей мере, один из N является мутантным, 15 и 16, и молекулы РНК с нуклеотидными последовательностями, кодируемыми нуклеотидными последовательностями, выбранными из группы, включающей SEQ ID №2, 5, 6, 14, в которых, по меньшей мере, один из N является мутантным, 15 и 16.
Способ применения
Вышеописанные векторы предпочтительно интродуцируют в клетку-хозяин для профилактического и терапевтического лечения вирусной инфекции, для сохранения вектора вируса, а также по иным причинам. Соответственно настоящее изобретение относится к клетке-хозяину, содержащей вектор, заявленный в соответствии с настоящим изобретением. Выделение клеток-хозяев и/или поддержание таких клеток или клеточных линий в культуре стало рутинным способом и может быть осуществлено средним специалистом в данной области исследований.
В частности, вектор, как описано выше, предпочтительно используют для профилактического и терапевтического лечения вирусной инфекции, предпочтительно инфекции, вызванной вирусом дикого типа, преимущественно РНК-вирусом дикого типа, более предпочтительно ретровирусом дикого типа и оптимально ВИЧ дикого типа.
Способ предусматривает контактирование клетки-хозяина, способной инфицироваться вирусом дикого типа, с кондиционированным реплицирующимся вектором, который способен реплицироваться только в клетке-хозяине, пермиссивной для репликации вектора, наличие, транскрипция или трансляция которого ингибируют репликацию штамма вируса дикого типа в клетке-хозяине. Желательно, если вектор реплицируется более одного раза и содержит, по меньшей мере, одну последовательность нуклеиновой кислоты, наличие, транскрипция и трансляция которой обусловливают селективное преимущество в клетке-хозяине указанного вектора по отношению к штамму вируса дикого типа, который в оптимальном случае является штаммом, на основе которого был получен вектор.
Согласно данному способу последовательность нуклеиновой кислоты предпочтительна такой последовательностью, которая содержит или кодирует генетический антивирусный агент, неблагоприятным образом воздействующий на репликацию и/или экспрессию вируса, отличного от вектора. Желательно, чтобы генетический антивирусный агент был выбран из группы, включающей антисмысловую молекулу, рибозим и иммуноген. Оптимальным генетическим агентом является рибозим, каталитический домен которого предпочтительно расщепляет 3'-нуклеотидную последовательность NUH (особенно последовательность GUC). Необязательно, чтобы рибозим кодировался, по меньшей мере частично, последовательностью, выбранной из группы, включающей SEQ ID №3 и SEQ ID №4. Желательно, чтобы рибозим расщеплял участок вируса штамма дикого типа или его транскриптов, но не участок вектора или его транскриптов. Предпочтительно это обусловлено тем, что штамм вируса дикого типа содержит последовательность, кодируемую SEQ ID №1, тогда как вектор в случае ДНК-вектора содержит нуклеотидную последовательность, выбранную из группы, включающей SEQ ID № 2, 5, 6, 14, в которых, по меньшей мере, один из N является мутантным, 15 и 16, и в случае РНК-вектора содержит нуклеотидную последовательность, кодируемую нуклеотидной последовательностью, выбранной из группы, включающей SEQ ID № 2, 5, 6, 14, в которых, по меньшей мере, один из N является мутантным, 15 и 16.
Желательно также, чтобы при осуществлении способа вектор содержал, по меньшей мере, одну последовательность нуклеиновой кислоты, наличие, транскрипция или трансляция которой обеспечивают селективное преимущество клетке-хозяину, инфицированной вектором, перед клеткой, инфицированной штаммом вируса дикого типа, который в оптимальном случае является штаммом вируса, на основе которого был получен вектор. С этой точки зрения вектор может содержать, по меньшей мере, одну последовательность нуклеиновой кислоты, которая обеспечивает селективное преимущество клетке-хозяину, инфицированной вирусом, и по меньшей мере, одну последовательность нуклеиновой кислоты, которая обеспечивает селективное преимущество вектору по сравнению со штаммом дикого типа, на основе которого был получен вектор.
Соответственно предпочтительно осуществление способа, когда последовательность нуклеиновой кислоты представляет собой последовательность, обеспечивающую множественную лекарственную устойчивость. Альтернативно, способ реализуют, в том случае, когда последовательность нуклеиновой кислоты представляет собой последовательность, кодирующую мутантную (мутант) протеазу, и нуклеотидную последовательность, кодирующую мутантную (мутант) обратную транскриптазу, и когда вирусная инфекция, в отношении которой предусмотрено профилактическое или терапевтическое лечение, вызвана ретровирусом.
В предпочтительном варианте способ предусматривает дополнительное введение в клетку-хозяин агента, выбранного из группы, включающей цитотоксический агент, ингибитор протеазы и ингибитор обратной транскриптазы.
Таким образом, вектор может быть использован согласно вышеописанному способу не только для терапии вирусной инфекции, но и для защиты потенциальной клетки-хозяина от вирусной инфекции, т.е. как способ профилактики вирусной инфекции или "вакцинации" против заданного вируса, такого как РНК-вирус, в частности ретровирус, например ВИЧ. Способ обеспечивает существенное ингибирование репликации штамма вируса дикого типа перед тем, как клетка-хозяин вступит в контакт со штаммом вируса дикого типа. С этой точки зрения вектор может содержать или кодировать белки, которые блокируют суперинфекцию вирусом дикого типа. Способ предусматривает контактирование клетки-хозяина с кондиционно реплицирующимся вектором, как описано выше, и "хелперным экспрессирующим вектором", т.е. вирусным геномом. Кондиционно реплицирующийся вектор обладает селективным преимуществом в отношении упаковки и/или размножения. Более того, вектор, например, может содержать последовательность, которая повышает способность клетки к выживанию, стимулирует образование вируса, индуцирует апоптоз, облегчает образование белка и/или стимулирует иммунную функцию и/или нацеленность. Конструкция "хелперный экспрессирующий вектор" является экспрессирующим вектором, который компенсирует неспособность "вектора" к репликации. Такие хелперные экспрессирующие векторы являются обычными, и средние специалисты могут легко сконструировать их. Хелперный экспрессирующий вектор может быть либо упакован в вирионы, как основной вектор, либо экспрессироваться без необходимости упаковки. Поскольку "вектор" имеет селективное преимущество при упаковке и/или размножении, указанная система обеспечивает надежное средство для достижения высокого уровня репликации вируса без возможных патогенных эффектов, которые потенциально может вызвать живой аттенуированный вирус. Кроме того, вектор может быть смешан с неспецифическими адъювантами для повышения иммуногенности. Такие адъюванты известны специалистам и включают (но не ограничиваются указанным) полный или неполный адъювант Фрейнда, эмульсии, содержащие компоненты клеточной стенки бактерий и микобактерий, и т.д.
При использовании вектора согласно вышеописанному способу для профилактики вирусной инфекции вектор может кодировать антигенный белок, который не кодируется вирусом дикого типа, например мутантный вирусный или невирусный белок. Соответственно антиген, кодируемый вектором, может быть бактериальной природы или, например, происходить из раковой клетки. Более того, "вектор" может кодировать и ген МНС (Главного комплекса гистосовместимости) для надлежащей презентации антигена иммунной системе хозяина. Таким образом, эти векторы могут быть использованы для облегчения получения устойчивого иммунологического ответа против широкого круга потенциальных патогенов и/или эндогенных белков (например, опухолеспецифических антигенов), которые селективно экспрессируются в аномальных клетках.
Более того, "хелперный вирусный" (также называемый здесь "хелперный") экспрессирующий вектор, который экспрессируется только в специфических типах клеток (например, стволовых клетках, специальных антиген-презентирующих клетках и опухолевых клетках), может быть получен генно-инженерными способами посредством введения (или удаления) специфического генетического элемента/фактора либо в векторе (из вектора), либо в экспрессирующий хелперный вирус (из вируса), который позволяет клеточно-специфическому вектору реплицироваться и распространяться. Таким образом, вектор распространяется также при комплементации с хелперным вирусом, но это распространение является клеточно-специфическим и зависящим от добавления или удаления определенного генетического элемента/фактора к вектору (из вектора) или экспрессирующему хелперному вирусу (из вируса). Указанный подход может быть использован отдельно или в сочетании с другими вышеупомянутыми подходами.
Например, может быть сконструирован кондиционно реплицирующийся ВИЧ-вектор для специфической репликации в макрофагах, а не в Т-клетках. Вектор, который может представлять Tat-дефектный ВИЧ (вектор кодирует другие белки ВИЧ, но они не экспрессируются вследствие отсутствия трансактиватора транскрипции Tat), может кодировать рибозим, который расщепляет ВИЧ дикого типа, но не РНК кондиционного реплицирующегося ВИЧ. Хелперный экспрессирующий вектор для указанного вектора может кодировать ген tat, экспрессирующийся с помощью специфического промотора макрофагов. Таким образом, crВИЧ мог бы кондиционно реплицироваться только в клетках макрофагов, будучи при этом неспособным к репликации в Т-клетках или клетках других типов.
Альтернативно, ген tat может быть оперативно связан с опухолеспецифическим промотором; таким образом, crВИЧ в этом случае может реплицироваться только в опухолевых CD4 клетках, а не в нормальных клетках. Генетический элемент/фактор может представлять собой модифицированную промоторную последовательность вектора, такую, которая экспрессируется только в клетках определенного типа, а не в клетках других типов, в комплексе с экспрессирующим "хелперным вирусом".
В другом варианте осуществления изобретения белки оболочки хелперной экспрессирующей конструкции или векторной конструкции (если такие конструкции предусматривают наличие в них белков оболочки) могут быть модифицированы таким образом, что вектор-вирион будет специфически инфицировать клетки определенных типов (например, опухолевые клетки), будучи неспособным инфицировать клетки других типов (например, нормальные клетки). Согласно еще одному варианту осуществления изобретения аденовирус, у которого отсутствует один или несколько ключевых факторов, необходимых для репликации, мог бы подвергаться комплементации с использованием хелперной конструкции, которая обеспечивает указанные факторы, связанные с опухолеспецифическим промотором. Таким образом, факторы, которые комплементируют репликацию аденовируса, экспрессировались бы только в опухолевых клетках, обеспечивая таким образом репликацию вируса в опухолевых клетках (с экспрессией белков, необходимых для уничтожения клетки), но не в нормальных клетках.
Таким образом, настоящее изобретение также относится к способу лечения рака и, в частности, лечения Т-клеточного лейкоза. "Лечение рака" в соответствии с изобретением предусматривает введение хозяину дальнейшим образом модифицированного вектора (как раскрывается в настоящей заявке) с целью генерации терапевтического ответа. Такой ответ может быть оценен, например, мониторингом уменьшения роста опухоли и/или регрессии опухоли. "Рост опухоли" подразумевает увеличение размера опухоли и/или числа самих опухолей. "Регрессия опухоли" означает уменьшение массы опухоли.
Термин "Рак" в соответствии с заявленным изобретением означает заболевания, которые характеризуются аномальной пролиферацией клеток и отсутствием контактного ингибирования, что подтверждается образованием опухоли. Указанное понятие относится как к самим опухолям, а также и к таким злокачественным клеткам, которые распространяются из опухоли локально путем инвазии или системно путем метастазирования. Теоретически, любой тип рака можно лечить при использования способа. Предпочтительным, однако, является рак вирусной природы.
Наконец, вышеописанные векторы могут быть непосредственно использованы для генотерапии in vivo. Известные стратегии генотерапии несовершенны, поскольку они не могут обеспечить доставку гена в большую часть клеток; инфицируется только незначительный процент клеток. Это особенно важно в случае противораковых стратегий, когда решающим моментом является трансдукция гена всей опухолевой популяции. При использовании "вектора" в сочетании с "хелпером" непосредственно трансдуцированные клетки будут формировать вирусные частицы, которые способны инфицировать соседние клетки, и что приводит к высокому уровню и наиболее эффективной трансдукции. В одном варианте осуществления этого изобретения ретровирус человека (который может быть ВИЧ или элементом ретротранспозона) способен доставляться в ткань (или клетки in vitro) совместно с "хелперной" конструкцией. Клетки, получившие вектор и хелпер, будут продуцировать вирус и кондиционно упаковывать вектор в вирионы. Эти вирионы будут способны вызывать высокоэффективную трансдукцию соседних клеток (поскольку контакт типа "клетка-клетка" является наиболее эффективным средством их трансдукции). Немедленно трансдуцированные клетки могут или не могут погибнуть в зависимости от того, приводит ли комбинация вектор/хелпер к цитолитической инфекции. В случае ретротранспозона хелпер может необязательно включать структурные белки, поскольку нормальные или опухолевые клетки могут содержать белок/фактор, необходимый для инкапсидации в вирионы. В этом случае хелпер может быть только (без ограничений указанным) белком трансактиватора, который активирует транскрипцию факторов, необходимых для инкапсидации ретротранспозона. В случае ВИЧ другие факторы могут, но не необязательно, требоваться для инкапсидации генома ВИЧ в вирионы потомства для инфицирования/трансдукции клеток.
Вышеописанные векторы могут быть использованы против биологических и химических способов ведения войны. Например, кондиционно реплицирующийся вектор может быть введен индивидууму, недавно инфицированному высокопатогенным вирусом или бактерией или химическим агентом (например, токсином). Вектор будет интерферировать с репликацией патогенного вируса, как описано ранее. Однако кондиционно реплицирующийся вектор может быть также использован в сочетании с хелперным экспрессирующим вектором ("хелпером") и при осуществлении противобактериальных и противохимических стратегий.
Например, кондиционно реплицирующийся вектор может определять секрецию антител против бактерий или токсинов после того, как "хелпер" обеспечит его экспрессию и размножение. "Хелпер" может (но не обязательно) контролироваться индуцибельным промотором, который направляет его экспрессию при активации бактерией, цитокином (в ответ на бактериальную инфекцию), антибиотиком (как в случае системы тетрациклин-индуцируемых промоторов (Paulus et al., J. Virol., 79, 62-67 (1996)) или химическим агентом (например, самим токсином). Таким образом, кондиционно реплицирующийся вектор мог бы не только селективно размножаться с помощью "хелпера" в ответ на введенный патоген или токсин (как результат активации хелпера), но и секретировать антитела против патогена или токсина для ингибирования патологических эффектов опухолевого антигена, патогена или химического агента (например, токсина). Таким образом, любой белок, фактор или генетический элемент, который может быть транскрибирован с образованием мРНК и/или белка, может быть введен в кондиционно реплицирующийся вектор для ингибирования патогенной реакции в комплексе с "хелпером", который способствует его селективному размножению и экспрессии (селективному, потому что продукты хелпера экспрессируются кондиционно, например в следующих случаях, но не ограничиваясь указанным: (а) система индуцибельного промотора является фактором, который в опухолевой клетке активирует образование хелперного фактора, токсин-чувствительной последовательностью, которая экспрессирует хелперный фактор или цитокин-чувствительным промотором, который индуцирует образование хелперного фактора, (б) хелперные РНК/белок/фактор селективно стабилизированы в определенных клетках, но не в других клетках и (в) непрямая индукция третьего гена, который воздействует на образование белка хелперного вируса, обусловливая направленность, структуру и другие биологические функции). Такие стратегии могут быть использованы в трансгенных растениях и животных для их защиты от патогенов. Подобным образом такие стратегии могут быть использованы в трансгенных системах для получения гетерологичных ценных белков/факторов.
Согласно другому варианту осуществления заявленного способа может быть получена клеточная линия с целью скрининга лекарственного вещества/фактора для определения, например того, какая часть белка/фактора является важной для осуществления данной функции. Может быть сконструирован вектор для экспрессии мутагенизированного белка, представляющего интерес, в заданной клеточной линии. РНК, кодирующей мутагенизированный белок, однако, придают резистентность к рибозиму с помощью инсерции молчащих точковых мутаций, например. Экспрессия белка дикого типа, однако, ингибируется в клеточной линии. И могут быть сконструированы и векторы, экспрессирующие рибозим к белку, представляющему интерес, которые экспрессируют мутантный тест-белок. При трансдукции вектора в клетки большая часть нативной РНК, кодирующей нормальный белок, расщепляется, тогда как мутантный тест-белок экспрессируется. Этот способ может быть осуществлен при использовании недавно разработанных методик доставки и селекции в качестве быстрой и эффективной процедуры определения, как действует данный белок и каким образом система фактор/лекарственное вещество взаимодействует с белком.
Могут быть осуществлены и другие многочисленные варианты применения способа и векторов, заявленных в соответствии с настоящим изобретением, in vitro. Например, векторы могут быть использованы для установления определенных деталей репликации вирусов и функции рибосом. Подобным образом рибозим-содержащие векторы могут быть использованы как диагностические инструменты, например, для оценки мутаций в больных клетках или для исследования дрейфа генов. Сказанное выше не является исчерпывающим в отношении использования настоящего изобретения.
Преимущества изобретения
Преимущества использования стратегии crВИЧ для генетической терапии СПИДа и других вирусных заболеваний являются значительными. Например, решается проблема доставки вектора в клетки, инфицированные ВИЧ. После трансфекции in vivo crВИЧ инфицированных CD4+ клеток, crВИЧ упаковывается в вирионы потомства с использованием эндогенных белков оболочки инфекционного ВИЧ. Таким образом, РНК crВИЧ проникает в вирионы потомства и заражает типы клеток, в норме инфицирующиеся тем определенным штаммом ВИЧ, формирует непатогенные вирионы. Это учитывает трудности доставки вектора к клеткам, таким как микроглия головного мозга, которые являются основным резервуаром ВИЧ-инфекции центральной нервной системы. Вероятно, существует небольшая токсичность, ассоциированная с crВИЧ-векторами, которые заражают неинфицированные CD4+ клетки, поскольку crВИЧ-векторы не кодируют никаких вирусных белков. Более того, результатом конкуренции crВИЧ-вектора с ВИЧ дикого типа является образование непатогенных частиц, которые приводят к снижению вирусной нагрузки. Снижение нагрузки патогенного ВИЧ-1 не только может увеличить продолжительность жизни инфицированных индивидуумов, но и уменьшить скорость передачи вируса неинфицированным индивидуумам, поскольку частицы crВИЧ также могут распространяться системно (т.е. как инфекционный ВИЧ). Сниженные нагрузки патогенного ВИЧ-1 в крови могут быть особенно важными для беременных ВИЧ-инфицированных женщин, поскольку образование crВИЧ может уменьшать и передачу ВИЧ-1 от инфицированных матерей их плоду in utero.
Смесь "плазмидная ДНК/липид", которая может быть использована для интродукции crВИЧ-вектора в клетки-хозяева, является стабильной и недорогой по сравнению с более дорогими стратегиями ex vivo. Конечно, способ по изобретению является гибким по своей природе в том плане, что он мог бы применяться для доставки генов ех vivo, если бы указанное было желательно. Независимо от этого доступность связанного с липосомами подхода открывает возможность лечения основной части больных, что неосуществимо при использовании имеющихся стратегий генной терапии. Могут быть сконструированы crВИЧ-векторы, которые содержат несколько рибозимов, направленных к различным мишеням в геноме ВИЧ. Это снижает возможность мутаций инфекционного ВИЧ и избежания им действия антиВИЧ-рибозимов. Более того, стратегия на основе кондиционно репликативно-компетентного вируса может быть использована для лечения других вирусных инфекций, особенно имеющих высокую скорость прохождения цикла.
Особенно полезным свойством crВИЧ-векторов является то, что они могут быть использованы для экспрессии генетических антивирусных агентов, например рибозимов, пост-транскрипционным образом. Соответственно заражение неинфицированных клеток crВИЧ-векторами приводит к снижению токсичности, поскольку с промотора длинного концевого повтора (LTR) ВИЧ при отсутствии белка Tat происходит незначительная экспрессия. Высокие уровни экспрессии crВИЧ и его последующая антивирусная активность обнаруживается только тогда, когда белок Tat комплементируется ВИЧ дикого типа. Таким образом, crВИЧ-векторы разработаны не для защиты клеток от ВИЧ-инфекции, но для снижения общей вирусной нагрузки ВИЧ дикого типа посредством селективного накопления непатогенных частиц crВИЧ.
Не будучи связанными какой-либо определенной теорией, касающейся использования изобретения, авторы считают, что рибозимы могут быть использованы, как описано в следующих Примерах, для получения геномов crВИЧ с селективным преимуществом, обусловленным двумя полезными признаками: (1) высоким уровнем специфичности и (2) относительной эффективностью, зависящей от способности геномов к совместной локализации с РНК-мишенями (Cech, Science, 236, 1532-1539 (1987)). Специфичность рибозимов обусловливается их специфической гибридизацией с комплементарными последовательностями-мишенями, содержащими caйт XUY. Рибозимы обладают относительной эффективностью, поскольку они расщепляют РНК-мишени с высокой эффективностью только тогда, когда они совместно локализованы с РНК-мишенями. При смешанной инфекции ВИЧ/crВИЧ должна происходить совместная локализация рибозим-содержащих РНК crВИЧ с РНК ВИЧ дикого типа, поскольку геномы РНК ВИЧ димеризуются перед упаковкой в вирионы потомства. Расщепление негеномных типов РНК ВИЧ дикого типа, необходимое для образования вирусных белков, вероятно, является менее эффективным, чем расщепление геномной РНК ВИЧ дикого типа, потому что негеномные РНК ВИЧ не димеризуются. В описанных здесь экспериментах обнаружено, что селективное преимущество, обеспечиваемое РНК crВИЧ, обусловлено селективной упаковкой crВИЧ в вирусные частицы. Эти результаты позволяют предположить, что наиболее эффективное расщепление происходит внутриклеточно во время димеризации, приводя к селективному разрушению РНК ВИЧ дикого типа нуклеазами хозяина. Это обеспечивает предпочтительную упаковку РНК crВИЧ в вирусные частицы.
Применение crВИЧ-векторов для терапии ВИЧ может включать не только селекцию crВИЧ на уровне геномов, но также и селекцию клеток, образующих частицы crВИЧ, на уровне клеток. В противном случае клетки, образующие ВИЧ дикого типа, будут продуцировать частицы ВИЧ дикого типа с селективным преимуществом перед клетками, образующими частицы crВИЧ, и будут в скором времени доминировать. Селективное преимущество может быть обеспечено crВИЧ-экспрессирующим клеткам посредством встраивания в геномы crВИЧ гена (например, гена множественной лекарственной устойчивости), который обеспечивает crВИЧ-экспрессирующим клеткам (в присутствии лекарственного вещества) преимущества в выживаемости перед клетками, экспрессирующими ВИЧ дикого типа. В этих условиях клетки, экспрессирующие ВИЧ дикого типа, погибают прогрессирующим образом, но еще образуют какое-то количество ВИЧ дикого типа, тогда как crВИЧ-экспрессирующие клетки, которые селективно образуют crВИЧ, выживают. Инфекция crВИЧ-содержащих клеток остающимся ВИЧ дикого типа приведет к дальнейшему образованию crВИЧ-содержащих вирусных частиц. Таким образом, шифт вирусного генома может привести к кумулятивному инфицированию CD4+ клеток геномами crВИЧ, изменяя баланс вирусов в хозяине от патогенного ВИЧ дикого типа к непатогенным геномам crВИЧ. Такая стратегия может привести к освобождению от ВИЧ дикого типа, когда баланс геномов ВИЧ селективно сдвигается от ВИЧ дикого типа к crВИЧ. Репликация вирусов действительно снижается, поскольку crВИЧ может реплицироваться только в присутствии хелперных геномов ВИЧ дикого типа. В связи с этим, принимая во внимание такие взаимно ограничивающие условия, становится возможным конструирование crВИЧ-векторов, которые не только уменьшают нагрузки ВИЧ дикого типа, но и освобождают от ВИЧ-инфицированного хозяина.
Средства введения
Согласно изобретению вектор интродуцируют в клетку-хозяин, нуждающуюся в генотерапии вирусной инфекции, как описано ранее. Средства введения предусматривают контактирование хозяина, способного к инфицированию вирусом, с вектором по изобретению. Такое контактирование предпочтительно предусматривает любые средства, с помощью которых вектор вводят в клетку-хозяин; способ не зависит ни от каких определенных средств введения и не требует обсуждения этого. Средства введения вектора хорошо известны специалистам, а также приведены здесь в примерах.
Соответственно интродукция может быть осуществлена, например, либо in vitro (способ генотерапии типа ex vivo), либо in vivo, что включает электропорацию, трансформацию, трансдукцию, конъюгацию или трехродительское скрещивание, трансфекцию, инфицирование, слияние мембран с катионными липидами, высокоскоростную бомбардировку микрочастицами, инкубирование преципитата ДНК с фосфатом кальция, прямую микроинъекцию в отдельные клетки и т.д. Другие способы также доступны и известны специалистам.
Предпочтительна, однако, интродукция векторов и рибозимов с помощью катионных липидов, например липосом. Такие липосомы имеются в продаже (например, Lipofectin®, Lipofectamine™ и т.д., предлагаемые Life Technologies, Gibco BRL, Gaithersburg, MD). Более того, липосомы, имеющие повышенную переносящую способность и/или пониженную токсичность in vivo (например, как описанные в патентной заявке РСТ №WO 95/21259), могут быть использованы при осуществлении настоящего изобретения. Для введения липосом можно следовать рекомендациям, изложенным в заявке РСТ №93/23569. В целом, при таком применении препарат поглощается большинством лимфоцитов в течение 8 час, при 37°С, более чем 50% введенной дозы определяется в селезенке через час после внутривенного введения. Другие средства доставки препаратов включают гидрогели и полимеры с контролируемым высвобождением.
Форма вектора, введенного в клетку-хозяин, может варьировать, в частности, от того, введен ли вектор in vitro или in vivo. Например, нуклеиновая кислота может быть замкнутой в кольцо, иметь однонитевые разрывы или быть линейной в зависимости от того, должен ли вектор поддерживаться экстрагеномно (т.е. как автономно реплицирующийся вектор), интегрирован ли он как провирус или профаг, временно трансфицирован, временно инфицирован, как при использовании репликационно-дефектного или кондиционно реплицирующегося вируса, или стабильно введен в геном хозяина посредством событий рекомбинации с помощью двойного или одинарного кроссинговера.
Перед интродукцией хозяину вектор по изобретению может быть введен в различные композиции для применения в профилактических и терапевтических способах. В частности, вектор может быть введен в фармацевтическую композицию совместно с подходящими фармацевтически приемлемыми носителями или разбавителями и может быть получен в виде препарата, пригодного как для введения человеку, так и для ветеринарии.
Таким образом, композиция используемая при осуществлении способа по настоящему изобретению, может содержать один или более вышеупомянутых векторов, предпочтительно в комбинации с фармацевтически приемлемым носителем. Фармацевтически приемлемые носители известны специалистам, как и подходящие способы введения. Выбор носителя будет частично определяться определенным вектором, а также определенным способом введения композиции. Специалист способен понять, что приемлемы различные методы введения композиции, и хотя более чем один способ может быть использован для введения, определенный метод способен обеспечивать более быструю и более эффективную реакцию, чем другой способ. В соответствии с указанным имеется широкий ряд подходящих составов на основе композиции, заявленной в соответствии с настоящим изобретением.
Композиция, содержащая заявленный вектор, как сам по себе, так и в сочетании с другими антивирусными соединениями, может быть приготовлена в виде состава, пригодного для парентерального введения, предпочтительно интраперитонеального введения. Такой препарат может представлять собой водные и неводные изотонические стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферы, бактериостатики и растворенные вещества, которые обеспечивают изотоничность состава по отношению к крови предполагаемого реципиента, а также водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты, солюбилизаторы, загустители, стабилизаторы и консерванты. Препараты могут быть представлены единичной дозой или мультидозными запечатанными контейнерами, такими как ампулы и флаконы, и могут храниться в высушенной замораживанием (лиофилизированной) форме, требующей только добавления стерильного жидкого носителя, например воды для инъекций, непосредственно перед применением. Инъекционные растворы и суспензии непостоянного состава могут быть приготовлены из стерильных порошков, гранул и таблеток, как описано здесь.
Препарат, пригодный для перорального применения, может представлять собой жидкий раствор, такой как раствор эффективного количества соединения в разбавителях, например воде, физиологическом растворе или фруктовом соке; капсулы, пакетики или таблетки, содержащие определенное количество активного ингредиента в виде твердого вещества или гранул; растворы или суспензии в водной среде; эмульсии типа "масло в воде" или эмульсии типа "вода в масле". Таблетированные формы могут включать один или более из следующих компонентов: лактозу, маннит, кукурузный крахмал, картофельный крахмал, микрокристаллическую целлюлозу, гуммиарабик, желатин, коллоидный диоксид кремния, кроскармеллозу натрия, тальк, стеарат магния, стеариновую кислоту и другие наполнители, окрашивающие агенты, разбавители, буферные агенты, смачивающие агенты, консерванты, придающие вкус агенты и фармакологически приемлемые носители.
Может быть приготовлен и аэрозольный препарат для ингаляционного введения. Аэрозольный препарат может быть помещен в подходящий пропеллант, находящийся под давлением, такой как дихлордифторметан, пропан, азот и т.д.
Подобным образом препарат, пригодный для перорального введения, может представлять собой леденец, который может содержать активный ингредиент в носителе, придающем запах и вкус, обычно сахарозе и гуммиарабике или трагаканте; пастилки, содержащие активный ингредиент в инертной основе, такой как желатин и глицерин или сахароза и гуммиарабик; полоскания для рта, содержащие активный ингредиент в подходящем жидком носителе, а также кремы, эмульсии, гели и т.д., содержащие кроме активного ингредиента носители, известные из уровня техники.
Препарат, пригодный для наружного применения, может представлять собой крем, мазь или лосьон.
Препарат для ректального введения может представлять собой суппозиторий с подходящей основой, например маслом какао или салицилатом. Препарат, пригодный для вагинального введения, может быть представлен вагинальным суппозиторием, тампоном, кремом, гелем, пастой, пеной или спреем, содержащим в дополнение к активному ингредиенту такие носители, которые, как известно из уровня техники, являются подходящими. Подобным образом, активный ингредиент может быть скомбинирован со смазывающим агентом в виде покрытия для презерватива.
Доза, введенная животному, в частности человеку, в соответствии с настоящим изобретением, должна быть достаточной для генерации терапевтического ответа у инфицированного индивидуума через приемлемый период времени. Доза будет определяться возможностями определенного вектора, применяемого для лечения, тяжестью заболевания, а также массой тела и возрастом инфицированного индивидуума. Величина дозы будет зависеть и от возможных нежелательных побочных эффектов, которые могут сопровождать применение конкретного вектора. Насколько возможно, необходимо свести к минимуму указанные нежелательные побочные эффекты.
Препарат может быть в форме единичной дозы, такой как таблетка или капсула. Термин "единичная доза", как используется в настоящем описании, относится к физически дискретным единицам, пригодным для введения в качестве отдельных доз человеку и животному, при этом каждая доза содержит заданное количество вектора, как самого по себе, так и в сочетании с другими антивирусными агентами, рассчитанное по количеству, достаточному для получения желательного эффекта в комплексе с фармацевтически приемлемым разбавителем, носителем или доставляющим агентом. Форма единичной дозы по настоящему изобретению будет зависеть от используемого соединения или соединений и эффекта, который следует получить, а также от фармакодинамики каждого соединения в организме хозяина. Вводимая доза должна быть "антивирусным эффективным количеством" или количеством, необходимым для достижения "эффективного уровня" у отдельного больного.
Поскольку "эффективный уровень" используют как предпочтительное конечное значение дозировки, действительная доза и схема введения препарата могут меняться в зависимости от различий между индивидуумами, связанными фармакокинетикой, распределением, и метаболизма лекарственного вещества. "Эффективный уровень" может быть определен, например, как желательный для больного уровень препарата в крови или ткани, который соответствует концентрации одного или более вектора(ов) по изобретению, ингибирующей вирус, такой как ВИЧ, при осуществлении анализа, прогнозирующего клиническую антивирусную активность химических соединений. "Эффективный уровень" соединений по настоящему изобретению может изменяться и в том случае, когда заявленные композиции используют в комплексе с зидовудином или другими известными антивирусными соединениями или их комбинациями.
Специалист может легко установить соответствующую дозу, схему и способ введения определенного состава используемой композиции с достижением желаемого "эффективного уровня" у отдельного больного. Кроме того, специалист может легко выявить и использовать подходящий индикатор "эффективного уровня" соединений, заявленных в соответствии с настоящем изобретением прямым (например, аналитическим химическим анализом) или непрямым (например, с помощью суррогатных индикаторов вирусной инфекции, таких как р24 или обратная транскриптаза, для лечения СПИДа и подобных СПИДу заболеваний) анализом соответствующих образцов, полученных от больного (например, образцов крови и/или тканей).
Далее, для определения эффективного уровня препарата у больного при лечении СПИДа или подобных СПИДу заболеваний, в частности, могут быть использованы подходящие модели на животных, которые широко применяются для оценки in vivo эффективности в отношении ВИЧ различных методик генотерапии (Sarver et al. (1993b), supra). Эти модели разработаны на мышах, обезьянах и кошках. Хотя эти животные не являются естественным образом восприимчивыми к заболеванию, вызываемому ВИЧ, химерные модельные мыши (например, SCID, bg/nu/xid, BALB/c с удаленным костным мозгом), содержащие человеческие мононуклеарные клетки периферической крови (РВМС), лимфатические узлы или эмбриональные ткани печени/тимуса, могут быть инфицированы ВИЧ и использованы как модели патогенеза ВИЧ и генотерапевтических подходов. Подобным образом могут быть использованы модели на обезьянах (вирус иммунодефицита обезьян (SIV)) и кошках (вирус иммунодефицита кошек (FIV)).
В целом, количество вектора, достаточное для достижения концентрации в ткани введенного рибозима (или вектора) от примерно 50 до 300 мг/кг массы тела в день является предпочтительным, в особенности от примерно 100 до 200 мг/кг массы тела в день. При некоторых способах применения, например наружном, глазном или вагинальном, предпочтительны множественные ежедневные дозы. Более того, количество доз будет изменяться в зависимости от средств доставки и особенностей определенного вектора.
При лечении некоторых инфицированных вирусом индивидуумов может быть желательным применение схемы "мегадоз", при которой вводят большую дозу вектора, позволяют соединению некоторое время действовать, а затем индивидууму вводят подходящий реагент для инактивации активного соединения(ий). При осуществлении способа по настоящему изобретению терапевтическое воздействие (т.е. репликация вектора при конкуренции с вирусом, на который направлено воздействие) является обязательно ограниченным. Другими словами, при снижении уровня, например, ВИЧ уровень вектора, зависимый от ВИЧ с точки зрения образования вирионов, будет также снижаться.
Фармацевтическая композиция для лечения СПИДа может содержать другие фармацевтические агенты в сочетании с вектором, заявленным в соответствии с изобретением. Другие фармацевтические агенты могут быть использованы традиционным образом (т.е. как агенты для лечения ВИЧ-инфекции) или более специфически для селекции вирусов crВИЧ in vivo. Такая селекция, как описано в настоящей заявке, будет способствовать распространению кондиционного реплицирующегося ВИЧ и обеспечивать кондиционно реплицирующемуся ВИЧ более эффективную конкуренцию с ВИЧ дикого типа, что будет обязательно ограничивать патогенность ВИЧ дикого типа. В особенности, имеется в виду использование антиретровирусного агента, предпочтительно зидовудина. Далее приведены примеры дополнительных фармацевтических агентов, которые могут быть использованы в дополнение к описанным ранее, в том числе антивирусных соединений, иммуномодуляторов, иммуностимуляторов, антибиотиков и других агентов, а также способы лечения (включая те, которые называют альтернативной медициной), которые могут быть использованы для терапии СПИДа. Антивирусные соединения включают, но не ограничиваются ddI, ddC, ганцикловиром, фторированными дидезоксинуклеотидами, соединениями ненуклеозидных аналогов, таким и как невирапин (Shin et al., PNAS, 88, 9878-9882 (1991)), производными TIBO, такими как R82913 (White et al., Antiviral Research, 16, 257-266 (1991)) и DI-RJ-70 (Shih et al., Am. J. Med., 90 (Suppl. 4A), 8S-17S (1991)). Иммуномодуляторы и иммуностимуляторы включают, но не ограничиваются различными интерлейкинами, CD4, цитокинами, препаратами антител, ртансфузионными препаратами крови и клеток. Антибиотики включают, но не ограничиваются противогрибковыми агентами, антибактериальными агентами и агентами против Pneumocystis carinii.
Применение вирус-ингибирующего соединения с другими антиретровирусными агентами, в частности с известными ингибиторами RT (обратной транскриптазы), такими как ddC, зидовудином, ddI, ddA или другими ингибиторами, которые активны в отношении других белков ВИЧ, например анти-ТАТ агентами, будет в основном ингибировать большинство или все стадии репликации жизненного цикла вируса. Дозы ddC и зидовудина, используемые для больных СПИДом или ARC, опубликованы. Вирусостатический диапазон ddC составляет в среднем 0,05 мкМ - 1,0 мкМ. Диапазон, составляющий примерно 0,005-0,25 мг/кг массы тела является вирусостатическим для большинства больных. Интервал доз для перорального введения несколько шире и составляет, например, 0,001-0,25 мг/кг; дозы принимают однократно или многократно с интервалами 2, 4, 6, 8 и 12 и т.д. час. Предпочтительно, дозу ddC 0,01 мг/кг массы тела, принимают каждые 8 час. При использовании в комбинированной терапии другое антивирусное соединение, например, может быть введено в то же самое время, что и вектор по изобретению, или при необходимости дозировка может быть изменена. Дозы каждого агента могут быть меньше при использовании в комбинации с другими агентами, чем в том случае, когда применяются индивидуально.
ПРИМЕРЫ
Соединения и способы, заявленные в соответствии с настоящим изобретением, далее описываются в следующих примерах. Эти примеры служат для дальнейшей иллюстрации настоящего изобретения и не предназначены для ограничения объема изобретения.
Пример 1
В этом примере описывается конструирование кондиционно репликационно-компетентных векторов. В частности, данный пример характеризует конструирование кондиционно реплицирующихся векторов на основе ВИЧ, т.е. crВИЧ-векторов. Одним из самых важных аспектов патогенеза ВИЧ-1 является образование генетических вариантов вируса. Быстрое образование вариантов ВИЧ in vivo указывает на то, что вирус может рассматриваться с точки зрения генетического моделирования по Дарвину (см., например, Coffin, Curr. Top. Vicroboil. Immunol., 176, 143-164 (1992) и Coffin, Science, 267, 483-489 (1995)). Варианты образуются вследствие нестабильности молекулы обратной транскриптазы, которая генерирует мутации во вновь транскрибированных провирусах с геномной РНК вируса. Вследствие этого в условиях in vivo при отсутствии важных узких мест и многочисленных циклов репликации происходит существенное количество генетических вариаций с образованием многочисленных вариантов вируса. Однако ВИЧ дикого типа доминирует и в таких неограничивающих условиях он имеет самое высокое селективное преимущество. Однако в присутствии ингибитора, например зидовудина, селективно отбирается вариант вируса, который обладает большим селективным преимуществом, чем штамм дикого типа, и он впоследствии становится доминирующим (Coffin (1992) и (1995), supra). В соответствии с указанным настоящее изобретение обеспечивает кондиционно реплицирующийся вирусный вектор, который образует непатогенные геномы ВИЧ-1 с селективным преимуществом перед патогенным ВИЧ-1 дикого типа.
Непатогенные кондиционно реплицирующиеся ВИЧ (crВИЧ)-векторы являются дефектными ВИЧ, репликация и упаковка которых происходит только в клетках, которые инфицированы ВИЧ дикого типа. Геномы crВИЧ конкурируют с патогенным ВИЧ дикого типа и снижают вирусную нагрузку. Эффект снижения вирусной нагрузки ВИЧ дикого типа в инфицированном хозяине должен приводить к увеличению вероятности выживания. Он должен также уменьшать способность инфицированных хозяев передавать ВИЧ дикого типа неинфицированным индивидуумам. Для успешной конкуренции crВИЧ с ВИЧ-1 дикого типа важными являются два фактора: (1) селективное преимущество геномов crВИЧ перед геномами ВИЧ дикого типа и (2) селективное преимущество crВИЧ-экспрессирующих клеток перед клетками, экспрессирующими ВИЧ дикого типа.
CrВИЧ-векторы кондиционно реплицируются вследствие того факта, что они содержат последовательности, необходимые для экспрессии РНК, димеризации и упаковки, но не экспрессируют активные (т.е. дикого типа) белки ВИЧ-1. Селективное преимущество векторов crВИЧ обеспечивают встраиванием в них кассеты рибозимов, которая расщепляет участок U5 генома ВИЧ дикого типа, но не РНК U5 crВИЧ.
Рибозимы, входящие в состав векторов, не расщепляют РНК crВИЧ, потому что участок U5 РНК crВИЧ модифицируют консервативным замещением основания (замещения оснований обнаруживаются в других штаммах ВИЧ) для того, чтобы препятствовать эффективному связыванию и расщеплению соответствующих сайтов рибозимами. Более того, crВИЧ являются непатогенными, потому что они не кодируют белков, которые, как считается, являются ответственными за гибель CD4+ клеток. Когда ВИЧ-инфицированные клетки (трансфицированные crВИЧ-вектором)активируются, то становятся способными комплементировать геномные дефекты crВИЧ, приводя к образованию вирионов потомства crВИЧ.
В основном геномы crВИЧ конструируют на основе инфекционного полноразмерного клона ВИЧ pNL4-3 (Adachi et al. (1986), supra). Все реакции клонирования и манипуляции с ДНК, РНК и белками проводят, используя способы, которые описаны, например, Maniatis et al., Molecular Cloning: A Laboratory Manual, 2nd ed. (Cjld Spring Harbir Laboratory, NY (1982)). Ферменты и реагенты, используемые в соответствующих реакциях, получают из коммерческих источников (например, New England Biolabs, Inc., Beverly, MA; Clontech, Palo Alto, CA и Boehringer Mannheim, Inc., Indianapolis, IN) и применяют в соответствии с рекомендациями производителей. Более того, поддержание и размножение вектора проводят с помощью способов, которые хорошо известны из уровня техники и описаны ранее (например, Dropulic' et al. (1992), supra; и Dropulic' et al. (1993), supra).
pNL4-3 расщепляют ферментами Pst I (который расщепляет gag приблизительно в положении +1000 от начала транскрипции) и Xho I (который расщепляет nef приблизительно в положении +8400 от начала транскрипции) и вводят полилинкер, содержащий удобные сайты рестрикции. Фрагмент BgI II до Bam HI длиной 0,86 т.п.н., содержащий отвечающий элемент rev (RRE) клонируют в сайт Bam HI, присутствующий в полилинкере. Эти манипуляции приводят к делеции в геноме ВИЧ дикого типа от кодирующего участка gag до кодирующего участка U3 (т.е., таким образом к делеции гена nef). Хотя вектор способен образовывать усеченный транскрипт gag, он не экспрессирует полного активного белка Gag. Однако, поскольку функции Gag дикого типа не являются необходимыми в соответствии с изобретением, последовательности gag могут быть мутантными для предотвращения трансляции белка Gag.
Кассету рибозимов, содержащую либо один, либо многочисленные рибозимы, как описывается в настоящей заявке, вводят в сайт Sal I, локализованный в положение "downstreem" по отношению к сайту Bam HI. Для выполнения этого комплементарные дезоксиолигонуклеотиды, кодирующие последовательности рибозимов, синтезируют, отжигают и затем клонируют в сайт Sal I. Рибозимы, используемые для конструирования crВИЧ-векторов, представляют собой рибозимы в форме головки молотка. Эти рибозимы содержат каталитический домен из 22 пар оснований и два гибридизационных домена из 9 пар оснований каждый. Рибозимы "направлены" на сайт +115 или +113 (число пар оснований после начала транскрипции) последовательности РНК U5. Гибридизационные домены и каталитический домен (подчеркнут) рибозимов, направленные на сайт +115 и сайт +113, имеют следующую структуру:
CACACAACACTGATGAGGCCGAAAGGCCGAAACGGGCACA (рибозим +115) [SEQ ID №3]
ATCTCTAGTCTGATGAGGCCGAAAGGCCGAAACCAGAGTC ("рибозим +133) [SEQ ID №4]
Кассета рибозимов содержит один, два или три рибозима, расположенных тандемно. В векторах, содержащих либо один (т.е. "crВИЧ-1.1"-вектор, Фигура 1В), либо три (т.е. crВИЧ-1.111-вектор, Фигура 1Е) рибозима, рибозимы нацелены на один и тот же сайт РНК U5 ВИЧ в положении +115. В векторах, содержащих два рибозима, рибозимы нацелены либо на тот же самый сайт в положении +115, (т.е. crВИЧ-1.11-вектор, Фигура 1C), либо на различные сайты в положениях +115 и +133 PHK U5 ВИЧ, crВИЧ-1.12 (т.е. crВИЧ-1.12-вектор, Фигура 1D). Указанные векторы в целом рассматриваются здесь как "crВИЧ"-векторы.
При завершении конструирования crВИЧ-векторам придают резистентность к расщеплению рибозимами (при использовании их РНК-форм) посредством генерации мутаций в сайте, узнаваемым рибозимами в форме головки молотка, который находится в области U5 генома crВИЧ. Чтобы выполнить указанное, двунитевый олигонуклеотид
(т.e. AAGCTTGCCTTGAGTGCTCAAAGTAGTGTGTGCCCACCTGTTGTGTGACTCTG GCAGCTAGAGATCCCACAGACCCTTTTAGTCAGTGTGGAAAATCTCTAGCAGTGGC GCC [SEQ ID №13]), содержащий замещения оснований, приведенные на Фигуре 2 [SEQ ID №2] используют для введения модифицированных сайтов в вектор. Более точно, замещения оснований вводят в сайтах гибридизации и расщепления рибозима в паре оснований 115 и 133. В частности, как показано на Фигуре 2, мутации генерируют в парах оснований 113, 114, 132, 134 и 142. Эти сайты могут быть модифицированы таким образом, что они содержат какую-либо мутацию (т.е. GTGTGCCCNNCTGTTGTGTGACTCTGGNANCTAGAGANC, где N может быть любым нуклеотидом [SEQ ID №14]).
Предпочтительно, однако, когда последовательности мутируют таким образом, что в них имеется, например, замена G на А в сайте +113 (т.е. так, что последовательность содержит GTGTGCCCATCTGTTGTGTGACTCTGGTAACTAGAGATC [SEQ ID №15]), замена U (т.е. Т в случае ДНК) на С в сайте +114 [SEQ ID №5],
замена U (т.е. Т в случае ДНК) на С в сайте+132 [SEQ ID №6] замена А на G в сайте +134 (т.е. так, что последовательность содержит GTGTCGCCGTCTGTTTGTGTGACTCTGGTAGCTAGAGATC [SEQ ID №16] и замена U (т.е. Т в значения последовательности ДНК) на А в сайте +142, причем указанные мутации могут быть генерированы либо по отдельности, либо в комбинации. В частности, при отсутствии других мутаций в U5 замена U (т.е. Т в случае ДНК) на С в сайте +114 [SEQ ID №5] и/или в сайте +132 [SEQ ID №6] в РНК U5 crВИЧ препятствует разрезанию ее рибозимами (Uhlenbeck (1987), supra). Инсерции замен оснований - обнаруживаются в различных других штаммах ВИЧ (Myers et al., HIV Sequence Database, Los Alamos Nat. Lab. (1994)), это указывает, что такие замены не снижают способности генома ВИЧ к репликации.
Способ, как подтверждается настоящим описанием, может быть использован для конструирования других кондиционно реплицирующихся векторов, например, содержащих геномы различных вирусов (например, различных РНК-вирусов) или содержащих различные генетические антивирусные агенты. Далее, кондиционно реплицирующийся вектор может быть далее модифицирован таким образом, что он обеспечивает клетке-хозяину, в которую он введен, селективное преимущество перед клеткой-хозяином, содержащей вирус дикого типа. Например, указанный вектор может быть модифицирован так, что определяет множественную лекарственную устойчивость или кодирует мутантную протеазу или обратную транскриптазу.
Пример 2
В этот примере показана устойчивость кондиционно реплицирующихся векторов и, в частности, crВИЧ-векторов к расщеплению рибозимом.
Для подтверждения устойчивости crВИЧ-векторов к расщеплению рибозимом осуществляют транскрипцию in vitro. Для выполнения этого последовательности рибозимов клонируют в сайт Xho I pBluescript KSII (Stratagene, La Jolla, CA). Фрагмент BgI II длиной 0,21 кб (т.п.о.), содержащий мутантный участок U5 crВИЧ, подобным образом вырезают из crВИЧ-вектора и вводят в сайт Bam HI pBluescript KSII. Полученные модифицированные векторы pBluescript KSII линеаризируют с помощью Dss HII перед транскрипцией in vitro. Аналогичную плазмиду, экспрессирующую PHKU5 ВИЧ дикого типа (описанную Myers et al. (1994), supra), используют в качестве контроля. Ее линеаризируют Eco RI перед транскрипцией in vitro.
Меченную радиоизотопной меткой PHK U5 ВИЧ и РНК рибозима получают при транскрипции векторов in vitro, как описано ранее (Dropulic' et al. (1992), supra). Меченные радиоизотопной меткой транскрипты инкубируют вместе (при молярном соотношении мишень - рибозим 1:2) в 1Х транскрипционном буфере, содержащем 40 мМ Трис-HCl, рН 7,5, 6 мМ MgCl2, 2 мМ Спермидина и 10 мМ NaCl. Образцы нагревают до 65°С, а затем охлаждают до 37°С за 5 минут перед добавлением восстанавливающего буферного раствора, содержащего 95% формамида, 20 мМ EDTA (этилендиаминтетрауксусная кислота), 0,05% бромфенолового синего и 0,05% ксиленцианола FF. Затем продукты разделяют электрофорезом в полиакриламидном геле (PAGE) в денатурирующих условиях и определяют авторадиографически.
Когда PHK U5 ВИЧ дикого типа инкубируют с транскриптом, содержащим один рибозим к сайту+115, расщепление легко заметить. Такое расщепление приводит к образованию продуктов Р1 и Р2. Расщепление также можно видеть, когда РНК ВИЧ дикого типа инкубируют с РНК, содержащими двойные рибозимы либо к одному и тому же сайту, либо к различным сайтам. Когда рибозим-содержащий транскрипт, направленный на два различных сайта, инкубируют с РНК ВИЧ дикого типа, получают продукты Р1, Р2 и Р3. Р3 образуется в результате расщепления сайта +133.
Для сравнения, когда модифицированную U5-содержащую РНК crВИЧ инкубируют либо с одним рибозимом, направленным на сайт +115, либо с двойным рибозимом, направленным на сайт +115 или на сайт +133, продукты расщепления не обнаруживаются. Таким образом, эти результаты подтверждают, что РНК U5 crВИЧ являются резистентными к расщеплению рибозимами, тогда как РНК U5 ВИЧ дикого типа расщепляются рибозимами, нацеленными на U5. Более того, приведенные результаты подтверждают, что подход, используемый при осуществлении настоящего изобретения, может быть применен для получения кондиционно реплицирующихся векторов (включая векторы, отличные от crВИЧ-векторов) с селективным преимуществом по репликации при введении в клетку-хозяин по сравнению с штаммом вируса дикого типа.
Пример 3
В этом примере показана способность рибозим-содержащих кондиционно реплицирующихся векторов внутриклеточно расщеплять РНК вируса дикого типа. В частности, этот пример подтверждает способность crВИЧ-векторов внутриклеточно расщеплять РНК ВИЧ дикого типа.
Эффективность опосредованного crВИЧ-вектором ингибирования ВИЧ дикого типа тестируют совместной трансфекцией геномов в клетку Jurkat. Для проведения трансфекции промывают приблизительно 106 клеток Jurkat в среде Opti-MEM (Life Technologies, Gibco BRL, Gaithersburg, MD) и затем котрансфицируют клетки приблизительно 0,6 мкг ДНК ВИЧ дикого типа (т.е. pNL4-3) и приблизительно 1,8 мкг ДНК crВИЧ. Используют молярное соотношение ВИЧ дикого типа к провирусу crВИЧ 1:3 для того, чтобы гарантировать, что все клетки, трансфицированные ВИЧ дикого типа, содержат также провирусы crВИЧ. ДНК перемешивают в растворе липофектина (Life Technologies) в течение 30 мин, а затем инкубируют с клетками Jurkat примерно в течение 3-6 час, после чего добавляют полную среду RPMI 1640, содержащую эмбриональную бычью сыворотку (FBS). Вирус-содержащие супернатанты собирают каждые 2-4 дня и анализируют уровни вируса по активности обратной транскриптазы в клеточных супернатантах, как описано ранее (Dropulic' et al. (1992), supra).
Влияние геномов crВИЧ на репликацию ВИЧ дикого типа показано на Фигуре 3. Когда ВИЧ дикого типа котрансфицируют с crВИЧ-1.1, рост вируса задерживается (Фигура 3, незакрашенные прямоугольники) в отношении клеток, котрансфицированных ВИЧ дикого типа и контрольным вирусом (Фигура 3, черные прямоугольники), но не ингибируется. Поскольку анти-U5 рибозимы могут ингибировать репликацию ВИЧ in vivo в условиях совместной локализации (см., например, Dropulic' et al. (1992), supra) наблюдаемый рост вируса может быть результатом либо: (а) предпочтительной упаковки РНК ВИЧ дикого типа в вирионы потомства, (б) образованием РНК ВИЧ дикого типа, резистентных к расщеплению рибозимами, (в) накоплением неактивных рибозимов в РНК crВИЧ.
Природу "избегающего" роста вирусов тестируют котрансфекцией ВИЧ дикого типа с crВИЧ-векторами, которые содержат двойные рибозимы. Если предпочтительная упаковка ВИЧ дикого типа является ответственной за рост вируса, то культуры, содержащие crВИЧ с двойным рибозимом, будут обладать сходной кинетикой роста с культурами, содержащими crВИЧ с одиночными рибозимами. Если, однако, рост вируса обусловлен РНК ВИЧ дикого типа, которая становится резистентной к действию рибозима (т.е. в результате нестабильности обратной транскриптазы вируса), то кинетика роста вируса обнаруживает более значительную задержку у культур, содержащих crВИЧ-1.12 (т.е. направленных против двух сайтов вируса) по сравнению с культурами, содержащими crВИЧ-1.11 (т.е. направленными против одного сайта вируса). Альтернативно, если наблюдают задержку роста вируса, которая сравнима с таковой в культурах, содержащих crВИЧ с различными двойными рибозимами, то можно предположить, что часть одиночно экспрессируемых по одному рибозимов является неактивной in vivo.
Как видно из Фигуры 3, культуры, содержащие crВИЧ-1.11 (Фигура 3, незакрашенные перечеркнутые прямоугольники) или crВИЧ-1.12 (Фигура 3, заштрихованные прямоугольники), обнаруживают большую задержку начала роста вируса, чем crВИЧ-1.1, который содержит один транскрибированный рибозим (Фигура 3, незакрашенные прямоугольники). Однако задержка начала роста вируса является сходной для crВИЧ-1.11 и crВИЧ-1.12, указывая на третью возможность, а именно, что одиночные транскрибированные рибозимы кинетически менее эффективны при расщеплении РНК-мишеней, чем двойные рибозимы. Это позволяет предположить, что при определенном соотношении внутриклеточно транскрибирующиеся рибозимы могут образовать неактивную, возможно, неправильно уложенную конформацию, поскольку эксперименты с котрансфекцией проводят при молекулярном избытке рибозим-содержащих геномов crВИЧ.
Используют способность множественных рибозимов ослаблять это кинетическое ограничение повышением вероятности ассоциации активных рибозимов с РНК ВИЧ дикого типа. В этих экспериментах клетки Jurkat котрансфицируют ВИЧ дикого типа и crВИЧ-1.111, который содержит тройной рибозим к сайту +115. Как можно видеть из Фигуры 5 (заштрихованные прямоугольники), не существует доказательства роста вируса при использовании тройного рибозима, даже после 22 дней культивирования. Эти результаты являются особенно важными в свете того факта, что нормальные первичные Т-клетки часто быстро погибают (например, в течение недели) после инфекции ВИЧ.
Более того, эти результаты подтверждают, что рибозим-содержащие кондиционно реплицирующиеся векторы, такие как crВИЧ-векторы, и особенно те, которые содержат множественные рибозимы, могут быть использованы для обеспечения внутриклеточной конкуренции с геномом вируса дикого типа, такого как ВИЧ.
Пример 4
Этом пример иллюстрирует исследования механизма, лежащего в основе способности рибозим-содержащих кондиционно реплицирующихся векторов, особенно crВИЧ-векторов, внутриклеточно расщеплять РНК вируса дикого типа.
Для этих экспериментов культуры, котрансфицированные РНК из клеточного супернатанта ВИЧ дикого типа и crВИЧ-1.111, исследуют с помощью обратно-транскриптазной полимеразной цепной реакции (ОТ-ПЦР), как описано в настоящем описании. ОТ-ПЦР проводят, используя праймеры, представленные на Фигурах 5А-С. А именно: РНК рибозима определяют, используя праймеры R1 и R2, РНК ВИЧ дикого типа определяют, используя праймеры V1 и V3, РНК crВИЧ определяют, используя праймеры V2 и V3. Каждый из праймеров R1 (TGTGACGTCGACCACACAACACTGATG [SEQ ID No7]) и R2 (TGTGACGTCGACTCTAGATGTGCCCGTTTCGGC [SEQ ID No8]) содержит сайт рестрикции Sal I и амплифицирует РНК анти U5-рибозима связыванием гибридизирующихся последовательностей рибозима. В клетках, экспрессирующих crВИЧ-1.111, обнаруживают продукты амплификации одиночного, двойного и тройного рибозима. Каждый из праймеров V1 (GGTTGGATCCGGGTGGCAAGTGGTCAAAAAG [SEQ ID No9]) и V1 (GGTTGGATCCGGGTGGCAAGTGGTCAAAAAG [SEQ ID No10]) содержит сайты рестрикции Bam HI или Hind III и амплифицирует РНК ВИЧ дикого типа. Как и вышеупомянутый праймер V1, праймер V3 (CGGATCCACGCGTGTCGACGAGCTCCCATGGTGATCAG [SEQ ID No11]) содержит Bam HI и другие сайты рестрикции. Этот набор праймеров амплифицирует РНК crВИЧ с crВИЧ-специфической полилинкерной последовательности.
Для проведения ОТ-ПЦР РНК вирионов и внутриклеточную РНК выделяют, используя Trizol™ (Life technologies). Внутриклеточные вирусные РНК выделяют непосредственно из клеточных осадков, полученных при микроцентрифугировании. РНКвирионов выделяют из супернатантов культур, которые сначала очищают от клеток и дебриса микроцентрифугированием при 12000×g в течение 5 мин, Trizol™ добавляют к бесклеточным супернатантам и инкубируют смеси в течение 5 мин перед добавлением хлороформа для разделения фаз. Водную фазу переносят в чистую пробирку и осаждают РНКизопропанолом, используя гликоген. После восстановления осадка РНК проводят обратную транскрипцию вирусных РНК, а затем амплифицируют их с помощью ПЦР, используя праймеры с радиоизотопными метками.
Обратную транскрипцию проводят в течение 1 часа при 42°С в буфере для первой цепи, содержащем 50 мМ Трис-HCl, рН 8,3, 75 мМ KCl, 3 мМ MgCl2, 5 мМ DTT (дитиотреитол), 1 мМ dNTP (дезоксинуклеотидтрифосфаты) и 20 единиц (U) ингибитора РНКазы, к которому добавляют 25 U обратной транскриптазы. После завершения обратной транскрипции обратную транскриптазу инактивируют нагреванием при 65°С в течение 10 мин. Затем смесь целиком добавляют непосредственно в буфер для ПЦР с получением смеси, содержащей конечную концентрацию 10 мМ Трис-HCl, рН 8,3, 50 мМ KCl, 1,5 мМ MgCl2. Проводят 30 циклов амплификации смеси, используя 2,5 Eg фермента Taq. Продукты ПЦР с радиоизотопной меткой разделяют PAGE в денатурирующих условиях и определяют авторадиографией.
РНК рибозимов crВИЧ-1.111 обнаруживаются в супернатантах клеток более чем через двадцать дней после котрансфекции геномами провирусов ВИЧ-1 дикого типа и crВИЧ-1.111. Это доказывают наличием продуктов ПЦР РНК одиночных, двойных и тройных рибозимов. По сравнению с этим такие продукты не обнаруживают в вирионах, полученных в контрольных культурах, трансфицированных ВИЧ дикого типа. В течение этого периода времени клетки выглядят нормальными без очевидных признаков crВИЧ-индуцированной цитотоксичности. Это подтверждает, что crВИЧ упаковываются в вирусные частицы даже при отсутствии активности обратной транскриптазы. Более того, это указывает на возможность внутриклеточной комплементации crВИЧ при функционировании генов ВИЧ.
Таким образом, приведенные результаты показывают, что crВИЧ ингибирует репликацию ВИЧ дикого типа путем подавления распространения ВИЧ дикого типа. Результаты также подтверждают, что другие кондиционно реплицирующиеся векторы, например другие вирусные векторы и/или векторы, содержащие другие генетические антивирусные агенты, могут быть подобным образом использованы для ингибирования репликации и распространения вируса дикого типа.
Пример 5
В этом примере показано дальнейшее использование механизма, лежащего в основе способности рибозим-содержащих кондиционно реплицирующихся векторов, в частности crВИЧ-векторов, внутриклеточно расщеплять РНК вируса дикого типа.
Один из возможных механизмов заключается в том, что РНК обоих ВИЧ дикого типа и crВИЧ упаковывается в вирионы потомства, и здесь происходит эффективное расщепление вследствие совместной локализации рибозима и РНК-мишеней. Альтернативно, селективная упаковка РНК crВИЧ в вирионы потомства может происходить, потому что расщепление РНК ВИЧ дикого типа в основном осуществляется внутриклеточно, а не в вирионе ВИЧ. В настоящем изобретении используются указанные механизмы.
Средства, с помощью которых crВИЧ-1.111 ингибирует распространение ВИЧ дикого типа, исследуют с помощью ОТ-ПЦР вирион- и клеточно-ассоциированных вирусных РНК в клеточных культурах, трансфицированных только ВИЧ дикого типа или совместно трансфицированных ВИЧ дикого типа и crВИЧ-1.111. РНК crВИЧ-1.111 избирательно обнаруживаются в вирионах потомства, образующихся после котрансфекции. По сравнению с этим контрольные трансфицированные ВИЧ дикого типа культуры образуют вирионы, которые содержат только РНК ВИЧ дикого типа. Внутриклеточные РНК обоих ВИЧ дикого типа и crВИЧ-1.111 обнаруживаются в котрансфицированных культурах. Поэтому, хотя РНК ВИЧ дикого типа и crВИЧ синтезируются внутриклеточно, РНК crВИЧ селективно упаковываются в вирионы потомства. На основании этого предполагают, что crВИЧ-1.111 ингибирует распространение ВИЧ дикого типа путем селективного расщепления геномных РНК ВИЧ дикого типа перед инкапсидацией, позволяя при этом некоторым субгеномным РНК дикого типа транслироваться в белки для образования вирионов.
Для тестирования селективного расщепления геномных РНК дикого типа с помощью РНК crВИЧ типы внутриклеточных РНК, обнаруживаемых в культурах клеток Jurkat приблизительно через 20 дней после котрансфекции, исследуют способом Нозерн-гибридизации. Зонд, используемый для Нозерн-блоттинга, как показано на Фигуре 5, выделяют из Bge-II-фрагмента длиной 0,21 т.п.о. участка U5 pNL4-3.
Культуры, трансфицированные ВИЧ дикого типа, экспрессируют все виды РНК ВИЧ дикого типа, т.е. геномную и субгеномную РНК. По сравнению с этим культуры, котрансфицированные crВИЧ-1.111, не экспрессируют в значительных количествах геномную (9,7 т.п.о.) РНК ВИЧ дикого типа. Низкомолекулярные РНК (отражающие присутствие субгеномных РНК ВИЧ дикого типа) выявляют в котрансфицированных культурах. Обнаружение следов РНК ВИЧ в этих образцах позволяет предположить, что некоторое количество деградированных РНК ВИЧ может присутствовать в этих низкомолекулярных РНК. По сравнению с данным следы РНК ВИЧ дикого типа из контрольных клеток с ВИЧ дикого типа объясняют деградацией РНК, которая существует при значительном цитопатическом эффекте (СРЕ), наблюдаемом на поздних стадиях инфицирования ВИЧ.
Соответственно приведенные результаты подтверждают, что геномные РНК ВИЧ дикого типа селективно расщепляются и деградируют в клетках, содержащих геномы ВИЧ дикого типа и crВИЧ-1.111, что позволяет РНК crВИЧ селективно упаковываться в вирионы. Более того, эти результаты показывают, что способ может быть подобным образом использован для других вирусов, особенно РНК-вирусов.
Пример 6
Этот пример иллюстрирует изучение способности рибозим-содержащих кондиционно реплицирующихся векторов, в частности crВИЧ-вирусов, проходить полный цикл репликации вируса в присутствии хелперного вируса дикого типа.
Для подтверждения того, что геномы crВИЧ проходят полный цикл репликации вируса в присутствии хелперного генома ВИЧ дикого типа, изучают образование вирусных частиц, содержащих геномы crВИЧ, в жестких условиях. В частности, исследуют первый цикл образования вирусных частиц, содержащих геномы crВИЧ, в активированных клетках АСН2 (AIDS Reagent Refernce Program, Rockville, Maryland). Эти клетки представляют собой латентно инфицированную ВИЧ-1 клеточную линиию. Затем исследуют способность любых частиц crВИЧ, выделенных из этих культур, заражать инфицированные клетки Jurkat и образовывать ДНК crВИЧ.
Осуществление указанных экспериментов приблизительно 106 клеток АСН2 трансфицируют 2,5 мкг ДНК-вектора. Клетки стимулируют 50 нМ 12-О-тетрадеканоилфорбол 13-ацетата (ТРА) примерно через 24 час после трансфекции. РНК выделяют из клеточных супернатантов приблизительно через 72 часа после трансфекции. ОТ-ПЦР проводят, используя праймеры R1 и R2, как описано в Примере 4. РНК рибозимов crВИЧ определяют в вирионах, образуемых активированными клетками АСН2 после трансфекции crВИЧ-1.11, но не после трансфекции контрольной плазмидой hGEM 3Z (Promega, Madison, WI). Таким образом трансфекция crВИЧ-векторов инфицированных CD4+ клеток приводит к образованию вирусных частиц, которые содержат РНК crВИЧ.
Затем исследуют способность вирионов crВИЧ, выделенных из этих культур, заражать неинфицированные клетки Jurkat и образовывать провирусы crВИЧ. Такие провирусы обнаруживают, выделяя клеточную ДНК при использовании Trizol™, расщепляя ДНК Eco RI и амплификацируя рибозимную ДНК с помощью ПЦР, используя праймеры R1 и R2, как описано в Примере 4. ДНК crВИЧ образуется в клетках Jurkat после заражения клеточными супернатантами из трансфицированных crВИЧ клеток АСН2. А именно в этом случае показана специфическая амплификация рибосомной ДНК crВИЧ-1.11. По сравнению с этим в клетках, инфицированных только супернатантами стимулированных клеток АСН2 (т.е. при отсутствии какого-либо инфицирования клеток АСН2 crВИЧ-1.111), не обнаруживают продуктов рибозимной ДНК.
Поскольку crВИЧ-векторы распространяются только в присутствии хелперных геномов ВИЧ дикого типа, исследуют способность неинфицированных клеток, содержащих геномы crВИЧ, избегать инфекции ВИЧ дикого типа. Эти эксперименты проводят, осуществляя первую трансфекцию клеток crВИЧ-1.11 (вектором crВИЧ) и затем супертрансфекцию ВИЧ дикого типа (т.е. pNL4-3). Соответственно приблизительно 106 клеток Jurkat трансфицируют примерно 2,5 мкг ДНК crВИЧ. Клетки подращивают около 72 часов перед инфицированием штаммом ВИЧ дикого типа. Клетки Jurkat, трансфицированные crВИЧ-1.11, инкубируют с штаммом pNL4-3 (2×105 единиц TCID50 на 106 клеток) около 2 час при 37°С, трижды промывают в среде с уменьшенным содержанием сыворотки Opti-MEMSM, а затем ресуспендируют в полной среде (RPMI 1640 с 10% FBS). РНК выделяют из клеточных супернатантов, как описано в Примере 4, приблизительно через 5 дней после инфекции.
Для анализа TCID50 (доза вируса, инфекционная для 50% клеток) супернатанты, содержащие ВИЧ, помещают в 96-луночные планшеты при 5-кратном лимитирующем разведении. Приблизительно 104 клеток МТ4 (AIDS Reagent Reference Program, Pockville, Maryland и Harada et al., Science, 229, 563-566 (1985)) добавляют к разведенным вирусным суспензиям и инкубируют полученные суспензии в течение 7 дней до получения полного роста вирусов. Клетки МТ4 являются модифицированными Т-клетками, которые содержат ген Tax HTLV-1, который является трансактиваторным геном, аналогичным Tat ВИЧ-1. Затем супернатанты анализируют на активность обратной транскриптазы и учитывают, как описано ранее (Dropulic' et al. (1992), supra). Инфекционную дозу для культуры ткани определяют способом, описанным Reed and Muench (In: Tech. in HIV Res., Johnson et al., eds., Stockon Press, 71-76 (1990)).
Суперинфекция crВИЧ-инфицированных клеток Jurkat ВИЧ дикого типа приводит к включению геномов crВИЧ в вирусные частицы. Геномы crВИЧ упаковываются в вирусные частицы после суперинфекции ВИЧ дикого типа. В течение этого периода клетки выглядят нормальными без существенных проявлений цитотоксического эффекта.
Указанные результаты свидетельствуют о том, что геномы crВИЧ способны к прохождению полного цикла репликации после комплементации хелперным вирусом ВИЧ дикого типа. Кроме того, результаты подтверждают, что другие вирусные геномы, вероятно, способны проходить полный цикл репликации после комплементации соответствующим вирусом дикого типа.
Пример 7
Этот пример раскрывает природу "избегающего" роста вируса, охарактеризованного в предыдущих примерах.
Для исследования природы "избегающего" роста вируса в культурах, трансфицированных ВИЧ дикого типа или котрансфицированных ВИЧ дикого типа иcrВИЧ-1.11, анализируют РНК вирионов, используя ОТ-ПЦР, как ранее описано. Вирусы, образующиеся в культурах на ранних стадиях роста вируса (т.е. культура, трансфицированная на день +11 ВИЧ дикого типа, культура, котрансфицированная crВИЧ-1.11 на день +19), содержат в основном РНК crВИЧ. По сравнению с этим культуры на поздних стадиях роста вируса (т.е. культура, трансфицированная на день +17 ВИЧ дикого типа, культура, котрансфицированная crВИЧ-1.11 на день +23) содержат в основном РНК ВИЧ дикого типа. Вследствие этого рост вирусов в клетках, котрансфицированных провирусами ВИЧ дикого типа и crВИЧ-1.11, очевидно, являются результатом роста ВИЧ дикого типа, который избегает внутриклеточной рестрикции рибозимом. Важно, что геномы crВИЧ еще содержат в существенной пропорции тотальные геномы ВИЧ даже в культурах на поздних стадиях роста вируса. Это позволяет предположить, что, хотя геномы ВИЧ дикого типа преобладают, геномы crВИЧ тем не менее распространяются в культуре, хотя и с меньшей эффективностью, чем геномы ВИЧ дикого типа.
Указанное подтверждает, что crВИЧ-векторы, так же, как и другие кондиционно реплицирующиеся векторы, могут эффективно конкурировать с геномами вирусов дикого типа при репликации вирусов.
Пример 8
Это пример также раскрывает природу "избегающего" роста вирусов, охарактеризованного в предыдущих примерах.
Эффект упаковки РНКcrВИЧ в вирионы при "избегающем" росте вирусов изучают, определяя титры инфекционного ВИЧ дикого типа. Исследования TCID50 путем лимитирующего разведения (как описано в Примере 6) проводят с вирусными супернатантами культур на экспоненциальной стадии роста вируса (т.е. культур ВИЧ дикого типа на день +14, культур crВИЧ-1.1 на день +16, культур crВИЧ-1.11 или crВИЧ-1.12 на день +20). Эти образцы нормализуют перед анализом, используя активность обратной транскриптазы. Супернатанты культур ВИЧ дикого типа, crВИЧ-1.1, crВИЧ-1.11 и crВИЧ-1.12 имеют инфекционную дозу 1,3×104 TCID50/мл, 5,4×103 TCID50/мл, 3,8×103 TCID50/мл и 3,8×103 TCID50/мл соответственно. Таким образом, упаковка РНК crВИЧ в вирионы во время "избегающего" роста вирусов приводит к снижению числа образующихся инфекционных частиц ВИЧ дикого типа.
Далее исследуют, является ли снижение титра инфекционного ВИЧ дикого типа результатом расщепления РНК ВИЧ дикого типа в "избежавших" вирионах. Продукты расщепления РНК из вирионов, обнаруживаемых в супернатантах котрансфицированных клеток, оценивают методом удлинения праймера. Используют праймер РЕ
(GGTTAAGCTTGTCGCCGCCCCTCGCCTCTTG [SEQ ID No12]), приведенный на Фигуре 6 и содержащий сайт рестрикции Hind III. Удлинение праймера по сайту расщепления проводят в течение 2 час при 42°С в буфере для первой цепи, содержащем 50 мМ Трис-HCl, рН 8,3, 75 мМ KCl, 3 мМ MgCl2, 5 мМ DTT, 1 мМ dNTP и 20 Eg ингибитора РНКазы, к которому добавляют 25 Eg обратной транскриптазы MuLV. Вирусные РНК выделяют из концентрированных вирусных препаратов, полученных из концентрированных культур crВИЧ. Клетки и дебрис удаляют центрифугированием при 2000×g в течение 15 мин при 4°С. Затем вирус концентрируют ультрацентифугированием при 30000×g в течение 4 час при 4°С. Вирусную РНК затем выделяют из осадка вирусов, используя Trizol™, как описано ранее.
РНК вирусов выделяют из супернатантов культур, трансфицированных ВИЧ дикого типа и котрансфицированных crВИЧ-1.11 на поздних стадиях роста вирусов (т.е. культур, трансфицированных ВИЧ дикого типа на день +17, культур, котрансфицированных crВИЧ-1.11 на день +23). Вирионы в этих культурах содержат геномные РНК обоих ВИЧ дикого типа и crВИЧ. Удлиненную праймером кДНК полной длины обнаруживают в обеих культурах - трансфицированной ВИЧ дикого типа и котрансфицированной crВИЧ-1.11. Не обнаруживают меньших по размеру кДНК, которые были бы результатом расщепления PHK U5, несмотря на эффективный анализ методом удлинения праймера. Таким образом, снижение титров инфекционного ВИЧ дикого типа не является результатом внутривирусного расщепления РНК ВИЧ дикого типа, но является следствием количественного замещения РНКcrВИЧ в вирионах потомства.
Приведенные результаты, таким образом, показывают, что описанный способ может быть использован для замещения геномов дикого типа, например геномов ВИЧ и других геномов, в вирионах потомства при использовании кондиционно реплицирующихся векторов по изобретению.
Пример 9
Этот пример демонстрирует, что crВИЧ-векторы могут ингибировать репликацию ВИЧ дикого типа после контрольного заражения плазмидой или рекомбинантным вирусом crВИЧ-1.111.
Клетки Jurkat инфицируют штаммом ВИЧ (клон pNL 4-3) и заражают либо (1) плазмидной ДНК, содержащей конструкцию crВИЧ-1.111, либо (2) рекомбинантным вирусом crВИЧ-1.111, упакованным в клетках 293, т.е. мутантным crВИЧ1.М (Nadlini et al., Science, 272, 263-267 (1996)). Клетки трансфицируют с помощью DLS-липидов (Thierry et al., PNAS, 92, 9742-9746 (1995)) или crВИЧ-опосредованной доставкой. Репликацию вируса определяют по активности обратной транскриптазы через 12 дней после исходного инфицирования ВИЧ. Культуры дикого типа, служащие положительным контролем, обнаруживают нормальные уровни роста ВИЧ дикого типа. Когда клетки, инфицированные ВИЧ дикого типа, заражают мутантным crВИЧ-1.М посредством DLS-обусловленной трансфекции, рост ВИЧ дикого типа не нарушается. В противоположность этому, когда клетки, инфицированные ВИЧ дикого типа, заражают crВИЧ-1.111, который кодирует анти-ВИЧ рибозим, DLS-обусловленной трансфекцией, рост (т.е. репликация) ВИЧ дикого типа значительно ингибируется. Более того, когда осуществляют совместное заражение мутантным crВИЧ-1.М и ВИЧ дикого типа, репликация ВИЧ дикого типа не нарушается. В противоположность этому, когда осуществляют совместное заражение ВИЧ дикого типа и crВИЧ-1.111, репликация ВИЧ дикого типа значительно ингибируется. Данные показывают, что crВИЧ-векторы могут быть использованы для существенного внутриклеточного ингибирования репликации ВИЧ дикого типа.
Пример 10
Этот пример раскрывает применение кондиционно реплицирующихся векторов для терапии рака.
Может быть сконструирован кондиционно реплицирующийся вирусный вектор для лечения рака, который является дефектным по репликации в нормальных клетках, поскольку у него отсутствует вирусный белок, необходимый для репликации. Однако, когда данный вектор инфицирует раковую клетку, уникальные свойства раковой клетки обеспечивают фактор (например, предпочтительно тот же мутантный клеточный белок, который способствует аберрантному росту раковых клеток), который облегчает репликацию дефектного вектора, предназначенного для лечения рака. Соответственно данный способ отличается от способа, применяемого для лечения вирусной инфекции в том, что не происходит селективной упаковки вирусного вектора, а вместо этого происходит предпочтительный лизис раковых клеток, обусловленный упаковкой вирионов потомства, происходящих из вектора, в клетке. Однако данный способ сходен со способом, используемым для лечения вирусных инфекций в том, что и в этом случае можно использовать экспрессирующий вектор хелперного вируса для селективного размножения кондиционно реплицирующегося вектора в раковых клетках. Могут быть сконструированы вектор и/или экспрессирующий вектор хелперного вируса, чувствительные к опухолеспецифическим факторам, что облегчает селективное распространение вектора в опухолевых клетках.
Опухолеспецифические факторы, которые могут быть использованы в данном способе лечения, включают (без ограничений указанным) факторы, которые действуют на уровне: (1) проникновения вируса в клетку (например, наличие опухолеспецифического рецептора, который обеспечивает селективное проникновение вирусного вектора в раковую клетку, но не в нормальную клетку); (2) транскрипции вируса (например, мутантный белок раковой клетки, обеспечивающий избирательную транскрипцию РНК вектора, предназначенного для лечения рака в раковых клетках в противоположность нормальным клеткам) и (3) созревания и выхода вируса (например, мутантные белки раковых клеток могут обеспечивать селективное созревание кондиционно реплицирующегося вектора, предназначенного для лечения рака, например, при ассоциации мутантных клеточных белков с белками или геномом вируса, приводящей к стимуляции созревания и выхода вируса). Соответственно мутантные белки, которые существуют в раковых клетках, могут взаимодействовать с вирусными белками (или геномной РНК или ДНК) на многих стадиях цикла репликации вируса. Этими взаимодействиями можно манипулировать для создания кондиционно реплицирующихся векторов, предназначенных для лечения рака, которые являются дефектными в нормальных клетках и могут реплицироваться в раковых клетках.
В частности, описываемый способ может быть использован для лечения Т-клеточного лейкоза. Т-клеточные лейкозы представляют собой тяжелую форму рака с неблагоприятным прогнозом. Многие из лейкозных Т-клеток являются CD4+-клетками. Таким образом, кондиционно реплицирующийся вектор, предназначенный для лечения Т-клеточного лейкоза, может быть сконструирован при использовании ВИЧ дикого типа в качестве остова вектора. Поскольку ВИЧ очевидным образом проникает в клетку с помощью гликопротеина CD4, то соответствующий вектор действует на уровне проникновения вируса в клетки.
Вектор для лечения рака может быть получен, например, при введении делеции(ий) в ВИЧ дикого типа. В геном ВИЧ могут быть введены мутации, когда он находится в форме ДНК, и может быть осуществлен сайт-специфический мутагенез, как описано ранее. Подобным образом способ может быть осуществлен посредством комплементации дефектов вируса другими супрессорными опухолевыми мутациями или негативными онкогенами или посредством других опухолеспецифических факторов, которые взаимодействуют с вирусными белками. Например, может быть генерирована делеция гена tat, который кодирует белок, важный для репликации ВИЧ. При отсутствии Tat ВИЧ не может более регулировать по типу обратной связи свою экспрессию, которая является абсолютно необходимой для размножения ВИЧ. Белок Tat действует посредством связывания со структурой "ствол-петля" РНК TAR, которая ассоциирована с промотором ВИЧ, и способен увеличивать по типу обратной связи экспрессию ВИЧ более чем в 100 раз. Таким образом, без Tat вектор на основе ВИЧ не экспрессирует белки ВИЧ, не размножается и не вызывает гибель нормальных (т.е. нераковых) Т-клеток.
Однако лейкозные Т-клетки обычно содержат функционально измененную молекулу, которая является либо мутантной, сверэкспрессируемой, либо молчащей. Это изменение функции молекулы не ассоциируется с нормальными клетками. В немутантном состоянии (не в мутантном состоянии) эта молекула задействована в регуляции пролиферации клетки и/или апоптоза (запрограммированной гибели клетки). Изменения, ассоциированные с мутантным состоянием, могут быть использованы для специфической стимуляции размножения кондиционно реплицирующегося вирусного вектора как в присутствии, так и при отсутствии экспрессирующего вектора хелперного вируса (вектора). Например, дефект в Tat может быть комплементирован хелперным экспрессирующим вектором, который направляется опухолеспецифическим промотором, при этом промотор происходит из сверхэкспрессирующегося гена лейкозных клеток. Такой вектор может реплицироваться только в лейкозных Т-клетках, а не в нормальных клетках. Экспрессия и размножение вируса в лейкозных Т-клетках должны приводить к лизису и гибели клеток при образовании вируса. Вектор может содержать и дополнительные элементы для стимуляции гибели клетки (например, последовательность, кодирующую токсин, цитокин или антиген стимулирующий иммуннологическое нацеливание).
Другие методы и стратегии могут быть сходным образом использованы при конструировании следующих кондиционно реплицирующихся векторов, предназначенных для лечения рака.
Пример 11
Данный пример иллюстрирует конструирование crВИЧ второго поколения (cr2ВИЧ), которые лучше способны к размножению, чем crВИЧ-1.111-векторы.
Векторы второго поколения обеспечивают повышенный уровень образования частиц crВИЧ в crВИЧ-продуцирующих клетках. Образование увеличенного количества частиц crВИЧ облегчает их распространение и препятствует эффективному росту ВИЧ дикого типа в культурах. Не имея последовательностей, кодирующих белки, которые блокируют суперинфекцию ВИЧ дикого типа, векторы содержат все последовательности нативного ВИЧ дикого типа, но не содержат гена Tat. Вместо гена Tat встроена кассета тройного анти-Tat рибозима ([SEQ ID No18]), направленного к трем различным сайтам гена Tat. Осуществлена также делеция сплайсингового-сайта гена Tat, так что Tat-рибозимы селективно расщепляют геномные РНК ВИЧ дикого типа и не подвергшиеся сплайсингу РНК ВИЧ дикого типа, которые комплементируют дефект в Tat и облегчают репликацию crВИЧ. В противоположность известным векторам, которые не кодируют белки, отличные, возможно, от белкового генетического антивирусного агента, такого как иммуноген, векторы второго поколения кодируют, но экспрессируют эти белки только в присутствии Tat. В клетке, которая содержит оба генома - ВИЧ дикого типа и crВИЧ, геномы crВИЧ не только селективно упаковываются, но и образуется намного больше вирионов, чем в клетках с crВИЧ-1.111, поскольку структурные белки образуются не только с геномов ВИЧ дикого типа, но с геномов crВИЧ. Соответственно вектор обладает селективным преимуществом при размножении, поскольку не только образует вирионы на матрицах ВИЧ дикого типа, но и на матрицах crВИЧ.
Векторы второго поколения характеризуются также тем, что содержат ил и кодируют рибозимы, каталитические домены участков-мишеней которых отличны от таковых самих векторов. В противоположность crВИЧ-1.111, который содержит или кодирует рибозимы, направленные на участок U5 лидерной последовательности ВИЧ, обусловливающей необходимость инкорпорации модифицированных последовательностей U5 в лидерную последовательность crВИЧ-вектора, рибозимы участков-мишеней векторов второго поколения не находятся в самом векторе, устраняя таким образом необходимость в модификации последовательности вектора. Это уменьшает вероятность образования резистентных ВИЧ при рекомбинации ВИЧ дикого типа с модифицированными последовательностями U5 crВИЧ. Таким образом, рекомбинация ВИЧ дикого типа с последовательностями crВИЧ не обеспечивала бы преимущество ВИЧ дикого типа; инкорпорация последовательностей рибозима в ВИЧ дикого типа являлась бы лишь нежелательной для ВИЧ дикого типа.
Векторы второго поколения далее характеризуются также введением в их состав различных рибозимов, каждый из которых направлен на различные сайты, для снижения вероятности образования рибозим-устойчивых мутантов ВИЧ дикого типа.
При дальнейшем усовершенствовании векторной системы для целей безопасности кондиционно реплицирующаяся вакцинная конструкция "хелперного-вектора" может быть еще в большей степени улучшена добавлением генетических элементов/факторов, которые специфически облегчают репликацию и распространение crВИЧ безопасным образом. Одним из возможных вариантов осуществления является встраивание рибозимов в хелперный вектор для предотвращения его генетической рекомбинации с вектором с образованием вируса дикого типа. Таким образом, вышеописанный cr2ВИЧ-вектор может быть комплементирован Tat-хелперным экспрессирующим вектором для облегчения его распространения. При инсерции анти-ВИЧ рибозимов в хелперный экспрессирующий вектор вероятность рекомбинации минимизируют, поскольку встреча вектора с РНК хелперного вектора привела бы к их взаимному расщеплению и деструкции. Вследствие этого хелперный экспрессирующий вектор может быть модифицирован различным образом для разработки определенной профилактической или терапевтической стратегии. Соответственно векторы cr2ВИЧ находят применение как вакцины против ВИЧ, т.к. они (1) реплицируются и таким образом непрерывно стимулируют иммунный ответ хозяина и (2) позволяют хозяину узнавать различные эпитопы, поскольку они выделены из ВИЧ и антигенно изменяются.
Все приведенные в настоящем описании ссылки, в том числе патенты, заявки на патенты и публикации, включены во всей их полноте, исключительно для отражения известного уровня техники.
Поскольку в описании изобретения изложены предпочтительные варианты его осуществления, для специалистов очевидно, что могут быть осуществлены и использованы различные модификации предпочтительных вариантов изобретения, и оно может быть применено на практике другим образом, чем здесь описано. Настоящее изобретение подразумевает указанные модификации и альтернативные подходы. В соответствии с этим изобретение охватывает все модификации, входящие в его объем, а его сущность выражается ниже формулой изобретения.







Реферат
Изобретение относится к области биотехнологии и может быть использовано для лечения вирусных заболеваний. Описывается условно реплицирующийся ретровирусный вектор для ингибирования репликации ретровируса дикого типа. Он содержит последовательности длинных концевых повторов ретровирусов; ретровирусный сигнал упаковки; нуклеотидную последовательность, содержащую или кодирующую (экспрессирующую) генетический антивирусный агент; и при необходимости вторую нуклеотидную последовательность. Представлен способ получения указанного вектора и его репродуцирования. Далее описана выделенная и очищенная молекула нуклеиновой кислоты (НК), обеспечивающая вектору селективное преимущество в отношении упаковки в вирионы вирусного потомства. Раскрыты способы использования ретровирусного вектора, в частности, для получения специфических антител. Использование изобретения позволяет получать новые генетические антивирусные агенты, с генерацией длительных и устойчивых иммунологических ответов в отношении, например, вирусов СПИДа и рака. 19 н. и 78 з.п. ф-лы, 5 ил.


Комментарии