Мутантные полимеразы вируса гепатита в - RU2625021C2
Код документа: RU2625021C2
Чертежи






























































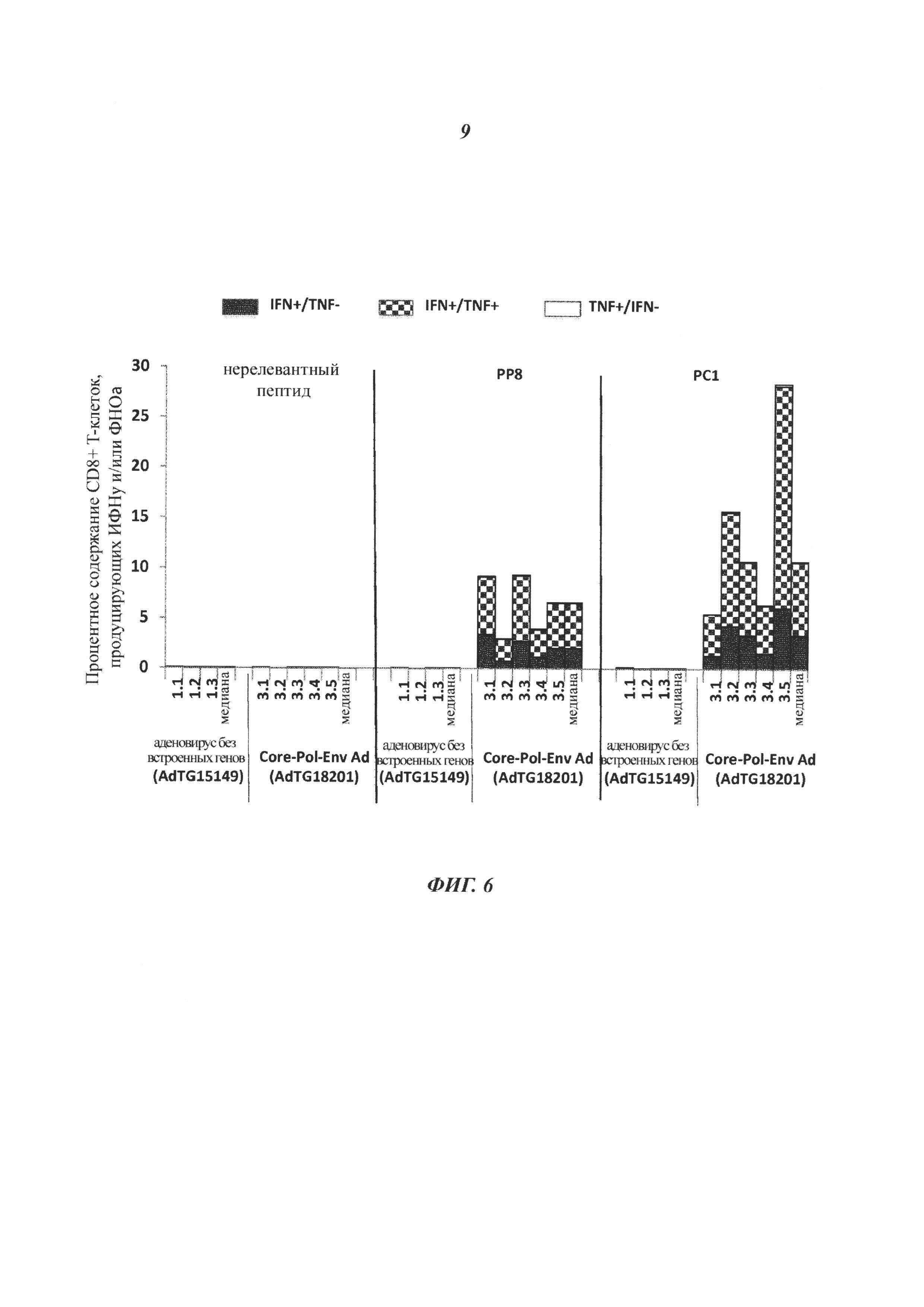




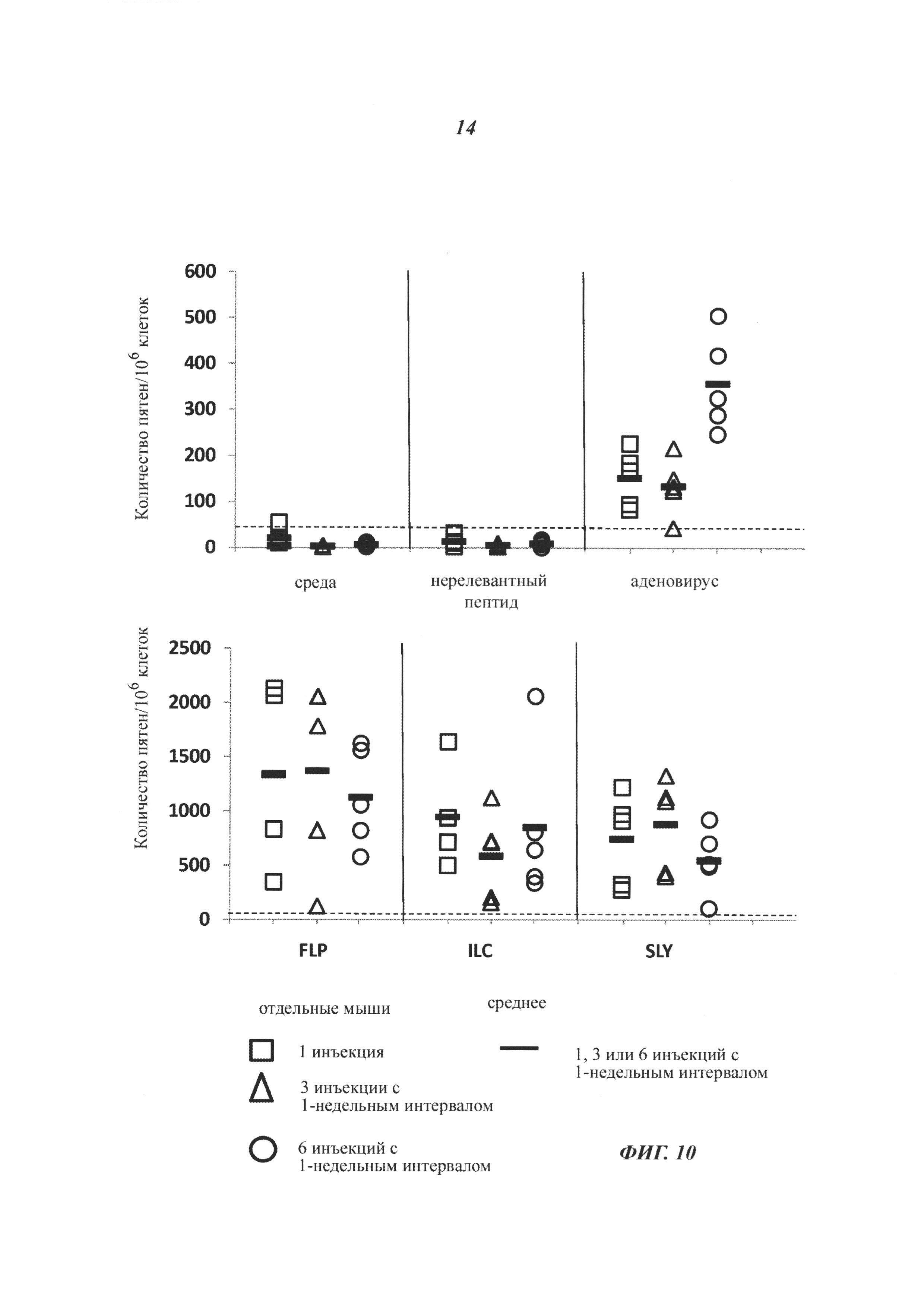


Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к мутантным полипептидам полимеразы вируса гепатита В, имеющим в своем составе мутантный домен полимеразы, у которого подавлена функциональная активность полимеразы, и гибридным белкам, имеющим в своем составе такой мутантный полипептид полимеразы. Настоящее изобретение также относится к молекуле нуклеиновой кислоты и экспрессирующему вектору для экспрессии указанного мутантного полипептида полимеразы, а также к композиции, которая может применяться для индукции иммунного ответа на вирус гепатита В с целью обеспечения защитного или терапевтического эффекта, направленного против инфекции, вызванной ВГВ. Изобретение представляет особый интерес в области иммунотерапии, и в частности, при лечении пациентов, инфицированных вирусом гепатита В, особенно хронически инфицированных.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Гепатит В представляет собой серьезную проблему здоровья населения, в мире более 350 миллионов человек имеют хроническую инфекцию, из них от 20 до 40% имеют риск развития хронических заболеваний печени, цирроза и гепатоцеллюлярной карциномы. Несмотря на существование эффективной вакцинопрофилактики, инфекция, вызванная вирусом гепатита В (ВГВ) по-прежнему значительно распространена во многих странах, даже развитых, предполагаемое количество новых случаев инфицирования в мире ежегодно составляет около 4,5 миллионов. Несмотря на рекомендации ВОЗ о проведении всеобщей вакцинации, полный курс профилактической вакцинации проходят от 25% населения в Азии до 75-90% в Европе. В настоящее время гепатит В находится 10 месте среди причин смертности (приблизительно 1 миллион смертей в год), а карцинома печени, вызванная ВГВ, стоит на 5 месте среди самых распространенных форм рака. Географическое распределение инфекции ВГВ неоднородно, в западных странах распространенность составляет менее 1%, а в юго-восточных странах, большей части Африки и экваториальной Южной Америки - более 10%.
Вирус гепатита В является представителем гепаднавирусов и прежде всего поражает печень, реплицируясь в гепатоцитах. Вирусные частицы, способные заражать клетки, так называемые частицы Дейна размером 42-45 нм, имеют внешнюю липопротеиновую оболочку, содержащую поверхностные белки (HBs) трех различных типов, и внутренний нуклеокапсид, основным структурным белком которого является коровый белок (НВс-антиген, НВсАд). Внутри нуклеокапсида находится единственная копия генома ВГВ, связанная с вирусным белком полимеразой (Р). Кроме вирионов размером 42-45 нм, в крови пациентов, инфицированных ВГВ, содержатся сферические частицы размером 20 нм, состоящие из HBsAg и липидов организма-хозяина, высвобождающихся из инфицированых клеток. Количество этих сферических частиц превосходит количество вирионов в 104-106 раз.
После проникновения вирионов в гепатоциты, опосредуемого неизвестным на данный момент рецептором, нуклеокапсиды с геномной ДНК ВГВ транспортируются к ядру, где релаксированная кольцевая ДНК превращается в ковалентно замкнутую кольцевую ДНК (cccDNA). cccDNA выполняет функцию матрицы при транскрипции четырех вирусных РНК, которые поступают в цитоплазму и используются в качестве мРНК для трансляции белков ВГВ. РНК наибольшего размера (прегеномная) также выполняет функцию матрицы при репликации ВГВ, которая происходит в нуклеокапсидах в цитоплазме. Некоторые из капсидов, содержащих ДНК ВГВ и полимеразу, затем транспортируются обратно в ядро, где они высвобождают вновь образованную открытую кольцевую ДНК, из которой формируется новые порции cccDNA. cccDNA отвечает за персистенцию ВГВ, поскольку время ее полужизни больше, чем у гепатоцитов, она. Другие капсиды заключаются в оболочку путем почкования через мембраны эндоплазматического ретикулума и секретируются после прохождения через комплекс Гольджи.
Структурную и функциональную организацию генома ВГВ исследовали на протяжении более 30 лет. Геном ВГВ представлен открытой кольцевой частично двухнитевой ДНК размером приблизительно 3200 нуклеотидов, состоящей из полной минус-цепи и более короткой плюс-цепи. Она содержит 4 перекрывающихся открытых рамки считывания (ORF), С, S, Ρ и X. Открытая рамка считывания С кодирует коровый белок (или НВсАд), белок из 183 аминокислот, составляющий нуклеокапсид, и второй белок, обнаруживаеый в сыворотке пациентов при репликации вируса и известный как HBeAg, который содержит имеет часть прекорового белка на N-конце и часть HBcAg. С-конец корового белка обладает выраженными основными свойствами и содержит 4 богатых аргинином домена, которые предположительно связывают нуклеиновые кислоты и имеют множество сайтов фосфорилирования. Открытая рамка считывания S кодирует три поверхностных белка, все они имеют одинаковый С-конец, но различные N-концы из-за наличия внутри рамки считывания трех стартовых кодонов ATG, делящих открытую рамку считывания S на три участка, S (226 аминокислот), pre-S2 (55 аминокислот) и pre-S1 (108 аминокислот), соответственно. Большой поверхностный белок (белок оболочки) (L) образуется при инициации трансляции первым стартовым кодоном ATG и содержит 389 аминокислотных остатков (preS1-preS2-S). Средний поверхностный белок (М) образуется в результате трансляции участков S и pre-S2 при инициации трансляции вторым ATG, тогда как малый поверхностный белок, состоящий из 226 аминокислот (S, также обозначаемый HBsAg), образуется в результате трансляции S участка, инициируемой третьим стартовым кодоном ATG. Поверхностные белки ВГВ представляют собой гликопротеины с боковыми углеводными цепочками (гликанами), присоединенными посредством N-гликозидных связей. Открытая рамка считывания Ρ кодирует вирусную полимеразу, а открытая рамка считывания X кодирует белок, известный как белок X, который предположительно выполняет роль активатора транскрипции.
Вирусная полимераза состоит примерно из 832-845 аминокислотных остатков, в зависимости от генотипа ВГВ, и кодируется длинной открытой рамкой считывания ("Р"), которая перекрывается с З'концом гена корового белка и всех генов поверхностных белков. Вирусная полимераза является многофункциональным белком, состоящим из четырех доменов, включающих три функциональных домена, соответственно домены концевого белка, полимеразы и РНКазы Н, катализирующих основные этапы репликации ВГВ (инициация, синтез ДНК и удаление матриц РНК), а также вспомогательного спейсерного домена, находящегося между доменом концевого белка и полимеразы (см., например, Radziwill et al., 1990, J. Virol. 64:613; Bartenschlager et al., 1990, J. Virol. 64, 5324). Были охарактеризованы каталитические сайты, отвечающие за ферментативную активность. Было показано, что четыре остатка, образующих консервативный мотив YMDD (остатки с 538 по 541, нумерация указана для полимеразы размером 832 остатка), имеют принципиальное значение для ДНК- и РНК-зависимой активности ДНК-полимеразы, тогда как активность РНКазы H опосредована мотивом DEDD, включающим четыре аминокислотных остатка, не расположенных последовательно, а именно Asp (D) в положении 689, Glu (Ε) в положении 718, Asp (D) в положении 737 и Asp (D) в положении 777, а также несколько других аминокислотных остатков, включая Val (V) в положении 769 и Thr (Τ) в положении 776. Описаны различные мутации, подавляющие активность ОТ-полимеразы и РНКазы Η (Chang et al., 1990, J. Virol. 64: 5553; Bartenschlager et al., 1990, J. Virol. 64, 5324, Radziwill et al., 1990, J. Virol. 64:613 and Chen et al., 1996, J. Virol. 70:6151). Нескольким группам удалось экспрессировать белок полимеразы ВГВ в различных системах-хозяевах, но эта экспрессия оказывалась токсичной для экспрессирующих клеток и требовала использования индуцибельных промоторов (Choi et al., 2002, Antiviral Res. 55:279; Karimi et al., 2002, J. Virol. 76:8609).
Ряд доклинических и клинических испытаний доказали важность CD4+ и CD8+ Т-клеточных иммунных ответов для эффективного противовирусного ответа. Действительно, было обнаружено, что пациенты естественным образом излечившиеся от гепатита В, имели повышенный мультиспецифический и продолжительный иммунный ответ, опосредованный Т-хелперными (TH) и цитотоксическими Τ (CTL) лимфоцитами, которые легко обнаруживаются в периферической крови. Появление антител к НВе и HBs указывает на благоприятный исход заболевания. Антитела, специфические к HbsAg, являются нейтрализующими, опосредуют защитный иммунитет и персистируют в течение жизни после клинического выздоровления.
Однако, хроническая инфекция, вызванная ВГВ, только в редких случаях побеждается иммунной системой. Преобладающее большинство пациентов с хронической инфекцией демонстрируют слабый и непродолжительный CD4 и CD8 Т-клеточный иммунный ответ, который рестриктирован по определенным антигенам и является недостаточно эффективным для элиминации вирусной инфекции. Причина такого нарушения эффекторных механизмов клеточного иммунного ответа при хроническом гепатите В в настоящее время недостаточно ясна, даже притом, что у пациентов с хронической инфекцией ВГВ наблюдалось повышение различных ингибиторных молекул, таких как PD-1, CTLA4. Следовательно, существует потребность в иммуномодулирующих подходах, которые бы позволили индуцировать эффективный Т-клеточный ответ.
Стандартная терапия при хроническом гепатите В включает пегилированный интерферон альфа (ИФНа) и аналоги нуклеозидов/нуклеотидов (NUCs), такие как ламивудин, и в последнее время энтекавир, телбивудин, адефовир и тенофовир. ИФНа является молекулой, которая обладает выраженным противовирусным действием, тем самым ингибирует репликацию вируса, но при этом вызывает серьезные побочные эффекты почти у 25-30% пациентов. NUCs действуют как конкурентные ингибиторы полимеразы ВГВ, направленные на ингибирование обратной транскрипции прегеномной РНК, в результате которой образуется минус-цепь ДНК и затем двуцепочечная вирусная ДНК. Они ограничивают образование новых вирионов, но неэффективны для удаления суперспирализованной cccDNA, спрятанной в ядре инфицированных гепатоцитов, которая является источником новых поколений вирусов. Это может объяснить, почему эффективность NUC является временной и сразу после прекращения лечения наступает рецидив, что заставляет пациентов находиться на терапии пожизненно. Кроме того, долгосрочная эффективность также является умеренной из-за появления резистентных мутантов ВГВ (более 24% после 1 года и приблизительно 66% после 4 лет лечения ламивудином по данным некоторых исследований, хотя новые NUCs вызывали появление резистентных к лекарству мутантов ВГВ гораздо реже). В настоящее время выделен ряд штаммов ВГВ, обладающих пониженной чувствительностью к противовирусным агентам, и секвенирование их генома позволило обнаружить участок с высокой частотой встречаемости мутаций по типу замены в полимеразном домене, в том числе мотиве YMDD (US 2008-0233557; Zoulim and Locarnini, 2009, Gastroenterology, 137:1593).
Кроме противовирусной терапии в настоящее время делаются попытки разработать дополнительные способы лечения, нацеленные на улучшение иммунного ответа хозяина, особенно реакций, опосредуемых цитотоксическими и хелперными Τ лимфоцитами. Было разработано несколько обнадеживающих стратегий вакцинации, нацеленных на поверхностные белки S, preS1 и/или preS2 вируса гепатита В (Zanetti et al., 2008, Vaccine 26: 6266; Mancini-Bourguine et al., 2006, Vaccine 24:4482), a также мультивалентных вакцин, одновременно направленных против множества антигенов ВГВ. Например, в доклинических исследованиях на моделях у мышей было показано, что иммунизация полиэпитопной ДНК-вакциной, кодирующей множество поверхностных, коровых и полимеразных эпитопов, запускает реакции, опосредованные цитотоксическими и хелперными Т-лимфоцитами (Depla et al., 2008, J. Virol. 82: 435). Подход, в при котором использовалась смесь плазмидной ДНК, кодирующей HBsAg, НВсАд и полимеразу ВГВ (WO2005/056051; WO2008/020656), продемонстрировал специфические клеточные и гуморальные ответы, направленные против ВГВ, на модели хронического гепатита В у трансгенных мышей (Chae Young Kim et al., 2008, Exp.Mol. Medicine 40: 669). В Южной Корее были начаты клинические исследования I фазы с участием носителей ВГВ, получающих ламивудин (Yang et al., 2006, Gene Ther. 13: 1110). Другой недавно разработанный подход включает применение векторной терапевтической вакцины, кодирующей НВс и полимеразу ВГВ вместе с иммуногенными доменами Hbs (WO2011/01565). Мыши, иммунизированные векторной вакциной на основе аденовируса, демонстрировали Т-клеточный ответ, направленный против всех экспрессируемых антигенов ВГВ, в частности, против полимеразы.
Можно ожидать, что ВГВ будет по-прежнему представлять собой серьезную угрозу для здоровья населения во всем мире на протяжении многих лет вследствие хронической и персистирующей природы инфекции, ее высокой распространенности, продолжающейся трансмиссии ВГВ и высокой частоте сопутствующих заболеваний. Таким образом, необходимо разработать более эффективные приемы для улучшения профилактики и лечения инфекций, вызванных ВГВ, или заболеваний или нарушений, обусловленных ВГВ. В частности, по-прежнему существует потребность в приемах, при которых опосредованные Т-клетками иммунные реакции, направленные против антигена(ов) ВГВ, особенно против коровых антигенов, сочетались бы с низкой потенциальной токсичностью. Такие приемы наиболее целесообразны при лечении субъектов с хронической инфекцией, вызванной ВГВ.
Данная техническая задача решена путем разработки воплощений, описанных в формуле изобретения.
Другие аспекты, признаки и преимущества настоящего изобретения станут очевидными из следующего ниже описания предпочтительных в настоящий момент воплощений изобретения. Эти воплощения приводятся в целях раскрытия изобретения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение касается мутантного полипептида полимеразы, имеющего в своем составе по меньшей мере 500 аминокислотных остатков нативной полимеразы ВГВ, где указанный мутантный полипептид полимеразы имеет в своем составе домен полимеразы с внутренней делецией, которая подавляет функциональную активность полимеразы, и где указанная внутренняя делеция включает по меньшей мере мотив YMDD, присутствующий в полимеразном домене нативной полимеразы в природных условиях.
Настоящее изобретение также касается молекулы нуклеиновой кислоты, кодирующей указанный мутантный полипептид полимеразы, вектора, содержащего указанную молекулу нуклеиновой кислоты, или композиции, содержащей или кодирующей указанный мутантный полипептид полимеразы.
Настоящее изобретение также относится к применению этого мутантного полимеразного полипептида, молекулы нуклеиновой кислоты, вектора или композиции, предпочтительно в сочетании с дополнительными полипептидами (например, с одним или более полипептидом(ами) ВГВ) для лечения, предупреждения или подавления инфекции, вызванной ВГВ, или улучшения состояния, связанного с инфекцией, вызванной ВГВ.
Следующий аспект настоящего изобретения включает способ лечения, предупреждения или подавления инфекции, вызванной ВГВ, или улучшения состояния, связанного с инфекцией, вызванной ВГВ, у нуждающегося в этом субъекта, включающий предоставление или введение этого мутантного полипептида полимеразы, молекулы нуклеиновой кислоты, вектора или композиции, возможно в комбинации с дополнительными полипептидами (например, с одним или более полипептидом(ами) ВГВ) и/или со стандартным лечением.
Еще один аспект настоящего изобретения касается способа индукции иммунного ответа у субъекта, который в этом нуждается, включающего предоставление или введение этого мутантного полипептида полимеразы, молекулы нуклеиновой кислоты, вектора или композиции, возможно в комбинации с дополнительными полипептидами (например, с одним или более полипептидом(ами) ВГВ) и/или со стандартным лечением с целью индукции или стимуляции иммунного ответа у этого субъекта или для лечения инфекции, вызванной ВГВ, или улучшения состояния или симптома, связанного с инфекцией, вызванной ВГВ.
Еще в одном аспекте настоящего изобретения предложен набор элементов, включающий некоторое количество контейнеров и инструкций для предоставления или введения субъекту этого мутантного полипептида полимеразы, молекулы нуклеиновой кислоты, вектора или композиции, возможно в комбинации с дополнительными полипептидами (например, с одним или более полипептидом(ами) ВГВ), в соответствии с композициями и способами, описанными в данном документе.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложен мутантный полипептид полимеразы, который имеет в своем составе мутантный домен полимеразы с внутренней делецией, которая подавляет функциональную активность полимеразы, где указанная внутренняя делеция включает по меньшей мере мотив YMDD, присутствующий в полимеразном домене нативной полимеразы в природных условиях. Такой мутантный полипептид полимеразы или кодирующий его вектор могут применяться в композициях и способах для лечения или предупреждения инфекции, вызванной ВГВ, или состояния, связанного с инфекцией, вызванной ВГВ, возможно в комбинации с другими полипептидами ВГВ и/или стандартным лечением. Данное изобретение предусматривает экспрессию и продукцию мутантного полипептида полимеразы в различных векторных системах благодаря подавлению связанной с ним ферментативной активности. Изобретение особенно подходит для применения у человека и может применяться для усиления стандартной терапии (например, стандартного лечения). В моделях на животных иммунизация вектором, кодирующим этот мутантный полипептид полимеразы, гибридизованный с иммуногенными доменами НВс и Hbs, индуцировала Т-клеточный ответ, специфический в отношении ВГВ, при этом было неожиданным, что наблюдавшийся сильный иммунный ответ был направлен как против НВс, так и против полимеразы.
В следующем ниже разделе приводится подробное объяснение значений некоторых терминов, употребляющихся в данном документе.
Определения
В данной заявке, когда употребляют единственное число, подразумевают "по меньшей мере один", "по меньшей мере первый", "один или более чем один" или "множество" упоминаемых соединений или стадий, если контекстом не продиктовано иное.
Термин "и/или" при использовании здесь включает значение "и", "или" и "все или любая другая комбинация элементов, объединенных указанным термином".
Термин "примерно" или "приблизительно", используемый здесь, означает в пределах 10%, предпочтительно в пределах 8% и более предпочтительно в пределах 5% данного значения или интервала. Термины "аминокислоты", "остатки" и "аминокислотные остатки" являются синонимами и охватывают как природные аминокислоты, так и аналоги аминокислот (например, не имеющие природного происхождения, синтетические и модифицированные аминокислоты, включая D или L оптические изомеры).
Термины "полипептид", "пептид" и "белок" обозначают полимеры аминокислотных остатков, которые имеют в своем составе по меньшей мере девять или более аминокислот, соединенных пептидными связями. Полимер может быть линейным, разветвленным или циклическим и может иметь в своем составе аминокислоты природного происхождения и/или аналоги аминокислот и может быть прерван не аминокислотами. В качестве общего указания, если аминокислотный полимер состоит более чем из 50 аминокислотных остатков, на него предпочтительно ссылаются как на полипептид или белок, тогда как если он состоит из 50 аминокислот или менее, на него ссылаются как на "пептид".
В данном документе при обозначении продуктов, композиций и способов термин "содержащий" (и любая его форма, например "содержать" и "содержит"), "имеющий" (и любая его форма, например "иметь" и "имеет"), "включающий" (и любая его форма, например "включает" и "включать") или "имеющий в своем составе" (и любая его форма, например "имеет в своем составе" и "иметь в своем составе") являются неограничивающими и не исключают дополнительных, не указанных элементов или этапов способа. Так, полипептид "содержит" аминокислотную последовательность, когда аминокислотная последовательность является частью конечной аминокислотной последовательности полипептида. Такой полипептид может иметь до нескольких сотен дополнительных аминокислотных остатков. Под "состоящим по существу из" следует понимать исключающий другие компоненты или стадии какой-либо существенной значимости. Так, композиция, по существу состоящая из указанных компонентов, не будет исключать следовые примеси и фармацевтически приемлемые носители. Полипептид "по существу состоит из" аминокислотной последовательности, когда в такой аминокислотной последовательности может быть только несколько дополнительных аминокислотных остатков. "Состоящий из" означает исключение более чем следовых элементов других компонентов или стадий. Например, полипептид "состоит из" аминокислотной последовательности, когда полипептид не содержит каких-либо аминокислотных остатков помимо указанных в аминокислотной последовательности.
В данном документе "ВГВ" и "вирус гепатита В" используются взаимозаменяемо и обозначают любого представителя гепаднавирусов (см., например, Ganem and Schneider in Hepadnaviridae (2001) "The viruses and their replication", pp2923-2969, Knipe DM et al., eds. Fields Virology, 4th ed. Philadelphia, Lippincott Williams & Wilkins or subsequent edition). Аминокислотные последовательности различных полипептидов ВГВ и кодирующие нуклеотидные последовательности можно найти в специальных базах данных (например, упоминавшихся выше) и в литературе (см., например, Valenzuela et al., 1980, The nucleotide sequence of the hepatitis В viral genome and the identification of the major viral genes (pp57-70) in "Animal Virus Genetics"; eds В. Fields, et al.; Academic Press Inc., New York and Vaudin et al., 1988, J. Gen. Virol. 69: 1383).
В данном документе термин "полимераза ВГВ" обозначает полипептид, у которого сохранено по меньшей мере 500 аминокислотных остатков, содержащихся в нативном белке полимеразы ВГВ. Желательно, эти по меньшей мере 500 аминокислотных остатков распределены по трем функциональным доменам и предпочтительно по четырем доменам, присутствующим в нативной полимеразе ВГВ в природных условиях. Этот термин охватывает нативные (т.е. природного происхождения) полипептиды полимеразы любого штамма, изолята или генотипа ВГВ, которые можно обнаружить, выделить, получить из такого источника ВГВ в природе, как, например, перечисленные выше в связи с термином "ВГВ", а также модифицированную полимеразу (т.е. мутантный полипептид полимеразы) и их фрагменты. В иллюстративных целях аминокислотные остатки полимеразы ВГВ, описанные в данном документе, пронумерованы как в полимеразе, состоящей из 832 аминокислот, у которой Туг в мотиве Tyr Met Asp Asp (YMDD) находится в положении 538. Специалист в данной области сможет адаптировать нумерацию аминокислотных остатков для других полимераз (например, состоящих из 843 или 845 аминокислот).
В данном документе термин "нативный" или "имеющий природное происхождение", использующиеся в отношении любой аминокислотной последовательности (например, пептида, полипептида, белка и т.д.) или нуклеотидной последовательности (например, гена, молекулы нуклеиновой кислоты, полинуклеотида и т.д.), обозначают аминокислотную последовательность или нуклеотидную последовательность, которая может быть обнаружена, выделена, получена из источника в природе, и которая отличается от искусственным образом модифицированной или измененной человеком в лаборатории (т.е. мутантной). Такие источники в природе включают биологические образцы (например, кровь, плазму, сыворотку, семенную жидкость, слюну, образцы тканей, биопсийный материал и т.д.), взятые у инфицированного или подвергшегося воздействию ВГВ организма, культивируемые клетки (такие как HepG2.2.15, HuH6-C15 (Sureau et al., 1986, Cell 47:37; Sells et al., 1987, Proc. Natl. Acad. Sci. 84(4): 1005); HuH7.TA61 or HuH7.TA62 (Sun et al., 2006, J Hepatol. 45(5):636), культуры тканей, а также рекомбинантный материал. Рекомбинантный материал включает изоляты ВГВ (например, имеющиеся в депозитарных учреждениях), геном ВГВ, библиотеки геномной РНК или библиотеки кДНК, векторы, содержащие геном ВГВ или его фрагмент(ы) или любые векторы предшествующего уровня техники, известные как включающие такие элементы, но не ограничиваются ими.
В иллюстративных целях "нативная полимераза ВГВ" означает полимеразу ВГВ, которая кодируется открытой рамкой считывания Ρ любого генотипа, штамма или изолята ВГВ, имеющего природное происхождение, известного из уровня техники (например, полипептида, имеющего в своем составе от 832 до 845 аминокислот, в зависимости от генотипа), или его фрагмента. Термин "нативный" также охватывает полипептид/пептиды полимеразы ВГВ, которые являются репрезентативными для определенного генотипа и, следовательно, включают аминокислотную последовательность, соответствующую или близкую консенсусной последовательности, которая обычно определяется при сопоставлении последователностей различных полимераз ВГВ конкретного генотипа.
Термин "мутант" в данном документе обозначает полипептид, имеющий одну или более мутаций по сравнению с нативным аналогом. В иллюстративных целях "мутантный полипептид полимеразы" обозначает полипептид полимеразы, происходящий из нативной полимеразы, которую человек искусственным образом модифицировал или изменил в лабораторных условиях, как описано в данном документе. Предусматриваются различные мутации, включая замену, вставку и/или делецию одного или более нуклеотидов/аминокислотных остатков, не встречающиеся в природе перестройки (например, гибридизацию с чужеродными полипептидами/пептидами), а также любые их комбинации. Если предполагается несколько мутаций, они могут затрагивать остатки, расположенные как последовательно, так и не последовательно. Мутации могут быть осуществлены с помощью ряда методов, известных специалистам, таких как сайт-специфический мутагенез (например, с помощью системы для проведения мутагенеза in vitro Sculptor™ производства Amersham, Les Ullis, France), мутагенеза с помощью ПЦР, перестройки ДНК и с помощью методов химического синтеза (например, приводящие к получению синтетической молекулы нуклеиновой кислоты). Согласно предпочтительным воплощениям, мутации, которые предусматриваются настоящим изобретением, охватывают делецию(и) и/или замену(ы) одного или более аминокислотных остатков (расположенных последовательно или нет), которые прямо или косвенно связаны по меньшей мере с одной ферментативной активностью, проявляемой нативной полимеразой ВГВ, для подавления указанной по меньшей мере одной ферментативной активности, например, активности полимеразы и/или активности РНКазы Н. В контексте изобретения полученный мутантный полипептид полимеразы в целом сохраняет высокую степень идентичности (например, по меньшей мере 80%) с соответствующей нативной полимеразой ВГВ в участках, не подвергавшихся мутации.
Термин "подавлять", который в данном документе используется в связи с указанной ферментативной активностью, или любое его производное, например, "подавляющий" означает "устранять" (полное отсутствие остаточной активности) или "существенно снижать" (остаточная активность менее 20% от активности, проявляемой нативной полимеразой).
Термин "идентичность" обозначает точное соответствие по аминокислотам или нуклеотидам между двумя полипептидами или нуклеотидными последовательностями. Процент идентичности между двумя последовательностями является функцией количества позиций, идентичных для двух последовательностей, с учетом количества разрывов, которые нужно ввести для оптимального выравнивания, и длины каждого разрыва. В области техники существуют различные компьютерные программы и математические алгоритмы для определения процента идентичности между аминокислотными последовательностями, например, программа Blast, предоставляемая NCBI, или ALIGN в Атласе белковых последовательностей и структур (Dayhoffed., 1981, Suppl., 3 482-489). Доступ к программам для определения гомологии между нуклеотидными последовательностями также можно получить в специализированных базах данных (например, Genbank, the Wisconsin Sequence Analysis Package, программы BESTFIT, FASTA и GAP). В иллюстративных целях "идентичность по меньшей мере 80%" в данном документе означает 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%.
В данном документе термин "выделенный" обозначает белок, полипептид, пептид, полинуклеотид, плазмидный вектор, вирусный вектор или клетку-хозяина, которая извлечена из своего естественного окружения (т.е. отделена от по меньшей мере одного другого компонента, с которым она связана естественным образом).
Последовательность ВГВ
Ряд последовательностей ВГВ подходят для применения в воплощениях, описанных в данном документе, включая те последовательности, которые известны специалистам в данной области, включая последовательности ВГВ, описанные в Genbank и PubMed, но не ограничиваясь ими. В иллюстративных целях, многочисленные филогенетические исследования, позволили выделить 8 основных генотипов вируса гепатита В (от А до Н), для которых, несмотря на высокую степень консервативности последовательностей, характерно различное географическое распределение и исход заболевания. Было выделено 9 различных подтипов ВГВ (ayw1, ayw2, ayw3, ayw4, ayr, adw2, adw4, adrq+ and adqr-) в зависимости от серотипов HBsAg (см. обзор Mamum-AI Mahtab et al., 2008, Hepatobiliary Pancrease Dis Int 5: 457; Schaeffer, 2007, World Gastroenterol. 7: 14). Каждый генотип и серотип охватывает различные штаммы и изоляты ВГВ. Изолят соответствует определенному вирусу, выделенному из конкретного источника ВГВ (например, образца пациента или другого биологического источника ВГВ), тогда как штамм охватывает различные изоляты с близкими геномными последовательностями.
Приведенный в качестве примера ВГВ с генотипом А включает изолят НВ-JI444AF и штамм HB-JI444A (регистрационный номер АР007263), но не ограничивается ими. Приведенный в качестве примера ВГВ с генотипом В включает клон pJDW233 (регистрационный номер D00329), изолят HBV/14611 (регистрационный номер AF121243), HBV-B1 (регистрационный номер GenBank AF282917.1), штамм HBVWhutj-37 (регистрационный номер GenBank AY2933309.1), китайский штамм HBV GDH1 (регистрационный номер GenBank AY766463.1) и изолят HBV 57-1 подтипа adw (регистрационный номер GenBank AY518556.1), но не ограничивается ими. Приведенный в качестве примера ВГВ с генотипом С включает изолят AH-1-ON980424 (регистрационный номер АВ113879), штамм НСС-3-ТТ (регистрационный номер АВ113877), изолят HBV SWT3.3 (регистрационный номер GenBank EU916241.1), изолят HBV Н85 (регистрационный номер GenBank AY306136.1), штамм HBV С1248 (регистрационный номер GenBank DQ975272.1), изолят HBV CHN-H155 (регистрационный номер GenBank DQ478901.1) и изолят HBV GZ28-1 (регистрационный номер GenBank EF688062), но не ограничивается ими. Приведенный в качестве примера ВГВ с генотипом D включает изоляты КАМСНАТКА27 (регистрационный номер АВ188243), ALTAY136 (регистрационный номер АВ188245) и Y07587 (регистрационный номер GenBank Y07587 и Stoll-Becker et al., 1997, J. Virol. 71: 5399), а также изолят ВГВ, описанный под регистрационным номером АВ267090, но не ограничивается ими. Приведенный в качестве примера ВГВ с генотипом Ε включает изолят HB-JI411F и штамм НВ-JI411 (регистрационный номер АР007262). Приведенный в качестве примера ВГВ с генотипом F включает изоляты HBV-BL597 (регистрационный номер АВ214516) и HBV-BL592 (регистрационный номер АВ166850), но не ограничивается ими. Приведенный в качестве примера ВГВ с генотипом G включает изолят HB-JI444GF и штамм HB-JI444G (регистрационный номер АР007264), но не ограничивается ими. Приведенный в качестве примера ВГВ с генотипом H включает изолят HBV ST0404 (регистрационный номер АВ298362) и изолят HB-JI260F и штамм HB-JI260 (регистрационный номер АР007261), но не ограничивается ими.
Следует понимать, что настоящее изобретение не ограничивается данными последовательностями ВГВ, приведенными в качестве примера. Более того, нуклеотидные и аминокислотные последовательности любых возможных полипептидов/пептидов ВГВ, согласно настоящему изобретению, могут варьировать у различных изолятов и генотипов ВГВ, и такие естественные генетические вариации находятся в рамках изобретения. Более того, полипептиды/пептиды ВГВ по данному изобретению могут представлять определенный генотип и, таким образом, включать аминокислотную последовательность, соответствующую или близкую консенсусной последовательности.
Кроме того, каждый из полипептидов/пептидов ВГВ может независимо происходить из любого генотипа, штамма или изолята ВГВ, известного в настоящее время, например, любого из указанных выше в связи с термином "ВГВ". Такая конфигурация позволяет обеспечить защиту против более широкого спектра генотипов ВГВ или адаптацию к определенному географическому региону, за счет использования генотипа(ов) ВГВ, который(е) являе(ю)тся эндемичным(и) для данного региона или для определенной популяции пациентов. При этом, генотипы А и С больше всего распространены в США, генотипы А и D в странах Западной Европы, а генотип D в странах Средиземноморья, тогда как генотипы В и С чаще всего встречаются в Китае. Ограниченные данные по Индии позволяют предположить, что генотипы А и D являются преобладающими в Индии. Специалист в данной области может выбрать соответствующие генотипы, серотипы, штаммы и/или изоляты ВГВ в зависимости от популяции, которая будет получать лечение, и/или географического региона.
Согласно предпочтительному воплощению, полипептиды/пептиды ВГВ, применяющиеся в данном изобретении, происходят из вируса с генотипом D, наиболее предпочтительным является изолят ВГВ Y07587.
Мутантная полимераза ВГВ
Мутантный полипептид полимеразы по изобретению включает мутированный домен полимеразы с внутренней делецией, которая подавляет функциональную активность полимеразы и включает по меньшей мере мотив YMDD, который присутствует в полимеразном домене нативной полимеразы в природных условиях. Подавление полимеразной активности, проявляющееся у полученного мутантного полипептида полимеразы, можно оценить с помощью методов, хорошо известных в области техники (например, определение эндогенной полимеразы, описанное Radziwill et al., 1990, J Virol. 64:613).
Общая аминокислотная последовательность, охватывающая полимеразный домен нативных полимераз ВГВ генотипов В, С и D, приведена в SEQ ID NO: 1, где остаток Хаа в положении 7 представляет собой Thr (Τ) или Ala (А); остаток Хаа в положении 13 представляет собой Asn (Ν), Arg (R) или His (H); остаток Хаа в положении 16 представляет собой Ile (I) или Thr (Т); остаток Хаа в положении 38 представляет собой Thr (Τ) или Ala (А); остаток Хаа в положении 53 представляет собой Ser (S) или Asn (N); остаток Хаа в положении 54 представляет собой Thr (Τ) или Туг (Y); остаток Хаа в положении 55 представляет собой His (Η) или Arg (R); остаток Хаа в положении 91 представляет собой Ile (I) или Leu (L); остаток Хаа в положении 109 представляет собой Pro (Ρ) или Ser (S); остаток Хаа в положении 118 представляет собой Thr (Τ) или Asn (N); остаток Хаа в положении 121 представляет собой Asn (Ν) или Ile (I); остаток Хаа в положении 122 представляет собой Ile (I) или Phe (F); остаток Хаа в положении 124 представляет собой Туг (Y) или Asn (N); остаток Хаа в положении 127 представляет собой Gly (G) или Arg (R); остаток Хаа в положении 131 представляет собой Asp (D) или Asn (N); остаток Хаа в положении 134 представляет собой Asp (D) или Asn (N); остаток Хаа в положении 145 представляет собой Leu (L) или Met (M); остаток Хаа в положении 149 представляет собой Lys (К) или Gin (Q); остаток Хаа в положении 151 представляет собой Phe (F) или Tyr (Y); остаток Хаа в положении 221 представляет собой Phe (F) или Tyr (Y); остаток Хаа в положении 222 представляет собой Thr (Τ) или Ala (А); остаток Хаа в положении 223 представляет собой Ser (S) или Ala (А); остаток Хаа в положении 224 представляет собой Ile (I) или Val (V); остаток Хаа в положении 238 представляет собой Asn (Ν) или His (H); остаток Хаа в положении 248 представляет собой Asn (Ν) или His (H); остаток Хаа в положении 256 представляет собой Ser (S) или Cys (С); остаток Хаа в положении 257 представляет собой Trp (W) или Tyr (Y); остаток Хаа в положении 259 представляет собой Thr (Τ) или Ser (S); остаток Хаа в положении 263 представляет собой Glu (Ε) или Asp (D); остаток Хаа в положении 266 представляет собой Val (V) или Не (I); остаток Хаа в положении 267 представляет собой Leu (L) или Gin (Q); остаток Хаа в положении 271 представляет собой Gin (Q), Met (M) или Glu (E); остаток Хаа в положении 317 представляет собой Ser (S) или Ala (А); и остаток Хаа в положении 332 представляет собой Cys (Τ) или Ser (S).
В соответствии с настоящим изобретением, в мутированном полимеразном домене в составе мутантного полипептида полимеразы по изобретению отсутствует по меньшей мере мотив YMDD, находящийся в положениях с 203 по 206 этого общего полимеразного домена с последовательностью SEQ ID NO: 1.
Настоящее изобретение также охватывает любые другие внутренние делеции по меньшей мере 4 аминокислотных остатков и самое большее 30 аминокислотных остатков, которые включают по меньшей мере этот мотив YMDD.
Репрезентативный мутантный полипептид полимеразы по изобретению включает мутированный полимеразный домен, включающий аминокислотную последовательность, приведенную в SEQ ID NO: 1, но не имеющий по меньшей мере остатка Туг в положении 203, остатка Met в положении 204, остатка Asp в положении 205 и остатка Asp в положении 206.
Помимо мотива YMDD внутренняя делеция предпочтительно охватывает частично или полностью соседний мотив WL, находящийся на С конце мотива YMDD нативного полимеразного домена ВГВ (соответствует остаткам в положениях 207-209 по SEQ ID NO: 1 и остаткам в положениях 542-544 нативной полимеразы из 832 аминокислот). Такой мотив WL может вносить вклад в формирование "соединенных" эпитопов (например, коллинеарно образованных нео-эпитопов), с которыми связан риск снижения или ослабления иммунного ответа хозяина, направленного против одного или более эпитопов, относящихся к полимеразе ВГВ.
Предпочтительно, мутантный полипептид полимеразы по изобретению содержит мутированный домен полимеразы, имеющий аминокислотную последовательность, приведенную в SEQ ID NO: 1, у которого отсутствует по меньшей мере остаток Туг в положении 203, остаток Met в положении 204, остаток Asp в положении 205, остаток Asp в положении 206, остаток Val в положении 207, остаток Val в положении 208 и остаток Leu в положении 209.
Более предпочтительно, мутантный полипептид полимеразы по изобретению содержит домен полимеразы, имеющий в своем составе или, в альтернативном случае, по существу состоящий из, или, в альтернативном случае, состоящий из аминокислотной последовательности, которая идентична по меньшей мере на 80%, преимущественно по меньшей мере на 85%, предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95% и еще более предпочтительно на 100% аминокислотной последовательности, приведенной в SEQ ID NO: 2. Еще более предпочтительно, мутированный домен полимеразы содержит аминокислотную последовательность, приведенную в SEQ ID NO: 2.
Альтернативно или дополнительно мутантный полипептид полимеразы по изобретению также содержит мутированный домен РНКазы Н, имеющий мутацию(и) одного или более аминокислотных остатков, подавляющую(ие) функциональную активность РНКазы Н, которую обычно проявляет нативная полимераза ВГВ.
Как обсуждалось выше, функциональный домен, задействованный в активности РНКазы Н, располагается в С-концевой части, более конкретно, от положения 680 до С-конца нативной полимеразы ВГВ, состоящей из 832 аминокислот (или от положения 693 до С-конца нативной полимеразы ВГВ из 845 аминокислот), и настоящее изобретение охватывает любую(ые) мутацию(и) в этом домене, связанную(ые) с подавлением активности РНКазы H (т.е. возможно приводящие к слабой остаточной активности менее 20% от активности нативной РНКазы Н). Подавление активности РНКазы Н, которое проявляется у мутантного полипептида полимеразы, можно оценивать с помощью исследований, хорошо известных в области техники (например, определение активности РНКазы H in vitro или молекулярный анализ тандемов ДНК-РНК, описанный Radziwill et al., 1990, J Virol. 64:613 или Lee et al., 1997, Biochem. Bioph. Res. Commun. 233(2):401).
Общая аминокислотная последовательность, охватывающая домен РНКазы H нативных полимераз ВГВ с генотипами В, С и D, приведена в SEQ ID NO: 3, где остаток Хаа в положении 2 представляет собой Ser (S) или Pro (Р); остаток Хаа в положении 19 представляет собой Ala (А) или Val (V); остаток Хаа в положении 20 представляет собой Ile (I) или Met (M); остаток Хаа в положении 30 представляет собой Val (V) или Leu (L); остаток Хаа в положении 31 представляет собой Ala (А) или Ser (S); остаток Хаа в положении 53 представляет собой Lys (К) или Asn (N); остаток Хаа в положении 54 представляет собой Leu (L) или Ile (I); остаток Хаа в положении 55 представляет собой Leu (L) или Не (I); остаток Хаа в положении 97 представляет собой Ala (А) или Thr (Т); остаток Хаа в положении 108 представляет собой Tyr (Y) или Ser (S); остаток Хаа в положении 115 представляет собой Pro (Ρ) или Leu (L); остаток Хаа в положении 116 представляет собой Phe (F) или Tyr (Y); остаток Хаа в положении 128 представляет собой Val (V) или Asp (D).
Преимущественно, одна или более мутаций, имеющихся в домене РНКазы H мутантного полипептида полимеразы по изобретению, выбраны из группы, состоящей из:
- делеции по меньшей мере 8 аминокислот и самое большее 60 аминокислот, включающей по меньшей мере часть SEQ ID NO: 3, продолжающуюся приблизительно от остатка Glu (Ε) в положении 39 приблизительно до остатка Ala (А) в положении 46 (del ELLAACFA);
- замены остатка Asp (D) в положении 10 согласно SEQ ID NO: 3 на аминокислотный остаток, отличный от D;
- замены остатка Val (V) в положении 90 согласно SEQ ID NO: 3 на аминокислотный остаток, отличный от V;
- замены остатка Thr (Τ) или Ala (А) в положении 97 согласно SEQ ID NO: 3 на аминокислотный остаток, отличный от Τ или А;
- замены остатка Asp (D) в положении 98 согласно SEQ ID NO: 3 на аминокислотный остаток, отличный от D; и любой их комбинации.
Репрезентативные примеры подходящих комбинаций включают (а) замены аминокислотных остатков в положении 10, 90, 97 и 98; (б) делецию от 8 до 60 аминокислотных остатков, включая мотив GLLAACFA, и замены аминокислотных остатков в любом из указанных положений; или (в) комбинацию всех перечисленных мутаций, но не ограничиваются ими.
Соответственно, замещенный(е) остаток(ки) в положении 10, 90, 97 или 98 согласно SEQ ID NO: 3 по-отдельности замещаются на остаток His (H) или на остаток Туг (Y), особенно предпочтительно остаток в положении 10 согласно SEQ ID NO: 3 замещается на остаток (H) (D689H), остаток в положении 90 согласно SEQ ID NO: 3 замещается на остаток Tyr (Y) (V769Y), остаток в положении 97 согласно SEQ ID NO: 3 замещается на остаток Туг (Y) (T776Y или A776Y) и/или остаток в положении 98 согласно SEQ ID NO: 3 замещается на остаток His (H) (D777H).
Соответственно, делеция, находящаяся в мутированном домене РНКазы Н, включает участок по меньшей мере из 19 аминокислотных остатков, продолжающийся приблизительно от остатка Glu (Ε) в положении 39 приблизительно до остатка Thr (Τ) в положении 57 согласно SEQ ID NO: 3, предпочтительно участок по меньшей мере из 25 аминокислотных остатков, продолжающийся приблизительно от остатка Glu (Ε) в положении 39 приблизительно до остатка Leu (L) в положении 63 согласно SEQ ID NO: 3, и более предпочтительно участок по меньшей мере из 33 аминокислотных остатков, продолжающийся приблизительно от остатка Хаа (А или S) в положении 31 приблизительно до остатка Leu (L) в положении 63 согласно SEQ ID NO: 3.
Предпочтительно, мутантный полипептид полимеразы по изобретению содержит мутированный домен РНКазы Н, имеющий в своем составе аминокислотную последовательность, приведенную в SEQ ID NO: 3, но (а) не имеющий участка из 33 аминокислотных остатков, продолжающегося приблизительно от остатка Хаа (X) в положении 31 приблизительно до остатка Leu (L) в положении 63, и имеющий (б) замену остатка Asp (D) в положении 10 на остаток His (H) (D689H); (в) замену остатка Val (V) в положении 90 на остаток Tyr (Y) (V769Y); (г) замену остатка в положении 97 на остаток Tyr (Y) (T/A776Y) и (д) замену остатка Asp (D) в положении 98 на остаток His (H) (D777H).
Более предпочтительно, мутантный полипептид полимеразы по изобретению содержит мутированный домен РНКазы Н, имеющий в своем составе, или в альтернативном случае по существу состоящий из, или в альтернативном случае состоящий из аминокислотной последовательности, которая идентична по меньшей мере на 80%, преимущественно по меньшей мере на 85%, предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, еще более предпочтительно на 100% аминокислотной последовательности, приведенной в SEQ ID NO: 4.
В еще более предпочтительном воплощении мутантный полипептид полимеразы по изобретению содержит, в альтернативном случае по существу состоит из, или в альтернативном случае состоит из аминокислотной последовательности, которая идентична по меньшей мере на 80%, преимущественно по меньшей мере на 85%, предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, еще более предпочтительно на 100% аминокислотной последовательности, приведенной в SEQ ID NO: 5. Еще более предпочтительным является мутантный полипептид полимеразы, имеющий в своем составе аминокислотную последовательность, приведенную в SEQ ID NO: 5.
В контексте изобретения мутантный полипептид полимеразы по изобретению может иметь дополнительные мутации. Однако, предпочтительно избегать модификаций, которые окажутся пагубными для иммуногенной активности, особенно в участках с высоким содержанием В, CTL и/или TH эпитопов.
Примеры дополнительных модификаций включают укорочения (отсечения) на N-конце. Наиболее целесообразными являются отсечения по меньшей мере 20 аминокислотных остатков и самое большее 100 аминокислотных остатков, обычно находящихся на N-конце нативной полимеразы ВГВ или последовательности SEQ ID NO: 5, наибольшее предпочтение отдается отсечению аминокислот начиная от положения 1 (инициатор Met) или 2 приблизительно до положения 47 согласно SEQ ID NO: 5. Эта модификация имеет особое значение для комбинации мутантного полипептида полимеразы с нативным коровым полипептидом ВГВ, поскольку такое укорочение на N-конце помогает сократить или удалить перекрывающиеся участки этих двух полипептидов. Однако, этого же можно добиться с использованием неукороченного мутантного полипептида полимеразы в комбинации с укороченным на С-конце коровым полипептидом ВГВ, как описано ниже.
Желательно, полученный мутантный полипептид полимеразы сохраняет иммуногенные свойства, в частности способность стимулировать клеточно-опосредованный иммунный ответ, в той же степени или, возможно, более выражено по сравнению с нативной полимеразой.
Комбинация/гибридизация с другим(и) полипептидом(ами) В другом воплощении мутантный полипептид полимеразы по изобретению может применяться в комбинации с одним или более дополнительными полипептидами или пептидами.
Термин "комбинация" и такие его варианты, как "комбинированное применение" обозначают действие введения в тот же самый организм-хозяин двух или более соединений, один из которых является объектом изобретения. Как правило, по меньшей мере два соединения можно вводить различными путями и с различной периодичностью. Подходящая комбинация включает комбинацию мутантного полипептида полимеразы, описанного здесь (или кодирующего его вектора), с противовирусным(и) препаратом(ами) (стандартное лечение) и/или с другим(и) дополнительным(и) полипептидом(ами) или вектором(ами), кодирующим(и) такой(ие) дополнительный(е) полипептид(ы), но не ограничивается ей. Такая комбинация может быть в форме (а) смеси (например, смеси двух или более полипептидов или векторов), (б) гибридизации двух или более соединений или (в) определенной системы экспрессии (например, бицистронная экспрессия или независимая экспрессия). Например, два или более соединений могут экспрессироваться независимо в том же самом векторе при использовании разных регуляторных элементов (например, разных промоторных и терминирующих последовательностей). Независимая экспрессия особенно подходит для экспрессии в плазмидах или векторах на основе вируса кори. В альтернативном случае, два или более соединений можно экспрессировать в бицистронных векторах под контролем одинаковых промоторных и терминирующих последовательностей, но с использованием дополнительных регуляторных элементов, таких как 1RES (внутренние сайты связывания рибосом), обеспечивающих трансляцию двух или более цистронов той же самой мРНК. В области техники существует большой выбор 1RES, например, ведущих происхождение от полиовируса, вируса гепатита С и вируса энцефаломиокардита (EMCV) (например, см. WO 95/24485). Бицистронные конструкции особенно подходят для экспрессии с использованием векторов с более ограниченной клонирующей емкостью, например, аденовирусных векторов.
Термин "гибридизация" или "гибридный белок" в данном документе обозначают комбинацию двух или более полипептидов/пептидов в одной полипептидной цепи. Предпочтительно, гибридизация осуществляется с использованием генетических методов, т.е. путем соединения в рамке считывания нуклеотидных последовательностей, кодирующих каждый из указанных полипептидов/пептидов. "Соединение в рамке считывания" означает, что экспрессия гибридизованных кодирующих последовательностей позволяет получить единый белок в отсутствие терминатора трансляции между каждым из гибридизующихся полипептидов/пептидов. Гибридизация может быть прямой (т.е. без каких-либо дополнительных аминокислотных остатков между ними) или посредством линкера (например, пептида размером от 3 до 30 аминокислотных остатков, состоящего из повторов аминокислотных остатков, таких как глицин, серии, треонин, аспарагин, аланин и/или пролин).
Дополнительный(е) полипептид(ы) или пептид(ы) для применения в комбинации с мутантным полипептидом полимеразы по изобретению предпочтительно представляет(ют) собой полипептид или пептид, кодируемый в геноме ВГВ, например, любой(ые) нативный(е) полипептид(ы) ВГВ, их модифицированные производные и/или фрагменты. Репрезентативные примеры таких полипептидов или пептидов ВГВ включают НВс (коровый), HBs, белок X и любые их иммунногенные фрагменты, но не ограничиваются ими.
Согласно изобретению, как указано выше, любой из дополнительных полипептидов или пептидов ВГВ, применяющихся в изобретении, могут происходить из различных или одинаковых генотипов, штаммов или изолятов ВГВ, как и генотип, штамм или изолят ВГВ, из которого происходит мутантный полипептид полимеразы по изобретению. Предпочтительно, такие дополнительные полипептиды ВГВ происходят из ВГВ с генотипом D, и в частности, изолята Y07587.
Предпочтительная комбинация находится в форме гибридного белка, составленного из мутантного полипептида полимеразы, описанного здесь, и дополнительного(ых) полипептида(ов). Такая гибридизация предпочтительно является прямой, без какого-либо линкера между гибридизуемыми соединениями.
Комбинация с коровым полипептидом
В данном документе термин "коровый полипептид" обозначает полипептид, сохраняющий по меньшей мере 100 аминокислотных остатков, содержащихся в нативном коровом белке (НВс) ВГВ. Этот термин охватывает нативные (т.е. имеющие природное происхождение) коровые полипептиды любого штамма, изолята или генотипа ВГВ, которые могут быть обнаружены, выделены, получены из источника ВГВ в природе, например, такого как указанные выше в связи с термином "ВГВ", а также модифицированные коровые полипептиды и их фрагменты.
Коровый полипептид ВГВ, применяющийся в изобретении, может происходить из вируса ВГВ, имеющего такой же или иной генотип по сравнению с генотипом, из которого происходит мутантный полипептид полимеразы. Предпочтительно, они оба происходят из вируса с генотипом D, и более конкретно, из изолята Y07587. Коровые полипептиды и кодирующие их последовательности могут быть получены с помощью ряда способов, известных специалистам в данной области, например, химическим синтезом кодирующей последовательности (например, приводящим к получению синтетической молекулы нуклеиновой кислоты) или рекомбинантными способами (например, с помощью сайт-специфического мутагенеза соответствующей нуклеотидной последовательности, мутагенеза с помощью ПЦР, перестройки ДНК).
Предусматриваются любые модификации, с тем условием, что у полученного корового полипептида при комбинировании или гибридизации с мутантным полипептидом полимеразы, описанным здесь, сохраняется выраженная иммуногенная активность, которая предпочтительно находится на том же уровне или превышает таковую нативного аналога.
Подходящие модификации включают отсечение по меньшей мере 10 аминокислотных остатков и самое большее 41 аминокислотного остатка, обычно находящихся на С-конце нативного корового полипептида или в составе его С-концевого участка, наибольшее предпочтение отдается отсечению аминокислот начиная от остатка 143, 144, 145, 146, 147, 148 или остатка 149 до С-конца (остаток 183) нативного корового полипептида. Другие подходящие модификации включают внутреннюю делецию одного или более аминокислотных остатков, особенно в участке(ах), экспонированных на поверхности, например, как в участке, расположенном вблизи остатка 80, предположительно формирующем внешнюю петлю (Argos et al. 1988, EMBO J. 7: 819; Borisova et al., 1993, J. Virol. 67: 3696; Schodel et al., 1992, J. Virol. 66: 106; Yon et al., 1992, J. Gen Virol. 73: 2569; and Pumpens et al., 1995, Intervirology 38: 63).
В предпочтительном воплощении комбинация выполняется в виде гибридизации. Соответственно, изобретение относится к гибридному белку, содержащему мутантный полипептид полимеразы, описанный здесь, и партнер по гибридизации. Предпочтительно, партнер по гибридизации представляет собой коровый полипептид ВГВ, особенно предпочтительным является коровый полипептид, который укорочен на С-конце и, в частности, укорочен до остатка 148.
Предпочтительно, коровый полипептид ВГВ соединен в рамке считывания с N-концом мутантного полипептида полимеразы, описанного здесь, что позволяет получить гибридный белок, начинающийся инициирующей аминокислотой Met, и содержащий коровый полипептид (модифицированный или нативный) без какого-либо стоп-кодона, мутантный полипептид полимеразы (без инициирующей аминокислоты Met) и стоп-кодон.
Предпочтительный гибридный белок содержит, в альтернативном случае по существу состоит из, или в альтернативном случае состоит из аминокислотной последовательности, которая идентична по меньшей мере на 80%, преимущественно по меньшей мере на 85%, предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95% и еще более предпочтительно на 100% аминокислотной последовательности, приведенной в SEQ ID NO: 6. Более предпочтительно, гибридный белок по изобретению содержит аминокислотную последовательность, приведенную в SEQ ID NO: 6.
Комбинация с иммуногенными доменами HbsAg
Альтернативно или дополнительно к предыдущему воплощению (комбинация с коровым полипептидом) мутантный полипептид полимеразы по изобретению может применяться в комбинации с HbsAg или его иммуногенным(и) фрагментом(ами)/доменом(ами).
В данном документе термин "иммуногенный домен" обозначает полипептид, имеющий приблизительно от 15 приблизительно до 100 аминокислотных остатков и предпочтительно по меньшей мере 20 и самое большее 60 последовательно расположенных аминокислот, включающий по меньшей мере один В- и/или Т-клеточный эпитоп, специфичный для Т-хелперных (TH) клеток и/или цитотоксических Т-клеток (CTL), обычно присутствующий в нативном белке HBsAg. Кроме того, такие эпитопы могут быть рестриктированы по различным антигенам I и/или II класса МНС (например, А2, А24, DR, DP, и т.д.). Предпочтительно, один или более иммуногенных доменов HbsAg, использовавшихся в изобретении, не включают каких-либо участков полипептидов preS1 и preS2 ВГВ.
Каждый иммуногенный домен в отдельности может происходить из того же самого или иного вируса ВГВ, который может быть тем же самым вирусом ВГВ, из которого происходит мутантный полипептид полимеразы, описанный здесь (и возможно, коровый полипептид) или иным вирусом ВГВ. Предпочтительно, один или более иммуногенных доменов происходят из ВГВ с генотипом D и в частности, из изолята Y07587.
Приведенные в качестве примера иммуногенные домены, которые могут применяться в изобретении, описаны в области техники (например, WO 93/03764; WO 94/19011; Desombere et al., 2000, Clin. Exp. Immunol 122: 390; Loirat et al., 2000, J. Immunol. 165: 4748; Schirmbeck et al., 2002, J. Immunol 168: 6253; Depla et al., 2008, J. Virol. 82: 435 и WO2011/015656). Наиболее предпочтительные иммуногенные домены включают домены env1 и env2, описанные в WO 2011/015656. «Env1» соответствует части нативного HBsAg приблизительно от положения 14 приблизительно до положения 51, a env2 - части HBsAg приблизительно от положения 165 приблизительно до положения 194.
В предпочтительном воплощении комбинация осуществляется в виде гибридизации и изобретение относится к гибридному белку, содержащему мутантный полипептид полимеразы, описанный здесь, и один или более иммуногенных доменов HbsAg, или к гибридному белку, описанному выше (содержащему по меньшей мере мутантный полипептид полимеразы, описанный здесь, и полипептид НЬс), также содержащему один или более иммуногенных доменов HBsAg. Один или более иммуногенных доменов могут располагаться на N-конце, на С-конце и/или внутри гибридного белка, например, внутри мутантного полипептида полимеразы (например, на месте участка, отсутствующего в мутированных доменах полимеразы и/или РНКазы Н) или между коровым полипептидом и мутантным полипептидом полимеразы. Специалист в данной области способен определить необходимость регуляторных элементов, опосредующих трансляцию, и их расположение (например, инициирующая аминокислота Met и кодон STOP на N- и С-концах гибридного белка).
Гибридные белки, представляющие особый интерес, содержат мутантный полипептид полимеразы, описанный здесь, коровый полипептид и два иммуногенных домена HBsAg, наиболее предпочтителен гибрид, имеющий на N-конце коровый полипептид (например, нативный из 183 остатков или укороченный из 148 остатков с инициирующей аминокислотой Met), гибридизованный с мутантным полипептидом полимеразы (без инициирующей аминокислоты Met), содержащим один или два иммуногенных домена HbsAg, встроенных в участке внутренней делеции мутированного домена полимеразы (например, env1) и/или в участке делеции мутированного домена РНКазы H (например, env2).
В предпочтительном аспекте данного воплощения гибридный белок по изобретению содержит, или в альтернативном случае по существу состоит из, или в альтернативном случае состоит из аминокислотной последовательности, которая идентична по меньшей мере на 80%, преимущественно по меньшей мере на 85%, предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, и еще более предпочтительно на 100% любой аминокислотной последовательности, приведенной в SEQ ID NO: 7-9. Наиболее предпочтительное воплощение относится к гибридному белку, содержащему аминокислотную последовательность, приведенную в SEQ ID NO: 8.
В контексте изобретения мутантный полипептид полимеразы по изобретению или гибридный белок по изобретению могут также иметь дополнительные структурные характеристики.
В одном воплощении он может содержать дополнительный(е) компонент(ы) (например, пептид или полипептид), предназначенные для улучшения его иммуногенной активности в организме-хозяине. Такие компоненты, способные усиливать иммуногенность, были описаны в литературе и включают кальретикулин (Cheng et al., 2001, J. Clin. Invest. 108: 669), белок теплового шока 70 (HSP70) микобактерий туберкулеза (Chen et al., 2000, Cancer Res. 60: 1035), убиквитин (Rodriguez et al., 1997, J. Virol. 71: 8497), бактериальный токсин, такой как домен транслокации экзотоксина A (ETA(dlll)) Pseudomonas aeruginosa (Hung et al., 2001 Cancer Res. 61: 3698), а также эпитоп(ы) Т-хелперов, такие как пептид Pan-Dr (Sidney et al., 1994, Immunity 1: 751), эпитоп pstS1 GCG (Vordermeier et al., 1992, Eur. J. Immunol. 22: 2631), пептиды столбнячного токсина P2TT (Panina-Bordignon et al., 1989, Eur. J. Immunol. 19: 2237) и P30TT (Demotz et al., 1993, Eur. J. Immunol. 23: 425), эпитоп вируса гриппа (Lamb et al., 1982, Nature 300: 66) и эпитоп гемаглютинина (Rothbard et al., 1989, Int. Immunol. 1: 479), но не ограничиваются ими.
Другие полезные структурные характеристики выгодны для синтеза, процессинга, стабильности и растворимости мутантного полипептида полимеразы или гибридного белка по изобретению (например, направленные на модификацию потенциальных сайтов расщепления, потенциальных сайтов гликозилирования и/или связывания с мембраной для улучшения презентирования на клеточной мембране).
Для иммунного ответа может быть выгодно направить синтез мутантного полипептида полимеразы или гибридного белка, описанных здесь, на клеточную поверхность с помощью соответствующих последовательностей, хорошо известных в области техники, таких как сигнальные пептиды и/или трансмембранные пептиды. Вкратце, сигнальные пептиды обычно располагаются на N-конце мембрано-презентируемых или секретируемых полипептидов и запускают их транспорт в эндоплазматический ретикулум (ЭПР). Они обычно содержат от 15 до 35, в основном гидрофобных аминокислот, которые затем удаляются особыми эндопептидазами, расположенными в ЭПР, с образованием зрелого полипептида. Трансмембранные пептиды также обладают выраженной гидрофобностью и служат для закрепления полипептида в клеточной мембране. Выбор трансмембранных и/или сигнальных пептидов, которые могут применяться в контексте настоящего изобретения, очень широк. Они могут быть получены из любых мембраносвязанных и/или секретируемых полипептидов (например, клеточных или вирусных полипептидов), таких как полипептиды иммуноглобулинов, тканевого активатора плазминогена, инсулина, гликопротеина вируса бешенства, гликопротеина оболочки ВИЧ или белка F вируса кори или могут быть синтетическими.
В одном воплощении мутантный полипептид полимеразы или гибридный белок по изобретению соединен в рамке считывания с сигнальным пептидом, который встроен на N-конце в нисходящем направлении от кодона инициации трансляции. В другом воплощении мутантный полипептид полимеразы или гибридный белок по изобретению соединен в рамке считывания с сигнальным пептидом (например, встроенным на его N-конце) и с трансмембранным пептидом (например, встроен на С-конце, например, непосредственно перед стоп-кодоном). Предпочтительно, сигнальные и трансмембранные пептиды, используемые в контексте изобретения, происходят из гликопротеина вируса бешенства (см. например, WO 99/03885 или WO 2008/138649). Предпочтительные воплощения касаются мутантного полипептида полимеразы ВГВ и гибридного белка, содержащего, или в альтернативном случае по существу состоящего из, или в альтернативном случае состоящего из аминокислотной последовательности, которая идентична по меньшей мере на 80%, преимущественно по меньшей мере на 85%, в частности по меньшей мере на 90%, предпочтительно по меньшей мере на 95% и более предпочтительно на 100% аминокислотной последовательности, приведенной в SEQ ID NO: 10, SEQ ID NO: 11 или SEQ ID NO: 12.
Молекула нуклеиновой кислоты
В другом аспекте настоящего изобретения предложена выделенная молекула нуклеиновой кислоты, кодирующая мутантные полипептиды полимеразы и гибридные белки, описанные здесь.
В контексте настоящего изобретения термины "нуклеиновая кислота", "молекула нуклеиновой кислоты", "полинуклеотид" и "нуклеотидная последовательность" используются взаимозаменяемо и описывают полимер любой длины, из полидезоксирибонуклеотидов (ДНК) (например, кДНК, геномная ДНК, плазмиды, векторы, вирусные геномы, выделенная ДНК, зонды, праймеры и любые их смеси), полирибонуклеотидов (РНК) (например, мРНК, антисмысловая РНК) или смесей полирибо-полидезоксирибонуклеотидов. Они включают одно- или двуцепочечные, линейные или кольцевые полинуклеотиды естественного или синтетического происхождения. Более того, полинуклеотиды могут содержать нуклеотиды, не имеющие природного происхождения, и могут прерываться компонентами, которые не являются нуклеотидами.
Молекулы нуклеиновых кислот по настоящему изобретению могут быть получены из любого источника с использованием сведений о последовательностях, известных в области техники, и информации о последовательностях, приведенной в данном документе. Например, последовательности ДНК, кодирующие полимеразу ВГВ и, в случае необходимости, коровый полипептид и иммуногенные домены HbsAg, могут быть независимо получены из содержащих ВГВ клеток, библиотек кДНК и геномных библиотек, вирусных геномов или любых содержащих их векторов предшествующего уровня техники, а затем надлежащим образом связаны между собой с использованием стандартных методов молекулярной биологии или технологии ПЦР. В альтернативном случае молекулы нуклеиновых кислот по изобретению могут быть также получены при помощи химического синтеза в ходе автоматизированных процессов (например, собраны из перекрывающихся синтетических олигонуклеотидов или синтетических генов). Модификации могут быть осуществлены при помощи ряда способов, известных специалистам, например, при помощи химического синтеза, сайт-специфического мутагенеза, мутагенеза с помощью ПЦР, перестройки ДНК и т.д.
Особый интерес представляют любые молекулы нуклеиновых кислот, выбранные из группы, состоящей из:
- молекулы нуклеиновой кислоты, кодирующей мутантный полипептид полимеразы, содержащий домен полимеразы, имеющий аминокислотную последовательность, приведенную в SEQ ID NO: 1 или 2;
- молекулы нуклеиновой кислоты, кодирующей мутантный полипептид полимеразы, содержащий домен РНКазы Н, имеющий аминокислотную последовательность, приведенную в SEQ ID NO: 3 или 4;
- молекулы нуклеиновой кислоты, кодирующей мутантный полипептид полимеразы, содержащий аминокислотную последовательность, идентичную по меньшей мере на 80% (например, 80%, 85%, 90%, 95%, 97%, 100%) аминокислотной последовательности, приведенной в SEQ ID NO: 5; или
- молекулы нуклеиновой кислоты, кодирующей гибридный белок, содержащий аминокислотную последовательность, которая идентична по меньшей мере на 80% (например, 80%, 85%, 90%, 95%, 97%, 100%) аминокислотной последовательности, приведенной в любой из SEQ ID NO: 6-12.
Настоящее изобретение не исчерпывается этими приведенными в качестве примера нуклеотидными последовательностями и охватывает любые модификации, направленные на улучшение клонирования, экспрессии, стабильности молекул нуклеиновых кислот, применяющихся в изобретении (например, удаление соответствующих сайтов рестрикции и/или оптимизацию нуклеотидной последовательности для оптимизации трансляции в заданной клетке-хозяине и/или подавление возможных негативных элементов, которые могут дестабилизировать молекулу нуклеиновой кислоты или ее транскрипт). Когда предусматривается несколько модификаций, они могут затрагивать остатки, расположенные последовательно и/или непоследовательно. Эти модификации, предусмотренные в данном изобретении, включают молчащие модификации, которые не изменяют аминокислотной последовательности кодируемых полипептидов и гибридных белков, а также модификации, которые транслируются на уровне кодируемых полипептидов и гибридных белков.
В одном воплощении молекула нуклеиновой кислоты по изобретению может быть вырожденной по всей длине нуклеотидной последовательности или ее части(ей) для уменьшения гомологии между последовательностями молекул нуклеиновых кислот, применяющихся в контексте изобретения или с молекулами нуклеиновых кислот клеток-хозяев. Действительно, рекомендуют, чтобы участки последовательностей нуклеиновых кислот, имеющие высокую степень идентичности нуклеотидных последовательностей, были вырождены, и специалисты в данной области способны идентифицировать такие участки при сопоставлении последовательностей. Например, если вектор несет молекулу нуклеиновой кислоты, кодирующую мутантный полипептид полимеразы, согласно данному описанию, и молекулу нуклеиновой кислоты, кодирующую другой полипептид ВГВ, кодируемый перекрывающимися последовательностями в геноме ВГВ, может быть целесообразно вырождение одной или обеих молекул нуклеиновых кислот в перекрывающихся участках, во избежание гомологичной рекомбинации в ходе продуцирования.
Альтернативно или дополнительно, молекула нуклеиновой кислоты по изобретению может быть оптимизирована для обеспечения высокого уровня экспрессии в конкретной клетке-хозяине или организме-хозяине. Действительно, было обнаружено, что когда аминокислота кодируется более чем одним кодоном, частота использования кодонов у организмов не является случайной, и использование кодонов может значительно различаться у разных хозяев. Поскольку нуклеотидные последовательности, охватываемые изобретением, преимущественно происходят из вирусов (ВГВ), их паттерн использования кодонов может оказаться неподходящим для эффективной экспрессии в таких клетках-хозяевах, как клетки бактерий, низших или высших эукариот. Обычно оптимизацию кодонов осуществляют путем замены одного или более "нативных" кодонов (например, ВГВ), соответствующих кодону, редко используемому клеткой/организмом-хозяином, представляющими интерес, одним или более кодоном, кодирующим ту же аминокислоту, чаще используемым клеткой/организмом-хозяином, представляющими интерес. Не требуется заменять все нативные кодоны, соответствующие редко используемым кодонам, поскольку можно добиться повышенной экспрессии даже при частичной замене. Кроме того, возможны некоторые отклонения от предпочтительного использования кодонов для введения сайта(ов) рестрикции в получаемую молекулу нуклеиновой кислоты.
Кроме того, экспрессия в клетках-хозяевах или организмах может быть улучшена за счет дополнительных модификаций нуклеотидной последовательности, чтобы избежать группирования редких неоптимальных кодонов и/или для удаления или по меньшей мере частичной модификации негативных элементов последовательности, которые предположительно будут негативно влиять на уровень экспрессии (например, АТ-богатых или GC-богатых участков последовательности; нестабильных прямых или инвертированных повторов последовательности; вторичных структур РНК; и/или внутренних криптических регуляторных элементов, таких как внутренние ТАТА-боксы, Хи-сайты, сайты присоединения рибосом и/или донорные/акцепторные сайты сплайсинга).
Наиболее предпочтительное воплощение настоящего изобретения относится к молекуле нуклеиновой кислоты, содержащей, в альтернативном случае по существу состоящей из, или в альтерантивном случае состоящей из нуклеотидной последовательности, которая идентична по меньшей мере на 80%, преимущественно по меньшей мере на 85%, предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95% и еще более предпочтительно на 100% нуклеотидной последовательности, приведенной в любой из SEQ ID NO: 13-17.
Другое воплощение изобретения относится к фрагментам молекулы нуклеиновой кислоты по изобретению, например, фрагментам, полученным с помощью рестрикционных эндонуклеаз и ПЦР. Такие фрагменты могут использоваться как зонды, праймеры или фрагменты, кодирующие имуногенную часть кодируемого иммуногенного полипептида.
Векторы
В другом аспекте настоящего изобретения предложены векторы, содержащие молекулу нуклеиновой кислоты по настоящему изобретению.
Термин "вектор", используемый в данном документе, обозначает носитель, предпочтительно молекулу нуклеиновой кислоты или вирусную частицу, содержащую элементы, необходимые для обеспечения доставки, размножения и/или экспрессии одной или более молекул нуклеиновой кислоты внутри клетки-хозяина или организма-хозяина. Этот термин охватывает векторы для поддержания (клонирующие векторы) или векторы для экспрессии в различных клетках-хозяевах или организмах-хозяевах (экспрессирующие векторы), внехромосомные векторы (например, мультикопийные плазмиды) или векторы для интегрирования (например, предназначенные для интегрирования в геном клетки-хозяина и продуцирования дополнительных копий молекул нуклеиновой кислоты при репликации клетки-хозяина), а также челночные векторы (например, работающие в хозяевах прокариотах и/или эукариотах) и переносящие векторы (например, для переноса молекул(ы) нуклеиновой кислоты в вирусный геном). Для целей изобретения векторы могут происходить из естественных генетических источников, быть синтетическими или искусственными, или представлять собой некую комбинацию генетических элементов естественного и искусственного происхождения.
В контексте изобретения термин "вектор" следует понимать в широком смысле, включая плазмидные и вирусные векторы. "Плазмидный вектор" в данном документе обозначает реплицируемую ДНК-конструкцию. Обычно плазмидные векторы содержат гены селектируемых маркеров, которые позволяют проводить положительную или отрицательную селекцию клеток-хозяев, несущих плазмидный вектор, в присутствии соответствующего селективного агента. В области техники известны разнообразные маркерные гены для положительной и отрицательной селекции. В качестве иллюстрации можно привести ген устойчивости к антибиотику, который может применяться в качестве маркерного гена для положительной селекции, позволяющего выполнять селекцию клеток-хозяев в присутствии соответствующего антибиотика.
Термин "вирусный вектор" в данном документе обозначает вектор нуклеиновой кислоты, который включает по меньшей мере один элемент вирусного генома и может быть упакован в вирусную частицу. Термины "вирус", "вирионы", "вирусные частицы" и "вирусные векторные частицы" используются взаимозаменяемо и обозначают вирусные частицы, которые образуются при трансдукции вектора нуклеиновой кислоты в соответствующую клетку или клеточную линию в соответствии с условиями, подходящими для образования инфекционных вирусных частиц. В контексте настоящего изобретения термин "вирусный вектор" следует понимать в широком смысле, включая векторы на основе нуклеиновых кислот (например, векторы на основе вирусной ДНК), а также вирусные частицы, образованные из них. Термин "инфекционный" обозначает способность вирусного вектора инфицировать и поступать в клетку-хозяина или в организм-хозяин. Вирусные векторы могут быть репликационно-компетентными или репликационно-селективными (например, быть сконструированы для лучшей или селективной репликации в специфических клетках-хозяевах) или могут быть генетически повреждены таким образом, чтобы быть репликационно-дефектными или иметь нарушенную репликацию.
Векторы, подходящие для настоящего изобретения, включают бактериофаги, плазмидные или космидные векторы для экспрессии в клетках хозяев-прокариот, таких как бактерии (например, Е. coli, Bacillus subtilis или Listeria); векторы для экспрессии в дрожжах (например, Saccharomyces cerevisiae, Saccharomyces pombe, Pichia pastoris); бакуловирусные векторы для экспрессии в клетках насекомых (например, клетках Sf 9); вирусные и плазмидные векторы для экспрессии в клетах растений (например, Ti-плазмиды, вирус мозаики цветной капусты CaMV; вирус табачной мозаики TMV); а также вирусные и плазмидные векторы для экспрессии в клетках или организмах высших эукариот, но не ограничиваются ими.
Обычно такие векторы доступны для приобретения (например, в компаниях Invitrogen, Stratagene, Amersham Biosciences, Promega, и т.д.) или доступны в депозитарных институтах, таких как американская коллекция типовых культур (АТСС, Rockville, Md.) или являются предметом многочисленных публикаций, описывающих их последовательность, структуру и способы получения, позволяющие специалистам в данной области использовать их.
Репрезентативные примеры подходящих плазмидных векторов включают pREP4, рСЕР4 (Invitrogen), pCI (Promega), pVAX (Invitrogen) и pgWiz (Gene Therapy System Inc), но не ограничиваются ими.
Репрезентативные примеры подходящих вирусных векторов получены из множества различных вирусов (например, ретровируса, аденовируса, адено-ассоциированного вируса (AAV), поксвируса, вируса герпеса, вируса кори, пенящего вируса, альфавируса, вируса везикулярного стоматита и т.д.). Как отмечено выше, термин "вирусный вектор" охватывает векторную ДНК, геномную ДНК, а также вирусные частицы, полученные на их основе.
Настоящее изобретение также охватывает векторы (например, плазмидную ДНК), образующие комплексы с липидами или полимерами с формированием корпускулярных структур, таких как липосомы, липоплексы или наночастицы.
В одном воплощении вектор по изобретению представляет собой аденовирусный вектор. Он может быть получен на основе множества аденовирусов, поражающих человека или животных (например, собак, овец, обезьян и т.д.). Может использоваться любой серотип.Желательно, аденовирусный вектор является репликационно-дефектным и происходит из аденовируса человека, более конкретно, из человеческого аденовируса с редким серотипом или из аденовируса шимпанзе. Репрезентативные примеры аденовирусов человека включают подрод С Ad2 Ad5 и Ad6, подрод В Ad11, Ad34 и Ad35 и подрод D Ad19, Ad24, Ad48 и Ad49. Репрезентативные примеры аденовирусов шимпанзе включают AdCh3 (Peruzzi et al., 2009, Vaccine 27: 1293), AdCh63 (Dudareva et al., 2009, vaccine 27: 3501) и любые из тех, которые описаны в области техники (см., например, WO 03/000283; WO 03/046124; WO 2005/071093; WO 2009/073103; WO 2009/073104; WO 2009/105084; WO 2009/136977 и WO 2010/086189), но не ограничиваются ими.
Репликационно-дефектные аденовирусные векторы могут быть получены, как описано в области техники, например, при делеции по меньшей мере той области генома аденовируса, которая необходима для репликации вируса, или ее части, особенно предпочтительной является делеция области Е1, включающая в себя последовательности, кодирующие Е1 (например, продолжающаяся приблизительно от положения 459 до 3510, согласно последовательности человеческого аденовируса 5 типа, опубликованной в GeneBank под регистрационным номером M 73260 и в публикации Chroboczek et al., 1992, Virol. 186:280). Настоящее изобретение также охватывает векторы, имеющие дополнительные делеции/модификации в составе генома аденовируса (всей несущественной области ЕЗ или ее части или других существенно важных областей Е2, Е4 согласно описанию WO 94/28152; Lusky et al., 1998, J. Virol 72: 2022).
Молекула нуклеиновой кислоты по настоящему изобретению может быть встроена в любом местоположении генома аденовируса, и может быть расположена в смысловой и антисмысловой ориентации относительно естественного направления транскрипции интересующей области. Предпочтительно, молекула нуклеиновой кислоты по изобретению встроена взамен области Е1 аденовируса и находится под контролем промотора CMV.
Другие вирусные векторы, подходящие в контексте изобретения, представляют собой векторы на основе поксвирусов, которые могут быть получены из любого представителя семейства Poxviridae, особенно предпочтительными являются векторы на основе поксвирусов, происходящие из вируса Canarypox (оспы канареек), вируса Fowlpox (оспы кур) или вируса Vaccinia, последний является предпочтительным. Подходящие вирусы Vaccinia включают штамм Copenhagen (Goebel et al., 1990, Virol. 179: 247; Johnson et al., 1993, Virol. 196: 381), штамм Wyeth и особенно модифицированный штамм Ankara (MVA) (Antoine et al., 1998, Virol. 244: 365), но не ограничиваются ими. Общие положения для конструирования рекомбинантных поксвирусов хорошо известны в области техники. Молекула нуклеиновой кислоты по настоящему изобретению предпочтительно встроена в несущественный локус генома поксвируса. Ген тимидин-киназы особенно подходит для встраивания в вектор на основе вируса Vaccinia Copenhagen и для вставки в делеции II или III вектора MVA. Предпочтительно, молекула нуклеиновой кислоты по изобретению встроена в участке делеции III вектора MVA и находится под контролем промоторов вируса Vaccinia 7.5К или pH5R.
Другими вирусными векторами, подходящими в контексте изобретения, являются морбилливирусы, которые могут быть получены из семейства парамиксовирусов, особенно предпочтительным является вирус кори. В области техники известны различные ослабленные штаммы (Brandler et al, 2008, CIMID, 31: 271; Singh et al., 1999, J. virol. 73(6): 4823), такие как штаммы Edmonston А и В (Griffin et al., 2001, Field's in Virology, 1401-1441), штамм Schwartz (Schwarz A, 1962, Am J Dis Child, 103: 216), штаммы S-191 или C-47 (Zhang et al., 2009, J Med Virol. 81 (8): 1477), не исчерпывающиеся ими. Вставка между Ρ и M генами наиболее предпочтительна.
В соответствии с настоящим изобретением молекулы нуклеиновой кислоты, входящие в состав вектора по изобретению, находятся в форме, подходящей для экспрессии в клетке-хозяине или организме, что означает, что молекула нуклеиновой кислоты помещена под контроль соответствующих регуляторных последовательностей. В данном документе термин "регуляторные элементы" обозначает любые элементы, которые позволяют, способствуют или модулируют экспрессию молекулы нуклеиновой кислоты в заданной клетке-хозяине или организме, включая репликацию, дупликацию, транскрипцию, сплайсинг, трансляцию, стабильность и/или транспорт нуклеиновой кислоты или ее производного (т.е. мРНК).
Специалистам в данной области очевидно, что выбор регуляторных последовательностей может зависеть от таких факторов, как сам вектор, клетка-хозяин, необходимый уровень экспрессии и т.д. Особенно важное значение имеет промотор. В контексте изобретения он может быть конститутивным, направляющим экспрессию молекулы нуклеиновой кислоты во многих типах клеток-хозяев, или специфическим для определенных клеток-хозяев (например, печень-специфические регуляторные последовательности) или регулируемым в ответ на специфические события или экзогенные факторы (например, на температуру, питательные вещества, гормоны и т.д.) или в зависимости от фазы репликативного цикла вируса (например, поздней или ранней). Возможно также использование промоторов, которые подвергаются репрессии на стадии продукции в ответ на определенные события или экзогенные факторы, для оптимизации продукции вектора и во избежание потенциальной токсичности экспрессируемых полипептидов.
Промоторы, подходящие для конститутивной экспрессии в клетках млекопитающих, включают предранний промотор цитомегаловируса (CMV) (Boshart et al., 1985, Cell 41: 521), промотор RSV, основной поздний промотор аденовируса, промотор фосфоглицерокиназы (PGK) (Adra et al., 1987, Gene 60: 65), промотор тимидинкиназы (ТК) вируса простого герпеса (HSV)-1 и промотор Т7 полимеразы, но не ограничиваются ими. Промоторы вируса Vaccinia особенно подходят для экспрессии в векторах на основе поксвирусов. Репрезентативные примеры включают промоторы вируса Vaccinia 7.5К, H5R, 11К7.5 (Erbs et al., 2008, Cancer Gene Ther. 15: 18), ТК, р28, р11 и K1L, а также синтетические промоторы, такие как описанные Chakrabarti et al. (1997, Biotechniques 23: 1094), Hammond et al. (1997, J. Virological Methods 66: 135) и Kumar and Boyle (1990, Virology 179: 151), а также ранние/поздние химерные промоторы, но не ограничиваются ими. Промоторы, подходящие для экспрессии, опосредованной вирусом кори, включают любые промоторы, направляющие экспрессию транскрипционных единиц вируса кори (Brandler and Tangy, 2008, CIMID 31: 271), но не ограничиваются ими. Печень-специфические промоторы включают промоторы HMG-CoA редуктазы (Luskey, 1987, Mol. Cell. Biol. 7: 1881); стерол-регулирующего элемента 1 (SRE-1; Smith et al., 1990, J. Biol. Chem. 265: 2306); альбумина (Pinkert et al., 1987, Genes Dev. 1: 268); фосфоенол-пируват-карбоксикиназы (PEPCK) (Eisenberger et al., 1992, Mol. Cell Biol. 12: 1396); альфа-1 антитрипсина (Ciliberto et al., 1985, Cell 41: 531); человеческого трансферрина (Mendelzon et al., 1990, Nucleic Acids Res. 18: 5717); и генов FIX (US 5,814,716), но не ограничиваются ими.
Специалистам в данной области очевидно, что регуляторные элементы, контролирующие экспрессию молекулы нуклеиновой кислоты по изобретению, могут также содержать дополнительные элементы для надлежащей инициации, регуляции и/или терминации транскрипции (например, последовательность терминации транскрипции polyA), транспорта мРНК (например, сигнальные последовательности - сигналы ядерной локализации), процессинга (например, сигналы сплайсинга) и стабильности (например, интроны и некодирующие 5' и 3' последовательности), трансляции (например, инициирующая аминокислота Met, тройственная лидерная последовательность, внутренние сайты связывания рибосом 1RES, последовательности Шайна-Дальгарно и т.д.) в клетке-хозяине или организме и этапов очистки (например, таг).
Наиболее предпочтительные воплощения изобретения относятся к векторам (или вирусным частицам), выбранным из группы, состоящей из:
- дефектного аденовирусного вектора, содержащего встроенную на месте области Е1 молекулу нуклеиновой кислоты, помещенную под контроль промотора, такого как промотор CMV, и кодирующую мутантный полипептид полимеразы, содержащий аминокислотную последовательность, приведенную в SEQ ID NO: 5, или гибридный белок, содержащий аминокислотную последовательность, приведенную в SEQ ID NO: 6 или SEQ ID NO: 8;
- дефектного аденовирусного вектора, содержащего встроенную на месте области Е1 молекулу нуклеиновой кислоты, помещенную под контроль промотора, такого как промотор CMV, и содержащую нуклеотидную последовательность, приведенную в SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15;
- репликационно-дефектного аденовирусного вектора, в частности дефектного AdCh3, содержащего встроенную на месте области Е1 молекулу нуклеиновой кислоты, помещенную под контроль промотора, такого как промотор CMV, и содержащую нуклеотидную последовательность, приведенную в SEQ ID NO: 16 или SEQ ID NO: 17;
- вектора MVA, содержащего молекулу нуклеиновой кислоты, помещенную под контроль промотора вируса Vaccinia, такого как промотор 7.5К или pH5R, и кодирующую мутантный полипептид полимеразы, содержащий аминокислотную последовательность, приведенную в SEQ ID NO: 5 или SEQ ID NO: 10 или гибридный белок, содержащий аминокислотную последовательность, приведенную в SEQ ID NO: 6, SEQ ID NO: 8 или SEQ ID NO: 12; и
- вектора MVA, содержащего молекулу нуклеиновой кислоты, помещенную под контроль промотора вируса Vaccinia, такого как промотор 7.5К или pH5R, и содержащую нуклеотидную последовательность, приведенную в SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15. Предпочтительно указанная молекула нуклеиновой кислоты встроена в участке делеции III генома MVA.
При необходимости вектор по изобретению может также содержать один или более трансгенов, например, ген, представляющий интерес, экспрессирующийся вместе с молекулой нуклеиновой кислоты по изобретению в клетке-хозяине или организме-хозяине, для улучшения терапевтического или защитного действия в отношении инфекции, вызванной ВГВ, или любого заболевания или состояния, вызванного или связанного с инфекцией, вызванной ВГВ. Подходящие трансгены включают иммуномодуляторы, такие как цитокины и любые другие антигены, происходящие из организмов, потенциально способных вызывать сочетанную инфекцию (например, ВИЧ, микобактерия туберкулеза, и т.д.), но не ограничиваются ими. Если используется трансген, его экспрессия может обеспечиваться вектором по изобретению или независимым вектором, применяющимся в комбинации, как тем же самым, так и отличающимся от вектора по изобретению. Например, может быть предусмотрено использование комбинации аденовируса, экспрессирующего мутантный полипептид полимеразы или гибридный белок по изобретению, и аденовируса, экспрессирующего иммуномодулятор.
Согласно предпочтительному воплощению, вектор по изобретению находится в форме инфекционных вирусных частиц. Как правило, такие вирусные частицы продуцируются в ходе процесса, включающего стадии (а) введения вирусного вектора по изобретению в подходящую клеточную линию, (б) культивирования указанной клеточной линии в подходящих условиях, обеспечивающих продукцию указанных инфекционных вирусных частиц, (в) выделения полученных вирусных частиц из культуры указанной клеточной линии и (г) возможно, очистки указанных выделенных вирусных частиц.
Когда вирусный вектор является дефектным, частицы обычно продуцируют в комплементационной клеточной линии или с применением хелперного вируса, который комплементирует в транс-положении нефункциональные гены вируса. Например, подходящие клеточные линии для комплементации аденовирусных векторов с делецией Е1 включают клетки 293 (Graham et al., 1997, J. Gen. Virol. 36: 59-72), а также клетки HER-96 и PER-C6 (например, Fallaux et al., 1998, Human Gene Ther. 9: 1909-1917; WO97/00326) или любые производные этих клеточных линий. Однако в контексте настоящего изобретения можно использовать любую другую клеточную линию, в частности любую клеточную линию, которую используют для получения продукта, предназначенного для применения у человека, например, клетки Vero, клетки HeLa и клетки птиц, особенно подходящие для размножения векторов на основе поксвирусов. Подходящие клетки птиц включают первичные фибробласты эмбрионов цыплят (CEF), препарированные из куриных эмбрионов, полученных из оплодотворенных яиц, и линии утиных клеток (например, как описанные в WO 03/076601, WO 2009/004016, WO 2010/130756 и US 2011-008872), но не ограничиваются ими.
Инфекционные вирусные частицы можно выделить из культуральной надосадочной жидкости и/или из клеток после лизиса. Их можно дополнительно очистить согласно стандартным методам (хроматография, ультрацентрифугирование в градиенте хлорида цезия, как описано, например, в WO 96/27677, WO 98/00524, WO 98/22588, WO 98/26048, WO 00/40702, ЕР 1016700 и WO 00/50573).
Настоящее изобретение также охватывает векторы или вирусные частицы, которые были модифицированы для обеспечения преимущественной направленности в конкретную клетку-хозяина. Характерным признаком направленных векторов является присутствие на их поверхности лиганда, способного распознавать и связывать клеточный и экспонированный на поверхности компонент, такой как маркер, специфический для клетки (например, клетки, инфицированной ВГВ), ткане-специфический маркер (например, печень-специфический маркер), а также вирусный антиген (например, ВГВ). Примеры подходящих лигандов включают антитела или их фрагменты, направленные против антигенных доменов ВГВ. Направленность на клетки может обеспечиваться за счет генетического встраивания лиганда в полипептид, присутствующий на поверхности вируса (например, белок фибр аденовируса, пентон, р1Х или продукт гена вируса Vaccinia р14).
Клетки-хозяева
В другом аспекте изобретение также относится к клеткам-хозяевам, которые содержат молекулы нуклеиновой кислоты или векторы (или вирусные частицы) по изобретению.
В данном документе термин "клетка-хозяин" следует понимать в широком смысле, как охватывающий как изолированные клетки, так и организованные в конкретные ткани или органы. Такие клетки могут представлять собой один тип клеток или группу различных типов клеток, например, культивируемые клеточные линии, первичные клетки и пролиферирующие клетки. В контексте изобретения термин "клетки-хозяева" включает клетки прокариот, клетки низших эукариот, таких как дрожжи, и клетки других эукариот, например, клетки насекомых, растений и млекопитающих (например, человеческие или не человеческие), а также клетки, способные продуцировать вектор по изобретению (например, клетки 293, HER96, PERC.6, Vero, HeLa, CEF, линии утиных клеток, и т.д.). Этот термин также включает клетки, которые могут быть или были реципиентами вектора, описанного здесь, а также потомства таких клеток. Клетки-хозяева можно культивировать в стандарных биореакторах-ферментерах, флаконах и чашках Петри. Культивирование может выполняться при температуре, рН и содержании кислорода, подходящих для заданной клетки-хозяина. Здесь не будут подробно описываться различные прокариотические и эукариотические клетки-хозяева и известные способы продукции полипептидов и векторов, применяющиеся в изобретении.
Согласно определенному воплощению изобретения, клетки-хозяева могут быть также инкапсулированы. Технология инкапсуляции клеток хорошо известна в области техники.
Еще один аспект настоящего изобретения представляет собой способ рекомбинантной продукции мутантного полипептида полимеразы или гибридного белка по изобретению, в котором используются векторы (или инфекционные вирусные частицы) и/или клетки-хозяева по изобретению. Как правило, способ включает (а) введение вектора в подходящую клетку-хозяина с получением трансфицированной или инфицированной клетки-хозяина, (б) культивирование in vitro указанной трансфицированной или инфицированной клетки-хозяина в условиях, подходящих для выращивания клетки-хозяина, (в) выделение клеточной культуры и (г) возможно, очистку мутантного полипептида полимеразы или гибридного белка из выделенных клеток и/или культуральной надосадочной жидкости.
Предполагается, что специалистам в данной области известны различные системы экспрессии, известные в области техники для экспрессии мутантного полипептида полимеразы или гибридного белка в соответствующих клетках-хозяевах (таких, как описанные выше), и способы введения вектора в клетку-хозяина. Такие способы включают микроинъекции, CaPO4-опосредованную трансфекцию, DEAE-декстран-опосредованную трансфекцию, электропорацию, липофекцию/слияние с липосомами, генные пушки, трансдукцию, инфицирование вирусами, а также непосредственное введение в организм-хозяин различными способами, но не ограничиваются ими. Вектор по изобретению может применяться в сочетании с реагентами для трансфекции для облегчения введения в клетку-хозяина, например, поликатионными полимерами (например, хитозаном, полиметакрилатом, полиэтиленимином, и т.д.) и катионными липидами (например, DC-Chol/DOPE, трансфектамом, липофектином, доступными для приобретения в компании Promega).
Клетки-хозяева можно культивировать в стандартных биореакторах-ферментерах, флаконах и чашках Петри. Культивирование может выполняться при температуре, рН и содержании кислорода, подходящих для заданной клетки-хозяина. Мутантный полипептид полимеразы или гибридный белок затем могут быть очищены с помощью известных способов очистки, включающих преципитацию сульфатом аммония, кислотную экстракцию, электрофорез в геле; фильтрацию и хроматографические методы (например, обращенно-фазовую, эксклюзионную, ионообменную, аффинную хроматографию, хроматографию гидрофобных взаимодействий, хроматографию на гидроксиапатите, высокоэффективную жидкостную хроматографию и т.д.). Условия и методы, которые будут применяться, зависят от таких факторов, как суммарный заряд, молекулярный вес, гидрофобность, гидрофильность, и будут очевидны для специалистов в данной области. Более того, степень очистки будет зависеть от предполагаемого применения.
Композиции
В другом аспекте данного изобретения предложена композиция, содержащая по меньшей мере мутантный полипептид полимеразы или гибридный белок, молекулу нуклеиновой кислоты, вектор (например, инфекционную вирусную частицу) или клетку-хозяина, описанные здесь (которые здесь также обозначаются "активный агент") или любую их комбинацию (например, комбинацию различных полипептидов или векторов/вирусных частиц, описанных здесь, или комбинацию различных генотипов). Предпочтительно, композиция представляет собой фармацевтическую композицию, которая помимо терапевтически эффективного количества активного агента содержит фармацевтически приемлемый носитель.
В данном документе "фармацевтически приемлемый носитель" включает любые возможные носители, растворители, дилюенты, эксципиенты, адъюванты, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты и замедляющие абсорбцию агенты, и т.п., совместимые с введением в организм-хозяин и, в частности, с введением человеку.
В данном документе "терапевтически эффективное количество" представляет собой дозу, достаточную для смягчения одного или более симптомов, обычно связанных с инфекцией, вызванной ВГВ, или любым заболеванием или состоянием, вызванным или связанным с инфекцией, вызванной ВГВ. Если речь идет о профилактике, этот термин обозначает дозу, достаточную для того, чтобы предотвратить или отсрочить инфицирование ВГВ. "Терапевтические" композиции предназначены и вводятся в организм-хозяин, уже инфицированный ВГВ, для ослабления или облегчения по меньшей мере одного заболевания или состояния, вызванного или связанного с указанной инфекцией, вызванной ВГВ, возможно в комбинации с одним или несколькими стандартными терапевтическими средствами, описанным в данном документе (например, терапией нуклеозидами, аналогами нуклеотидов и/или терапией на основе интерферона). Например, терапевтически эффективное количество для индукции иммунного ответа может представлять собой такое количество, которое необходимо для активации иммунной системы (например, приводящей в результате к развитию ответа, направленного против ВГВ).
Термин "организм-хозяин" обычно обозначает позвоночного, в частности, представителя различных видов млекопитающих и особенно домашних животных, сельскохозяйственных животных, животных для занятий спортом и приматов, включая людей, которым необходим или может быть полезен любой продукт и способ по изобретению, например, организм, у которого была диагностирована ВГВ-инфекция, или у которого существует риск заражения ВГВ и, который, следовательно, предрасположен или подвержен риску развития заболевания или состояния, вызванного или связанного с инфекцией, вызванной ВГВ. В предпочтительных воплощениях организм-хозяин представляет собой больного человека с хронической ВГВ-инфекцией или в альтернативном случае, коинфицированного вирусом ВГВ и другим вирусом (например, вирусом иммунодефицита человека, ВИЧ). Инфицирующий ВГВ может принадлежать к тому же генотипу, штамму или изоляту, как и любой ВГВ, из которого происходит мутантный полипептид полимеразы или любой другой полипептид/пептид ВГВ, применяющийся в настоящем изобретении (например, генотипу D), или он может принадлежать к другому генотипу (например, генотипу В или С). Перекрестный защитный эффект композиции вакцины на основе генотипа D был недавно исследован авторами изобретения (см. заявку на патент США US 13/423,193). Компьютерное моделирование показало, что аминокислотные последовательности полимеразы ВГВ, коровых белков и белков оболочки являются высококонсервативными у генотипов В, С и D на уровне всего белка, а также на уровне эпитопов, распознаваемых Т-клетками. In vivo иммунизация в подходящей модели на животных подтвердила возможность индукции перекрестных реакций Т-клеток, распознающих эпитопы вирусов генотипов В и С.Даже несмотря на то, что это исследование касалось только HLA-А2-рестриктированных эпитопов, оно подтвердило концепцию, что композиция вакцины на основе антигенов вируса с генотипом D способна индуцировать Т-клеточный ответ, обеспечивающий перекрестный защитный эффект в отношении ВГВ других генотипов.
Композиция по изобретению соответствующим образом забуферена, чтобы быть приемлемой для применения у человека, и имеет физиологические или слегка щелочные значения рН (например, приблизительно от рН 7 до приблизительно рН 9). Подходящие буферы включают фосфатный буфер (например, ФСБ), бикарбонатный буфер и/или Трис-буфер, но не ограничиваются ими.
Композиция по изобретению может также содержать дилюент, приемлемый для применения у человека или животных. Предпочтительно он является изотоническим, гипотоническим или слабо гипертоническим и имеет относительно низкую ионную силу. Репрезентативные примеры включают стерильную воду, физиологический раствор (например, хлорид натрия), раствор Рингера, растворы глюкозы, трегалозы или сахарозы, раствор Хенкса и другие водные физиологически сбалансированные солевые растворы (см., например, последнее издание Remington: The Science and Practice of Pharmacy, A. Gennaro, Lippincott, Williams & Wilkins).
Фармацевтически приемлемые носители, входящие в состав композиции по изобретению, должны также обеспечивать сохранение ее стабильности в условиях изготовления и длительного хранения (т.е. по меньшей мере в течение одного месяца, предпочтительно по меньшей мере в течение одного года) при замораживании (например, -70°С, -20°С), охлаждении (например, 4°С) или при температуре окружающей среды. При этом составы, которые особенно подходят для композиции по изобретению, включают (а) 1М сахарозу, 150 мМ NaCl, 1 мМ MgCl2, 54 мг/л Tween 80, 10 мМ Трис, рН 8,5 (в частности, когда активный агент представляет собой аденовирусный вектор), (б) 10 мг/мл маннитол, 1 мг/мл ЧСА, 20 мМ Трис, рН 7,2, и 150 мМ NaCl и (в) физиологический раствор.
Дополнительные фармацевтически приемлемые эксципиенты могут применяться для обеспечения желаемых фармацевтических или фармакодинамических свойств, включая например, модификацию или поддержание рН, осмолярности, вязкости, прозрачности, окраски, стерильности, стабильности, скорости растворения состава, модификации или поддержания высвобождения или абсорбции в организме человека или животного, облегчения транспорта через кровяной барьер или проникновение в конкретный орган (например, печень).
Кроме того, композиция по изобретению может содержать один или более адъювантов, подходящих для системного введения или введения в слизистую оболочку человека. Предпочтительно, адъювант способен стимулировать иммунный ответ на композицию по изобретению, в частности иммунный ответ, опосредованный Т-клетками, например, через toll-подобные рецепторы (TLR), такие как TLR-7, TLR-8 и TLR-9. Репрезентативные примеры подходящих адъювантов включают алюминиевые квасцы, эмульсию минерального масла, такую как полный и неполный адъювант Фрейнда (IFA), липополисахарид или его производное (Ribi et al., 1986, Immunology and Immunopharmacology of Bacterial Endotoxins, Plenum Publ. Corp., NY, p407-419), сапонины, такие как QS21 (Sumino et al., 1998, J. Virol. 72: 4931; WO 98/56415), соединения имидазо-холина, такие как Imiquimod (Suader, 2000, J. Am Acad Dermatol. 43: S6), S-27609 (Smorlesi, 2005, Gene Ther. 12: 1324) и родственные соединения, такие как описанные в WO 2007/147529, цитозинфосфатгуанозиновые олигонуклеотиды, такие как CpG (Chu et al., 1997, J. Exp. Med. 186: 1623; Tritel et al., 2003, J. Immunol. 171: 2358) и катионные пептиды, такие как IC-31 (Kritsch et al., 2005, J. Chromatogr Anal. Technol Biomed Life Sci 822: 263), но не ограничиваются ими.
Композиция по настоящему изобретению подходит для разнообразных способов введения.
Термин "введение" (и любая форма введения, например, "введенный"), используемый в данном документе, обозначает доставку терапевтического агента, такого как мутантный полипептид полимеразы, гибридный белок, молекула нуклеиновой кислоты, вектор, описанные здесь, в клетку-хозяина или организм. В области техники известен ряд способов и средств, такие как непосредственное введение в организм-хозяин.
Непосредственное введение может осуществляться с помощью системного, местного введения или введения в слизистую оболочку. Системное введение включает, например, подкожную, внутрикожную, внутримышечную, внутривенную (например, инъекцию в вену, питающую кровью печень, такую как воротная вена), внутрибрюшинную, внутриопухолевую, внутрисосудистую, внутриартериальную инъекцию (например, инфузию в печеночную артерию), а также скарификацию. Инъекции могут осуществляться с использованием стандартных шприцев и игл, или любых других подходящих средств, известных в области техники (например, электропорации). В альтернативном случае композицию по настоящему изобретению можо вводить в слизистую оболочку, например, пероральным/алиментарным, интраназальным, интратрахеальным, внутрилегочным, интравагинальным или интраректальным путем. Введение в респираторный тракт может осуществляться пульверизацией или распылением капель, аэрозоля или сухой порошковой композиции с использованием соответствующего диспенсера. Местное введение также может осуществляться с использованием чрескожных средств (например, пластыря и т.п.).
В контексте изобретения композиция предпочтительно представляет собой препарат для внутримышечного, подкожного, внутрикожного введения или скарификации.
Композиции по изобретению могут находиться в различных формах, например, твердой, жидкой или замороженной. Твердые (например, сухие порошковые или лиофилизированные) композиции могут быть получены с помощью процесса, включающего вакуумную сушку и сублимационную сушку. Для введения в слизистые оболочки композиции могут быть приготовлены в виде капсул, резистентных к действию желудочного сока, и гранул для перорального введения, суппозиториев для ректального или вагинального введения, возможно в комбинации с веществами, способствующими всасыванию, применяющимися для увеличения размера пор мембран слизистых оболочек. Такие вещества, усиливающие абсорбцию, обычно представляют собой вещества, обладающие структурным сходством с фосфолипидными доменами мембран слизистых оболочек, такие как дезоксихолат натрия, гликолят натрия, диметил-бета-циклодекстрин, лаурил-1-лизофосфатидилхолин).
Подходящая дозировка может быть адаптирована в зависимости от различных параметров, в частности, способа введения; используемой композиции; возраста, состояния здоровья и веса организма-хозяина; природы и степени выраженности симптомов; сопутствующего лечения; регулярности лечения и/или необходимости профилактики или лечения. Дальнейшее уточнение расчетов, необходимое для определения соответствующей дозировки для лечения обычно выполняется практикующим врачом с учетом соответствующих обстоятельств.
В качестве общей информации, подходящая дозировка для композиции, содержащей вектор, варьирует приблизительно от 105 приблизительно до 1013 ВЧ (вирусных частиц), ИЕ (инфекционных единиц) или БОЕ (бляшкообразующих единиц), в зависимости от вектора и использованного способа количественной оценки. Способы, существующие для оценки количества ВЧ, ИЕ и БОЕ, присутствующих в образце, являются стандартными в области техники. Например, количество аденовирусных частиц (ВЧ) обычно определяется по поглощению А260 или при помощи ВЭЖХ, титр ИЕ путем количественного измерения иммунофлуоресценции ДНК-связывающего белка, а БОЕ путем подсчета количества бляшек после инфицирования чувствительных клеток. Предпочтительно соотношение ВЧ/ИЕ составляет менее 100 в соответствии с рекомендациями FDA. Предпочтительные дозы содержат приблизительно от 105 до приблизительно 1012 ВЧ, особенно предпочтительны дозы, составляющие приблизительно 5×108, приблизительно 109, приблизительно 5×109, приблизительно 1010, приблизительно 5×1010 ВЧ или приблизительно 1011 ВЧ аденовирусного вектора по изобретению. Дозы приблизительно от 5×105 приблизительно до 109 БОЕ предпочтительны для композиций на основе вируса Vaccinia (MVA), особенно предпочтительны дозы приблизительно 5×106, приблизительно 107, приблизительно 5×107, приблизительно 108 или приблизительно 5×108 БОЕ. Композицию на основе векторных плазмид можно вводить в дозах между 10 мкг и 20 мг, преимущественно между 100 мкг и 2 мг. Белковую композицию можно вводить в одной или более дозах между 10 нг и 20 мг, особенно предпочтительны дозы от приблизительно 0,1 мкг до приблизительно 2 мг иммуногенного полипептида на кг веса тела. Введение может осуществляться в однократной дозе или с повторением дозы один или несколько раз через определенный интервал времени.
В другом конкретном воплощении мутантный полипептид полимеразы, гибридный белок, молекула нуклеиновой кислоты, вектор, клетка-хозяин или композиция по изобретению могут применяться в комбинации с дополнительными полипептидами или пептидами или вектором, кодирующим такие дополнительные полипептиды или пептиды. Предпочтительно, указанный дополнительный полипептид или пептид представляет собой антиген ВГВ, наиболее предпочтительным является полипептид Hbc и/или один или более иммуногенных доменов HBs по данному описанию. Полипептид или пептид ВГВ можно экспрессировать с использованием вектора, в частности, вектора, выбранного из группы, состоящей из плазмидной ДНК, аденовирусного (например, Ad5, AdCh3, AdCh63, и т.д.), поксвирусного вектора (например, на основе вируса Vaccinia, такого как MVA) и вектора на основе вируса кори. Соответственно изобретение также относится к композиции, содержащей смесь вектора, кодирующего мутантный полипептид полимеразы или гибридный белок по изобретению, и вектора, кодирующего по меньшей мере один дополнительный полипептид/пептид, такой как коровый полипептид/пептид ВГВ, и/или иммуногенные домены HBs, согласно данному описанию.
Мутантный полипептид полимеразы, гибридный белок, молекула нуклеиновой кислоты, вектор, клетка-хозяин или композиция по изобретению могут применяться в способах лечения множества заболеваний и патологических состояний, в частности, вызванных или связанных с инфекцией, вызванной ВГВ. Соответственно, настоящее изобретение также охватывает мутантный полипептид полимеразы, гибридный белок, молекулу нуклеиновой кислоты, вектор, клетку-хозяина или композицию по изобретению для применения в лечении или предупреждении ВГВ-инфекции, ВГВ-ассоциированных заболеваний и патологических состояний, в соответствии с описанными здесь приемами, и в частности, хронической инфекции, вызванной ВГВ. Настоящее изобретение также относится к способу лечения организма, нуждающегося в этом, включающему по меньшей мере одно введение указанному организму по меньшей мере одного такого активного агента в количестве, достаточном для лечения или предупреждения инфекций, вызванных ВГВ (например, в частности, хронической инфекции ВГВ), или смягчения одного или более симптомов, относящихся к заболеваниям, связанным с ВГВ, и патологическим состояниям, в соответствии с описанными здесь приемами. В конкретном воплощении активный(е) агент(ы) и способ(ы) по изобретению могут использоваться в соответствии с описанными здесь приемами для нейтрализации специфической иммунологической толерантности к ВГВ, обычно встречающейся у субъектов с хронической инфекцией, вызванной ВГВ.
Термин "лечить" (и любая его форма, например, "лечение") в данном документе обозначают профилактику (например, предупреждение инфицирования ВГВ субъекта, имеющего такой риск) и/или лечение (например, субъекта, у которого диагностирована инфекция, вызванная ВГВ). Это особенно целесообразно для лечения хронической инфекции, вызванной ВГВ, и/или поражений печени у пациентов, инфицированных ВГВ, включая цирроз и рак печени. Лечение требует введения наружно или внутрь в клетку-хозяина или организм-хозяин терапевтического агента, такого как описанный здесь мутантный полипептид полимеразы, возможно в комбинации с другим(и) полипептидом(ами) ВГВ или стандартным лечением (например, лечением нуклеозидами или аналогами нуклеотидов).
Как правило, введение в организм-хозяин мутантного полипептида полимеразы, гибридного белка, молекулы нуклеиновой кислоты, вектора, клетки-хозяина и/или композиции по изобретению, в соответствии с описанными здесь приемами, обеспечивает благоприятный терапевтический эффект для получающего лечение организма-хозяина по сравнению с исходным состоянием или по сравнению с ожидаемым состоянием в отсутствие лечения. Благоприятный терапевтический эффект можно выявить при помощи любого соответствующего клинического показателя, обычно используемого врачами или другими медицинскими специалистами, включая, например, снижение вирусной нагрузки ВГВ, определяемой в крови, плазме или сыворотке крови организма, получающего лечение, и/или снижение активности печеночных ферментов (например, аланин-аминотрансферазы (АЛТ) и/или аспартат-аминотрансферазы (ACT)), и/или стабилизации (отсутствии ухудшения) выраженности заболевания (например, стабилизация или подавление состояний, обычно связанных с инфекцией, вызванной ВГВ, таких как воспаление тканей печени/стеатоз/фиброз), и/или снижение уровня серологических маркеров, таких как HBeAg или HBsAg (например, сероконверсия по НВе или HBs) и/или улучшение ответа организма, получающего лечение, на стандартную терапию и/или увеличение продолжительности жизни по сравнению с ожидаемой продолжительностью жизни в отсутствие лечения.
В контексте изобретения благоприятный терапевтический эффект может быть кратковременным (один или два месяца после прекращения введения) или продолжительным (несколько месяцев или лет). Поскольку естественное изменение клинического статуса может существенно варьировать от субъекта к субъекту, благоприятный терапевтический эффект не должен наблюдаться у каждого организма, получающего лечение, но должен наблюдаться у существенного числа организмов (например, статистически достоверное различие между двумя группами может быть выявлено при помощи любого статистического теста, известного в области техники, например, такого как параметрический критерий Тьюки, критерий Крускала-Уоллиса, U-критерий Манна-Уитни, t-критерий Стьюдента, критерий Вилкоксона и т.д.).
Такие определения можно выполнять перед введением, описанным здесь (исходный уровень), и в различных временных точках во время лечения, а также по меньшей мере в течение 12 недель после прекращения лечения. В качестве общих указаний, вирусную нагрузку можно определять с помощью количественной ПЦР или любой другой методики, принятой в области техники (например, Roche Ampli Prep/Cobas taqman assay v2.0, Abbott real-time hepatitis В virus performance assay). В предпочтительных воплощениях введение мутантного полипептида полимеразы, гибридного белка, молекулы нуклеиновой кислоты, вектора, клетки-хозяина и/или композиции по изобретению в результате приводит к кратковременному или продолжительному снижению вирусной нагрузки, по меньшей мере на величину log10, предпочтительно по меньшей мере на 1,5 log10 и более предпочтительно по меньшей мере на 2 log10 по сравнению с вирусной нагрузкой, определенной исходно, или по сравнению с контрольной группой (субъекты, не получавшие лечение). Введение активного(ых) агента(ов), описанное здесь, может в результате приводить по меньшей мере к кратковременному возвращению АПТ и/или ACT к нормальным значениям по сравнению с исходным уровнем или по сравнению с контрольной группой. Уровни активности печеночных ферментов можно оценивать в медицинских лабораториях и больницах обычным способом. В альтернативном случае введение активного(ых) агента(ов), описанное здесь, приводит в результате к по меньшей мере к кратковременному снижению серологических маркеров НВе и/или HBs по меньшей мере на величину log10, предпочтительно по меньшей мере на 1,5 1одю и более предпочтительно по меньшей мере на 2 log10 по сравнению с уровнем серологических маркеров, измеренных исходно, или по сравнению с контрольной группой (субъекты, не получавшие лечение). Уровни серологических маркеров ВГВ можно определять в медицинских лабораториях и больницах обычным способом, для этого существует ряд наборов (например, иммунологические тесты, разработанные Abbott Laboratories, Organon Technika).
Предпочтительно, мутантный полипептид полимеразы, гибридный белок, молекула нуклеиновой кислоты, вектор, клетка-хозяин, и/или композиция по изобретению используются или вводятся для индукции или стимуляции иммунного ответа организма, получающего лечение. Следовательно, настоящее изобретение также охватывает способ индукции или стимуляции иммунного ответа, направленного против ВГВ, при введении в организм-хозяин мутантного полипептида полимеразы, гибридного белка, молекулы нуклеиновой кислоты, вектора, клетки-хозяина и/или композиции по изобретению.
Индуцированный или стимулированный иммунный ответ может быть специфическим (т.е. направленным против эпитопов/антигенов ВГВ) и/или неспецифическим (врожденным), гуморальным и/или клеточным. В контексте изобретения иммунный ответ предпочтительно представляет собой Т-клеточный ответ, CD4+ или CD8+ - опосредованный, или и тот, и другой, направленный против полипептида/эпитопа ВГВ.
Способность активного(ых) агента(ов), описанного(ых) здесь, вызывать иммунный ответ можно оценивать in vitro или in vivo с помощью множества прямых или непрямых методов, которые являются стандартными в данной области техники. Определение и валидация также проиллюстрированы в прилагающемся разделе Примеры.
Для общего описания методик, существующих для оценки развития и активации иммунного ответа, см., например, Coligan et al. (1992 and 1994, Current Protocols in Immunology; ed J Wiley & Sons Inc, National Institute of Health or subsequent editions). Способность стимулировать гуморальный ответ можно определять по связыванию антитела и/или конкуренции за связывание (см., например, Harlow, 1989, Antibodies, Cold Spring Harbor Press).
Неспецифический иммунитет можно оценивать, например, исследуя NK/NKT-клетки (например, репертуара и уровня активации), а также связанные с ИФН каскады, приводящие к образованию цитокинов и/или хемокинов, активацию TLR и другие маркеры врожденного иммунитета (Scott-Algara et al., 2010 PLOS One 5(1), e8761; Zhou et al., 2006, Blood 107, 2461-2469; Chan, 2008, Eur. J. Immunol. 38, 2964-2968).
Клеточный иммунитет можно оценивать, например, при помощи количественного определения цитокинов, произведенных активированными Т-клетками, включая те, которые образованы CD4+ и CD8+ Т-клетками, с помощью стандартных биологических методов (например, характеризации и/или количественному определению Т-клеток методом ELISpot, многоцветной проточной цитометрии или внутриклеточному окрашиванию цитокинов (ICS), исследованию цитокинового профиля с помощью технологии multiplex или твердофазного ИФА), путем определения пролиферативной способности Т-клеток (например, исследования пролиферации Т-клеток по включению [3Н] тимидина), путем исследования цитотоксической активности антиген-специфических Т-лимфоцитов у сенсибилизированного субъекта или при иммунизации в соответствующих моделях на животных.
Иммуногенную активность мутантного полипептида полимеразы, гибридного белка, молекулы нуклеиновой кислоты, вектора, клетки-хозяина и/или композиции по изобретению можно также валидировать в моделях на животных, которые могут подвергаться воздействию соответствующих инфекционных или опухолеиндуцирующих агентов (например, вируса Vaccinia или бактерий Listeria Monocytogenes, экспрессирующих продукты генов ВГВ) или которым можно инъецировать ДНК, кодирующую полноразмерный геном ВГВ (как описано Huan et al., 2010, Proc. Natl. Acad. Sci. 107: 9340), для исследования нейтрализации инфекционных или опухолеиндуцирующих агентов и, возможно, частичного противодействия ассоциированным симптомам, отражающих индукцию или усиление иммунного ответа против ВГВ. Примеры моделей на животных включают мышей, трансгенных по HLA-A2.1, описанных в Примерах, и мышей, трансгенных по ВГВ, таких как описанью Chisari et al. (1996, Curr. Top. Microbiol. Immunol., 206: 149) и Halverscheid al. (2008, J. Med. Virol. 80: 583), но не ограничиваются ими.
Указанное применение или способ включает одно или более введений (1, 2, 3, 4, 5, 6, 7, 8, 9, 10, и т.д.) терапевтически эффективного количества указанного(ых) активного(ых) агента(ов), указанные введения отделены одно от другого соответствующим периодом времени и осуществляются тем же путем или различными путями, в тот же сайт или в разные сайты. Внутримышечный и подкожный пути являются наиболее предпочтительными в контексте изобретения. Три подкожных введения, которые друг от друга отделяет приблизительно одна неделя, особенно подходят для композиций и векторов на основе MVA, тогда как одно или два внутримышечных или подкожных введения, которые могут отделять друг от друга приблизительно один месяц или более, особенно подходят для композиций и векторов на основе аденовируса. За первой серией введений может следовать одно или более последующих введений того же (тех же) активного(ых) агента(ов), через два или неколько месяцев, что позволяет вызвать вторичный иммунный ответ против ВГВ.
При необходимости способ или применение по изобретению могут осуществляться в комбинации с одним или более стандартными терапевтическими средствами (например, лучевой терапией, химиотерапией и/или хирургическим вмешательством). Предпочтительно, способ или применение по изобретению связаны с применением одного или более лекарств, предназначенных для лечения или предупреждения инфекций, вызванных ВГВ, ВГВ-ассоциированных заболеваний и патологических состояний. Их введение может предшествововать, быть одновременным или последовательным относительно введения активного агента по изобретению. Репрезентативные примеры подходящих лекарств включают ингибиторы полимераз, ингибиторы РНКазы Н, аналоги нуклеозидов, аналоги нуклеотидов, агонисты TLR, ИФН, ингибиторы N-гликозилирования, siRNA, антисмысловые олигонуклеотиды, антитела к ВГВ, иммунномодуляторы, терапевтические вакцины и противоопухолевые агенты, которые обычно используют при лечении рака печени, ассоциированного с ВГВ (например, адриамицин, адриамицин с липиодолом или сорафенибом), но не ограничиваются ими. Кроме того, активный(е) агент(ы) можно применять в комбинации с другими терапевтическими вакцинами, такими как синтетические пептиды, рекомбинантные антигены, вирусоподобные частицы, векторы, кодирующие белки ВГВ (коровый, preS1, PreS2, S и/или полимеразу), особенно подходящими для запуска гуморального ответа против ВГВ. Наиболее подходящий способ или применение согласно изобретению осуществляют в комбинации со стандартным лечением и, в частности, лечением цитокинами (например, ИФНальфа, пегилированным ИФНальфа 2а или 2b, таким как пегасис (Roche), пегинтрон (Schering Plough) или интрон A (Schering Plough)), и/или аналогами нуклеотидов или нуклеозидов (NUCs), такими как ламивудин, энтекавир, телбивудин, адефовир дипивоксил или тенофовир. Эффективность лечения NUCs только частичная (разрешение инфекции наблюдается только у 3-5% субъектов через 1 год лечения) и требует длительной терапии (возможно пожизненной). Предполагается, что активные агенты и способы по изобретению создают иммунный механизм, дополняющий воздействие NUC на репликацию вируса, что таким образом приводит к улучшению эффекта лечения (например, в виде уменьшения доз NUC или длительности лечения NUC, необходимых для достижения благоприятного терапевтического эффекта) или повышению частоты разрешения инфекции (выше 5%).
В определенном воплощении способ или применение по изобретению можно осуществлять согласно режиму «прайм-буст», включающему последовательные введения одной или более примирующих композиций и одной или более бустерных композиций. Как правило, в примирующей и бустерной композиции используют различные векторы, которые содержат или кодируют по меньшей мере один общий антигенный домен. Кроме того, примирующую и бустерную композиции можно вводить в один и тот же сайт или в альтернативные сайты, используя тот же путь или различные пути введения. Например, композиции на основе полипептида можно вводить в слизистую оболочку, тогда как композиции на основе векторов предпочтительно вводят путем инъекции, например, подкожной инъекции в случае вектора MVA, внутримышечной инъекции в случае ДНК плазмиды и подкожной или внутримышечной инъекции в случае аденовирусного вектора.
В одном воплощении для примирования используют вектор MVA, а для бустерной инъекции - аденовирусный вектор, наиболее предпочтительными являются вектор MVA и/или аденовирусный вектор, кодирующие мутантный белок полимеразы или гибридный белок, описанные здесь, например, гибридный белок, показанный в SEQ ID NO: 8. Вектор MVA вводят в организм один или несколько раз с последующим одним или несколькими введениями аденовирусного вектора, наиболее предпочтительно по меньшей мере 3 подкожных введения MVA вектора разделены периодом времени от 3 дней до 3 месяцев, за которыми следует внутримышечное или подкожное бустерное введение аденовирусного вектора (например, приблизительно спустя период времени от 1 месяца до 1 года после примирования MVA).
В другом воплощении для примирования используют плазмидный ДНК вектор, а для бустерной инъекции - вектор MVA, наиболее предпочтительными являются плазмидный вектор и/или вектор MVA, кодирующие мутантный полимеразный белок или гибридный белок, описанные здесь, например, гибридный белок, показанный в SEQ ID NO: 8. ДНК-вектор вводят в организм один или несколько раз с последующим одним или несколькими введениями вектора MVA, наиболее предпочтительно осуществляют по меньшей мере 3 внутримышечных введения ДНК-вектора, разделенных периодом времени, варьирующим от 2 недель до 3 месяцев, и по меньшей мере одно бустерное введение вектора MVA (например, через промежуток времени приблизительно от 1 месяца до 1 года после примирования ДНК). Предпочтительно, ДНК вектор вводят путем электропорации.
Настоящее изобретение также относится к набору компонентов для применения в лечении инфекции, вызванной ВГВ, или ВГВ-ассоциированного заболевания или патологического состояния, где указанный набор содержит совокупность активных агентов, выбранных из группы, состоящей из мутантного полипептида полимеразы, гибридного белка, молекулы нуклеиновой кислоты, вектора, клетки-хозяина и/или композиции по изобретению и инструкций для введения совокупности указанных активных агентов организму, нуждающемуся в этом. Более предпочтительно, организм представляет собой пациента с хронической инфекцией, вызванной ВГВ.
Все цитируемые выше описания патентов, публикаций и доступов в базы данных включены сюда посредством ссылки в той же степени, как если бы для каждого патента, публикации или доступа в базы данных отдельно и специально было указано, что они включены сюда во всей своей полноте путем ссылки.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1 иллюстрирует мутантные полипептиды полимеразы, гибридные белки и антигенные комбинации, описанные в изобретении.
Фиг. 2 иллюстрирует определение ИФН-гамма методом Elispot, проводившееся после иммунизации мышей, трансгенных по HLA-A2, плазмидами pTG18188 (Core-Pol-Env1-Pol-Env2-Pol), pTG18194 (Core-Pol) или pTG13135 (без встроенных генов). Результаты представлены как количество пятен на 106 клеток, соответствующее количеству клеток, продуцирующих ИФН-гамма, специфических в отношении каждого HLA-А2-рестриктированного пептида ВГВ, оценивавшемуся в эксперименте на 106 клеток селезенки иммунизированных мышей. Каждый столбец представляет отдельную мышь, вакцинированную той или иной плазмидой, с указанием ее номера (1.1 или 2.3 … и т.д.), для каждой группы также представлено среднее значение по всем мышам, иммунизированным одинаковой плазмидой (столбец обозначен на графике как "среднее"). Для отдельных мышей и средних значений количество клеток, продуцирующих ИФН-гамма, специфических к различным тестируемым пептидам, суммировано. Столбцы заполнены различными символами, каждый из символов обозначает ответ на один определенный пептид ВГВ, в соответствии с легендой графика.
Фиг. 3А-Е иллюстрируют анализ внутриклеточного окрашивания цитокинов (ICS), выполненный после иммунизации HLA-А2-трансгенных мышей плазмидами PTG18188 (Core-Р-Е1-Р-Е2-Р или Core-Pol-Env1-Pol-Env2-Pol), pTG18194 (Core-Pol) или pTG13135 (без встроенных генов). Результаты представлены как процентное содержание CD8 (Фиг. 3А, 3Б, 3Г и 3Е) или CD4 (Фиг. 3В и 3Д) Т-клеток, продуцирующих ИФН-гамма (отдельно или вместе с ФНО-альфа), специфических в отношении каждого HLA-А2-рестриктированного пептида ВГВ (Фиг. 3А) или пула пептидов, представляющих коровые (Фиг. 3Б и 3В), полимеразные (Фиг. 3Г и 3Д) и поверхностные (Фиг. 3Е) антигены ВГВ. Каждый столбец обозначает отдельную мышь, вакцинированную той или иной плазмидой, с указанием ее номера (1.1 или 2.3 … и т.д.), и для каждой группы также представлено среднее значение по мышам, иммунизированным одинаковой плазмидой (столбец обозначен на графике как "среднее"). Для каждой отдельной мыши и для средних показателей количество CD8 или CD4 Т-клеток, специфических к различным протестированным пептидам, суммировали. Столбцы заполнены различными символами, каждый из символов обозначает ответ на один определенный пептид ВГВ, в соответствии с легендой графика.
Фиг. 4 иллюстрирует анализ ИФН-гамма методом Elispot, проведенный после иммунизации трансгенных по HLA-A2 мышей аденовирусами AdTG18201 (Core-Pol-Env), AdTG18202 (Core-Pol), AdTG18203 (Pol) и AdTG15149 (без встроенных генов). Результаты представлены как количество пятен на 106 клеток, соответствующее количеству клеток, продуцирующих ИФН-гамма, специфических в отношении каждого пула пептидов, представляющих интересующий антиген, оценивавшемуся в эксперименте на 106 клеток селезенки иммунизированных мышей. Каждый столбец представляет отдельную мышь, вакцинированную той или иной плазмидой, с указанием ее номера (1.1 или 2.3 … и т.д.), и для каждой группы также представлено среднее значение по всем мышам, иммунизированным одинаковой плазмидой (столбец обозначен на графике как "среднее"). Для отдельных мышей и средних показателей количество клеток, продуцирующих ИФН-гамма, специфических к различным тестируемым пептидам, суммировали. Столбцы заполнены различными символами, каждый из символов обозначает ответ на один определенный пептид ВГВ, в соответствии с легендой графика.
Фиг. 5 иллюстрирует анализ ИФН-гамма методом Elispot, проведенный после иммунизации трансгенных по HLA-A2 мышей AdTG18201 (Core-Pol-Env Ad). Результаты представлены как количество пятен на 10 клеток, соответствующее количеству клеток, продуцирующих ИФН-гамма, специфических к каждому HLA-A2-рестриктированному эпитопу ВГВ или нерелевантному пептиду, оценивавшемуся в эксперименте на 106 клеток селезенки иммунизированных мышей. Каждый столбец представляет отдельную мышь, вакцинированную AdTG18201 (с указанием ее номера от 3.1 до 3.8), и показано значение медианы для всех мышей, иммунизированных AdTG18201 (столбец обозначен на графике как "медиана"). Для отдельных мышей и для показателя медианы количество клеток, продуцирующих ИФН-гамма, специфических к различным HLA-А2-рестриктированным эпитопам ВГВ, суммировано, тогда как количество клеток, продуцирующих ИФН-гамма в присутствии нерелевантного пептида, представлено отдельным столбцом (обозначен на графике «нерелев» для каждой мыши). Столбцы заполнены различными символами, каждый из символов обозначает ответ на один определенный пептид ВГВ, в соответствии с легендой графика.
Фиг. 6 иллюстрирует анализ внутриклеточного окрашивания цитокинов (ICS), проведенный после иммунизации HLA-А2-мышей аденовирусами AdTG18201 (Core-Pol-Env) или AdTG15149 (без встроенных генов). Результаты представлены как процентное содержание CD8 Т-клеток, продуцирующих только ИФН-гамма или ИФН-гамма вместе с ФНО-альфа, специфических в отношении двух выбранных пулов пептидов, обозначенных РР8 и РС1, и представляющих соответственно часть полимеразы ВГВ (аминокислоты от 725 до 835) и часть корового белка ВГВ (аминокислоты от 1 до 100). Каждый столбец обозначает отдельную мышь, вакцинированную тем или иным аденовирусом, с указанием ее номера (1.1 или 2.3 … и т.д.), и для каждой группы также представлено значение медианы для всех мышей, иммунизированных одинаковым аденовирусом (столбец обозначен на графике как "медиана"). Столбцы заполнены различными символами, каждый из символов обозначает цитокин(ы), произведенный(е) зарегистрированными CD8 Т-клетками, в соответствии с легендой графика.
Фиг.7 иллюстрирует анализ цитолитического действия лимфоцитов in vivo, выполненный после иммунизации HLA-А2-мышей аденовирусами AdTG18201 (Core-Pol-Env) или AdTG15149 (без встроенных генов). Результаты представлены как степень выраженности (в процентах) специфического лизиса in vivo, т.е. цитолитической активности, специфической в отношении тестируемых HLA-A2-рестриктированных эпитопов ВГВ. Каждый квадрат или треугольник обозначает отдельную мышь, и для каждой группы представлено среднее значение по всем мышам, иммунизированным одинаковым аденовирусом (обозначено на графике жирной чертой).
Фиг. 8 иллюстрирует анализ внутриклеточного окрашивания цитокинов (ICS), проведенный после иммунизации трансгенных по ВГВ мышей аденовирусами AdTG18201 (Core-Pol-Env) или AdTG15149 (без встроенных генов). Результаты представлены как процентное содержание CD8 Т-клеток, продуцирующих как ИФН-гамма, так и ФНО-альфа, специфических к эпитопам полимеразы ВГВ (смесь 2 пептидов, обозначенных VSA и N13F) или оболочки ВГВ (1 пептид, обозначенный F13L) и обнаруженных как в селезенке, так и в печени вакцинированных мышей. Каждый столбец представляет отдельную мышь, вакцинированную тем или иным аденовирусом, с указанием ее номера (1.1 или 3.2 … и т.д.), и для каждой группы также показано показано значение медианы для всех мышей, иммунизированных одинаковым аденовирусом (столбец, обозначен на графике как "медиана"). Пунктирная линия на графиках соответствует предельному значению, установленному в эксперименте, т.е. пороговому уровню, при превышении которого процентное содержание CD8 Т-клеток расценивали как положительный иммунный ответ.
Фиг. 9 иллюстрирует анализ ИФН-гамма методом Elispot, проведенный после иммунизации трансгенных по HLA-A2 мышей аденовирусом AdTG18201 (Core-Pol-Env) в различных дозах от 105 ИЕ до 109 ИЕ. Результаты представлены как количество пятен на 106 клеток, соответствующее количеству клеток, продуцирующих ИФН-гамма, специфических в отношении каждого HLA-A2-рестриктированного эпитопа ВГВ или нерелевантного пептида, или только в присутствии среды, оценивавшемуся в эксперименте на 106 клеток селезенки иммунизированных мышей. Каждая сплошная или пунктирная линия обозначает отдельную мышь, вакцинированную AdTG18201, а также показано среднее значение по всем мышам, иммунизированным AdTG18201 в одной определенной дозе (заштрихованные столбцы). Различные дозы обозначены различными цветами или символами, в соответствии с легендой графика. Пунктирная линия обозначает предельное значение, которое определяли, как описано в Материалах и Методах, при превышении которого наблюдавшийся Т-клеточный ответ расценивали как положительный.
Фиг. 10 иллюстрирует анализ ИФН-гамма методом Elispot, проведенный после иммунизации трансгенных по HLA-A2 мышей аденовирусом AdTG18202 (Core-Pol) в соответствии с различными схемами иммунизации. Мышей иммунизировали либо однократно (квадраты), либо выполняли 3 инъекции с 1-недельным интервалом (треугольники) или 6 инъекций с 1-недельным интервалом (круги). Результаты представлены как количество пятен на 106 клеток, соответствующее количеству клеток, продуцирующих ИФН-гамма, специфических в отношении каждого HLA-А2-рестриктированного эпитопа ВГВ или аденовирусного вектора или нерелевантного пептида или в присутствии только самой среды, оценивавшемуся в эксперименте на 106 клеток селезенки иммунизированных мышей. Каждый символ (квадрат, треугольник или круг) обозначает отдельную мышь, вакцинированную AdTG18202, а среднее значение по всем мышам, иммунизированным AdTG18202 в соответствии с одной из тестируемых схем, показано сплошной жирной линией. Различные дозы обозначены различными цветами или символами, в соответствии с легендой графика. Пунктирная линия обозначает предельное значение, которое определяли, как описано в Материалах и Методах, при превышении которого наблюдавшийся Т-клеточный ответ расценивали как положительный.
Фиг. 11 иллюстрирует анализ ИФН-гамма методом Elispot, проведенный после иммунизации трансгенных по HLA-A2 мышей аденовирусом AdTG18202 (Core-Pol) в соответствии с различными схемами иммунизации. Мышей иммунизировали либо однократно за 2 недели до исследования Т-клеточного ответа (группа 1, обозначена квадратами), либо однократно за 20 недель до исследования Т-клеточного ответа (группа 2, обозначена треугольниками), или двукратно с 2-месячным интервалом (группа 3, обозначена кругами), или двукратно с 4-месячным интервалом (группа 4, обозначена крестиками), или трехкратно с 2-месячным интервалом (группа 5, обозначенная ромбами). Во всех группах, кроме группы 2, Т-клеточный ответ оценивали через 2 недели после последней инъекции. Результаты представлены как количество пятен на 106 клеток, соответствующее количеству клеток, продуцирующих ИФН-гамма, специфических в отношении каждого HLA-A2-рестриктированного эпитопа ВГВ или нерелевантного пептида, или в присутствии среды как таковой, оценивавшемуся в эксперименте на 106 клеток селезенки иммунизированных мышей. Каждый символ (квадрат, треугольник, круг, крестик, ромб) обозначает отдельную мышь, вакцинированную AdTG18202, а среднее значение по всем мышам, иммунизированным AdTG 18202 в соответствии с одной из тестируемых схем, показано сплошной жирной линией. Пунктирная линия обозначает предельное значение, которое определяли, как описано в Материалах и Методах, при превышении которого наблюдавшийся Т-клеточный ответ расценивали как положительный.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
1. Материалы и методы
Конструкции, описанные ниже (см. Фиг.1), выполнены в соответствии с общими методиками генной инженерии и молекулярного клонирования, подробно описанными Maniatis et al. (1989, Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor NY или subsequent editions) или в соответствии с рекомендациями производителя при использовании коммерческого набора. Методы ПЦР амплификации известны специалистам в данной области (см. например, PCR protocols -A guide to methods and applications, 1990, published by Innis, Gelfand, Sninsky and White, Academic Press). Рекомбинантные плазмиды, несущие ген устойчивости к ампициллину, реплицировали в Е. coli С600 (Stratagene) на агаре или в жидкой среде с добавлением 100 мкг/мл антибиотика.
Конструирование вектора MVA осуществляли путем гомологичной рекомбинации между челночной плазмидой и геномом MVA, как описано ранее Erbs et al. (2008, Cancer gene Ther. 15: 18). "Исходная" челночная плазмида содержит сайт множественного клонирования, промотор вируса Vaccinia (W), окруженный последовательностями, фланкирующими делецию III, а также селектируемый ген ксантин-гуанин фосфорибозил-трансферазы (GPT) Е. Coli, находящийся под контролем промотора вируса Vaccinia р11К7.5 (Falkner and Moss, 1988). Вкратце, клетки CEF инфицировали геномной ДНК MVA без вставки какого-либо трансгена (MVA-null), а затем трансфицировали методом CaCl2-преципитации челночной плазмидой, несущей интересующий ген, клонированный «ниже» по ходу транскрипции относительно промотора VV. Гомологичная рекомбинация происходила между MVA-null и челночной плазмидой, и рекомбинантные вирусы отбирали при помощи нескольких циклов селекции в присутствии микофеноловой кислоты. Рекомбинантные вирусы MVA проверяли с помощью ПЦР, амплифицировали в CEF и определяли титр вирусного материала в CEF при помощи анализа бляшкообразования.
Для конструкции аденовирусного вектора вначале конструировали аденовирусную челночную плазмиду путем встраивания интересующей молекулы нуклеиновой кислоты в "исходную" челночную плазмиду pTG13135. Как правило, молекулу нуклеиновой кислоты встраивали между рестрикционными сайтами NheI и NotI pTG13135, содержащей экспрессионную кассету, находящуюся под контролем промотора CMV, окруженную последовательностями аденовируса (нуклеотиды аденовируса 1-454 и 3513-5781, соответственно) для возможности последующего получения генома вектора при гомологичной рекомбинации (Chartier et al., 1996, J. Virol. 70:4805). Затем получали аденовирусный вектор в результате гомологичной рекомбинации между рекомбинантным челночным вектором, расщепленным Bst11071 и Рас/, и pTG15375 (кодирующей полный геном аденовируса), линеаризованной путем расщепления С/а/. Полученный аденовирусный вектор имел делеции Е3 (нуклеотиды 27867-30743) и Е1 (нуклеотиды 455-3512), и область Е1 была замещена на экспрессионную кассету, содержащую в направлении от 5' к 3' предранний промотор/энхансер CMV, химерный интрон β-глобина/IgG человека (как и в векторе pCl, предоставляемом компанией Promega), молекулу нуклеиновой кислоты, представляющей интерес, и поздний сигнал полиаденилироваия SV40. Затем получали частицы аденовируса путем трансфекции клеточной линии, комплементирующей делецию Е1, геномной ДНК вируса, линеаризованной Pacl. Размножение вируса, очистку и титрование осуществляли, как описано ранее (Erbs et al., 2000, Cancer Res. 60:3813)
1.1. Конструирование и получение векторов
Векторы, проиллюстрированные ниже, были созданы для экспрессии мутантного полипептида полимеразы, возможно гибридизованного с коровым полипептидом и/или иммуногенными доменами белка оболочки. Все последовательности ВГВ происходили из штамма ВГВ Y07587, последовательность которого описана в международных базах данных (Genbank Y07587) и различных публикациях. Он представляет собой вирус с генотипом D и серотипом ayw.
В следующих ниже примерах проиллюстрирована гибридизация укороченного корового полипептида (АК 1-148) с мутированным полипептидом полимеразы (обозначенным Pol*), имеющим две внутренние делеции (от положения 538 до 544 и от положения 710 до 742) и 4 аминокислотные замены (D689H, V769Y, T776Y и D777H, соответственно), как показано в SEQ ID NO: 6, а также получение более длинного гибрида, дополнительно включающего два иммуногенных домена белка оболочки (Env1 и Env2, продолжающимися, соответственно, от аминокислоты
14 до 51 и от аминокислоты 165 до 194 белка HBs), встроенными вместо удаленных областей полимеразы, как показано в SEQ ID NO: 8.
1.1.1. Конструирование и получение плазмидных и аденовирусных векторов, экспрессирующих укороченный гибридный белок Core-Pol*-Env1-Env2 (или Core-Pol-Env1-Pol-Env2-Pol)
Синтетический ген (3024 нуклеотидов, описан в SEQ ID NO: 15), кодирующий укороченный гибридный белок Core-Pol*-Env1-Env2 (аминокислотная последовательность приведена в SEQ ID NO: 8) был синтезирован в компании GENEART (Regensburg, Germany). Синтетический фрагмент был встроен в челночную плазмиду pTG13135 между рестрикционными сайтами Nhel и Notl, с получением pTG18188. Затем был получен аденовирусный вектор в результате гомологичной рекомбинации между pTG18188, расщепленной Bst1107l и Рас/, и pTG15375, линеаризованной при расщеплении С/а/. Полученный аденовирусный вектор pTG18201 имел делеции ЕЗ и Е1, область Е1 была замещена экспрессионной кассетой, содержащей синтетическую последовательность, кодирующую укороченный Core-Pol*-Env1-Env2, находящуюся под контролем промотора CMV. Аденовирусные частицы (AdTG18201) были получены при трансфекции клеточной линии, комплементирующей делецию Е1, геномной ДНК вируса, линеаризованной Pacl
1.1.2. Конструирование и получение плазмидных и аденовирусных векторов, экспрессирующих укороченный Core-Pol*
Синтетический ген (2820 нуклеотидов, описан в SEQ ID NO: 14), кодирующий укороченный гибридный белок Core-РоГ, был синтезирован в компании GENEART (Regensburg, Germany). Синтетический фрагмент был встроен в челночную плазмиду pTG13135 между рестрикционными сайтами Nhel и Notl, с получением pTG18194. Затем в результате гомологичной рекомбинации между pTG18194, расщепленной Bst1107l и Pacl, и pTG15375, линеаризованной при расщеплении Clal, был получен аденовирусный вектор. Полученный аденовирусный вектор pTG18202 имел делеции Е3 и Е1, область Е1 была замещена экспрессионной кассетой, содержащей синтетическую последовательность, кодирующую укороченный Core-Pol*, находящуюся под контролем промотора CMV. Аденовирусные частицы (AdTG18202) были получены при трансфекции клеточной линии, комплементирующей делецию Е1, геномной ДНК вируса, линеаризованной Pacl
1.1.3. Конструирование и получение плазмидных и аденовирусных векторов, экспрессирующих Pol*
Синтетический ген (2379 нуклеотидов, описан в SEQ ID NO: 13), кодирующий мутантный полипептид Pol, был синтезирован в компании GENEART (Regensburg, Germany). Синтетический фрагмент был встроен в челночную плазмиду pTG13135 между рестрикционными сайтами Nhel и Notl, с получением pTG18195. Затем в результате гомологичной рекомбинации между pTG18195, расщепленной Bst1107l и Рас/, и pTG 15375, линеаризованной при расщеплении Clal, был получен аденовирусный вектор. Полученный аденовирусный вектор pTG18203 имел делеции Е3 и Е1, область Е1 была замещена экспрессионной кассетой, содержащей синтетическую последовательность, кодирующую Pol*, находящуюся под контролем промотора CMV. Аденовирусные частицы (AdTG 18203) были получены при трансфекции клеточной линии, комплементирующей делецию Е1, геномной ДНК вируса, линеаризованной Pacl.
1.2. Оценка иммуногенности в модели на мышах
Иммуногенность антигенов оценивали in vivo с помощью определения ИФНγ методом Elispot и с помощью внутриклеточного окрашивания цитокинов (ICS) после иммунизации HLA-трансгенных мышей.
1.2.1 Модель на мышах
Трансгенные по HLA-A2.1 мыши, использованные в исследовании, были описаны Pascolo et al. (1997, J. Exp. Med. 185:2043). У этих мышей был произведен нок-аут генов H-2Db и мышиного β2-микроглобулина и они экспрессируют трансгенные одноцепочечные молекулы I класса гистосовместимости (молекулы HHD), у которых С-конец человеческого β2m ковалентно связан с N-концом химерной тяжелой цепи (α1-α2 домены HLA-А*0201; α3, трансмембранный и цитоплазматический домены H-2Db). Иммунизировали мышей в возрасте от 7 до 10 недель (самцов и самок). Средний вес мышей составлял приблизительно 25-30 г.
Трансгенные по ВГВ мыши, использованные в исследовании, были описаны Halverscheid et al (2008, J. Med. Virol. 80: 583-590) и любезно предоставлены Reinhold Schirmbeck. Эти мыши имеют генетический фон C57BI/6J и являются трансгенными по геному ВГВ (1.4 копии генома ВГВ с мутацией в положении 1438 (замена Τ на С), что позволяет избежать экспрессии малых белков HBsAg и подавляет образование инфекционных частиц ВГВ). Иммунизировали мышей в возрасте от 10 до 16 недель (самцов и самок). Средний вес мышей составлял приблизительно 25-30 г.
1.2.2. Протоколы иммунизации
1.2.2.1 Протоколы иммунизации ДНК
Иммунизацию ДНК выполняли для оценки иммуногенности различных гибридных белков, кодируемых плазмидами, описанными в Примере 1.1. ДНК, которую использовали для иммунизации, была получена в отсутствии эндотоксинов. Мышей иммунизировали дважды с 15-дневным интервалом при помощи инъекции 100 мкг каждой из тестируемых плазмид внутримышечно в переднюю большеберцовую мышцу. Инъекцию кардиотоксина выполняли перед первой инъекцией ДНК для усиления иммуногенности ДНК. Клеточный иммунный ответ оценивали через 15 дней после последней инъекции ДНК.
1.2.2.2 Протоколы иммунизации аденовирусами
Иммунизацию аденовирусами выполняли для сравнения иммуногенности различных гибридных белков, кодируемых аденовирусными векторами, которые были получены, как описано в Примере 1.1. Мышей иммунизировали однократно аденовирусом, кодирующим различные гибридные белки (108 ИЕ/мышь/инъекцию) подкожно в основании хвоста. Клеточный иммунный ответ оценивали через 15 дней после последней инъекции аденовируса.
Для AdTG 18201 оценивали различные дозы аденовируса. Мышей иммунизировали однократно 105, 106, 107, 108 или 109 ИЕ AdTG18201 подкожно в основании хвоста.
Для AdTG 18202 также изучали различные схемы иммунизации, мыши получали одну, две, три или 6 инъекций с различным интервалом времени. С каждой инъекцией вводили 108ИЕ/мышь подкожно в основании хвоста. Сравнивали между собой схемы, включающие 1, 3 или 6 инъекций с 1-недельным интервалом. Также сравнивали между собой схемы, включающие 1 инъекцию за 2 недели или 20 недель до момента оценки индуцированного Т-клеточного ответа, 2 инъекции с интервалом 2 или 4 месяца и 3 инъекции с интервалом 2 месяца.
1.2.3 Пептиды
Пептиды, использованные для активации клеток in vitro, представляли собой либо короткие пептиды из 9-10 аминокислот, которые описаны как HLA-A2-рестриктированные эпитопы или предположительно представляют собой HLA-A2-рестриктированные эпитопы, либо длинные пептиды из 15 аминокислот, находящиеся в пептидных библиотеках, охватывающих все интересующие антигены.
Короткие пептиды, соответствующие описанным или предсказанным HLA-A2-рестриктированным эпитопам корового белка, белка полимеразы или доменов белка оболочки, были синтезированы компанией Eurogentec (Belgium) и растворены в 100% ДМСО (sigma, D2650) в концентрации 10 мМ.
Пептидные библиотеки, охватывающие все домены Core, Pol и Env, были синтезированы Prolmmune (Oxford, United Kingdom). Библиотеки Core, Pol и Env состояли из пептидов длиной 15 аминокислотных остатков, перекрывающихся по 11 аминокислотам. Каждый исходный пептид растворяли в 100% ДМСО (sigma, D2650) в концентрации 50 мг/мл. Для каждой библиотеки пептиды пулировали при концентрации каждого пептида 2 мг/мл:
- коровый белок ВГВ был представлен 2 пулами из 21 и 22 пептидов (пул 1 (РС1): 22 пептида, представляющих остатки корового белка с 1 по 100; пул 2 (РС2): 21 пептида, представляющих остатки корового белка с 89 по 183);
- белок полимеразы ВГВ был представлен 8 пулами из 24 пептидов (Pool 1 (РР1): 24 пептида, представляющих аминокислотные остатки с 45 по 151; пул 2 (РР2): 24 пептида, представляющих аминокислотные остатки с 141 по 251 (пептид из аминокислотных остатков с 205 по 219 был исключен из-за его нерастворимости в 100% ДМСО или ДМСО + Трис 100 мМ рН9; пептид из аминокислотных остатков от 221 по 235 был растворен в ДМСО + Трис 100 мМ, рН9 из-за его нерастворимости в 100% ДМСО); пул 3 (РР3): 24 пептида, представляющих аминокислотные остатки с 241 по 347; Pool 4 (РР4): 24 пептида, представляющих аминокислотные остатки с 337 по 447 (пептид из аминокислотных остатков с 373 по 387 был исключен из-за его нерастворимости в 100% ДМСО или ДМСО + Трис 100 мМ, рН9); пул 5 (РР5): 24 пептида, представляющих аминокислотные остатки с 437 по 543; пул 6 (РР6): 24 пептида, представляющих аминокислотные остатки с 533 по 639; пул 7 (РР7): 24 пептида, представляющих аминокислотные остатки с 629 по 735; пул 8 (РР8): 24 пептида, представляющих аминокислотные остатки с 725 по 835);
- домены белка оболочки были представлены 2 пулами из 9 и 10 пептидов (пул 1 (РЕ1): 10 пептидов, представляющих аминокислотные остатки HBs с 9 по 59; пул 2 (РЕ2): 9 пептидов, представляющих аминокислотные остатки HBs с 157 по 194).
В экспериментах на трансгенных по ВГВ мышах с генетическим фоном C57BL/6J для стимуляции клеток in vitro использовали пептиды ВГВ, которые были описаны в литературе или у которых в предыдущих экспериментах была выявлена реакционная способность у мышей с генетическим фоном C57BI/6J. Они либо представляют собой короткие пептиды (VSAAFYHLPL для полимеразы; SEQ ID NO: 24) или длинные пептиды (NLNVSIPWTHKVGNF, обозначенные N13F, для полимеразы (SEQ ID NO: 25) и FLWEWASARFSWLSL, обозначенные F13L, для белка оболочки (SEQ ID NO: 26)). Они были синтезированы в компаниях Eurogentec (Belgium) или Prolmmune (Oxford, United Kingdom). Каждый пептид растворяли в 100% ДМСО (sigma D2650) в концентрации 10 мМ. При внутриклеточном окрашивании цитокинов их использовали в концентрации 10 мкМ (даже при исследовании смесей 2 пептидов).
1.2.4. Определение ИФН-гамма методом Elispot
Собирали спленоциты иммунизированных мышей и лизировали красные кровяные клетки (Sigma, R7757). 2×105 клеток на лунку культивировали в трипликатах в течение 40 ч в планшетах Multiscreen (Millipore, MSHA S4510), покрытых моноклональным антителом к мышиному ИФН-гамма (BD Biosciences; 10 мкг/мл, 551216) в среде для культивирования MEM (Gibco, 22571) с добавлением 10% эмбриональной телячьей сыворотки (JRH, 12003-100М), 80 Ед/мл пенициллина / 80 мкг/мл стрептомицина (PAN, Р06-07-100), 2 мМ L-глутамина (Gibco, 25030), 1х заменимых аминокислот (Gibco, 11140), 10 мМ Hepes (Gibco, 15630), 1 мМ пирувата натрия (Gibco, 31350) и 50 мкМ β-меркаптоэтанола (Gibco, 31350) в присутствии рекомбинантного мышиного IL2 (Peprotech, 212-12) в концентрации 10 ед/мл (отрицательный контроль) или рекомбинантного мышиного IL2 в сочетании с:
- 10 мкМ выбранного рестриктированного по HLA-A2 пептида, присутствующего в антигенах ВГВ, кодируемого плазмидами (FLP, ILC для корового белка, VLQ, FLG и GLS для белков оболочки и SLY для полимеразы), описанных SEQ ID NO: 18-23) или нерелевантного пептида;
- пулом пептидов с конечной концентрацией каждого пептида 5 мкг/мл;
- 5 мкг/мл конканавалина A (Sigma, С5275) в качестве положительного контроля.
Определение количества Т-клеток, продуцирующих ИФН-гамма, проводили с помощью метода Elispot (цитокин-специфического иммуноферментного спот-анализа), как описано ранее (Himoudi et al., 2002, J. Virol. 76:12735). Число пятен (соответствующее Т-клеткам, продуцирующим ИФН-гамма) в лунках, служивших отрицательным контролем, вычитали из числа пятен, детектируемых в экспериментальных лунках, содержащих пептиды ВГВ. Результаты приведены в виде средних значений, полученных в трипликатах. Пороговый уровень (или предельное значение), установленный эмпирически, соответствовал среднему количеству пятен на 106 клеток, наблюдавшемуся при использовании среды как таковой, + 2 стандартных отклонения. Нижний предел измерений считывающего устройства CTL Elispot составлял 50 пятен/106 клеток (это значение, выше которого CV (коэффициент вариации) считывающего устройства был систематически ниже 20%). Наибольшее из значений (нижний предел измерений или пороговый уровень, установленный эмпирически в каждом эксперименте) выбирали в качестве предельного значения в каждом эксперименте. Для статистического анализа результатов, полученных методом Elispot, использовали критерий Манна-Уитни. Значения Р, равные или меньшие 0,05, считали статистически значимыми.
1.2.5. Анализ внутриклеточного окрашивания цитокинов (ICS)
В спленоцитах каждого животного каждой группы проводили внутриклеточное окрашивание цитокинов. После лизирования красных кровяных клеток лизирующим буфером (Sigma, R7757), 2×106 клеток на лунку в плоскодонном 96-луночном планшете инкубировали в полной среде для культивирования альфа-MEM (Gibco BRL, 22571) в присутствии 10 ед/мл мышиного рекомбинантного IL-2 (Peprotech, 212-12) как такового (отрицательный контроль) или в присутствии 10 мкМ определенного пептида ВГВ или пула пептидов с конечной концентрацией каждого пептида 5 мкг/мл, или в присутствии 10 мкМ нерелевантного пептида. Немедленно добавляли реагент GolgiPlug (BD Biosciences, 555029) в конечной концентрации 1 мкл/мл и оставляли на 5 ч. Затем клетки собирали в 96-луночные планшеты с V-образным дном и отмывали 1% раствором эмбриональной телячьей сыворотки в ФСБ. Окрашивание выполняли с помощью моноклональных антител против CD3 (моноклональное антитело хомяка анти-CD3e-РЕ, разведение 1/200), CD8 (моноклональное антитело крысы анти-CD8a-АРС, разведение 1/600) и CD4 (моноклональное антитело крысы анти-CD4-PerCP, разведение 1/600) (все - BD Biosciences, 553063, 553035 и 553052, соответственно) в 50 мкл 1% эмбриональной телячьей сыворотки в ФСБ в течение 15 мин при комнатной температуре. После отмывки клетки фиксировали и пермеабилизовали Cytofix/Cytoperm и отмывали раствором Perm/Wash (BD Biosciences, 554714). Затем добавляли конъюгированные с РЕ антитела к мышиному ИФН-гамма (BD Biosciences, 554412557724) и конъюгированные с Alexa488 антитела к мышиному ФНО-альфа (BD Biosciences, 557719) или конъюгированные с РЕ антитела к мышиному ИФН-гамма (BD Biosciences, 554412557724) на 15 мин при комнатной температуре и после отмывки Perm/Wash клетки ресуспендировали в 1% растворе эмбриональной телячьей сыворотки в ФСБ и исследовали методом проточной цитометрии на приборе FacsCalibur (Becton Dickinson). Для определения процентного содержания популяций клеток ИФН-гамма+ CD8+ или ИФН-гамма+ CD4+ Τ или ФНО-альфа+ CD8+ или ФНО-альфа+ CD4+ Τ или ИФН-гамма+ ФНО-альфа+ CD8+ или ИФН-гамма+ ФНО-альфа+ CD4+ Τ производили гейтирование клеток CD3e+, CD8a+ или клеток CD3e+, CD4+. Процентное содержание, полученное в среде как таковой, считали фоновым.
В экспериментах, проводившихся на мышах, трансгенных по ВГВ, также выполняли внутриклеточное окрашивание цитокинов в клетках печени каждого животного каждой группы. После умерщвления животного выполняли перфузию печени in situ через воротную вену печени холодным ФСБ до побледнения органа. Печень изолировали, помещали в 2% раствор эмбриональной телячьей сыворотки в ФСБ, разрезали на маленькие кусочки, осторожно продавливали через сито для клеток (стрейнер) с ячейками 70 мкм и затем растворяли в холодном растворе 2% эмбриональной телячьей сыворотки в ФСБ. После центрифугирования клетки снова отмывали холодным раствором 2% эмбриональной телячьей сыворотки в ФСБ. После нового центрифугирования осадок, содержащий клетки, ресуспендировали в 10 мл раствора перколла, центрифугировали в течение 12 минут при 700 g при комнатной температуре и снова отмывали раствором 2% эмбриональной телячьей сыворотки в ФСБ. Затем красные кровяные клетки лизировали, как описано выше для спленоцитов, и выполняли последующие этапы, как описано в предыдущем параграфе для спленоцитов. Следует отметить, что поскольку для печени количество собранных Т-лимфоцитов было ограничено, количество клеток в лунках варьировало: для культивирования все полученные клетки распределяли между всеми лунками в равном количестве.
1.2.6 Анализ цитолитического действия Т-лимфоцитов (CTL) in vivo
Анализ цитолитического действия Т-лимфоцитов in vivo выполняли на трансгенных по HLA-A2 мышах, как описано Foumillier et al. (2007, Vaccine, 25: 7339-53). Суспензии спленоцитов получали из селезенки сингенных мышей и после лизиса красных кровяных клеток доводили концентрацию клеток до 20×106 клеток/мл. Половину клеток инкубировали с интересующим пептидом ВГВ (SLY, FLP или ILC) в конечной концентрации 10 мкМ в течение 1 ч при 37°С, а половину клеток оставляли неактивированными. Затем к неактивированным клеткам на 10 мин добавляли 10 мкМ сукцинимидильного эфира 5(6)-карбоксифлуоресцеин диацетата (CFSE) (Molecular probes, С1157) (CFSE-high), а к клеткам, активированным пептидом ВГВ - 1 мкМ (CFSE-low). После отмывки ФСБ все популяции смешивали и мышам делали инъекции под анестезией 20×106 клеток в ретроорбитальный синус, мышей предварительно (за 2 недели) иммунизировали AdTG18201 или AdTG15149. Таким образом, популяция CFSE-low представляла специфические мишени, которые, как предполагали, должны были лизироваться цитотоксическими Т-клетками, индуцированными за счет вакцинации, а популяция CFSE-high служила внутренним контролем, позволяющим выполнить нормализацию результатов анализа. Для детекции клеток, меченных CFSE, спленоциты мышей-реципиентов анализировали через 24 ч при помощи проточной цитометрии. Для каждого животного рассчитывали соотношение между мишенями, активированными пептидом, и неактивированными мишенями (R = число клеток CFSE-low / число клеток CFSE-high). Степень выраженности специфического лизиса в процентах для каждого животного рассчитывали по следующей формуле: % лизиса = (1-Rмышu/Rреф.)×100, где Rреф. обозначает среднее R, полученное для 2 наивных трансгенных по HLA-A2 мышей, получавших инъекции такой же суспензии меченных CFSE мишеней. Ответ считали положительным, если степень выраженности специфического лизиса в процентах превышала 10%.
1.3 Анализ AdTG18201 при помощи электронной микроскопии in vitro
Клетки А549 (линия эпителиальных клеток аденокарциномы легких целовека) инфицировали в суспензии и в уменьшенном объеме среды AdTG18201 при различной множественности заражения (от 25 до 100), а затем культивировали в течение 16 ч, 24 ч или 48 ч перед тем как собрать для анализа. Клетки собирали в эти различные временные точки и затем фиксировали 2% глутаральдегидом, разведенным в 0,2 M натрий-какодилатном буфере. Затем клетки высушивали, заключали в смолу, после чего изготавливали ультра-тонкие срезы. Полученные срезы затем окрашивали с помощью ацетата уранила и цитрата свинца и наблюдали под электронным микроскопом.
2. Результаты
2.1. Иммуногенность гибридных белков ВГВ, экспрессируемых ДНК-плазмидами pTG18188 и pTG18194
Иммуногенность гибридных белков ВГВ, экспрессируемых ДНК-плазмидами, оценивали у трансгенных по HLA-A2 мышей. После проведения двух внутримышечных инъекций pTG18188 (tCore-Pol*-Env1-Env2) или pTG18194 (tCore-Pol*) или pTG13135 в качестве отрицательного контроля (плазмида без встроенных генов) оценивали специфический Т-клеточный ответ при помощи определения ИФН-гамма методом Elispot и внутриклеточного окрашивания цитокинов (ИФН-гамма/ФНО-альфа), с использованием известных рестриктированных по HLA-A2 эпитопов, присутствующих в доменах полимеразы, корового белка или белка оболочки и/или пулов перекрывающихся пептидов, представляющих интересующие антигены ВГВ.
2.1.1. Оценка количества специфических в отношении ВГВ клеток, продуцирующих ИФНγ, методом Elispot
Как показано на Фиг.2, иммунизация плазмидой pTG18194, кодирующей гибридный белок ВГВ "tCore-Ροl*", индуцировала клетки, продукцирующие ИФН-гамма, специфические в отношении HLA-А2-рестриктированного эпитопа SLY (SEQ ID NO: 23), присутствующего в составе полимеразы ВГВ (положения 816-824). Иммунизация плазмидой pTG18194 также приводила к индукции большого количества клеток, продуцирующих ИФН-гамма, специфических в отношении двух HLA-A2-рестриктированных эпитопов корового белка: FLP (SEQ ID NO: 18, присутствует в коровом белке ВГВ в положении 18-27) и ILC (SEQ ID NO: 19, присутствует в коровом белке ВГВ в положении 99-108). Положительные ответы наблюдались у 4 из 8 вакцинированных мышей.
Как показано на Фиг.2, плазмида pTG18188, кодирующая гибридный белок ВГВ "Core-Pol*-Env1-Env2", также индуцировала клетки, продуцирующие ИФН-гамма, специфические в отношении HLA-A2- рестриктированных эпитопа SLY полимеразы и двух HLA-A2- рестриктированных эпитопов корового белка FLP и ILC. Положительные ответы наблюдались у 4 из 8 вакцинированных мышей. Кроме того, у 1 вакцинированной мыши также обнаруживались клетки, продуцирующие ИФН-гамма, специфические в отношении HLA-A2-рестриктированных эпитопа GLS (SEQ ID NO: 22 присутствует в составе Env2 в положениях 185-194 HBsAg), хотя и в малом количестве.
2.1.2. Оценка индуцированных специфических в отношении ВГВ CD8+ и CD4+ Т-клеток, продуцирующих ИФН-гамма, при помощи внутриклеточного окрашивания
2.1.2.1. CD8 Т-клеточный ответ, специфический в отношении HLA-A2-рестриктированных эпитопов
Процентное содержание CD8 Т-клеток, продуцирующих либо только ИФН-гамма, либо ИФН-гамма в сочетании с ФНО-альфа, распознающих HLA-A2-рестриктированные эпитопы, входящие в состав доменов полимеразы (SLY), корового белка (FLP и ILC) и белка оболочки (VLQ, FLG и GLS), оценивали при помощи внутриклеточного окрашивания цитокинов. Результаты показаны на Фиг.3А в виде процентного содержания CD8+Т-клеток, специфических к этим эпитопам и продуцирующих ИФН-гамма (сумма клеток, продуцирующих только ИФН-гамма, или клеток, продуцирующих ИФН-гамма и ФНО-альфа). У четырех из 8 животных, иммунизированных pTG18194 (экспрессирующей tCore-Ροl*) выросло число CD8+ Т-клеток, продуцирующих ИФН-гамма, специфических к HLA-A2-рестриктированным эпитопам FLP, ILC и SLY, присутствующим соответственно в антигенах корового белка и полимеразы. Аналогично, у 4 из 8 животных, иммунизированных pTG18188 (экспрессирующей tCore-Pol*-Env1-Env2), также выросло число CD8+Т-клеток, продуцирующих ИФН-гамма, специфических к эпитопам FLP, ILC и SLY. Кроме того, как уже было показано методом ELISPOT, 1 из 8 мышей, иммунизированных плазмидой pTG18188, демонстрировала ответ, специфический в отношении HLA-А2-рестриктированного эпитопа GLS, присутствующего в составе домена Env2, опосредованный CD8+ Т-клетками, продуцирующими ИФН-гамма. Как и ожидалось, иммунизация pTG13135 не вызывала какого-либо специфического ответа.
2.1.2.2 CD8 и CD4 Т-клеточный ответ, специфический в отношении пулов пептидов, представляющих коровый белок, белок полимеразы и домены белка оболочки.
Ответ, специфический в отношении пулов пептидов, представляющих коровый белок
Процентное содержание CD8 и CD4 Т-клеток, способных продуцировать либо только ИФН-гамма, либо ИФН-гамма в сочетании с ФНО-альфа в ответ на пулы пептидов, представляющих коровый белок (PC), оценивали при помощи внутриклеточного окрашивания цитокинов. Результаты представлены как процентное содержание CD8+ или CD4+ Т-клеток, специфических к этим пулам пептидов и продуцирующих ИФН-гамма (сумма клеток, продуцирующих только ИФН-гамма клеток, и клеток, продуцирующих ИФН-гамма и ФНО-альфа).
Как показано на Фиг. 3Б, CD8+ Т-клетки, продуцирующие ИФН-гамма, обнаруживались в ответ на два пула пептидов, представляющих коровый белок (РС1 и РС2), при этом ответ CD8+ Т-клеток был главным образом направлен на 1 пул пептидов корового белка. В случае обоих пептидных пулов (1 и 2) процентное содержание реакционноспособных CD8+ Т-клеток у мышей, вакцинированных pTG18194 или pTG18188, существенно отличалось от их процентного содержания у мышей, вакцинированных плазмидой, служившей отрицательным контролем (pTG13135) (р<0,05, критерий Манна-Уитни).
Как показано на Фиг. 3В, CD4+ Т-клетки, продуцирующие ИФН-гамма, были также обнаружены в ответ на один пул пептидов, представляющих коровый белок, а именно 2 коровый пул в обеих группах мышей, вакцинированных pTG18194 или pTG18188. В случае корового пула 2 процентное содержание реакционноспособных CD4+ Т-клеток у мышей, вакцинированных pTG18188, существенно отличалось от их процентного содержания у мышей, вакцинированных плазмидой, служившей отрицательным контролем (pTG13135) (р<0,05, критерий Манна-Уитни).
Ответ, специфический в отношении пулов пептидов, представляющих белок полимеразы
Процентное содержание CD8 и CD4 Т-клеток, способных продуцировать либо только ИФН-гамма, либо ИФН-гамма в сочетании с ФНО-альфа в ответ на пулы пептидов, представляющих белок полимеразы, оценивали при помощи внутриклеточного окрашивания цитокинов. Результаты представлены как процентное содержание CD8+ или CD4+ Т-клеток, специфических в отношении этих пулов пептидов и продуцирующих ИФН-гамма (сумма клеток, продуцирующих только ИФН-гамма, и клеток, продуцирующих ИФН-гамма и ФНО-альфа).
Как показано на Фиг. 3Г, CD8+ Т-клетки, продуцирующие ИФН-гамма, преимущественно выявлялись в ответ на один пул пептидов, РР8. В частности, в случае РР8, процентное содержание реакционноспособных CD8+Т-клеток у мышей, вакцинированных pTG18194 или pTG18188, существенно отличалось от их процентного содержания у мышей, вакцинированных плазмидой, служившей отрицательным контролем (pTG13135) (р<0,05, критерий Манна-Уитни). Следует отметить, что у одной из мышей, вакцинированных pTG18188, продуцирующие ИФН-гамма CD8+ Т-клетки также обнаруживались в ответ на пул 4, пул 5 и пул 6.
Как показано на Фиг. 3Д, в обеих группах мышей, вакцинированных pTG18194 или pTG18188, было обнаружено невысокое процентное содержание CD4+ Т-клеток, продуцирующих ИФН-гамма, в ответ на 4 пула пептидов, представляющих белок полимеразы, пул Pol 1, пул Pol 4, пул Pol 5 и пул Pol 6, при этом ответ наблюдался по меньшей мере у 3 из 8 исследуемых мышей в каждой группе.
Ответ, специфический в отношении пулов пептидов, представляющих домены белка оболочки
Процентное содержание CD8 и CD4 Т-клеток, способных продуцировать либо только ИФН-гамма, либо ИФН-гамма в сочетании с ФНО-альфа в ответ на пулы пептидов, представляющих домены белка оболочки, Env1 и Env2, оценивали при помощи внутриклеточного окрашивания на цитокины. В этом эксперименте не было зарегистрировано специфического ответа CD4+ Т-клеток. Результаты для CD8+ Т-клеточного ответа показаны на Фиг. 3Е в виде процентного содержания CD8+ Т-клеток, специфических к этим пулам пептидов и продуцирующих ИФН-гамма (сумма клеток, продуцирующих только ИФН-гамма, и клеток, продуцирующих ИФН-гамма и ФНО-альфа). В частности, у 1 мыши, вакцинированной pTG18188, было зарегистрировано невысокое процентное содержание CD8+ Т-клеток, продуцирующих ИФН-гамма, в ответ на один пул пептидов, пул Env2.
2.2. Иммуногенность гибридных белков ВГВ, экспрессируемых аденовирусными векторами AdTG18201, AdTG18202 и AdTG18203
2.2.1. Оценка ИФНγ-продуцирующих Т-клеток, специфических в отношении ВГВ, при помощи определения ИФНγ методом Elispot с использованием пулов перекрывающихся пептидов
Иммуногенность мутантной полимеразы ВГВ и гибридных белков, экспрессируемых человеческим аденовирусом 5 типа оценивали у трансгенных по HLA-A2 мышей, иммунизированных AdTG18201 или AdTG18202 или AdTG18203 или AdTG 15149 (аденовирус без встроенных генов, использованный в качестве отрицательного контроля). Специфические Т-клеточные ответы, индуцированные после одной подкожной инъекции аденовируса, оценивали при помощи определения ИФН-гамма методом Elispot с использованием пулов перекрывающихся пептидов, представляющих интересующие антигены ВГВ (корового белка (РС1-2), полимеразы (РР1-8) и доменов белка оболочки (РЕ1-2)).
Как показано на Фиг. 4, AdTG18203, кодирующий только мутантный полипептид полимеразы ВГВ, способен индуцировать клетки, продуцирующих ИФН-гамма, специфические в отношении 4, 5, 6 и 8 пулов пептидов полимеразы. Все иммунизированные мыши демонстрировали специфический Т-клеточный ответ с большим количеством клеток, продуцирующих ИФН-гамма, преимущественно в ответ на 4 и 8 пулы пептидов полимеразы.
Как показано на Фиг. 4, AdTG18202, кодирующий гибридный белок ВГВ "tCore-Ροl*", индуцировал клетки, продуцирующие ИФН-гамма, специфические к пептидным пулам РР2, РР3, РР4, РР5 и РР8; ответ, специфический в отношении полимеразы, был в основном направлен против РР2, РР3 и РР8. Иммунизация AdTG18202 также приводила к индукции большого количества клеток, продуцирующих ИФН-гамма, специфических к 2 пулам коровых пептидов РС1 и РС2, при этом количество Т-клеток, распознающих РС1, было выше. Положительный ответ, направленный как на антигены полимеразы, так и антигены корового белка, наблюдался у 5 из 5 вакцинированных мышей.
AdTG18201, кодирующий гибридный белок ВГВ "Core-Pol*-Env1-Env2", также оказался иммуногенным, как показано на Фиг.4. Более конкретно, у всех вакцинированных мышей были индуцированы клетки, продуцирующие ИФН-гамма, специфические в отношении пулов пептидов полимеразы РР2, РРЗ и РР8, а также в отношении РР4 и РР5, хотя при этом число пятен и число ответивших мышей было меньше. Иммунизация AdTG18201 также приводила к индукции у всех вакцинированных мышей (5/5) большого числа клеток, продуцирующих ИФН-гамма, специфических в отношении 2 пулов коровых пептидов РС1 и РС2. Иммунизация AdTG18201 также индуцировала специфический Т-клеточный ответ, направленный против доменов белка оболочки, хотя эти ответы были слабыми и спорадическими, 1 из 5 мышей демонстрировала ответ, направленный на РЕ1, и 2 из 5 мышей демонстрировали ответ, направленный на РЕ2.
2.2.2. Оценка ИФН-гамма-продуцирующих Т-клеток, специфических в отношении ВГВ, при помощи определения ИФН-гамма методом Elispot с использованием HLA-А2-рестриктированных пептидов после иммунизации AdTG18201.
Иммуногенность одного из гибридных белков ВГВ, экспрессируемых AdTG18201, оценивали у мышей, трансгенных по HLA-A2. Животных иммунизировали одной подкожной инъекцией AdTG18201 или AdTG15149 (аденовирус без встроенного гена, использованный в качестве отрицательного контроля). Специфический Т-клеточный ответ оценивали при помощи определения ИФН-гамма методом Elispot с использованием HLA-А2-рестриктированных эпитопов, присутствующих в полимеразе (SLY), коровом белке (FLP и ILC) и белке оболочки (VLQ и GLS).
Как показано на Фиг. 5, AdTG18201, кодирующий гибридный белок ВГВ «Core-Pol*-Env1-Env2», оказался иммуногенным. Более конкретно, у всех мышей, вакцинированных AdTG18201, были индуцированы клетки, продуцирующие ИФН-гамма, специфические в отношении HLA-А2-рестриктированного эпитопа полимеразы SLY. В то же время, AdTG18201 также индуцировал большое количество ИФН-гамма-продуцирующих клеток, специфических в отношении двух HLA-A2-pecTpHKTnpoBaHHbix эпитопов корового белка, FLP и ILC. Иммунизация AdTG18201 также индуцировала специфический Т-клеточный ответ, направленный против доменов белка оболочки, хотя количество клеток и число ответивших мышей было ниже, положительный Т-клеточный ответ против пептида VLQ демонстрировали 2 из 8 исследуемых мышей, а положительный Т-клеточный ответ против пептида GLSP демонстрировали 5 из 8 исследуемых мышей.
2.2.3. Оценка специфических в отношении ВГВ СР8+Т-клеток, продуцирующих ИФН-гамма и/или ФНО-альфа, при помощи внутриклеточного окрашивания после иммунизации HLA-A2-мышей AdTG18201 с использованием выбранных пептидных пулов.
Процентное содержание CD8+ Т-клеток, способных продуцировать только ИФН-гамма или ИФН-гамма в сочетании с ФНО-альфа в ответ на выбранные пулы пептидов, представляющих часть белка полимеразы (РР8, аминокислоты с 725 по 835) и часть корового белка ВГВ (РС1, аминокислоты от 1 до 100), оценивали при помощи внутриклеточного окрашивания цитокинов. Результаты выражали в виде процентного содержания CD8+ Т-клеток, специфических к этим пулам пептидов и продуцирующих только ИФН-гамма и ИФН-гамма в сочетании с ФНО-альфа.
Как показано на Фиг. 6, AdTG18201 в частности способен индуцировать большое количество CD8+ Т-клеток, продуцирующих как один ИФН-гамма, так и ИФН-гамма в сочетании с ФНО-альфа, распознающих пептиды пулов РР8 и РС1. Все вакцинированные мыши демонстрировали высокое процентное содержание специфических CD8+ Т-клеток, продуцирующих как один цитокин (только ИФН-гамма), так и два цитокина (ИФН-гамма и ФНО-альфа).
Следует отметить, что аналогичные эксперименты, проведенные на другой модели на мышах, мышах C57BI6, показали аналогичные результаты в отношении иммуногенности AdTG18201 (результаты не приведены).
2.2.4. Оценка индукции функциональных CD8+ Т-клеток in vivo с помощью анализа цитолитического действия Т-лимфоцитов in vivo после иммунизации HLA-А2-мышей AdTG18201.
Способность AdTG18201 индуцировать in vivo функциональные CD8 T-клетки, демонстрирующие цитолитическую активность, оценивали при помощи анализа цитотолитического действия Т-лимфоцитов (или CTL) in vivo у HLA-A2-мышей после иммунизации AdTG18201 или AdTG15149 (отрицательный контроль) с использованием трех HLA-А2-рестриктированных эпитопов, которые, как уже было показано, способны распознаваться индуцированными CD8+ Т-клетками, продуцирующими ИФН-гамма (SLY, FLP и ILC).
Как показано на Фиг. 7, AdTG18201 способен индуцировать in vivo высокую цитолитическую активность, специфическую в отношении эпитопа полимеразы SLY, при этом специфический лизис определялся у всех иммунизированных мышей, а его степень выраженности находилась в диапазоне от 42% до 75% (Фиг. 7а). Было также показано, что AdTG18201 способен индуцировать in vivo высокую цитолитическую активность, специфическую в отношении 2 исследуемых HLA-A2-рестриктированных эпитопов корового белка FLP (Фиг. 7а) и ILC (Фиг. 7б), степень выраженности специфического лизиса находилась в диапазоне от 32% до 69% и от 3% до 64%, соответственно. Ответ на эпитоп белка оболочки детектировался, но был слабо выраженным.
Эти данные четко продемонстрировали способность AdTG18201 индуцировать in vivo функциональные CD8+ Т-клетки, демонстрирующие цитолитическую активность, направленную как на белок полимеразы ВГВ, так и на коровый белок ВГВ.
2.2.5. Оценка индукции функциональных CD8+ Т-клеток у трансгенных по ВГВ мышей после иммунизации AdTG18201 с помощью внутриклеточного окрашивания цитокинов.
Способность AdTG18201 индуцировать функциональные Т-клетки в модели на толерантных мышах оценивали у мышей, трансгенных по ВГВ. Действительно, эти мыши трансгенны по геному ВГВ и, таким образом, толерантны к антигенам ВГВ, что в некоторой степени имитирует толерантность, встречающуюся у пациентов с хроническим ВГВ. Трансгенных по ВГВ мышей иммунизировали при помощи однократной подкожной инъекции AdTG18201 (108 ИЕ) или AdTG15149, который использовали в качестве отрицательного контроля. Индуцированные Т-клетки регистрировали как в селезенке, так и в печени вакцинированных мышей при помощи внутриклеточного окрашивания цитокинов (детекция CD8+ Т-клеток, продуцирующих как ИФН-гамма, так и ФНО-альфа). В этой специфической модели для скрининга индуцированного Т-клеточного ответа использовали пептиды, которые были реакционноспособными у мышей C57BI/6J: пул пептидов VSA и N13F в случае полимеразы и пептид F13L в случае белка оболочки.
Как показано на Фиг. 8, функциональные CD8+ Т-клетки, продуцирующие как ИФН-гамма, так и ФНО-альфа, обнаруживали в селезенке и в печени мышей, вакцинированных AdTG18201, у 4 из 5 исследуемых мышей в обоих органах обнаруживали функциональные CD8+ Т-клетки, продуцирующие ИФН-гамма/ФНО-альфа, специфические в отношении полимеразы, и у 2 из 5 исследуемых мышей обнаруживали функциональные CD8+ Т-клетки, продуцирующие ИФН-гамма/ФНО-альфа, специфические в отношении белка оболочки. Как и ожидалось, у мышей, иммунизированных вектором AdTG15149 без встроенных генов, или при стимуляции нерелевантным пептидом, ответ не регистрировался.
В совокупности эти данные демонстрируют способность вирусного вектора AdTG18201, экспрессирующего гибридный белок, содержащий мутантную полимеразу, дефектную по активности РНКазы H и имеющую делецию YMDD, домены белка оболочки и коровый полипептид, индуцировать функциональные CD8+ Т-клетки, продуцирующие как ИФН-гамма, так и ФНО-альфа, в толерантной к ВГВ модели.
2.3 Оценка различных доз и схем иммунизации AdTG18201 или AdTG18202.
2.3.1. Оценка дозы аденовируса.
У трансгенных по HLA-A2 мышей оценивали иммуногенность различных доз гибридного белка ВГВ, экспрессируемого AdTG18201. Животных иммунизировали с помощью однократной подкожной инъекции AdTG18201 в дозе 105 ИЕ или 106 ИЕ или 107 ИЕ или 108 ИЕ или 109 ИЕ или AdTG15149 в дозе 109 ИЕ (аденовирус без встроенных генов, использованный в качестве отрицательного контроля). Специфический Т-клеточный ответ оценивали при помощи определения ИФН-гамма методом Elispot с использованием HLA-A2- рестриктированных эпитопов, присутствующих в полимеразе (SLY), коровом белке (FLP и ILC) и белке оболочки (VLQ и GLS).
Как показано на Фиг. 9, AdTG18201, кодирующий гибридный белок ВГВ «Core-Pol*-Env1-Env2» оказывался иммуногенным при инъекции в дозах 107 ИЕ, 108 ИЕ и 109 ИЕ. Более конкретно, при дозах 105 и 10е ИЕ не было обнаружено клеток, продуцирующих ИФН-гамма, специфических к исследуемым HLA-A2-рестриктированным эпитопам корового белка, полимеразы или доменов белка оболочки. Специфические ИФН-гамма-продуцирующие клетки, распознающие 2 исследуемых эпитопа корового белка и исследуемый эпитоп полимеразы, были обнаружены при дозах 107, 108 и 109 ИЕ. Дозозависимый эффект наблюдался для 3 эпитопов (SLY, FLP и ILC). Для 2 эпитопов доменов оболочки (VLQ и GLS), количество клеток, продуцирующих ИФН-гамма, было низким при дозах 107 и 108, тогда как количество отчетливо повышалось при дозе 109 ИЕ.
2.3.2. Оценка схемы многократной иммунизации в краткосрочной перспективе.
Иммуногенность одного из гибридных белков ВГВ, экспрессируемого AdTG18202, оценивали у трансгенных по HLA-A2 мышей с применением различных схем иммунизации. AdTG 18202 вводили однократно или 3 раза (1 инъекция/нед в течение 3 недель) или 6 раз (1 инъекция/нед в течение 6 недель) и оценивали индуцированный Т-клеточный ответ через 2 недели после последней инъекции при помощи определения ИФН-гамма методом Elispot с использованием HLA-A2-рестриктированных эпитопов SLY (полимераза) и FLP и ILC (коровый белок). Некоторых мышей иммунизировали 6 раз аденовирусом без встроенных генов, который использовали в качестве отрицательного контроля (данные не приведены).
Как показано на Фиг. 10, AdTG18202, кодирующий гибридный белок «Core-Pol*», оказывался иммуногенным независимо от используемой схемы. Более конкретно, при использовании среды как таковой и нерелевантного пептида специфический Т-клеточный ответ не регистрировался, тогда как в присутствии 3 исследуемых эпитопов ВГВ SLY, FLP и ILC регистрировали большое и схожее число клеток, продуцирующих ИФН-гамма. Количество зарегистрированных Т-клеток, продуцирующих ИФН-гамма, оказывалось сопоставимым в группах мышей, получавших 1, 3 или 6 инъекций с 1-недельным интервалом, без истощения Т-клеток вследствие чрезмерно большого числа иммунизаций в течение короткого периода времени, оцениваемому по продукции ИФН-гамма. Специфический в отношении аденовируса Т-клеточный ответ был выше, когда мыши получали 6 инъекций, по сравнению с однократной или трехкратной инъекциями. Как ожидалось, при иммунизации аденовирусом без встроенных генов специфический к ВГВ Т-клеточный ответ не наблюдался.
2.3.3. Оценка схемы многократной иммунизации в долгосрочной перспективе.
Иммуногенность одного из гибридных белков ВГВ, экспрессируемых AdTG18202, оценивали у трансгенных по HLA-A2 мышей с использованием различных схем иммунизации. AdTG 18202 вводили либо однократно (за 2 (группа 1) или 20 (группа 2) недель до исследования Т-клеточного ответа) или двукратно (2 инъекции с интервалом 2 (группа 3) или 4 (группа 4) месяца, Т-клеточный ответ оценивали через 2 недели после последней иммунизации), или трехкратно (с интервалом 2 месяца (группа 5), Т-клеточный ответ оценивали через 2 недели после последней инъекции). Индуцированные Т-клетки выявляли с помощью определения ИФН-гамма методом Elispot с использованием HLA-A2-рестриктированных эпитопов SLY (полимераза) и FLP и ILC (коровый белок). Некоторых мышей иммунизировали один или три раза с интервалом 2 месяца аденовирусом без встроенных генов, который использовали в качестве отрицательного контроля (данные не приведены).
Как показано на Фиг.11, AdTG18202, кодирующий гибридный белок «Core-Pol*», оказался иммуногенным независимо от используемой схемы, тогда как при иммунизации AdTG18202 в присутствии среды как таковой или нерелевантного пептида специфический Т-клеточный ответ не регистрировался. Более конкретно, специфический Т-клеточный ответ, наблюдавшийся в группе 2, показал, что даже будучи ниже, чем в группе 1 через 2 недели после 1 иммунизации, индуцированный Т-клеточный ответ после одной инъекции AdTG18202 все еще существует спустя 20 недель после инъекции. Т-клеточные ответы, наблюдавшиеся в группах 3 и 4, продемонстрировали, что 2ая иммунизация через 2 или 4 месяца после первой иммунизации способна вызвать вторичный Т-клеточный ответ, специфический в отношении эпитопов ВГВ, по меньшей мере соответствующий уровню первичного иммунного ответа, наблюдавшегося в группе 1, или даже несколько выше в случае эпитопа SLY. Аналогичное наблюдение было сделано на мышах, которых иммунизировали три раза с интервалом 2 месяца (группа 5), с развитием вторичного индуцированного Т-клеточного ответа после 2й и 3й инъекций до уровня, сопоставимого с уровнем, наблюдавшимся в группе 1. Как ожидалось, при иммунизации аденовирусом без встроенных генов специфический к ВГВ Т-клеточный ответ не наблюдался.
2.4 Наблюдения с использованием электронной микроскопии
Клетки А549 инфицировали in vitro AdTG18201 при множественности заражения 25, 50 или 100 и собирали клетки через 16 ч, 24 ч или 48 ч после инфицирования. Собранные клетки затем обрабатывали для исследования под электронным микроскопом.
В ядре и цитоплазме клеток, инфицированных AdTG18201, наблюдалось некоторое количество вирусоподобных частиц (VLP), тогда как в клетках, инфицированных аденовирусом без встроенных генов, эти структуры не наблюдались. Эти VLP в основном были локализованы в ядре. В некоторых клетках наблюдались как агрегаты белков, так и VLP.
Реферат
Настоящее изобретение относится к биохимии, в частности к мутантному полипептиду полимеразы ВГВ, содержащему мутантный домен полимеразы ВГВ с внутренней делецией, которая подавляет функциональную активность полимеразы, и мутантный домен РНКазы Н с внутренней делецией и мутациями, которые подавляют функциональную активность РНКазы Н. Настоящее изобретение также относится к гибридному белку, содержащему указанный мутантный полипептид полимеразы ВГВ и коровый полипептид ВГВ или иммуногенные домены HBsAg envl и env2. Указанный мутантный полипептид и гибридные белки используют для индукции или стимуляции иммунного ответа против ВГВ. Настоящее изобретение также раскрывает молекулу нуклеиновой кислоты и экспрессирующий вектор, а также композицию и набор для лечения или предотвращения инфекции, вызванной ВГВ, или ассоциированных с ВГВ заболеваний и патологических состояний. Настоящее изобретение также раскрывает клетку-хозяина и способ для получения указанных гибридных белков и способ получения вирусных частиц, использующий указанный вектор экспрессии. Настоящее изобретение позволяет улучшить иммуногенность мутантных полипептидов ВГВ с сохранением при этом безопасности при их использовании. 11 н. и 35 з.п. ф-лы, 11 ил., 2 пр.
Формула
Документы, цитированные в отчёте о поиске
Композиции на основе белка вируса гепатита в и стрессового белка и их применение

Комментарии