Композиции на основе белка вируса гепатита в и стрессового белка и их применение - RU2295536C2
Код документа: RU2295536C2
Чертежи


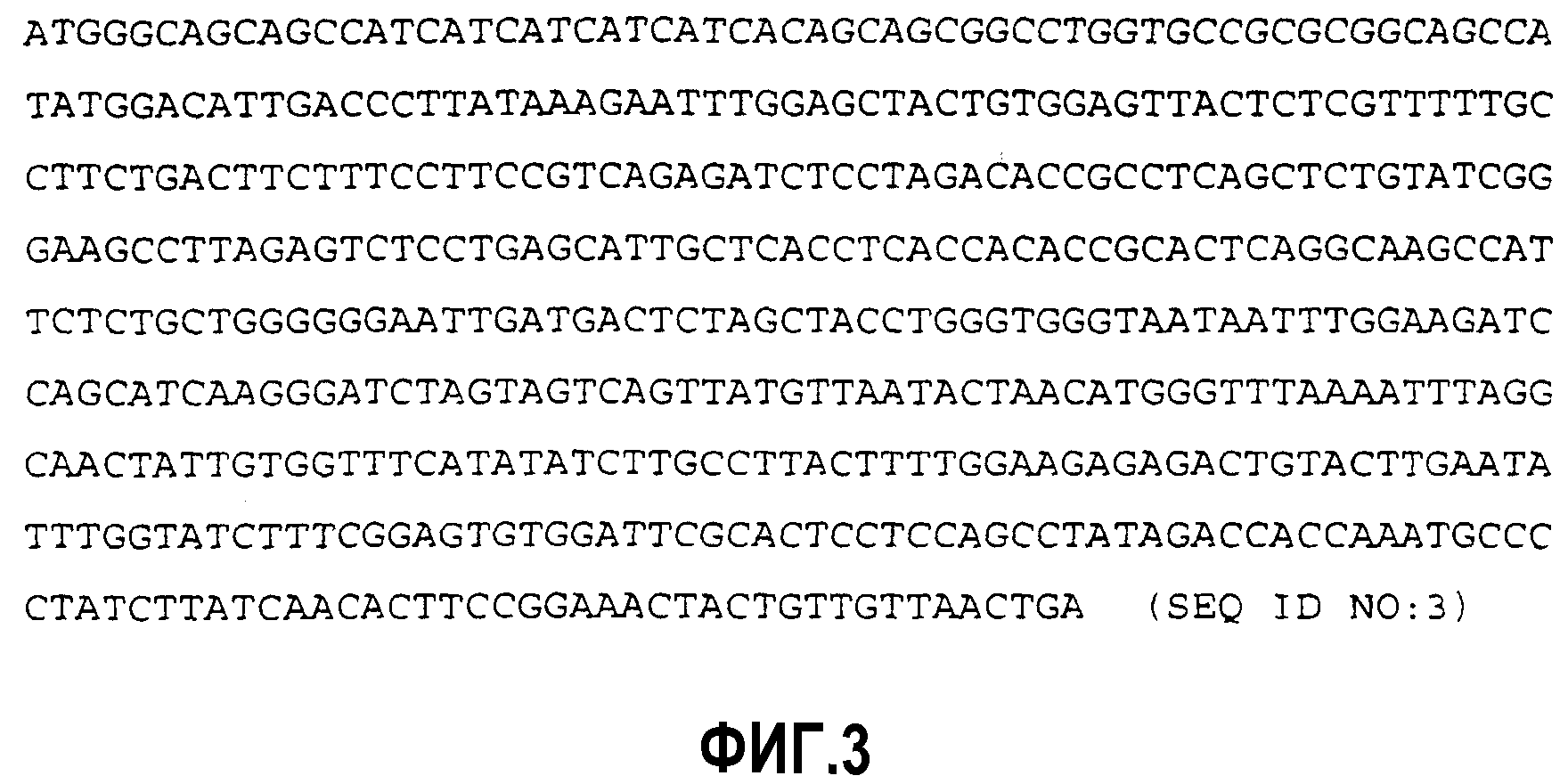

















Описание
Настоящая заявка притязает на приоритет по дате подачи заявки США № 60/266733 (февраль 5, 2001). Содержание заявки № 60/266733 полностью включено в настоящую заявку в качестве ссылки.
Область изобретения
Изобретение относится к области иммунотерапии вируса гепатита B.
Предпосылки изобретения
Вирус гепатита B (HBV) представляет собой нецитопатический ДНК-содержащий вирус, который заражает людей и может привести к двум клиническим исходам. В большинстве случаев клинического инфицирования взрослых (90-95%) вирус исчезает после нескольких недель или месяцев, а у пациента развивается пожизненный иммунитет против повторного инфицирования. Однако в остальных случаях не происходит удаление вируса из тканей, и пациент остается хронически инфицированным. Последствия хронической инфекции являются серьезными: у таких субъектов с высокой вероятностью развивается рубцевание ткани печени (цирроз), а со временем может развиться гепатоцеллюлярная карцинома.
Существует профилактическая вакцина против HBV, и многие развитые страны внедрили программы детской вакцинации для уменьшения общего риска инфицирования. К сожалению, так как заболеваемость и смертность в результате инфицирования HBV происходят в течение десятилетий, воздействие вакцинации не будет, как следует, реализовано до наступления будущего. Действительно, ожидают, что ежегодный процент инфицирования HBV у взрослых снизится менее чем до 5% в течение следующих восьми лет. К 2008 году в Соединенных Штатах ежегодно будет происходить более 150000 новых случаев инфицирования и ожидают даже более в Европе и Японии. Данные субъекты составят огромный резервуар вируса, из которого возникнут от 20000 до 40000 случаев хронического инфицирования в год. Очевидно, что, несмотря на доступность вакцины, хроническая инфекция HBV продолжит оставаться серьезной проблемой для здоровья многих последующих лет.
Современные способы лечения хронического HBV включают альфа, интерферон (IFN-α) и ламивудин. Данные способы лечения оценивают по их способности уменьшать вирусную нагрузку и вызывать сероконверсию или потерю Hbe-антигена, маркера репликации HBV, и вирусемии высокого титра. IFN-α способен элиминировать Hbe, но только примерно у одной трети пациентов, у тех, у которых низка вирусная нагрузка. Лечение является дорогим и связано со значительными нежелательными побочными эффектами. Ламивудин представляет собой противовирусное средство с малой молекулой, которое хорошо переносится при оральном введении. Данное соединение эффективно в уменьшении вирусной нагрузки у пациентов, но относительно мало пациентов отвечают потерей Hbe, а прекращение лечения обычно приводит к увеличению вирусной нагрузки. С другой стороны, непрерывная терапия может привести к селекции устойчивых к ламивудину мутантных вариантов. Совместное лечение IFN-α и ламивудином не показало повышенной эффективности. Очевидно, что успешная иммунотерапия для лечения инфекций HBV является крайне желательной.
Сущность изобретения
В настоящем изобретении представлены композиции, включающие стрессовый белок или его часть и антиген HBV. Данные композиции детально обсуждают ниже. Мы отмечаем здесь, что их компоненты можно получить из различных источников, а их длина и содержание могут варьировать. Например, стрессовый белок может представлять собой белок, который экспрессируется в естественных условиях у любого млекопитающего (например, у человека или других приматов) или у любого другого класса организмов, экспрессирующих стрессовый белок (например, у бактерий или микобактерий); стрессовый белок или антиген HBV может являться полноразмерным, укороченным или удлиненным посредством добавления одного или нескольких аминокислотных остатков; и, в дополнение, содержание стрессового белка или антигена HBV может варьировать (например, стрессовый белок или его часть и антиген HBV могут содержать один или несколько аминокислотных замен). Результатом любого изменения, однако, должна являться композиция, которая может индуцировать или усилить иммунный ответ против HBV у млекопитающих. Предпочтительно, иммунный ответ является по существу достаточным, чтобы пациент, инфицированный HBV, почувствовал улучшение в признаке или симптоме инфекции. Таким образом, антиген включает встречающиеся в природе антигены, а также его фрагменты и другие варианты, которые при введении субъекту (например, посредством описанных здесь способов) индуцируют иммунный ответ на один или несколько эпитопов, представленных во фрагменте или варианте.
Также, в дополнение к полноразмерным или встречающимся в природе стрессовым белкам, композиции по изобретению могут включать фрагменты стрессовых белков, которые представляют собой иммуностимуляторы (например, фрагменты, которые способствуют иммунному ответу на антиген). Стрессовый белок или его фрагмент способствует иммунному ответу тогда, когда иммунный ответ является более значительным или в любом отношении лучшим, чем иммунный ответ, который обычно происходит при введении одного антигена HBV.
Иммунный ответ может представлять собой или гуморальный или клеточный ответ. Например, антигенный фрагмент может содержать один или несколько пептидных антигенов для HLA класса I, как описано здесь. Клеточный иммунный ответ включает в себя антиген-специфические клетки, такие как цитотоксические T-лимфоциты (CTL), а также, возможно, T-хелперные лимфоциты (Th) и клетки врожденной иммунной системы, такие как моноциты, макрофаги, дендритные клетки, натуральные киллерные клетки и γδ -T-клетки. Специалист в данной области легко способен обнаружить или иным образом оценить иммунный ответ, который выражается, например, посредством индукции цитотоксических T-лимфоцитов (см. примеры ниже), клеточным пролиферативным ответом, индукцией цитокинов или комбинацией этих событий.
В конкретном осуществлении, антиген HBV может представлять собой коровый антиген, или его фрагмент, или производное. Производные антигена HBV включают варианты антигена HBV, такие как варианты, содержащие одну или несколько аминокислотных замен (например, консервативные замены аминокислот). Например, вариант антигена HBV может содержать 1-2, 2-5, 5-10, 10-25 или более замещенных аминокислотных остатков. Альтернативно, замены или другие мутации, такие как делеции или укорочения (трункации), могут составлять 1-2, 2-5, 5-10 или 10-25% последовательности полноразмерного антигена HBV. Подобно антигенной части композиции, вариант стрессового белка может содержать одну или несколько аминокислотных замен (например, консервативные замены аминокислот). Например, вариант стрессового белка может содержать 1-2, 2-5, 5-10, 10-25 или более консервативных замен аминокислот. Здесь замены или другие мутации, такие как делеции или укорочения, опять могут составлять 1-2, 2-5, 5-10 или 10-25% последовательности полноразмерного стрессового белка.
Различные комбинации стрессовых белков и антигенов HBV также находятся в объеме изобретения. Например, композиции по изобретению включают композиции, в которых полноразмерный антиген HBV подвергнут слиянию с полноразмерным стрессовым белком; антиген, состоящий из фрагмента или другого варианта антигена HBV, объединен с полноразмерным стрессовым белком; полноразмерный антиген HBV объединен с фрагментом или другим вариантом стрессового белка, и в которых фрагмент или другой вариант антигена HBV объединен с фрагментом или другим вариантом стрессового белка. Конечно, как описано здесь, может присутствовать более чем один каждого из этих компонентов (например, более чем один антиген HBV и более чем один стрессовый белок), а каждый из компонентов может присутствовать в виде полноразмерного белка или его иммунологически активного фрагмента или варианта.
Более того, в любом из описанных здесь воплощений, антиген HBV и стрессовый белок можно объединять любым образом. Например, стрессовый белок и антиген HBV можно представить в форме полипептида слияния (где стрессовый белок и антиген HBV ковалентно связывают во время трансляции слитой открытой рамки считывания). Альтернативно, стрессовый белок и антиген HBV можно связать посредством химической конъюгации после индивидуальной трансляции или синтеза каждого из них. Компоненты можно объединять нековалентно (например, в смеси или более упорядоченной композиции). Термины "полипептид" или "белок" применяют попеременно для описания цепи аминокислотных остатков, исключая случаи, когда из контекста ясно, что подразумевают определенный смысл.
Несмотря на то, что стрессовый белок обсуждается ниже, здесь авторы настоящего изобретения замечают, что стрессовый белок может представлять собой белок теплового шока (Hsp). Более того, Hsp может представлять собой микобактериальный Hsp, такой как Hsp65 (например, Hsp65 из Mycobacterium bovis) или любой представитель семейства белков Hsp из любых видов.
Можно составить композиции по изобретению для введения субъекту различными путями и, необязательно, содержащие адъювант. Дополнительные необязательные компоненты композиции включают фармацевтически приемлемые разбавители, наполнители и носители.
Также изобретение содержит в себе способы лечения инфекций HBV у субъекта (например, у млекопитающего, такого как человек) посредством введения композиции по изобретению субъекту, инфицированному HBV, и способы предотвращения (или уменьшения вероятности) инфицирования субъекта (например, млекопитающего, такого как человек) HBV посредством введения субъекту композиции по изобретению до инфицирования HBV.
Компоненты композиции не обязательно вводить субъекту непосредственно в виде полипептидов. Вместо этого можно вводить нуклеиновую кислоту, кодирующую стрессовый белок, антиген HBV или белок слияния, содержащий один или несколько каждого из них, и белок, антиген или белок слияния будут экспрессироваться у субъекта in vivo. Нуклеиновая кислота может представлять собой часть вирусного вектора, например часть генома вирусного вектора, или ее можно инкапсулировать, например, в липосомы. Альтернативно, нуклеиновую кислоту можно доставлять как голую нуклеиновую кислоту, такую как плазмидная ДНК, находящуюся под контролем регуляторных последовательностей, специфичных для эукариотических клеток или клеток млекопитающих. Способы введения молекул нуклеиновой кислоты хорошо известны в данной области.
Кроме того, изобретение включает применение композиций по изобретению (например, белков слияния, содержащих HBV, кодирующих их молекул нуклеиновой кислоты и содержащих их фармацевтических композиций) для производства лекарственного средства для лечения инфекций вируса гепатита B в соответствии с описанными здесь способами.
Другие возможности или преимущества настоящего изобретения станут ясны из детального описания, чертежей и формулы изобретения. Все цитированные здесь заявки на выдачу патента, патенты и публикации включены полностью посредством ссылки.
Краткое описание чертежей
Фигура 1 представляет собой последовательность ДНК, кодирующую коровый антиген (HBc) (SEQ ID NO:1) у HBV (подтип adw).
Фигура 2 представляет собой аминокислотную последовательность корового антигена (SEQ ID NO:2) у HBV (подтип adw).
Фигура 3 представляет собой последовательность ДНК конструкции hisHepCorT(149/87S97F), которая кодирует меченный гистидином укороченный коровый антиген HBV (аминокислоты 1-149; SEQ ID NO:3).
Фигура 4 представляет собой аминокислотную последовательность, кодируемую последовательностью ДНК, указанной на фигуре 3 (SEQ ID NO:4).
Фигура 5 представляет собой последовательность ДНК конструкции hisHepCor(97F)Hsp65, которая кодирует меченный гистидином белок слияния, включающий полноразмерный коровый антиген HBV и белок Hsp65 (SEQ ID NO:5)
Фигура 6 представляет собой аминокислотную последовательность, кодируемую последовательностью ДНК, указанной на фигуре 5 (SEQ ID NO:6).
Фигура 7 представляет собой последовательность ДНК конструкции hisHepCorT(149/87S97F)Hsp65, которая кодирует меченный гистидином белок слияния, включающий укороченный (аминокислоты 1-149) коровый антиген HBV, слитый с белком Hsp65 (SEQ ID NO:7).
Фигура 8 представляет собой аминокислотную последовательность, кодируемую последовательностью ДНК, указанной на фигуре 7 (SEQ ID NO:8).
Фигура 9 представляет собой последовательность ДНК конструкции HepCorT(151/97F)Hsp65, которая кодирует белок слияния, включающий укороченный (аминокислоты 1-151) коровый антиген HBV, слитый с белком Hsp65 (SEQ ID NO:9).
Фигура 10 представляет собой аминокислотную последовательность, кодируемую последовательностью ДНК фигуры 9 (SEQ ID NO:10).
Фигура 11 представляет собой последовательность ДНК конструкции HepCor(97F)Hsp65, которая кодирует белок слияния, включающий полноразмерный коровый антиген HBV, слитый с белком Hsp65 (SEQ ID NO:11).
Фигура 12 представляет собой аминокислотную последовательность, кодируемую последовательностью ДНК, указанной на фигуре 11 (SEQ ID NO:12).
Фигура 13 представляет собой график, отображающий активность примирования CTL (корректированный % лизиса в зависимости от соотношения эффектор:цель) у мышей C57BL/6, иммунизированных различными иммуногенами (HepCorT(151/97F)Hsp65, HepCor(97F)Hsp65, HepCorT(151/97F), HepCor(97F) и hisHepCorT(149/87S97F)Hsp65). Результирующую активность CTL оценивали по сравнению с клетками EL4, предварительно импульсно активированных контрольным пептидом MUT-1.52-59.Kb. Контрольным мышам инъецировали плацебо (буфер).Фигура 14 представляет собой график, отображающий активность примирования CTL (корректированный % лизиса в зависимости от соотношения эффектор:цель) у мышей C57BL/6, иммунизированных различными иммуногенами (как на фигуре 13). Результирующую активность CTL оценивали по сравнению с клетками EL4, предварительно импульсно активированных специфичным для антигена HBV пептидом HBc.93-100.Kb. Контрольным мышам инъецировали плацебо (буфер).
Фигура 15 представляет собой график, отображающий активность примирования CTL (корректированный % лизиса в зависимости от соотношения эффектор:цель) у мышей C57BL/6, иммунизированных различными иммуногенами (как на фигуре 13). Результирующую активность CTL оценивали по сравнению с клетками EL4.HBc.1D7, экспрессирующими коровый антиген гепатита B. Контрольным мышам инъецировали плацебо (буфер).
Фигура 16 представляет собой график, отображающий активность примирования CTL (IFN-γ (пкг/мл) в зависимости от соотношения эффектор:цель) у мышей C57BL/6, иммунизированных различными иммуногенами (как на фигуре 13). Способность получающихся в результате CTL секретировать гамма интерферон (IFN-γ) оценивали по сравнению с клетками EL4, культивированными совместно со специфичным для антигена HBV пептидом HBc.93-100.Kb. Контрольным мышам инъецировали плацебо (буфер).
Фигура 17 представляет собой график, отображающий активность примирования CTL (TNF-α (OD410)) у мышей C57BL/6, иммунизированных различными иммуногенами (как на фигуре 13). Способность образовавшихся CTL секретировать фактор некроза опухоли альфа (TNF-α) оценивали по сравнению с клетками EL4, культивированными совместно со специфичным для антигена HBV пептидом HBc.93-100.Kb. Контрольным мышам инъецировали плацебо (буфер).
Детальное описание
Изобретение относится к композициям, содержащим антиген HBV, подходящим для лечения или предотвращения инфекции HBV. Состав композиций может варьировать, как описано здесь, но композиции включают стрессовый белок или его часть (например, фрагмент) или его производное и антиген HBV. Ниже обсуждают различные материалы и процедуры, подходящие для применения в способах по изобретению.
Так как последовательности нуклеиновой кислоты, кодирующие стрессовый белок и белки HBV известны и доступны, конструкции нуклеиновой кислоты, кодирующие их (по одному или как продукт слияния) можно легко получить с использованием способов, регулярно применяемых в данной области. Например, нуклеиновые кислоты, кодирующие стрессовый белок (Hsp), факультативно связанные с антигеном, смотри в WO 89/12455, WO 94/29459, WO 98/23735, WO 99/07860 и ссылках, цитированных в них. Белки слияния можно получать не только посредством рекомбинантных способов, но также посредством конъюгации стрессового белка (например, Hsp) и антигена HBV после трансляции. Способы конъюгации описаны, например, у Hermanson (Bioconjugate Techniques, Academic Press, San Diego, CA, 1996), Lussow et al. (Eur. J. Immun. 21:2297-2302, 1991) и у Barrios et al. (Eur J. Immun. 22:1365-1372, 1992). Такие способы конъюгации включают применение связывающих средств, таких как глютаральдегида, карбодиимидов и бисдиазобензидина; применение гетеробифункциональных веществ, образующих поперечные связи, таких как сложного эфира M-малеимидобензоил-N-гидроксисукцинимида или использование цистеиновых остатков (которые присутствуют в естественных условиях и/или которые включили рекомбинантным способом) стрессового белка и антигена для содействия формированию межмолекулярных дисульфидных связей.
Для включения в белок слияния или композицию по изобретению подходит любой антиген HBV. Предпочтительный антиген HBV представляет собой коровый антиген HBV или его фрагмент или производное. Для облегчения тестирования антиген HBV необязательно можно модифицировать так, чтобы включать известные рестрицированные по MHC мышиные эпитопы CTL, например, такие как рестрицированные по H-2Kb мышиные эпитопы CTL. Пример такой модификации описан в примерах (например, в штамме HBV adw, остаток 97 представляет собой изолейцин, его замена на фенилаланин приводит к получению рестрицированного по H-2Kb эпитопа CTL). Кроме того, антиген можно модифицировать, так чтобы он включал эпитопы HLA человека более чем из одного подтипа HBV (например, adw, ayw, adr или ayr). Например, единичная замена треонина на валин в позиции 91 корового антигена HBV, показанного на фигуре 2, воспроизведет последовательность известного рестрицированного по HLA-A11 эпитопа CTL, обнаруженного и в подтипе HBV adw и в подтипе HBV adr. Другие производные корового антигена HBV включают укорочения. Такие укорочения включают в качестве неограничивающих примеров укорочения, при которых удаляется весь богатый аргинином C-концевой домен или его часть (аминокислоты HBc от 150 до 185). Подходящие укороченные фрагменты HBc включают фрагменты, состоящие только из первых N-концевых 149 аминокислот или из первых N-концевых 151 аминокислот HBc. В любом случае, подходящий фрагмент антигена HBc (или любого подходящего антигена HBV) в идеале могли бы включать один или несколько B-клеточных или T-клеточных эпитопов (один или несколько B-клеточных эпитопов или один или несколько T-клеточных эпитопов), предпочтительно один или несколько эпитопов CTL. Дополнительно, концевой цистеин корового антигена HBV можно удалить или заменить другой аминокислотой. Можно произвести другие модификации аминокислотной последовательности. Другой пример представляет собой замену якорного остатка известного рестрицированного по HLA эпитопа CTL для усиления активности связывания пептида с молекулой MHC класса I. Хотя данные модифицированные коровые антигены HBV подходят для включения в белки слияния, для получения иммунного ответа на HBV их также можно применять самостоятельно (факультативно сформулированных с адъювантом).
Дополнительные антигены HBV, подходящие для применения по настоящему изобретению, включают коровый антиген HBV, антиген HBV e (HBeAg), белок x (HBx), полипептид полимеразы и белки оболочки HBV S, M и L (Seeger and Mason, Microbiol. Mol. Biol. Rev. 64:51-68, 2000; Ganem and Schneider, Hepadnavirdae: The viruses and their replication. In: Knipe, DM and Howley, PM, eds. Fields Virology, Philadelphia: Lippincott Williams & Wilkins, 2001:2923-2969).
Как описано выше, антиген HBV, стрессовый белок или оба вместе могут содержать одну или несколько аминокислотных замен (например, консервативные замены аминокислот). Данные замены можно, хотя и не обязательно, произвести вместо одного или нескольких предсказанных одного или нескольких несущественных аминокислотных остатков. Термин "консервативная замена аминокислоты" представляет собой замену, в которой один аминокислотный остаток заменяют другим аминокислотным остатком, обладающим схожей боковой цепью. В данной области установлены семейства аминокислотных остатков, обладающие схожими боковыми цепями. Данные семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Независимо от того, рассчитывают ли произвести замену в предсказанном несущественном участке или вносят случайно во всю кодирующую последовательность антигена HBV или стрессового белка (например, посредством насыщающего мутагенеза) или ее часть, получающиеся в результате мутанты можно скринировать на антигенную и иммуностимулирующую активности, соответственно, для определения мутантов, сохраняющих биологическую активность. Вслед за мутагенезом кодируемые белки можно рекомбинантно экспрессировать и определить активность белков.
Антиген HBV можно подвергнуть слиянию или с N-концом или с C-концом стрессового белка, с линкером или промежуточной экзогенной последовательностью или без них. В альтернативном осуществлении два антигена HBV (встречающиеся в естественных условиях или вариант, как описано здесь) можно присоединить к стрессовому белку (один к N-концу, а другой к C-концу стрессового белка; оба к N-концу или оба к C-концу). Дополнительно, один или несколько антигенов HBV (опять, встречающиеся в естественных условиях или их фрагменты, или другие варианты, или из того же или другого белков HBV) можно присоединить или к N-концу или к C-концу стрессового белка или к обоим. Для специалистов в данной области ясно, что можно произвести дополнительные альтернативные расположения, если включить более чем один стрессовый белок.
Стрессовый белок и антиген HBV (или их комбинации, например стрессовый белок и два или несколько антигенов HBV) можно связать посредством химической конъюгации после того, как каждый транслируется и синтезируется индивидуально. Как отмечено выше, компоненты можно также объединять нековалентно (например, в смеси или более упорядоченной композиции). Композиции, содержащие стрессовый белок или его иммуностимуляторные фрагменты, нековалентно объединенные с антигеном HBV, можно получить, как описано в патентах США №№ 6048530, 6017544, 6017540, 6007821, 5985270, 5948646, 5935576, 5837251, 5830464 или 5750119. Также см. патенты США №№ 5997873, 5961979, 6030618, 6139841, 6156302, 6168793 и Международную публикацию № WO 97/06821.
Кроме того, в композицию можно включать более чем один тип вирусного антигена. Например, в дополнение к антигену HBV, композиции по изобретению могут включать (или кодировать; любые описанные здесь белки можно вводить непосредственно или посредством нуклеиновых кислот) антиген другого патогенного организма. Таким образом, в дополнение к антигену HBV, композиции могут включать (или кодировать) антиген гепатита C, антиген вируса простого герпеса (HSV), антиген вируса иммунодефицита человека (HIV), антиген цитомегаловируса (CMV), антиген вируса Эпштейна-Барр (EBV), антиген респираторно-синцитиального вируса (RSV), антиген вируса папилломы человека (HPV), антиген вируса герпеса или их комбинации. Такие же альтернативы, какие были описаны для осуществлений, в которых композиции содержали только HBV в качестве вирусного антигена (например, способ объединения со стрессовым белком, включение полноразмерных, фрагментированных белков или их вариантов; различное количество компонентов и их расположение), подходят для осуществлений, в которых в композиции присутствуют (или ею кодируются), по меньшей мере, один антиген HBV и, по меньшей мере, один другой вирусный антиген.
Неожиданно также обнаружили, что удаление С-концевого богатого аргинином домена из корового антигена приводит к получению полипептида, способного индуцировать иммунный ответ к коровому антигену, конкретно клеточный и/или иммунный ответ посредством CTL. Богатый аргинином домен корового антигена расположен между 150 и 183 аминокислотами корового антигена (Nassal, J. Virol. 66:4107-4116, 1992). Походящие фрагменты корового антигена включают, но не ограничиваются ими, фрагменты без всего данного региона или его части. Например, подходящие фрагменты корового антигена могут содержать первые 149 или 151 аминокислота (или менее чем 149 или 151 аминокислота).
Композиции по изобретению могут факультативно включать адъювант. Пример адъювантов, которые могут быть эффективны, включают в качестве неограничивающих примеров полный адъювант Фрейнда (FCA), неполный адъювант Фрейнда (FIA), SAF, мурамил дипептид (MDP), липополисахарид (LPS), липид A, монофосфорил липид A (MPL), токсин коклюша (PT), стеарилтирозин, γ-инулин, RIBI (содержащий три компонента, выделенных из бактерий), Quil-A, сапонины (QS21), квасцы (гидрохлорид алюминия, фосфат алюминия), фосфат кальция, MF-59, иммуностимуляторные комплексы (ISCOMS), олигонуклеотиды CpG и цитокины (Gupta and Siber, Vaccine 13:1263-1276, 1995; Singh and O'Hagan, Nature Biotechnology 17:1075-1081, 1999).
Подходящий фрагмент или производное антигена HBV в идеале должен содержать, по меньшей мере, один B-клеточный или T-клеточный эпитоп (или оба). В предпочтительном осуществлении, фрагмент или производное должны содержать, по меньшей мере, один эпитоп для CTL.
Изолированы, клонированы и охарактеризованы множество стрессовых белков из разнообразного множества организмов (Mizzen, Biotherapy 10:173-189, 1998). Любой иммуностимулирующий Hsp или его иммуностимулирующий фрагмент подходят для применения в полипептидах слияния и композициях. Например, среди главных детерминант, узнаваемых посредством иммунных ответов хозяев в ответ на инфекцию Mycobacterium tuberculosis и Mycobacterium leprae находятся Hsp70, Hsp60, Hsp20-30 (Hsp с низкой молекулярной массой) и Hsp10 (гомолог GroES). В дополнение обнаружено, что Hsp65 из Bacille Calmette Guerin (BCG), штамма Mycobacterium bovis представляет собой эффективный иммуностимулирующий агент, как описано в примере ниже.
Семейства стрессовых генов и белков для применения по настоящему изобретению хорошо известны в данной области и включают, например, Hsp100-200, Hsp100, Hsp90, Lon, Hsp70, Hsp60, TF55, Hsp40, FKBP, циклофилины, Hsp20-30, ClpP, GrpE, Hsp10, убиквитин, калнексин и дисульфидизомеразы белка. См., например, Macario, Cold Spring Harbor Laboratory Res. 25:59-70, 1995; Parsell et al., Rev. Genet. 27:437-496, 1993 и патент США № 5232833.
Примеры белков Hsp100-200 включают Grp170 (белок регулируемый глюкозой). Grp170 находится в просвете ER и в компартменте, предшествующем аппарату Гольджи, и может играть роль в укладке и сборке иммуноглобулинов.
Примеры белков Hsp100 включают Hsp100 млекопитающих, Hsp104 дрожжей и ClpA, ClpB, ClpC, ClpX и ClpY E. coli.
Примеры белков Hsp90 включают HtpG E. coli, Hsp83 и Hsc83 дрожжей и Hsp90alpha, Hsp90beta и Grp94 (малый gp96) человека. Hsp90 связывает группы белков, которые представляют собой типичные регуляторные молекулы, такие как рецепторы стероидных гормонов (например, рецепторы глюкокортикоидов, эстрогенов, прогестерона и тестостерона), транскрипционные факторы и протеинкиназы, которые играют роль в механизмах передачи сигналов. Белки Hsp90 также участвуют в формировании больших, часто встречающихся комплексов белков, включающих другие стрессовые белки.
Lon представляет собой тетрамерную АТФ-зависимую протеазу, которая разрушает несобственные белки E. coli.
Примеры белков Hsp70 включают Hsp72 и Hsc73 клеток млекопитающих, DnaK бактерий или микобактерий, таких как Mycobacterium leprae, Mycobacterium tuberculosis, and Mycobacterium bovis (такие как Bacille Calmette Guerin; указанный здесь выше как Hsp71), DnaK E. coli, дрожжей и других прокариот и BiP и Grp78. Hsp70 способен специфически связывать АТФ, а также развернутые полипептиды и пептиды и принимать участие в укладке и разворачивании, а также в сборке и разрушении комплексов белков.
Примеры белков Hsp60 включают Hsp65 микобактерий. Бактериальный Hsp60 также широко известен как GroEL. Hsp60 формирует большие гомоолигомерные комплексы и, кажется, играет ключевую роль в укладке белка. Гомологи Hsp60 присутствуют в митохондриях и хлоропластах эукариот.
Примеры белков TF55 включают Tcp1, TRiC и термосому. Данные белки обычно встречаются в цитоплазме эукариот и некоторых архебактерий и формируют многочленные кольца, способствующие укладке белка. Также они слабо гомологичны с Hsp60.
Примеры белков Hsp40 включают DnaJ прокариот, таких как E. coli и микобактерии и HSJ1, HDJ1 и Hsp40. В числе других активных веществ клетки Hsp40 играет роль в качестве молекулярного шаперона в укладке белка, обеспечении термоустойчивости и репликации ДНК.
Примеры FKBP включают FKBP12, FKBP13, FKBP25 и FKBP59, Fprl и Nepl. Обычно белки обладают пептидилпропилизомеразной активностью и взаимодействуют с иммуносупрессорами, такими как FK506 и рапамицин. Белки обычно обнаруживают в цитоплазме и эндоплазматическом ретикулуме.
Пример циклофилина включают циклофилины A, B и C. Белки обладают пептидилпропилизомеразной активностью и взаимодействуют с иммуносупрессором циклоспорином A.
Hsp20-30 также называют малый Hsp. Hsp20-30 обычно обнаруживают в больших гомоолигомерных комплексах или, возможно, гетероолигомерных комплексах. Организм или тип клеток может экспрессировать несколько различных типов малых Hsp. Hsp20-30 взаимодействует со структурами цитоскелета и может играть роль в регуляции полимеризации/деполимеризации актина. Hsp20-30 быстро фосфорилируется при стрессе или воздействии на покоящиеся клетки ростовых факторов. Гомологи Hsp20-30 включают альфа-кристаллин.
ClpP представляет собой протеазу E. coli, вовлеченную в деградацию аномальных белков. Гомологи ClpP обнаружены в хлоропластах. ClpP формирует гетероолигомерные комплексы с ClpA.
GrpE представляет собой белок E. coli массой примерно 20 кДа, который вовлечен в поиск поврежденных стрессом белков, а также деградацию поврежденных белков. GrpE играет роль в регуляции экспрессии стрессовых генов у E. coli.Примеры Hsp10 включают GroES and Cpn10. Hsp10 обнаружен у E. coli и в митохондриях и хлоропластах эукариотических клеток. Hsp10 формирует семичленное кольцо, ассоциированное с олигомерами Hsp60. Hsp10 также вовлечен в укладку белков.
Обнаружено, что убиквитин связывает белки в координации с протеолитическим удалением белков посредством АТФ-зависимой цитозольной протеазы.
В дополнение к полноразмерным стрессовым белкам, любые иммуностимулирующие фрагменты или производные могли бы являться пригодными по настоящему изобретению. Иммуностимулирующий фрагмент или производное (например, иммуностимулирующий фрагмент Hsp) представляет собой фрагмент или производное, которые способствуют иммунному ответу на антиген. Фрагмент или производное могут способствовать иммунному ответу рядом способов. Например, фрагмент может индуцировать иммунный ответ, который не мог бы возникнуть иначе, или усиливать иммунный ответ, который мог бы. Описан ряд иммуностимулирующих фрагментов. Подходящие фрагменты включают в качестве неограничивающих примеров (a) 161-370 аминокислоты Hsp70 микобактерий (конкретно, Hsp70 M. tuberculosis) (Huang et al., J. Exp. Med. 191:403-408; 2000, заявка на патент США 09/761534, поданная 16 января 2001 года); (b) АТФазный домен или связывающий пептиды домен Hsp70 микобактерий (конкретно, Hsp70 M. tuberculosis) (Young, заявка США № 09/025178, поданная 25 ноября 1997 года); (c) 280-385 аминокислоты мышиного Hsc70 (основного представителя семейства Hsc70) (Udono et al., Int. Immunol. 13:1233-1242, 2001); (d) 359-610 аминокислоты Hsp70 M. tuberculosis (Wand et al., Immunity 15:971-983, 2001); (e) соответствующие с (a) по (d) регионы гомологов Hsp70 других видов и (f) с 1 по 200 аминокислоты Hsp65 микобактерий (конкретно, Hsp65 M. bovis) (Chu et al., заявка США № 09/613303, поданная 10 июля 2000 года).
Стрессовые белки, пригодные по настоящему изобретению, можно получить из любого подходящего организма, включая в качестве неограниченных примеров грамположительные бактерии, грамотрицательные бактерии, энтеробактерии (например, E. coli), микобактерии (конкретно, M. leprae, M. tuberculosis, M. vaccae, M. smegmatis и M. bovis), дрожжи, дрозофилу и позвоночных (например, птиц, таких как цыплята, или млекопитающих, таких как крысы, мыши или приматы, включая людей).
Для получения терапевтической (например, иммунотерапевтической) композиции, содержащей белок слияния, полипептид можно получать рекомбинантным способом в бактериях, дрожжах, растениях или клетках растений или животных или клетках животных. Например, полипептиды слияния по изобретению можно получать посредством трансформации (трансфекции, трансдукции или инфекции) клеток-хозяев фрагментом ДНК, кодирующим полипептид, в подходящем экспрессирующем носителе. Подходящие экспрессирующие носители включают плазмиды, вирусные частицы и фаги. Для клеток насекомых подходят бакуловирусные экспрессирующие векторы. Целый экспрессирующий носитель или его часть может интегрироваться в геном клетки-хозяина. В некоторых обстоятельствах это желательно для использования индуцибельного экспрессирующего вектора, например, для LACSWITCH® Inducible Expression System (Stratagene; La Jolla, CA).
Специалистам в области молекулярной биологии понятно, что можно применять любую из обширного множества экспрессирующих систем для доставки рекомбинантных полипептидов слияния. Определенная клетка-хозяин и вектор не критичны для изобретения.
Белки и полипептиды можно получать с помощью клеток растений. Для клеток растений подходят вирусные экспрессирующие векторы (например, вирус мозаики цветной капусты и вирус табачной мозаики) и плазмидные экспрессирующие векторы (например, плазмида Ti). Такие клетки и векторы доступны из широкого диапазона источников (например, the American Type Culture Collection, Manassas, VA; также см., например, Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, New York, 1994). Способы трансформации и трансфекции и выбор экспрессирующего носителя зависит от избранной системы-хозяина. Способы трансформации и трансфекции ранее описаны, например, у Ausubel et al. Экспрессирующие носители можно выбрать из экспрессирующих носителей, описанных, например, в Pouwels et al., Cloning Vectors: A Laboratory Manual, 1985, Supp. 1987. Клетки-хозяева, содержащие экспрессирующий носитель, можно культивировать в обычной питательной среде, адаптированной как необходимо для активации или репрессии выбранных генов, отбора трансформированных клеток или амплификации выбранных генов.
Когда уместно и выгодно, нуклеиновая кислота, кодирующая полипептид слияния, может включать сигнальную последовательность для выделения полипептида слияния, например, для облегчения выделения полипептида из культуры клеток. Для эффективной трансляции вставленных последовательностей нуклеиновой кислоты также могут являться необходимыми специфические сигналы инициации. Данные сигналы включают инициирующий кодон ATG и расположенные рядом последовательности. В некоторых случаях необходимо предоставить внешние сигналы контроля трансляции, включая, возможно, инициирующий кодон ATG. Более того, для обеспечения трансляции целой вставки, инициирующий кодон должен находиться в фазе с рамкой считывания желательной кодирующей последовательности. Данные внешние сигналы контроля трансляции и инициирующие кодоны могут быть различного происхождения: и естественного, и синтетического. Эффективность экспрессии можно увеличить посредством включения соответствующих усиливающих транскрипцию или трансляцию элементов (например, которые описаны в Bittner et al., Methods in Enzymol. 153:516, 1987). Дополнительно генную последовательность можно модифицировать для оптимального использования кодонов в соответствующей экспрессирующей системе или, альтернативно, экспрессирующего хозяина можно модифицировать для экспрессии специфических молекул тРНК для содействия экспрессии желательного гена.
Могло бы оказаться полезным, если бы полипептиды слияния растворялись при нормальных физиологических условиях. Также в изобретении представлены способы применения белков слияния (или других конфигураций белков, включая ковалентные и нековалентные комплексы и микстуры), в которых стрессовый белок (или его иммуностимулирующий фрагмент) и антиген HBV подвергнут слиянию (или иначе объединены) с не имеющим к ним отношения третьим белком или полипептидом для создания, по меньшей мере, белка, состоящего из трех частей, или смеси белков. Третий белок может облегчить очистку, обнаружение или растворение белка слияния или другого комплекса или он может обеспечивать некоторые другие функции. Например, для создания белков слияния с lacZ, можно применять экспрессирующий вектор pUR278 (Ruther et al., EMBO J. 2:1791, 1983). Для экспрессии чужеродных полипептидов как белков слияния, содержащих глутатион-S-трансферазу (GST), можно применять векторы pGEX. В общих чертах, такие белки слияния растворимы и их можно легко очистить из лизированных клеток посредством адсорбции на глутатион-агарозных гранулах, с последующей элюцией в присутствии свободного глутатиона. Векторы pGEX сконструированы так, чтобы включать участки расщепления протеазой тромбином или фактором Xa так, чтобы клонированный целевой генный продукт мог высвобождаться от части GST.
Белок слияния или ковалентный комплекс можно очистить с применением антитела, которое специфически связывает часть белка слияния или комплекса. Альтернативно, для очистки можно использовать другие свойства включенного белка (например, связывание металла). Например, система, описанная у Janknecht et al. (Proc. Natl. Acad. Sci. USA. 88:8972, 1981), позволяет быструю очистку неденатурированных белков, экспрессирующихся в линиях клеток человека. В данной системе, интересующий ген субклонирован в рекомбинантную плазмиду коровьей оспы так, чтобы открытая рамка считывания гена при трансляции подвергалась слиянию с аминоконцевой меткой, состоящей из шести гистидиновых остатков. Экстракты клеток, зараженных рекомбинантным вирусом коровьей оспы, помещали на колонки с Ni2+ нитрилацетатагарозой, и меченные гистидином белки селективно элюировали буферами, содержащими имидазол. Такую же процедуру можно применять для бактериальных культур.
Альтернативно, третий белок может представлять собой иммуноглобулиновый Fc-домен. Такой белок слияния можно легко выделить с применением аффинной колонки.
Полипептиды слияния, конкретно содержащие короткие антигенные фрагменты, можно получать посредством химического синтеза (например, с помощью способов, описанных в Solid Phase Peptide Synthesis, 2nd ed., 1984 The Pierce Chemical Co., Rockford, IL).
После выделения полипептид слияния можно, если необходимо, очистить и/или концентрировать при условии, что дальнейшая обработка не уменьшит его способности индуцировать (например, посредством индукции или усиления) иммунный ответ, достаточный для выполнения способов по изобретению. В данной области известно множество способов очистки и концентрации (см., например, Fisher, Laboratory Techniques In Biochemistry And Molecular Biology, Work and Burdon, eds., Elsevier, 1980), включающих ультрацентрифугирование и/или преципитацию (например, посредством сульфата аммония), микрофильтрацию (например, через 0,45 мкм фильтры из ацетата целлюлозы), ультрафильтрацию (например, с применением сортирующей мембраны и рециркулирующей фильтрации), гель-фильтрацию (например, колонки, заполненные сефарозой CL-6B, CL-4B, CL-2B, 6B, 4B или 2B, сефакрилом S-400 или S-300, Superose 6 или Ultrogel A2, A4 или A6; все доступные от Pharmacia Corp.), жидкостную хроматографию для ускоренного разделения белков (FPLC) и высокоэффективную жидкостную хроматографию (HPLC).
Полипептиды в композициях по изобретению могут включать антигенные или иммуностимулирующие детерминанты или целые белки более чем одного стрессового белка и/или более чем одного белка HBV. Факультативно, белки могут включать другие последовательности, к которым необходим иммунный ответ.
Изобретение включает иммунотерапевтические композиции, содержащие, по меньшей мере, один полипептид слияния, как описано здесь, и, факультативно, фармацевтически допустимый носитель, такой как разбавитель, например солевой раствор, фосфатно-солевой буфер или раствор гидрокарбоната (например, 0,24 М NaHCO3). Носители, применяемые в композиции, выбирают на основе способа и пути введения и стандартной фармацевтической практики. Подходящие фармацевтические носители и разбавители, а также необходимые фармацевтические добавки и компоненты для их использования описаны в Remington's Pharmaceutical Sciences. Адъювант, например холерный токсин, термолабильный энтеротоксин Escherichia coli (LT), липосома или иммуностимулирующий комплекс (1SCOM), также можно включить в иммунотерапевтические композиции.
Композиции можно составлять в виде раствора (подходит для внутримышечного, интрадермального или внутривенного введения), суспензии, суппозитория, таблетки, гранул, порошков, капсулы, мази или крема. Для получения данных композиций можно включать один или несколько фармацевтических носителей. Примеры фармацевтически приемлемых носителей включают растворы (например, вода или физиологический солевой раствор), растворители (например, этанол, полисорбаты или Cremophor EL®), средства для создания изотоничности, консерванты, антиоксиданты, наполнители (например, лактоза, крахмал, кристаллическая целлюлоза, маннит, мальтоза, трегалоза, гидрофосфат кальция, легкий ангидрид кремниевой кислоты или карбонат кальция), связующие вещества (например, крахмал, поливинилпирролидон, гидроксипропилцеллюлоза, этилцеллюлоза, карбоксиметилцеллюлоза или гуммиарабик), смазочные материалы (например, стеарат магния, тальк или отвержденные масла) или стабилизаторы (например, лактоза, маннит, мальтоза, полисорбаты, макрогели или касторовое масло, отвержденное полиоксиэтиленом). Если необходимо добавляют глицерин, диметилацетамид, лактат натрия, сурфактант, гидроксид натрия, этилендиамин, этаноламин, бикарбонат натрия, аргинин, меглумин или трисаминометан. При необходимости замедленного высвобождения композиции в качестве уплотняющего матрикса можно применять биодеградируемые полимеры, такие как поли-D,L-лактид-когликолид или полигликолид (см., например, патенты США №№ 5417986, 4675381 и 4450150). Как замечено выше, с данными компонентами можно формировать фармацевтические препараты, такие как растворы, таблетки, гранулы или капсулы. Если композиции вводят орально, можно добавлять вкусовые добавки и красители.
Иммунотерапевтические композиции можно вводить подходящим путем, например внутривенно, внутриартериально, местно, посредством инъекции (например, интраперитонеально, интраплеврально, подкожно, внутримышечно), орально, интрадермально, под язык, интраэпидермально, интраназально (например, посредством ингаляции), интрапульмонально или ректально.
Количество вводимой иммунотерапевтической композиции должно зависеть, например, от конкретной композиции стрессового белка/антигена, от того введен ли совместно с композицией адъювант, типа совместно введенного адъюванта, способа и частоты введения и необходимого эффекта (например, предохранение или лечение), что может быть определено специалистом в данной области. В общих чертах, иммунотерапевтические композиции вводят в количествах в диапазоне между 1 мкг и 100 мг на дозу взрослому человеку. Предпочтительно вводят между 50 и 10000 мкг (например, примерно от 100 до 5000 мкг, в частности примерно 500, 1000, 1500 или 2000 мкг) белка слияния. Если совместно с иммунотерапевтическим средством вводят адъюванты, как правило, можно использовать количества в диапазоне между 1 нг и 100 мг на дозу взрослому человеку. При необходимости, что может быть определено специалистом в данной области, введение повторяют. Например, за начальной дозой может следовать одна или более поддерживающих доз через недельные или месячные интервалы. Поддерживающую дозу можно давать с 3 по 12 неделю после первой иммунизации, а вторую поддерживающую дозу можно давать с 3 по 12 неделю после первой поддерживающей дозы, применяя ту же или другую лекарственную форму. Для тестирования иммунного ответа, индуцированного иммунотерапевтическим средством против антигена HBV, включенного в белок слияния у индивида можно получать сыворотки, PBL или PBMC. Способы анализа антител или цитотоксических T-клеток против специфического антигена хорошо известны в данной области. Если необходимо, можно давать дополнительные поддерживающие дозы. Посредством изменения количества полипептида слияния в композиции можно оптимизировать протокол иммунизации для индукции максимального иммунного ответа.
Конечно, полипептиды (самостоятельно или как часть белка слияния) можно доставлять посредством введения нуклеиновой кислоты, такой как вирусный вектор (например, ретровирусный или аденовирусный вектор).
Иммунотерапевтическое средство по изобретению можно также вводить в комбинации с одним или несколькими соединениями или композициями, обладающими активностью против HBV (средство против HBV). Например, пациента вначале можно лечить средством против HBV для уменьшения тяжести инфекции HBV (что измеряют, например, по уменьшению или прекращению циркуляции антигена HBe (индикатор репликации HBV и виремии с высоким титром), появлению антител против HBe, уменьшению или исчезновению ДНК HBV в сыворотке или уменьшению уровней аланинаминотрансферазы (ALT)). Когда достигается подходящее уменьшение, пациенту можно вводить иммунотерапевтическое средство по изобретению. Альтернативно, средство против HBV и иммунотерапевтическое средство можно вводить в основном в одно и то же время (учитывая, что средство против вируса и иммунотерапевтическое средство могут обладать различными путями введения), или иммунотерапевтическое средство можно ввести первым, с последующим лечением средством против вируса. Антивирусные соединения или композиции, подходящие для применения в таких комбинациях с иммунотерапевтическим средством включают в качестве неограничивающих примеров интерферон-α2b (Intron A, Schering Plough), пегилированный интерферон-α2b и нуклеозидные аналоги, такие как ламивудин [(-)-β-L-3'-тиа-2',3'-дидезоксицитидин или 3TC] (Epivir-HBV, Glaxo Welcome) и рибавирин (Rebetron™, ICN Pharmaceuticals). Существует ряд дополнительных экспериментальных возможно подходящих соединений, и они включают: гемтрицитабин (2',3'-дидезокси-5'-фтор-3'-тиацитидин, FTC, ковирацил, Triangle Pharmaceuticals), клевудин (2'-фтор-5-метил-β -L-арабинофуранозилурацил, L-FMAU, Triangle), адефовир (9-2-фосфонилметил)аденин, PMEA, Gilead Sciences), энтекавир (Bristol-Myers Squibb), (-)-бета-D-2,6-диаминопурин диоксолан (DAPD), β -L-2', 3'-дидезокси-5-фторцитидин (β-L-FddC), β-L-2',3'-дидегидро-дидезокси-5-фторцитидин (β-L-Fd4C) и фамцикловир.
Полагают, что специалист в данной области без дополнительного совершенствования, базируясь на приведенном выше описании и примерах ниже, может использовать настоящее изобретение в его наиболее полном объеме. Следующий пример следует интерпретировать только в качестве иллюстрации того, как специалист в данной области может выделить и использовать полипептид слияния и, в любом случае, не ограничивает оставшееся описание. Все публикации, цитированные в данном описании, включены сюда посредством ссылки.
Примеры
Пример 1
Конструирование белков слияния корового антигена HBV и Hsp
Основные способы и процедуры получения белков слияния можно найти в WO 94/29459, WO 98/23735, WO 99/07860; там же приведены ссылки.
Ген, кодирующий подтип HBV adw, получали из плазмиды pBR/HBV (приобретена в ATCC, ATCC 45020). Последовательность нуклеотидов, кодирующая полноразмерный белок, приведена на Фигуре 1; последовательность аминокислот полноразмерного белка показана на Фигуре 2.
Ген, кодирующий полноразмерный белок Hsp65 из M. bovis BCG, получали из плазмиды pET65 (см. WO 99/07860).
Для получения белка с использованием описанных исходных материалов и соответствующих праймеров подготовили и клонировали в pET28a (Novagen) следующие конструкции:
1.1 hisHepCorT(149/87S97F): фрагмент ДНК, кодирующий укороченный коровый антиген HBV (аминокислоты с 1 по 149). Конструкция содержит также последовательность из 20 N-концевых аминокислот, содержащих гистидиновую метку. Данная конструкция содержит две аминокислотные замены по сравнению с белком дикого типа: аминокислота в положении 87 заменена с аспарагина на серин, а аминокислота в положении 97 заменена с изолейцина на фенилаланин. Данные замены проводили, чтобы воспроизвести известные эпитопы CTL мыши. Также к C-концу укороченного белка добавили экзогенный аспарагиновый остаток. Последовательность ДНК показана на фигуре 3, кодируемая последовательность аминокислот показана на фигуре 4.
1.2 hisHepCor(97F)Hsp65: ДНК, кодирующая белок слияния, включающий аминокислоты полноразмерного корового белка HBV, слитые с N-концом Hsp65 из M. bovis BCG. Также конструкция содержит последовательность из 20 N-концевых аминокислот, содержащих гистидиновую метку и замену аминокислоты в положении 97 с изолейцина на фенилаланин. Между коровым белком HBV и белком Hsp65 вставили два дополнительных аминокислотных остатка: аспарагин и валин. Последовательность ДНК показана на фигуре 5, кодируемая последовательность аминокислот показана на фигуре 6.
1.3 hisHepCorT(149/87S97F)Hsp65: ДНК, кодирующая белок слияния, содержащий с 1 по 149 аминокислоты корового белка HBV, слитые с N-концом Hsp65 из M. bovis BCG. Конструкция также содержит последовательность из 20 N-концевых аминокислот, содержащих гистидиновую метку, и содержит дополнительный аспарагиновый остаток между коровым белком HBV и белком Hsp65. Последовательность ДНК показана на фигуре 7, кодируемая последовательность аминокислот показана на фигуре 8.
1.4 HepCorT(151/97F)Hsp65: ДНК, кодирующая белок слияния, содержащий с 1 по 151 аминокислоты корового белка HBV, слитые с N-концом Hsp65 из M. bovis BCG (без вставки дополнительных аминокислот между двумя последовательностями). Последовательность корового белка HBV модифицировали следующим образом: в отличие от последовательности дикого типа изолейцин в положении 97 заменяли на фенилаланин. Последовательность ДНК показана на фигуре 9, кодируемая последовательность аминокислот показана на фигуре 10. 1.5 HepCor(97F)Hsp65: ДНК, кодирующая белок слияния, содержащий полноразмерный коровый белок HBV, слитый с N-концом Hsp65 из M. bovis BCG (без вставки дополнительных аминокислот между двумя последовательностями). Как и в предыдущей конструкции, аминокислоту в положении 97 корового белка HBV заменяли с изолейцина на фенилаланин. Последовательность ДНК показана на фигуре 11, кодируемая последовательность аминокислот показана на фигуре 12.
1.6 HepCorT(151/97F). ДНК, кодирующая укороченный коровый антиген HBV (аминокислоты с 1 по 151). Помимо того, что белок adw в данной конструкции укорочен до 151 аминокислоты, в нем присутствует одна замена аминокислоты по сравнению с диким типом, представленным на фигуре 2: аминокислоту в положении 97 заменили с изолейцина на фенилаланин, чтобы воспроизвести известный эпитоп CTL мыши.
1.7 HepCor(97F). ДНК, кодирующая полноразмерный коровый антиген HBV. В данной конструкции присутствует одна аминокислотная замена по сравнению с белком adw дикого типа, представленным на фигуре 2: аминокислоту в положении 97 заменили с изолейцина на фенилаланин, чтобы воспроизвести известный эпитоп CTL мыши.
Дополнительные конструкции можно построить с использованием других стрессовых белков, таких как Hsp70 Mycobacterium tuberculosis.
Молекулу HBc в некоторых случаях модифицировали введением одной или более аминокислотных замен в продукт гена HBc, чтобы воспроизвести известные специфичные для мыши эпитопы CTL. Одну из аминокислотных замен вводили в положении 87, где аспарагин заменяли на серин. Эта замена создавала эпитоп CTL мыши (87SYVNTNMGL95), рестрицированный по H-2Kd (HBc.Kd) (Kuhrober, et al., Int. Immunol. 9:1203-1212, 1997). Вторую аминокислотную замену вводили в положении 97, где изолейцин заменяли на фенилаланин. Эта замена создавала мышиный CTL эпитоп (93MGLKFRQLl00), рестрицированный по H-2Kb (HBc.Kb) (Kuhober et al., J. Immunol. 156:3687-3695, 1996). Фрагмент ДНК, кодирующий 20 аминокислот, содержащих шесть гистидиновых остатков (His-метка), присоединяли к N-концу некоторых конструкций для облегчения очистки. Белки слияния можно легко получить без данных модификаций.
Пример 2
Очистка белка
Использованы следующие сокращения: BCG - Mycobacterium bovis var. Bacille Calmette-Guerin; CV - объем колонки; ET - эндотоксин; EU - эндотоксиновые единицы; IB - тельце или тельца включения; MT - Mycobacterium tuberculosis; и PBS - фосфатно-солевой буфер.
Все конструкции растили в 15 л ферментаторе (Braun ED). Биомассу бактериальных клеток до применения для выделения белка хранили при -70°C.
2.1 Очистка hisHepCorT(149/87S97F)
Лизис клеток: примерно 277 г замороженной клеточной биомассы смешивали с 800 мл лизирующего буфера (30 мМ Tris, 10 мМ 2-меркаптоэтанол, 2 мМ EDTA, 0,2 мМ PMSF, pH 8,5). Затем добавляли лизоцим до 200 мкг/мл и 50 мкл BenzonaseTM. Клетки замораживали в течение ночи при -70°C, затем оттаивали в течение часа, разливали аликвоты в 50 мл центрифужные пробирки, хранили на льду и разрушали ультразвуком посредством BRANSON Sonifier II, оснащенного наконечником размером 0,5 дюйма, в режиме 9, 6 раз по 45 сек.
Клеточные обломки и IB отделяли от супернатанта центрифугированием при 17000 об/мин (Beckman, Avanti J-30, ротор JA30.50) 20 мин при 4°C. Осадок в каждой пробирке ресуспендировали в 25 мл буфера для промывки (30 мМ Tris, 10 мМ 2-меркаптоэтанол, 2% (об/об) Тритон X-100, pH 8,5). После центрифугирования при 22000 об/мин 20 мин при 4°C супернатант удаляли и добавляли 20 мл 8 М мочевины, 30 мМ Tris, 10 мМ 2-меркаптоэтанол, 1 мМ EDTA, 0,2 мМ PMSF, pH 8,5 и инкубировали в течение ночи при 4°C. Супернатант с растворенными IB собирали посредством центрифугирования при 22000 об/мин 30 мин затем разделяли на две порции и замораживали при -70°C.
Ni-хелатная хроматография: 250 мл хелатирующей сефарозы для быстрого протока (Amersham-Pharmacia) набивали в колонку XK50/30 (Amersham-Pharmacia). Смолу промывали по 3 CV каждого из 50 мМ ЭДТА, воды, качества Milli-QTM, 0,5 М NaOH, 2 М NaCl, воды, качества Milli-QTM, 70% (об/об) этанола и воды, качества Milli-QTM. Затем смолу заряжали 200 мМ NiSO4, промывали водой, качества Milli-QTM и уравновешивали 5 CV исходного буфера (6 М гуанидин-HCl, 30 мМ Tris, 2 мМ 2-меркаптоэтанол, 20 мМ имидазол, pH 8,5).
Одну часть образца наносили на колонку со скоростью 5 мл/мин, затем промывали исходным буфером со скоростью 10 мл/мин, пока измеряемое при 280 нм фоновое поглощение не достигало базового уровня. Для удаления ET колонку промывали 5 CV 6 М гуанидина-HCl, 30 мМ Tris, 2 мМ 2-меркаптоэтанола, 20 мМ имидазола, 2% (об/об) Тритона X-100, pH 8,5. Потом колонку промывали 6 М мочевины, 30 мМ Tris, 2 мМ 2-меркаптоэтанола, 20 мМ имидазола, pH 8,5, затем белок элюировали 5 CV градиента от 0 до 500 мМ имидазола в 6 М мочевины, 30 мМ Tris, 2 мМ 2-меркаптоэтанола, 20 мМ имидазола, pH 8,5, со скоростью 5 мл/мин.
Данную стадию хроматографии повторяли для второй части образца, и фракции, содержащие относительно чистый белок, объединяли.
Анионообменная хроматография с использованием Source 15Q: 60 мл смолы Source 15Q (Amersham-Pharmacia) набивали в колонку XK26/40 (Amersham-Pharmacia). Смолу промывали со скоростью 5 мл/мин 2 CV воды, качества Milli-QTM, 3 CV 1 М NaOH, 3 CV воды, качества Milli-QTM, 2 CV NaCl, 2 CV воды, качества Milli-QTM, 2 CV смеси 10% (об/об) уксусной кислоты и 40% (об/об) изопропанола, 2 CV воды, качества Milli-QTM, затем уравновешивали 3 CV исходного буфера (6 М мочевина, 30 мМ Tris, 10 мМ 2-меркаптоэтанол, 1 мМ ЭДТА, pH 8, 5).
Объединенный образец, полученный на предыдущей стадии, наносили на колонку со скоростью 0,5 мл/мин, затем промывали исходным буфером со скоростью 6 мл/мин, пока измеряемое при 280 нм фоновое поглощение не достигало базового уровня. Затем колонку промывали 10 CV 2% (об/об) Тритона X-100 в исходном буфере. Белок элюировали 11 CV от 0 до 600 мМ NaCl в исходном буфере.
Данную стадию хроматографии повторяли, и фракции, содержащие относительно чистый белок, объединяли.
Катионообменная хроматография с использованием Source 15S: 50 мл смолы Source 15S (Amersham-Pharmacia) набивали в колонку XK26/40 (Amersham-Pharmacia). Смолу промывали со скоростью 5 мл/мин 2 CV 1 М NaOH, 3 CV воды, качества Milli-QTM, 2 CV NaCl, 2 CV воды, качества Milli-QTM, 2 CV смеси 10% (об/об) уксусной кислоты и 40% (об/об) изопропанола, 2 CV воды, качества Milli-QTM, затем уравновешивали 3 CV исходного буфера (6 М мочевины, 23 мМ ацетата натрия, 10 мМ 2-меркаптоэтанола, 1 мМ ЭДТА, pH 4,8).
Объединенный образец, полученный на предыдущей стадии, наносили на колонку со скоростью 3 мл/мин, затем промывали исходным буфером со скоростью 3 мл/мин, пока измеряемое при 280 нм фоновое поглощение не достигало базового уровня. Белок частично элюировали 15 CV от 0 до 1000 мМ NaCl в исходном буфере, со скоростью 6 мл/мин, для напоминания с 6 М гуанидина-HCl, 30 мМ Tris, 10 мМ 2-меркаптоэтанола, 1 мМ ЭДТА, pH 8,5.
Диализ и приготовление образцов: Впоследствии проводили диализ объединенного образца против следующих растворов, в данном порядке:
1. 4 л 6 М мочевины, 30 мМ Tris-HCl pH 8,5, 10 мМ 2 меркаптоэтанола, 1 мМ ЭДТА, 0,8 М аргинина, в течение ночи при 4°C.
2. 4 л 3 М мочевины, 30 мМ Tris-HCI pH 8,5, 2 мМ 2 меркаптоэтанола, 1 мМ ЭДТА, 25% (масс/об) сахарозы, в течение ночи при 4°C. 3. 2 л 30 мМ Tris-HCl pH 8,5, 4,5 мМ восстановленного глутатиона, 0,5 мМ окисленного глутатиона, 0,8 М аргинина, 25% (масс/об) сахарозы, в течение ночи при 4°C.
4. 2 л 10 мМ PBS pH 7,4, 4,5 мМ восстановленного глутатиона, 0,5 мМ окисленного глутатиона, 25% (масс/об) сахарозы, в течение ночи при 4°C.
5. Повторение стадии 4.
Полагая, что каждую стадию диализа заканчивали при достижении равновесия, конечные концентрации ингредиентов составляли: 10 мМ PBS, 4,5 мМ восстановленного глутатиона, 0,5 мМ окисленного глутатиона, аргинина ≤48 мМ, мочевины ≤25 мМ, 730 мМ или 25% (масс/об) сахарозы.
2.2 Очистка hisHepCorT(149/87S97F)Hsp65
Лизис клеток: 79 г замороженной клеточной биомассы смешивали с 1000 мл лизирующего буфера (30 мМ Tris, 10 мМ 2-меркаптоэтанол, pH 7,5). Лизат замораживали в течение ночи при -70°C. Затем лизат размораживали, добавляли лизоцим до 200 мкг/мл и инкубировали клетки в течение часа. Добавляли смесь нескольких ингибиторов протеаз (по 40 мг/мл апротинина, лейпептина и пепстатина) и 15 мкл Benzonase™. Лизат подвергали воздействию ультразвука в 250 мл кювете Rosette Cooling Cell (Fisher) с помощью BRANSON Sonifier II, оснащенного наконечником 0,5 дюйма, в режиме 7, 6 раз по 60 сек.
Клеточные осколки и IB отделяли от супернатанта центрифугированием при 23000 об/мин (Beckman, Avanti J-30, ротор JA30.50) в течение 20 мин при 4°C. К супернатанту добавляли гуанидин-HCl до концентрации 6 М, доводя объем до 1400 мл. Образец разделяли на одну фракцию объемом 400 мл и две фракции объемом 500 мл.
Ni-хелатная хроматография: 187 мл хелатирующей сефарозы для быстрого протока (Amersham-Pharmacia) набивали в колонку XK50/30 (Amersham-Pharmacia). Смолу, предварительно регенерированную по рекомендациям производителя, уравновешивали 5 CV исходного буфера (6 М гуанидин-HCl, 50 мМ имидазол, 30 мМ Tris, 1 мМ 2-меркаптоэтанол, pH 7,5).
Образец объемом 400 мл наносили на колонку со скоростью 10 мл/мин, затем промывали исходным буфером, пока измеряемое при 280 нм фоновое поглощение не достигало базового уровня. Для удаления ET колонку промывали 5 CV 6 М гуанидина-HCl, 30 мМ Tris, 1 мМ 2-меркаптоэтанола, 2% (об/об) Тритона X-100, pH 7,5. Затем колонку промывали 8 М мочевиной, 30 мМ Tris, pH 8,5. Затем белок элюировали в градиенте от 0 до 500 мМ имидазола в 8 М мочевине, 30 мМ Tris, 1 мМ 2-меркаптоэтаноле, pH 7, 5.
Эту стадию хроматографии повторяли, используя две фракции по 500 мл из предыдущей стадии. Фракции, собранные после всех трех элюций, объединяли.
Анионообменная хроматография с использованием Source 30Q: 167 мл смолы Source 15Q (Amersham-Pharmacia) набивали в колонку XK50/30 (Amersham-Pharmacia). Смолу регенерировали 5 CV 2 М NaCl, 1 М NaOH, воды, качества Milli-QTM, 40% (об/об) изопропанола, 10% (об/об) уксусной кислоты, воды, качества Milli-QTM. Затем колонку уравновешивали 3 CV исходного буфера (6 М мочевины, 30 мМ Tris, 10 мМ 2-меркаптоэтанола, pH 7,5).
Объединенные фракции, полученные на предыдущей стадии, наносили на колонку со скоростью 10 мл/мин, затем промывали исходным буфером, пока измеряемое при 214 нм, 254 нм и 280 нм фоновое поглощение не достигало базового уровня. Белок элюировали в градиенте от 0 до 500 мМ NaCl в исходном буфере, со скоростью 6 мл/мин. Фракции, содержащие искомый белок, объединяли.
Хроматография с использованием керамического гидроксиапатита: 53 мл керамического гидроксиапатита набивали в колонку XK26/40 (Amersham-Pharmacia), регенерировали 3 CV 1 М NaOH и 0,5 М фосфата натрия, pH 6,8. Затем колонку уравновешивали 6М мочевины, 20 мМ фосфата натрия, pH 6,8.
Объединенные после предыдущей колонки фракции наносили со скоростью 5 мл/мин, затем промывали 6 М мочевиной, 20 мМ фосфатом натрия, pH 6,8, пока измеряемое при 214 нм, 254 нм и 280 нм фоновое поглощение не достигало базового уровня. Примеси связывались на колонке, в то время как hisHepCorT(149/87S97F)Hsp65 оставался в проточной фазе.
Диализ и приготовление образцов: Проток после предыдущей хроматографии объединяли (250 мл) и проводили диализ против следующих растворов, в данном порядке:
1. 4 л 3 М гуанидина-HCl, 10 мМ фосфата натрия, 0,8 М аргинина, 4,5 мМ восстановленного глутатиона, 0,5 мМ окисленного глутатиона, 25% (масс/об) сахарозы, в течение ночи при 4°C.
2. 4 л 10 мМ фосфата натрия, 4, 5 мМ восстановленного глутатиона, 0,5 мМ окисленного глутатиона, 25% (масс/об) сахарозы, в течение ночи при 4°C.
3. Повторяли предыдущую стадию. Полагая, что каждую стадию диализа заканчивали при достижении равновесия, конечные концентрации ингредиентов составляли: 10 мМ фосфата натрия, 1,85 мМ мочевины, 4,5 мМ восстановленного глутатиона, 0,5 мМ окисленного глутатиона, 730 мМ или 25% (масс/об) сахарозы.
Гель-фильтрационная хроматография: колонку для гель-фильтрации HiLoad 26/60 Superdex 200 (Amersham-Pharmacia), предварительно набитую производителем, регенерировали 1 М NaOH, затем уравновешивали 10 мМ фосфата натрия, 4,5 мМ восстановленного глутатиона, 0,5 мМ окисленного глутатиона, 25% (масс/об) сахароза, pH 7.4.
Образец после диализа разделяли на три порции (30 мл, 20 мл, 20 мл), по отдельности пропускали через колонку в буфере для уравновешивания со скоростью 1,5 или 2 мл/мин, и объединяли фракции, содержащие белок.
2.3 Очистка HepCorT(151/97F)Hsp65
Лизис клеток: 500 г замороженной клеточной биомассы смешивали с 2500 мл лизирующего буфера (30 мМ Tris, 10 мМ 2-меркаптоэтанол, 2 мМ ЭДТА, 0, 1 мМ PMSF, 10 мг/мл апротинин, 10 мг/мл лейпептин, 5 мМ п-аминобензамидин, 0,2 мг/мл лизоцим, pH 7,5), затем, по меньшей мере, два часа замораживали при -70°C.
Замороженную суспензию клеток оттаивали при 37°C, хранили на льду и подвергали обработке ультразвуком (Branson Sonifier 450, наконечник 3/4 дюйма) 4 раза по 1 мин. Лизат центрифугировали при 15000g, растворимую фракцию осветляли при 64000g, и собирали растворенный образец. После добавления 6 М мочевины к растворимой фракции, ее разделяли на три равные порции.
Хроматография с использованием Source 30Q: Колонку XK50/30 (Amersham-Pharmacia), содержащую 190 мл смолы Source 30Q (Amersham-Pharmacia), регенерировали, затем уравновешивали 3 CV исходного буфера (6 М мочевина, 30 мМ Tris, 10 мМ 2-меркаптоэтанол, 1 мМ ЭДТА, pH 7,5).
Одну порцию материала наносили на колонку. Смолу промывали исходным буфером, пока измеряемое при 214 нм, 254 нм и 280 нм фоновое поглощение не достигало базового уровня, затем белок элюировали 5 CV линейного градиента от 0 до 500 мМ NaCl в исходном буфере. Фракции, содержащие HepCor65T(151/97F), объединяли.
Стадию хроматографии повторяли для двух других порций материала. Объемы всех трех порций объединяли и подвергали диализу против 6 М мочевины, 25 мМ ацетата натрия, 10 мМ 2-меркаптоэтанола, 1 мМ ЭДТА, pH 5,5. Затем образец разделяли на две порции.
Хроматография с использованием Source 15S при pH 5,5: Колонку XK26/40 (Amersham-Pharmacia), содержащую 50 мл смолы Source 15S (Amersham-Pharmacia), регенерировали, затем уравновешивали исходным буфером Sl (6 М мочевины, 25 мМ ацетата натрия, 10 мМ 2-меркаптоэтанола, 1 мМ ЭДТА, pH 5,5).
Одну порцию образца после Source 30Q наносили на колонку, промывали a) исходным буфером S1, пока фоновое поглощение при 280 нм не стабилизировалось, b) 10 CV 2% (об/об) Тритона X-100 в исходном буфере S1 и c) исходным буфером S1, пока фоновое поглощение при 280 нм не стабилизировалось. В заключение белок элюировали 18 CV линейного градиента от 0 до 230 мМ NaCl. Оставшийся белок удаляли с колонки на стадии промывки 1 M NaCl.
Стадию хроматографии повторяли для второй порции образца после Source 30Q. Фракции, содержащие HepCor65T(151/97F), объединяли, концентрированной уксусной кислотой доводили pH до 4,8 и разделяли на две порции.
Хроматография с использованием Source 15S при pH 4,8: Колонку Source 15S регенерировали и уравновешивали исходным буфером S2 (6 М мочевина, 25 мМ ацетат натрия, 10 мМ 2-меркаптоэтанол, 1 мМ ЭДТА, pH 4,8).
Одну порцию образца после Source 15S наносили на колонку, промывали a) исходным буфером S2, пока фоновое поглощение при 280 нм не стабилизировалось, b) 10 CV 2% (об/об) Тритона X-100 в исходном буфере S2, и c) исходным буфером S2, пока фоновое поглощение при 280 нм не стабилизировалось.
Белок элюировали 10 CV линейного градиента от 0 до 500 мМ NaCl в исходном буфере S2. Оставшийся белок удаляли с колонки промывкой 2 CV 1 М NaCl и финальной промывкой 3 CV 6 М гуанидина-HCl. Фракции, содержащие HepCorT(151/97F)Hsp65, объединяли.
Хроматография с использованием Source 15S при pH 4,8 - удаление эндотоксина: После диализа объединенных фракций из предыдущей стадии в исходном буфере S2, их наносили повторно на колонку Source 15S.
Колонку Source 15S регенерировали и уравновешивали в исходном буфере S2. Половину образца после Source 15S наносили на колонку, промывали исходным буфером S2, пока фоновое поглощение при 280 нм не стабилизировалось, затем 10 CV 2% (об/об) Тритона X-100 в исходном буфере S2 и снова исходным буфером S2, пока фоновое поглощение при 280 нм не стабилизировалось.
Белок элюировали на стадии промывки 4 CV 1 М NaCl и финальной промывкой 3 CV 6 М гуанидина-HCl. Фракции, содержащие HepCor65T(151/97F), объединяли и проводили три стадии диализа в DPBS, 10% (масс/об) сахарозе.
2.4 Очистка HepCor(97F)Hsp65
Лизис клеток: 200 г замороженной клеточной биомассы смешивали с 600 мл буфера для лизиса (30 мМ Tris, 20 мМ 2-меркаптоэтанол, 5 мМ ЭДТА, 0,1 мМ PMSF, 0,2 мг/мл лизоцим, pH 7,5) и перемешивали при 4°C примерно 30 мин.
Суспензию клеток подвергали воздействию ультразвука (Branson Sonifier 450, наконечник 3/4 дюйма, режим 9) 4 раза по 1 мин. Лизат центрифугировали при 18500g и собирали растворенный образец. Раствор белка осветляли центрифугированием при 108850g 20 мин при 4°C.
Осаждение сульфатом аммония: К осветленному раствору белка добавляли сульфат аммония до 25% насыщения, и осаждали белок при 10000g. Осадок ресуспендировали в буфере для лизиса.
Осаждение уксусной кислотой: Раствор белка осторожно доводили 1 М уксусной кислотой до pH 4,5, а затем перемешивали 20 мин при 4°C. Затем белок осаждали центрифугированием при 10000g 10 мин при 4° C. Осадок белка ресуспендировали в Q-буфере A (6 М мочевины, 30 мМ Tris, 10 мМ 2-меркаптоэтанола, 5 мМ ЭДТА, 0,1 мМ PMSF, pH 8,5).
Высокоэффективная хроматография на Q-сефарозе: Колонку XK50/30 (Amersham Pharmacia), содержащую 150 мл смолы высокоэффективной Q-сефарозы (Amersham-Pharmacia), восстанавливали, затем уравновешивали 3-5 CV Q-буфера A.
Образец наносили на колонку и собирали в проточной фазе. Добавляли 2-меркаптоэтанол до 150 мМ и объем белка инкубировали 1 час при 4°C.
Вторая высокоэффективная хроматография на Q-сефарозе: Колонку, содержащую высокоэффективную Q-сефарозу, регенерировали, затем уравновешивали Q-буфером A.
На колонку наносили проток после первой колонки с Q-сефарозой для быстрого протока и снова собирали проточную фазу. Добавляли 2-меркаптоэтанол до 300 мМ. Добавляли гуанидинхлорид до 6 М. Затем образец белка инкубировали 72 часа при комнатной температуре, после чего фильтровали через фильтр с диаметром пор 0,22 мкм.
Гель-фильтрационная хроматография с использованием Superdex 200: Колонку XK50/90 (Amersham Pharmacia), содержащую 1800 мл смолы Superdex 200 (Amersham-Pharmacia), уравновешивали 2 CV буфера GF (6 М мочевины, 30 мМ Tris, 20 мМ 2-меркаптоэтанола, 2 мМ ЭДТА, pH 7,5).
Образец разделяли на 10 равных порций по 70 мл. Затем отдельные порции пропускали через колонку и объединяли фракции, содержащие HepCor(97F)Hsp65.
Высаливающая гель-фильтрационная хроматография на сефадексе 25: колонку XK50/30 (Amersham-Pharmacia), содержащую 300 мл смолы сефадекс 25 (Amersham-Pharmacia) регенерировали, затем уравновешивали буфером GF25 (6 М мочевины, 50 мМ уксусной кислоты, 5 мМ NaOH, 1 мМ ЭДТА, 10 мМ 2-меркаптоэтанола, pH 4,7).
Образец разделяли на порции по 75 мл, после чего обрабатывали. Фракции, содержащие белок, объединяли.
Высокоэффективная хроматография на SP-сефарозе: 275 мл высокоэффективной SP-сефарозы (Amersham-Pharmacia) регенерировали, затем уравновешивали SP-буфером A (6 М мочевины, 50 мМ уксусной кислоты, 5 мМ NaOH, 1 мМ ЭДТА, 10 мМ 2-меркаптоэтанола, pH 4,7).
Объединенный образец, полученный на предыдущей стадии, смешивали со смолой и инкубировали в горизонтальном шейкере 30 мин при комнатной температуре. Затем суспензию набивали в колонку XK50/30 (Amersham-Pharmacia) и промывали 2 CV SP-буфера A. Затем колонку промывали 15 CV 2% (об/об) Тритона X-100 в SP-буфере A. Детергент удаляли промывкой 5 CV SP-буфера A и 2 CV 1 М NaCl в SP-буфере A. Затем белок изократически элюировали 6 М мочевины, 10 мМ Tris, pH 7,5.
Хроматография на медьсодержащей хелатирующей сефарозе для быстрого протока: Колонку XK50/30 (Amersham-Pharmacia), содержащую 180 мл хелатирующей сефарозы для быстрого протока (Amersham Pharmacia), регенерировали, насыщали сульфатом меди, затем уравновешивали 2 CV Cu-буфера A (6 М гуанидингидрохлорида, 30 мМ фосфат натрия, pH 7,0).
Образец наносили на колонку, промывали 3 CV Cu-буфера A, затем 5 CV 2% (об/об) Тритона X-100 в Cu-буфере A и в заключение, 3 CV Cu-буфера A для удаления детергента. Белок элюировали 300 мМ имидазолом в Cu-буфере A. Потом проводили 5 стадий диализа белка в DPBS.
2.5 Очистка HepCorT(151/97F)
Лизис клеток: 425 г замороженной клеточной биомассы смешивали с 2,5 л охлажденного на льду 10 мМ ЭДТА, 100 мМ NaCl, 1 мМ 2-меркаптоэтанола, pH 8,0. После перемешивания клеточной суспензии, клетки осаждали центрифугированием 10 мин при 10500g. Клетки ресуспендировали в 50 мМ NaCl, 1 мМ ЭДТА, 1 мМ 2-меркаптоэтанола, 0, 2 г/мл лизоцима, pH 8,0, перемешивали и инкубировали на льду 1 час.
Суспензию клеток подвергали воздействию ультразвука (Branson Sonifier 450, наконечник 3/4 дюйма, режим 8) 2 раза по 2 мин. Лизат центрифугировали при 18500g и собирали растворенный образец.
Осаждение сульфатом аммония: К растворимой фракции добавляли сульфат аммония до 25% насыщения, затем осаждали примеси 40 мин при 10000g. К супернатанту дополнительно добавляли сульфат аммония до 35% насыщения. После перемешивания в течение 30 мин белок осаждали центрифугированием при 10000g 30 мин. Осадок ресуспендировали в 1 мМ ЭДТА, 1 мМ 2-меркаптоэтанола, pH 8,0 и осветляли центрифугированием при 76500g 20 мин.
Повторное осаждение сульфатом аммония: После первого осаждения образец растворяли в 1 мМ ЭДТА, 1 мМ 2-меркаптоэтанола, pH 8,0 и подвергали такой же процедуре, как описано выше.
Хроматография на фенилсефарозе для быстрого протока: Колонку XK50/30 (Amersham Pharmacia), содержащую 200 мл фенилсефарозы для быстрого протока (Amersham-Pharmacia) регенерировали, затем уравновешивали 0,85 М сульфата аммония, 20 мМ фосфата натрия, 1 мМ ЭДТА, 1 мМ 2-меркаптоэтанола, pH 6,8.
К образцу добавляли 1 М фосфат натрия, 1 мМ ЭДТА, 1 мМ BME, pH 6,8, доводя концентрацию фосфата натрия до 10 мМ и процент насыщения сульфата аммония до 20%.
Половину образца наносили на колонку и промывали буфером для уравновешивания, пока измеряемое при 280 нм фоновое поглощение не достигало базового уровня. Белок элюировали 300 мл обратного линейного градиента до концентрации 20 мМ фосфата натрия, 1 мМ ЭДТА, 1 мМ 2-меркаптоэтанола, pH 6,8. Фракции, содержащие HepCorT(151/97F), объединяли.
Повторная хроматография на фенилсефарозе для быстрого потока: Колонку регенерировали и уравновешивали 0,85 М сульфата аммония, 20 мМ фосфата натрия, 1 мМ ЭДТА, 1 мМ 2-меркаптоэтанола, pH 6,8.
Объединенный образец после первой колонки с фенилсефарозой FF разводили буфером для уравновешивания до концентрации белка 2,5 мг/мл. Затем разведенный образец наносили на колонку, промывали буфером для уравновешивания, пока измеряемое при 280 нм фоновое поглощение не достигало базового уровня, и элюировали 300 мл линейного градиента до концентрации 20 мМ фосфата натрия, 1 мМ ЭДТА, 1 мМ 2-меркаптоэтанола, pH 6,8.
Фракции, содержащие HepCorT(151/97F), объединяли и белок осаждали добавлением сульфата аммония до 35% насыщения с последующим центрифугированием при 12000g в течение 50 мин. Затем осадок снова растворяли в 700 мл 8 М мочевины, 10 мМ ацетата натрия, 30 мМ уксусной кислоты, 25 мМ NaCl, 0,5 мМ ЭДТА, 5 мМ 2-меркаптоэтанола, pH 8,0.
Хроматография на SP-сефарозе для быстрого потока: Колонку XK50/30 (Amersham-Pharmacia), содержащую 180 мл SP-сефарозы для быстрого потока (Amersham-Pharmacia) регенерировали, затем уравновешивали 5 CV 8 М мочевины, 10 мМ ацетата натрия, 30 мМ уксусной кислоты, 25 мМ NaCl, 0,5 мМ ЭДТА, 5 мМ 2-меркаптоэтанола, pH 8,0.
Половину образца наносили на колонку и промывали буфером для уравновешивания, пока измеряемое при 280 нм фоновое поглощение не достигало базового уровня. Белок элюировали 600 мл линейного градиента от буфера для уравновешивания до 10 мМ ацетата натрия, 30 мМ уксусной кислоты, 1 М NaCl, 5 мМ 2-меркаптоэтанола, 0, 5 мМ ЭДТА. В заключение, колонку отмывали 6 М гуанидином-HCl, 50 мМ Tris, pH 8,5.
Процедуру повторяли для второй половины образца, затем фракции, содержащие HepCorT, объединяли и подвергали диализу против 6 М мочевины, 20 мМ Tris, pH 8,5, 0,5 мМ ЭДТА, 5 мМ 2-меркаптоэтанола, pH 8,5, и, в заключение, против 6 М мочевины, 20 мМ Tris, 5 мМ 2-меркаптоэтанола, pH 8,5.
Хроматография с использованием Source 30Q: Колонку XK50/30 (Amersham-Pharmacia), содержащую 150 мл смолы Source 30Q (Amersham-Pharmacia), регенерировали, затем уравновешивали 4 CV буфера для уравновешивания (6 М мочевины, 20 мМ Tris, 5 мМ 2-меркаптоэтанола, pH 8,5).
Одну треть образца наносили на колонку, промывали 95% буфера для уравновешивания и 5% буфера для элюции (6 М мочевины, 1 мМ NaCl, 20 мМ Tris, 5 мМ 2-меркаптоэтанола, pH 8,5), затем белок элюировали 1 л линейного градиента до 100% буфера для элюции.
Вторую и третью части образца обрабатывали таким же образом. Фракции, содержащие HepCorT объединяли, затем подвергали диализу против 6 М мочевины, 20 мМ ацетата натрия, 20 мМ уксусной кислоты, 0,5 мМ ЭДТА, 1 мМ 2-меркаптоэтанола, pH 8,0.
Высокоэффективная хроматография на SP-сефарозе: Колонку XK50/30 (Amersham Pharmacia), содержащую 180 мл высокоэффективной SP-сефарозы (Amersham Pharmacia), регенерировали, затем уравновешивали 5 CV 6 М мочевины, 20 мМ ацетата натрия, 20 мМ уксусной кислоты, 0,5 мМ ЭДТА, 1 мМ 2-меркаптоэтанола, pH 8,0.
Половину образца наносили на колонку и промывали буфером для уравновешивания, пока измеряемое при 280 нм фоновое поглощение не достигало базового уровня.
Примеси элюировали двумя линейными градиентами, т.е. от 0 до 1 М NaCl в буфере для уравновешивания, затем линейный градиент до буфера для элюции 2 (6 М мочевины, 40 мМ ацетата натрия, 10 мМ уксусной кислоты, 0,5 мМ ЭДТА, 1 мМ 2-меркаптоэтанола, pH 8,0). Колонку промывали 2% (об/об) Тритона X-100 в буфере для элюции 2, затем 10 CV буфера для элюции для удаления детергента. Затем белок элюировали в градиенте концентрации до 6 M мочевины, 50 мМ Tris, 0,5 мМ ЭДТА, 5 мМ 2-меркаптоэтанола, pH 8.0.
После повторения процедуры для второй половины образца фракции, содержащие HepCorT(151/9F), объединяли и подвергали белок двум стадиям диализа в 5 мМ фосфате натрия, 50 мМ NaCl, 3,1 мМ мочевине, 20% (масс/об) сахарозе, pH 8,5.
2.6 Очистка HepCor(97F)
Лизис клеток: 100 г замороженной клеточной биомассы смешивали с 400 мл охлажденного на льду 5 мМ ЭДТА, 5 мМ 2-меркаптоэтанолом, pH 8,0. После перемешивания суспензии клеток добавляли лизоцим до 0,2 г/мл, суспензию перемешивали и инкубировали во льду 1 час.
Суспензию клеток подвергали воздействию ультразвука (Branson Sonifier 450, наконечник 3/4 дюйма, режим 8) 2 раза по 2 мин, затем добавляли 200 мл охлажденного на льду 20 мМ ацетата натрия, 5 мМ уксусной кислоты, 3 М сульфата аммония и хорошо перемешивали. Суспензию подвергали воздействию ультразвука (Branson Sonifier 450, наконечник 3/4 дюйма, режим 8) 3 мин. В заключение лизат центрифугировали при 18500g и собирали растворенный образец.
Осаждение сульфатом аммония: Растворимую фракцию разводили в 1 л 0,85 М сульфата аммония. При перемешивании медленно добавляли 70 г/л твердого сульфата аммония. После дальнейшего перемешивания в течение 30 мин суспензию центрифугировали при 18500g 60 мин. Потом осадок ресуспендировали в 500 мл 1 мМ ЭДТА, 5 мМ 2-меркаптоэтанола. При перемешивании медленно добавляли 113,4 г/л сульфата аммония и перемешивали еще 30 мин. Белок осаждали центрифугированием при 76500g 20 мин.
Осадок снова растворяли посредством добавления 1 М фосфата натрия, 1 мМ ЭДТА, 5 мМ 2-меркаптоэтанола, сульфата аммония в 20% насыщении до конечной концентрации фосфата натрия 5 мМ.
Хроматография на фенилсефарозе для быстрого потока: Колонку XK50/30 (Amersham Pharmacia), содержащую 200 мл фенилсефарозы для быстрого потока (Amersham-Pharmacia), регенерировали, затем уравновешивали 0,85 М сульфата аммония, 5 мМ фосфата натрия, 1 мМ ЭДТА, 5 мМ 2-меркаптоэтанола, pH 6,8.
Образец наносили на колонку и промывали буфером для уравновешивания, пока измеряемое при 280 нм фоновое поглощение не достигало базового уровня. Белок элюировали ступенчатым градиентом до 6 М мочевины. Фракции, содержащие HepCorT, объединяли, и белок осаждали добавлением сульфата аммония до 32% насыщения. После осаждения белка центрифугированием при 12100g в течение 50 мин, его снова растворяли в 500 мл 8 М мочевины, 5 мМ Tris, 5 мМ 2-меркаптоэтанола, pH 7,5.
Хроматография с использованием Source 30Q: Колонку XK50/30 (Amersham-Pharmacia), содержащую 150 мл смолы Source 30Q (Amersham-Pharmacia), регенерировали, затем уравновешивали 4 CV буфера для уравновешивания (6 М мочевины, 5 мМ Tris, 5 мМ 2-меркаптоэтанола, pH 7,5).
Образец наносили на колонку, промывали буфером для уравновешивания. Белок элюировали в линейном градиенте от буфера для уравновешивания до 6 М мочевины, 1 М NaCl, 5 мМ Tris, 5 мМ 2-меркаптоэтанола, pH 7,5. Фракции, содержащие HepCor(97F), объединяли и разделяли на три порции.
Хроматография на высокоэффективной SP-сефарозе: Колонку XK50/30 (Amersham Pharmacia), содержащую 190 мл высокоэффективной SP-сефарозы (Amersham Pharmacia), регенерировали, затем уравновешивали 5 CV 6 М мочевины, 30 мМ ацетата натрия, 10 мМ уксусной кислоты, 1 мМ ЭДТА, 5 мМ 2-меркаптоэтанола, pH 8,0.
Одну порцию образца наносили на колонку и промывали 20 CV 6 М мочевины, 40 мМ ацетата натрия, 10 мМ уксусной кислоты, 0,5 мМ ЭДТА, 1 мМ 2-меркаптоэтанола, 2% (об/об) Тритона X-100, pH 8,0. Затем для удаления Тритона X-100 колонку промывали 10 CV 6 М мочевины, 40 мМ ацетата натрия, 10 мМ уксусной кислоты, 0,5 мМ ЭДТА, 1 мМ 2-меркаптоэтанола, pH 8,0.
Белок элюировали 600 мл линейного градиента до 6 М мочевины, 20 мМ Tris, 1 М NaCl, 1 мМ 2-меркаптоэтанола, 0,5 мМ ЭДТА, pH 8, 5.
Процедуру повторяли с двумя другими порциями материала, затем фракции, содержащие HepCor(97F), объединяли. Затем белок подвергали 5 стадиям диализа в 40 мМ ацетате натрия, 0,05 мМ DTT, pH 6,5.
Пример 3
Примирование активности CTL мышей
Мыши: Мыши C57BL/6 (H-2b) приобретены в Charles River Laboratories (St. Constant, PQ).
Клеточные линии: линия клеток тимомы EL4 (H-2b) получена из ATCC и культивирована в модифицированной по Дульбекко среде Игла, содержащей 10% FBS и 2 мМ L-глутамина (DMEM-10). Клетки EL4.HBc.1D7, экспрессирующие антиген HBc выведены на Stressgen посредством трансфицирования клеток EL4 плазмидой, кодирующей полноразмерный ген HBc и маркер устойчивости к неомицину. Ген полноразмерного антигена HBc клонировали из подтипа HBV adw и модифицировали для кодирования известных последовательностей мышиных рестрицированных по H-2Kb и H-2Kd эпитопов CTL (в белке adw провели 2 замены аминокислот по сравнению с белком дикого типа: аминокислоту в положении 87 изменили с аспарагина на серин, а аминокислоту в положении 97 изменили с изолейцина на фенилаланин. Данные две замены провели для воспроизведения известных мышиных эпитопов CTL). Трансфицированные клетки отбирали в DMEM-10, содержащей 1500 мкг/мл G418 и клонировали посредством ограничивающих разведений для получения клона EL4.HBc.1D7. Экспрессию белка HBc в данной клеточной линии подтверждали посредством анализа вестерн-иммуноблоттинга с использованием антител, специфичных к HBc. Презентацию MHC класса 1 рестрицированного по H-2Kb эпитопа CTL подтверждали посредством лизиса с линией CTL, специфичной к этому эпитопу. Анализ FACS выявил высокий уровень экспрессии MHC класса 1 на трансфицированных клетках, сходный с уровнем экспрессии родительской клеточной линии.
Примирование активности CTL мышей: Мышей иммунизировали (посредством подкожной инъекции либо в заднюю часть шеи либо область между лопатками) буфером или 2,9 нмоль одного из следующих: HepCorT(151/97F)Hsp65, HepCorT(97F)Hsp65, hisHepCorT(149/87S97F)Hsp65, HepCorT(151/97F) или HepCorT(97F). На седьмые сутки после иммунизации мышей подвергли эвтаназии посредством ингаляции CO2 или цервикальной дислокации и изъяли их селезенки. Получили единую клеточную суспензию клеток селезенки в среде для CTL (RPMI-1640, 10% FBS, 2 мМ L-глутамина, 1 мМ пирувата натрия, 50 мкМ 2-ME и 45 мкг/мл гентамицина) 30×106 жизнеспособных лимфоидных клеток рестимулировали посредством инкубации при 37°С/5% CO2 в присутствии 1 мкМ пептида HBc.93-100.Kb, MGLKFRQL эпитопа HBc CTL (Kuhober et al., J. Immunol. 156:3687-95, 1996). Данный синтетический пептид (синтезированный Research Genetics, Huntsville, AL), применяемый для рестимуляции, включает мышиный эпитоп CTL рестрицированный по H-2Kb.
Эффекторные клетки собирали после 7 суток и культивировали в круглодонных 96-луночных планшетах для микротитрования вместе с меченными51Cr целевыми клетками. Контрольные цели EL4 представляли собой клетки, предварительно импульсно активированные несвязанным, рестрицированным по H-2Kb (MUT-1.52-59.Kb) пептидом (см. фигуру 13). Целевые клетки представляли собой клетки EL4, предварительно импульсно активированные или пептидом HBc.93-100.Kb (см. фигуру 14) или EL4.HBc.1D7 (см. фигуру 15). CTL (100 мкл) культивировали с 5×103 или 5×104 целевыми клетками (100 мкл) в различных соотношениях эффектор:целевая клетка (100:1, 33:1 или 11:1). Для определения спонтанного высвобождения метки равное количество целевых клеток культивировали без эффекторных клеток в общем объеме 200 мкл среды для CTL. Общее высвобождение метки определяли посредством добавления 100 мкл Тритона X-100 (2% об/об в воде) к равному количеству целевых клеток. После 4 часов инкубации планшеты для микротитрования центрифугировали при 200g 5 мин и собирали 100 мкл супернатанта культуры. Высвобожденную радиоактивность определяли посредством подсчета сцинцилляций. Корректированный % лизиса рассчитывали по формуле:
Корректированный % лизиса (CL)=100×(CPMtest-CPMspont)/(CPMtotal-CPMspont).
Анализ цитокинов: для подсчета высвобождения гамма интерферона (IFN-γ) и фактора некроза опухоли (TNF-α) из рестимулированных CTL, эффекторные клетки помещали в круглодонные 96-луночные планшеты для микротитрования и культивировали вместе с 1 мкМ пептида HBc.93-100.Kb и целевыми клетками в соотношениях эффектор:цель 100:1, 33:1 или 11:1. Супернатанты собирали после 4 или 24 часов инкубации и анализировали уровень IFN-γ (фигура 16) или TNF-α (фигура 17) посредством сэндвич-ELISA.
Реферат
Изобретение относится к области иммунотерапии. Предложен белок слияния, включающий стрессовый белок и белок вируса гепатита В (HBV). Белок при введении индивидууму индуцирует или усиливает иммунный ответ против белка HBV. Предложены также нуклеиновые кислоты, кодирующие такой белок, фармацевтическая композиция, векторы и способы получения такого белка. Кроме того, предложены способы индукции или усиления иммунного ответа против белка HBV. Изобретение может быть использовано в медицине. 14 н. и 32 з.п. ф-лы, 17 ил.

Комментарии