Иммуноглобулин с двойными вариабельными доменами и его применения - RU2515108C2
Код документа: RU2515108C2
Чертежи














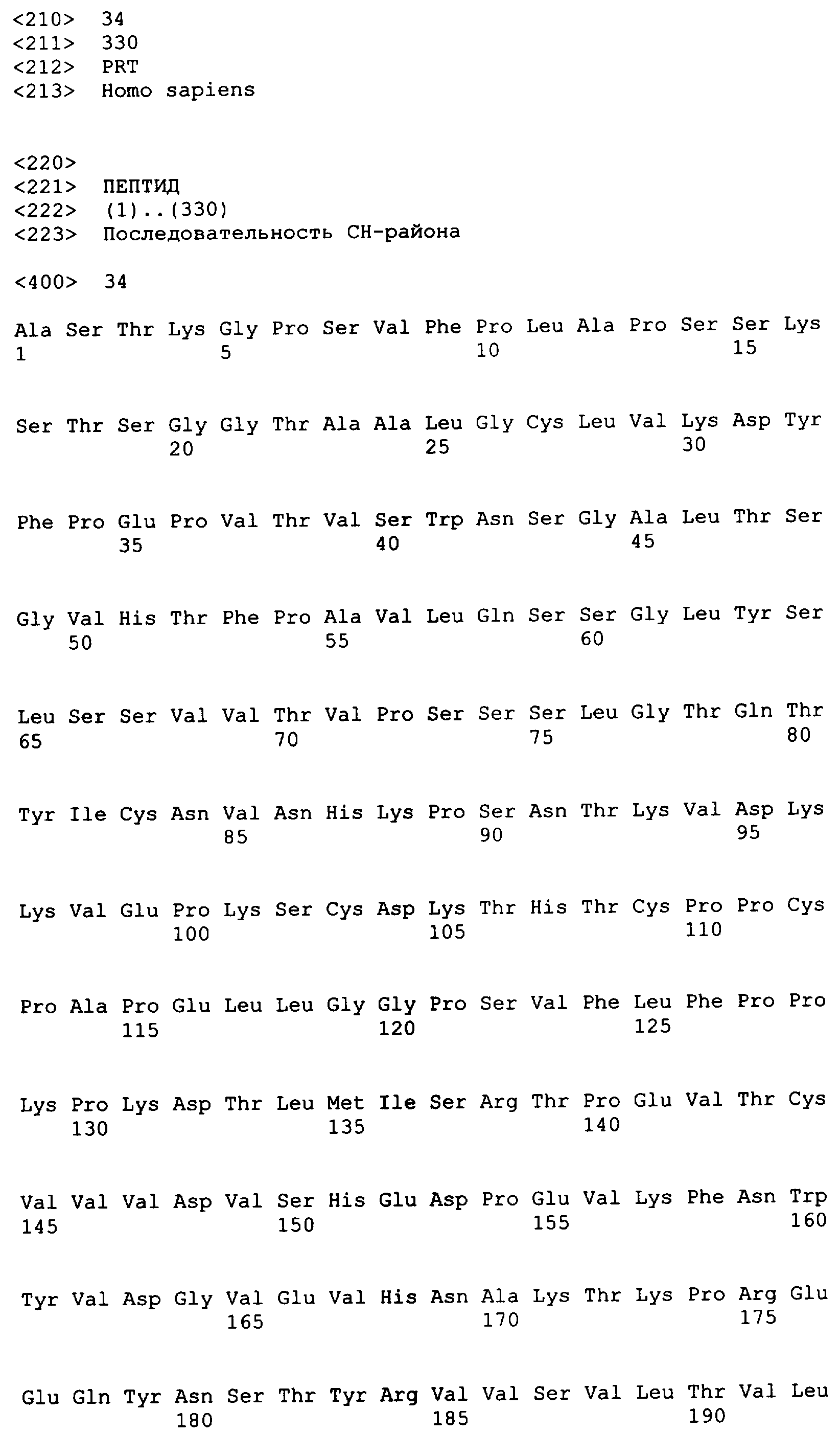



















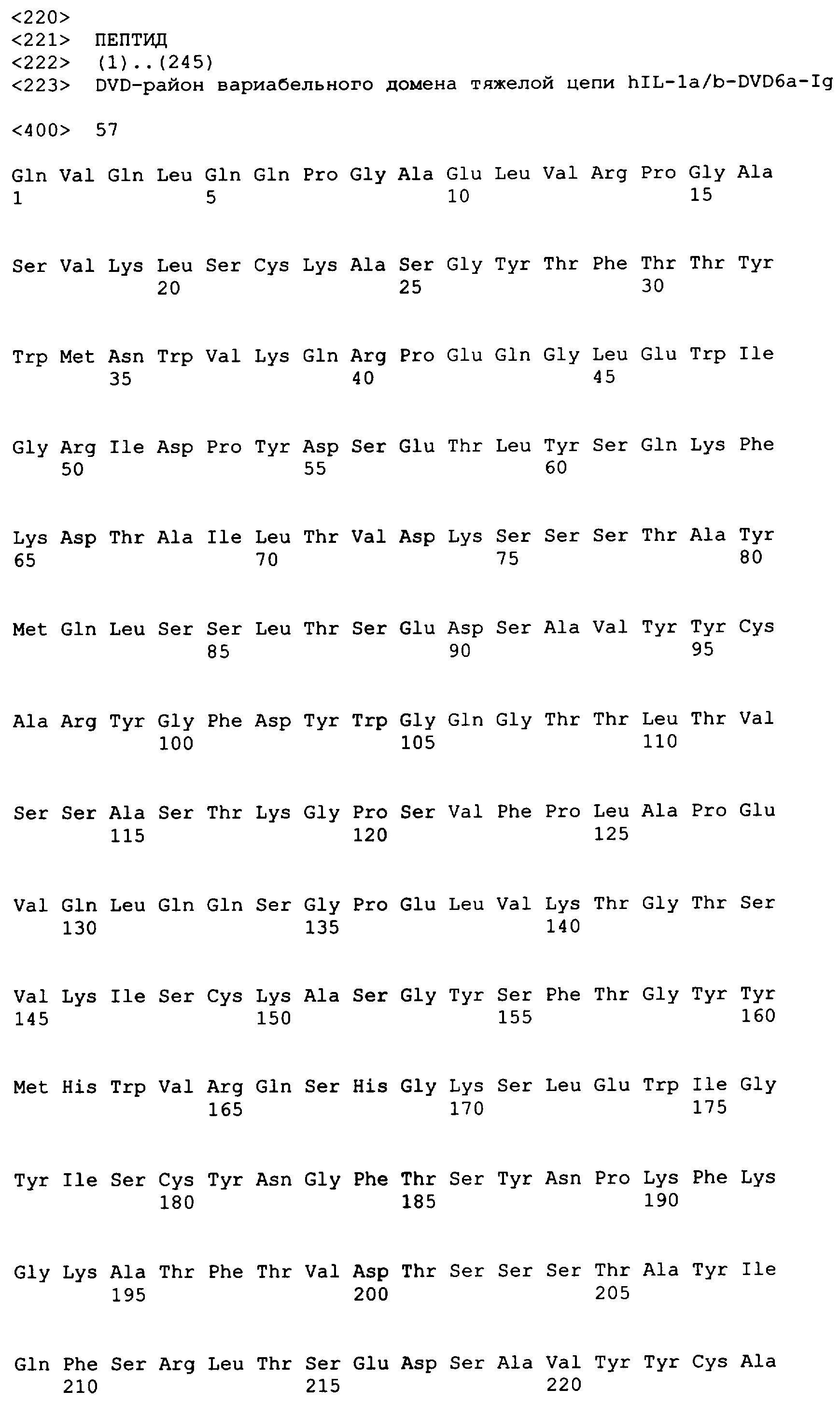






























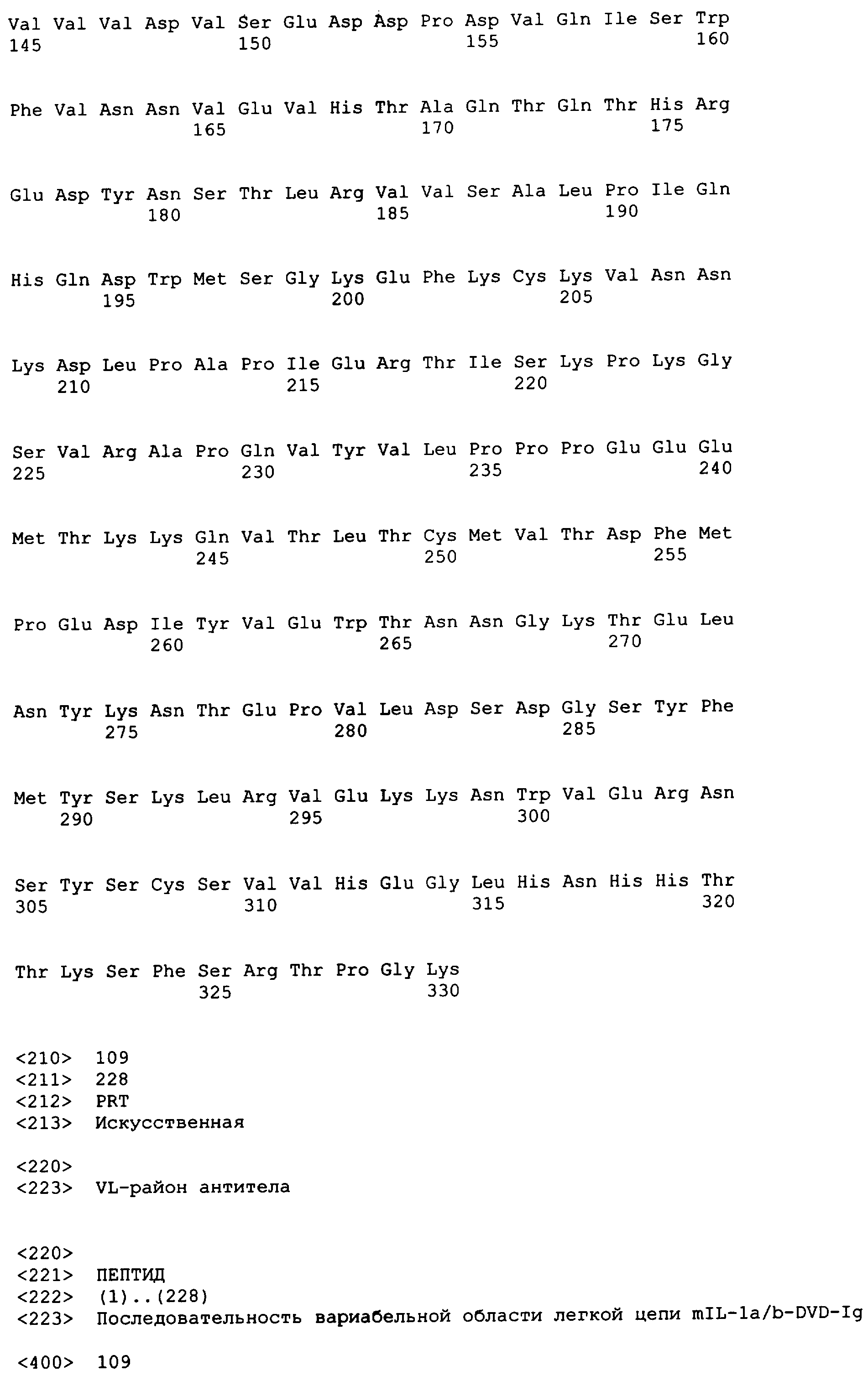






Описание
Перекрестная ссылка на родственную заявку
В настоящей заявке заявляется приоритет по предварительной заявке США №60/709911, поданной 19 августа 2005 года, и предварительной заявке США №60/732892, поданной 2 ноября 2005 года.
Область техники, к которой относится изобретение
Данное изобретение относится к мультивалентным и мультиспецифическим связывающим белкам, способам получения и, в частности, к их применениям в предупреждении и/или лечении острых и хронических воспалительных, раковых и других заболеваний.
Уровень техники
Сконструированные белки, такие как мультиспецифические антитела, способные связывать два или более антигенов, известны в данной области. Такие мультиспецифические связывающие белки могут быть получены путем слияния клеток, химической конъюгации или способами рекомбинантных ДНК.
Биспецифические антитела получали с использованием технологии квадром (см. Milstein, С. and А.С.Cuello, Nature, 1983. 305(5934): p.537-40), основанной на соматическом слиянии двух разных гибридомных клеточных линий, экспрессирующих мышиные моноклональные антитела с желаемой специфичностью биспецифического антитела. Вследствие случайного спаривания двух разных тяжелых и легких цепей Ig в полученной гибрид-гибридомной (или квадромной) клеточной линии получали до десяти разных видов иммуноглобулинов, из которых только один является функциональным биспецифическим антителом. Присутствие ошибочно спаренных побочных продуктов и значимо уменьшенные выходы означают, что необходимы сложные методы очистки.
Биспецифические антитела могут быть получены химической конъюгацией двух разных mAb (см. Staerz, U.D., et al., Nature, 1985. 314(6012): p. 628-31). Этот подход не приводит к гомогенному препарату. В других подходах использовали химическую конъюгацию двух разных моноклональных антител или меньших фрагментов антител (см. Brennan, M., et al., Science, 1985. 229(4708): p. 81-3). Другим способом является связывание двух исходных антител с гетеро-бифункциональным сшивающим агентом, но полученные препараты биспецифических антител имели недостаток, заключающийся в существенной молекулярной гетерогенности, так как реакция сшивающего агента с исходными антителами не является сайт-направленной. Для получения более гомогенных препаратов биспецифических антител два разных Fab-фрагмента химически сшивали в их остатках цистеинов сайт-направленным образом (см. Glennie, M.J., et al., J Immunol, 1987. 139(7): p. 2367-75). Но этот способ приводит к F(ab')2-фрагментам, а не к полной молекуле IgG.
В последнее время было разработано широкое разнообразие других форматов рекомбинантных биспецифических антител (см. Kriangkum, J., et al., Biomol Eng, 2001. 18(2): p. 31-40). Среди них наиболее широко используемыми форматами для конструирования рекомбинантных биспецифических антител являются тандемные одноцепочечные Fv-молекулы и диатела и их различные производные. По стандартной методике конструирование этих молекул начинается с двух одноцепочечных Fv (scFv)-фрагментов, которые распознают различные антигены (см. Economides, A.N., et al., Nat Med, 2003. 9(1): p. 47-52). Тандемные молекулы scFv(taFv) представляют прямой формат, прямо соединяющий две молекулы scFv дополнительным пептидным линкером. Два scFv-фрагмента, присутствующие в этих тандемных молекулах scFv, образуют отдельные элементы укладки (фолдинга). Могут быть использованы разные линкеры для соединения двух scFv-фрагментов и линкеры с длиной до 63 остатков (см. Nakanishi, K., et al., Annu Rev Immunol, 2001. 19: p. 423-74). Хотя исходные scFv-фрагменты могут обычно экспрессироваться в растворимой форме в бактериях, часто наблюдается, что тандемные молекулы scFv образуют нерастворимые агрегаты в бактериях. Таким образом, протоколы рефолдинга или применения систем экспрессии млекопитающих используют обычным путем для получения тандемных молекул scFv. В недавнем исследовании сообщалось об экспрессии in vivo трансгенными кроликами и крупным рогатым скотом тандемного scFv, направленного против CD28 и ассоциированного с меланомой протеогликана (см. Gracie, J.A., et al., J Clin Invest, 1999. 104(10): p. 1393-401). В этой конструкции две молекулы scFv соединяли CH1-линкером и обнаруживали сывороточные концентрации биспецифического антитела до 100 мг/л. Для получения растворимой экспрессии в бактериях использовали различные стратегии, включая варьирования порядка доменов или использование средних линкеров варьируемой длины или гибкости. В настоящее время в нескольких исследованиях сообщалось об экспрессии растворимых тандемных молекул scFv в бактериях (см. Leung, B.P., et al., J Immunol, 2000. 164(12): p. 6495-502; Ito, A., et al., J Immunol, 2003. 170(9): p. 4802-9; Karni, A., et al., J Neuroimmunol, 2002. 125(1-2): p. 134-40) с использованием либо очень короткого линкера Ala3, либо длинных богатых глицином/серином линкеров. В недавнем исследовании использовали фаговый дисплей тандемного scFv-репертуара, содержащего рандомизированные средние линкеры длиной из 3 или 6 остатков, для обогащения в отношении молекул, которые продуцируются в растворимой и активной форме в бактериях. Этот подход приводил к выделению предпочтительной тандемной молекулы scFv с линкером из 6 аминокислотных остатков (см. Arndt, M. and J. Krauss, Methods Mol Biol, 2003. 207: p. 305-21). Неясно, представляет ли эта линкерная последовательность общее решение растворимой экспрессии тандемных молекул scFv. Тем не менее, данное исследование продемонстрировало, что фаговый дисплей тандемных молекул scFv в комбинации с направленным мутагенезом является мощным инструментом для обогащения этими молекулами, которые могут быть экспрессированы в бактериях в активной форме.
В биспецифических диателах (Db) для экспрессии используется димерный формат. Диатела получают из scFv-фрагментов уменьшением длины линкера, соединяющего VH- and VL-домен, до приблизительно 5 остатков (см. Peipp, M. and T. Valerius, Biochem Soc Trans, 2002. 30(4): p. 507-11). Уменьшение размера линкера облегчает димеризацию двух полипептидных цепей кроссоверным спариванием VH- и VL-доменов. Биспецифические диатела получают экспрессией двух полипептидных цепей либо со структурой VHA-VLB и VHB-VLA (конфигурацией VH-VL), либо со структурой VLA-VHB и VLB-VHA (конфигурацией VL-VH) в одной и той же клетке. В прошлом было получено большое разнообразие различных биспецифических диател, и большинство из них могут быть экспрессированы в растворимой форме в бактериях. Однако недавнее сравнительное исследование демонстрирует, что ориентация вариабельных доменов может влиять на экспрессию и образование активных связывающих сайтов (см. Mack, M., G. Riethmuller, and P. Kufer, Proc Natl Acad Sci U S A, 1995. 92(15): p. 7021-5). Тем не менее, растворимая экспрессия в бактериях представляет важное преимущество по сравнению с тандемными молекулами scFv. Однако поскольку две различные полипептидные цепи экспрессируются в одной клетке, вместе с активными гетеродимерами могут быть получены неактивные гомодимеры. Это создает необходимость введения дополнительных стадий очистки для получения гомогенных препаратов биспецифических диател. Одним из подходов для ускорения генерирования биспецифических диател является получение диател типа knob-into-hole (выпуклость-в-углубление) (см. Holliger, P., T. Prospero, and G. Winter, Proc Natl Acad Sci U S A, 1993. 90(14): p. 6444-8.18). Это было продемонстрировано для биспецифического диатела, направленного против HER2 и CD3. Большую «выпуклость» вводили в VH-домен заменой Val37 на Phe и Leu45 на Trp, а комплементарное «углубление» получали в VL-домене мутацией Phe98 в Met и Tyr87 в Ala в вариабельных доменах либо анти-HER2, либо анти-CD3. Используя такой подход, продуцирование биспецифических диател удалось увеличить с 72% исходного диатела до более 90% с использованием knob-into-hole диатела. Важно то, что выходы только слегка уменьшались в результате мутаций. Однако уменьшение антигенсвязывающей активности наблюдали для нескольких анализируемых конструкций. Таким образом, этот довольно сложный подход требует анализа многочисленных конструкций для идентификации мутаций, которые дают гетеродимерную молекулу с неизмененной связывающей активностью. Кроме того, такой подход требует мутационной модификации последовательности иммуноглобулина в константной области, что создает ненативную и неприродную форму последовательности антитела, что может приводить к увеличенной иммуногенности, плохой стабильности in vivo, а также нежелательной фармакокинетике.
Одноцепочечные диатела (scDb) представляют альтернативную стратегию для улучшения образования биспецифических диателоподобных молекул (см. Holliger, P. and G. Winter, Cancer Immunol Immunother, 1997. 45(3-4): p. 128-30; Wu, A.M., et al., Immunotechnology, 1996. 2(1): p. 21-36). Биспецифические одноцепочечные диатела получают соединением двух диателообразующих полипептидных цепей с дополнительным помещенным в середине линкером с длиной приблизительно 15 аминокислотных остатков. Таким образом, все молекулы с молекулярной массой, соответствующей мономерным одноцепочечным диателам (50-60 кДа), являются биспецифическими. Несколько исследований продемонстрировали, что биспецифические одноцепочечные диатела экспрессируются в бактериях в растворимой и активной форме, причем большинство очищенных молекул присутствуют в виде мономеров (см. Holliger, P. and G. Winter, Cancer Immunol Immunother, 1997. 45(3-4): p. 128-30; Wu, A.M., et al., Immunotechnology, 1996. 2(1): p. 21-36; Pluckthun, A. and P. Pack, Immunotechnology, 1997. 3(2): p. 83-105; Ridgway, J.B., et al., Protein Eng, 1996. 9(7): p. 617-21). Таким образом, одноцепочечные диатела объединяют преимущества тандемных scFvs (все мономеры являются биспецифическими) и диател (растворимая экспрессия в бактериях).
Позже диатело было слито с Fc для генерирования более Ig-подобных молекул, названных ди-диателом (см. Lu, D., et al., J Biol Chem, 2004. 279(4): p. 2856-65). Кроме того, была описана мультивалентная конструкция антитела, содержащая два Fab-повтора в тяжелой цепи IgG и способная связывать четыре молекулы антигена (см. WO 0177342A1, and Miller, K., et al., J Immunol, 2003. 170(9): p. 4854-61).
В данной области существует потребность в улучшенных мультивалентных связывающих белках, способных связывать два или более антигенов. Данное изобретение обеспечивает новое семейство связывающих белков, способных связывать два или более антигенов с высокой аффинностью.
Сущность изобретения
Данное изобретение относится к мультивалентным связывающим белкам, способным связывать два или более антигенов. Изобретение обеспечивает новое семейство связывающих белков, способных связывать два или более антигенов с высокой аффинностью.
В одном из вариантов осуществления данное изобретение обеспечивает связывающий белок, содержащий полипептидную цепь, причем указанная полипептидная цепь содержит VD1-(X1)n-VD2-C-(X2)n, где VD1 означает первый вариабельный домен, VD2 означает второй вариабельный домен, C означает константный домен, X1 представляет аминокислоту или полипептид, X2 представляет Fc-район и n равно 0 или 1. В предпочтительном варианте осуществления VD1 и VD2 в связывающем белке означают вариабельные домены тяжелой цепи. Более предпочтительно вариабельный домен тяжелой цепи выбран из группы, состоящей из мышиного вариабельного домена тяжелой цепи, вариабельного домена тяжелой цепи человека, CDR-трансплантированного вариабельного домена тяжелой цепи и гуманизированного вариабельного домена тяжелой цепи. В предпочтительном варианте осуществления VD1 и VD2 способны связывать один и тот же антиген. В другом варианте осуществления VD1 и VD2 способны связывать различные антигены. Предпочтительно С означает константный домен тяжелой цепи. Более предпочтительно X1 означает линкер при условии, что X1 не является CH1. Наиболее предпочтительно X1 означает линкер, выбранный из группы, состоящей из AKTTPKLEEGEFSEAR; AKTTPKLEEGEFSEARV; AKTTPKLGG; SAKTTPKLGG; AKTTPKLEEGEFSEARV; SAKTTP; SAKTTPKLGG; RADAAP; RADAAPTVS; RADAAAAGGPGS; RADAAAA(G4S)4;SAKTTP; SAKTTPKLGG; SAKTTPKLEEGEFSEARV; ADAAP; ADAAPTVSIFPP; TVAAP; TVAAPSVFIFPP; QPKAAP; QPKAAPSVTLFPP; AKTTPP; AKTTPPSVTPLAP; AKTTAP; AKTTAPSVYPLAP; ASTKGP; ASTKGPSVFPLAP, GGGGSGGGGSGGGGS; GENKVEYAPALMALS; GPAKELTPLKEAKVS и GHEAAAVMQVQYPAS. Предпочтительно X2 означает Fc-район. Более предпочтительно X2 является вариантным Fc-районом.
В предпочтительном варианте осуществления связывающий белок, описанный выше, содержит полипептидную цепь, причем указанная полипептидная цепь содержит VD1-(X1)n-VD2-C-(X2)n, где VD1 означает первый вариабельный домен тяжелой цепи, VD2 означает второй вариабельный домен тяжелой цепи, C означает константный домен тяжелой цепи, X1 означает линкер при условии, что он не является CH1 и X2 не является Fc-районом.
В другом варианте осуществления VD1 и VD2 в связывающем белке являются вариабельными доменами легкой цепи. Предпочтительно вариабельный домен легкой цепи выбран из группы, состоящей из мышиного вариабельного домена легкой цепи, вариабельного домена легкой цепи человека, CDR-трансплантированного вариабельного домена легкой цепи и гуманизированного вариабельного домена легкой цепи. В одном варианте осуществления VD1 и VD2 способны связывать один и тот же антиген. В другом варианте осуществления VD1 и VD2 способны связывать различные антигены. Предпочтительно С означает константный домен легкой цепи. Более предпочтительно X1 означает линкер при условии, что X1 не является CL1. Предпочтительно X1 является линкером, выбранным из группы, состоящей из AKTTPKLEEGEFSEAR; AKTTPKLEEGEFSEARV; AKTTPKLGG; SAKTTPKLGG; AKTTPKLEEGEFSEARV; SAKTTP; SAKTTPKLGG; RADAAP; RADAAPTVS; RADAAAAGGPGS; RADAAAA(G4S)4;SAKTTP; SAKTTPKLGG; SAKTTPKLEEGEFSEARV; ADAAP; ADAAPTVSIFPP; TVAAP; TVAAPSVFIFPP; QPKAAP; QPKAAPSVTLFPP; AKTTPP; AKTTPPSVTPLAP; AKTTAP; AKTTAPSVYPLAP; ASTKGP и ASTKGPSVFPLAP. Предпочтительно связывающий белок не содержит X2.
В предпочтительном варианте осуществления описанный выше связывающий белок содержит полипептидную цепь, причем указанная полипептидная цепь содержит VD1-(X1)n-VD2-C-(X2)n, где VD1 означает первый вариабельный домен легкой цепи, VD2 означает второй вариабельный домен легкой цепи, C означает константный домен легкой цепи, X1 означает линкер при условии, что он не является CH1 и X2 не содержит Fc-район.
В другом предпочтительном варианте осуществления данное изобретение обеспечивает связывающий белок, содержащий две полипептидные цепи, причем указанная первая полипептидная цепь содержит VD1-(X1)n-VD2-C-(X2)n, где VD1 означает первый вариабельный домен тяжелой цепи, VD2 означает второй вариабельный домен тяжелой цепи, C означает константный домен тяжелой цепи, X1 означает линкер при условии, что он не является CH1 и X2 не является Fc-районом; и указанная вторая полипептидная цепь содержит VD1-(X1)n-VD2-C-(X2)n, где VD1 означает первый вариабельный домен легкой цепи, VD2 означает второй вариабельный домен легкой цепи, C означает константный домен легкой цепи, X1 означает линкер при условии, что он не является CH1 и X2 не содержит Fc-район. Наиболее предпочтительно связывающий белок с двойными вариабельными доменами (DVD) содержит четыре полипептидные цепи, причем первые две полипептидные цепи содержат VD1-(X1)n-VD2-C-(X2)n, соответственно, где VD1 означает первый вариабельный домен тяжелой цепи, VD2 означает второй вариабельный домен тяжелой цепи, C означает константный домен тяжелой цепи, X1 означает линкер при условии, что он не является CH1 и X2 является Fc-районом; и вторые две полипептидные цепи содержат VD1-(X1)n-VD2-C-(X2)n, соответственно, где VD1 означает первый вариабельный домен легкой цепи, VD2 означает второй вариабельный домен легкой цепи, C означает константный домен легкой цепи, X1 означает линкер при условии, что он не является CH1 и X2 не содержит Fc-район. Такой белок с двойными вариабельными доменами (DVD) имеет четыре антигенсвязывающих сайта.
В другом предпочтительном варианте осуществления описанные выше связывающие белки способны связывать одну или несколько мишеней. Предпочтительно мишень выбрана из группы, состоящей из цитокинов, белков клеточной поверхности, ферментов и рецепторов. Предпочтительно связывающий белок способен модулировать биологическую функцию одной или нескольких мишеней. Более предпочтительно связывающий белок способен нейтрализовать одну или несколько мишеней. Связывающий белок согласно изобретению способен связывать цитокины, выбранные из группы, состоящей из лимфокинов, монокинов и полипептидных гормонов. В конкретном варианте осуществления связывающий белок способен связывать пары цитокинов, выбранные из группы, состоящей из IL-1α и IL-1β; IL-12 и IL-18, TNFα и IL-23, TNFα и IL-13; TNF и IL-18; TNF и IL-12; TNF и IL-1β; TNF и MIF; TNF и IL-17; и TNF и IL-15; TNF и VEGF; VEGFR и EGFR; IL-13 и IL-9; IL-13 и IL-4; IL-13 и IL-5; IL-13 и IL-25; IL-13 и TARC; IL-13 и MDC; IL-13 и MIF; IL-13 и TGF-β; IL-13 и агониста LHR; IL-13 и CL25; IL-13 и SPRR2a; IL-13 и SPRR2b; IL-13 и ADAM8; и TNFα и PGE4, IL-13 и PED2, TNF и PEG2. В другом варианте осуществления связывающий белок согласно изобретению способен связывать пары мишеней, выбранные из группы, состоящей из CD138 и CD20; CD138 и CD40; CD19 и CD20; CD20 и CD3; CD38 и CD138; CD38 и CD20; CD38 и CD40; CD40 и CD20; CD-8 и IL-6; CSPG и RGM A; CTLA-4 и BTNO2; IGF1 и IGF2; IGF1/2 и Erb2B; IL-12 и TWEAK; IL-13 и IL-1β; MAG и RGM A; NgR и RGM A; NogoA и RGM A; OMGp и RGM A; PDL-1 и CTLA-4; RGM A и RGM B; Te38 и TNFα; TNFα и Blys; TNFα и CD-22; TNFα и CTLA-4; TNFα и GP130; TNFα и IL-12p40; и TNFα и лиганда RANK.
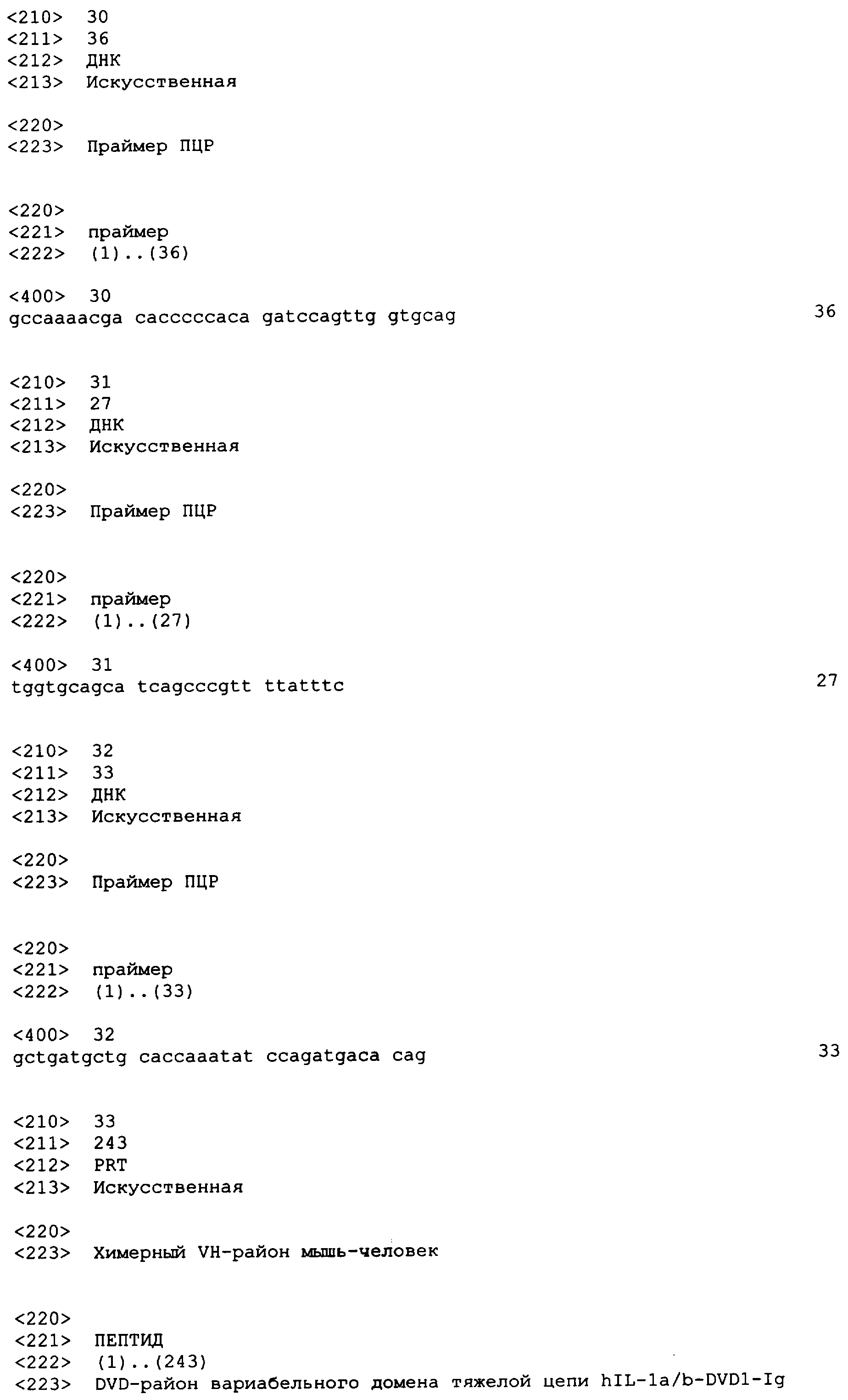
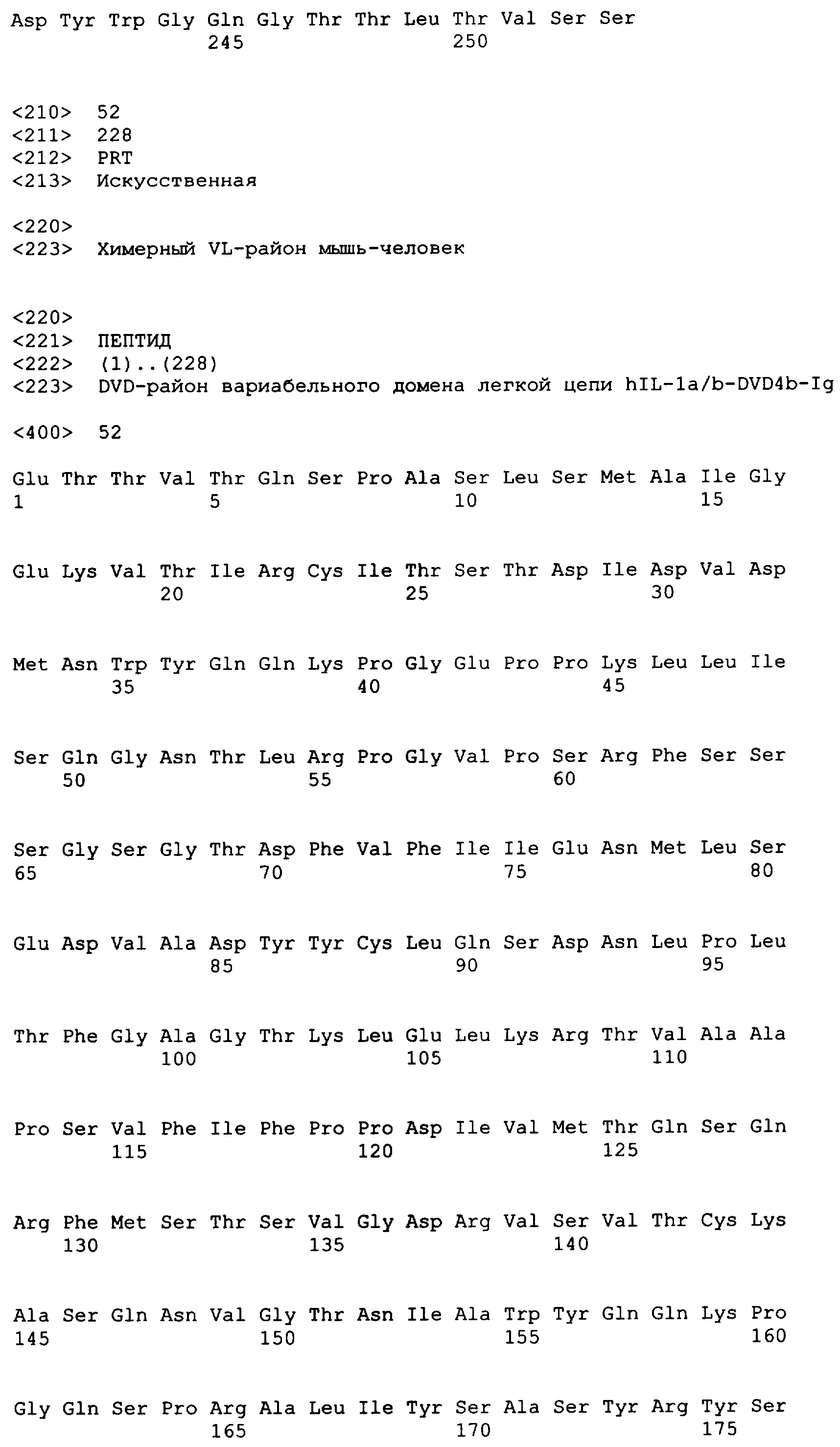
В одном варианте осуществления связывающий белок, способный связывать IL-1α человека и IL-1β человека, содержит аминокислотную последовательность тяжелой цепи DVD, выбранную из группы, состоящей из SEQ ID NO. 33, SEQ ID NO. 37, SEQ ID NO. 41, SEQ ID NO. 45, SEQ ID NO. 47, SEQ ID NO. 51, SEQ ID NO. 53, SEQ ID NO. 55, SEQ ID NO. 57 и SEQ ID NO. 59; и аминокислотную последовательность легкой цепи DVD, выбранную из группы, состоящей из SEQ ID NO. 35, SEQ ID NO. 39, SEQ ID NO. 43, SEQ ID NO. 46, SEQ ID NO. 49, SEQ ID NO. 52, SEQ ID NO. 54, SEQ ID NO. 56, SEQ ID NO. 58 и SEQ ID NO. 60. В другом варианте осуществления связывающий белок, способный связывать мышиный IL-1α и мышиный IL-1β, содержит аминокислотную последовательность тяжелой цепи DVD SEQ ID NO. 105 и аминокислотную последовательность легкой цепи DVD SEQ ID NO. 109.
В одном варианте осуществления связывающий белок, способный связывать IL-12 и IL-18, содержит аминокислотную последовательность тяжелой цепи DVD, выбранную из группы, состоящей из SEQ ID NO. 83, SEQ ID NO. 90, SEQ ID NO. 93, SEQ ID NO. 95 и SEQ ID NO. 114; и аминокислотную последовательность легкой цепи DVD, выбранную из группы, состоящей из SEQ ID NO. 86, SEQ ID NO. 91, SEQ ID NO. 94, SEQ ID NO. 46, SEQ ID NO. 96 и SEQ ID NO. 116.
В одном варианте осуществления связывающий белок, способный связывать CD20 и CD3, содержит аминокислотную последовательность тяжелой цепи DVD SEQ ID NO. 97 и аминокислотную последовательность легкой цепи DVD SEQ ID NO. 101.
В другом варианте осуществления связывающий белок согласно изобретению способен связывать один, два или более цитокинов, цитокин-родственных белков и рецепторов цитокинов, выбранных из группы, состоящей из BMP1, BMP2, BMP3B (GDF10), BMP4, BMP6, BMP8, CSF1 (M-CSF), CSF2 (GM-CSF), CSF3 (G-CSF), EPO, FGF1 (aFGF), FGF2 (bFGF), FGF3 (int-2), FGF4 (HST), FGF5, FGF6 (HST-2), FGF7 (KGF), FGF9, FGF10, FGF11, FGF12, FGF12B, FGF14, FGF16, FGF17, FGF19, FGF20, FGF21, FGF23, IGF1, IGF2, IFNA1, IFNA2, IFNA4, IFNA5, IFNA6, IFNA7, IFNB1, IFNG, IFNW1, FIL1, FIL1 (EPSILON), FIL1 (ZETA), IL1A, IL1B, IL2, IL3, IL4, IL5, IL6, IL7, IL8, IL9, IL10, IL11, IL12A, IL12B, IL13, IL14, IL15, IL16, IL17, IL17B, IL18, IL19, IL20, IL22, IL23, IL24, IL25, IL26, IL27, IL28A, IL28B, IL29, IL30, PDGFA, PDGFB, TGFA, TGFB1, TGFB2, TGFB3, LTA (TNF-b), LTB, TNF (TNF-a), TNFSF4 (лиганда OX40), TNFSF5 (лиганда CD40), TNFSF6 (FasL), TNFSF7 (лиганда СD27), TNFSF8 (лиганда CD30), TNFSF9 (лиганда 4-1BB), TNFSF10 (TRAIL), TNFSF11 (TRANCE), TNFSF12 (APO3L), TNFSF13 (April), TNFSF13B, TNFSF14 (HVEM-L), TNFSF15 (VEGI), TNFSF18, FIGF (VEGFD), VEGF, VEGFB, VEGFC, IL1R1, IL1R2, IL1RL1, IL1RL2, IL2RA, IL2RB, IL2RG, IL3RA, IL4R, IL5RA, IL6R, IL7R, IL8RA, IL8RB, IL9R, IL10RA, IL10RB, IL11RA, IL12RB1, IL12RB2, IL13RA1, IL13RA2, IL15RA, IL17R, IL18R1, IL20RA, IL21R, IL22R, IL1HY1, IL1RAP, IL1RAPL1, IL1RAPL2, IL1RN, IL6ST, IL18BP, IL18RAP, IL22RA2, AIF1, HGF, LEP (лептина), PTN и THPO.
Связывающий белок согласно изобретению способен связывать один или несколько хемокинов, рецепторов хемокинов и хемокин-родственных белков, выбранных из группы, состоящей из CCL1 (I-309), CCL2 (MCP-1/MCAF), CCL3 (MIP-1a), CCL4 (MIP-1b), CCL5 (RANTES), CCL7 (MCP-3), CCL8 (mcp-2), CCL11 (эотаксина), CCL13 (MCP-4), CCL15 (MIP-1d), CCL16 (HCC-4), CCL17 (TARC), CCL18 (PARC), CCL19 (MIP-3b), CCL20 (MIP-3a), CCL21 (SLC/эксодуса-2), CCL22 (MDC/STC-1), CCL23 (MPIF-1), CCL24 (MPIF-2/эотаксин-2), CCL25 (TECK), CCL26 (эотаксин-3), CCL27 (CTACK/ILC), CCL28, CXCL1 (GRO1), CXCL2 (GRO2), CXCL3 (GRO3), CXCL5 (ENA-78), CXCL6 (GCP-2), CXCL9 (MIG), CXCL10 (IP 10), CXCL11 (I-TAC), CXCL12 (SDF1), CXCL13, CXCL14, CXCL16, PF4 (CXCL4), PPBP (CXCL7), CX3CL1 (SCYD1), SCYE1, XCL1 (лимфотактина), XCL2 (SCM-1b), BLR1 (MDR15), CCBP2 (D6/JAB61), CCR1 (CKR1/HM145), CCR2 (mcp-1RB/RA), CCR3 (CKR3/CMKBR3), CCR4, CCR5 (CMKBR5/ChemR13), CCR6 (CMKBR6/CKR-L3/STRL22/DRY6), CCR7 (CKR7/EBI1), CCR8 (CMKBR8/TER1/CKR-L1), CCR9 (GPR-9-6), CCRL1 (VSHK1), CCRL2 (L-CCR), XCR1 (GPR5/CCXCR1), CMKLR1, CMKOR1 (RDC1), CX3CR1 (V28), CXCR4, GPR2 (CCR10), GPR31, GPR81 (FKSG80), CXCR3 (GPR9/CKR-L2), CXCR6 (TYMSTR/STRL33/Bonzo), HM74, IL8RA (IL8Ra), IL8RB (IL8Rb), LTB4R (GPR16), TCP10, CKLFSF2, CKLFSF3, CKLFSF4, CKLFSF5, CKLFSF6, CKLFSF7, CKLFSF8, BDNF, C5R1, CSF3, GRCC10 (C10), EPO, FY (DARC), GDF5, HIF1A, IL8, PRL, RGS3, RGS13, SDF2, SLIT2, TLR2, TLR4, TREM1, TREM2 и VHL. Связывающий белок согласно изобретению способен связывать белок клеточной поверхности, выбранный из группы, состоящей из интегринов. Связывающий белок согласно изобретению способен связывать фермент, выбранный из группы, состоящей из киназ и протеаз. Связывающий белок согласно изобретению способен связывать рецептор, выбранный из группы, состоящей из рецептора лимфокина, рецептора монокина и рецептора полипептидного гормона.
В предпочтительном варианте осуществления связывающий белок является мультивалентным. Более предпочтительно связывающий белок является мультиспецифическим. Мультивалентные и/или мультиспецифические связывающие белки, описанные выше, обладают желаемыми свойствами, в частности, с терапевтической точки зрения. Например, мультивалентный и/или мультиспецифический связывающий белок может (1) быть интернализован (и/или катаболизирован) быстрее, чем бивалентное антитело, клеткой, экспрессирующей антиген, с которым антитела связываются; (2) быть антителом-агонистом; и/или (3) индуцировать смерть клетки и/или апоптоз клетки, экспрессирующей антиген, с которым мультивалентное антитело может связываться. «Исходное антитело», которое обеспечивает по меньшей мере одну антигенсвязывающую специфичность мультивалентных и/или мультиспецифических связывающих белков, может быть антителом, которое интернализуется (и/или катаболизируется) клеткой, экспрессирующей антиген, с которым связывается антитело); и/или может быть агонистом, индуцирующим смерть клетки и/или индуцирующим апоптоз, и описанный здесь мультивалентный и/или мультиспецифический связывающий белок может проявлять улучшение (улучшения) в одном или нескольких из указанных свойств. Кроме того, исходное антитело может быть лишено любого одного или нескольких из этих свойств, но может быть наделено ими при конструировании в виде описанного здесь мультивалентного связывающего белка.
В другом варианте осуществления связывающий белок согласно изобретению имеет константу скорости ассоциации (Kon) в отношении одной или нескольких мишеней, выбранную из группы, состоящей из значений указанной константы, составляющих по меньшей мере приблизительно 102M-1с-1; по меньшей мере приблизительно 103M-1с-1; по меньшей мере приблизительно 104M-1с-1; по меньшей мере приблизительно 105M-1с-1; и по меньшей мере приблизительно 106M-1с-1, как измерено с использованием резонанса поверхностного плазмона. Предпочтительно связывающий белок согласно изобретению имеет константу скорости ассоциации (Kon) в отношении одной или нескольких мишеней, составляющую от 102M-1с-1 до 103M-1с1; от 103M-1с1до 104M-1с1; от 104M-1с-1 до 105M-1с-1 или от 105M-1с-1 до 106M-1с-1, как измерено с использованием резонанса поверхностного плазмона.
В другом варианте осуществления связывающий белок имеет константу скорости диссоциации (Koff) в отношении одной или нескольких мишеней, выбранную из группы, состоящей из значений указанной константы, составляющих самое большее приблизительно 10-3с-1; самое большее приблизительно 10-4с-1; самое большее приблизительно 10-5с-1; и самое большее приблизительно 10-6с-1, как измерено с использованием резонанса поверхностного плазмона. Предпочтительно связывающий белок согласно изобретению имеет константу скорости диссоциации (Koff) по отношению к одной или нескольким мишеням, составляющую от 10-3с-1до 10-4с-1; от 10-4с-1до 10-5с-1; или от 10-5с-1до 10-6с-1, как измерено с использованием резонанса поверхностного плазмона.
В другом варианте осуществления связывающий белок имеет константу диссоциации (KD) в отношении одной или нескольких мишеней, выбранную из группы, состоящей из значений указанной константы, составляющих самое большее приблизительно 10-7 M; самое большее приблизительно 10-8 M; самое большее приблизительно 10-9 M; самое большее приблизительно 10-10 M; самое большее приблизительно 10-11 M; самое большее приблизительно 10-12 M; и самое большее 10-13M. Предпочтительно связывающий белок согласно изобретению имеет константу диссоциации (KD) в отношении IL-12 или IL-23, составляющую от 10-7 M до 10-8 M; от 10-8 M до 10-9 M; от 10-9 M до 10-10 M; от 10-10 до 10-11 M; от 10-11 M до 10-12 M; или от 10-12 до M 10-13M.
В другом варианте осуществления описанный выше связывающий белок является конъюгатом, дополнительно содержащим агент, выбранный из группы, состоящей из молекулы иммуноадгезии, агента визуализации, терапевтического агента и цитотоксического агента. Предпочтительно агент визуализации выбран из группы, состоящей из радиоизотопной метки, фермента, флуоресцентной метки, люминесцентной метки, биолюминесцентной метки, магнитной метки и биотина. Более предпочтительно агентом визуализации является радиоизотопная метка, выбранная из группы, состоящей из3H,14C,35S,90Y,99Tc,111In,125I,131I,177Lu,166Ho и153Sm. Предпочтительно терапевтический или цитотоксический агент выбран из группы, состоящей из антиметаболита, алкилирующего агента, антибиотика, фактора роста, цитокина, антиангиогенного агента, антимитотического агента, антрациклина, токсина и апоптотического агента.
В другом варианте осуществления описанный выше связывающий белок является кристаллизованным связывающим белком и существует в виде кристалла. Предпочтительно этот кристалл является не содержащим носитель фармацевтическим кристаллом регулируемого высвобождения. Более предпочтительно кристаллизованный связывающий белок имеет больший период полу-жизни in vivo, чем растворимый аналог указанного связывающего белка. Наиболее предпочтительно кристаллизованный связывающий белок сохраняет биологическую активность.
В другом варианте осуществления описанный выше связывающий белок является гликозилированным. Предпочтительно гликозилирование является гликозилированием, характерным для человека.
Один из аспектов данного изобретения относится к выделенной нуклеиновой кислоте, кодирующей любой из описанных выше связывающих белков. Дополнительный вариант осуществления обеспечивает вектор, содержащий описанную выше нуклеиновую кислоту, причем указанный вектор выбран из группы, состоящей из pcDNA; pTT (Durocher et al., Nucleic Acids Research 2002, Vol 30, No.2); pTT3 (pTT с дополнительным сайтом множественного клонирования; pEFBOS (Mizushima, S. and Nagata, S., (1990) Nucleic acids Research Vol 18, No. 17); pBV; pJV; pcDNA3.1 TOPO, pEF6 TOPO и pBJ.
В другом аспекте клетку-хозяина трансформируют описанным выше вектором. Предпочтительно клеткой-хозяином является прокариотическая клетка. Более предпочтительно клеткой-хозяином является E.coli. В родственном варианте осуществления клеткой-хозяином является эукариотическая клетка. Предпочтительно эукариотическая клетка выбрана из группы, состоящей из клетки протиста, клетки животного, клетки растения и грибковой клетки. Более предпочтительно клеткой-хозяином является клетка млекопитающего, включая, но не ограничиваясь ими, СНО и COS; или грибковая клетка, такая как Saccharomyces cerevisiae; или клетка насекомого, такая как Sf9.
В другом аспекте данного изобретения предусмотрен способ получения описанного выше связывающего белка, включающий культивирование любой из клеток-хозяев, также описанных выше, в культуральной среде в условиях, достаточных для продуцирования связывающего белка. Предпочтительно 50%-75% связывающего белка, полученного указанным способом, являются четырехвалентным связывающим белком с двойной специфичностью. Более предпочтительно 75%-90% связывающего белка, полученного указанным способом, являются четырехвалентным белком с двойной специфичностью. Наиболее предпочтительно 90%-95% получаемого связывающего белка являются четырехвалентным связывающим белком с двойной специфичностью.
Другой вариант осуществления обеспечивает связывающий белок, полученный в соответствии с описанным выше способом.
Один из вариантов осуществления обеспечивает композицию для высвобождения связывающего белка, где композиция содержит готовую форму, которая, в свою очередь, содержит описанный выше кристаллизованный связывающий белок и ингредиент; и по меньшей мере один полимерный носитель. Предпочтительно полимерным носителем является полимер, выбранный из одной или нескольких групп, состоящих из поли(акриловой кислоты), поли(цианоакрилатов), поли(аминокислот), поли(ангидридов), поли(депсипептидов), поли(сложных эфиров), поли(молочной кислоты), сополимера молочной и гликолевой кислот или PLGA, поли(β-гидроксибутирата), поли(капролактона), поли(диоксанона); поли(этиленгликоля), поли(гидроксипропил)метакриламида, поли[(органо)фосфацена], поли(сложных ортоэфиров), поли(винилового спирта), поли(винилпирролидона), сополимеров малеинового ангидрида и алкилвинилового эфира, полиолов плуроников, альбумина, альгината, целлюлозы и производных целлюлозы, коллагена, фибрина, желатина, гиалуроновой кислоты, олигосахаридов, гликаминогликанов, сульфатированных полисахаридов, их смесей и сополимеров. Предпочтительно ингредиент выбран из группы, состоящей из альбумина, сахарозы, трегалозы, лактита, желатина, гидроксипропил-β-циклодекстрина, метоксиполиэтиленгликоля и полиэтиленгликоля. В другом варианте осуществления представлен способ лечения млекопитающего, включающий стадию введения млекопитающему эффективного количества описанной выше композиции.
Данное изобретение обеспечивает также фармацевтическую композицию, содержащую описанный выше связывающий белок и фармацевтически приемлемый носитель. В следующем варианте осуществления фармацевтическая композиция содержит по меньшей мере один дополнительный терапевтический агент для лечения нарушения. Предпочтительно дополнительный агент выбран из группы, состоящей из терапевтического агента, агента визуализации, цитотоксического агента, ингибиторов ангиогенеза (включая, но не ограничиваясь ими, анти-VEGF-антитела или VEGF-trap); ингибиторов киназ (включая, но не ограничиваясь ими, ингибиторы KDR и TIE-2); блокаторов молекул костимуляции (включая, но не ограничиваясь ими, анти-B7.1, анти-B7.2, CTLA4-Ig, анти-CD20); блокаторов молекул адгезии (включая, но не ограничиваясь ими, анти-LFA-1-Ab, анти-E/L селектин-Ab, ингибиторы с малой молекулой); анти-цитокин-антитела или его функционального фрагмента (включая, но не ограничиваясь ими, анти-IL-18, анти-TNF, антитела против IL-6/рецептора цитокина); метотрексата; циклоспорина; рапамицина; FK506; детектируемой метки или репортера; антагониста TNF; противоревматического агента; миорелаксанта, наркотического агента, нестероидного противовоспалительного лекарственного средства (NSAID), аналгезирующего агента, анестезирующего агента, седативного средства, местного анестезирующего средства, нервно-мышечного блокатора, противомикробного агента, антипсориатического агента, кортикостероида, анаболического стероида, эритропоэтина, иммунизации, иммуноглобулина, иммунодепрессанта, гормона роста, замещающего гормон лекарственного средства, радиофармацевтического средства, антидепрессанта, антипсихотического средства, стимулятора, противоастматического средства, бета-агониста, ингалируемого стероида, эпинефрина или его аналога, цитокина и антагониста цитокина.
В другом аспекте данное изобретение обеспечивает способ лечения субъекта-человека, страдающего от нарушения, в котором мишень или мишени, способные связываться описанным выше связывающим белком, является (являются) вредными, предусматривающий введение этому субъекту-человеку описанного выше связывающего белка так, чтобы ингибировать активность мишени или мишеней у субъекта-человека и добиться лечения. Предпочтительно нарушение выбрано из группы, состоящей из артрита, остеоартрита, хронического ювенильного артрита, септического артрита, артрита Лайма, псориатического артрита, реактивного артрита, спондилоартропатии, системной красной волчанки, болезни Крона, язвенного колита, воспалительного заболевания кишечника, инсулинзависимого сахарного диабета, тиреоидита, астмы, аллергических заболеваний, псориаза, дерматита, склеродермии, болезни трансплантат против хозяина, отторжения трансплантатов органов, острого или хронического иммунного заболевания, ассоциированного с трансплантацией органов, саркоидоза, атеросклероза, диссеминированного внутрисосудистого свертывания, болезни Кавасаки, болезни Грейвса, нефротического синдрома, синдрома хронической усталости, гранулематоза Вегенера, пурпуры Геноха-Шенлейна, микроскопического васкулита почек, хронического активного гепатита, увеита, септического шока, синдрома токсического шока, синдрома сепсиса, кахексии, инфекционных заболеваний, паразитарных заболеваний, синдрома приобретенного иммунодефицита, острого поперечного миелита, хореи Гентингтона, болезни Паркинсона, болезни Альцгеймера, инсульта, первичного билиарного цирроза, гемолитической анемии, злокачественных заболеваний, сердечной недостаточности, инфаркта миокарда, болезни Аддисона, спорадической плюригландулярной недостаточности типа I и плюригландулярной недостаточности типа II, синдрома Шмидта, (острого) респираторного дистресс-синдрома взрослых, алопеции, гнездной (очаговой) алопеции, сероотрицательной артропатии, артропатии, болезни Рейтера, псориатической артропатии, артропатии язвенного колита, энтеропатического синовита, ассоциированной с Chlamydia, Yersinia и Salmonella артропатии, спондилоартропатии, атероматозного заболевания/артериосклероза, атопической аллергии, аутоиммунного буллезного заболевания, пузырчатки обыкновенной, листовидной пузырчатки, пемфигоида, линейного IgA-заболевания, аутоиммунной гемолитической анемии, положительной гемолитической анемии Кумбса, приобретенной пернициозной анемии, ювенильной пернициозной анемии, миалгического энцефалита/британского миалгического энцефалита, хронического кожно-слизистого кандидоза, гигантоклеточного артериита, первичного склерозирующего гепатита, криптогенного аутоиммунного гепатита, синдрома приобретенного иммунодефицита, заболеваний, родственных приобретенному иммунодефициту, гепатита В, гепатита С, общего транзиторного иммунодефицита (общей транзиторной гипогаммаглобулинемии), дилатационной кардиомиопатии, женского бесплодия, угасания функции яичников, преждевременного угасания функции яичников, фибротического заболевания легких, криптогенного фиброзирующего альвеолита, послевоспалительного интерстициального заболевания легких, интерстициального пневмонита, ассоциированной с болезнью соединительной ткани интерстициальной болезни легких, ассоциированной с болезнью смешанной соединительной ткани болезни легких, ассоциированной с системным склерозом интерстициальной болезни легких, ассоциированной с ревматоидным артритом интерстициальной болезни легких, ассоциированной с системной красной волчанкой болезни легких, ассоциированной с дерматомиозитом/полимиозитом болезни легких, ассоциированной с болезнью Шегрена болезни легких, ассоциированной с анкилозирующим спондилитом болезни легких, васкулитной диффузной болезни легких, ассоциированной с гемосидерозом болезни легких, индуцированной лекарственным средством интерстициальной болезни легких, фиброза, лучевого фиброза, облитерирующего бронхиолита, хронической эозинофильной пневмонии, лимфоцитарного инфильтративного заболевания легких, постинфекционного интерстициального заболевания легких, подагрического артрита, аутоиммунного гепатита, аутоиммунного гепатита типа-1 (классического аутоиммунного или люпоидного гепатита), аутоиммунного гепатита типа-2 (гепатита с анти-LKM-антителами), аутоиммунно опосредованной гипогликемии, инсулинорезистентности типа В с папиллярно-пигментной дистрофией кожи (acanthosis nigricans), гипопаратиреоза, острого иммунного заболевания, ассоциированного с трансплантацией органа, хронического иммунного заболевания, ассоциированного с трансплантацией органа, остеоартроза, первичного склерозирующего холангита, псориаза типа 1, псориаза типа 2, идиопатической лейкопении, аутоиммунной нейтропении, почечного заболевания NOS (БДУ), гломерулонефрита, микроскопического васкулита почек, болезни Лайма, дискоидной красной волчанки, мужского бесплодия идиопатического или NOS (БДУ), аутоиммунности спермы, рассеянного склероза (всех подтипов), симпатической офтальмии, легочной гипертензии, вторичной относительно заболевания соединительной ткани, синдрома Гудпасчера, легочной манифестации нодозного полиартериита, острой ревматической лихорадки, ревматоидного спондилита, болезни Стилла, системного склероза, синдрома Шегрена, болезни Такаясу/артериита, аутоиммунной тромбоцитопении, идиопатической тромбоцитопении, аутоиммунного заболевания щитовидной железы, гипертиреоза, зобного аутоиммунного гипотиреоза (болезни Хашимото), атрофического аутоиммунного гипотиреоза, первичной микседемы, факогенного увеита, первичного васкулита, витилиго, острого заболевания печени, хронического заболевания печени, алкогольного цирроза, индуцированного алкоголем повреждения печени, холестаза, идиосинкратической болезни печени, индуцированного лекарственным средством гепатита, неалкогольного стеатогепатита, аллергии и астмы, стрептококковой инфекции группы В (GBS), психических нарушений (например, депрессии и шизофрении), Th типа 2- и Th типа 1-опосредованных заболеваний, острой и хронической боли (различных форм боли) и раковых заболеваний, таких как рак легкого, молочной железы, желудка, мочевого пузыря, ободочной кишки, поджелудочной железы, яичников, предстательной железы и прямой кишки, и гемопоэтических злокачественных заболеваний (лейкоза и лимфомы), абеталипопротеинемии, акроцианоза, острых и хронических паразитарных или инфекционных процессов, острого лейкоза, острого лимфобластного лейкоза (ALL), острого миелоидного лейкоза (AML), острой или хронической бактериальной инфекции, острого панкреатита, острой почечной недостаточности, аденокарцином, предсердных эктопических систол, комплекса СПИД-деменция, индуцированного алкоголем гепатита, аллергического конъюнктивита, аллергического контактного дерматита, аллергического ринита, отторжения аллотрансплантата, недостаточности альфа-l-антитрипсина, амиотрофического бокового склероза, анемии, стенокардии, дегенерации клеток переднего рога спинного мозга, анти-cd3-терапии, антифосфолипидного синдрома, аллергических реакций на противорецепторные антитела, аневризмы аорты и периферических сосудов, рассечения аорты, артериальной гипертензии, артериосклероза, атриовентрикулярной фистулы, атаксии, предсердной фибрилляции (стойкой или пароксизмальной), трепетания предсердий, атриовентрикулярной блокады, В-клеточной лимфомы, отторжения костного трансплантата, отторжения трансплантата костного мозга (BMT), межжелудочковой блокады, лимфомы Беркитта, ожогов, сердечных аритмий, синдрома временной остановки сердца, опухолей сердца, кардиомиопатии, воспалительной реакции при искусственном кровообращении, отторжения трансплантата хряща, церебеллярных кортикальных дегенераций, церебеллярных нарушений, хаотической или мультиочаговой предсердной тахикардии, ассоциированных с химиотерапией нарушений, хронического миелоцитарного лейкоза (CML), хронического алкоголизма, хронических воспалительных патологий, хронического лимфоцитарного лейкоза (CLL), хронической обструктивной болезни легких (COPD), хронической интоксикации салицилатом, рака ободочной кишки, застойной сердечной недостаточности, конъюнктивита, контактного дерматита, легочного сердца, болезни коронарных артерий, болезни Крейтцфельдта-Якоба, отрицательного в культуре сепсиса, муковисцидоза, ассоциированных с терапией цитокинами нарушений, боксерской деменции, демиелинизирующих заболеваний, геморрагической лихорадки Денге, дерматита, дерматологических состояний, диабета, сахарного диабета, диабетического артериосклеротического заболевания, заболевания с диффузными тельцами Леви, дилатационной застойной кардиомиопатии, нарушений базальных (подкорковых) ядер головного мозга, синдрома Дауна в среднем возрасте, индуцированных лекарственными средствами нарушений движения, нарушений, индуцированных лекарственными средствами, которые блокируют рецепторы допамина ЦНС, чувствительности к лекарственным средствам, экземы, энцефаломиелита, эндокардита, эндокринопатии, эпиглоттита, инфекции вирусом Эпштейна-Барр, эритромелалгии, экстрапирамидных и церебеллярных нарушений, семейного гематофагоцитарного лимфоцитарного гистиоцитоза, отторжения имплантата фетальной вилочковой железы, атаксии Фридрейха, функциональных периферических артериальных нарушений, грибкового сепсиса, газовой (анаэробной) гангрены, язвы желудка, гломерулонефрита, отторжения трансплантата любого органа или любой ткани, грамотрицательного сепсиса, грамположительного сепсиса, гранулем, вызываемых внутриклеточными организмами, лейкемического ретикулоэндотелиоза, болезни Халлеррордена-Шпатца, тиреоидита Хашимото, сенной лихорадки, отторжения трансплантата сердца, гемохроматоза, гемодиализа, гемолитического уремического синдрома/тромболитической тромбоцитопенической пурпуры, кровотечения, гепатита (A), аритмии пучка Гиса, ВИЧ-инфекции/ВИЧ-невропатии, болезни Ходжкина, гиперкинетических нарушений движения, аллергических реакций, аллергического пневмонита, гипертензии, гипокинетических нарушений движения, диагностики системы гипоталамус-гипофиз-надпочечники, идиопатической болезни Аддисона, идиопатического легочного фиброза, опосредованной антителами цитотоксичности, астении, детской спинально-мышечной атрофии, воспаления аорты, гриппа А, воздействия ионизирующей радиацией, иридоциклита/увеита/неврита зрительного нерва, ишемического/реперфузионного повреждения, ишемического инсульта, ювенильного ревматоидного артрита, ювенильной спинально-мышечной атрофии, саркомы Капоши, отторжения трансплантата почки, инфекций микобактерией Legionella, лейшманиоза, проказы, повреждений кортико-спинальной системы, жирового отека, отторжения трансплантата печени, лимфатического отека, малярии, злокачественной лимфомы, злокачественного гистиоцитоза, злокачественной меланомы, менингита, менингококкемии, метаболической/идиопатической, кластерной головной боли, митохондриального мультисистемного нарушения, заболевания смешанной соединительной ткани, моноклональной гаммопатии, множественной миеломы, дегенераций множественных систем (Mencel Dejerine-Thomas Shi-Drager и Machado-Joseph), тяжелой псевдопаралитической миастении, Мycobacterium avium intracellulare, туберкулезной бациллы, синдрома миелодисплазии, инфаркта миокарда, ишемических нарушений миокарда, рака носоглотки, хронического заболевания легких новорожденных, нефрита, нефроза, нейродегенеративных заболеваний, нейрогенных I мышечных атрофий, нейрогенной лихорадки, не-Ходжкинской лимфомы, закупорки брюшной аорты и ее ответвлений, окклюзивных артериальных нарушений, okt3-терапии, орхита/эпидидимита, процедур после лечения орхита/вазэктомии, органомегалии, остеопороза, отторжения трансплантата поджелудочной железы, рака поджелудочной железы, паранеопластического синдрома/гиперкальциемии при злокачественных заболеваниях, отторжения трансплантата паращитовидной железы, воспалительного заболевания почечных лоханок, круглогодичного ринита, заболевания перикарда, периферического атеросклеротического заболевания, периферических васкулярных нарушений, перитонита, пернициозной анемии, пневмонии, вызываемой Рneumocystis carinii, пневмонии, синдрома POEMS (полиневропатии, органомегалии, эндокринопатии, моноклональной гаммопатии и синдрома изменений кожи), постперфузионного синдрома, постгемодиализного синдрома, синдрома пост-MI-кардиотомии, пре-эклампсии, прогрессирующего супрануклеарного паралича, первичной легочной гипертензии, лучевой терапии, феномена и болезни Рейно, болезни Рейно, болезни Рефсума, тахикардии с регулярными узкими QRS, реноваскулярной (почечно-сосудистой) гипертензии, реперфузионного повреждения, рестриктивной кардиомиопатии, сарком, склеродермии, сенильной хореи, сенильной деменции, ассоциированной с тельцами Леви, сероотрицательных артропатий, шока, серповидно-клеточной анемии, отторжения аллотрансплантата кожи, синдрома изменений кожи, отторжения трансплантата тонкой кишки, солидных опухолей, специфических аритмий, спинальной атаксии, спинально-церебеллярных дегенераций, стрептококкового миозита, структурных повреждений мозжечка, подострого склерозирующего панэнцефалита, обморока (синкопе), сердечно-сосудистого сифилиса, системной анафилаксии, синдрома системной воспалительной реакции, системного ювенильного ревматоидного артрита, T-клеточного или FAB ALL (острого лимфобластного лейкоза), телангиэктазии, облитерирующего тромбоангиита, тромбоцитопении, токсичности, трансплантатов, травмы/кровотечения, аллергических реакций типа III, аллергии типа IV, нестабильной стенокардии, уремии, уросепсиса, крапивницы, вальвулярных сердечных заболеваний, варикозных вен, васкулита, венозных заболеваний, венозного тромбоза, фибрилляции (мерцания) желудочков, вирусных и грибковых инфекций, острого энцефалита с высоким риском смертельного исхода/асептического менингита, гемафагоцитарного синдрома, ассоциированного с высоким риском смертельного исхода, синдрома Вернике-Корсакова, заболевания Вильсона, отторжения ксенотрансплантата любого органа или любой ткани.
В другом аспекте данное изобретение обеспечивает способ лечения пациента, страдающего от нарушения, предусматривающий стадию введения любого из описанных выше связывающих белков до, одновременно или после введения второго агента, как обсуждалось выше. В предпочтительном варианте осуществления второй агент выбран из группы, состоящей из буденозида, эпидермального фактора роста, кортикостероидов, циклоспорина, сульфасалазина, аминосалицилатов, 6-меркаптопурина, азатиоприна, метронидазола, ингибиторов липоксигеназы, месаламина, олсалазина, балсалазида, антиоксидантов, ингибиторов тромбоксана, антагонистов рецептора IL-1, моноклональных анти-IL-1β-антител, моноклональных анти-IL-6-антител, факторов роста, ингибиторов эластазы, пиридинилимидазольных соединений, антител или агонистов TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-12, IL-13, IL-15, IL-16, IL-18, IL-23, EMAP-II, GM-CSF, FGF и PDGF, антител CD2, CD3, CD4, CD8, CD-19, CD25, CD28, CD30, CD40, CD45, CD69, CD90 или их лигандов, метотрексата, циклоспорина, FK506, рапамицина, микофенолята мофетила, лефлуномида, NSAID, ибупрофена, кортикостероидов, преднизолона, ингибиторов фосфодиэстеразы, агонистов аденозина, антитромботических агентов, ингибиторов комплемента, адренергических агентов, IRAK, NIK, IKK, p38, ингибиторов MAP-киназы, ингибиторов IL-1β-превращающего фермента, ингибиторов TNFα-превращающего фермента, ингибиторов передачи сигнала Т-клеток, ингибиторов металлопротеиназы, сульфасалазина, азатиоприна, 6-меркаптопуринов, ингибиторов ангиотензин-превращающего фермента, растворимых рецепторов цитокинов, растворимого рецептора TNF р55, растворимого рецептора TNF р75, sIL-1RI, sIL-1RII, sIL-6R, противовоспалительных цитокинов, IL-4, IL-10, IL-11, IL-13 и TGFβ.
В предпочтительном варианте осуществления описанные выше фармацевтические композиции вводят субъекту по меньшей мере одним способом, выбранным из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, внутрибрюшного, интракапсулярного, внутрихрящевого, внутриполостного, внутриклеточного, интрацеребеллярного, интрацеребровентрикулярного, внутрикишечного, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутритазового, интраперикардиального, внутрибрюшинного, внутриплеврального, внутрипростатического, внутрилегочного, интраректального, интраренального, интраретинального, интраспинального, интрасиновиального, внутригрудного, внутриматочного, интравезикулярного, болюсного, вагинального, ректального, буккального, сублингвального, интраназального и трансдермального способов.
В одном из аспектов настоящего изобретения предусмотрено по меньшей мере одно антиидиотипическое антитело по меньшей мере для одного связывающего белка согласно изобретению. Это антиидиотипическое антитело включает в себя любую содержащую белок или пептид молекулу, которая содержит по меньшей мере часть молекулы иммуноглобулина, такую как, без ограничения, по меньшей мере один определяющий комплементарность район (CDR) тяжелой или легкой цепи или его связывающую лиганд часть, вариабельный район тяжелой цепи или легкой цепи, константный район тяжелой цепи или легкой цепи, каркасный район или любую их часть, которые могут быть включены в связывающий белок согласно изобретению.
В другом варианте осуществления связывающие белки согласно изобретению способны связывать одну или несколько мишеней, выбранных из группы, состоящей из ABCF1; ACVR1; ACVR1B; ACVR2; ACVR2B; ACVRL1; ADORA2A; Aggrecan; AGR2; AICDA; AIF1; AIG1; AKAP1; AKAP2; AMH; AMHR2; ANGPT1; ANGPT2; ANGPTL3; ANGPTL4; ANPEP; APC; APOC1; AR; AZGP1 (цинк-a-гликопротеина); B7.1; B7.2; BAD; BAFF; BAG1; BAI1; BCL2; BCL6; BDNF; BLNK; BLR1 (MDR15); BlyS; BMP1; BMP2; BMP3B (GDF10); BMP4; BMP6; BMP8; BMPR1A; BMPR1B; BMPR2; BPAG1 (плектина); BRCA1; C19orf10 (IL27w); C3; C4A; C5; C5R1; CANT1; CASP1; CASP4; CAV1; CCBP2 (D6/JAB61); CCL1 (I-309); CCL11 (эотаксина); CCL13 (MCP-4); CCL15 (MIP-1d); CCL16 (HCC-4); CCL17 (TARC); CCL18 (PARC); CCL19 (MIP-3b); CCL2 (MCP-1); MCAF; CCL20 (MIP-3a); CCL21 (MIP-2); SLC; exodus-2; CCL22 (MDC/STC-1); CCL23 (MPIF-1); CCL24 (MPIF-2/эотаксина-2); CCL25 (TECK); CCL26 (эотаксина-3); CCL27 (CTACK/ILC); CCL28; CCL3 (MIP-1a); CCL4 (MIP-1b); CCL5 (RANTES); CCL7 (MCP-3); CCL8 (mcp-2); CCNA1; CCNA2; CCND1; CCNE1; CCNE2; CCR1 (CKR1/HM145); CCR2 (mcp-1RB/RA); CCR3 (CKR3/CMKBR3); CCR4; CCR5 (CMKBR5/ChemR13); CCR6 (CMKBR6/CKR-L3/STRL22/DRY6); CCR7 (CKR7/EBI1); CCR8 (CMKBR8/TER1/CKR-L1); CCR9 (GPR-9-6); CCRL1 (VSHK1); CCRL2 (L-CCR); CD164; CD19; CD1C; CD20; CD200; CD-22; CD24; CD28; CD3; CD37; CD38; CD3E; CD3G; CD3Z; CD4; CD40; CD40L; CD44; CD45RB; CD52; CD69; CD72; CD74; CD79A; CD79B; CD8; CD80; CD81; CD83; CD86; CDH1 (E-кадгерина); CDH10; CDH12; CDH13; CDH18; CDH19; CDH20; CDH5; CDH7; CDH8; CDH9; CDK2; CDK3; CDK4; CDK5; CDK6; CDK7; CDK9; CDKN1A (p21Wap1/Cip1); CDKN1B (p27Kip1); CDKN1C; CDKN2A (p16INK4a); CDKN2B; CDKN2C; CDKN3; CEBPB; CER1; CHGA; CHGB; хитиназы; CHST10; CKLFSF2; CKLFSF3; CKLFSF4; CKLFSF5; CKLFSF6; CKLFSF7; CKLFSF8; CLDN3; CLDN7 (клаудина-7); CLN3; CLU (кластерина); CMKLR1; CMKOR1 (RDC1); CNR1; COL18A1; COL1A1; COL4A3; COL6A1; CR2; CRP; CSF1 (M-CSF); CSF2 (GM-CSF); CSF3 (GCSF); CTLA4; CTNNB1 (b-катенина); CTSB (катепсина B); CX3CL1 (SCYD1); CX3CR1 (V28); CXCL1 (GRO1); CXCL10 (IP-10); CXCL11 (I-TAC/IP-9); CXCL12 (SDF1); CXCL13; CXCL14; CXCL16; CXCL2 (GRO2); CXCL3 (GRO3); CXCL5 (ENA-78/LIX); CXCL6 (GCP-2); CXCL9 (MIG); CXCR3 (GPR9/CKR-L2); CXCR4; CXCR6 (TYMSTR/STRL33/Bonzo); CYB5; CYC1; CYSLTR1; DAB2IP; DES; DKFZp451J0118; DNCL1; DPP4; E2F1; ECGF1; EDG1; EFNA1; EFNA3; EFNB2; EGF; EGFR; ELAC2; ENG; ENO1; ENO2; ENO3; EPHB4; EPO; ERBB2 (Her-2); EREG; ERK8; ESR1; ESR2; F3 (TF); FADD; FasL; FASN; FCER1A; FCER2; FCGR3A; FGF; FGF1 (aFGF); FGF10; FGF11; FGF12; FGF12B; FGF13; FGF14; FGF16; FGF17; FGF18; FGF19; FGF2 (bFGF); FGF20; FGF21; FGF22; FGF23; FGF3 (int-2); FGF4 (HST); FGF5; FGF6 (HST-2); FGF7 (KGF); FGF8; FGF9; FGFR3; FIGF (VEGFD); FIL1 (EPSILON); FIL1 (ZETA); FLJ12584; FLJ25530; FLRT1 (фибронектина); FLT1; FOS; FOSL1 (FRA-1); FY (DARC); GABRP (GABAa); GAGEB1; GAGEC1; GALNAC4S-6ST; GATA3; GDF5; GFI1; GGT1; GM-CSF; GNAS1; GNRH1; GPR2 (CCR10); GPR31; GPR44; GPR81 (FKSG80); GRCC10 (C10); GRP; GSN (гелсолина); GSTP1; HAVCR2; HDAC4; HDAC5; HDAC7A; HDAC9; HGF; HIF1A; HIP1; гистамина и рецепторов гистамина; HLA-A; HLA-DRA; HM74; HMOX1; HUMCYT2A; ICEBERG; ICOSL; ID2; IFN-a; IFNA1; IFNA2; IFNA4; IFNA5; IFNA6; IFNA7; IFNB1; IFNгамма; IFNW1; IGBP1; IGF1; IGF1R; IGF2; IGFBP2; IGFBP3; IGFBP6; IL-1; IL10; IL10RA; IL10RB; IL11; IL11RA; IL-12; IL12A; IL12B; IL12RB1; IL12RB2; IL13; IL13RA1; IL13RA2; IL14; IL15; IL15RA; IL16; IL17; IL17B; IL17C; IL17R; IL18; IL18BP; IL18R1; IL18RAP; IL19; IL1A; IL1B; IL1F10; IL1F5; IL1F6; IL1F7; IL1F8; IL1F9; IL1HY1; IL1R1; IL1R2; IL1RAP; IL1RAPL1; IL1RAPL2; IL1RL1; IL1RL2 IL1RN; IL2; IL20; IL20RA; IL21R; IL22; IL22R; IL22RA2; IL23; IL24; IL25; IL26; IL27; IL28A; IL28B; IL29; IL2RA; IL2RB; IL2RG; IL3; IL30; IL3RA; IL4; IL4R; IL5; IL5RA; IL6; IL6R; IL6ST (гликопротеина 130); IL7; IL7R; IL8; IL8RA; IL8RB; IL8RB; IL9; IL9R; ILK; INHA; INHBA; INSL3; INSL4; IRAK1; IRAK2; ITGA1; ITGA2; ITGA3; ITGA6 (a6-интегрина); ITGAV; ITGB3; ITGB4 (b4-интегрина); JAG1; JAK1; JAK3; JUN; K6HF; KAI1; KDR; KITLG; KLF5 (GC Box BP); KLF6; KLK10; KLK12; KLK13; KLK14; KLK15; KLK3; KLK4; KLK5; KLK6; KLK9; KRT1; KRT19 (кератина 19); KRT2A; KRTHB6 (специфического для волос кератина типа II); LAMA5; LEP (лептина); Lingo-p75; Lingo-Troy; LPS; LTA (TNF-b); LTB; LTB4R (GPR16); LTB4R2; LTBR; MACMARCKS; MAG или Omgp; MAP2K7 (c-Jun); MDK; MIB1; мидкина; MIF; MIP-2; MKI67 (Ki-67); MMP2; MMP9; MS4A1; MSMB; MT3 (металлотионектина-III); MTSS1; MUC1 (муцина); MYC; MYD88; NCK2; нейрокана; NFKB1; NFKB2; NGFB (NGF); NGFR; NgR-Lingo; NgR-Nogo66 (Nogo); NgR-p75; NgR-Troy; NME1 (NM23A); NOX5; NPPB; NR0B1; NR0B2; NR1D1; NR1D2; NR1H2; NR1H3; NR1H4; NR1I2; NR1I3; NR2C1; NR2C2; NR2E1; NR2E3; NR2F1; NR2F2; NR2F6; NR3C1; NR3C2; NR4A1; NR4A2; NR4A3; NR5A1; NR5A2; NR6A1; NRP1; NRP2; NT5E; NTN4; ODZ1; OPRD1; P2RX7; PAP; PART1; PATE; PAWR; PCA3; PCNA; PDGFA; PDGFB; PECAM1; PF4 (CXCL4); PGF; PGR; фосфакана; PIAS2; PIK3CG; PLAU (uPA); PLG; PLXDC1; PPBP (CXCL7); PPID; PR1; PRKCQ; PRKD1; PRL; PROC; PROK2; PSAP; PSCA; PTAFR; PTEN; PTGS2 (COX-2); PTN; RAC2 (p21Rac2); RARB; RGS1; RGS13; RGS3; RNF110 (ZNF144); ROBO2; S100A2; SCGB1D2 (липофилина B); SCGB2A1 (маммаглобина 2); SCGB2A2 (маммаглобина 1); SCYE1 (эндотелиального моноцит-активирующего цитокина); SDF2; SERPINA1; SERPINA3; SERPINB5 (маспина); SERPINE1 (PAI-1); SERPINF1; SHBG; SLA2; SLC2A2; SLC33A1; SLC43A1; SLIT2; SPP1; SPRR1B (Spr1); ST6GAL1; STAB1; STAT6; STEAP; STEAP2; TB4R2; TBX21; TCP10; TDGF1; TEK; TGFA; TGFB1; TGFB1I1; TGFB2; TGFB3; TGFBI; TGFBR1; TGFBR2; TGFBR3; TH1L; THBS1 (тромбоспондина-1); THBS2; THBS4; THPO; TIE (Tie-1); TIMP3; тканевого фактора; TLR10; TLR2; TLR3; TLR4; TLR5; TLR6; TLR7; TLR8; TLR9; TNF; TNF-a; TNFAIP2 (B94); TNFAIP3; TNFRSF11A; TNFRSF1A; TNFRSF1B; TNFRSF21; TNFRSF5; TNFRSF6 (Fas); TNFRSF7; TNFRSF8; TNFRSF9; TNFSF10 (TRAIL); TNFSF11 (TRANCE); TNFSF12 (APO3L); TNFSF13 (April); TNFSF13B; TNFSF14 (HVEM-L); TNFSF15 (VEGI); TNFSF18; TNFSF4 (лиганда OX40); TNFSF5 (лиганда CD40); TNFSF6 (FasL); TNFSF7 (лиганда CD27); TNFSF8 (лиганда CD30); TNFSF9 (лиганда 4-1BB); TOLLIP; Toll-подобных рецепторов; TOP2A (топоизомеразы Iia); TP53; TPM1; TPM2; TRADD; TRAF1; TRAF2; TRAF3; TRAF4; TRAF5; TRAF6; TREM1; TREM2; TRPC6; TSLP; TWEAK; VEGF; VEGFB; VEGFC; версикана; VHL C5; VLA-4; XCL1 (лимфотактина); XCL2 (SCM-1b); XCR1 (GPR5/CCXCR1); YY1; и ZFPM2.
Краткое описание рисунков
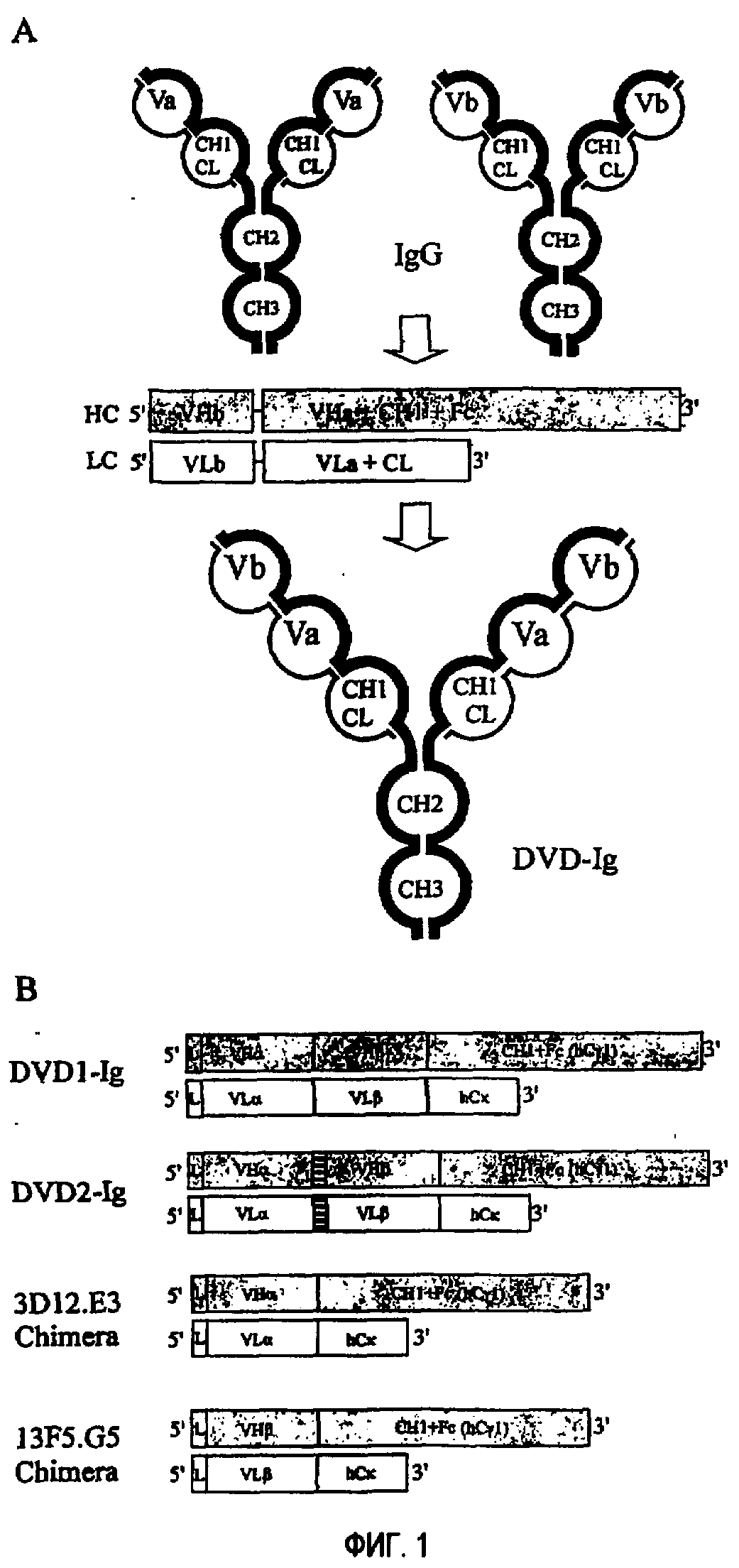
Фиг.1A является схематическим представлением конструкций Двойной Вариабельный Домен (DVD)-Ig и показывает стратегию генерирования DVD-Ig из двух исходных антител; Фиг.1B является схематическим представлением конструкций DVD1-Ig, DVD2-Ig и двух химерных моноспецифических антител из двух гибридомных клонов 2D13.E3 (анти-IL-1α) и 13F5.G5 (анти-IL-1β).
Подробное описание изобретения
Данное изобретение относится к мультивалентным и/или мультиспецифическим связывающим белкам, способным связывать два или более антигенов. Конкретно, изобретение относится к иммуноглобулинам с двойными вариабельными доменами (DVD-Ig) и их фармацевтическим композициям, а также к нуклеиновым кислотам, рекомбинантным экспрессирующим векторам и клеткам-хозяевам для получения таких DVD-Ig. В данное изобретение также включены способы применения DVD-Ig согласно изобретению для детектирования специфических антигенов либо in vitro, либо in vivo.
Если нет других определенных здесь указаний, научные и технические термины, используемые в связи с настоящим изобретением, будут иметь значения, которые обычно понимаются специалистами в данной области. Значение и объем данных терминов должны быть ясны, однако в случае любой неопределенности приведенные здесь определения следует считать превалирующими над любым словарным или иным определением. Кроме того, если контекст не требует явно иного значения, термины в единственном числе будут подразумевать и множественное число, а термины во множественном числе будут включать в себя и единственное число. В этой заявке использование «или» означает «и/или», если нет другого указания. Кроме того, использование термина «включающий в себя», а также других форм, таких как «включает в себя» и «включали в себя» не является ограничивающим. Термины, такие как «элемент» или «компонент» включают в себя как элементы, так и компоненты, содержащие одну единицу, и элементы и компоненты, которые содержат более чем одну субъединицу, если нет конкретного другого указания.
Обычно номенклатуры (и способы), используемые в связи с культурой клеток и ткани, молекулярной биологией, иммунологией, микробиологией, генетикой и химией белков и нуклеиновых кислот и гибридизацией, описанными в данном документе, являются номенклатурами, хорошо известными и обычно используемыми в данной области. Методы и способы согласно изобретению выполняют обычно в соответствии с общепринятыми способами, хорошо известными в данной области и описанными в различных общих и более конкретных ссылках, которые цитируются и обсуждаются во всем данном описании, если нет других указаний. Ферментативные реакции и способы очистки выполняют в соответствии с описаниями изготовителя, как это обычно выполняется в данной области или описано здесь. Номенклатуры (и лабораторные процедуры и способы), используемые в связи с аналитической химией, синтетической органической химией и медицинской и фармацевтической химией, описанные здесь, являются хорошо известными и обычно применяемыми в данной области. Стандартные способы используют для химических синтезов, химического анализа, фармацевтического приготовления, получения готовых форм и доставки и для лечения пациентов.
Для более легкого понимания настоящего изобретения выбранные термины определены ниже.
Используемый в данном описании термин “полипептид” относится к любой полимерной цепи аминокислот. Термины “пептид” и “белок” используются взаимозаменяемо и также относятся к полимерной цепи аминокислот. Термин “полипептид” включает в себя нативные или искусственные белки, фрагменты белков и полипептидные аналоги белковой последовательности. Полипептид может быть мономерным или полимерным.
Термин “выделенный белок" или “выделенный полипептид" означает белок или полипептид, который вследствие его происхождения или источника получения не ассоциирован с природно-ассоциированными компонентами, которые сопутствуют ему в его нативном состоянии; по существу не содержит других белков из того же самого вида; экспрессируется клеткой из другого вида или не встречается в природе. Таким образом, полипептид, который химически синтезирован или синтезирован в клеточной системе, отличающейся от клетки, из которой он происходит в природе, будет «выделенным» из его природно-ассоциированных компонентов. Белок может быть также по существу освобожден от природно-ассоциированных компонентов выделением с использованием способов очистки белков, хорошо известных в данной области.
Используемый в данном описании термин “извлечение” относится к способу по существу освобождения химической разновидности, такой как полипептид, от природно-ассоциированных компонентов путем выделения, например, с использованием способов очистки белков, хорошо известных в данной области.
“Биологическая активность” в данном контексте относится ко всем биологическим свойствам, присущим антигену. Биологические свойства включают в себя, но не ограничиваются ими, связывание рецептора, индукцию пролиферации клеток, ингибирование роста клеток, индукции других цитокинов, индукцию апоптоза и ферментативную активность.
Термины “специфическое связывание” или “специфически связывающий” в данном контексте со ссылкой на взаимодействие антитела, белка или пептида со второй химической частицей означает, что это взаимодействие зависит от присутствия конкретной структуры (например, антигенной детерминанты или эпитопа) на указанной химической частице; например, антитело узнает конкретную структуру белка и связывается с конкретной структурой белка, а не с белками в целом. Если антитело является специфическим в отношении эпитопа «А», то присутствие молекулы, содержащей эпитоп А, (или свободного, немеченого А) в реакции, содержащей меченое «А» и антитело, будет уменьшать количество меченого А, связанного с указанным антителом.
Термин “антитело” в данном контексте относится в широком смысле к любой молекуле иммуноглобулина (Ig), содержащей четыре полипептидные цепи, две тяжелые (H) цепи и две легкие (L) цепи, или к любому функциональному фрагменту, мутанту, варианту или их производному, которое сохраняет основные признаки связывания эпитопа молекулы Ig. Такие форматы мутанта, варианта или производного антитела известны в данной области. Их неограничивающие варианты обсуждаются ниже.
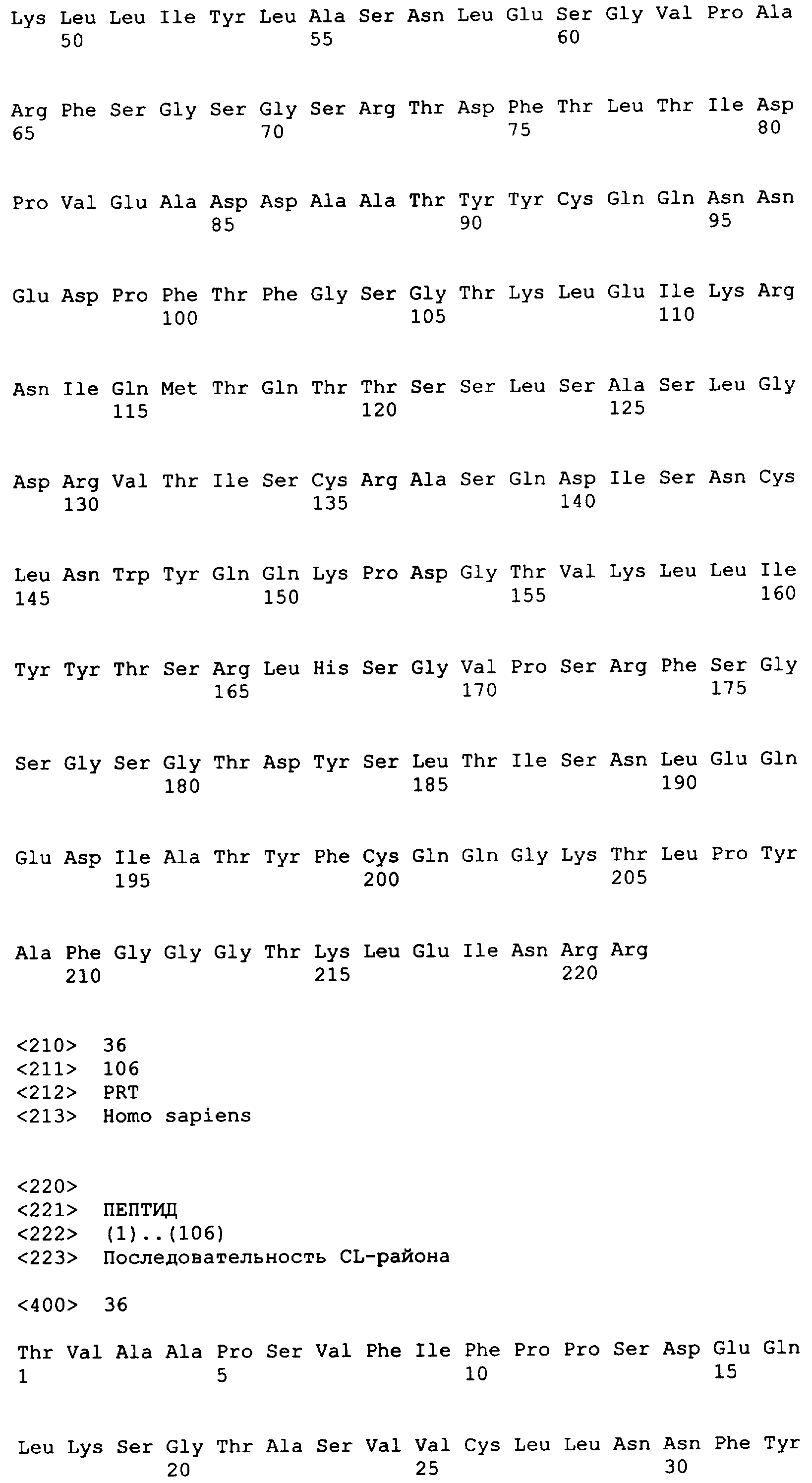
В полноразмерном антителе каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно обозначаемой здесь как HCVR или VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно обозначаемой здесь как LCVR или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. Области VH и VL могут быть дополнительно подразделены на гипервариабельные районы, называемые определяющими комплементарность районами (CDR), перемежаемыми районами, которые являются более консервативными, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Молекулы иммуноглобулина могут быть молекулами любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса.
Термин “Fc-район” используют для определения C-концевого района тяжелой цепи иммуноглобулина, которая может быть получена расщеплением папаином интактного антитела. Fc-район может быть нативной последовательностью Fc-района или вариантным Fc-районом. Fc-район иммуноглобулина обычно содержит два константных домена, CH2-домен и CH3-домен, и необязательно содержит CH4-домен. В данной области известны замены аминокислотных остатков в Fc-части для изменения эффекторной функции антитела (Winter, et al. US PAT NOS 5,648,260; 5624821). Fc-часть антитела опосредует несколько важных эффекторных функций, например, индукцию цитокинов, ADCC, фагоцитоз, комплементзависимую цитотоксичность (CDC) и период полу-жизни/скорость клиренса антитела и комплексов антиген-антитело. В некоторых случаях эти эффекторные функции являются желательными для терапевтического антитела, но в других случаях могут быть не требующимися или даже вредными, в зависимости от терапевтических целей. Некоторые изотипы IgG человека, в частности, IgG1 и IgG3, опосредуют ADCC и CDC через связывание с FcγR и комплемент C1q, соответственно. Неонатальные рецепторы Fc (FcRn) являются решающими компонентами, определяющими период полу-жизни антител в кровотоке. Еще в одном варианте осуществления по меньшей мере один аминокислотный остаток заменен в константной области антитела, например, Fc-районе антитела, так что эффекторные функции антитела изменяются. Димеризация двух идентичных тяжелых цепей иммуноглобулина опосредуется димеризацией CH3-доменов и стабилизируется дисульфидными связями в шарнирной области (Huber et al. Nature; 264: 415-20; Thies et al 1999 J Mol Biol; 293: 67-79.). Мутация остатков цистеина в шарнирных областях для предотвращения образования дисульфидных связей между двумя тяжелыми цепями будет дестабилизировать димеризацию CH3-доменов. Остатки, ответственные за димеризацию СН3, были идентифицированы (Dall'Acqua 1998 Biochemistry 37: 9266-73.). Таким образом, можно генерировать моновалентный полу-Ig. Интересно, что эти моновалентные полу-Ig-молекулы были обнаружены в природе для подклассов IgG и IgА (Seligman 1978 Ann Immunol 129: 855-70; Biewenga et al 1983 Clin Exp Immunol 51: 395-400). Было определено, что стехиометрия FcRn:Fc-район Ig была 2:1 (West et al. 2000 Biochemistry 39: 9698-708) и полу-Fc является достаточным для опосредования связывания FcRn (Kim et al 1994 Eur J Immunol; 24: 542-548). Мутации для разрушения димеризации CH3-домена могут не оказывать большего влияния на его связывание FcRn, так как остатки, важные для димеризации CH3, расположены на внутренней поверхности раздела β-складчатой структуры CH3, тогда как район, ответственный за связывание FcRn, расположен на наружной поверхности раздела CH2-CH3-доменов. Однако молекула полу-Ig может иметь определенное преимущество в проникновении в ткань вследствие ее малого размера по сравнению с размером обычного антитела. В одном варианте осуществления по меньшей мере один аминокислотный остаток заменен в константной области связывающего белка согласно изобретению, например, Fc-районе, так что димеризация тяжелых цепей разрушается, что приводит к молекулам DVD-Ig.
Термин “антигенсвязывающая часть” антитела (или просто “часть антитела”) относится в данном контексте к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связываться с антигеном. Было показано, что антигенсвязывающая функция антитела может выполняться фрагментами полноразмерного антитела. Такие варианты антител могут быть также биспецифическими, двойными специфическими или мультиспецифическими; специфически связывающимися с двумя или более различными антигенами. Примеры связывающих фрагментов, охватываемых термином “антигенсвязывающая часть” антитела, включают в себя (i) Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) F(ab')2-фрагмент, двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CH1; (iv) Fv-фрагмент, состоящий из доменов VL и VH единственного плеча антитела, (v) dAb-фрагмент (Ward et al., (1989) Nature341:544-546, Winter et al., публикация PCT WO 90/05144 A1, включенные в данное описание путем ссылки), который содержит единственный вариабельный домен; и (vi) выделенный определяющий комплементарность район (CDR). Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, они могут быть соединены, с использованием рекомбинантных способов, синтетическим линкером, который позволяет получить их в виде единой белковой цепи, в которой области VL и VH спариваются с образованием моновалентных молекул (известных как одноцепочечный Fv (scFv); см., например, Bird et al. (1988) Science242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA85:5879-5883). Предполагается, что такие одноцепочечные антитела также включены в термин “антигенсвязывающая часть антитела”. В этот термин включены также и другие формы одноцепочечных антител, такие как диатела. Диатела являются бивалентными, биспецифическими антителами, в которых домены VH и VL экспрессируются на единственной полипептидной цепи, но использование линкера, который является слишком коротким для создания возможности спаривания между двумя доменами на одной и той же цепи, заставляет эти домены спариваться с комплементарными доменами другой цепи и создает два антигенсвязывающих сайта (см., например, Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA90:6444-6448; Poljak, R.J., et al. (1994) Structure2:1121-1123). Такие антигенсвязывающие части известны в данной области (Kontermann and Dubel eds., Antibody Engineering (2001) Springer-Verlag. New York. 790 pp. (ISBN 3-540-41354-5). Кроме того, одноцепочечные антитела включают в себя также “линейные антитела”, содержащие пару тандемных Fv-сегментов (VH-CH1-VH-CH1), которые вместе с комплементарным полипептидом легкой цепи образуют пару антигенсвязывающих районов (Zapata et al. Protein Eng. 8(10):1057-1062 (1995); и патент США № 5641870).
Термин “мультивалентный связывающий белок” используется во всем описании для обозначения связывающего белка, содержащего два или более антигенсвязывающих сайтов. Мультивалентный связывающий белок предпочтительно сконструирован таким образом, что он имеет три или более антигенсвязывающих сайтов и обычно не является встречающимся в природе антителом. Термин “мультиспецифический связывающий белок” относится к связывающему белку, способному связывать две или более родственных или неродственных мишеней. Связывающие белки с двойными вариабельными доменами (DVD) согласно изобретению содержат два или более антигенсвязывающих сайтов и являются четырехвалентными или мультивалентными связывающими белками. DVD-связывающие белки могут быть моноспецифическими, т.е. способными связывать один антиген, или мультиспецифическими, т.е. способными связывать два или более антигенов. DVD-связывающие белки, содержащие два DVD-полипептида тяжелой цепи и два DVD-полипептида легкой цепи, называют DVD-Ig. Каждая половина DVD-Ig содержит DVD-полипептид тяжелой цепи и DVD-полипептид легкой цепи и два антигенсвязывающих сайта. Каждый сайт связывания содержит вариабельный домен тяжелой цепи и вариабельный домен легкой цепи с 6 CDR в целом, участвующими в связывании антигена, на один антигенсвязывающий сайт.
Термин “биспецифическое антитело” относится в данном контексте к полноразмерным антителам, которые генерируют технологией квадром (см. Milstein, C. and A.C. Cuello, Nature, 1983. 305(5934): p. 537-40), химической конъюгацией двух разных mAb (см. Staerz, U.D., et al., Nature, 1985. 314(6012): p. 628-31) или с использованием подхода «выпуклость-в-углубление», или подобных подходов, которые вводят мутации в Fc-район (см. Holliger, P., T. Prospero, and G. Winter, Proc Natl Acad Sci U S A, 1993. 90(14): p. 6444-8.18) с образованием множественных различных видов иммуноглобулина, из которых только один вид является функциональным биспецифическим антителом. По молекулярной функции биспецифическое антитело связывает один антиген (или эпитоп) на одном из его двух плеч (одной паре HC/LC) и связывает его второй антиген (или эпитоп) на его втором плече (другой паре HC/LC). По этому определению биспецифическое антитело имеет два разных антигенсвязывающих плеча (как по специфичности, так и по CDR-последовательностям) и является моновалентным в отношении каждого антигена, с которым оно связывается.
Термин “антитело с двойной специфичностью” относится в данном контексте к полноразмерным антителам, которые могут связывать два разных антигена (или эпитопа) в каждом из его двух связывающих плеч (пары HC/LC) (см. публикацию PCT WO 02/02773). Соответственно, связывающий белок с двойной специфичностью имеет два идентичных антигенсвязывающих плеча с идентичной специфичностью и идентичными CDR-последовательностями и является бивалентным в отношении каждого антигена, с которым он связывается.
“Функциональным антигенсвязывающим сайтом” связывающего белка является сайт, который способен связывать антиген-мишень. Антигенсвязывающая аффинность антигенсвязывающего сайта не является обязательно такой же сильной, как в случае исходного антитела, из которого получен этот антигенсвязывающий сайт, но эта способность связывать антиген должна быть измеримой с использованием любого из различных способов, известных для оценки связывания антитела с антигеном. Кроме того, антигенсвязывающая аффинность каждого из антигенсвязывающих сайтов мультивалентного антитела не должна быть здесь количественно одной и той же.
Термин” цитокин” является общим термином для белков, высвобождаемых одной клеточной популяцией, которые действуют на другую клеточную популяцию в качестве межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. В цитокины включены также гормон роста, например, гормон роста человека, N-метионил-гормон роста человека и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреоидстимулирующий гормон (TSH) и лютеинизирующий гормон (LH); фактор роста печени; фактор роста фибробластов; пролактин, плацентарный лактоген; фактор-альфа и фактор-бета некроза опухолей; фактор регрессии мюллерова канала; ассоциированный с гонадотропином пептид мыши; ингибин; активин; васкулярный эндотелиальный фактор роста; интегрин; тромбопоэтин (ТРО); фактор роста нервов, такой как NGF-альфа; фактор роста тромбоцитов; трансформирующие рост факторы (TGF), такие как TGF-α и TGF-β; инсулиноподобный фактор роста 1 и 11; эритропоэтин (ЕРО); остеоиндуктивные факторы; интерфероны, такие как интерферон-альфа, -бета и -гамма, колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гранулоцитарно-макрофагальный-CSF (GM-CSF); и гранулоцитарный-CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-15, IL-18, IL-23; фактор некроза опухолей, такой как TNF-α или TNF-β; и другие полипептидные факторы, включая LIF и kit-лиганд (KL). В данном контексте термин цитокин включает в себя белки из природных источников или из культуры рекомбинантных клеток и биологически активные эквиваленты цитокинов с нативными последовательностями.
Термин “линкер” используется для обозначения полипептидов, содержащих два или более аминокислотных остатков, соединенных пептидными связями, и его используют для связывания одной или нескольких антигенсвязывающих частей. Такие линкерные полипептиды хорошо известны в данной области (см., например, Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA90:6444-6448; Poljak, R.J., et al. (1994) Structure2:1121-1123). Предпочтительные линкеры включают в себя, но не ограничиваются ими, AKTTPKLEEGEFSEAR; AKTTPKLEEGEFSEARV; AKTTPKLGG; SAKTTPKLGG; AKTTPKLEEGEFSEARV; SAKTTP; SAKTTPKLGG; RADAAP; RADAAPTVS; RADAAAAGGPGS; RADAAAA(G4S)4; SAKTTP; SAKTTPKLGG; SAKTTPKLEEGEFSEARV; ADAAP; ADAAPTVSIFPP; TVAAP; TVAAPSVFIFPP; QPKAAP; QPKAAPSVTLFPP; AKTTPP; AKTTPPSVTPLAP; AKTTAP; AKTTAPSVYPLAP; ASTKGP; ASTKGPSVFPLAP.
Константный домен иммуноглобулина означает константный домен тяжелой или легкой цепи. Аминокислотные последовательности константного домена тяжелой цепи и легкой цепи IgG человека известны в данной области.
Термин “моноклональное антитело” относится в данном контексте к антителу, полученному из популяции по существу гомогенных антител, т.е. индивидуальные антитела, составляющие эту популяцию, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высокоспецифическими, будучи направлены против единственного антигена. Кроме того, в противоположность препаратам поликлональных антител, которые обычно включают в себя разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против единственной детерминанты на данном антигене. Определение «моноклональное» не должно пониматься как требование получения антитела каким-либо конкретным способом.
Термин “антитело человека” в данном контексте включает в себя антитела, имеющие вариабельные и константные области, происходящие из последовательностей иммуноглобулина зародышевой линии человека. Антитела человека согласно изобретению могут включать в себя аминокислотные остатки, не кодируемые последовательностями иммуноглобулина зародышевой линии человека (например, мутации, введенные случайным или сайт-направленным мутагенезом in vitro, или соматической мутацией in vivo), например, в CDR и, в частности, CDR3. Однако термин «антитело человека» в данном контексте не предназначен для включения антител, в которых CDR-последовательности, происходящие из зародышевой линии другого вида млекопитающего, такого как мышь, были привиты («трансплантированы») на каркасные последовательности человека.
Термин “рекомбинантное антитело человека” в данном контексте включает в себя все антитела человека, которые получают, экспрессируют, создают или выделяют рекомбинантными способами, например, антитела, экспрессируемые рекомбинантным экспрессирующим вектором, трансфицированным в клетку-хозяина (описанную дополнительно в Разделе II C, ниже), антитела, выделенные из рекомбинантной, комбинаторной библиотеки антител человека (Hoogenboom H.R., (1997) TIB Tech. 15:62-70; Azzazy H., and Highsmith W.E., (2002) Clin. Biochem. 35:425-445; Gavilondo J.V., and Larrick J.W. (2002) BioTechniques 29:128-145; Hoogenboom H., and Chames P. (2000) Immunology Today 21:371-378), антитела, выделенные у животного (например, мыши), которая является трансгенной относительно генов иммуноглобулина человека (см., например, Taylor, L. D., et al. (1992) Nucl. Acids Res. 20:6287-6295; Kellermann S-A., and Green L.L. (2002) Current Opinion in Biotechnology 13:593-597; Little M. et al (2000) Immunology Today 21:364-370), или антитела, полученные, экспрессированные, созданные или выделенные любым другим способом, который включает в себя сплайсинг последовательностей генов иммуноглобулина человека в другие ДНК-последовательности. Такие рекомбинантные антитела человека имеют вариабельные и константные области, происходящие из последовательностей иммуноглобулина зародышевой линии человека. Однако в некоторых вариантах осуществления такие рекомбинантные антитела человека подвергают мутагенезу in vitro (или, если используют животное, трансгенное относительно Ig-последовательностей человека, соматическому мутагенезу in vivo), и, следовательно, аминокислотные последовательности областей VH и VL указанных рекомбинантных антител являются последовательностями, которые, хотя и происходят из последовательностей VH и VL зародышевой линии человека, не могут существовать в природе в репертуаре зародышевой линии антител человека in vivo.
“Аффинно зрелым” антителом является антитело с одним или несколькими изменениями в одном или нескольких из его CDR, которые приводят к улучшению аффинности данного антитела в отношении антигена по сравнению с исходным антителом, которое не имеет этого изменения (этих изменений). Предпочтительные аффинно зрелые антитела будут иметь наномолярные или даже пикомолярные аффинности в отношении антигена-мишени. Аффинно зрелые антитела получают способами, известными в данной области. Marks et al. BidlTechnology 10:779-783 (1992) описывает аффинное созревание перетасовкой доменов VH и VL. Случайный мутагенез остатков CDR и/или каркаса описан Barbas et al. Proc Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier et al. Gene 169:147-155 (1995); Yelton et al. J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995) и Hawkins et al, J. Mol. BioL 226:889-896 (1992).
Термин “химерное антитело” относится к антителам, которые содержат последовательности вариабельных областей тяжелой и легкой цепи из одного вида и последовательности константных областей из другого вида, например, к антителам, которые имеют мышиные вариабельные области тяжелой и легкой цепи, связанные с константными областями человека.
Термин “CDR-трансплантированное антитело” относится к антителам, которые содержат последовательности вариабельных областей тяжелой и легкой цепи из одного вида, но в которых последовательности одного или нескольких CDR-районов VH и/или VL заменены CDR-последовательностями другого вида, например, к антителам, имеющим мышиные вариабельные области тяжелой и легкой цепи, в которых один или несколько мышиных CDR (например, CDR3) заменены CDR-последовательностями человека.
Термин “гуманизированное антитело” относится к антителам, которые содержат последовательности вариабельных областей тяжелой и легкой цепи из вида не-человека (например, мыши), но в которых по меньшей мере часть последовательности VH и/или VL была изменена таким образом, что она является более «человекоподобной», т.е. более подобной вариабельным последовательностям зародышевой линии человека. Одним из типов гуманизированного антитела является CDR-трансплантированное антитело, в котором CDR-последовательности человека введены в последовательности VH и VL не-человека для замены соответствующих CDR не-человека.
Термины “нумерация Кабата", “определения Кабата” и “мечение Кабата" используются здесь взаимозаменяемо. Указанные термины, которые признаются в данной области, относятся к системе нумерации аминокислотных остатков, которые являются более вариабельными (т.е. гипервариабельными), чем другие аминокислотные остатки в вариабельных областях тяжелой и легкой цепи антитела, или его антигенсвязывающей части (Kabat et al. (1971) Ann. NY Acad, Sci.190:382-391 и Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Для вариабельной области тяжелой цепи гипервариабельный район находится в диапазоне положений аминокислот 31-35 для CDR1, положений аминокислот 50-65 для CDR2 и положений аминокислот 95-102 для CDR3. Для вариабельной области легкой цепи гипервариабельный район находится в диапазоне положений аминокислот 24-34 для CDR1, положений аминокислот 50-65 для CDR2 и положений аминокислот 89-97 для CDR3.
В данном контексте термин “CDR" относится к определяющему комплементарность району в вариабельных последовательностях антитела. В каждой из вариабельных областей тяжелой цепи и легкой цепи имеются три CDR, которые названы CDR1, CDR2 и CDR3, для каждой из этих вариабельных областей. Термин “набор CDR” относится в данном контексте к группе из трех CDR, которые встречаются в единственной вариабельной области, способной связывать антиген. Точные границы этих CDR определялись различно в соответствии с разными системами. Система, описанная Кабатом (Kabat et al., Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md. (1987) and (1991)), не только обеспечивает недвусмысленную систему нумерации остатков, применимую к любой вариабельной области антитела, но также обеспечивает точные границы остатков, определяющие указанные три CDR. Эти CDR могут быть названы в соответствии с CDR Кабата. Cothia и соавторами (Chothia &Lesk, J. Mol. Biol. 196:901-917 (1987) и Chothia et al., Nature 342:877-883 (1989)) обнаружено, что некоторые подчасти в CDR Кабата принимают почти идентичные конформации пептидного скелета, несмотря на большое разнообразие на уровне аминокислотной последовательности. Эти подчасти были названы L1, L2 и L3 или H1, H2 и H3, где "L" и "H" означают области легкой цепи и тяжелой цепи, соответственно. Данные области могут быть названы CDR Хотиа, которые имеют границы, которые перекрываются с CDR Кабата. Другие границы, определяющие CDR, перекрывающиеся с CDR Кабата, были описаны Padlan (FASEB J. 9:133-139 (1995)) и MacCallum (J Mol Biol 262(5):732-45 (1996)). Другие определения границ CDR могут не соответствовать строго одной из вышеуказанных систем, но будут, тем не менее, перекрываться с CDR Кабата, хотя они могут быть укороченными или удлиненными в свете предсказания или экспериментального обнаружения того, что конкретные остатки или группы остатков, или даже полные CDR по существу не влияют на связывание антигена. В применяемых здесь способах можно использовать CDR, определенные в соответствии с любой из указанных систем, хотя в предпочтительных вариантах осуществления используют CDR, определенные Кабатом или Хотиа.
В данном контексте термин «каркас» или «каркасная последовательность» относится к остальным последовательностям вариабельной области минус CDR. Поскольку точное определение последовательности CDR может быть определено с помощью разных систем, значение каркасной последовательности рассматривается соответственно различным интерпретациям. Шесть CDR (CDR-L1, -L2 и -L3 легкой цепи и CDR-H1, -H2 и -H3 тяжелой цепи) также разделяют каркасные области на четыре подобласти легкой цепи и тяжелой цепи (FR1, FR2, FR3 и FR4) на каждой цепи, в которой CDR1 расположен между FR1 и FR2, CDR2 между FR2 и FR3 и CDR3 между FR3 и FR4. Без описания конкретных подобластей, таких как FR1, FR2, FR3 или FR4, каркасная область, цитируемая другими авторами, представляет объединенные FR в вариабельной области единой, встречающейся в природе цепи иммуноглобулина. В данном контексте FR представляет одну из четырех подобластей и FR представляет две или более из четырех подобластей, составляющих каркасную область.
В данном контексте термин “ген антитела зародышевой линии” или “фрагмент гена" относится к последовательности иммуноглобулина, кодируемой нелимфоидными клетками, которые не подвергались процессу созревания, приводящему к генетической реаранжировке и мутации для экспрессии конкретного иммуноглобулина. (См., например, Shapiro et al., Crit. Rev. Immunol. 22(3): 183-200 (2002); Marchalonis et al., Adv Exp Med Biol. 484:13-30 (2001)). Одно из преимуществ, обеспечиваемых различными вариантами осуществления данного изобретения, происходит из признания того, что гены антитела зародышевой линии с большей вероятностью, чем зрелые гены антитела, сохраняют основные структуры аминокислотной последовательности, характерные для индивидуумов в этом виде, в связи с чем с меньшей вероятностью узнаются как происходящие из чужеродного источника при использовании терапевтически в этом виде.
В данном контексте термин “гуманизированное антитело” означает антитело или его вариант, производное, аналог или фрагмент, которые иммуноспецифически связываются с представляющим интерес антигеном и которые содержат каркасную область (FR), имеющую по существу аминокислотную последовательность антитела человека и определяющий комплементарность район (CDR), имеющий по существу аминокислотную последовательность антитела не-человека. Используемый в данном описании термин «по существу» в контексте CDR относится к CDR, имеющему аминокислотную последовательность по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности CDR антитела не-человека. Гуманизированное антитело содержит по существу все из по меньшей мере одного и обычно двух вариабельных доменов (Fab, Fab', F(ab')2, FabC, Fv), в которых все или по существу все районы CDR соответствуют районам CDR иммуноглобулина не-человека (т.е. донорского антитела) и все или по существу все из каркасных областей являются каркасными областями консенсусной последовательности иммуноглобулина человека. Предпочтительно, гуманизированное антитело также содержит по меньшей мере часть константной области (Fc) иммуноглобулина, обычно эту часть иммуноглобулина человека. В некоторых вариантах осуществления гуманизированное антитело содержит как легкую цепь, так и по меньшей мере вариабельный домен тяжелой цепи. Антитело может также включать в себя СН1, шарнирную область, CH2-, CH3- и CH4-области тяжелой цепи. В некоторых вариантах осуществления гуманизированное антитело содержит только гуманизированную легкую цепь. В некоторых вариантах осуществления гуманизированное антитело содержит только гуманизированную тяжелую цепь. В некоторых вариантах осуществления гуманизированное антитело содержит только гуманизированный вариабельный домен легкой цепи и/или гуманизированную тяжелую цепь.
В данном контексте термин “нейтрализация” относится к нейтрализации биологической активности цитокина при специфическом связывании связывающего белка с цитокином. Предпочтительно нейтрализующий связывающий белок связывает цитокин и уменьшает его биологическую активность по меньшей мере на приблизительно 20%, 40%, 60%, 80%, 85% или более.
Термин “активность" включает в себя такие активности, как специфичность связывания/аффинность DVD-Ig в отношении двух или более антигенов.
Термин “эпитоп" включает в себя любую полипептидную детерминанту, способную специфически связываться с иммуноглобулином или Т-клеточным рецептором. В некоторых вариантах осуществления эпитопные детерминанты включают в себя химически активные поверхностные группировки молекул, таких как аминокислоты, боковые цепи сахаров, фосфорил или сульфонил, и, в некоторых вариантах осуществления, могут иметь специфические трехмерные структурные характеристики и/или специфические характеристики зарядов. Эпитоп является районом антигена, который связывается антителом. В некоторых вариантах осуществления считают, что антитело специфически связывает антиген, когда оно преимущественно распознает его антиген-мишень в сложной смеси белков и/или макромолекул.
Термин “резонанс поверхностного плазмона" в данном контексте относится к оптическому явлению, которое делает возможным анализ реального времени биоспецифических взаимодействий путем определения изменений концентраций белка в биосенсорном матриксе, например, с использованием системы BIAcore (Pharmacia Biosensor AB, Uppsala, Sweden and Piscataway, NJ). В отношении дополнительных описаний см. Jönsson, U., et al. (1993) Ann. Biol. Clin. 51:19-26; Jönsson, U., et al. (1991) Biotechniques 11:620-627; Johnsson, B., et al. (1995) J. Mol. Recognit. 8:125-131; и Johnnson, B., et al. (1991) Anal. Biochem. 198:268-277.
Термин “Kon" в данном контексте относится к константе скорости ассоциации антитела с антигеном с образованием комплекса антитело/антиген, как известно в данной области.
Термин “Koff" в данном контексте относится к константе скорости дисссоциации антитела от комплекса антитело/антиген, как известно в данной области.
Термин “Kd" в данном контексте относится к константе диссоциации конкретного взаимодействия антиген-антитело, как известно в данной области.
Термин “меченый связывающий белок” в данном контексте относится к белку с включенной меткой, которая обеспечивает идентификацию связывающего белка. Предпочтительно, меткой является детектируемый маркер, например, включение радиоактивно меченной аминокислоты или присоединение к полипептиду биотинильных групп, которые могут быть детектированы меченым авидином (например, стрептавидином, содержащим флуоресцентный маркер или обладающим ферментативной активностью, которая может быть детектирована оптическим или колориметрическим способами). Примеры меток для полипептидов включают в себя, но не ограничиваются ими, следующие метки: радиоизотопы или радионуклиды (например,3H,14C,35S,90Y,99Tc,111In,125I,131I,177Lu,166Ho или153Sm); флуоресцентные метки (например, FITC, родамин, лантанидные люминофоры), ферментные метки (например, пероксидаза хрена, люцифераза, щелочная фосфатаза); хемилюминесцентные маркеры; биотинильные группы; заранее определенные полипептидные эпитопы, узнаваемые вторичным репортером (например, парные последовательности лейциновой молнии, сайты связывания вторичных антител, домены связывания металлов, эпитопные метки) и магнитные агенты, такие как хелаты гадолиния.
Термин “конъюгат” относится к связывающему белку, такому как антитело, химически связанному со второй химической частью молекулы, такой как терапевтический или цитотоксический агент. Термин “агент" используется здесь для обозначения химического соединения, смеси химических соединений, биологической макромолекулы или экстракта, полученного из биологических материалов. Предпочтительно терапевтические или цитотоксические агенты включают в себя, но не ограничиваются ими, коклюшный токсин, таксол, цитохалазин В, грамицидин D, этидийбромид, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропанолол и пуромицин и их аналоги или гомологи.
Термины “кристалл” и “кристаллизованный” в данном контексте относится к антителу или его антигенсвязывающей части, которая существует в форме кристалла. Кристаллы являются одной из форм рассматриваемого твердого состояния, которая отличается от других форм, таких как аморфное твердое состояние или жидкокристаллическое состояние. Кристаллы состоят из регулярных, повторяющихся, трехмерных массивов атомов, ионов, молекул (например, белков, таких как антитела) или молекулярных ансамблей (например, комплексов антиген/антитело). Эти трехмерные массивы расположены в соответствии с конкретными математическими взаимосвязями, которые хорошо понимаются в данной области. Фундаментальное элементарное звено, или элемент структуры, который повторяется в кристалле, называют асимметричным элементом структуры. Повторение асимметричного элемента структуры в структуре, которая соответствует конкретной, хорошо определенной кристаллографической симметрии, обеспечивает элементарную ячейку кристалла. Повторение элементарной ячейки путем регулярных перемещений во всех трех измерениях обеспечивает кристалл. См. Giege, R. and Ducruix, A. Barrett, “Crystallization of Nucleic Acids and Proteins, a Practical Approach, 2nd ea., pp. 20 1-16, Oxford University Press, New York, New York, (1999).”
Термин “полинуклеотид" в данном контексте означает полимерную форму двух или более нуклеотидов, либо рибонуклеотидов, либо дезоксинуклеотидов, или модифицированную форму любого типа нуклеотида. Этот термин включает в себя одноцепочечные и двухцепочечные формы ДНК, но предпочтительно означает двухцепочечную ДНК.
Термин “выделенный полинуклеотид” в данном контексте будет означать полинуклеотид (например, геномную ДНК, кДНК или полинуклеотид синтетического происхождения, или некоторую их комбинацию), причем, в силу его происхождения, «выделенный полинуклеотид», не ассоциирован со всем полинуклеотидом или с частью полинуклеотида, с которой этот «выделенный полинуклеотид” находится в природе; функционально связан с полинуклеотидом, который не связан с ним в природе; или не встречается в природе в виде большей последовательности.
Термин “вектор" в данном контексте относится к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой она была связана. Одним типом вектора является “плазмида", которая относится к кольцевой двухцепочечной петле ДНК, в которую могут быть лигированы дополнительные ДНК-сегменты. Другим типом вектора является вирусный вектор, в котором дополнительные ДНК-сегменты могут быть лигированы в вирусный геном. Некоторые векторы способны к автономной репликации в клетке-хозяине, в которую их вводят (например, бактериальные векторы, имеющие бактериальный сайт инициации репликации, и эписомные векторы млекопитающих). Другие векторы (например, не-эписомные векторы млекопитающих) могут быть интегрированы в геном клетки-хозяина после введения в клетку-хозяина и посредством этого реплицируются вместе с геномом хозяина. Кроме того, некоторые векторы способны управлять экспрессией генов, с которыми они функционально связаны. Такие векторы называют здесь «рекомбинантными экспрессирующими векторами» (или просто «экспрессирующими векторами»). Как правило, экспрессирующие векторы, используемые в способах рекомбинантных ДНК, часто находятся в форме плазмид. В данном описании «плазмида» и «вектор» могут быть использованы взаимозаменяемо, так как плазмида является наиболее часто используемой формой вектора. Однако данное изобретение включает в себя такие другие формы экспрессирующих векторов, как вирусные векторы (например, дефектные по репликации ретровирусы, аденовирусы и аденоассоциированные вирусы), которые выполняют эквивалентные функции.
Термин “функционально связанные" относится к непосредственному соседству, в котором описанные компоненты находятся в связи, позволяющей им функционировать предполагаемым для них образом. Регуляторную последовательность, «функционально связанную» с кодирующей последовательностью, лигируют таким образом, что достигается экспрессия кодирующей последовательности в условиях, совместимых с регуляторными последовательностями. «Функционально связанные» последовательности включают в себя как регуляторные последовательности экспрессии, которые являются смежными с представляющим интерес геном, так и регуляторные последовательности экспрессии, которые действуют intrans или на расстоянии для регуляции представляющего интерес гена. Термин “регуляторная последовательность гена” относится в данном контексте к полинуклеотидным последовательностям, которые являются необходимыми для выполнения экспрессии и процессинга кодирующих последовательностей, с которыми они лигированы. Регуляторные последовательности экспрессии включают в себя подходящие последовательности инициации, терминации транскрипции, промоторные и энхансерные последовательности; эффективные сигналы процессинга РНК, такие как сигналы сплайсинга и полиаденилирования; последовательности, которые стабилизируют цитоплазматическую мРНК; последовательности, которые усиливают эффективность трансляции (т.е. консенсусную последовательность Козака); последовательности, которые усиливают стабильность белка; и, при желании, последовательности, которые усиливают секрецию белка. Природа таких регуляторных последовательностей различается в зависимости от организма-хозяина; в прокариотах такие регуляторные последовательности обычно включают в себя промотор, сайт связывания рибосом и последовательность терминации транскрипции; в эукариотах обычно такие регуляторные последовательности включают в себя промоторы и последовательность терминации транскрипции. Термин «регуляторные последовательности» включает в себя компоненты, присутствие которых является важным для экспрессии и процессинга, и может также включать в себя дополнительные компоненты, присутствие которых является полезным, например, лидерные последовательности и последовательности партнеров слияния.
“Трансформация" в данном контексте относится к любому процессу, при помощи которого экзогенная ДНК входит в клетку-хозяина. Трансформация может происходить в природных или искусственных условиях с использованием различных способов, хорошо известных в данной области. Трансформация может быть основана на любом известном способе для встраивания чужеродных последовательностей нуклеиновых кислот в прокариотическую или эукариотическую клетку-хозяина. Способ выбирают на основе клетки-хозяина, подлежащей трансформации, и он может включать в себя, но не ограничивается ими, вирусную инфекцию, электропорацию, липофекцию и бомбардировку частицами. Такие “трансформированные” клетки включают в себя стабильно трансформированные клетки, в которых встроенная ДНК способна к репликации либо в виде автономно реплицирующейся плазмиды, либо в виде части хромосомы хозяина. Они могут включать в себя клетки, которые транзиторно экспрессируют встроенную ДНК или РНК в течение ограниченных периодов времени.
Термин “рекомбинантная клетка-хозяин” (или просто “клетка-хозяин”) относится в данном контексте к клетке, в которую была введена экзогенная ДНК. Должно быть понятно, что такие термины относятся не только к конкретной рассматриваемой клетке, но и к потомству такой клетки. Поскольку некоторые модификации могут встречаться в следующих поколениях вследствие либо мутации, либо влияний окружающей среды, такое потомство может фактически не быть идентичным родительской клетке, но все еще охватываться используемым здесь термином «клетка-хозяин». Предпочтительно клетки-хозяева включают в себя прокариотические и эукариотические клетки, выбранные из любого из существующих видов. Предпочтительные эукариотические клетки включают в себя клетки протистов, грибов, растений и животных. Наиболее предпочтительно клетки-хозяева включают в себя, но не ограничиваются ими, линию прокариотических клеток E.coli; линии клеток млекопитающих СНО, НЕК 293 и COS; линию клеток насекомых Sf9 и линию грибковых клеток Saccharomyces cerevisiae.
Стандартные способы могут быть использованы для рекомбинантных ДНК, олигонуклеотидного синтеза и культуры ткани и трансформации (например, электропорация, липофекция). Ферментативные реакции и способы очистки можно выполнять в соответствии с описаниями изготовителя или как обычно выполняют в данной области, или как описано в данном документе. Вышеописанные способы и процедуры можно обычно выполнять в соответствии с общепринятыми способами, хорошо известными в данной области, и как описано в различных общих и более конкретных ссылках, которые цитируются и обсуждаются во всем данном описании. См., например, руководство Sambrook et al., Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989)), которое включено в данное описание путем ссылки для любой цели.
“Трансгенный организм”, как известно в данной области и как используется в данном описании, означает организм, имеющий клетки, которые содержат трансген, где трансген, введенный в организм (или предок организма), экспрессирует полипептид, не экспрессируемый естественным путем в данном организме. “Трансген” является ДНК-конструкцией, которая стабильно и функционально интегрируется в геном клетки, из которой развивается трансгенный организм, управляя экспрессией кодируемого генного продукта в одном или нескольких типах клеток или тканях трансгенного организма.
Термины “регулируют” и “модулируют” используются взаимозаменяемо и относятся в данном контексте к перемене или изменению активности представляющей интерес молекулы (например, биологической активности цитокина). Модуляция может быть увеличением или уменьшением величины определенной активности или функции представляющей интерес молекулы. Типичные примеры активности и функции молекулы включают в себя, но не ограничиваются ими, характеристики связывания, ферментативную активность, активацию клеточного рецептора и трансдукцию сигнала.
Соответственно, термин «модулятор» означает в данном контексте соединение, способное менять или изменять активность или функцию представляющей интерес молекулы (например, биологическую активность цитокина). Например, модулятор может вызывать увеличение или уменьшение величины определенной активности или функции молекулы по сравнению с величиной активности или функции, наблюдаемой в отсутствие модулятора. В некоторых вариантах осуществления модулятором является ингибитор, который уменьшает величину по меньшей мере одной активности или функции молекулы. Примеры ингибиторов включают в себя, но не ограничиваются ими, белки, пептиды, антитела, «пептитела», углеводы или малые органические молекулы. «Пептитела» описаны, например, в WO01/83525.
Термин “агонист" в данном контексте относится к модулятору, который при контакте с представляющей интерес молекулой вызывает увеличение величины определенной активности или функции этой молекулы по сравнению с величиной активности или функции, наблюдаемой в отсутствие агониста. Конкретные представляющие интерес агонисты могут включать в себя, но не ограничиваются ими, полипептиды, нуклеиновые кислоты, углеводы или любые другие молекулы, которые связываются с данным антигеном.
Термин “антагонист” или “ингибитор” в данном контексте относится к модулятору, который при контактировании с представляющей интерес молекулой вызывает уменьшение величины определенной активности или функции этой молекулы по сравнению с величиной активности или функции, наблюдаемой в отсутствие данного антагониста. Конкретные представляющие интерес антагонисты включают в себя антагонисты, которые блокируют или модулируют биологическую или иммунологическую активность данного антигена. Антагонисты и ингибиторы антигенов могут включать в себя, но не ограничиваются ими, белки, нуклеиновые кислоты, углеводы или любые другие молекулы, которые связываются с данным антигеном.
В данном контексте термин “эффективное количество" относится к количеству терапевтического агента, которое является достаточным для уменьшения или ослабления тяжести и/или продолжительности нарушения или одного или нескольких его симптомов, предотвращения прогрессирования нарушения, инициации регресса нарушения, предотвращения рецидива, развития, возникновения или прогрессирования одного или нескольких симптомов, ассоциированных с нарушением, детектирования нарушения или усиления или улучшения профилактических или терапевтических эффектов другого терапевтического агента (например, профилактического или терапевтического агента).
Термин “проба" в данном контексте используется в его самом широком значении. “Биологическая проба” в данном контексте включает в себя, но не ограничивается ими, любое количество вещества от живого существа или ранее живого существа. Такие живые существа включают в себя, но не ограничиваются ими, людей, мышей, крыс, обезьян, собак, кроликов и других животных. Такие вещества включают в себя, но не ограничиваются ими, кровь, сыворотку, синовиальную жидкость, клетки, органы, ткани, костный мозг, лимфатические узлы и селезенку.
I. Генерирование связывающего белка DVD (с двойными вариабельными доменами)
Данное изобретение относится к связывающим белкам с двойными вариабельными доменами, способным связывать одну или несколько мишеней, и способам их получения. Предпочтительно связывающий белок содержит полипептидную цепь, причем указанная полипептидная цепь содержит VD1-(X1)n-VD2-C-(X2)n, где VD1 является первым вариабельным доменом, VD2 является вторым вариабельным доменом, C является константным доменом, X1 представляет аминокислоту или полипептид, X2 представляет Fc-район и n равно 0 или 1. Связывающий белок согласно изобретению может быть генерирован с использованием различных способов. Данное изобретение обеспечивает экспрессирующие векторы, клетки-хозяева и способы генерирования связывающего белка.
А. Генерирование исходных моноклональных антител
Вариабельные домены связывающего белка DVD могут быть получены из исходных антител, включая поликлональные и моноклональные антитела, способные связывать представляющие интерес антигены. Данные антитела могут быть встречающимися в природе или могут быть получены с помощью рекомбинантной технологии.
Моноклональные антитела могут быть получены с использованием большого разнообразия способов, известных в данной области, включая использование гибридом, рекомбинантые технологии и технологии фагового дисплея или их комбинации. Например, моноклональные антитела могут быть получены с использованием гибридомных способов, включая способы, известные в данной области и описанные, например, у Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981) (указанные ссылки полностью включены в данное описание путем ссылки). Термин “моноклональное антитело" в данном контексте используют без ограничения антителами, получаемыми с помощью гибридомной технологии. Термин “моноклональное антитело" относится к антителу, которое получено из единственного клона, включая любой эукариотический, прокариотический или фаговый клон, а не к способу, которым оно получено. Гибридомы отбирают, клонируют и подвергают дополнительному скринингу на желаемые характеристики, включая устойчивый рост гибридомы, высокую продукцию антитела и желаемые характеристики антитела, как описано в примере 1 ниже. Гибридомы можно культивировать и размножать in vivo в сингенных животных, в животных, которые лишены иммунной системы, например, голых мышах, или в культуре клеток in vitro. Способы отбора, клонирования и размножения гибридом хорошо известны обычным специалистам в данной области. В предпочтительном варианте осуществления гибридомы представляют собой мышиные гибридомы. В другом предпочтительном варианте осуществления гибридомы получают в виде, не являющемся человеком, не являющемся мышью, таком как крысы, овцы, свиньи, козы, крупный рогатый скот или лошади. В другом варианте осуществления гибридомы представляют собой гибридомы человека, у которых несекреторная миеломная клетка человека слита с клеткой человека, экспрессирующей антитело, способное связывать специфический антиген.
Рекомбинантные моноклональные антитела получают также из отдельных, выделенных лимфоцитов с использованием методики, называемой в данной области способом селектируемых антител лимфоцитов (SLAM), описанным в патенте США № 5627052, публикации PCT WO 92/02551 и Babcock, J.S. et al. (1996) Proc. Natl. Acad. Sci. USA93:7843-7848. В этом способе отдельные клетки, секретирующие представляющие интерес антитела, например, лимфоциты, полученные от иммунизированного животного, идентифицируют и кДНК вариабельных областей тяжелой и легкой цепи высвобождают из клеток при помощи обратно-транскриптазной ПЦР, а затем эти вариабельные области экспрессируют, в контексте подходящих константных областей иммуноглобулина (например, константных областей человека), в клетках-хозяевах млекопитающего, таких как клетки COS или СНО. Клетки-хозяева, трансфицированные амплифицированными последовательностями иммуноглобулина, полученными из выбранных in vivo лимфоцитов, могут быть затем подвергнуты дополнительному анализу и выбору in vitro, например, пэннингом трансфицированных клеток с выделением клеток, экспрессирующих антитела к представляющему интерес антигену. Амплифицированные последовательности иммуноглобулина могут быть затем подвергнуты манипуляциям in vitro, таким как способы созревания аффинности in vitro, например, способы, описанные в публикации PCT WO 97/29131 и публикации PCT WO 00/56772.
Моноклональные антитела получают также путем иммунизации животного-не-человека, содержащего некоторую часть, или весь, локус иммуноглобулина человека с представляющим интерес антигеном. В предпочтительном варианте осуществления животным-не-человеком является трансгенная мышь XENOMOUSE, сконструированный методом генной инженерии штамм мыши, который содержит большие фрагменты локусов иммуноглобулина человека и является дефектным по продуцированию мышиных антител. См., например, Green et al. Nature Genetics 7:13-21 (1994) и патенты США 5916771, 5939598, 5985615, 5998209, 6075181, 6091001, 6114598 и 6130364. См. также WO 91/10741, опубликованную 25 июля 1991 года, WO 94/02602, опубликованную 3 февраля 1994 года, WO 96/34096 и WO 96/33735, обе опубликованные 31 октября 1996 года, WO 98/16654, опубликованную 23 апреля 1998 года, WO 98/24893, опубликованную 11 июня 1998 года, WO 98/50433, опубликованную 12 ноября 1998 года, WO 99/45031, опубликованную 10 сентября 1999 года, WO 99/53049, опубликованную 21 октября 1999 года, WO 00 09560, опубликованную 24 февраля 2000 года и WO 00/037504, опубликованную 29 июня 2000 года. Трансгенная мышь XENOMOUSE продуцирует репертуар полностью человеческих антител, подобный репертуару антител взрослого человека, и генерирует антиген-специфические mAb человека. Трансгенная мышь XENOMOUSE содержит приблизительно 80% репертуара антител человека посредством введения YAC-фрагментов со структурой зародышевой линии и размером мега-п.н. локусов тяжелой цепи человека и х локусов легкой цепи. См. Mendez et al., Nature Genetics 15:146-156 (1997), Green and Jakobovits J. Exp. Med. 188:483-495 (1998), описания которых включены в данное описание путем ссылки.
Способы in vitro также могут быть использованы для получения исходных антител, в которых библиотеку антител подвергают скринингу для идентификации антитела, имеющего желаемую специфичность связывания. Способы такого скрининга библиотек рекомбинантных антител хорошо известны в данной области и включают в себя способы, описанные, например, у Ladner et al. патент США № 5223409; Kang et al. публикация PCT № WO 92/18619; Dower et al. публикация PCT № WO 91/17271; Winter et al. публикация PCT № WO 92/20791; Markland et al. публикация PCT № WO 92/15679; Breitling et al. публикация PCT № WO 93/01288; McCafferty et al. публикация PCT № WO 92/01047; Garrard et al. публикация PCT № WO 92/09690; Fuchs et al. (1991) Bio/Technology9:1370-1372; Hay et al. (1992) Hum Antibod Hybridomas3:81-85; Huse et al. (1989) Science246:1275-1281; McCafferty et al., Nature (1990) 348:552-554; Griffiths et al. (1993) EMBO J12:725-734; Hawkins et al. (1992) J Mol Biol 226:889-896; Clackson et al. (1991) Nature352:624-628; Gram et al. (1992) PNAS89:3576-3580; Garrad et al. (1991) Bio/Technology9:1373-1377; Hoogenboom et al. (1991) Nuc Acid Res19:4133-4137; и Barbas et al. (1991) PNAS88:7978-7982, в публикации заявки на патент США 20030186374 и публикации PCT № WO 97/29131, содержание каждого из которых включено в данное описание путем ссылки.
Исходные антитела согласно изобретению могут быть также генерированы с использованием различных способов фагового дисплея, известных в данной области. В способах фагового дисплея функциональные домены антител представлены на поверхности фаговых частиц, которые несут полинуклеотидные последовательности, кодирующие их. В частности, такой фаг может быть использован для представления антигенсвязывающих доменов, экспрессируемых из репертуара или комбинаторной библиотеки антител (например, человека или мышиных). Фаг, экспрессирующий антигенсвязывающий домен, который связывает представляющий интерес антиген, может быть выбран или идентифицирован антигеном, например, с использованием меченого антигена или антигена, связанного или привязанного к твердой поверхности или грануле. Фаг, используемый в данных способах, является обычно нитчатым фагом, включающим в себя домены связывания fd и М13, экспрессируемые из фага, причем домены Fab, Fv или стабилизированные дисульфидом Fv-домены антител рекомбинантно слиты либо с белком гена III, либо с белком гена VIII фага. Примеры способов фагового дисплея, которые могут быть использованы для получения антител согласно изобретению, включают в себя способы, описанные у Brinkman et al., J. Immunol. Methods 182:41-50 (1995); Ames et al., J. Immunol. Methods 184:177-186 (1995); Kettleborough et al., Eur. J. Immunol. 24:952-958 (1994); Persic et al., Gene 187 9-18 (1997); Burton et al., Advances in Immunology 57:191-280 (1994); в заявке PCT№ PCT/GB91/01134; публикациях PCT WO 90/02809; WO 91/10737; WO 92/01047; WO 92/18619; WO 93/11236; WO 95/15982; WO 95/20401; и патентах США №№ 5698426; 5223409; 5403484; 5580717; 5427908; 5750753; 5821047; 5571698; 5427908; 5516637; 5780225; 5658727; 5733743 и 5969108; каждый из которых полностью включен в данное описание путем ссылки.
Как описано в приведенных выше ссылках, после выбора фага кодирующие области антитела из фага могут быть выделены и использованы для генерирования целых антител, включая антитела человека или любой другой желаемый антигенсвязывающий фрагмент, и экспрессированы в любом желаемом хозяине, включая клетки млекопитающего, клетки насекомых, клетки растений, дрожжи и бактерии, например, как описано подробно ниже. Например, способы рекомбинантного получения фрагментов Fab, Fab' и F(ab')2 могут быть также использованы с применением способов, известных в данной области, таких как способы, описанные в публикации PCT WO 92/22324; Mullinax et al., BioTechniques 12(6):864-869 (1992); и Sawai et al., AJRI 34:26-34 (1995); и Better et al., Science 240:1041-1043 (1988) (указанные ссылки полностью включены в данное описание путем ссылки). Примеры способов, которые могут быть использованы для получения одноцепочечных Fv и антител, включают в себя способы, описанные в патентах США 4946778 и 5258498; Huston et al., Methods in Enzymology 203:46-88 (1991); Shu et al., PNAS 90:7995-7999 (1993); и Skerra et al., Science 240:1038-1040 (1988).
Альтернативно скринингу библиотек рекомбинантных антител с использованием фагового дисплея, для идентификации исходных антител могут быть использованы другие методологии, известные в данной области для скрининга больших комбинаторных библиотек. Одним типом альтернативной системы экспрессии является система экспрессии, в которой библиотеку рекомбинантных антител экспрессируют в виде слияний РНК-белок, как описано в публикации PCT № WO 98/31700 Szostak and Roberts и у Roberts, R.W. and Szostak, J.W. (1997) Proc. Natl. Acad. Sci. USA94:12297-12302. В этой системе создают ковалентное слияние между мРНК и пептидом или белком, который кодируется трансляцией in vitro синтетических мРНК, которые несут пуромицин, пептидильный акцепторный антибиотик, на их 3'-конце. Таким образом, специфическая мРНК может быть обогащена из комплексной смеси мРНК (например, комбинаторной библиотеки) на основе свойств кодируемого пептида или белка, например, антитела или его части, например, связыванием антитела или его части с антигеном с двойной специфичностью. Последовательности нуклеиновых кислот, кодирующие антитела или их части, извлеченные из скрининга таких библиотек, могут быть экспрессированы рекомбинантными способами, как описано выше (например, в клетках-хозяевах млекопитающего), и, кроме того, могут быть подвергнуты дополнительному созреванию аффинности либо дополнительными раундами скрининга слияний мРНК-пептид, в которых могли быть введены мутации в первоначально выбранные последовательности, либо другими способами для созревания аффинности in vitro рекомбинантных антител, как описано выше.
В другом подходе исходные антитела могут быть также генерированы с использованием способа дрожжевого дисплея, известного в данной области. В способах дрожжевого дисплея используют генетические способы для присоединения доменов антител к стенке дрожжевой клетки и их экспрессии на поверхности дрожжей. В частности, такие дрожжи могут быть использованы для экспрессии антигенсвязывающих доменов, экспрессируемых из репертуара комбинаторной библиотеки антител (например, человека или мыши). Примеры способов дрожжевого дисплея, которые могут быть использованы для получения исходных антител, включают в себя способы, описанные у Wittrup, et al. в патенте США № 6699658, включенном в данное описание путем ссылки.
Описанные выше антитела могут быть дополнительно модифицированы для генерирования CDR-трансплантированных и гуманизированных исходных антител. CDR-трансплантированные исходные антитела содержат последовательности вариабельных областей тяжелой и легкой цепи из антитела человека, где один или несколько CDR-районов VH и/или VL заменены CDR-последовательностями мышиных антител, способных связывать представляющий интерес антиген. Каркасная последовательность из любого антитела человека может служить в качестве шаблона для трансплантации CDR. Однако прямая замена цепи на такой каркас часто приводит к некоторой потере связывающей аффинности в отношении антигена. Чем более гомологичным является антитело человека относительно исходного мышиного антитела, тем менее вероятной является возможность того, что объединение мышиных CDR с каркасом человека будет вводить нарушения в CDR, которые могут уменьшать аффинность. Таким образом, предпочтительно, чтобы вариабельный каркас человека, который выбран для замены мышиного вариабельного каркаса, кроме CDR, имел по меньшей мере 65% идентичность последовательности с каркасом вариабельной области мышиного антитела. Более предпочтительно, чтобы вариабельные области человека и мыши, кроме CDR, имели по меньшей мере 70% идентичность последовательности. Еще более предпочтительно, чтобы вариабельные области человека и мыши, кроме CDR, имели по меньшей мере 75% идентичность последовательности. Наиболее предпочтительно, чтобы вариабельные области человека и мыши, кроме CDR, имели по меньшей мере 80% идентичность последовательности. Способы получения таких антител известны в данной области (см. EP 239400; публикацию PCT WO 91/09967; патенты США №№ 5225539; 5530101 и 5585089), например, облицовка или изменение поверхности (EP 592106; EP 519596; Padlan, Molecular Immunology 28(4/5):489-498 (1991); Studnicka et al., Protein Engineering 7(6):805-814 (1994); Roguska et al., PNAS 91:969-973 (1994)) и перетасовка цепи (патент США № 5565352).
Гуманизированные антитела являются молекулами антител из антитела вида не-человека, которое связывает желаемый антиген, имеющими один или несколько определяющих комплементарность районов (CDR) из молекулы иммуноглобулина видов не-человека и каркасные области из молекулы иммуноглобулина человека. Известные Ig-последовательности человека описаны, например, в
www.ncbi.nlm.nih.gov/entrez- /query.fcgi; www.atcc.org/phage/hdb.html; www.sciquest.com/; www.abcam.com/; www.antibodyresource.com/onlinecomp.html; www.public.iastate.edu/.about.pedro/research_tools.html; www.mgen.uni-heidelberg.de/SD/IT/IT.html; www.whfreeman.com/immunology/CH- 05/kuby05.htm; www.library.thinkquest.org/12429/Immune/Antibody.html; www.hhmi.org/grants/lectures/1996/vlab/; www.path.cam.ac.uk/.about.mrc7/m- ikeimages.html; www.antibodyresource.com/; mcb.harvard.edu/BioLinks/Immuno- logy.html.www.immunologylink.com/; pathbox.wustl.edu/.about.hcenter/index.- html; www.biotech.ufl.edu/.about.hcl/; www.pebio.com/pa/340913/340913.html- ; www.nal.usda.gov/awic/pubs/antibody/; www.m.ehime-u.acjp/.about.yasuhito- /Elisa.html; www.biodesign.com/table.asp; www.icnet.uk/axp/facs/davies/lin- ks.html; www.biotech.ufl.edu/.about.fccl/protocol.html; www.isac-net.org/sites_geo.html; aximtl.imt.uni-marburg.de/.about.rek/AEP- Start.html; baserv.uci.kun.nl/.about.jraats/linksl.html; www.recab.uni-hd.de/immuno.bme.nwu.edu/; www.mrc-cpe.cam.ac.uk/imt-doc/pu- blic/INTRO.html; www.ibt.unam.mx/vir/V_mice.html; imgt.cnusc.fr:8104/; www.biochem.ucl.ac.uk/.about.martin/abs/index.html; antibody.bath.ac.uk/; abgen.cvm.tamu.edu/lab/wwwabgen.html; www.unizh.ch/.about.honegger/AHOsem- inar/Slide01.html; www.cryst.bbk.ac.uk/.about.ubcg07s/; www.nimr.mrc.ac.uk/CC/ccaewg/ccaewg.htm; www.path.cam.ac.uk/.about.mrc7/h- umanisation/TAHHP.html; www.ibt.unam.mx/vir/structure/stat_aim.html; www.biosci.missouri.edu/smithgp/index.html; www.cryst.bioc.cam.ac.uk/.abo- ut.fmolina/Web-pages/Pept/spottech.html; www.jerini.de/fr roducts.htm; www.patents.ibm.com/ibm.html. Kabat et al., Sequences of Proteins of Immunological Interest, U.S. Dept. Health (1983),
каждая из которых включена в данное описание путем ссылки. Такие импортированные последовательности могут быть использованы для уменьшения иммуногенности или уменьшения, усиления или модификации связывания, аффинности, скорости ассоциации, скорости диссоциации, авидности, специфичности, периода полу-жизни или любой другой характеристики, как известно в данной области.
Каркасные остатки в каркасных областях человека могут быть заменены соответствующим остатком из CDR донорского антитела для изменения, предпочтительно улучшения, связывания антигена. Эти каркасные замены идентифицируют способами, хорошо известными в данной области, например моделированием взаимодействий остатков CDR и каркасных остатков для идентификации каркасных остатков, важных для связывания антигена и сравнения последовательностей для идентификации необычных каркасных остатков в конкретных положениях (См., например, Queen et al., патент США № 5585089; Riechmann et al., Nature 332:323 (1988), которые полностью включены в данное описание путем ссылки). Трехмерные модели иммуноглобулина являются обычно доступными и известны квалифицированным специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и изображают возможные трехмерные конформационные структуры выбранных кандидатных последовательностей иммуноглобулинов. Исследование этих дисплеев позволяет анализировать вероятную роль остатков в функционировании кандидатной последовательности иммуноглобулина, т.е. анализировать остатки, которые влияют на способность кандидатного иммуноглобулина связывать его антиген. Таким образом, остатки FR могут быть выбраны и комбинированы из консенсусных и импортных последовательностей так, что достигают желаемой характеристики антитела, такой как увеличенная аффинность в отношении антигена-мишени (антигенов-мишеней). Как правило, остатки CDR непосредственно и наиболее существенно участвуют в действии на связывание антигена. Антитела могут быть гуманизированы с использованием различных способов, известных в данной области, таких как, но не ограничивающихся ими, способы, описанные у Jones et al., Nature 321:522 (1986); Verhoeyen et al., Science 239:1534 (1988)), Sims et al., J. Immunol. 151: 2296 (1993); Chothia and Lesk, J. Mol. Biol. 196:901 (1987), Carter et al., Proc. Natl. Acad. Sci. U.S.A. 89:4285 (1992); Presta et al., J. Immunol. 151:2623 (1993), Padlan, Molecular Immunology 28(4/5):489-498 (1991); Studnicka et al., Protein Engineering 7(6):805-814 (1994); Roguska. et al., PNAS 91:969-973 (1994); в публикации PCT WO 91/09967, PCT/: US98/16280, US96/18978, US91/09630, US91/05939, US94/01234, GB89/01334, GB91/01134, GB92/01755; WO90/14443, WO90/14424, WO90/14430, EP 229246, EP 592106; EP 519596, EP 239400, патентах США №№ 5565332, 5723323, 5976862, 5824514, 5817483, 5814476, 5763192, 5723323, 5766886, 5714352, 6204023, 6180370, 5693762, 5530101, 5585089, 5225539; 4816567, каждый из которых полностью включен в данное описание путем ссылки, включая цитируемые в них ссылки.
Исходные моноклональные антитела могут быть выбраны из различных моноклональных антител, способных связывать специфические мишени и хорошо известных в данной области. Они включают в себя, но не ограничиваются ими, анти-TNF-антитело (патент США № 6258562), анти-IL-12 и/или анти-IL-12p40-антитело (патент США № 6914128); анти-IL-18-антитело (US 2005/0147610 A1), анти-C5, анти-CBL, анти-CD147, анти-gp120, анти-VLA-4, анти-CD11a, анти-CD18, анти-VEGF, анти-CD40L, анти-Id, анти-ICAM-1, анти-CXCL13, анти-CD2, анти-EGFR, анти-TGF-бета 2, анти-E-селектин, анти-Fact VII, анти-Her2/neu, анти-F gp, анти-CD11/18, анти-CD14, анти-ICAM-3, анти-CD80, анти-CD4, анти-CD3, анти-CD23, анти-бета2-интегрин, анти-альфа4бета7, анти-CD52, анти-HLA DR, анти-CD22, анти-CD20, анти-MIF, анти-CD64 (FcR), анти-TCR альфа бета, анти-CD2, анти-Hep B, анти-CA 125, анти-EpCAM, анти-gp120, анти-CMV, анти-gpIIbIIIa, анти-IgE, анти-CD25, анти-CD33, анти-HLA, анти-VNRинтегрин, анти-IL-1альфа, анти-IL-1бета, анти-IL-1 рецептор, анти-IL-2 рецептор, анти-IL-4, анти-IL-4 рецептор, анти-IL5, анти-IL-5 рецептор, анти-IL-6, анти-IL-8, анти-IL-9, анти-IL-13, анти-IL-13 рецептор, анти-IL-17 и анти-IL-23 (см. Presta LG. 2005 Selection, design, and engineering of therapeutic antibodies J Allergy Clin Immunol. 116:731-6 и
http://www.path.cam.ac.uk/~mrc7/humanisation/antibodies.html ).
Исходные моноклональные антитела могут быть также выбраны из различных терапевтических антител, одобренных для применения в клинических испытаниях или находящихся в разработке для клинического применения. Такие терапевтические антитела включают в себя, но не ограничиваются ими, ритуксимаб (Rituxan®, IDEC/Genentech/Roche) (см., например, патент США № 5736137), химерное анти-CD20-антитело, одобренное для лечения не-Ходжкинской лимфомы; HuMax-CD20, анти-CD20, в настоящее время разрабатываемое Genmab, анти-CD20-антитело, описанное в патенте США № 5500362, AME-133 (Applied Molecular Evolution), hA20 (Immunomedics, Inc.), HumaLYM (Intracel) и PRO70769 (PCT/US2003/040426, озаглавленный "Immunoglobulin Variants and Uses Thereof"), трастузумаб (Herceptin®, Genentech) (см., например, патент США № 5677171), гуманизированное анти-Her2/neu-антитело, одобренное для лечения рака молочной железы; пертузумаб (rhuMab-2C4, Omnitarg®), в настоящее время разрабатываемое Genentech; анти-Her2-антитело, описанное в патенте США № 4753894; цетуксимаб (Erbitux®, Imclone) (патент США № 4943533; PCT WO 96/40210), химерное анти-EGFR-антитело в клинических испытаниях для различных типов рака; ABX-EGF (патент США № 6235883), в настоящее время разрабатываемое Abgenix-Immunex-Amgen; HuMax-EGFr (патент США № 10/172317), в настоящее время разрабатываемое Genmab; 425, EMD55900, EMD62000 и EMD72000 (Merck KGaA) (патент США № 5558864; Murthy et al. 1987, Arch Biochem Biophys. 252(2):549-60; Rodeck et al., 1987, J Cell Biochem. 35(4):315-20; Kettleborough et al., 1991, Protein Eng. 4(7):773-83); ICR62 (Institute of Cancer Research) (PCT WO 95/20045; Modjtahedi et al., 1993, J. Cell Biophys. 1993, 22(1-3):129-46; Modjtahedi et al., 1993, Br J Cancer. 1993, 67(2):247-53; Modjtahedi et al, 1996, Br J Cancer, 73(2):228-35; Modjtahedi et al, 2003, Int J Cancer, 105(2):273-80); TheraCIM hR3 (YM Biosciences, Canada and Centro de Immunologia Molecular, Cuba (патент США № 5891996; патент США № 6506883; Mateo et al, 1997, Immunotechnology, 3(1):71-81); mAb-806 (Ludwig Institue for Cancer Research, Memorial Sloan-Kettering) (Jungbluth et al. 2003, Proc Natl Acad Sci USA. 100(2):639-44); KSB-102 (KS Biomedix); MR1-1 (IVAX, National Cancer Institute) (PCT WO 0162931A2) и SC100 (Scancell) (PCT WO 01/88138); алемтузумаб (Campath®, Millenium), гуманизированное моноклональное антитело, в настоящее время одобренное для лечения В-клеточного хронического лейкоцитарного лейкоза; муромонаб-CD3 (Orthoclone OKT3®), анти-CD3-антитело, разработанное Ortho Biotech/Johnson & Johnson, ибритумомаб-тиуксетан (Zevalin®), анти-CD20-антитело, разработанное IDEC/Schering AG, гемтузумаб-озогамицин (Mylotarg®), анти-CD33 (белок p67)-антитело, разработанное Celltech/Wyeth, алефацепт (Amevive®), анти-LFA-3-Fc-слияние, разработанное Biogen), абциксимаб (ReoPro®), разработанное Centocor/Lilly, базиликсимаб (Simulect®), разработанное Novartis, паливизумаб (Synagis®), разработанное Medimmune, инфликсимаб (Remicade®), анти-TNFальфа-антитело, разработанное Centocor, адалимумаб (Humira®), анти-TNFальфа-антитело, разработанное Abbott, Humicade®, анти-TNFальфа-антитело, разработанное Celltech, этанерцепт (Enbrel®), анти-TNFальфа-Fc-слияние, разработанное Immunex/Amgen, ABX-CBL, анти-CD147-антитело, разработанное Abgenix, ABX-IL8, анти-IL8-антитело, разработанное Abgenix, ABX-MA1, анти-MUC18-антитело, разработанное Abgenix, пемтумомаб (R1549, 90Y-muHMFG1), анти-MUC1, находящееся в разработке Antisoma, Therex (R1550), анти-MUC1-антитело, разрабатываемое Antisoma, ангиомаб (AS1405), разрабатываемое Antisoma, HuBC-1, разрабатываемое Antisoma, Тиоплатин (AS1407), разрабатываемое Antisoma, Antegren® (натализумаб), анти-альфа-4-бета-1 (VLA-4) и альфа-4-бета-7-антитело, разрабатываемое Biogen, VLA-1-mAb, анти-VLA-1-интегрин-антитело, разрабатываемое Biogen, LTBR mAb, анти-лимфотоксин бета-рецептор(LTBR)-антитело, разрабатываемое Biogen, CAT-152, анти-TGF-β2-антитело, разрабатываемое Cambridge Antibody Technology, J695, анти-IL-12-антитело, разрабатываемое Cambridge Antibody Technology и Abbott, CAT-192, анти-TGFβ1-антитело, разрабатываемое Cambridge Antibody Technology и Genzyme, CAT-213, анти-эотаксин1-антитело, разрабатываемое Cambridge Antibody Technology, LymphoStat-B® анти-Blys-антитело, разрабатываемое Cambridge Antibody Technology и Human Genome Sciences Inc., TRAIL-R1mAb, анти-TRAIL-R1-антитело, разрабатываемое Cambridge Antibody Technology и Human Genome Sciences, Inc., Avastin® бевацизумаб, (rhuMAb-VEGF), анти-VEGF-антитело, разрабатываемое Genentech, анти-семейство HER-рецепторов-антитело, разрабатываемое Genentech, анти-тканевой фактор (ATF), анти-тканевый фактор-антитело, разрабатываемое Genentech, Xolair® (омализумаб), анти-IgE-антитело, разрабатываемое Genentech, Raptiva® (эфализумаб), анти-CD11a-антитело, разрабатываемое Genentech и Xoma, MLN-02-антитело (ранее LDP-02), разрабатываемое Genentech и Millenium Pharmaceuticals, HuMax CD4, анти-CD4-антитело, разрабатываемое Genmab, HuMax-IL15, анти-IL15-антитело, разрабатываемое Genmab и Amgen, HuMax-Inflam, разрабатываемое Genmab и Medarex, HuMax-Cancer, анти-гепараназа I-антитело, разрабатываемое Genmab и Medarex и Oxford GcoSciences, HuMax-лимфома, разрабатываемое Genmab и Amgen, HuMax-TAC, разрабатываемое Genmab, IDEC-131, и анти-CD40L-антитело, разрабатываемое IDEC Pharmaceuticals, IDEC-151 (кленоликсимаб), анти-CD4-антитело, разрабатываемое IDEC Pharmaceuticals, IDEC-114, анти-CD80-антитело, разрабатываемое IDEC Pharmaceuticals, IDEC-152, антиi-CD23, разрабатываемое IDEC Pharmaceuticals, анти-фактор миграции макрофагов (MIF)-антитела, разрабатываемые IDEC Pharmaceuticals, BEC2, антиидиотипическое антитело, разрабатываемое Imclone, IMC-1C11, анти-KDR-антитело, разрабатываемое Imclone, DC101, анти-flk-1-антитело, разрабатываемое Imclone, анти-VE-кадгерин-антитела, разрабатываемые Imclone, CEA-Cide® (лабетузумаб), анти-карциноэмбриональный антиген (CEA)-антитело, разрабатываемое Immunomedics, LymphoCide® (эпратузумаб), анти-CD22-антитело, разрабатываемое Immunomedics, AFP-Cide, разрабатываемое Immunomedics, MyelomaCide, разрабатываемое Immunomedics, LkoCide, разрабатываемое Immunomedics, ProstaCide, разрабатываемое Immunomedics, MDX-010, анти-CTLA4-антитело, разрабатываемое Medarex, MDX-060, анти-CD30-антитело, разрабатываемое Medarex, MDX-070, разрабатываемое Medarex, MDX-018, разрабатываемое Medarex, Osidem® (IDM-1) и анти-Her2-антитело, разрабатываемое Medarex и Immuno-Designed Molecules, HuMax®-CD4, анти-CD4-антитело, разрабатываемое Medarex и Genmab, HuMax-IL15, анти-IL15-антитело, разрабатываемое Medarex и Genmab, CNTO 148, анти-TNFα-антитело, разрабатываемое Medarex и Centocor/J&J, CNTO 1275, анти-цитокин-антитело, разрабатываемое Centocor/J&J, MOR101 и MOR102, анти-молекула-1 межклеточной адгезии (ICAM-1)(CD54)-антитела, разрабатываемые MorphoSys, MOR201, анти-рецептор-3 фактора роста фибробластов (FGFR-3)-антитело, разрабатываемое MorphoSys, Nuvion® (визилизумаб), анти-CD3-антитело, разрабатываемое Protein Design Labs, HuZAF®, анти-гамма-интерферон-антитело, разрабатываемое Protein Design Labs, Anti-α5β1-интегрин-антитело, разрабатываемое Protein Design Labs, anti-IL-12-антитело, разрабатываемое Protein Design Labs, ING-1, анти-Ep-CAM-антитело, разрабатываемое Xoma, Xolair® (мализумаб), гуманизированное анти-IgE-антитело, разрабатываемое Genentech и Novartis, и MLN01, анти-бета2-интегрин-антитело, разрабатываемое Xoma, все цитируемые выше ссылки в этом абзаце специально включены в данное описание путем ссылки.
B. Конструирование молекул с двойными вариабельными доменами (DVD-молекул)
Молекулу иммуноглобулина с двойными вариабельными доменами (DVD-Ig) конструируют таким образом, что два разных вариабельных домена легкой цепи (VL) из двух разных исходных mAb связывают в тандеме непосредственно или через короткий линкер способами рекомбинантных ДНК, за которым следует константный домен легкой цепи. Аналогично, тяжелая цепь содержит два разных вариабельных домена тяжелой цепи (VH), связанных в тандеме, за которым следуют константный домен СН1 и Fc-район (фиг.1А).
Вариабельные домены могут быть получены с использованием способов рекомбинантных ДНК из исходного антитела, генерированного любым из описанных выше способов. В предпочтительном варианте осуществления вариабельным доменом является вариабельный домен тяжелой или легкой цепи. Более предпочтительно вариабельным доменом является CDR-трансплантированный или гуманизированный вариабельный домен тяжелой или легкой цепи. Наиболее предпочтительно вариабельным доменом является вариабельный домен тяжелой или легкой цепи иммуноглобулина человека.
В одном из вариантов осуществления первый и второй вариабельные домены связывают непосредственно друг с другом с использованием способов рекомбинантных ДНК. В другом варианте осуществления вариабельные домены связывают через линкерную последовательность. Предпочтительно связывают два вариабельных домена. Три или более вариабельных доменов могут быть также связаны непосредственно или через линкерную последовательность. Вариабельные домены могут связывать один и тот же антиген или могут связывать разные антигены. DVD-молекулы согласно изобретению могут включать в себя один вариабельный домен иммуноглобулина и один вариабельный домен не-иммуноглобулина, например, лигандсвязывающий домен рецептора, активный домен фермента. DVD-молекулы могут также содержать 2 или более доменов не-Ig.
Линкерная последовательность может быть единственной аминокислотой или полипептидной последовательностью. Предпочтительно линкерные последовательности выбраны из группы, состоящей из AKTTPKLEEGEFSEAR; AKTTPKLEEGEFSEARV; AKTTPKLGG; SAKTTPKLGG; AKTTPKLEEGEFSEARV; SAKTTP; SAKTTPKLGG; RADAAP; RADAAPTVS; RADAAAAGGPGS; RADAAAA(G4S)4;SAKTTP; SAKTTPKLGG; SAKTTPKLEEGEFSEARV; ADAAP; ADAAPTVSIFPP; TVAAP; TVAAPSVFIFPP; QPKAAP; QPKAAPSVTLFPP; AKTTPP; AKTTPPSVTPLAP; AKTTAP; AKTTAPSVYPLAP; ASTKGP; ASTKGPSVFPLAP; GGGGSGGGGSGGGGS; GENKVEYAPALMALS; GPAKELTPLKEAKVS и GHEAAAVMQVQYPAS. Выбор линкерной последовательности основан на анализе структуры кристаллов нескольких Fab-молекул. Существует природная гибкая связь между вариабельным доменом и константным доменом CH1/CL в молекулярной структуре Fab или антитела. Эта природная связь содержит приблизительно 10-12 аминокислотных остатков, в которые входят 4-6 остатков из С-конца V-домена и 4-6 остатков из N-конца домена CL/CН1. DVD-Ig согласно изобретению генерировали с использованием N-концевых 5-6 аминокислотных остатков или 11-12 аминокислотных остатков, CL или CH1 в качестве линкера в легкой цепи и тяжелой цепи DVD-Ig, соответственно. N-концевые остатки CL- или CH1-доменов, в частности, первые 5-6 аминокислотных остатков, принимают конформацию петли без сильных вторичных структур и, следовательно, могут действовать в качестве гибких линкеров между двумя вариабельными доменами. N-концевые остатки CL- или CH1-доменов являются природным удлинением вариабельных доменов, так как они являются частью Ig-последовательностей и, следовательно, минимизируют большую степень любой иммуногенности, потенциально возникающей от линкеров и соединений.
Другие линкерные последовательности могут включать в себя любую последовательность любой длины CL/CH1-домена, но не все остатки CL/CH1-домена; например, первые 5-12 аминокислотных остатков CL/CH1-доменов; линкеры легкой цепи могут быть произведены из Cκ или Cλ; а линкеры тяжелой цепи могут быть произведены из CH1 любых изотипов, включая Cγ1, Cγ2, Cγ3, Cγ4, Cα1, Cα2, Cδ, Cε и Cµ. Линкерные последовательности могут быть также произведены из других белков, таких как Ig-подобные белки (например, TCR, FcR, KIR); последовательностей на основе G/S (например, повторов G4S); произведенных из шарнирной области последовательностей; и других природных последовательностей из других белков.
В предпочтительном варианте осуществления константную область связывают с двумя связанными вариабельными доменами с использованием технологий рекомбинантных ДНК. Предпочтительно последовательность, содержащую связанные вариабельные домены тяжелой цепи, связывают с константным доменом тяжелой цепи, а последовательность, содержащую связанные вариабельные домены легкой цепи, связывают с константным доменом легкой цепи. Предпочтительно константными доменами являются константный домен тяжелой цепи человека и константный домен легкой цепи человека, соответственно. Наиболее предпочтительно тяжелую цепь DVD связывают дополнительно с Fc-районом. Fc-районом может быть Fc-район с нативной последовательностью или вариантный Fc-район. Наиболее предпочтительно Fc-район является Fc-районом человека. В предпочтительном варианте осуществления Fc-район включает в себя Fc-район из IgG1, IgG2, IgG3, IgG4, IgA, IgM, IgE или IgD.
В наиболее предпочтительном варианте осуществления два полипептида DVD тяжелой цепи и два полипептида DVD легкой цепи объединяют с образованием молекулы DVD-Ig. Подробное описание специфических молекул DVD-Ig, способных связывать специфические мишени, и способов их получения представлены в разделе Примеры ниже.
C. Получение DVD-белков
Связывающие белки согласно изобретению могут быть получены любым из ряда способов, известных в данной области. Например, экспрессией из клеток-хозяев, где экспрессирующий вектор (векторы), кодирующий тяжелые цепи DVD и легкие цепи DVD трансфицируют в клетку-хозяина стандартными способами. Предполагается, что различные формы термина «трансфекция» включают в себя широкое разнообразие способов, обычно используемых для введения экзогенной ДНК в прокариотическую или эукариотическую клетку-хозяина, например, электропорацию, осаждение фосфатом кальция, трансфекцию с использованием DEAE-декстрана и т.п. Хотя DVD-белки согласно изобретению можно экспрессировать либо в прокариотических, либо в эукариотических клетках-хозяевах, экспрессия DVD-белков в эукариотических клетках является предпочтительной и наиболее предпочтительной в клетках-хозяевах млекопитающего, так как такие эукариотические клетки (и, в частности, клетки млекопитающих) должны с большей вероятностью, чем прокариотические клетки, собираться и секретировать правильно уложенный и иммунологически активный DVD-белок.
Предпочтительные клетки-хозяева млекопитающих для экспрессии рекомбинантных антител согласно изобретению включают в себя клетки яичника Китайского хомячка (клетки СНО) (в том числе клетки dhfr- CHО, описанные в Urlaub and Chasin, (1980) Proc. Natl. Acad. Sci. USA77:4216-4220, используемые с DHFR-селектируемым маркером, например, описанные у R.J. Kaufman and P.A. Sharp (1982) Mol. Biol.159:601-621), клетки миеломы NS0, клетки COS и клетки SP2. При введении рекомбинантных экспрессирующих векторов, кодирующих DVD-белки, в клетки-хозяева млекопитающих DVD-белки получают культивированием клеток-хозяев в течение периода времени, достаточного для экспрессии DVD-белков в клетках-хозяевах или, более предпочтительно, секреции DVD-белков в культуральную среду, в которой растут клетки-хозяева. DVD-белки могут быть извлечены из культуральной среды с использованием стандартных способов очистки.
В предпочтительной системе для рекомбинантной экспрессии DVD-белков согласно изобретению рекомбинантный экспрессирующий вектор, кодирующий как тяжелую цепь DVD, так и легкую цепь DVD, вводят в клетки dhfr- CHO опосредованной фосфатом кальция трансфекцией. В этом рекомбинантном экспрессирующем векторе гены тяжелой и легкой цепи DVD функционально связаны с регуляторными элементами энхансер CMV/промотор AdMLP для запуска высоких уровней транскрипции генов. Рекомбинантный экспрессирующий вектор несет также ген DHFR, который делает возможным отбор клеток СНО, которые были трансфицированы этим вектором, с использованием отбора с метотрексатом/амплификации. Отобранные трансформированные клетки-хозяева культивируют для экспрессии тяжелой и легкой цепей DVD и интактный DVD-белок извлекают из культуральной среды. Для получения рекомбинантного экспрессирующего вектора используют стандартные способы молекулярной биологии, трансфекции клеток-хозяев, отбора трансформантов, культивирования клеток-хозяев и извлечения DVD-белка из культуральной среды. Дополнительно данное изобретение предоставляет способ синтеза DVD-белка согласно изобретению культивированием клетки-хозяина в подходящей культуральной среде до тех пор, пока не синтезируется DVD-белок. Способ дополнительно предусматривает выделение DVD-белка из культуральной среды.
Важным признаком DVD-Ig является то, что он может быть получен и очищен таким же образом, как и обычное антитело. Получение DVD-Ig приводит к гомогенному, единственному основному продукту с желаемой двойной специфической активностью без какой-либо модификации константной области или химических модификаций любого рода. Другие ранее описанные способы генерирования «биспецифических», «мультиспецифических» и «мультиспецифических мультивалентных» полноразмерных связывающих белков не приводят к единственному первичному продукту, но приводят вместо этого к внутриклеточному или секретируемому продуцированию смеси собранных, неактивных, моноспецифических, мультиспецифических, мультивалентных, полноразмерных связывающих белков и мультивалентных полноразмерных связывающих белков с комбинацией различных сайтов связывания. Например, на основе схемы, описанной Miller and Presta (публикация PCT WO 2001/077342(A1), возможны 16 комбинаций тяжелых и легких цепей. Таким образом, по-видимому только 6,25% белка находится в желаемой активной форме. Отделение полноразмерных форм белка от неактивных и частично активных форм белка с использованием стандартных способов хроматографии, обычно используемых в крупномасштабном производстве, еще должно быть продемонстрировано.
Неожиданно дизайн “мультивалентных полноразмерных связывающих белков с двойной специфичностью” согласно изобретению приводит к легкой цепи с двойным вариабельным доменом и тяжелой цепи с двойным вариабельным доменом, которые собираются первично в желаемые “имеющие двойную специфичность мультивалентные полноразмерные связывающие белки”.
По меньшей мере 50%, предпочтительно 75% и более предпочтительно 90% собранных и экспрессируемых молекул иммуноглобулина с двойными вариабельными доменами являются желаемым четырехвалентным белком, имеющим двойную специфичность. Данный аспект настоящего изобретения особенно усиливает коммерческую применимость изобретения. Таким образом, настоящее изобретение включает в себя способ экспрессии легкой цепи с двойным вариабельным доменом и тяжелой цепи с двойным вариабельным доменом в единственной клетке, приводящий к единственному первичному продукту “имеющего двойную специфичность четырехвалентного связывающего белка”.
Настоящее изобретение предоставляет предпочтительный способ для экспрессии легкой цепи с двойным вариабельным доменом и тяжелой цепи с двойным вариабельным доменом в единственной клетке, приводящий к “первичному продукту” “имеющего двойную специфичность четырехвалентного связывающего белка”, где “первичный продукт” составляет более чем 50% всего собранного белка, содержащего легкую цепь с двойным вариабельным доменом и тяжелую цепь с двойным вариабельным доменом.
Данное изобретение предоставляет более предпочтительный способ для экспрессии легкой цепи с двойным вариабельным доменом и тяжелой цепи с двойным вариабельным доменом в единственной клетке, приводящий к “первичному продукту” “имеющего двойную специфичность четырехвалентного связывающего белка”, где “первичный продукт” составляет более чем 75% всего собранного белка, содержащего легкую цепь с двойным вариабельным доменом и тяжелую цепь с двойным вариабельным доменом.
Данное изобретение предоставляет наиболее предпочтительный способ для экспрессии легкой цепи с двойным вариабельным доменом и тяжелой цепи с двойным вариабельным доменом в единственной клетке, приводящий к “первичному продукту” “имеющего двойную специфичность четырехвалентного связывающего белка”, где “первичный продукт” составляет более чем 90% всего собранного белка, содержащего легкую цепь с двойным вариабельным доменом и тяжелую цепь с двойным вариабельным доменом.
II. Дериватизированные связывающие DVD-белки:
Один из вариантов осуществления обеспечивает меченый связывающий белок, причем этот связывающий белок согласно изобретению дериватизирован или связан с другой функциональной молекулой (например, другим пептидом или белком). Например, меченый связывающий белок согласно изобретению может быть образован функциональным связыванием связывающего белка согласно изобретению (химическим связыванием, генетическим слиянием, нековалентной ассоциацией или иным образом) с одной или несколькими другими молекулярными частицами, такими как другое антитело (например, биспецифическое антитело или диатело), детектируемый агент, цитотоксический агент, фармацевтический агент и/или белок или пептид, которые могут опосредовать ассоциацию связывающего белка с другой молекулой (такой как сердцевинная часть стрептавидина или полигистидиновая метка).
Применимые детектируемые агенты, которыми может быть дериватизирован связывающий белок согласно изобретению, включают в себя флуоресцентные соединения. Примеры флуоресцентных детектируемых агентов включают в себя флуоресцеин, флуоресцеинизотиоцианат, родамин, 5-диметиламин-1-нафталинсульфонилхлорид, фикоэритрин и т.п. Связывающий белок может быть также дериватизирован детектируемыми ферментами, такими как щелочная фосфатаза, пероксидаза хрена, глюкозооксидаза и т.п. При дериватизации связывающего белка детектируемым ферментом его детектируют добавлением дополнительных реагентов, которые этот фермент использует для продуцирования детектируемого продукта реакции. Например, когда присутствует детектируемый агент пероксидаза хрена, добавление пероксида водорода и диаминобензидина приводит к окрашенному продукту реакции, который может быть детектирован, связывающий белок может быть также дериватизирован биотином и детектирован опосредованным измерением связывания авидина или стрептавидина.
Другой вариант осуществления изобретения обеспечивает получение кристаллизованного связывающего белка и готовых форм и композиций, содержащих такие кристаллы. В одном варианте осуществления кристаллизованный связывающий белок имеет больший период полу-жизни in vivo, чем растворимый аналог этого связывающего белка. В другом варианте осуществления связывающий белок сохраняет биологическую активность после кристаллизации.
Кристаллизованный связывающий белок согласно изобретению может быть получен в соответствии со способами, известными в данной области и описанными в WO 02072636, включенной в данное описание путем ссылки.
Другой вариант данного изобретения обеспечивает гликозилированный связывающий белок, в котором антитело или его антигенсвязывающая часть содержит один или несколько углеводных остатков. Получение белка in vivo может подвергаться дополнительному процессингу, известному как посттрансляционная модификация. В частности, остатки сахара (гликозильные остатки) могут быть добавлены ферментативно, процессом, известным как гликозилирование. Полученные белки, несущие ковалентно связанные олигосахаридные боковые цепи, известны как гликозилированные белки или гликопротеины. Антитела являются гликопротеинами с одним или несколькими углеводными остатками в Fc-домене, а также в вариабельном домене. Углеводные остатки в Fc-домене оказывают важное действие на эффекторную функцию Fc-домена с минимальным действием на связывание антигена или период полу-жизни антитела (R. Jefferis, Biotechnol. Prog.21 (2005), pp. 11-16). В противоположность этому, гликозилирование вариабельного домена может оказывать действие на антигенсвязывающую активность антитела. Гликозилирование в вариабельном домене может оказывать отрицательное действие на связывающую аффинность антитела, по-видимому, вследствие стерического препятствия (Co, M.S., et al., Mol. Immunol. (1993) 30:1361-1367), или приводит к увеличенной аффинности в отношении антигена (Wallick, S.C., et al., Exp. Med. (1988) 168:1099-1109; Wright, A., et al., EMBO J. (1991) 10:2717 2723).
Один из аспектов данного изобретения относится к генерированию мутантов сайта гликозилирования, в которых О- или N-связанный сайт гликозилирования связывающего белка был мутирован. Специалист в данной области сможет генерировать такие мутанты с использованием стандартных хорошо известных технологий. Мутанты сайта гликозилирования, которые сохраняют биологическую активность, но имеют увеличенную или уменьшенную связывающую активность, являются другим объектом настоящего изобретения.
Еще в одном варианте осуществления гликозилирование антитела или его антигенсвязывающей части согласно изобретению является модифицированным. Например, может быть получено дегликозилированное (агликозилированное) антитело (т.е. антитело, лишенное гликозилирования). Гликозилирование может быть изменено, например, для увеличения аффинности антитела в отношении антигена. Такие углеводные модификации могут быть выполнены, например, изменением одного или нескольких сайтов гликозилирования в последовательности антитела. Например, могут быть произведены замены одной или нескольких аминокислот, которые приводят к элиминации одного или нескольких сайтов гликозилирования вариабельной области с элиминацией посредством гликозилирования в этом сайте. Такое агликозилирование может увеличивать аффинность антитела в отношении антигена. Такой подход описан более подробно в публикации РСТ WO2003016466А2 и патентах США №№ 5714350 и 6350861, каждый из которых полностью включен в данное описание путем ссылки.
Дополнительно или альтернативно, может быть создан модифицированный связывающий белок согласно изобретению, который имеет измененный тип гликозилирования, такой как гипофукозилированное антитело, имеющее уменьшенные количества фукозильных остатков, или антитело, имеющее увеличенное рассечение на две части структур GlcNAc. Такие измененные картины гликозилирования были продемонстрированы для увеличения ADCC-способности антител. Такие углеводные модификации могут быть выполнены, например, экспрессией антитела в клетке-хозяине с измененным аппаратом гликозилирования. Клетки с измененным аппаратом гликозилирования были описаны в данной области и могут быть использованы в качестве клеток-хозяев, в которых экспрессируются рекомбинантные антитела согласно изобретению, для получения тем самым антитела с измененным гликозилированием. См., например, Shields, R. L. et al. (2002) J. Biol. Chem. 277:26733-26740; Umana et al. (1999) Nat. Biotech. 17:176-1, а также европейский патент № EP 1176195; публикации PCT WO 03/035835; WO 99/5434280, все из которых полностью включены в данное описание путем ссылки.
Гликозилирование белка зависит от аминокислотной последовательности представляющего интерес белка, а также клетки-хозяина, в которой экспрессируется этот белок. Различные организмы могут продуцировать разные ферменты гликозилирования (например, гликозилтрансферазы и гликозидазы) и имеют разные доступные субстраты (нуклеотидсахара). За счет таких факторов картина гликозилирования белка и состав гликозильных остатков могут различаться в зависимости от системы хозяина, в котором экспрессируется конкретный белок. Гликозильные остатки, используемые в данном изобретении, могут включать в себя, но не ограничиваются ими, глюкозу, галактозу, маннозу, фукозу, н-ацетилглюкозамин и сиаловую кислоту. Предпочтительно гликозилированный связывающий белок содержит гликозилированные остатки, которые создают картину гликозилирования белка человека.
Квалифицированным в данной области специалистам известно, что различающееся гликозилирование белков может приводить к различающимся характеристикам белков. Например, эффективность терапевтического белка, продуцируемого в микроорганизме-хозяине, таком как дрожжи, и гликозилирование с использованием эндогенного пути дрожжей могут быть уменьшенными по сравнению с гликозилированием того же самого белка, экспрессируемого в клетке млекопитающего, такой как линия клеток СНО. Такие гликопротеины могут быть также иммуногенными у людей и обнаруживать уменьшенный период полу-жизни in vivo после введения. Специфические рецепторы у людей и других животных могут узнавать специфические гликозильные остатки и стимулировать быстрый клиренс белка из кровотока. Другие неблагоприятные эффекты могут включать в себя изменения в укладке белков, растворимости, чувствительности к протеазам, направленной миграции, транспорте, компартментализации, секреции, узнавании другими белками или факторами, антигенности или аллергенности. Таким образом, практик может предпочесть терапевтический белок с конкретным составом и конкретной картиной гликозилирования, например, с составом и картиной гликозилирования, идентичными или по меньшей мере сходными с составом и картиной гликозилирования, продуцируемыми в клетках человека или в видоспецифических клетках предполагаемого субъекта-животного.
Экспрессии гликозилированных белков, отличающихся от белков клетки-хозяина, можно добиться генетической модификацией клетки-хозяина для экспрессии гетерологичных ферментов гликозилирования. Используя способы, известные в данной области, практик может генерировать антитела или их антигенсвязывающие части, обнаруживающие гликозилирование белков человека. Например, штаммы дрожжей могут быть генетически модифицированы для экспрессии не встречающихся в природе ферментов гликозилирования, так что гликозилированные белки (гликопротеины), продуцируемые в этих штаммах дрожжей, обнаруживают гликозилирование белков, идентичное гликозилированию клеток животных, в частности, клеток человека (заявки на патент США 20040018590 и 2002137134 и публикация РСТ WO2005100584 А2).
Кроме связывающих белков, данное изобретение относится также к антиидиотипическому (анти-Id) антителу, специфическому в отношении таких связывающих белков согласно изобретению. Анти-Id-антитело представляет собой антитело, которое узнает уникальные детерминанты, обычно ассоциированные с антигенсвязывающей областью другого антитела. Анти-Id может быть получено путем иммунизации животного связывающим белком или его содержащим CDR районом. Иммунизированное животное будет узнавать и отвечать на идиотипические детерминанты иммунизирующего антитела и продуцировать анти-Id-антитело. Анти-Id-антитело может быть также использовано в качестве “иммуногена” для индукции иммунного ответа у другого животного с получением так называемого анти-анти-Id-антитела.
Кроме того, квалифицированному специалисту в данной области будет понятно, что представляющий интерес белок может быть экспрессирован с использованием библиотеки клеток-хозяев, генетически сконструированных для экспрессии различных ферментов гликозилирования, так что клетки-хозяева, члены этой библиотеки, продуцируют представляющий интерес белок с вариантными распределениями (картинами) гликозилирования. Затем практик может отобрать и выделить представляющий интерес белок с конкретными новыми картинами гликозилирования. Предпочтительно, белок, имеющий конкретно отобранную новую картину гликозилирования, проявляет улучшенные или измененные биологические свойства.
III. Применения DVD-Ig
Учитывая их способность связываться с двумя или более антигенами, связывающие белки согласно изобретению могут быть использованы для детектирования антигенов (например, в биологической пробе, такой как сыворотка или плазма) с помощью общепринятого иммуноанализа, такого как твердофазный иммуноферментный анализ (ELISA), радиоиммуноанализ (RIA) или иммуногистохимия ткани. DVD-Ig прямо или опосредованно метят детектируемым веществом для облегчения детектирования связанного или несвязанного антитела. Подходящие детектируемые вещества включают в себя различные ферменты, простетические группы, флуоресцентные вещества, люминесцентные вещества и радиоактивные вещества. Примеры подходящих ферментов включают в себя пероксидазу хрена, щелочную фосфатазу, β-галактозидазу или ацетилхолинэстеразу; примеры подходящих комплексов простетических групп включают в себя стрептавидин/биотин и авидин/биотин; примеры подходящих флуоресцентных веществ включают в себя умбеллиферон, флуоресцеин, флуоресцеинизотиоцианат, родамин, дихлортриазиниламин-флуоресцеин, дансилхлорид или фикоэритрин; пример люминесцентного вещества включает в себя люминол; и примеры подходящего радиоактивного вещества включают в себя3H,14C,35S,90Y,99Tc,111In,125I,131I,177Lu,166Ho или153Sm.
Связывающие белки согласно изобретению предпочтительно способны нейтрализовать активность антигенов in vitro и in vivo. Таким образом, такие DVD-Ig могут быть использованы для ингибирования активности антигенов, например, в клеточной культуре, содержащей эти антигены, у субъектов-людей или у других субъектов-млекопитающих, имеющих антигены, с которыми перекрестно реагирует связывающий белок согласно изобретению. В другом варианте осуществления данное изобретение обеспечивает способ уменьшения активности антигена у субъекта, страдающего от заболевания или нарушения, для которого активность этого антигена является вредной. Связывающий белок согласно изобретению можно вводить субъекту-человеку для терапевтических целей.
В данном контексте термин “нарушение, при котором активность антигена является вредной” включает в себя заболевания и другие нарушения, при которых присутствие конкретного антигена у субъекта, страдающего от этого нарушения, является, как было показано, ответственным, или ожидается, что оно либо является ответственным за патофизиологию этого нарушения, либо является фактором, способствующим ухудшению этого нарушения. Таким образом, нарушение, при котором активность антигена является вредной, представляет собой нарушение, при котором, как ожидается, уменьшение активности антигена будет ослаблять симптомы и/или прогрессирование этого нарушения. Такие нарушения могут быть обнаружены, например, по увеличению концентрации антигена в биологической жидкости субъекта, страдающего от этого нарушения (например, по увеличению концентрации антигена в сыворотке, плазме, синовиальной жидкости и т.д. этого субъекта). Неограничивающие примеры нарушений, которые можно лечить связывающими белками согласно изобретению, включают в себя примеры нарушений, обсуждаемых ниже и в разделе, относящемся к фармацевтическим композициям антител согласно изобретению.
DVD-Ig согласно изобретению могут связывать один антиген или множественные антигены. Такие антигены включают в себя, но не ограничиваются ими, мишени, перечисленные в следующих базах данных, включенных в данное описание путем ссылки. Эти базы данных-мишени включают в себя следующие перечни:
Терапевтические мишени (http://xin.cz3.nus.edu.sg/group/cjttd/ttd.asp);
Цитокины и рецепторы цитокинов (http://www.cytokinewebfacts.com/, http://www.copewithcytokines.de/cope.cgi, и
http://cmbi.bjmu.edu.cn/cmbidata/cgf/CGF_Database/cytokine.medic.kumamoto-u.ac.jp/CFC/indexR.html);
Хемокины (http://cytokine.medic.kumamoto-u.ac.jp/CFC/CK/Chemokine.html);
Рецепторы хемокинов и GPCR (http://csp.medic.kumamoto-u.ac.jp/CSP/Receptor.html, http://www.gpcr.org/7tm/);
Обонятельные рецепторы (http://senselab.med.yale.edu/senselab/ORDB/default.asp);
Рецепторы (http://www.iuphar-db.org/iuphar-rd/list/index.htm);
Раковые мишени (http://cged.hgc.jp/cgi-bin/input.cgi);
Секретируемые белки в качестве потенциальных антител-мишеней (http://spd.cbi.pku.edu.cn/);
Протеинкиназы (http://spd.cbi.pku.edu.cn/) и
Маркеры CD человека (http://content.labvelocity.com/tools/6/1226/CD_table_final_locked.pdf) и (Zola H, 2005 CD molecules 2005: human cell differentiation molecules Blood, 106:3123-6).
DVD-Ig применимы в качестве терапевтических агентов для одновременного блокирования двух разных мишеней для усиления эффективности/безопасности и/или увеличения охвата пациентов. Такие мишени могут включать в себя растворимые мишени (IL-13 и TNF) и мишени-рецепторы клеточной поверхности (VEGFR и EGFR). Можно также использовать индукцию изменения направления цитотоксичности между опухолевыми клетками и Т-клетками (Her2 и CD3) для раковой терапии или между аутореактивной клеткой и эффекторными клетками для аутоиммунитета/трансплантации, или между любой клеткой-мишенью и эффекторной клеткой для элиминации индуцирующих заболевание клеток в любом конкретном заболевании.
Кроме того, DVD-Ig может быть использован для запуска образования скоплений (кластеринга) и активации рецептора при программе нацеливания на два различных эпитопа на одном и том же рецепторе. Это может быть выгодным при получении агонистических и антагонистических анти-GPCR-терапевтических средств. В этом случае DVD-Ig может быть использован для нацеливания на два разных эпитопа на одной клетке для кластеринга/передачи сигнала (двух молекул клеточной поверхности) или передачи сигнала (на одной молекуле). Аналогично, молекула DVD-Ig может быть сконструирована для запуска лигирования CTLA-4 и отрицательного сигнала нацеливанием на два разных эпитопа (или 2 копии одного и того же эпитопа) внеклеточного домена CTLA-4, что приводит к отрицательной регуляции иммунной реакции. CTLА-4 является клинически валидизированной мишенью для терапевтического лечения ряда иммунологических нарушений. Взаимодействия CTLA-4/B7 негативно регулируют активацию Т-клеток аттенуацией прогрессирования клеточного цикла, продуцирования IL-2 и пролиферации Т-клеток после активации, и участие CTLA-4 (CD152) может отрицательно регулировать активацию Т-клеток и стимулировать индукцию иммунологической толерантности. Однако стратегия аттенуации Т-клеток участием агонистического антитела с использованием СTLA-4 была безуспешной, так как активация CTLA-4 требует лигирования. Молекулярное взаимодействие CTLA-4/B7 происходит в рядах “перекошенной молнии”, как показано структурным анализом кристаллов (Stamper 2001 Nature 410:608). Однако ни один из доступных в настоящее время агентов связывания CTLA-4 не обладает свойствами лигирования, включая моноклональные анти-CTLA-4-антитела. Предпринималось несколько попыток преодоления этой проблемы. В одном случае генерировали связанное с клеточной мембраной одноцепочечное антитело, которое значительно ингибировало аллогенное отторжение у мышей (Hwang 2002 JI 169:633). В другом случае генерировали искусственное связанное с поверхностью АРС одноцепочечное антитело к CTLA-4 и показали, что оно аттенуирует Т-клеточные реакции (Griffin 2000 JI 164:4433). В обоих случаях лигирование CTLA-4 достигалось близко локализованными мембраносвязанными антителами в искусственных системах. Хотя эти эксперименты обеспечивают доказанную концепцию иммунной понижающей регуляции путем запуска CTLA-4 негативной передачи сигнала, реагенты, используемые в указанных сообщениях, не подходят для терапевтического использования. Для данной цели лигирование CTLA-4 может быть достигнуто путем использования молекулы DVD-Ig, которая нацелена на два разных эпитопа-мишени (или 2 копии одного и того же эпитопа) внеклеточного домена CTLA-4. Основанием для этого является то, что расстояние, разделяющее два сайта связывания IgG, приблизительно 150-170 Ангстрем, является слишком большим для активного лигирования CTLA-4 (30-50 Е между 2 гомодимерами CTLA-4). Однако расстояние между двумя сайтами связывания на DVD-Ig (на одном плече) является гораздо более коротким, также в диапазоне 30-50 Е, что делает возможным правильное лигирование CTLA-4.
Аналогично, DVD-Ig может быть нацелен на два различных члена комплекса рецепторов клеточной поверхности (например, IL-12R альфа и бета). Кроме того, DVD-Ig может быть нацелен на CR1 и растворимый белок/патоген для запуска быстрого клиренса растворимого белка/патогена-мишени.
Кроме того, DVD-Ig согласно изобретению могут быть использованы для тканеспецифической доставки (нацеливания на тканевый маркер и медиатор заболевания для усиленного локального PK и, следовательно, более высокой эффективности и/или более низкой токсичности), включая внутриклеточную доставку (нацеливание на интернализующий рецептор и внутриклеточную молекулу), доставку во внутреннюю часть головного мозга (нацеливание на рецептор трансферрина и медиатор заболевания ЦНС для пересечения гематоэнцефалического барьера). DVD-Ig может также служить в качестве белка-носителя для доставки антигена в специфическое местоположение посредством связывания с не-нейтрализующим эпитопом данного антигена, а также для увеличения периода полу-жизни антигена. Кроме того, DVD-Ig может быть сконструирован либо для физического связывания с медицинскими устройствами, имплантируемыми пациентам, либо для нацеливания этих медицинских устройств (см. Burke, Sandra E.; Kuntz, Richard E.; Schwartz, Lewis B., Zotarolimus (ABT-578) eluting stents. Advanced Drug Delivery Reviews (2006), 58(3), 437-446; Surface coatings for biological activation andfunctionalization of medical devices, Hildebrand, H. F.; Blanchemain, N.; Mayer, G.; Chai, F.; Lefebvre, M.; Boschin, F., Surface and Coatings Technology (2006), 200(22-23), 6318-6324; Drug/device combinations for local drug therapies and infection prophylaxis, Wu, Peng; Grainger, David W., Biomaterials (2006), 27(11), 2450-2467; Mediation of the cytokine network in theimplantation of orthopedic devices., Marques, A. P.; Hunt, J. A.; Reis, Rui L., Biodegradable Systems in Tissue Engineering and Regenerative Medicine (2005), 377-397). Кратко, направление подходящих типов клетки к сайту медицинского имплантата может стимулировать заживление и восстановление нормальной функции ткани. Альтернативно, обеспечено также ингибирование медиаторов (в том числе, но не только, цитокинов), высвобождаемых после имплантации устройства, посредством DVD, связанного с устройством или нацеленного на устройство. Например, в течение многих лет в инвазивной кардиологии использовали стенты для очистки блокированных артерий и для улучшения тока крови к сердечной мышце. Однако известно, что традиционные стенты из оголенного металла вызывают рестеноз (повторное сужение артерии в обработанной зоне) у некоторых пациентов и могут приводить к тромбам. Недавно был описан покрытый анти-CD34-антителом стент, который уменьшал рестеноз и предотвращал появление тромбов путем захвата эндотелиальных клеток-предшественников (ЕРС), циркулирующих в крови. Эндотелиальные клетки являются клетками, которые выстилают кровеносные сосуды, обеспечивая гладкое протекание крови. ЕРС прикрепляются к твердой поверхности стента, образуя гладкий слой, который не только стимулирует заживление, но и предотвращает рестеноз и тромбы, осложнения, ранее ассоциированные с применением стентов (Aoji et al. 2005 J Am Coll Cardiol. 45(10):1574-9). Кроме улучшения исходов для пациентов, которым необходимы стенты, имеются также осложнения для пациентов, требующих операции для сердечно-сосудистого шунтирования. Например, протезный сосудистый канал (искусственная артерия), покрытая анти-ЕРС-антителами, мог бы исключить необходимость применения артерий ног или рук пациента для трансплантататов обходного шунтирования. Это могло бы уменьшить время операции и анестезии, что, в свою очередь, будет уменьшать количество смертей при аорто-коронарном шунтировании. DVD-Ig конструируют таким образом, что он связывается с маркером клеточной поверхности (таким как CD34), а также белком (или эпитопом любого рода, в том числе, но не только, с липидами и полисахаридами), который был нанесен на имплантированном устройстве для облегчения рекрутинга клеток. Такие подходы могут быть также использованы для других медицинских имплантатов в общем. Альтернативно, DVD-Ig могут быть нанесены на медицинские устройства и после имплантации и высвобождения всех DVD из этого устройства (или при любой другой необходимости, которая может требовать дополнительного свежего DVD-Ig, включая старение и денатурацию уже нанесенного DVD-Ig), это устройство могло бы перезагружаться системным введением свежего DVD-Ig пациенту, причем этот DVD-Ig предназначается для связывания с представляющей интерес мишенью (цитокином, маркером клеточной поверхности (таким как CD34) и т.д.) с использованием одного набора сайтов связывания и с мишенью, нанесенной на это устройство (включая белки, эпитоп любого рода, в том числе, но не только, липиды, полисахариды и полимеры), с использованием другого набора сайтов связывания. Данный способ обладает преимуществом пролонгирования применимости покрытых имплантатов.
A. Применение DVD-Ig при различных заболеваниях
Молекулы DVD-Ig согласно изобретению применимы также в качестве терапевтических молекул для лечения различных заболеваний. Такие молекулы DVD могут связывать одну или несколько мишеней, участвующих в конкретном заболевании. Примеры таких мишеней в разных заболеваниях описаны ниже.
1. Аутоиммунная и воспалительная реакция человека
Считалось, что многие белки участвуют в общих аутоиммунных и воспалительных реакциях, включая C5, CCL1 (I-309), CCL11 (эотаксин), CCL13 (mcp-4), CCL15 (MIP-1d), CCL16 (HCC-4), CCL17 (TARC), CCL18 (PARC), CCL19, CCL2 (mcp-1), CCL20 (MIP-3a), CCL21 (MIP-2), CCL23 (MPIF-1), CCL24 (MPIF-2/эотаксин-2), CCL25 (TECK), CCL26, CCL3 (MIP-1a), CCL4 (MIP-1b), CCL5 (RANTES), CCL7 (mcp-3), CCL8 (mcp-2), CXCL1, CXCL10 (IP-10), CXCL11 (I-TAC/IP-9), CXCL12 (SDF1), CXCL13, CXCL14, CXCL2, CXCL3, CXCL5 (ENA-78/LIX), CXCL6 (GCP-2), CXCL9, IL13, IL8, CCL13 (mcp-4), CCR1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CX3CR1, IL8RA, XCR1 (CCXCR1), IFNA2, IL10, IL13, IL17C, IL1A, IL1B, IL1F10, IL1F5, IL1F6, IL1F7, IL1F8, IL1F9, IL22, IL5, IL8, IL9, LTA, LTB, MIF, SCYE1 (эндотелиальный активирующий моноциты цитокин), SPP1, TNF, TNFSF5, IFNA2, IL10RA, IL10RB, IL13, IL13RA1, IL5RA, IL9, IL9R, ABCF1, BCL6, C3, C4A, CEBPB, CRP, ICEBERG, IL1R1, IL1RN, IL8RB, LTB4R, TOLLIP, FADD, IRAK1, IRAK2, MYD88, NCK2, TNFAIP3, TRADD, TRAF1, TRAF2, TRAF3, TRAF4, TRAF5, TRAF6, ACVR1, ACVR1B, ACVR2, ACVR2B, ACVRL1, CD28, CD3E, CD3G, CD3Z, CD69, CD80, CD86, CNR1, CTLA4, CYSLTR1, FCER1A, FCER2, FCGR3A, GPR44, HAVCR2, OPRD1, P2RX7, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, BLR1, CCL1, CCL2, CCL3, CCL4, CCL5, CCL7, CCL8, CCL11, CCL13, CCL15, CCL16, CCL17, CCL18, CCL19, CCL20, CCL21, CCL22, CCL23, CCL24, CCL25, CCR1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CX3CL1, CX3CR1, CXCL1, CXCL2, CXCL3, CXCL5, CXCL6, CXCL10, CXCL11, CXCL12, CXCL13, CXCR4, GPR2, SCYE1, SDF2, XCL1, XCL2, XCR1, AMH, AMHR2, BMPR1A, BMPR1B, BMPR2, C19orf10 (IL27w), CER1, CSF1, CSF2, CSF3, DKFZp451J0118, FGF2, GFI1, IFNA1, IFNB1, IFNG, IGF1, IL1A, IL1B, IL1R1, IL1R2, IL2, IL2RA, IL2RB, IL2RG, IL3, IL4, IL4R, IL5, IL5RA, IL6, IL6R, IL6ST, IL7, IL8, IL8RA, IL8RB, IL9, IL9R, IL10, IL10RA, IL10RB, IL11, IL11RA, IL12A, IL12B, IL12RB1, IL12RB2, IL13, IL13RA1, IL13RA2, IL15, IL15RA, IL16, IL17, IL17R, IL18, IL18R1, IL19, IL20, KITLG, LEP, LTA, LTB, LTB4R, LTB4R2, LTBR, MIF, NPPB, PDGFB, TBX21, TDGF1, TGFA, TGFB1, TGFB1I1, TGFB2, TGFB3, TGFBI, TGFBR1, TGFBR2, TGFBR3, TH1L, TNF, TNFRSF1A, TNFRSF1B, TNFRSF7, TNFRSF8, TNFRSF9, TNFRSF11A, TNFRSF21, TNFSF4, TNFSF5, TNFSF6, TNFSF11, VEGF, ZFPM2 и RNF110 (ZNF144). В одном аспекте обеспечены DVD-Ig, способные связывать один или несколько из мишеней, перечисленных выше.
2. Астма
Аллергическая астма характеризуется наличием эозинофилии, метаплазии бокаловидных (эпителиальных) клеток, изменений эпителиальных клеток, гиперреактивности дыхательных путей (AHR) и экспрессии цитокинов Th2 и Th1, а также повышенными уровнями сывороточного IgE. В настоящее время широко признается, что воспаление дыхательных путей является ключевым фактором, лежащим в основе патогенеза астмы, включающим в себя сложное взаимодействие воспалительных клеток, таких как Т-клетки, В-клетки, эозинофилы, тучные клетки и макрофаги, и их секретируемых медиаторов, включая цитокины и хемокины. В настоящее время кортикостероиды являются наиболее важными противовоспалительными средствами в лечении астмы, однако их механизм действия является неспецифическим и существуют проблемы безопасности, особенно в популяции юношеских пациентов. Таким образом, оправданной является разработка более специфических и нацеленных методов терапии. Имеется растущее доказательство того, что IL-13 у мышей имитирует многие признаки астмы, включая AHR, гиперсекрецию слизи и фиброз дыхательных путей, независимо от эозинофильного воспаления (Finotto et al., International Immunology (2005), 17(8), 993-1007; Padilla et al., Journal of Immunology (2005), 174(12), 8097-8105).
Предполагалось, что IL-13 играет центральную роль в индукции патологических реакций, ассоциированных с астмой. Развитие терапии с использованием моноклональных анти-IL-13-антител для уменьшения эффектов IL-13 в легком является захватывающим новым подходом, который предоставляет важную перспективу в качестве нового лечения астмы. Однако другие медиаторы дифференциальных иммунологических путей также участвуют в патогенезе астмы, и блокирование этих медиаторов, наряду с IL-13, могут принести дополнительную терапевтическую пользу. Такие пары мишеней включают в себя, но не ограничиваются ими, IL-13 и провоспалительный цитокин, такой как фактор-α некроза опухолей (TNF-α). TNF-α может усиливать воспалительную реакцию при астме и может быть связан с тяжестью заболевания (McDonnell, et al., Progress in Respiratory Research (2001), 31(New Drugs for Asthma, Allergy and COPD), 247-250). Это предполагает, что блокирование как IL-13, так и TNF-α может иметь благоприятные действия, в частности, при тяжелом заболевании дыхательных путей. В предпочтительном варианте осуществления DVD-Ig согласно изобретению связывается с мишенями IL-13 и TNF-α и используется для лечения астмы.
Модели животных, такие как модель OVA-индуцированной астмы мыши, где могут оцениваться как воспаление, так и AHR, известны в данной области и могут быть использованы для определения способности различных молекул DVD-Ig в лечении астмы. Модели животных для изучения астмы описаны у Coffman, et al., Journal of Experimental Medicine (2005), 201(12), 1875-1879; Lloyd, et al., Advances in Immunology (2001), 77, 263-295; Boyce et al., Journal of Experimental Medicine (2005), 201(12), 1869-1873; and Snibson, et al., Journal of the British Society for Allergy and Clinical Immunology (2005), 35(2), 146-52. Кроме рутинных способов оценивания безопасности этих пар мишеней, специфические тесты на степень иммуносупрессии могут быть оправданными и полезными в отборе наилучших пар мишеней (см. Luster et al., Toxicology (1994), 92(1-3), 229-43; Descotes, et al., Developments in biological standardization (1992), 77 99-102; Hart et al., Journal of Allergy and Clinical Immunology (2001), 108(2), 250-257).
На основе описанного выше обоснования и с использованием той же самой модели оценивания на эффективность и безопасность могут быть определены другие пары мишеней, которые могут связывать молекулы DVD-Ig и быть применимы для лечения астмы. Предпочтительно такие мишени включают в себя, но не ограничиваются ими, IL-13 и IL-1бета, поскольку IL-1бета также участвует в воспалительной реакции при астме; IL-13 и цитокины и хемокины, которые участвуют в воспалении, такие как IL-13 и IL-9; IL-13 и IL-4; IL-13 и IL-5; IL-13 и IL-25; IL-13 и TARC; IL-13 и MDC; IL-13 и MIF; IL-13 и TGF-β; IL-13 и агонист LHR; IL-13 и CL25; IL-13 и SPRR2a; IL-13 и SPRR2b; и IL-13 и ADAM8. Данное изобретение обеспечивает также DVD-Ig, способные связывать одну или несколько мишеней, участвующих в астме, выбранных из группы, состоящей из CSF1 (MCSF), CSF2 (GM-CSF), CSF3 (GCSF), FGF2, IFNA1, IFNB1, IFNG, гистамина и рецепторов гистамина, IL1A, IL1B, IL2, IL3, IL4, IL5, IL6, IL7, IL8, IL9, IL10, IL11, IL12A, IL12B, IL13, IL14, IL15, IL16, IL17, IL18, IL19, KITLG, PDGFB, IL2RA, IL4R, IL5RA, IL8RA, IL8RB, IL12RB1, IL12RB2, IL13RA1, IL13RA2, IL18R1, TSLP, CCL1, CCL2, CCL3, CCL4, CCL5, CCL7, CCL8, CCL13, CCL17, CCL18, CCL19, CCL20, CCL22, CCL24, CX3CL1, CXCL1, CXCL2, CXCL3, XCL1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CX3CR1, GPR2, XCR1, FOS, GATA3, JAK1, JAK3, STAT6, TBX21, TGFB1, TNFSF6, YY1, CYSLTR1, FCER1A, FCER2, LTB4R, TB4R2, LTBR и хитиназы.
3. Ревматоидный артрит
Ревматоидный артрит (RA), системное заболевание, характеризуется хронической воспалительной реакцией в синовии суставов и ассоциировано с дегенерацией хряща и эрозией околосуставной кости. В заболевших суставах экспрессируются многие провоспалительные цитокины, включая TNF, хемокины и факторы роста. Было показано, что системное введение анти-TNF-антитела или слитого белка sTNFR в модели RA мыши является противовоспалительным и защищающим суставы. Клинические исследования, в которых активность TNF у пациентов с RA блокировали введенным внутривенно инфликсимабом (Harriman G, Harper LK, Schaible TF. 1999 Summary of clinical trials in rheumatoid arthritis using infliximab, an anti-TNFalpha treatment. Ann Rheum Dis 58 Suppl 1:I61-4), химерным моноклональным анти-TNF-антителом (mAB), обеспечивали доказательство того, что TNF регулирует продуцирование IL-6, IL-8, MCP-1 и VEGF, рекрутинг иммунных и воспалительных клеток в суставы, ангиогенез и уменьшение уровней в крови матриксных металлопротеиназ-1 и -3. Лучшее понимание воспалительного пути в ревматоидном артрите привело к идентификации других терапевтических мишеней, участвующих в ревматоидном артрите. Подающие надежду способы лечения, такие как способы с использованием антагонистов интерлейкина-6 (MRA), CTLA4Ig (абатацепта, Genovese Mc et al. 2005 Abatacept for rheumatoid arthritis refractory to tumor necrosis factor alpha inhibition. N Engl J Med. 353:1114-23.), и анти-B-клеточной терапии (ритуксимаб, Okamoto H, Kamatani N. 2004 Rituximab for rheumatoid arthritis. N Engl J Med. 351:1909) уже были испытаны в рандомизированных контролируемых испытаниях на протяжении прошлого года. Были идентифицированы другие цитокины, и было показано, что они являются полезными в моделях животных, в том числе интерлейкин-15, интерлейкин-17 и интерлейкин-18, и клинические испытания этих агентов проводятся в настоящее время. Терапия с использованием антитела с двойной специфичностью, объединяющая анти-TNF-антитело и другой медиатор, имеет большой потенциал в увеличении клинической эффективности и/или охвата пациентов. Например, блокирование как TNF, так и VEGF может потенциально ликвидировать воспаление и ангиогенез, оба из которых участвуют в патофизиологии RA. Обсуждается также блокирование других пар мишеней, участвующих в RA, включающих в себя, но не ограничивающихся ими, TNF и IL-18; TNF и IL-12; TNF и IL-23; TNF и IL-1бета; TNF и MIF; TNF и IL-17; и TNF и IL-15, специфическими DVD-Ig. Кроме рутинных способов оценивания безопасности этих пар мишеней, специфические тесты на степень иммуносупрессии могут быть оправданными и полезными в отборе наилучших пар мишеней (см. Luster et al., Toxicology (1994), 92(1-3), 229-43; Descotes, et al., Developments in biological standardization (1992), 77 99-102; Hart et al., Journal of Allergy and Clinical Immunology (2001), 108(2), 250-257). Будет ли молекула DVD-Ig применима для лечения ревматоидного артрита, может быть оценено с использованием преклинических моделей RA животных, таких как мышиные модели индуцированного коллагеном артрита. Другие применимые модели также хорошо известны в данной области (см. Brand DD., Comp Med. (2005) 55(2):114-22).
4. Системная красная волчанка (SLE)
Отличительным признаком иммунопатогенеза SLE является активация поликлональных B-клеток, которая приводит к гиперглобулинемии, продуцированию аутоантител и образованию иммунных комплексов. Фундаментальной аномалией является, по-видимому, неспособность Т-клеток подавлять запретные клоны В-клеток вследствие генерализованной нарушенной регуляции Т-клеток. Кроме того, взаимодействие B- и T-клеток облегчается несколькими цитокинами, такими как IL-10, а также костимулирующими молекулами, такими как CD40 и CD40L, B7 и CD28 и CTLA-4, которые инициируют второй сигнал. Эти взаимодействия вместе с нарушенным фагоцитарным клиренсом иммунных комплексов и апоптотического материала сохраняют навсегда эту иммунную реакцию с полученным тканевым повреждением. Следующие мишени могут участвовать в SLE и могут быть потенциально использованы для подхода DVD-Ig для терапевтического вмешательства: нацеленные на В-клетки способы терапии: CD-20, CD-22, CD-19, CD28, CD4, CD80, HLA-DRA, IL10, IL2, IL4, TNFRSF5, TNFRSF6, TNFSF5, TNFSF6, BLR1, HDAC4, HDAC5, HDAC7A, HDAC9, ICOSL, IGBP1, MS4A1, RGS1, SLA2, CD81, IFNB1, IL10, TNFRSF5, TNFRSF7, TNFSF5, AICDA, BLNK, GALNAC4S-6ST, HDAC4, HDAC5, HDAC7A, HDAC9, IL10, IL11, IL4, INHA, INHBA, KLF6, TNFRSF7, CD28, CD38, CD69, CD80, CD83, CD86, DPP4, FCER2, IL2RA, TNFRSF8, TNFSF7, CD24, CD37, CD40, CD72, CD74, CD79A, CD79B, CR2, IL1R2, ITGA2, ITGA3, MS4A1, ST6GAL1, CD1C, CHST10, HLA-A, HLA-DRA и NT5E.; костимулирующие сигналы: CTLA4 или B7.1/B7.2; ингибирование выживания В-клеток: BlyS, BAFF; инактивация комплемента: C5; модуляция цитокинов: ключевым принципом является то, что чистая биологическая реакция в любой ткани является результатом баланса между локальными уровнями провоспалительных или противовоспалительных цитокинов (см. Sfikakis PP et al 2005 Curr Opin Rheumatol 17:550-7). Считается, что SLE является запускаемым Th-2 заболеванием с документированными увеличениями в сыворотке IL-4, IL-6, IL-10. Обсуждаются также DVD-Ig, способные связывать одну или несколько мишеней, выбранных из группы, состоящей из IL-4, IL-6, IL-10, IFN-α и TNF-α. Комбинация обсуждаемых выше мишеней будет увеличивать терапевтическую эффективность в отношении SLE, которая может быть испытана в ряде преклинических моделей волчанки (см. Peng SL (2004) Methods Mol Med.; 102:227-72).
5. Рассеянный склероз
Рассеянный склероз (MS) является комплексным заболеванием аутоиммунного типа человека преимущественно неизвестной этиологии. Иммунологическая деструкция миелинового основного белка (МВР) во всей нервной системе является основной патологией рассеянного склероза. MS является заболеванием комплексных патологий, которое включает в себя инфильтрацию CD4+ и CD8+ T-клетками и реакцию в центральной нервной системе. Экспрессия в ЦНС цитокинов, реакционноспособные молекулы азота и костимулирующие молекулы - все были описаны в MS. Наиболее важными являются иммунологические механизмы, которые способствуют развитию аутоиммунитета. В частности, экспрессия антигенов, взаимодействия цитокинов и лейкоцитов и регуляторные Т-клетки, которые способствуют балансу/модуляции других Т-клеток, таких как клетки Th1 и Th2, являются важными областями для идентификации терапевтических мишеней.
IL-12 является провоспалительным цитокином, который продуцируется АРС и стимулирует дифференцировку Th1-эффекторных клеток. IL-12 продуцируется в развивающихся повреждениях пациентов с MS, а также у ЕАЕ-пораженных животных. Ранее было показано, что вмешательство в IL-12-пути эффективно предотвращает EAE у грызунов и что нейтрализация in vivo IL-12p40 с помощью анти-IL-12-mAb оказывает благоприятные действия в индуцированной миелином модели EAE у обыкновенных мартышек.
TWEAK является членом TNF-семейства, конститутивно экспрессируемым в центральной нервной системе (ЦНС), с провоспалительным, пролиферативным или апоптотическим действиями в зависимости от типов клеток. Его рецептор, Fn14, экспрессируется в ЦНС эндотелиальными клетками, реактивными астроцитами и нейронами. Экспрессия мРНК TWEAK и Fn14 увеличивалась в спинном мозгу во время экспериментального аутоиммунного энцефаломиелита (EAE). Лечение анти-TWEAK-антителом при индуцированном миелин-олигодендроцитным-гликопротеином (MOG) EAE у мышей C57BL/6 приводило к уменьшению тяжести заболевания и инфильтрации лейкоцитами при лечении мышей после фазы праймирования.
Один аспект данного изобретения относится к молекулам DVD-Ig, способным связывать одну или несколько мишеней, предпочтительно две мишени, выбранные из группы, состоящей из IL-12, TWEAK, IL-23, CXCL13, CD40, CD40L, IL-18, VEGF, VLA-4, TNF, CD45RB, CD200, IFN-γ, GM-CSF, FGF, C5, CD52 и CCR2. Предпочтительный вариант осуществления включает в себя имеющий двойную специфичность анти-IL-12/TWEAK-DVD-Ig в качестве терапевтического агента, полезного для лечения MS. В данной области известны несколько моделей животных для оценки применимости молекул DVD для лечения MS (см. Steinman L, et al., (2005) Trends Immunol. 26(11):565-71; Lublin FD., et al., (1985) Springer Semin Immunopathol.8(3):197-208; Genain CP, et al., (1997) J Mol Med. 75(3):187-97; Tuohy VK, et al., (1999) J Exp Med. 189(7):1033-42; Owens T, et al., (1995)Neurol Clin.13(1):51-73; and 't Hart BA, et al., (2005) J Immunol 175(7):4761-8. Кроме рутинных способов оценивания безопасности этих пар мишеней, специфические тесты на степень иммуносупрессии могут быть оправданными и полезными в отборе наилучших пар мишеней (см. Luster et al., Toxicology (1994), 92(1-3), 229-43; Descotes, et al., Developments in biological standardization (1992), 77 99-102; Jones R. 2000 Rovelizumab (ICOS Corp). IDrugs.3(4):442-6).
6. Сепсис
Патофизиология сепсиса инициируется компонентами наружной мембраны как грамотрицательных организмов (липосахаридом [LPS], липидом А, эндотоксином), так и грамположительных организмов (липотейхоевой кислотой, пептидогликаном). Эти компоненты наружной мембраны способны связываться с CD14-рецептором на поверхности моноцитов. Затем, посредством недавно описанных toll-подобных рецепторов сигнал переносится в клетку, приводя к конечному продуцированию провоспалительных цитокинов фактора-альфа некроза опухолей (TNF-α) и интерлейкина-1 (IL-I). Сокрушительные воспалительные и иммунные реакции являются важными признаками септического шока и играют центральную роль в патогенезе повреждения ткани, недостаточности множественных органов и смерти, индуцированных сепсисом. Было показано, что цитокины, в частности фактор некроза опухолей (TNF) и интерлейкин (IL-1), являются решающими медиаторами септического шока. Эти цитокины оказывают прямое токсическое действие на ткани; они также активируют фосфолипазу А2. Эти и другие действия приводят к увеличенным концентрациям активирующего тромбоциты фактора, стимуляции активности синтазы оксида азота, стимуляции инфильтрации тканей нейтрофилами и стимуляции активности нейтрофилов.
Лечение сепсиса и септического шока остается клинической загадкой, и недавние перспективные испытания с модификаторами биологических реакций (т.е. анти-TNF, анти-MIF), нацеленными на воспалительную реакцию, показали только умеренную клиническую пользу. Недавно интерес переместился в направлении способов терапии, нацеленных на обращение сопутствующих периодов иммунной супрессии. Исследования на экспериментальных животных и критически больных пациентах показали, что увеличенный апоптоз лимфоидных органов и некоторых паренхимных тканей способствует иммунной супрессии, анергии и дисфункции системы органов. Во время синдромов сепсиса апоптоз лимфоцитов мог запускаться отсутствием IL-2 или высвобождением глюкокортикоидов, гранзимов или так называемых цитокинов «смерти»: фактора альфа некроза опухолей или Fas-лиганда. Апопотоз протекает через аутоактивацию цитозольных и митохондриальных каспаз, на которые влияют про- и антиапоптотические члены Bcl-2-семейства. У экспериментальных животных лечение ингибиторами апоптоза может не только предотвращать апоптоз лимфоидных клеток; оно может также улучшать исход заболевания. Хотя клинические испытания с использованием антиапоптотических агентов остаются отдаленными, по большей части, вследствие технических трудностей, связанных с их введением и нацеливанием на ткани, ингибирование апоптоза лимфоцитов представляет привлекательную терапевтическую мишень для септического пациента. Подобным образом, имеющий двойную специфичность агент, поражающий как воспалительный медиатор, так и апоптотический медиатор, может иметь дополнительное преимущество. Один аспект данного изобретения относится к DVD-Ig, способному связывать одну или несколько мишеней, участвующих в сепсисе, предпочтительно две мишени, выбранных из группы, состоящей из TNF, IL-1, MIF, IL-6, IL-8, IL-18, IL-12, IL-23, FasL, LPS, Toll-подобных рецепторов, TLR-4, тканевого фактора, MIP-2, ADORA2A, CASP1, CASP4, IL10, IL1B, NFKB1, PROC, TNFRSF1A, CSF3, IL10, IL1B, IL6, ADORA2A, CCR3, IL10, IL1B, IL1RN, MIF, NFKB1, PTAFR, TLR2, TLR4, GPR44, HMOX1, мидкина, IRAK1, NFKB2, SERPINA1, SERPINE1 и TREM1. Эффективность таких DVD-Ig в отношении сепсиса можно оценить на преклинических моделях животных, известных в данной области (см. Buras JA, et al.,(2005) Nat Rev Drug Discov. 4(10):854-65 и Calandra T, et al., (2000) Nat Med. 6(2):164-70).
7. Неврологические нарушения
7.1 Нейродегенеративные заболевания
Хронические нейродегенеративные заболевания обычно связанными со старением заболеваниями, характеризующимися прогрессирующей потерей нейронных функций (смертью нервных клеток, демиелинизацией), потерей подвижности и потерей памяти. Появляющееся знание механизмов, лежащих в основе хронических нейродегенеративных заболеваний (например, болезни Альцгеймера) показывает комплексную этиологию, и было признано, что различные факторы способствуют их развитию и прогрессированию, например, старение, гликемический статус, продуцирование и мультимеризация амилоида, накопление прогрессирующих конечных продуктов гликозилирования (AGE), которые связываются с их рецептором (RAGE) (рецептором AGE), увеличенный окислительный стресс головного мозга, уменьшенный церебральный кровоток, нейровоспаление, включая высвобождение воспалительных цитокинов и хемокинов, дисфункцию нейронов и активацию микроглии. Таким образом, эти хронические нейродегенеративные заболевания представляют комплексное взаимодействие между множественными типами клеток и медиаторами. Стратегии лечения для таких заболеваний ограничены и в основном составляют либо блокирование воспалительных процессов неспецифическими противовоспалительными агентами (например, кортикостероидами, ингибиторами COX) или агентами для предотвращения потери нейронов и/или синаптических функций. Эти способы лечения не могут остановить прогрессирование заболевания. Недавние исследования предполагают, что более нацеленные терапевтические средства, такие как антитела к растворимому A-b-пептиду (включая A-b-олигомерные формы) могут не только останавливать прогрессирование заболевания, но и могут также поддерживать память. Эти предварительные наблюдения предполагают, что специфические способы терапии, поражающие более чем один медиатор (например, A-b и провоспалительный цитокин, такой как TNF), могут обеспечивать даже лучшую терапевтическую эффективность в отношении хронических дегенеративных заболеваний, чем эффективность, наблюдаемая с нацеливанием на механизм единственного заболевания (например, только растворимый A-balon) (см. C.E. Shepherd, et al., Neurobiol Aging. 2005 Oct 24; Nelson RB., Curr Pharm Des. 2005; 11:3335; William L. Klein.; Neurochem Int. 2002; 41:345; Michelle C Janelsins, et al., J Neuroinflammation. 2005; 2:23; Soloman B., Curr Alzheimer Res. 2004; 1:149; Igor Klyubin, et al., Nat Med. 2005;11:556-61; Arancio O, et al., EMBO Journal (2004) 1-10; Bornemann KD, et al., Am J Pathol. 2001; 158:63; Deane R, et al., Nat Med. 2003; 9:907-13; и Eliezer Masliah, et al., Neuron. 2005; 46:857).
Молекулы DVD-Ig согласно изобретению могут связывать одну или несколько мишеней, участвующих в хронических нейродегенеративных заболеваниях, таких как болезнь Альцгеймера. Такие мишени включают в себя, но не ограничиваются ими, любой медиатор, растворимый или находящийся на клеточной поверхности, участвующий в патогенезе AD, например, AGE (S100 A, амфотерин), провоспалительные цитокины (например, IL-1), хемокины (например, MCP 1), молекулы, которые ингибируют регенерацию нерва (например, Nogo, RGM A), молекулы, которые усиливают рост нейритов (нейротрофины). Эффективность молекул DVD-Ig может быть валидизирована на преклинических моделях животных, таких как трансгенные мыши, которые сверхэкспрессируют белок-предшественник амилоида или RAGE и развивают симптомы болезни, подобной болезни Альцгеймера. Кроме того, молекулы DVD-Ig могут быть сконструированы и испытаны в отношении эффективности на моделях животных, и наилучшие терапевтические DVD-Ig могут быть отобраны для тестирования на пациентах-людях. Молекулы DVD-Ig могут быть также использованы для лечения других нейродегенеративных заболеваний, таких как болезнь Паркинсона. Альфа-синуклеин участвует в патологии болезни Паркинсона. DVD-Ig, способные нацеливаться на альфа-синуклеин и воспалительные медиаторы, такие как TNF, IL-1, MCP-1, могут оказаться эффективной терапией для болезни Паркинсона и также рассматриваются в данном изобретении.
7.2 Регенерация нейронов и повреждение спинного мозга
Несмотря на увеличение знания патологических механизмов, повреждение спинного мозга (SCI) все еще является разрушительным состоянием и представляет собой медицинское показание, характеризуемое высокой потребностью в лекарственных препаратах. Большинство повреждений спинного мозга являются контузионными или компрессионными повреждениями, и за первичным повреждением обычно следуют вторичные механизмы повреждения (воспалительные медиаторы, например, цитокины и хемокины), которые ухудшают начальное повреждение и приводят к значительному увеличению площади повреждения, иногда более чем в 10 раз. Эти первичные и вторичные механизмы в SCI очень сходны с механизмами в повреждении головного мозга, вызванном иным образом, например, инсультом. Не существует удовлетворительное лечение, и болюсная инъекция высокой дозы метилпреднизолона (МР) является единственной используемой терапией в узком окне времени 8 ч после повреждения. Однако эта обработка предназначена только для предотвращения вторичного повреждения, не вызывая любое значимое функциональное восстановление. Она в сильной степени критикуется за отсутствие недвусмысленной эффективности и тяжелые вредные побочные действия, такие как иммуносупрессия с последующими инфекциями и тяжелыми гистопатологическими мышечными изменениями. Не существуют одобренные другие лекарственные средства, биологические агенты или малые молекулы, стимулирующие эндогенный регенерационный потенциал, но в недавние годы перспективные принципы лечения и лекарства-кандидаты обнаруживали эффективность на животных моделях SCI. В большой степени отсутствие функционального восстановления в SCI человека обусловлено факторами, ингибирующими рост нейритов в участках повреждения, в ткани рубцов, в миелине, а также ассоциированных с повреждением клетках. Такими факторами являются миелин-ассоциированные белки NogoA, OMgp и MAG, RGM A, связанные с рубцами CSPG (хондроитинсульфатпротеогликаны) и ингибирующие факторы на реактивных астроцитах (некоторые семафорины и эфрины). Однако в участке повреждения обнаружены не только ингибирующие рост молекулы, но также стимулирующие рост нейритов факторы, такие как нейротрофины, ламинин, L1 и другие. Этот ансамбль ингибирующих рост нейритов и стимулирующих рост молекул может объяснить то, что блокирующие единственные факторы, такие как NogoA или RGM A, приводили к значимому функциональному восстановлению на моделях SCI грызунов, поскольку уменьшение ингибирующих действий могло смещать баланс с ингибирования роста к стимуляции роста. Однако наблюдаемые восстановления с блокированием молекулы, ингибирующей вырост единственного нейрита, были неполными. Для достижения более быстрых и более ярко выраженных проявлений восстановления может быть желательным либо блокирование двух молекул, ингибирующих вырост нейрита, например, Nogo и RGM A, либо блокирование молекулы, ингибирующей вырост нейрита и усиливающей функции увеличивающей вырост нейрита молекулы, например, Nogo и нейротрофинов, либо блокированием молекулы, ингибирующей вырост нейрита, например, Nogo и провоспалительной молекулы, например, TNF (см. McGee AW, et al., Trends Neurosci. 2003; 26:193; Marco Domeniconi, et al., J Neurol Sci. 2005; 233:43; Milan Makwana1, et al., FEBS J. 2005; 272:2628; Barry J. Dickson, Science. 2002; 298:1959; Felicia Yu Hsuan Teng, et al., J Neurosci Res. 2005; 79:273; Tara Karnezis, et al., Nature Neuroscience 2004; 7, 736; Gang Xu, et al., J. Neurochem. 2004; 91; 1018).
В одном аспекте обеспечены DVD-Ig, способные связывать пары мишеней, такие как NgR и RGM A; NogoA и RGM A; MAG и RGM A; OMGp и RGM A; RGM A и RGM B; CSPGs и RGM A; аггрекан, мидкин, нейрокан, версикан, фосфокан, Te38 и TNF-a; Aβ-глобуломер-специфические антитела, комбинированные с антителами, стимулирующими спрутинг дендритов и аксонов. Патология дендритов является очень ранним признаком AD, и известно, что NOGO A ограничивает рост дендритов. Можно комбинировать такой тип Ab с любым из SCI-кандидатных (миелиновые белки) Ab. Другие мишени DVD-Ig могут включать в себя любую комбинацию NgR-p75, NgR-Troy, NgR-Nogo66 (Nogo), NgR-Lingo, Lingo-Troy, Lingo-p75, MAG или Omgp. Кроме того, мишени могут включать в себя также любой медиатор, растворимый или находящийся на клеточной поверхности, участвующий в ингибировании нейрита, например, Nogo, Ompg, MAG, RGM A, семафорины, эфрины, растворимый A-b, провоспалительные цитокины (например, IL-1), хемокины (например, MIP 1a), молекулы, которые ингибируют регенерацию нейронов. Эффективность анти-nogo/анти-RGM A или подобных молекул DVD-Ig может быть валидизирована на преклинических моделях повреждения спинного мозга животных. Кроме того, молекулы DVD-Ig могут быть сконструированы и испытаны в отношении эффективности на моделях животных, и наилучшие терапевтические DVD-Ig могут быть отобраны для тестирования на пациентах-людях. Кроме того, могут быть сконструированы молекулы DVD-Ig, которые нацелены на два разных сайта связывания лиганда на единственном рецепторе, например, рецепторе Nogo, который связывает три лиганда Nogo, Ompg и MAG, и RAGE, который связывает A-b и S100 A. Кроме того, ингибиторы выроста нейритов, например, nogo и рецептор nogo, также играют роль в предотвращении регенерации нервов при иммунологических заболеваниях, таких как рассеянный склероз. Было показано, что взаимодействие nogo-рецептор nogo усиливает восстановление на моделях рассеянного склероза животных. Таким образом, молекулы DVD-Ig, которые могут блокировать функцию одного иммунного медиатора, например, цитокина, такого как Ig-12, и молекулы ингибирования выроста нейрита, например, nogo или RGM, могут обеспечивать более быструю и более высокую эффективность, чем блокирование только либо иммунной молекулы, либо молекулы ингибитора выроста нейрита.
8. Онкологические нарушения
Терапия с использованием моноклональных антител возникла как важный терапевтический способ для рака (von Mehren M, et al 2003 Monoclonal antibody therapy for cancer. Annu Rev Med.; 54:343-69). Антитела могут проявлять противоопухолевые действия индуцированием апоптоза, изменением направленности цитотоксичности, вмешательством во взаимодействия лиганд-рецептор или предотвращением экспрессии белков, которые являются критическими в отношении неопластического фенотипа. Кроме того, антитела могут быть нацелены на компоненты-мишени опухолевого окружения для искажения жизненных структур, например образования опухоль-ассоциированной сосудистой сети. Антитела могут быть также нацелены на рецепторы-мишени, лигандами которых являются факторы роста, такие как рецептор эпидермального фактора роста. Таким образом, это антитело ингибирует природные лиганды, которые стимулируют рост клеток, препятствуя их связыванию с опухолевыми клетками-мишенями. Альтернативно, антитела могут индуцировать антиидиотипическую сеть, комплемент-опосредованную цитотоксичность или антителозависимую клеточную цитотоксичность (ADCC). Применение антитела с двойной специфичностью, которое нацелено на два отдельных опухолевых медиатора, будет, по-видимому, создавать дополнительное преимущество по сравнению с моноспецифической терапией. Рассматриваются также DVD-Ig, способные связывать следующие пары мишеней, для лечения онкологического заболевания: IGF1 и IGF2; IGF1/2 и Erb2B; VEGFR и EGFR; CD20 и CD3, CD138 и CD20, CD38 и CD20, CD38 и CD138, CD40 и CD20, CD138 и CD40, CD38 и CD40. Другие комбинации мишеней включают в себя один или несколько членов семейства EGF/erb-2/erb-3. Другие мишени (одна или несколько), участвующие в онкологических заболеваниях, которые могут связывать DVD-Ig, включают в себя, но не ограничиваются ими, мишени, выбранные из группы, состоящей из: CD52, CD20, CD19, CD3, CD4, CD8, BMP6, IL12A, IL1A, IL1B, IL2, IL24, INHA, TNF, TNFSF10, BMP6, EGF, FGF1, FGF10, FGF11, FGF12, FGF13, FGF14, FGF16, FGF17, FGF18, FGF19, FGF2, FGF20, FGF21, FGF22, FGF23, FGF3, FGF4, FGF5, FGF6, FGF7, FGF8, FGF9, GRP, IGF1, IGF2, IL12A, IL1A, IL1B, IL2, INHA, TGFA, TGFB1, TGFB2, TGFB3, VEGF, CDK2, EGF, FGF10, FGF18, FGF2, FGF4, FGF7, IGF1, IGF1R, IL2, VEGF, BCL2, CD164, CDKN1A, CDKN1B, CDKN1C, CDKN2A, CDKN2B, CDKN2C, CDKN3, GNRH1, IGFBP6, IL1A, IL1B, ODZ1, PAWR, PLG, TGFB1I1, AR, BRCA1, CDK3, CDK4, CDK5, CDK6, CDK7, CDK9, E2F1, EGFR, ENO1, ERBB2, ESR1, ESR2, IGFBP3, IGFBP6, IL2, INSL4, MYC, NOX5, NR6A1, PAP, PCNA, PRKCQ, PRKD1, PRL, TP53, FGF22, FGF23, FGF9, IGFBP3, IL2, INHA, KLK6, TP53, CHGB, GNRH1, IGF1, IGF2, INHA, INSL3, INSL4, PRL, KLK6, SHBG, NR1D1, NR1H3, NR1I3, NR2F6, NR4A3, ESR1, ESR2, NR0B1, NR0B2, NR1D2, NR1H2, NR1H4, NR1I2, NR2C1, NR2C2, NR2E1, NR2E3, NR2F1, NR2F2, NR3C1, NR3C2, NR4A1, NR4A2, NR5A1, NR5A2, NR6A1, PGR, RARB, FGF1, FGF2, FGF6, KLK3, KRT1, APOC1, BRCA1, CHGA, CHGB, CLU, COL1A1, COL6A1, EGF, ERBB2, ERK8, FGF1, FGF10, FGF11, FGF13, FGF14, FGF16, FGF17, FGF18, FGF2, FGF20, FGF21, FGF22, FGF23, FGF3, FGF4, FGF5, FGF6, FGF7, FGF8, FGF9, GNRH1, IGF1, IGF2, IGFBP3, IGFBP6, IL12A, IL1A, IL1B, IL2, IL24, INHA, INSL3, INSL4, KLK10, KLK12, KLK13, KLK14, KLK15, KLK3, KLK4, KLK5, KLK6, KLK9, MMP2, MMP9, MSMB, NTN4, ODZ1, PAP, PLAU, PRL, PSAP, SERPINA3, SHBG, TGFA, TIMP3, CD44, CDH1, CDH10, CDH19, CDH20, CDH7, CDH9, CDH1, CDH10, CDH13, CDH18, CDH19, CDH20, CDH7, CDH8, CDH9, ROBO2, CD44, ILK, ITGA1, APC, CD164, COL6A1, MTSS1, PAP, TGFB1I1, AGR2, AIG1, AKAP1, AKAP2, CANT1, CAV1, CDH12, CLDN3, CLN3, CYB5, CYC1, DAB2IP, DES, DNCL1, ELAC2, ENO2, ENO3, FASN, FLJ12584, FLJ25530, GAGEB1, GAGEC1, GGT1, GSTP1, HIP1, HUMCYT2A, IL29, K6HF, KAI1, KRT2A, MIB1, PART1, PATE, PCA3, PIAS2, PIK3CG, PPID, PR1, PSCA, SLC2A2, SLC33A1, SLC43A1, STEAP, STEAP2, TPM1, TPM2, TRPC6, ANGPT1, ANGPT2, ANPEP, ECGF1, EREG, FGF1, FGF2, FIGF, FLT1, JAG1, KDR, LAMA5, NRP1, NRP2, PGF, PLXDC1, STAB1, VEGF, VEGFC, ANGPTL3, BAI1, COL4A3, IL8, LAMA5, NRP1, NRP2, STAB1, ANGPTL4, PECAM1, PF4, PROK2, SERPINF1, TNFAIP2, CCL11, CCL2, CXCL1, CXCL10, CXCL3, CXCL5, CXCL6, CXCL9, IFNA1, IFNB1, IFNG, IL1B, IL6, MDK, EDG1, EFNA1, EFNA3, EFNB2, EGF, EPHB4, FGFR3, HGF, IGF1, ITGB3, PDGFA, TEK, TGFA, TGFB1, TGFB2, TGFBR1, CCL2, CDH5, COL18A1, EDG1, ENG, ITGAV, ITGB3, THBS1, THBS2, BAD, BAG1, BCL2, CCNA1, CCNA2, CCND1, CCNE1, CCNE2, CDH1 (E-кадгерина), CDKN1B (p27Kip1), CDKN2A (p16INK4a), COL6A1, CTNNB1 (b-катенина), CTSB (катепсина B), ERBB2 (Her-2), ESR1, ESR2, F3 (TF), FOSL1 (FRA-1), GATA3, GSN (гелсолина), IGFBP2, IL2RA, IL6, IL6R, IL6ST (гликопротеина 130), ITGA6 (a6-интегрина), JUN, KLK5, KRT19, MAP2K7 (c-Jun), MKI67 (Ki-67), NGFB (NGF), NGFR, NME1 (NM23A), PGR, PLAU (uPA), PTEN, SERPINB5 (маспина), SERPINE1 (PAI-1), TGFA, THBS1 (тромбоспондина-1), TIE (Tie-1), TNFRSF6 (Fas), TNFSF6 (FasL), TOP2A (топоизомеразы Iia), TP53, AZGP1 (цинк-a-гликопротеина), BPAG1 (плектина), CDKN1A (p21Wap1/Cip1), CLDN7 (клаудина-7), CLU (кластерина), ERBB2 (Her-2), FGF1, FLRT1 (фибронектина), GABRP (GABAa), GNAS1, ID2, ITGA6 (a6-интергрина), ITGB4 (b4-интегрина), KLF5 (GC-блок BP), KRT19 (кератина 19), KRTHB6 (кератина, специфического для волос типа II), MACMARCKS, MT3 (металлотионектина-III), MUC1 (муцина), PTGS2 (COX-2), RAC2 (p21Rac2), S100A2, SCGB1D2 (липофилина B), SCGB2A1 (маммаглобина 2), SCGB2A2 (маммаглобина 1), SPRR1B (Spr1), THBS1, THBS2, THBS4, and TNFAIP2 (B94).
IV. Фармацевтические композиции
Данное изобретение обеспечивает также фармацевтические композиции, содержащие связывающий белок согласно изобретению и фармацевтически приемлемый носитель. Фармацевтические композиции, содержащие связывающие белки согласно изобретению, являются композициями для применения в, но не только, диагностике, детектировании или мониторинге нарушения, в предотвращении, терапии, лечении или ослаблении нарушения или одного или нескольких его симптомов и/или исследовании. В конкретном варианте осуществления композиция содержит один или несколько связывающих белков согласно изобретению. В другом варианте осуществления фармацевтическая композиция содержит один или несколько связывающих белков согласно изобретению и один или несколько профилактических или терапевтических агентов, иных, чем связывающие белки согласно изобретению, для лечения нарушения. Предпочтительными являются профилактические или терапевтические агенты, о которых известно, что они применимы или были использованы или используются в настоящее время для предотвращения, терапии, лечения или ослабления нарушения или одного или нескольких его симптомов. В соответствии с этими вариантами осуществления композиция может дополнительно содержать носитель, разбавитель или эксципиент.
Связывающие белки согласно изобретению могут быть включены в фармацевтические композиции, подходящие для введения субъекту. Обычно фармацевтическая композиция содержит связывающий белок согласно изобретению и фармацевтически приемлемый носитель. В данном контексте «фармацевтически приемлемый носитель» включает в себя любой или все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и задерживающие абсорбцию агенты и т.п., которые являются физиологически совместимыми. Примеры фармацевтически приемлемых носителей включают в себя один или несколько из таких носителей, как вода, солевой раствор, забуференный фосфатом солевой раствор, декстроза, глицерин, этанол и т.п., а также их комбинации. Во многих случаях предпочтительно включать в композицию изотонические агенты, например, сахара, полиспирты, такие как маннит, сорбит или хлорид натрия. Фармацевтически приемлемые носители могут дополнительно содержать минорные количества вспомогательных веществ, таких как увлажняющие или эмульгирующие агенты, консерванты или буферы, которые увеличивают срок хранения (срок годности) или эффективность антитела или части антитела.
Различные системы доставки известны и могут быть использованы для введения одного или нескольких антител согласно изобретению или комбинации одного или нескольких антител согласно изобретению и профилактического агента или терапевтического агента, применимых для предотвращения, лечения, терапии или ослабления нарушения или одного или нескольких его симптомов, например, инкапсулирование в липосомах, микрочастицы, микрокапсулы, рекомбинантные клетки, способные экспрессировать антитело или фрагмент антитела, рецептор-опосредованный эндоцитоз (см., например, Wu and Wu, J. Biol. Chem. 262:4429-4432 (1987)), конструирование нуклеиновой кислоты в виде части ретровирусного или другого вектора и т.д. Способы введения профилактического или терапевтического агента согласно изобретению включают в себя, но не ограничиваются ими, парентеральное введение (например, интрадермальное, внутримышечное, внутрибрюшинное, внутривенное и подкожное), эпидуральное введение, внутриопухолевое введение и введение через слизистую оболочку (например, интраназальный и пероральный способы). Кроме того, могут быть использованы легочное введение, например, с использованием ингалятора или распылителя, и готовая форма с образующим аэрозоль агентом. См., например, патенты США №№ 6019968, 5985320, 5985309, 5934272, 5874064, 5855913, 5290540 и 4880078; и публикации PCT №№ WO 92/19244, WO 97/32572, WO 97/44013, WO 98/31346 и WO 99/66903, которые полностью включены в данное описание путем ссылки. В одном варианте осуществления связывающий белок согласно изобретению, комбинированное терапевтическое средство или композицию согласно изобретению вводят с использованием легочной технологии доставки лекарственного средства Alkermes AIR® (Alkermes, Inc., Cambridge, Mass.). В конкретном варианте осуществления профилактические или терапевтические агенты согласно изобретению вводят внутримышечно, внутривенно, внутрь опухоли, перорально, интраназально, легочным путем или подкожно. Профилактические или терапевтические агенты можно вводить любым удобным способом, например, инфузией или болюсной инъекцией, абсорбцией через эпителиальные или кожно-слизистые выстилки (например, через слизистую оболочку полости рта, ректальную или кишечную слизистую оболочку и т.д.) и можно вводить вместе с другими биологически активными агентами. Введение может быть системным или местным.
В конкретном варианте осуществления может быть желательно введение профилактических или терапевтических агентов согласно изобретению локально в зону, нуждающуюся в лечении; это может быть достигнуто, например, но не только, локальной инфузией, инъекцией или при помощи имплантата, причем указанный имплантат является пористым или непористым материалом, в том числе мембранами или матриксами, такими как мембраны из силастика, полимеры, волокнистые матриксы (например, Tissuel®) или коллагеновые матриксы. В одном варианте осуществления эффективное количество антагонистов одного или нескольких антител согласно изобретению вводят локально в пораженную зону субъекта для предотвращения, терапии, лечения и/или ослабления нарушения или его симптома. В другом варианте осуществления эффективное количество одного или нескольких антител согласно изобретению вводят локально в пораженную зону в комбинации с эффективным количеством одного или нескольких терапевтических средств (например, одного или нескольких профилактических или терапевтических агентов), иных, чем связывающий белок согласно изобретению, субъекту для предотвращения, терапии, лечения и/или ослабления нарушения или его симптомов.
В другом варианте осуществления профилактический или терапевтический агент может быть доставлен в системе с регулируемым высвобождения или замедленным высвобождением. В одном варианте осуществления может быть использован насос для достижения регулируемого или замедленного высвобождения (см., например, Langer, выше; Sefton, 1987, CRC Crit. Ref. Biomed. Eng. 14:20; Buchwald et al., 1980, Surgery 88:507; Saudek et al., 1989, N. Engl. J. Med. 321:574). В другом варианте осуществления могут быть использованы полимерные материалы для достижения регулируемого или замедленного высвобождения терапевтических агентов согласно изобретению (см., например, Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Fla. (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Ranger and Peppas, 1983, J., Macromol. Sci. Rev. Macromol. Chem. 23:61; см. также Levy et al., 1985, Science 228:190; During et al., 1989, Ann. Neurol. 25:351; Howard et al., 1989, J. Neurosurg. 7 1:105); патент США № 5679377; патент США № 5916597; патент США № 5912015; патент США № 5989463; патент США № 5128326; публикация PCT № WO 99/15154; и публикация PCT № WO 99/20253. Примеры полимеров, используемых в формах с замедленным высвобождением, включают в себя, но не ограничиваются ими, поли(2-гидроксиэтилметакрилат), поли(метилметакрилат), поли(акриловую кислоту), сополимер этилена и винилацетата, поли(метакриловую кислоту), полигликолиды (PLG), полиангидриды, поли(N-винилпирролидон), поли(виниловый спирт), полиакриламид, поли(этиленгликоль), полилактиды (PLA), сополимер лактида и гликолида (PLGA) и полиортоэфиры. В предпочтительном варианте осуществления полимер, используемый в форме с замедленным высвобождением, является инертным, не содержащим выщелачиваемых примесей, стабильным при хранении, стерильным и биодеградируемым. Еще в одном варианте осуществления система с регулируемым или замедленным высвобождением может быть помещена вблизи от профилактической или терапевтической мишени, что позволяет использовать только часть системной дозы (см., например, Goodson, in Medical Applications of Controlled Release, выше, vol. 2, pp. 115-138 (1984)).
Системы с регулируемым высвобождением обсуждаются в обзоре Langer (1990, Science 249:1527-1533). Любой способ, известный квалифицированному специалисту в данной области, может быть использован для получения форм с замедленным высвобождением, содержащих один или несколько терапевтических агентов согласно изобретению. См., например, патент США № 4526938, публикацию PCT WO 91/05548, публикацию PCT WO 96/20698, Ning et al., 1996, "Intratumoral Radioimmunotheraphy of a Human Colon Cancer Xenograft Using a Sustained-Release Gel," Radiotherapy & Oncology 39:179-189, Song et al., 1995, "Antibody Mediated Lung Targeting of Long- Circulating Emulsions," PDA Journal of Pharmaceutical Science & Technology 50:372-397, Cleek et al., 1997, "Biodegradable Polymeric Carriers for a bFGF Antibody for Cardiovascular Application," Pro. Int'l. Symp. Control. Rel. Bioact. Mater. 24:853-854 и Lam et al., 1997, "Microencapsulation of Recombinant Humanized Monoclonal Antibody for Local Delivery," Proc. Int'l. Symp. Control Rel. Bioact. Mater. 24:759-760, которые полностью включены в данное описание путем ссылки.
В конкретном варианте осуществления, где композиция согласно изобретению является нуклеиновой кислотой, кодирующей профилактический или терапевтический агент, нуклеиновая кислота может быть введена in vivo для стимуляции экспрессии кодируемого ею профилактического или терапевтического агента, конструированием ее в виде части экспрессирующего вектора нуклеиновой кислоты и введением его таким образом, что он становится внутриклеточным, например, с использованием ретровирусного вектора (см., например, патент США № 4980286), или прямой инъекцией, или с использованием бомбардировки микрочастицами (например, с использованием генного пистолета; Biolistic, Dupont), или нанесением липидов или рецепторов клеточной поверхности, или трансфицирующих агентов, или введением ее в связи с гомеобокс-подобным пептидом, который, как известно, входит в ядро (см., например, Joliot et al., 1991, Proc. Natl. Acad. Sci. USA 88:1864-1868). Альтернативно, нуклеиновая кислота может быть введена внутриклеточно и включена в ДНК клетки-хозяина для экспрессии гомологичной рекомбинацией.
Фармацевтическую композицию согласно изобретению готовят таким образом, что она совместима с предполагаемым способом введения. Примеры способов введения включают в себя, но не ограничиваются ими, парентеральное, например, внутривенное, интрадермальное, подкожное, пероральное, интраназальное (например, ингаляцией), трансдермальное (например, местное), трансмукозальное (чресслизистое) и ректальное введение. В конкретном варианте осуществления композицию составляют в соответствии с рутинными процедурами в виде фармацевтической композиции, приспособленной для внутривенного, подкожного, внутримышечного, перорального, интраназального или локального введения людям. Обычно композиции для внутривенного введения представляют собой растворы в стерильном изотоничном водном буфере. Если необходимо, композиция может также включать солюбилизирующий агент и местный анестетик, такой как лидокаин, для облегчения боли в месте инъекции.
Если композиции согласно изобретению должны быть введены местно, то они могут быть изготовлены в форме мази, крема, трансдермального пластыря, лосьона, геля, шампуня, спрея, аэрозоля, раствора, эмульсии или другой формы, хорошо известной квалифицированному специалисту в данной области. См., например, Remington's Pharmaceutical Sciences and Introduction to Pharmaceutical Dosage Forms, 19th ed., Mack Pub. Co., Easton, Pa. (1995). Для не распыляемых в виде спрея местных дозированных форм обычно используют вязкие-полутвердые или твердые формы, содержащие носитель или один или несколько эксципиентов, совместимых с местным применением и имеющих динамическую вязкость предпочтительно больше, чем вязкость воды. Подходящие готовые формы включают в себя, без ограничения, растворы, суспензии, эмульсии, кремы, мази, порошки, линименты, бальзамы и т.п., которые являются, если желательно, стерилизованными или смешанными со вспомогательными агентами (например, консервантами, стабилизаторами, увлажняющими агентами, буферами или солями) для воздействия на различные свойства, такие как, например, осмотическое давление. Другие подходящие местные дозированные формы включают в себя разбрызгиваемые аэрозольные препараты, в которых активный ингредиент, предпочтительно в комбинации с твердым или жидким инертным носителем, упакован в смеси с находящимся под давлением летучим компонентом (например, газообразным пропеллентом, таким как фреон) или в склянке с нажимаемым клапаном. Увлажнители или увлажняющие агенты могут быть также добавлены в фармацевтические композиции и дозированные формы, если желательно. Примеры таких дополнительных ингредиентов хорошо известны в данной области.
Если способ согласно изобретению предусматривает интраназальное введение композиции, то композиция может быть приготовлена в аэрозольной форме, в виде спрея, «тумана» или в виде капель. В частности, профилактический или терапевтический агенты для применения в соответствии с данным изобретением могут быть удобно доставлены в форме предоставления аэрозольного спрея из находящейся под давлением упаковки или распылителя, с использованием подходящего пропеллента (например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа). В случае находящегося под давлением аэрозоля дозированная единица может быть определена обеспечением клапана для доставки отмеренного количества. Могут быть изготовлены капсулы и «патроны» (картриджи) (состоящие, например, из желатина) для использования в ингаляторе или инсуффляторе, содержащие порошковую смесь соединения и подходящей порошковой основы, такой как лактоза или крахмал.
Если способ согласно изобретению предусматривает пероральное введение, то композиции могут быть приготовлены в форме таблеток, капсул, крахмальных облаток, желатиновых капсул, растворов, суспензий и т.п. Таблетки или капсулы могут быть приготовлены общепринятыми способами с фармацевтически приемлемыми эксципиентами, такими как связывающие агенты (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); дезинтеграторы (например, картофельный крахмал или натриевый гликолят крахмала) или увлажняющие агенты (например, лаурилсульфат натрия). На таблетки может быть нанесено покрытие способами, хорошо известными в данной области. Жидкие препараты для перорального введения могут иметь форму, без ограничения, растворов, сиропов или суспензий, или они могут быть представлены в виде сухого продукта для воссоздания водой или другим подходящим наполнителем перед употреблением. Такие жидкие препараты могут быть приготовлены общепринятыми способами с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сироп сорбита, производные целлюлозы или гидрированные пищевые жиры); эмульгирующие агенты (например, лецитин или аравийская камедь); неводные носители (например, миндальное масло, масляные эфиры, этиловый спирт или фракционированные растительные масла) и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Препараты могут также содержать буферные соли, ароматизирующие, красящие и подслащивающие агенты, в случае необходимости. Препараты для перорального введения могут быть подходящим образом составлены для замедленного высвобождения, регулируемого высвобождения или пролонгированного высвобождения профилактических или терапевтических агентов.
Способ согласно изобретению может предусматривать легочное введение, например, с использованием, ингалятора или распылителя, композиции, составленной с образующим аэрозоль агентом. См., например, патенты США №№ 6019968, 5985320, 5985309, 5934272, 5874064, 5855913, 5290540 и 4880078; и публикации PCT №№ WO 92/19244, WO 97/32572, WO 97/44013, WO 98/31346 и WO 99/66903, каждая из которых полностью включена в данное описание путем ссылки. В конкретном варианте осуществления связывающий белок согласно изобретению, комбинированное терапевтическое средство и/или композицию согласно изобретению вводят с использованием легочной технологии доставки лекарственного средства Alkermes AIR® (Alkermes, Inc., Cambridge, Mass.).
Способ согласно изобретению может предусматривать введение композиции, составленной для парентерального введения, инъекцией (например, болюсной инъекцией или непрерывной инфузией). Готовые формы для инъекции могут быть представлены в стандартной лекарственной форме (например, в ампулах или многодозовых контейнерах) с добавленным консервантом. Композиции могут иметь такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать облегчающие приготовление агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в порошковой форме для воссоздания подходящим носителем (например, стерильной не содержащей пирогенов водой) перед использованием.
Способы согласно изобретению могут дополнительно предусматривать введение композиций, составленных в виде депо-препаратов. Такие готовые формы пролонгированного действия можно вводить путем имплантации (например, подкожно или внутримышечно) или внутримышечной инъекции. Таким образом, например, эти композиции могут быть составлены с подходящими полимерными или гидрофобными веществами (например, в виде эмульсии в приемлемом масле), или ионообменными смолами, или в виде слабо растворимых производных (например, слабо растворимой соли).
Способы согласно изобретению охватывают введение композиций, составленных в виде нейтральных или солевых форм. Фармацевтически приемлемые соли включают в себя соли, образованные с анионами, такие как соли, образованные из хлористоводородной, фосфорной, уксусной, щавелевой, винной кислот и т.д., и соли, образованные с катионами, такие как соли, образованные из натрия, калия, аммония, кальция, гидроксидов трехвалентного железа, изопропиламина, триэтиламина, 2-этиламиноэтанола, гистидина, прокаина и т.д.
Как правило, ингредиенты композиций поставляются либо отдельно, либо в смеси в стандартной лекарственной форме, например, в виде сухого лиофилизированного порошка или не содержащего воды концентрата в герметично заделанном контейнере, таком как ампула или капсула (облатка), указывающая количество активного агента. Если способом введения является инфузия, то композиция может быть помещена в инфузионную склянку, содержащую стерильную воду или стерильный солевой раствор фармацевтической степени чистоты. Если способом введения является инъекция, то может быть предусмотрена ампула со стерильной водой для инъекции или солевым раствором, так что ингредиенты могут быть смешаны перед введением.
В частности, данное изобретение также обеспечивает то, что один или несколько профилактических или терапевтических агентов, или фармацевтические композиции согласно изобретению упакованы в герметично заделанном контейнере, таком как ампула или саше, указывающие количество этого агента. В одном варианте осуществления один или несколько профилактических или терапевтических агентов, или фармацевтические композиции согласно изобретению поставляются в виде сухого стерилизованного лиофилизированного порошка или не содержащего воды концентрата в герметично заделанном контейнере и могут быть воссозданы (например, водой или солевым раствором) до подходящей концентрации для введения субъекту. Предпочтительно, один или несколько профилактических или терапевтических агентов, или фармацевтические композиции согласно изобретению поставляются в виде сухого стерильного лиофилизированного порошка в герметично заделанном контейнере в стандартной дозе по меньшей мере 5 мг, более предпочтительно по меньшей мере 10 мг, по меньшей мере 15 мг, по меньшей мере 25 мг, по меньшей мере 35 мг, по меньшей мере 45 мг, по меньшей мере 50 мг, по меньшей мере 75 мг или по меньшей мере 100 мг. Лиофилизированные профилактические или терапевтические агенты, или фармацевтические композиции согласно изобретению должны храниться при 2°C-8°C в первоначальном контейнере и эти профилактические или терапевтические агенты или фармацевтические композиции согласно изобретению должны вводиться в пределах 1 недели, предпочтительно в пределах 5 дней, в пределах 72 часов, в пределах 48 часов, в пределах 24 часов, в пределах 12 часов, в пределах 6 часов, в пределах 5 часов, в пределах 3 часов или в пределах 1 часа после воссоздания. В альтернативном варианте осуществления один или несколько профилактических или терапевтических агентов, или фармацевтические композиции согласно изобретению поставляются в жидкой форме в герметично заделанном контейнере, указывающем количество и концентрацию этого агента. Предпочтительно, жидкая форма вводимой композиции поставляется в герметично заделанном контейнере при по меньшей мере 0,25 мг/мл, более предпочтительно по меньшей мере 0,5 мг/мл, по меньшей мере 1 мг/мл, по меньшей мере 2,5 мг/мл, по меньшей мере 5 мг/мл, по меньшей мере 8 мг/мл, по меньшей мере 10 мг/мл, по меньшей мере 15 мг/мл, по меньшей мере 25 мг/мл, по меньшей мере 50 мг/мл, по меньшей мере 75 мг/мл или по меньшей мере 100 мг/мл. Жидкая форма должна храниться при 2°C-8°C в ее первоначальном контейнере.
В фармацевтическую композицию, подходящую для парентерального введения, могут быть включены связывающие белки согласно изобретению. Предпочтительно, антитело или части антитела готовят в виде инъекционного раствора, содержащего 0,1-250 мг/мл связывающего белка. Этот инъекционный раствор может состоять либо из жидкой, либо из лиофилизированной дозированной формы во флаконе из кремневой гальки или янтаря, ампуле или заранее заполненном шприце. Буфером может быть L-гистидин (1-50 мМ), оптимально 5-10 мМ, при рН 5,0-7,0 (оптимально рН 6,0). Другие подходящие буферы включают в себя, но не ограничиваются ими, сукцинат натрия, цитрат натрия, фосфат натрия или фосфат калия. Хлорид натрия может быть использован для модификации токсичности этого раствора при концентрации 0-300 мМ (оптимально 150 мМ для жидкой дозированной формы). Криопротекторы могут быть включены для лиофилизированной дозированной формы, в основном 0-10% сахароза (оптимально 0,5-1,0%). Другие подходящие криопротекторы включают в себя трегалозу и лактозу. Агенты-наполнители могут быть включены для лиофилизированной дозированной формы, в основном 1-10% маннит (оптимально 2-4%). Как в жидкой, так и в лиофилизированной форме могут быть использованы стабилизаторы, в основном 1-50 мМ L-метионин (оптимально 5-10 мМ). Другие подходящие наполнители включают в себя глицин, аргинин, в качестве поверхностно-активного вещества может быть включен полисорбат-80 в количестве 0-0,05% (оптимально 0,005-0,01%). Дополнительные поверхностно-активные агенты включают в себя, но не ограничиваются ими, полисорбат 20 и BRIJ. Фармацевтическая композиция, содержащая связывающие белки согласно изобретению, приготовленные в виде инъекционного раствора для парентерального введения, может дополнительно содержать агент, используемый в качестве адъюванта, такой как агент, используемый для увеличения абсорбции или дисперсии терапевтического белка (например, антитело). Особенно используемым адъювантом является гиалуронидаза, такая как Hylenex® (рекомбинантная гиалуронидаза человека). Добавление гиалуронидазы в инъекционный раствор улучшает биодоступность для человека после парентерального введения, особенно подкожного введения. Это добавление делает возможными также большие объемы на участок инъекции (т.е. более чем 1 мл) с меньшей болью и меньшим дискомфортом, и минимальную частоту возникновения реакций участка инъекции (см. WO2004078140 и US2006104968, включенные в данное описание путем ссылки).
Композиции согласно изобретению могут находиться в различных формах. Они включают в себя, например, жидкие, полутвердые и твердые дозированные формы, такие как жидкие растворы (например, инъекционные и инфузируемые растворы), дисперсии или суспензии, таблетки, пилюли, порошки, липосомы и суппозитории. Предпочтительная форма зависит от предполагаемого способа введения и терапевтического применения. Типичные предпочтительные композиции находятся в форме инъекционных или инфузионных растворов, например, композиций, сходных с композициями, используемыми для пассивной иммунизации человека другими антителами. Предпочтительным способом введения является парентеральный способ (например, внутривенный, подкожный, внутрибрюшинный, внутримышечный). В предпочтительном варианте осуществления антитело вводят внутривенной инфузией или инъекцией. В другом предпочтительном варианте осуществления антитело вводят внутримышечной или подкожной инъекцией.
Терапевтические композиции обычно должны быть стерильными и стабильными в условиях приготовления и хранения. Композиция может быть приготовлена в виде раствора, микроэмульсии, дисперсии, липосомы или другой упорядоченной структуры, подходящей для получения высокой концентрации лекарственного средства. Стерильные инъекционные растворы могут быть приготовлены включением активного соединения (т.е. антитела или части антитела) в требуемом количестве в подходящем растворителе с одним ингредиентом или с комбинацией ингредиентов, перечисленных выше, если необходимо, с последующей стерилизацией фильтрованием. Как правило, дисперсии готовят включением активного соединения в стерильный носитель, который содержит базовую дисперсионную среду и требуемые другие ингредиенты из перечисленных выше ингредиентов. В случае стерильных, лиофилизированных порошков для приготовления стерильных инъекционных растворов предпочтительными способами приготовления являются вакуумная сушка и сушка распылением, которая дает порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из его предварительно стерильно-отфильтрованного раствора. Должная текучесть раствора может поддерживаться, например, с использованием покрытия, такого как лецитин, поддержанием требуемого размера частиц в случае дисперсии и с использованием поверхностно-активных веществ. Пролонгированная абсорбция инъецируемых композиций может быть получена включением в композиции агента, который задерживает абсорбцию, например, моностеаратных солей и желатина.
Связывающие белки согласно изобретению можно вводить различными способами, известными в данной области, хотя для многих видов терапевтического применения предпочтительным путем/способом введения является подкожная инъекция, внутривенная инъекция или инфузия. Как будет понятно квалифицированному в данной области специалисту, путь и/или способ введения будет варьироваться в зависимости от желаемых результатов. В некоторых вариантах осуществления активное соединение может быть приготовлено с носителем, который будет защищать это соединение против быстрого высвобождения, например, в виде формы с регулируемым высвобождением, включающей в себя имплантаты, трансдермальные пластыри и микроинкапсулированные системы доставки. Могут быть использованы биодеградируемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Многие способы приготовления таких готовых форм запатентованы или обычно известны квалифицированным специалистам в данной области. См., например, Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978.
В некоторых вариантах осуществления связывающий белок согласно изобретению можно вводить перорально, например, с инертным разбавителем или ассимилируемым пригодным для пищи носителем. Это соединение (и другие ингредиенты, если желательно) могут быть также заключены в капсулу с твердой или мягкой оболочкой, спрессованы в таблетки или включены непосредственно в рацион субъекта. Для пероральнрого терапевтического введения эти соединения могут быть включены с эксципиентами и использованы в форме принимаемых внутрь таблеток, буккальных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток и т.п. Для введения соединения согласно изобретению иным способом, чем парентеральное введение, может быть необходимым покрытие этого соединения материалом или совместного введения этого соединения с материалом для предотвращения его инактивации.
Дополнительные активные соединения могут быть также включены в эти композиции. В некоторых вариантах осуществления связывающий белок согласно изобретению совместно получают или совместно вводят с одним или несколькими дополнительными терапевтическими агентами, которые применимы для лечения нарушений, в которых активность IL-12 является вредной. Например, связывающий белок согласно изобретению может быть получен совместно и/или совместно введен с одним или несколькими дополнительными антителами, которые связывают другие мишени (например, антителами, которые связывают другие цитокины или которые связывают молекулы клеточной поверхности). Кроме того, одно или несколько антител согласно изобретению могут быть использованы в комбинации с двумя или более предыдущими терапевтическими агентами. В таких комбинированных методах терапии можно выгодно использовать более низкие дозы вводимых терапевтических агентов, что позволяет избежать, таким образом, возможной токсичности или осложнений, ассоциированных с различными методами монотерапии.
В некоторых вариантах осуществления связывающий белок связан с удлиняющим период полужизни носителем, известным в данной области. Такие носители включают в себя, но не ограничиваются ими, Fc-домен, полиэтиленгликоль и декстран. Такие носители описаны, например, в заявке на патент США с регистрационным номером 09/428082 и опубликованной заявке на патент США № WO 99/25044, которые включены в данное описание путем ссылки для любой цели.
В конкретном варианте осуществления последовательности нуклеиновых кислот, кодирующие связывающий белок согласно изобретению или другой профилактический или терапевтический агент согласно изобретению, вводят для терапии, предотвращения, лечения или ослабления нарушения или одного или нескольких его симптомов с использованием генной терапии. Генной терапией называют терапию, выполняемую путем введения субъекту экспрессированной или экспрессируемой нуклеиновой кислоты. В данном варианте осуществления изобретения нуклеиновые кислоты продуцируют кодируемое ими антитело или профилактический или терапевтический агент согласно изобретению, который опосредует профилактическое или терапевтическое действие.
Любой из способов генной терапии, доступных в данной области, может быть использован в соответствии с данным изобретением. В отношении общего обзора способов генной терапии см. Goldspiel et al., 1993, Clinical Pharmacy 12:488-505; Wu and Wu, 1991, Biotherapy 3:87-95; Tolstoshev, 1993, Ann. Rev. Pharmacol. Toxicol. 32:573-596; Mulligan, Science 260:926-932 (1993); и Morgan and Anderson, 1993, Ann. Rev. Biochem. 62:191-217; May, 1993, TIBTECH 11(5):155-215. Способы, обычно известные в области технологии рекомбинантных ДНК, которые могут быть использованы, описаны у Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, NY (1993); и Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY (1990). Подробное описание различных способов генной терапии приведено в US20050042664 A1, который включен в данное описание путем ссылки.
Связывающие белки согласно изобретению применимы при лечении различных заболеваний, где мишени, которые узнаются этими связывающими белками, являются вредными для здоровья. Такие заболевания включают в себя, но не ограничиваются ими, ревматоидный артрит, остеоартрит, хронический ювенильный артрит, септический артрит, артрит Лайма, псориатический артрит, реактивный артрит, спондилоартропатию, системную красную волчанку, болезнь Крона, язвенный колит, воспалительное заболевание кишечника, инсулинзависимый сахарный диабет, тиреоидит, астму, аллергические заболевания, псориаз, дерматит, склеродермию, болезнь трансплантат против хозяина, отторжение трансплантатов органов, острое или хроническое иммунное заболевание, ассоциированное с трансплантацией органов, саркоидоз, атеросклероз, диссеминированное внутрисосудистое свертывание, болезнь Кавасаки, болезнь Грейвса, нефротический синдром, болезнь хронической усталости, гранулематоз Вегенера, пурпуру Геноха-Шенлейна, микроскопический васкулит почек, хронический активный гепатит, увеит, септический шок, синдром токсического шока, синдром сепсиса, кахексию, инфекционные заболевания, паразитарные заболевания, синдром приобретенного иммунодефицита, острый поперечный миелит, хорею Гентингтона, болезнь Паркинсона, болезнь Альцгеймера, инсульт, первичный билиарный цирроз, гемолитическую анемию, злокачественные заболевания, сердечную недостаточность, инфаркт миокарда, болезнь Аддисона, спорадическую плюригландулярную недостаточность типа I и плюригландулярную недостаточность типа II, синдром Шмидта, (острый) респираторный дистресс-синдром взрослых, алопецию, гнездную (очаговую) алопецию, сероотрицательную артропатию, артропатию, болезнь Рейтера, псориатическую артропатию, артропатию язвенного колита, энтеропатический синовит, ассоциированную с Chlamydia, Yersinia и Salmonella артропатию, спондилоартропатию, атероматозное заболевание/артериосклероз, атопическую аллергию, аутоиммунное буллезное заболевание, пузырчатку обыкновенную, листовидную пузырчатку, пемфигоид, линейное IgA-заболевание, аутоиммунную гемолитическую анемию, положительную гемолитическую анемию Кумбса, приобретенную пернициозную анемию, ювенильную пернициозную анемию, миалгический энцефалит/британский миалгический энцефалит, хронический кожно-слизистый кандидоз, гигантоклеточный артериит, первичный склерозирующий гепатит, криптогенный аутоиммунный гепатит, синдром приобретенного иммунодефицита, заболевания, родственные приобретенному иммунодефициту, гепатит В, гепатит С, общий транзиторный иммунодефицит (общую транзиторную гипогаммаглобулинемию), дилатационную кардиомиопатию, женское бесплодие, угасание функции яичников, преждевременное угасание функции яичников, фибротическое заболевание легких, криптогенный фиброзирующий альвеолит, послевоспалительное интерстициальное заболевание легких, интерстициальный пневмонит, ассоциированную с заболеванием соединительной ткани интерстициальную болезнь легких, ассоциированную с заболеванием смешанной соединительной ткани болезнь легких, ассоциированную с системным склерозом интерстициальную болезнь легких, ассоциированную с ревматоидным артритом интерстициальную болезнь легких, ассоциированную с системной красной волчанкой болезнь легких, ассоциированную с дерматомиозитом/полимиозитом болезнь легких, ассоциированную с болезнью Шегрена болезнь легких, ассоциированную с анкилозирующим спондилитом болезнь легких, васкулитное диффузное заболевание легких, ассоциированную с гемосидерозом болезнь легких, индуцированную лекарственным средством интерстициальную болезнь легких, фиброз, лучевой фиброз, облитерирующий бронхиолит, хроническую эозинофильную пневмонию, лимфоцитарное инфильтративное заболевание легких, постинфекционное интерстициальное заболевание легких, подагрический артрит, аутоиммунный гепатит, аутоиммунный гепатит типа-1 (классический аутоиммунный или люпоидный гепатит), аутоиммунный гепатит типа-2 (гепатит с анти-LKM-антителами), аутоиммунно опосредованную гипогликемию, инсулинорезистентность типа В с папиллярно-пигментной дистрофией кожи (acanthosis nigricans), гипопаратиреоз, острое иммунное заболевание, ассоциированное с трансплантацией органа, хроническое иммунное заболевание, ассоциированное с трансплантацией органа, остеоартроз, первичный склерозирующий холангит, псориаз типа 1, псориаз типа 2, идиопатическую лейкопению, аутоиммунную нейтропению, почечное заболевание NOS (БДУ), гломерулонефрит, микроскопический васкулит почек, болезнь Лайма, дискоидную красную волчанку, мужское бесплодие идиопатическое или NOS (БДУ), аутоиммунность спермы, рассеянный склероз (всех подтипов), симпатическую офтальмию, легочную гипертензию, вторичную относительно заболевания соединительной ткани, синдром Гудпасчера, легочную манифестацию нодозного полиартериита, острую ревматическую лихорадку, ревматоидный спондилит, болезнь Стилла, системный склероз, синдром Шегрена, болезнь Такаясу/артериит, аутоиммунную тромбоцитопению, идиопатическую тромбоцитопению, аутоиммунное заболевание щитовидной железы, гипертиреоз, зобный аутоиммунный гипотиреоз (болезнь Хашимото), атрофический аутоиммунный гипотиреоз, первичную микседему, факогенный увеит, первичный васкулит, витилиго, острое заболевание печени, хроническое заболевание печени, алкогольный цирроз, индуцированное алкоголем повреждение печени, холестаз, идиосинкратическую болезнь печени, индуцированный лекарственным средством гепатит, неалкогольный стеатогепатит, аллергию и астму, стрептококковую инфекцию группы В (GBS), психические нарушения (например, депрессию и шизофрению), Th типа 2- и Th типа 1-опосредованные заболевания, острую и хроническую боль (различные формы боли) и раковые заболевания, такие как рак легкого, молочной железы, желудка, мочевого пузыря, ободочной кишки, поджелудочной железы, яичников, предстательной железы и прямой кишки, и гемопоэтические злокачественные заболевания (лейкоз и лимфому), абеталипопротеинемию, акроцианоз, острые и хронические паразитарные или инфекционные процессы, острый лейкоз, острый лимфобластный лейкоз (ALL), острый миелоидный лейкоз (AML), острую или хроническую бактериальную инфекцию, острый панкреатит, острую почечную недостаточность, аденокарциномы, предсердные эктопические систолы, СПИД-ассоциированный комплекс деменций, индуцированный алкоголем гепатит, аллергический конъюнктивит, аллергический контактный дерматит, аллергический ринит, отторжение аллотрансплантата, недостаточность альфа-l-антитрипсина, амиотрофический боковой склероз, анемию, стенокардию, дегенерацию клеток переднего рога спинного мозга, анти-cd3-терапию, антифосфолипидный синдром, аллергические реакции на противорецепторные антитела, аневризмы аорты и периферических сосудов, рассечение аорты, артериальную гипертензию, артериосклероз, атриовентрикулярную фистулу, атаксию, предсердную фибрилляцию (стойкую или пароксизмальную), трепетание предсердий, атриовентрикулярную блокаду, В-клеточную лимфому, отторжение костного трансплантата, отторжение трансплантата костного мозга (BMT), межжелудочковую блокаду, лимфому Беркитта, ожоги, сердечные аритмии, синдром временной остановки сердца, опухоли сердца, кардиомиопатию, воспалительную реакцию при искусственном кровообращении, отторжение трансплантата хряща, церебеллярные кортикальные дегенерации, церебеллярные нарушения, хаотическую или мультиочаговую предсердную тахикардию, ассоциированные с химиотерапией нарушения, хронический миелоцитарный лейкоз (CML), хронический алкоголизм, хронические воспалительные патологии, хронический лимфоцитарный лейкоз (CLL), хроническую обструктивную болезнь легких (COPD), хроническую интоксикацию салицилатом, рак ободочной кишки, застойную сердечную недостаточность, конъюнктивит, контактный дерматит, легочное сердце, болезнь коронарных артерий, болезнь Крейтцфельдта-Якоба, отрицательный в культуре сепсис, муковисцидоз, ассоциированные с терапией цитокинами нарушения, боксерскую деменцию, демиелинизирующие заболевания, геморрагическую лихорадку Денге, дерматит, дерматологические состояния, диабет, сахарный диабет, диабетическое артериосклеротическое заболевание, заболевание с диффузными тельцами Леви, дилатационную застойную кардиомиопатию, нарушения базальных (подкорковых) ядер головного мозга, синдром Дауна в среднем возрасте, индуцированные лекарственными средствами нарушения движения, нарушения, индуцированные лекарственными средствами, которые блокируют рецепторы допамина ЦНС, чувствительность к лекарственным средствам, экзему, энцефаломиелит, эндокардит, эндокринопатию, эпиглоттит, инфекцию вирусом Эпштейна-Барр, эритромелалгию, экстрапирамидные и церебеллярные нарушения, семейный гематофагоцитарный лимфоцитарный гистиоцитоз, отторжение имплантата фетальной вилочковой железы, атаксию Фридрейха, функциональные периферические артериальные нарушения, грибковый сепсис, газовую (анаэробную) гангрену, язву желудка, гломерулонефрит, отторжение трансплантата любого органа или любой ткани, грамотрицательный сепсис, грамположительный сепсис, гранулемы, вызываемые внутриклеточными организмами, лейкемический ретикулоэндотелиоз, болезнь Халлеррордена-Шпатца, тиреоидит Хашимото, сенную лихорадку, отторжение трансплантата сердца, гемохроматоз, гемодиализ, гемолитический уремический синдром/тромболитическую тромбоцитопеническую пурпуру, кровотечение, гепатит (A), аритмию пучка Гиса, ВИЧ-инфекцию/ВИЧ-невропатию, болезнь Ходжкина, гиперкинетические нарушения движения, аллергические реакции, аллергический пневмонит, гипертензию, гипокинетические нарушения движения, оценку системы гипоталамус-гипофиз-надпочечники, идиопатическую болезнь Аддисона, идиопатический легочный фиброз, опосредованную антителами цитотоксичность, астению, детскую спинально-мышечную атрофию, воспаление аорты, грипп А, воздействие ионизирующей радиацией, иридоциклит/увеит/неврит зрительного нерва, ишемическое/реперфузионное повреждение, ишемический инсульт, ювенильный ревматоидный артрит, ювенильную спинально-мышечную атрофию, саркому Капоши, отторжение трансплантата почки, инфекции микобактерией Legionella, лейшманиоз, проказу, повреждения кортико-спинальной системы, жировой отек, отторжение трансплантата печени, лимфатический отек, малярию, злокачественную лимфому, злокачественный гистиоцитоз, злокачественную меланому, менингит, менингококкемию, метаболическую/идиопатическую, кластерную головную боль, митохондриальное мультисистемное нарушение, заболевание смешанной соединительной ткани, моноклональную гаммопатию, множественную миелому, дегенерации множественных систем (Mencel Dejerine- Thomas Shi-Drager и Machado-Joseph), тяжелую псевдопаралитическую миастению, Мycobacterium avium intracellulare, туберкулезную бациллу, синдром миелодисплазии, инфаркт миокарда, ишемические нарушения миокарда, рак носоглотки, хроническое заболевание легких новорожденных, нефрит, нефроз, нейродегенеративные заболевания, нейрогенные I мышечные атрофии, нейрогенную лихорадку, не-Ходжкинскую лимфому, закупорку брюшной аорты и ее ответвлений, окклюзивные артериальные нарушения, okt3-терапию, орхит/эпидидимит, процедуру после лечения орхита/вазэктомии, органомегалию, остеопороз, отторжение трансплантата поджелудочной железы, рак поджелудочной железы, паранеопластический синдром/гиперкальциемию при злокачественных заболеваниях, отторжение трансплантата паращитовидной железы, воспалительное заболевание почечных лоханок, круглогодичный ринит, заболевание перикарда, периферическое атеросклеротическое заболевание, периферические васкулярные нарушения, перитонит, пернициозную анемию, пневмонию, вызываемую Рneumocystis carinii, пневмонию, синдром POEMS (полиневропатию, органомегалию, эндокринопатию, моноклональную гаммопатию и синдром изменений кожи), постперфузионный синдром, постгемодиализный синдром, синдром пост-MI-кардиотомию, пре-эклампсию, прогрессирующий супрануклеарный паралич, первичную легочную гипертензию, лучевую терапию, феномен и болезнь Рейно, болезнь Рейно, болезнь Рефсума, тахикардию с регулярными узкими QRS, реноваскулярную (почечно-сосудистую) гипертензию, реперфузионное повреждение, рестриктивную кардиомиопатию, саркомы, склеродермию, сенильную хорею, сенильную деменцию, ассоциированную с тельцами Леви, сероотрицательные артропатии, шок, серповидно-клеточную анемию, отторжение аллотрансплантата кожи, синдром изменений кожи, отторжение трансплантата тонкой кишки, солидные опухоли, специфические аритмии, спинальную атаксию, спинально-церебеллярные дегенерации, стрептококковый миозит, структурные повреждения мозжечка, подострый склерозирующий панэнцефалит, обморок (синкопе), сердечно-сосудистый сифилис, системную анафилаксию, синдром системной воспалительной реакции, системный ювенильный ревматоидный артрит, T-клеточный или FAB ALL (острый лимфобластный лейкоз), телангиэктазию, облитерирующий тромбангиит, тромбоцитопению, токсичность, трансплантаты, травму/кровотечение, аллергические реакции типа III, аллергию типа IV, нестабильную стенокардию, уремию, уросепсис, крапивницу, вальвулярные сердечные заболевания, варикозные вены, васкулит, венозные заболевания, венозный тромбоз, фибрилляцию (мерцание) желудочков, вирусные и грибковые инфекции, острый энцефалит с высоким риском смертельного исхода/асептический менингит, гемафагоцитарный синдром, ассоциированный с высоким риском смертельного исхода, синдром Вернике-Корсакова, заболевание Вильсона, отторжение ксенотрансплантата любого органа или любой ткани. (См. Peritt et al. публикацию PCT № WO 2002097048А2, Leonard et al., публикацию PCT № WO 9524918 А1 и Salfeld et al., публикацию PCT № WO 00/56772А1).
Связывающие белки согласно изобретению могут быть использованы для лечения людей, страдающих от аутоиммунных заболеваний, в частности, от заболеваний, связанных с воспалением, включая ревматоидный артрит, спондилит, аллергию, аутоиммунный диабет, аутоиммунный увеит.
Предпочтительно, связывающие белки согласно изобретению или их антигенсвязывающие части используют для лечения ревматоидного артрита, болезни Крона, рассеянного склероза, инсулинзависимого сахарного диабета и псориаза.
Связывающий белок согласно изобретению можно также вводить с одним или несколькими дополнительными терапевтическими агентами, применимыми в лечении различных заболеваний.
Связывающий белок согласно изобретению может быть использован отдельно или в комбинации для лечения таких заболеваний. Должно быть понятно, что связывающие белки могут быть использованы отдельно или в комбинации с дополнительным агентом, например, терапевтическим агентом, причем указанный дополнительный агент выбирается квалифицированным специалистом для его предполагаемой цели. Например, дополнительным агентом может быть терапевтический агент, который признается в данной области в качестве агента, применимого для лечения заболевания или состояния, подлежащего лечению антителом согласно изобретению. Дополнительным агентом может также быть агент, который придает полезный признак данной терапевтической композиции, например, агент, который влияет на вязкость композиции.
Должно быть также понятно, что комбинации, которые должны быть включены в объем данного изобретения, являются комбинациями, применимыми для их предполагаемой цели. Агенты, приведенные ниже, являются иллюстративными для этих целей и не являются ограничивающими. Комбинациями, которые являются частью настоящего изобретения, могут быть антитела согласно изобретению и по меньшей мере один дополнительный агент, выбранный из перечней, приведенных ниже. Комбинация может также включать в себя более одного дополнительного агента, например, два или три дополнительных агента, если эта комбинация является такой, что образованная композиция может выполнять ее предполагаемую функцию.
Предпочтительными комбинациями для лечения аутоиммунных и воспалительных заболеваний являются нестероидные противовоспалительные лекарственные средства, также называемые NSAID, которые включают в себя лекарственные средства, подобные ибупрофену. Другими предпочтительными комбинациями являются кортикостероиды, включая преднизолон; хорошо известные побочные действия применения стероидов могут быть уменьшены или даже исключены снижением дозы стероида при лечении пациентов в комбинации с DVD-Ig согласно изобретению. Неограничивающие примеры терапевтических агентов для ревматоидного артрита, с которыми можно комбинировать антитело или часть антитела согласно изобретению, включают в себя следующее: подавляющие цитокины противовоспалительные лекарственные средства (CSAID); антитела к другим цитокинам или факторам роста человека или антагонисты других цитокинов или факторов роста человека, например, TNF, LT, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, IL-21, IL-23, интерфероны, EMAP-II, GM-CSF, FGF и PDGF. Связывающие белки согласно изобретению или их антигенсвязывающие части можно комбинировать с антителами к молекулам клеточной поверхности, таким как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80 (B7.1), CD86 (B7.2), CD90, CTLA или их лиганды, включая CD154 (gp39 или CD40L).
Предпочтительные комбинации терапевтических агентов могут быть препятствием в разных точках в аутоиммунном и последующем воспалительном каскаде; предпочтительные примеры включают в себя антагонисты TNF, такие как химерные, гуманизированные анти-TNF-антитела или анти-TNF-антитела человека, D2E7, (публикация PCT № WO 97/29131), CA2 (Remicade™), CDP 571 и растворимые TNF-рецепторы p55 или p75, их производные (p75TNFR1gG (Enbrel™) или p55TNFR1gG (Lenercept), а также ингибиторы TNFα превращающего фермента (TACE); аналогично, ингибиторы IL-1 (ингибиторы интерлейкин-1-превращающего фермента, IL-1RA и т.д.) могут быть эффективными по той же самой причине. Другие предпочтительные комбинации включают в себя интерлейкин-11. Другие предпочтительные комбинации включают в себя ключевые члены аутоиммунной реакции, которые могут действовать параллельно функции IL-12, в зависимости от функции IL-12 или совместно с функцией IL-12; особенно предпочтительными являются антагонисты IL-18, включающие в себя антитела IL-18 или растворимые рецепторы IL-18, или IL-18-связывающие белки. Было показано, что IL-12 и IL-18 имеют перекрывающиеся, но отличающиеся функции, и комбинация антагонистов к обоим из них может быть наиболее эффективной. Еще одной предпочтительной комбинацией являются неистощающие анти-CD4-ингибиторы. Другие предпочтительные комбинации включают в себя антагонисты костимулирующего пути CD80 (B7.1) или CD86 (B7.2), включающие в себя антитела, растворимые рецепторы или антагонистические лиганды.
Связывающие белки согласно изобретению можно также комбинировать с такими агентами, как метотрексат, 6-MP, азатиоприн-сульфасалазин, месалазин, олсалазин, хлорохинин/гидроксихлорохин, пенцилламин, ауротиомалат (внутримышечный и пероральный), азатиоприн, кохицин, кортикостероиды (пероральные, ингалируемые и вводимые локальной инъекцией), агонисты бета-2-адренорецептора (салбутамол, тербуталин, салметерал), ксантины (теофиллин, аминофиллин), кромогликат, недокромил, кетотифен, ипратропий и окситропий, циклоспорин, FK506, рапамицин, микофенолят-мофетил, лефлуномид, NSAID, например, ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические агенты, ингибиторы комплемента, адренергические агенты, агенты, которые препятствуют передаче сигнала провоспалительными цитокинами, такими как TNF-α или IL-1 (например, ингибиторы IRAK, NIK, IKK, p38 или MAP-киназы), ингибиторы IL-1β превращающего фермента, ингибиторы TNFα превращающего фермента (TACE), ингибиторы передачи сигнала T-клеток, такие как ингибиторы киназы, ингибиторы металлопротеиназы, сулфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензин-превращающего фермента, растворимые рецепторы цитокинов и их производные (например, растворимые рецепторы TNF p55 или p75 и их производные p75TNFRIgG (Enbrel™ и p55TNFRIgG (Lenercept)), sIL-1RI, sIL-1RII, sIL-6R), противовоспалительные цитокины (например, IL-4, IL-10, IL-11, IL-13 and TGFβ), целекоксиб, фолиевая кислота, гидроксихлорохина сульфат, рофекоксиб, этанерцепт, инфликсимаб, напроксен, валдекоксиб, сульфасалазин, метилпреднизолон, мелоксикам, метилпреднизолона ацетат, золото-натрий-тиомалат, аспирин, триамцинолона ацетонид, пропоксифена напсилат/арар, фолат, набуметон, диклофенак, пироксикам, этодолак, диклофенак-натрий, оксапрозин, оксикодона гидрохлорид, гидрокодона битартрат/apap, диклофенак-натрий/мизопростол, фентанил, анакинра, рекомбинант человека, трамадола гидрохлорид, салсалат, сулиндак, цианокобаламин/fa/пиридоксин, ацетаминофен, алендронат-натрий, преднизолон, морфина сульфат, лидокаина гидрохлорид, индометацин, глюкозамина сульф/хондроитин, амитриптилина гидрохлорид, сульфадиазин, оксикодона гидрохлорид/ацетаминофен, олопатадина гидрохлорид, мизопростол, напроксен-натрий, омепразол, циклофосфамид, ритуксимаб, IL-1 TRAP, MRA, CTLA4-IG, IL-18 BP, анти-IL-18, анти-IL15, BIRB-796, SCIO-469, VX-702, AMG-548, VX-740, рофлумиласт, IC-485, CDC-801 и мезопрам. Предпочтительные комбинации включают в себя метотрексат или лефлуномид и, в умеренных или тяжелых случаях ревматоидного артрита, циклоспорин.
Неограничивающие дополнительные агенты, которые могут быть также использованы в комбинации со связывающим белком для лечения ревматоидного артрита, включают в себя, но не ограничиваются ими, следующие агенты: нестероидные противовоспалительные лекарственные средства (NSAID); подавляющие цитокины противовоспалительные лекарственные средства (CSAID); CDP-571/BAY-10-3356 (гуманизированное анти-TNFα-антитело; Celltech/Bayer); cA2/инфликсимаб (химерное анти-TNFα-антитело; Centocor); 75 kdTNFR-IgG/этанерцепт (слитый белок 75 кД TNF-рецептор-IgG; Immunex; см., например, Arthritis & Rheumatism (1994) Vol. 37, S295; J. Invest. Med. (1996) Vol. 44, 235A); 55 kdTNF-IgG (слитый белок 55 кД TNF-рецептор-IgG; Hoffmann-LaRoche); IDEC-CE9.1/SB 210396 (неистощающее приматизированное анти-CD4-антитело; IDEC/SmithKline; см., например, Arthritis & Rheumatism (1995) Vol. 38, S185); DAB 486-IL-2 и/или DAB 389-IL-2 (IL-2-слитые белки; Seragen; см., например, Arthritis & Rheumatism (1993) Vol. 36, 1223); Anti-Tac (гуманизированные анти-IL-2Rα; Protein Design Labs/Roche); IL-4 (противовоспалительный цитокин; DNAX/Schering); IL-10 (SCH 52000; рекомбинантный IL-10, противовоспалительный цитокин; DNAX/Schering); IL-4; IL-10 и/или агонисты IL-4 (например, агонистические антитела); IL-1RA (антагонист IL-1-рецептора; Synergen/Amgen); анакинра (Kineret®/Amgen); TNF-bp/s-TNF (растворимый TNF-связывающий белок; см., например, Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S284; Amer. J. Physiol. - Heart and Circulatory Physiology (1995) Vol. 268, pp. 37-42); R973401 (ингибитор фосфодиэстеразы типа IV; см., например, Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S282); MK-966 (ингибитор COX-2; см., например, Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S81); илопрост (см., например, Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S82); метотрексат, талидомид (см., например, Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S282) и родственные талидомиду лекарственные средства (например, целген); лефлуномид (противовоспалительный агент и ингибитор цитокинов; см., например, Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S131; Inflammation Research (1996) Vol. 45, pp. 103-107); транексамовую кислоту (ингибитор активации плазминогена; см., например, Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S284); T-614 (ингибитор цитокинов; см., например, Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S282); простагландин E1 (см., например, Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S282); тенидап (нестероидное противовоспалительное средство; см., например, Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S280); напроксен (нестероидное противовоспалительное средство; см., например, Neuro Report (1996) Vol. 7, pp. 1209-1213); мелоксикам (нестероидное противовоспалительное средство); ибупрофен (нестероидное противовоспалительное средство); пироксикам (нестероидное противовоспалительное средство); диклофенак (нестероидное противовоспалительное средство); индометацин (нестероидное противовоспалительное средство); сульфасалазин (см., например, Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S281); азатиоприн (см., например, Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S281); ICE-ингибитор (ингибитор интерлейкин-1β-превращающего фермента); ингибитор zap-70 и/или lck (ингибитор тирозинкиназы zap-70 или lck); ингибитор VEGF и/или ингибитор VEGF-R (ингибиторы фактора роста васкулярных эндотелиальных клеток или рецептора фактора роста васкулярных эндотелиальных клеток; ингибиторы ангиогенеза); кортикостероидные противовоспалительные лекарственные средства (например, SB203580); ингибиторы TNF-конвертазы; анти-IL-12-антитела; анти-IL-18-антитела; интерлейкин-11 (см., например, Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S296); интерлейкин-13 (см., например, Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S308); ингибиторы интерлейкина-17 (см., например, Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S120); золото; пеницилламин; хлорохин; хлорамбуцил; гидроксихлорохин; циклоспорин; циклофосфамид; общее лимфоидное облучение; анти-тимоцит-глобулин; анти-CD4-антитела; CD5-токсины; перорально вводимые пептиды и коллаген; лобензарит-динатрий; регулирующие цитокины агенты (CRA) HP228 and HP466 (Houghten Pharmaceuticals, Inc.); антисмысловые фосфоротиоатные олигодезоксинуклеотиды ICAM-1 (ISIS 2302; Isis Pharmaceuticals, Inc.); растворимый рецептор 1 комплемента (TP10; T Cell Sciences, Inc.); преднизон; орготеин; гликозаминогликана полисульфат; миноциклин; анти-IL2R-антитела; морские и ботанические липиды (жирные кислоты рыб и семян растений; см., например, DeLuca et al. (1995) Rheum. Dis. Clin. North Am. 21:759-777); ауранофин; фенилбутазон; меклофенамовую кислоту; внутривенный иммуноглобулин; цилейтон; азарибин; микофеноловую кислоту (RS-61443); такролимус (FK-506); сиролимус (рапамицин); амиприлозу (терафектин); кладрибин (2-хлордезоксиаденозин); метотрексат; антивирусные агенты и иммуномодулирующие агенты.
В одном варианте осуществления связывающий белок или его антигенсвязывающие части вводят в комбинации с одним из следующих агентов для лечения ревматоидного артрита: ингибитор KDR с малой молекулой (ABT-123), ингибитор Tie-2 с малой молекулой; метотрексат; преднизон; целекоксиб, фолиевая кислота; гидроксихлорохина сульфат; рофекоксиб; этанерцепт; инфликсимаб; лефлуномид; напроксен; валдекоксиб; сульфасалазин; метилпреднизолон; ибупрофен; мелоксикам; метилпреднизолона ацетат; золото-натрий-тиомалат; аспирин; азатиоприн; триамцинолона ацетонид; пропоксифена напсилат/apap; фолат; набуметон; диклофенак; пиоксикам; этодолак; диклофенак-натрий; оксапрозин; оксикодона гидрохлорид; гидрокодона битартрат/apap; диклофенак-натрий/мизопростол; фентанил; анакинра, рекомбинант человека; трамадола гидрохлорид; салсалат; сулиндак; цианокобаламин/fa/пиридоксин; ацетаминофен; алендронат-натрий; преднизолон; морфина сульфат; лидокаина гидрохлорид; индометацин; глюкозамина сульфат/хондроитин; циклоспорин; амитриптилина гидрохлорид; сульфадиазин; оксикодона гидрохлорид/ацетаминофен; олопатадина гидрохлорид; мизопростол; напроксен-натрий; омепразол; микофенолят-мофетил; циклофосфамид; ритуксимаб; IL-1 TRAP; MRA; CTLA4-IG; IL-18 BP; ABT-874; ABT-325; анти-IL-18; анти-IL-15; BIRB-796; SCIO-469; VX-702; AMG-548; VX-740; рофлумиласт; IC-485; CDC-801 и мезопрам.
Неограничивающие примеры терапевтических агентов для воспалительного заболевания кишечника, с которыми связывающие белки согласно изобретению можно комбинировать, включают в себя следующие агенты: буденозид; эпидермальный фактор роста; кортикостероиды; циклоспорин, сульфасалазин; аминосалицилаты; 6-меркаптопурин; азатиоприн; метронидазол; ингибиторы липоксигеназы; мезаламин; олсалазин; балсалазид; антиоксиданты; ингибиторы тромбоксана; антагонисты IL-1-рецептора; моноклональные анти-IL-1β-антитела; моноклональные анти-IL-6 антитела; факторы роста; ингибиторы эластазы; пиридинилимидазольные соединения; антитела к другим цитокинам или факторам роста человека или антагонисты к другим цитокинам или факторам роста человека, например, TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-17, IL-18, EMAP-II, GM-CSF, FGF и PDGF. Антитела согласно изобретению или их антигенсвязывающие части можно комбинировать с антителами к молекулам клеточной поверхности, таким как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD90 или их лиганды. Антитела согласно изобретению или их антигенсвязывающие части можно также комбинировать с такими агентами, как метотрексат, циклоспорин, FK506, рапамицин, микофенолят-мофетил, лефлуномид, NSAID, например, ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические агенты, ингибиторы комплемента, адренергические агенты, агенты, которые препятствуют передаче сигнала провоспалительными цитокинами, такими как TNF-α или IL-1 (например, ингибиторы киназ IRAK, NIK, IKK, p38 или MAP), ингибиторы IL-1β превращающего фермента, ингибиторы TNFα превращающего фермента, ингибиторы передачи сигнала T-клеток, такие как ингибиторы киназ, ингибиторы металлопротеиназ, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензин-превращающего фермента, растворимые рецепторы цитокинов и их производные (например, растворимые рецепторы TNF p55 или p75, sIL-1RI, sIL-1RII, sIL-6R) и противовоспалительные цитокины (например, IL-4, IL-10, IL-11, IL-13 и TGFβ).
Предпочтительные примеры терапевтических агентов для болезни Крона, с которыми связывающий белок можно комбинировать, включают в себя следующие агенты: антагонисты TNF, например, анти-TNF-антитела, D2E7 (публикация PCT No. WO 97/29131; HUMIRA), CA2 (REMICADE), CDP 571, конструкции TNFR-Ig, ингибиторы (p75TNFRIgG (ENBREL) и p55TNFRIgG (LENERCEPT)) и ингибиторы PDE4. Антитела согласно изобретению или их антигенсвязывающие части можно комбинировать с кортикостероидами, например, буденозидом и дексаметазоном. Связывающие белки согласно изобретению или их антигенсвязывающие части можно также комбинировать с такими агентами, как сульфасалазин, 5-аминосалициловая кислота и олсалазин, и агентами, которые препятствуют синтезу или действию провоспалительных цитокинов, таких как IL-1, например, ингибиторов IL-1β-превращающего фермента и IL-1ra. Антитела согласно изобретению или их антигенсвязывающие части могут быть также использованы с ингибиторами передачи сигнала Т-клеток, например, ингибиторами тирозинкиназы 6-меркаптопуринами. Связывающие белки согласно изобретению или их антигенсвязывающие части можно комбинировать с IL-11. Связывающие белки согласно изобретению или их антигенсвязывающие части можно комбинировать со следующими средствами: мезаламин, преднизон, азатиоприн, меркаптопурин, инфликсимаб, метилпреднизолон-натрий сукцинат, дифеноксилат/атроп сульфат, лоперамида гидрохлорид, метотрексат, омеразол, фолатом, ципрофлоксацин/декстроза-вода, гидрокодона битартрат/арар, тетрациклина гидрохлорид, флуоцинонид, метронидазол, тимеросал/борная кислота, холестирамин/сахароза, ципрофлоксацина гидрохлорид, гиосциамина сульфат, меперидина гидрохлорид, мидазолама гидрохлорид, оксодона гидрохлорид/ацептаминофен, прометазина гидрохлорид, фосфат натрия, сульфаметоксазол/триметоприм, целекоксиб, поликарбофил, пропоксифена напсилат, гидрокортизон, мультивитамины, динатрий-балсалазид, кодеина фосфат/арар, колесевелама гидрохлорид, цианокобаламин, фолиевая кислота, левофлоксацин, метилпреднизолон, натализумаб и интерферон-гамма.
Неограничивающие примеры терапевтических агентов для рассеянного склероза, с которыми связывающие белки согласно изобретению можно комбинировать, включают в себя следующие агенты: кортикостероиды; преднизолон; метилпреднизолон; азатиоприн; циклофосфамид; циклоспорин; метотрексат; 4-аминопиридин; тизанидин; интерферон-β1а (AVONEX; Biogen); интерферон-β1b (BETASERON; Chiron/Berlex); интерферон-α-n3) (Interferon Sciences/Fujimoto), интерферон-α (Alfa Wassermann/J&J), интерферон-βA-IF (Serono/Inhale Therapeutics), Пэг-интерферон-α2b (Enzon/Schering-Plough), Сополимер 1 (Cop-1; COPAXONE; Teva Pharmaceutical Industries, Inc.); гипербарический кислород; внутривенный иммуноглобулин; клабрибин; антитела к другим цитокинам или факторам роста или их рецепторам человека или антагонисты других цитокинов или факторов роста или их рецепторов человека, например, TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-23, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF и PDGF. Связывающие белки согласно изобретению можно комбинировать с антителами к молекулам клеточной поверхности, таким как CD2, CD3, CD4, CD8, CD19, CD20, CD25, CD28, CD30, CD40, CD45, CD69, CD80, CD86, CD90 или их лиганды. Связывающие антитела согласно изобретению можно также комбинировать с такими агентами, как метотрексат, циклоспорин, FK506, рапамицин, микофенолят-мофетил, лефлуномид, NSAID, например, ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические агенты, ингибиторы комплемента, адренергические агенты, агенты, которые препятствуют передаче сигнала провоспалительными цитокинами, такими как TNF-α или IL-1 (например, ингибиторы киназ IRAK, NIK, IKK, p38 или MAP), ингибиторы IL-1β превращающего фермента, ингибиторы TACE, ингибиторы передачи сигнала T-клеток, такие как ингибиторы киназы, ингибиторы металлопротеиназы, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензин-превращающего фермента, растворимые рецепторы цитокинов и их производные (например, растворимые рецепторы TNF p55 или p75, sIL-1RI, sIL-1RII, sIL-6R) и противовоспалительные цитокины (например, IL-4, IL-10, IL-11, IL-13 и TGFβ).
Предпочтительные примеры терапевтических агентов для рассеянного склероза, с которыми связывающие белки согласно изобретению можно комбинировать, включают в себя интерферон-β, например, IFNβ1a и IFNβ1b; копаксон, кортикостероиды, ингибиторы каспаз, например, ингибиторы каспазы-1, ингибиторы IL-1, ингибиторы TNF и антитела к CD40-лиганду и CD80.
Связывающие белки согласно изобретению можно комбинировать также с такими агентами, как алемтузумаб, дронабинол, унимед, даклизумаб, митоксантрон, ксалипродена гидрохлорид, фампридин, глатирамера ацетат, натализумаб, синнабидол, a-иммунокин NNSO3, ABR-215062, AnergiX.MS, антагонисты рецептора хемокинов, BBR-2778, калагуалин, CPI-1189, LEM (инкапсулированный в липосоме митоксантрон), THC.CBD (агонист каннабиноида) MBP-8298, мезопрам (ингибитор PDE4), MNA-715, анти-IL-6-рецептор-антитело, нейровакс, пирфенидон-аллотрап 1258 (RDP-1258), sTNF-R1, талампанел, терифлуномид, TGF-beta2, типлимотид, антагонисты VLA-4 (например, TR-14035, VLA4 Ultrahaler, Antegran-ELAN/Biogen), антагонисты интерферона-гамма, агонисты IL-4.
Неограничивающие примеры терапевтических агентов для стенокардии, с которыми можно комбинировать связывающие белки согласно изобретению, включают в себя следующие агенты: аспирин, нитроглицерин, изосорбида мононитрат, метопролола сукцинат, атенолол, метропролола тартрат, амплодипина безилат, дилтиазема гидрохлорид, изосорбида динитрат, клопидогрела бисульфат, нифедипин, аторвастатин-кальций, хлорид калия, фуросемид, симвастатин, верапамила гидрохлорид, дигоксин, пропанолола гидрохлорид, карведилол, лизиноприл, спиронолактон, гидрохлоротиазид, эналаприла малеат, надолол, рамиприл, эноксапарин-натрий, гепарин-натрий, валсартан, соталола гидрохлорид, фенофибрат, эзетимиб, буметанид, лозартан-калий, лизиноприл/гидрохлоротиазид, фелодипин, каптоприл, бисопролола фумарат.
Неограничивающие примеры терапевтических агентов для анкилозирующего спондилита, с которыми можно комбинировать связывающие белки согласно изобретению, включают в себя следующие агенты: ибупрофен, диклофенак и мизопростол, напроксен, мелоксикам, индометацин, диклофенак, целекоксиб, рофекоксиб, сульфасалазин, метотрексат, азатиоприн, миноциклин, преднизон, этанерцерт, инфликсимаб.
Неограничивающие примеры терапевтических агентов для астмы, с которыми можно комбинировать связывающие белки согласно изобретению, включают в себя следующие агенты: албутерол, салметерол/флутиказон, монтелукаст-натрий, флутиказона пропионат, будезонид, преднизон, салметерола ксинафоат, левалбутерола гидрохлорид, албутерола сульфат/ипратропий, преднизолон-натрия фосфат, триамцинолона ацетонид, беклометазона дипропионат, ипратория бромид, азитромицин, пирбутерола ацетат, преднизолон, теофиллин безводный, метилпреднизолон-натрия сукцинат, кларитромицин, зафирлукаст, формотерола фумарат, вакцина вируса гриппа, метилпреднизолон, амоксициллина тригидрат, флунисолид, инъекция против аллергии, кромолин-натрий, фексофенадина гидрохлорид, флунисолид/ментол, амоксициллин/клавуланат, левофлоксацин, ингаляторное устройство, гвайфенезин, дексаметазон-натрия фосфат, моксифлоксацина гидрохлорид, доксициклина хиклат, гвайфенесин/d-меторфан, p-эфедрин/кодеин/хлорфенир, гатифлоксацин, цетиризина гидрохлорид, мометазона фуроат, салметерола ксинафоат, бензонатат, цефалексин, пе/гидрокодон/хлорфенир, цетиризина гидрохлорид/псевдоэфедрин, фенилэфрин/кодеин/прометазин, кодеин/прометазин, цефпрозил, дексаметазон, гвайфенесин/псевдоэфедрин, хлорфенирамин/гидрокодон, недокромил-натрий, тербуталина сульфат, эпинефрин, метилпреднизолон, метапротеренола сульфат.
Неограничивающие примеры терапевтических агентов для COPD, с которыми можно комбинировать связывающие белки согласно изобретению, включают в себя следующие агенты: албутерола сульфат/ипратропий, ипратропия бромид, салметерол/флутиказон, албутерол, салметерола ксинафоат, флутиказона пропионат, преднизон, теофиллин безводный, метилпреднизолон-натрия сукцинат, монтелукаст-натрий, будезонид, формотерола фумарат, триамцинолона ацетонид, левофлоксацин, гвайфенесин, азитромицин, беклометазона дипропионат, левабутерола гидрохлорид, флунисолид, цефтриаксон-натрий, амоксициллина тригидрат, гатифлоксацин, зафирлукаст, амоксиллин/клавуланат, флунисолид/ментол, хлорфенирамин/гидрокодон, метапротеренола сульфат, метилпреднизолон, мометазона фуроат, п-эфедрин/кодеин/хлорфенир, пирбутерола ацетат, п-эфедрин/лоратадин, тетрабуталина сульфат, тиотропия бромид, (R,R)-формотерол, TgAAT, циломиласт, рофлумиласт.
Неограничивающие примеры терапевтических агентов для HCV, с которыми можно комбинировать связывающие белки согласно изобретению, включают в себя следующие агенты: интерферон-альфа-2a, интерферон-альфа-2b, интерферон-альфа con1, интерферон-альфа-n1, пэгилированный интерферон-альфа-2a, пэгилированный интерферон-альфа-2b, рибавирин, ПЭГ-интерферон-альфа-2b + рибавирин, урсодезоксихолевая кислота, глицирризиновая кислота, тималфасин, максамин, VX-497 и любые соединения, которые используются для лечения HCV посредством воздействия на следующие мишени: полимеразу HCV, протеазу HCV, геликазу HCV, IRES HCV (внутренний сайт связывания рибосом).
Неограничивающие примеры терапевтических агентов для идиопатического пневмофиброза (интерстициальной пневмонии), с которыми можно комбинировать связывающие белки согласно изобретению, включают в себя следующие агенты: преднизон, азатиоприн, албутерол, колхицин, албутерола сульфат, дигоксин, гамма-интерферон, метилпреднизолон-натрия сукцинат, лоразепам, фуросемид, лизиноприл, нитроглицерин, спиронолактон, циклофосфамид, ипратропия бромид, актиномицин d, алтеплаза, флутиказона пропионат, левофлоксацин, метапротеренола сульфат, морфина сульфат, оксикодона гидрохлорид, хлорид калия, триамцинолона ацетонид, такролимус безводный, кальций, интерферон-альфа, метотрексат, микофенолят-мофетил, интерферон-гамма-1β.
Неограничивающие примеры терапевтических агентов для инфаркта миокарда, с которыми можно комбинировать связывающие белки согласно изобретению, включают в себя следующие агенты: аспирин, нитроглицерин, метопролола тартрат, эноксапарин-натрий, гепарин-натрий, клопидогрела бисульфат, карведилол, атенолол, морфина сульфат, метропролола сукцинат, варфарин-натрий, лизиноприл, изосорбида мононитрат, дигоксин, фуросемид, симвастатин, рамиприл, тенектеплаза, энаприла малеат, торсемид, ретаваза, лозартан-калий, хинаприла гидрохлорид/маг карб, буметанид, алтеплаза, эналаприлат, амиодарона гидрохлорид, тирофибана гидрохлорида моногидрат, дилтиазема гидрохлорид, каптоприл, ирбесартан, валсартан, пропанолола гидрохлорид, фозиноприл-натрий, лидокаина гидрохлорид, эптифибатид, цефазолин-натрий, атропина сульфат, аминокапроновая кислота, спиронолактон, интерферон, соталола гидрохлорид, калия хлорид, докусат-натрий, добутамина гидрохлорид, алпразолам, правастатин-натрий, аторвастатин-кальций, мидазолама гидрохлорид, меперидина гидрохлорид, изосорбида динитрат, эпинефрин, допамина гидрохлорид, бивалирудин, розувастатин, эзетимиб/симвастатин, авасимиб, карипорид.
Неограничивающие примеры терапевтических агентов для псориаза, с которыми можно комбинировать связывающие белки согласно изобретению, включают в себя следующие агенты: ингибитор с малой молекулой KDR (ABT-123), ингибитор с малой молекулой Tie-2, кальципотриен, клобетазола пропионат, триамцинолона ацетонид, галобетазола пропионат, тазаротен, метотрексат, флуоцинонид, бетаметазона дипропионат стимулированный, флуцинолона ацетонид, ацитретин, шампунь-деготь, бетаметазона валерат, мометазона фуроат, кетоконазол, прамоксин/флуоцинолон, гидрокортизона валерат, флурандренолид, мочевина, бетаметазон, клобетазола пропионат/эмолл, флутиказона пропионат, азитромицин, гидрокортизон, увлажняющая смесь, фолиевая кислота, дезонид, пимекролимус, каменноугольный деготь, дифлоразона диацетат, этанерцепта фолат, молочная кислота, метокссален, hc/bismuth subgal/znox/resor, метилпреднизолона ацетат, преднизон, солнцезащитные средства, халцинонид, салициловая кислота, антралин, клокортолона пивалат, каменноугольный экстракт, каменноугольный деготь/салициловая кислота, каменноугольный деготь/салициловая кислота/сера, дезоксиметазон, диазепам, смягчающее средство, флуоцинонид/смягчающее средство, минеральное масло/касторовое масло/na lact, минеральное масло/арахисовое масло, вазелин/изопропилмиристат, псорален, салициловая кислота, мыло/трибромсалан, тимеросал/борная кислота, целекоксиб, инфликсимаб, циклоспорин, алефацепт, эфализумаб, такролимус, пимекролимус, PUVA, UVB, сульфасалазин.
Неограничивающие примеры терапевтических агентов для псориатического артрита, с которыми можно комбинировать связывающие белки согласно изобретению, включают в себя следующие агенты: метотрексат, этанерцепт, рофекоксиб, целекоксиб, фолиевая кислота, сульфасалазин, напроксен, лефлуномид, метилпреднизолона ацетат, индометацин, гидроксихлорохина сульфат, преднизон, сулиндак, бетаметазона дипропионат стимулированный, инфликсимаб, метотрексат, фолат, триамцинолона ацетонид, диклофенак, диметилсульфоксид, пироксикам, диклофенак-натрий, кетопрофен, мелоксикам, метилпреднизолон, набуметон, толметин-натрий, кальципотриен, циклоспорин, диклофенак-натрий/мизопростол, флуоцинонид, глюкозамина сульфат, тиомалат золота-натрия, гидрокодона битартрат/apap, ибупрофен, ризедронат-натрий, сульфадиазин, тиогуанин, валдекоксиб, алефацепт, эфализумаб.
Неограничивающие примеры терапевтических агентов для рестеноза, с которыми можно комбинировать связывающие белки согласно изобретению, включают в себя следующие агенты: сиролимус, паклитаксел, эверолимус, такролимус, ABT-578, ацетаминофен.
Неограничивающие примеры терапевтических агентов для ишиалгии, с которыми можно комбинировать связывающие белки согласно изобретению, включают в себя следующие агенты: гидрокодона битартрат/apap, рофекоксиб, циклобензаприна гидрохлорид, метилпреднизолон, напроксен, ибупрофен, оксикодона гидрохлорид/ацетаминофен, целекоксиб, валдекоксиб, метилпреднизолона ацетат, преднизон, кодеина фосфат/apap, трамадола гидрохлорид/ацетаминофен, метаксалон, мелоксикам, метокарбамол, лидокаина гидрохлорид, диклофенак-натрий, габапентин, дексаметазон, каризопродол, кеторолак-трометамин, индометацин, ацетаминофен, диазепам, набуметон, оксикодона гидрохлорид, тизанидина гидрохлорид, диклофенак-натрий/мизопростол, пропоксифена напсилат/apap, аза/оксикод/оксикодон тер, ибупрофен/гидрокодон бит, трамадола гидрохлорид, этодолак, пропоксифена гидрохлорид, амитриптилина гидрохлорид, каризопродол/кодеин фос/аза, морфина сульфат, мультвитамины, напроксен-натрий, орфенадрина цитрат, темазепам.
Предпочтительные примеры терапевтических агентов для SLE (волчанки), с которыми можно комбинировать белки согласно изобретению, включают в себя следующие агенты: NSAID, например, диклофенак, напроксен, ибупрофен, пироксикам, индометацин; ингибиторы COX2, например, целекоксиб, рофекоксиб, валдекоксиб; противомалярийные средства, например, гидроксихлорохин; стероиды, например, преднизон, преднизолон, буденозид, дексаметазон; цитотоксические агенты, например, азатиоприн, циклофосфамид, микофенолят-мофетил, метотрексат; ингибиторы PDE4 или ингибиторы синтеза пуринов, например, целлсепт. Связывающие белки согласно изобретению можно также комбинировать с такими агентами, как сульфасалазин, 5-аминосалициловая кислота, олсалазин, имуран, и агентами, которые препятствуют синтезу, продуцированию или действию провоспалительных цитокинов, таких как IL-1, например, ингибиторы каспаз, такие как ингибиторы IL-1β-превращающего фермента и IL-1ra. Связывающие белки согласно изобретению могут быть также использованы с ингибиторами передачи сигнала Т-клеток, например, ингибиторами тирозинкиназ; или молекулами, которые нацелены на молекулы активации Т-клеток, например, CTLA-4-IgG или анти-B7-семейство-антитела, анти-PD-1-семейство-антитела. Связывающие белки согласно изобретению можно комбинировать с IL-11 или анти-цитокин-антителами, например, фонотолизумабом (анти-IFNg-антителом), или противорецепторными антителами, например, анти-IL-6-рецептор-антителом и антителами к молекулам поверхности В-клеток. Антитела согласно изобретению или их антигенсвязывающие части могут быть также использованы с LJP 394 (абетимусом), агентами, которые истощают или инактивируют В-клетки, например, ритуксимабом (анти-CD20-антителом), лимфостатом-B (анти-BlyS-антителом), антагонистами TNF, например, анти-TNF-антителами, D2E7 (публикация PCT № WO 97/29131; HUMIRA), CA2 (REMICADE), CDP 571, конструкциями TNFR-Ig, (p75TNFRIgG (ENBREL) и p55TNFRIgG (LENERCEPT)).
Фармацевтические композиции согласно изобретению могут включать в себя "терапевтически эффективное количество" или "профилактически эффективное количества" связывающего белка согласно изобретению. "Терапевтически эффективное количество” означает количество, эффективное в дозах и в течение периодов времени, необходимых для достижения желаемого терапевтического результата. Терапевтически эффективное количество связывающего белка может быть определено специалистом в данной области и может варьироваться в соответствии с такими факторами, как состояние заболевания, возраст, пол и масса индивидуума, и способностью этого связывающего белка индуцировать желаемую реакцию у индивидуума. Терапевтически эффективным количеством является также количество, при котором любые токсичные или пагубные эффекты антитела или части антитела перевешиваются терапевтически полезными эффектами. "Профилактически эффективное количество" означает количество, эффективное при дозах и в течение периодов времени, необходимых для достижения желаемого профилактического результата. Обычно, поскольку профилактическую дозу используют для субъектов до или при ранней стадии заболевания, то это профилактически эффективное количество будет меньше, чем терапевтически эффективное количество.
Режимы дозирования могут быть приспособлены для обеспечения оптимальной желаемой реакции (например, терапевтической или профилактической реакции). Например, может быть введен единственный болюс, могут быть введены несколько разделенных доз на протяжении времени или эта доза может быть пропорционально уменьшена или увеличена, как диктуется необходимостью конкретной терапевтической ситуации. Особенно предпочтительно готовить парентеральные композиции в стандартной лекарственной форме для легкости введения и однородности дозы. Стандартной лекарственной формой называют здесь физически дискретные единицы, подходящие в качестве единичных доз для субъектов-млекопитающих, подлежащих лечению; каждая единица, содержащая заранее определенное количество активного соединения, рассчитана для получения желаемого терапевтического эффекта в ассоциации с требуемым фармацевтическим носителем. Спецификация в отношении стандартных лекарственных форм диктуется (a) уникальными характеристиками активного соединения и конкретным достигаемым терапевтическим или профилактическим эффектом, и (b) ограничениями, присущими типу компаундирования такого активного соединения для воздействия на чувствительность у индивидуумов, и зависит от указанных характеристик и ограничений.
Примерный, неограничивающий диапазон для терапевтически или профилактически эффективного количества связывающего белка согласно изобретению составляет 0,1-20 мг/кг, более предпочтительно 1-10 мг/кг. Следует отметить, что величины доз могут варьироваться в зависимости от типа и тяжести состояния, подлежащего облегчению. Кроме того, должно быть понятно, что для любого конкретного субъекта конкретные режимы дозирования должны корректироваться на протяжении времени в соответствии с индивидуальной потребностью и профессиональным суждением лица, осуществляющего введение или контролирующего введение этих композиций, и что установленные здесь диапазоны доз являются лишь примерными и не предназначены для ограничения объема или применения на практике заявленной композиции.
Квалифицированным в данной области специалистам будет вполне очевидно, что другие подходящие модификации и адаптации способов изобретения, описанных здесь, являются очевидными и могут быть произведены с использованием подходящих эквивалентов без отклонения от объема данного изобретения или описанных здесь вариантов осуществления. После подробного описания изобретения то же самое будет понятно со ссылкой на следующие примеры, которые включены только для целей иллюстрации и не предназначены для ограничения данного изобретения
Примеры
Пример 1: Генерирование имеющего двойные вариабельные домены иммуноглобулина (DVD-Ig)
Имеющую двойные вариабельные домены молекулу иммуноглобулина (DVD-Ig) конструируют таким образом, что два различных вариабельных домена легкой цепи (VL) из двух различных исходных mAb связывают в тандеме непосредственно или через короткий линкер способами рекомбинантных ДНК с последующим константным доменом легкой цепи. Аналогично, тяжелая цепь содержит два различных вариабельных домена тяжелой цепи (VH), связанных в тандеме, с последующим константным доменом CH1 и Fc-районом (фиг.1A).
Пример 1.1: Генерирование мышиных моноклональных антител к IL-1α и IL-1β
Моноклональные антитела к IL-1α и IL-1β генерировали следующим образом с использованием гибридомной технологии, хорошо известной в данной области.
Пример 1.1.A: Иммунизация мышей
Очищенный рекомбинантный IL-1α человека и IL-1β мыши (R&D Systems) использовали в качестве иммуногенов, а также антигенов покрытия в анализах титра и ELISA-скрининге. Иммунизирующие дозы находились в диапазоне 5,0-20,0 мкг/мышь/инъекция для всех антигенов как для первичных, так и для повторных иммунизаций (бустер-иммунизаций). Адъювант ImmunEasy приобретали у Qiagen (Waltham, MA) и использовали при отношении адъювант/антиген, составляющем 20 мл адъюванта ImmunEasy на 10,0 мкг антигена. Каждая группа животных, подлежащих иммунизации, содержала 5 мышей с нокаутом IL-1αβ, полученных от Dr. Yoichiro Iwakura (University of Tokyo, Minato-ku, Tokyo, Japan). Мышей иммунизировали в соответствии со схемой введения доз, описанной ниже. Клетки MRC-5 приобретали у АТСС (Manassas, VA) и использовали для биоанализа IL-1. Наборы ELISA IL-8 человека и контрольные мышиные анти-hIL-1α и -β-антитела (MAB200 и MAB201) приобретали у R&D Systems (Minneapolis, MN).
Кратко, смесь адъювант-антиген готовили сначала осторожным смешиванием адъюванта во флаконе с использованием вортекса. Желаемое количество адъюванта удаляли из флакона и помещали в автоклавированную микроцентрифужную пробирку на 1,5 мл. Антиген готовили в PBS или солевом растворе с концентрацией в диапазоне 0,5-1,0 мг/мл. Затем рассчитанное количество антигена добавляли в микроцентрифужную пробирку с адъювантом и раствор осторожно перемешивали пипеткой вверх и вниз 5 раз. Смесь адъювант-антиген инкубировали при комнатной температуре в течение 15 минут и затем смешивали опять осторожно пипеткой вверх и вниз 5 раз. Раствор адъювант-антиген извлекали подходящим шприцом для инъекции животному. Всего 5-20 мкг антигена инъецировали в объеме 50-100 мкл. Каждое животное иммунизировали и затем повторно иммунизировали 2-3 раза в зависимости от титра. Животные с хорошими титрами получали конечную внутривенную бустер-иммунизацию перед слиянием и генерированием гибридом.
Пример 1.1.B: Скрининг гибридом
Гибридомы, генерированные, как описано выше, подвергали скринингу и определяли титр антител с использованием ELISA:белковые антигены наносили непосредственно на планшеты ELISA для детектирования специфических антител с использованием стандартных методик ELISA. Кратко, планшеты ELISA покрывали 100 мкл либо rhIL-1α, либо rhIL-1β (1,0 мкг/мл в PBS) в течение ночи при 4°C. Планшеты промывали 3 раза 250 мкл PBS/0,5% Твин20 и блокировали 200 мкл блокирующего буфера (2% BSA в PBS с 0,5% Твин20). В каждую лунку добавляли разведенные сыворотки или супернатант гибридом (100 мкл) и инкубировали при комнатной температуре в течение 2 часов. Затем планшеты промывали 3 раза PBS/0,5% Твин20, для детектирования использовали HRP-козьи антитела против мышиного IgG и OD связывания наблюдали при 450 нм. Гибридомные клоны, продуцирующие антитела, которые обнаруживают высокоспецифическую связывающую активность в ELISA, субклонировали и очищали, и аффинность (Biacore) и эффективность (MRC-5-биоанализ) антител характеризовали следующим образом.
Пример 1.1.C: Характеристика мышиных моноклональных антител к IL-1α и IL-1β
Следующие анализы использовали для характеристики антител, продуцированных гибридомами, описанными в примере 1.1.B.
Пример 1.1.C.1: Резонанс поверхностного плазмона
Связывающие взаимодействия в режиме реального времени между захваченным антителом (мышиным анти-rmIL1-антителом, захваченным на биосенсорном матриксе посредством козьего антитела против мышиного IgG) и rmIL-1 измеряли с помощью резонанса поверхностного плазмона (SPR), используя систему BIAcore (Biacore AB, Uppsala, Sweden), в соответствии с инструкциями изготовителя и стандартными методиками. Кратко, rmIL-1 разводили в рабочем буфере HBS (Biacore AB) и аликвоты 50 мкл инъецировали через матриксы иммобилизованного белка при скорости тока 5 мл/мин. Используемые концентрации rhIL1 составляли 62,5, 125, 187,5, 250, 375, 500, 750, 1000, 1500 и 2000 нМ. Для определения константы диссоциации (скорости диссоциации), константы ассоциации (скорости ассоциации) использовали программу кинетической оценки BIAcore (версия 3.1).
Пример 1.1.C.2: Биоанализ анти-IL-1-антитела
Клеточная линия MRC-5 является линией фибробластных клеток человека, которая продуцирует IL-8 в ответ на IL-1α и IL-1β человека зависимым от дозы образом (см. Dinarello C. A., K. Muegge, and S.K. Durum. 2000. Current Protocols in Immunology 6:1). Клетки MRC-5 культивировали в среде МЕМ, дополненной 10% FBS, и выращивали при 37°C в термостате с 5% СО2. Для определения нейтрализующих активностей mAb против рекомбинантных IL-1α и IL-1β человека различные концентрации (0-10 мкг/мл) mAb (50 мкл) добавляли в 96-луночный планшет и предынкубировали с 50 мкл rhIL-1a или rhIL-1b (10-50 пг/мл) в течение 1 часа при 37°C. Супернатанты собирали, разводили и концентрации IL-8 измеряли при помощи ELISA с использованием стандартного набора ELISA для IL-8 (R&D Systems). Активность антитела определяли по его способности ингибировать продуцирование IL-8 клетками MRC-5.
На основе анализа Biacore и биоанализа MRC-5 идентифицировали ряд мышиных антител анти-hIL-1a и анти-hIL-1b с высокой аффинностью, как показано в таблице 1 ниже:
Пример 1.1.D: Клонирование и секвенирование мышиных моноклональных антител к IL-1α и IL-1β
Клонирование и секвенирование генов вариабельных доменов тяжелой цепи (VH) и легкой цепи (VL) всех анти-IL-1a/b-mAb, описанных в таблице 1, и дополнительных антител проводили после выделения и очистки общей РНК из каждой гибридомной клеточной линии с использованием реагента Тризола (Invitrogen) в соответствии с инструкциями изготовителя. Амплификацию как гена VH, так и гена VL проводили с использованием олигонуклеотидов IgGVH и IgκVL из набора праймеров мышиного Ig (Novagen, Madison, WI) с набором One-tube RT-PCR (Qiagen) в соответствии с рекомендацией изготовителя. ДНК-фрагменты, полученные из продуктивных амплификаций, клонировали в вектор pCR-TOPO (Invitrogen) в соответствии с инструкциями изготовителя. Затем множественные клоны VH и VL секвенировали по способу дидезокси-терминации цепи с использованием секвенатора ABI 3000 (Applied Biosystems, Foster City, CA). Последовательности генов VL и VH всех mAb показаны ниже в таблице 2.
Пример 1.2: Генерирование и характеристика химерных антител мышь-человек
Все описанные выше mAb превращали в химерные (с константной областью человека) и экспрессировали, очищали и характеризовали для подтверждения активности и использовали в качестве контролей для последующего анализа DVD-Ig. Для превращения 3D12.E3 в химерную форму 3D12.E3-VL амплифицировали при помощи ПЦР с использованием праймеров P1 и P2; между тем, ген Ck человека (в векторе pBOS, генерированном в лаборатории авторов при ABC) амплифицировали с использованием праймеров P3 и P4. Обе реакции ПЦР выполняли в соответствии со стандартными способами и методиками ПЦР. Два продукта ПЦР очищали из геля и использовали вместе в виде перекрывающейся матрицы для последующей перекрывающейся ПЦР-реакции с использованием праймеров P1 и P4 в стандартных условиях ПЦР. Конечный продукт ПЦР, химерную легкую цепь 3D12.E3-VL-hCk, субклонировали в экспрессирующий вектор млекопитающих pEF6 TOPO (Invitrogen) TOPO-клонированием в соответствии с инструкциями изготовителя. В таблице 3 показаны последовательности праймеров ПЦР:
Для превращения тяжелой цепи 3D12.E3 в химерную форму 3D12.E3-VH амплифицировали при помощи ПЦР с использованием праймеров P5 и P6; между тем, ген Cγ1 человека (в векторе pBOS, генерированном в лаборатории авторов при ABC) амплифицировали с использованием праймеров P7 и P8. Обе реакции ПЦР выполняли в соответствии со стандартными способами и методиками ПЦР. Два ПЦР-продукта очищали из геля и использовали вместе в виде перекрывающейся матрицы для последующей перекрывающейся ПЦР-реакции с использованием праймеров P5 и P8 в стандартных условиях ПЦР. Конечный продукт ПЦР, химерную легкую цепь 3D12.E3-VН-hCγ1, субклонировали в экспрессирующий вектор млекопитающих pсDNA3.1 TOPO (Invitrogen) в соответствии с инструкциями изготовителя. В таблице 4 показаны последовательности праймеров ПЦР:
Подобным образом, химерную форму 13F5.G5-VH-Cγ1 генерировали с использованием праймеров Р21/Р22 (для VH) и P7/P8 (для hCγ1) и клонировали в вектор pcDNA3.1 TOPO, а химерную форму 13F5.G5-VL-Cκ генерировали с использованием праймеров P23/P24 (для VL) и P3/P4 (для hCk) и клонировали в вектор pEF6 TOPO. В таблице 5 показаны последовательности праймеров ПЦР:
Для экспрессии химерных Ab 13F5.G5-VL-Cκ и 13F5.G5-VH-Сγ1 коэкспресировали в COS с использованием липофектамина (Invitrogen) в течение 72 часов, среду собирали и IgG очищали Белок А-хроматографией. Аналогичным образом, 13F5.G5-VL-Cκ и 13F5.G5-VH-Сγ1 коэкспрессировали в COS с использованием липофектамина (Invitrogen) в течение 72 часов, среду собирали и IgG очищали Белок А-хроматографией. Оба очищенных химерных Ab характеризовали с использованием Biacore и MRC-5-биоанализа для подтверждения активности. Результаты показали, что эти химерные Ab проявляли сходную аффинность и активность с аффинностью и активностью исходных мышиных mAb.
Пример 1.3: Конструирование, экспрессия и очистка имеющего двойные вариабельные домены IL-1α/β-иммуноглобулина (DVD-Ig)
Конструкция, используемая для генерирования DVD-Ig, способная связывать hIL-1α и hIL-1β, проиллюстрирована на фиг.1B. Кратко, исходные mAb, включающие в себя два высокоаффинных мышиных Ab, анти-hIL-1α (клон 3D12.E3) и анти-hIL-1β (клон 13F5.G5), получали иммунизацией мышей Balb/c рекомбинантным белком IL-1α (rhIL-1α) и рекомбинантным белком IL-1β (rhIL-1β), соответственно. Гены VL/VH этих двух гибридомных клонов выделяли при помощи ОТ-ПЦР с использованием набора праймеров для Ig мыши (Novagen, Madison, WI). Гены VL/VH сначала превращали в химерные антитела (с константными областями иммуноглобулина человека) для подтверждения активности и эффективности. Для генерирования DVD1-Ig VH и VL 13F5.G5 сливали непосредственно с N-концом VH и VL 3D12.E3, соответственно (как показано на фиг.1B). DVD2-Ig конструировали аналогичным образом, за тем исключением, что он имел линкер между двумя вариабельными доменами как в легкой цепи (линкерную последовательность ADAAP), так и в тяжелой цепи (линкерную последовательность AKTTPP). Эти последовательности выбирали из N-концов мышиных последовательностей Сk и CH1. Указанные линкерные последовательности, выбранные из N-концов мышиных последовательностей Ck и CH1, являются природным удлинением вариабельных доменов и обнаруживают гибкую конформацию без значительных вторичных структур на основе анализа нескольких кристаллических структур Fab. Подробные методики ПЦР-клонирования описаны ниже.
Пример 1.3.A: Молекулярное клонирование hIL-1a/b-DVD1-Ig
13F5.G5-VH амплифицировали при помощи ПЦР с использованием праймеров P21 и P25; между тем, 3D12.E3-VH-hСγ1 амплифицировали с использованием праймеров P14 и P8. Обе ПЦР-реакции выполняли в соответствии со стандартными способами и методиками ПЦР. Два продукта ПЦР очищали из геля и использовали вместе в виде перекрывающейся матрицы для последующей перекрывающейся реакции ПЦР с использованием праймеров P21 и P8 в стандартных условиях ПЦР. Конечный продукт ПЦР, тяжелую цепь DVD1-Ig hIL-1a/bDVD1-VH-hСγ1, субклонировали в экспрессирующий вектор млекопитающих pcDNA3.1 TOPO (Invitrogen) в соответствии с инструкциями изготовителя. В таблице 6 показаны последовательности праймеров ПЦР:
Для генерирования легкой цепи hIL-1a/bDVD1-Ig 13F5.G5-VL амплифицировали при помощи ПЦР с использованием праймеров P23 и P26; между тем, 3D12.E3-VH-hСκ амплифицировали с использованием праймеров P16 и P4. Обе ПЦР-реакции выполняли в соответствии со стандартными способами и методиками ПЦР. Два продукта ПЦР очищали из геля и использовали вместе в виде перекрывающейся матрицы для последующей перекрывающейся реакции ПЦР с использованием праймеров P23 и P4 в стандартных условиях ПЦР. Конечный продукт ПЦР, легкую цепь hIL-1a/bDVD1-Ig hIL-1a/bDVD1-VL-hСκ, субклонировали в экспрессирующий вектор млекопитающих pEF6 TOPO (Invitrogen) в соответствии с инструкциями изготовителя. В таблице 7 показаны последовательности праймеров ПЦР:
Пример 1.3.B: Молекулярное клонирование hIL-1a/b-DVD2-Ig
13F5.G5-VH амплифицировали при помощи ПЦР с использованием праймеров P21 и P17; между тем, 3D12.E3-VH-hСγ1 амплифицировали с использованием праймеров P18 и P8. Обе ПЦР-реакции выполняли в соответствии со стандартными способами и методиками ПЦР. Два продукта ПЦР очищали из геля и использовали вместе в виде перекрывающейся матрицы для последующей перекрывающейся реакции ПЦР с использованием праймеров P21 и P8 в стандартных условиях ПЦР. Конечный продукт ПЦР, тяжелую цепь DVD2-Ig hIL-1a/bDVD2-VH-hСγ1, субклонировали в экспрессирующий вектор млекопитающих pcDNA3.1 TOPO (Invitrogen) в соответствии с инструкциями изготовителя. В таблице 8 показаны последовательности праймеров ПЦР:
Для генерирования легкой цепи hIL-1a/bDVD2-Ig 13F5.G5-VL амплифицировали при помощи ПЦР с использованием праймеров P23 и P19; между тем, 3D12.E3-VH-hСκ амплифицировали с использованием праймеров P20 и P4. Обе ПЦР-реакции выполняли в соответствии со стандартными способами и методиками ПЦР. Два продукта ПЦР очищали из геля и использовали вместе в виде перекрывающейся матрицы для последующей перекрывающейся реакции ПЦР с использованием праймеров P23 и P4 в стандартных условиях ПЦР. Конечный продукт ПЦР, легкую цепь hIL-1a/bDVD2-Ig hIL-1a/bDVD2-VL-hСκ, субклонировали в экспрессирующий вектор млекопитающих pEF6 TOPO (Invitrogen) в соответствии с инструкциями изготовителя. В таблице 9 показаны последовательности праймеров ПЦР:
Конечные последовательности hIL-1a/bDVD1-Ig и hIL-1a/bDVD2-Ig описаны в таблице 10:
Пример 1.3.С: Экспрессия и очистка hIL-1a/bDVD1-Ig
Тяжелую и легкую цепь каждой конструкции субклонировали в векторы pcDNA3.1 TOPO и pEF6 TOPO (Invitrogen Inc.), соответственно, и секвенировали для гарантии точности. Плазмиды, кодирующие тяжелую и легкую цепи каждой конструкции, транзиторно экспрессировали с использованием реагентов липофектамина 2000 и 293-фектина, соответственно, в клетках COS, а также в клетках 293 эмбриональной почки человека (American Type Culture Collection, Manassas, VA). Среду культуры клеток собирали спустя 72 часа после транзиторной трансфекции и антитела очищали с использованием Белок А-хроматографии (Pierce, Rockford, IL) в соответствии с инструкциями изготовителя. Ab анализировали с помощью SDS-PAGE и определяли количественно с использованием A280 и BCA (Pierce, Rockford, IL). В таблице 11 показано, что уровни экспрессии hIL-1a/bDVD1-Ig и hIL-1a/bDVD2-Ig сравнимы с уровнями экспрессии химерных Ab, свидетельствуя, что DVD-Ig может эффективно экспрессироваться в клетках млекопитающих.
Пример 1.4: Масс-спектрометрия и SEC-анализ hIL-1a/b-DVD-Ig
Для измерения молекулярной массы (MW) легкой и тяжелой цепей DVD-Ig 10 мкл DVD-Ig (0,8 мкг/мкл) восстанавливали 1,0M раствором DTT (5 мкл). Колонку белка PLRP-S, 8 µ, 4000 A, и 1×150 мм (Michrom BioResource, Auburn, MA) использовали для разделения тяжелой и легкой цепей DVD-Ig. Agilent HP1100 Capillary HPLC (Agilent Technologies Inc., Pala Alto, CA) использовали с масс-спектрометром QSTAR (Applied Biosystems, Foster City, CA). Клапан valco устанавливали на 10 минут для выключения потока из отходов к МС для обессоливания пробы. Буфер А содержал 0,02% ТФУК, 0,08% FA, 0,1% ACN и 99,8% ВЭЖХ-H2O. Буфер В содержал 0,02% ТФУК, 0,08% FA, 0,1% ВЭЖХ-H2O и 99,8% ACN. Скорость тока ВЭЖХ составляла 50 мкл/мин, и инжекционный объем пробы составлял 8,0 мл. Температуру печи колонки устанавливали на 60°C, и градиент разделения представлял собой: 5% В в течение 5 минут; 5% B-65% B в течение 35 минут; 65% B-95% B в течение еще 5 минут и 95% B-5% B в течение 5 минут. Скан TOFMS был равен от 800 до 2500 аем, и циклы были равны 3600. Для определения MW полноразмерного DVD-Ig использовали картридж (патрон) Protein MicroTrap (Michrom BioResource, Auburn, MA) для обессоливания пробы. ВЭЖХ-градиент представлял собой: 5% B в течение 5 минут; 5% B-95% B в течение 1 минуты и 95% B-5% B остальные 4 минуты. Скан QSTAR TOFMS был от 2000 до 3500 аем, и циклы были равны 899. Все необработанные данные МС анализировали с использованием программного обеспечения Analyst QS (Applied Biosystems). Для SEC-анализа DVD-Ig, очищенный DVD-Ig и химерные Ab, в PBS, наносили на колонку Superose 6 10/300 G2, 300×10 мм (Amersham Bioscience, Piscataway, NJ). Для SEC использовали устройство ВЭЖХ, модель 10A (Shimadzu, Columbia, MD). Все белки определяли с использованием УФ-детектирования при 280 нм и 214 нм. Элюирование было изократическим при скорости тока 0,5 мл/мин. Для исследования стабильности пробы в диапазоне концентраций 0,2-0,4 мг/мл в PBS подвергали 3 циклам замораживания-оттаивания между -80°C и 25°C, или инкубировали при 4°C, 25°C или 40°C в течение 4 недель и 8 недель с последующим SEC-анализом.
DVD-Ig и химерные Ab очищали Белок А-хроматографией. Выход очистки (3-5 мг/л) соответствовал определению количества hIgG экспрессионной среды для каждого белка. Состав и чистоту очищенных DVD-Ig и химерных Ab анализировали с помощью SDS-PAGE как в не восстанавливающих, так и в восстанавливающих условиях. В не восстанавливающих условиях каждый из четырех белков мигрировал в виде единственной полосы. Белки DVD-Ig обнаруживали величину MW больше, чем химерные Ab, как и ожидалось. В не восстанавливающих условиях каждый из четырех белков давал две полосы, одну тяжелую цепь и одну легкую цепь. Вновь, тяжелые и легкие цепи DVD-Ig были больше по размеру, чем тяжелые и легкие цепи химерных Ab. SDS-PAGE показал, что каждый DVD-Ig экспрессируется в виде единой частицы, и тяжелые и легкие цепи эффективно спариваются с образованием IgG-подобной молекулы. Размеры тяжелых и легких цепей, а также полноразмерного белка двух молекул DVD-Ig соответствуют их рассчитанной молекулярной массе на основе аминокислотных последовательностей (см. таблицу 11).
Для определения точной молекулярной массы DVD-Ig использовали масс-спектрометрию. Как показано в таблице 1, экспериментально определенная молекулярная масса каждого DVD-Ig, включая легкую цепь, тяжелую цепь и полноразмерный белок, вполне соответствует предсказанной величине. Для дополнительного исследования физических свойств DVD-Ig в растворе использовали метод эксклюзионной (гель-проникающей) хроматографии размеров (SEC) для анализа каждого белка. Как химерные Ab, так и DVD2-Ig обнаруживали единственный пик, что указывает на физическую гомогенность в виде мономерных белков. Химерное Ab 3D12.E3 обнаруживало меньший физический размер, чем химерное Ab 13F5.G5, что указывало на то, что химерное Ab 3D12.E3 принимало более компактную, глобулярную форму. DVD1-Ig обнаруживал основной пик, а также пик в виде плеча справа, позволяя предполагать, что часть DVD1-Ig, возможно, находится в агрегированной форме в этих буферных условиях.
Пример 1.5: Анализ стабильности in vitro hIL-1a/bDVD-Ig
Физическую стабильность DVD-Ig испытывали следующим образом. Очищенные антитела в диапазоне концентраций 0,2-0,4 мг/мл в PBS подвергали 3 циклам замораживания-оттаивания между -80°C и 25°C, или инкубировали при 4°C, 25°C или 40°C в течение 4 недель и 8 недель с последующим анализом методом эксклюзионной хроматографии размеров (SEC) (см. таблицу 12).
Таблица 12
Анализ стабильности in vitro hIL-1a/bDVD-Ig при помощи SEC
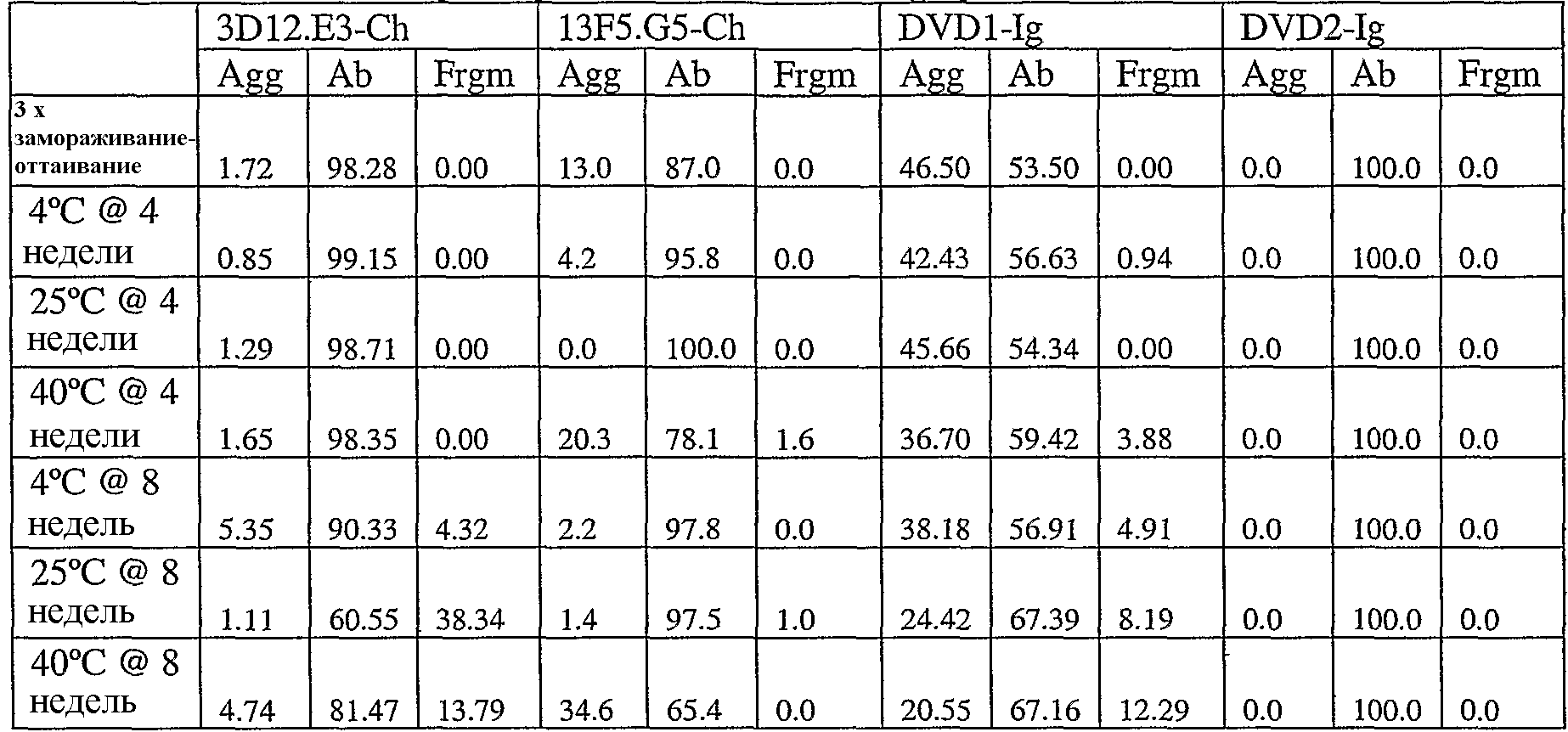
Степень агрегации и фрагментации показана в процентах, тогда как процент Ab представляет интактную молекулу
Agg: агрегаты
Ab: интактное антитело
Frgm: фрагменты
Оба химерных Ab показали минорные степени агрегации и фрагментации, обычные для нормальной молекулы IgG. DVD1-Ig обнаруживал некоторую агрегацию на SЕС после очистки. В анализе стабильности DVD1-Ig обнаруживал также агрегации в PBS в различных условиях; однако процент агрегированной формы DVD1-Ig не увеличивался во время продолжительного хранения или при более высоких температурах. Процентное содержание фрагментированной формы DVD1-Ig находилось в нормальном диапазоне, аналогичном диапазону химерного Ab 3D12.E3. В противоположность этому, DVD2-Ig демонстрировал исключительную стабильность. Ни агрегацию, ни фрагментацию не определяли для DVD2-Ig во всех испытанных условиях, и 100% DVD2-Ig сохранялось в виде интактной мономерной молекулы.
Пример 1.6: Определение антигенсвязывающей аффинности hIL-1a/bDVD-Ig
Кинетику связывания DVD-Ig с rhIL1-α и rhIL1-β определяли измерениями на основе резонанса поверхностного плазмона при помощи прибора Biacore 3000 (Biacore AB, Uppsala, Sweden) с использованием HBS-EP (10 мМ HEPES, pH 7,4, 150 мМ NaCl, 3 мМ ЭДТА и 0,005% поверхностно-активное вещество P20) при 25°C. Все химикаты получали от Biacore AB (Uppsala, Sweden) или, в противном случае, из другого источника, описанного здесь. Приблизительно 5000 RU козьего специфического поликлонального антитела против Fcγ-фрагмента IgG человека (Pierce Biotechnology Inc, Rockford, IL), разведенного в 10 мМ ацетате натрия (pH 4,5), иммобилизовали непосредственно на биосенсорном чипе категории «для исследований» CM5, используя стандартный набор для аминосвязывания, в соответствии с инструкциями и методиками изготовителя при 25 мг/мл. Не прореагировавшие частицы на поверхности биосенсора блокировали этаноламином. Поверхность модифицированного карбоксиметилдекстрана в проточной ячейке 2 и 4 использовали в качестве реакционной поверхности. Не модифицированный карбоксиметилдекстран без козьего антитела против IgG человека в проточной ячейке 1 и 3 использовали в качестве ссылочной (эталонной) поверхности. Для кинетического анализа уравнения скорости, полученные из модели связывания 1:1 Langmuir, подгоняли одновременно для фаз ассоциации и диссоциации всех десяти инжекций (с использованием глобального анализа подгонки) при помощи программного обеспечения Bioevaluation 4.0.1. Очищенные пробы DVD-Ig разводили в HEPES-забуференном солевом растворе для захвата через специфические для козьего антитела против Fc IgG человека реакционные поверхности и инжектировали на реакционные матриксы при скорости тока 5 мл/мин. Константы скоростей ассоциации и диссоциации, kon (M-1s-1) и koff (s-1), определяли при непрерывной скорости тока 25 мл/мин. Константы скорости получали выполнением кинетических измерений связывания при десяти различных концентрациях антигена в диапазоне 1,25-1000 нМ. Затем константу равновесной диссоциации (М) реакции между DVD-Ig и rhIL1α/β рассчитывали из констант кинетических скоростей по следующей формуле: KD=koff/kon. Аликвоты проб rhIL1α/β инжектировали также одновременно на контрольную ссылочную и реакционную СМ-поверхность для регистрации и вычитания любого фона неспецифического связывания с исключением большей части изменения показателя преломления и инжекционного шума (фона). Поверхности регенерировали двумя последующими инжекциями по 25 мл 10 мМ глицина (рН 1,5) при скорости тока 5 мл/мин. Поверхности иммобилизованного анти-Fc-антитела полностью регенерировались и сохраняли их полную захватывающую способность на протяжении двенадцати циклов. Видимую стехиометрию захваченного комплекса DVD-Ig-rhIL1α/β рассчитывали в условиях насыщающего связывания (равновесия стационарного состояния) с использованием следующей формулы:

Анализ Biacore показал химерные Ab, обладающие значениями кинетики и аффинности связывания с IL-1, аналогичными соответствующим значениям гибридомных mAb, указывая на то, что были выделены правильные последовательности VL/VH (таблица III). Общие параметры связывания этих двух DVD-Ig с hIL-1α были аналогичными, со значениями аффинности DVD-Ig, являющимися только в 2-3 раза меньшими, чем значение аффинности химерного Ab 3D12.E3. Аффинность связывания DVD2-Ig с hIL-1β была немного меньше, чем аффинность химерного Ab 13F5.G5, но в 3 раза более высокой, чем аффинность DVD1-Ig. Аффинность связывания этих двух DVD-Ig с hIL-1 по сравнению с аффинностью химерных Ab в отношении hIL-1 была аналогичной, как показано уравнением стехиометрии с IL-1. Оба химерных Ab, будучи бивалентными моноспецифическими, связывались с IL-1α и с IL-1β на Biocore со стехиометрией 1,6 и 1,7, соответственно. Это является обычным для IgG вследствие межмолекулярного препятствия при тесной иммобилизации антител на сенсорном чипе Biacore, приводящей к стехиометрии в диапазоне 1,5-2,0. Стехиометрия обоих DVD-Ig в отношении hIL-1α и hIL-1β была сходной со стехиометрией этих двух химерных Ab, указывая на то, что оба DVD-Ig обладали бивалентной способностью связывания с каждым антигеном.
Кроме того, четырехвалентное связывание DVD-Ig двух специфических антигенов анализировали также при помощи Biacore (таблица 14). DVD-Ig сначала захватывали через козье антитело против Fc человека на сенсорном чипе Biacore и первый антиген инжектировали и наблюдали сигнал связывания. Затем, когда DVD-Ig насыщался первым антигеном, инжектировали второй антиген и наблюдали второй сигнал. Это выполняли инжекцией сначала IL-1β и затем IL-1α или инжекцией сначала IL-1α и затем IL-1β для DVD2-Ig. В любой последовательности определяли двойную связывающую активность. Аналогичные результаты получали для DVD1-Ig. Таким образом, каждый DVD-Ig был способен связывать оба антигена одновременно в виде четырехвалентной молекулы с двойной специфичностью. Как показано в таблице IV, стехиометрия обоих DVD-Ig с первым антигеном, либо hIL-1α, либо hIL-1β, была большей, чем 1,5, подобно стехиометрии моноспецифического бивалентного связывания. После инжекции второго антигена, хотя DVD-Ig был уже занят первым антигеном, стехиометрия обоих DVD-Ig в отношении второго антигена (т.е. hIL-1α или hIL-1β) была 1,0-1,3. Таким образом, DVD-Ig способен связывать две молекулы IL-1α и две молекулы IL-1β. DVD-Ig сначала захватывали через козье антитело против Fc человека на сенсорном чипе Biacore и сначала инжектировали первый антиген и наблюдали сигнал связывания с последующей инжекцией второго антигена.
Пример 1.7: Определение функциональной гомогенности DVD-Ig
Поскольку DVD2-Ig очищали Белок А-хроматографией вместо мишень-специфической аффинной хроматографии, любые потенциальные ошибочно уложенные и/или ошибочно спаренные домены VL/VH, если они присутствуют, можно оценивать исследованиями связывания против этих 2 различных антигенов. Такой анализ связывания проводили эксклюзионной жидкостной хроматографией (SEC). DVD2-Ig, один или после 120-минутного инкубационного периода при 37°C с IL-1α, IL-1β или как с IL-1α, так и с IL-1β, в эквимолярном соотношении, наносили на колонку. Каждый из антигенов пропускали также отдельно в качестве контролей. Результаты SEC показали, что DVD2-Ig был способен связывать IL-1α и IL-1β в растворе, и такое связывание приводило к смещению сигнала SEC, указывающему на увеличение динамического размера DVD2-Ig, когда он находился в комплексе с любым антигеном. Это смещение сигнала DVD2-Ig было 100%, не частичным, позволяющим предположить, что все молекулы DVD2-Ig были способны связывать этот антиген. В присутствии как IL-1α, так и IL-1β, происходило дополнительное смещение сигнала DVD2-Ig, свидетельствуя о том, что все молекулы DVD2-Ig были способны связывать оба антигена однородным образом. Этот эксперимент продемонстрировал, что DVD-Ig экспрессировался в виде функционально гомогенного белка. Это имеет существенное значение, так как демонстрирует, что DVD-Ig может быть получен в виде гомогенной, отдельной функциональной частицы, которая отличается от всех ранее описанных биспецифических, мультиспецифических и мультивалентных иммуноглобулин-подобных и произведенных из иммуноглобулина молекул.
Пример 1.8: Определение биологической активности DVD-Ig
Биологическую активность DVD-Ig измеряли с использованием биоанализа MRC-5. Клеточная линия MRC-5 является линией фибробластных клеток человека, которая продуцирует IL-8 в ответ на IL-1α и IL-1β человека зависимым от дозы образом. Клетки MRC-5 получали из АТСС и культивировали в среде МЕМ, дополненной 10% FBS, при 37°C в термостате с 5% СО2. Для определения нейтрализующей активности DVD-Ig против IL-1α или IL-1β человека 50 мкл Ab (1Е7-1Е-12 М) в МEM/10%FBS добавляли в 96-луночный планшет и предынкубировали с 50 мкл hIL-1α или hIL-1β (200 пг/мл) в течение 1 часа при 37°C, 5% CO2. Затем клетки MRC-5 в концентрации 1E5/мл добавляли (100 мкл) во все лунки и планшеты инкубировали в течение ночи при 37°C в термостате с 5% СО2. Супернатанты собирали и продуцирование IL-8 человека измеряли при помощи стандартного ELISA (R&D Systems, Minneapolis, MN). Нейтрализующую активность DVD-Ig определяли по его способности ингибировать продуцирование IL-8.
Как показано в таблице 13, оба DVD-Ig были способны нейтрализовать hIL-1α и hIL-1β. В соответствии со связывающей аффинностью с hIL-1α нейтрализующие активности DVD1-Ig и DVD2-Ig против hIL-1α были также сходными, т.е. в 3 раза меньшими, чем нейтрализующие активности химерных Ab (см. таблицу 3). В соответствии со связывающей аффинностью в отношении hIL-1β нейтрализующая активность DVD2-Ig против hIL-1β была немного меньше, чем нейтрализующая активность химерного Ab 13F5.G5, но в 3 раза более высокой, чем нейтрализующая активность DVD1-Ig. В целом, не было значимого уменьшения биологических активностей молекул DVD-Ig по сравнению с исходными mAb.
Для определения, способен ли DVD-Ig ингибировать продуцирование IL-8 в присутствии как IL-1α, так и IL-1β, равные количества hIL-1α и hIL-1β добавляли в ту же самую систему культуры анализа MRC-5. Как DVD1-Ig, так и DVD2-Ig были способны ингибировать синтез IL-8 клетками MRC-5 в присутствии как IL-1α, так и IL-1β, с активностями, сходными с активностями моноанализов, где присутствовал только один цитокин (таблица 13). В этом анализе, где присутствовали как IL-1α, так и IL-1β, двойная ингибирующая активность DVD2-Ig (1,2 нМ) была более высокой, чем ингибирующая активность DVD1-Ig (2,2 нМ).
Пример 2: Анализ размера линкера и ориентации вариабельного домена в молекуле DVD-Ig
Конструировали дополнительные молекулы DVD-Ig с различными исходными парами mAb, как показано в таблице 15. Для каждой пары mAb генерировали четыре различные конструкции DVD-Ig: 2 с коротким линкером и 2 с длинным линкером, каждая в двух разных ориентациях доменов: a-b-C (альфа-бета-константный домен) и b-a-C (бета-альфа-константный домен). Линкерные последовательности производили из N-концевой последовательности Сk или СН1-домена, следующим образом:
Короткий линкер: легкая цепь: TVAAP; тяжелая цепь: ASTKGP;
Длинный линкер: легкая цепь: TVAAPSVFIFPP; тяжелая цепь: ASTKGPSVFPLAP.
Все конструкции тяжелых и легких цепей субклонировали в экспрессирующий вектор pBOS и экспрессировали в клетках COS или клетках 293 дикого типа.
Для конструирования новых клонов DVD вариабельные домены двух mAb, как легкой цепи, так и тяжелой цепи, сначала сочленяли в тандеме с использованием перекрывающейся ПЦР, как описано для hIL-1abDVD1-Ig и hIL-1abDVD2-Ig. Затем эти сочлененные куски субклонировали в векторе pBOS с использованием гомологичной рекомбинации. Кратко, векторы линеаризовали рестрикционным расщеплением (2 мкг вектора pBOS-hCk расщепляли рестриктазами FspAI и BsiWI в O+ буфере и 2 мкг вектора pBOS-hCγ z, non a расщепляли FspAI и SaII в O+ буфере). Расщепленные пробы подвергали электрофорезу на 1% агарозном геле и каркасный фрагмент очищали в 50 мкл воды. Для гомологичной рекомбинации и трансформации компетентные клетки DH5α оттаивали на льду и смешивали с 20-50 нг сочлененного продукта ПЦР и 20-50 нг линеаризованного вектора (в каждые 50 мкл клеток DH5α). Смесь осторожно смешивали и инкубировали на льду в течение 45 минут с последующим тепловым шоком при 42°C в течение 1 минуты. Затем добавляли 100 мкл среды SOC и инкубировали при 37°C в течение 1 часа. Культуру для трансформации инокулировали на чашках LB/агар, содержащих ампициллин, и инкубировали при 37°C в течение 18-20 часов. Выделяли бактериальные клоны, из которых очищали ДНК и подвергали ее анализу секвенирования. Окончательные клоны с подтвержденной последовательностью котрансфицировали (спариванием HV и LC одной и той же пары Ab) в клетках COS или 293 для экспрессии и очистки Ab, как описано ранее.
Характеристики очищенных белков DVD-Ig суммированы в таблице 16. Левая часть таблицы 16 показывает специфичность, аффинность связывания и нейтрализующую активность 2 пар mAb, используемых для конструирования новых молекул hIL-1a/bDVD-Ig. Антитела 18F4.2C8 и 1B12.4H4 (см. пример 1.1.D) использовали для конструирования hIL-1a/bDVD3a-Ig, hIL-1a/bDVD4a-Ig, hIL-1a/bDVD3b-Ig и hIL-1a/bDVD4b-Ig. hIL-1a/bDVD3a-Ig и hIL-1a/bDVD4a-Ig были в ориентации a-b-C, с коротким линкером и длинным линкером, соответственно. hIL-1a/bDVD3b-Ig и hIL-1a/bDVD4b-Ig были в ориентации b-a-C, с коротким и длинным линкером, соответственно. Антитела 6H3.1A4 и 6B12.4F6 использовали для конструирования hIL-1a/bDVD5a-Ig, hIL-1a/bDVD6a-Ig, hIL-1a/bDVD5b-Ig и hIL-1a/bDVD6b-Ig. hIL-1a/bDVD5a-Ig и hIL-1a/bDVD6a-Ig были в ориентации a-b-C, с коротким и длинным линкером, соответственно. hIL-1a/bDVD5b-Ig и hIL-1a/bDVD6b-Ig были в ориентации b-a-C, с коротким и длинным линкером, соответственно. Молекулярное клонирование этих дополнительных hIL-1a/bDVD-Ig выполняли при помощи методики, ранее описанной для hIL-1a/bDVD1-Ig (см. пример 1.3), с использованием перекрывающихся ПЦР-методик. Аминокислотные последовательности этих дополнительных hIL-1a/bDVD-Ig представлены в таблице 15.
Характеристики новых конструкций DVD суммированы в таблице 16. Аффинность (Kd) и биологическую активность (IC50) определяли при помощи Biacore и MRC-5-биоанализа, соответственно. Анализ SDS-PAGE всех новых DVD-белков показал нормальные картины миграции как в восстанавливающих, так и в не восстанавливающих условиях, подобно нормальному антителу и DVD1/2-Ig.
Таблица 16
Характеристика новых молекул DVD-Ig, произведенных из новых пар mAb
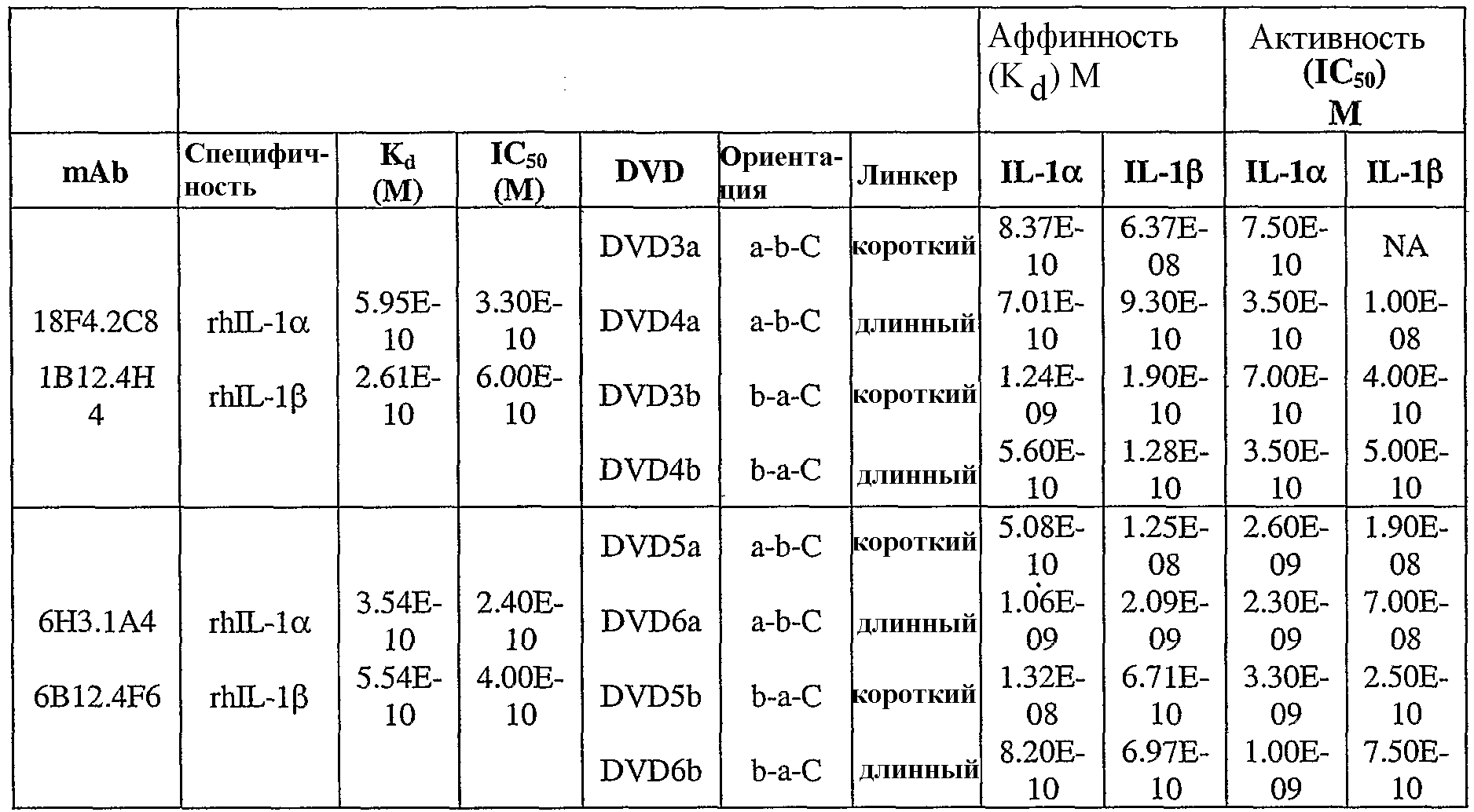
NA: нейтрализующую активность не определяли.
Функциональная характеристика новых молекул DVD выявила, что с любой ориентацией DVD с длинным линкером функционировали лучше, чем DVD с коротким линкером, в отношении связывания и нейтрализации обоих антигенов. Что касается DVD с длинными линкерами, то DVD с ориентацией b-a-C демонстрировали хорошее связывание с обоими антигенами и хорошую нейтрализацию обоих антигенов, в то время как DVD с ориентацией a-b-C демонстрировали хорошие связывание и нейтрализацию IL-1α и уменьшенные связывание и нейтрализацию IL-1β (например, DVD4b против DVD4а). Молекула DVD-Ig, DVD4b, связывала и нейтрализовала как IL-1α, так и IL-1β с суб-нМ и полностью сохраняла характеристики связывания и нейтрализации исходных mAb.
Пример 3: Генерирование DVD-Ig, способного связывать IL-12 и IL-18
Молекулы DVD-Ig, способные связывать IL-12 и IL-18, конструировали, как описано выше, с использованием двух исходных mAb, одного против IL-12p40 человека (АВТ874) и другого против IL-18 человека (АВТ325). Генерировали четыре различных конструкции анти-IL-12/18-DVD-Ig: 2 с коротким линкером и 2 с длинным линкером, каждая в двух разных ориентациях доменов: 12-18-С и 18-12-С (таблица VI). Линкерные последовательности, произведенные из N-концевой последовательности домена человека Cλ/Сκ или CH1, были следующими:
Для конструкций DVD1218 (ABT874 имеет Vλ):
легкая цепь (λ): короткий линкер: QPKAAP; длинный линкер: QPKAAPSVTLFPP
тяжелая цепь (γ1): короткий линкер: ASTKGP; длинный линкер: ASTKGPSVFPLAP
Для конструкций DVD1812 (ABT325 имеет Vκ):
легкая цепь (κ): короткий линкер: TVAAP; длинный линкер: TVAAPSVFIFPP
тяжелая цепь (γ1): короткий линкер: ASTKGP; длинный линкер: ASTKGPSVFPLAP.
Все конструкции тяжелых и легких цепей субклонировали в экспрессирующий вектор pBOS и экспрессировали в клетках COS или в клетках 293 дикого типа с последующей очисткой Белок-А-хроматографией. Очищенные материалы подвергали SDS-PAGE, и их профили были сходными с профилями DVD2-Ig.
В таблице 17 ниже описаны конструкции тяжелых цепей и легких цепей, использованные для экспрессии каждого белка анти-IL12/IL18-DVD-Ig.
Пример 3.1.1: Молекулярное клонирование конструкций ДНК для DVD1218SL and DVD1218LL
Для генерирования конструкций тяжелой цепи DVD1218HC-LL и DVD1218HC-SL VH-домен ABT-874 ПЦР-амплифицировали с использованием праймеров: Праймер 1 и Праймер 2L или Праймер 2S, соответственно; между тем, VH-домен ABT-325 амплифицировали с использованием праймеров: Праймер 3L или Праймер 3S и Праймер 4, соответственно. Обе ПЦР-реакции выполняли в соответствии со стандартными способами и методиками ПЦР. Два продукта ПЦР очищали из геля и использовали вместе в качестве перекрывающейся матрицы для последующей перекрывающейся ПЦР-реакции с использованием Праймера 1 и Праймера 4 в стандартных условиях ПЦР. Продукты перекрывающейся ПЦР субклонировали в дважды расщепленный Srf I и Sal I экспрессирующий вектор млекопитающих pBOS-hCγ1,z non-a (Abbott) с использованием стандартного подхода гомологичной рекомбинации.
Для генерирования конструкций легкой цепи DVD1218LC-LL и DVD1218LC-SL VL-домен ABT-874 ПЦР-амплифицировали с использованием праймеров: Праймер 5 и Праймер 6L или Праймер 6S, соответственно; между тем, VL-домен ABT-325 амплифицировали с использованием праймеров: Праймер 7L или Праймер 7S и Праймер 8, соответственно. Обе ПЦР-реакции выполняли в соответствии со стандартными способами и методиками ПЦР. Два продукта ПЦР очищали из геля и использовали вместе в качестве перекрывающейся матрицы для последующей перекрывающейся ПЦР-реакции с использованием Праймера 5 и Праймера 8 в стандартных условиях ПЦР. Эти продукты перекрывающейся ПЦР субклонировали в дважды расщепленный Srf I и NotI экспрессирующий вектор млекопитающих pBOS-hCk (Abbott) с использованием стандартного подхода гомологичной рекомбинации. Праймеры, использованные для таких конструкций, приведены в таблице 18 ниже:
Таблица 18

Подобный подход использовали для генерирования DVD1812SL и DVD1812LL, как описано ниже.
Пример 3.1.2: Молекулярное клонирование конструкций ДНК для DVD1812SL и DVD1812LL
Для генерирования конструкций тяжелой цепи DVD1812HC-LL и DVD1812HC-SL VH-домен ABT-325 ПЦР-амплифицировали с использованием праймеров: Праймер 1 и Праймер 9L или Праймер 9S, соответственно; между тем, VH-домен ABT-874 амплифицировали с использованием праймеров: Праймер 10L или Праймер 10S и Праймер 4, соответственно. Обе ПЦР-реакции выполняли в соответствии со стандартными способами и методиками ПЦР. Два продукта ПЦР очищали из геля и использовали вместе в качестве перекрывающейся матрицы для последующей перекрывающейся ПЦР-реакции с использованием Праймера 1 и Праймера 4 в стандартных условиях ПЦР. Эти продукты перекрывающейся ПЦР субклонировали в дважды расщепленный Srf I и Sal I экспрессирующий вектор млекопитающих pBOS-hCγ1,z non-a (Abbott) с использованием стандартного подхода гомологичной рекомбинации. Последовательности праймеров приведены ниже.
Для генерирования конструкций легкой цепи DVD1812LC-LL и DVD1812LC-SL VL-домен ABT-325 ПЦР-амплифицировали с использованием праймеров: Праймер 11 и Праймер 12L или Праймер 12S, соответственно; между тем, VL-домен ABT-874 амплифицировали с использованием праймеров: Праймер 13L или Праймер 13S и Праймер 14, соответственно. Обе ПЦР-реакции выполняли в соответствии со стандартными способами и методиками ПЦР. Два продукта ПЦР очищали из геля и использовали вместе в качестве перекрывающейся матрицы для последующей перекрывающейся ПЦР-реакции с использованием Праймера 11 и Праймера 14 в стандартных условиях ПЦР. Эти продукты перекрывающейся ПЦР субклонировали в дважды расщепленный Srf I и NotI экспрессирующий вектор млекопитающих pBOS-hCk (Abbott) с использованием стандартного подхода гомологичной рекомбинации. Праймеры, использованные для этих конструкций, приведены в таблице 19 ниже:
Таблица 19


Окончательные ДНК-последовательности для восьми конструкций тяжелых и легких цепей анти-IL12/IL18-DVD-Ig показаны в таблице 20:
Пример 3.2.: Определение антигенсвязывающей аффинности IL-12/IL-18-DVD-Ig
Связывающую аффинность анти-IL-12/18-DVD-Ig в отношении hIL-12 и hIL-18 определяли при помощи Biacore (таблица 21). Нейтрализующую активность против IL-18 определяли при помощи KG-1-анализа (Konishi, K., et al.). Кратко, пробы IL-18 (в конечной концентрации 2 нг/мл) предынкубировали с DVD-Ig (в конечных концентрациях 0-10 мг/мл) при 37°C в течение 1 часа, а затем добавляли к клеткам KG-1 (3×106/мл) в среде RPMI, содержащей 10 нг/мл hTNF, с последующей инкубацией при 37°C в течение 16-20 часов. Культуральные супернатанты собирали и продуцирование IFN-γ человека в каждой пробе определяли при помощи ELISA (R&D Systems). Активности ингибирования молекул DVD против IL-18, представленные величинами IC50, показаны в таблице VI. Для определения активностей ингибирования молекул анти-IL-12/18-DVD против IL-12 использовали анализ IL-12-индуцированного продуцирования IFN-γ из активированных PHA бластных клеток (D'Andrea, A et al.) Для продуцирования IFN-γ человека PHA-бластные клетки инкубировали в течение 18 часов с IL-12 человека. Субмаксимальную стимуляцию (55-75% максимума) получали с концентрацией IL-12 человека 200 пг/мл. Супернатанты анализировали на IFN-γ при помощи специфического для IFN-γ человека ELISA (Endogen, Cambridge, MA). Нейтрализующие IL-12 DVD препятствуют индуцированному IL-12 продуцированию IFN-γ. Нейтрализующую активность DVD определяли измерением концентрации DVD, требуемой для ингибирования 50% продуцирования IFN-γ РНА-бластными клетками человека, как показано в таблице 21.
Таблица 21
Характеристика молекул анти-IL-18/IL-12-DVD-Ig
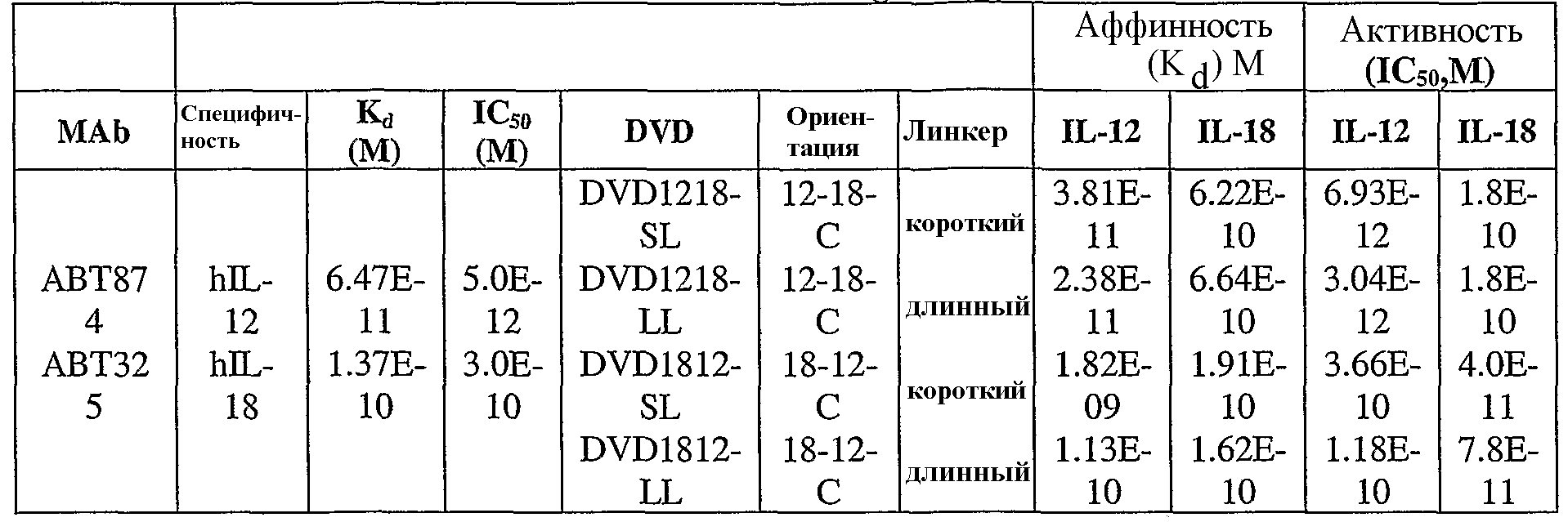
Аффинность (KD) определяли при помощи Biacore, а активность (IC50) определяли при помощи KG-1-биоанализа (IL-18) и PBMC-анализа (IL-12).
В таблице 21 показаны специфичность, аффинность связывания и нейтрализующая активность 2 полноразмерных mAb человека, использованных для конструирования молекул анти-IL-12/IL-18-DVD. Как показано в таблице 4, эти mAb обладают высокой аффинностью и высокой нейтрализующей активностью. Суммирование характеристики конструкций анти-IL-18/IL-12-DVD показано в таблице VI. Анализ SDS-PAGE всех новых DVD-белков показал нормальные картины миграции как в восстанавливающих, так и в не восстанавливающих условиях, сходные с обычным антителом и DVD1/2-Ig. SEC-анализ показал, что все молекулы были нормальными, обнаруживающими пики в области 200 кД. Данные связывания Biacore согласуются с нейтрализующей активностью в этих биологических анализах.
Пример 3.3: Биологическая активность анти-IL-12/IL-18 DVD-Ig in vivo
Как IL-12, так и IL-18 необходимы для продуцирования оптимального IFN-γ в ответ на различные стимулы. Биологическую активность анти-IL-12/IL-18-DVD-Ig in vivo определяли с использованием модели huPBMC-SCID мыши. Для этой модели анти-IL-12-антитело (ABT-874), анти-IL-18-антитело (ABT-325) или анти-IL-12/анти-IL-18-DVD-Ig инъецировали i.p. или i.v. (250 мг/мышь каждого) с последующим переносом свежеочищенных PBMC человека (huPBMC) i.p. мышам SCID. Спустя пятнадцать минут мышей стимулировали высушенными клетками Staphylococcus aureus (SAC) для индукции продуцирования IFNγ человека. Животных (n=7-8/группа) умерщвляли спустя 18-20 часов и сывороточные уровни huIFNγ определяли методом ELISA. ABT 874 и ABT-325 ингибировали SAC-индуцированный IFNγ приблизительно на 70%, что представляет максимальное ингибирование IFNγ каждым соединением для этой модели. Однако обработка мышей ABT-874 + ABT-325 и анти-IL-12/анти-IL-18-DVD-Ig ингибировала продуцирование IFNγ почти на 100%. Эти результаты предполагают, что молекула анти-IL-12/анти-IL-18-DVD-Ig является функционально активной in vivo.
Пример 3.4 Фармакокинетические и фармакодинамические исследования анти-IL-12/IL-18-DVD-Ig
Общий фармакокинетический и фармакодинамический профиль анти-IL-12/IL-18 DVD-Ig был аналогичен профилю исходных mAb у мышей, т.e. имела место 73% биодоступность, сравнимая с обычным IgG. Подобную фармакокинетику, т.е. быстрый клиренс после дня 6-8, наблюдали для других mAb (например, человека, крысы и т.д.), возможно, вследствие реакции анти-IgG человека.
Самцам крыс SD вводили дозы анти-IL-12/IL-18-DVD-Ig, составляющие 4 мг/кг, либо i.v., либо s.c. Ранняя часть этих PK-кривых выглядела нормальной и очень похожей на эту часть РК-кривых других антител человека. Точный период полужизни в обеих группах не мог быть определен вследствие быстрого клиренса DVD-Ig, начиная с дня 6. Неожиданное падение концентрации DVD-Ig после для 6 могло быть вызвано реакцией RAHA. Однако аналогичный профиль наблюдали также для одного из исходных антител (АВТ-874), использованного для конструирования этого DVD-Ig в этом конкретном эксперименте, а также других моноспецифических антител человека, исследованных ранее. На основе концентрации DVD-Ig до дня 6 определяли биодоступность DVD-Ig в обеих группах s.c. и i.v. Две из трех крыс обнаружили 80-95% биодоступность, и средняя биодоступность у этих трех крыс составляла 73%.
Пример 3.5: Физическая/химическая характеристика анти-IL-12/anti-IL-18-DVD-Ig
Результаты физической и химической характеристики полученного из клеток 293, очищенного Белок А-хроматографией анти-IL-12/анти-IL-18-DVD-Ig суммированы в таблице 22.
Пример 3.6: Генерирование дополнительного анти-12/анти-18-DVD-Ig (1D4.1-ABT325)
Конструировали дополнительную молекулу анти-IL-12/IL-18-DVD-Ig с отличающимся исходным анти-IL-12-mAb (клоном № 1D4.1), как показано в таблице 23. Конструкцию 1D4.1-ABT325-DVD-Ig генерировали с коротким линкером, произведенным из N-концевой последовательности домена Сk и СН1 человека, следующим образом:
Короткий линкер: легкая цепь: TVAAP; тяжелая цепь: ASTKGP.
Все конструкции тяжелой и легкой цепи субклонировали в экспрессирующий вектор pBOS, экспрессировали в клетках COS или клетках 293 дикого типа и характеризовали, как описано выше. 1D4.1-ABT325-DVD-Ig полностью сохраняет активности двух исходных mAb (таблица 24).
Пример 4: Генерирование анти-CD20/анти-CD3-DVD-Ig
Анти-CD20/анти-CD3-DVD-Ig генерировали с использованием мышиных анти-CD20 человека (клон 5F1) и анти-CD3 человека (клон OKT3) исходных антител. Исходные конструкции включали в себя 2 DVD-Ig с различными ориентациями доменов. Анти-CD3/анти-CD20-DVD-Ig конструировали в последовательности VCD3-линкер-VCD20-константный домен, а анти-CD20/анти-CD3-DVD-Ig конструировали в последовательности VCD20-линкер-VCD3-константный домен. Однако в предварительном исследовании связывания клеточной поверхности анти-CD20-связывающая активность уменьшалась в молекуле анти-CD3/анти-CD20-DVD-Ig, даже хотя анти-CD3-активность сохранялась в этой структуре. В противоположность этому, как анти-CD3-, так и анти-CD20-связывающие активности были полностью сохранены в молекуле анти-CD20/анти-CD3-DVD-Ig, указывая на то, что в этом случае имела место оптимальная ориентация доменов для комбинации этих двух mAb/мишеней в формате DVD-Ig. Таким образом, конструкция анти-CD20/анти-CD3-DVD-Ig была выбрана для последующих исследований.
Анти-CD20/анти-CD3-DVD-Ig генерировали в виде химерного Ig, т.е. константной областью была константная область человека. Для анализа связывания линию Jurkat Т-клеток человека и линию Raji В-клеток блокировали IgG человека и затем окрашивали мышиным анти-hCD3-mAb ОКТ3, мышиным анти-hCD20-mAb 1F5 и анти-CD20/анти-CD3-DVD-Ig. Затем клетки промывали и окрашивали FITC-меченным козьим антителом против мышиного IgG (не имеющим перекрестной реактивности с анти-hIgG). Анти-CD20/анти-CD3-DVD-Ig связывал как Т-клетки, так и В-клетки, тогда как CD3- и CD20-mAb связывали только Т-клетки или В-клетки, соответственно. Аминокислотная последовательность CD20/CD3-DVD-Ig описана в таблице 25.
Пример 5: Генерирование mIL-1α/β-DVD-Ig
Для исследования ключевых проблем, касающихся фармакокинетики, эффективности in vivo, проникновения в ткань и иммуногенности молекул DVD-Ig, мышиные молекулы DVD-Ig против мышиного IL-1α/β конструировали, как описано ниже.
Пример 5.1: Конструирование mIL-1α/β-DVD-Ig
Мышиные молекулы DVD-Ig против IL-1α/β мыши конструировали с использованием двух мышиных mAb против IL-1α/β мыши (9H10 и 10G11), генерированных от мышей с двойным КО (нокаутом) IL-1α/β. Мышиные моноклональные антитела, против мышиного IL-1α и против мышиного IL-1β, генерировали иммунизацией мышей с двойным КО (нокаутом) IL-1α/β мышиным IL-1α или мышиным IL-1β, соответственно. Одно мышиное mAb против мышиного IL-1α (клон 9Н10) и одно мышиное mAb против мышиного IL-1β (клон 10G11) отбирали и использовали для генерирования молекул mIL-1α/β-DVD-Ig. Испытывали разные размеры линкера и разные ориентации доменов. Окончательные функциональные молекулы mIL-1α/β-DVD-Ig конструировали в ориентации V(анти-mIL-1β)-линкер-V(анти-mIL-1β)-мышиный константный домен (Cγ2а и Cκ). Методики клонирования, экспрессии и очистки были аналогичны методикам для hIL-1α/β-DVD-Ig. Клонирование mIL-1α/β-DVD-Ig проводили с использованием сходной перекрывающейся ПЦР и гомологичной рекомбинации, как описано для hIL-1α/β-DVD3-Ig. Последовательности mIL-1α/β-DVD-Ig показаны ниже в таблице 26:
Мышиный mIL-1α/β-DVD-Ig сохранял аффинность/активность in vitro против как IL-1α, так и IL-1β. В таблице 27 показана характеристика mAb 9Н10 (анти-mIL-1α), 10G11 (анти-mIL-1β) и mIL-1α/β-DVD-Ig.
Пример 5.2: In vivo активность mIL-1α/β-DVD-Ig на модели артрита
Терапевтические эффекты анти-IL-1альфа, анти-IL-1бета, комбинированных анти-IL-1-альфа/анти-IL-1бета и мышиного анти-IL-1альфа/бета-DVD4-Ig оценивали на мышиной модели индуцированного коллагеном артрита, хорошо известной в данной области. Кратко, самцов мышей DBA-1 иммунизировали бычьим коллагеном типа II в CFA введением в основание хвоста. Мышей повторно иммунизировали Зимозаном внутрибрюшинно (i.p) в день 21. После возникновения заболевания в день 24-27 мышей отбирали и делили на отдельные группы по 10 мышей каждая. Среднюю оценку артрита контрольной группы и групп с антителами против цитокинов сравнивали в начале обработки. Для нейтрализации IL-1 мышей инъецировали каждый второй день 1-3 мг/кг анти-IL-1альфа-mAb, анти-IL-1бета-mAb, комбинацией анти-IL-1-альфа/анти-IL-1бета-mAb или мышиным анти-IL-1альфа/бета-DVD4-Ig внутрибрюшинно. Мышей осторожно обследовали три раза в неделю визуально на внешние признаки артрита в периферических суставах и определяли оценки активности заболевания.
Блокада IL-1 в терапевтическом режиме эффективно уменьшала тяжесть артрита, причем анти-IL-1бета-антитело обнаруживало более высокую эффективность (24% уменьшение средней оценки артрита по сравнению с контрольной группой), чем анти-IL-1-альфа-антитело (10% уменьшение). Дополнительный эффект наблюдали между анти-IL-1-альфа и анти-IL-1бета, с 40% уменьшением в средней оценке артрита у мышей, обработанных как анти-IL-1альфа, так и анти-IL-1бета-mAb. Неожиданно, при том же самом уровне дозы обработка mDVD-Ig обеспечивала 47% уменьшение средней оценки артрита, демонстрируя терапевтическую эффективность in vivo mDVD-Ig. Подобную эффективность авторы изобретения наблюдали также в измерениях опухания суставов на этой модели животного.
Данное изобретение включает путем ссылки в их полном объеме способы, хорошо известные в области молекулярной биологии и доставки лекарственного средства. Эти способы включают в себя, но не ограничиваются ими, способы, описанные в следующих публикациях:
Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, NY (1993);
Ausubel, F.M. et al. eds., Short Protocols In Molecular Biology (4th Ed. 1999) John Wiley & Sons, NY. (ISBN 0-471-32938-X).
Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984);
Giege, R. and Ducruix, A. Barrett, Crystallization of Nucleic Acids and Proteins, a Practical Approach, 2nd ea., pp. 20 1-16, Oxford University Press, New York, New York, (1999);
Goodson, in Medical Applications of Controlled Release, vol. 2, pp. 115-138 (1984);
Hammerling, et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981;
Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988);
Kabat et al., Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md. (1987) and (1991);
Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242;
Kontermann and Dubel eds., Antibody Engineering (2001) Springer-Verlag. New York. 790 pp. (ISBN 3-540-41354-5).
Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY (1990);
Lu and Weiner eds., Cloning and Expression Vectors for Gene Function Analysis (2001) BioTechniques Press. Westborough, MA. 298 pp. (ISBN 1-881299-21-X).
Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Fla. (1974);
Old, R.W. & S.B. Primrose, Principles of Gene Manipulation: An Introduction To Genetic Engineering (3d Ed. 1985) Blackwell Scientific Publications, Boston. Studies in Microbiology; V.2:409 pp. (ISBN 0-632-01318-4);
Sambrook, J. et al. eds., Molecular Cloning: A Laboratory Manual (2d Ed. 1989) Cold Spring Harbor Laboratory Press, NY. Vols. 1-3. (ISBN 0-87969-309-6);
Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978;
WINNACKER, E.L. FROM GENES TO CLONES: INTRODUCTION TO GENE TECHNOLOGY (1987) VCH PUBLISHERS, NY (TRANSLATED BY HORST IBELGAUFTS). 634 PP. (ISBN 0-89573-614-4).
ССЫЛКИ
Патенты США:
4526938; 4753894; 4816567; 4880078; 4943533; 4946778; 4980286; 5500362; 5916597; 5985309; 5128326; 5223409; 5225539; 5258498; 5290540; 5403484; 5427908; 5516637; 5530101; 5558864; 5565332; 5571698; 5580717; 5585089; 5624821; 5627052 5641870; 5648260; 5658727; 5677171; 5679377; 5693762; 5698426; 5714350; 5714352; 5723323; 5733743; 5736137; 5750753; 5763192; 5766886; 5780225; 5814476; 5817483; 5821047; 5824514; 5855913; 5874064; 5891996; 5912015; 5916771; 5934272; 5939598; 5969108; 5976862; 5985320; 5985309; 5985615; 5989463; 5998209; 6019968; 6075181; 6091001; 6114598; 6130364; 6180370; 6204023; 6235883; 6258562 6350861; 6506883; 6699658; 6914128
Заявки на патенты США:
10/172,317
09/428,082
Публикации заявок на патенты США
20020137134; 20030186374; 20040018590; 20050147610 A1; 20050042664 A1; 2006104968;
Иностранные патентные документы
PCT/GB91/01134; PCT/US2003/040426; PCT/US91/05939; PCT/US91/09630; PCT/US94/01234; PCT/US96/18978; PCT/US98/16280; WO 00 09560; WO 00/037504; WO 00/56772; WO 01/58956; WO 01/77342 WO 01/83525; WO 01/88138; WO 0162931A2; WO 0177342A1; WO 02/02773; WO 02072636; WO 03/035835; WO 90/02809; WO 90/05144 A1; WO 91/05548; WO 91/09967; WO 91/10737; WO 91/10741; WO 91/17271; WO 92/01047; WO 92/02551 WO 92/09690; WO 92/15679; WO 92/18619; WO 92/19244; WO 92/20791; WO 92/22324 WO 93/01288; WO 93/11236; WO 94/02602; WO 95/15982; WO 95/20045 WO 95/20401; WO 96/20698; WO 96/33735; WO 96/34096; WO 96/40210; WO 97/29131; WO 97/32572; WO 97/44013; WO 98/16654; WO 98/24893; WO 98/31346; WO 98/31700; WO 98/50433; WO 99/15154; WO 99/20253; WO 99/25044; WO 99/45031; WO 99/53049; WO 99/54342; WO 99/66903; WO00/56772A1; WO2001/077342(A1); WO2002097048A2; WO2003016466A2; WO2004078140; WO2005100584 A2 WO90/14424; WO90/14430; WO90/14443; WO9524918 A1; EP 1,176,195; EP 229,246; EP 239,400; EP 519,596; EP 519,596; EP 592,106; GB89/01334;; GB91/01134;; GB92/01755.
Другие ссылки
Ames et al., J. Immunol. Methods 184:177-186 (1995);
Aoji et al., 2005 J Am Coll Cardiol. 45(10):1574-9;
Arancio O, et al., EMBO Journal (2004) 1-10;
Arndt, M. and J. Krauss, Methods Mol Biol, 2003. 207: p. 305-21;
Azzazy H., and Highsmith W.E., (2002) Clin. Biochem. 35:425-445;
Babcock, J.S. et al. (1996) Proc. Natl. Acad. Sci. USA 93:7843-7848;
Barbas et al. (1991) PNAS 88:7978-7982;
Barbas et al. Proc Nat. Acad. Sci, USA 91:3809-3813 (1994);
Barry J. Dickson, Science. (2002) 298:1959;
Better et al., Science 240:1041-1043 (1988);
Biewenga et al. 1983 Clin Exp Immunol 51: 395-400;
Bird et al. (1988) Science 242:423-426;
Bornemann KD, et al., Am J Pathol. 2001;158:63;
Boyce et al., Journal of Experimental Medicine (2005), 201(12), 1869-1873;
Brand DD. (2005) Comp Med. 55(2):114-22;
Brennan, M., et al., Science, (1985). 229(4708): p. 81-3);
Brinkman et al., J. Immunol. Methods 182:41-50 (1995);
Buchwald et al., 1980, Surgery 88:507;
Buras JA, et al., (2005) Nat Rev Drug Discov. 4(10):854-65;
Burke, Sandra E., et al., Advanced Drug Delivery Reviews (2006), 58(3), 437-446;
Burton et al., Advances in Immunology 57:191-280 (1994);
C.E. Shepherd, et al., Neurobiol Aging. 2005 Oct 24;
Calandra T, et al., (2000) Nat Med. 6(2):164-70;
Carter et al., Proc. Natl. Acad. Sci. U.S.A. 89:4285 (1992);
Chothia & Lesk, J. Mol. Biol. 196:901-917 (1987);
Chothia et al., Nature 342:877-883 (1989);
Clackson et al. (1991) Nature 352:624-628;
Cleek et al., 1997, Pro. Int'l. Symp. Control. Rel. Bioact. Mater. 24:853-854;
Co, M.S., et al., Mol. Immunol. (1993) 30:1361- 1367;
Coffman, et al., Journal of Experimental Medicine (2005), 201(12), 1875-1879;
Dall'Acqua 1998 Biochemistry 37: 9266-73;
D'Andrea, A., et al., J Exp Med, 1992, 176(5): p. 1387-98;
Deane R, et al., Nat Med. 2003;9:907-13;
Descotes J, et al., Developments in biological standardization (1992), 77 99-102;
Dinarello, C. A., K. Muegge, and S. K. Durum, 2000, Current Protocols in Immunology 6:1;
During et al., 1989, Ann. Neurol. 25:351;
Durocher et al., Nucleic Acids Research 2002, Vol 30, No.2;
Economides, A.N., et al., Nat Med, 2003. 9(1): p. 47-52;
Eliezer Masliah, et al., Neuron. 2005; 46:857;
Felicia Yu Hsuan Teng, et al., J Neurosci Res. (2005) 79:273;
Finotto et al., International Immunology (2005), 17(8), 993-1007;
Fuchs et al. (1991) Bio/Technology 9:1370-1372;
Gang Xu, et al., J. Neurochem.2004; 91; 1018;
Garrad et al. (1991) Bio/Technology 9:1373-1377;
Gavilondo J.V., and Larrick J.W. (2002) BioTechniques 29:128-145;
Genain CP, et al., (1997) J Mol Med. 75(3):187-97;
Genovese Mc et al 2005 N Engl J Med. 353:1114-23;
Glennie, M.J., et al., J Immunol, 1987. 139(7): p. 2367-75;
Goldspiel et al., 1993, Clinical Pharmacy 12:488-505;
Gracie, J.A., et al., J Clin Invest, 1999. 104(10): p. 1393-401;
Gram et al. (1992) PNAS 89:3576-3580;
Green and Jakobovits J. Exp. Med. 188:483-495 (1998);
Green et al. Nature Genetics 7:13-21 (1994);
Griffin (2000) JI 164:4433;
Griffiths et al. (1993) EMBO J 12:725-734;
Harriman G, Harper LK, Schaible TF. 1999 Ann Rheum Dis 58 Suppl 1:I 61-4;
Hart et al., Journal of Allergy and Clinical Immunology (2001), 108(2), 250-257);
Hawkins et al. (1992) J Mol Biol 226:889-896;
Hay et al. (1992) Hum Antibod Hybridomas 3:81-85;
Hildebrand, H. F., et al., Surface and Coatings Technology (2006), 200(22-23), 6318-6324;
Holliger, P. and G. Winter, Cancer Immunol Immunother, 1997, 45(3-4): p. 128-30;
Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448;
Holliger, P., T. Prospero, and G. Winter, Proc Natl Acad Sci U S A, 1993, 90(14): p. 6444-8;
Hoogenboom et al. (1991) Nuc Acid Res 19:4133-4137;
Hoogenboom H., and Chames P. (2000) Immunology Today 21:371-378;
Hoogenboom H.R., (1997) TIB Tech. 15:62-70;
Howard et al., 1989, J. Neurosurg, 7 1:105);
Huber et al. Nature; 264: 415-20; Thies et al 1999 J Mol Biol; 293: 67-79;
Huse et al. (1989) Science 246:1275-1281;
Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883;
Huston et al., Methods in Enzymology 203:46-88 (1991);
Hwang 2002 JI 169:633;
Igor Klyubin, et al., Nat Med. 2005, 11:556-61;
Ito, A., et al., J Immunol, 2003, 170(9): p. 4802-9;
Jackson et al., J. Immunol. 154(7):3310-9 (1995);
Johnnson, B., et al. (1991) Anal. Biochem, 198:268-277;
Johnsson, B., et al. (1995) J. Mol. Recognit. 8:125-131;
Joliot et al., 1991, Proc. Natl. Acad. Sci. USA 88:1864-1868;
Jones et al., Nature 321:522 (1986);
Jones R. 2000 Idrugs, 3(4):442-6;
Jönsson, U., et al. (1991) Biotechniques 11:620-627;
Jönsson, U., et al. (1993) Ann. Biol. Clin. 51:19-26;
Joosten, L.A., et al., Arthritis Rheum, 1996, 39(5): p. 797-809;
Jungbluth et al. 2003, Proc Natl Acad Sci USA. 100(2):639-44);
Kabat et al. (1971) Ann. NY Acad, Sci. 190:382-391;
Karni, A., et al., J Neuroimmunol, 2002, 125(1-2): p. 134-40;
Kellermann S-A., and Green L.L. (2002) Current Opinion in Biotechnology 13:593-597;
Kettleborough et al., 1991, Protein Eng. 4(7):773-83);
Kettleborough et al., Eur. J. Immunol. 24:952-958 (1994);
Kim et al 1994 Eur J Immunol; 24: 542-548;
Kipriyanov, S.M., et al., Int J Cancer, 1998. 77(5): p. 763-72;
Konishi, K., et al., J Immunol Methods, 1997. 209(2): p. 187-91;
Kostelny, S.A., M.S. Cole, and J.Y. Tso, J Immunol, 1992. 148(5): p. 1547-53;
Kriangkum, J., et al., Biomol Eng, 2001. 18(2): p. 31-40;
Lam et al., 1997, Proc. Int'l. Symp. Control Rel. Bioact. Mater. 24:759-760;
Langer (1990), Science 249:1527-1533;
Le Gall, F., et al., FEBS Lett, 1999, 453(1-2): p. 164-8;
Le Gall, F., et al., J Immunol Methods, 2004, 285(1): p. 111-27;
Leung, B.P., et al., J Immunol, 2000. 164(12): p. 6495-502;
Levy et al., 1985, Science 228:190;
Little M. et al (2000) Immunology Today 21:364-370;
Lloyd, Clare M., et al., Advances in Immunology (2001), 77 263-295;
Lu, D., et al., J Biol Chem, 2004, 279(4): p. 2856-65;
Lublin F.D., et al., (1985) Springer Semin Immunopathol, 8(3):197-208;
Luster et al., Toxicology (1994), 92(1-3), 229-43;
MacCallum, J Mol Biol 262(5):732-45 (1996);
Mack, M., et al., Proc Natl Acad Sci U S A, 1995, 92(15): p. 7021-5;
Marchalonis et al., Adv Exp Med Biol. 484:13-30 (2001);
Marco Domeniconi, et al., J Neurol Sci. 2005, 233:43;
Marks et al. BioTechnology 10:779-783 (1992);
Marques, A. P., et al., Biodegradable Systems in Tissue Engineering and Regenerative Medicine (2005), 377-397;
Mateo et al, 1997, Immunotechnology, 3(1):71-81);
May, 1993, TIBTECH 11(5):155-215;
McCafferty et al., Nature (1990) 348:552-554;
McDonnell, et al., Progress in Respiratory Research (2001), 31(New Drugs for Asthma, Allergy and COPD), 247-250;
McGee AW, et al., Trends Neurosci. 2003, 26:193;
McIntosh, J.K., et al., J Immunol, 1989, 143(1): p. 162-7;
Mendez et al., Nature Genetics 15:146-156 (1997);
Merchant, A.M., et al., Nat Biotechnol, 1998, 16(7): p. 677-81;
Michelle C Janelsins, et al., J Neuroinflammation. 2005; 2:23;
Milan Makwanal, et al., FEBS J. 2005, 272:2628;
Miller, K., et al., J Immunol, 2003. 170(9): p. 4854-61;
Milstein, C. and A.C. Cuello, Nature, 1983. 305(5934): p. 537-40;
Mizushima, S. and Nagata, S., (1990) Nucleic acids Research Vol 18, No. 17;
Modjtahedi et al, 1996, Br J Cancer, 73(2):228-35;
Modjtahedi et al, 2003, Int J Cancer, 105(2):273-80;
Modjtahedi et al., 1993, Br J Cancer, 1993, 67(2):247-53;
Modjtahedi et al., 1993, J. Cell Biophys, 1993, 22(1-3):129-46;
Morgan and Anderson, 1993, Ann. Rev. Biochem, 62:191-217;
Mulligan, Science 260:926- 932 (1993);
Mullinax et al., BioTechniques 12(6):864-869 (1992);
Murthy et al. 1987, Arch Biochem Biophys, 252(2):549-60;
Nakanishi, K., et al., Annu Rev Immunol, 2001. 19: p. 423-74;
Nelson RB, Curr Pharm Des. 2005; 11:3335;
Ning et al., 1996, Radiotherapy and Oncology 39:179-189;
Okamoto H, Kamatani N. 2004. N Engl J Med. 351:1909;
Owens T, et al., (1995)Neurol Clin. 3(1):51-73;
Padilla et al., Journal of Immunology (2005), 174(12), 8097-8105;
Padlan, FASEB J. 9:133-139 (1995);
Padlan, Molecular Immunology 28(4/5):489-498 (1991);
Peipp, M. and T. Valerius, Biochem Soc Trans, 2002, 30(4): p. 507-11;
Peng SL (2004) Methods Mol Med.; 102: 227-72;
Persic et al., Gene 187 9-18 (1997);
Pluckthun, A. and P. Pack, Immunotechnology, 1997. 3(2): p. 83-105;
Poljak, R.J., et al. (1994) Structure 2:1121-1123;
Presta et al., J. Immunol. 151:2623 (1993),
Presta LG. 2005 J Allergy Clin Immunol., 116:731-6;
R. Jefferis, Biotechnol. Prog, 21 (2005), pp. 11-16;
R.J. Kaufman and P.A. Sharp (1982) Mol. Biol. 159:601-621;
Ranger and Peppas, 1983, J. Macromol, Sci. Rev. Macromol. Chem. 23:61;
Ridgway, J.B., et al., Protein Eng, 1996. 9(7): p. 617-21;
Riechmann et al., Nature 332:323 (1988);
Roberts, R.W. and Szostak, J.W. (1997) Proc. Natl. Acad. Sci. USA 94:12297-12302;
Rodeck et al., 1987, J Cell Biochem. 35(4):315-20;
Roguska et al., PNAS 91:969-973 (1994);
Saudek et al., 1989, N. Engl. J. Med. 321:574;
Sawai et al., AJRI 34:26-34 (1995);
Schier et al. Gene 169:147- 155 (1995);
Sefton, 1987, CRC Crit. Ref. Biomed. Eng. 14:20;
Seligman 1978 Ann Immunol 129: 855-70.;
Sfikakis PP et al (2005) Curr Opin Rheumatol 17:550-7;
Shapiro et al., Crit. Rev. Immunol. 22(3): 183-200 (2002);
Shields, R. L. et al. (2002) J. Biol. Chem. 277:26733-26740;
Shu et al., PNAS 90:7995-7999 (1993);
Sims et al., J. Immunol. 151: 2296 (1993);
Skerra et al., Science 240:1038-1040 (1988);
Snibson K J; et al., Journal of the British Society for Allergy and Clinical Immunology (2005), 35(2), 146-52;
Soloman B, Curr Alzheimer Res. 2004; 1:149;
Song et al., 1995, PDA Journal of Pharmaceutical Science &Technology 50:372-397;
Staerz, U.D., et al., Nature, 1985. 314(6012): p. 628-31;
Steinman L, et al., (2005) Trends Immunol. 26(11):565-71;
Studnicka et al., Protein Engineering 7(6):805-814 (1994);
't Hart BA, et al., (2005) J Immunol 175(7):4761-8;
Tara Karnezis, et al., Nature Neuroscience (2004) 7, 736;
Taylor, L. D., et al. (1992) Nucl. Acids Res. 20:6287-6295;
Tolstoshev, 1993, Ann. Rev. Pharmacol. Toxicol. 32:573-596;
Tuohy VK, et al., (1999) J Exp Med. 189(7):1033-42;
Umana et al. (1999) Nat. Biotech. 17:176-1;
Urlaub and Chasin, (1980) Proc. Natl. Acad. Sci. USA 77:4216-4220;
Verhoeyen et al., Science 239:1534 (1988)),
von Mehren M, et al (2003) Annu Rev Med.;54:343-69;
Wallick, S.C., et al., Exp. Med. (1988) 168:1099-1109;
Ward et al., (1989) Nature 341:544-546;
West et al., 2000 Biochemistry 39: 9698-708;
William L. Klein, Neurochem Int. 2002; 41:345;
Wright, A., et al., EMBO J. (1991) 10:2717 2723;
Wu and Wu, 1991, Biotherapy 3:87-95;
Wu and Wu, J. Biol. Chem. 262:4429-4432 (1987);
Wu, A.M., et al., Immunotechnology, 1996. 2(1): p. 21-36;
Wu, A.M., et al., Immunotechnology, 1996. 2(1): p. 21-36;
Wu, Peng; Grainger, David W., Biomaterials (2006), 27(11), 2450-2467;
Yelton et al. J. Immunol. 155:1994-2004 (1995);
Zapata et al. Protein Eng. 8(10):1057-1062 (1995).
Хотя выше были описаны ряд вариантов и признаков, квалифицированным специалистам в данной области будет понятно, что модификации и вариации описанных вариантов осуществления и признаков могут быть произведены без отклонения от данного раскрытия или изобретения, определенного в виде прилагаемой формулы изобретения. Каждая из упоминаемых в данном описании публикаций включена путем ссылки.
Реферат
Настоящее изобретение относится к иммунологии и биотехнологии. Предложен связывающий белок для связывания одной или более мишеней, содержащий четыре полипептидные цепи, которые образуют четыре функциональных антигенсвязывающих сайта. Две полипептидные цепи содержат VD1-(X1)n-VD2-С-(Х2)n. VD1 означает первый вариабельный домен тяжелой цепи, VD2 означает второй вариабельный домен тяжелой цепи, С означает СН1 домен, X1 означает полипептидный линкер, при условии, что он не является константным доменом, и Х2 означает Fc-область, а n равно 0 или 1. Две полипептидные цепи содержат VD1-(X1)n-VD2-С. VD1 означает первый вариабельный домен легкой цепи, VD2 означает второй вариабельный домен легкой цепи, С означает CL домен, X1 означает линкер, при условии, что он не является константным доменом; и n равно 0 или 1. Описан конъюгат связывающего белка с визуализирующим, детектирующим, цитотоксическим или терапевтическим агентом. Раскрыты нуклеиновые кислоты (НК), кодирующие полипептидные цепи, а также: экспрессирующие вектора, вектора для репликации, клетки-хозяина их содержащие и способ получения антитела, использующий клетки. Описана фармацевтическая композиция для лечения или предупреждения связанного с мишенью заболевания или нарушения на основе связывающего белка. Раскрыт способ лечения путем введения связывающего белка. Использование изобретения обеспечивает новый формат (DVD-Ig) антигенсвязывающих молекул, которые при той же дозировке обладают большей активностью в отношении мишени, чем соответствующие полноразмерные антитела, что может найти применение в медицине для профилактики, лечения различных заболеваний. 13 н. и 52 з.п. ф-лы, 27 табл., 5 п�
Формула
где указанные четыре полипептидные цепи указанного связывающего белка образуют четыре функциональных антигенсвязывающих сайта.
первую выделенную нуклеиновую кислоту, кодирующую первую полипептидную цепь по п.1, содержащую VD1-(X1)n-VD2-C-(Х2)n, где VD1 означает первый вариабельный домен тяжелой цепи, VD2 означает второй вариабельный домен тяжелой цепи, С означает СН1 домен, X1 означает линкер, при условии, что он не является константным доменом, Х2 означает Fc-область, и n равно 0 или 1; и
вторую выделенную нуклеиновую кислоту, кодирующую вторую полипептидную цепь по п.1, содержащую VD1-(X1)n-VD2-C-(Х2)n, где VD1 означает первый вариабельный домен легкой цепи, VD2 означает второй вариабельный домен легкой цепи, С означает CL домен, X1 означает линкер, при условии, что он не является константным доменом; и n равно 0 или 1;
где указанный вектор является пригодным для реплицирования указанных нуклеиновых кислот.
первую выделенную нуклеиновую кислоту, кодирующую первую полипептидную цепь по п.1, содержащую VD1-(X1)n-VD2-C-(Х2)n, где VD1 означает первый вариабельный домен тяжелой цепи, VD2 означает второй вариабельный домен тяжелой цепи, С означает СН1 домен, X1 означает линкер, при условии, что он не является константным доменом, Х2 означает Fc-область, и n равно 0 или 1; и
вторую выделенную нуклеиновую кислоту, кодирующую вторую полипептидную цепь по п.1, содержащую VD1-(X1)n-VD2-C-(Х2)n, где VD1 означает первый вариабельный домен легкой цепи, VD2 означает второй вариабельный домен легкой цепи, С означает CL домен, X1 означает линкер, при условии, что он не является константным доменом; и n равно 0 или 1;
где указанный вектор является пригодным для экспрессирования указанных нуклеиновых кислот.
Документы, цитированные в отчёте о поиске
Cd19xcd3-специфические полипептиды и их применение

Комментарии