Нуклеиновая кислота, содержащая или кодирующая структуру "стебель-петля" гистонов и последовательность поли(а) или сигнал полиаденилирования, для повышения экспрессии кодируемого терапевтического белка - RU2634391C2
Код документа: RU2634391C2
Чертежи



























































Описание
Настоящее изобретение относится к последовательности нуклеиновой кислоты, содержащей или кодирующей кодирующую область, кодирующую по меньшей мере один пептид или белок, содержащий терапевтический белок или его фрагмент, вариант или производное, по меньшей мере одну структуру "стебель-петля" гистонов и последовательность поли(A) или сигнал полиаденилирования. Кроме того, настоящее изобретение относится к применению нуклеиновой кислоты для повышения экспрессии указанного кодируемого пептида или белка, например, в генной терапии. Настоящее изобретение также относится к применению указанной нуклеиновой кислоты для получения фармацевтической композиции, предназначенной для использования в генной терапии, в частности, при лечении заболеваний, требующих применения терапевтического пептида или белка, предпочтительно рассмотренных в настоящем описании изобретения. Настоящее изобретение, кроме того, относится к способу повышения экспрессии пептида или белка, содержащего терапевтический белок или его фрагмент, вариант или производное, используя нуклеиновую кислоту, содержащую или кодирующую структуру "стебель-петля" гистонов и последовательность поли(A) или сигнал полиаденилирования.
Генная терапия предполагает использование нуклеиновых кислот в качестве фармацевтического средства для лечения заболевания. Генная терапия получила свое название благодаря использованию нуклеиновых кислот для дополнения или изменения экспрессии гена в клетках индивида в качестве метода лечения заболевания. Наиболее распространенной формой генной терапии является использование нуклеиновых кислот, кодирующих функциональный терапевтический белок, для замены мутированного гена. Другие формы генной терапии включают прямую коррекцию мутации или использование нуклеиновых кислот, кодирующих терапевтический белок, в качестве лекарственного средства.
Генная терапия представляют собой способы молекулярной медицины, которые уже зарекомендовали себя в лечении и профилактики заболеваний и, как правило, демонстрируют значительный эффект в повседневной медицинской практике, в частности, при лечении заболеваний, как упомянуто в настоящем документе. Генная терапия основана на введении в клетки или ткани пациента нуклеиновых кислот и дальнейшем процессинге информации, кодируемой нуклеиновой кислотой, которую ввели в клетки или ткани, то есть (белковой) экспрессии желаемых полипептидов.
Генная терапия позволяет получить благоприятные результаты при лечении целого ряда наследственных или приобретенных заболеваний, в том числе инфекционных заболеваний, новообразований (например, раковых или опухолевых заболеваний), заболеваний крови и кроветворных органов, заболеваний эндокринной системы, заболеваний, связанных с питанием и обменом веществ, заболеваний нервной системы, заболеваний сердечно-сосудистой системы, заболеваний дыхательной системы, заболеваний пищеварительной системы, заболеваний кожи и подкожной ткани, заболеваний костно-мышечной системы и соединительной ткани и заболеваний мочеполовой системы.
При генотерапевтических подходах, как правило, используют ДНК, хотя в недавних разработках также появилась информация об использовании РНК. Важно отметить, что во всех этих генотерапевтических подходах мРНК действует как посредник для информации о последовательности кодируемого белка, вне зависимости от того, используется ДНК, вирусная РНК или мРНК.
Как правило, РНК считают нестабильной молекулой: РНКазы встречаются повсеместно и известно, что они трудно поддаются инактивации. Кроме того, РНК химически более лабильна, чем ДНК. Таким образом, вероятно, является неожиданностью тот факт, что "состояние по умолчанию" для мРНК в эукариотической клетке характеризуется относительной стабильностью и для разрушения отдельных мРНК необходимы специфические сигналы. Основной причиной этого обнаружения, по-видимому, является тот факт, что разрушение мРНК в клетках катализируют практически только экзонуклеазы. Однако концы эукариотических мРНК защищены от этих ферментов специфическими концевыми структурами и связанными с ними белками: кэпом m7GpppN на 5ʹ-конце и, как правило, последовательностью поли(A) на 3ʹ-конце. Таким образом, удаление двух концевых модификаций считают лимитирующим скорость разрушения мРНК. Хотя в 3ʹ-UTR мРНК альфа-глобина охарактеризован стабилизирующий элемент, последовательности РНК, воздействующие на функциональный цикл эукариотических мРНК, как правило, действуют как промотор разрушения, как правило, ускоряя деаденилирование (обзор Meyer, S., C. Temme, et al. (2004), Crit Rev Biochem Mol Biol 39(4): 197-216.).
Как указано выше, 5ʹ-концы эукариотических мРНК, как правило, посттранскрипционно модифицированы метилированной кэпирующей структурой, например, m7GpppN. Кроме ее роли в сплайсинге, стабилизации и транспорте РНК, кэпирующая структура значительно повышает привлечение субъединицы 40S рибосомы к 5ʹ-концу мРНК при инициации трансляции. Для реализации последней функции требуется распознавание кэпирующей структуры комплексом факторов инициации эукариот eIF4F. Последовательность поли(A) дополнительно стимулирует трансляцию посредством повышенного привлечения субъединицы 40S к мРНК, эффект, требующий вмешательства связывающего поли(A) белка (PABP). Недавно было показано, что в свою очередь PABP физически взаимодействует с eIF4G, который является частью связанного с кэпом комплекса eIF4F. Таким образом, была постулирована модель закрытой петли инициации трансляции на кэпированной полиаденилированной мРНК (Michel, Y.M., D. Poncet, et al. (2000), J Biol Chem 275(41): 32268-76.).
Такой последовательностью поли(A), которую добавляют на их 3ʹ-конец повсеместно встречающаяся система расщепления/полиаденилирования, заканчиваются почти все эукариотические мРНК. Наличие последовательности поли(A) на 3ʹ-конце является одной из наиболее распознаваемых характеристик эукариотических мРНК. После расщепления большинство пре-мРНК, за исключением зависимых от репликации транскриптов гистонов, получают полиаденилированный хвост. В этом контексте, процессинг 3ʹ-конца представляет собой ядерный совместный с транскрипцией процесс, который способствует транспорту мРНК из ядра в цитоплазму и влияет на стабильность и трансляцию мРНК. Формирование 3ʹ-конца происходит в двухстадийной реакции под управлением системы расщепления/полиаденилирования и зависит от присутствия двух элементов последовательности в предшественниках мРНК (пре-мРНК), высококонсервативного гексануклеотида AAUAAA (сигнала полиаденилирования) и расположенной ниже последовательности, богатой G/U. На первой стадии происходит расщепление пре-мРНК между двумя этими элементами. На второй стадии, тесно связанной с первой стадией, происходит достройка вновь сформированного 3ʹ-конца посредством добавления последовательности поли(A), состоящей из 200-250 аденилатов, которые затем влияют на все аспекты метаболизма мРНК, включая экспорт, стабильность и трансляцию мРНК (Dominski, Z. и W.F. Marzluff (2007), Gene 396(2): 373-90.).
Единственным известным исключением из этого правила являются зависимые от репликации мРНК гистоны, которые вместо последовательности поли(A) заканчиваются структурой "стебель-петля" гистонов. Примеры последовательностей структуры "стебель-петля" гистонов описаны в Lopez et al. (Dávila López, M., & Samuelsson, T. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10.1261/rna.782308.).
Как правило, за структурами "стебель-петля" в пре-мРНК гистонов расположена последовательность, богатая пуринами, известная как нижерасположенный элемент гистонов (HDE). Эти пре-мРНК подвергаются процессингу в ядре посредством одного эндонуклеолитического расщепления приблизительно на 5 нуклеотидов ниже структуры "стебель-петля", катализируемого мяРНП U7 посредством спаривания оснований мяРНК U7 с HDE. Последовательность 3ʹ-UTR, содержащую структуру "стебель-петля" гистонов и нижерасположенный элемент гистонов (HDE) (участок связывания мяРНП U7), как правило, обозначают как 3ʹ-сигнал процессинга гистонов (см. например, Chodchoy, N., N.B. Pandey, et al. (1991). Mol Cell Biol 11(1): 497-509.).
Из-за необходимости упаковки вновь синтезированной ДНК в хроматин, синтез гистонов контролируется согласованно с клеточным циклом. Повышенный синтез гистоновых белков в течение S-фазы достигается посредством активации транскрипции генов гистонов, а также посттранскрипционной регуляции уровней мРНК гистонов. Можно показать, что структура "стебель-петля" гистонов необходима для всех посттранскрипционных стадий регуляции экспрессии гистонов. Она необходима для эффективного процессинга, экспорта мРНК в цитоплазму, помещения в полирибосомы и регуляции стабильности мРНК.
В указанном выше случае идентифицирован белок 32 кДа, который в ядре и цитоплазме связан со структурой "стебель-петля" гистонов на 3ʹ-конце мРНК гистонов. Уровень экспрессии этого связывающего структуру "стебель-петля" белка (SLBP) регулируется клеточным циклом и наибольшим является в течение S-фазы, когда повышены уровни мРНК гистонов. SLBP необходим для эффективного 3ʹ-концевого процессинга пре-мРНК гистонов посредством мяРНП U7. После завершения процессинга SLBP остается связанным со структурой "стебель-петля" на конце зрелых мРНК гистонов и стимулирует их трансляцию в гистоновые белки в цитоплазме. (Dominski, Z. and W.F. Marzluff (2007), Gene 396(2): 373-90). Интересен тот факт, что РНК-связывающий домен SLBP является консервативным у всех представителей метазоа и протозоа (Dávila López, M., & Samuelsson, T. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10.1261/rna.782308), и можно показать, что его связывание с последовательностью структуры "стебель-петля" гистонов зависит от структуры "стебель-петля", и что минимальный участок связывания содержит по меньшей мере 3 нуклеотида с 5ʹ-конца и 2 нуклеотида с 3ʹ-конца от структуры "стебель-петля" (Pandey, N.B., et al. (1994), Molecular and Cellular Biology, 14(3), 1709-1720 и Williams, A.S., & Marzluff, W.F., (1995), Nucleic Acids Research, 23(4), 654-662.).
Хотя гены гистонов, как правило, классифицируют как "зависимые от репликации", дающие начало мРНК, оканчивающимся структурой "стебель-петля" гистонов, или "заместительного типа", дающие начало мРНК, несущим вместо этого поли(A)-хвост, в некоторых редких случаях идентифицированы природные мРНК, содержащие и структуру "стебель-петля" гистонов и поли(A) или олиго(A) с 3ʹ-конца. Sanchez et al. изучали действие природных олиго(A)-хвостов, добавляемых c 3ʹ-конца от структуры "стебель-петля" гистонов в мРНК гистонов, при оогенезе Xenopus с использованием в качестве репортерного белка люциферазы и выявили, что олиго(A)-хвост является активной частью механизма репрессии трансляции, который осуществляет сайленсинг мРНК гистонов при оогенезе, и его удаление является частью механизма, который активирует трансляцию мРНК гистонов (Sanchez, R. and W. F. Marzluff (2004), Mol Cell Biol 24(6): 2513-25).
Кроме того, исследовали необходимые условия регуляции зависимых от репликации гистонов на уровне процессинга пре-мРНК и стабильности мРНК, используя искусственные конструкции, кодирующие маркерный белок альфа-глобин, используя преимущество того факта, что ген глобина, в отличие от безинтронных генов гистонов, содержит интроны. Для этой цели получали конструкции, в которых после кодирующей последовательности альфа-глобина располагалась сигнальная последовательность структуры "стебель-петля" гистонов (структура "стебель-петля" гистонов с последующим нижерасположенным элементом гистонов) и сигнал полиаденилирования (Whitelaw, E., et al. (1986). Nucleic Acids Research, 14(17), 7059-7070.; Pandey, N.B., & Marzluff, W.F. (1987). Molecular and Cellular Biology, 7(12), 4557-4559.; Pandey, N.B., et al. (1990). Nucleic Acids Research, 18(11), 3161-3170).
В другом подходе Lüscher et al. исследовали зависимую от клеточного цикла регуляцию гена рекомбинантного гистона H4. Получали конструкции, в которых после кодирующей последовательности H4 располагалась сигнальная последовательность структуры "стебель-петля" и сигнал полиаденилирования, два сигнала процессинга, независимо разделенные кодирующей последовательностью галактокиназы (Lüscher, B. et al., (1985). Proc. Natl. Acad. Sci. USA, 82(13), 4389-4393).
Кроме того, Stauber et al. идентифицировали минимальную последовательность, необходимую для зависимой от клеточного цикла регуляции на уровне мРНК гистона H4. Для этих исследований использовали конструкции, содержащие кодирующую последовательность селективного маркера ксантин : гуанин фосфорибозилтрансферазы (GPT), предшествующую сигнальной последовательности структуры "стебель-петля" гистонов со следующим за ней сигналом полиаденилирования (Stauber, C. et al., (1986). EMBO J, 5(12), 3297-3303).
Исследуя процессинг пре-мРНК гистонов, Wagner et al. идентифицировали факторы, необходимые для расщепления пре-мРНК гистонов, с использованием репортерной конструкции, где между сигнальной последовательностью структуры "стебель-петля" гистонов и сигналом полиаденилирования помещен EGFP так, что EGFP экспрессируется только в случае нарушения процессинга пре-мРНК гистонов (Wagner, E.J. et al., (2007). Mol Cell 28(4), 692-9).
Следует отметить, что трансляция полиаденилированной мРНК, как правило, требует, чтобы 3ʹ-последовательность поли(A) сблизилась с 5ʹ-кэпом. Это опосредовано белок-белковым взаимодействием между связывающим поли(A) белком и эукариотическим фактором инициации eIF4G. В отношении зависимых от репликации мРНК гистонов был обнаружен аналогичный механизм. Для этого случая Gallie et al. показали, что структура "стебель-петля" гистонов функционально сходна с последовательностью поли(A) в том, что увеличивает эффективность трансляции и одновременно зависит от 5ʹ-кэпа для обеспечения эффективного уровня трансляции. Они показали, что структура "стебель-петля" гистонов необходима и достаточна для усиления трансляции репортерной мРНК трансфицированных клеток яичника китайского хомяка, но для оптимального функционирования она должна находиться на 3ʹ-конце. Таким образом, подобно поли(A)-хвосту других мРНК, 3ʹ-конец этих мРНК гистонов, по-видимому, необходим для трансляции in vivo и функционально аналогичен поли(A)-хвосту (Gallie, D.R., Lewis, N.J., & Marzluff, W.F. (1996), Nucleic Acids Research, 24(10), 1954-1962).
Кроме того, можно показать, что SLBP связан с цитоплазматической мРНК гистонов и необходим для ее трансляции. Хотя SLBP не взаимодействует с eIF4G напрямую, домен, необходимый для трансляции мРНК гистонов, взаимодействует с недавно выявленным белком SLIP1. На следующей стадии, SLIP1 взаимодействует с eIF4G и обеспечивает циркуляризацию мРНК гистонов и поддержку эффективной трансляция мРНК гистонов по механизму, сходному с трансляцией полиаденилированных мРНК.
Как указано выше, в генотерапевтических подходах для переноса кодирующей информации в клетку в норме используют ДНК, которая затем транскрибируется в мРНК, несущую природные элементы мРНК, в частности, 5ʹ-кэпирующую структуру и 3ʹ-последовательность поли(A), для экспрессии кодируемого терапевтического или антигенного белка.
Однако во многих случаях экспрессирующие системы на основе введения таких нуклеиновых кислот в клетки или ткани пациента и последующей экспрессии желаемых полипептидов, кодируемых этими нуклеиновыми кислотами, не демонстрируют желаемого или даже необходимого уровня экспрессии, которым мог бы обеспечить эффективную терапию, вне зависимости от того используют ли ДНК или РНК.
В уровне техники ранее принимались различные попытки повышения выхода экспрессии кодируемого белка, в частности, используя улучшенные экспрессирующие системы, in vitro и/или in vivo. Способы повышения экспрессии, в основном описанные в уровне техники, как правило, основаны на использовании векторов экспрессии или кассет, содержащих специфические промоторы и соответствующие регуляторные элементы. Так как эти векторы экспрессии или кассеты, как правило, ограничены конкретными клеточными системами, то эти экспрессирующие системы необходимо адаптировать для использования в других клеточных системах. Затем такие адаптированные экспрессирующие векторы или кассеты, как правило, трансфицировали в клетки и, как правило, обрабатывали в зависимости от конкретной линии клеток. Таким образом, предпочтение отдают преимущественно тем молекулам нуклеиновой кислоты, которые способны экспрессировать кодируемые белки в клетке-мишени посредством систем, характерных для клетки, вне зависимости от промоторов и регуляторных элементов, которые специфичны для конкретных типов клеток. В этом контексте, можно различать стабилизирующие мРНК элементы и элементы, которые увеличивают эффективность трансляции мРНК.
мРНК с оптимизированной кодирующей последовательностью и в основном подходящие для такой цели описаны в заявке WO 02/098443 (CureVac GmbH). Например, в WO 02/098443 описаны мРНК, стабилизированные в основной форме и оптимизированные для трансляция кодирующих областей. В WO 02/098443, кроме того, описан способ определения модификаций последовательности. В WO 02/098443 дополнительно описаны возможности замены адениновых и урациловых нуклеотидов в последовательностях мРНК для повышения содержания в последовательностях гуанина/цитозина (G/C). По WO 02/098443 такие замены и адаптации с повышением содержания G/C можно использовать для генотерапевтических приложений, а также для генетических вакцин для лечения злокачественных опухолей или инфекционных заболеваний. В этом контексте, в WO 02/098443, как правило, указаны последовательности в виде основных последовательностей для таких модификаций, в которых модифицированная мРНК кодирует по меньшей мере один биологически активный пептид или полипептид, который у пациента, получаемого лечение, например, не транслируется или транслируется некорректно или с дефектами. Альтернативно, в WO 02/098443 предоставлены мРНК, кодирующие антигены, например, терапевтические белки или вирусные антигены, в виде основных последовательностей для таких модификаций.
В дополнительном подходе в отношении повышения экспрессии кодируемого белка в заявке WO 2007/036366 описано положительное действие длинных последовательностей поли(A) (особенно длиннее 120 п.н.) и комбинации по меньшей мере двух 3ʹ-нетранслируемых областей гена бета-глобина на стабильность и активность трансляции мРНК.
Однако хотя во всех этих последних документах уровня техники были уже сделаны попытки получить достаточно эффективные инструменты для генотерапевтических подходов и дополнительно повысить стабильность и активность трансляции мРНК, все еще остается проблема по существу меньшей стабильности при использовании РНК-вакцин по сравнению с ДНК-вакцинами и с генотерапевтическими подходами на основе ДНК. Таким образом, в данной области существует необходимость получения улучшенных инструментов для генотерапевтических подходов или как дополнительная терапия для общепринятых способов лечения, как указано выше, которые позволят обеспечить кодируемыми белками in vivo, например, посредством дополнительно повышенной стабильности и/или активности трансляции мРНК, предпочтительно, для генной терапии.
Кроме того несмотря на общий прогресс в данной области, эффективная экспрессия кодируемого пептида или белка в бесклеточных системах, клетках или организмах (рекомбинантная экспрессия) все еще остается серьезной проблемой.
Таким образом, целью настоящего изобретения является получение дополнительных и/или альтернативных способов повышения экспрессии кодируемого белка, предпочтительно, за счет дополнительной стабилизации мРНК и/или повышения эффективности трансляции такой мРНК в отношении таких нуклеиновых кислот, которые, как известно из уровня техники, используются в генотерапии для лечения или профилактики наследственных или приобретенных заболеваний, в частности, рассмотренных в настоящем описании изобретения.
Эту задачу решают благодаря объектам, перечисленным в приложенной формуле изобретения. В частности, целью настоящего изобретения является в соответствии с первым аспектом последовательность нуклеиновой кислоты по изобретению, содержащая или кодирующая
a) кодирующую область, кодирующую по меньшей мере один пептид или белок, который содержит терапевтический белок или его фрагмент, вариант или производное;
b) по меньшей мере одну структуру "стебель-петля" гистонов и
c) последовательность поли(A) или сигнал полиаденилирования,
предпочтительно, для повышения экспрессии указанного кодируемого пептида или белка.
Альтернативно, в соответствии с настоящим изобретением во всех его аспектах и вариантах осуществления можно использовать любую подходящую последовательность структуры "стебель-петля", отличающуюся от последовательности структуры "стебель-петля" гистонов (получаемую из генов гистонов, в частности, генов гистонов семейств H1, H2A, H2B, H3 и H4).
В этом контексте особенно предпочтительно, что нуклеиновую кислоту по изобретению в соответствии с первым аспектом настоящего изобретения получают, по меньшей мере частично, посредством синтеза ДНК или РНК, предпочтительно, как описано в настоящем документе, или нуклеиновая кислота представляет собой выделенную нуклеиновую кислоту.
Настоящее изобретение основано на неожиданном обнаружении авторами настоящего изобретения, что комбинация последовательности поли(A) или сигнала полиаденилирования и по меньшей мере одной структуры "стебель-петля" гистонов, несмотря на то, что обе в природе являются альтернативными механизмами, действует синергически, так как эта комбинация повышает экспрессию белка значительно выше уровня, наблюдаемого при использовании любого из элементов отдельно. Синергическое действие комбинации поли(A) и по меньшей мере одной структуры "стебель-петля" гистонов отличают вне зависимости от порядка поли(A) и структуры "стебель-петля" гистонов и вне зависимости от длины последовательности поли(A).
Таким образом, особенно предпочтительной является последовательность нуклеиновой кислоты по изобретению, которая содержит или кодирует a) кодирующую область, кодирующую по меньшей мере один пептид или белок, который содержит терапевтический белок или его фрагмент, вариант или производное; b) по меньшей мере одну структуру "стебель-петля" гистонов, и c) последовательность поли(A) или последовательность полиаденилирования; предпочтительно, для повышения уровня экспрессии указанного кодируемого пептида или белка, где кодируемый белок, предпочтительно, не является гистоновым белком, в частности, не является гистоновым белком гистоновых семейств H4, H3, H2A и/или H2B или его фрагментом, производным или вариантом, сохраняющим гистоновую (гистоноподобную) функцию), а именно, возможность формирования нуклеосомы. Также кодируемый белок, как правило, не является линкерным гистоновым белком семейства гистонов H1. Как правило, молекула нуклеиновой кислоты по изобретению не содержит никаких регуляторных сигнальных последовательностей (с 5ʹ-конца и/или, особенно, с 3ʹ-конца) от гена гистона мышь, в частности, гена гистона H2A мыши, и, кроме того, наиболее предпочтительно, гена гистона H2A614 мыши. В частности, она не содержит гистон со структурой "стебель-петля" и/или сигнальную последовательность процессинга гистона со структурами "стебель-петля" из гена гистона мыши, в частности, гена гистона H2A мыши и, наиболее предпочтительно, гена гистона H2A614 мыши.
Также нуклеиновая кислота по изобретению, как правило, не содержит репортерный белок (например, люциферазу, GFP, EGFP, β-галактозидазу, в частности, EGFP), галактокиназу (galK) и/или маркерный или селективный белок (например, альфа-глобин, галактокиназу и ксантин:гуанинфосфорибозилтрансферазу (GPT)) или бактериальный репортерный белок, например, хлорамфеникол ацетилтрансферазу (CAT) или другие белки, устойчивые к бактериальным антибиотикам, например, происходящие из бактериального гена neo в его элементе (а).
Следует отметить, что репортерный, маркерный или селективный белок не является терапевтическим белком по настоящему изобретению. Репортерный, маркерный или селективный белок либо его ген обычно используют в качестве научно-исследовательского инструмента в бактериях, культурах клеток, животных или растениях. Указанные белки сообщают экспрессирующим их организмам (предпочтительно гетерологично) легко идентифицируемый признак, который может быть измерен или позволяет произвести отбор. Маркерные или селективные белки выполняют функцию отбора. Такие селективные, маркерные или репортерные белки обычно отсутствуют у человека или других млекопитающих, но указанные белки выделяют из других организмов, в частности, из бактерий или растений. Таким образом, белки, обладающие селективной, маркерной или репортерной функцией и выделенные из видов, отличных от млекопитающих, в частности, отличных от человека, предпочтительно, исключаются из определения “терапевтический белок” по настоящему изобретению. В частности, селективный, маркерный или репортерный белок позволяет идентифицировать трансформированные клетки при выполнении анализов in vitro при помощи флуоресцентных или других спектроскопических методов и определить устойчивость к антибиотикам. Селективные, репортерные или маркерные гены, сообщающие такие свойства трансформированным клеткам, обычно не считаются терапевтическими белками по настоящему изобретению.
В любом случае репортерные, маркерные или селективные белки обычно не выполняют какую-либо терапевтическую функцию. Если какой-либо единичный репортерный, маркерный или селективный белок тем не менее должен выполнять такую функцию (помимо репортерной, селективной или маркерной функции), то такой репортерный, маркерный или селективный белок, предпочтительно, не является ”терапевтическим белком” в значении, использованном в настоящем изобретении.
Напротив, терапевтический белок (включая его фрагменты, варианты и производные), за исключением генов гистона семейств Н1, Н2А, Н2В, Н3 и Н4 по настоящему изобретению, обычно не проявляет селективного, маркерного или репортерного действия. Если какой-либо единичный “терапевтический белок” тем не менее выполняет такую функцию (помимо своих терапевтпических функций), то такой терапевтический белок, предпочтительно, не является “селективным, маркерным или репортерным белком” в значении, использованном в настоящем изобретении.
Терапевтический белок по настоящему изобретению, который, наиболее предпочтительно, выделяют у млекопитающего, в частности, человека, не определяется как селективный, маркерный или репортерный белок.
Таким образом, предпочтительно, кодирующая область (a), кодирующая по меньшей мере один пептид или белок, является гетерологичной по меньшей мере (b) по меньшей мере одной структуре "стебель-петля" гистонов или, более широко, любой подходящей структуре "стебель-петля". Другими словами, "гетерологичный" в контексте настоящего изобретения означает, что по меньшей мере одна последовательность структуры "стебель-петля" не встречается в природе как (регуляторная) последовательность (например, как 3ʹ-UTR) конкретного гена, кодирующего (терапевтический) белок или пептид, элемента (a) нуклеиновой кислоты по изобретению. Таким образом, структура "стебель-петля" (гистонов) нуклеиновой кислоты по изобретению, предпочтительно, происходит из 3ʹ-UTR гена, отличного от гена, содержащего кодирующую область элемента (a) нуклеиновой кислоты по изобретению. Например, кодирующая область элемента (a) не кодирует гистоновый белок или его фрагмент, вариант или производное (сохраняющие функцию гистонового белка), если нуклеиновая кислота по изобретению является гетерологичной, а кодирует любой другой пептид или последовательность (того же или другого вида), который проявляет биологическое действие, предпочтительно, терапевтическую функцию, отличную от гистонового (гистоноподобного) действия, например, кодирует терапевтический белок (выполняющий терапевтическую функцию, например, в случае эндокринных нарушений, и заменяющий дефектные эндогенные белки, например, белки млекопитающего, в частности, белки человека).
В этом контексте особенно предпочтительна нуклеиновая кислота по изобретению в направлении от 5ʹ к 3ʹ, которая содержит или кодирует:
a) кодирующую область, кодирующую по меньшей мере один пептид или белок, который содержит терапевтический белок или его фрагмент, вариант или производное;
b) по меньшей мере одну структуру "стебель-петля" гистонов, необязательно без нижерасположенного элемента гистона (HDE) с 3ʹ-конца от структуры "стебель-петля" гистонов;
c) последовательность поли(A) или сигнал полиаденилирования.
Термин "нижерасположенный элемент гистона (HDE)" относится к полинуклеотидному участку, богатому пуринами, длиной приблизительно от 15 до 20 нуклеотидов с 3ʹ-конца от природных структур "стебель-петля" гистонов, который представляет собой участок связывания мяРНК U7, вовлеченной в процессинг пре-мРНК гистонов в зрелую мРНК гистонов. Например, у морских ежей HDE представляет собой CAAGAAAGA (Dominski, Z. and W.F. Marzluff (2007), Gene 396(2): 373-90).
Кроме того, предпочтительно, чтобы нуклеиновая кислота по настоящему изобретению в первом аспекте не содержала интрон.
В другом конкретном предпочтительном варианте осуществления последовательность нуклеиновой кислоты по изобретению в первом аспекте настоящего изобретения в направлении от 5ʹ-конца к 3ʹ-концу содержит или кодирует:
a) кодирующую область, предпочтительно, кодирующую по меньшей мере один пептид или белок, который содержит терапевтический белок или его фрагмент, вариант или производное;
b) последовательность поли(A) и
c) по меньшей мере одну структуру "стебель-петля" гистонов.
Последовательность нуклеиновой кислоты по изобретению по первому варианту осуществления настоящего изобретения содержит любую подходящую нуклеиновую кислоту, например, выбранную из любой (одноцепочечной или двухцепочечной) ДНК, предпочтительно, без ограничения ими, например, из геномной ДНК, плазмидной ДНК, одноцепочечных молекул ДНК, двухцепочечных молекул ДНК, или ее можно выбирать, например, из любых ПНК (пептидные нуклеиновые кислоты), или ее можно выбирать, например, из любой (одноцепочечной или двухцепочечной) РНК, предпочтительно, матричной РНК (мРНК); и т.д. Также последовательность нуклеиновой кислоты по изобретению может содержать вирусную РНК (вРНК). Однако последовательность нуклеиновой кислоты по изобретению может не быть вирусной РНК или может не содержать вирусной РНК. Более конкретно, последовательность нуклеиновой кислоты по изобретению может не содержать элементов вирусных последовательностей, например, вирусных энхансеров, или вирусных промоторов (например, не содержать инактивированного вирусного промотора или элементов последовательностей, более конкретно, не инактивированных посредством стратегий замен), или других элементов вирусных последовательностей, или последовательностей нуклеиновых кислот вирусов или ретровирусов. Более конкретно, последовательность нуклеиновой кислоты по изобретению может не быть ретровирусным или вирусным вектором или модифицированным ретровирусным или вирусным вектором.
В любом случае, последовательность нуклеиновой кислоты по изобретению может содержать или не содержать энхансерную и/или промоторную последовательности, которые могут быть модифицированными или нет или которые могут быть активированными или нет. Энхансер и/или промотор могут быть экспрессируемыми или неэкспрессируемыми у растений, и/или экспрессируемыми или неэкспрессируемыми у эукариот, и/или экспрессируемыми или неэкспрессируемыми у прокариот. Последовательность нуклеиновой кислоты по изобретению может содержать последовательность, кодирующую (самосплайсируемый) рибозим, или нет.
В конкретных вариантах осуществления последовательность нуклеиновой кислоты по изобретению может представлять собой или может содержать самореплицирующуюся РНК (репликон).
Предпочтительно, последовательность нуклеиновой кислоты по изобретению представляет собой плазмидную ДНК или РНК, в частности, мРНК.
В конкретных вариантах осуществления первого аспекта настоящего изобретения нуклеиновая кислота по изобретению представляет собой последовательность нуклеиновой кислоты, содержащуюся в нуклеиновой кислоте, подходящей для транскрипции in vitro, в частности, в подходящем векторе для транскрипции in vitro (например, в плазмиде или в линейной последовательности нуклеиновой кислоты, содержащей специфические промоторы для транскрипции in vitro, такие как промоторы T3, T7 или Sp6).
В дополнительных конкретных предпочтительных вариантах осуществления первого аспекта настоящего изобретения нуклеиновая кислота по изобретению содержится в нуклеиновой кислоте, подходящей для транскрипции и/или трансляции в экспрессирующей системе (например, в экспрессирующих векторе или плазмиде), в частности, в прокариотической (например, бактерии, такие как E. coli) или эукариотической (например, клетки млекопитающих, такие как клетки CHO, дрожжевые клетки или клетки насекомых, или целые организмы, такие как растения или животные) экспрессирующей системе.
Термин "экспрессирующая система" означает систему (культуру клеток или целые организмы), которая подходит для продукции пептидов, белков или РНК, особенно мРНК (рекомбинантная экспрессия).
Последовательность нуклеиновой кислоты по изобретению в первом аспекте настоящего изобретения содержит или кодирует по меньшей мере одну структуру "стебель-петля" гистонов. Вообще, структура "стебель-петля" (вне зависимости от того, является ли она структурой "стебель-петля" гистонов или нет) может встречаться в одноцепочечной ДНК или, более часто, в РНК. Структура также известна как шпилька или петля шпильки и, как правило, состоит из стебля и (концевой) петли в пределах непрерывной последовательности, где стебель формируется двумя соседними полностью или частично обратно комплементарными последовательностями, разделенными короткой последовательностью в качестве своего рода спейсера, который формирует петлю структуры "стебель-петля". Две соседних полностью или частично обратно комплементарных последовательности можно определять, например, как элементы структуры "стебля-петли" стебель1 и стебель2. Структура "стебель-петля" формируется, когда эти две соседних полностью или частично обратно комплементарных последовательности, например, элементы структуры "стебель-петля" стебель1 и стебель2, формируют пары оснований друг с другом, что приводит к образованию участка двухцепочечной последовательности нуклеиновой кислоты, содержащего на своем конце неспаренную петлю, сформированную короткой последовательностью, расположенной между элементами структуры "стебель-петля" стебель1 и стебель2 на непрерывной последовательности. Таким образом, неспаренная петля, как правило, представляет собой область нуклеиновой кислоты, которая не способна к спариванию оснований ни с каким из этих элементов структуры "стебель-петля". Полученная в результате структура в форме леденца на палочке представляет собой ключевой структурный элемент многих вторичных структур РНК. таким образом формирование структуры "стебель-петля" зависит от стабильности образующихся областей стебля и петли, где первым необходимым условием, как правило, является присутствие последовательностей, которая может загибаться сама на себя с формированием спаренной двойной цепи. Стабильность спаренных элементов структуры "стебель-петля" определяется длиной, количеством содержащихся в ней несоответствий или выпетливаний (небольшое количество несоответствий, как правило, допустимо, особенно в большом двухцепочечном участке) и составом оснований спаренной области. В контексте настоящего изобретения, допустима длина петли от 3 до 15 оснований, хотя более предпочтительная длина петли составляет 3-10 оснований, более предпочтительно, от 3 до 8, от 3 до 7, от 3 до 6 или, еще более предпочтительно, от 4 до 5 оснований, и наиболее предпочтительно, 4 основания. Длина последовательности стебля, формирующей двухцепочечную структуру, как правило, составляет от 5 до 10 оснований, более предпочтительно, от 5 до 8 оснований.
В контексте настоящего изобретения, структура "стебель-петля" гистонов, как правило, происходит из генов гистонов (например, гены семейств гистонов H1, H2A, H2B, H3, H4) и содержит внутримолекулярное спаривание оснований двух соседних полностью или частично обратно комплементарных последовательностей, таким образом, формируя структуру "стебель-петля". Как правило, 3ʹ-UTR структура "стебель-петля" гистонов представляет собой элемент РНК, вовлеченный в ядерно-цитоплазматический транспорт мРНК гистонов и в регуляцию стабильности и эффективности трансляции в цитоплазме. В мРНК генов гистонов многоклеточных отсутствует полиаденилирование и поли-A хвост, вместо этого 3ʹ-концевой процессинг происходит в участке между этими высококонсервативными структурой "стебель-петля" и богатой пуринами областью приблизительно на 20 нуклеотидов ниже (нижерасположенный элемент гистона, или HDE). Структуру "стебель-петля" гистонов связывает связывающий структуру "стебель-петля" белок массой 31 кДа (SLBP, также называемый связывающий шпильку гистонов белок или HBP). Такие структуры "стебель-петля" гистонов, предпочтительно, используют в настоящем изобретении в комбинации с другими элементами и структурами последовательностей, которые не встречаются в природе (что означает у нетрансформированных живых организмов/клеток) в генах гистонов, но которые комбинируют - по изобретению - для получения искусственной, гетерологичной нуклеиновой кислоты. Таким образом, настоящее изобретение, в частности, основано на том открытии, что искусственная (неприродная) комбинация структуры "стебель-петля" гистонов с другими гетерологичными элементами последовательностей, которые не встречаются в генах гистонов или генах гистонов многоклеточных и выделены из функциональных и/или регуляторных областей последовательностей (влияющих на транскрипцию и/или трансляцию) генов, кодирующих белки, отличные от гистонов, обеспечивает благоприятное действие. Таким образом, в одном из аспектов изобретения предоставлена комбинация структуры "стебель-петля" гистонов с последовательностью поли(A) или последовательностью, представляющей сигнал полиаденилирования (с 3ʹ-конца от кодирующей области), которая не встречается в генах гистонов многоклеточных.
Другим предпочтительным аспектом изобретения является комбинация структура "стебель-петля" гистонов с кодирующей областью, кодирующей терапевтический белок, который, предпочтительно, отсутствует в генах гистона многоклеточных (кодирующая область и последовательность структуры “стебель-петля” гистонов являются гетерологичными). Желательно, чтобы такие терапевтические белки присутствовали в природе в организме млекопитающих, предпочтительно, человека. В другом предпочтительном варианте осуществления изобретения все элементы (а), (b) и (с) нуклеиновой кислоты по настоящему изобретению являются гетерологичными в отношении друг друга и объединены искусственно из трех разных источников, например, (а) кодирующая область терапевтического белка гена человека, (b) структура "стебель-петля" гистонов из нетранслированной области многоклеточного, например, гена гистона млекопитающего, отличного от человека, или человека и (с) последовательность поли(А) или сигнал полиаденилирования, например, из нетранслированной области гена, отличного от гена гистона и отличного от гена, кодирующего терапевтический белок, являющийся элементом (а) нуклеиновой кислоты по настоящему изобретению.
Таким образом, структура "стебель-петля" гистонов представляет собой структуру "стебель-петля", как описано в настоящем документе, которая, если предпочтительно, функционально определена, проявляет/сохраняет свойство связывания с ее природным партнером по связыванию, связывающим структуру "стебель-петля" белком (SLBP, также называемым связывающим шпильку гистонов белком или HBP).
По настоящему изобретению последовательность структуры "стебель-петля" гистонов в соответствии с компонентом (b) по п. 1 может не происходить из гистонового белка мыши. Более конкретно, последовательность структуры "стебель-петля" гистонов может не происходить из гена гистона H2A614 мыши. Также, нуклеиновая кислота по изобретению может не содержать ни последовательности структуры "стебель-петля" гистонов мыши, ни гена гистона H2A614 мыши. Кроме того, последовательность нуклеиновой кислоты по изобретению может не содержать сигнал процессинга структуры "стебель-петля", более конкретно, сигнал процессинга гистонов мыши и, точнее говоря, может не содержать сигнал процессинга структуры "стебель-петля" H2kA614 мыши, даже если последовательность нуклеиновой кислоты по изобретению может содержать по меньшей мере один ген гистона млекопитающих. Однако по меньшей мере один ген гистона млекопитающих может не представлять собой SEQ ID NO: 7 из WO 01/12824.
В одном из предпочтительных вариантов осуществления первого аспекта изобретения последовательность нуклеиновой кислоты по изобретению содержит или кодирует по меньшей мере одну последовательность структуры "стебель-петля" гистонов, предпочтительно, по меньшей мере по одной из следующих формул (I) или (II):
формула (I) (последовательность структуры "стебель-петля" без граничащих со стеблем элементов):

формула (II) (последовательность структуры "стебель-петля" с граничащими со стеблем элементами):

где:
граничащие со стеблем1 или стеблем2 элементы N1-6 представляют собой непрерывные последовательности из N в количестве от 1 до 6, предпочтительно, от 2 до 6, более предпочтительно, от 2 до 5, еще более предпочтительно, от 3 до 5, наиболее предпочтительно, от 4 до 5 или 5, где каждый N независимо от другого выбран из нуклеотидов, выбранных из A, U, T, G и C или аналогов этих нуклеотидов;
стебель1 [N0-2GN3-5] является обратно комплементарным или частично обратно комплементарным с элементом стебель2 и представляет собой непрерывную последовательность длиной от 5 до 7 нуклеотидов;
где N0-2 представляет собой непрерывную последовательность из N в количестве от 0 до 2, предпочтительно, от 0 до 1, более предпочтительно, 1, где каждый N независимо от другого выбран из нуклеотидов, выбранных из A, U, T, G и C или аналогов этих нуклеотидов;
где N3-5 представляет собой непрерывную последовательность из N в количестве от 3 до 5, предпочтительно, от 4 до 5, более предпочтительно, 4, где каждый N независимо от другого выбран из нуклеотидов, выбранных из A, U, T, G и C или аналогов этих нуклеотидов, и
где G представляет собой гуанозин или его аналог и необязательно может быть замещен цитидином или его аналогом, при условии, что комплементарный ему нуклеотид цитидин в стебле2 замещен гуанозином;
последовательность петли [N0-4(U/T)N0-4] расположена между элементами стебель1 и стебель2, и представляет собой непрерывную последовательность из нуклеотидов в количестве от 3 до 5, более предпочтительно, из 4 нуклеотидов;
где каждая N0-4 не зависит от другой непрерывной последовательности из N в количестве от 0 до 4, предпочтительно, от 1 до 3, более предпочтительно, от 1 до 2, где каждый N независимо от другого выбран из нуклеотидов, выбранных из A, U, T, G и C или аналогов этих нуклеотидов; и
где U/T представляет собой уридин или необязательно тимидин;
стебель2 [N3-5CN0-2] является обратно комплементарным или частично обратно комплементарным с элементом стебель1 и представляет собой непрерывную последовательность из нуклеотидов в количестве от 5 до 7;
где N3-5 представляет собой непрерывную последовательность из N в количестве от 3 до 5, предпочтительно, от 4 до 5, более предпочтительно, 4, где каждый N независимо от другого выбран из нуклеотидов, выбранных из A, U, T, G и C или аналогов этих нуклеотидов;
где N0-2 представляет собой непрерывную последовательность из N в количестве от 0 до 2, предпочтительно, от 0 до 1, более предпочтительно, 1, где каждый N независимо от другого выбран из нуклеотидов, выбранных из A, U, T, G или C или аналогов этих нуклеотидов; и
где C представляет собой цитидин или его аналог и необязательно может быть замещен гуанозином или его аналогом при условии, что комплементарный ему нуклеотид гуанозин в стебле1 замещен цитидином;
где
стебель1 и стебель2 способны к спариванию оснований друг с другом с формированием обратно комплементарной последовательности, где спаривание оснований может происходить между стеблем1 и стеблем2, например, посредством спаривания оснований по Уотсону-Крику нуклеотидов A и U/T или G и C или посредством не уотсон-криковского спаривания оснований, например, спаривания неоднозначных пар оснований, обратного спаривания оснований по Уотсону-Крику, хугстиновского спаривания оснований, обратного хугстиновского спаривания оснований, или они способны к спариванию оснований друг с другом с формированием частично обратно комплементарной последовательности, где между стеблем1 и стеблем2 может происходить неполное спаривание оснований на основании того, что одно или несколько оснований в одном из стеблей не имеют комплементарного основания в обратно комплементарной последовательности другого стебля.
В указанном выше контексте спаривание неоднозначных пар оснований, как правило, представляет собой не уотсон-криковское спаривание оснований двух нуклеотидов. В контексте настоящего изобретения четыре основные неоднозначные пары оснований, которые можно использовать, представляют собой гуанозин-уридин, инозин-уридин, инозин-аденозин, инозин-цитидин (G-U/T, I-U/T, I-A и I-C) и аденозин-цитидин (A-C).
Таким образом, в контексте настоящего изобретения, неоднозначное основание представляет собой основание, которое формирует неоднозначную пару оснований с другим основанием, как описано выше. Таким образом, в стебле структуры "стебель-петля" гистонов по настоящему изобретению может встречаться не уотсон-криковское спаривание оснований, например, спаривание неоднозначных пар оснований.
В указанном выше контексте частично обратно комплементарная последовательность в структуре стебля последовательности структуры "стебель-петля" содержит максимально 2, предпочтительно, только одно несоответствие, формируемое спариванием оснований стебля1 и стебля2. Другими словами, стебель1 и стебель2, предпочтительно, способны к (полному) спариванию оснований друг с другом на всем протяжении всех последовательностей стебель1 и стебель2 (100% из возможных корректных уотсон-криковских или не уотсон-криковских спариваний оснований), таким образом, формируя обратно комплементарную последовательность, где каждое основание имеет свое корректное уотсон-криковское или не уотсон-криковское дополнительное основание в качестве комплементарного партнера по связыванию. Альтернативно, стебель1 и стебель2, предпочтительно, способны к частичному спариванию оснований друг с другом на всем протяжении всех последовательностей стебель1 и стебель2, где по меньшей мере приблизительно 70%, 75%, 80%, 85%, 90% или 95% из 100% возможных корректных уотсон-криковских или не уотсон-криковских спариваний оснований участвуют в корректном уотсон-криковском или не уотсон-криковском спаривании оснований, а максимум приблизительно 30%, 25%, 20%, 15%, 10% или 5% из оставшихся оснований являются неспаренными.
В предпочтительно варианте осуществления первого аспекта изобретения по меньшей мере одна последовательность структуры "стебель-петля" гистонов (с граничащими со стеблем элементами) длина последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, составляет приблизительно от 15 до приблизительно 45 нуклеотидов, предпочтительно, приблизительно от 15 до приблизительно 40 нуклеотидов, предпочтительно, приблизительно от 15 до приблизительно 35 нуклеотидов, предпочтительно, приблизительно от 15 до приблизительно 30 нуклеотидов и еще более предпочтительно, приблизительно от 20 до приблизительно 30, а наиболее предпочтительно, приблизительно от 24 до приблизительно 28 нуклеотидов.
В дополнительном предпочтительном варианте осуществления первого аспекта изобретения по меньшей мере длина одной последовательности структуры "стебель-петля" гистонов (без граничащих со стеблем элементов) последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, составляет приблизительно от 10 до приблизительно 30 нуклеотидов, предпочтительно, приблизительно от 10 до приблизительно 20 нуклеотидов, предпочтительно, приблизительно от 12 до приблизительно 20 нуклеотидов, предпочтительно, приблизительно от 14 до приблизительно 20 нуклеотидов и еще более предпочтительно, приблизительно от 16 до приблизительно 17, а наиболее предпочтительно, приблизительно 16 нуклеотидов.
В дополнительном предпочтительном варианте осуществления первого аспекта изобретения последовательность нуклеиновой кислоты по изобретению в первом аспекте настоящего изобретения может содержать или кодировать по меньшей мере одну последовательность структуры "стебель-петля" гистонов по меньшей мере по одной из следующих определенных формул (Ia) или (IIa):
формула (Ia) (последовательность структуры "стебель-петля" без граничащих со стеблем элементов):

формула (IIa) (последовательность структуры "стебель-петля" с граничащими со стеблем элементами):

где:
N, C, G, T и U являются такими, как определено выше.
В дополнительном еще более предпочтительном варианте первого аспекта последовательность нуклеиновой кислоты по изобретению может содержать или кодировать по меньшей мере одну последовательность структуры "стебель-петля" гистонов по меньшей мере по одной из следующих определенных формул (Ib) или (IIb):
формула (Ib) (последовательность структуры "стебель-петля" без граничащих со стеблем элементов):

формула (IIb) (последовательность структуры "стебель-петля" с граничащими со стеблем элементами):

где: N, C, G, T и U являются такими, как определено выше.
В еще более предпочтительном варианте осуществления первого аспекта изобретения последовательность нуклеиновой кислоты по изобретению первого аспекта настоящего изобретения может содержать или кодировать по меньшей мере одну последовательность структуры "стебель-петля" гистонов по меньшей мере по одной из следующих определенных формул (Ic)-(Ih) или (IIc)-(IIh), альтернативно представленной в виде ее структуры "стебель-петля" и в виде линейной последовательности, представляющей последовательности структур "стебель-петля" гистонов как получают в соответствии с Примером 1:
формула (Ic): (консенсусная последовательность структуры "стебель-петля" гистонов многоклеточных и простейших без граничащих со стеблем элементов):


(линейная последовательность) (SEQ ID NO: 1),
формула (IIc): (консенсусная последовательность структуры "стебель-петля" гистонов многоклеточных и простейших с граничащими со стеблем элементами):

(линейная последовательность) (SEQ ID NO: 2),
формула (Id): (без граничащих со стеблем элементов)
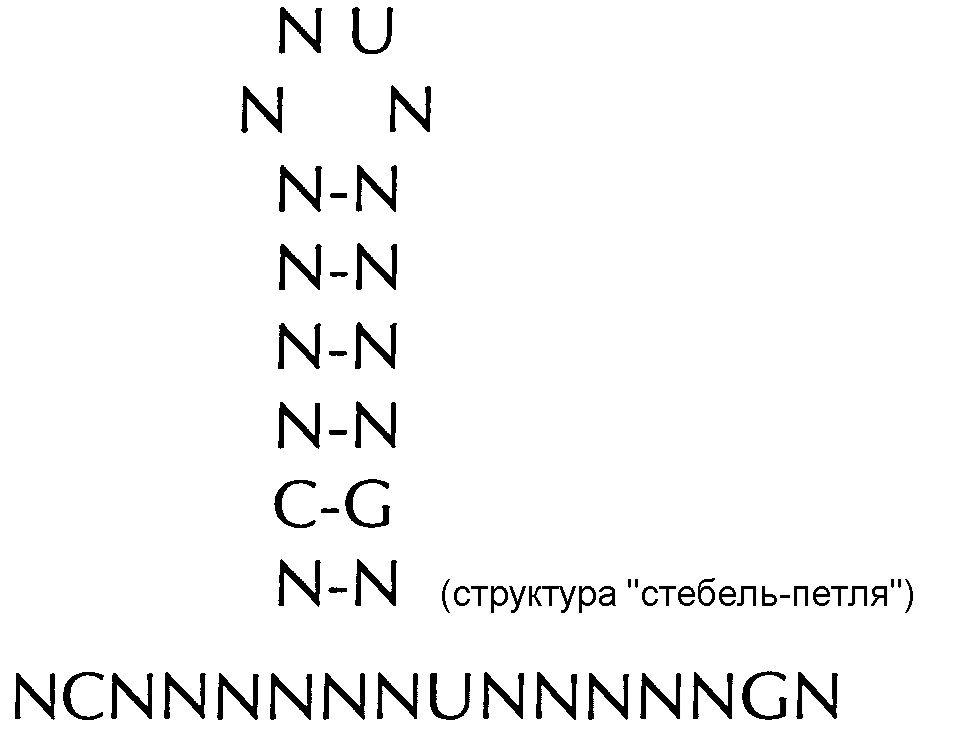
(линейная последовательность) (SEQ ID NO: 3),
формула (IId): (с граничащими со стеблем элементами)

(линейная последовательность) (SEQ ID NO: 4),
формула (Ie): (консенсусная последовательность структуры "стебель-петля" гистонов простейших без граничащих со стеблем элементов)

(линейная последовательность) (SEQ ID NO: 5),
формула (IIe): (консенсусная последовательность структуры "стебель-петля" гистонов простейших с граничащими со стеблем элементами)

(линейная последовательность) (SEQ ID NO: 6),
формула (If): (консенсусная последовательность структуры "стебель-петля" гистонов многоклеточных без граничащих со стеблем элементов)

(линейная последовательность) (SEQ ID NO: 7),
формула (IIf): (консенсусная последовательность структуры "стебель-петля" гистонов многоклеточных с граничащими со стеблем элементами)

(линейная последовательность) (SEQ ID NO: 8)
формула (Ig): (консенсусная последовательность структуры "стебель-петля" гистонов позвоночных без граничащих со стеблем элементов)
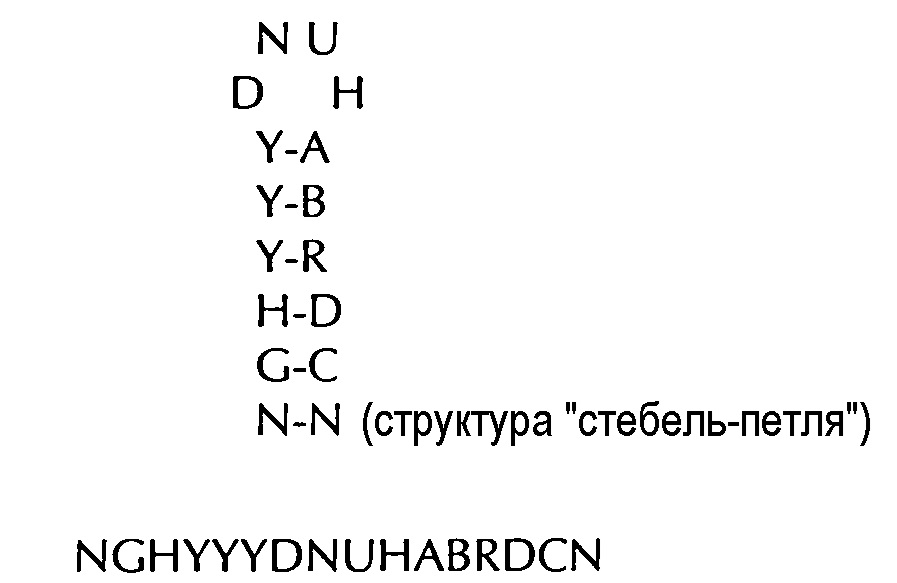
(линейная последовательность) (SEQ ID NO: 9),
формула (IIg): (консенсусная последовательность структуры "стебель-петля" гистонов позвоночных с граничащими со стеблем элементами)

(линейная последовательность) (SEQ ID NO: 10),
формула (Ih): (консенсусная последовательность структуры "стебель-петля" гистонов человека (Homo sapiens) без граничащих со стеблем элементов)

(линейная последовательность) (SEQ ID NO: 11),
формула (IIh): (консенсусная последовательность структуры "стебель-петля" гистонов человека (Homo sapiens) с граничащими со стеблем элементами)

(линейная последовательность) (SEQ ID NO: 12),
где в каждой из указанных выше формул (Ic)-(Ih) или (IIc)-(IIh):
N, C, G, A, T и U являются такими, как определено выше;
каждый U можно замещать T;
каждый (высоко)консервативный G или C в элементах стебля 1 и 2 можно замещать комплементарным ему нуклеотидным основанием C или G, при условии, что комплементарный ему нуклеотид в соответствующем стебле параллельно замещен комплементарным ему нуклеотидом; и/или
G, A, T, U, C, R, Y, M, K, S, W, H, B, V, D и N представляют собой нуклеотидные основания, как определено в следующей таблице:
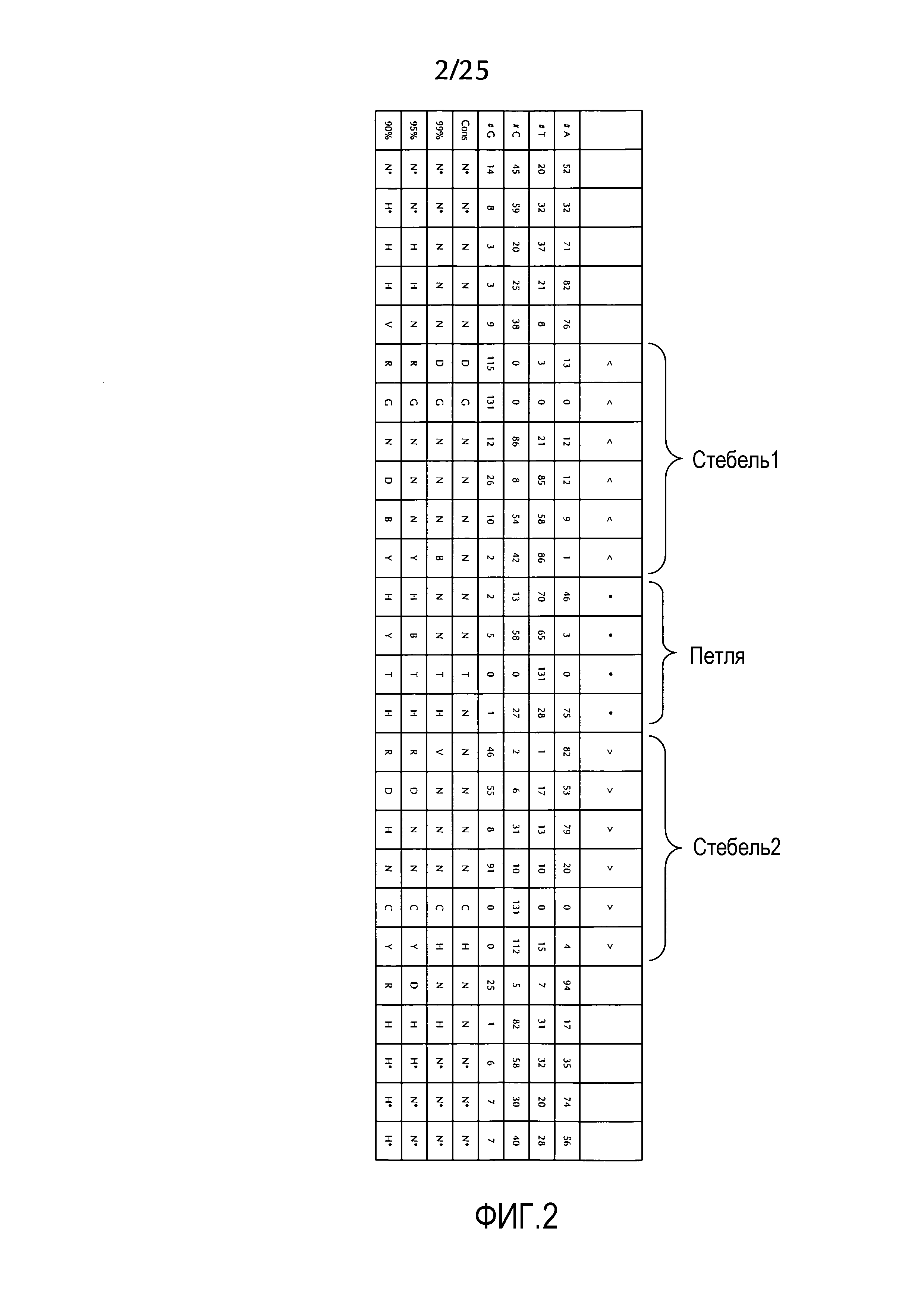
В этом контексте особенно предпочтительно, чтобы последовательность структуры "стебель-петля" гистонов по меньшей мере по одной из формул (I) или (Ia)-(Ih), или (II), или (IIa)-(IIh) по настоящему изобретению была выбрана из природных последовательностей структур "стебель-петля" гистонов, еще более предпочтительно, из последовательностей структур "стебель-петля" гистонов простейших или многоклеточных, и даже еще более предпочтительно, из последовательностей структур "стебель-петля" гистонов позвоночных, а наиболее предпочтительно, млекопитающих, особенно из последовательностей структур "стебель-петля" гистонов человека.
В особенно предпочтительном варианте осуществления первого аспекта последовательность структуры "стебель-петля" гистонов по меньшей мере по одной из определенных формул (I) или (Ia)-(Ih) или (II) или (IIa)-(IIh) по настоящему изобретению представляет собой последовательность структуры "стебель-петля" гистонов, в каждом положении нуклеотида содержащая наиболее часто встречающийся нуклеотид или любой из наиболее часто встречающегося или второго по частоте встречаемости нуклеотида природных последовательностей структур "стебель-петля" гистонов многоклеточных и простейших (фиг. 1), простейших (фиг. 2), многоклеточных (фиг. 3), позвоночных (фиг. 4) и человека (фиг. 5), как представлено на фиг. 1-5. В этом контексте особенно предпочтительно, чтобы по меньшей мере 80%, предпочтительно, по меньшей мере 85% или, наиболее предпочтительно, по меньшей мере 90% всех нуклеотидов соответствовали нуклеотидам, наиболее часто встречающимся в природных последовательностей структур "стебель-петля" гистонов.
В дополнительном конкретном варианте первого аспекта последовательность структуры "стебель-петля" гистонов по меньшей мере по одной из конкретных формул (I) или (Ia)-(Ih) по настоящему изобретению выбрана из приведенных ниже последовательностей структур "стебель-петля" гистонов (без граничащих со стеблем элементов), представляющих последовательности структур "стебель-петля" гистонов, как получено в соответствии с примером 1:
VGYYYYHHTHRVVRCB (SEQ ID NO: 13 по формуле (Ic));
SGYYYTTYTMARRRCS (SEQ ID NO: 14 по формуле (Ic));
SGYYCTTTTMAGRRCS (SEQ ID NO: 15 по формуле (Ic));
DGNNNBNNTHVNNNCH (SEQ ID NO: 16 по формуле (Ie));
RGNNNYHBTHRDNNCY (SEQ ID NO: 17 по формуле (Ie));
RGNDBYHYTHRDHNCY (SEQ ID NO: 18 по формуле (Ie));
VGYYYTYHTHRVRRCB (SEQ ID NO: 19 по формуле (If));
SGYYCTTYTMAGRRCS (SEQ ID NO: 20 по формуле (If));
SGYYCTTTTMAGRRCS (SEQ ID NO: 21 по формуле (If));
GGYYCTTYTHAGRRCC (SEQ ID NO: 22 по формуле (Ig));
GGCYCTTYTMAGRGCC (SEQ ID NO: 23 по формуле (Ig));
GGCTCTTTTMAGRGCC (SEQ ID NO: 24 по формуле (Ig));
DGHYCTDYTHASRRCC (SEQ ID NO: 25 по формуле (Ih));
GGCYCTTTTHAGRGCC (SEQ ID NO: 26 по формуле (Ih));
GGCYCTTTTMAGRGCC (SEQ ID NO: 27 по формуле (Ih)).
Кроме того, в этом контексте особенно предпочтительными являются приведенные ниже последовательности структур "стебель-петля" гистонов (с граничащими со стеблем элементами), как получено в соответствии с примером 1 по одной из определенных формул (II) или (IIa)-(IIh):
H*H*HHVVGYYYYHHTHRVVRCBVHH*N*N* (SEQ ID NO: 28 по формуле (IIc));
M*H*MHMSGYYYTTYTMARRRCSMCH*H*H* (SEQ ID NO: 29 по формуле (IIc));
M*M*MMMSGYYCTTTTMAGRRCSACH*M*H* (SEQ ID NO: 30 по формуле (IIc));
N*N*NNNDGNNNBNNTHVNNNCHNHN*N*N* (SEQ ID NO: 31 по формуле (IIe));
N*N*HHNRGNNNYHBTHRDNNCYDHH*N*N* (SEQ ID NO: 32 по формуле (IIe));
N*H*HHVRGNDBYHYTHRDHNCYRHH*H*H* (SEQ ID NO: 33 по формуле (IIe));
H*H*MHMVGYYYTYHTHRVRRCBVMH*H*N* (SEQ ID NO: 34 по формуле (IIf));
M*M*MMMSGYYCTTYTMAGRRCSMCH*H*H* (SEQ ID NO: 35 по формуле (IIf));
M*M*MMMSGYYCTTTTMAGRRCSACH*M*H* (SEQ ID NO: 36 по формуле (IIf));
H*H*MAMGGYYCTTYTHAGRRCCVHN*N*M* (SEQ ID NO: 37 по формуле (IIg));
H*H*AAMGGCYCTTYTMAGRGCCVCH*H*M* (SEQ ID NO: 38 по формуле (IIg));
M*M*AAMGGCTCTTTTMAGRGCCMCY*M*M* (SEQ ID NO: 39 по формуле (IIg));
N*H*AAHDGHYCTDYTHASRRCCVHB*N*H* (SEQ ID NO: 40 по формуле (IIh));
H*H*AAMGGCYCTTTTHAGRGCCVMY*N*M* (SEQ ID NO: 41 по формуле (IIh));
H*M*AAAGGCYCTTTTMAGRGCCRMY*H*M* (SEQ ID NO: 42 по формуле (IIh)).
В дополнительном предпочтительном варианте осуществления первого аспекта изобретения последовательность нуклеиновой кислоты по изобретению содержит или кодирует по меньшей мере одну последовательность структуры "стебель-петля" гистонов демонстрирующую по меньшей мере приблизительно 80%, предпочтительно, по меньшей мере приблизительно 85%, более предпочтительно, по меньшей мере приблизительно 90% или еще более предпочтительно, по меньшей мере приблизительно 95% идентичности последовательности не со 100% консервативных нуклеотидов в последовательностях структур "стебель-петля" гистонов по меньшей мере по одной из определенных формул (I) или (Ia)-(Ih) или (II) или (IIa)-(IIh) или с природной последовательностью структуры "стебель-петля" гистонов.
В предпочтительном варианте осуществления последовательность структуры "стебель-петля" гистонов не содержит последовательность петли 5ʹ-UUUC-3ʹ. Более конкретно, структура "стебель-петля" гистонов не содержит последовательность стебель1 5ʹ-GGCUCU-3ʹ и/или последовательность стебель2 5ʹ-AGAGCC-3ʹ, соответственно. В другом предпочтительном варианте осуществления последовательность структуры "стебель-петля" не содержит последовательность петли 5ʹ-CCUGCCC-3ʹ или последовательность петли 5ʹ-UGAAU-3ʹ. Более конкретно, стебель-петля не содержит последовательность стебель1 5ʹ-CCUGAGC-3ʹ или не содержит последовательность стебель1 5ʹ-ACCUUUCUCCA-3ʹ и/или последовательность стебель2 5ʹ-GCUCAGG-3ʹ или 5ʹ-UGGAGAAAGGU-3ʹ, соответственно. Также, поскольку изобретение конкретно не ограничено последовательностями структур "стебель-петля" гистонов, последовательности структур "стебель-петля" предпочтительно, не происходят из 3ʹ-нетранслируемой области рецептора инсулина млекопитающих. Также предпочтительно, нуклеиновая кислота по изобретению может не содержать сигналы процессинга структур "стебель-петля" гистонов, в частности, не содержать сигналы процессинга структур "стебель-петля" гистонов, происходящие из гена гистона H2A614 мыши (H2kA614).
Последовательность нуклеиновой кислоты по изобретению в первом аспекте настоящего изобретения, необязательно, может содержать или кодировать последовательность поли(A). Если присутствует, то такая последовательность поли(A) содержит последовательность длиной приблизительно от 25 до приблизительно 400 аденозиновых нуклеотидов, предпочтительно, последовательность длиной приблизительно от 30 или, более предпочтительно, приблизительно от 50 до приблизительно 400 аденозиновых нуклеотидов, более предпочтительно, последовательность длиной приблизительно от 50 до приблизительно 300 аденозиновых нуклеотидов, еще более предпочтительно, последовательность длиной приблизительно от 50 до приблизительно 250 аденозиновых нуклеотидов, наиболее предпочтительно, последовательность длиной приблизительно от 60 до приблизительно 250 аденозиновых нуклеотидов. В этом контексте термин "приблизительно" относится к отклонению ±10% от значения(ий), к которому он добавлен. Таким образом, последовательность поли(A) содержит по меньшей мере 25 или более чем 25, более предпочтительно, по меньшей мере 30, более предпочтительно, по меньшей мере 50 аденозиновых нуклеотидов. Таким образом, такая последовательность поли(A), как правило, не содержит менее 20 аденозиновых нуклеотидов. Более конкретно, последовательность не содержит 10 и/или менее 10 аденозиновых нуклеотидов.
Предпочтительно, нуклеиновая кислота по настоящему изобретению не содержит одного или двух, или по меньшей мере одного или всех, но один или все из компонентов из группы, состоящей из: последовательности, кодирующей рибозим (предпочтительно, самосплайсируемый рибозим), вирусной последовательности нуклеиновой кислоты, сигнала процессинга структуры "стебель-петля" гистонов, в частности, последовательности процессинга структуры "стебель-петля" гистонов, происходящей из гена гистона H2A614 мыши, гена Neo, инактивированной промоторной последовательности и инактивированной энхансерной последовательности. Еще более предпочтительно, нуклеиновая кислота по изобретению не содержит рибозима, предпочтительно, самосплайсируемого рибозима, и одного элемента из группы, состоящей из: гена Neo, инактивированной промоторной последовательности, инактивированной энхансерной последовательности, сигнала процессинга структуры "стебель-петля" гистонов, в частности, последовательности процессинга структуры "стебель-петля" гистонов, происходящей из гена гистона H2A614 мыши. Таким образом, нуклеинов кислота в предпочтительном варианте осуществления может не содержать ни рибозима, предпочтительно, самосплайсируемого рибозима, ни гена Neo или, альтернативно, ни рибозима, предпочтительно, самосплайсируемого рибозима, ни какого-либо гена устойчивости (например, как правило, используемого для отбора). В другом предпочтительном варианте осуществления нуклеиновая кислота по изобретению может не содержать ни рибозима, предпочтительно, самосплайсируемого рибозима, ни сигнала процессинга структуры "стебель-петля" гистонов, в частности, последовательности процессинга структуры "стебель-петля" гистонов, происходящей из гена гистона H2A614 мыши.
Альтернативно, в первом аспекте настоящего изобретения нуклеотидная последовательность по изобретению необязательно содержит сигнал полиаденилирования, который определен в настоящем документе как сигнал, который осуществляет полиаденилирование (транскрибируемой) мРНК посредством специфических белковых факторов (например, специфического фактора расщепления и полиаденилирования (CPSF), фактора стимуляции расщепления (CstF), факторов расщепления I и II (CF I и CF II), поли(A)-полимеразы (PAP)). В этом контексте консенсусный сигнал полиаденилирования, предпочтительно, содержит консенсусную последовательность NN(U/T)АNA. В конкретном предпочтительном аспекте сигнал полиаденилирования содержит одну из следующих последовательностей: AA(U/T)AAA или A(U/T)(U/T)AAA (где уридин, как правило, присутствует в РНК, а тимидин, как правило, присутствует в ДНК). В некоторых вариантах осуществления сигнал полиаденилирования, используемый в нуклеиновой кислоте по изобретению, не соответствует последовательностям мяРНК U3, U5, сигнала процессинга полиаденилирования из гена G-CSF человека или сигнала полиаденилирования SV40. В частности, указанные выше сигналы полиаденилирования не комбинируют ни с какими генам устойчивости к антибиотикам (или какими-либо другими репортерными, маркерными или селективными генами), в частности, не с геном устойчивости neo (неомицинфосфотрансфераза) (в качестве гена кодирующей области в соответствии с элементом (a) нуклеиновой кислоты по изобретению. И в нуклеиновой кислоте по изобретению никакой из указанных выше сигналов полиаденилирования (которые, как правило, не присутствуют в нуклеиновой кислоте по изобретению), предпочтительно, не комбинируют со структурой "стебель-петля" гистонов или сигналом процессинга структуры "стебель-петля" гистонов из гена гистона H2A614 мыши.
Последовательность нуклеиновой кислоты в первом аспекте настоящего изобретения далее кодирует белок или пептид, содержащий терапевтический белок или его фрагмент, вариант или производное.
Терапевтические белки по настоящему изобретению являются пептидами или белками, которые оказывают благоприятное воздействие при лечении любого наследственного или приобретенного заболевания или улучшают состояние индивида. Терапевтические белки играют важную роль при создании терапевтических средств, способных наряду с другими функциями модифицировать и устранять генетические ошибки, разрушать раковые клетки или клетки, инфицированные патогенными организмами, лечить нарушения иммунной системы, лечить метаболические или эндокринные нарушения. Например, эритропоэтин (ЕРО), белковый гормон, может быть использован для лечения индивида с недостаточностью эритроцитов, что является распространенной причиной осложнений, поражающих почки. В определение терапевтических белков входят адъювантные белки и терапевтические антитела, применяемые также в гормонозаместительной терапии, например, для лечения женщин в период менопаузы. В новейших методах лечения соматические клетки индивида используют для перепрограммирования их в плюрипотентные стволовые клетки, которые заменяют вызывающее споры лечение стволовыми клетками. Указанные белки, используемые для перепрограммирования соматических клеток или для дифференцировки стволовых клеток, определяются в настоящем описании изобретения как терапевтические белки. Терапевтические белки могут быть также использованы для других целей, например, для заживления ран, регенерации тканей, развития кровеносных сосудов и т.д.
Терапевтические белки могут быть использованы для разных целей, включая лечение разных заболеваний, таких как, например, инфекционные заболевания, новообразования (например, раковые или опухолевые заболевания), заболевания крови и кроветворных органов, заболевания эндокринной системы, заболевания, связанные с питанием и обменом веществ, заболевания нервной системы, заболевания сердечно-сосудистой системы, заболевания дыхательной системы, заболевания пищеварительной системы, заболевания кожи и подкожной ткани, заболевания костно-мышечной системы и соединительной ткани и заболевания мочеполовой системы, независимо от того, являются ли указанные заболевания наследственными или приобретенными.
В данном контексте особенно предпочтительные терапевтические белки, которые могут быть использованы наряду с прочим для лечения метаболических или эндокринных нарушений, выбраны из следующих белков: кислая сфингомиелиназа (болезнь Ниманна-Пика), адипотид (ожирение), бета-агалсидаза (галактозидаза А человека) (болезнь Фабри; предотвращает накопление липидов, которые могут вызвать осложнения, поражающие почки и сердечно-сосудистую систему), альглюкозидаза (болезнь Помпе (гликогеновая болезнь II типа)), альфа-галактозидаза А (альфа-GAL A, альфа-агалсидаза) (болезнь Фабри), альфа-глюкозидаза (гликогеновая болезнь (GSD), Morbus Pompe), альфа-L-идуронидаза (мукополисахаридозы (MPS), синдром Гурлер, синдром Шейе), альфа-N-ацетилглюкозаминидаза (синдром Санфилиппо), амфирегулин (рак, метаболическое нарушение), ангиопоэтин (Ang1, Ang2, Ang3, Ang4, ANGPTL2, ANGPTL3, ANGPTL4, ANGPTL5, ANGPTL6, ANGPTL7) (ангиогенез, укрепление сосудов), бетацеллюлин (метаболическое нарушение), бета-глюкуронидаза (синдром Слая), костный морфогенетический белок (ВМР) (ВМР1, ВМР2, ВМР3, ВМР4, ВМР5, ВМР6, ВМР7, ВМР8а, ВМР8b, ВМР10, ВМР15) (регенеративный эффект, костные заболевания, хроническое заболевание почек (CKD)), белок CLN6 (атипичная поздняя инфантильность, вариант позднего развития, раннее взросление, липофусциноз нервных клеток (NCL)), эпидермальный фактор роста (EGF) (заживление ран, регуляция роста, пролиферации и дифференцировки клеток), эпиген (метаболическое нарушение), эпирегулин (метаболическое нарушение), фактор роста фибробластов (FGF, FGF-1, FGF-2, FGF-3, FGF-4, FGF-5, FGF-6, FGF-7, FGF-8, FGF-9, FGF-10, FGF-11, FGF-12, FGF-13, FGF-14, FGF-16, FGF-17, FGF-17, FGF-18, FGF-19, FGF-20, FGF-21, FGF-22, FGF-23) (заживление ран, ангиогенез, эндокринные нарушения, регенерация тканей), галсульфаза (мукополисахаридоз VI), грелин (синдром раздраженной толстой кишки (IBS), ожирение, синдром Прадера-Вилли, сахарный диабет II типа), глюкоцеребросидаза (болезнь Гоше), GM-CSF (регенеративный эффект, образование лейкоцитов, рак), гепаринсвязывающий EGF-подобный фактор роста (HB-EGF) (заживление ран, сердечная гипертрофия, развитие и функционирование сердца), фактор роста гепатоцитов (HGF) (регенеративный эффект, заживление ран), гепцидин (нарушения метаболизма железа, бета-талассемия), альбумин человека (пониженное образование альбумина (гипопротеинемия), повышенная потеря альбумина (нефротический синдром), гиповолемия гипербилирубинемия), идурсульфаза (идуронат-2-сульфатаза) (мукополисахаридоз II (синдром Гунтера)), интегрины αVβ3, αVβ5 и α5β1 (связывание макромолекул матрикса и протеиназ, ангиогенез), лудуронат-сульфатаза (синдром Гунтера), ларонидаза (формы мукополисахаридоза I Гурлера и Гурлера-Шейе), N-ацетилгалактозамин-4-сульфатаза (rhASB, галсульфаза, арилсульфатаза А (ARSA), арилсульфатаза В (ARSB) (недостаточность арилсульфатазы В, синдром Марото-Лами, мукополисахаридоз VI), N-ацетилглюкозамин-6-сульфатаза (синдром Санфилиппо), фактор роста нервов (NGF, нейротрофический фактор головного мозга (BDNF), нейротрофин-3 (NT-3) и нейротрофин 4/5 (NT-4/5) (регенеративный эффект, сердечно-сосудистые заболевания, атеросклероз коронарной артерии, ожирение, диабет 2 типа, метаболический синдром, острая коронарная недостаточность, слабоумие, депрессия, шизофрения, аутизм, синдром Ретта, нейрогенная анорексия, нейрогенная булимия, заживление ран, кожные язвы, язвы роговицы, болезнь Альцгеймера), нейрегулин (NRG1, NRG2, NRG3, NRG4) (метаболическое нарушение, шизофрения), нейропилин (NRP-1, NRP-2) (развитие кровеносных сосудов, центральный хроматолиз, выживание клеток, миграция клеток), обестатин (синдром раздраженной толстой кишки (IBS), ожирение, синдром Прадера-Вилли, сахарный диабет II типа), фактор роста тромбоцитов (PDGF) (PDGF-A, PDGF-B, PDGF-C, PDGF-D) (регенеративный эффект, заживление ран, нарушение развития кровеносных сосудов, артериосклероз, фиброз, рак), рецепторы бета-TGF (эндоглин, рецептор бета-TGF 1, рецептор бета-TGF 2, рецептор бета-TGF 3) (фиброз почки, почечная болезнь, диабет, последняя стадия почечной болезни (ESRD), развитие кровеносных сосудов), тромбопоэтин (ТНРО) (фактор роста и развития мегакариоцитов (МСDF)) (нарушения тромбоцитов, тромбоциты для переливания, восстановление числа тромбоцитов после химиотерапии, направленной на подавление функции костного мозга), трансформирующий фактор роста (TGF) (TGF-a, бета-TGF (TGFbeta1, TGFbeta2 и TGFbeta3)) (регенеративный эффект, заживление ран, иммунитет, рак, порок сердца, диабет, синдром Марфана, синдром Лоеса-Дитца), VEGF (VEGF-A, VEGF-B, VEGF-C, VEGF-D, VEGF-E, VEGF-F и PIGF) (регенеративный эффект, развитие кровеносных сосудов, заживление ран, рак, проницаемость сосудов), незиритид (острая декомпенсированная застойная сердечная недостаточность), трипсин (пролежень, циркуляторная варикозная язва, хирургическая оработка струпа, спонтанно раскрывающаяся рана, солнечная эритема, мекониевая непроходимость кишечника), адренокортикотрофический гормон (АСТН) (болезнь Аддисона, мелкоклеточный рак, адренолейкодистрофия, врожденная гиперплазия надпочечников, синдром Кушинга, синдром Нельсона, детские спазмы), пептид натрийуретика предсердия (ANP) (эндокринные нарушения), холецистокинин (смешанная инфекция), гастрин (гипогастринемия), лептин (диабет, гипертриглицеридемия, ожирение), окситоцин (стимулирует грудное вскармливание, медленные роды), соматостатин (симптоматическое лечение карциноидного синдрома, кровотечение из варикозно расширенных вен, акромегалия, поликистозные заболевания печени и почек, акромегалия и симптомы, вызываемые нейроэндокринными опухолями), вазопрессин (антидиуретический гормон), (несахарный диабет), кальцитонин (постклимактерический остеопороз, гиперкальциемия, болезнь Паджета, костные метастазы, фантомная боль, стеноз спинного мозга), эксенатид (диабет 2 типа, не поддающийся лечению метформином и сульфонилмочевиной), гормон роста (GH), соматотропин (замедление роста из-за недостаточности GH или хроническая почечная недостаточность, синдром Прадера-Вилли, синдром Тернера, истощение или кахексия при СПИДе при проведении антивирусной терапии), инсулин (сахарный диабет, диабетический кетоацидоз, гииперкалиемия), инсулиноподобный фактор роста 1 (IGF-1) (нарушение роста у детей при делеции гена СН или тяжелой первичной недостаточности IGF-1, нейродегенеративное заболевание, сердечно-сосудисные заболевания, сердечная недостаточность), мекасермин ринфабат, аналог IGF-1 (нарушение роста у детей при делеции гена СН или тяжелой первичной недостаточности IGF-1, нейродегенеративное заболевание, сердечно-сосудисные заболевания, сердечная недостаточность), мекасермин, аналог IGF-1 (нарушение роста у детей при делеции гена СН или тяжелой первичной недостаточности IGF-1, нейродегенеративное заболевание, сердечно-сосудисные заболевания, сердечная недостаточность), пегвисомант (акромегалия), прамлинтид (сахарный диабет, в сочетании с инсулином), терипаратид (остатки 1-34 паратиреоидного гормона человека) (тяжелая форма остеопороза), бекаплермин (вспомогательное средство при хирургической обработке диабетических язв), альфа-диботермин (костный морфогенетический белок 2) (хирургическое лечение артродеза позвонков, лечение переломов костей), ацетат гистрелина (гонадотропный гормон, GnRH) (преждевременное половое созревание), октреотид (акромегалия, симптоматическое лечение VIP-секретирующей аденомы и ментастазирующих карциноидных опухолей) и палифермин (фактор роста кератиноцитов, KGF) (тяжелая форма воспаления слизистой оболочки полости рта у индивидов, проходящих лечение химиотерапией, заживление ран). (В скобках указано конкретное заболевание, для лечения которого использован терапевтический белок). Вышеуказанные и другие белки считаются терапевтическими, так как предназначены для лечения индивида путем замены дефектного эндогенного белка продуцированием функционального белка в достаточном количестве. Поэтому такие терапевтические белки обычно являются белками млекопитающего, в частности, белками человека.
Для лечения болезней крови, заболеваний сердечно-сосудистой системы, заболеваний дыхательной системы, раковых или опухолевых заболеваний, инфекционных заболеваний или иммунодефицитов могут быть использованы следующие терапевтические белки: альтеплаза (активатор плазминогена ткани, tPA) (эмболия легочной артерии, инфаркт миокарда, инсульт, окклюзия центральной вены), анистреплаза (тромболиз), антитромбин III (AT-III) (наследственная недостаточность АТ-III, тромбоэмболия), бивалирудин (уменьшает риск тромбообразования при реконструкции коронарных сосудов и вызванная гепарином тромбоцитопения), альфа-дарбепоэтин (лечение анемии у индивидов, страдающих хронической почечной недостаточностью (+/- диализ)), альфа-дротрекогин (активированный белок С) (сильный сепсис с высоким риском смерти), эритропоэтин, альфа-эпоэтин, эртропоэтин (анемия при хроническом заболевании, миелодисплазия, анемия вследствие почечной недостаточности или химиотерапии, подготовка к операции), фактор IX (гемофилия В), фактор VIIa (кровотечение у индивидов, страдающих гемофилией А или В и ингибиторы фактора VIII или фактора IX), фактор VIII (гемофилия А), лепирудин (вызванная гепарином тромбоцитопения), концентрат белка С (тромбоз вен, молниеносная пурпура), ретеплаза (белок делеции tPA) (лечение острого инфаркта миокарда, улучшение функции желудочков сердца), стрептокиназа (острый трансмуральный инфаркт миокарда, эмболия легочной артерии, тромбоз глубоких вен, тромбоз или эмболия артерий, окклюзия артериовенозного катетера), тенектеплаза (острый инфаркт миокарда), урокиназа (эмболия легочной артерии), ангиостатин (рак), иммунотоксин против CD22 (рецидивирующий CD33+ острый миелоидный лейкоз), денилейкин дифтитокс (кожная Т-клеточная лимфома (СTCL)), иммуноцианин (рак мочевого пузыря и предстательной железы), MPS (металлопанстимулин) (рак), афиберцепт (немелкоклеточный рак легкого (NSCLC), метастазирующий колоректальный рак (mCRC), невосприимчивый к гормонам метастазирующий рак предстательной железы, дегенерация желтого пятна), эндостатин (рак, воспалительные заболевания, подобные ревматоидному артриту, а также болезнь Крона, диабетическая ретинопатия, псориаз и эндометриоз), коллагеназа (хирургическая обработка хронических кожных язв и сильно обожженных участков кожи, контрактура Дюпюитрена, болезнь Пейрони), дезоксирибонуклеаза I человека, дорназа (муковисцидоз; уменьшает инфекционное поражение дыхательных путей индивидов, у которых FVC превышает 40% от прогнозированного значения), гиалуронидаза (используется в качестве адъюванта для увеличения адсорбции и диспергирования инъецируемых лекарственных средств, в частности, анестезирующих средств при офтальмологических микрохирургических операциях, и определенных визуализирующих агентов), папаин (хирургическая обработка некротических тканей или разжижение отторгающихся некротических масс в случае острых и хронических поражений, таких как пролежни, варикозные и диабетические язвы, ожоги, послеоперационные раны, дермоидные фистулы, карбункулы и другие раны), L-аспарагиназа (острый лимфолейкоз, требующий экзогенного аспарагина для пролиферации), Peg-аспарагиназа (острый лимфолейкоз, требующий экзогенного аспарагина для пролиферации), расбуриказа (дети с лейкозом, лимфомой и солидными опухолями, проходящие курс противораковой терапии, которая может вызвать синдром лизиса опухоли), хорионический гонадотропин человека (HCG) (вспомогательная репродукция), фолликулостимулирующий гормон человека (FSH) (вспомогательная репродукция), альфа-лутропин (бесплодие из-за недостаточности лютеинизирующего гормона), пролактин (гипопролактинемия, недостаточность сывороточного пролактина, дисфункция яичников у женщин, состояние тревоги, артериогенная эректильная дисфункция, преждевременная эякуляция, олигоспермия, астеноспермия, гипофункция семенных пузырьков, женский ложный гермафродитизм у мужчин), ингибитор альфа-1-протеиназы (врожденная недостаточность антитрипсина), лактаза (метеоризм, вздутие, колики и диарея из-за непереваривания лактозы), ферменты поджелудочной железы (липаза, амилаза, протеаза) (муковисцидоз, хронический панкреатит, недостаточность поджелудочной железы, шунтирование желудка, непроходимость протока поджелудочной железы, стеаторея, медленное пищеварение, метеоризм, вздутие), аденозиндеаминаза (бычья пегадемаза, PEG-ADA) (тяжелая форма иммунодефицита вследствие недостаточности аденозиндеаминазы), абатацепт (ревматоидный артрит (особенно невосприимчивый к ингибированию TNFa)), алефацепт (бляшкообразующий псориаз), анакинра (ревматоидный артрит), этанерцепт (ревматоидный артрит, юношеский ревматоидный полиартрит, псориатический артрит, анкилозирующий спондилоартрит, бляшкообразующий псориаз), антагонист рецептора интерлейкина-1 (IL-1), анакинра (воспаление и разрушение хряща, обусловленное ревматоидным артритом), тимулин (нейродегенеративные заболевания, ревматизм, нейрогенная анорексия), антагонист альфа-TNF (аутоиммунные нарушения, такие как ревматоидный артрит, анкилозирующий спондилоартрит, болезнь Крона, псориаз, гидраденит, стойкая астма), энфувиртид (ВИЧ-1) и тимозин α1 (гепатит В и С). (В скобках указано конкретное заболевание, при лечении которого использован данный терапевтический белок).
В определение терапевтических белков также входят адъювантные или иммуностимулирующие белки. Адъювантные или иммуностимулирующие белки могут быть использованы в настоящем изобретении для индуцирования, изменения или улучшения иммунной реакции у индивида для лечения конкретного заболевания или для ослабления симптомов заболевания у индивида.
Адъювантные белки могут быть выбраны из адъювантных белков млекопитающего, в частности, человека, которые обычно включают любой белок или пептид человека, способный вызывать врожденную иммунную реакцию (у млекопитающего), например, в виде реакции связывания экзогенного лиганда TLR с TLR. Адъювантные белки человека, предпочтительно, выбраны из группы, состоящей из белков, которые являются компонентами и лигандами сигнальной сети паттерн-распознающих рецепторов, которые включают TLR, NLR, RLH, в том числе TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11; NOD1, NOD2, NOD3, NOD4, NOD5, NALP1, NALP2, NALP3, NALP4, NALP5, NALP6, NALP6, NALP7, NALP7, NALP8, NALP9, NALP10, NALP11, NALP12, NALP13, NALP14, IPAF, NAIP, CIITA, RIG-1, MDA5 и LGP2, трансдукторы сигналов сигнального пути TLR, включающие адапторные белки, например, Trif и Cardif; компоненты сигнального пути мелких GTPаз (RhoA, Ras, Rac1, Cdc42, Rab и т.д.), компоненты сигнального пути РIP (PI3K, Src-киназы и т.д.), компоненты МуD88-зависимого сигнального пути (MyD88, IRAK1, IRAK2, IRAK4, TIRAP, TRAF6 и т.д.), компоненты MyD88-независимого сигнального пути (TICAM1, TICAM2, TRAF6, TBK1, IRF3, TAK1, IRAK1 и т.д.); активированные киназы, включающие, например, Akt, MEKK1, MKK1, MKK3, MKK4, MKK6, MKK7, ERK1, ERK2, GSK3, PKC киназы, PKD киназы, GSK3 киназы, JNK, p38MAPK, TAK1, IKK и ТАК1; активированные факторы транскрипции, включающие, например, NF-κB, c-Fos, c-Jun, c-Myc, CREB, AP-1, Elk-1, ATF2, IRF-3, IRF-7.
Адъювантные белки млекопитающих, в частности, человека, могут быть также выбраны из группы, состоящей из белков теплового шока, таких как HSP10, HSP60, HSP65, HSP70, HSP75 и HSP90, gp96, фибриноген, дополнительный домен А повтора TypIII фибронектина; компонентов системы комплементов, включающих C1q, MBL, C1r, C1s, C2b, Bb, D, MASP-1, MASP-2, C4b, C3b, C5a, C3a, C4a, C5b, C6, C7, C8, C9, CR1, CR2, CR3, CR4, C1qR, C1INH, C4bp, MCP, DAF, H, I, P и CD59, или индуцированных генов-мишеней, включающих, например, бета-дефенсин, белки поверхности клетки; адъювантных белков человека, включающих trif, лиганд flt-3, Gp96 или фибронектин и т.д., или гомолога любых из вышеуказанных адъювантных белков человека.
Адъювантные белки млекопитающих, в частности, человека, могут также включать цитокины, индуцирующие или усиливающие врожденную иммунную реакцию, которые включают альфа-IL-1, бета-IL-1, IL-2, IL-6, IL-7, IL-8, IL-9, IL-12, IL-13, IL-15, IL-16, IL-17, IL-18, IL-21, IL-23, альфа-TNF, альфа-IFN, бета-IFN, гамма-IFN, GM-CSF, G-CSF, М-CSF; хемокины, включающие IL-8, IP-10, MCP-1, альфа-MIP-1, RANTES, эотаксин, CCL21; цитокины, высвобождаемые из макрофагов, которые включают IL-1, IL-6, IL-8, IL-12 и альфа-TNF, а также IL-1R1 и альфа-IL-1.
Терапевтические белки, предназначенные для лечения болезней крови, заболеваний сердечно-сосудистой системы, заболеваний дыхательной системы, раковых или опухолевых заболеваний, инфекционных заболеваний или иммунодефицитов, или адъювантные белки обычно являются белками млекопитающих, предпочтительно, человека, в зависимости от того, какое животное подлежит лечению. Например, для лечения человека предпочтительно используют терапевтические белки человека.
Адъювантные белки патогенных организмов обычно включают любые адъювантные белки патогенных организмов, способные вызывать врожденную иммунную реакцию (у млекопитающего), и предпочтительно могут быть выбраны из адъювантных белков патогенных организмов, выделяемых из бактерий, простейших, вирусов или грибов и т.д., включающих, например, бактериальные (адъювантные) белки, (адъювантные) белки простейших (например, профилиноподобный белок Toxoplasma gondii), вирусные (адъювантные) белки или грибные (адъювантные) белки и т.д.
Бактериальные (адъювантные) белки могут быть выбраны из группы, состоящей из бактериальных белков теплового шока или белков-компаньонов, включающих Hsp60, Hsp70, Hsp90, Hsp100; OmpA (белок наружной мембраны) из грамотрицательных бактерий; бактериальных поринов, включающих OmpF; бактериальных токсинов, включающих коклюшный токсин (РТ) из Bordetella pertussis, аденилатциклазу коклюшного токсина СуаА и СуаС из Bordetella pertussis, мутант РТ-9К/129G из коклюшного токсина, аденилатциклазу коклюшного токсина СуаА и СуаС из Bordetella pertussis, столбнячный токсин, холерный токсин (СТ), В-субъединицу холерного токсина, мутант СТК63 из холерного токсина, мутант СТЕ112К из СТ, термолабильный энтеротоксин (LT) Escherichia coli, В-субъединицу из термолабильного энтеротоксина (LTB), мутанты термолабильного энтеротоксина Escherichia coli с уменьшенной токсичностью, включая LTK63, LTR72; модулина, растворимого в феноле; нейтрофил-активирующего белка (HP-NAP) из Gelicobacter pylori, поверхностно-активного белка D; липопротеина наружного белка А из Borrelia burgdorferi, Ag38 (антиген длиной 38 кДа)) из Mycobacterium tuberculosis, белков из бактериальной фимбрии; энтеротоксина СТ из Vibrio cholerae, пилина из пили грамотрицательных бактерий, поверхностно-активного белка А и т.д., или любого гомолога вышеуказанных бактериальных (адъювантных) белков.
Бактериальные (адъювантные) белки могут также включать бактериальные флагеллины. В контексте настоящего изобретения бактериальные флагеллины могут быть выбраны из флагеллин организмов, которые включают, не ограничиваясь ими, Agrobacterium, Aquifex, Azospirillum, Bacillus, Bartonella, Bordetella, Borrelia, Burkholderia, Campylobacter, Caulobacte, Clostridium, Escherichia, Helicobacter, Lachnospiraceae, Legionella, Listeria, Proteus, Pseudomonas, Rhizobium, Rhodobacter, Roseburia, Salmonella, Serpulina, Serratia, Shigella, Treponema, Vibrio, Wolinella, Yersinia, более предпочтительно, из флагеллин видов, которые включают, не ограничиваясь ими, Agrobacterium tumefaciens, Aquifex pyrophilus, Azospirillum brasilense, Bacillus subtilis, Bacillus thuringiensis, Bartonella bacilliformis, Bordetella bronchiseptica, Borrelia burgdorferi, Burkholderia cepacia, Campylobacter jejuni, Caulobacter crescentus, Clostridium botulinum strain Bennett clone 1, Escherichia coli, Helicobacter pylori, Lachnospiraceae bacterium, Legionella pneumophila, Listeria monocytogenes, Proteus mirabilis, Pseudomonas aeroguinosa, Pseudomonas syringae, Rhizobium meliloti, Rhodobacter sphaeroides, Roseburia cecicola, Roseburis hominis, Salmonella typhimurium, Salmonella bongori, Salmonella typhi, Salmonella enteritidis, Serpulina hyodysenteriae, Serratia marcescens, Shigella boydii, Treponema phagedenis, Vibrio alginolyticus, Vibrio cholerae, Vibrio parahaemolyticus, Wolinella succinogenes и Yersinia enterocolitica.
(Адъювантные) белки простейших являются еще одним примером адъювантных белков патогенных организмов. (Адъювантные) белки простейших могут быть выбраны из любого белка простейших, обладающего адъювантными свойствами, более предпочтительно, из группы, в которую входят, не ограничиваясь ими, Тс52 из Trypanosoma cruzi, PFTG из Trypanosoma gondii, белки теплового шока простейших, LeIF из Leishmania spp., профилиноподобный белок из Toxoplasma gondii и т.д.
Вирусные (адъювантные) белки являются еще одним примером адъювантных белков патогенных организмов. В контексте настоящего изобретения вирусные (адъювантные) белки могут быть выбраны из любого вирусного белка, обладающего адъювантными свойствами, более предпочтительно, из группы, в которую входят, не ограничиваясь ими, гибридный гликопротеин респираторно-синцитиального вируса (F-протеин), белок оболочки вируса ММТ, белок вируса лейкоза мыши, белок гемагглютинина вируса кори дикого типа и т.д.
Грибные (адъювантные) белки являются еще одним примером адъювантных белков патогенных организмов. В контексте настоящего изобретения грибные (адъювантные) белки могут быть выбраны из любого грибного белка, обладающего адъювантными свойствами, более предпочтительно, из группы, состоящей из грибного иммуномодулирующего белка (FIP, LZ-8) и т.д.
И наконец, адъювантные белки могут быть также выбраны из группы, состоящей из гемоцианина лимфы улитки (KLH), OspA и т.д.
В другом варианте осуществления изобретения терапевтические белки могут быть использованы в гормонозаместительной терапии, в частности, для лечения женщин в период менопаузы. Указанные терапевтические белки, предпочтительно, выбраны из эстрогенов, прогестерона или прогестинов и иногда из тестостерона.
Кроме того, терапевтические белки могут быть использованы для перепрограммирования соматических клеток в плюри- или омнипотентные стволовые клетки. В научной литературе описано несколько факторов, предназначенных для указанной цели, в частности, Oct-3/4, семейство Sox генов (Sox1, Sox2, Sox3 и Sox15), семейство Klf (Klf1, Klf2, Klf4 и Klf5), семейство Myc (c-myc, L-myc и N-myc), Nanog и LIN28.
Как было указано выше, в настоящем описании изобретения в качестве терапевтических белков также представлены терапевтические антитела.
Такие терапевтические антитела, предпочтительно, выбраны из антител, используемых наряду с прочим для лечения раковых или опухолевых заболеваний, как, например, 131I-тозитумомаб (фолликулярная лимфома, В-клеточные лимфомы, лейкоз), 3F8 (нейробластома), 8Н9, абаговомаб (рак яичника), адекатумумаб (рак предстательной железы и молочной железы), афутузумаб (лимфома), алацизумаб пеголь, алемтузумаб (В-клеточный хронический лимфолейкоз, Т-клеточная лимфома), аматуксимаб, АМЕ-133v (фолликулярная лимфома, рак), AMG 102 (запущенный почечно-клеточный рак), анатумомаб мафенатокс (немелкоклеточный рак легкого), аполизумаб (солидные опухоли, лейкоз, неходжкинская лимфома, лимфома), бавитуксимаб (рак, вирусные инфекции), бектумомаб (неходжкинская лимфома), белимумаб (неходжкинская лимфома), бевацизумаб (рак ободочной кишки, рак молочной железы, опухоли головного мозга и центральной нервной системы, рак легкого, печеночно-клеточный рак, рак почки, рак молочной железы, рак поджелудочной железы, рак мочевого пузыря, саркома, меланома, рак пищевода, рак желудка, метастазирующий почечно-клеточный рак, рак почки, глиобластома, рак печени, пролиферативная диабетическая ретинопатия, дегенерация желтого пятна), биватузумаб мертанзин (плоскоклеточный рак), блинатумомаб, брентуксимаб ведотин (рак кроветворной системы), кантузумаб (рак ободочной кишки, рак желудка, рак поджелудочной железы, NSCLC), кантузумаб мертанзин (колоректальный рак), кантузумаб равтанзин (раки), капромаб пендетид (рак предстательной железы), карлумаб, сатумаксомаб (рак яичника, новообразования маточной трубы, новообразования брюшинной полости), цетуксимаб (метастазирующий колоректальный рак, рак головы и шеи), цитатузумаб богатокс (рак яичника и другие солидные опухоли), циксутумумаб (солидные опухоли), кливатузумаб тетраксетан (рак поджелудочной железы), CNTO 328 (В-клеточная неходжкинская лимфома, множественная миелома, болезнь Каслмана, рак яичника), CNTO 95 (меланома), конатумумаб, дацетузумаб (раки кроветворной системы), далотузумаб, денозумаб (миелома, гигантоклеточная опухоль кости, рак молочной железы, рак предстательной железы, остеопороз), детумомаб (лимфома), дрозитумаб, экромексимаб (злокачественная меланома), эдреколомаб (колоректальный рак), элотузумаб (множественная миелома), элсилимомаб, энаватузумаб, энситуксимаб, эпратузумаб (аутоиммунные заболевания, системная красная волчанка, неходжкинская лимфома, лейкоз), эртумаксомаб (рак молочной железы), эртумаксомаб (рак молочной железы), этарацизумаб (меланома, рак предстательной железы, рак яичника), фарлетузумаб (рак яичника), FBTA05 (хронический лимфолейкоз), фиклатузумаб (рак), фигитумумаб (рак надпочечников, немелкоклеточный рак легкого), фланвотумаб (меланома), галиксимаб (В-клеточная лимфома), галиксимаб (неходжкинская лимфома), ганитумаб, GC1008 (запущенный почечно-клеточный рак, злокачественная меланома, пневмофиброз), гемтузумаб (лейкоз), гемтузумаб озогамицин (острый миелогенный лейкоз), гирентуксимаб (светлоклеточный рак почки), глембатумумаб ведотин (меланома, рак молочной железы), GS6624 (идиопатический пневмофиброз и солидные опухоли), HuC242-DM4 (рак ободочной кишки, рак желудка, рак поджелудочной железы), HuHMFG1 (рак молочной железы), HuN901-DM1 (миелома), ибритумомаб (рецидивирующая или резистентная низкодифференцированная фолликулярная или трансформированная В-клеточная неходжкинская лимфома (NHL)), икрукумаб, ID09C3 (неходжкинская лимфома), индатуксимаб равтанзин, инотузумаб озогамицин, интетумумаб (солидные опухоли (рак предстательной железы, меланома)), ипилимумаб (саркома, меланома, рак легкого, рак яичника, лейкоз, лимфома, опухоли головного мозга и центральной нервной системы, рак яичка, рак предстательной железы, рак поджелудочной железы, рак молочной железы), иратумумаб (лимфома Ходжкина), лабетузумаб (колоректальный рак), лексатумумаб, линтузумаб, лорвотузумаб мертанзин, лукатумумаб (множественная миелома, неходжкинская лимфома, лимфома Ходжкина), лумиликсимаб (хронический лимфолейкоз), мапатумумаб (рак ободочной кишки, миелома), матузумаб (рак легкого, рак шейки матки, рак пищевода), MDX-060 (лимфома Ходжкина, лимфома), MEDI 522 (солидные опухоли, лейкоз, лимфома, рак тонкой кишки, меланома), митумомаб (мелкоклеточный рак легкого), могамулизумаб, MORab-003 (рак яичника, рак маточной трубы, рак брюшинной полости), MORab-009 (рак поджелудочной желекзы, мезотелиома, рак яичника, немелкоклточный рак легкого, рак маточной трубы, рак брюшинной полости), моксетумомаб пазудотокс, МТ103 (неходжкинская лимфома), наколомаб тафенатокс (колоректальный рак), наптумомаб эстафенатокс (немелкоклеточный рак легкого, почечно-клеточный рак), нарнатумаб, нецитумумаб (немелкоклеточный рак легкого), нимотузумаб (плоскоклеточный рак, рак головы и шеи, рак носоглотки, глиома), нимотузумаб (плоскоклеточный рак, глиома, солидные опухоли, рак легкого), оларатумаб, онартузумаб (рак), опортузумаб монатокс, ореговомаб (рак яичника), ореговомаб (рак яичника, рак маточной трубы, рак брюшинной полости), РАМ4 ((рак поджелудочной железы), панитумумаб (рак ободочной кишки, рак легкого, рак молочной железы, рак мочевого пузыря, рак яичника), патритумаб, пемтумомаб, пертузумаб (рак молочной железы, рак яичника, рак легкого, рак предстательной железы), притумумаб (рак головного мозга), ракотумомаб, радретумаб, рамуцирумаб (солидные опухоли), рилотумумаб (солидные опухоли), ритуксимаб (крапивница, ревматоидный артрит, неспецифический язвенный колит, хронический фокальный энцефалит, неходжкинская лимфома, лимфома, хронический лимфолейкоз), робатумумаб, самализумаб, SGN-30 (лимфома Ходжкина, лимфома), SGN-40 (неходжкинская лимфома, миелома, лейкоз, хронический лимфолейкоз), сибротузумаб, силтуксимаб, табалумаб (В-клеточные раки), такатузумаб тетраксетан, таплитумомаб паптокс, тенатумомаб, тепротумумаб (опухоли кроветворной системы), TGN1412 (хронический лимфолейкоз, ревматоидный артрит), тицилимумаб (= тремелимумаб), тигатузумаб, TNX-650 (лимфома Ходжкина), тозитумомаб (лимфома маточной троубы, В-клеточные лимфомы, лейкоз, миелома), трастузумаб (рак молочной железы, рак эндометрия, солидные опухоли), TRBS07 (меланома), тремелимумаб, TRU-016 (хронический лимфолейкоз), TRU-016 (неходжкинская лимфома), тукотузумаб целмолейкин, ублитуксимаб, урелумаб, велтузумаб (неходжкинская лимфома), велтузумаб (IMMU-106) (неходжкинская лимфома), волоциксимаб (почечно-клеточный рак, рак поджелудочной железы, меланома), вотумумаб (колоректальные опухоли), WX-G250 (почечно-клеточный рак), залутумумаб (рак головы и шеи, плоскоклеточный рак) и занолимумаб (Т-клеточная лимфома);
из антител, используемых наряду с прочим для лечения иммунных нарушений, как, например, эфализумаб (псориаз), эпратузумаб (аутоиммунные заболевания, системная красная волчанка, неходжкинская лимфома, лейкоз), этролизумаб (воспалительное заболевание кишечника), фонтолизумаб (болезнь Крона), иксекизумаб (аутоиммунные заболевания), меполизумаб (гиперэозинофильный синдром, астма, эозинофильный гастроэнтерит, синдром Чарга-Штрауса, эозинофильный эзофагит), милатузумаб (множественная миелома и другие злокачественные новообразования кроветворной системы), смешанные иммуноглобулины (первичный иммунодефицит), приликсимаб (болезнь Крона, рассеянный склероз), ритуксимаб (крапивница, ревматоидный артрит, неспецифический язвенный колит, хронический фокальный энцефалит, неходжкинская лимфома, лимфома, хронический лимфолейкоз), ронтализумаб (системная красная волчанка), руплизумаб (ревматические заболевания), сарилумаб (ревматоидный артрит, анкилозирующий спондилоартрит), ведолизумаб (болезнь Крона, неспецифический язвенный колит), визилизумаб (болезнь Крона, неспецифический язвенный колит), реслизумаб (воспаления дыхательных путей, кожи и желудочно-кишечного тракта), адалимумаб (ревматоидный артрит, болезнь Крона, алкилозирующий спондилоартрит, псориатический артрит), азелизумаб (индивиды с серьезными травмами), атинумаб (лечение неврологических систем), атлизумаб (ревматоидный артрит, системный юношеский идиопатический артрит), бертилимумаб (тяжелые аллергические нарушения), безилесомаб (воспалительные поражения и метастазы), BMS-945429, ALD518 (рак и ревматоидный артрит), бриакинумаб (псориаз, ревматоидный артрит, вспалительные заболевания кишечника, рассеянный склероз), бродалумаб (воспалительные заболевания), канакинумаб (ревматоидный артрит), канакинумаб (криопиринсвязанные периодические синдромы (CAPS), ревматоидный артрит, хроническое обструктивное заболевание легких), цертолизумаб пеголь (болезнь Крона), эрлизумаб (сердечный приступ, инсульт, травматический шок), фезакинумаб (ревматоидный артрит, псориаз), голимумаб (ревматоидный артрит, псориатический артрит, анкилозирующий спондилоартрит), гомиликсимаб (аллергическая астма), инфликсимаб (ревматоидный артрит, болезнь Крона, анкилозирующий спондилоартрит, псориатический артрит, бляшкообразующий псориаз, болезнь Бехтерева, неспецифический язвенный колит), маврилимумаб (ревматоидный артрит), натализумаб (рассеянный склероз), окрелизумаб (рассеянный склероз, ревматоидный артрит, красная волчанка, рак кроветворной системы), одулимомаб (профилактика отторжения трансплантированных органов, иммунологические заболевания), офатумумаб (хронический лимфолейкоз, фолликулярная неходжкинская лимфома, В-клеточная лимфома, ревматоидный артрит, рецидивирующий ремиттирующий рассеянный склероз, лимфома, В-клеточный хронический лимфолейкоз), озорализумаб (воспаление), пекселизумаб (устранение побочных эффектов операции на сердце), ровелизумаб (геморрагический шок), SBI-087 (ревматоидный артрит), SBI-087 (системная красная волчанка), секукинумаб (увеит, ревматоидный артрит, псориаз), сирукумаб (ревматоидный артрит), тализумаб (аллергическая реакция), тоцилизумаб (ревматоидный артрит, системный юношеский идиопатический артрит, болезнь Каслмана), торализумаб (ревматоидный артрит, волчаночный нефрит), TRU-015 (ревматоидный артрит), TRU-016 (аутоиммунное заболевание и воспаление), устекинумаб (рассеянный склероз, псориаз, псориатический артрит), устекинумаб (блокатор IL-12/IL-23) (бляшкообразующий псориаз, псориатический артрит, рассеянный склероз, саркоидоз), вепалимомаб (воспаление), золимомаб аритокс (системная красная волчанка, реакция ”трансплантат против хозяина”), сифалимумаб (SLE, дерматомиозит, полимиозит), лумиликсимаб (аллергии) и Rho(D) иммуноглобулин (гемолитическая болезнь); или
из антител, используемых для лечения инфекционных заболеваний, как, например, афелимомаб (сепсис), CR6261 (инфекционное заболевание/грипп А), эдобакомаб (сепсис, вызванный грамотрицательными бактериями), эфунгумаб (инвазивная инфекция, вызванная грибами рода Candida), эксбивирумаб (гепатит В), фелвизумаб (респираторно-синцитиальная вирусная инфекция), форавирумаб (бешенство (профилактика)), ибализумаб (ВИЧ-инфекция), либивирумаб (гепатит В), мотавизумаб (респираторно-синцитиальный вирус (профилактика)), небакумаб (сепсис), тувирумаб (хронический гепатит В), уртоксазумаб (диарея, вызванная E. coli), бавитуксимаб (смешанные вирусные инфекции), пагибаксимаб (сепсис (например, Staphylococcus)), паливизумаб (профилактика респираторно-синцитиальной вирусной инфекции у детей с высоким риском заражения), панобакумаб (инфекция Pseudomonas aeruginosa), PRO 140 (ВИЧ-инфекция), рафивирумаб (бешенство (профилактика)), раксибакумаб (сибирская язва (профилактика и лечение)), регавирумаб (инфекция, вызванная цитомегаловирусом), севирумаб (инфекция, вызванная цитомегаловирусом), сувизумаб (вирусные инфекции) и тефибазумаб (инфекция, вызванная Staphylococcus aureus);
из антител, используемых наряду с прочим для лечения болезней крови, например, абциксимаб (шунтирование коронарной артерии), аторолимумаб (гемолитическая болезнь новорожденных), экулизумаб (ночная пароксизмальная гемоглобинурия), меполизумаб (синдром гиперэозинофилии, астма, эозинофильный гастроэнтерит, синдром Чарга-Штрауса, эозинофильный эзофагит) и милатузумаб (множественная миелома и другие злокачественные новообразования кроветворной системы);
из антител, используемых наряду с прочим для иммунорегуляции, как, например, антитимоцитарный глобулин (острое отторжение трансплантированной почки, апластическая анемия), базиликсимаб (профилактика отторжения аллотрансплантата у индивидов с трансплантированной почкой, проходящих курс иммуносупрессорной терапии, включающей циклоспорин и кортикостероиды), цеделизумаб (профилактика отторжения трансплантированных органов, лечение аутоиммунных заболеваний), даклизумаб (профилактика острого отторжения аллотрансплантата у индивидов с трансплантированной почкой, рассеянный склероз), гавилимомаб (реакция ”трансплантат против хозяина”), инолимомаб (реакция ”трансплантат против хозяина”), муромонаб-CD3 (профилактика отторжения трансплантированных органов), муромонаб-CD3 (острое отторжение аллотрансплантата почки или устойчивое к стероидам отторжение аллотрансплантата сердца или печени), одулимомаб (профилактика отторжения трансплантированных органов, иммунологические болезни) и сиплизумаб (псориаз, реакция ”трансплантат против хозяина” (профилактика));
из антител, используемых для лечения диабета, например, гевокизумаб (диабет), отеликсизумаб (сахарный диабет I типа) и теплизумаб (сахарный диабет I типа);
из антител, используемых для лечения болезни Альцгеймера, как, например, бапинеузумаб, кренезумаб, гантенерумаб, понезумаб, R1450 и соланезумаб;
из антител, используемых для лечения астмы, как, например, бенрализумаб, энокизумаб, келиксимаб, лебрикизумаб, омализумаб, окселумаб, пасколизумаб и тралокинумаб;
и из антител, используемых для лечения смешанных нарушений, как, например, блосозумаб (остеопороз), CaroRx (кариозный распад зубов), фрезолимумаб (идиопатический пневмофиброз, фокальный сегментарный гломерулосклероз, рак), фулранумаб (боль), ромосозумаб (остеопороз), стамулумаб (мышечная дистрофия), танезумаб (боль) и ранибизумаб (возрастная дегенерация желтого пятна с образованием новых сосудов).
Кодирующая область нуклеиновой кислоты по изобретению в первом аспекте настоящего изобретения может присутствовать в виде моно-, ди- или даже полицистронной нуклеиновой кислоты, т.е. нуклеиновой кислоты, несущей кодирующие последовательности одного, двух или более белков или пептидов. Такие кодирующие последовательности в ди- или даже полицистронных нуклеиновых кислотах могут быть разделены по меньшей мере одной последовательностью внутреннего участка связывания рибосомы (IRES), например, как описано в настоящем документе или сигнальными пептидами, которые индуцируют расщепление полученного полипептида, содержащего несколько белков или пептидов.
В первом аспекте настоящего изобретения, последовательность нуклеиновой кислоты по изобретению содержит кодирующую область, кодирующую пептид или белок, содержащий терапевтический белок или его фрагмент, вариант или производное. Предпочтительно, кодируемый терапевтический белок не является гистоновым белком. В контексте настоящего изобретения такой гистоновый белок, как правило, представляет собой сильнощелочной белок, находящийся в ядрах эукариотических клеток, который упаковывает и упорядочивает ДНК в структурные единицы, называемые нуклеосомами. Гистоновые белки являются главными белковыми компонентами хроматина, действующими в качестве катушек, вокруг которых закручивается ДНК, и играют роль в регуляции генов. Без гистонов незакрученная ДНК в хромосомах могла бы быть очень длинной (отношение длины к ширине в ДНК человека более 10 миллионов к одному). Например, каждая клетка человека содержит приблизительно 1,8 метров ДНК, но закрученная на гистоны она составляет приблизительно 90 миллиметров хроматина, что при дупликации и конденсации во время митоза приводит приблизительно к 120 микрометрам хромосом. Более предпочтительно, в контексте настоящего изобретения такой гистоновый белок, как правило, определяют как высококонсервативный белок, выбранный из одного из следующих пяти основных классов гистонов: H1/H5, H2A, H2B, H3 и H4", предпочтительно, выбранный из гистонов млекопитающих, более предпочтительно, из гистонов или гистоновых белков человека. Такие гистоны или гистоновые белки, как правило, организованы в два суперкласса, определяемых как коровые гистоны, содержащие гистоны H2A, H2B, H3 и H4, и линкерные гистоны, содержащие гистоны H1 и H5.
В этом контексте, линкерные гистоны, предпочтительно, исключаемые из области защиты рассматриваемого изобретения, предпочтительно, линкерные гистоны млекопитающих, более предпочтительно, линкерные гистоны человека, как правило, выбраны из H1, включая H1F, в частности, включая H1F0, H1FNT, H1FOO, H1FX, и H1H1, в частности, включая HIST1H1A, HIST1H1B, HIST1H1C, HIST1H1D, HIST1H1E, HIST1H1T.
Кроме того, коровые гистоны, предпочтительно, исключаемые из области защиты рассматриваемого изобретения, предпочтительно, коровые гистоны млекопитающих, более предпочтительно, коровые гистоны человека, как правило, выбраны из H2A, включая H2AF, в частности, включая H2AFB1, H2AFB2, H2AFB3, H2AFJ, H2AFV, H2AFX, H2AFY, H2AFY2, H2AFZ и H2A1, в частности, включая HIST1H2AA, HIST1H2AB, HIST1H2AC, HIST1H2AD, HIST1H2AE, HIST1H2AG, HIST1H2AI, HIST1H2AJ, HIST1H2AK, HIST1H2AL, HIST1H2AM и H2A2, в частности, включая HIST2H2AA3, HIST2H2AC; H2B, включая H2BF, в частности, включая H2BFM, H2BFO, H2BFS, H2BFWT H2B1, в частности, включая HIST1H2BA, HIST1H2BB, HIST1H2BC, HIST1H2BD, HIST1H2BE, HIST1H2BF, HIST1H2BG, HIST1H2BH, HIST1H2BI, HIST1H2BJ, HIST1H2BK, HIST1H2BL, HIST1H2BM, HIST1H2BN, HIST1H2BO и H2B2, в частности, включая HIST2H2BE; H3, включая H3A1, в частности, включая HIST1H3A, HIST1H3B, HIST1H3C, HIST1H3D, HIST1H3E, HIST1H3F, HIST1H3G, HIST1H3H, HIST1H3I, HIST1H3J и H3A2, в частности, включая HIST2H3C и H3A3, в частности, включая HIST3H3; H4, включая H41, в частности, включая HIST1H4A, HIST1H4B, HIST1H4C, HIST1H4D, HIST1H4E, HIST1H4F, HIST1H4G, HIST1H4H, HIST1H4I, HIST1H4J, HIST1H4K, HIST1H4L и H44, в частности, включая HIST4H4 и H5.
В первом аспекте настоящего изобретения последовательность нуклеиновой кислоты по изобретению содержит кодирующую область, кодирующую пептид или белок, который содержит терапевтический белок или его фрагмент, вариант или производное. Предпочтительно, кодируемый терапевтический белок не является репортерным белком (например, люциферазой, зеленым флуоресцентным белком (GFP), улучшенным зеленым флуоресцентным белком (EGFP), β-галактозидазой) и не является маркерным или селективным белком (например, альфа-глобином, галактокиназой и ксантин:гуанинфосфорибозилтрансферазой (GPT)). Предпочтительно, последовательность нуклеиновой кислоты по изобретению не содержит (бактериального) гена устойчивости к антибиотикам, в частности, последовательности гена neo (гена устойчивости к неомицину) или последовательности гена CAT (кодирующей ацетилтрансферазу хлорамфеникола; ген устойчивости к хлорамфениколу).
Нуклеиновая кислота по изобретению, как определено выше, содержит или кодирует a) кодирующую область, кодирующую пептид или белок, который содержит терапевтический белок или его фрагмент, вариант или производное; b) по меньшей мере одну структуру "стебель-петля" гистонов и c) последовательность поли(A) или сигнал полиаденилирования; предпочтительно, для повышения экспрессии указанного кодируемого пептида или белка, где кодируемый пептид или белок, предпочтительно, не является гистоновым белком, не является репортерным белком и/или не является маркерным или селективным белком, как определено выше. Элементы b)-c) нуклеиновой кислоты по изобретению могут присутствовать в нуклеиновой кислоте по изобретению в любом порядке, т.е. элементы a), b) и c) могут присутствовать в последовательности нуклеиновой кислоты по изобретению в направлении от 5ʹ-конца к 3ʹ-концу в порядке a), b) и c) или a), c) и b), где также могут содержаться дополнительные элементы, как описано в настоящем документе, такие как 5ʹ-кэпирующая структура, последовательность поли(C), стабилизирующие последовательности, последовательности IRES и т.д. Также каждый из элементов a)-c) нуклеиновой кислоты по изобретению, особенно a) в ди- или полицистронных конструкциях и/или каждый из элементов b) и c), более предпочтительно, элемент b), в нуклеиновой кислоте по изобретению могут повторяться по меньшей мере однократно, предпочтительно, дважды или более. В качестве примера нуклеиновая кислота по изобретению может содержать элементы своей последовательности a), b) и необязательно c), например, в следующем порядке:
5ʹ - кодирующая область - структура "стебель-петля" гистонов - последовательность поли(A) - 3ʹ; или
5ʹ - кодирующая область - структура "стебель-петля" гистонов - сигнал полиаденилирования - 3ʹ; или
5ʹ - кодирующая область - последовательность поли(A) - структура "стебель-петля" гистонов - 3ʹ; или
5ʹ - кодирующая область - сигнал полиаденилирования- структура "стебель-петля" гистонов - 3ʹ; или
5ʹ - кодирующая область - кодирующая область - структура "стебель-петля" гистонов - сигнал полиаденилирования - 3ʹ; или
5ʹ - кодирующая область - структура "стебель-петля" гистонов - структура "стебель-петля" гистонов - последовательность поли(A) - 3ʹ; или
5ʹ - кодирующая область - структура "стебель-петля" гистонов - структура "стебель-петля" гистонов - сигнал полиаденилирования - 3ʹ; и т.д.
В этом контексте, особенно предпочтительно последовательность нуклеиновой кислоты по изобретению содержит или кодирует a) кодирующую область, кодирующую пептид или белок, который содержит терапевтический белок или его фрагмент, вариант или производное; b) по меньшей мере одну структуру "стебель-петля" гистонов и c) последовательность поли(A) или последовательность полиаденилирования; предпочтительно, для повышения уровня экспрессии указанного кодируемого пептида или белка, где кодируемый белок, предпочтительно, не является гистоновым белком, не является репортерным белком (например, люциферазой, GFP, EGFP, β-галактозидазой, в частности, EGFP) и/или не является маркерным или селективным белком (например, альфа-глобином, галактокиназой и ксантин:гуанинфосфорибозилтрансферазой (GPT)).
В дополнительном предпочтительном варианте осуществления первого аспекта последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, также может находиться в форме модифицированной нуклеиновой кислоты.
В этом контексте последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, можно модифицировать для получения "стабилизированной нуклеиновой кислоты", предпочтительно, стабилизированной РНК, более предпочтительно, РНК, которая по существу устойчива к разрушению in vivo (например, экзо- или эндонуклеазами). Например, стабилизированную нуклеиновую кислоту можно получать посредством модификации содержания G/C в кодирующей области последовательности нуклеиновой кислоты по изобретению, посредством введения аналогов нуклеотидов (например, нуклеотидов с модификациями каркаса, модификациями сахаров или модификациями оснований) или посредством введения стабилизирующих последовательностей в 3ʹ- и/или 5ʹ-нетранслируемые области последовательности нуклеиновой кислоты по изобретению.
Как указано выше, последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе может содержать аналоги/модификации нуклеотидов, например, модификации каркаса, модификации сахаров или модификации оснований. Модификация каркаса в применении к настоящему изобретению представляет собой модификацию, при которой фосфаты каркаса нуклеотидов, содержащихся в последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, химически модифицируют. Модификация сахаров в применении к настоящему изобретению представляет собой химическую модификацию сахара нуклеотидов последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе. Кроме того, модификация оснований в применении к настоящему изобретению представляет собой химическую модификацию молекулы основания нуклеотидов молекулы нуклеиновой кислоты последовательности нуклеиновой кислоты по изобретению. В этом контексте аналоги или модификации нуклеотидов, предпочтительно, выбраны из аналогов нуклеотидов, которые пригодны для транскрипции и/или трансляции.
В конкретном предпочтительном варианте первого аспекта настоящего изобретения определенные в настоящем документе аналоги/модификации нуклеотидов выбраны из модификаций оснований, которые дополнительно увеличивают экспрессию кодируемого белка и которые, предпочтительно, выбраны из 2-амино-6-хлорпуринрибозид-5ʹ-трифосфата, 2-аминоаденозин-5ʹ-трифосфата, 2-тиоцитидин-5ʹ-трифосфата, 2-тиоуридин-5ʹ-трифосфата, 4-тиоуридин-5ʹ-трифосфата, 5-аминоаллилцитидин-5ʹ-трифосфата, 5-аминоаллилуридин-5ʹ-трифосфата, 5-бромцитидин-5ʹ-трифосфата, 5-бромуридин-5ʹ-трифосфата, 5-йодцитидин-5ʹ-трифосфата, 5-йодуридин-5ʹ-трифосфата, 5-метилцитидин-5ʹ-трифосфата, 5-метилуридин-5ʹ-трифосфата, 6-азацитидин-5ʹ-трифосфата, 6-азауридин-5ʹ-трифосфата, 6-хлорпуринрибозид-5ʹ-трифосфата, 7-деазааденозин-5ʹ-трифосфата, 7-деазагуанозин-5ʹ-трифосфата, 8-азааденозин-5ʹ-трифосфата, 8-азидоаденозин-5ʹ-трифосфата, бензимидазолрибозид-5ʹ-трифосфата, N1-метиладенозин-5ʹ-трифосфата, N1-метилгуанозин-5ʹ-трифосфата, N6-метиладенозин-5ʹ-трифосфата, O6-метилгуанозин-5ʹ-трифосфата, псевдоуридин-5ʹ-трифосфата, или пуромицин-5ʹ-трифосфата, ксантинозин-5ʹ-трифосфата. Конкретное предпочтение отдается нуклеотидам с модификациями оснований, выбранными из группы нуклеотидов с модифицированными основаниями, состоящей из 5-метилцитидин-5ʹ-трифосфата, 7-деазагуанозин-5ʹ-трифосфата, 5-бромцитидин-5ʹ-трифосфата и псевдоуридин-5ʹ-трифосфата.
В дополнительном варианте осуществления в последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, может присутствовать модификация липидами. Такая модифицированная липидами нуклеиновая кислота, как правило, содержит нуклеиновую кислоту, как определено в настоящем документе. Такая модифицированная липидами молекула нуклеиновой кислоты последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, как правило, дополнительно содержит по меньшей мере один линкер, ковалентно связанный с этой молекулой нуклеиновой кислоты, и по меньшей мере один липид, ковалентно связанный с соответствующим линкером. Альтернативно, модифицированная липидами молекула нуклеиновой кислоты содержит по меньшей мере одну молекулу нуклеиновой кислоты, как определено в настоящем документе, и по меньшей мере один (бифункциональный) липид, ковалентно связанный (без линкера) с этой молекулой нуклеиновой кислоты. В соответствии с третьей альтернативой модифицированная липидами молекула нуклеиновой кислоты содержит молекулу нуклеиновой кислоты, как определено в настоящем документе, по меньшей мере один линкер, ковалентно связанный с этой молекулой нуклеиновой кислоты, и по меньшей мере один липид, ковалентно связанный с соответствующим линкером, а также по меньшей мере один (бифункциональный) липид, ковалентно связанный (без линкера) с этой молекулой нуклеиновой кислоты. В этом контексте особенно предпочтительно, чтобы модификацию липидами проводили на концах линейной последовательности нуклеиновой кислоты по изобретению.
В другом предпочтительном варианте осуществления первого аспекта изобретения последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, особенно, если предоставлена в виде (м)РНК, таким образом, можно стабилизировать для противостояния разрушению РНКазами посредством добавления структуры так называемого "5ʹ-кэпа".
В дополнительном предпочтительном варианте осуществления первого аспекта изобретения, последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, можно модифицировать посредством последовательности по меньшей мере из 10 остатков цитидина, предпочтительно, по меньшей мере 20 остатков цитидина, более предпочтительно, по меньшей мере 30 остатков цитидина (так называем "последовательность поли(C)"). В частности, последовательность нуклеиновой кислоты по изобретению может содержать или кодировать последовательность поли(C) длиной, как правило, приблизительно от 10 до 200 цитидиновых нуклеотидов, предпочтительно, приблизительно от 10 до 100 цитидиновых нуклеотидов, более предпочтительно, приблизительно от 10 до 70 цитидиновых нуклеотидов или еще более предпочтительно, приблизительно от 20 до 50 или даже от 20 до 30 цитидиновых нуклеотидов. Последовательность поли(C) предпочтительно, расположена с 3ʹ-конца от кодирующей области, содержащейся в нуклеиновой кислоте в первом аспекте настоящего изобретения.
В особенно предпочтительном варианте осуществления настоящего изобретения в последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, изменяют содержание G/C кодирующей области, кодирующей по меньшей мере один пептид или белок, который содержит терапевтический белок или его фрагмент, вариант или производное, в частности, увеличивают, по сравнению с содержанием G/C в этой конкретной кодирующей области дикого типа, т.е. немодифицированной кодирующей области. Кодируемую кодирующей областью аминокислотную последовательность по сравнению с кодируемой аминокислотной последовательностью конкретной кодирующей областью дикого типа, предпочтительно, не модифицируют.
Изменение содержания G/C кодирующей области последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, основано на том факте, что для эффективной трансляции этой мРНК важна последовательность любой области мРНК для трансляции. Таким образом, важны состав и последовательность различных нуклеотидов. В частности, последовательности мРНК с повышенным содержанием G (гуанозина)/C (цитозина) являются более стабильными, чем последовательности мРНК с повышенным содержанием A (аденозина)/U (урацила). Таким образом, в соответствии с изобретением, кодоны кодирующей области изменяют по сравнению с этой кодирующей областью дикого типа, сохраняя транслируемую аминокислотную последовательность, так, что они включают увеличенное количество нуклеотидов G/C. В соответствии с тем фактом, что одну и ту же аминокислоту кодируют несколько кодонов (так называемая вырожденность генетического кода), можно определять наиболее подходящие для стабильности кодоны (так называемое альтернативное использование кодонов).
В зависимости от аминокислоты, кодируемой кодирующей областью последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, существуют различные возможности модификации последовательности нуклеиновой кислоты, например, кодирующей области, по сравнению с этой кодирующей областью дикого типа. В случае аминокислот, которые кодируют кодоны, содержащие исключительно нуклеотиды G или C, никакой замены кодонов не нужно. Таким образом, кодоны для Pro (CCC или CCG), Arg (CGC или CGG), Ala (GCC или GCG) и Gly (GGC или GGG) не требуют модификации, так как в них не присутствует A или U.
В отличие от этого, кодоны, которые содержат нуклеотиды A и/или U можно модифицировать, посредством замены на другие кодоны, которые кодируют те же аминокислоты, но не содержат A и/или U. Их примеры представляют собой:
кодоны для Pro можно модифицировать c CCU или CCA на CCC или CCG;
кодоны для Arg можно модифицировать c CGU или CGA или AGA или AGG на CGC или CGG;
кодоны для Ala можно модифицировать c GCU или GCA на GCC или GCG;
кодоны для Gly можно модифицировать c GGU или GGA на GGC или GGG.
В других случаях, хотя нуклеотиды A или U нельзя удалить из кодонов, однако возможно снизить содержание A и U, используя кодоны, которые содержат меньшее количество нуклеотидов A и/или U. Их примеры представляют собой:
кодоны для Phe можно модифицировать c UUU на UUC;
кодоны для Leu можно модифицировать с UUA, UUG, CUU или CUA на CUC или CUG;
кодоны для Ser можно модифицировать c UCU или UCA или AGU на UCC, UCG или AGC;
кодон для Tyr можно модифицировать c UAU на UAC;
кодон для Cys можно модифицировать c UGU на UGC;
кодон для His можно модифицировать c CAU на CAC;
кодон для Gln можно модифицировать c CAA на CAG;
кодоны для Ile можно модифицировать c AUU или AUA на AUC;
кодоны для Thr можно модифицировать c ACU или ACA на ACC или ACG;
кодон для Asn можно модифицировать c AAU на AAC;
кодон для Lys можно модифицировать c AAA на AAG;
кодоны для Val можно модифицировать c GUU или GUA на GUC или GUG;
кодон для Asp можно модифицировать c GAU на GAC;
кодон для Glu можно модифицировать c GAA на GAG;
стоп-кодон UAA можно модифицировать на UAG или UGA.
С другой стороны, в случае кодонов для Met (AUG) и Trp (UGG) возможностей для модификации последовательности нет.
Перечисленные выше замены для увеличения содержания G/C кодирующей области последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, по сравнению с этой конкретной кодирующей областью дикого типа (т.е. исходной последовательностью) можно использовать отдельно или во всех возможных комбинациях. Таким образом, например, все кодоны для Thr, встречающиеся в последовательности дикого типа можно заменить на ACC (или ACG).
В указанном выше контексте представлены кодоны, присутствующие в мРНК. Таким образом, уридин, присутствующий в мРНК, также может присутствовать в виде тимидина в соответствующей ДНК, кодирующей конкретную мРНК.
Предпочтительно, содержание G/C кодирующей области последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, по сравнению с содержанием G/C в кодирующей области дикого типа увеличивают по меньшей мере на 7%, более предпочтительно, по меньшей мере на 15%, в частности, предпочтительно, по меньшей мере на 20%. В конкретном варианте осуществления в кодирующей области, кодирующей по меньшей мере один пептид или белок, который содержит терапевтический белок или его фрагмент, вариант или производное, замещены по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, более предпочтительно, по меньшей мере 70%, еще более предпочтительно, по меньшей мере 80%, а наиболее предпочтительно, по меньшей мере 90%, 95% или даже 100% из замещаемых кодонов, таким образом, увеличивая содержание G/C в указанной кодирующей области.
В этом контексте, особенно предпочтительно, повысить содержание G/C кодирующей области последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, по сравнению с кодирующей областью дикого типа до максимума (т.е. 100% замещаемых кодонов).
По изобретению дополнительная предпочтительная модификация кодирующей области последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, кодирующей по меньшей мере один пептид или белок, который содержит терапевтический белок или его фрагмент, вариант или производное, основана на том открытии, что эффективность трансляции также определена различной частотой встречаемости тРНК в клетках. Таким образом, если в кодирующей области последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, в большей степени присутствуют так называемые "редкие кодоны", соответствующая модифицированная последовательность нуклеиновой кислоты транслируется в значительно меньшей степени, чем в случае, когда присутствуют кодоны, кодирующие относительно "частые" тРНК.
В этом контексте кодирующая область последовательности нуклеиновой кислоты по изобретению, предпочтительно, модифицирована по сравнению с соответствующей кодирующей областью дикого типа там, что по меньшей мере один кодон последовательности дикого типа, который кодирует тРНК, которая в клетке является относительно редкой, заменяют на кодон, который кодирует тРНК, которая в клетке является относительно частой и кодирует ту же аминокислоту, что и относительно редкая тРНК. Посредством этой модификации, кодирующую область последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, модифицируют так, что вводят кодоны, для которых доступны часто встречающиеся тРНК. Другими словами, в изобретении посредством этой модификации все кодоны кодирующей области дикого типа, которые кодируют тРНК, которая в клетке является относительно редкой, в каждом случае можно заменить на кодоны, которые кодируют тРНК, которая в клетке является относительно частой и которая, в каждом случае, кодирует ту же аминокислоту, что и относительно редкая тРНК.
Некоторые тРНК встречаются в клетке относительно часто, а некоторые, напротив, встречаются относительно редко, как известно специалисту в данной области; см. например, Akashi, Curr. Opin. Genet. Dev. 2001, 11(6): 660-666. Особенно предпочтительными являются кодоны, которые используются для конкретной аминокислоты в тРНК, которая встречается наиболее часто, например, кодон для Gly, который используется в тРНК, которая наиболее часто наиболее часто встречается в клетке (человека).
По изобретению, особенно предпочтительно, связывать непрерывное содержание G/C, которое в кодирующей области последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, увеличено, в частности, максимизировано, с "частыми" кодонами без модификации аминокислотной последовательности пептида или белка, кодируемого кодирующей областью последовательности нуклеиновой кислоты. Этот предпочтительный вариант осуществления обеспечивает получение особенно эффективно транслируемой и стабилизированной (модифицированной) последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе.
В другом предпочтительном варианте осуществления первого аспекта изобретения последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, предпочтительно, дополнительно содержит по меньшей мере одну 5ʹ и/или 3ʹ стабилизирующую последовательность. Эти стабилизирующие последовательности в 5ʹ- и/или 3ʹ-нетранслируемых областях обладают эффектом увеличения времени полужизни нуклеиновой кислоты, в частности, мРНК в цитозоле. Эти стабилизирующие последовательности могут быть на 100% идентичны с природными последовательностями, которые встречаются в вирусах, бактериях и эукариотах, но также могут быть частично или полностью синтетическими. В качестве примера стабилизирующих последовательностей, которые можно использовать в настоящем изобретении для стабилизированной нуклеиновой кислоты, можно указать нетранслируемые последовательности (UTR) гена (альфа-)глобина, например, Homo sapiens или Xenopus laevis. Другой пример стабилизирующей последовательности имеет общую формулу (C/U)CCANxCCC(U/A)PyxUC(C/U)CC (SEQ ID NO: 55), которая содержится в 3ʹ-UTR очень стабильных РНК, которые кодируют (альфа-)глобин, коллаген типа(I), липоксигеназу 15 или тирозингидроксилазу (см. Holcik et al., Proc. Natl. Acad. Sci. USA 1997, 94: 2410-2414). Конечно, такие стабилизирующие последовательности можно использовать отдельно или в комбинации с любой другой, а также в комбинации с другими стабилизирующими последовательностями, известными специалисту в данной области. В этом контексте особенно предпочтительно, чтобы с 3ʹ-конца кодирующей области, кодирующей по меньшей мере один пептид или белок, который содержит терапевтический белок или его фрагмент, вариант или производное, содержащейся в последовательности нуклеиновой кислоты по изобретению в первом аспекте настоящего изобретения, располагалась последовательность 3ʹ-UTR гена альфа-глобина.
Замены, добавления или удаления оснований в последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, предпочтительно, проводят с использованием матричной ДНК для получения последовательности нуклеиновой кислоты способами, хорошо известного сайт-специфического мутагенеза, или стратегией лигирования олигонуклеотидов (см. например, Maniatis et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 3rd ed., Cold Spring Harbor, NY, 2001).
Для последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, а также для любой нуклеиновой кислоты, как используют в контексте настоящего изобретения, можно использовать любые из указанных выше модификаций, и их можно, если подходит или необходимо, комбинировать друг с другом в любой комбинации, при условии, что эти комбинации модификаций в соответствующей нуклеиновой кислоте не мешают друг другу. Специалист в данной области может сделать соответствующий выбор.
Последовательности нуклеиновой кислоты, используемые по настоящему изобретению, как определено в настоящем документе, можно получать с использованием любого известного в данной области способа, включая способы синтеза, например, такие как твердофазный синтез, а также способы in vitro, такие как реакции транскрипции in vitro или реакции транскрипции in vivo, такие как размножение плазмидных ДНК в бактериях in vivo.
В таком способе для получения последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, особенно если нуклеиновая кислота находится в форме мРНК, соответствующую молекулу ДНК можно транскрибировать in vitro. Эта матричная ДНК, предпочтительно, содержит подходящий промотор, например, промотор T7 или SP6, для транскрипции in vitro, за которым расположена желаемая для получения молекулы нуклеиновой кислоты, например, мРНК, последовательность нуклеотидов, и сигнал терминации для транскрипции in vitro. Молекула ДНК, формирующая матрицу по меньшей мере для одной из представляющих интерес РНК, можно получать посредством ферментативной пролиферация и последующего выделения в качестве части плазмиды, которую можно реплицировать в бактериях. Плазмиды, которые можно указать, как подходящие для настоящего изобретения, например, представляют собой плазмиды pT7T (номер доступа GenBank U26404; Lai et al., Development 1995, 121: 2349-2360), ряд pGEM®, например, pGEM®-1 (номер доступа GenBank X65300; из Promega) и pSP64 (номер доступа GenBank X65327); также см. Mezei and Storts, Purification of PCR Products, in: Griffin and Griffin (ed.), PCR Technology: Current Innovation, CRC Press, Boca Raton, FL, 2001.
Последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, а также белки или пептиды, как их кодирует эта последовательность нуклеиновой кислоты, могут содержать фрагменты или варианты этих последовательностей. Такие фрагменты или варианты, как правило, могут содержать последовательность, идентичную с одной из указанных выше нуклеиновых кислот или с одним из белков или пептидов или одной из последовательностей, если их кодирует последовательность нуклеиновой кислоты по изобретению, по меньшей мере на 5%, 10%, 20%, 30%, 40%, 50%, 60%, предпочтительно, по меньшей мере на 70%, более предпочтительно, по меньшей мере на 80%, также более предпочтительно, по меньшей мере на 85%, еще более предпочтительно, по меньшей мере на 90% и наиболее предпочтительно, по меньшей мере на 95% или даже на 97%, 98% или 99% от полной последовательности дикого типа на уровне нуклеиновой кислоты или на уровне аминокислот.
"Фрагменты" белков или пептидов в контексте настоящего изобретения (например, как их кодирует последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе) могут содержать последовательность белка или пептида, как определено в настоящем документе, которая в отношении ее аминокислотной последовательности (или кодирующей ее молекулы нуклеиновой кислоты), с N-конца, C-конца и/или внутри последовательности обрезана/укорочена по сравнению с аминокислотной последовательностью исходного (нативного) белка (или кодирующей ее молекулой нуклеиновой кислоты). Таким образом, такое укорочение может происходить на уровне аминокислот или, соответственно, на уровне нуклеиновой кислоты. Таким образом, идентичность последовательности в отношении такого фрагмент, как определено в настоящем документе, предпочтительно, может относиться к целому белку или пептиду, как определено в настоящем документе, или целой (кодирующей) молекуле нуклеиновой кислоты для такого белка или пептида. Подобным образом, "фрагменты" нуклеиновых кислот в контексте настоящего изобретения могут содержать последовательность нуклеиновой кислоты, как определено в настоящем документе, которая, в отношении ее молекулы нуклеиновой кислоты, с 5ʹ-конца, 3ʹ-конца и/или внутри последовательности обрезана/укорочена по сравнению с молекулой нуклеиновой кислоты исходной (нативной) молекулы нуклеиновой кислоты. Таким образом, идентичность последовательности в отношении такого фрагмента, как определено в настоящем документе, предпочтительно, может относиться к целой нуклеиновой кислоте, как определено в настоящем документе, и предпочтительный уровень идентичности последовательностей является таким, как указано в настоящем документе. Фрагменты обладают той же биологической функцией или специфической активностью, например, специфической антигенной или терапевтической активностью, или по меньшей мере сохраняют активность природного полноразмерного белка по меньшей мере на 50%, более предпочтительно, по меньшей мере на 70%, еще более предпочтительно, по меньшей мере на 90% (как измеряют при помощи соответствующего функционального анализа, например, при помощи анализа ферментативной или связывающей активности фрагмента терапевтического белка) по сравнению с полноразмерным нативным пептидом или белком, например, его специфические антигенные или терапевтические свойства. Таким образом, в предпочтительном варианте осуществления "фрагмент" представляет собой часть полноразмерного (природного) wt терапевтического белка, обладающего лечебными свойствами по настоящему изобретению.
Кроме того, можно понять, что фрагмент белка также может включать/соответствовать домены белка, подобные внеклеточному домену, внутриклеточному домену или трансмембранному домену, и укороченные или обрезанные версии белка.
Последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, может кодировать "варианты" белков или пептидов, как определено в контексте настоящего изобретения. Таким образом, можно получать белок или пептид с аминокислотной последовательностью, которая отличается от исходной последовательности одной или несколькими (2, 3, 4, 5, 6, 7 или более) мутациями, такими, как одна или несколько замещенных, вставленных и/или удаленных аминокислот. Предпочтительным уровнем идентичности последовательностей "вариантов", учитывая последовательности полноразмерных природных белков, как правило, является такой, как указано в настоящем документе. Предпочтительно, варианты имеют ту же биологическую функцию или специфическую активность или по меньшей мере сохраняют активность природного wt полноразмерного белка по меньшей мере на 50%, более предпочтительно, по меньшей мере на 70%, еще более предпочтительно, по меньшей мере на 90% (как измеряют при помощи соответствующего функционального анализа, например, при помощи анализа ферментативной или связывающей активности варианта терапевтического белка) по сравнению с полноразмерным нативным пептидом или белком, например, его специфические терапевтические свойства. Таким образом, в предпочтительном варианте осуществления "вариант" представляет собой вариант терапевтического белка, который проявляет терапевтические свойства в степени, указанной в настоящем описании изобретения.
"Варианты" белков или пептидов, как определено в контексте настоящего изобретения (например, как кодирует нуклеиновая кислота, как определено в настоящем документе), могут содержать консервативную аминокислотную замену(ы) по сравнению с их нативной, т.е. немутированной физиологической последовательностью. Эти аминокислотные последовательности, а также кодирующие их нуклеотидные последовательности в том числе соответствуют термину варианты, как определено в настоящем документе. Замены, где друг на друга заменяют аминокислоты, происходящие из одного и того же класса, называют консервативными заменами. В частности, они представляют собой аминокислоты с алифатическими боковыми цепями, положительно или отрицательно заряженными боковыми цепями, ароматическими группами в боковых цепях или аминокислоты, боковые цепи которых могут участвовать в водородных мостиках, например, боковые цепи, которые содержат гидроксильную функциональную группу. Это означает, что, например, аминокислоту с полярной боковой цепью замещают другой аминокислотой с подобной полярной боковой цепью, или, например, аминокислоту, характеризующуюся гидрофобной боковой цепью, заменяют другой аминокислотой с подобной гидрофобной боковой цепью (например, серин (треонин) треонином (серином) или лейцин (изолейцин) изолейцином (лейцином)). Возможны вставки и замены, в частности, в тех положениях последовательности, которые не вызывают модификаций трехмерной структуры или не влияют на связывающую область. Модификации трехмерной структуры при вставке(ах) или делеции(ях) можно легко определять, например, с использованием спектра CD (спектр кругового дихроизма) (Urry, 1985, Absorption, Circular Dichroism and ORD of Polypeptides, in: Modern Physical Methods in Biochemistry, Neuberger et al. (ed.), Elsevier, Amsterdam).
Кроме того, варианты белков или пептидов, как определено в настоящем документе, которые может кодировать последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, также могут содержать последовательности, где нуклеотиды нуклеиновой кислоты заменены в соответствии с вырожденностью генетического кода без вызова изменения соответствующей аминокислотной последовательности белка или пептида, т.е. в пределах указанного выше определения аминокислотная последовательность или по меньшей мере ее часть могут не отличаться от исходной последовательности одной или несколькими мутациями.
Для определения процентов идентичности двух последовательностей, например, последовательностей нуклеиновой кислоты или аминокислотных последовательностей, как определено в настоящем документе, предпочтительно, аминокислотных последовательностей, кодируемых последовательностями нуклеиновой кислоты по изобретению, как определено в настоящем документе, или самих аминокислотных последовательностей, последовательности можно выравнивать для последующего сравнения одной c другой. Таким образом, например, положение первой последовательности можно сравнивать с соответствующим положением второй последовательности. Если в положении первой последовательности находится тот же компонент, то и в случае положения во второй последовательности, две последовательности являются идентичными в этом положении. Если это не так, последовательности отличаются в этом положении. Если во второй последовательности по сравнению с первой последовательностью находятся вставки, в первую последовательность можно ввести пропуски для обеспечения дополнительного выравнивания. Если во второй последовательности по сравнению с первой находятся делеции, для обеспечения дополнительного выравнивания пропуски можно вводить во вторую последовательность. Затем, проценты идентичности двух последовательностей, являются функцией количества идентичных положений, деленных на общее количество положений, включающих положения, где присутствует только одна последовательность. Проценты идентичности двух последовательностей можно определять с использованием математического алгоритма. Предпочтительно, но без ограничения, примером математического алгоритма, который можно использовать, является алгоритм Karlin et al. (1993), PNAS USA, 90:5873-5877 или Altschul et al. (1997), Nucleic Acids Res., 25:3389-3402. Такой алгоритм интегрирован в программу BLAST. Последовательности, до определенной степени идентичные с последовательностями по настоящему изобретению можно идентифицировать этой программой.
Последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, может кодировать производные пептида или белка. Такое производное пептида или белка представляет собой молекулу, которая происходит из другой молекулы, такой как указанный пептид или белок. Как правило, "производное" содержит полноразмерную последовательность природного wt пептида или белка и дополнительные элементы последовательности, например, на N- или на C-концах, которые могут обеспечивать природному полноразмерному пептиду/белку дополнительную функцию. Также такие производные обладают той же биологической функцией или специфической активностью или по меньшей мере сохраняют активность природного wt полноразмерного белка по меньшей мере на 50%, более предпочтительно, по меньшей мере на 70%, еще более предпочтительно, по меньшей мере на 90% (измеренной при помощи соответствующего функционального анализа, см. выше, например анализа связывающей или ферментативной активности), по сравнению с полноразмерным нативным пептидом или белком, например, его специфические терапевтические свойства. Таким образом, "производное" пептида или белка также включает (химерные) слитые пептиды/белки, содержащие пептид или белок, используемый в настоящем изобретении, или природный полноразмерный белок (или его вариант/фрагмент), слитый с другим пептидом/белком, например, придающим слитому пептиду/белку две или более биологических функции. Например, гибрид может содержать метку, такую как, например, эпитоп, например, эпитоп FLAG, или эпитоп V5, или эпитоп HA. Например, эпитоп представляет собой эпитоп FLAG. Такая метка пригодна, например, для очистки слитого белка.
В этом контексте "вариант" белка или пептида может содержать по меньшей мере 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99% идентичных аминокислот на участке 10, 20, 30, 50, 75 или 100 аминокислот такого белка или пептида. Аналогично, "вариант" последовательности нуклеиновой кислоты или, в частности, фрагмент может содержать по меньшей мере 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99% идентичных нуклеотидов на участке 10, 20, 30, 50, 75 или 100 нуклеотидов такой последовательности нуклеиновой кислоты; однако, как правило, в отношении к природной полноразмерной последовательности. В случае "фрагментов" идентичность последовательности для фрагмента, как правило, определяют по длине (фрагмента) на части полноразмерного белка (соответствующей такой же длине, как у фрагмента), которая демонстрирует наибольший уровень идентичности последовательностей.
В дополнительном предпочтительном варианте осуществления первого аспекта настоящего изобретения последовательность нуклеиновой кислоты по изобретению для повышения эффективности трансфекции и/или иммуностимулирующих свойств последовательности нуклеиновой кислоты по изобретению связана с носителем, средством для трансфекции или комплексообразования. Особенно предпочтительными в этом контексте средствами, подходящими для повышения эффективности трансфекции, являются катионные или поликатионные соединения, включая протамин, нуклеолин, спермин или спермидин, или другие катионные пептиды или белки, такие как поли-L-лизин (PLL), полиаргинин, основные полипептиды, пептиды для проникновения в клетку (CPP), включая связывающие ВИЧ пептиды, Tat ВИЧ-1 (ВИЧ), происходящие из Tat пептиды, пенетратин, происходящие из VP22 или аналогичные пептиды, VP22 HSV (Herpes simplex), MAP, KALA или домены белковой трансдукции (PTD), PpT620, богатые пролином пептиды, богатые аргинином пептиды, богатые лизином пептиды, MPG-пептид(ы), Pep-1, L-олигомеры, пептид(ы) кальцитонина, получаемые у Antennapedia пептиды (в частности у Drosophila antennapedia), pAntp, pIsl, FGF, лактоферрин, транспортан, буфорин-2, Bac715-24, SynB, SynB(1), pVEC, происходящие из hCT пептиды, SAP или гистоны. Кроме того, предпочтительные катионные или поликатионные белки или пептиды можно выбирать из приведенных ниже белков или пептидов со следующей общей формулой: (Arg)l;(Lys)m;(His)n;(Orn)o;(Xaa)x, где l + m + n +o + x = 8-15, а l, m, n или o независимо друг от друга могут представлять собой любое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, при условии, что общее содержание Arg, Lys, His и Orn составляет по меньшей мере 50% от всех аминокислот олигопептида; и Xaa может представлять собой любую аминокислоту, выбранную из природных (= встречающихся в природе) или неприродных аминокислот, исключая Arg, Lys, His или Orn; и x может представлять собой любое число, выбранное из 0, 1, 2, 3 или 4, при условии, что общее содержание Xaa не превышает 50% всех аминокислот олигопептида. Особенно предпочтительными катионными пептидами в этом контексте являются, например, Arg7, Arg8, Arg9, H3R9, R9H3, H3R9H3, YSSR9SSY, (RKH)4, Y(RKH)2R и т.д. Дополнительные предпочтительные катионные или поликатионные соединения, которые можно использовать в качестве средства для трансфекции, могут включать катионные полисахариды, например, хитозан, полибрен, катионные полимеры, например, полиэтиленимин (PEI), катионные липиды, например, DOTMA: [1-(2,3-сиолеилокси)пропил)]-N,N,N-триметилхлорид аммония, DMRIE, ди-C14-амидин, DOTIM, SAINT, DC-Chol, BGTC, CTAP, DOPC, DODAP, DOPE: диолеилфосфатидилэтаноламин, DOSPA, DODAB, DOIC, DMEPC, DOGS: диоктадециламидоглицилспермин, DIMRI: бромид димиристооксипропилдиметилгидроксиэтиламмония, DOTAP: диолеоилокси-3-(триметиламмонио)пропан, DC-6-14: хлорид O,O-дитетрадеканоил-N-(α-триметиламмониоацетил)диэтаноламина, CLIP1: рац-[(2,3-диоктадецилоксипропил)(2-гидроксиэтил)]диметилхлорид аммония, CLIP6: рац-[2(2,3-дигексадецилоксипропилоксиметилокси)этил]триметиламмоний, CLIP9: рац-[2(2,3-дигексадецилоксипропилоксисукцинилокси)этил]триметиламмоний, олигофектамин, или катионные или поликатионные полимеры, например, модифицированные полиаминокислоты, такие как β-аминокислотные полимеры или обращенные полиамиды и т.п., модифицированные полиэтилены, такие как PVP (бромид поли(N-этил-4-винилпиридиния)) и т.п., модифицированные акрилаты, такие как pDMAEMA (поли(диметиламиноэтилметилакрилат)) и т.п., модифицированные амидоамины, такие как pAMAM (поли(амидоамин)) и т.д., модифицированные сложные полибетааминоэфиры (PBAE), такие как модифицированные по диаминовому концу полимеры 1,4-бутандиолдиакрилата и 5-амино-1-пентанола и т.п., дендримеры, такие как полипропиламиновые дендримеры или дендримеры на основе pAMAM и т.п., полиимины, такие как PEI: поли(этиленимин), поли(пропиленимин) и т.п., полиаллиламин, полимеры на основе каркаса из сахаров, такие как полимеры на основе циклодекстрина, полимеры на основе декстрана, хитозан и т.п., полимеры на основе силанового каркаса, такие как сополимеры PMOXA-PDMS и т.п., блок-полимеры, состоящие из комбинации одного или нескольких катионных блоков (например, выбранных из катионных полимеров, как указано выше) и одного или нескольких гидрофильных или гидрофобных блоков (например, полиэтиленгликоля); и т.п.
В этом контексте особенно предпочтительно, чтобы нуклеиновая кислота по изобретению образовывала комплекс, по меньшей мере частично, с катионным или поликатионным соединением, предпочтительно, катионными белками или пептидами. Частично означает, что только часть нуклеиновой кислоты по изобретению образовывает комплекс с катионным или поликатионным соединением, и что остаток нуклеиновой кислоты по изобретению находится в форме без образования комплекса ("свободной"). Предпочтительно, соотношение образующей комплекс нуклеиновой кислоты к свободной нуклеиновой кислоте выбрано из отношений приблизительно от 5:1 (масс./масс.) до приблизительно 1:10 (масс./масс.), более предпочтительно, из отношений приблизительно от 4:1 (масс./масс.) до приблизительно 1:8 (масс./масс.), еще более предпочтительно, из отношений приблизительно от 3:1 (масс./масс.) до приблизительно 1:5 (масс./масс.) или 1:3 (масс./масс.), а наиболее предпочтительно, отношение образующей комплекс нуклеиновой кислоты к свободной нуклеиновой кислоте выбрано из отношения приблизительно 1:1 (масс./масс.).
Предпочтительно, чтобы последовательность нуклеиновой кислоты по изобретению была предоставлена в свободной форме или в форме комплекса, например, с поликатионным соединением какой-либо химической структуры, предпочтительно, с поликатионными (поли)пептидами или синтетическими поликатионными соединениями. Предпочтительно, последовательность нуклеиновой кислоты не предоставляют вместе с упаковывающей клеткой.
В дополнительном аспекте изобретение относится к композиции или набору или набор частей, содержащих множество или более одной, предпочтительно, от 2 до 10, более предпочтительно, от 2 до 5, наиболее предпочтительно, от 2 до 4 последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе. Эти композиции по изобретению содержат более одной последовательности нуклеиновой кислоты по изобретению, предпочтительно, кодирующих различные пептиды или белки, которые содержат, предпочтительно, различные терапевтические белки или их фрагменты, варианты или производные.
В дополнительном аспекте настоящее изобретение также относится к способу повышения экспрессии кодируемого пептида или белка, включающему стадии, например, a) получение последовательности нуклеиновой кислоты или композиции по настоящему изобретению, содержащей несколько (обычно более 1, 2, 3, 4, 5, 6 или более 10 нуклеиновых кислот, например, 2-10, предпочтительно, 2-5 нуклеиновых кислот) последовательностей нуклеиновых кислот по настоящему изобретению; b) внесения или введения последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, в экспрессирующую систему, например, в бесклеточную экспрессирующую систему, клетку (например, экспрессирующую клетку-хозяина или соматическую клетку), ткань или организм. Способ можно использовать в лабораторных, исследовательских, диагностических целях, в целях коммерческого получения пептидов или белков и/или в терапевтических целях. В этом контексте, как правило, после получения последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, ее, как правило, вносят или вводят в бесклеточную экспрессирующую систему, клетку (например, экспрессирующую клетку-хозяина или соматическую клетку), ткань или организм, например, в свободной или образующей комплекс форме или в виде фармацевтической композиции, как описано в настоящем документе, предпочтительно, посредством трансфекции или любыми способами введения, как описано в настоящем документе. Способ можно проводить in vitro, in vivo или ex vivo. Кроме того, способ можно проводить в отношении лечения конкретного заболевания, предпочтительно, как определено в настоящем документе.
В этом контексте in vitro в настоящем документе определяют как трансфекцию или трансдукцию нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, в клетки в культуре вне организма; in vivo в настоящем документе определяют как трансфекцию или трансдукцию нуклеиновой кислоты по изобретению или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению (обычно более 1, 2, 3, 4, 5, 6 или более 10 нуклеиновых кислот, например, 2-10, предпочтительно, 2-5 нуклеиновых кислот) в клетки посредством внесения нуклеиновой кислоты по изобретению или композиции по изобретению в целый организм или индивидууму; и ex vivo в настоящем документе определяют как трансфекцию или трансдукцию нуклеиновой кислоты по изобретению или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению в клетки вне организма или индивидуума и последующее внесение трансфицированных клеток в организм или индивидууму.
Подобным образом, в другом аспекте настоящее изобретение также относится к использованию последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, предпочтительно, в диагностических или терапевтических целях, для повышения экспрессии кодируемого пептида или белка, в частности, в генной терапии, например, посредством внесения или введения последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, например, в бесклеточную экспрессирующую систему, клетку (например, экспрессирующую клетку-хозяина или соматическую клетку), ткань или организм. Использование можно проводить в лабораторных, исследовательских, диагностических целях, в целях коммерческого получения пептидов или белков и/или в терапевтических целях, предпочтительно, в генной терапии. В этом контексте, как правило, после получения последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, ее, как правило, вносят или вводят в бесклеточную экспрессирующую систему, клетку (например, экспрессирующую клетку-хозяина или соматическую клетку), ткань или организм, предпочтительно, в свободной или образующей комплекс форме или в виде фармацевтической композиции, как описано в настоящем документе, предпочтительно, посредством трансфекции или любыми способами введения, как описано в настоящем документе. Использование можно проводить in vitro, in vivo или ex vivo. Кроме того, использование можно проводить в отношении лечения конкретного заболевания, предпочтительно, как определено в настоящем документе.
В еще одном аспекте настоящее изобретение также относится к экспрессирующей системе по изобретению, содержащей последовательность нуклеиновой кислоты по изобретению, или экспрессирующему вектору или плазмиде в первом аспекте настоящего изобретения. В этом контексте экспрессирующая система может представлять собой бесклеточную экспрессирующую систему (например, систему транскрипции/трансляции in vitro), клеточную экспрессирующую систему (например, клетки млекопитающих, такие как клетки CHO, клетки насекомых, дрожжевые клетки, клетки бактерий, таких как E. coli) или организмы, используемые для экспрессии пептидов или белков (например, растения или животные, такие как коровы).
Кроме того, в другом аспекте настоящее изобретение также относится к использованию нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, для получения фармацевтической композиции для повышения экспрессии кодируемого пептида или белка, в частности, при использовании в генной терапии, например, для лечения заболевания, предпочтительно, как определено в настоящем документе, например, для внесения или введения нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, в клетку (например, экспрессирующую клетку-хозяина или соматическую клетка), ткань или организм, предпочтительно, в свободной форме или образующей комплекс форме или в виде фармацевтической композиции, как описано в настоящем документе, более предпочтительно, любыми способами введения, как описано в настоящем документе.
Таким образом, в конкретном предпочтительном аспекте, настоящее изобретение также относится к фармацевтической композиции, содержащей нуклеиновую кислоту по изобретению, как определено в настоящем документе, или композицию по изобретению, содержащую множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, и необязательно фармацевтически приемлемый носитель и/или транспортер.
В качестве первого ингредиента фармацевтическая композиция по изобретению содержит по меньшей мере одну нуклеиновую кислоту по изобретению, как определено в настоящем документе.
В качестве второго ингредиента фармацевтическая композиция по изобретению необязательно может содержать по меньшей мере один дополнительный фармацевтически активный компонент. Фармацевтически активный компонент в этом контексте представляет собой соединение, которое оказывает терапевтическое действие в отношении лечения, улучшения состояния или предотвращения конкретного симптома или заболевания, как указано в настоящем документе. Такие соединения, не подразумевая каких-либо ограничений, включают пептиды или белки, предпочтительно, как определено в настоящем документе, нуклеиновые кислоты, предпочтительно, как определено в настоящем документе, (терапевтически активные) низкомолекулярные органические или неорганические соединения (молекулярная масса менее 5000, предпочтительно, менее 1000), сахара, антигены или антитела, предпочтительно, как определено в настоящем документе, терапевтические средства, уже существующие на известном уровне техники, антигенные клетки, антигенные клеточные фрагменты, клеточные фракции; компоненты клеточной стенки (например, полисахариды), модифицированные, аттенуированные или деактивированные (например, химически или посредством облучения) патогенные микроорганизмы (вирусы, бактерии и т.п.), адъюванты, предпочтительно, как определено в настоящем документе, и тому подобное.
Кроме того, фармацевтическая композиция по изобретению может содержать фармацевтически приемлемый носитель и/или транспортер. В контексте настоящего изобретения фармацевтически приемлемый носитель, как правило, включает жидкую или нежидкую основу фармацевтической композиции по изобретению. Если фармацевтическая композиция по изобретению предоставлена в жидкой форме, носитель, как правило, представляет собой апирогенную воду; изотонический солевой раствор или забуференные (водные) растворы, например, забуференные фосфатом, цитратом и т.д. растворы. Инъекционный буфер по отношению к конкретному эталонному носителю может быть гипертоническим, изотоническим или гипотоническим, т.е. буфер может иметь более высокое, идентичное или меньшее содержание солей по сравнению с конкретным эталонным носителем, где, предпочтительно, можно использовать такие концентрации указанных выше солей, которые не приводят к повреждению клеток вследствие осмоса или других концентрационных эффектов. Эталонные носители представляют собой, например, жидкости, существующие в способах "in vivo", такие как кровь, лимфа, цитозольные жидкости, или другие жидкости организма, или, например, жидкости, которые можно использовать в качестве эталонных носителей в способах "in vitro", такие как общие буферы или жидкости. Такие общие буферы или жидкости известны специалисту. В качестве жидкого основания особенно предпочтителен лактатный раствор Рингера.
Однако для фармацевтической композиции по изобретению также можно использовать один или несколько совместимых твердых или жидких наполнителей или разбавителей или инкапсулирующих соединений, которые подходят для введения пациенту, получаемому лечение. Как используют в настоящем документе, термин "совместимый" обозначает, что эти составляющие фармацевтической композиции по изобретению можно смешивать с нуклеиновой кислотой по изобретению, как определено в настоящем документе, таким образом, что не происходит интеркаляции, которая может значительно снижать фармацевтическую эффективность фармацевтической композиции по изобретению в типичных условиях использования.
В конкретном варианте осуществления фармацевтическая композиция по изобретению может содержать адъювант. В этом контексте адъювант можно понимать как любое соединение, которое подходит для инициации или усиления иммунного ответа врожденной иммунной системы, т.е. неспецифического иммунного ответа. Другими словами, при введении, фармацевтическая композиция по изобретению, благодаря адъюванту, необязательно содержащемуся в ней, предпочтительно, вызывает врожденный иммунный ответ. Предпочтительно, такой адъювант можно выбирать из адъювантов, известных специалисту и подходящих для настоящего случая, т.е. поддержки индукции врожденного иммунного ответа у млекопитающего, например, адъювантного белка, как определено выше, или адъюванта, как определено далее.
Особенно предпочтительными в качестве адъювантов, подходящих для хранения и доставки, являются катионные или поликатионные соединения, как определено выше для последовательности нуклеиновой кислоты по изобретению в качестве носителя, средства для трансфекции или образования комплекса.
Дополнительные добавки, которые можно включать в фармацевтическую композицию по изобретению, представляют собой эмульгаторы, такие как, например, Tween®; средства для смачивания, такие как, например, лаурилсульфат натрия; красители; придающие вкус средства, фармацевтические носители; формирующие таблетку средства; стабилизаторы; антиоксиданты; консерванты.
Кроме того, фармацевтическая композиция по изобретению может содержать любое дополнительное соединение, которое известно как иммуностимулирующее ввиду его аффинности связывания (в качестве лиганда) с Toll-подобными рецепторами человека TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10 или ввиду его аффинности связывания (в качестве лиганда) c Toll-подобными рецепторами мыши TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13.
Фармацевтическую композицию по изобретению можно вводить перорально, парентерально, посредством ингаляционного спрея, местно, ректально, назально, буккально, вагинально или посредством имплантируемого резервуара. Как используют в настоящем документе, термин парентеральный включает подкожный, внутривенный, внутримышечный, внутрисуставный, интрасиновиальный, интрастернальный, интратекальный, внутрипеченочный, внутриочаговый, интракраниальный, трансдермальный, интрадермальный, внутрилегочный, интраперитонеальный, интракардиальный, внутриартериальный и сублингвальный способы инъекции или инфузии.
Предпочтительно, фармацевтическую композицию по изобретению можно вводить посредством парентеральной инъекции, более предпочтительно, посредством подкожного, внутривенного, внутримышечного, внутрисуставного, интрасиновиального, интрастернального, интратекального, внутрипеченочного, внутриочагового, интракраниального, трансдермального, интрадермального, внутрилегочного, интраперитонеального, интракардиального, внутриартериального и сублингвального способов инъекции или инфузии. Особенно предпочтительной является интрадермальная и внутримышечная инъекция. Стерильными инъецируемыми формами фармацевтических композиций по изобретению могут быть водная или масляная суспензии. Эти суспензии можно формулировать способами, известными в данной области, с использованием подходящих диспергирующих средств или средств для смачивания и суспендирующих средств.
Фармацевтическую композицию по изобретению, как определено в настоящем документе, также можно вводить перорально в любой перорально приемлемой лекарственной форме, включая в качестве неограничивающих примеров, капсулы, таблетки, водные суспензии или растворы.
Фармацевтическую композицию по изобретению также можно вводить местно, особенно, когда цель лечения включает области и органы, легко доступные при местном применении, например, включая заболевании кожи или любой другой доступной эпителиальной ткани. Для каждого из этих областей или органов легко получать подходящие местные составы. Для местного применения фармацевтическую композицию по изобретению можно формулировать в подходящей мази, содержащей нуклеиновую кислоту по изобретению, как определено в настоящем документе, суспендированной или растворенной в одном или нескольких носителях.
Как правило, фармацевтическая композиция по изобретению содержит "безопасное и эффективное количество" компонентов фармацевтической композиции по изобретению, в частности, последовательности(ей) нуклеиновой кислоты по изобретению, как определено в настоящем документе. Как используют в настоящем документе, "безопасное и эффективное количество" означает такое количество последовательности(ей) нуклеиновой кислоты по изобретению, как определено в настоящем документе, как количество, которого достаточно для значимой индукции положительного изменения заболевания или нарушения, как определено в настоящем документе. Однако, в то же время, "безопасное и эффективное количество" является достаточно малым, чтобы избежать серьезных побочных эффектов и обеспечить оптимальную отношение между преимуществом и риском. Определение указанных пределов обычно находится в компетенции лечащего врача.
Кроме того, настоящее изобретение относится к определенным применениям и использованиям последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, композиций по изобретению, содержащих множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, фармацевтической композиции по изобретению, содержащей последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, или наборов, содержащих их.
В одном конкретном аспекте настоящее изобретение относится к первому медицинскому применению последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, в качестве лекарственного средства в генной терапии, предпочтительно, для лечения заболеваний, рассмотренных в настоящем описании изобретения.
В другом аспекте настоящее изобретение относится ко второму медицинскому применению последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, для лечения заболеваний, как определено в настоящем документе, предпочтительно, к использованию последовательности нуклеиновой кислоты по изобретению, как определено в настоящем документе, композиции по изобретению, содержащей множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, фармацевтической композиции, содержащих их, или наборов, содержащих их, для получения лекарственного средства для профилактики, лечения и/или улучшение состояния заболеваний, как определено в настоящем документе. Предпочтительно, фармацевтическую композицию для этой цели используют или следует вводить нуждающемуся в этом пациенту.
Заболевания, рассмотренные в настоящем описании изобретения, предпочтительно, выбраны из инфекционных заболеваний, новообразований (например, раковых или опухолевых заболеваний), заболеваний крови и кроветворных органов, заболеваний эндокринной системы, заболеваний, связанных с питанием и обменом веществ, заболеваний нервной системы, заболеваний сердечно-сосудистой системы, заболеваний дыхательной системы, заболеваний пищеварительной системы, заболеваний кожи и подкожной ткани, заболеваний костно-мышечной системы и соединительной ткани и заболеваний мочеполовой системы.
В контексте настоящего изобретения особенно предпочтительными являются наследственные заболевания, выбранные из нижеследующих болезней: синдром делеции 1р36, синдром делеции 18р, недостаточность 21-гидроксилазы, 45,Х (синдром Тернера), 47,ХХ,+21 (синдром Дауна), 47,ХХХ (синдром тройной хромосомы), 47,XXY (синдром Клайнфелтера), 47,XY,+21 (синдром Дауна), синдром 47,XYY, порфирия вследствие недостаточности дегидратазы 5-ALA (недостаточность дегидратазы ALA), порфирия вследствие недостаточности дегидратазы 5-аминолевулиновой кислоты (недостаточность дегидратазы ALA), синдром делеции 5р (Cri du chat), 5р-синдром (Cri du chat), А-Т (атаксия-телангиэктазия), ААТ (недостаточность альфа-1-антитрипсина), отсутствие семявыносящего протока (врожденное билатеральное отсутствие семявыносящего протока), ацерулоплазминемия, ACG2 (ахондрогенез II типа), АСН (ахондроплазия), ахондрогенез II типа, ахондроплазия, недостаточность кислой бета-глюкозидазы (болезнь Гоше 1 типа), акроцефалосиндактилия (синдром Апера), акроцефалосиндактилия V типа (синдром Пфейффера), акроцефалия (синдром Апера), острая церебральная болезнь Гоше (болезнь Гоше 2 типа), острая перемежающаяся порфирия, недостаточность ACY2 (болезнь Канавана), AD (болезнь Альцгеймера), краниосиностоз (синдром Мунке), аденоматозный полипоз (наследственный аденоматозный полипоз), аденоматозный полипоз ободочной кишки (наследственный аденоматозный полипоз), ADP (недостаточность дегидратазы ALA), недостаточность аденилсукцинат-лиазы, нарушения надпочечников (недостаточность 21-гидроксилазы), адреногенитальный синдром (недостаточность 21-гидроксилазы), адренолейкодистрофия, AIP (острая перемежающаяся порфирия), AIS (синдром невосприимчивости к андрогену), AKU (алкаптонурия), порфирия вследствие недостаточности ALA дегидратазы (недостаточность дегидратазы ALA), ALA-D порфирия (недостаточность дегидратазы ALA), недостаточность дегидратазы ALA, алкаптонурия, болезнь Александера, алкаптонурия, охроноз, обусловленный алкаптонурией (алкаптонурия), недостаточность альфа-1-антитрипсина, ингибитор альфа-1-протеиназы (недостаточность альфа-1-антитрипсина), эмфизема, обусловленная альфа-1-антитрипсином (недостаточность альфа-1-антитрипсина), недостаточность альфа-галактозидазы А (болезнь Фабри), ALS (боковой амиотрофический склероз), синдром Алстрома, ALX (болезнь Александера), болезнь Альцгеймера, несовершенный амелогенез, недостаточность дегидратазы аминолевулиновой кислоты (недостаточность дегидратазы ALA), недостаточность аминоацилазы 2 (болезнь Канавана), боковой амиотрофический склероз, болезнь Андерсона-Фабри (болезнь Фабри), синдром невосприимчивости к андрогену, анемия, наследственная сидеробластная анемия (Х-сцепленная сидеробластная анемия), сцепленная с полом гипохромная сидеробластная анемия (Х-сцепленная сидеробластная анемия), наследственная спленомегалическая анемия (болезнь Гоше), синдром Ангелмана, ангиокератома (болезнь Фабри), диффузная ангиокератома (болезнь Фабри), ангиоматоз сетчатки (болезнь Гиппеля-Линдау), ANH1 (Х-сцепленная сидеробластная анемия), устойчивость к АРС лейденовского типа (тромбофилия Лейдена, обусловленная фактором V), синдром Аперта, недостаточность AR (синдром невосприимчивости к андрогену), AR-CMT2 ee (болезнь Шарко-Мари-Тута 2 типа), арахнодактилия (синдром Марфана), ARNSHL (бессиндромная аутосомная рецессивная глухота), наследственная прогрессирующая артроофтальмопатия (синдром Стиклера, COL2A1), множественная артрохалазия (синдром Элерса-Данлоса типа артрохалазии), AS (синдром Ангелмана), недостаточность Asp (болезнь Канавана), недостаточность Aspa (болезнь Канавана), недостаточность аспартоацилазы (болезнь Канавана), атаксия-телангиэктазия, синдром аутизма-деменции-атаксии-утраты целевого использования руки (синдром Ретта), аутосомный доминантный юношеский ALS (боковой амиотрофический склероз 4 типа), синдром Опица G/BBB (синдром делеции 22q11.2), аутосомная рецессивная форма юношеского ALS 3 типа (боковой амиотрофический склероз 2 типа), аутосомная рецессивная нессиндромная потера слуха (бессиндромная аутосомная рецессивная глухота), аутосомное рецессивное нейросенсорное ухудшение слуха (синдром Пендреда), AxD (болезнь Александера), синдром Айерсы (первичная легочная гипертензия), вариант В ганглиозидоза, обусловленного гексозамидазой GM2 (болезнь Сандхоффа), BANF (нейрофиброматоз 2), синдром Баре-Стивенсона, доброкачественный пароксизмальный перитонит (семейная средиземноморская лихорадка), синдром Бенджамина, бета-талассемия, недостаточность ВН4 (недостаточность тетрагидробиоптерина), билательный акустический нейрофиброматоз (нейрофиброматоз 2), недостаточность биотинидазы, рак мочевого пузыря, геморрагические нарушения (тромбофилия Лейдена, обусловленная фактором V), синдром Блоха-Сульцбергера (пигментный дерматоз), синдром Блума, заболевания костей, заболевания костного мозга (Х-сцепленная сидеробластная анемия), синдром Бонневи-Уллриха (синдром Тернера), болезнь Бурневилля (туберозный склероз), факоматоз Бурневилля (туберозный склероз), заболевания головного мозга, рак молочной железы, синдром Бирта-Хогга-Дубе, несовершенный остеогенез, синдром Рубинстайна-Тейби), бронзовый диабет (гемохроматоз), бронзовый цирроз (гемохроматоз), Х-сцепленная атрофия бульбоспинальных мышц (болезнь Кеннеди), синдром Бургена-Груца (наследственная недостаточность липопротеин-липазы), CADASIL, хронический грануломатоз (CGD), камптодактилия, болезнь Канавана, рак, наследственный синдром рака (наследственный неполипозный колоректальный рак), рак молочной железы, рак мочевого пузыря, множественная поздняя недостаточность карбоксилазы (недостаточность биотинидазы), кардиомиопатия (синдром Нунана), синдром кошачьего крика (Cri du chat), CAVD (врожденное билатеральное отсутствие семявыносящего протока), кардиофациальный синдром Кайлора (синдром делеции 22q11.2), CBAVD (врожденное билатеральное отсутствие семявыносящего протока), болезнь солнечного сплетения, СЕР (врожденная эритропоэтическая порфирия), недостаточность керамид-тригексосидазы (болезнь Фабри), наследственный мозжечково-ретинальный ангиоматоз, наследственная болезнь Гиппеля-Линдау, церебральная артериопатия с субкортикальным инфарктом и лейкоцефалопатией (CADASIL), церебральная аутосомная доминантная артериопатия с субкортикальным инфарктом и лейкоэнцефалопатией (CADASIL), церебральный склероз (туберозный склероз), цереброатрофическая гипераммониемия (синдром Ретта), наследственный глюкоцереброзидоз (болезнь Гоше), CF (кистозный фиброз), СН (врожденный гипотиреоз), болезнь Шарко (боковой амиотрофический склероз), болезнь Шарко-Мари-Тута, хондродистрофия (ахондроплазия), синдром хондродистрофии (ахондроплазия), хондродистрофия с нейросенсорной глухотой (отоспонгиоз), несовершенный хондрогенез (ахондрогенез II типа), синдром хореоатетоза с самоповреждением (синдром Леша-Найхана), классическая галактоземия (галактоземия), классический синдром Элерса-Данлоса (синдром Элерса-Данлоса классического типа), классическая фенилкетонурия (фенилкетонурия), расщелина губы и неба (синдром Стиклера), череп в виде клеверного листа со смертельной недоразвитостью (смертельная дисплазия 2 типа), CLS (синдром Коффина-Лоури), СМТ (болезнь Шарко-Мари-Тута), синдром Коккейна, синдром Кофина-Лоури, коллагенопатия II и XI типов, наследственный неполиползный рак ободочной кишки (наследственный неполипозный колоректальный рак), наследственный рак ободочной кишки (наследственный аденоматозный полипоз), колоректальный рак, полная недостаточность HPRT (синдром Леша-Найхана), полная недостаточность гипоксантингуанин-фосфорибозитрансферазы (синдром Леша-Найхана), компрессионная невропатия (наследственная невропатия с предрасположенностью к параличу со сдавлением нерва), врожденная гиперплазия надпочечника (недостаточность 21-гидроксилазы), врожденное билатеральное отсутствие семявыносящего протока (врожденное отсутствие семявыносящего протока), врожденная эритропоэтическая порфирия, врожденный порок сердца, врожденная гипомиелинизация (болезнь Шарко-Мари-Тута 1 типа/болезнь Шарко-Мари-Тута 4 типа), врожденный гипотиреоз, врожденная метгемоглобинемия (метгемоглобинемия), врожденный остеосклероз (ахондроплазия), врожденная сидеробластная анемия (Х-сцепленная сидеробластная анемия), заболевание соединительной ткани, синдром лицевой аномалии (синдром делеции 22q11.2), анемия Кули (бета-талассемия), болезнь накопления меди (болезнь Вильсона), болезнь переноса меди (болезнь Менке), наследственная копропорфирия, недостаточность копропорфириноген-оксидазы (наследственная копропорфирия), синдром Каудена, недостаточность СРО (наследственная копропорфирия), недостаточность CPRO (наследственная копропорфирия), недостаточность СРХ (наследственная копропорфирия), черепно-лицевой дизатроз (синдром Крузона), черепно-лицевой дизостоз (синдром Крузона), кретинизм (врожденный гипотиреоз), болезнь Крейтцфельда-Якоба (спастический псевдосклероз), Cri du chat (болезнь Крона, фибростеноз), синдром Крузона, синдром Крузона с акантозом (дермоскелетный синдром Крузона), дермоскелетный синдром Крузона, CS (синдром Коккейна) (синдром Каудена), синдром Куршманна-Баттена-Штейнерта (миотоническая дистроофия), синдром Баре-Стивенсона (синдром свернутой кожи Баре-Стивенсона), мутация хромосомы, недостаточность D-глицерат-дегидрогеназы (первичная гипероксалурия), синдром метафизита (спондилоэпиметафизарная дисплазия типа Струдвика), DAT-деменция типа болезни Альцгеймера (болезнь Альцгеймера), генетическая гиперкальциурия (болезнь Дента), DBMD (мышечная дистрофия типа болезни Дюшенна и Бекера), глухота с зобом (синдром Пендреда), синдром глухоты с пигментным ретинитом (синдром Ушера), болезнь, обусловленная недостаточностью фенилаланингидроксилазы (фенилкетонурия), дегенеративные заболевания нервной системы, синдром 1 Гроши, синдром Дежерина-Сотта (болезнь Шарко-Мари-Тута), порфирия, обусловленная недостаточностью дельта-аминолевулинат-дегидратазы (недостаточность дегидратазы ALA), деменция (CADASIL), демиелогенная лейкодистрофия (болезнь Александера), синдром Элерса-Данлоса дерматоспараксического типа, дерматоспараксис (синдром Элерса-Данлоса дерматоспараксического типа), инвалидность вследствие порока развития, dHMN (боковой амиотрофический склероз 4 типа), DHMN-V (атрофия спинных мышц V типа), недостаточность DHTR (синдром невосприимчивости к андрогену), диффузный глобоидный склероз (болезнь Краббе), синдром ДиЖорже, недостаточность рецепторов дигидротестостерона (синдром невосприимчивости к андрогену), атрофия спинных мышц V типа, DM1 (миотоническая дистрофия 1 типа), DM2 (миотоническая дистрофия 2 типа), синдром Дауна, DSMAV (атрофия спинных мышц V типа), DSN (болезнь Шарко-Мари-Тута 4 типа), DSS (болезнь Шарко-Мари-Тута 4 типа), мышечная дистрофия Дюшенна/Бекера (мышечная дистрофия типа болезни Дюшена и Бекера), хондродистрофическое недоразвитие (ахондроплазия), смертельное недоразвитие (смертельная дисплазия), карликовость, синдром умственной отсталости - атрофии сетчатки - глухоты (синдром Коккейна), дисмиелиногенная лейкодистрофия (болезнь Александера), миотоническая дистрофия, синдром дистрофии-пигментного ринита-дизостоза (синдром Ушера), ранняя наследственная болезнь Альцгеймера (EOFAD) (болезнь Альцгеймера), EDS (синдром Элерса-Данлоса), синдром Элерса-Данлоса, болезнь Экмана-Лобштейна (несовершенный остеогенез), невропатия с ущемлением нерва (наследственная невропатия с предрасположенностью к параличу со сдавлением нерва), эпилойя (туберозный склероз), ЕРР (эритропоэтическая протопорфирия), эритробластная анемия (бета-талассемия), эритропеченочная протопорфирия (эритропоэтическая протопорфирия), недостаточность эритроидной 5-аминолевулинат-синтетазы (Х-сцепленная сидеробластная анемия), эритропоэтическая порфирия (врожденная эритропоэтическая порфирия), эритропоэтическая протопорфирия, эритропоэтическая уропорфирия (врожденная эритропоэтическая порфирия), рак глаза (ретинобластома, FA - атаксия Фридрейха), болезнь Фабри, повреждения и нарушения лица, тромбофилия Лейдена, обусловленная фактором V, FALS (боковой амиотрофический склероз), наследственная невринома слухового нерва (нейрофиброматоз II типа), наследственный аденоматозный полипоз, наследственная болезнь Альцгеймера (FAD) (болезнь Альцгеймера), наследственный боковой амиотрофический склероз (боковой амиотрофический склероз); наследственная вегетативная дистония, наследственная жировая гипертриглицеридемия (наследственная недостаточность липопротеин-липазы), наследственный гемохроматоз (гемохроматоз), наследственная недостаточность LPL (наследственная недостаточность липопротеин-липазы), наследственный неполипозный рак ободочной кишки (наследственный неполипозный колоректальный рак), наследственный пароксизмальный полисерозит (семейная средиземноморская лихорадка), наследственная РСТ (кожная порфирия), наследственная компрессионная невропатия (наследственная невропатия с предрасположенностью к параличу со сдавлением нерва), наследственная первичная легочная гипертензия (FPPH) (первичная легочная гипертензия), наследственный синдром Тернера (синдром Нунана), наследственная лейкоэнцефалопатия сосудов (CADASIL), FAP (наследственный аденоматозный полипоз), FD (наследственная вегетативная дистония), женский псевдосиндром Тернера (синдром Нунана), недостаточность феррохелатазы (эритропоэтическая протопорфирия), болезнь, обусловленная ферропортином (гемохроматоз 4 типа), лихорадка (семейная средиземноморская лихорадка), синдром FG, FGR3-связанный синостоз венечного шва (синдром Мунке), фибриноидная дегенерация астроцитов (болезнь Александера), фиброцистозная болезнь поджелудочной железы (муковисцидоз), FMF (семейная средиземноморская лихорадка), болезнь Фоллинга (фенилкетонурия), синдром fra(X) (синдром слабой Х-хромосомы), синдром слабой Х-хромосомы, несовершенный остеогенез, синдром FRAXA (синдром слабой Х-хромосомы), FRDA (атаксия Фридрейха), атаксия Фридрейха, FXS (синдром слабой Х-хромосомы), недостаточность G6PD, недостаточность галактокиназы (галактоземия), недостаточность галактоза-1-фосфат-уридилтрансферазы (галактоземия), галактоземия, недостаточность галактозилкерамидазы (болезнь Краббе), липидоз, обусловленный галактозилкерамидом (болезнь Краббе), недостаточность галактозилцереброзидазы (болезнь Краббе), липидоз, обусловленный галактозилсфингозином (болезнь Краббе), недостаточность GALC (болезнь Краббе), недостаточность GALT (галактоземия), болезнь Гоше, болезнь, подобная болезни Гоше (псевдоболезнь Гоше), недостаточность GBA (болезнь Гоше 1 типа), CD (болезнь Гоше), генетические нарушения головного мозга, генетическая эмфизема (недостаточность альфа-1-антитрипсина), генетический гемохроматоз (гемохроматоз), врожденный гигантоклеточный гепатит (врожденный гемохроматоз), недостаточность GLA (болезнь Фабри), глиобластома сетчатки (ретинобластома), глиома сетчатки (ретинобластома), глобоидно-клеточная лейкодистрофия (GCL, GLD) (болезнь Краббе), глобоидно-клеточная лейкоэнцефалопатия (болезнь Краббе), недостаточность глюкоцереброзидазы (болезнь Гоше), глюкоцереброзидоз (болезнь Гоше), глюкозилцереброзидный липидоз (болезнь Гоше), недостаточность глюкозилкерамидазы (болезнь Гоше), недостаточность глюкозилкерамид-бета-глюкозидазы (болезнь Гоше), глюколзилкерамидный липидоз (болезнь Гоше), глицериновая ацидурия (первичная гипероксалурия), глициновая энцефалопатия (некетоновая гиперглицинемия), гликолевая ацидурия (первичная гипероксалурия), ганглиодоз GM2 1 типа (болезнь Тея-Сакса), синдром глухоты Гойтера (синдром Пендреда), синдром Графе-Ушера (синдром Ушера), синдром Гронблада-Страндбера (псевдоксантома), порфирия Гюнтера (врожденная эритропоэтическая порфирия), болезнь Гюнтера (врожденная эритропоэтическая порфирия), гемохроматоз, синдром Галлгрена (синдром Ушера), ихтиоз Гарлеквина, болезнь Hb S (серповидно-клеточная анемия), НСН (гипохондроплазия), НСР (наследственная копропорфирия), неправильное формирование головы и головного мозга, нарушения слуха и глухота, проблемы со слухом у детей, HEF2A (гемохроматоз 2 типа), HEF2B (гемохроматоз 2 типа), гематопорфирия (порфирия), недостаточность гемсинтетазы (эритропоэтическая протопорфирия), гемохроматоз, болезнь, обусловленнапя гемоглобином М (метгемоглобинемия типа бета-глобина), болезнь, обусловленная гемоглобином S (серповидно-клеточная анемия), гемофилия, НЕР (гепатоэритропоэтическая порфирия), недостаточность печеночного AGT (первичная гипероксалурия), гепатоэритропоэтическая порфирия, синдром гепатолентикулярной дегенерации (болезнь Вильсона), наследственная артроофтальмопатия (синдром Стиклера), наследственная копропорфирия, наследственный дистрофический липидоз (болезнь Фабри), наследственный гемохроматоз (ННС) (гемохроматоз), наследственная миопатия, обусловленная вирусными включениями (регенерация скелетных мышц), наследственная железодефицитная анемия (Х-сцепленная сидеробластная анемия), наследственная невропатия двигательных и чувствительных нервов (болезнь Шарко-Мари-Тута), наследственная невропатия двигательных нервов (атрофия спинных мышц), наследственная невропатия двигательных нервов V типа (атрофия спинных мышц V типа), наследственный множественный экзостоз, наследственный неполипозный колоректальный рак, синдром наследственной периодической лихорадки (семейная средиземноморская лихорадка), наследственный полипоз (наследственный аденоматозный полипоз), наследственная легочная эмфизема (недостаточность альфа-1-антитрипсина), наследственная устойчивость к активированному протеину С (тромбофилия Лейдена, обусловленная фактором V), наследственная невропатия чувствительных и вегетативных нервов III типа (наследственная вегетативная дистония), наследственная спастическая параплегия (наследственный детский восходящий спастический паралич), наследственная атаксия спинного мозга (атаксия Фридрейха), наследственный склероз спинного мозга (атаксия Фридрейха), анемия Геррика (серповидно-клеточная анемия, гетерозиготная OSMED (синдром Вессенбахера-Цвеймюллера), гетерозиготная отоспондиломегаэпифизарная дисплазия (синдром Вессенбахера-Цвеймюллера), недостаточность HexA (болезнь Тея-Сакса), недостаточность гексозаминидазы А (болезнь Тея-Сакса), недостаточность альфа-субъединицы гексозаминидазы (вариант В) (болезнь Тея-Сакса), HFE-связанный гемохроматоз (гемохроматоз), HGPS (прогерия), болезнь Гиппеля-Линдау, HLAH (гемохроматоз), HMN V (атрофия спинных мышц V типа), HMSN (болезнь Шарко-Мари-Тута), HNPCC (наследственный неполипозный колоректальный рак), HNPP (наследственная невропатия с предрасположенностью к параличу со сдавлением нерва), гомоцистинурия, недостаточность оксидазы гомогентизиновой кислоты (алкаптонурия), алкаптонурия, гомозиготная порфирия (гепатоэритропоэтическая порфирия), НР1 (первичная гипероксалурия), НР2 (первичная гипероксалурия), НРА (гиперфенилаланинемия), HPRT - недостаточность гипоксантингуанин-фосфорибозилтрансферазы (синдром Леша-Найхана), НSAN III типа (наследственная вегетативная дистония), HSAN3 (наследственная вегетативная дистония), HSN-III (наследственная вегетативная дистония), дерматоспараксис (синдром Элерса-Данлоса дерматоспараксического типа), болезнь Гентингтона, синдром прогерии Гетчинсона-Гилфорда (прогерия), гиперандрогенизм неклассического типа вследствие недостаточности 21-гидроксилазы (недостаточность 21-гидроксилазы), гипергиломикронемия (наследственная недостаточность липопротеин-липазы), гиперглицинемия с кетоацидозом и лейкопенией (пропионовая ацидемия), гиперлипопротеинемия I типа (наследственная недостаточность липопротеин-липазы), первичная гипероксалурия гиперфенилаланинемия, гипохондродисплазия (гипохондроплазия), гипохондрогенез, гипохондроплазия, гипохромная анемия (Х-сцепленная сидеробластная анемия), врожденная гипокупремия (синдром Менке), недостаточность гипоксантинфосфорибозилтрансферазы (HPRT) (синдром Леша-Найхана), IAHSP (наследственный детский восходящий спастический паралич), идиопатический гемохроматоз (гемохроматоз 3 типа), идиопатический неонатальный гемохроматоз (неонатальный гемохроматоз), идиопатическая легочная гипертензия (первичная легочная гипертензия), нарушения иммунной системы (тяжелая форма Х-сцепленного комбинированного иммунодефицита), пигментная инконтиненция, детская церебральная болезнь Гоше (болезнь Гоше 2 типа), детская болезнь Гоше (болезнь Гоше 2 типа), наследственный детский восходящий спастический паралич), бесплодие, наследственная эмфизема (недостаточность альфа-1-антитрипсина), наследственная трансмиссивная губковидная энцефалопатия, наследственная предрасположенность к параличу со сдавлением нерва (наследственная невропатия с предрасположенностью к параличу со сдавлением нерва), синдром Инслея-Астлея (отоспондиломегаэпифизарная дисплазия), синдром перемежающейся острой порфирии (острая перемежающаяся порфирия), синдром полипоза кишечника и пигментации кожи (синдром Пейтца-Егерса), IP (пигментная инконтиненция), нарушение накопления железа (гемохроматоз), изодицентрическая хромосома 15 (idic 15), изолированная глухота (бессиндромная глухота), синдром Джексона-Вейсса, JH (гемохроматоз 2 типа), синдром Юберта, JPLS (юношеский первичный боковой склероз), юношеский боковой амиотрофический склероз (боковой амиотрофический склероз 2 типа), юношеская подагра, хореоатетоз, синдром умственной отсталости (синдром Леша-Найхана), синдром юношеской гиперурицемии (синдром Леша-Найхана), JWS (синдром Джексона-Вейсса), KD (Х-сцепленная мышечная атрофия продолговатого мозга), болезнь Кеннеди (Х-сцепленная мышечная атрофия продолговатого мозга), мышечная атрофия продолговатого мозга Кеннеди (Х-сцепленная мышечная атрофия продолговатого мозга), гистиоцитоз, обусловленный керазином (болезнь Гоше), липоидоз, обусловленный керазином (болезнь Гоше), тезаурисмоз, обусловленный керазином (болезнь Гоше), кетоновая глицинемия (пропионовая ацидемия), кетоновая гиперглицинемия (пропионовая ацидемия), болезни почек (первичная гипероксалурия), синдром Клайнфелтера, дисплазия Книста, болезнь Краббе, лакунарная деменция (CADASIL), ахондрогенез Лангера-Сальдино (ахондрогенез II типа), дисплазия Лангера-Сальдино (ахондрогенез II типа), поздняя болезнь Альцгеймера (болезнь Альцгеймера 2 типа), поздняя наследственная болезнь Альцгеймера (AD2) (болезнь Альцгеймера 2 типа), поздняя болезнь Краббе (LOKD) (болезнь Краббе), нарушения познавательной функции (неспособность к обучению), периоральный лентигиноз (синдром Пейтца-Егерса), синдром Леша-Найхана, лейкодистрофия, лейкодистрофия с лихорадкой Розенталя (болезнь Александера), губковидная лейкодистрофия (болезнь Канавана), LFS (синдром Ли-Фраумени), недостаточность липазы D (наследственная недостаточность липопротеин-липазы), недостаточность LIPD (наследственная недостаточность липопротеин-липазы), наследственный цереброзидоз (болезнь Гоше), детский ганглиозидный липидоз (болезнь Тея-Сакса), липоидный гистоцитоз (обусловленный керазином) (болезнь Гоше), наследственная недостаточность липопротеин-липазы, болезни печени (галактоземия), болезнь Луи Герига (боковой амиотрофический склероз), синдром Луи-Бар (атаксия-телангиэктазия), синдром Линча (наследственный неполипозный колоректальный рак), недостаточность лизилгидроксилазы (синдром Элерса-Данлоса типа кифосколиоза), болезнь Мачадо-Джозефа (атаксия спинного мозга и мозжечка 3 типа), рак грудной железы у мужчин (рак грудной железы), нарушения мужских половых органов, мужской синдром Тернера (синдром Нунана), злокачественное новообразование молочной железы (рак молочной железы), злокачественная опухоль молочной железы (рак молочной железы), злокачественная опухоль мочевого пузыря (рак мочевого пузыря), синдром Марфана 15, синдром маркера Х (синдром слабой Х-хромосомы), синдром Мартина-Белла (синдром слабой Х-хромосомы), синдром Мак-Куна-Олбрайта, синдром Мак-Леода, MEDNIK, средиземноморская анемия (бета-талассемия), семейная средиземноморская лихорадка, мегаэпифизарная карликовость (отоспондилолмегаэпифизарная дисплазия), синдром Менке, умственная отсталость с костно-хрящевыми аномалиями (синдром Коффина-Лоури), нарушения обмена веществ, метатропная карликовость II типа (дисплазия Книста), метатропная дисплазия II типа (дисплазия Книста), метгемоглобинемия, обусловленная бета-глобином, метилмалоновая ацидемия, MFS (синдром Марфана), МНАМ (синдром Каудена), МК (синдром Менке), микросиндром, микроцефалия, ММА (метилмалоновая ацидемия), MNK (синдром Менке), синдром моносомии 1р36 (синдром делеции 1р36), моносомия Х (синдром Тернера), заболевание двигательных нейронов, боковой амиотрофический склероз, нарушения движений, синдром Мовата-Вильсона, мукополисахаридоз (MPS I), муковисцидоз (фиброзно-кистозная дегенерация), синдром Мунке, деменция, обусловленная несколькими инфарктами (CADASIL), поздняя недостаточность карбоксилазы, (недостаточность биотинидазы), синдром множественной гамартомы (синдром Каудена), множественный нейрофиброматоз (нейрофиброматоз), мышечная дистрофия, мышечная дистрофия типа болезни Дюшенна и Бекера, дистрофическая миотония), врожденная микседема (врожденный гипотиреоз), синдром Нансе-Инслея (отоспондиломегаэпифизарная дисплазия), хондродисплазия Нансе-Свинея (отоспондиломегаэпифизарная дисплазия), NBIA1 (нейродегенерация, связанная с пантотенат-киназой), синдром Нейлла-Дингволла (синдром Коккейна), нейробластома сетчатки (ретинобластома), нейродегенерация с накоплением железа в головном мозге 1 типа (нейродегенерация, связанная с пантотенат-киназой), нейрофиброматоз I типа, нейрофиброматоз II типа, неврологические болезни, нервно-мышечные нарушения, невропатия, наследственная атрофия двигательных нервов V типа (атрофия мышц спины V типа), наследственная невропатия двигательных нервов с пирамидальными нейронами (боковой амиотрофический склероз 4 типа), NF (нейрофиброматоз), болезнь Ниманна-Пика, синдром Ноака (синдром Пфейффера), некетоновая гиперглицинемия (глициновая энцефалопатия), ненейрогенная болезнь Гоше (болезнь Гоше 1 типа), нефенилкетоновая гиперфенилаланинемия (недостаточность тетрагидробиоптерина), бессиндромная глухота, синдром Нунана, болезнь Норрботтниана-Гоше (болезнь Гоше 3 типа), охроноз (алкаптонурия), охронозный артрит (алкаптонурия), OI (несовершенный остеогенез), OSMED (отоспондиломегаэпифизарная дисплазия), несовершенный остеогенез, остеопсатироз (несовершенный остеогенез), врожденный остеосклероз (ахондроплазия), отоспондиломегаэпифизарная дисплазия, оксалоз (первия гипероксалурия), первичная оксалурия (первичная гипероксалурия), нейродегенерация, связанная с пантотенат-киназой, синдром Патау (трисомия 13), недостаточность PBGD (острая перемежающаяся порфирия), недостаточность РСС (пропионовая ацидемия), РСТ (позняя кожная порфирия), PDM (миотоническая дистрофия 2 типа), синдром Пендреда, периодическая болезнь (семейная средиземноморская лихорадка), периодический перитонит (семейная средиземноморская лихорадка), синдром лентигиноза (синдром Пейтца-Егерса), нарушения периферических нервов (наследственная вегетативная дистония), периферический нейрофиброматоз (нейрофиброматоз 1), мышечная атрофия малоберцовой кости (болезнь Шарко-Мари-Тута), недостаточность пероксисомной аланин:глиоксилат-аминотрансферазы (первичная гипероксалурия), синдром Пейтца-Егерса, синдром Пфейффера, недостаточность фенилаланингидроксилазы (фенилкетонурия), фенилкетонурия, феохромоцитома (болезнь Гиппеля-Линдау), синдром Робена с хондродисплазией плода (синдром Вессенбахера-Цвеймюллера), пигментный цирроз печени (гемохроматоз), PJS (синдром Пейтца-Егерса), PKAN (нейродегенерация, связанная с пантотенат-киназой), PKU (фенилкетонурия), плюмбопорфирия (порфирия, обусловленная недостаточностью ALA), РМА (болезнь Шарко-Мари-Тута), полиоссальная фиброзная остеодисплазия (синдром Мак-Куна-Олбрайта), полипоз (наследственный аденоматозный полипоз), гамартома кишечника (синдром Пейтца-Егерса), полипоз кишечника II (синдром Пейтца-Егерса), симндром полипов и пятен (синдром Пейтца-Егерса), недостаточность порфобилиногенсинтазы (порфирия, обусловленная недостаточностью ALA), порфирия, нарушение, обусловленное порфирином (порфирия), РРН (первичная легочная гипертензия), недостаточность РРОХ (порфирия), синдром Прадера-Лабхарта-Вилли (синдром Прадера-Вилли), синдром Прадера-Вилли, пресенильная и сенильная деменция (болезнь Альцгеймера), первичный гемохроматоз (гемохроматоз), синдром первичной гиперурицемии (синдром Леша-Найхана), первичная легочная гипертензия, первичная старческая дегенеративная деменция (болезнь Альцгеймера), мутант проколлагена типа EDS VII (синдром Элерса-Данлоса типа артрохалазии), прогерия (синдром прогерии Гетчинсона-Гилфорда), прогерия-подобный синдром (синдром Коккейна), прогероидный нанизм (синдром Коккейна), прогрессирующая хорея, наследственная хроническая хорея Гентингтона (болезнь Гентингтона), прогрессирующая мышечная атрофия (атрофия спинных мышц), прогрессирующий деформирующий несовершенный остеогенез с нормальной склерой (несовершенный остеогенез III типа), PROMM (миотоническая дистрофия 2 типа), пропионовая ацидемия, недостаточность пропионил-СоА-карбоксилазы (пропионовая ацидемия), недостаточность протеина С, недостаточность протеина S, протопорфирия (эритропоэтическая протопорфирия), недостаточность протопорфириноген-оксидазы (пятнистая порфирия), проксимальная миотоническая дистрофия (миотоническая дистрофия 2 типа), проксимальная миотоническая миопатия (миотоническая дистрофия 2 типа), псевдоболезнь Гоше (псевдосиндром Уллриха-Тернера (синдном Нунана), псевдоксантома, психозный липидоз (болезнь Краббе), гипертензия легочной артерии (первичная легочная гипертензия), легочная гипертензия (первичная легочная гипертензия), PWS (синдром Прадера-Вилли), РХЕ - псевдоксантома, Rb (ретинобластома), болезнь Реклингхаузена (нейрофиброматоз 1), рецидивирующий полисерозит (семейная средиземноморская лихорадка), нарушения сетчатки, синдром пигментного ретинита-глухоты (синдром Ушера), ретинобластома, синдром Ретта, RFALS 3 типа (боковой амиотрофический склероз 2 типа), синдом Рикера (миотоническая дистроофия 2 типа), синдром Райли-Дея (наследственная вегетативная дистония), синдром Русси-Леви (болезнь Шарко-Мари-Тута), RSTS (синдром Рубинстайна-Тейби), RTS (синдром Ретта) (синдром Рубинстайна-Тейби), RTT (синдром Ретта), синдром Рубинстайна-Тейби, синдром Сака-Барабаса (синдром Элерса-Данлоса сосудистого типа), SADDAN, синдром наследственной саркомы Ли и Фрамени (синдром Ли-Фрамени), синдром саркомы, рака молочной железы, лейкоза и рака надпочечников (SBLA) (синдром Ли-Фрамени), синдром SBLA (синдром Ли-Фрамени), SBMA (Х-сцепленная мышечная атрофия продолговатого мозга), SCD (серповидно-клеточная анемия), двухсторонняя невринома слухового нерва (нейрофиброматоз 2), SCIDX1 (тяжелая форма Х-сцепленного комбинированного иммунодефицита), туберозный склероз, SDAT (болезнь Альцгеймера), врожденная SED (врожденная спондилоэпифизарная дисплазия), SED Струдвика (спондилоэпиметафизарная дисплазия типа болезни Струдвика), SEDc (врожденная спондилоэпифизарная дисплазия), SEMD типа болезни Струдвика (спондилоэпиметафизарная дисплазия типа болезни Струдвика), старческая деменция (болезнь Альцгеймера 2 типа), тяжелая форма ахондроплазии с отставанием развития и акантозом (SADDAN), синдром Шпринцена (синдром делеции 22q11.2), серповидно-клеточная анемия, синдром скелета-кожи-головного мозга (SADDAN), нарушения пигментации кожи, SMA (мышечная атрофия спинного мозга), SMED типа болезни Струдвика (спондилоэпиметафизарная дисплазия типа болезни Струдвика), SMED I типа (спондилоэпиметафизарная дисплазия типа болезни Струдвика), синдром Смита-Лемли-Опица, южноафриканская генетическая порфирия (пятнистая порфирия), детский восходящий спастический паралич (детский наследственный восходящий спастический паралич), нарушения речи и общения, сфинголипидоз Тея-Сакса (болезнь Тея-Сакса), мышечная атрофия продолговатого мозга, мышечная атрофия спинного мозга, дистальная мышечная атрофия спинного мозга V типа (дистальная мышечная атрофия спинного мозга V типа), дистальная мышечная атрофия спинного мозга с преобладающим поражением верхних конечностей (дистальная мышечная атрофия спинного мозга V типа), атаксия спинного мозга и мозжечка, спондилоэпиметафизарная дисплазия типа болезни Струдвика, врожденная спондилоэпифизарная дисплазия, спондилоэпифизарная дисплазия (коллагенопатия II и XI типов), врожденная спондилометаэпифизарная дисплазия типа болезни Струдвика (спондилоэпиметафизарная дисплазия типа болезни Струдвика), спондилометафизарная дисплазия (SMD) (спондилометафизарная дисплазия типа болезни Струдвика), спондилометафизарная дисплазия типа болезни Струдвика (спондилоэпиметафизарная дисплазия типа болезни Струдвика), губковидная дегенерация центральной нервной системы (болезнь Канавана), губковидная дегенерация головного мозга (болезнь Канавана), губковидная дегенерация белого вещества у новорожденных (болезнь Канавана), спорадическая первичная легочная гипертензия (первичная легочная гипертензия), синдром SSB (SADDAN), синдром сидерозных волос (синдром Менке), болезнь Штейнера (миотоническая дистрофия), синдром миотонической дистрофии Штейнера (миотоническая дистрофия), синдром Стиклера, инсульт (CADASIL), синдром Струдвика (спондилоэпиметафизарная дисплазия типа болезни Струдвика), подострая невропатия Гоше (болезнь Гоше 3 типа), шведская генетическая порфирия (острая перемежающаяся порфирия), шведская порфирия (острая перемежающаяся порфирия), хрящевая дисплазия (дисплазия Кнеста), болезнь Тея-Сакса, TD - смертельная недоразвитость (смертельная дисплазия), TD с прямыми бедренными костями и черепом в виде клеверного листа (смертельная дисплазия 2 типа), мозжечково-глазолицевая телеангиэктазия (атаксия-телеангиэктазия), синдром феминизации при мужском псевдогермафродитизме (синдром невосприимчивости к андрогену), недостатотчность тетрагидробиоптерина, TFM - синдром феминизации при мужском псевдогермафродитизме (синдром невосприимчивости к андрогену), средняя талассемия (бета-талассемия), большая талассемия (бета-талассемия), смертельная дисплазия, мегалобластная анемия, обусловленная тиамином, с сахарным диабетом и перцептивной глухотой, тромбофилия вследствие недостаточности кофактора для активированного протеина С типа болезни Лейдена (тромбофилия Лейдена, обусловленная фактором V), болезнь щитовидной железы, томаккулезная невропатия (наследственная невропатия с предрасположенностью к параличу со сдавлением нерва), полная недостаточность HPRT (синдром Леша-Найхана), полная недостаточность гипоксантингуанин-фосфорибозилтрансферазы (синдром Леша-Найхана), синдром Туретте, трансмиссивная деменция, трансмиссивная губковидная энцефалопатия, синдром Тришера-Коллинза, Trias fragilitis оssium (несовершенный остеогенез I типа), синдром тройной Х-хромосомы, синдром трех Х (синдром тройной Х-хромосомы), трисомия 21 (синдром Дауна), трисомия Х (синдром тройной Х-хромосомы), синдром Троизьера-Гано-Шаффарда (гемохроматоз), TS (синдром Тернера), ТSD (болезнь Тея-Сакса), TSEs (болезнь, вызываемая прионом), туберозный склероз, синдром Тернера, синдром Тернера у женщин с Х-хромосомой (синдром Нунана), фенотип Тернера (синдром Нунана), синдром, подобный болезни Тернера (синдром Нунана), болезнь Гоше 2 типа, болезнь Гоше 3 типа, болезнь, обусловленная недостаточностью UDP-галактозо-4-эпимеразы (галактоземия), недостаточность UDP-глюкозогексоза-1-фосфат-уридилилтрансферазы (галактоземия), синдром Уллриха-Нунана (синдром Нунана), синдром Уллриха-Тернера (синдром Тернера), недифференцированная глухота (бессиндрромная глухота), недостаточность UPS (острая перемежающаяся порфирия), рак мочевого пузыря, недостаточность UROD (поздняя кожная порфирия), недостаточность уропорфириноген-декарбоксилазы (поздняя кожная порфирия), недостаточность уропорфириноген-синтазы (острая перемежающаяся порфирия), недостаточность UROS (врожденная эритропоэтическая порфирия), синдром Ушера, недостаточность UTP гексоза-1-фосфат-уридилилтрансферазы (галактоземия), синдром Богарта-Бертрана (болезнь Канавана), синдром Хова (несовершенный остеогенез I типа), пятнистая порфирия, небно-лицевой синдром (синдром делеции 22q11.2), синдром VHL (болезнь Гиппеля-Линдау), ухудшение зрения и слепота (синдром Альстрома), болезнь Богарта-Бертрана (болезнь Канавана), болезнь Гиппеля-Линдау, болезнь Реклингхаузена-Эпплбаума (гемохрноматоз), болезнь Реклингхаузена (нейрофиброматоз 1), VP (пятнистая порфирия), болезнь Вролика (несовершенный остеогенез), синдром Ваарденберга, синдром Варберга-Фледелиуса (микросиндром), WD (болезнь Вильсона), синдром Вессенбахера-Цвеймюллера, болезнь Вильсона, синдром Вульффа-Гиршхорна, периодическая болезнь Вульффа (семейная средиземноморская лихорадка), WZS (синдром Вессенбахера-Цвеймюллера), пигментная ксеродерма, Х-сцепленная умственная отсталость и макроорхидизм (синдром слабой Х-хромосомы), Х-сцепленная первичная гиперурицемия (синдром Леша-Найхана), тяжелая форма Х-сцепленного комбинированного иммунодефицита, Х-сцепленная сидеробластная анемия, Х-сцепленная мышечная атрофия продолговатого мозга (болезнь Кеннеди), Х-сцепленный дефект фермента мочевой ацидурии (синдром Леша-Найхана), Х-SCID (тяжелая форма Х-сцепленного комбинированного иммунодефицита), XLSA (Х-сцепленная сидеробластная анемия), XSCID (тяжелая форма Х-сцепленного комбинированного иммунодефицита), синдром ХХХ (синдром тройной Х-хромосомы), синдром ХХХХ (48, ХХХХ), синдром ХХХХХ (49, ХХХХХ), синдром XXY (синдром Клайнфелтера), трисомия ХХY (синдром Клайнфелтера), кариотип ХYY (синдром 47,XYY), синдром XYY (синдром 47,XYY) и синдром YY (синдром 47,XYY).
В дополнительном предпочтительном аспекте последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, или композицию по изобретению, содержащую множество последовательностей нуклеиновой кислоты по изобретению, как определено в настоящем документе, можно использовать для получения фармацевтической композиции, предназначенной для вышеуказанных целей, предпочтительно, для применения в генотерапии для лечения заболеваний, рассмотренных в настоящем описании изоретения.
Кроме того, фармацевтическую композицию по изобретению можно использовать в генной терапии для лечения заболевания или нарушения, предпочтительно, указанного в настоящем описании изобретения.
В последнем аспекте настоящее изобретение также относится к наборам, в частности, наборам частей. Такие наборы, в частности, наборы частей, как правило, в качестве компоненты содержат, отдельно или в комбинации с дополнительными компонентами, как определено в настоящем документе, по меньшей мере одну последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, фармацевтическую композицию по изобретению или вакцину, содержащую последовательность нуклеиновой кислоты по изобретению. По меньшей мере одна последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, например, необязательно находится в комбинации с дополнительными компонентами, как определено в настоящем документе, таким образом по меньшей мере одна нуклеиновая кислота по изобретению предоставлено отдельно (первая часть набора) от по меньшей мере одной другой части набора, содержащей один или несколько других компонентов. Например, фармацевтическая композиция по изобретению может находиться в одной или разных частях набора. В качестве примера, например, по меньшей мере одна часть набора может содержать по меньшей мере одну последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, и по меньшей мере одна дополнительная часть набора по меньшей мере один другой компонент, как определено в настоящем документе, например, по меньшей мере одна другая часть набора может содержать по меньшей мере одну фармацевтическую композицию или ее часть, например, по меньшей мере одна часть набора может содержать последовательность нуклеиновой кислоты по изобретению, как определено в настоящем документе, по меньшей мере одна дополнительная часть набора по меньшей мере один другой компонент, как определено в настоящем документе, по меньшей мере одна дополнительная часть набора по меньшей мере один компонент фармацевтической композиции по изобретению, или фармацевтическую композиция по изобретению, как целое, и по меньшей мере одна дополнительная часть набора, например, по меньшей мере один фармацевтический носитель или транспортер и т.д. В случае, если набор или набор частей содержит множество последовательностей нуклеиновой кислоты по изобретению, один компонент набора может содержать только одну, несколько или все последовательности нуклеиновой кислоты по изобретению, содержащиеся в наборе. В альтернативном варианте осуществления каждая последовательность нуклеиновой кислоты по изобретению может содержаться в различных/отдельных компонентах набора так, что каждый компонент формирует часть набора. Также в первом компоненте в качестве части набора может содержаться более одной нуклеиновой кислоты, при этом один или несколько других (второй, третий и т.д.) компоненты (предоставляющих одну или несколько других частей набора) могут содержать одну или более одной нуклеиновых кислот по изобретению, которые могут быть идентичны или частично идентичны или отличаться от первого компонента. Кроме того, набор или набор частей может содержать технические инструкции с информацией о введении и дозировании последовательностей нуклеиновой кислоты по изобретению, фармацевтической композиции по изобретению или любого из его компонентов или частей, например, если набор получают в виде набора частей.
Настоящее изобретение относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
где указанный пептид или белок, содержащий терапевтический белок или его фрагмент, вариант или производное, может быть терапевтическим белком, предпочтительно, терапевтическим белком, используемым для лечения метаболических или эндокринных нарушений, нарушений крови, заболеваний сердечно-сосудистой системы, заболеваний дыхательной системы, раковых или опухолевых заболеваний, инфекционных заболеваний или иммунодефицитов, в гормонозаместительной терапии или перепрограммировании соматических клеток;
терапевтическим белком, выбранным из адъювантных или иммуностимулирующих белков, адъювантных белков человека, бактериальных (адъювантных) белков, (адъювантных) белков простейших, вирусных (адъювантных) белков, грибных (адъювантных) белков; или
антителом, предпочтительно, антителом, выбранным из антител, используемых для лечения раковых или опухолевых заболеваний, антител, используемых для лечения иммунных нарушений, антител, используемых для лечения инфекционных заболеваний, антител, используемых для лечения нарушений крови, антител, используемых для иммунорегуляции, антител, используемых для лечения диабета, антител, используемых для лечения болезни Альцгеймера, антител, используемых для лечения астмы, или антител, используемых для лечения смешанных нарушений.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Кроме того, изобретение относится к способу повышения экспрессии кодируемого пептида или белка, включающему стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты и применения или введения указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань и/или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, который может быть терапевтическим белком, используемым:
для лечения метаболических или эндокринных нарушений,
для лечения нарушений крови, заболеваний сердечно-сосудистой системы, заболеваний дыхательной системы, раковых или опухолевых заболеваний, инфекционных заболеваний или иммунодефицитов,
в гормонозаместительной терапии или
в перепрограммировании соматических клеток.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Кроме того, настоящее изобретение относится к способу повышения экспрессии кодируемого пептида или белка, включающему стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты и применения или введения последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань и/или организм.
Настоящее изобретение дополнительно, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтический белок, выбранный из адъювантных или иммуностимулирующих белков, более предпочтительно, из адъювантных белков человека, бактериальных (адъювантных) белков, (адъювантных) белков простейших, вирусных (адъювантных) белков, грибных (адъювантных) белков.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Кроме того, изобретение относится к способу повышения экспрессии кодируемого пептида или белка, включающему стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты и применения или введения последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань и/или организм.
Настоящее изобретение дополнительно, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтический белок или его фрагмент, вариант или производное, который является терапевтическим антителом, более предпочтительно, антителом, выбранным из антител, используемых для лечения раковых или опухолевых заболеваний, антител, используемых для лечения иммунных нарушений, антител, используемых для лечения инфекционных заболеваний, антител, используемых для лечения нарушений крови, антител, используемых для иммунорегуляции, антител, используемых для лечения диабета, антител, используемых для лечения болезни Альцгеймера, антител, используемых для лечения астмы, или антител, используемых для лечения смешанных нарушений.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применение или введение указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтический белок, используемый для лечения метаболических или эндокринных нарушений;
более предпочтительно, пептид или белок, выбранный из кислой сфингомиелиназы, адипотида, бета-агалсидазы, альглукозидазы, альфа-галактозидазы А, альфа-глюкозидазы, альфа-L-идуронидазы, альфа-N-ацетилглюкозаминидазы, амфирегулина, ангиопоэтинов (Ang1, Ang2, Ang3, Ang4, ANGPTL2, ANGPTL3, ANGPTL4, ANGPTL5, ANGPTL6, ANGPTL7), бета-целлулина, бета-глюкуронидазы, костных морфогенетических белков (ВМР) (ВМР1, ВМР2, ВМР3, ВМР4, ВМР5, ВМР6, ВМР7, ВМР8а, ВМР8b, ВМР10, ВМР15), белка CLN6, эпидермального фактора роста (EGF), эпигена, эпирегулина, фактора роста фибробластов (FGF, FGF-1, FGF-2, FGF-3, FGF-4, FGF-5, FGF-6, FGF-7, FGF-8, FGF-9, FGF-10, FGF-11, FGF-12, FGF-13, FGF-14, FGF-16, FGF-17, FGF-18, FGF-19, FGF-20, FGF-21, FGF-22, FGF-23), галсульфазы, грелина, глюкоцереброзидазы, GM-CSF, гепарин-связывающего EGF-подобного фактора роста (НВ-EGF), фактора роста гепатоцитов (HGF), гепцидина, альбумина человека, повышенной потери альбумина, идурсульфазы (идуронат-2-сульфатаза), интегринов αVβ3, αVβ5 и α5β1, лудуронат-сульфатазы, ларонидазы, N-ацетилгалактозамин-4-сульфатазы (rhASB; галсульфазы, арилсульфатазы А (ARSA), арилсульфатазы В (ARSB)), N-ацетилглюкозамин-6-сульфатазы, фактора роста нервов (NGF, нейротрофический фактор, выделенный из головного мозга (BDNF), нейротрофина-3 (NT-3) и нейротрофина 4/5 (NT-4/5), нейрегулина (NRG1, NRG2, NRG3, NRG4), нейропилина (NRP-1, NRP-2), обестатина, тромбоцитарного фактора роста (PDGF (PDFF-A, PDGF-B, PDGF-C, PDGF-D), рецепторов бета-TGF (эндоглин, рецептор бета-TGF 1, рецептор бета-TGF 2, рецептор бета-TGF 3), тромбопоэтина (ТНРО) (фактор роста и развития мегакариоцитов (MGDF)), трансформирующего фактора роста (TGF (TGF-a, бета-TGF (TGFbeta1, TGFbeta2 и TGFbeta3))), VEGF (VEGF-A, VEGF-B, VEGF-C, VEGF-D, VEGF-E, VEGF-F и PIGF), незиритида, трипсина, адренокортикотрофического гормона (АСТН), атриал-натриуретического пептида (ANP), холецистокинина, гастрина, лептина, окситоцина, соматостатина, вазопрессина (антидиуретический гормон), кальцитонина, эксенатида, гормона роста (GH), соматотропина, инсулина, инсулиноподобного фактора роста 1 (IGF-1), мекасерминринфабата, аналога IGF-1, мекасермина, аналога IGF-1, пегвисоманта, прамлинтида, терипаратида (остатки 1-34 паращитовидного гормона человека), бекаплермина, альфа-диботермина (костный морфогенетический белок 2), ацетата гистрелина (гонадолиберин, GnRH), октреотида и палифермина (фактор роста кератиноцитов, KGF).
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применение или введение указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтический белок, используемый для лечения нарушений крови, заболеваний сердечно-сосудистой системы, заболеваний дыхательной системы, раковых или опухолевых заболеваний, инфекционных заболеваний или иммунодефицитов, более предпочтительно, пептид или белок, выбранный из альтеплазы (активатор плазминогена ткани, tPA), анистреплазы, антитромбина III (АТ-III), бивалирудина, альфа-дарбепоэтина, альфа-дротрекогина (активированный протеин С), эритропоэтина, альфа-эпоэтина, эритропоэтина, эртропоэтина, фактора IX, фактора VIIa, фактора VIII, лепирудина, концентрата протеина С, ретеплазы (делеционный мутеин tPA), стрептокиназы, тенектеплазы, урокиназы, ангиостатина, иммунотоксина против CD22, денилейкин дифтитокса, иммуноцианина, MPS (металлопанстимулин), афлиберцепта, эндостатина, коллагеназы, дезоксириболнуклеазы I человека, дорназы, гиалуронидазы, папаина, L-аспарагиназы, Peg-аспарагиназы, расбуриказы, хорионического гонадотропина человека (HCG), фолликулостимулирующего гормона человека (FSH), альфа-лутропина, пролактина, ингибитора альфа-1-протеиназы, лактазы, ферментов поджелудочной железы (липаза, амилаза, протеаза), аденозиндеаминазы (бычья пегадемаза, PEG-ADA), абатацепта, алефацепта, анакинры, этанерцепта, антагониста рецептора интерлейкина-1 (IL-1), тимулина, антагониста альфа-TNF, энфувиртида и α1-тимозина.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применения или введение указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение предпочтительно относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтический белок, используемый в гормонозаместительной терапии, более предпочтительго, пептид или белок, выбранный из эстрогенов, прогестерона или прогестинов и тестостерона.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применения или введения указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру “стебель-петля” гистонов, и
с) последовательность поли(А) или сигнал полиаденилирования;
где указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтический белок, используемый для перепрограммирования соматических клеток в плюри- или омнипотентные стволовые клетки, более предпочтительно, пептид или белок, выбранный из Oct-3/4, семейства Sox генов (Sox1, Sox2, Sox3 и Sox15), семейства Klf (Klf1, Klf2, Klf4 и Klf5), семейства Мус (с-myc, L-myc и N-myc), Nanog и LIN28.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применения или введения указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение предпочтительно относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтический белок, выбранный из адъювантных или иммуностимулирующих белков, адъювантных белков человека, бактериальных (адъювантных) белков, (адъювантнгых) белков простейших, вирусных (адъювантных) белков, грибных (адъювантных) белков.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применения или введения указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтический белок, выбранный из адъювантных или иммуностимулирующих белков, адъювантных белков человека, бактериальных (адъювантных) белков, (адъювантных) белков простейших, вирусных (адъювантных) белков, грибных (адъювантных) белков, более предпочтительно, выбранный из адъювантных белков человека, наиболее предпочтительно, из паттерн-распознающих рецепторов TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11; NOD1, NOD2, NOD3, NOD4, NOD5, NALP1, NALP2, NALP3, NALP4, NALP5, NALP6, NALP6, NALP7, NALP7, NALP8, NALP9, NALP10, NALP11, NALP12, NALP13, NALP14, IPAF, NAIP, CIITA, RIG-1, MDA5 и LGP2, трансдукторов сигналов сигнального пути TLR, включающих адапторные белки, например, Trif и Cardif; компонентов сигнального пути мелких GTPаз (RhoA, Ras, Rac1, Cdc42, Rab и т.д.), компонентов сигнального пути РIP (PI3K, Src-киназы и т.д.), компонентов МуD88-зависимого сигнального пути (MyD88, IRAK1, IRAK2, IRAK4, TIRAP, TRAF6 и т.д.), компонентов MyD88-независимого сигнального пути (TICAM1, TICAM2, TRAF6, TBK1, IRF3, TAK1, IRAK1 и т.д.); активированных киназ, включающих, например, Akt, MEKK1, MKK1, MKK3, MKK4, MKK6, MKK7, ERK1, ERK2, GSK3, PKC киназы, PKD киназы, GSK3 киназы, JNK, p38MAPK, TAK1, IKK и ТАК1; активированных факторов транскрипции, включающих, например, NF-κB, c-Fos, c-Jun, c-Myc, CREB, AP-1, Elk-1, ATF2, IRF-3, IRF-7, белки теплового шока, такие как HSP10, HSP60, HSP65, HSP70, HSP75 и HSP90, gp96, фибриноген, дополнительный домен А повтора TypIII фибронектина; компонентов системы комплементов, включающих C1q, MBL, C1r, C1s, C2b, Bb, D, MASP-1, MASP-2, C4b, C3b, C5a, C3a, C4a, C5b, C6, C7, C8, C9, CR1, CR2, CR3, CR4, C1qR, C1INH, C4bp, MCP, DAF, H, I, P и CD59, или индуцированные гены-мишени, включающие, например, бета-дефенсин, белки поверхности клетки; адъювантных белков человека, включающих trif, лиганд flt-3, Gp96 или фибронектин, цитокины, индуцирующие или усиливающие врожденную иммунную реакцию, которые включают альфа-IL-1, бета-IL-1, IL-2, IL-6, IL-7, IL-8, IL-9, IL-12, IL-13, IL-15, IL-16, IL-17, IL-18, IL-21, IL-23, альфа-TNF, альфа-IFN, бета-IFN, гамма-IFN, GM-CSF, G-CSF, М-CSF; хемокинов, включающих IL-8, IP-10, MCP-1, альфа-MIP-1, RANTES, эотаксин, CCL21; цитокинов, высвобождаемых из макрофагов, включающих IL-1, IL-6, IL-8, IL-12 и альфа-TNF, а также IL-1R1 и альфа-IL-1.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применения или введения указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтический белок, выбранный из адъювантных или иммуностимулирующих белков, адъювантных белков человека, бактериальных (адъювантных) белков, (адъювантных) белков простейших, вирусных (адъювантных) белков, грибных (адъювантных) белков, более предпочтительно, выбранный из бактериальных (адъювантных) белков, наиболее предпочтительно, выбранный из бактериальных белков теплового шока или белков-компаньонов, включающих Hsp60, Hsp70, Hsp90, Hsp100; OmpA (белок наружной мембраны) из грамотрицательных бактерий; бактериальных поринов, включающих OmpF; бактериальных токсинов, включающих коклюшный токсин (РТ) из Bordetella pertussis, аденилатциклазу коклюшного токсина СуаА и СуаС из Bordetella pertussis, мутант РТ-9К/129G из коклюшного токсина, столбнячный токсин, холерный токсин (СТ), В-субъединицу холерного токсина, мутант СТК63 из холерного токсина, мутант СТЕ112К из СТ, термолабильный энтеротоксин (LT) Escherichia coli, В-субъединицу из термолабильного энтеротоксина (LTB), мутанты термолабильного энтеротоксина Escherichia coli с уменьшенной токсичностью, включающие LTK63, LTR72; модулин, растворимый в феноле; нейтрофил-активирующий белок (HP-NAP) из Нelicobacter pylori, поверхностно-активный белок D; липопротеин наружного белка А из Borrelia burgdorferi, Ag38 (антиген длиной 38 кДа) из Mycobacterium tuberculosis, белок из бактериальной фимбрии; энтеротоксин СТ из Vibrio cholerae, пилин из пили грамотрицательных бактерий, поверхностно-активный белок А и бактериальные флагеллины.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применения или введения указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтический белок, выбранный из адъювантных или иммуностимулирующих белков, адъювантных белков человека, бактериальных (адъювантных) белков, (адъювантных) белков простейших, вирусных (адъювантных) белков, грибных (адъювантных) белков, более предпочтительно, выбранный из (адъювантных) белков простейших, наиболее предпочтительно, выбранный из Тс52 из Trypanosoma cruzi, PFTG из Trypanosoma gondii, белков теплового шока простейших, LeIF из Leishmania spp., профилирующего белка из Toxoplasma gondii.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применения или введения указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
где указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтический белок, выбранный из адъювантных или иммуностимулирующих белков, адъювантных белков человека, бактериальных (адъювантных) белков, (адъювантных) белков простейших, вирусных (адъювантных) белков, грибных (адъювантных) белков, более предпочтительно, выбранный из вирусных (адъвантных) белков, наиболее предпочтительно, выбранный из гибридного гликопротеина респираторно-синцитиального вируса (F-протеин), белка оболочки вируса ММТ, белка вируса лейкоза мыши, белка гемагглютинина вируса кори дикого типа.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение дополнительно относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применения или введения указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтический белок, выбранный из адъювантных или иммуностимулирующих белков, адъювантных белков человека, бактериальных (адъювантных) белков, (адъювантных) белков простейших, вирусных (адъювантных) белков, грибных (адъювантных) белков, более предпочтительно, выбранный из грибных (адъювантных) белков, наиболее предпочтительно, выбранный из грибного иммуномодулирующего белка (FIP, LZ-8) и гемоцианина лимфы улитки (KLH), OspA.
Настоящее изобретение дополнительно относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применения или введения указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
где указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтическое антитело, выбранное из антител, используемых для лечения раковых или опухолевых заболеваний, которые, предпочтительно, включают 131I-тозитумомаб, 3F8, 8H9, абаговомаб, адекатумумаб, афутузумаб, алацизумаб пеголь, алемтузумаб, аматуксимаб, АМЕ-133v, AMG 102, анатумомаб мафенатокс, аполизумаб, бавитуксимаб, бектумомаб, белимумаб, бевацизумаб, биватузумаб мертанзин, блинатумомаб, брентуксимаб ведотин, кантузумаб, кантузумаб мертанзин, кантузумаб равтанзин, капромаб пендетид, карлумаб, катумаксомаб, цетуксимаб, цитатузумаб богатокс, циксутумумаб, кливатузумаб тетраксетан, CNTO 328, CNTO 95, конатумумаб, дацетузумаб, далотузумаб, денозумаб, детумомаб, дрозитумаб, экромексимаб, эдреколомаб, элотузумаб, элсилимомаб, энаватузумаб, энситуксимаб, эпратузумаб, эртумаксомаб, эртумаксомаб, этарацизумаб, фарлетузумаб, FBTA05, фиклатузумаб, фигитумумаб, фланвотумаб, галиксимаб, ганитумаб, GC1008, гемтузумаб, гемтузумаб озогамицин, гирентуксимаб, глембатумумаб ведотин, GS6624, HuC242-DM4, HuHMFG1, HuN901-DM1, ибритумомаб, икрукумаб, ID09C3, индатуксимаб равтанзин, инотузумаб озогамицин, интетумумаб, ипилимумаб, иратумумаб, лабетузумаб, лексатумумаб, линтузумаб, лорвотузумаб мертанзин, лукатумумаб, лумиликсимаб, мапатумумаб, матузумаб, MDX-060, MEDI 522, митумомаб, могамулизумаб, MORab-003, MORab-009, моксетумомаб пазудотокс, МТ103, наколомаб тафенатокс, наптумомаб эстафенатокс, нарнатумаб, нецитумумаб, нимотузумаб, оларатумаб, онартузумаб, опортузумаб монатокс, ореговомаб, РАМ4, панитумумаб, патритумаб, пемтумомаб, пертузумаб, притумумаб, ракотумомаб, радретумаб, рамуцирумаб, рилотумумаб, ритуксимаб, робатумумаб, самализумаб, SGN-30, SGN-40, сибротузумаб, силтуксимаб, табалумаб, такатузумаб тетраксетан, таплитумомаб паптокс, тенатумомаб, тепротумумаб, TGN1412, тицилимумаб (= тремелимумаб), тигатузумаб, TNX-650, тозитумомаб, трастузумаб, TRBS07, тремелимумаб, TRU-016, тукотузумаб целмолейкин, ублитуксимаб, урелумаб, велтузумаб, велтузумаб (IMMU-106), волоциксимаб, волумумаб, WX-G250, залутумумаб и занолимумаб.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение дополнительно относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение дополнительно относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применения или введения указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтическое антитело, выбранное из антител, используемых для лечения иммунных нарушений, которые, предпочтительно, включают эфализумаб, эпратузумаб, этролизумаб, фонтолизумаб, иксекизумаб, меполизумаб, милатузумаб, смешанные иммуноглобулины, приликсимаб, ритуксимаб, ронтализумаб, руплизумаб, сарилумаб, ведолизумаб, визилизумаб, реслизумаб, адалимумаб, азелизумаб, атинумаб, атлизумаб, бертилимумаб, безилесомаб, BMS-945429, бриакинумаб, бродалумаб, канакинумаб, цертолизумаб пеголь, эрлизумаб, фезакинумаб, голимумаб, гомиликсимаб, инфликсимаб, маврилимумаб, натализумаб, окрелизумаб, одулимомаб, офатумумаб, озорализумаб, пекселизумаб, ровелизумаб, SBI-087, SBI-087, секукинумаб, сирукумаб, тализумаб, тоцилизумаб, торализумаб, TRU-015, TRU-016, устекинумаб, вепалимомаб, золимомаб аритокс, сифалимумаб, лумиликсимаб и иммуноглобулин Rho(D).
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применения или введения указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
где указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтическое антитело, выбранное из антител, используемых для лечения раковых или опухолевых заболеваний, предпочтительно, из антител, используемых для лечения инфекционных заболеваний, включающих, в частности, афелимомаб, CR6261, эдобакомаб, эфунгумаб, эксбивирумаб, фелвизумаб, форавирумаб, ибализумаб, либивирумаб, мотавизумаб, небакумаб, тувирумаб, уртоксазумаб, бавитуксимаб, пагибаксимаб, паливизумаб, панобакумаб, PRO 140, рафивирумаб, раксибакумаб, регавирумаб, севирумаб, сувизумаб и тефибазумаб.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применения или введения указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтическое антитело, выбранное из антител, используемых для лечения раковых или опухолевых заболеваний, предпочтительно, из антител, используемых для лечения нарушений крови, включающих, в частности, абциксимаб, аторолимумаб, экулизумаб, меполизумаб и милатузумаб.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применения или введения указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтическое антитело, выбранное из антител, используемых для лечения раковых или опухолевых заболеваний, предпочтительно, из антител, используемых для имунорегуляции, включающих, в частности, антитимоцитарный глобулин, базиликсимаб, цеделизумаб, даклизумаб, гавилимомаб, инолимомаб, муромонаб-CD3, одулимомаб и сиплизумаб.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышению экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применения или введения указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтическое антитело, выбранное из антител, используемых для лечения раковых и опухолевых заболеваний, предпочтительно, из антител, используемых для лечения диабета, включающих, в частности, гевокизумаб, отеликсизумаб и теплизумаб.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применения или введения указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтическое антитело, выбранное из антител, используемых для лечения раковых или опухолевых заболеваний, предпочтительно из антител, используемых для лечения болезни Альцгеймера, включающих, в частности, бапинеузумаб, кренезумаб, гантенерумаб, понезумаб, R1450 и соланезумаб.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применение или введение указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтическое антитело, выбранное из антител, используемых для лечения раковых или опухолевых заболеваний, предпочтительно, из антител, используемых для лечения астмы, включающих, в частности, бенрализумаб, энокизумаб, келиксимаб, лебрикизумаб, омализумаб, окселумаб, пасколизумаб и тралокинумаб.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применение или введение последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтическое антитело, выбранное из антител, используемых для лечения раковых или опухолевых заболеваний, предпочтительно из антител, используемых для лечения смешанных нарушений, включающих, в частности, блосозумаб, CaroRx, фрезолимумаб, фулранумаб, ромосозумаб, стамулумаб, танезумаб и ранибизумаб.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применение или введение указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, который может быть терапевтическим белком, используемым
для лечения метаболических или эндокринных нарушений,
для лечения нарушений крови, заболеваний сердечно-сосудистой системы, заболеваний дыхательной системы, раковых или опухолевых заболеваний, инфекционных заболеваний или иммунодефицитов,
в гормонозаместительной терапии или
в перепрограммировании соматических клеток,
более предпочтительно, терапевтическим белком, выбранным из кислой сфингомиелиназы, адипотида, бета-агалсидазы, альглюкозидазы, альфа-галактозидазы А, альфа-глюкозидазы, альфа-L-идуронидазы, альфа-N-ацетилглюкозаминидазы, амфирегулина, ангиопоэтинов (Ang1, Ang2, Ang3, Ang4, ANGPTL2, ANGPTL3, ANGPTL4, ANGPTL5, ANGPTL6, ANGPTL7), бета-целлулина, бета-глюкуронидазы, костных морфогенетических белков ВМР (ВМР1, ВМР2, ВМР3, ВМР4, ВМР5, ВМР6, ВМР7, ВМР8а, ВМР8b, ВМР10, ВМР15), белка CLN6, эпидермального фактора роста (EGF), эпигена, эпирегулина, фактора роста фибробластов (FGF, FGF-1, FGF-2, FGF-3, FGF-4, FGF-5, FGF-6, FGF-7, FGF-8, FGF-9, FGF-10, FGF-11, FGF-12, FGF-13, FGF-14, FGF-16, FGF-17, FGF-18, FGF-19, FGF-20, FGF-21, FGF-22, FGF-23), галсульфазы, грелина, глюкоцереброзидазы, GM-CSF, гепарин-связывающего EGF-подобного фактора роста (НВ-EGF), фактора роста гепатоцитов (HGF), гепцидина, альбумина человека, повышенной потери альбумина, идурсульфазы (идуронат-2-сульфатаза), интегринов αVβ3, αVβ5 и α5β1, лудуронат-сульфатазы, ларонидазы, N-ацетилгалактозамин-4-сульфатазы (rhASB; галсульфаза, арилсульфатаза А (ARSA), арилсульфатаза В (ARSB)), N-ацетилглюкозамин-6-сульфатазы, фактора роста нервов (NGF, нейротрофический фактор, выделенный из головного мозга (BDNF), нейротрофина-3 (NT-3) и нейротрофина 4/5 (NT-4/5), нейрегулина (NRG1, NRG2, NRG3, NRG4), нейропилина (NRP-1, NRP-2), обестатина, тромбоцитарного фактора роста (PDGF (PDFF-A, PDGF-B, PDGF-C, PDGF-D), рецепторов бета-TGF (эндоглин, рецептор бета-TGF 1, рецептор бета-TGF 2, рецептор бета-TGF 3), тромбопоэтина (ТНРО) (фактор роста и развития мегакариоцитов (MGDF)), трансформирующего фактора роста (TGF (TGF-a, бета-TGF (TGFbeta1, TGFbeta2 и TGFbeta3))), VEGF (VEGF-A, VEGF-B, VEGF-C, VEGF-D, VEGF-E, VEGF-F и PIGF), незиритида, трипсина, адренокортикотрофического гормона (АСТН), атриал-натриуретического пептида (ANP), холецистокинина, гастрина, лептина, окситоцина, соматостатина, вазопрессина (антидиуретический гормон), кальцитонина, эксенатида, гормона роста (GH), соматотропина, инсулина, инсулиноподобного фактора роста 1 (IGF-1), мекасерминринфабата, аналога IGF-1, мекасермина, аналога IGF-1, пегвисоманта, прамлинтида, терипаратида (остатки 1-34 паращитовидного гормона человека), бекаплермина, альфа-диботермина (костный морфогенетический белок 2), ацетата гистрелина (гонадолиберин, GnRH), октреотида и палифермина (фактор роста кератиноцитов, KGF), альтеплазы (активатор плазминогена ткани, tPA), анистреплазы, антитромбина III (AT-III), бивалирудина, альфа-дарбепоэтина, альфа-дротрекогина (активированный белок С), эритропоэтина, альфа-эпоэтина, фактора IX, фактора VIIa, фактора VIII, лепирудина, концентрата белка С, ретеплазы (делеционный мутеин tPA), стрептокиназы, тенектеплазы, урокиназы, ангиостатина, иммунотоксина против CD22, денилейкин дифтитокса, иммуноцианина, MPS (металлопанстимулин), афлиберцепта, эндостатина, коллагеназы, дезоксирибонуклеазы I человека, дорназы, гиалуронидазы, папаина, L-аспарагиназы, Peg-аспарагиназы, расбуриказы, хорионического гонадотропина человека (HCG), фолликулостимулирующего гормона человека (FSH), альфа-лутропина, пролактина, ингибитора альфа-1-протеиназы, лактазы, ферментов поджелудочной железы (липаза, амилаза, протеаза), аденозиндеаминазы (бычья пегадемаза, PEG-ADA), абатацепта, алефацепта, анакинры, этанерцепта, антагониста рецептора интерлейкина-1 (IL-1), тимулина, антагониста альфа-TNF, энфувиртида, тимозина α1, эстрогенов, прогестерона или прогестинов, тестостерона, Oct-3/4, семейства Sox генов (Sox1, Sox2, Sox3 и Sox15), семейства Klf (Klf1, Klf2, Klf4 и Klf5), семейства Myc (c-myc, L-myc и N-myc), Nanog и LIN28.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и введение указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтический белок, выбранный из адъювантных или иммуностимулирующих белков, адъювантных белков человека, бактериальных (адъювантных) белков, (адъювантных) белков простейших, вирусных (адъювантных) белков, грибных (адъювантных) белков, более предпочтительно, выбранный из адъювантных белков человека, наиболее предпочтительно, выбранный из паттерн-распознающих рецепторов TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, NOD1, NOD2, NOD3, NOD4, NOD5, NALP1, NALP2, NALP3, NALP4, NALP5, NALP6, NALP6, NALP7, NALP7, NALP8, NALP9, NALP10, NALP11, NALP12, NALP13, NALP14, IPAF, NAIP, CIITA, RIG-1, MDA5 и LGP2, трансдукторов сигналов сигнального пути TLR, включающих адапторные белки, например, Trif и Cardif; компонентов сигнального пути мелких GTPаз (RhoA, Ras, Rac1, Cdc42, Rab и т.д.), компонентов сигнального пути РIP (PI3K, Src-киназы и т.д.), компонентов МуD88-зависимого сигнального пути (MyD88, IRAK1, IRAK2, IRAK4, TIRAP, TRAF6 и т.д.), компонентов MyD88-независимого сигнального пути (TICAM1, TICAM2, TRAF6, TBK1, IRF3, TAK1, IRAK1 и т.д.); активированных киназ, включающих, например, Akt, MEKK1, MKK1, MKK3, MKK4, MKK6, MKK7, ERK1, ERK2, GSK3, PKC киназы, PKD киназы, GSK3 киназы, JNK, p38MAPK, TAK1, IKK и ТАК1; активированных факторов транскрипции, включающих, например, NF-κB, c-Fos, c-Jun, c-Myc, CREB, AP-1, Elk-1, ATF2, IRF-3, IRF-7, белки теплового шока, такие как HSP10, HSP60, HSP65, HSP70, HSP75 и HSP90, gp96, фибриноген, дополнительный домен А повтора TypIII фибронектина; компонентов системы комплементов, включающих C1q, MBL, C1r, C1s, C2b, Bb, D, MASP-1, MASP-2, C4b, C3b, C5a, C3a, C4a, C5b, C6, C7, C8, C9, CR1, CR2, CR3, CR4, C1qR, C1INH, C4bp, MCP, DAF, H, I, P и CD59, или индуцированные гены-мишени, включающие, например, бета-дефенсин, белки поверхности клетки; адъювантных белков человека, включающих trif, лиганд flt-3, Gp96 или фибронектин, цитокины, индуцирующие или усиливающие врожденную иммунную реакцию, которые включают альфа-IL-1, бета-IL-1, IL-2, IL-6, IL-7, IL-8, IL-9, IL-12, IL-13, IL-15, IL-16, IL-17, IL-18, IL-21, IL-23, альфа-TNF, альфа-IFN, бета-IFN, гамма-IFN, GM-CSF, G-CSF, М-CSF; хемокинов, включающих IL-8, IP-10, MCP-1, альфа-MIP-1, RANTES, эотаксин, CCL21; цитокинов, высвобождаемых из макрофагов, включающих IL-1, IL-6, IL-8, IL-12 и альфа-TNF, а также IL-1R1 и альфа-IL-1, бактериальные белки теплового шока или белки-компаньоны, включающие Hsp60, Hsp70, Hsp90, Hsp100; OmpA (белок наружной мембраны) из грамотрицательных бактерий; бактериальных поринов, включающих OmpF; бактериальных токсинов, включающих коклюшный токсин (РТ) из Bordetella pertussis, аденилатциклазу коклюшного токсина СуаА и СуаС из Bordetella pertussis, мутант РТ-9К/129G из коклюшного токсина, аденилатциклазу коклюшного токсина СуаА и СуаС из Bordetella pertussis, столбнячный токсин, холерный токсин (СТ), В-субъединицу холерного токсина, мутант СТК63 из холерного токсина, мутант СТЕ112К из СТ, термолабильный энтеротоксин (LT) Escherichia coli, В-субъединицу из термолабильного энтеротоксина (LTB), мутанты термолабильного энтеротоксина Escherichia coli с уменьшенной токсичностью, включая LTK63, LTR72; модулина, растворимого в феноле; нейтрофил-активирующего белка (HP-NAP) из Нelicobacter pylori, поверхностно-активного белка D; липопротеина наружного белка А из Borrelia burgdorferi, Ag38 (антиген длиной 38 кДа)) из Mycobacterium tuberculosis, белков из бактериальной фимбрии; энтеротоксина СТ из Vibrio cholerae, пилина из пили грамотрицательных бактерий, поверхностно-активного белка А и бактериальных флагеллинов, Тс52 из Trypanosoma cruzi, PFTG из Trypanosoma gondii, белков теплового шока простейших, LeIF из Leishmania spp., профилирующего белка из Toxoplasma gondii, гибридного гликопротеина респираторно-синцитиального вируса (F-протеин), белка оболочки вируса ММТ, белка вируса мышиного лейкоза, белка гемагглютинина вируса кори дикого типа, грибного иммуномодулирующего белка (FIP, LZ-8) и гемоцианина лимфы улитки (KLH), OspA.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтическое антитело, выбранное из антител, используемых для лечения раковых или опухолевых заболеваний, которые, предпочтительно, включают 131I-тозитумомаб, 3F8, 8H9, абаговомаб, адекатумумаб, афутузумаб, алацизумаб пеголь, алемтузумаб, аматуксимаб, АМЕ-133v, AMG 102, анатумомаб мафенатокс, аполизумаб, бавитуксимаб, бектумомаб, белимумаб, бевацизумаб, биватузумаб мертанзин, блинатумомаб, брентуксимаб ведотин, кантузумаб, кантузумаб мертанзин, кантузумаб равтанзин, капромаб пендетид, карлумаб, катумаксомаб, цетуксимаб, цитатузумаб богатокс, циксутумумаб, кливатузумаб тетраксетан, CNTO 328, CNTO 95, конатумумаб, дацетузумаб, далотузумаб, денозумаб, детумомаб, дрозитумаб, экромексимаб, эдреколомаб, элотузумаб, элсилимомаб, энаватузумаб, энситуксимаб, эпратузумаб, эртумаксомаб, эртумаксомаб, этарацизумаб, фарлетузумаб, FBTA05, фиклатузумаб, фигитумумаб, фланвотумаб, галиксимаб, ганитумаб, GC1008, гемтузумаб, гемтузумаб озогамицин, гирентуксимаб, глембатумумаб ведотин, GS6624, HuC242-DM4, HuHMFG1, HuN901-DM1, ибритумомаб, икрукумаб, ID09C3, индатуксимаб равтанзин, инотузумаб озогамицин, интетумумаб, ипилимумаб, иратумумаб, лабетузумаб, лексатумумаб, линтузумаб, лорвотузумаб мертанзин, лукатумумаб, лумиликсимаб, мапатумумаб, матузумаб, MDX-060, MEDI 522, митумомаб, могамулизумаб, MORab-003, MORab-009, моксетумомаб пазудотокс, МТ103, наколомаб тафенатокс, наптумомаб эстафенатокс, нарнатумаб, нецитумумаб, нимотузумаб, оларатумаб, онартузумаб, опортузумаб монатокс, ореговомаб, РАМ4, панитумумаб, патритумаб, пемтумомаб, пертузумаб, притумумаб, ракотумомаб, радретумаб, рамуцирумаб, рилотумумаб, ритуксимаб, робатумумаб, самализумаб, SGN-30, SGN-40, сибротузумаб, силтуксимаб, табалумаб, такатузумаб тетраксетан, таплитумомаб паптокс, тенатумомаб, тепротумумаб, TGN1412, тицилимумаб (= тремелимумаб), тигатузумаб, TNX-650, тозитумомаб, трастузумаб, TRBS07, тремелимумаб, TRU-016, тукотузумаб целмолейкин, ублитуксимаб, урелумаб, велтузумаб, велтузумаб (IMMU-106), волоциксимаб, волумумаб, WX-G250, залутумумаб, занолимумаб, эфализумаб, эпратузумаб, этролизумаб, фонтолизумаб, иксекизумаб, меполизумаб, милатузумаб, смешанные иммуноглобулины, приликсимаб, ритуксимаб, ронтализумаб, руплизумаб, сарилумаб, ведолизумаб, визилизумаб, реслизумаб, адалимумаб, азелизумаб, атинумаб, атлизумаб, бертилимумаб, безилесомаб, BMS-945429, бриакинумаб, бродалумаб, канакинумаб, цертолизумаб пеголь, эрлизумаб, фезакинумаб, голимумаб, гомиликсимаб, инфликсимаб, маврилимумаб, натализумаб, окрелизумаб, одулимомаб, офатумумаб, озорализумаб, пекселизумаб, ровелизумаб, SBI-087, SBI-087, секукинумаб, сирукумаб, тализумаб, тоцилизумаб, торализумаб, TRU-015, TRU-016, устекинумаб, вепалимомаб, золимомаб аритокс, сифалимумаб, лумиликсимаб, иммуноглобулин Rho(D), афелимомаб, CR6261, эдобакомаб, эфунгумаб, эксбивирумаб, фелвизумаб, форавирумаб, ибализумаб, либивирумаб, мотавизумаб, небакумаб, тувирумаб, уртоксазумаб, бавитуксимаб, пагибаксимаб, паливизумаб, панобакумаб, PRO 140, рафивирумаб, раксибакумаб, регавирумаб, севирумаб, сувизумаб, тефибазумаб, абциксимаб, аторолимумаб, экулизумаб, меполизумаб, милатузумаб, антитимоцитарный глобулин, базиликсимаб, цеделизумаб, даклизумаб, гавилимомаб, инолимомаб, муромонаб-CD3, одулимомаб, сиплизумаб, гевокизумаб, отеликсизумаб, теплизумаб, бапинеузумаб, кренезумаб, гантенерумаб, понезумаб, R1450, соланезумаб, бенрализумаб, энокизумаб, келиксимаб, лебрикизумаб, омализумаб, окселумаб, пасколизумаб, тралокинумаб, блосозумаб, CaroRx, фрезолимумаб, фулранумаб, ромосозумаб, стамулумаб, танезумаб и ранибизумаб.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применение или введение последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтический белок, который является белковым гормоном.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применение или введение указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
Настоящее изобретение, предпочтительно, относится к последовательности нуклеиновой кислоты, содержащей или кодирующей:
а) кодирующую область, кодирующую по меньшей мере один пептид или белок;
b) по меньшей мере одну структуру "стебель-петля" гистонов, и
c) последовательность поли(A) или сигнал полиаденилирования;
при этом указанный пептид или белок содержит терапевтический белок или его фрагмент, вариант или производное, предпочтительно, терапевтический белок, который является белковым гормоном.
Настоящее изобретение далее относится к применению такой последовательности нуклеиновой кислоты в генной терапии, как определено в настоящем описании. Настоящее изобретение далее относится к набору или набору частей, содержащему такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к фармацевтической композиции, содержащей такую последовательность нуклеиновой кислоты. Настоящее изобретение далее относится к способу повышения экспрессии кодируемого пептида или белка, который включает стадии получения такой последовательности нуклеиновой кислоты или композиции, содержащей такую последовательность нуклеиновой кислоты, и применение или введение указанной последовательности нуклеиновой кислоты или композиции в бесклеточную экспрессирующую систему, клетку, ткань или организм.
В настоящем изобретении, если не указано иначе, различные свойства альтернатив и вариантов осуществления можно комбинировать друг с другом. Кроме того, термин "содержащий" не следует рассматривать, как означающий "состоящий из", если это конкретно не указано. Однако, если это применимо в контексте настоящего изобретения, термин "содержащий" можно заменять термином "состоящий из".
Фигуры:
Приведенные ниже фигуры предназначены для дополнительной иллюстрации изобретения, и их не следует рассматривать в качестве дополнительного ограничения настоящего изобретения.
Фигура 1: представлена консенсусная последовательность структуры "стебель-петля" гистонов, полученная из последовательностей структур "стебель-петля" многоклеточных и простейших (как опубликовано в Dávila López, M., & Samuelsson, T. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10.1261/rna.782308). Выровнено 4001 последовательности структур "стебель-петля" гистонов из многоклеточных и простейших и для каждого положения в последовательности структуры "стебель-петля" указано количество встречающихся нуклеотидов. Полученная консенсусная последовательность, представляющая все нуклеотиды, присутствующие в анализируемых последовательностях, приведена с использованием однобуквенного кода нуклеотидов. В дополнение к консенсусной последовательности приведены последовательности, представляющие по меньшей мере 99%, 95% и 90% нуклеотидов, присутствующих в анализируемых последовательностях.
Фигура 2: представлена консенсусная последовательность структуры "стебель-петля" гистонов, полученная из последовательности структур "стебель-петля" простейших (как опубликовано в Dávila López, M., & Samuelsson, T. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10,1261/rna.782308). Выровнено 131 последовательность структур "стебель-петля" гистонов из простейших и для каждого положения в последовательности структуры "стебель-петля" указано количество встречающихся нуклеотидов. Полученная консенсусная последовательность, представляющая все нуклеотиды, присутствующие в анализируемых последовательностях, приведена с использованием однобуквенного кода нуклеотидов. В дополнение к консенсусной последовательности приведены последовательности, представляющие по меньшей мере 99%, 95% и 90% нуклеотидов, присутствующих в анализируемых последовательностях.
Фигура 3: представлена консенсусная последовательность структуры "стебель-петля" гистонов, полученная из последовательности структур "стебель-петля" многоклеточных (как опубликовано в Dávila López, M., & Samuelsson, T. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10,1261/rna.782308). Выровнено 3870 последовательностей структур "стебель-петля" гистонов из многоклеточных и для каждого положения в последовательности структуры "стебель-петля" указано количество встречающихся нуклеотидов. Полученная консенсусная последовательность, представляющая все нуклеотиды, присутствующие в анализируемых последовательностях, приведена с использованием однобуквенного кода нуклеотидов. В дополнение к консенсусной последовательности приведены последовательности, представляющие по меньшей мере 99%, 95% и 90% нуклеотидов, присутствующих в анализируемых последовательностях.
Фигура 4: представлена консенсусная последовательность структуры "стебель-петля" гистонов, полученная из последовательности структур "стебель-петля" позвоночных (как опубликовано в Dávila López, M., & Samuelsson, T. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10,1261/rna.782308). Выровнено 1333 последовательностей структур "стебель-петля" гистонов позвоночных и для каждого положения в последовательности структуры "стебель-петля" указано количество встречающихся нуклеотидов. Полученная консенсусная последовательность, представляющая все нуклеотиды, присутствующие в анализируемых последовательностях, приведена с использованием однобуквенного кода нуклеотидов. В дополнение к консенсусной последовательности приведены последовательности, представляющие по меньшей мере 99%, 95% и 90% нуклеотидов, присутствующих в анализируемых последовательностях.
Фигура 5: представлена консенсусная последовательность структуры "стебель-петля" гистонов, полученная из последовательности структур "стебель-петля" человека (Homo sapiens) (как опубликовано в Dávila López, M., & Samuelsson, T. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10,1261/rna.782308). Выровнены 84 последовательности структур "стебель-петля" гистонов человека и для каждого положения в последовательности структуры "стебель-петля" указано количество встречающихся нуклеотидов. Полученная консенсусная последовательность, представляющая все нуклеотиды, присутствующие в анализируемых последовательностях, приведена с использованием однобуквенного кода нуклеотидов. В дополнение к консенсусной последовательности приведены последовательности, представляющие по меньшей мере 99%, 95% и 90% нуклеотидов, присутствующих в анализируемых последовательностях.
Фигуры 6-19: представлена мРНК после транскрипции in vitro.
Приведены обозначения и последовательность мРНК, полученных транскрипцией in vitro. Используют следующие сокращения:
ppLuc (GC): обогащенная GC последовательность мРНК, кодирующая люциферазу Photinus pyralis;
ag: 3ʹ-нетранслируемая область (UTR) гена альфа-глобина;
A64: последовательность поли(A) с 64 остатками аденилата;
A120: последовательность поли(A) с 120 остатками аденилата;
histoneSL: структура "стебель-петля" гистонов;
aCPSL: структура "стебель-петля", которую выбрали из библиотеки вследствие ее специфического связывания с белком αCP-2KL;
PolioCL: 5ʹ-лист клевера геномной РНК вируса полиомиелита;
G30: последовательность поли(G) c 30 остатками гуанилата;
U30: последовательность поли(U) c 30 остатками уридилата;
SL: неспецифическая/искусственная стебель-петля;
N32: неспецифическая последовательность из 32 нуклеотидов;
MmEPO (GC): последовательность мРНК с большим содержанием GC, кодирующая ЕРО мыши.
В последовательностях выделены следующие элементы: кодирующая область (ORF) (заглавные буквы), ag (жирным), histoneSL (подчеркнуто), различные дополнительные тестированные последовательности (курсив).
Фигура 6: представлена последовательность мРНК ppLuc(GC)-ag (SEQ ID NO: 43).
Посредством линеаризации исходного вектора в участке рестрикции непосредственно после 3ʹ-UTR альфа-глобина (ag) получена мРНК без последовательности поли(A).
Фигура 7: представлена последовательность мРНК ppLuc(GC)-ag-A64 (SEQ ID NO: 44).
Посредством линеаризации исходного вектора в участке рестрикции непосредственно после последовательность поли(A) A64 получена мРНК, заканчивающаяся последовательностью поли(A) A64.
Фигура 8: представлена последовательность мРНК ppLuc(GC)-ag-histoneSL (SEQ ID NO: 45).
Последовательность поли(A) A64 замещена histoneSL. Последовательность структуры "стебель-петля" гистонов, используемую в примерах, получали по Cakmakci et al. (2008). Molecular and Cellular Biology, 28(3), 1182-1194.
Фигура 9: представлена последовательность мРНК ppLuc(GC)-ag-A64-histoneSL (SEQ ID NO: 46).
С 3ʹ-конца от поли(A) A64 добавляли histoneSL.
Фигура 10: представлена последовательность мРНК ppLuc(GC)-ag-A120 (SEQ ID NO: 47).
Последовательность поли(A) A64 замещали последовательностью поли(A) A120.
Фигура 11: представлена последовательность мРНК ppLuc(GC)-ag-A64-ag (SEQ ID NO: 48).
С 3ʹ-конца от поли(A) A64 добавляли вторую 3ʹ-UTR альфа-глобина.
Фигура 12: представлена последовательность мРНК ppLuc(GC)-ag-A64-aCPSL (SEQ ID NO: 49).
С 3ʹ-конца от поли(A) A64 добавляли структуру "стебель-петля". Структуру "стебель-петля" выбирали из библиотеки вследствие ее специфического связывания с белком αCP-2KL (Thisted et al., (2001), The Journal of Biological Chemistry, 276(20), 17484-17496). αCP-2KL представляет собой изоформу αCP-2, наиболее сильно экспрессированного белка αCP (связывающего поли(C) мРНК альфа-глобина белок) (Makeyev et al., (2000), Genomics, 67(3), 301-316), группы связывающих РНК белков, которые связываются с 3ʹ-UTR альфа-глобина (Chkheidze et al., (1999), Molecular and Cellular Biology, 19(7), 4572-4581).
Фигура 13: представлена последовательность мРНК ppLuc(GC)-ag-A64-PolioCL (SEQ ID NO: 50).
С 3ʹ-конца от поли(A) A64 добавляли 5ʹ-лист клевера из геномной РНК вируса полиомиелита.
Фигура 14: представлена последовательность мРНК ppLuc(GC)-ag-A64-G30 (SEQ ID NO: 51).
С 3ʹ-конца от поли(A) A64 добавляли участок из 30 остатков гуанилата.
Фигура 15: представлена последовательность мРНК ppLuc(GC)-ag-A64-U30 (SEQ ID NO: 52).
С 3ʹ-конца от поли(A) A64 добавляли участок из 30 остатков уридилата.
Фигура 16: представлена последовательность мРНК ppLuc(GC)-ag-A64-SL (SEQ ID NO: 53).
С 3ʹ-конца от поли(A) A64 добавляли структуру "стебель-петля". Верхняя часть стебля и петли получали по (Babendure et al., (2006), RNA (New York, N.Y.), 12(5), 851-861). Структура "стебель-петля" состоит из 17 пар оснований, богатого CG стебля и петли из 6 оснований.
Фигура 17: представлена ppLuc(GC)-ag-A64-N32 (SEQ ID NO: 54).
Посредством линеаризации исходного вектора в альтернативном участке рестрикции получена мРНК с 32 дополнительными нуклеотидами после поли(A).
Фигура 18: представлена последовательность мРНК MmEPO (GC)-ag-A64-C30 (SEQ ID NO: 55).
Фигура 19: представлена последовательность мРНК MmEPO (GC)-ag-A64-C30-histonSL (SEQ ID NO: 56).
Фигура 20: показано, что комбинация поли(A) и histoneSL повышает экспрессию белка с мРНК синергическим образом.
Исследовали влияние последовательности поли(A), histoneSL и комбинации поли(A) и histoneSL на экспрессию люциферазы с мРНК. Таким образом, различные мРНК электропорировали в клетки HeLa. Уровни люциферазы измеряли через 6, 24 и 48 часов после трансфекции. С последовательности мРНК, не содержащей ни последовательности поли(A), ни histoneSL, экспрессировалось мало люциферазы. Последовательность поли(A) или histoneSL увеличивают уровень люциферазы. Однако удивительно, что комбинация поли(A) и histoneSL дополнительно сильно увеличивает уровень люциферазы, во много раз выше уровня, наблюдаемого при использовании любого из элементов отдельно, таким образом действуй синергически. Данные нанесены на диаграмму в виде среднего количества RLU ± SD (относительных световых единиц ± стандартное отклонение) из трансфекций в трех повторениях. Конкретные RLU приведены в примере 10.2.
Фигура 21: показано, что комбинация поли(A) и histoneSL повышает экспрессию белка c мРНК вне зависимости от их порядка.
Исследовали влияние последовательности поли(A), histoneSL, комбинации поли(A) и histoneSL и их порядка на экспрессию люциферазы с мРНК. Таким образом, в клетки HeLa посредством липофекции вводили различные мРНК. Уровни люциферазы измеряли через 6, 24 и 48 часов после начала трансфекции. Последовательность поли(A) A64 или histoneSL обеспечивали сравнимые уровни люциферазы. Увеличение длины последовательности поли(A) с A64 до A120 или до A300 умеренно увеличивает уровень люциферазы. В отличие от этого комбинация поли(A) и histoneSL увеличивает уровень люциферазы намного больше, чем удлинение последовательности поли(A). Комбинация поли(A) и histoneSL действует синергически, так как это увеличивает уровень люциферазы во много раз выше уровня, наблюдаемого при использовании любого из элементов отдельно. Синергическое действие комбинации поли(A) и histoneSL наблюдают вне зависимости от порядка поли(A) и histoneSL и вне зависимости от длины поли(A) мРНК с A64-histoneSL или histoneSL-A250. Данные нанесены на диаграмму в виде среднего количества RLU ± SD из трансфекций в трех повторениях. Конкретные RLU приведены в примере 10.3.
Фигура 22: показано, что повышение экспрессии белка комбинацией поли(A) и histoneSL является специфическим.
Исследовали влияние комбинирования поли(A) и histoneSL или поли(A) и альтернативных последовательностей на экспрессию люциферазы с мРНК. Таким образом в клетки HeLa электропорировали различные мРНК. Уровни люциферазы измеряли через 6, 24 и 48 часов после трансфекции. Последовательность поли(A) или histoneSL обеспечивали сравнимые уровни люциферазы. Комбинация поли(A) и histoneSL сильно увеличивает уровень люциферазы, во много раз выше уровня, наблюдаемого при использовании любого из элементов отдельно, таким образом, действуя синергически. В отличие от этого, комбинирования поли(A) с любой из других последовательностей не оказывало влияние на уровень люциферазы по сравнению с мРНК, содержащей только последовательность поли(A). Таким образом, комбинация поли(A) и histoneSL действует специфически и синергически. Данные нанесены на диаграмму в виде среднего количества RLU ± SD из трансфекций в трех повторениях. Конкретные RLU приведены в примере 10.4.
Фигура 23: показано, что комбинация поли(A) и histoneSL повышает экспрессию белка c мРНК синергическим образом in vivo.
Исследовали влияние последовательности поли(A), histoneSL и комбинация поли(A) и histoneSL на экспрессию люциферазы с мРНК in vivo. Таким образом, мышам интрадермально инъецировали различные мРНК. Через 16 часов после инъекции мышей умерщвляли и измеряли уровни люциферазы в участках инъекций. Люцифераза экспрессируется с мРНК, содержащих histoneSL или последовательностью поли(A). Однако удивительно, что комбинация поли(A) и histoneSL сильно увеличивает уровень люциферазы, во много раз выше уровня, наблюдаемого при использовании любого из элементов отдельно, таким образом, действуя синергически. Данные нанесены на диаграмму в виде среднего количества RLU ± SEM (относительные световые единицы ± стандартная ошибка среднего). Конкретные RLU приведены в примере 10.5.
Фигура 24: показана последовательность мРНК трастузумаб (GC)-ag-A64-C30 (SEQ ID NO: 57). Указанная последовательность кодирует антитело трастузумаб (герцептин), содержащее легкую и тяжелую цепи, которое описано в публикации WO 2008/083949.
Фигура 25: показана последовательность мРНК трастузумаб (GC)-ag-A64-C30-histonSL (SEQ ID NO: 58). Указанная последовательность кодирует антитело трастузумаб (герцептин), содержащее легкую и тяжелую цепи, которое описано в публикации WO 2008/083949.
Примеры
Приведенные ниже примеры предназначены для дополнительной иллюстрации изобретения, и их не следует рассматривать в качестве дополнительного ограничения настоящего изобретения.
1. Получение консенсусных последовательностей гистон-стебель-петля
Перед проведением экспериментов определяли консенсусные последовательности структур "стебель-петля" гистонов на основе последовательностей структур "стебель-петля" гистонов многоклеточных и простейших. Последовательности получали из приложения, предоставленного Lopez et al. (Dávila López, M., & Samuelsson, T. (2008), RNA (New York, N.Y.), 14(1), 1-10. doi:10.1261/rna.782308), где определено большое количество природных последовательностей структур "стебель-петля" гистонов посредством поиска геномных последовательностей и маркеров экспрессируемых последовательностей. Сначала все последовательности многоклеточных и простейших (4001 последовательность), или все последовательности простейших (131 последовательность), или, альтернативно, многоклеточных (3870 последовательностей), или позвоночных (1333 последовательности) или людей (84 последовательности) группировали и выравнивали. Затем определяли количество встречающихся нуклеотидов в каждом положении. На основе полученных таким образом таблиц получали консенсусные последовательности для 5 различных групп последовательностей, представляющие все нуклеотиды, присутствующие в анализируемых последовательностях. Кроме того, также получали более ограниченные консенсусные последовательности, более выделяя консервативные нуклеотиды.
2. Получение матричных ДНК
Конструировали вектор для транскрипции in vitro, содержащий промотор T7 с последующей обогащенной GC последовательностью, кодирующей люциферазу Photinus pyralis (ppLuc(GC)), центральной частью 3ʹ-нетранслируемой области (UTR) альфа-глобина (ag) и последовательностью поли(A). Непосредственно за последовательностью поли(A) следовал участок рестрикции, используемый для линеаризации вектора перед транскрипцией in vitro для получения мРНК, заканчивающейся последовательностью поли(A) A64. мРНК, получаемую из этого вектора, соответственно, посредством транскрипции in vitro, обозначают как "ppLuc(GC)-ag-A64".
Линеаризация этого вектора в альтернативных участках рестрикции перед транскрипцией in vitro позволяла получать мРНК, дополненную дополнительными нуклеотидами с 3ʹ-конца от A64 или с отсутствием A64. Кроме того, исходный вектор модифицировали для включения альтернативных последовательностей. В итоге из этих векторов посредством транскрипции in vitro получали представленные ниже мРНК (последовательности мРНК представлены на фиг. 6-17):
ppLuc(GC) - ag (SEQ ID NO: 43);
ppLuc(GC) - ag - A64 (SEQ ID NO: 44);
ppLuc(GC) - ag - histoneSL (SEQ ID NO: 45);
ppLuc(GC) - ag - A64 - histoneSL (SEQ ID NO: 46);
ppLuc(GC) - ag - A120 (SEQ ID NO: 47);
ppLuc(GC) - ag - A64 - ag (SEQ ID NO: 48);
ppLuc(GC) - ag - A64 - aCPSL (SEQ ID NO: 49);
ppLuc(GC) - ag - A64 - PolioCL (SEQ ID NO: 50);
ppLuc(GC) - ag - A64 - G30 (SEQ ID NO: 51);
ppLuc(GC) - ag - A64 - U30 (SEQ ID NO: 52);
ppLuc(GC) - ag - A64 - SL (SEQ ID NO: 53);
ppLuc(GC) - ag - A64 - N32 (SEQ ID NO: 54).
Кроме того, таким образом, как описано выше, получали последовательности плазмидной ДНК, кодирующие терапевтический белок ЕРО.
В итоге, с этих векторов посредством транскрипции in vitro получали приводимые ниже мРНК (последовательности мРНК приведены на фиг. 18-19):
MmEPO (GC)-ag-A64-C30 (SEQ ID NO: 55);
MmEPO (GC)-ag-A64-C30-histoneSL (SEQ ID NO: 56)
Последовательности плазмидных ДНК, кодирующие антитело трастузумаб, могут быть получены вышеописанным способом.
Нижеследующие мРНК были получены из указанных векторов путем транскрипции in vitro (последовательность мРНК показаны на фиг. 24 и 25).
Трастузумаб (GC)-ag-A64-C30 (SEQ ID NO: 57)
Трастузумаб (GC)-ag-A64-C30-histoneSL (SEQ ID NO: 58).
3. Транскрипция in vitro
Матричную ДНК по примеру 2 линеаризировали и транскрибировали in vitro с использованием полимеразы T7. Затем матричную ДНК расщепляли посредством обработки ДНКазой. Все транскрипты мРНК содержали 5ʹ-кэпирующую структуру, полученную посредством добавления избытка N7-метилгуанозин-5ʹ-трифосфат-5ʹ-гуанозина к реакции транскрипции. Полученную таким образом мРНК очищали и ресуспендировали в воде.
4. Ферментативное аденилирование мРНК
Две мРНК ферментативно аденилировали:
ppLuc(GC)-ag-A64 и ppLuc(GC)-ag-histoneSL.
С этой целью, РНК инкубировали с поли(A)-полимеразой E. coli и АТФ (набор Poly(A) Polymerase Tailing Kit, Epicentre, Madison, USA) по инструкциям производителя. мРНК с достроенной последовательностью поли(A) очищали и ресуспендировали в воде. Длину последовательности поли(A) определяли посредством электрофореза в агарозном геле. Начальную мРНК достраивали приблизительно 250 остатками аденилата, полученные мРНК обозначают как
ppLuc(GC)-ag-A300 и ppLuc(GC)-ag-histoneSL-A250, соответственно.
5. Экспрессия люциферазы посредством электропорации мРНК
Клетки HeLa трипсинизировали и промывали в опти-MEM. 1×105 клеток в 200 мкл опти-MEM электропорировали 0,5 мкг кодирующей ppLuc мРНК. В качестве контроля, отдельно проводили электропорацию мРНК, не кодирующей ppLuc. Электропорированные клетки высевали в 24-луночные планшеты в 1 мл среды RPMI 1640. Через 6, 24 или 48 часов после трансфекции среду отбирали и клетки лизировали в 200 мкл лизирующего буфера (25 мМ Tris, pH 7,5 (HCl), 2 мМ ЭДТА, 10% глицерин, 1% Triton X-100, 2 мМ DTT, 1 мМ PMSF). Лизаты хранили при -20°C до измерения активности ppLuc.
6. Экспрессия люциферазы посредством липофекции мРНК
Клетки HeLa высевали в 96-луночные планшеты при плотности 2×104 клеток на лунку. Через сутки клетки отмывали в опти-MEM, а затем трансфицировали 0,25 мкг образующей комплекс с липофектином кодирующей ppLuc мРНК в 150 мкл опти-MEM. В качестве контроля отдельно проводили липофекцию мРНК, не кодирующей ppLuc. Через 6 часов после начала трансфекции в некоторых лунках опти-MEM отбирали и клетки лизировали в 200 мкл лизирующего буфера. В это время в оставшихся лунках опти-MEM заменяли на среду RPMI 1640. В этих лунках среду отбирали и клетки лизировали в 200 мкл лизирующего буфера через 24 или 48 часов после начала трансфекции. Лизаты хранили при -20°C до измерения активности ppLuc.
7. Измерение активности люциферазы
Активность ppLuc измеряли в виде относительных световых единиц (RLU) в планшетном спектрофотометре BioTek SynergyHT при времени измерения 5 секунд с использованием 50 мкл лизата и 200 мкл люциферинового буфера (25 мМ глицилглицин, pH 7,8 (NaOH), 15 мМ MgSO4, 2 мМ АТФ, 75 мкМ люциферин). Конкретные RLU рассчитывали, вычитая RLU контрольной РНК из общих RLU.
8. Экспрессия люциферазы посредством интрадермальной инъекции мРНК (экспрессия люциферазы in vivo)
Мышей анестезировали смесью ромпуна и кетавета. Каждую кодирующую ppLuc мРНК инъецировали интрадермально (0,5 мкг мРНК в 50 мкл на инъекцию). В качестве контроля отдельно инъецировали мРНК, не кодирующую ppLuc. Через 16 часов после инъекции мышей умерщвляли и собирали ткань. Образцы ткани быстро замораживали в жидком азоте и лизировали в устройстве для лизиса ткани (Qiagen) в 800 мкл лизирующего буфера (25 мМ Tris, pH 7,5 (HCl), 2 мМ ЭДТА, 10% глицерин, 1% Triton X-100, 2 мМ DTT, 1 мМ PMSF). Затем образцы центрифугировали при 13500 об/мин при 4°C в течение 10 минут. Лизаты хранили при -80°C до измерения активности ppLuc (см. 7. измерение активности люциферазы).
9. Экспрессия MmEPO в клетках HeLa
Клетки HeLa обрабатывали трипсином и промывали в среде opti-MEM. 1×105 клеток в 200 мкл среды opti-MEM электропорировали 0,5 мкг MmEPO-кодирующей мРНК. В качестве контрольного образца отдельно электропорировали постороннюю мРНК. Электропорированные клетки высевали на 24-луночные планшеты в 1 мл среды RPMI 1640. Через 6, 24 или 48 часов после трансфекции из культур клеток удаляли супернатанты. Содержание ЕРО в супернатантах измеряли, используя набор для анализа методом ELISA эритропоэтин-квантикин мышей/крыс (R&D Systems) в соответствии с инструкциями производителя.
10. Результаты
10.1. Последовательности структуры "стебель-петля" гистонов:
Для характеристики последовательностей структуры "стебель-петля" гистонов группировали и выравнивали последовательности многоклеточных и простейших (4001 последовательность), или простейших (131 последовательность) или альтернативно многоклеточных (3870 последовательностей) или позвоночных (1333 последовательности) или людей (84 последовательности). Затем определяли количество встречающихся нуклеотидов в каждом положении. На основе полученных таким образом таблиц получали консенсусные последовательности для 5 различных групп последовательностей, представляющие все нуклеотиды, присутствующие в анализируемых последовательностях. В комбинированной консенсусной последовательности многоклеточных и простейших 3 нуклеотида являются консервативными, T/U в петле и G и C в стебле, формирующих пары оснований. Как правило, структурно формируется стебель из 6 пар оснований и петля из 4 нуклеотидов. Однако обычными являются измененные структуры: из 84 структур "стебель-петля" гистонов, принадлежащих человеку, две содержат стебель только из 5 нуклеотидов, содержащий 4 пары оснований и одно несоответствие. Другая структура "стебель-петля" гистонов человека содержит стебель только из 5 пар оснований. Еще четыре структуры "стебель-петля" гистонов человека содержат стебель длиной 6 нуклеотидов, но содержат одно несоответствие в трех различных положениях, соответственно. Кроме того, четыре структуры "стебель-петля" гистонов человека содержат одну пару неоднозначных оснований в двух различных положениях, соответственно. В отношении петли, по-видимому, длина в 4 нуклеотида необходима не строго, так как у D. discoideum идентифицирована петля из 5 нуклеотидов.
В дополнение к консенсусной последовательности, представляющей все нуклеотиды, присутствующие в анализируемых последовательностях, также получали более ограниченные консенсусные последовательности, более выделяя консервативные нуклеотиды. В итоге, получали следующие последовательности:
(Конс): представляет все присутствующие нуклеотиды.
(99%): представляет по меньшей мере 99% всех присутствующих нуклеотидов.
(95%): представляет по меньшей мере 95% всех присутствующих нуклеотидов.
(90%): представляет по меньшей мере 90% всех присутствующих нуклеотидов.
Результаты анализа последовательностей структуры "стебель-петля" гистонов обобщены в приведенных ниже таблицах 1-5 (также см. фиг. 1-5):



где использованные сокращения определяли следующим образом:
10.2. Комбинация поли(A) и histoneSL повышает экспрессию белка c мРНК синергичным образом.
Для исследования влияния комбинации поли(A) и histoneSL на экспрессию белка c мРНК синтезировали мРНК с различными последовательностями с 3ʹ-конца от 3ʹ-UTR альфа-глобина: мРНК, на 3ʹ-конце просто заканчивающиеся 3ʹ-UTR, таким образом, не имея последовательности поли(A) и histoneSL, или содержащие с 3ʹ-конца от 3ʹ-UTR последовательность поли(A) A64 или histoneSL в качестве альтернативы друг другу, или и поли(A) A64, и histoneSL. Кодирующую люциферазу мРНК или контрольную мРНК электропорировали в клетки HeLa. Уровни люциферазы измеряли через 6, 24 и 48 часов после трансфекции (см. приведенную ниже таблицу 6 и фиг. 20).
С последовательности мРНК, не содержащей ни последовательности поли(A), ни histoneSL, экспрессировалось мало люциферазы. Последовательность поли(A) или histoneSL увеличивают уровень в сходной степени. Любая мРНК обеспечивала уровень люциферазы, намного больший, чем мРНК с отсутствием поли(A) и histoneSL. Однако удивительно, что комбинация поли(A) и histoneSL дополнительно сильно увеличивала уровень люциферазы, во много раз выше уровня, наблюдаемого при использовании любого из элементов отдельно. Величина повышения уровня люциферазы при комбинировании поли(A) и histoneSL в одной и той же мРНК демонстрирует, что они действуют синергически.
Синергию между поли(A) и histoneSL количественно определяли, деля сигнал от мРНК с поли(A)-histoneSL (+/+) на сумму сигналов от мРНК с histoneSL (-/+) и мРНК с поли(A) (+/-) (см. приведенную ниже таблицу 7).
Рассчитанный таким образом показатель указывает на то, насколько уровень люциферазы с мРНК с комбинацией поли(A) и histoneSL превышает уровень, который можно было бы ожидать, если бы влияние поли(A) и histoneSL было чисто аддитивным. Уровень люциферазы с мРНК с комбинацией поли(A) и histoneSL до величины в 16,6 раз превышал уровень, который мог бы присутствовать, если бы их эффекты были чисто аддитивными. Этот результат подтверждает, что комбинация поли(A) и histoneSL действует, существенно синергически увеличивая экспрессию белка.
10.3. Комбинация поли(A) и histoneSL повышает экспрессию белка c мРНК вне зависимости от их порядка.
Влияние комбинации поли(A) и histoneSL может зависеть от длины последовательности поли(A) и порядка поли(A) и histoneSL. Таким образом, синтезировали мРНК с увеличенной длиной последовательности поли(A) и мРНК c поли(A) и histoneSL в обратном порядке: две мРНК содержали с 3ʹ-конца от 3ʹ-UTR последовательность поли(A) A120 или A300. Одна дополнительная мРНК с 3ʹ-конца от 3ʹ-UTR содержала сначала histoneSL с последующей последовательностью поли(A) A250. Кодирующую люциферазу мРНК или контрольную мРНК посредством липофекции вводили в клетки HeLa. Уровни люциферазы измеряли через 6, 24 и 48 часов после начала трансфекции (см. приведенную ниже таблицу 8 и фиг. 21).
Последовательность поли(A) A64 или histoneSL обеспечивали сравнимые уровни люциферазы. В соответствии с предыдущим экспериментом комбинация A64 и histoneSL сильно увеличивала уровень люциферазы, во много раз выше уровня, наблюдаемого при использовании любого из элементов отдельно. Величина подъема уровня люциферазы при комбинации поли(A) и histoneSL в одной мРНК демонстрируют, что они действуют синергически. Синергию между A64 и histoneSL количественно определяли, как и ранее, на основе уровней люциферазы мРНК с A64-histoneSL, A64 и histoneSL (см. приведенную ниже таблицу 9). Уровень люциферазы, получаемой с мРНК с комбинацией A64 и histoneSL, до величины в 61,7 раз превышал уровень, который мог бы присутствовать, если бы эффекты поли(A) и histoneSL были чисто аддитивными.
В отличие от этого, увеличение длины последовательности поли(A) с A64 до A120 или до A300 только умеренно увеличивало уровень люциферазы (см. таблицу 8 и фиг. 19). мРНК с наибольшей последовательностью поли(A), A300, также сравнивали с мРНК, в которой последовательность поли(A) сходной длины комбинировали с histoneSL, histoneSL-A250. В дополнение к наличию длинной последовательности поли(A) в этой мРНК относительно мРНК с A64-histoneSL изменяли порядок histoneSL и поли(A). Комбинация A250 и histoneSL сильно увеличивала уровень люциферазы, во много раз выше уровня, наблюдаемого или с histoneSL, или с A300. Также синергию между A250 и histoneSL количественно определяли как ранее, сравнивая RLU, полученные для мРНК с histoneSL-A250, с RLU, полученные для мРНК с A300 и мРНК с histoneSL (см. приведенную ниже таблицу 10). Уровень люциферазы с мРНК, комбинирующей A250 и histoneSL до величины в 17,0 раз превышал уровень, мог бы присутствовать, если бы эффекты поли(A) и histoneSL были чисто аддитивными.
Таким образом, высокое синергическое действие комбинации histoneSL и поли(A) на экспрессию белка c мРНК показано для значительно различающихся длин поли(A) и вне зависимости от порядка поли(A) и histoneSL.
10.4. Повышение экспрессии белка посредством комбинации поли(A) и histoneSL является специфичным
Для исследования специфичности влияния комбинации поли(A) и histoneSL на экспрессию белка c мРНК, синтезировали мРНК с альтернативными последовательностями в комбинации с поли(A): эти мРНК с 3ʹ-конца от A64 содержали одну из семи различных последовательностей, соответственно. Кодирующую люциферазу мРНК или контрольную мРНК электропорировали в клетки HeLa. Уровни люциферазы измеряли через 6, 24 и 48 часов после трансфекции (см. приведенную ниже таблицу 11 и фигуру 22).
Последовательность поли(A) или histoneSL обеспечивали сравнимые уровни люциферазы. Также комбинация поли(A) и histoneSL сильно увеличивала уровень люциферазы, во много раз выше уровня, наблюдаемого при использовании любого из элементов отдельно, таким образом, действуя синергически. В отличие от этого, комбинирование поли(A) с любой из альтернативных последовательностей не демонстрировала действия на уровень люциферазы по сравнению с мРНК, содержащей только последовательность поли(A). Таким образом, комбинация поли(A) и histoneSL повышает экспрессию белка c мРНК синергичным образом, и это влияние является специфичным.
10.5. Комбинация поли(A) и histoneSL повышает экспрессию белка c мРНК синергичным образом in vivo.
Для исследования влияния комбинации поли(A) и histoneSL на экспрессию белка c мРНК in vivo, мышам интрадермально инъецировали кодирующую люциферазу мРНК с различными последовательностями с 3ʹ-конца от 3ʹ-UTR альфа-глобина или контрольную мРНК: мРНК с 3ʹ-конца от 3ʹ-UTR содержали последовательность поли(A) A64 или histoneSL в качестве альтернативы друг другу, или и поли(A) A64, и histoneSL. Уровни люциферазы измеряли через 16 часов после инъекция (см. приведенную ниже таблицу 12 и фиг. 23).
Люцифераза экспрессировалась с мРНК с histoneSL или с последовательностью поли(A). Однако удивительно, что комбинация поли(A) и histoneSL дополнительно сильно увеличивала уровень люциферазы, во много раз выше уровня, наблюдаемого при использовании любого из элементов отдельно. Величина повышения уровня люциферазы при комбинировании поли(A) и histoneSL в одной мРНК демонстрирует, что они действуют синергически.
Синергию между поли(A) и histoneSL количественно определяли, деля сигнал от мРНК с поли(A)-histoneSL (+/+) на сумму сигналов от мРНК с histoneSL (-/+) и мРНК с поли(A) (+/-) (см. приведенную ниже таблицу 13).
Рассчитанный таким образом показатель указывает на то, насколько уровень люциферазы с мРНК с комбинацией поли(A) и histoneSL превышает уровень, который можно было бы ожидать, если бы влияние поли(A) и histoneSL было чисто аддитивным. Уровень люциферазы с мРНК с комбинацией поли(A) и histoneSL до величины в 8 раз превышал уровень, который мог бы присутствовать, если бы их эффекты были чисто аддитивными. Этот результат подтверждает, что комбинация поли(A) и histoneSL действует, существенно синергически увеличивая экспрессию белка in vivo.
11. Экспрессия антител и их исследование
Линия клеток
Гуманизированные антитела экспрессируют на основе РНК в клетках СНО-К1 или ВНК-21 (HER2-отрицательные клетки почки сирийского хомячка). HER2 экспрессирован на высоком уровне в линии опухолевых клеток ВТ-474, поэтому указанные клетки используют для определения уровней антител при помощи анализа FACS. Все линии клеток за исключением СНО культивируют в среде RPMI, содержащей FCS и глутамин, в соответствии с информацией поставщика. Клетки СНО выращивают в среде Хэма F12, содержащей 10% FCS. Все линии клеток могут быть приобретены в Германской коллекции культур клеток (DSMZ, Braunschweig, Germany).
Экспрессия антител
Разные количества мРНК (с большим содержанием G/C, как показано на фигурах 24 и 25), кодирующей гуманизированное антитело герцептин (трастузумаб), трансфицируют в клетки СНО или ВНК методом электропорации (300 В, 450 мкФ для клеток СНО и 300 В, 150 мкФ для клеток ВНК). Трансфицированные клетки высевают на 24-луночные планшеты для культур клеток с плотностью 200000-400000 клеток/лунку. Для сбора секретированного белка среду заменяют 250 мкл свежей среды после сцепления клеток с пластиковой поверхностью. Секретированный белок собирают в течение 24-96 часов и хранят при 4°С. Кроме того, клетки собирают в 50 мкл физиологического раствора с фосфатным буфером (однократный буфер PBS), содержащим 0,5% BSA, и разрушают, выполняя три цикла замораживания-оттаивания. Клеточный лизат очищают центрифугированием и хранят при -80°С.
Анализ методом вестерн-блоттинга
Для обнаружения трансляции трансфицированной РНК белки из супернатантов культур клеток или клеточные лизаты отделяют при помощи электрофореза в полиакриламидном геле в присутствии 12% додецилсульфата натрия (SDS-PAGE) и наносят на нитроцеллюлозную мембрану. В качестве контрольного образца может быть использовано гуманизированное антитело герцептин (Roche). После окончания блоттинга мембраны инкубируют с биотинилированным антителом козы против IgG человека (Dianiva), стрептавидином, связанным с пероксидазой из хрена (BD), и хемилюминесцентным субстратом (SuperSignal West Pico, Pierce). Окрашивание детектируют при помощи хемилюминесцентной камеры Fuji LAS-1000.
Анализ методом FACS
Образование функциональных антител можно продемонстрировать путем окрашивания антиген-экспрессирующих клеток-мишеней методом FACS. Для исследования продуцирования функциональных антител супернатанты культур РНК-трансфицированных клеток собирают через 48-96 часов. Примерно 200000 клеток-мишеней ВТ-474, экспрессирующих HER2, инкубируют с контрольными антителами (герцептин, Roche) или супернатантами культур клеток. Для обнаружения связанных антител клетки окрашивают биотинилированным антителом козы против IgG человека (Dianova) и РЕ-меченным стрептавидином (Invitrogen). Клетки анализируют в устройстве FACSCanto II (BD).
Реферат
Группа изобретений относится к области биотехнологии. Предложены нуклеиновая кислота, кодирующая терапевтический белок или антитело, структуру «стебель-петля» гистонов, и последовательность поли(А) или сигнал полиаденилирования, набор и фармацевтическая композиция, содержащие одну или более указанную нуклеиновую кислоту, для использования в генной терапии, а также способ повышения экспрессии кодируемого белка и применение указанных нуклеиновой кислоты, набора или композиции для повышения экспрессии кодируемого белка. Строение предложенной нуклеиновой кислоты, заключающееся в комбинации элементов последовательности поли(А) или сигнала полиаденилирования совместно со структурой «стебель-петля» гистонов, обеспечивает повышение экспрессии белка значительно выше уровня, наблюдаемого при использовании указанных элементов отдельно. Предложенная группа изобретений может быть использована в медицине в генной терапии. 6 н. и 15 з.п. ф-лы, 25 ил., 15 табл., 11 пр.
Формула




Документы, цитированные в отчёте о поиске
Днк, повышающая продуцирование белка, и ее применение

Комментарии