Новый fab-фрагмент антитела против ceacam5 человека - RU2779165C2
Код документа: RU2779165C2
Чертежи
Описание
ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее изобретение относится к новому Fab-фрагменту антитела против CEACAM5 человека. Настоящее изобретение также относится к композиции для диагностики, содержащей Fab-фрагмент антитела против CEACAM5 человека, и к способу диагностики злокачественного новообразования с использованием Fab-фрагмента.
УРОВЕНЬ ТЕХНИКИ
[0002] CEA (карциноэмбриональный антиген) или CEACAM (карциноэмбриональная антиген-связанная молекула клеточной адгезии) представляет собой опухолевый маркер, открытый в 1965 г. (J. Exp. Med.; 1965; 121: 439-462; и PNAS; 1969; 64: 161-167), и до настоящего времени было обнаружено 23 СЕА-связанных молекул (BioMed Central Biology; 2010; 8: 12-33). Среди них CEACAM5 редко экспрессируется в нормальных тканях, но экспрессируется в желудочно-кишечном тракте плода или колоректальном раке (BBA; 1990; 1032: 177-189; и Mol. Pathol.; 1999; 52: 174-178). Известно, что CEACAM5 также экспрессируется при раке молочной железы, раке легких и раке щитовидной железы (Diagn. Cytopathol.; 1993; 9: 377-382; Cancer Res.; 1990; 50: 6987-6994; Histopathology; 2000; 37: 530-535).
[0003] Концентрация CEACAM5 в крови у пациентов с колоректальным раком выше, чем у здоровых людей (J. Exp. Med.; 1965; 121: 439-462), и CEACAM5 используется в качестве опухолевого маркера. Согласно гистологическим исследованиям пациентов с колоректальным раком, CEACAM5 высоко экспрессируется в 90% или более тканей (British J. Cancer; 2013; 108: 662-667).
[0004] Поскольку раннее метастазирование колоректального рака локализуется в печени, то раннее выявление и лечение метастазов в печени может снизить частоту рецидивов (Cell Mol. Gastroenterol. Hepatol.; 2017; 3: 163-173). В диагностике метастазирования в печени используются КТ (компьютерная томография), МРТ (магнитно-резонансная томография) или ФДГ-ПЭТ (позитронно-эмиссионная томография с фтордезоксиглюкозой). Чувствительность определения КТ, МРТ и ФДГ-ПЭТ составляет 74,4, 80,3 и 81,4%, соответственно, а чувствительность детектирования опухоли размером 1 см или менее снижается до 47,3% для КТ и 60,2% для МРТ (Radiology; 2010; 257: 674-684). МРТ с использованием специфических для печени контрастных веществ также используется, хотя чувствительность детектирования опухоли до 1 см или меньше составляет от 29 до 38% (Radiology; 2005; 237: 89-98).
[0005] Противоопухолевые агенты или антитела, меченные радиоизотопом металла, используются для диагностики или лечения злокачественных новообразований. Направленное воздействие с использованием антител обладает высокой специфичностью к опухолевым клеткам и вызывает меньше нежелательных явлений. До сих пор некоторые моноклональные антитела, меченные радиоизотопами металлов, клинически применялись для диагностики и лечения (Cancer Control; 2012; 19: 196-203).
[0006] Между тем, антитела обычно имеют длительный период полужизни в крови и требуют периода от 4 дней до 5 дней для достижения отношения опухоль-кровь, которое обеспечивает отношение сигнал-фон, достаточное для визуализации злокачественного новообразования, после введения в организм (Clin. Pharmacol. Ther.; 2010; 87: 586-592). Также Fc-области антител вызывают фармакологический эффект антителозависимой клеточной цитотоксичности (ADCC) или комплементзависимой цитотоксичности (CDC) (Glycoconj. J.; 2013; 30: 227-236; и Curr. Opin. Biotechnol.; 2002; 13: 609-614). Кроме того, антитела метаболизируются в печени и поэтому накапливаются в печени, независимо от цели. Тем не менее, с помощью антител трудно обнаружить поражения печени метастазами, так как ранний метастаз колоректального рака локализуется в печени (Clin. Pharmacol. Ther.; 2010; 87: 586-592).
[0007] Фрагменты низкомолекулярных рекомбинантных антител, такие как Fab, scFv и диатело, легко попадают в очаги поражения благодаря их высокому проникновению в ткани и используются в качестве терапевтических антител, поскольку можно ожидать низкозатратного получения с использованием системы экспрессии в E.coli или дрожжах. С другой стороны, об их использовании в качестве диагностического лекарственного средства также сообщалось в связи с их короткими периодами полужизни в крови и особенностями почечной экскреции (Nat. Biotechnol.; 2005; 23: 1126-1136).
[0008] M5A (PTL 1), гуманизированное антитело мышиного моноклонального антитела T84.66, известно как антитело против CEACAM5 человека, применяемое для диагностического лекарственного средства. Сообщалось, что M5A, меченное64Cu, требует 22 часов или более после введения для получения подходящих изображений ПЭТ в тесте с использованием мышей с подкожной трансплантацией опухолевых клеток (NPL 1) и попадает в нормальную ткань печени и участок поражения печени на том же уровне через 3 часа после введения и на существенно отличном уровне через 24 часа в тесте с использованием мышиных моделей с метастазированием в печень (NPL 2).
[0009] Что касается фрагмента антитела против CEACAM5 человека, то сообщалось, что CEA-Scan, меченный99mTc Fab мышиного моноклонального антитела NP-4, можно использовать для диагностики колоректального рака (NPL 3). Однако поглощение CEA-Scan в области поражения не превышает его поглощения в нормальной печени, и его чувствительность обнаружения для метастазов в печени ниже, чем у FDG-PET (NPL 4). CEA-Scan был одобрен FDA в качестве диагностического препарата для лечения колоректального рака в 1999 году, но больше не продается (NPL 5).
СПИСОК ЛИТЕРАТУРЫ
ПАТЕНТНАЯ ЛИТЕРАТУРА
[0010]
PTL 1: международная публикация № WO 2005/086875
НЕПАТЕНТНАЯ ЛИТЕРАТУРА
[0011]
NPL 1: Bioconjug. Chem.; 2008; 19: 89-96
NPL 2: PLOS ONE; 2014; 9 (9): e106921
NPL 3: Ann. Surg.; 1997; 226: 621-631
NPL 4: J. Nucl. Med.; 2000; 41: 1657-1663
NPL 5: Kenneth T. Cheng, «99mTc-Arcitumomab», [online], Update: March 17, 2008, Molecular Imaging and Contrast Agent Database, [searched on May 17, 2017], internet
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
[0012] Одновалентные Fab-фрагменты имеют молекулярную массу приблизительно 50 кДа, что меньше, чем у антител (приблизительно 150 кДа), которые вырабатываются почками, а также имеют короткий период полужизни в крови. Следовательно, они достигают отношения опухоль-кровь, которое обеспечивает отношение сигнал-фон, достаточное для того, чтобы можно было обнаружить метастазы в печени и визуализировать злокачественное новообразование в течение 2-32 часов после введения. Они лишены Fc-области, и поэтому они не вызывают ни ADCC, ни CDC. Исходя из этих особенностей, можно ожидать, что Fab-фрагменты будут более эффективными в качестве диагностических лекарственных средств по сравнению с антителами.
[0013] Однако активность связывания Fab-фрагментов часто ослабляется из-за того, что они являются небольшими молекулами. Антитела должны быть помечены детектируемым веществом, таким как ПЭТ-индикатор или флуоресцентный краситель, для их использования в качестве диагностических лекарственных средств in vivo. Еще одной проблемой Fab-фрагментов является ослабление их связывающей активности из-за мечения таким веществом.
[0014] Целью настоящего изобретения является предоставление Fab-фрагмента антитела против CEACAM5 человека, который полезен для детектирования CEACAM5 человека и, как ожидается, накапливается в участке поражения опухоли в течение короткого времени (например, 4 часа) после введения. Другой целью настоящего изобретения является создание композиции для диагностики, содержащей Fab-фрагмент, которая, как ожидается, позволит ставить диагноз в день введения, и к способу диагностики с использованием этой композиции.
РЕШЕНИЕ ПРОБЛЕМЫ
[0015] Авторы настоящего изобретения провели значительные тщательные исследования по приготовлению Fab-фрагмента антитела против CEACAM5 человека, полезного для детектирования CEACAM5 человека, и, следовательно, получили Fab-фрагмент антитела против CEACAM5 человека, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот с 1 по 121 SEQ ID NO: 2, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот с 1 по 112 SEQ ID NO: 4 (Пример 1), и обнаружили, что: Fab-фрагмент антитела против CEACAM5 человека свободен от ослабления связывающей активности против CEACAM5 человека за счет связывания меченого фрагмента (Пример 3); и конъюгат, содержащий Fab-фрагмент антитела против CEACAM5 человека, накапливается в CEACAM5-положительных опухолевых клетках человека на моделях подкожной трансплантации и на моделях трансплантации печени через 4 часа после введения и позволяет детектировать CEACAM5-положительные опухолевые клетки человека (Примеры 5 и 6). В частности, настоящее изобретение относится к Fab-фрагменту антитела против CEACAM5 человека, который накапливается при злокачественном новообразовании, и к конъюгату, содержащему Fab-фрагмент антитела против CEACAM5 человека.
[0016] Настоящее изобретение включает аспекты, приведенные ниже, как полезные с медицинской или промышленной точки зрения вещества и способы.
[0017] Конкретно, в одном аспекте настоящее изобретение может быть таким, как изложено ниже:
(1) Fab-фрагмент антитела против CEACAM5 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, содержащую CDR1, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот 31-35 последовательности SEQ ID NO: 2, CDR2, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот 50-66 SEQ ID NO: 2, и CDR3, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот 99-110 SEQ ID NO: 2, и легкую цепь, содержащую вариабельную область легкой цепи, содержащую CDR1, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот 24-38 SEQ ID NO: 4, CDR2, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот 54-60 SEQ ID NO: 4, и CDR3, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот 93-101 SEQ ID NO: 4.
(2) Fab-фрагмент антитела против CEACAM5 человека в по п. (1), выбранный из группы, состоящей из следующих (а) и (b):
(a) Fab-фрагмент антитела против CEACAM5 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот 1-121 последовательности SEQ ID NO: 2, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот 1-112 SEQ ID NO: 4; и
(b) Fab-фрагмент антитела против CEACAM5 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, полученную из вариабельной области тяжелой цепи, состоящей из аминокислотной последовательности, соответствующей положениям аминокислот 1-121 SEQ ID NO: 2, посредством модификации глутаминовой кислоты в положении аминокислоты 1 SEQ ID NO: 2 в пироглутаминовую кислоту, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот 1-112 SEQ ID NO: 4.
(3) Fab-фрагмент антитела против CEACAM5 человека по п. (2), выбранный из группы, состоящей из следующих (а) и (b):
(a) Fab-фрагмент антитела против CEACAM5 человека, содержащий фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 2, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4; и
(b) Fab-фрагмент антитела против CEACAM5 человека, содержащий фрагмент тяжелой цепи, полученный из фрагмента тяжелой цепи, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 2, путем модификации глутаминовой кислоты в положении аминокислоты 1 SEQ ID NO: 2 в пироглутаминовую кислоту, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4.
(4) Fab-фрагмент антитела против CEACAM5 человека по п. (3), содержащий фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 2, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO.: 4.
(5) Конъюгат, содержащий меченый фрагмент и Fab-фрагмент антитела против CEACAM5 человека по любому из (1) - (4).
(6) Конъюгат по п. (5), отличающийся тем, что меченый фрагмент представляет собой (i) лиганд и линкер, (ii) лиганд, (iii) флуоресцентный краситель и линкер или (iv) флуоресцентный краситель.
(7) Конъюгат по п. (6), отличающийся тем, что меченый фрагмент представляет собой (i) лиганд и линкер или (ii) лиганд.
(8) Конъюгат по п. (7), отличающийся тем, что лиганд представляет собой лиганд, представленный следующей формулой (А):
[Химическая Формула 1]

где волнистая линия представляет собой связывание с Fab-фрагментом антитела против CEACAM5 человека или с линкером.
(9) Конъюгат по п. (7), отличающийся тем, что меченый фрагмент представляет собой (i) лиганд и линкер, где лиганд и линкер представляют собой группу, представленную следующей формулой (A'):
[Химическая Формула 2]
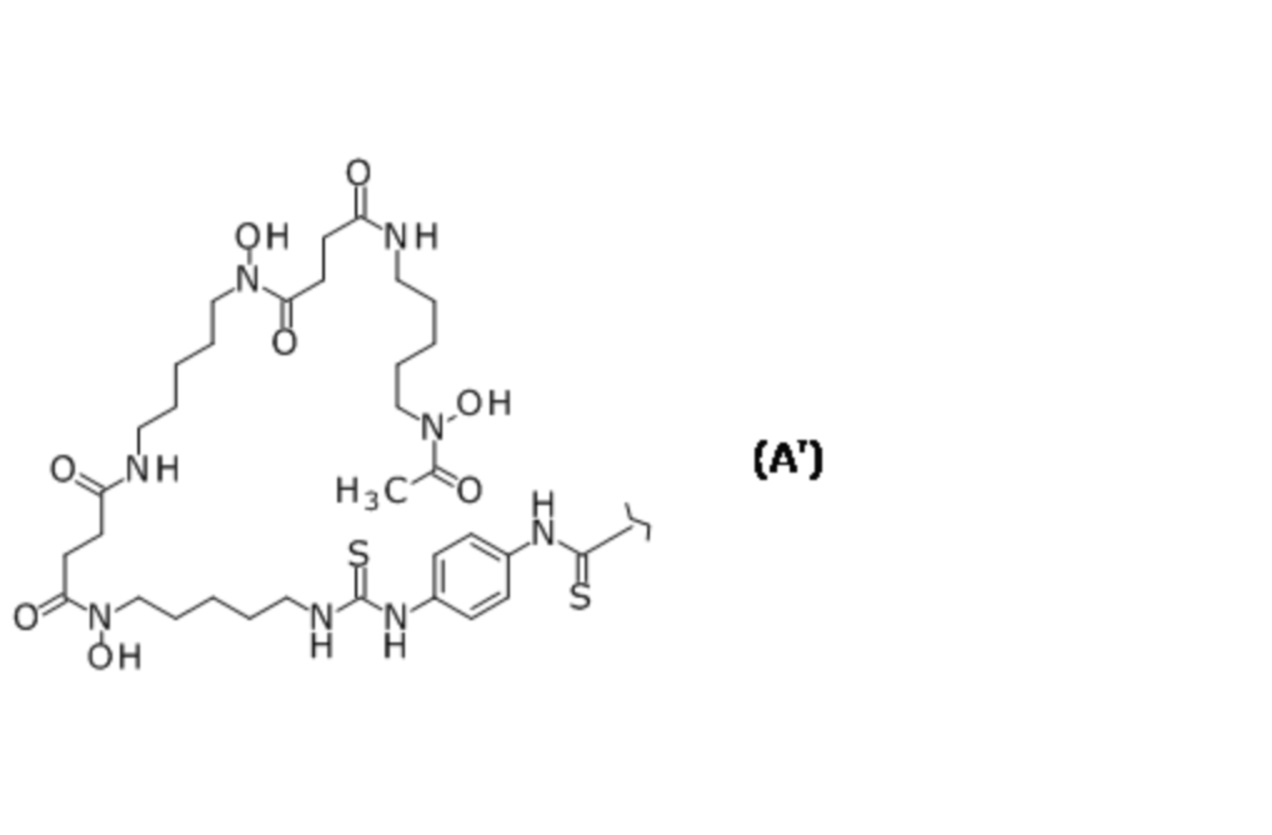
где волнистая линия представляет собой связывание с Fab-фрагментом антитела против CEACAM5 человека.
(10) Конъюгат по п. (9), отличающийся тем, что Fab-фрагмент антитела против CEACAM5 человека связан с атомом углерода концевой C(=S)-группы меченого фрагмента через аминогруппу в Fab-фрагменте.
(11) Конъюгат по п. (7), представленный следующей формулой (I):
(L-X)p-Ab (I)
где Ab представляет собой Fab-фрагмент антитела против CEACAM5 человека;
L представляет собой лиганд;
Х представляет собой линкер или связь; и
р представляет собой натуральное число от 1 до 25.
(12) Конъюгат по п. (11), отличающийся тем, что L представляет собой лиганд, представленный следующей формулой (А):
[Химическая Формула 3]

где волнистая линия представляет собой связывание с Х (или Ab, когда Х является связью).
(13) Конъюгат по пп. (9) или (12), представленный следующей формулой (II):
[Химическая Формула 4]

где Ab представляет собой Fab-фрагмент антитела против CEACAM5 человека; и
р представляет собой натуральное число от 1 до 25, где
Ab связано с атомом углерода концевой C(=S)-группы меченого фрагмента через аминогруппу в Ab.
(14) Конъюгат по любому из пп. (11) - (13), отличающийся тем, что p представляет собой натуральное число от 1 до 16.
(15) Конъюгат по любому из пп. (11) - (13), отличающийся тем, что р представляет собой натуральное число от 4 до 16.
(16) Конъюгат по любому из пп. (6) - (15), дополнительно содержащий металл.
(17) Конъюгат по п. (16), отличающийся тем, что металл представляет собой радиоизотоп металла.
(18) Конъюгат по п. (16), отличающийся тем, что металл представляет собой89Zr.
(19) Конъюгат по пп. (17) или (18) для применения в качестве ПЭТ-индикатора.
(20) Полинуклеотид, выбранный из группы, состоящей из следующих (а) и (b):
(а) полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека (а) по п. (2); и
(b) полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека (а) по п. (2).
(21) Полинуклеотид, выбранный из группы, состоящей из следующих (а) и (b):
(а) полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по п. (4); и
(b) полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека по п. (4).
(22) Экспрессирующий вектор, содержащий следующие (а) и/или (b):
(а) полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека (а) по п. (2); и
(b) полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека (а) по п. (2).
(23) Экспрессирующий вектор, содержащий следующие (а) и/или (b):
(а) полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по п. (4); и
(b) полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека по п. (4).
(24) Клетка-хозяин, выбранная из группы, состоящей из следующих (а) - (d):
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека (а) по п. (2);
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека (а) по п. (2);
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека (а) по п. (2), и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека (а) по п. (2); и
(d) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека (а) по п. (2), и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека (а) по п. (2).
(25) Клетка-хозяин, выбранная из группы, состоящей из следующих (а) - (d):
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по п. (4);
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека по п. (4);
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по п. (4), и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмент антитела против CEACAM5 человека по п. (4); и
(d) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по п. (4), и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека по п. (4).
(26) Способ получения Fab-фрагмента антитела против CEACAM5 человека, включающий стадию культивирования клетки-хозяина, выбранной из группы, состоящей из следующих (a) - (c), для экспрессии Fab-фрагмента антитела против CEACAM5 человека:
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека (а) по п. (2), и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека (а) по п. (2);
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека (a) по п. (2), и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 (a) человека по п. (2); и
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека (a) по п. (2), и клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека (a) по п. (2).
(27) Способ получения Fab-фрагмента антитела против CEACAM5 человека, включающий стадию культивирования клетки-хозяина, выбранной из группы, состоящей из следующих (a) - (c), для экспрессии Fab-фрагмента антитела против CEACAM5 человека:
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по п. (4), и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмент антитела против CEACAM5 человека по п. (4);
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по п. (4), и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека по п. (4); и
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по п. (4), и клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека по п. (4).
(28) Способ получения конъюгата, содержащего меченый фрагмент и Fab-фрагмент антитела против CEACAM5 человека, включающий стадии: получения Fab-фрагмента антитела против CEACAM5 человека способом по п. (26) или (27); и ковалентное связывание Fab-фрагмента с меченым фрагментом.
(29) Способ получения конъюгата, содержащего лиганд и Fab-фрагмент антитела против CEACAM5 человека, включающий стадии: получения Fab-фрагмента антитела против CEACAM5 человека способом по п. (26) или (27); и ковалентное связывание Fab-фрагмента с лигандом через линкер или напрямую.
(30) Способ получения конъюгата, содержащего меченый фрагмент, меченный радиоактивным изотопом металла, и Fab-фрагмент антитела против CEACAM5 человека, включающий стадии: получения конъюгата, содержащего лиганд и Fab-фрагмент антитела против CEACAM5 человека, способом по п. 29; и связывание радиоизотопа металла с лигандом конъюгата через координационную связь.
(31) Композиция для диагностики, содержащая конъюгат по любому из пп. (16) - (19) и фармацевтически приемлемый носитель.
(32) Композиция для диагностики по п. (31), которая представляет собой лекарственное средство для определения клинической стадии заболевания.
(33) Композиция для диагностики по п. (31) или (32) для применения при диагностике колоректального рака, рака молочной железы, рака легкого, рака щитовидной железы или рака, возникающего в результате метастазирования этих злокачественных новообразований.
(34) Композиция для диагностики по (33) для применения при диагностике колоректального рака или рака, возникающего в результате метастазирования колоректального рака.
(35) Композиция для диагностики по п. (34), отличающаяся тем, что рак, возникающий в результате метастазирования колоректального рака, представляет собой метастатический рак печени.
(36) Применение конъюгата по любому из пп. (16) - (19) для получения композиции для диагностики колоректального рака, рака молочной железы, рака легкого, рака щитовидной железы или рака, возникающего в результате метастазирования этих злокачественных новообразований.
(37) Конъюгат по любому из пп. (16) - (19) для применения при диагностике колоректального рака, рака молочной железы, рака легкого, рака щитовидной железы или рака, возникающего в результате метастазирования этих злокачественных новообразований.
(38) Способ диагностики рака ободочной и прямой кишки, рака молочной железы, рака легкого, рака щитовидной железы или рака, возникающего в результате метастазирования этих злокачественных новообразований, включающий введение пациенту конъюгата по любому из пп. (16) - (19).
(38) Способ диагностики рака ободочной и прямой кишки, рака молочной железы, рака легкого, рака щитовидной железы или рака, возникающего в результате метастазирования этих злокачественных новообразований, включающий введение пациенту конъюгата по любому из пп. (16) - (19).
(40) Применение Fab-фрагмента антитела против CEACAM5 человека по любому из пп. (1) - (4) для получения конъюгата, содержащего меченый фрагмент.
(41) Fab-фрагмент антитела против CEACAM5 человека по п. (39), отличающийся тем, что конъюгат, содержащий меченый фрагмент, представляет собой конъюгат по любому из пп. (5) - (18).
(42) Применение Fab-фрагмента антитела против CEACAM5 человека по п. (40), отличающееся тем, что конъюгат, содержащий меченый фрагмент, представляет собой конъюгат по любому из пп. (5) - (18).
ПРЕИМУЩЕСТВЕННЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
[0018] Fab-фрагмент антитела против CEACAM5 человека по настоящему изобретению полезен для детектирования CEACAM5 человека и, как ожидается, будет полезен при диагностике рака, такого как колоректальный рак, рак молочной железы, рак легкого, рак щитовидной железы или рак, возникающий в результате метастазирования этих злокачественных новообразований.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0019]
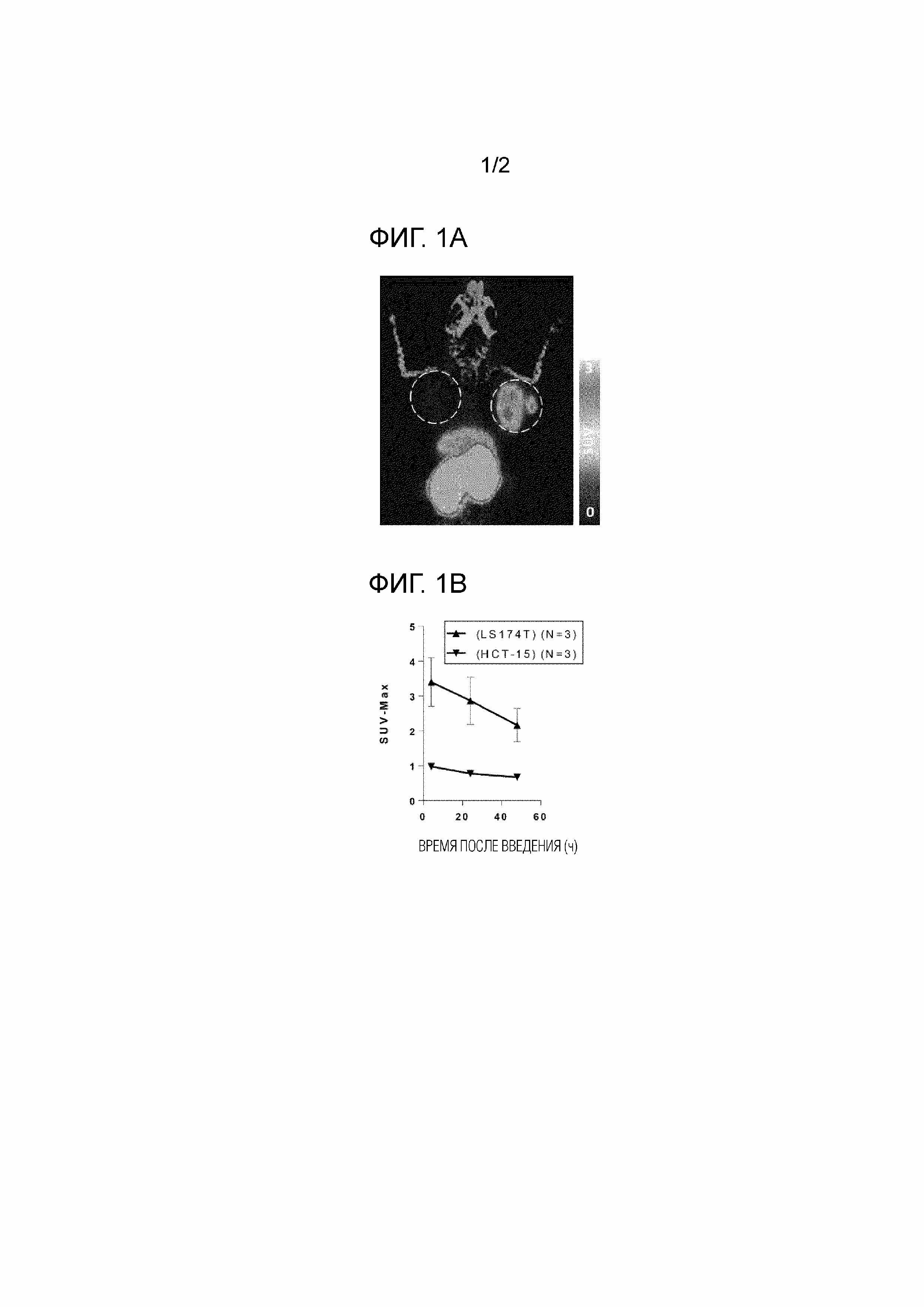
[Фиг. 1A] Фиг. 1A представляет собой репрезентативное изображение, полученное с помощью ПЭТ через 4 часа после введения PB009-03 мыши, которой были подкожно трансплантированы в правое плечо клетки линии колоректального рака человека LS174T (клетки, положительные по CEACAM5 человека), в то время как клетки клеточной линии колоректального рака человека HCT-15 (клетки, отрицательные по CEACAM5 человека) подкожно трансплантировали в левое плечо. Поскольку мышь сфотографировали лицевой стороной вниз, правый кружок изображает правое плечо мыши с трансплантированными клетками LS174T, а левый кружок изображает левое плечо мыши с трансплантированными клетками HCT-15. Правая полоса показывает максимальное стандартизированное значение поглощения (SUV-Max) для опухоли.
[Фиг. 1B] Фиг. 1B представляет собой график, показывающий результаты анализа изображений, полученных с помощью ПЭТ, через 4 часа, 24 часа и 48 часов после введения PB009-03 мыши, которой были подкожно трансплантировали в правое плечо клетки клеточной линии колоректального рака человека LS174T (клетки, положительные по CEACAM5 человека), в то время как клетки линии колоректального рака человека HCT-15 (клетки, отрицательные по CEACAM5 человека) подкожно трансплантировали в левое плечо. На ординате изображено значение SUV-Max PB009-03, накопленное в месте опухоли. Планки погрешностей на графике показывают среднее значение±среднее стандартное отклонение (среднее±SEM).
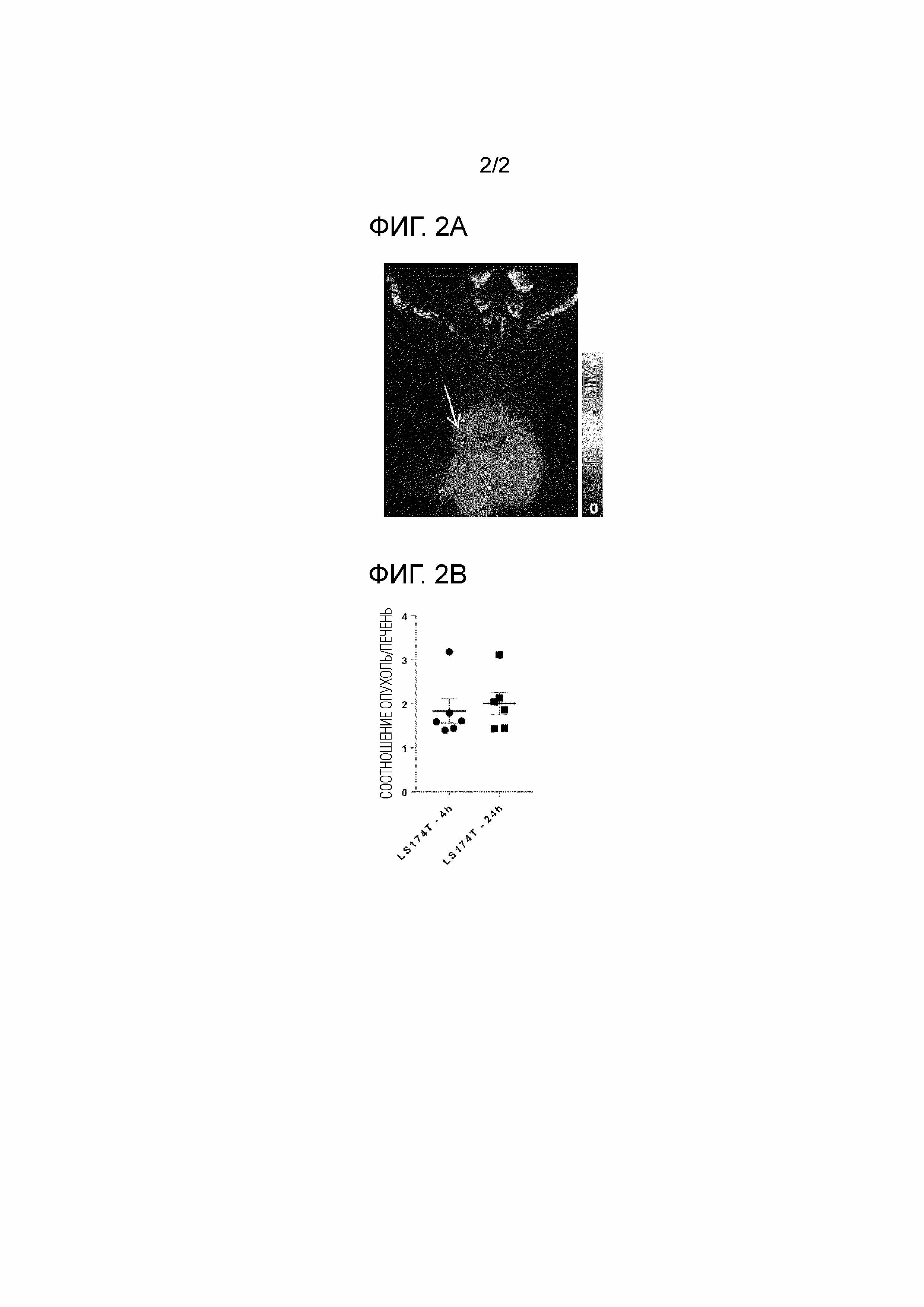
[Фиг. 2A] Фиг. 2A представляет собой репрезентативное изображение, полученное с помощью ПЭТ через 4 часа после введения PB009-03 мыши, которой были трансплантированы в печень клетки LS174T, экспрессирующие люциферазу (клетки, положительные по CEACAM5 человека). Стрелка изображает участок трансплантации клеток. Правая полоса отображает значение SUV-Max.
[Фиг. 2B] Фиг. 2B представляет собой график, показывающий результаты анализа изображений, полученных с помощью ПЭТ через 4 часа и 24 часа после введения PB009-03 мыши, которой были трансплантированы в печень клетки LS174T, экспрессирующие люциферазу (клетки, положительные по CEACAM5 человека). Ордината изображает соотношение между значениями SUV-Max PB009-03, который накапливаются в печени и опухолевом участке (соотношение опухоль/печень). Планки погрешностей на графике показывают среднее значение±среднее стандартное отклонение (среднее±SEM).
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0020] Далее настоящее изобретение будет описано подробно. Однако настоящее изобретение этим не ограничивается. Научные термины и технические термины, используемые в отношении настоящего изобретения, имеют значения, обычно понятные специалистам в данной области техники, если в настоящем описании не указано иное.
[0021] Авторы настоящего изобретения провели значительные тщательные исследования по приготовлению антитела против CEACAM5 человека или его антигенсвязывающего фрагмента и, следовательно, успешно получили Fab-фрагмент антитела против CEACAM5 человека, пригодный для детектирования CEACAM5 человека.
[0022] Базовая структура молекулы антитела является общей среди классов и состоит из тяжелых цепей с молекулярной массой от 50000 до 70000 и легких цепей с молекулярной массой от 20000 до 30000. Тяжелая цепь обычно состоит из полипептидной цепи, содержащей приблизительно 440 аминокислот, имеет структуру, характерную для каждого класса, и называется γ, μ, α, δ, и ε цепями, соответствующими IgG, IgM, IgA, IgD и IgE. IgG дополнительно содержит IgG1, IgG2, IgG3 и IgG4, которые называются γ1, γ2, γ3 и γ4, соответственно. Легкая цепь обычно состоит из полипептидной цепи, содержащей приблизительно 220 аминокислот, и известна как относящаяся к двум типам, L- и K-типу, которые называются λ и κ цепями, соответственно. Что касается пептидной конфигурации базовой структуры молекулы антитела, две гомологичные тяжелые цепи и две гомологичные легкие цепи связаны через дисульфидные связи (связи S-S) и нековалентные связи с образованием молекулярной массы от 150000 до 190000. Две легкие цепи могут соединяться с любой из тяжелых цепей. Отдельная молекула антитела постоянно состоит из двух идентичных легких цепей и двух идентичных тяжелых цепей.
[0023] Четыре (или пять для μ и ε цепи) и две внутрицепочечные S-S связи присутствуют в тяжелой цепи и легкой цепи, соответственно, и каждая составляет одну петлю на 100-110 аминокислотных остатков. Эта конформация одинакова среди петель и называется структурной единицей или доменом. Как для тяжелой цепи, так и для легкой цепи домен, расположенный в N-концевой области, не имеет постоянной аминокислотной последовательности даже среди препаратов одного и того же класса (подкласса) животных одного и того же вида и поэтому называется вариабельной областью. Соответствующие домены называются вариабельной областью тяжелой цепи (домен VH) и вариабельной областью легкой цепи (домен VL). Аминокислотная последовательность в С-концевой области является почти постоянной на уровне класса или подкласса и называется константной областью. Соответствующие домены представлены CH1, CH2, CH3 и CL.
[0024] Специфичность связывания антитела с антигеном зависит от аминокислотной последовательности фрагмента, состоящего из вариабельной области тяжелой цепи и вариабельной области легкой цепи. С другой стороны, биологическая активность, такая как связывание с белками системы комплемента или различными клетками, отражает разницу в структуре между константными областями Ig соответствующих классов. Известно, что вариабельность вариабельных областей тяжелой цепи и легкой цепи ограничена по существу тремя небольшими гипервариабельными областями, присутствующими в обеих цепях. Эти области называются областями, определяющими комплементарность (CDR; CDR1, CDR2 и CDR3 по порядку с N-конца). Остальные фрагменты вариабельной области называются каркасными областями (FR) и являются относительно постоянными.
[0025] Область между доменом CH1 и доменом CH2 константной области тяжелой цепи антитела называется шарнирной областью. Эта область богата пролиновыми остатками и содержит множество межцепочечных S-S связей, которые соединяют две тяжелые цепи. Например, шарнирные области человеческого IgG1, IgG2, IgG3 и IgG4 содержат 2, 4, 11 и 2 остатка цистеина, соответственно, которые образуют S-S-связи между тяжелыми цепями. Шарнирная область является областью, очень чувствительной к протеолитическому ферменту, такому как папаин или пепсин. В случае расщепления антитела папаином тяжелые цепи расщепляются в положении на N-конце от S-S связей между тяжелыми цепями шарнирной области и, таким образом, разлагаются на два Fab-фрагмента и один фрагмент Fc. Fab-фрагмент состоит из легкой цепи и фрагмента тяжелой цепи, содержащего вариабельную область тяжелой цепи, домен CH1 и часть шарнирной области. Fab-фрагмент содержит вариабельные области и обладает антигенсвязывающей активностью.
[0026]
Fab-фрагмент антитела против CEACAM5 человека по настоящему изобретению включает Fab-фрагмент, имеющий следующую особенность:
Fab-фрагмент антитела против CEACAM5 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот 1-121 SEQ ID NO: 2, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот 1-112 SEQ ID NO: 4.
[0027] Любая константная область Igγ1, Igγ2, Igγ3 или Igγ4 и т. д. может быть выбрана в качестве константной области тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению. В одном варианте осуществления константная область тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению представляет собой константную область Igγ1 человека.
[0028] Любая константная область Igλ или Igκ может быть выбрана в качестве константной области легкой цепи Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению. В одном варианте осуществления константная область легкой цепи Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению представляет собой константную область Igκ человека.
[0029] В одном варианте осуществления Fab-фрагмент антитела против CEACAM5 человека по настоящему изобретению представляет собой следующий Fab-фрагмент:
Fab-фрагмент антитела против CEACAM5 человека, содержащий фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 2, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4.
[0030] В случае экспрессии антитела, включая Fab-фрагмент, в клетках, известно, что антитело подвергается посттрансляционной модификации. Примеры посттрансляционной модификации включают в себя отщепление С-концевого лизина тяжелой цепи карбоксипептидазой, модификацию N-концевого глутамина или глутаминовой кислоты тяжелой цепи и легкой цепи в пироглутаминовую кислоту путем пироглутамилирования, гликозилирования, окисления, дезамидирования и гликирования. Известно, что такая посттрансляционная модификация встречается в различных антителах (J. Pharm. Sci., 2008; 97: 2426-2447).
[0031] Fab-фрагмент антитела против CEACAM5 человека по настоящему изобретению также может включать Fab-фрагмент, полученный в результате посттрансляционной модификации. Примеры Fab-фрагментов антитела против CEACAM5 человека по настоящему изобретению, которые могут быть получены в результате посттрансляционной модификации, включают Fab-фрагмент антитела против CEACAM5 человека, имеющий пироглутамилированную по N-концу тяжелую цепь. В данной области известно, что такая посттрансляционная модификация с помощью N-концового пироглутамилирования не имеет заметного влияния на активность антитела (Anal. Biochem., 2006; 348: 24-39).
[0032] В одном варианте осуществления Fab-фрагмент антитела против CEACAM5 человека по настоящему изобретению представляет собой Fab-фрагмент антитела против CEACAM5 человека, имеющий следующую особенность:
Fab-фрагмент антитела против CEACAM5 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, полученную из вариабельной области тяжелой цепи, состоящей из аминокислотной последовательности, соответствующей положениям аминокислот 1-121 последовательности SEQ ID NO: 2, посредством модификации глутаминовой кислоты в положении аминокислоты 1 SEQ ID NO: 2 в пироглутаминовую кислоту, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот 1-112 SEQ ID NO: 4.
[0033] В другом варианте осуществления Fab-фрагмент антитела против CEACAM5 человека по настоящему изобретению представляет собой Fab-фрагмент антитела против CEACAM5 человека, имеющий следующую особенность:
Fab-фрагмент антитела против CEACAM5 человека, содержащий фрагмент тяжелой цепи, полученный из фрагмента тяжелой цепи, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 2, путем модификации глутаминовой кислоты в положении аминокислоты 1 SEQ ID NO: 2 в пироглутаминовую кислоту, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4.
[0034] Настоящее изобретение также включает в себя Fab-фрагмент антитела против CEACAM5 человека, имеющий следующую особенность:
Fab-фрагмент антитела против CEACAM5 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, содержащую CDR1, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот 31-35 последовательности SEQ ID NO: 2, CDR2, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот 50-66 SEQ ID NO: 2, и CDR3, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот 99-110 SEQ ID NO: 2, и легкую цепь, содержащую вариабельную область легкой цепи, содержащую CDR1, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот 24-38 SEQ ID NO: 4, CDR2, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот 54-60 SEQ ID NO: 4, и CDR3, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот 93-101 SEQ ID NO: 4.
[0035] Fab-фрагмент антитела против CEACAM5 человека по настоящему изобретению связывается с CEACAM5 человека. Способ измерения активности связывания полученного Fab-фрагмента антитела против CEACAM5 человека с CEACAM5 человека включает такие методы, как анализ с помощью поверхностного плазмонного резонанса (SPR) и ИФА. В случае использования, например, анализа с помощью SPR, константа скорости ассоциации (ka), константа скорости диссоциации (kd) и константа диссоциации (KD) могут быть измерены с использованием Biacore T200 (GE Healthcare Japan Corp.), набора с иммобилизацией биотина Biotin CAPture Kit (GE Healthcare Japan Corp.) и биотинилированного CEACAM5 человека на сенсорном чипе и добавления туда последовательно разведенного Fab-фрагмента.
[0036] Fab-фрагмент антитела против CEACAM5 человека по настоящему изобретению может быть легко получен специалистами в данной области с использованием метода, известного в данной области, на основе информации о последовательности фрагмента тяжелой цепи и легкой цепи Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению, раскрытой в настоящем описании. Fab-фрагмент антитела против CEACAM5 человека по настоящему изобретению можно получить способом, описанным, например, в «Способе получения Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению», упомянутом позже, но не ограничиваясь этим.
[0037] <Конъюгат по настоящему изобретению>
Конъюгат по настоящему изобретению представляет собой конъюгат, содержащий меченый фрагмент и Fab-фрагмент антитела против CEACAM5 человека по настоящему изобретению.
[0038] «Меченый фрагмент» представляет собой (i) лиганд и линкер, (ii) лиганд, (iii) флуоресцентный краситель и линкер или (iv) флуоресцентный краситель. Определенная форма представляет собой (i) лиганд и линкер или (ii) лиганд, содержащий металл. Определенная форма представляет собой (iii) флуоресцентный краситель и линкер. Определенная форма представляет собой (i) лиганд и линкер. Лиганд «меченого фрагмента» может дополнительно содержать металл. Определенная форма представляет собой (i) лиганд и линкер, содержащий металл, или (ii) лиганд, составляющий его, и другая форма представляет собой (i) лиганд, образующий хелатный комплекс с металлом, и линкер, или (ii) лиганд, образующий хелатный комплекс с металлом.
[0039] Конъюгат по настоящему изобретению, содержащий металл, флуоресцентный краситель или неметаллический радиоизотоп, может быть использован в различных контрастных средах и тому подобном и используется, например, в контрастной среде МРТ, ПЭТ-индикатре и флуоресцентно меченном молекулярном визуализирующем агенте.
[0040] В настоящем описании «металл» означает ион парамагнитного металла или радиоизотоп металла. Металл конкретно ничем не ограничен при условии, что металл образует координационную связь с каждым лигандом. Соответствующая известная комбинация лиганда и металла выбирается в соответствии с целью использования конъюгата.
[0041] Ион парамагнитного металла подходящим образом используется в контрастной среде МРТ. Примеры формы иона парамагнитного металла включают, но не ограничиваются ими, Fe2+, Fe3+, Cu2+, Ni2+, Rh2+, Co2+, Gd3+, Eu3+, Dy3+, Tb3+, Pm3+, Nd3+, Tm3+, Ce3+, Y3+, Ho3+, Er3+, La3+, Yb3+, Mn3+, и Mn2+. Определенной формой является Gd3+, Mn3+, Mn2+, Fe2+, или Fe3+. Определенной формой является Mn3+ или Mn2+. В этом случае галоген или тому подобное можно использовать в качестве противоаниона в конъюгате. Альтернативно, противоанион может представлять собой C(=O)O- лиганда. Конъюгат может дополнительно иметь противокатион, такой как Na+.
[0042] Радиоизотоп металла используется, например, в ПЭТ-индикаторе. Примеры формы радиоизотопа металла включают, но не ограничиваются ими,89Zr,51Mn,52Fe,60Cu,67Ga,68Ga,72As,99mTc, и111In. Определенная форма представляет собой89Zr,60Cu,67Ga,68Ga,99mTc, или111In. Определенная форма представляет собой радиоизотоп циркония. Определенная форма представляет собой89Zr.
[0043] «Лиганд» представляет собой группу, способную образовывать хелатный комплекс с металлом в этом конъюгате, и означает группу, состоящую из хелатирующего агента в определенной форме. Составляющая группа представляет собой группу, образующую связь в результате удаления протона из хелатирующего агента.
[0044] «Хелатирующий агент» представляет собой соединение, которое может образовывать координационную связь с металлом.
[0045] Примеры «хелатирующего агента» включают сидерофор и не сидерофор. Примеры определенной формы включают MAG3 (меркаптоацетил-глицил-глицил-глицин, CAS №: 66516-09-4) и его известные реакционноспособные производные. Примеры сидерофора включают сидерофор типа гидроксамовой кислоты, типа катехина и типа смешанного лиганда. Примеры сидерофоров типа гидроксамовой кислоты включают феррихром, дефероксамин (DFO), представленный следующей формулой:
[0046]
[Химическая Формула 5]

фузаринин С, орнибактин, родоторуловая кислота и их известные реакционноспособные производные. Примеры сидерофоров катехинового типа включают энтеробактин, бациллибактин, вибриобактин и их известные реакционноспособные производные. Примеры сидерофора лиганда смешанного типа включают азотобактин, пиовердин, иерсиниабактин и их известные реакционноспособные производные. В случае сидерофора DFO может реагировать через его реакционноспособную функциональную группу -NH2 с линкером или Fab-фрагментом, и сидерофор, отличный от DFO, также может реагировать через его реакционноспособную функциональную группу, такую как карбоксигруппа, гидроксигруппа или аминогруппа с линкером или Fab-фрагментом способом, обычно используемым специалистами в данной области.
[0047] Примеры не сидерофора включают DTPA (диэтилентриаминпентауксусная кислота, CAS №: 67-43-6), DTPA-BMA (1,7-бис(метилкарбамоилметил)-1,4,7-триазагептан-1,4,7-триуксусная кислота, CAS №: 119895-95-3), EOB-DTPA (этоксибензил-DTPA,2-[[(2S)-2-[бис(карбоксиметил)амино]-3-(4-этоксифенил) пропил]-[2-[бис(карбоксиметил)амино]этил]амино]уксусная кислота), TTHA (триэтилентетрамингексауксусная кислота, CAS №: 869-52-3), DO3A (1,4,7,10-тетраазациклододекан-1,4,7-триуксусная кислота, CAS №: 217973-03-0), HP-DO3A (10-(2-гидроксипропил)-1,4,7,10-тетраазациклододекан-1,4,7-триуксусная кислота, CAS №: 120041-08-9), DOTA (1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота, CAS №: 60239-18-1) и их известные реакционноспособные производные.
[0048] Соединения и конъюгаты, описанные в настоящем документе, также охватывают свободные формы и их соли, если не указано иное. В этом контексте «его соль» представляет собой соль, которая может быть образована соединением или конъюгатом, который может образовывать соль присоединения кислоты или соль с основанием, в зависимости от типа заместителя в соединении или конъюгате. Их конкретные примеры включают соли присоединения кислоты с неорганическими кислотами, такими как соляная кислота, бромоводородная кислота, йодоводородная кислота, серная кислота, азотная кислота и фосфорная кислота, или органические кислоты, такие как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, миндальная кислота, винная кислота, дибензоилвинная кислота, дитолуоилвинная кислота, лимонная кислота, метансульфокислота, этансульфокислота, бензолсульфокислота, п-толуолсульфокислота, аспарагиновая кислота и глутаминовая кислота; соли с неорганическими основаниями, такими как натрий, калий, магний, кальций и алюминий, или органическими основаниями, такими как метиламин, этиламин, этаноламин, лизин и орнитин; соли с различными аминокислотами и производными аминокислот, такими как ацетиллейцин; и соли аммония. Например, DFO существует в виде метансульфоната дефероксамина или в виде других солей. DTPA существует как в свободной форме, так и в виде натриевой соли.
[0049] Определенная форма «хелатирующего агента» для использования в контрастной среде МРТ представляет собой хелатирующий агент сидерофора или не сидерофора, описанный выше.
[0050] Определенная форма «хелатирующего агента» для применения в ПЭТ-индикаторе представляет собой хелатирующий агент на основе сисдерофора или не сидерофора, описанного выше. Определенная форма представляет собой MAG3. Определенная форма представляет собой DFO.
[0051] Примеры определенной формы «хелатирующего агента», состоящего из лиганда, содержащегося в конъюгате по настоящему изобретению, включают DFO, DTPA, DTPA-BMA, EOB-DTPA, DO3A, HP-DO3A, и DOTA. Определенная форма представляет собой DFO, DTPA, или DOTA. Определенная форма представляет собой DFO.
[0052] «Линкер» представляет собой группу, которая создает расстояние между Fab-фрагментов антитела против CEACAM5 человека и лигандом. Примеры определенной формы «линкера» в конъюгате включают следующую формулу:
[0053]
[Химическая Формула 6]

(далее обозначается как -C(=S)-NH-(1,4-фенилен)-NH-C(=S)-), -CH2-(1,4-фенилен)-NH-C(=S)- и -C(=O)-(C1-20алкилен)-C(=O)-. В этом контексте «C1-20алкилен» представляет собой линейный или разветвленный алкилен, содержащий от 1 до 20 атомов углерода. Определенная форма С1-20алкилена представляет собой С1-10алкилен или С1-2алкилен. Определенной формой С1-20алкилена является этилен. Определенной формой является -C(=S)-NH-(1,4-фенилен)-NH-C(=S)-. Определенной формой является -C(=O)-C2H4-C(=O)-. Примеры реагента, который можно использовать для образования линкера, включают HO-C(=O)-(C1-20алкилен)-C(=O)-OH, янтарную кислоту и п-фенилендиизотиоцианат.
[0054] Конъюгат по настоящему изобретению, содержащий флуоресцентный краситель, можно использовать в качестве флуоресцентно меченного молекулярного визуализирующего агента.
[0055] Краситель, имеющий максимум поглощения и максимум излучения на длине волны ближнего инфракрасного диапазона (650-1000 нм), обычно используемый при фотоизображении, может быть использован в качестве флуоресцентного красителя для применения в конъюгате по настоящему изобретению. Примеры определенной формы флуоресцентного красителя включают соединения цианина и индоцианина. Примеры определенной формы включают IRDye800CW (LI-COR, Inc.), Cy (Molecular Probes, Inc.), Alexa Fluor, BODIPY, и DyLight (Thermo Fisher Scientific Inc.), CF790 (Biotium, Inc.), DY (Dyomics GmbH), HiLyte Fluor 680 и HiLyte Fluor 750 (AnaSpec Inc.), и PULSAR650, и QUASAR670 (LGC Biosearch Technologies). Определенная форма представляет собой IRDye800CW. Флуоресцентный краситель может реагировать через его карбоксигруппу, гидроксигруппу, аминогруппу или тому подобное или через активную группу, вводимую способом, обычно используемым специалистами в данной области техники, с Fab-фрагментом или линкером. Определенная форма флуоресцентного красителя, имеющего введенную активную группу, представляет собой флуоресцентный краситель, этерифицированный N-гидроксисукцинимидной (NHS) группой. Например, NHS-эфиры IRDye800CW, упомянутые выше, являются коммерчески доступными, и их можно использовать.
[0056] Конъюгат по настоящему изобретению, содержащий неметаллический радиоизотоп, можно использовать в качестве ПЭТ-индикатора.
[0057] Примеры неметаллического радиоизотопа для использования в конъюгате по настоящему изобретению включают18F,11C,15O и13N. Определенная форма представляет собой18F. Например, N-сукцинимидил-4-[18F]фторбензойная кислота ([18F] SFB) может быть использована для связывания соединения, содержащего неметаллический радиоизотоп.
[0058] Связывание Fab-фрагмента антитела против CEACAM5 по настоящему изобретению с меченым фрагментом может быть соответствующим образом выполнено специалистами в данной области с использованием известного подхода. Например, меченый фрагмент может быть связана с одной или более аминогруппами (например, N-концевой аминогруппой и аминогруппой аминокислотной боковой цепи), одной или более тиольными группами (например, тиольной группой аминокислотной боковой цепи) или одной или более карбоксильными группами (например, С-концевыми карбоксильными группами и аминокислотной боковой цепи) Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению. Определенная форма конъюгата по настоящему изобретению представляет собой конъюгат, в котором меченый фрагмент связан с одной или более аминогруппами Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению.
[0059] Когда меченый фрагмент представляет собой лиганд и линкер, конъюгат по настоящему изобретению можно получить путем взаимодействия хелатирующего агента, образующего лиганд, с веществом, полученным в результате реакции Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению с линкером. Он может быть получен путем взаимодействия Fab-фрагмента антитела против СЕАСАМ человека по настоящему изобретению с веществом, полученным в результате реакции хелатирующего агента, образующего лиганд, с линкером. В качестве примера реакции вещество, полученное в результате реакции аминогруппы хелатирующего агента с линкером, реагирует с одной или более аминогруппами (например, N-концевой аминогруппой и аминогруппой боковой цепи лизина) Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению. Когда меченый фрагмент представляет собой лиганд, он может быть получен путем взаимодействия хелатирующего агента, образующего лиганд, с Fab-фрагментом антитела против CEACAM5 человека по настоящему изобретению. В качестве примера реакции хелатирующий агент реагирует с одной или более аминогруппами (например, N-концевой аминогруппой и аминогруппой боковой цепи лизина) Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению. Реакция синтеза тиомочевины путем добавления изотиоцианата к амину, реакция синтеза амида путем добавления карбоновой кислоты к амину или тому подобное могут быть использованы при получении конъюгата по настоящему изобретению. Реакция может быть осуществлена путем применения метода, известного специалистам в данной области. Соединение лиганда, заранее связанного с линкером, может быть использовано в качестве исходного материала. Примеры соединения лиганда, связанного с линкером, включают в себя соединение p-SCN-Bn-DFO (DFO, замещенный п-изотиоцианофениламинотиокарбонильной группой, CAS №: 1222468-90-7), представленное следующей формулой:
[0060]
[Химическая Формула 7]

DTPA, замещенный п-изотиоцианобензильной группой (p-SCN-Bn-DTPA, CAS №: 102650-30-6), DOTA, замещенный п-изотиоцианобензильной группой (p-SCN-Bn-DOTA, CAS №: 127985-74 -4) и p-SCN-Bn-CHX-A''-DTPA([(R)-2-амино-3-(4-изотиоцианатофенил)пропил]-транс-(S, S)-циклогексан-1,2)-диамин-пентауксусная кислота, CAS №: 157380-45-5).
[0061] Конъюгат по настоящему изобретению может быть получен в виде, например, конъюгата, содержащего Fab-фрагмент, связанный по меньшей мере с одним меченым фрагментом через аминогруппы, путем взаимодействия одной или более аминогрупп (например, N-концевой аминогруппы и аминогруппы аминокислотной боковой цепи) Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению с меченым фрагментом, имеющим группу изоциановой кислоты.
[0062] Металл (ион парамагнитного металла или радиоизотоп металла) может быть добавлен к Fab-фрагменту антитела против CEACAM5 человека по настоящему изобретению, связанному, по меньшей мере, с одним меченым фрагментом, полученной способом получения конъюгата по настоящему изобретению, содержащего металл.
[0063] Конъюгат по настоящему изобретению представляет собой конъюгат, содержащий Fab-фрагмент антитела против CEACAM5 человека по настоящему изобретению, связанный по меньшей мере с одним меченым фрагментом. Определенной формой конъюгата по настоящему изобретению является Fab-фрагмент антитела против CEACAM5 человека, связанный с 1-25 мечеными фрагментами. Определенной формой является Fab-фрагмент антитела против CEACAM5 человека, связанный с 1-23 мечеными фрагментами. Определенной формой является Fab-фрагмент антитела против CEACAM5 человека, связанный с 1-16 мечеными фрагментами. Определенной формой является Fab-фрагмент антитела против CEACAM5 человека, связанный с 1-11 мечеными фрагментами. Определенной формой является Fab-фрагмент антитела против CEACAM5 человека, связанный с 1-10 мечеными фрагментами. Определенной формой является Fab-фрагмент антитела против CEACAM5 человека, связанный с 1-9 мечеными фрагментами. Определенной формой является Fab-фрагмент антитела против CEACAM5 человека, связанный с 4-23 мечеными фрагментами. Определенной формой является Fab-фрагмент антитела против CEACAM5 человека, связанный с 4-16 мечеными фрагментами. Определенной формой является Fab-фрагмент антитела против CEACAM5 человека, связанный с 4-10 мечеными фрагментами. Определенной формой является Fab-фрагмент антитела против CEACAM5 человека, связанный с 4-9 мечеными фрагментами. Определенной формой является Fab-фрагмент антитела против CEACAM5 человека, связанный с 3-23 мечеными фрагментами. Определенной формой является Fab-фрагмент антитела против CEACAM5 человека, связанный с 3-16 мечеными фрагментами. Определенной формой является Fab-фрагмент антитела против CEACAM5 человека, связанный с 3-10 мечеными фрагментами. Определенной формой является Fab-фрагмент антитела против CEACAM5 человека, связанный с 3-9 мечеными фрагментами. Определенной формой конъюгата по настоящему изобретению является Fab-фрагмент антитела против CEACAM5 человека, связанный, по меньшей мере, с одним меченым фрагментом, дополнительно содержащим металл. Определенная форма конъюгата по настоящему изобретению может представлять собой смесь конъюгатов, различающихся по количеству связанных меченых фрагментов.
[0064] В одном варианте осуществления конъюгат по настоящему изобретению представляет собой конъюгат, содержащий меченый фрагмент и Fab-фрагмент антитела против CEACAM5 человека по настоящему изобретению.
[0065] В определенном варианте осуществления конъюгат по настоящему изобретению представляет собой конъюгат, в котором меченый фрагмент представляет собой (i) лиганд и линкер или (ii) лиганд.
[0066] В определенном варианте осуществления конъюгат по настоящему изобретению представляет собой конъюгат, в котором меченый фрагмент представляет собой (i) лиганд и линкер или (ii) лиганд, и лиганд представляет собой лиганд, представленный следующей формулой (A):
[0067]
[Химическая Формула 8]

где волнистая линия представляет собой связывание с Fab-фрагментом антитела против CEACAM5 человека или с линкером.
[0068] В определенном варианте осуществления конъюгат по настоящему изобретению представляет собой конъюгат, в котором меченый фрагмент представляет собой (i) лиганд и линкер, а лиганд и линкер представляют собой группу, представленную следующей формулой (A'):
[0069]
[Химическая формула 9]

где волнистая линия представляет собой связывание с Fab-фрагментом антитела против CEACAM5 человека.
[0070] В определенном варианте осуществления конъюгат по настоящему изобретению представляет собой конъюгат, в котором меченый фрагмент представляет собой группу, представленную формулой (A'), и Fab-фрагмент антитела против CEACAM5 человека связан с атомом углерода концевой C(=S)-группы меченого фрагмента через аминогруппу в Fab-фрагменте.
[0071] В определенном варианте осуществления конъюгат по настоящему изобретению представляет собой конъюгат, представленный следующей формулой (I):
(L-X)p-Ab (I)
где Ab представляет собой Fab-фрагмент антитела против CEACAM5 человека по настоящему изобретению;
L представляет собой лиганд;
Х представляет собой линкер или связь; и
р представляет собой натуральное число от 1 до 25.
Определенная форма р представляет собой натуральное число от 1 до 23. Определенная форма представляет собой натуральное число от 1 до 16. Определенная форма представляет собой натуральное число от 1 до 11. Определенная форма представляет собой натуральное число от 1 до 10. Определенная форма представляет собой натуральное число от 1 до 9. Определенная форма представляет собой натуральное число от 4 до 23. Определенная форма представляет собой натуральное число от 4 до 16. Определенная форма представляет собой натуральное число от 4 до 10. Определенная форма представляет собой натуральное число от 4 до 9. Определенная форма представляет собой натуральное число от 3 до 23. Определенная форма представляет собой натуральное число от 3 до 16. Определенная форма представляет собой натуральное число от 3 до 10. Определенная форма представляет собой натуральное число от 3 до 9.
[0072] В определенном варианте осуществления конъюгат по настоящему изобретению представляет собой конъюгат формулы (I), где L представляет собой лиганд, представленный следующей формулой (A):
[0073]
[Химическая Формула 10]

где волнистая линия представляет собой связывание с Х (или Ab, когда Х является связью).
[0074] В определенном варианте осуществления конъюгат формулы (I) представляет собой конъюгат, представленный следующей формулой (II):
[0075]
[Химическая формула 11]

где Ab представляет собой Fab-фрагмент антитела против CEACAM5 человека по настоящему изобретению; и
р представляет собой натуральное число от 1 до 25.
Определенная форма р представляет собой натуральное число от 1 до 23. Определенная форма представляет собой натуральное число от 1 до 16. Определенная форма представляет собой натуральное число от 1 до 11. Определенная форма представляет собой натуральное число от 1 до 10. Определенная форма представляет собой натуральное число от 1 до 9. Определенная форма представляет собой натуральное число от 4 до 23. Определенная форма представляет собой натуральное число от 4 до 16. Определенная форма представляет собой натуральное число от 4 до 10. Определенная форма представляет собой натуральное число от 4 до 9. Определенная форма представляет собой натуральное число от 3 до 23. Определенная форма представляет собой натуральное число от 3 до 16. Определенная форма представляет собой натуральное число от 3 до 10. Определенная форма представляет собой натуральное число от 3 до 9.
Ab связано с атомом углерода концевой C(=S) группы меченого фрагмента через аминогруппу в Ab.
[0076] В определенном варианте осуществления конъюгат по настоящему изобретению представляет собой конъюгат формулы (I), дополнительно содержащий металл. Определенная форма металла представляет собой радиоизотоп металла. Определенная форма радиоизотопа металла представляет собой89Zr.
[0077] В определенном варианте осуществления конъюгат по настоящему изобретению представляет собой конъюгат формулы (II), дополнительно содержащий металл. Определенная форма металла представляет собой радиоизотоп металла. Определенная форма радиоизотопа металла представляет собой89Zr.
[0078] Конъюгат по настоящему изобретению также включает конъюгат, который представляет собой смесь множества конъюгатов. Например, конъюгат, который представляет собой смесь конъюгата, содержащего меченый фрагмент и не модифицированный посттрансляционно Fab-фрагмент антитела против CEACAM5 человека по настоящему изобретению, и конъюгат, содержащий меченый фрагмент и Fab-фрагмент антитела против CEACAM5 человека по настоящему изобретению, полученный в результате посттрансляционной модификации Fab-фрагмента антитела против CEACAM5 человека, также включены в конъюгат по настоящему изобретению.
[0079] Некоторые варианты осуществления конъюгата по настоящему изобретению, который представляет собой смесь множества конъюгатов по настоящему изобретению, будут показаны ниже.
(1) Конъюгат, который представляет собой смесь конъюгата, в котором меченый фрагмент представляет собой лиганд и линкер, представленный формулой (A'), и Fab-фрагмент антитела против CEACAM5 человека представляет собой Fab-фрагмент антитела против CEACAM5 человека, содержащий фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 2, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4, и конъюгата, в котором меченый фрагмент представляет собой лиганд и линкер, представленный формулой (A'), и Fab-фрагмент антитела против CEACAM5 человека представляет собой Fab-фрагмент антитела против CEACAM5 человека, содержащий фрагмент тяжелой цепи, полученный из фрагмента тяжелой цепи, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 2, с помощью модификации глутамина в положении аминокислоты 1 SEQ ID NO: 2 в пироглутаминовую кислоту, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4.
(2) Конъюгат (1), дополнительно содержащий металл.
(3) Конъюгат, который представляет собой смесь конъюгата (1), дополнительно содержащего металл, и конъюгата (1), не содержащего металл.
(4) Конъюгат (2) или (3), в котором металл представляет собой радиоизотоп металла.
(5) Конъюгат (4), в котором радиоизотоп металла представляет собой89Zr.
[0080] <Полинуклеотид по настоящему изобретению>
Полинуклеотид по настоящему изобретению включает полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению.
[0081] В одном варианте осуществления полинуклеотид по настоящему изобретению представляет собой полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной положениями аминокислот 1-121 SEQ ID NO: 2, или полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной положениями аминокислот 1-112 SEQ ID NO: 4.
[0082] Примеры полинуклеотида, содержащего нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной положениями аминокислот 1-121 последовательности SEQ ID NO: 2, включают полинуклеотид, содержащий нуклеотидную последовательность, соответствующую нуклеотидным положениям 1-363 SEQ ID NO: 1.
[0083] Примеры полинуклеотида, содержащего нуклеотидную последовательность, кодирующую легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, соответствующей положениям аминокислот 1-112 SEQ ID NO: 4, включают полинуклеотид, содержащий нуклеотидную последовательность, соответствующую нуклеотидным положениям 1-336 SEQ ID NO: 3.
[0084] В предпочтительном варианте осуществления полинуклеотид по настоящему изобретению представляет собой полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 2, или полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4.
[0085] Примеры полинуклеотида, содержащего нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 2, включают полинуклеотид, содержащий нуклеотидную последовательность, представленную SEQ ID NO: 1.
[0086] Примеры полинуклеотида, содержащего нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4, включают полинуклеотид, содержащий нуклеотидную последовательность, представленную SEQ ID NO: 3.
[0087] Полинуклеотид по настоящему изобретению можно синтезировать с помощью метода синтеза генов, известного в данной области, на основе нуклеотидных последовательностей, сконструированных на основе аминокислотных последовательностей фрагмента тяжелой цепи и легкой цепи Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению. Различные способы, известные специалистам в данной области, такие как способы синтеза гена антитела, описанные в международной публикации №. WO 90/07861, можно использовать в качестве таких способов синтеза генов.
[0088] <Экспрессирующий вектор по настоящему изобретению>
Экспрессирующий вектор по настоящему изобретению включает экспрессирующий вектор, содержащий полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению, экспрессирующий вектор, содержащий полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению, и экспрессирующий вектор, содержащий полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению.
[0089] Экспрессирующий вектор по настоящему изобретению предпочтительно включает экспрессирующий вектор, содержащий полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной положениями аминокислот 1-121 SEQ ID NO: 2, экспрессирующий вектор, содержащий полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной положениями аминокислот 1-112 SEQ ID NO: 4, и экспрессирующий вектор, содержащий полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной положениями аминокислот 1-121 SEQ ID NO: 2, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной положениями аминокислот 1-112 SEQ ID NO: 4.
[0090] Экспрессирующий вектор по настоящему изобретению предпочтительно включает экспрессирующий вектор, содержащий полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 2, экспрессирующий вектор, содержащий полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4, и экспрессирующий вектор, содержащий полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 2, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4.
[0091] Экспрессирующий вектор по настоящему изобретению конкретно ничем не ограничен при условии, что полипептид, кодируемый полинуклеотидом по настоящему изобретению, может продуцироваться в различных клетках-хозяевах прокариотических клеток и/или эукариотических клеток. Примеры таких экспрессирующих векторов включают плазмидные векторы и вирусные векторы (например, аденовирусный и ретровирусный). Предпочтительно можно использовать pEE6.4 или pEE12.4 (Lonza Group AG).
[0092] Экспрессирующий вектор по настоящему изобретению может содержать промотор, функционально связанный с геном, кодирующим фрагмент тяжелой цепи и/или легкую цепь в полинуклеотиде по настоящему изобретению. Примеры промотора для экспрессии Fab-фрагмента по настоящему изобретению в клетке-хозяине включают в себя промотор Trp, промотор lac, промотор recA, промотор λPL, промотор lpp и промотор tac, когда клетка-хозяин представляет собой бактерию рода Escherichia. Примеры промотора для экспрессии в дрожжах включают промотор PH05, промотор PGK, промотор GAP и промотор ADH. Примеры промотора для экспрессии в бактериях рода Bacillus включают промотор SL01, промотор SP02 и промотор penP. Примеры включают промоторы, полученные из вирусов, таких как CMV, RSV и SV40, ретровирусный промотор, актиновый промотор, промотор EF (фактор элонгации) 1α и промотор белка теплового шока, когда хозяин представляет собой эукариотическую клетку, такую как клетка млекопитающего.
[0093] В случае использования бактерии, в частности E. coli, в качестве клетки-хозяина, экспрессирующий вектор по настоящему изобретению может дополнительно содержать старт-кодон, стоп-кодон, терминаторную область и реплицируемый блок. С другой стороны, в случае использования дрожжей, клеток животных или клеток насекомых в качестве хозяина экспрессирующий вектор по настоящему изобретению может содержать старт-кодон и стоп-кодон. В этом случае в нем могут содержаться последовательность энхансера, 5'- и 3'-нетранслируемые области гена, кодирующего фрагмент тяжелой цепи и/или легкую цепь по настоящему изобретению, сигнальная последовательность секреции, соединение сплайсинга, сайт полиаденилирования или реплицируемый блок и т. д. Кроме того, обычно используется маркер селекции (например, ген устойчивости к тетрациклину, ген устойчивости к ампициллину, ген устойчивости к канамицину, ген устойчивости к неомицину и ген дигидрофолатредуктазы) в зависимости от цели.
[0094] <Трансформированная клетка-хозяин по настоящему изобретению>
Трансформированная клетка-хозяин по настоящему изобретению включает клетку-хозяина, трансформированную экспрессирующим вектором по настоящему изобретению, выбранную из группы, состоящей из следующих (а) - (d):
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению;
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению;
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению; и
(d) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению, и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению.
[0095] В одном варианте осуществления трансформированная клетка-хозяин по настоящему изобретению представляет собой клетку-хозяина, трансформированную экспрессирующим вектором по настоящему изобретению, выбранную из группы, состоящей из следующих (а) - (d):
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной положениями аминокислот 1-121 SEQ ID NO: 2;
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной положениями аминокислот 1-112 последовательности SEQ ID NO: 4;
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной положениями аминокислот 1-121 SEQ ID NO: 2, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной положениями аминокислот 1-112 последовательности SEQ ID NO: 4; и
(d) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной положениями аминокислот 1-121 SEQ ID NO: 2, и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной положениями аминокислот 1-112 SEQ ID NO: 4.
[0096] В одном варианте осуществления трансформированная клетка-хозяин по настоящему изобретению представляет собой клетку-хозяина, трансформированную экспрессирующим вектором по настоящему изобретению, выбранную из группы, состоящей из следующих (а) - (d):
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 2;
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4;
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 2, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленную SEQ ID NO: 4; и
(d) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 2, и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4.
[0097] Предпочтительные примеры трансформированной клетки-хозяина по настоящему изобретению включают клетку-хозяин, трансформированную экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению, и клетку-хозяин, трансформированную экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению, и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению.
[0098] Клетка-хозяин, подлежащая трансформации, конкретно ничем не ограничивается при условии, что она совместима с используемым экспрессирующим вектором и может быть трансформирована с помощью экспрессирующего вектора для экспрессии Fab-фрагмента. Их примеры включают различные клетки, такие как природные клетки и искусственно созданные клетки, обычно используемые в области техники настоящего изобретения (например, бактерии (бактерии рода Escherichia и бактерии рода Bacillus), дрожжи (рода Saccharomyces, рода Pichia, и т. д.), клетки животных и клетки насекомых (например, Sf9)) и клеточные линии млекопитающих (например, культивируемые клетки, такие как клетки CHOK1SV, клетки CHO-DG44 и клетки 293). Сама трансформация может быть выполнена известным способом, например, кальцийфосфатным методом или методом электропорации.
[0099] <Способ получения Fab-фрагмента антитела против CEACAM5 человека в соответствии с настоящим изобретением>
Способ получения Fab-фрагмента антитела против CEACAM5 человека в соответствии с настоящим изобретением включает стадию культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против CEACAM5 человека.
[0100] В одном варианте осуществления трансформированная клетка-хозяин по настоящему изобретению, которая должна культивироваться в способе получения Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению, выбрана из группы, состоящей из следующих пунктов (а) - (с):
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмент антитела против CEACAM5 человека по настоящему изобретению;
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению, и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению; и
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению, и клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению.
[0101] Определенная форма трансформированной клетки-хозяина по настоящему изобретению, которая должна культивироваться в способе получения Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению, выбрана из группы, состоящей из следующих пунктов (а) - (с):
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной положениями аминокислот 1-121 SEQ ID NO: 2, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной положениями аминокислот 1-112 SEQ ID NO: 4;
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной положениями аминокислот 1-121 SEQ ID NO: 2, и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной положениями аминокислот 1-112 SEQ ID NO: 4; и
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной положениями аминокислот 1-121 SEQ ID NO: 2, и клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной положениями аминокислот 1-112 SEQ ID NO: 4.
[0102] Определенная форма трансформированной клетки-хозяина по настоящему изобретению, которая должна культивироваться в способе получения Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению, выбрана из группы, состоящей из следующих пунктов (а) - (с):
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 2, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4;
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 2, и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4; и
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 2, и клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 4.
[0103] Используемая трансформированная клетка-хозяин по настоящему изобретению предпочтительно представляет собой клетку-хозяина, трансформированную экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению, или клетку-хозяина, трансформированную экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению, и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению.
[0104] В способе получения Fab-фрагмента антитела против CEACAM5 человека в соответствии с настоящим изобретением трансформированную клетку-хозяина можно культивировать в питательной среде. Питательная среда предпочтительно содержит источник углерода, источник неорганического азота или источник органического азота, необходимый для роста трансформированной клетки-хозяина. Примеры источника углерода включают глюкозу, декстран, растворимый крахмал и сахарозу. Примеры неорганического источника азота или органического источника азота включают соли аммония, нитраты, аминокислоты, кукурузный отвар, пептон, казеин, мясные экстракты, соевую муку и картофельные экстракты. Также при желании в них могут содержаться другие питательные вещества (например, неорганические соли (например, хлорид кальция, дигидрофосфат натрия и хлорид магния), витамины и антибиотики (например, тетрациклин, неомицин, ампициллин и канамицин)).
[0105] Само культивирование трансформированной клетки-хозяина проводят известным способом. Условия культивирования, например, температура, среднее pH и время культивирования, выбираются соответствующим образом. Когда хозяином является, например, животная клетка, среда MEM (Science; 1952; 122: 501), среда DMEM (Virology; 1959; 8: 396-97), среда RPMI1640 (J. Am. Med. Assoc.; 1967; 199: 519-24), среда 199 (Proc. Soc. Exp. Biol. Med.; 1950; 73: 1-8) или тому подобное, содержащие приблизительно 5-20% эмбриональной бычьей сыворотки, могут использоваться в качестве среды. РН среды предпочтительно составляет приблизительно от 6 до 8. Культивирование обычно проводят при температуре приблизительно от 30 до 40 °С в течение приблизительно от 15 до 336 часов, и при необходимости также можно проводить аэрацию или перемешивание. Когда хозяином является клетка насекомого, то примеры среды включают среду Грейса (PNAS; 1985; 82: 8404-8), содержащую эмбриональную бычью сыворотку. Ее рН предпочтительно составляет приблизительно от 5 до 8. Культивирование обычно проводят при температуре приблизительно от 20 до 40 °С в течение от 15 до 100 часов, и при необходимости также можно проводить аэрацию или перемешивание. Когда хозяином является бактерия, актиномицет, дрожжи или нитчатый гриб, то подходит, например, жидкая среда, содержащая источник питательных веществ, описанный выше. Среда с pH от 5 до 8 является предпочтительной. Когда хозяином является E.coli, предпочтительные примеры среды включают среду LB и среду М9 (Miller et al., Exp. Mol. Genet, Cold Spring Harbor Laboratory; 1972: 431). В таком случае культивирование обычно можно проводить при температуре от 14 до 43 °С в течение приблизительно от 3 до 24 часов с аэрацией или перемешиванием, если необходимо. Когда хозяином является бактерия рода Bacillus, то культивирование обычно можно проводить при температуре от 30 до 40 °С в течение приблизительно от 16 до 96 часов с аэрацией или перемешиванием, если это необходимо. Когда хозяин представляет собой дрожжи, примеры среды включают минимальную среду Burkholder (PNAS; 1980; 77: 4505-8). Желательно, чтобы ее рН составляло от 5 до 8. Культивирование обычно проводят при температуре приблизительно от 20 до 35 °С в течение приблизительно от 14 до 144 часов, и при необходимости также можно проводить аэрацию или перемешивание.
[0106] Способ получения Fab-фрагмента антитела против CEACAM5 человека в соответствии с настоящим изобретением может включать стадию выделения, предпочтительно выделения или очистки экспрессированного Fab-фрагмента антитела против CEACAM5 человека, в дополнение к стадии культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против CEACAM5 человека. Примеры метода выделения или очистки включают: методы, использующие растворимость, такие как высаливание и метод осаждения растворителем; методы, использующие разницу в молекулярной массе, такие как диализ, ультрафильтрация, гель-фильтрация и электрофорез в додецилсульфат натрий-полиакриламидном геле; методы с использованием заряда, такие как ионообменная хроматография и гидроксилапатитная хроматография; методы, использующие специфическую аффинность, такие как аффинная хроматография; методы, использующие разницу в гидрофобности, такие как высокоэффективная жидкостная хроматография с обращенной фазой; и способы, использующие разницу в изоэлектрической точке, такие как изоэлектрическая фокусировка.
[0107] <Способ получения конъюгата в соответствии с настоящим изобретением >
Способ получения конъюгата в соответствии с настоящим изобретением включает стадию ковалентного связывания Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению с меченым фрагментом. Способ получения конъюгата по настоящему изобретению может также включать стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против CEACAM5 человека; и ковалентное связывание Fab-фрагмента с меченым фрагментом. Способ получения конъюгата по настоящему изобретению может также включать стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против CEACAM5 человека; извлечение экспрессированного Fab-фрагмента; и ковалентное связывание Fab-фрагмента с меченым фрагментом. Можно использовать линкер, лиганд или флуоресцентный краситель и т. д. такие, как описано в разделе <Конъюгат по настоящему изобретению>.
[0108] В одном варианте осуществления способ получения конъюгата по настоящему изобретению представляет собой способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против CEACAM5 человека; и ковалентное связывание Fab-фрагмента с меченым фрагментом. Определенной формой способа получения конъюгата по настоящему изобретению является способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против CEACAM5 человека; извлечение экспрессированного Fab-фрагмента; и ковалентное связывание Fab-фрагмента с меченым фрагментом.
[0109] Определенной формой способа получения конъюгата по настоящему изобретению является способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против CEACAM5 человека; и i) связывание Fab-фрагмента через линкер с лигандом или ii) ковалентное связывание Fab-фрагмента непосредственно с лигандом. Определенной формой способа получения конъюгата по настоящему изобретению является способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против CEACAM5 человека; извлечение экспрессированного Fab-фрагмента; и i) связывание Fab-фрагмента через линкер с лигандом или ii) ковалентное связывание Fab-фрагмента непосредственно с лигандом.
[0110] Определенной формой способа получения конъюгата по настоящему изобретению является способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против CEACAM5 человека; ковалентное связывание Fab-фрагмента через линкер или непосредственно с лигандом; и связывание металла с лигандом конъюгата посредством координационной связи (то есть, образуя хелатный комплекс). Определенной формой способа получения конъюгата по настоящему изобретению является способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против CEACAM5 человека; извлечение экспрессированного Fab-фрагмента; ковалентное связывание Fab-фрагмента через линкер или непосредственно с лигандом; и связывание металла с лигандом конъюгата посредством координационной связи.
[0111] Определенной формой способа получения конъюгата по настоящему изобретению является способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против CEACAM5 человека; ковалентное связывание Fab-фрагмента через линкер или непосредственно с лигандом; и связывание радиоизотопа металла с лигандом конъюгата посредством координационной связи (то есть, с образованием хелатного комплекса). Определенной формой способа получения конъюгата по настоящему изобретению является способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против CEACAM5 человека; извлечение экспрессированного Fab-фрагмента; ковалентное связывание Fab-фрагмента через линкер или непосредственно с лигандом; и связывание радиоизотопа металла с лигандом конъюгата через координационную связь.
[0112] Способ получения конъюгата по настоящему изобретению может быть выполнен как способ, включающий две или более стадий, определенных выше как последовательность стадий, или может быть выполнен как способ, включающий по меньшей мере одну из стадий, определенных выше. Например, способ, включающий стадию связывания Fab-фрагмента антитела против CEACAM5 по настоящему изобретению с меченым фрагментом, и способ, включающий стадию мечения Fab-фрагмента антитела против CEACAM5 по настоящему изобретению, связанного с меченым фрагментом, с использованием металла, также включен в способ получения конъюгата по настоящему изобретению. Кроме того, способ получения конъюгата по настоящему изобретению включает способ, имеющий различный порядок стадий. Например, способ, включающий мечение лиганда радиоизотопом металла и затем ковалентное связывание лиганда с Fab-фрагментом антитела против CEACAM5 человека по настоящему изобретению, также включен в способ получения конъюгата по настоящему изобретению.
[0113] <Композиция для диагностики и способ диагностики в соответствии с настоящим изобретением>
Настоящее изобретение относится к композиции для диагностики, содержащей конъюгат по настоящему изобретению, содержащий флуоресцентный краситель, радиоизотоп металла или неметаллический радиоизотоп (далее называемый детектируемым конъюгатом по настоящему изобретению). Детектируемый конъюгат по настоящему изобретению может быть приготовлен в соответствии с обычным способом и использован в качестве лекарственного средства для определения клинической стадии заболевания (в частности, для диагностики злокачественного новообразования). Лекарственное средство для определения клинической стадии заболевания означает диагностическое лекарственное средство, способное исследовать степень прогрессирования заболевания. Например, для злокачественного новообразования это означает диагностическое лекарственное средство, способное исследовать его клиническую стадию. Злокачественное новообразование, которое может быть диагностировано композицией для диагностики по настоящему изобретению, выбрано из группы, состоящей из колоректального рака, рака молочной железы, рака легкого, рака щитовидной железы и рака, возникающего в результате метастазирования этих злокачественных новообразований. Злокачественное новообразование предпочтительно представляет собой колоректальный рак или рак, возникающий в результате метастазирования колоректального рака. Злокачественное новообразование, более предпочтительно, представляет собой рак, возникающий в результате метастазирования колоректального рака. Такое злокачественное новообразование включает метастазы в печени.
[0114] Количество детектируемого конъюгата по настоящему изобретению, добавляемого для приготовления композиции для диагностики по настоящему изобретению, различается в зависимости от степени симптомов или возраста пациента, используемой лекарственной формы или титра связывания Fab-фрагмент и т. д., например, приблизительно от 0,001 до 100 мг/кг в расчете на массу Fab-фрагмента можно использовать на единицу массы тела пациента.
[0115] Примеры лекарственной формы композиции для диагностики по настоящему изобретению могут включать парентеральные агенты, такие как инъекции, и агенты для капельной инфузии. Введение предпочтительно выполняется путем внутривенной инъекции, локальной внутримышечной инъекции в мишень, подкожной инъекции или тому подобного. Для приготовления можно использовать носитель или добавку, подходящую для этих лекарственных форм, в фармацевтически приемлемом диапазоне. Тип фармацевтически приемлемого носителя или добавки конкретно ничем не ограничен, и можно использовать носитель или добавку, хорошо известные специалистам в данной области.
[0116] Настоящее изобретение также относится к применению детектируемого конъюгата по настоящему изобретению для производства композиции для диагностики злокачественного новообразования или композиции для определенной стадии в определенной форме. Настоящее изобретение также относится к детектируемому конъюгату по настоящему изобретению для применения при диагностике злокачественного новообразования или для применения при определенной стадии в определенной форме.
[0117] Кроме того, настоящее изобретение также относится к способу диагностики злокачественного новообразования, включающему предоперационное или интраоперационное введение детектируемого конъюгата по настоящему изобретению пациенту. В этом контексте «пациент» - это человек или любое другое млекопитающее, нуждающееся в постановке диагноза. Определенная форма представляет собой человека, нуждающегося в постановке диагноза. Эффективное количество детектируемого конъюгата по настоящему изобретению в способе диагностики по настоящему изобретению может быть таким же, как эффективное количество детектируемого конъюгата по настоящему изобретению для композиции, описанной выше. В способе диагностики по настоящему изобретению детектируемый конъюгат по настоящему изобретению предпочтительно вводят путем внутривенной инъекции или тому подобного. Конъюгат по настоящему изобретению для использования в качестве ПЭТ-индикатора можно фотографировать с помощью ПЭТ через 1,5-48 часов, через 2-48 часов в определенной форме, через 4-24 часа в определенной форме, через 4-6 часов в определенной форме или через 1,5-6 часов в определенной форме после введения. В способе диагностики по настоящему изобретению в случае использования флуоресцентно-меченного конъюгата по настоящему изобретению при интраоперационной диагностике конъюгат вводят пациенту, например, за 2-48 часов, предпочтительно за 4 часа до операции.
[0118] В альтернативном варианте осуществления настоящее изобретение также относится к применению Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению для получения конъюгата по настоящему изобретению. В определенном варианте осуществления настоящее изобретение также относится к применению Fab-фрагмента антитела против CEACAM5 человека по настоящему изобретению для получения композиции для диагностики, содержащей конъюгат по настоящему изобретению.
[0119] Настоящее изобретение в целом описано выше. Конкретные примеры будут предоставлены в настоящем описании для справки, чтобы получить дополнительное понимание. Однако они приведены в иллюстративных целях и не ограничивают настоящее изобретение.
ПРИМЕРЫ
[0120] (Пример 1: Получение Fab-фрагмента антитела против CEACAM5 человека)
Антитело, имеющее вариабельные области, которые, как ожидается, не будут ослаблять аффинность, даже при связывании меченого фрагмента, было сконструировано с использованием молекулярной модели гуманизированного антитела, сконструированного в соответствии с публикацией (Proteins: Structure, Function, and Bioinformatics; 2014; 82: 1624-1635) после гуманизации мышиного антитела против CEACAM5 человека, T84.66, со ссылкой на метод, описанный в публикации (Protein Eng. Des. Sel.; 2004; 17: 481-489).
[0121] Ген, кодирующий сигнальную последовательность (Protein Engineering; 1987; 1: 499-505), и ген Fab-области Igγ1 человека (состоящий из нуклеотидной последовательности, соответствующей положениям нуклеотидов 364-678 SEQ ID NO: 1) были связаны с 5'-областью и 3'-областью, соответственно, гена вариабельной области тяжелой цепи антитела, и этот ген фрагмента тяжелой цепи был вставлен в вектор GS pEE6.4 (Lonza Group AG). Кроме того, ген, кодирующий сигнальную последовательность и ген константной области Igκ человека (состоящий из нуклеотидной последовательности, соответствующей положениям нуклеотидов 337- 657 SEQ ID NO: 3), были связаны с 5'-областью и 3'-областью, соответственно, гена вариабельной области легкой цепи антитела, и этот ген легкой цепи был вставлен в GS-вектор pEE12.4 (Lonza Group AG). Вышеупомянутые векторы pEE, соответственно, содержащие вставки фрагмента тяжелой цепи и гена легкой цепи антитела, расщепляли рестриктазами NotI и PvuI и лигировали с использованием набора для лигирования TAKARA Ligation Kit Ver 2.1 (Takara Bio Inc.) для конструирования вектора GS, содержащего обе вставки гена фрагмента тяжелой цепи и гена легкой цепи.
[0122] Антитело экспрессировали двумя типами способов, с помощью транзиторной экспрессии и конститутивной экспрессии, используя вышеупомянутый GS-вектор, содержащий обе вставки гена фрагмента тяжелой цепи и гена легкой цепи. Для транзиторной экспрессии клетки Expi293F (Thermo Fisher Scientific Inc.), культивированные до приблизительно 3000000 клеток/мл в среде экспрессии Expi293 (Thermo Fisher ScientificInc.), трансфецировали вышеупомянутым вектором GS, содержащим обе вставки гена фрагмента тяжелой цепи и гена легкой цепи с использованием набора для трансфекции ExpiFectamine 293 (Thermo Fisher Scientific Inc.) и культивировали в течение 5-7 дней. Культуральный супернатант очищали с использованием KappaSelect (GE Healthcare Japan Corp.) для получения Fab-фрагмента. Для конститутивной экспрессии клетки CHOK1SV (Lonza Group AG) трансфецировали линейным вектором, полученным с использованием PvuI из вышеупомянутого GS-вектора, содержащего обе вставки гена фрагмента тяжелой цепи и гена легкой цепи, путем электропорации с использованием Gene Pulser (Bio-Rad Laboratories Inc.). На следующий день после трансфекции добавляли метионинсульфоксимин с последующим культивированием в течение 5-7 дней. Клетки инокулировали в полутвердую среду, содержащую метилцеллюлозу. После образования колонии клетки, имеющие высокий уровень экспрессии Fab-фрагмента, получали с использованием ClonePix FL (Molecular Devices, LLC). Культуральный супернатант клеток очищали с использованием Capto L (GE Healthcare Japan Corp.), Q Sepharose Fast Flow (GE Healthcare Japan Corp.) и BioPro S75 (YMC Co., Ltd.) для получения Fab-фрагмента.
[0123] Нуклеотидная последовательность, кодирующая фрагмент тяжелой цепи приготовленного Fab-фрагмента антитела против CEACAM5 человека (обозначенный как PB009-01), представлена в SEQ ID NO: 1, а кодированная аминокислотная последовательность представлена в SEQ ID NO: 2. Нуклеотидная последовательность, кодирующая легкую цепь PB009-01, представлена в SEQ ID NO: 3, а аминокислотная последовательность, кодированная таким образом, представлена в SEQ ID NO: 4. Вариабельная область тяжелой цепи PB009-01 состоит из аминокислотной последовательности, соответствующей положениям аминокислот 1-121 SEQ ID NO: 2, а CDR1, CDR2 и CDR3 тяжелой цепи состоят из аминокислотных последовательностей, соответствующих положениям аминокислот 31-35, 50-66 и 99-110, соответственно, SEQ ID NO: 2. Вариабельная область легкой цепи PB009-01 состоит из аминокислотной последовательности, соответствующей положениям аминокислот 1-112 SEQ ID NO: 4, а CDR1, CDR2 и CDR3 легкой цепи состоят из аминокислотных последовательностей, соответствующей положениям аминокислот 24-38, 54-60 и 93-101, соответственно, SEQ ID NO: 4.
[0124] Вариабельные области и последовательности CDR определяли в соответствии с нумерацией Kabat (Kabat et al., 1991, Sequences of Proteins of Immunological Interest, 5th Ed., United States Public Health Service, National Institute of Health, Bethesda).
[0125] (Пример 2: Получение конъюгата Fab-фрагмента)
p-SCN-Bn-DFO (DFO, замещенный п-изотиоцианофениламинотиокарбонильной группой) (Macrocyclics, Inc.) использовали для связывания хелатирующего агента DFO с Fab-фрагментом PB009-01. 1/5 количества 0,1 М раствора карбоната натрия (рН 9,0) добавляли к раствору Fab-фрагмента, доведенному до 1 мг/мл с помощью фосфатно-буферного солевого раствора (рН 7,4). Туда добавляли p-SCN-Bn-DFO в конечной концентрации 1 мг/мл и проводили реакцию при 37 °С в течение 1,5 часов. После реакции Fab-фрагмент, связанный с DFO через линкер (-C(=S)-NH-(1,4-фенилен)-NH-C(=S)-) (обозначенный как PB009-02), очищали с использованием Amicon Ultra 3K-0,5 мл центрифужного фильтра (Merck Millipore).
[0126] Количество лигандов, образованных DFO, связанным с PB009-02, было подтверждено масс-спектрометрией. PB009-02 обессоливали, используя колонку микрообессоливания MassPREP (Waters Corp.), и измерения проводили с использованием масс-спектрометра SYNAPT G2 (Waters Corp.). В результате была подтверждена молекула, в которой по меньшей мере от 3 до 10 лигандов, образованных DFO, были связаны с одним PB009-01.
[0127] (Пример 3: Оценка активности связывания)
Для того чтобы измерить детальную активность связывания PB009-02, анализ проводили с помощью SPR. В этом примере Fab-фрагмент M5A (обозначаемый как M5A-Fab), гуманизированного антитела T84.66, использовали в качестве сравнительного Fab-фрагмента. M5A-Fab, связанный с DFO через линкер (называемый M5A-Fab-DFO), получали с использованием способа, описанного в Примере 2.
[0128] Анализ методом SPR проводился с использованием Biacore T200 (GE Healthcare Japan Corp.). 10 мкг/мл человеческого CEACAM5 (R & D Systems, Inc.), биотинилированного с помощью набора Biotin CAPture, серии S (GE Healthcare Japan Corp.) и набора-NH2 для мечения биотином (Dojindo Laboratories), добавляли к поверхности сенсорного чипа со скоростю потока 5 мкл/мин в течение 2 минут и иммобилизовали на нем. PB009-01, PB009-02, M5A-Fab и M5A-Fab-DFO разбавляли раствором HBS-EP+ (GE Healthcare Japan Corp.) последовательно 6 раз в 2-кратном соотношении от 400 нМ и добавляли по 100 мкл каждого в канал при скорости потока 50 мкл/мин. В этой системе измерения константа диссоциации (KD) PB009-01, PB009-02, M5A-Fab или M5A-Fab-DFO для CEACAM5 человека была рассчитана с использованием программного обеспечения для анализа данных (BIA Evaluation, GE Healthcare Japan Corp.). В результате, как показано в таблице, приведенной ниже, активность связывания M5A-Fab была ослаблена связыванием DFO, тогда как активность связывания PB009-01 не ослаблялась связыванием DFO.
[0129]
[Таблица 1]
[0130] (Пример 4: Мечение89Zr конъюгата Fab-фрагмента, связанного с DFO)
89Zr был приобретен как Zr-оксалат у 3D Imaging LLC. 20 мкл Zr-оксалата (2,6 мКи) нейтрализовали 10 мкл 2 М карбоната натрия. Затем к нему добавляли 20 мкл 5 мг/мл гентизиновой кислоты. Кроме того, туда добавляли 110 мкл 20 мМ HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислоты), содержащей 0,05% полисорбата 80. К нему добавляли 40 мкл 10 мг/мл PB009-02 и оставляли реакцию при комнатной температуре в течение 30 минут, а затем дополнительно подвергали реакции при 37°C в течение 30 минут. После реакции PB009-02, меченный89Zr (обозначенный как PB009-03), очищали с использованием центрифужного фильтра Amicon Ultra 10K-0,5 мл (Merck Millipore).
[0131] (Пример 5: Контрастная оценка конъюгата в модели подкожного ксенотрансплантата)
1х106 клеток клеточной линии колоректального рака человека LS174T (ATCC®; CL-188) были подкожно ксенотрансплантированы в виде клеток, положительных по CEACAM5 человека, в правое плечо иммунодефицитной мыши (мышь NOG; Taconic Biosciences), и 5х106 клеток клеточной линии колоректального рака человека HCT-15 (ATCC®; CCL-225) подкожно ксенотрансплантировали как клетки, отрицательные по CEACAM5 человека, в левое плечо. Этот пример был выполнен при N=3. После того, как объем опухоли достигал приблизительно 300 мм3, внутривенно вводили PB009-03 (приблизительно 20 мкг, приблизительно 120 мкКи). Фотографии были сделаны с помощью ПЭТ через 4 часа, 24 часа и 48 часов после введения PB009-03, и был измерен SUV-Max участка опухоли. В результате, как показано на Фиг.1А, было показано, что PB009-03 накапливается в клетках LS174T (клетки, положительные по CEACAM5 человека) больше, чем в клетках HCT-15 (клетки, отрицательные по CEACAM5 человека) через 4 часа после введения. Как показано на Фиг. 1B, было обнаружено, что PB009-03 позволяет детектировать опухолевые клетки, положительные по CEACAM5 человека, через 4 часа и 48 часов после введения.
[0132] (Пример 6: Контрастная оценка конъюгата в модели трансплантации в печень)
1х106 клеток LS174T, экспрессирующих люциферазу, трансплантировали в печень иммунодефицитной мыши (мышь NSG; The Jackson Laboratory) под наркозом. Этот пример был выполнен при N=6. Приживление клеток в печени было подтверждено экспрессией люциферазы в качестве показателя с использованием системы визуализации IVIS (PerkinElmer, Inc.). Затем PB009-03 (приблизительно 14 мкг, приблизительно 100 мкКи), приготовленный таким же образом, как в Примере 4, вводили туда внутривенно. Фотографии были сделаны PET через 4 часа и 24 часа после введения PB009-03. SUV-Max печени и опухоли LS174T (которая относится к состоянию, когда трансплантированные клетки LS174T были трансплантированы в печень) измеряли для расчета отношения SUV-Max опухоли к SUV-Max печени. В результате, как показано на Фиг.2А, показано, что PB009-03 накапливается в опухоли LS174T, трансплантированной в печень, через 4 часа после введения. Соотношения сигнала опухоль-печень через 4 часа и 24 часа после введения соответствовали значениям, представленным на Фиг. 2B. На их основе было обнаружено, что PB009-03 позволяет детектировать опухолевые клетки, положительные по CEACAM5 человека, присутствующие в печени через 4 часа и 24 часа после введения.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
[0133] Ожидается, что Fab-фрагмент антитела против CEACAM5 человека по настоящему изобретению и конъюгат, содержащий Fab-фрагмент антитела против CEACAM5 человека, будут полезны для диагностики злокачественного новообразования, выбранного из группы, состоящей из колоректального рака, рака молочной железы, рака легкого, рака щитовидной железы и рака, возникающего в результате метастазирования этих злокачественных новообразований.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ В СВОБОДНОЙ ФОРМЕ
[0134] Числовой субтитр <223> в приведенном ниже списке последовательностей будет описывать «Искусственную последовательность». В частности, нуклеотидные последовательности, представленные SEQ ID NO: 1 и 3 в списке последовательностей, представляют собой нуклеотидные последовательности фрагмента тяжелой цепи и легкой цепи, соответственно, PB009-01. Аминокислотные последовательности, представленные SEQ ID NO: 2 и 4, представляют собой аминокислотные последовательности фрагмента тяжелой цепи и легкой цепи, кодируемые SEQ ID NO: 1 и 3, соответственно.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Астеллас Фарма Инк.
<120> НОВЫЙ FAB-ФРАГМЕНТ АНТИТЕЛА ПРОТИВ CEACAM5 ЧЕЛОВЕКА
<130> A18007A00
<150> JP 2017-133698
<151> 2017-07-07
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 678
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК, кодирующая тяжелую цепь Fab PB009-01
<220>
<221> Кодирующая последовательность
<222> (1)..(678)
<400> 1
gaa gtg cag ctg gtg gaa tct ggc ggc gga ctg gtg cag cct ggc gga 48
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
tct ctg aga ctg agc tgt gcc gcc agc ggc ttc aac atc cgg gac acc 96
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Arg Asp Thr
20 25 30
tac atg cac tgg gtg cgc cag gcc cct ggc aag gga ctg gaa tgg gtg 144
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
gcc aga atc gac ccc gcc aac ggc aac agc aga tac gtg ccc aag ttc 192
Ala Arg Ile Asp Pro Ala Asn Gly Asn Ser Arg Tyr Val Pro Lys Phe
50 55 60
cag ggc cgg ttc acc atc agc gcc gac acc agc aga aac acc gcc tac 240
Gln Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Arg Asn Thr Ala Tyr
65 70 75 80
ctg cag atg aac agc ctg cgg gcc gag gac acc gcc gtg tac tac tgt 288
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
gcc ccc ttc ggc tac tac gtg tcc gac tac gcc atg gcc tat tgg ggc 336
Ala Pro Phe Gly Tyr Tyr Val Ser Asp Tyr Ala Met Ala Tyr Trp Gly
100 105 110
cag ggc acc ctc gtg aca gtg tcc tca gcc tcc acc aag ggc cca tcg 384
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
gtc ttc ccc ctg gca ccc tcc tcc aag agc acc tct ggg ggc aca gcg 432
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
gcc ctg ggc tgc ctg gtc aag gac tac ttc ccc gaa ccg gtg acg gtg 480
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
tcg tgg aac tca ggc gcc ctg acc agc ggc gtg cac acc ttc ccg gct 528
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
gtc cta cag tcc tca gga ctc tac tcc ctt agt agc gtg gtg acc gtg 576
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
ccc tcc agc agc ttg ggc acc cag acc tac atc tgc aac gtg aat cac 624
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
aag ccc agc aac acc aag gtg gac aag aaa gtt gag ccc aaa tct tgt 672
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
gac tga 678
Asp
225
<210> 2
<211> 225
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 2
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Arg Asp Thr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Asp Pro Ala Asn Gly Asn Ser Arg Tyr Val Pro Lys Phe
50 55 60
Gln Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Arg Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Pro Phe Gly Tyr Tyr Val Ser Asp Tyr Ala Met Ala Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp
225
<210> 3
<211> 657
<212> DNA
<213> Искусственная последовательность
<220>
<223> ДНК, кодирующая легкую цепь антитела
<220>
<221> Кодирующая последовательность
<222> (1)..(657)
<400> 3
gac atc cag ctg acc cag agc cct agc agc ctg tct gcc agc gtg ggc 48
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
gac aga gtg acc atc acc tgt aga gcc ggc gag agc gtg gac atc ttc 96
Asp Arg Val Thr Ile Thr Cys Arg Ala Gly Glu Ser Val Asp Ile Phe
20 25 30
ggc gtg gga ttt ctg cac tgg tat cag cag aag ccc ggc aag gcc ccc 144
Gly Val Gly Phe Leu His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
aag ctg ctg atc tac aga gcc agc aac ctg gaa agc ggc atc ccc agc 192
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Ile Pro Ser
50 55 60
aga ttc agc ggc agc ggc tcc aga acc gac ttc acc ctg acc atc agc 240
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
agc ctg cag ccc gag gac ttc gcc acc tac tac tgc cag cag acc aac 288
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Asn
85 90 95
gag gac ccc tac acc ttt ggc cag ggc acc aag gtg gaa atc aag cgt 336
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
acg gtg gct gca cca tct gtc ttc atc ttc ccg cca tct gat gag cag 384
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
ttg aaa tct gga act gcc tct gtt gtg tgc ctg ctg aat aac ttc tat 432
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
ccc aga gag gcc aaa gta cag tgg aag gtg gat aac gcc ctc caa tcg 480
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
ggt aac tcc cag gag agt gtc aca gag cag gac agc aag gac agc acc 528
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
tac agc ctg agc agc acc ctg acg ctg agc aaa gca gac tac gag aaa 576
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
cac aaa gtc tac gcc tgc gaa gtc acc cat cag ggc ctg agc tcg ccc 624
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
gtc aca aag agc ttc aac agg gga gag tgt tag 657
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 4
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 4
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Gly Glu Ser Val Asp Ile Phe
20 25 30
Gly Val Gly Phe Leu His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Ile Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<---
Реферат
Изобретение относится к области биотехнологии. Предложен Fab-фрагмент антитела против CEACAM5 человека. Также предложены конъюгат, включающий указанный Fab-фрагмент, композиция и способ диагностики рака с использованием конъюгата, в частности, для диагностики колоректального рака, рака молочной железы, рака легкого, рака щитовидной железы или рака, возникающего в результате метастазирования этих злокачественных новообразований. Кроме того, предложены полинуклеотиды, векторы экспрессии и клетки-хозяева для получения Fab-фрагментов и конъюгатов по изобретению. Изобретение обеспечивает связывание Fab-фрагмента с детектируемым веществом при отсутствии ослабления связывающей активности против CEACAM5 человека, а также накопление конъюгата, включающего Fab-фрагмент, в участке поражения опухоли в течение короткого времени после введения. 16 н. и 20 з.п. ф-лы, 4 ил., 1 табл., 6 пр.
Формула
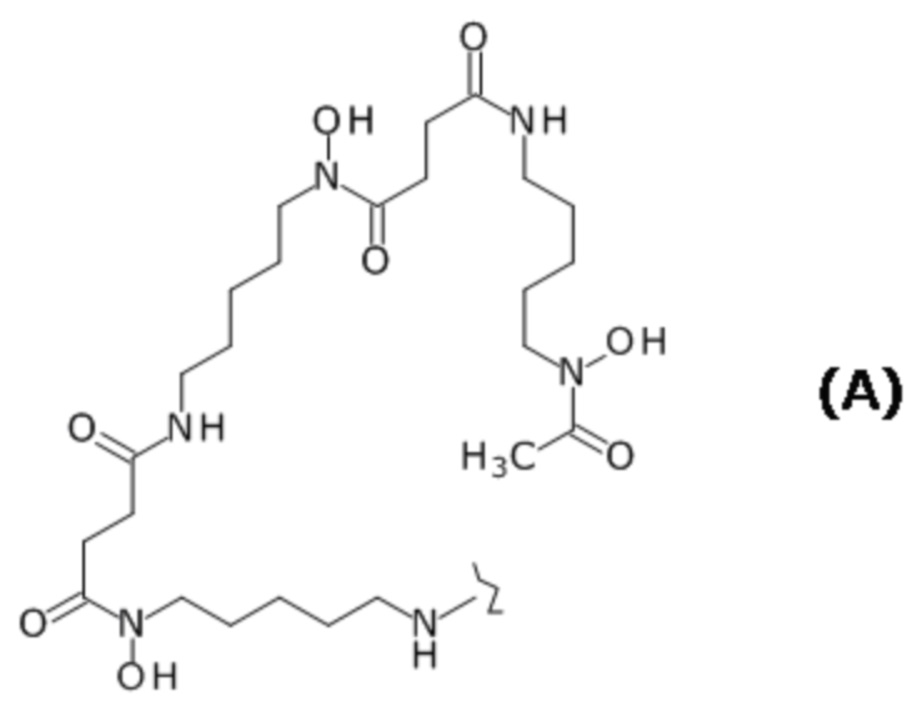



Документы, цитированные в отчёте о поиске
Фрагменты антитела, специфичные в отношении человеческого раково-эмбрионального антигена (cea)

Комментарии