Фрагменты антитела, специфичные в отношении человеческого раково-эмбрионального антигена (cea) - RU2294939C2
Код документа: RU2294939C2
Чертежи



Описание
Область, к которой относится изобретение
Настоящее изобретение относится к области иммунологии, а в частности к фрагментам одноцепочечного антитела типа Fv, к его моновалентным и двухвалентным (ди-антитело) формам, полученным методами рекомбинантных ДНК из мышиного моноклонального антитела с подтвержденной клинической эффективностью, которое является специфичным в отношении человеческого раково-эмбрионального антигена.
Предшествующий уровень техники
Раково-эмбриональный антиген (СЕА) представляет собой гликопротеин размером 180 кДа, секретируемый преимущественно клетками опухолей желудочно-кишечного тракта человека и клетками других карцином, но он может также обнаруживаться и в некоторых незлокачественных тканях, таких как слизистая толстой кишки. Физиологическая роль этого антигена полностью не выяснена, и до настоящего времени считалось, что этот антиген в определенной степени ассоциирован с процессами клеточной адгезии (Gold P., Freedman S.O. Journal of Experimental Medicine 122: 467; 1965; Zimmermann W. et al. PNAS USA 84: 2960-2964; 1987; Paxton R.J. et al., PNAS USA 84:920-924, 1987; Beauchemin N. et al. Molec. Cellular Biol. 7:3221-3230, 1987; Gold P., Goldenberg N.A. MJM 3:46-66, 1997).
CEA является членом суперсемейства иммуноглобулинов, что обусловлено его структурой, характеризующейся наличием повторяющихся доменов (Oikawa S. et al., BBRC 144:634-642, 1987; Thompson J., Zimmermann W. Tumor Biology 9:63-83, 1988; Hammarstrom S. Seminars in Cancer Biology 67-81, 1999). СЕА имеет высокую степень гомологии с другими молекулами этого суперсемейства, такими как NCA, мекониевый антиген, билиарный гликопротеин типа А и гликопротеин b, ассоциированный с беременностью (von Kleist S. Burtin P. Immunodiagnosis of Cancer. Marcel Dekker. 322-341, 1979; Buchegger F. et al. Int. J. Cancer 33, 643-649, 1984; Matsuoka Y. et al. Cancer Res. 42:2012-2018, 1982; Svenberg T. Int. J. Cancer 17:588-596, 1976).
Поскольку уже многие годы считается, что увеличение уровней СЕА в кровотоке является одним из наилучших показателей возможных рецидивов и/или метастазов, то пациентов с первичными опухолями толстой и прямой кишки, экспрессирующими этот антиген, направляли на хирургическую операцию (Gold P., Goldenberg N.A. MJM 3:46-66, 1997). Измерение уровней СЕА в кровотоке также получило распространение в качестве метода наблюдения за развитием карцином у человека (молочной железы, легких) в случаях, когда перед операцией были выявлены значительные уровни этого опухолевого маркера (Gold P., Goldenberg N.A. MJM 3:46-66, 1997).
Со времени разработки метода продуцирования моноклональных антител (Mab; Kohler G, Milstein C. Nature 256:52-53, 1975) специфичность иммуноанализов для измерения уровней СЕА в кровотоке заметно повысилась и использование этих анализов получило широкое распространение.
В течение уже многих лет проводятся исследования СЕА как возможной "клеточной мишени" для специфического нацеливания на нее радиоактивных изотопов в целях in vivo - диагностики (Goldenberg D.M. Int. J. of Biol. Markers 7, 183-188, 1992) и проведения in situ лучевой терапии (Ledermann et al., Int. J. Cancer 47:659-664, 1991). Было высказано предположение, что этот антиген может быть также использован для нацеливания токсинов, лекарственных средств и других биоактивных продуктов на опухолевые клетки (Bagshawe K.D. Drug Dev. Res. 34:220-230, 1995).
Анти-СЕА-антитела являются главными носителями, используемыми в этих целях, начиная с поликлональных препаратов и кончая полученными позже мышиными Mab, их Fab-фрагментами, фрагментами антител, продуцированными из мышиного Mab методами генной инженерии и совсем недавно полученными из библиотек мышиных и человеческих антител, представленных в нитчатом фаге (Hammarstrom S. et al., Cancer Res. 49, 4852-4858, 1989; Hudson P.J. Curr. Opinion Immunology 11:548-557, 1999; Griffiths A.D. et al., EMBO J. 12, 1993; 725-734; Griffiths A.D. et al., EMBO J. 13, 3245-3260, 1994; WO 93/11236; Chester K. et al., 1995, WO 95/15341; Allen D.J. et al. 1996, US5872215).
Способы экспрессии антител и фрагментов антител в прокариотических клетках, таких как E.coli, и в других микроорганизмах хорошо известны специалистам (Pluckthun A. Bio/Technology 9:545-551, 1991; Gavilondo J, Larrick J.W. Biotechniques 29:128-132, 134-136, 2000). Способы экспрессии антител и фрагментов антител в высших эукариотических клетках в культуре также известны специалистам (Reff M.E. Curr Opinion Biotech. 4:573-576, 1993; Trill J.J. et al., Curr. Opinion Biotech 6:553-560, 1995).
Мышиное Mab, имеющее общее название СВ-СЕА.1 или ior-CEA.1 (и далее обозначаемое СВ/ior-CEA.1), известно специалистам. Это Mab обладает высокой специфичностью в отношении человеческого СЕА, но при этом оно не вызывает нежелательных перекрестных реакций с такими молекулами, как NCA, и не распознает нормальные ткани, за исключением клеток эпителия нормальной толстой кишки, где СЕА может в основном наблюдаться в поляризованной форме (Tormo B. et al., APMIS 97:1073-1080, 1989). Это Mab обладает очень высокой аффинностью к СЕА (Perez L. et al., Applied Biochem. Biotechnol. 24:79-82, 1996). Такое Mab, меченное99mTc, было с успехом использовано для диагностики опухолей толстой и прямой кишки у человека и для наблюдения за этими опухолями. Клинические исследования по радиоиммунодетекции показали, что указанное антитело обладает 91,3%-ной чувствительностью, 77,1%-ной специфичностью и 82,8%-м положительным прогностическим значением (Oliva J.P. et al., Rev. Esp. Med. Nucl. 13:4-10, 1994). Отсюда очевидно, что его эффективность превосходит лишь эффективность другого моноклонального анти-СЕА-антитела, используемого в аналогичных целях в современных клиниках всего мира, а именно антитела СЕА-Scan (99mTc-Arcitumomab) от Immunomedics (Morris Plains, NJ, USA).
В 1992 году (Ayala M. et al., Biotechniques 13:790-799, 1992) сообщалось о получении одноцепочечного Fv-фрагмента антитела (scFv), генерированного посредством полимеразной цепной реакции (ПЦР) из РНК, экстрагированной из гибридомы, продуцирующей указанное Mab CB/ior-CEA.1. В соответствии с экспериментальной стратегией, амплификация вариабельных доменов CB/ior-CEA.1 была осуществлена с использованием вырожденных олигонуклеотидов для каркасных областей обоих вариабельных доменов. scFv был продуцирован в E.coli и распознавал СЕА в анализе ELISA и в цитохимических исследованиях, но при этом его аффинность по отношению к иммобилизованному антигену была в 200 раз ниже аффинности Fab, продуцируемого естественным образом (Perez L. et al. Applied Biochem. Biotechnol. 24:79-82, 1996). Этот scFv-фрагмент был клонирован, экспрессирован и продуцирован в Pichia pastoris (Freyre F.M. et al., J. Biotechnol. 76(2-3):157-163, 2000), но при этом он не обладал какой-либо повышенной аффинностью по отношению к человеческому СЕА, а исследования, проводимые на экспериментальных животных с использованием радиоактивно меченного фрагмента, указывали на аномальное биораспределение этого фрагмента (Pimentel G.J. et al. Nucl. Med. Commun. 22:1089-94, 2001), что явилось причиной прекращения его дальнейшего исследования.
Сущность изобретения
Настоящее изобретение относится к одноцепочечным Fv-фрагментам (scFv) антитела, к его моновалентным и двухвалентным (ди-антитело) формам, полученным методами рекомбинантных ДНК из мышиного моноклонального антитела против раково-эмбрионального антигена (СЕА) CB/ior-CEA.1 (Tormo B. et al., APMIS 97:1073-1080, 1989). Это Mab обладает очень высокой аффинностью в отношении СЕА (Perez L. et al., Applied Biochem. Biotechnol. 24:79-82, 1996), и оно было с успехом использовано для диагностики опухолей толстой и прямой кишки у человека и для наблюдения за этими опухолями (Oliva J.P. et al., Rev. Esp. Med. Nucl. 13:4-10, 1994). Фрагменты scFv моновалентного антитела и ди-антитела, описанные в настоящем изобретении, могут быть продуцированы посредством их экспрессии в рекомбинантных микроорганизмах, таких как бактерии и дрожжи. Как и исходное Mab, моновалентные и двухвалентные фрагменты (ди-антитело) scFv являются специфичными в отношении эпитопа человеческого СЕА, в зависимости от степени сохранения углеводов и от степени аффинности к этому антигену. По своей способности к распознаванию in vitro нормальных и опухолевых клеток и тканей человека фрагменты scFv моновалентного антитела и ди-антитела аналогичны исходному Mab, и, также как и Mab, после их радиоактивного мечения они обладают способностью идентифицировать опухолевые клетки, которые экспрессируют повышенные уровни человеческого СЕА у бестимусных мышей с врожденной мутацией по гену "nude". Фрагменты scFv моновалентного антитела и ди-антитела не имеют Fc-доменов и имеют меньший размер молекулы, чем мышиное Mab, что дает им возможность лучше проникать в ткани in vivo и оказывать меньшее иммуногенное действие при введении человеку в диагностических или терапевтических целях.
По сравнению с другими scFv, полученными ранее из того же самого Mab, фрагменты scFv моновалентного антитела и ди-антитела, описанные в настоящем изобретении, имеют важные отличия в аминокислотном составе вариабельных доменов тяжелой цепи (VH) и легкой цепи (VL) и обладают более высокой аффинностью к СЕА, лучшей способностью распознавать клетки и ткани и более высокой эффективностью в определении локализации опухолей, которые продуцируют повышенные уровни человеческого СЕА у мышей in vivo.
Рекомбинантные моновалентные и двухвалентные фрагменты (ди-антитело) scFv, описанные в настоящем изобретении, были получены посредством ПЦР и методами клонирования и экспрессии в рекомбинантных микроорганизмах исходя из РНК, экстрагированной из гибридомы CB/ior-CEA.1. Для амплификации и выделения нуклеотидных последовательностей, кодирующих домены VH и VL Mab, были использованы наборы олигонуклеотидов, отличающихся от тех олигонуклеотидов, которые были использованы для получения уже известных scFv (Ayala M. et al., Biotechniques 13:790-799, 1992). В настоящем изобретении показано, что, по сравнению с уже полученным ранее scFv, новые фрагменты scFv моновалентного антитела и ди-антитела имеют важные отличия в аминокислотных последовательностях доменов VH и VL и что, в отличие от уже известных scFv, они состоят из 16 аминокислот в каркасных участках 1 (FR1) и 3 (FR3) и в гипервариабельной области 2 (CDR2) домена VH и содержат 3 аминокислоты между FR1 и FR3 доменов VL, в отличие от уже полученного ранее scFv. Это указывает на то, что такие домены имеют другое клональное происхождение по сравнению с доменами, описанными Ayala et al. (Biotechniques 13:790-799, 1992). В случае ди-антитела этот домен также отличается от уже полученного ранее scFv по размеру и по аминокислотному составу связующего сегмента (линкера), который используется для конструирования молекулы типа scFv.
Эти отличия неожиданно отразились на биохимических и биологических свойствах новых фрагментов и сообщали им поведение, очень схожее с поведением Mab CB/ior-CEA.1, но при этом свойства этих новых фрагментов были значительно лучше, чем свойства уже известного scFv. Новый моновалентный фрагмент scFv, имеющий линкер, идентичный линкеру уже известного scFv (Ayala M. et al., Biotechniques 13:790-799, 1992), но при этом имеющий вышеупомянутые изменения аминокислотного состава в вариабельных доменах, обладает гораздо более высокой константой аффинности по отношению к человеческому СЕА, чем уже известный scFv. Кроме того, по своей константе аффинности по отношению к человеческому СЕА ди-антитело превосходит моновалентные формы scFv. Два новых моновалентных и двухвалентных фрагмента scFv сохраняют свойства исходного Mab, такие как специфичность в отношении распознавания СЕА, идентификация опухолевых клеток и тканей, отсутствие перекрестной реактивности с NCA и способность к селективной аккумуляции в опухоли, которая продуцирует человеческий СЕА при ее трансплантации мышам, и при этом все указанные фрагменты обладают значительно более высокой эффективностью, чем уже известный scFv.
Указанные два новых моновалентных и двухвалентных фрагмента scFv имеют размер молекулы, по меньшей мере в 5 и 2,5 раз меньше, чем исходное Mab, соответственно, поэтому они лучше проникают в ткани и оказывают меньшее иммуногенное действие на организм человека, что делает их все более привлекательными и, предположительно, более эффективными, чем исходное Mab CB/ior-CEA.1, для нацеливания радиоизотопов, лекарственных средств, токсинов и других биологически активных элементов на опухоли, экспрессирующие человеческий СЕА.
В настоящем изобретении показан возможный способ ПЦР-амплификации доменов VH и VL Mab CB/ior-CEA.1 с использованием синтетических олигонуклеотидов, которые гибридизуются с нуклеотидными последовательностями, кодирующими сигнальные пептиды и константные домены СН1 и Ск. Были также продемонстрированы возможность сборки амплифицированных доменов VH и VL в указанном порядке с помощью ПЦР и получение различных форм фрагментов scFv с изменением размеров линкера, соединяющего эти домены. Ди-антитело типа scFv получали с использованием 14 аминокислот исходной моновалентной формы scFv, где это число аминокислот снижали до пяти.
В настоящем изобретении было продемонстрировано, что экспрессия моновалентных и двухвалентных фрагментов scFv может быть осуществлена в бактериях E.coli и в дрожжах Pichia pastoris и что эти фрагменты in vitro распознают человеческий СЕА, специфически связанный или не связанный с опухолевыми клетками. В настоящем изобретении было также продемонстрировано, что радиоактивно меченный моновалентный и двухвалентный scFv позволяет идентифицировать опухолевые клетки in vivo, которые экспрессируют человеческий СЕА и которые образуют опухоли у мышей; причем поведение указанных scFv в высокой степени аналогично поведению Mab CB/ior-CEA.1, а их свойства значительно превосходят свойства полученного ранее scFv. В настоящем изобретении также описаны способы очистки и свойства новых моновалентных и двухвалентных фрагментов scFv.
Фрагменты антител, описанные в настоящем изобретении, могут быть использованы для диагностики и лечения рака, при этом их преимущества заключаются в том, что они происходят от Mab с подтвержденной клинической эффективностью, имеют меньший размер и не содержат домена Fc, что способствует их лучшему проникновению в ткани, и благодаря своей низкой способности к индукции ответа с выработкой человеческих антител против мышиных иммуноглобулинов они могут быть использованы в повторных курсах лечения (HAMA; Schroff et al., Cancer Res. 45:879-885, 1985; DeJager et al. Proc. Am. Assoc. Cancer Res. 29:377, 1988). НАМА-ответы являются нежелательными для лечения из-за нейтрализации биологического эффекта вводимого антитела, что приводит к необходимости снижать дозу, а также из-за возможности продуцирования аллергических реакций, возникновения "сывороточной" болезни и поражения почек.
Терминология
Антитела и их специфические фрагменты
Эти термины описывают иммуноглобулин и его части, обладающие антигенной специфичностью и встречающиеся в природе или продуцируемые, полностью или частично, синтетическими способами. Эти термины также охватывают любой полипептид или белок, имеющий связывающий домен, который может представлять собой сайт связывания антитела или его гомолога. Эти полипептиды или белки могут быть продуцированы естественным образом, либо они могут быть частично или полностью синтезированы. Примерами антител являются иммуноглобулины различных классов и подклассов и их фрагменты, содержащие один или несколько антигенсвязывающих сайтов, такие как Fab, scFv, Fv и ди-антитела.
Антителами и фрагментами антител являются любые полипептиды, которые содержат связывающий домен иммуноглобулина и которые могут быть продуцированы естественным образом, либо они могут быть частично или полностью синтезированы; и химерные молекулы, которые содержат связывающий домен иммуноглобулина или его эквивалент, присоединенный к другому полипептиду.
Было показано, что фрагменты целого антитела могут выполнять функцию связывания с антигеном. Примерами таких связывающих фрагментов являются (i) Fab-фрагмент, который включает в себя домены VL, VH, CL и СН1 иммуноглобулина; (ii) Fd-фрагмент, состоящий из доменов VH и СН1; (iii) Fv-фрагмент, состоящий из доменов VL и VH данного антитела; (iv) scFv-фрагмент, где домены VH и VL указанного антитела соединены пептидным линкером, что позволяет этим двум доменам ассоциироваться друг с другом и образовывать антигенсвязывающий сайт (Bird et al., Science 242: 423-426, 1988; Huston et al., PNAS USA 85:5879-5883, 1988); (v) "ди-антитела", мультивалентные или мультиспецифические фрагменты, сконструированные так же, как и scFv, но лишь с тем отличием, что в указанных фрагментах небольшой размер линкера не позволяет доменам VH и VL одной и той же молекулы scFv ассоциироваться друг с другом, а антигенсвязывающие сайты образуются путем ассоциации двух или нескольких scFv (WO 94/13804; Holliger P. et al. PNAS USA 90, 6444-6448, 1993); (vi) другие фрагменты, такие как dAb (Ward S.E. et al., Nature 341:544-546, 1989), выделенные области CDR, F(ab')2-фрагменты и биспецифические димеры scFv (РСТ/US92/09965; Holliger P. Winter G. Current Opinion Biotechnol. 4:446-449, 1993; de Haard H. et al., Adv. Drug. Delivery Rev. 31:5-31, 1998).
Ди-антитела и scFv могут быть сконструированы без Fc-областей, с использованием лишь вариабельных доменов, что дает возможность минимизировать эффекты антиизотипических реакций при введении человеку. Они также являются особенно подходящими благодаря возможности их продуцирования в E.coli и в рекомбинантных дрожжах. Их размер меньше размера полного иммуноглобулина, а поэтому они обладают большей способностью проникать в ткани.
Антигенсвязывающий сайт
Этот термин означает часть антитела, содержащего область, которая специфически взаимодействует со всем антигеном или с его частью. Если такой антиген является крупным, то антитело может связываться только с конкретной частью этого антигена, называемой эпитопом. Антигенсвязывающий сайт может обеспечиваться одним или несколькими вариабельными доменами антитела. Предпочтительно, чтобы антигенсвязывающий сайт содержал вариабельную область (или домен) легкой цепи (VL) и вариабельную область (или домен) тяжелой цепи (VH) антитела.
Специфичность
Этот термин используется в случае, когда антитело или его фрагменты не обнаруживают заметного связывания с другими молекулами, отличающимися от их партнера связывания. Этот термин также применяется в случае, когда антигенсвязывающий сайт является специфическим по отношению к конкретному эпитопу, который присутствует в ряде родственных или неродственных антигенов, то есть в этом случае связывающий сайт должен обладать способностью связываться с определенным антигеном, несущим этот эпитоп.
Подробное описание изобретения
В соответствии с настоящим изобретением, были получены специфические полипептидные молекулы, образованные одним или несколькими антигенсвязывающими сайтами, происходящими от мышиного Mab, которое является специфическим по отношению к человеческому СЕА. Антигенсвязывающий сайт может быть собран в виде моновалентного, двухвалентного и других форм фрагментов антитела в зависимости от способа конструирования полипептидной молекулы.
Полипептидная молекула в форме моновалентного scFv-фрагмента, специфичного в отношении человеческого СЕА, имеет константу аффинности к этому антигену, составляющую (5,0 ± 0,4) х 109 л·моль-1, и содержит домены VH и VL, связанные в указанном порядке посредством 14-аминокислотного связующего сегмента (линкера), с аминокислотной последовательностью, представленной SEQ ID NO:16.
Полипептидная молекула в форме двухвалентного scFv-фрагмента (ди-антитела), специфичного в отношении человеческого СЕА, имеет константу аффинности к этому антигену, составляющую (2,8 ± 0,3) х 1010 л·моль-1, и содержит пару из двух идентичных молекул, каждая из которых образована доменами VH и VL, связанными в указанном порядке посредством 5-аминокислотного связующего сегмента (линкера), с аминокислотной последовательностью, представленной SEQ ID NO:17.
В другом аспекте настоящего изобретения моновалентные и двухвалентные фрагменты scFv не связываются или слабо связываются с нормальными тканями или клетками, происходящими от нормальных тканей печени, почек, легких, яичек, крови, селезенки и поджелудочной железы. В случае слизистой толстой кишки моновалентные и двухвалентные фрагменты scFv реагируют исключительно с продуктами люминальной секреции и в апикальных зонах или в некоторых железах. Отсутствие способности моновалентных и двухвалентных фрагментов scFv реагировать с нормальными лимфоцитами и нейтрофилами указывает на отсутствие какого-либо значительного уровня перекрестной реактивности с антигеном NCA (von Kleist S, Burtin P. Immunodiagnosis of Cancer. Marcel Dekker. 322-341, 1979; Buchegger F. et al. Int. J. Cancer 33, 643-649, 1984).
Моновалентные и двухвалентные фрагменты scFv могут связываться с растворимым СЕА, с СЕА, абсорбированным на твердых поверхностях, или с СЕА, ассоциированным с клетками, продуцирующими этот антиген, а также с опухолевыми тканями, которыми могут быть аденокарциномы толстой и прямой кишки, молочной железы, легких, поджелудочной железы и желудка человека. Моновалентные и двухвалентные фрагменты scFv и Mab CB/ior-CEA.1 связываются с растворимым СЕА и с СЕА, связанным с твердой поверхностью, в форме, которая зависит от сохранения характера гликозилирования человеческого СЕА, в результате чего можно предположить, что углеводы этого антигена играют определенную роль в таком распознавании.
Полипептидные молекулы, происходящие от моновалентных и двухвалентных фрагментов scFv, описанных в настоящем изобретении, которые сохраняют способность связывания с СЕА, свою аффинность, способность к специфическому распознаванию эпитопа и аналогичные и эквивалентные биологические и биохимические свойства этих фрагментов, описанных в настоящем изобретении, рассматриваются как эквивалентные вариантные формы и входят в объем настоящего изобретения. Эти полипептидные молекулы могут присутствовать в форме других рекомбинантных фрагментов антител, таких как scFv, где за доменом VL следует VH, либо в форме Fab, Fab', F(ab')2, Fabc, Facb, тримерные и тетрамерные scFv и т.п. (Winter G, Milstein C. Nature 349: 293-299, 1991; WO 94/13804; de Haard H. et al., Adv. Drug. Delivery Rev. 31:5-31, 1998), и других связующих сегментов (линкеров), известных специалистам. Они могут также присутствовать в форме биспецифических молекул антител, где одна часть такой молекулы сохраняет специфичность к СЕА, а другая часть имеет другую специфичность.
Настоящее изобретение в равной степени относится к вариантным формам моновалентных и двухвалентных фрагментов scFv, которые имеют свойства, описанные в предыдущих разделах, и которые должны быть получены в результате так называемой "гуманизации для снижения иммуногенности", где эпитопы В- и Т-клеток, присутствующие в вариабельных доменах, модифицируют так, чтобы способность к распознаванию антигена не изменялась, но чтобы при этом снижалась иммуногенность полученной молекулы при ее введении человеку, например, как описано у Carr F.J. et al., 2000, EP 983303A1 и Rodriguez Perez R. et al., US 5712120-A. В настоящем изобретении также рассматриваются вариантные формы, продуцируемые посредством так называемой "трансплантации CDR", где последовательности CDR первого антитела помещают внутри рамки считывания последовательностей, которые не происходят от данного антитела, например, как описано в ЕР-В-0239400, ЕР-А-184187, GB 2188638A или ЕР-А-239400, и сохраняют способность связываться в СЕА с аналогичной аффинностью, способность к конкурентному связыванию, способность к распознаванию конкретного эпитопа и биологические и биохимические свойства, аналогичные и эквивалентные свойствам моновалентных и двухвалентных фрагментов scFv, описанных в настоящем изобретении.
Помимо последовательностей антител, полипептидные молекулы, описанные в настоящем изобретении, могут содержать и другие аминокислоты, которые образуют пептид или полипептид или наделяют данную молекулу функциональными свойствами, не относящимися к связыванию с антигеном СЕА, например, добавляют метку для очистки или идентификации, фермент или его фрагмент, модификатор биологического ответа, токсин или лекарственное средство и т.п.
В соответствии с настоящим изобретением, моновалентные и двухвалентные фрагменты scFv могут быть введены в выделенной или очищенной форме.
Настоящее изобретение относится к использованию некоторых из вышеописанных полипептидных молекул в качестве диагностического реагента для выявления форм рака, при которых экспрессируется СЕА, например, аденокарциномы толстой кишки, легких, молочной железы или т.п.
СЕА-специфические полипептидные молекулы, описанные выше, могут быть радиоактивно меченными и могут быть использованы в качестве агентов для получения изображений в целях специфической идентификации присутствия и локализации опухолей, экспрессирующих СЕА у человека. Настоящее изобретение относится к способу определения присутствия клетки или опухоли, экспрессирующей СЕА, где указанный способ предусматривает контактирование указанных клеток с полипептидными молекулами, описанными выше, и определяет их связывание с клетками. Этот способ может быть осуществлен in vivo или в образце клеток, взятых из живого организма, in vitro или ex vivo.
Настоящее изобретение относится к способу связывания полипептидной молекулы, описанной выше, с человеческим СЕА. Такое связывание может происходить in vitro, ex vivo или in vivo. При связывании in vivo указанный способ может предусматривать введение полипептидной молекулы одному или нескольким млекопитающим. Как было экспериментально продемонстрировано в настоящем описании, моновалентные и двухвалентные фрагменты scFv согласно изобретению связываются с человеческим СЕА, экспрессируемым опухолевыми клетками трансфицированной мыши, которые в результате своего роста после их трансплантации мышам образуют опухоль, а следовательно, представляют собой подходящую экспериментальную модель для изучения, исследования и получения молекул, способных к специфическому связыванию, и изучения их свойств.
Реакционная способность антител на клеточных образцах может быть детектирована любым подходящим способом. Одним из таких способов может быть мечение отдельными репортерными молекулами. Репортерные молекулы могут генерировать сигналы, которые могут быть детектированы прямыми или непрямыми способами, а предпочтительно они могут быть измерены. Присоединение репортерных молекул может быть прямым или опосредованным, ковалентным или нековалентным. Связывание посредством пептидной связи может быть осуществлено путем рекомбинантной экспрессии гибридного гена, который кодирует антитело и связанную с ним репортерную молекулу. Способ определения связывания не играет решающей роли для осуществления настоящего изобретения, и каждым специалистом может быть выбрана адекватная модель по его желанию и в соответствии с имеющейся у него конкретной информацией.
В случае использования радионуклидов, таких как125I,111In или99mTc, для мечения моновалентных и двухвалентных фрагментов scFv и их эквивалентных форм и в случае, если эти радионуклиды предпочтительно локализуются в опухолях, а не в нормальных тканях, присутствие радионуклидной метки в опухолевой ткани может быть детектировано и количественно оценено с использованием гамма-камеры. Качество полученного изображения прямо пропорционально коррелирует с отношением "радиосигнал : шум" (Goldenberg D.M. Int. J. of Biol. Markers 1992, 7, 183-188). В настоящем описании проиллюстрирован эксперимент с использованием125I.
Настоящее изобретение также относится к элементам, в сочетании с которыми моновалентные и двухвалентные фрагменты scFv и их эквивалентные варианты, описанные выше, могут быть использованы в качестве терапевтического реагента, например, путем их объединения, конъюгирования или связывания с молекулами, обладающими терапевтической эффективностью, или путем их продуцирования в виде рекомбинантного гибридного белка. Моновалентные и двухвалентные фрагменты scFv и их эквивалентные варианты согласно изобретению могут быть использованы для нацеливания токсина, радиоактивной метки, Т- и NK-клеток или других молекул на опухоли, которые экспрессируют СЕА, либо они могут быть использованы для индуцирования ответа в данном организме в виде выработки антиидиотипических антител, которые могут обеспечивать желаемый терапевтический эффект. В соответствии с этим, в другом своем аспекте, настоящее изобретение относится к элементам, используемым в методах лечения, предусматривающих введение моновалентных и двухвалентных фрагментов scFv или их эквивалентных вариантов в качестве лекарственных средств или фармацевтических композиций.
В соответствии с настоящим изобретением, указанные композиции могут быть введены индивидуумам, предпочтительно в "терапевтически эффективном количестве", достаточном для ослабления у пациента по меньшей мере одного симптома. Конкретное количество вводимого лекарственного средства, частота и интервалы его введения зависят от природы и тяжести заболевания, подвергаемого лечению, и назначение конкретного курса лечения может быть осуществлено специалистами-медиками и лечащими врачами. Подходящие дозы антитела хорошо известны специалистам (Ledermann J.A. et al. Int. J. Cancer 47:659-664, 1991; Bagshawe K.D. et al. Antibody, Immunoconjugates and Radiopharmaceuticals 4:915-922, 1991).
Композиция может быть введена отдельно или в комбинации с другими терапевтическими средствами, либо одновременно, либо последовательно, в зависимости от заболевания, подвергаемого лечению.
Фармацевтические композиции согласно изобретению и их применение в соответствии с настоящим изобретением могут содержать, помимо активного ингредиента, наполнитель, буфер, стабилизатор или фармацевтически приемлемый носитель, или другие материалы, хорошо известные специалистам. Эти материалы не должны быть токсичными, не должны негативно влиять на эффективность активного ингредиента и их конкретная природа зависит от способа введения, которое может быть осуществлено перорально или путем инъекции, например, внутривенной.
Моновалентные и двухвалентные фрагменты scFv и их эквивалентные варианты согласно изобретению могут быть получены посредством экспрессии кодирующей нуклеиновой кислоты. Нуклеиновая кислота, которая кодирует любую из полипептидных молекул, описанных выше, является частью настоящего изобретения, также как и способ экспрессии такой нуклеиновой кислоты. В другом варианте осуществления изобретения указанная нуклеиновая кислота может кодировать аминокислотные последовательности, представленные в SEQ ID NO:16 и 17.
Для рекомбинантной экспрессии моновалентного и двухвалентного scFv и его эквивалентных вариантов могут быть выбраны или сконструированы подходящие векторы, содержащие адекватные регуляторные последовательности, включая промотор, терминатор, энхансер, последовательность полиаденилирования, маркерные гены и другие подходящие последовательности. Такими векторами могут быть плазмиды. Многие известные протоколы и методы модификации нуклеиновых кислот, например получение конструкций нуклеиновых кислот, полимеразная цепная реакция, мутагенез, секвенирование, введение ДНК в клетки, экспрессия генов, анализ белка и т.п., подробно описаны в нескольких руководствах, таких, например, как, Molecular Cloning: A Laboratory Manual: 2nd edition, Sambrook et al., Cold Spring Harbor Laboratory Press, 1989, или Short Protocols in Molecular Biology, Second edition, Ausubel et al., eds. John Wiley & Sons, 1992 или Erlich HA PCR Technology, Stockton Press, 1989. Соответствующая информация включена в настоящее описание посредством ссылки.
В другом своем аспекте настоящее изобретение относится к клетке-хозяину, содержащей чужеродную нуклеиновую кислоту, и к способам введения такой нуклеиновой кислоты в клетки-хозяева. Это введение может быть осуществлено любым способом, применяемым для этих целей. Для бактериальных и дрожжевых клеток таким способом может быть электропорация. Указанное введение может быть осуществлено путем стимуляции или создания условий для экспрессии нуклеиновой кислоты, например, путем культивирования клеток-хозяев в условиях, благоприятных для экспрессии гена. В одном из вариантов осуществления изобретения нуклеиновая кислота согласно изобретению интегрируется в геном клеток-хозяев.
После их продуцирования моновалентные и двухвалентные фрагменты scFv и их эквивалентные варианты могут быть использованы в любой из описанных здесь форм, таких как препарат, изготовленный на основе композиции, такой как фармацевтический или диагностический продукт, содержащийся в наборе реагентов, который, помимо специфически связывающегося агента, включает в себя один или несколько реагентов для определения уровня связывания указанного агента с клетками или с СЕА, не связанного с клетками, как обсуждалось выше.
Другие аспекты настоящего изобретения и способы их осуществления очевидны каждому специалисту. Для лучшего понимания настоящего изобретения ниже приводятся примеры, которые не должны рассматриваться как ограничение его притязаний и объема. В настоящем описании приводятся ссылки на описанный ниже графический материал.
Краткое описание графического материала
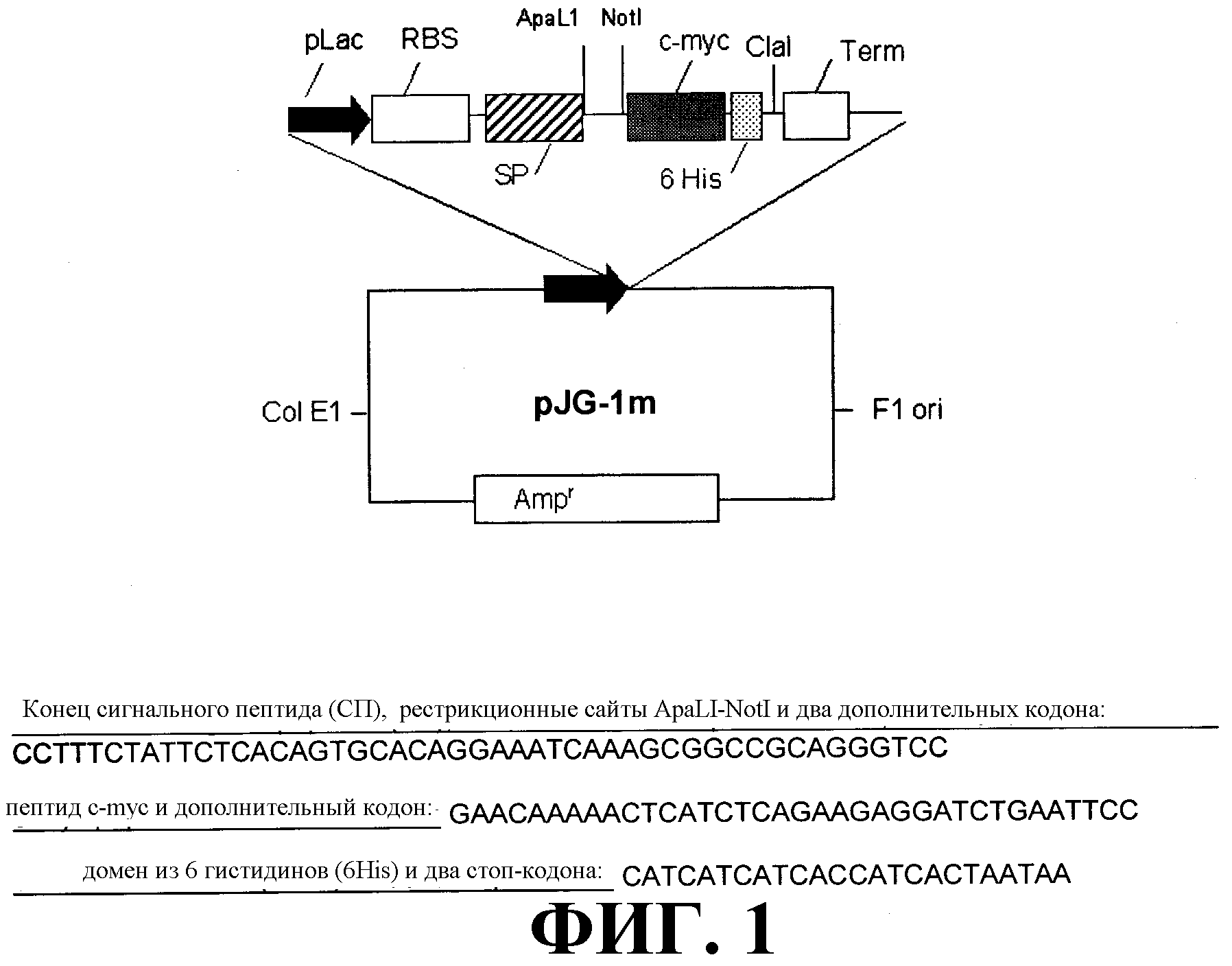
На фиг. 1 схематически представлен вектор pJG-1m, используемый для экспрессии моновалентного scFv и ди-антитела в E.coli. В соответствии с векторной областью, обозначенной жирной горизонтальной линией, показаны нуклеотидные последовательности сайта клонирующего фрагмента, пептида с-myc, домена из 6 гистидиновых остатков и некоторых областей, расположенных внутри и вне доменов (SEQ ID NO:13).
На фиг. 2 проиллюстрировано выравнивание аминокислотных последовательностей (представленных однобуквенным кодом), выведенных из нуклеотидных последовательностей для (1) моновалентного фрагмента scFv (SEQ ID NO:16) и (2) двухвалентного фрагмента (ди-антитела)(SEQ ID NO:17). Домены обеих конструкций расположены в указанном порядке: VH - линкерный сегмент - VL. Аминокислоты линкерных сегментов, используемые в каждой из двух молекул, отмечены жирным шрифтом.
На фиг. 3 проиллюстрировано распознавание СЕА, экспрессируемого в культуре опухолевых клеток AsPC-1 (АТСС CRL-1682), (А) антителом Mab CB/ior-CEA.1, (В) моновалентным scFv и (С) ди-антителом в непрямом иммунофлуоресцентном анализе. В А, В и С видна характерная флуоресценция мембраны, а рядом - цитоплазмы. Увеличение - 200х.
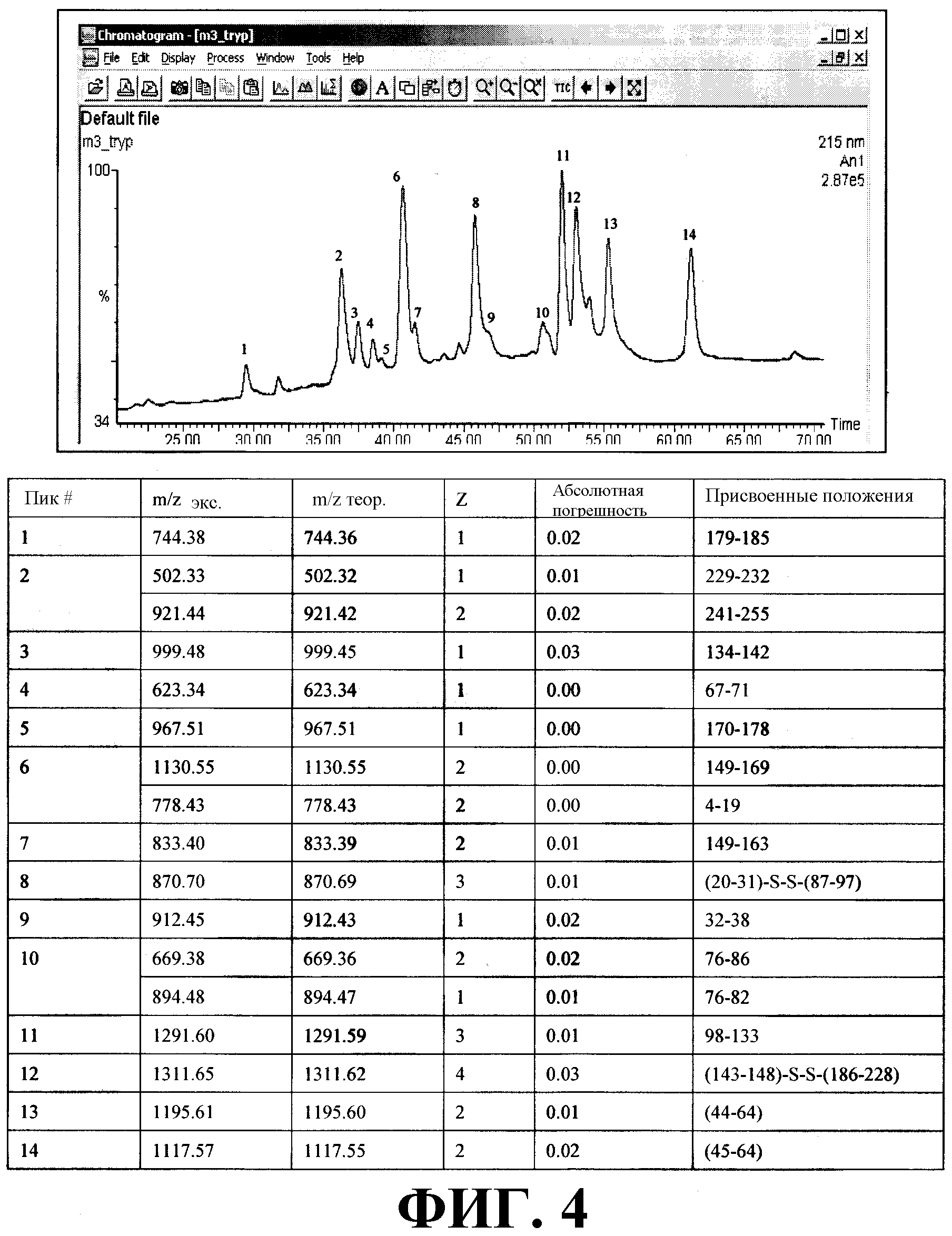
На фиг. 4 показан хроматографический профиль протеолитического гидролиза ди-антитела и положения, присвоенные триптическим пептидам и полученные с помощью масс-спектрометрии. Вверху: Хроматографический профиль триптического гидролиза ди-антитела. Внизу: Систематизированная таблица положений, присвоенных триптическим пептидам. М/z ехр: экспериментальная масса; теоретическое m/z: теоретическая масса; Z: заряд. В полученных спектрах сигналы, соответствующие "неправильно" присоединенным линкерным цистеинам, не детектировались.
На фиг. 5 в упрощенном виде показано подтверждение аминокислотной последовательности ди-антитела (SEQ ID NO:21). Области последовательности белка, которые были подтверждены с помощью масс-спектрометрии, показаны жирным шрифтом, а области последовательности, которые не были выявлены после гидролиза трипсином, показаны курсивом. Области, показанные жирным шрифтом, полностью совпадают с аминокислотной последовательностью, выведенной из нуклеотидной последовательности ди-антитела. Последовательность пептида с-myc и конечных 6 гистидинов в векторе pJG-1m (фиг. 1) также видна в С-концевой части.
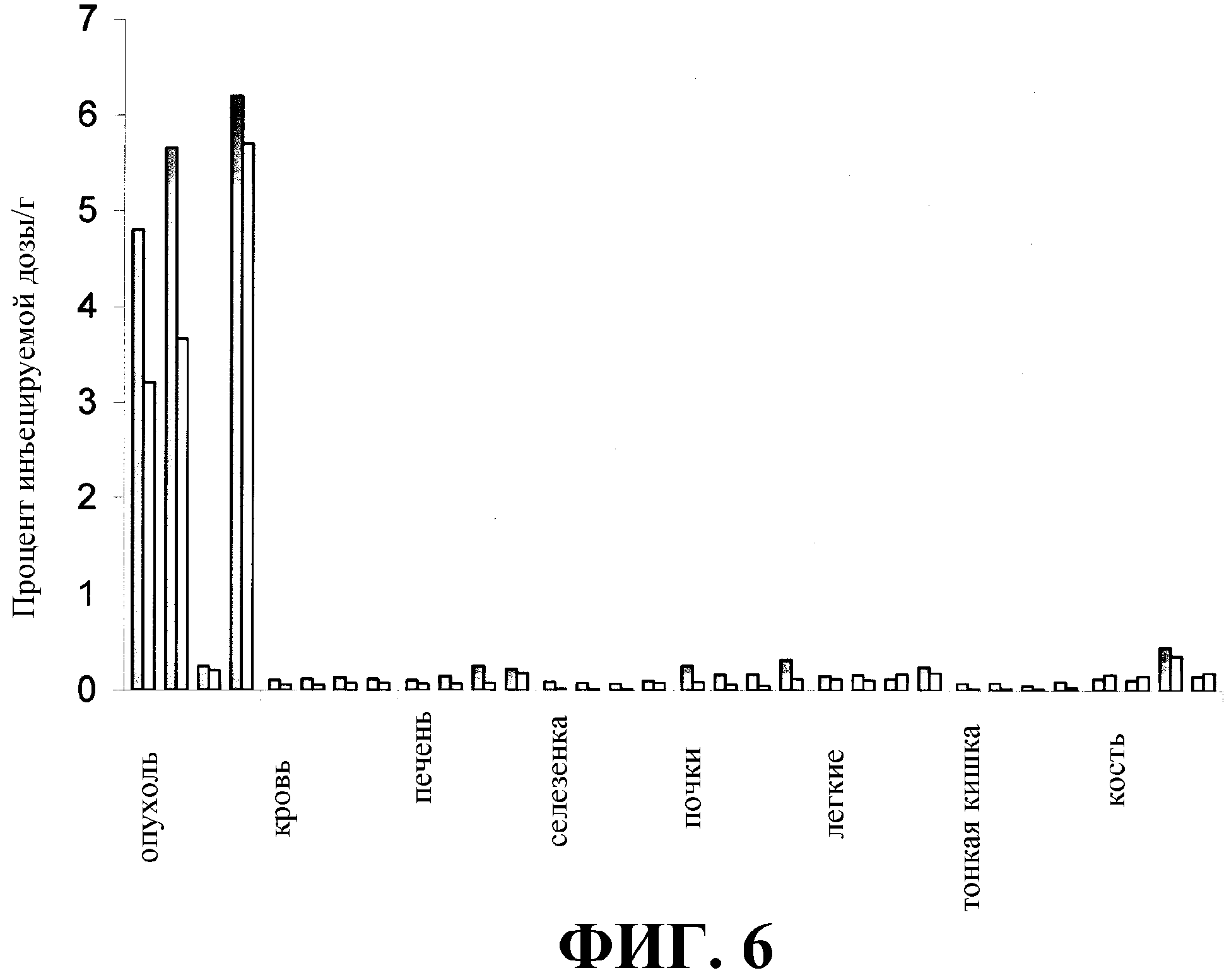
На фиг. 6 приводится процент инъецированной дозы на грамм ткани через 24 часа (незаштрихованные столбцы) и 48 часов (заштрихованные столбцы) после инокуляции мышей, несущих опухоли, экспрессирующие человеческий СЕА со следующими молекулами, радиоактивно меченными125I: слева направо, и в группах из четырех двойных полос: (а) ди-антитело, (b) scFv, (с) F3 и (d) Mab CB/ior-CEA.1. Каждый столбец представляет собой среднее значение из величин, полученных для органов, взятых у 12 мышей. За период времени от 24 до 48 часов после инъекции результаты показали следующий уровень радиоактивности в опухоли: радиоактивность в крови сохранялась на высоком уровне для ди-антитела, scFv и Mab, где последнее имело наиболее высокие значения, а за ним следовали значения для димерной молекулы. F3 обнаруживало очень низкие значения, при этом его поведение in vivo было неадекватным, что может быть обусловлено снижением аффинности к СЕА.
Все упомянутые здесь документы вводятся в настоящее описание посредством ссылки.
Примеры
1. ПЦР-амплификация, клонирование и секвенирование вариабельных доменов Mab CB/ior-CEA.1.
2. Сборка scFv и ди-антитела, экспрессия в E.coli и демонстрация распознавания ими человеческого СЕА.
3. Экспрессия scFv и ди-антитела в Pichia pastoris и демонстрация распознавания ими человеческого СЕА.
4. Очистка scFv и ди-антитела, продуцированных в бактериях.
5. Характеризация указанного ди-антитела с помощью протеолитического расщепления и масс-спектрометрии.
6. Исследование распознавания дегликозилированного СЕА.
7. Иммуноцитологическое и гистохимическое исследование нормальных и опухолевых тканей.
8. Определение константы аффинности.
9. Определение способности125I-меченных фрагментов и антитела к специфическому распознаванию in vivo у мышей С57ВI/6, несущих опухоли, индуцированные путем инокуляции клеток В16-СЕА13.
Пример 1. ПЦР-амплификация, клонирование и секвенирование вариабельных доменов Mab CB/ior-CEA.1
Процедура (а). Очистка РНК и амплификация вариабельных областей
Полноразмерную РНК экстрагировали из 106 клеток мышиной гибридомы CB/ior-CEA.1 (Tormo B. et al., APMIS 97:1073-1080, 1989) с использованием реагента TriPureТМ (Boehringer Mannheim). Комплементарную ДНК (кДНК) синтезировали методом синтеза первой цепи кДНК в соответствии с инструкцией, приложенной к набору для ОТ-ПЦР (Boehringer Mannheim), с использованием oligo-dT в качестве праймера. Специфическую амплификацию генов вариабельного домена тяжелой и легкой цепей проводили с помощью полимеразной цепной реакции (ПЦР). Используемые синтетические праймеры обозначали исходя из консенсусных последовательностей для мышиных IgG и каппа-цепей, описанных Kabat et al. (US Department of Health and Human Services, NIH, 1991), и в соответствии с экспериментами, разработанными ранее в данной лаборатории (Coloma, MJ et al. Biotechniques 11:152-156, 1991). Последовательности олигонуклеотидов, используемых в ПЦР, приводятся в таблице I.
Таблица I . Синтетические олигонуклеотиды, используемые в ПЦР для амплификации последовательностей, кодирующих вариабельные домены тяжелой (VH) и легкой (VL) цепей Mab CB/ior-CEA.1
Тяжелая цепь
Олигонуклеотид 1. Сигнальный пептид VH (SEQ ID NO:1)
5'...GGGGATATCCACCATGRACTTCGGGYTGAGCTKGGTTTT...3'
Олигонуклеотид 2. Область СН1 (SEQ ID NO:2)
5'...AYCTCCACACACAGGRCCAGTGGATAGAC...3'
Легкая цепь
Олигонуклеотид 3. Сигнальный пептид VL (SEQ ID NO:3)
5'...GGGGATATCCACCATGGAGWCACAKWCTCAGGTCTTTRTA...3'
Олигонуклеотид 4. Константная область Ск (SEQ ID NO:4)
5'...ACTGGATGGTGGGAAGATGGA...3'
Для осуществления ПЦР использовали набор PCR Core Kit (Boehringer-Mannheim). ПЦР проводили при следующих условиях: 25 циклов - денатурация, 94°С, 1 минута; отжиг, 55°С, 1 минута, удлинение при температуре до 72°С, 1 минута; и дополнительный цикл в течение 5 минут для роста цепи при температуре, уже указанной в последнем цикле; всю процедуру проводили на оборудовании MJ Research Minicycler. Конечные объемы каждой реакционной смеси составляли 100 мкл. Все олигонуклеотиды использовали до конечной концентрации 1 мкМ.
Амплифицированные ДНК-фрагменты с предполагаемым размером примерно 320-530 п.н. очищали на низкоплавких агарозных гелях (Sigma), с использованием набора для экстракции из геля QIAquick (QIAGEN, GmbH), и независимо клонировали в векторе pMOS (Amersham Pharmacia Biotech), сконструированном для "затупления" клонирующих ДНК-фрагментов.
Процедура (b). Нуклеотидная последовательность вариабельных доменов
Для определения нуклеотидной последовательности вариабельных доменов легкой и тяжелой цепей, клонированных в векторе pMOS, использовали олигонуклеотиды, рекомендованные производителем (Amersham Pharmacia Biotech). Нуклеотидную последовательность получали автоматизированными методами с использованием оборудования ALFexpress II equipment of Pharmacia (Amersham Biosciences) и набора для реакции секвенирования, содержащего краситель для терминации цепи ("Thermus Sequenase 5 Cy Dye Terminator Kit"). Плазмиды рVL2 и pVH5 выбирали как репрезентативные плазмиды, содержащие последовательности VL и VH соответственно.
Пример 2. Сборка scFv и ди-антитела, экспрессия в E.coli и демонстрация распознавания ими человеческого СЕА
Процедура (а). Повторная амплификация вариабельных доменов и сборка scFv и ди-антитела
Для сборки доменов VH и VL в форме scFv и ди-антитела, содержащихся в плазмидах рVL2 и pVH5, использовали ПЦР.
Синтетические олигонуклеотиды конструировали исходя из последовательностей VH и VL в плазмидах рVL2 и pVH5. Они включали сайты рестрикции для клонирования в векторе pJG-1m и вводили линкерные сегменты из 14 и 5 аминокислот для сборки мономерного scFv и ди-антитела (таблицы II и III).
Таблица II. Аминокислотные последовательности связующих сегментов (линкеров), используемые для конструирования фрагментов scFv и ди-антитела.
scFv - линкер L1: EGKSSGSGSESKVD (SEQ ID NO:5)
Ди-антитело - линкер L2: GGGGS (SEQ ID NO:6)
Таблица III: Синтетические олигонуклеотиды, используемые в ПЦР для сборки scFv и ди-антитела.
Олигонуклеотид 5. ApaL1-FR1 VH (SEQ ID NO:7)
5'...TCTCACAGTGCACAGGAAGTGAAGCTGGTGGAGTCTGGG...3'
Олигонуклеотид 6. Линкер из 14 аминокислот/FR4 VH (SEQ ID NO:8)
5'...GTCGACTTTGGATTCGGAGCCTGATCCTGAGGATTTACCCTCTGAGGAGACTGTGAGAGTGGT...3'
Олигонуклеотид 7. Линкер из 14 аминокислот/FR1 VL (SEQ ID NO:9)
5'...GAGGGTAAATCCTCAGGATCAGGCTCCGAATCCAAAGTCGACGACATTGTGATGACCCAGTC...3'
Олигонуклеотид 8. NotI-FR4 VL (SEQ ID NO:10)
5'...AAGGAAAAAAGCGGCCGCTTTCAGCTCCAGCTTGGTT...3'
Олигонуклеотид 9. Линкер из 5 аминокислот/FR4 VH (SEQ ID NO:11)
5'...AGAGCCGCCGCCACCTGAGGAGACTGTGAGAGTGGT...3'
Олигонуклеотид 10. Линкер из 5 аминокислот/FR1 VL (SEQ ID NO:12)
5'...GGTGGCGGCGGCTCTGACATTGTGATGACCCAGTCT...3'
Для сборки фрагментов в первой стадии амплификации проводили независимую ПЦР:
1. Для доменов, которые должны вводить сайт инициации в моновалентный scFv, проводили следующие реакции: Реакцию 1: с использованием плазмиды pVH5 в качестве матрицы с олигонуклеотидами 5 и 6 (таблица III); Реакцию 2: с использованием плазмиды pVL2 с олигонуклеотидами 7 и 8 (таблица III).
2. Для доменов, которые должны вводить сайт инициации в ди-антитело, проводили следующие реакции: Реакцию 3: с использованием плазмиды pVH5 с олигонуклеотидами 5 и 9 (таблица III); Реакцию 4: с использованием плазмиды pVL2 в качестве матрицы с олигонуклеотидами 8 и 10 (таблица III).
Условия и реагенты, используемые для ПЦР, описаны выше. Все олигонуклеотиды использовали до конечной концентрации 1 мкМ.
Для сборки scFv проводили новую ПЦР путем смешивания 4 мкл реакционных смесей 1 и 2 с олигонуклеотидами 5 и 8 (таблица III) в конечной концентрации 1 мкМ и с олигонуклеотидами 6 и 7 (таблица III) в конечной концентрации 0,01 мкМ.
Для сборки ди-антитела проводили новую ПЦР путем смешивания 4 мкл реакционных смесей 3 и 4 с олигонуклеотидами 5 и 8 (таблица III) в конечной концентрации 1 мкМ и с олигонуклеотидами 6 и 7 (таблица III) в конечной концентрации 0,01 мкМ.
Амплифицированные ДНК-фрагменты детектировали как основные полосы примерно в 700 п.н., которые были выделены из гелей с низкоплавкой агарозой, как описано выше.
Процедура (b). Клонирование в векторе pJG-1m
Вектор pJG-1m представляет собой плазмиду, сконструированную для экспрессии фрагментов антитела в периплазме E.coli (фиг. 1). В качестве основных элементов этот вектор содержит промотор LacZ, сигнальный пептид, рестрикционные сайты ApaL и NotI для инсерции генного фрагмента; пептид с-myc и последовательность, кодирующую 6 гистидинов. Эта последовательность используется в качестве метки для очистки продуктов экспрессии с помощью аффинной хроматографии на иммобилизованных ионах металла (IMAC; Porath J. Prot. Expr. Purif. 3:263-281, 1992). Последовательности оснований рестрикционных сайтов для клонирования scFv в рассматриваемом векторе и С-концевые аминокислоты, которые были присоединены к scFv, показаны на фиг. 1 (SEQ ID NO:13).
ДНК-фрагменты, соответствующие scFv и ди-антителу, и вектор pJG-1m гидролизовали рестрицирующими ферментами ApaLI и NotI (Promega) и полосы и вектор независимо лигировали с использованием ДНК-лигазы Т4 (Promega). Продукты реакции лигирования использовали для трансформации компетентных E.coli (штамм XL-1Bluе; Stratagene) путем электропорации, и трансформированные клетки культивировали на твердой селективной среде (на агаре LB с 100 мкг/мл ампициллина) в течение 16 часов при 37°С. Используемые методы описаны в руководстве Molecular Cloning, A Laboratory Manual, Second Edition, Sambrook, Fritsch, Maniatis. 1989.
Рекомбинантные плазмиды отбирали после выделения плазмидной ДНК из нескольких колоний (набор QIAGEN MiniPrep) и соответствующего анализа путем гидролиза рестрицирующими ферментами, описанными выше для предполагаемых продуктов лигирования. В этих рестрикционных анализах получали полосы размером приблизительно 3,5 т.п.н., соответствующие линеаризованному вектору, а также полосы размером приблизительно 700 п.н. для генов, кодирующих фрагменты scFv и ди-антитела.
Пять клонов каждой конструкции секвенировали с использованием специально сконструированных праймеров, которые гибридизуются с внешними клонирующими областями вектора pJG-1m (таблица IV) способом, описанным выше.
Таблица IV. Синтетические олигонуклеотиды для секвенирования нуклеотидов scFv и ди-антитела, собранных с помощью ПЦР и клонированных в векторе pJG-1m
Олигонуклеотид 11. (SEQ ID NO:14)
5'...GTTGTTCCTTTCTATTCTCAC...3'
Олигонуклеотид 12. (SEQ ID NO:15)
5'...CTCTTCTGAGATGAGTTTTTGTTC...3'
Аминокислотные последовательности, выведенные из нуклеотидных последовательностей, полученных для моновалентного scFv (клон pJG1m-25) и ди-антитела (клон pJG1m-18), представлены на фиг. 2 (SEQ ID NO:16 и SEQ ID NO:17). По сравнению с уже полученными ранее scFv (Ayala M. et al., Biotechniques 13:790-799, 1992), последовательности VH и VL, полученные в настоящем изобретении для нового моновалентного scFv и ди-антитела, имеют 16 отличающихся аминокислот в доменах VH FR1, CDR2 и FR3 и 3 отличающиеся аминокислоты в доменах VL FR1 и FR3.
Эти результаты показали, что вариабельные домены, амплифицированные и клонированные из гибридомы CB/ior-CEA.1 для конструирования нового моновалентного scFv и ди-антитела, могут происходить от РНК, отличающейся от той РНК, которая была использована для амплификации в целях клонирования описанного ранее scFv.
Линкерный сегмент нового моновалентного scFv идентичен линкерному сегменту ранее полученного scFv. Связывающий сегмент для нового двухвалентного scFv (ди-антитело) отличается от сегмента уже известного scFv тем, что он включает только 5 аминокислот. В этих экспериментах были также подтверждены последовательности линкерных сегментов L1 и L2, представленные в таблице II.
Процедура (с). Подтверждение экспрессии scFv и ди-антитела в E.coli с помощью электрофореза в ДСН-ПААГ и Вестерн-блот-анализа
Компетентные клетки TG1 E.coli независимо трансформировали плазмидами pJG1m-25 и pJG1m-18, содержащими информацию для обоих фрагментов антитела. Использование этого штамма позволяет осуществлять периплазматическую экспрессию гетерологичного белка или его секрецию в культуральную среду.
Трансформированные бактерии высевали на твердую селективную среду и культивировали при 37оС в течение 16 часов. Репрезентативную колонию каждой из двух конструкций культивировали на жидкой среде до OD530нм=1 и индуцировали в течение 12 часов путем добавления 1 мМ IPTG в культуральную среду. Клетки центрифугировали и периплазматическое содержимое выделяли с помощью осмотического шока и быстрой обработки ультразвуком (в течение нескольких секунд) для его оценки путем электрофореза в 12% полиакриламидном геле с ДСН (ДСН-ПААГ). Этот тест выявил экспрессию обоих белков с ожидаемым размером молекул (приблизительно 27 кДа), которые затем оценивали с помощью Вестерн-блот-анализа с использованием в качестве "первого" антитела Mab (9Е10), специфичного к пептиду, происходящему от с-myc, который входит в состав этого белка (1 мкг/мл), а в качестве "второго" антитела - конъюгированные с пероксидазой хрена кроличьи антитела против мышиных IgG (Sigma). Перенос белков из ДСН-ПААГ на нитроцеллюлозу HybondС Extra (Amersham Life Science) осуществляли используя оборудование для полусухого переноса (BioRad). Для проявления использовали нерастворимый субстрат DAB (Sigma).
Для этих двух конструкций рекомбинантные белки вышеупомянутого размера идентифицировали с использованием Mab 9Е10.
Процедура (d). Специфическое распознавание человеческого СЕА фрагментом scFv и ди-антителом в анализе ELISA
ELISA-тест проводили на покрытых поливинилом планшетах (Costar, 96-луночные виниловые планшеты для анализов) с человеческим СЕА (Calbochem 219369), добавленным до концентрации 1 мкг/мл. После блокирования планшетов сепарированным молоком образцы бактериальной периплазмы, соответствующие двум концентрациям, добавляли при разведениях 1:5, 1:10 и 1:20 в PBS с 2% сепарированным молоком и инкубировали в течение 2 часов при комнатной температуре.
Для детекции связывания фрагментов с СЕА использовали Mab 9Е10 (1 мкг/мл), а затем конъюгированные с пероксидазой хрена мышиные антитела против мышиных IgG (Sigma). После проведения нескольких промывок реакцию проявляли с использованием OPD (Sigma) и H2O2 в качестве хромогена и субстрата, после чего проводили количественную оценку реакций путем считывания данных при 492 нм в сканирующем устройстве LabSystems Multiskan MS.
В этом тесте в качестве позитивного контроля использовали Mab CB/ior-CEA.1. В качестве негативного контроля использовали периплазматические фракции, соответствующие клеткам TG1, трансформированным вектором pJG-1m без вставки, и неродственное Mab. Планшеты также сенсибилизировали следующими нерелевантными антигенами: 10 мкг/мл альбумина бычьей сыворотки (BSA, Sigma), 10 мкг/мл овальбумина, 10 мкг/мл лизоцима и 10 мкг/мл гемоцианина лимфы улитки (Sigma). Во всех планшетах находились лунки, которые включали лишь забуференный фосфатом физиологический раствор (PBS) без антигена (контроль). Величины оптической плотности в 4 раза превышающие величины, полученные для негативного контроля, рассматривались как положительные.
В этих экспериментах образцы периплазмы с конструкциями scFv и ди-антитела были положительными по их способности распознавать человеческий СЕА, адсорбированный на поливиниловых планшетах. Те же самые образцы были отрицательными для всех нерелевантных антигенов.
Процедура (е). Распознавание ассоциированного с клетками человеческого СЕА фрагментом scFv и ди-антителом методом ELISA и непрямой иммунофлуоресценции
Опухолевые человеческие клеточные линии LoVo (ATCC CCL-229), AsPC-1 (ATCC CRL-1682) и LS 174T (ATCC CL-188), каждая из которых экспрессирует СЕА в культуре, высевали в 96-луночные полистироловые планшеты (Costar). После достижения клетками конфлюэнтности лунки два раза промывали PBS, воду сливали и сушили на воздухе. Затем клетки фиксировали на пластике с использованием холодной смеси 1:1 (об./об.) ацетон-метанол в течение 3 минут. После нескольких промывок дистиллированной водой для удаления остатков планшеты использовали в качестве твердой фазы в ELISA-тестах, где образцы бактериальной периплазмы, соответствующие двум указанным конструкциям, добавляли при разведении 1:2, 1:8 и 1:16 в PBS с 2% сепарированным молоком и инкубировали в течение 2 часов при комнатной температуре. После нескольких промывок использовали Mab 9Е10 (1 мкг/мл), а затем использовали конъюгированные с пероксидазой хрена антитела против мышиных IgG (Sigma) для детекции связывания фрагментов с СЕА. После нескольких промывок реакцию проявляли хромогеном OPD (Sigma) и H2O2, используемым в качестве субстрата, после чего проводили количественную оценку реакций исходя из данных, полученных при 492 нм на сканирующем устройстве LabSystems Multiskan MS. Для проведения стадии считывания супернатанты переносили на свежий планшет. В этом анализе в качестве позитивного контроля использовали Mab CB/ior-CEA.1. В качестве негативного контроля использовали периплазматические фракции, соответствующие клеткам TG1, трансформированным вектором pJG-1m без вставки, и неродственное Mab. В качестве негативного контроля также использовали планшет с человеческими клетками НЕК 293 (АТСС CRL-1573), которые не экспрессируют СЕА. Критерии положительного результата были аналогичны критериям, используемым в ELISA, описанным в предыдущей процедуре.
В этом эксперименте периплазматические образцы конструкций scFv и ди-антитела распознавали только клетки LoVo, AsPC-1 и LS174T. Все негативные контроли были отрицательными. Таким образом, анализ ELISA, проводимый с использованием клеток (с-ELISA), продемонстрировал способность scFv и ди-антитела к распознаванию человеческого СЕА на человеческих опухолевых клетках, экспрессирующих этот антиген и фиксированных на полистироловых планшетах.
В другом эксперименте клетки LoVo, AsPC-1 и LS174T высевали в полистироловые планшеты диаметром 35 мм (COSTAR) и культивировали до конфлюэнтности. Планшеты два раза промывали PBS, сливали воду, сушили на воздухе, и клетки фиксировали на пластике с использованием холодной смеси 1:1 (об./об.) ацетон-метанол. После нескольких промывок дистиллированной водой для удаления остатков планшеты использовали в качестве твердой фазы в непрямых иммунофлуоресцентных тестах. Для этого на поверхности с фиксированными клетками определяли кольцевые зоны, в которых независимо инкубировали образцы бактериальной периплазмы, соответствующие двум конструкциям и разведенные в отношении 1:2, 1:4 и 1:8 в PBS-3% BSA. В этих анализах использовали такие же позитивный и негативный контроли, как и в с-ELISA.
Инкубирование осуществляли при комнатной температуре (к.т.) во влажной камере в течение часа, после чего несколько раз промывали холодным PBS-3% BSA и во все монослои добавляли Mab 9Е10 (10 мкг/мл) в течение 1 часа при комнатной температуре также во влажной камере. После нескольких промывок холодным PBS-3% BSA монослой инкубировали в темной влажной камере в течение 30 минут с антителами против мышиных IgG, конъюгированными с флуоресцеинизотиоцианатом (ФИТЦ, Sigma) и разведенными 1:64 в PBS-3% BSA, а затем пять раз промывали PBS-3% BSA и еще один раз - PBS и наконец окрашивали раствором голубого Эванса в течение нескольких минут.
Монослой покрывали PBS-10% глицерином, герметично закрывали покровным стеклом и оценивали с использованием флуоресцентной лампы Olympus BH2-RFL, вмонтированной в микроскоп Olympus BHT. Планшеты с человеческими клетками НЕК 293 также использовали в качестве негативного контроля. Критерием положительного результата служило присутствие мембранной флуоресценции и цитоплазматической флуоресценции цвета зеленого яблока, при условии отсутствия такой флуоресценции в образцах негативного контроля или в человеческих клетках, негативных по СЕА.
В этом эксперименте периплазматические образцы с конструкциями scFv и ди-антитела распознавали только клетки LoVo, AsPC-1 и LS174T. Все негативные контроли были отрицательными. Таким образом, была продемонстрирована способность scFv и ди-антитела к распознаванию человеческого СЕА на человеческих опухолевых клетках, экспрессирующих этот антиген и фиксированных на полистироловых планшетах, на что указывал непрямой иммунофлуоресцентный анализ. Характерные результаты представлены на фиг. 3.
Пример 3. Экспрессия scFv и ди-антитела в Pichia pastoris и демонстрации распознавания ими человеческого СЕА
Процедура (а). Повторная амплификация scFv и ди-антитела и клонирование в вектор рРS7
Гены, кодирующие scFv и ди-антитело, амплифицировали с помощью ПЦР с использованием конструкций pJG1-25 и pJG1-18 соответственно в качестве матриц и конструировали олигонуклеотиды для введения Nсо1-сайта в 5'- и 3'-концы указанных генов (олигонуклеотиды 13 и 14; таблица V) в целях клонирования в экспрессирующем векторе рРS7 Pichia pastoris. Процедура амплификации была аналогична процедуре, описанной выше. Плазмида рРS7 представляет собой интегрирующий вектор, содержащий фрагмент размером 1,15 т.п.н., соответствующий промотору фермента алкоголь-оксидазы (АОХ.1), за которым расположены ген, кодирующий сигнал секреции сахарозо-инвертазы (sucII) Saccharomyces cerevisiae, уникальный Nсо1-сайт клонирования, 960 п.н.-фрагмент фермента глицеральдегид-3-фосфатдегидрогеназы (Gapt) для гарантии завершения транскрипции и ген НIS3 Saccharomyces cerevisiae в качестве селективного маркера. Кроме того, этот вектор содержит фрагмент размером 2.1 т.п.н., соответствующий 3'-последовательности гена АОХ.1. Все указанные элементы встраивали в вектор pUC18 (Herrera Martinez LS et al., EP0438200A1).
Таблица V. Синтетические олигонуклеотиды, используемые в ПЦР для амплификации и модификации последовательностей, кодирующих первые основания VH и последние основания VL, в целях клонирования scFv и ди-антитела в векторе рPS7 и секвенирования этих клонов.
Олигонуклеотид 13. Nco1 - FR1 VH (SEQ ID NO:18)
5'...CATGCCATGGGGAATCCGAAGTGAAGCTGGTGGAG...3'
Олигонуклеотид 14. Nco1 - 6 гистидинов (антисмысловой) (SEQ ID NO:19)
5'...CATGCCATGGATCCCGGGGTGATGGTGATGGTGATG...3'
Олигонуклеотид 15. Промотор алкоголь-оксидазы рАОХ.1 (SEQ ID NO:20)
5'...GACTGGTTCCAATTGACAAGC...3'
После NcoI-гидролиза (Promega) амплифицированных полос, соответствующих scFv и ди-антителу, эти полосы независимо лигировали в вектор рРS7, предварительно гидролизованный тем же самым ферментом, и продукты лигирования использовали для независимой трансформации в штамм XL-1Bluе E.coli. Выделенные колонии, соответствующие штамму, трансформированному каждым рекомбинантным вектором, анализировали с помощью ПЦР колоний и с использованием праймера, который гибридизуется в области промотора (олигонуклеотид 15, таблица V) и другого праймера для 3'-конца VL (олигонуклеотид 8, таблица III). Затем отбирали колонии, содержащие правильно встроенную вставку. Секвенирование клонированных генов проводили в соответствии с описанной выше процедурой (процедура b примера 1) с использованием олигонуклеотида 15 (таблица V). Последовательности, полученные для VH- и VL-доменов рекомбинантных плазмид рРSМ2 (scFv) и рРSМ3 (ди-антитело), совпадали с последовательностями, описанными выше в SEQ ID NO:16 и SEQ ID NO:17.
Рекомбинантные штаммы Pichia pastoris получали с использованием этих двух плазмид путем электропорации обеих упомянутых плазмид, предварительно гидролизованных рестрицирующим ферментом PvuII (Promega), в штамм дикого типа МР36-his 3 (Yong V. et al., Biotechnol. Applic. 9: 55-61, 1992) и путем отбора на минимальной среде с дефицитом гистидина. Благодаря различным механизмам рекомбинации рекомбинантных плазмид, содержащих специфические сайты в геноме Pichia pastoris, для каждой конструкции могут быть выделены два различных фенотипа секреторных штаммов: (а) штаммов, в которых ген АОХ.1 не подвергается негативному воздействию во время события рекомбинации, а поэтому он растет на среде с метанолом и обнаруживает рост, аналогичный росту штамма дикого типа (Mut+), и (b) штаммы, в которых ген АОХ.1 заменен на экспрессионный кластер и обнаруживает медленный рост в присутствии метанола (Mut s).
Процедура (b). Исследования экспрессии
Исследования экспрессии фрагмента антитела проводили исходя из прототрофных колоний His+, выращенных в планшетах с селективной средой MD (азотистое основание дрожжей, биотин, декстроза). Выбранные колонии инокулировали в 10 мл обогащенной и забуференной среды BMGY (дрожжевой экстракт, пептон, фосфат калия, азотистые основания дрожжей, биотин и глицерин) в 50-миллиметровых пробирках и помещали при 28°С с вращением при 150 об/мин. После того как OD культуры при 600 нм достигала 2 единиц, как было измерено на оборудовании SPECTRONIC GENESIS 2, эти культуры центрифугировали при 2000 об/мин в течение 10 минут. Клеточный осадок ресуспендировали в 10 мл обогащенной среды с метанолом (BMMY) в качестве единственного источника углерода, который использовали вместо глицерина. С этого момента и в последующие 96 часов нужные белки индуцировали путем ежедневного добавления чистого метанола до конечной концентрации 1% в культуре. В качестве негативного контроля использовали штамм МР36-his 3, трансформированный вектором без вставки.
По окончании культивирования клетки центрифугировали, культуральную среду, преобразованную в ходе метаболизма во время проведения фазы индуцирования, собирали, снова центрифугировали для ее полного осветления и осуществляли детекцию scFv или ди-антитела с помощью электрофореза в 15% полиакриламидном геле с ДСН (ДСН-ПААГ). Этот тест выявил экспрессию для обоих белков с предполагаемым размером молекул (приблизительно 27 кДа), которые затем оценивали с помощью Вестерн-блот-анализа с использованием в качестве "первого" антитела Mab 9Е10, а затем, в качестве "второго" антитела, конъюгированных с пероксидазой хрена кроличьих антител против мышиных IgG (Sigma). Перенос белков осуществляли, как описано выше. Для проявления использовали DAB (Sigma) в качестве нерастворимого субстрата. Для двух конструкций рекомбинантные белки идентифицировали с использованием Mab 9Е10.
Процедура (с). Распознавание человеческого СЕА фрагментом scFv и ди-антителом в анализе ELISA
ELISA-тест проводили способом, почти аналогичным способу, описанному выше для материала, происходящего от E.coli, и использовали аналогичные твердые фазы, реагенты и покрытия, а также аналогичные условия инкубации, проявления и позитивного контроля. Образцы метаболизированной культуры индуцированных рекомбинантных штаммов разводили в PBS-1% молоко и добавляли при концентрации 100 мкл/лунку, после чего образцы инкубировали в течение 2 часов при комнатной температуре. В качестве негативного контроля использовали метаболизированную среду, соответствующую штамму МР36-his 3, и неродственное Mab. Полученные величины рассматривали как положительные, если поглощение по меньшей мере в 4 раза превышало таковое в условиях негативного контроля.
В этом эксперименте образцы конструкций scFv и ди-антитела в среде, метаболизированной в фазе индукции, которые экспрессировались в Pichia pastoris, давали положительный результат в отношении их способности к распознаванию человеческого СЕА, абсорбированного на поливиниловых планшетах.
Процедура (d). Распознавание человеческого СЕА, ассоциированного с клетками, в ELISA-анализе с использованием клеток (с-ELISA) и в непрямом иммунофлуоресцентном анализе
ELISA-тест проводили способом, почти аналогичным способу, описанному выше для материала, происходящего от E.coli, с использованием аналогичных твердых фаз, реагентов и покрытий, а также аналогичных условий инкубирования, проявления и позитивного контроля. Образцы метаболизированной культуры индуцированных рекомбинантных штаммов разводили в PBS-2% молоко, добавляли в планшеты с фиксированными клетками LoVo, AsPC-1 и LS174T и инкубировали в течение 2 часов при комнатной температуре и при легком помешивании. В этом тесте в качестве позитивного контроля использовали Mab CB/ior-CEA.1. Метаболизированные в фазе индуцирования культуры штамма МР36-his, трансформированного вектором рРS7, не содержащим вставки, и неродственное Mab использовали в качестве негативного контроля. Кроме того, в качестве негативного контроля использовали планшет с человеческими клетками НЕК 293.
В этом эксперименте была продемонстрирована способность scFv и ди-антитела к специфическому распознаванию человеческого СЕА на человеческих опухолевых клетках, фиксированных на полистироловых носителях, как показал метод ELISA.
Непрямой иммунофлуоресцентный анализ проводили способом, почти аналогичным способу, описанному выше для материала, происходящего от E.coli, где использовали аналогичные клетки для культивирования и аналогичные условия их фиксации, реагенты, условия инкубирования, проявления, заливки препарата, наблюдения под микроскопом и аналогичные критерии положительного результата. На планшетах с фиксированными клетками LoVo, AsPC-1 и LS174T определяли независимые зоны, на которые наносили образцы индуцированных культур рекомбинантных штаммов, соответствующих указанным двум конструкциям и образующих негативные зоны, разведенные в PBS-3% BSA, 0,02% азида натрия.
Инкубирование проводили при комнатной температуре в течение 1 часа во влажной камере, а затем несколько раз промывали холодной смесью PBS-BSA-азид натрия, и во все монослои в течение 1 часа при комнатной температуре во влажной камере добавляли Mab 9Е10. После нескольких промывок холодным PBS-3% BSA монослой инкубировали в темной влажной камере в течение 30 минут с антителами против мышиных IgG, конъюгированными с флуоресцеинизотиоцианатом (Sigma) и разведенными 1:64 в PBS-3% BSA. Планшеты пять раз промывали PBS-3% BSA, затем еще один раз - PBS и наконец окрашивали раствором голубого Эванса в течение нескольких минут. Монослои, покрытые PBS-10% глицерином, накрывали покровными стеклами и оценивали под ультрафиолетовым микроскопом.
В этом анализе в качестве позитивного контроля использовали Mab CB/ior-CEA.1. В качестве негативного контроля использовали индуцированную культуральную среду штамма МР36-his3, трансформированного вектором рРS7 без вставки, и неродственное Mab. Кроме того, в качестве негативного контроля использовали предметное стекло с клетками НЕК293. В этом эксперименте образцы индуцированных культур, секретирующих рекомбинантный scFv и ди-антитело, распознавали только клетки LoVo, AsPC-1 и LS174T. Все негативные контроли давали отрицательный результат. Таким образом, была продемонстрирована способность scFv и ди-антитела, продуцированного в Pichia pastoris, распознавать человеческий СЕА на человеческих опухолевых клетках, экспрессирующих этот антиген, фиксированный на полистироловых планшетах, на что указывал непрямой иммунофлуоресцентный анализ.
Пример 4. Очистка scFv и ди-антитела, продуцированных в бактериях
Процедура (а). Очистка фрагментов scFv и ди-антитела путем аффинной хроматографии на иммобилизованных ионах металла (IMAC) и ионообменной хроматографии
Присутствие домена из шести гистидинов в рекомбинантном белке, обеспечиваемое вектором pJG-1m, использовали для очистки. Эти последовательности сообщают белкам очень высокую аффинность по отношению к ионам металлов (например, к Zn2+, Cu2+, Ni2+), которые могут образовывать хелатные комплексы с различными хроматографическими носителями, что позволяет проводить простую и воспроизводимую очистку.
Рекомбинантные бактерии, полученные, как описано выше, центрифугировали, и периплазматическое содержимое выделяли с помощью осмотического шока и быстрой обработки ультразвуком (секунды), а затем диализовали в течение 72 часов в связующем буфере (Трис-HCl 20 мМ, 1М NaCl, 20 мМ имидазола, рН 7,0). Бактериальные периплазматические препараты, содержащие scFv и ди-антитело, наносили непосредственно и независимо на матрицу Сефароза-IDA-Cu2+ (Pharmacia). После связывания белков гели сначала промывали 10-кратным объемом связующего буфера, а затем аналогичным образом промывали промывочным буфером (Трис-HCl 20 мМ, 1М NaCl, 150 мМ имидазола, рН 7,0) для удаления примесных белков E.coli. Элюирование scFv и ди-антитела осуществляли Трис-HCl 20 мМ, 1М NaCl, 250 мМ имидазолом, рН 7,0. Образцы пиков элюирования подвергали электрофорезу в 12% ПААГ с ДСН для подтверждения присутствия нужных белков. Элюированные фракции, содержащие scFv и ди-антитело, концентрировали в устройствах UltraFree 15 (Amicon), диализовали в буферном растворе, содержащем Трис-HCl 20 мМ, рН 8,7, а затем подвергали второй стадии очистки с использованием ионообменника. Для этого образцы наносили на колонку Mono Q (Pharmacia) и элюировали линейным градиентом NaCl (0-1М). Образцы собранных пиков оценивали с помощью электрофореза в 12% ПААГ с ДСН. Затем подтверждали присутствие scFv и ди-антитела предполагаемых размеров (приблизительно 27 кДа). Конечная чистота этих двух молекул была почти аналогичной и составляла примерно 95%, на что указывал электрофорез в ПААГ с ДСН и окрашивание серебром. Пики чистого scFv и ди-антитела концентрировали в устройствах UltraFree 15 (Amicon) до 2 мг/мл. Биологическую активность очищенных препаратов подтверждали с помощью метода ELISA, а затем проводили процедуру, аналогичную процедуре, уже описанной в настоящем изобретении. Все образцы хранили при 4°С.
Процедура (b). Анализ scFv и ди-антитела с помощью гель-фильтрации
scFv и ди-антитело, очищенные, как описано в предыдущей процедуре, исследовали с помощью хроматографии на молекулярных ситах для определения гомогенности образцов и присутствия мультимеров. Для этой цели использовали Superdex 200 (Pharmacia), а стандартный метод гель-фильтрации осуществляли на ВЭЖХ-оборудовании. Было установлено, что scFv, сконцентрированный в главном пике размером приблизительно 27 кДа, соответствует мономерной форме. Ди-антитело, имеющее в основном размер приблизительно 45 кДА, соответствует димерной форме.
Пример 5. Характеристика указанного ди-антитела, полученная посредством протеолитического расщепления и масс-спектрометрии
Очищенное ди-антитело диализовали в течение ночи при 4°С против буферного раствора, содержащего 1% NH4НСО3 при рН 8,3 и мочевину в концентрации 2 моль/л. Диализованный белок гидролизовали трипсином, имеющим достаточную для секвенирования степень чистоты (Promega), в соотношении фермент:субстрат = 1:50, в течение 4 часов при 37°С. Протеолитический гидролиз прекращали путем подкисления равным объемом водного раствора 1% трифторуксусной кислоты и хранили при -20°С до проведения анализа на жидкостном хроматографе, подсоединенном к масс-спектрометру (ЖХ-МС).
Триптический гидролизат выделяли с помощью обращенно-фазовой хроматографии на жидкостном хроматографе АКТА Basic (Amersham Pharmacia Biotech) с использованием линейного градиента 0%-80% раствора В в течение 100 минут. Для получения градиента использовали следующие растворы: А: H2O/TFA, 0,05% и В: ацетонитрил/TFA, 0,05%.
Фракции, полученные в процессе протеолитического гидролиза, анализировали с помощью масс-спектрометрии с ионизацией электрораспылением (ESI-MS), которую проводили путем подсоединения масс-спектрометра к линии хроматографической системы, с получением комплексного ЖХ-МС-спектрометра с ортогональной геометрией QTOF-2 (Micromass Ltd). В процессе ЖХ-МС-измерения масс-спектры регистрировали в пределах 350-1800 за 0,98 секунд, где интервал между сканированиями составлял 0,02 секунд. Масс-спектрометр был откалиброван с использованием физиологического раствора, состоящего из смеси иодида натрия и цезия. Напряжение в конусе и капилляре составляло 50 и 3000 вольт соответственно. Спектры обрабатывали с использованием программ MassLinx v 3,5 (Micromass Ltd).
На фиг. 4 и в прилагаемой таблице представлены хроматографический профиль гидролиза ди-антитела трипсином и положения, присвоенные триптическим пептидам. В ESI-MS-спектрах не обнаруживались сигналы, указывающие на неправильно присоединенные цистеины, на что указывают систематизированные данные таблицы, приведенной на фиг. 4 для фракций 8-12, которые содержат пептиды (20Phe-Arg31)-S-S-(87Ser-Arg97) и (143Val-Lys148)-S-S-(186Ile-Lys228), связанные дисульфидными связями (-S-S-) между цистеинами 22 и 95 и 147 и 212 соответственно.
Из пептидов, проанализированных с помощью ESI-MS, 92% последовательности ди-антитела может быть получено за один цикл протеолитического гидролиза (фиг. 5). В этой последовательности наблюдалось полное совпадение с аминокислотными последовательностями, выведенными из нуклеотидной последовательности доменов VH и VL (SEQ ID NO:16 и 17), амплифицированной с помощью ПЦР исходя из РНК гибридомы, продуцирующей Mab CB/ior-CEA.1, последовательности линкерного сегмента, состоящего из 5 аминокислот (SEQ ID NO:10), а в С-концевой области последовательности пептида с-myc и конечных 6 гистидинов, присутствующих в векторе pJG-1m (фиг. 2).
Пример 6. Исследование распознавания дегликозилированного СЕА
Человеческое СЕА (Calbochem) ферментативно дегликозилировали эндогликозидазой PNGasa F (New England Biolabs), специфичной для N-гликозилирования. СЕА растворяли в фосфатном буфере 20 мМ рН 7,8 и денатурировали ДСН и 2-меркаптоэтанолом при 100°С в течение 5 минут. Затем в течение 2 часов при 37оС добавляли NP-40 и 1 мкл PNGasa F. Контрольные и дегликозилированные образцы анализировали с помощью электрофореза в ДСН-ПААГ с окрашиванием кумасси синим, в результате чего было выявлено значительное снижение молекулярной массы (примерно на 50%) после гидролиза эндогликозидазой. Вестерн-блот-анализ осуществляли с использованием (а) Mab CB/ior-CEA.1, (b) очищенного двухвалентного scFv (ди-антитела) или (с) антисыворотки против человеческого СЕА, полученной от мышей, в качестве "первых антител", а затем - поликлональных антител против Fab Mab CB/ior-CEA.1, конъюгированных с пероксидазой хрена, для (а) и (b), и антител против мышиных IgG, конъюгированных с пероксидазой хрена, для (с). Перенос и проявление осуществляли, как описано выше в процедуре Вестерн-блот-анализа согласно изобретению. Mab CB/ior-CEA.1 и ди-антитело распознавали только недегликозилированный антиген. Поликлональная антисыворотка распознавала СЕА до и после дегликозилирования.
Образцы нативного человеческого СЕА анализировали с помощью дот-блот-системы для распознавания специфических лектинов. В качестве лектинов использовали агглютинин Sambucus nigra (SNA) и агглютинин Maackia amurensis (MAA), специфичные в отношении концевой сиаловой кислоты и связанные альфа-2,6- и альфа-2, 3-связями соответственно. Лектины, используемые в этих экспериментах, конъюгировали с дигоксигенином, который идентифицировали с помощью антитела против дигоксигенина, меченного щелочной фосфатазой. Образцы, положительные по взаимодействию "лектин-олигосахарид", проявляли путем проведения реакции с субстратами, специфичными в отношении фосфатазы (смесь 4-нитросинего хлорида тетразолия и 5-бром-4-хлор-3-индолилфосфата). Из этих двух лектинов в качестве позитивного контроля в этом эксперименте использовали фетуин. Нативный СЕА распознавался SNA, но не МАА, что указывало на значительно преобладающее присутствие концевых сиаловых кислот, связанных альфа-2,6-связью.
Затем человеческий СЕА гидролизовали ферментами NANAзой II и экзогликозидазой (сиалидазой), способными гидролизовать концевые сиаловые кислоты с альфа-2,6-связями. Продукты гидролиза разделяли с помощью электрофореза в ДСН-ПААГ, и исследование по их способности к распознаванию проводили с помощью Вестерн-блот-анализа с использованием Mab CB/ior-CEA.1 в качестве "первых" антител, а также с использованием антисыворотки против человеческого СЕА, взятой у мыши. Результаты показали, что нативный СЕА, используемый в качестве контроля, распознавался обоими образцами, а СЕА, гидролизованный NANAзой II, распознавался только мышиной антисывороткой против СЕА.
Пример 7. Иммуноцитологическое и гистохимическое исследование нормальных и опухолевых тканей человека
Исследование тканей проводили на образцах, отобранных из архивов нормальных и опухолевых тканей, полученных при аутопсии. Минимальную панель тканей использовали для подтверждения распознавания, уже описанного для Mab CB/ior-CEA.1 (Tormo B. et al., APMIS 97: 1073-1080, 1989). Эти образцы включали в себя карциномы легких, кожи, молочной железы, шейки матки, пищевода и почек; аденокарциномы толстой кишки, предстательной железы, поджелудочной железы, желчного пузыря, тонкого кишечника и желудка; опухоли нервного, гемопоэтического и саркоматозного происхождения; а также нормальные ткани слизистой толстой кишки и нормальные ткани печени, почек, легких, яичек, селезенки и поджелудочной железы, включая также клетки крови.
Это исследование проводили в соответствии с уже известными процедурами (Tormo B. et al., APMIS 97:1073-1080, 1989), но с некоторыми изменениями. Образцы тканей фиксировали в 10% забуференном формалине, дегидратировали, осветляли и заливали в парафин в соответствии с рутинными процедурами. Гистопатологический анализ проводили в срезах, окрашенных гематоксилинэозином. Затем срезы указанных блоков, оцененные с помощью гистопатологического анализа, использовали в иммунопероксидазном методе.
Повторно гидратированные срезы без парафина обрабатывали 3% H2O2 в течение 30 минут для блокирования эндогенной пероксидазы, промывали забуференным фосфатом физиологическим раствором (PBS) и инкубировали с образцами, после чего их разводили в PBS-1% альбумине бычьей сыворотки (буфер для разведения) в течение одного часа. Затем предметные стекла инкубировали в течение 30 минут с биотинилированными поликлональными кроличьими антителами против IgG при разведении 1:100, полученными путем иммунизации Fab-фрагментом Mab CB/ior-CEA.1, и наконец в течение того же периода времени с комплексом "пероксидаза-стрептавидин" при разведении 1:500 (Amersham).
Оцениваемые образцы представляли собой:
(а) Mab CB/ior-CEA.1 (позитивный контроль) при концентрации 20 мкг/мл,
(b) scFv E.coli, очищенный, как описано в примере 4 в процедуре (а), при концентрации 50 мкг/мл,
(с) ди-антитело E.coli, очищенное, как описано в примере 4 в процедуре (а), при концентрации 50 мкг/мл,
(d) предварительно полученный и очищенный scFv, обозначенный "F3" в этих примерах (Ayala M. et al., Biotechniques 13:790-799, 1992; Perez L. et al., Applied Biochem. Biotechnol. 24:79-82, 1996), при концентрациях 50 и 100 мкг/мл.
Все разведения делали в буфере для разведения, а инкубирование проводили при комнатной температуре во влажной камере. В промежутках между стадиями проводили 3 промывки по 1 минуте, каждую из которых осуществляли буфером для разведения или PBS. Иммунопероксидазную реакцию проявляли путем инкубации в течение 5-10 минут с раствором, содержащим 3 мг диаминобензидина, 5 мл PBS и 5 мл 30% H2O2. Предметные стекла подвергали контрастному окрашиванию гематоксилином Мейера. Характерную цветовую реакцию с коричневой окраской регистрировали как отрицательную и положительную, с тремя увеличивающимися уровнями интенсивности (1+, 2+, 3+). На каждом предметном стекле мечение проводили с использованием нужного образца, а в примыкающей зоне - с использованием буфера для разведения в качестве негативного контроля.
Для исследований в клетках крови эритроциты сначала удаляли, а оставшиеся лейкоциты наносили на предметные стекла, покрытые желатином, и фиксировали смесью ацетон:метанол=1:1 (об./об.). Остальная часть этой техники была разработана в основном так, как описано выше.
Полученные результаты, относящиеся к исследуемым тканям, были систематизированы в таблице VI. Исследуемые нормальные ткани (печени, почек, легких, яичек, крови, селезенки, поджелудочной железы) не распознавались указанными фрагментами или Mab. В случае слизистой толстой кишки и в соответствии с данными, полученными выше для Mab CB/ior-CEA.1, фрагмент scFv F3, новый фрагмент scFv и ди-антитело реагировали исключительно с продуктами люминальной секреции и в апикальных зонах некоторых желез. Интенсивность реакции в случае scFv F3 была ниже, и то же самое позже наблюдалось для некоторых опухолей. В случае клеток крови Mab, scFv и ди-антитело не обнаруживали какой-либо реакции с нормальными лимфоцитами и нейтрофилами, что указывало на отсутствие значительной перекрестной реактивности с антигеном NCA. И напротив, фрагмент scFv F3 обнаруживал некоторый слабый уровень распознавания этих клеток.
Mab, scFv и ди-антитело реагировали с большинством опухолей желудочно-кишечного тракта, и интенсивное мечение наблюдалось в большинстве этих случаев как в апикальной зоне опухолевых клеток, так и в цитоплазме. Ни один из этих образцов не обнаруживал меченых опухолей гемопоэтического и саркоматозного происхождения или других опухолей эпителиального происхождения, за исключением канальцевой карциномы молочной железы и крупноклеточной карциномы легких. В высокодифференцированных аденокарциномах толстой кишки интенсивное мечение наблюдалось в апикальной зоне цитоплазмы и в продуктах люминальной секреции, а в умеренно- и низкодифференцированных аденокарциномах мечение наблюдалось по всей цитоплазме. Исключение составляли лишь очень немногие образцы, где интенсивности окрашивания были почти одинаковыми для всех трех молекул.
В случае F3 наблюдалось общее снижение интенсивности окрашивания, даже в тех некоторых случаях, когда концентрации в два раза превышали концентрации, используемые для scFv и ди-антитела. Более низкая интенсивность окрашивания могла приводить к тому, что некоторые образцы, распознаваемые другими антителами, не распознавались F3.
Пример 8. Определение константы аффинности
Для определения константы аффинности использовали неконкурентный анализ ELISA (Beatty J.D. et al., J. Immunol. Meth. 100:173-184, 1987), основанный на законе действующих масс. Константа аффинности Кaff равна [AgAb]/[Ag][Ab], где AgAb представляет собой комплекс антиген-антитело в л/моль (М-1), [Ag] представляет собой концентрацию свободного антигена (моль), а [Ab] представляет собой концентрацию свободного антитела (моль).
Для покрытия поливиниловых ELISA-планшетов (Costar) использовали четыре двойных серийных разведения человеческого СЕА (Calbochem). Планшеты блокировали PBS-сепарированным молоком, 1%. На эти планшеты наносили образцы (scFv F3, scFv, ди-антитело, Mab CB/ior-CEA.1, все образцы были очищенными) при различных концентрациях. После промывки лунки, соответствующие трем первым образцам, инкубировали с Mab 9E10 (10 мкг/мл), а для лунок, соответствующих Mab CB/ior-CEA.1, использовали блокирующий раствор. На следующей стадии добавляли конъюгированное с пероксидазой хрена антитело против мышиных IgG (Sigma) при разведении 1:2500 и выдерживали в течение 1 часа при 37°С. В качестве субстрата использовали OPD, и реакцию проявляли в течение 15 минут. Считывание оптической плотности проводили при 492 нм на устройстве LabSystems Multiskan MS. Для каждого случая строили кривые, где на оси ординат (Y) откладывали величины оптической плотности (OD), а на оси абсцисс (Х) откладывали концентрацию в нг/мл, в виде логарифма с основанием 10. OD 100 принимали за величину, при которой поддерживался максимальный сигнал. Для каждой кривой вычисляли половину от величины при OD 100 (OD 50). Для каждой кривой определяли величины концентрации для каждого образца при OD 50, а аффинность вычисляли по следующей формуле: Кaff=(n-1)/2(n), где n=[Ab']t/[Ab]t. [Ab']t представляет собой величину концентрации образца, которая соответствует величине при OD 50 для наивысшей сравниваемой концентрации антигена, а [Ab]t представляет собой величину концентрации образца, которая соответствует величине при OD 50 для самой низшей сравниваемой концентрации антигена. Конечную величину Кaff определяли как среднюю величину из шести возможных определений аффинности для 4 построенных кривых.
В таблице VII представлены величины Кaff, вычисленные для каждого из анализируемых вариантов. scFv имеет Кaff (5,0 ± 0,4) х 109 л·моль-1, и эта величина на один порядок больше и наполовину выше величины, полученной для F3 (Кaff (9,2 ± 0,8) х 107 л·моль-1). Это последнее значение в основном соответствует значению, вычисленному для F3 при измерениях, проводимых другим методом (Perez L. et al., Applied Biochem. Biotechnol. 24:79-82, 1996). Ди-антитело имеет Кaff (2,8 ± 0,3) х 1010 л·моль-1, а Mab CB/ior-CEA.1 имеет Кaff (6,1 ± 0,5) х 1010 л·моль-1.
Пример 9. Определение способности 125I-меченных фрагментов и антитела к специфическому распознаванию in vivo у мышей С57ВI/6, несущих опухоли, индуцированные путем инокуляции клеток В16-СЕА13
Для определения способности фрагментов антитела к специфическому распознаванию in vivo нижеследующие молекулы метили125I (Amersham, UK) иодогенным методом (Fraker P.J., Speck J.C. Jr. Biochem. Biophys Res. Comm. 80:849-857, 1978), а именно следующих фрагментов:
(а) scFv, выделенный из E.coli (удельная активность 1,1 МБк/5 мкг);
(b) ди-антитело, выделенное из E.coli (удельная активность 1,2 МБк/5 мкг);
(с) Mab CB/ior-CEA.1 (удельная активность 1,8 МБк/5 мкг);
(d) очищенный scFv F3 (Ayala et al., Biotechniques 13:790-799, 1992; Perez L. et al., Applied Biochem. Biotechnol. 24:79-82, 1996) (удельная активность 1,0 МБк/5 мкг).;
Радиоактивно меченные продукты анализировали с помощью тонкослойной хроматографии для определения включений в белок, и были получены величины, составляющие 95-98% радиоактивности. Способность радиоактивных продуктов к детекции СЕА анализировали в системе, в которой полистироловые пробирки покрывали СЕА (5 мкг/мл; Calbochem), блокировали и добавляли образцы радиоактивно меченных продуктов, скорректированных по количеству антитела, которое может быть иммобилизовано на этой твердой фазе. После инкубирования и промывки было определено, что для образцов (а)-(d), описанных выше, твердой фазой было захвачено 80%, 79%, 83% и 81% радиоактивности соответственно, что указывало на то, что процедура радиоактивного мечения не оказывала заметного воздействия на биологическую активность антител.
Для исследования биологического распределения брали 4 группы животных, каждая из которых включала в себя 12 мышей С57ВI/6 (CENPALAB, Cuba). Этих животных внутримышечно инокулировали 1 х 106 клеток В16-СЕА13 на животное путем внутримышечного введения. Через 7 дней появлялись опухоли, которые были заметны и пальпировались (приблизительно 0,3-0,5 г), после чего мышам в хвостовую вену инъецировали нужный радиоактивно меченный продукт, и через 12, 24 и 48 часов мышей умерщвляли, а затем хирургически удаляли опухоль и нормальные ткани селезенки, печени, почек, тонкой кишки, мышц, костного мозга и крови. Накопление радиоактивности выражали как процент вводимой дозы на грамм ткани. Калибровку проводили с использованием стандартного образца вводимой дозы. Радиоактивность определяли с использованием сцинтилляционного гамма-счетчика.
Клетки В16-СЕА13, используемые в этих экспериментах, получали путем трансфекции гена, кодирующего внеклеточные домены человеческого СЕА, клонированные в векторе pDisplayTM (Cat. № V660-20, Invitrogen). Этот ген получали с помощью ПЦР исходя из РНК, экстрагированной из клеток CRL-1682, с использованием олигонуклеотидов, сконструированных для модификации известной последовательности человеческого СЕА. Рекомбинантную плазмиду pDisplay-CEA очищали и трансфицировали в клетки меланомы В16-F10 мышей С57В1/6 (АТСС CRL-6475) с использованием липофектамина (Lipofectamine PLUSTM) (Gibco BRL) и 5 мкг ДНК для трансфекции. Отбор стабильных трансфектантов проводили с использованием 4,0 мг/мл сульфата генетицина (G418, Gibco-BRL) в течение 14 дней, после чего выжившие культивированные клетки клонировали путем лимитирующего разведения, и клоны, которые экспрессировали на своей поверхности человеческий СЕА, идентифицировали непрямым иммунофлуоресцентным методом с использованием Mab CB/ior-CEA.1 в качестве "первого" антитела и антитела против мышиных IgG, конъюгированного с ФИТЦ (Sigma) для проявления реакции. Было обнаружено, что 73% клонов представляли более чем 80% клеток со специфической мембранной флуоресценцией, что указывало на то, что человеческий СЕА был правильно уложен и гликозилирован на их поверхности.
Клетки, не трасфицированные В16-F10, использовали в качестве контроля. Копии клонов, отобранных как положительные посредством непрямого иммунофлуоресцентного анализа, размножали и независимо инъецировали мышам С57В1/6 в количестве 1 х 106 клеток на животное путем внутримышечного введения. Из 10 клонов, которые образовывали опухоли, один клон, обозначенный В16-СЕА13, обнаруживал более быстро прогрессирующий рост и был отобран для описанных здесь экспериментов.
На фиг. 6 приведен процент радиоактивности исследуемой ткани через различные промежутки времени (по отношению к общей инъецированной дозе) и отношение "радиоактивность в опухоли: радиоактивность в крови". Результаты, приведенные в таблице VIII, показали, что через 24-48 часов отношение "радиоактивность в опухоли: радиоактивность в крови" поддерживалась на высоком уровне для ди-антитела, scFv и Mab, где последнее имело наиболее высокие значения, а за ним следовали значения для димерной молекулы. F3 обнаруживало очень низкие значения с неадекватным поведением in vivo, что могло быть обусловлено пониженной аффинностью к СЕА.
Реферат
Изобретение относится к области биотехнологии и может найти применение в медицине для иммунотерапии опухолей. Изобретение касается моновалентных и двухвалентных одноцепочечных (ди-антитело) Fv-фрагментов (scFv) антител, полученных с использованием РНК, экстрагированной и продуцирующей Mab CB/ior-CEA.1 гибридомы. Фрагменты антител по изобретению имеют установленную аминокислотную последовательность (приведена в перечне последовательностей), специфичны в отношении человеческого СЕА, имеют константу аффинности к СЕА, составляющую для моновалентного фрагмента (5, 0±0,4)х109 л·моль-1 и (2,8±0,3)х1010 л·моль-1 для ди-антитела. Показана возможность их использования в составе фармацевтических композиций для лечения СЕА-экспрессирующих человеческих опухолей и определения in vivo локализации опухоли. Описана генетически модифицированная клетка, экспрессирующая указанный фрагмент антитела, а также многоклеточный генетический модифицированный организм, в частности трансгенное растение. Описан плазмидный вектор, содержащий нуклеотидную последовательность, кодирующую указанный фрагмент антитела. Фрагменты scFv моновалентного антитела и ди-антитела не имеют Fc-доменов и имеют меньший размер молекулы, чем мышиное Mab, что дает возможность фрагментам лучше проникать в ткани in vivo и оказывать меньшее иммуногенное действие при использовании на живом организме. 9 н. и 3 з.п. ф-лы, 6 ил., 8 табл.

Комментарии