Антитела и иммуноконъюгаты и их применения - RU2436796C2
Код документа: RU2436796C2
Чертежи




















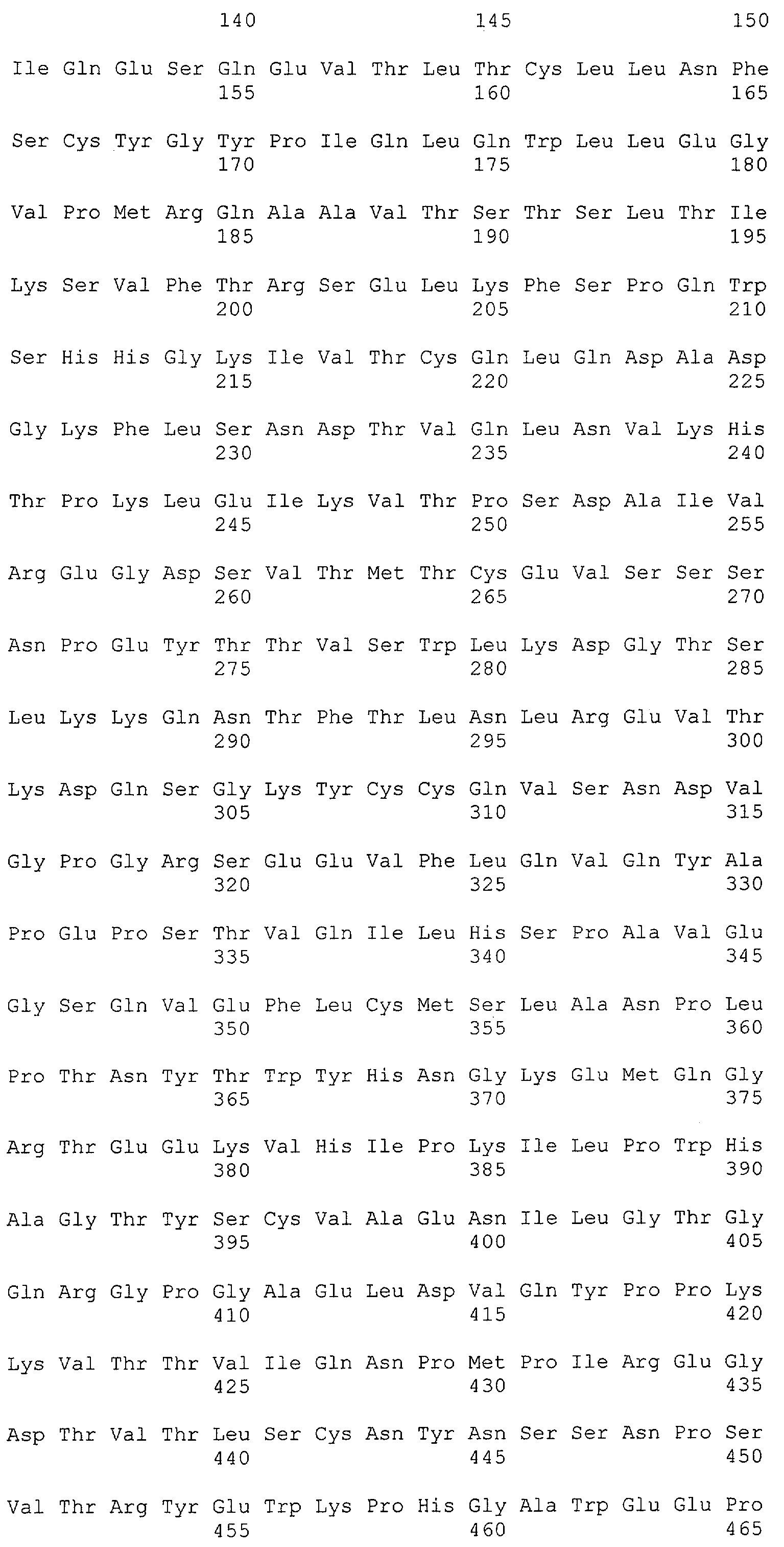




































































Описание
Эта заявка представляет собой непредварительную заявку, поданную в соответствии с 37 CFR раздел 1.53(b), по которой испрашивается приоритет в соответствии с 35 USC раздел 119(e) предварительных заявок США с серийными номерами 60/809328, поданной 30 мая 2006 года, 60/908941, поданной 29 марта 2007 года, и 60/911829, поданной 13 апреля 2007 года, полное содержание которых, таким образом, приведено в описании в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителам к CD22 и их иммуноконъюгатам. Изобретение, кроме того, относится к способам применения антител к CD22 и их иммуноконъюгатов.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Лимфоциты представляют собой один из многих типов лейкоцитов, образующихся в костном мозге в процессе гемопоэза. Существуют две популяции лимфоцитов: B-лимфоциты (B-клетки) и T-лимфоциты (T-клетки). В настоящей заявке лимфоцитами, представляющими особый интерес, являются B-клетки.
B-клетки созревают в костном мозге и покидают костный мозг, экспрессируя на своей поверхности антигенсвязывающее антитело. Когда наивная B-клетка впервые встречает антиген, к которому специфично ее связанное с мембраной антитело, клетка начинает быстро делиться и ее потомство дифференцируется в B-клетки памяти и эффекторные клетки, называемые "плазматические клетки". B-клетки памяти обладают более длительной продолжительностью жизни и продолжают экспрессировать связанное с мембраной антитело с той же специфичностью, что и исходная родительская клетка. Плазматические клетки не продуцируют связанное с мембраной антитело, но вместо этого продуцируют антитело в форме, которую можно секретировать. Секретируемые антитела являются основными эффекторными молекулами гуморального иммунитета.
Связанные с B-клетками нарушения включают, в качестве неограничивающих примеров, злокачественную лимфому (неходжкинская лимфома, NHL), множественную миелому и хронический лимфолейкоз (CLL, B-клеточный лейкоз (CD5+ B-лимфоциты). Неходжкинские лимфомы (NHL), гетерогенная группа злокачественных опухолей, преимущественно возникающих из B-лимфоцитов, представляют собой приблизительно 4% всех вновь диагностированных злокачественных опухолей (Jemal, A. et al., CA-Cancer J. Clin., 52: 23-47, (2002)). Агрессивная NHL включает приблизительно 30-40% взрослых NHL (Harris, N.L. et al., Hematol. J. 1: 53-66 (2001)) и включает диффузную крупноклеточную B-клеточную лимфому (DLBCL), лимфому мантийных клеток (MCL), лимфому периферических T-клеток и анапластическую крупноклеточную лимфому. Передовая сочетанная химиотерапия вылечивает менее чем половину пациентов с агрессивной NHL, и большинство пациентов, в конечном счете, умирают от этого заболевания (Fisher, R.I. Semin. Oncol. 27(suppl. 12): 2-8 (2000)).
Связанные с B-клетками нарушения также включают аутоиммунные заболевания. Аутоиммунные заболевания остаются клинически важными заболеваниями у людей. Как видно из названия, аутоиммунные заболевания воздействуют посредством собственной иммунной системы организма. Хотя у конкретных типов аутоиммунных заболеваний патологические механизмы отличаются, один из основных механизмов включает связывание определенных антител (называемых в настоящем документе как аутореактивные антитела или аутоантитела) с эндогенными белками организма. Доктора и ученые идентифицировали более 70 клинически определенных аутоиммунных заболеваний, включая ревматоидный артрит, рассеянный склероз, васкулит, иммуноопосредованный диабет и волчанку, такую как системная красная волчанка. Хотя многие аутоиммунные заболевания являются редкими - поражая менее 200000 индивидуумов - в совокупности эти заболевания поражают миллионы американцев, приблизительно пять процентов населения, где большинство заболеваний непропорционально поражает женщин. Хронический характер этих заболеваний приводит к громадной социальной и финансовой нагрузке.
Цитотоксические средства, нацеленные на поверхностные антигены B-клеток, представляют собой важный фокус лечения связанной с B-клетками злокачественной опухоли. Один такой поверхностный антиген B-клеток представляет собой CD20. Первым терапевтическим антителом, одобренным United States Food and Drug Administration для лечения рецидивирующей или устойчивой низкодифференцированной или фолликулярной NHL, был ритуксимаб (ритуксан; Genentech, Inc. (South San Francisco, CA) и IDEC Pharmaceutical Corp. (San Diego, CA)), химерное (мышь/человек) моноклональное антитело к CD20 (Leonard, J.P. et al., Clin. Cane. Res. 10: 5327-5334 (2004)).
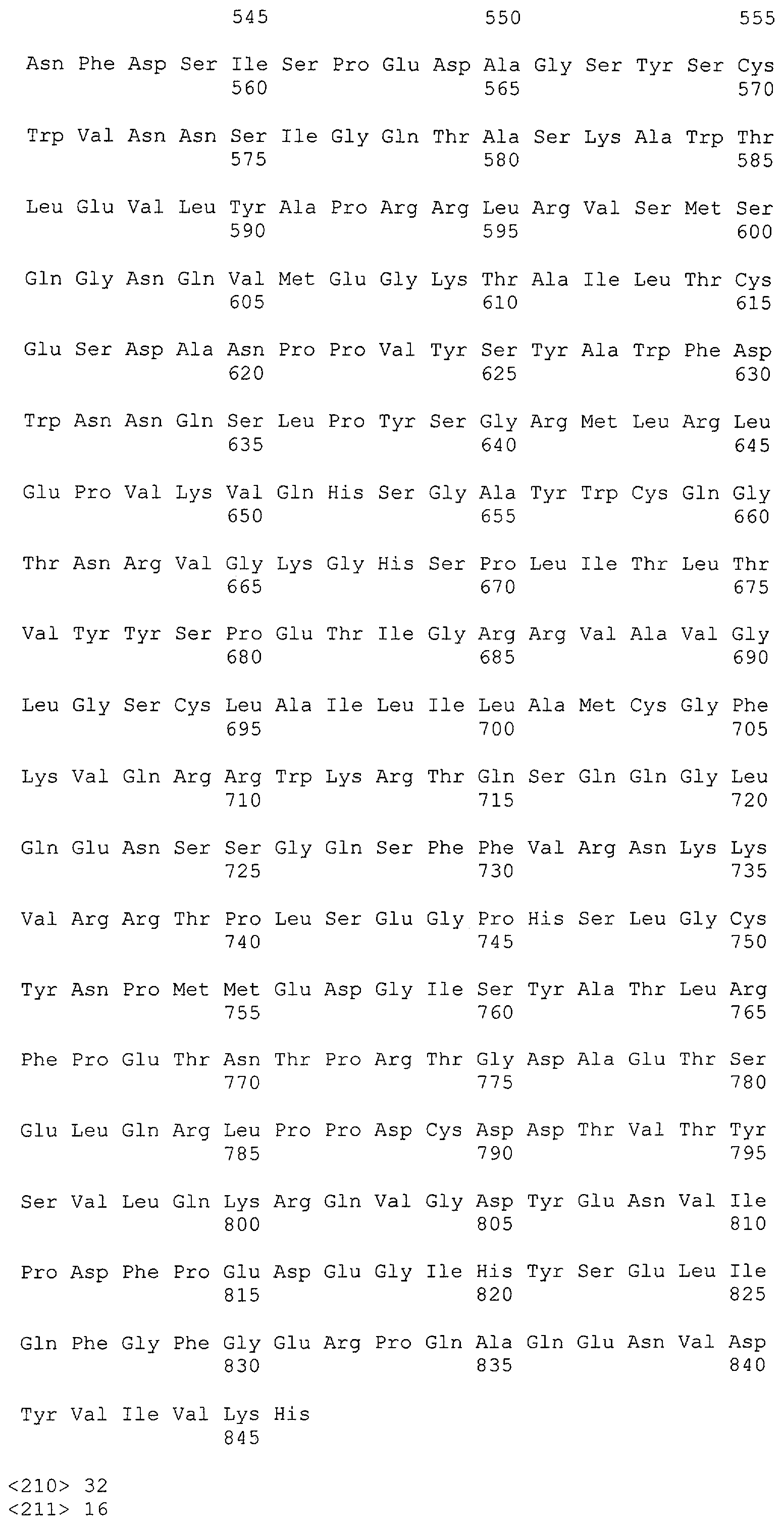
Другие B-клеточные антигены, такие как CD19, CD22 и CD52, представляют мишени терапевтического потенциала для лечения лимфомы (Grillo-Lopez A.J. et al., Curr. Pharm. Biotechnol., 2: 301-11, (2001)). CD22 представляет собой 135 кДа рестриктированный B-клетками сиалогликопротеин, экспрессируемый только на поверхности B-клеток на поздних стадиях дифференцировки (Dorken, B. et al., J. Immunol. 136: 4470-4479 (1986)). Преобладающей формой CD22 у людей является CD22-бета, который содержит во внеклеточном домене семь доменов иммуноглобулинового суперсемейства (фиг.1) (Wilson, G.L. et al., J. Exp. Med. 173: 137-146 (1991)). У другой формы, CD22-альфа, отсутствуют домены иммуноглобулинового суперсемейства 3 и 4 (Stamenkovic, I. and Seed, B., Nature 345: 74-77 (1990)). Показано, что связывание лигандов с CD22 человека ассоциировано с доменами иммуноглобулинового суперсемейства 1 и 2 (также обозначаемыми как эпитопы 1 и 2) (Engel, P. et al., J. Exp. Med. 181: 1581-1586, 1995).
При B-клеточной NHL экспрессия CD22 находится в диапазоне от 91% до 99% в агрессивной и медленно растущей популяциях, соответственно (Cesano, A. et al., Blood 100: 350a (2002)). CD22 может функционировать в качестве компонента активационного комплекса B-клетки (Sato, S. et al., Semin. Immunol. 10: 287-296 (1998)) и в качестве молекулы адгезии (Engel, Pl et al., J. Immunol. 150:4719-4732 (1993)). B-клетки мышей с отсутствием CD22 обладают более короткой продолжительностью жизни и усиленным апоптозом, что свидетельствует о ключевой роли этого антигена в жизнеспособности B-клеток (Otipoby, K.L. et al., Nature (Lond) 384: 634-637 (1996)). После связывания с ее природным лигандом(ами) или антителами CD22 быстро интернализуется, обеспечивая мощный костимулирующий сигнал в первичных B-клетках и проапоптотические сигналы в неопластических B-клетках (Sato, S. et al., Immunity 5: 551-562 (1996)).
Антитела к CD22 исследовали в качестве потенциальных лекарственных средств для B-клеточных злокачественных опухолей и других B-клеточных пролиферативных заболеваний. Такие антитела к CD22 включают RFB4 (Mansfield, E. et al., Blood 90: 2020-2026 (1997)), CMC-544 (DiJoseph, J.F., Blood 103: 1807-1814 (2004)) и LL2 (Pawlak-Byczkowska, E.J. et al., Cancer Res. 49: 4568-4577 (1989)). Антитело LL2 (ранее называемое HPB-2) представляет собой моноклональное антитело IgG2a мыши, направленное к антигену CD22 (Pawlak-Byczkowska, E.J. et al., (1989), выше). Иммуногистохимические анализы in vitro продемонстрировали реактивность антитела LL2 относительно 50 из 51 тестируемых образцов B-клеточной NHL, но не относительно других злокачественных опухолей или нормальных лимфоидных тканей (Pawlak-Byczkowska (1989), выше; Stein, R. et al., Cancer Immunol. Immunother. 37: 293-298 (1993)).
Применение конъюгатов антитело-лекарственное средство для локальной доставки цитотоксических или цитостатических средств, т.е. лекарственных средств для уничтожения или ингибирования опухолевых клеток при лечении злокачественной опухоли (Syrigos and Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drg Del. Rev. 26: 151-172; патент США 4975278), обеспечивает направленную доставку молекулы лекарственного средства к опухолям и накопление внутри них, когда системное введение этих неконъюгированных лекарственных средств может приводить к неприемлемым уровням токсичности для нормальных клеток, также как и для опухолевых клеток, которые необходимо устранить (Baldwin et al., (1986) Lancet pp.(Mar. 15, 1986): 603-05; Thorpe, (1985) "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", в Monoclonal Antibodies '84: Biological And Clinical Applications, A. Pinchera et al., (ed.), p.475-506). Таким образом добиваются максимальной эффективности с минимальной токсичностью. Как о пригодных при этих стратегиях сообщалось и о поликлональных антителах, и о моноклональных антителах (Rowland et al., (1986) Cancer Immunol. Immunother., 21: 183-87). Лекарственные средства, применяемые в этих способах, включают дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al., Cancer Immunol. Immunother. 21: 183-87 (1986)). Токсины, применяемые в конъюгатах антитело-токсин, включают бактериальные токсины, такие как дифтерийный токсин, растительные токсины, такие как рицин, низкомолекулярные токсины, такие как гелданамицин (Kerr et al., (1997) Bioconjugate Chem. 8(6): 781-784; Mandler et al., (2000) Journal of the Nat. Cancer Inst. 92(19): 1573-1581; Mandler et al., (2000) Bioorganic & Med. Chem. Letters 10: 1025-1028; Mandler et al., (2002) Bioconjugate Chem. 13: 786-791), майтанзиноиды (EP 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93: 8618-8623) и калихимицин (Lode et al., (1998) Cancer Res. 58: 2928; Hinman et al., (1993) Cancer Res. 53: 3336-3342). Токсины могут осуществлять свое цитотоксическое и цитостатическое действие посредством механизмов, включающих связывание тубулина, связывание ДНК или ингибирование топоизомеразы (Meyer, D.L. and Senter, P.D. "Recent Advances in Antibody Drug Conjugates for Cancer Therapy" в Annual Reports in Medicinal Chemistry, Vol.38 (2003) Chapter 23, 229-237). Некоторые цитотоксические лекарственные средства при конъюгации с большими антителами или белковыми лигандами рецепторов имеют тенденцию становиться неактивными или менее активными.
ZEVALIN® (зевалин®) (ибритумомаб тиуксетан, Biogen/Idec) представляет собой конъюгат антитело-радиоактивный изотоп, состоящий из моноклонального антитела IgG1 каппа мыши, направленного к антигену CD20, находящемуся на поверхности нормальных и злокачественных B-лимфоцитов, и радиоактивного изотопа111In или90Y, связанного посредством тиомочевинного линкера-хелатора (Wiseman et al., (2000) Eur. Jour. Nucl. Med. 27(7): 766-77; Wiseman et al., (2002) Blood 99(12): 4336-42; Witzig et al., (2002) J. Clin. Oncol. 20(10): 2453-63; Witzig et al., (2002) J. Clin. Oncol. 20(15): 3262-69). Хотя зевалин обладает активностью против B-клеточной неходжкинской лимфомы (NHL), введение у большинства пациентов приводит к тяжелым и продолжительным цитопениям. В 2000 году для лечения острого миелолейкоза посредством инъекции одобрен MYLOTARG™ (милотарг™) (гемтузумаб озогамицин, Wyeth Pharmaceuticals), конъюгат антитело-лекарственное средство, состоящий из антитела CD33 человека, связанного с калихимицином (Drugs of the Future (2000) 25(7):686; патенты США №4970198; 5079233; 5585089; 5606040; 5693762; 5739116; 5767285; 5773001). Для лечения злокачественных опухолей, экспрессирующих антиген CanAg, таких как злокачественная опухоль толстого кишечника, поджелудочной железы, желудка и других, разработан кантузумаб мертанзин (Immunogen, Inc.), конъюгат антитело-лекарственное средство, состоящий из антитела huC242, связанного посредством дисульфидного линкера SPP с молекулой майтанзиноидного лекарственного средства, DM1. В разработке для потенциального лечения опухолей предстательной железы находится MLN-2704 (Millennium Pharm., BZL Biologies, Immunogen Inc.), конъюгат антитело-лекарственное средство, состоящий из моноклонального антитела к специфическому мембранному антигену простаты (PSMA), связанного с молекулой майтанзиноидного лекарственного средства, DM1. Ту же молекулу майтанзиноидного лекарственного средства, DM1, посредством недисульфидного линкера, SMCC, связали с моноклональным антителом мыши, TA.1 (Chari et al., (1992) Cancer Research 52: 127-131). Сообщалось, что этот конъюгат в 200 раз менее эффективен, чем соответствующий конъюгат с дисульфидным линкером. В приведенном документе предположено, что линкер SMCC был "нерасщепляемым".
Из морского моллюска, Dolabella auricularia, выделено несколько коротких пептидных соединений и обнаружено, что они обладают биологической активностью (Pettit et al., (1993) Tetrahedron 49: 9151; Nakamura et al., (1995) Tetrahedron Letters 36: 5059-5062; Sone et al., (1995) Journal Org. Chem. 60: 4474). Также получены аналоги этих соединений и для некоторых из них обнаружено, что они обладают биологической активностью (для ознакомления, см. Pettit et al., (1998) Anti-Cancer Drug Design 13: 243-277). Например, ауристатин E (US 5635483) представляет собой синтетический аналог природного морского продукта доластатина 10, средства, ингибирующего полимеризацию тубулина посредством связывания того же участка на тубулине, что и противораковое лекарственное средство винкристин (G.R. Pettit, (1997) Prog. Chem. Org. Nat. Prod. 70: 1-79). Доластатин 10, ауристатин PE и ауристатин E представляют собой линейные пептиды из четырех аминокислот, три из которых являются уникальными для соединений класса доластатина, и C-концевой амид.
Ауристатиновые пептиды, ауристатин E (AE) и монометилауристатин (MMAE), синтетические аналоги доластатина, конъюгировали с (i) химерными моноклональными антителами cBR96 (специфичными к антигенам Lewis Y на карциномах); (ii) cAC10, специфичным к CD30 на злокачественных новообразованиях гематологического происхождения (Klussman, et al. (2004), Bioconjugate Chemistry 15(4): 765-773; Doronina et al. (2003) Nature Biotechnology 21(7): 778-784; "Monometylvaline Compounds Capable of Conjugation to Ligands"; Francisco et al. (2003) Blood 102(4): 1458-1465; US 2004/0018194); (iii) антителами к CD20, такими как Rituxan® (ритуксан®, ритуксимаб) (WO 04/032828), для лечения экспрессирующих CD20 злокачественных опухолей и иммунных нарушений; (iv) антителами к EphB2 2H9 и антителами к IL-8 для лечения колоректального рака (Mao, et al. (2004) Cancer Research 64(3): 781-788); (v) антителом к E-селектину (Bhaskar et al. (2003) Cancer Res. 63: 6387-6394) и (vi) другими антителами к CD30 (WO 03/043583). Монометилауристатин (MMAE) также конъюгировали с 2H9 антителом к EphB2R, который представляет собой т/м тирозинкиназный рецептор 1 типа с большой гомологией у мыши и человека и который сверхэкспрессирован в клетках колоректального рака (Mao et al. (2004) Cancer Res. 64: 781-788).
Монометилауристатин MMAF, вариант ауристатина E (MMAE) с фенилаланином на C-конце (патент США №5767237; патент США №6124431), является менее сильнодействующим, чем MMAE, но более сильнодействующим при конъюгации с моноклональными антителами (Senter et al., Proceedings of the American Association for Cancer Research, Volume 45, реферат номер 623, представленный 28 марта 2004 года). Ауристатин F фенилендиамин (AFP); вариант MMAE с фенилаланином соединяли с mAb к CD70, 1F6, посредством C-конца 1F6 через фенилендиаминовый спейсер (Law et al., Proceedings of the American Association for Cancer Research, Volume 45, реферат номер 625, представленный 28 марта 2004 года).
В качестве возможных терапевтических соединений также исследовали конъюгаты антитело к CD22-токсину. Например, в прежних публикациях в качестве противораковых средств описаны содержащие цепь рицина A иммунотоксины, направленные к анти-CD22 (May, R.D. et al., Chemical Abstracts 106(21): 168656x pages 35-36 (1987); Ghetie, M.A. et al., Cancer Research 48: 2610-2617 (1988); и Amlot, P.L. et al., Blood 82(9):2624-2633 (1993)). В случае если токсин представлял собой радиоактивный изотоп, для эпратузумаба, гуманизированной версии (привитая на CDR) IgG1 LL2, показано наличие терапевтической активности радиоиммуноконъюгата (Juweid, M.E. et al., Clin. Cancer Res. 5 (Suppl 10): 3292s-3303s (1999); Griffiths, G.L. et al., J. Nucl. Med. 44: 77-84 (2003); Linden, O. et al., Clin. Cancer Res. 5(suppl 10): 3287s-3291s (1999)).
В данной области существует необходимость в дополнительных лекарственных средствах для лечения различных связанных с B-клетками злокачественных опухолей, таких как лимфомы, такая как неходжкинская лимфома и другие B-клеточные пролиферативные нарушения. Особенно пригодные для данной цели лекарственные средства включают направленные к B-клеткам против CD22 конъюгаты антитело-лекарственное средство, обладающие значительно меньшей токсичностью, при приемлемой терапевтической эффективности. Настоящее изобретение относится к этим и другим ограничениям и проблемам прошлого.
Приведение в данной заявке любой ссылки не является признанием того, что ссылка относится к известному уровню техники для данной заявки. Все цитируемые в данном документе ссылки, включая патенты, патентные заявки и публикации, в полном объеме включены в качестве ссылки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к антителам к CD22 и способам их использования.
В одном из аспектов предоставлено антитело, связывающееся с CD22, где антитело содержит, по меньшей мере, одну, две, три, четыре, пять или шесть HVR, выбранных из
(1) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 2;
(2) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 4;
(3) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 6;
(4) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 10;
(5) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 12; и
(6) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 14.
В другом аспекте антитело, связывающееся с CD22, содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 10, и (b) по меньшей мере, одну, две, три, четыре или пять HVR, выбранных из
(1) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 2;
(2) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 4;
(3) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 6;
(4) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 12; и
(6) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 14.
В другом аспекте антитело, связывающееся с CD22, содержит (a) HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 9, и (b) по меньшей мере, одну, две, три, четыре или пять HVR, выбранных из
(1) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 2;
(2) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 4;
(3) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 6;
(4) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 12; и
(6) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 14.
В другом аспекте антитело, связывающееся с CD22, содержит (a) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 6, и (b) по меньшей мере, одну, две, три, четыре или пять HVR, выбранных из
(1) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 2;
(2) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 4;
(3) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 9;
(4) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 12; и
(5) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 14.
В другом аспекте антитело, связывающееся с CD22, содержит (a) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 6, и (b) по меньшей мере, одну, две, три, четыре или пять HVR, выбранных из
(1) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 2;
(2) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 4;
(3) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 10;
(4) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 12; и
(5) HVR-L3, содержащей аминокислотную последовательность SEQ ID NO: 14.
В одном из вариантов осуществления антитело содержит HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 10. В одном из вариантов осуществления антитело дополнительно содержит HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 2, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 4. В одном из вариантов осуществления антитело дополнительно содержит HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 12, и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 14.
В определенных вариантах осуществления любое из указанных выше антител дополнительно содержит, по меньшей мере, один каркас, выбранный из консенсусного каркаса подгруппы III VH и консенсусного каркаса подгруппы I VL.
В одном из аспектов предоставлено антитело, связывающееся с CD22, где антитело содержит вариабельный домен тяжелой цепи с последовательностью, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентичной аминокислотной последовательности SEQ ID NO: 16. В одном из вариантов осуществления антитело содержит вариабельный домен тяжелой цепи SEQ ID NO: 16.
В одном из аспектов антитело дополнительно содержит вариабельный домен легкой цепи с последовательностью, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентичной аминокислотной последовательности SEQ ID NO: 17. В одном из вариантов осуществления антитело содержит вариабельный домен легкой цепи SEQ ID NO: 17.
В одном из аспектов антитело дополнительно содержит вариабельный домен легкой цепи с последовательностью, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98% или, по меньшей мере, на 99% идентичной аминокислотной последовательности SEQ ID NO: 18. В одном из вариантов осуществления антитело содержит вариабельный домен легкой цепи SEQ ID NO: 18.
В одном из вариантов осуществления антитело содержит вариабельный домен тяжелой цепи с последовательностью, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98%, по меньшей мере, на 99% или на 100% идентичной аминокислотной последовательности SEQ ID NO: 16 и вариабельный домен легкой цепи с последовательностью, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98%, по меньшей мере, на 99% или на 100% идентичной аминокислотной последовательности SEQ ID NO: 17. В одном из вариантов осуществления антитело содержит вариабельный домен тяжелой цепи с последовательностью, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98%, по меньшей мере, на 99% или на 100% идентичной аминокислотной последовательности SEQ ID NO: 16 и вариабельный домен легкой цепи с последовательностью, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98%, по меньшей мере, на 99% или на 100% идентичной аминокислотной последовательности SEQ ID NO: 18. В одном из вариантов осуществления вариабельный домен тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 16, а вариабельный домен легкой цепи содержит аминокислотную последовательность SEQ ID NO: 17. В одном из вариантов осуществления вариабельный домен тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 16, а вариабельный домен легкой цепи содержит аминокислотную последовательность SEQ ID NO: 18.
В определенных вариантах осуществления предоставлен полинуклеотид, кодирующий любое из указанных выше антител. В одном из вариантов осуществления предоставлен вектор, содержащий полинуклеотид. В одном из вариантов осуществления предоставлена клетка-хозяин, содержащая вектор. В одном из вариантов осуществления клетка-хозяин является эукариотической. В одном из вариантов осуществления клетка-хозяин представляет собой клетку яичника китайского хомяка (CHO). В одном из вариантов осуществления предоставлен способ получения антитела к CD22, где способ включает культивирование клетки-хозяина в условиях, подходящих для экспрессии полинуклеотида, кодирующего антитело, и выделение антитела.
В одном из аспектов предоставлено антитело, связывающееся с CD22, экспрессируемым на поверхности клетки. В одном из вариантов осуществления антитело связывается с эпитопом в области CD22 человека или мыши, содержащей домен 1, или домен 2, или домены 1 и 2. В одном из вариантов осуществления клетка представляет собой клетку млекопитающего. В одном из вариантов осуществления клетка представляет собой клетку человека. В одном из вариантов осуществления клетка представляет собой злокачественную клетку. В одном из вариантов осуществления клетка представляет собой B-клетку. В одном из вариантов осуществления злокачественная клетка представляет собой B-клетку.
В определенных вариантах осуществления любое из указанных выше антител представляет собой моноклональное антитело. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из фрагментов Fab, Fab'-SH, Fv, scFv или (Fab')2. В одном из вариантов осуществления антитело является гуманизированным. В одном из вариантов осуществления антитело представляет собой антитело человека.
В одном из аспектов предоставлен способ выявления присутствия CD22 в биологическом образце, где способ включает приведение биологического образца в контакт с любым из указанных выше антител в условиях, позволяющих связывание антитела с CD22, и выявление того, образовался ли комплекс между антителом и CD22. В одном из вариантов осуществления биологический образец содержит B-клетки. В одном из вариантов осуществления биологический образец получен у млекопитающего с B-клеточным нарушением и/или с B-клеточным пролиферативным нарушением, включая в качестве неограничивающих примеров лимфому, неходжкинскую лимфому (NHL), агрессивную NHL, рецидивирующую агрессивную NHL, рецидивирующую медленно растущую NHL, рефракторную NHL, рефракторную медленно растущую NHL, хронический лимфолейкоз (CLL), мелкоклеточную лимфому, лейкоз, волосатоклеточный лейкоз (HCL), острый лимфоцитарный лейкоз (ALL) и лимфому мантийных клеток, или у млекопитающего с подозрением этого нарушения.
В одном из аспектов предоставлен способ диагностики клеточного пролиферативного нарушения, ассоциированного с увеличенной экспрессией CD22, где способ включает приведение тестируемой клетки в контакт с любым из указанных выше антител; определение уровня экспрессии CD22 посредством определения связывания антитела с CD22; и сравнения уровня экспрессии CD22 тестируемой клеткой с уровнем экспрессии CD22 контрольной клеткой, где более высокий уровень экспрессии CD22 тестируемой клеткой по сравнению с контрольной клеткой указывает на наличие клеточного пролиферативного нарушения, ассоциированного с увеличенной экспрессией CD22. В одном из вариантов осуществления тестируемая клетка представляет собой клетку пациента с подозрением на наличие клеточного пролиферативного нарушения, такого как B-клеточное пролиферативное нарушение. В одном из вариантов осуществления клеточное пролиферативное нарушение выбрано из B-клеточных нарушений, включающих в качестве неограничивающих примеров лимфому, неходжкинскую лимфому (NHL), агрессивную NHL, рецидивирующую агрессивную NHL, рецидивирующую медленно растущую NHL, рефракторную NHL, рефракторную медленно растущую NHL, хронический лимфолейкоз (CLL), мелкоклеточную лимфому, лейкоз, волосатоклеточный лейкоз (HCL), острый лимфоцитарный лейкоз (ALL) и лимфому мантийных клеток. В одном из вариантов осуществления способ включает определение уровня экспрессии CD22 на поверхности тестируемой клетки и сравнение уровня экспрессии CD22 на поверхности тестируемой клетки с уровнем экспрессии CD22 на поверхности контрольной клетки.
В одном из аспектов предоставлен способ диагностики клеточного пролиферативного нарушения, ассоциированного с увеличением количества клеток, таких как B-клетки, экспрессирующие CD22, где способ включает приведение тестируемых клеток в биологическом образце в контакт с любым из указанных выше антител; определение уровня антитела, связанного с тестируемыми клетками в образце посредством определения связывания антитела с CD22; и сравнение с уровнем антитела, связанного с клетками в контрольном образце, где уровень связанного антитела в тестируемом и контрольном образцах нормализован на количество экспрессирующих CD22 клеток и где более высокий уровень связанного антитела в тестируемом образце по сравнению с контрольным образцом указывает на наличие клеточного пролиферативного нарушения, ассоциированного с клетками, экспрессирующими CD22.
В одном из аспектов предоставлен способ определения растворимого CD22 в крови или сыворотке, где способ включает приведение тестируемого образца крови или сыворотки млекопитающего с подозрением на наличие B-клеточного пролиферативного нарушения в контакт с антителом к CD22 по изобретению и определение увеличения растворимого CD22 в тестируемом образце относительно контрольного образца крови или сыворотки нормального млекопитающего. В определенном варианте осуществления способ определения пригоден в качестве способа диагностики B-клеточного пролиферативного нарушения, ассоциированного с увеличением растворимого CD22 в крови или сыворотке млекопитающего.
В одном из аспектов антитела по изобретению включают модифицированные цистеином антитела, где одна или несколько аминокислот исходного антитела замещены аминокислотой свободного цистеина, как описано в WO 2006/034488 (включенной в настоящий документ в качестве ссылки в полном объеме). Так можно модифицировать, т.е. подвергнуть мутации, любую форму антитела к CD22. Например, можно модифицировать исходный Fab-фрагмент антитела так, чтобы получить модифицированный цистеином Fab, обозначенный в настоящем документе как "ThioFab". Подобным образом можно модифицировать исходное моноклональное антитело с получением "ThioMab". Следует отметить, что вследствие димерной природы антитела IgG одноучастковая мутация в тиофаб дает один полученный в результате конструирования цистеиновый остаток, тогда как одноучастковая мутация в тиомаб дает два полученных в результате конструирования цистеиновых остатка. Модифицированные цистеином антитела к CD22 по изобретению включают моноклональные антитела, гуманизированные или химерные моноклональные антитела и антигенсвязывающие фрагменты антител, слитые полипептиды и аналоги, которые предпочтительно связывают связанные с клетками полипептиды CD22. Модифицированное цистеином антитело может альтернативно содержать антитело, содержащее цистеин в описываемом в настоящем документе положении в антителе или Fab, полученный в результате конструирования последовательности и/или отбора антитела, без обязательного изменения исходного антитела, такого как посредством конструирования и отбора антитела посредством фагового дисплея или посредством конструирования каркасных последовательностей и константных областей легких цепей и/или тяжелых цепей de novo. Модифицированное цистеином антитело содержит одну или несколько аминокислот свободного цистеина со значением реакционноспособности тиоловых групп в диапазонах от 0,6 до 1,0; 0,7 до 1,0 или 0,8 до 1,0. Аминокислота свободного цистеина представляет собой остаток цистеина, полученный в результате конструирования в исходном антителе и не являющийся частью дисульфидного мостика. Модифицированные цистеином антитела пригодны для присоединения цитотоксических и/или визуализирующих соединений в участке встроенного цистеина, например, посредством малеимида или галогенацетила. Нуклеофильная реакционноспособность тиоловой функциональной группы остатка Cys по отношению к малеимидной группе приблизительно в 1000 раз больше, чем у любой другой функциональной группы аминокислот в белке, такой как аминогруппа остатков лизина или N-концевая аминогруппа. Специфичная для тиолов функциональная группа в йодацетильных и малеимидных реагентах может реагировать с аминогруппами, но необходимы более высокий pH (>9,0) и более длительное время реакции (Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London).
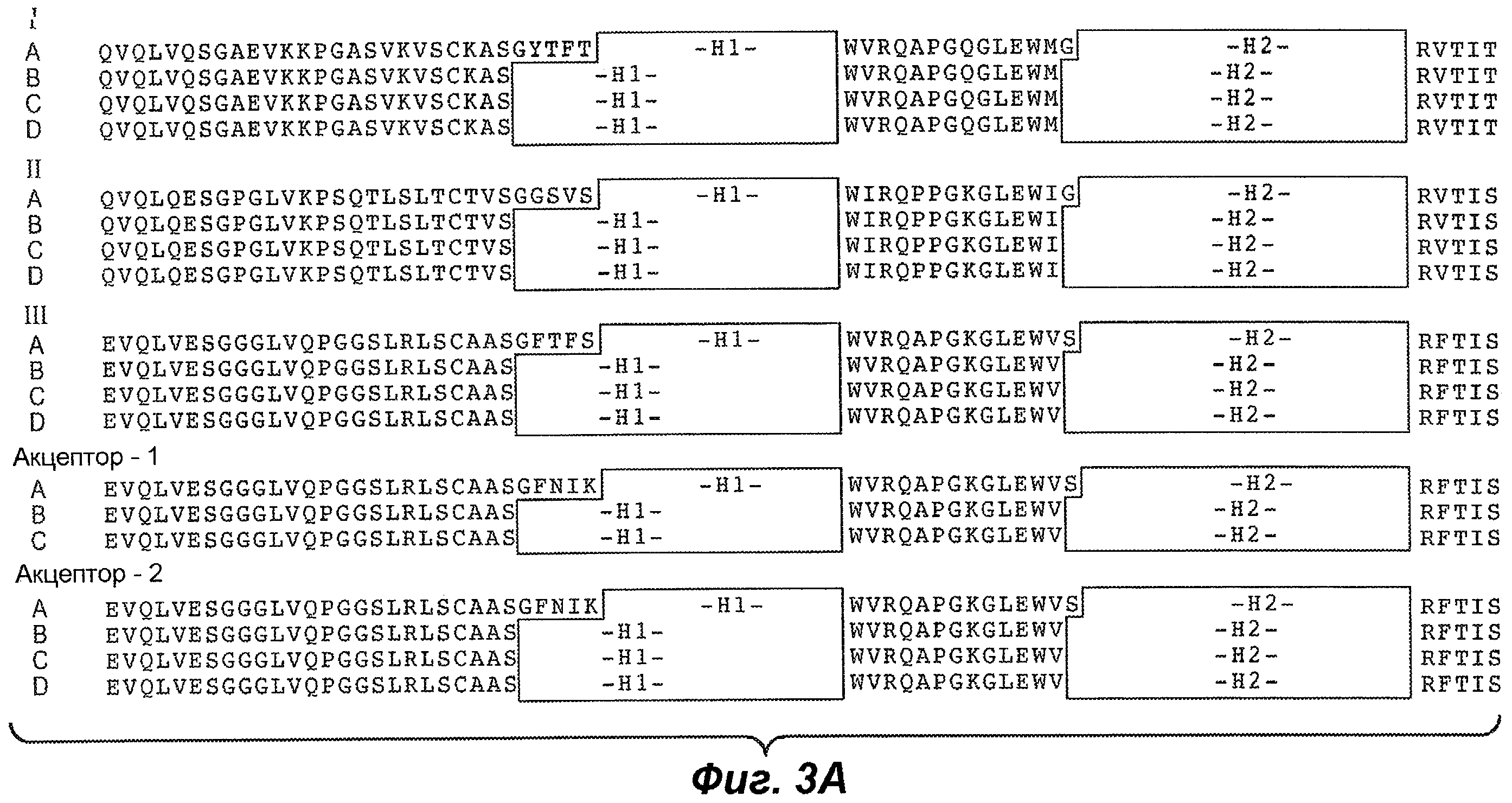
В одном из вариантов осуществления модифицированное цистеином антитело к CD22 по изобретению содержит полученный в результате конструирования цистеин в любом из следующих положений, где положение представляет собой номер по Kabat et al. в легкой цепи (см. Kabat et al., (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD) и по нумерации EU в тяжелой цепи (включая Fc-область) (см. Kabat et al., (1991), выше), где константная область легкой цепи, обозначенная подчеркиванием на фиг.17A, начинается в положении 108 (нумерация Kabat), а константная область тяжелой цепи, обозначенная подчеркиванием на фиг.17B и 17C, начинается в положении 118 (нумерация EU). Положение также можно указать в виде его положения в последовательной нумерации аминокислот полноразмерных легкой цепи или тяжелой цепи, представленных на фиг.17A-17C. По одному из вариантов осуществления изобретения антитело к CD22 содержит полученный в результате конструирования цистеин в LC-V205C (нумерация Kabat: Val 205; последовательный номер 210 на фиг.17A модифицирован так, чтобы в этом положении находился Cys). Полученный в результате конструирования цистеин в легкой цепи на фиг.17A показан полужирным шрифтом с двойным подчеркиванием. По одному из вариантов осуществления антитело к CD22 содержит полученный в результате конструирования цистеин в HC-A118C (номер EU: Ala 118; последовательный номер 121 на фиг.17B модифицирован так, чтобы в этом положении находился Cys). Полученный в результате конструирования цистеин в тяжелой цепи приведен полужирным шрифтом с двойным подчеркиванием на фиг.17B. По одному из вариантов осуществления антитело к CD22 содержит полученный в результате конструирования цистеин Fc-S400C (номер EU: Ser 400; последовательный номер 403 на фиг.17C модифицирован так, чтобы в этом положении находился Cys). Полученный в результате конструирования цистеин в Fc-области тяжелой цепи приведен на фиг.17C полужирным шрифтом с двойным подчеркиванием. В других вариантах осуществления полученный в результате конструирования цистеин тяжелой цепи (включая Fc-область) находится в любом из указанных положений: (по нумерации EU): 41, 88, 116, 118, 120, 171, 282, 375 или 400. Таким образом, изменения аминокислот в этих положениях в исходном антителе к CD22 по изобретению представляют собой: A41C, A88C, S116C, A118C, T120C, A171C, V282C, S375C или S400C. В других вариантах осуществления полученный в результате конструирования цистеин легкой цепи находится в любом из указанных положений (по нумерации Kabat): 15, 43, 110, 144, 168, 205. Таким образом, изменения аминокислот в этих положениях в исходном антителе к CD22 по изобретению представляют собой: V15C, A43C, V110C, A144C, S168C или V205C.
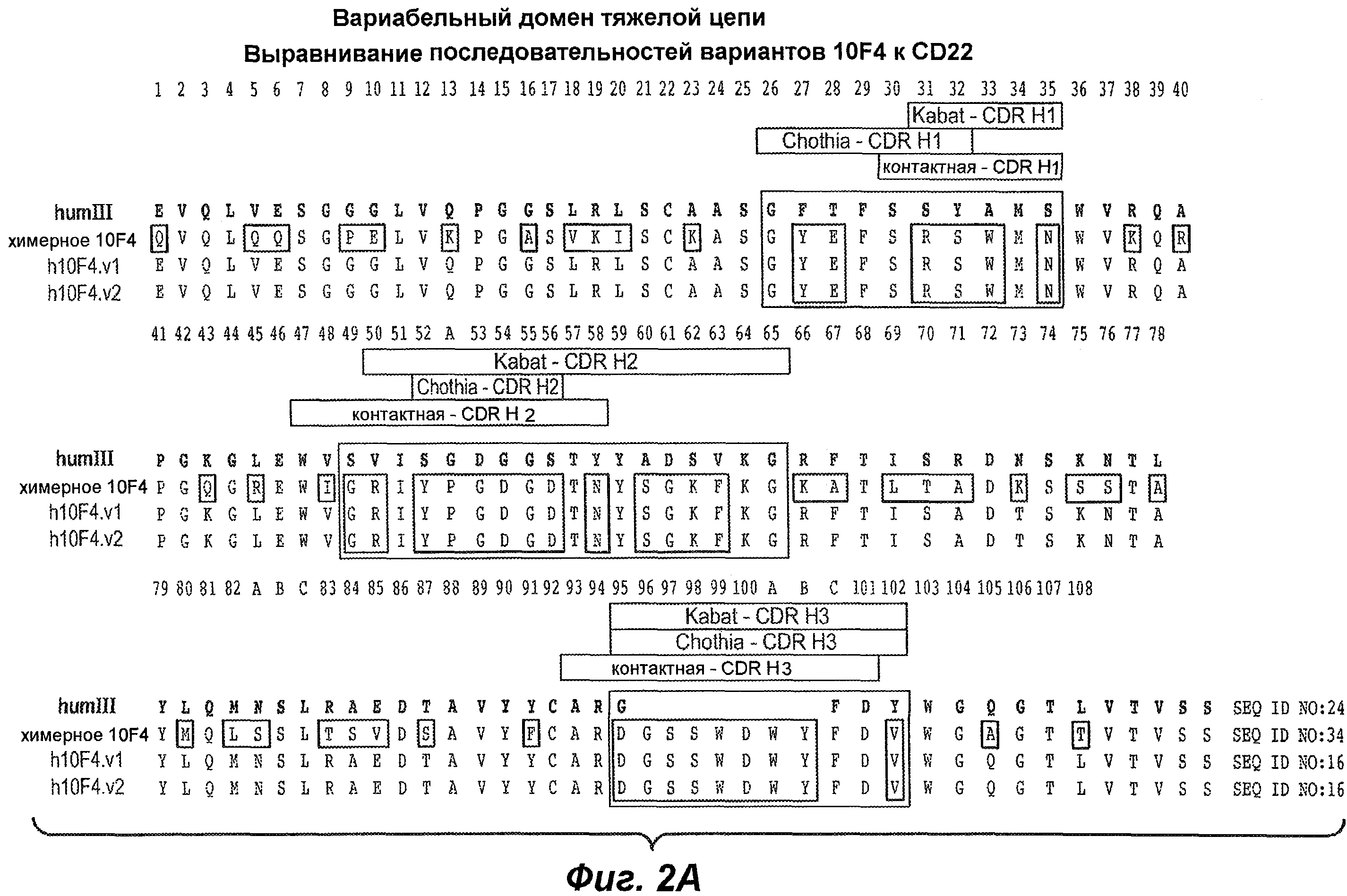
Модифицированное цистеином антитело к CD22 содержит одну или несколько аминокислот свободного цистеина, где модифицированное цистеином антитело к CD22 связывается с полипептидом CD22 и получено способом, включающим замену одного или нескольких аминокислотных остатков исходного антитела к CD22 цистеином, где исходное антитело содержит, по меньшей мере, одну последовательность HVR, выбранную из
(a) последовательности HVR-L1 RSSQSIVHSNGNTFLE (SEQ ID NO: 9) или последовательности HVR-L1 RSSQSIVHSVGNTFLE (SEQ ID NO: 10) (фиг.2B);
(b) последовательности HVR-L2 KVSNRFS SEQ ID NO: 12 (фиг.2B);
(c) последовательности HVR-L3 FQGSQFPYT (SEQ ID NO: 14) (фиг.2B);
(d) последовательности HVR-H1 GYEFSRSWMN (SEQ ID NO: 2) (фиг.2A);
(e) последовательности HVR-H2 GRIYPGDGDTNYSGKFKG (SEQ ID NO: 4 (фиг.2A) и
(f) последовательности HVR-H3 DGSSWDWYFDV (SEQ ID NO: 6) (фиг.2A).
В определенном аспекте изобретение относится к модифицированному цистеином антителу к CD22, содержащему аминокислотную последовательность, по меньшей мере, приблизительно с 80% идентичностью аминокислотных последовательностей, альтернативно, по меньшей мере, приблизительно с 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью аминокислотных последовательностей с модифицированным цистеином антителом с полноразмерной аминокислотной последовательностью, как описано в настоящем документе, или с аминокислотной последовательностью модифицированного цистеином антитела без сигнального пептида, как описано в настоящем документе.
В еще одном дополнительном аспекте изобретение относится к выделенному модифицированному цистеином антителу к CD22, содержащему аминокислотную последовательность, кодируемую нуклеотидной последовательностью, гибридизующейся с комплементарной молекулой ДНК, кодирующей (a) модифицированное цистеином антитело с полноразмерной аминокислотной последовательностью, как описано в настоящем документе, (b) аминокислотную последовательность модифицированного цистеином антитела без сигнального пептида, как описано в настоящем документе, (c) внеклеточный домен белка трансмембранного модифицированного цистеином антитела, с сигнальным пептидом или без него, как описано в настоящем документе, (d) аминокислотную последовательность, кодируемую любой из последовательностей нуклеиновой кислоты, описываемых в настоящем документе, или (e) любой другой конкретно определенный фрагмент полноразмерной аминокислотной последовательности модифицированного цистеином антитела, как описано в настоящем документе.
В конкретном аспекте изобретение относится к выделенному модифицированному цистеином антителу к CD22 без N-концевой сигнальной последовательности и/или без инициирующего метионина и кодируемому нуклеотидной последовательностью, кодирующей такую аминокислотную последовательность, как описано в настоящем документе. Способы их получения также описаны в настоящем документе, где эти способы включают культивирование клетки-хозяина, содержащей вектор, содержащий соответствующую кодирующую молекулу нуклеиновой кислоты, в условиях, подходящих для экспрессии модифицированного цистеином антитела, и восстановление модифицированного цистеином антитела из клеточной культуры.
Другой аспект изобретения относится к выделенному модифицированному цистеином антителу к CD22 с удаленным трансмембранным доменом или инактивированным трансмембранным доменом. Способы их получения также описаны в настоящем документе, где эти способы включают культивирование клетки-хозяина, содержащей вектор, содержащий соответствующую кодирующую молекулу нуклеиновой кислоты, в условиях, подходящих для экспрессии модифицированного цистеином антитела, и восстановление модифицированного цистеином антитела из клеточной культуры.
В других вариантах осуществления изобретение относится к выделенным химерным модифицированным цистеином антителам к CD22, содержащим любое из описанных в настоящем документе модифицированных цистеином антител, слитых с гетерологичным (не являющимся CD22) полипептидом. Пример таких химерных молекул включает любое из описанных в настоящем документе модифицированных цистеином антител, слитое с гетерологичным полипептидом, например, таким как концевая последовательность эпитопа или Fc-область иммуноглобулина.
Модифицированное цистеином антитело к CD22 может представлять собой моноклональное антитело, фрагмент антитела, химерное антитело, гуманизированное антитело, одноцепочечное антитело или антитело, конкурентно ингибирующее связывание антитело к полипептиду CD22 с его соответствующим антигенным эпитопом. Антитела по настоящему изобретению необязательно могут быть конъюгированы с ингибирующим рост средством или цитотоксическим средством, таким как токсин, включая, например, ауристатин, антибиотик, радиоактивный изотоп, нуклеаза или т.п. Антитела по настоящему изобретению необязательно можно получать в клетках CHO или бактериальных клетках, и они предпочтительно ингибируют рост или пролиферацию или индуцируют гибель клетки, с которой они связываются. Для диагностических целей антитела по настоящему изобретению можно метить детектируемой меткой, присоединять к твердой подложке или т.п.
В других вариантах осуществления настоящего изобретения изобретение относится к векторам, содержащим ДНК, кодирующую любое из описанных в настоящем документе антител к CD22 и модифицированных цистеином антител к CD22. Также предоставлены клетки-хозяева, содержащие любой такой вектор. В качестве примера клетки-хозяева могут представлять собой клетки CHO, клетки E.coli или дрожжевые клетки. Дополнительно предоставлен способ получения любого из описанных в настоящем документе полипептидов, и он включает культивирование клеток-хозяев в условиях, подходящих для экспрессии описанного полипептида, и восстановление желаемого полипептида из клеточной культуры.
Модифицированные цистеином антитела могут быть пригодными при лечении злокачественной опухоли, и они включают антитела, специфичные для клеточной поверхности и трансмембранных рецепторов и опухолеспецифических антигенов (TAA). Такие антитела можно использовать в виде свободных антител (неконъюгированных с лекарственным средством или молекулой-меткой) или в виде конъюгатов антитело-лекарственное средство (ADC). Модифицированные цистеином антитела по изобретению могут быть сайт-специфически и эффективно связаны с реагирующим с тиолами реагентом. Реагирующий с тиолами реагент может представлять собой полифункциональный линкер, метку захвата, флуорофор или промежуточное соединение лекарственное средство-линкер. Модифицированное цистеином антитело можно метить детектируемой меткой, иммобилизовать на твердофазной подложке и/или конъюгировать с молекулой лекарственного средства. Реакционноспособность тиоловых групп может являться общей для любого антитела, где можно провести замену аминокислот реакционноспособными аминокислотами цистеина в диапазонах в легкой цепи, выбранных из диапазонов аминокислот: от L-10 до L-20; от L-38 до L-48; от L-105 до L-115; от L-139 до L-149; от L-163 до L-173; и в диапазонах в тяжелой цепи, выбранных из диапазонов аминокислот: от H-35 до H-45; от H-83 до H-93; от H-114 до H-127 и от H-170 до H-184, и в Fc-области в диапазонах, выбранных из диапазонов от H-268 до H-291; от H-319 до H-344; от H-370 до H-380 и от H-395 до H-405, где нумерация положений аминокислот начинается в положении 1 по системе нумерации Kabat (Kabat et al., (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD), а затем последовательно продолжается, как описано в WO 2006034488. Реакционноспособность тиоловых групп также может являться общей для определенных доменов антитела, таких как константный домен легкой цепи (CL) и константные домены тяжелых цепей, CH1, CH2 и CH3. Можно проводить замены на цистеин, приводящие к значениям реакционноспособности тиоловых групп 0,6 и выше в константных доменах α, δ, ε, γ и µ тяжелых цепей исходных антител: IgA, IgD, IgE, IgG, и IgM, соответственно, включая подклассы IgG: IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Такие антитела и их использование описаны в WO 2006/034488.
Модифицированные цистеином антитела по изобретению предпочтительно сохраняют антигенсвязывающую способность их вариантов исходных антител дикого типа. Таким образом, модифицированные цистеином антитела способны к связыванию, предпочтительно специфическому, с антигенами. Такие антигены включают, например, опухолеспецифические антигены (TAA), белки рецепторов клеточной поверхности и другие молекулы клеточной поверхности, трансмембранные белки, сигнальные белки, факторы, регулирующие жизнеспособность клеток, факторы, регулирующие клеточную пролиферацию, молекулы, ассоциированные (например, известные или предположительно функционально способствующие) с развитием или дифференцировкой тканей, лимфокины, цитокины, молекулы, вовлеченные в регуляцию клеточного цикла, молекулы, вовлеченные в ангиогенез, и молекулы, ассоциированные (например, известные или предположительно функционально способствующие) с ангиогенезом. Опухолеспецифический антиген может представлять собой фактор кластера дифференцировки (т.е. белок CD, включая в качестве неограничивающих примеров CD22). Модифицированные цистеином антитела к CD22 по изобретению сохраняют способность связывать антиген их вариантов исходных антител к CD22 дикого типа. Таким образом, модифицированные цистеином антитела к CD22 по изобретению способны к связыванию, предпочтительно специфическому, с антигенами CD22, включая изоформы анти-CD22-бета и/или -альфа человека, включая варианты, когда такие антигены экспрессированы на поверхности клеток, включая в качестве неограничивающих примеров B-клетки.
Антитело по изобретению можно конъюгировать с другими реагирующими с тиолами средствами, в которых реактивная группа представляет собой, например, малеимид, йодацетамид, пиридилдисульфид или другой реагирующий с тиолами партнер по конъюгации (Haugland, 2003, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley, 1992, Bioconjugate Chem. 3:2; Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1:2; Hermanson, G. в Bioconjugate Techniques (1996) Academic Press, San Diego, p.40-55, 643-671). Партнер может представлять собой цитотоксическое средство (например, токсин, такой как доксорубицин или токсин коклюша), флуорофор, такой как флуоресцентный краситель, подобно флуоресцеину или родамину, хелатирующее средство для визуализации или радиотерапевтический металл, пептидную или непептидную метку, или детектируемую метку, или измеряющее клиренс средство, такое как различные изомеры полиэтиленгликоля, пептид, который связывает третий компонент, или другое углеводное или липофильное средство.
В одном из аспектов антитела по изобретению можно конъюгировать с любой молекулой-меткой, которую можно ковалентно присоединить к антителу посредством реакционноспособной группы, активируемой группы или реакционноспособной тиоловой группы цистеина (Singh et al., (2002) Anal. Biochem. 304: 147-15; Harlow E. and Lane, D. (1999) Using Antibodies: A Laboratory Manual, Cold Springs Harbor Laboratory Press, Cold Spring Harbor, NY; Lundblad R.L. (1991) Chemical Reagents for Protein Modification, 2nd ed. CRC Press, Boca Raton, FL). Присоединенная метка может функционировать для (i) обеспечения детектируемого сигнала; (ii) взаимодействия со второй меткой для модификации детектируемого сигнала, обеспечиваемого первой или второй меткой, например, для получения FRET (резонансного переноса энергии флуоресценции); (iii) стабилизации взаимодействий или увеличения аффинности связывания с антигеном или лигандом; (iv) воздействия на подвижность, например, электрофоретическую подвижность или клеточную проницаемость, посредством заряда, гидрофобности, формы или других физических параметров, или (v) обеспечения захватывающей группы для модуляции аффинности лиганда, связывания антитела/антигена или ионного комплексообразования.
Меченные модифицированные цистеином антитела могут быть пригодными в диагностических анализах, например, для детекции экспрессии представляющего интерес антигена в конкретных клетках, тканях или сыворотке. Для диагностических приложений антитело, как правило, метят детектируемой группой. Доступно множество меток, которые, как правило, можно сгруппировать в следующие категории:
Радиоактивные изотопы (радионуклиды), такие как3H,11C,14C,18F,32P,35S,64Cu,68Ga,86Y,99Tc,111In,123I,124I,125I,131I,133Xe,177Lu,211At или213Bi. Меченные радиоактивными изотопами антитела пригодны для экспериментов, направленных на визуализацию рецепторов. Антитело можно метить реагентами лигандов, которые связывают, хелатируют или иным образом образуют комплекс с радиоактивным изотопом металла, где реагент способен к реакции с тиолом полученного в результате конструирования цистеина в антителе, с использованием способов, описанных в Current Protocols in Immunology, Volumes 1 and 2, Coligen et al., Ed. Wiley-Interscience, New York, NY, Pubs. (1991). Хелатирующие лиганды, которые могут образовывать комплекс с ионом металла, включают DOTA, DOTP, DOTMA, DTPA и TETA (Macrocyclics, Dallas, TX). Радионуклиды можно направлять посредством образования комплексов с конъюгатами антитело-лекарственное средство по изобретению (Wu et al., (2005) Nature Biotechnology 23(9): 1137-1146).
Линкерные реагенты, такие как DOTA-малеимид (4-малеимидобутирамидобензил-DOTA), можно получать реакцией аминобензил-DOTA с 4-малеимидомасляной кислотой (Fluka), активированной изопропилхлорформиатом (Aldrich) по способу Axworthy et al., (2000) Proc. Natl. Acad. Sci. USA 97(4): 1802-1807). Реагенты DOTA-малеимид вступают в реакцию с аминокислотами свободного цистеина модифицированных цистеином антител и образуют на антителе лиганд, образующий комплексы с металлами (Lewis et al., (1998) Bioconj. Chem. 9: 72-86). Хелатирующие линкерные метящие реагенты, такие как DOTA-NHS (моно (N-гидроксисукцинимидный сложный эфир) 1,4,7,10-тетраазациклододекан-l,4,7,10-тетрауксусной кислоты) являются коммерчески доступными (Macrocyclics, Dallas, TX). Направленная на рецепторы визуализация меченными радионуклидами антителами может обеспечить маркер активации каскадов реакций посредством детекции и количественного определения возрастающего накопления антител в опухолевой ткани (Albert et al., (1998) Bioorg. Med. Chem. Lett. 8: 1207-1210). Конъюгированные радиоактивные металлы после лизосомальной деградации могут оставаться внутри клеток.
Металл-хелатные комплексы, подходящие в качестве меток антител для визуализирующих экспериментов, описаны в патенте США 5342606; патенте США 5428155; патенте США 5316757; патенте США 5480990; патенте США 5462725; патенте США 5428139; патенте США 5385893; патенте США 5739294; патенте США 5750660; патенте США 5834456; Hnatowich et al., (1983) J. Immunol. Methods 65: 147-157; Meares et al., (1984) Anal. Biochem. 142: 68-78; Mirzadeh et al., (1990) Bioconjugate Chem. 1:59-65; Meares et al., (1990) J. Cancer 1990, Suppl. 10: 21-26; Izard et al., (1992) Bioconjugate Chem. 3: 346-350; Nikula et al., (1995) Nucl. Med. Biol. 22: 387-90; Camera et al., (1993) Nucl. Med. Biol. 20: 955-62; Kukis et al., (1998) J. Nucl. Med. 39: 2105-2110; Verel et al., (2003) J. Nucl. Med. 44: 1663-1670; Camera et al., (1994) J. Nucl. Med. 21: 640-646; Ruegg et al., (1990) Cancer Res. 50: 4221-4226; Verel et al., (2003) J. Nucl. Med. 44: 1663-1670; Lee et al., (2001) Cancer Res. 61: 4474-4482; Mitchell, et al., (2003) J. Nucl. Med. 44: 1105-1112; Kobayashi et al., (1999) Bioconjugate Chem. 10: 103-111; Miederer et al., (2004) J. Nucl. Med. 45: 129-137; DeNardo et al., (1998) Clinical Cancer Research 4: 2483-90; Blend et al., (2003) Cancer Biotherapy & Radiopharmaceuticals 18:355-363; Nikula et al., (1999) J. Nucl. Med. 40: 166-76; Kobayashi et al., (1998) J. Nucl. Med. 39: 829-36; Mardirossian et al., (1993) Nucl. Med. Biol. 20: 65-74; Roselli et al., (1999) Cancer Biotherapy & Radiopharmaceuticals, 14: 209-20.
(b) Флуоресцентные метки, такие как редкоземельные хелаты (хелаты европия), классы флуоресцеина, включая FITC, 5-карбоксифлуоресцеин, 6-карбоксифлуоресцеин; классы родамина, включая TAMRA; дансил; лиссамин; цианины; фикоэритрины; техасский красный и их аналоги. Флуоресцентные метки можно конъюгировать с антителами с использованием способов, описанных, например, в Current Protocols in Immunology, выше. Флуоресцентные красители и реагенты флуоресцентных меток включают флуоресцентные красители и реагенты флуоресцентных меток, которые коммерчески доступны в Invitrogen/Molecular Probes (Eugene, OR) и Pierce Biotechnology, Inc. (Rockford, IL).
(c) Доступны или описаны различные метки фермент-субстрат (патент США 4275149). Фермент, как правило, катализирует химическую модификацию хромогенного субстрата, которую можно измерять различными способами. Например, фермент может катализировать изменение окраски субстрата, которое можно измерять спектрофотометрически. Альтернативно фермент может изменять флуоресценцию или хемилюминесценцию субстрата. Способы количественной оценки изменения флуоресценции описаны выше. Хемилюминесцентный субстрат при химической реакции становится электронно-возбужденным, а затем может испускать свет, который можно измерять (например, с применением хемилюминометра), или передавать энергию флуоресцентному акцептору. Примеры ферментативных меток включают люциферазы (например, светлячковую люциферазу и бактериальную люциферазу; патент США 4737456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназу, уреазу, пероксидазу, такую как пероксидаза хрена (HRP), щелочную фосфатазу (AP), β-галактозидазу, глюкоамилазу, лизоцим, оксидазы сахаров (например, глюкозооксидаза, галактозооксидаза и глюкозо-6-фосфатдегидрогеназа), оксидазы гетероциклов (такие как уриказа и ксантиноксидаза), лактопероксидазу, микропероксидазу и т.п. Способы конъюгации ферментов с антителами описаны в O'Sullivan et al., (1981) "Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay", в Methods in Enzym. (ed J. Langone & H. Van Vunakis), Academic Press, New York, 73: 147-166.
Примеры сочетаний фермент-субстрат включают, например,
(i) пероксидазу хрена (HRP) с перекисью водорода в качестве субстрата, где перекись водорода окисляет предшественник красителя (например, ортофенилендиамин (OPD) или 3,3',5,5'-гидрохлорид тетраметилбензидина (TMB));
(ii) щелочную фосфатазу (AP) c пара-нитрофенилфосфатом в качестве хромогенного субстрата; и
(iii) β-D-галактозидазу (β-D-Gal) с хромогенным субстратом (например, п-нитрофенил-β-D-галактозидаза) или флуорогенным субстратом 4-метилумбеллиферил-β-D-галактозидаза.
Специалистам в данной области доступно множество других сочетаний фермент-субстрат. Для общего обзора см. патент США 4275149 и патент США 4318980.
Метку можно непрямым способом конъюгировать с боковой цепью аминокислот, с активированной боковой цепью аминокислот, с модифицированным цистеином антителом и т.п. Например, антитело можно конъюгировать с биотином, а любую из трех широких категорий меток, указанных выше, можно конъюгировать с авидином или стрептавидином, или наоборот. Биотин селективно связывается со стрептавидином и, таким образом, метку можно конъюгировать с антителом таким непрямым способом. Альтернативно, для осуществления непрямой конъюгации метки с вариантом полипептида вариант полипептида конъюгируют с небольшим гаптеном (например, дигоксином), а один из различных типов меток, указанных выше, конъюгируют с вариантом полипептида против гаптена (например, антитело к дигоксину). Таким образом, можно осуществить непрямую конъюгацию метки с вариантом полипептида (Hermanson, G. (1996) в Bioconjugate Techniques Academic Press, San Diego).
Антитело по настоящему изобретению можно применять в любом известном способе анализа, таком как ELISA, анализы конкурентного связывания, прямой и непрямой сэндвич-анализы и анализы иммуноосаждения (Zola, (1987) Monoclonal Antibodies: A Manual of Techniques, pp.147-158, CRC Press, Inc.).
Детектируемая метка может быть пригодной для локализации, визуализации и количественного определения события связывания или узнавания. Мечеными антителами по изобретению можно определять рецепторы клеточной поверхности. Другое использование детектируемо меченных антител представляет собой способ иммунозахвата на основе гранул, включающий конъюгацию гранул с флуоресцентно меченным антителом и детекцию флуоресцентного сигнала после связывания лиганда. В сходных способах детекции используют эффект поверхностного плазмонного резонанса (SPR) для измерения и детекции взаимодействий антитело-антиген.
Детектируемые метки, такие как флуоресцентные красители и хемилюминесцентные красители (Briggs et al., (1997) "Synthesis of Functionalised Fluorescent Dyes and Their Coupling to Amines and Amino Acids", J. Chem. Soc., Perkin-Trans. 1: 1051-1058), обеспечивают детектируемый сигнал и, как правило, применимы для меченых антител, предпочтительно со следующими свойствами: (i) меченое антитело должно давать очень высокий сигнал с низким фоном так, чтобы небольшие количества антител можно было с высокой чувствительностью детектировать в бесклеточных и основанных на клетках анализах; и (ii) меченое антитело должно быть фотостабильным так, чтобы флуоресцентный сигнал можно было наблюдать, измерять и записывать без значительного фотообесцвечивания. Для применений, включающих связывание клеточной поверхности меченых антител с мембранами или клеточными поверхностями, в частности живых клеток, метки предпочтительно (iii) обладают хорошей растворимостью в воде для достижения эффективной концентрации конъюгатов и чувствительности детекции и (iv) являются нетоксичными для живых клеток так, чтобы не нарушать нормальных метаболических процессов в клетках или не вызывать преждевременную гибель клеток.
Прямое количественное определение интенсивности клеточной флуоресценции и подсчет событий флуоресцентного мечения, например, связывание конъюгатов пептид-краситель с клеточной поверхностью, можно проводить в системе (FMAT® 8100 HTS System, Applied Biosystems, Foster City, Calif.), которая автоматизирует смешивание и считывание, нерадиоактивные анализы с живыми клетками или гранулами (Miraglia, "Homogeneous cell- and bead-based assays for high throughput screening using fluorometric microvolume assay technology", (1999) J. of Biomolecular Screening 4: 193-204). Использование меченых антител также включает анализы связывания поверхностных рецепторов, анализы иммунозахвата, твердофазный иммунофлуоресцентный анализ (FLISA), расщепление каспазой (Zheng, "Caspase-3 controls both cytoplasmic and nuclear events associated with Fas-mediated apoptosis in vivo", (1998) Proc. Natl. Acad. Sci. USA 95: 618-23; патент США 6372907), апоптоз (Vermes, "A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V" (1995) J. Immunol. Methods 184: 39-51) и цитотоксический анализ. Для идентификации позитивной или негативной регуляции молекулой, которая имеет мишень на клеточной поверхности, можно использовать способ флуориметрического анализа в микрообъемах (Swartzman, "A homogeneous and multiplexed immunoassay for high-throughput screening using fluorometric microvolume assay technology", (1999) Anal. Biochem. 271: 143-51).
Меченые антитела по изобретению пригодны в качестве биомаркеров и зондов для визуализации различными способами и средствами биомедицинской и молекулярной визуализации, такими как (i) MRI (магнитно-резонансная томография); (ii) MicroCT (компьютерная томография); (iii) SPECT (однофотонная эмиссионная компьютерная томография); (iv) PET (позитронно-эмиссионная томография) Chen et al., (2004) Bioconjugate Chem. 15: 41-49; (v) биолюминесценция; (vi) флуоресценция и (vii) ультразвук. Иммуносцинтиграфия представляет собой способ визуализации, при котором антитела, меченные радиоактивными веществами, вводят пациенту, животному или человеку и получают изображение участка в организме, где локализуется антитело (патент США 6528624). Визуализирующие биомаркеры можно объективно измерять и оценивать как индикатор нормальных биологических процессов, патогенетических процессов или фармакологического ответа на терапевтическое вмешательство. Биомаркеры могут быть нескольких типов: тип 0 представляют собой природные исторические маркеры заболевания и лонгитудинально коррелирует с известными клиническими индексами, например, обследование MRI синовиального воспаления при ревматоидном артрите; маркеры типа I выявляют эффект вмешательства в соответствии с механизмом действия, даже если механизм может не быть ассоциированным с клиническим исходом; маркеры типа II функционируют в качестве заместительных конечных точек, где изменение биомаркера или сигнал от него предполагает клиническое преимущество для "подтверждения" заданного ответа, такого как измерение эрозии костей при ревматоидном артрите посредством CT. Таким образом, визуализирующие биомаркеры могут предоставить фармакодинамическую (PD) терапевтическую информацию: (i) об экспрессии целевого белка, (ii) о связывании терапевтического средства с целевым белком, т.е. о селективности, и (iii) о фармакокинетических данных клиренса и времени полужизни. Преимущества визуализирующих биомаркеров in vivo относительно лабораторных биомаркеров включают неинвазивное воздействие, количественную оценку во всем организме, повторное дозирование и оценку, т.е. несколько временных точек и потенциально переносимое воздействие от преклинических (небольшое животное) к клиническим (человек) результатам. Для некоторых применений биовизуализация заменяет или минимизирует количество экспериментов на животных при преклинических исследованиях.
Способы мечения пептидов хорошо известны. См. Haugland, 2003, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley, 1992, Bioconjugate Chem. 3:2; Garman, (1997) Non-Radioactive Labelling: A Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1:2; Glazer et al., (1975) Chemical Modification of Proteins. Laboratory Techniques in Biochemistry and Molecular Biology (T.S. Work and E. Work, Eds.) American Elsevier Publishing Co., New York; Lundblad, R.L. and Noyes, C.M. (1984) Chemical Reagents for Protein Modification, Vols. I and II, CRC Press, New York; Pfleiderer, G. (1985) "Chemical Modification of Proteins", Modern Methods in Protein Chemistry, H. Tschesche, Ed., Walter DeGryter, Berlin and New York; and Wong (1991) Chemistry of Protein Conjugation and Cross-linking, CRC Press, Boca Raton, Fla.); De Leon-Rodriguez et al., (2004) Chem. Eur. J. 10: 1149-1155; Lewis et al., (2001) Bioconjugate Chem. 12: 320-324; Li et al., (2002) Bioconjugate Chem. 13: 110-115; Mier et al., (2005) Bioconjugate Chem. 16: 240-237.
Пептиды и белки, меченные двумя различными молекулами, флуоресцентным репортером и гасителем, в достаточной близости, претерпевают резонансный перенос энергии флуоресценции (FRET). Репортерные группы, как правило, являются флуоресцентными красителями, которые возбуждаются световым излучением при определенной длине волны и переносят энергию на акцептор или гаситель, группу, с соответствующим сдвигом Стокса для эмиссии при максимальной яркости. Флуоресцентные красители включают молекулы с большой степенью ароматизации, такие как флуоресцеин и родамин и их производные. Флуоресцентный репортер в исходном пептиде может быть частично или в значительной степени погашен молекулой гасителя. После расщепления пептида пептидазой или протеазой можно измерять детектируемое увеличение флуоресценции (Knight, C. (1995) "Fluorimetric Assays of Proteolytic Enzymes", Methods in Enzymology, Academic Press, 248: 18-34).
Меченые антитела по изобретению также можно использовать в качестве аффинного очищающего средства. В данном способе меченое антитело иммобилизовано на твердой фазе, такой как смола сефадекс или фильтровальная бумага, хорошо известными в данной области способами. Иммобилизованное антитело контактирует с образцом, содержащим очищаемый антиген, а затем подложку промывают подходящим растворителем, который удаляет по существу все вещество в образце за исключением очищаемого антигена, который связан с иммобилизованным вариантом полипептида. Наконец подложку отмывают другим подходящим растворителем, таким как глициновый буфер, pH 5,0, который высвобождает антиген от варианта полипептида.
Метящие реагенты, как правило, несут реакционноспособную функциональную группу, которая может реагировать (i) непосредственно с тиолом цистеина модифицированного цистеином антитела с формированием меченого антитела, (ii) с линкерным реагентом с формированием промежуточного продукта линкер-метка или (iii) с линкерным антителом с формированием меченого антитела. Реакционноспособная функциональная группа метящих реагентов включает малеимид, галогенацетил, сукцинимидиловый сложный эфир йодацетамида (например, NHS, N-гидроксисукцинимид), изотиоцианат, сульфонилхлорид, 2,6-дихлортриазинил, пентафлуорениловый сложный эфир и фосфорамидит, хотя также можно использовать другие функциональные группы.
Иллюстративной реакционноспособной функциональной группой является сложный N-гидроксисукцинимидильный эфир (NHS) заместителя карбоксильной группы детектируемой метки, например биотина или флуоресцентного красителя. Сложный NHS эфир метки можно заранее получать, выделять, очищать и/или характеризовать, или его можно получать in situ и подвергать реакции с нуклеофильной группой антитела. Как правило, карбоксильная форма метки активируется посредством реакции с определенным сочетанием карбодиимидного реагента, например дициклогексилкарбодиимида, диизопропилкарбодиимида или урониевого реагента, например TSTU (тетрафторборат O-(N-сукцинимидил)-N,N,N',N'-тетраметилурония), HBTU (гексафторфосфат O-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония) или HATU (гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония); активатора, такого как 1-гидроксибензотриазол (HOBt) и N-гидроксисукцинимида с получением сложного NHS эфира метки. В некоторых случаях метку и антитело можно связывать посредством активации и реакции метки с антителом in situ с формированием конъюгата метка-антитело в одну стадию.
Другие активирующие и связывающие реагенты включают TBTU (гексафторфосфат 2-(1H-бензотриазо-1-ил)-1-1,3,3-тетраметилурония), TFFH (2-фтор-гексафторфосфат N,N',N'',N'''-тетраметилурония), PyBOP (гексафторфосфат бензотриазол-1-ил-окси-трис-пирролидинофосфония, EEDQ (2-этокси-1-этоксикарбонил-1,2-дигидрохинолин), DCC (дициклогексилкарбодиимид); DIPCDI (диизопропилкарбодиимид), MSNT (1-(мезитилен-2-сульфонил)-3-нитро-1H-1,2,4-триазол и арилсульфонилгалогениды, например, триизопропилбензолсульфонилхлорид.
Соединения альбуминсвязывающий пептид-Fab по изобретению:
В одном из аспектов, антитело по изобретению слито с альбуминсвязывающим белком. Связывание белками плазмы может представлять собой эффективный способ улучшения фармакокинетических свойств короткоживущих молекул. Альбумин представляет собой наиболее представленный белок в плазме. Альбуминсвязывающие пептиды (ABP), связывающие сывороточный альбумин, могут изменять фармакодинамику слитых белков с активными доменами, включая изменение захвата, проникновения и диффузии в тканях. Эти фармакодинамические параметры можно изменять посредством конкретного выбора соответствующей последовательности связывающего сывороточный альбумин пептида (патент США 20040001827). Ряд альбуминсвязывающих пептидов определен скринингом посредством фагового дисплея (Dennis et al., (2002) "Albumin Binding As A General Strategy For Improving The Pharmacokinetics Of Proteins" J. Biol. Chem. 277: 35035-35043; WO 01/45746). Соединения по изобретению включают ABP последовательности указанные в (i) Dennis et al., (2002) J. Biol. Chem. 277: 35035-35043 в таблицах III и IV, страница 35038; (ii) патент США 20040001827 в [0076] SEQ ID NO: 9-22 и (iii) WO 01/45746 на страницах 12-13, все из которых включены в настоящий документ в качестве ссылки в полном объеме. Альбуминсвязывающие (ABP)-Fab конструируют посредством слияния альбуминсвязывающего пептида с C-концом тяжелой цепи Fab в стехиометрическом соотношении 1:1 (1 ABP/1 Fab). Показано, что ассоциация этих ABP-Fab с альбумином увеличивала время полужизни антитела у кроликов и мышей более чем в 25 раз. Таким образом, описанные выше реакционноспособные остатки Cys можно вводить в эти ABP-Fab и использовать для сайт-специфической конъюгации с цитотоксическими лекарственными средствами с последующим изучением на животных in vivo.
Иллюстративные последовательности альбуминсвязывающих пептидов включают в качестве неограничивающих примеров аминокислотные последовательности, перечисленные в SEQ ID NO: 42-46:
Конъюгаты антитело-лекарственное средство
В другом аспекте изобретение относится к иммуноконъюгатам или конъюгатам антитело-лекарственное средство (ADC), содержащим антитело, конъюгированное с цитотоксическим средством, таким как химиотерапевтическое средство, лекарственное средство, ингибирующее рост средство, токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения или их фрагменты) или радиоактивный изотоп (т.е. радиоконъюгат). В другом аспекте изобретение дополнительно относится к способам применения иммуноконъюгатов. В одном из аспектов иммуноконъюгат содержит любое из указанных выше антител к CD22, ковалентно присоединенное к цитотоксическому средству или детектируемому средству.
Использование конъюгатов антитело-лекарственное средство для локальной доставки цитотоксических или цитостатических средств, т.е. лекарственные средства для уничтожения или ингибирования опухолевых клеток при лечении злокачественной опухоли (Syrigos and Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drg Del. Rev. 26:151-172; патент США 4975278), обеспечивает направленную доставку молекулы лекарственного средства к опухолям и внутриклеточное накопление в них там, где системное введение этих неконъюгированных лекарственных средств, кроме опухолевых клеток, которые нужно удалить, может привести к неприемлемым уровням токсичности для нормальных клеток (Baldwin et al., (1986) Lancet pp.(Mar. 15, 1986):603-05; Thorpe, (1985) "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", в Monoclonal Antibodies '84: Biological And Clinical Applications, A. Pinchera et al., (ed.s), pp.475-506). Таким образом, желательной является максимальная эффективность при минимальной токсичности. Сообщалось, что для этих способов пригодны и поликлональные антитела, и моноклональные антитела (Rowland et al., (1986) Cancer Immunol. Immunother., 21:183-87). Лекарственные средства, используемые в этих способах, включают дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al., (1986) выше). Токсины, используемые в конъюгатах антитело-токсин, включают бактериальные токсины, такие как дифтерийный токсин, растительные токсины, такие как рицин, низкомолекулярные токсины, такие как гелданамицин (Mandler et al., (2000) Jour. of the Nat. Cancer Inst. 92(19): 1573-1581; Mandler et al., (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al., (2002) Bioconjugate Chem. 13:786-791), майтанзиноиды (EP 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623) и калихимицин (Lode et al., (1998) Cancer Res. 58:2928; Hinman et al., (1993) Cancer Res. 53:3336-3342). Токсины могут проявлять их цитотоксическое и цитостатическое действие посредством механизмов, включающих связывание тубулина, связывание ДНК или ингибирование топоизомеразы. Некоторые цитотоксические лекарственные средства, как правило, инактивируются или становятся менее активными при конъюгации с большими антителами или лигандами рецепторных белков.
ZEVALIN® (ибритумомаб тиуксетан, Biogen/Idec) представляет собой конъюгат антитело-радиоактивный изотоп, состоящий из моноклонального антитела IgG1 каппа мыши, направленного к антигену CD20, находящемуся на поверхности нормальных и злокачественных B-лимфоцитов, и радиоактивного изотопа111In или90Y, связанного тиомочевинным линкером-хелатором (Wiseman et al., (2000) Eur. Jour. Nucl. Med. 27(7):766-77; Wiseman et al., (2002) Blood 99(12): 4336-42; Witzig et al., (2002) J. Clin. Oncol. 20(10): 2453-63; Witzig et al., (2002) J. Clin. Oncol. 20(15): 3262-69). Хотя зевалин обладает активностью в отношении B-клеточной неходжкинской лимфомы (NHL), введение приводит к тяжелым и длительным цитопениям у большинства пациентов. В 2000 году для лечения острого миелолейкоза посредством инъекции одобрен MILOTARGTM (гемтузумаб озогамицин, Wyeth Pharmaceuticals), конъюгат антитело-лекарственное средство, составленный из антитела к huCD33, связанного с калихимицином (Drugs of the Future (2000) 25(7):686; патенты США №4970198; 5079233; 5585089; 5606040; 5693762; 5739116; 5767285; 5773001). Фазу II испытаний для лечения злокачественных опухолей, экспрессирующих CanAg, таких как злокачественная опухоль толстого кишечника, поджелудочной железы, желудка и другие, проходит кантузумаб мертанзин (Immunogen, Inc.), конъюгат антитело-лекарственное средство, составленный из антитела huC242, связанного через дисульфидный линкер SPP с молекулой майтанзиноидного лекарственного средства, DM1. В разработке для возможного лечения опухолей предстательной железы находится MLN-2704 (Millennium Pharm., BZL Biologics, Immunogen Inc.), конъюгат антитело-лекарственное средство, составленный из моноклонального антитела к специфическому мембранному антигену простаты (PSMA), связанного с молекулой майтанзиноидного лекарственного средства, DM1. Ауристатиновые пептиды, ауристатин E (AE) и монометилауристатин (MMAE), синтетические аналоги доластатина, конъюгированы с химерными моноклональными антителами cBR96 (специфичными к Lewis Y на карциномах) и cACIO (специфичными к CD30 у гематологических злокачественных образований) (Doronina et al., (2003) Nature Biotechnology 21(7): 778-784) и находятся в стадии терапевтической разработки.
В настоящем документе описаны химиотерапевтические средства, пригодные для получения иммуноконъюгатов. Ферментативно активные токсины и их фрагменты, которые можно использовать, включают цепь A дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, цепь A экзотоксина (из Pseudomonas aeruginosa), цепь A рицина, цепь A абрина, цепь A модецина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогелин, рестриктоцин, феномицин, эномицин и трихотецены. См., например, WO 93/21232, опубликованную 28 октября 1993 года. Для получения радиоконъюгированных антител доступно множество радионуклидов. Примеры включают212Bi,131I,131In,90Y и186Re. Конъюгаты антитела с цитотоксическим средством получают с применением множества бифункциональных связывающих белки средств, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCL), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидо соединения (такие как бис-(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-соединения активного фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, рициновый иммунотоксин можно получать, как описано в Vitetta et al., (1987) Science, 238:1098. Иллюстративным хелатирующим средством для конъюгации радионуклида с антителом является меченная по углероду-14 1-изотиоцианатбензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) (WO 94/11026).
Также в настоящем документе рассматривают конъюгаты антитела и одного или нескольких низкомолекулярных токсинов, таких как калихимицин, майтанзиноиды, доластатины, ауристатины, трихотецен и CC1065 и производные этих токсинов, которые обладают токсической активностью.
Майтанзин и майтанзиноиды
В некоторых вариантах осуществления иммуноконъюгат содержит антитело (полноразмерное или фрагменты) по изобретению, конъюгированное с одной или несколькими молекулами майтанзиноидов.
Майтанзиноиды представляют собой ингибиторы митоза, которые действуют, ингибируя полимеризацию тубулина. Майтанзин впервые выделили из восточно-африканского кустарника Maytenus serrata (патент США №3896111). Впоследствии обнаружили, что определенные микроорганизмы также продуцируют майтанзиноиды, такие как майтанзинол и сложные эфиры майтанзинола по C-3 (патент США №4151042). Также описаны синтетический майтанзинол и его производные и аналоги, например, в патентах США №4137230; 4248870; 4256746; 4260608; 4265814; 4294757; 4307016; 4308268; 4308269; 4309428; 4313946; 4315929; 4317821; 4322348; 4331598; 4361650; 4364866; 4424219; 4450254; 4362663 и 4371533.
Молекулы майтанзиноидных лекарственных средств являются привлекательными молекулами в конъюгатах антитело-лекарственное средство потому, что они (i) относительно доступны для получения посредством ферментации или химической модификации, дериватизации продуктов ферментации, (ii) поддаются дериватизации функциональными группами, подходящими для конъюгации через недисульфидные линкеры к антителам, (iii) стабильны в плазме и (iv) эффективны против ряда линий опухолевых клеток.
Майтанзиновые соединения, пригодные для использования в качестве молекул майтанзиноидных лекарственных средств, хорошо известны в данной области, и их можно выделять из природных источников известными способами, получать способами генетической инженерии (см. Yu et al., (2002) PNAS 99: 7968-7973), или майтанзинол и аналоги майтанзинола известными способами получают синтетически.
Иллюстративные молекулы майтанзиноидных лекарственных средств включают молекулы с модифицированным ароматическим кольцом, таким как C-19-дехлоро (патент США 4256746) (полученным посредством восстановления ансамитоцина P2 гидридом алюминия лития); C-20-гидрокси (или C-20-деметил) +/- C-19-дехлоро (патенты США №4361650 и 4307016) (полученным деметилированием с использованием Streptomyces или Actinomyces или дехлорированием с применением LAH); и C-20-деметокси, C-20-ацилокси (-OCOR), +/-дехлоро (патент США №4294757) (полученного посредством ацилирования с применением ацилхлоридов) и молекулы с модификациями в других положениях.
Иллюстративные молекулы майтанзиноидных лекарственных средств также включают молекулы с такими модификациями как C-9-SH (патент США 4424219) (полученная посредством реакции майтанзинола с H2S или P2S5); C-14-алкоксиметил(деметокси/CH2OR) (патент США 4331598); C-14-гидроксиметил или ацилоксиметил (CH2OH или CH2OAc) (патент США 4450254) (полученные из Nocardia); C-15-гидрокси/ацилокси (патент США 4364866) (полученная посредством конверсии майтанзинола Streptomyces); C-15-метокси (патенты США №4313946 и 4315929) (выделенная из Trewia nudlflora); C-18-N-деметил (патенты США №4362663 и 4322348) (полученная посредством деметилирования майтанзинола Streptomyces) и 4,5-дезокси (патент США 4371533) (полученная посредством восстановления майтанзинола трихлоридом титана/LAH).
Иллюстративные варианты осуществления молекул майтанзиноидных лекарственных средств включают DM1; DM3 и DM4, со следующими структурами:



где волнистая линия означает ковалентное присоединение атома серы лекарственного средства к линкеру (L) конъюгата антитело-лекарственное средство. Сообщалось о HERCEPTIN® (герцептин®, трастузумаб, антитело к HER2), связанном посредством SMCC с DM1 (WO 2005/037992, которая в полном объеме включена в настоящий документ в качестве ссылки). Конъюгат антитело-лекарственное средство по настоящему изобретению можно получать описанными в ней способами.
Другие иллюстративные конъюгаты антитело-лекарственное средство с майтанзиноидами имеют следующие структуры и обозначения (где Ab представляет собой антитело, а p представляет собой число от 1 до приблизительно 8):

Иллюстративные конъюгаты антитело-лекарственное средство, где DM1 связан через линкер BMPEO с тиольной группой антитела, имеют следующие структуру и обозначение:
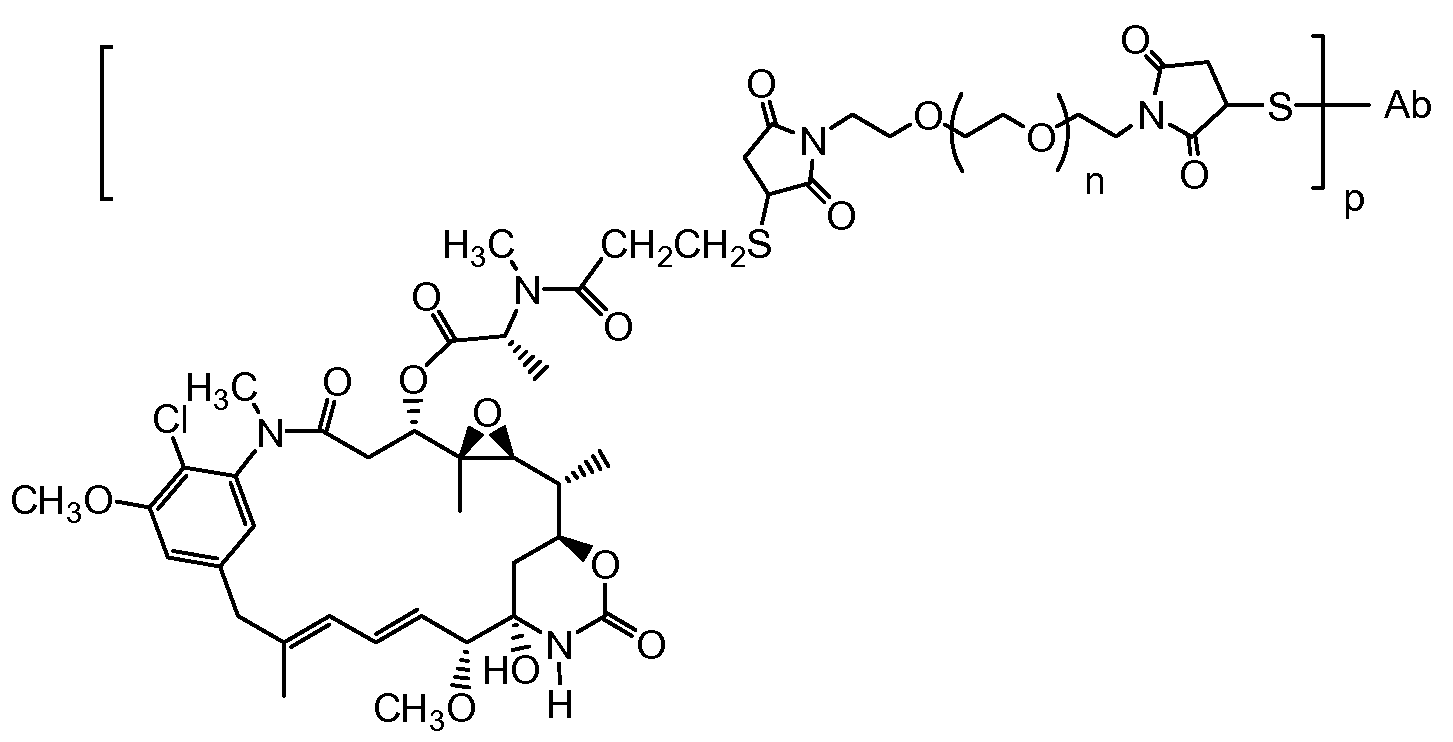
где Ab представляет собой антитело; n представляет собой 0, 1 или 2; а p представляет собой 1, 2, 3 или 4.
Иммуноконъюгаты, содержащие майтанзиноиды, способы их получения и их терапевтическое применение описаны, например, в патентах США №5208020; 5416064; 6441163 и европейском патенте EP 0425235 B1, описания которых включены в настоящий документ в качестве ссылки в полном объеме. В Liu et al., Proc. Natl. Acad. Sci. USA 93: 8618-8623 (1996) описаны иммуноконъюгаты, содержащие майтанзиноид, обозначенный DM1, связанный с моноклональным антителом C242, направленным против колоректального рака человека. Выявлено, что конъюгат высокоцитотоксичен для культивируемых клеток рака толстого кишечника, и показана противоопухолевая активность в анализе роста опухоли in vivo. В Chad et al., Cancer Research 52: 127-131 (1992) описаны иммуноконъюгаты, в которых майтанзиноид через дисульфидный линкер конъюгирован с мышиным антителом A7, связываясь с антигеном клеточных линий рака толстого кишечника человека, или с другим моноклональным антителом мыши TA.1, которое связывается с онкогеном HER-2/neu. Цитотоксичность конъюгата TA.1-майтанзиноид тестировали in vitro на клеточной линии рака молочной железы человека SK-BR-3, экспрессирующей 3×105 поверхностных антигенов HER-2 на клетку. Лекарственный конъюгат достигал степени цитотоксичности, сходной со степенью цитотоксичности свободного майтанзиноидного лекарственного средства, которую можно увеличить, увеличивая количество майтанзиноидных молекул на молекулу антитела. Конъюгат A7-майтанзиноид продемонстрировал низкую системную цитотоксичность у мышей.
Конъюгаты антитело к CD22-майтанзиноид получают посредством химического связывания антитела с молекулой майтанзиноида без значительного снижения биологической активности антитела или молекулы майтанзиноида. См., например, патент США №5208020 (описание которого, таким образом, включено в настоящее описание в качестве ссылки в полном объеме). В среднем 3-4 молекулы майтанзиноида, конъюгированные с одной молекулой антитела, продемонстрировали эффективность в отношении усиления цитотоксичности для клеток-мишеней без отрицательного воздействия на функцию или растворимость антитела, хотя можно ожидать, что даже одна молекула токсина/антитело увеличивает цитотоксичность по сравнению с применением одного антитела. Майтанзиноиды хорошо известны в данной области и их можно синтезировать известными способами или выделять из природных источников. Подходящие майтанзиноиды описаны, например, в патенте США №5208020 и в других патентных и непатентных публикациях, на которые приводятся ссылки выше в данном документе. Предпочтительными майтанзиноидами являются майтанзинол и аналоги майтанзинола, модифицированные по ароматическому кольцу или по другим положениям молекулы майтанзинола, такие как различные сложные эфиры майтанзинола.
Существует множество известных в данной области линкерных групп для получения конъюгатов антитело-майтанзиноид, включающих, например, линкерные группы, описанные в патентах США №5208020, 6441163 или европейском патенте 0425235 B1, Chari et al., Cancer Research 52: 127-131 (1992) и патенте США 2005/0169933 A1, описания которых включены в настоящий документ в качестве ссылки в полном объеме. Конъюгаты антитело-майтанзиноид, содержащие линкерный компонент SMCC, можно получать, как описано в патентной заявке США №11/141344, зарегистрированной 31 мая 2005 года, "Antibody Drug Conjugates and Methods". Линкерные группы включают дисульфидные группы, тиоэфирные группы, кислотолабильные группы, фотолабильные группы, пептидазолабильные группы или эстеразолабильные группы, как описано в указанных выше патентах. Дополнительные линкерные группы описаны и проиллюстрированы в настоящем документе.
Конъюгаты антитела и майтанзиноида можно получать с применением множества бифункциональных связывающих белки средств, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидо соединения (такие как бис-(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-соединения активного фтора (такие как 1,5-дифтор-2,4-динитробензол). Особенно предпочтительные связывающие средства включают N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (Carlsson et al., Biochem. J. 173: 723-737 (1978)) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPP) для образования дисульфидной связи.
Линкер можно присоединять к молекуле майтанзиноида в различных положениях в зависимости от типа связи. Например, сложноэфирную связь можно формировать посредством реакции с гидроксильной группой с применением традиционных способов связывания. Реакция может проходить по положению C-3, в котором находится гидроксильная группа, по положению C-14, модифицированному гидроксиметилом, по положению C-15, модифицированному гидроксильной группой, и по положению C-20, в котором находится гидроксильная группа. В предпочтительном варианте осуществления связь формируют по положению C-3 майтанзинола или аналога майтанзинола.
В одном из вариантов осуществления любое антитело по изобретению (полноразмерное или фрагмент) конъюгировано с одной или несколькими молекулами майтанзиноидов. В одном из вариантов осуществления иммуноконъюгата цитотоксическое средство D представляет собой майтанзиноид DM1. В одном из вариантов осуществления иммуноконъюгата линкер представляет собой SMCC. В одном из вариантов осуществления конъюгат антитело-линкер-лекарственное средство представляет собой антитело к CD22, как описано в настоящем документе, к которому через линкер SMCC ковалентно присоединено цитотоксическое средство DM1.
Ауристатины и долостатины
В некоторых вариантах осуществления иммуноконъюгат содержит антитело по изобретению, конъюгированное с доластатинами или пептидными аналогами и производными долостатинов, ауристатинами (патенты США №5635483; 5780588). Показано, что доластатины и ауристатины препятствуют активности микротрубочек, гидролизу ГТФ и делению ядра и клетки (Woyke et al., (2001) Antimicrob. Agents and Chemother. 45(12):3580-3584) и обладают противоопухолевой (патент США 5663149) и противогрибковой активностью (Pettit et al., (1998) Antimicrob. Agents Chemother. 42:2961-2965). Молекулу лекарственного средства доластатина или ауристатина можно связывать с антителом через N-конец (амино) или C-конец (карбоксильный) пептидной группы лекарственного средства (WO 02/088172).
Иллюстративные варианты осуществления ауристатина включают присоединенные по N-концу группы лекарственного средства монометилауристатина DE и DF, описанные в "Senter et al., Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 623, представленной 28 марта 2004 года, описание которой приведено в качестве ссылки в полном объеме.
Иллюстративный вариант осуществления ауристатина представляет собой MMAE (где волнистая линия указывает ковалентную связь с линкером (L) конъюгата антитело-лекарственное средство).

Другой иллюстративный вариант осуществления ауристатина представляет собой MMAF, где волнистая линия указывает ковалентную связь с линкером (L) конъюгата антитело-лекарственное средство (патент США 2005/0238649):

Дополнительные иллюстративные варианты осуществления, содержащие MMAE или MMAF, и различные линкерные компоненты (описанные далее в настоящем документы) имеют следующие структуры и сокращения (где Ab означает антитело, а p представляет собой число от 1 до приблизительно 8):



Как правило, пептидные группы лекарственных средств можно получать посредством формирования пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи можно получать, например, способом синтеза в жидкой фазе (см. E. Schröder and K. Lübke, "The Peptides", volume 1, pp 76-136, 1965, Academic Press), который хорошо известен в области пептидной химии. Ауристатиновые/доластатиновые группы лекарственных средств можно получать способами по патенту США 5635483; патенту США 5780588; Pettit et al., (1989) J. Am. Chem. Soc. 111: 5463-5465; Pettit et al., (1998) Anti-Cancer Drug Design 13: 243-277; Pettit, G.R., et al., Synthesis, 1996, 719-725; Pettit et al., (1996) J. Chem. Soc. Perkin Trans. 1 5: 859-863 и Doronina (2003) Nat. Biotechnol. 21(7): 778-784.
Калихимицин
В других вариантах осуществления иммуноконъюгат содержит антитело по изобретению, конъюгированное с одной или несколькими молекулами калихимицина. Калихимициновое семейство антибиотиков способно к образованию двухцепочечных разрывов в ДНК в субпикомолярных концентрациях. Для получения конъюгатов калихимицинового семейства см. патенты США №5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5877296 (все выданы American Cyanamid Company). Структурные аналоги калихимицина, которые можно использовать, включают в качестве неограничивающих примеров γ1I, α2I, α3I, N-ацетил-γ1I, PSAG и θ1I (Hinman et al., Cancer Research 53:3336-3342 (1993), Lode et al., Cancer Research 58:2925-2928 (1998) и указанные выше патенты США, выданные American Cyanamid). Другим противоопухолевым лекарственным средством, с которым можно конъюгировать антитело, является QFA, представляющее собой антифолат. И калихимицин, и QFA содержат внутриклеточные участки действия и с трудом проходят через плазматическую мембрану. Таким образом, клеточный захват этих средств вследствие опосредованной антителом интернализации значительно усиливает их действие.
Другие цитотоксические средства
Другие противоопухолевые средства, которые можно конъюгировать с антителами по изобретению, включают BCNU, стрептозоицин, винкристин и 5-фторурацил, семейство средств, в совокупности известных как комплекс LL-E33288, описанный в патентах США 5053394, 5770710, а также эсперамицины (патент США 5877296).
Ферментативно активные токсины и их фрагменты, которые можно использовать, включают цепь A дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, цепь A экзотоксина (из Pseudomonas aeruginosa), цепь A рицина, цепь A абрина, цепь A модецина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогелин, рестриктоцин, феномицин, эномицин и трихотецены. См., например, WO 93/21232, опубликованную 28 октября 1993 года.
Настоящее изобретение дополнительно относится к иммуноконъюгату, образованному антителом и соединением с нуклеолитической активностью (например, рибонуклеазой или ДНК-эндонуклеазой, такой как дезоксирибонуклеаза; ДНКаза).
Для избирательного разрушения опухоли антитело может содержать высокорадиоактивный атом. Для получения радиоконъюгированных антител доступно множество радиоактивных изотопов. Примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. Когда конъюгат применяют для детекции, он может содержать радиоактивный атом для сцинтиграфических исследований, например tc99m или I123, или спиновую метку для получения изображения ядерно-магнитного резонанса (ЯМР) (также известного как магнитно-резонансная томография, МРТ), такую как снова йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиоактивные или другие метки можно вводить в конъюгат известными способами. Например, пептид можно биосинтезировать или синтезировать посредством химического синтеза аминокислот с применением подходящих предшественников аминокислот, содержащих, например, фтор-19 вместо водорода. Метки, такие как tc99m или I123, Re186, Re188 и In111, можно присоединить через цистеиновый остаток в пептиде. Иттрий-90 можно присоединять посредством лизинового остатка. Для введения йода-123 можно использовать способ IODOGEN (Fraker et al (1978) Biochem. Biophys. Res. Commun. 80:49-57). В "Monoclonal Antibodies in Immunoscintigraphy" (Chatal, CRC Press 1989) подробно описаны другие способы.
Конъюгаты антитела и цитотоксического средства можно получать с применением различных связывающих белки средств, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидо соединения (такие как бис-(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол 2,6-диизоцианат) и бис-соединения активного фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, рициновый иммунотоксин можно получать, как описано в Vitetta et al. Science, 238:1098 (1987). Меченная по углероду-14 1-изотиоцианатбензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) представляет собой иллюстративное хелатирующее средство для конъюгации радионуклеотида с антителом. См. WO 94/11026. Линкер может представлять собой "расщепляемый линкер", облегчающий высвобождение цитотоксического лекарственного средства в клетке. Например, можно использовать кислотолабильный линкер, пептидазочувствительный линкер, фотолабильный линкер, диметильный линкер или содержащий дисульфид линкер (Chari et al., Cancer Research 52: 127-131 (1992); патент США №5208020).
Соединения по изобретению включают в качестве неограничивающих примеров ADC, полученные с перекрестно-сшивающими реагентами: BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, в Pierce Biotechnology, Inc., Rockford, IL., U.S.A). См. страницы 467-498, 2003-2004 Applications Handbook and Catalog.
Получение конъюгатов антитело-лекарственное средство:
В конъюгатах антитело-лекарственное средство (ADC) по изобретению, антитело (Ab) конъюгировано с одним или несколькими молекулами лекарственного средства (D), например, с молекулами лекарственного средства в количестве от приблизительно 1 до приблизительно 20 на антитело, посредством линкера (L). ADC формулы I можно получать несколькими способами с применением реакций органической химии, условий и реагентов, известных специалистам в данной области, включая (1) реакцию нуклеофильной молекулы антитела с бивалентным линкерным реагентом, с формированием Ab-L посредством ковалентной связи с последующей реакцией с молекулой лекарственного средства D; и (2) реакцию нуклеофильной группы из молекулы лекарственного средства с бивалентным линкерным реагентом с формированием D-L посредством ковалентной связи с последующей реакцией с нуклеофильной группой антитела. В настоящем документе описаны дополнительные способы получения ADC.
Линкер может состоять из одного или нескольких линкерных компонентов. Иллюстративные линкерные компоненты включают 6-малеимидокапроил ("MC"), малеимидопропаноил ("MP"), валин-цитруллин ("val-cit"), аланин-фенилаланин ("ala-phe"), п-аминобензилоксикарбонил ("PAB"), N-сукцинимидил-4-(2-пиридилтио)пентаноат ("SPP"), N-сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат ("SMCC") и N-сукцинимидил(4-йодацетил)аминобензоат ("SIAB"). Дополнительные линкерные компоненты известны в данной области, и некоторые описаны в настоящем документе.
В некоторых вариантах осуществления линкер может содержать аминокислотные остатки. Иллюстративные аминокислотные линкерные компоненты включают дипептид, трипептид, тетрапептид или пентапептид. Иллюстративные дипептиды включают валин-цитруллин (vc или val-cit), аланин-фенилаланин (af или ala-phe). Иллюстративные трипептиды включают глицин-валин-цитруллин (gly-val-cit) и глицин-глицин-глицин (gly-gly-gly). Аминокислотные остатки, содержащиеся в аминокислотном линкерном компоненте, включают остатки, встречающиеся в природе, а также минорные аминокислоты и невстречающиеся в природе аналоги аминокислот, такие как цитруллин. Аминокислотные линкерные компоненты можно конструировать и оптимизировать по их селективности для ферментативного расщепления конкретными ферментами, например, ассоциированной с опухолью протеазой, катепсином B, C и D или протеазой плазмином.
Иллюстративные структуры линкерных компонентов представлены ниже (где волнистая линия указывает участки ковалентного присоединения к другим компонентам ADC):

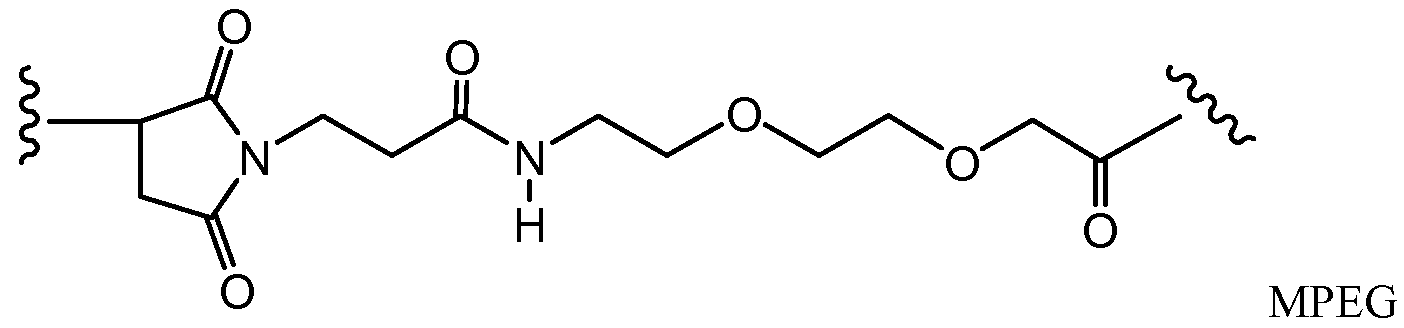
Дополнительные иллюстративные линкерные компоненты и сокращения включают (где антитело (Ab) и линкер изображены, а p представляет собой число от 1 до приблизительно 8):
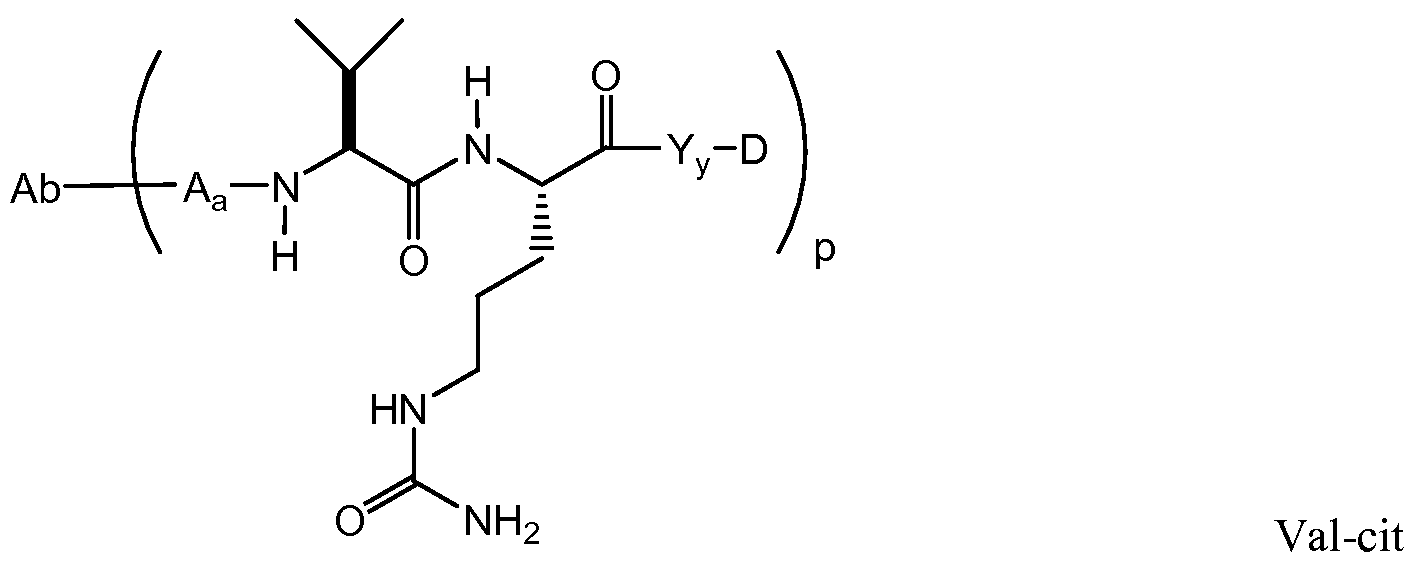

Нуклеофильные группы антител включают в качестве неограничивающих примеров (i) N-концевые аминогруппы, (ii) аминогруппы боковой цепи, например, лизина, (iii) тиольные группы боковой цепи, например цистеина, и (iv) гидроксильные или аминогруппы сахаров, когда антитело гликозилировано. Аминогруппы, тиольные и гидроксильные группы являются нуклеофильными и способны к реакции с формированием ковалентных связей с электрофильными группами на линкерных молекулах и линкерных реагентах, включая (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галогенформиаты и галогенангидриды; (ii) алкилгалогениды и бензилгалогениды, такие как галогенацетамиды; (iii) альдегидные, кетоновые, карбоксильные и малеимидные группы. Определенные антитела содержат восстанавливаемые межцепочечные дисульфиды, т.е. цистеиновые мостики. Антитела можно сделать реакционноспособными для конъюгации с линкерными реагентами посредством обработки восстановителем, таким как DTT (дитиотреитол). Таким образом, каждый цистеиновый мостик, теоретически, будет формировать два реакционноспособных тиоловых нуклеофила. Дополнительные нуклеофильные группы можно вводить в антитела посредством реакции лизинов с 2-иминотиоланом (реагент Трота), что приводит к превращению амина в тиол. Реакционноспособные тиольные группы можно вводить в антитело (или в его фрагмент) посредством введения одного, двух, трех, четырех или более остатков цистеина (например, получая мутантные антитела, содержащие один или несколько неприродных аминокислотных остатков цистеина).
Конъюгаты антитело-лекарственное средство по изобретению можно также получать посредством модификации антитела с введением электрофильных групп, которые могут реагировать с нуклеофильными заместителями на линкерном реагенте или лекарственном средстве. Сахара гликозилированных антител можно окислять, например, с помощью периодатных окисляющих реагентов с формированием альдегидных или кетоновых групп, которые могут реагировать с аминогруппами линкерных реагентов или молекул лекарственного средства. Полученные группы иминовых оснований Шиффа могут формировать стабильную связь или их можно восстанавливать, например, боргидридными реагентами с формированием стабильных аминовых связей. В одном из вариантов осуществлением реакция углеводной части гликозилированного антитела с оксидазой галактозы или с метапериодатом натрия может приводить к образованию в белке карбонильных групп (альдегида и кетона), которые могут реагировать с соответствующими группами на лекарственном средстве (Hermanson, Bioconjugate Techniques). В другом варианте осуществления белки, содержащие N-концевые остатки серина или треонина, могут реагировать с метапериодатом натрия, приводя к получению альдегида вместо первой аминокислоты (Geoghegan & Stroh, (1992) Bioconjugate Chem. 3: 138-146; US 5362852). Такие альдегиды могут реагировать с молекулой лекарственного средства или нуклеофилом линкера.
Подобным образом, нуклеофильные группы на молекуле лекарственного средства включают в качестве неограничивающих примеров аминогруппы, тиольные, гидроксильные, гидразидные, оксимные, гидразиновые, тиосемикарбазоновые, гидразинкарбоксилатные и арилгидразидные группы, способные к реакции с формированием ковалентных связей с электрофильными группами на линкерных молекулах и линкерных реагентах, включая (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галогенформиаты и галогенангидриды; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегидные, кетоновые, карбоксильные и малеимидные группы.
В еще одном аспекте антитело содержит один или несколько остатков лизина, которые можно химически модифицировать с введением одной или нескольких сульфгидрильных групп. Антительная часть молекулы связывается с линкерной частью молекулы через атом серы сульфгидрильной группы. Реагенты, которые можно использовать для модификации лизина, включают в качестве неограничивающих примеров N-сукцинимидил S-ацетилтиоацетат (SATA) и гидрохлорид 2-иминотиолана (реагент Трота).
В другом варианте осуществления антитело может содержать одну или несколько углеводных групп, которые можно химически модифицировать так, чтобы они содержали одну или несколько сульфгидрильных групп. Антительная часть молекулы связывается с линкерной частью молекулы, такой как элемент Stretcher, посредством атома серы сульфгидрильной группы, как описано в настоящем документе.
В другом варианте осуществления антитело может содержать одну или несколько углеводных групп, которые можно окислять с получением альдегидной (-CHO) группы (см., например, Laguzza, et al., J. Med. Chem. 1989, 32(3), 548-55). Соответствующий альдегид может формировать связь с реактивным центром на элементе Stretcher. Реактивные центры на элементе Stretcher, который может реагировать с карбонильной группой на антителе, включают в качестве неограничивающих примеров гидразин и гидроксиламин. Другие протоколы для модификации белков с присоединением или ассоциацией элементов лекарственных средств описаны в Coligan et al., Current Protocols in Protein Science, Vol.2, John Wiley & Sons (2002), включенной в настоящий документ в качестве ссылки в полном объеме.
Способы конъюгации молекул линкер-лекарственное средство с направленными к клеткам белкам, такими как антитела, иммуноглобулины или их фрагменты находятся, например, в US5208020; US6441163; WO 2005037992; WO 2005081711 и WO 2006/034488, которые, таким образом, все включены в настоящее описание в качестве ссылки в полном объеме.
Альтернативно можно получать слитый белок, содержащий антитело и цитотоксическое средство, например, рекомбинантными способами или пептидным синтезом. Отрезок ДНК может содержать соответствующие области, кодирующие две части конъюгата, примыкающие друг к другу или разделенные областью, кодирующей линкерный пептид, который не нарушает желаемых свойств конъюгата.
В другом варианте осуществления антитело можно конъюгировать с "рецептором" (таким как стрептавидин) для использования в предварительном нацеливании, где конъюгат антитело-рецептор вводят пациенту с последующим удалением несвязанного конъюгата из циркуляции с применением очищающего средства, а затем вводят "лиганд" (например, авидин), который конъюгирован с цитотоксическим средством (например, радионуклиотидом).
В одном из вариантов осуществления иммуноконъюгата цитотоксическое средство, D, представляет собой ауристатин формулы DE или DF


и где каждый из R2 и R6 представляет собой метил, каждый из R3 и R4 представляет собой изопропил, R7 представляет собой втор-бутил, каждый R8 независимо выбран из CH3, O-CH3, OH и H; R9 представляет собой H; R10 представляет собой арил; Z представляет собой -O- или -NH-; R11 представляет собой H, C1-C8-алкил, или -(CH2)2-O-(CH2)2-O-(CH2)2-O-CH3; и R18 представляет собой -C(R8)2-C(R8)2-арил; и
(d) p находится в диапазоне от приблизительно 1 до 8.
Приведенные ниже варианты осуществления относятся к любому из указанных выше иммуноконъюгатов. В одном из вариантов осуществления иммуноконъюгат обладает активностью в отношении уничтожения клеток in vitro или in vivo. В одном из вариантов осуществления линкер присоединен к антителу через тиольную группу на антителе. В одном из вариантов осуществления линкер подвержен расщеплению протеазой. В одном из вариантов осуществления линкер содержит дипептид val-cit. В одном из вариантов осуществления линкер содержит п-аминобензильную группу. В одном из вариантов осуществления п-аминобензильная группа в линкере располагается между лекарственным средством и участком расщепления протеазы. В одном из вариантов осуществления п-аминобензильная группа представляет собой п-аминобензилоксикарбонил (PAB). В одном из вариантов осуществления линкер содержит 6-малеимидокапроил. В одном из вариантов осуществления 6-малеимидокапроил в линкере расположен между антителом и участком расщепления протеазы. Указанные выше варианты осуществления можно осуществлять по одному или в любом сочетании друг с другом.
В одном из вариантов осуществления лекарственное средство выбрано из MMAE и MMAF. В одном из вариантов осуществления иммуноконъюгат имеет формулу

где Ab представляет собой любое из указанных выше антител к CD22, S представляет собой атом серы, а p находится в диапазоне от 2 до 5. В одном из вариантов осуществления иммуноконъюгат имеет формулу

где Ab представляет собой любое из указанных выше антител к CD22, S представляет собой атом серы, а p находится в диапазоне от приблизительно 1 до приблизительно 6, от приблизительно 2 до приблизительно 5, от приблизительно 2 до приблизительно 6, от приблизительно 2 до приблизительно 4, от приблизительно 2 до приблизительно 3, от приблизительно 3 до приблизительно 4, от приблизительно 3 до приблизительно 5, от приблизительно 3 до приблизительно 6 или от приблизительно 4 до приблизительно 6.
Способы визуализации с меченым антителом:
В другом варианте осуществления изобретения модифицированные цистеином антитела можно метить посредством тиольных групп цистеина радионуклидами, флуоресцентными красителями, запускающими биолюминесценцию молекулами субстрата, запускающими хемилюминесценцию молекулами субстрата, ферментами и другими детектируемыми метками для экспериментов по визуализации с диагностическими, фармакодинамическими и терапевтическими применениями. Как правило, меченое модифицированное цистеином антитело, т.е. "биомаркер" или "зонд", вводят посредством инъекции, перфузии или перорального введения в живой организм, например, человеку, грызуну или другому небольшому животному, перфузируемый орган или образец ткани. С течением времени детектируют распределение зонда и представляют в виде изображения.
Промышленные изделия:
В другом варианте осуществления изобретения предоставлено промышленное изделие или "набор", содержащий вещества, пригодные для лечения описанных выше заболеваний. Промышленное изделие содержит контейнер и ярлык или вкладыш в упаковку на контейнере или относящиеся к нему. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы, блистерные упаковки и т.д. Контейнеры можно получать из множества материалов, таких как стекло или пластик. Контейнер содержит композицию конъюгата антитело-лекарственное средство (ADC), которая эффективна для лечения патологического состояния, и может иметь стерильное входное отверстие (например, контейнер может представлять собой пакет для внутривенного раствора или флакон с пробкой, поддающийся прокалыванию иглой для подкожных инъекций). По меньшей мере одно активное средство в композиции представляет собой ADC. В ярлыке или вкладыше в упаковку указано, что композицию применяют для лечения выбранного состояния, такого как злокачественная опухоль. Альтернативно или дополнительно промышленное изделие может дополнительно содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-солевой буфер, раствор Рингера и раствор декстрозы. Дополнительно оно может включать другие материалы, желательные с коммерческой или пользовательской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Фармацевтические композиции:
В одном из аспектов предоставлена фармацевтическая композиция, содержащая любой из указанных иммуноконъюгатов и фармацевтически приемлемый носитель. В одном из аспектов предоставлен способ лечения B-клеточного пролиферативного нарушения, где способ включает введение индивидууму фармацевтической композиции. В одном из вариантов осуществления B-клеточное пролиферативное нарушение выбрано из лимфомы, неходжкинской лимфомы (NHL), агрессивной NHL, рецидивирующей агрессивной NHL, рецидивирующей медленно растущей NHL, рефракторной NHL, рефракторной медленно растущей NHL, хронического лимфолейкоза (CLL), мелкоклеточной лимфомы, лейкоза, волосатоклеточного лейкоза (HCL), острого лимфоцитарного лейкоза (ALL) и лимфомы мантийных клеток. В одном из вариантов осуществления клеточное пролиферативное нарушение ассоциировано с увеличенной экспрессией CD22 на поверхности клетки.
В одном из аспектов предоставлен способ ингибирования клеточной пролиферации, где способ включает воздействие на клетку любым из указанных выше иммуноконъюгатов в условиях, позволяющих связывание иммуноконъюгата с CD22. В одном из вариантов осуществления B-клетка представляет собой опухолевую клетку. В одном из вариантов осуществления опухолевая клетка представляет собой B-клетку млекопитающего, с наличием или с подозрением на наличие B-клеточного пролиферативного нарушения, выбранного из лимфомы, неходжкинской лимфомы (NHL), агрессивной NHL, рецидивирующей агрессивной NHL, рецидивирующей медленно растущей NHL, рефракторной NHL, рефракторной медленно растущей NHL, хронического лимфолейкоза (CLL), мелкоклеточной лимфомы, лейкоза, волосатоклеточного лейкоза (HCL), острого лимфоцитарного лейкоза (ALL) и лимфомы мантийных клеток, клетка представляет собой ксенотрансплантат. В одном из вариантов осуществления воздействие происходит in vitro. В одном из вариантов осуществления воздействие происходит in vivo.
В одном из аспектов предоставлен способ применения антитело к CD22 по изобретению для анализа сывороточного растворимого CD22 у млекопитающих с лейкозом или лимфомой для диагностики B-клеточного лейкоза или B-клеточной лимфомы, для контроля клинического прогресса или регресса заболеваний или для оценки опухолевой массы или рецидива. Такие способы описаны в патенте США 20050244828 (Kreitman, R.J. et al., содержание которого, таким образом, включено в качестве ссылки в полном объеме), где применяют конъюгат антитела RFB4 к CD22 и токсина PE38 (фрагмент 38 экзотоксина A Pseudomonas) (см. Kreitman, R.J. et al., NEJM 345: 241-247 (2001)).
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг.1A-1D: фиг.1A представляет собой диаграмму CD22, демонстрирующую семь иммуноглобулин-подобных доменов внеклеточного домена бета-изоформы. В альфа-изоформе отсутствуют домены 3 и 4. "TM" относится к трансмембранному домену. На фиг.1B изображена аминокислотная последовательность бета-формы CD22 (SEQ ID NO: 27). В альфа-форме CD22 отсутствуют аминокислоты, изображенные курсивом (кодирующие домены 3 и 4 внеклеточного домена). Внеклеточный домен зрелой формы белка подчеркнут (SEQ ID NO: 28). Аминокислоты 1-21 представляют собой сигнальную последовательность, отщепляемую от зрелой формы. Фиг.1C представляет собой аминокислотную последовательность CD22-альфа (SEQ ID NO: 29). ECD CD22-альфа подчеркнут (SEQ ID NO: 30). Фигура 1D представляет собой аминокислотную последовательность CD22 яванского макака (cyno) (SEQ ID NO: 31). Первые 19 аминокислот CD22 cyno представляют собой сигнальную последовательность.
Фиг.2A-2B: фиг.2A представляет собой аминокислотную последовательность вариабельной области тяжелой цепи антитела 10F4 к CD22 мыши по изобретению (m10F4), выравненную с гуманизированной версией 1 антитела 10F4 (h10F4v1) и выравненную с последовательностью человека подгруппы III. HVR заключены в рамку (HVR-H1, HVR-H2, HVR-H3). Последовательности, охватывающие HVR, представляют собой каркасные последовательности (от FR-H1 до FR-H4). Последовательности пронумерованы в соответствии с нумерацией Kabat. CDR по Kabat, Chothia и контактные CDR указаны над заключенными в рамку HVR. На фиг.2B приведена аминокислотная последовательность вариабельной области легкой цепи антитела 10F4 к CD22 мыши по изобретению (m10F4), выравненная с гуманизированной версией 1 антитела 10F4 (h10F4v1) и выравненную с последовательностью человека каппа I. Версии 2 и 3 гуманизированного антитела 10F4 (h10F4v2 и h10F4v3) у секретируемой зрелой формы содержат те же аминокислотные последовательности. Антитела h10F4v2 и h10F4v3 отличаются от h10F4v1 аминокислотой 28 HVR-L1 (N28V). HVR заключены в рамку. последовательности FR-L1, FR-L2, FR-L3 и FR-L4 охватывают HVR (HVR-L1, HVR-L2, HVR-L3). Последовательности пронумерованы в соответствии с нумерацией Kabat. CDR по Kabat, Chothia и контактные CDR указаны над заключенными в рамки HVR.
На фиг.3A и 3B показаны иллюстративные акцепторные консенсусные каркасные последовательности вариабельных фрагментов тяжелых цепей человека для применения в практическом осуществлении настоящего изобретения с идентификаторами последовательностей, как указано ниже, где SEQ ID NO: FR перечислены в порядке FR-H1, FR-H2, FR-H3, FR-H4:
- консенсусный каркас "A" VH подгруппы I человека без CDR по Kabat (SEQ ID NO: 26, 47, 48, 7);
- консенсусные каркасы "B", "C" и "D" VH подгруппы I человека без расширенных гипервариабельных областей (SEQ ID NO: 50, 51, 52, 7; SEQ ID NO: 50, 51, 52, 7 и SEQ ID NO: 50, 51, 53, 7);
- консенсусный каркас "A" VH подгруппы II человека без CDR по Kabat (SEQ ID NO: 54, 55, 56, 7);
- консенсусные каркасы "B", "C" и "D" VH подгруппы II человека без расширенных гипервариабельных областей (SEQ ID NO: 57, 58, 56, 7 SEQ ID NO: 57, 58, 59, 7; и SEQ ID NO: 57, 58, 60, 7);
- консенсусный каркас "A" VH подгруппы III человека без CDR по Kabat (SEQ ID NO: 61, 62, 63, 7);
- консенсусные каркасы "B", "C" и "D" VH подгруппы III человека без расширенных гипервариабельных областей (SEQ ID NO: 64, 65, 63, 7; SEQ ID NO: 64, 65, 66, 7 и SEQ ID NO: 64, 65, 67, 7);
- каркас "A" акцепторной VH 1 человека без CDR по Kabat (SEQ ID NO: 68, 62, 69, 7);
- каркасы "B" и "C" акцепторной VH человека без расширенных гипервариабельных областей (SEQ ID NO: 64, 65, 69, 7; и SEQ ID NO: 64, 65, 70, 7);
- каркас "A" акцепторной VH 2 человека без CDR по Kabat (SEQ ID NO: 68, 62, 71, 7);
- каркасы "B", "C" и "D" акцепторной VH 2 человека без расширенных гипервариабельных областей (SEQ ID NO: 64, 65, 71, 7; SEQ ID NO: 64, 65, 72, 7 и SEQ ID NO: 64, 65, 73, 7).
На фиг.4A и 4B показаны иллюстративные акцепторные консенсусные каркасные последовательности вариабельных фрагментов легких цепей (VL) человека для применения в практическом осуществлении настоящего изобретения с идентификаторами последовательностей, как указано ниже:
- консенсусный каркас (κv1-1) VL каппа подгруппы 1-1 человека: SEQ ID NO: 74, 75, 76, 77;
- консенсусный каркас (κv1) VL каппа подгруппы I человека: SEQ ID NO: 74, 78, 76, 77;
- консенсусный каркас (κv2) VL каппа подгруппы II человека: SEQ ID NO: 49, 79, 80, 77;
- консенсусный каркас (κv3) VL каппа подгруппы III человека: SEQ ID NO: 81, 82, 83, 77;
- консенсусный каркас (κv4) VL каппа подгруппы IV человека: SEQ ID NO: 84, 85, 86, 77.
Фиг.5A и 5B: на фиг.5A приведены выравнивания последовательностей Fc-областей природных последовательностей IgG человека humIgG1 (аллотип не-A, SEQ ID NO: 38; и аллотип A, где аминокислотная последовательность SREEM в SEQ ID NO: 38 заменена на SRDEL), humIgG2 (SEQ ID NO: 39), humIgG3 (SEQ ID NO: 40) и humIgG4 (SEQ ID NO: 41) с различиями между последовательностями, обозначенными звездочками. Номера над последовательностями представляют собой нумерацию по системе EU. Также приведена иллюстративная константная область каппа. На фиг.5B представлены полноразмерные аминокислотные последовательности (вариабельные и константные области) легких и тяжелых цепей гуманизированного антитела к CD22 10F4v2, изотип IgG1. Подчеркнутые участки означают константные домены.
На фиг.6A-6D показаны результаты анализов по измерению эффективности ADC с CD22 в лимфомных клеточных линиях. На фиг.6A показано, что более высокие уровни CD22 на клеточной поверхности коррелируют с меньшей IC50 анти-CD22-MCC-DM1 (большая эффективность). На фиг.6B показано, что увеличенная интернализация анти-CD22-MCC-DM1 коррелирует с меньшей IC50 анти-CD22-MCC-DM1. На фиг.6C показано, что увеличенная собственная чувствительность клеток к свободному лекарственному средству коррелирует с меньшей IC50 анти-CD22-MCC-DM1. Фиг.6D представляет собой микрофотографию, на которой показана интернализация флуоресцентно меченного антитела к CD22 после связывания с CD22 на клеточной поверхности.
Фиг.7A-7B: фиг.7A представляет собой график уменьшения объема опухоли in vivo в модели на ксенотрансплантате, который демонстрирует, что введение антител к CD22 mu10F4-smcc-DM1 и hu10F4v1-smcc-DM1 мышам SCID с пересаженными B-клеточными опухолями человека значительно уменьшает объем опухоли. Нагрузка лекарственным средством составляла приблизительно 4 и 4,6, см. таблицу 4. Фиг.7B представляет собой график сходного исследования, но нагрузка лекарственным средством была немного меньшей, приблизительно 2,9 и 3,0 (см. таблицу 5), а эффективность mu10F4-smcc-DM1 и hu10F4v2-smcc-DM1 сравнивали с контрольным антителом и неконъюгированным mu10F4. Фиг.7C представляет собой график уменьшения опухоли in vivo в модели с ксенотрансплантатом, где анти-CD22-spp-DM1 вводили, как указано в таблице 6.
Фиг.8A и 8B: фиг.8A представляет собой график для антител к CD22 5E8.1.8-smcc-DM1 и RFB4-smcc-DM1, вводимых в ксенотрансплантаты клеток Ramos. Фиг.8B представляет собой график для антител к CD22 5E8.1.8-smcc-DM1 и RFB4-smcc-DM1, вводимых в ксенотрансплантаты BJAB-luc.
Фиг.9 представляет собой график, демонстрирующий относительное воздействие на объем опухоли в зависимости от времени после введения анти-CD22(RFB4)-smcc-DM1 при низкой, средней и высокой нагрузках лекарственным средством.
Фиг.10 представляет собой график, демонстрирующий относительное воздействие на объем опухоли в зависимости от времени после введения анти-CD22(RFB4)-MC-vcPAB-MMAF или анти-CD22(RFB4)-MC-MMAF в ксенотрансплантаты Ramos.
Фиг.11 представляет собой график, демонстри рующий относительное воздействие на объем опухоли в зависимости от времени после введения анти-CD22(RFB4)-smcc-DM1 или -MCvcPAB-MMAE.
Фиг.12 представляет собой график, демонстрирующий относительное воздействие на объем опухоли в зависимости от времени после введения гуманизированных вариантов анти-CD22 10F4 в виде иммуноконъюгатов с MMAF или DM1, как описано в таблице 12.
Фиг.13A-13C представляют собой графики, демонстрирующие относительное воздействие на объем опухоли в зависимости от времени после введения анти-CD22-smcc-DM1 или анти-CD22-MC-MMAF в различных моделях ксенотрансплантатов B-клеточной лимфомы: SuDHL-4 (фиг.13A), DoHH2 (фиг.13B) и Granta-519 (фиг.13C).
На фиг.14 показаны диаграммы доменов CD22, удаляемых при картировании эпитопов, как описано в примерах. Домены пронумерованы 1-7. "TM" относится к трансмембранному домену.
На фиг.15 приведены изображения модифицированных цистеином конъюгатов антитело к CD22-лекарственное средство (ADC), где молекула лекарственного средства присоединена к полученной в результате конструирования цистеиновой группе в легкой цепи (LC-ADC); тяжелой цепи (HC-ADC) и Fc-области (Fc-ADC).
На фиг.16 показаны стадии: (i) восстановление дисульфидных аддуктов цистеина и межцепочечных и внутрицепочечных дисульфидов в модифицированном цистеином антителе к CD22 (тиомаб) восстановителем TCEP (гидрохлорид трис-(2-карбоксиэтил)фосфина); (ii) частичное окисление, т.е. повторное окисление для восстановления межцепочечных и внутрицепочечных дисульфидов dhAA (дегидроаскорбиновая кислота); и (iii) конъюгация повторно окисленного антитела с промежуточным соединением лекарственное средство-линкер с формированием конъюгата модифицированное цистеином антитело к CD22-лекарственное средство (ADC).
На фиг.17A-17C приведены аминокислотные последовательности модифицированных цистеином антител к CD22 по изобретению, в которых легкая цепь, или тяжелая цепь, или Fc-область изменены с введением цистеина в выбранных положениях аминокислот. На фиг.17A приведена аминокислотная последовательность легкой цепи варианта антитела к CD22 10F4, в которой валин в положении по Kabat 205 (положение в последовательности - валин 210) заменен на цистеин. На фиг.17B приведена аминокислотная последовательность тяжелой цепи варианта антитела к CD22 10F4, в которой аланин в положении по EU 118 (положение в последовательности - аланин 121) заменен на цистеин. На фиг.17C приведена аминокислотная последовательность Fc-области варианта антитела к CD22 10F4, в которой серин в положении по EU 400 (положение в последовательности - серин 403) заменен на цистеин. На каждой фигуре измененная аминокислота показана полужирным шрифтом с двойным подчеркиванием. Подчеркивание одиночной линией означает константные области. Вариабельные области не подчеркнуты.
Фиг.18A-18E представляют собой диаграммы FACS, демонстрирующие, что связывание конъюгатов тиомаб к CD22 и лекарственного средства (TDC) по изобретению, связывающегося с CD22, экспрессированным на поверхности клеток BJAB-lucs, является сходным с вариантами тиомаб LC, HC и Fc тиомаб, также как и для конъюгатов с различными приведенными лекарственными средствами.
Фиг.19 представляет собой график, на котором показаны изменения среднего объема опухоли с течением времени в модели на ксенотрансплантате, обработанном различными TDC к CD22, различающимися по положению полученного в результате конструирования цистеина (LC, HC или Fc) и/или по конъюгированию с лекарственным средством (MMAF или MMAE). В моделях на ксенотрансплантатах, обработанных TDC, антитело к CD22 10F4-LC-V210C-MCvcPAB-MMAE и антитело к CD22 10F4-HC-A121C-MCvcPAB-MMAE, показано уменьшение объема опухоли в ходе исследования.
Фиг.20A представляет собой график, на котором показаны изменения среднего объема опухоли с течением времени в ксенотрансплантате лимфомы мантийных клеток Granta-519 человека мышам SCID CB17, обработанных тяжелыми цепями A118C TDC к CD22, конъюгированными с различными молекулами линкер-лекарственное средство и/или введенными в различных дозах, как показано. По-видимому, TDC антитело к CD22 10F4-HC(A118C)-MCvcPAB-MMAE является наиболее эффективным из протестированных в этом эксперименте средств. Фиг.20B представляет собой график, на котором показаны изменения среднего объема опухоли с течением времени в ксенотрансплантате фолликулярной лимфомы DOHH2 мышам SCID CB17, обработанных теми же тяжелыми цепями A118C TDC к CD22, но в больших дозах. По-видимому, TDC антитело к CD22 10F4-HC(A118C)-MCvcPAB-MMAE является наиболее эффективным из протестированных в этом эксперименте средств. Фиг.20C представляет собой график процентного изменения массы у мышей из исследования с ксенотрансплантатами DOHH2, демонстрирующий отсутствие значимого изменения массы в течение первых 14 суток исследования.
Фиг.21A и 21B представляют собой столбчатые диаграммы, демонстрирующие изменения сывороточной AST (аспартатаминотрансфераза) (фиг.21A) и сывороточных нейтрофилов (фиг.21B) на сутки 0 и 5, где вводили ADC, содержащий расщепляемый и нерасщепляемый линкер.
Фиг.22A и 22B представляют собой графики, демонстрирующие снижение количества периферических B-клеток (клетки CD20+) у яванских макак, которым дозировали 10, 20 и 30 мг/кг антитела к CD22 с MMAF (фиг.22A) и антитела к CD22 с DM1 (фиг.22B).
Фиг.23A и 23B представляют собой графики, демонстрирующие отсутствие значимых изменений CD4+ лимфоцитов при 10, 20 и 30 мг/кг антитела к CD22 с MMAF (фиг.23A) и антитела к CD22 с DM1 (фиг.23B).
На фиг.24A и 24B приведены гистологические образцы ткани миндалевидных желез яванских макак, где в образце миндалевидной железы животного, которому вводили дозу 10 мг/кг hu10F4v3-SMCC-DM1, снижается количество B-клеток в герминальных центрах, видимых при дозировании контроля в виде носителя (фиг.24A).
Фиг.25A представляет собой диаграмму, демонстрирующую области фолликула селезенки, из которой взят образец ткани для исследования, в котором показано, что ADC к CD22 у яванских макак удаляет B-клетки из покоящейся ткани. Деление клеток в герминативном центре фолликула селезенки cyno в делящихся герминативных центрах селезенок cyno у животных, которым вводили дозу 10 мг/кг hu10F4v3-MC-MMAF, уменьшалось (фиг.25B и 25C). Неделящиеся наивные B-клетки в тех же условиях не уменьшались (фиг.25D и 25E).
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Предоставлены выделенные антитела, связывающиеся с CD22. Дополнительно предоставлены иммуноконъюгаты, содержащие антитела к CD22. Дополнительно предоставлены модифицированные цистеином антитела к CD22 и их иммуноконъюгаты. Антитела и иммуноконъюгаты по изобретению пригодны, например, для диагностики или лечения нарушений, ассоциированных с измененной экспрессией, например, увеличенной экспрессией, CD22. В определенных вариантах осуществления антитела или иммуноконъюгаты по изобретению пригодны для диагностики или лечения клеточного пролиферативного нарушения, такого как опухоль или злокачественная опухоль. В определенных вариантах осуществления антитела или иммуноконъюгаты по изобретению пригодны для детекции CD22, например, CD22, экспрессированного на клеточной поверхности.
Предоставлены полинуклеотиды, кодирующие антитела к CD22. Предоставлены векторы, содержащие полинуклеотиды, кодирующие антитела к CD22, и предоставлены клетки-хозяева, содержащие такие векторы. Также предоставлены композиции, включающие фармацевтические препараты, содержащие любой один или несколько из полинуклеотидов, антител к CD22 или иммуноконъюгатов по изобретению.
Общие способы
Способы и процедуры, описанные или указанные в настоящем документе, как правило, широко распространены и обычно применяются специалистами в данной области с использованием традиционной методологии, например, такой, как широко используемые способы, описанные в Sambrook et al., Molecular Cloning: A Laboratory Manual 3rd, edition (2001) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.; Current Protocols in Molecular Biology (F.M.Ausubel, et al., eds., (2003)); серия Methods in Enzymology (Academic Press, Inc.): Pcr 2: A Practical Approach (M.J.MacPherson, B.D.Hames and G.R.Taylor eds. (1995)), Harlow and Lane, eds. (1988) Antibodies, A Laboratory Manual, and Animal Cell Culture (R.I.Freshney, ed. (1987)); Oligonucleotide Synthesis (M.J.Gait, ed., 1984): Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E.Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I.Freshney), ed., 1987); Introduction to Cell and Tissue Culture (J.P.Mather and P.E.Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A.Doyle, J.B.Griffiths, and D.G.Newell, eds., 1993-8) J. Wiley and Sons; Handbook of Experimental Immunology (D.M.Weir and C.C.Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M.Miller and M.P.Calos, eds., 1987); PCR: The Polymerase Chain Reaction. (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E.Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A.Janeway and P.Travers, 1997); Antibodies (P.Finch, 1997); Antibodies: A Practical Approach (D.Catty., ed., IRL Press, 1988-1989); Monoclonal Antibodies: A Practical Approach (P.Shepherd and C.Dean, eds., Oxford University Press, 2000); Using Antibodies: A Laboratory Manual (E.Harlow and D.Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M.Zanetti and J.D.Capra, eds., Harwood Academic Publishers, 1995); и Cancer: Principles and Practice of Oncology (V.T.DeVita et al., eds., J.B.Lippincott Company, 1993).
ОПРЕДЕЛЕНИЯ И СОКРАЩЕНИЯ
Определения
"Выделенное" антитело представляет собой антитело, которое идентифицировано и отделено от компонентов его природного окружения и/или выделено из них. Загрязняющими компонентами его природного окружения являются вещества, которые могут мешать диагностическим или терапевтическим применениям антитела, и они могут включать ферменты, гормоны и другие белковые и небелковые растворы. В некоторых вариантах осуществления антитело очищают (1) до более чем 95% по массе антитела, как определяют методом Лоури, а в некоторых вариантах осуществления - более чем до 99% по массе, (2) до степени, достаточной для получения, по меньшей мере, 15 остатков N-концевой или внутренней аминокислотной последовательности при применении секвенатора с вращающимся стаканом, или (3) до гомогенности при SDS-PAGE в невосстанавливающих или восстанавливающих условиях с применением красителя кумасси синего или серебра. Выделенное антитело включает антитело в рекомбинантных клетках in situ, так как отсутствует, по меньшей мере, один компонент природного окружения антитела. Однако, как правило, выделенное антитело получают посредством, по меньшей мере, одной стадии очистки.
"Выделенная" молекула нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты, которая отделена, по меньшей мере, от одной другой молекулы нуклеиновой кислоты, с которой она, как правило, ассоциирована, например, в ее природном окружении. Выделенная молекула нуклеиновой кислоты дополнительно включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые, как правило, экспрессируют молекулу нуклеиновой кислоты, но молекула нуклеиновой кислоты находится вне хромосомы или в хромосоме, но в положении, отличающемся от ее природного положения в хромосоме.
"Очищенная" означает, что молекула находится в образце в концентрации, по меньшей мере, 95% по массе или, по меньшей мере, 98% по массе образца, в котором она содержится.
Как применяют в настоящем документе, термин "в значительной степени сходный" или "по существу такой же", означает в достаточной степени высокое сходство между двумя числовыми значениями (например, одним, ассоциированным с антителом по изобретению, а другим, ассоциированным с референсным/сравниваемым антителом) так, что специалист в данной области может считать разницу между двумя значениями малой или не имеющей биологической и/или статистической значимости в пределах контекста измеряемых указанными значениями биологических характеристик (например, значения Kd). Различие между указанными двумя значениями составляет, например, менее чем приблизительно 50%, менее чем приблизительно 40%, менее чем приблизительно 30%, менее чем приблизительно 20% и/или менее чем приблизительно 10% в зависимости от референсного/сравниваемого значения.
Как применяют в настоящем документе, фраза "в значительной степени уменьшенный" или "существенно отличающийся" означает достаточно большую степень различий между двумя числовыми значениями (как правило, одним, ассоциированным с молекулой, а другим, ассоциированным с референсной/сравниваемой молекулой) так, что специалист в данной области может считать разницу между двумя значениями статистически значимой в пределах контекста измеряемых указанными значениями биологических характеристик (например, значения Kd). Различие между указанными двумя значениями составляет, например, больше, чем приблизительно 10%, больше, чем приблизительно 20%, больше, чем приблизительно 30%, больше, чем приблизительно 40% и/или больше чем приблизительно 50% в зависимости от значения для референсной/сравниваемой молекулы.
Как применяют в настоящем документе, термин "вектор", предназначен для обозначения молекулы нуклеиновой кислоты, способной к транспортировке другой нуклеиновой кислоты, с которой он соединен. Одним из типов векторов является "плазмида", которая обозначает кольцевую двухцепочечную ДНК, в которую можно лигировать дополнительные участки ДНК. Другим типом вектора является фаговый вектор. Другим типом вектора является вирусный вектор, в котором дополнительные участки ДНК могут быть лигированы в вирусный геном. Некоторые векторы способны к автономной репликации в клетке-хозяине, в которую их вводят (например, бактериальные векторы с бактериальным участком начала репликации и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) могут интегрироваться в геном клетки-хозяина при введении в клетку-хозяина и, таким образом, реплицироваться вместе с геномом хозяина. Кроме того, некоторые векторы способны управлять экспрессией генов, с которыми они функционально связаны. Такие векторы в настоящем документе обозначают как "рекомбинантные экспрессирующие векторы" или просто, "экспрессирующие векторы". Как правило, экспрессирующие векторы, пригодные в способах рекомбинантной ДНК, часто находятся в форме плазмид. В настоящем описании "плазмида" и "вектор" могут быть использованы взаимозаменяемо, так как плазмида представляет собой наиболее общеупотребительную форму вектора.
"Полинуклеотид" или "нуклеиновая кислота", как взаимозаменяемо используют в настоящем документе, относится к полимерам нуклеотидов любой длины и включает ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги или любой субстрат, который можно встроить в полимер ДНК- или РНК-полимеразой или посредством синтетической реакции. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. Если присутствует, модификацию структуры нуклеотида можно проводить до или после сборки полимера. Последовательность нуклеотидов может прерываться ненуклеотидными компонентами. Полинуклеотид может содержать модификацию(и), осуществленную после синтеза, такую как конъюгация метки. Другие типы модификаций включают, например, "кэпирование", замену одного или нескольких встречающихся в природе нуклеотидов аналогом, межнуклеотидные модификации, например, такие как модификации с незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и т.д.) и с заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.д.), модификации, содержащие боковые группы, например, такие как белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, ply-L-лизин и т.д.), модификации с интеркаляторами (например, акридин, псорален и т.д.), модификации, содержащие хелаторы (например, металлы, радиоактивные металлы, бор, окислительные металлы и т.д.), модификации, содержащие алкилирующие средства, модификации с модифицированными связями (например, альфа-аномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида(ов). Кроме того, можно замещать любые гидрофильные группы, обычно присутствующие на сахарах, например, фосфонатными группами, фосфатными группами, они могут быть защищены стандартными защитными группами или активированы с получением дополнительных связей с дополнительными нуклеотидами и могут быть конъюгированы с твердой или полутвердой подложкой. 5'- и 3'-концевой OH может быть фосфорилирован или замещен аминами или органическими кэпирующими группами с количеством атомов углерода от 1 до 20. Другие гидроксилы также могут быть дериватизированы стандартными защитными группами. Полинуклеотиды также могут содержать формы, аналогичные сахарам рибозе и дезоксирибозе, которые, как правило, известны в данной области, включая, например, 2'-O-метил-, 2'-O-аллил-, 2'-фтор- или 2'-азидорибозу, аналоги карбоциклических сахаров, α-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, нециклические аналоги и основные нуклеозидные аналоги, такие как метилрибозид. Одну или несколько фосфодиэфирных связей можно заменить альтернативными связывающими группами. Эти альтернативные связывающие группы включают в качестве неограничивающих примеров варианты осуществления, где фосфат замещен посредством P(O)S ("тиоат"), P(S)S ("дитиоат"), (O)NR2 ("амидат"), P(O)R, P(O)OR', CO или CH2 ("формацеталь"), в которых каждый R или R' независимо представляет собой H или замещенный или незамещенный алкил (1-20 C), необязательно содержащий эфирную (-O-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралкил. Не все связи в полинуклеотиде должны быть идентичными. Предшествующее описание применимо ко всем полинуклеотидам, приводимым в настоящем документе, включая РНК и ДНК.
Как применяют в настоящем документе, "олигонуклеотид", как правило, относится к коротким, как правило, одноцепочечным, как правило, синтетическим полинуклеотидам, длина которых, как правило, но необязательно, составляют менее чем приблизительно 200 нуклеотидов. Термины "олигонуклеотид" и "полинуклеотид" не являются взаимоисключающими. Приведенное выше описание для полинуклеотидов в равной степени и полностью применимо к олигонуклеотидам.
"Процент (%) идентичности аминокислотной последовательности" по отношению к референсной полипептидной последовательности определен как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в референсной полипептидной последовательности после выравнивания последовательностей и внесения, если необходимо, пропусков, для достижения максимального процента идентичности последовательностей, и не рассматривая никакие консервативные замены как часть, определяющую идентичность последовательностей. Выравнивание с целью определения процента идентичности аминокислотных последовательностей можно получать различными известными специалистам в данной области способами, например, с применением общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить подходящие параметры для выравнивания последовательностей, включающие любые алгоритмы, необходимые для достижения максимального выравнивания между сравниваемыми полноразмерными последовательностями. Однако для целей по настоящему документу значения % идентичности аминокислотных последовательностей получают с применением компьютерной программы сравнения последовательностей ALIGN-2. Компьютерная программа сравнения последовательностей ALIGN-2 создана в Genentech, Inc. и исходный код подан вместе с документацией для пользователя в U.S. Copyright Office, Washington D.C., 20559, где он зарегистрирован под U.S. Copyright Registration No. TXU510087. Программа ALIGN-2 общедоступна в Genentech, Inc., South San Francisco, California, или ее можно скомпилировать из исходного кода. Программу ALIGN-2 следует компилировать для применения в операционной системе UNIX, предпочтительно цифровой UNIX V4.0D. Все параметры сравнения последовательностей устанавливаются программой ALIGN-2 и не изменяются.
В тех случаях, когда для сравнения аминокислотных последовательностей применяют ALIGN-2, % идентичности аминокислотной последовательности данной аминокислотной последовательности A с данной аминокислотной последовательностью B (что, альтернативно, можно сформулировать как то, что данная аминокислотная последовательность A имеет или содержит определенный % идентичности аминокислотной последовательности с данной аминокислотной последовательностью B) рассчитывают следующим образом:
100 умножить на отношение X/Y,
где X представляет собой количество аминокислотных остатков, засчитанных программой выравнивания последовательностей ALIGN-2 в этом программном выравнивании A и B как идентичные совпадения, и где Y представляет собой общее количество аминокислотных остатков в B. Понятно, что там, где длина аминокислотной последовательности A не равна длине аминокислотной последовательности B, % идентичности аминокислотной последовательности A с B не будет равным % идентичности аминокислотной последовательности B с A. Если конкретно не указано иначе, все значения % идентичности аминокислотных последовательностей, используемые в настоящем документе, получены как описано в непосредственно предшествующем параграфе с применением компьютерной программы ALIGN-2.
"Поверхностный маркер B-клеток" или "поверхностный антиген B-клеток" в настоящем документе представляет собой антиген, экспрессируемый на поверхности B-клетки, который может служить мишенью для антагониста, который связывается с ним, включая в качестве неограничивающих примеров антитела к поверхностному антигену B-клеток, или растворимую форму поверхностного антигена B-клеток, способную к противодействию связыванию лиганда с встречающимся в природе B-клеточным антигеном. Иллюстративные поверхностные маркеры B-клеток включают поверхностные маркеры лейкоцитов CD10, CD19, CD20, CD21, CD22, CD23, CD24, CD37, CD40, CD53, CD72, CD73, CD74, CDw75, CDw76, CD77, CDw78, CD79a, CD79b, CD80, CD81, CD82, CD83, CDw84, CD85 и CD86 (для описания, см. The Leukocyte Antigen Facts Book, 2nd Edition. 1997, ed. Barclay et al., Academic Press, Harcourt Brace & Co., New York). Другие поверхностные маркеры B-клеток включают RP105, FcRH2, B-клеточный CR2, CCR6, P2X5, HLA-DOB, CXCR5, FCER2, BR3, BAFF, BLyS, Btig, NAG14, SLGC16270, FcRH1, IRTA2, ATWD578, FcRH3, IRTA1, FcRH6, BCMA и 239287. Поверхностный маркер B-клеток, представляющий особый интерес, предпочтительно экспрессирован на B-клетках по сравнению с другими не B-клеточными тканями млекопитающего и может быть экспрессирован на предшественниках B-клеток и на зрелых B-клетках.
Как применяют в настоящем документе, термин "CD22" относится к любому природному CD22, источником которого может служить любое позвоночное, включая млекопитающих, таких как приматы (например, люди, яванский макак (cyno)) и грызуны (например, мыши и крысы), если не указано иначе. Термин включает "полноразмерный", непроцессированный CD22, а также любую форму CD22, которая является результатом процессинга в клетке. Термин также включает встречающиеся в природе варианты CD22, например, варианты сплайсинга, аллельные варианты и изоформы. Основная изоформа CD22 (CD22бета) содержит 847 аминокислот и семь иммуноглобулин-подобных областей во внеклеточном домене (см. Wilson, G.L. et al., J. Exp. Med. 173: 137-146 (1991)). Второстепенная изоформа, CD22-альфа, содержит 647 аминокислот и в ее внеклеточном домене отсутствуют иммуноглобулин-подобные домены 3 и 4 (см. Stamenkovic, I. and Seed, B., Nature 345: 74-77 (1990)) и Wilson et al., (1991), выше). Аминокислотная последовательность CD22бета приведена на фиг.1B, где подчеркнутая область представляет собой внеклеточный домен (ECD), а область, отображенная курсивом, указывает аминокислоты, отсутствующие в последовательности внеклеточного домена CD22 альфа. На фиг.1C представлена аминокислотная последовательность CD22альфа, в которой ECD подчеркнут. Аминокислотная последовательность от аминокислоты 1 до аминокислоты 21 представляет сигнальную последовательность, отщепляемую от зрелой формы белка. В одном из вариантов осуществления CD22 экспрессирован на клеточной поверхности, так как на поверхности нормальной B-клетки или опухолевой B-клетки. На фиг.1D представлена аминокислотная последовательность CD22 яванского макака.
"Антитела" (Ab) и "иммуноглобулины" (Ig) представляют собой гликопротеины со сходными структурными характеристиками. В то время как антитела демонстрируют специфичность связывания с конкретным антигеном, иммуноглобулины включают и антитела и другие подобные антителам молекулы, у которых, как правило, отсутствует антигенная специфичность. Полипептиды последнего типа образуются, например, на низких уровнях лимфатической системой и на повышенных уровнях миеломами.
Термины "антитело" и "иммуноглобулин" используют взаимозаменяемо в самом широком смысле, и они включают моноклональные антитела (например, полноразмерные или интактные моноклональные антитела), поликлональные антитела, моновалентные антитела, поливалентные антитела, полиспецифические антитела (например, биспецифические антитела при условии, что они проявляют желательную биологическую активность), а также могут включать определенные фрагменты антител (как более подробно описано в настоящем документе). Антитело может быть химерным, человеческим, гуманизированным и/или аффинно зрелым.
Термин "антитело к CD22" или "антитело, связывающееся с CD22" относится к антителу, которое способно к связыванию с CD22 с достаточной аффинностью так, что антитело пригодно в качестве диагностического и/или терапевтического средства с направленной доставкой к CD22. Предпочтительно, степень связывания антител к CD22 к неродственному белку, не являющемуся CD22, составляет менее чем приблизительно 10% от связывания антитела с CD22 как измерено, например, посредством радиоиммунологического анализа (RIA). В определенных вариантах осуществления антитело, связывающееся с CD22, обладает константой диссоциации (Kd) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ или ≤0,1 нМ. В определенных вариантах осуществления антитело к CD22 связывается с эпитопом CD22, который консервативен в CD22 у различных видов.
"Вариабельная область" или "вариабельный домен" антитела относится к аминоконцевым доменам тяжелой или легкой цепи антитела. Вариабельный домен тяжелой цепи можно обозначать как "VH". Вариабельный домен легкой цепи можно обозначать как "VL". Эти домены, как правило, являются наиболее вариабельными частями антитела и содержат антигенсвязывающие участки.
Термин "вариабельный" относится к тому факту, что определенные части вариабельных доменов сильно отличаются по последовательности среди антител и используются в связывании и специфическом узнавании каждым конкретным антителом его конкретного антигена. Однако вариабельность распределена на всем протяжении вариабельных доменов антител не равномерно. Она сосредоточена в трех сегментах, называемых определяющими комплементарность областями (CDR) или гипервариабельными областями (HVR) в вариабельных доменах легких цепей и тяжелых цепей. Более высококонсервативные части вариабельных доменов называют каркасными областями (FR). Вариабельные домены исходных тяжелых и легких цепей содержат по четыре области FR, в основном принимающие конфигурацию бета-слоя, связанные тремя CDR, которые формируют петли, соединяющие, а в некоторых случаях формирующие часть структуры бета-слоев. CDR в каждой цепи удерживаются вместе в непосредственной близости областями FR и вместе с CDR из другой цепи участвуют в формировании антигенсвязывающего участка антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, National Institute of Health, Bethesda, MD (1991)). Константные домены напрямую не участвуют в связывании антитела с антигеном, но обладают различными эффекторными функциями, такими как участие антитела в антителозависимой клеточной токсичности.
"Легкие цепи" антител (иммуноглобулинов) любого вида позвоночных на основе аминокислотных последовательностей их константных доменов можно отнести к одному из двух четко выраженных типов, называемых каппа (κ) и лямбда (λ).
В зависимости от аминокислотных последовательностей константных доменов их тяжелых цепей антитела (иммуноглобулины) можно отнести к различным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, а некоторые из них можно дополнительно разделить на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелых цепей, соответствующие различным классам иммуноглобулинов, называются α, δ, ε, γ и µ, соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны и в основном описаны, например, в Abbas et al., Cellular and Mol. Immunology, 4th ed. (2000). Антитело может являться частью более крупной слитой молекулы, сформированной ковалентным или нековалентным соединением антитела с одним или несколькими другими белками или пептидами.
Термины "полноразмерное антитело", "интактное антитело" и "целое антитело" используют в настоящем документе взаимозаменяемо для обозначения антитела в его по существу интактной форме, а не в виде фрагментов антител, как определено ниже. Термины, в частности, относятся к антителу с тяжелыми цепями, которые содержат Fc-области.
"Фрагменты антител" содержат только часть интактного антитела, где эта часть сохраняет, по меньшей мере, одну и до большинства или все, из функций, в норме ассоциированных с данной частью, когда она находится в интактном антителе. В одном из вариантов осуществления фрагмент антитела содержит антигенсвязывающий участок интактного антитела и таким образом сохраняет способность связывать антиген. В другом варианте осуществления фрагмент антитела, например, фрагмент, содержащий Fc-область, сохраняет по меньшей мере одну из биологических функций, в норме ассоциированных с Fc-областью, когда она находится в интактном антителе, такую как связывание FcRn, модуляция времени полужизни антитела, функция ADCC и связывание комплемента. В одном из вариантов осуществления фрагмент антитела представляет собой моновалентное антитело, обладающее временем полужизни in vivo, по существу сходным со временем для интактного антитела. Например, такой фрагмент антитела может содержать антигенсвязывающее плечо, связанное с последовательностью Fc, способной обеспечивать стабильность фрагмента in vivo.
Расщепление антител папаином приводит к образованию двух идентичных антигенсвязывающих фрагментов, называемых "Fab"-фрагменты, каждый с одним антигенсвязывающим участком, и одного остаточного "Fc"-фрагмента, название которого отражает его способность к легкой кристаллизации. Обработка пепсином приводит к образованию фрагмента (Fab')2, содержащего два антигенсвязывающих участка и все еще способного к перекрестному связыванию антигена.
"Fv" представляет собой минимальный фрагмент антитела, содержащий полный антигенсвязывающий участок. В одном из вариантов осуществления двухцепочечная молекула Fv состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи в тесной нековалентной ассоциации. В молекуле одноцепочечного Fv (scFv) один вариабельный домен тяжелой цепи и один вариабельный домен легкой цепи могут быть ковалентно связаны посредством гибкого пептидного линкера так, что легкая и тяжелая цепь могут ассоциировать в "димерную" структуру, аналогичную структуре двухцепочечной молекулы Fv. Именно в этой конфигурации три CDR каждого вариабельного домена взаимодействуют с образованием антигенсвязывающего участка на поверхности димера VH-VL. Вместе шесть CDR обеспечивают антителу специфичность связывания антигена. Однако даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичные для антигена) обладает способностью распознавать и связывать антиген, хотя и с меньшей аффинностью, чем целый участок связывания.
Фрагмент Fab содержит вариабельные домены тяжелой и легкой цепей, а также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Фрагменты Fab' отличаются от фрагментов Fab добавлением нескольких остатков на C-конце CH1 домена тяжелой цепи, включая один или несколько цистеинов из шарнирной области антитела. Fab'-SH в настоящем документе представляет собой обозначение для Fab', в котором остаток цистеина(ов) константных доменов несет свободную тиольную группу. Фрагменты (Fab')2 антител исходно получали как пары фрагментов Fab', которые содержат между собой шарнирные цистеины. Также известны другие химические соединители фрагментов антител.
Фрагменты антител "одноцепочечные Fv" или "scFv" содержат домены антитела VH и VL, где эти домены находятся в одной полипептидной цепи. Как правило, полипептид scFv между VH и VL доменами дополнительно содержит полипептидный линкер, который позволяет scFv формировать желаемую для связывания антигена структуру. Для обзора см. scFv Pluckthun, в The Pharmacology of Monoclonal Antibodies, Vol.113, Rosenburg and Moore eds., Springer-Verlag, New York, pp.269-315 (1994).
Термин "диатела" относится к небольшим фрагментам антител с двумя антигенсвязывающими участками, где эти фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в той же полипептидной цепи (VH-VL). Посредством использования линкера, который является слишком коротким, чтобы позволить спаривание между двумя доменами одной цепи, домены вынуждают образовывать пару с комплементарными доменами другой цепи и получают два антигенсвязывающих участка. Диатела могут быть бивалентными или биспецифическими. Диатела более полно описаны, например, в EP 404097; WO 93/1161; Hudson et al., (2003) Nat. Med. 9: 129-134; и Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993). В Hudson et al., (2003) Nat. Med. 9: 129-134 также описаны триатела и тетратела.
Как применяют в настоящем документе, термин "моноклональное антитело" относится к антителу, полученному из группы по существу гомогенных антител, т.е. отдельные антитела, составляющие группу, являются идентичными за исключением возможных мутаций, например, встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Таким образом, определение "моноклональный" указывает на характеристику антитела как не являющегося смесью различных антител. В определенных вариантах осуществления такое моноклональное антитело, как правило, включает антитело, содержащее полипептидную последовательность, которая связывает мишень, где связывающая мишень полипептидная последовательность получена способом, который включает отбор связывающей одну мишень полипептидной последовательности из множества полипептидных последовательностей. Например, процесс отбора может представлять собой отбор уникального клона из множества клонов, таких как пул гибридомных клонов, фаговых клонов или клонов рекомбинантной ДНК. Следует понимать, что выбранную связывающую мишень последовательность можно дополнительно изменять, например, для увеличения аффинности в отношении мишени, для гуманизации связывающей мишень последовательности, для увеличения продукции в клеточной культуре, для уменьшения ее иммуногенности in vivo, для получения полиспецифического антитела и т.д., и что антитело, содержащее измененную связывающую мишень последовательность также представляет собой моноклональное антитело по данному изобретению. В отличие от препаратов поликлональных антител, которые, как правило, содержат различные антитела, направленные к различным детерминантам (эпитопам), каждое моноклональное антитело из препарата моноклонального антитела направлено к одной детерминанте на антигене. В дополнение к их специфичности, препараты моноклональных антител имеют преимущество в том, что они, как правило, не загрязнены другими иммуноглобулинами.
Определение "моноклональный" указывает на характеристику антитела, как полученного по существу из гомогенной группы антител, и его не следует рассматривать как требующего получения антитела каким-либо конкретным способом. Например, моноклональные антитела для применения по настоящему изобретению можно получать множеством способов, включая, например, гибридомный способ (например, Kohler et al., Nature, 256: 495 (1975); Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981)), способы рекомбинантной ДНК (например, см. патент США №4816567), технологии фагового дисплея (например, см. Clackson et al., Nature, 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222: 581-597 (1992); Sidhu et al., J. Mol. Biol. 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004) и Lee et al., J. Immunol. Methods 284(1-2): 119-132(2004), и способы получения антител человека или подобных антителам человека у животных, которые имеет части или все локусы или гены иммуноглобулинов человека, кодирующие последовательности иммуноглобулинов человека (например, см. WO 98/24893; WO 96/34096; WO 96/33735; WO 91/10741; Jakobovits et al., Proc. Natl. Acad. Sci. USA 90: 2551 (1993); Jakobovits et al., Nature 362: 255-258 (1993); Bruggemann et al., Year in Immunol. 7:33 (1993); патенты США №5545807; 5545806; 5569825; 5625126; 5633425; 5661016; Marks et al., Bio. Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368: 812-813 (1994); Fishwild et al., Nature Biotechnol. 14: 845-851 (1996); Neuberger, Nature Biotechnol. 14: 826 (1996) и Lonberg and Huszar, Intern. Rev. Immunol. 13: 65-93 (1995).
Моноклональные антитела в настоящем документе, в частности, включают "химерные" антитела, у которых часть тяжелой и/или легкой цепи является идентичной или гомологичной соответствующим последовательностям антител, полученных у конкретного вида или принадлежащих конкретному классу или подклассу антител, тогда как оставшаяся часть цепи(ей) идентична или гомологична соответствующим последовательностям антител, полученных у другого вида или принадлежащих другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют желательную биологическую активность (патент США №4816567 и Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)).
"Гуманизированные" формы не принадлежащих человеку (например, мышиных) антител представляют собой химерные антитела, содержащие минимальную последовательность, полученную из не принадлежащего человеку иммуноглобулина. В одном из вариантов осуществления гуманизированное антитело представляет собой иммуноглобулин человека (реципиентное антитело), в котором остатки из гипервариабельной области реципиента заменены остатками из гипервариабельной области не являющихся человеком видов (донорное антитело), таких как мышь, крыса, кролик, или не являющийся человеком примат с желательной специфичностью, аффинностью и/или емкостью. В некоторых случаях соответствующими не принадлежащими человеку остатками замещают остатки каркасной области (FR) иммуноглобулина человека. Кроме того, гуманизированные антитела могут содержать остатки, которые не существуют в реципиентном антителе или в донорном антителе. Эти модификации можно проводить для дальнейшего повышения эффективности антитела. В основном гуманизированное антитело содержит по существу весь, по меньшей мере, один, а, как правило, два, вариабельных домена, в которых все или по существу все гипервариабельные петли соответствуют гипервариабельным петлям не принадлежащего человеку иммуноглобулина, и все или по существу все FR представляют собой FR последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также содержит, по меньшей мере, часть константной области иммуноглобулина (Fc), как правило, часть константной области иммуноглобулина человека. Более подробно, см. Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-329 (1988) и Presta, Curr. Op. Struct. Biol. 2: 593-596 (1992). Также см. следующие обзорные статьи и цитируемые в них ссылки: Vaswani and Hamilton, Ann. Allergy, Asthma & Immunol. 1: 105-115 (1998); Harris, Biochem. Soc. Transactions 23: 1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5: 428-433 (1994).
"Антитело человека" представляет собой антитело, которое содержит аминокислотную последовательность, соответствующую аминокислотной последовательности антитела, продуцируемого человеком, и/или полученную любым из способов получения антител человека, как описано в настоящем документе. Это определение антитела человека конкретно исключает гуманизированное антитело, содержащее не принадлежащие человеку антигенсвязывающие остатки.
При использовании в настоящем документе термин "гипервариабельная область", "HVR" или "HV" относится к областям вариабельного домена антитела, которые являются гипервариабельными в последовательности и/или формируют структурно заданные петли. Как правило, антитела содержат шесть гипервариабельных областей; три в VH (H1, H2, H3) и три в VL (L1, L2, L3). В природных антителах наибольшее разнообразие из шести гипервариабельных областей демонстрируют H3 и L3, и полагают, что конкретно H3 играет уникальную роль в придании антителам высокой специфичности. Xu et al., (2000) Immunity 13: 37-45; Johnson and Wu (2003) в Methods in Molecular Biology 248: 1-25 (Lo, ed., Human Press, Totowa, NJ). Действительно, встречающиеся в природе антитела верблюда, состоящие только из тяжелой цепи, функциональны и стабильны в отсутствие легкой цепи. Hamers-Casterman et al., (1993) Nature 363: 446-448; Sheriff et al., (1996) Nature Struct. Biol. 3: 733-736.
В настоящем документе применяется и находится в обращении ряд описаний гипервариабельных областей. Определяющие комплементарность области (CDR) по Kabat основаны на вариабельности последовательности и являются наиболее общеупотребительными (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Вместо этого Chothia указывает на положение структурных петель (Chothia and Lesk J. Mol. Biol. 196: 901-917 (1987)). Гипервариабельные области AbM представляют компромисс между CDR по Kabat и структурными петлями по Chothia и их используют в программном обеспечении моделирования антител Oxford Molecular's AbM. "Контактные" гипервариабельные области основаны на анализе доступных комплексных кристаллических структур. Ниже указаны остатки каждой из этих гипервариабельных области.
Гипервариабельные области могут содержать "расширенные гипервариабельные области", как указано далее: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 или 89-96 (L3) в VL и 26-35 (H1), 50-65 или 49-65 (H2) и 93-102, 94-102, или 95-102 (H3) в VH. В каждом из этих определений остатки вариабельных доменов нумеруют по Kabat et al., выше. Гипервариабельные области HVR-H1 и HVR-H2 of антител 10F4 к CD22 по изобретению представляют собой H26-H35 и H49-H65 с использованием нумерации по Kabat.
"Каркасные" или "FR" остатки представляют собой те остатки вариабельных доменов, которые отличаются от остатков гипервариабельных областей, как определено в настоящем документе.
Термин "нумерация остатков вариабельного домена как в Kabat" или "нумерация положений аминокислот как в Kabat" и их варианты относится к системе нумерации, используемой для вариабельных доменов тяжелых цепей или вариабельных доменов легких цепей в представлении антител в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991). С применением этой системы нумерации фактическая линейная аминокислотная последовательность может содержать меньше аминокислот или дополнительные аминокислоты, соответствующие укорочению или вставке в FR или HVR вариабельного домена. Например, вариабельный домен тяжелой цепи может включать вставку одной аминокислоты (остаток 52a по Kabat) после остатка 52 H2 и вставленные остатки (например, остатки 82a, 82b и 82c и т.д. по Kabat) после остатка 82 FR тяжелой цепи. Нумерацию остатков по Kabat для данного антитела можно определить посредством выравнивания по областям гомологии последовательности антитела со "стандартной" пронумерованной по Kabat последовательностью.
"Аминокислота свободного цистеина" относится к аминокислотному остатку цистеина, который вставлен биоинженерным способом в исходное антитело, несет тиольную функциональную группу (-SH) и не спарен в качестве или не является частью иным образом внутримолекулярного или межмолекулярного дисульфидного мостика.
Термин "значение тиоловой реакционноспособности" представляет собой количественную характеристику реактивности аминокислот свободного цистеина. Значение тиоловой реакционноспособности представляет собой процент аминокислоты свободного цистеина в модифицированном цистеином антителе, который вступает в реакцию с реагирующим с тиолами реагентом и преобразуется в максимальное значение 1. Например, аминокислота свободного цистеина в модифицированном цистеином антителе, которая со 100% выходом вступает в реакцию с реагирующим с тиолами реагентом, таким как биотинмалеимидный реагент, с формированием меченного биотином антитела имеет значение тиоловой реакционноспособности 1,0. Другая аминокислота цистеина, вставленная в то же или другое исходное антитело, которая с 80% выходом вступает в реакцию с реагирующим с тиолами реагентом, имеет значение тиоловой реакционноспособности 0,8. Другая аминокислота цистеина, вставленная в то же или другое исходное антитело, которая совсем не вступает в реакцию с реагирующим с тиолами реагентом, имеет значение тиоловой реакционноспособности 0. Определение значения тиоловой реакционноспособности конкретного цистеина можно проводить посредством анализа ELISA, масс-спектроскопии, жидкостной хроматографии, ауторадиографии или других количественных аналитических тестов. Вступающие в реакцию с тиолами реагенты, позволяющие захват модифицированного цистеином антитела и сравнение и количественный анализ реактивности цистеина, включают биотин-PEO-малеимид ((+)-биотинил-3-малеимидопропионамидил-3,6-диоксаоктаиндиамин, Oda et al., (2001) Nature Biotechnology 19:379-382, Pierce Biotechnology, Inc.) Биотин-BMCC, PEO-йодацетилбиотин, йодацетил-1C-биотин и биотин-HPDP (Pierce Biotechnology, Inc.) и Na-(3-малеимидилпропионил)биоцитин (MPB, Molecular Probes, Eugene, OR). Другие коммерческие источники для биотинилирование, бифункциональные и полифункциональные линкерные реагенты включают Molecular Probes, Eugene, OR и Sigma, St. Louis, MO.
"Исходное антитело" представляет собой антитело, содержащее аминокислотную последовательность, на основании которой один или несколько аминокислотных остатков замещают одним или несколькими остатками цистеина. Исходное антитело может содержать природную последовательность или последовательность дикого типа. Исходное антитело может содержать предсуществующие модификации аминокислотной последовательности (такие как добавления, делеции и/или замены) относительно других природных, дикого типа или модифицированных форм антитела. Исходное антитело может быть направлено к представляющему интерес антигену-мишени, например, к биологически важному полипептиду. Также рассматривают антитела, направленные к неполипептидным антигенам (таким как ассоциированные с опухолями гликолипидные антигены; см. патент США 5091178).
В настоящем документе используют следующие аббревиатуры, и они имеют указанные определения: BME представляет собой бета-меркаптоэтанол, Boc представляет собой N-(трет-бутоксикарбонил), cit представляет собой цитруллин (2-амино-5-уреидопентановая кислота), dap представляет собой долапроин, DCC представляет собой 1,3-дициклогексилкарбодиимид, DCM представляет собой дихлорметан, DEA представляет собой диэтиламин, DEAD представляет собой диэтилазодикарбоксилат, DEPC представляет собой диэтилфосфорилцианидат, DIAD представляет собой диизопропилазодикарбоксилат, DIEA представляет собой N,N-диизопропилэтиламин, dil представляет собой долаизолейцин, DMA представляет собой диметилацетамид, DMAP представляет собой 4-диметиламинопиридин, DME представляет собой простой диметиловый эфир этиленгликоля (или 1,2-диметоксиэтан), DMF представляет собой N,N-диметилформамид, DMSO представляет собой диметилсульфоксид, doe представляет собой долафенин, dov представляет собой N,N-диметилвалин, DTNB представляет собой 5,5'-дитиобис(2-нитробензойную кислоту), DTPA представляет собой диэтилентриаминпентауксусную кислоту, DTT представляет собой дитиотреитол, EDCI представляет собой гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида, EEDQ представляет собой 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, ES-MS представляет собой электроспрейную масс-спектрометрию, EtOAc представляет собой этилацетат, Fmoc представляет собой N-(9-флуоренилметоксикарбонил), gly представляет собой глицин, HATU представляет собой гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония, HOBt представляет собой 1-гидроксибензотриазол, ВЭЖХ представляет собой высокоэффективную жидкостную хроматографию, ile представляет собой изолейцин, lys представляет собой лизин, MeCN (CH3CN) представляет собой ацетонитрил, MeOH представляет собой метанол, Mtr представляет собой 4-анизилдифенилметил (или 4-метокситритил), nor представляет собой (1S,2R)-(+)-норэфедрин, PAB представляет собой п-аминобензилкарбамоил, PBS представляет собой фосфатно-солевой буфер (pH 7), PEG представляет собой полиэтиленгликоль, Ph представляет собой фенил, Pnp представляет собой п-нитрофенил, MC представляет собой 6-малеимидокапроил, phe представляет собой L-фенилаланин, PyBrop представляет собой гексафторфосфат бром-трис-пирролидинофосфония, SEC представляет собой эксклюзионную хроматографию, Su представляет собой сукцинимид, TFA представляет собой трифторуксусную кислоту, TLC представляет собой тонкослойную хроматографию, UV представляет собой ультрафиолет и val представляет собой валин.
"Аффинно зрелое" антитело представляет собой антитело с одним или несколькими изменениями в одной или нескольких его HVR, что приводит к улучшению аффинности антитела в отношении антигена по сравнению с исходным антителом, в котором нет такого изменения(ий). В одном из вариантов осуществления аффинно зрелое антитело обладает наномолярными или даже пикомолярными аффинностями для антигена-мишени. Аффинно зрелые антитела получают известными в данной области способами. В Marks et al., Bio/Technology 10: 779-783 (1992) описано созревание аффинности посредством перестановки доменов VH и VL. Случайный мутагенез HVR и/или каркасных остатков описан в Barbas et al., Proc. Nat. Acad. Sci. USA 91: 3809-3813 (1994); Schier et al., Gene 169: 147-155 (1995); Yelton et al., J. Immunol. 155: 1994-2004 (1995); Jackson et al., J. Immunol. 154(7): 3310-9 (1995) и Hawkins et al, J. Mol. Biol. 226: 889-896 (1992).
"Блокирующее" антитело или "антагонистическое" антитело представляет собой антитело, которое ингибирует или снижает биологическую активность связываемого им антигена. Определенные блокирующие антитела или антагонистические антитела в значительной степени или полностью ингибируют биологическую активность антигена.
Как применяют в настоящем документе, "агонистическое антитело", представляет собой антитело, которое имитирует, по меньшей мере, один из видов функциональной активности представляющего интерес полипептида.
"Эффекторные функции" антитела относятся к тем видам биологической активности, которые свойственны Fc-области (Fc-область с природной последовательностью или Fc-область с вариантом аминокислотной последовательности) антитела, и варьируют в зависимости от изотипа антитела. Примеры эффекторных функций антител включают связывание C1q и обусловленную комплементом цитотоксичность; связывание Fc-рецептора; антителозависимую опосредованную клетками цитотоксичность (ADCC); фагоцитоз; негативную регуляцию клеточных поверхностных рецепторов (например, B-клеточный рецептор) и активацию B-клеток.
"Fc-рецептор" или "FcR" описывает рецептор, который связывается с Fc-областью антитела. В некоторых вариантах осуществления FcR представляет собой природный FcR человека. В некоторых вариантах осуществления FcR представляет собой FcR, который связывает антитело IgG (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и формы альтернативного сплайсинга этих рецепторов. Рецепторы FcγRII включают FcγRIIA ("активирующий рецептор") и FcγRIIB ("ингибирующий рецептор"), со сходными аминокислотными последовательностями, которые в основном отличаются их цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит в своем цитоплазматическом домене иммунорецепторный активирующий мотив на основе тирозина (ITAM). Ингибирующий рецептор FcγRIIB содержит в своем цитоплазматическом домене иммунорецепторный ингибирующий мотив на основе тирозина (ITIM) (см. Daëron, Annu. Rev. Immunol. 15: 203-234 (1997)). FcR рассмотрены в Ravetch and Kinet, Annu. Rev. Immunol. 9: 457-92 (1991); Capel et al., Immunomethods 4: 25-34 (1994); и de Haas et al., J. Lab. Clin. Med. 126: 330-41 (1995). В настоящем документе термин "FcR" охватывает и другие FcR, включая FcR, которые будут идентифицированы в будущем.
Термин "Fc-рецептор" или "FcR" также включает неонатальный рецептор, FcRn, который отвечает за перенос материнских IgG плоду (Guyer et al., J. Immunol. 117: 587 (1976) и Kim et al., J. Immunol. 24: 249 (1994)) и регуляцию гомеостаза иммуноглобулинов. Способы измерения связывания с FcRn известны (см., например, Ghetie 1997, Hinton 2004). Связывание с FcRn человека in vivo и время полужизни в сыворотке FcRn человека полипептидов с высокой аффинностью связывания можно оценить, например, у трансгенных мышей или трансфицированных клеточных линий человека, экспрессирующих FcRn человека, или у приматов, которым ввели варианты полипептидов Fc.
В WO 00/42072 (Presta) описаны варианты антител с улучшенным или сниженным связыванием с FcR. Содержание этой патентной публикации включено в настоящий документ в качестве ссылки в полном объеме. Также см. Shields et al., J. Biol. Chem. 9(2): 6591-6604 (2001).
"Эффекторные клетки человека" представляют собой лейкоциты, экспрессирующие один или несколько FcR и осуществляющие эффекторные функции. В определенных вариантах осуществления клетки экспрессируют, по меньшей мере, FcγRIII и осуществляют эффекторную функцию(и) ADCC. Примеры лейкоцитов человека, опосредующих ADCC, включают мононуклеарные клетки периферической крови (PBMC), естественные киллерные (NK) клетки, моноциты, цитотоксические T-клетки и нейтрофилы. Эффекторные клетки можно выделять из природного источника, например из крови.
"Обусловленная антителами опосредованная клетками цитотоксичность" или "ADCC" относится к форме цитотоксичности, при которой секретируемые Ig связывается Fc-рецепторами (FcR), находящимися на определенных цитотоксических клетках (например, естественные киллерные (NK) клетки, нейтрофилы и макрофаги), позволяя этим цитотоксическим эффекторным клеткам специфически связываться с несущей антиген клеткой-мишенью, а затем уничтожать клетку-мишень цитотоксинами. Первичные клетки, опосредующие ADCC, NK клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках суммирована в таблице 3 на странице 464 Ravetch and Kinet, Annu. Rev. Immunol 9: 457-92 (1991). Для оценки активности ADCC представляющей интерес молекулы можно проводить анализ ADCC in vitro, такой как анализ, описанный в патенте США №5500362 или 5821337, или патенте США №6737056, выданном Presta. Пригодные для таких анализов эффекторные клетки включают мононуклеарные клетки периферической крови (PBMC) и естественные киллерные (NK) клетки. Альтернативно или дополнительно, активность ADCC представляющей интерес молекулы можно оценивать in vivo, например, в модели на животных, такой как модель, описанная в Clynes et al., PNAS (USA) 95: 652-656 (1998).
"Обусловленная комплементом цитотоксичность" или "CDC" относится к лизису клетки-мишени в присутствии комплемента. Активация классического пути комплемента инициируется связыванием первого компонента системы комплемента (C1q) с антителами (подходящего подкласса), которые связаны с узнаваемым ими антигеном. Для оценки активации комплемента можно проводить анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996).
Варианты полипептидов с измененными аминокислотными последовательностями Fc-области и увеличенной или сниженной способностью связывания C1q описаны в патенте США №6194551B1 и WO 99/51642. Содержания этих патентных публикаций включены в настоящий документ в качестве ссылки в полном объеме. Также см. Idusogie et al., J. Immunol. 164: 4178-4184 (2000).
Термин "содержащий Fc-область полипептид" относится к полипептиду, такому как антитело или иммуноадгезин, который содержит Fc-область. C-концевой лизин (остаток 447 по нумерации системы EU) Fc-области можно удалять, например, при очистке полипептида или посредством рекомбинантного конструирования кодирующей полипептид нуклеиновой кислоты. Таким образом, композиция, содержащая полипептид с Fc-областью по данному изобретению, может содержать полипептиды с K447, со всеми удаленными K447 или смесь полипептидов с остатком K447 и без него.
"Акцепторный каркас человека" для целей настоящего документа представляет собой каркас, содержащий аминокислотную последовательность каркаса VL или VH, полученную из каркаса иммуноглобулина человека или консенсусного каркаса человека. Акцепторный каркас человека "полученный из" каркаса иммуноглобулина человека или консенсусного каркаса человека может содержать такую же их аминокислотную последовательность или он может содержать предсуществующие изменения в аминокислотной последовательности. В некоторых вариантах осуществления количество предсуществующих замен аминокислот составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее или 2 или менее. Там, где в VH присутствуют предсуществующие замены аминокислот, предпочтительно эти замены происходят только по трем, двум или одному положениям 71H, 73H и 78H; например, аминокислотные остатки в этих положениях могут представлять собой 71A, 73T и/или 78A. В одном из вариантов осуществления акцепторный каркас VL человека идентичен последовательности каркаса VL иммуноглобулина человека или последовательности консенсусного каркаса человека.
"Консенсусный каркас человека" представляет собой каркас, который представляет наиболее часто встречающиеся аминокислотные остатки при выборе каркасных последовательностей VL или VH иммуноглобулина человека. Как правило, выбор последовательностей VL или VH иммуноглобулина человека проводят из подгруппы последовательностей вариабельных доменов. Как правило, подгруппа последовательностей представляет собой подгруппу, как в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991). В одном из вариантов осуществления VL подгруппа представляет собой подгруппу каппа I как в Kabat et al., выше. В одном из вариантов осуществления VH подгруппа представляет собой подгруппу III как в Kabat et al., выше.
"Консенсусный каркас VH подгруппы III" содержит консенсусную последовательность, полученную из аминокислотных последовательностей в подгруппе III вариабельных доменов тяжелых цепей в Kabat et al., выше. В одном из вариантов осуществления аминокислотная последовательность консенсусного каркаса VH подгруппы III содержит, по меньшей мере, часть из каждой или все следующие последовательности:
EVQLVESGGGLVQPGGSLRLSCAAS (FR-H1, SEQ ID NO: 1)-HVR-H1-
WVRQAPGKGLEWV (FR-H2, SEQ ID NO: 3)-HVR-H2-
RFTISADTSKNTAYLQMNSLRAEDTAVYYC (FR-H3, SEQ ID NO: 5)-HVR-H3-
WGQGTLVTVSS (FR-H4, SEQ ID NO: 7).
"Консенсусный каркас VL подгруппы I" содержит консенсусную последовательность, полученную из аминокислотных последовательностей в подгруппе I вариабельных доменов легких цепей каппа в Kabat et al., выше. В одном из вариантов осуществления аминокислотная последовательность консенсусного каркаса VL подгруппы I содержит, по меньшей мере, часть из каждой или все следующие последовательности:
DIQMTQSPSSLSASVGDRVTITC (FR-L1, SEQ ID NO: 8)-HVR-L1-
WYQQKPGKAPKLLIY (FR-L2, SEQ ID NO: 11)-HVR-L2-
GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (FR-L3, SEQ ID NO: 13)-HVR-L3-FGQGTKVEIK (FR-L4, SEQ ID NO: 15).
"Секреторная сигнальная последовательность" или "сигнальная последовательность" относится к последовательности нуклеиновой кислоты, кодирующей короткий сигнальный пептид, который можно использовать для направления вновь синтезированного представляющего интерес белка через клеточную мембрану, как правило, внутреннюю мембрану или внутреннюю или наружные мембраны прокариот. Поэтому представляющий интерес белок, такой как полипептид легкой или тяжелой цепи иммуноглобулина, секретируется в периплазму прокариотических клеток-хозяев или в среду для культивирования. Сигнальный пептид, кодируемый секреторной сигнальной последовательностью, может быть эндогенным для клеток-хозяев, или он может быть экзогенным, включая сигнальные пептиды, встречающиеся с экспрессируемым полипептидом в природе. Секреторные сигнальные последовательности, как правило, находятся на аминоконце экспрессируемого полипептида и, как правило, ферментативно удаляются в промежутке между биосинтезом и секрецией полипептида из цитоплазмы. Таким образом, сигнальный пептид, как правило, не присутствует в продукте зрелого белка.
Как правило, "аффинность связывания" относится к силе суммы общих нековалентных взаимодействий между одним участком связывания молекулы (например, антитела) и его партнера по связыванию (например, антигена). Как применяют в настоящем документе, если не указано иначе, "аффинность связывания" относится к естественной аффинности связывания, которая отражает взаимодействие 1:1 между партнерами пары связывания (например, антитело и антиген). Аффинность молекулы X для ее партнера Y, как правило, можно представить константой диссоциации (Kd). Аффинность можно измерять общеизвестными в данной области способами, включая способы, описываемые в настоящем документе. Низкоаффинные антитела, как правило, медленно связывают антиген и имеют тенденцию к легкой диссоциации, тогда как высокоаффинные антитела, как правило, связывают антиген быстрее и имеют тенденцию оставаться связанными дольше. В данной области известно множество способов измерения аффинности связывания, любой из которых можно использовать для целей настоящего изобретения. Конкретные иллюстративные варианты осуществления описаны ниже.
В одном из вариантов осуществления "Kd" или "значение Kd" по данному изобретению измеряют посредством анализа связывания радиоактивных антигенов (RIA), проводимого с Fab-вариантом представляющего интерес антитела и его антигеном, как описано в следующем анализе. Аффинность связывания Fab для антигена в растворе измеряют посредством уравновешивания Fab с минимальной концентрацией меченного (125I) антигена в присутствии титрующих разведений немеченого антигена, затем проводя захват связанного антигена на покрытом антителами к Fab планшете (Chen, et al., (1999) J. Mol. Biol. 293: 865-881). Для создания условий для анализа планшеты для микротитрования (Dynex) покрывают в течение ночи 5 мкг/мл захватывающего антитела к Fab (Cappel Labs) в 50 мМ карбонате натрия (pH 9,6), а затем блокируют 2% (масс./об.) бычьим сывороточным альбумином в PBS в течение от двух до пяти часов при комнатной температуре (приблизительно 23°C). В неадсорбирующем планшете (Nunc №269620), 100 пМ или 26 мМ [125I]-антиген смешивают с серийными разведениями представляющего интерес Fab (например, в соответствии с оценкой антитела к VEGF, Fab-12, в Presta et al., (1997) Cancer Res. 57: 4593-4599). Затем представляющий интерес Fab инкубируют в течение ночи; однако, инкубацию можно продолжать и более длительный период (например, приблизительно 65 часов) для гарантии того, что равновесие достигнуто. Затем смеси переносят на захватывающий планшет для инкубации при комнатной температуре (например, в течение одного часа). Затем раствор удаляют и планшет промывают восемь раз 0,1% Tween-20 в PBS. После высушивания планшетов добавляют 150 мкл/лунка сцинтиллятора (MicroScint-20; Packard) и на планшетах проводят подсчет на гамма-счетчике Topcount (Packard) в течение десяти минут. Концентрации каждого Fab, дающие меньшие или равные 20% максимального связывания, выбирают для применения в анализах конкурентного связывания.
По другому варианту осуществления, Kd или значение Kd измеряют посредством использования анализов поверхностного плазмонного резонанса с применением BIAcoreTM-2000 или BIAcoreTM-3000 (BIAcore, Inc., Piscataway, NJ) при 25°C с применением чипов CM5 с иммобилизованным антигеном при ~10 единицах ответа (RU). В кратком изложении, карбоксиметилированные декстрановые биосенсорные чипы (CM5, BIAcore Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) по инструкциям поставщика. Перед инъекцией при скорости потока 5 мкл/минута с достижением приблизительно 10 единиц ответа (RU) связанного белка антиген разводят 10 мМ ацетатом натрия, pH 4,8, до 5 мкг/мл (~0,2 мкМ). После инъекции антигена инъецируют 1 M этаноламин для блокирования непрореагировавших групп. Для кинетических измерений инъецируют двукратные серийные разведения Fab (от 0,78 нМ до 500 нМ) в PBS с 0,05% Tween 20 (PBST) при 25°C при скорости потока приблизительно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) подсчитывают с применением простой модели связывания Лэнгмюра один-к-одному (BIAcore Evaluation Software version 3.2) посредством одновременного построения сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (Kd) подсчитывают как отношение koff/kon. См., например, Chen, Y., et al., (1999) J. Mol. Biol. 293: 865-881. Если скорость образования при анализе поверхностного плазмонного резонанса превышает 106 М-1с-1, тогда скорость образования можно определять с применением способа гашения флуоресценции, который измеряет увеличение или уменьшение интенсивности излучения флуоресценции (возбуждение = 295 нм; излучение = 340 нм, полоса пропускания 16 нм) при 25°C 20 нМ антитела к антигену (в форме Fab) в PBS, pH 7,2, в присутствии увеличивающихся концентраций антигена, как измеряют в спектрометре, таком как оборудованные остановленным потоком спектрофотометр (Aviv Instruments) или спектрофотометр SLM-Aminco 8000 серии (ThermoSpectronic) с применением кюветы с перемешиванием.
"Скорость образования", "скорость ассоциации" или "kon" по данному изобретению также можно определять так, как описано выше с применением системы BIAcoreTM-2000 или BIAcoreTM-3000 (BIAcore, Inc., Piscataway, NJ).
"Нарушение" представляет собой любое патологическое состояние или заболевание, на которое можно благоприятно воздействовать при применении лечения веществом/молекулой или способом по изобретению. Оно включает хронические или острые нарушения, включая патологические состояния, которые предрасполагают млекопитающего к рассматриваемому нарушению. Неограничивающие примеры нарушений для лечения по настоящему документу включают злокачественные состояния, такие как B-клеточные пролиферативные нарушения и/или B-клеточные опухоли, например, лимфому, неходжкинскую лимфому (NHL), агрессивную NHL, рецидивирующую агрессивную NHL, рецидивирующую медленно растущую NHL, рефракторную NHL, рефракторную медленно растущую NHL, хронический лимфолейкоз (CLL), мелкоклеточную лимфома, лейкоз, волосатоклеточный лейкоз (HCL), острый лимфоцитарный лейкоз (ALL) и лимфому мантийных клеток.
Термины "клеточное пролиферативное нарушение" и "пролиферативное нарушение" относятся к нарушениям, которые ассоциированы с определенной степенью аномальной клеточной пролиферации. В одном из вариантов осуществления клеточное пролиферативное нарушение представляет собой злокачественную опухоль.
Как применяют в настоящем документе, "опухоль" относится к любому росту и пролиферации неопластических клеток, злокачественному или доброкачественному и ко всем предзлокачественным и злокачественным клеткам и тканям. Термины "злокачественная опухоль", "злокачественный", "клеточное пролиферативное нарушение", "пролиферативное нарушение" и "опухоль" не являются взаимоисключающими, как указано в настоящем документе.
Термины "злокачественная опухоль" и "злокачественный" относятся к физиологическому состоянию у млекопитающих, которое, как правило, характеризуется нерегулируемым клеточным ростом/пролиферацией, или описывают его. Примеры злокачественной опухоли включают в качестве неограничивающих примеров, злокачественные B-клеточные пролиферативные нарушения, где B-клеточное пролиферативное нарушение выбрано из лимфомы, неходжкинской лимфомы (NHL), агрессивной NHL, рецидивирующей агрессивной NHL, рецидивирующей медленно растущей NHL, рефракторной NHL, рефракторной медленно растущей NHL, хронического лимфолейкоза (CLL), мелкоклеточной лимфомы, лейкоза, волосатоклеточного лейкоза (HCL), острого лимфоцитарного лейкоза (ALL) и лимфомы мантийных клеток. Включены другие злокачественные состояния, например, карцинома, лимфома (например, ходжкинская и неходжкинская лимфома), бластома, саркома и лейкоз. Более конкретные примеры таких злокачественных опухолей включают плоскоклеточную злокачественную опухоль, мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких, плоскоклеточную карциному легких, злокачественную опухоль брюшной полости, печеночно-клеточную злокачественную опухоль, желудочно-кишечную злокачественную опухоль, рак поджелудочной железы, глиому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстого кишечника, колоректальный рак, карциному эндометрия или матки, карциному слюнной железы, рак почки, рак печени, рак предстательной железы, рак женских наружных половых органов, рак щитовидной железы, печеночную карциному, лейкоз и другие лимфопролиферативные нарушения и различные типы рака головы и шеи.
"B-клеточное злокачественное новообразование" в настоящем документе включает неходжкинскую лимфому (NHL), включая высокодифференцированную/фолликулярную NHL, мелкоклеточную (SL) NHL, промежуточной степени дифференцировки/фолликулярную NHL, промежуточной степени дифференцировки диффузную NHL, высокодифференцированную иммунобластную NHL, высокодифференцированную лимфобластную NHL, высокодифференцированную NHL из мелких нерасщепляющихся клеток, NHL с массивным поражением, лимфому мантийных клеток, связанную со СПИД лимфому и макроглобулинемию Вальденстрема, неходжкинскую лимфому (NHL), болезнь Ходжкина с преобладанием лимфоцитов (LPHD), мелкоклеточную лимфому (SLL), хронический лимфолейкоз (CLL), медленно растущую NHL, включая рецидивирующую медленно растущую NHL и рефракторную к ритуксимабу медленно растущую NHL; лейкоз, включая острый лимфобластный лейкоз (ALL), хронический лимфолейкоз (CLL), волосатоклеточный лейкоз, хронический миелобластный лейкоз; лимфому мантийных клеток и другие гематологические злокачественные новообразования. Такие злокачественные новообразования можно лечить антителами, направленными к поверхностным маркерам B-клеток, таким как CD22. Такие заболевания рассматриваются в настоящем документе как подлежащие лечению введением антител, направленных к поверхностному B-клеточному маркеру, такому как CD22, и введение включает введение неконъюгированного ("свободного") антитела или антитела, конъюгированного с цитотоксическим средством, как описано в настоящем документе. Также такие заболевания рассматриваются в настоящем документе, как подлежащие комбинированному лечению, включающему антитело к CD22 или конъюгат антитело к CD22-лекарственное средство по изобретению в сочетании с другим антителом или конъюгатом антитело-лекарственное средство, другим цитотоксическим средством, лечением радиоактивностью или другим лечением, проводимым одновременно или последовательно. В иллюстративном способе лечения по изобретению антитело к CD22 по изобретению вводят в сочетании с антителом к CD20, иммуноглобулином, или его связывающим CD20 фрагментом, вместе или последовательно. Антитело к CD20 может представлять собой свободное антитело или конъюгат антитело-лекарственное средство. В варианте осуществления комбинированного лечения антитело к CD22 представляет собой антитело по настоящему изобретению, а антитело к CD20 представляет собой Rituxan® (ритуксан®, ритуксимаб).
Как применяют в настоящем документе, термин "неходжкинская лимфома" или "NHL" относится к злокачественной опухоли лимфатической системы, отличной от ходжкинских лимфом. Ходжкинские лимфомы, как правило, можно отличить от неходжкинских лимфом по присутствию клеток Рида-Штернберга при ходжкинских лимфомах и отсутствию указанных клеток при неходжкинских лимфомах. Примеры неходжкинских лимфом, охватываемых термином, как применяют в настоящем документе, включают любую неходжкинскую лимфому, которую специалист в данной области (например, онколог или патолог) идентифицирует как неходжкинскую в соответствии с известными в данной области схемами классификации, такими как схема Revised European-American Limphoma (REAL), как описано в Color Atlas of Clinical Hematology (3rd edition), A. Victor Hoffbrand and John E. Pettit (eds.) (Harcourt Publishers Ltd., 2000). В частности, см. списки на фиг.11.57, 11.58 и 11.59. Более конкретные примеры включают в качестве неограничивающих примеров рецидивирующую или рефракторную NHL, пограничную низкодифференцированную NHL, NHL стадии III/IV, устойчивую к химиотерапии NHL, лимфобластный лейкоз и/или лимфому из предшественников B-клеток, мелкоклеточную лимфому, B-клеточный хронический лимфолейкоз, и/или пролимфоцитарный лейкоз, и/или мелкоклеточную лимфому, B-клеточную пролимфоцитарную лимфому, иммуноцитому и/или лимфоплазматическую лимфому, лимфоплазматическую лимфому, лимфому B-клеток краевой зоны, лимфому селезеночной краевой зоны, внеузловую лимфому краевой зоны - MALT, узелковую лимфому краевой зоны, волосатоклеточный лейкоз, плазмоцитому и/или миелому плазматических клеток, низкодифференцированную/фолликулярную лимфому, промежуточной степени дифференцировки/фолликулярную NHL, лимфому мантийных клеток, лимфому центров фолликулов (фолликулярную), промежуточной степени дифференцировки диффузную NHL, диффузную крупноклеточную B-клеточную лимфому, агрессивную NHL (включая агрессивную пограничную NHL и агрессивную рецидивирующую NHL), NHL, рецидивирующую после трансплантации аутологичных стволовых клеток или рефракторную к ней, первичную медиастинальную крупноклеточную B-клеточную лимфому, первичную эксудативную лимфому, низкодифференцированную иммунобластную NHL, высокодифференцированную лимфобластную NHL, высокодифференцированную NHL из мелких нерасщепляющихся клеток, NHL с массивным поражением, лимфому Беркита, лейкоз из предшественников (периферических) больших гранулярных лимфоцитов, грибовидный микоз и/или синдром Сезари, кожные лимфомы, анапластическую крупноклеточную лимфому, ангиоцентрическую лимфому.
"Аутоиммунное заболевание" в настоящем документе представляет собой заболевание или нарушение, возникающее из и направленное против собственных тканей или органов индивидуума, или его отдельные симптомы или проявления, или возникающее вследствие него состояние. При многих из этих аутоиммунных и воспалительных нарушениях может существовать ряд клинических и лабораторных маркеров, включая в качестве неограничивающих примеров, гипергаммаглобулинемию, высокие уровни аутоантител, отложения комплексов антиген-антитело в тканях, улучшение после кортикостероидного или иммуносупрессирующего лечения и агрегаты лимфоидных клеток в пораженных тканях. Без ограничения какой-либо теорией, относительно опосредованного B-клетками аутоиммунного заболевания, полагают, что B-клетки проявляют патогенное действие при аутоиммунных заболеваниях человека посредством множества механических путей, включая продукцию аутоантител, формирование иммунных комплексов, активацию дендритных и T-клеток, синтез цитокинов, непосредственное высвобождение хемокинов и обеспечение очага для эктопического неолимфогенеза. Каждый из этих путей может принимать участие в патогенезе аутоиммунного заболевания в различной степени.
"Аутоиммунное заболевание" может представлять собой органоспецифическое заболевание (т.е. иммунный ответ специфично направлен против системы органов, такой как эндокринная система, система гемопоэза, кожа, сердечно-легочная система, система желудочно-кишечного тракта и печени, система почек, щитовидная железа, уши, нервно-мышечная система, центральная нервная система и т.д.) или системное заболевание, которое может поражать несколько органных систем (например, системная красная волчанка (СКВ), ревматоидный артрит, полимиозит и т.д.). Предпочтительные такие заболевания включают аутоиммунные ревматологические нарушения (например, такие как ревматоидный артрит, синдром Шегрена, склеродермия, волчанка, такая как СКВ и волчаночный нефрит, полимиозит/дерматомиозит, криоглобулинемия, синдром антифосфолипидных антител и псориатический артрит), аутоиммунные желудочно-кишечные и печеночные нарушения (например, такие как воспалительные заболевания кишечника (например, язвенный колит и болезнь Крона), аутоиммунный гастрит и пернициозная анемия, аутоиммунный гепатит, первичный биллиарный цирроз, первичный склерозирующий холангит и глютеиновая болезнь), васкулит (например, такой как ANCA-негативный васкулит и ANCA-ассоциированный васкулит, включая васкулит Черджа-Стросс, гранулематоз Вегенера и микроскопический полиангиит), аутоиммунные неврологические нарушения (например, такие как рассеянный склероз, опсоклонический миоклонический синдром, миастения gravis, оптикомиелит, болезнь Паркинсона, болезнь Альцгеймера и аутоиммунные полинейропатии), почечные нарушения (например, такие как гломерулонефрит, синдром Гудпасчера и болезнь Бергера), аутоиммунные дерматологические нарушения (например, такие как псориаз, крапивница, сыпь, обыкновенная пузырчатка, буллезный пемфигоид и кожный волчаночный эритематоз), гематологические нарушения (например, такие как тромбоцитопеническая пурпура, тромботическая тромбоцитопеническая пурпура, посттрансфузионная пурпура и аутоиммунная гемолитическая анемия), атеросклероз, увеит, аутоиммунные болезни слуха (например, такие как болезнь внутреннего уха и потеря слуха), болезнь Бехчета, синдром Рейно, трансплантат органа и аутоиммунные эндокринные нарушения (например, такие как связанные с диабетом аутоиммунные заболевания, такие как инсулинозависимый сахарный диабет (IDDM), болезнь Аддисона и аутоиммунное заболевание щитовидной железы (например, болезнь Грейвса и тиреоидит)). Более предпочтительные такие заболевания включают, например, ревматоидный артрит, язвенный колит, ANCA-ассоциированный васкулит, волчанку, рассеянный склероз, синдром Шегрена, болезнь Грейвса, IDDM, пернициозную анемию, тиреоидит и гломерулонефрит.
Конкретные примеры других аутоиммунных заболеваний, как определено в настоящем документе, которые в некоторых случаях включают аутоиммунные заболевания, перечисленные выше, включают в качестве неограничивающих примеров, артрит (острый и хронический ревматоидный артрит, включая юношеский ревматоидный артрит и стадии, такие как ревматоидный синовиит, подагра или подагрический артрит, острый иммунологический артрит, хронический воспалительный артрит, дегенеративный артрит, индуцированный коллагеном II типа артрит, инфекционный артрит, артрит Лайма, пролиферативный артрит, псориатический артрит, болезнь Стилла, артрит позвоночника, остеоартрит, хронический прогредиентный артрит, деформирующий артрит, первичный хронический полиартрит, реактивный артрит, менопаузальный артрит, артрит вследствие снижения эстрогенов и анкилозирующий спондилит/ревматоидный спондилит), аутоиммунное лимфопролиферативное заболевание, воспалительные гиперпролиферативные кожные заболевания, псориаз, такой как пятнистый псориаз, каплевидный псориаз, пустулезный псориаз и псориаз ногтей, аллергию, включая аллергические заболевания, такие как сенная лихорадка и синдром Джоба, дерматит, включая контактный дерматит, хронический контактный дерматит, шелушащийся дерматит, аллергический дерматит, аллергический контактный дерматит, сыпь, герпетиформный дерматит, монетовидный дерматит, себорейный дерматит, неспецифический дерматит, первичный контактный дерматит от раздражающих веществ и атопический дерматит, x-сцепленный синдром гипер IgM, аллергические внутриглазные воспалительные заболевания, крапивница, такая как хроническая аллергическая крапивница и хроническая идиопатическая крапивница, включая хроническую аутоиммунную крапивницу, миозит, полимиозит/дерматомиозит, юношеский дерматомиозит, токсический эпидермальный некролиз, склеродермию (включая системную склеродермию), склероз, такой как системный склероз, рассеянный склероз (РС), такой как спинооптический РС, первичный прогрессирующий РС (ППРС) и ремитирующий-рецидивирующий РС (РРРС), прогрессирующий системный склероз, атеросклероз, артериосклероз, рассеянный склероз, атаксический склероз, оптиконейромиелит (NMO), воспалительное заболевание кишечника (IBD) (например, болезнь Крона, аутоиммуноопосредованные желудочно-кишечные заболевания, желудочно-кишечное воспаление, колит, такой как язвенный колит, язвенный колит, микроскопический колит, коллагенозный колит, полипозный колит, некротизирующий энтероколит и трансмуральный колит и аутоиммунное воспалительное заболевание кишечника), воспаление кишечника, гангренозную пиодермию, узелковую эритему, первичный склерозирующий холангит, респираторный дистресс-синдром, включая респираторный дистресс-синдром взрослых или синдром острой дыхательной недостаточности (ARDS), менингит, воспаление всей или части сосудистой оболочки глаза, ирит, хориоидит, аутоиммунное гематологическое нарушение, реакция "трансплантат против хозяина", ангионевротический отек, такой как наследственный ангионевротический отек, повреждение черепных нервов как при менингите, герпес беременных, пемфигоид беременных, воспалительный зуд, аутоиммунное раннее прекращение овуляции, неожиданную потерю слуха вследствие аутоиммунного патологического состояния, опосредованные IgE заболевания, такие как анафилаксия и аллергический и атопический ринит, энцефалит, такой как энцефалит Расмуссена и лимбический энцефалит и/или энцефалит ствола головного мозга, увеит, такой как передний увеит, острый передний увеит, гранулематозный увеит, негранулематозный увеит, факоантигенный увеит, задний увеит или аутоиммунный увеит, гломерулонефрит (GN) с нефротическим синдромом и без него, такой как хронический или острый гломерулонефрит, такой как первичный GN, иммуноопосредованный GN, мембранный GN (мембранная нефропатия), идиопатический мембранный GN или идиопатическая мембранная нефропатия, мембрано- или мембранный пролиферативный GN (MPGN), включая тип I и тип II и быстро прогрессирующий GN (RPGN), пролиферативный нефрит, аутоиммунная полижелезистая эндокринная недостаточность, баланит, включая ограниченный плазмаклеточный баланит, баланопостит, центробежная кольцевидная эритема, пепельный дерматоз, мультиформная эритема, кольцевидная гранулема, блестящий лишай, склеротический атрофический лишай, простой хронический лишай, шиповидный лишай, плоский лишай, чешуйчатый ихтиозы, эпидермолитический гиперкератоз, предраковый кератоз, гангренозная пиодермия, аллергические состояния и ответы, пищевые аллергии, аллергии на лекарственные средства, аллергии на насекомых, редкие аллергические нарушения, такие как мастоцитоз, аллергическая реакция, экзема, включая аллергическую или атопическую экзему, астеатозную экзему, дисгидротическую экзему и пузырчатую ладонно-подошвенную экзему, астму, такую как бронхиальная астма и аутоиммунная астма, состояния, включающие инфильтрацию T-клеток и хронический воспалительный ответ, иммунные реакции против чужеродных антигенов, такие как группы крови A-B-О плода при беременности, хроническое легочное воспалительное заболевание, аутоиммунный миокардит, недостаточность адгезии лейкоцитов, волчанку, включая волчаночный нефрит, волчаночный энцефалит, педиатрическую волчанку, непочечную волчанку, экстраренальную волчанку, дисковидную волчанку и дисковидный волчаночный эритематоз, волчаночную алопецию, СКВ, такую как кожная СКВ или подострая кожная СКВ, неонатальный волчаночный синдром (NLE) и волчаночный диссеминированный эритематоз, юношеский (типа I) сахарный диабет, включая детский IDDM, сахарный диабет взрослых (диабет типа II), аутоиммунный диабет, идиопатический несахарный диабет, диабетическую ретинопатию, диабетическую нефропатию, диабетический колит, диабетическое нарушение крупных артерий, иммунный ответ, ассоциированный с острой или замедленной гиперчувствительностью, опосредованной цитокинами и T-лимфоцитами, туберкулез, саркоидоз, гранулематоз, включая лимфоматоидный гранулематоз, агранулоцитоз, васкулит (включая васкулит больших сосудов, такой как ревматическая полимиалгия и гигантоклеточный (Такаясу) артериит, васкулит средних сосудов, такой как синдром Кавасаки и узелковый полиартериит/узелковый периартериит, иммуноваскулит, васкулит ЦНС, кожный васкулит, васкулит вследствие гиперчувствительности, некротизирующий васкулит, такой как фибриноидный некротизирующий васкулит и системный некротизирующий васкулит, ANCA-негативный васкулит и ANCA-ассоциированный васкулит, такой как синдром Черджа-Стросс (CSS), гранулематоз Вегенера и микроскопический полиангиит), височный артериит, апластическую анемию, аутоиммунную апластическую анемию, положительную на тест Кумбса анемию, анемию Даймонда-Блэкфана, гемолитическую анемию или иммунную гемолитическую анемию, включая аутоиммунную гемолитическую анемию (AIHA), пернициозную анемию (anemia perniciosa), болезнь Аддисона, истинную эритроцитарную анемию или аплазию (PRCA), дефицит фактора VIII, гемофилию A, аутоиммунную нейтропению(и), цитопении, такие как панцитопения, лейкопения, заболевания, включающие диапедез лейкоцитов, воспалительные нарушения ЦНС, болезнь Альцгеймера, болезнь Паркинсона, синдром полиорганного повреждения, такой как вторичные синдромы септицимии, травмы или кровоизлияния, опосредованные комплексами антиген-антитело заболевания, болезнь антител к базальной мембране клубочков, синдром антител к фосфолипидам, мотоневрит, аллергический неврит, болезнь/синдром Бехчета, синдром Кастлмена, синдром Гудпасчера, синдром Рейно, синдром Шегрена, синдром Стивенса-Джонсона, пемфигоид или пемфигус, такой как буллезный пемфигоид, рубцовый (слизистая оболочки) пемфигоид, кожный пемфигоид, обыкновенная пузырчатка, паранеопластический пемфигус, слоистый пемфигус, пемфигусный пемфигоид слизистой оболочки и пемфигусный эритематоз, приобретенный буллезный эпидермолиз, глазное воспаление, предпочтительно аллергическое глазное воспаление, такое как аллергический конъюнктивит, буллезное заболевание линейного IgA, аутоиммунно индуцированное воспаление конъюнктивы, аутоиммунные полиэндокринопатии, болезнь или синдром Рейтера, тепловое повреждение вследствие аутоиммунного состояния, предэклампсию, нарушение вследствие иммунных комплексов, такой как нефрит иммунных комплексов, опосредованный антителами нефрит, нейровоспалительные нарушения, полинейропатии, хроническую нейропатию, такую IgM полинейропатии или опосредованная IgM нейропатия, тромбоцитопению (например, как развивается у пациентов с инфарктом миокарда), включая тромботическую тромбоцитопеническую пурпуру (TTP), посттрансфузионную пурпуру (PTP), индуцированную гепарином тромбоцитопению и аутоиммунную или иммуноопосредованную тромбоцитопению, включая, например, идиопатическую тромбоцитопеническую пурпуру (ITP), включая хроническую или острую ITP, склерит, такой как идиопатический кератосклерит, эписклерит, аутоиммунное заболевание семенников и яичников, включая аутоиммунный орхит и оофорит, первичный гипотиреоз, гипопаратиреоз, аутоиммунные эндокринные заболевания, включая тиреоидит, такой как аутоиммунный тиреоидит, болезнь Хашимото, хронический тиреоидит (тиреоидит Хашимото), или подострый тиреоидит, аутоиммунную болезнь щитовидной железы, идиопатический гипотиреоз, болезнь Грейва, болезнь Грейва глаз (офтальмопатия или ассоциированная с щитовидной железой офтальмопатия), полигландулярные синдромы, такие как аутоиммунные полигландулярные синдромы, например, типа I (или полигландулярные эндокринопатические синдромы), паранеопластические синдромы, включая неврологические паранеопластические синдромы, такие как миастенический синдром Ламберта-Итона или синдром Ламберта-Итона, синдром застывшего человека или застывшего индивидуума, энцефаломиелит, такой как аллергический энцефаломиелит и экспериментальный аллергический энцефаломиелит (EAE), миастению gravis, такую как ассоциированную с тимомой миастению gravis, дегенерацию мозжечка, нейромиотонию, опсоклонус или опсоклонический миоклонический синдром (OMS) и сенсорную нейропатию, полифокальную моторную нейропатию, синдром Шихана, аутоиммунный гепатит, хронический гепатит, волчаночный гепатит, гигантоклеточный гепатит, хронический активный гепатит или аутоиммунный хронический активный гепатит, пневмонит, такой как лимфоидный интерстициальный пневмонит (LIP), облитерирующий бронхолит (не трансплантат) против NSIP, синдром Гийена-Барре, болезнь Бергера (IgA-нефропатия), идиопатическую IgA-нефропатию, дерматоз линейных IgA, острый фебрильный нейтрофильный дерматоз, подроговичный пустулезный дерматоз, транзиторный акантолитический дерматоз, цирроз, такой как первичный биллиарный цирроз и пневмоноцирроз, аутоиммунный синдром энтеропатии, глютеновую энтеропатию или целиакию, рефракторную спру, идиопатическую спру, криоглобулинемию, такую как смешанная криоглобулинемия, боковой амиотрофический склероз (ALS; болезнь Лоу-Герига), болезнь коронарных артерий, аутоиммунное заболевание ушей, такое как аутоиммунное заболевание внутреннего уха (AIED), аутоиммунную потерю слуха, полихондрит, такой как рефракторный или рецидивирующий полихондрит, легочный альвеолярный протеиноз, кератит, такой как синдром Когана/несифилитический интерстициальный кератит, паралич Белла, болезнь/синдром Свита, аутоиммунную розацеа, боль, связанную с опоясывающим лишаем, амилоидоз, незлокачественный лимфоцитоз, первичный лимфоцитоз, который включает B-клеточный лимфоцитоз (например, доброкачественную моноклональную гаммапатию и моноклональную гаммапатию неопределенной значимости, MGUS), периферическую нейропатию, паранеопластический синдром, каналопатии, такие как эпилепсия, мигрень, аритмия, мышечные нарушения, глухота, слепота, пароксизмальный паралич и каналопатии CNS, аутизм, воспалительная миопатия, фокальный или сегментарный или фокально-сегментарный гломерулосклероз (FSGS), эндокринную офтальмопатию, увеоретинит, хориоретинит, аутоиммунное гепатологическое нарушение, фибромиалгию, множественную эндокринную недостаточность, синдром Шмидта, адреналит, атрофию желудка, пресенильную деменцию, демиелинизирующие заболевания, такие как аутоиммунные демиелинизирующие заболевания и хроническую воспалительную демиелинизирующую полинейропатию, синдром Дресслера, очаговую алопецию, полную алопецию, синдром CREST (кальциноз, феномен Рейнарда, эзофагальная дискинезия, склеродактилия и телангиэктазия), мужское и женское аутоиммунное бесплодие, например, вследствие антител к сперматозоидам, смешанное поражение соединительной ткани, болезнь Чагаса, ревматическую лихорадку, привычный выкидыш, легкое фермера, полиморфную эритему, посткардиотомический синдром, синдром Кушинга, легкое птицеводов, аллергический гранулематозный васкулит, мягкий лимфоцитный васкулит, синдром Альпорта, альвеолит, такой как аллергический альвеолит и фиброзирующий альвеолит, интерстициальное заболевание легких, трансфузионную реакцию, лепру, малярию, паразитарные заболевания, такие как лейшманиоз, кипаносомиоз, шистозомоз, аскаридоз, аспергиллез, синдром Сэмптера, синдром Каплана, лихорадка денге, эндокардит, эндомиокардиальный фиброз, диффузный интерстициальный легочный фиброз, интерстициальный легочный фиброз, фиброзный медиастинит, легочный фиброз, идиопатический легочный фиброз, кистозный фиброз, эндофтальмит, стойкую возвышающуюся эритему, эритробластоз плода, эозинофильный фациит, синдром Шульмана, синдром Фелти, флариаз, циклит, такой как хронический циклит, гетерохронный циклит, иридоциклит (острый или хронический) или циклит Фуха, пурпура Шенлейн-Геноха, инфекцию вирусом иммунодефицита человека (HIV), SCID, синдром приобретенного иммунодефицита (СПИД), эховирусную инфекцию, сепсис (синдром системного воспалительного ответа (SIRS)), эндотоксикоз, панкреатит, тироксикоз, парвовирусную инфекцию, инфекцию вирусом краснухи, поствакционные синдромы, врожденную инфекцию краснухи, инфекцию вирусом Эпштейна-Барр, инфекционный паротит, синдром Эвана, аутоиммунное поражение гонад, хорея Сиденгама, постстрептококковый нефрит, облитерирующий тромбангиит, тиреотоксикоз, сухотку спинного мозга, хориоидит, гигантоклеточную полимиалгию, хронический гиперчувствительный пневмонит, конъюнктивит, такой как весенний катар, сухой кератоконъюнктивит и эпидемический кератоконъюнктивит, идиопатический почечный синдром, нефропатия с минимальными изменениями, мягкое семейное повреждение и повреждение вследствие ишемии-реперфузии, реперфузия трансплантированного органа, аутоиммунная реакция на сетчатку, воспаление суставов, бронхит, хроническая легочная непроходимость/непроходимость дыхательных путей, силикоз, афты, афтозный стоматит, артериосклеротические нарушения (церебральная сосудистая недостаточность), такие как артериосклеротическая энцефалопатия и артериосклеротическая ретинопатия, аспермиогенез, аутоиммунный гемолиз, болезнь Бека, криоглобулинемию, контрактуру Дюпюитрена, факоанафилактическую эндофтальмию, аллергический энтерит, лепрозную узелковую эритему, идиопатический лицевой паралич, синдром хронической усталости, ревматическую лихорадку, болезнь Хаммена-Рича, сенсоневральную потерю слуха, пароксизмальную гемоглобинурию, гипогонадизм, региональный илеит, лейкопению, инфекционный мононуклеоз, поперечный миелит, первичную идиопатическую микседему, нефроз, симпатический офтальмит, неонатальный офтальмит, оптический неврит, гранулематозный орхит, панкреатит, острый множественный радикулит, гангренозную пиодермию, тиреоидит Квервайна, приобретенную атрофию селезенки, незлокачественную тимому, лимфофолликулярный тимит, витилиго, синдром токсического шока, пищевое отравление, состояния, включающие инфильтрацию T-клеток, недостаточность адгезии лейкоцитов, иммунный ответ, ассоциированный с острой или замедленной гиперчувствительностью, опосредованной цитокинами и T-лимфоцитами, заболевания, включающие лейкоцитарный диапедез, синдром полиорганной недостаточности, заболевания, опосредованные комплексами антиген-антитело, заболевание, обусловленное антителами к базальной мембране клубочков, аутоиммунные полиэндокринопатии, оофорит, первичную микседему, аутоиммунный атрофический гастрит, ревматические заболевания, смешанное поражение соединительной ткани, нефротический синдром, инсулит, полиэндокринная недостаточность, аутоиммунные полигландулярные синдромы, включая полигландулярный синдром типа I, идиопатический гипопаратиреоз взрослых (AOIH), кардиомиопатию, такую как распространенную кардиомиопатию, приобретенный буллезный эпидермолиз (EBA), гемохроматоз, миокардит, нефротический синдром, первичный склерозирующий холангит, гнойный или негнойный синусит, острый или хронический синусит, этмоидный, фронтальный, максиллярный или сфеноидный синусит, аллергический синусит, связанное с эозинофилами нарушение, такое как эозинофилия, легочная инфильтрирующая эозинофилия, синдром эозинофилии-миалгии, синдром Лефлера, хроническая эозинофильная пневмония, тропическая легочная эозинофилия, бронхопневмонический аспергиллез, аспергиллему или гранулемы, содержащие эозинофилы, анафилаксию, спондилоартропатии, серонегативные спондилоартриты, полиэндокринное аутоиммунное заболевание, склерозирующий холангит, склерозный, эписклерозный, хронический кожно-слизистый кандидоз, синдром Брутона, преходящую гипогаммаглобулинемию детского возраста, синдром Вискотта-Олдрича, синдром атаксии-телеангиэктазии, ангиэктазию, аутоиммунные нарушения, ассоциированные с коллагеновым заболеванием, ревматизм, такой как хронический артроревматизм, лимфаденит, ответ снижением кровяного давления, сосудистую дисфункцию, повреждение тканей, кардиососудистую ишемию, гипералгезию, почечную ишемию, ишемию головного мозга и заболевание, сопровождающее васкуляризацию, нарушения в виде аллергической гиперчувствительности, гломерулонефриты, реперфузионное повреждение, ишемическое реперфузионное повреждение, реперфузионное повреждение миокардиальной или других тканей, лимфоматозный трахеобронхит, воспалительные дерматозы, дерматозы с острыми воспалительными компонентами, полиорганную недостаточность, буллезные заболевания, почечный кортикальный некроз, острый гнойный менингит или другие воспалительные нарушения центральной нервной системы, окулярные и орбитальные воспалительные нарушения, ассоциированные с трансфузией гранулоцитов синдромы, индуцированную цитокинами токсичность, нарколепсию, острое тяжелое воспаление, хроническое не поддающееся лечению воспаление, пиелит, эндартериальную гиперплазию, пептическую язву, вальвулит и эндометриоз. Такие заболевания рассматривают в настоящем документе как подлежащие лечению посредством введения антител, которые связываются с поверхностным маркером B-клеток, таким как CD22, а лечение включает введение неконъюгированного ("свободного") антитела или антитела, конъюгированного с цитотоксическим средством, как описано в настоящем документе. Такие заболевания также рассматривают в настоящем документе как подлежащие лечению посредством комбинированного лечения, включающего антитело к CD22 или конъюгат антитела к CD22-лекарственное средство по изобретению в сочетании с другим антителом или конъюгатом антитело-лекарственное средство, другим цитотоксическим средством, радиацией или другим лекарственным средством, вводимым одновременно или последовательно.
Как применяют в настоящем документе, "лечение" (и варианты, такие как "лечить" или "подвергать лечению") относится к клиническому вмешательству с целью изменения естественного течения заболевания у индивидуума или изменения клетки, подвергаемой лечению, и его можно проводить или для профилактики или в течение клинического патологического процесса. Желательные эффекты лечения включают предотвращение возникновения или рецидива заболевания, облегчения симптомов, уменьшение любых прямых или непрямых патологических последствий заболевания, предотвращение метастазирования, снижение скорости прогрессирования заболевания, облегчение или временное ослабление состояния при заболевании и ремиссию или улучшенный прогноз. В некоторых вариантах осуществления антитела по изобретению используют для задержки развития заболевания или нарушения или для замедления прогрессирования заболевания или нарушения.
"Индивидуум" представляет собой позвоночное. В определенных вариантах осуществления позвоночное представляет собой млекопитающее. Млекопитающие включают в качестве неограничивающих примеров сельскохозяйственных животных (таких как коровы), спортивных животных, домашних животных (таких как коровы, собаки и лошади), приматов, мышей и крыс. В определенных вариантах осуществления млекопитающее представляет собой человека.
"Эффективное количество" относится к количеству, эффективному при дозировках и в течение периодов времени, необходимых для достижения желаемого терапевтического или профилактического результата.
"Терапевтически эффективное количество" вещества/молекулы по изобретению может варьировать в зависимости от таких факторов, как стадия заболевания, возраст, пол и масса индивидуума, и способности вещества/молекулы вызывать желаемый ответ у индивидуума. Терапевтически эффективное количество включает количество, при котором любые токсические или вредные эффекты вещества/молекулы перевешиваются терапевтически положительным воздействием. "Профилактически эффективное количество" относится к количеству, эффективному при дозировках и в течение периодов времени, необходимых для достижения желаемого профилактического результата. Как правило, но необязательно, так как профилактическую дозу используют у субъектов до или на ранней стадии заболевания, профилактически эффективное количество будет меньшим, чем терапевтически эффективное количество.
Как применяют в настоящем документе, термин "цитотоксическое средство" относится к веществу, которое ингибирует или предотвращает функцию клеток и/или вызывает гибель или разрушение клеток. Термин предназначен для включения радиоактивных изотопов (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu), химиотерапевтических средств (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин C, хлорамбуцил, даунорубицин или другие интеркаляторы, ферменты и их фрагменты, такие как нуклеазы, антибиотики и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты, токсины, ингибирующие рост средства, молекулы лекарственных средств и различные противоопухолевые или противораковые средства, описанные ниже. Ниже описаны другие цитотоксические средства. Противоопухолевое средство вызывает разрушение опухолевых клеток.
"Токсин" представляет собой любое вещество, способное оказывать разрушительное действие на рост или пролиферацию клетки.
"Химиотерапевтическое средство" представляет собой химическое соединение, пригодное для лечения злокачественной опухоли. Примеры химиотерапевтических средств включают алкилирующие средства, такие как тиотепа и циклофосфамид CYTOXAN® (цитоксан®); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; ацетогенины (особенно буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL® (маринол®)); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (включая синтетический аналог топотекан (HYCAMTIN® (гикамтин®)), CPT-11 (иринотекан, CAMPTOCAR® (камптосар®)), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (особенно криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и CB1-TM1); элеутеробин; панкретистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлоретамин, гидрохлорид оксида мехлоретамина, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урациловый иприт; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как ендииновые антибиотики (например, калихимицин, особенно калихимицин гамма1I и калихимицин омегаI1 (см., например, Agnew, Chem. Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин A; эсперамицин; а также неокарциностатиновый хромофор и родственные хромопротеиновые ендииновые антибиотические хромофоры), аклациномицины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин ADRIAMYCIN® (включая морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, порфиромицин, пиромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; антиадреналиновые средства, такие как аминоглютетимид, митотан, трилостан; компенсаторы фолиевой кислоты, такие как фролиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновую кислоту; енилурацил; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколцин; диазиквон; эльфорнитин; ацетат эллиптиния; эпофилон; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лонидамин; майтанзиноиды, такие как майтанзин и анзамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2"-трихлортриэтиламин; трихотецены (особенно токсин T-2, верракурин A, роридин A и ангуидин); уретан; виндезин (ELDISINE®, FILDESIN®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); тиотепа; таксоиды, например, паклитаксел TAXOL® (Bristol-Myers Squibb Oncology, Princeton, N.J.), ABRAXANE™ без кремофора, сконструированный с альбумином наночастичный препарат паклитаксела (American Pharmaceutical Partners, Schaumberg, Illinois) и доцетаксел TAXOTERE® (Rhone-Poulenc Rorer, Antony, France); хлоранбуцил; гемцитабин (GEMZAR®); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (VELBAN®); платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ONCOVIN®); оксалиплатин; лейкововин; винорелбин (NAVELBINE®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин (XELODA®); фармацевтически приемлемые соли, кислоты или производные любого из указанного выше; а также сочетания двух или более из указанных выше, такие как CHOP, сокращение для комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном, и FOLFOX, сокращение для схемы лечения оксалиплатином (ELOXATIN™) в сочетании с 5-FU и лейкововином.
Также в это определение включены противогормональные средства, которые действуют для регуляции, снижения, блокирования или ингибирования действия гормонов, которые могут стимулировать рост злокачественной опухоли и их часто назначают в форме системного или общего лечения. Они могут представлять собой сами гормоны. Примеры включают антиэстрогены и селективные модуляторы эстрогеновых рецепторов (SERM), включая, например, тамоксифен (включая тамоксифен NOLVADEX®), ралоксифен EVISTA®, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон, и торемифен FARESTON®; противопрогестероновые средства; негативные регуляторы эстрогеновых рецепторов (ERD); средства, функционирующие с подавлением или выключением яичников, например, агонисты релизинг-фактор лютеинизирующего гормона (LHRH), такие как ацетат лейпролида LUPRON® и ELIGARD®, ацетат гозерелина, ацетат бузерилина и триптерелин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, которые ингибируют фермент ароматазу, регулирующую продукцию эстрогенов в надпочечниках, например, такие как 4(5)-имидазолы, аминоглутетимид, ацетат мегестрола MEGASE®, экземестан AROMASIN®, форместанин, фадрозол, ворозол RIVISOR®, летрозол FEMARA® и анастрозол ARIMIDEX®. Кроме того, такое определение химиотерапевтических средств включает бисфосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), этидронат DIDROCAL®, NE-58095, золедроновая кислота/золедронат ZOMETA®, алендронат FOSAMAX®, памидронат AREDIA®, тилудронат SKELID® или ризедронат ACTONEL®; а также троксацитабин (1,3-диоксолановый аналог нуклеозида цитозина); антисмысловые олигонуклеотиды, особенно такие, которые ингибируют экспрессию генов в пути передачи сигнала, вовлеченном в аберантной клеточной пролиферации, например, такие как PKC-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина THERATOPE® и генотерапевтические вакцины, например, вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; ингибитор топоизомеразы 1 LURTOTECAN®; ABARELIX® rmRH; дитозилат лапатиниба (низкомолекулярный ингибитор двух тирозинкиназ ErbB-2 и EGFR, также известный как GW572016); и фармацевтически приемлемые соли, кислоты или производные любого из указанного выше.
"Ингибирующее рост средство" при использовании в данном документе относится к соединению или композиции, которые ингибируют рост клетки (такой как клетка, экспрессирующая CD22) in vitro или in vivo. Таким образом, ингибирующее рост средство может представлять собой средство, которое значительно снижает процент клеток (таких как клетки, экспрессирующие CD22) в S-фазе. Примеры ингибирующих рост средств включают средства, которые блокируют прохождение клеточного цикла (в месте, отличном от S-фазы), такие как средства, индуцирующие арест в G1 и арест в фазе M. Классические блокаторы M-фазы включают барвинок (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Те же средства, которые осуществляют арест в G1, также дают побочным результатом арест в S-фазе, например, алкилирующие ДНК средства, такие как тамоксифен, преднизон, дакарбазин, мехлоретамин, цисплатин, метотрексат, 5-фторурацил и ara-C. Дополнительную информацию можно найти в The Molecular Basis of Cancer, Mendelsohn and Israel, eds., Chapter 1, entitled "Cell cycle regulation, oncogenes, and antineoplastic drugs", Murakami et al., (WB Saunders: Philadelphia, 1995), особенно на стр.13. Таксаны (паклитаксел и доцетаксел) представляют собой противораковые лекарственные средства, полученные из тисового дерева. Доцетаксел (TAXOTERE®, Rhone-Poulenc Rorer), полученный из европейского тиса, представляет собой полусинтетический аналог паклитаксела (TAXOL®, Bristol-Myers Squibb). Паклитаксел и доцетаксел стимулируют сборку микротрубочек из димеров тубулина и стабилизируют микротрубочки, предотвращая деполимеризацию, что приводит к ингибированию митоза в клетках.
Термин "внутриклеточный метаболит" относится к соединению, являющемуся результатом метаболического процесса или метаболической реакции внутри клетки из конъюгата антитело-лекарственное средство (ADC). Метаболический процесс или метаболическая реакция могут представлять собой ферментативный процесс, такой как протеолитическое отщепление пептидного линкера ADC или гидролиз функциональной группы, такой как гидразон, сложный эфир или амид. Внутриклеточные метаболиты включают в качестве неограничивающих примеров антитела и свободное лекарственное средство, которое претерпевает внутриклеточное расщепление после вхождения, диффузии, захвата или транспорта в клетку.
Термины "внутриклеточно отщепленный" и "внутриклеточное отщепление" относятся к метаболическому процессу или реакции внутри клетки с конъюгатом антитело-лекарственное средство (ADC), посредством которого разрушается ковалентное соединение, т.е. линкер, между молекулой лекарственного средства (D) и антителом (Ab), что приводит к отделению свободного лекарственного средства от антитела внутри клетки. Таким образом, отщепленные группы ADC являются внутриклеточными метаболитами.
Термин "биодоступность" относится к системной доступности (т.е. уровни в крови/плазме) данного количества лекарственного средства, вводимого пациенту. Биодоступность представляет собой безусловный термин, который означает измерение времени (скорости) и общего количества (величины) лекарственного средства, которое достигает общего кровотока из введенной лекарственной формы.
Термин "цитотоксическая активность" относится к уничтожающему клетки, цитостатическому или ингибирующему рост действию конъюгата антитело-лекарственное средство или внутриклеточного метаболита конъюгата антитело-лекарственное средство. Цитотоксическую активность можно выразить как значение IC50, которое представляет собой концентрацию (молярную или массовую) на единицу объема, при которой выживает половина клеток.
"Алкил" представляет собой C1-C18-углеводород, содержащий нормальные, вторичные, третичные или циклические атомы углерода. Примеры представляют собой метил (Me, -CH3), этил (Et, -CH2CH3), 1-пропил (n-Pr, н-пропил, -CH2CH2CH3), 2-пропил (i-Pr, изопропил, -CH(CH3)2), 1-бутил (n-Bu, н-бутил, -CH2CH2CH2CH3), 2-метил-1-пропил (i-Bu, изобутил, -CH2CH(CH3)2), 2-бутил (s-Bu, втор-бутил, -CH(CH3)CH2CH3), 2-метил-2-пропил (t-Bu, трет-бутил, -C(CH3)3), 1-пентил (н-пентил, -CH2CH2CH2CH2CH3), 2-пентил (-CH(CH3)CH2CH2CH3), 3-пентил (-CH(CH2CH3)2), 2-метил-2-бутил (-C(CH3)2CH2CH3), 3-метил-2-бутил (-CH(CH3)CH(CH3)2), 3-метил-1-бутил (-CH2CH2CH(CH3)2), 2-метил-1-бутил (-CH2CH(CH3)CH2CH3), 1-гексил (-CH2CH2CH2CH2CH2CH3), 2-гексил (-CH(CH3)CH2CH2CH2CH3), 3-гексил (-CH(CH2CH3)(CH2CH2CH3)), 2-метил-2-пентил (-C(CH3)2CH2CH2CH3), 3-метил-2-пентил (-CH(CH3)CH(CH3)CH2CH3), 4-метил-2-пентил (-CH(CH3)CH2CH(CH3)2), 3-метил-3-пентил (-C(CH3)(CH2CH3)2), 2-метил-3-пентил (-CH(CH2CH3)CH(CH3)2), 2,3-диметил-2-бутил (-C(CH3)2CH(CH3)2), 3,3-диметил-2-бутил (-CH(CH3)C(CH3)3.
Как применяют в настоящем документе, термин "C1-C8-алкил" относится к насыщенному или ненасыщенному углеводороду с прямолинейной или разветвленной цепью с количеством атомов углерода от 1 до 8. Репрезентативные "C1-C8-алкильные" группы включают в качестве неограничивающих примеров -метил, -этил, -н-пропил, -н-бутил, -н-пентил, -н-гексил, -н-гептил, -н-октил, -н-нонил и -н-децил; тогда как разветвленные C1-C8-алкилы включают в качестве неограничивающих примеров -изопропил, -втор-бутил, -изобутил, -трет-бутил, -изопентил, 2-метилбутил, ненасыщенные C1-C8-алкилы включают в качестве неограничивающих примеров -винил, -аллил, -1-бутенил, -2-бутенил, -изобутиленил, -1-пентенил, -2-пентенил, -3-метил-1-бутенил, -2-метил-2-бутенил, -2,3-диметил-2-бутенил, 1-гексил, 2-гексил, 3-гексил, -ацетиленил, -пропинил, -1-бутинил, -2-бутинил, -1-пентинил, -2-пентинил, -3-метил-1-бутинил, метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, изогексил, 2-метилпентил, 3-метилпентил, 2,2-диметилбутил, 2,3-диметилбутил, 2,2-диметилпентил, 2,3-диметилпентил, 3,3-диметилпентил, 2,3,4-триметилпентил, 3-метилгексил, 2,2-диметилгексил, 2,4-диметилгексил, 2,5-диметилгексил, 3,5-диметилгексил, 2,4-диметилпентил, 2-метилгептил, 3-метилгептил, н-гептил, изогептил, н-октил и изооктил. C1-C8-алкильная группа может быть незамещенной или замещенной одной или несколькими группами, включающими в качестве неограничивающих примеров -C1-C8-алкил, -O-(C1-C8-алкил), -арил, -C(O)R', -OC(O)R', -C(O)OR', -C(O)NH2, -C(O)NHR', -C(O)N(R')2 -NHC(O)R', -SO3R', -S(O)2R', -S(O)R', -OH, -галоген, -N3, -NH2, -NH(R'), -N(R')2 и -CN; где каждый R' независимо выбран из H, -C1-C8-алкила и арила.
"Алкенил" представляет собой C2-C18-углеводород, содержащий нормальные, вторичные, третичные или циклические атомы углерода, по меньшей мере, с одним участком ненасыщенности, т.е. двойной связью sp2 углерод-углерод. Примеры включают в качестве неограничивающих примеров этилен или винил (-CH=CH2), аллил (-CH2CH=CH2), циклопентенил (-C5H7) и 5-гексенил (-CH2CH2CH2CH2CH=CH2).
"Алкинил" представляет собой C2-C18-углеводород, содержащий нормальные, вторичные, третичные или циклические атомы углерода, по меньшей мере, с одним участком ненасыщенности, т.е. тройной связью sp углерод-углерод. Примеры включают в качестве неограничивающих примеров ацетилен (-C=CH) и пропаргил (-CH2C=CH).
"Алкилен" относится к насыщенному, разветвленному или прямолинейному или циклическому углеводородному радикалу из 1-18 атомов углерода и обладающему двумя моновалентными радикальными центрами, образующимися при удалении двух атомов водорода от одного и того же или двух различных атомов углерода в исходном алкане. Типичные алкиленовые радикалы включают в качестве неограничивающих примеров метилен (-CH2-), 1,2-этил (-CH2CH2-), 1,3-пропил (-CH2CH2CH2-), 1,4-бутил (-CH2CH2CH2CH2-) и т.п.
"C1-C10-алкилен" представляет собой прямолинейную насыщенную углеводородную группу формулы -(CH2)1-10-. Примеры C1-C10-алкилена включают метилен, этилен, пропилен, бутилен, пентилен, гексилен, гептилен, октилен, нонилен и декален.
"Алкенилен" относится к ненасыщенному разветвленному или неразветвленному углеводородному радикалу из 2-18 атомов углерода и обладающему двумя моновалентными радикальными центрами, образующимися при удалении двух атомов водорода от одного и того же или двух различных атомов углерода в исходном алкене. Типичные алкениленовые радикалы включают в качестве неограничивающих примеров 1,2-этилен (-CH=CH-).
"Алкинилен" относится к ненасыщенному, разветвленному или неразветвленному углеводородному радикалу из 2-18 атомов углерода и обладающему двумя моновалентными радикальными центрами, образующимися при удалении двух атомов водорода от одного и того же или двух различных атомов углерода в исходном алкине. Типичные алкиниленовые радикалы включают в качестве неограничивающих примеров ацетилен (-С≡C-), пропаргил (-CH2C≡C-) и 4-пентинил (-CH2CH2CH2C≡C-).
"Арил" относится к карбоциклической ароматической группе. Примеры арильных групп включают в качестве неограничивающих примеров фенил, нафтил и антраценил. Карбоциклическая ароматическая группа или гетероциклическая ароматическая группа может быть незамещенной или замещенной одной или несколькими группами, включающими в качестве неограничивающих примеров -C1-C8-алкил, -O-(C1-C8-алкил), -арил, -C(O)R', -OC(O)R', -C(O)OR', -C(O)NH2, -C(O)NHR', -C(O)N(R')2-NHC(O)R', -S(O)2R', -S(O)R', -OH, -галоген, -N3, -NH2, -NH(R'), -N(R')2 и -CN; где каждый R' независимо выбран из H, -C1-C8-алкила и арила.
"Арилен" представляет собой арильную группу, которая обладает двумя ковалентными связями и может находиться в орто-, мета- или пара-конфигурациях, как показано на следующих структурах:

в которых фенильная группа может быть незамещенной или замещенной до 4 группами, включая в качестве неограничивающего примера -C1-C8-алкил, -O-(C1-C8-алкил), -арил, -C(O)R', -OC(O)R', -C(O)OR', -C(O)NH2, -C(O)NHR', -C(O)N(R')2-NHC(O)R', -S(O)2R', -S(O)R', -OH, -галоген, -N3, -NH2, -NH(R'), -N(R')2 и -CN; где каждый R' независимо выбран из H, -C1-C8-алкила и арила.
"Арилалкил" относится к ациклическому алкильному радикалу, в котором один из атомов водорода, связанных с атомом углерода, как правило, с концевым или sp3-атомом углерода, замещен арильным радикалом. Типичные арилалкильные группы включают в качестве неограничивающих примеров бензил, 2-фенилэтан-1-ил, 2-фенилэтен-1-ил, нафтилметил, 2-нафтилэтан-1-ил, 2-нафтилэтен-1-ил, нафтобензил, 2-нафтофенилэтан-1-ил и т.п. Арилалкильная группа содержит от 6 до 20 атомов углерода, например, алкильная группа, включая алканильную, алкенильную или алкинильную группы, арилалкильная группа состоит из 1-6 атомов углерода, а арильная группа состоит из 5-14 атомов углерода.
"Гетероарилалкил" относится к ациклическому алкильному радикалу, в котором один из атомов водорода, связанных с атомом углерода, как правило, с концевым или sp3-атомом углерода, замещен гетероарильным радикалом. Типичные гетероарилалкильные группы включают в качестве неограничивающих примеров 2-бензимидазолилметил, 2-фурилэтил и т.п. Гетероарилалкильная группа содержит от 6 до 20 атомов углерода, например, алкильная группа, включая алканильную, алкенильную или алкинильную группы, гетероарилалкильная группа состоит из 1-6 атомов углерода, а гетероарильная группа состоит из 5-14 атомов углерода и из 1-3 гетероатомов, выбранных из N, O, P и S. Гетероарильная группа гетероарилалкильной группы может представлять собой моноцикл с количеством кольцевых членов от 3 до 7 (от 2 до 6 атомов углерода) или бицикл с количеством кольцевых членов от 7 до 10 (от 4 до 9 атомов углерода и от 1 до 3 гетероатомов, выбранных из N, O, P и S), например, система бицикло [4,5], [5,5], [5,6] или [6,6].
"Замещенный алкил", "замещенный арил" и "замещенный арилалкил" означают алкил, арил и арилалкил, соответственно, в которых один или несколько атомов водорода, каждый независимо, замещены заместителем. Типичные заместители включают в качестве неограничивающих примеров -X, -R, -O-, -OR, -SR, -S-, -NR2, -NR3, =NR, -CX3, -CN, -OCN, -SCN, -N=C=O, -NCS, -NO, -NO2, =N2, -N3, NC(=O)R, -C(=O)R, -C(=O)NR2, -SO3-, -SO3H, -S(=O)2R, -OS(=O)2OR, -S(=O)2NR, -S(=O)R, -OP(=O)(OR)2, -P(=O)(OR)2, -PO3-, -PO3H2, -C(=O)R, -C(=O)X, -C(=S)R, -CO2R, -CO2-, -C(=S)OR, -C(=O)SR, -C(=S)SR, -C(=O)NR2, -C(=S)NR2, -C(=NR)NR2, где каждый из X независимо представляет собой галоген: F, Cl, Br или I; а каждый R независимо представляет собой -H, C2-C18-алкил, C6-C20-арил, C3-C14-гетероцикл, защитная группа или молекула пролекарственного средства. Алкиленовая, алкениленовая и алкиниленовая группы, как описано выше, также могут быть замещены подобным образом.
"Гетероарил" и "гетероцикл" относятся к циклической системе, в которой один или несколько кольцевых атомов являются гетероатомами, например, азотом, кислородом и серой. Гетероциклический радикал содержит от 1 до 20 атомов углерода и от 1 до 3 гетероатомов, выбранных из N, O, P и S. Гетероцикл может представлять собой моноцикл с количеством кольцевых членов от 3 до 7 (от 2 до 6 атомов углерода и от 1 до 3 гетероатомов, выбранных из N, O, P и S) или бицикл с количеством кольцевых членов от 7 до 10 (от 4 до 9 атомов углерода и от 1 до 3 гетероатомов, выбранных из N, O, P и S), например, система бицикло [4,5], [5,5], [5,6] или [6,6].
Гетероциклы описаны в Paquette, Leo A.; "Principles of Modern Heterocyclic Chemistry" (W.A. Benjamin, New York, 1968), конкретно в главах 1, 3, 4, 6, 7 и 9; "The Chemistry of Heterocyclic Compounds, A series of Monographs" (John Wiley & Sons, New York, с 1950 до настоящего времени), в конкретных томах 13, 14, 16, 19 и 28; и J. Am. Chem. Soc. (1960) 82:5566.
Примеры гетероциклов включают в качестве примера, а не ограничения, пиридил, дигидропиридил, тетрагидропиридил (пиперидил), тиазолил, тетрагидротиофенил, окисленный серой тетрагидротиофенил, пиримидинил, фуранил, тиенил, пирролил, пиразолил, имидазолил, тетразолил, бензофуранил, тианафталинил, индолил, индоленил, хинолинил, изохинолинил, бензимидазолил, пиперидинил, 4-пиперидонил, пирролидинил, 2-пирролидонил, пирролинил, тетрагидрофуранил, бис-тетрагидрофуранил, тетрагидропиранил, бис-тетрагидропиранил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидрохинолинил, октагидроизохинолинил, азоцинил, триазинил, 6H-1,2,5-тиадизинил, 2H,6H-1,5,2-дитиазинил, тиенил, тиантренил, пиранил, изобензофуранил, хроменил, ксантенил, феноксатинил, 2H-пирролил, изотиазолил, изоксазолил, пиразинил, пиридазинил, индолизинил, изоиндолил, 3H-индолил, 1H-индазолил, пуринил, 4H-хинолизинил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, циннолинил, птеридинил, 4aH-карбазолил, карбазолил, β-карболинил, фенантридинил, акридинил, пиримидинил, фенантролинил, феназинил, фенотиазинил, фуразанил, феноксазинил, изохроманил, хроманил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперазинил, индолинил, изоиндолинил, хинуклидинил, морфолинил, оксазолидинил, бензотриазолил, бензизоксазолил, охиндолил, бензоксазолинил и изатиноил.
В качестве примера, а не ограничения, связанные по углероду гетероциклы связаны в положении 2, 3, 4, 5 или 6 пиридина, положении 3, 4, 5 или 6 пиридазина, положении 2, 4, 5 или 6 пиримидина, положении 2, 3, 5 или 6 пиразина, положении 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофурана, тиофена, пиррола или тетрагидропиррола, положении 2, 4 или 5 оксазола, имидазола или тиазола, положении 3, 4 или 5 изоксазола, пиразола или изотиазола, положении 2 или 3 азиридина, положении 2, 3 или 4 азетидина, положении 2, 3, 4, 5, 6, 7 или 8 хинолина или положении 1, 3, 4, 5, 6, 7 или 8 изохинолина. Даже более типично, связанные по углероду гетероциклы включают 2-пиридил, 3-пиридил, 4-пиридил, 5-пиридил, 6-пиридил, 3-пиридазинил, 4-пиридазинил, 5-пиридазинил, 6-пиридазинил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 6-пиримидинил, 2-пиразинил, 3-пиразинил, 5-пиразинил, 6-пиразинил, 2-тиазолил, 4-тиазолил или 5-тиазолил.
В качестве примера, а не ограничения, связанные по азоту гетероциклы связаны в положении 1 азиридина, азетидина, пиррола, пирролидина, 2-пирролина, 3-пирролина, имидазола, имидазолидина, 2-имидазолина, 3-имидазолина, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина, пиперазина, индола, индолина, 1H-индазола, положении 2 изоиндола или изоиндолина, положении 4 морфолина и положении 9 карбазола или β-карболина. Даже более типично, связанные по азоту гетероциклы включают 1-азиридил, 1-азетедил, 1-пирролил, 1-имидазолил, 1-пиразолил и 1-пиперидинил.
"C3-C8-гетероцикл" относится к ароматическому или неароматическому C3-C8 карбоциклу, в котором от одного до четырех циклических атомов углерода независимо замещены гетероатомом из группы, состоящей из O, S и N. Репрезентативные примеры C3-C8-гетероцикла включают в качестве неограничивающих примеров бензофуранил, бензотиофен, индолил, бензопиразолил, кумаринил, изохинолинил, пирролил, тиофенил, фуранил, тиазолил, имидазолил, пиразолил, триазолил, хинолинил, пиримидинил, пиридинил, пиридонил, пиразинил, пиридазинил, изотиазолил, изоксазолил и тетразолил. C3-C8-гетероцикл может быть незамещенным или замещенным группами в количестве до семи, включая в качестве неограничивающих примеров, -C1-C8-алкил, -O-(C1-C8-алкил), -арил, -C(O)R', -OC(O)R', -C(O)OR', -C(O)NH2, -C(O)NHR', -C(O)N(R')2 -NHC(O)R', -S(O)2R', -S(O)R', -OH, -галоген, -N3, -NH2, -NH(R'), -N(R')2 и -CN; где каждый R' независимо выбран из H, -C1-C8-алкила и арила.
"C3-C8-гетероцикло" относится к C3-C8-гетероциклической группе, определенной выше, где один из атомов водорода гетероциклической группы замещен связью. C3-C8-гетероцикло может быть незамещенной или замещенной группами в количестве до шести, включая в качестве неограничивающих примеров, -C1-C8-алкил, -O-(C1-C8-алкил), -арил, -C(O)R', -OC(O)R', -C(O)OR', -C(O)NH2, -C(O)NHR', -C(O)N(R')2 -NHC(O)R', -S(O)2R', -S(O)R', -OH, -галоген, -N3, -NH2, -NH(R'), -N(R')2 и -CN; где каждый R' независимо выбран из H, -C1-C8-алкила и арила.
"Карбоцикл" означает насыщенную или ненасыщенную циклическую систему с количеством атомов углерода от 3 до 7 в виде моноцикла или с количеством атомов углерода от 7 до 12 в виде бицикла. Моноциклические карбоциклы содержат от 3 до 6 циклических атомов, даже более типично - 5 или 6 циклических атомов. Бициклические карбоциклы содержат от 7 до 12 циклических атомов, например, расположенных в виде системы бицикло [4,5], [5,5], [5,6] или [6,6], или 9 или 10 циклических атомов, расположенных в виде системы бицикло [5,6] или [6,6]. Примеры моноциклических углеродных циклических систем включают циклопропил, циклобутил, циклопентил, 1-циклопент-1-енил, l-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-1-енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил, циклогептил и циклооктил.
"C3-C8-карбоцикл" представляет собой 3-, 4-, 5-, 6-, 7- или 8-членную насыщенную или ненасыщенную неароматическую карбоциклическую кольцевую систему. Репрезентативные C3-C8-карбоциклы включают в качестве неограничивающих примеров -циклопропил, -циклобутил, -циклопентил, -циклопентадиенил, -циклогексил, -циклогексенил, -1,3-циклогексадиенил, -1,4-циклогексадиенил, -циклогептил, -1,3-циклогептадиенил, -1,3,5-циклогептатриенил, -циклооктил и -циклооктадиенил. Группа C3-C8-карбоцикла может быть незамещенной или замещенной одной или несколькими группами, включающими в качестве неограничивающих примеров -C1-C8-алкил, -O-(C1-C8-алкил), -арил, -C(O)R', -OC(O)R', -C(O)OR', -C(O)NH2, -C(O)NHR', -C(O)N(R')2 -NHC(O)R', -S(O)2R', -S(O)R', -OH, -галоген, -N3, -NH2, -NH(R'), -N(R')2 и -CN; где каждый R' независимо выбран из H, -C1-C8-алкила и арила.
"C3-C8-карбоцикло" относится к группе C3-C8-карбоцикла определенной выше, где один из атомов водорода группы карбоцикла замещен связью.
"Линкер" относится к химической группе, содержащей ковалентную связь или цепь атомов, которые ковалентно присоединяют антитело к молекуле лекарственного средства. В различных вариантах осуществления линкеры включают двухвалентный радикал, такой как алкилдиил, арилдиил, гетероарилдиил, группы, такие как -(CR2)nO(CR2)n-, повторяющиеся единицы алкилокси (например, полиэтиленокси, PEG, полиметиленокси) и алкиламино (например, полиэтиленамино, Jeffamine™); и сложные эфиры и амиды двухосновных кислот, включая сукцинат, сукцинамид, дигликолат, малонат и капроамид.
Термин "хиральный" относится к молекулам, которые обладают свойством несовместимости со своим зеркальным отображением, тогда как термин "ахиральный" относится к молекулам, которые являются совместимыми со своим зеркальным отображением.
Термин "стереоизомеры" относится к соединениям, которые обладают одинаковым химическим составом, но отличаются по расположению атомов или групп в пространстве.
"Диастереомер" относится к стереоизомеру с двумя или более центрами хиральности и молекулы которого не являются зеркальными отражениями друг друга. Диастереомеры обладают различными физическими свойствами, например температурой плавления, температурой кипения, спектральными свойствами и реактивностями. Смеси диастереомеров можно разделять аналитическими способами с высоким разрешением, такими как электрофорез и хроматография.
"Энантиомеры" относятся к стереоизомерам соединений, которые являются неналагающимися зеркальными изображениями друг друга.
Стереохимические определения и соглашения, используемые в настоящем документе, в основном согласуются с S.P.Parker, Ed., McGraw-Hill Dictionary of Chemical Terms (1984) McGraw-Hill Book Company, New York; и Eliel, E. and Wilen, S., Stereochemistry of Organic Compounds (1994) John Wiley & Sons, Inc., New York. Многие органические соединения существуют в оптически активных формах, т.е. они обладают способностью вращать плоскость плоскополяризованного света. При описании оптически активного соединения для обозначения абсолютной конфигурации молекулы рядом с ее хиральным центром(ами) используют префиксы D и L или R и S. Префиксы d и l или (+) и (-) используют для обозначения знака вращения плоскополяризованного света соединением, где (-) или l означает, что соединение является левовращающим. Соединение с префиксом (+) или d является правовращающим. Для данной химической структуры эти стереоизомеры являются идентичными за исключением того, что они являются зеркальными отображениями друг друга. Конкретный стереоизомер также можно обозначить как энантиомер, а смесь таких изомеров часто называют энантиомерной смесью. Смесь энантиомеров 50:50 обозначают как рацемическую смесь или рацемат, который может образовываться, когда при химической реакции или процессе нет стереоселективности или стереоспецифичности. Термины "рацемическая смесь" и "рацемат" относятся к эквимолярной смеси двух энантиомерных молекул, лишенной оптической активности.
"Уходящая группа" относится к функциональной группе, которую можно замещать другой функциональной группой. В данной области хорошо известны некоторые уходящие группы, а примеры включают в качестве неограничивающих примеров галогениды (например, хлорид, бромид, йодид), метансульфонил (мезил), п-толуолсульфонил (тозил), трифторметилсульфонил (трифлат) и трифторметилсульфонат.
Сокращения
ЛИНКЕРНЫЕ КОМПОНЕНТЫ:
MC = 6-малеимидокапроил
Val-Cit или "vc" = валин-цитруллин (иллюстративный дипептид в расщепляемом протеазой линкере)
Цитруллин = 2-амино-5-уреидопентановая кислота
PAB = п-аминобензилоксикарбонил (пример "саморазрушающегося" линкерного компонента)
Me-Val-Cit = N-метил-валин-цитруллин (где линкерная пептидная связь модифицирована для предотвращения ее расщепления катепсином B)
MC(PEG)6-OH = малеимидокапроил-полиэтиленгликоль (может быть присоединен к цистеинам антитела)
SPP = N-сукцинимидил-4-(2-пиридилтио)пентаноат
SPDP = N-сукцинимидил-3-(2-пиридилдитио)пропионат
SMCC = сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат
IT = иминотиолан
ЦИТОТОКСИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА:
MMAE = монометилауристатин E (MW 718)
MMAF = вариант ауристатина E (MMAE) с фенилаланином на C-конце лекарственного средства (MW 731,5)
MMAF-DMAEA = MMAF с DMAEA (диметиламиноэтиламин) в амидной связи с C-концевым фенилаланином (MW 801,5)
MMAF-TEG = MMAF с тетраэтиленгликолем, находящимся в сложноэфирной связи с фенилаланином
MMAF-NtBu = N-трет-бутил, присоединенный в виде амида к C-концу MMAF
DM1 = N(2')-деацетил-N(2')-(3-меркапто-1-оксопропил)майтанзин
DM3 = N(2')-деацетил-N2-(4-меркапто-1-оксопентил)майтанзин
DM4 = N(2')-деацетил-N2-(4-меркапто-4-метил-1-оксопентил)майтанзин.
Дополнительные сокращения представляют собой следующее: AE представляет собой ауристатин E, Boc представляет собой N-(трет-бутоксикарбонил), cit представляет собой цитруллин, dap представляет собой долапроин, DCC представляет собой 1,3-дициклогексилкарбодиимид, DCM представляет собой дихлорметан, DEA представляет собой диэтиламин, DEAD представляет собой диэтилазодикарбоксилат, DEPC представляет собой диэтилфосфорилцианидат, DIAD представляет собой диизопропилазодикарбоксилат, DIEA представляет собой N,N-диизопропилэтиламин, dil представляет собой долаизолейцин, DMA представляет собой диметилацетамид, DMAP представляет собой 4-диметиламинопиридин, DME представляет собой диметиловый эфир этиленгликоля (или 1,2-диметоксиэтан), DMF представляет собой N,N-диметилформамид, DMSO представляет собой диметилсульфоксид, doe представляет собой долафенин, dov представляет собой N,N-диметилвалин, DTNB представляет собой 5,5'-дитиобис(2-нитробензойную кислоту), DTPA представляет собой диэтилентриаминпентауксусную кислоту, DTT представляет собой дитиотреитол, EDCI представляет собой гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида, EEDQ представляет собой 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, ES-MS представляет собой электроспрейную масс-спектрометрию, EtOAc представляет собой этилацетат, Fmoc представляет собой N-(9-флуоренилметоксикарбонил), gly представляет собой глицин, HATU представляет собой гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония, HOBt представляет собой 1-гидроксибензотриазол, ВЭЖХ представляет собой высокоэффективную жидкостную хроматографию, ile представляет собой изолейцин, lys представляет собой лизин, MeCN (CH3CN) представляет собой ацетонитрил, MeOH представляет собой метанол, Mtr представляет собой 4-анизилдифенилметил (или 4-метокситритил), nor представляет собой (1S,2R)-(+)-норэфедрин, PBS представляет собой фосфатно-солевой буфер (pH 7,4), PEG представляет собой полиэтиленгликоль, Ph представляет собой фенил, Pnp представляет собой п-нитрофенил, MC представляет собой 6-малеимидокапроил, phe представляет собой L-фенилаланин, PyBrop представляет собой гексафторфосфат бром-трис-пирролидинфосфония, SEC представляет собой эксклюзионную хроматографию, Su представляет собой сукцинимид, TFA представляет собой трифторуксусную кислоту, TLC представляет собой тонкослойную хроматографию, UV представляет собой ультрафиолет и val представляет собой валин.
КОМПОЗИЦИИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ
Изобретение относится к антителам, которые связывают CD22. Также к иммуноконъюгатам, содержащим анти-CD22 антитела. Антитела и иммуноконъюгаты по изобретению могут использоваться, например, для диагностики или лечения расстройств, связанных с измененной экспрессией, например повышенной экспрессией, CD22. В конкретных вариантах осуществления антитела или иммуноконъюгаты по настоящему изобретению могут использоваться для диагностики или лечения расстройств, связанных с нарушением клеточной пролиферации, например, злокачественных опухолей.
Анти-CD22 антитела
В одном из аспектов изобретение относится к антителам, связывающимся с CD22. В некоторых вариантах осуществления предоставлены антитела, которые связываются со взрослой формой CD22 человека и яванского макака (cyno). В одном таком варианте осуществления зрелая форма CD22 человека обладает аминокислотной последовательностью SEQ ID NO: 27. Основная зрелая изоформа человека содержит внеклеточный домен, содержащий семь Ig-подобных доменов, и имеет аминокислотную последовательность SEQ ID NO: 28. В другом варианте осуществления минорная изоформа CD22 человека с отсутствующими внеклеточными доменами 3 и 4 имеет аминокислотную последовательность SEQ ID NO: 29. Аминокислотная последовательность внеклеточного домена минорной изоформы представляет собой SEQ ID NO: 30. CD22 cyno имеет аминокислотную последовательность SEQ ID NO: 31. В некоторых вариантах осуществления антитело к CD22 связывается со зрелой формой CD22, экспрессируемой на клеточной поверхности. В некоторых вариантах осуществления антитело, связывающееся со зрелой формой CD22, экспрессируемой на клеточной поверхности, ингибирует рост клетки. В некоторых вариантах осуществления антитело к CD22 связывается со зрелой формой CD22, экспрессируемой на клеточной поверхности, и ингибирует клеточную пролиферацию. В определенных вариантах осуществления антитело к CD22 связывается со зрелой формой CD22, экспрессируемой на клеточной поверхности, и индуцирует гибель клетки. В некоторых вариантах осуществления антитело к CD22 связывается со зрелой формой CD22, экспрессируемой на поверхности злокачественных клеток. В некоторых вариантах осуществления антитело к CD22 связывается со зрелой формой CD22, которая сверхэкспрессирована на поверхности злокачественных клеток по сравнению с нормальными клетками того же тканевого происхождения. В некоторых вариантах осуществления антитело к CD22 является конъюгированным с цитотоксином или детектируемой меткой и связывается с CD22 на клеточной поверхности. В некоторых вариантах осуществления конъюгат антитело-токсин ингибирует рост клетки. В некоторых вариантах осуществления конъюгат антитело-детектируемая метка обусловливает то, что клетка, экспрессирующая на своей поверхности CD22, становится детектируемой in vitro или in vivo.
В одном из аспектов антитело к CD22 представляет собой моноклональное антитело. В одном из аспектов антитело к CD22 представляет собой фрагмент антитела, например, фрагмент Fab, Fab'-SH, Fv, scFv или (Fab')2. В одном из аспектов антитело к CD22 представляет собой химерное, гуманизированное антитело или антитело человека. В одном из аспектов любое из антител к CD22, описываемых в настоящем документе, является очищенным.
В настоящем документе предоставлены иллюстративные моноклональные антитела, полученные из фаговой библиотеки. Антигеном, используемым для скрининга библиотеки, являлся полипептид с последовательностью из аминокислотных последовательностей SEQ ID NO: 28 или SEQ ID NO: 30, соответствующих внеклеточным доменам (ECD) CD22 бета и альфа. Антитела, полученные на основании скрининга библиотеки, являются аффинно зрелыми.
В одном из аспектов предоставлены моноклональные антитела, которые конкурируют с 10F4.4.1 мыши, гуманизированными 10F4v1 и v3, и 5E8.1.8 мыши за связывание с CD22. Также предоставлены моноклональные антитела, которые связывают тот же эпитоп, что и 10F4.4.1 мыши, гуманизированные 10F4v1 и v3, и 5E8.1.8 мыши.
В одном аспектов изобретения предоставлены полинуклеотиды, кодирующие антитела к CD22. В определенных вариантах осуществления предоставлены векторы, содержащие полинуклеотиды, кодирующие антитела к CD22. В определенных вариантах осуществления предоставлены клетки-хозяева, содержащие такие векторы. В другом аспекте изобретения предоставлены композиции, содержащие антитела к CD22 или полинуклеотиды, кодирующие антитела к CD22. В определенных вариантах осуществления композиция по изобретению представляет собой фармацевтический препарат для лечения клеточного пролиферативного нарушения, такого как перечисленные в настоящем документе нарушения.
Введение и препарат антитела
В одном из вариантов осуществления антитело к CD22 или конъюгат антитело к CD22-лекарственное средство (включая в качестве неограничивающих примеров, конъюгат тиомаб к CD22-лекарственное средство по изобретению) по изобретению вводят в сочетании с антагонистом поверхностного антигена B-клеток. Введение "в сочетании с" одним или несколькими дополнительными терапевтическими средствами включает одновременное (параллельное) и последовательное введение в любом порядке. В одном из вариантов осуществления введение является последовательным или поочередным. В другом варианте осуществления введение является одновременным, параллельным или совмещенным в одном и том же препарате. В одном из вариантов осуществления антагонист поверхностного антигена B-клеток представляет собой антитело или его связывающий антиген фрагмент. В одном из вариантов осуществления антагонист поверхности B-клетки представляет собой конъюгат антитело-лекарственное средство.
Препараты по настоящему документу по мере необходимости для конкретного показания, подлежащего лечению, могут содержать более одного активного соединения, предпочтительно активные соединения с дополняющей активностью, которые не влияют друг на друга неблагоприятным образом. Например, в дополнение к антителу к CD22, конъюгату антитело к CD22-лекарственное средство или связывающему CD22 олигопептиду, может являться желательным включить в один препарат дополнительное антитело, например, второе антитело к CD22, которое связывает другой эпитоп на полипептиде CD22, или второе антитело, которое связывает другой поверхностный антиген B-клеток, или антитело к какой-либо другой мишени, такой как фактор роста, который действует на рост конкретной злокачественной опухоли. Альтернативно или дополнительно композиция может дополнительно содержать химиотерапевтическое средство, цитотоксическое средство, цитокин, ингибирующее рост средство, противогормональное средство и/или кардиопротектор. Такие молекулы соответственно находятся в сочетании в количествах, которые эффективны для назначенных целей.
В настоящее время, в зависимости от стадии злокачественной опухоли, лечение злокачественных опухолей включает одну или комбинацию из следующих видов терапии: хирургическое вмешательство для удаления злокачественной ткани, радиационная терапия и химиотерапия. Терапия антителами к CD22, конъюгатом антитело к CD22-лекарственное средство или олигопептиды к CD22 может являться особенно желаемой у пожилых пациентов, кто неудовлетворительно переносит токсичность и побочные эффекты химиотерапии и при метастазирующем заболевании, когда радиационная терапия имеет ограниченную пригодность. Нацеленные на опухоль антитела к CD22, конъюгат антитело к CD22-лекарственное средство или олигопептид к CD22 по изобретению пригодны для облегчения экспрессирующих CD22 злокачественных опухолей при исходном диагнозе заболевания или при рецидиве. Для терапевтического применения антитело к CD22, конъюгат антитело к CD22-лекарственное средство или олигопептид к CD22 можно использовать отдельно или в комбинированном лечении, например, с гормонами, антиангиогенными средствами или радиоактивно меченными соединениями или совместно с хирургией, криотерапией и/или радиотерапией. Лечение антителом к CD22, конъюгатом антитело к CD22-лекарственное средство или олигопептидом к CD22 можно проводить в сочетании с другими формами традиционной терапии, последовательно с традиционной терапией, до или после нее. В настоящем способе по изобретению для лечения или облегчения злокачественной опухоли пациенту со злокачественной опухолью можно вводить антитело к CD22, конъюгат антитело к CD22-лекарственное средство или олигопептид к CD22 в сочетании с лечением одним или несколькими ранее известными химиотерапевтическими средствами. Антитело к CD22, конъюгат антитело к CD22-лекарственное средство или олигопептид к CD22 вводят с терапевтически эффективной дозой химиотерапевтического средства. В другом варианте осуществления антитело к CD22, конъюгат антитело к CD22-лекарственное средство или олигопептид к CD22 вводят в сочетании с химиотерапией для усиления активности и эффективности химиотерапевтического средства. В The Physicians' Desk Reference (PDR) описаны дозировки этих средств, которые используют для лечения различных злокачественных опухолей. Режимы дозирования и дозировки этих указанных выше химиотерапевтических лекарственных средств, которые являются терапевтически эффективными, зависят от конкретной злокачественной опухоли, подлежащей лечению, степени заболевания и других факторов, хорошо известных практикующим специалистам в данной области, и доктор легко может их определить.
В одном конкретном варианте осуществления пациенту вводят конъюгат, содержащий антитело к CD22, конъюгат антитело к CD22-лекарственное средство или олигопептид к CD22, конъюгированный с цитотоксическим средством. Предпочтительно иммуноконъюгат, связанный с белком CD22, интернализуется клеткой, в результате приводя к увеличенной терапевтической эффективности иммуноконъюгата при уничтожении злокачественных клеток, с которыми он связывается. В одном из вариантов осуществления цитотоксическое средство поражает или блокирует нуклеиновую кислоту в злокачественной клетке. Примеры цитотоксических средств описаны выше и включают ауристатины, майтанзиноиды, калихимицины, рибонуклеазы и эндонуклеазы ДНК или их биологически активные производные.
Антитела к CD22, конъюгаты антитело к CD22-лекарственное средство или олигопептиды к CD22 или их конъюгаты с токсинами вводят человеческому пациенту известными способами, такими как внутривенное введение, например, в виде болюсной или непрерывной инфузии в течение периода времени, внутримышечным, интраперитонеальным, интрацереброспинальным, подкожным, внутрисосудистым, интрасиновиальным, интратекальным, пероральным, местным или ингаляционным способами. Предпочтительными являются внутривенное или подкожное введение антитела, конъюгата антитело к CD22-лекарственное средство или олигопептида к CD22.
С введением антитела к CD22, конъюгата антитело к CD22-лекарственное средство или олигопептида к CD22 можно комбинировать другие схемы лечения. Комбинированное введение включает совместное введение с применением отдельных препаратов или одного фармацевтического препарата и последовательное введение в любом порядке, где предпочтительно существует период времени, когда оба (или все) активные средства одновременно проявляют их биологическую активность. Предпочтительно такое комбинированное лечение приводит к синергическому терапевтическому эффекту.
Также может быть желательным комбинировать введение антитела к CD22 или антител, конъюгатов антитело к CD22-лекарственное средство или олигопептидов к CD22 с введением антител, направленных к другому антигену опухоли или поверхностному антигену B-клеток, ассоциированному с конкретной злокачественной опухолью.
В еще одном варианте осуществления способы терапевтического лечения по настоящему изобретению включают комбинированное введение анти-CD22 антитела (или антител), конъюгата(ов) анти-CD22 антитела и лекарственного средства или олигопептида(ов) вместе с одним или несколькими химиотерапевтическими средствами или средствами, ингибирующими рост, включая совместное введение коктейля из различных химиотерапевтических средств. Химиотерапевтические средства включают фосфат эстрамустина, преднимустин, цисплатин, 5-фторурацил, мелфалан, циклофосфамид, гидроксимочевину и гидроксиуретаксаны (такие как паклитаксел и доксетаксел) и/или антрациклиновые антибиотики, а также сочетание средств, таких как, но ими не ограничиваясь, СНОР или FOLFOX. Протоколы получения и дозирования для таких химиотерапевтических средств можно использовать в соответствии с инструкциями производителей или как определено эмпирически практикующими специалистами. Протоколы получения и дозирования для такой химиотерапии также описаны в Chemotherapy Service Ed., M.C. Perry, Williams & Wilkins, Baltimore, MD (1992).
Антитело вводят любым подходящим способом, включая парентеральное, топическое, подкожное, интраперитонеальное, внутрилегочное, интраназальное и/или внутриочаговое введение. Парентеральные введения включают внутримышечное, внутривенное, внутриартериальное, интраперитонеальное или подкожное введение. Также предусмотрено интратекальное введение (относительно интратекальной доставки антитела к CD20 см., например, патентную заявку США 2002/0009444, Grillo-Lopez, A). Предпочтительно, дозирование проводят внутривенно или подкожно.
Второе лекарственное средство можно вводить с первоначальным воздействием и/или более поздним воздействием терапевтического антитела или иммуноадгезина, где комбинированное введение включает совместное введение с использованием раздельных препаратов или одного фармацевтического препарата, и последовательное введение в любом порядке, где предпочтительно существует период времени, когда оба (или все) активные средства одновременно проявляют их биологическую активность.
Хотя терапевтическое антитело к CD22, конъюгат антитело к CD22-лекарственное средство, иммуноадгезин или другое биологическое средство для лечения аутоиммунного заболевания можно вводить в качестве единственного средства, как правило, терапевтическое антитело или иммуноадгезин сочетают с одним или несколькими вторичными лекарственными средствами. Например, для RA и других аутоиммунных заболеваний, антитело, иммуноадгезин или другое биологическое лекарственное средство предпочтительно комбинируют с любым одним или несколькими из иммуносупрессирующих средств, химиотерапевтических средств, антагонистами BAFF, антагонистами или антителами к интегринам и/или цитокинами, перечисленными в разделе определений выше; с любым одним или несколькими модифицирующими заболевание антиревматическими лекарственными средствами (DMARD), такими как гидроксихлороквин, сульфасалазин, метотрексат, лефлюномид, азатиоприн, D-пеницилламин, золото (перорально), золото (внутримышечно), миноциклин, циклоспорин; иммуноадсорбцией стафилококкового белка A; внутривенным иммуноглобулином (IVIG); нестероидными противовоспалительными лекарственными средствами (NSAID); глюкокортикоидом (например, посредством инъекции в сосуды); кортикостероидом (например, метилпреднизолон и/или преднизон); фолатом; антагонистом к антителу к фактору некроза опухоли (TNF), например, этанерцепт/ENBREL™, инфликсимаб/REMICADE™, D2E7 (Knoll) или CDP-870 (Celltech); антагонистом IL-1R (например, кинерет); антагонистом 1L-10 (например, илодекакин); модулятором свертывания крови (например, WinRho); антагонистом IL-6/антителом к TNF (CBP 1011); антагонистом CD40 (например, IDEC 131); антагонистом Ig-Fc-рецептора (MDX33); иммуномодулятором (например, талидомид или ImmuDyn); антителом к CD5 (например, H5g1.1); ингибитором макрофагов (например, MDX 33); костимулирующим блокатором (например, BMS 188667 или толеримаб); ингибитором комплемента (например, h5G1.1, 3E10 или антитело к ускоряющему распад фактору (DAF)); антагонистом IL-2 (zxSMART); ингибитором EGFR (см. определение выше); ингибитором тирозинкиназы (см. определение выше); антиангиогенным средством (например, антитело к VEGF, такое как бевацизумаб); антителами к CD22, такими как LL2 или эпратузумаб (LYMFOCIDE®; Immunomedics), включая эпратузумаб Y-90 (Juweid et al., Cancer Res 55(23 Suppl):5899s-5907s (1995)), антителом к CD22 Abiogen (Abiogen, Italy), CMC 544 (Wyeth/Celltech), комботоксом (UT Soutwestern), BL22 (NIH) и LympoScan Tc99 (Immunomedics); антителом к EpCAM, таким как 17-1A (PANOREX®); антителом ∀v∃3 (например, VITAXIN®; Medimmune); антителом к CD37, таким как TRU016 (Trubion); антителом к IL-21 (Zymogenetics/Novo Nordisk); антителом к B-клеткам (Impheron); направленным на B-клетки MAb (Immunogen/Aventis); 1D09C3 (Morphosys/GPC); LymphoRad 131 (HGS); антителом к Lym-1 Y-90 (USC); LIF 226 (Enhanced Lifesci.); антителом к BAFF (например, WO 03/33658); антителом к рецептору BAFF (например, WO 02/24909); антителом BR3; антителом Blys, таким как белимумаб; LYMPHOSCD22-B™; онколимом к Lym-1 (USC/Peregrine); ISF 154 (UCSD/Roche/Tragen); гомиликсимой (Idec 152; Biogen Idec); антителом к рецептору IL-6, таким как атлизумаб (ACTEMRA™; Chugai/Roche); антителом к IL-15, таким как HuMax-Il-15 (Genmab/Amgen); антителом к рецептору хемокинов, таким как антитело к CCR2 (например, MLN1202; Millieneum); антителом к комплементу, таким как антитело к C5 (например, экулизумаб, 5G1.1; Alexion); пероральным препаратом иммуноглобулина человека (например, IgPO; Protein Therapeutics); антителом к IL-12, таким как ABT-874 (CAT/Abbott); тенеликсимабом (BMS-224818); B-клеточной вакциной; DN-BAFF (Xencor); CRx-119 (CombinatoRx); антагонист BAFF Amgen; пентостатином (Pfizer); IC-485 (ICOS); антагонистом хемокинов, таким как T-487 (туларик) или ретикулоза (AVR-118); SCO-323 (SCIOS); антагонистом интегринов 683699, танабе, NGD-2001-1 (Neurogen); SCIO-469 (SCIOS); BIRB-796 (Boehringer Ingelheim); VX702, VX850 (Vertex); антагонистом лейкотриена B-4 (таким как амелубунт, BIIL-284; BI); модулятором микротрубочек (Paxceed; Angiotech); ингибитором протеаз (MBS561392; BMS); AGIX-4207 (Atherogenics); ISIS-104838 (ISIS/Elan); MFG-IRAP (Univ. Pitt.); ловушкой IL-1 (RGN-303; Regeneron/Novartis); опрелвекином (Wyeth); эверолимусом (цертикан; Novartis); амевивом (Biogen Idec); ORG-39141 (Organon); FK-506 (Fujisawa); и антагонистом IL-2 (такролимус; Fujisawa).
Подробное описание иллюстративных антител к CD22 представляет собой следующее:
1. Конкретные варианты осуществления антител к CD22
В одном из аспектов изобретение относится к антителу, содержащему, по меньшей мере, один, два, три, четыре, пять или шесть HVR, выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 2; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 4; (c) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO: 6; (d) HVR-L1, содержащей аминокислотную последовательность из любого одного из SEQ ID NO: 9, 10, 19, 20, 21, 22, 23; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 12 и (f) HVR-L3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO: 14.
В одном из аспектов изобретение относится к антителу к CD22, содержащему, по меньшей мере, одну, по меньшей мере, две, или все три последовательности HVR VH, выбранные из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 2; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 4; (c) HVR-H3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO: 6. В одном из аспектов изобретение относится к антителу к CD22, содержащему HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 2. В одном из аспектов изобретение относится к антителу к CD22, содержащему HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 4. В одном из аспектов изобретение относится к антителу к CD22, содержащему HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 6.
В одном из аспектов изобретение относится к антителу к CD22, содержащему HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 6, и HVR-H1, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 2.
В одном из аспектов изобретение относится к антителу к CD22, содержащему HVR-H3, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 6, и HVR-H2, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 4.
В одном из аспектов изобретение относится к антителу к CD22, содержащему HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 2, и HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 4.
В одном из аспектов изобретение относится к антителу к CD22, содержащему HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 2; HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 4; и HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 6.
В одном из аспектов изобретение относится к антителу к CD22, содержащему, по меньшей мере, одну, по меньшей мере, две или все три последовательности HVR VL, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10; (b) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 12; и (c) HVR-L3, содержащей аминокислотную последовательность, выбранную из SEQ ID NO: 14. В одном из аспектов изобретение относится к антителу к CD22, содержащему HVR-L1, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 9. В одном из аспектов изобретение относится к антителу к CD22, содержащему HVR-L1, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 10. В одном из аспектов изобретение относится к антителу к CD22, содержащему HVR-L1, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 19-23. В одном из аспектов HVR-L1 содержит аминокислотную последовательность SEQ ID NO: 9, где N28 замещен на V (аминокислотная замена N28V, дающая последовательность SEQ ID NO: 10). В одном из аспектов HVR-L1 содержит аминокислотную последовательность SEQ ID NO: 9, где N28 замещен на A (аминокислотная замена N28A, дающая SEQ ID NO: 19). В одном из аспектов HVR-L1 содержит аминокислотную последовательность SEQ ID NO: 9, где N28 замещен на Q (аминокислотная замена N28Q, дающая SEQ ID NO: 20). В одном из аспектов HVR-L1 содержит аминокислотную последовательность SEQ ID NO: 9, где N28 замещен на S (аминокислотная замена N28S, дающая SEQ ID NO: 21). В одном из аспектов HVR-L1 содержит аминокислотную последовательность SEQ ID NO: 9, где N28 замещен на D (аминокислотная замена N28D, дающая SEQ ID NO: 22). В одном из аспектов HVR-L1 содержит аминокислотную последовательность SEQ ID NO: 9, где N28 замещен на I (аминокислотная замена N28I, дающая SEQ ID NO: 23). В одном из аспектов изобретение относится к антителу к CD22, содержащему HVR-L1, содержащую аминокислотную последовательность из любого одного из SEQ ID NO: 9, 10, 19, 20, 21, 22, 23. В одном из аспектов HVR-L1 представляют собой любую одну из SEQ ID NO: 9, 10, 19, 20, 21, 22 или 23 и аминокислота в положении N30 (аспарагин в положении 30) замещена на A (аминокислотная замена N30A). В одном из аспектов HVR-L1 представляют собой любую одну из SEQ ID NO: 9, 10, 19, 20, 21, 22 или 23 и аминокислота в положении N30 (аспарагин в положении 30) замещена на Q (аминокислотная замена N30Q).
В одном из аспектов изобретение относится к антителу к CD22, содержащему (a) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 6, и (b) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 14. В некоторых вариантах осуществления антитело к CD22 дополнительно содержит (a) HVR-H1, содержащую SEQ ID NO: 2, и HVR-H2, содержащую SEQ ID NO: 4.
В одном из аспектов изобретение относится к антителу к CD22, содержащему (a) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 6, и (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 12. В некоторых вариантах осуществления антитело к CD22 дополнительно содержит (a) HVR-H1, содержащую SEQ ID NO: 2, и HVR-H2, содержащую SEQ ID NO: 4.
В одном из аспектов изобретение относится к антителу к CD22, содержащему (a) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 6, и (b) HVR-L1, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 9, 10, 19, 20, 21, 22 и 23. В некоторых вариантах осуществления антитело к CD22 дополнительно содержит (a) HVR-H1, содержащую SEQ ID NO: 2, и HVR-H2, содержащую SEQ ID NO: 4. В некоторых вариантах осуществления аминокислотная последовательность SEQ ID NO: 9, 10, 19, 20, 21, 22 или 23 содержит аминокислотную замену N30A или N30Q. В некоторых вариантах осуществления антитело к CD22 дополнительно содержит HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 12. В некоторых вариантах осуществления антитело к CD22 дополнительно содержит HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 14.
В одном из аспектов изобретение относится к антителу к CD22, содержащему (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 2; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 4; (c) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 6; (d) HVR-L1, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 9, 10, 19, 20, 21, 22, 23; (e) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 12; и HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 14. В некоторых вариантах осуществления изобретение дополнительно относится к аминокислотной последовательности SEQ ID NO: 9, 10, 19, 20, 21, 22 или 23, выбранной как HVR-L1, модифицированной аминокислотной заменой N30A или N30Q.
В одном из аспектов изобретение относится к антителу к CD22, содержащему вариабельный домен тяжелой цепи, содержащий SEQ ID NO: 16 (см. фиг.2A, h10F4v1). В одном из аспектов изобретение относится к антителу к CD22, содержащему вариабельный домен легкой цепи, содержащий SEQ ID NO: 17 (см. фиг.2B, h10F4v1). В одном из аспектов изобретение относится к антителу к CD22, содержащему вариабельный домен легкой цепи, содержащий SEQ ID NO: 18 (см. фиг.2B, h10F4v3).
В одном из аспектов изобретение относится к антителу к CD22, содержащему тяжелую цепь, содержащую SEQ ID NO: 34 (см. фиг.2A, m10F4). В одном из аспектов изобретение относится к антителу к CD22, содержащему легкую цепь, содержащую SEQ ID NO: 35 (см. фиг.2B, m10F4).
В одном из аспектов изобретение относится к антителу к CD22, содержащему 1, 2, 3, 4, 5 или 6 из последовательностей HVR антитела 10F4.4.1, полученного посредством гибридомы, депонированной в ATCC и имеющей инвентарный номер PTA-7621.
В одном из аспектов изобретение относится к антителу к CD22, содержащему 1, 2, 3, 4, 5 или 6 из последовательностей HVR антитела 5E8.1.8, полученного посредством гибридомы, депонированной в ATCC и имеющей инвентарный номер PTA-7620.
Антитело к CD22 может содержать любую каркасную последовательность вариабельного домена при условии, что антитело сохраняет способность связывать CD22. Например, в некоторых вариантах осуществления антитела к CD22 по изобретению содержат консенсусную каркасную последовательность тяжелой цепи подгруппы III человека. В одном из вариантов осуществления этих антител консенсусная каркасная последовательность тяжелой цепи содержит замену(ы) в положениях 71, 73 и/или 78.
В одном из вариантов осуществления этих антител положение 71 представляет собой A, положение 73 представляет собой T и/или положение 78 представляет собой A. В одном из вариантов осуществления эти антитела содержат каркасную последовательность вариабельного домена тяжелой цепи huMAb4D5-8, например, SEQ ID NO: 1, 3, 5, 7 (FR-H1, FR-H2, FR-H3, FR-H4, соответственно). huMAb4D5-8 коммерчески известно как GERCEPTIN® антитело к HER2, Genentech, Inc., South San Francisco, CA, USA; также указанное в патентах США № 6407213 и 5821337 и Lee et al., J. Mol. Biol. (2004), 340(5):1073-93. В одном таком варианте осуществления эти антитела дополнительно содержат консенсусную каркасную последовательность легкой цепи человека ☐I. В одном таком варианте осуществления эти антитела содержат каркасную последовательность вариабельного домена легкой цепи huMAb4D5-8, например, SEQ ID NO: 8, 1, 13, 15 (FR-L1, FR-L2, FR-L3, FR-L4, соответственно).
В одном из вариантов осуществления антитело к CD22 содержит вариабельный домен тяжелой цепи, содержащий каркасную последовательность и гипервариабельные области, где каркасная последовательность содержит последовательности FR-H1-FR-H4 SEQ ID NO: 1, 3, 5 и 7, соответственно; HVR H1 содержит аминокислотную последовательность SEQ ID NO: 2; HVR-H2 содержит аминокислотную последовательность SEQ ID NO: 4 и HVR-H3 содержит аминокислотную последовательность, выбранную из SEQ ID NO: 6. В одном из вариантов осуществления антитело к CD22 содержит вариабельный домен легкой цепи, содержащий каркасную последовательность и гипервариабельные области, где каркасная последовательность содержит последовательности FR-L1-FR-L4 SEQ ID NO: 8, 11, 13 и 15, соответственно; HVR-L1 содержит аминокислотную последовательность, выбранную из SEQ ID NO: 9, 10, 19, 20, 21, 22 и 23, где любая из SEQ ID NO: 9-10 или 19-23 может содержать аминокислотную замену N30A или N30Q; HVR-L2 содержит аминокислотную последовательность SEQ ID NO: 12 и HVR-L3 содержит аминокислотную последовательность, выбранную из SEQ ID NO: 14. В одном из вариантов осуществления этих антител вариабельный домен тяжелой цепи содержит SEQ ID NO: 16, а вариабельный домен легкой цепи содержит SEQ ID NO: 17 или 18.
В некоторых вариантах осуществления изобретение относится к антителу к CD22, содержащему вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную с аминокислотной последовательностью SEQ ID NO: 16. В некоторых вариантах осуществления аминокислотная последовательность, по меньшей мере, с 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности содержит замены, инсерции или делеции по отношению к референсной последовательности, но антитело, содержащее данную аминокислотную последовательность, сохраняет способность связываться с CD22. В некоторых вариантах осуществления в последовательности SEQ ID NO: 16 замещены, вставлены или удалены всего от 1 до 10 аминокислот. В некоторых вариантах осуществления замены, вставки и удаления проводят в областях вне HVR (т.е. в FR). В некоторых вариантах осуществления антитело к CD22 содержит вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 16.
В некоторых вариантах осуществления изобретение относится к антителу к CD22, содержащему вариабельный домен тяжелой цепи, как приведено ниже.
1 Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Glu Phe Ser Arg Ser Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly Arg Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Ser Gly Lys Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Asp Gly Ser Ser Trp Asp Trp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser 113 (SEQ ID NO: 16) (остатки HVR подчеркнуты).
В некоторых вариантах осуществления последовательности HVR и FR тяжелой цепи содержат следующее:
HVR-H1 (Gly Tyr Glu Phe Ser Arg Ser Trp Met Asn, SEQ ID NO: 2)
HVR-H2 (Gly Arg Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Ser Gly Lys Phe Lys Gly, SEQ ID NO: 4)
HVR-H3 (Asp Gly Ser Ser Trp Asp Try Tyr Phe Asp Tyr, SEQ ID NO: 6)
FR-H1 (Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser, SEQ ID NO: 1)
FR-H2 (Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val, SEQ ID NO: 3)
FR-H3 (Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg, SEQ ID NO: 5)
FR-H4 (Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser, SEQ ID NO: 7)
В некоторых вариантах осуществления изобретение относится к антителу к CD22, содержащему вариабельный домен легкой цепи, как приведено ниже.
1 Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Phe Leu Glu Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Phe Gln Gly Ser Gln Phe Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg 108 (SEQ ID NO: 17) (остатки HVR подчеркнуты, а положение N28 напечатано полужирным шрифтом)
или
1 Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Gln Ser Ile Val His Ser Val Gly Asn Thr Phe Leu Glu Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Phe Gln Gly Ser Gln Phe Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg 108 (SEQ ID NO: 18) (остатки HVR подчеркнуты, а положение N28 напечатано полужирным шрифтом).
В некоторых вариантах осуществления последовательности HVR легкой цепи содержат следующее:
HVR-L1 (Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Phe Leu Glu, SEQ ID NO: 9)
HVR-L1 (Arg Ser Ser Gln Ser Ile Val His Ser Val Gly Asn Thr Phe Leu Glu, SEQ ID NO: 10)
HVR-L1 (Arg Ser Ser Gln Ser Ile Val His Ser Ala Gly Asn Thr Phe Leu Glu, SEQ ID NO: 19)
HVR-L1 (Arg Ser Ser Gln Ser Ile Val His Ser Gln Gly Asn Thr Phe Leu Glu, SEQ ID NO: 20)
HVR-L1 (Arg Ser Ser Gln Ser Ile Val His Ser Ser Gly Asn Thr Phe Leu Glu, SEQ ID NO: 21)
HVR-L1 (Arg Ser Ser Gln Ser Ile Val His Ser Asp Gly Asn Thr Phe Leu Glu, SEQ ID NO: 22)
HVR-L1 (Arg Ser Ser Gln Ser Ile Val His Ser Ile Gly Asn Thr Phe Leu Glu, SEQ ID NO: 23)
HVR-L1 (Arg Ser Ser Gln Ser Ile Val His Ser Ile Gly Ala Thr Phe Leu Glu, SEQ ID NO: 32)
HVR-L1 (Arg Ser Ser Gln Ser Ile Val His Ser Ile Gly Gln Thr Phe Leu Glu, SEQ ID NO: 33)
HVR-L2 (Lys Val Ser Asn Arg Phe Ser, SEQ ID NO: 12)
HVR-L3 (Phe Gln Gly Ser Gln Phe Pro Tyr Thr, SEQ ID NO: 14).
В некоторых вариантах осуществления последовательности FR легкой цепи содержат следующее:
FR-L1 (Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys, SEQ ID NO: 8);
FR-L2 (Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr, SEQ ID NO: 11);
FR-L3 (Gly Val Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys, SEQ ID NO: 13)
FR-L4 (Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg, SEQ ID NO: 15).
В одном из аспектов изобретение относится к антителу к CD22, содержащему вариабельный домен легкой цепи, содержащий аминокислотную последовательность, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, идентичную с аминокислотной последовательностью, выбранной из SEQ ID NO: 17 или 18. В некоторых вариантах осуществления аминокислотная последовательность, по меньшей мере, с 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности содержит замены, добавления или делеции относительно референсной последовательности, но антитело, содержащее эту аминокислотную последовательность, сохраняет способность связываться с CD22. В некоторых вариантах осуществления в последовательности, выбранной из SEQ ID NO: 17 или 18, замещены, вставлены или удалены всего от 1 до 10 аминокислот. В некоторых вариантах осуществления замены, вставки и удаления проводят в областях вне HVR (т.е. в FR). В некоторых вариантах осуществления антитело к CD22 содержит вариабельный домен легкой цепи, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 17 или 18.
В одном из аспектов изобретение относится к антителу к CD22, содержащему (a) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, идентичную аминокислотной последовательности, выбранной из SEQ ID NO: 16; и (b) вариабельный домен легкой цепи, содержащий аминокислотную последовательность, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, идентичную аминокислотной последовательности, выбранной из SEQ ID NO: 17 или 18. В некоторых вариантах осуществления аминокислотная последовательность, по меньшей мере, с 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности содержит замены, добавления или делеции относительно референсной последовательности, но антитело, содержащее эту аминокислотную последовательность, сохраняет способность связываться с CD22. В некоторых вариантах осуществления в референсной последовательности замещены, вставлены или удалены всего от 1 до 10 аминокислот. В некоторых вариантах осуществления замены, вставки и удаления проводят в областях вне HVR (т.е. в FR). В некоторых вариантах осуществления антитело к CD22 содержит вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 16, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 18.
В одном из аспектов изобретение относится к антителу к CD22, содержащему (a) одну, две или три HVR VH, выбранных из HVR VH, представленных на фиг.2A, и/или (b) одну, две или три HVR VL, выбранных из HVR VL, представленных на фиг.2B. В одном из аспектов изобретение относится к антителу к CD22, содержащему вариабельный домен тяжелой цепи, выбранный из вариабельных доменов тяжелой цепи, представленных на фиг.2A, и вариабельный домен легкой цепи, выбранный из вариабельных доменов легкой цепи, представленных на фиг.2B.
В одном из аспектов антитело к CD22 по изобретению содержит 1, 2, 3, 4, 5 или 6 из гипервариабельных областей антитела 5E8.1.8, получаемого посредством гибридомы, депонированной в ATCC и имеющей инвентарный номер PTA-7620.
2. Фрагменты антител
Настоящее изобретение относится к фрагментам антител. Фрагменты антител можно получать традиционными способами, такими как ферментативное расщепление, или рекомбинантными способами. При определенных обстоятельствах существуют преимущества использования фрагментов антител, а не целых антител. Меньший размер фрагментов обеспечивает быстрый клиренс и может приводить к улучшенному доступу к солидным опухолям. Для обзора некоторых фрагментов антител см. Hudson et al., (2003) Nat. Med. 9:129-134.
Для получения фрагментов антител разработаны различные способы. Традиционно эти фрагменты получают посредством протеолитического расщепления исходных антител (например, см. Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992); и Brennan et al., Science, 229:81 (1985)). Однако эти фрагменты в настоящее время можно получать непосредственно посредством рекомбинантных клеток-хозяев. Все фрагменты антител Fab, Fv и ScFv можно экспрессировать в E.coli и секретировать из E.coli, таким образом, обеспечивая легкое получение больших количеств этих фрагментов. Фрагменты антител можно выделять из фаговых библиотек антител, обсуждаемых выше. Альтернативно, фрагменты Fab'-SH можно непосредственно восстанавливать из E.coli и химически связывать с формированием фрагментов (Fab')2 (Carter et al., Bio/Technology 10:163-167 (1992)). В соответствии с другим подходом фрагменты (Fab')2 можно непосредственно выделять из культуры рекомбинантных клеток-хозяев. В патенте США № 5869046 описан фрагмент Fab и (Fab')2 с увеличенным временем полужизни in vivo, содержащий остатки эпитопа связывания рецептора спасения. Практикующим специалистам очевидны другие способы получения фрагментов антител. В определенных вариантах осуществления антитело представляет собой одноцепочечный фрагмент Fv (scFv). См. WO 93/16185; патенты США № 5571894 и 5587458. Только Fv и scFv представляют собой молекулы с интактными антигенсвязывающими участками, лишенными константных областей; таким образом, они могут подходить для сниженного неспецифического связывания при использовании in vivo. Можно конструировать слитые белки scFv с получением слияния эффекторного белка с амино- или C-концом scFv. См. Antibody Engineering, ed. Borrebaeck, выше. Фрагмент антитела также может представлять собой "линейное" антитело, например, как описано в патенте США № 5641870. Такие линейные антитела могут быть моноспецифичными или биспецифичными.
3. Гуманизированные антитела
Данное изобретение относится к гуманизированным антителам. В данной области известны различные способы гуманизирования антител, не принадлежащих человеку. Например, гуманизированное антитело может содержать один или несколько аминокислотных остатков, введенных в него из источника, который не принадлежит человеку. Эти не принадлежащие человеку аминокислотные остатки часто обозначают как "импортные" остатки, которые, как правило, берут из "импортного" вариабельного домена. По существу, гуманизирование можно проводить способом Winter с коллегами (Jones et al., (1986) Nature 321:522-525; Riechmann et al., (1988) Nature 332:323-327; Verhoeyen et al., (1988) Science 239:1534-1536), замещая последовательностями гипервариабельной области соответствующие последовательности антитела человека. Таким образом, такие "гуманизированные" антитела представляют собой химерные антитела (патент США № 4816567), где по существу менее одного интактного вариабельного домена человека замещено соответствующей последовательностью из не являющихся человеком видов. На практике гуманизированные антитела, как правило, представляют собой антитела человека, в которых некоторые остатки гипервариабельной области и возможно некоторые остатки FR замещены остатками из аналогичных участков антител грызунов.
Выбор вариабельных доменов человека, легкой и тяжелой цепей, для использования в получении гуманизированных антител может быть важен для снижения антигенности. В соответствии с так называемым способом "наилучшего приближения" последовательность вариабельного домена антитела грызуна скринируют относительно полной библиотеки известных последовательностей вариабельных доменов человека. Затем последовательность человека, наиболее близкую к последовательности грызуна, принимают как каркас для гуманизированного антитела (Sims et al., (1993) J. Immunol. 151:2296; Chothia et al., (1987) J. Mol. Biol. 196:901). В другом способе используют конкретный каркас, полученный из консенсусной последовательности всех антител человека конкретной подгруппы легких или тяжелых цепей. Тот же каркас можно использовать для некоторых других гуманизированных антител (Carter et al., (1992) Proc. Natl. Acad. Sci. USA, 89:4285; Presta et al., (1993) J. Immunol, 151:2623).
Как правило, также важно, чтобы антитела гуманизировали с сохранением высокой аффинности к антигену и других благоприятных биологических свойств. Для достижения этой цели в соответствии с одним из способов гуманизированные антитела получают способом анализа исходных последовательностей и различных воображаемых гуманизированных продуктов с применением трехмерных моделей исходной и гуманизированной последовательностей. Трехмерные модели иммуноглобулинов являются общедоступными и хорошо известны специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и отображают возможные трехмерные конформационные структуры выбранных возможных последовательностей иммуноглобулинов. Исследование этих изображений позволяет проводить анализ возможной роли остатков в функционировании возможной последовательности иммуноглобулина, т.е. анализ остатков, влияющих на способность иммуноглобулина-кандидата связывать его антиген. Таким образом, можно выбрать и объединить остатки FR из реципиентной и импортируемой последовательностей так, чтобы добиться желательной характеристики антитела, такой как увеличенная аффинность к антигену(ам)-мишени. Как правило, остатки гипервариабельной области непосредственно и наиболее значительно вовлечены в воздействие на связывание антигена.
4. Антитела человека
Антитела человека к CD22 по изобретению можно конструировать, комбинируя последовательность(и) вариабельного домена клона Fv, выбранные из полученных от человека библиотек фагового дисплея, с известными последовательностями константных доменов человека, как описано выше. Альтернативно, гибридомным способом, можно получать моноклональные антитела человека к CD22 по изобретению. Клеточная линия миеломы человека и гетеромиеломная клеточная линия мыши-человека для получения моноклональных антител человека описана, например, в Kozbor J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp.51-63 (Marcel Dekker, Inc., New York, 1987); и Boerner et al., J. Immunol., 147: 86 (1991).
В настоящее время можно получать трансгенных животных (например, мышей), которые после иммунизации способны к продукции полного спектра антител человека в отсутствие продукции эндогенных иммуноглобулинов. Например, описано, что гомозиготная делеция гена соединительной области (JH) тяжелой цепи антитела у химерных и мутантных по зародышевой линии мышей приводит к полному ингибированию продукции эндогенных антител. Перенос набора генов иммуноглобулинов зародышевой линии человека таким мутантным по зародышевой линии мышам приводит при стимуляции антигеном к продукции антител человека. Например, см., Jakobovits et al., Proc. Natl. Acad. Sci USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255 (1993); Bruggermann et al., Year in Immunol., 7:33 (1993).
Также для получения антител человека из антител, не принадлежащих человеку, например, грызуна, где антитело человека обладает сходными аффинностями и специфичностями относительно исходного, не принадлежащего человеку антитела, можно использовать перестановку генов. В соответствии с этим способом, который также называют "отпечаток эпитопа", вариабельную область тяжелой или легкой цепи фрагмента не принадлежащего человеку антитела, полученного способом фагового дисплея, как описано в настоящем документе, заменяют репертуаром генов V-домена человека, получая группу химерных scFv или Fab с не принадлежащей человеку цепью/цепью человека. Отбор с антигеном приводит к выделению химерного scFv или Fab с не принадлежащей человеку цепью/цепью человека, где репертуар цепей человека восстанавливает антигенсвязывающий участок, разрушенный при удалении соответствующей не принадлежащей человеку цепи в первичном клоне из фагового дисплея, т.е. эпитоп обусловливает (отпечатывает) выбор партнера цепи человека. Когда процесс повторяют для замещения оставшейся не принадлежащей человеку цепи, получают антитело человека (см. PCT WO 93/06213, опубликованный 1 апреля 1993 года). В отличие от традиционного гуманизирования не принадлежащих человеку антител, посредством прививания CDR, этот способ обеспечивает полностью человеческое антитело, которое не содержит остатков FR или CDR, происходящих не от человека.
5. Биспецифические антитела
Биспецифические антитела представляют собой моноклональные антитела, которые обладают специфичностью связывания, по меньшей мере, для двух различных антигенов. В определенных вариантах осуществления биспецифические антитела представляют собой антитела человека или гуманизированные антитела. В определенных вариантах осуществления одна из специфичностей связывания является специфичностью связывания для CD22, а другая специфичность связывания является специфичностью связывания для любого другого антигена. В определенных вариантах осуществления биспецифические антитела могут связывать два различных эпитопа CD22. Биспецифические антитела также можно использовать для локализации цитотоксических средств в клетках, экспрессирующих CD22. Эти антитела несут плечо, связывающее CD22, и плечо, связывающее цитотоксическое средство, например, такое как сапорин, анти-интерферон-α, алкалоид барвинка, цепь рицина A, метотрексат или гаптен радиоактивного изотопа. Биспецифические антитела можно получать в виде полноразмерных антител или фрагментов антител (например, биспецифические антитела (Fab')2).
Способы получения биспецифических антител известны в данной области. Традиционно рекомбинантное получение биспецифических антител основано на совместной экспрессии двух пар тяжелых цепей-легких цепей иммуноглобулина, где две тяжелые цепи обладают различными специфичностями (Milstein and Cuello, Nature, 305:537 (1983)). Вследствие случайной сортировки легких и тяжелых цепей иммуноглобулинов эти гибридомы (квадромы) продуцируют потенциальную смесь 10 различных молекул антител, из которых только одна обладает правильной биспецифической структурой. Очистка правильной молекулы, которую, как правило, проводят на стадиях аффинной хроматографии, является довольно трудной, и выход продукта является низким. Подобные способы описаны в WO 93/08829, опубликованной 13 мая 1993 года, и в Traunecker et al., EMBO J., 10:3655 (1991).
В соответствии с другим подходом вариабельные домены антител с желаемыми специфичностями связывания (антигенсвязывающие участки антитело-антиген) сливают с константным доменом последовательности иммуноглобулина. Слияние, например, проводят с константным доменом тяжелой цепи иммуноглобулина, содержащей, по меньшей мере, часть областей шарнира, CH2 и CH3. В определенных вариантах осуществления, по меньшей мере, в одном из слияний присутствует первая константная область тяжелой цепи (CH1), содержащая участок, необходимый для связывания легкой цепи. ДНК, кодирующая слияния тяжелой цепи иммуноглобулина и, при желании, легкой цепи иммуноглобулина, вставляют в раздельные экспрессирующие векторы и совместно трансфицируют в подходящий организм-хозяина. Это обеспечивает большую гибкость в регулировке соответствующих пропорций трех полипептидных фрагментов в вариантах осуществления, когда неравные отношения трех полипептидных цепей, используемых в конструкции, обеспечивают оптимальный выход. Однако когда экспрессия, по меньшей мере, двух полипептидных цепей в равных отношениях приводит к высоким выходам или когда отношения не имеют особой значимости, кодирующие последовательности для двух или всех трех полипептидных цепей можно вставлять в один экспрессирующий вектор.
В одном из вариантов осуществления этого подхода биспецифические антитела состоят из гибридной тяжелой цепи иммуноглобулина с первой специфичностью связывания на одном плече и с парой гибридных тяжелой цепи-легкой цепи иммуноглобулина (обеспечивающих вторую специфичность связывания) на другом плече. Выявлено, что эта асимметричная структура облегчает отделение желаемого биспецифического соединения от нежелательных сочетаний цепей иммуноглобулина, так как присутствие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы обеспечивает легкий путь разделения. Этот подход описан в WO 94/04690. Более подробно о получении биспецифических антител см., например, Suresh et al., Methods in Enzymology, 121:210(1986).
В соответствии с другим подходом можно сконструировать поверхность контакта между парой молекул антитела для максимизации процента гетеродимеров, которые восстанавливаются из культуры рекомбинантных клеток. Поверхность контакта содержит, по меньшей мере, часть домена CH3 константного домена антитела. В данном способе одну или несколько небольших боковых цепей аминокислот из поверхности контакта молекулы первого антитело замещают большими боковыми цепями (например, тирозином или триптофаном). На поверхности контакта молекулы второго антитела создают компенсаторные "углубления" идентичного или меньшего размера относительно большой боковой цепи(ей) посредством замены больших боковых цепей аминокислот меньшими (например, аланином или треонином). Это обеспечивает механизм для увеличения выхода гетеродимера по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры.
Биспецифические антитела включают перекрестно-связанные или "гетероконъюгированные" антитела. Например, одно из антител в гетероконъюгате может быть связано с авидином, а другое с биотином. Такие антитела предложены, например, для направления клеток иммунной системы к нежелательным клеткам (патент США № 4676980) и для лечения ВИЧ-инфекции (WO 91/00360, WO 92/00373 и EP 03089). Гетероконъюгированные антитела можно получать с использованием подходящего способа перекрестного связывания. Подходящие связывающие средства хорошо известны в данной области и описаны в патенте США № 4676980 вместе с рядом способов перекрестного связывания.
Методики получения биспецифических антител из фрагментов антител также описаны в литературе. Например, биспецифические антитела могут быть получены, используя химическое связывание.
В статье Brennan et al., Science, 229: 81 (1985), описана методика, в которой интактные антитела протеолитически обрабатывают с получением фрагментов F(ab')2. Эти фрагменты восстанавливают в присутствии дитиольного сложного агента арсенита натрия для стабилизации соседних диолов и предотвращения образования дисульфидной связи. Фрагменты Fab' образуются после преобразования в тионитробензоатные (TNB) производные. Один из производных Fab'-TNB затем преобразуют в Fab'-тиол путем восстановления меркаптоэтиламином и смешивают с эквимолярным количеством другого производного Fab'-TNB с образованием биспецифического антитела. Полученные биспецифические антитела могут использоваться в качестве агентов для селективной иммобилизации ферментов.
Недавний прогресс облегчил прямое восстановление фрагментов Fab'-SH, которые можно химически связать с формированием биспецифических антител, из E.coli. В Shalaby et al., J. Exp. Med., 175: 217-225 (1992) описано получение полностью гуманизированной молекулы биспецифического антитела (Fab')2. Каждый фрагмент Fab' отдельно секретировали из E.coli и подвергали прямому химическому связыванию in vitro с формированием биспецифического антитела. Сформированное таким образом биспецифическое антитело было способно связываться с клетками, сверхэкспрессирующими рецептор HER2, и нормальными T-клетками человека, а также запускать литическое действие цитотоксических лимфоцитов человека против мишеней рака молочной железы человека.
Также описаны различные способы получения и выделения фрагментов биспецифических антител непосредственно из культуры рекомбинантных клеток. Например, биспецифические антитела получали с использованием лейциновых молний. Kostelny et al., J. Immunol., 148(5): 1547-1553 (1992). Пептиды лейциновых молний из белков Fos и Jun связывали с фрагментами Fab' двух различных антител посредством слияния генов. Гомодимеры антител восстанавливали в шарнирной области с формированием мономеров, а затем снова окисляли с формированием гетеродимеров антител. Этот способ также можно применять для получения гомодимеров антител. Технология "диател", описанная Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993), предоставила альтернативный механизм для получения фрагменты биспецифических антител. Фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) посредством линкера, который является слишком коротким, чтобы позволить связывание двух доменов на одной цепи. Таким образом, домены VH и VL одного фрагмента принуждают образовывать пару с комплементарными доменами VL и VH другого фрагмента, таким образом формируя два антигенсвязывающих участка. Также сообщалось о другой стратегии для получения фрагментов биспецифических антител посредством использование димеров одноцепочечных Fv (sFv). См. Gruber et al., J. Immunol., 152: 5368 (1994).
Рассматривают антитела более чем с двумя валентностями. Например, можно получать триспецифические антитела. Tutt et al., J. Immunol. 147: 60 (1991).
6. Поливалентные антитела
Клетка, экспрессирующая антиген, с которым связываются антитела, может интернализировать (и/или катаболизировать) поливалентное антитело быстрее, чем бивалентное антитело. Антитела по настоящему изобретению могут представлять собой поливалентные антитела (которые отличаются от класса IgM) с тремя или более антигенсвязывающими участками (например, тетравалентные антитела), которые можно легко получать посредством рекомбинантной экспрессии нуклеиновой кислоты, кодирующей полипептидные цепи антитела. Поливалентное антитело может содержать домен димеризации и три или более антигенсвязывающих участка. В определенных вариантах осуществления домен димеризации содержит (или состоит из) Fc-область или шарнирную область. В этом варианте антитело содержит Fc-область и три или более антигенсвязывающих участка с N-конца Fc-области. В определенных вариантах осуществления поливалентное антитело содержит (или состоит из) от трех до приблизительно восьми антигенсвязывающих участков. В одном таком варианте осуществления поливалентное антитело содержит (или состоит из) четыре антигенсвязывающих участка. Поливалентное антитело содержит, по меньшей мере, одну полипептидную цепь (например, две полипептидных цепи), где полипептидная цепь(и) содержит два или более вариабельных домена. Например, полипептидная цепь(и) может содержать VD1-(X1)n-VD2-(X2)n-Fc, где VD1 представляет собой первый вариабельный домен, VD2 представляет собой второй вариабельный домен, Fc представляет собой одну полипептидную цепь Fc-области, X1 и X2 представляют собой аминокислоту или полипептид, а n представляет собой 0 или 1. Например, полипептидная цепь(и) могут содержать цепь VH-CH1-гибкий линкер-VH-CH1-Fc-область или цепь VH-CH1-VH-CH1-Fc-область. Поливалентное антитело по настоящему документу может дополнительно содержать, по меньшей мере, два (например, четыре) полипептида вариабельных доменов легкой цепи. Поливалентное антитело по настоящему документу может, например, содержать от приблизительно двух до приблизительно восьми полипептидов вариабельных доменов легкой цепи. Рассматриваемые в настоящем разделе полипептиды вариабельных доменов легкой цепи содержат вариабельный домен легкой цепи и, необязательно, дополнительно содержат домен CL.
7. Однодоменные антитела
В некоторых вариантах осуществления антитело по изобретению представляет собой однодоменное антитело. Однодоменное антитело представляет собой цепь из одного полипептида, содержащую весь вариабельный домен тяжелой цепи или его часть или весь вариабельный домен легкой цепи или его часть антитела. В определенных вариантах осуществления однодоменное антитело представляет собой однодоменное антитело человека (Domantis, Inc., Waltham, MA; например, см. патент США № 6248516 B1). В одном из вариантов осуществления однодоменное антитело состоит из всего или части вариабельного домена тяжелой цепи антитела.
8. Варианты антител
В некоторых вариантах осуществления предусмотрена модификация(и) аминокислотной последовательности антител, описываемая в настоящем документе. Например, может быть желательным улучшить аффинность связывания и/или другие биологические свойства антитела. Варианты аминокислотной последовательности антитела можно получать, проводя соответствующие изменения нуклеотидной последовательности, кодирующей антитело или посредством пептидного синтеза. Такие модификации включают, например, делеции остатков из аминокислотных последовательностей, и/или вставки остатков в аминокислотные последовательности, и/или замены остатков в аминокислотных последовательностях антител. Для получения конечной конструкции можно осуществлять любое сочетание делеций, вставок и замен, при условии, что финальная конструкция обладает желательными характеристиками. Изменения аминокислот можно проводить в указанной аминокислотной последовательности антитела во время получения последовательности.
Подходящий способ идентификации определенных остатков или областей антитела, которые представляют собой предпочтительным места для мутагенеза, называется "мутагенез со сканированием аланином", как описано в Cunningham and Wells (1989) Science, 244: 1081-1085. В этом способе для влияния на взаимодействие аминокислот с антигеном определяют остаток или группу намеченных остатков (например, заряженные остатки, такие как arg, asp, his, lys и glu) и замещают нейтральной или отрицательно заряженной аминокислотой (например, аланин или полиаланин). Затем те положения аминокислот, которые демонстрируют функциональную чувствительность к заменам, улучшают посредством введения дополнительных или других вариантов в участки замены или для участков замены. Таким образом, хотя участок осуществления изменения аминокислотной последовательности предопределен, предопределять природу мутации по существу не нужно. Например, для анализа свойств мутации в данном участке, в намеченном кодоне или намеченной области проводят ala-сканирование или случайный мутагенез и экспрессируемые иммуноглобулины подвергают скринингу на желательную активность.
Вставки в аминокислотную последовательность включают N- и/или C-концевые слияния в диапазоне длины от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки одного или нескольких аминокислотных остатков внутри последовательности. Примеры концевых вставок включают антитело с N-концевым остатком метионина. Другие варианты молекулы антитела с инсерциями включают слияние N- или C-конца антитела с ферментом (например, для ADEPT) или полипептидом, который увеличивает время полужизни антитела в сыворотке.
В определенных вариантах осуществления антитело по изобретению изменяют для увеличения или уменьшения степени гликозилирования антитела. Гликозилирование полипептидов, как правило, является или N-сцепленным или O-сцепленным. N-сцепленное относится к присоединению молекулы углевода к боковой цепи аспарагинового остатка. Распознаваемыми последовательностями для ферментативного присоединения молекулы углевода к боковой цепи аспарагина являются трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин, где X представляет собой любую аминокислоту за исключением пролина. Таким образом, присутствие любой из этих трипептидных последовательностей в полипептиде создает потенциальный участок гликозилирования. O-сцепленное гликозилирование относится к присоединению одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, как правило, серину или треонину, хотя также можно использовать 5-гидроксипролин или 5-гидроксилизин.
Добавление или делецию участков гликозилирования антитела удобно проводить, изменяя аминокислотную последовательность так, чтобы создавалась или удалялась одна или несколько из описанных выше трипептидных последовательностей (для N-сцепленных участков гликозилирование). Изменение также можно осуществлять добавлением, удалением или заменой в последовательности исходного антитела (для O-сцепленных участков гликозилирования) одного или нескольких остатков серина или треонина.
Когда антитело содержит Fc-область, можно изменять связанный с ней углевод. Например, в патентной заявке США № US 2003/0157108 (Presta, L.) описаны антитела со зрелой углеводной структурой, в которых отсутствует присоединенная к Fc-области антитела фукоза. Также см. US 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). В WO 2003/011878, Jean-Mairet et al., и патенте США № 6602684, Umana et al., указаны антитела с разделяющим пополам N-ацетилглюкозамином (GlcNAc) в углеводе, присоединенном к Fc-области антитела. В WO 1997/30087, Patel et al., сообщается об антителах, по меньшей мере, с одним остатком галактозы в олигосахариде, присоединенном к Fc-области антитела. Также относительно антител с измененным углеводом, присоединенным к его Fc-области, см. WO 1998/58964 (Raju, S.) и WO 1999/22764 (Raju, S.). Об антигенсвязывающих молекулах с модифицированным гликозилированием см. также US 2005/0123546 (Umana et al.).
В определенных вариантах осуществления вариант гликозилирования включает Fc-область, где в структуре углевода, присоединенного к Fc-области, отсутствует фукоза. Такие варианты обладают улучшенной функцией ADCC. Необязательно Fc-область дополнительно содержит в себе одну или несколько аминокислотных замен, которые дополнительно улучшают ADCC, например, замены в положениях 298, 333 и/или 334 Fc-области (нумерация остатков по Eu). Примеры публикаций, относящихся к "дефукозилированным" или "фукозодефицитным" антителам включают US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO2005/053742; Okazaki et al., J. Mol. Biol. 336:1239-1249 (2004); Yamane-Ohnuki et al., Biotech. Bioeng. 87:614 (2004). Примеры клеточных линий, продуцирующих дефукозилированные антитела, включают клетки CHO Lec13 с недостатком фукозилирующего белка (Ripka et al., Arch. Biochem. Biophys. 249:533-545 (1986); патентная заявка США № US 2003/0157108 A1, Presta, L. и WO 2004/056312 A1, Adams et al., особенно в примере 11) и клеточные линии с нокаутом, такие как клетки CHO с нокаутом гена альфа-1,6-фукозилтрансферазы, FUT8 (Yamane-Ohnuki et al., Biotech. Bioeng. 87: 614(2004)).
В одном из вариантов осуществления антитело изменяют для улучшения времени полужизни в сыворотке. Для увеличения времени полужизни антитела в сыворотке в антитело (особенно во фрагмент антитела) можно встраивать один эпитоп связывания рецептора спасения, как описано, например, в патенте США 5739277. Как применяют в настоящем документе, термин "эпитоп связывания рецептора спасения" относится к эпитопу Fc-области молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), который отвечает за увеличение времени полужизни молекулы IgG в сыворотке in vivo (патент США 2003/0190311, US6821505; патент США 6165745; патент США 5624821; патент США 5648260; патент США 6165745; патент США 5834597).
Другим типом варианта является замена варианта аминокислоты. Эти варианты содержат, по меньшей мере, один аминокислотный остаток в молекуле антитела, замещенный другим остатком. Представляющие интерес для замещающего мутагенеза участки включают гипервариабельные области, но также предусмотрены изменения FR. Консервативные замены представлены в таблице 1 под заголовком "предпочтительные замены". Если такие замены приводят к желательному изменению биологической активности, тогда можно провести более значительные изменения, обозначенные в таблице 1 как "иллюстративные замены", или как дополнительно описано ниже в отношении классов аминокислот, и провести скрининг продуктов.
Существенные модификации биологических свойств антитела проводят посредством выбора замен, которые значительно отличаются по их действию на поддержание (a) структуры каркаса полипептида в области замены, например, конформация в виде слоя или спирали, (b) заряда или гидрофобности молекулы в участке-мишени или (c) размеров боковой цепи. Аминокислоты можно сгруппировать по сходству свойств их боковых цепей (в A.L. Lehninger, в Biochemistry, second ed., pp.73-75, Worth Publishers, New York (1975)):
(1) неполярные: Ala (A), Val (V), Leu (L), Ile (I), Pro (P), Phe (F), Trp (W), Met (M)
(2) незаряженные полярные: Gly (G), Ser (S), Thr (T), Cys (C), Tyr (Y), Asn (N), Gln (Q)
(3) кислые: Asp (D), Glu (E)
(4) основные: Lys (K), Arg (R), His (H).
Альтернативно встречающиеся в природе остатки можно разделить на группы на основе общих свойств боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислотные: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, влияющие на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены приводят к замене представителя одного из этих классов на другой класс. Такие замещенные остатки также можно вводить в участки консервативных замен или в оставшиеся (неконсервативные) участки.
Один из типов замещенных вариантов включает замену одного или нескольких остатков гипервариабельной области исходного антитела (например, гуманизированного антитела или антитела человека). Как правило, полученный вариант(ы), отбираемый для дальнейшего усовершенствования, содержит измененные (например, улучшенные) биологические свойства относительно исходного антитела, из которого их получают. Удобный способ получения таких замещенных вариантов включает созревание аффинности с применением фагового дисплея. В кратком изложении несколько участков гипервариабельных областей (например, 6-7 участков) подвергают мутированию с получением всех возможных аминокислотных замен в каждом участке. Полученные таким образом антитела экспонируют на частицах нитевидного фага в виде слияний, по меньшей мере, с частью белка оболочки фага (например, продукт гена III M13), упакованного в каждой частице. Затем экспонированные на фаге варианты подвергают скринингу на их биологическую активность (например, аффинность связывания). Для идентификации участков-кандидатов гипервариабельных областей для модификации можно проводить сканирующий мутагенез (например, сканирование аланином) для определения остатков гипервариабельной области, вносящих значительный вклад в связывание антигена. Альтернативно или дополнительно может быть выгодным анализировать кристаллическую структуру комплекса антигена-антитело для определения точек контакта антитела и антигена. Такие контактирующие остатки и соседние остатки являются кандидатами на замену известными в данной области способами, включая способы, представленные в настоящем документе. После получения таких вариантов панель вариантов подвергают скринингу с применением известных в данной области способов, включая способы, описываемые в настоящем документе, и антитела с наилучшими свойствами в одном или нескольких релевантных анализах можно отобрать для дальнейшего усовершенствования.
Молекулы нуклеиновой кислоты, кодирующие варианты аминокислотной последовательности антитела, получают множеством известных в данной области способов. Эти способы включают в качестве неограничивающих примеров выделение из природного источника (в случае встречающихся в природе вариантов аминокислотной последовательности) или получение посредством опосредованного олигонуклеотидами (или сайт-специфического) мутагенеза, мутагенеза ПЦР и кассетного мутагенеза ранее полученного варианта или безвариантной версии антитела.
Может быть желательным провести одну или несколько модификаций аминокислот в Fc-области антител по изобретению, получая, как правило, вариант Fc-области. Вариант Fc-области может содержать последовательность Fc-области человека (например, Fc-область IgG1, IgG2, IgG3 или IgG4 человека), содержащую аминокислотную модификацию (например, замену) в одном или нескольких положениях аминокислот, включая положение цистеина в шарнире.
В соответствии с описанием и способами в данной области предусмотрено, что в некоторых вариантах осуществления антитело по изобретению может содержать одно или несколько изменений по сравнению с соответствующим антителом дикого типа, например, в Fc-области. Тем не менее эти антитела будут сохранять по существу те же характеристики, необходимые для терапевтического применения, по сравнению с их аналогом дикого типа. Например, полагают, что в Fc-области можно проводить определенные изменения, которые приведут к измененным (т.е. или улучшенным или сниженным) связыванию C1q и/или обусловленной комплементом цитотоксичностью (CDC), например, как описано в WO 99/51642. Относительно других примеров вариантов Fc-области также см. Duncan & Winter Nature 322: 738-40 (1988); патент США № 5648260; патент США № 5624821 и WO 94/29351. В WO 00/42072 (Presta) и WO 2004/056312 (Lowman) описаны варианты антител с улучшенным или сниженным связыванием с FcR. Содержания этих патентных публикаций включены в настоящий документ в качестве ссылки в полном объеме. Также см. Shields et al., J. Biol. Chem. 9(2): 6591-6604 (2001). В US 2005/0014934A1 (Hinton et al.) описаны антитела с увеличенным временем полужизни и улучшенным связыванием с неонатальным рецептором Fc (FcRn), который отвечает за перенос материнских IgG плоду (Guyer et al., J. Immunol. 117: 587 (1976) и Kim et al., J. Immunol. 24: 249 (1994)), как описано в US2005/0014934A1 (Hinton et al.). Эти антитела содержат Fc-область с одной или несколькими заменами в ней, которые улучшают связывание Fc-области с FcRn. В патенте США № 6194551B1, WO 99/51642 описаны варианты полипептидов с измененными аминокислотными последовательностями Fc-области и способностью к увеличенному или сниженному связыванию C1q. Содержания этих патентных публикаций включены в настоящий документ в качестве ссылки в полном объеме. Также см. Idusogie et al., J. Immunol. 164: 4178-4184 (2000).
В одном из аспектов изобретение относится к антителам, содержащим модификации на поверхности контакта полипептидов Fc, содержащих Fc-область, где модификации облегчают и/или стимулируют гетеродимеризацию. Эти модификации включают введение выступа в первый полипептид Fc и полости во второй полипептид Fc, где выступ располагается в полости так, чтобы стимулировать образование комплекса первого и второго полипептидов Fc. Способы получения антител с этими модификациями известны в данной области, например, как описано в патенте США № 5731168.
9. Производные антител
Антитела по настоящему изобретению можно дополнительно модифицировать так, чтобы они содержали дополнительные небелковые группы, которые хорошо известны в данной области и легкодоступны. Предпочтительно группы, подходящие для дериватизации антител, представляют собой водорастворимые полимеры. Неограничивающие примеры водорастворимых полимеров включают в качестве неограничивающих примеров полиэтиленгликоль (PEG), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (или гомополимеры или статистические сополимеры) и декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры полипропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Пропионовый альдегид полиэтиленгликоля может обладать преимуществами при производстве вследствие его стабильности в воде. Полимер может быть любой молекулярной массы и быть разветвленным или неразветвленным. Количество присоединенных к антителу полимеров может варьировать, и если присоединено более одного полимера, они могут являться одинаковыми или различными молекулами. Как правило, количество и/или тип используемых для дериватизации полимеров можно определить на основании представлений, включающих в качестве неограничивающих примеров, конкретные свойства и функции антитела для улучшения, будут ли производное антитело использовать для терапии в определенных условиях и т.д.
В другом варианте осуществления предоставлены конъюгаты антитела и небелковой молекулы можно селективно нагревать под воздействием излучения. В одном из вариантов осуществления небелковая молекула представляет собой углеродную нанотрубку (Kam et al., Proc. Natl. Acad. Sci. 102: 11600-11605 (2005)). Излучение может быть любой волны и включает в качестве неограничивающих примеров длины волн, которые не приносят вреда обычным клеткам, но которые нагревают небелковую молекулу до температуры, при которой клетки рядом с антителом-небелковой молекулой погибают.
Некоторые способы получения антител
1. Некоторые основанные на гибридомах способы
Моноклональные антитела к CD22 по изобретению можно получать гибридомным способом, впервые описанным Kohler et al., Nature, 256: 495 (1975), или можно получать способами рекомбинантных ДНК (патент США № 4816567).
В гибридомном способе мышь или другое подходящее животное-хозяина, такое как хомяк, иммунизируют для стимуляции лимфоцитов, продуцирующих или способных продуцировать антитела, которые специфически связываются с белком, используемым при иммунизации. Антитела к CD22, как правило, индуцируют у животного посредством нескольких подкожных (sc) или интраперитонеальных (ip) инъекций CD22 и адъюванта. CD22 можно получать хорошо известными в данной области способами, некоторые из которых дополнительно описаны в настоящем документе. Например, CD22 можно получать рекомбинантным способом. В одном из вариантов осуществления животных иммунизируют производным CD22, которое содержит внеклеточную часть CD22, слитую с Fc-частью тяжелой цепи иммуноглобулина. В одном из вариантов осуществления животных иммунизируют слитым белком CD22-IgG1. В одном из вариантов осуществления животных иммунизируют иммуногенными производными CD22 в растворе с монофосфориллипидом A (MPL)/дикриномиколатом трегалозы (TDM) (Ribi Immunochem. Research, Inc., Hamilton, MT) и раствор инъецируют интрадермально в несколько участков. Через две недели животных повторно иммунизируют. Через период от семи до четырнадцати суток у животных забирают кровь и сыворотку анализируют на титр антител к CD22. Животных продолжают иммунизировать до выхода титра на плато.
Альтернативно, лимфоциты можно иммунизировать in vitro. Затем лимфоциты сливают с миеломными клетками с применением подходящего средства для слияния, такого как полиэтиленгликоль, с формированием гибридомной клетки (Goding, Monoclonal Antibodies: Principles and Practice, p.59-103 (Academic Press, 1986)).
Полученные таким образом гибридомные клетки высевают и растят в подходящей среде для культивирования, например, среде, содержащей одно или несколько веществ, ингибирующих рост или выживание неслитых исходных миеломных клеток. Например, если в исходных миеломных клетках отсутствовал фермент гипоксантингуанинфосфорибозилтрансфераза (HGPRT или HPRT), среда для культивирования гибридом, как правило, будет содержать гипоксантин, аминоптерин и тимидин (среда HAT), которые предотвращают рост клеток с дефицитом HGPRT.
В определенных вариантах осуществления миеломные клетки представляют собой клетки, которые эффективно сливаются, поддерживают стабильный высокий уровень продукции антител выбранными продуцирующими антитело клетками и чувствительны к среде, такой как среда HAT. Иллюстративные миеломные клетки включают в качестве неограничивающих примеров линии миеломы мышей, такие как линии, полученные из опухолей мышей MOPC-21 и MPC-11, доступные от Salk Institute Cell Distribution Center, San Diego, California USA, и клетки SP-2 или X63-Ag8-653, доступные от American Type Culture Collection, Rockville, Maryland USA. Также для получения моноклональных антител человека описаны клеточные линии миеломы человека и гетеромиеломные клеточные линии мышь-человек (Kozbor, J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp.51-63 (Marcel Dekker, Inc., New York, 1987)).
Среду для культивирования, в которой растут гибридомные клетки, анализируют на продукцию моноклональных антител, связывающихся с CD22. Предпочтительно специфичность связывания продуцируемых гибридомными клетками моноклональных антител определяют посредством иммунопреципитации или посредством анализа связывания in vitro, такого как радиоиммунологический анализ (RIA) или твердофазный иммуноферментный анализ (ELISA). Например, аффинность связывания моноклонального антитела можно определять посредством анализа Скэтчарда из Munson et al., Anal. Biochem., 107: 220 (1980).
После определения того, что гибридомные клетки продуцируют антитела желаемой специфичности, аффинности и/или активности, клоны можно субклонировать посредством серийных разведений и растить стандартными способами (Goding, Monoclonal Antibodies: Principles and Practice, p.59-103 (Academic Press, 1986)). Подходящие среды для культивирования для этой цели включают, например, среду D-MEM или RPMI-1640. Кроме того, гибридомные клетки можно растить in vivo в виде асцитных опухолей у животного. Моноклональные антитела, секретируемые субклонами, подходящим способом выделяют из среды для культивирования, асцитной жидкости или сыворотки общепринятыми способами очистки иммуноглобулинов, например, таких как белок A-сефароза, хроматография на гидроксиапатите, электрофорез в геле, диализ или аффинная хроматография.
2. Некоторые способы скрининга библиотек
Антитела к CD22 по изобретению можно получать с применением комбинаторных библиотек для скрининга на антитела с желательным видом активности или видами активности. Например, в данной области известно множество способов получения библиотек фагового дисплея и скрининга таких библиотек на антитела, обладающие желаемыми характеристиками связывания. Такие способы описаны в основном в Hoogenboom et al., (2001) in Methods in Molecular Biology 178: 1-37 (O'Brien et al., ed., Human Press, Totowa, NJ) и в определенных вариантах осуществления в Lee et al., (2004) J. Mol. Biol. 340: 1073-1093.
В принципе, синтетические клоны антител выбирают посредством скрининга фаговых библиотек, содержащих фаг, экспонирующий различные фрагменты вариабельной области (Fv) антитела, слитые с белком оболочки фага. Такие фаговые библиотеки подвергают аффинной хроматографии с желаемым антигеном. Клоны, экспрессирующие фрагменты Fv, способные связываться с желаемым антигеном, адсорбируются на антигене и, таким образом, отделяются от несвязывающихся клонов в библиотеке. Затем связывающиеся клоны элюируют с антигена и их можно обогащать посредством дополнительных циклов адсорбции антигена/элюции. Любое из антител к CD22 по изобретению можно получать, разработав подходящий способ скрининга для отбора представляющего интерес фагового клона с последующим конструированием клона полноразмерного антитела к CD22 с использованием последовательностей Fv из представляющего интерес фагового клона и подходящей последовательности константной области (Fc) последовательности, описанной в Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3.
В определенных вариантах осуществления антигенсвязывающий домен антитела получают из двух вариабельных (V) областей приблизительно из 110 аминокислот, по одной из каждой легкой (VL) и тяжелой (VH) цепей, где на обеих присутствуют три гипервариабельные петли (HVR) или определяющие комплементарность области (CDR). Вариабельные домены могут функционально экспонироваться на фаге в виде одноцепочечных фрагментов Fv (scFv), в которых VH и VL ковалентно связаны через короткий, гибкий пептид, или в виде Fab-фрагментов, в которых каждый из них слит с константным доменом, и они взаимодействуют нековалентно, как описано в Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Как используют в настоящем документе, кодирующие scFv фаговые клоны и кодирующие Fab фаговые клоны в совокупности обозначают как "фаговые клоны Fv" или "клоны Fv".
Репертуар генов VH и VL можно по отдельности клонировать полимеразной цепной реакцией (ПЦР) и случайным образом рекомбинировать в фаговые библиотеки, в которых затем можно искать антигенсвязывающие клоны, как описано в Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Библиотеки из иммунизированных источников предоставляют высокоаффинные антитела к иммуногенам без необходимости конструирования гибридом. Альтернативно можно клонировать исходный репертуар для обеспечения одного источника антител человека для широкого диапазона несобственных, а также собственных антигенов без какой-либо иммунизации, как описано в Griffiths et al., EMBO J, 12: 725-734 (1993). Наконец, исходные библиотеки также можно получать синтетически, клонируя неперестановленные сегменты V-генов из стволовых клеток и с применением праймеров ПЦР, содержащих случайную последовательность для кодирования высоковариабельных областей CDR3 и для облегчения перестановки in vitro, как описано в Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992).
В определенных вариантах осуществления для экспонирования фрагментов антител посредством слияния с минорным белком оболочки pIII используют нитеобразный фаг. Фрагменты антител можно экспонировать в виде одноцепочечных Fv-фрагментов, в которых домены VH и VL соединены на одной полипептидной цепи гибким полипептидным спейсером, например, как описано в Marks et al., J. Mol. Biol., 222: 581-597 (1991), или в виде Fab-фрагментов, в которых одна цепь слита с pIII, а другая секретируется в периплазму бактериальной клетки-хозяина, где происходит сборка структуры Fab-белок оболочки, которая экспонируется на поверхности фага, посредством замещения некоторых оболочечных белков дикого типа, например, как описано в Hoogenboom et al., Nucl. Acids Res., 19: 4133-4137 (1991).
Как правило, нуклеиновые кислоты, кодирующие фрагменты генов антител, получают из иммунных клеток, получаемых у людей или животных. Если желательна библиотека, направленная на получение клонов к CD22, субъект иммунизируют CD22 с вызовом ответа антителами и для конструирования библиотеки выделяют клетки селезенки и/или циркулирующие B-клетки, другие лимфоциты периферической крови (PBL). В предпочтительном варианте осуществления библиотеку фрагментов генов антител человека, направленную на получение клонов к CD22, получают генерируя ответ антителами к CD22 у трансгенных мышей, несущих функционирующую матрицу генов иммуноглобулинов человека (и с отсутствием функционирующей системы продукции эндогенных антител) так, что иммунизация CD22 служит источником B-клеток, продуцирующих антитела человека к CD22. Получение продуцирующих антитела человека мышей описано ниже.
Дополнительное обогащение группами реагирующих на CD22 клеток можно проводить с использованием подходящего способа скрининга для выделения B-клеток, экспрессирующих специфичное к CD22 мембраносвязанное антитело, например, посредством разделения клеток с использованием аффинной хроматографии с CD22 или адсорбции на клетки меченного флуорохромом CD22 с последующей активируемой потоком сортировкой клеток (FACS).
С другой стороны, использование клеток селезенки и/или B-клеток или других PBL от неиммунизированного донора обеспечивает лучшее представление возможного репертуара антител, а также позволяет конструировать библиотеку антител с использованием животного любого вида (человека или не являющегося человеком), у которого CD22 не является антигенным. Для библиотек, содержащих генные конструкции антител in vitro, у субъекта берут стволовые клетки для получения нуклеиновых кислот, кодирующих неперестроенные генные сегменты антител. Представляющие интерес иммунные клетки можно получать у множества видов животных, таких видов, как человек, мышь, крыса, зайцеобразные, волчьи, собачьи, кошачьи, свиньи, коровы, лошади и птицы и т.д.
Нуклеиновую кислоту, кодирующую генные сегменты вариабельных доменов антител (включая сегменты VH и VL), выделяют из представляющих интерес клеток и амплифицируют. В случае генных библиотек перестроенных генов VH и VL желаемую ДНК можно получить выделяя геномную ДНК или мРНК из лимфоцитов с последующей полимеразной цепной реакцией (ПЦР) с праймерами, совпадающими с 5' и 3'-концами перестроенных генов VH и VL, как описано в Orlandi et al., Proc. Natl. Acad. Sci. (USA), 86: 3833-3837 (1989), получая, таким образом, разнообразие репертуара V-генов для экспрессии. V-гены можно амплифицировать с кДНК и геномной ДНК с обратным праймеров на 5'-конце экзона, кодирующего зрелый V-домен, и прямым праймером, расположенным в пределах J-сегмента, как описано в Orlandi et al., (1989) и Ward et al., Nature, 341: 544-546 (1989). Однако, для амплификации с кДНК обратные праймеры могут располагаться в первом экзоне, как описано в Jones et al., Biotechnol., 9: 88-89 (1991), а прямые праймеры могут находиться в константной области, как описано в Sastry et al., Proc. Natl. Acad. Sci. (USA), 86: 5728-5732 (1989). Для максимизации комплементарности в праймерах можно создать вырожденность, как описано в Orlandi et al., (1989) или Sastry et al., (1989). В определенных вариантах осуществления разнообразие библиотеки максимизируют посредством использования праймеров ПЦР, направленных к каждому семейству V-генов для амплификации всех возможных расстановок VH и VL присутствующих в образце нуклеиновой кислоты иммунных клеток, например, как описано в способе Marks et al., J. Mol. Biol., 222: 581-597 (1991), или как описано в способе Orum et al., Nucleic Acids Res., 21: 4491-4498 (1993). Для клонирования амплифицированной ДНК в экспрессирующие векторы в праймер ПЦР можно внести редкие участки рестрикции в качестве маркера на одном из концов, как описано в Orlandi et al., (1989), или посредством дополнительной амплификации ПЦР с меченым праймером, как описано в Clackson et al., Nature, 352: 624-628 (1991).
Репертуар синтетически перестроенных V-генов можно получить in vitro из сегментов V-генов. Большинство из сегментов VH-генов человека клонировано и секвенировано (опубликовано в Tomlinson et al., J. Mol. Biol., 227: 776-798 (1992)), и картировано (опубликовано в Matsuda et al., Nature Genet., 3: 88-94 (1993); эти клонированные сегменты (включая все основные конформации петли H1 и H2) можно использовать для получения разнообразия репертуара VH-генов с применением праймеров ПЦР, кодирующих петли H3 с различной последовательностью и длиной, как описано в Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992). Репертуар VH также можно получать во всем разнообразии последовательностей, собранных в длинной петле H3 одной длины, как описано в Barbas et al., Proc. Natl. Acad. Sci. USA, 89: 4457-4461 (1992). Сегменты Vκ и Vλ человека клонированы и секвенированы (опубликовано в Williams and Winter, Eur. J. Immunol., 23: 1456-1461 (1993)) и их можно использовать для получения репертуара синтетических легких цепей. Репертуар синтетических V-генов на основе ряда укладок VH и VL и длин L3 и H3 кодирует антитела со значительным разнообразием структуры. После амплификации кодирующей V-гены ДНК сегменты V-генов зародышевой линии можно переставлять in vitro способом Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992).
Репертуар фрагментов антител можно получать, комбинируя вместе репертуар генов VH и VL различными путями. Каждый репертуар можно получать в различных векторах, а векторы рекомбинировать in vitro, например, как описано в Hogrefe et al., Gene, 128: 119-126 (1993), или in vivo посредством сочетанной инфекции, например, системы loxP, описанной в Waterhouse et al., Nucl. Acids Res., 21: 2265-2266 (1993). В подходе рекомбинации in vivo для преодоления предела размера библиотеки, задаваемого эффективностью трансформации E.coli, используют двухцепочечную природу Fab-фрагментов. Репертуар наивных VH и VL клонируют раздельно, один в фагмиду, а другой в фаговый вектор. Затем две библиотеки комбинируют посредством фаговой инфекции содержащих фагмиды бактерий так, чтобы каждая клетка содержала различное сочетание, а размер библиотеки ограничивался только количеством присутствующих клеток (приблизительно 1012 клонов). Оба вектора содержат сигналы рекомбинации in vivo так, что гены VH и VL рекомбинируют в один репликон и совместно пакуются в фаговые вирионы. Эти огромные библиотеки обеспечивают большое количество разнообразных тел с хорошей аффинностью (Kd-1 приблизительно 10-8 M).
Альтернативно, репертуары можно клонировать последовательно в тот же вектор, например, как описано в Barbas et al., Proc. Natl. Acad. Sci. USA, 88: 7978-7982 (1991), или собирать вместе посредством ПЦР, а затем клонировать, например, как описано в Clackson et al., Nature, 352: 624-628 (1991). Сборку ПЦР также можно использовать для соединения ДНК VH и VL с ДНК, кодирующей гибкий пептидный спейсер с формированием репертуаров одноцепочечных Fv (scFv). В еще одном способе используют "сборку ПЦР в клетке" для комбинирования генов VH и VL в лимфоцитах посредством ПЦР, а затем клонирования репертуаров сцепленных генов, как описано в Embleton et al., Nucl. Acids Res., 20: 3831-3837 (1992).
Антитела, продуцируемые посредством библиотек из наивных клеток (природных или синтетических), могут быть средней аффинности (Kd-1 от приблизительно 106 до 107 M-1), но in vitro также можно имитировать созревание аффинности посредством конструирования и повторного выбора из вторичных библиотек, как описано в Winter et al., (1994), выше. Например, можно случайным образом внести мутацию in vitro посредством использования вносящей ошибки полимеразы (опубликовано в Leung et al., Technique, 1: 11-15 (1989)) в способе Hawkins et al., J. Mol. Biol., 226: 889-896 (1992) или в способе Gram et al., Proc. Natl. Acad. Sci USA, 89: 3576-3580 (1992). Дополнительно можно осуществлять созревание аффинности посредством проведения случайного мутагенеза одного или нескольких CDR, например, с использованием ПЦР с праймерами, несущими случайную последовательность, перекрывающую представляющий интерес CDR, в выбранных отдельных клонах Fv и проводить скрининг на наиболее аффинные клоны. В WO 9607754 (опубликовано 14 марта 1996 года) описан способ индукции мутагенеза в определяющей комплементарность области легкой цепи иммуноглобулина для получения библиотеки генов легкой цепи. Другой эффективный подход представляет собой рекомбинацию доменов VH или VL, отобранных посредством фагового дисплея с репертуаром встречающихся в природе вариантов V-доменов, полученных от неиммунизированных доноров, и скрининг на наибольшую аффинность в нескольких циклах перестановки цепей, как описано в Marks et al., Biotechnol., 10: 779-783 (1992). Этот способ позволяет получать антитела и фрагменты антител с аффинностями 10-9 M или менее.
Скрининг библиотек можно проводить различными известными в данной области способами. Например, CD22 можно использовать для покрытия лунок адсорбирующих планшетов, экспрессировать на клетках-хозяевах, прикрепленных на адсорбирующих планшетах или используемых в сортировке клеток, или конъюгировать с биотином для захвата с применением покрытых стрептавидином гранул, или использовать любым другим способом для пэннинга библиотек фагового дисплея.
Образцы фаговой библиотеки приводят в контакт с иммобилизованным CD22 в условиях, подходящих для связывания, по меньшей мере, части фаговых частиц с адсорбентом. Как правило, условия, включающие pH, ионную силу, температуру и т.п., выбирают так, чтобы имитировать физиологические условия. Фаги, связанные с твердой фазой, отмывают, а затем элюируют кислотой, например, как описано в Barbas et al., Proc. Natl. Acad. Sci USA, 88: 7978-7982 (1991), или щелочью, например, как описано в Marks et al., J. Mol. Biol., 222: 581-597 (1991), или посредством конкуренции антигена CD22, например, в способе, сходным со способом конкуренции антигена Clackson et al., Nature, 352: 624-628 (1991). Фаги можно обогатить в 20-1000 раз за один цикл селекции. Кроме того, обогащенные фаги можно растить в бактериальной культуре и подвергать дополнительным циклам селекции.
Эффективность селекции зависит от многих факторов, включая кинетику диссоциации при отмывке, и того, могут ли несколько фрагментов антител на одном фаге одновременно связываться с антигеном. Антитела с быстрой кинетикой диссоциации (и низкими аффинностями связывания) можно сохранять, используя короткое время отмывки, поливалентный фаговый дисплей и высокую плотность покрытия антигеном в твердой фазе. Высокая плотность не только стабилизирует фаг посредством поливалентных взаимодействий, но и благоприятствует повторному связыванию диссоциировавшего фага. Отбор антител с медленной кинетикой диссоциации (и хорошими аффинностями связывания) можно проводить посредством использования длительных времен отмывки и моновалентного фагового дисплея, как описано в Bass et al., Proteins, 8: 309-314 (1990) и в WO 92/09690, и низкой плотности покрытия антигеном, как описано в Marks et al., Biotechnol., 10: 779-783 (1992).
Для CD22 можно проводить выбор между фаговыми антителами с различными аффинностями, даже с аффинностями, которые отличаются слабо. Однако вероятно, что случайный мутагенез отобранного антитела (например, как проводят в некоторых способах созревания аффинности) вызовет множество мутаций, большинство из которых связываются с антигеном, и меньшинство с большей аффинностью. С ограниченным количеством CD22 редкие фаги с высокой аффинностью могли бы конкурировать. Для сохранения всех мутантов с высокой аффинностью фаги можно инкубировать с избытком биотинилированного CD22, но с биотинилированным CD22 в концентрации с меньшей молярностью, чем намеченная молярная константа аффинности для CD22. Затем фаги, связывающиеся с высокой аффинностью, можно захватывать покрытыми стрептавидином парамагнитными гранулами.
Такой "равновесный захват" позволяет отбирать антитела по их аффинностям связывания с чувствительностью, которая позволяет выделять мутантные клоны с аффинностью только в два раза большей, чем у большого избытка фагов с меньшей аффинностью. Также можно варьировать условия, используемые при отмывке фагов, связанных с твердой фазой, для разделения на основании кинетики диссоциации.
Клоны против CD22 можно отбирать на основе активности. В определенных вариантах осуществления изобретение относится к антителам к CD22, которые связываются с живыми клетками, которые в природе экспрессируют CD22. В одном из вариантов осуществления изобретение относится к антителам к CD22, которые блокируют связывание между лигандом CD22 и CD22, но не блокируют связывание между лигандом CD22 и другим белком. Клоны Fv, соответствующие таким антителам к CD22, можно отбирать посредством (1) выделения клонов против CD22 из фаговой библиотеки, как описано выше, и необязательной амплификации выделенной популяции фаговых клонов, выращивая популяцию в подходящем бактериальном хозяине; (2) отбора CD22 и другого белка, против которого желательна блокирующая и неблокирующая активность, соответственно; (3) адсорбции фаговых клонов против CD22 на иммобилизованном CD22; (4) использования избытка другого белка для элюции любых нежелательных клонов, распознающих связывающие CD22 детерминанты с перекрытием, или являются общими со связывающими детерминантами другого белка; и (5) элюции клонов, которые остались адсорбированными после стадии (4). Необязательно клоны с желаемыми блокирующими/неблокирующими свойствами можно дополнительно обогащать, повторяя процедуры селекции, описываемые в данном разделе один или несколько раз.
ДНК, кодирующую получаемые из гибридом моноклональные антитела или Fv-клоны фагового дисплея по изобретению, легко выделять и секвенировать общепринятыми способами (например, с использованием олигонуклеотидных праймеров, сконструированных для специфической амплификации представляющих интерес областей, кодирующих тяжелые и легкие цепи, с матрицы гибридомной или фаговой ДНК). После выделения ДНК можно помещать в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E.coli, клетки COS обезьян, клетки яичника китайского хомяка (CHO) или миеломные клетки, которые иначе не продуцируют иммуноглобулиновый белок, с получением синтеза желаемых моноклональных антител в рекомбинантных клетках-хозяевах. Обзорные статьи о рекомбинантной экспрессии в бактериях кодирующей антитела ДНК включают Skerra et al., Curr. Opinion in Immunol., 5: 256 (1993) и Pluckthun, Immunol. Revs, 130: 151 (1992).
ДНК, кодирующую Fv-клоны по изобретению, можно комбинировать с известными последовательностями ДНК, кодирующими константные области тяжелой цепи и/или легкой цепи (например, подходящие последовательности ДНК можно получать по Kabat et al., выше) с получением клонов, кодирующих полноразмерные и/или неполноразмерные тяжелые и/или легкие цепи. Понятно, что для данной цели можно использовать константные области любого изотипа, включая константные области IgG, IgM, IgA, IgD и IgE, и что такие константные области можно получать у человека и любого вида животных. Как применяют в настоящем документе, Fv-клон, полученный из ДНК вариабельного домена одного вида животного (такого как человек), а затем слитый с ДНК константной области другого вида животного с получением кодирующей последовательности(ей) для "гибридной" полноразмерной тяжелой цепи и/или легкой цепи включен в определение "химерное" и "гибридное" антитело. В определенных вариантах осуществления Fv-клон, полученный из ДНК вариабельного домена человека, сливают с ДНК константной области человека с получением кодирующей последовательности(ей) полноразмерных или неполноразмерных тяжелых и/или легких цепей человека.
ДНК, кодирующую антитело к CD22 по изобретению, полученное из гибридом, также можно модифицировать, например, помещая кодирующую последовательность константных доменов тяжелых и легких цепей человека на место гомологичных мышиных последовательностей, полученных из гибридомного клона (например, как в способе Morrison et al., Proc. Natl. Acad. Sci. USA, 81: 6851-6855 (1984)). ДНК, кодирующую полученное из гибридов или Fv-клонов антитело или его фрагмент, можно дополнительно модифицировать посредством ковалентного связывания с кодирующей последовательностью иммуноглобулина всей или части кодирующей последовательности не являющегося иммуноглобулином пептида. Таким образом, получают "химерные" или "гибридные" антитела, обладающие специфичностью связывания полученных из Fv-клонов или гибридом антител по изобретению.
3. Векторы, клетки-хозяева и рекомбинантные способы
Для рекомбинантного получения антител по изобретению кодирующую их нуклеиновую кислоту выделяют и вставляют в реплицируемый вектор для дальнейшего клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующую антитело, легко выделять и секвенировать общепринятыми способами (например, с использованием олигонуклеотидных праймеров, способных к специфическому связыванию с генами, кодирующими тяжелые и легкие цепи антител). Доступно множество векторов. Выбор вектора частично зависит от используемой клетки-хозяина. Как правило, клетки-хозяева или прокариотического, или эукариотического (как правило, клетками млекопитающих) происхождения. Понятно, что для данной цели можно использовать константные области любого изотипа, включая константные области IgG, IgM, IgA, IgD и IgE, и что такие константные области можно получать у человека или любого вида животного.
Получение антител с использованием прокариотических клеток-хозяев:
Конструирование векторов
Полинуклеотидные последовательности, кодирующие полипептидные компоненты антитела по изобретению, можно получать стандартными рекомбинантными способами. Желательные полинуклеотидные последовательности можно выделять и секвенировать из продуцирующих антител клеток, таких как гибридомные клетки. Альтернативно, полинуклеотиды можно синтезировать с использованием нуклеотидного синтезатора или способы ПЦР. После получения кодирующие полипептиды последовательности вставляют в рекомбинантный вектор, способный к репликации и экспрессии гетерологичных полинуклеотидов в прокариотических хозяевах. Для данной цели настоящего по настоящему изобретению можно использовать множество векторов, которые доступны и известны в данной области. Выбор подходящего вектора в основном зависит от размера нуклеиновых кислот для вставки в вектор и от конкретной клетки-хозяина для трансформации вектором. Каждый вектор содержит различные компоненты, в зависимости от его функции (амплификация или экспрессия гетерологичного полинуклеотида или и то, и другое) и его совместимости с конкретной клеткой-хозяином, в которой он находится. Векторные компоненты, как правило, включают в качестве неограничивающих примеров участок начала репликации, селективный маркерный ген, промотор, участок связывания рибосомы (RBS), сигнальную последовательность, вставку гетерологичной нуклеиновой кислоты и последовательность терминации транскрипции.
В основном, применительно к этим хозяевам используют плазмидные векторы, содержащие репликон и контрольные последовательности, которые получены из вида, совместимого с клеткой-хозяином. Вектор, как правило, несет участок репликации, а также маркирующие последовательности, которые способны обеспечить фенотипическую селекцию в трансформированных клетках. Например, E.coli, как правило, трансформируют с использованием pBR322, плазмиды, полученной из видов E.coli. pBR322 содержит гены, кодирующие устойчивость к ампициллину (Amp) и тетрациклину (Tet), и, таким образом, обеспечивает простой способ идентификации трансформированных клеток. pBR322, ее производные или другие микробные плазмиды или бактериофаги также может содержать или ее можно модифицировать так, чтоб она содержала, промоторы, которые может использовать микробный организм для экспрессии эндогенных белков. Примеры производных pBR322, используемых для экспрессии конкретных антител, подробно описаны в Carter et al., патент США № 5648237.
Кроме того, применительно к этим хозяевам в качестве трансформирующих векторов можно использовать фаговые векторы, содержащие репликон и контрольные последовательности, которые совместимы с микроорганизмом-хозяином. Например, в получении рекомбинантного вектора, который можно использовать для трансформации подходящих клеток-хозяев, таких как E.coli LE392, можно использовать бактериофаг, такой как λGEM.TM.-11.
Экспрессирующий вектор по изобретению может содержать две или более пар промотор-цистрон, кодирующие каждый из компонентов полипептида. Промотор представляет собой нетранслируемую регуляторную последовательность, расположенную выше (5') цистрона, которая модулирует его экспрессию. Прокариотические промоторы, как правило, разделяют на два класса, индуцибельные и конститутивные. Индуцибельный промотор представляет собой промотор, который инициирует повышенные уровни транскрипции контролируемого им цистрона в ответ на изменения условий культивирования, например, присутствие или отсутствие питательного вещества или изменение температуры.
Хорошо известен большой ряд промоторов, распознаваемых множеством потенциальных клеток-хозяев. Выбранный промотор можно функционально связать с ДНК цистрона, кодирующей легкую или тяжелую цепь посредством удаления промотора из ДНК-источника посредством расщепления рестрикционными ферментами и вставки выделенной промоторной последовательности в вектор по изобретению. Для контроля амплификации и/или экспрессии целевых генов можно использовать природную промоторную последовательность и множество гетерологичных промоторов. В некоторых вариантах осуществления используют гетерологичные промоторы, так как они, как правило, обеспечивают более высокую транскрипцию и более высокие выходы экспрессированного целевого гена по сравнению с природным промотором целевого полипептида.
Промоторы, пригодные для использования в прокариотических хозяевах, включают промотор PhoA, промоторные системы β-галактамазы и лактозы, промоторную систему триптофана (trp) и гибридные промоторы, такие как промотор tac или trc. Однако также подходят другие промоторы, которые функционируют в бактериях (таких как другие известные бактериальные или фаговые промоторы). Их нуклеотидные последовательности опубликованы, таким образом, позволяя специалисту действовать, лигируя их с цистронами, кодирующими целевые легкие и тяжелые цепи (Siebenlist et al., (1980) Cell 20: 269), с использованием линкеров или адаптеров добавления любых требуемых участков рестрикции.
В одном из аспектов изобретения каждый цистрон в рекомбинантном векторе содержит компонент секреторной сигнальной последовательности, который направляет трансляцию экспрессируемых полипептидов через мембрану. Как правило, сигнальная последовательность может представлять собой компонент вектора, или она может являться частью ДНК целевого полипептида, которую вставляют в вектор. Сигнальная последовательность, выбираемая для цели по данному изобретению, должна представлять собой сигнальную последовательность, которую распознает и обрабатывает (т.е. отщепляет сигнальной пептидазой) клетка-хозяин. Для прокариотических клеток-хозяев, которые не распознают и не обрабатывают сигнальные последовательности, встречающиеся в природе с гетерологичными полипептидами, сигнальная последовательность замещена выбранной прокариотической сигнальной последовательностью, например, из группы, состоящей из лидирующих последовательностей щелочной фосфатазы, пенициллиназы, Ipp или термостабильного энтеротоксина II (STII), LamB, PhoE, PelB, OmpA и MBP. В одном из вариантов осуществления изобретения сигнальные последовательности, используемые в обоих цистронах экспрессирующей системы, представляют собой сигнальные последовательности STII или их варианты.
В другом аспекте продукция иммуноглобулинов по изобретению может проходить в цитоплазме клетки-хозяина и, таким образом, не требовать наличия секреторных сигнальных последовательностей в каждом цистроне. Таким образом, легкие и тяжелые цепи иммуноглобулинов экспрессируются, укладываются и собираются с формированием функциональных иммуноглобулинов в цитоплазме. Определенные хозяйские штаммы (например, штаммы E.coli trxB) обеспечивают условия в цитоплазме, которые благоприятствуют формированию дисульфидных связей, таким образом, обеспечивая правильную укладку и сборку экспрессированных белковых субъединиц. Proba and Pluckthun Gene, 159: 203 (1995).
Антитела по изобретению также можно получать с применением экспрессирующей системы, в которой количественное отношение экспрессируемых компонентов полипептида можно регулировать для максимизации выхода секретированных и правильно собранных антител по изобретению. Такую регулировку осуществляют, по меньшей мере частично, посредством одновременной регулировки силы трансляции для полипептидных компонентов.
Один из способов регулировки силы трансляции описан в Simmons et al., патент США № 5840523. В нем используют варианты области инициации трансляции (TIR) внутри цистрона. Для данной TIR можно получать ряд вариантов последовательности аминокислот или нуклеиновой кислоты с диапазоном сил трансляции, таким образом, обеспечивая удобные средства для приспособления этого фактора для желаемого уровня экспрессии в конкретной цепи. Варианты TIR можно получать общепринятыми способами мутагенеза, которые приводят к изменениям кодонов, которые могут изменять аминокислотную последовательность. В определенных вариантах осуществления изменения нуклеотидной последовательности являются молчащими. Изменения в TIR, наряду с изменениями в сигнальной последовательности, могут включать, например, изменения в количестве или расположении последовательностей Шайна-Дальгарно. Один из способов получения мутантных сигнальных последовательностей представляет собой получение "банка кодонов" в начале кодирующей последовательности, которые не изменяют аминокислотную последовательность сигнальной последовательности (т.е. изменения являются молчащими). Это можно осуществлять, изменяя нуклеотид в третьем положении каждого кодона; дополнительно, некоторые аминокислоты, такие как лейцин, серин и аргинин, имеют несколько первых и вторых положений, что может внести сложность в получение банка. Этот способ мутагенеза подробно описан в Yansura et al., (1992) METHODS: A Companion to Methods in Enzymol. 4: 151-158.
В одном из вариантов осуществления получают набор векторов с диапазоном силы TIR для каждого цистрона в них. Этот ограниченный набор позволяет сравнить уровни экспрессии каждой цепи, а также выход желаемых продуктов антитела при разных сочетаниях силы TIR. Силу TIR можно определить посредством количественного определения уровня экспрессии репортерного гена, как подробно описано в Simmons et al., патент США № 5840523. На основе сравнения силы трансляции выбирают желаемые отдельные TIR для комбинации в конструкциях экспрессирующих векторов по изобретению.
Прокариотические клетки-хозяева, подходящие для экспрессии антител по изобретению, включают Archaebacteria и Eubacteria, такие как грамотрицательные или грамположительные организмы. Примеры пригодных бактерий включают Escherichia (например, E.coli), Bacilli (например, B. subtilis), Enterobacteria, виды Pseudomonas (например, P. aeruginosa), Salmonella typhimurium, Serratia marcescans, Klebsiella, Proteus, Shigella, Rhizobia, Vitreoscilla или Paracoccus. В одном из вариантов осуществления используют грамотрицательные клетки. В одном из вариантов осуществления в качестве хозяев для изобретения используют клетки E.coli. Примеры штаммов E.coli включают штамм W3110 (Bachmann, Cellular and Molecular Biology, Vol.2 (Washington, D.C.: American Society for Microbiology, 1987), p.1190-1219; ATCC Deposit No. 27325) и его производные, включая штамм 33D3 с генотипом W3110 ΔfhuA (ΔtonA) ptr3 lac Iq lacL8 ΔompTΔ(nmpc-fepE) degP41 kanR (патент США № 5639635). Также подходят другие штаммы и их производные, такие как E.coli 294 (ATCC 31446), E.coli B, E.coliλ 1776 (ATCC 31537) и E.coli RV308 (ATCC 31608). Эти примеры являются иллюстративными, а не ограничивающими. Способы получения производных любой из указанных выше бактерий с определенными генотипами известны в данной области и описаны, например, в Bass et al., Proteins, 8: 309-314 (1990). Как правило, необходимо выбирать подходящие бактерии, принимая в расчет реплицируемость репликона в клетках бактерий. Например, виды E.coli, Serratia или Salmonella можно подходящим образом использовать как хозяина, когда для доставки репликона используют хорошо известные плазмиды, такие как pBR322, pBR325, pACYC177 или pKN410. Как правило, клетка-хозяин должна секретировать минимальные количества протеолитических ферментов, а в клеточную культуру может быть желательным вводить дополнительные ингибиторы протеаз.
Продукция антител
Клетки-хозяева трансформируют описанными выше экспрессирующими векторами и культивируют в общепринятых питательных средах, при необходимости модифицированных для обеспечения индукции промоторов, селекции трансформированных клеток и амплификации генов, кодирующих требуемые последовательности.
Трансформация означает введение ДНК прокариотическому хозяину, так что ДНК реплицируема в виде внехромосомного элемента или в интегрированном в хромосому виде. В зависимости от применяемой клетки-хозяина трансформацию проводят стандартными способами, подходящими для такой клетки. Для бактериальных клеток, которые содержат существенные барьеры в виде клеточной стенки, как правило, применяют обработку кальцием с использованием хлорида кальция. В другом способе трансформации используют полиэтиленгликоль/DMSO. Еще один способ представляет собой электропорацию.
Прокариотические клетки, используемые для получения полипептидов по изобретению, выращивают в средах, известных в данной области и подходящих для культивирования выбранных клеток-хозяев. Примеры подходящих сред включают бульон Лурия (LB) с необходимыми питательными добавками. В некоторых вариантах осуществления среды также содержат средство для селекции, выбранное на основе конструкции экспрессирующего вектора, для избирательного обеспечения роста прокариотических клеток, содержащих экспрессирующий вектор. Например, в среду для роста клеток, экспрессирующих ген устойчивости к ампициллину, добавляют ампициллин.
Кроме источников углерода, азота и неорганического фосфата, также можно добавлять любые необходимые добавки в подходящих концентрациях, отдельно или в смеси с другой добавкой или средой, например, с комплексным источником азота. Необязательно среда для культивирования может содержать один или несколько восстановителей, выбранных из группы, состоящей из глутатиона, цистеина, цистамина, тиогликолята, дитиоэритрола и дитиотреитола.
Прокариотические клетки-хозяева культивируют при подходящих температурах. В определенных вариантах осуществления для роста E.coli температуры роста варьируют от приблизительно 20°C до приблизительно 39°C; от приблизительно 25°C до приблизительно 37°C или составляют приблизительно 30°C. pH среды может принимать любое значение в диапазоне от приблизительно 5 до приблизительно 9, как правило, в зависимости от организма-хозяина. В определенных вариантах осуществления pH для E.coli составляет от приблизительно 6,8 до приблизительно 7,4, или приблизительно 7,0.
Если в экспрессирующем векторе по изобретению используют индуцируемый промотор, экспрессию белка индуцируют в условиях, подходящих для активации промотора. В одном из аспектов изобретения для контроля транскрипции полипептидов применяют промоторы PhoA. Таким образом, трансформированные клетки-хозяева культивируют в среде с ограниченным фосфатом для индукции. В определенных вариантах осуществления среда с ограниченным фосфатом представляет собой среду C.R.A.P. (например, см. Simmons et al., J. Immunol. Methods (2002), 263: 133-147). В соответствии с используемой векторной конструкцией можно использовать различные другие индукторы, как это известно в данной области.
В одном из вариантов осуществления экспрессированные полипептиды по настоящему изобретению секретируются в периплазму клеток-хозяев и их выделяют оттуда. Выделение белка, как правило, включает разрушение микроорганизма, как правило, такими средствами, как осмотический шок, обработка ультразвуком или лизис. Как только клетки разрушают, можно удалять клеточный дебрис или целые клетки посредством центрифугирования или фильтрации. Белки далее можно очищать, например, хроматографией на аффинной смоле. Альтернативно, белки могут транспортироваться в среды для культивирования и их можно выделять оттуда. Клетки можно удалять из культуры, а культуральную надосадочную жидкость можно фильтровать и концентрировать для дальнейшей очистки продуцированных белков. Затем экспрессированные полипептиды можно выделять и идентифицировать с использованием широко известных способов, таких как электрофорез в полиакриламидном геле (PAGE) и анализ посредством вестерн-блоттинга.
В одном из аспектов изобретения получение антитела проводят в большом количестве посредством процесса ферментации. Доступны различные широкомасштабные процедуры полунепрерывной ферментации для получения рекомбинантных белков. Широкомасштабные ферментации проводят, по меньшей мере, в емкостях на 1000 литров, а в определенных вариантах осуществления в емкостях на приблизительно от 1000 до 100000 литров. В данных ферментерах применяются лопастные мешалки для распределения кислорода и питательных элементов, в особенности, глюкозы (предпочтительного источника углерода/энергии). Ферментация в малом масштабе, как правило, относится к ферментации в ферментере, объем которого составляет не более чем приблизительно 100 литров и может изменяться от приблизительно 1 литра до приблизительно 100 литров.
В процессе ферментации индукцию экспрессию белка, как правило, проводят после того, как клетки выращивают в подходящих условиях до требуемой плотности, например, до OD550, равной приблизительно 180-220, когда клетки находятся в ранней стационарной фазе. Можно использовать различные индукторы, в соответствии с применяемой конструкцией вектора, как это известно в данной области и описано выше. Клетки перед индукцией можно выращивать в течение более коротких периодов времени. Клетки обычно индуцируют приблизительно в течение 12-50 часов, хотя можно использовать более длительное или более короткое время индукции.
Для улучшения выхода продукции и качества полипептидов по изобретению можно модифицировать различные условия ферментации. Например, для улучшения правильной сборки и фолдинга секретируемых полипептидов антитела для совместной трансформации прокариотических клеток-хозяев можно использовать дополнительные векторы, сверхэкспрессирующие белки-шапероны, например, белки Dsb (DsbA, DsbB, DsbC, DsbD и или DsbG) или FkpA (пептидилпролил-цис,транс-изомераза с активностью шаперона). Показано, что белки-шапероны облегчают правильный фолдинг и растворимость гетерологичных белков, продуцируемых в бактериальных клетках-хозяевах. Chen et al., (1999) J. Biol. Chem. 274: 19601-19605; Georgiou et al., патент США № 6083715; Georgiou et al., патент США № 6027888; Bothmann and Pluckthun (2000) J. Biol. Chem. 275: 17100-17105; Ramm and Pluckthun (2000) J. Biol. Chem. 275: 17106-17113; Arie et al., (2001) Mol. Microbiol. 39: 199-210.
Для минимизации протеолиза экспрессированных гетерологичных белков (в особенности, тех, которые являются чувствительными к протеолизу), по настоящему изобретению можно использовать некоторые штаммы-хозяева, дефицитные по протеолитическим ферментам. Например, штаммы клеток-хозяев можно модифицировать с осуществлением генной(ых) мутации(ий) в генах, кодирующих известные бактериальные протеазы, такие как протеаза III, OmpT, DegP, Tsp, протеаза I, протеаза Mi, протеаза V, протеаза VI и их сочетания. Некоторые штаммы E.coli, дефицитные по протеазе, доступны и описаны, например, в Joly et al., (1998), выше; Georgiou et al., в патенте США № 5264365; Georgiou et al., в патенте США № 5508192; Hara et al., Microbial Drug Resistance, 2: 63-72 (1996).
В одном из вариантов осуществления в качестве клеток-хозяев в экспрессирующей системе по изобретению используют штаммы E.coli, дефицитные по протеолитическим ферментам и трансформированные плазмидами, сверхэкспрессирующими один или несколько белков-шаперонов.
Очистка антитела
В одном из вариантов осуществления продуцируемый по изобретению белок антитела дополнительно очищают для получения по существу гомогенных препаратов для дальнейших анализов и способов применения. Можно использовать стандартные, известные в данной области способы очистки белков. Следующие процедуры являются иллюстративными примерами подходящих процедур очистки: фракционирование на иммуноаффинных или ионообменных колонках, осаждение этанолом, обращенно-фазовая ВЭЖХ, хроматография на диоксиде кремния или на катионообменной смоле, такой как DEAE, хроматофокусирование, SDS-PAGE, осаждение сульфатом аммония и гель-фильтрация, с использованием, например, Sephadex G-75.
В одном из аспектов для иммуноаффинной очистки продуктов-антител по изобретению применяют белок A, иммобилизованный на твердой фазе. Белок A представляет собой белок клеточной стенки массой 41 кДа из Staphylococcus aureus, который с высокой аффинностью связывается с Fc-областью антител. Lindmark et al., (1983) J. Immunol. Meth. 62: 1-13. Твердая фаза, на которой иммобилизуют белок A, может представлять собой колонку, содержащую поверхность из стекла или диоксида кремния, или колонку из стекла с контролируемым размером пор или колонку с кремниевой кислотой. В некоторых вариантах применения колонку покрывают реагентом, таким как глицерин, для возможного предотвращения неспецифического прилипания примесей.
В качестве первой стадии очистки препарат, полученный из клеточной культуры, описанной выше, можно помещать на твердую фазу с иммобилизованным белком А, для обеспечения специфичного связывания антитела, представляющего интерес, с белком A. Затем твердую фазу промывают для удаления неспецифически связанных с ней примесей. Наконец, представляющее интерес антитело отделяют от твердой фазы путем элюции.
Получение антител с использованием эукариотических клеток-хозяев:
Вектор для применения в эукариотической клетке-хозяине, как правило, включает один или несколько следующих неограничивающих компонентов: сигнальная последовательность, участок начала репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
Компонент сигнальной последовательности
Вектор для применения в эукариотической клетке-хозяине может также содержать сигнальную последовательность или другой полипептид, имеющий специфичный участок расщепления с N-конца зрелого белка или полипептида, представляющего интерес. Гетерологичная сигнальная последовательность может представлять собой последовательность, которая распознается и процессируется (т.е. расщепляется сигнальной пептидазой) в клетке-хозяине. Для экспрессии в клетке млекопитающего доступны сигнальные последовательности млекопитающих, а также вирусные секреторные лидерные последовательности, например, сигнал вируса простого герпеса gD. ДНК для такой области белка-предшественника лигируют в рамку считывания с ДНК, кодирующей антитело.
Участок начала репликации
Как правило, компонент участка начала репликации не требуется в экспрессирующих векторах млекопитающих. Например, участок начала репликации SV40, как правило, можно использовать только потому, что он содержит ранний промотор.
Компонент селективного гена
Экспрессирующий и клонирующий векторы могут содержать селективный ген, также называемый селективным маркером. Типичные селективные гены кодируют белки, которые (a) обеспечивают устойчивость к антибиотикам или другим токсинам, например, к ампициллину, неомицину, метотрексату или тетрациклину, (b) компенсируют ауксотрофные дефициты, если это уместно, или (c) предоставляют необходимые питательные элементы, недоступные из комплексной среды.
В одном из примеров схемы селекции используют лекарственное средство для предотвращения роста клетки-хозяина. Те клетки, которые успешно трансформированы гетерологичным геном, продуцируют белок, обеспечивающий устойчивость к лекарственному средству и, таким образом, переживают режим селекции. В примерах такой доминантной селекции применяют лекарственные средства неомицин, микофеноловая кислота и гигромицин.
Другим примером подходящих селективных маркеров для клетки млекопитающих являются те, которые обеспечивают идентификацию клеток, компетентных относительно захвата нуклеиновой кислоты антитела, например, DHFR, тимидинкиназа, металлотионеин-I и -II, предпочтительно гены металлотионеинов приматов, аденозиндезаминаза, орнитиндекарбоксилаза, и т.д.
Например, в некоторых вариантах осуществления клетки, трансформированные селективным геном DHFR, вначале идентифицируют путем культивирования всех трансформированных клеток в среде для культивирования, которая содержит метотрексат (Mtx), конкурентный антагонист DHFR. В некоторых вариантах осуществления подходящей клеткой-хозяином, в которой используется DHFR дикого типа, является клеточная линия яичника китайского хомячка (CHO), дефицитная по активности DHFR (например, ATCC CRL-9096).
Альтернативно, клетки-хозяева (в частности, хозяева дикого типа, которые содержат эндогенный DHFR), трансформированные или совместно трансформированные последовательностями ДНК, кодирующими антитело, белок DHFR дикого типа и другой селективный маркер, такой как аминогликозид-3'-фосфотрансфераза (APH), можно подвергать селекции выращиванием в среде, содержащей средство селекции для селективного маркера, такое как антибиотик-аминогликозид, например, канамицин, неомицин или G418. См. патент США № 4965199.
Компонент промотора
Экспрессирующие и клонирующие векторы, как правило, содержат промотор, который распознается организмом хозяина и функционально связан с нуклеиновой кислотой, кодирующей представляющий интерес полипептид (например, антитело). У эукариот известны промоторные последовательности. Например, по существу, все эукариотические гены имеют AT-богатую область, расположенную приблизительно на 25-30 оснований выше участка инициации транскрипции. Другая последовательность, находящаяся на 70-80 оснований выше старта транскрипции многих генов, представляет собой область CNCAAT, в которой N может представлять собой любой нуклеотид. С 3'-конца большинства эукариотических генов находится последовательность AATAAA, которая может представлять собой сигнал добавления поли-A-хвоста к 3'-концу кодирующей последовательности. В определенных вариантах осуществления в эукариотические экспрессирующие векторы подходящим образом можно встраивать любые или все из данных последовательностей.
Транскрипция с векторов в клетках-хозяевах млекопитающих контролируется, например, промоторами, полученными из геномов вирусов, таких как вирус полиомы, вирус куриной оспы, аденовирус (такой как аденовирус 2), вирус папилломы крупного рогатого скота, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита B и вирус обезьян 40 (SV40), из гетерологичных промоторов млекопитающих, например, промотора актина или промотора иммуноглобулина, из промоторов белков теплового шока, при условии того, что такие промоторы совместимы с системами клетки-хозяина.
Ранние и поздние промоторы вируса SV40 удобно получать в виде рестрикционных фрагментов SV40, которые также содержат участок начала репликации вируса SV40. Предранний промотор цитомегаловируса человека удобно получать в виде фрагмента рестрикции HindIII E. В патенте США № 4419446 описана система экспрессии ДНК в хозяевах-млекопитающих с использованием вируса папилломы крупного рогатого скота в качестве вектора. Модификация данной системы описана в патенте США № 4601978. См. также Reyes et al., Nature 297: 598-601 (1982), где описана экспрессия кДНК β-интерферона человека в клетках мыши под контролем промотора тимидинкиназы из вируса простого герпеса. Альтернативно, в качестве промотора можно использовать длинный терминальный повтор вируса саркомы Рауса.
Компонент энхансерного элемента
Транскрипцию ДНК, кодирующей антитело по данному изобретению, высшими эукариотами, часто усиливают встраиванием в вектор энхансерной последовательности. В настоящее время известно множество энхансерных последовательностей из генов млекопитающих (глобин, эластаза, альбумин, α-фетопротеин и инсулин). Однако, как правило, используют энхансер из вируса эукариотических клеток. Примеры включают энхансер SV40 с поздней стороны точки инициации репликации (100-270 п.н.), энхансер раннего промотора цитомегаловируса, энхансер полиомы с поздней стороны точки инициации репликации и энхансеры аденовирусов. См. также Yaniv, Nature 297: 17-18 (1982), где описаны энхансерные элементы для активации эукариотических промоторов. Энхансер может встраиваться в вектор в положении 5' или 3' относительно последовательности, кодирующей полипептид антитела, но, как правило, он расположен в участке с 5'-конца от промотора.
Компонент терминации транскрипции
Экспрессирующие векторы, используемые в эукариотических клетках-хозяевах, могут также содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно доступны из 5'- и, иногда, 3'-концевых нетранслируемых областей эукариотической или вирусной ДНК или кДНК. Такие области содержат нуклеотидные сегменты, транскрибируемые в виде полиаденилированных фрагментов в нетранслируемой части мРНК, кодирующей антитело. Одним из подходящих компонентов для терминации транскрипции является область полиаденилирования гормона роста крупного рогатого скота. См. WO94/11026 и описанный в данной заявке экспрессирующий вектор.
Селекция и трансформация клеток-хозяев
Клетки-хозяева, подходящие для клонирования или экспрессии ДНК в описанных в настоящем документе векторах, включают клетки высших эукариот, описываемые в настоящем документе, включая клетки-хозяева позвоночных. Размножение клеток позвоночных в культуре (культура ткани) стало рутинной процедурой. Примеры подходящих линий клеток-хозяев млекопитающих представляют собой линию почки обезьяны CV1, трансформированные SV40 (COS-7, ATCC CRL 1651); линию эмбриональной почки человека (клетки 293 или клетки 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36: 59 (1977)); клетки почки джунгарского хомячка (BHK, ATCC CCL 10); клетки яичника китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77: 4216 (1980)); клетки Сертолли мыши (TM4, Mather, Biol. Reprod. 23: 243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени буйволовой крысы (BRL 3A, ATCC CRL 1442); клетки легких человека (W138, ATCC CCL 75); клетки почки человека (Hep G2, HB 8065); опухоль молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383: 44-68 (1982)); клетки MRC 5; клетки FS4 и линию гепатомы человека (Hep G2).
Клетки-хозяева трансформируют описанными выше экспрессирующими или клонирующими векторами для получения антитела и культивируют в общепринятых питательных средах, модифицированных при необходимости для индукции промоторов, селекции трансформированных клеток или амплификации генов, кодирующих требуемые последовательности.
Культивирование клеток-хозяев
Клетки-хозяева, используемые для получения антитела по данному изобретению, можно культивировать в различных средах. Для культивирования клеток-хозяев можно использовать коммерчески доступные среды, такие как Ham's F10 (Sigma), минимальная поддерживающая среда ((MEM), (Sigma), RPMI-1640 (Sigma) и модифицированная по способу Дульбекко среда Игла ((DMEM), Sigma). Кроме того, в качестве сред для культивирования клеток-хозяев можно использовать любые среды, описанные в Ham et al., Meth. Enz. 58: 44 (1979), Barnes et al., Anal. Biochem. 102: 255 (1980), патентах США № 4767704; 4657866; 4927762; 4560655 или 5122469; WO 90/03430; WO 87/00195; или патенте США Re. 30985. Любые из данных сред можно дополнять по мере необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, кальция, магния и фосфат), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство GENTAMYCINTM), микроэлементами (которые определяются как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Также можно включать любые другие известны специалистам в данной области добавки в подходящих концентрациях. Условия культивирования, такие как температура, pH, и т.п., соответствуют тем, которые используют для клеток-хозяев, выбранных для экспрессии, и, как правило, они известны специалистам в данной области.
Очистка антитела
При использовании рекомбинантных способов антитело может продуцироваться внутриклеточно или оно может непосредственно секретироваться в среду. Если антитело продуцируется внутриклеточно, на первой стадии удаляют дебрис из макрочастиц, то есть клетки-хозяева или лизированные фрагменты, например, посредством центрифугирования или ультрафильтрации. Если антитело секретируется в среду, образцы надосадочной жидкости такой системы экспрессии можно вначале концентрировать с использованием коммерчески доступного фильтра для концентрирования белков, например, устройства для ультрафильтрации Amicon или Millipore Pellicon. На любой из указанных выше стадий можно добавлять ингибитор протеаз, такой как PMSF, для ингибирования протеолиза, и можно добавлять антибиотики для предотвращения роста побочных загрязнений.
Полученную из клеток композицию антитела можно очищать, например, с использованием хроматографии на гидроксиапатите, электрофореза в геле, диализа и аффинной хроматографии, с аффинной хроматографией, являющейся удобным способом. Возможность применения белка A в качестве аффинного лиганда зависит от вида и изотипа иммуноглобулинового Fc-домена, который присутствует в антителе. Белок A можно использовать для очистки антител, которые основаны на тяжелых цепях γ1, γ2 или γ4 человека (Lindmark et al., J. Immunol. Methods 62: 1-13 (1983)). Белок G рекомендован для всех изотипов мыши и для γ3 человека (Guss et al., EMBO J. 5: 1567-1575 (1986)). Матрикс, к которому присоединяют аффинный лиганд, может представлять собой агарозу, хотя доступны и другие матриксы. Механически стабильные матриксы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол, обеспечивают большие скорости потока и меньшие периоды обработки, по сравнению с аналогичными показателями, достигаемыми при использовании агарозы. Там, где антитело содержит домен CH3, для очистки использует смолу Bakerbond ABX™ (J.T. Baker, Phillipsburg, NJ). В зависимости от антитела, которое нужно получить, доступны другие способы очистки белка, такие как фракционирование на ионообменной колонке, осаждение этанолом, обращенно-фазовая ВЭЖХ, хроматография на диоксиде кремния, хроматография на SEPHAROSE™ с гепарином, хроматография на анионо- или катионообменной смоле (такой как колонка с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE, и осаждение сульфатом аммония.
После любой(ых) стадии(й) предварительной очистки смесь, содержащую представляющее интерес антитело и загрязнители, можно подвергать дальнейшей очистке, например, посредством хроматографии гидрофобных взаимодействий с низким pH, с использованием буфера для элюции с pH приблизительно в интервале 2,5-4,5, предпочтительно проводимой при низкой концентрации солей (например, приблизительно в интервале 0-0,25 M соли).
Как правило, различные способы получения антител для использования в исследованиях, тестирования и для клинического применения в данной области хорошо разработаны, в соответствии с описанными выше способами и/или с мнением специалиста в данной области для конкретного представляющего интерес антитела.
Иммуноконъюгаты
Изобретение также относится к иммуноконъюгатам (взаимозаменяемо, обозначаемых как "конъюгаты антитело-лекарственное средство" или "ADC"), содержащим любые антитела к CD22 по изобретению, конъюгированные с одним или несколькими цитотоксическими средствами, такими как химиотерапевтическое средство, лекарственное средство, ингибирующее рост средство, токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения, или их фрагменты) или радиоактивный изотоп (т.е. радиоконъюгат).
В определенных вариантах осуществления иммуноконъюгат содержит антитело к CD22 и химиотерапевтическое средство или другой токсин. Химиотерапевтические средства, пригодные для получения иммуноконъюгатов, описаны в настоящем документе (например, выше). Также можно использовать ферментативно активные токсины и их фрагменты, и они описаны в настоящем документе.
В определенных вариантах осуществления иммуноконъюгат содержит антитело к CD22 и один или несколько низкомолекулярных токсинов, включая в качестве неограничивающих примеров низкомолекулярные лекарственные средства, такие как калихимицин, майтанзиноид, доластатин, ауристатин, трихотецен и CC1065, и производные этих лекарственных средств, которые обладают цитотоксической активностью. Далее подробно обсуждены примеры таких иммуноконъюгатов.
1. Иллюстративные иммуноконъюгаты - конъюгаты антитело-лекарственное средство
Иммуноконъюгат (или "конъюгат антитело-лекарственное средство" ("ADC")) по изобретению может быть формулы I, ниже, где антитело к CD22 конъюгировано (т.е. ковалентно связано) с одной или несколькими группами лекарственного средства (D) посредством необязательного линкера (L).
Таким образом, антитело к CD22 можно конъюгировать с лекарственным средством или непосредственно, или через линкер. В формуле I p представляет собой среднее количество групп лекарственного средства на антитело, которое может находиться в диапазоне, например, от приблизительно 1 до приблизительно 20 групп лекарственного средства на антитело, а в определенных вариантах осуществления от 1 до приблизительно 8 групп лекарственного средства на антитело.
Иллюстративные линкеры
В настоящем документе описаны иллюстративные линкеры и группы лекарственных средств. Линкер может содержать один или несколько линкерных компонентов. Иллюстративные линкерные компоненты включают 6-малеимидокапроил ("MC"), малеимидопропаноил ("MP"), валин-цитруллин ("val-cit" или "vc"), аланин-фенилаланин ("ala-phe"), п-аминобензилоксикарбонил ("PAB"), N-сукцинимидил 4-(2-пиридилтио) пентаноат ("SPP"), N-сукцинимидил 4-(N-малеимидометил) циклогексан-1-карбоксилат ("SMCC"), и N-сукцинимидил (4-йодацетил)аминобензоат ("SIAB"). В данной области известны различные линкерные компоненты, некоторые из которых описаны ниже.
Линкер может представлять собой "расщепляемый линкер", облегчающий высвобождение лекарственного средства в клетку. Например, можно использовать кислотолабильный линкер (например, гидразон), чувствительный к протеазам (например, чувствительный к пептидазе) линкер, фотолабильный линкер, диметильный линкер или содержащий дисульфид линкер (Chari et al., Cancer Research 52:127-131 (1992); патент США № 5208020).
В некоторых вариантах осуществления линкерный компонент может содержать "удлинитель", который связывает антитело с другим линкерным компонентом или с молекулой лекарственного средства. Иллюстративные удлинители приведены ниже (где волнистая линия указывает участки ковалентной связи с анителом):


В некоторых вариантах осуществления линкерный компонент может содержать аминокислотную единицу. В одном таком варианте осуществления аминокислотная единица допускает расщепление линкера протеазой, таким образом облегчая высвобождение лекарственного средства из иммуноконъюгата при воздействии внутриклеточной протеазы, такой как лизосомальные ферменты. Например, см. Doronina et al., (2003) Nat. Biotechnol. 21:778-784. Иллюстративные аминокислотные единицы включают в качестве неограничивающих примеров дипептид, трипептид, тетрапептид и пентапептид. Иллюстративные дипептиды включают валин-цитруллин (vc или val-cit), аланин-фенилаланин (af или ala-phe); фенилаланин-лизин (fk или phe-lys) или N-метил-валин-цитруллин (Me-val-cit). Иллюстративные трипептиды включают глицин-валин-цитруллин (gly-val-cit) и глицин-глицин-глицин (gly-gly-gly). Аминокислотная единица может содержать аминокислотные остатки, которые встречаются в природе, а также минорные аминокислоты и не встречающиеся в природе аналоги аминокислот, такие как цитруллин. Аминокислотные единицы можно конструировать и оптимизировать по их селективности для ферментативного расщепления посредством конкретного фермента, например, ассоциированной с опухолью протеиназ, катепсина B, C и D или протеазы плазмин.
В некоторых вариантах осуществления линкерный компонент может содержать "спейсерную" единицу, которая связывает антитело с молекулой лекарственного средства, напрямую или посредством удлинителя и/или аминокислотной единицы. Спейсерная единица может быть "саморазрушаемой" или "несаморазрушаемой". "Несаморазрушаемая" спейсерная единица представляет собой спейсерную единицу, остающуюся связанной с молекулой лекарственного средства при ферментативном (например, протеолитическом) расщеплении ADC. Примеры несаморазрушаемых спейсерных единиц включают в качестве неограничивающих примеров глициновую спейсерную единицу и спейсерную единицу глицин-глицин. Также рассматривают другие сочетания пептидных спейсеров, подходящие для специфического для последовательности ферментативного расщепления. Например, ферментативное расщепление ADC, содержащего спейсерную единицу глицин-глицин посредством ассоциированной с опухолевыми клетками протеазы, приводит к высвобождению группы глицин-глицин-молекула лекарственного средства от остатка. В одном таком варианте осуществления группа глицин-глицин-молекула лекарственного средства затем подвергается отдельной стадии гидролиза в опухолевой клетке, таким образом отделяя спейсерную единицу глицин-глицин спейсерная единица от молекулы лекарственного средства.
"Саморазрушающаяся" спейсерная единица обеспечивает высвобождение молекулы лекарственного средства без отдельной стадии гидролиза. В определенных вариантах осуществления спейсерная единица линкера содержит п-аминобензильную единицу. В одном таком варианте осуществления к аминокислотной единице посредством амидной связи присоединен п-аминобензиловый спирт, и между бензиловым спиртом и цитотоксическим средством образуется карбамат, метилкарбамат или карбонат. Например, см. Hamann et al., (2005) Expert Opin. Ther. Patents (2005) 15:1087-1103. В одном из вариантов осуществления спейсерная единица представляет собой п-аминобензилоксикарбонил (PAB). В определенных вариантах осуществления фениленовая часть п-аминобензильной единицы замещена Qm, где Q представляет собой -C1-C8-алкил, -O-(C1-C8-алкил), -галоген,- нитро или -циано; а m представляет собой целое число в диапазоне 0-4. Примеры саморазрушающихся спейсерных единиц дополнительно включают в качестве неограничивающих примеров ароматические соединения, которые электронно сходны с п-аминобензиловым спиртом (например, см. патент США 2005/0256030 A1), такие как производные 2-аминоимидазол-5-метанола (Hay et al., (1999) Bioorg. Med. Chem. Lett. 9:2237) и орто- или пара-аминобензилацетали. Можно использовать спейсеры, которые претерпевают образование цикла при гидролизе амидной связи, такие как замещенные и незамещенные амиды 4-аминомасляной кислоты (Rodrigues et al., Chemistry Biology, 1995, 2, 223); соответствующим образом замещенные кольцевые системы бицикло[2.2.1] и бицикло[2.2.2] (Storm, et al., J. Amer. Chem. Soc, 1972, 94, 5815) и амиды 2-аминофенилпропионовой кислоты (Amsberry, et al., J. Org. Chem., 1990, 55, 5867). Примерами саморазрушающихся спейсеров, пригодных для ADC, также является элиминация содержащих амины лекарственных средств, замещенных по a-положению глицина (Kingsbury, et al., J. Med. Chem., 1984, 27, 1447).
В одном из вариантов осуществления спейсерная единица представляет собой разветвленную бис(гидроксиметил)стирольную (BHMS) единицу, как описано ниже, которую можно использовать для встраивания и высвобождения нескольких лекарственных средств.
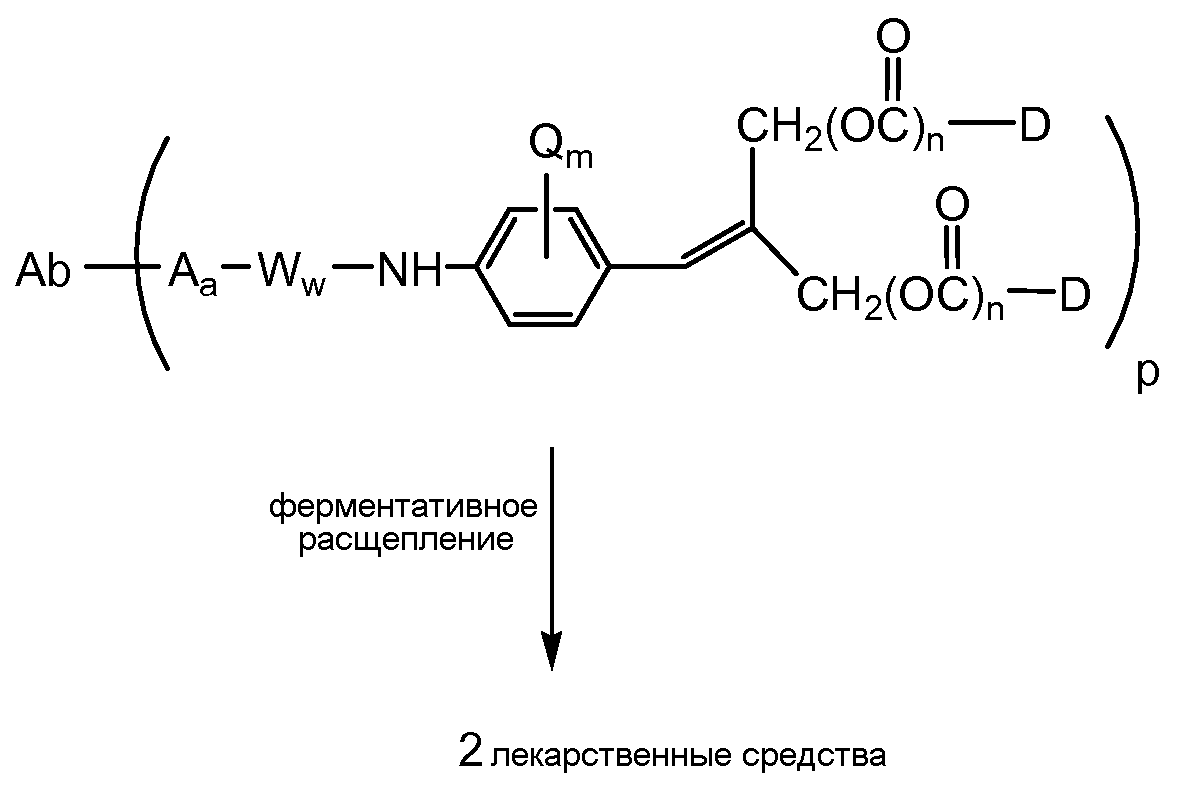
где Q представляет собой -C1-C8-алкил, -O-(C1-C8-алкил), -галоген, -нитро или -циано; m представляет собой целое число в диапазоне от 0-4; n представляет собой 0 или 1; и p находится в диапазоне от 1 до приблизительно 20.
Линкер может содержать любой один или несколько из указанных выше линкерных компонентов. В определенных вариантах осуществления линкер соответствует указанному в скобках в следующей формуле II ADC
где A представляет собой удлинитель, и a представляет собой целое число от 0 до 1; W представляет собой аминокислотную единицу, а w представляет собой целое число от 0 до 12; Y представляет собой спейсерную единицу, а y представляет собой 0, 1 или 2; и Ab, D и p определены, как указано выше для формулы I. Иллюстративные варианты осуществления таких линкеров описаны в патенте США 20050238649 A1, который включен в настоящий документ в качестве ссылки в полном объеме.
Иллюстративные линкерные компоненты и их сочетания показаны ниже в контексте формулы II ADC


Линкерные компоненты, включая удлинитель, спейсер и аминокислотные единицы, можно синтезировать известными в данной области способами, такими как способы, описанные в патенте США 2005-0238649 A1.
Иллюстративные группы лекарственных средств
Майтанзин и майтанзиноиды
В некоторых вариантах осуществления иммуноконъюгат содержит антитело по изобретению, конъюгированное с одной или несколькими молекулами майтанзиноидов. Майтанзиноиды представляет собой ингибиторы митоза, которые действуют, ингибируя полимеризацию тубулина. Майтанзин впервые выделен из восточно-африканского кустарника Maytenus serrata (патент США № 3896111). Впоследствии обнаружено, что некоторые микроорганизмы также продуцируют майтанзиноиды, такие как майтанзинол и сложные C-3 эфиры майтанзинола (патент США № 4151042). Синтетический майтанзинол и его производные и аналоги описаны, например, в патентах США № 4137230; 4248870; 4256746; 4260608; 4265814; 4294757; 4307016; 4308268; 4308269; 4309428; 4313946; 4315929; 4317821; 4322348; 4331598; 4361650; 4364866; 4424219; 4450254; 4362663 и 4371533.
Молекулы майтанзиноидных лекарственных средств являются привлекательными группами лекарственных средств для конъюгатов антитело-лекарственное средство, так как они (i) относительно доступны для получения посредством ферментации или химической модификации или дериватизации продуктов ферментации, (ii) поддаются дериватизации функциональными группами, подходящими для конъюгации с антителами посредством не являющихся дисульфидными линкерами, (iii) стабильны в плазме и (iv) эффективны против множества линий опухолевых клеток.
Соединения майтанзина, пригодные для использования в виде молекул майтанзиноидных лекарственных средств, хорошо известны в данной области и их можно выделять из природных источников известными способами или получать способами генетической инженерии (см. Yu et al., (2002) PNAS 99:7968-7973). Майтанзинол и аналоги майтанзинола также можно получать синтетически известными способами.
Иллюстративные варианты осуществления групп майтанзиноидных лекарственных средств включают DM1; DM3 и DM4, как описано в настоящем документе.
Ауристатины и доластатины
В некоторых вариантах осуществления иммуноконъюгат содержит антитело по изобретению, конъюгированное с доластатином или пептидным аналогом или производным, например, ауристатином (патенты США № 5635483; 5780588). Показано, что доластатины и ауристатины препятствуют динамике микротрубочек, гидролизу ГТФ и делению ядер и клеток (Woyke et al., (2001) Antimicrob. Agents and Chemother. 45(12):3580-3584) и обладают противоопухолевой (патент США № 5663149) и противогрибковой активностью (Pettit et al., (1998) Antimicrob. Agents Chemother. 42:2961-2965). Молекулу лекарственного средства доластатина или ауристатина можно присоединять к антителу на N-(амино)конце или C-(карбоксильном)конце пептидной молекулы лекарственного средства (WO 02/088172).
Иллюстративные варианты осуществления ауристатина включают присоединяемые на N-конце группы лекарственного средства монометилауристатина DE и DF, описанные в Senter et al., Proceedings of the American Association for Cancer Research, том 45, реферат № 623, представленной 28 марта 2004 года, описание которой включено в настоящее описание в качестве ссылки в полном объеме.
Пептидную молекулу лекарственного средства можно выбрать из формул DE и DF ниже:

где волнистая линия DE и DF указывает на участок ковалентного присоединения к антителу или антителу-линкерному компоненту, и независимо, в каждом положении
R2 выбран из H и C1-C8-алкила;
R3 выбран из H, C1-C8-алкила, C3-C8-карбоцикла, арила, C1-C8-алкиларила, C1-C8-алкил-(C3-C8-карбоцикла), C3-C8-гетероцикла и C1-C8-алкил-(C3-C8-гетероцикла);
R4 выбран из H, C1-C8-алкила, C3-C8-карбоцикла, арила, C1-C8-алкиларила, C1-C8-алкил-(C3-C8-карбоцикла), C3-C8-гетероцикла и C1-C8-алкил-(C3-C8-гетероцикла);
R5 выбран из H и метила;
или R4 и R5 совместно образуют карбоциклическую кольцевую систему и имеют формулу -(CRaRb)n-, где Ra и Rb независимо выбраны из H, C1-C8-алкила и C3-C8-карбоцикла, а n выбран из 2, 3, 4, 5 и 6;
R6 выбран из H и C1-C8-алкила;
R7 выбран из H, C1-C8-алкила, C3-C8-карбоцикла, арила, C1-C8-алкиларила, C1-C8-алкил-(C3-C8-карбоцикла), C3-C8-гетероцикла и C1-C8-алкил-(C3-C8-гетероцикла);
каждый R8 независимо выбран из H, OH, C1-C8-алкила, C3-C8-карбоцикла и O-(C1-C8-алкила);
R9 выбран из H и C1-C8-алкила;
R10 выбран из арила или C3-C8-гетероцикла;
Z представляет собой O, S, NH, или NR12, где R12 представляет собой C1-C8-алкил;
R11 выбран из H, C1-C20-алкила, арила, C3-C8-гетероцикла, -(R13O)m-R14, или -(R13O)m-CH(R15)2;
m представляет собой целое число в диапазоне 1-1000;
R13 представляет собой C2-C8-алкил;
R14 представляет собой H или C1-C8-алкил;
каждое появление R15 независимо представляет собой H, COOH, -(CH2)n-N(R16)2, -(CH2)n-SO3H или -(CH2)n-SO3-C1-C8-алкил;
каждое появление R16 независимо представляет собой H, C1-C8-алкил или -(CH2)n-COOH;
R18 выбран из -C(R8)2-C(R8)2-арила, -C(R8)2-C(R8)2-(C3-C8-гетероцикла) и -C(R8)2-C(R8)2-(C3-C8-карбоцикла); и
n представляет собой целое число в диапазоне от 0 до 6.
В одном из вариантов осуществления R3, R4 и R7 независимо представляют собой изопропил или втор-бутил, а R5 представляет собой -H или метил. В иллюстративном варианте осуществления каждый из R3 и R4 представляют собой изопропил, R5 представляет собой -H, а R7 представляет собой втор-бутил.
В другом варианте осуществления каждый из R2 и R6 представляют собой метил, а R9 представляет собой -H.
В другом варианте осуществления каждое появление R8 представляет собой -OCH3.
В иллюстративном варианте осуществления каждый из R3 и R4 представляют собой изопропил, каждый из R2 и R6 представляют собой метил, R5 представляет собой -H, R7 представляет собой втор-бутил, каждое появление R8 представляет собой -OCH3, а R9 представляет собой -H.
В одном из вариантов осуществления Z представляет собой -O- или -NH-.
В одном из вариантов осуществления R10 представляет собой арил.
В иллюстративном варианте осуществления R10 представляет собой фенил.
В иллюстративном варианте осуществления, когда Z представляет собой -O-, R11 представляет собой -H, метил или трет-бутил.
В одном из вариантов осуществления, когда Z представляет собой -NH, R11 представляет собой -CH(R15)2, где R15 представляет собой -(CH2)n-N(R16)2, а R16 представляет собой -C1-C8-алкил или -(CH2)n-COOH.
В другом варианте осуществления, когда Z представляет собой -NH, R11 представляет собой -CH(R15)2, где R15 представляет собой -(CH2)n-SO3H.
Иллюстративный вариант осуществления ауристатина формулы DE представляет собой MMAE, где волнистая линия указывает ковалентную связь конъюгата антитело-лекарственное средство с линкером (L):

Иллюстративный вариант осуществления ауристатина формулы DF представляет собой MMAF, где волнистая линия указывает ковалентную связь конъюгата антитело-лекарственное средство с линкером (L) (см. патент США 2005/0238649 и Doronina et al., (2006) Bioconjugate Chem. 17:114-124):

Другие группы лекарственного средства включают следующие производные MMAF, где волнистая линия указывает ковалентную связь конъюгата антитело-лекарственное средство с линкером (L):


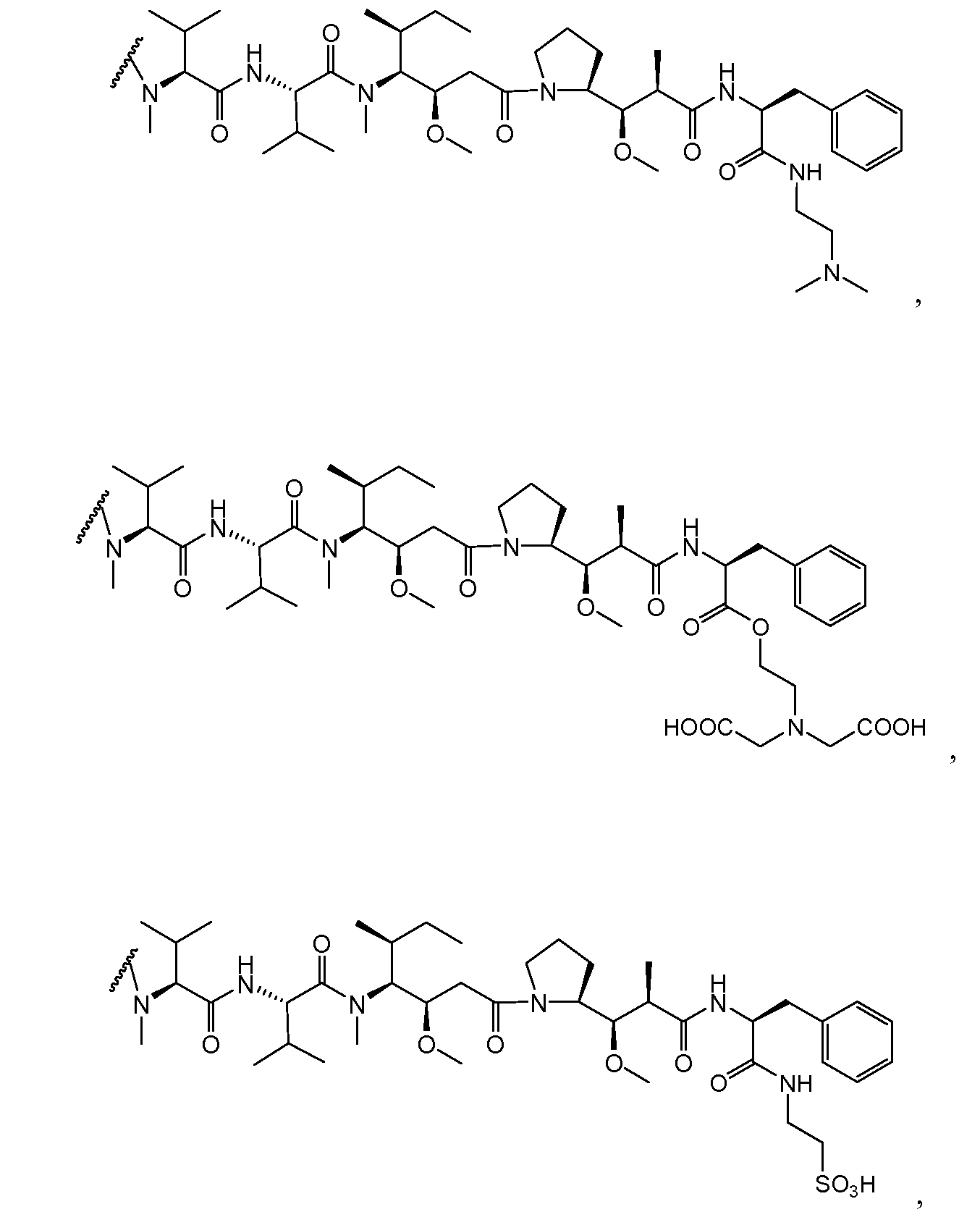

и

В одном из аспектов к молекуле лекарственного средства по R11 можно присоединить гидрофильные группы, включая в качестве неограничивающих примеров сложные эфиры триэтиленгликоля (TEG), как показано выше. Без связи с какой-либо конкретной теорией гидрофильные группы помогают в интернализации и препятствуют агломерации молекул лекарственного средства.
Иллюстративные варианты осуществления ADC формулы I, содержащих ауристатин/доластатин или их производные, описаны в патенте США 2005-0238649 A1 и Doronina et al., (2006) Bioconjugate Chem. 17:114-124, которые включены в настоящий документ в качестве ссылки в полном объеме. Иллюстративные варианты осуществления ADC формулы I, содержащие MMAE или MMAF и различные линкерные компоненты, имеют следующие структуры и сокращения (где "Ab" представляет собой антитело; p представляет собой от 1 до приблизительно 8, "Val-Cit" представляет собой дипептид валин-цитруллин; и "S" представляет собой атом серы:


Иллюстративные варианты осуществления ADC формулы I, содержащие MMAF и различные линкерные компоненты, дополнительно включают Ab-MC-PAB-MMAF и Ab-PAB-MMAF. Интересно, что показано, что иммуноконъюгаты, содержащие MMAF, присоединенный к антителу посредством линкера, который протеолитически не расщепляется, обладают активностью, сравнимой с иммуноконъюгатами, содержащими MMAF, присоединенный к антителу посредством протеолитически расщепляемого линкера. См., Doronina et al., (2006) Bioconjugate Chem. 17:114-124. В таких случаях полагают, что высвобождение лекарственного средства действует посредством разрушения антитела в клетке. Id.
Как правило, группы пептидных лекарственных средств можно получать, образуя пептидную связь между двух или более аминокислот и/или пептидных фрагментов. Такие пептидные связи можно получать, например, способом жидкофазного синтеза (см. E. Schröder and K. Lübke, "The Peptides", volume 1, p.76-136, 1965, Academic Press), который хорошо известен в области пептидной химии. Группы лекарственных средств ауристатина/доластатина можно получать способами из патента США 2005-0238649 A1; патента США № 5635483; патента США № 5780588; Pettit et al., (1989) J. Am. Chem. Soc. 111: 5463-5465; Pettit et al., (1998) Anti-Cancer Drug Design 13: 243-277; Pettit, G.R., et al., Synthesis, 1996, 719-725; Pettit et al., (1996) J. Chem. Soc. Perkin Trans. 1 5: 859-863; и Doronina (2003) Nat. Biotechnol. 21(7): 778-784.
В частности, группы лекарственных средств ауристатина/доластатина формулы DF, такие как MMAF и их производные, можно получать способами, описанными в патенте США 2005-0238649 A1 и Doronina et al., (2006) Bioconjugate Chem. 17: 114-124. Группы лекарственных средств ауристатина/доластатина формулы DE, такие как MMAE и их производные, можно получать способами, описанными в Doronina et al., (2003) Nat. Biotech. 21:778-784. Группы лекарственное средство-линкер MC-MMAF, MC-MMAE, MC-vc-PAB-MMAF и MC-vc-PAB-MMAE можно удобно синтезировать обычными способами, например, как описано в Doronina et al., (2003) Nat. Biotech. 21:778-784, и публикации патентной заявки № US 2005/0238649 A1, а затем конъюгировать с представляющим интерес антителом.
Нагрузка лекарственным средством
Нагрузку лекарственным средством обозначают как p, и она представляет собой среднее количество молекул лекарственного средства на антитело в молекуле формулы I. Нагрузка лекарственным средством может находиться в диапазоне от 1 до 20 молекул лекарственного средства (D) на антитело. ADC формулы I включают коллекции антител, конъюгированных с группой молекул лекарственного средства, от 1 до 20. Среднее количество молекул лекарственного средства на антитело в препаратах ADC после реакций конъюгации можно охарактеризовать традиционными способами, такими как масс-спектроскопия, анализ ELISA и ВЭЖХ. Также можно определять количественное распределение ADC с точки зрения p. В некоторых случаях разделение, очистку и характеризацию гомогенного ADC, где p представляет собой определенное значение, от другого ADC с другой нагрузкой лекарственным средством можно проводить такими способами, как обращенно-фазовая ВЭЖХ или электрофорез.
Для некоторых конъюгатов антитело-лекарственное средство p может быть ограничено количеством участков присоединения на антителе. Например, там, где присоединение происходит по тиолу цистеина, как в иллюстративных вариантах осуществления, представленных выше, антитело может нести только одну или несколько тиольных групп цистеина, или оно может нести только одну или несколько достаточно реакционноспособных тиольных групп, через которые можно присоединять линкер. В определенных вариантах осуществления более высокая нагрузка лекарственным средством, например, p>5, может приводить к агрегации, нерастворимому состоянию, токсичности или потере клеточной проницаемости определенных конъюгатов антитело-лекарственное средство. В определенных вариантах осуществления нагрузка лекарственным средством для ADC по изобретению находится в диапазоне от 1 до приблизительно 8; от приблизительно 2 до приблизительно 6; от приблизительно 3 до приблизительно 5; от приблизительно 3 до приблизительно 4; от приблизительно 3,1 до приблизительно 3,9; от приблизительно 3,2 до приблизительно 3,8; от приблизительно 3,2 до приблизительно 3,7; от приблизительно 3,2 до приблизительно 3,6; от приблизительно 3,3 до приблизительно 3,8; или от приблизительно 3,3 до приблизительно 3,7. В действительности, было показано, что для определенных ADC оптимальное соотношение молекул лекарственного средства на антитело может составлять менее чем 8, и может составлять от приблизительно 2 до приблизительно 5. См. патент США 2005-0238649 A1 (включенный в настоящий документ в качестве ссылки в полном объеме).
В определенных вариантах осуществления в ходе реакции конъюгации с антителом конъюгируется количество молекул лекарственных средств, меньшее чем теоретический максимум молекул лекарственного средства. Например, антитело может содержать остатки лизина, которые не реагируют с промежуточным соединением лекарственное средство-линкер или линкерным реагентом, как рассмотрено ниже. Только наиболее реакционноспособные группы лизина могут реагировать с линкерным реагентом, реагирующим с амином. Как правило, антитела не содержат множества свободных и реакционноспособных тиольных групп цистеина, которые могут связываться с молекулой лекарственного средства; в действительности, большинство тиольных остатков цистеина находятся в антителах в качестве дисульфидных мостиков. В определенных вариантах осуществления антитело можно восстанавливать восстановителем, таким как дитиотреитол (DTT) или трикарбонилэтилфосфин (TCEP), в условиях частичного или полного восстановления, с получением реакционноспособных тиольных групп цистеина. В определенных вариантах осуществления антитело подвергают условиям денатурации для выявления реакционноспособных нуклеофильных групп, таких как лизин или цистеин.
Нагрузку (соотношение лекарственное средство/антитело) ADC можно контролировать различными способами, например, посредством (i) ограничения молярного избытка промежуточного соединения лекарственное средство-линкер или линкерного реагента относительно антитела, (ii) ограничения времени реакции конъюгации или температуры, (iii) условий частичного или ограниченного восстановления для модификации тиола цистеина, (iv) конструирования рекомбинантными способами аминокислотной последовательности антитела так, чтобы модифицировать количество и положение остатков цистеина для контроля количества и/или положения присоединений линкер-лекарственное средство (такое как thioMab или thioFab, полученные, как описано в настоящем документе и в WO 2006/034488 (включенной в настоящий документ в качестве ссылки в полном объеме)).
Следует понимать, что когда с промежуточным соединением лекарственное средство-линкер или линкерным реагентом реагирует более одной нуклеофильной группы с последующим реагентом молекулы лекарственного средства, то полученный продукт представляет собой смесь соединений ADC с распределением одной или нескольких молекул лекарственного средства, присоединенных к антителу. Среднее количество лекарственных средств на антитело можно вычислить в смеси анализом ELISA с двумя антителами, специфичными для антитела и специфичными для лекарственного средства. Отдельные молекулы ADC можно идентифицировать в смеси посредством масс-спектроскопии и разделять посредством ВЭЖХ, например, хроматографией гидрофобного взаимодействия (например, см. Hamblett, K.J., et al., "Effect of drug loading on the pharmacology, pharmacokinetics, and toxicity of an anti-CD30 antibody-drug conjugate", Abstract No. 624, American Association for Cancer Research, 2004 Annual Meeting, March 27-31, 2004, Proceedings of the AACR, Volume 45, March 2004; Alley, S.C., et al., "Controlling the location of drug attachment in antibody-drug conjugates", Abstract No. 627, American Association for Cancer Research, 2004 Annual Meeting, March 27-31, 2004, Proceedings of the AACR, Volume 45, March 2004). В определенных вариантах осуществления из смеси конъюгатов можно выделять гомогенный ADC с одним значением нагрузки посредством электрофореза или хроматографии.
Некоторые способы получения иммуноконъюгатов
ADC формулы I можно получать несколькими способами, используя реакции, условия и реагенты органической химии, известные специалистам в данной области, включая (1) реакцию нуклеофильной группы антитела с бивалентным линкерным реагентом, с образованием Ab-L посредством ковалентной связи с последующей реакцией с молекулой лекарственного средства D; и (2) реакцию нуклеофильной группы молекулы лекарственного средства с бивалентным линкерным реагентом с образованием D-L посредством ковалентной связи с последующей реакцией с нуклеофильной группой антитела. Иллюстративные способы получения ADC формулы I последним способом описаны в патенте США 20050238649 A1, который включен в настоящий документ в качестве ссылки в полном объеме.
Нуклеофильные группы на антителах включают в качестве неограничивающих примеров (i) N-концевые аминогруппы, (ii) аминогруппы боковых цепей, например, лизина, (iii) тиольные группы боковых цепей, например, цистеина, и (iv) гидроксилы или аминогруппы сахаров, когда антитело гликозилировано. Аминогруппы, тиольные и гидроксильные группы являются нуклеофильными и способны реагировать с образованием ковалентных связей с электрофильными группами на линкерных группах и линкерных реагентах, включая (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галогенформиаты и кислые галогениды; (ii) алкильные и бензильные галогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильную и малеимидную группы. Некоторые антитела обладают поддающимися восстановлению межцепочечными дисульфидами, т.е. цистеиновыми мостиками. Антитела можно преобразовывать в реакционноспособные для конъюгации с линкерными реагентам посредством обработки восстановителем, таким как DTT (дитиотреитол) или трикарбонилэтилфосфин (TCEP), так чтобы антитело было полностью или частично восстановлено. Таким образом, каждый цистеиновый мостик будет, теоретически, образовывать два реакционноспособных тиольных нуклеофила. Альтернативно, сульфгидрильные группы можно вводить в антитела посредством модификации остатков лизина, например, реакцией остатков лизина с 2-иминотиоланом (реагент Трота), приводящей к превращению амина в тиол. Реакционноспособные тиольные группы можно вводить в антитело посредством введения одного, двух, трех, четырех или более остатков цистеина (например, посредством получения вариантов антител, содержащих один или несколько не встречающихся в природе аминокислотных остатков цистеина).
Конъюгаты антитело-лекарственное средство по изобретению также можно получать реакцией между электрофильной группой на антителе, такой как карбонильная альдегидная или кетоновая группа, с нуклеофильной группой на линкерном реагенте или лекарственном средстве. Пригодные нуклеофильные группы на линкерном реагенте включают в качестве неограничивающих примеров гидразид, оксим, амино, гидразин, тиосемикарбазон, карбоксилат гидразина и арилгидразид. В одном из вариантов осуществления антитело модифицируют для введения электрофильных групп, которые способны реагировать с нуклеофильными заместителями на линкерном реагенте или лекарственном средстве. В другом варианте осуществления сахара гликозилированных антител можно окислять, например, посредством окисляющих реагентов на основе перйодата с образованием альдегидных или кетоновых групп, которые могут реагировать с аминогруппой линкерных реагентов или молекул лекарственного средства. Полученные иминные группы основания Шиффа могут образовывать стабильную связь или их можно восстанавливать, например, боргидридными реагентами с образованием стабильных аминных связей. В одном из вариантов осуществления реакция углеводной части гликозилированного антитела либо с галактозооксидазой, либо с метаперйодатом натрия может давать в результате карбонильную группу (альдегид и кетон) в антителе, которая может реагировать с соответствующими группами на лекарственном средстве (Hermanson, Bioconjugate Techniques). В другом варианте осуществления антитела, содержащие N-концевые остатки серина или треонина, можно подвергать реакции с метаперйодатом натрия, приводящей к образованию альдегида вместо первой аминокислоты (Geoghegan & Stroh, (1992) Bioconjugate Chem. 3:138-146; патент США 5362852). Такой альдегид можно подвергать реакции с молекулой лекарственного средства или нуклеофилом линкера.
Нуклеофильные группы на молекуле лекарственного средства включают в качестве неограничивающих примеров аминогруппы, тиольные, гидроксильные, гидразидные, оксимные, гидразинные, тиосемикарбазонные группы, группы карбоксилата гидразина и арилгидразида, способные вступать в реакции с электрофильными группами на линкерных группах и линкерных реагентах с образованием ковалентных связей, включая (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галогенформиаты и кислые галогениды; (ii) алкильные и бензильные галогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильную и малеимидную группы.
Соединения по изобретению конкретно включают в качестве неограничивающих примеров ADC, полученный со следующими поперечно-сшивающими реагентами: BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, в Pierce Biotechnology, Inc., Rockford, IL., U.S.A; см. страницы 467-498, 2003-2004 Applications Handbook and Catalog.
Иммуноконъюгаты, содержащие антитело и цитотоксическое средство, также можно получать с использованием различных бифункциональных средств для присоединения белка, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (таких как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицина можно получать, как описано в Vitetta et al., Science 238:1098 (1987). Иллюстративным хелатирующим средством для конъюгации радионуклида с антителом является меченная углеродом-14 1-изотиоцианатбензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA). См. WO94/11026.
Альтернативно, можно получать слитый белок, содержащий антитело и цитотоксическое средство, например, рекомбинантными способами или пептидным синтезом. Рекомбинантная молекула ДНК может содержать участки, кодирующие антитело и цитотоксические части конъюгата, расположенные рядом друг с другом или разделенные участком, кодирующим линкерный пептид, который не нарушает желаемые свойства конъюгата.
В другом варианте осуществления антитело можно конъюгировать с "рецептором" (таким как стрептавидин) для применения в предварительном нацеливании на опухоль, где конъюгат антитело-рецептор вводят пациенту с последующим удалением не связавшегося конъюгата из кровотока с использованием средства для выведения и с последующим введением "лиганда" (например, авидина), который конъюгирован с цитотоксическим средством (например, с радионуклидом).
2. Иллюстративные иммуноконъюгаты - Конъюгаты тиоантитело-лекарственное средство
Получение модифицированных цистеином антител к CD22
ДНК, кодирующую вариант аминокислотной последовательности модифицированных цистеином антител к CD22 и исходное антитело к CD22 по изобретению, получают различными способами, которые включают в качестве неограничивающих примеров выделение из природного источника (в случае встречающихся в природе вариантов аминокислотной последовательности), получение сайт-специфическим (или опосредуемым олигонуклеотидами) мутагенезом (Carter (1985) et al., Nucleic Acids Res. 13: 4431-4443; Ho et al., (1989) Gene (Amst.) 77: 51-59; Kunkel et al., (1987) Proc. Natl. Acad. Sci. USA 82: 488; Liu et al., (1998) J. Biol. Chem. 273: 20252-20260), ПЦР-мутагенезом (Higuchi, (1990), PCR Protocols, pp.177-183, Academic Press; Ito et al., (1991) Gene 102: 67-70; Bernhard et al., (1994) Bioconjugate Chem. 5: 126-132; и Vallette et al., (1989) Nuc. Acids Res. 17: 723-733) и кассетным мутагенезом (Wells et al., (1985) Gene 34: 315-323) ранее полученной ДНК, кодирующей полипептид. Протоколы мутагенеза, наборы и реагенты являются коммерчески доступными, например, QuikChange® Multi Site-Direct Mutagenesis Kit (Stratagene, La Jolla, CA). Единичные мутации также получают опосредуемым олигонуклеотидами мутагенезом с использованием двухцепочечной плазмидной ДНК в качестве матрицы посредством мутагенеза на основе ПЦР (Sambrook and Russel, (2001) Molecular Cloning: A Laboratory Manual, 3rd edition; Zoller et al., (1983) Methods Enzymol. 100: 468-500; Zoller, M.J. and Smith, M. (1982) Nucl. Acids Res. 10: 6487-6500). Варианты рекомбинантных антител можно конструировать также посредством манипулирования фрагментами рестрикции или посредством перекрывания удлинения ПЦР с синтетическими олигонуклеотидами. Мутагенные праймеры кодируют замену(ы) кодона цистеина. Для получения ДНК, кодирующей мутантные модифицированные цистеином антитела, можно использовать стандартные способы мутагенеза (Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989; и Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing and Wiley-Interscience, New York, N.Y., 1993).
Для получения антител человека к CD22 и фрагментов антител in vitro из набора генов вариабельного (V) домена иммуноглобулина из неиммунизированных доноров можно использовать технологию фагового дисплея (McCafferty et al., (1990) Nature 348: 552-553). В соответствии с этим способом гены V-домена антитела клонируют в рамку считывания в ген основного или минорного белка оболочки нитевидного бактериофага, такого как M13 или fd, и экспонируют в качестве функциональных фрагментов антител на поверхности фаговой частицы. Так как нитевидная частица содержит одноцепочечную копию ДНК фагового генома, селекция на основе функциональных свойств антител также приводит к селекции гена, кодирующего антитело, обладающего этими свойствами. Таким образом, фаг имитирует некоторые из свойств B-клеток (Johnson et al., (1993) Current Opinion in Structural Biology 3:564-571; Clackson et al., (1991) Nature, 352:624-628; Marks et al., (1991) J. Mol. Biol. 222:581-597; Griffith et al., (1993) EMBO J. 12:725-734; патент США 5565332; патент США 5573905; патент США 5567610; патент США 5229275).
Антитела к CD22 можно синтезировать химически с использованием известных способов синтеза олигопептидов или их можно получать и очищать с использованием рекомбинантных технологий. Пригодную аминокислотную последовательность или ее части можно получать прямым пептидным синтезом с использованием твердофазных способов (Stewart et al., Solid-Phase Peptide Synthesis, (1969) W.H. Freeman Co., San Francisco, CA; Merrifield, (1963) J. Am. Chem. Soc, 85:2149-2154). Синтез белков in vitro можно проводить с использованием ручных способов или с помощью автоматов. Автоматизированный твердофазный синтез можно проводить, например, с использованием защищенных посредством t-BOC или Fmoc аминокислот и с применением устройства для синтеза пептидов Applied Biosystems Peptide Synthesizer (Foster City, CA) по инструкциям изготовителя. Различные части антитела к CD22 или полипептида CD22 можно синтезировать химически по отдельности и объединять с использованием химических или ферментативных способов с получением требуемого антитела к CD22 или полипептида CD22.
Для получения фрагментов антител разработаны различные способы. Как правило, эти фрагменты получали посредством протеолитического расщепления исходных антител (Morimoto et al., (1992) Journal of Biochemical and Biophysical Methods 24:107-117; и Brennan et al., (1985) Science, 229:81) или продуцируют непосредственно с помощью рекомбинантных клеток-хозяев. Фрагменты Fab, Fv и ScFv антител к CD22 можно экспрессировать в E.coli и секретировать из E.coli, таким образом, обеспечивая легкое получение больших количеств этих фрагментов. Фрагменты антител можно выделять из фаговых библиотек антител, обсуждаемых в настоящем документе. Альтернативно, фрагменты Fab'-SH можно непосредственно выделять из E.coli и химически связывать с образованием фрагментов (Fab')2 (Carter et al., (1992) Bio/Technology 10:163-167) или выделять непосредственно из культуры рекомбинантных клеток-хозяев. Антитело к CD22 может представлять собой одноцепочечный фрагмент Fv (scFv) (WO 93/16185; патент США 5571894; патент США 5587458). Фрагмент антитела к CD22 также может представлять собой "линейное антитело" (патент США 5641870). Такие линейные фрагменты антител могут быть моноспецифическими или биспецифическими.
Представленное ниже описание относится, главным образом, к получению антител к CD22 посредством культивирования клеток, трансформированных или трансфицированных вектором, содержащим нуклеиновую кислоту, кодирующую антитело к CD22. ДНК, кодирующую антитела к CD22, можно получать из библиотеки кДНК, полученной из ткани, предположительно содержащей мРНК антитела к CD22 и экспрессирующей ее на детектируемом уровне. Таким образом, ДНК антитела к CD22 или полипептида CD22 человека можно удобным образом получать из библиотеки кДНК, полученной из ткани человека. Ген, кодирующий антитело к CD22, также можно получать из геномной библиотеки или известными способами синтеза (например, автоматизированным синтезом нуклеиновых кислот).
Способы конструирования, селекции и получения по изобретению позволяют получать модифицированные цистеином антитела к CD22 с электрофильными группами, которые являются реакционноспособными. Эти способы дополнительно позволяют получать соединения конъюгатов антитела, таким как соединения конъюгат антитело-лекарственное средство (ADC), с молекулами лекарственного средства в указанных, сконструированных, выделенных участках. Реакционноспособные остатки цистеина на поверхности антитела обеспечивают специфическую конъюгацию молекулы лекарственного средства посредством реакционноспособной группы тиола, такой как малеимид или галогенацетил. Нуклеофильная реакционноспособность тиоловой функциональной группы остатка Cys с группой малеимида является приблизительно в 1000 большей, по сравнению с любой другой функциональной группой аминокислот в белке, такой как аминогруппа остатков лизина или N-концевая аминогруппа. Специфичная для тиолов функциональная группа в йодацетильных и малеимидных реагентах может реагировать с аминогруппами, но требуется более высокое значение pH (>9,0) и более длительное время реакции (Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London). Количество свободных тиолов в белке можно определить стандартным анализом Эллмана. Примером связанного дисульфидной связью пентамера является иммуноглобулин M, в то время как примером белка с внутренними дисульфидными мостиками, связывающими вместе субъединицы, является иммуноглобулин G. В таких белках, как эти, для образования реакционноспособного тиола требуется восстановление дисульфидных связей реагентом, таким как дитиотреитол (DTT) или селенол (Singh et al., (2002) Anal. Biochem. 304:147-156). Этот подход может привести к утрате третичной структуры антитела и специфичности связывания антигена.
Анализ Pheselector (Phage ELISA for Selection of Reactive Thiols) позволяет проводить скрининг реакционноспособных групп цистеина в антителах в фаговом формате ELISA, способствуя, таким образом, конструированию модифицированных цистеином антител (WO 2006/034488). Модифицированным цистеином антителом покрывают поверхности лунок, а затем инкубируют с фаговыми частицами, добавляют меченное HRP вторичное антитело и проводят определение поглощения. Мутантные белки, экспонированные на фаге, можно подвергать скринингу быстрым, надежным и высокопроизводительным способом. Можно получать библиотеки модифицированных цистеином антител и подвергать их селекции связывания с использованием того же подхода для идентификации включения соответствующим образом реактивных центров свободного Cys из случайных библиотек антител белок-фаг или других белков. Этот способ включает проведение реакции цистеина мутантных белков, экспрессированных на фаге, с аффинным реагентом или репортерной группой, которая также способна реагировать с тиолом.
Анализ PHESELECTOR позволяет скрининг реактивных тиольных групп в антителах. Идентификация варианта A121C этим способом является иллюстративной. Для идентификации большего количества вариантов ThioFab с реактивными тиольными группами можно эффективно просмотреть целую молекулу Fab. Для идентификации и количественного подсчета доступности растворителя для аминокислотных остатков в полипептиде применяли параметр фракционная поверхностная доступность. Поверхностную доступность можно выражать в виде площади поверхности (Å2), которая может контактировать с молекулой растворителя, например, водой. Пространство, занимаемое водой, приблизительно составляет сферу радиусом 1,4 Å. Программное обеспечение является свободно доступным или лицензируемым (Secretary CCP4, Daresbury Laboratory, Warrington, WA4 4AD, United Kingdom, Fax: (+44) 1925 603825 или в интернете: www.ccp4.ac.uk/dist/html/TNDEX.html) как CCP4 Suite кристаллографических программ, в которых применяются алгоритмы для расчета поверхностной доступности каждой аминокислоты белка с известными рентгенокристаллографически полученными координатами ("The CCP4 Suite: Programs for Protein Crystallography" (1994) Acta. Cryst. D50:760-763). Два иллюстративных модуля программного обеспечения, осуществляющих расчеты поверхностной доступности, представляют собой "AREAIMOL" и "SURFACE", на основе алгоритмов B. Lee и F.M. Richards (1971) J. Mol. Biol. 55: 379-400. AREAIMOL определяет доступную для растворителя поверхность белка как геометрическое место точек центра измерительной сферы (представляющей молекулу растворителя) при прокатывании ее по ван-дер-ваальсовой поверхности белка. AREAIMOL рассчитывает доступную для растворителя площадь поверхности посредством создания точек поверхности на расширенной у каждого атома сфере (на дистанции от центра атома, равной сумме радиусов атома и измерителя) и удаляя те из них, которые лежат lie в эквивалентных сферах, ассоциированных с соседними атомами. AREAIMOL находит доступные для растворителя области атомов в файле координат PDB и суммирует доступные области по остаткам, по цепям и для целой молекулы. Доступные области (или различия областей) для отдельных атомов можно записывать в выходной псевдо-PDB файл. AREAIMOL предполагает один радиус для каждого элемента и распознает только ограниченный ряд различных элементов.
AREAIMOL и SURFACE дают абсолютные доступности, т.е. число ангстрем (Å) в квадрате. Фракционную поверхностную доступность рассчитывают относительно стандартного состояния, свойственного для аминокислоты в полипептиде. Стандартное состояние представляет собой трипептид Gly-X-Gly, где X представляет собой представляющую интерес аминокислоту, и стандартное состояние должно представлять собой "растянутую" конформацию, т.е. подобно конформации в бета-слоях. Растянутая конформация максимизирует доступность X. Рассчитанную доступную область делят на доступную область в стандартном состоянии в трипептиде Gly-X-Gly и получают коэффициент, который представляет собой фракционную доступность. Процент доступности представляет собой фракционную доступность, умноженную на 100. Другой иллюстративный алгоритм для расчета поверхностной доступности основан на модуле SOLV программы xsae (Broger, C., F. Hoffman-LaRoche, Basel), который рассчитывает фракционную доступность аминокислотного остатка для водной сферы на основе радиографических координат полипептида. Фракционную поверхностную доступность для каждой аминокислоты в антителе можно рассчитать с использованием информации о доступных кристаллических структурах (Eigenbrot et al., (1993) J. Mol. Biol. 229: 969-995).
ДНК, кодирующую модифицированные цистеином антитела, легко выделять и секвенировать традиционными способами (например, с использованием олигонуклеотидных зондов, которые способны к специфическому связыванию с генами, кодирующими тяжелые и легкие цепи мышиных антител). В качестве источника такой ДНК служат гибридомные клетки. После выделения ДНК можно помещать в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E.coli, клетки COS обезьян, клетки яичника китайского хомяка (CHO) или другие клетки-хозяева млекопитающих, такие как миеломные клетки (патент США 5807715; патент США 2005/0048572; патент США 2004/0229310), которые иначе не продуцируют белок антитела, с получением синтеза моноклональных антител в рекомбинантных клетках-хозяевах.
После конструирования и отбора модифицированные цистеином антитела, например, ThioFab, со встроенными, высокореактивными, неспаренными остатками Cys, можно получать посредством (i) экспрессии в бактериях, например, системе E.coli (Skerra et al., (1993) Curr. Opinion in Immunol. 5:256-262; Pluckthun (1992) Immunol. Revs. 130:151-188) или системе культуры клеток млекопитающего (WO 01/00245), например, клеток китайского хомяка (CHO); и (ii) очистки с использованием обычных способов очистки белков (Lowman et al., (1991) J. Biol. Chem. 266(17):10982-10988).
Встроенные тиольные группы Cys вступают в реакцию с электрофильными линкерными реагентами и промежуточными соединениями лекарственное средство-линкер с формированием модифицированных цистеином конъюгатов антитело-лекарственное средство и других меченых модифицированных цистеином антител. Остатки Cys модифицированных цистеином антител и находящиеся в исходных антителах, которые являются спаренными и формируют межцепочечные и внутрицепочечные дисульфидные связи, не несут никаких реактивных тиольных групп (если не обработаны восстановителем) и не реагируют с электрофильными линкерными реагентами или промежуточными соединениями лекарственное средство-линкер. Вновь встроенный остаток Cys может остаться неспаренным и способным к реакции, т.е. конъюгировать с электрофильным линкерным реагентом или промежуточным соединением лекарственное средство-линкер, таким как лекарственное средство-малеимид. Иллюстративные промежуточные соединения лекарственное средство-линкер включают MC-MMAE, MC-MMAF, MC-vc-PAB-MMAE и MC-vc-PAB-MMAF. Структурные положения встроенных остатков Cys тяжелых и легких цепей нумеруют в соответствии с системой последовательной нумерации. Эта система последовательной нумерации коррелирует с системой нумерации по Kabat (Kabat et al., (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD), начиная от N-конца, отличаясь от системы нумерации по Kabat (нижняя строка) вставками, обозначенными a, b, c. С использованием системы нумерации по Kabat фактическая линейная аминокислотная последовательность может содержать меньше или дополнительно аминокислот в соответствии с укорочением, вставкой в FR или CDR вариабельного домена. Варианты участков модифицированных цистеином тяжелых цепей указывают по системам последовательной нумерации и нумерации по Kabat.
В одном из вариантов осуществления модифицированное цистеином антитело к CD22 получают способом, включающим
(a) замену одного или нескольких аминокислотных остатков исходного антитела к CD22 цистеином и
(b) определения реакционноспособности тиоловых групп модифицированного цистеином антитела к CD22 посредством реакцией модифицированного цистеином антитело с реагирующим с тиолами реагентом.
Модифицированное цистеином антитело может быть более реакционноспособным с реагирующим с тиолами реагентом, чем исходное антитело.
Аминокислотные остатки свободного цистеина могут находиться в тяжелых или легких цепях или в константных или вариабельных доменах. Фрагменты антител, например, Fab, также можно модифицировать одним или несколькими аминокислотами цистеина, замещая аминокислоты фрагмента антитела, с получением модифицированных цистеином фрагментов антител.
Другой вариант осуществления изобретения относится к способу получения (создания) модифицированного цистеином антитела к CD22, включающему
(a) введение одной или нескольких аминокислот цистеина в исходное антитело к CD22 для получения модифицированного цистеином антитела к CD22 и
(b) определение реакционноспособности тиоловых групп модифицированного цистеином антитела к CD22 посредством реакции модифицированного цистеином антитела с реагирующим с тиолами реагентом;
где модифицированное цистеином антитело является более реакционноспособным с реагирующим с тиолами реагентом, чем исходное антитело.
Стадия (a) способа получения модифицированного цистеином антитела может включать
(i) проведение мутагенеза последовательности нуклеиновой кислоты, кодирующей модифицированное цистеином антитело;
(ii) экспрессию модифицированного цистеином антитела и
(iii) выделение и очистку модифицированного цистеином антитела.
Стадия (b) способа получения модифицированного цистеином антитела может включать экспрессию модифицированного цистеином антитела на вирусной частице, выбранной из фаговой или фагмидной частицы.
Стадия (b) способа получения модифицированного цистеином антитела также может включать
(i) реакцию модифицированного цистеином антитела с реагирующим с тиолом аффинным реагентом с получением аффинно меченного, модифицированного цистеином антитела; и
(ii) измерение связывания аффинно меченного, модифицированного цистеином антитела с захватывающими средами.
Другой вариант осуществления изобретения представляет собой способ скрининга модифицированных цистеином антител с высокореактивными, неспаренными аминокислотами цистеина на реакционноспособность тиоловых групп, включающий
(a) введение одной или нескольких аминокислот цистеина в исходное антитело для получения модифицированного цистеином антитела;
(b) реакцию модифицированного цистеином антитела с реагирующим с тиолами аффинным реагентом с получением аффинно меченного, модифицированного цистеином антитела; и
(c) измерение связывания аффинно меченного, модифицированного цистеином антитела с захватывающими средами; и
(d) определение реакционноспособности тиоловых групп модифицированного цистеином антитела с реагирующим с тиолами реагентом.
Стадия (a) способа скрининга модифицированного цистеином антитела может включать
(i) проведение мутагенеза последовательности нуклеиновой кислоты, кодирующей модифицированное цистеином антитело;
(ii) экспрессию модифицированного цистеином антитела и
(iii) выделение и очистку модифицированного цистеином антитела.
Стадия (b) способа скрининга модифицированных цистеином антител может включать экспрессию модифицированного цистеином антитела на вирусной частице, выбранной из фаговой или фагмидной частицы.
Стадия (b) способа скрининга модифицированных цистеином антител также может включать
(i) реакцию модифицированного цистеином антитела с реагирующим с тиолом аффинным реагентом с получением аффинно меченного, модифицированного цистеином антитела; и
(ii) измерение связывания аффинно меченного, модифицированного цистеином антитела с захватывающими средами.
Модификация вариантов IgG 10F4 к CD22 цистеином
Цистеин вводили в участок 118 (нумерация EU) (эквивалентно положению 121 тяжелой цепи при последовательной нумерации) тяжелой цепи в полноразмерные, химерные исходные моноклональные антитела к CD22 способами модификации цистеином, описываемыми в настоящем документе.
Исходное антитело, "std Anti-CD22 Hu 10F4v3 Fc" (последовательность тяжелой цепи: SEQ ID NO: 88, последовательность легкой цепи: SEQ ID NO: 87, фиг.5B) модифицировали цистеином с получением "A118C thio hu anti-CD22 10F4v3" (последовательность тяжелой цепи: SEQ ID NO: 92, последовательность легкой цепи: SEQ ID NO: 91, фиг.17), "S400C thio hu anti-CD22 10F4v3" (последовательность тяжелой цепи: SEQ ID NO: 93, последовательность легкой цепи: SEQ ID NO: 91, фиг.17), или "V205C thio anti-CD22 10F4v3" (последовательность тяжелой цепи: SEQ ID NO: 88, последовательность легкой цепи: SEQ ID NO: 91, фиг.5B и 17).
Эти модифицированные цистеином моноклональные антитела экспрессировали в клетках CHO (китайского хомячка) кратковременной ферментации в средах, содержащих 1 мМ цистеин.
Меченые модифицированные цистеином антитела к CD22
Модифицированные цистеином антитела к CD22 можно сайт-специфически и эффективно связывать с реагирующим с тиолами реагентом. Реагирующий с тиолами реагент может представлять собой полифункциональный линкерный реагент, захватывающий, т.е. аффинный, метящий реагент (например, реагент в виде биотинового линкера), детектируемую метку (например, флуорофорный реагент), средство иммобилизации на твердой фазе (например, SEPHAROSE™, полистироле или стекле) или промежуточное соединение лекарственное средство-линкер. Один пример реагирующего с тиолами реагента представляет собой N-этилмалеимид (NEM). В иллюстративном варианте осуществления реакция ThioFab с реагентом биотин-линкер дает биотинилированный ThioFab, посредством которого можно детектировать и измерять присутствие и реактивность сконструированного остатка цистеина. Реакция ThioFab с полифункциональным линкерным реагентом дает ThioFab с функциональным линкером, с которым можно дополнительно проводить реакцию с реагентом молекулы лекарственного средства или другой меткой. Реакция ThioFab с промежуточным соединением лекарственное средство-линкер дает конъюгат ThioFab-лекарственное средство.
Иллюстративные способы, описанные в настоящем документе, можно применять в основном для идентификации и получения антител, а в более общем смысле для других белков посредством применения конструирования и этапов скрининга, описываемых в настоящем документе.
Такой подход можно применять для конъюгации других вступающих в реакцию с тиолами реагентов, в которых реактивная группа представляет собой, например, малеимид, йодацетамид, пиридилдисульфид, или другой вступающий в реакцию с тиолами конъюгационный партнер (Haugland, 2003, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley, 1992, Bioconjugate Chem. 3:2; Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1:2; Hermanson, G. in Bioconjugate Techniques (1996) Academic Press, San Diego, pp.40-55, 643-671). Реагирующий с тиолами реагент может представлять собой молекулу лекарственного средства, флуорофор, такой как флуоресцентный краситель, подобный флуоресцеину или родамину, хелатирующее средство для визуализации или радиотерапевтический металл, пептидную или непептидную метку или детектируемую метку или модифицирующее клиренс средство, такое как различные изомеры полиэтиленгликоля, пептид, связывающийся с третьим компонентом, или другое углеводное или липофильное средство.
Использование модифицированных цистеином антител к CD22
Модифицированные цистеином антитела к CD22 и их конъюгаты могут найти применение в качестве терапевтических и/или диагностических средств. Настоящее изобретение дополнительно относится к способам профилактики, регуляции, лечения или облегчения одного или нескольких симптомов, ассоциированных со связанным с B-клетками нарушением. В частности настоящее изобретение относится к способам профилактики, регуляции, лечения или облегчения одного или нескольких симптомов, ассоциированных с клеточным пролиферативным нарушением, таким как злокачественная опухоль, например, лимфома, неходжкинская лимфома (NHL), агрессивная NHL, рецидивирующая агрессивная NHL, рецидивирующая медленно растущая NHL, рефракторная NHL, рефракторная медленно растущая NHL, хронический лимфолейкоз (CLL), мелкоклеточная лимфома, лейкоз, волосатоклеточный лейкоз (HCL), острый лимфоцитарный лейкоз (ALL) и лимфома мантийных клеток. Настоящее изобретение дополнительно относится к способам диагностики связанного с CD22 нарушения или предрасположенности к развитию такого нарушения, а также к способам выявления антител и антигенсвязывающих фрагментов антител, которые предпочтительно связываются с ассоциированными с B-клетками полипептидами CD22.
Другой вариант осуществления настоящего изобретения относится к использованию модифицированных цистеином антител к CD22 для получения лекарственного средства, пригодного для лечения состояния, которое отвечает за связанное с B-клетками нарушение.
Конъюгаты модифицированное цистеином антитело-лекарственное средство (конъюгаты тиоантитело-лекарственное средство)
Другим аспектом изобретения является соединение конъюгата антитело-лекарственное средство, содержащее модифицированное цистеином антитело к CD22 (Ab) и молекула лекарственного средства (D) ауристатин, где модифицированное цистеином антитело посредством линкерной группы (L) связано одним или несколькими аминокислотами свободного цистеина с D; где соединение имеет формулу I:
где p представляет собой 1, 2, 3 или 4; и где модифицированное цистеином антитело получают способом, включающим замену одного или нескольких аминокислотные остатков исходного антитела к CD22 одной или несколькими аминокислотами свободного цистеина.
На фиг.10 показаны варианты осуществления модифицированных цистеином конъюгатов антитело к CD22-лекарственное средство (ADC), где молекула лекарственного средства ауристатина связана с функциональной группой полученного в результате конструирования цистеина в легкой цепи (LC-ADC); тяжелой цепи (HC-ADC) и Fc-области (Fc-ADC).
Потенциальные преимущества модифицированных цистеином конъюгатов антитело к CD22-лекарственное средство включают улучшенную безопасность (больший терапевтический индекс), улучшенные параметры PK, сохраняются межцепочечные дисульфидные связи антитела, которые могут стабилизировать конъюгат и сохранять его активную связывающую конформацию, определены участки конъюгации лекарственного средства и получение модифицированных цистеином конъюгатов антитело-лекарственное средство посредством конъюгации модифицированных цистеином антител с реагентами лекарственное средство-линкер приводит к более гомогенному продукту.
Линкеры
"Линкер", "линкерная единица" или "линк" означает химическую молекулу, содержащую ковалентную связь или цепь атомов, которые ковалентно связывают антитело с молекулой лекарственного средства. В различных вариантах осуществления линкер указан как L. "Линкер" (L) представляет собой бифункциональную или полифункциональную молекулу, которую можно использовать для связывания одной или нескольких молекул лекарственного средства (D) и антитела (Ab) с получением конъюгатов антитело-лекарственное средство (ADC) формулы I. Конъюгаты антитело-лекарственное средство (ADC) можно удобно получать с использованием линкера с реакционноспособной функциональной группой для связывания с лекарственным средством и с антителом. Тиол цистеина модифицированного цистеином антитела (Ab) может формировать связь с электрофильной функциональной группой линкерного реагента, молекулой лекарственного средства или промежуточным соединением лекарственное средство-линкер.
В одном из аспектов линкер содержит реактивный центр, который содержит электрофильную группу, которая может реагировать с нуклеофильным цистеином, находящимся на антителе. Тиол цистеина антитела реагирует с электрофильной группой на линкере и образует ковалентную связь с линкером. Пригодные электрофильные группы включают в качестве неограничивающих примеров малеимидную и галогенацетамидную группы.
Линкеры включают бивалентный радикал, такой как алкилдиил, арилен, гетероарилен, такие группы, как -(CR2)nO(CR2)n-, повторяющиеся единицы алкилокси (например, полиэтиленокси, PEG, полиметиленокси) и алкиламино (например, полиэтиленамино, Jeffamine™); и сложный эфир двухосновной кислоты и амиды, включая сукцинат, сукцинамид, дигликолат, малонат и капроамид.
Модифицированные цистеином антитела реагируют с линкерными реагентами или промежуточными соединениями лекарственное средство-линкер, с электрофильными функциональными группами, такими как малеимид или α-галогенкарбонил, в соответствии со способом конъюгации на странице 766 в Klussman, et al., (2004), Bioconjugate Chemistry 15(4):765-773, и в соответствии с протоколом примера x.
Линкер может состоять из одного или нескольких линкерных компонентов. Иллюстративные линкерные компоненты включают 6-малеимидокапроил ("MC"), малеимидопропаноил ("MP"), валин-цитруллин ("val-cit" или "vc"), аланин-фенилаланин ("ala-phe" или "af'), п-аминобензилоксикарбонил ("PAB"), N-сукцинимидил 4-(2-пиридилтио)пентаноат ("SPP"), N-сукцинимидил 4-(N-малеимидометил)циклогексан-1-карбоксилат ("SMCC), N-сукцинимидил-(4-йодацетил)аминобензоат ("SIAB"), этиленокси-CH2CH2O- в виде одной или нескольких повторяющихся единиц ("EO" или "PEO"). Дополнительные линкерные компоненты известны в данной области, а некоторые описаны в настоящем документе.
В одном из вариантов осуществления линкер L ADC имеет формулу:
-Aa-Ww-Yy-
где
-A- представляет собой удлинитель, ковалентно связанный с тиолом цистеина антитела (Ab);
a представляет собой 0 или 1;
каждый -W- независимо представляет собой аминокислотную единицу;
w независимо представляет собой целое число в диапазоне от 0 до 12;
-Y- представляет собой спейсерную единицу ковалентно связанную с молекулой лекарственного средства; и
y представляет собой 0, 1 или 2.
Удлинитель
Удлинитель (-A-), когда присутствует, способен к связыванию антитела с аминокислотной единицей (-W-). При этом антитело (Ab) несет функциональную группу, которая может формировать связь с функциональной группой удлинителя. Пригодные функциональные группы, которые могут присутствовать на антителе в природе или посредством химической манипуляции, включают в качестве неограничивающих примеров сульфгидрильную (-SH), амино, гидроксильную, карбокси, аномерную гидроксильную группу углевода и карбоксил. В одном из аспектов функциональные группы антитела представляют собой сульфгидрильные или аминогруппы. Сульфгидрильные группы можно получать посредством восстановления внутримолекулярной дисульфидной связи антитела. Альтернативно, сульфгидрильные группы можно получать посредством реакции аминогруппы остатка лизина антитела с применением 2-иминотиолана (реагент Трота) или другого дающего сульфгидрилы реагента. В одном из вариантов осуществления антитело (Ab) несет свободную тиольную группу цистеина, которая может образовывать связь с электрофильной функциональной группой удлинителя. Иллюстративные удлинители в конъюгатах формулы I изображены формулами II и III, где Ab-, -W-, -Y-, -D, w и y являются такими, как определено выше, и R17 представляет собой бивалентный радикал, выбранный из (CH2)r, C3-C8-карбоциклила, O-(CH2)r, арилена, (CH2)r-арилена, -арилен-(CH2)r-, (CH2)r-(C3-C8-карбоциклила), (C3-C8-карбоциклил)-(CH2)r, C3-C8-гетероциклила, (CH2)r-(C3-C8-гетероциклила), -(C3-C8-гетероциклил)-(CH2)r-, -(CH2)rC(O)NRb(CH2)r-, -(CH2CH2O)r-, -(CH2CH2O)r-CH2-, -(CH2)rC(O)NRb(CH2CH2O)r-, -(CH2)rC(O)NRb(CH2CH2O)r-CH2-, -(CH2CH2O)rC(O)NRb(CH2CH2O)r-, -(CH2CH2O)rC(O)NRb(CH2CH2O)r-CH2- и -(CH2CH2O)rC(O)NRb(CH2)r-; где Rb представляет собой H, C1-C6-алкил, фенил или бензил; и r независимо представляет собой число в диапазоне 1-10.
Арилен включает бивалентные ароматические углеводородные радикалы из 6-20 атомов углерода, полученные посредством удаления двух атомов водорода из ароматической циклической системы. Типичные ариленовые группы включают в качестве неограничивающих примеров радикалы, происходящие из бензола, замещенного бензола, нафталина, антрацена, бифенила и т.п.
Гетероциклические группы включают циклическую систему, в которой один или несколько циклических атомов представляют собой гетероатом, например, азот, кислород и серу. Гетероциклический радикал содержит от 1 до 20 атомов углерода и от 1 до 3 гетероатомов, выбранных из N, O, P и S. Гетероцикл может представлять собой моноцикл с количеством членов в цикле от 3 до 7 (от 2 до 6 атомов углерода и от 1 до 3 гетероатомов, выбранных из N, O, P и S) или бицикл с количеством циклических членов от 7 до 10 (от 4 до 9 атомов углерода и от 1 до 3 гетероатомов, выбранных из N, O, P и S), например, система бицикло [4,5], [5,5], [5,6] или [6,6]. Гетероциклы описаны в Paquette, Leo A.; "Principles of Modern Heterocyclic Chemistry" (W.A. Benjamin, New York, 1968), особенно в главах 1, 3, 4, 6, 7 и 9; "The Chemistry of Heterocyclic Compounds, A series of Monographs" (John Wiley & Sons, New York, с 1950 года до настоящего времени), конкретно в томах 13, 14, 16, 19 и 28; и J. Am. Chem. Soc. (1960) 82:5566.
Примеры гетероциклов включают в качестве примера, а не ограничения пиридил, дигидропиридил, тетрагидропиридил (пиперидил), тиазолил, тетрагидротиофенил, окисленный серой тетрагидротиофенил, пиримидинил, фуранил, тиенил, пирролил, пиразолил, имидазолил, тетразолил, бензофуранил, тианафталинил, индолил, индоленил, хинолинил, изохинолинил, бензимидазолил, пиперидинил, 4-пиперидонил, пирролидинил, 2-пирролидонил, пирролинил, тетрагидрофуранил, бис-тетрагидрофуранил, тетрагидропиранил, бис-тетрагидропиранил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидрохинолинил, октагидроизохинолинил, азоцинил, триазинил, 6H-1,2,5-тиадизинил, 2H,6H-1,5,2-дитиазинил, тиенил, тиантренил, пиранил, изобензофуранил, хроменил, ксантенил, феноксатинил, 2H-пирролил, изотиазолил, изоксазолил, пиразинил, пиридазинил, индолизинил, изоиндолил, 3H-индолил, 1H-индазолил, пуринил, 4H-хинолизинил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, циннолинил, птеридинил, 4Ah-карбазолил, карбазолил, β-карболинил, фенантридинил, акридинил, пиримидинил, фенантролинил, феназинил, фенотиазинил, фуразинил, феноксазинил, изохроманил, хроманил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперазинил, индолинил, изоиндолинил, хинуклидинил, морфолинил, оксазолидинил, бензотриазолил, бензизоксазолил, оксиндолил, бензоксазолинил и изатиноил.
Карбоциклические группы включают насыщенные или ненасыщенные циклические системы с количеством атомов углерода от 3 до 7 в виде моноцикла или от 7 до 12 в виде бицикла. Моноциклические карбоциклы содержат от 3 до 6 циклических атомов, более обычно 5 или 6 циклических атомов. Бициклические карбоциклы содержат от 7 до 12 циклических атомов, например, расположенных в виде системы бицикло [4,5], [5,5], [5,6] или [6,6], или 9 или 10 циклических атомов, расположенных в виде системы бицикло [5,6] или [6,6]. Примеры моноциклических углеродных циклических систем включают циклопропил, циклобутил, циклопентил, 1-циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-1-енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил, циклогептил и циклооктил.
На основании всех иллюстративных вариантов осуществления ADC формулы I, таких как II-VI, следует понимать, что даже когда явно не указано, с антителом связано от 1 до 4 молекул лекарственного средства (p=1-4), в зависимости от количество встроенных остатков цистеина.

Иллюстративный удлинитель формулы II получен из малеимидо-капроила (MC), где R17 представляет собой -(CH2)5-:

Иллюстративный удлинитель формулы II получен и из малеимидо-пропаноила (MP), где R17 представляет собой -(CH2)2-:

Другой иллюстративный удлинитель формулы II, где R17 представляет собой -(CH2CH2O)r-CH2- и r представляет собой 2:

Другой иллюстративный удлинитель формулы II, где R17 представляет собой -(CH2)rC(O)NRb(CH2CH2O)r-CH2-, где Rb представляет собой H и каждый r представляет собой 2:
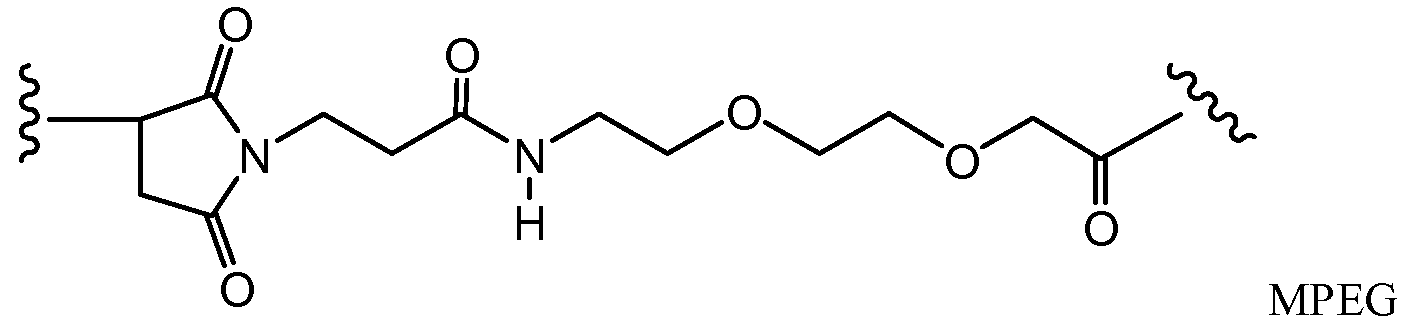
Иллюстративный удлинитель формулы III, где R17 представляет собой -(CH2)5-:

В другом варианте осуществления удлинитель связан с модифицированным цистеином антителом к CD22 посредством дисульфидной связи между встроенным атомом серы цистеина антитела и атомом серы удлинителя. Репрезентативный удлинитель по этому варианту изобретения представлен формулой IV, где R17, Ab-, -W-, -Y-, -D, w и y являются такими, как определено выше.

В другом варианте осуществления реактивная группа удлинителя содержит реагирующую с тиолами функциональную группу, которая может формировать связь со свободным тиолом цистеина антитела. Примеры реагирующих с тиолами функциональных групп включают в качестве неограничивающих примеров малеимид, α-галогенацетил, активированные сложные эфиры, такие как сукцинимидные сложные эфиры, 4-нитрофенильные сложные эфиры, пентафлуоренильные сложные эфиры, тетрафлуоренильные сложные эфиры, ангидриды, хлорангидриды, сульфонилхлориды, изоцианаты и изотиоцианаты. Репрезентативные удлинители по данному варианту осуществления представлены формулами Va и Vb, где -R17-, Ab-, -W-, -Y-, -D, w и y являются такими, как определено выше;


В другом варианте осуществления линкер может представлять собой линкер разветвленного типа для ковалентного присоединения к антителу более одной молекулы лекарственного средства через разветвленную полифункциональную молекулу линкера (Sun et al., (2002) Bioorganic & Medicinal Chemistry Letters 12:2213-2215; Sun et al., (2003) Bioorganic & Medicinal Chemistry 11:1761-1768; King (2002) Tetrahedron Letters 43:1987-1990). Разветвленные линкеры могут увеличивать молярное соотношение лекарственного средства к антителу, т.е. нагрузку, которая связана с эффективностью ADC. Таким образом, когда модифицированное цистеином антитело несет только одну реакционноспособную тиольную группу цистеина, множество молекул лекарственного средства можно присоединить посредством разветвленного линкера.
Аминокислотная единица
Линкер может содержать аминокислотные остатки. Аминокислотная единица (-Ww-), когда присутствует, связывает антитело (Ab) с молекулой лекарственного средства (D), модифицированного цистеином конъюгата антитело-лекарственное средство (ADC) по изобретению.
-Ww- представляет собой дипептидную, трипептидную, тетрапептидную, пентапептидную, гексапептидную, гептапептидную, октапептидную, нонапептидную, декапептидную, ундекапептидную или додекапептидную единицу. Аминокислотные остатки, составляющие аминокислотную единицу, включают остатки, встречающиеся в природе, а также минорные аминокислоты и не встречающиеся в природе аналоги аминокислот, такие как цитруллин. Каждая единица -W- независимо обладает приведенной ниже в квадратных скобках формулой, а w представляет собой целое число в диапазоне от 0 до 12:

где R19 представляет собой водород, метил, изопропил, изобутил, втор-бутил, бензил, п-гидроксибензил, -CH2OH, -CH(OH)CH3, -CH2CH2SCH3, -CH2CONH2, -CH2COOH, -CH2CH2CONH2, -CH2CH2COOH, -(CH2)3NHC(=NH)NH2, -(CH2)3NH2, -(CH2)3NHCOCH3, -(CH2)3NHCHO, -(CH2)4NHC(=NH)NH2, -(CH2)4NH2, -(CH2)4NHCOCH3, -(CH2)4NHCHO, -(CH2)3NHCONH2, -(CH2)4NHCONH2, -CH2CH2CH(OH)CH2NH2, 2-пиридилметил-, 3-пиридилметил-, 4-пиридилметил-, фенил, циклогексил.

Когда R19 отличается от водорода, атом углерода, с которым связан R19, является хиральным. Каждый атом углерода, к которому присоединен R19, независимо находится в (S)- или (R)-конфигурации, или в рацемической смеси. Таким образом, аминокислотные единицы могут быть энантиомерно чистыми, рацемическими или диастереомерными.
Иллюстративные аминокислотные единицы -Ww- включают дипептид, трипептид, тетрапептид или пентапептид. Иллюстративные дипептиды включают валин-цитруллин (vc или val-cit), аланин-фенилаланин (af или ala-phe). Иллюстративные трипептиды включают глицин-валин-цитруллин (gly-val-cit) и глицин-глицин-глицин (gly-gly-gly). Аминокислотные остатки, которые составляют аминокислотный линкерный компонент, включают остатки, встречающиеся в природе, а также минорные аминокислоты и не встречающиеся в природе аналоги аминокислот, такие как цитруллин.
Аминокислотную единицу можно ферментативно расщеплять одним или несколькими ферментами, включая ассоциированную с опухолями протеазу, с высвобождением молекулы лекарственного средства (-D), которая в одном из вариантов осуществления после высвобождения in vivo протонируется с получением лекарственного средства (D). Аминокислотные линкерные компоненты можно сконструировать и оптимизировать по их селективности для ферментативного расщепления посредством конкретных ферментов, например, ассоциированной с опухолями протеазой, катепсином B, C и D или протеазой плазмином.
Спейсерная единица
Спейсерная единица (-Yy-), когда она присутствует (y=1 или 2), связывает аминокислотную единицу (-Ww-) с молекулой лекарственного средства (D), когда аминокислотная единица присутствует (w=1-12). Альтернативно, спейсерная единица связывает удлинитель с молекулой лекарственного средства, когда аминокислотная единица отсутствует. Спейсерная единица также связывает молекулу лекарственного средства с единицей антитела, когда аминокислотная единица и удлиняющий элемент отсутствуют (w, y=0). Спейсерные единицы бывают двух основных типов: самоудаляющиеся и не самоудаляющиеся. Не самоудаляющаяся спейсерная единица представляет собой спейсерную единицу, в которой часть спейсерной единицы или вся спейсерная единица остается в связанном состоянии с молекулой лекарственного средства после отщепления, в частности ферментативного, аминокислотного элемента от конъюгата антитело-лекарственное средство или молекула лекарственного средства-линкер. Когда ADC, содержащий глицин-глициновую спейсерную единицу или глициновую спейсерную единицу, подвергается ферментативному расщеплению ассоциированной с опухолевыми клетками протеазой, ассоциированной со злокачественной опухолью протеазой или ассоциированной с лимфоцитами протеазой, глицин-глицин-молекула лекарственного средства или глицин-молекула лекарственного средства отщепляются от Ab-Aa-Ww-. В одном из вариантов осуществления в клетке-мишени происходит независимая реакция гидролиза, расщепляющая связь глицин-молекула лекарственного средства и высвобождающая лекарственное средство.
В другом варианте осуществления -Yy- представляет собой п-аминобензилкарбамоильную (PAB) единицу, у которой фениленовая часть замещена Qm, где Q представляет собой -C1-C8-алкил, -O-(C1-C8-алкил), -галоген, -нитро или -циано; и m представляет собой число в диапазоне от 0-4.
Иллюстративные варианты осуществления не самоудаляющейся спейсерной единицы (-Y-) представляют собой: -Gly-Gly-; -Gly-; -Ala-Phe-; -Val-Cit-.
В одном из вариантов осуществления предоставлена молекула лекарственного средства-линкер или ADC, в которых спейсерная единица отсутствует (y=0), или их фармацевтически приемлемая соль или сольват.
Альтернативно, ADC, содержащий самоудаляющуюся спейсерную единицу, может высвобождать -D. В одном из вариантов осуществления -Y- представляет собой группу PAB, которая связана с -Ww- посредством атома азота амино в группе PAB, и соединена непосредственно с -D через карбонатную, карбаматную группу или группу простого эфира, где ADC имеет иллюстративную структуру:

где Q представляет собой -C1-C8-алкил, -O-(C1-C8-алкил), -галоген, -нитро или -циано; m представляет собой целое число в диапазоне от 0-4; и p находится в диапазоне от 1 до 4.
Другие примеры самоудаляющихся спейсеров включают в качестве неограничивающих примеров ароматические соединения, которые электронно сходны с группой PAB, такой как производные 2-аминоимидазол-5-метанола (Hay et al., (1999) Bioorg. Med. Chem. Lett. 9:2237), гетероциклические аналоги PAB (патент США 2005/0256030), бета-гликуронид (WO 2007/011968), и орто- или парааминобензилацетали. Можно использовать спейсеры, которые подвергаются циклизации при гидролизе амидной связи, такие как замещенные и незамещенные амиды 4-аминомасляной кислоты (Rodrigues et al., (1995) Chemistry Biology 2:223), соответствующим образом замещенные кольцевые системы бицикло[2.2.1] и бицикло[2.2.2] (Storm et al., (1972) J. Amer. Chem. Soc. 94:5815) и амиды 2-аминофенилпропионовой кислоты (Amsberry, et al., (1990) J. Org. Chem. 55:5867). Удаление содержащих амин лекарственных средств, которые замещены по глицину (Kingsbury et al., (1984) J. Med. Chem. 27:1447), также является примером самоудаляющегося спейсера, пригодного в ADC.
Иллюстративные спейсерные единицы (-Yy-) соответствуют формулам X-XII:
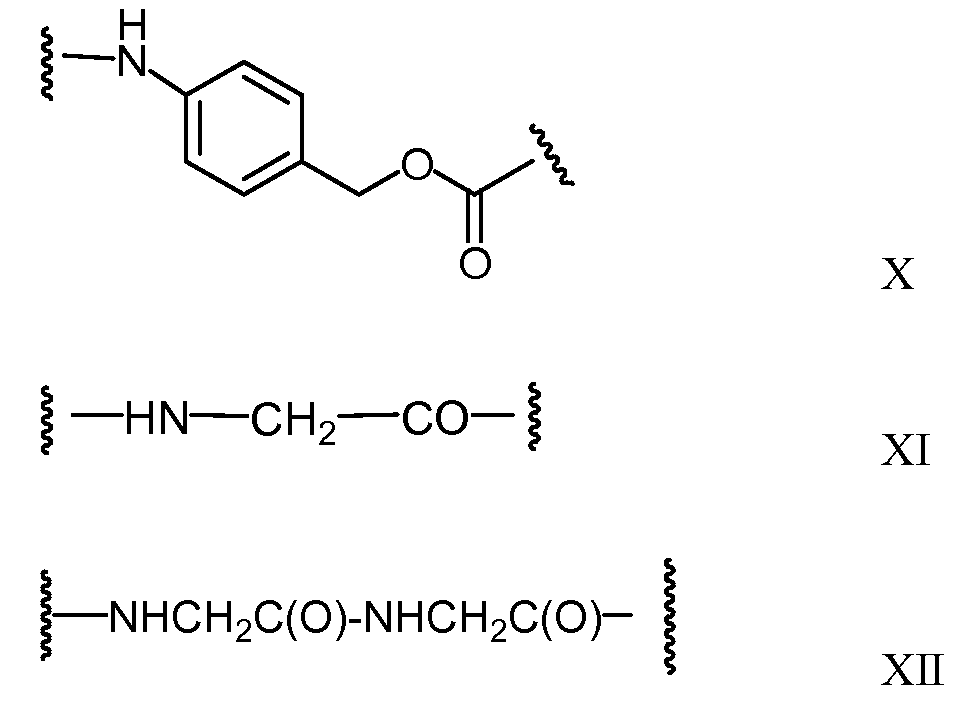
Разветвленные линкеры
В другом варианте осуществления линкер L может представлять собой линкер разветвленного типа для ковалентного присоединения к антителу более чем одной молекулы лекарственного средства посредством разветвленной полифункциональной линкерной группы (Sun et al., (2002) Bioorganic & Medicinal Chemistry Letters 12:2213-2215; Sun et al., (2003) Bioorganic & Medicinal Chemistry 11:1761-1768). Разветвленные линкеры могут повышать молярное соотношение лекарственного средства и антитела, т.е. нагрузку, которая связана с эффективностью ADC. Таким образом, когда модифицированное цистеином антитело обладает только одной реакционноспособной тиольной группой цистеина, через разветвленный линкер можно присоединять большое число молекул лекарственного средства. Иллюстративные варианты осуществления разветвленных разветвленных линкеров включают 2,6-бис(гидроксиметил)-п-крезольные и 2,4,6-трис(гидроксиметил)фенольные дендримерные элементы (WO 2004/01993; Szalai et al., (2003) J. Amer. Chem. Soc. 125:15688-15689; Shamis et al., (2004) J. Amer. Chem. Soc. 126:1726-1731; Amir et al., (2003) Angew. Chem. Int. Ed. 42:4494-4499).
В одном из вариантов осуществления спейсерная единица представляет собой разветвленный бис(гидроксиметил)стирол (BHMS), который можно использовать для включения и высвобождения множества лекарственных средств, обладающий структурой:

содержащий 2-(4-аминобензилиден)пропан-1,3-диоловую разветвленную единицу (WO 2004/043493; de Groot et al., (2003) Angew. Chem. Int. Ed. 42:4490-4494), где Q представляет собой -C1-C8-алкил, -O-(C1-C8-алкил), -галоген, -нитро или -циано; m представляет собой целое число в диапазоне от 0-4; n представляет собой 0 или 1; и p находится в диапазоне от 1 до 4.
Иллюстративные варианты осуществления соединений конъюгатов антитело-лекарственное средство формулы I включают XIIIa (MC), XIIIb (val-cit), XIIIc (MC-val-cit) и XIIId (MC-val-cit-PAB):
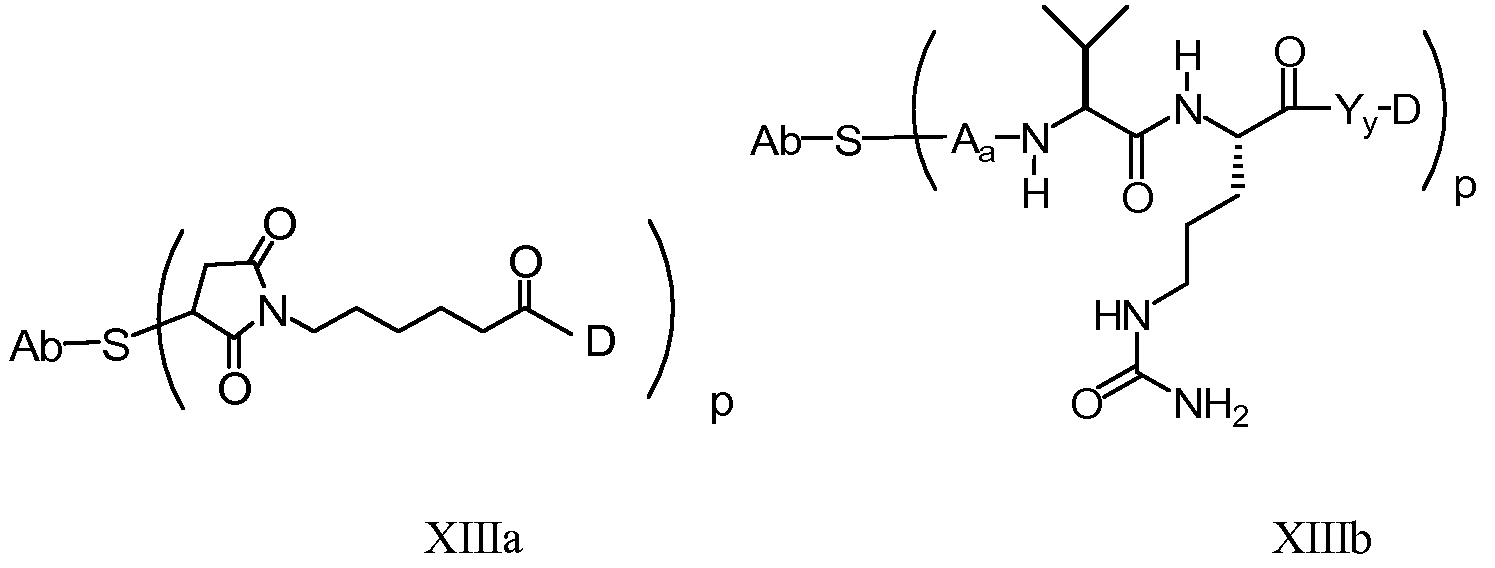
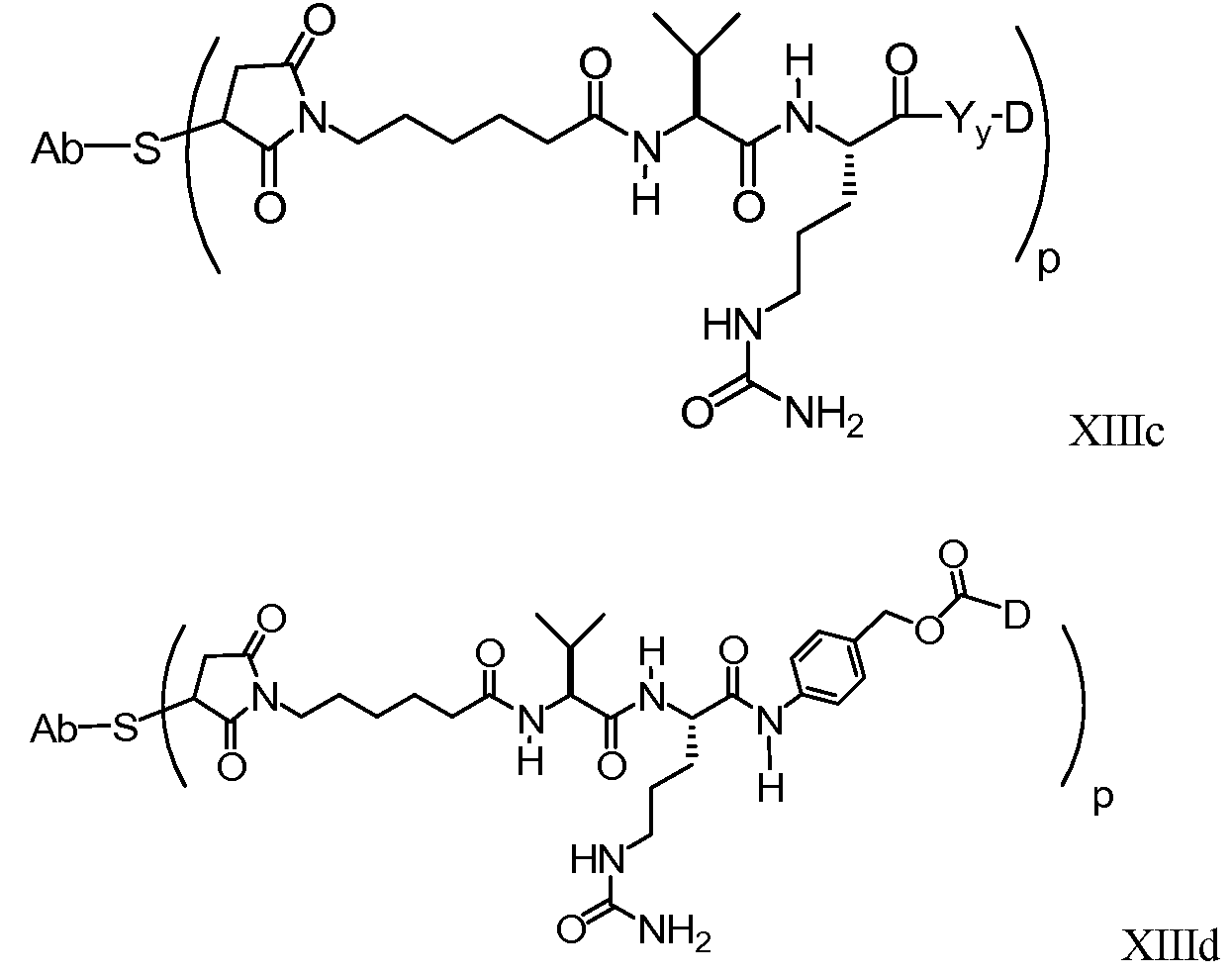
Другие иллюстративные варианты осуществления соединений конъюгатов антитело-лекарственное формулы Ia включают XIVa-e:
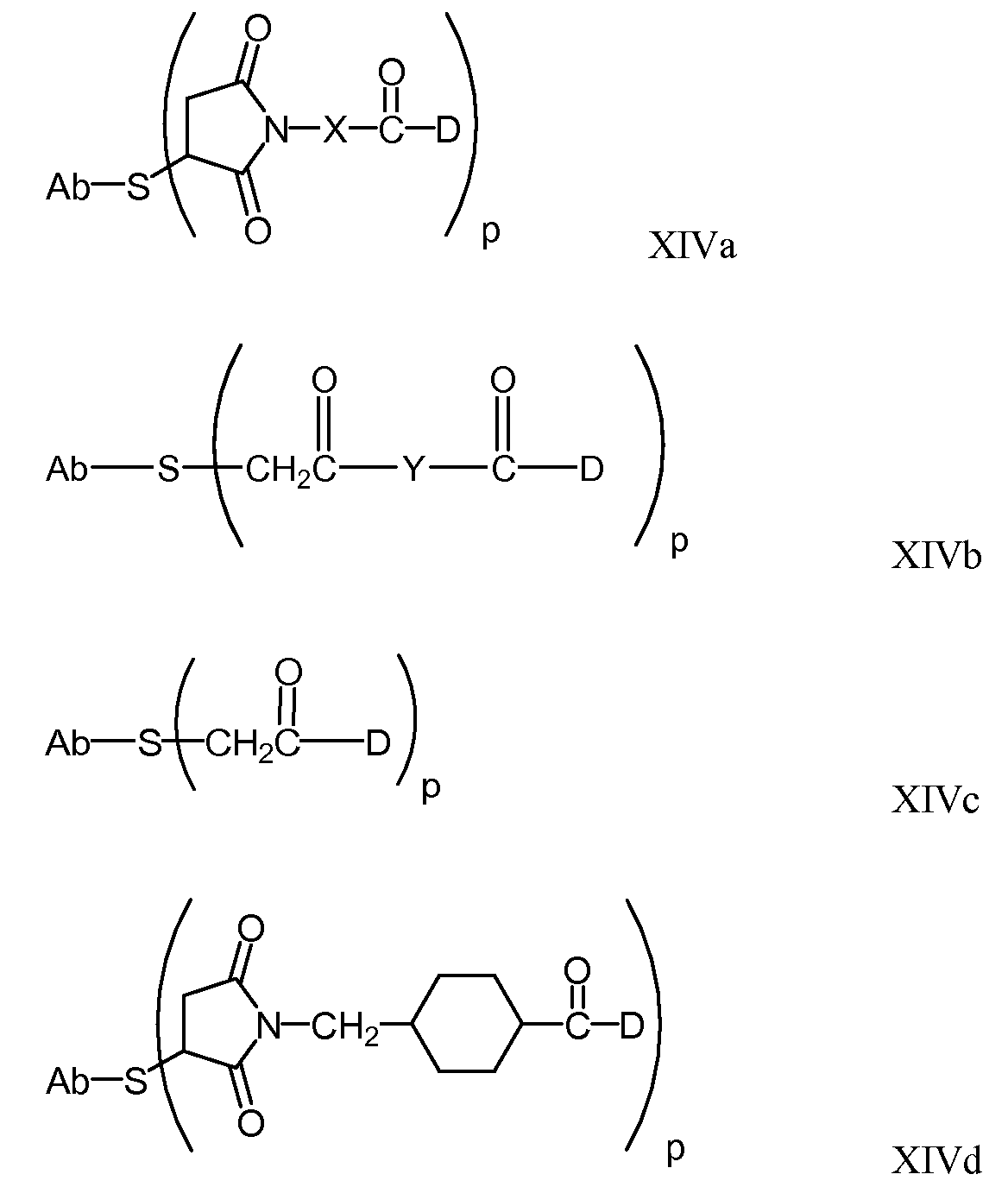

где X представляет собой:
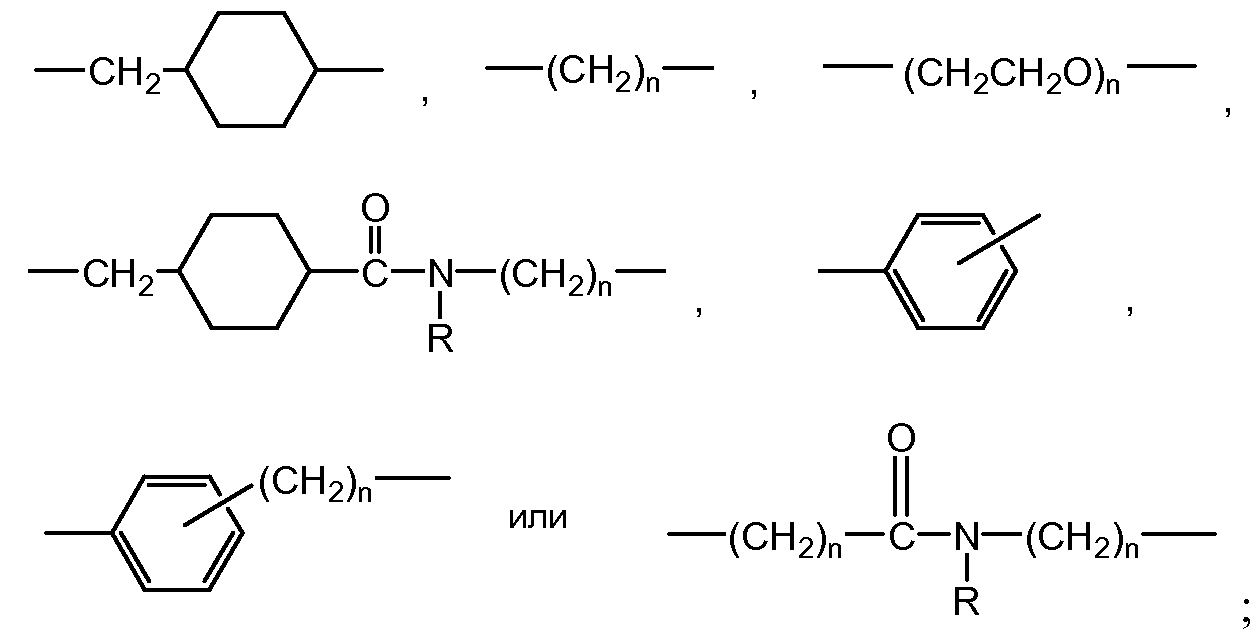
Y представляет собой:

и R независимо представляет собой H или C1-C6-алкил; и n представляет собой от 1 до 12.
В другом варианте осуществления линкер обладает реакционноспособной функциональной группой, которая обладает нуклеофильной группой, которая реагирует с электрофильной группой, присутствующей на антителе. Пригодные электрофильные группы на антителе включают в качестве неограничивающих примеров карбонильные группы альдегидов и кетонов. Гетероатом нуклеофильной группы линкера может реагировать с электрофильной группой на антителе и образовывать ковалентную связь с единицей антитела. Пригодные нуклеофильные группы на линкере включают в качестве неограничивающих примеров гидразид, оксим, амино, гидразин, тиосемикарбазон, карбоксилат гидразина и арилгидразид. Электрофильная группа на антитело обеспечивает удобный участок для связывания с линкером.
Как правило, линкеры пептидного типа можно получать посредством образования пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи можно получать, например, в соответствии со способом синтеза в жидкой фазе (E. Schröder and K. Lubke (1965) "The peptides", volume 1, pp 76-136, Academic Press), которые хорошо известны в области химии пептидов. Промежуточные соединения линкера можно собирать посредством любого сочетания или последовательности реакций, включающих спейсерную, удлиняющую и аминокислотную единицы. Спейсерная, удлиняющая и аминокислотная единицы могут использовать реакционноспособные функциональные группы, которые являются электрофильными, нуклеофильными или свободно-радикальными. Реакционноспособные функциональные группы включают в качестве неограничивающих примеров карбоксилы, гидроксилы, пара-нитрофенилкарбонат, изотиоцианат и уходящие группы, такие как O-мезил, O-тозил, -Cl, -Br, -I; или малеимид.
В другом варианте осуществления линкер может быть замещен группами, которые модулируют растворимость или реакционную способность. Например, заряженный заместитель, такой как сульфонат (-SO3-) или аммоний, может повышать растворимость в воде реагента и облегчать реакцию присоединения линкерного реагента к антителу или молекуле лекарственного средства, или облегчать реакцию связывания Ab-L (промежуточное соединение антитело-линкер) с D, или D-L (промежуточное соединение лекарственное средство-линкер) с Ab, в зависимости от способа синтеза, используемого для получения ADC.
Линкерные реагенты
Конъюгаты антитела и ауристатин можно получать с использованием множества бифункциональных линкерных реагентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол).
Конъюгаты антитело-лекарственное средство также можно получать с линкерными реагентами: BMPEO, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC, и сульфо-SMPB, и SVSB (сукцинимидил-(4-винилсульфон)бензоат), и включая бис-малеимидные реагенты: DTME, BMB, BMDB, BMH, BMOE, BM(PEO)3 и BM(PEO)4, которые коммерчески доступны от Pierce Biotechnology, Inc., Customer Service Department, P.O. Box 117, Rockford, TL. 61105 U.S.A, U.S.A 1-800-874-3723, International +815-968-0747. Бис-малеимидные реагенты позволяют присоединение тиольной группы модифицированного цистеином антитела к содержащей тиол молекуле лекарственного средства, метке или промежуточному соединению линкера, последовательно или одновременно. Другие функциональные группы, помимо малеимида, которые реагируют с тиольной группой модифицированного цистеином антитела, молекулой лекарственного средства, меткой или промежуточным соединением линкера, включают йодацетамид, бромацетамид, винилпиридин, дисульфид, пиридилдисульфид, изоцианат и изотиоцианат.

Пригодные линкерные реагенты также можно получать из других коммерческих источников, таких как Molecular Biosciences Inc. (Boulder, CO), или синтезировать в соответствии со способами, описанными в Toki et al., (2002) J. Org. Chem. 67:1866-1872; Walker, M.A. (1995) J. Org. Chem. 60:5352-5355; Frisch et al., (1996) Bioconjugate Chem. 7:180-186; патенте США 6214345; WO 02/088172; патенте США 2003130189; US 2003096743; WO 03/026577; WO 03/043583 и WO 04/032828.
Удлинители формулы (IIIa) можно вводить в линкер реакцией следующих линкерных реагентов с N-концом аминокислотной единицы:

где n представляет собой число в диапазоне от 1-10 и T представляет собой -H или -SO3Na;

где n представляет собой число в диапазоне от 0-3;



Удлинители можно вводить в линкер реакцией следующих бифункциональных реагентов с N-концом аминокислотной единицы:

где X представляет собой Br или I.
Удлинители формулы также можно вводить в линкер реакцией следующих бифункциональных реагентов с N-концом аминокислотной единицы:


Иллюстративный дипептидный линкерный реагент валин-цитруллин (val-cit или vc), содержащий малеимидный удлинитель и пара-аминобензилкарбамоильный (PAB) самоудаляющийся спейсер, обладает структурой:

Иллюстративный дипептидный линкерный реагент phe-lys (Mtr, моно-4-метокситритил), содержащий малеимидный удлинитель и самоудаляющуюся спейсерную единицу PAB, можно получать по Dubowchik, et al., (1997) Tetrahedron Letters, 38:5257-60, и он обладает структурой:

Иллюстративные соединения конъюгат антитело-лекарственное средство по изобретению включают:


где Val представляет собой валин; Cit представляет собой цитруллин; p представляет собой 1, 2, 3 или 4; и Ab представляет собой модифицированное цистеином антитело к CD22.
Получение модифицированных цистеином конъюгатов антитело к CD22-лекарственное средство
ADC формулы I можно получать несколькими способами, используя реакции, условия и реагенты органической химии, известные специалистам в данной области, включая (1) реакцию группы цистеина модифицированного цистеином антитела с линкерным реагентом, с образованием промежуточного соединения антитело-линкер Ab-L, через ковалентную связь, с последующей реакцией с активированной молекулой лекарственного средства D; и (2) реакцию нуклеофильной группы молекулы лекарственного средства с линкерным реагентом, с образованием промежуточного соединения лекарственное средство-линкер D-L, через ковалентную связь, с последующей реакцией с группой цистеина, модифицированного цистеином антитела. Способы конъюгации (1) и (2) можно использовать для множества модифицированных цистеином антител, молекул лекарственного средства и линкеров с получением конъюгатов антитело-лекарственное средство формулы I.
Тиольные группы цистеина антитела являются нуклеофильными и способны реагировать с образованием ковалентных связей с электрофильными группами на линкерных реагентах и промежуточных соединениях лекарственное средство-линкер, включая (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галогенформиаты и кислые галогениды; (ii) алкильные и бензильные галогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильную и малеимидную группы; и (iv) дисульфиды, включая пиридилдисульфиды, посредством сульфидного обмена. Нуклеофильные группы на молекуле лекарственного средства включают в качестве неограничивающих примеров амин, тиол, гидроксил, гидразид, оксим, гидразин, тиосемикарбазон, карбоксилат гидразина и арилгидразидные группы, способные реагировать с образованием ковалентных связей с электрофильными группами на линкерных группах и линкерных реагентах.
Модифицированные цистеином антитела можно преобразовывать в реакционноспособные для конъюгации с линкерными реагентами обработкой восстановителем, таким как DTT (реактив Клеланда, дитиотреитол) или TCEP (гидрохлорид трис(2-карбоксиэтил)фосфина; Getz et al., (1999) Anal. Biochem. Vol.273: 73-80; Soltec Ventures, Beverly, MA), с последующим повторным окислением для повторного образования межцепочечных и внутрицепочечных дисульфидных связей (пример x). Например, полноразмерные, модифицированные цистеином моноклональные антитела (тиомабы), экспрессированные в клетках CHO восстанавливают посредством приблизительно 50-кратного избытка TCEP в течение 3 ч при 37°C для восстановления дисульфидных связей в цистеиновых аддуктах, которые могут образовываться между вновь введенными остатками цистеина и цистеином, присутствующим в средах для культивирования. Восстановленный тиомаб разбавляют и наносят на колонку HiTrap S в 10 мМ ацетате натрия, pH 5 и элюируют посредством PBS, содержащего 0,3 M хлорид натрия. Дисульфидные связи повторно устанавливали между остатками цистеина, присутствующими в исходном Mab с разбавленным (200 нМ) водным сульфатом меди (CuSO4) при комнатной температуре, в течение ночи. Альтернативно, дегидроаскорбиновая кислота (DHAA) является эффективным окислителем для повторного установления межцепочечных дисульфидных групп модифицированного цистеином антитела после восстановительного расщепления цистеиновых аддуктов. Можно использовать другие окислители, т.е. окисляющие вещества, и условия окисления, которые известны в данной области. Также является эффективным окисление атмосферным воздухом. Эта стадия мягкого частичного повторного окисления приводит к эффективному образованию межцепочечных дисульфидов с высокой надежностью и сохраняет тиольные группы вновь внесенных остатков цистеина. Приблизительно 10-кратный избыток промежуточного соединения лекарственное средство-линкер, например, MC-vc-PAB-MMAE, добавляли, перемешивали и оставляли стоять в течение приблизительно часа при комнатной температуре для достижения конъюгации и образования конъюгата антитело к CD22 10F4v3-лекарственное средство. Смесь для конъюгации подвергали гель-фильтрации и наносили в колонку HiTrap S и элюировали через нее для удаления избытка промежуточного соединения лекарственное средство-линкер и других примесей.
На фиг.12 показан общий процесс получения модифицированного цистеином антитела, экспрессированного из клеточной культуры, для конъюгации. Когда клеточные среды для культивирования содержат цистеин, между вновь внесенной цистеиновой аминокислотой и цистеином из среды могут образовываться дисульфидные аддукты. Эти цистеиновые аддукты, изображенные в качестве окружности в иллюстративном тиомабе (слева) на фиг.12, необходимо восстанавливать для получения реакционноспособных модифицированных цистеином антител для конъюгации. Цистеиновые аддукты, предположительно совместно с различными межцепочечными дисульфидными связями, подвергают восстановительному отщеплению с получением восстановленной формы антитела, посредством восстановителей, таких как TCEP. Межцепочечные дисульфидные связи между образующими пару остатками цистеина повторно образуются в условиях частичного окисления сульфатом меди, DHAA, или воздействия атмосферного кислорода. Вновь внесенные, преобразованные способами инженерии и не образовавшие пару остатки цистеина остаются доступными для реакции с линкерными реагентами или промежуточными соединениями лекарственное средство-линкер с образованием конъюгатов антитела по изобретению. Тиомабы, экспрессированные в клеточных линиях млекопитающих, приводят к внутреннему конъюгированному аддукту Cys с внесенным способами инженерии Cys через образование связи -S-S-. Таким образом, очищенные тиомабы обрабатывают способами восстановления и повторного окисления, как описано в примере x, с получением реакционноспособных тиомабов. Эти тиомабы используют для конъюгации с малеимидом, содержащим цитотоксические лекарственные средства, флуорофоры и другие метки.
Способы скрининга
Другой вариант осуществления настоящего изобретения относится к способу определения наличия полипептида CD22 в образце, предположительно содержащем полипептид CD22, где способ включает воздействие на образец модифицированного цистеином антитела к CD22 или его конъюгата антитело-лекарственное средство, который связывается с полипептидом CD22, и определение связывания модифицированного цистеином антитела к CD22, или его конъюгата антитело-лекарственное средство с полипептидом CD22 в образце, где наличие такого связывания указывает на наличие полипептида CD22 в образце. Необязательно, образец может содержать клетки (которые могут представлять собой злокачественные клетки), предположительно экспрессирующие полипептид CD22. Модифицированное цистеином антитело к CD22 или его конъюгат антитело-лекарственное средство, используемые в способе, необязательно можно метить поддающейся детекции меткой, присоединять к твердой подложке, или сходными с ней.
Другой вариант осуществления настоящего изобретения относится к способу диагностики наличия опухоли у млекопитающего, где способ включает (a) приведение в контакт тестируемого образца, содержащего клетки ткани, полученные от млекопитающего, с модифицированным цистеином антителом к CD22 или его конъюгатом антитело-лекарственное средство, которые связываются с полипептидом CD22, и (b) детекцию образования комплекса между модифицированным цистеином антителом к CD22, или его конъюгатом антитело-лекарственное средство, и полипептидом CD22 в тестируемом образце, где образование комплекса указывает на наличие у млекопитающего опухоли. Необязательно, модифицированное цистеином антитело к CD22 или его конъюгат антитело-лекарственное средство подвергают мечению поддающейся детекции меткой, присоединяют к твердой подложке, или сходными с ней, и/или тестируемый образец клеток ткани получают от индивидуума, предположительно обладающего злокачественной опухолью.
Метаболиты конъюгатов антитело-лекарственное средство
Также в объеме данного изобретения находятся метаболические продукты in vivo соединений ADC, описываемых в настоящем документе, в той степени, в которой продукты являются новыми и неочевидными по сравнению с предшествующим уровнем техники. Такие продукты могут быть следствием, например, окисления, восстановления, гидролиза, амидирования, этерификации, ферментативного расщепления, и т.п., вводимого соединения. Таким образом, изобретение включает новые и неочевидные соединения, продуцируемые посредством процесса, включающего приведение в контакт соединения по данному изобретению с млекопитающим в течение периода времени, достаточного для получения его метаболического продукта.
Метаболические продукты, как правило, идентифицируют получением меченного радиоактивной меткой (например,14C или3H) ADC, введением его парентерально в поддающейся детекции дозе (например, большей чем приблизительно 0,5 мг/кг) животному, такому как крыса, мышь, морская свинка, обезьяна или человеку, выжидания достаточного периода времени для прохождения метаболизма (как правило, от приблизительно 30 секунд до 30 часов) и выделение продуктов его превращения из мочи, крови или других биологических образцов. Эти продукты легко выделять, поскольку они являются мечеными (другие выделяют с использованием антител, способных связывать эпитопы, сохраняющиеся в метаболите). Структуры метаболитов определяют традиционным образом, например, посредством анализа MS, LC/MS или ЯМР. В основном, анализ метаболитов проводят таким же образом, как и традиционные исследования метаболизма лекарственных средств, хорошо известные специалистам в данной области. Продукты превращения, при условии, что они в ином случае не встречаются in vivo, пригодны для диагностических анализов для терапевтического дозирования соединений ADC по изобретению.
Фармацевтические препараты
Введение конъюгатов антитело-лекарственное средство, включающих конъюгаты тио-антитело-лекарственное средство
Конъюгаты антитело-лекарственное средство (ADC), включающие конъюгаты тио-антитело-лекарственное средство (TDC), по изобретению можно вводить любым способом, пригодным для состояния, подлежащего лечению. ADC, как правило, будут вводить парентерально, т.е. инфузией, подкожно, внутримышечно, внутривенно, внутрикожно, интратекально и эпидурально.
Для лечения этих злокачественных опухолей, в одном из вариантов осуществления конъюгат антитело-лекарственное средство вводят посредством внутривенной инфузии. Дозировка, вводимая посредством инфузии, находится в диапазоне от приблизительно 1 мкг/м2 до приблизительно 10000 мкг/м2 на дозу, как правило с одной дозой в неделю посредством всего одной, двух, трех или четырех доз. Альтернативно, диапазон дозировок составляет от приблизительно 1 мкг/м2 до приблизительно 1000 мкг/м2, от приблизительно 1 мкг/м2 до приблизительно 800 мкг/м2, от приблизительно 1 мкг/м2 до приблизительно 600 мкг/м2, от приблизительно 1 мкг/м2 до приблизительно 400 мкг/м2, от приблизительно 10 мкг/м2 до приблизительно 500 мкг/м2, от приблизительно 10 мкг/м2 до приблизительно 300 мкг/м2, от приблизительно 10 мкг/м2 до приблизительно 200 мкг/м2 и от приблизительно 1 мкг/м2 до приблизительно 200 мкг/м2. Дозу можно вводить один раз в сутки, один раз в неделю, несколько раз в неделю, но менее чем один раз в сутки, несколько раз в месяц, но менее чем один раз в сутки, несколько раз в месяц, но менее чем один раз в неделю, один раз в месяц или периодически для облегчения или смягчения симптомов заболевания. Введение можно продолжать посредством любого из описанных промежутков до ремиссии опухоли или симптомов лимфомы, лейкоза, подлежащих лечению. Введение можно продолжать после достижения ремиссии или облегчения симптомов, где такую ремиссию или облегчение симптомов продлевают таким продолжающимся введением.
Также изобретение относится к способу смягчения аутоиммунного заболевания, включающему введению пациенту, страдающему аутоиммунным заболеванием, терапевтически эффективного количества конъюгата гуманизированное антитело 10F4-лекарственное средство по любому из предшествующих вариантов осуществления. В предпочтительных вариантах осуществления антитело вводят внутривенно или подкожно. Конъюгат антитело-лекарственное средство вводят внутривенно в дозировке в диапазоне от приблизительно 1 мкг/м2 до приблизительно 100 мг/м2 на дозу и в конкретном варианте осуществления дозировка составляет от 1 мкг/м2 до приблизительно 500 мкг/м2. Дозу можно вводить один раз в сутки, один раз в неделю, несколько раз в неделю, но менее чем один раз в сутки, несколько раз в месяц, но менее чем один раз в сутки, несколько раз в месяц, но менее чем один раз в неделю, один раз в месяц или периодически для облегчения или смягчения симптомов заболевания. Введение можно продолжать с любым из описанных промежутков до облегчения или смягчения симптомов аутоиммунного заболевания, подлежащего лечению. Введение можно продолжать после достижения облегчения или смягчения симптомов, где такое облегчение или смягчение симптомов продлевают таким продолжающимся введением.
Также изобретение относится к способу лечения B-клеточного нарушения, включающему введение пациенту, страдающему B-клеточным нарушением, таким как B-клеточное пролиферативное нарушение (включая, в качестве неограничивающих примеров, лимфому и лейкоз) или аутоиммунное заболевание, терапевтически эффективного количества гуманизированного антитела 10F4 по любому из предшествующих вариантов осуществления, причем это антитело не конъюгировано с цитотоксической молекулой или поддающейся детекции молекулой. Антитело, как правило, будут вводить в дозировке в диапазоне от приблизительно 1 мкг/м2 до приблизительно 1000 мг/м2.
В одном из аспектов изобретение дополнительно относится к фармацевтическим препаратам, содержащим, по меньшей мере, одно антитело к CD22 по изобретению, и/или, по меньшей мере, один его иммуноконъюгат, и/или, по меньшей мере, один конъюгат антитело к CD22-лекарственное средство по изобретению. В некоторых вариантах осуществления фармацевтический препарат содержит 1) антитело к CD22, и/или его конъюгат антитело к CD22-лекарственное средство, и/или иммуноконъюгат, и 2) фармацевтически приемлемый носитель. В некоторых вариантах осуществления фармацевтический препарат содержит 1) антитело к CD22 и/или его иммуноконъюгат, и необязательно, 2) по меньшей мере, одно дополнительное терапевтическое средство.
Фармацевтические препараты, содержащие антитело или иммуноконъюгат по изобретению или конъюгат антитело-лекарственное средство по изобретению, получают для хранения смешиванием антитела или конъюгата антитело-лекарственное средство, обладающего требуемой степенью чистоты с необязательными физиологически приемлемыми носителями, эксципиентами или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)) в форме водных растворов или лиофилизированных или других высушенных препаратов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в используемых дозировках и концентрациях и включают буферы, такие как фосфат, цитрат, гистидин и другие органические кислоты; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензэтония); фенол, бутил или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (менее чем приблизительно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие средства, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексные соединения с металлами (например, комплексы Zn-белок); и/или неионные поверхностно-активные средства, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG). Фармацевтические препараты, подлежащие применению для введения in vivo, как правило, являются стерильными. Этого легко достигать фильтрацией через стерильные фильтрационные мембраны.
Активные ингредиенты также можно заключать в микрокапсулу, полученную, например, способами коацервации или интерфазной полимеризации, например, микрокапсулу на основе гидроксиметилцеллюлозы или желатина и микрокапсулу на основе поли(метилметацилата), соответственно, в коллоидных системах для доставки лекарственного средства (например, липосомах, микросферах на основе альбумина, микроэмульсиях, наночастицах и нанокапсулах), или в микроэмульсиях. Такие способы описаны в Remington's Pharmaceutical Sciences, 16th edition, Oslo, A., Ed., (1980).
Можно получать препараты с замедленным высвобождением. Пригодные примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы твердых гидрофобных полимеров, содержащие антитело, где матрицы находятся в форме имеющих определенную форму изделий, например пленок, или микрокапсул. Примеры матриц с замедленным высвобождением включают полиэфиры, гидрогели (например, поли-2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, недеградируемый этилен-винилацетат, деградируемые сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и ацетата леупролида), и поли-D-(-)-3-гидроксимасляную кислоту. В то время как полимеры, такие как этилен-винилацетат и молочная кислота-гликолевая кислота обеспечивают высвобождение молекул в течение 100 суток, определенные гидрогели высвобождают белки в течение более коротких периодов времени. Когда инкапсулированные антитела остаются в организме в течение длительного времени, они могут денатурировать или образовывать агрегаты в результате воздействия влажности при 37°C, приводящего к потере биологической активности и возможным изменениям иммуногенности. Для стабилизации можно разрабатывать целесообразные стратегии, в зависимости от вовлеченного механизма. Например, если выявлено, что механизм агрегации представляет собой межмолекулярное образование связи S-S через тио-дисульфидный обмен, стабилизации можно достигать посредством модификации сульфгидрильных остатков, лиофилизации из кислых растворов, контроля степени влажности, с использованием соответствующих добавок и разработки определенных композиций полимерных матриц.
Способы лечения конъюгатом антитело-лекарственное средство
Предполагается, что конъюгаты антитело-лекарственное средство (ADC) по настоящему изобретению можно использовать для лечения различных заболеваний или нарушений, например, характеризующихся сверхэкспрессией опухолевого антигена. Иллюстративные состояния или гиперпролиферативные нарушения включают доброкачественные или злокачественные опухоли; лейкоз и лимфоидные злокачественные новообразования. Другие нарушения включают нейрональные, глиальные, астроцитарные, гипоталамические, гландулярные, макрофагальные, эпителиальные, стромальные, связанные с бластоцелем, воспалительные, ангиогенные и иммунологические, включая аутоиммунные, нарушения.
Соединения ADC, которые идентифицированы в моделях на животных и клеточных анализах, можно далее тестировать у обладающих опухолью высших приматов и в клинических испытаниях у человека. Клинические испытания у человека могут быть предназначены для тестирования эффективности моноклонального антитела к CD22 или иммуноконъюгата по изобретению у пациентов, обладающих B-клеточным пролиферативным нарушением, включая в качестве неограничивающих примеров лимфому, неходжкинскую лимфому (NHL), агрессивную NHL, рецидивирующую агрессивную NHL, рецидивирующую медленно растущую NHL, рефракторную NHL, рефракторную медленно растущую NHL, хронический лимфолейкоз (CLL), мелкоклеточную лимфому, лейкоз, волосатоклеточный лейкоз (HCL), острый лимфоцитарный лейкоз (ALL) и лимфому мантийных клеток. Клиническое испытание может быть предназначено для оценки эффективности ADC в сочетаниях с известными схемами лечения, такими как лучевая терапия и/или химиотерапия, вовлекающими известные химиотерапевтические и/или цитотоксические средства.
Как правило, заболевание или нарушение, подлежащее лечению, представляет собой гиперпролиферативное заболевание, такое как B-клеточное пролиферативное нарушение и/или B-клеточная злокачественная опухоль. Примеры злокачественной опухоли, подлежащей лечению по настоящему документу, включают, в качестве неограничивающих примеров, B-клеточное пролиферативное нарушение, выбранное из лимфомы, неходжкинской лимфомы (NHL), агрессивной NHL, рецидивирующей агрессивной NHL, рецидивирующей медленно растущей NHL, рефракторной NHL, рефракторной медленно растущей NHL, хронического лимфолейкоза (CLL), мелкоклеточной лимфомы, лейкоза, волосатоклеточного лейкоза (HCL), острого лимфоцитарного лейкоза (ALL) и лимфомы мантийных клеток.
Злокачественная опухоль может содержать экспрессирующие CD22 клетки, так что ADC по настоящему изобретению способны связываться со злокачественными клетками. Для определения экспрессии CD22 в злокачественной опухоли доступны различные диагностические/прогностические способы анализа. В одном из вариантов осуществления сверхэкспрессию CD22 можно анализировать посредством IHC. Погруженные в парафин тканевые срезы из биоптата опухоли можно подвергать анализу IHC и согласовывать с критериями интенсивности окрашивания белка CD22 в отношении степени окрашивания и того, в какой пропорции находятся исследуемые опухолевые клетки.
Для профилактики или лечения заболевания пригодная дозировка ADC будет зависеть от типа заболевания, подлежащего лечению, как определено выше, тяжести и течения заболевания, от профилактических или терапевтических целей введения молекулы, предшествующего лечения, клинического анамнеза пациента и ответа на антитело и от решения лечащего врача. Молекулу целесообразно вводить пациенту однократно или в течение серии введений. В зависимости от типа и тяжести заболевания доза от приблизительно 1 мкг/кг до 50 мг/кг (например, 0,1-20 мг/кг) молекулы является исходной возможной дозой для введения пациенту, например, либо посредством одного, либо посредством нескольких отдельных введений, или посредством постоянной инфузии. Типичная суточная дозировка может варьировать от приблизительно 1 мкг/кг до 100 мг/кг или более, в зависимости от факторов, упомянутых выше. Иллюстративная дозировка ADC, подлежащего введению пациенту, находится в диапазоне от приблизительно 0,1 до приблизительно 10 мг/кг массы пациента.
В случае повторяющихся введений на протяжении нескольких суток или более, в зависимости от состояния, лечение продолжают до достижения требуемого подавления симптомов заболевания. Иллюстративная схема дозирования включает введение исходной нагрузочной дозы приблизительно 4 мг/кг с последующей еженедельной поддерживающей дозой приблизительно 2 мг/кг антитела к ErbB2. Могут быть пригодны другие режимы дозирования. Мониторинг хода этого лечения легко проводить общепринятыми способами и анализами.
Комбинированное лечение
Конъюгат антитело-лекарственное средство (ADC) по изобретению можно комбинировать в фармацевтическом комбинированном препарате или режиме дозирования в качестве комбинированного лечения, со вторым соединением, обладающим свойствами против злокачественной опухоли. Второе соединение фармацевтического комбинированного препарата или режима дозирования предпочтительно обладает видом активности, дополняющим ADC сочетания, так что они не оказывают неблагоприятного эффекта друг на друга.
Второе соединение может представлять собой химиотерапевтическое средство, цитотоксическое средство, цитокин, ингибирующее рост средство, противогормональное средство и/или кардиопротектор. Целесообразно, чтобы такие молекулы присутствовали в сочетании в количествах, которые эффективны для предполагаемой цели. Фармацевтическая композиция, содержащая ADC по изобретению, также может обладать терапевтически эффективным количеством химиотерапевтического средства, такого как ингибитор образования тубулина, ингибитор топоизомеразы или связывающее ДНК средство.
В одном из аспектов первое соединение представляет собой ADC к CD22 по изобретению и второе соединение представляет собой антитело к CD20 (либо простое антитело, либо ADC). В одном из вариантов осуществления второе соединение представляет собой антитело к CD20 ритуксимаб (Rituxan®) или 2H7 (Genentech, Inc., South San Francisco, CA). Другие антитела, пригодные для комбинированной иммунотерапии посредством ADC к CD22 по изобретению, включают, но не ограничиваются ими, антитело к VEGF (например, Avastin®).
С проведением противоракового лечения, идентифицированного в соответствии с данным изобретением, можно комбинировать другие схемы лечения, включающие в качестве неограничивающего примера лучевую терапию, и/или трансплантации костного мозга и периферической крови, и/или цитотоксическое средство, химиотерапевтическое средство или ингибирующее рост средство. В одном из таких вариантов осуществления химиотерапевтическое средство представляет собой средство или сочетание средств, например, такое как циклофосфамид, гидроксидаунорубицин, адриамицин, доксорубицин, винкристин (Oncovin™), преднизолон, CHOP, CVP, или COP, или иммунотерапевтические средства, такие как антитело к CD20 (например, Rituxan®) или антитело к VEGF (например, Avastin®). Комбинированное лечение можно проводить в качестве одновременного или поочередного режима. При последовательном введении сочетание можно вводить за два или более введений. Комбинированное введение включает совместное введение, с использованием отдельных препаратов или одного фармацевтического препарата, и последовательное введение в любом порядке, где предпочтительно существует период времени, в течение которого оба (или все) активных средства совместно проявляют свою биологическую активность.
В одном из вариантов осуществления лечение посредством ADC вовлекает комбинированное введение противоракового средства, идентифицированного в настоящем документе, и одного или нескольких химиотерапевтических средств или ингибирующих рост средств, включая одновременное введение "смесей" из различных химиотерапевтических средств. Химиотерапевтические средства включают таксаны (такие как паклитаксел и доцетаксел) и/или антрациклиновые антибиотики. Препараты и схемы дозирования для таких химиотерапевтических средств можно использовать по инструкциям производителя или как эмпирически определит квалифицированный специалист. Препараты и схемы дозирования для такой химиотерапии также описаны в "Chemotherapy Service", (1992) Ed., M.C. Perry, Williams & Wilkins, Baltimore, Md.
Стабильные дозировки для любого из указанных выше совместно вводимых средств представляют собой дозировки, используемые в настоящее время, и их можно снижать вследствие комбинированного действия (синергии) вновь идентифицированного средства и других химиотерапевтических средств или способов лечения.
Комбинированное лечение может обеспечить "синергию" и показать "синергический" эффект, т.е. эффект, достигаемый, когда активные ингредиенты применяют вместе, превышает сумму эффектов при применении соединений по отдельности. Синергический эффект может быть достигнут, когда активные ингредиенты (1) совместно изготовлены и одновременно введены или доставлены в комбинированном стандартном лекарственном составе; (2) доставлены поочередно или параллельно в качестве отдельных препаратов; или (3) каким-либо другим режимом. При доставке с поочередным лечением синергический эффект может быть достигнут, когда соединения вводят или доставляют последовательно, например, посредством различных инъекций в отдельных шприцах. В основном, в ходе поочередного лечения эффективную дозировку каждого активного ингредиента вводят последовательно, т.е. сериями, в то время как при комбинированном лечении эффективные дозировки двух или более активных ингредиентов вводят совместно.
Метаболиты конъюгатов антитело-лекарственное средство
Также в объеме данного изобретения находятся метаболические продукты in vivo соединений ADC, описываемых в настоящем документе, в той степени, в которой продукты являются новыми и неочевидными по сравнению с предшествующим уровнем техники. Такие продукты могут быть следствием, например, окисления, восстановления, гидролиза, амидирования, этерификации, ферментативного расщепления, и т.п., вводимого соединения. Таким образом, изобретение включает новые и неочевидные соединения, продуцируемые посредством процесса, включающего приведение в контакт соединения по данному изобретению с млекопитающим в течение периода времени, достаточного для получения его метаболического продукта.
Метаболические продукты, как правило, идентифицируют получением меченного радиоактивной меткой (например,14C или3H) ADC, введением его парентерально в поддающейся детекции дозе (например, большей, чем приблизительно 0,5 мг/кг) животному, такому как крыса, мышь, морская свинка, обезьяна, или человеку, выжидания достаточного периода времени для прохождения метаболизма (как правило, от приблизительно 30 секунд до 30 часов) и выделение продуктов его превращения из мочи, крови или других биологических образцов. Эти продукты легко выделять, поскольку они являются мечеными (другие выделяют с использованием антител, способных связывать эпитопы, сохраняющиеся в метаболите). Структуры метаболитов определяют традиционным образом, например, посредством анализа MS, LC/MS или ЯМР. В основном, анализ метаболитов проводят таким же образом, как и традиционные исследования метаболизма лекарственных средств, хорошо известные специалистам в данной области. Продукты превращения, при условии, что они в ином случае не встречаются in vivo, пригодны для диагностических анализов для терапевтического дозирования соединений ADC по изобретению.
ДОПОЛНИТЕЛЬНЫЕ СПОСОБЫ ПРИМЕНЕНИЯ АНТИТЕЛ К CD22 И ИММУНОКОНЪЮГАТОВ
Диагностические способы и способы детекции
В одном из аспектов антитела к CD22 и иммуноконъюгаты по изобретению пригодны для детекции наличия CD22 в биологическом образце. Термин "детекция", как применяют в настоящем документе, охватывает количественную или качественную детекцию. В определенных вариантах осуществления биологический образец содержит клетку или ткань. В определенных вариантах осуществления такие ткани включают нормальные и/или злокачественные ткани, которые экспрессируют CD22 на более высоких уровнях относительно других тканей, например, B-клетки и/или ассоциированные с B-клетками ткани.
В одном из аспектов изобретение относится к способу детекции наличия CD22 в биологическом образце. В определенных вариантах осуществления способ включает приведение в контакт биологического образца с антителом к CD22 в условиях, позволяющих связывание антитела к CD22 с CD22, и детекцию того, происходит ли образование комплекса между антителом к CD22 и CD22.
В одном из аспектов изобретение относится к способу диагностики нарушения, ассоциированного с увеличенной экспрессией CD22. В определенных вариантах осуществления способ включает приведение в контакт тестируемой клетки с антителом к CD22; определение уровня экспрессии (либо количественно, либо качественно) CD22 тестируемой клеткой посредством детекции связывания антитела к CD22 с CD22; и сравнение уровня экспрессии CD22 тестируемой клеткой с уровнем экспрессии CD22 контрольной клеткой (например, нормальной клеткой, источником которой является та же ткань, или клеткой, которая экспрессирует CD22 на уровнях, сравнимых с такой нормальной клеткой), где более высокий уровень экспрессии CD22 тестируемой клеткой по сравнению с контрольной клеткой указывает на наличие нарушения, ассоциированного с увеличенной экспрессией CD22. В определенных вариантах осуществления тестируемая клетка получена от индивидуума, предположительно обладающего нарушением, ассоциированным с увеличенной экспрессией CD22. В определенных вариантах осуществления нарушение представляет собой клеточное пролиферативное нарушение, такое как злокачественная опухоль или опухоль.
Иллюстративные клеточные пролиферативные нарушения, которые можно диагностировать с использованием антитела по изобретению, включают B-клеточное нарушение и/или B-клеточное пролиферативное нарушение, включая в качестве неограничивающих примеров, лимфому, неходжкинскую лимфому (NHL), агрессивную NHL, рецидивирующую агрессивную NHL, рецидивирующую медленно растущую NHL, рефракторную NHL, рефракторную медленно растущую NHL, хронический лимфолейкоз (CLL), мелкоклеточную лимфому, лейкоз, волосатоклеточный лейкоз (HCL), острый лимфоцитарный лейкоз (ALL) и лимфому мантийных клеток.
В определенных вариантах осуществления способ диагностики или детекции, такой как описан выше, включает детекцию связывания антитела к CD22 с CD22, экспрессированным на поверхности клетки или в препарате мембраны, полученном из клетки, экспрессирующей CD22 на ее поверхности. В определенных вариантах осуществления способ включает приведение в контакт клетки с антителом к CD22 в условиях, позволяющих связывание антитела к CD22 с CD22 и детекцию того, образуется ли комплекс между антителом к CD22 и CD22 на клеточной поверхности. Иллюстративный анализ для детекции связывания антитела к CD22 с CD22, экспрессированного на поверхности клетки, представляет собой анализ "FACS".
Для детекции связывания антител к CD22 с CD22 можно использовать некоторые другие способы. Такие способы включают, в качестве неограничивающих примеров, анализы связывания антигена, которые хорошо известны в данной области, такие как вестерн-блоттинги, радиоиммунологические анализы, ELISA (твердофазный иммуноферментный анализ), иммунологические "сэндвич"-анализы, анализы иммунопреципитации, флуоресцентные иммунологические анализы, иммунологические анализы с белком A и иммуногистохимию (IHC).
В определенных вариантах осуществления антитела к CD22 являются мечеными. Метки включают в качестве неограничивающих примеров, метки или группы, которые детектируют прямо (такие как флуоресцентные, хромофорные, электроноплотные, хемилюминесцентные и радиоактивные метки), а также группы, такие как ферменты или лиганды, которые выявляют непрямо, например, посредством ферментативной реакции или молекулярного взаимодействия. Иллюстративные метки включают, в качестве неограничивающих примеров, радиоактивные изотопы32P,14C,125I,3H и131I, флуорофоры, такие как редкоземельные хелаты или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люцифераза святляка и бактериальная люцифераза (патент США № 4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидаза хрена (HRP), щелочная фосфатаза, β-галактозидаза, глюкоамилаза, лизоцим, сахарид оксидазы, например, глюкоза оксидаза, галактоза оксидаза, и глюкоза-6-фосфатдегидрогеназа, гетероциклические оксидазы, такие как уриказа и ксантиноксидаза, связанная с ферментом, который использует перекись водорода для окисления предшественника красителя, таким как HRP, лактопероксидаза, или микропероксидаза, биотин/авидин, спиновые метки, бактериофаговые метки, стабильные свободные радикалы и т.п.
В определенных вариантах осуществления антитела к CD22 иммобилизованы на нерастворимой матрице. Иммобилизация приводит к отделению антитела к CD22 от любого CD22, который остается свободным в растворе. Это обычно проводят либо переведением антитела к CD22 в нерастворимую форму перед анализом, например, адсорбцией на нерастворимую в воде матрицу или поверхность (Bennich et al., U.S. 3720760), либо ковалентным связыванием (например, с использованием поперечного сшивания глутаральдегидом), либо посредством переведения антитела к CD22 в нерастворимую форму после образования комплекса между антителом к CD22 и CD22, например, с помощью иммунопреципитации.
Любой из указанных выше вариантов осуществления диагностики или детекции можно проводить с использованием иммуноконъюгата по изобретению вместо антитела к CD22 или в дополнение к нему.
Терапевтические способы
Антитело или иммуноконъюгат по изобретению можно использовать, например, в терапевтических способах in vitro, ex vivo и in vivo. В одном из аспектов изобретение относится к способам ингибирования роста клеток или пролиферации, либо in vivo или in vitro, причем способ включает воздействие на клетку антитела к CD22 или его иммуноконъюгата в условиях, позволяющих связывание иммуноконъюгата с CD22. "Ингибирование роста клеток или пролиферации" означает снижение клеточного роста или пролиферации, по меньшей мере, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 100% и включает индукцию клеточной гибели. В определенных вариантах осуществления клетка представляет собой опухолевую клетку. В определенных вариантах осуществления клетка представляет собой B-клетку. В определенных вариантах осуществления клетка представляет собой ксенотрансплантат, например, как объяснено в настоящем документе.
В одном из аспектов антитело или иммуноконъюгат по изобретению применяют для лечения или профилактики B-клеточного пролиферативного нарушения. В определенных вариантах осуществления клеточное пролиферативное нарушение ассоциировано с повышенной экспрессией и/или активностью CD22. Например, в определенных вариантах осуществления B-клеточное пролиферативное нарушение ассоциировано с увеличенной экспрессией CD22 на поверхности B-клетки. В определенных вариантах осуществления B-клеточное пролиферативное нарушение представляет собой опухоль или злокачественную опухоль. Примеры B-клеточных пролиферативных нарушений, подлежащих лечению антителами или иммуноконъюгатами по изобретению, включают в качестве неограничивающих примеров лимфому, неходжкинскую лимфому (NHL), агрессивную NHL, рецидивирующую агрессивную NHL, рецидивирующую медленно растущую NHL, рефракторную NHL, рефракторную медленно растущую NHL, хронический лимфолейкоз (CLL), мелкоклеточную лимфому, лейкоз, волосатоклеточный лейкоз (HCL), острый лимфоцитарный лейкоз (ALL) и лимфому мантийных клеток.
В одном из аспектов изобретение относится к способам лечения B-клеточного пролиферативного нарушения, включающим введение индивидууму эффективного количества антитела к CD22 или его иммуноконъюгата. В определенных вариантах осуществления способ лечения B-клеточного пролиферативного нарушения включает введение индивидууму эффективного количества фармацевтического препарата, содержащего антитело к CD22 или иммуноконъюгат к CD22 и, необязательно, по меньшей мере, одного дополнительного терапевтического средства, такого как средства, представленные ниже. В определенных вариантах осуществления способ лечения клеточного пролиферативного нарушения включает введение индивидууму эффективного количества фармацевтического препарата, содержащего 1) иммуноконъюгат, содержащий антитело к CD22 и цитотоксическое средство; и необязательно, 2) по меньшей мере, одно дополнительное терапевтическое средство, такое как средства, представленные ниже.
В одном из аспектов, по меньшей мере, некоторые из антител или иммуноконъюгатов по изобретению могут связывать CD22 из видов, отличных от человека. Таким образом, антитела или иммуноконъюгаты по изобретению можно использовать для связывания CD22, например, в клеточной культуре, содержащей CD22, у людей, или у других млекопитающих, обладающих CD22, с которым антитело или иммуноконъюгат по изобретению вступает в перекрестные реакции (например, шимпанзе, бабуин, мартышка, яванский макак и макак-резус, свинья или мышь). В одном из вариантов осуществления антитело к CD22 или иммуноконъюгат можно использовать для нацеливания CD22 на B-клетки посредством приведения в контакт антитела или иммуноконъюгата и CD22 с образованием антитела или комплекса иммуноконъюгат-антиген, так что конъюгированный цитотоксин иммуноконъюгата проникает внутрь клетки. В одном из вариантов осуществления CD22 представляет собой CD22 человека.
В одном из вариантов осуществления антитело к CD22 или иммуноконъюгат можно использовать в способе связывания CD22 у индивидуума, страдающего нарушением, ассоциированным с повышенной экспрессией и/или активностью CD22, причем способ включает введение индивидууму антитела или иммуноконъюгата, так что происходит связывание CD22 у индивидуума. В одном из вариантов осуществления связанное антитело или иммуноконъюгат интернализуется в B-клетку, экспрессирующую CD22. В одном из вариантов осуществления CD22 представляет собой CD22 человека, и индивидуум представляет собой человека. Альтернативно, индивидуум может представлять собой млекопитающее, экспрессирующее CD22, с которым связывается антитело к CD22. Кроме того, индивидуум может представлять собой млекопитающего, которому был введен CD22 (например, посредством введения CD22 или посредством экспрессии трансгена, кодирующего CD22).
Антитело к CD22 или иммуноконъюгат можно вводить человеку для терапевтических целей. Кроме того, антитело к CD22 или иммуноконъюгат можно вводить не принадлежащему человеку млекопитающему, экспрессирующему CD22, с которым антитело перекрестно реагирует (например, примату, свинье, крысе или мыши) для ветеринарных целей или в качестве модели заболевания человека на животных. В отношении последнего, такие модели на животных могут быть пригодны для оценки терапевтической эффективности антител или иммуноконъюгатов по изобретению (например, тестирование дозировок и режима введения).
Антитела или иммуноконъюгаты по изобретению можно применять в терапии либо отдельно, либо в сочетании с другими композициями. Например, антитело или иммуноконъюгат по изобретению можно вводить совместно, по меньшей мере, с одним дополнительным терапевтическим средством и/или адъювантом. В определенных вариантах осуществления дополнительное терапевтическое средство представляет собой цитотоксическое средство, химиотерапевтическое средство или ингибирующее рост средство. В одном из таких вариантов осуществления химиотерапевтическое средство представляет собой средство или сочетание средств, например, такое как циклофосфамид, гидроксидаунорубицин, адриамицин, доксорубицин, винкристин (Oncovin™), преднизолон, CHOP, CVP или COP, или иммунотерапевтические средства, такие как антитело к CD20 (например, Rituxan®) или антитело к VEGF (например, Avastin®), где комбинированное лечение пригодно при лечении злокачественных опухолей и/или B-клеточных нарушений, таких как B-клеточные пролиферативные нарушения, включающие лимфому, неходжкинскую лимфому (NHL), агрессивную NHL, рецидивирующую агрессивную NHL, рецидивирующую медленно растущую NHL, рефракторную NHL, рефракторную медленно растущую NHL, хронический лимфолейкоз (CLL), мелкоклеточную лимфому, лейкоз, волосатоклеточный лейкоз (HCL), острый лимфоцитарный лейкоз (ALL) и лимфому мантийных клеток.
Такие способы комбинированного лечения, отмеченные выше, охватывают комбинированное введение (где два или более терапевтических средства включены в один или в разные препараты) и отдельное введение, в случае которого введение антитела или иммуноконъюгата по изобретению может происходить до, одновременно и/или после введения дополнительного терапевтического средства и/или адъюванта. Антитела или иммуноконъюгаты по изобретению также можно использовать в сочетании с лучевой терапией.
Антитело или иммуноконъюгат по изобретению (и любое дополнительное терапевтическое средство или адъювант) можно вводить любым пригодным способом, включая парентеральное, подкожное, интраперитонеальное, внутрилегочное и интраназальное введение, и, при желании, для местного лечения, введение в рану. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, интраперитонеальное или подкожное введение. Кроме того, антитело или иммуноконъюгат целесообразно вводить пульсовой инфузией, в частности со снижающимися дозами антитела или иммуноконъюгата. Дозирование можно проводить любым пригодным способом, например, посредством инъекций, таких как внутривенные или подкожные инъекции, в зависимости, частично, от того, является ли введение кратковременным или длительным.
Антитела или иммуноконъюгаты по изобретению можно изготавливать, дозировать и вводить способом, согласующимся с добросовестной медицинской практикой. Факторы, учитываемые в этом контексте, включают конкретное нарушение, подлежащее лечению, конкретное млекопитающее, подвергаемое лечению, клиническое состояние отдельного пациента, причину нарушения, область доставки средства, способ введения, схему введения и другие факторы, известные врачам-терапевтам. Антитело или иммуноконъюгат не должны быть изготовлены, но необязательно изготовлены с одним или несколькими средствами, применяемыми в настоящее для профилактики или лечения представляющего интерес нарушения. Эффективное количество таких других средств зависит от количества антитела или иммуноконъюгата, присутствующего в препарате, типа нарушения или лечения и других факторов, рассмотренных выше. Их, как правило, используют в таких же дозировках и со способами введения, которые описаны в настоящем документе, или от приблизительно 1 до 99% от дозировок, описываемых в настоящем документе, или в любой дозировке и посредством любого способа, который эмпирически/клинически определен, как пригодный.
Для профилактики или лечения заболевания пригодная дозировка антитела или иммуноконъюгата по изобретению (при применении отдельно или в сочетании с одним или несколькими другими дополнительными терапевтическими средствами, такими как химиотерапевтические средства) будет зависеть от типа заболевания, подлежащего лечению, типа антитела или иммуноконъюгата, тяжести и течения заболевания, от профилактических или терапевтических целей введения антитела или иммуноконъюгата, предшествующего лечения, клинического анамнеза пациента и ответа на антитело или иммуноконъюгат и от решения лечащего врача. Антитело или иммуноконъюгат целесообразно вводить пациенту однократно или в течение серии введений. В зависимости от типа и тяжести заболевания доза от приблизительно 1 мкг/кг до 100 мг/кг (например, 0,1-20 мг/кг) антитела или иммуноконъюгата является исходной возможной дозой для введения пациенту, например, либо посредством одного, либо посредством нескольких отдельных введений, или посредством постоянной инфузии. Одна типичная суточная дозировка может варьировать от приблизительно 1 мкг/кг до 100 мг/кг или более, в зависимости от факторов, упомянутых выше. В случае повторяющихся введений на протяжении нескольких суток или более, в зависимости от состояния, лечение продолжают до достижения требуемого подавления симптомов заболевания. Одна иллюстративная дозировка антитела или иммуноконъюгата находится в диапазоне от приблизительно 0,05 мг/кг до приблизительно 10 мг/кг. Таким образом, пациенту можно вводить одну или несколько доз антитела или иммуноконъюгата, составляющих приблизительно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или любое их сочетание). Такие дозы можно вводить периодически, например, каждую неделю или каждые три недели (например, так, что пациент получает от приблизительно двух до приблизительно двадцати, или например, приблизительно шесть доз антитела или иммуноконъюгата). Можно вводить исходную более высокую нагрузочную дозу, с последующими одной или несколькими более низкими дозами. Иллюстративный режим дозирования включает введение исходной нагрузочной дозы, составляющей приблизительно 4 мг/кг, с последующей еженедельной поддерживающей дозой, составляющей приблизительно 2 мг/кг антитела. Однако могут быть пригодны другие режимы дозирования. Мониторинг хода лечения легко проводить посредством общепринятых способов и анализов.
Анализы
Антитела к CD22 и иммуноконъюгаты по изобретению можно охарактеризовать по их физическим/химическим свойствам и/или видам биологической активности различными способами анализа, известными в данной области.
Анализы активности
В одном из аспектов предусмотрены анализы для идентификации антитела к CD22 или их иммуноконъюгатов, обладающих биологической активностью. Биологическая активность может включать, например, способность ингибировать клеточный рост или пролиферацию (например, активность в отношении "уничтожения клеток"), или способность индуцировать клеточную гибель, включая запрограммированную клеточную гибель (апоптоз). Также предусмотрены антитела или иммуноконъюгаты, обладающие такой биологической активностью in vivo и/или in vitro.
В определенных вариантах осуществления антитело к CD22 или его иммуноконъюгат тестируют в отношении его способности ингибировать клеточный рост или пролиферацию in vitro. Анализы ингибирования клеточного роста или пролиферации хорошо известны в данной области. В некоторых анализах клеточной пролиферации, примерами которых являются анализы "уничтожения клеток", описываемые в настоящем документе, измеряют жизнеспособность клеток. Одним таким анализом является люминесцентный анализ жизнеспособности клеток CellTiter-Glo™ Luminescent Cell Viability Assay, который коммерчески доступен от Promega (Madison, WI). В этом анализе определяют количество жизнеспособных клеток в культуре на основе количественного определения присутствующего АТФ, который является признаком метаболически активных клеток. См. Crouch et al., (1993) J. Immunol. Meth. 160: 81-88, патент США № 6602677. Анализ можно проводить в 96- или 384-луночном формате, что обеспечивает его пригодность для автоматизированного высокопроизводительного скрининга (HTS). См. Cree et al., (1995) AntiCancer Drugs 6: 398-404. Способ анализа вовлекает добавление одного реагента (реагента CellTiter-Glo®) непосредственно к культивируемым клеткам. Это приводит к клеточному лизису и формированию люминесцентного сигнала, продуцируемого люциферазной реакцией. Люминесцентный сигнал пропорционален количеству присутствующего АТФ, которое прямо пропорционально количеству жизнеспособных клеток, присутствующих в культуре. Данные можно регистрировать посредством люминометра или устройства для визуализации с камерой CCD. Выход люминесценции выражают в качестве относительных световых единиц (RLU).
Другим анализом клеточной пролиферации является анализ "MTT", колориметрический анализ, который измеряет окисление бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия до формазана митохондриальной редуктазой. Подобно анализу CellTiter-Glo™, этот анализ показывает количество метаболически активных клеток, присутствующих в клеточной культуре. Например, см. Mosmann (1983) J. Immunol. Meth. 65: 55-63, и Zhang et al., (2005) Cancer Res. 65: 3877-3882.
В одном из аспектов антитело к CD22 тестируют в отношении его способности индуцировать клеточную гибель in vitro. Анализы для индукции клеточной гибели хорошо известны в данной области. В некоторых вариантах осуществления такие анализы измеряют, например, утрату целостности мембран, на что указывает захват йодида пропидия (PI), трипанового синего (см. Moore et al., (1995) Cytotechnology, 17:1-11) или 7AAD. В иллюстративном анализе захвата PI клетки культивируют в модифицированной Дульбекко среде Игла (D-MEM):F-12 Хэма (50:50), дополненной 10% инактивированной нагреванием FBS (Hyclone) и 2 мМ L-глутамином. Таким образом, анализ проводят в отсутствие комплемента и иммунных эффекторных клеток. Клетки высевают с плотностью 3×106 на чашку в 100×20 мм чашки и позволяют прикрепляться в течение ночи. Среду удаляют и заменяют свежей средой отдельно или средой, содержащей различные концентрации антитела или иммуноконъюгата. Клетки инкубируют в течение 3 суток. После обработки монослои промывают PBS и открепляют трипсинизацией. Затем клетки центрифугируют при 1200 об/мин в течение 5 минут при 4°C, осадок ресуспендируют в 3 мл холодного связывающего Ca2+ буфера (10 мМ Hepes, pH 7,4, 140 мМ NaCl, 2,5 мМ CaCl2) и разделяют на аликвоты в накрытые 35-мм сеткой 12×75 мм пробирки (1 мл на пробирку, 3 пробирки для обрабатываемой группы) для удаления клеточных комочков. Затем в пробирки добавляют PI (10 мкг/мл). Образцы анализируют с использованием проточного цитометра FACSCAN™ и программного обеспечения FACSCONVERT™ CellQuest (Becton Dickinson). Таким образом, идентифицируют антитела или иммуноконъюгаты, которые индуцируют статистически значимые уровни клеточной гибели, как определяют по захвату PI.
В одном из аспектов антитело к CD22 или иммуноконъюгат тестируют в отношении их способности индуцировать апоптоз (запрограммированную клеточную гибель) in vitro. Иллюстративным способом анализа антител или иммуноконъюгатов, которые индуцируют апоптоз, является анализ связывания аннексина. В иллюстративном анализе связывания аннексина клетки культивируют и высевают в чашки, как рассмотрено в предыдущем абзаце. Среду удаляют и заменяют свежей средой отдельно или средой, содержащей от 0,001 до 10 мкг/мл антитела или иммуноконъюгата. После инкубации в течение трех суток монослои промывают PBS и открепляют трипсинизацией. Затем клетки центрифугируют, ресуспендируют в связывающем Ca2+ буфере и разделяют на аликвоты в пробирки, как рассмотрено в предыдущем абзаце. Затем в пробирки добавляют аннексин (например, аннексин V-FITC) (1 мкг/мл). Образцы анализируют с использованием проточного цитометра FACSCAN™ и программного обеспечения FACSCONVERT™ CellQuest (Becton Dickinson). Таким образом, идентифицируют антитела или иммуноконъюгаты, которые индуцируют статистически значимые уровни связывания аннексина относительно контроля. Другим иллюстративным анализом в отношении антител или иммуноконъюгатов, которые индуцируют апоптоз, является колориметрический анализ ДНК гистонов ELISA для детекции межнуклеосомной деградации геномной ДНК. Такой анализ можно проводить с использованием, например, набора Cell Death Detection ELISA (Roche, Palo Alto, CA).
Клетки для применения в любом из указанных выше анализов in vitro включают клетки или клеточные линии, которые в природе экспрессируют CD22 или которые были сконструированы для экспрессии CD22. Такие клетки включают опухолевые клетки, которые сверхэкспрессируют CD22 относительно нормальных клеток, источником которых является та же ткань. Такие клетки также включают клеточные линии (включающие линии опухолевых клеток), которые экспрессируют CD22, и клеточные линии, которые в норме не экспрессируют CD22, но были трансфицированы нуклеиновой кислотой, кодирующей CD22.
В одном из аспектов антитело к CD22 или его иммуноконъюгат тестируют в отношении их способности ингибировать клеточный рост или пролиферацию in vivo. В определенных вариантах осуществления антитело к CD22 или его иммуноконъюгат тестируют в отношении их способности ингибировать рост опухоли in vivo. Для такого тестирования можно использовать модельные системы in vivo, такие как модели ксенотрансплантатов. В иллюстративных системах с ксенотрансплантатами опухолевые клетки человека вводят не принадлежащему человеку животному с пригодным образом ослабленным иммунитетом, например, мышь SCID. Антитело или иммуноконъюгат по изобретению вводят животному. Измеряют способность антитела или иммуноконъюгата ингибировать или снижать рост опухоли. В определенных вариантах осуществления указанной выше системы с ксенотрансплантатами опухолевые клетки человека представляют собой опухолевые клетки от пациента-человека. Такие клетки, пригодные для получения моделей ксенотрансплантатов, включают клеточные линии лейкоза и лимфомы человека, которые включают, в качестве неограничивающих примеров, клетки BJAB-luc (EBV-негативная клеточная линия лимфомы Беркитта, трансфицированная люциферазным репортерным геном), клетки Ramos (ATCC, Manassas, VA, CRL-1923), клетки Raji (ATCC, Manassas, VA, CCL-86), клетки SuDHL-4 (DSMZ, Braunschweig, Germany, AAC 495), клетки DoHH2 (см. Kluin-Neilemans, H.C. et al., Leukemia 5: 221-224 (1991), и Kluin-Neilemans, H.C. et al., Leukemia 8: 1385-1391 (1994)), клетки Granta-519 (см. Jadayel, D.M. et al., Leukemia 11(1): 64-72 (1997)). В определенных вариантах осуществления опухолевые клетки человека вводят не принадлежащему человеку животному с пригодным образом ослабленным иммунитетом посредством подкожной инъекции или посредством трансплантации в пригодную область, такую как жировое тело молочной железы.
Анализы связывания и другие анализы
В одном из аспектов антитело к CD22 тестируют в отношении его антигенсвязывающей активности. Например, в определенных вариантах осуществления антитело к CD22 тестируют в отношении его способности связываться с CD22, экспрессируемым на поверхности клетки. Для такого тестирования можно использовать анализ FACS.
В одном из аспектов для идентификации моноклонального антитела, которое конкурирует с антителом 10F4.4.1 мыши, гуманизированным антителом 10F4v1, гуманизированным антителом 10F4v3 и/или антителом 5E8.1.8 мыши за связывание с CD22, можно использовать конкурентные анализы. В определенных вариантах осуществления такое конкурирующее антитело связывается с тем же эпитопом (например, линейным или конформационным эпитопом), с которым связывается антитело 10F4.4.1 мыши, гуманизированное антитело 10F4v1, гуманизированное антитело 10F4v3 и/или антитело 5E8.1.8 мыши. Иллюстративные конкурентные анализы включают в качестве неограничивающих примеров общепринятые анализы, такие как представлены в Harlow and Lane (1988) Antibodies: A Laboratory Manual ch. 14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, NY). Подробные иллюстративные способы картирования эпитопа, с которым связывается антитело, представлены в Morris (1996) "Epitope Mapping Protocols", в Methods in Molecular Biology Vol.66 (Humana Press, Totowa, NJ). Говорят, что два антитела связываются с одним эпитопом, если каждое из них блокирует связывание другого на 50% или более.
В иллюстративном конкурентном анализе иммобилизованный CD22 инкубируют в растворе, содержащем первое меченое антитело, связывающееся с CD22 (например, антитело 10F4.4.1 мыши, гуманизированное антитело 10F4v1, гуманизированное антитело 10F4v3 и/или антитело 5E8.1.8 мыши) и второе немеченое антитело, которое тестируют в отношении его способности конкурировать с первым антителом за связывание с CD22. Второе антитело может находиться в супернатанте гибридомы. В качестве контроля иммобилизованный CD22 инкубируют в растворе, содержащем первое меченое антитело, но не второе немеченое антитело. После инкубации в условиях, позволяющих связывание первого антитела с CD22, избыток несвязавшегося антитела удаляют и измеряют количество метки, связанной с иммобилизованным CD22. Если количество метки, связанной с иммобилизованным CD22 существенно снижается в тестируемом образце относительно контрольного образца, то это указывает на то, что второе антитело конкурирует с первым антителом за связывание с CD22. В определенных вариантах осуществления иммобилизованный CD22 находится на поверхности клетки или в препарате мембраны, полученном из клетки, экспрессирующей CD22 на ее поверхности.
В одном из аспектов очищенные антитела к CD22 можно далее охарактеризовать серией анализов, включающих, в качестве неограничивающих примеров, N-концевое секвенирование, анализ аминокислот, неденатурирующую эксклюзионную высокоэффективную жидкостную хроматографию (ВЭЖХ), масс-спектрометрию, ионообменную хроматографию и расщепление папаином.
В одном из вариантов осуществления изобретение относится к измененному антителу, которое обладает некоторыми, но не всеми, эффекторными функциями, что делает его желательным кандидатом для множества применений, в которых время полужизни in vivo антитела является важным, но являются необходимыми или вредными определенные эффекторные функции (такие как комплемент и ADCC). В определенных вариантах осуществления измеряют виды активности Fc антитела для того, чтобы убедиться, что сохраняются только желательные свойства. Анализы цитотоксичности in vitro и/или in vivo можно проводить для подтверждения снижения/устранения активности CDC и/или ADCC. Например, анализы связывания Fc-рецептора (FcR) можно проводить, чтобы убедиться, что в антителе отсутствует связывание FcγR (таким образом, вероятно, отсутствует активность ADCC), но сохранена способность связывать FcRn. Главные клетки, опосредующие ADCC, NK клетки, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках обобщенно представлена в таблице 3 на странице 464 Ravetch и Kinet, Annu. Rev. Immunol. 9:457-92 (1991). Пример анализа in vitro для оценки активности ADCC представляющей интерес молекулы описан в патенте США № 5500362 или 5821337. Пригодные эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (PBMC) и естественные киллерные (NK) клетки. Альтернативно, или дополнительно, активность ADCC представляющей интерес молекулы можно оценивать in vivo, например, в моделях на животных, таких как модели, описанные в Clynes et al., PNAS (USA) 95:652-656 (1998). Анализы связывания C1q также можно проводить для подтверждения того, что антитело не способно связывать C1q и, таким образом, лишено активности CDC. Для оценки активации комплемента можно проводить анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996). Определение связывания FcRn и выведение/время полужизни in vivo также можно проводить с использованием известных в данной области способов.
ПРИМЕРЫ
Далее представлены примеры способов и композиций по изобретению. Понятно, что на практике можно применять различные другие варианты осуществления, учитывая общее описание, представленное выше.
Пример 1: Получение моноклонального антитела мыши к CD22 человека
Получали моноклональные антитела мыши, способные специфически связывать CD22. Самок мышей BALB/c, в возрасте шести недель, иммунизировали в их подушечки лап очищенным внеклеточным доменом CD22 человека, меченным his-8, лишенным доменов 3 и 4 (SEQ ID NO: 30 (ECD) плюс последовательность GRAHHHHHHHH на C-конце), или внеклеточным доменом CD22, меченным his-8, содержащим домены 1-7 (SEQ ID NO: 28 (ECD) плюс указанная выше метка из последовательности His) в адъюванте Ribi. Последующие инъекции проводили аналогичным образом через одну и три недели после исходных иммунизаций. Через трое суток после конечной инъекции паховые и подколенные лимфатические узлы удаляли и объединяли, и получали суспензию отдельных клеток, пропуская ткань через стальную сетку. Клетки подвергали слиянию в соотношении 4:1 с миеломой мыши, такой как P3X63-Ag8.653 (ATCC CRL 1580) в среде с высоким содержанием глюкозы (DMEM), содержащей 50% масс./об. полиэтиленгликоля 4000. Затем слитые клетки высевали в 96-луночные планшеты для культивирования тканей с плотностью 2×105 на лунку. Через 24 часа добавляли селективную среду HAT (гипоксантин/аминоптерин/тимидин, Sigma, #H0262). Через пятнадцать суток после слияния супернатанты растущих клеток тестировали в отношении наличия антител, специфических к CD22 человека, с использованием твердофазного иммуноферментного анализа (ELISA).
Для последующего исследования были выбраны моноклональные антитела мыши к CD22 человека 10F4.4.1 (mu10F4) и 5E8.1.8 (mu5E8), исходя из клеточных анализов и анализов в планшетах, которые показали, что антитела специфически связываются с CD22 человека. Эти анализы описаны в следующих абзацах.
Анализы на основе ELISA: Скрининг антитела к CD22 посредством ELISA проводят следующим образом, причем все инкубации проводят при комнатной температуре. На тестируемые планшеты (Nunc Immunoplate) наносят в течение 2 часов очищенный CD22 в 50 мМ натрий-карбонатном буфере, pH 9,6, затем блокируют 0,5% бычьим сывороточным альбумином в фосфатно-солевом буфере (PBS) в течение 30 минут, а затем промывают четыре раза посредством PBS, содержащей 0,05% Tween 20 (PBST). Добавляют супернананты с тестируемым антителом и инкубируют в течение двух часов при встряхивании, затем промывают четыре раза посредством PBST. Планшеты проявляют добавлением 100 мкл/лунка раствора, содержащего 10 мг дигидрохлорида o-фенилендиамина (Sigma, #P8287) и 10 мкл 30% пероксида водорода в 25 мл фосфатно-цитратном буфере, pH 5,0, и инкубацией в течение 15 минут. Реакцию останавливают добавлением 100 мкл/лунка 2,5 M серной кислоты. Данные получают считыванием планшетов в автоматическом устройстве для считывания планшетов ELISA при поглощении 490 нм.
Пример 2: Анализы на основе FACS для исследования моноклональных антител (MAb) к CD22 человека
Клетки CHO, экспрессирующие CD22 человека на их поверхности, инкубировали с супернатантом гибридомы с антителами к CD22 в 100 мкл буфера FACS (0,1% BSA, 10 мМ азид натрия в PBS, pH 7,4) в течение 30 минут при 4°C, с последующим одним промыванием буфером FACS. Величину связывания антитела к CD22 определяли инкубацией аликвоты антитела/клеточной смеси с поликлональным конъюгированным с FITC IgG козы или кролика против антител мыши (Accurate Chem. Co., Westbury, NY) (для тестируемых антител мыши) или IgG козы или кролика против антител человека (для гуманизированных антител) в течение 30 минут при 4°C с последующими тремя промываниями буфером FACS.
Пример 3: Получение гуманизированных антител к CD22
Получали гуманизированные 10F4 антитела, где аминокислотные остатки гипервариабельной области (HVR) (взаимозаменяемо, обозначаемые как определяющие комплементарность области или CDR) были модифицированы сайт-специфическим мутагенезом (Kunkel et al., Methods Enzymol. (1987), 154:367-382) с получением двух вариантов, гуманизированного 10F4v1 и гуманизированного 10F4v2 (также обозначенных в настоящем документе как "10F4v1", "hu10F4v1", "10F4v2" или "hu10F4v2", соответственно). Третий вариант, гуманизированное 10F4v3 ("10F4v3" или "hu10Fv3"), используемое в некоторых исследованиях, описываемых в настоящем документе, обладает такими же аминокислотными последовательностями легкой и тяжелой цепи для зрелого белка, как и hu10F4v2, однако содержит отличающуюся сигнальную последовательность в векторе, используемом для экспрессии белка.
Гуманизацию антитела 10F4 мыши проводили, как описано в настоящем документе. В кратком изложении, гипервариабельные области легкой и тяжелых цепей 10F4 мыши клонировали в модифицированные консенсусные каркасные последовательности с получением аминокислотных последовательностей вариабельных областей легкой и тяжелой цепей, представленных на фиг.2A и 2B. Альтернативные каркасные последовательности легкой и тяжелой цепи, которые можно использовать в качестве каркасных последовательностей антител по изобретению, представлены на фиг.3 и 4.
Для гуманизации антитела 10F4 использовали одновалентную векторную (pV0350-2B) фагмиду для дисплея Fab-g3, имеющую две открытые рамки считывания под контролем промотора phoA, в основном, как описано в Lee et al., J. Mol. Biol. 340:1073-93 (2004). Первая открытая рамка считывания содержала сигнальную последовательность термостабильного STII E.coli для секреции белка, слитую с доменами VL и CH1 акцепторной последовательности легкой цепи. Вторая открытая рамка считывания содержала сигнальную последовательность STII, слитую с доменами VH и CH1 акцепторной последовательности тяжелой цепи, за которой следует укороченный минорный белок P3 оболочки фага.
Домены VH и VL из 10F4 мыши (SEQ ID NO: 89 и 90, соответственно) выравнивали с консенсусным доменом человека VH III подгруппы (huIII) (SEQ ID NO: 24) и консенсусным доменом человека каппа I (huK1) (SEQ ID NO: 25), соответственно. Аминокислотные последовательности гипервариабельных областей (HVR, взаимозаменяемо обозначенных в настоящем документе как определяющие комплементарность области (CDR)) MAb мыши против CD22 человека 10F4 встраивали в консенсусные каркасные последовательности следующим образом. HVR легких цепей (HVR-L1 (положения по Kabat 24-34), HVR-L2 (положения по Kabat 50-56) и HVR-L3 (положения по Kabat 89-97) антитела mu10F4 встраивали в каркас антитела человека с консенсусной последовательностью каппа I (huKI) с получением гуманизированной легкой цепи 10F4v1 (SEQ ID NO: 17, фиг.2B). HVR тяжелой цепи (HVR-H1 (положения по Kabat 26-35), HVR-H2 (положения по Kabat 49-65) и HVR-H3 (положения по Kabat 95-102) антитела mu10F4 встраивали в модифицированный консенсусный домен человека VH подгруппы III (humIII), который отличается от последовательности humIII по трем положениям: R71A, N73T и L78A (см. Carter et al., Proc. Natl. Acad. Sci. USA 89:4285 (1992)), с получением гуманизированной вариабельной области тяжелой цепи 10F4v1 (SEQ ID NO: 16, фиг.2A). Генетическое встраивание HVR в акцепторные каркасы проводили мутагенезом Kunkel с использованием отдельного олигонуклеотида для каждой гипервариабельной области. Последовательность каждого клона определяли стандартными способами секвенирования ДНК. Гипервариабельные области и каркасные области, показанные на фиг.2A и 2B, пронумерованы по нумерации Kabat (Kabat et al., (1991), выше). Легкие и тяжелые цепи секвенировали и аминокислотные последовательности вариабельных областей (включая HVR и каркасные области (FR)) huKI, humIII, 10F4 мыши, гуманизированного 10F4v1 и гуманизированного 10F4v2 представлены на фиг.2A и 2B. Гуманизированное антитело 10F4v3 обладает аминокислотной последовательностью, идентичной 10F4v2.
Молекулы нуклеиновой кислоты, кодирующие варианты аминокислотной последовательности антитела, фрагмента антитела, домена VL или домена VH, получают множеством известных в данной области способов. Эти способы включают в качестве неограничивающих примеров выделение из природного источника (в случае встречающихся в природе вариантов аминокислотной последовательности) или получение опосредуемым олигонуклеотидами (или сайт-специфическим) мутагенезом, ПЦР-мутагенезом и кассетным мутагенезом ранее полученного измененного или неизмененного варианта антитела, фрагмента антитела, домена VL или домена VH. Например, можно создавать библиотеки нацеливанием на доступные аминокислотные положения в VL, VH и необязательно в одном или нескольких CDR, для замены аминокислот отличающимися аминокислотами с использованием способа Kunkel. См., например, Kunkel et al., Methods Enzymol. (1987), 154:367-382 и примеры в ней. Получение рандомизированных последовательностей также описано ниже в примерах.
Последовательность олигонуклеотидов включает один или несколько из предусмотренных наборов кодонов для конкретного положения в CDR (HVR) или FR-области полипептида по изобретению. Набор кодонов представляет собой набор различных нуклеотидных триплетных последовательностей, используемых для кодирования требуемых вариантных аминокислот. Наборы кодонов могут быть представлены с использованием символов для обозначения конкретных нуклеотидов или эквимолярных смесей нуклеотидов, как представлено ниже в соответствии с кодом IUB.
КОДЫ IUB
G Гуанин
A Аденин
T Тимин
C Цитозин
R (A или G)
Y (C или T)
M (A или C)
K (G или T)
S (C или G)
(A или T)
H (A или C или T)
B (C или G или T)
V (A или C или G)
D (A или G или T)
N (A или C или G или T)
Например, в наборе кодонов DVK, D может представлять собой нуклеотиды A или G или T; V может представлять собой A или G или C; и K может представлять собой G или T. Этот набор кодонов может представлять собой 18 различных кодонови может кодировать аминокислоты Ala, Trp, Tyr, Lys, Thr, Asn, Lys, Ser, Arg, Asp, Glu, Gly и Cys.
Наборы олигонуклеотидов или праймеров можно синтезировать с использованием стандартных способов. Можно синтезировать набор олигонуклеотидов, например, твердофазным синтезом, содержащий последовательности, которые соответствуют всем возможным сочетаниям нуклеотидных триплетов, обеспечиваемым набором кодонов, и которые будут кодировать требуемую группу аминокислот. Синтез олигонуклеотидов с выбранной "вырожденностью" нуклеотидов в определенных положениях хорошо известен в данной области. Такие наборы нуклеотидов, имеющие определенные наборы кодонов, можно синтезировать с использованием коммерческих устройств для синтеза нуклеиновых кислот (доступных, например, от Applied Biosystems, Foster City, CA) или можно получать коммерчески (например, от Life Technologies, Rockville, MD). Таким образом, набор синтезированных олигонуклеотидов, обладающих конкретным набором кодонов, как правило, будет включать множество олигонуклеотидов с отличающимися последовательностями, причем отличия определяются набором кодонов в пределах всей последовательности. Олигонуклеотиды, используемые по изобретению, обладают последовательностями, которые позволяют гибридизацию с матрицей нуклеиновой кислоты вариабельного домена и также могут включать участки для фермента рестрикции для целей клонирования.
В одном способе последовательности нуклеиновой кислоты, кодирующие вариантные аминокислоты, можно создавать олигонуклеотид-опосредуемым мутагенезом. Этот способ хорошо известен в данной области, как описано Zoller et al., 1987, Nucleic Acids Res. 10:6487-6504. В кратком изложении, последовательности нуклеиновой кислоты, кодирующие вариантные аминокислоты, создают гибридизацией набора олигонуклеотидов, кодирующих требуемые наборы кодонов с ДНК-матрицей, где матрица представляет собой одноцепочечную форму плазмиды, содержащей матричную последовательность нуклеиновой кислоты вариабельной области. После гибридизации используют ДНК-полимеразу для синтеза целой второй комплементарной цепи матрицы, которая, таким образом, будет включать олигонуклеотидный праймер и будет содержать наборы кодонов, обеспечиваемые набором олигонуклеотидов.
Как правило, используют олигонуклеотиды длиной по меньшей мере 25 нуклеотидов. Оптимальный олигонуклеотид будет иметь от 12 до 15 нуклеотидов, которые полностью комплементарны матрице с каждой стороны нуклеотида(ов), кодирующего мутацию(и). Это обеспечивает надлежащую гибридизацию олигонуклеотида с одноцепочечной молекулой ДНК-матрицы. Олигонуклеотиды легко синтезируют с применением известных в данной области способов, таких как способы, описанные Crea et al., Proc. Nat'l. Acad. Sci. USA, 75:5765 (1978).
ДНК-матрицу получают либо посредством векторов, которые образованы из векторов бактериофага M13 (пригодны коммерчески доступные векторы M13mp18 и M13mp19), либо посредством векторов, которые содержат одноцепочечный фаговый участок начала репликации, как описано Viera et al., Meth. Enzymol., 153:3 (1987). Таким образом, ДНК, которая подлежит мутации, можно встраивать в один из этих векторов в целях получения одноцепочечной матрицы. Получение одноцепочечной матрицы описано в разделах 4.21-4.41 Sambrook et al., выше.
Для изменения нативной последовательности ДНК олигонуклеотид гибридизуют с одноцепочечной матрицей в пригодных условиях гибридизации. Затем добавляют фермент полимеризации ДНК, как правило, ДНК-полимеразу T7 или фрагмент Кленова ДНК-полимеразы I, для синтеза комплементарной цепи матрицы с использованием олигонуклеотида в качестве праймера для синтеза. Таким образом, образуется гетеродуплексная молекула, так что одна цепь ДНК кодирует мутантную форму гена 1, а другая цепь (исходная матрица) кодирует нативную неизмененную последовательность гена 1. Затем эту гетеродуплексную молекулу трансформируют в пригодную клетку-хозяина, как правило, в прокариотическую клетку, такую как E.coli JM101. После выращивания клеток их помещают на агарозные планшеты и подвергают скринингу с использованием олигонуклеотидного праймера, радиоактивно меченного 32-фосфатом, для идентификации колоний бактерий, которые содержат мутантную ДНК.
Способ, описанный непосредственно выше, можно модифицировать для создания гомодуплексной молекулы, где обе цепи плазмиды содержат мутацию(и). Модификации являются следующими: одноцепочечный олигонуклеотид отжигают с одноцепочечной матрицей, как описано выше. Смесь трех дезоксирибонуклеотидов, дезоксирибоаденозина (dATP), дезоксирибогуанозина (dGTP) и дезоксириботимидина (dTT), объединяют с модифицированным тиодезоксирибоцитозином, называемым dCTP-(aS) (который можно получить от Amersham). Эту смесь добавляют к комплексу матрица-олигонуклеотид. При добавлении к этой смеси ДНК-полимеразы образуется цепь ДНК, идентичная матрице, за исключением мутантных оснований. Кроме того, эта новая цепь ДНК будет содержать dCTP-(aS) вместо dCTP, который служит для защиты от расщепления рестрикционной эндонуклеазой. После разрезания матричной цепи двухцепочечного гетеродуплекса с помощью соответствующего фермента рестрикции матричную цепь можно расщепить нуклеазой ExoIII или другой пригодной нуклеазой после области, которая содержит участок(участки), подлежащий мутагенезу. Затем реакцию останавливают, чтобы осталась молекула, которая является только частично одноцепочечной. Затем образуют полный двухцепочечный гомодуплекс ДНК с использованием ДНК-полимеразы в присутствии всех четырех дезоксирибонуклеотидтрифосфатов, АТФ и ДНК-лигазы. Затем эту гомодуплексную молекулу можно трансформировать в пригодную клетку-хозяина.
Как указано ранее, последовательность набора олигонуклеотидов обладает достаточной длиной для гибридизации с матричной нуклеиновой кислотой и также может, но необязательно, содержать участки рестрикции. ДНК-матрицу можно получать либо посредством векторов, которые образованы из векторов бактериофага M13, либо посредством векторов, которые содержат одноцепочечный фаговый участок начала репликации, как описано Viera et al., Meth. Enzymol., 153:3 (1987). Таким образом, ДНК, которая подлежит мутации, необходимо встраивать в один из этих векторов в целях получения одноцепочечной матрицы. Получение одноцепочечной матрицы описано в разделах 4.21-4.41 Sambrook et al., выше.
В соответствии с другим способом библиотеку можно получать, предоставляя наборы вышерасположенных и нижерасположенных олигонуклеотидов, причем каждый набор обладает множеством олигонуклеотидов с отличающимися последовательностями, причем различные последовательности определяются наборами кодонов, представленными в последовательности олигонуклеотидов. Наборы верхних и нижних олигонуклеотидов, совместно с матричной последовательностью нуклеиновой кислоты вариабельного домена, можно использовать в полимеразной цепной реакции для создания "библиотеки" продуктов ПЦР. Продукты ПЦР могут быть обозначены как "кассеты нуклеиновых кислот", поскольку они могут быть слитыми с другими родственными или неродственными последовательностями нуклеиновой кислоты, например, вирусных белков оболочки и доменов димеризации, с использованием известных способов молекулярной биологии.
Наборы олигонуклеотидов можно использовать в полимеразной цепной реакции с использованием матричной последовательности нуклеиновой кислоты вариабельного домена в качестве матрицы для создания кассет нуклеиновых кислот. Матричная последовательность нуклеиновой кислоты вариабельного домена может представлять собой любую часть тяжелых цепей иммуноглобулинов, содержащую последовательности нуклеиновой кислоты-мишени (т.е. последовательности нуклеиновой кислоты, кодирующие аминокислоты, предназначенные для замены). Матричная последовательность нуклеиновой кислоты вариабельной области представляет собой часть двухцепочечной молекулы ДНК, обладающую первой цепью нуклеиновой кислоты и комплементарной второй цепью нуклеиновой кислоты. Матричная последовательность нуклеиновой кислоты вариабельного домена содержит по меньшей мере часть вариабельного домена и имеет по меньшей мере один CDR. В некоторых случаях матричная последовательность нуклеиновой кислоты вариабельной области содержит более одного CDR. Вышерасположенная часть и нижерасположенная часть матричной последовательности нуклеиновой кислоты вариабельной области может быть предназначена для гибридизации с членами набора вышерасположенных олигонуклеотидов и набора нижерасположенных олигонуклеотидов.
Первый олигонуклеотид набора вышерасположенных праймеров может гибридизоваться с первой цепью нуклеиновой кислоты, и второй олигонуклеотид набора нижерасположенных праймеров может гибридизоваться со второй цепью нуклеиновой кислоты. Олигонуклеотидные праймеры могут включать один или несколько наборов кодонов, и они могут быть сконструированы для гибридизации с частью матричной последовательности нуклеиновой кислоты вариабельной области. Применение этих олигонуклеотидов может внести два или более набора кодонов в продукт ПЦР (т.е. кассету нуклеиновой кислоты) после ПЦР. Олигонуклеотидный праймер, который гибридизуется с участками последовательности нуклеиновой кислоты, кодирующей вариабельный домен антитела, включает участки, которые кодируют остатки CDR, которые предназначены для замены аминокислот.
Наборы вышерасположенных и нижерасположенных олигонуклеотидов также можно синтезировать, чтобы они включали участки рестрикции в последовательности олигонуклеотида. Эти участки рестрикции могут облегчать встраивание кассет нуклеиновых кислот (т.е. продуктов ПЦР-реакции) в экспрессирующий вектор, обладающий дополнительной последовательностью антитела. В одном из вариантов осуществления участки рестрикции предназначены для облегчения клонирования кассет нуклеиновой кислоты без введения лишних последовательностей нуклеиновой кислоты или удаления исходных последовательностей нуклеиновой кислоты CDR или каркаса.
Кассеты нуклеиновых кислот можно клонировать в любой пригодный вектор для экспрессии части или всей последовательности легкой или тяжелой цепи, содержащей намеченные замены аминокислот, полученные посредством ПЦР-реакции. В соответствии со способами, подробно описанными для этого изобретения, кассету нуклеиновой кислоты клонируют в вектор, позволяющий продукцию части или полной последовательности легкой или тяжелой цепи, слитую со всем белком оболочки вируса или его частью (т.е. создающий слитый белок), и воспроизводят на поверхности частицы или клетки. Несмотря на то, что доступно и можно использовать для применения на практике этого изобретения несколько типов векторов, фагмидные векторы являются предпочтительными векторами для применения по настоящему документу, поскольку их можно относительно легко конструировать и можно легко амплифицировать. Фагмидные векторы, как правило, содержат различные компоненты, включающие промоторы, сигнальные последовательности, фенотипические селективные гены, участки начала репликации и другие необходимые компоненты, известные специалистам в данной области.
Когда экспрессии подлежит конкретное сочетание вариантных аминокислот, кассета нуклеиновой кислоты содержит последовательность, которая способна кодировать весь вариабельный домен тяжелой или легкой цепи или его часть и способна кодировать сочетания вариантных аминокислот. Для получения антител, содержащих эти вариантные аминокислоты или сочетания вариантных аминокислот, как в случае библиотек, кассеты нуклеиновых кислот можно встраивать в экспрессирующий вектор, содержащий дополнительную последовательность антитела, например, все или части вариабельных или константных доменов вариабельных областей легкой и тяжелой цепей. Эти дополнительные последовательности антитела также могут быть слитыми с другими последовательностями нуклеиновых кислот, такими как последовательности, которые кодируют белки оболочки вируса и, таким образом, продуцируют слитый белок.
Пример 4: Определение последовательности вариабельной области
Последовательности нуклеиновых кислот и аминокислотные последовательности моноклональных антител 10F4 мыши и гуманизированных моноклональных антител 10F4 определяли стандартными способами. Из гибридомных клеток экстрагировали тотальную РНК, продуцирующую моноклональные антитела мыши против CD22 человека 10F4.4.1 с использованием RNeasy® Mini Kit (Qiagen, Germany). Вариабельные домены легкой цепи (VL) и вариабельные домены тяжелой цепи (VH) амплифицировали с использованием ОТ-ПЦР с вырожденными праймерами. Прямые праймеры были специфичны для аминокислотных последовательностей N-концов участков VL и VH антител. Соответственно, обратные праймеры для легкой цепи и тяжелой цепи были сконструированы для отжига с участком в константном домене легкой цепи (CL) и константном домене 1 тяжелой цепи (CH1), которые являются высококонсервативными среди видов. Амплифицированные VH и VL клонировали в экспрессирующий вектор клеток млекопитающих pRK (Shields et al., J. Biol. Chem. 276:659-04 (2000)). Полинуклеотидную последовательность вставок определяли с использованием общепринятых способов секвенирования. Аминокислотные последовательности вариабельных областей легкой и тяжелой цепи мышиного химерного 10F4 и гуманизированного 10F4v1 и гуманизированного 10F4v2 представлены на фиг.2A и 2B.
Гуманизированное 10F4v1 далее модифицировали в положении 28 HVR-L1 (N28) (SEQ ID NO: 9) (см. фиг.2B). Остаток аспарагина в этом положении заменен остатком валина (N28V) с получением HVR-L1 (SEQ ID NO: 10) для вариантов hu10F4v2 и hu10F4v3, которая показала повышенную аффинность связывания. Эти варианты содержат одинаковые последовательности вариабельных и константных доменов зрелого антитела и отличаются только сигнальной последовательностью, не встречающейся в зрелом антителе по изобретению.
Проводили дополнительные модификации аминокислотной последовательности в одной или обеих из аминокислот Asn28 (N28) и/или Asn30 (N30) гипервариабельной области HVR-L1 (см. фиг.2B) hu10F4v1. Поскольку N28 и N30 являются возможными участками для дезаминирования, тестировали аминокислотные замены в этих участках. Например, аспарагин в положении 28 (N28) заменяли альтернативно на A, Q, S, D, V или I и аспарагин в положении 30 (N30) заменяли альтернативно на A или Q. Изменения аминокислотной последовательности в домене HVR-L1 по изобретению представлены в таблице 2 совместно с их аффинностью связывания, тестированной конкурентным анализом в фаговом анализе ELISA (IC50) с использованием стандартных способов.
Для получения вариантов гуманизированного антитела 10F4 с полноразмерным человеческим IgG1 тяжелые и легкие цепи субклонируют отдельно в ранее описанные плазмиды pRK (Gorman, C.M. et al., (1990), DNA Protein Eng. Tech. 2:3). Соответствующие плазмиды для тяжелой и легкой цепей (в зависимости от требуемого изменения(ий) последовательности) котрансфицируют в трансформированную аденовирусом клеточную линию эмбриональной почки человека, известную как 293 (Graham, F.L. et al. (1977), J. Gen. Virol. 36: 59), с использованием высокоэффективного способа (Graham et al., выше & Gorman, C.M., Science 221: 551). Среду заменяют на бессывороточную и собирают каждые сутки вплоть до 5 суток. Антитела очищают из объединенных супернатантов с использованием CL-4B с белком A-Sepharose (Pharmacia). Элюируемое антитело подвергают замене буфера в PBS посредством гель-фильтрации G25, концентрируют ультрафильтрацией с использованием Centriprep-30 или Centricon-100 (Millipore) и хранят при 4°C. Концентрацию антитела определяют с использованием ELISA со связыванием тотальных IgG.
Иллюстративные константные домены тяжелой цепи IgG1 по изобретению представлены на фиг.5A. Иллюстративный человеческий константный домен κ легкой цепи содержит, например,
RTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHDVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 37). Полноразмерная аминокислотная последовательность h10F4v2 представлена на фиг.5B, на которой константные области легких и тяжелых цепей указаны подчеркиванием. Антитела h10F4v1, v2 и v3 представляют собой антитела изотипа IgG1.
Характеристика антител к CD22
Пример 5: Картирование эпитопов:
Эпитопы CD22, с которыми связываются антитела 10F4.4.1 и 5E8.1.8, определяли следующими способами. Последовательности CD22, лишенные различных из семи иммуноглобулин-подобных доменов основной изоформы CD22 (CD22бета), клонировали и трансформировали в клетки для стабильной экспрессии. Например, варианты CD22, лишенные домена 1 (Δ1), домена 2 (Δ2) или доменов 3 и 4 (Δ3,4), клонировали, трансформировали в клетки CHO и экспрессировали на клетках. Контрольные клетки экспрессировали CD22бета. Делеции проводили с использованием набора реагентов Stratagene QuikChange XL™. Делецию домена 1 проводили посредством делеции аминокислот 22-138; делецию домена 2 проводили посредством делеции аминокислот 139-242; и делеция доменов 3 и 4 была доступна в качестве минорной изоформы CD22альфа (делеция аминокислот 241-417). Все номера аминокислот относятся к нумерации полноразмерного предшественника CD22бета, Wilson, G.L. et al., (см. фиг.1 в Wilson, G.L. et al., J. Exp. Med. 173: 137-146 (1991)). На фиг.14 представлена диаграмма делетированных доменов. Связывание проводили посредством проточной цитометрии с использованием изотипического контроля. Связывание 10F4.4.1 детектировали с использованием IgG козы против антител мыши Alexa 488. Детекцию связывания 5E8.1.8 проводили с использованием биотинилированного IgG козы против антител мыши плюс стрептавидин PE. Неблагоприятный эффект на связывание антител 10F4.4.1 мыши или 5E8.1.8 мыши в отсутствии конкретных доменов ECD показал, что антитело связывает эти домены. 10F4.4.1 и 5E8.1.8 мыши показали одинаковые характеристики связывания в этих условиях. Ни одно из них не связывало CD22, лишенный домена 1 или домена 2, и оба из них связывали CD22, содержащий 1 и 2, но лишенный доменов 3 и 4. С использованием этого способа было определено, что 10F4.4.1 и 5E8.1.8 связываются с доменами 1 и 2 CD22 человека, в последовательности с аминокислоты 22 по аминокислоту 240 SEQ ID NO: 27 (см. Wilson, G.L. et al., (1991) выше).
Пример 6: Характеристика аффинности связывания с растворимым антигеном
Аффинность связывания антитела 10F4 мыши и гуманизированного антитела 10F4 с растворимым внеклеточным доменом CD22 (ECD) определяли с помощью измерения посредством поверхностного плазмонного резонанса с использованием системы BIACORE® 3000 (Biacore, Inc., Piscataway, NJ). В кратком изложении, биосенсорные чипы на основе карбоксиметилированного декстрана (CM5, Biacore Inc.) активировали гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщика. На эти активированные чипы наносили антитело IgG1 10F4 к CD22 (мыши или гуманизированное) разведением до 5 мкг/мл 10 мМ ацетатом натрия, pH 4,8, с последующей инъекцией со скоростью потока 5 мкл/минута для достижения приблизительно 500 единиц ответа (RU) присоединенного антитела. Далее инъецировали 1M этаноламин для блокирования не вступивших в реакцию групп. Для измерения кинетики двукратные серийные разведения человеческого растворимого антигена CD22-бета, меченного ECD-His (от приблизительно 500 нМ до приблизительно 7,8 нМ), инъецировали в PBS с 0,05% Tween 20 при 25°C со скоростью потока 30 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) вычисляли с использованием простой взаимно однозначной модели связывания Ленгмюра (Программное обеспечение BIAevaluation версии 3.2). Равновесную константу диссоциации (Kd) вычисляли как соотношение koff/kon. В качестве контроля использовали антитело к CD22, RFB4 (Chemicon International, Inc., Temecula, CA, каталожный no. CBL147). Результаты этого эксперимента представлены в таблице 2, ниже.
Пример 7: Характеристика аффинности связывания с антигеном клеточной поверхности
Аффинность связывания 10F4.4.1 мыши и гуманизированного 10F4v1 и 10F4v2 с CD22 человека и яванской макаки (cyno), экспрессированным на поверхности клеток CHO, исследовали с использованием конкурентного анализа. В кратком изложении, в клетках CHO стабильно экспрессировали полноразмерный CD22 человека (SEQ ID NO: 27) или CD22 яванской макаки (cyno) (SEQ ID NO: 31). Антитело к CD22 (10F4v1 или v2 мыши или гуманизированное 10F4v1 или v2) йодировали реагентом Iodogen® [125I] до удельной активности приблизительно 10 мкКи/мкг. Клеточный анализ конкурентного связывания проводили с использованием серийно разведенного немеченого антитела к CD22. Антителам позволяли связываться с клетками в течение 4 часов при 4°C. Аффинность связывания, Kd, антител определяли стандартным анализом Скэтчарда, проводимым с использованием программы для обработки нелинейной кривой (например, см. Munson et al., Anal. Biochem., 107: 220-239, 1980). Результаты этого эксперимента представлены в таблице 3 ниже.
Результаты указывают на то, что 10F4 мыши и гуманизированное 10F4 связывает CD22 человека и cyno, экспрессированный на поверхности клеток CHO приблизительно с эквивалентной аффинностью.
Пример 8: Получение конъюгатов антитело к CD22-лекарственное средство
ADC к CD22 получали конъюгацией антител к CD22 RFB4, 5E8 мыши, 10F4 мыши, гуманизированного 10F4v1, гуманизированного тиомаба 10F4v1 (тио-10F4v1), гуманизированного 10F4v2 и гуманизированного 10F4v3 со следующими группами лекарственное средство-линкер: spp-DM1, smcc-DM1, MC-vc-PAB-MMAE; MC-vc-PAB-MMAF; MC-MMAE и MC-MMAF, причем эти группы лекарственных средств и линкеров описаны в настоящем документе, а также в WO 2004/010957, опубликованной 5 февраля 2004 года, и WO 2006/034488, опубликованной 9 сентября 2005 года (все из этих патентных заявок включены в настоящий документ в качестве ссылок в полном объеме). Перед конъюгацией антитела частично восстанавливали посредством TCEP с использованием стандартных способов в соответствии с технологией, описанной в WO 2004/010957. Частично восстановленные антитела конъюгировали с указанными выше группами лекарственное средство-линкер с использованием стандартных способов в соответствии с технологией, описанной в Doronina et al., (2003) Nat. Biotechnol. 21:778-784 и патенте США 2005/0238649 A1. В кратком изложении, частично восстановленные антитела объединяли с группами лекарственное средство-линкер для возможности конъюгации групп с остатками цистеина. Реакции конъюгации гасили и ADC очищали. Нагрузку лекарственным средством (среднее количество групп лекарственного средства на антитело) для каждого ADC определяли посредством ВЭЖХ. Другие пригодные линкеры для получения ADC включают в качестве неограничивающих примеров BMPEO, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC, и сульфо-SMPB, и SVSB (сукцинимидил-(4-винилсульфон)бензоат), и включая бис-малеимидные реагенты: DTME, BMB, BMDB, BMH, BMOE, BM(PEO)3, и BM(PEO)4.
ADC к CD22 также получают конъюгацией с остатками лизина антитела. Лизины антитела превращают в сульфгидрильные группы с использованием, например, реагента Траута (Pierce Chemical Co.), как описано в настоящем документе. Для получения ADC полученные сульфгидрильные группы способны реагировать с линкерами или молекулами линкер-лекарственное средство. Альтернативно, ADC получают реакцией лизина на антителе к CD22 с линкером, SPP (N-сукцинимидил-4-(2'-пиридилдитио)пентаноатом, который может быть уже присоединен к молекуле лекарственного средства или может впоследствии вступать в реакцию с молекулой лекарственного средства, такой как майтанзиноид. Например, антитело модифицируют реакцией с SPP, с последующей конъюгацией с f, как описано в Wang, L. et al., Protein Science 14:2436-2446 (2005), которая включена, таким образом, в качестве ссылки в полном объеме. Остатки лизина на антителе к CD22 также можно подвергать реакции с линкером, SMCC (Pierce Chemical Co.), при pH 7-9, так что реагирующий с амином N-гидроксисукцинимид (NHS сложный эфир) SMCC образует стабильную амидную связь с антителом. Реагирующую с сульфгидрилом малеимидную группу SMCC подвергают реакции с сульфгидрильной группой DM1 при pH 6,5-7,5 (см. Pierce Chemical Co., piercenet.com) с образованием ADC. Лизин или остатки цистеина подвергают реакции с группой линкер-лекарственное средство с получением ADC, обладающих средней нагрузкой лекарственным средством приблизительно 1-8 молекул линкер-лекарственное средство на антитело, альтернативно 1-6, 1-4, 1-3 или 1-2 молекул линкер-лекарственное средство на антитело.
Этим способом получили ADC анти-CD22(RFB4)-SMCC-DM1 и анти-GP120-SMCC-DM1, где RFB4-smcc-DM1 был получен с низкой (1,95), средней (3,7) и высокой (6,75) нагрузкой лекарственным средством. Был получен анти-GP120-smcc-DM1 с высокой (6,1) нагрузкой лекарственным средством. Было оказано, что эти ADC являются эффективными in vivo, как показано в примере 9 и таблица 9 в настоящем документе ниже.
Пример 9: Эффективность конъюгатов антитело к CD22-лекарственное средство
Исследования детерминант эффективности in vitro
Определяли детерминанты эффективности ADC к CD22 (или TDC) в клеточной линии лимфомы. Известно, что CD22, экспрессированный на поверхности B-клеток, интернализуется при связывании его лиганда(ов) или антител (Sato, S. et al., Immunity 5:551-562 (1996)). Для тестирования того, влияет ли уровень экспрессии на поверхности B-клетки CD22 и/или интернализация CD22 на эффективность, и каким образом это происходит, проводили следующие исследования in vitro.
Поверхностная экспрессия CD22 человека на множестве клеточных линий лимфом
Девятнадцать клеточных линий лимфом, экспрессирующих различные количества CD22 на их поверхности, культивировали и собирали в log-фазе. Клетки ресуспендировали в буфере для промывания FACS (PBS; 0,5% бычий сывороточный альбумин; 0,1% азид натрия), содержащем 100 мкг/мл каждого из нормального IgG мыши и нормального IgG человека и поддерживали на льду. Приблизительно 1×106 клеток/100 мкл окрашивали посредством APC к huCD22 (mIgG1, клон RFB4, Southern Biotech #9361-11) или изотипа IgG1 APC мыши(BD Pharmingen #555751) в течение 30 минут на льду. Погибшие клетки окрашивали посредством 7-AAD (BD Pharmingen #559925). Данные получали на проточном цитометре BD FacsCalibur™ и анализировали с помощью программного обеспечения FlowJo™. Определение IC50 для hu10F4v3-SMCC-DM1 или каждого свободного лекарственного средства (DM1, MMAF или MMAE) проводили культивированием клеток лимфомы, как описано выше, сбором культивированных клеток в log-фазе и высеванием 5000 клеток в 90 мкл среды для культивирования на лунку в 96-луночном планшете. ADC и свободное лекарственное средство разбавляли серийно в пределах диапазона детекции (начиная с 300 мкг/мл для ADC, или 90 нМ для свободного лекарственного средства, и с разведением до практически нулевого количества анализируемой мишени). 10 мкл аликвот ADC или свободного лекарственного средства добавляли в дублируемые лунки, содержащие клетки, и инкубировали в течение 3 суток при 37°C. В каждую лунку добавляли 100 мкл CellTiter Glo™ и инкубировали в течение 30 мин. Проводили детекцию хемилюминесценции и данные анализировали с использованием программного обеспечения Prism™. Результаты представлены на фиг.6A, на который высокие уровни поверхностного CD22 коррелируют с низкой IC50 (более высокая эффективность) hu10F4v3-SMCC-DM1. На фиг.6C показано, что существует более сильная корреляция между собственной чувствительностью клеток к свободному лекарственному средству и IC50 ADC.
Интернализацию hu10F4v3-SMCC-DM1 определяли анализом FACS
В кратком изложении, клетки лимфомы окрашивали стандартными способами FACS с помощью CD22-FITC (RFB4) в присутствии hu10F4v3-SMCC-DM1 и инкубировали на льду в течение 20-30 минут. Для определения уровней CD22 на клеточной поверхности после исходного окрашивания клетки промывали в холодных средах RPMI/10% FBS и добавляли 200 мкл предварительно нагретой RPMI/10% FBS и инкубировали при 37°C в течение 15 минут. Добавляли 80 мкл буфера для окрашивания и 20 мкл инактивированной нагреванием нормальной сыворотки мыши (HI NMS), с последующей инкубацией на льду в течение 15 минут. Добавляли анти-DM1-Alexa-647, инкубировали на льду в течение 20-30 минут и клетки промывали и фиксировали 200 мкл смеси PBS/1% параформальдегид перед анализом FACS. Для определения поверхностного и внутреннего окрашивания CD22 после исходного окрашивания клетки промывали холодной RPMI/10% FBS, добавляли предварительно нагретую RPMI/10% FBS и клетки инкубировали в течение 15 минут при 37°C. Затем клетки промывали FACS Wash и фиксировали Fix Reagent A (Dako™ #k2311) при комнатной температуре в течение 15 минут, и стадию повторяли с Fix Reagent B (Dako™). Добавляли буфер для окрашивания и HI NMS и клеточную смесь инкубировали на льду в течение 15 мин. Добавляли Fix Reagent B, а затем анти-DM1-Alexa-647 и инкубировали при комнатной температуре в течение 20-30 минут. Клетки промывали FACS Wash и фиксировали смесью PBS/1% параформальдегид. Проводили анализ FACS каждой клеточной смеси (поверхность, поверхность после интернализации и внутреннее окрашивание) с использованием проточного цитометра BD FacsCalibur™ и анализировали с помощью программного обеспечения FlowJo™. Результаты представлены на фиг.6B, на которой высокие количества интернализованного DM1 коррелируют с низкой IC50 (высокая эффективность); и на фиг.6D, на которой интернализованный DM1 визуализируют флуоресцентной микроскопией.
Исследования эффективности in vivo
Для тестирования эффективности конъюгированных с токсином или неконъюгированных моноклональных антител к CD22 в отношении способности снижать объем опухоли in vivo использовали следующий протокол.
Каждой мыши SCID инокулировали подкожно в бок 2×107 клеточной линии B-клеточной лимфомы человека. Клеточные линии человека включали клеточные линии лимфомы Беркита человека клетки Daudi, Ramos и Raji (доступные от American Type Culture Collection, Manassas, VA, USA), и другие B-клеточные линии, включающие клетки U-698-M и клетки Su-DHL-4 (доступные от DSMZ, Braunschweig, Germany; клетки Su-DHL-4 трансфицировали люциферазным репортерным геном), клетки DoHH2 (Kluin-Neilemans, H.C. (1991), выше), и Granta-519 (клетки лимфомы мантийных клеток, Jadayel, D.M. et al., Leukemia 11(1):64-72 (1997)), и клетки BJAB-luc (B-клеточная лимфобластоидная клеточная линия BJAB человека, которая экспрессирует репортерный ген люциферазы). Когда опухоли достигали среднего объема опухоли между 100-200 мм3, мышей разделяли на группы, и на 0 сутки проводили внутривенную инъекцию конъюгированного с токсином антитела или неконъюгированного антитела, как показано в таблицах 4-16, ниже.
Конъюгаты с лекарственным средством антитело к CD22-майтанзин снижают объем B-клеточной опухоли
Шестидесяти пяти мышам SCID подкожно инъецировали 2×107 клеток BJAB-luc в объеме 0,2 мл на мышь в бок. Клетки суспендировали в HBSS. Когда средний объем опухоли достигал 100-200 мм3, мышей случайным образом разделяли на четыре группы по 9 мышей в каждой и проводили однократное внутривенное введение (через хвостовую вену) антитела к CD22 или контрольного антитела, указанного в таблице 4, ниже.
"TI" - встречаемость опухоли в последний момент времени для каждой группы; числитель относится к количеству обладающих опухолью животных, и знаменатель относится к общему количеству животных. "PR" относится к количеству животных с опухолью, подвергшейся 50-99% регрессии от ее исходного объема. "CR" относится к количеству животных, достигших полной ремиссии.
Средний объем опухоли подвергали мониторингу в каждой группе по введению в течение 32 суток после инъекции антитела. Измерение опухоли проводили с помощью штангенциркуля. Эффективность конъюгированных с токсином антител к CD22 определяли сравнением с контрольными и неконъюгированными антителами. Результаты представлены на фиг.7A. Моноклональные антитела 10F4v1-smcc-DM1 мыши и гуманизированные моноклональные антитела 10F4v1-smcc-DM1 значительно замедляли рост опухоли относительно неконъюгированного антитела к CD22 и неспецифического контрольного антитела.
С использованием такого же протокола, как указано выше, проводили анализ, сравнивающий конъюгированное с токсином гуманизированное 10F4v2 с конъюгированным с токсином антителом мыши и простым гуманизированным антителом, как указано в таблице 5, ниже.
"TI"- встречаемость опухоли в последний момент времени для каждой группы; числитель относится к количеству обладающих опухолью животных, и знаменатель относится к общему количеству животных. "PR" относится к количеству животных с опухолью, подвергшейся 50-99% регрессии от ее исходного объема. "CR" относится к количеству животных, достигших полной ремиссии.
Средний объем опухоли подвергали мониторингу в каждой группе по введению в течение 32 суток после инъекции антитела. Измерение опухоли проводили с помощью штангенциркуля. Эффективность конъюгированных с токсином антител к CD22 определяли сравнением с контрольными и неконъюгированными антителами. Результаты представлены на фиг.7B. Моноклональные антитела 10F4-smcc-DM1 мыши и гуманизированное 10F4v2-smcc-DM1 значительно замедляли рост опухоли относительно неконъюгированного антитела к CD22 и неспецифического контрольного антитела.
Антитело к CD22 конъюгировали с DM1 через линкер spp или линкер smcc в соответствии со способами конъюгации, описываемыми в настоящем документе. В качестве положительного контроля использовали простое антитело к CD20 и в качестве отрицательных контролей использовали конъюгаты с токсином, анти-HER2-spp-DM1 и анти-HER2-smcc-DM1. Восьмидесяти мышам SCID подкожно инъецировали 2×107 клеток BJAB-luc в объеме 0,2 мл на мышь в бок. Клетки суспендировали в HBSS. Когда средний размер опухоли достигал 100-200 мм3, мышей случайным образом разделяли на шесть групп по 10 мышей в каждой и проводили внутривенную инъекцию тестируемых или контрольных антител. Дозы повторяли один раз каждую неделю всего для трех доз. См. таблицу 6.
Средний объем опухоли подвергали мониторингу два раза каждую неделю в течение 3 недель, а затем один раз каждую неделю всего в течение 8 недель. Изменения объема опухоли с течением времени (фиг.7C) показывает, что анти-CD22-spp-DM1, дозируемый в количестве 214 и 107 мкг/м2 DM1, и анти-CD22-smcc-DM1, дозируемый в количестве 405 мкг/м2, показали сильную и сравнимую противоопухолевую активность в ксенотрансплантатах опухолей BJAB-luc. Все группы ADC к CD22 показали полные ответы.
Антитела к CD22, RFB4, 5E8 и 7A2 конъюгировали с DM1 через линкер smcc способами конъюгации, описываемыми в настоящем документе. В качестве отрицательного контроля использовали конъюгат с токсином, анти-HER2-smcc-DM1 (обозначаемый взаимозаменяемо в настоящем документе как HER-smcc-DM1 или HER2-smcc-DM1).
Исследовали способность этих антител снижать объем опухоли в различных ксенотрансплантатах у мышей SCID. Клеточные линии B-клеточной лимфомы человека, используемые для получения ксенотрансплантатов опухолей у мышей, представляли собой клетки Ramos и клетки BJAB-luc. Для каждого ксенотрансплантата мышам SCID подкожно инъецировали 5×106 клеток B-клеточной лимфомы человека Ramos в объеме 0,1 мл на мышь в бок (или 2×107 клеток BJAB-luc в 0,2 мл). Клетки суспендировали в HBSS. Когда средний размер опухоли достигал 100-200 мм3, мышей случайным образом разделяли на группы по 8-10 мышей в каждой и каждой мыши проводили однократную внутривенную инъекцию тестируемого или контрольного антитела. Нагрузку лекарственным средством DM1 приводили к 200 мкг/м2 для каждой группы с получением дозы вводимого DM1. Мониторинг среднего объема опухоли проводили два раза каждую неделю в течение 4 недель. Результаты представлены ниже в таблицах 7 и 8 и изображены на графиках на фиг.8A и 8B, соответственно.
Эти результаты показывают, что конъюгаты антитело-лекарственное средство анти-CD22-smcc-DM1 значительно снижают объем B-клеточной опухоли в ксенотрансплантатах Ramos и BJAB-luc относительно контрольного антитела или простого антитела к CD22.
Исследовали влияние нагрузки антитела лекарственным средством (среднее количество конъюгированных молекул лекарственного средства на антитело в совокупности антител) на способность конъюгатов антитело-лекарственное средство анти-CD22-smcc-DM1 снижать объем опухоли в ксенотрансплантатах BJAB-luc мышей SCID. Ста сорока мышам SCID подкожно инъецировали 2×107 клеток BJAB-luc в объеме 0,2 мл на мышь в бок. Клетки суспендировали в HBSS. Когда средний размер опухоли достигал 100-200 мм3, мышей случайным образом разделяли на группы по 8-10 мышей в каждой и каждой мыши проводили однократную внутривенную инъекцию тестируемого или контрольного антитела. В качестве тестируемых антител вводили популяции анти-CD22(RFB4)-smcc-DM1, обладающие относительно низкими, средними или высокими нагрузками лекарственным средством (средние нагрузки лекарственным средством 1,95, 3,7 или 6,75 конъюгированных молекул DM1 молекулы на антитело, соответственно). Простое антитело RFB4 и анти-GP120-smcc-DM1 (высокая нагрузка лекарственным средством) представляли собой контроли. Дозы конъюгатов антитело-лекарственное средство (тестируемых и контрольных) приводили к уровню дозы 5 мг/кг белка. Присоединение линкерного конъюгата к антителам проводили через остатки лизина. См. таблицу 9.
При дозировании при подобранном уровне белка (5 мг/кг), анти-CD22(RFB4)-smcc-DM1, нагруженное с высокой нагрузкой лекарственным средством (6,75 молекул DM1 на молекулу антитела), снижало объем опухоли немного больше, чем конъюгат антитело-лекарственное средство со средней нагрузкой 3,7, в то время как воздействие конъюгата антитело-лекарственное средство с низкой нагрузкой лекарственным средством не отличалось от контрольного конъюгата или простого антитела. Результаты представлены на графике на фиг.9.
Конъюгаты с лекарственным средством антитело к CD22-ауристатин снижают объем B-клеточной опухоли
Исследовали воздействие конъюгатов антитела к CD22 с лекарственным средством ауристатином MMAF на объем опухоли в ксенотрансплантатах мыши. Антитело к CD22(RFB4) и контрольное антитело к GP120 конъюгировали с MMAF через линкер MC-vcPAB или линкер MC в соответствии со способами, описываемыми в настоящем документе. Мышам SCID подкожно инъецировали 5×106 клеток Ramos в объеме 0,2 мл на мышь в бок. Клетки суспендировали в HBSS. Когда средний объем опухоли достигал 100-200 мм3, мышей случайным образом разделяли на группы по 8-10 мышей в каждой и каждой мыши проводили однократную внутривенную инъекцию тестируемого или контрольного антитела. Доза лекарственного средства, нагрузка лекарственным средством (соотношение для лекарственного средства) и доза антитела, вводимого мыши, представлены в таблице 10.
Анти-CD22-MC-MMAF показало сравнимую активность с анти-CD22-MC-vc-PAB-MMAF в ксенотрансплантатах Ramos RA1. Результаты представлены на графике на фиг.10.
Исследовали воздействие конъюгатов антитела к CD22 с лекарственным средством ауристатином MMAE и DM1 на объем опухоли в ксенотрансплантатах мыши. Антитело к CD22(RFB4) и контрольное антитело к GP120 конъюгировали с MMAE через линкер MC-vcPAB или линкер MC, или с DM1 через линкер smcc в соответствии со способами, описываемыми в настоящем документе. Мышам SCID подкожно инъецировали 5×106 клеток Ramos в объеме 0,1 мл на мышь в бок. Клетки суспендировали в HBSS. В качестве контроля вводили PBS. Когда средний объем опухоли достигал 100-200 мм3, мышей случайным образом разделяли на группы по 8-10 мышей в каждой, и каждой мыши проводили однократную внутривенную инъекцию тестируемого или контрольного антитела. Доза лекарственного средства, нагрузка лекарственным средством (соотношение для лекарственного средства) и доза антитела, вводимого мыши, представлены в таблице 11.
Анти-CD22-MCvcPAB-MMAE показали мощную противоопухолевую активностью в ксенотрансплантатах Ramos RA1. Анти-CD22-MCvcPAB-MMAE показал более высокую активность по сравнению с анти-CD22-smcc-DM1. Контроль ADC, анти-GP120-MCvcPAB-MMAE не показали значительной активности. Результаты представлены на графике на фиг.11.
Исследовали воздействие конъюгатов антитела к CD22 с лекарственным средством ауристатином MMAF и DM1 на объем опухоли в ксенотрансплантатах мыши. Вводили антитело к CD22 hu10F4v2-MC-MMAF, hu10F4v2-smcc-DM1 и тио-10F4v1-MC-MMAF и сравнивали в отношении воздействия на объем опухоли. Контрольные антитела представляли собой анти-Her2-MC-MMAF и анти-Her2-smcc-DM1. Мышам SCID подкожно инъецировали 2×107 клеток BJAB-luc в объеме 0,2 мл на мышь в бок. Клетки суспендировали в HBSS. Когда средний объем опухоли достигал 100-200 мм3, мышей случайным образом разделяли на группы по 8-10 мышей в каждой и каждой мыши проводили однократную внутривенную инъекцию тестируемого или контрольного антитела. "Тио" относится к тиомабу, как описано в настоящем документе, в котором линкер-молекула лекарственного средства конъюгированы с антителом через модифицированный цистеином участок на антителе. Доза лекарственного средства, нагрузка лекарственным средством (соотношение для лекарственного средства) и доза антитела, вводимого мыши, представлены в таблице 12.
ADC Hu10F4v2 показали мощную противоопухолевую активность в опухоли ксенотрансплантата BJAB-luc. Результаты представлены на графике на фиг.12.
С использованием способов, как описано в представленных выше экспериментах, исследовали эффективность ADC hu10F4v3 с -smcc-DM1 и -MC-MMAF в различных ксенотрансплантатах в различных дозах. Ксенотрансплантаты SuDHL4-luc, DoHH2 и Granta-519 получали, как описано в настоящем документе, выше. Когда средний объем опухоли достигал 100-200 мм3, мышей случайным образом разделяли на группы по 8-10 мышей в каждой и каждой мыши проводили однократную внутривенную инъекцию тестируемого или контрольного антитела. Доза лекарственного средства, нагрузка лекарственным средством (соотношение для лекарственного средства) и доза антитела, вводимого мыши, представлены в таблицах 13A-13C и результаты представлены на фиг.13A-13C.
ADC к CD22 hu10F4v3-smcc-DM1 и -MC-MMAF показали выраженное уменьшение опухоли во всех тестируемых моделях с ксенотрансплантатами.
Пример 10: Получение модифицированных цистеином антител к CD22
Получение модифицированных цистеином антитела к CD22 проводили, как описано в настоящем документе. ДНК, кодирующую антитело 10F4v3, обладающую такими же последовательностями вариабельной и константной области, что и 10F4v2 (легкая цепь, SEQ ID NO: 87; и тяжелая цепь, SEQ ID NO: 88, фиг.5B), подвергали мутагенезу способами, описываемыми в настоящем документе, для модификации легкой цепи, тяжелой цепи или Fc-области тяжелой цепи. ДНК, кодирующую легкую цепь, подвергали мутагенезу для замены цистеином валина в положении по Kabat 205 в легкой цепи (положение в последовательности 210), как представлено на фиг.17A (легкая цепь SEQ ID NO: 91 гуманизированного антитела 10F4v3 тиомаба). ДНК, кодирующую тяжелую цепь, подвергали мутагенезу для замены цистеином аланина в положении EU 118 в тяжелой цепи (положение в последовательности 121), как показано на фиг.17B (тяжелая цепь SEQ ID NO: 92 гуманизированного антитела 10F4v3 тиомаба). Fc-область подвергали мутагенезу для замены цистеином серина в положении EU 400 в тяжелой цепи Fc-области (положение в последовательности 403), как представлено на фиг.17C (тяжелая цепь SEQ ID NO: 93).
Получение модифицированных цистеином антител к CD22 для конъюгации посредством восстановления и повторного окисления
Полноразмерные, модифицированные цистеином моноклональные антитела к CD22 (тиомабы), экспрессированные в клетках CHO, растворяют в 500 мМ борате натрия и 500 мМ хлориде натрия при приблизительно pH 8,0 и восстанавливают приблизительно 50-100-кратным избытком 1 мМ TCEP гидрохлорид (трис(2-карбоксиэтил)фосфин; Getz et al., (1999) Anal. Biochem. Vol 273: 73-80; Soltec Ventures, Beverly, MA) в течение приблизительно 1-2 ч при 37°C. Восстановленный тиомаб растворяют и помещают на колонку HiTrap S в 10 мМ ацетате натрия, pH 5 и элюируют посредством PBS, содержащего 0,3 M хлоридом натрия. Элюированный восстановленный тиомаб обрабатывают 2 мМ дегидроаскорбиновой кислотой (dhAA) при pH 7 в течение 3 часов или 2 мМ водным сульфатом меди (CuSO4) при комнатной температуре в течение ночи. Окисление атмосферным воздухом также может быть эффективным. Буфер заменяют элюированием через смолу G25 и элюируют посредством PBS с 1 мМ DTPA. Величину тиол/Ab проверяют определением концентрации восстановленного антитела, исходя из поглощения при 280 нм раствора, и концентрации тиола реакцией с DTNB (Aldrich, Milwaukee, WI) и определением поглощения при 412 нм.
Пример 11: Получение модифицированных цистеином конъюгатов антитело к CD22-лекарственное средство конъюгацией модифицированных цистеином антител к CD22 и промежуточных соединений лекарственное средство-линкер
После способов восстановления и повторного окисления примера 10 модифицированное цистеином антитело к CD22 растворяют в PBS (фосфатно-солевом буфере) и охлаждают на льду. Приблизительно 1,5 молярных эквивалентов относительно полученных в результате конструирования цистеинов на антитело промежуточного соединения лекарственное средство ауристатин-линкер, такого как MC-MMAE (малеимидокапроил-монометил ауристатин E), MC-MMAF, MC-val-cit-PAB-MMAE, или MC-val-cit-PAB-MMAF, с реагирующей с тиолом функциональной группой, такой как малеимидо, растворяют в DMSO, разбавляют ацетонитрилом и водой и добавляют к охлажденному восстановленному, повторно окисленному антителу в PBS. Приблизительно через один час добавляют избыток малеимида для гашения реакции и кэпирования любых не вступивших в реакцию тиольных групп антитела. Реакционную смесь концентрируют ультрафильтрационным центрифугированием и модифицированный цистеином конъюгат антитело к CD22-лекарственное средство очищают и обессоливают элюированием через смолу G25 в PBS, фильтруют через 0,2-мкм фильтры в стерильных условиях и замораживают для хранения.
Получение тиомаб hu 10F4v3 HC(A118C)-BMPEO-DM1 проводили следующим образом. Свободный цистеин на тиомабе hu 10F4v3 HC(A118C) модифицировали бис-малеимидореагентом BM(PEO)4 (Pierce Chemical), оставляя не вступившую в реакцию группу малеимидо на поверхности антитела. Это проводили растворением BM(PEO)4 в 50% смеси этанол/вода до концентрации 10 мМ и добавлением десятикратного молярного избытка BM(PEO)4 к раствору, содержащему ThioFab hu4D5Fabv8-(V110C) в фосфатно-солевом буфере в концентрации приблизительно 1,6 мг/мл (10 микромолярная) и позволяя реагировать в течение 1 часа. Избыток BM(PEO)4 удаляли гель-фильтрацией (колонка HiTrap, Pharmacia) в 30 мМ цитрате, pH 6, с 150 мМ буфером NaCl. К промежуточному соединению hu4D5Fabv8-(VI10C) ThioFab-BMPEO добавляли приблизительно 10-кратный молярный избыток DM1, растворенный в диметилацетамиде (DMA). Также для растворения реагента группы лекарственного средства можно использовать диметилформамид (DMF). Реакционной смеси позволяли реагировать в течение ночи перед гель-фильтрацией или диализом в PBS для удаления не вступившего в реакцию лекарственного средства. Для удаления высокомолекулярных агрегатов и получения очищенного тиомаб hu 10F4v3 HC(A118C) тиомаб-BMPEO-DM1 применяли гель-фильтрацию на колонках S200 в PBS.
Посредством указанных протоколов получали контрольный HC (A118C) MAb-MC-MMAF, контрольный HC Тиомаб-MC-MMAF, контрольный HC Тиомаб-MCvcPAB-MMAE и контрольный HC Тиомаб-BMPEO-DM1.
Способами, указанными выше, получали и тестировали следующие модифицированные цистеином конъюгаты антитело к CD22-лекарственное средство:
тио hu тио-HC-10F4v3-MC-MMAF посредством конъюгации A118C тио hu 10F4v3 и MC-MMAF;
тио hu тио-HC-10F4v3-MC-val-cit-PAB-MMAE посредством конъюгации A118C тио hu 10F4v3 и MC-val-cit-PAB-MMAE;
тио hu HC-10F4v3-bmpeo-DM1 посредством конъюгации A118C тио hu HC-10F4v3 и bmpeo-DM1;
тио hu LC-10F4v3-MC-val-cit-PAB-MMAE посредством конъюгации V205C тио hu LC-10F4v3 и MC-val-cit-PAB-MMAE; и
тио hu Fc-10F4v3-MC-val-cit-PAB-MMAE посредством конъюгации S400C тио hu Fc-10F4v3 и MC-val-cit-PAB-MMAE.
Пример 12: Характеристика аффинности связывания конъюгатом модифицированный цистеиномом тиомаб-лекарственное средство с антигеном клеточной поверхности
Аффинность связывания конъюгатов тио hu 10F4v3-лекарственное средство к CD22, экспрессированному на клетках BJAB-luc, определяли анализом FACS. В кратком изложении, приблизительно 1×106 клетки в 100 мкл подвергали контактированию с различными количествами одного из следующих конъюгатов антитела к CD22 Тиомаб-лекарственное средство: тио hu LC(V205C) 10F4v3-MCvcPAB-MMAE, тио hu Fc(S400C) 10F4v3-MCvcPAB-MMAE, тио hu HC(A118C) 10F4v3-MCvcPAB-MMAE, тио hu HC(A118C) 10F4v3-MC-MMAF, или тио hu HC(A118C) 10F4v3-BMPEO-DM1 (см. фиг.18A-18E, соответственно). Антитело к CD22, связавшееся с клеточной поверхностью, подвергали детекции с использованием биотинилированного анти-huFc козы плюс стрептавидин-PE. Графики на фиг.18A-18E указывают, что связывание антигена было приблизительно одинаковым для всех тестируемых конъюгатов тиомаб-лекарственное средство.
Пример 13: Анализ уменьшения объема опухоли in vivo посредством конъюгатов тиомаб к CD22-лекарственное средство
Способность конъюгатов тиомаб-лекарственное средство, полученных по примеру 11, уменьшать объем B-клеточной опухоли в моделях ксенотрансплантата тестировали в соответствии со способом, описанным в примере 9, в настоящем документе. Мышам SCID, обладающим ксенотрансплантатом опухоли из клеток Granta-519, контрольные конъюгаты и конъюгаты гуманизированное 10F4v3 тиомаб к CD22-лекарственное средство вводили на 0 сутки в дозах, представленных в таблице 14, ниже. Контрольное HC(A118C) тиомаб представляло собой антитело к HER2 4D5.
Результаты этого эксперимента представлены на фиг.19. Введение конъюгатов тиомаб-лекарственное средство тио 10F4v3-LC-(V205C)-MCvcPAB-MMAE и тио 10F4v3-HC(A118C)-MCvcPAB-MMAE в дозах, представленных в таблице 14, вызывало снижение среднего объема опухоли на протяжении исследования.
Дополнительные конъюгаты тиомаб-лекарственное средство тестировали в ксенотрансплантатах Granta-519 у мышей CB17 SCID с использованием указанного протокола, но с отличающимися дозами лекарственного средства. Контрольное антитело или контрольный тиомаб представляли собой антитело к HER2 4D5 или тиомаб HC(A118C). Результаты представлены в таблице 15, ниже.
Результаты этого эксперимента представлены на фиг.20A. Введение конъюгата тиомаб-лекарственное средство тио 10F4v3-HC(A118C)-MCvcPAB-MMAE в количестве 150 и 75 мкг/м2 приводило к уменьшению объема опухоли на протяжении исследования. В этом же исследовании, в группах с каждой дозировкой определяли процентное изменение массы тела в течение первых 7 суток. Результаты, представленные на графике на фиг.20B, указывают на то, что введение этих конъюгатов тиомаб-лекарственное средство не вызывает снижения массы тела в течение этого времени.
В сходном исследовании с использованием такого же протокола исследования с ксенотрансплантатами, как описано в приведенных выше примерах, исследовали различные TDC и вводимые дозы, эффективность TDC в ксенотрансплантатах фолликулярной лимфомы DOHH2 у мышей CB17 SCID. TDC и дозы представлены в таблице 16, ниже.

На фиг.20C представлен график, на котором изображены изменения среднего объема опухоли с течением времени в ксенотрансплантате фолликулярной лимфомы DOHH2 у мышей CB17 SCID, которым вводили те же TDC к CD22 с тяжелой цепью A118C, но в более высоких дозах, как представлено в таблице 16. Оказалось, что TDC к CD22 10F4v3-HC(A118C)-MCvcPAB-MMAE является наиболее эффективным среди тестируемых веществ в этом исследовании. Однако при повышенных уровнях дозы в этом эксперименте была отмечена некоторая эффективность в контролях анти-HER2-HC(A18C)-MCvcPAB-MMAE. Вероятно, эта активность свойственна высвобождению лекарственного средства из ADC в кровотоке. Тестируемые вещества к CD22 hu10F4-HC(A118C)-MC-MMAF и -BMPEO-DM1 показали промежуточную эффективность и, согласуясь с повышенной стабильностью этих линкеров, несвязывающиеся контроли анти-HER2 показали небольшую активность. На фиг.20D представлен график процентного изменения массы у мышей в исследовании ксенотрансплантата DOHH2, показывающем, что не происходит существенного изменения массы в ходе первых 14 суток исследования.
Пример 14: Безопасность конъюгатов антитело к CD22-лекарственное средство у крыс и яванских макак
Антитело hu10F4 к CD22 перекрестно реагирует с CD22 яванской (cyno) макаки с аффинностью, эквивалентной CD22 человека. Антитело hu10F4 к CD22 не реагирует перекрестно с CD22 крысы. В результате, оценивали независимую от мишени и зависимую от мишени безопасность и токсичность конъюгатов антитело к CD22 лекарственное средство у крыс и cyno, соответственно.
Безопасность и токсичность у крыс
Для исследований безопасности и токсичности у крыс проводили два исследования. В одном исследовании крысам внутривенно дозировали на 1 сутки конъюгаты hu10F4v3-SMCC-DM1, -SPP-DM1, -MC-vc-PAB-MMAE или -MC-MMAF, в которых лекарственное средство было связано через расщепляемый (-vc- или -spp-) или нерасщепляемый (MC или SMCC (также обозначаемый как MCC)) линкер. В качестве контроля вводили носитель. Сбор образцов крови проводили на 5 сутки для фармакокинетического анализа и на 12 сутки (при аутопсии). Клинические наблюдения и регистрацию массы тела проводили, по меньшей мере, три раза в неделю. В качестве показателя токсичности проводили мониторинг сывороточной AST (аспартатаминотрансферазы). Сывороточные уровни AST возрастали на 5 сутки относительно 0 суток у крыс, которым дозировали 20 мг/кг hu10F4v3-vcMMAE и hu10F4v3-SPP-DM1, содержащих расщепляемые линкеры (фиг.21A). Уровни нейтрофилов возрастали на 5 сутки относительно 0 суток у крыс, которым дозировали 20 мг/кг hu10F4v3-MC-MMAF или hu10F4v3-MCC-DM1 (нерасщепляемые линкеры, фиг.21B). Уровни нейтрофилов были снижены на 5 сутки относительно 0 суток у крыс, которым дозировали hu10F4v3-vc-MMAE или hu10F4v3-SPP-DM1. Повышенная сывороточная AST и сниженные нейтрофилы у крыс, которым дозировали ADC, содержащие расщепляемые линкеры, указывают на повышенную токсичность таких ADC.
В том же исследовании на крысах шести животным на группу дозировали 20, 40 или 60 мг/кг hu10F4v3-MC-MMAF или hu10F4v3-SMCC-DM1 на 1 сутки и подвергали мониторингу в течение двенадцати суток. У животных, которым дозировали hu10F4v3-MC-MMAF, не было выявлено следующих показателей: сниженная масса тела, повышение в сыворотке ферментов печени, снижение количества тромбоцитов или снижение количества нейтрофилов. У крыс, которым дозировали hu10F4v3-SMCC-DM1, наблюдали обратимое снижение массы тела и обратимое повышение в сыворотке ферментов печени при уровнях доз 40 и 60 мг/кг, в то время как при дозах 60 мг/кг наблюдали обратимое снижение количества нейтрофилов и временное снижение количества тромбоцитов.
Безопасность и токсичность у яванских макак
Для оценки безопасности и токсичности ADC к CD22 в модели на приматах тридцать макак cyno распределяли на следующие группы по введению: контроль в виде носителя (6 животных), hu10F4v3-smcc-DM1 в дозах лекарственного средства 2, 4 и 6 мг/м2 (эквивалентных 0, 10, 20 и 30 мг/кг дозы на антитело; 4 животных на группу по дозированию), и hu10F4v3-MC-MMAF в дозах 2, 4 и 6 мг/м2 (4 животных на группу по дозированию). Животным проводили внутривенное дозирование на 1 сутки и 22 сутки. У животных оценивали изменение массы тела, потребления пищи и признаки патологии. Образцы крови собирали и оценивали для оценки токсикологических, фармакодинамических эффектов и эффектов антител против лекарственного средства. Половину животных в каждой группе умерщвляли каждые 25 суток и 43 суток и собирали образцы тканей.
Не было отмечено заметных изменений массы тела ни в одной группе по ADC. Уровни в сыворотке ферментов печени AST (аспартатаминотрансферазы), ALT (аминотрансферазы) и GGT (гамма-глутамилтранспептидазы) оценивали в соответствии со стандартными способами, известными в соответствующих областях. Обратимое повышение в сыворотке ферментов печени наблюдали у животных, которым дозировали 30 мг/кг в случае каждого ADC, хотя ALT была повышена в группе DM1, а AST и GGT были повышены в группе MMAF. Дегенерация седалищного нерва была от минимальной до мягкой в группе DM1 у 2 из 4 животных в дозе 20 мг/кг и у 4 из 4 животных в дозе 30 мг/кг. Дегенерация седалищного нерва была минимальной в группе MMAF у 1 из 4 животных в дозе 30 мг/кг. Ткань из различных органов исследовали микроскопически. Два из четырех животных в группе 30 мг/кг MMAF обладали повреждением легких неизвестного происхождения, в то время как его не было выявлено ни у одного из животных в группе DM1.
Истощение периферических B-клеток посредством ADC hu10F4v3-MC-MMAF и -SMCC-DM1 определяли, измеряя уровни клеток CD20+ в крови в течение 43 суток у обезьян cyno, которым проводили дозирование на 0 сутки и 22 сутки. Кровь, собираемую периодически в ходе исследования, оценивали посредством FACS с использованием флуоресцентно меченного антитела к CD20. ADC к CD22 MMAF и DM1 приводит к истощению у cyno периферических B-клеток, как представлено на фиг.22A (группа MMAF) и на фиг.22B (группа DM1). Не было выявлено достоверных эффектов ADC MMAF или DM1 на другие популяции лимфоцитов, как показано на фиг.23A и 23B, на которых показано, что не происходило существенного истощения клеток CD4+ в течение того же периода времени.
Hu10F4v3-SMCC-DM1 приводил к истощению B-клеток герминативного центра миндалевидных желез у обезьян cyno относительно контроля, как показано на микрофотографиях на фиг.24A и 24B. Иллюстративные герминативные центры обведены кружком на фиг.24A. Полное исчезновение B-клеток герминативного центра наблюдали при уровне дозы 10 мг/кг, как показано на фиг.24B. Те же результаты были получены после введения ADC hu10F4v3-MC-MMAF в тех же условиях.
Hu10F4v3-MC-MMAF, дозированный в количестве 10 мг/кг, приводил к истощению делящихся B-клеток в герминативных центрах фолликула селезенки у обезьян cyno. См. диаграмму на фиг.25A и микрофотографии тканей на фиг.25B и 25C. Такие же результаты были получены, когда тестировали ADC hu10F4v3-SMCC-DM1 в тех же условиях. Герминативные центры видны в качестве темных областей на фиг.25B при применении окрашивания Ki-67 и в качестве неокрашенных областей, окруженных темными областями, при окрашивании меченным поддающейся детекции меткой антителом к IgD на фиг.25D. Утрата герминативных центров вследствие истощения B-клеток герминативного центра посредством анти-10F4v3-MC-MMAF представлена на фиг.25C и 25E. Таким образом, эти противомитотические лекарственные средства влияют на пролиферирующие популяции B-клеток.
Представленная ниже гибридома была депонирована в American Type Culture Collection, PO Box 1549, Manassas, VA, 20108, USA (ATCC):
Эти образцы были депонированы согласно условиям Будапештского договора о международном признании депонирования микроорганизмов для целей патентной процедуры и его нормативным документам (Будапештский договор). Это гарантирует поддержание жизнеспособного депонированного образца в течение 30 лет от даты депонирования. Эти клеточные линии станут доступны в ATCC согласно условиям Будапештского договора и предмету соглашения между Genentech, Inc. и ATCC, которое гарантирует постоянную и неограниченную доступность клеточных линий обществу после выдачи соответствующего патента США или после публикации для общества любой патентной заявки США или другой страны, в зависимости от того, что произойдет ранее, и гарантирует доступность клеточных линий лицу, определенному комиссаром США по патентам и торговым знакам для присвоения ему названия в соответствии с 35 USC §122 и правилами для комиссаров согласно ему (включая 37 CFR §1.14 с конкретной ссылкой на 886 OG 638).
Патентообладатель настоящей заявки согласен с тем, что если депонированные клеточные линии будут утрачены или разрушены при культивировании при пригодных условиях, они будут сразу заменены при уведомлении образцом такой же клеточной линии. Доступность депонированных клеточных линий не следует истолковывать как разрешение для применения на практике изобретения при нарушении прав, выданных в соответствии с полномочиями какого-либо правительства в соответствии его патентными законами.
Несмотря на то, что представленное выше изобретение описано в некоторых деталях для иллюстрации примеров в целях ясности понимания, описания и примеры не следует истолковывать как ограничивающие объем изобретения. Описания всех цитированных патентных и научных источников литературы включены в настоящий документ в качестве ссылки в полном объеме.
Реферат
Настоящее изобретение относится к иммунологии и биотехнологии. Предложены варианты антител, специфичных к эпитопу CD22, расположенному от аминокислоты 22 до аминокислоты 240 CD22. Раскрыты: кодирующий полинуклеотид, вектор экспрессии, клетка-хозяин на его основе и способ получения антитела с использованием клетки. Описаны варианты способа детекции CD22 на основе антител. Раскрыты варианты иммуноконъюгата против CD22 и фармацевтические композиции на их основе для лечения нарушения пролиферации В-клеток, а также варианты способа лечения с использованием фармацевтической композиции. Раскрыт способ ингибирования пролиферации В-клеток на основе иммуноконъюгата. Описаны варианты сконструированного антитела с цистеиновыми заменами, специфичного к CD22 с одним или несколькими свободными цистеинами с величиной тиоловой реактивности в пределах от 0,6 до 1,0. Раскрыты варианты конъюгата «антитело-лекарственное средство», иммуноконъюгата и фармацевтические составы для лечения нарушения пролиферации В-клеток на их основе. Также описаны способ детекции белка CD22 в образце на основе иммуноконъюгата, способ детекции В-клеток и способ лечения злокачественной опухоли на основе конъюгата «антитело-лекарственное средство». Раскрыты: изделие для лечения нарушения пролиферации В-клеток на основе фармацевтического состава и способ получения конъюгата антитело-лекарственное средство. Использование изобретения обеспечивает новые специфичные антитела к CD22 и лекарственные средства на их основе с приемлемой терапевтической эффективностью при пониженной токсичности, что может найти применение в терапии опухолей. 32 н. и 195 з.п. ф-лы, 25
Формула
(1) HVR-L1, содержащую аминокислотную последовательность, выбранную из SEQ ID NO:9, 10, 19-23, 32 и 33, и
(2) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:2;
(3) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:4;
(4) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:6;
(5) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:12; и
(6) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:14, причем антитело связывается с эпитопом в области CD22, расположенным от аминокислоты 22 до аминокислоты 240 последовательности SEQ ID NO:27.
вариабельный домен легкой цепи, выбранный из группы, состоящей из последовательности, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO:17, и последовательности, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO:18,
причем антитело связывается с эпитопом в области CD22,
расположенным от аминокислоты 22 до аминокислоты 240 последовательности SEQ ID NO:27.
a) культивирование клетки-хозяина по п.30 в условиях, подходящих для экспрессии полинуклеотида, кодирующего антитело, и
b) выделение антитела.
приведение биологического образца в контакт с антителом по п.1 в условиях, допускающих связывание антитела с CD22, и детекцию того, формируется ли комплекс между антителом и CD22,
где наличие CD22 в биологическом образце определяют по образованию комплекса между антителом и CD22.
приведение биологического образца в контакт с антителом по п.22 в условиях, допускающих связывание антитела с CD22, и детекцию того, формируется ли комплекс между антителом и CD22,
где наличие CD22 в биологическом образце определяют по образованию комплекса между антителом и CD22.

где: (a) Ab представляет собой антитело по п.1;
(b) L представляет собой линкер;
(c) D представляет собой молекулу лекарственного средства; и
(d) p равно от 1 до приблизительно 20.

и где каждый R2 и R6 представляют собой метил, каждый R3 и R4
представляют собой изопропил, R7 представляет собой втор-бутил, каждый R8 независимо выбран из СН3, O-СН3, ОН и Н; R9 представляет собой Н; R10представляет собой арил; Z представляет собой -О- или -NH-; R11 представляет собой Н, C1-C8-алкил или -(СН2)2-O-(СН2)2-O-(СН2)2-O-СН3; и R18 представляет собой -C(R8)2-C(R8)2-арил; и (d) p находится в диапазоне приблизительно от 1 до 8.

где (a) Ab представляет собой антитело по п.22;
(b) L представляет собой линкер;
(c) D представляет собой молекулу лекарственного средства; и
(d) p равно от 1 до приблизительно 20.

где L представляет собой линкер, а р находится в диапазоне от 2 до 5.
(1) HVR-L1, содержащую аминокислотную последовательность, выбранную из SEQ ID NO:9, 10, 19-23, 32 и 33, и
(2) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:2;
(3) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:4;
(4) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:6;
(5) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:12; и
(6) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:14.
где сконструированное антитело с цистеиновыми заменами является более реакционноспособным в отношении тиолового реагента, чем родительское антитело.
вариабельный домен тяжелой цепи, который по меньшей мере на 90% идентичен аминокислотной последовательности SEQ ID NO:16, и вариабельный домен легкой цепи, выбранный из группы, состоящей из последовательности, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO:17, и последовательности, которая по меньшей мере на 90% идентична аминокислотной последовательности SEQ ID NO:18.
где сконструированное антитело с цистеиновыми заменами является более реакционноспособным в отношении тиолового реагента, чем родительское антитело.
(1) HVR-L1, содержащую аминокислотную последовательность, выбранную из SEQ ID NO:9, 10, 19-23, 32 и 33, и
(2) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO:2;
(3) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO:4;
(4) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO:6;
(5) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO:12; и
(6) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO:14,
причем антитело связывается с эпитопом в области CD22, расположенным от аминокислоты 22 до аминокислоты 240 последовательности SEQ ID NO:27,
и дополнительно содержит цистеин в одном или нескольких положениях, выбранных из 15, 43, 110, 144, 168 и 205 легкой цепи по правилам нумерации Кабат и 41, 88, 115, 118, 120, 171, 172, 282, 375 и 400 тяжелой цепи по правилам нумерации EU.

где р представляет собой 1, 2, 3 или 4.
где А представляет собой удлинитель, ковалентно связанный с тиолом цистеина сконструированного антитела с цистеиновыми заменами (Ab);
а равно 0 или 1;
каждый W независимо представляет собой аминокислотную единицу;
w представляет собой целое число в диапазоне от 0 до 12;
Y представляет собой спейсерную единицу, ковалентно связанную с молекулой лекарственного средства; и
y представляет собой 0, 1 или 2.

где РАВ представляет собой пара-аминобензилкарбамоил, a R17 представляет собой бивалентный радикал, выбранный из (CH2)r, С3-С8-карбоциклила, O-(СН2)r, арилена, (СН2)r-арилена, -арилен-(СН2)r-(СН2)r-(С3-С8-карбоциклила), (С3-С8-карбоциклила)-(СН2)r, С3-С8-гетероциклила,
(СН2)r-(С3-С8-гетероциклила), -(С3-С8-гетероциклил)-(СН2)r-,
-(CH2)rC(O)NRb(CH2)r-, -(CH2CH2O)r-, -(CH2CH2O)r-CH2-,
-(CH2)rC(O)NRb(CH2CH2O)r-, -(CH2)rC(O)NRb(CH2CH2O)r-CH2-,
-(CH2CH2O)rC(O)NRb(CH2CH2O)r-, -(CH2CH2O)rC(O)NRb(CH2CH2O)r-CH2- и
-(CH2CH2O)rC(O)NRb(CH2)r-; где Rb представляет собой Н, C1-С6-алкил, фенил или бензил; и r независимо представляет собой целое число в диапазоне от 1 до 10.



где волнистая линия указывает участок связывания с линкером L.

где волнистая линия указывает участок связывания с линкером L.
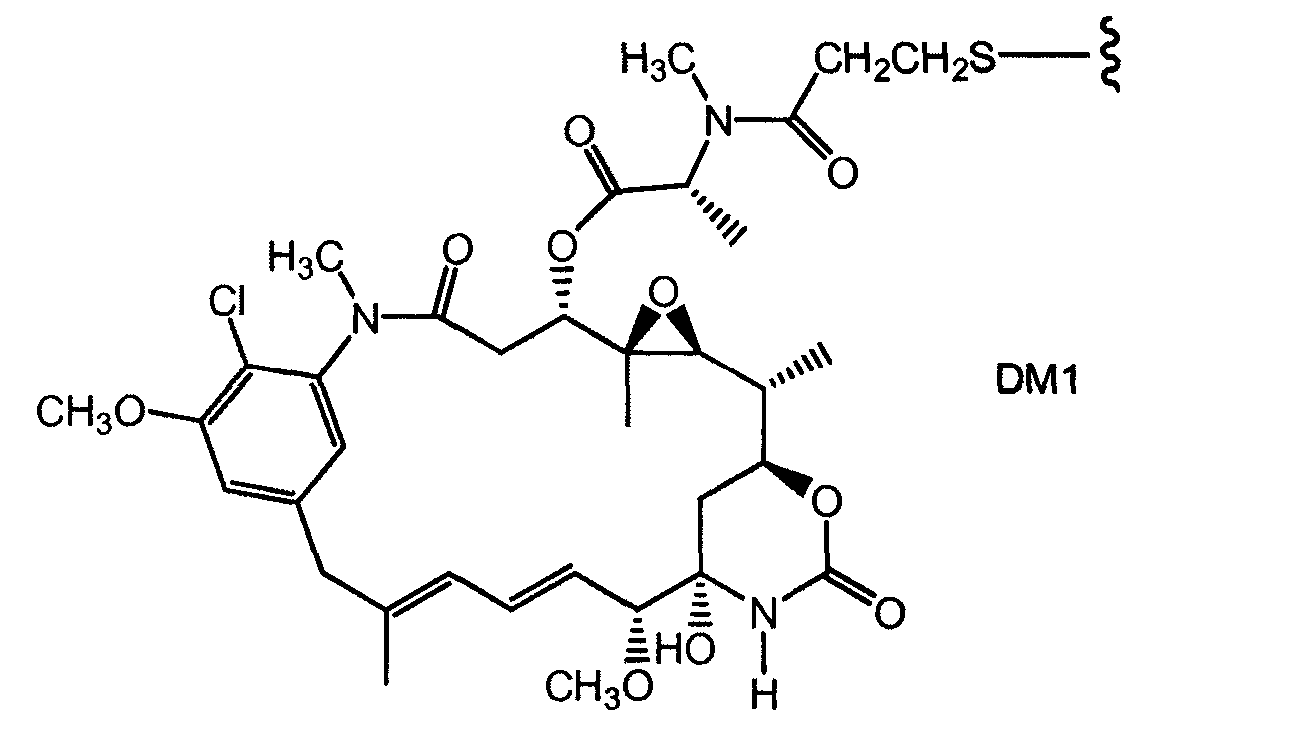
где волнистая линия указывает участок связывания с линкером L.

где Val представляет собой валин; Cit представляет собой цитруллин; р представляет собой 1, 2, 3 или 4; и Ab представляет собой антитело против CD22 по п.175.

(a) воздействие на клетки конъюгатом антитело-лекарственное средство; и
(b) определение степени связывания конъюгата антитело-лекарственное средство с клетками.
- фармацевтический состав по п.211;
- контейнер; и
- вкладыш или ярлык, указывающий, что соединение можно использовать для лечения злокачественной опухоли, характеризующейся сверхэкспрессией полипептида CD22.

где р равно 1, 2, 3 или 4;
где способ включает стадии:
(a) взаимодействия полученной в результате конструирования группы цистеина антитела с линкерным реагентом с образованием промежуточного продукта антитело-линкер (Ab-L); и
(b) взаимодействия Ab-L с активированной молекулой лекарственного средства D; в результате чего образуется конъюгат антитело-лекарственное средство;
или где способ включает стадии:
(c) взаимодействия нуклеофильной группы молекулы лекарственного средства с линкерным реагентом с образованием промежуточного продукта лекарственное средство-линкер (D-L); и
(d) взаимодействия D-L с полученной в результате конструирования группой цистеина антитела; в результате чего образуется конъюгат антитело-лекарственное средство.
Документы, цитированные в отчёте о поиске
Антитела, специфичные к cd22 человека, и их применения в терапии и диагностике

Комментарии