Медицинское применение - RU2684315C2
Код документа: RU2684315C2
Чертежи























Описание
Настоящее изобретение относится к медицинскому применению молекул, в частности к применению молекул для лечения заболеваний, в развитии которых играет роль активность андрогенного (АР) и/или эстрадиолового (ЭР) рецептора.
Перечисление или обсуждение в описании настоящего изобретения документов, опубликованных ранее, не обязательно означает признание этих документов частью существующего уровня техники или общеизвестными фактами.
Эндометриоз представляет собой распространенное заболевание у женщин репродуктивного возраста, при котором клетки внутренней выстилки полости матки оказываются вне полости матки, чаще всего на яичниках, и размножаются там. Это заболевание склонно к хроническому течению и после лечения может рецидивировать, и проявляется хронической болью внизу живота и бесплодием. Эндометриоз является наиболее частой причиной госпитализации по поводу боли в животе и бесплодия и по оценкам специалистов встречается у 5-10% женщин.
Современные способы лечения эндометриоза имеют многочисленные недостатки.
Нестероидные противовоспалительные средства (НПВС), такие, как ибупрофен и напроксен эффективны при лечении воспалительного процесса, обусловленного эндометриозом, а также боли и ощущения дискомфорта, однако могут вызвать тошноту, рвоту и диарею. Длительное применение НПВС может стать причиной раздражения желудочно-кишечного тракта, поражения почек и повышенного риска инфаркта миокарда и инсульта и снижает эффективность терапии аспирином, назначаемого больным в целях уменьшения побочных эффектов со стороны сердечнососудистой системы. Прием НПВС может вызвать судороги на фоне лечения антибиотиками, которые относятся к хинолонам.
Пациенткам с эндометриозом, может быть назначен парацетамол и кодеин (в сочетании с парацетамолом или без него), однако эти препараты часто вызывают запор, который усиливает симптомы эндометриоза.
Краеугольным камнем в терапии эндометриоза с 1950-х гг. являются комбинированные оральные контрацептивы. Хотя эти препараты не излечивают эндометриоз, они обычно облегчают основные симптомы, связанные с болью, подавляя менструальный цикл, и хорошо переносятся. Схема терапии вариабельна - от трехнедельного курса с последующим недельным перерывом (как при контрацепции) до трех- или четырехмесячных курсов с последующим недельным перерывом (при тяжелом течении заболевания). К частым побочным эффектам относятся нерегулярные маточные кровотечения, задержка жидкости в организме, метеоризм, прибавка в весе, повышенный аппетит, тошнота, головная боль, болезненное нагрубание молочных желез и депрессия. Существенным недостатком является контрацептивный эффект этих препаратов, поэтому применение их у женщин, которые хотят сохранить фертильную функцию, исключается.
Синтетический прогестерон (например, прогестины/прогестагены) предотвращает овуляцию и успешно применяется для лечения эндометриоза с середины 1950-х гг., например в составе внутриматочного средства, (такого как внутриматочное средство «Мирена»). Помимо очевидного контрацептивного эффекта, прогестины/прогестагены также дают побочные эффекты, такие, как изменчивость настроение, метеоризм, нерегулярные маточные кровотечения и прибавка в весе.
Антипрогестагены, такие, как синтетические производные тестостерона (например, Даназол и Гестринон) применяются для индуцирования состояния, напоминающего менопаузу, путем снижения уровня естественного эстрогена и прогестерона; однако антипрогестагены могут вызвать повышение веса, появление угревой сыпи, рост волос и огрубение голоса.
Аналоги гонадотропин-рилизинг-гормона (GnRH), например госерелин, нафарелин, лейпрорелин/лейпрон и трипторелин, также индуцируют искусственную менопаузу посредством блокирования выработки эстрогена. Однако эти препараты часто вызывают побочные эффекты, например ощущение жара в виде приливов, сухость влагалища, снижение полового влечения. Длительное применение, например более 6 мес, приводит к рарефикации костей, ведущей к остеопорозу.
Относительно недавно была изучена возможность применения ингибиторов ароматазы (например, летрозола и анастрозола), которые блокируют превращение тестостерона в эстроген, в сочетании с агонистами GnRH, которые необходимы для предупреждения гиперстимуляции яичников и появления овариальных кист у женщины в пременопаузе. Однако в этом случае для уменьшения рарефикации костей, наблюдающейся при длительной терапии, приходится дополнительно назначать препараты кальция, витамин D и бисфосфонаты.
Для хирургического лечения эндометриоза выполняют в основном три типа вмешательств. Первым является лапароскопия (так называемые операции «через замочную скважину где для удаления очагов поражений используется термо-, электро- или фотокоагуляция, что часто выполняется в процессе диагностики. В типичных случаях длительность эффекта такой операции превышает восемь лет (до выполнения повторной лапароскопии), и симптомы часто рецидивируют из-за неполной коагуляции очагов эндометриоза или из-за наличия скрытых очагов. Вторым типом вмешательств является лапаротомия, однако этот тип операций относится к большим хирургическим вмешательствам и требует длительного пребывания в больнице. Наконец третий тип вмешательств состоит в выполнении гистерэктомии, но и эта операция не гарантирует от рецидивов эндометриоза, особенно если яичники не удаляют.
Ngô и соавт. (J. Pathol 2010; 222: 148-157) проанализировали возможность предотвращения прогрессирования эндометриоза в эксперименте in vitro и in vivo и идентифицировали сигнальный путь внеклеточной протеинкиназы (ERK), который может служить новой мишенью для консервативного лечения эндометриоза. Однако авторы подчеркивают, что необходимы дальнейшие исследования для того, чтобы выяснить эффективность нового способа лечения и его переносимость пациентами, но при этом не упоминают о том, сохраняется ли фертильная функция.
Из приведенных выше данных следует, что все еще существует необходимость лечения эндометриоза и/или других состояний, в развитии которых играет роль активность АР и/или ЭР, таким способом, который позволяет сохранить фертильную функцию и который предпочтительно имеет меньше недостатков, чем имеющиеся способы лечения.
Авторы изобретения неожиданно обнаружили, что подавление взаимодействия между тирозинкиназой Src и АР или ЭР может принести облечение симптомов эндометриоза и в то же время не оказывает контрацептивный эффект.
Известно, что как АР, так и ЭР взаимодействуют с тирозинкиназой Src и, возможно, с другими киназами семейства Src. Андрогенный рецептор связывается с SH3-доменом Src (Migliaccio et al (Oncogene 2007, 26:6619)). SH3-домены имеют длину 50-70 аминокислотных остатков и часто присутствуют в белках сигнальных путей и цитоскелета эукариот. Эти домены связываются с пептидами обогащенными пролином и тем самым играют важную роль в регуляции киназной активности, а также локализации и распознавании субстрата. Эстрогенный рецептор связывается с SH2-доменом Src (Migliaccio et al (Cancer Research 2005, 65(22): 10585-93)). SH2-домены обычно имеют длину, примерно равную 100 аминокислотным остаткам и в типичных случаях связываются с фосфорилированным остатком тирозина в более длинном пептидном мотиве в белке-мишени.
Не желая ограничивать себя какими-либо теориями, авторы изобретения полагают, что уменьшив взаимодействие между киназой семейства Src и АР или ЭР, можно селективно ингибировать негеномную регуляцию трансдукции сигнала стероидными гормонами (например, активацию передачи сигнала киназой семейства Src, экспрессию гена, кодирующего белок циклин D1, и синтез ДНК), в то время как геномная регуляция транскрипции сигнала стероидными гормонами сохраняется. Это позволяет избежать многих побочных эффектов, ассоциированных с обычной блокадой или аблацией (которая устраняет как геномные, так и негеномные эффекты) и лечение может быть более длительным. Кроме того авторы изобретения неожиданно обнаружили, что подавление взаимодействия между киназой семейства Src и АР или ЭР, не оказывает контрацептивный эффект. Это принципиально отличается от существующих способов лечения. Сохранение фертильности является важным преимуществом в лечении эндометриоза, так как в настоящее время, если женщина, получающая терапию антиандрогенами и/или антиэстрогенами, планирует беременность, то для зачатия терапию этими гормонами приходится прекратить, а это может вызвать рецидив заболевания. Таким образом, авторы изобретения полагают, что использование этого взаимодействия в качестве мишени может оказать лечебный эффект при эндометриозе и/или других состояниях, в развитии которых играет роль активность АР и/или ЭР.
Таким образом, первый объект настоящего изобретения касается молекулы, которая ингибирует или предотвращает взаимодействие между киназой семейства Src и АР или ЭР, и ее применения ее у человека для профилактики или лечения нераковых заболеваний, в развитии которых играет роль активность АР и/или ЭР, или применения для профилактики и лечения онкологического заболевания, в развитии которого играет роль активность рецепторов АР и/или ЭР у субъекта, желающего сохранить фертильную функцию, или применения для профилактики или лечения гинекологических заболеваний, в развитии которых играет роль активность АР и/или ЭР.
Аналогично в изобретении предлагается использовать молекулу, которая ингибирует или предотвращает взаимодействие между киназой семейства Src и АР или ЭР, в изготовлении медикамента для профилактики или лечения нераковых заболеваний у, в развитии которых у субъекта играет роль активность АР и/или ЭР, или для профилактики или лечения онкологического заболевания, в развитии которого играет роль активность АР и/или ЭР у субъекта, желающего сохранить фертильную функцию, или для профилактики или лечения гинекологических заболеваний, в развитии которых у субъекта играет роль активность АР и/или ЭР.
Аналогично в изобретении предлагается способ профилактики или лечения нераковых заболеваний, в развитии которых у субъекта играет роль активность АР и/или ЭР, или для профилактики или лечения онкологического заболевания, в развитии которого играет роль активность АР и/или ЭР у субъекта, желающего сохранить фертильную функцию, или для профилактики или лечения гинекологических заболеваний, в развитии которых у субъекта играет роль активность АР и/или ЭР, причем этот способ включает введение субъекту, который нуждается в лечении, эффективного количества этой молекулы, которое подавляет или предотвращает взаимодействие между киназой семейства Src и АР или ЭР.
Под словами «профилактика или лечение» заболевания, в развитии которого играет роль активность АР и/или ЭР, мы имеем в виду, что изобретение может быть использовано для уменьшения симптомов заболевания (например, при паллиативном лечении) или лечения заболевания (например, путем ингибирования или устранения этиологического фактора) или в профилактических целях (например, профилактическое применение, либо для предотвращения усугубления или прогрессирования симптомов, либо для снижения темпов прогрессирования заболевания).
Предпочтительно, чтобы профилактика или лечение заболевания, в развитии которого играет роль активность АР и/или ЭР, проводились у млекопитающего, в частности человека. При альтернативном варианте субъектом может быть животное, например домашнее животное (например, собака или кошка), лабораторное животное (например, грызун, мышь, крыса или кролик) либо животное, которое ценится в сельском хозяйстве (то есть домашний скот), например, крупный рогатый скот, овца, лошадь или коза. Субъектом может быть самка или самец.
В семейство Src киназ мы включаем любую киназу семейства Src. Например, киназа может быть любой нетирозиновой киназой, выбираемой из Src, Yes, Fyn и Fgr (то есть киназа подсемейства SrcA), Lck, Blk и Lyn (то есть киназа подсемейства SrcB) и Frk (Amanchy et al, Proteome Res 2008, 7(8): 3447). Наиболее предпочтительной киназой семейства Src является Src-киназа.
В семейство киназ Src мы включаем киназу семейства Src человека, такую, как Src-киназу, под андрогенным рецептором (АР) мы понимаем АР человека и под рецептором эстрадиола (ЭР) мы понимаем ЭР человека, последовательности всех белков могут быть найдены в Migliaccio et al. (Cancer Research 2005, 65(22): 10585-93), Migliaccio et al. (Oncogene 2007, 26: 6619), Venter et al. (Science 2001, 291 (5507): 1304-51) и в публикации WO 2008/113770. Ясно, что нуклеотидные последовательности генов и мРНК имеют естественную вариабельность, и эта вариабельность включена в значение каждой киназы из семейства Src (например Src-киназы), АР и ЭР.
Варианты киназ семейства Src (например, Src-киназы), АР и/или ЭР также включены при условии, что имеют одну или более активностей родительской киназы семейства Src (например, Src-киназы), АР или ЭР. Иными словами, варианты являются функционально активными вариантами. Например, варианты могут иметь последовательность, которая идентична по меньшей мере на 60%, например по меньшей мере на 65%, 70%, 75%, 80% и 85% и более предпочтительно на 90%, 95% или 99% соответствующей последовательности человека. Вариации включают инсерции, делеции и замены как консервативные, так и неконсервативные. Под «консервативными заменами» подразумевают такие комбинации, как Gly, Ala; Val, Ile, Leu; Asp, Glu; Asn, Gln; Ser, Thr; Lys, Arg; и Phe, Tyr.
Под термином киназы семейства Src (например, Src-киназа), АР и ЭР мы также подразумеваем ортологи киназ семейства Src человека (например, Src-киназы), АР и ЭР. Примеры подходящих гомологичных киназ семейства Src, АР и ЭР включают киназы мышей и крыс. Другие ортологи включают ортологи, полученные от видов животных, перечисленных на фиг. 3. Понятно, что имеется естественная вариабельность последовательностей гена и мРНК, кодирующих ортологи этих киназ семейства Src, АР и ЭР человека, и что эта вариабельность включена в значение гомологичной киназы семейства Src, АР и ЭР.
В одном варианте осуществления изобретения молекула ингибирует или предотвращает взаимодействие между SH3-доменом киназы семейства Src (например, Src-киназы) и андрогенным рецептором. Детали этого взаимодействия описаны Migliaccio et al (Oncogene 2007, 26: 6619).
Понятие «SH3-домен» киназы семейства Src включает N-концевой гомологичный домен 3 киназ семейства Src (например, Src-киназы). SH3-домены в типичном случае построены из 50-70 аминокислотных остатков и присоединяются к обогащенным пролином пептидам. Исследование Migliaccio и соавт. (ЕМВО J 2000, 19: 5406-5417) показало важное значение SH3-домена Src-киназы в ее взаимодействии с АР.
В другом варианте осуществления изобретения молекула по изобретению ингибирует или предотвращает взаимодействие между SH2-доменом киназ семейства Src (например, Src-киназы) и рецептором эстрадиола. Подробнее об этом взаимодействии написано в статье Migliaccio и соавт. (Cancer Research 2005, 65(22): 10585-93).
Понятие «SH2-домен» киназы семейства Src включает гомологичный домен 2 киназ семейства Src (например, Src-киназы). SH2-домен обычно имеет длину около 100 аминокислотных остатков и в типичных случаях связывается с фосфорилированными остатками тирозина.
В контексте лечения субъекта, которым является млекопитающее, молекула может ингибировать или предотвращать взаимодействие между киназами семейства Src (например, Src-киназой) и андрогенным рецептором или рецептором эстрадиола данного вида млекопитающего. Например, когда млекопитающим субъектом является человек, молекула может ингибировать или предотвращать взаимодействие между киназой семейства Src человека (например, Src-киназой) и АР человека или ЭР человека и т.д.
Молекула, которая предотвращает или ингибирует взаимодействие между киназами семейства Src и АР или ЭР, означает, что она, во-первых, препятствует взаимодействию, не давая продукту образоваться, и, во-вторых, уменьшает взаимодействие, если продукт уже образовался. Предпочтительно, чтобы молекула препятствовала или уменьшала взаимодействие до уровня, который не поддается детекции.
В предпочтительном варианте осуществления изобретения молекула предотвращает или ингибирует взаимодействие между киназами семейства Src (например, Src-киназой) и АР или ЭР соответственно. Например, предпочтительно, чтобы молекула предотвращала или ингибировала взаимодействие между киназами семейства Src и АР или ЭР в большей степени (например, в 5 раз, 10 раз, 20 раз, 50 раз, 100 раз или 1000 раз), чем она предотвращает взаимодействие между киназама семейства Src и любой другой молекулой. Аналогично предпочтительно, чтобы молекула предотвращала или ингибировала взаимодействие между АР или ЭР и киназами семейства Src в большей степени (например, по меньшей мере в 5 раз, в 10 раз, 20 раз, 50 раз, 100 раз или 1000 раз), чем она предотвращает взаимодействие между АР или ЭР и любой другой молекулой.
Предотвращает ли молекула взаимодействие между киназами семейства Src и АР или ЭР или ингибирует это взаимодействие, обычно определяют по взаимодействию между киназами семейства Src и АР или ЭР в присутствии или в отсутствие конкретной молекулы. Как упоминалось ранее, полагают, что SH3-домен Src-киназы опосредует взаимодействие между Src-киназой и АР и таким образом взаимодействие между SH3-доменом киназ семейства Src (Src-киназы) и АР можно оценить в присутствии и в отсутствие конкретной молекулы. Аналогично полагают, что SH2-домен Src-киназы опосредует взаимодействие между Src-киназой и ЭР и таким образом взаимодействие между SH2-доменом киназы семейства Src (например, Src-киназы) и ЭР можно оценить в присутствии или в отсутствие конкретной молекулы. Способы оценки взаимодействия между двумя белками хорошо известны специалистам в данной области, и из них можно выбрать любой подходящий. Примеры включают твердофазный иммуноферментный анализ, метод поверхностного плазмонного резонанса, методы конкурентного связывания с белком, анализ на основе микрочиповых технологий, иммуноцитофлуоресцентный метод, дрожжевой двухгибридный анализ и фаговый дисплей. Все эти методы широко используются на практике и описаны, например в Plant et al (1995) Analyt Biochem, 226(2), 342-348 и Sambrook et al. (2001) Volecular Cloning. A Laboratory manual. Third Edition. Cold Spring harbor laboratory Press, Cold Spring Harbor, New York. К другим методам оценки белковых взаимодействий относится ультрафильтрация с масс-спектроскопией с ионизацией распылением в электрическом поле/ВЭЖХ и другие физические или аналитические методы. Например, можно использовать хорошо знакомые специалистам методы детектирования резонансного переноса энергии флуоресценции (FRET), с помощью которых можно измерить связывание двух меченных флуоресцентной меткой молекул путем измерения взаимодействия флуоресцентных меток, когда они расположены близко друг от друга. В частности, в предпочтительном варианте осуществления изобретения используется реакция иммунопреципитации, например описанная в работе Migliaccio и соавт. (Oncogene 2007, 26:6619) для оценки взаимодействия между SH3-доменом киназ семейства Src (например, Src-киназы) и АР и/или взаимодействия между SH2-доменом киназ семейства Src (например, Src-киназы) и ЭР.
В предпочтительном варианте осуществления изобретения молекула содержит или состоит из последовательности:
Bj-[(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m-Rp или Bj-[lys-Ile-arg-ala-his-pro-his-xr-(pro)n]m-Rp или их производные или фрагменты,
где В является первым химическим фрагментом, j равен 0 или 1, n является целым числом от 1 до 10, X является любой аминокислотой, r является целым числом от 0 до 2, m является целым числом от 1 до 3, R является вторым химическим фрагментом, p равен 0 или 1, и [lys-ile-arg-ala-his-pro-his-xr-(pro)n] является ретроинверсной формой пептида [(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys].
Понятно, что молекула, которая содержит или состоит из последовательности Bj-[(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-lys]m-Rp или Bj-[lys-ile-arg-ala-his-pro-his-xr-(pron)]m-Rp, обычно имеет пептидный фрагмент [(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m или [lys-ile-arg-ala-his-pro-his-xr-(pro)n]m и если необходимо другие химические фрагменты на одном или обоих концах (то есть Bj и Rp). Иными словами, j=0 и p=0; или j=1 и p=0; или j=0 и p=1; или j=1 и p=1. В одном варианте осуществления изобретения j=0 и p=0, так что молекула является пептидом со следующей структурой [(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m или [lys-ile-arg-ala-his-pro-his-xr-(pro)n]m.
В и R могут быть независимо друг от друга любым химическим фрагментом, например липидом (например, гликолипидом, фосфолипидом, сфинголипидом), жирной кислотой, триглицеридом, глицеролом, фенилом или изофенилом (например, фарнезилом или геранил-геранилом), углеводом (например, моно- и полисахаридами), аминокислотой, пептидом, полипептидом или нуклеиновой кислотой или их комбинацией. Таким образом, этот фрагмент может быть гликопептидом или липопептидом. Фрагмент может быть низко- или высокомолекулярным полиэтиленгликолем, например иметь молекулярную массу от 200 до 70000. Любой подходящий дополнительный фрагмент может определить специалист.
В одном варианте осуществления изобретения В может быть H или ацетильной группой или одной аминокислотой или аминокислотной последовательностью, имеющей свободную или ацетилированную аминогруппу.
В другом варианте осуществления изобретения R является ОН-группой, аминогруппой или одной аминокислотой либо последовательностью аминокислот с С-концевой карбоксамидной группой.
Химические фрагменты В и R молекулы можно при необходимости присоединить к пептидной части молекулы, так что они могут отщепиться от пептидной части, когда молекулу вводят субъекту. Например, фрагмент В или R молекулы может содержать сайт расщепления, который при введении в организм может расщепляеться. Обычно сайт расщепления является протеазным сайтом расщепления, который может расщепиться протеазой, которая вырабатывается в организме субъекта.
Химические фрагменты В и/или R молекулы можно присоединить к пептидной части любым подходящим способом, известным из предшествующего уровня техники. Например, фрагменты В и/или R можно присоединить к пептидной части любым из традиционных способов сшивания полипептидов, например способами, описанными в O'Sullivan et al. Anal. Biochem. (1979) 100, 100-108. Например, первый фрагмент можно обогатить тиоловыми группами, а второй - бифункциональным агентом, который может взаимодействовать с этими тиоловыми группами, например N-гидроксисукцинимидным эфиром йодуксусной кислоты (NHIA) или N-сукцинимидил-3-(2-пиридилдитио)пропионатом (SPDP), гетеробифункциональным сшивающим агентом, который вводит дисульфидный мостик между двумя конъюгированными частями. Амидная и тиоэфирная связи, например, возникающие с m-малеимидобензоил-N-гидроксисукцинимидным сложным эфиром, обычно в условиях in vivo более стабильны, чем дисульфидные связи.
Другие подходящие сшивающие агенты включают N-гидроксисукцинимидный эфир S-ацетилтиогликолевой кислоты (SATA), который является тиолированным реагентом для первичных аминов, позволяющим снять защиту с сульфгидрильной группы в мягких условиях (Julian et al (1983) Anal. Biochem. 132, 68), диметилсуберимидат дигидрохлорид и Ν,Ν-ο-фенилендималеимид.
Другие пути связывания химического фрагмента В и/или R с пептидной частью включают протокол химического лигирования, протокол взаимодействия с помощью клик-химии или хорошо известный специалистам протокол взаимодействия с помощью лигирования по Штаудингеру. Специалист может определить и другие подходящие способы.
Если химическими фрагментами В и/или R являются пептиды или полипептиды, понятно, что пептидная часть молекулы и химические фрагменты В и/или R могут быть частью слитого полипептида, который можно закодировать в молекуле нуклеиновой кислоты. Например, химический фрагмент В и/или R можно сконструировать методами генной инженерии так, чтобы они содержали пептидный участок молекулы, используя хорошо известные методы генной инженерии.
Условно пептидная часть [(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m или [lys-ile-arg-ala-his-pro-his-xr-(pro)n]m молекулы имеет длину 57 аминокислотных остатков, например менее 55, 50, 45, 40, 35, 30, 25, 20 или 15 аминокислотных остатков. Таким образом, пептидная часть молекулы может иметь длину от 8 до 60 аминокислотных остатков или длину от 10 до 15 аминокислотных остатков или длину от 15 до 20 аминокислотных остатков или длину от 20 до 25 аминокислотных остатков или длину от 25 до 30 аминокислотных остатков или длину от 30 до 35 аминокислотных остатков или длину от 35 до 40 аминокислотных остатков или длину от 40 до 45 аминокислотных остатков или длину от 45 до 50 аминокислотных остатков или длину от 50 до 55 аминокислотных остатков. Предпочтительно пептидная часть молекулы имеет длину 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 аминокислот.
Понятно, что фрагмент молекулы, содержащий или состоящий из структуры [(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m-Rp или Bj-[lys-ile-arg-ala-his-pro-his-xr-(pro)n]m-Rp, может быть использован при условии, что он может предупредить или ингибировать взаимодействие между киназой семейства Src (например, Src-киназой) и АР и/или ЭР. Таким образом, молекула может содержать меньше упомянутых выше 8 аминокислотных остатков. В типичном случае фрагментом является фрагмент пептидной части [(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m или [lys-ile-arg-ala-his-pro-his-xr-(pro)n]m молекулы и он обычно имеет длину, равную по меньшей мере 3 аминокислотным остаткам, например по меньшей мере 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислотным остаткам. Таким образом, молекула может содержать или состоять из пептидного фрагмента [(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m или [lys-ile-arg-ala-his-pro-his-xr-(pro)n]m, при условии, что он может предупредить или ингибировать взаимодействие между киназой семейства Src (например, Src-киназой) и АР и/или ЭР.
Об использовании производного или соли фрагмента говорится далее. Например, для повышения стабильности молекулы можно к одному или обоим ее концам присоединить кэпирующие части.
Подходящий фрагмент можно выбрать из группы, состоящей из HPHARIK, HPHAR, PHPHAR, НРН, РНРН, РРНРН, РРРНРН, РРРН, РРН и РРР. Производные или соли фрагментов можно выбрать из группы, состоящей из: AC-HPHARIK-NH2, Ас-HPHAR-NH2, Ac-PHPHAR-NH2, Ac-PHPH-NH2, Ac-PPHPH-NH2, Ac-PPPHPH-NH2, Ac-PHP-NH2, Ac-PPHP-NH2, Ac-PPPHP-NH2P, Ac-PPPH-NH2, Ac-PPH-NH2 и Ac-PPP-NH2.
Понятно, что если фрагменты В и/или R молекулы являются пептидами, вся молекула может быть пептидом и такой пептид может иметь длину более 57 аминокислотных остатков. Однако если вся молекула является пептидом, предпочтительно, чтобы ее длина была меньше 150 аминокислотных остатков, например, менее 140, 130, 120, 110, 100, 90, 80, 70 или 60 аминокислотных остатков.
Обычно молекулярная масса молекулы меньше 50 кДа, например меньше 40, 30, 20, 10 или 5 кДа. В типичном случае масса молекулы соответствует диапазону от 1000 до 5000 Да. То есть масса молекулы может составлять около 4500, 4000, 3500, 3000 или 2500 Да или соответствовать диапазону от 1000 до 2500 Да.
В одном варианте осуществления изобретения n является любым числом из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, более предпочтительно, чтобы n=3. В другом варианте осуществления изобретения m является любым числом из 1, 2 или 3 и наиболее предпочтительно, чтобы m=1. Таким образом, в особенно предпочтительном варианте изобретения n равно 3, а m равно 1.
Xr представляет собой фрагмент из 1 или 2 аминокислотных остатков, причем один из них или оба остатка могут независимо друг от друга быть любым аминокислотным остатком. Таким образом, аминокислотные остатки, представленные Xr могут быть любым природным аминокислотным остатком, кодируемым ДНК, который можно выбрать из аланина (Ala, А), аргинина (Arg, R), аспарагина (Asn, Ν), аспарагиновой кислоты (Asp, D), цистеина (Cys, С), глутамина (Gln, Q), глутаминовой кислоты (Glu, Ε), глицина (Gly, G), гистидина (His, H), изолейцина (Ile, I), лейцина (Leu, L), лизина (Lys, K), метионина (Met, M), фенилаланина (Phe, F), пролина (Pro, Ρ), серина (Ser, S), треонина (Thr, Τ), триптофана (Trp, W), тирозина (Tyr, Y) и валина (Val, V). Однако во всех случаях, кроме случая, когда пептидную часть получают путем экспрессии полинуклеотида, аминокислотные остатки, представленные Xr, могут содержать один или более аминокислотный остаток, который не кодируется ДНК, включая остатки, описанные ниже. В одном варианте осуществления изобретения r является 0, а в альтернативном варианте r является 1, а X - треониновым остатком.
Чтобы не было сомнений молекула не является АР или ЭР.
Не желая ограничивать себя какими-либо теориями, автор полагает, что пептид PPPHPHARIK является частью АР человека, который опосредует взаимодействие с SH3-доменом киназы семейства Src. Таким образом, в предпочтительном варианте осуществления изобретения пептидная часть [(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m или [lys-ile-arg-ala-his-pro-his-xr-(pro)n]m молекулы является PPPHPHARIK или ее ретроинверсная форма пептид kirahphppp.
Пептид PPPHPHARIK эквивалентен аминокислотным остаткам 377-386 АР человека. Не желая ограничивать себя какими-либо теориями, автор полагает, что соответствующие участки АР других видов животных будут иметь такую же активность. Под выражением «соответствующие участки» мы понимаем последовательность аминокислотных остатков в другом АР, которая выравнивается с данной аминокислотной последовательностью АР человека при сравнении последнего с другим АР, например, с помощью такого средства, как MacVector или CLUSTALW. Таким образом, в другом предпочтительном варианте изобретения пептидной частью является пептид, который соответствует аминокислотной последовательности в позиции 377-386 (PPPHPHARIK) АР человека. Например, соответствующим пептидом в АР мышей и крыс является PPTHPHARIK, поэтому пептидной частью может быть пептид PPTHPHARIK или его ретроинверсная форма пептид kirahphtpp. Соответствующие пептиды у других видов животных приводятся на фиг. 3, так что пептидной частью может быть любой из пептидов, перечисленных на фиг. 3 или ретроинверсные формы этих пептидов. Предпочтительно, чтобы пептид PPPHPHARIK вводили человеку, а пептид PPTHPHARIK - мышам или крысам и т.д.
Выравнивание последовательностей двух белков можно выполнить с помощью программы Clustal W (Thompson et al., 1994). Для этого можно использовать следующие параметры быстрого парного выравнивания: k-tuple (размер слова); 1 размер окна; 5 штраф на внесение разрыва; 3 число непрерывно совпадающих к-плетов; 5 Способ определения веса выравнивания: в процентах. Параметры множественного выравнивания: штрафы на внесение разрыва; 10 штраф на продолжение разрыва; 0,05; матрица сравнения аминокислот: BLOSUM.
В особенно предпочтительном варианте осуществления изобретения молекула содержит или состоит из пептида PPPHPHARIK или PPTHPHARIK.
Пептидная часть [(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m или [lys-ile-arg-ala-his-pro-his-xr-(pro)n]m или ее фрагмент в молекуле, определение которой было дано выше, в типичном случае получают методами химии белка, например, частичным гидролизом (экзо- или эндолитическим) или путем синтеза de novo. В качестве альтернативы пептиды можно получить с помощью рекомбинантной ДНК, используя методы генной инженерии. Подходящие способы клонирования, манипулирования, модификации и экспрессии нуклеиновых кислот и очистки экспрессированных белков хорошо известны специалистам и описаны, например, в Sambrook et al (2001) "Molecular Cloning, a Laboratory Manual", 3rd edition, Sambrook et al (eds), Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, USA.
Пептидную часть [(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m или [lys-ile-arg-ala-his-pro-his-xr-(pro)n]m или ее фрагмент в молекуле, определение которой дано выше, также можно получить путем химического синтеза, например, твердофазного пептидного синтеза по Merrifield et al (1964). В качестве альтернативы пептидную часть молекулы можно синтезировать методом стандартных растворов. Пептид, синтезированный de novo, можно очистить, например, с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) и охарактеризовать, например, с помощью масс-спектрометрии или анализа аминокислотной последовательности.
Понятно, что подходящей молекулой может быть любое антитело независимо от того, направлено ли оно против киназы семейства Src (например, Src-киназы) или АР либо ЭР, которое способно предотвратить или ингибировать взаимодействие между киназой семейства Src (например, Src-киназой) и АР или ЭР. Как упоминалось ранее, автор считает, что SH3-домен Src-киназы и аминокислотные остатки 377-386 АР опосредует взаимодействие между Src-киназой и АР. Таким образом, понятно, что подходящие молекулы, которые ингибируют или предотвращают взаимодействие между киназой семейства Src (например, Src-киназой) и АР и ЭР, включают антитело против SH3-домена киназы семейства Src (например, Src-киназы) или антитело, которое связывается с АР в положении, соответствующем аминокислотным остаткам 377-386 АР человека (например, антитело против пептида, имеющего структуру (Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys, где n является целым числом от 0 до 10, X является любой аминокислотой и r является целым числом от 0 до 2, такое, как PPPHPHARIK или PPTHPHARIK). Аналогично считают, что SH2-домен Src-киназы опосредует взаимодействие между Src-киназой и ЭР. Таким образом, понятно, что подходящие молекулы, которые ингибируют или предотвращают взаимодействие между киназой семейства Src (например, Src-киназой) и АР и ЭР, включают антитело против SH2-домена киназы семейства Src (например, Src-киназы). Предпочтительно, чтобы антитело избирательно предотвращало или ингибировало взаимодействие между киназой семейства Src (например Src-киназой) и АР или ЭР, как обсуждалось выше.
Термин «антитело», используемый в описании, включает, но не ограничивается ими, поликлональные, моноклональные, химерные, одноцепочечные антитела, Fab-фрагменты и фрагменты, образуемые библиотекой экспрессии Fab-фрагментов. Такие фрагменты включают фрагменты целых антител, которые сохраняют способность связываться с веществом-мишенью, Fv, F(ab') и F(ab')2 фрагменты, а также одноцепочечные антитела (scFv), слитые белки и другие синтетические белки, которые содержат антигенсвязывающий сайт антитела. Антитела включают в себя также доменные антитела (dAbs), диатела, верблюжьи антитела и сконструированные верблюжьи антитела. Кроме того, для введения человеку антитела и их фрагменты могут быть гуманизированными антителами, что в настоящее время хорошо известно (Janeway et al (2001) Immunology, 5th ed., Garland Publishing).
Подходящие антитела, описанные выше, которые связываются с конкретной областью киназ семейства Src (например, Src-киназы) или с АР и ЭР, могут быть получены специалистом с помощью давно известной технологии. Способы получения моноклональных антител и фрагментов антител хорошо известны из предшествующего уровня техники и включают гибридомную технологию (Kohler and Milstein (1975) "Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 256: 495-497); фаговый дисплей антител (Winter et al (1994) "Making antibodies by phage display technology." Annu Rev. Immunol. 12: 433-455), рибосомный дисплей (Schaffitzel et al (1999) "Ribosome display: an in vitro method for selection and evolution of antibodies from libraries." J. Immunol. Methods 231: 119-135); и итерационный метод скрининга колоний на фильтре (Giovannoni et al (2001) "Isolation of anti-angiogenesis antibodies from a large combinatorial repertoire by colony filter screening." Nucleic Acids Res. 29: E27). Кроме того, антитела и фрагменты антител, подходящие для использования в данном изобретении, описаны, например, в следующих публикациях: "Monoclonal Hybridoma Antibodies: Technique and Application", Hurrell (CRC Press, 1982); "monoclonal Antibodies: A Manual of Techniques", H. Zola, CRC Press, 1987, ISBN: 0-84936-476-0; "Antibodies: A Laboratory Manual" 1st Edition, Harlow and Lane, Eds, Cold Spring Harbor Laboratory Press, New York, 1988. ISBN 0-87969-314-2; "Using Antibodies: A Laboratory Manual" 2nd Edition, Harlow and Lane, Eds, Cold Spring Harbor Laboratory Press, New York, 1999. ISBN 0-87969-543-9; and "Handbook of Therapeutic Antibodies" Stefan Dübel, Ed., 1st Edition, - Wiley-VCH, Weinheim, 2007. ISBN: 3-527-31453-9.
Понятно, что молекула по изобретению может включать последовательность пептида, проникающего в клетку (которую называют также доменом трансдукции белка), который облегчает проникновение в клетку. Как известно из уровня техники, пептиды, проникающие в клетку, как правило, представляют собой короткие пептиды длиной до 30 аминокислотных остатков, несущие положительный заряд и действующие независимо от рецепторов и энергии (Lindgren et al. 2000; Deshayes et al, 2005a and 2005b; Takeuchi et al, 2006, все источники, касающиеся пептидов, пенетрирующих в клетку, включены в описание путем ссылки). Таким образом, В или R фрагменты, упомянутые выше, могут быть пептидом, проникающим в клетку. Если это так, пептид, проникающий в клетку, предпочтительно отщепляется от той части молекулы, которая ответственна за ингибирование или предотвращение взаимодействия между киназой семейства Src (например, Src-киназой) и АР или ЭР. Например, он может расщепляться внутри клетки.
Молекулу по изобретению можно также модифицировать, чтобы ее легче было детектировать, например, путем биотинилирования или встраивания любой детектируемой метки, известной из предшествующего уровня техники, например радиоактивной метки, флуоресцентной метки или ферментной метки.
Аминокислотные остатки молекул по изобретению могут принадлежать к L-изомерам. Однако остатки в D-изомерной форме можно заместить L-изомерами, пока молекулы могут еще ингибировать или предотвращать взаимодействие между киназой семейства Src (например, Src-киназой) и АР или ЭР. Это определение включает (если особо не указано иное) химически модифицированные аминокислотные остатки включая аналоги аминокислот (такие, как пеницилламин, 3-меркапто-D-валин), природные не протеиногенные аминокислоты (например, норлейцин) и соединения, полученные путем химического синтеза, обладающие свойствами, которые из предшествующего уровня техники известны как отличительные свойства. Термин «протеиногенный» указывает, что аминокислота может быть включена в белок в клетке с помощью хорошо известных метаболических путей.
Таким образом, в одном варианте осуществления изобретения пептидная часть молекулы, упомянутой выше, является ретроинверсной формой пептида [(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m или его фрагментом (преимущества которого были определены выше). В понятие ретроинверсный пептид (который известен и как Bce-D-ретро или ретроэнантиопептиды) мы вкладываем пептид, в котором все L-амикислоты замещены D-аминокислотами, а пептидная связь реверсирована. Таким образом, пептиды включают D-аминокислоты, собранные в обратном порядке по отношению к родительской L-последовательности. Ретроинверсный пептид [(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m является [lys-ile-arg-ala-his-pro-his-xr-(pro)n]m (где пептид, написанный строчными буквами обозначает соответствующие D-аминокислоты). Ретроинверсные пептиды можно синтезировать способом, известным в технике, например способом, описанным в статье Meziere et al (1997) J. Immunol. 159 3230-3237. Этот подход включает получение псевдопептидов, содержащих изменения охватывающие каркас, а не боковые цепи, которые сохраняют выраженное сходство с родительским пептидом. Ретроинверсные пептиды гораздо более резистентны к протеолизу.
Чтобы не было сомнений все преимущества, указанные выше для Xr, применимы также к соответствующей D-аминокислоте xr.
Пептидная часть молекулы по изобретению, описанной выше, может быть «миметиком», то есть пептидомиметиками, которые имеют структурное сходство с пептидами, содержащими или состоящими из аминокислотной последовательности, как описано выше.
Пептидомиметики, которые не являются пептидами по природе, могут быть спроектированы и синтезированы стандартными методами органической химии. Такие пептидомиметики могут быть даже более предпочтительными для использования в терапевтических целях и возможности применения внутрь, они лучше противодействуют разрушению, легче проникают в клетку.
Пептидомиметики представляют собой небольшие молекулы, которые могут присоединяться к белкам, имитируя некоторые структурные аспекты пептидов и белков. Они широко используются и медицине и в качестве агонистов и антагонистов белковых и пептидных лигандов клеточных и других рецепторов и в качестве субстратов или аналогов субстратов ферментов. В качестве нескольких примеров укажем алкалоиды опия (натуральные аналоги эндорфинов), пенициллины (полусинтетические) и ингибиторы протеазы ВИЧ (синтетические). Такие соединения имеют структурные особенности, имитирующие пептид или белок и распознаются и связываются другими белками. Связывание пептидомиметика индуцирует выполнение белком нормальной функции (агонист) или блокирует выполнение белком своей функции (антагонист, ингибитор).
Главная цель в конструировании пептидомиметиков состояла в том, чтобы уменьшить подверженность миметиков расщеплению и инактивации пептидазами. При одном подходе, например подходе, разработанном Sherman et al (1990), две или более амидных связи замещали по существу изостерически различными химическими функциональными группами. Этот пошаговый подход увенчался некоторым успехом, так как были получены активные аналоги. В некоторых случаях эти аналоги имели более длительный биологический период полураспада, чем их натуральные аналоги. При другом подходе были использованы различные некодированные или модифицированные аминокислоты, такие, как D-аминокислоты и N-метиламинокислоты для модификации пептидов млекопитающих. В качестве альтернативы предполагаемую биологически активную конформацию стабилизировали путем ковалентной модификации, например путем циклизации или встраивания гамма-лактамных или других мостиков (Veber et al. 1978) и Thorsett et al. 1983). Другой подход был разработан Rich (1986) для конструирования пептидов путем применения концепции аналога переходного состояния в конструировании ингибитора фермента. Например, известно, что вторичный спирт статина имитирует тетраэдрическую переходную конфигурацию неподвижной амидной связи субстрата пепсина.
В US 5,552,534 описаны непептидные соединения, которые имитируют или ингибируют химическую или биологическую активность различных пептидов. Такие соединения можно получить, добавляя к определенным центрально расположенным группам, таким, как тетрагидропиранильное кольцо, химические функциональные группы, которые делают соединения, по меньшей мере частично, способными вступать в перекрестную реакцию с пептидом. Другие методики получения пептидомиметиков описаны в патентах US 5,550,251 и US 5,288,707.
Для конструирования небольших пептидов и/или пептидомиметиков, преимущественно негидролизуемых аналогов как специфических антагонистов/ингибиторов, можно использовать имеющиеся в продаже компьютерные программы. Подходящее коммерческое программное обеспечение для анализа кристаллической структуры, конструирования и оптимизации малых пептидов и пептидомиметиков включает, но не исчерпывается ими, макромолекулярную рентгеновскую кристаллографию QUANTA Environment (Molecular Simulations, Inc.); TeXsan, BioteX и SQUASH (Molecular Structure Corporation); и Crystallographica (Oxford Cryostsystems).
Понятно, что соль или производное молекулы, описываемой здесь, могу оказаться подходящими для предупреждения или лечения заболевания, в развитии которого играет роль активность АР и/или ЭР при условии, что соль или производное могут предупредить или ингибировать взаимодействие киназы семейства Src (например, Src-киназы) с АР или ЭР. Под словом «производное» мы понимаем пептиды (например, пептидной частью [(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m является [lys-ile-arg-ala-his-pro-his-xr-(pro)n]m упомянутой выше молекулы), имеющие один или более остатков, дериватизированные путем химического взаимодействия с функциональной боковой группой. Такие дериватизированные молекулы включают, например, молекулы, где свободные аминогруппы дериватизированы и образуют гидрохлориды аминов, p-толуолсульфонильные группы, карбобензоксигруппы, t-бутилоксикарбонильную группу, хлорацетильную группы или формильную группы. Свободные карбоксильные группы могут быть дериватизированы в соли, метиловый и этиловый сложные эфиры или другие типы сложных эфиров или гидразиды. Свободные гидроксильные группы могут быть дериватизированы в О-ацильное или О-алкильное производные. В качестве производных включали также пептидные части, которые содержат одно или более натуральное производное аминокислоты двадцати стандартных аминокислот. Например, пролин можно заместить 4-гидроксипролином; лизин можно заменить 5-гидроксилизином; гистидин - 3-метилгистидином; серии - гомосерином и оринитин - лизином. Получение производных не включает изменения функциональных групп, которые меняют одну аминокислоту на другую.
Некоторые применимые модификации разработаны с тем, чтобы повысить стабильность и, следовательно, увеличить период полужизни молекул (например, пептидов) в растворах, в частности в биологических жидкостях, например крови, плазме или сыворотке крови, путем блокирования протеолитической активности крови. Таким образом, пептид может иметь стабилизирующую группу на одном или обоих концах. Типичные стабилизирующие группы включают амидную, ацетильную, бензильную, фенильную, тозильную, алкоксикарбонильную, алкилкарбонильную, бензилоксикарбонильную и подобные модификации концевых групп. Дополнительные модификации включают использование вместо концевой «L» аминокислоты «D» аминокислоту, вместо аминогруппы или карбоксильной группы амидную группу для ингибирования экзопептидазной активности. Таким образом, понятно, что пептидная часть [(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m является [lys-ile-arg-ala-his-pro-his-xr-(pro)n]m молекулы, определенной выше может иметь кэпирующий фрагмент на одном или обоих концах, предпочтительно фрагмент, которая имеет молекулярную массу менее 200 Да. Другие кэпирующие фрагменты включают нафтильную группу или полиэтиленгликолевую группу. Понятно, ретроинверсные пептиды являются уже стабильными и могут не потребовать дополнительных кэпирующих фрагментов.
Таким образом, в особенно предпочтительном варианте осуществления изобретения молекула содержит или состоит из структуры Ac-Pro-Pro-Pro-His-Pro-His-Ala-Arg-Ile-Lys-NH2 или Ac-Pro-Pro-Thr-His-Pro-His-Ala-Arg-Ile-Lys-NH2, в которой Ас является ацетильной группой.
Молекула по изобретению является молекулой, которая не снижает и не блокирует фертильность субъекта. Как было описано в примерах, авторы изобретения показали, что введение пептида Ac-Pro-Pro-Pro-His-Pro-His-Ala-Arg-Ile-Lys-NH2 мышам не влияет на фертильность и можно ожидать, что и другие молекулы, которые предотвращают или ингибируют взаимодействие между киназой семейства Src (например, Src-киназой) и АР или ЭР имеют такое же свойство. Способы оценки фертильности субъекта известны из предшествующего уровня техники и включают анализы, такие, как описанные в примерах.
В одном варианте осуществления изобретения молекулу по изобретению вводят в качестве вакцины для генерирования антител. Например, молекула, имеющая структуру, определенную выше, может быть использована для выработки антител, которые специфично присоединяются к АР и поэтому могут быть использованы для получения вакцины.
Желательно связать молекулу по изобретению с молекулой-носителем, такой как проиммуногенной молекулой. Подходящие примеры такой молекулы включают человеческий сывороточный альбумин или гемоцианин лимфы улитки. Кроме того, дополнительно или в качестве альтернативы молекула может быть заключена в липидную композицию, такую, как липидная частица, нанокапсула, липосома или липидная везикула. Молекулу по изобретению можно также встроить в капсулу для медленного высвобождения, как будет описано далее.
В заболевания, в развитии которых играет роль активность АР и/или ЭР, мы включаем любое биологическое или медицинское состояние или нарушение, при котором по меньшей мере часть патологии опосредуется активностью АР и/или ЭР. Патология может быть обусловлена как повышением, так и снижением активности АР и/или ЭР. Активность АР и/или ЭР может непосредственно способствовать развитию заболевания. Обычно заболевание, при котором активность АР и/или ЭР является способствующим фактором, является заболевание, в развитии которого играют роль аберрантные сигнальные пути, реализующиеся через АР и/или ЭР (например, заболевание, при котором пролиферация клеток модулируется АР и/или ЭР). Например, заболевание может включать в себя аберрантные сигнальные пути, реализующиеся с участием киназы семейства Src. Такие заболевания можно легко диагностировать с помощью традиционных методов, известных из уровня техники.
Заболевание может быть нераковым (включая неонкологические пролиферативные заболевания) или может быть онкологическим (например, высокодифференцированный или низкодифференцированный рак). Заболевание может вовлекать репродуктивную систему, часть ее органов или все органы или ткани. Заболевание репродуктивной системы может быть гинекологическим заболеванием, то есть заболеванием, которое поражает женскую репродуктивную систему.
В первом предпочтительном варианте изобретения заболевание является нераковым, включающим любое пролиферативное заболевание, в развитии которого играет роль активность АР и/или ЭР. Примеры такого заболевания включают эндометриоз, овариальные кисты, фиброзно-полипозную гиперплазию, неоплазию, ановуляторное кровотечение, разрастание эндометрия в мошонке, мочевом пузыре или предстательной железе, нераковые пролиферативные заболевания ткани молочной железы. Предпочтительно, чтобы заболеванием был эндометриоз.
Во втором варианте осуществления изобретения, патологическим состоянием является онкологическое заболевание, а субъектом является пациент, желающий сохранить фертильность. Выражение «желающий сохранить фертильность» означает, что субъект не хочет, чтобы его фертильная функция снизилась. Например, субъект может хотеть зачать. Такие субъекты, следовательно, представляют собой подгруппу онкологических больных, которые хоть и больны раком, хотят сохранить фертильность. Примеры таких онкологических заболеваний включают миому матки, фиброзно-полипозную гиперплазию, рак яичника, рак мочевого пузыря, рак шейки матки, рак эндометрия, рак яичника и рак предстательной железы.
В третьем предпочтительном варианте осуществления изобретения заболеванием (например, нераковым или онкологическим) является гинекологическое заболевание. Предпочтительно, чтобы заболеванием был эндометриоз.
В первом и третьем предпочтительных вариантах осуществления изобретения особенно желательно применять молекулу у субъектов, которые желают сохранить фертильность. Таким образом, в этих вариантах осуществления изобретения также предпочтительно, если субъектом является больной, желающий сохранить фертильность. Наиболее предпочтительно, чтобы заболеванием был эндометриоз и субъектом был больной, желающий сохранить фертильность.
Понятно, что для приготовления препарата молекулу по изобретению, ее производное или фрагмент, которые были описаны здесь, можно скомпоновать с фармацевтически приемлемым эксципиентом, растворителем, разбавителем или носителем (включая их комбинации). Носитель, разбавитель, растворитель или эксципиент должны быть «приемлемыми» в том смысле, что должны быть совместимы с молекулой по изобретению или ее производным и не оказывать отрицательного воздействия на реципиента. В типичном случае носителями могут быть стерильные и апирогенные вода или солевой раствор (например, физиологический раствор). Подходящие эксципиенты включают маннитол и декстрозу. Приемлемые носители, растворители, разбавители и эксципиенты для терапевтического применения известны фармацевтам и описаны, например в Remington's Pharmaceutical Sciences, Mack Publishing Co. (A.R. gennaro ed. 1985). Фармацевтически приемлемый носитель, растворитель, эксципиент или разбавитель можно выбрать с учетом пути введения и стандартной фармацевтической практики. Фармацевтические композиции могут включать, в том числе в качестве дополнения к носителю, эксципиенту, растворителю или разбавителю любое подходящее связующее вещество, лубрикант, суспендирующий агент, вещество для покрытия или разжижающий агент. В фармацевтическую композицию могут быть включены консерванты, стабилизаторы, красители и даже ароматизирующие агенты.
Для удобства композиции могут быть представлены в дозированной форме и могут быть приготовлены любым из способов, известных в фармацевтике. Такие способы включают этап связывания молекулы по изобретению с носителем, который содержит один или более дополнительный ингредиент. В общем, препараты готовят, ассоциируя активный ингредиент с жидкими или мелкоизмельченными твердыми носителями или и теми и другими и затем, если необходимо, формуя полученный продукт.
Композиции по изобретению, подходящие для приема внутрь, могут быть представлены в виде дискретных единиц, например капсулах, крахмальных облатках или таблетках, содержащих определенное количество активного ингредиента; в виде порошка или гранул; в виде раствора или суспензии в воде или другой жидкости; или в виде эмульсии типа «масло в воде» или «вода в масле». Активный ингредиент может быть представлен также в виде болюса, электуария или пасты.
Таблетку можно сделать путем прессования или формования, при необходимости добавляя один или более ингредиент. Прессованная таблетка может быть приготовлена путем прессования в подходящей машине активного ингредиента в свободнотекучей форме, такой, как порошок или гранулы, при необходимости смешанных со связующим веществом (например, повидоном, желатином, гидроксипропилметилцеллюлозой), лубрикантом, инертным разбавителем, консервантом, дезинтегрантом (например, натриевой солью гликолята крахмала, сшитого повидона, сшитой натрий-карбоксиметилцеллюлозы), поверхностно-активным веществом или диспергирующим веществом. Таблетки можно изготовить формованием в подходящей машине смеси порошкового соединения, смоченного инертным жидким разбавителем. При необходимости таблетки можно покрыть или нанести на них разделительную риску или сделать их такими, чтобы активный ингредиент выделялся из них медленно, используя для этого, например, гидроксипропилметилцеллюлозу в различных пропорциях в зависимости от желаемого профиля высвобождения.
Композиции, подходящие для местного применения в при заболеваниях полости рта включают леденцы, содержащие активный ингредиент в ароматизированной основе, обычно сукрозе и аравийской камеди или трагаканте; пастилки, содержащие активный ингредиент в инертной основе, например желатине и глицерине, или сукрозе и аравийской камеди; и раствор для полоскания полости рта, содержащий активный ингредиент в подходящем жидком носителе.
Композиции для парентерального применения включают водный или неводный стерильный раствор для инъекций, который может содержать антиоксиданты, буферы, бактериостатические вещества и растворенные вещества, которые приводят композицию в изотоническое состояние с кровью реципиента; водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Композиция может находиться в однодозном или многодозном контейнере, например в запаянных ампулах или герметично закупоренных флаконах, и храниться в лиофилизированном виде, требующем только добавления стерильного жидкого носителя, например воды для инъекций, перед самым употреблением. Растворы и суспензии можно приготовить ех tempore из стерильных порошков, гранул и таблеток, которые были описаны ранее.
Помимо ингредиентов, упомянутых выше, композиции по изобретению могут включать другие агенты, обычно применяемые в подобных композициях, например композициях, подходящих для приема внутрь могут включать ароматизаторы.
Молекулу по изобретению или ее производное или фрагмент либо композицию, приготовленную из нее, можно вводить любым из традиционных путей введения: внутрь, интраназально и парентерально (например, подкожно или внутримышечно). Предпочтительным является прием внутрь или внутривенный либо подкожный путь введения. Лечение может состоять во введении однократной дозы или нескольких доз в течение определенного периода. Молекула по изобретению или ее производное может быть приготовлена в виде препарата с длительным высвобождением активного агента, обеспечивающего постепенное высвобождение в течение длительного периода, превышающего 2 или 4 недели или 6 недель или 8 недель. Предпочтительно, чтобы медленное высвобождение препарата происходило в течение не менее 4 нед.
В предпочтительном варианте осуществления изобретения, молекула по изобретению, ее производное или фрагмент включены в препарат, который можно вводить непосредственно в репродуктивную систему. Таким образом, молекула по изобретению, ее производное или фрагмент могут быть приготовлены в виде вагинальных или ректальных суппозиториев, вагинального тампона, вагинального кольца, вагинального пессария, вагинальной губки или внутриматочного средства, начиненного препаратом (ВМС).
Изобретение включает молекулу, которая ингибирует или предотвращает взаимодействие между киназой семейства Src (например, Src-киназой) и андрогенным рецептором или рецептором эстрадиола, в частности молекулу, включающую последовательности, определенные выше Bj-[(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m-Rp или Bj-[lys-ile-arg-ala-his-pro-his-xr-(pro)n]m-Rp, приготовленную таким образом, что ее можно непосредственно вводить в репродуктивную систему, или применять в форме, обеспечивающей медленное длительное высвобождение. Таким образом, изобретение включает молекулу, которая ингибирует или предотвращает взаимодействие между киназой семейства Src (например, Src-киназой) и андрогенным рецептором или рецептором эстрадиола, такую, как молекула, содержащая или состоящая из структуры Bj-[(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m-Rp или Bj-[lys-ile-arg-ala-his-pro-his-xr-(pro)n]m-Rp или ее производного или фрагмента, изготовленная в виде вагинальных или ректальных суппозиториев; вагинального тампона, вагинального кольца, вагинального пессария, вагинальной губки, внутриматочного средства, начиненного препаратом; или препарата с замедленным высвобождением. Иными словами, в изобретении предлагается фармацевтическая композиция, содержащая молекулу, которая ингибирует или предотвращает взаимодействие между киназой семейства Src (например, Src-киназой) и андрогенным рецептором или рецептором эстрадиола и которая адаптирована для препарата в форме вагинальных или ректальных суппозиториев; вагинального тампона, вагинального кольца, вагинального пессария, вагинальной губки, внутриматочного средства (ВМС), начиненного препаратом; или препарата с замедленным высвобождением, и которая при необходимости содержит фармацевтически приемлемый эксципиент, носитель или разбавитель.
Количество молекул, ее производных или фрагментов, вводимое субъекту, является количеством, достаточным для преодоления заболевания у субъекта. Это количество может определить врач.
В одном варианте осуществления изобретения молекулу, например содержащую или состоящую из структуры Bj-[(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m-Rp или Bj-[lys-ile-arg-ala-his-pro-his-xr-(pro)n]m-Rp, определенной выше, вводят субъекту в суточной дозе от 1 до 1000 нг, например в дозе 1-900 нг, 1-800 нг, 1-700 нг, 1-600 нг, 1-500 нг, 1-400 нг, 1-300 нг, 1-200 нг или 1-100 нг. Таким образом, молекулу, содержащую или состоящую из структуры Bj-[(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m-Rp или Bj-[lys-ile-arg-ala-his-pro-his-xr-(pro)n]m-Rp, определенной выше, можно вводить субъекту в суточной дозе, равной по меньшей мере 1 нг, 10 нг, 20 нг, 30 нг, 40 нг, 50 нг, 60 нг, 70 нг, 80 нг, 90 нг или 100 нг или по меньшей мере 150 нг или 200 нг.
В другом варианте осуществления изобретения молекулу, в частности молекулу, содержащую или состоящую из структуры Bj-[(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m-Rp или Bj-[lys-ile-arg-ala-his-pro-his-xr-(pro)n]m-Rp, определенной выше, вводят через интервалы (например, ежедневно, раз в два дня или раз в неделю при длительности курса, равной по меньшей мере 5, 10, 15, 20, 25, 30, 40, 45, 50, 55 или 60 дням и даже при длительности курса, равной 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или 18 мес, или при длительности курса, равной 2, 3, 4 или 5 годам. Если молекулу по изобретению или ее производное вводят через определенные интервалы, желательно использовать разные пути введения и разные интервалы между введениями. Например, молекулу по изобретению или ее производное можно сначала ввести в виде инъекции, а затем вживить подкожный имплантат. Оптимальным интервалом введения и длительность лечения обычно зависят от того, насколько серьезно заболевание.
В одном варианте осуществления изобретения субъекту вводят, помимо молекулы по изобретению или ее производного, другой терапевтический агент. Например, при введении молекулы по изобретению или ее производного для профилактики или лечения конкретного заболевания можно вводить и другой терапевтический агент, о котором известно, что он подходит для профилактики или лечения данного заболевания. Таким образом, при профилактике и лечении эндометриоза другим терапевтическим агентом может быть агент, который применяется для лечения эндометриоза, при профилактике и лечении миомы матки другим терапевтическим агентом может быть агент, который применяется для профилактики и лечения миомы матки, и т.д.
В типичном случае заболевание, при котором играют роль АР и/или ЭР, является пролиферативным заболеванием, поэтому другим терапевтическим агентом может быть любой агент, который подавляет пролиферацию, например любой цитостатик или цитоцидный агент либо противоопухолевый агент.
Другой терапевтический агент можно вводить в одно и то же время с молекулой по изобретению или ее производным, описанным здесь (например, одновременно и при необходимости в виде комбинированного препарата) или в другое время (то есть вводят последовательно, при этом введение другого терапевтического агента может либо предшествовать введению молекулы по изобретению или ее производного, либо следовать за ее введением). Другой терапевтический агент можно вводить таким же путем, как молекулу по изобретению, или иным путем, обычным для данного терапевтического агента.
Второй объект настоящего изобретения касается композиции, содержащей (i) молекулу, которая ингибирует или предотвращает взаимодействие между киназой семейства Src (например, Src-киназой) и андрогенным рецептором или рецептором эстрадиола, и (ii) терапевтический агент, подходящий для профилактики или лечения нераковых заболеваний, в развитии которых играет роль активность АР и/или ЭР, вместе с фармацевтически приемлемым эксципиентом, носителем или разбавителем. Композицией может быть фармацевтическая композиция, которая содержит фармацевтически приемлемый эксципиент, носитель или разбавитель.
Предпочтительные молекулы и их производные, другие терапевтические агенты, заболевания и субъекты, которых необходимо лечить, были упомянуты выше при описании первого объекта изобретения. Например, молекула по изобретению может содержать или состоять из структуры:
Bj-[(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m-Rp, или Bj-[lys-ile-arg-ala-his-pro-his-xr-(pro)n]m-Rp или ее производного или фрагмента, где В является первой химической частью, j является 0 или 1, n является целым числом от 1 до 10, m является целым числом от 1 до 3, R является второй химической частью, p является 0 или 1 и [lys-ile-arg-ala-his-pro-his-xr-(pro)n] является ретроинверстным пептидом [(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]. Наиболее предпочтительно, чтобы молекула по изобретению имела структуру Ac-Pro-Pro-Pro-His-Pro-His-Ala-Arg-Ile-Lys-NH2 или Ac-Pro-Pro-Thr-His-Pro-His-Ala-Arg-Ile-Lys-NH2, где Ас является ацетильной группой. Предпочтительно, чтобы субъектом был человек. Предпочтительно, чтобы другим терапевтическим агентом был агент, подходящий для профилактики или лечения эндометриоза.
Таким образом, изобретение включает композицию, содержащую (i) молекулу, которая ингибирует или предотвращает взаимодействие между киназой семейства Src (например, Src-киназой) и андрогенным рецептором или рецептором эстрадиола, и (ii) терапевтический агент, подходящий для профилактики или лечения неракового заболевания, в развитии которого играют роль АР и/или ЭР, вместе с фармацевтически приемлемым эксципиентом, носителем или разбавителем для применения в целях профилактики или лечения неракового заболевания, в развитии которого у субъекта играет роль активность АР и/или ЭР. Композицией может быть фармацевтическая композиция, которая содержит фармацевтически приемлемый эксципиент, носитель или разбавитель.
Аналогично изобретение включает использование композиции, содержащей (i) молекулу, которая ингибирует или предотвращает взаимодействие между киназой семейства Src (например, Src-киназой) и андрогенным рецептором или рецептором эстрадиола, и (ii) терапевтический агент, подходящий для профилактики и лечения неракового заболевания, в развитии которого играет роль активность АР и/или ЭР, вместе с фармацевтически приемлемым эксципиентом, носителем или разбавителем, в изготовлении препарата для профилактики или лечения неракового заболевания, в развитии которого у субъекта играет роль активность АР и/или ЭР. Композицией может быть фармацевтическая композиция, которая содержит еще и фармацевтически приемлемый эксципиент, носитель или разбавитель.
Изобретение включает молекулу, которая ингибирует или предотвращает взаимодействие между киназой семейства Src (например, Src-киназой) и андрогенным ренцептором и рецептором эстрадиола, и применяется для профилактики или лечения неракового заболевания, в развитии которого играет роль активность АР и/или ЭР, или применения для профилактики или лечения онкологического заболевания, в развитии которого играет роль активность АР и/или ЭР у субъекта, который желает сохранить фертильную функцию, или для применения для профилактики или лечения гинекологических заболеваний, в развитии которых у субъекта играет роль активность АР и/или ЭР, причем субъекту вводят также терапевтический агент, подходящий для профилактики или лечения данного заболевания.
Равным образом понятно, что изобретение включает применение молекулы, которая ингибирует или предотвращает взаимодействие между киназой семейства Src (например, Src-киназой) и андрогенным рецептором или рецептором эстрадиола, в изготовлении медикамента для профилактики или лечения неракового заболевания, в развитии которого у субъекта играет роль активность АР и/или ЭР или для профилактики или лечения онкологического заболевания, в развитии которого играет роль активность АР и/или ЭР у субъекта, который желает сохранить фертильность, или для профилактики или лечения гинекологического заболевания, в развитии которого у субъекта играет роль активность АР и/или ЭР, и при котором субъекту вводят также терапевтический агент, подходящий для профилактики или лечения неракового заболевания, в развитии которого играет роль активность АР и/или ЭР.
Предпочтительно, чтобы молекула по изобретению содержала или состояла из структуры:
Bj-[(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]m-Rp или Bj-[lys-ile-arg-ala-his-pro-his-xr-(pro)n]m-Rp, или ее производного или фрагмента, в которой В является первым химическим фрагментом, j равен 0 или 1, n является целым числом от 1 до 10, m является целым числом 1 до 3, R является вторым химическим фрагментом молекулы, p является 0 или 1, и [lys-ile-arg-ala-his-pro-his-xr-(pro)n] является ретроинверсным пептидом [(Pro)n-Xr-His-Pro-His-Ala-Arg-Ile-Lys]. Более предпочтительно, чтобы молекула по изобретению имела структуру Ac-Pro-Pro-Pro-His-Pro-His-Ala-Arg-Ile-Lys-NH2 или Ac-Pro-Pro-Thr-His-Pro-His-Ala-Arg-Ile-Lys-NH2, где Ас является ацетильной группой.
Авторы изобретения обнаружили, что молекулами, которые ингибируют или предотвращают взаимодействие между киназой семейства Src и АР и/или ЭР, можно предупредить или лечить нераковые заболевания, в развитии которых играет роль активность АР и/или ЭР. Таким образом, понятно, что, оценивая эффект тестируемых агентов на это взаимодействие, можно идентифицировать те из них, с помощью которых можно предупредить или лечить нераковые заболевания.
Таким образом, другой объект изобретения касается способа выбора агента для профилактики и лечения нераковых заболеваний, в развитии которых играет роль активность АР и/или ЭР, способа, который позволяет определить, подавляет ли тестируемый агент взаимодействие между (a) АР или ЭР или частью их, которая может связываться с киназой семейства Src, и (b) киназой семейства Src или ее частью, которая может связываться с АР или ЭР.
Предпочтительными для АР, ЭР и киназы семейства Src и неракового заболевания являются те рецепторы и киназы, которые были определены при описании первого объекта изобретения.
Нет необходимости использовать целиком АР или ЭР или киназу семейства Src для скрининга, для этого можно воспользоваться лишь частью молекулы АР или ЭР, которая может связываться с киназой семейства Src (например, Src-киназой) и частью киназы семейства Src (например, Src-киназы), которая может связываться с АР или ЭР. Например, как было описано выше, SH3- и SH2-домены киназы семейства Src (например, Src-киназы) опосредуют взаимодействие между киназой семейства Src и соответственно АР и ЭР. Таким образом, можно использовать киназу семейства Src (например, Src-киназа), соответствующую SH3-домену или его части, способной связываться с АР, или часть киназы семейства Src (например, Src-киназы), соответствующую SH2-домену или его части, способной связываться с ЭР. Равным образом можно использовать часть АР, соответствующую аминокислотным остаткам 377-386, которая, как полагают, опосредует взаимодействие между АР и SH3-доменом киназы семейства Src (например, Src-киназы). Другие подходящие части могут определить специалисты в данной области; они описаны в Migliaccio et al (Oncogene 2007, 26: 6619) и Migliaccio et al (Cancer Research 2005, 65(22): 10585-93).
Тестируемым агентом может быть любой подходящий тестируемый агент, включающий полипептид, антитело, малую молекулу, натуральный продукт, пептидомиметик или нуклеиновую кислоту. Библиотеку тестируемых агентов можно скринировать как часть скрининга с высокой пропускной способностью.
Для определения эффекта, оказываемого тестируемым агентом на взаимодействие между АР или ЭР и киназой семейства Src (например, Src-киназой) или ее частью, можно использовать различные методики, например описанные выше и известные из уровня техники (например, из Migliaccio et al (Oncogene 2007, 26: 6619) и Migliaccio et al (Cancer Research 2005, 65(22): 10585-93).
В одном варианте осуществления изобретения способ по изобретению включает этап изолирования тестируемого агента, который уменьшает взаимодействие между (a) АР или ЭР или их частью, причем упомянутая часть способна связываться с киназой семейства Src, и (b) киназой семейства Src или ее частью, причем упомянутая часть способна связываться с АР или ЭР.
Предпочтительно, чтобы выбранный тестируемый агент уменьшал взаимодействие (a) АР или ЭР или части их, причем упомянутая часть способна связываться с киназой семейства Src, и (b) киназой семейства Src или ее частью, если эта часть способна связываться с АР или ЭР, по меньшей мере на 10%, 20%, 30%, 40% или 50% по сравнению с исходным взаимодействием в отсутствие тестируемого агента и более предпочтительно, чтобы по меньшей мере на 60%, 70%, 80%, 90% или 95%.
В одном варианте осуществления изобретения способ по изобретению далее включает идентификацию тестируемого агента, который предотвращает или лечит нераковое заболевание, в развитии которого играет роль активность АР и/или ЭР. Например, способ по изобретению далее может включать оценку эффективности тестируемого агента с помощью подходящего теста для конкретного заболевания (например, модели заболевания на животном). Например, способ можно использовать для того, чтобы выбрать агент на модели эндометриоза. Подходящие модели таких заболеваний также известны из уровня техники.
Выбранным тестируемым агентом является агент, который ингибирует или предотвращает взаимодействие между киназой семейства Src и АР или ЭР в контексте первого объекта изобретения и поэтому может использоваться для этой цели.
В описанном здесь способе по изобретению, который может быть способом скрининга препаратов (термин, хорошо знакомый специалистам в данной области), тестируемым агентом может быть подобное лекарству соединение, или соединение-прототип для получения подобного лекарству соединения.
Термин «подобное лекарству соединение» хорошо известен специалистам в данной области и может означать соединение, свойства которого делают его подходящим для применения в медицине, например в качестве активного ингредиента медикамента. Таким образом, подобным лекарству соединением может, например, быть молекула, которую можно синтезировать методами органической химии, менее предпочтительно методами молекулярной биологии или биохимии и предпочтительно малая молекула, молекулярная масса которой менее 5000 дальтон и которая может быть водорастворимой. Подобное лекарству соединение может дополнительно проявлять свойства избирательно взаимодействовать с конкретным белком или белками и быть биодоступной и/или способной проникать через мембрану целевой клетки или через гематоэнцефалический барьер, однако эти свойства подобного лекарству соединения не являются главными.
Термин «соединение-прототип» также хорошо известно специалистам в данной области и может означать, что, несмотря на то что данное соединение не подходит для использования в качестве лекарства (например, из-за того, что недостаточно активно по отношению к мишени, не обладает селективностью действия, недостаточно стабильно, плохо растворимо, трудно синтезируется или имеет низкую биодоступность), может служить стартовой точкой для конструирования других соединений, которые могут иметь более привлекательные свойства.
В одном варианте осуществления изобретения способ применен in vitro. В in vitro мы включаем как бесклеточный, так и клеточный анализ. Например, способ можно применять на клеточных линиях человека или клеточных линиях, которыми можно легко манипулировать в лабораторных условиях (например, Escherichia coli и Saccharomyces cerevisiae).
В другом варианте осуществления изобретения способ применен in vivo, например, на модели конкретных заболеваний у животных, например, на модели эндометриоза).
В изобретении предлагаются молекула, ее применение, способ или композиция, описанные по существу в данном тексте.
Далее изобретение описывается с помощью следующих фигур и примеров.
Фиг. 1: Вес мышей в зависимости от дозы пептида.
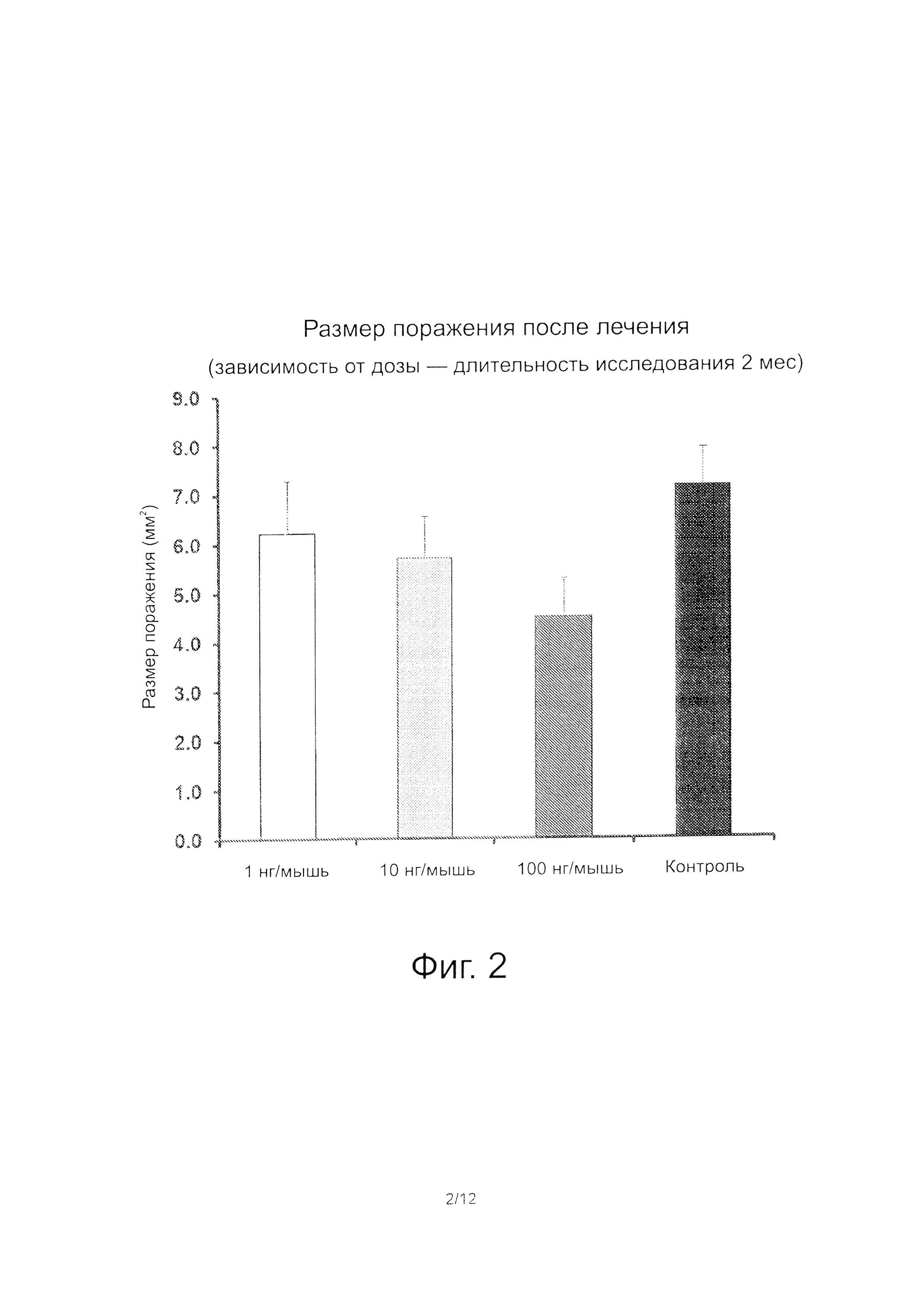
Фиг. 2: Уменьшение размеров поражения (мм) в зависимости от дозы пептида
Фиг.3: Гомологи PPPHPHARIK в отбираемых пептидах
ПРИМЕР 1: Пептид Ac-PPPHPHARIK-NH2 проявляет терапевтическую эффективность при эндометриозе, не влияя на фертильность.
Резюме
Выполнено два исследования, продемонстрировавшие эффективность пептида Ас-PPPHPHARIK-NH2 (обозначенного в табл. 1-4 также ValiRx1) в лечении эндометриоза без снижения фертильности.
Результаты
Первое исследование проведено на 4 опытных и 5 контрольных животных с новой моделью эндометриоза: трансгенных мышей K-rasV12/Ah-Cre скрещивали с мышами линии Rosa26R для генерирования трансгенных мышей KrasV12+/-/Ah-Cre+/-/ROSA26R-LacZ+/- (Research Horizons, University of Cambridge, 2009 Issue 8, GB 0715635.9). Потомков первого поколения подвергали близкородственному скрещивали для получения трансгенной мыши F2 K-rasV12+/-/Ah-Cre+/+/ROSA26R-LacZ+/+. Наличие трансгенов определяли с помощью ПЦР, используя генспецифические праймеры для k-ras, Cre и Rosa26R-LacZ. Образец ткани получали от животных-доноров, которых ранее лечили гормонами и т.д. и делили между животными дикого типа, а затем вводили с лекарством или растворителем в течение 21 дня.
Из четырех леченых животных у трех после лечения отмечено полное отсутствие поражения, у одного ответа на лечение не было. В контрольной группе из 5 животных у одного смоделировать поражение не удалось.
Второе исследование было проведено для оценки эффекта пептида на репродуктивную функцию здоровых мышей и развитие эндометриоза после аутотрансплантации эндометрия у одного животного (Becker et al., AM J Pathol 178(4): 1782-91).
Эстральный цикл
Восьми-десятинедельных нерожавших самок мышей линии C57BL6 акклиматизировали в течение 1 нед. Группе из 10 животных перед выполнением на них эксперимента вводили подкожно пептид в дозе 10 нг в течение 3 дней. Контрольной группе из 10 животных вводили только растворитель. В течение 10 дней брали ежедневно влагалищные мазки. Во всех случаях при исследовании мазков выявлена нормальная картина.
Спаривание (опытная группа самок)
Восьми-десятинедельных нерожавших самок мышей линии C57BL6 акклиматизировали в течение 1 нед. Группе из 10 животных перед выполнением на них эксперимента вводили подкожно пептид в дозе 10 нг в течение 3 дней. Контрольной группе из 10 животных вводили только растворитель.
Пять самцов мышей линии C57BL6 были внесены в клетку к самкам и у последних ежедневно проверяли образование слизистой «пробки» во влагалище (до 9 ч утра). При проверке слизистой пробки у самок определяли:
а) примерный срок беременности (в днях)
б) количество детенышей в помете
в) аномалии развития у детенышей
У всех животных был нормальный приплод (за исключением одного животного опытной группы)
Спаривание (опытная группа самцов)
Восьми-десятинедельных нерожавших самок мышей линии C57BL6 акклиматизировали в течение 1 нед. Группе из пяти самцов за 3 дня до эксперимента ежедневно вводили пептид в дозе 10 нг, а 5 самцам контрольной группы вводили подкожно только растворитель. К каждой группе самцов подсаживали 10 нелеченых самок мышей линии C57BL6 и ежедневно проверяли образование слизистой пробки во влагалище (до 9 ч утра). При проверке слизистой пробки у самок определяли:
а) примерный срок беременности (в днях)
б) количество детенышей в помете
в) аномалии развития у детенышей
Как и в предыдущем эксперименте, у всех животных был нормальный приплод.
Спаривание (второе поколение от леченых животных)
Потомство леченых самок спаривали и проверяли на фертильность для исключения возможного бесплодия. Животных проверяли, как и в ранее описанных экспериментах, на образование слизистой пробки во влагалище. Аномалий развития не выявили.
Возможность профилактики в зависимости от дозы
Восьми-десятинедельным самкам мышей линии C57BL6 трансплантировали 6 фрагментов ткани матки, взятой от животных-доноров после недельной акклиматизации. Трем группам мышей по 5 животных в каждой группе сразу стали вводить подкожно по 1 нг, 10 нг или 100 нг ARP ежедневно и контрольной группе из 5 животных вводили только растворитель. Рост площади поражения у животных, которых лечили, по сравнению с животными контрольной группы был значительно меньше (рис. 2).
Данная модель оказалась превосходной моделью эндометриоза с высоким показателем воспроизведения поражения у животных (97,67%-100%, табл. 4). В табл. 2 и табл. 3 приводятся соответственно площадь поражения (6,02 мм2, 5,53 мм2 и 4,52 мм2 против 7,18 мм2) и ее увеличение (6,23 мм2, 5,72 мм2 и 4,52 мм2 против 7,18 мм2) в опытных и контрольной группах животных.
Что касается дозы, то можно синхронизировать эстральный цикл с одиночной инъекцией эстрогена, выполнив ее за 2-3 дня до хирургического вмешательства.
Результаты описанных выше экспериментов проиллюстрированы на фиг. 1 и 2 и в табл. 1-4.

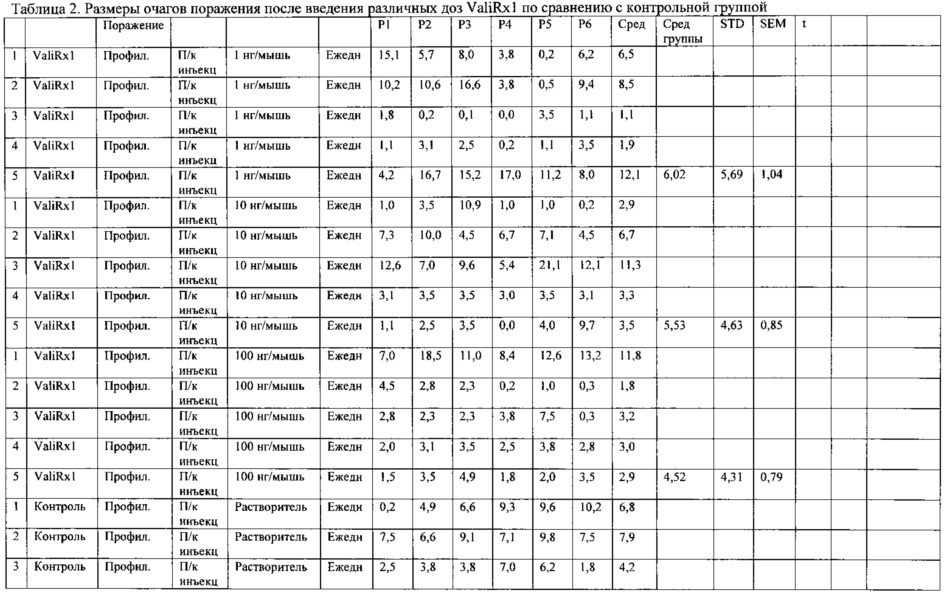



Реферат
Изобретение относится к области биохимии, в частности к применению молекулы, которая ингибирует или предотвращает взаимодействие между киназой семейства Src и андрогенным или рецептором эстрадиола. Также раскрыт способ профилактики или лечения неракового заболевания с помощью указанной молекулы. Раскрыта композиция, содержащая указанную молекулу, для профилактики или лечения неракового заболевания. Изобретение позволяет эффективно лечить нераковые заболевания. 7 н. и 29 з.п. ф-лы, 10 ил, 4 табл, 1 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ применения ингибиторов циклооксигеназы-2 в качестве антиангиогенных средств

Комментарии