Реферат
Изобретение относится к биотехнологии. Предложены: полипептид фрагмента антитела MR1-1, который сохраняет способность узнавать и связывать EGFRvIII, и нуклеиновая
кислота, кодирующая его. Полипептид получен из известного антитела MR1 путем мутирования CDR3 VH- и VL-цепей. Описано применение полипептида для получения иммунотоксина,
обладающего цитотоксичностью к клеткам, несущим антиген рецептора эпидермального фактора роста EGFRvIII. Раскрыт иммунотоксин на основе полипептида. Предложен способ получения полипептида, включающий
аминокислотное замещение, по меньшей мере, одной аминокитслоты в гипервариабельной области CDR, аминокислотой, кодируемой кодоном, содержащим нуклеотид, принадлежащий к мотиву горячей точки. Мотив
горячей точки выбирают из AGY или RGYW, где R представляет собой А или G, Y представляет собой С или Т и W представляет собой А или Т. Получаемый полипептид имеет Kd для EGFRvIII, равную 7 нМ или
менее. Описан способ киллинга клетки, экспрессирующей антиген EGFRvIII с использованием полипептида. Использование изобретения обеспечивает антитела с повышенной цитотоксичностью и улучшенным
связыванием EGFRvIII по сравнению с исходным антителом MR1, что может найти применение для целеноправленной доставки иммунотоксинов при лечении злокачественных образований. 6 н. и 28 з.п. ф-лы, 7
табл., 6 ил.
Формула
1. Полипептид, представляющий собой фрагмент мутированного MR1 антитела, сохраняющий способность узнавать и связываться
с антигеном рецептора эпидермального фактора роста типа III (EGFRvIII), содержащий мутированные вариабельную область тяжелой цепи (VH) антитела и/или вариабельную область легкой цепи (VL) антитела, причем каждая из трех гипервариабельных областей CDR 1-3 полипептида VH цепи отличается от MR1:
(a) заменой серина на пролин в CDR3 в позиции 98
вариабельной области тяжелой цепи MR1 антитела,
(b) заменой треонина CDR3 в позиции 99 вариабельной области тяжелой цепи MR1 антитела на аминокислоту, отобранную из группы,
состоящей из тирозина, аспарагина, триптофана, изолейцина, фенилаланина и валина, и,
(c) при необходимости, заменой фенилаланина на триптофан в позиции 92 CDR3 вариабельной
области легкой цепи MR1 антитела и причем указанный пептид, при необходимости, содержит эффекторную молекулу, терапевтическую группу или детектируемую метку.
2. Способ получения полипептида, сохраняющего способность узнавать и связываться с антигеном рецептора эпидермального фактора роста типа III (EGFRvIII), содержащего мутированные
вариабельную область тяжелой цепи (VH) MR1 антитела и/или вариабельную область его легкой цепи (VL), отличающиеся соответственно от VH и VL исходного
антитела MR1 аминокислотным замещением, по меньшей мере, одной аминокислоты в гипервариабельной области (CDR) аминокислотой, кодируемой кодоном, содержащим нуклеотид, принадлежащий к мотиву горячей
точки, выбранному среди AGY или RGYW, где R представляет собой А или G, Y представляет собой С или Т и W представляет собой А или Т, причем указанный полипептид имеет Kd для EGFRvIII, равную 7 нМ или
менее.
3. Полипептид по п.1, где указанный полипептид представляет собой scFv.
4. Полипептид по п.1, где
указанный полипептид представляет собой dsFv, Fab или F(ab')2.
5. Полипептид по п.1, где замещениями в тяжелой цепи являются S98P-T99Y и
замещением в легкой цепи является F92W.
6. Полипептид по п.1, дополнительно содержащий эффекторную молекулу, терапевтическую группу или детектируемую
метку.
7. Полипептид по п.6, где терапевтической группой является токсичная группа.
8. Полипептид по п.7,
где токсичная группа представляет собой экзотоксин Pseudomonas или его цитотоксичный фрагмент.
9. Полипептид по п.7, где токсичная группа представляет
собой цитотоксичный фрагмент, представляющий собой РЕ38.
10. Полипептид по п.7, где указанный полипептид имеет IC50 7 нг/мл или
менее.
11. Полипептид по п.7, где указанный полипептид имеет IC50 5 нг/мл или менее.
12.
Полипептид по п.7, где указанный полипептид имеет IC50 около 3,5 нг/мл.
13. Полипептид по п.10, где указанный полипептид имеет выход, по
меньшей мере, 3%.
14. Полипептид по п.10, где указанный полипептид имеет выход примерно 7%.
15.
Полипептид по п.7, где токсичную группу выбирают из группы, состоящей из дифтерийного токсина или его цитотоксичного фрагмента, сапорина или его цитотоксичного фрагмента, антивирусного токсина
фитолакки американской или его цитотоксичного фрагмента, рицина или его цитотоксичного фрагмента и бриодина 1 или его цитотоксичного фрагмента.
16.
Полипептид по п.10, где замещениями в тяжелой цепи являются S98P-T99Y и замещением в легкой цепи является F92W.
17. Полипептид по п.1, соединенный с
белком гена бактериофага М13.
18. Иммунотоксин, обладающий цитотоксичностью по отношению к клеткам, несущим на своей поверхности антиген рецептора
эпидермального фактора типа III (EGFRvIII), состоящий из полипептида, охарактеризованного в п.1, и токсической группы РЕЗВ.
19. Применение полипептида,
охарактеризованного в п.1, для получения иммунотоксина, обладающего цитотоксичностью по отношению к клеткам, несущим на своей поверхности антиген рецептора эпидермального фактора роста III
(EGFRvIII).
20. Молекула нуклеиновой кислоты, кодирующая полипептид, охарактеризованный в п.1.
21.
Молекула нуклеиновой кислоты по п.20, где указанный полипептид имеет последовательность, отличающуюся от scFv MR1 аминокислотным замещением, по меньшей мере, одной аминокислоты в CDR1 или CDR2
мутированной вариабельной области тяжелой цепи или мутированной вариабельной области легкой цепи.
22. Молекула нуклеиновой кислоты по п.20, где
замещениями в тяжелой цепи являются S98P-T99Y и замещением в легкой цепи является F92W.
23. Молекула нуклеиновой кислоты по п.20, операбельно связанная
с промотором.
24. Молекула нуклеиновой кислоты по п.21, операбельно связанная с промотором.
25. Молекула
нуклеиновой кислоты по п.22, операбельно связанная с промотором.
26. Способ киллинга клетки, экспрессирующей EGFRvIII антиген, включающий приведение
клетки в контакт с полипептидом, охарактеризованным в п.1.
27. Способ по п.26, где в указанном полипептиде замещена, по меньшей мере, одна аминокислота
в CDR1 или CDR2 мутированной вариабельной области тяжелой цепи фрагмента антитела или в CDR1 или CDR2 мутированной вариабельной области легкой цепи фрагмента антитела.
28. Способ по п.26, где CDR3 мутированной вариабельной области легкой цепи содержит замену фенилаланина на триптофан в позиции 92.
29. Способ по п.26, где замещениями в VH являются S98P-T99Y, а замещением в VL является F92W.
30. Способ по п.26, где клетка
является злокачественной клеткой.
31. Способ по п.26, где злокачественная клетка является клеткой глиомы.
32. Способ по п.26, где злокачественная клетка является клеткой рака молочной железы.
33. Способ по п.26, где злокачественная клетка
является клеткой рака легких.
34. Способ по п.26, где злокачественная клетка является клеткой рака яичников.
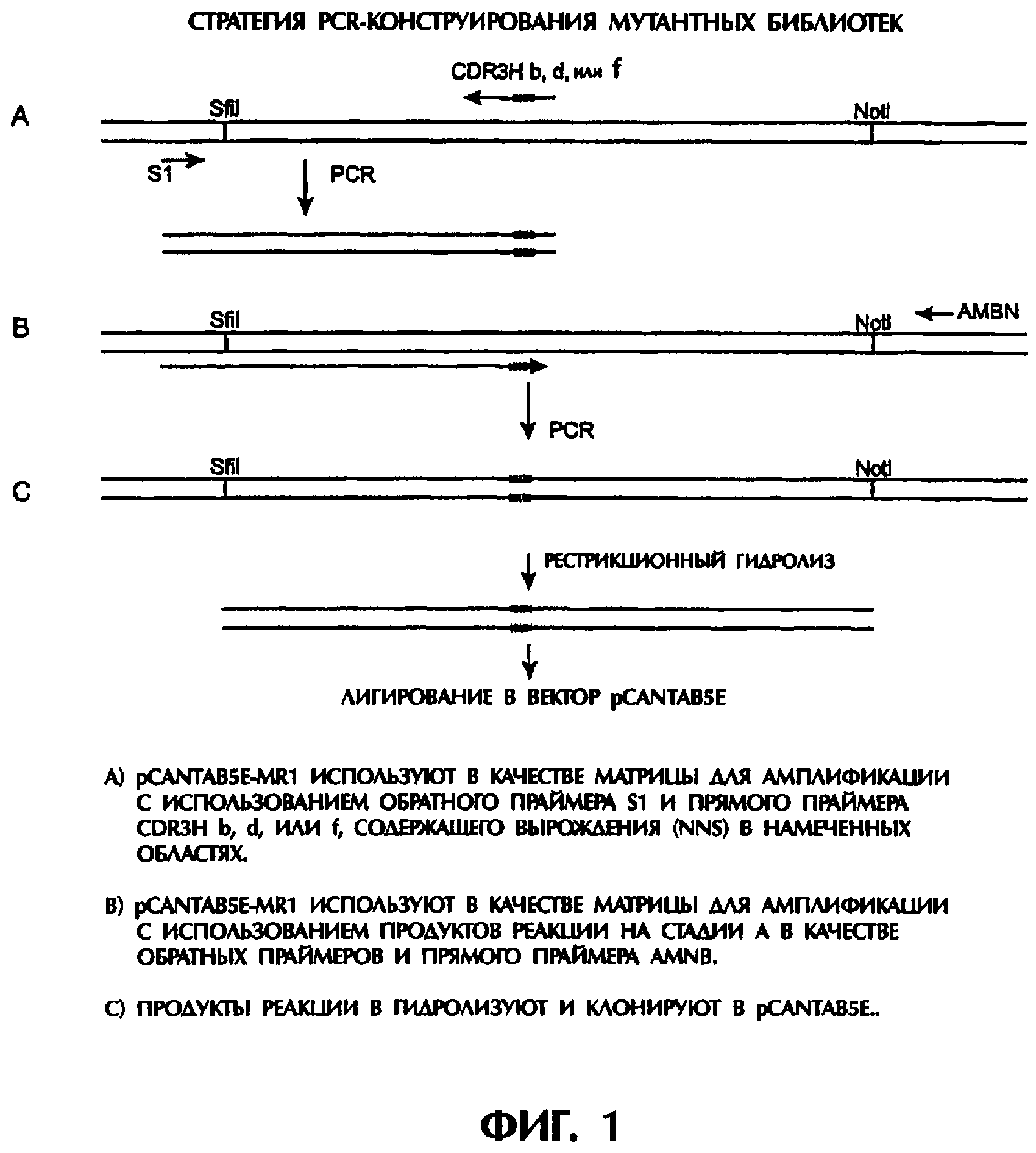
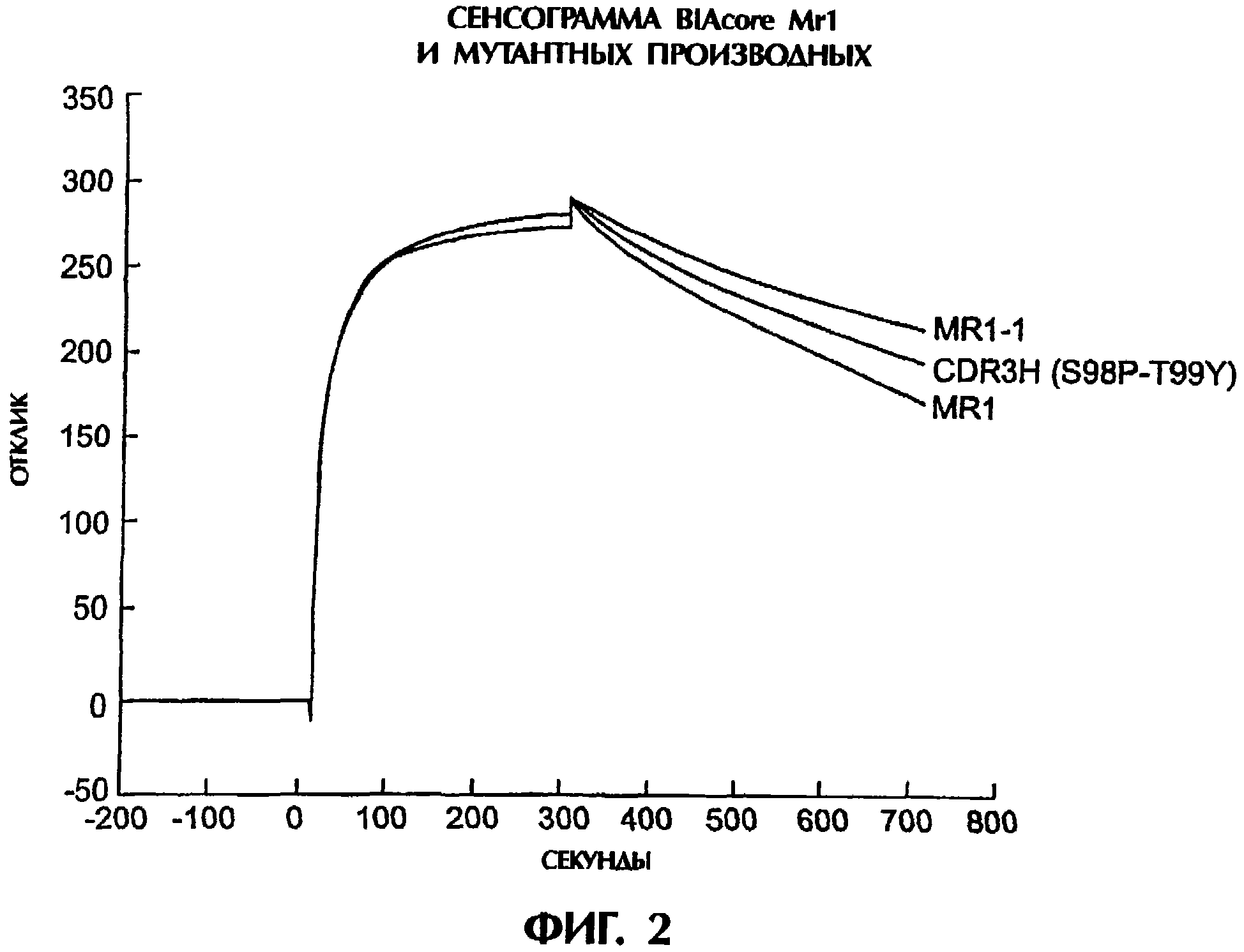
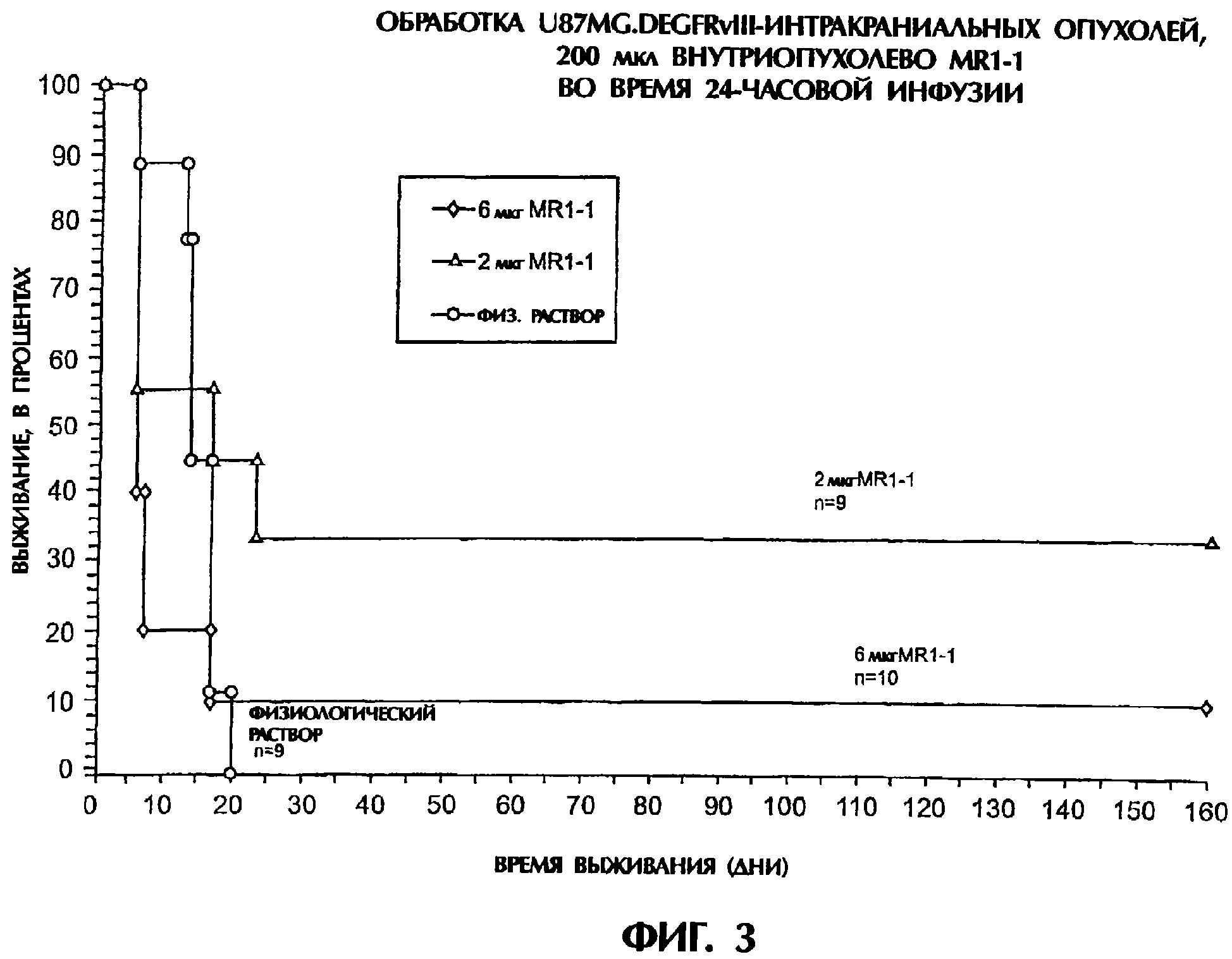
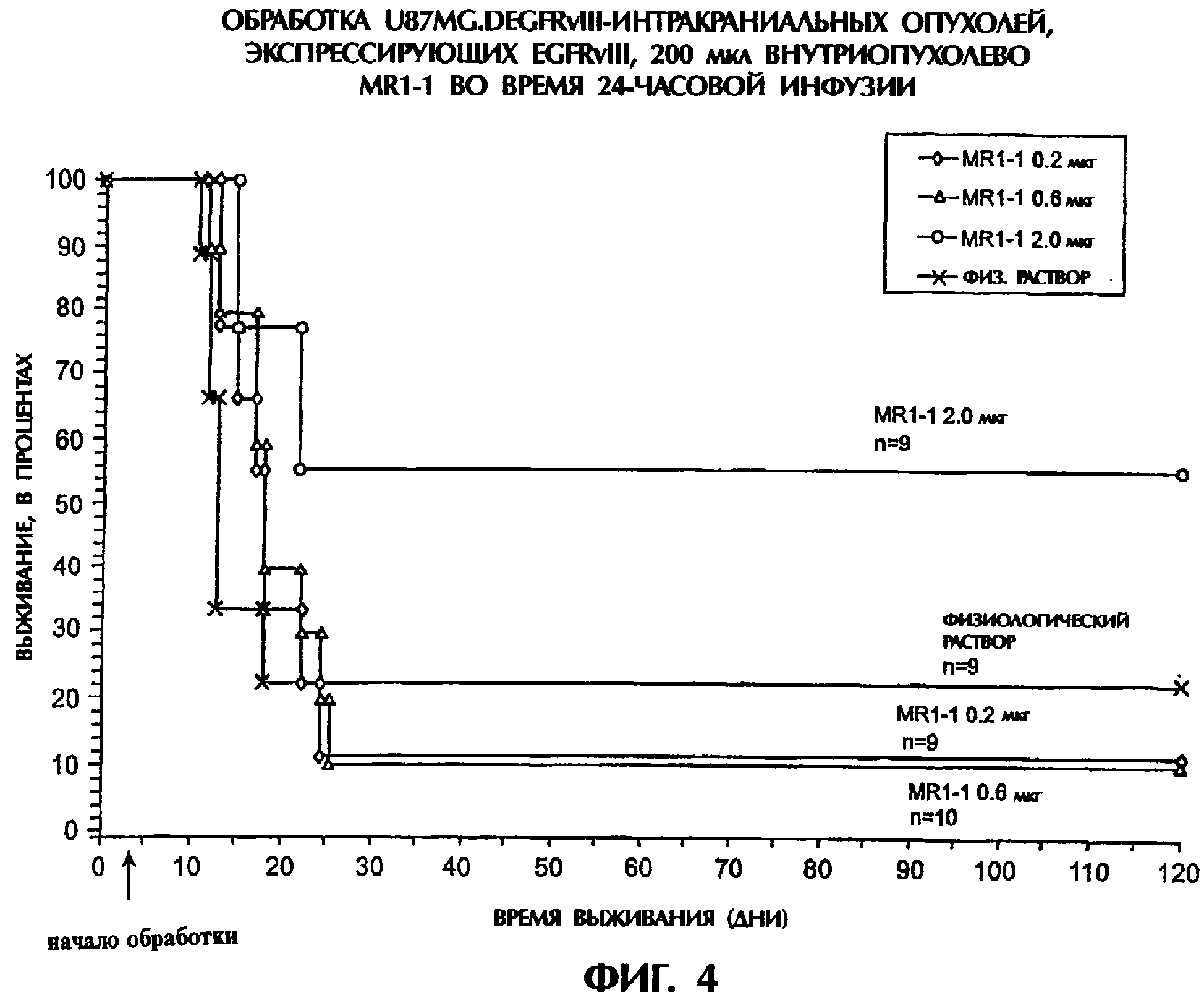
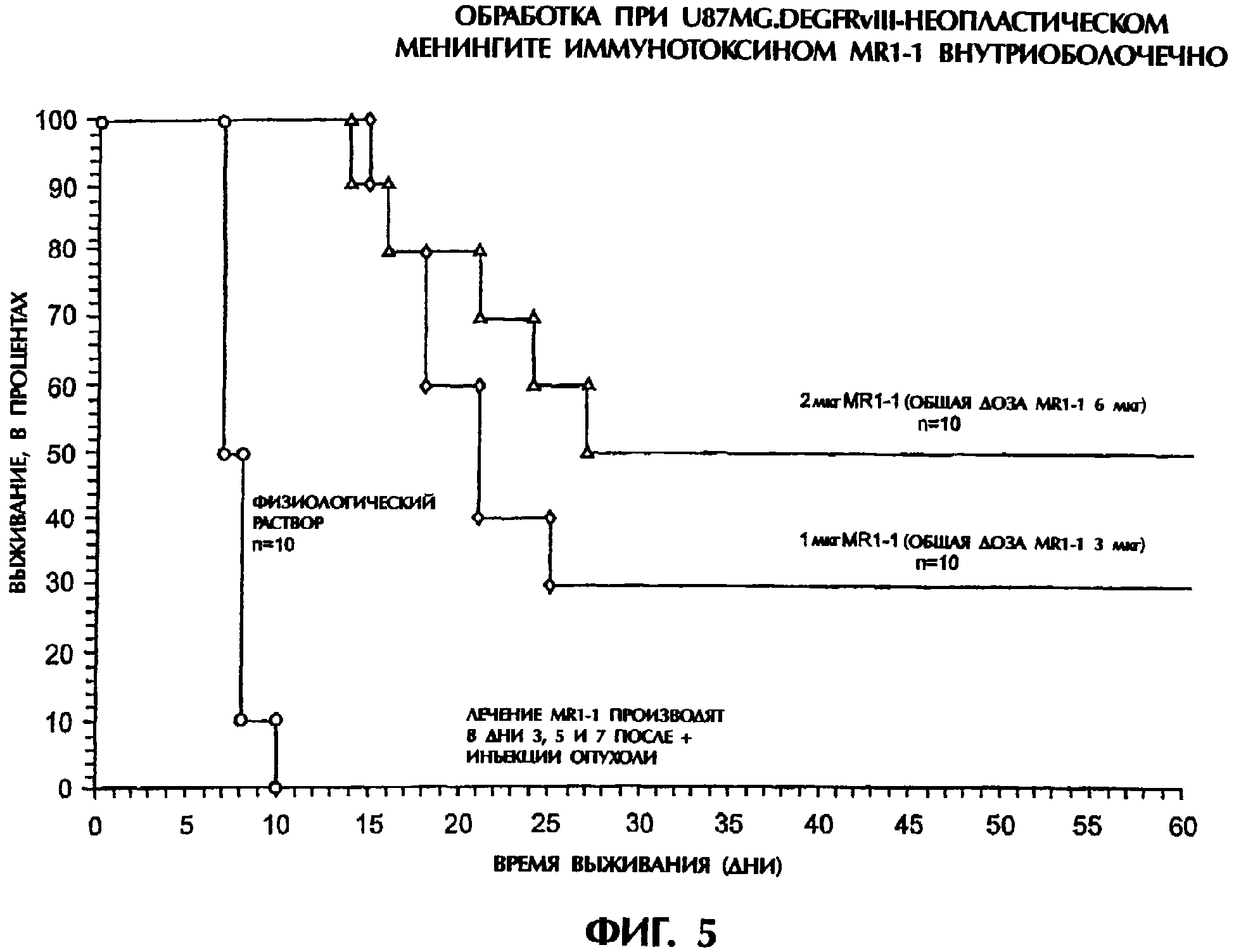
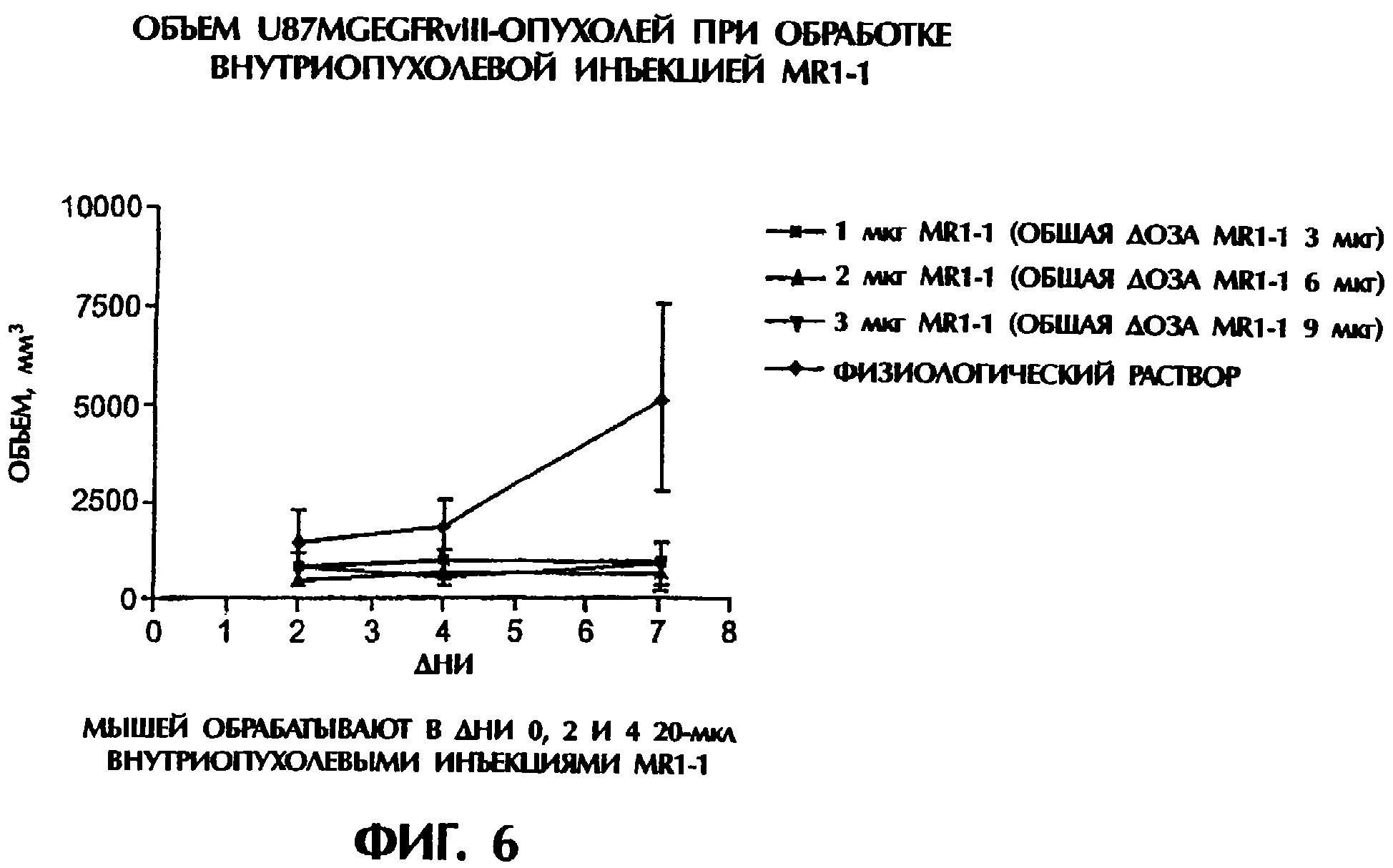





























































































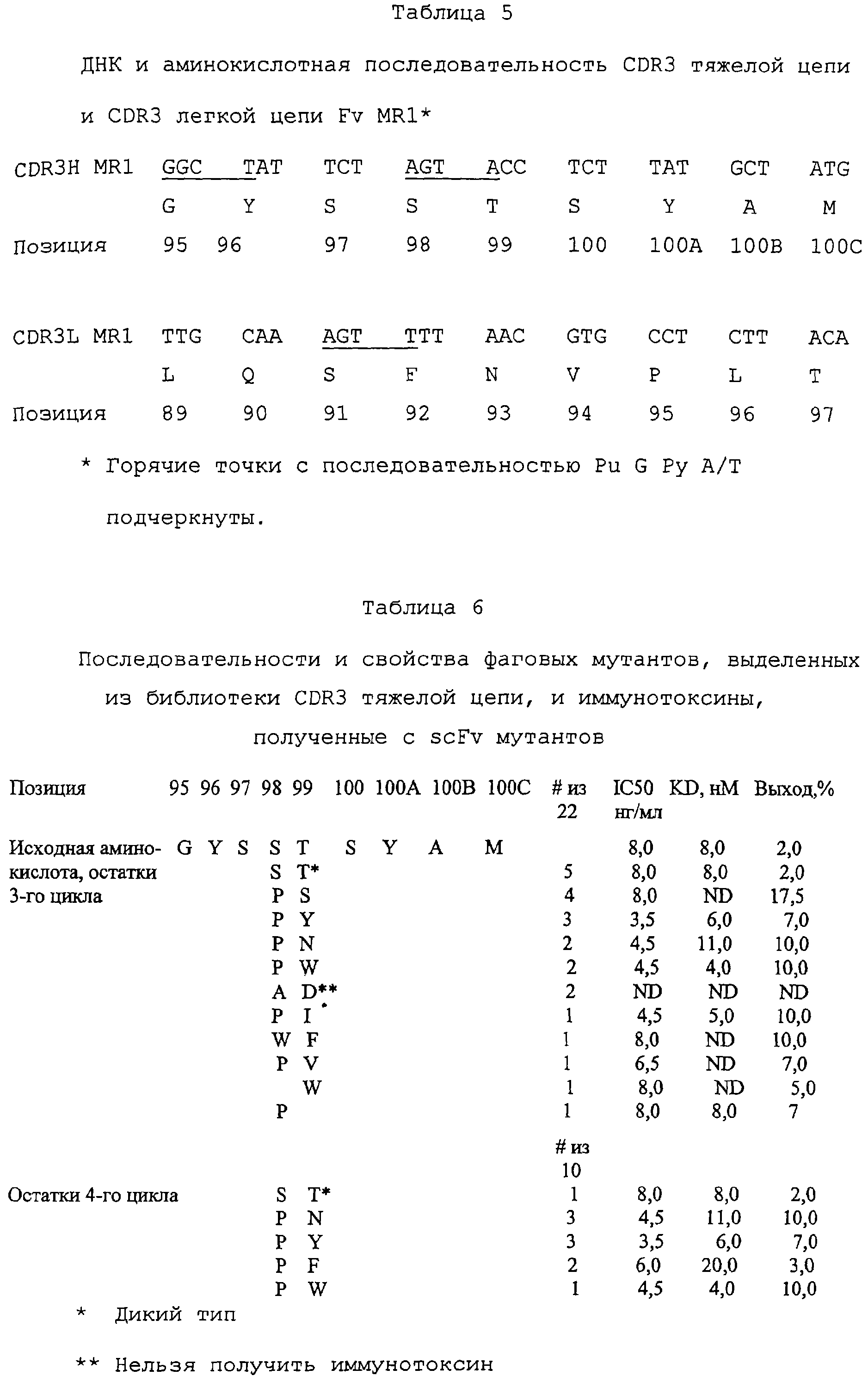
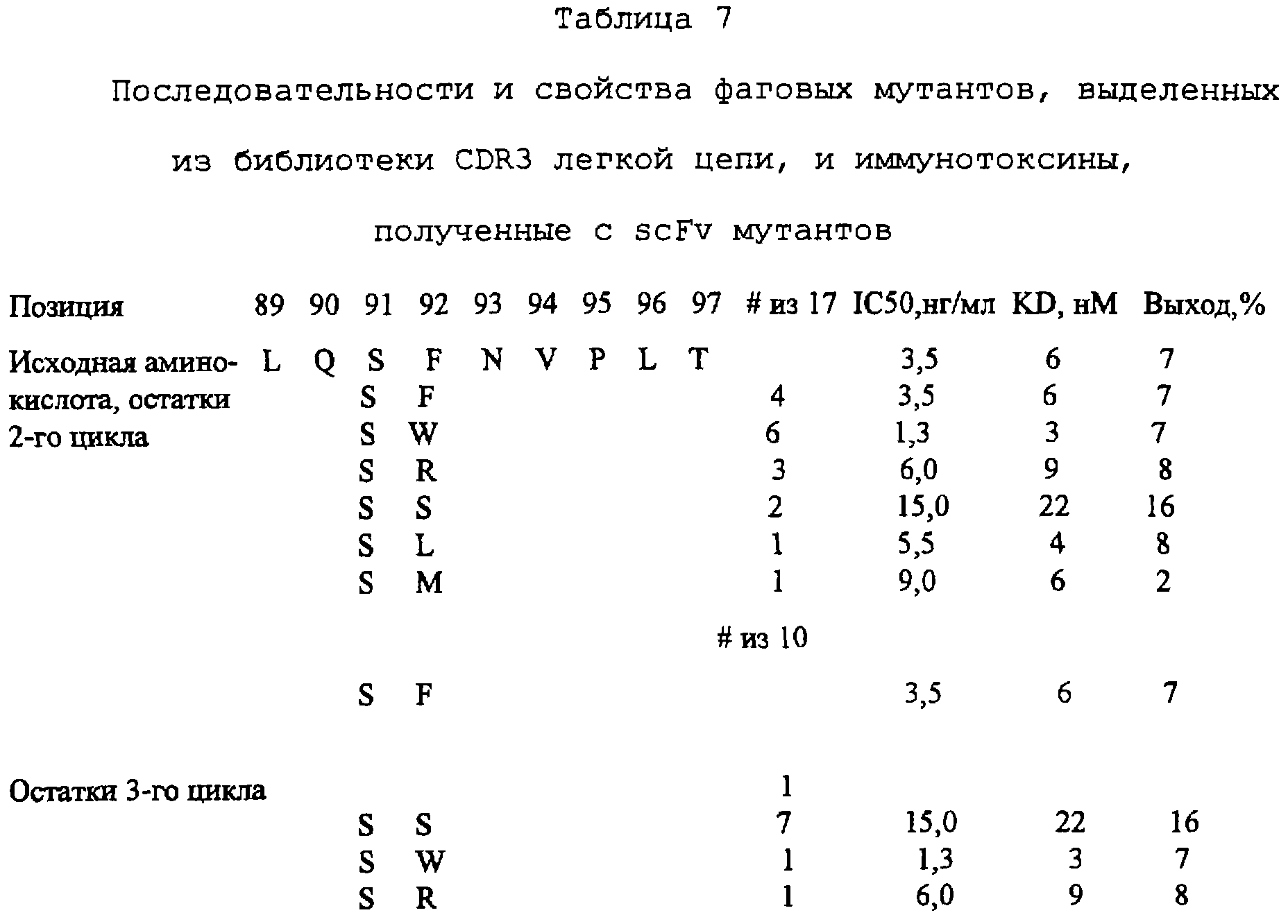

Комментарии