Иммуноконьюгат, способ получения иммуноконьюгата и фармацевтическая композиция - RU2129018C1
Код документа: RU2129018C1
Чертежи




Описание
Изобретение относится к новым слитым белкам, которые включают в себя опухолеассоциированный и направленный против клетки-мишени элемент, предпочтительно моноклональное антитело или его фрагмент, распознающие молекулу, экспрессирующуюся преимущественно на опухолевых клетках человека, например, такую, как рецептор эпидермального фактора роста (EGFR); и биологически активный лиганд, например, такой, как фактор роста и/или фактор дифференцировки. Полученный гибридный белок может быть использован для доставки биологически активного лиганда к специфическим клеткам-мишеням или тканям-мишеням. Новые иммуноконъюгаты могут быть использованы для лечения опухолевых заболеваний.
Для лечения раковых
заболеваний было разработано множество различных терапевтических методов. В последние годы были проведены клинические испытания с использованием моноклональных антител, которые обладают способностью к
специфическому или преимущественному распознаванию молекул клеточной поверхности, экспрессируемых на злокачественных клетках. Целью описанной методики является индукция антитело-зависимой клеточной
цитотоксичности (ADCC) или комплект опосредованной цитотоксичности (CDC) для удаления опухолевых клеток. Второй способ, разработанный за последнее время, заключается в цитокин-опосредованной активации
иммунного ответа. Такая цитокин-индуцированная противоопухолевая активность может быть опосредована:
1) прямым цитотоксическим/цитостатическим воздействием цитотоксина на рост опухоли%
2) "опухоль-антиген" - неспецифическими механизмами, такими, как LAK-активность, или моноцит/макрофаг-опосредованная цитотоксичность;
3) "опухоль-антиген" - специфическими иммунными
реакциями, опосредованными CD4 и CD8-положительными T-клетками. В этом случае системный иммунитет против опухолей наблюдался на моделях животных.
К сожалению, токсичность цитокинов таких, как ШД-2 или TNFα , не позволяет широко использовать их для системного введения (Rubin, Cancer Inverst., II, 460-172, 1990, Balkwill Nature 361: 206-207, 1993). Для обеспечения достаточной концентрации цитокинов в месте локализации опухоли их необходимо вводить в довольно высоких дозах, и эти дозы, как правило, превышают предельно допустимые дозы. Отсюда очевидно, что негативный эффект применения обусловлен, в основном, их системным введением; однако возможность использования цитокинов при лечении опухолей не вызывает сомнений. На моделях животных было проиллюстрировано, что присутствие in situ цитокина, обусловленное либо внутриопухолевой инъекцией, либо секрецией трансфецированных опухолевых клеток, может приводить к регрессии опухоли (Носок и др., PNAS, 90: 2774 - 2778, 1993; Colombo и др., Cancer Res. 52: 4853 - 4857, 1992; Mcbride и др., Cancer Res. 52: 3931 - 3937, 1992; Tepper и др., Science 287: 548 - 551, 1992; Mullen и др., Cancer Res. 52: 6020 - 6024, 1992; Blankenstein и др., J.Exp. Med. 173: 1047 - 1052, 1991; Gansdbacher и др. J.Exp Med. 172: 1217 - 1224, 1990). В этих системах цитокины не ослабляют опухолевую пролиферацию, но активируют и сильную антиопухолевую реакцию. Поэтому, физическая комбинация эффекторной молекулы и элемента, направленного против мишени, должна способствовать снижению периферического количества биологически активного лиганда и увеличению его количества внутри опухоли. Кроме того, эти молекулы могут быть также направлены на одиночные опухолевые клетки или микро-метастазы.
Указанный биологически активный лиганд, обеспечивающий антитело-направленную доставку конъюгата к клеткам-мишеням, должен индуцировать деструкцию клетки-мишени либо непосредственно, либо посредством создания условий, летальных для клетки-мишени. Таким биологически активным лигандом может быть цитокин, например, IL-1, LI-2, IL-4, IL-6, IL-7, IL-10, IL-13, IFN, TNFα, или CSF. Было показано, что эти цитокины обладают либо непосредственным противоопухолевым действием, либо способностью активировать защитные механизмы хозяина (Mire-Sluis TIBTECH 11:74-77, 1993; Colombo и др., Cancer Res. 52: 4853-4857, 1992; Thomas $ Balkwill, Pharmac Ther. 52:307.
Например, IL-2 является, как предполагают, центральным медиатором иммунного ответа. Было показано, что IL-2 стимулирует пролиферацию T-клеток и NK-клеток (природных киллеров), а также индуцирует лимфокин-активированные клетки-киллеры (LAK). IL-2 индуцируют пролиферацию T-лимфоцитов, вызывающих инфильтрацию опухоли. Кроме того, IL-2 усиливают цитотоксичность T-клеток и моноцитов. IL-2 индуцируют каскад цитокинов, секретируемых T-клетками, NK-клетками и моноцитами, что способствует дополнительному потенцированию иммунной реакции.
TNFα находит широкое применение в опухолевой терапии, главным образом, благодаря своей непосредственной цитотоксичности в отношении некоторых опухолевых клеток, и способностью индуцировать геморрагический регресс опухоли. Помимо этого, TNFα способствует усилению иммунного ответа, поскольку он является костимулирующим фактором пролиферации T-клеток, и индуцирует экспрессию антигенов ГКС класса I и класса II, а также секрецию TNFα , IFN и IL-1 макрофагами. IL-4 был первоначально описан как фактор роста B-клеток. В последующих исследованиях было показано, что IL-4 стимулирует антиген-специфические цитотоксические T-клетки, и оказывает специфическое воздействие на T-клетки, подобные LAK-клеткам, а не на NK-клетки, подобные LAK-клеткам. IL-4 ингибирует рост клеток меланомы человека и усиливает экспрессию их ГКС класса I и класса II. Факт индуцирования макрофаг-опосредованного противоопухолевого действия IL-4 остается пока спорным.
IL-7 представляет собой фактор роста пре-B-клеток, а также периферических CD4- и CD8-положительных T-клеток. IL-7 непосредственно увеличивает цитотоксичность CЭ8-положительной субпопуляции T-клеток. помимо этого, IL-7 способствует продуцированию IL-1, IL-6 и TNFα периферическими моноцитами. in vitro, противоопухолевая активность моноцитов/макрофагов может быть стимулирована вышеуказанным фактором IL-7, и возможно опосредована цитокинами, такими, как TNFα .
Эпидермальный фактор роста (EGF) представляет собой полипептидный гормон, который является митогенным для эпидермальных и эпителиальных клеток. При взаимодействии EGF с чувствительными клетками, он связывается с мембранными рецепторами (EGFP). EGFP представляет собой трансмембранный гликопротеин (около 170 кДа), и является генным продуктом c-evb-B протоонкогена.
Было обнаружено, что мышиное моноклональное антитело MAb 425, продуцируемое против клеточной линии карциномы А 431 человека (АТСС CPI 1555), связывается с эпитопом полипептида на внешнем домене EGFP. Как было установлено, это антитело ингибирует связывание EGF, опосредует in vitro - цитотоксичность по отношению к опухолям, и подавляет опухолевый рост in vitro клеточных линий, происходящих от эпидермальной и колоректальной карциномы (Rodeck и др. , 1987, Cancer Res. 47, 3692). Гуманизированные и химерные варианты MAb 425 описаны в WO 92/15683.
В литературе были описаны иммуноконъюгаты "антитело-цитокин" в различных комбинациях, предназначенных для направленной доставки активных белков к тканям-мишеням. Il-2 был объединен со специфическим антителом против карциномы человека L6 (Fell и др., 1991, J. Immunol. 146: 2446 - 2452, EP-OS-0439095), или с антителом против ганглиозида CD2 (Gillies и др., 1992, PN AS 89: 1428-1432, WO 92/08495). Были также генерированы иммуноконъюгаты, состоящие из антиданзилового антитела и IGFI, и обеспечивающие направленную доставку гормонов к тканям-мишеням (Shin & Morrison 1990, PNAS 87: 5322-5326, WO 91/14438).
Таким образом, целью настоящего изобретения является продуцирование антител или их фрагментов, содержащих (I) эпитоп, направленный против EGFP - антигена на поверхности опухолевой клетки, и (2) биологически активной лиганд, обладающий высокой степенью способности индуцировать цитотоксичность, и тем самым, интенсифицировать противоопухолевый эффект in situ.
Настоящее изобретение относится к иммуноконъюгатам, включающим в себя часть моноклонального антитела, или, по крайней мере, его сайт распознавания антигена, либо полное моноклональное антитело; и биологически активный лиганд. Конструкции, кодирующие указанные иммуноконъюгаты, получают с использованием техники рекомбинантных ДНК. Эти иммуноконъюгата содержат вариабельную область тяжелой цепи антитела и СР1-домен константой области (антитело-СР1-конъюгат), или CH1- и СР2-домены контактной области (антитело-CH2-конъюгат), или CH1-, CH2- или CH3-домены контактной области (антитело-CH3-конюъгат), связанные с биологически активным лигандом. Кроме того, могу быть генерированы иммуноконъгаты, которые содержат соответствующую легкую цепь, и которые направлены на антиген-несущие клетки и способны обеспечивать доставку активного лиганда к контрольному участку организма (фиг. 1 a-c).
С помощью имммуноконъюгатов настоящего изобретения могут быть обнаружены и подвергнуты успешному лечению такие опухоли, как меланома, глиома и карцинома.
В соответствии с этим, целью настоящего изобретения является получение иммуноконъюгата, состоящего из (I) моноклонального антитела или его фрагмента, направленного против опухолевой клетки, несущей антигенную детерминанту (эпитоп) рецептора эпидермального фактора роста (EGFR); и (2) биологически активный лиганд, предпочтительно, цитокин, который сцеплен с указанным антителом или его фрагментом, и обладает цитотоксической способностью специфически лизировать опухолевую клетку in situ, или индуцировать опухолеспецифический иммунный ответ.
В предпочтительном варианте осуществления настоящего изобретения, цитокины выбирают из TNFα , IL-2, IL-4 и IL-7.
В другом предпочтительном варианте осуществления настоящего изобретения, антитело или его фрагмент происходит от мышиного, гумманизированного или химерного MAb 425.
В еще одном предпочтительном варианте осуществления настоящего изобретения, иммуноконъюнгатами является MAb 425-CH1-INF, MAb 425-CH2-INF и MAb 425-CH3-INF, MAb 425-CH1-IL2 и MAb 425-CH2-IL2, MAb 425-CH3-IL-7, MAb 425-CH2-IL-7 и MAb 425-CH3-IL-7.
Кроме того, целью настоящего изобретения является разработка способа получения иммуноконъюгата, определенного выше и в нижеприведенной формуле изобретения, который осуществляют с использованием организма-хозяина, и который заключается в том, что: получают гибридную конструкцию, содержащую ДНК-последовательность, кодирующую антитело или его фрагмент, и биологически активный лиганд; полученную конструкцию вставляют в экспрессирующий вектор, которым трансформируют указанный хозяйский организм; хозяйские клетки культивируют в питательном растворе; и гибридный белок экспрессируют.
А предпочтительном варианте осуществления настоящего изобретения используется технология, в которой ДНК-последовательности, кодирующие антитело или его фрагмент, и биологически активный лиганд, сливают на одноцепочечной ДНК с использованием олигонуклеотида, комплеменатарного ДНК-последовательности нужной для слияния.
Кроме того, целью настоящего изобретения является получение фармацевтической композиции, содержащей по крайней мере один иммуноконъюгант, определенный выше и в формуле изобретения, и физиологически приемлемый носитель.
И наконец, еще одной целью настоящего изобретения является использование иммуноконъюгатов, определенных выше и в формуле изобретения, для изготовления противоопухолевого лекарственного средства.
Было обнаружено, что в случае использования иммуноконъюгатов "антитело-CH2" и "антилтело-CH3", например, таких, как МAb 425-CH2-TNFα и MAb 425-CH3-TNFα , наблюдается особенно высокая степень индукции клеточной цитотоксичности по сравнению с неконъюгированным TNFα . Этот факт, вероятно, обусловлен сочетанием связывающих свойств, индуцирования ACC (антитело-зависимой клеточной цитотоксичности) константными областями моноклонального антитела, и активности цитокинов.
Преимущество конъюгатов "антитело-CH1" настоящего изобретения заключается в небольшом размере из молекулы, а также в их способности экспрессироваться в прокариотах. Малый размер молекулы облегчает проникновение конъюгата в ткани (опухоль).
Кроме того, иммуноконъюгаты настоящего изобретения обнаруживают хорошую способность к связыванию и пролиферации по сравнению с моноклональным антителом (предпочтительно MAb 425) как таковым или его фрагментами.
Материалы и методы.
Моноклональные антитела.
MAb 425 представляет собой мышиное моноклональное антитело IoG1, продуцируемое против клеточной линии карциномы А431 человека (АТСС CPL 1555). MAb 425 связывается с полипептидным эпитопом внешнего домена EGF-рецептора человека и конкурирует за связывание с EGF. Было обнаружено, что MAb 425 опосредует опухолевую цитотоксичность in vitro, и подавляет in vitro рост клеток эпидермальной и колоректальной карциномы (Rodeck и др., 1987, Cancer Res 47:3692). Гуманизированные и химерные варианты MAb 425 были описаны в WO 92/15683.
Цитокины.
Цитокинкодирующие кДНК поставлялись от фирмы British Biotechnology Limited (Herrmann Biermann GMBH, Ban Nauheim FRG:
чел. IL -2 BBG30, чел. IL-4 BBG15, чел. IL-7 BBG
43, чел. TNF BBG 18). В коммерчески доступных кДРК отсутствует сигнальная последовательность, необходимая для выделения белка. Цитокин-кодирующие кДНК могут быть генерированы из мРНК, выделенной из
цитокин-продуцирующих клеток.
Векторы.
pUC19 является одним из серии родственных мультикопийных E.coli-плазмидных векторов клонирования и содержит части pBP322 и M13 mp19. pUC19 содержит индуцибельный lac-бактериальный промотор-оператор и расположенный за ним множественный клонирующий сайт (Yanisch-Perron и др., Gene 33: 103-109, 1985). Векторы pUC являются коммерчески доступными (например, New England Biolahs). Фазмидные векторы pBlue script KS/SK + и KS/SK - происходит от p C19. Эти векторы являются коммерчески доступными (Stratagene).
Эукариотический экспрессирующий вектор pHCM V (Gil Lies и др., 1983, Cell 33:717) содержит сайт инициации репликации обезьяньего вируса 40 (SV40) и область промотора и энхансера цитомегаловируса человека. Указанная область просмотра/энхансера расположена за сайтом мультиклонирования (mcs) для введения экспрессируемых генов. В этом векторе для генерирования гибридного белка с тяжелой цепью MAb 425 были объединены химерная форма вариабельной области тяжелой цепи m AB425 и области C γ Δ Sac 11, сцепленная с эффекторной молекулой в конце домена CH1, CH2 или CH3, соответственно. Гибридная цепь Ig может быть включена в иммуноконьюгат путем ее объединения с соответствующей легкой цепью, в результате чего образуется моновалентная область связывания с антигеном, которая может быть затем использована для продуцирования иммуноконьюгата, специфического для антигена-мишени (фиг. 1). Конструкция с тяжелой и легкой цепью могут быть введены в тот же самый или в разные векторы.
Вектор для экспрессии в прокариотах получают на основе вектора pSW1 (Ward и др., Nature 341:544-546, 1989), который происходит от вектора pUC19. pSW1 содержит последовательность, колирующую лидерный пептид бактериального peIB-гена от Erwinia carotovra (Lei и др., J. Bact 169: 4379 - 4383, 1987). Чужеродные ДНК могут быть введены с сохранением рамки считывания ниже лидерной последовательности peIB для регулирования экспрессии белка в периплазме.
Краткое описание чертежей и таблиц.
Таблица I. PCP-праймеры, используемые для генерирования MAb 425-цитокин-гибридных белков (зукариотическая экспрессия).
* Обратный праймер, гибридизирующийся с векторами (Stratagene) SR+/- и KS+/- (коммерческий продукт);
** Этот праймер
гибридизируется с константной областью CgL, включая уникальный Sac 11-сайт;
*** Обратный праймер, гибридизирующийся с векторами, происходящими из М13 (коммерческий продукт).
Таблица II. PCR-праймеры, используемые для генерирования MAb 425-цитокин-гибридных белков (прокариотическая экспрессия)
Фиг. 1. Модель иммуноконьюгатов "антитело-цитокин"
C = цитокин;
VH = вариабельная область тяжелой цепи; VL = вариабельная область легкой цепи; CH = константная область тяжелой цепи; CL = константная область легкой цепи. (а) конъюгат "антитело-CHI"; (b) конъюгат
"антитело-CH2"; (c) конъюгат "антитело-CH3".
Фиг. 2. Связывание иммуноконъюгатов с EGF-рецептором (EGFR) в EGFR- специфическом ELISA - анализе.
Супернатанты кратковременно трансфицированных клеток CO S-7 анализировали на содержание иммуноконъюгата. Вертикальная ось:% оптической плотности при 490 нм; горизонтальная ось: разведение супернатанта (log.2).
MAb 425 CHI-TNFα (заштрихованные (cilled) кружочки), MAb 425 CH2-TNFα (заштрихованные квадраты), MAb 425 CH3-TNFα (заштрихованные треугольники), MAb 425-контроль (заштрихованные ромбы); MAb 425 FAb-контроль (перевернутый заштрихованный треугольник); MAb 425 F(ab')2 в своей первоначальной форме (очищенный белок) (заштрихованный шестиугольник).
Фиг. 3А. IL-2-активность иммуноконъюгата "MAb 425-CHI-IL-2", экспрессированного в клетках COS-7.
Клетки CTLL-2 использовали в качестве индикаторной клеточной линии, пролиферативная активность серийно разведенного COS-супернатанта, содержащего MAb 425-CHI-II-2, показана на левой панели (заштрихованные кружки). В качестве контроля использовали COS-супернатант, содержащий MAb 425 Fab-контроль (незаштрихованные кружки). Пролиферативный ответ клеток CTLL-2 на активацию рекомбинантным коммерческим IL-2-белком или без IL-2 (KO) показан на правой панели.
Фиг. 3B. IL-2-активность иммуноконъюгата "MAb 425-CHI-IL-2", экспрессированного в E.coli.
Клетки CTLL-2 использовали в качестве индикаторной клеточной линии. Пролиферативная активность серийно разведенного иммуноконъюгата MAb 425-CHI-IL-2, экспрессированного в E.coli, и аффинноочищенного на идиотипической колонке против MAb 425, показана на левой панели (заштрихованные треугольники). В качестве контроля использовали COS-супернатант, содержащий MAb 425-CHI-IL-2 (зачерненные (closed)кружки). Буфер для диализа - зачерненные квадраты. Для того, чтобы убедиться, что буфер не влияет на IL-2-активность, буфер для диализа титровали в присутствии постоянной концентрации IL-2 (I ед. /мл) (заштрихованные перевернутые треугольники). Пролиферативный ответ клеток CTLL.2 на активно коммерчески рекомбинантным белкам с IL-2 или при отсутствии IL-2 (КО) показан на правой панели.
Фиг. 3C. Индуцирование TIL-пролиферация с помощью иммуноконъюгата MAb 425-CHI-IL-2.
Лимфоциты, вызывающие инфильтрацию меланомы, культивировали в отсутствии (КО) или в присутствии серийно разведенных COS-супернатантов, содержащих иммуноконъюгат 425-CHI-IL-2 (левая панель). Пролиферативный ответ TII на активацию рекомбинантным коммерческим IL-2 показан на правой панели.
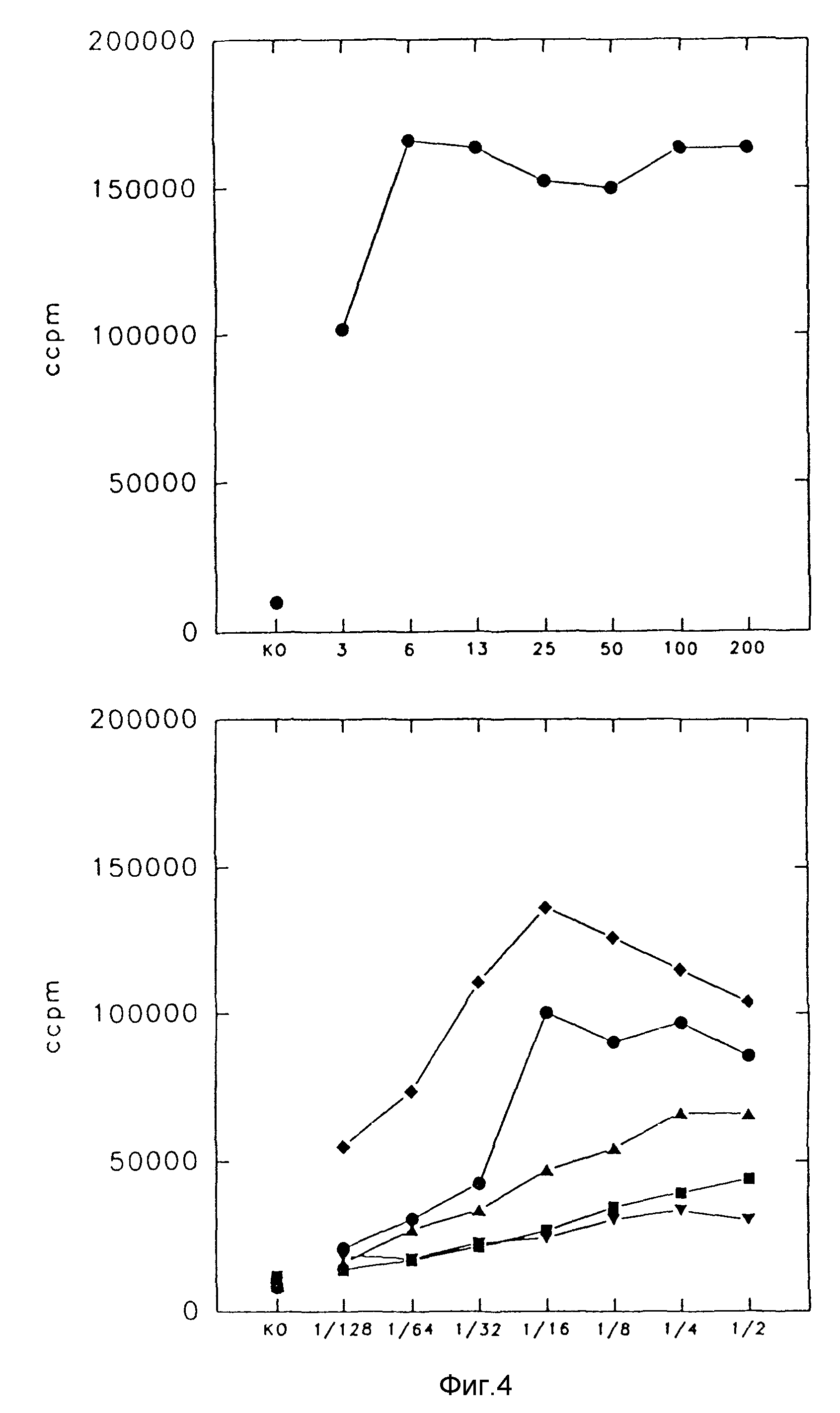
Фиг. 4. Индуцирование HPBL-пролиферации с помощью
иммуноконъюгата MAb 425-IL-4
PHA - активированные HPBL культивировали в присутствии серийно разведенных COS - супернатантов, содержащих MAb 425-CH2-IL-4 (зачерненные кружочки), MAb
425-CH3-IL-4 (зачерненные треугольники) - гибридные белки. Супернатанты, содержащие MAb 425 (зачерненные квадраты), IL -4 (зачерненный ромб), и векторный контроль (зачерненный перечеркнутый
треугольник), использовали в качестве контроля. Пролиферативный ответ HPBL на активацию рекомбинатным коммерческим IL-4 и при отсутствии фактора роста (КО) показан на правой панели.
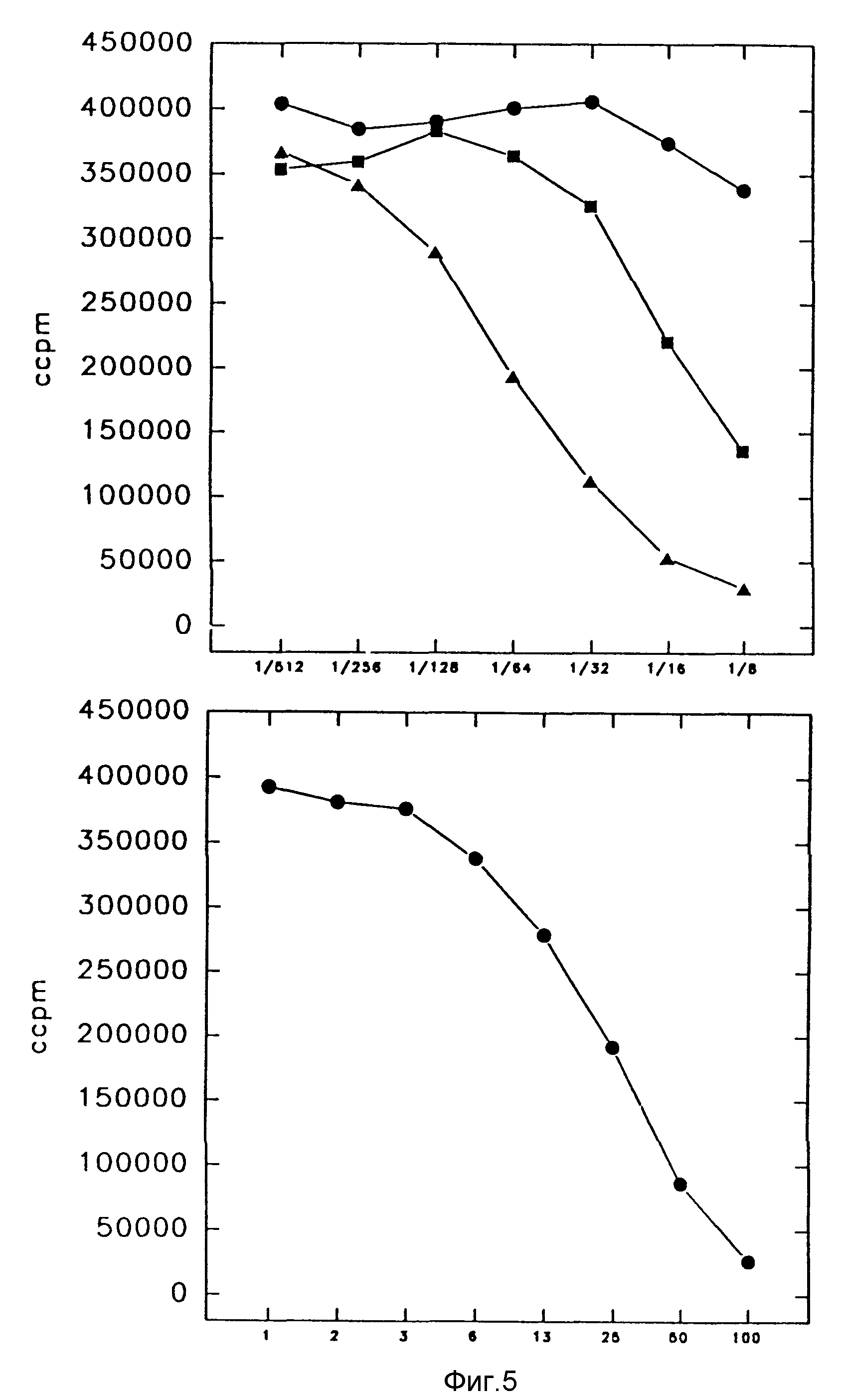
Фиг. 5. Цитотоксичность иммуноконъюгата MAb 425-TNFL по отношению к клеткам EHI 164
Клеточную линию TNFL-чувствительной мышиной фибросаркомы WEHI 164 культивировали 48 часов в присутствии
серийно разведенных COS-супернатантов (левая панель), содержащих 425-CHI-TNFα-иммуноконъюгат (заштрихованные квадраты) или 425-CH2-TNFα-иммуноконъюгат (заштрихованные треугольники), или
MAb 425Fab-контроль (заштрихованные кружки). Ингибирование роста индикаторных клеток, индуцированного коммерчески рекомбинантным TNFα-человека, проиллюстрировано на правой панели.
Фиг. 6. Цитолиз опухолевых клеток лимфоцитами периферической крови, опосредованной MAb 425 - TNFL-иммуноконъюгатом
Неактивированные лимфоциты периферической крови (PBMC)
использовали в качестве эффекторных клеток и культивировали вместе с аллогенными EGF-R-положительными51Cr-меченными клетками-мишенями C8161 в отношении эффектор/мишень = 30:1.
Процент специфического лизиса вычисляли после 18-часового совместного культивирования в отсутствие или в присутствии серийно разведенных COS-супернатантов, содержащих иммуноконъюгат MAb
425-CH3-TNFα (заштрихованные столбцы). Рекомбинатный TNFα (Genzym) был экспрессирован в E.coli как 36 кДа-димер (точечные столбцы).
Другие микроорганизмы, клеточные линии, плазмиды, промоторы маркеры резистентности, сайты инициации репликации, рестрикционные сайты или другие фрагменты векторов, которые упоминаются в настоящем описании, являются коммерчески доступными, либо они могут быть продуцированы стандартными методами. Если это не оговорено особо, то все указанные элементы могут быть использованы лишь в иллюстрированных целях, и в основном, не относятся к настоящему изобретению, причем, они могут быть заменены другими подходящими элементами и биологическими материалами, соответственно.
Способы, относящиеся к настоящему изобретению, подробно описаны ниже. Другие способы, которые являются стандартными и достаточно хорошо известными специалистам и которые упоминаются в настоящем описании, более подробно описываются в цитируемых работах, патентных заявках и в специальной литературе (см. , например, "Antibodies, A Laboratory Manual, Harlon, Lane, Cold Spring Harbor, 1988).
Экспрессия гибридных белков в эукариотических клетках.
Конструирование экспрессирующих векторов для эукариотической экспрессии Fab 425-цитокин-гибридного белка.
Слияние MAb 425 и цитокинов с использованием техники выпетливания.
Генерирование TNFα-конструкций.
Sac11/Xba1-фрагмент Sac11-cγ1- клона вставляли в вектор Bluescript SK+, содержащий цитокин-кодирующие последовательности, такие, как TNFα-кДНК.
TNFα-кДНК вводили между сайтами Smal и EcoRI. Эту конструкцию получали в виде одноцепочечной ДНК путем
добавления соответствующего фага-хелпера. Домен CH2 или CH3 сливали с сохранением рамки считывания к 5'-концу TNFα-колирующей последовательности. Олигонуклеотиды

являются гомологичными 3'-концу CH2-домена и CH3-домена, соответственно, и 5'-концу TNA α -кодирующей последовательности. Одноцепочечные ДНК-последовательности соединяли друг с другом посредством олигонуклеотида, а нежелательные последовательности, расположенные между ними, из конструкции удаляли. Олигонуклеотиды имели противоположную ориентацию, поскольку верхнюю цепь продуцировали как одноцепочечную ДНК.
К полученной ДНК достраивали вторую цепь с помощью секвеназы-полимеразы. Этот фермент не подвержен ошибкам, как ДНК-полимераза Amplitag, а поэтому была определена лишь ДНК-последовательность области соединения выделенных клонов. Клоны с правильной последовательностью были лигированы с последовательностями, необходимыми для генерирования полного 425-гибридного белка, и клонированы в вектор pHCMV для экспрессии в эукариотических клетках.
Генерирование IL-4-конструкций.
Для генерирования указанных конструкций, полный ΔSac11-cγ1-клон вставляли в Bluescript RS+ в качестве Kpnl/Sall
-фрагмента. IL-4 клонировали как Hind 111/EcoRL -фрагмент в тот же самый вектор. Генерирование гибрида осуществляли так же, как и для TNF-конструкций, но с использованием следующих
олигонуклеотидов:

для слияния с CH2- и CH3-доменом, соответственно.
Клоны с правильной последовательностью объединяли с последовательностями, необходимыми для генерирования полного mab 425-гибридного белка, и клонировали в вектор pHCM для экспрессии в эукариотических клетках.
Получение гибрида "MAb 425-цитокины" с помощью PCP-технологии.
ДНК-полимераза Amplitag подвержена ошибкам, и во избежании возможных ошибок, были определены последовательности вышеуказанных фрагментов, амплифицированных с помощью PCR-технологии. Праймеры, использованные в этих экспериментах, систематизированы в табл. 1.
Генерирование CHI-гибридных белков.
Плазмида pUH5 содержат последовательности фрагмента FAb 425 тяжелой цепи для прокариотической экспрессии и N-концевой pelB-лидерной последовательности, происходящей из Erwinia carotovora (Lei и др., J/Bact 169: 4379-4383, 1987), и обеспечивающей секрецию белка. Hind 111/Not1-фрагмент субклонировали в вектор Bluescript KS+. Цитокины IL-4 и IL-7 были амплифицированы с помощью PCP-технологии и введены в рестрикционные 5' Ncol и 3' Bam H1-сайты, соответственно. IL-2 и TNFα уже содержали 5' Hcol и 3' BamH1-сайты рестрикции. Все цитокины были клонированы в качестве Ncol/Bam H1 - фрагментов позади CHI-домена. В этих конструкциях, последовательности цитокинов были введены без сохранения рамки считывания. Поэтому, между Sall- и Ncol- сайтами рестрикции был введен адаптор (5'TGGACAAGAAAG 3'). В полученных конструкциях тяжелая цепь и цитокин были экспрессированы как гибридный белок с одной дополнительной аминокислотой (AIa), введенной последовательностью адаптора. Dra 111/BamH1-фрагменты были клонированы в экспрессирующий вектор pHCM, содержащий полный кДНК-клон тяжелой цепи MAb 425. В этой конструкции, pelB-лидерная последовательность была замена на лидерную последовательность кДНК тяжелой цепи MAb 425.
Генерирование CH2- и CH3-гибридных белков.
Sac11-cγ1-ДНК была амплифицирована с помощью PCR-технологии в двух отдельных реакциях с использованием CH2-3'-концевых праймеров, которые перекрывались (с сохранением рамки считывания) с 5'-концом соответствующего цитокина, такого, как IL-2 и IL-7. IL-2 и IL-7-кДНК-клоны были также амплифицированы с помощью PCR. Для облегчения субклонирования в SK+-вектор, а затем в экспрессирующий вектор pHCMV, в IL-2-конструкцию (у 3'-конца) были введены уникальные Not1- и Sa11-сайты, а в IL-7-конструкцию был введен уникальный Xot1-сайт. Генерирование гибрида IL-2- и IL-7-PCP-продуктов с полной Δ Sac11-cγ1-областью осуществляли путем PCR-рекомбинации. Полученный BamH1/Not1-фрагмент ΔSac11-cγ'-CH2-IL-2 субклонировали в SK+, содержащий вариабельную область тяжелой цепи MAb 425. Sac11/Xba1-фрагмент ΔSa11-CH-2-IL-7 субклонировали в вектор SK+, содержащий вариабельную область тяжелой цепи MAb 425 и Sac11-cγ1-область до Sa11-сайта. В результате этой процедуры были генерированы полные MAb425-CH2-IL-2- и IL-7-гибридные гены, соответственно. Аналогичным образом был генерирован полный MAb 425-CH3-IL-2-гибридный ген за тем лишь исключением, что ΔSa11-c γ1 был амплифицирован из уникального Sac11-сайта в качестве 5'-конца. Sac11/Pst/-фрагмент MAb 425-CH2-IL-2 в SK+, содержащем CH2-IL-2-гибрид, затем заменяли Sac11/Pst-фрагментом, содержащим CH3-IL-2-гибрид. После этого полные MAb 425-гибридные гены клонировали в вектор pHCMV для экспрессии в аукариотических клетках.
Экспрессия иммуноконъюгатов.
Введение векторных конструкций в хозяйские клетки для экспрессии моновалентного иммуноконъюгата, содержащего лишь CH1-домен, или дивалентных иммуноконъюгатов, содержащих CH2-и CH2- плюс CH3-домены, может быть осуществлено путем электропорации, методами с использованием DEAE-декстрана, кальцийфосфата, липофектина, или путем слияния протопластов. При этом, может быть использован любой тип клетки-хозяина, при условии, что рекомбинантные ДНК-последовательности, кодирующие иммуноконъюгат и соответствующую легкую цепь, правильно транскрибируются в мРНК в клетках этого типа. Такими клетками-хозяевами могут быть клетки мышиной миеломы, которые не продуцируют иммуноглобулин, например, Sp2/0-AG14 (ATCC CPL 1581), P3X63Ag8.653 (ATCC CPL 1580), или клетки хомячка, такие, как CHO-K1 (ATCC CCL 61), или CHO/dhF - (ATCC CPL 9096), или ВНК-21 (ATCC CCL 10). Для кратковременной экспрессии могут быть использованы COS-1 (ATCC CPL 1650) или COS-7 (ATCC CPL 1651).
Кратковременная экспрессия иммуноконъюгатов.
Экспрессирующий вектор pHCMV содержит сайт инициации репликации обезьяньего вируса 40 (SV 40). Клеточная линия COS-7 происходит от обезьяньей клеточной линии CV-1, которая была трансформирована вирусом SV40, не содержащим точки инициации репликации. Поэтому, для улучшения продуцирования иммуноконъюгатов, амплифицировали плазмиды, содержащие точку инициации репликации вируса SV40. Через 72 часа, супернатанты собирали и анализировали на связывание с EGF-рецептором и на концентрацию цитокина.
Постоянная экспрессия иммуноконъюгатов.
Векторы, содержащие рекомбинантные конструкции, и предназначенные для экспрессии иммуноконъюгатов, вводили в соответствующие клетки-хозяева. Конструкции, содержащие тяжелую и легкую цепи могут быть введены в тот же самый вектор или в разные векторы. В последнем случае оба вектора могут нести идентичные селективные маркеры, такие, как резистентность к неомицину, или dhFr, либо два различных селективных маркера для отбора на присутствие этих векторов. Отбор на dhFR-маркер может быть осуществлен лишь в dhFr-отрицательных клеточных линиях, таких, как CHO/dhFr. Клоны анализировали на экспрессию иммуноконъюгатов с помощью EGFP-специфического анализа ELISA. Отобранные клоны подвергали дополнительной очистке путем клонирования методом серийных разведений.
Конструирование векторов для экспрессии MAb 425-CH1-цитокин-гибридного белка в прокариотах.
ДНК-последовательности, кодирующие легкую цепь MAb 425 и Fd-фрагмент тяжелой цепи, вводили в сайт множественного клонирования вектора pSWl. Перед последовательностью, кодирующей зрелую легкую цепь, и последовательностью, кодирующей зрелую тяжелую цепь, находился лидерный пептид pelB-бактериального гена. Последовательность, кодирующая тяжелую цепь, содержала 3'Ncol-сайт. Цитокин-кодирующие кДНК были модифицированы посредством PCR для введения рестрикционных Ncol (5'-конец) и Not (3'-конец)-сайтов. Гены цитокина сливали с сохранением рамки считывания непосредственно с CH1-доменом тяжелой цепи. Праймеры, используемые в этих экспериментах. Систематизированы в таблице II.
Эти векторы способны к эффективной экспрессии функциональных FAb-цитоксин-гибридных белков в E.coli. Белок-гибрид, содержащий легкую и тяжелую цепь и цитокин, локализован на дицистронной мРНК, находящейся под контролем индуцибельного Iac-промотора (Skerra и Pluckthun Science 242: 1038 - 104, 1988). Поэтому, экспрессия FAb-гибридного белка может быть индуцирована в соответствии с требуемыми условиями культивирования. Трансляция обоих белков с дицистронной мРНК способствует синтезу равных количеств Fd-IL-2-гибридного белка и легкой цепи, повышая, тем самым, вероятность правильной сборки функциональных Fab-гибридных белков. Эти два полипептида выделяются в периплазму E. coli, где происходит укладка, образование дисульфидных связей и сборка функционального FAb 425 CH1-гибридного белка. При продолжительном культивировании бактерий, белки выделяются в культуральную среду.
Экспрессия MAb 425-CH1-IL-2-гибридного белка в E. coli и его очистка.
Штаммы E. coli, подходящие для экспрессии белка, трансформировали экспрессирующими плазмидами. Клетки культивировали до уровня оптической плотности ОП580 = 0,5, и индуцировали с использованием IPTG (1 мМ). Эти клетки культивировали в течение ночи, после чего супернатанты и клетки собирали. Супернатант наносили антиидиотипическую колонку против MAb 425. Эту колонку промывали забуференным фосфатом 0,5 м NaCl, и связанные белки элюировали 100 мМ глицина 0,5 М NaCl, pH 2,5. Элюат сразу нейтрализовали 2,5 М - Трисом, pH 8. Фракции, содержащие MAb 425-CH1-IL-2, объединяли, концентрировали и диализовали против PBS.
Связывающие свойства MAb 425-иммуноконъюгатов.
Способность MAb 425 к связыванию определяли с помощью EGF-рецептор-специфического ELISA-анализа. В общих чертах, эту процедуру проводили следующим образом: планшеты для микротитрования покрывали (4oC, в течение ночи) очищенным EGF-рецептором, и промывали для удаления несвязанного белка. Затем планшеты инкубировали с супернатантами, содержащими гибридный белок, или с супернатантами, содержащими неконъюгированные MAb, или Fab-фрагменты, или белки в очищенной форме. Планшеты промывали и инкубировали с козьими античеловечьими IgG и IgM (тяжелая и легкая цепь), конъюгированными с пероксидазой. Затем добавляли субстрат, и путем измерения при 450 нм (фиг. 2) определяли количество связанного EGFR-специфического белка. Концентрацию цитокина определяли с помощью коммерческого набора для ELISA, специфического для каждого цитокина, в соответствии с инструкциями изготовителей (данные не приводятся).
Пролиферация лейкоцитов.
Опухолеспецифические эффекторные клетки.
Одноядерные лейкоциты периферической крови и опухолеинфильтрующие лимфоциты (TIL), полученные от пациентов, страдающих меланомой, культивировали вместе с облученными (30Gy) аутологичными опухолевыми клетками в среде RPMI 1640 (1% пенициллин/стрептомицин, 1% глутамин, 20 мМ Hepes, 50 мМ β-меркаптоэтанола, 10% околоплодной сыворотки теленка, 20 ед./мл IL-2, 20 ед. /мл IL-4). Иммунореактивные клетки были слегка стимулированы аутологичными опухолевыми клетками.
Оценка пролиферации.
Цитокин-опосредованная пролиферация может быть определена с помощью:
(a)
соответствующих индикаторных клеточных линий. В случае IL-2, может быть использована IL-2-зависимая мышиная клеточная линия CTLL-2 (ATCC TIB 241) (фиг. 3A) или другие IL-2 зависимые клеточные линии;
(b) in vitro - развивающихся опухолеинфильтрующих лимфоцитов (фиг. 3B);
(c) свежевыделенных одноядерных клеток, предварительно обработанных РНА-М (Sigma). В этом случае, эксперимент
проводили с MAb 425-IL-4-гибридными белками (фиг. 4).
Свежевыделенные лейкоциты периферической крови человека, полученные от здоровых доноров или от пациентов с меланомой, либо TIL, полученные от пациентов с меланомой, культивировали in vitro (см. выше). Для оценки гибридных белков, лимфоциты культивировали в 96-луночных плоскодонных планшетах для микротитрования при плотности 1 • 105 клеток на лунку в конечном объеме 200 мкл. Затем клетки инкубировали с супернатантами, содержащими гибридный белок, или с супернатантами, содержащими неконъюгированные MAb, или с супернатантами, содержащими неконъюгированные цитокины, или белки в очищенной форме. Через 72 часа, клетки подвергали импульсному мечению с использованием 0,5 мкКи3H-тимидина. Введение радиоактивной метки определяли после ночного инкубирования путем β-счета подложки в жидком сцинтилляторе. Результаты выражали как среднее число импульсов в минуту.
Определение
цитотоксичности MAb 425-TNFα-иммуноконъюгатов
Определение TNFα-опосредованной цитотоксичности
Известно, что TNFα обладает прямой цитотоксичностью в отношении
некоторых клеток, включая, ряд опухолевых клеток. Непосредственное цитотоксическое действие TNFα может быть определено с использованием мышиных фибробластов L929 (ATCC CCL 1)/ или EH1 164 (ATCC
CPL 1751), или других TNFα-чувствительных клеточных линий, описанных в литературе (Flick & Gifford 1984, J. Immunol Meth 68 : 167). На фиг. 4 цитотоксическое действие MAb 425
CH1-TNFα и MAb 425 CH2-TNFα проиллюстрировано на клетках WEH1 164, используемых в качестве индикаторной клеточной линии.
Определение TNFα-индуцированной цитотоксичности.
В качестве клеток-мишеней для цитолиза, опосредованного аллогенными опухолеинфильтрующими лимфоцитами или свежевыделенными лимфоцитами периферической крови человека, полученными от пациентов с меланомой или от здоровых доноров, могут быть использованы EGF-рецептор-положительные клеточные линии, такие, как в высокой степени инвазивная и спонтанно метастатическая EGFR-положительная клеточная линия С8161 (Welch и др., 1991, Int. J. Cancer 47: 227, и работы, цитированные выше). Условия культивирования опухолевых клеток и TIL были описаны ранее (Shimizu и др., 1991, Cancer Res. 51: 6153).
In vitro - анализ на цитотоксичность осуществляли с использованием51Cr-меченных опухолевых клеток-мишеней. Эти клетки-мишени
подвергали мечению в течение 1 ч с использованием51Cr (100 мкКИ / 107 клеток), а затем промывали в три стадии для удаления избыточного51Cr.
После этого клетки-мишени (2 • 103 клеток на лунку) инкубировали вместе с эффекторными клетками в 96-луночных планшетах для микротитрования в присутствии супернатантов, содержащих
слитый белок, или супернатантов, содержащих неконъюгированные MAb, или супернатантов, содержащих неконъюгированные цитокины (контроль), или белков в очищенной форме. Супернатанты или очищенные белки
серийно разводили в культуральной среде и анализировали в трех дубликатах. Планшеты инкубировали в течение 4 ч при 37oC в атмосфере 10% CO2. Затем клетки удаляли путем
центрифугирования, а радиоактивность в супернатантах оценивали с помощью γ-счетчика. Процент специфического51Cr-высвобождения вычисляли по следующей формуле:

Терапевтическое использование иммуноконъюгатов.
Иммуноконъюгаты настоящего изобретения могут быть введен человеку для проведения терапии. Поэтому, целью настоящего изобретения является получение фармацевтических композиций, которые, в качестве активного ингредиента, содержат, по крайней мере, один слитый белок, определенный выше или в формуле изобретения, в сочетании с одним или несколькими фармацевтическими приемлемыми носителями, наполнителями или разбавителями.
Иммуноконъюгаты настоящего изобретения, в основном, вводят путем внутривенной инъекции или другими парентеральными способами. Дозы вводимых иммуноконъюгатов должны быть достаточными для получения желаемого эффекта подавления опухоли и лизиса опухолевых клеток. Диапазон вводимых доз зависит от возраста, состояния здоровья, пола и степени тяжести заболевания пациента, и может варьироваться от 0, 1 до 200,0 мг/кг, а предпочтительно от 0,1 до 100,0 мг/кг на одну или несколько доз в день, которые могут быть введены в течение одного или нескольких дней.
Препараты для парентерального введения могут быть изготовлены в виде стерильных водных или безводных растворов, суспензий и эмульсий. Примерами безводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие, как оливковое масло, инъецируемые органические сложные эфиры, такие, как этилолеат, и другие растворители, которые обычно используются специалистами в этих целях. Иммуноконъюгаты настоящего изобретения могут быть введены в композиции, содержащие физиологически приемлемый носитель. Примерами таких носителей являются физиологический раствор, PBS, раствор Рингера, или лактатсодержащий раствор Рингера. В указанных фармацевтических препаратах могут также присутствовать консерванты, и другие добавки, такие, как антибиотики, антиоксиданты, и хелатообразующие агенты.
Фармацевтические композиции настоящего изобретения могут быть использованы для лечения любых видов опухолей, включая меланомы, глиомы, и карциномы, а также опухоли крови и твердые опухоли.
Реферат
Изобретение относится к области биохимии, в частности к новым слитым белкам, и может быть использовано при лечении опухолевых заболеваний. Иммуноконьюгат представляет собой моноклональное антитело или его фрагмент, соединенный с биологически активным лигандом. Антитело или его фрагмент направлены против опухолевой клетки, несущей антигенный эпитон рецептора эпидермального фактора роста. В качестве биологически активного лиганда использован цитокин. Для получения иммуноконьюгата используют слияние ДНК-последовательности, кодирующей антитело или его фрагмент, и ДНК-последовательности, кодирующей биологически активный лиганд. Полученную конструкцию вводят в вектор экспрессии. Вектор экспрессии культивируют в хозяйских клетках. Изобретение может быть использовано для лечения любых видов опухолей. 3 с. и 10 з.п. ф-лы, 6 ил., 2 табл.


Комментарии