Антитела против il2 - RU2425054C2
Код документа: RU2425054C2
Чертежи





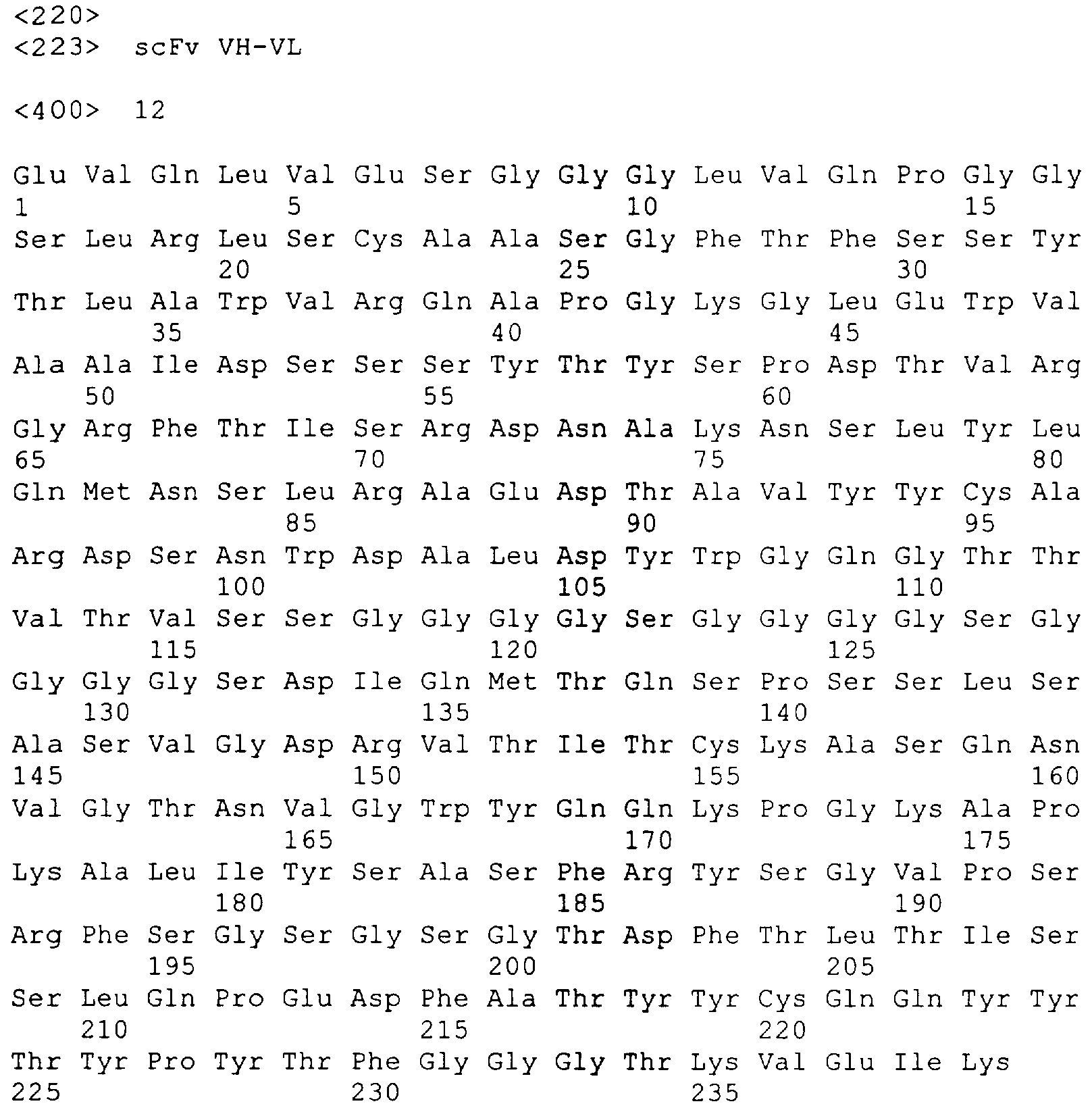
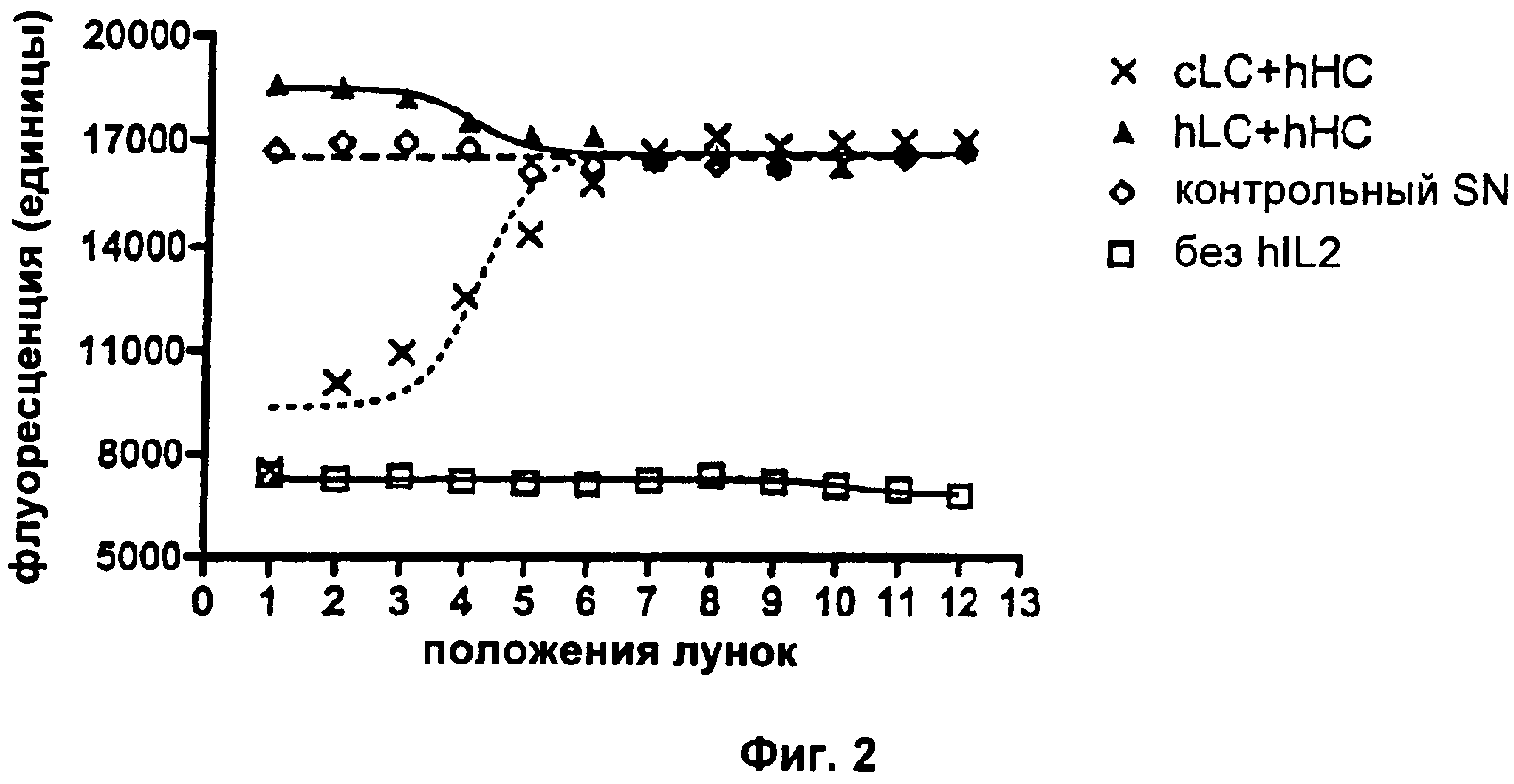







Описание
Данное изобретение относится к антителам и их фрагментам, которые специфически связываются с человеческим цитокином IL2 (интерлейкин 2). Данное изобретение дополнительно относится к полинуклеотидам, кодирующим такие антитела и их фрагменты, к фармацевтическим композициям, содержащим их, и к медицинским применениям, включающим такие антитела и их фрагменты.
Человеческий IL2 представляет собой белок из 133 аминокислот (15,4 кДа), который не имеет значительной гомологии последовательности с какими-либо другими факторами. IL2 синтезируется как белок-предшественник из 153 аминокислот с первыми 20 аминоконцевыми аминокислотами, функционирующими в качестве гидрофобной секреторной сигнальной последовательности. Данный белок содержит одну дисульфидную связь (связывающую положения Cys58/105), существенную для биологической активности.
Биологические активности IL2 опосредованы мембранным рецептором, который экспрессируется почти исключительно на активированных, но не находящихся в стадии покоя (Go), Т-клетках. Полный IL2-рецептор состоит из трех трансмембранных белковых субъединиц типа I: альфа, бета и гамма; функциональный рецептор с меньшей аффинностью может быть образован только бета- и гамма-рецепторными белками. В-клетки в стадии Go и мононуклеарные лейкоциты в стадии Go редко экспрессируют этот рецептор. Экспрессия IL2-рецeптора, в частности альфа-субъединицы, модулируется множеством факторов, например IL5, IL6 и фактором, индуцирующим L2R/p55.
Как мышиный, так и человеческий IL2 вызывают пролиферацию Т-клеток гомологичных видов с высокой эффективностью. Человеческий IL2 также является функциональным на мышиных клетках, но не наоборот. IL2 представляет собой фактор роста для всех субпопуляций Т-лимфоцитов. Он является фактором антиген-неспецифической пролиферации Т-клеток, который индуцирует прогрессию клеточного цикла в клетках в стадии Go, и, таким образом, обеспечивает клональное размножение активированных Т-лимфоцитов. IL2 также стимулирует пролиферацию и дифференцировку активированных В-клеток. Как и в случае с пролиферацией Т-клеток, эта активность также требует присутствия дополнительных факторов, например IL4.
Благодаря этим эффектам на Т-клетки и В-клетки IL2 представляет собой центральный регулятор иммунных ответов. Центральное значение IL2 в инициации и усилении адаптивных иммунных ответов хорошо проиллюстрировано клинической эффективностью лекарственных средств, которые чаще всего используются для подавления нежелательных иммунных ответов как, например, при отторжении трансплантатов. Иммуносупрессивные лекарственные средства циклоспорин А и FK506 (такролимус) ингибируют продукцию IL2 путем нарушения сигнализации через Т-клеточный рецептор, тогда как рапамицин (сиролимус) ингибирует сигнализацию через IL2-рецептор. Циклоспорин А и рапамицин действуют синергично для ограничения иммунных ответов путем предотвращения размножения клонов Т-клеток, запускаемого IL2. Однако все эти соединения нацелены на внутриклеточные сигнальные пути, которые препятствуют не исключительно IL, но также и другим факторам. Это подразумевает, что клиническое применение этих лекарственных средств включает значительный риск нежелательных побочных эффектов из-за их ограниченной специфичности к мишени.
В данной области также известны многочисленные примеры антител-ингибиторов активности IL2, например, имеющееся в продаже антитело даклизумаб (Zenapax®, Protein Design Lab, Inc.). Однако известные антитела-ингибиторы активности IL2 оказывают свой биологический эффект путем связывания с IL2-рецептором, а не с самим антигеном. Принимая во внимание важные клинические применения ингибиторов активности IL2, целью настоящего изобретения является предложение альтернативных специфических ингибиторов активности IL2.
Соответственно согласно одному аспекту данного изобретения предложено гуманизированное моноклональное антитело или его фрагмент, которые специфически связываются с человеческим интерлейкином-2 (IL2), где указанное гуманизированное моноклональное антитело нейтрализует активность человеческого IL2 путем связывания с указанным человеческим IL2 до, во время и/или после связывания указанного человеческого IL2 с человеческим IL2-рецептором, и где вариабельная область легкой цепи указанного гуманизированного моноклонального антитела содержит в своей второй каркасной области последовательность смежных аминокислот КАРКА, предпочтительно в аминокислотных положениях 42-46.
Термины "гуманизированное моноклональное антитело", или "гуманизированное антитело", или "гуманизированный иммуноглобулин", или их грамматически родственные варианты в том виде, как они здесь используются, применяются взаимозаменяемо в отношении молекулы, содержащей антиген-связывающий сайт, происходящий из одного или более чем одного иммуноглобулина, не являющегося человеческим, причем указанная молекула дополнительно содержит по меньшей мере часть, например, по меньшей мере одну из каркасных областей вариабельного домена легкой или тяжелой цепи, происходящую из одного или более чем одного человеческого иммуноглобулина или их последовательностей зародышевой линии. Термин "гуманизированное антитело" в том виде, как он здесь используется, включает гуманизированный вариабельный домен легкой цепи иммуноглобулина и гуманизированный вариабельный домен тяжелой цепи иммуноглобулина. Гуманизированное антитело может включать константную область, частично или полностью происходящую (включая синтетические аналоги) из одной или более чем одной последовательности человеческого гена. Ожидается, что гуманизированное антитело будет связываться с тем же самым антигеном-мишенью, что и донорное антитело, которое обеспечивает CDR. Типично, все сегменты или участки гуманизированного антитела или иммуноглобулина, за исключением CDR, являются по существу идентичными или по существу гомологичными соответствующим сегментам или участкам встречающихся в природе или консенсусных последовательностей человеческих иммуноглобулинов.
Вариабельная область легкой цепи (VL) указанного гуманизированного моноклонального антитела содержит в своей второй каркасной области последовательность смежных аминокислот КАРКА, предпочтительно в аминокислотных положениях 42-46. Эта предпочтительная нумерация последовательности, т.е. положения 42-46, относится к нумерации, как изложено в базе данных "VBase" (© MRC Centre for Protein Engineering), доступной по адресу в Интернете http://www.mrc-cpe.cam.ac.uk. Для ясности, выравнивания последовательностей каркасных VL-областей (таких как последовательности V-каппа и V-лямбда) и VH-областей зародышевой линии включены в настоящую заявку в том виде, как они находятся в Vbase (см. соответственно Фиг.7, 8 и 9; в частности, Фиг.8а и 9а в отношении нумерации вторых каркасных областей легких цепей в человеческих последовательностях V-каппа и V-лямбда зародышевой линии).
В то время как здесь приведена предпочтительная нумерация (т.е. положения аминокислот 42-46) аминокислотной последовательности КАРКА (т.е. Lys-Ala-Pro-Lys-Ala), для легкости корреляции с процитированной выше ссылкой следует понимать, что природа аминокислот в этой частичной последовательности, а не нумерация последовательности в ней и сама по себе последовательность, является определяющей для активности гуманизированного моноклонального антитела по изобретению. Как известно специалисту в данной области, существует множество способов нумерации последовательностей человеческих антител зародышевой линии, причем процитированная выше ссылка (VBase) представляет собой только один из них. Следовательно, частичной аминокислотной последовательности КАРКА, содержащейся во второй каркасной области некоторых вариабельных областей легкой цепи человеческой зародышевой линии, может быть приписана другая нумерация согласно иному способу нумерации, чем тот, который определен в приведенной выше ссылке. В таком случае частичная аминокислотная последовательность КАРКА несла бы нумерацию, отличную от положений предпочтительных аминокислот 42-46, тогда как последовательность, соответствующая предпочтительным аминокислотным положениям 42-46 при этом другом способе нумерации, вероятно, была бы аминокислотной последовательностью, отличной от КАРКА. В таком случае, как будет понятно специалисту в данной области, частичная аминокислотная последовательность с "правильной" последовательностью (КАРКА), но с отклоняющейся нумерацией (какой-либо другой, чем предпочтительные аминокислотные положения 42-46) должна рассматриваться как существенный отличительный признак данного изобретения, а не другая частичная аминокислотная последовательность, нумерация которой является "правильной" (предпочтительные аминокислотные положения 42-46), но природа которой является отличной от КАРКА.
Неожиданно обнаружили, что антитела или их фрагменты, не имеющие консенсусной последовательности КАРКА во второй каркасной области легкой цепи, в частности не имеющие в этом отрезке концевого остатка аланина, способны специфически связываться с IL2, но не способны нейтрализовать его активность. Это имеет место особенно, когда CDR-области, содержащиеся в вариабельных областях легкой и тяжелой цепей гуманизированного моноклонального антитела, являются такими, как представлено в SEQ ID NO 1-3 (соответственно для CDR 1-3 вариабельной области легкой цепи) и в SEQ ID NO 4-6 (соответственно для CDR 1-3 вариабельной области тяжелой цепи). Не будучи связанными теорией, авторы данного изобретения приписывают эту потерю нейтрализующей активности при исключении консенсусной последовательности КАРКА, в частности, при замещении концевого остатка аланина в этом отрезке другой аминокислотой, отличной от аланина, дестабилизации и/или конформационным перестройкам, оказывающим неблагоприятный эффект на нейтрализацию, но не на связывающую активность.
Термин "специфически связывает" или грамматически родственные выражения, такие как "специфическое связывание", "связывающий специфически", "специфический связыватель" и т.д. в том виде, как они здесь используются, относятся к способности гуманизированного моноклонального антитела или его фрагмента различать человеческий IL2 и любое количество других потенциальных антигенов, отличных от человеческого IL2, в такой степени, что из пула множества разных антигенов в качестве потенциальных партнеров связывания связывается или в значительной степени связывается только человеческий IL2. В пределах значения по данному изобретению человеческий IL2 "значительно" связывается, когда в пуле из множества в равной степени доступных разных антигенов в качестве потенциальных связывающих партнеров человеческий IL2 связывается по меньшей мере в 10 раз, предпочтительно в 50 раз, наиболее предпочтительно в 100 раз или чаще (в кинетическом смысле), чем другие антигены, отличные от человеческого IL2. Как понятно обычному специалисту в данной области, такие кинетические измерения можно провести, например, на установке Biacore.
Гуманизированное антитело или его фрагмент по данному изобретению является моноклональным. Термин "моноклональное" в том виде, как он здесь используется, следует понимать как имеющий значение, обычно приписываемое ему в данной области, а именно антитело, которое распознает один эпитоп на связанном антигене. Этим оно отличается от поликлонального антитела, которое представляет собой набор отличающихся антител, связывающихся с одним и тем же антигеном, хотя и с разными эпитопами на этом антигене. По этой причине одна молекула антигена может одновременно связываться многими молекулами поликлонального антитела, специфического к этому антигену, но только одной молекулой конкретного моноклонального антитела, специфического к этому антигену; после связывания одной молекулой моноклонального антитела связанный эпитоп блокируется и, следовательно, больше не является доступным для связывания другой молекулой идентичного моноклонального антитела. Моноклональная природа антитела делает его особенно подходящим для применения в качестве терапевтического агента, так как такое антитело будет существовать в виде одиночных гомогенных молекулярных частиц, которые можно хорошо охарактеризовать, воспроизводимо получить и очистить. Эти факторы приводят к получению продукта, биологическую активность которого можно предсказать с высоким уровнем точности, что является очень важным фактором, если для такой молекулы собираются получить одобрение регулирующего органа для терапевтического введения млекопитающим, в частности людям.
Термин "нейтрализация", "нейтрализатор", "проведение нейтрализации" и его грамматически родственные варианты в том виде, как он здесь используется, относится к частичному или полному ослаблению биологического(их) эффекта(ов) IL2. Такое частичное или полное ослабление биологического(их) эффекта(ов) IL2 происходит в результате модификации, прерывания и/или отмены IL2-опосредованной сигнальной трансдукции, что проявляется, например, во внутриклеточной сигнализации, клеточной пролиферации, высвобождении растворимых веществ, в повышающей или понижающей регуляции внутриклеточной активации генов, например, которая приводит к экспрессии поверхностных рецепторов для лигандов, отличных от IL2. Как понятно специалисту в данной области, существует множество способов определения того, следует ли агент, например рассматриваемое антитело или его фрагмент, классифицировать как нейтрализатор. Обычно это можно осуществить стандартным тестом in vitro, который обычно проводят следующим образом. В первом эксперименте по пролиферации клеточную линию, для которой известно, что уровень ее пролиферации зависит от активности IL2, инкубируют в серии образцов с варьирующими концентрациями IL2, после чего измеряют уровень пролиферации данной клеточной линии. Из этого измерения определяют концентрацию IL2, которая обеспечивала полумаксимальную пролиферацию клеток. Затем проводят второй эксперимент по пролиферации с использованием в каждой серии образцов того же количества клеток, которое используется в первом эксперименте по пролиферации, концентрации IL2, определенной выше, и, на этот раз, варьирующих концентраций антитела или его фрагмента, которое, как подозревают, является нейтрализатором IL2. Снова измеряют пролиферацию клеток для определения концентрации антитела или его фрагмента, достаточной для осуществления полумаксимального ингибирования роста. Если получающийся график ингибирования роста относительно концентрации антитела (или его фрагмента) имеет сигмоидную форму, тогда осуществлялась некоторая степень антитело-зависимого ингибирования роста, т.е. активность IL2 была в некоторой степени нейтрализована. В таком случае данное антитело или его фрагмент следует рассматривать как "нейтрализатор" в контексте настоящего изобретения. Одним примером клеточной линии, для которой известно, что уровень ее пролиферации зависит от активности IL2, является клеточная линия CTLL-2, имеющаяся в продаже от LGC Promochem. Другим примером подходящей клеточной линии является NK92 (DSMZ).
Неожиданно, гуманизированное моноклональное антитело по изобретению нейтрализует активность человеческого IL2 путем связывания с указанным человеческим IL2 до, во время и/или после связывания указанного человеческого IL2 с человеческим IL2-рецептором. Этот способ нейтрализации является весьма неожиданным. Традиционно антитело-опосредованная нейтрализация биологической активности лиганда, где указанная биологическая активность зависит от связывания указанного лиганда с рецептором, осуществляется путем предотвращения образования такого лиганд-рецепторного комплекса. Согласно этому классическому сценарию нейтрализации нейтрализующее антитело связывает лиганд или рецептор в участке на границе контакта лиганда и рецептора. Таким образом, присутствие антитела стерически и/или электростатически предотвращает образование лиганд-рецепторного комплекса: лиганд-рецепторный комплекс не образуется, и биологическая активность, обычно приписываемая связыванию лиганда с его рецептором, не осуществляется.
Способ нейтрализации, наблюдаемый для гуманизированного моноклонального антитела по данному изобретению, резко отличается от этого классического сценария тем, что отмена биологической активности, обычно приписываемой IL2, не зависит от предотвращения образования комплекса между IL2 и его рецептором. Это означает, что биологическая активность IL2 отменяется независимо от того, был ли IL2 уже связан с IL2-рецептором или нет, подразумевая, что эпитоп, распознаваемый гуманизированным моноклональным антителом по изобретению, не располагается на участке IL2, который взаимодействует с IL2-рецептором. Нейтрализация IL2, как таковая, может быть достигнута гуманизированным моноклональным антителом по изобретению несколькими способами.
Согласно первому способу данное антитело связывается с IL2 в растворе перед образованием комплекса между IL2 и его рецептором, так что IL2-опосредованная трансдукция сигнала не происходит в случае, когда IL2 связывается с его рецептором.
Согласно второму способу данное антитело связывается с IL2 одновременно с образованием комплекса IL2 с его рецептором. Здесь одновременное образование тройного комплекса рецептор-IL2-антитело снова не приводит к какой-либо или по меньшей мере к какой-либо значительной трансдукции сигнала.
Согласно третьему способу IL2 уже образовал комплекс с его рецептором, и антитело связывается с IL2, в то время как IL2 находится в комплексе с его рецептором на поверхности клетки, несущей IL2-рецептор. По этому третьему сценарию любая IL2-опосредованная трансдукция сигнала, уже имеющая место до связывания IL2 антителом, отменяется, как только связывается антитело.
Такая неклассическая нейтрализация, т.е. нейтрализация в том виде, как она осуществляется гуманизированным моноклональным антителом по изобретению, является весьма неожиданной и имеет несколько терапевтических преимуществ.
Во-первых, поскольку гуманизированное моноклональное антитело по изобретению распознает эпитоп IL2, который не принимает непосредственного участия в контакте с IL2-рецептором, между терапевтическим антителом, с одной стороны, и IL2-рецептором, с другой стороны, не возникает конкуренции. Эффект состоит в том, что пациенту можно вводить более низкие концентрации терапевтического антитела, чем было бы возможно в ином случае, если бы между антителом и IL2-рецептором существовала конкуренция за связывание одного и того же эпитопа. Это эффективно увеличивает терапевтическую эффективность гуманизированного моноклонального антитела по изобретению, так как можно уменьшить вводимую концентрацию (относительно той, которая требуется при условии классического способа нейтрализации) без потери биологического эффекта. Введение меньшего количества терапевтического агента является весьма желательным не только с точки зрения переносимости пациентом, но также и с экономической точки зрения, так как ценовое бремя данной терапии снижается или, с другой стороны, большее число пациентов может получить пользу от данного количества терапевтического антитела.
Во-вторых, как упомянуто выше, способность гуманизированного моноклонального антитела по изобретению связываться с IL2 и нейтрализовать его биологическую активность уже в комплексе с его рецептором имеет огромное преимущество в том, что уже происходящая IL2-опосредованная трансдукция сигнала может быть выключена без необходимости первоначальной диссоциации IL2 от его рецептор-связывающего партнера. Конечный эффект этого состоит в том, что желательная нейтрализующая биологическая активность гуманизированного моноклонального антитела по изобретению реализуется in vivo более быстро, чем это возможно для других "классических" антител-нейтрализаторов, которые сначала должны конкурировать с IL2-рецептором за связываемый эпитоп на IL2 перед тем, как вызвать какой-либо терапевтический эффект. Эта скорость действия может быть особенно полезной при острых сценариях, таких как иммунное отторжение трансплантатов органов, которое является известной областью для анти-IL2 терапии.
Третье преимущество такого нетипичного способа нейтрализации, как описано выше, относится к тому факту, что IL2-рецепторы локализуются на поверхности Т-клеток. Т-клетки сами продуцируют IL2 и также отвечают на IL2 пролиферацией, потенцируя тем самым свою собственную пролиферацию. При некоторых острых воспалительных реакциях, таких как отторжение ткани после операции по трансплантации, желательно не только снизить величину воспалительной реакции, приписываемой существующим Т-клеткам, но также уменьшить количество Т-клеток, генерирующих иммунный ответ. Гуманизированное моноклональное антитело по изобретению является особенно эффективным в достижении этой цели. Как было объяснено выше, биологическая активность IL2, уже связанного с его рецептором на поверхности Т-клетки, будет отменяться. Однако после такой отмены гуманизированное моноклональное антитело по изобретению обычно будет оставаться связанным с IL2 (который сам связан с IL2-рецептором) в течение некоторого периода времени, программируя, таким образом, Т-клетку на разрушение посредством антителозависимой клеточной цитотоксичности ("ADCC", antibody-dependent cellular cytotoxicity). При ADCC клетка-мишень, которая покрыта иммуноглобулином, убивается эффекторной клеткой с Fc-рецепторами, распознающими Fc-участок иммуноглобулина, покрывающего клетку-мишень. В большинстве случаев эффекторные клетки, участвующие в ADCC, представляют собой натуральные киллеры ("NK", natural killer), которые несут на своей поверхности, среди прочих, Fc-рецептор Fc-гамма-RIII. Таким образом, убиваются только клетки, покрытые иммуноглобулином, так что специфичность убийства клеток прямо коррелирует со специфичностью связывания антитела. Тогда в контексте настоящего изобретения Т-клетки, которые декорированы гуманизированным моноклональным антителом по изобретению через IL2 в комплексе с его рецептором, становятся клетками-мишенями в упомянутом выше смысле, которые затем лизируются, среди прочих, NK-клетками. Данный эффект является быстрым и эффективным ослаблением иммунного ответа, приписываемого клеткам, несущим IL2-рецепторы, таким как Т-клетки.
Согласно одному воплощению данного изобретения по меньшей мере одна из первой, третьей и/или четвертой области(ей) каркасной области легкой цепи, содержащейся в человеческом моноклональном антителе или его фрагменте, соответствует(ют) человеческой последовательности зародышевой линии для этой области/этих областей.
Согласно другому воплощению данного изобретения вариабельная область легкой цепи гуманизированного моноклонального антитела или его фрагмента по изобретению содержит в ее CDR1-области аминокислотную последовательность, представленную в SEQ ID NO:1. Согласно другому воплощению данного изобретения вариабельная область легкой цепи гуманизированного моноклонального антитела или его фрагмента по изобретению содержит в ее CDR2-области аминокислотную последовательность, представленную в SEQ ID NO:2. Согласно другому воплощению данного изобретения вариабельная область легкой цепи гуманизированного моноклонального антитела или его фрагмента по изобретению содержит в ее CDR3-области аминокислотную последовательность, представленную в SEQ ID NO:3.
Согласно другому воплощению данного изобретения вариабельная область легкой цепи гуманизированного моноклонального антитела или его фрагмента по изобретению дополнительно содержит в ее CDR1-области аминокислотную последовательность, представленную в SEQ ID NO:1, в ее CDR2-области - аминокислотную последовательность, представленную в SEQ ID NO:2, и в ее CDR3-области - аминокислотную последовательность, представленную в SEQ ID NO:3.
Согласно другому воплощению данного изобретения вариабельная область тяжелой цепи содержит в ее CDR1-области аминокислотную последовательность, представленную в SEQ ID NO:4. Согласно другому воплощению данного изобретения вариабельная область тяжелой цепи содержит в ее CDR2-области аминокислотную последовательность, представленную в SEQ ID NO:5. Согласно другому воплощению данного изобретения вариабельная область тяжелой цепи содержит в ее CDR3-области аминокислотную последовательность, представленную в SEQ ID NO:6.
Согласно другому воплощению данного изобретения вариабельная область тяжелой цепи содержит в ее CDR1-области аминокислотную последовательность, представленную в SEQ ID NO:4, в ее CDR2-области - аминокислотную последовательность, представленную в SEQ ID NO:5, и в ее CDR3-области - аминокислотную последовательность, представленную в SEQ ID NO:6.
Согласно другому воплощению данного изобретения вариабельная область легкой цепи гуманизированного моноклонального антитела или его фрагмента по изобретению дополнительно содержит в ее CDR1-области аминокислотную последовательность, представленную в SEQ ID NO:1, в ее CDR2-области - аминокислотную последовательность, представленную в SEQ ID NO:2, и в ее CDR3-области - аминокислотную последовательность, представленную в SEQ ID NO:3, и вариабельная область тяжелой цепи содержит в ее CDR1-области аминокислотную последовательность, представленную в SEQ ID NO:4, в ее CDR2-области - аминокислотную последовательность, представленную в SEQ ID NO:5, и в ее CDR3-области - аминокислотную последовательность, представленную в SEQ ID NO:6. Было обнаружено, что эти CDR-области являются особенно полезными при связывании с IL2 и нейтрализации биологического эффекта IL2 способом, описанным выше.
Согласно другому воплощению данного изобретения аминокислотная последовательность первой каркасной области легкой цепи, остальные аминокислотные последовательности второй каркасной области легкой цепи и аминокислотная последовательность третьей каркасной области легкой цепи соответствуют любой из последовательностей подгруппы VKI человеческой зародышевой линии в локусах O12, O2, O18, O8, А30, L1, L15, L4, L18, L5, L19, L8, L23, L9, L11 или L12; или подгруппы VL1 человеческой зародышевой линии в локусе 1а; или любой из последовательностей подгруппы VL2 человеческой зародышевой линии в локусах 2с, 2е, 2а2 или 2b2. В этом воплощении выражение "остальные аминокислотные последовательности второй каркасной области легкой цепи" относится к тем аминокислотам во второй каркасной области легкой цепи, которые отличаются от последовательности КАРКА. Таким образом, при использовании нумерации базы данных Vbase выражение "остальные аминокислотные последовательности второй каркасной области легкой цепи" означает аминокислоты в положениях второй каркасной области легкой цепи 35-41 и 47-49 включительно, независимо от того, является ли каркасная область этой легкой цепи V-каппа или V-лямбда каркасной областью (см. Фиг.7а и 8а в отношении нумерации последовательностей человеческой зародышевой линии, относящихся соответственно к каркасной области V-каппа и V-лямбда). Предпочтительным в этом воплощении является дополнительное включение в четвертую каркасную область легкой цепи последовательности, соответствующей последовательности, обнаруженной в последовательности JK4 человеческой зародышевой линии, в частности FGGGTKVEIK.
Другие аминокислотные последовательности, подходящие для применения в качестве четвертой каркасной области легкой цепи, включают, но не ограничиваются FGQGTKVEIK, FGQGTKLEIK, FGPGTKVDIK, FGQGTRLEIK, FGTGTKVTVL, FGGGTKLTVL и FGGGTQLTVL.
Согласно другому воплощению по меньшей мере одна из первой, второй и/или третьей каркасной области(ей) тяжелой цепи, содержащейся в человеческом моноклональном антителе или его фрагменте, соответствует последовательности этой области/этих областей в человеческой зародышевой линии.
Согласно другому воплощению аминокислотная последовательность первой каркасной области тяжелой цепи, аминокислотная последовательность второй каркасной области тяжелой цепи и аминокислотная последовательность третьей каркасной области тяжелой цепи соответствует любой из последовательностей подгруппы VH3 человеческой зародышевой линии, в частности в локусе 3-07, где аминокислотная последовательность первой каркасной области тяжелой цепи представляет собой EVQLVESGGGLVQPGGSLRLSCAASGFTFS, аминокислотная последовательность второй каркасной области тяжелой цепи представляет собой WVRQAPGKGLEWVA, и аминокислотная последовательность третьей каркасной области тяжелой цепи представляет собой RFTISRDNAKNSLYLQMNSLRAEDTAVYYCAR. Предпочтительно можно выбрать аминокислотную последовательность четвертой каркасной области тяжелой цепи, например, в комбинации с тремя каркасными последовательностями, процитированными выше, в локусе 3-07 зародышевой линии из одной из следующих последовательностей: WGQGTLVTVSS, WGRGTLVTVSS, WGQGTMVTVSS, WGQGTLVTVSS, WGQGTLVTVSS и WGQGTTVTVSS.
В предпочтительном воплощении гуманизированное моноклональное антитело или его фрагмент содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность, представленную в SEQ ID NO:7 и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, представленную в SEQ ID NO:8. Особенно предпочтительным является гуманизированное моноклональное антитело, которое содержит легкую цепь, содержащую аминокислотную последовательность, представленную в SEQ ID NO:9, и тяжелую цепь, содержащую аминокислотную последовательность, представленную в SEQ ID NO:10. Далее гуманизированное антитело IgG1 против IL1, содержащее SEQ ID NO 9 и 10 и/или SEQ ID NO 7 и 8, будет именоваться "Aнтн-IL2".
Данное гуманизированное моноклональное антитело может находиться в форме антитела IgG, в частности антитела IgG1 или IgG4. Как хорошо известно в данной области, IgG содержит не только вариабельные области антитела, ответственные за высокоизбирательное распознавание и связывание антигена, но также и константные области тяжелой и легкой полипептидных цепей антитела, обычно присутствующие в эндогенно продуцируемых антителах, и, в некоторых случаях, даже декорирование в одном или более чем одном сайте углеводами, причем такое гликозилирование обычно присутствует на Fc-участке IgG. Известно, что эти Fc-участки вызывают разные эффекторные функции in vivo, такие как ADCC и комплемент-зависимую цитотоксичность ("CDC"). Механизм ADCC описан здесь выше. При CDC два идентичных иммуноглобулина связываются с двумя идентичными антигенами (например, в данном случае с IL2 на Т-клетке) на поверхности клетки-мишени, так что их соответствующие Fc-участки находятся очень близко друг к другу. Этот сценарий вовлекает белки комплемента, среди них белки комплемента, например C1q, С3, С4 и С9, последний из которых создает пору в клетке-мишени. Клетка-мишень погибает в результате этой перфорации. В то же время клетка(и)-мишень(и) также станови(я)тся декорированными в других участках на ее/их поверхности(ях). Это декорирование вовлекает эффекторные клетки, которые затем убивают клетку(и)-мишень(и) способом, аналогичным способу, описанному выше в контексте механизма ADCC (см., например, Gelderman et al. (2004), Trends Immunology 25, 158-64).
Предпочтительно антитело IgG представляет собой антитело IgG1 или антитело IgG4, форматы, которые являются предпочтительными, так как их механизм действия in vivo является особенно хорошо понятым и охарактеризованным. Это особенно верно для антител IgG1.
Согласно другому воплощению данного изобретения фрагмент гуманизированного моноклонального антитела может представлять собой scFv, однодоменное антитело, Fv, диатело, тандемное диатело, Fab, Fab′ или F(ab)2. Эти форматы обычно можно подразделить на два подкласса, а именно на подкласс форматов, которые состоят из одной полипептидной цепи, и на подкласс форматов, которые содержат по меньшей мере две полипептидные цепи. Члены первого подкласса включают scFv (включающий одну VH-область и одну VL-область, соединенные в одну полипептидную цепь посредством полипептидного линкера); и однодоменное антитело (включающее один вариабельный домен антитела, который специфически связывает человеческий IL2). Члены последнего подкласса включают Fv (включающий одну VH-область и одну VL-область в виде отдельных полипептидных цепей, которые нековалентно связаны друг с другом); диатело (включающее две нековалентно связанные полипептидные цепи, каждая из которых содержит две вариабельные области антитела - обычно одну VH и одну VL на полипептидную цепь - и организованные так, что при нековалентной связи VH на одной полипептидной цепи с VL на соответствующей другой полипептидной цепи и наоборот образуется молекула двухвалентного антитела); тандемное диатело (биспецифические одноцепочечные Fv-антитела, содержащие четыре ковалентно связанные вариабельные иммуноглобулиновые VH- и VL-области двух разных специфичностей, образующие гомодимер, который в два раза больше, чем диатело, описанное выше); Fab (содержащий в качестве одной полипептидной цепи целую легкую цепь антитела, которая сама по себе содержит VL-область, и целую константную область легкой цепи и в качестве другой полипептидной цепи часть тяжелой цепи антитела, содержащую целую VH-область, и часть константной области тяжелой цепи, причем две указанные полипептидные цепи связаны между собой посредством межцепьевой дисульфидной связи); Fab' (такой же, как и Fab, описанный выше, за исключением того, что на тяжелой цепи антитела содержатся дополнительные восстановленные дисульфидные связи); и F(ab)2 (содержащий две молекулы Fab', причем каждая молекула Fab' связана с соответствующей другой молекулой Fab' посредством межцепочечных дисульфидных связей). В общем, фрагменты антитела описанных здесь выше типов обеспечивают большую гибкость в формировании, например, фармакокинетических свойств антитела, желательного для терапевтического введения, в соответствии с конкретными имеющимися запросами. Например, может быть желательным уменьшение размера введенного антитела для того, чтобы увеличить степень проникновения в ткань при лечении тканей, для которых известно, что они являются слабо васкуляризованными (например, суставы). В некоторых обстоятельствах также может быть желательным увелические скорости, с которой терапевтическое антитело устраняется из организма, причем указанная скорость обычно ускоряется путем уменьшения размера вводимого антитела.
Согласно другому воплощению данного изобретения гуманизированное моноклональное антитело может присутствовать в одновалентной моноспецифической или многовалентной моно- или мультиспецифической, в частности, в двухвалентной моно- или биспецифической формах. В общем, многовалентное моноспецифическое, в частности двухвалентное моноспецифическое антитело, может давать терапевтическое преимущество в том, что нейтрализация, осуществляемая таким антителом, усиливается эффектами авидности, т.е. связыванием многих молекул одного и того же антигена, здесь человеческого IL2, одним и тем же антителом. Несколько одновалентных моноспецифических форм антитела по изобретению было описано выше (например scFv, Fv или однодоменное антитело). Многовалентные мультиспецифические, в частности двухвалентные, биспецифические формы гуманизированного моноклонального антитела против человеческого IL2 по изобретению могут включать целый IgG, в котором один связывающий домен связывается с человеческим IL2, тогда как другой связывающий домен связывается с другим антигеном, отличным от человеческого IL2. Другой многовалентной мультиспецифичной, в частности двухвалентной, биспецифической формой преимущественно может быть гуманизированное одноцепочечное биспецифическое антитело, т.е. конструкция рекомбинантного гуманизированного антитела, содержащая две структуры scFv, как описано выше, соединенные в одну непрерывную полипептидную цепь коротким полипептидным спейсером между двумя указанными структурами scFv, как известно в данной области. Здесь один scFv-участок биспецифического одноцепочечного антитела, содержащийся в данном биспецифическом одноцепочечном антителе, будет специфически связывать человеческий IL2, как изложено выше, тогда как другой соответствующий scFv-участок этого биспецифического одноцепочечного антитела будет связывать другой антиген, для которого определено, что он будет иметь терапевтическую пользу.
Согласно другому воплощению из гуманизированного моноклонального антитела или его фрагмента может быть получено производное, например, с органическим полимером, например с одной или более чем одной молекулой полиэтиленгликоля ("ПЭГ"). Как известно в данной области, такое получение производных может быть полезным при модуляции фармакодинамических свойств антител или их фрагментов.
scFv является особенно предпочтительным (одновалентным моноспецифическим) фрагментом антитела, особенно scFv, содержащий аминокислотную последовательность, представленную в SEQ ID NO:11 или SEQ ID NO:12.
Согласно другому аспекту данного изобретения предложено человеческое моноклональное антитело или его фрагмент, содержащие аминокислотную последовательность, имеющую по меньшей мере 70%-ную гомологию, предпочтительно по меньшей мере 80, 90 или даже более чем по меньшей мере 95%-ную гомологию с аминокислотной последовательностью, представленной в любой из SEQ ID NO:1-12. Гомологию можно определить стандартными программами выравнивания последовательностей, такими как Vector NTI (InforMax™, Maryland, США). Такие программы сравнивают выровненные последовательности по принципу аминокислота за аминокислотой, и в них можно установить различные уровни строгости для сравнения (например, идентичная аминокислота, консервативная аминокислотная замена и пр.). В том виде, как здесь используется данный термин, две рассматриваемые аминокислоты считаются "консервативной заменой" друг друга, если они принадлежат к одной и той же основной группе. В качестве неограничивающего примера две разные аминокислоты, принадлежащие к группе неполярных аминокислот, рассматривались бы "консервативной заменой" друг друга, даже если бы эти две аминокислоты не были бы идентичными, тогда как неполярная аминокислота, с одной стороны, и основная аминокислота, с другой стороны, не рассматривались бы "консервативной заменой" друг друга. Панель 3.1 "Molecular Biology of the Cell", 4th Edition (2002), by Alberts, Johnson, Lewis, Raff, Roberts and Walter делит аминокислоты на четыре главные группы: кислые, неполярные, незаряженные полярные и основные. Такое группирование может быть использовано для определения, для целей настоящего изобретения, является ли конкретная аминокислота "консервативной заменой" другой рассматриваемой аминокислоты.
Согласно другому аспекту данного изобретения предложена полинуклеотидная молекула. Эта полинуклеотидная молекула содержит нуклеотидную последовательность, кодирующую аминокислотную последовательность, представленную в любой из SEQ ID NO:1-12, или нуклеотидную последовательность, демонстрирующую по меньшей мере 60%-ную, предпочтительно 65, 70, 75, 80, 85, 90 или 95%-ную гомологию с указанной нуклеотидной последовательностью. Здесь гомология может быть определена путем сравнения полинуклеотидной молекулы, содержащей нуклеотидную последовательность, кодирующую аминокислотную последовательность любой из SEQ ID NO:1-12, с полинуклеотидной молекулой, имеющей рассматриваемую нуклеотидную последовательность ("тестируемую последовательность"), путем выравнивания последовательностей, и где нуклеотид в тестируемой последовательности считается гомологичным, если он либо идентичен соответствующему нуклеотиду в нуклеотидной последовательности, кодирующей соответствующую аминокислотную последовательность любой из SEQ ID NO:1-12, или если одно или более чем одно нуклеотидное отклонение в тестируемой последовательности от соответствующего(их) нуклеотида(ов) в нуклеотидной последовательности, кодирующей аминокислотную последовательность любой из SEQ ID NO:1-12, приводит к образованию триплета нуклеотидов, который при трансляции дает аминокислоту, которая является либо идентичной (из-за вырожденного триплета) соответствующей аминокислоте в соответствующей аминокислотной последовательности любой из SEQ ID NO:1-12, либо ее консервативной заменой. Здесь термин "консервативная замена" следует понимать, как описано выше.
Согласно другому аспекту данного изобретения предложена фармацевтическая композиция, содержащая гуманизированное моноклональное антитело или его фрагмент, или полинуклеотидную молекулу, имеющую нуклеотидную последовательность, кодирующую аминокислотную последовательность, представленную в любой из SEQ ID NO:1-12, или кодирующую аминокислотную последовательность, содержащую аминокислотную последовательность, имеющую по меньшей мере 70%-ную гомологию с любой из SEQ ID NO:1-12, где "гомологию" следует понимать, как объяснено здесь выше.
Согласно этому изобретению термин "фармацевтическая композиция" относится к композиции для введения пациенту, являющемуся млекопитающим, преимущественно пациенту, являющемуся человеком. В предпочтительном воплощении данная фармацевтическая композиция содержит композицию для парентеральной инъекции или инфузии. Такая парентеральная инъекция или инфузия может использовать преимущество процесса ресорбции в форме, например, внутрикожной, подкожной, внутримышечной и/или внутрибрюшинной инъекции или инфузии. В качестве альтернативы такая парентеральная инъекция или инфузия может обойти процессы ресорбции и быть в форме, например, внутрисердечной, внутриартериальной, внутривенной, внутрипоясничной и/или внутричерепной инъекции или инфузии. В другом предпочтительном воплощении данная фармацевтическая композиция содержит композицию для введения через кожу. Одним примером введения через кожу является накожное введение, при котором фармацевтическую композицию наносят, например, в виде раствора, суспензии, эмульсии, пены, втирания, мази, пасты и/или пластыря на кожу. В качестве альтернативы введение фармацевтической композиции можно осуществлять через одну или более чем одну слизистую оболочку. Например, введение может быть трансбуккальным, лингвальным или сублингвальным, т.е. через слизистую(ые) оболочку(и) рта и/или языка, и может осуществляться, например, в виде таблетки, пастилки, покрытой сахаром пилюли (т.е. драже) и/или раствора для полоскания. В качестве альтернативы введение может быть энтеральным, т.е. через слизистую(ые) оболочку(и) желудка и/или кишечного тракта, и может осуществляться, например, в виде таблетки, покрытой сахаром пилюли (т.е. драже), капсулы, раствора, суспензии и/или эмульсии. В качестве альтернативы введение может быть ректальным и может осуществляться, например, в виде суппозитория, ректальной капсулы и/или мази, или втирания. В качестве альтернативы введение может быть интраназальным и может осуществляться, например, в виде капель, мази или втирания и/или спрея. В качестве альтернативы введение может быть легочным, т.е. через слизистую(ые) оболочку(и) бронхов и/или альвеол, и может осуществляться, например, в виде аэрозоля и/или средства для ингаляции. В качестве альтернативы введение может быть конъюнктивальным и может осуществляться, например, в виде глазных капель, мази для глаз и/или промывки для глаз. В качестве альтернативы введение может осуществляться через слизистую(ые) оболочку(и) мочеполового тракта, например, может быть интравагинальным или интрауретральным, и может осуществляться, например, в виде суппозитория, мази и/или карандаша. Следует понимать, что приведенные выше альтернативные варианты введения не являются взаимоисключающими, и что комбинация любого их числа может составлять эффективную схему лечения.
Фармацевтическая композиция по настоящему изобретению может дополнительно содержать фармацевтически приемлемый носитель. Примеры подходящих фармацевтических носителей являются хорошо известными в данной области и включают физиологические растворы с фосфатным буфером, воду, эмульсии, такие как эмульсии масло/вода, разные типы увлажнителей, стерильные растворы и т.д. Композиции, содержащие такие носители, можно приготовить в виде препаратов хорошо известными традиционными способами. Эти фармацевтические композиции можно вводить субъекту в подходящей дозе. Схема дозировки будет определяться лечащим врачом и клиническими факторами. Как хорошо известно в области медицины, дозировки для какого-либо пациента зависят от многих факторов, включая размеры пациента, площадь поверхности тела, возраст, конкретное соединение, подлежащее введению, пол, время и путь введения, общее состояние здоровья и другие лекарственные средства, которые вводят одновременно. Например, препараты для парентерального введения включают стерильные водные или неводные растворы, суспензии, эмульсии и липосомы. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъецируемые органические эфиры, такие как этилолеат. Водные носители включают воду, спиртовые/водные растворы, эмульсии или суспензии, включающие физиологический раствор и забуференные среды. Наполнители, подходящие для обычного парентерального введения, включают раствор хлорида натрия, декстрозу Рингера, декстрозу и хлорид натрия, лактат Рингера или нелетучие масла. Наполнители, подходящие для внутривенного или внутриартериального введения, включают жидкие и питательные наполнители, электролитные наполнители (такие как наполнители на основе декстрозы Рингера) и тому подобное. Также могут присутствовать консерванты и другие добавки, такие как, например, противомикробные агенты, антиоксиданты, хелатирующие агенты, инертные газы и тому подобное. Кроме того, фармацевтическая композиция по настоящему изобретению может содержать белковые носители, подобные, например, сывороточному альбумину или иммуноглобулину, предпочтительно человеческого происхождения. Предусматривается, что фармацевтическая композиция по изобретению, помимо гуманизированного моноклонального антитела или его фрагмента (как описано в этом изобретении), может содержать дополнительные биологически активные агенты, в зависимости от предполагаемого применения данной фармацевтической композиции. Такие агенты могут представлять собой лекарственные средства, действующие на желудочно-кишечную систему, лекарственные средства, действующие как цитостатики, лекарственные средства, предотвращающие гиперурикемию, лекарственные средства, ингибирующие иммунореакции (например, кортикостероиды), лекарственные средства, модулирующие воспалительную реакцию, лекарственные средства, действующие на систему кровообращения, и/или такие агенты, как цитокины, известные в данной области.
Согласно другому аспекту данного изобретения предложено применение гуманизированного моноклонального антитела или его фрагмента, как изложено выше, или полинуклеотидной молекулы, как изложено выше, в изготовлении лекарственного средства, возможно содержащего один или более чем один дополнительный противовоспалительный агент, для лечения воспалительных заболеваний у млекопитающих, предпочтительно людей. Преимущественно такие воспалительные заболевания выбраны из группы, состоящей из ревматоидного артрита (RA), астмы, рассеянного склероза (MS), хронического обструктивного заболевания легких (COPD), острого респираторного дистресс-синдрома (ARDS), идиопатического легочного фиброза (IPF), воспалительного заболевания кишечника (IBD), увеита, дегенерации желтого пятна, колита, псориаза, Уоллеровской дегенерации, антифосфолипидного синдрома (APS), острого коронарного синдрома, рестеноза, атеросклероза, рецидивирующего полихондрита (RP), острого или хронического гепатита, неудачного приживления ортопедических имплантатов, гломерулонефрита, волчанки, аутоиммунных расстройств, острого панкреатита или анкилозирующего спондилита (AS).
Согласно другому аспекту данного изобретения предложено применение гуманизированного моноклонального антитела или его фрагмента, как изложено выше, или полинуклеотидной молекулы, как изложено выше, в изготовлении лекарственного средства, возможно содержащего один или более чем один дополнительный противораковый агент, для лечения опухолевого заболевания или другого состояния с замедленным апоптозом клеток, повышенным выживанием или пролиферацией клеток у млекопитающих, предпочтительно людей. Предпочтительно опухолевое заболевание представляет собой рак, причем указанный рак предпочтительно представляет собой лейкоз, множественную миелому, карциному желудка или карциному кожи.
Согласно другому аспекту данного изобретения предложен способ лечения воспалительного заболевания, при котором гуманизированное моноклональное антитело или его фрагмент, как изложено выше, или полинуклеотидную молекулу, как изложено выше, вводят (возможно вместе с одним или более чем одним дополнительным противовоспалительным агентом) млекопитающему, предпочтительно субъекту, являющемуся человеком, в достаточном количестве и в течение достаточного промежутка времени для предупреждения и/или облегчения указанного воспалительного заболевания. Преимущественно такие воспалительные заболевания выбраны из группы, состоящей из ревматоидного артрита (RA), астмы, рассеянного склероза (MS), хронического обструктивного заболевания легких (COPD), острого респираторного дистресс-синдрома (ARDS), идиопатического легочного фиброза (IPF), воспалительного заболевания кишечника (IBD), увеита, дегенерации желтого пятна, колита, псориаза, Уоллеровской дегенерации, антифосфолипидного синдрома (APS), острого коронарного синдрома, рестеноза, атеросклероза, рецидивирующего полихондрита (RP), острого или хронического гепатита, неудачного приживления ортопедических имплантатов, гломерулонефрита, волчанки, аутоиммунных расстройств, острого панкреатита или анкилозирующего спондилита (AS).
Согласно другому аспекту данного изобретения предложен способ лечения опухолевого заболевания, при котором гуманизированное моноклональное антитело или его фрагмент, как изложено выше, или полинуклеотидную молекулу, как изложено выше, вводят (возможно вместе с одним или более чем одним дополнительным противораковым агентом) млекопитающему, предпочтительно субъекту, являющемуся человеком, в достаточном количестве и в течение достаточного промежутка времени для предупреждения и/или облегчения указанного опухолевого заболевания или другого состояния с замедленным апоптозом клеток, повышенным выживанием или пролиферацией клеток. Предпочтительно опухолевое заболевание представляет собой рак, причем указанный рак предпочтительно представляет собой лейкоз, множественную миелому, карциному желудка или карциному кожи.
Данное изобретение теперь будет проиллюстрировано следующими неограничивающими графическими материалами и примерами. Краткое описание фигур приведено ниже:
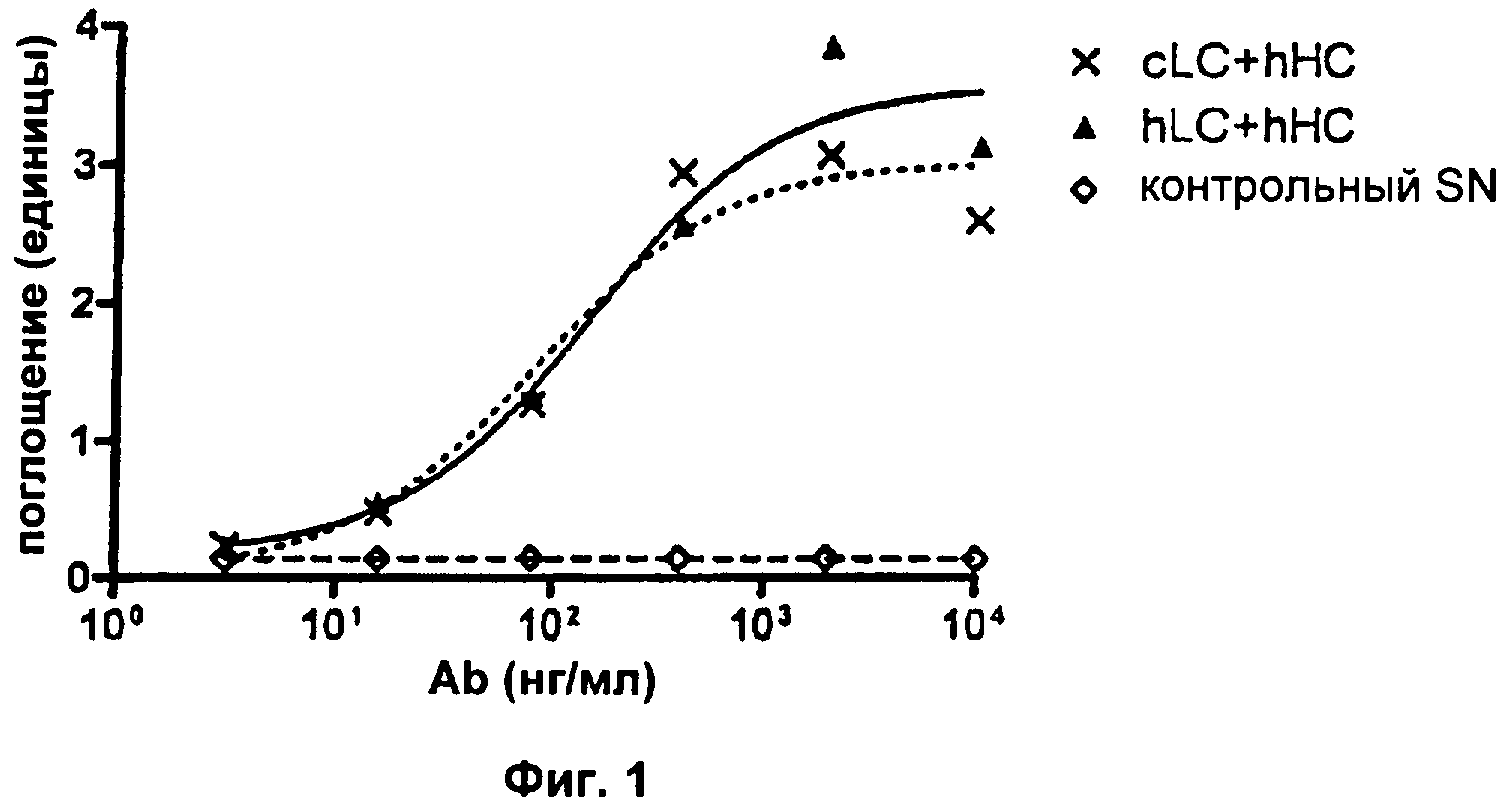
Фиг.1. Сохраняющееся связывание антигена после гуманизации VL-области.
Фиг.2. Потеря нейтрализующей активности после гуманизации VL-области.
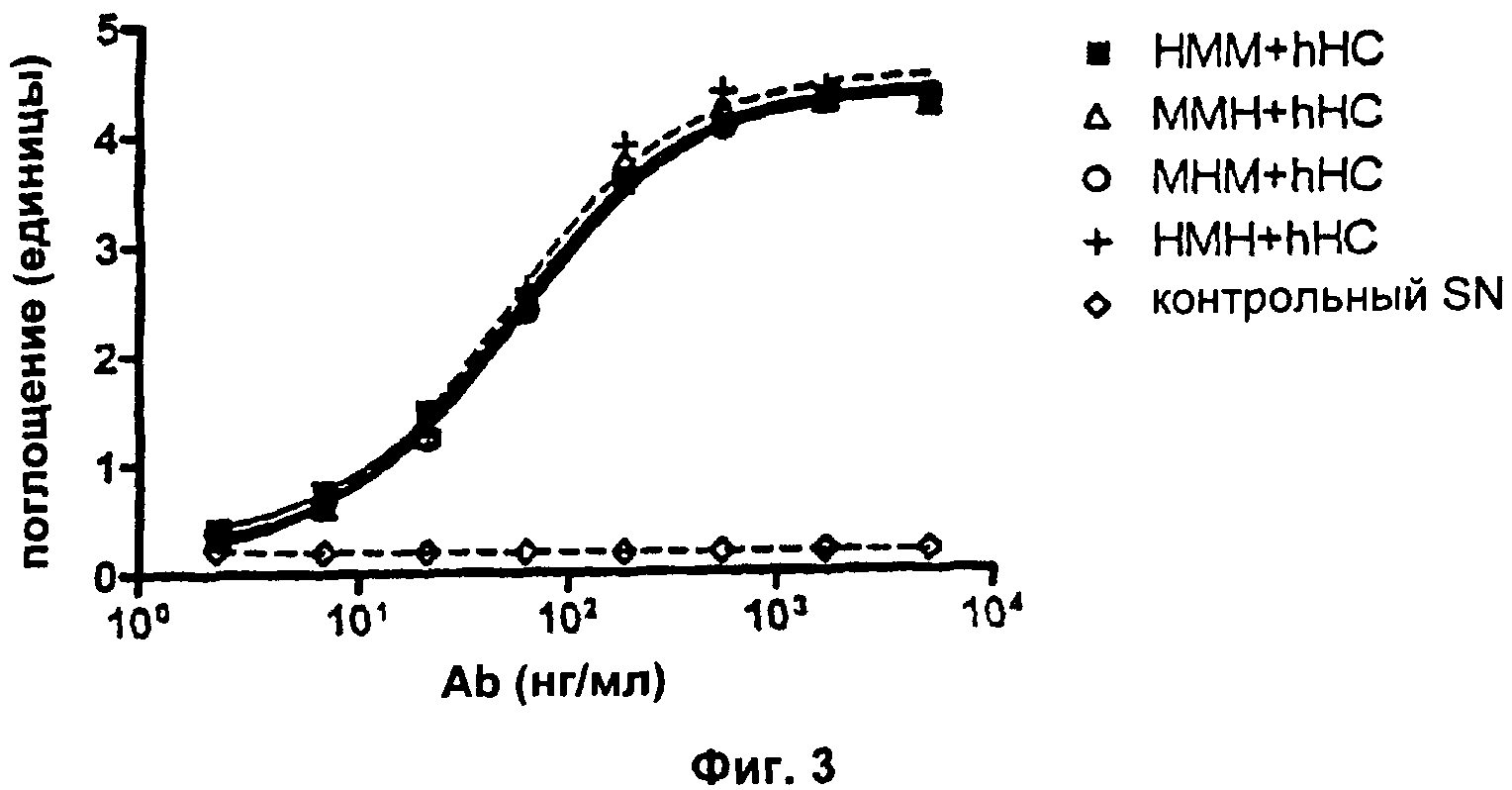
Фиг.3. Связывание IL2 не подвержено влиянию замен в человеческих/мышиных каркасных областях в VL-области.
Фиг.4. Потеря нейтрализующей активности после введения второй каркасной области легкой цепи человека.
Фиг.5. Аминокислотные замены в положениях 42-46 VL-области (во второй каркасной области легкой цепи) не влияют на связывание антигена.
Фиг.6. Мутация лейцина до аланина в положении 46 второй каркасной области легкой цепи приводит к восстановлению нейтрализующей активности.
Фиг.7а. Аминокислотные последовательности человеческой зародышевой линии для первой и второй каркасных областей легкой цепи (V-каппа). CDR-области были исключены; остальная нумерация оставшихся каркасных областей является такой, как опубликовано в базе данных он-лайн "Vbase" (см. выше Web-ссылку).
Фиг.7б. Аминокислотные последовательности человеческой зародышевой линии для третьей каркасной области легкой цепи (V-каппа). CDR-области были исключены; остальная нумерация оставшихся каркасных областей является такой, как опубликовано в базе данных он-лайн "Vbase" (см. выше Web-ссылку).
Фиг.8а. Аминокислотные последовательности человеческой зародышевой линии для первой и второй каркасных областей легкой цепи V-лямбда). CDR-области были исключены; остальная нумерация оставшихся каркасных областей является такой, как опубликовано в базе данных он-лайн "Vbase" (см. выше Web-ссылку).
Фиг.8б. Аминокислотные последовательности человеческой зародышевой линии для третьей каркасной области легкой цепи (V-каппа). CDR-области были исключены; остальная нумерация оставшихся каркасных областей является такой, как опубликовано в базе данных он-лайн "Vbase" (см. выше Web-ссылку).
Фиг.9а. Аминокислотные последовательности человеческой зародышевой линии для первой и второй каркасных областей тяжелой цепи. CDR-области были исключены; остальная нумерация оставшихся каркасных областей является такой, как опубликовано в базе данных он-лайн "Vbase" (см. выше Web-ссылку).
Фиг.9б. Аминокислотные последовательности человеческой зародышевой линии для третьей каркасной области тяжелой цепи. CDR-области были исключены; остальная нумерация оставшихся каркасных областей является такой, как опубликовано в базе данных он-лайн "Vbase" (см. выше Web-ссылку).
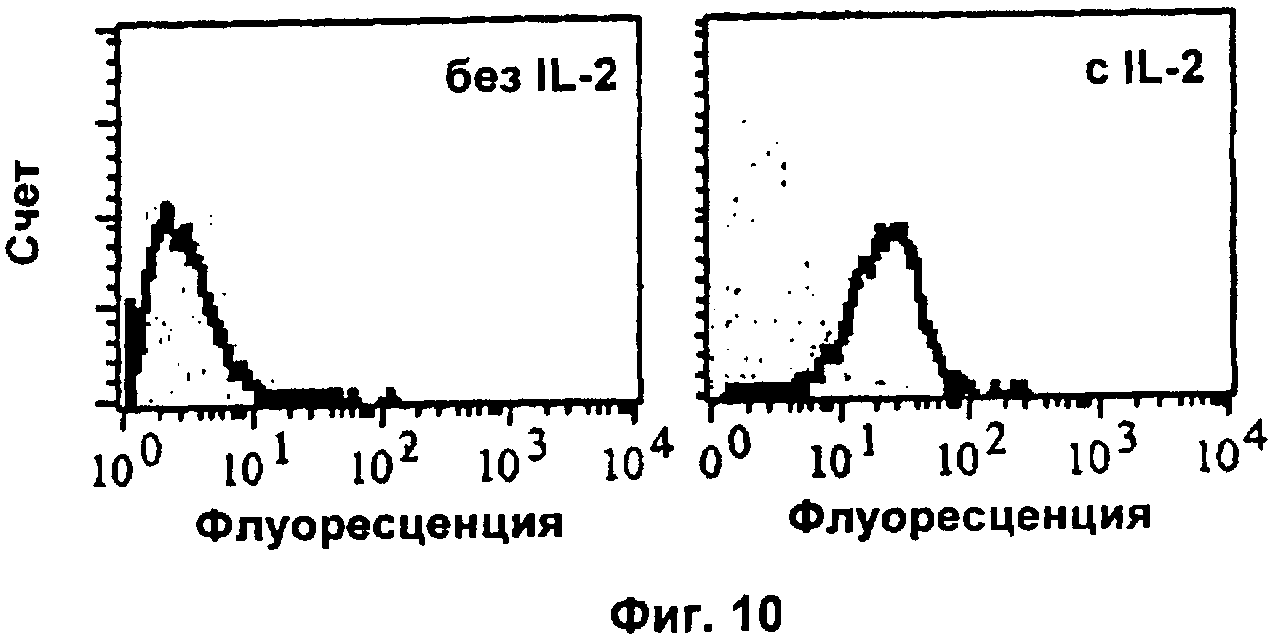
Фиг.10. Специфичность связывания гуманизированного антитела против IL2 "Анти-IL2" с лимфомной клеточной линией NKL естественных киллеров.
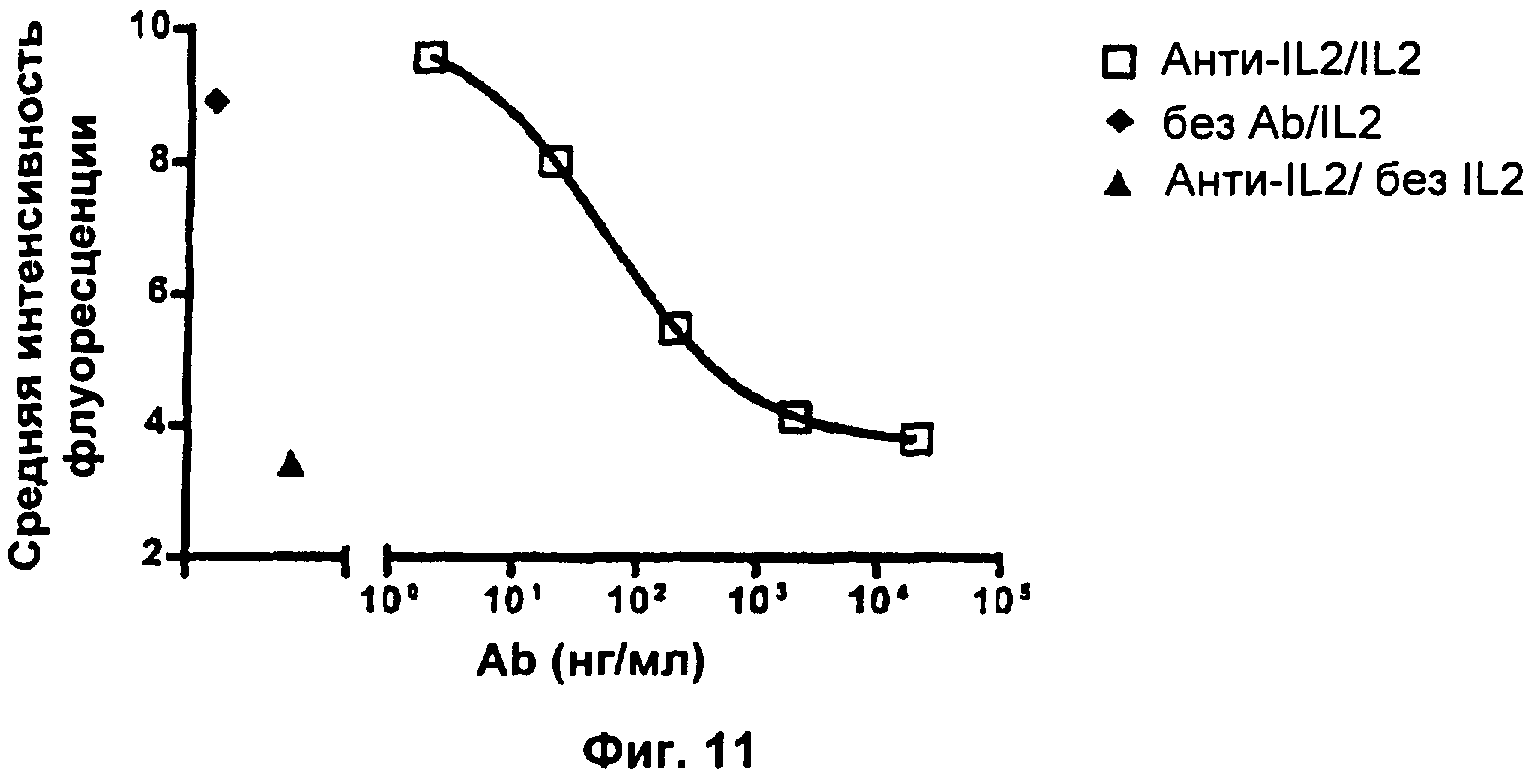
Фиг.11. Анти-IL2 отменяет IL2-зависимую повышающую регуляцию экспрессии CD124 на поверхности клеткок CTLL-2.
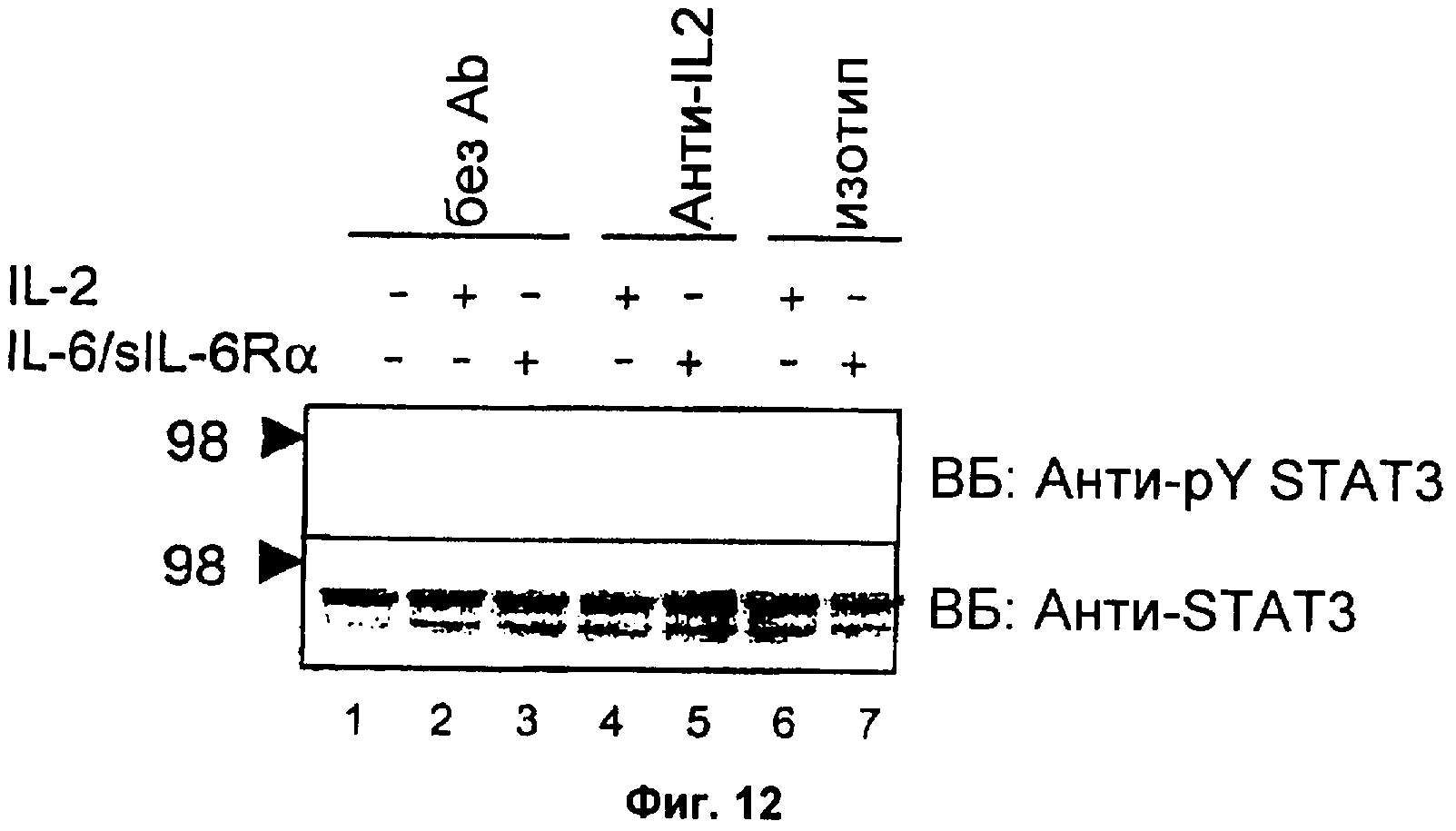
Фиг.12. Анти-IL2 специфически блокирует трансдукцию сигнала IL2 ниже IL2-рецептора в клеточном сигнальном пути.
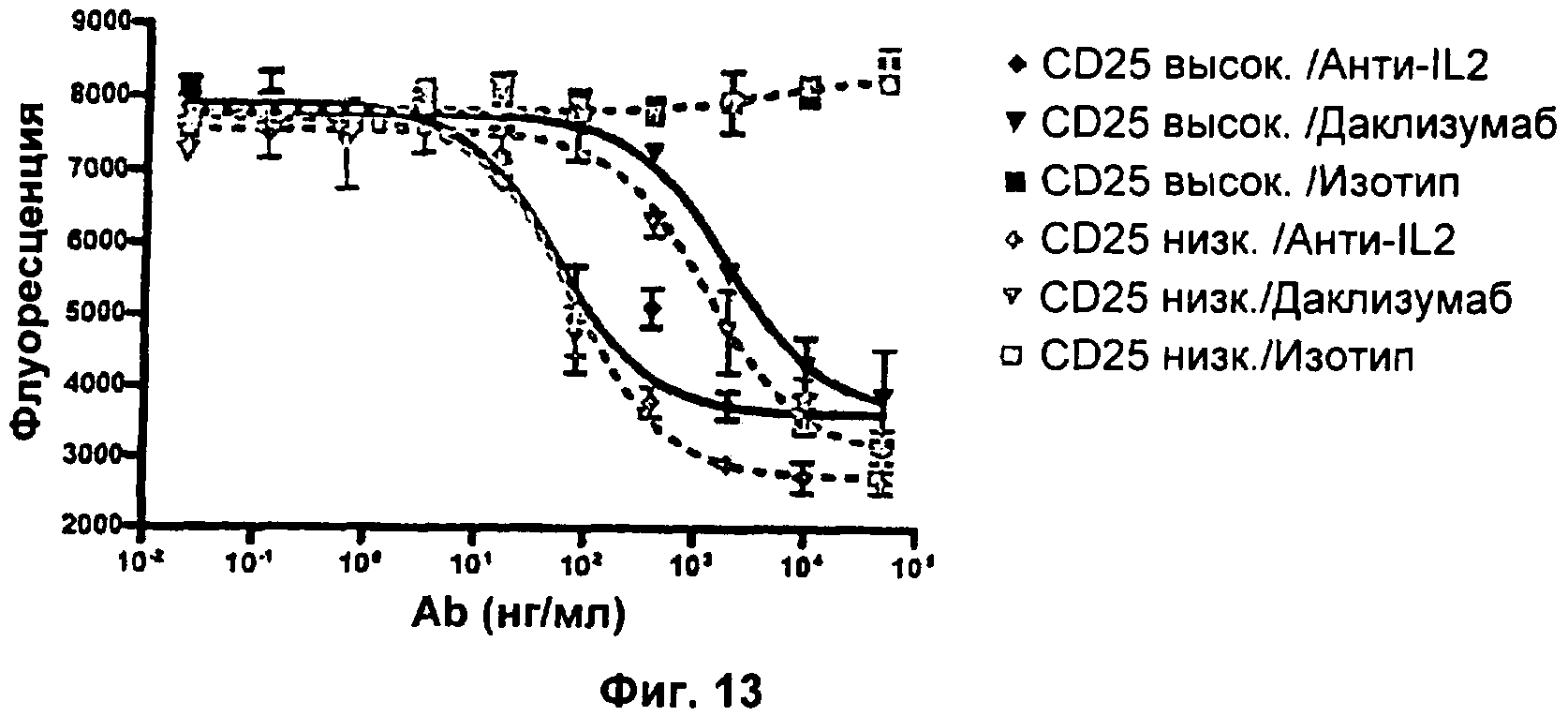
Фиг.13. На эффективность анти-IL2 и даклизумаба дифференциально влияет уровень экспрессии CD25.
Фиг.14. Результаты, показывающие влияние анти-IL2 и даклизумаба на IL2-зависимую пролиферацию первичных человеческих NK-клеток.
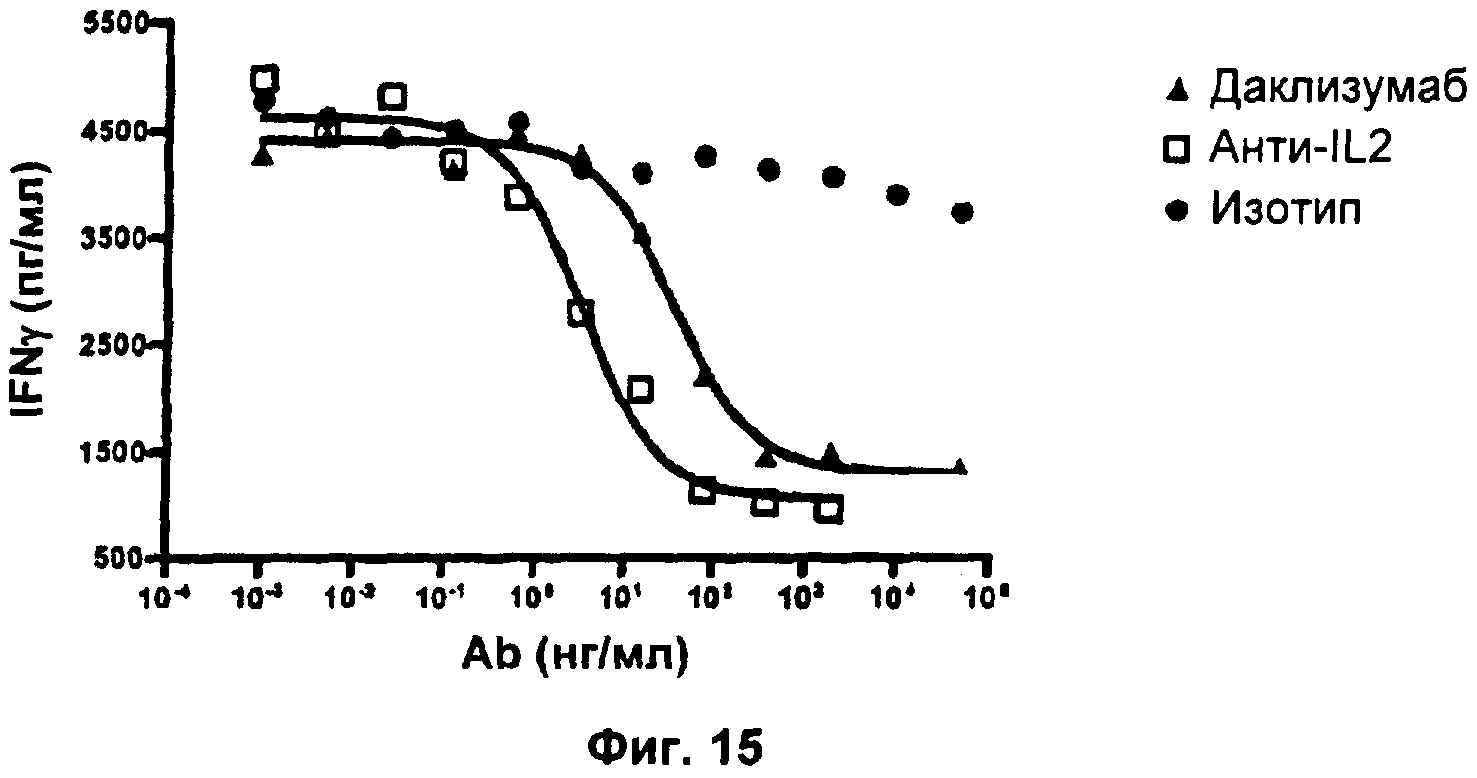
Фиг.15. Результаты, показывающие влияние анти-IL2 и даклизумаба на IL2-зависимое высвобождение IFN-гамма NK-клетками.
Пример 1: Получение антигена - человеческого IL2 ("hIL2")
Целью экспериментальных подходов, описанных ниже в Примерах 1а, 1б и 1в, было получение рекомбинантного IL2 антигенного материала, происходящего из разных источников: антигена, экспрессирующегося в прокариотических клетках, в эукариотических клетках, и рекомбинантного белкового антигена, имеющегося в продаже в качестве сертифицированного терапевтического средства.
Пример 1а: Рекомбинантная экспрессия из Е.coli
Зрелый hIL2 (т.е. кодирующий аминокислотные остатки APTSSS…IISTLT) клонировали в виде одной открытой рамки считывания ("ORF") в прокариотический экспрессирующий вектор pBAD (Invitrogen), используя стандартную ПЦР и методы молекулярной биологии. На 5'-конце добавляли три нуклеотида, кодирующих метионин, на 3'-конце перед стоп-кодоном встраивали нуклеотидную последовательность, которая сливает гексагистидиновую метку с С-концом белка.
Эту конструкцию использовали для трансформации компетентного штамма Е.coli (штамм BL21(DE3), Stratagene), используя инструкции, предоставленные производителем. Бактерии выращивали в стандартной среде LB до плотности OD(600 нм), равной 0,5, затем в течение 5 ч добавляли L-арабинозу до концентрации 0,2% мас./об. для того, чтобы запустить экспрессию. Сбор Е.coli осуществляли путем центрифугирования при 10000 g в течение 15 мин. Затем получали нерастворимую фракцию (тельца включений), используя реагент и протокол BugBuster (Novagen) согласно инструкциям производителя.
Тельца включений солюбилизировали в 6 М гуанидин-гидрохлориде ("GuHCl") и затем разбавляли до 0,1 мг/мл буфером, содержащим 2 М GuHCl (рН=8,0)/1 мМ глутатиона окисл./10 мМ глутатиона восст., и инкубировали в течение 16 ч при 20°С. После инкубации рН доводили до 6,0 путем медленного добавления ледяной уксусной кислоты при энергичном перемешивании. Наконец, использовали три последовательных хроматографических подхода для получения высокоочищенного и гомогенного белкового препарата hIL2his: аффинную хроматографию с иммобилизованным металлом (IMAC), ВЭЖХ с обращенной фазой, ионообменную хроматографию. Функциональность очищенного белка подтверждали в эксперименте по клеточной пролиферации (см, ниже).
Пример 1б: Рекомбинантная экспрессия из клеток млекопитающих
Зрелый hIL2 (т.е. кодирующий аминокислотные остатки APTSSS…IISTLT) клонировали в эукариотический экспрессирующий вектор pEFdhfr (Mack М. et al. (1995) PNAS 92, 7021-5), используя стандартную ПЦР и методы молекулярной биологии. На 5'-конце добавляли нуклеотидную последовательность, кодирующую лидерный пептид человеческого IgG для обеспечения эффективного процессинга и секреции, на 3'-конце перед стоп-кодоном встраивали нуклеотидную последовательность, которая сливает гексагистидиновую метку с С-концом данного белка.
Клетки 293 (DSMZ, код заказа АСС305) сеяли с такой плотностью, чтобы покрыть 25-35% поверхности чашки, и культивировали в течение 24 ч. Затем данные клетки трансфицировали экспрессирующим вектором pEFdhfr-hIL2, используя реагент "Transfast" (Promega) согласно инструкциям производителя. После дополнительного 60-часового периода культивирования собирали клеточные супернатанты и белок hIL2-his очищали, используя подход IMAC с последующей ионообменной хроматографией. Функциональность очищенного белка подтверждали в эксперименте по клеточной пролиферации.
Пример 1в: Покупка пролейкина
Пролейкин (приготовленный в виде препарата рекомбинантный hIL2, экспрессирующийся в Е.coli) покупали у Chiron.
При использовании описанных выше подходов получили три разных источника полностью функционального рекомбинантного антигена hIL2.
Пример 2: Продукция гуманизированного моноклонального антитела против hIL2
Было желательным производить гуманизированное моноклональное антитело ("mAb") с особенно подходящим способом действия, которое имеет в качестве специфической мишени человеческий hIL2 и нейтрализует его биоактивность. Обычно нейтрализующие mAb, имеющие в качестве мишени секретируемый растворимый белок, такой как цитокин hIL2, распознают эпитоп, который по меньшей мере частично перекрывается с эпитопом, распознаваемым компонентом соответствующего цитокинового рецептора. Таким образом, mAb непосредственно конкурирует с данным рецептором за связывание цитокина. Этот механизм действия подразумевает, что можно достичь эффективной нейтрализации. Данное mAb должно использоваться в достаточно высокой дозе для того, чтобы конкурировать за цитокиновый рецептор.
Пример 2а: Исходная точка → имеющееся в продаже моноклональное антитело против hIL2 в виде белка
Для достижения понимания степени, до которой разные mAb против hIL2 могли бы осуществлять нейтрализацию, как упомянуто выше, получали mAb против hIL2 путем иммунизации мышей с последующим отбором клеток селезенки и гибридомным слиянием, причем все делали согласно стандартным протоколам. Кроме того, приобретали имеющиеся в продаже mAb против hIL2. Использовали пул доступных mAb для сравнения свойств разных антител в трех анализах: связывания с растворимым антигеном, протестированным в ELISA (твердофазный иммуноферментный анализ), связывания с антигеном, ассоциированным с клеточной поверхностью, протестированного в FACS, и способности нейтрализовать биоактивность hIL2, протестированной с помощью анализа клеточной пролиферации.
Анализ ELISA осуществляли следующим образом.
Все инкубации осуществляли при 20°С. Использовали покрытые стрептавидином 96-луночные планшеты для ELISA (Nunc) для прикрепления ПЭГ-биотинилированного пролейкина, 0,1 мкг в 100 мкл PBS-TB (забуференный фосфатами физиологический раствор, рН=7,4, 0,05% об./об. Tween-20, 1% мас./об. БСА) на лунку в течение 30 минут. Затем планшет промывали 3 раза 200 мкл на лунку PBS-T (забуференный фосфатами физиологический раствор, рН=7,4, 0,05% об./об. Tween-20). Добавляли образцы различных mAb, по 100 мкл на лунку, и инкубировали образцы в течение 1 часа. Затем планшет промывали 3 раза 200 мкл на лунку PBS-T. Используемым определяющим антителом было mAb козы против IgG человека, конъюгированное с HRP (Jackson Immunoresearch), разведенное 1:1000 в PBS-TB, 100 мкл на лунку, и инкубацию осуществляли в течение 1 часа. Затем планшет промывали 3 раза 200 мкл на лунку PBS-T. Наконец, производили количественную оценку связывания антитела с антигеном путем инкубации с субстратом для HRP: 100 мкл субстратного буфера 2,2'-азино-ди[3-этил-бензтиазолин-6-сульфоновой кислоты] ("ABTS") (Roche Diagnostics, таблетки ABTS), и инкубировали планшет в течение 5-10 минут до тех пор, пока не развивалось зеленое окрашивание. Данное окрашивание измеряли при 405 нм на считывающем устройстве для 96-луночных планшетов.
Анализ FACS осуществляли следующим образом.
Для оптимального роста в условиях культивирования клеток лимфомная клеточная линия человеческих натуральных киллеров NKL зависит от присутствия примерно 5 нг/мл hIL2 в среде (минимальная питательная среда в модификации Iscove (Biochrom AG); 10% об./об. фетальной бычьей сыворотки (Biochrom AG); 100 мкг/мл пенициллина/стрептомицина (Biochrom AG)). При подготовке эксперимента NKL-клетки, 1×106 на мл, лишали hlL2 на 24 часа путем культивирования в среде, не содержащей hIL2. Непосредственно перед экспериментом данные клетки промывали средой, не содержащей hIL2. Все следующие инкубации осуществляли при 4°С в течение 30 минут; для промывки также использовали буфер PBS-F (забуференный фосфатами физиологический раствор, 3% об./об. фетальной бычьей сыворотки) при 4°С. Сначала 2×105 NKL-клеток в 200 мкл среды инкубировали с 1 мкг рекомбинантного человеческого hIL2 или оставляли без hIL2 в тех же условиях. Затем промывали клетки 3 раза, причем каждую промывку осуществляли 2 мл PBS-F. Затем 2×105 клеток инкубировали с разными мышиными mAb против hIL2, 1 мкг в 200 мкл среды, при 4°С в течение 30 минут. Данные клетки снова промывали три раза, как указано выше, и, наконец, инкубировали с FITC-конъюгированным детектирующим mAb козы против IgG мыши (Jackson Immunoresearch), разбавленным 1:1000 в 200 мкл PBS-F. После трех дополнительных промывок на установке FACS анализировали клеточную флуоресценцию клеток, удерживающих hIL2 на своей поверхности, по сравнению с обычными клетками.
Анализ пролиферации осуществляли следующим образом.
Для оптимального роста в условиях культивирования мышиная CTL клеточная линия CTLL-2 (LGCPromochem) зависит от присутствия примерно 5 нг/мл hIL2 в среде (минимальная питательная среда в модификации Iscove (Biochrom AG); 10% об./об. фетальной коровьей сыворотки (Biochrom AG); 100 мкг/мл пенициллина/стрептомицина (Biochrom AG); 0,5 мМ 2-меркаптоэтанола (Gibco)). Как мышиный, так и человеческий hIL2 одинаково хорошо работают, поддерживая выживание и пролиферацию клеток CTLL-2. При подготовке эксперимента клетки CTLL-2, 1×106 на мл, лишали hIL2 на 12 часов путем культивирования в среде, не содержащей hIL2.
Непосредственно перед экспериментом данные клетки промывали средой, не содержащей hIL2. Для проведения эксперимента по пролиферации и оценке ингибирования биоактивности hIL2 различными mAb использовали 96-луночный планшет для тканевых культур. Использовали конечный аналитический объем 200 мкл на лунку, причем этот объем включал: 5×104клеток CTLL-2, 2 нг/мл hIL2 (для обеспечения приблизительно полумаксимальной пролиферации) и различные mAb против hIL2 в концентрации 5000 нг/мл, 1000 нг/мл, 200 нг/мл и 40 нг/мл. Все образцы получали в тройной повторности. Соответствующие смеси инкубировали 48 часов при 37°С в увлажненной камере в присутствии 5% диоксида углерода. Затем определяли жизнеспособные клетки, используя данные флуоресцентного окрашивания AlamarBlue (Biosource International) и флуоресцентное считывающее устройство для 96-луночных планшетов в соответствии с рекомендациями производителя.
Обнаружили, что mAb202 (имеющееся в продаже от фирмы R&D Systems) (1) связывается с растворимым антигеном, (2) связывается с антигеном, ассоциированным с клеточной поверхностью, и (3) эффективно нейтрализует биоактивность hIL2. Среди протестированных антител только mAb 202 давало положительные результаты во всех трех анализах и, следовательно, рассматривалось как многообещающий кандидат согласно свойствам, определенным выше и, следовательно, было выбрано отправной точкой для последующих экспериментов.
Пример 2б: Определение первичной последовательности антитела против hIL2 путем секвенирования: идентификация последовательностей из вариабельной области тяжелой цепи ("VH") и вариабельной области легкой цепи ("VL")
Из-за отсутствия доступного гибридомного клона mAb202, mAb секвенировали для идентификации VH- и VL-аминокислотных последовательностей. Для этого получали Fab-фрагменты mAb202. Эти фрагменты подвергали протеолитическому расщеплению с последующей он-лайн ВЭЖХ для разделения пептидов. Затем отдельные пептиды анализировали в отношении аминокислотного состава и последовательности с помощью МС/МС масс-спектрометрии. Этот подход приводил к идентификации VH- и VL-белковых последовательностей.
Пример 2в: Контроль за сохранением функциональности: слияние секвенированных областей VH/VL с известными мышиными константными областями
Было желательным функциональное подтверждение результатов секвенирования, полученных в результате секвенирования белка mAb202, описанного выше. Так, ген, кодирующий секвенированную VH, синтезировали и клонировали в экспрессирующий вектор, обеспечивающий константные области IgG1 мыши. Аналогично, ген, кодирующий секвенированную VL, синтезировали и клонировали в экспрессирующий вектор, обеспечивающий С-каппа домен мыши. Эти два экспрессирующих вектора идеально позволили бы реконструировать исходное mAb202, функциональность которого затем можно было бы повторно тестировать, как описано выше. После коэкспрессии обоих векторов в клетках 293 в клеточных супернатантах определяли mAb против IL2 со свойствами, сравнимыми со свойствами, которые наблюдали у исходного mAb202. Соответствие активности (определенной с помощью ELISA, а также в анализе пролиферации с использованием клеточной линии CTLL-2), наблюдаемой у реконструированного mAb после секвенирования белка, с активностью родительского mAb202 может быть принято как подтверждение того, что последовательности, определенные для VH- и VL-областей этого антитела, были правильными.
Пример 2г: Гуманизация тяжелой цепи
Целью гуманизации является полное сохранение специфичности связывания и биологической активности антитела при минимизации содержания последовательностей, не являющихся человеческими, присутствующих в mAb. Последняя цель приводит к получению антитела, которое с меньшей вероятностью вызывает иммунный ответ при введении субъекту, являющемуся человеком, чем его родительское антитело нечеловеческого происхождения. Первоначально получали экспрессирующий вектор для химерной тяжелой цепи, содержащей исходную VH мыши вместе с доменами С1, С2 и С3 человеческого изотипа IgG1. После экспрессии химерной тяжелой цепи при объединении с химерной легкой цепью (см. ниже) свойства исходного мышиного mAb могли быть воспроизведены (см. ниже). Следующей логической стадией была гуманизация VH-области. Во избежание изменений специфичности CDR-последовательности оставляли неизменными. Поэтому на основе исходной мышиной VH искали наиболее близкородственную человеческую VH каркасную последовательность. Обнаружили, что из всех человеческих VH каркасных областей человеческая каркасная область 1-3/3-07/J6 имеет наиболее высокую степень гомологии с исходной мышиной каркасной областью. Обнаружили, что каркасная область 1-3/3-07/J6 отличается по 16 аминокислотным остаткам от соответствующих мышиных VH каркасных областей. Выравнивание, приведенное ниже, показывает прямое сравнение между исходной мышиной и человеческой 1-3/3-07/J6 VH каркасными областями; исходные CDR-последовательности подчеркнуты, и идентичность аминокислот между обеими последовательностями указана звездочкой.
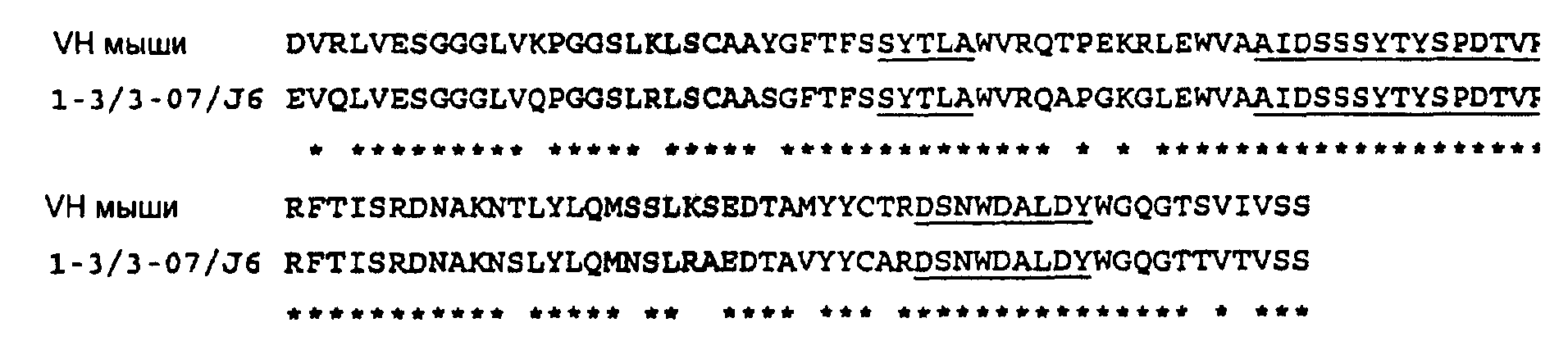
Конструкции, содержащие исходную мышиную VH или гуманизированную VH, в последующем тексте будут соответственно называться как сНС (химерная тяжелая цепь, содержащая VH мыши и С1, С2, С3 человека) и hHC (гуманизированная тяжелая цепь, включающая VH-содержащие CDR-области мыши в каркасной области VH человека и С1, С2, С3 человека). В целях экспрессии рекомбинантного белка гуманизированной тяжелой цепи клонировали открытые рамки считывания, кодирующие гуманизированную VH в комбинации с С1, С2 и С3 доменами человеческого изотипа IgG1 в подходящий вектор (Raum Т et al. (2001) Cancer Immunol Immunother. 50, 141-50).
Пример 2д: Гуманизация легкой цепи
Гуманизацию осуществляли аналогично подходу, описанному выше для тяжелой цепи. Кратко, получали экспрессирующий вектор для химерной легкой цепи, содержащий исходную VL мыши вместе с Ск доменом человека, и тестировали после коэкспрессии с химерной тяжелой цепью (см. выше). Опять, как и на второй стадии, на основе исходной VL мыши находили наиболее близкородственную каркасную последовательность VL человека. Все три CDR сохранялись. Каркасная область O12/Jk4 VL человека оказалась наиболее родственной по последовательности. При сравнении VL мыши и O12/Jk4 человека в каркасных областях VL различались всего 22 аминокислотных остатка. Выравнивание, приведенное ниже, демонстрирует прямое сравнение между исходной мышиной и человеческой каркасными областями O12/Jk4; исходные CDR-последовательности подчеркнуты, идентичность аминокислот между обеими последовательностями указана звездочкой.

Конструкции, содержащие исходную мышиную VL или гуманизированную VL, в последующем тексте будут соответственно называться как cLC (химерная легкая цепь, содержащая VL мыши и Скаппа человека) и hLC (гуманизированная легкая цепь, включающая VL, содержащую мышиные CDR-области в каркасной области VL человека и Скаппа человека). В целях экспрессии рекомбинантного белка гуманизированной легкой цепи клонировали открытые рамки считывания, кодирующие гуманизированную VL в комбинации с Ск доменом человека, в подходящий вектор (Raum Т et al. (2001) Cancer Immunol Immunother. 50, 141-50).
Пример 2д.1: Перестановка человеческой и мышиной последовательностей в виде целых каркасных областей: оценка связывания и нейтрализации с помощью анализа пролиферации
После проведения успешной гуманизации и тяжелой, и легкой цепи тестировали свойства полученных гуманизированных mAb по сравнению с химерным mAb, т.е. с молекулой антитела, содержащей целые мышиные вариабельные домены. Так как химерное mAb показало нейтрализацию биоактивности IL2, сравнимую с исходным mAb, его использовали в этих экспериментах в качестве контроля. Для временной котрансфекции клеток 293 (используемый протокол был идентичен методике трансфекции, описанной в Примере 1б за исключением того, что клетки трансфицировали одновременно двумя плазмидами) использовали пары экспрессирующих векторов, кодирующих тяжелую и легкую цепи.
После экспрессии в клетках 293 сравнимые количества разных варинтов mAb в клеточных супернатантах подтверждали с помощью анти-hIgG ELISA, которую осуществляли следующим образом.
В 96-луночном планшете для ELISA (Nunc) инкубировали mAb против hIgG (Abcam LTD) в разведении 1:2000 в PBS, 100 мкл на лунку, в течение 12 часов при 4°С. Каждую лунку три раза промывали 200 мкл буфера PBS-T, затем собирали 100 мкл чистых супернатантов от клеток 293, наполняли каждую лунку серийным разведением супернатантов в среде и инкубировали в течение 1 часа при 20°С. Снова промывали каждую лунку 3 раза 200 мкл буфера PBS-T. Добавляли в лунки mAb козы против IgG человека, конъюгированное с HRP (Jackson Immunoresearch), разведенное 1:1000 в PBS-TB, 100 мкл на лунку, и инкубировали в течение 1 часа при 20°С. Затем планшет промывали 3 раза 200 мкл на лунку PBS-T. Наконец, количественно оценивали связывание антитела с hIgG путем инкубации с субстратом HRP: 100 мкл буфера с субстратом ABTS (Roche Diagnostics, таблетки ABTS), и инкубировали планшет в течение 5-10 минут, пока не развивалось зеленое окрашивание. Данное окрашивание измеряли при 405 нм на считывающем устройстве для 96-луночных планшетов. Для всех последующих экспериментов использовали только супернатанты со сравнимыми количествами mAb. Связывание антигена разными mAb тестировали с помощью ELISA (см. выше).
Свойства полученных mAb в отношении связывания растворимого антигена и в отношении нейтрализации биоактивности IL2 анализировали соответственно с помощью ELISA и анализа пролиферации CTLL-2 (см. Пример 2а выше для подробных экспериментальных протоколов). В экспериментах с ELISA увеличивающиеся единицы поглощения будут указывать на повышенные количества mAb, связывающихся с антигеном hIL2. В анализе пролиферации CTLL-2 увеличивающиеся единицы флуоресценции будут указывать на повышенное количество метаболически активных (=живых) клеток. Все клеточные супернатанты ("SN"), содержащие разные варианты mAb, контролировали на одинаковые концентрации mAb с помощью анти-hIgG ELISA перед тем, как подвергали их следующим экспериментам. Результаты типичного эксперимента показаны на Фиг.1. Здесь обе комбинации hLC+hHC (hLC=гуманизированная легкая цепь, hHC=гуманизированная тяжелая цепь) и cLC+hHC (cLC=химерная легкая цепь) демонстрируют сравнимое связывание с антигеном hIL2. Результаты анализа CTLL-2 (Фиг.2) показывают, что hLC+hHC не приводит к какой-либо детектируемой нейтрализации биоактивности hIL2, так как детектируемая флуоресценция не отличается от контрольного SN. Напротив, cLC+hHC снижает количество живых клеток, что очевидно из зависимого от концентрации mAb снижения флуоресценции. Использование двух отдельных цепей cLC или hHC в этом анализе не оказывало влияния на hIL2-зависимое выживание клеток (данные не показаны). Каждая экспериментальная точка в типичном эксперименте, представленном на Фиг.2, представляет собой средний результат для образцов в двойной повторности. Результаты описанных анализов просуммированы в Таблице 1:
Эти результаты показывают, что, несмотря на то, что связывание с растворимым антигеном, по-видимому, не отличается, нейтрализация теряется, как только используется hLC с вариантом гуманизированной тяжелой цепи. Вывод: гуманизация VL влечет за собой некоторое функциональное ухудшение mAb.
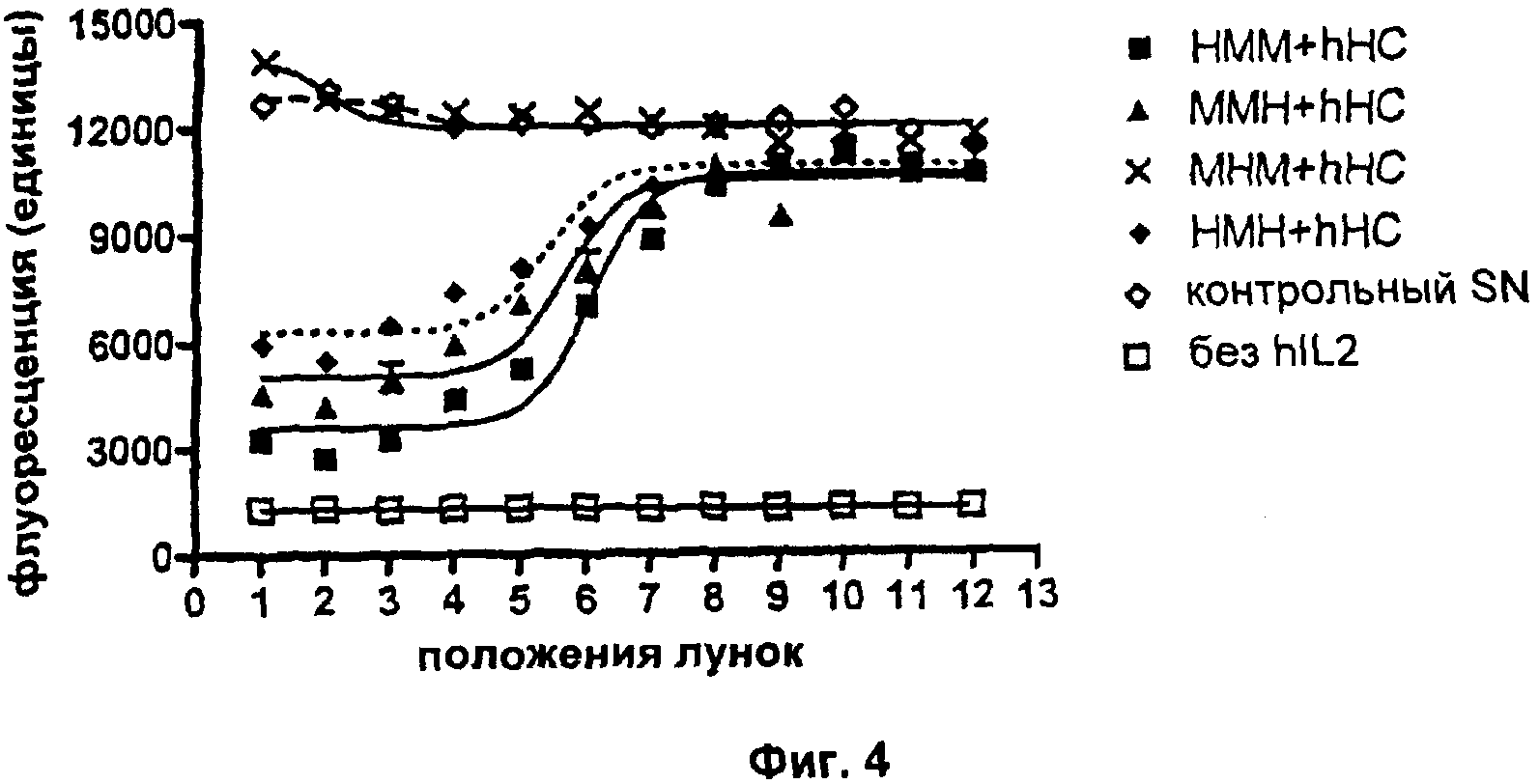
Для того чтобы определить, где, т.е. в какую каркасную область было введено это ухудшение, гуманизацию VL каркасной области cLC осуществляли в разных сегментах, изменяя за один раз только одну каркасную область (т.е. каркасную область 1, каркасную область 2 или каркасную область 3), а не все три каркасных области одновременно от мыши до человека. Была разработана сокращенная номенклатура, и она будет использоваться здесь ниже при обозначении этих вариантов гуманизации. Согласно этой номенклатуре три прописные буквы используются для создания триплетов, обозначающих каждую из первых трех каркасных областей 1, 2 и 3, где первое положение в триплете означает природу каркасной области 1, второе положение в триплете означает природу каркасной области 2, и третье положение в триплете означает природу каркасной области 3. Например, "НММ" указывало бы на человеческую каркасную область 1 в VL, которая в противном случае имеет мышиное происхождение, тогда как "МНМ" указывает на то, что только каркасная область 2 является человеческой, тогда как каркасные области 1 и 3 имеют мышиное происхождение.
Свойства разных человеческих/мышиных гибридных VL-доменов анализировали относительно их эффектов. Снова связывание антигена hIL2 и нейтрализацию биоактивности IL2 анализировали с помощью ELISA и анализа пролиферации CTLL-2 соответственно (см. Пример 2а выше для подробных экспериментальных протоколов). В эксперименте с ELISA увеличивающиеся единицы поглощения указывают на повышенные количества mAb, связывающегося с антигеном hIL2. В анализе пролиферации CTLL-2 увеличивающиеся единицы флуоресценции указывают на повышенное количество метаболически активных (=живых) клеток. Все клеточные супернатанты ("SN"), содержащие разные варианты mAb, контролировали на одинаковые концентрации mAb, используя анти-hIgG ELISA перед тем, как подвергнуть их следующим экспериментам. На Фиг.3 показаны результаты типичного сравнительного эксперимента. Здесь можно видеть, что все человеческие/мышиные гибридные варианты VL демонстрируют сравнимое связывание с антигеном hIL2 при объединении с hHC. Результаты анализа CTLL-2 (Фиг.4) показывают, что нейтрализация биоактивности hIL2 наблюдается только при условии, что каркасная область 2 VL является мышиной; MHM+hHC не изменяет количества живых клеток по сравнению с контрольным SN. Каждая экспериментальная точка в типичном эксперименте, показанном на Фиг.4, представляет собой среднее значение для образцов в двойной повторности. Результаты описанных анализов просуммированы в Таблице 2:
Эти эксперименты довольно ясно показывают, что каркасная область 2 VL определяет, способно ли mAb нейтрализовать биоактивность IL2 или нет. Более подробное сравнение мышиных и человеческих последовательностей каркасной области 2 выявляет, что эти последовательности отличаются по трем аминокислотам. В частности, мышиная каркасная область 2 содержит частичную аминокислотную последовательность QSPKA, тогда как соответствующая человеческая последовательность представляет собой KAPKL (аминокислоты, различающиеся у человека и мыши, были подчеркнуты для ясности).
Пример 2д.2: Перестановка человеческих и любых мышиных последовательностей в каркасной области 2; оценка связывания и нейтрализации с помощью анализа пролиферации и анализа индукции гена-мишени
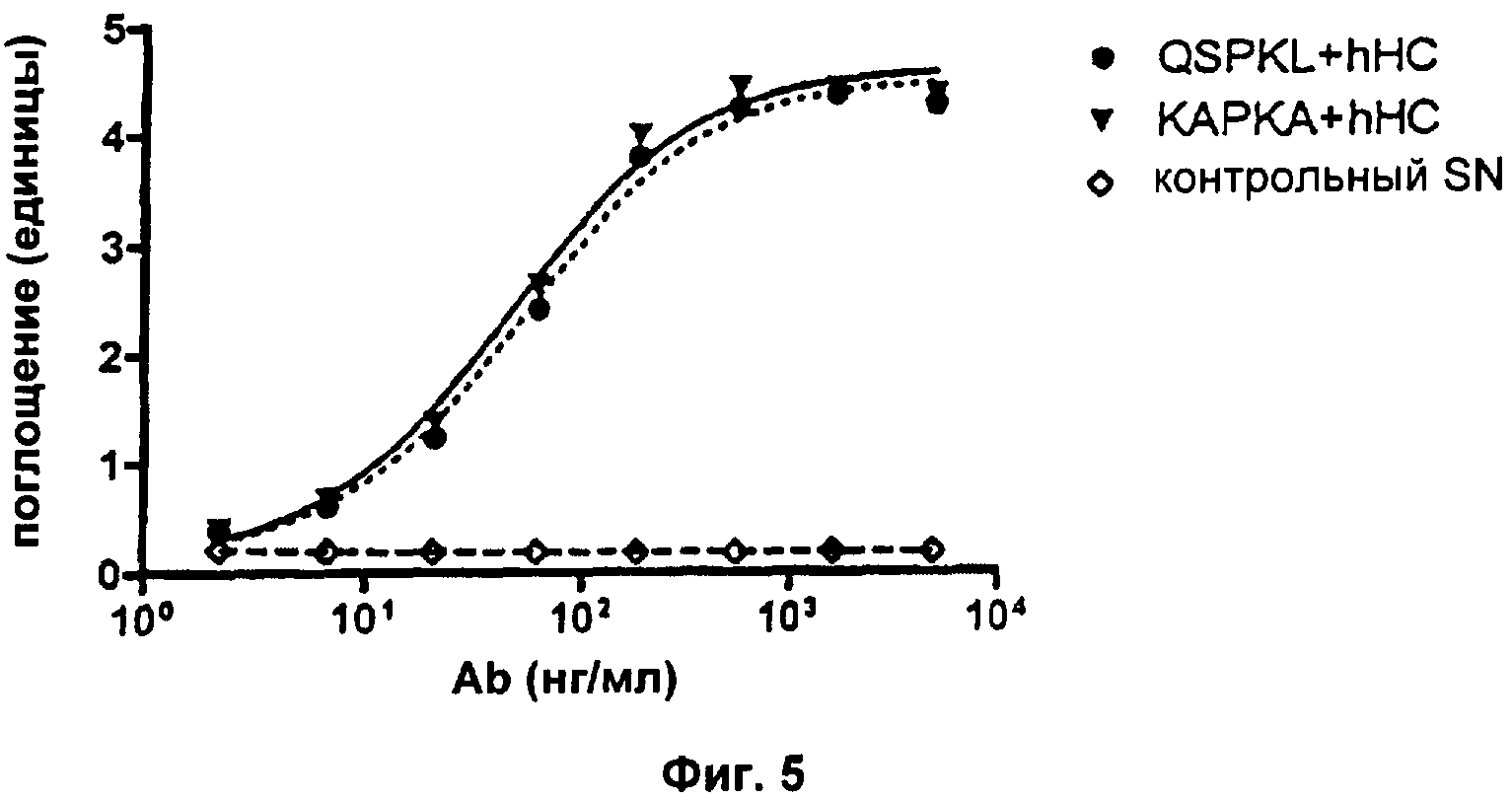
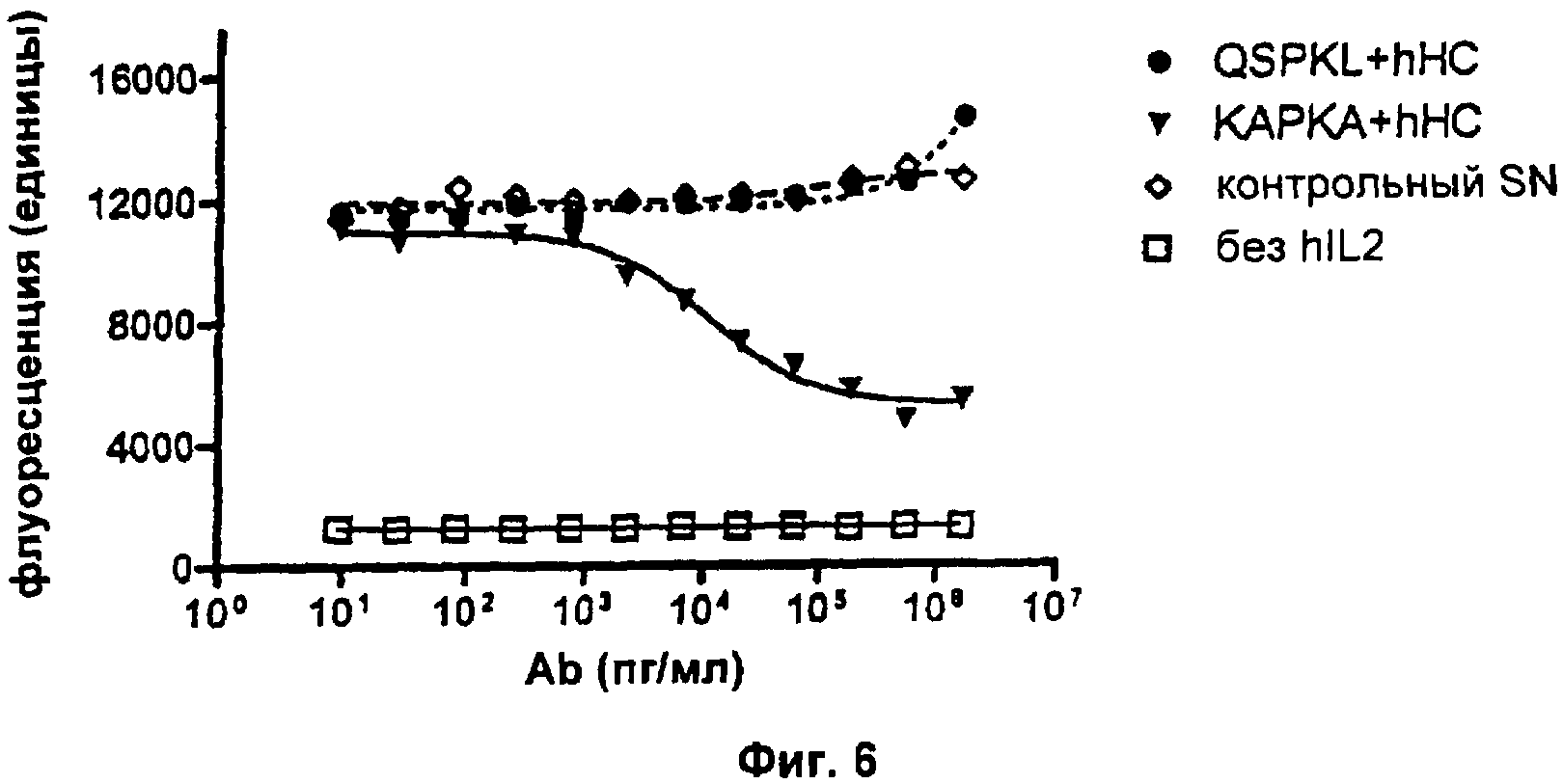
Чтобы определить, являются ли все три аминокислотные замены или только некоторые из них решающими в контексте получения нейтрализующего mAb, выполняли дополнительную серию экспериментов. Для этого аминокислотные остатки QS или А мышиного происхождения повторно вводили в hLC.
Свойства полученных mAb в отношении связывания растворимого антигена и нейтрализации биоактивности IL2 анализировали соответственно с помощью ELISA и анализа пролиферации CTLL-2 (см. Пример 2а выше в отношении подробных экспериментальных протоколов). В эксперименте с ELISA увеличивающиеся единицы поглощения указывают на повышенные количества mAb, связывающегося с антигеном hIL2. В анализе пролиферации CTLL-2 увеличивающиеся единицы флуоресценции указывают на повышенное количество метаболически активных (=живых) клеток. Все клеточные SN, содержащие разные варианты mAb, контролировали на одинаковые концентрации mAb с помощью анти-hIgG ELISA перед тем, как подвергнуть их следующим экспериментам. На Фиг.5 показаны результаты типичного эксперимента. Как можно ясно видеть, оба варианта: QSPKL+hHC и КАРКА+hHC показывают сравнимое связывание с антигеном hIL2. Анализ CTLL-2 (Фиг.6) показывает, что QSPKL+hHC не приводит к какой-либо детектируемой нейтрализации биоактивности hIL2, так как определенная флуоресценция не отличается от контрольного SN. Напротив, KAPKA+hHC снижает количество живых клеток, что очевидно из зависимого от концентрации mAb снижения флуоресценции. Каждая экспериментальная точка в типичном эксперименте, показанном на Фиг.6, представляет собой среднее значение для образцов в двойной повторности. Результаты описанных анализов просуммированы в Таблице 3:
Это показывает, что один аминокислотный остаток, локализованный в каркасной области 2 VL, определяет, нейтрализует ли mAb биоактивность IL2: остаток аланина в этом положении, происходящий из мышиной каркасной области 2, обеспечивает нейтрализацию, а остаток лейцина, происходящий из человеческой каркасной области 2, нет.
Пример 3: Определение способа нейтрализации
Термин "анти-IL2", используемый ниже, означает гуманизированное антитело против IL2, содержащее легкую цепь, содержащую аминокислотную последовательность, представленную в SEQ ID NO:9 (которая сама по себе содержит VL-область с аминокислотной последовательностью, представленной в SEQ ID NO:7), и тяжелую цепь, содержащую аминокислотную последовательность, представленную в SEQ ID NO:10 (которая сама содержит VL-область с аминокислотной последовательностью, представленной в SEQ ID NO:8). VL антитела против IL2 содержит аминокислотную последовательность "КАРКА", как объяснено выше в Примере 2д.2.
Было желательным лучше понять способ нейтрализации hIL2 с помощью анти-IL2. С этой целью провели эксперименты для исследования природы связывания hIL2 с компонентами hIL2-рецептора, с одной стороны, и с анти-IL2, с другой стороны.
Поскольку для выживания NKL-клеток требуется IL2, то можно заключить, что эти клетки действительно экспрессируют функциональный рецептор для IL2. Провели эксперимент с FACS согласно методикам, подробно описанным выше. Кратко, данные клетки инкубировали со смесью анти-hIL2 mAb и видоспецифического вторичного детектирующего антитела ("предварительно приготовленная смесь"). Вторичное антитело было конъюгировано с флуоресцентной меткой. Клеточную флуоресценцию отслеживали в присутствии и в отсутствие NL2 с использованием FACS. Выполняли следующие экспериментальные сценарии для ответа на вопрос, требуется ли определенный порядок инкубации для наблюдаемых эффектов.
В первом сценарии предварительно приготовленную смесь инкубировали в присутствии или в отсутствие hIL2 в течение 30 мин, затем добавляли NKL-клетки. Клеточную флуоресценцию наблюдали hIL2-зависимым образом. Во втором сценарии NKL-клетки инкубировали в присутствии или в отсутствие hIL2 в течение 30 мин, затем добавляли предварительно приготовленную смесь. Снова наблюдали клеточную флуоресценцию hIL-2-зависимым образом. Эти эксперименты демонстрируют, что hIL2 при связывании с анти-IL2 все еще может связываться со своим рецептором, и, кроме того, что hIL2 при ассоциации со своим рецептором все еще может взаимодействовать с анти-IL2.
Эти результаты демонстрируют, что эпитоп hIL2, связанный антителом против IL2, полученным, как описано выше, отличается, по меньшей мере частично, от эпитопа hIL2, связываемого hIL2-рецептором. Это способ нейтрализации примечателен тем, что он подразумевает, что нейтрализация hIL2 может осуществляться путем связывания этой молекулы как в ее растворимой форме, так и в рецептор-связанной форме. Тогда с хронологической точки зрения это означает, что событие связывания между hIL2 и анти-IL2 может происходить либо до, либо после образования комплекса между hIL2 и hIL2-рецептором; в любом случае осуществляется нейтрализация биоактивности hIL2. Поэтому путем экстраполяции можно предположить, что нейтрализация также осуществляется в случае, когда два релевантных события связывания - образование комплекса между hIL2 и hIL2-рецептором и комплекса между hIL2 и анти-IL2 - происходят одновременно.
Следует отметить, что такой способ нейтрализации, какой наблюдается для анти-IL2, резко отличается от других известных способов нейтрализации, при которых эпитоп, связываемый нейтрализующим антителом против лиганда и рецептором к лиганду, является одним и тем же. При таком традиционном сценарии невозможно существование тройного комплекса между лигандом, лиганд-рецептором и нейтрализующим антителом против лиганда. Другими словами, при таком традиционном способе нейтрализации лиганд должен связываться нейтрализующим антителом против лиганда в то время, когда лиганд все еще находится в растворимой форме, так что образование комплекса между лигандом и лиганд-рецептором предотвращается.
Пример 4: IL2-зависимое связывание анти-IL2 с человеческой лимфомной клеточной линией NKL натуральных киллеров
В этом примере исследовали специфичность связывания анти-IL2 с hIL2, ассоциированным с клеточной поверхностью. Родительское Ab против IL2 (mAb202) демонстрировало строго IL2-зависимое связывание с клеточной поверхностью NKL-клеток. Следовательно, это особое свойство должно быть подтверждено для анти-IL2.
NKL-клетки лишали hIL2 на 24 ч перед экспериментом. Анти-IL2 или человеческое контрольное антитело изотипа IgG1 инкубировали в отсутствие или в присутствии 2-кратного молярного избытка hIL2 при 20°С в течение 60 мин. Соответствующие смеси затем добавляли к NKL-клеткам (105 клеток на образец) и затем инкубировали в течение 30 мин на льду. Затем данные клетки тщательно промывали и добавляли флуоресцентно меченое детектирующее антитело козы против IgG человека, с последующей инкубацией в течение 30 мин на льду. Снова промывали клетки и затем подвергали FACS-анализу для исследования клеточно-ассоциированной флуоресценции.
Как и ожидалось, в отсутствие hIL2 не определялось значимой клеточно-ассоциированной флуоресценции как с анти-IL2, так и с контрольным антителом (Фиг.10, левый график). В присутствии hIL2 клеточно-ассоциированная флуоресценция с контрольным антителом не изменялась (Фиг.10, правый график, заштрихованный пик). Напротив, инкубация с hIL2 и анти-IL2 приводила к значительному увеличению флуоресценции (Фиг.10, правый график, обведенный черным пик), что указывает на специфическое IL2-зависимое связывание анти-IL2 с клеточной поверхностью. Таким образом, у анти-IL2 сохранялась способность распознавать hIL2, ассоциированный с клеточной поверхностью. Этот эксперимент обеспечил доказательство того, что анти-IL2 распознает hIL2 не только в растворе, но также распознает hIL2, который ассоциирован с одним или с несколькими компонентами его рецептора. Следовательно, hIL2 может связываться с анти-IL2 и с компонентом(ами) IL2-рецептора невзаимоисключающим образом.
Пример 5: Анти-IL2 отменяет IL2-зависимую повышающую регуляцию экспрессии CD124 на клеточной поверхности клеток CTLL-2
После стимуляции с помощью hIL2 клетки CTLL-2 пролиферируют и в них осуществляется повышающая регуляция экспрессии CD124 на клеточной поверхности (IL-4R альфа) (Puri, R.K., et al. (1990). Immunology 70, 492). Следовательно, клетки CTLL-2 получают повышенную чувствительность к сопутствующей стимуляции через IL-4 посредством IL2-стимула. Следовательно, анти-IL2 может не только ограничивать IL2-опосредованную пролиферацию, но также и воздействовать на экспрессию CD124.
Для проверки этой гипотезы клетки CTLL-2 культивировали в отсутствие hIL2 в течение 12 ч до эксперимента и затем стимулировали с помощью 0,5 нг/мл hIL2 в течение 5 ч в присутствии или в отсутствие титруемых концентраций анти-IL2. Уровни экспрессии CD124 оценивали с помощью FACS-анализа, используя флуоресцентно меченое CD124-специфическое антитело. Средние значения определенных интенсивностей флуоресценции наносили на график относительно разных концентраций анти-IL2 (Фиг.11, незакрашенные квадратики с черной линией); средние значения флуоресценции, зарегистрированные в отсутствие анти-IL2 (Фиг.11, закрашенный ромбик) или в отсутствие IL2 (Фиг.11, закрашенный треугольник), включали в качестве контролей. Как следует из Фиг.11, анти-IL2 снижало экспрессию CD124 дозозависимым способом; IC50, рассчитанная из этого анализа, составляла приблизительно 3,3×10-10 М. Эти данные подразумевают, что анти-IL2 не только воздействует на пролиферацию клеток CTLL-2, но также и на другие IL2-зависимые клеточные реакции, такие как экспрессия CD124.
Пример 6: Анти-IL2 специфически блокирует IL2-сигнальную трансдукцию ниже IL2R в клеточном сигнальном пути
Этот эксперимент проводили для дополнительного исключения возможности того, что анти-IL2 опосредует свои эффекты на hIL2-зависимые клеточные реакции частично с помощью некоторого цитотоксического механизма, и для подтверждения того, что механизм действия анти-IL2 является высокоспецифическим для сигналов, стимулируемых hIL2, но не действует на родственные пути. Среди самых быстрых клеточных событий IL2-опосредованных клеточных сигналов находится фосфорилирование тирозина транскрипционного фактора STAT3 (Leonard, W.J. 2000. IL2 Family Cytokines and their Receptors). Другие цитокины, такие как IL-6, запускают частично перекрывающиеся клеточные сигнальные пути, которые также включают STAT3 (Hemmann, U., et al. (1996). J Biol Chem 271, 12999; Stahl, N., et al. (1995). Science 267, 1349).
Следовательно, анти-IL2 тестировали относительно его эффектов на фосфорилирование тирозина STAT3, запускаемое IL2 и IL6. Лимфоциты периферической крови выделяли из свежей донорской крови, инкубировали в концентрации 2×106 клеток/мл, предварительно стимулировали 48 ч лецитином и затем оставляли в покое в среде на 24 ч до стимуляции. Затем клетки стимулировали насыщающими концентрациями IL2 или IL6/sIL6Rα без mAb, или в присутствии анти-IL2, или изотипического контрольного моноклонального антитела в течение 15 минут. После разделения цитоплазматических экстрактов с помощью ПААГ-ДСН (электрофорез в полиакриламидном геле с додецилсульфатом натрия), исследовали статус фосфорилирования STAT3 с помощью иммуноблоттинга с использованием антитела, специфического к STAT, фосфорилированному по тирозину (Фиг.12, верхняя панель). Для контроля сравнимой загрузки также осуществляли блоттинг на общий белок STAT3 (Фиг.12, нижняя панель). Электрофоретическая подвижность стандартных белков указана на Фиг.12 слева от каждой панели.
Стимуляция как IL2, так и IL6 значительно усиливала клеточное фосфорилирование STAT3 по тирозину в отсутствие анти-IL2 (Фиг.12, полосы 2 и 3 по сравнению с 1 или полосы 6 и 7 по сравнению с 1). Следовательно, анти-IL2 специфически воздействует на фосфорилирование STAT3 по тирозину после IL2 стимуляции, но не после IL6 стимуляции (Фиг.12, дорожка 4 по сравнению с дорожкой 5). Эти данные демонстрируют, что анти-IL2 является высокоспецифическим к вмешательству в биологию hIL2 и не действует на пути, регулируемые другими факторами, и анти-IL2 не обладает очевидными цитотоксическими эффектами.
Пример 7: На эффективность анти-IL2 и даклизумаба дифференциально влияют уровни экспрессии CD25
Ингибиторную активность даклизумаба, гуманизированного mAb против CD25, параллельно сравнивали с ингибиторной активностью анти-IL2 и изотипического контрольного антитела в анализе пролиферации с использованием IL2-зависимой клеточной линии NKL (Фиг.13).
Для исследования эффекта уровней экспрессии CD25 на клеточной поверхности на ингибирование IL2-индуцированной клеточной пролиферации любым из анти-IL2 или даклизумаба NKL-клетки сортировали с помощью FACS по низким или высоким уровням экспрессии CD25, и обе популяции клеток параллельно исследовали в этом эксперименте. mAb против CD25, используемое для FACS-сортировки, не препятствовало связыванию IL2 или даклизумаба с CD25 (данные не показаны). Сразу после сортировки было возможным ясное различение CD25низк. и CD25высок. популяций с помощью FACS; в ходе пятисуточного эксперимента две данные популяции сближались, что приводило к уровням экспрессии CD25, сравнимым с популяциями перед сортировкой. Это подразумевает, что результаты, полученные в этом анализе, отражают только четко разделенные популяции CD25низк. по сравнению с CD25высок. для исходной фазы, но не для более поздних фаз этого эксперимента. Следовательно, различия, которые будут наблюдаться в отношении ингибирования пролиферации антителом против IL2 и даклизумабом при сравнении популяций CD25низк. и CD25высок., ограничены из-за нестабильных уровней экспрессии CD25; все же из этих данных можно вывести четкую тенденцию, указывающую на дифференциальную зависимость эффективности даклизумаба и анти-IL2 от CD25. При подготовке данного эксперимента NKL-клетки испытывали недостаток в hIL2 в течение 16 часов при культивировании в среде, не содержащей hIL2. Использовали конечный объем среды для анализа 200 мкл на лунку, который включал: 1×104 NKL-клеток, 2 нг/мл hIL2 (для обеспечения полумаксимальной пролиферации) и разные моноклональные антитела в титруемых концентрациях. Все образцы готовили в двойной повторности. Инкубации соответствующих смесей происходили в течение 120 часов, затем жизнеспособные клетки визуализировали с использованием флуоресцентного красителя.
В общем, в этом анализе анти-IL2 было более эффективным в нейтрализации IL2-опосредованной пролиферации по сравнению с даклизумабом. Как и предполагалось, на эффективность анти-IL2 не влияли уровни экспрессии CD25: в NKL-клетках CD25низк. и CD25высок. кривые, полученные с анти-IL2, по существу накладывались друг на друга. Напротив, кривые, полученные с даклизумабом, показывают четкое различие в NKL-клетках с CD25низк. по сравнению с CD25высок.. Изотипическое контрольное Ab не оказывало эффекта (Фиг.13). Таким образом, этот эксперимент обеспечил доказательство in vitro, что эффективность даклизумаба, но не анти-IL2, зависит от уровней CD25.
Пример 8: Влияние анти-IL2 или даклизумаба на IL2-зависимую пролиферацию первичных NK-клеток человека
Не только первичные Т-клетки, но также и первичные NK-клетки могут пролиферировать в ответ на IL2-стимуляцию. Таким образом, в дополнительном эксперименте исследовали ингибирование IL2-индуцированной пролиферации свежевыделенных NK-клеток человека.
Данные клетки получали негативным выделением из донорской крови и инкубировали с hIL2 (5,5 нг/мл) в присутствии или в отсутствие титруемого анти-IL2 или даклизумаба. Контрольное антитело использовали только в самой высокой концентрации; другой контроль осуществляли с клетками в отсутствие IL2 и антитела. Жизнеспособные клетки количественно оценивали с использованием флуоресцентного красителя в конце однонедельного периода инкубации. Анти-IL2 в этом эксперименте существенно снижало IL2-индуцированную пролиферацию первичных NK-клеток человека. При высоких концентрациях анти-IL2 пролиферация по существу ограничивается уровнями, наблюдаемыми в отсутствие IL2, что указывает на то, что анти-IL2 влияет на все IL2-отвечающие NK-клетки, присутствующие в данном анализе. Напротив, даклизумаб демонстрировал эффект только со значительно сниженной амплитудой, что говорит о том, что присутствие этого антитела влияло только на фракцию NK-клеток (Фиг.14). Для дальнейшего исследования этой находки отслеживали уровни экспрессии CD25 на протяжении однонедельной инкубации с IL2 и антителами: только примерно 11% из всех NK-клеток показанного донора обнаруживали экспрессию CD25 с максимумом на 3-и сутки и со снижением до 2% на 7-е сутки. Соответственно свежевыделенные NK-клетки от всех доноров не обнаруживали детектируемой экспрессии CD25, и при использовании NK-клеток у всех проанализированных доноров были обнаружены аналогичные уровни и кинетики экспрессии CD25 (данные не показаны). Это объясняло, почему даклизумаб мог ингибировать пролиферацию только фракции NK-клеток (Фиг.14). Анти-IL2 снова продемонстрировало независимость от уровней экспрессии CD25 и блокировало пролиферацию всех NK-клеток со значением IC50 приблизительно 3×10-10 М. Эти результаты строго указывают на то, что анти-IL2, но не даклизумаб, способно препятствовать IL2-опосредованным сигналам через IL2-рецептор CD122/CD132 с промежуточной аффинностью, независимый от CD25.
Пример 9: Влияние анти-IL2 или даклизумаба на IL2-зависимое высвобождение IFN-гамма NK-клетками
Помимо пролиферации типичным и быстрым ответом первичных NK-клеток на стимуляцию цитокином является высвобождение IFN-гамма. Высвобождение последнего, как зависимого от анти-IL2 и от даклизумаба, измеряли в дополнительном эксперименте.
В этом анализе свежевыделенные МК-клетки человека стимулировали смесью, содержащей hIL2 (5,5 нг/мл), hIL12 (5 нг/мл) и hIL18 (5 нг/мл), запуская эффективную продукцию и высвобождение IFN-гамма этими клетками. Сравнивали эффекты титруемого анти-IL2, даклизумаба и изотипического контрольного антитела на высвобождение IFN-гамма в течение первых 48 ч инкубации. И анти-IL2, и даклизумаб снижали экспрессию IFN-гамма дозозависимым способом, тогда как контрольное антитело не оказывало эффекта (Фиг.15). Анти-IL2 представляло собой более мощный ингибитор высвобождения IFN-гамма, имея IC50 приблизительно 1,3×10-10 М по сравнению с приблизительно 1,1×10-9 М для даклизумаба (Фиг.15). В отличие от эксперимента, описанного в предыдущем примере, все NK-клетки в этом эксперименте демонстрировали экспрессию CD25 (данные не показаны), объясняя более глубокий эффект даклизумаба на IFN-гамма по сравнению с пролиферацией NK-клеток.
Таблица 4 обобщает равновесную константу связывания (KD) для анти-IL2 и даклизумаба, а также значения IC50, полученные в параллельных сравнительных экспериментах с обоими Ab, как описано выше в Примерах 8 и 9.
Реферат
Гуманизированное моноклональное антитело и его активный фрагмент по изобретению нейтрализует активность человеческого IL2 путем связывания с указанным человеческим IL2 до, во время и/или после связывания указанного человеческого IL2 с человеческим рецептором IL2. Вариабельная область легкой цепи указанного антитела содержит в ее второй каркасной области последовательность смежных аминокислот КАРКА и дополнительно содержит в CDR1-CDR3 областях аминокислотные последовательности, представленные в SEQ ID NO 1-3, раскрытые в описании, а вариабельная область тяжелой цепи содержит в CDR1-CDR3 областях аминокислотные последовательности, представленные в SEQ ID NO 4-6, раскрытые в описании. В изобретении описана полинуклеотидная молекула, кодирующая антитело по изобретению или его активный фрагмент, фармацевтическая композиция на основе указанного антитела или его активного фрагмента, обладающая нейтрализующим действием в отношении человеческого IL2, а также применение указанного антитела или его активного фрагмента или кодирующей его полинуклеотидной молекулы для изготовления лекарственного средства, которое возможно содержит дополнительный противовоспалительный или противораковый агент для лечения воспалительных заболеваний или опухолевого заболевания соответственно. Изобретение обеспечивает альтернативные специфические ингибиторы активности IL2, которые непосредственно связываются с человеческим IL2. 5 н. и 19 з.п. ф-лы, 15 ил., 4 табл.
Формула
где указанное гуманизированное моноклональное антитело нейтрализует активность человеческого IL2 путем связывания с указанным человеческим IL2 до, во время и/или после связывания указанного человеческого IL2 с человеческим рецептором IL2,
где вариабельная область легкой цепи указанного гуманизированного моноклонального антитела содержит в ее второй каркасной области последовательность смежных аминокислот КАРКА, и
где вариабельная область легкой цепи дополнительно содержит в ее CDR1-области аминокислотную последовательность, представленную в SEQ ID NO:1, в ее СDR2-области аминокислотную последовательность, представленную в SEQ ID NO:2, и в ее CDR3-области аминокислотную последовательность, представленную в SEQ ID NO:3; и где вариабельная область тяжелой цепи содержит в ее CDR1-области аминокислотную последовательность, представленную в SEQ ID NO:4, в ее СDR2-области аминокислотную последовательность, представленную в SEQ ID NO:5, и в ее CDR3-области аминокислотную последовательность, представленную в SEQ ID NO:6.
Документы, цитированные в отчёте о поиске
Самоусиливающиеся фармакологически контролируемыеэкспрессионные системы
Антитела против il-6, композиции, способы и применение

Комментарии