Антитела к человеческому интерлейкину-2 и их применение - RU2745451C1
Код документа: RU2745451C1
Чертежи


Описание
Область техники
Настоящее изобретение имеет отношение к антителу, связывающемуся с человеческим интерлейкином (hIL-2) и, конкретнее, с анти-hIL-2 антителом, которое специфически связывается с конкретным эпитопом hIL-2, таким образом, ингибируя связывание hIL-2 с CD25.
Уровень техники
Интерлейкин-2 (IL-2) представляет собой плейотропный цитокин, играющий существенную роль в выживаемости, экспансии и функционировании различных лимфоцитов, включая Treg (Foxp3+ CD4+ регуляторные T) клетки, естественные клетки-киллеры (NK клетки) и тому подобные, которые экспрессируют IL-2 рецептор. Рецептор интерлейкина-2 (IL-2R) присутствует в виде высокоаффинного IL-2 рецептора (IL-2R) и низкоаффинного IL-2 рецептора (IL-2R) в зависимости от его аффинности. Высокоаффинный IL-2 рецептор состоит из трех цепей, IL-2Rγc (CD132), IL-2Rβ (CD122) и IL-2Rα (CD25), а низкоаффинный IL-2 рецептор состоит только из IL-2Rγc и IL-2Rβ цепей (Boyman, O., et al., Nat Rev Immunol, 2012. 12(3): p. 180-90).
Поскольку IL-2 стимулирует CD8+ T-клетки и NK-клетки с противоопухолевой активностью, он клинически использовался в США и Европе в 1990-х годах для лечения метастатической меланомы и метастатического рака почки (Rosenberg, S.A., J Immunol, 2014. 192(12): p. 5451-8). Однако, IL-2 терапия была эффективной только у 10% пациентов с раком, получавших такое лечение, и вызывала серьезные побочные эффекты. Это связано с тем, что введенный IL-2 имеет очень короткое время полужизни in vivo, при этом CD8 T-клетки и NK-клетки с противоопухолевой активностью экспрессируют низкоаффинный IL-2 рецептор, и, таким образом, требуется введение большого количества IL-2. Именно поэтому тяжелые заболевания множественных органов наступают вследствие синдрома пропотевания жидкости из сосудов и гипотензии (Lotze, M.T., et al., J Immunol, 1985. 134(1): p. 157-66, Schwartz, R.N., et al., Oncology (Williston Park), 2002. 16(11 Suppl 13): p. 11-20). Другая проблема заключается в том, что введение IL-2 вызывает сильное размножение Treg клеток, экспрессирующих высокоаффинный IL-2 рецептор и ингибирующих противоопухолевый иммунитет, опосредованный CD8+ T-клетками и NK-клетками (Brandenburg, S., et al., Eur J Immunol, 2008. 38(6): p. 1643-53; Facciabene, A., et al., Cancer Res, 2012. 72(9): p. 2162-71). Методом преодоления этих отрицательных свойств IL-2 терапии является увеличение in vivo времени полужизни IL-2 и, одновременно, селективное активирование CD8+ T клеток и NK-клеток, которые экспрессируют низкоаффинный IL-2 рецептор. Было предпринято много попыток сделать это, но с небольшим успехом (Arenas-Ramirez, N., et al., Sci Transl Med, 2016. 8(367): p. 367ra166).
В последнее время в качестве решения была предложена модификация аминокислотных остатков IL-2, которые связываются с высокоаффинным IL-2 рецептором. Однако, этот метод имеет ограничение, состоящее в том, что он может предоставить модифицированный IL-2, обладающий иммуногенностью или чувствительностью к протеазам, вызывающим деградацию искусственно введенной аминокислотной последовательности (Levin, A.M., et al., Nature, 2012. 484(7395): p. 529-33).
Соответственно, настоящие изобретатели предприняли экстенсивные усилия для разработки метода, который продлевает in vivo время полужизни IL-2, не вызывая неестественную модификацию IL-2, и вместе с тем селективно активирует CD8+ T-клетки и NK-клетки, экспрессирующие низкоаффинный IL-2 рецептор. В результате, настоящие изобретатели обнаружили, что, когда анти-IL-2 моноклональное антитело (mAb), обладающее конкретной специфичностью, связывается с IL-2, оно селективно ингибирует связывание IL-2 с высокоаффинным IL-2 рецептором, тем самым завершив настоящее изобретение.
Информация, раскрытая в разделе Уровень техники, предназначается только для улучшения понимания уровня техники настоящего изобретения, и поэтому может не содержать информации, составляющей предшествующий уровень техники, который уже может быть известен среднему специалисту в данной области техники.
Раскрытие изобретения
Техническая задача
Цель настоящего изобретения - предоставить анти-hIL-2 антитело или его антигенсвязывающий фрагмент, который специфически связывается с человеческим интерлейкином-2 (hIL-2) и ингибирует связывание hIL-2 с CD25.
Другая цель настоящего изобретения - предоставить нуклеиновую кислоту, кодирующую анти-hIL-2 антитело или его антигенсвязывающий фрагмент, вектор, содержащий нуклеиновую кислоту, клетку, трансформированную вектором, и способ продуцирования анти-hIL-2 антитела или его антигенсвязывающего фрагмента с использованием того же самого.
Еще одна цель настоящего изобретения состоит в предоставлении композиции и способа лечения для предотвращения или лечения рака, который включает анти-hIL-2 антитело или его антигенсвязывающий фрагмент в качестве активного ингредиента.
Следующей целью настоящего изобретения является предоставление биспецифического антитела или конъюгата антитело-лекарственное средство, содержащего анти-hIL-2 антитело или его антигенсвязывающий фрагмент, и композиции и метода лечения для предотвращения или лечения рака, который включает биспецифическое антитело или конъюгат антитело-лекарственное средство в качестве активного ингредиента.
Следующей целью настоящего изобретения является предоставление совместного применения композиции и метода лечения рака, включающей анти-hIL-2 антитело или его антигенсвязывающий фрагмент и ингибитор иммунной контрольной точки.
Техническое решение
Для достижения вышеупомянутой цели настоящее изобретение предоставляет анти-hIL-2 антитело или его антигенсвязывающий фрагмент, содержащий: вариабельный участок тяжелой цепи, включающий CDR1 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 11, CDR2 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 12, и CDR3 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 13; и вариабельный участок легкой цепи, включающий CDR1 легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 14, CDR2 легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 15, и CDR3 легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 16.
Настоящее изобретение также предоставляет нуклеиновую кислоту, кодирующую анти-hIL-2 антитело или его антигенсвязывающий фрагмент, вектор, содержащий нуклеиновую кислоту, клетку, трансформированную этим вектором, и способ получения анти-hIL-2 антитела или его антигенсвязывающего фрагмента с использованием того же самого.
Настоящее изобретение также предоставляет комплекс, в котором анти-hIL-2 антитело или его антигенсвязывающий фрагмент связывается с hIL-2.
Настоящее изобретение также предоставляет композицию и способ для предотвращения или лечения рака, включающую анти-hIL-2 антитело или его антигенсвязывающий фрагмент в качестве активного ингредиента.
Настоящее изобретение также предоставляет биспецифическое антитело или конъюгат антитело-лекарственное средство, содержащий анти-hIL-2 антитело или его антигенсвязывающий фрагмент, и композицию и способ для предотвращения или лечения рака, включающую биспецифическое антитело или конъюгат антитело-лекарственное средство в качестве активного ингредиента.
Настоящее изобретение также предоставляет для совместного применения композицию и способ для лечения рака, включающую анти-hIL-2 антитело или его антигенсвязывающий фрагмент и ингибитор контрольных иммунных точек.
Настоящее изобретение также обеспечивает использование анти-hIL-2 антитела или его антигенсвязывающего фрагмента для предотвращения или лечения рака.
Настоящее изобретение также обеспечивает использование анти-hIL-2 антитела или его антигенсвязывающего фрагмента для приготовления лекарственного препарата для предотвращения или лечения рака.
Настоящее изобретение также предоставляет композицию для увеличения эффективности вакцины, которая содержит анти-hIL-2 антитело или его антигенсвязывающий фрагмент в качестве активного ингредиента.
Краткое описание чертежей
Фиг. 1 показывает результаты тестирования специфичности связывания TCB2 моноклонального антитела к hIL-2.
Фиг. 2 показывает in vivo иммуностимулирующий эффект hIL-2/TCB2 комплекса. Фиг. 2A показывает результаты анализа количества иммунных клеток; фиг. 2B показывает результаты анализа экспрессии CD44 и CD62L в CD4 и CD8 T-клетках; фиг. 2C показывает результаты статистического анализа экспериментов; и фиг. 2D показывает эффект hIL-2/MAB602 или hIL-2/TCB2 комплекса на экспансию иммунных клеток и результаты статистического анализа экспериментов (**p <0.01, ***p <0.001 (двухвыборочный t-критерий для независимых выборок)).
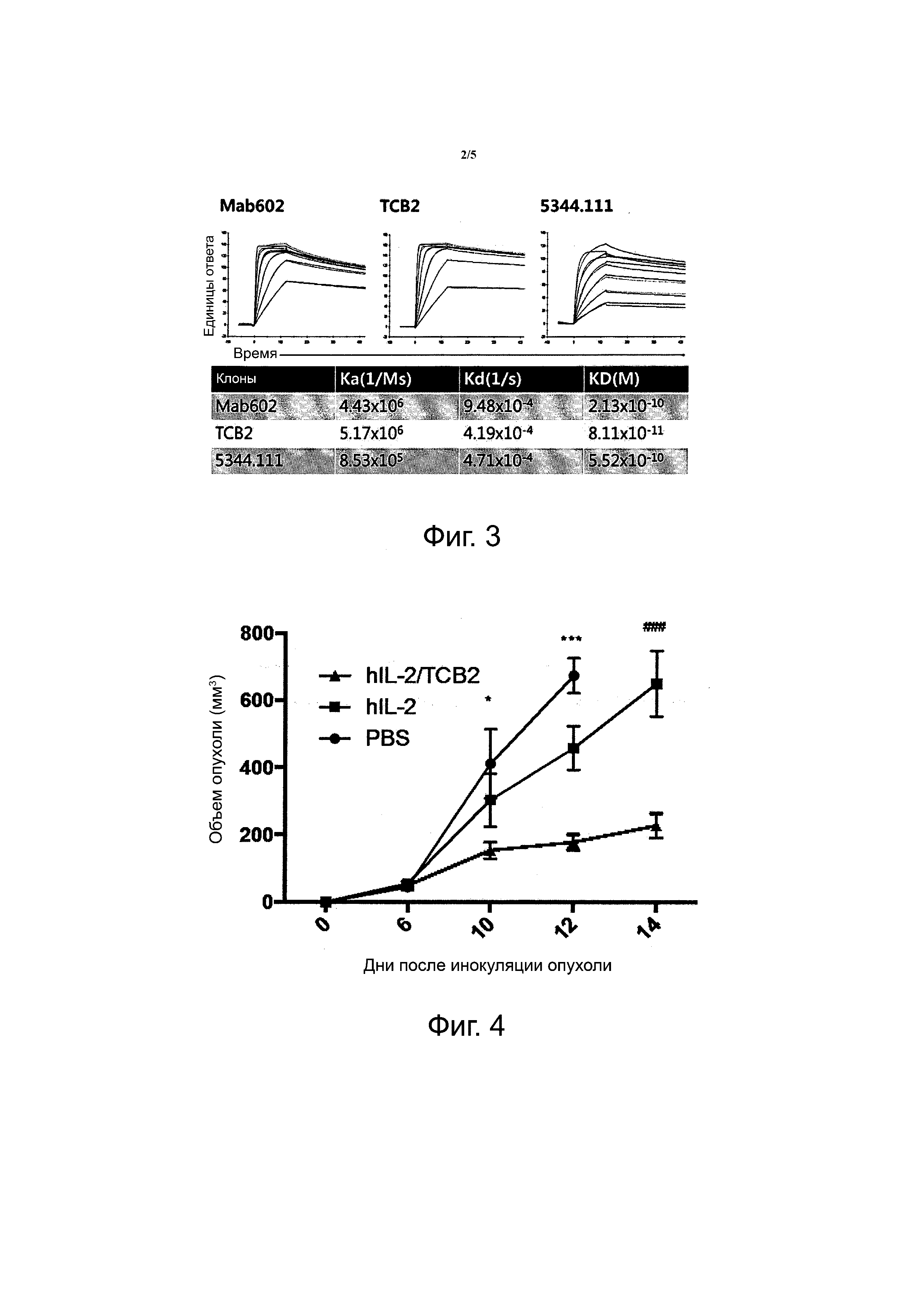
Фиг. 3 показывает кривые поверхностного плазмонного резонанса, полученные с использованием Biacore T100 в отношении аффинности анти-hIL-2 mAbs к hIL-2.
Фиг. 4 показывает эффект hIL-2/TCB2 комплекса против солидной опухоли (***p <0.001 (двухфакторный дисперсионный анализ ANOVA для 12 дня, двухвыборочный t-критерий для независимых выборок для 14 дня)).
Фиг. 5 показывает эффект TCB2 mAb против метастатической опухоли (***p <0.001 (двухвыборочный t-критерий)).
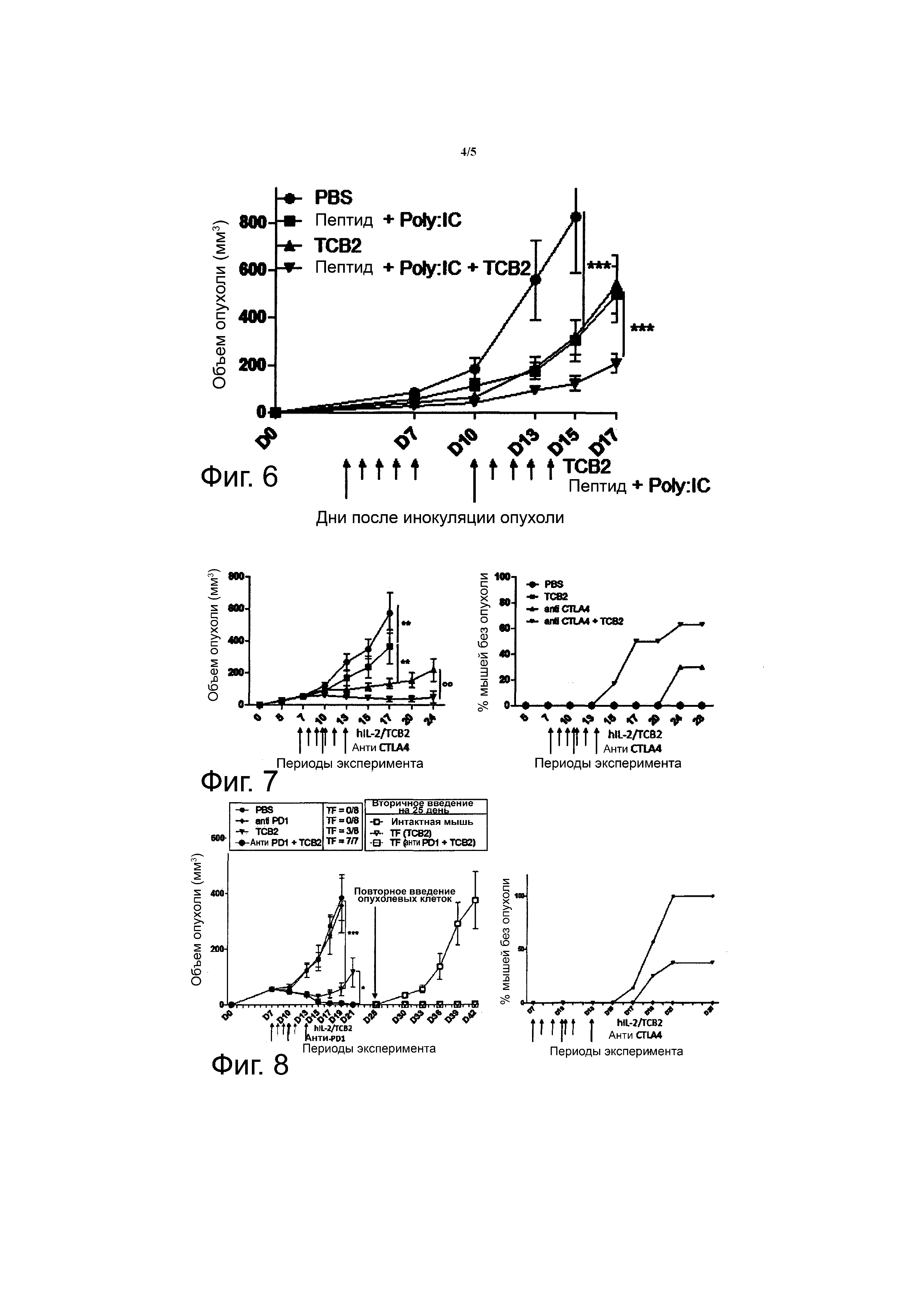
Фиг. 6 показывает противоопухолевый эффект при лечении комбинацией hIL-2/TCB2 комплекса и пептида на B6F10 моделях меланомы (***p <0.001 (двухфакторный дисперсионный анализ ANOVA)).
Фиг. 7 показывает противоопухолевый эффект комбинации hIL-2/TCB2 комплекса и анти-CTLA-4 антитела на CT26 опухолевых моделях (Balb/C рак толстой кишки) (**p <0.01 (двухфакторный дисперсионный анализ на 17 день, двухвыборочный t-критерий на 24 день)).
Фиг. 8 показывает противоопухолевый эффект комбинации hIL-2/TCB2 комплекса и анти-PD-1 антитела на MC38 опухолевых моделях (рак толстой кишки B6) (*p <0.05, **p <0.01 (двухфакторный дисперсионный анализ ANOVA на день 19, двухвыборочный t-критерий на 21 день)).
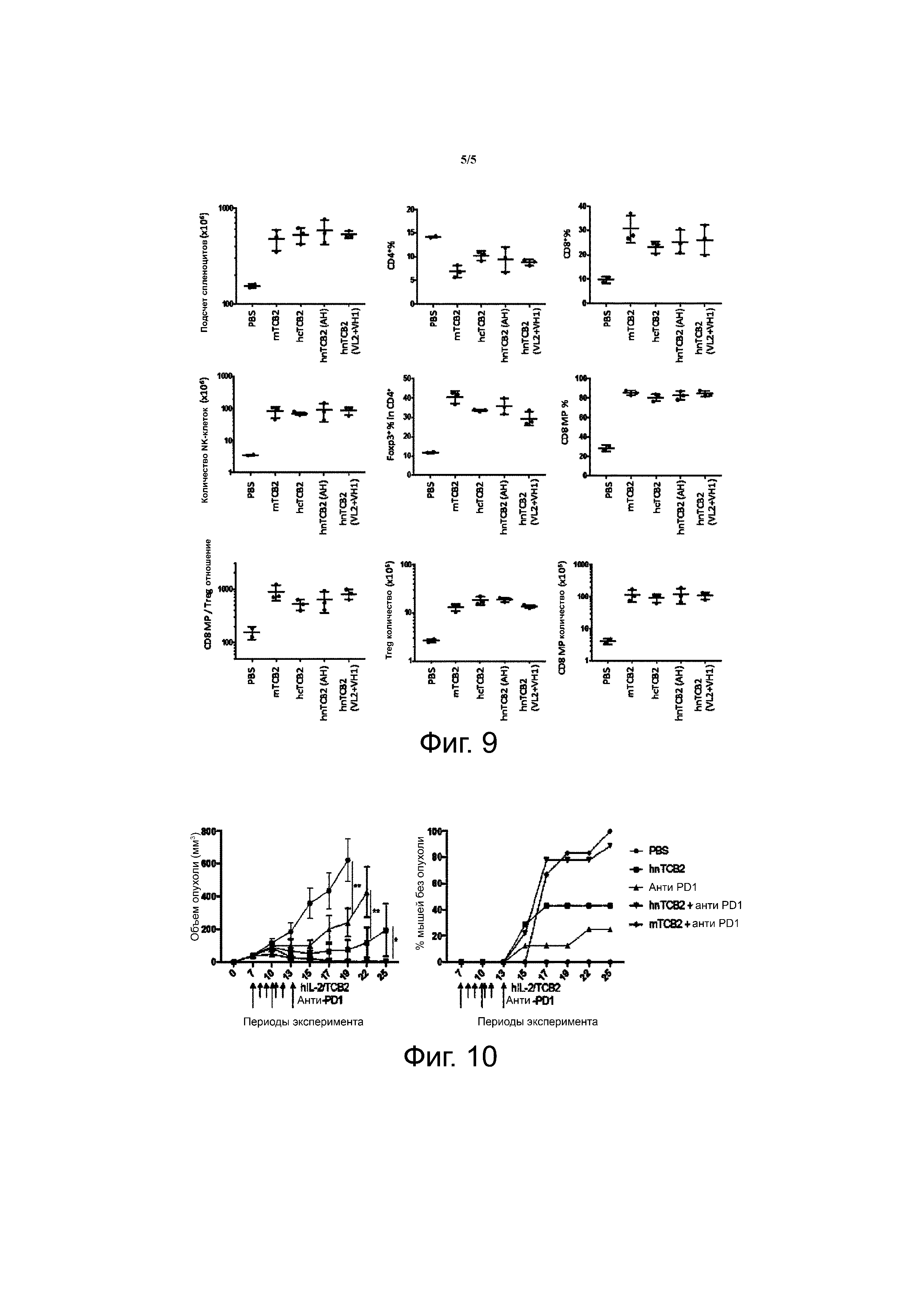
Фиг. 9 показывает in vivo иммуностимулирующую активность hIL-2/hnTCB2 комплекса и результаты статистических анализов экспериментов.
Фиг. 10 показывает противоопухолевый эффект комбинации hIL-2/hnTCB2 комплекса и анти-PD-1 антитела на MC38 опухолевых моделях (B6 рак толстой кишки) (*p <0.05, **p <0.01 (двухфакторный дисперсионный анализ на день 19 и день 22, двухвыборочный t-критерий на 25 день)).
Лучший вариант осуществления изобретения
Если не указано иное, все технические и научные термины, использованные в описании, имеют то же самое значение, которое, как правило, понятно среднему специалисту в области техники, к которой относится настоящее раскрытие. В общем, использованная в описании терминология хорошо известна и повсеместно используется в данной области техники.
В ходе настоящего изобретения были предприняты усилия для разработки способа, который увеличивает in vivo время полужизни IL-2, не вызывая неестественной модификации IL-2, и в то же самое время селективно активирует CD8+ T-клетки и NK-клетки, которые экспрессируют низкоаффинный IL-2 рецептор. В результате было обнаружено, что анти-IL-2 моноклональное антитело (mAb), обладающее конкретной специфичностью, связывается с IL-2, оно селективно ингибирует связывание IL-2 с высокоаффинным IL-2 рецептором.
В одном аспекте, настоящее изобретение относится к анти-hIL-2 антителу (называемому “TCB2” в этом подробном описании) или его антигенсвязывающему фрагменту, которое специфически связывается с человеческим интерлейкином-2 (hIL-2) и ингибирует связывание hIL-2 с CD25.
При использовании в описании термин “человеческий интерлейкин-2 (hIL-2)” имеет отношение к белку из 133 аминокислот (15,4 kDa), не имеющему существенной гомологии последовательности с какими-либо другими факторами.
При использовании в описании термин “CD25” относится к IL-2Rα цепи IL-2 рецептора. IL-2 рецептор присутствует в качестве высокоаффинного IL-2 рецептора (IL-2R) и низкоаффинного IL-2 рецептора (IL-2R) в зависимости от его аффинности, и CD25 представляет собой цепь, которая не присутствует в низкоаффинном IL-2 рецепторе и имеется только в высокоаффинном IL-2 рецепторе.
Термин “антитело”, использованный в изобретении, относится к субстанции, полученной под воздействием стимула антигена в иммунной системе, при этом его разновидности не ограничиваются особенным образом. В последнее время антитела широко используются для лечения болезней. Поскольку антитела являются очень устойчивыми как in vivo, так и in vitro, и имеют длительный период полужизни, они являются подходящими для массивной экспрессии и продуцирования. Кроме того, так как антитело от природы имеет димерную структуру, оно обладает достаточно высокой авидностью. Интактное антитело имеет структуру, включающую две полноразмерные легкие цепи и две полноразмерные тяжелые цепи, при этом каждая легкая цепь связывается с каждой тяжелой цепью через дисульфидную связь. Константная область антитела подразделяется на константную область тяжелой цепи и константную область легкой цепи, при этом константная область тяжелой цепи имеет гамма (γ), мю (μ), альфа (α), дельта (δ) и эпсилон (ε) типы, и имеет гамма1 (γ1), гамма2 (γ2), гамма3 (γ3), гамма4 (γ4), альфа1 (α1) и альфа2 (α2) в качестве их подклассов. Константная область легкой цепи имеет типы каппа (κ) и лямбда (λ).
Антитело в изобретении может включать антитело животного происхождения, химерное антитело, гуманизированное антитело или полностью человеческое антитело. Антитело животного происхождения, которое получают путем иммунизации животного желательным антигеном, в общем может инициировать ответ в виде иммунного отторжения при введении человеку с целью лечения, поэтому было разработано химерное антитело, чтобы подавить такой ответ иммунного отторжения. Химерное антитело формируется путем замещения константной области антитела животного происхождения, которая является причиной антиизотипического ответа, константной областью человеческого антитела с использованием инженерных методов. Химерное антитело обладает существенно улучшенным антиизотипическим ответом по сравнению с антителами животного происхождения, однако аминокислоты животного происхождения все еще присутствуют в его вариабельных участках и таким образом, оно по-прежнему сохраняет в себе способность вызывать побочные действия, возникающие в результате антиидиотипического ответа. Таким образом, это гуманизированное антитело может быть разработано с целью улучшения подобных побочных действий. Это производится путем «пересадки» CDR (определяющих комплементарность областей или гипервариабельных участков) вариабельных участков химерного антитела, которые играют важную роль в связывании антигена на каркасном участке человеческого антитела.
«Гуманизированное антитело» при использовании в описании включает гуманизированный вариабельный домен легкой цепи иммуноглобулина и гуманизированный вариабельный домен тяжелой цепи иммуноглобулина. Гуманизированное антитело может включать константную область, частично или полностью происходящую (включая синтетические аналоги) из одной или больше последовательностей гена человека. Ожидается, что гуманизированное антитело связывается с тем же самым целевым антигеном, как и донорное антитело, которое предоставляет CDR. Как правило, все сегменты или участки гуманизированного антитела или иммуноглобулина, за исключением CDR, являются практически идентичными или в основном гомологичными соответствующим сегментам или участкам консенсусных последовательностей или последовательностей природного происхождения иммуноглобулина человека. В технологии «пересадки» CDR для производства гуманизированного антитела важно выбрать оптимизированное человеческое антитело, которое может получить лучший CDR антитела животного происхождения, и для этой цели используются базы данных антител, анализ кристаллической структуры, методы молекулярного моделирования и т.д. И тем не менее, хотя CDR антитела животного происхождения «пересаживается» в оптимизированный каркас человеческого антитела, существует большое число случаев, когда аффинность связывания антигена не сохраняется, потому что имеются аминокислоты, которые оказывают влияние на связывание антигена, будучи расположенными в каркасе антитела животного происхождения. В этом отношении, может возникнуть необходимость применения дополнительной технологии инженерии антитела для восстановления аффинности связывания антигена.
При использовании в описании термин «моноклональное антитело (mAb)» имеет то же самое значение, которое обычно используется в области техники, к которой относится настоящее изобретение, и означает антитело, распознающее отдельный эпитоп на антигене, с которым он связывается. В этом состоит отличие от поликлонального антитела, которое представляет собой «комплект» разных антител, которые связываются с одним и тем же антигеном, но связываются с разными эпитопами на антигене. Поэтому молекула отдельного антигена может быть связана одновременно с некоторым количеством поликлональных антител, но отдельное моноклональное антитело, специфичное для данного антигена, может связываться только с одной молекулой. После связывания отдельной молекулой моноклонального антитела, связанный эпитоп блокируется, и таким образом более не связывается другими моноклональными антителами. Моноклональная природа антител подходит, в частности, для использования их в качестве терапевтических средств. Это связано с тем, что эти антитела являются отдельными гомологичными разновидностями молекул, и поэтому могут быть очень хорошо охарактеризованы, могут продуцироваться воспроизводимым образом и могут быть очищены. Эти факторы делают возможным продуцирование продуктов, биологическая активность которых может быть предсказана с очень высоким уровнем точности. Эти факторы особенно важны, потому что эти молекулы должны получать разрешение от официальных органов для терапевтического введения млекопитающим, в частности, человеку.
Термин «тяжелая цепь» при использовании в описании включает полноразмерную тяжелую цепь, содержащую вариабельный участок VH домен, включающий аминокислотную последовательность, имеющую последовательность вариабельного участка, достаточную для обеспечения специфичности к антигену, три константных участка CH1, CH2 и CH3 домены, и шарнирный участок, и ее фрагмент. Также термин «легкая цепь» при использовании в описании включает полноразмерную легкую цепь, включая вариабельный участок VL домена, содержащий аминокислотную последовательность, имеющую последовательность вариабельного участка, достаточную для обеспечения специфичности к антигену, и константный участок CL домен, и ее фрагмент.
В настоящем изобретении анти-hIL-2 антитело или его антигенсвязывающий фрагмент может содержать: вариабельный участок тяжелой цепи, включающий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NOS: 3, 23, 28, 32 и 34; и вариабельный участок легкой цепи, включающий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NOS: 4, 24, 26 и 30. Предпочтительно, Анти-hIL-2 антитело или его антигенсвязывающий фрагмент может содержать: вариабельный участок тяжелой цепи SEQ ID NO: 3 и вариабельный участок легкой цепи SEQ ID NO: 4; вариабельный участок тяжелой цепи SEQ ID NO: 23 и вариабельный участок легкой цепи SEQ ID NO: 24; вариабельный участок тяжелой цепи SEQ ID NO: 28 и вариабельный участок легкой цепи SEQ ID NO: 26; вариабельный участок тяжелой цепи SEQ ID NO: 32 и вариабельный участок легкой цепи SEQ ID NO: 30; или вариабельный участок тяжелой цепи SEQ ID NO: 34 и вариабельный участок легкой цепи SEQ ID NO: 30.
При использовании в описании термин «участок, определяющий комплементарность или гипервариабельный участок (CDR)» имеет отношение к аминокислотной последовательности гипервариабельного участок тяжелой цепи или легкой цепи иммуноглобулина. Каждая из тяжелых и легких цепей может содержать три CDR (т.е. CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи; и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи). CDR обеспечивает важные связывающие остатки для связывания антитела с антигеном или эпитопом.
В настоящем изобретении анти-hIL-2 антитело или его антигенсвязывающий фрагмент может содержать: вариабельный участок тяжелой цепи, включающий CDR1 тяжелой цепи, содержащий последовательность ДНК SEQ ID NO: 5, CDR2 тяжелой цепи, содержащий последовательность ДНК SEQ ID NO: 6, и CDR3 тяжелой цепи, содержащий последовательность ДНК SEQ ID NO: 7; и вариабельный участок легкой цепи, включающий CDR1 легкой цепи, содержащий последовательность ДНК SEQ ID NO: 8, CDR2 легкой цепи, содержащий последовательность ДНК SEQ ID NO: 9, и CDR3 легкой цепи, содержащий последовательность ДНК SEQ ID NO: 10.
В настоящем изобретении анти-hIL-2 антитело или его антигенсвязывающий фрагмент может содержать: вариабельный участок тяжелой цепи, включающий CDR1 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 11, CDR2 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 12, и CDR3 тяжелой цепи, содержащий аминокислотную последовательность SEQ ID NO: 13; и вариабельный участок легкой цепи, содержащий CDR1 легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 14, CDR2 легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 15, и CDR3 легкой цепи, содержащий аминокислотную последовательность SEQ ID NO: 16.
При использовании в описании термин «специфическое связывание» имеет то же самое значение, которое известно среднему специалисту в данной области техники, и указывает, что антиген и антитело специфически взаимодействуют друг с другом, приводя к иммунологическому ответу. В настоящем изобретении человеческое моноклональное антитело или его фрагмент обладает способностью отличать человеческий IL-2 (hIL-2) от некоторых других потенциальных антигенов. Обеспечивается такая способность к различению тем, что моноклональное антитело или его фрагмент связывается только или в значительной степени с hIL-2 как с возможным партнером по связыванию в пуле множества различным антигенов. В этом отношении, “связывается в значительной степени с hIL-2” означает, что hIL-2 в качестве возможного партнера по связыванию в пуле множества равнодоступных различных антигенов связывается с аффинностью, по меньшей мере, в 10 раз, предпочтительно 50 раз, предпочтительно 100 раз более высокой, чем антигены, отличные от hIL-2.
При использовании в описании термин «антигенсвязывающий фрагмент», который является фрагментом полной структуры иммуноглобулина, имеет отношение к отдельному полипептиду, содержащему участок, с которым может связываться антиген. Например, это может быть scFv, (scFv)2, Fab, Fab′ или F(ab′)2, но без ограничения этим. Из числа перечисленных выше антигенсвязывающих фрагментов, Fab, который является структурой, имеющей вариабельные участки легкой цепи и тяжелой цепи, константный участок легкой цепи и первый константный участок (CH1) тяжелой цепи, имеет один антигенсвязывающий участок. Fab′ отличается от Fab тем, что Fab′ имеет шарнирный участок, включающий, по меньшей мере, один остаток цистеина на C-конце CH1домена тяжелой цепи. F(ab′)2образуется в том случае, когда остатки цистеина на шарнирном участке Fab′ соединяются дисульфидной связью. Fv представляет собой минимальный фрагмент антитела, имеющий только вариабельные участки тяжелой цепи и вариабельные участки легкой цепи, и рекомбинантная технология получения Fv фрагмента хорошо известна в данной области техники. Двухцепочечный Fv может иметь структуру, в которой вариабельные участки тяжелой цепи связываются с вариабельными участками легкой цепи нековалентной связью, и одноцепочечный Fv может образовывать димерную структуру как в двухцепочечном Fv, при этом вариабельные участки тяжелой цепи ковалентно связываются с вариабельными участками легкой цепи посредством пептидного линкера или вариабельные участки тяжелой и легкой цепи непосредственно соединяются друг с другом на их C-концах. Линкер может быть пептидным линкером, содержащим от 1 до 100 или от 2 до 50 любых аминокислот, и их собственные последовательности известны в данной области техники. Антигенсвязывающий фрагмент можно получить с помощью протеазы (например, целое антитело может быть обработано папаином для получения Fab фрагментов, или может быть обработано пепсином для получения F(ab′)2фрагментов), или он может быть получен с помощью рекомбинантной генетической технологии. Антигенсвязывающий фрагмент антитела настоящего изобретения может быть фрагментом, содержащим один или более CRDs.
В настоящем изобретении анти-hIL-2 антитело или его антигенсвязывающий фрагмент может индуцировать экспансию CD8+ T-клеток и NK-клеток. В примере настоящего изобретения было обнаружено, что анти-hIL-2 антитело согласно настоящему изобретению вызывало активацию CD8+ T-клеток и NK-клеток и индуцировало незначительную экспансию Treg клеток.
В другом аспекте настоящее изобретение имеет отношение к нуклеиновой кислоте, кодирующей анти-hIL-2 антитело или его антигенсвязывающий фрагмент.
В настоящем изобретении нуклеиновая кислота, кодирующая анти-hIL-2 антитело или его антигенсвязывающий фрагмент, может содержать последовательность SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 25, SEQ ID NO: 27, SEQ ID NO: 29, SEQ ID NO: 31 или SEQ ID NO: 33. Конкретнее, нуклеиновая кислота, кодирующая тяжелую цепь антитела согласно настоящему изобретению, может содержать последовательность SEQ ID NO: 27, 31 или 33, и/или нуклеиновая кислота, кодирующая легкую цепь антитела согласно настоящему изобретению, может содержать последовательность SEQ ID NO: 2, 25 или 29.
Антитело или его антигенсвязывающий фрагмент настоящего изобретения может продуцироваться рекомбинантным путем посредством изолирования нуклеиновой кислоты, кодирующей антитело или его антигенсвязывающий фрагмент. Нуклеиновую кислоту изолируют и «вставляют» в реплицируемый вектор, чтобы далее привести к клонированию (амплификации ДНК) или экспрессии.
При использовании в описании термин «нуклеиновая кислота» имеет широкое значение, включающее ДНК (гДНК и кДНК) и РНК молекулы. Нуклеотиды, основные элементы нуклеиновых кислот, включают природные нуклеотиды, а также аналоги, в которых сахар или основание являются модифицированными. Последовательность нуклеиновой кислоты, кодирующая вариабельные участки тяжелой и легкой цепи настоящего изобретения, может быть модифицирована. Такие модификации включают вставку, делецию или неконсервативную замену или консервативную замену нуклеотидов.
Нуклеиновая кислота настоящего изобретения включает последовательность нуклеотидов, которая демонстрирует значительную степень идентичности с нуклеотидной последовательностью. Значительная степень идентичности подразумевает последовательность нуклеотидов, демонстрирующую, по меньшей мере, 80% гомологию, более предпочтительно, по меньшей мере, 90% гомологию и наиболее предпочтительно, по меньшей мере, 95% гомологию при выравнивании нуклеотидной последовательности настоящего изобретения с любой другой последовательностью насколько возможно и анализе выровненной последовательности при помощи алгоритмов, широко используемых в данной области техники.
ДНК, кодирующая антитело, может быть легко выделена или синтезирована при помощи общепринятых методов (например, с использованием олигонуклеотидного зонда, способного специфически связываться с ДНК, кодирующей тяжелую цепь и легкую цепь антитела).
В следующем аспекте настоящее изобретение имеет отношение к рекомбинантному вектору, содержащему нуклеиновую кислоту.
Многие векторы являются доступными. Компоненты вектора обычно включают, но не ограничиваясь этим, одно или более из следующего: сигнальную последовательность, точку начала репликации, один или более маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
Термин «вектор» при использовании в описании включает плазмидный вектор; космидный вектор; бактериофаговый вектор и вирусный вектор, например, аденовирусный вектор, ретровирусные векторы и аденоассоциированные вирусные векторы, предназначенные для экспрессии целевых генов в клетке-хозяине. Нуклеиновая кислота, кодирующая антитело, в векторе является функционально связанной с промотором.
При использовании в описании термин «функционально связанный» имеет отношение к функциональной связи между нуклеиновокислотной последовательностью контроля экспрессии (например, набор из промотора, сигнальной последовательности, или сайта связывания фактора регуляции транскрипции) и другой нуклеиновокислотной последовательностью, и таким образом контролирующая последовательность контролирует транскрипцию и/или трансляцию другой нуклеиновокислотной последовательности.
В том случае, когда прокариотическая клетка используется в качестве хозяина, как правило, включаются сильный промотор, способный к стимулированию транскрипции (такой как tac промотор, lac промотор, lacUV5 промотор, lpp промотор, pLλ промотор, pRλ промотор, rac5 промотор, amp промотор, recA промотор, SP6 промотор, trp промотор и T7 промотор), сайт связывания рибосом для инициации трансляции и последовательность терминации транскрипции/трансляции. Затем, например, в том случае, когда эукариотическая клетка используется в качестве хозяина, промотор происходящий из генома клетки млекопитающего (например, промотор металлотионеина, β-актиновый промотор, промотор гемоглобина человека и креатиновый промотор мышц человека) или промотор, происходящий от вируса млекопитающего, (например, поздний аденовирусный промотор, 7.5K промотор вируса коровьей оспы, SV40 промотор, промотор цитомегаловируса (CMV), HSV tk промотор, промотор вируса опухоли молочной железы мышей (MMTV), HIV LTR промотор, промотор вируса Эпштейна-Барр (EBV), промотор вируса Молоуни и промотор вируса саркомы Рауса (RSV)) может использоваться и, как правило, имеет последовательность полиаденилирования в качестве последовательности терминации транскрипции.
Необязательно вектор может быть соединен с другой последовательностью для того, чтобы облегчить очистку экспрессированного антитела. Объединенные (слитые) последовательности включают, например, глутатион S-трансферазу (Pharmacia, USA), мальтозо-связывающий белок (NEB, США), FLAG (IBI, USA) и 6× His (гексагистидин; Quiagen, США).
Векторы включают ген устойчивости к антибиотикам, обычно используемый в данной области техники в качестве селективного маркера, и могут включать, например, гены, обусловливающие резистентность к ампициллину, гентамицину, карбенициллину, хлорамфениколу, стрептомицину, канамицину, генетицину, неомицину и тетрациклину.
В еще одном аспекте настоящее изобретение имеет отношение к клетке, трансформированной рекомбинантным вектором. Клетки, используемые для продуцирования антитела настоящего изобретения, могут быть прокариотическими клетками, дрожжевыми клетками или другими высшими эукариотическими клетками, однако, без ограничения этим.
В настоящем изобретении в качестве трансформированной клетки может использоваться прокариотическая клетка-хозяин, например, штамм, относящийся к роду Bacillus, такой как Escherichia coli, Bacillus subtilis и Bacillus thuringiensis, Streptomyces, Pseudomonas (например, Pseudomonas putida), Proteus mirabilis и Staphylococcus (например, Staphylococcus carnosus).
Вместе с тем, заинтересованность в клетках животных является наиболее значительной, и примерами используемых линий клеток-хозяев могут быть, но без ограничения этим, COS-7, BHK, CHO, CHOK1, DXB-11, DG-44, CHO/-DHFR, CV1, COS-7, HEK293, BHK, TM4, VERO, HELA, MDCK, BRL 3A, W138, Hep G2, SK-Hep, MMT, TRI, MRC 5, FS4, 3T3, RIN, A549, PC12, K562, PER.C6, SP2/0, NS-0, U205 или HT1080.
В следующем аспекте настоящее изобретение имеет отношение к способу получения анти-hIL-2 антитела или его антигенсвязывающего фрагмента, включающему культивирование клетки, экспрессирующей при этом анти-hIL-2 антитело или его антигенсвязывающий фрагмент согласно настоящему изобретению.
Клетки могут культивироваться в различных средах. Коммерчески доступные среды могут использоваться в качестве среды для культивирования без ограничения. Все другие необходимые добавки, известные специалистам в данной области техники, могут включаться в подходящих концентрациях. Условия культивирования, например, температура и pH, которые используются вместе с отобранными для экспрессии клетками-хозяевами, известны специалистам в данной области техники.
После выделения (восстановления) антитела или его антигенсвязывающего фрагмента загрязняющие вещества можно удалить, например, путем центрифугирования или ультрафильтрования, и полученный в результате продукт может быть очищен, например, с помощью аффинной хроматографии. Могут использоваться дополнительные методики очистки, такие как анионо- или катионообменная хроматография, хроматография гидрофобного взаимодействия и гидроксиапатитная хроматография.
В следующем аспекте настоящее изобретение имеет отношение к комплексу, в котором анти-hIL-2 антитело или его антигенсвязывающий фрагмент связывается с hIL-2.
В еще одном аспекте настоящее изобретение имеет отношение к конъюгату антитело-лекарственное средство (ADC), содержащему лекарственное средство, конъюгированное с анти-hIL-2 антителом или его антигенсвязывающим фрагментом.
Для конъюгата антитело-лекарственное средство (ADC) необходимо, чтобы противоопухолевое лекарственное средство было устойчиво связано с антителом до того, как противоопухолевое средство доставляется в целевые раковые клетки. Лекарственное средство, доставленное в «цель» должно освобождаться от антитела и вызывать гибель клеток-мишеней. Для этой цели лекарственное средство должно быть устойчиво связано с антителом и, вместе с этим, должно обладать достаточной цитотоксичностью, чтобы вызывать смерть клеток-мишеней при отделении от антитела.
В настоящем изобретении анти-hIL-2 антитело или его антигенсвязывающий фрагмент и цитотоксические вещества, включая лекарственные средства, такие как противоопухолевые лекарственные средства, могут быть связаны друг с другом, например, ковалентной связью, пептидной связью или тому подобным, так что они могут использоваться в виде конъюгатов или гибридных белков (для случаев, когда цитотоксические вещества и/или маркирующие вещества являются протеинами). Цитотоксическое вещество может быть любой субстанцией, обладающей токсичностью в отношении раковых клеток, в частности, клеток солидного рака, и может быть одним или более, выбранным из группы, состоящей, но без ограничения, из радиоизотопов, цитотоксических соединений (малых молекул), цитотоксических белков, противоопухолевых средств и тому подобного. Цитотоксические белки могут быть одним или более, выбранными из группы, состоящей, но без ограничения, из рицина, сапорина, гелонина, момордина, дебоуганина, дифтерийного токсина и токсина синегнойной палочки. Радиоизотопы могут быть одним или более, выбранным из группы, состоящей, но без ограничения, из 131I, 188Rh и 90Y. Цитотоксические соединения могут быть одним или более, выбранным из группы, состоящей, но без ограничения, из дуокармицина, монометил ауристатина E (MMAE), монометил ауристатина F (MMAF), N2'-деацетил-N2'-(3-меркапто-1-оксопропил)майтансина (DM1) и PBD(пирролобензодиазепин) димера.
В настоящем изобретении конъюгат антитело-лекарственное средство можно получить согласно методу, хорошо известному в области техники, к которой относится настоящее изобретение.
В настоящем изобретении конъюгат антитело-лекарственное средство, может представлять собой такой конъюгат, в котором антитело или его антигенсвязывающий фрагмент связывается с лекарственным средством при помощи линкера.
В настоящем изобретении линкер может быть расщепляемым линкером или нерасщепляемым линкером.
Линкер представляет собой участок, соединяющий анти-hIL-2 антитело и лекарственное средство. Например, линкеру придается такая конфигурация, которая подвергается расщеплению при внутриклеточных условиях, то есть лекарственное средство может освобождаться от антитела путем расщепления линкера во внутриклеточном окружающем пространстве.
Линкер может быть расщеплен при помощи расщепляющего агента, присутствующего во внутриклеточном окружающем пространстве, например, лизосоме или эндосоме. Линкер может быть пептидным линкером, который может быть расщеплен внутриклеточной пептидазой или протеазой, например, протеазой лизосомы или эндосомы. В большинстве случаев пептидный линкер имеет в длину, по меньшей мере, две аминокислоты. Расщепляющие агенты включают катепсин B, катепсин D и плазмин, способные гидролизовать пептид, чтобы обеспечить возможность высвобождения лекарственного средства в целевых клетках. Пептидный линкер может быть расщеплен тиолзависимой протеазой катепсином B, которая высоко экспрессируется в злокачественной опухолевой ткани. Например, линкер, используемый в настоящем изобретении, может быть Phe-Leu или Gly-Phe-Leu-Gly линкером. Кроме того, пептидный линкер также может быть Val-Cit или Phe-Lys линкером, расщепляемым, например, внутриклеточной протеазой.
В настоящем изобретении расщепляемый линкер является pH-чувствительным, т.е., подверженным гидролизу при определенных значениях pH. Как правило, pH-чувствительный линкер поддается гидролизу при кислых условиях. Например, может использоваться кислото-неустойчивый линкер, который подвергается гидролизу в лизосоме (например, гидразон, семикарбазон, тиосемикарбазон, цис-аконитовый амид, ортоэфир, ацеталь, кеталь или тому подобное).
Линкер является расщепляемым при восстанавливающих условиях (например, дисульфидный линкер). Целый ряд дисульфидных линкеров может быть образован при использовании SATA (N-сукцинимидил-S-ацетилтиоацетата), SPDP (N-сукцинимидил-3- (2-пиридилдитио)пропионата), SPDB (N-сукцинимидил-3-(2-пиридил-дитио)бутирата) и SMPT (N-сукцинимидил-оксикарбонил-альфа-метил-альфа-(2-пиридил-дитио)толуола).
В настоящем изобретении лекарственное средство и/или лекарственное средство-линкер могут соединяться случайным образом через лизин антитела или могут быть конъюгированы через цистеин, который становится доступным при восстановлении цепочки дисульфидной связи. В некоторых случаях, линкер и лекарственное средство могут связываться через цистеин, присутствующий в генно-инженерной метке, например, пептиде или белке. Генно-инженерная метка, например, пептид или белок, может включать аминокислотный мотив, который может распознаваться, например, изопреноидной трансферазой. Вышеупомянутый пептид или протеин имеет делецию на карбокси-конце пептида или протеина, или имеет вставку на карбокси (C) конце пептида или протеина за счет использования ковалентного связывания с единицей спейсера. Пептид или протеин может ковалентно связываться непосредственно с аминокислотным мотивом или может ковалентно связываться с аминокислотным мотивом при помощи ковалентного связывания с единицей спейсера. Аминокислотная единица спейсера состоит из 1 - 20 аминокислот, и представляет собой единицу глицина.
Линкер может включать бета-глюкуронидный линкер, который распознается и гидролизуется β-глюкуронидазой, присутствующей в лизосомах или экспрессируемой на высоких уровнях в некоторых опухолевых клетках. В отличие от пептидного линкера, бета-глюкуронидный линкер имеет преимущество, заключающееся в том, что он обладает высокой гидрофильностью, и, таким образом, может повышать растворимость конъюгата антитело-лекарственное средство, когда он связывается с высокогидрофобным лекарственным средством.
Кроме того, линкер может быть нерасщепляемым линкером. В этом случае лекарственное средство может высвобождаться только за одну стадию (гидролиза антитела), продуцируя таким образом, например, конъюгат аминокислота-линкер-лекарственное средство. Линкер такого типа может быть тиоэфиром или малеимидокапроилом и может сохранять свою стабильность в крови.
В настоящем изобретении лекарственное средство может быть химиотерапевтическим средством, токсином, микро РНК (miРНК), siРНК, shРНК или радиоизотопом. Лекарственное средство, иначе говоря, композиция, демонстрирующая фармакологическое действие, может быть конъюгировано с антителом.
Химиотерапевтическое средство может быть цитотоксическим средством или ингибитором иммунной контрольной точки. Конкретнее, химиотерапевтическое средство включает химиотерапевтическое средство, способное функционировать в качестве ингибитора микротрубочек, ингибитора митоза, ингибитора топоизомераз или ДНК-интеркалятора. В дополнение к этому, химиотерапевтическое средство может включать иммуномодулирующее соединение, противоопухолевое средство, противовирусное средство, антибактериальное средство, противогрибковое средство, противопаразитарное средство или их комбинацию.
Лекарственное средство может быть одним или более, выбранным из группы, состоящей, но без ограничения, из, например, майтансиноида, ауристатина, аминоптерина, актиномицина, блеомицина, талисомицина, камптотецина, N8-ацетил спермидина, 1-(2-хлорэтил)-1,2-метилсульфонил гидразина, эсперамицина, этопозида, 6-меркаптопурина, доластатина, трикотецена, калихеамицина, таксола, таксана, паклитакселя, доцетакселя, метотрексата, винкристина, винбластина, доксорубицина, мелфалана, митомицина Ф, митомицина С, хлорамбуцила, дуокармицина, L-аспарагиназы, меркаптопурина, тиогуанина, гидроксимочвины, цитарабина, циклофосфамида, ифосфамида, нитрозомочевины, цисплатина, карбоплатина, митомицина, дакарбазина, прокарбазина, топотекана, производных азотистого иприта, цитоксана, этопозида, 5-фторурацила, бисхлорэтилнитрозомочевины (BCNU), иринотекана, камптотецина, блеомицина, идарубицина, даунорубицина, дактиномицина, пликамицина, митоксантрона, аспарагиназы, винорельбина, хлорамбуцила, мелфалана, кармустина, ломустина, бусульфана, треосульфана, декарбазина, этопозида, тенипозида, топотекана, 9-аминокамптотецина, криснатола, митомицина C, триметрексата, микофеноловой кислоты, тиазофурина, рибавирина, 5-этинил-1-бета-D-рибофуранозилимидазол-4-карбоксамид (EICAR), гидроксимочевины, дефероксамина, флоксуридина, доксифлуридина, ралтитрекседа, цитарабина (ара C), цитозин арабинозида, флударабина, тамоксифена, ралоксифена, мегестрола, госерелина, лейпролида ацетата, флутамида, бикалутамида, EB1089, CB1093, KH1060, вертепорфина, фталоцианина, фотосенсибилизатора Pe4, диметокси гипокреллина A, интерферона-α, интерферона-γ, фактора некроза опухоли, гемцитабина, велкада, ревамида, таламида, ловастатина, 1-метил-4-фенилпиридиниумиона, стауроспорина, актиномицина D, дактиномицина, блеомицина A2, блеомицина B2, пепломицина, эпирубицина, пирарубицина, зорубицина, митоксантрона, верапамила и тапсигаргина, нуклеазы и токсинов, происходящих от бактерий или животных/растений.
В настоящем изобретении лекарственное средство может включать одну или более нуклеофильных групп, выбранных из группы, состоящей из амина, тиола, гидроксила, гидразида, оксима, гидразина, тиосемикарбазона, гидразин карбоксилата и арил-гидразидных групп, которые могут вступать в реакции с формированием ковалентных связей с линкером и электрофильной группой на линкерном реагенте.
В другом дополнительном аспекте настоящее изобретение имеет отношение к биспецифическому антителу, содержащему анти-hIL-2 антитело или его антигенсвязывающий фрагмент.
В настоящем изобретении биспецифическое антитело означает форму антитела, в которой одно из двух плечей антитела содержит анти-hIL-2 антитело или его антигенсвязывающий фрагмент согласно настоящему изобретению, а другое плечо содержит или антитело, специфическое для антигена, отличного от hIL-2, предпочтительно антигена, связанного с раком, или антигена белка иммунной контрольной точки, или антитело или его антигенсвязывающий фрагмент, который специфически связывается с антигеном, родственным с иммунной эффекторной клеткой.
Антиген, к которому антитело, отличное от анти-hIL-2 антитела, включенного в биспецифическое антитело, связывается, является антигеном, связанным с раком, или антигена белка иммунной контрольной точки, который может быть выбран из числа Her2, EGFR, VEGF, VEGF-R, CD-20, MUC16, CD30, CD33, CD52, 4-1BB, TIM3, PD-1, PD-L1, CTLA4, BTLA4, EphB2, E-селектина, EpCam, CEA, PSMA, PSA, ERB3, c-MET и тому подобного, и антиген, родственный с иммунной эффекторной клеткой может быть выбран из числа, но не ограничиваясь этим, TCR/CD3, CD16 (FcγRIIIa), CD28, CD28, CD44, CD56, CD69, CD64 (FcγRI), CD89, CD11b/CD18 (CR3) и тому подобного.
В следующем дополнительном аспекте настоящее изобретение имеет отношение к композиции для предотвращения или лечения рака, которая включает анти-hIL-2 антитело или его антигенсвязывающий фрагмент в качестве активного ингредиента.
В еще одном дополнительном аспекте настоящее изобретение имеет отношение к композиции для предотвращения или лечения рака, которая включает биспецифическое антитело или конъюгат антитело-лекарственное средство в качестве активного ингредиента.
«Рак» относится к состоянию, при котором клетки пролиферируют аномально и избыточно вследствие проблемы, связанной с функцией регулирования нормального деления, дифференцировки и смерти клеток, и проникают в окружающие ткани и органы, вследствие этого образуя массу, разрушая или деформируя существующие структуры. “Солидный рак” относится к раку, имеющему отличные свойства от свойств рака крови, и который состоит из массы, образованной вследствие аномального роста клеток в различных солидных органах, включая мочевой пузырь, молочную железу, кишечник, почки, легкие, мозг, пищевод, желчный пузырь, яичник, поджелудочную железу, желудок, шейку матки, щитовидную железу, предстательную железу, кожу и тому подобное. «Метастатический рак» вызывается метастазированием раковых клеток, отделившихся от места первичной опухоли, в другое место через кровеносные сосуды, лимфатические сосуды и тому подобное, и пролиферацией метастазировавших раковых клеток. Композиция настоящего изобретения может использоваться для предотвращения или лечения солидных видов рака и/или метастатических видов рака. Композиция настоящего изобретения может использоваться для предотвращения или лечения, без ограничения, например, рака кожи, рака молочной железы, колоректального рака, рака почки, рака легкого, рака печени, рака мозга, рака пищевода, рака желчного пузыря, рака яичника, рака поджелудочной железы, рака желудка, рака шейки матки, рака щитовидной железы, рака предстательной железы и рака мочевого пузыря, но без ограничения этим.
При использовании в описании, термин «предотвращение» относится ко всем действиям, которые ингибируют метастазирование, рост и тому подобное рака или задерживают начало развития рака при введении композиции. При использовании в описании, термин «лечение» имеет отношение к любому действию, приводящему к улучшению симптомов рака или благоприятному изменению рака вследствие введения композиции.
Композиция настоящего изобретения может дополнительно содержать фармацевтически приемлемый носитель. Носитель, в большинстве случаев используемый в композиции лекарственных средств, может быть одним или более, выбранным из группы, состоящей, но без ограничения, из лактозы, декстрозы, сахарозы, сорбитола, маннитола, крахмала, гуммиарабика, фосфата кальция, альгината, силиката кальция, микрокристаллической целлюлозы, поливинилпирролидона, целлюлозы, воды, сиропов, метил целлюлозы, метилгидроксибензоата, пропилгидроксибензоата, талька, стеарата магния и минерального масла. В дополнение к этому, композиция может также содержать одно или более, выбранное из группы, состоящей из эксципиентов, смазывающих веществ, увлажняющих веществ, подсластителей, ароматических веществ, эмульгаторов, суспензий и консервирующих веществ.
Композиция или фармацевтическая композиция антитела может вводиться перорально или парентерально. Парентеральное введение включает внутривенную инъекцию, подкожную инъекцию, внутримышечную инъекцию, внутрибрюшинную инъекцию, эндотелиальное введение, местное введение, назальное введение, внутрилегочное введение, ректальный способ введения и т.д. По той причине, что белок или пептид расщепляется при пероральном введении, предпочтительным является создание композиции для перорального введения в виде покрывающего активное вещество слоя или в виде защитного слоя против разрушения в желудке. Кроме того, композиция может вводиться с помощью любого устройства, которое может транспортировать активные вещества в клетки-мишени.
Содержание анти-hIL-2 антитела (TCB2 mAb) в композиции может варьироваться в зависимости от различных факторов, таких как метод создания композиции, способ введения, возраст, вес тела, пол или патологическое состояние пациента, диета, время введения, интервал между введениями, способ введения препарата, скорость экскреции и аллергическая реакция. Например, ежедневная дозировка анти-hIL-2 антитела (TCB2 mAb) может составлять в пределах от 0,001 до 1,000 мг/кг, в частности, от 0,01 до 100 мг/кг, конкретнее от 0,1 до 50 мг/кг, но без ограничения. Эффективная дозировка для однократного введения анти-hIL-2 антитела (TCB2 mAb) может быть создана в виде стандартной лекарственной формы или может приготавливаться путем впрыскивания в многодозовый флакон, содержащий соответствующие количества. «Фармацевтически эффективная дозировка» при использовании в описании имеет отношение к содержимому или дозе активного ингредиента, способной оказывать желательный фармакологический эффект, и определяется в зависимости от различных факторов, таких как способ создания композиции, способ введения, возраст, вес тела, пол или патологическое состояние пациента, диета, время введения, интервал между введениями, способ введения препарата, скорость экскреции и аллергическая реакция.
В состав композиции могут включаться фармацевтически приемлемые носители и/или эксципиенты согласно способу, который может быть легко осуществлен средним специалистом в области техники, к которой относится настоящее изобретение, и композиция может быть предоставлена в стандартной лекарственной форме или может содержаться в многодозовом флаконе. Композиция может быть создана в виде раствора, суспензии, сиропа или эмульсии в масле или водной среде, или может представлять собой экстракты, порошки, гранулы, таблетки или капсулы, и может дополнительно включать диспергирующее вещество или стабилизирующее вещество. Кроме того, композиция может вводиться отдельно или в комбинации с другими терапевтическими средствами.
В частности, композиция, содержащая анти-hIL-2 антитело (TCB2 mAb), включает антитело, и в связи с этим может быть создана в виде иммунолипосомы. Липосома, содержащая антитело, может быть получена согласно методу, хорошо известному в рассматриваемой области техники. Иммунолипосома представляет собой липидную композицию, содержащую фосфатидилхолин, холестерин и фосфатидилэтаноламин, полученный из полиэтиленгликоля, и может быть получена с помощью метода обращенно-фазового выпаривания. Например, Fab' фрагмент антитела может быть конъюгирован с липосомой с помощью реакции дисульфидного обмена.
В еще одном аспекте настоящее изобретение имеет отношение к совместному введению композиции для лечения рака, которая содержит анти-hIL-2 антитело или его антигенсвязывающий фрагмент и ингибитор иммунной контрольной точки.
В настоящем изобретении ингибитор иммунной контрольной точки (также называемый «ингибитор контрольных точек») может быть анти-CTLA-4 антителом или анти-PD-1 антителом, без ограничения.
При использовании в описании термин «совместное введение» (также называемый «комбинация») означает, что анти-hIL-2 антитело или его антигенсвязывающий фрагмент и ингибитор иммунной контрольной точки могут вводиться одновременно, последовательно или в обратном порядке, и анти-hIL-2 антитело или его антигенсвязывающий фрагмент и ингибитор иммунной контрольной точки могут вводиться в комбинации соответствующих эффективных количеств активных ингредиентов в пределах, установленных специалистами в данной области техники.
В примере настоящего изобретения было обнаружено, что, когда анти-CTLA-4 или анти-PD-1 антитело и анти-hIL-2 антитело согласно настоящему изобретению применяются последовательно, рост опухолевых клеток дополнительно подавляется.
Композиция для совместного введения включает анти-hIL-2 антитело и те же самые компоненты, которые входят в состав вышеописанной композиции для предотвращения или лечения рака. Таким образом, описание каждого состава применимо аналогичным образом к композиции для совместного введения.
В другом дополнительном аспекте настоящее изобретение имеет отношение к способу предотвращения и/или лечения рака, содержащему стадию введения пациенту терапевтически эффективного количества анти-hIL-2 антитела или его антигенсвязывающего фрагмента, биспецифического антитела или конъюгата антитело-лекарственное средство.
Композиция настоящего изобретения может вводиться в качестве отдельного терапевтического средства или в комбинации с другими терапевтическими средствами, и может вводиться последовательно или одновременно с общепринятыми терапевтическими средствами.
Любой противоопухолевый препарат, например, цисплатин, имеет побочные действия, такие как кахексия, саркопения, мышечная атрофия, костная атрофия или непроизвольная потеря массы тела. Таким образом, настоящее изобретение может включать композицию или способ для лечения рака, который лечит рак, предотвращая, сводя к минимуму или уменьшая тяжесть, частоту или появление кахексии, саркопении, мышечной атрофии, костной атрофии или непроизвольной потери массы тела.
Способ содержит стадию введения фармацевтической композиции, содержащей эффективное количество анти-hIL-2 антитела настоящего изобретения, в комбинации, по меньшей мере, с одним противоопухолевым средством. В конкретных вариантах осуществления настоящее изобретение включает способ, который лечит рак, предотвращая, сводя к минимуму или уменьшая тяжесть, частоту или появление кахексии, саркопении, мышечной атрофии, костной атрофии или непроизвольной потери массы тела, при этом способ включает стадию введения пациенту фармацевтической композиции, содержащей эффективное количество анти-hIL-2 антитела настоящего изобретения в комбинации с одним или более противоопухолевыми средствами, которые как известно, вызывают или увеличивают тяжесть, частоту или появление кахексии, саркопении, мышечной атрофии, костной атрофии или непроизвольной потери массы тела.
В следующем аспекте настоящее изобретение имеет отношение к способу лечения рака, содержащему стадию совместного введения композиции, включающей анти-hIL-2 антитело или его антигенсвязывающий фрагмент с ингибитором иммунной контольной точки.
В способе лечения рака согласно настоящему изобретению анти-hIL-2 антитело или его антигенсвязывающий фрагмент и ингибитор иммунной контольной точки могут вводиться одновременно, последовательно или в обратном порядке. Предпочтительно, способ может включать стадии: (A) лечение ингибитором иммунной контольной точки; и (B) лечение анти-hIL-2 антителом или его антигенсвязывающим фрагментом, но без ограничения.
Ингибитор иммунной контрольной точки может быть анти-CTLA-4 антителом или анти-PD-1 антителом, но без ограничения. Способ лечения рака включает композицию, содержащую анти-hIL-2 антитело и такие же компоненты, как компоненты, включенные в вышеописанную композицию. Таким образом, описание каждого состава аналогичным образом относится к способу лечения рака путем совместного введения.
В еще одном аспекте настоящее изобретение имеет отношение к использованию анти-hIL-2 антитела или его антигенсвязывающего фрагмента для предотвращения или лечения рака.
В следующем дополнительном аспекте настоящее изобретение имеет отношение к использованию анти-hIL-2 антитела или его антигенсвязывающего фрагмента для приготовления медицинского препарата для предотвращения или лечения рака.
В следующем аспекте настоящее изобретение имеет отношение к композиции для усиления эффективности вакцины, которая содержит анти-hIL-2 антитело или его антигенсвязывающий фрагмент в качестве активного ингредиента.
При использовании в описании термин «вакцина» относится к биологическому средству, содержащему антиген, иммунизирующий живой организм, и подразумевает иммуногенное или антигенное вещество, которое продуцирует иммунитет in vivo при введении человеку и животным с целью предотвращения инфицирования.
Примеры
Далее настоящее изобретение будет подробно описано со ссылкой на примеры. Среднему специалисту в данной области техники понятно, что эти примеры предоставляются только с иллюстративной целью и не должны рассматриваться, как ограничивающие рамки настоящего изобретения.
Пример 1. Эксперимент в отношении специфичности связывания TCB2 моноклонального антитела с hIL-2
Для оценки терапевтической эффективности hIL-2/TCB2 mAb комплекса использовали мышиные модели in vivo. По этой причине, для того чтобы проверить, демонстрируют ли TCB2 mAb перекрестную специфичность с мышиным IL-2 (mIL-2), была протестирована специфичность связывания TCB2 mAb в отношении hIL-2. Во-первых, спленоциты BALB/c мышей, иммунизированных hIL-2 3-4 раза в течение нескольких недель, были «слиты» с миеломными клетками SP/2. Когда появились колонии гибридомы, провели анализ культуральной среды с помощью ELISA. 5 мкг/мл hIL-2 или mIL-2 добавляли к или смешивали с PBS и всего 50 мкл смеси наносили на ELISA планшет. Затем, 200 мкл 10% FBS добавили к PBS и инкубировали при комнатной температуре в течение 30 минут для предотвращения неспецифического связывания, и титрованную дозу моноклонального антитела инкубировали в течение 30 минут. Связывание моноклонального антитела с нанесенным hIL-2 или mIL-2 обнаруживали с помощью анти-мышиного IgG HRP или анти-крысиного IgG HRP. На каждой стадии планшеты промывали 3-5 раз 200 мкл PBS. В качестве положительных контролей использовали коммерчески доступные моноклональные антитела. В качестве положительных контролей для hIL-2 использовали Mab602, и в качестве положительных контролей для mIL-2 использовали JES6-1 и S4B6.
В результате, Mab602, использованные в качестве положительного контроля для hIL-2, показали низкую перекрестную специфичность, тогда как TCB2 mAb не показали перекрестной специфичности с mIL-2 (фиг. 1). Таким образом, можно видеть, что TCB2 mAb специфически связываются только с hIL-2.
Пример 2. In Vivo иммуностимулирующий эффект hIL-2/TCB2 комплекса
MAB602, описанное ранее мышиное анти-hIL-2 mAb, стимулировало человеческие CD8+ T-клетки у гуманизированных мышей, таким образом демонстрируя эффективность hIL-2/mAb комплекса для противоопухолевой иммунотерапии в клинической практике. Однако, последовательность CDR участка MAB602 не была опубликована, и пока неясно, является ли MAB602 антителом, которое обладает максимальным противоопухолевым действием при использовании в качестве hIL-2/анти-hIL-2 mAb комплекса. Таким образом, была предпринята попытка разработать исключительное hIL-2 mAb, вызывающее максимальную активацию CD8+ T-клеток и NK-клеток и минимальное увеличение экспансии Treg клеток.
В дни 0, 1, 2 и 3 hIL-2/TCB2 mAb (0,8мкг/8 мкг) комплекс вводили B6 мышам и на 5 день анализировали степень наращивания селезеночных CD8+ T-клеток и Treg клеток. Комплекс hIL-2/TCB2 снижал до минимума экспансию Treg клеток и CD4 T-клеток, но вызывал сильную экспансию CD8+ T-клеток и NK-клеток (фиг. 2). Конкретнее, когда вводили hIL-2/TCB2 mAb комплекс, количество клеток иммунологической памяти (MP) CD8+ T увеличилось примерно в 59 раз, и увеличенное количество MP CD8+ T-клеток составляло большинство CD8+ T-клеток. NK-клетки также увеличились в 18 раз, однако количество клеток Treg было увеличено только примерно в 5 раз, что было ниже степени экспансии CD8+ T-клеток и NK-клеток. Эффективное отношение MP CD8+ T-клеток к увеличенным клеткам Treg составляло 970% для hIL-2/TCB2 mAb комплекса. Следовательно, можно видеть, что TCB2 mAb представляет собой моноклональное антитело, которое селективно стимулирует CD8+ T-клетки и NK-клетки, но не клетки Treg.
Кроме того, эффективное отношение MP CD8+ T-клеток к увеличенным клеткам Treg составляло 970% для комплекса hIL-2/TCB2 mAb, но 530% для комплекса hIL-2/MAB602 (фиг. 2D). Таким образом, TCB2 является моноклональным антителом, превосходящим MAB602.
Пример 3. Анализ аффинности TCB2 в отношении hIL-2
Селективное стимулирование CD8+ T-клеток и NK-клеток TCB2 антителом требует, чтобы антитело связывалось с эпитопом hIL-2. Поскольку эпитоп hIL-2 также распознается высокоаффинным IL-2R (CD25), TCB2 вероятно связывается с hIL-2 близко от сайта, с которым связывается IL-2Rα цепь. Поскольку MAB602 вероятно также связывается с hIL-2 близко от сайта, с которым связывается IL-2Rα цепь, был проведен конкурентный анализ TCB2 с MAB602, для того чтобы наблюдать специфичность TCB2, которое является анти-hIL-2 mAb. В качестве контроля было использовано другое анти-hIL-2 mAb (5344.111), которое является коммерчески доступным и, как известно, связывается с эпитопом, отличным от эпитопа, с которым связывается MAB602.
Для обнаружения hIL-2 использовали сэндвич-ELISA. 900 RU (Rmax=90) анти-hIL-2 клонов было иммобилизировано на CM5 чипе с помощью иммобилизации по амино-группе. hIL-2(100 нM) в 2-кратном разведении «выливали» на чип со скоростью 10 мкл/мин в течение 3 минут, и затем контролировали диссоциацию hIL-2 в течение 10 минут.
В результате конкурентного анализа было обнаружено, что TCB2 конкурирует с MAB602. Было показано, что вследствие своей специфичности TCB2 mAb не конкурирует с 5344.111, но конкурирует с MAB602. В итоге было подтверждено, что TCB2 обладает более высокой аффинностью к человеческому IL-2, чем другие анти-hIL-2 mAb (фиг. 3).
Пример 4. Противоопухолевое действие hIL-2/TCB2 комплекса
Пример 4-1. Эффект TCB2 mAb против солидной опухоли
Для того, чтобы продемонстрировать клиническую полезность TCB2 mAb против солидной опухоли, 1 x 106 B16F10 клеток меланомы было введено подкожно мышам B6, и затем PBS, hIL-2 (0,8 мкг) отдельно или hIL-2/TCB2 (0,8 мкг/8 мкг) комплекс вводили с 4 по 7 дни. Затем, развитие опухоли контролировали в течение 7 дней.
В результате было показано, ингибирование роста солидной опухоли коррелирует с величиной цитокин-индуцированной экспансии CD8+ T-клеток и NK-клеток (фиг. 4). Комплекс hIL-2/TCB2 mAb ингибировал рост опухоли лучше, чем hIL-2 в отдельности.
Пример 4-2. Эффект TCB2 mAb против метастатической опухоли
Для того, чтобы продемонстрировать клиническую полезность TCB2 mAb против метастатической опухоли, 3 x 105 клеток B16F10 меланомы вводили внутривенно мышам B6. Через 7 дней после инъекции опухоли вводили hIL-2 в отдельности (0,8 мкг) или hIL-2/TCB2 (0,8 мкг/8 мкг) комплекс с 7 по 10 день. На день 18 измеряли количество опухолевых узлов в легких.
В результате, ингибирование hIL-2/TCB2 хорошо препятствовало возникновению опухолевых узлов в легких в отличие от hIL-2 (фиг. 5). Таким образом, очевидно, что TCB2 mAb обладает потенциальным противоопухолевым действием при использовании в качестве hIL-2/TCB2 mAb комплекса.
Пример 5. Анализ эффективности комбинации hIL-2/TCB2 комплекса и других противоопухолевых препаратов
Противораковая терапия, в настоящее время развивающаяся по всему миру, включает метод, который иммунизирует пациентов при помощи опухолевого нео-антигена, и метод, использующий ингибиторы контрольных точек, такие как анти-CTLA-4 антитела или анти-PD-1 антитела. В этом Примере было проанализировано, может ли hIL-2/TCB2 комплекс использоваться в комбинации с этими способами противораковой терапии.
Пример 5-1. Эффект комбинации hIL-2/TCB2 комплекса и противораковой терапии на основе нео-антигена
Для того, чтобы проверить совместимость hIL-2/TCB2 комплекса с терапией на основе нео-антигена, 1 x 106 B16F10 клеток было введено подкожно B6 мышам в день 0. Затем, PBS или смесь TRP2 пептида (100 мкг) и Poly I:C (100 мкг) вводили в дни 3 и 7. hIL-2/TCB2 комплекс (0,8 мкг/8 мкг) вводили в виде двух курсов лечения по 4 ежедневной инъекции в дни с 4 по 7 и дни с 11 по 14. Затем контролировали развитие опухоли в течение 5 дней.
В результате, введение hIL-2/TCB2 комплекса и терапия на основе нео-антигена ингибировали рост B16F10 опухоли в сопоставимой степени. Однако, когда мышей совместно лечили hIL-2/TCB2 комплексом и терапией на основе нео-антигена, наблюдалось более выраженное ингибирование опухоли (фиг. 6). Таким образом, очевидно, что hIL-2/TCB2 комплекс может использоваться в комбинации с терапией на основе нео-антигена.
Пример 5-2. Эффект комбинации hIL-2/TCB2 комплекса и ингибитора контрольной точки
Чтобы протестировать, может ли hIL-2/TCB2 комплекс использоваться в комбинации с ингибиторами контрольных точек, использовали CT26 (Balb/C рак толстой кишки и MC38 (B6 рак толстой кишки) модели. После лечения hIL-2/TCB2 комплексом в комбинации с анти-CTLA-4 антителом или анти-PD-1 антителом или лечения каждым из этих антител наблюдался рост опухоли.
Для эксперимента, в котором мышей лечили hIL-2/TCB2 комплексом в комбинации с анти-CTLA-4 антителом, 5 x 105 CT26 клеток было введено подкожно Balb/C мышам (день 0), и анти-CTLA-4 антитела (100 мкг) вводили три раза с 3-дневными интервалами с 7 дня. hIL-2/TCB2 комплекс (0,8 мкг/8 мкг) вводили один раз в день с 8 по 11 день (четыре раза). В итоге, анти-CTLA-4 антитело сильно ингибировало рост CT26 опухоли, и отторжение опухоли происходило у 33% мышей. У мышей, которым был введен hIL-2/TCB2 комплекс, рост опухоли был меньше ингибирован, чем у мышей, получавших инъекцию анти-CTLA-4 антитела. Однако, когда мышей лечили комбинацией анти-CTLA-4 антитела с hIL-2/TCB2 комплексом, рост опухоли был ингибирован сильнее, чем при лечении анти-CTLA-4 антителом, и отторжение опухоли происходило у 63% мышей (фиг. 7).
Для эксперимента, в котором мышей лечили hIL-2/TCB2 комплексом в комбинации с анти-PD-1 антителом, 5 x 105 MC38 клеток инъецировали подкожно B6 мышам (день 0). Затем, анти-PD-1 антитела (100 мкг) инъецировали три раза с 3-дневными интервалами с 7 дня, и hIL-2/TCB2 комплекс (1.5 мкг/15 мкг) инъецировали с 8 дня по 11 день (четыре раза). В результате, лечение анти-PD-1 антителом было неэффективным в отношении задержки роста опухоли (анти-PD-1 антитело использовали в дозе, меньшей, чем оптимальная доза), но лечение hIL-2/TCB2 комплексом сильно ингибировало рост MC38 опухоли, причем наблюдалось отторжение опухоли у 37% мышей. В том случае, когда hIL-2/TCB2 комплекс и анти-PD-1 антитело вводили вместе, отторжение опухоли происходило у 100% мышей (фиг. 8).
Пример 5-3. Эффект приобретения вторичного ответа при иммунной противораковой терапии hIL-2/TCB2 комплексом
Для того, чтобы проверить, приобрели ли мыши, у которых происходило отторжение опухоли, вторичный иммунный ответ к той же самой опухоли, 5 x 105 MC38 клеток вводили интактным B6 мышам (которым никогда не была инокулирована опухоль) или мышам, у которых наблюдалось отторжение опухоли при hIL-2/TCB2 в Примере 5-2 (день 25). MC38 опухоль вырастала быстро у интактных B6 мышей, которым она была инокулирована, однако не выросла у мышей, у которых ранее происходило отторжение опухоли (фиг. 8). Это подтверждает, что иммунотерапия hIL-2/TCB2 комплексом особенно помогает при предотвращении рецидива рака у пациентов.
Принимая во внимание эти результаты, очевидно, что hIL-2/TCB2 комплекс может использоваться в комбинации с ингибиторами контрольных точек, такими как анти-CTLA-4 антитело или анти-PD-1 антитело, и является более эффективным при использовании в комбинации с этими ингибиторами контрольных точек.
Пример 6. Секвенирование моноклонального антитела TCB2
Определяющая комплементарность область (CDR) TCB2 mAb была секвенирована (таблицы 1-3).
Таблица 1. ДНК-последовательность и аминокислотная последовательность вариабельного участка TCB2 антитела
Таблица 2. ДНК-последовательность CDR TCB2 антитела
Таблица 3. Аминокислотная последовательность CDR TCB2 антитела
Видно, что аминокислотная последовательность TCB2 отличается от последовательности Nara1 (таблица 4), которая представляет собой анти-hIL-2 mAb антитело, недавно разработанное Onur Boyman и Natalia Ramirez (WO 2016005950 A1). Сходство CDR между TCB2 и Nara1 составляет 40%, 52,94% и 8,33% для CDR тяжелых цепей с 1 по 3, соответственно, и 33,33%, 14,28% и 55,55% CDR легких цепей с 1 по 3 (таблица 5).
Таблица 4. Аминокислотная последовательность CDR Nara1 антитела
Таблица 5. Сравнение аминокислотной последовательности CDR между TCB2 и Nara1 антителами
Исходя из результатов секвенирования, Fab участок TCB2 mAb был клонирован в IgG2 вектор экспрессии. Аминокислотная последовательность клонированного вектора показана в таблице 6 ниже.
Таблица 6. Аминокислотная последовательность человеческого химерного TCB2
Пример 7. Гуманизированное TCB2 антитело
Для того, чтобы уменьшить иммунный ответ хозяина на мышиный IgG, TCB2 mAb было гуманизировано и экспрессировалось вместе с человеческим IgG1 Fc (таблица 7). CDR мышиного TCB2 (mTCB2) был введен в вариабельный участок человеческого IgG. Затем, для эксперимента in vivo были отобраны три гуманизированных TCB2 (hnTCB2) mAb клона (VH1 + VL2, VH2 + VL2 и AH03463 (VL03463 + VH03463)), обладающие самой высокой аффинностью (таблица 8).
Таблица 7. ДНК последовательность и аминокислотная последовательность вариабельного участка гуманизированного TCB2
Остатки в аминокислотной последовательности VL03463, отличающиеся от остатков в VL2, подчеркнуты. Для сравнения последовательности участка тяжелой цепи, остатки в VH2 и VH03463, отличающиеся от остатков в VH1, подчеркнуты. VL2 использовали вместе с VH1 или VH2, чтобы экспрессировать два разных гуманизированных TCB2 антитела (VL2 + VH1 или VL2 + VH2).
Таблица 8. Аффинность гуманизированного TCB2 к hIL-2
Для сравнения функции активации иммунных клеток между исходным мышиным TCB2, человеческим химерным TCB2 (hcTCB2) и гуманизированным TCB2 (hnTCB2), hIL-2 давали возможность образовывать комплексы с разными TCB2 (мышиным TCB2 (mTCB2), hcTCB2 и hnTCB2). Каждый из комплексов был инъецирован B6 мышам один раз в день с 0 дня по 3 день (четыре раза), и на день 5 иммунные клетки селезенки анализировали с помощью проточной цитометриии. В итоге, было показано, что аффинность hnTCB2 была немного ниже, чем аффинность mTCB2 или hcTCB2 (Таблица 8), но функционирование hnTCB2 в отношении активации иммунных клеток было сходно с функционированием mTCB2 (фиг. 9; VL2+VH2 не показано вследствие низкой функциональной возможности). Таким образом, было продемонстрировано, что mTCB2 было успешно гуманизировано.
Для того, чтобы проверить, обладает ли hnTCB2 противоопухолевой активностью в дополнение к функции активирования иммунных клеток, 5x105 клеток MC38 было подкожно инъецировано B6 мышам в день 0, и анти-PD-1 антитело (200 мкг) вводили три раза с 3-дневными интервалами с 7 дня. Затем, hIL-2/hnTCB2 (VL2+ VH1, 1,5 мкг/15 мкг) комплекс вводили один раз в день с 8 дня по 11 день (четыре раза), и затем наблюдали за ростом MC38 опухоли. В итоге, рост опухоли был отсрочен даже при лечении одним анти-PD-1 антителом в высокой концентрации, однако, когда мышей лечили hIL-2/hnTCB2 комплексом, наблюдалось сильное ингибирование роста MC38 опухоли до уровня, сходного с уровнем, показанным при лечении hIL-2/mTCB2 комплексом, при этом опухоль отторгалась у 40% мышей. В том случае, когда hIL-2/hnTCB2 или hIL-2/mTCB2 комплекс был инъецирован вместе с анти-PD-1 антителом, опухоль отторгалась у 85% мышей (фиг. 10). Таким образом, было подтверждено, что функция исходного mTCB2 была сохранена в гуманизированном TCB2.
Промышленная применимость
Анти-hIL-2 антитело настоящего изобретения специфически связывается с отдельным эпитопом hIL-2, тем самым ингибируя связывание hIL-2 с CD25, таким образом, сводя к минимуму экспансию Treg клеток. Кроме того, оно стимулирует CD8+ T-клетки и NK-клетки, обладающие противоопухолевой активностью. Таким образом, анти-hIL-2 антитело настоящего изобретения может использоваться в качестве нового противоракового терапевтического средства.
Несмотря на то, что настоящее изобретение подробно описывается со ссылкой на специфические признаки, специалистам в данной области техники понятно, что это описание дается только для предпочтительного варианта осуществления и не ограничивает объем настоящего изобретения. Таким образом, реально существующие рамки настоящего изобретения будут определяться прилагаемыми пунктами формулы изобретения и их эквивалентами.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ИНСТИТЬЮТ ФОР БЕЙСИК САЙЕНС
ПОУСТЕК АКАДЭМИ ИНДАСТРИ ФАУНДЕЙШН
<120> АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ ИНТЕРЛЕЙКИНУ-2 И ИХ ПРИМЕНЕНИЕ
<130> MPO19-101RU
<150> KR 10-2017-0064815
<151> 2017-05-25
<150> PCT/KR2018/005955
<151> 2018-05-25
<160> 34
<170> KoPatentIn 3.0
<210> 1
<211> 363
<212> DNA
<213> Artificial Sequence
<220>
<223> TCB2 Heavy chain Variable region
<400> 1
gaggtgcaac tgcagcagtc tggggctgag ctggcaagac ctggggcttc agtgaagttg 60
tcctgcaagg cttctggcta cacctttact acctactgga ttcagtgggt gaaacagagg 120
cctggacagg gtctggaatg gattggggct atttatcctg gagatggtga tactaggtac 180
attcagaatt tcaagggcaa ggccacattg actgcagata aatcctccag cacagcctac 240
atgcaactca gcagcttggc atctgaggac tctgcggtct attactgtgc aagatccctg 300
gcaactcggg gcttctatgc tatggactac tggggtcaag gaacctcagt caccgtctcc 360
tca 363
<210> 2
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> TCB2 Light chain Variable region
<400> 2
gacattgtga tgacccagtc tccagcatcc ctgtccatgg ctataggaga aaaagtcacc 60
atcagatgca taaccagcac tgatattgat gatgatatga actggtacca gcagaagcca 120
ggggaacctc ctaagctcct tatttcagaa ggcaatactc ttcgtcctgg agtcccatcc 180
cgattctcca gcagtggcta tggtacagat tttgttttta caattgaaaa catgctctca 240
gaagatgttg cagattacta ctgtttgcaa agtgataact tgccgtacac gttcggaggg 300
gggaccaagc tggaaataaa a 321
<210> 3
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<223> TCB2 Heavy chain Variable region
<400> 3
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Ile Gln Trp Val Lys Gln Arg Pro Gly Gln Gly Glu Trp Ile Gly
35 40 45
Ala Ile Tyr Pro Gly Asp Gly Asp Thr Arg Tyr Ile Gln Asn Phe Lys
50 55 60
Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr Met
65 70 75 80
Gln Leu Ser Ser Leu Ala Ser Glu Asp Ser Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ser Leu Ala Thr Arg Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 4
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> TCB2 Light chain Variable region
<400> 4
Asp Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ser Met Ala Ile Gly
1 5 10 15
Glu Lys Val Thr Ile Arg Cys Ile Thr Ser Thr Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Glu Pro Pro Lys Leu Leu Ile
35 40 45
Ser Glu Gly Asn Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Ser
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Val Phe Thr Ile Glu Asn Met Leu Ser
65 70 75 80
Glu Asp Val Ala Asp Tyr Tyr Cys Leu Gln Ser Asp Asn Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 5
<211> 15
<212> DNA
<213> Artificial Sequence
<220>
<223> TCB2 Heavy chain CDR1
<400> 5
acctactgga ttcag 15
<210> 6
<211> 51
<212> DNA
<213> Artificial Sequence
<220>
<223> TCB2 Heavy chain CDR2
<400> 6
gctatttatc ctggagatgg tgatactagg tacattcaga atttcaaggg c 51
<210> 7
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> TCB2 Heavy chain CDR3
<400> 7
tccctggcaa ctcggggctt ctatgctatg gactac 36
<210> 8
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> TCB2 Light chain CDR1
<400> 8
ataaccagca ctgatattga tgatgatatg aac 33
<210> 9
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> TCB2 Light chain CDR2
<400> 9
gaaggcaata ctcttcgtcc t 21
<210> 10
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> TCB2 Light chain CDR3
<400> 10
ttgcaaagtg ataacttgcc gtacacg 27
<210> 11
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> TCB2 Heavy chain CDR1
<400> 11
Thr Tyr Trp Ile Gln
1 5
<210> 12
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> TCB2 Heavy chain CDR2
<400> 12
Ala Ile Tyr Pro Gly Asp Gly Asp Thr Arg Tyr Ile Gln Asn Phe Lys
1 5 10 15
Gly
<210> 13
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> TCB2 Heavy chain CDR3
<400> 13
Ser Leu Ala Thr Arg Gly Phe Tyr Ala Met Asp Tyr
1 5 10
<210> 14
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> TCB2 Light chain CDR1
<400> 14
Ile Thr Ser Thr Asp Ile Asp Asp Asp Met Asn
1 5 10
<210> 15
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> TCB2 Light chain CDR2
<400> 15
Glu Gly Asn Thr Leu Arg Pro
1 5
<210> 16
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> TCB2 Light chain CDR3
<400> 16
Leu Gln Ser Asp Asn Leu Pro Tyr Thr
1 5
<210> 17
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Nara1 Heavy chain CDR1
<400> 17
Asn Tyr Leu Ile Glu
1 5
<210> 18
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Nara1 Heavy chain CDR2
<400> 18
Val Ile Asn Pro Gly Ser Gly Gly Thr Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 19
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Nara1 Heavy chain CDR3
<400> 19
Trp Arg Gly Asp Gly Tyr Tyr Ala Tyr Phe Asp Val
1 5 10
<210> 20
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Nara1 Light chain CDR1
<400> 20
Lys Ala Ser Gln Ser Val Asp Tyr Asp Gly Asp Ser Tyr Met Asn
1 5 10 15
<210> 21
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Nara1 Light chain CDR2
<400> 21
Ala Ala Ser Asn Leu Glu Ser
1 5
<210> 22
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Nara1 Light chain CDR3
<400> 22
Gln Gln Ser Asn Glu Asp Pro Tyr Thr
1 5
<210> 23
<211> 447
<212> PRT
<213> Artificial Sequence
<220>
<223> human chimeric TCB2 Heavy chain Variable region
<400> 23
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Ile Gln Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asp Gly Asp Thr Arg Tyr Ile Gln Asn Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Ala Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Thr Arg Gly Phe Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys
210 215 220
Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser
290 295 300
Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 24
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> human chimeric TCB2 Light chain Variable region
<400> 24
Asp Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ser Met Ala Ile Gly
1 5 10 15
Glu Lys Val Thr Ile Arg Cys Ile Thr Ser Thr Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Glu Pro Pro Lys Leu Leu Ile
35 40 45
Ser Glu Gly Asn Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Ser
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Val Phe Thr Ile Glu Asn Met Leu Ser
65 70 75 80
Glu Asp Val Ala Asp Tyr Tyr Cys Leu Gln Ser Asp Asn Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 25
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> humanized TCB2_VL03463
<400> 25
gacattcaga tgacccagag cccttccagc ctgagcgcca gcgtcgggga cagagtgacc 60
attacctgca ttacctccac agacattgac gatgacatga actggtacca gcagaagcca 120
gggaaagccc ccaagctgct gatctatgag ggaaatactc tgcggcccgg cgtgcctagc 180
agattcagct cctctggctc tgggaccgat ttcaccttta caatcagttc actgcagccc 240
gaagacattg ctacatacta ttgcctgcag agcgacaacc tgccttacac cttcggggga 300
gggaccaaac tggaaatcaa a 321
<210> 26
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> humanized TCB2_VL03463
<400> 26
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ile Thr Ser Thr Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Glu Gly Asn Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Ser
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Ser Asp Asn Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 27
<211> 363
<212> DNA
<213> Artificial Sequence
<220>
<223> humanized TCB2_VH03463
<400> 27
gaagtgcagc tggtgcagag cggagcagaa gtgaaaaagc ctggggcaag cgtgaaggtg 60
tcctgtaaag caagcggata tacattcacc acatactgga tccagtgggt gaagcaggca 120
ccaggacagg gactggagtg gatgggagca atctaccctg gagacggcga tacacgatat 180
attcagaact tcaaaggccg ggtgactatg accagagaca catctactag taccgtctat 240
atggagctga gctccctgag gagcgaagat accgctgtct actattgcgc ccgctctctg 300
gctacaagag ggttctacgc tatggattat tggggacagg ggacactggt caccgtcagc 360
agc 363
<210> 28
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> humanized TCB2_VH03463
<400> 28
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Ile Gln Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Ile Tyr Pro Gly Asp Gly Asp Thr Arg Tyr Ile Gln Asn Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Thr Arg Gly Phe Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 29
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> humanized TCB2_VL2
<400> 29
gacatcgtga tgacccagag ccccagttcc ctgagcgcca gcgtcggaga cagagtgact 60
attaggtgta ttacttccac agatattgac gatgacatga actggtacca gcagaagcca 120
ggcaaagccc ccaagctgct gatcagcgag ggaaatactc tgcgaccagg agtgccttct 180
agattctctg gcagtgggta tggaaccgat ttcaccttta caatcagctc cctgcagccc 240
gaagatattg ctgactacta ttgcctgcag agcgataacc tgccatacac cttcggcggg 300
gggaccaaac tggaaatcaa a 321
<210> 30
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> humanized TCB2_VL2
<400> 30
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Arg Cys Ile Thr Ser Thr Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Ser Glu Gly Asn Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Asp Tyr Tyr Cys Leu Gln Ser Asp Asn Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 31
<211> 363
<212> DNA
<213> Artificial Sequence
<220>
<223> humanized TCB2_VH1
<400> 31
caggtgcagc tggtccagtc aggagcagaa gtcaagaagc ccggagcaag cgtcaaagtg 60
tcatgcaaag caagcggata tacatttacc acatactgga tccagtgggt gcgacaggca 120
ccaggacagg gactggagtg gatgggagca atctaccctg gagacggcga tacaagatat 180
attcagaact tcaagggccg ggtgactatg accagagaca catctactag taccgtctat 240
atggagctga gctccctgag gagcgaagat accgctgtct actattgcgc ccgctctctg 300
gctacaaggg ggttctacgc aatggattac tgggggcagg ggacactggt caccgtctca 360
tca 363
<210> 32
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> humanized TCB2_VH1
<400> 32
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Ile Tyr Pro Gly Asp Gly Asp Thr Arg Tyr Ile Gln Asn Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Thr Arg Gly Phe Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 33
<211> 363
<212> DNA
<213> Artificial Sequence
<220>
<223> humanized TCB2_VH2
<400> 33
caggtccagc tggtccagag cggagccgag gtgaagaagc ccggagcaag cgtcaaactg 60
tcatgcaagg caagcggata cactttcacc acatactgga tccagtgggt gaagcaggca 120
ccaggacagg gactggagtg gatcggagca atctaccctg gagacggcga tacacggtat 180
attcagaact tcaaaggcag agtgactatg accgctgaca catctactag taccgtctat 240
atggagctga gctccctgag gagcgaagat accgccgtct actattgcgc ccggtctctg 300
gctacaaggg gcttttatgc tatggattat tggggacagg gcacactggt caccgtctca 360
tct 363
<210> 34
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> humanized TCB2_VH2
<400> 34
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Ile Gln Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asp Gly Asp Thr Arg Tyr Ile Gln Asn Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Ala Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Thr Arg Gly Phe Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<---
Реферат
Настоящее изобретение относится к области иммунологии. Предложено анти-hIL-2 антитело или его антигенсвязывающий фрагмент, нуклеиновая кислота, рекомбинантный вектор, способ получения анти-hIL-2 антитела или его антигенсвязывающего фрагмента. Также рассмотрен комплекс для применения в минимизации экспансии клеток Treg и стимуляции Т-клеток CD8+ и клеток NK, композиция для применения при предотвращении или лечении рака. Кроме того, рассмотрена композиция для совместного введения для применения при лечении рака и композиция для применения при увеличении эффективности вакцины. Данное изобретение может найти дальнейшее применение в качестве противораковой терапии. 9 н. и 6 з.п. ф-лы, 10 ил., 8 табл., 7 пр.
Формула
Документы, цитированные в отчёте о поиске
Антитела против il2

Комментарии