Контролирование образования дисульфидных связей в белковых растворах с помощью добавления восстанавливающих средств - RU2721592C2
Код документа: RU2721592C2
Чертежи










Описание
РОДСТВЕННАЯ ЗАЯВКА
[1] Настоящая заявка испрашивает приоритет согласно заявке на патент США № 14/668820, поданной 25 марта 2015 года, которая заявляет преимущество предварительной заявки на патент США № 62/004175, поданной 28 мая 2014 года, раскрытия которых непосредственно включены в данный документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[2] Настоящее изобретение относится к способам биотехнологии и биологического производства рекомбинантных белков и антител.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[3] Образование дисульфидных связей между полипептидами белка является важнейшим аспектом правильной сборки и структуры белка. Мультимеризация белков может зависеть от достаточных уровней образования дисульфидных связей между полипептидами (например, полипептидными мономерами/мультимерами). Антитела представляют собой один класс белков, который особенно сильно зависит от образования дисульфидных связей.
[4] Антитела обычно состоят из четырех полипептидов, двух легких цепей и двух тяжелых цепей (L:H:H:L). Большинство антител содержат дисульфидные связи между четырьмя полипептидными цепями. Иногда дисульфидные связи между полипептидами тяжелых цепей не образуются, что приводит к образованию антитела, не содержащего межцепочечных дисульфидных связей между двумя парами тяжелых и легких цепей. См. в целом фигуру 1. Эти антитела были названы полуантителами (сокращенно в данном документе как "Hab").
[5] Конкретные классы и типы антител, такие как антитела подкласса 4 иммуноглобулинов G (в данном документе сокращенно как "IgG4"), в большей степени подвержены образованию полуантител. При получении как природных, так и рекомбинантных антител значительную долю антител IgG4, составляющую по меньшей мере до 35%, получают в виде полуантител. (Miesages et al., 2012, Biotechnol Bioeng. 109(8): 2048-58).
[6] В физиологических условиях полуантитела, как правило, существуют в виде полных функциональных антител благодаря сильным нековалентным взаимодействиям между двумя половинами антител из тяжелой цепи и легкой цепи, несмотря на отсутствие межцепочечных дисульфидных связей. (Rose et al., 2011, Structure, 19(9):1274-82). Образование полуантител было ассоциировано с образованием аберрантных белков (см. фигуру 1). Например, образование полуантител среди антител IgG4 может быть связано с первичной аминокислотной последовательностью и структурой шарнирного участка, что обуславливает способность антител IgG4 осуществлять динамический обмен Fab-фрагментами, при котором два антитела могут рекомбинировать друг с другом с образованием биспецифических антител. (См., например, патент США № 4470925; публикацию заявки на патент США № US 2011/0086366 A1). Такая особенность подтипа IgG4 может объясняться повышенной гибкостью последовательности шарнирного участка, которая облегчает образование циклической внутрицепочечной дисульфидной связи. (Bloom et al., 1997, Protein Sci. 6(2):407-15; Schuurman et al., 2001, Mol Immunol. 38(1):1-8). Образование полуантител может также быть следствием делеций в константных доменах тяжелых цепей, как, например, в случае антител, продуцируемых конкретными миеломами (Spiegelberg et al., 1975, Biochemistry 14(10):2157-63).
[7] В настоящее время неизвестно, ассоциированы ли полуантитела с каким-либо определенным клиническим синдромом или видом токсичности. Тем не менее, уровень полуантитела является одним из важнейших показателей качества для получения и/или производства терапевтических антител IgG4. Степень, в которой могут быть использованы условия предшествующей или последующей обработки антител для контроля образования дисульфидных связей между полипептидами мультимерных белков в готовых лекарственных веществах, выяснена недостаточно.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[8] Настоящее изобретение, раскрытое в данном документе, охватывает методику, которая была разработана для контроля образования дисульфидных связей между полипептидами получаемого с помощью биологического способа белка. В одном аспекте настоящее изобретение предусматривает способы контролирования числа дисульфидных связей между полипептидами получаемого с помощью биологического способа мультимерного белка. Определенные варианты осуществления данного аспекта предусматривают следующие стадии: (a) приведение в контакт полипептидов с кондиционированным раствором в конкретный момент времени в ходе биологического способа, где кондиционированный раствор характеризуется одним или несколькими предварительно определенными параметрами раствора, и (b) инкубирование кондиционированного раствора, содержащего полипептиды, в течение предварительно определенного времени при предварительно определенной температуре, где посредством инкубирования полипептидов с кондиционированным раствором контролируют образование дисульфидных связей между полипептидами белка. В определенных вариантах осуществления, когда применяют раскрытые способы, количество дисульфидных связей между полипептидами белка увеличивается. В других вариантах осуществления количество дисульфидных связей между полипептидами белка уменьшается. В еще одних вариантах осуществления количество дисульфидных связей между полипептидами белка сохраняется.
[9] В определенных вариантах осуществления раскрытых способов предварительно определенные параметры раствора представляют собой одно или несколько из следующих: наименование окислительно-восстановительного реагента, концентрация окислительно-восстановительного реагента, значение рН, наименование газа, уровни содержания растворенных газов, проводимость и плотность жизнеспособных клеток.
[10] В определенных вариантах осуществления раскрытых способов наименование окислительно-восстановительного реагента представляет собой 2-меркаптоэтиламин (2-МЕА), восстановленный глутатион, окисленный глутатион, 2-меркаптоэтанол, дитиотреитол (DTT), цистеин, цистин, дитиобутиламин или сульфит натрия. В некоторых из данных вариантов осуществления наименование окислительно-восстановительного реагента представляет собой 2-МЕА. В некоторых из этих вариантов осуществления отношение молярности окислительно-восстановительного реагента к молярности белка составляет по меньшей мере 4:1, 8:1, 16:1 или 32:1.
[11] В определенных вариантах осуществления раскрытых способов предварительно определенная температура инкубирования составляет от приблизительно 2°C до приблизительно 23oC. В других вариантах осуществления предварительно определенная температура инкубирования составляет от приблизительно 23°C до приблизительно 37°C или выше. В некоторых вариантах осуществления раскрытых способов кондиционированный раствор, содержащий полипептиды мультимерного белка, перемешивают в ходе инкубирования.
[12] В некоторых вариантах осуществления биологический способ в раскрытых способах представляет собой периодический, полунепрерывный или непрерывный биологический способ. В некоторых вариантах осуществления полипептиды мультимерного белка приводят в контакт с кондиционированным раствором в конкретный момент времени в ходе биологического способа, который происходит после технологической операции в биореакторе и/или операции с периодической подпиткой культуры клеток в биологическом способе.
[13] В определенных вариантах осуществления раскрытые способы дополнительно предусматривают стадию выведения полипептидов из биологического способа в конкретный момент времени в ходе биологического способа. В некоторых из этих вариантов осуществления раскрытые способы дополнительно предусматривают стадию возвращения полипептидов в биологический способ после инкубирования.
[14] В другом аспекте раскрытых способов полипептиды мультимерного белка приводят в контакт с кондиционированным раствором в конкретный момент времени в ходе биологического способа, когда полипептиды находятся в растворе, содержащем множество клеток. В некоторых из данных вариантов осуществления конкретный момент времени представляет собой момент времени, когда полипептиды находятся в биореакторе, емкости для выдерживания или в сосуде для отдельных технологических операций за пределами биореактора, содержащих множество клеток.
[15] В другом аспекте раскрытых способов полипептиды мультимерного белка приводят в контакт с кондиционированным раствором в конкретный момент времени, когда полипептиды мультимерного белка находятся в не содержащем клетки растворе. В некоторых из этих вариантов осуществления конкретный момент времени наступает в ходе стадии инактивации вируса, регулирования, хроматографии, фильтрации, разбавления, концентрации или любой стадии биологического способа, на которой не используют клетки. В других вариантах осуществления конкретный момент времени наступает в ходе стадии очистки, стадии сбора очищенного материала, стадии захвата, стадии промежуточной хроматографии или стадии доочистки посредством хроматографии в биологическом способе. В некоторых из этих вариантов осуществления конкретный момент времени в ходе биологического способа представляет собой момент времени, при котором полипептиды находятся в емкости для выдерживания. В других определенных вариантах осуществления значение рН содержащего полипептиды кондиционированного раствора после стадии инкубирования составляет от приблизительно 3,0 до приблизительно 5,0.
[16] В одном варианте осуществления не содержащий клетки раствор, содержащий полипептиды мультимерного белка, содержит элюат белка A. В другом варианте осуществления не содержащий клетки раствор, содержащий полипептиды мультимерного белка, содержит собранный очищенный материал.
[17] В некоторых вариантах осуществления раскрытых способов полипептиды мультимерного белка представляют собой мономеры белка. В других вариантах осуществления полипептиды мультимерного белка представляют собой мультимеры белка.
[18] В другом аспекте мультимерный белок, который контролируется в соответствии с раскрытыми способами, представляет собой антитело. В некоторых из этих вариантов осуществления полипептиды мультимерного белка представлены полипептидами тяжелых цепей. В других вариантах осуществления полипептиды мультимерного белка представлены полипептидами легких цепей. В еще одних вариантах осуществления полипептиды мультимерного белка представлены полипептидами тяжелых цепей и полипептидами легких цепей. В одном варианте осуществления антитело в раскрытых способах представляет собой антитело IgG4. В другом варианте осуществления антител в раскрытых способах представляет собой натализумаб, гемтузумаб или фрезолимумаб.
[19] В другом аспекте мультимерный белок, который контролируют в соответствии с раскрытыми способами, представляет собой фрагмент антитела. В некоторых из этих вариантов осуществления полипептиды мультимерного белка представлены полипептидами тяжелых цепей. В других вариантах осуществления полипептиды мультимерного белка представлены полипептидами легких цепей. В еще одних вариантах осуществления полипептиды мультимерного белка представлены полипептидами тяжелых цепей и полипептидами легких цепей. В одном варианте осуществления фрагмент антитела в раскрытых способах представляет собой фрагмент антитела IgG4.
[20] В еще другом аспекте мультимерный белок, который контролируют в соответствии с раскрытыми способами, представляет собой белок, не являющийся антителом. В определенных вариантах осуществления белок, не являющийся антителом, представляет собой фермент.
[21] В другом аспекте в данном документе раскрыт способ контролирования доли молекул полуантител в растворе, содержащем совокупность молекул антител. Определенные варианты осуществления данного аспекта предусматривают следующие стадии: (a) приведение в контакт раствора, содержащего совокупность молекул антител, с кондиционированным раствором, где кондиционированный раствор характеризуется предварительно определенными параметрами раствора, и (b) инкубирование кондиционированного раствора, содержащего молекулы антител, в течение предварительно определенного времени при предварительно определенной температуре, где путем инкубирования молекул антител с кондиционированным раствором контролируют долю молекул полуантител в кондиционированном растворе антител. В определенных вариантах осуществления данного аспекта предварительно определенные параметры раствора предусматривают выбор окислительно-восстановительного реагента, концентрацию окислительно-восстановительного реагента, значение рН, выбор газа, уровни содержания растворенных газов, проводимость, плотность жизнеспособных клеток и/или концентрацию белка.
[22] В некоторых вариантах осуществления доля молекул полуантител в кондиционированном растворе антител составляет менее 30 процентов (%). В других вариантах осуществления доля молекул полуантител в кондиционированном растворе антител составляет менее 20 процентов (%). В еще одних вариантах осуществления доля молекул полуантител в кондиционированном растворе антител составляет менее 15 процентов (%).
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
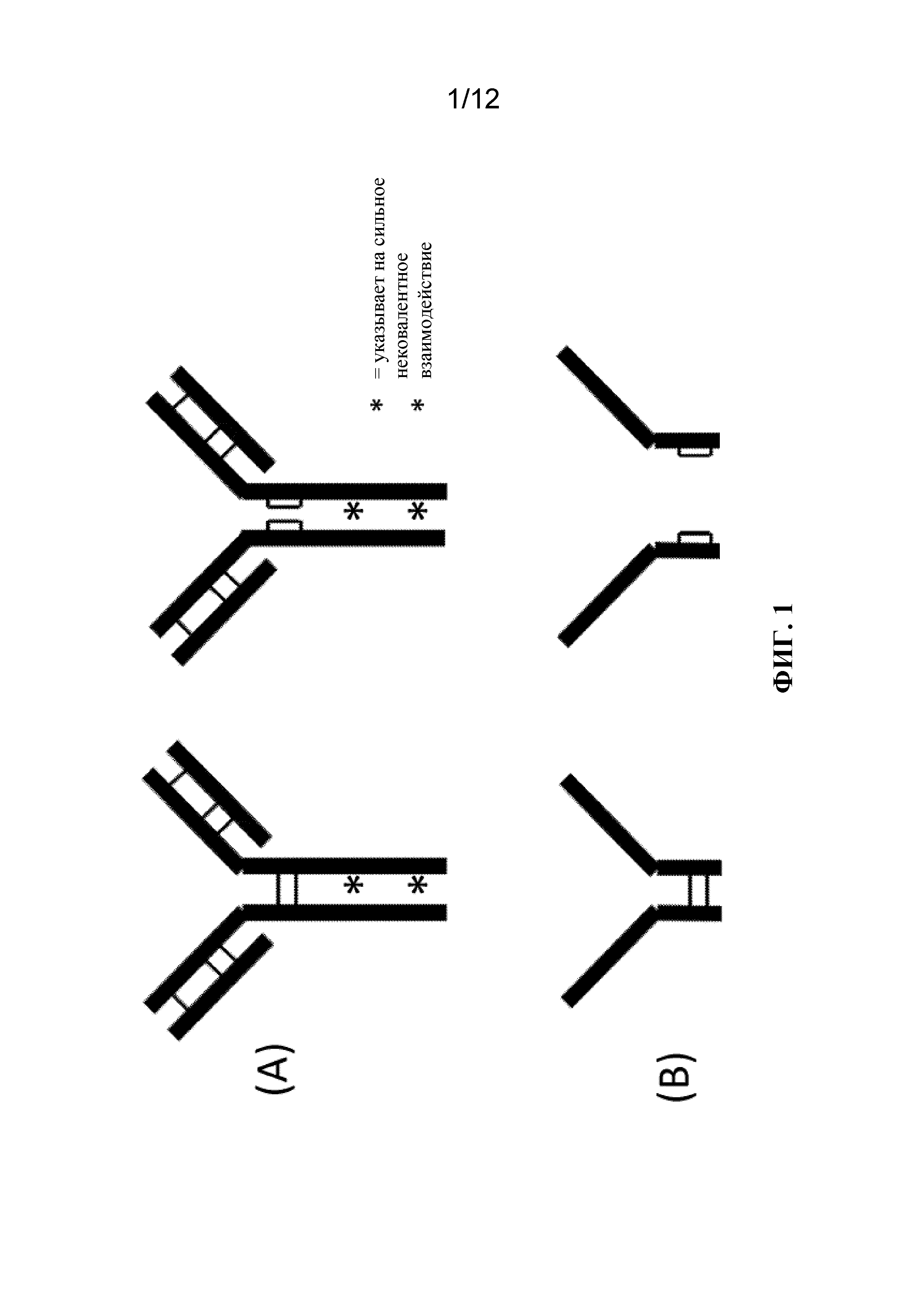
[23] Фигура 1: схематические представления иллюстративных мультимерных белков, по отношению к которым можно применить способ биологического производства для контроля образования дисульфидных связей. На фигуре 1А показано полное антитело (слева) и полуантитело (справа), в которых мономерные субъединицы белка (толстые линии) связаны друг с другом дисульфидными связями (тонкие линии) и сильными нековалентными взаимодействиями (звездочки). В данном примере полные антитела содержат дисульфидные связи между всеми мультимерными субъединицами, в том числе межцепочечные дисульфиды между двумя более крупными субъединицами тяжелых цепей. Вместо этого, в полуантителе в качестве внутрицепочечных дисульфидных связей существуют межцепочечные дисульфидные связи, в результате чего между субъединицами тяжелых цепей ковалентная связь отсутствует. Тем не менее, сильные нековалентные взаимодействия сохраняют сильную ассоциацию между двумя субъединицами тяжелых цепей. Полные антитела или полуантитела могут характеризоваться специфичностью в отношении одной мишени или двух различных мишеней (биспецифичностью). На фигуре 1В показаны фрагменты антител, соединенные друг с другом посредством межцепочечных дисульфидных связей (слева) или полностью отделенные друг от друга (справа) в случае внутрицепочечных дисульфидных связей внутри фрагмента. В данном случае из-за отсутствия конкретных сегментов белка сильные нековалентные взаимодействия между фрагментами отсутствуют, и, следовательно, фрагменты антител не связаны друг с другом, в то время как внутрицепочечные дисульфидные связи присутствуют. Эти фрагменты могут характеризоваться специфичностью в отношении одной и той же мишени или двух различных мишеней (биспецифичностью).
[24] Фигура 2: схематическое представление отдельных технологических операций биологического способа, включающего разные моменты времени для осуществления раскрытых способов. Способы можно реализовать (1) в пределах отдельных технологических операций, например путем добавления в биореактор или введение в стадию промывки на хроматографической колонке, (2) между отдельными технологическими операциями, например, в ходе переноса между биореактором и накопительной емкостью для выдерживания собранного материала, или (3) в ходе стадии выдерживания для промежуточного процесса, такого как сбор элюата при хроматографии или сбор материала из биореактора. Возможны альтернативные схемы биологического способа, в том числе включение различных или дополнительных отдельных технологических операций в пределах биологического способа. Примеры изменений включают альтернативные технологические операции очистки (отличные от центрифугирования и глубинной фильтрации) или включение дополнительной стадии хроматографии.
[25] На фигуре 3 показано исследование с выдерживанием (неочищенного материала) с использованием раствора, содержащего клетки, при котором варьировали время выдерживания, температуру и исходную плотность жизнеспособных клеток (VCD). Содержание полуантител в процентах от общего содержания молекул антител показано на фигуре 3А и фигуре 3С в зависимости от времени выдерживания (в днях). На фигуре 3А содержание полуантител измеряли в зависимости от времени выдерживания при трех разных температурах: 8oC/холод (круги), 21oC/температура окружающей среды (квадраты) или 37oC/тепло (треугольники). На фигуре 3C показана зависимость содержания полуантител от времени выдерживания либо для перемешанных образцов (круги), либо неперемешанных образцов с низким VCD (ромбы). Плотность жизнеспособных клеток в миллионах клеток на мл (x106 клеток на мл) показана в зависимости от времени выдерживания (в днях) и изображена на фигуре 3В и на фигуре 3D. На фигуре 3В показана зависимость содержания полуантител от времени выдерживания при трех разных температурах: 8oC/холод (круги), 21oC/температура окружающей среды (квадраты) или 37oC/тепло (треугольники). На фигуре 3D показана зависимость содержания полуантител от времени выдерживания либо для перемешанных образцов (круги), либо неперемешанных образцов с низким VCD (ромбы).
[26] На фигуре 4 показано влияние перемешивания на полуантитело IgG4 в исследовании с выдерживанием (неочищенного собранного материала), в котором использовали содержащий клетки раствор. Содержание полуантител в процентах от общего содержания молекул антител показано в зависимости от времени выдерживания (в днях) либо с перемешиванием (круги со штриховыми линиями), либо без перемешивания (круги со сплошными линиями) посредством плавного вращения. Образцы выдерживали при 8°C. Исходная жизнеспособность клеток для обоих условий составляла приблизительно 2,5×106 клеток/мл.
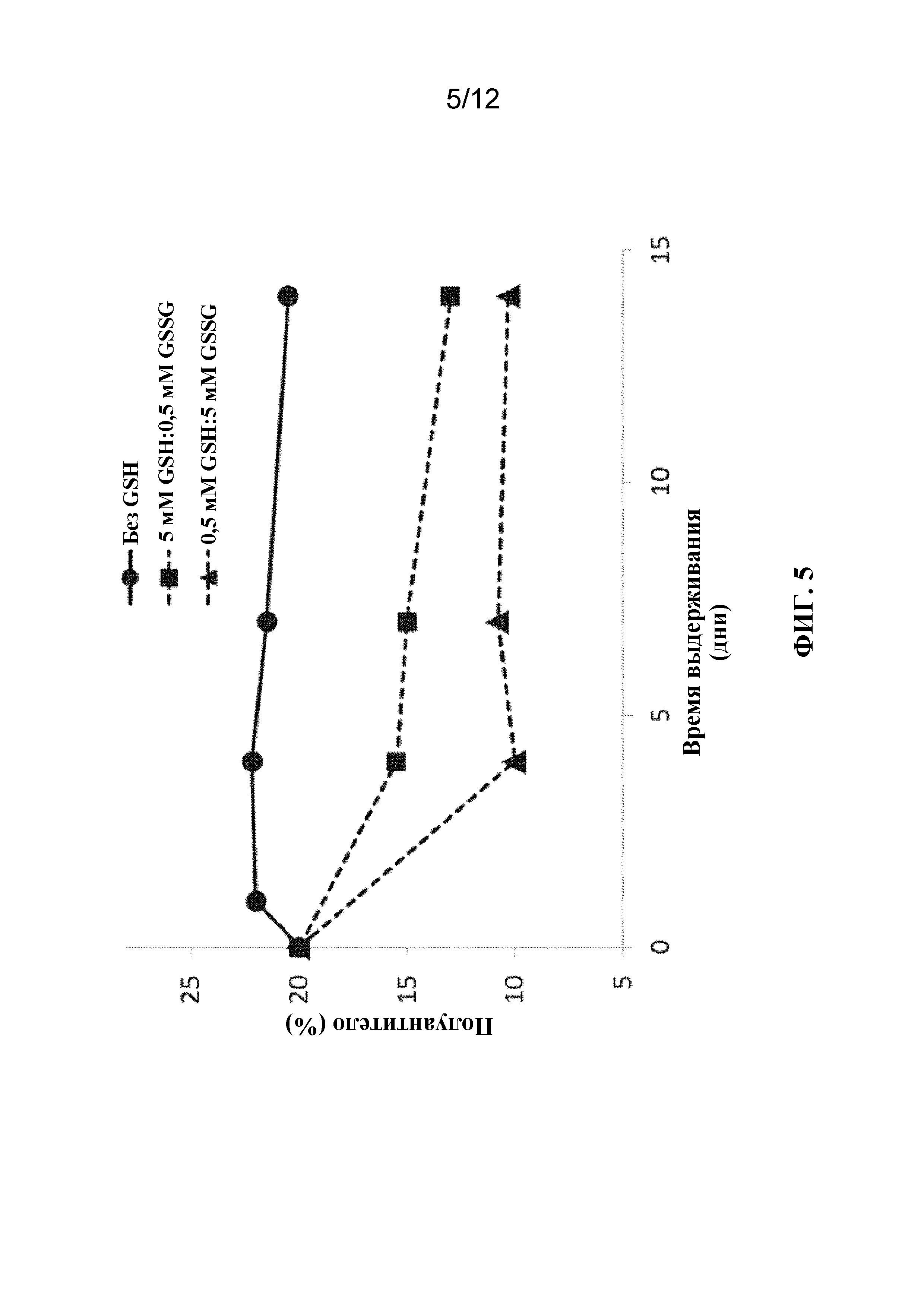
[27] На фигуре 5 показано влияние добавления окислительно-восстановительного реагента в исследовании с выдерживанием (неочищенного собранного материала), в котором использовали систему, содержащую клетки. Содержание полуантител в процентах от общего содержания молекул антител показано в зависимости от времени выдерживания (в днях), при этом зависимость представлена без добавления глутатиона (круги), с добавлением 5 мМ восстановленного глутатиона (GSH) и 0,5 мМ окисленного глутатиона (GSSG, квадраты), или с добавлением 0,5 мМ GSH и 5 мМ GSSG (треугольники). Образцы выдерживали в течение указанных промежутков времени при 8°C. Исходная жизнеспособность клеток для всех трех условий составляла примерно 2,5×106 клеток/мл.
[28] На фигуре 6 показано влияние добавления окислительно-восстановительных реагентов 0,5 мМ 2-MEA, 2 мМ 2-МЕА и 5 мМ восстановленного глутатиона (GSH) в биореактор ближе к завершению в нем рабочего цикла как при высоком заданном значении рН (7,1), так и при низком заданном значении рН (6,9). Содержание полуантител в процентах от общего содержания молекул антител показано в зависимости от времени выдерживания (в часах) в условиях добавления 2 мМ 2-MEA при значении рН 7,1 (незаполненные квадраты) или рН 6,9 (заполненные квадраты), добавления 0,5 мМ 2-MEA при значении рН 7,1 (круги) или рН 6,9 (заполненные круги), или добавления 5 мМ восстановленного глутатиона (GSH) (заполненные ромбы). Ряды данных для заполненных и незаполненных квадратов практически перекрываются.
[29] На фигуре 7 показано влияние двух разных исходных показателей жизнеспособности клеток на долю полуантител, обработанных 2-MEA. Содержание полуантител в процентах от общего содержания молекул антител показано в зависимости от времени выдерживания после обработки (в часах). Образцы получали из биореактора, который контролировали при заданных уровнях для разных параметров. Два разных исследованных исходных показателя жизнеспособности составляли 70% жизнеспособность в день 12 (D12) культуры с периодической подпиткой (круги) и 45% жизнеспособность в день 14 (D14) культуры с периодической подпиткой (квадраты).
[30] На фигуре 8 показано влияние условий температуры и значения рН на очищенный собранный материал, полученный из биореактора, предварительно обработанного 2-MEA. Содержание полуантител в процентах от общего содержания молекул антител показано в зависимости от времени выдерживания (в часах), в зависимости от выдерживания при 2-8°C с увеличением значения рН менее чем на 0,1 (заполненные ромбы) или с увеличением значения рН более чем на 0,5 (незаполненные ромбы), или при комнатной температуре (21oC) с увеличением значения рН менее чем на 0,1 (заполненные треугольники) или с увеличением значения рН более чем на 0,5 (незаполненные треугольники).
[31] На фигуре 9 показано влияние обработки 2-MEA на долю полуантител в собранном очищенном материале после выдерживания с инкубированием при комнатной температуре (21°C) или 8°C. На фигуре 9 показаны доли полуантител в каждом образце в течение первых двух часов с обработкой 2-MEA или без нее. Условия испытаний включали комнатную температуру (21oC) без добавления 2-MEA (круги), комнатную температуру (21oC) с добавлением 2-MEA (ромбы), 8°C без добавления 2-MEA (квадраты) и 8°C без добавления 2-MEA (треугольники).
[32] На фигуре 10 показано влияние обработки 2-MEA на долю полуантител в собранном очищенном материале после выдерживания с инкубированием при комнатной температуре (21°C) или 8°C. На фигуре 10 показаны доли полуантител каждого образца в течение 7 суток (168 часов) с обработкой 2-MEA или без нее. Условия испытаний включали комнатную температуру (21oC) без добавления 2-MEA (круги), комнатную температуру (21oC) с добавлением 2-MEA (ромбы), 8°C без добавления 2-MEA (квадраты) и 8°C без добавления 2-MEA (треугольники).
[33] На фигуре 11 показаны результаты электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия в невосстанавливающих условиях (SDS-PAGE) для оценки различных окислительно-восстановительных реагентов в отношении их способности контролировать долю полуантител, находящихся в биологическом способе. Окислительно-восстановительные реагенты добавляли к элюату белка A и инкубирование проводили в течение 2-х часов при комнатной температуре при значении рН 4,8. Все образцы повторно выделяли на колонке с белком А, чтобы удалить любой присутствующий окислительно-восстановительный реагент. Условия испытаний не включали окислительно-восстановительный реагент (дорожка 1),: 2 мМ 2-MEA (дорожка 2),: 3 мМ 2-MEA (дорожка 3), 2 мМ MEA+2 мМ окисленного глутатиона (GSSG) (дорожка 4), 2 мМ восстановленного глутатиона (GSH) (дорожка 5), 2 мМ GSH+2 мМ GSSG (дорожка 6), 2 мМ меркаптоэтанола (дорожка 7) и 2 мМ дитиотреитола (дорожка 8).
[34] На фигуре 12 изображен электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия в невосстанавливающих условиях (SDS-PAGE) для анализа антитела IgG4. В денатурирующих условиях, таких как условия при SDS-PAGE, полуантитела появляются в виде отчетливых дорожек, отдельно от полных антител. Дорожка 1: маркеры молекулярного веса, дорожка 10: испытуемый образец IgG4 до обработки согласно способу для контроля образования полуантител, дорожка 11: Образцы для испытаний IgG4 обрабатывали согласно способу для контроля образования полуантител, предназначенного для уменьшения общего содержания полуантител.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[35] Настоящее раскрытие включает способы контролирования образования дисульфидных связей между полипептидами получаемого с помощью биологического способа белка. Один из путей оценки измерения (например числа) дисульфидных связей между полипептидами заключается в измерении доли молекул полуантител (Hab), находящихся в растворе, содержащем совокупность молекул антител. Оценивая влияние кондиционированного раствора на уровень полуантитела, находящегося в растворе антитела иммуноглобулина G подкласса 4 (IgG4), оценивают влияние кондиционированного раствора на образование дисульфидной связи между полипептидами. Как раскрыто в данном документе, конкретные параметры полипептид-содержащего раствора оказали неожиданное и сильное влияние на образование дисульфидных связей между полипептидами. Раскрыт ряд способов контроля образования дисульфидной связи, в том числе стратегии уменьшения, увеличения или сохранения уровней образования дисульфидных связей между полипептидами. Как подробно раскрыто в данном документе, такие способы можно применять во многих точках в пределах типичного биологического способа, используемого для получения белка, в том числе, например, получения белков-антител или фрагментов антител. (Фигура 2).
[36] IgG4 обладают несколькими свойствами, которые делают их перспективными кандидатами для терапии, а также превосходной моделью для оценки образования дисульфидных связей между полипептидами. Например, IgG4 характеризуются длительным временем полужиизни в сыворотке крови и низкой функцией Fc и/или эффекторной функцией. (Bruggemann et al., 1987, J Exp. Med. 166(5):1351-61). Тем не менее, антитела IgG4 также обладают необычными свойствами, которые in vivo являются нежелательными: антитела IgG4 являются нестабильными динамическим молекулами, которые вовлечены в обмен Fab-фрагментами. При введении терапевтического антитела IgG4 может происходить обмен с эндогенными антителами IgG4 с нежелательными специфичностями. Случайный характер такого процесса вводит непредсказуемость, которая является крайне нежелательной для иммунотерапии человека.
[37] Такие неопределенности, связанные с ролью IgG4 в обмене Fab-фрагментами и влиянием in vivo полуантител, требуют сведения к минимуму уровня полуантител, находящихся в готовой композиции на основе терапевтических антител. Ранее доли Hab уменьшались из-за мутации аминокислотной последовательности шарнирного участка антитела IgG4 по отношению к такой последовательности шарнирного участка IgG1, который, как было показано, существенно стабилизирует ковалентное дисульфидное взаимодействие между тяжелыми цепями IgG4 (Angal et al., 1993, Mol. Immunol. 30(1):105-8; Schuurman et al., 2001; публикация заявки на патент США № US 2011/0086366 A1). Изменение аминокислотной последовательности и полученной в результате структуры белка антитела, особенно для терапевтического антитела, уже проходящего стадию активного клинического исследования, представляет как научные, так и нормативные проблемы. В результате данная стратегия мутагенеза не может применяться во многих ситуациях, когда клинические и даже доклинические испытания с терапевтическим IgG4, характеризующимся конкретными уровнями полуантитела, были значимыми. Следовательно стратегии контроля уровней полуантитела должны быть установлены для обеспечения молекулярного постоянства на протяжении последующего клинического исследования и коммерческой реализации терапевтической молекулы IgG4.
[38] Способы, раскрытые в данном документе, предусматривают многочисленные способы контролирования образования дисульфидных связей между полипептидами получаемого с помощью биологического способа мультимерного белка. Способы, раскрытые в данном документе, включают способы с применением клеток и cпособы без применения клеток, в которых применяют кондиционированные растворы с предварительно определенными параметрами раствора, в том числе наименование окислительно-восстановительного реагента, концентрация окислительно-восстановительного реагента, значение рН, наименование газа, уровни содержания растворенных газов, проводимость и/или плотность жизнеспособных клеток. Такие способы можно реализовывать в одной или нескольких точках в биологическом способе для контроля, уменьшения, увеличения или сохранения образования дисульфидных связей между полипептидами мультимерного белка, например, между тяжелыми цепями антитела IgG4. Контроль образования дисульфидных связей между полипептидными мономерами и/или мультимерами необходим для обеспечения качественной стабильности продукта в пределах срока годности мультимерного белкового продукта или при получении биологически эквивалентных или биологически подобных типов мультимерного белка.
Кондиционированные растворы
[39] В одном аспекте в способах, представленных в данном документе, раскрывается приведение в контакт полипептидов белка с "кондиционированным раствором", который оптимизировали для получения требуемого образования или числа дисульфидных связей между полипептидами. Параметры данного кондиционированного раствора были предварительно определены для осуществления контроля образования дисульфидных связей, что и требовалось. В определенных вариантах осуществления параметры кондиционированного раствора предварительно определяли для уменьшения числа дисульфидных связей между полипептидами белка. В других вариантах осуществления параметры кондиционированного раствора предварительно определяли для увеличения числа дисульфидных связей между полипептидами белка. В еще одних вариантах осуществления параметры кондиционированного раствора предварительно определяли для сохранения числа дисульфидных связей между полипептидами белка. Влияние условий инкубирования и предварительно определенных параметров условий на образование дисульфидных связей может быть продемонстрировано путем измерения доли полуантитела IgG4, находящегося в белковом растворе. В некоторых вариантах осуществления раскрытых способов доля молекул полуантител (Hab) в растворе, содержащем мультимерный белок, является определенной. Определение доли молекул полуантител можно использовать в качестве способа оценки образования дисульфидных связей между полипептидами мультимерного белка.
[40] "Кондиционированный раствор", используемый в соответствии с раскрытыми способами, предусматривает один или несколько предварительно определенных параметров раствора. Перед применением раскрытых способов в отношении биологического способа, в ходе которого получают белок, в определенных вариантах осуществления параметры кондиционированного раствора определяют до применения данных способов в отношении биологического способа, используемого для получения представляющего интерес белка. В одном аспекте данных способов кондиционированный раствор представляет собой раствор, содержащий клетки. В другом аспекте кондиционированный раствор представляет собой не содержащий клетки раствор. Дополнительные подробности, относящиеся к каждому из данных аспектов, раскрыты в других частях данного описания (см. ниже).
[41] На контроль образования или числа дисульфидных связей могут влиять свойства конкретного полипептида, белка и/или класса белков, выбранных для применения в способах по настоящему изобретению. Также на контроль образования дисульфидных связей могут влиять характеристики биологического способа, используемого для получения представляющего интерес белка, в том числе, например, схема биологического способа и характеристики отдельных технологических операций в составе биологического способа. Таким образом, может быть необходимым проведение предварительных испытательных исследований с целью оптимизации одного или нескольких параметров кондиционированных растворов для достижения требуемого результата с выбранным белком и биологическим способом. Неограничивающие примеры таких испытательных исследований и экспериментов раскрыты в данном документе (см. раздел "Примеры" ниже).
[42] Различные предварительно определенные условия раствора, раскрытые в данном документе, можно применять либо независимо, либо в комбинации с другими предварительно определенными условиями раствора. Для ознакомления с иллюстративным исследованием см. таблицу 2 (ниже). Каждое из условий, раскрытых в данном документе, обеспечивает некоторый уровень контроля над образованием дисульфидных связей между полипептидами белков в соответствии с раскрытыми способами. Одно предварительно определенное условие раствора может оказывать влияние на одно или несколько из других предварительно определенных условий раствора в любом данном растворе. В определенных вариантах некоторые предварительно определенные условия раствора будут "комплементарными" к одному или нескольким из других предварительно определенных условий раствора, что позволит использовать менее экстремальные условия для получения требуемого результата в отношении образования дисульфидных связей. Например, при использовании конкретного газа и давления газа (например, кислорода) в растворе может потребоваться сниженная концентрация окислительно-восстановительного реагента для достижения такого же результата, как и с раствором, где конкретный газ не используется. В определенных вариантах осуществления применение комбинации предварительно определенных условий раствора оказывает дополнительный эффект в отношении образования дисульфидных связей. В других вариантах осуществления применение комбинации предварительно определенных условий раствора оказывает синергический эффект в отношении образования дисульфидных связей.
[43] Используемое в данном документе выражение "предварительно определенные параметры раствора" относится к одному или нескольким параметрам, свойствам, качествам, композиции, составу и/или другим характеристикам раствора.
[44] В некоторых применениях раскрытых способов доля молекул Hab в растворе является требуемым результатом образования дисульфидных связей. В одном аспекте раскрытые способы используются для контроля доли молекул полуантител в растворе, содержащем совокупность молекул антител. В таких случаях раскрытые способы используют для контроля дисульфидных связей, принимающих участие в образовании Hab. При помощи данных способов возможным является получение кондиционированного раствора антител с требуемой долей молекул Hab.
[45] В некоторых вариантах осуществления требуемая доля молекул Hab в растворе подобрана в виде абсолютного количества или диапазона абсолютных количеств. При использовании раскрытых способов долю молекул Hab в растворе можно контролировать для достижения требуемого абсолютного количества или абсолютной доли Hab. Раскрытые способы можно использовать либо для увеличения, либо для уменьшения доли Hab. В определенных вариантах осуществления требуемая доля молекул Hab в растворе составляет менее 5%, приблизительно 5-10%, 10-15%, 15-20%, 20-25%, 25-30%, 30-50% или более 50%.
[46] В других вариантах осуществления требуемая доля молекул Hab в растворе подобрана в виде процентного изменения или диапазона процентных изменений (например, процентное увеличение или уменьшение) по сравнению с раствором до применения раскрытых способов. При использовании раскрытых способов долю молекул Hab в растворе можно контролировать для достижения требуемого абсолютного количества или доли Hab.
[47] В некоторых вариантах осуществления требуемое изменение доли молекул Hab в растворе уменьшено на приблизительно 1%, 2%, 5%, 10%, 15%, 20%, 25%, 50% или более. В других определенных вариантах осуществления требуемое изменение доли молекул Hab в растворе уменьшено на приблизительно 1-5%, 5-10%, 10-15%, 15-20%, 20-25%, 25-30%, 30-50% или более 50%. В еще одних вариантах осуществления требуемое изменение доли молекул Hab в растворе уменьшено на приблизительно 1-50%.
[48] В других вариантах осуществления требуемое изменение доли молекул Hab в растворе увеличено на приблизительно 1%, 2%, 5%, 10%, 15%, 20%, 25%, 50% или более. В других определенных вариантах осуществления требуемое изменение доли молекул Hab в растворе увеличено на приблизительно 1-5%, 5-10%, 10-15%, 15-20%, 20-25%, 25-30%, 30-50% или более 50%. В еще одних вариантах осуществления требуемое изменение доли молекул Hab в растворе увеличено на приблизительно 1-50%.
Окислительно-восстановительные реагенты
[49] В одном аспекте раскрытых способов предварительно определенный параметр раствора представляет собой наименование окислительно-восстановительного реагента, используемого в кондиционированном растворе. Используемый в данном документе термин "окислительно-восстановительный реагент" относится к средству, содержащему в смеси его восстановленную форму, его окисленную форму или комбинацию его восстановленной формы и его окисленной формы. В соответствии с раскрытыми способами окислительно-восстановительный реагент может находиться в кондиционированном растворе или отсутствовать в нем в зависимости от требуемого результата образования дисульфидных связей для конкретного белка и/или биологического способа. В вариантах осуществления, где окислительно-восстановительный реагент находится в кондиционированном растворе, определенный окислительно-восстановительный реагент предназначен для внесения в кондиционированный раствор.
[50] Неограничивающие примеры окислительно-восстановительных реагентов, подходящих для раскрытых способов, включают 2-меркаптоэтиламин (2-MEA), восстановленный глутатион, окисленный глутатион, 2-меркаптоэтанол, дитиотреитол (DTT), цистеин, цистин, дитиобутиламин и сульфит натрия. Некоторые окислительно-восстановительные реагенты могут приводить к превосходным результатам в зависимости от конкретного белка и/или раствора. Специалист в данной области способен провести идентифицирование, выбор и испытание различных окислительно-восстановительных реагентов на конкретном белковом растворе для определения того, какой окислительно-восстановительный реагент использовать в соответствии с раскрытыми способами. (См., например, публикацию заявки на патент США № US 2013/0259882/0086366 A1). В определенных вариантах осуществления окислительно-восстановительный реагент, используемый в раскрытых в данном документе способах, представляет собой меркаптоэтиламин (2-МЕА). Было показано, что 2-MEA специфически уменьшает количество дисульфидных связей в шарнирном участке IgG4. (Palmer et al., 1963, J Biol. Chem., 238(7):2393-2398).
[51] Использование окислительно-восстановительных реагентов было изучено в области антител для различных целей. Например, окислительно-восстановительные реагенты, такие как 2-меркаптоэтиламин (2-MEA), использовали для специфического уменьшения межцепочечной дисульфидной связи между двумя Fab-фрагментами с целью содействия обмену Fab-фрагментами. (King et al., 1992, Biochem J. 281(2):317-23).
[52] В определенных вариантах осуществления раскрытых способов один предварительно определенный параметр раствора представляет собой концентрацию окислительно-восстановительного реагента, используемого в кондиционированном растворе. Диапазон концентраций подобранного(подобранных) окислительно-восстановительного(окислительно-восстановительных) реагента(реагентов) можно использовать в соответствии с раскрытыми способами. После того, как подобран окислительно-восстановительный реагент, концентрацию окислительно-восстановительного реагента необходимо оптимизировать в соответствии с подобранным окислительно-восстановительным реагентом, белком и/или биологическим способом. В некоторых вариантах осуществления способов, где окислительно-восстановительный реагент находится в кондиционированном растворе, более низкие концентрации окислительно-восстановительного реагента в кондиционированном растворе будут приводить к увеличению образования дисульфидных связей между полипептидами белков. Например, в одном эксперименте использование более низких концентраций окислительно-восстановительного реагента в кондиционированном растворе приводит к уменьшению доли молекул полуантител в совокупности молекул антител в растворе (таблица 2).
[53] В других вариантах осуществления способов, где окислительно-восстановительный реагент находится в кондиционированном растворе, более высокие концентрации окислительно-восстановительного реагента в кондиционированном растворе будут приводить к уменьшению образования или числа дисульфидных связей между полипептидами белка. Например, в одном эксперименте использование более высоких концентраций окислительно-восстановительного реагента в кондиционированном растворе приводит к увеличению доли молекул полуантител в совокупности молекул антител в растворе. (Таблица 2).
[54] В определенных вариантах осуществления оптимальная концентрация окислительно-восстановительного реагента составляет 0,01, 0,1, 0,5, 1, 2, 5, 25, 50 мМ или выше.
[55] Оптимальная концентрация окислительно-восстановительного реагента может также зависеть от концентрации белка или полипептидов в растворе. Таким образом, в определенных вариантах осуществления отношение концентрации окислительно-восстановительного реагента к концентрации белка можно оценить при определении оптимальных параметров окислительно-восстановительного реагента в кондиционированном растворе. Отношение концентрации окислительно-восстановительного реагента к концентрации белка можно определить в дополнение или, в качестве альтернативы, к определению концентрации окислительно-восстановительного реагента для кондиционированного раствора.
[56] В определенных вариантах осуществления оптимальное отношение молярности окислительно-восстановительного реагента к молярности белков составляет по меньшей мере 2:1, 4:1, 8:1, 16:1, 32:1, 64:1, 72:1, 88:1, 100:1 или выше. В определенных вариантах осуществления способов, таких как с применением конкретных не содержащих клетки белковых растворов, отношение молярности окислительно-восстановительного реагента к молярности белка составляет от приблизительно 4:1 до приблизительно 40:1.
Время инкубирования
[57] В другом аспекте раскрытых способов кондиционированный раствор инкубируют с полипептидами мультимерного белка в течение предварительно определенного времени. Как видно из других аспектов раскрытых способов, на предварительно определенное время инкубирования могут оказывать влияние свойства белка, биологический способ и/или другие условия раствора, выбранные для применения в способах по настоящему изобретению. В зависимости от предварительно определенных параметров кондиционированного раствора, время инкубирования может составлять по меньшей мере 1 минуту или менее, или больше чем неделя или более. Например, если концентрация окислительно-восстановительного реагента в кондиционированном растворе высокая, то время инкубирования по возможности должно быть коротким, чтобы избежать повреждения белка. С другой стороны, если концентрация окислительно-восстановительного реагента является низкой, то время инкубирования по возможности должно быть более длительным, чтобы достичь требуемого контроля дисульфидных связей. В качестве еще одного иллюстративного примера, если инкубирование белка в течение продолжительного периода времени при определенном значении рН может приводить к нестабильности белка, тогда тот же самый белок может оставаться стабильным при том же самом значении рН, если его инкубировать только на протяжении короткого периода. Таким образом, по отношению к некоторым белкам можно задействовать предельные значения рН, если время инкубирования соответственно корректируют, чтобы свести нестабильность белка к минимуму. Дополнительные неограничивающие примеры таких испытательных исследований и экспериментов раскрыты в примере 2 и на фигуре 3.
Температура инкубирования
[58] В другом аспекте раскрытых способов кондиционированный раствор инкубируют с полипептидами при предварительно определенной температуре. Как видно из других аспектов раскрытых способов, на предварительно определенную температуру инкубирования могут оказывать влияние свойства белка, биологический способ и/или другие условия раствора, выбранные для применения в способах по настоящему изобретению. Кроме того, разные белки характеризуются разными показателями стабильности при конкретных температурах. Например, требуемого результата можно достигать быстрее или медленнее в зависимости от температуры инкубирования. В определенных вариантах осуществления температуру можно уменьшать для того, чтобы стимулировать образованию дисульфидной связи и превращение полуантитела в полные антитела. В других вариантах осуществления температуру можно увеличивать, чтобы стимулировать превращение полных антител в полуантитело. Дополнительные неограничивающие примеры таких испытательных исследований и экспериментов раскрыты в примере 4 и на фигуре 3.
[59] В определенных вариантах осуществления раскрытых способов кондиционированный раствор инкубируют с полипептидами при предварительно определенной температуре от приблизительно 2°C до приблизительно 40°C.
Значение pH
[60] В другом аспекте раскрытых способов один предварительно определенный параметр кондиционированного раствора представляет собой значение pH кондиционированного раствора. Как видно из других аспектов раскрытых способов, на оптимальное значение pH кондиционированного раствора могут оказывать влияние свойства белка, биологический способ и/или другие условия раствора, выбранные для применения в способах по настоящему изобретению. Кроме того, период времени, в течение которого белок инкубируют при конкретном значении рН, также можно оптимизировать. Как правило, значение рН кондиционированного раствора подбирают в соответствии с требуемым значением рН полученного полипептид-содержащего раствора после инкубирования с кондиционированным раствором. В некоторых вариантах осуществления значение рН не регулируют и оставляют при приблизительно нейтральном значении рН (например от 6 до 8). В других определенных вариантах осуществления рН полипептид-содержащего раствора доводят до значения от приблизительно 4,0 до приблизительно 4,8. В других вариантах осуществления рН полипептид-содержащего раствора доводят до значения от приблизительно 3,0 до 4,0. В других вариантах осуществления рН полипептид-содержащего раствора доводят до значения от приблизительно 2,5 до 4,8. В еще одних вариантах осуществления рН полипептид-содержащего раствора доводят до значения приблизительно 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7 или приблизительно 4,8. В других определенных вариантах осуществления рН полипептид-содержащего раствора доводят до значения приблизительно 2,5 или ниже. В еще одних определенных вариантах осуществления рН полипептид-содержащего раствора доводят до значения приблизительно 4,8 или выше. Дополнительные неограничивающие примеры таких испытательных исследований и экспериментов раскрыты в примере 10 и таблице 3.
Наименование газа и уровни содержания растворенных газов
[61] В другом аспекте данных способов один предварительно определенный параметр раствора представляет собой наименование окислительно-восстановительного реагента, добавляемого в кондиционированный раствор. В соответствии с раскрытыми способами газ может находиться в кондиционированном растворе или отсутствовать в нем в зависимости от требуемого результата образования дисульфидных связей для конкретного белка и/или биологического способа. В вариантах осуществления, где газ находится в кондиционированном растворе, один или несколько газов выбраны для введения в кондиционированный раствор. Примеры газов, которые можно подобрать, представляют собой кислород (O2), диоксид углерода (CO2), азот (N) и различные композиции смешанных газов, такие как 20% O2/10% CO2/70% воздуха или 20% O2/5% CO2/75% воздуха.
[62] В определенных вариантах осуществления описанных способов, где газ находится в кондиционированном растворе, другим предварительно определенным параметром раствора является уровень содержания растворенного газа в кондиционированном растворе. Диапазон уровней содержания растворенного газа или газов можно использовать в соответствии с раскрытыми способами. После того, как подобран газ, концентрацию газа необходимо оптимизировать в соответствии с подобранным газом, белком и/или биологическим способом.
Проводимость
[63] В другом аспекте данных способов один предварительно определенный параметр раствора представляет собой проводимость кондиционированного раствора. В соответствии с раскрытыми способами можно задавать требуемый уровень проводимости в зависимости от требуемого результата образования дисульфидных связей для конкретного белка и/или биологического способа. Проводимость можно контролировать посредством добавления солей, таких как хлорид натрия, хлорид калия, сульфат аммония, фосфат натрия, или других химических веществ, известных в данной области, для изменения проводимости раствора. Кроме того, конкретные стадии в биологическом способе можно выбирать в качестве контрольных точек для полуантител в соответствии с их типичной проводимостью. Например, процесс культивирования культуры клеток обычно проводят при физиологической проводимости (10-15 мСм/см), в то время как загружаемый материал для ионного обмена, как правило, характеризуется низкой проводимостью (<10 мСм/см).
Плотность жизнеспособных клеток
[64] В другом аспекте раскрытых способов один предварительно определенный параметр раствора представляет собой плотность жизнеспособных клеток кондиционированного раствора. В некоторых вариантах осуществления отдельную технологическую операцию в биореакторе завершают в конкретный день производственного цикла биореактора, который совпадал с предполагаемой плотностью жизнеспособных клеток. В соответствии с раскрытыми способами жизнеспособные клетки могут находиться в кондиционированном растворе или отсутствовать в нем в зависимости от требуемого результата образования дисульфидных связей для конкретного белка и/или биологического способа. В определенных вариантам осуществления плотность жизнеспособных клеток составляет по меньшей мере 2×106 клеток/мл.
Способы, в которых используют среду с клетками
[65] В одном аспекте раскрытые способы можно применять в момент времени в биологическом способе, когда белок или полипептиды присутствуют в растворе, содержащем множество клеток (также называемом "раствор, содержащий клетки", "суспензия, содержащая клетки" или "собранный неочищенный материал"). Для типичных биологический способов, используемых в получении белков, представляющий интерес белок находится в растворе, содержащем множество клеток, в конкретные моменты времени в ходе биологического способа. В такие моменты времени белок может находиться в нескольких возможных местоположениях в пределах биологического способа, в том числе, например, в биореакторе, емкости для выдерживания или сосуде для отдельных технологических операций за пределами биореактора, содержащем множество клеток. Собранный неочищенный материал можно получить в результате таких процессов в биореакторе, как периодическая подпитка, однократная подпитка или перфузионные (непрерывные) процессы. В некоторых вариантах осуществления способы можно применять в сосуде, отделенном от биореактора. В еще одних вариантах осуществления способы можно применять в пределах сосуда для отдельной технологической операции, специально сконструированного для достижения требуемого образования дисульфидных связей с помощью определенного кондиционированного раствора. Например, сосуд для отдельных операций можно сконструировать для достижения требуемого превращения полуантитела в полное антитело при определенных условиях. Неограничивающие примеры таких отдельных сосудов включают трубчатый реактор, химический реактор непрерывного действия с мешалкой (CSTR) и контур рециркуляции. Дополнительная информация об их местоположениях в пределах биологического способа представлена в других частях данного описания.
[66] В некоторых вариантах осуществления способов, где представляющий интерес белок находится в растворе, содержащем множество клеток, белок приводят в контакт с кондиционированным раствором, который включает совокупность жизнеспособных клеток. В таких определенных вариантах осуществления кондиционированный раствор может представлять собой тот же самый раствор, который содержит белок и множество клеток. Например, если раскрытые способы применяют по отношению к белку, находящемуся в биореакторе, то раствор в биореакторе (например, культуральная среда) будет считаться кондиционированным раствором, который содержит жизнеспособные клетки. Таким образом, в данном иллюстративном предварительно определенные параметры раствора будут соответствовать параметрам раствора, уже содержащего представляющий интерес белок. В других таких вариантах осуществления способ предусматривает инкубирование белка с кондиционированным раствором, который получен в результате проведения биологического способа, с таким как, например, раствор, содержащий жизнеспособные клетки, полученный при завершении производственного цикла в биореакторе с периодической загрузкой или в биореакторе с однократной загрузкой. В некоторых вариантах осуществления раскрытые способы применяют по завершению производственного цикла биореактора с периодической загрузкой или биореактора с однократной загрузкой, а также перед стадиями очистки или захвата в биологическом способе получения белка. Тем не менее, в зависимости от определенного белка, биологического способа и требуемого результата образования дисульфидных связей, стадию "выдерживания" можно проводить практически на любой стадии биологического способа получения белка в зависимости от таких факторов, как время, необходимое для достижения результата образования дисульфидных связей, стоимость реагентов и/или легкость проведения.
[67] В определенных вариантах осуществления раскрытый способ предусматривает стадию, где содержащий клетки раствор, который содержит белок, подвергают "выдерживанию" в течение конкретного предварительного определенного периода времени. Такая стадия "выдерживания" является нетиповой стадией в типичном биологическом способе получения белка. Как показано в примерах, в зависимости от условий испытаний и параметров кондиционированного раствора, выдерживание биотерапевтического средства на основе антитела IgG4 в присутствии клеток неожиданно способно уменьшать, увеличивать или практически сохранять долю полуантител, присутствующих в совокупности антител (см., например, фигуру 3 и примеры 1-7). Таким образом, путем инкубирования кондиционированного раствора, содержащего жизнеспособные клетки с полипептидами, в течение предварительно определенного времени, можно контролировать образование дисульфидных связей между полипептидами.
[68] В определенных вариантах осуществления неконтролируемую подпитку в ходе стадии "выдерживания" не используют. В другом варианте осуществления, для еще более усовершенствованного процесса, биореактор можно использовать в качестве сосуда для выдерживания, и типичные элементы управления биореактором или устройством для подачи, предназначенные для поддержания жизнеспособности клеток, могут быть отключены. Если стадию выдерживания проводят в биореакторе, то контролируемая подпитка может быть непрерывной, изменяемой или останавливаемой в течение времени выдерживания с инкубированием. В определенных вариантах осуществления условия в ходе стадии "выдерживания" в данных способах не отслеживают и не регулируют настолько четко, как в биореакторе. Например, в некоторых таких вариантах осуществления концентрации кислорода и параметры рН "выдержанного" образца антитела являются лишь минимальными и не отслеживаются, а их регулируют при помощи способа, предназначенного для поддержания или контроля жизнеспособности или продуктивности клеток.
[69] В других вариантах осуществления условия в ходе стадии "выдерживания" в данных способах активно отслеживают и регулируют. Например, в некоторых таких вариантах осуществления концентрации кислорода и параметры рН "выдержанного" образца антитела активно и четко отслеживают и регулируют. Активное отслеживание и регулирование условий кондиционированного раствора в ходе стадии выдерживания может происходить в ходе всей стадии выдерживания, в ходе части стадии выдерживания или не происходить в ходе стадии выдерживания. Активное отслеживание и регулирование условий кондиционированного раствора в ходе стадии выдерживания можно применять для обеспечения воспроизводимости требуемого результата на образце антител, даже если это активное отслеживание и регулирование могут быть необязательными для достижения требуемых результатов образования дисульфидной связи. Данный способ, предусматривающий стадию выдерживания, продемонстрировали в нескольких масштабах с использованием разных условий, растворов и конфигураций, что раскрыто в данном документе. Отдельную технологическую операцию выдерживания раствора, содержащего мультимерный белок (например, "стадию выдерживания" в раскрытых способах), можно проводить с использованием по меньшей мере одного резервуара. Объем резервуара можно варьировать в широких пределах в зависимости от биологического способа, используемого для получения белка. Например, резервуар, который можно использовать для выполнения отдельной технологической операции, может иметь объем от приблизительно 1 мл до приблизительно 20000 л, как, например, в биологическом способе для коммерческого получения. Резервуар может удерживать текучую среду, содержащую антитела, в течение широкого диапазона периодов времени, варьирующих от приблизительно 1 минуты до 3 недель или дольше в определенных вариантах осуществления схемы получения. Резервуар можно использовать как для выдерживания, так и для заморозки (например, при температуре менее 25°C, менее 15°C или менее 10°C), или выдерживания и нагревания (например, при температуре выше 25°C, выше 30°C или выше 35°C) раствора, содержащего антитело. Резервуар может иметь любую форму, в том числе кругового цилиндра, овального цилиндра или практически прямоугольной, герметизированной и непроницаемой камеры.
[70] Было показано, что разные условия инкубирования при выдерживании собранного неочищенного материала приводят к разным результатам. В одном аспекте наиболее значимые параметры предварительно кондиционированного раствора для белковых растворов, содержащих клетки, включают время выдерживания, температуру выдерживания, жизнеспособность клеток при сборе (что контролируют в день сбора) и перемешивание (см. фигуры 3-4). В одном иллюстративном варианте осуществления (неочищенный) материал, содержащий клетки, можно собирать и охлаждать до 8°C в течение 10 или более дней перед дальнейшей обработкой в последовательных стадиях очистки и захвата.
[71] Кроме того, как описано выше, представленные в данном документе способы раскрывают добавление окислительно-восстановительных реагентов к белковым растворам, содержащим клетки, чтобы ускорить образование дисульфидных связей между полипептидами. Например, как было отмечено при превращении полуантитела в полное антитело, в белковых растворах, содержащих клетки, которые содержат окислительно-восстановительные реагенты, доля Hab может уменьшаться с высокой интенсивностью и в большей степени, чем в образцах собранного неочищенного материала без окислительно-восстановительного реагента (фигура 5). В одном варианте осуществления для уменьшения уровня полуантитела смесь окислительно-восстановительных реагентов, таких как, например, 0,5 мМ восстановленный глутатион и 5 мМ окисленный глутатион, можно добавлять к содержащему клетки собранному материалу в течение нескольких дней, а не недель, перед дальнейшей последовательной обработкой.
Способы с примением не содержащих клеток растворов
[72] В другом аспекте раскрытые способы можно применять в момент времени в биологическом способе, стадии биологического способа или отдельной технологической операции, когда полипептиды находятся в "не содержащем клетки" растворе. Такие не содержащие клетки растворы содержат представляющий интерес белок, однако, по сути, клетки в растворе отсутствуют. Чем ниже уровень неоднородности и сложности таких не содержащих клетки растворов, тем более предпочтительным является применение способов, раскрытых в данном документе. В некоторых вариантах осуществления не содержащий клетки раствор содержит элюат белка А. В других вариантах осуществления не содержащем клетки раствор содержит собранный очищенный материал. В соответствии со способами, раскрытыми в данном документе, для не содержащего клетки раствора можно использовать другие растворы, буферы и/или элюаты.
[73] Для типичных биологических способов, используемых в получении белков, представляющий интерес белок находится в не содержащем клетки растворе в конкретные моменты времени в биологическом способе, стадии биологического способа или отдельной технологической операции. В определенных иллюстративных вариантах осуществления раскрытые способы применяют в момент времени в биологическом способе в ходе стадии инактивации вируса, регулирования, хроматографии, фильтрации, разбавления, концентрирования или любой другой стадии биологического способа, на которой не используют клетки. (Фигура 2). Дополнительные неограничивающие примеры стадий в ходе биологического способа, где белковый раствор может быть не содержащем клетки раствором, включают без ограничения очистку собранного материала, захват элюата, процесс промежуточной хроматографии промежуточных продуктов или процесс доочистки промежуточных продуктов посредством хроматографии. (Фигура 2). Существует много перспектив для применения раскрытых способов на протяжении всего биологического способа, который, как правило, включает стадии, на которых активно управляют условиями жидкой фазы, в том числе, например, когда значение рН снижают для достижения инактивации вируса, или когда значение рН или проводимость регулируют до или после технологической операции на хроматографической колонке. В некоторых вариантах осуществления раскрытые способы следует применять на стадии очистки собранного материала. В некоторых других вариантах осуществления раскрытые способы следует применять на стадии захвата элюата. В некоторых вариантах осуществления не содержащие клетки раствор представляет собой раствор для последующего захвата.
[74] Как описано в данном документе, оптимальные условия инкубирования и предварительно определенные параметры условий для способов с не содержащими клетками растворами прежде всего должны быть определены для конкретного представляющего интерес белка. Влияние условий инкубирования и предварительно определенных параметров условий на образование дисульфидных связей может быть продемонстрировано путем измерения доли полуантитела (например, полуантитела IgG4), находящегося в белковом растворе. В некоторых вариантах осуществления окислительно-восстановительные реагенты можно добавлять в не содержащий клетки раствор, например, в промежуточном процессе для быстрого увеличения уровня образования дисульфидных связей между полипептидами мультимерного белка. Используя описанные в данном документе способы, путем измерения доли полуантитела IgG4 в не содержащем клетки белковом растворе, образование дисульфидных связей между полипептидами можно эффективно контролировать путем добавления конкретных окислительно-восстановительных реагентов в определенных концентрациях, в том числе например, 2-MEA. Например, проводили исследования с целью оптимизации условий инкубирования и предварительно определенных параметров условий для уменьшения уровня полуантител, оценки иллюстративных условий, таких как значение рН, время, температура, концентрация окислительно-восстановительного реагента и концентрация антитела IgG4. См., например, примеры 9-15. В одном таком иллюстративном исследовании, когда собранный очищенный материал, содержащий антитело IgG4, инкубировали с окислительно-восстановительным реагентом 2-меркаптоэтиламином (2-MEA) при 2-8°C и выделяли на колонке с белком А для удаления окислительно-восстановительного реагента, доля Hab уменьшалась от приблизительно 18% до приблизительно 9% в пределах 1 часа и, при конкретных условиях, в течение всего 10 минут. (См., например, фигуру 9). В определенных вариантах осуществления окислительно-восстановительный реагент, используемый в раскрытых в данном документе способах, представляет собой 2-МЕА. Было показано, что 2-МЕА является наиболее эффективным окислительно-восстановительным реагентом для уменьшения содержания Hab в прошедших испытание иллюстративных растворах антител. В определенных вариантах осуществления образование дисульфидных связей между полипептидами в не содержащих клетки растворах сильно зависит от значения рН кондиционированного раствора.
Определения
[75] Используемое в данном документе единственное число обозначает одно или несколько из конкретных существительных. Например, выражение "антитело" обозначает "одно или несколько антител."
[76] Термин "антитело", используемый в данном документе, относится в широком смысле к любой молекуле иммуноглобулина (Ig), содержащей четыре полипептидные цепи, две тяжелые (Н) цепи и две легкие (L) цепи, или к любому функциональному мутанту, варианту или их производному, которые сохраняют основные характеристики связывания эпитопа молекулы иммуноглобулина (Ig). В большинстве антител каждая тяжелая цепь содержит вариабельный участок тяжелой цепи (в данном документе имеет аббревиатуру HCVR или VH) и константный участок тяжелой цепи. Константный участок тяжелой цепи содержит три домена: CH1, CH2 и CH3. Каждая легкая цепь содержит вариабельный участок легкой цепи (в данном документе приведен под аббревиатурой LCVR или VL) и константный участок легкой цепи. Константный участок легкой цепи содержит один домен. Участки VH и VL могут быть дополнительно подразделены на гипервариабельные участки, называемые определяющими комплементарность участками (CDR), которые чередуются с более консервативными участками, называемыми каркасными участками (FR). Каждый VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Антитело может быть также биспецифическим антителом, триспецифическим антителом, димерным антителом, тримерным антителом или мультимерным антителом. (См., например, публикацию заявки на патент США № US 2012/0251541 A1).
[77] Термин "фрагмент антитела", используемый в данном документе, относится к части полного антитела и обычно представляет собой одну полипептидную цепь (либо тяжелую (Н) цепь, либо легкую (L) цепь), которая сохраняет основные характеристики связывания эпитопа молекулы Ig, или любой функциональный мутант, вариант или их производное. Примеры фрагментов антител включают без ограничения фрагменты Fab, Fab', F(ab')2 и Fv, функциональные фрагменты тяжелой цепи, функциональные фрагменты легкой цепи, Affibodies® и Nanobodies®.
[78] "Гуманизированное антитело" представляет собой антитело, которое получено от вида, не относящегося к человеку, в котором конкретные аминокислоты в каркасном и константном доменах тяжелой и легкой цепей мутировали таким образом, чтобы избежать иммунного ответа у человека или устранить его. Гуманизированные формы антител, не относящихся к человеческим (например мышиные), представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина, не относящегося к человеческому. В большинстве своем гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из гипервариабельного участка реципиента заменены остатками гипервариабельного участка вида, не относящегося к человеку (донорное антитело), такого как мышь, крыса, кролик или примат, не относящийся к человеку, имеющие требуемую специфичность, аффинность и активность. В некоторых случаях остатки Fv-каркасного участка (FR) иммуноглобулина человека заменены соответствующими остатками иммуноглобулина, не относящегося к человеческому. Кроме того, гуманизированные антитела могут содержать остатки, которые не обнаружены в реципиентном антителе или в донорном антителе. Данные модификации созданы для дополнительного улучшения характеристик антитела. Как правило, гуманизированное антитело будет содержать, по сути, по меньшей мере один, а обычно два вариабельных домена, в которых все или, по сути, все гипервариабельные петли соответствуют таковым петлям в иммуноглобулине, не относящемся к человеческому, а все или, по сути, все FR-участки получены из последовательности иммуноглобулина человека. Также гуманизированное антитело обычно может содержать по меньшей мере часть константного участка иммуноглобулина (Fc), как правило, часть константного участка иммуноглобулина человека. Подробнее см. Jones et al., 1986, Nature 321:522-525; Riechmann et al., 1988, Nature 332:323-329; Presta et al., 1992, Curr. Op. Struct. Biol. 2:593-596.
[79] Неограничивающие примеры терапевтических антител включают: панитумумаб, омализумаб, абаговомаб, абциксимаб, актоксумаб, адалимумаб, адекатумумаб, афелимомаб, афутузумаб, алацизумаб, альтумомаб, аматуксимаб, анатумомаб, аполизумаб, атинумаб, тоцилизумаб, базилизимаб, бектумомаб, белимумаб, бевацизумаб, бициромаб, канакинумаб, цетуксимаб, даклизумаб, денсумаб, экулизумаб, эдреколомаб, эфализумаб, эфунгумаб, эртумаксомаб, этарацизумаб, этанерцепт, голимумаб, инфликсимаб, натализумаб, паливизумаб, панитумумаб, пертузумаб, ранибизумаб, ритуксимаб, тоцилизумаб и трастузумаб.
[80] Выражение "белок, не являющийся антителом" используется в данном документе применительно к любому белку, который не способен связываться посредством любого из следующих, специфических для иммуноглобулинов аффинных взаимодействий: связывание белка A с Fc-участком, связывание белка G с Fab-участком, связывание белка G с Fc-участком или связывание белка L с легкой цепью иммуноглобулина. В определенных вариантах осуществления белок, не являющийся антителом, представляет собой биотерапевтический белок. Биотерапевтический белок может быть, например, сконструированным белком, ферментом, гормоном, гематологическим фактором, фактором роста или иммунологическим фактором. Выражение "белок, не являющийся антителом" может означать белковый продукт на любой стадии биологического способа, в том числе перед стадией выделения, в ходе нее или после нее. Белок, не являющийся антителом, представляет собой рекомбинантный белок, который выделяют и/или извлекают из гетерогенного раствора, содержащего белок, не являющийся антителом, и другие компоненты. Примерами таких компонентов являются контаминирующие белки, липиды и нуклеиновые кислоты, находящиеся в жидкой культуральной среде или происходящие из клетки-хозяина (например, из млекопитающего, дрожжей или бактериальной клетки-хозяина), и другие биологические контаминанты (например, вирусные и бактериальные контаминанты).
[81] Термин "мультимерный белок" определен в данном документе для того, чтобы включать белки, содержащие один или несколько полипептидов, которые связаны или соединены одной или несколькими дисульфидными связями. Мультимерный белок может существовать в виде комплекса из более чем одной мономерной субъединицы полипептида, в которой каждая мономерная субъединица связана с одним или несколькими другими мономерными субъединицами одной или несколькими дисульфидными связями. Мультимерный белок может содержать две или более идентичных полипептидных цепи, в то же время он не содержит каких-либо других полипептидных цепей ("гомомультимерный"). "Гомомультимер" состоит из двух или более копий одной и той же полипептидной цепи. Аналогичным образом, "гомодимер" состоит из двух копий одной и той же полипептидной цепи, "гомотример" состоит из трех копий одной и той же полипептидной цепи и т.д. В качестве альтернативы, мультимерный белок может содержать по меньшей мере две разные полипептидные цепи ("гетеромультимерный"). Если гетеромультимер имеет три или более полипептидных цепи, то некоторые из них могут быть идентичными друг другу до тех пор, пока по меньшей мере одна из них отличается от других. Термин "мультимер" охватывает такие термины, как "димер", "тример" или "тетрамер", которые указывают, сколько полипептидных цепей содержит мультимер. Антитела представляют собой примеры мультимерных белков. Примеры антителоподобных мультимерных белков включают молекулы ScFv, диатела и тритела или триатела, или мультимеры белков слияния Fc. Примеры белков, не являющихся антителами, которые могут существовать в виде мультимерных белков, включают фибриноген, гетеродимеры аполипопротеина, тромбоцитарный фактор роста, рилин и муцин подчелюстной железы свиньи.
[82] Термин "полипептид", используемый в данном документе, означает полипептидную последовательность длиной по меньшей мере или приблизительно 4 аминокислоты, по меньшей мере или приблизительно 5 аминокислот, по меньшей мере или приблизительно 6 аминокислот, по меньшей мере или приблизительно 7 аминокислот, по меньшей мере или приблизительно 8 аминокислот, по меньшей мере или приблизительно 9 аминокислот, по меньшей мере или приблизительно 10 аминокислот, по меньшей мере или приблизительно 11 аминокислот, по меньшей мере или приблизительно 12 аминокислот, по меньшей мере или приблизительно 13 аминокислот, по меньшей мере или приблизительно 14 аминокислот, по меньшей мере или приблизительно 15 аминокислот, по меньшей мере или приблизительно 16 аминокислот, по меньшей мере или приблизительно 17 аминокислот, по меньшей мере или приблизительно 18 аминокислот, по меньшей мере или приблизительно 19 аминокислот, или по меньшей мере или приблизительно 20 аминокислот, или длиной более 20 аминокислот. Определение «полипептиды», используемое в данном документе, предусматривает как мономерные (например мономеры), так и мультимерные формы (например, димеры, тримеры и т.д.) белка. Фибриноген является одним из примеров гексамерного белка. Другие примеры полипептидов включают пептиды, составляющие тяжелые и легкие цепи антител.
[83] Термин "полное антитело" включает антитела, в которых между тяжелыми цепями присутствует(присутствуют) дисульфидная(дисульфидные) связь(связи), то есть полное антитело визуально наблюдают в виде комбинации двух полипептидов легких цепей и двух полипептидов тяжелых цепей при использовании электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия в невосстанавливающих условиях или других аналитических методик с использованием невосстанавливающих денатурирующих условий раствора. (См., например, фигуру 11 и фигуру 12).
[84] Термин "полуантитело" включает антитела (например, антитела IgG4), в которых между тяжелыми цепями отсутствует(отсутствуют) дисульфидная(дисульфидные) связь(связи), то есть полуантитело визуально наблюдают в виде комбинации одного полипептида легкой цепи и одного полипептида тяжелой цепи при использовании электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия в невосстанавливающих условиях или других аналитических методик с использованием невосстанавливающих денатурирующих условий раствора. При неденатурирующих условиях полуантитела трудно обнаруживать из-за сильных межцепочечных нековалентных взаимодействий, которые по-прежнему преобладают при отсутствии межцепочечных дисульфидных связей. (Taylor et al., 2006, Anal Biochem. 353(2):204-208). Полуантитела показаны на фигуре 1А, а результаты анализа содержащего образец полуантитела с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия включены в фигуру 12.
[85] Выражение "превращение полуантитела" или "переход полуантитела", используемое в данном документе, относится к биохимическому процессу, с помощью которого полуантитело становится полным антителом, например, путем образования или перестройки межцепочечных дисульфидных связей.
[86] Выражение "активность" включает такие активности, как специфичность связывания и аффинность антитела или полуантитела по отношению к одному или нескольким антигенам, мишеням или лигандам.
[87] Термин "IgG4" включает подкласс иммуноглобулинов IgG, которые продуцируются при вторичном иммунном ответе и наиболее часто встречаются в крови. Эти антитела IgG обычно содержат тяжелую цепь γ4.
[88] Способы, раскрытые в данном документе, обеспечивают значительные преимущества для антител IgG4, в частности, терапевтических антител IgG4. Неограничивающие примеры антител IgG4, которые можно получить с помощью представленных в данном документе способов, включают натализумаб (Tysabri®, Biogen Idec), гемтузумаб (Mylotarg®, Pfizer) и фрезолимумаб (Genzyme). Натализумаб, который направлен на субъединицу α4 интегринов α4β1 (VLA-4) и α4β7, и гемтузумаб, который является специфичным к CD33, представляют собой два гуманизированные антитела IgG4, ранее одобренных для введения в организм человека. Натализумаб эффективен в лечении рассеянного склероза (MS), а гемтузумаб, конъюгированный с производным цитотоксического средства калихеамицин, используют для лечения острого миелоидного лейкоза (AML) (Zohren et al., 2008, Blood 111:3893-3895). Разработку другого терапевтического средства на основе гуманизированного IgG4, TGN1412 (CD28-специфичное), было прекращено после того, как оно вызвало непредвиденные побочные явления у здоровых индивидуумов. Натализумаб также был связан с побочными явлениями, в частности, прогрессирующей многоочаговой лейкоэнцефалопатией, инфекцией центральной нервной системы (CNS) полиомавирусом JC.
[89] Выражение "обмен полумолекулами" относится к типу белковой модификации для антитела, такого как IgG4, при которой происходит замена тяжелой цепи антитела и прикрепленной легкой цепи (полумолекулы) парой тяжелая-легкая цепь из другой молекулы IgG4. Таким образом, молекула антитела может получать два отличающихся Fab-фрагмента, распознающих два разных антигена (что приводит к образованию биспецифических молекул), в то время как структура их Fc-домена остается неизменной. (Labrijn et al., 2013, Proc Natl Acad Sci USA. 110(13):5145-50). Также может происходить обмен между видами полумолекулами, что в результате приводит к изменению структуры Fc-домена, то есть молекула содержит домены от каждого из двух видов источников. (Labrijn et al., 2009, Nature Biotechnol. 27(8):767-771). Обмен полумолекулами также называют как "обмен Fab-фрагментами". (Rispens et al., 2011, J Am Chem Soc. 133(26):10302-10311).
[90] Термин "невосстанавливающие" относится к условиям, при которых сохраняются дисульфидные связи (например, дисульфидное(дисульфидные) звено(звенья)). В частности, условия, при которых дисульфидные связи остаются интактными и не превращаются в свободные сульфгидрилы.
[91] Термин "по сути, свободный" означает композицию (например, жидкую культуральную среду), которая является по меньшей мере или приблизительно на 90% свободной (например, по меньшей мере или приблизительно на 95%, 96%, 97%, 98%, или по меньшей мере или приблизительно на 99% свободной, или приблизительно на 100% свободной) от указанного вещества.
[92] Выражение "культивирование" или "культивирования клеток" означает поддержание или пролиферацию клеток при контролируемом комплексе физических условий.
[93] Выражение "непрерывный процесс" означает процесс, с помощью которого непрерывно достигают результата или получают результат (например процесс, при котором непрерывно получают лекарственное вещество на основе терапевтического белка из жидкой культуральной среды). Например, лекарственное вещество на основе терапевтического антитела получают непрерывно, пока системы находятся в процессе эксплуатации (разумеется, принимая во внимание исходный период задержки, пока антитело проходит через систему к выходному отверстию). (См, в общем плане, Shuler et al., 1992. Bioprocess engineering: basic concepts. New York: Prentice-Hall.) Одна иллюстративная биологической системы для непрерывного производства описана в Международной заявке на патент № PCT/US2014/019909.
[94] Выражение "полунепрерывный процесс" означает процесс, который в основном является непрерывным процессом выделения целевой молекулы, где подача или выведение текучего материала на какой-либо одной стадии процесса являются периодическими или прерывистыми. Например, подаваемый в стадии процесса (например, стадия связывания и элюирования при хроматографии) материал можно загружать непрерывно; тем не менее, выводимый материал можно собирать периодически, тогда как другие стадии процесса в процессе очистки являются непрерывными. Соответственно, в некоторых вариантах осуществления описанные в данном документе способы являются "полунепрерывными" в том плане, что они включают по меньшей мере одну отдельную технологическую операцию, которая происходит прерывисто, тогда как другие отдельные технологические операции в процессе или системе могут происходить непрерывным образом.
[95] Термин "извлекать" или "извлечение" означает стадию, проводимую для частичного выделения или отделения (например, по меньшей мере с или с приблизительно 5%, например, по меньшей мере или приблизительно 10%, 15%, 20%, 25%, 30%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, или по меньшей мере или приблизительно 95% чистотой по весу белка от одного или нескольких других компонентов, находящихся в жидкой культуральной среде или в разбавленной жидкой культуральной среде (например, белков культуральной среды или одного или нескольких других компонентов (например, ДНК, РНК или других белков)), находящихся в клетках млекопитающих или секретируемых клетками млекопитающих). Как правило, захват проводят с использованием смолы, которая связывает белок (например, посредством использования аффинной хроматографии). Неограничивающие способы захвата белка из жидкой культуральной среды или разбавленной жидкой культуральной среды описаны в данном документе, а другие известны в данной области. Белок можно извлечь из жидкой культуральной среды с использованием хроматографической колонки или хроматографической мембраны (например, любой из хроматографических колонок или хроматографических мембран, описанных в данном документе).
[96] Выражение "выделение" означает стадию, проводимую для отделения антитела от одного или нескольких других компонентов, находящихся в текучей среде, содержащей антитело (например, белков жидкой культуральной среды или одного или нескольких других компонентов (например, ДНК, РНК или других белков), находящихся в клетках млекопитающих или секретируемых клетками млекопитающих). Например, выделение можно проводить после стадии первичного захвата. Выделение можно проводить с использованием смолы, которая связывает антитело (например, путем использования аффинной хроматографии, анион- или катионообменной хроматографии, или хроматографии на молекулярных ситах). Антитело можно очищать в ходе доочистки от текучей среды, содержащей белок, с помощью хроматографической колонки или хроматографической мембраны (например, с помощью любой из хроматографиеских колонок или хроматографических мембран, описанных в данном документе).
[97] Термин "элюат" является специальным термином и означает текучую среду, которая выходит из хроматографической колонки или хроматографической мембраны, содержащей поддающееся выявлению количество антитела. Одним неограничивающим примером является элюат белка А.
[98] Термин "фильтрация" означает удаление по меньшей мере части (например, по меньшей мере 80%, 90%, 95%, 96%, 97%, 98% или 99%) нежелательных биологических контаминантов (например, клеток млекопитающих, бактерий, дрожжевых клеток, вирусов или микобактерий) и/или твердых частиц (например, осажденных белков) из жидкости (например, жидкой культуральной среды или текучей среды, находящихся в любой из систем или процессов, описанных в данном документе).
[99] Термин "очистка" означает удаление клеток, клеточного дебриса и других крупных примесей биореактора или культуры клеток из жидкости (например, из жидкой культуральной среды). В данной области известны несколько способов очистки образца белка. Неограничивающие примеры способов очистки включают центрифугирование, микрофильтрацию, глубинную фильтрацию, стерилизующую фильтрацию, осаждение, флокуляцию и жидкость-жидкостную экстракцию. Раствор, полученный сразу же после завершения стадии очистки, обычно называют "собранным очищенным материалом". Благодаря процедуре очистки, собранный очищенный материал является, по сути, не содержащим клетки материалом.
[100] Термин "стадия регулирования" означает стадию в пределах биологического способа, где одну текучую среду, содержащую полипептид, комбинируют с одной или несколькими дополнительными текучими средами для изменения параметров полипептид-содержащей текучей среды, таких как концентрация окислительно-восстановительного реагента, значение рН, уровни содержания растворенных газов, проводимость и/или плотность жизнеспособных клеток. Неограничивающие примеры способов регулирования включают добавление раствора с низким или высоким значением рН для того, чтобы соответственно уменьшить или увеличить значение рН, добавление концентрата для увеличения проводимости или концентрации окислительно-восстановительного реагента, или добавление содержащей клетки текучей среды в не содержащую клетки жидкость. Способы добавления текучей среды включают непосредственное добавление в сосуд для выдерживания, такую как емкость или камера, или поточное добавление, при котором две или более текучей среды комбинируют друг с другом в пределах технологического процесса. В некоторых вариантах осуществления стадию регулирования проводят с использованием буферного резервуара для регулирования.
[101] Термин "перфузионный биореактор" означает биореактор, содержащий множество клеток в первой жидкой культуральной среде, где культивирование клеток, находящихся в биореакторе, включает периодическое или непрерывное удаление первой жидкой культуральной среды и одновременное добавление или вскоре после удаления добавление в биореактор, по сути, эквивалентного объема второй жидкой культуральной среды. В некоторых примерах постепенно изменяют (например, увеличивают или уменьшают) объем первой жидкой культуральной среды, удаляемой и добавляемой в течение дополнительных периодов (например, приблизительно 24-часовой период, период от приблизительно 1 минуты до приблизительно 24 часов, или период более 24 часов) в ходе периода культивирования (например, скорость повторной подпитки культуральной среды ежесуточно). Фракция среды, которую удаляют и заменяют каждый день, может изменяться в зависимости от конкретных подлежащих культивированию клеток, исходной плотности посева и плотности клеток в конкретный момент времени. "RV" или "объем реактора" означает объем культуральной среды, имеющийся в начале процесса культивирования (например, общий объем культуральной среды, имеющийся после посева).
[102] Термин "биореактор с периодической загрузкой" является специальным термином и означает биореактор, содержащий множество клеток в первой жидкой культуральной среде, где культивирование клеток, находящихся в биореакторе, включает периодическое или непрерывное добавление второй жидкой культуральной среды в первую жидкую культуральную среду без существенного или значительного удаления первой жидкой культуральной среды или второй жидкой культуральной среды из культуры клеток. Вторая жидкая культуральная среда может быть такой же, как и первая жидкая культуральная среда. В некоторых примерах культуры с периодической подпиткой вторая жидкая культуральная среда представляет собой концентрированную форму первой жидкой культуральной среды. В некоторых примерах культуры с периодической подпиткой вторую жидкую культуральную среду добавляют в виде сухого порошка.
[103] Термин "биологический способ", используемый в данном документе, обычно относится к любому способу, применяемому по отношению к белку в соответствии с раскрытыми способами. В некоторых вариантах осуществления биологический способ представляет собой одну или несколько функциональных стадий ("отдельных технологических операций"), которые можно проводить в способе изготовления лекарственного вещества на основе терапевтического белка из жидкой культуральной среды. Пример типичного биологического способа показан на фигуре 2. Неограничивающие примеры биологического способа включают фильтрование (например, удаление контаминирующих бактерий, дрожжей, вирусов или микобактерий, и/или конкретного вещества из жидкости, содержащей антитело), захват, удаление эпитопной метки, выделение, выдерживание или хранение, доочистку, инактивацию вирусов, регулирование концентрации ионов и/или значения рН жидкости, содержащей антитело, а также удаление нежелательных солей. В определенных вариантах осуществления биологический способ включает способ в биореакторе, систему посевных ферментеров, хроматографию с захватом, промежуточную хроматографию, фильтрацию, центрифугирование, осаждение, флокуляцию, УФ-облучение и/или инактивацию вирусов. В некоторых вариантах осуществления биологический способ осуществляют внутри биореактора или хроматографического аппарата.
[104] В некоторых вариантах осуществления термин "отслеживание" относится к способности измерять конкретные параметры процесса или выходные данные процесса, такие как показатели качества продукта (в том числе уровень полуантител), значение рН, растворенный кислород, компоненты среды, отдельные технологические операции биологического способа и скорость потока. Отслеживание можно применять в соответствии с конкретным планом эксперимента или биологического способа. Например, отслеживание можно применять в одном или нескольких конкретных моментах времени в биологическом способе, в ходе конкретных стадий или периодов времени в пределах биологического способа, или в ходе всего периода проведения биологического способа.
[105] В некоторых вариантах осуществления термин "контролирование", используемый в данном документе, относится к способности изменять образование или число дисульфидных связей между полипептидами мультимерного белка путем регулирования одного или нескольких условий инкубирования и/или предварительно определенных параметров раствора. "Контролирование" также относится к способности увеличивать, уменьшать или сохранять образование или число дисульфидных связей между полипептидами мультимерного белка в течение конкретного момента времени биологического способа. В некоторых вариантах осуществления термин "контролирование" относится к способности изменять уровень полуантител, находящихся среди антител IgG4, в пределах конкретной стадии, или стадии биологического способа, или отдельной технологической операции. Неограничивающие примеры таких параметров, которые можно регулировать, включают время, температуру, значение рН, наименование окислительно-восстановительного реагента и концентрацию, наименование газа, уровни содержания растворенных газов, проводимость и/или плотность жизнеспособных клеток.
[106] Используемый в данном документе термин "критический показатель качества", также упоминаемый как "CQA", означает физическое, химическое, биологическое или микробиологическое свойство или характеристику, которые должны находиться в пределах соответствующего предела, диапазона или распределения для обеспечения требуемого качества продукта. Одним из примеров CQA является число дисульфидных связей между полипептидами мультимерного белка. Другим примером CQA является доля полуантитела в растворе антител. Другие неограничивающие примеры CQA включают чистоту продукта, эффективность, профиль заряженных изоформ, пост-трансляционные модификации, окисление, восстановление, дезамидирование, образование аддукта, усеченные формы, ферментативное расщепление, специфическую активность, пептидную карту, содержание димеров, агрегацию продукта, сайт-специфичное гликозилирование, общее содержание гликанов и/или профиль гликозилирования. Выбор соответствующих CQA и соответствующих анализов для определенных применений раскрытых способов находятся в пределах возможностей специалиста в данной области.
[107] В некоторых вариантах осуществления CQA антитела определяют путем измерения. В некоторых таких вариантах осуществления CQA измеряют с помощью высокопроизводительной и/или ускоренной аналитической методики. В некоторых вариантах осуществления CQA измеряют с использованием аналитической методики, включающей следующие неограничивающие примеры: высокоэффективную жидкостную хроматографию (HPLC), дифференциальную рефрактометрию, флуоресценцию, ультраэффективную жидкостную хроматографию (UPLC), анализ с использованием многоуглового лазерного светорассеяния (MALLS), масс-спектроскопию, тандемную масс-спектроскопию, изоэлектрическое фокусирование, SDS-PAGE и/или дифференциальную сканирующую калориметрию. В других вариантах осуществления высокопроизводительную и/или ускоренную аналитическую методику проводят с помощью робота. В других вариантах осуществления робот представляет собой робот для манипуляций с жидкостями.
Хроматография
[108] Биологические способы получения белка, описанные в данном документе, часто предполагают использование одной или нескольких колонок для хроматографии. При хроматографии можно использоватьс один или несколько различных типов буфера. Как известно в данной области, один или несколько типов буфера, используемого в способах, описанных в данном документе, будут зависеть от смолы, находящейся в хроматографической колонке или хроматографической мембране хроматографической колонки, представляющего интерес белка и отдельной технологической операции. Например, объем и тип(типы) буфера, используемого для хроматографической колонки в любом из процессов, описанных в данном документе, могут быть выбраны для того, чтобы оптимизировать один или несколько CQA или одно или несколько из следующих свойств белка: общий выход белка, активность белка, уровень чистоты антитела и удаление биологических контаминантов из текучей среды, содержащей белок (например, отсутствие активных вирусов, микобактерий, дрожжей, бактерий или клеток млекопитающих).
[109] Отдельные технологические операции, которые можно проводить в описанном биологическом способе, включают, например, очистку белка, захват белка, инактивацию вирусов, находящихся в текучей среде, содержащей белок, выделение белка, выдерживание текучей среды, содержащей белок, выдерживание текучей среды, содержащей белок и клетки, фильтрование или удаление дисперсного материала и/или клеток из текучей среды, содержащей белок, а также регулирование концентрации ионов и/или значения рН текучей среды, содержащей белок.
[110] Отдельную технологическую операцию извлечения можно проводить с помощью хроматографической колонки или хроматографической смолы, например, той, которую используют в процедуре извлечения. Неограничивающие примеры процедур извлечения включают процедуру извлечения путем связывания с белком А, процедуру извлечения путем связывания с белками или фрагментами белков, процедуру извлечения путем связывания с субстратами, процедуру извлечения путем связывания с аптамерами, процедуру извлечения путем связывания с метками (например, процедуру извлечения на основе метки поли-His) и процедуру извлечения путем связывания с кофакторами. Захват также можно проводить с помощью смолы, которую можно использовать для выполнения катион- или анионообменной хроматографии или хроматографии на молекулярных ситах. Неограничивающие смолы, которые можно использовать для извлечения белка, описаны в данном документе.
[111] Отдельную технологическую операцию выделения белка можно проводить с помощью хроматографической колонки или хроматографической мембраны, которая содержит смолу, например которую используют в системе извлечения. Неограничивающие примеры процедур извлечения включают процедуру извлечения путем связывания с белком А, процедуру извлечения путем связывания с белками или фрагментами белков, процедуру извлечения путем связывания с субстратами, процедуру извлечения путем связывания с аптамерами, процедуру извлечения путем связывания с метками (например, процедуру извлечения на основе метки поли-His) и процедуру извлечения путем связывания с кофакторами. Выделение также можно проводить с использованием смолы, которую можно использовать для проведения катион- или анионообменной хроматографии или хроматографии на молекулярных ситах. Неограничивающие смолы, которые можно использовать для выделения белка, описаны в данном документе.
[112] Отдельные технологические операции фильтрования текучей среды, содержащей белок, можно выполнять с помощью фильтра, или хроматографической колонки, или хроматографической мембраны, которая содержит смолу в качестве молекулярного сита. Как известно в данной области, большое разнообразие фильтров для удаления субмикронных частиц (например, фильтр с размером пор менее 1 мкм, менее 0,5 мкм, менее 0,3 мкм, приблизительно 0,2 мкм, менее 0,2 мкм, менее 100 нм, менее 80 нм, менее 60 нм, менее 40 нм, менее 20 нм или менее 10 нм) доступно в данной области, которые способны удалять любой осажденный материал и/или клетки (например, осажденный, несвернутый белок, осажденные, нежелательные белки клетки-хозяина, осажденные липиды, бактерии, дрожжевые клетки, клетки грибов, микобактерии и/или клетки млекопитающих). Известно, что фильтры с размером пор приблизительно 0,2 мкм или менее 0,2 мкм эффективно удаляют бактерии из текучей среды, содержащей белок. Хроматографическая колонка или хроматографическая мембрана, содержащие в качестве молекулярного сита смолу, также можно использовать для проведения отдельной технологической операции фильтрования жидкости, содержащей белок.
Способы культивирования
[113] Некоторые из описанных в данном документе способов дополнительно включают стадию культивирования клеток, которые продуцируют мультимерный белок или полипептидные субъединицы мультимерного белка в биореакторе (например, перфузионный или с периодической загрузкой биореактор), который содержит жидкую культуральную среду, где объем жидкой культуральной среды, которая либо содержит клетки, либо, по сути, не содержит клетки, непрерывно или периодически удаляют из биореактора. Биореактор может иметь объем, например, от приблизительно 1 л до приблизительно 10000 л (например, от приблизительно 1 л до приблизительно 50 л, от приблизительно 50 л до приблизительно 500 л, от приблизительно 500 л до приблизительно 1000 л, от 500 л до приблизительно 5000 л, от приблизительно 500 л до приблизительно 10000 л, от приблизительно 5000 л до приблизительно 10000 л, от приблизительно 1 л до приблизительно 10000 л, от приблизительно 1 л до приблизительно 8000 л, от приблизительно 1 л до приблизительно 6000 л, от приблизительно 1 л до приблизительно 5000 л, от приблизительно 100 л до приблизительно 5000 л, от приблизительно 10 л до приблизительно 100 л, от приблизительно 10 л до приблизительно 4000 л, от приблизительно 10 л до приблизительно 3000 л, от приблизительно 10 л до приблизительно 2000 л или от приблизительно 10 л до приблизительно 1000 л) или более. Количество жидкой культуральной среды, находящейся в биореакторе, может составлять, например, от приблизительно 0,5 л до приблизительно 5000 л (например, от приблизительно 0,5 л до приблизительно 25 л, от приблизительно 25 л до приблизительно 250 л, от приблизительно 250 л до приблизительно 500 л, от 250 л до приблизительно 2500 л, от приблизительно 250 л до приблизительно 5000 л, от приблизительно 2500 л до приблизительно 5000 л, от приблизительно 0,5 л до приблизительно 5000 л, от приблизительно 0,5 л до приблизительно 4000 л, от приблизительно 0,5 л до приблизительно 3000 л, от приблизительно 0,5 л до приблизительно 2500 л, от приблизительно 50 л до приблизительно 2500 л, от приблизительно 5 л до приблизительно 50 л, от приблизительно 5 л до приблизительно 2000 л, от приблизительно 5 л до приблизительно 1500 л, от приблизительно 5 л до приблизительно 1000 л или от приблизительно 5 л до приблизительно 500 л). Культивирование клеток можно проводить, например, с помощью биореактора периодического действия или перфузионного биореактора. Неограничивающие примеры и различные аспекты культивирования клеток раскрываются ниже, и могут быть использованы в любой комбинации.
Клетки
[114] Клетки, которые культивируют в некоторых описанных в данном документе процессах, могут быть бактериями (например, грамотрицательными бактериями), дрожжами (например, Saccharomyces cerevisiae, Pichia pastoris, Hansenula polymorpha, Kluyveromyces lactis, Schizosaccharomyces pombe, Yarrowia lipolytica или Arxula adeninivorans) или клетками млекопитающих. Клетка млекопитающего может представлять собой клетку, которая растет в суспензии или в виде адгезивной клетки. Неограничивающие примеры клеток млекопитающих, которые можно культивировать в любом из процессов, описанных в данном документе, включают: клетки яичника китайского хомячка (СНО), (например, клетки СНО DG44 или клетки CHO-K1s), Sp2.0, клетки миеломы (например, NS/0), В-клетки, клетки гибридомы, Т-клетки, эмбриональные клетки почки человека (НЕК) (например, НЕК 293E и НЕК 293F), клетки эпителия почки африканской зеленой мартышки (клетки Vero) и клетки почки Madin-Darby Canine (кокер-спаниель) (клетки MDCK). В некоторых примерах, где культивируют адгезивную клетку, культура может содержать также множество микроносителей (например, микроносителей, которые содержат одну или несколько пор). Дополнительные клетки млекопитающих, которые можно культивировать в любом из процессов, описанных в данном документе, известны в данной области.
[115] Клетка млекопитающего может содержать рекомбинантную нуклеиновую кислоту (например, нуклеиновую кислоту, стабильно интегрированную в геном клетки млекопитающего), которая кодирует белок. Неограничивающие примеры рекомбинантных нуклеиновых кислот, которые кодируют иллюстративные антитела, описаны ниже, как и антитела, которые можно получить с помощью способов, описанных в данном документе. В некоторых случаях клетку млекопитающего, которую культивируют в биореакторе (например, в любом из биореакторов, описанных в данном документе), получили из более крупной культуры.
[116] Нуклеиновую кислоту, кодирующую белок, можно ввести в клетку млекопитающего с помощью широкого спектра способов, известных в молекулярной биологии и молекулярной генетике. Неограничивающие примеры включают трансфекцию (например, липофекцию), трансдукцию (например, инфекцию лентивирусом, аденовирусом или ретровирусом) и электропорацию. В некоторых случаях нуклеиновая кислота, которая кодирует белок, не стабильно интегрирована в хромосому клетки млекопитающего (транзиентная трансфекция), в то время как в другие данная нуклеиновая кислота интегрирована. В качестве альтернативы или в дополнение, нуклеиновая кислота, кодирующая белок, может присутствовать в плазмиде и/или в искусственной хромосоме млекопитающего (например, искусственной хромосоме человека). В качестве альтернативы или в дополнение, нуклеиновую кислоту можно вводить в клетку с помощью вирусного вектора (например, лентивирусного, ретровирусного или аденовирусного векторов). Нуклеиновая кислота может быть функционально связана с промоторной последовательностью (например, сильного промотора, такого как промотор β-актина и промотор CMV, или индуцируемого промотора). Вектор, содержащий нуклеиновую кислоту, может при необходимости также содержать селектируемый маркер (например ген, который придает клетке млекопитающего устойчивость к гигромицину, пуромицину или неомицину).
[117] В некоторых случаях данный белок является секретируемым белком и высвобождается клеткой млекопитающего во внеклеточную среду (например, первую и/или вторую жидкую культуральную среду). Например, последовательность нуклеиновой кислоты, кодирующая растворимый белок, может содержать последовательность, которая кодирует сигнальный пептид для секреции на N- или С-конце белка, который расщепляется ферментом, присутствующим в клетке млекопитающего, и затем высвобождается во внеклеточную среду (например, первую и/или вторую жидкую культуральную среду).
Культуральная среда
[118] Жидкую культуральную среду (например, первую и/или вторую среду для культуры тканей) можно дополнить сывороткой млекопитающего (например, эмбриональной телячьей сывороткой и бычьей сывороткой), и/или гормоном роста или фактором роста (например, инсулином, трансферрином и эпидермальным факторами роста). В качестве альтернативы или в дополнение, жидкая культуральная среда (например, первая и/или вторая жидкая культуральная среда) может быть жидкой культуральной средой с известным химическим составом, жидкой культуральной средой, не содержащей компонентов животного происхождения, жидкой культуральной средой, не содержащей сыворотку, или жидкой культуральной средой, содержащей сыворотку. Неограничивающие примеры жидкой культуральной среды с известным химическим составом, жидкой культуральной среды, не содержащей компонентов животного происхождения, жидкой культуральной среды, не содержащей сыворотку, и жидкой культуральной среды, содержащей сыворотку, являются коммерчески доступными.
[119] Жидкая культуральная среда обычно содержит источник энергии (например углевод, такой как глюкоза), незаменимые аминокислоты (например, набор из двадцати основных аминокислот плюс цистеин), витамины и/или другие органические соединения, требуемые в низких концентрациях, свободные жирные кислоты и/или микроэлементы. Жидкую культуральную среду (например, первую и/или вторую жидкую культуральную среду) можно при необходимости дополнить, например, гормоном или фактором роста млекопитающих (например, инсулином, трансферрином или эпидермальным фактором роста), солями и буферами (например, солями кальция, магния и фосфатами), нуклеозидами и основаниями (например, аденозином, тимидином и гипоксантином), белком и тканевыми гидролизатами и/или любой комбинацией таких добавок.
[120] Большое разнообразие различных жидких культуральных сред, которые можно использовать для культивирования клеток в любом из способов, описанных в данном документе, известны в данной области. Компоненты среды, которые также можно использовать в процессах по настоящему изобретению, включают без ограничения окислительно-восстановительные реагенты, гидролизаты с известным химическим составом (CD), например, CD-пептон, CD-полипептиды (две или более аминокислоты) и CD-факторы роста. Дополнительные примеры жидкой культуральной среды для культуры тканей и компонентов среды известны в данной области. Квалифицированные специалисты-практики примут во внимание, что описанные в данном документе первая жидкая культуральная среда и вторая жидкая культуральная среда могут представлять собой один и тот же тип сред или разные среды.
[121] Для типичных биологический способов, используемых в получении белков, представляющий интерес белок (например, мультимерный белок) находится в растворе, содержащем множество клеток, в конкретные моменты времени в ходе биологического способа. В такие моменты времени белок может находиться в нескольких возможных местоположениях, в том числе, например, в биореакторе, емкости для выдерживания или сосуде для отдельных технологических операций за пределами биореактора, содержащих множество клеток.
Биореактор с периодической загрузкой
[122] Одним неограничивающим примером биореактора, который можно использовать для культивирования множества клеток, находящихся в растворе с белком, является биореактор с периодической загрузкой. Культивирование клетки в биореакторе с периодической загрузкой включает, в течение большей части периода культивирования, добавление (например, периодическое или непрерывное добавление) в первую жидкую культуральную среду второго объема второй жидкой культуральной среды. Добавление второй жидкой культуральной среды можно проводить в непрерывном режиме (например со скоростью, которая наращивает объем от 0,1% до 300% (например, от 1% до 250%, от 1% до 100%, от 100% до 200%, от 5% до 150%, от 10% до 50%, от 15% до 40%, от 8% до 80% и от 4% до 30%) от объема биореактора или объема первой жидкой культуральной среды за любой указанный период времени (например, в течение 24-часового периода, в течение нарастающего периода времени от приблизительно 1 часа до приблизительно 24 часов, или в течение нарастающего периода времени, составляющего более 24 часов) или периодически (например, один раз каждый третий день, один раз во все последующие дни, один раз в день, два раза в день, три раза в день, четыре раза в день, или пять раз в день), или в любой их комбинации. Если проводится периодически, то добавляемый объем (например, в течение приблизительно 24-часового периода, в течение нарастающего периода времени от приблизительно 1 часа до приблизительно 24 часов, или в течение нарастающего периода времени, составляющего более 24 часов) может составлять, например, от 0,1% до 300% (например, от 1% до 200%, от 1% до 100%, от 100% до 200%, от 5% до 150%, от 10% до 50%, от 15% до 40%, от 8% до 80% и от 4% до 30%) от объема биореактора или объема первой жидкой культуральной среды. Использование биореакторов с периодической загрузкой в отношении клеточной культуры для получения белков хорошо описано в данной области.
Перфузионный биореактор
[123] Стадию культивирования, описанную в данном документе, можно проводить с помощью перфузионного биореактора. Культивирование клетки в перфузионном биореакторе включает удаление из биореактора первого объема первой жидкой культуральной среды (например, содержащей клетки в любой концентрации, например, первого объема первой жидкой культуральной среды, которая, по сути, не содержит клеток) и добавление в первую жидкую культуральную среду второго объема второй жидкой культуральной среды. Удаление и добавление можно проводить одновременно или последовательно, или путем их комбинирования. Кроме того, удаление и добавление можно проводить непрерывно или периодически, или в любой их комбинации. Удаление первого объема первой жидкой культуральной среды и добавление второго объема второй жидкой культуральной среды можно в некоторых случаях проводить примерно аналогично в течение каждого 24-часового периода (или, в качестве альтернативы, нарастающего периода времени от приблизительно 1 часа до приблизительно 24 часов или нарастающего периода времени, составляющего более 24 часов) в течение всего периода культивирования или его части. Как известно в данной области, можно варьировать скорость удаления первого объема первой жидкой культуральной среды (объем/единица времени), и скорость добавления второго объема второй жидкой культуральной среды (объем/единица времени). Скорость удаления первого объема первой жидкой культуральной среды (объем/единица времени) и скорость добавления второго объема второй жидкой культуральной среды (объем/единица времени) могут быть приблизительно аналогичными или могут быть разными. Использование перфузионных биореакторов в отношении культуры клеток для получения белков хорошо описаны в данной области.
[124] Внутренняя поверхность любого из биореакторов, описанных в данном документе, может иметь по меньшей мере одно покрытие (например, по меньшей мере одно покрытие из желатина, коллагена, поли-L-орнитина, полистирола и ламинина) и, как известно в данной области, одно или несколько отверстий для барботирования O2, CO2 и N2 в жидкую культуральную среду, а также механизм для ротационного перемешивания жидкой культуральной среды. В биореакторе можно инкубировать культуру клеток в контролируемой влажной атмосфере (например, при влажности более 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90% или 95%, или влажности 100%). Также биореактор может быть оснащен механическим устройством, которое способно удалять объем жидкой культуральной среды из биореактора, и, необязательно, фильтром внутри механического устройства, который удаляет клетки из жидкой культуральной среды в процессе переноса жидкой культуральной среды из биореактора (например, ATF-системы).
[125] Концентрация белка в растворах в соответствии с заявляемыми способами может cоставлять более приблизительно 1,0 мг/мл, более приблизительно 1,5 мг/мл, более приблизительно 2,0 мг/мл, более приблизительно 2,5 мг/мл, более приблизительно 3,0 мг/мл, более приблизительно 3,5 мг/мл, более приблизительно 4,0 мг/мл, более приблизительно 4,5 мг/мл, более приблизительно 5,0 мг/мл, более приблизительно 5,5 мг/мл, более приблизительно 6,0 мг/мл, более приблизительно 6,5 мг/мл, более приблизительно 7,0 мг/мл, более приблизительно 7,5 мг/мл, более приблизительно 8,0 мг/мл, более приблизительно 8,5 мг/мл, более приблизительно 9,0 мг/мл, более чем приблизительно 10,0 мг/мл, более приблизительно 12,5 мг/мл или более приблизительно 15,0 мг/мл. В определенных вариантах осуществления концентрация белка в содержащих клетки растворах согласно заявляемым способам составляет от приблизительно 0,01 мг/мл до приблизительно 20 мг/мл. В других вариантах осуществления концентрация белка в не содержащих клетки растворах согласно заявляемым способам составляет от приблизительно 0,1 мг/мл до приблизительно 100 мг/мл.
В целом при осуществлении на практике настоящего изобретения применяют, если не указано иное, традиционные методики химии, молекулярной биологии, технологии рекомбинантных ДНК, иммунологии (особенно, например, технологии иммуноглобулинов) и стандартные методики электрофореза. См., например, Sambrook et al., 1989, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press; Paul, S. (ed.), 1995, Antibody engineering protocols (Vol. 51). Humana Press; McCafferty et al. (eds.), 1996, Antibody engineering: a practical approach, Practical Approach Series, 169, IRL press; Harlow et al. (eds.), 1999, Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Ausubel et al., 2007, Current Protocols in Molecular Biology, John Wiley & Sons, NY; Bousse et al., 2001, Anal. Chem. 73:1207-1212; Knapp et al., 2001, Proceedings of the μTAS 2001 Symposium, Micro Total Analysis Systems 2001, 7-10, Kluwer Academic Publishers, Dordrecht, Netherlands; Mhatre et al., 1999, Rapid Commun Mass Spectrom. 13(24):2503-10. Методики, раскрытые в данных публикациях, включены посредством ссылки во всей их полноте.
[126] Если не определено иначе, вся техническая и научная терминология, используемая в данном документе, имеет то же значение, которое обычно понимает специалист в данной области, к которой принадлежит настоящее изобретение. Научные методики и материалы описаны в данном документе для использования в настоящем изобретении; также можно использовать другие подходящие методики и материалы. Материалы, методики и примеры являются только иллюстративными и не предназначены для ограничения. Все публикации, патентные заявки, патенты, последовательности, записи в базах данных и другие ссылки, упомянутые данном документе, включены посредством ссылки во всей своей полноте. В случае противоречий настоящее описание, включая определения, будет иметь преимущественную силу.
[127] Приведенные ниже примеры иллюстрируют конкретные варианты осуществления настоящего изобретения и различные их применения. Они приведены только для пояснительных целей, и их не следует рассматривать как каким-либо образом ограничивающие объем настоящего изобретения.
ПРИМЕРЫ
Example 1. Контроль доли полуантитела IgG4: оценка неочищенных собранных материалов
[128] Общий подход
[129] Возможность контролировать уровень полуантитела IgG4 изучали на неочищенном собранном материале культуры клеток, который представляет собой систему, содержащую клетки. В данном примере неосветленный собранный материал, полученный по завершении производственного цикла биореактора с периодической загрузкой, подвергали ряду экспериментальных условий и отслеживали, в зависимости от времени, процент полуантитела (Hab), находящегося в совокупности IgG4. Ключевые условия эксперимента включали следующие: время выдерживания неочищенного собранного материала, температуру выдерживания и жизнеспособность клеток в собранном материале (контролировали в день сбора материала). Наряду с уровнем полуантител, вторичные экспериментальные выходные данные включали ряд параметров жидкой фазы, такие как значение рН, плотность жизнеспособных клеток и растворенные газы.
[130] Материалы, способы и аналитические методики
[131] Для того чтобы измерить содержание полуантител, выделение неочищенного образца собранного материала проводили с помощью 0,2 мкм фильтрации с последующей очисткой на устройстве для манипуляций с жидкостями Freedom EVO 150 Tecan с использованием PreDictor RoboColumns (200 мкл), заполненного смолой MabSelect SuRe, приобретенной у компании GE Life Sciences. Анализ полуантител проводили с помощью SDS-PAGE в невосстанавливающих условиях. SDS-PAGE в невосстанавливающих условиях проводили в соответствии со стандартными методиками (например, см. Sambrook et al., 1989; Ausubel et al., 2007). Окрашивание гелей проводили при помощи Simply Blue SafeStain (Life Technologies, № по кат. LC6065). Уровень полуантитела измеряли по сканированному изображению геля и количественно определяли с помощью денситометра.
[132] Подготовка и обработка образца неочищенного собранного материала
[133] Примерно 20 мл неочищенного собранного материала распределяли в несколько PETG-бутылок объемом 20 мл с минимальным свободном пространством. Процедуру распределения неочищенного собранного материала в 20 мл образцах разрабатывали для обеспечения гомогенности и стерильности каждого образца при переносе неочищенного собранного материала в роллерную колбу, которую непрерывно взбалтывали, в то время как образцы получали путем последовательного пипетирования. Бутылки открывали только один раз для анализа и/или выделения. Особое внимание уделяли контролю исходной плотности клеток в ходе распределения образцов неочищенного собранного материала. В указанные моменты времени проверяли характеристики жидкой фазы образцов неочищенного собранного материала, такие как значение рН, растворенные газы и плотность жизнеспособных клеток с последующим выделением путем захвата. Затем выделенный образец анализировали на содержание Hab.
[134] Результаты экспериментов, представленные в данном примере, также подтверждали в образцах неочищенного собранного материала объемом 2 л и 5 л, которые собирали с использованием одноразовой камеры. Таким образом, раскрытые в данном документе способы можно воспроизводить в увеличенном масштабе для получения антител в больших объемах, например, при коммерческом получении и/или производстве антител.
Example 2. Время выдерживания: неочищенный собранный материал
[135] В первичном экспериментальном исследовании изучали несколько ключевых переменных, чтобы продемонстрировать способность контролировать уровень полуантитела IgG4, находящегося в образце антител. Эти ключевые переменные включали время выдерживания неочищенного собранного материала, температуру выдерживания и исходную плотность жизнеспособных клеток (которую контролировали путем оценки жизнеспособности в ходе сбора).
[136] Для установления значения доли полуантител на исходном уровне для каждого эксперимента, содержание полуантител измеряли в образце антител, полученном с использованием традиционного протокола, который предусматривал время выдерживания 0 минут (например, без стадии выдерживания) и отсутствие регулирования каких-либо других условий в соответствии со способами, раскрытыми в данном документе. Содержание полуантител в данном выделенном образце составляло в среднем приблизительно 21% (что измерено с помощью SDS-PAGE в невосстанавливающих условиях.).
[137] Неочищенный собранный текучий материал получали из культур терапевтической молекулы IgG4 с периодической подпиткой. Культивирование клеток проводили в стеклянных 15 л биореакторах Broadley James с системой контроля Delta V. На протяжении всего периода выдерживания образца неочищенного собранного материала плотность жизнеспособных клеток и процент жизнеспособности измеряли с использованием анализатора жизнеспособности клеток Vi-Cell Cell Viability Analyzer (Beckman Coulter), а значения рН, pCO2 и pO2 измеряли с использованием анализатора газов крови Blood Gas Analyzer (Siemens).
[138] В зависимости от условий испытаний, посредством выдерживания биотерапевтического IgG4 в присутствии клеток удавалось уменьшать, увеличивать или практически сохранять уровень полуантитела, находящегося в совокупности антител. Результаты этих экспериментов представлены на фигуре 3.
Example 3. Исходная плотность жизнеспособных клеток: неочищенный собранный материал
[139] Вторая важнейшая экспериментальная переменная или контрольный параметр, проверяемые в данном исследовании, представляли собой исходную плотность жизнеспособных клеток (фигуры 3B и 3D).
[140] Из биореактора образцы отбирали в два разных дня сбора, что соответствовало примерно 70% и 35% жизнеспособности клеток. В этом эксперименте исходную плотность жизнеспособных клеток определяли при 4,5×106 клеток/мл (более ранний день сбора из реактора с периодической загрузкой) или 2,5×106 клеток/мл (более поздний день сбора из реактора с периодической загрузкой). Температуру выдерживания между двумя условиями проверки плотности клеток поддерживали постоянной при 8°C. В этом эксперименте при 8°C уровень полуантител не уменьшался в образце со сравнительно низкой исходной плотностью жизнеспособных клеток 2,5×106 клеток/мл.
[141] При более тщательном анализе было отмечено, что как только значение плотности жизнеспособных клеток уменьшалось до примерно 2×106 клеток/мл, дальнейшее уменьшение уровня полуантитела не происходило при любом экспериментальном условии испытания (фигура 3). Данное явление наблюдали в обоих образцах с различными исходными плотностями жизнеспособных клеток Наблюдали сильную зависимость превращения Hab от плотности жизнеспособных клеток по всему набору данных, и результаты, представленные на фигурах 3B и 3D, являются репрезентативными.
Example 4. Температура выдерживания: неочищенный собранный материал
[142] Неочищенный собранный материал выдерживали при трех разных температурах: 2-10°C (холодная комната), 20-22°C (температура окружающей среды) и 37°C (теплая комната).
[143] Несколько потенциальных контрольных параметров возникли в результате анализа результатов эксперимента. Было установлено, что содержание полуантител существенно зависит от присутствия жизнеспособных клеток в неочищенном собранном материале.
[144] На фигуре 3А наиболее резкое уменьшение уровня полуантитела наблюдали для условия выдерживания при холодной температуре (8°C), что соответствовало самому высокому уровню плотности жизнеспособных клеток, которую оценивали в данном исследовании. Характер изменения полуантитела в теплых условиях (37°С) включает как немедленное уменьшение с 21% до 19%, так и, в конечном счете, увеличение уровня полуантител до предельного, составляющего приблизительно 25%. Изменение прогрессии полуантител при 37°C от уменьшения до увеличения относилось непосредственно к точке, в которой по-прежнему находящиеся в образце клетки больше не были жизнеспособными (фигура 3В), еще одно доказательство важной роли жизнеспособных клеток в контроле процесса образования полуантител.
[145] Таким образом, воздействие повышенной температуры на состояние выдерживания (неочищенного) собранного материала, содержащего клетки, служило контрольным параметром, с помощью которого уровень полуантитела можно было увеличить.
Example 5. Перемешивание в ходе выдерживания: неочищенный собранный материал
[146] В дополнение к изменениям температуры выдерживания, влияние перемешивания или взбалтывания проверяли путем помещения выбранных образцов неочищенного собранного материала на вращатель на период выдерживания, а другие образцы оставляли неподвижными (статическими) на протяжении всего выдерживания.
[147] Также изучали влияние перемешивания раствора, содержащего клетки, на уровень полуантитела IgG4 (фигура 4). Образец с низкой исходной плотностью жизнеспособных клеток (из фигуры 3С) выдерживали либо в (1) статическом, неперемешиваемом состоянии, либо (2) непрерывно перемешивали с помощью вращателя. Перемешиванием раствора неочищенного собранного материала удавалось значительно ускорять уменьшение содержания полуантитела, достигая примерно 13% содержания полуантитела после двух недель выдерживания при 8°C по сравнению с более чем 20% содержания полуантитела без какого-либо перемешивания при тех же условиях времени и температуры (фигура 4).
Example 6. Добавление окислительно-восстановительных реагентов в систему, содержащую клетки: оценка неочищенного собранного материала
[148] Для дальнейшего ускорения превращения полуантитела в полное антитело окислительно-восстановительные реагенты, в частности, восстановленный и окисленный глутатион, непосредственно добавляли в систему, содержащую клетки, неочищенный собранный материал, с последующей очисткой и аналитической оценкой. Образец неочищенного собранного материала выдерживали при 8°С.
[149] В первом эксперименте исходная жизнеспособность клеток в образце неочищенного собранного материала была низкой, всего лишь 2,5×106 клеток/мл. Хотя при таком низком состоянии жизнеспособности клеток каких-либо изменений в уровнях полуантител при отсутствии глутатиона не проявлялось (фигура 5, круги), добавление глутатиона либо с 5 мМ окисленного глутатиона и 0,5 мМ восстановленного глутатиона (фигура 5, квадраты), либо с 0,5 мМ окисленного глутатиона и 5 мМ восстановленного глутатиона (фигура 5, треугольники), значительно снижало уровни полуантител и делало это гораздо быстрее, чем при любом из изученных условий без окислительно-восстановительных реагентов.
[150] Как показано на фигуре 5, наиболее низкий уровень полуантител достигался для условия с 0,5 мМ восстановленного глутатиона и 5 мМ окисленного глутатиона в течение примерно 4 дней выдерживания собранного материала, содержащего клетки, в условиях при 8°С (фигура 5, треугольники). Вполне возможно, что низкое содержание полуантител достигалось ранее 4 дней. Тем не менее, самый ранний момент времени измерения для данных условий составлял четыре дня. Для условия с повышенным уровнем восстановленного глутатиона (отношение 5 мМ восстановленного глутатиона к 5 мМ окисленного глутатиона), также наблюдали значительно уменьшенный уровень полуантитела, хотя только после более длительного периода инкубирования в течение двух недель. (Фигура 5, квадраты).
Example 7. Добавление окислительно-восстановительных реагентов в систему, содержащую клетки: в ходе проведения технологической операции в биореакторе
[151] Во втором эксперименте еще один окислительно-восстановительный реагент, 2-МЕА, оценивали при непосредственном добавлении 2-MEA в другую систему, содержащую клетки, находящуюся в биологическом способе в биореакторе. Также исследовали влияние значения рН биореактора на контроль образования полуантител при использовании окислительно-восстановительных реагентов. В частности, влияние 0,5 мМ и 2 мМ 2-МЕА, а также 5 мМ восстановленного глутатиона (GSH) исследовали в культурах биореактора путем добавления окислительно-восстановительного реагента при двух уровнях значения рН (высокое значение рН: 7,1, низкое значение pH: 6,9). Результаты этого исследования показаны на фигуре 6. Определили, что значение рН культуры не оказывало влияния на превращение Hab и стабильность Hab, что свидетельствовало о том, что превращение Hab посредством добавления окислительно-восстановительных реагентов было устойчивым с учетом значения рН для условий, испытываемых в системе, содержащей клетки, в биореакторе.
[152] Такие исследования доли полуантител в системе, содержащей клетки, в биореакторе показали, что 2-МЕА был наиболее эффективным из испытанных окислительно-восстановительных реагентов, и что концентрация 2 мМ 2-MEA была эффективной в контролировании доли Hab в биореакторе в пределах 8-10% на протяжении по меньшей мере 24 ч. (фигура 6, квадраты и треугольники). Для всех испытанных условий доля Hab значительно снижалась в течение кратчайшего времени после добавления окислительно-восстановительного реагента, достигая ниже 10% для всех условий, за исключением одного (фигура 6). Интересно отметить, что при всех условиях, кроме 2 мМ 2-MEA, доля Hab увеличивалась со временем до уровней, приближающихся к исходному уровню Hab. (Фигура 6). Обратное образование полуантител было наиболее быстрым при 0,5 мМ 2-MEA, указывая на то, что концентрация окислительно-восстановительного реагента может быть ключевым параметром в контролировании доли Hab в растворе антител.
[153] Также проводили дополнительные эксперименты с целью определения потенциального влияния исходной жизнеспособности клеток в биореакторе на изменения уровня Hab и способность 2-MEA обеспечивать контроль доли Hab. В этом исследовании 2 мМ 2-МЕА добавляли в два отдельных биореактора ближе к завершению прогона производственного цикла биореактора с периодической загрузкой при жизнеспособности клеток либо 70%, либо 45% (дни 12 и 14, соответственно). В обоих биореакторах при добавлении 2-MEA удавалось уменьшить долю Hab до уровня ниже 10% практически сразу же после добавления. (Фигура 7). В соответствии с наблюдениями, связанными с описанной выше жизнеспособностью клеток, доля Hab в биореакторе в зависимости от времени зависела от исходной жизнеспособности клеток в момент добавления 2-MEA. При более низкой исходной жизнеспособности (45%) доля Hab увеличивалась с 8% до 14% после 24 часового воздействия 2-MEA в биореакторе (фигура 7, квадраты). Тем не менее, культура с более высокой исходной жизнеспособностью (70%) давала стабильный профиль Hab в течение 24 часов после воздействия на нее 2-MEA в биореакторе (фигура 7, кружки). Такие результаты показывают, что плотность жизнеспособных клеток культуры в биореакторе может влиять на стабильность превращения Hab в полное антитело.
Example 8. Добавление окислительно-восстановительных реагентов в систему, содержащую клетки: оценка стабильности после удаления клеток
[154] Стабильность превращения Hab в полные антитела с использованием окислительно-восстановительных реагентов в системе, содержащей клетки, также оценивали после удаления клеток с получением очищенного собранного материала для соответствующих образцов путем удаления клеток и клеточного дебриса из образцов неочищенного собранного материала. В данном исследовании систему (биореактор), содержащую клетки, обрабатывали 2 мМ 2-MEA в течение 24 часов. Образец неочищенного собраного материала отбирали из системы, содержащей клетки, а затем очищали для удаления клеток и клеточного дебриса, получая таким образом очищенный собранный материал. Долю Hab отслеживали в аликвотах образца очищенного собранного материала, выдержанного при различных условиях в термостате, в том числе при двух температурах (2-8°С или 21oC/комнатная температура), с разными величинами повышения значения рН посредством управления объемом газа в свободном пространстве. Результаты показаны на фигуре 8.
[155] Результаты этих измерений показывают, что температура может служить в качестве еще одного параметра для контроля образования полуантител. Например, когда очищенный собранный материал, обработанный 2-МЕА, выдерживали при температуре 2-8°С, доля Hab снижалась с 9-10%, измеренных в начале времени выдерживания (t=0), до 6% в течение семи дней. (Фигура 8, сплошные и незаполненные ромбы). И наоборот, доля Hab в очищенном собранном, материале, обработанном 2-МЕА, фактически увеличивалась в течение семи дней, когда его выдерживали при комнатной температуре (21oC) (фигура 8, сплошные и незаполненные треугольники).
[156] Никаких различий не наблюдали между теми образцами очищенного собранного материала, которые хранили без присутствия свободного пространства (фигура 8, сплошные треугольники/ромбы), и теми, которые хранили с наличием свободного пространства. (Фигура 8, незаполненные треугольники/ромбы). Результаты этого конкретного эксперимента показали, что при изученных условиях дрейф значения рН не влияет на доли Hab очищенного от примесей сбора, обработанного 2-МЕА.
[157] Эти исследования показывают, что добавление окислительно-восстановительных реагентов, таких как 2-MEA и глутатион, непосредственно в содержащий клетки биореактор ближе к завершению рабочего цикла можно использовать для контроля доли полуантител, присутствующих в процессе. Кроме того, с помощью этих исследований с использованием окислительно-восстановительных реагентов оценивали влияние выбранных параметров на контроль доли Hab, включая наименование окислительно-восстановительного реагента и концентрацию, значение рН и жизнеспособность клеток.
Example 9. Контролирование доли полуантитела IgG4 в системе без применения клеток: оценка добавления окислительно-восстановительных реагентов к собранному осветленному материалу
[158] Исследования были проведены с целью дальнейшей оценки непосредственного добавления 2-MEA к собранному осветленному материалу, который представлял собой не содержащий клетки образец. В этих экспериментах осветленные образцы получали либо 2 мМ 2-MEA, либо не получали окислительно-восстановительный реагент, с последующим выдерживанием с инкубированием при 2-8°С или при комнатной температуре (21oC). Долю Hab определяли в течение 7 дней (168 часов) инкубирования. Результаты за первых 2 часа показаны на фигуре 9, а результаты до окончания 7 дней показаны на фигуре 10. Эти результаты указывают на то, что добавление 2-MEA с последующим инкубированием при 8°С может значительно снижать долю Hab до уровня ниже 10% (фигура 9, треугольники), и что доля Hab остается ниже 10% в течение по меньшей мере 7 дней (фигура 10, треугольники). В образцах, содержащих 2-MEA, которые инкубировали при комнатной температуре (21oC), доля Hab также быстро снижалась почти сразу же после добавления 2-MEA (фигура 9, ромбы). Тем не менее, уровень содержания Hab увеличивался вскоре после исходного снижения, достигая соответствующего уровня примерно 11% Hab в течение 1-7 дней инкубирования (фигура 10, ромбы). В контрольных образцах в материале, хранящемся при температуре либо 8oC, либо при комнатной температуре (21oC) без 2-MEA, доля Hab не изменялась (фигура 9, квадраты; фигура 10, круги).
[159] Данное исследование указывает на то, что окислительно-восстановительные реагенты, подобные 2-MEA, можно добавлять непосредственно в не содержащие клетки системы, такие как осветленный собранный материал, для достижения контроля уровня полуантител. Кроме того, такой вариант представляет собой дополнительную стадию в пределах биологического способа, когда доли Hab можно контролировать. Также изучали влияние температуры на осветленный собранный материал, обработанный 2-MEA, и при этом обнаружили, что оно согласуется с результатами, полученными выше для образцов осветленного собранного материала, где ранее в процессе добавляли 2-MEA в биореактор с системой, содержащей клетки. Способность контролировать доли Hab с помощью окислительно-восстановительных реагентов, подобных 2-MEA, во многие моменты времени в способе обеспечивает гибкость при проектировании биологического способа с достаточным контролем доли Hab.
Example 10. Подтверждение качества продукта
[160] Несколько образцов очищенного и неочищенного собранного материала, которые подвергали обработке 2-MEA в соответствии с вышеприведенными примерами, анализировали в отношении ряда показателей качества продукта, в том числе профиль гликозилирования, заряженные варианты, масс-спектрофотометрические профили и анализ чистоты с помощью гель-электрофореза. Во всех случаях не наблюдали различий между необработанными и обработанными образцами за исключением уровня полуантитела, находящегося в образце (данные не показаны).
Example 11. Контролирование доли полуантитела IgG4 в системе без применения клеток: оценка раствора после захвата
[161] Общий подход
[162] Изучали восстанавливающие и окисляющие средства для того, чтобы оценить способность контролировать уровень содержания полуантитела IgG4 в не содержащей клетки системе. В настоящем исследовании захваченный элюат белка А (раствор после захвата), очищенный от собранного материала культуры клеток, использовали для изучения контрольных параметров исследования, которые влияют на уровень полуантитела. Высказывали предположение о том, что восстанавливающие средства, такие как 2-меркаптоэтиламин (2-MEA), могут быть эффективными в уменьшении содержания полуантител в образцах антител. Проводили исследования с целью оптимизации условий для снижения уровня содержания полуантитела, оценки условий инкубирования, таких как значение рН, время, температура, концентрация 2-MEA и концентрация IgG4.
[163] Материалы, способы и аналитические методики
[164] Экспериментальная процедура: собранный неочищенный материал, отобранный из культуры антитела IgG4 с периодической подпиткой, очищали от примесей фильтрованием, а затем выделяли с использованием колонки, заполненной смолой MabSelect Sure с белком А (GE Healthcare). Элюат белка А регулировали до указанных экспериментальных условий, инкубировали и затем повторно выделяли с помощью PreDictor RoboColumns (200 мкл), заполненной MabSelect SuRe с белком, чтобы удалить любые добавленные восстанавливающие или окислительные реагенты. Гель-анализ SDS в невосстанавливающих условиях проводили на повторно выделенных при помощи RoboColumn элюатах белка A с использованием 4-20% трис-глицинового геля, приобретенного у компании Invitrogen. Окрашивание гелей проводили при помощи Simply Blue SafeStain (Life Technologies, № по кат. LC6065). Уровень полуантитела измеряли по сканированному изображению геля и количественно определяли с помощью денситометра. Пример геля изображен на фигуре 11.
Example 12. Добавление окислительно-восстановительных реагентов в систему без использования клеток: оценка раствора после захвата
[165] Несколько восстанавливающих и окислительных реагентов испытывали на их способность уменьшать или увеличивать уровень полуантитела, находящегося в совокупности IgG4 в растворе после захвата. 2-MEA является наиболее эффективным с точки зрения снижения уровня полуантитела IgG4 в элюате белка А (раствор после захвата) по сравнению с другими испытанными восстанавливающими средствами, которые включали 2-меркаптоэтанол и восстановленный глутатион (GSH). Значение рН поддерживали постоянным при 4,8 для всех условий испытаний окислительно-восстановительного реагента в ходе этого скринингового исследования. Также испытывали окислительно-восстановительный реагент дитиотреитол (DTT), однако он оказался неподходящим для использования в соответствии с описанными способами. Было отмечено, что DTT снижал содержание интактного антитела IgG4 относительно фрагментов тяжелых и легких цепей, а также повышал уровни полуантитела (фигура 11, полоса 8). Было невозможно точно вычислить процент Hab в образце DTT из-за наличия фрагментов тяжелых и легких цепей. Результаты показаны в таблице 1 и дополнительно показаны на фигуре 11.
[166] Интересно отметить, что добавление окисленного глутатиона (GSSG) к элюату белка А не оказывало поддающегося измерению влияния на наблюдаемое уменьшение уровня полуантител в присутствии либо 2-MEA, либо восстановленного глутатиона (таблица 1).
Таблица 1. Оценка различных окислительно-восстановительных реагентов в отношении контролирования уровня полуантитела Номер дорожки соответствует гелю, изображенному на фигуре 11
(*) - Полученные фрагменты тяжелых и легких цепей. Таким образом, долю полуантител количественно не определяли.
Example 13. Влияние концентрации окислительно-восстановительного реагента 2-MEA на долю полуантител
[167] Было показано, что 2-МЕА являлся наиболее эффективным испытанным восстанавливающим средством для уменьшения содержания Hab, и поэтому его выбрали для дополнительных экспериментов. Для оценки влияния 2-MEA на качество продукта, элюат белка А (примерно 9-10 мг/мл общего содержания антитела) оценивали без регулирования и с регулированием при помощи 2-MEA (при оптимальных условиях). Эти эксперименты разрабатывали для изучения влияния концентрации 2-MEA на уровень полуантитела в очищенных образцах. Испытанные концентрации 2-MEA приведены в таблице 2 и находились в диапазоне от 0 мМ до 50 мМ. В отсутствии какого-либо количества 2-MEA (0 мМ) наблюдали, что содержание Hab составляло 27% (таблица 2). Тем не менее, при концентрациях 2-MEA от 0,5 до 5 мМ уровень полуантитела IgG4 в образцах уменьшался (таблица 2, выделенные жирным строки). Что особенно важно, уровень полуантитела снижался от 27% до 15,2% в присутствии 1 мМ 2-MEA. Более высокие концентрации 2-MEA (25 мМ и 50 мМ) приводили к повышению уровней полуантитела (46 и 58%), а также способствовали формированию фрагментов тяжелых и легких цепей (таблица 2).
[168] Интересно, что уровень полуантитела уменьшался в течение прим. 30 минут в присутствии 2-MEA (1, 2 и 3 мМ при значении рН 4,8). Аналогичную величину уменьшения наблюдали при инкубирования в течение 5, 15 и 22 часов, что указывало на то, что быстро достигали условий равновесия и что увеличение периода инкубирования не было благоприятным (результаты не показаны).
Таблица 2. Влияние концентрации 2-MEA на уровень полуантитела в элюате белка A
(*) - Полученные фрагменты тяжелых и легких цепей. Таким образом, долю полуантител количественно не определяли.
Example 14. Влияние значения рН на долю полуантител
[169] Также изучали влияние значения рН очищенного образца антител на уровень полуантитела. Образцы антител, содержащие 2-MEA в концентрации 0 мМ или 2 мМ, испытывали при значениях рН=4,0, 4,8 или 7.
[170] Для образцов антител, содержащих 2-MEA при 2 мМ, снижение уровня полуантитела было значительно выше при более низких значениях рН (4,0 и 4,8), чем при нейтральном значении рН 7,0 (таблица 3). При значении рН 4 уровень полуантитела снижался с 27,1% при отсутствии 2-MEA (0 мМ) до 20,8% в растворе, содержащем 2-MEA в концентрации 2 мМ. (Таблица 3). При значении рН 4,8 уровень полуантитела снижался с 28,9% при отсутствии 2-MEA (0 мМ) до 20,4% в растворе, содержащем 2-MEA в концентрации 2 мМ. (Таблица 3). Тем не менее, при значении рН 7 уровень полуантител снижался с 27,4% при отсутствии 2-MEA (0 мМ) до всего лишь 24,5% в растворе, содержащем 2-MEA в концентрации 2 мМ. (Таблица 3).
[171] Добавление хлорида натрия до концентрации 40 мМ в раствор элюата белка А не оказывало поддающегося измерению влияния на уровень полуантитела в присутствии 2 мМ 2-MEA при значении рН 4,8 или нейтральном рН 7,0 (таблица 3).
Таблица 3. Влияние значения рН и концентрации хлорида натрия на контролирование уровня полуантитела
[172] Уровень полуантитела снижался в течение 30 минут в присутствии 2-MEA (1, 2 и 3 мМ при значении рН 4,8). Аналогичные результаты с увеличенным временем инкубирования (инкубирование 5, 15 и 22 часа) указывали на то, что условия равновесия достигались быстро (результаты не показаны).
Example 15. Определяющий фактор идентификации
[173] Для того, чтобы выявить определяющий фактор(факторы), влияющий(влияющие) на уровни полуантител в очищенном элюате белка A в присутствии 2-MEA, проводили полный двухуровневый факторный эксперимент с пятью факторами: значение рН, температура, время инкубирования, концентрация восстанавливающего средства (2-MEA) и концентрация IgG4. Низкие и высокие значения для пяти факторов выбирали на основе экспериментальных результатов, раскрытых в вышеприведенных примерах, а также различных других проведенных ранее экспериментов для определения диапазона доз и экспериментов с целью оптимизации. Значения, испытанные в данных экспериментах, приведены ниже в таблице 4, а репрезентативный гель показан на фигуре 12.
Таблица 4. Низкие и высокие заданные величины для 2-уровневого полного факторного плана с 5 повторностями в центральных точках
[174] Испытывали тридцать семь образцов. Исходный уровень полуантитела, измеренный в элюате белка А (18,5%), снижался до 8-9% в течение 30 минут при значении рН 3,4 в присутствии 2-MEA в низких концентрациях (0,5 и 3 мМ). В данном конкретном примере изучали дополнительные факторы, в том числе температуру, время, концентрацию 2-MEA и концентрацию IgG4, при этом статистически значимого влияния на уровень полуантитела в исследованных диапазонах не выявили.
[175] В совокупности данные результаты указывают на то, что уровень полуантитела IgG4 можно эффективно контролировать путем добавления окислительно-восстановительного реагента 2-MEA к раствору после захвата, такому как элюат белка А.
Реферат
Группа изобретений относится к биотехнологии и биологическому производству рекомбинантных белков и антител. Предложены способ контроля образования дисульфидных связей между полипептидами получаемого с помощью биологического способа мультимерного белка и способ контроля доли молекул полуантител в растворе, содержащем совокупность молекул антител. Приводят в контакт раствор, содержащий полипептиды или совокупность молекул антител, находящиеся в не содержащем клеток растворе, с кондиционированным раствором, включающим 2-меркаптоэтиламин (2-МЕА) в концентрации от 0,5 мМ до 2,0 мМ и имеющим рН от 4,0 до 4,8. Инкубируют смесь при температуре от 2°C до 8°C. Изобретения обеспечивают быстрое снижение, в течение примерно 30 мин, уровня полуантитела и позволяют эффективно контролировать число дисульфидных связей между полипептидами мультимерного белка и уровень полуантител. 2 н. и 7 з.п. ф-лы, 12 ил., 4 табл., 15 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ рефолдинга рекомбинантных антител

Комментарии