Гибридный полипептид, презентирующий аминокислотные последовательности, и его применение - RU2630660C2
Код документа: RU2630660C2
Чертежи





















































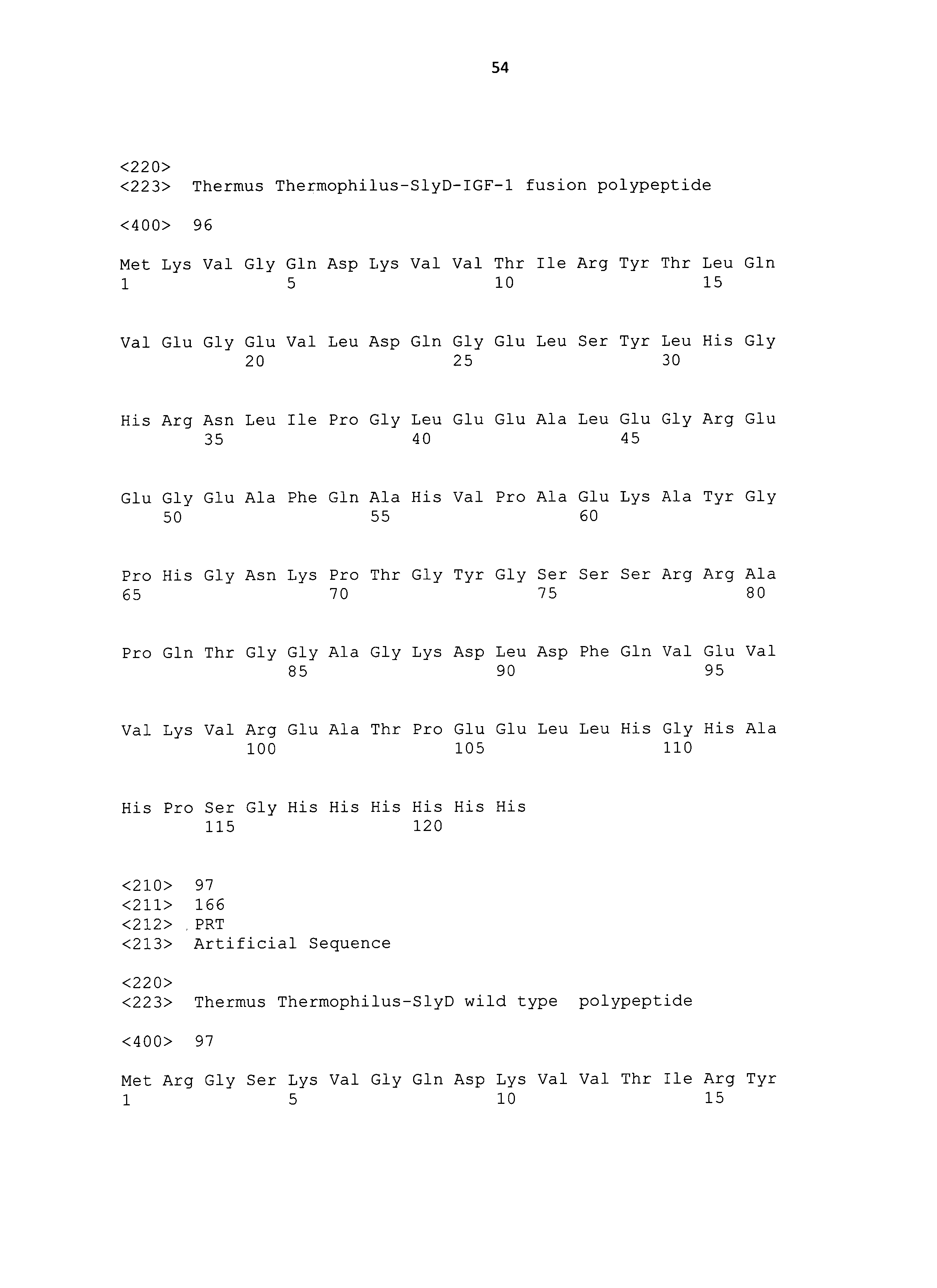






















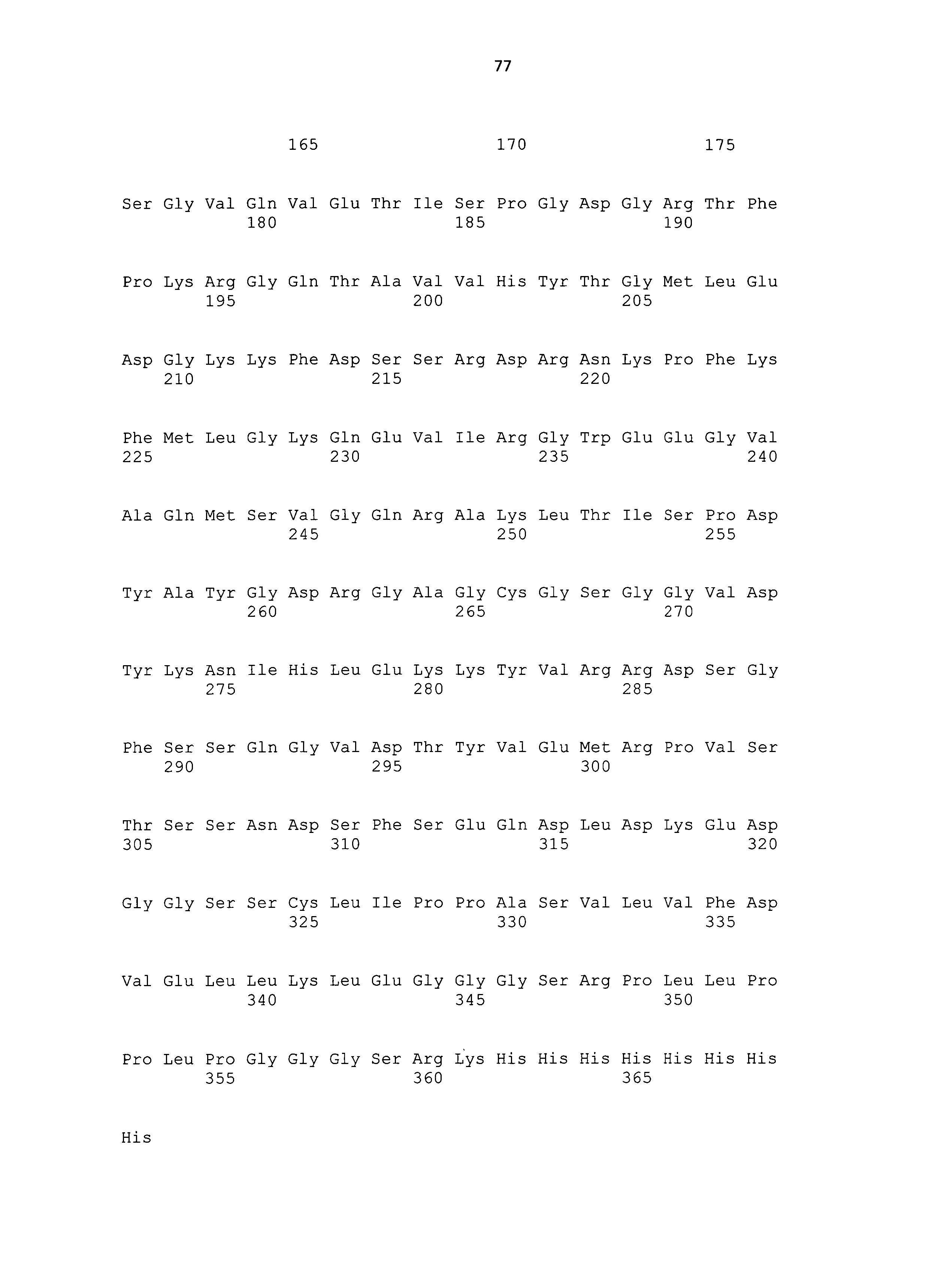


















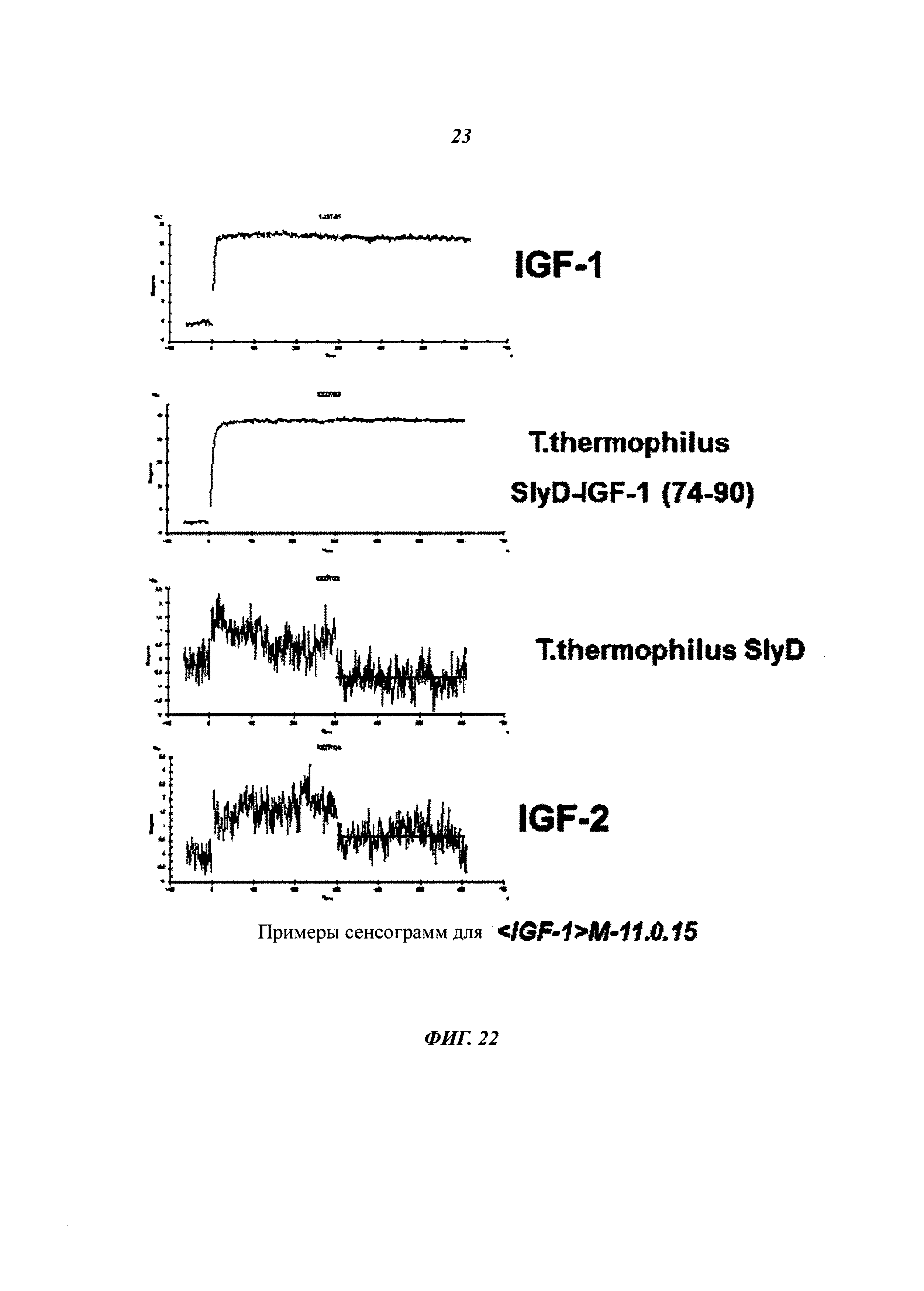

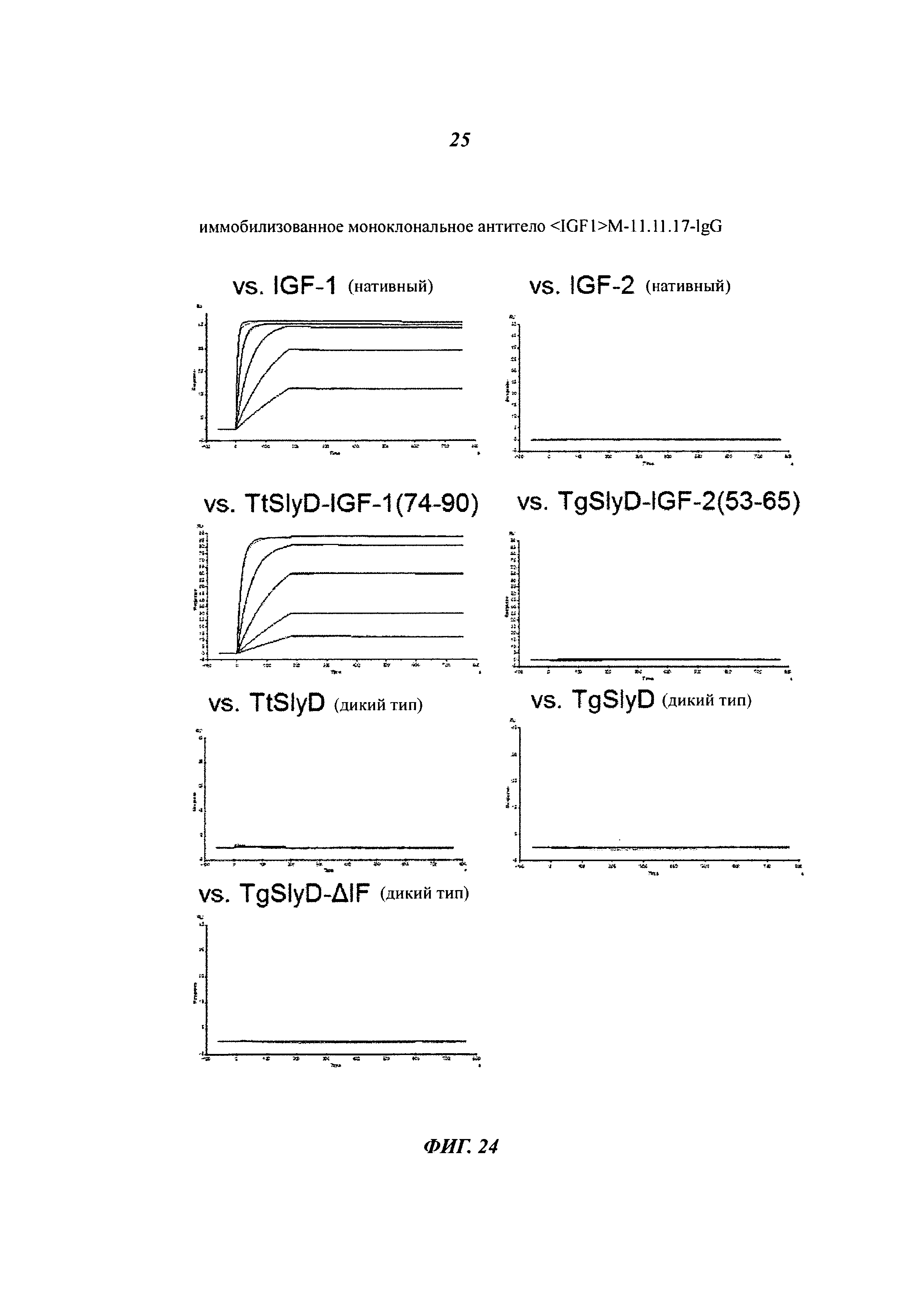



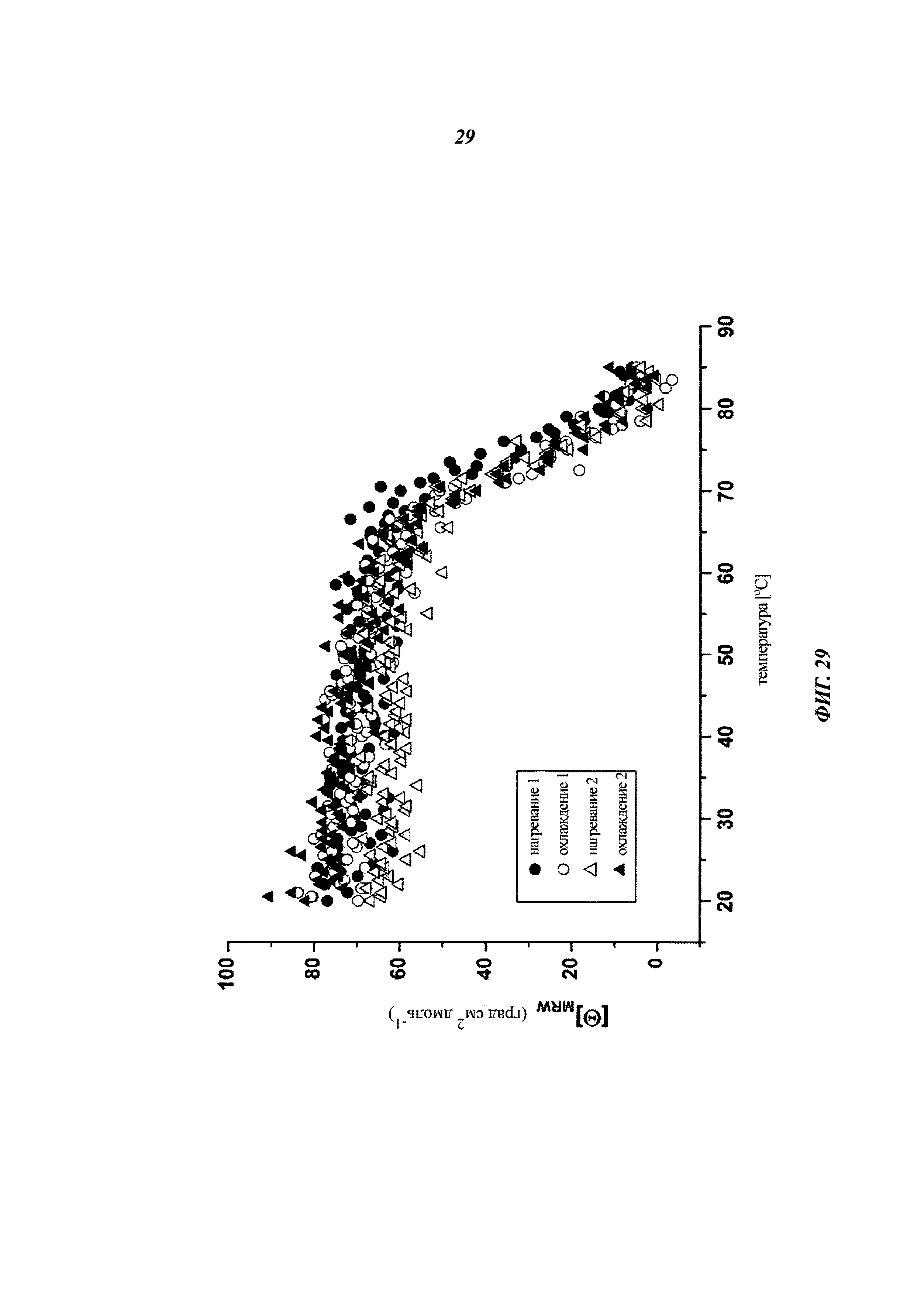
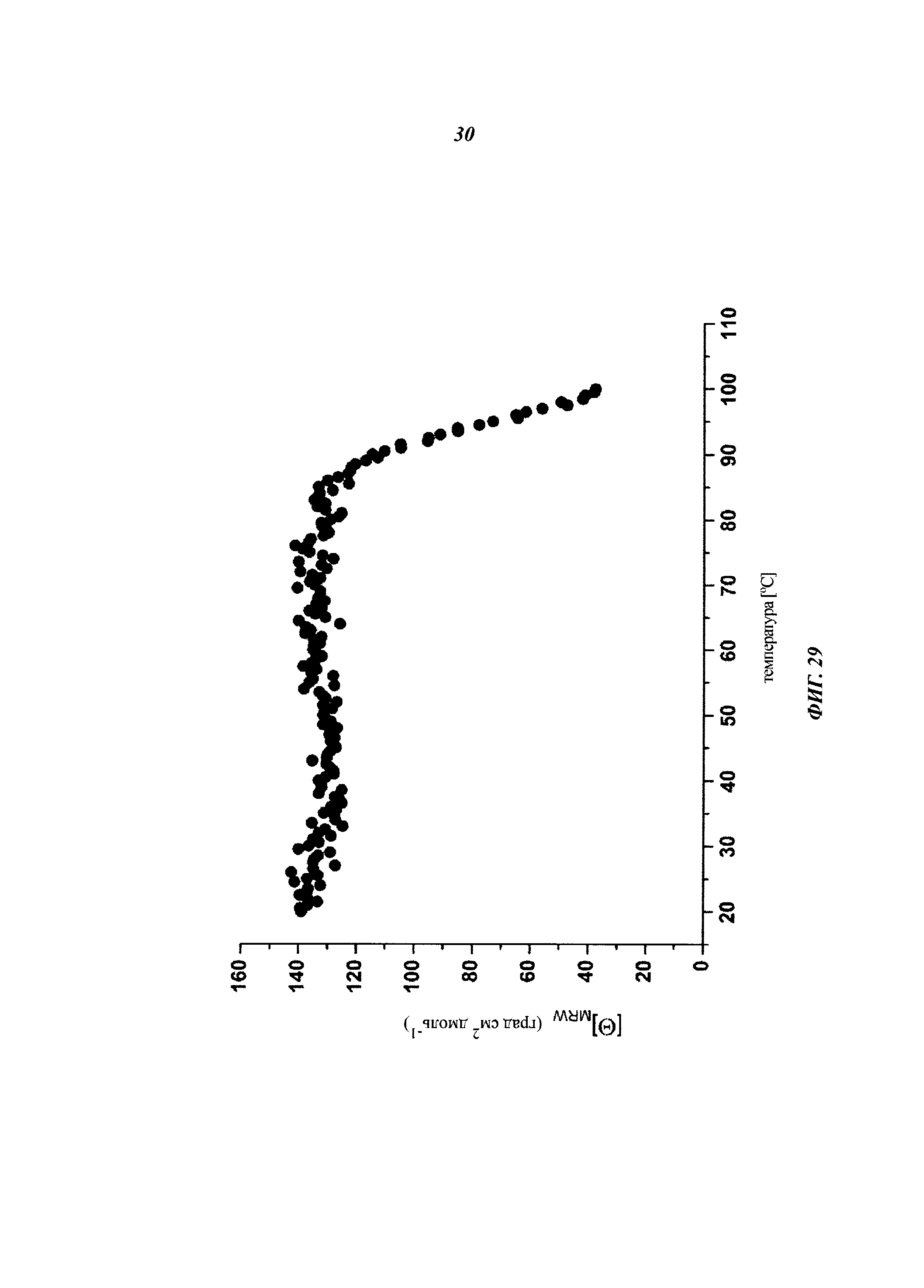





Описание
Здесь предложен гибридный полипептид, содержащий один или более фрагментов одной или более пептидил-пролил цис/транс изомеразы или одного или более представителей семейства FKBP, и его применение в способах скрининга/селекции антител, картирования эпитопов, а также для применения в качестве иммуногена для получения антител, специфически связывающихся с иммуногенным пептидом или вторичной структурой, которая презентирована гибридным полипептидом.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
В последние годы продукция антител, используемых в терапевтических целях, неуклонно увеличивалась, и возможно, что антитела, используемые в терапевтических целях, в ближайшем будущем станут самой большой группой терапевтических средств, предлагаемых для лечения различных заболеваний. Эффект антител, используемых в терапевтических целях, обусловлен их специфичностью, а именно функцией специфического распознавания и связывания мишеней.
Антитела можно получать с применением экспериментальных животных, которых иммунизируют иммуногеном. Иммуноген в большинстве случаев представляет собой полипептид или фрагмент полипептида. Для получения иммуногена в достаточном количестве и с достаточной степенью чистоты можно использовать иммуногены, полученные рекомбинантным способом.
Как правило, для продукции рекомбинантных полипептидов можно использовать прокариотические и эукариотические клетки. Рекомбинантные полипептиды можно получать либо в растворимой форме, либо в виде преципитата (телец включений). Перед хроматографической очисткой нерастворимые полипептиды, содержащиеся во включениях, необходимо растворить.
Как правило, иммуноген представляет собой синтетический или пептидный или рекомбинантный или гибридный или химерный или конъюгированный с носителем полипептид. Для иммунизации иммуноген можно вводить как в чистом виде, так и в сочетании с адъювантом, таким как адъювант Фрейнда.
Knappe, Т.А., et al. (J. Mol. Biol. 368 (2007) 1458-1468) показали, что участок Flap FKBP12 можно заменить IF доменом шаперона SlyD E.coli, обладающего схожей структурой. Химерный гибридный полипептид FKBP12-SlyD проявляет активность пептидил-пролил-цис/транс изомеразы, которая в 200 раз выше, чем у изолированного полипептида.
SlyD E.coli и FKBP12 (дикого типа и мутанты С23А и C23S) могут быть получены рекомбинантным путем в E.coli в растворимой форме с высоким выходом (Standaert, R.F., et al., Nature 346 (1990) 671-674).
FKBP, полученный из термофильных организмов, и SlyD E.coli можно применять в качестве шаперонов для рекомбинантной экспрессии гибридных белков в E.coli (Ideno, A., et al., Appl. Microbiol. Biotechnol. 64 (2004) 99-105). Полипептиды SlyD E.coli и FKBP12 представляют собой полипептиды, у которых процесс фолдинга является обратимым (Scholz, С., et al., J. Biol. Chem. 271 (1996) 12703-12707).
Аминокислотная последовательность полипептида FKBP12 содержит единственный остаток триптофана в положении 60. Таким образом, для исследования структурной целостности мутантов FKBP12 достаточно проанализировать флуоресценцию, обусловленную триптофаном (DeCenzo, M.T., et al., Protein Eng. 9 (1996) 173-180). Исследование остаточной каталитической активности мутанта FKBP12 можно выполнять путем определения остаточной активности ротамазы (Brecht, S., et al., Neuroscience 120 (2003) 1037-1048; Schories, В., et al., J. Pept. Sci. 13 (2007) 475-480; Timerman, A.P., et al., J. Biol. Chem. 270 (1995) 2451-2459). Кроме того, можно определить структурную целостность мутантов FKBP12, определив связывание FK506- или рапамицина (DeCenzo, M.T., et al., Protein Eng. 9 (1996) 173-180).
McNamara, A., et al. (J. Org. Chem. 66 (2001) 4585-4594) описали пептиды с ограниченной конформационной свободой за счет образования алифатических связей между двумя С(альфа) сайтами: дизайн, синтез и неожиданные конформационные свойства i,(i+4)-связанного пептида.
Suzuki, et al. (Suzuki, R., et al., J. Mol. Biol. 328 (2003) 1149-1160) описали трехмерную структуру FKBP архебактерий в растворе, обладающего как функцией пептидил-пролил-цис-транс изомеразы, так и шапероноподобной активностью. Вектор экспрессии, хозяин, гибридный белок, способ получения гибридного белка и способ получения белка описаны в ЕР 1516928. Knappe, Т.A., et al., продемонстрировали, что вставка домена шаперона превращает FKBP12 в мощный катализатор фолдинга белков (J. Mol. Biol. 368 (2007) 1458-1468). Химерный гибридный белок с улучшенной шаперонной активностью и способностью обеспечивать фолдинг описан в WO 2007/077008. В WO 03/000878 описано применение шаперонов FKBP в качестве средства экспрессии. В ЕР 1621555 описаны иммуноген, композиция для иммунологического применения и способ получения антитела с его применением. Rebuzzini, G. (диссертационная работа, выполненная в университете Milano-Bicocca (Италия) (2009)) описал исследование домена NS3 хеликазы вируса гепатита C с целью применения в хемилюминесцентном иммунологическом анализе.
В WO 2007/077008 описаны химерные гибридные белки с улучшенной шаперонной активностью и способностью обеспечивать фолдинг. Превращение FKBP12 в мощный катализатор фолдинга белков за счет вставки домена шаперона описано Knappe et al. (Knappe, T.A., et al., J. Mol. Biol. 368 (2007) 1458-1468).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Описанные здесь гибридные полипептиды представляют собой гибридные полипептиды, содержащие i) одну или более частей, полученных из одного, т.е. того же самого, или из разных полипептидов, обладающих активностью PPI или принадлежащих семейству FKBP, и ii) иммуногенного полипептида, встроенного между ними.
Описанные здесь гибридные полипептиды можно применять для иммунизации животного с целью получения антител, специфически связывающихся с иммуногенным полипептидом, встроенным в один или несколько участков одного или более полипептидов, обладающих активностью PPI или принадлежащих семейству FKBP.
Один из аспектов данного описания представляет собой гибридный полипептид согласно формуле I

где
X1 содержит либо произвольно составленную аминокислотную последовательность, либо аминокислотную последовательность, полученную из первого полипептида,
S2 и S1 представляют собой неперекрывающиеся аминокислотные последовательности, полученные из второго полипептида, и
- обозначает пептидную связь,
где второй полипептид представляет собой полипептид, обладающий активностью пептидил-пролил цис/транс-изомеразы (активность PPI) или полученный из полипептидов семейства, имеющих домен FKBP.
Было обнаружено, что с использованием гибридных полипептидов, описанных здесь, можно получить антитела, которые специфически связываются с внутренними (так называемыми скрытыми или погруженными) эпитопами (естественного происхождения) аминокислотной последовательности. Внутренние эпитопы недоступны при иммунизации по классическим протоколам, поскольку они становятся доступны, например, только после активации и последующих конформационных перестроек антигенного полипептида (такого, как рецептор). Более того, можно получить антитела, которые специфически связываются с иммуногенными полипептидами, которые получены на основе структур, которые иначе трудно получить в достаточном количестве или с достаточным качеством.
Гибридные полипептиды, описанные здесь, представляют собой химерные рекомбинантные полипептиды, которые можно использовать для экспонирования вторичной и третичной структуры пептидов, например, в способах скрининга/селекции антител или для картирования эпитопов, а также в качестве иммуногенов для получения антител, специфически связывающихся с презентированной аминокислотной последовательностью или вторичной структурой антигена. Полипептиды, описанные здесь, могут быть получены рекомбинантным способом, являются термодинамически стабильными, мономерными и растворимыми в водных растворах.
Один из аспектов данного описания представляет собой гибридный полипептид согласно формуле II

где
X1 содержит либо произвольно составленную аминокислотную последовательность, либо аминокислотную последовательность, полученную из первого полипептида,
S2 и S1 представляют собой неперекрывающиеся аминокислотные последовательности, полученные из второго полипептида, и
S3 и S0 либо отсутствуют, либо представляют собой неперекрывающиеся аминокислотные последовательности, полученные из третьего полипептида,
S4 либо отсутствует, либо представляет собой аминокислотную последовательность, полученную из четвертого полипептида,
Х2 либо отсутствует, либо представляет собой линкерную пептидную последовательность, и
- обозначает пептидную связь,
где второй полипептид и третий полипептид и четвертый полипептид отличаются друг от друга и представляют собой полипептиды, обладающие активностью пептидил-пролил цис/транс-изомеразы (активность PPI) или полученные полипептидов семейства, имеющих домен FKBP.
В одном воплощении всех аспектов данного описания второй полипептид, обладающий активностью пептидил-пролил цис/транс-изомеразы или полученный из полипептидов семейства, имеющих домен FKBP, представляет собой SlyD.
В одном воплощении всех аспектов данного описания второй полипептид представляет собой полипептид термофила.
В одном воплощении термофил представляет собой термофильную бактерию. В одном воплощении термофильная бактерия принадлежит семейству Thermaceae. В одном воплощении термофил представляет собой Thermus thermophilus.
В одном воплощении термофил представляет собой термофильную архебактерию. В одном воплощении термофильная архебактерия представляет собой гипертермофильную архебактерию. В одном воплощении термофил принадлежит классу Thermococci. В одном воплощении термофил представляет собой Thermococcus gammatolerans.
В одном воплощении оптимальная температура роста термофила составляет по меньшей мере 60°С.
В одном воплощении всех аспектов данного описания в составе аминокислотной последовательности X1 содержится иммуногенная последовательность. В одном воплощении аминокислотная последовательность X1 содержит иммуногенную последовательность и один или более участков, полученных из дополнительного полипептида, обладающего активностью пептидил-пролил цис/транс-изомеразы (активностью PPI), или полученных из дополнительного полипептида из семейства имеющих домен FKBP полипептидов, обеспечивающих фолдинг белков, где дополнительный полипептид отличается от второго полипептида.
Аминокислотная последовательность X1 встроена вместо IF-домена (от англ. «insert-in-flap») второго полипептида. Таким образом, если X1 идентичен IF-домену, т.е. имеет аминокислотную последовательность IF-домена, гибридный полипептид S2-X1-S1 идентичен соответствующей части второго полипептида естественного происхождения.
В одном воплощении всех аспектов данного описания аминокислотные последовательности S2 и S1, полученные из второго полипептида, связаны друг с другом (непосредственно) через IF-домен второго полипептида дикого типа (естественного происхождения).
В одном воплощении всех аспектов данного описания X1 встроен вместо IF-домена (от англ. «insert-in-flap») второго полипептида.
Один аспект данного описания представляет собой полипептид, имеющий аминокислотную последовательность по меньшей мере на 70% идентичную таковой полипептида описываемого формулой I, при исключении из анализа X1, или формулой II, при исключении из анализа X1, X2 и отсутствующих последовательностей. В одном воплощении полипептид имеет аминокислотную последовательность идентичную по меньшей мере на 80%. В одном воплощении полипептид имеет аминокислотную последовательность идентичную по меньшей мере на 90%. В одном воплощении полипептид имеет аминокислотную последовательность идентичную по меньшей мере на 95%. В одном воплощении полипептид имеет аминокислотную последовательность идентичную по меньшей мере на 98%.
В одном воплощении всех аспектов данного описания X1 содержит аминокислотную последовательность, которая соответствует скрытому эпитопу.
В одном воплощении всех аспектов данного описания X1 имеет аминокислотную последовательность размером от 4 до приблизительно 500 аминокислотных остатков. В одном воплощении X1 имеет аминокислотную последовательность размером от 5 до приблизительно 100 аминокислотных остатков. В одном воплощении X1 имеет аминокислотную последовательность размером от приблизительно 7 до приблизительно 60 аминокислотных остатков.
В одном воплощении всех аспектов данного описания по меньшей мере один аминокислотный остаток X1 имеет пост-трансляционные модификации. В одном воплощении один, или два, или три, или четыре, или пять, или шесть, или семь, или восемь, или девять, или десять аминокислотных остатков X1 имеют посттрансляционные модификации.
В одном воплощении гибридный полипептид описывается следующей формулой
NH2-S3-S2-X1-S1-S0-COOH
где
X1 содержит либо произвольно составленную аминокислотную последовательность, либо аминокислотную последовательность, полученную из первого полипептида,
S2 и S1 представляют собой неперекрывающиеся аминокислотные последовательности, полученные из второго полипептида,
S3 и S0 либо отсутствуют, либо представляют собой неперекрывающиеся аминокислотные последовательности, полученные из третьего полипептида, и
- обозначает пептидную связь,
где второй полипептид и третий полипептид отличаются друг от друга и представляют собой полипептиды, обладающие активностью пептидил-пролил цис/транс-изомеразы (активность PPI) или полученные из полипептидов семейства, имеющих домен FKBP.
В одном воплощении всех аспектов данного описания второй полипептид и третий полипептид и четвертый полипептид происходят из различных биологических видов.
В одном воплощении всех аспектов данного описания второй полипептид представляет собой человеческий полипептид или растительный полипептид или бактериальный полипептид или полипептид архебактерий.
В одном воплощении всех аспектов данного описания третий полипептид представляет собой человеческий полипептид или бактериальный полипептид или полипептид архебактерий.
В одном воплощении всех аспектов данного описания четвертый полипептид представляет собой бактериальный полипептид или полипептид архебактерий.
В одном воплощении всех аспектов данного описания четвертый полипептид представляет собой бактериальный полипептид. В одном воплощении бактериальный полипептид представляет собой полипептид термофильных бактерий. В одном воплощении термофиль относится к семейству Thermaceae. В одном воплощении термофил представляет собой Thermus thermophilus.
В одном воплощении всех аспектов данного описания четвертый полипептид представляет собой полипептид архебактерий. В одном воплощении полипептид архебактерий представляет собой полипептид гипертермофильных архебактерий. В одном воплощении термофил относится к классу Thermococci. В одном воплощении организм архебактерий представляет собой Thermococcus gammatolerans.
В одном воплощении всех аспектов данного описания оптимальная температура роста термофила составляет по меньшей мере 60°С.
В одном воплощении всех аспектов данного описания первый полипептид представляет собой человеческий полипептид.
В одном воплощении всех аспектов данного описания X1 либо представляет собой произвольно составленную аминокислотную последовательность, либо аминокислотную последовательность, полученную из первого полипептида, где на N-конце добавлен дипептид GS и на С-конце добавлен трипептид GSS.
В одном воплощении всех аспектов данного описания X1 представляет собой полипептид согласно формуле III

где Х0 либо представляет собой произвольно составленную аминокислотную последовательность, либо аминокислотную последовательность первого полипептида, и
где каждый из Xa до Xh обозначает аминокислотный остаток (естественного происхождения) и любой из Xa-h в отдельности может присутствовать или отсутствовать.
В одном воплощении всех аспектов данного описания X1 представляет собой полипептид, выбранный из группы, представленной формулами с IV по XIII,

где Х0 либо представляет собой произвольно составленную аминокислотную последовательность, либо аминокислотную последовательность, полученную из первого полипептида.
В одном воплощении Х0 по N- и С-концам фланкирован отдельными (одиночными) остатками цистеина.
В одном воплощении X1 содержит остаток цистеина в составе N-концевых аминокислотных остатков и остаток цистеина в составе C-концевых аминокислотных остатков. В одном воплощении N- или C-концевые аминокислотные остатки составляют восемь концевых остатков. В одном воплощении X1 содержит один остаток цистеина на своем N-конце и один остаток цистеина на своем С-конце.
В одном воплощении X1 представляет собой замкнутый в кольцо полипептид с ограниченной конформационной свободой.
В одном воплощении X1 представляет собой замкнутый в кольцо полипептид.
В одном воплощении расстояние между альфа-углеродными атомами остатков цистеина X1 составляет от 4,3 ангстрема до 6,5 ангстрема. В одном воплощении расстояние между альфа-углеродными атомами остатков цистеина X1 составляет 4,5 ангстрема. В одном воплощении среднее расстояние между альфа-углеродными атомами остатков цистеина X1 составляет 5,6 ангстрема.
В одном воплощении всех аспектов данного описания X1 или Х0 имеют размер, составляющий от 4 до приблизительно 500 аминокислотных остатков.
В одном воплощении всех аспектов данного описания Х2 представляет собой линкерную аминокислотную последовательность, имеющую приблизительно от 10 до приблизительно 30 аминокислотных остатков.
В одном воплощении всех аспектов данного описания второй полипептид представляет собой FKBP13 Arabidopsis thaliana (SEQ ID NO:01), или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, при этом S4, X2, S3 и S0 отсутствуют. В одном воплощении S2 имеет аминокислотную последовательность SEQ ID NO:02 (DRGAGC), a S1 имеет аминокислотную последовательность SEQ ID NO:03 (CLIPPASV), при этом S4, X2, S3 и S0 отсутствуют. В одном воплощении S2 имеет аминокислотную последовательность SEQ ID NO:04, при этом S1 имеет аминокислотную последовательность SEQ ID NO:05, S4, X2, S3, при этом 8о отсутствует, а X1 представляет собой полипептид согласно формуле IV (GS-X0-GSS).
В одном воплощении всех аспектов данного описания второй полипептид представляет собой человеческий FKBP12 (SEQ ID NO:06), или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, а S4, X2, S3 и S0 отсутствуют. В одном воплощении S2 имеет аминокислотную последовательность SEQ ID NO:07, а S1 имеет аминокислотную последовательность SEQ ID NO:08 (LVFDVELLKLE), a S4, X2, S3 и S0 отсутствуют, а X1 представляет собой полипептид согласно формуле III (GS-X0-GSS) или формуле VI ((P)CG-X0-GC).
В одном воплощении всех аспектов данного описания второй полипептид представляет собой SlyD Thermus thermophilus (SEQ ID NO:09) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, а S4, X2, S3 и S0 отсутствуют. В одном воплощении S2 имеет аминокислотную последовательность SEQ ID NO:10, a S1 имеет аминокислотную последовательность SEQ ID NO:11, а S4, X2, S3 и S0 отсутствуют, a X1 представляет собой полипептид согласно формуле V (AGS-X0-GSS) или формуле VI ((P)CG-X0-GC).
В одном воплощении всех аспектов данного описания второй полипептид представляет собой FKBP13 Arabidopsis thaliana (SEQ ID NO:01), или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, а третий полипептид представляет собой человеческий FKBP12 (SEQ ID NO:06) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, а S4 и Х2 отсутствуют. В одном воплощении S3 имеет аминокислотную последовательность SEQ ID NO:07, S2 имеет аминокислотную последовательность SEQ ID NO:02 (DRGAGC), S1 имеет аминокислотную последовательность SEQ ID NO:03 (CLIPPASV), S0 имеет аминокислотную последовательность SEQ ID NO:08 (LVFDVELLKLE), S4 и X2 отсутствуют, а X1 представляет собой полипептид согласно формуле IV (GS-X0-GSS) или формуле VI ((P)CG-X0-GC).
В одном воплощении всех аспектов данного описания второй полипептид представляет собой FKBP13 Arabidopsis thaliana (SEQ ID NO:01) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, а третий полипептид представляет собой SlyD Thermus thermophilus (SEQ ID NO:09) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, а S4 и Х2 отсутствуют. В одном воплощении S3 имеет аминокислотную последовательность SEQ ID NO:10, S2 имеет аминокислотную последовательность SEQ ID NO:02 (DRGAGC), S1 имеет аминокислотную последовательность SEQ ID NO:03 (CLIPPASV), S0 имеет аминокислотную последовательность SEQ ID NO:11 (LVFDVELLKLE), S4 и Х2 отсутствуют, a X1 представляет собой полипептид согласно формуле IV (GS-X0-GSS) или формуле VI ((P)CG-X0-GC).
В одном воплощении всех аспектов данного описания второй полипептид представляет собой FKBP13 Arabidopsis thaliana (SEQ ID NO:01) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, а третий полипептид представляет собой человеческий FKBP12 (SEQ ID NO:06) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, а S4 и X2 отсутствуют. В одном воплощении S3 имеет аминокислотную последовательность SEQ ID NO:07, S2 имеет аминокислотную последовательность SEQ ID NO:02 (DRGAGC), S1 имеет аминокислотную последовательность SEQ ID NO:03 (CLIPPASV), S0 имеет аминокислотную последовательность SEQ ID NO:08 (LVFDVELLKLE), S4 и Х2 отсутствуют, а X1 представляет собой полипептид согласно формуле IV (GS-X0-GSS) или формуле VI ((P)CG-X0-GC).
В одном воплощении всех аспектов данного описания второй полипептид представляет собой FKBP13 Arabidopsis thaliana (SEQ ID NO:01) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, третий полипептид представляет собой человеческий FKBP12 (SEQ ID NO:06) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, а четвертый полипептид представляет собой SlyD E.coli (SEQ ID NO:12) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%. В одном воплощении S4 имеет аминокислотную последовательность SEQ ID N0:12, Х2 имеет аминокислотную последовательность SEQ ID NO:13, S3 имеет аминокислотную последовательность SEQ ID NO:07, S2 имеет аминокислотную последовательность SEQ ID NO:02 (DRGAGC), S1 имеет аминокислотную последовательность SEQ ID NO:03 (CLIPPASV), S0 имеет аминокислотную последовательность SEQ ID NO:08 (LVFDVELLKLE), a X1 представляет собой полипептид согласно формуле IV (GS-X0-GSS) или формуле VI ((P)CG-X0-GC).
В одном воплощении всех аспектов данного описания второй полипептид представляет собой FKBP13 Arabidopsis thaliana (SEQ ID NO:01) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, третий полипептид представляет собой SlyD Thermus thermophilus (SEQ ID NO:09) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, а четвертый полипептид представляет собой SlyD E.coli (SEQ ID NO:12), или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%. В одном воплощении S4 имеет аминокислотную последовательность SEQ ID N0:12, Х2 имеет аминокислотную последовательность SEQ ID NO:13, S3 имеет аминокислотную последовательность SEQ ID NO:10, S2 имеет аминокислотную последовательность SEQ ID NO:02 (DRGAGC), S1 имеет аминокислотную последовательность SEQ ID NO:03 (CLIPPASV), S0 имеет аминокислотную последовательность SEQ ID NO:11 (LVFDVELLKLE), a X1 представляет собой полипептид согласно формуле IV (GS-X0-GSS) или формуле VI ((P)CG-X0-GC).
В одном воплощении всех аспектов данного описания второй полипептид представляет собой SlyD Thermus thermophilus (SEQ ID NO:09) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, а четвертый полипептид представляет собой SlyD E.coli (SEQ ID NO:12) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, a S3 и S0 отсутствуют. В одном воплощении S4 имеет аминокислотную последовательность SEQ ID NO:12, Х2 имеет аминокислотную последовательность SEQ ID NO:13, S2 имеет аминокислотную последовательность SEQ ID NO:10, S1 имеет аминокислотную последовательность SEQ ID NO:11, S3 и S0 отсутствуют, a X1 представляет собой полипептид согласно формуле V (AGS-X0-GSS) или формуле VI ((P)CG-X0-GC).
В одном воплощении всех аспектов данного описания второй полипептид представляет собой FKBP13 Arabidopsis thaliana (SEQ ID NO:01) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, а четвертый полипептид представляет собой SlyD E.coli (SEQ ID NO:12) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, a S3 и S0 отсутствуют. В одном воплощении S4 имеет аминокислотную последовательность SEQ ID NO:12, Х2 имеет аминокислотную последовательность SEQ ID NO:13, S2 имеет аминокислотную последовательность SEQ ID NO:04, S1 имеет аминокислотную последовательность SEQ ID NO:05, S3 и S0 отсутствуют, а X1 представляет собой полипептид согласно формуле IV (GS-X0-GSS) или формуле VI ((P)CG-X0-GC).
В одном воплощении всех аспектов данного описания второй полипептид представляет собой SlyD Thermococcus gammatolerans (SEQ ID NO:106) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, a S4, X2, S3 и S0 отсутствуют. В одном воплощении S2 имеет аминокислотную последовательность SEQ ID NO:107, S1 имеет аминокислотную последовательность SEQ ID NO:108, S4, X2, S3 и S0 отсутствуют, а X1 представляет собой полипептид, выбранный из формул с IV по XIII.
В одном воплощении всех аспектов данного описания второй полипептид представляет собой FKBP13 Arabidopsis thaliana (SEQ ID NO:01) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, а третий полипептид представляет собой SlyD Thermococcus gammatolerans (SEQ ID NO:106) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, а S4 и Х2 отсутствуют. В одном воплощении Sa имеет аминокислотную последовательность SEQ ID NO:107, S2 имеет аминокислотную последовательность SEQ ID NO:02 (DRGAGC), S1 имеет аминокислотную последовательность SEQ ID NO:03 (CLIPPASV), S0 имеет аминокислотную последовательность SEQ ID NO:108, S4 и Х2 отсутствуют, a X1 представляет собой полипептид, выбранный из формул с IV по XIII.
В одном воплощении всех аспектов данного описания второй полипептид представляет собой FKBP13 Arabidopsis thaliana (SEQ ID NO:01) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, третий полипептид представляет собой человеческий FKBP12 (SEQ ID NO:06) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, а четвертый полипептид представляет собой SlyD Thermococcus gammatolerans (SEQ ID NO:106) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%. В одном воплощении S4 имеет аминокислотную последовательность SEQ ID NO:106, Х2 имеет аминокислотную последовательность SEQ ID NO:13, S3 имеет аминокислотную последовательность SEQ ID NO:07, S2 имеет аминокислотную последовательность SEQ ID NO:02 (DRGAGC), S1 имеет аминокислотную последовательность SEQ ID NO:03 (CLIPPASV), S0 имеет аминокислотную последовательность SEQ ID NO:08 (LVFDVELLKLE), a X1 представляет собой полипептид, выбранный из формул с IV по XIII.
В одном воплощении всех аспектов данного описания второй полипептид представляет собой FKBP13 Arabidopsis thaliana (SEQ ID NO:01) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, третий полипептид представляет собой SlyD Thermococcus gammatolerans (SEQ ID NO:106) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, а четвертый полипептид представляет собой E.coli SlyD (SEQ ID NO:12), или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%. В определенном воплощении S4 имеет аминокислотную последовательность SEQ ID NO:12, X2 имеет аминокислотную последовательность SEQ ID NO:13, S3 имеет аминокислотную последовательность of SEQ ID NO:107, S2 имеет аминокислотную последовательность SEQ ID NO:02 (DRGAGC), S1 имеет аминокислотную последовательность SEQ ID NO:03 (CLIPPASV), S0 имеет аминокислотную последовательность SEQ ID NO:108, a X1 представляет собой полипептид, выбранный из формул с IV по XIII.
В одном воплощении всех аспектов данного описания второй полипептид представляет собой SlyD Thermococcus gammatolerans (SEQ ID NO:106) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, а четвертый полипептид представляет собой SlyD E.coli (SEQ ID NO:12), или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, a S3 и S0 отсутствуют. В одном воплощении S4 имеет аминокислотную последовательность SEQ ID NO:12, Х2 имеет аминокислотную последовательность SEQ ID NO:13, S2 имеет аминокислотную последовательность SEQ ID NO:107, S1 имеет аминокислотную последовательность SEQ ID NO:108, S3 и S0 отсутствуют, а X1 представляет собой полипептид, выбранный из формул с IV по XIII.
В одном воплощении всех аспектов данного описания второй полипептид представляет собой FKBP13 Arabidopsis thaliana (SEQ ID NO:01) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, а четвертый полипептид представляет собой SlyD Thermococcus gammatolerans (SEQ ID NO:106) или полипептид с аминокислотной последовательностью, идентичной по меньшей мере на 70%, или по меньшей мере на 80%, или по меньшей мере на 90%, или по меньшей мере на 95%, или по меньшей мере на 98%, a S3 и S0 отсутствуют. В одном воплощении S4 имеет аминокислотную последовательность SEQ ID NO:107, Х2 имеет аминокислотную последовательность SEQ ID NO:13, S2 имеет аминокислотную последовательность SEQ ID NO:04, S1 имеет аминокислотную последовательность SEQ ID NO:05, S3 и S0 отсутствуют, a X1 представляет собой полипептид, выбранный из формул с IV по XIII.
Гибридные полипептиды в аспектах данного описания имеют множество применений, поскольку их можно получать рекомбинантным способом с хорошим выходом, например, в E.coli. Например, гибридные полипептиды можно применять для презентирования аминокислотных последовательностей для иммунизации, получения антител, скрининга антител, картирования эпитопов антител или иммуногистохимического скрининга.
В одном воплощении всех аспектов данного описания Хз имеет аминокислотную последовательность GGGSGGGSGGGSGGGSGGGSGGG (SEQ ID NO:14).
В одном воплощении всех аспектов данного описания X1 имеет аминокислотную последовательность GGGSGGNPX0GPTGGGS (SEQ ID NO:32), где X0 представляет собой аминокислотную последовательность размером от 4 до 85 аминокислотных остатков.
В одном воплощении гибридный полипептид, содержащий аминокислотные последовательности SlyD E.coli и человеческого FKBP12, применяют для презентирования полипептидов с нестабильной конформацией.
В одном воплощении гибридный полипептид, содержащий аминокислотные последовательности человеческого FKBP12 и FKBP13 Arabidopsis thaliana, или только SlyD Thermus thermophilus, или SlyD Thermus thermophilus и FKBP13 Arabidopsis thaliana, или только SlyD Thermococcus gammatolerans, или SlyD Thermococcus gammatolerans и FKBP13 Arabidopsis thaliana, применяют для презентирования стабильных вторичных структур.
Один аспект данного описания представляет собой применение гибридного полипептида согласно данному описанию для индукции у животного иммунного ответа против X1 или Х0.
Один аспект данного описания представляет собой способ индукции у животного иммунного ответа против полипептида, включающий этап введения животному гибридного полипептида согласно данному описанию, по меньшей мере однократно, при этом Х0 представляет собой иммуногенную аминокислотную последовательность.
Один аспект данного описания представляет собой способ получения нуклеиновой кислоты, кодирующей антитело, специфически связывающееся с целевым антигеном, включающий следующие этапы:
a) по меньшей мере однократное введение животному гибридного полипептида согласно данному описанию, у которого аминокислотная последовательность X1 содержит аминокислотную последовательность целевого антигена,
b) выделение В-клеток животного продуцирующих антитело, специфически связывающееся с целевым антигеном, через 3-10 дней после последнего введения полипептида, и
c) получение из В-клеток нуклеиновой кислоты, кодирующей антитело, специфически связывающееся с целевым антигеном.
Один аспект данного описания представляет собой способ получения антитела, специфически связывающегося с целевым антигеном, включающий следующие этапы:
a) по меньшей мере однократное введение животному гибридного полипептида согласно данному описанию, у которого аминокислотная последовательность X1 содержит аминокислотную последовательность целевого антигена,
b) выделение В-клеток животного, продуцирующих антитело, специфически связывающееся с целевым антигеном, через 3-10 дней после последнего введения полипептида,
c) возможно, получение из В-клеток нуклеиновой кислоты, кодирующей антитело, специфически связывающееся с целевым антигеном, и
d) культивирование клеток, содержащих нуклеиновую кислоту, кодирующую антитело, специфически связывающееся с целевым антигеном, и выделение антитела из клеток или среды, в которой их культивировали, с получением антитела, специфически связывающегося с целевым антигеном.
Один аспект данного описания представляет собой способ получения антитела, специфически связывающегося с целевым антигеном, включающий следующие этапы:
a) выделение В-клеток экспериментального животного, продуцирующих антитело, специфически связывающееся с целевым антигеном, которое имеет аминокислотную последовательность Х0, после введения гибридного полипептида согласно данному описанию, и
b) культивирование клеток, содержащих нуклеиновую кислоту, кодирующую антитело, специфически связывающееся с аминокислотной последовательностью Х0, и выделение антитела из клеток или среды, в которой их культивировали, с получением антитела специфически связывающегося с целевым антигеном.
Один аспект данного описания представляет собой применение гибридного полипептида согласно данному описанию для картирования эпитопов, при этом аминокислотная последовательность X1 содержит эпитоп.
Один аспект данного описания представляет собой способ отбора антитела, специфически связывающегося с целевым антигеном, включающий следующие этапы:
a) определение аффинности связывания множества антител с целевым антигеном, при этом аминокислотная последовательность X1 гибридного полипептида согласно данному описанию содержит аминокислотную последовательность целевого антигена,
b) отбор антител, у которых наблюдаемая стабильность комплекса превышает заданный пороговый уровень.
Один аспект данного описания представляет собой способ отбора антитела, подходящего для иммуногистохимического исследования целевого полипептида, включающий следующие этапы:
а) определение кинетики связывания множества антител,
с) отбор антител, у которых наблюдаемая стабильность комплекса превышает заданный пороговый уровень.
Один аспект данного описания представляет собой способ картирования сайта связывания антитела с целевой аминокислотной последовательностью, включающий следующие этапы:
а) приведение в контакт антитела с твердым носителем, на котором иммобилизован гибридный полипептид согласно данному описанию, у которого аминокислотная последовательность X1 содержит целевую аминокислотную последовательность,
b) определение кинетики взаимодействия антитела с гибридным полипептидом согласно данному описанию,
c) отбор антител, у которых наблюдаемая стабильность комплекса превышает заданный пороговый уровень.
Один аспект данного описания представляет собой применение гибридного полипептида согласно данному описанию для определения зависимости между структурой и функцией, при этом аминокислотная последовательность X1 содержит полипептид, для которого необходимо определить зависимость между структурой и функцией.
Один аспект данного описания представляет собой применение гибридного полипептида согласно данному описанию, у которого аминокислотная последовательность X1 содержит полипептид, для презентирования полипептида, имеющего правильную вторичную и/или третичную структуру.
Один аспект данного описания представляет собой применение гибридного полипептида согласно данному описанию в скрининговом способе.
В одном воплощении скрининговый способ представляет собой скрининговый способ для идентификации или отбора молекул, специфически связывающихся с X1. В одном воплощении молекула представляет собой низкомолекулярное соединение или полипептид. В одном воплощении полипептид представляет собой антитело или фрагмент антитела, или полипептид, гибридизованный с антителом.
Один аспект данного описания представляет собой применение гибридного полипептида согласно данному описанию для рибосомного дисплея.
Один аспект данного описания представляет собой применение гибридного полипептида согласно данному описанию для фагового дисплея.
Один аспект данного описания представляет собой применение полипептида согласно данному описанию для клеточного дисплея. В одном воплощении клетка представляет собой прокариотическую клетку. В одном воплощении прокариотическая клетка представляет собой бактериальную клетку. В одном воплощении клетка представляет собой эукариотическую клетку. В одном воплощении эукариотическая клетка представляет собой клетку СНО, или клетку HEK, или клетку BHK, или клетку Sp2/0, или клетку NS0, или дрожжевую клетку.
Один аспект данного описания представляет собой антитело, полученное способом согласно данному описанию.
Один аспект данного описания представляет собой фармацевтическую композицию, содержащую гибридный полипептид согласно данному описанию и фармацевтически приемлемый носитель.
Один аспект данного описания представляет собой диагностическую композицию, содержащую гибридный полипептид согласно данному описанию, конъюгированный с детектируемой меткой.
Один аспект данного описания представляет собой применение гибридного полипептида согласно данному описанию для изготовления лекарства.
Один аспект данного описания представляет собой применение гибридного полипептида согласно данному описанию для лечения заболевания.
Один аспект данного описания представляет собой способ лечения индивида, включающий введение индивиду эффективного количества гибридного полипептида согласно данному описанию.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Как правило, антиген или антигенная или иммуногенная аминокислотная последовательность, например, входящая в состав аминокислотной последовательности X1, встроена вместо IF-домена (от англ. «insert-in-flap») участка SlyD второго полипептида в составе гибридного полипептида согласно данному описанию.
В одном воплощении всех аспектов данного описания Х0 выбран из фрагмента полипептида естественного происхождения или представляет собой рандомизированную аминокислотную последовательность. В одном воплощении полипептид естественного происхождения представляет собой человеческий полипептид.
Гибридный полипептид, содержащий аминокислотную последовательность X1, можно, с одной стороны, применять для иммунизации животных для получения антител, а с другой стороны, для скрининга библиотек антител, полученных путем рандомизации или в результате иммунизации. Способность к специфическому связыванию можно также выявлять при помощи любого способа скрининга и дисплея, такого как, рибосомный дисплей, фаговый дисплей, клеточный дисплей, вирусный дисплей и дисплея с использованием гибридного полипептида согласно данному описанию.
SlyD Thermus thermophilus, а также SlyD Thermococcus gammadurans являются высоко стабильными белками, обладающими способностью к обратимому фолдингу даже при замене их Flap домена чужеродной аминокислотной вставкой Х1. Эти молекулы можно применять в рибосомном дисплее, по существу согласно методу roc. Natl. Acad. Sci USA 91 (1994) 9022-9026) для экспонирования полипептидной последовательности Х1 в рамках SlyD Thermus thermophilus или SlyD Thermococcus gammadurans. Так называемый тройной комплекс состоит из (1) рибосомальных субъединиц, присоединенных к (2) мРНК, кодирующей генетическую информацию (3) представленного на рибосоме гибридного полипептида.
Тройные комплексы можно применять для сортировки антител или фрагментов антител, специфически распознающих аминокислотную последовательность Х1.
Гибридный полипептид согласно данному описанию можно применять для скрининга/отбора антител, полученных при иммунизации животных с применением гибридного полипептида согласно данному описанию, где гибридный полипептид, применявшийся для иммунизации животного, и гибридный полипептид, применявшийся для скрининга полученных антител, имеют идентичную аминокислотную последовательность X1, а остальные части их аминокислотных последовательностей различны. Это позволяет проводить отбраковку антител, специфически связывающихся с каркасом, а не с иммуногенным пептидом X1.
В одном воплощении гибридный полипептид, применявшийся для иммунизации, и гибридный полипептид, применявшийся для скрининга, имеют последовательности идентичные менее чем на 20%. В одном воплощении последовательности идентичны менее чем на 10%.
В качестве одного аспекта здесь описан гибридный полипептид, содержащий на своем N-конце N-концевой фрагмент полипептида SlyD Thermus thermophilus (SEQ ID NO:10), т.е. остатки от 2 до 64 полипептида SlyD Thermus thermophilus (нумерация начинается с М как первого остатка SEQ ID NO:09). После него следует вставка иммуногенной последовательности, содержащейся в X1. С-конец гибридного полипептида образован аминокислотными остатками от 123 до 149 полипептида SlyD Thermus thermophilus (SEQ ID NO:11) и, как вариант, меткой, позволяющей осуществлять очистку, имеющей аминокислотную последовательность GSRKHHHHHHHH (SEQ ID NO:16).
В качестве одного аспекта здесь описан гибридный полипептид, содержащий на своем N-конце N-концевой фрагмент полипептида SlyD Thermococcus gammatolerans (SEQ ID NO:106), т.е. остатки от 2 до 85 полипептида SlyD Thermococcus gammatolerans (нумерация начинается с М как первого остатка SEQ ID NO:107). После него следует вставка иммуногенной последовательности, содержащейся в X1. С-конец гибридного полипептида образован аминокислотными остатками от 137 до 156 полипептида SlyD Thermococcus gammatolerans (SEQ ID NO:108) и, как вариант, меткой, позволяющей осуществлять очистку, имеющей аминокислотную последовательность GSRKHHHHHHHH (SEQ ID NO:16).
В качестве одного аспекта здесь описан полипептид, содержащий на своем N-конце N-концевой фрагмент полипептида SlyD E.coli, т.е. остатки от 1 до 165 of the полипептида SlyD E.coli (нумерация начинается с М как первого остатка). После него следует вставка линкера, соединяющего С-конец фрагмента SlyD E.coli с фрагментом N-концевой части человеческого полипептида FKBP12, т.е. остатками от 2 до 84 человеческого полипептида FKBP12 (нумерация начинается с М как первого остатка). После него может следовать вставка аминокислотной последовательности, содержащая от 5 до 500 аминокислотных остатков. С-конец полипептида образован аминокислотными остатками от 97 до человеческого полипептида FKBP12 и меткой, позволяющей осуществлять очистку, имеющей аминокислотную последовательность GSRKHHHHHHHH (SEQ ID NO:16).
Одним аспектом согласно данному описанию является вариант гибридного полипептида согласно данному описанию, который имеет аминокислотную последовательность идентичную по меньшей мере на 70% с родительским полипептидом, и более высокую температуру плавления по сравнению с родительским полипептидом. В одном воплощении температура плавления составляет по меньшей мере 55°С. В одном воплощении температура плавления составляет по меньшей мере 60°С. В одном воплощении температура плавления составляет по меньшей мере 65°С.
Термин "полученный на основе полипептида" означает, что имеется фрагмент полноразмерной аминокислотной последовательности соответствующего полипептида, причем аминокислотная последовательность фрагмента идентична по меньшей мере на 70% соответствующей последовательности полноразмерного полипептида.
Аминокислотные последовательности X1 и Х0, соответственно, могут быть выбраны произвольно, но при этом их размер должен составлять по меньшей мере 5 аминокислотных остатков. Например, встраиваемая последовательность может быть получена на основе, т.е. может содержать фрагмент лейкоцитарных маркеров CD2, CD3, CD4, CD5, CD6, CD7, CD8, CD11a,b,c, CD13, CD14, CD18, CD19, CD20, CD22, CD23, CD27 и его лиганда, CD28 и его лигандов В7.1, В7.2, В7.3, CD29 и его лиганда, CD30 и его лиганда, CD40 и его лиганда gp39, CD44, CD45 и его изоформ, CDw52 (антигена Campath), CD56, CD58, CD69, CD72, CTLA-4, LFA-1 и TCR; антигенов гистосовместимости МНС класса I или II, антигенов Lewis Y, SLex, SLey, SLea, и SLeb; интегринов VLA-1, VLA-2, VLA-3, VLA-4, VLA-5, VLA-6, αVβ3, и LFA-1, Мас-1, и pI50,95, αVβ1, gpIIbIIIa, αR β3, α6β4, αVβ 5, αVβ6, и αV 62 7; селектинов L-селектина, Р-селектина и Е-селектина и их рецепторов VCAM-1, ICAM-1, ICAM-2, и LFA-3; интерлейкинов IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, и IL-15; интерлейкиновых рецепторов, выбранных из группы, состоящей из IL-1R, IL-2R, IL-3R, IL-4R, IL-5R, IL-6R, IL-7R, IL-8R, IL-9R, IL-10R, IL-11R, IL-12R, IL-13R, IL-14R, и IL-15R; хемокинов, выбранных из группы, состоящей из PF4, RANTES, MIP1α, MCP1, NAP-2, Groα, Groβ, и IL-8; факторов роста, выбранных из группы, состоящей из TNFalpha, TGFbeta, TSH, VEGF/VPF, VEGFA, VEGFB, VEGF111, VEGF121, VEGF165, VEGF189, VEGF206, PTHrP, семейства EGF, FGF, семейства PDGF, эндотелина, фиброзина (FSF-1), человеческого ламинина и гастрин-высвобождающего пептида (GRP), PLGF, HGH, HGHR; рецепторов факторов роста, выбранных из группы, состоящей из TNFαR, RGFβR, TSHR, VEGFR/VPFR, FGFR, EGFR, PTHrPR, семейства PDGFR, EPO-R, GCSF-R и других гемопоэтических рецепторов; интерфероновых рецепторов, выбранных из группы, состоящей из IFNCαR, IFNβR, и IFNλR; иммуноглобулина и его рецепторов, выбранных из группы, состоящей из IgE, FcγRI, и FcγRII; опухолевых антигенов, выбранных из группы, состоящей из her2-neu, муцина, СЕА и эндосиалина; аллергенов, выбранных из группы, состоящей из антигена клеща домашней пыли, антигенов lol р1 (травы) и урушиола; вирусных полипептидов, выбранных из группы, состоящей из гликопротеинов ЦМВ В, Н, и gCIII, гликопротеинов оболочки ВИЧ-1, гликопротеинов оболочки РСВ, гликопротеинов оболочки ВПГ, гликопротеинов оболочки ВПЧ, поверхностных антигенов семейства вирусов гепатита; токсинов, выбранных из группы, состоящей из эндотоксина pseudomonas и остеопонтина/уропонтина, конотоксина пчелиного яда, змеиного яда и яда паука; факторов крови, выбранных из группы, состоящей из компонента комплемента C3b, компонента комплемента С4а, компонента комплемента C4b-9, Rh фактора, фибриногена, фибрина и миелин-ассоциированного ингибитора роста; и ферментов, выбранных из группы, состоящей из полипептида, переносящего эфиры холестерина, мембрано-связанных матриксных металлопротеаз и декарбоксилазы глутаминовой кислоты (GAD).
Термин "пептидная линкерная последовательность" означает пептидные линкеры естественного и/или синтетического происхождения. Они состоят из линейной цепочки аминокислот, где мономерными строительными блоками являются 20 аминокислот природного происхождения. Цепочка имеет длину от 10 до 50 аминокислот, в частности, от 10 до 30 аминокислот. Линкер может содержать повторяющиеся аминокислотные последовательности или последовательности полипептидов естественного происхождения, таких как полипептиды, выполняющие шарнирную функцию. В одном воплощении аминокислотная последовательность пептидного линкера представляет собой "аминокислотную последовательность синтетического линкера" которая богата остатками глицина, глутамина и/или серина. Эти остатки организованы, например, в небольшие повторы, содержащие до пяти аминокислот, такие как GGGGS, QQQQG или SSSSG (SEQ ID NO:17, 18 или 19). Эти небольшие повторы могут повторяться от двух до шести раз с образованием мультимерных единиц. На амино- и/или карбокси-концевых участках мультимерных единиц может находиться до шести дополнительных произвольно выбранных аминокислот естественного происхождения. Другие синтетические пептидные линкеры состоят из единственной аминокислоты, повторяющейся от 10 до 20 раз и могут содержать на амино- и/или карбокси-концевом участке до шести дополнительных произвольно выбранных аминокислот естественного происхождения, например, таких как серин в линкере GSSSSSSSSSSSSSSSG (SEQ ID NO:20). Аминокислотные последовательности конкретных линкеров указаны в следующей Таблице. В одном воплощении аминокислотная последовательность линкера выбрана из [GQ4]3GNN (SEQ ID NO:21), G3[SG4]2SG (SEQ ID NO:22), G3[SG4]2SG2 (SEQ ID NO:23), (G3S)5GGG (SEQ ID NO:24). Все пептидные линкеры могут кодироваться молекулой нуклеиновой кислоты и, таким образом, могут быть рекомбинантно экспрессированы.
"Процент (%) идентичности аминокислотной последовательности" относительно референсной полипептидной последовательности определяется как процент аминокислотных остатков в кандидатной последовательности, которые идентичны аминокислотным остаткам в референсной полипептидной последовательности после выравнивания последовательностей и расстановки пробелов (гэпов), если это необходимо для достижения наибольшего процента идентичности последовательностей, и без принятия каких-либо консервативных замен за часть идентичной последовательности. Выравнивание в целях определения процента идентичности аминокислотной последовательности может выполняться различными способами, известными в данной области техники, например, с помощью общедоступных компьютерных программ, таких как BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить надлежащие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Для целей настоящего описания, значения % идентичности аминокислотной последовательности получены при помощи компьютерной программы для сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 была разработана в компании Genentech, Inc., исходный код был представлен вместе с пользовательской документацией в бюро по охране авторских прав США, Washington D.C., 20559, где было зарегистрировано авторское право под номером TXU510087. Доступ к программе ALIGN-2 можно получить в компании Genentech, Inc., South San Francisco, California, или код программы может быть скомпилирован на основе исходного кода. Программа ALIGN-2 должна быть скомпилирована для работы на платформе UNIX, включая платформу digital UNIX V4.0D. Все параметры для сравнения последовательностей заданы программой ALIGN-2 и остаются неизменными.
В случаях когда для сравнения аминокислотных последовательностей используется ALIGN-2, процент идентичности заданной аминокислотной последовательности А к последовательности В, с последовательностью В, или по сравнению с заданной аминокислотной последовательностью В (что можно также сформулировать как заданная аминокислотная последовательность А, имеющая или содержащая определенный процент идентичной аминокислотной последовательности к последовательности В, с последовательностью В, или по сравнению с заданной аминокислотной последовательностью В) рассчитывается по формуле:
X/Y×100
где X это число аминокислотных остатков, которые были расценены программой для выравнивания последовательностей ALIGN-2 как абсолютные совпадения при выравнивании А и B в рамках этой программы, и где Y это общее число аминокислотных остатков в B. Следует принимать во внимание, что когда длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, процент идентичности аминокислотной последовательности А с последовательностью В не будет равен проценту идентичности аминокислотной последовательности В с последовательностью А. Если отдельно не указано иначе, все значения % идентичности аминокислотных последовательностей, приведенные здесь, получены согласно описанию в предыдущем параграфе о применении компьютерной программы ALIGN-2.
Термин "животное" означает животное, выбранное из группы, представленной мышью, крысой, кроликом, овцой, кошкой, собакой, хомяком, яванским макаком и шимпанзе. В частности, животное представляет собой мышь или кролика или хомяка или крысу. В одном воплощении животное представляет собой животное, не являющееся человеком.
В одном воплощении термин "выделение" включает a) (i) иммортализацию В-клеток животного, иммунизированного целевым антигеном, и (ii) скрининг полученных иммортализованных клеток по секреции антитела, специфически связывающегося с целевым антигеном, или б) (i) совместное культивирование одиночных В-клеток в присутствии фидерных клеток и (ii) скрининг супернатанта после культивирования на наличие антител, специфически связывающихся с целевым антигеном.
Термин "специфическое связывание с целевым антигеном" означает, что антитело связывается с целевым антигеном с константой диссоциации (=KDiss.), равной по меньшей мере 10-8 моль/л, в частности, с KDiss, равной по меньшей мере 10-10 моль/л. В то же время, способность неспецифически связываться с целевым антигеном выражается KDiss, равной 10-7 моль/л или более, например, 10-5 моль/л.
Термин "фармацевтическая композиция" обозначает препарат, который находится в такой форме, которая обеспечивает эффективную биологическую активность содержащегося в нем активного ингредиента, и не содержит дополнительных компонентов, которые являются неприемлемо токсичными в отношении субъекта, которому препарат будет вводиться.
"Фармацевтически приемлемый носитель" относится к ингредиенту в фармацевтической композиции, отличному от активного ингредиента, который является нетоксичным в отношении субъекта. Фармацевтически приемлемый носитель включает буфер, эксципиент, стабилизатор или консервант, но не ограничивается ими.
Термин "SlyD E.coli" означает полипептид, имеющий следующую аминокислотную последовательность:

Термин "означает полипептид, имеющий следующую аминокислотную последовательность" означает полипептид с заданной аминокислотной последовательностью, а также включает его варианты, имеющие такие же свойства, обусловленные X1, как и полипептид. В одном воплощении термин означает полипептид с аминокислотной последовательностью идентичной по меньшей мере на 70%. В одном воплощении термин означает полипептид с аминокислотной последовательностью идентичной по меньшей мере на 80%. В одном воплощении термин означает полипептид с аминокислотной последовательностью идентичной по меньшей мере на 90%. В одном воплощении термин означает полипептид с аминокислотной последовательностью идентичной по меньшей мере на 95%. В одном воплощении термин означает полипептид с аминокислотной последовательностью идентичной по меньшей мере на 98%.
Если полипептид произведен или получен из E.coli, амино-концевой остаток метионина обычно не эффективно отщепляется протеазами, таким образом, амино-концевой остаток метионина частично присутствует в полученном полипептиде. Для учета этого обстоятельства, все приведенные последовательности начинаются с остатка метионина.
Термин "SlyD Thermus thermophilus" означает полипептид, имеющий следующую аминокислотную последовательность:

Термин "SlyD Thermococcus gammatolerans" означает полипептид, имеющий следующую аминокислотную последовательность:
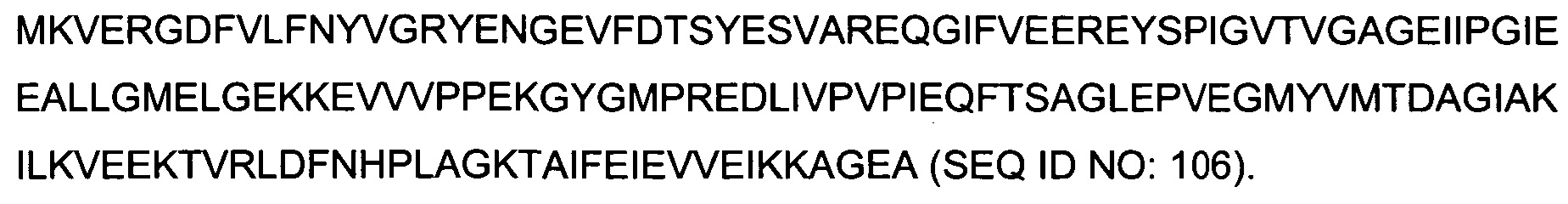
Термин "человеческий FKBP12" означает полипептид, имеющий следующую аминокислотную последовательность:
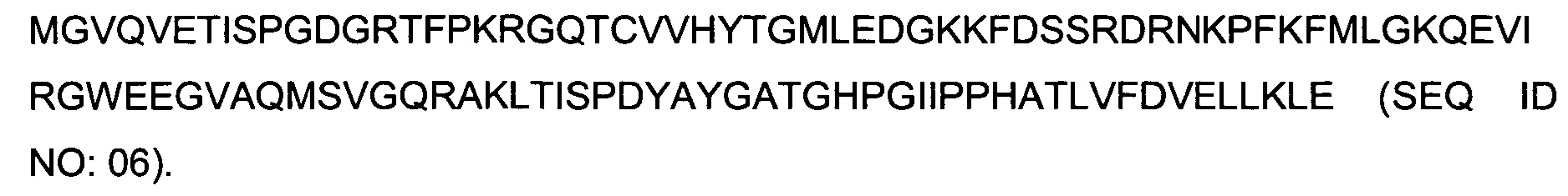
Термин "FKBP13 Arabidopsis thaliana" означает полипептид, имеющий следующую аминокислотную последовательность:
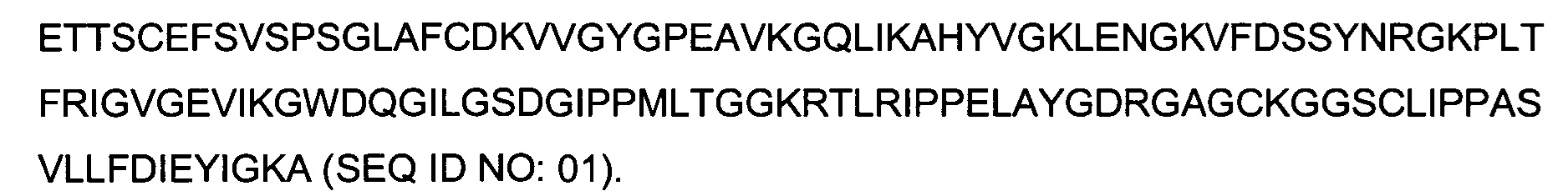
Термин "гибридный полипептид FKBP12" означает полипептид, имеющий следующую аминокислотную последовательность:

где X1 представляет собой аминокислотную последовательность линкера или пептида или антигена или вторичной или третичной структуры, которую должен презентировать гибридный полипептид FKBP12.
Эта аминокислотная последовательность и ее варианты являются отдельными аспектами данного описания.
Термин "гибридный полипептид SlyD-FKBP12" означает полипептид, имеющий следующую аминокислотную последовательность:

где X1 представляет собой аминокислотную последовательность линкера или пептида или антигена или вторичной или третичной структуры, которую должен презентировать гибридный полипептид SlyD-FKBP12, и
где Х2 представляет собой аминокислотную последовательность линкера.
Эта аминокислотная последовательность и ее варианты являются отдельными аспектами данного описания.
Термин "гибридный полипептид FKBP12/13" означает полипептид, имеющий следующую аминокислотную последовательность:

где X1 представляет собой аминокислотную последовательность линкера или пептида или антигена или вторичной или третичной структуры, которую должен презентировать гибридный полипептид FKBP12/13.
Эта аминокислотная последовательность и ее варианты являются отдельными аспектами данного описания.
Термин "гибридный полипептид SlyD-FKBP12/13" означает полипептид, имеющий следующую аминокислотную последовательность:

где X1 представляет собой аминокислотную последовательность линкера или пептида или антигена или вторичной или третичной структуры, которую должен презентировать гибридный полипептид SlyD-FKBP12/13, и
где Х2 представляет собой аминокислотную последовательность линкера.
Эта аминокислотная последовательность и ее варианты являются отдельными аспектами данного описания.
Термин "гибридный полипептид SlyD Thermus thermophilus" означает полипептид, имеющий следующую аминокислотную последовательность:

где X1 представляет собой аминокислотную последовательность линкера или пептида или антигена или вторичной или третичной структуры, которую должен презентировать гибридный полипептид SlyD Thermus thermophilus.
Эта аминокислотная последовательность и ее варианты являются отдельными аспектами данного описания.
Термин "гибридный полипептид SlyD-SlyD Thermus thermophilus" означает полипептид, имеющий следующую аминокислотную последовательность:

где X1 представляет собой аминокислотную последовательность линкера или пептида или антигена или вторичной или третичной структуры, которую должен презентировать гибридный полипептид SlyD-SlyD Thermus thermophilus, и
где Х2 представляет собой аминокислотную последовательность линкера.
Эта аминокислотная последовательность и ее варианты являются отдельными аспектами данного описания.
Термин "гибридный полипептид SlyD Thermococcus gammatolerans" означает полипептид, имеющий следующую аминокислотную последовательность:

где X1 представляет собой аминокислотную последовательность линкера или пептида или антигена или вторичной или третичной структуры, которую должен презентировать гибридный полипептид SlyD Thermococcus gammatolerans.
Эта аминокислотная последовательность и ее варианты являются отдельными аспектами данного описания.
Термин "гибридный полипептид SlyD-SlyD Thermococcus gammatolerans" означает полипептид, имеющий следующую аминокислотную последовательность:

где X1 представляет собой аминокислотную последовательность линкера или пептида или антигена или вторичной или третичной структуры, которую должен презентировать гибридный полипептид SlyD Thermococcus gammatolerans, и
где Х2 представляет собой аминокислотную последовательность линкера.
Эта аминокислотная последовательность и ее варианты являются отдельными аспектами данного описания.
Термин "гибридный полипептид SlyD Thermus thermophilus -FKBP13" означает полипептид, имеющий следующую аминокислотную последовательность:

где X1 представляет собой аминокислотную последовательность линкера или пептида или антигена или вторичной или третичной структуры, которую должен презентировать гибридный полипептид SlyD Thermus thermophilus -FKBP13.
Эта аминокислотная последовательность и ее варианты являются отдельными аспектами данного описания.
Термин "гибридный полипептид SlyD-SlyD Thermus thermophilus-FKBP13" означает полипептид, имеющий следующую аминокислотную последовательность:

где X1 представляет собой аминокислотную последовательность линкера или пептида или антигена или вторичной или третичной структуры, которую должен презентировать гибридный полипептид SlyD-SlyD Thermus thermophilus-FKBP13, и
где X2 представляет собой аминокислотную последовательность линкера.
Эта аминокислотная последовательность и ее варианты являются отдельными аспектами данного описания.
Термин "гибридный полипептид FKBP13 Arabidopsis thaliana" означает полипептид, имеющий следующую аминокислотную последовательность:

где X1 представляет собой аминокислотную последовательность линкера или пептида или антигена или вторичной или третичной структуры, которую должен презентировать гибридный полипептид FKBP13 Arabidopsis thaliana.
Эта аминокислотная последовательность и ее варианты являются отдельными аспектами данного описания.
Термин "гибридный полипептид SlyD-FKBP13 Arabidopsis thaliana" означает полипептид, имеющий следующую аминокислотную последовательность:

где X1 представляет собой аминокислотную последовательность линкера или пептида или антигена или вторичной или третичной структуры, которую должен презентировать гибридный полипептид SlyD-FKBP13 Arabidopsis thaliana, и
где Х2 представляет собой аминокислотную последовательность линкера.
Эта аминокислотная последовательность и ее варианты являются отдельными аспектами данного описания.
Термин "гибридный полипептид SlyD-FKBP12/13" означает полипептид, имеющий следующую аминокислотную последовательность:

где X1 представляет собой аминокислотную последовательность линкера или пептида или антигена или вторичной или третичной структуры, которую должен презентировать гибридный полипептид SlyD-FKBP12/13, и
где X2 представляет собой аминокислотную последовательность линкера.
В одном воплощении вышеперечисленных аспектов Х2 имеет аминокислотную последовательность GGGSGGGSGGGS (SEQ ID NO:13).
При прямом определении детектируемая метка может быть выбрана из любых известных детектируемых маркерных групп, таких как красители, группы с люминесцентными свойствами, такие как хемилюминесцентные группы, например, эфиры акридина или диоксетаны, или флуоресцентные красители, например, флуоресцеин, кумарин, родамин, оксазин, резоруфин, цианин и их производные. Другими примерами детектируемых меток являются люминесцентные комплексы металлов, такие как комплексы рутения или европия, ферменты, например, такие, которые используются в ИФА или в CEDIA (от англ. Cloned Enzyme Donor Immunoassay), и радиоактивные изотопы. Хелатные комплексы металлов, которые можно детектировать при помощи электрохемилюминесценции, в одном воплощении представляют собой группировки, являющиеся источником сигнала, и применяются в качестве детектируемых меток, при этом наибольшее предпочтение отдается хелатным комплексам рутения. В одном воплощении группировка, обеспечивающая введение метки, представляет собой хелатный комплекс (дипиридил)32+ рутения.
Системы непрямого определения включают, например, детектирующий реагент, например, детектирующее антитело, конъюгированное с меткой, которая является первым компонентом связывающейся пары. Примерами подходящих связывающихся пар являются гаптен или антиген/антитело, биотин или аналоги биотина, такие как аминобиотин, иминобиотин или дезтиобиотин/авидин или стрептавидин, углевод/лектин, нуклеиновая кислота или аналог нуклеиновой кислоты/комплементарная нуклеиновая кислота, и рецептор/лиганд, например, рецептор стероидного гормона/стероидный гормон. В одном воплощении первый компонент связывающейся пары выбран из гаптена, антигена и гормона. В одном воплощении гаптен выбран из дигоксина и биотина и его аналогов. Второй компонент такой связывающейся пары, например, антитело, стрептавидин, и т.д., обычно бывает связан с меткой, обеспечивающей прямое определение, например, с метками, перечисленными выше.
Гибридные полипептиды согласно данному описанию созданы на основе полипептидов из семейства белков, имеющих домен FKBP (т.е. белков, обладающих активностью PPI), таких как человеческий FKBP12 (Handschumacher, R.E., et al., Science 226 (1984) 544-547), или FKBP13 Arabidopsis thaliana, или SlyD E.coli, или SlyD Thermos thermophilus, или SlyD Thermococcus gammatolerans. Гибридные полипептиды согласно данному описанию являются каркасом для презентирования полипептидов, содержащихся в аминокислотной последовательности X1.
Аминокислотная последовательность X1 может заменять Flap домен (аминокислотные остатки от А85 до А96) и бета-петлю (аминокислотные остатки от S39 до Р46) в составе участка FKBP12 и/или IF домен (аминокислотные остатки от G69 до D120) в составе участка SlyD. Таким образом, возможно отказаться от занимающего много времени получения и очистки полноразмерных рекомбинантных белковых иммуногенов.
Указанное презентирование встроенных аминокислотных последовательностей и/или относящихся к ним структурных мотивов полипептидов X1 или Х0, соответственно, в гибридном полипептиде согласно данному описанию обеспечивает эффективное и экономически выгодное получение иммуногенных аминокислотных последовательностей, содержащихся в X1 и Х0, соответственно, в достаточном количестве, с достаточным качеством и с обеспечением правильной трехмерной структуры.
Встроены могут быть любые аминокислотные последовательности, такие как спирали, мотивы спираль-изгиб-спираль, суперспирализованные структуры, пучки спиралей, мотивы изгиб-петля, бета-шпилечные структуры, бета-слои, мотивы слой-спираль, мотивы слой-изгиб-слой и т.д. Также возможна презентация определенных нативных третичных структур, отдельных доменов мульти-доменных полипептидов или суб-доменов, связывающих доменов, фрагментов антител, ферментов и т.д.
Иммуногенный полипептид может превосходить полноразмерный полипептид, из которого получены аминокислотные последовательности X1 или Х0, соответственно, например, по растворимости и/или способности к обратимому фолдингу (ренатурации/денатурации). Гибридный полипептид согласно данному описанию обеспечивает каркас, в который встраивают аминокислотные последовательности X1, полученные из полипептида, к которому должно быть получено антитело, и он стабилизирует структуру аминокислотной последовательности X1 и Х0, соответственно, за счет уменьшения конформационной энтропии.
Если в наличии имеется N-концевой SlyD, он опосредует функции шаперона и поддерживает весь гибридный полипептид в виде мономерного растворимого и стабильного полипептида. Кроме того, он увеличивает молекулярный вес гибридного полипептида, что является целесообразным при применении в масс-чувствительных методах анализа, таких как поверхностный плазменный резонанс (SPR).
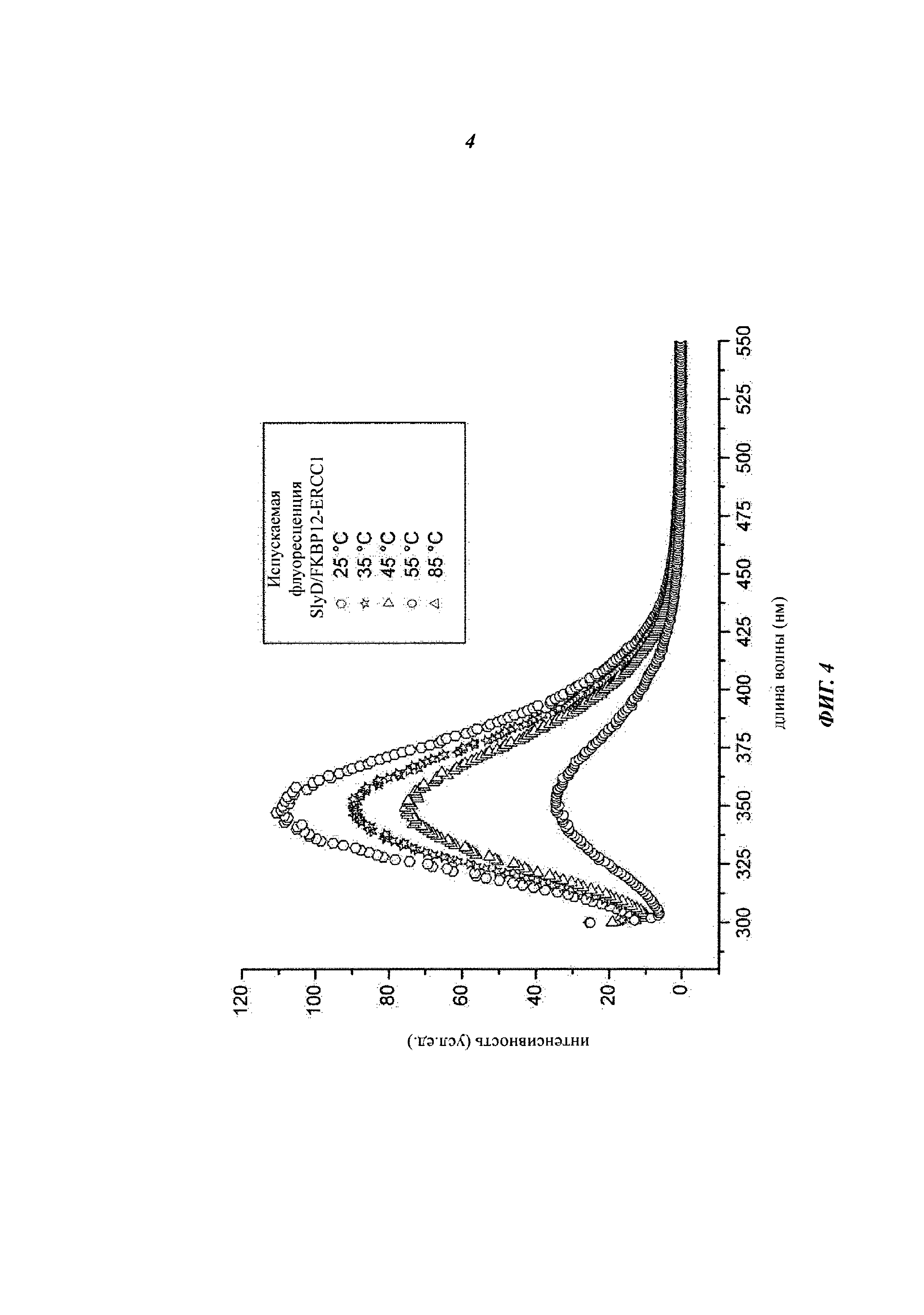
Полипептидная(ые) часть(и) гибридного полипептида, полученная(ые) на базе SlyD, сворачивается в правильную (нативную) трехмерную конформацию независимо от наличия FKBP12 с его flap-областью. Химерный домен FKBP12 гибридного полипептида, по видимому, сворачивается неправильно. В отличие от FKBP12 полипептида дикого типа, у которого пик испускаемой флуоресценции, обусловленной собственным Trp, находится при 320 нм, флуоресцентный спектроскопический анализ гибридного полипептида SlyD-FKBP12 показал отсутствие пика при 320 нм и смещение максимума флуоресценции в область 350 нм, что характерно для Trp, находящегося на поверхности молекулы. Пик при 350 нм расширен. Единственный Trp в составе гибридного полипептида SlyD-FKBP12 обращен к растворителю. Это указывает на то, что FKBP домен в составе гибридного полипептида SlyD-FKBP12 частично или полностью развернут.
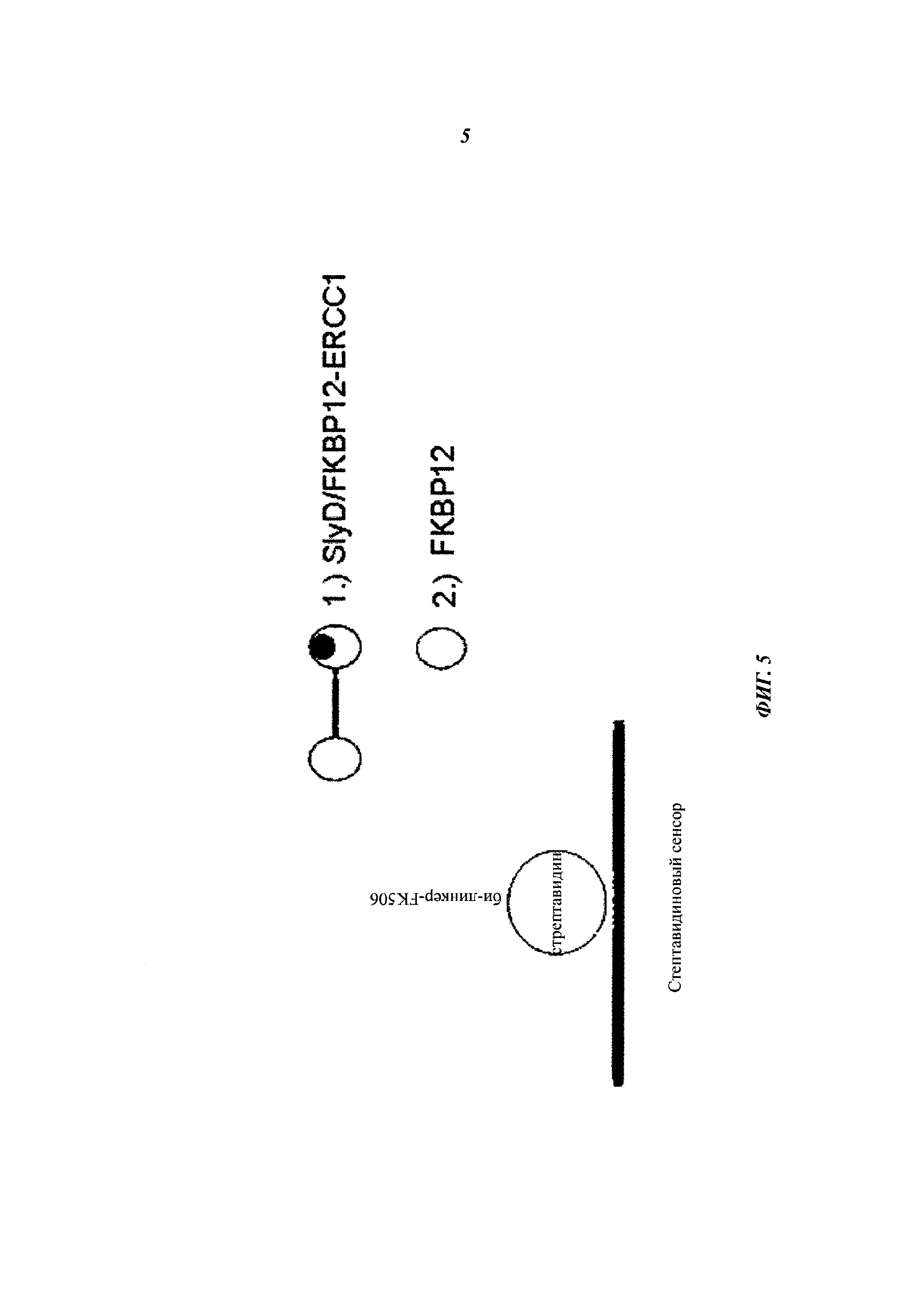
Кроме того, исследование связывания производного гибридного полипептида SlyD-FKBP12 с иммобилизованным би-FK506 с помощью биосенсора BIAcore показало отсутствие связывающей активности, указывающее на нарушение структуры и функции участка полипептида согласно данному описанию, полученного на основе FKBP12.
Основанная на этих наблюдениях, не связанная никакой теорией существующая структурная модель SlyD со вставкой FKBP12 такова, что полипептид состоит из правильно свернутого компонента SlyD и имеющего структурные дефекты FKBP12, у которого по меньшей мере единственный внутренний остаток Trp обращен к растворителю. Полипептид является мономерным, растворимым, способен к обратимому фолдингу и демонстрирует термостабильность достаточную для его применения.
Таким образом, гибридные полипептиды согласно данному описанию являются подходящими каркасами для моделирования структурного разнообразия мотивов вторичных структур пептидов, при условии, что встроенный мотив вторичной структуры пептидов не уложен в виде отдельной автономно сворачивающейся структуры.
Предполагают, что структурное разнообразие мотивов вторичных структур пептидов, например, имеет место в иммуногистохимических экспериментах с фиксированными в формалине и заключенными в парафин образцами ткани (Abe, et al., Anal. Biochem. 318 (2003) 118-123).
Аминокислотные последовательности X1 или X0, соответственно, могут быть фланкированы линкерной последовательностью G3S, обеспечивающей достаточную дистанцию и подвижность для аминокислотной последовательности второго полипептида во избежание влияния на структурную целостность аминокислотной последовательности X1 или X0, соответственно.
Гибридные полипептиды согласно данному описанию имеют молекулярный вес равный по меньшей мере 15 кДа. Это исключает необходимость конъюгирования полипептида с белками (такими как KLH или частицы) или веществами, выполняющими функцию носителей, для иммунизации и уменьшает вероятность возникновения нео-эпитопов при связывании с KLH.
Однако, при необходимости конъюгирования, его возможно осуществить путем избирательной активации остатка лизина в последовательности GSRKHHHHHHHH (SEQ ID NO:16), который можно активировать за счет взаимодействия соседних остатков гистидина и аргинина с LC-SPDP (сукцинимидил 6-(3-[2-пиридилдитио]-пропионамидо)гексаноатом).
Структурная или частичная/полная деформация или образование нео-эпитопов в условиях иммуногистохимического исследования обычно не учитываются при приготовлении белковых иммуногенов. В боковых цепях аминокислотных остатков Lys, Tyr, His, и Cys образуются поперечные связи, особенно при обработке формалином. Кроме того, третичные и четвертичные структуры полипептидов нарушаются в процессе подготовки тканей с применением фиксирующих реагентов, инкубации (с нагреванием), заливке парафином и дегидратации ткани при обработке спиртами (см., например, Fowler, С. В., et al., Lab. Invest. 88 (2008) 785-791). По-прежнему неизвестно, позволяет ли процесс демаскирования антигена полностью удалить поперечные связи, возникшие при обработке формалином, чтобы восстановить нативную конформационную структуру белков. Следовательно, новые вторичные структуры и нео-эпитопы могут сформироваться или сохраниться даже после процесса демаскирования.
Эти новые и не являющиеся нативными структуры отсутствуют в ходе иммунизации. Применение стандартных методов создания антител не позволяет получить или позволяет получить лишь ограниченное количество антител, подходящих для иммуногистохимии.
Кроме того, свободные полипептиды в растворе обладают большой конформационной энтропией, приводящей к возникновению переходных структур, что затрудняет иммунный ответ против определенных эпитопов со вторичной структурой, характеризующейся высокой энтальпией (см. например, Scott, K.A., et al., Proc. Natl. Acad. Sci. USA 104 (2007) 2661-2666; Gamacho, C.J., et al., PLoS Comput. Biol. 4 (2008) e1000231 1-8). Свободные пептиды, применяемые в качестве иммуногенов, могут обеспечить получение антител, направленных только против терминальных участков соответствующего пептида.
Кроме применения для иммунизации животных и развития иммунного ответа гибридные полипептиды согласно данному описанию можно применять для картирования эпитопов антител, таких как линейные или конформационные эпитопы. Аминокислотные последовательности X1 или X0, соответственно, могут презентировать различные структурные мотивы (= эпитоп, антигенная (иммуногенная) аминокислотная последовательность). Эти различные структурные мотивы также можно применять для создания антител, подходящих для иммуногистохимии (ИГХ), специфичных к аминокислотным последовательностям X1 или X0, соответственно. Для этого аминокислотная последовательность X1, выбирается таким образом, чтобы при обработке формалином можно было ожидать формирования только ограниченного количества нео-эпитопов. Выбирая соответствующую последовательность, можно ограничить количество остатков лизина, тирозина, гистидина и цистеина. Также возможно произвести замену отдельных остатков, таких как остатки цистеина, на остатки серина. В качестве последовательности X1 можно использовать, например, небольшие мотивы вторичной структуры, которые с высокой вероятностью будут сворачиваться в структуру с первоначальной конформацией. При пересадке X1 на FKBP домен концы встроенного полипептида уже не будут свободными и доступными, и структурная энтальпия будет повышаться.
Один аспект данного описания представляет собой гибридный полипептид согласно формуле I

где
X1 содержит либо произвольно составленную аминокислотную последовательность, либо аминокислотную последовательность, полученную из первого полипептида,
S2 и S1 представляют собой неперекрывающиеся аминокислотные последовательности, полученные из второго полипептида, и
- обозначает пептидную связь,
где второй полипептид является полипептидом, обладающим активностью пептидил-пролил цис/транс-изомеразы (активность PPI) или представителем семейства белков, имеющих домен FKBP.
В одном воплощении полипептидом, обладающим активностью пептидил-пролил цис/транс-изомеразы, является SlyD.
В одном воплощении второй полипептид представляет собой полипептид термофила.
В одном воплощении термофил представляет собой термофильную бактерию. В одном воплощении термофильная бактерия относится к семейству Thermaceae. В одном воплощении термофил представляет собой Thermus thermophilus.
В одном воплощении термофил представляет собой термофильную архебактерию. В одном воплощении термофильная архебактерия представляют собой гипертермофильную архебактерию. В одном воплощении термофил относится к классу Thermococci. В одном воплощении термофил представляет собой Thermococcus gammatolerans.
В одном воплощении оптимальная температура роста термофила составляет по меньшей мере 60°С.
Один аспект в данном описании представляет собой гибридный полипептид согласно формуле II

где
X1 представляет собой либо произвольно составленную аминокислотную последовательность, либо аминокислотную последовательность, полученную из первого полипептида,
S2 и S1 представляют собой неперекрывающиеся аминокислотные последовательности, полученные из второго полипептида, и
S3 и S0 либо отсутствуют, либо представляют собой неперекрывающиеся аминокислотные последовательности, полученные из третьего полипептида,
S4 либо отсутствует, либо представляет собой аминокислотную последовательность, полученную из четвертого полипептида,
Х2 либо отсутствует, либо представляет собой пептидную линкерную последовательность, и
- обозначает пептидную связь,
где второй полипептид и третий полипептид и четвертый полипептид отличаются друг от друга и являются полипептидами, обладающими активностью пептидил-пролил цис/транс-изомеразы (активность PPI) или представителями семейства белков, имеющих домен FKBP.
В одном воплощении гибридный полипептид согласно данному описанию содержит маркерную аминокислотную последовательность.
В одном воплощении маркерная аминокислотная последовательность выбрана из группы полигистидиновой последовательности (Poly-his-tag), метки Avitag, полиглутаминовой последовательности (Poly-glu-tag), полиаргининовой последовательности (Poly-arg-tag), метки Strep-tag, стрептавидин-связывающего пептида, эпитопных меток (Epitope-tags), а также их сочетания.
В одном воплощении маркерная аминокислотная последовательность представляет собой окта-гистидиновую последовательность.
Термин "маркерная аминокислотная последовательность" означает последовательность аминокислотных остатков, соединенных друг с другом при помощи пептидных связей, обладающих специфическими связывающими свойствами. В одном воплощении маркерная аминокислотная последовательность представляет собой аффинную метку или метку для проведения очистки. В воплощении маркерная аминокислотная последовательность выбрана из меток Arg-tag, His-tag, Flag-tag, 3xFlag-tag, Strep-tag, Nano-tag, SBP-tag, c-myc-tag, S-tag, кальмодулин-связывающего пептида, целлюлозо-связывающего домена, хитин-связывающего домена, GST-tag, или MBP-tag. В следующем воплощении маркерная аминокислотная последовательность выбрана из SEQ ID NO:16 (GSRKHHHHHHHH), или SEQ ID NO:62 (RRRRR), или SEQ ID NO:63 (RRRRRR), или SEQ ID NO:64 (HHHHHH), или SEQ ID NO:65 (KDHLIHNVHKEFHAHAHNK), или SEQ ID NO:66 (DYKDDDDK), или SEQ ID NO:67 (DYKDHDGDYKDHDIDYKDDDDK), или SEQ ID NO:68 (AWRHPQFGG), или SEQ ID NO:69 (WSHPQFEK), или SEQ ID NO:70 (MDVEAWLGAR), или SEQ ID NO:71 (MDVEAWLGARVPLVET), или SEQ ID NO:72 (MDEKTTGWRGGHWEGLAGELEQLRARLEHHPQGQREP), или SEQ ID NO:73 (EQKLISEEDL), или SEQ ID NO:74 (KETAAAKFERQHMDS), или SEQ ID NO:75 (KRRWKKNFIAVSAANRFKKISSSGAL), или SEQ ID NO:76 (связывающий целлюлозу домен), или SEQ ID NO:77 (связывающий целлюлозу домен), или SEQ ID NO:78 (TNPGVSAWQVNTAYTAGQLVTYNGKTYKCLQPHTSLAGWEPSNVPA LWQLQ), или SEQ ID NO:79 (GST-tag), или SEQ ID NO:80 (MBP-tag). В одном воплощении всех аспектов, описанных выше, маркерная аминокислотная последовательность имеет аминокислотную последовательность, выбранную из последовательностей от SEQ ID NO:62 до SEQ ID NO:80. В одном воплощении маркерная аминокислотная последовательность имеет аминокислотную последовательность SEQ ID NO:16, или SEQ ID NO:64, или SEQ ID NO:68.
Если полипептид был продуцирован в штамме E.coli, N-концевой остаток метионина обычно не подвергается эффективному отщеплению протеазами, поэтому N-концевой остаток метионина частично присутствует в образованном полипептиде. Поэтому все последовательности приведены здесь с N-концевым остатком метионина, хотя этот остаток может отсутствовать в выделенном полипептиде. Тем не менее, аминокислотная последовательность, содержащая N-концевой метионин, также будет охватывать аминокислотную последовательность, в которой этот метионин отсутствует.
Если аминокислотные последовательности X1 или X0 соответственно, имеют отличную от спирали структуру, на N-конце и С-конце аминокислотной последовательности X0 или X1, соответственно, может быть введен дополнительный линкер GGGS (SEQ ID NO:81).
Если аминокислотные последовательности X1 или X0 соответственно, имеют спиральную структуру, может быть вставлен GGGSGGNP-линкер (SEQ ID NO:82) на N-конце и GPTGGGS-линкер (SEQ ID NO:83) аминокислотной последовательности X0 или X1, соответственно.
Для презентирования антигена можно применять гибридные полипептиды SlyD/FKBP12-антиген, SlyD Thermus thermophilus-антиген и SlyD Thermococcus gammatolerans-антиген.
SlyD Thermus Thermophilus (Loew, C., et at., J. Mol. Biol. 398 (2010) 375-390) происходит из архебактерии Thermus Thermophilus. SlyD Thermococcus gammatolerans происходит из архебактерии Thermococcus gammatolerans. Оба белка демонстрируют повышенную термодинамическую стабильность в отличие от человеческого FKBP12, FKBP13, химерного FKBP12/13, а также SlyD E.coli. N-концевой полипептид, полученный на основе SlyD E.coli (т.е. когда четвертый полипептид представляет собой SlyD E.coli), можно не включать, когда в составе гибридного полипептида по данному описанию содержится SlyD Thermus Thermophilus или SlyD Thermococcus gammatolerans.
Как правило, гибридный полипептид FKBP12-антиген, содержащий маркерную аминокислотную последовательность по SEQ ID NO:16, имеет следующую аминокислотную последовательность:

где X1 представляет собой аминокислотную последовательность линкера или пептида или антигена или вторичной или третичной структуры, которую должен презентировать гибридный полипептид FKBP12-антиген.
Полипептид, полученный на основе человеческого FKBP12, может быть сшит N-концом с полипептидом, полученным на основе SlyD E.coli.
Гибридный полипептид SlyD/FKBP12-антиген, содержащий маркерную аминокислотную последовательность согласно SEQ ID NO:16, имеет следующую аминокислотную последовательность:

где X1 представляет собой аминокислотную последовательность линкера или пептида или антигена или вторичной или третичной структуры, которую должен презентировать гибридный полипептид SlyD/FKBP12-антиген.
Полипептид SlyD/FKBP12-контроль (результаты денатурирующего электрофореза в полиакриламидном геле и вестерн-блоттинга показаны на Фиг.1), содержащий маркерную аминокислотную последовательность согласно SEQ ID NO:16, имеет следующую аминокислотную последовательность:

Гибридный полипептид SlyD Thermus Thermophilus-антиген, содержащий маркерную аминокислотную последовательность согласно SEQ ID NO:16, имеет следующую аминокислотную последовательность:
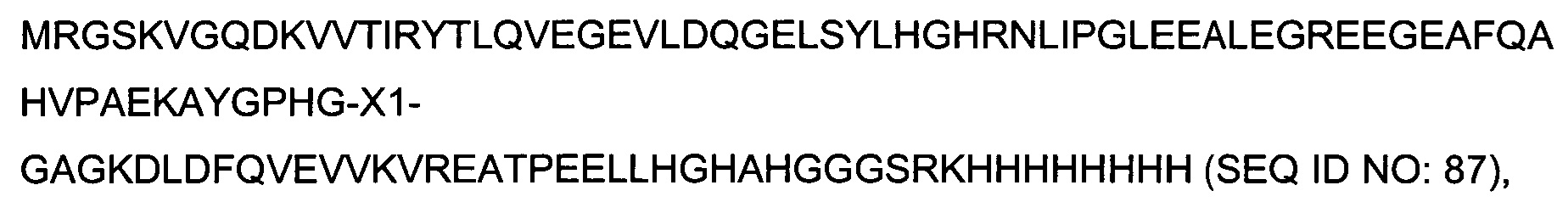
где X1 представляет собой аминокислотную последовательность линкера или пептида или антигена или вторичной или третичной структуры, которую должен презентировать гибридный полипептид SlyD Thermus Thermophilus-антиген.
Гибридный полипептид SlyD Thermococcus gammatolerans-антиген, содержащий маркерную аминокислотную последовательность согласно SEQ ID NO:16, имеет следующую аминокислотную последовательность:
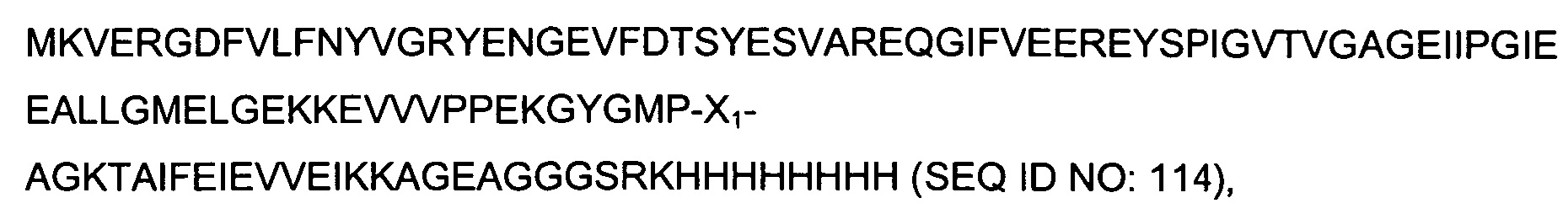
где X1 представляет собой аминокислотную последовательность линкера или пептида или антигена или вторичной или третичной структуры, которую должен презентировать гибридный полипептид SlyD Thermococcus gammatolerans-антиген.
Гибридный полипептид SlyD Thermus thermophilus-антиген и гибридный полипептид SlyD Thermococcus gammatolerans-антиген не требуют наличия N-концевого домена SlyD E.coli, обладающего шаперонной активностью. В этих гибридных полипептидах вставка иммуногенной последовательности (антигенной последовательности) может быть стабилизирована за счет дисульфидной связи в стволе петли антигена, что представляет собой воплощение в данном описании. В гибридный полипептид SlyD Thermus thermophilus-антиген может быть введено две мутации цистеина в положении аминокислот Н66С и А70С и каждый из остатков глицина может быть введен для оптимизации соединения между каркасом и вставкой.
Стабилизированный дисульфидными связями гибридный полипептид SlyD Thermus Thermophilus-антиген, содержащий маркерную аминокислотную последовательность согласно SEQ ID NO:16, имеет следующую аминокислотную последовательность:

где X1 представляет собой аминокислотную последовательность линкера или пептида или антигена или вторичной или третичной структуры, которую должен презентировать стабилизированный дисульфидными связями гибридный полипептид SlyD Thermus Thermophilus-антиген.
Стабилизированный дисульфидными связями гибридный полипептид SlyD Thermococcus gammatolerans-антиген, содержащий маркерную аминокислотную последовательность согласно SEQ ID NO:16, может иметь следующую аминокислотную последовательность:
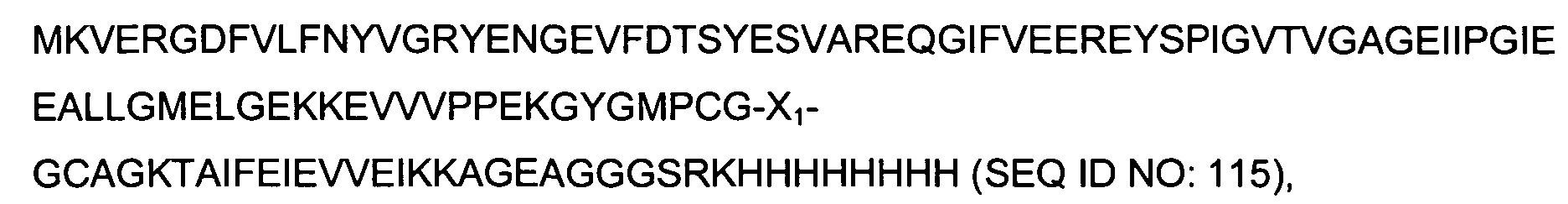
где X1 представляет собой аминокислотную последовательность линкера или пептида или антигена или вторичной или третичной структуры, которую должен презентировать стабилизированный дисульфидными связями гибридный полипептид SlyD Thermococcus gammatolerans-антиген.
Анти-ERCC1 антитела, подходящие для использования в иммуногистохимии:
В качестве реагента для проведения скрининга для создания анти-ERCC1 антител (от англ. Excision Repair Cross Complementing), подходящих для иммуногистохимического окрашивания, распознающих участок спираль-петля-спираль в составе С-концевого домена ERCC1 (Tripsianes, K., et al., Structure 13 (2005) 1849-1858), использовали гибридный полипептид SlyD/FKBP12-ERCC1.
Функция полипептида ERCC1 преимущественно состоит в вырезании нуклеотидов для репарации поврежденной ДНК (Aggarwal, С., et al., J. Natl. Compr. Cane. Netw. 8 (2010) 822-832; Rahn, J.J., et al., Environment. Mol. Mutagen. 51 (2010) 567-581; Westerveld, A., et al., Nature 310 (1984) 425-429).
ERCC1 имеет диагностическую значимость, поскольку является предсказательным и прогностическим маркером, тесно связанным с различными симптомами заболевания (Gandara, D.R., et al., J. Thorac Oncol. 5 (2010) 1933-1938; Hwang, I.G., et al., Cancer 113 (2008) 1379-1386; Azuma, K., et al., Cancer Chemother. Pharmacol. 64 (2009) 565-573).
Как правило, в условиях иммуногистохимического исследования возможно образование неоэпитопов, связанное с формированием поперечных сшивок, которое вызывает формалин (Lin, W., et al., J. Histochem. Cytochem. 45 (1997) 1157-1163, Webster, J.D., et al., J. Histochem. Cytochem. 57 (2009) 753-761). Естественная структура может быть частично или полностью денатурирована, или по меньшей мере структурно модифицирована под воздействием жестких условий в процессе подготовки ткани и последующего демаскирования антигена (Rait, V.K., et al., Lab. Invest. 84 (2004) 300-306). Возможно, что область эпитопа напоминает множество нестабильных первичных или вторичных структур, которые не могут быть надлежащим образом представлены линейным синтетическим пептидом. Следовательно, необходимо применение иммуногена или подходящего реагента для скрининга антител, способного справиться со всеми этими задачами, и в то же время являющегося стабильным и биохимически устойчивым.
Каркас SlyD/FKBP12-ERCC1 позволяет смоделировать структурное разнообразие линейных, полностью денатурированных, частично денатурированных, частично ренатурированых или интактных мотивов вторичной структуры, что, как полагают, имеет место при иммуногистохимическом применении. В то же время каркас обеспечивает термодинамическую стабильность и надежность в обращении.
Для скрининга подходящих для применения в иммуногистохимии анти-ERCC1 антител среди множества антител, полученных при иммунизации линейным пептидом, использовали гибридный полипептид SlyD/FKBP12-ERCC1.
Из структуры ERCC1 (PDB 1Z00) был выделен мотив вторичной структуры спираль-петля-спираль (Фигура 2). C-концевой домен ERCC1 может быть структурно охарактеризован как главным образом спиральный полипептид. Это затрудняет идентификацию секвенциального линейного эпитопа, которая обычно производится при иммунизации линейными пептидами. Для иммунизации животных применяли линейный KHL-связанный пептид для получения антител, специфически распознающих необходимый мотив последовательности.
Последовательность выделенного человеческого ERCC1 C274S представляет собой аминокислотную последовательность IAASREDLALSPGLGPQKARRLFD (SEQ ID NO:89). Последовательность представлена мотивом спираль-изгиб-спираль. Остаток цистеина, изначально находящийся в позиции 11 (подчеркнут в SEQ ID NO:89) встроенной последовательности был заменен на остаток серина во избежание агрегации при окислении.
Поскольку встроенная последовательность имеет конформацию спирали, на N-конце встроенной аминокислотной последовательности была введена дополнительная аминокислотная последовательность GGGSGGNP (SEQ ID NO:82), а на С-конце встроенной аминокислотной последовательности была введена аминокислотная последовательность GPTGGGS (SEQ ID NO:83). Таким образом, были получены концевые фланкирующие мотивы GGGGSGGNP и GPTGGGS. He связываясь никакой теорией, полагают, что эти мотивы способствуют спирализации за счет кэпирования спирали пролином.
Гибридный полипептид FKBP12-ERCC1, содержащий маркерную аминокислотную последовательность согласно SEQ ID NO:16, имеет следующую аминокислотную последовательность:

Гибридный полипептид SlyD/FKBP12-ERCC1, содержащий маркерную аминокислотную последовательность согласно SEQ ID NO:16, имеет следующую аминокислотную последовательность:

При скрининге для выявления клеточных клонов, продуцирующих анти-ERCC1 антитело, применяли гибридный полипептид SlyD/FKBP12-ERCC1 и контрольный полипептид SlyD/FKBP12.
Контрольный полипептид SlyD/FKBP12 имеет аминокислотную последовательность SEQ ID NO:86.
Как правило, для очистки гибридных полипептидов применяли аффинную хроматографию в денатурирующих условиях в присутствии хаотропных агентов. Гибридный полипептид связывался аффинным матриксом. Хаотропный буфер заменяли на буфер, обеспечивающий нативные условия, путем промывания колонки физиологическим буфером. Таким образом осуществили рефолдинг компонента SlyD E.coli в составе гибридного полипептида SlyD/FKBP12-ERCC1. После рефолдинга на колонке для аффинной хроматографии гибридный полипептид получали в физиологическом буфере.
После аффинной очистки гибридный полипептид диализировали и фильтровали (результаты денатурирующего электрофореза в полиакриламидном геле показаны на Фиг.3). SlyD/FKBP12-ERCC1 характеризовали при помощи спектроскопии в УФ и видимом диапазоне. Для исследования конформации SlyD/FKBP12-ERCC1 определяли флуоресценцию белка (Фиг.4). FKBP12 с мутацией С22А лучше всего подходит в качестве носителя для полипептидных вставок, поскольку единственный Trp в составе компонента FKBP12 можно использовать для определения структурной целостности компонента FKBP12 (Scholz, С., et al., J. Biol. Chem. 271 (1996) 12703-12707; Russo, A.T., et al., J. Mol. Biol. 330 (2003) 851-866). В спектре флуоресценции FKBP12 С22А, имеющего нативную структуру, наблюдается один пик при 320 нм (Zoldak, G., et al., J. Mol. Biol. 386 (2009) 1138-1152).
Интенсивность собственной флуоресценции триптофана при 350 нм, обусловленной сольватохромным эффектом, будет существенно ослабевать при нахождении триптофана внутри свернутого белка FKBP12, тогда как при развертывании FKBP12 она возрастает, что не связано никакой теорией. При изменении температуры от 25°С до 85°С не было выявлено других пиков в спектре испускаемой флуоресценции, но было обнаружено температуро-зависимое тушение флуоресценции при 350 нм. Эмиссии при длине волны 320 нм, являющейся показателем структурной целостности FKBP12, зарегистрировано не было (см. Фиг.4).
Исследование связывания на биосенсоре BIAcore с использованием гибридного полипептида SlyD/FKBP12-ERCC1 в качестве аналита в растворе и би-FK506, экспонируемого на поверхности сенсора, в качестве лиганда (Фиг.5 и 6) показало отсутствие связывающей активности в отношении FK506, указывающее на нарушение структуры и функций компонента FKBP12 в составе гибридного полипептида. Контрольный полипептид FKBP12 (С22А) обладал связывающей активностью в отношении FK506.
Отсутствие связывания гибридного полипептида SlyD/FKBP12-ERCC1 с иммобилизованным FK-506 свидетельствует, что конформация SlyD/FKBP12-ERCC1 отличается от таковой FKBP12 (С22А). Это сопровождается потерей связывающей активности химерного домена FKBP12.
Определение флуоресценции и исследование связывания FK506 подтверждают нарушение структуры и функции гибридного полипептида SlyD/FKBP12-ERCC1. N-концевой домен SlyD E.coli поддерживает гибридный белок в растворимом и мономерном состоянии. Это было доказано при ВЭЖХ-анализе гибридных полипептидов SlyD/FKBP12-ERCC1 и SlyD/FKBP12-контроль (см. Фиг.7 и 8).
Мышей иммунизировали внутрибрюшинно KHL-связанным пептидом, охватывающим аминокислоты 219-245 человеческого белка ERCC1 (от англ. Excision Repair Cross Complementing protein). Получение первичных культур гибридом выполняли согласно методике Koehler и Milstein. Гибридомы выделяли и проводили скрининг связывания антигена при помощи ИФА согласно описанию. Первичные культуры клеток гибридомы, демонстрировавшие в ИФА положительные результаты в отношении пептида ERCC1 [219-245], далее были отобраны для скрининга кинетики связывания (см. Фиг.9-12). Во избежание селекции антител, не подходящих для иммуногистохимии, при скрининге использовали гибридный полипептид согласно данному описанию. Для выявления антител, связывающихся с мотивом аминокислотной последовательности ERCC1, с применением кинетического скринингового подхода использовали гибридный полипептид SlyD/FKBP12-ERCC1 и контрольный полипептид SlyD/FKBP12. Из подходящих первичных культуры далее были получены кленовые культуры. Свойства отобранных клонов клеток показаны на Фиг.12. На Фиг.13 в качестве примера приведены исследования клона
Для исследования методом вестерн-блоттинга лизаты клеток OVCAR-3 или HEK293 загружали в лунки денатурирующего полиакриламидного геля. На Фиг.14 показаны результаты исследования клона
Для иммуногистохимического определения ERCC1 были приготовлены зафиксированные в формалине и заключенные в парафин образцы опухолевой ткани человека, страдающего мелкоклеточным раком легкого. На Фиг.15 приведен пример положительной иммуногистохимической окраски. Белые стрелки указывают на локусы специфического окрашивания ERCC1. Аналогичный скрининг и отбор был проведен с применением одного лишь полипептида, имеющего последовательность SEQ ID NO:89, т.е. с применением одного лишь полипептида без его интеграции в гибридный полипептид согласно данному описанию. Из 14 кандидатных клонов клеток, идентифицированных при таком скрининге, основанном на применении пептида, 9 клонов могли быть отобраны при помощи обоих способов скрининга. Пять успешных кандидатов, отобранных путем скрининга, основанного на применении полипептида, не связывались с гибридным полипептидом SlyD/FKBP12-ERCC1, несмотря на то, что они демонстрировали одинаковый уровень связывания с чипом BIAcore.
Было обнаружено, что гибридный полипептид SlyD Е.coli-FKBP12-антиген и гибридный полипептид SlyD Thermus Thermophilus-антиген (см., например, Kang, С.В., et al., Neurosignals 16 (2008) 318-325) и гибридный полипептид SlyD Thermococcus gammatolerans-антиген можно применять как в качестве иммуногена, так и для проведения скрининга при создании эпитоп-специфичных моноклональных антител, направленных против антигена, содержащегося в полипептиде.
Кроме того, было обнаружено, что гибридный полипептид SlyD E.coli-FKBP12/13-антиген и гибридный полипептид SlyD Thermus Thermophilus-антиген и гибридный полипептид SlyD Thermococcus gammatolerans-антиген также могут подвергаться посттрансляционной модификации и затем могут применяться в качестве иммуногена и для проведения скрининга при создании моноклональных антител, специфических к прошедшим посттрансляционную модификацию сайтам, направленных против посттрансляционных модификаций, существующих в полипептиде. В одном воплощении один из гибридных полипептидов согласно данному описанию применяется для создания антитела, а второй отличный от него гибридный полипептид согласно данному описанию применяется для отбора антитела, полученного с помощью первого гибридного полипептида, причем оба гибридных полипептида различаются, но содержат одну и ту же аминокислотную последовательность антигена, т.е. либо X1, либо X0 в обоих гибридных полипептидах идентичны.
Гибридные полипептиды согласно данному описанию можно применять для создания функциональных антител с использованием технологии с применением структурного миметика или каркаса, обеспечивающей нацеленное воздействие на эпитоп. Гибридные полипептиды согласно данному описанию особенно подходят для создания антител против антигенов, которые недоступны при проведении обычной иммунизации (т.н. скрытых эпитопов).
Анти-IGF-1 антитело:
Человеческие IGF-1 и IGF-2 имеют аминокислотные последовательности, гомологичные на 67%, и выраженную структурную гомологию (см. Фиг.16). В сыворотке IGF-2 присутствует в 500-кратном избытке по относительно IGF-1 (Jones, J.I. и Clemmons, D.R., Endocrin. Rev. 16 (1995) 3-34).
Таким образом, получение специфичного к IGF-1 антитела, т.е. антитела, не имеющего перекрестной реактивности с IGF-2, является непростой задачей. Между последовательностями IGF-1 и IGF-2 существует небольшое отличие в области мотива изгиб-петля IGF-1 в аминокислотах в положении 74-90 IGF-1, при начале нумерации от сигнального пептида и пропептида (код UniProtKB P05019, IGF1_human). Соответствующая аминокислотная последовательность NKPTGYGSSSRRAPQTG (SEQ ID NO:92) может быть встроена в SlyD/FKBP-12 или гибридный полипептид SlyD Thermus thermophilus или гибридный полипептид SlyD Thermococcus gammatolerans согласно данному описанию в качестве аминокислотной последовательности X0.
Гибридные полипептиды, содержащие аминокислотную последовательность NKPTGYGSSSRRAPQTG (SEQ ID NO:92) можно применять для иммунизации животных для получения антител, специфически связывающихся с этим мотивом изгиб-петля.
Для улучшения презентирования иммуногенного полипептида мотив IGF-1 изгиб-петля может быть фланкирован либо линкером GGGS (SEQ ID NO:81) на N-конце и С-конце аминокислотной последовательности, либо дипептидом HG на N-конце аминокислотной последовательности IGF-1 и дипептидом GA на С-конце аминокислотной последовательности IGF-1.
Гибридный полипептид SlyD/FKBP12-IGF-1 (74-90) применяли в качестве иммуногена, а также в качестве реагента для скрининга для создания анти-IGF-1 антитела, специфически связывающегося с аминокислотной последовательностью NKPTGYGSSSRRAPQTG IGF-1 (SEQ ID NO:92).
Гибридный полипептид FKBP12-IGF-1 (74-90), содержащий маркерную аминокислотную последовательность согласно SEQ ID NO:16, может иметь следующую аминокислотную последовательность:

Гибридный полипептид SlyD/FKBP12-IGF-1 (74-90), содержащий маркерную аминокислотную последовательность согласно SEQ ID NO:16, может иметь следующую аминокислотную последовательность:

Полипептид дикого типа SlyD Thermus Thermophilus, содержащий С-концевую маркерную аминокислотную последовательность согласно SEQ ID NO:16, имеет следующую аминокислотную последовательность:

Гибридный полипептид SlyD Thermus Thermophilus-IGF-1(74-90) (результаты денатурирующего электрофореза в полиакриламидном геле и вестерн-блоттинга показаны на Фиг.17) применяли в качестве иммуногена, а также в качестве реагента для скрининга при создании анти-IGF-1 антител, направленных против аминокислотной последовательности NKPTGYGSSSRRAPQTG IGF-1 (SEQ ID NO:92).
Гибридный полипептид SlyD Thermus Thermophilus-IGF-1(74-90), содержащий C-концевую маркерную аминокислотную последовательность согласно SEQ ID NO:16 (результаты денатурирующего электрофореза в полиакриламидном геле и вестерн-блоттинга показаны на Фиг.3), может иметь аминокислотную последовательность:
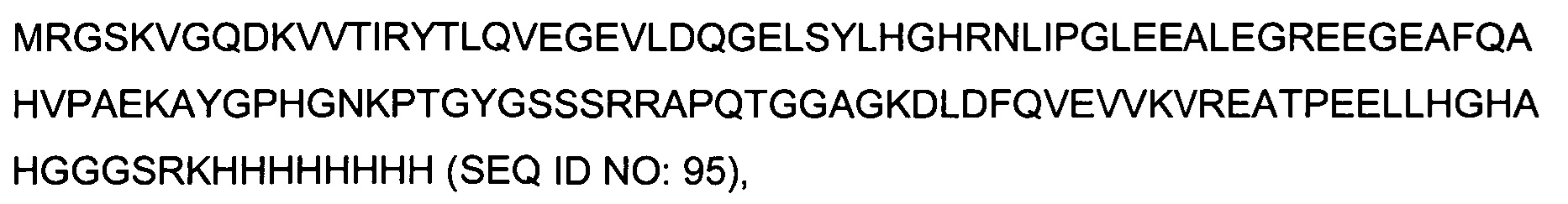
или аминокислотную последовательность:
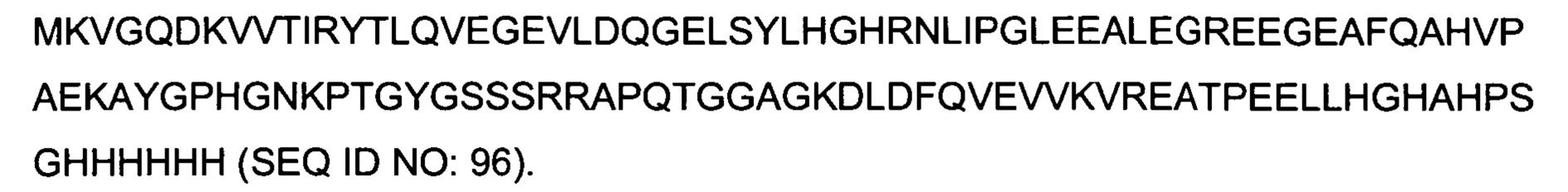
Для скрининга и исследования специфичности был получен гибридный полипептид SlyD-ΔIF Thermus thermophilus. У гибридного полипептида SlyD-ΔIF Thermus Thermophilus отсутствует IF домен, который был заменен на короткий аминокислотный мотив.
Гибридный полипептид SlyD-ΔIF Thermus Thermophilus, содержащий C-концевую маркерную аминокислотную последовательность согласно SEQ ID NO:16, может иметь аминокислотную последовательность:
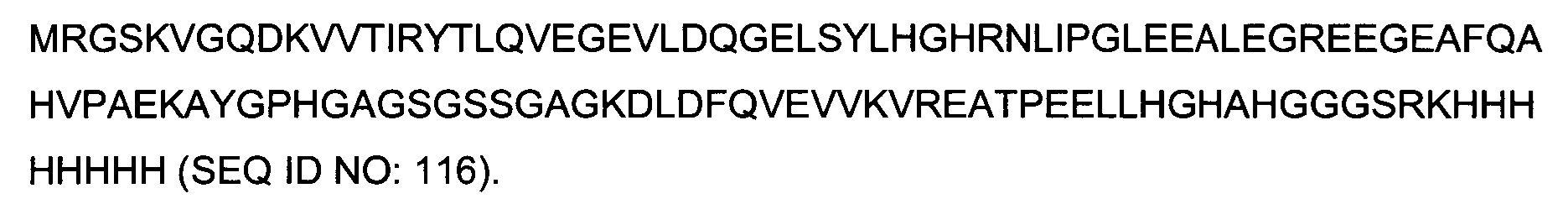
Для скрининга и исследования специфичности был получен гибридный полипептид SlyD Thermococcus gammatolerans со структурно гомологичной вставкой IGF-2(53-65) в форме шпильки.
Гибридный полипептид SlyD Thermococcus gammatolerans-IGF-2(53-65), содержащий C-концевую маркерную аминокислотную последовательность согласно SEQ ID NO:16, может иметь аминокислотную последовательность:

Все гибридные полипептиды были продуцированы в E.coli. Все гибридные полипептиды были очищены и подвергнуты рефолдингу с использованием по существу идентичных протоколов согласно данному описанию. Мышей иммунизировали внутрибрюшинно гибридным полипептидом SlyD/FKBP12-IGF-1(74-90) и гибридным полипептидом SlyD Thermus Thermophilus-IGF-1(74-90). Через 10 недель после иммунизации определяли титры антител при помощи ELISA (Фиг.19 и 20). У мышей, иммунизированных гибридным полипептидом SlyD/FKBP12-IGF-1(74-90), обнаруживались низкие титры к IGF-1, к имеющей ограниченную конформационную свободу пептидной петле IGF-1(74-90), к гибридному полипептиду SlyD/FKBP12-IGF-1(74-90) и к контрольному полипептиду SlyD/FKBP12. Только у одной мыши был получен достаточно высокий титр к IGF-1 (K1576M1 на Фиг.19) и ее использовали для получения гибридом.
У мышей, иммунизированных гибридным полипептидом SlyD Thermus Thermophilus-IGF-1(74-90) были обнаружены более высокие титры к гибридному полипептиду SlyD Thermus Thermophilus-IGF-1(74-90), чем к гибридному полипептиду SlyD/FKBP12-IGF-1(74-90) (см. Фиг.19 и 20).
Получение первичных культур гибридом выполняли по методике Koehler и Milstein. Первичные гибридомы выделяли путем предельного разведения и выполняли скрининг способности связывать антиген при помощи ИФА. Первичные культуры клеток гибридом, демонстрировавшие в ИФА положительные результаты в отношении гибридного полипептида SlyD/FKBP12-IGF-1(74-90), гибридного полипептида SlyD Thermus Thermophilus-IGF-1(74-90) и IGF-1, а также более низкий сигнал в отношении гибридного полипептида дикого типа SlyD Thermophilus и контрольного полипептида SlyD/FKBP12, далее исследовали при помощи кинетического скринингового метода.
Было обнаружено, что только две первичные культуры, полученные в результате иммунизации гибридным полипептидом SlyD/FKBP12-IGF-1 (74-90), демонстрировали в ИФА положительный сигнал в отношении IGF-1. После получения клоновых культур сигналы, указывающие на связывание, при исследовании методом поверхностного плазменного резонанса (SPR) не детектировались. Было выявлено несколько первичных культур, демонстрировавших в ИФА удовлетворительное связывание в отношении IGF-1 и гибридного полипептида SlyD Thermus Thermophilus-IGF-1(74-90) и сигналы более низкой интенсивности в отношении полипептида дикого типа SlyD Thermus Thermophilus (см. Фиг.21).
У первичных культур проводили скрининговое исследование кинетики связывания с нативным IGF-1, нативным IGF-2, гибридным полипептидом SlyD Thermus Thermophilus-IGF-1(74-90) и полипептидом дикого типа SlyD Thermus Thermophilus (Фиг.22). Были выявлены первичные культуры, продуцирующие антитело, специфичное к IGF-1, и выполнена их экспансия с предельным разведением для получения клоновых культур.
Способность клоновых культур специфически связывать IGF-1 исследовали при помощи ИФА (см. Фиг.23). На Фиг.24 приведены примеры исследования с помощью BIAcore анти-IGF-1 антитела, полученного в результате иммунизации гибридным полипептидом SlyD Thermus Thermophilus-IGF-1(74-90). Антитела специфически связывались с гибридным полипептидом SlyD Thermus Thermophilus-IGF-1(74-90) и нативным IGF-1 с аффинностью 10 пМ. Нативный IGF-2 и SlyD дикого типа Thermus Thermophilus не связывались (см. Фиг.25).
Было обнаружено, что для создания антител, специфичных к IGF-1, важное значение имеет стабилизация мотива IGF-1 изгиб-петля при помощи жесткого каркаса, характеризующегося высокой энтальпией, сохраняющего его нативную укладку. Не связываясь никакой теорией, предполагают, что при презентировании на метастабильном полипептидном каркасе, таком как FKBP12, последовательность NKPTGYGSSSRRAPQTG (SEQ ID NO:18) имеет слишком много степеней свободы вращения. В результате не было получено антитела, которое связывалось бы с нативным IGF-1.
При исследовании спектров кругового дихроизма (КД) в близком УФ диапазоне было обнаружено, что участок FKBP-12 в составе гибридного полипептида SlyD/FKBP12-IGF-1(74-90) оказался развернут. Исследование при помощи ВЭЖХ показало, что гибридный полипептид SlyD/FKBP12-IGF-1(74-90) является мономерным. Исследование при помощи дифференциальной сканирующей калориметрии показало, что гибридный полипептид способен обратимо сворачиваться и разворачиваться. Способный к обратимому фолдингу N-концевой домен SlyD E.coli поддерживает гибридный полипептид в стабильной и мономерной форме в растворе даже когда C-концевой домен FKBP частично или полностью развернут (см. Фиг.26), что не связано никакой теорией.
Как было ранее установлено в случае гибридного полипептида SlyD/FKBP12-ERCC1, гибридный полипептид SlyD/FKBP12-IGF-1(74-90) может презентировать структурное разнообразие линейных, полностью денатурированных, частично ренатурированных или интактных мотивов вторичной структуры.
Было обнаружено, что для создания антител, связывающих нативный IGF-1, необходимо использовать каркас, презентирующий встроенный полипептид в его нативной конформации. Таким образом, презентирующий гибридный полипептид должен быть полипептидом со стабильной укладкой. Было обнаружено, что этого можно добиться с применением FKPB домена экстремофильного (т.е. термофильного) организма, такого как SlyD Thermus thermophilus, или SlyD Thermococcus gammatolerans.
Чтобы установить, принимают ли гибридные полипептиды согласно данному описанию свернутую конформацию, исследовали спектры КД в ближнем УФ диапазоне. Спектры кругового дихроизма в ближнем УФ диапазоне определяются асимметрией окружения ароматических остатков полипептида и, таким образом, являются чувствительным тестом для определения упорядоченности третичной структуры. Нативный SlyD имеет характерный график КД в ближнем УФ диапазоне. Следовательно, деформация структуры или стерические затруднения вследствие инсерции в IF домене должны отражаться на спектре КД в ближнем УФ диапазоне. На Фиг.27 показаны наложенные спектры SlyD дикого типа Thermus thermophilus, FKBP домена SlyD дикого типа Thermus thermophilus, не имеющего IF домена (гибридный полипептид SlyD Thermus thermophilus - ΔIF), и гибридного полипептида SlyD Thermus thermophilus-антиген, в который был встроен внеклеточный фрагмент человеческого рецептора из 22 аминокислот. Было обнаружено, что замена IF домена Thermus thermophilus не приводит к изменению общей структуры оставшегося IF домена. Можно заметить, что графики спектров являются одинаковыми. Поскольку разворачивание привело бы к исчезновению какого-либо сигнала КД в ближнем УФ диапазоне, эти результаты доказывают, что у гибридного полипептида сохраняется укладка, близкая к нативной.
Гибридный полипептид SlyD Thermus thermophilus-антиген представляет собой гибридный полипептид, содержащий вставку вторичной структуры в форме бета-шпильки из внеклеточного домена (ECD) рецептора человеческого фактора роста, состоящую из 22 аминокислот. Графики КД свидетельствуют о том, что при 20°С все полипептиды оказываются правильно свернутыми в нативную структуру.
На Фиг.28 показаны спектры КД гибридного полипептида SlyD-ΔIF Thermus thermophilus в зависимости от температуры. После разворачивания, вызванного повышением температуры, FKBP домен SlyD Thermus thermophilus может вновь сворачиваться при охлаждении. Благодаря этому гибридные полипептиды могут подвергаться аффинной очистке и рефолдингу на колонках и, кроме того, в отличие от гибридного полипептида SlyD-FKBP12-IGF-1, гибридный полипептид SlyD Thermus thermophilus-IGF-1(74-90) обладает структурной стабильностью, позволяющей презентировать мотив вторичной структуры IGF-1 в домене FKBP в стабильной конформации. Спектры КД в ближнем УФ диапазоне гибридного полипептида SlyD Thermococcus gammatolerans-антиген в зависимости от температуры свидетельствуют о еще большей его стабильности по сравнению с гибридным полипептидом Thermus thermophilus-антиген (см. Фиг.29). Оба каркаса несут одинаковые вставки вторичной структуры в форме бета-шпильки из внеклеточного домена рецептора человеческого фактора роста, состоящие из 22 аминокислот. SlyD Thermococcus gammatolerans-антиген обратимо сворачивается и разворачивается. Было обнаружено, что при заданных физических условиях невозможно добиться полного разворачивания гибридного полипептида SlyD Thermococcus gammatolerans-антиген даже при температуре 100°С.
Было обнаружено, что стабильность доменов FKBP архебактерий позволяет осуществлять модификацию иммуногенных полипептидов путем замены их IF доменов, сохраняя при этом общую стабильность вновь полученного химерного каркасного белка.
Гибридный полипептид SlyD Thermus thermophilus-IGF-1(74-90) был очищен в виде стабильного мономерного полипептида (см. Фиг.18).
Мономерная фракция гибридного полипептида SlyD Thermococcus gammatolerans-антиген была подвергнута повторной хроматографии после нескольких циклов замораживания и оттаивания и температурного стресса (см. Фиг.30).
Мышей иммунизировали полипептидом с последовательностью SEQ ID NO:96. Полученные В-клетки исследовали с помощью ИФА. Гибридный полипептид SlyD Thermus Thermophilus-IGF-1(74-90), полипептид дикого типа SlyD Thermus Thermophilus, IGF-1 и IGF-2 использовали в качестве контроля.
Полипептид дикого типа SlyD Thermus Thermophilus, содержащий C-концевую маркерную аминокислотную последовательность согласно SEQ ID NO:16 (результаты денатурирующего электрофореза в полиакриламидном геле и вестерн-блоттинга показаны на Фиг.31), имеет следующую аминокислотную последовательность:

Супернатанты всех клоновых культур обеспечивали формирование стабильных комплексов с IGF-1 и гибридным полипептидом SlyD Thermus Thermophilus-IGF-1 при 37°С. Перекрестного реагирования с полипептидом дикого типа SlyD Thermus Thermophilus не было обнаружено ни с одним из супернатантов кленовых культур. Перекрестного реагирования с IGF-2 не было выявлено, за исключением одного клона (см. Фиг.32). На Фиг.33 показано, что у супернатантов первых 8 клоновых культур t/2дисс составляет 2 мин, тогда как аналит IGF-1 быстрее связывается с супернатантами последних 4 клоновых культур и медленнее диссоциирует. Он остается в составе комплекса более 40 мин. На Фиг.22 приведены примеры сенсограмм, полученные для одного из клонов. Можно заметить, что антитело связывается с IGF-1 и гибридным полипептидом Thermus thermophilus-IGF-1, тогда как связывание с IGF-1 и полипептидом дикого типа Thermus thermophilus не обнаруживается.
Таким образом, гибридные полипептиды SlyD Thermus Thermophilus-антиген и гибридные полипептиды SlyD Thermococcus gammatolerans-антиген можно применять в качестве иммуногена и для проведения скрининга при создании специфических к эпитопам моноклональных антител, направленных против иммуногена, входящего в состав полипептида.
На Фиг.25 показано, что у полученных с применением каркаса моноклональных антител
Моноклональное антитело М-2.28.44 было получено в результате стандартной иммунизации мышей рекомбинантным человеческим IGF-1. Хотя аффинность связывания антитела с IGF-1 составляет 30 пМ, антитело также перекрестно реагирует с IGF-2 (аффинность связывания 500 пМ). С применением в качестве аналита гибридного полипептида SlyD Thermus thermophilus-IGF-1(74-90) и гибридного полипептида SlyD Thermococcus gammatolerans-IGF-2(53-65) было показано, что перекрестно реагирующий с IGF-2 эпитоп находится за пределами области шпильки IGF-1/2.
Это было подтверждено при картировании линейного эпитопа (см. например, Frank, R. и Overwin, H., Methods in Molecular Biology 66 (1996) 149-169. Линейные структуры клонов 11.11.17 и 11.9.15, вносящие вклад в связывание IGF-1, распознают эпитоп TGYGSSSR (SEQ ID NO:124). Линейный связывающий участок клона 10.7.9 связывается с эпитопом PTGYGSSSR (SEQ ID NO:125). Эпитопы расположены на вершине шпилечной структуры IGF-1 и, следовательно, отсутствуют у IGF-2.
Как правило, гибридные полипептиды согласно данному описанию можно применять для создания функциональных антител при помощи технологии с применением структурного миметика, обеспечивающей нацеленное воздействие на эпитоп. Гибридные полипептиды согласно данному описанию особенно подходят для создания антител к антигенам, которые не являются легко доступными при использовании традиционного способа иммунизации с применением рекомбинантных иммуногенов. Было обнаружено, что т.н. скрытые эпитопы, погруженные внутрь белка, имеющего нативную конформацию, можно применять в качестве иммуногена, если они презентированы в виде вставки в составе гибридных полипептидов согласно данному описанию. Это имеет особое значение для неоэпитопов, которые становятся доступными только при индуцировании лигандами аллостерических конформационных перестроек, и которые можно применять в качестве иммуногенов при пересадке этих структур на гибридные полипептиды согласно данному описанию.
Химерные каркасы FKBP12/13:
Некоторые гибридные полипептиды согласно данному описанию построены на основе гибридного полипептида, содержащего части человеческого FKBP12 и части FKBP13 Arabidopsis thaliana. Было обнаружено, что гибридный полипептид, содержащий по меньшей мере часть человеческого FKBP12 и по меньшей мере часть FKBP13 Arabidopsis thaliana можно применять в качестве иммуногена. В таком гибридном полипептиде участок, полученный на основе человеческого FKBP12, термодинамически стабилизирован как каркас. FKBP13 содержит дисульфидную связь, стабилизирующую IF домен. Эта последовательность была пересажена на часть, полученную на основе человеческого FKBP12, для стабилизации гибридного полипептида.
Гибридный полипептид FKBP12/13, содержащий C-концевую маркерную аминокислотную последовательность согласно SEQ ID NO:16, имеет аминокислотную последовательность:

Гибридный полипептид FKBP12/13 был экспрессирован в E.coli (см. Фиг.34) в виде растворимого белка. Исследование методом ВЭЖХ (см. Фиг.35) показало, что гибридный полипептид FKBP12/13 является мономерным. Исследования спектров КД проводили, как описано выше. Спектры КД показали, что гибридный полипептид FKBP12/13 находится в свернутом состоянии при 20°С. Каркасы, полученные на основе Thermus thermophilus и Thermococcus gammatolerans, демонстрируют большую устойчивость к температуре по сравнению с гибридным полипептидом FKBP12/13.
Анти-PLGF антитело:
Встроенная аминокислотная последовательность в данном случае имеет мотив изгиб-петля и требуется создание антитела, подходящего для иммуногистохимии. Вставка имеет аминокислотную последовательность DWSEYPSEVEHMFSPSS (SEQ ID NO:98). C-концевой остаток цистеина иммуногена был заменен на остаток серина.
Гибридный полипептид FKBP12-PLGF, содержащий C-концевую маркерную аминокислотную последовательность согласно SEQ ID NO:16, имеет следующую аминокислотную последовательность:

Гибридный полипептид SlyD/FKBP12-PLGF, содержащий C-концевую маркерную аминокислотную последовательность, в этом случае имеет следующую аминокислотную последовательность:

Мышей иммунизировали иммуногеном, содержащим последовательность PLGF(60-76). Впоследствии были получены гибридомы и выполнены ИФА и скрининг кинетики связывания.
При проведении скрининга кинетики связывания для выявления супернатантов первичных культур, обладающих связывающей активностью в отношении PLGF(60-76), использовали гибридный полипептид SlyD/FKBP12-PLGF и биотинилированный пептид PLGF(60-76), который был в отдельности пришит к стрептавидину. Кинетика связывания для обоих аналитов соответствовала модели 1:1 Ленгмюра, однако у гибридного полипептида кривая диссоциации была предпочтительнее, а значение хи2 меньше по сравнению с биотинилированным пептидом PLGF с пришитой стрептавидиновой меткой. Таким образом, по сравнению со стрептавидиновой меткой, скрининг, основанный на применении гибридного полипептида, обеспечивает такие преимущества как мономерное состояние и лучшая доступность эпитопа иммуногена в составе гибридного полипептида.
Антитела, полученные с помощью этого подхода, как, например, клон 53.4.1, обладали способностью специфически распознавать PLGF в вестерн-блоттинге.
Гибридный полипептид SlyD-FKBP12/13-CSF1R:
Термин "гибридный полипептид SlyD-FKBP12/13-CSF1R" обозначает полипептид, имеющий следующую аминокислотную последовательность:

Полипептид был экспрессирован в E.coli согласно данному описанию и очищен согласно данному описанию. После аффинной очистки на агарозе, модифицированной нитрилотриуксусной кислотой и заряженной ионами Ni2+ (Ni-NTA), проводили эксклюзионную хроматографию. Гибридный полипептид загружали на колонку HiLoad 26/60 SuperdexTM 75 pg. Элюированные фракции анализировали при помощи нативного электрофореза (см. Фиг.37).
Аминокислотная последовательность X1, использованная для создания антител, соответствует содержащему киназную вставку внутриклеточному домену CSF1R. Src киназа, EGF1R и сам CSF1R могут фосфорилировать остатки тирозина, в частности, остатки тирозина в петле киназного домена, фланкированной треонином и валином (остаток Y в положении 297 в SEQ ID NO:119, выделенный курсивом и подчеркнутый).
После очистки гибридный полипептид может быть подвергнут фосфорилированию при помощи соответствующей киназы. Таким образом, возможно получить аминокислотную последовательность X1, имеющую пост-трансляционные модификации и, следовательно, возможно создать антитела против полипептидов с пост-трансляционными модификациями с применением гибридного полипептида согласно данному описанию. Гибридный полипептид может использоваться в различных применениях, например, таких как скрининг, исследование специфичности или в качестве иммуногена. Как правило, пептиды, являющиеся субстратами для ферментативных пост-трансляционных или химических модификаций могут быть встроены в каркасы в виде аминокислотной последовательности X1. Для исследования конформации гибридного полипептида SlyD/FKBP12/13-CSF1R определяли флуоресценцию белка. При 20°С и 25°С при сканировании в диапазоне от 300 нм до 425 нм наблюдается пик при 305 нм (см. Фиг.38). Компонент, содержащий единственный триптофан в составе FKBP12 домена, демонстрирует сольватохромный эффект, характерный для собственной флуоресценции триптофана, поскольку он погружен в гидрофобное ядро FKBP12 домена. Таким образом, предполагают, что участок FKBP12/13-CSF1R полипептида находится в свернутом состоянии. При 50°С пик эмиссии сдвигается к 344 нм, что свидетельствует о том, что компонент, содержащий триптофан, теперь находится в водном окружении и FKBP домен частично или полностью развернут. При t 30°С и 40°С определяются промежуточные состояния свернутого и развернутого белка.
Было обнаружено, что возможно стабилизировать FKBP12 домен гибридного полипептида путем создания из FKBP12 гибридного полипептида FKBP12/13, в котором FLAP домен FKBP12 заменен на содержащую дисульфидную связь структуру FKBP13 и структурный мотив в виде петли из рецептора CSF1R.
Уже при 40°С гибридный полипептид демонстрирует разворачивание значительного участка белка, который в основном относится к FKBP12/13-CSF1R домену, поскольку SlyD E.coli не содержит триптофана.
Эти сведения подчеркивают необходимость еще большей стабилизации химерного FKBP12 для создания неметастабильных каркасов для применения химерного домена FKBP в качестве каркаса для презентирования правильно свернутых нативных вторичных или третичных структур в качестве иммуногенов. Кроме того, не возможно не включать SlyD домен E.coli в гибридный полипептид, поскольку в этом случае выход экспрессируемого белка существенно понижается (данные не приведены).
Картирование эпитопов:
Гибридные полипептиды SlyD-FKBP могут также нести сложные вставки аминокислотных мотивов, как, например, вторичные структуры, содержащие дисульфидные связи. Поскольку гибридные полипептиды не имеют цистеинов, рефолдинг на колонке при соответствующих условиях облегчает правильное формирование дисульфидных связей внутри вставки, чему дополнительно способствует шаперонная функция самого SlyD.
В целях картирования эпитопов применяли гибридные полипептиды SlyD-FKBP12-CD81 и SlyD-FKBP12-контроль. Человеческий CD81 представляет собой рецептор гликопротеина Е2 оболочки вируса гепатита С. CD81 является трансмембранным белком, принадлежащим к семейству тетраспанинов. CD81 представляет собой гомодимерный белок размером 90 аминокислот, имеющего т.н. грибовидную структуру (PDB 1IV5). Остатки, задействованные в связывании вируса, могут быть картированы на т.н. "субдомене-шляпке" размером 35 аминокислот, что обеспечит возможность создания антивирусных лекарств и вакцин. Поскольку длина последовательности "субдомена-шляпки", участвующего в связывании вируса, составляет всего 35 аминокислот, картировать эпитопы антитела на белке CD81 размером 10 кДа с помощью стандартного перекрестного конкурентного анализа затруднительно.
Трудно отличить антитела, которые связываются непосредственно с доменом в форме грибовидной "шляпки", от антител, связывающихся только вблизи от него или в другом участке структуры CD81LEL. Все эти антитела будут конкурировать за связывание с белком оболочки HCV Е2, но не связываться специфически с целевой структурой, "субдоменом-шляпкой". Таким образом, пересадка структуры "субдомена-шляпки" на FKBP и последующее картирование эпитопа является эффективным методом. Во-первых, он позволяет обойти некоторые биохимические проблемы, связанные с белком CD81LEL, поскольку сам белок имеют склонность к олигомеризации. Во-вторых, он подходит для отбора эпитопов антитела среди большого числа антител, связывающихся только с полноразмерным белком CD81.
Гибридный полипептид SlyD-FKBP12-CD81:
Термин "гибридный полипептид SlyD-FKBP12-CD81" обозначает полипептид, имеющий следующую аминокислотную последовательность:

Гибридный полипептид SlyD-FKBP12-контроль (см. Фиг.1):
Термин "гибридный полипептид SlyD-FKBP12-контроль" обозначает полипептид, имеющий следующую аминокислотную последовательность:

Биосенсор BIAcore 2000 (GE Healthcare) использовали при 25°C с установленным в систему сенсором BIAcore CM5. Каждый белковый лиганд иммобилизовали в проточных ячейках 2, 3 и 4 при активации поверхности этил-диметил-аминопропил-карбодиимидом и гидроксисукцинимидом (EDC/NHS). Проточную ячейку 1 использовали в качестве референсной. На поверхности сенсора иммобилизовали следующие субстанции: проточная ячейка 2: SlyD-FKBP12-контроль, проточная ячейка 3: SlyD-FKBP12-CD81, и проточная ячейка 4: CD81LEL. В качестве аналитов инжектировали 31 антитело. После вычитания сигнала, зарегистрированного в референсной ячейке (2-1, 3-1 и 4-1), сенсограммы анализировали при помощи программного обеспечения BIAcore Evaluation software 4.1. Для количественной оценки максимального сигнала при связывании аналита фиксировали показатели в конце инжектирования аналита. Для нормализации данных наиболее высокий сигнал при связывании аналита принимали за 100%. Нормализованные ответы при связывании антител показали, что из 30 протестированных анти-CD81-LEL-антител только 6 связывались с эпитопом "домена-шляпки" CD81. Полипептид SlyD-FKBP12-контроль, служивший отрицательным контролем, не связывался. Полипептид CD81-LEL, служивший положительным контролем и являющийся в то же время иммуногеном, связывался всеми антителами. Slyd-FKBP12-CD81 связывался только когда эпитоп антитела был локализован в грибовидном домене.
Подтверждение результатов картирования эпитопа при помощи рентгеноструктурного кристаллографического анализа.
Fab фрагменты антител K05 и K04 были кристаллизованы совместно с белком CD81-LEL при помощи известных методов и проанализированы при помощи рентгеновского дифракционного анализа (Seth Harris, Palo Alto). Разрешение составляло 2,15 Å. K04 непосредственно распознает последовательность эпитопа-мишени, тогда как K05 связывается за пределами мишени. Таким образом, результаты рентгеновского анализа непосредственно коррелируют с результатами картирования эпитопов, основанного на технологии с применением каркаса.
Следующие ниже примеры, фигуры и последовательности дают возможность лучше понять данное изобретение, объем которого ограничивается приведенной формулой. Следует учитывать, что в приведенные процедуры могут быть внесены модификации, при этом не меняющие сути изобретения.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Пример 1
Экспрессия и очистка
Полипептиды продуцировали в E.coli (вектор pQE80L/клеточная линия E.coli BL21 CodonPlus-RP) согласно известным методам.
Для очистки неочищенных полипептидов применяли аффинную хроматографию в нативных или в денатурирующих условиях в присутствии хаотропных агентов. Для гибридного полипептида, содержащего участок SlyD, очистка в присутствии хаотропных агентов особенно подходит, поскольку позволяет полностью выделить гибридный полипептид из клеток E.coli. Кроме того, весь гибридный полипептид получают в конформации случайной спирали. Гибридный полипептид по-прежнему связанный с аффинной матрицей, переводили в нативные условия путем промывания колонки физиологическим солевым раствором. Благодаря спонтанному фолдингу участков SlyD и FKBP12 гибридного полипептида, встроенная аминокислотная последовательность также переходила в нативную конформацию. Рефолдированный гибридный полипептид элюировали с колонки для аффинной хроматографии в градиенте имидазола в физиологическом растворе.
Пример 2
Получение производных химическим методом
C-концевой остаток лизина активировали в кислых условиях (рН 6) при помощи LC-SPDP (сукцинимидил 6-(3-[2-пиридилдитио]-(пропионамидо) гексаноата)) ((Pierce, Cat.: 68181-17-9).
Аргинин и лизин являются основаниями, которые могут отнимать протон алкиламмониевой группы лизина. Дериватизацию свободной аминогруппы можно проводить с помощью угольной кислоты при активации гидроксил-сукцинимидилом.
Пример 3
Обработка формалином
Дериватизированные гибридные полипептиды можно обработать раствором формалина. Затем зафиксированные Дериватизированные гибридные полипептиды можно очистить при помощи эксклюзионной хроматографии для получения композиций с определенной степенью олигомеризации (мономерные, олигомерные, мультимерные).
Пример 4
Характеризация супернатантов кленовых культур, продуцирующих антитела, при помощи биосенсора BIAcore
Использовали биосенсор BIAcore T100 (GE Healthcare) с установленным в систему сенсором BIAcore CM5. Выполняли прекондиционирование сенсора путем инжектирования 0,1% SDS, 50 мМ NaOH, 10 мМ HCl и 100 мМ H3PO4 в течение 1 мин при скорости 100 мкл/мин.
В качестве системного буфера использовали HBS-ET (10 мМ HEPES (рН 7,4) с добавлением 150 мМ NaCl, 1 мМ EDTA, 0,05% (вес/об) Tween® 20). Буфер для внесения образцов предствлял собой системный буфер.
Система BIAcore T100 находилась под контролем программного обеспечения V1.1.1. Поликлональное кроличье антитело IgG
Антитела, содержащиеся в соответствующих супернатантах клоновых культур в концентрациях от 35 нМ до 190 нМ, иммобилизовали на поверхности с
Пример 5
Подготовка образцов для иммуногистохимии
Иммобилизованный на матриксе гибридный полипептид LC-SPDP обрабатывали при помощи органического растворителя, нагревали и обрабатывали кислым буфером. Затем связанные с матриксом полипептиды выделяли в восстанавливающих условиях. Для получения материала, имеющего определенный состав, можно проводить эксклюзионную хроматографию. Полученный таким образом материал имеет определенную степень олигомеризации (мономер, олигомер и полимер) и может применяться в качестве иммуногена для иммунизации экспериментальных животных, а также может применяться в качестве тестового антигена для отбора и скрининга антител.
Пример 6
Иммунизация
Полученный иммуногенный гибридный полипептид вводили внутрибрюшинно в разных дозах экспериментальному животному, такому как мышь, крыса, кролик, овца или хомяк. Перед забором В-клеток проводили повторную иммунизацию. B-клеточные гибридомы могут быть получены согласно методу Koehler и Millstein (Kohler, G. и Milstein, С., Nature 256 (1975) 495-497). Полученные гибридомы помещали в виде отдельных клонов или клеток в лунки многолуночного планшета. Первичные культуры гибридом, при тестировании показавшие положительные результаты в отношении связывания антигена секретируемым антителом, далее подвергали скринингу с исследованием кинетики связывания.
Пример 7
Анти-IGF-1 антитела
Клетки, полученные у четырех иммунизированных мышей NMRI, исследовали при помощи ИФА. Многолуночные планшеты Nunc Maxisorb F покрывали SlyD/FKBP12-IGF-1, SlyD/FKBP12-IGF-1(74-90), SlyD Thermus thermophilus-IGF-1, SlyD/FKBP12-контроль или SlyD дикого типа Thermus thermophilus путем нанесения раствора, содержащего 0,41 мкг полипептида на мл. Изолированный антиген IGF-1 иммобилизовали на лунках многолуночных планшетов StreptaWell High Bind SA путем нанесения раствора, содержащего биотинилированный IGF-1 в концентрации 90 нг/мл или биотинилированный фрагмент «пептидная петля IGF-1» в концентрации 500 нг/мл.
После этого свободные сайты связывания блокировали путем нанесения раствора, содержащего 1% RPLA в PBS в течение одного часа при комнатной температуре. Лунки отмывали три раза раствором, содержащим 0,9% (вес/об) хлорид натрия и 0,05% (вес/об) Tween. В качестве образцов использовали мышиную сыворотку, разведенную 1:50 в PBS. Как вариант, выполняли дальнейшее ступенчатое разведение 1:4 до конечного разведения 1:819,200. Время инкубации составляло 1 час при комнатной температуре. Лунки отмывали три раза раствором, содержащим 0,9% (вес/об) хлорид натрия и 0,05% (вес/об) Tween. В качестве детектирующего антитела использовали поликлональное антитело против константного домена целевых антител, конъюгированное с пероксидазой (PAK
Пример 8
Скрининг кинетики связывания в супернатантах, полученных из культур гибридом
Для отбора подходящих для иммуногистохимии антител было задано целевое время полужизни комплекса 10 мин при 37°С.
Скрининг кинетики связывания выполняли с помощью биосенсора BIAcore А100 под контролем программного обеспечения версии V1.1. В аппарат устанавливали чип BIAcore CM5 и согласно инструкциям производителя выполняли гидродинамическую адресацию, а затем проводили кондиционирование чипа. В качестве проточного буфера использовали HBS-EP (10 мМ HEPES (рН 7,4), 150 мМ NaCl, 1 мМ EDTA, 0,05% (вес/об) Р20). Композицию захватывающего поликлонального антитела анти-IgG Fc в концентрации 30 мкг/мл в 10 мМ натрий-ацетатном буфере (рН 4,5) концентрировали в зонах 1, 2, 4 и 5 в проточных ячейках 1, 2, 3 и 4. Антитело иммобилизовали до уровня 10,000 RU при помощи ковалентного связывания с использованием NHS/EDC. Затем сенсор деактивировали при помощи насыщения 1М раствором этаноламина. Зоны 1 и 2 затем использовали для определения, а зоны 2 и 4 использовали в качестве референсных. Перед нанесением на сенсор-чип супернатанты, полученные из культур гибридом, разводили 1:5 в буфере HBS-EP. Разведенный раствор наносили при скорости потока 30 мкл/мин в течение 1 мин. Непосредственно после этого инжектировали антиген при скорости потока 30 мкл/мин в течение 2 мин. Затем записывали сигнал в течение следующих 5 мин. Сенсор регенерировали при помощи инжектирования раствора 10 мМ глицин-HCl (рН 1,7) в течение 2 мин при скорости потока 30 мкл/мин. Сигнал, зарегистрированный незадолго до окончания инжектирования антигена обозначали как связывание в поздней фазе (BL). Сигнал, зарегистрированный незадолго до окончания записи диссоциации, обозначали как стабильность в поздней фазе (SL). Таким образом, наблюдаемую стабильность комплекса рассчитывали по следующей формуле:
(1-[BL(RU)-SL(RU)/BL(RU)].
Клетки гибридомы, отобранные при скрининге кинетики связывания, высаживали в виде одиночных клеток при помощи FACS (FACSAria (Becton Dickinson), Software V4.1.2). Моноклональные клоны культивировали в 24-луночных планшетах или в 100 мл флаконах с перемешиванием в среде для культивирования RPMI-1640.
Пример 9
Иммуногистохимические исследования
Иммуногистохимичесие исследования выполняли вручную или в автоматическом режиме с применением аппарата Ventana Benchmark XT или Discovery XT 8R. Антитела тестировали на подходящих зафиксированных в формалине или криоконсервированных тканях или клетках, демонстрирующих положительные или отрицательные результаты.
Как вариант клетки трансфецировали нуклеиновой кислотой, кодирующей целевой полипептид. Трансфецированные клетки лизировали и проверяли их на пригодность в качестве положительного или отрицательного контроля при помощи вестерн блоттинга.
Пример 10
Получение анти-ERCC1 антител с применением каркаса SlyD/FKB12-антиген
Иммунизация
8-12 недельных мышей SJL иммунизировали внутрибрюшинно связанным с KHL пептидом, произведенным на основе ERCC1, охватывающим аминокислоты 219-245 человеческого ERCC1 (Excision Repair Cross Complementing), в количестве 100 мкг. Производные ERCC1 были получены искусственно при помощи пептидного синтеза.
Мышей иммунизировали 3 раза (исходно и через 6 и 10 недель после первоначальной иммунизации). Первую иммунизацию выполняли с примением полного адъюванта Фрейнда, вторую и третью иммунизацию выполняли с применением неполного адъюванта Фрейнда. Заключительную бустерную инъекцию выполняли внутривенно с применением 100 мкг связанного с KLH пептидного антигена за три дня до процедуры слияния гибридом. Получение первичных культур гибридомы выполняли согласно Kohler и Milstein (Kohler, G. и Milstein, С., Nature 256 (1975) 495-497). Гибридомы выделяли в 96-луночных планшетах для микротитрования путем предельного разведения и выполняли скрининг способности связывать антиген при помощи ИФА. ИФА выполняли на приборе Tecan Sunrise со встроенной программой: V3.15 19/03/01; XREAD PLUS Version: V4.20. Первичные культуры клеток гибридомы, демонстрировавшие в ИФА положительное окрашивание при связывании с биотинилированным пептидом, полученным на основе ERCC1, охватывающим аминокислоты 219-245, отбирали для скрининга кинетики связывания согласно данному описанию.
Во избежание отбора антител, не пригодных для иммуногистохимии, связывающих только линейные пептиды, был проведен дальнейший скрининг с применением «каркасного» подхода. Применение «каркасного» подхода позволило отбраковать антитела, связывающие иммуногенный пептид на его концах.
Получение SlyD/FKBP12-ERCC1
Синтетический ген, кодирующий SlyD/FKBP12-ERCC1 и SlyD/FKBP12-контроль, был приобретен в Sloning Biotechnology GmbH (Germany) и клонирован в вектор экспрессии pQE80L. Для получения полипептидов в E.coli BL21 CodonPlus-RP использовали генные конструкции с оптимизированными для E.coli кодонами (см. Фиг.3 и 8).
Для очистки неочищенных гибридных полипептидов применяли аффинную хроматографию в денатурирующих условиях в присутствии хаотропных агентов. Для гибридного полипептида, содержащего участок SlyD, очистка в присутствии хаотропных агентов особенно подходит, поскольку позволяет полностью выделить гибридный полипептид из клеток E.coli. Кроме того, весь гибридный полипептид получали в конформации случайной спирали. Гибридный полипептид, по-прежнему связанный с аффинным матриксом, переводили в нативные условия путем промывания колонки физиологическим солевым раствором. Благодаря спонтанному фолдингу участков SlyD и FKBP12 гибридного полипептида, встроенная аминокислотная последовательность также может перейти в нативную конформацию. Рефолдированный гибридный полипептид элюировали с колонки для аффинной хроматографии в градиенте имидазола в физиологическом растворе. На Фиг.3 показаны результаты денатурирующего электрофореза в полиакриламидном геле и вестерн блоттинга гибридного полипептида SlyD/FKBP12-ERCC1. Вестерн блоттинг с антителом против гексагистидиновой метки демонстрирует целостность C-концевого участка гибридного полипептида. Другие полосы полипептидов не выявляются.
Исследование флуоресценции
После аффинной очистки гибридный полипептид диализовали против 75 мМ буфера HEPES (рН 7,5, 150 мМ NaCl, 6,5% (вес/об) сахароза, 10 мМ цистеин) и фильтровали. SlyD/FKBP12-ERCC1 характеризовали при помощи спектроскопии в ультрафиолетовом/видимом диапазоне в концентрации 7,4 мг/мл, используя коэффициент экстинкции, рассчитанный для полипептида 35380,301 Да (Фиг.4). Измерения в диапазоне длин волн от 220 нм до 340 нм позволили обнаружить пик абсорбции при 280 нм, обусловленный единственным остатком Trp FKBP12. При 340 нм абсорбции не регистрировалось.
Для исследования конформации SlyD/FKBP12-ERCC1 измеряли флуоресценцию белка. FKBP12 С22А особенно подходит в качестве носителя для вставок полипептидов, поскольку единственный Trp в составе компонента FKBP12 можно применять для установления стуктурной целостности компонента FKBP12 (Scholz, С., et al., J. Biol. Chem. 271 (1996) 12703-12707; Russo, A.T., et al., J. Mol. Biol. 330 (2003) 851-866). FKBP12 С22А в своей нативной структуре имеет единственный пик флуоресценции при 320 нм (Zoldak, G., et al., J. Mol. Biol. 386 (2009) 1138-1152).
SlyD/FKBP12-ERCC1 (250 мкл) с концентрацией 2,5 мг/мл в буфере HBS-E (рН 7,4) анализировали при различных температурах. Использовали прибор Сагу Eclipse с программным обеспечением Scan Software, версия 1.1(132), ширина полос возбуждения и эмиссии составляла 5 нм. Сканирование в диапазоне длин волн 300 нм - 600 нм проводили со скоростью 600 нм/мин. Собственную флуоресценцию триптофана возбуждали при 294 нм. При 350 нм был получен широкий пик (Фиг.4). Согласно теории, интенсивность собственной флуоресценции триптофана при 350 нм, обусловленной сольватохромным эффектом, будет существенно ослабевать при нахождении триптофана внутри свернутого белка FKBP12, тогда как при развертывании FKBP12 она возрастает. При изменении температуры от 25°С до 85°С не было выявлено других пиков в спектре испускаемой флуоресценции, но было обнаружено температуро-зависимое тушение флуоресценции при 350 нм. Эмиссии при 320 нм, являющейся показателем структурной целостности FKBP12, зарегистрировано не было.
Таким образом, единственный остаток Trp в составе гибридного полипептида SlyD/FKBP12-ERCC1 обращен к растворителю уже при 25°С, что указывает на то, что химерный FKBP12 в окружении SlyD-FKBP12 частично или полностью развернут.
Таким образом, каркас является идеальной платформой для моделирования и презентирования структурного разнообразия нестабильных конформации пептидов, которые обычно возникают в зафиксированных в формалине и заключенных в парафин тканях при проведении иммуногистохимических экспериментов (Abe, M., et al., Anal. Biochem. 318 (2003) 118-123).
Исследование связывания FK506 при помощи биосенсора BIAcore
В инструмент BIAcore 3000, находящийся под контролем программного обеспечения версии V4.1, устанавливали сенсор SAchip согласно инструкциям производителя. В качестве проточного буфера использовали HBS-EP (10 мМ HEPES, рН 7,4, 150 мМ NaCl, 1 мМ EDTA, 0,05% (вес/об) Р20 (10% водный раствор неионного сурфактанта Полисорбат 20 (Tween 20)). В проточной ячейке 4 иммобилизовали конъюгат би-линкер-FK506 (Roche Diagnostics Mannheim, Germany) до уровня 1213 RU.
300 нМ очищенного SlyD/FKBP12-ERCC1 гибридного полипептида и 300 нМ контрольного полипептида SlyD/FKBP12 инжектировали в систему при скорости 30 мкл/мин, время ассоциации составляло 3 мин, время диссоциации составляло 3 мин.
Для регенерации сенсора инжектировали 10 мМ раствор глицин-HCl (рН 1,7) в течение 2 мин при скорости 30 мкл/мин.
Исследование связывания 300 нМ гибридного полипептида SlyD/FKBP12-ERCC1 в качестве аналита в растворе с экспонированным на поверхности сенсора лигандом би-FK506 при помощи BIAcore (Фиг.5) не выявило связывающей активности (Фиг.6), что указывало на структурно-функциональные нарушения в составе компонента FKBP12 химерного гибридного полипептида. Контрольный полипептид FKBP12 (С22А) обладал связывающей активностью.
Неспособность гибридного полипептида SlyD/FKBP12-ERCC1 связываться с FK-506 является еще одним свидетельством того, что конформация SlyD/FKBP12-ERCC1 отличается от таковой FKBP12 (С22А). Это сопровождается потерей связывающей активности химерного домена FKBP12.
Хроматографический анализ с помощью аналитической ВЭЖХ
Хроматографический анализ гибридных полипептидов с помощью аналитической ВЭЖХ выполняли для установления степени олигомеризации гибридного полипептида.
Устройство для проведения ВЭЖХ Chromeleon Dionex использовали в соответствии с инструкциями производителя при 25°C с колонкой TSK3000SWXL, уравновешенной буфером HBS-E (рН 7,4). Скорость тока буфера составляла 0,7 мл/мин. В систему инжектировали 100 мкл раствора, содержащего SlyD/FKBP12-ERCC1 (7,4 мг/мл) (см. Фиг.8). В другом рабочем цикле в систему инжектировали раствор, содержащий SlyD/FKBP12 (9,5 мг/мл)-контроль (см. Фиг.7). В другом рабочем цикле в систему инжектировали раствор, содержащий SlyD Thermus thermophilus-IGF-1(74-90) (3 мг/мл) (см. Фиг.18). В другом рабочем цикле в систему инжектировали раствор, содержащий SlyD/FKBP12-IGF-1(74-90) (5,4 мг/мл) (см. Фиг.36). Детектор УФ/Вид был настроен на длину волны 280 нм. Данные оценивали согласно инструкциям производителя с помощью программного обеспечения Dionex 6.80 SP2 Build 2284. Калибровку системы выполняли с помощью стандарта молекулярных масс Oriental Yeast, Cat 46804000.
На Фиг.8 показан профиль элюирования с Ni-NTA колонки аффинно очищенного SlyD/FKBP12-ERCC1. По результатам интегрирования площади всего профиля элюирования 91,5% площади под кривой приходилось на пик No. 5 (1310,319 mAU), который элюировался с временем удерживания 12,37 мин. Профиль свидетельствует о том, что гибридный полипептид SlyD/FKBP12-ERCC1 является мономерным. Мономерный гибридный полипептид был получен уже после первоначального этапа очистки на Ni-NTA колонке.
Скрининг кинетики связывания
Гибридный полипептид SlyD/FKBP12-ERCC1 использовали в исследовании связывания с помощью поверхностного плазменного резонанса. Для определения кинетики связывания антитела согласно модели Ленгмюра целесообразно использовать мономерные и моновалентные аналиты в растворе. Кроме того, в исследованиях методом поверхностного плазменного резонанса целесообразно использовать аналит с повышенным, т.е. с большим молекулярным весом для повышения массочувствительности. В то же время необходимо обеспечивать доступность эпитопа.
Схема скринингового исследования с применением BIAcore приведена на Фиг.9.
Сравнительные кинетические исследования проводили на инструменте BIAcore A100 под контролем программного обеспечения версии V1.1. В биосенсор BIAcore устанавливали чип СМ5 и согласно инструкциям производителя выполняли гидродинамическую адресацию. После этого выполняли кондиционирование чипа. В качестве проточного буфера использовали HBS-EP (10 мМ HEPES, рН 7,4, 150 мМ NaCl, 1 мМ EDTA, 0,05% (вес/об) Р20). Композицию захватывающего поликлонального антитела анти-IgG Fc в концентрации 30 мкг/мл в 10 мМ натрий-ацетатном буфере (рН 4,5) концентрировали в зонах 1, 2, 4 и 5 в проточных ячейках 1, 2, 3 и 4. Антитело иммобилизовали при помощи ковалентного связывания с использованием NHS/EDC до уровня 10,000 RU. Затем сенсор деактивировали раствором 1 М этаноламина. Зоны 1 и 2 использовали для определения, а зоны 2 и 4 использовали как референсные. Перед нанесением на сенсор чип супернатанты гибридом разводили 1:5 буфером HBS-EP. Разведенный раствор наносили при скорости потока 30 мкл/мин в течение 1 мин. Вслед за этим инжектировали полученный антиген, такой как гибридный полипептид FKBP12, при скорости потока 30 мкл/мин в течение 2 мин. Затем регистрировали сигнал в течение последующих 5 мин. Регенерацию сенсора проводили путем инжектирования 10 мМ раствора глицин-HCl (рН 1,7) в течение 2 мин при скорости потока 30 мкл/мин. Сигнал, зарегистрированный незадолго до окончания инжектирования антигена обозначали как связывание в поздней фазе (binding late, BL). Сигнал, зарегистрированный незадолго до окончания записи диссоциации, обозначали как стабильность в поздней фазе (stability late, SL). Оба показателя нанесены на одном графике. Отобранные антитела имеют значение показателя связывания в поздней фазе, равное значению показателя стабильности в поздней фазе. Эти антитела занимают на графике область вблизи линии тренда, где BL=SL.
На Фиг.10 показаны данные отобранных анти-ERCC1 антител. Можно заметить, что взаимодействие SlyD/FKBP12-ERCC1 является высокоспецифичным. Взаимодействие с контрольным образцом SlyD/FKBP12 не было зарегистрировано. В целом, неспецифического связывания не было отмечено.
На Фиг.11 показан анализ валентности антител. Показано количество антигена, выраженное в единицах ответа (связывание в поздней фазе, RU), которое являлось насыщающим для антитела, экспонированного на поверхности (уровень иммобилизации, RU). Линии тренда и стрелки на Фиг.11 указывают валентности (молярное соотношение) антител, экспонированных на поверхности. Все сестринские клоны (ID 5.00х.35) занимают коридор валентностей MR 0,5 - MR 1,0, тогда как все другие клоны занимают коридор ниже MR 0,5, что указывает на их сниженную функциональность. Функционального связывания с контролем SlyD/FKBP12 зарегистрировано не было.
На Фиг.12 приведены количественные показатели по результатам скрининга кинетики связывания. Все 6 сестринских клонов (от 5.001.35 до 5.006.35) имеют удовлетворительные значения показателей связывания в поздней фазе и стабильности в поздней фазе. Значение kd скорости диссоциации (1/s) указывает на высокую стабильность антигенного комплекса, удовлетворяющую требованиям, предъявляемым к антителу, пригодному для иммуногистохимии. Рассчитанное время полужизни стабильного антигенного комплекса t1/2дисс составляет 204 мин для всех 6 сестринских клонов.
На Фиг.13 в качестве примера приведен график кинетики связывания клона 5.003.35 с аналитами SlyD/FKBP12-ERCC1 и SlyD/FKBP12-контроль. Поскольку SlyD/FKBP12-ERCC1 представляет собой стабильный, растворимый и мономерный аналит, он прекрасно соответствует модели диссоциации 1:1 Ленгмюра (черная линия на первичных показателях диссоциации, указанных красным). Неспецифического связывания не определялось. Взаимодействия с контролем SlyD/FKBP12 не определялось.
Вестерн блоттинг
На Фиг.14 показаны результаты исследования клона 5.001.35 методом вестерн-блоттинга. Вестерн блоттинг может показать, будет ли антитело пригодно для иммуногистохимии.
Для вестерн блоттинга в лунки 4-12% геля NuPAGE SDS (Invitrogen) загружали 5 мкг клеточного лизата OVCAR-3 и 5 мкг клеточного лизата HEK-293. Ни одна из клеточных линий не была предварительно обработана, например, подвергнута радиоактивному излучению или обработке цисплатином.
Вестерн блоттинг выполняли в соответствии со стандартными протоколами с буферами и реагентами NuPAGE (Invitrogen). Антитело 5.001.35 использовали в концентрации 50 нг/мл. Инкубацию с первичным антителом проводили в течение 30 мин при комнатной температуре (RT). Для проявки мембраны использовали Lumilmager вместе с реагентом LumiLight согласно инструкциям производителя (Roche Applied Science, Mannheim, Germany). Эндогенный ERCC1 в базальной концентрации специфически определялся при вестерн блоттинге в виде одной полосы, соответствующей 37 кДа.
Иммуногистохимические эксперименты
На Фиг.15 приведены результаты иммуногистохимического определения ERCC1 в зафиксированной в формалине и заключенной в парафин опухолевой ткани человека. Для иммуногистохимического определения были подготовлены 2 мкм срезы образцов опухоли при мелкоклеточном раке легкого. Все процедуры окрашивания проводились с применением аппарата для автоматизированной иммуногистохимической окраски Ventana Benchmark XT с применением реагентов и буферов Ventana в соответствии с инструкцией по эксплуатации от производителя. Первичное антитело (клон
Заключение
В отличие от пептида ERCC1, имеющего низкий молекулярный вес (2 кДа) каркас, использовавшийся здесь, является высокомолекулярным аналитом (36 кДа), позволяющим добиться усиления сигнала при скрининговом исследовании кинетики связывания с помощью поверхностного плазменного резонанса.
Применение пептидного реагента для скрининга связано с риском отбора антител, распознающих концы пептидов, чего можно полностью избежать при использовании технологии с применением каркасов согласно данному описанию, когда пептид встраивают между N-концом и C-концом внутри полипептида. Несмотря на размещение множества метастабильных пептидных вставок каркасный гибридный полипептид в целом является стабильным, растворимым и мономерным. Кинетику связывания в рамках модели 1:1 Ленгмюра можно легко проанализировать при помощи биосенсоров.
Применение гибридного полипептида в данной системе позволяет смоделировать ситуацию, имеющую место при иммуногистохимической окраске зафиксированных в формалине и заключенных в парафин образцов, следовательно, гибридный полипептид представляет собой подходящий реагент для скрининга при создании антител, подходящих для иммуногистохимии.
Гибридный полипептид содержит свернутый участок, произведенный на основе SlyD, и развернутый или частично развернутый участок, произведенный на основе человеческого FKBP12, за счет чего по меньшей мере его единственный внутренний остаток Trp оказывается открытым для контактов с растворителем, как это показано в случае SlyD/FKBP12-ERCC1, но не связано никакой теорией. SlyD способен к обратимому фолдингу и обладает термической стабильностью, достаточной для технических приложений.
Каркас SlyD/FKBP-12 является подходящей платформой для моделирования разнообразия мотивов вторичной структуры пептидов, представленных в зафиксированных в формалине и заключенных в парафин тканях при иммуногистохимических экспериментах (см. выше Abe, et al. (2003)).
Гибридный полипептид является более предпочтительным иммуногеном по сравнению с полноразмерным полипептидом, из которого получена встроенная (иммуногенная) аминокислотная последовательность, например, с учетом растворимости, обратимого фолдинга (ренатурации/денатурации) и отсутствия дисульфидных связей для правильной укладки. Гибридный полипептид согласно данному описанию предоставляет каркас, в который встраивается иммуногенная аминокислотная последовательность. Он стабилизирует структуру встроенной иммуногенной аминокислотной последовательности (за счет понижения конформационной энтропии, что не связано никакой теорией). Не связываясь никакой теорией предполагают, что N-концевой гибридный полипептид SlyD поддерживает весь химерный гибридный полипептид в растворимой и термодинамически стабильной, но частично развернутой форме.
Rebuzzini, G. (диссертационная работа, выполненная в университете Milano-Bicocca (Италия) (2009)) описал исследование домена NS3 хеликазы вируса гепатита C с целью применения в хемилюминесцентном иммунологическом анализе. В своей работе Rebuzzini сообщает, что химерный FKBP12, применявшийся в качестве иммуногена для презентирования домена NS3 хеликазы со встроенными последовательностями согласно Knappe, Т.A., et al. (J. Mol. Biol. 368 (2007) 1458-1468), является термодинамически нестабильным. Это согласуется с нашими наблюдениями, в которых химерный компонент FKBP12 в составе гибридного полипептида SlyD-FKBP12-антиген является частично или полностью развернутым. В отличие от наблюдений Rebuzzini, здесь было установлено, что гибридный полипептид SlyD/FKBP12-антиген является мономерным и стабильным.
Пример 11
Получение антител, специфических к IGF-1(74-90)
Антиген-специфические антитела были получены при иммунизации мышей химерным гибридным полипептидом SlyD Thermus Thermophilus-антиген. На поверхности каркаса в качестве мишеней может быть представлено множество эпитопов, среди которых путем дифференциального скрининга с применением SlyD дикого типа Thermus Thermophilus в качестве отрицательного контроля или нативного рекомбинантного антигена (IGF-1) в качестве положительного контроля, можно идентифицировать антитела, связывающиеся с целевым антигеном. В следующем примере показаны свойства производных SlyD архебактерий в сравнении с потенциально метастабильным человеческим FKBP12. SlyD Thermus Thermophilus позволяет презентировать жесткие и стабильные структуры, характеризующиеся высокой энтальпией, и следовательно, подходит для создания моноклональных антител, направленных против нативных белковых структур.
Получение гибридных полипептидов Thermus thermophilus SlyD
Гуанидингидрохлорид (GdmCI) (A-grade) был приобретен в NIGU (Waldkraiburg, Germany). Таблетированный не содержащий ЭДТА ингибитор протеаз Complete®, имидазол и ЭДТА были приобретены в Roche Diagnostics GmbH (Mannheim, Germany), все другие химические реагенты аналитической степени чистоты были приобретены в Merck (Darmstadt, Germany). Мембраны для ультрафильтрации (YM10, YM30) были приобретены в Amicon (Danvers, MA, USA), мембраны для микродиализа (VS/0,025 мкм) и приспособления для ультрафильтрации (фильтровальные устройства Biomax ultrafree) были приобретены в Millipore (Bedford, MA, USA). Мембраны из нитроцеллюлозы и ацетат-целлюлозы (размер пор 1,2 мкм, 0,45 мкм и 0,2 мкм) для фильтрации неочищенного лизата были приобретены в Sartorius (Goettingen, Germany).
Клонирование экспрессионных кассет
Последовательность полипептида SlyD из Thermus thermophilus была взята из базы данных SwissProt (асе. no. Q72H58). Последовательность полипептида SlyD из Thermococcus gammatolerans была взята из базы данных Prosite (ace. то. С5А738). Синтетические гены, кодирующие SlyD Thermus thermophilus, SlyD Thermus thermophilus-IGF-1(74-90), и SlyD-ΔIF Thermus thermophilus были приобретены в Sloning Biotechnology GmbH (Germany) и клонированы в вектор экспрессии pQE80L. Кодоны были оптимизированы для экспрессии в клетках-хозяевах Е.coli. Синтетические гены, кодирующие SlyD Thermococcus gammatolerans, SlyD Thermococcus gammatolerans-IGF-2(53-65), SlyD Thermus thermophilus-антиген и SlyD Thermococcus gammatolerans-атиген были приобретены в Geneart (Germany) и клонированы в вектор экспрессии рЕТ24 (Novagen, Madison, Wisconsin, USA). Кодоны были оптимизированы для экспрессии в клетках-хозяевах Е.coli.
Дополнительно, к карбокси-концу были пришиты GS-линкер (GGGS, SEQ ID NO:81) и гистидиновая метка для обеспечения аффинной очистки гибридных полипептидов при помощи хроматографии с использованием иммобилизованных ионов металла.
Для создания моноклональных антител, специфически связывающихся с фрагментом IGF-1 74-90 (аминокислотная последовательность NKPTGYGSSSRRAPQTG, SEQ ID NO:92), к аминокислотной последовательности соответствующего пептида был пришит молекулярный шаперон SlyD, полученный путем делеции аминокислот 68-120 исходного белка Thermus thermophilus. Для модификации угла вставки IGF-1, Asp в положении 70 и Leu в положении 88 были заменены на Gly (D70G и L88G). Таким образом, гибридный полипептид имеет аминокислотную последовательность:

В качестве контроля использовали нативный SlyD дикого типа из Thermus thermophilus:

Для скрининга и исследования специфичности был произведен гибридный полипептид SlyD-ΔIF Thermus thermophilus. Гибридный полипептид SlyD-ΔIF Thermus thermophilus не имеет IF домена, который был замещен на мотив аминокислотной последовательности AGSGSS, и содержит C-концевую маркерную аминокислотную последовательность согласно SEQ ID NO:16:
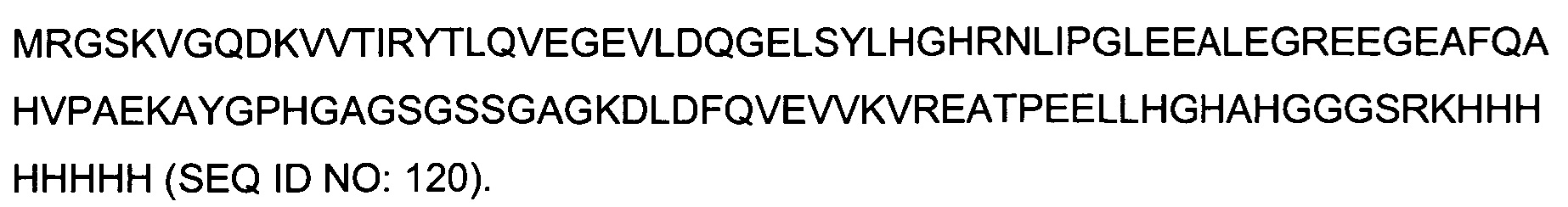
В качестве контроля использовали нативный SlyD из Thermococcus gammatolerans, содержащий C-концевую маркерную аминокислотную последовательность согласно SEQ ID NO:16:

Для контроля на перекрестную реактивность в SlyD Thermococcus gammatolerans была встроена гомологичная последовательность шпилечной структуры из человеческого IGF-2(53-65), которая С-концом была сшита с GS-линкером и гексагистидиновой меткой:

Экспрессия, очистка и рефолдинг гибридных полипептидов
Все полипептиды SlyD могут быть очищены и подвергнуты рефолдингу с использованием по существу идентичных протоколов. Клетки Е.coli BL21 (DE3), несущие конкретную экспрессирующую плазмиду, выращивали при 37°С в среде LB, содержащей соответствующий антибиотик для селективного выращивания (канамицин 30 мкг/мл или ампициллин (100 мкг/мл)), до OD600=1,5, а сверхэкспрессию в цитозоле индуцировали путем добавления 1 мМ изопропил-β-D-тиогалактозида (IPTG). Через три часа после индукции клетки собирали путем центрифугирования (20 мин при 5000 g), замораживали и хранили при -20°С. Для лизиса клеток замороженный осадок ресуспендировали в охлажденном 50 мМ натрий-фосфатном буфере (рН 8,0) с добавлением 7 М GdmCl и 5 мМ имидазола. Затем суспензию перемешивали в течение 2-10 часов на льду для завершения клеточного лизиса. После центрифугирования (25000 g, 1 ч) и фильтрации (нитроцеллюлозная мембрана, 8,0 мкм, 1,2 мкм, 0,2 мкм), лизат наносили на Ni-NTA колонку, уравновешенную лизирующим буфером. При последующем этапе отмывки концентрацию имидазола увеличивали до 10 мМ (в 50 мМ натрий-фосфатном буфере (рН 8,0), содержащем 7 М GdmCl, 5,0 мМ ТСЕР), и добавляли 5 мМ ТСЕР для поддержания тиоловых компонентов в восстановленной форме и для предупреждения преждевременного образования дисульфидных мостиков. Добавляли по меньшей мере от 15 до 20 объемов восстанавливающего промывочного буфера. Затем раствор GdmCl заменяли на 50 мМ натрий-фосфатный буфер (рН 8,0), содержащий 100 мМ NaCl, 10 мМ имидазол и 5 мМ ТСЕР, для индукции рефолдинга связанного с матриксом гибридного полипептида SlyD. Во избежание реактивации совместно очищающихся протеаз, в буфер для рефолдинга добавляли коктейль ингибиторов протеаз (Complete® EDTA-free, Roche). Всего в течение ночи буфер для рефолдинга использовали в объеме, равном 15-20 объемам колонки. Затем ТСЕР и коктейль ингибиторов Complete® EDTA-free удаляли путем отмывания 50 мМ натрий-фосфатным буфером (рН 8,0), содержащим 100 мМ NaCl и 10 мМ имидазола, в объеме, равном 10 объемам колонки. На последнем этапе отмывки (10 объемов колонки) концентрацию имидазола увеличивали до 30 мМ для удаления стойких примесей. Нативный полипептид элюировали путем внесения 250 мМ имидазола в том же буфере. При помощи электрофореза в трициновом ДСН-ПАГ оценивали степень чистоты фракций, содержащих белок (Schaegger, Н. и von Jagow, G., Anal. Biochem. 166 (1987) 368-379), и объединяли их. После этого белок подвергали эксклюзионной хроматографии (SuperdexTM HiLoad, Amersham Pharmacia) с применением фосфата калия в качестве буферной системы (50 мМ калий-фосфатный буфер (рН 7,0), 100 мМ KCl, 0,5 мМ EDTA). В заключение содержащие белок фракции объединяли и концентрировали в патронах Amicon (YM10) до концентрации ~5 мг/мл.
УФ спектроскопия
Концентрацию белков определяли с помощью двухлучевого спектрофотометра UVIKON XL. Молярные коэффициенты поглощения (λ280) для вариантов SlyD рассчитывали согласно Расе (Расе, С.N., et al., Protein Sci. 4 (1995) 2411-2423).
Спектроскопия кругового дихроизма
Для исследования способности химерных гибридных белков согласно изобретению принимать свернутую конформацию изучали спектры кругового дихроизма в ближнем УФ диапазоне. Спектры кругового дихроизма регистрировали и оценивали при помощи прибора JASCO J-720 и программного обеспечения JASCO согласно рекомендациям производителя. Использовали кварцевую кювету с длиной оптического пути 0,2 см. Прибор был настроен на режим детектирования 1, с разрешением 1°С, ширина полосы составляла 1 нм, а чувствительность 5 м°. Буфер для образцов представлял собой 50 мМ фосфат калия рН 7,5, 100 мМ NaCl, 1 мМ ЭДТА. Концентрация белкового аналита в каждом анализе составляла: 36 мкМ SlyD дикого типа Thermus thermophilus, 23 мкМ SlyD-ΔIF Thermus thermophilus, 16 мкМ SlyD Thermus thermophilus-антиген, 19 мкМ SlyD дикого типа Thermococcus gammatolerans и 16 мкМ SlyD Thermococcus gammatolerans-антиген. Сигналы кругового дихроизма в диапазоне между 250 нм и 330 нм с разрешением 0,5 нм и скоростью сканирования 20 нм в минуту регистрировали при 20°С. В следующем экспериментальном воплощении сигналы КД регистрировали при изменении температуры (20°С - 100°С) и (100°С - 20°С) для производных SlyD Thermococcus gammatolerans и (20°С - 85°С) и (85°С - 20°С) для производных SlyD Thermus thermophilus, соответственно, при постоянной длине волны 277 нм. Изменение температуры составляло 1°С в мин.
На Фиг.27 показаны наложенные графики трех спектров КД гибридных полипептидов SlyD дикого типа Thermus thermophilus, SlyD-ΔIF Thermus thermophilus и SlyD Thermus thermophilus-антиген. Графики КД показывают, что при 20°С все гибридные полипептиды свернуты в свою нативную структуру, даже когда IF домен отсутствует или замещен аминокислотной вставкой.
На Фиг.28 показан температуро-зависимый спектр КД гибридного полипептида SlyD Thermus thermophilus-антиген в ближнем УФ диапазоне в градиенте температур от 20°С до 85°С. SlyD Thermus thermophilus-антиген подвергается обратимому разворачиванию и рефолдингу.
В заданных физических условиях полного разворачивания SlyD Thermococcus gammatolerans-антиген не происходит даже при 100°С (см. Фиг.29). Чрезвычайная стабильность доменов FKBP архебактерий позволяет осуществлять модификацию полипептидов путем замены их IF доменов при сохранении в то же время общей стабильности вновь созданных химерных каркасных белков.
Иммунизация мышей Thermus thermophilus SlyD-IGF-1(74-90) и создание моноклональных антител к IGF-1
8-12 недельных мышей Balb/c и NMRI подвергали повторным внутрибрюшинным иммунизациям 100 мкг SlyD Thermus Thermophilus-IGF-1(74-90). Мышей иммунизировали три раза, через 6 и 10 недель после первоначальной иммунизации. Первую иммунизацию проводили с применением полного адъюванта Фрейнда, вторую и третью иммунизацию проводили с применением неполного адъюванта Фрейнда. Титры антител к нативному рекомбинантному IGF-1 и SlyD Thermus Thermophilus-IGF-1(74-90) в сыворотке мышей определяли через 12 недель при помощи метода ИФА согласно описанию ниже. Через 12 недель в сыворотке определяли титры антител при помощи ИФА. ИФА выполняли на приборе Tecan Sunrise со встроенной программой: V3.15 19/03/01; XREAD PLUS версия: V4.20. Многолуночные планшеты Nunc Maxisorb F покрывали SlyD Thermus Thermophilus-IGF-1(74-90) путем нанесения раствора, содержащего 0,5 мкг полипептида в мл. Изолированный антиген IGF-1 иммобилизовали в лунках многолуночных планшетов StreptaWell High Bind SA путем нанесения раствора, содержащего 90 нг/мл биотинилированного IGF-1. Затем свободные сайты связывания блокировали путем нанесения раствора, содержащего 1% RPLA в PBS в течение 1 ч при комнатной температуре. Лунки отмывали три раза раствором, содержащим 0,9% (вес/об) хлорид натрия и 0,05% (вес/об) Tween. В качестве образцов использовали мышиную сыворотку, разведенную 1:50 в PBS. Как вариант выполняли дальнейшее ступенчатое разведение 1:4 до конечного разведения 1:819,200. Время инкубации составляло 1 час при комнатной температуре. Лунки отмывали три раза раствором, содержащим 0,9% (вес/об) хлорид натрия и 0,05% (вес/об) Tween. В качестве детектирующего антитела использовали поликлональное антитело против константного домена целевых антител, конъюгированное с пероксидазой (PAK
За три дня до забора клеток селезенки и сплавления с клетками миеломной клеточной линии, выполняли заключительную бустерную иммунизацию при помощи внутривенной инъекции 100 мкг гибридного полипептида SlyD Thermus Thermophilus-IGF-1(74-90). Получение первичных культур гибридомы может выполняться согласно методике Koehler и Milstein (Koehler, G. и Milstein, С., Nature. 256 (1975) 495-497).
Скрининг при помощи ИФА
Реакционную способность супернатантов первичных культур в отношении иммуногена SlyD Thermus Thermophilus-IGF-1(74-90), биотинилированного нативного IGF-1 и SlyD дикого типа Thermus Thermophilus измеряли относительно «холостого» планшета при помощи ИФА. ИФА выполняли на приборе Tecan Sunrise со встроенной программой: V3.15 19/03/01; XREAD PLUS версия: V4.20. Многолуночные планшеты Nunc Maxisorb F покрывали раствором гибридных полипептидов SlyD с концентрацией 5 мкг/мл. Многолуночные планшеты StreptaWell High Bind SA покрывали раствором рекомбинантного биотинилированного антигена IGF-1 с концентрацией 125 нг/мл. Затем свободные сайты связывания блокировали 1% RPLA в PBS в течение 1 ч при комнатной температуре. Лунки отмывали три раза раствором, содержащим 0,9% (вес/об) хлорид натрия и 0,05% (вес/об) Tween. В качестве образцов использовали неразведенные супернатанты гибридом в среде RPMI 1640. Время инкубации составляло 1 час при комнатной температуре. Лунки отмывали три раза раствором, содержащим 0,9% (вес/об) хлорид натрия и 0,05% (вес/об) Tween. В качестве детектирующего антитела использовали поликлональное антитело против константного домена целевых антител, конъюгированное с пероксидазой (PAK<М-Fcγ>S-F(ab')2-POD). Детектирующее антитело наносили в концентрации 80 нг/мл в PBS, содержащем 1% (вес/об) кроличьего сывороточного альбумина. Время инкубации составляло 1 час при комнатной температуре. Лунки отмывали три раза раствором, содержащим 0,9% (вес/об) хлорид натрия и 0,05% (вес/об) Tween. После этого лунки инкубировали с раствором ABTS в течение 15 мин при комнатной температуре. Интенсивность развивающейся окраски определяли фотометрически при длине волны 405 нм. Референсная длина волны составляла 492 нм. Супернатанты первичных гибридом, демонстрирующие быстрое развитие выраженного окрашивания в ИФА при связывании рекомбинантного IGF-1, SlyD Thermus Thermophilus-IGF-1(74-90) и слабее связывающиеся с SlyD Thermus Thermophilus отбирали для скрининга кинетики связывания согласно описанию ниже.
Скрининг кинетики связывания с помощью метода SPR
SlyD Thermus Thermophilus-IGF-1(74-90), нативный рекомбинантный IGF-1, нативный рекомбинантный IGF-2, SlyD дикого типа Thermus Thermophilus и SlyD Thermus Thermophilus-IGF-1(74-90) использовали при скрининге кинетики связывания с помощью метода SPR. В исследованиях методом SPR при определении кинетики связывания антитела согласно модели Ленгмюра принято использовать мономерные и моновалентные аналиты в растворе. Кроме того, при исследованиях методом SPR целесообразно использовать аналит с более высоким молекулярным весом для повышения чувствительности измерений, поскольку SPR является масс-чувствительным методом анализа.
Скрининг кинетики связывания выполняли с помощью инструмента BIAcore А100 под контролем программного обеспечения версии V1.1. В аппарат устанавливали чип BIAcore CM5 и согласно инструкциям производителя выполняли гидродинамическую адресацию и кондиционирование. В качестве проточного буфера использовали HBS-EP (10 мМ HEPES (рН 7,4), 150 мМ NaCl, 1 мМ EDTA, 0,05% (вес/об) Р20). Захватывающее поликлональное кроличье антитело против Fc фрагмента IgG мыши иммобилизовали в концентрации 30 мкг/мл в 10 мМ натрий-ацетатном буфере (рН 4,5) в зонах 1, 2, 4 и 5 в проточных ячейках 1, 2, 3 и 4 до уровня 10,000 RU (Фиг.23). Антитело иммобилизовали при помощи ковалентного связывания с использованием NHS/EDC. Затем сенсор деактивировали при помощи 1М раствора этаноламина. Зоны 1 и 5 использовали для определения, а зоны 2 и 4 использовали как референсные. Перед нанесением на сенсор-чип супернатанты гибридомы разводили 1:2 в буфере HBS-EP. Разведенный раствор наносили при скорости потока 30 мкл/мин в течение 1 мин. Непосредственно после этого инжектировали аналит, такой как SlyD Thermus Thermophilus-IGF-1(74-90), гибридный полипептид инжектировали при скорости потока 30 мкл/мин в течение 2 мин. Затем регистрировали сигнал в фазе диссоциации на протяжении 5 мин. Сенсор регенерировали путем инжектирования раствора 10 мМ глицин-HCl (рН 1,7) в течение 2 мин при скорости потока 30 мкл/мин. Для описания кинетики связывания использовали два показателя: сигнал, зарегистрированный незадолго до окончания инжектирования аналита, обозначаемый как связывание в поздней фазе (BL) и сигнал, зарегистрированный незадолго до окончания времени диссоциации, стабильность в поздней фазе (SL).
Кроме того, в соответствии с моделью Ленгмюра рассчитывали константу скорости диссоциации kd (1/s) и рассчитывали время полужизни комплекса антитело/антиген в минутах по формуле In(2)/(60*kd).
Антитела получали путем иммунизации антигеном SlyD Thermus Thermophilus-IGF-1(74-90), и скрининга с применением SlyD Thermus Thermophilus-IGF-1(74-90), SlyD дикого типа Thermus Thermophilus, нативного IGF-1 и нативного IGF-2. Технология, основанная на применении каркасов, позволила получить антитела, специфически связывающиеся с заданным эпитопом шпилечной структуры IGF-1.
Затем из первичных культур методом предельного разведения согласно известным способам были получены кленовые культуры. У супернатантов клоновых культур определяли аффинность и специфичность при помощи функциональных исследований.
Характеризация супернатантов клоновых культур, продуцирующих антитела, с помощью биосенсора BIAcore
Инструмент BIAcore T200 (GE Healthcare) использовали с установленным в систему сенсором BIAcore CM5. Сенсор прекондиционировали путем инжектирования в течение 1 мин 0,1% SDS, 50 мМ NaOH, 10 мМ HCl и 100 мМ H3PO4 при скорости 100 мкл/мин.
Системный буфер представлял собой PBS-DT (10 мМ Na2HPO4, 0,1 мМ KH2PO4, 2,7 мМ KCl, 137 мМ NaCl, 0,05% Tween® 20, 5% DMSO). Буфером для образцов являлся системный буфер.
Система BIAcore T200 находилась под контролем программного обеспечения V1.1.1. Поликлональное кроличье IgG антитело
Супернатанты клоновых культур, содержащие соответствующие антитела в концентрации приблизительно 40 нМ, иммобилизовали в течение 2 мин при скорости потока 5 мкл/мин на поверхности
В данном документе используются следующие термины: mAb: моноклональное антитело; RU: относительные единицы ответа моноклонального антитела, иммобилизованного на сенсоре; антиген: антиген в растворе; кДа: молекулярный вес антигенов, инжектированных в качестве аналитов в растворе; ka: константа скорости ассоциации; kd: константа скорости диссоциации; t1/2 дисс: время полужизни комплекса антитело-антиген, рассчитанное по формуле t1/2 дисс = In(2)/60*kd; KD: константа диссоциации; RMAX: сигнал в конце фазы ассоциации при связывании аналита, инжектированного в количестве 90 нМ; MR: молярное соотношение; Хи2: неудовлетворительный результат измерения; n.d.: не определялось.
На Фиг.25 показано, что у полученных с применением каркаса моноклональных антител М-11.11.17 и М-10.7.9 аффинность к IGF-1 находилась в пикомолярном диапазоне. Перекрестной реактивности с IGF-2, или SlyD дикого типа Thermus thermophilus, или SlyD дикого типа Thermococcus gammatolerans, или с гибридным полипептидом SlyD-ΔIF Thermus thermophilus, или с гибридным полипептидом SlyD Thermococcus gammatolerans-IGF-2(53-65) обнаружено не было.
М-2.28.44 представляет собой моноклональное антитело, полученное при обычной иммунизации мышей рекомбинантным человеческим IGF-1. Несмотря на то, что аффинность антитела к IGF-1 находится на уровне 30 пМ, при концентрации 500 пМ обнаруживается перекрестная реактивность с IGF-2. При использовании SlyD Thermus thermophilus-IGF-1(74-90) и SlyD Thermococcus gammatolerans-IGF-2(53-65) в качестве аналита можно установить, что эпитоп, перекрестно реагирующий с IGF-2, находится вне области шпилечной структуры IGF.
Пример 12
Производство анти-PLGF антител
Мышей иммунизировали иммуногеном, содержащим последовательность PLGF(60-76). Затем получали гибридомы и выполняли ИФА и скрининг кинетики связывания (для подробного описания процедур см. Примеры 10 и 11).
В процессе скрининга кинетики связывания для выявления супернатантов первичных культур, обладающих связывающей активностью в отношении PLGF(60-76), использовали SlyD/FKBP12-PLGF и биотинилированный пептид PLGF(60-76)-би, который был отдельно пришит к стрептавидину. Кинетика связывания для обоих аналитов соответствовала модели 1:1 Ленгмюра, однако при наличии каркаса кривая диссоциации выглядела более предпочтительно, а значение хи2 было меньше, чем в случае биотинилированного пептида с пришитой стрептавидиновой меткой. По сравнению с тщательно приготовленной стептавидиновой меткой, методика скрининга с применением каркаса обеспечивает такие преимущества, как мономерное состояние и лучшая доступность эпитопа, находящегося в каркасе, что не связано никакой теорией.
Антитела, полученные при помощи данного подхода, например, как клон 53.4.1, были способны специфически распознавать PLGF в вестерн блоттинге.
Пример 13
Анти-IGF-1 антитела, полученные с применением SlyD-FKBP12-IGF-1(74-90)
Гибридные полипептиды SlyD/FKBP12-IGF-1(74-90) (см. Фиг.2 и 8) и SlyD/FKBP12-контроль (см. Фиг.7), были произведены в E.coli (вектор pQE80L/клеточная линия E.coli BL21 CodonPlus-RP) согласно известным способам. 8-12 недельных мышей Balb/c и NMRI подвергали повторным внутрибрюшинным иммунизациям 100 мкг SlyD/FKBP12-IGF-1(74-90).
Через 10 недель определяли титр антител в сыворотке при помощи ИФА. Многолуночные планшеты Nunc Maxisorb F покрывали SlyD/FKBP12-IGF-1(74-90) путем нанесения раствора, содержащего 0,41 мкг полипептида в мл. Изолированный антиген IGF-1 иммобилизовали в лунках многолуночных планшетов StreptaWell High Bind SA путем нанесения раствора, содержащего 90 нг/мл биотинилированного IGF-1. Затем свободные сайты связывания блокировали путем нанесения раствора, содержащего 1% RPLA в PBS в течение 1 ч при комнатной температуре. Лунки отмывали три раза раствором, содержащим 0,9% (вес/об) хлорид натрия и 0,05% (вес/об) Tween. В качестве образцов использовали мышиную сыворотку, разведенную 1:50 в PBS. Как вариант выполняли дальнейшее ступенчатое разведение 1:4 до конечного разведения 1:819,200. Время инкубации составляло 1 час при комнатной температуре. Лунки отмывали три раза раствором, содержащим 0,9% (вес/об) хлорид натрия и 0,05% (вес/об) Tween. В качестве детектирующего антитела использовали поликлональное антитело против константного домена целевых антител, конъюгированное с пероксидазой (PAK<М-Fcγ>S-F(ab')2-POD). Детектирующее антитело наносили в концентрации 80 нг/мл в PBS, содержащем 1% (вес/об) кроличьего сывороточного альбумина. Время инкубации составляло 1 час при комнатной температуре. Лунки отмывали три раза раствором, содержащим 0,9% (вес/об) хлорид натрия и 0,05% (вес/об) Tween. После этого лунки инкубировали с раствором ABTS в течение 15 мин при комнатной температуре. Интенсивность развивающейся окраски определяли фотометрически. На Фиг.19 показаны полученные титры в сыворотке мышей. Более низкие титры были получены при иммунизации SlyD/FKBP12-IGF-1(74-90), при сравнении с иммунизацией SlyD Thermus thermophilus-IGF-1(74-90) (Фиг.20). Дальнейшую работу с антителами проводили согласно описанию в Примере 12. В результате не удалось отобрать антитела, связывающиеся с IGF-1, при помощи скрининга кинетики связывания с применением BIAcore, описанного ранее.
Пример 14
Антитела, полученные с применением гибридного полипептида FKBP12/13
Гибридный полипептид согласно данному описанию, использовавшийся в данных примерах, содержит участок, полученный из человеческого FKBP12 и участок, полученный из FKBP13 Arabidopsis thaliana. Гибридный полипептид, состоящий из по меньшей мере одной аминокислотной последовательности человеческого FKBP12 и по меньшей мере одной аминокислотной последовательности FKBP13 Arabidopsis thaliana может термодинамически стабилизировать человеческий FKBP12 в виде каркаса, что позволит и избежать сшивания N-конца FKBP12 со SlyD E.coli. Для FKBP13 характерно наличие дисульфидной связи. Эта последовательность FKBP13 была пересажена на FKBP12 для стабилизации химерного полипептида для дальнейших модификаций аминокислотных последовательностей.
Химерный гибридный полипептид FKBP12/13, содержащий C-концевую маркерную аминокислотную последовательность согласно SEQ ID NO:16, имеет последовательность:

Гибридный полипептид FKBP12/13 был экспрессирован в E.coli, согласно описанию, в виде растворимого и мономерного белка. Регистрацию спектров КД проводили как описано в Примере 12. Спектры КД показали, что гибридный полипептид FKBP12/13 свернут при 20°С.
Пример 15
Создание гибридного полипептида SlyD-FKBP12/13-CSF1R
Полипептид экспрессировали в E.coli, как было описано выше, и очищали, как было описано выше. После аффинной очистки на Ni-NA колонке выполняли эксклюзионную хроматографию. 50 мг белка загружали на колонку HiLoad 26/60 SuperdexTM 75 pg (GE Healthcare). Элюированные фракции загружали в нативный гель и разделяли согласно известным методам.
После аффинной очистки гибридный полипептид диализировали против 50 мМ KH2PO4 буфера, рН 7,0, содержащего 100 мМ KCl и 0,5 мМ ЭДТА, и фильтровали через фильтр с порами 0,22 мкм. SlyD/FKBP12/13-CSF1R характеризовали при помощи спектроскопии в УФ и видимом диапазоне в концентрации 1,19 мг/мл, используя коэффициент экстинкции е=20525 л⋅моль-1⋅см-1, рассчитанный для полипептида 39744,9 Да.
Для исследования конформации SlyD/FKBP12/13-CSF1R определяли флуоресценцию белка. FKBP12 С22А, служащий носителем для полипептидных вставок, можно использовать в качестве референтного образца, поскольку единственный Trp компонента FKBP12 можно использовать для определения структурной целостности компонента FKBP12 (Scholz, С., et al., J. Biol. Chem. 271 (1996) 12703-12707; Russo, A.T., et al., J. Mol. Biol. 330 (2003) 851-866). FKBP12 С22А в нативной структуре имеет один пик в спектре флуоресценции при 320 нм (Zoldak, G., et al., J. Mol. Biol. 386 (2009) 1138-1152).
250 мкл SlyD-FKBP12/13-CSF1R с концентрацией 1,19 мг/мл в KH2PO4 буфере, рН 7,0 исследовали при различных температурах. KH2PO4 буфер, рН 7,0 использовали в качестве референтного образца. Использовали прибор Cary Eclipse с программным обеспечением Scan Software версии 1.1(132), ширина полосы возбуждения и эмиссии составляла 5 нм. Сканирование в диапазоне длин волн 300 нм - 425 нм проводили со скоростью 120 нм/мин. Собственную флуоресценцию триптофана возбуждали при длине волны 280 нм.
Пример 16
Технология обратного скрининга с применением каркаса для отбора антител, связывающихся с антигеном
Мышей NMRI в возрасте 6 недель 3-кратно иммунизировали внутрибрюшинно рекомбинантным химерным гибридным полипептидом, содержащим элемент SlyD Thermococcus gammadurans-антиген (TgSlyD-антиген), в количестве 100 мкг. Через 10 недель мышам проводили две бустерные инъекции 25 мкг TgSlyD-антиген. Клетки гибридомы получали согласно известным методам. Первичные гибридомы выделяли путем предельного разведения и проводили их скрининг на связывание антигена при помощи ИФА.
30x 384 луночных планшетов (Nunc) в течение ночи при 4°С покрывали отдельно гибридным полипептидом TgSlyD-антиген в концентрации 50 нг/мл, TgSlyDΔIF в концентрации 50 нг/мл и изолированным антигеном в концентрации 1 мкг/мл. Использовали буфер для иммобилизации, свежеприготовленный из 1 таблетки карбоната-бикарбоната (Sigma, C3041-100CAP99), растворенной в 100 мл бидистиллированной H2O (ddH2O). 100 мкл отмывочного буфера (150 мМ NaCl, 10 мл Tween 20 (Sigma), 40 мл Bromidox L (Roche) в 1 л dH2O). Лунки троекратно отмывали 100 мкл отмывочного буфера (150 мМ NaCl, 10 мл Tween20 (Sigma), 40 мл Bromidox L (Roche) в 1 л dH2O) с помощью устройства для отмывки планшетов BioTek. Лунки блокировали 30 мкл блокирующего буфера (10 г BSA, 10 таблеток PBS (Gibco) в 1 л ddH2O) в течение 1 часа при комнатной температуре, с последующей троекратной отмывкой 100 мкл отмывочного буфера. 30 мкл разведенных 1:1000 супернатантов гибридом переносили в лунки при помощи устройства Liquidator и инкубировали в течение 1 часа при комнатной температуре. В качестве положительного контроля использовали антиген-позитивную сыворотку. Лунки отмывали троекратно 100 мкл отмывочного буфера. Конъюгированный с пероксидазой F(ab')2 фрагмент козьего антитела к IgG мыши (Dianova) разводили 1:30000 в блокирующем буфере и добавляли по 30 мкл в каждую лунку. После инкубации в течение 1 часа при комнатной температуре проводили троекратную отмывку 100 мкл отмывочного буфера. В каждую лунку вносили 30 мкл готового к употреблению субстрата ABTS и инкубировали в течение 30 мин при комнатной температуре. Оптическую плотность регистрировали с помощью считывающего устройства PowerWave XS (BioTek) при 405 нм/492 нм. 15 культур гибридом, продемонстрировавших в ИФА положительные результаты в отношении гибридного полипептида, содержащего TgSlyD-антиген, и изолированного антигена и отсутствие сигналов в отношении гибридного полипептида, содержащего TgSlyDΔIF, были отобраны для дальнейшего культивирования.
Были собраны супернатанты первичных культур гибридом и проведен их обратный скрининг на связывание антигена при помощи второго ИФА, который выполняли аналогично описанию выше. При втором скрининге для уточнения специфичности антител, содержащихся в культуральных супернатантах, использовали дополнительные реагенты для скрининга.
384-луночные планшеты (Nunc) покрывали в течение часа при комнатной температуре гибридным полипептидом TgSlyD-антиген в концентрации 50 нг/мл, TgSlyDΔIF в концентрации 50 нг/мл, гибридным полипептидом ttSlyD-антиген в концентрации 500 нг/мл и изолированным антигеном в концентрации 1 мкг/мл. ИФА выполняли как описано выше. Вследствие происхождения из разных биологических видов T.th.SlyD и T.g.SlyD имеют незначительную гомологию последовательностей. Только 36% аминокислот являются идентичными и в соответствии с расчетами с использованием матрицы blossom 62 степень сходства последовательностей составляет только 48%. В любом случае, TgSlyDΔIF не имеет вставки. Следовательно, полипептиды очень хорошо подходят для применения в обратном скрининге при помощи ИФА.
Таким образом, при иммунизации с применением суррогатного каркасного полипептида мишенью может быть выбран специфический эпитоп в домене нативного антигена.
Пример 17
Картирование эпитопа
Гибридные полипептиды SlyD-FKBP могут также нести вставки сложных мотивов аминокислот, как, например, вторичные структуры, имеющие дисульфидные связи. Поскольку гибридные полипептиды не содержат цистеина, рефолдинг на колонке в соответствующих условиях облегчает правильное формирование дисульфидных связей внутри вставки, чему дополнительно способствует шаперонная функция самого SlyD. Гибридные полипептиды SlyD-FKBP были экспрессированы в E.coli и подвергнуты рефолдингу на колонке, как описано выше. SlyD-FKBP12-контроль в концентрации 9,5 мг/мл диализировали в 75 мМ буфере HEPES (рН 7,5), содержащем 150 мМ NaCl, 6,5% (вес/об) сахарозы, 10 мМ цистеина. Порцию гибридного полипептида SlyD-FKBP12-CD81 с концентрацией 1 мг/мл диализировали в 50 мМ калий-фосфатном буфере, рН 7,0, содержащем 100 мМ NaCl, 1 мМ ЭДТА, во избежание перераспределения дисульфидных связей во вставке CD81, содержащей 4 цистеина, формирующих две дисульфидные связи, имеющие важное структурно-функциональное значение. Гибридные полипептиды SlyD-FKBP12-CD81 и SlyD-FKBP12-контроль использовали в целях картирования эпитопов.
Человеческий CD81 представляет собой рецептор гликопротеина Е2 оболочки вируса гепатита С. CD81 является трансмембранным белком, принадлежащим к семейству тетраспанинов. CD81 представляет собой гомодимерный белок размером 90 аминокислот, имеющим т.н. грибовидную структуру (PDB 1IV5). Остатки, задействованные в связывании вируса, могут быть картированы на т.н. "субдомене-шляпке" размером 35 аминокислот, что обеспечит возможность создания антивирусных лекарств и вакцин. Поскольку длина последовательности "субдомена-шляпки", участвующего в связывании вируса, составляет всего 35 аминокислот, затруднительно картировать эпитопы антитела на белке CD81 размером 10 кДа с помощью стандартного перекрестного конкурентного анализа. Трудно отличить антитела, которые специфически связываются непосредственно с соответствующим доменом в форме грибовидной "шляпки", от антител, связывающихся вблизи него или в другом участке структуры CD81LEL. Все антитела независимо от их сайта связывания будут конкурировать за связывание с белком оболочки HCV Е2, но не будут связываться специфически со структурой-мишенью, "доменом-шляпкой". Пересадка соответствующей структуры "домена-шляпки" на FKBP и последующее картирование эпитопа является эффективным методом по многим причинам. Во-первых, он позволяет обойти некоторые биохимические проблемы, связанные с белком CD81LEL, поскольку сам белок имеют склонность к олигомеризации. Во-вторых, достаточно удобно идентифицировать эпитопы антитела среди большого числа антител, все из которых связываются с полноразмерным белком CD81.
На Фиг.40 показаны результаты денатурирующего электрофореза в полиакриламидном геле (слева) и вестерн блоттинга (справа) SlyD-FKBP12-CD81, очищенного при помощи хроматографии на Ni-NTA колонке.
Инструмент BIAcore T200 (GE Healthcare) использовали при 25°C с установленным в систему сенсором BIAcore CM5. Сенсор прекондиционировали путем инжектирования в течение 1 мин 0,1% SDS, 50 мМ NaOH, 10 мМ HCl и 100 мМ H3PO4 при скорости 100 мкл/мин. В качестве проточного буфера использовали буфер HBS-EP (10 мМ HEPES (рН 7,4), 150 мМ NaCl, 1 мМ ЭДТА, 0,05% (вес/об) Р20). Буфером для образцов являлся системный буфер. Каждый белковый лиганд иммобилизовали с использованием EDC/NHS в концентрации 30 мкг/мл в 10 мМ натрий-ацетатном буфере (рН 4,0) в проточных ячейках 2, 3 и 4. Проточную ячейку 1 использовали в качестве референсной. Сенсор деактивировали при помощи раствора 1 М этаноламина, рН 8,0. Масса иммобилизованных на сенсоре соединений выражалась в следующих единицах ответа (RU): проточная ячейка 2: 1800 RU SlyD-FKBP12-крнтроль (32,8 кДа), проточная ячейка 3: SlyD-FKBP12-CD81 (35,8 кДа), проточная ячейка 4: 900 RU CD81LEL (10 кДа). В качестве аналита инжектировали 31 антитело (по 50 нМ каждого) при скорости 30 мкл/мин, фаза ассоциации составляла 3 мин, фаза диссоциации составляла 3 мин. 30 антител были получены в результате иммунизации белком CD81LEL размером 10 кДа. Для регенерации поверхности сенсора использовали 100 мМ HCl при скорости 20 мкл/мин в виде 3 последовательных инъекций по 30 сек при скорости 20 мкл/мин.
После вычитания сигнала, зарегистрированного в референсной ячейке (проточная ячейка 2 минус проточная ячейка 1, 3-1 и 4-1), сенсограммы анализировали при помощи программного обеспечения BIAcore Evaluation 4.1. Для количественной оценки максимального сигнала при связывании аналита фиксировали показатели в конце инжектирования аналита. Для нормализации данных наиболее высокий сигнал при связывании аналита принимали за 100%.
В следующей таблице приведены нормализованные ответы при связывании антител. Из 30 протестированных
Подтверждение результатов картирования эпитопов при помощи рентгеновского кристаллографического анализа
Fab фрагменты антител K05 и K04 кристаллизовали совместно с белком CD81-LEL и изучали при помощи рентгеновского дифракционного анализа (Seth Harris, PaloAlto). Полученное разрешение составляло 2,15 Å. Тогда как антитело K05 связывается в грибовидном домене, антитело K04 связывается с эпитопом за пределами последовательности грибовидного домена.
Реферат
Изобретение относится к области биотехнологии, конкретно к получению гибридных полипептидов для иммунизации, что может быть использовано в медицине. Получают гибридные полипептиды, которые способны индуцировать иммунный ответ против Xу животного, кроме человека, согласно формуле I и IIгдеXсодержит аминокислотную последовательность, которая представляет собой целевой антиген или иммуногенную последовательность и необязательно включает линкерную или адапторную последовательность,обозначает пептидную связь,Sи Sпредставляют собой пару последовательностей SEQ ID NO: 3 и 2 соответственно. Изобретение позволяет эффективно добиваться иммунного ответа на целевой антиген и получать антитела к целевому антигену. 9 н. и 5 з.п. ф-лы, 40 ил., 2 табл., 17 пр.
Формула












Документы, цитированные в отчёте о поиске
Ингибиторы ферментативной активности ротамазы, являющиеся малыми молекулами

Комментарии