Композиции белка f rsv и способы их получения - RU2585227C2
Код документа: RU2585227C2
Чертежи


















































































































































































Описание
РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет по патентной заявке США № 61/225805, поданной 15 июля 2009 года, и патентной заявке США № 61/294426, поданной 12 января 2010 года. Все идеи указанных выше заявок включены в настоящий документ в качестве ссылок.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Респираторно-синцитиальный вирус (RSV) представляет собой оболочечный несегментированный вирус с отрицательной РНК-цепью семейства Paramyxoviridae, род Pneumovirus. Он является наиболее частой причиной бронхиолита и пневмонии среди детей на первом году жизни. RSV также вызывает повторяющиеся инфекции, включающие тяжелое заболевание нижних дыхательных путей, которое может возникать в любом возрасте, особенно среди пожилых людей или людей с нарушениями сердечной, легочной или иммунной систем.
Для инфицирования клетки-хозяина парамиксовирусам, таким как RSV, подобно другим оболочечным вирусам, таким как вирус гриппа и ВИЧ, требуется слияние мембраны вируса с мембраной клетки-хозяина. В случае RSV консервативный белок слияния (F RSV) осуществляет слияние вирусной и клеточной мембраны путем сопряжения необратимого сворачивания белка и соседнего положения мембран. В современных моделях, основанных на исследованиях парамиксовирусов, белок F RSV первоначально сворачивается в метастабильную конформацию "до слияния". В процессе вхождения в клетку конформация "до слияния" претерпевает повторное сворачивание и конформационные изменения в его стабильную конформацию "после слияния".
Белок F RSV транслируется с мРНК в белок из приблизительно 574 аминокислот, обозначаемый как F0. Посттрансляционный процессинг F0 включает удаление N-концевого сигнального пептида с помощью сигнальной пептидазы в эндоплазматической сети. F0 также расщепляется в двух участках (приблизительно 109/110 и приблизительно 136/137) клеточными протеазами (в частности, фурином) в транс-аппарате Гольджи. Это расщепление обеспечивает удаление короткой встроенной последовательности и приводит к образованию двух субъединиц, обозначаемых как F1 (~50 кДа; C-концевая; приблизительно остатки 137-574) и F2 (~20 кДа; N-концевая; приблизительно остатки 1-109), которые остаются связанными друг с другом. F1 содержит гидрофобный пептид слияния на его N-конце, а также две амфипатические области с семичленными повторами (HRA и HRB). HRA находится вблизи пептида слияния, а HRB расположен вблизи трансмембранного домена. Три гетеродимера F1-F2 собираются в вирионе в качестве гомотримеров F1-F2.
Вакцина против инфекции RSV в настоящее время не доступна, но является желательной. Одним возможным подходом для получения вакцины является субъединичная вакцина на основе очищенного белка F RSV. Однако для этого подхода желательно, чтобы очищенный белок F RSV находился в единой форме и конформации, которая стабильна с течением времени, является постоянной между партиями вакцин и которую удобно очищать.
Белок F RSV можно укорачивать, например, путем делеции трасмембранного домена и цитоплазматичекого конца, для обеспечения его экспрессии в качестве эктодомена, который может быть растворимым. Дополнительно, хотя белок F RSV первоначально транслируется в качестве мономера, мономеры расщепляются и собираются в тримеры. Когда белок F RSV находится в форме расщепленных тримеров, экспонируется гидрофобный пептид слияния. Экспонированные гидрофобные пептиды слияния на различных тримерах, например, растворимых тримерах эктодомена, могут связываться друг с другом с образованием розеткообразных структур. Гидрофобные пептиды слияния также могут связываться с липидами и липопротеинами, например из клеток, которые используют для экспрессии рекомбинантного растворимого белка F RSV. Вследствие комплексности процессинга, структуры и сворачивания белка F RSV, очищенные гомогенные иммуногенные препараты трудно получить.
Таким образом, существует потребность в усовершенствованных композициях белка F RSV и в способах получения композиций белка F RSV.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к иммуногенным композициям, которые содержат один или более полипептидов F RSV и к определенным сконструированным белкам F RSV и нуклеиновым кислотам, которые кодируют сконструированные белки F RSV.
В одном аспекте белок F RSV является растворимым. Например, в белке F RSV могут быть удалены трансмембранная область и цитоплазматический конец. В некоторых аспектах растворимый F RSV содержит одно или более из: 1) одна или более мутаций в одном или обоих участках расщепления фурином, 2) одна или более мутаций в пептиде слияния, 3) одна или более мутаций в линкере p27, 4) добавленную последовательность олигомеризации, и 5) добавленную аминокислотную последовательность, которая обеспечивает участок расщепления протеазой. В дополнительных или альтернативных аспектах, белок F RSV представляет собой мономер, тример или комбинацию мономеров и тримеров. Тример может быть монодисперсным или в форме розеткообразных структур. В следующих дополнительных или альтернативных аспектах белок F RSV может быть в конформации "до слияния", промежуточной конформации или конформации "после слияния".
В одном аспекте иммуногенная композиция содержит один или более полипептидов F респираторно-синцитиального вируса (F RSV), в которых аминокислоты 100-150 заменены аминокислотной последовательностью SEQ ID NO: 9, SEQ ID NO: 12, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7; SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 91 или SEQ ID NO: 92. В некоторых вариантах осуществления полипептид F RSV является растворимым (например эктодомен).
В другом аспекте иммуногенная композиция содержит полипептид F RSV, в котором аминокислоты 100-150 в F RSV заменены аминокислотной последовательностью SEQ ID NO: 12. В некоторых вариантах осуществления полипептид F RSV является растворимым (например, эктодомен).
В другом аспекте иммуногенная композиция содержит полипептид F RSV, в котором аминокислоты 100-150 F RSV заменены аминокислотной последовательностью SEQ ID NO: 9, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7; SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 13 или SEQ ID NO: 92. В некоторых вариантах осуществления полипептид F RSV является растворимым (например эктодомен).
В другом аспекте иммуногенная композиция содержит полипептид F RSV, в котором аминокислоты 100-150 заменены аминокислотной последовательностью SEQ ID NO: 9. В некоторых вариантах осуществления полипептид F RSV является растворимым (например эктодомен).
В другом аспекте иммуногенная композиция содержит полипептид F RSV, где F RSV содержит аминокислоты 23-99 и 151-524 SEQ ID NO: 1 или SEQ ID NO: 2. В некоторых вариантах осуществления полипептид F RSV является растворимым (например эктодомен).
В одном аспекте иммуногенная композиция содержит полипептид, выбранный из группы, состоящей из SEQ ID NO: 49, SEQ ID NO: 68, SEQ ID NO: 71, SEQ ID NO: 25, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 31, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 37, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 85, SEQ ID NO: 86, SEQ ID NO: 87, SEQ ID NO: 88, SEQ ID NO: 89 и SEQ ID NO: 93. В некоторых вариантах осуществления сигнальный пептид и/или HIS-метка отсутствуют. В некоторых вариантах осуществления полипептид F RSV является растворимым (например эктодомен).
В одном аспекте иммуногенная композиция содержит SEQ ID NO: 68 или альтернативно SEQ ID NO: 68, в которой сигнальный пептид и, необязательно, HIS-метка отсутствуют.
В другом аспекте иммуногенная композиция содержит полипептид, выбранный из группы, состоящей из SEQ ID NO: 49, SEQ ID NO: 71 и любой из указанных выше последовательностей, в которых сигнальный пептид, и, необязательно, HIS-метка отсутствуют. В некоторых вариантах осуществления полипептид F RSV является растворимым (например эктодомен).
В предпочтительных вариантах осуществления иммуногенная композиция включает адъювант. Адъювант предпочтительно представляет собой соль алюминия, эмульсию типа "сквален-в-воде" (такую как MF59), соединение бензонафтиридина, фосфолипидное соединение (такое как E6020), низкомолекулярный иммуностимулятор или комбинацию двух или нескольких из указанных выше.
Другой аспект изобретения относится к рекомбинантным полипептидам F RSV. F RSV может быть в форме мономера, тримера, розеткообразных структур из тримеров или комбинации мономеров и тримеров. Рекомбинантный полипептид может включать гетерологичный домен олигомеризации, эпитоп или сигнальный пептид. Гетерологичный домен олигомеризации предпочтительно представляет собой домен тримеризации из гемагглютинина вируса гриппа, из spike вируса SARS, или из gp41 ВИЧ, NadA, модифицированного GCN4 или ATCase.
В одном аспекте в рекомбинантном полипептиде F RSV аминокислоты 100-150 заменены аминокислотной последовательностью SEQ ID NO: 9, SEQ ID NO: 12, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 91 или SEQ ID NO: 92. В некоторых вариантах осуществления полипептид F RSV является растворимым (например эктодомен).
В другом аспекте в рекомбинантном полипептиде F RSV аминокислоты 100-150 F RSV заменены аминокислотной последовательностью SEQ ID NO: 12. В некоторых вариантах осуществления полипептид F RSV является растворимым (например эктодомен).
В другом аспекте в рекомбинантном полипептиде F RSV аминокислоты 100-150 F RSV заменены аминокислотной последовательностью SEQ ID NO: 9, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7; SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 13 или SEQ ID NO: 92. В некоторых вариантах осуществления полипептид F RSV является растворимым (например эктодомен).
В другом аспекте в рекомбинантном полипептиде F RSV аминокислоты 100-150 F RSV заменены аминокислотной последовательностью SEQ ID NO: 9. В некоторых вариантах осуществления полипептид F RSV является растворимым (например эктодомен).
В одном аспекте рекомбинантный полипептид выбран из группы, состоящей из SEQ ID NO: 49, SEQ ID NO: 68, SEQ ID NO: 71, SEQ ID NO: 25, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 31, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 37, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 47, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 85, SEQ ID NO: 86, SEQ ID NO: 87, SEQ ID NO: 88, SEQ ID NO: 89, SEQ ID NO: 93, и любой их комбинации. Необязательно, сигнальный пептид и/или HIS-метка отсутствуют. В некоторых вариантах осуществления полипептид F RSV является растворимым (например эктодомен).
Другой аспект относится к нуклеиновым кислотам, кодирующим любой из указанных выше полипептидов. Нуклеиновая кислота может представлять собой самореплицирующуюся молекулу РНК.
Другой аспект изобретения относится к иммуногенной композиции, содержащей самореплицирующуюся РНК, которая кодирует полипептид F RSV. Иммуногенная композиция может включать систему для доставки.
Другой аспект изобретения относится к способам индукции иммунного ответа на F RSV путем введения любой из иммуногенных композиций.
Изобретение относится к способам получения композиций и к композициям, которые содержат белок F RSV, такой как растворимые полипептиды эктодомена F RSV, в том числе к иммуногенным композициям. Полипептиды эктодомена F RSV могут быть в единой форме, такой как нерасщепленные мономеры, нерасщепленные тримеры, расщепленные тримеры, или розеткообразные структуры расщепленных тримеров. Полипептиды эктодомена F RSV также могут быть в двух или более формах, например двух или более формах, которые существуют в равновесном состоянии, таком как равновесное состояние между нерасщепленными мономерами и нерасщепленными тримерами. Изобретение имеет несколько преимуществ. Например, присутствие единой желаемой формы F RSV в иммуногенной композиции обеспечивает более предсказуемый иммунный ответ, когда композицию вводят индивидууму, и более постоянную стабильность и другие физические и химические характеристики при включении в состав вакцины.
В одном аспекте изобретение относится к способу получения композиции, содержащей расщепленные полипептиды эктодомена белка F RSV. Способ включает a) предоставление нерасщепленных полипептидов эктодоменов белка F RSV, содержащих один или более участков расщепления протеазой, которые при расщеплении образуют фрагменты F1 и F2, и b) расщепление нерасщепленных полипептидов эктодоменов белка F RSV протеазой или протеазами, которые распознают участок или участки расщепления протеазой. Как правило, аминокислотная последовательность нерасщепленных полипептидов эктодомена белка F RSV содержит измененные участки расщепления фурином, и полипептиды эктодомена белка F RSV секретируются из клетки-хозяина, которая продуцирует их нерасщепленными в положении от аминокислоты 101 до аминокислоты 161, (например не расщеплены в участках расщепления фурином в положениях 106-109 и 131-136). В некоторых вариантах осуществления нерасщепленные полипептиды эктодомена белка F RSV, предоставленные в a), являются очищенными.
Нерасщепленные полипептиды эктодомена белка F RSV, предоставленные в a), могут содержать неизмененный пептид слияния или измененный пептид слияния (например, делеция пептида слияния или мутация пептида слияния). Когда нерасщепленные полипептиды эктодомена белка F RSV, предоставленные в a), содержат неизмененный пептид слияния, расщепление на стадии b) приводит к образованию розеткообразных структур тримеров. Когда нерасщепленные полипептиды эктодомена белка F RSV, предоставленные в a), содержат измененный пептид слияния, расщепление на стадии b) приводит к образованию тримеров.
Дополнительно способ может включать необязательную стадию очистки розеткообразных структур или тримеров, образующихся при расщеплении нерасщепленных полипептидов эктодомена белка F RSV. В предпочтительных вариантах осуществления расщепленные полипептиды эктодомена белка F RSV, продуцируемые этим способом, по существу не содержат липидов и липопротеинов.
В другом аспекте изобретение представляет собой способ получения композиции, содержащей нерасщепленные мономеры, тримеры или комбинацию мономеров и тримеров полипептида эктодомена белка F RSV. Способ включает a) предоставление биологического материала, который содержит нерасщепленные полипептиды эктодомена белка F RSV; и b) очистку нерасщепленных мономеров или тримеров полипептида эктодомена белка F RSV из биологического материала. Как правило, аминокислотная последовательность нерасщепленных полипептидов эктодомена белка F RSV содержит измененные участки расщепления фурином, и полипептиды эктодомена белка F RSV секретируются клеткой-хозяином, которая продуцирует их нерасщепленными в положении от аминокислоты 101 до аминокислоты 161, (например, не расщеплены в участках расщепления фурином в положениях 106-109 и 131-136). В некоторых вариантах осуществления аминокислотная последовательность нерасщепленных полипептидов эктодомена белка F RSV дополнительно содержит измененные участки расщепления трипсином, и полипептиды эктодомена белка F RSV не расщепляются трипсином в участке между аминокислотой 101 и аминокислотой 161. В других вариантах осуществления аминокислотная последовательность нерасщепленных полипептидов эктодомена белка F RSV дополнительно содержит измененный пептид слияния.
В некоторых вариантах осуществления нерасщепленные тримеры полипептида эктодомена белка F RSV очищают. В других вариантах осуществления нерасщепленные мономеры полипептида эктодомена белка F RSV очищают. В других вариантах осуществления смесь нерасщепленных мономеров и тримеров эктодомена белка F RSV, которые могут быть в состоянии динамического равновесия, очищают. В предпочтительных вариантах осуществления расщепленные полипептиды эктодомена белка F RSV, получаемые способом, по существу не содержат липидов и липопротеинов.
В другом аспекте изобретения предусмотрен способ получения композиции, содержащей расщепленные мономеры, тримеры или комбинацию мономеров и тримеров полипептида эктодомена белка F RSV. Способ включает a) предоставление биологического материала, который содержит расщепленные полипептиды эктодомена белка F RSV, которые содержат измененный пептид слияния; и b) очистку расщепленных полипептидов эктодомена белка F RSV из биологического материала.
В некоторых вариантах осуществления расщепленные тримеры полипептида эктодомена белка F RSV очищают. В других вариантах осуществления расщепленные мономеры полипептида эктодомена белка F RSV очищают. В других вариантах осуществления смесь расщепленных мономеров и тримеров эктодомена белка F RSV, которые могут находиться в состоянии динамического равновесия, очищают. В предпочтительных вариантах осуществления расщепленные полипептиды эктодомена белка F RSV, получаемые согласно способу, предпочтительно по существу не содержат липидов и липопротеинов. В другом варианте осуществления расщепленный тример эктодомена белка F RSV, содержащий измененный пептид слияния, очищают.
В других аспектах изобретение относится к композициям, включающим иммуногенные композиции, продуцируемые с использованием способов по изобретению.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На ФИГ. 1 представлена схема F RSV дикого типа (ФИГ. 1A) и конструкции эктодомена, в которой трансмембранный домен и цитоплазматический конец удалены и на С-конец добавлена необязательная HIS6-метка (ФИГ. 1B). Для ясности, нумерация остатков относится к штамму A2 F RSV дикого типа, начиная с N-концевого сигнального пептида, и не изменена в конструкциях, содержащих делеции аминокислот. На схеме обозначена сигнальная последовательность или сигнальный пептид (sp). На ФИГ. 1A представлена схема белка F RSV, демонстрирующая сигнальную последовательность или сигнальный пептид (SP), линкерную область p27, пептид слияния (FP), домен HRA (HRA), домен HRB (HRB), трансмембранную область (TM) и цитоплазматический конец (CT). Границы C-конца в эктодомене могут варьировать. На ФИГ. 1B представлена общая схема конструкции эктодомена F RSV, на которой изображены общие признаки со схемой на ФИГ. 1A и включая необязательную HIS6-метку (HIS-МЕТКА). Участки расщепления фурином присутствуют в положениях аминокислот 109/110 и 136/137. Также на ФИГ. 1C представлена аминокислотная последовательность аминокислот 100-150 F RSV (дикий тип) (SEQ ID NO: 108) и нескольких белков (Furmt-SEQ ID NO: 3; Furdel-SEQ ID NO: 4; Furx-SEQ ID NO: 6; Furx R113Q, K123N, K124N-SEQ ID NO: 5; Furx R113Q, K123Q, K124Q-SEQ ID NO: 92; Delp21 furx-SEQ ID NO: 7; Delp23 furx-SEQ ID NO: 8; Delp23 furdel-SEQ ID NO: 9; N-term Furin-SEQ ID NO: 10; C-term Furin-SEQ ID NO: 11; Fusion Peptide Deletion1-SEQ ID NO: 12; и Factor Xa-SEQ ID NO: 13), в которых один или оба участка расщепления фурином и/или область пептида слияния подвергнуты мутации или удалены. На ФИГ. 1C, символ "-" указывает на то, что аминокислота в этом положении удалена.
На ФИГ. 2 представлена аминокислотная последовательность С-конца от положения аминокислоты 488 до начала TM-области в F RSV (дикий тип) (SEQ ID NO: 94) и нескольких белках (SEQ ID NO: 95-100), которые содержат добавленные к ним участки расщепления протеазой. На ФИГ. 2, символ "-" указывает на отсутствие аминокислоты в этом положении.
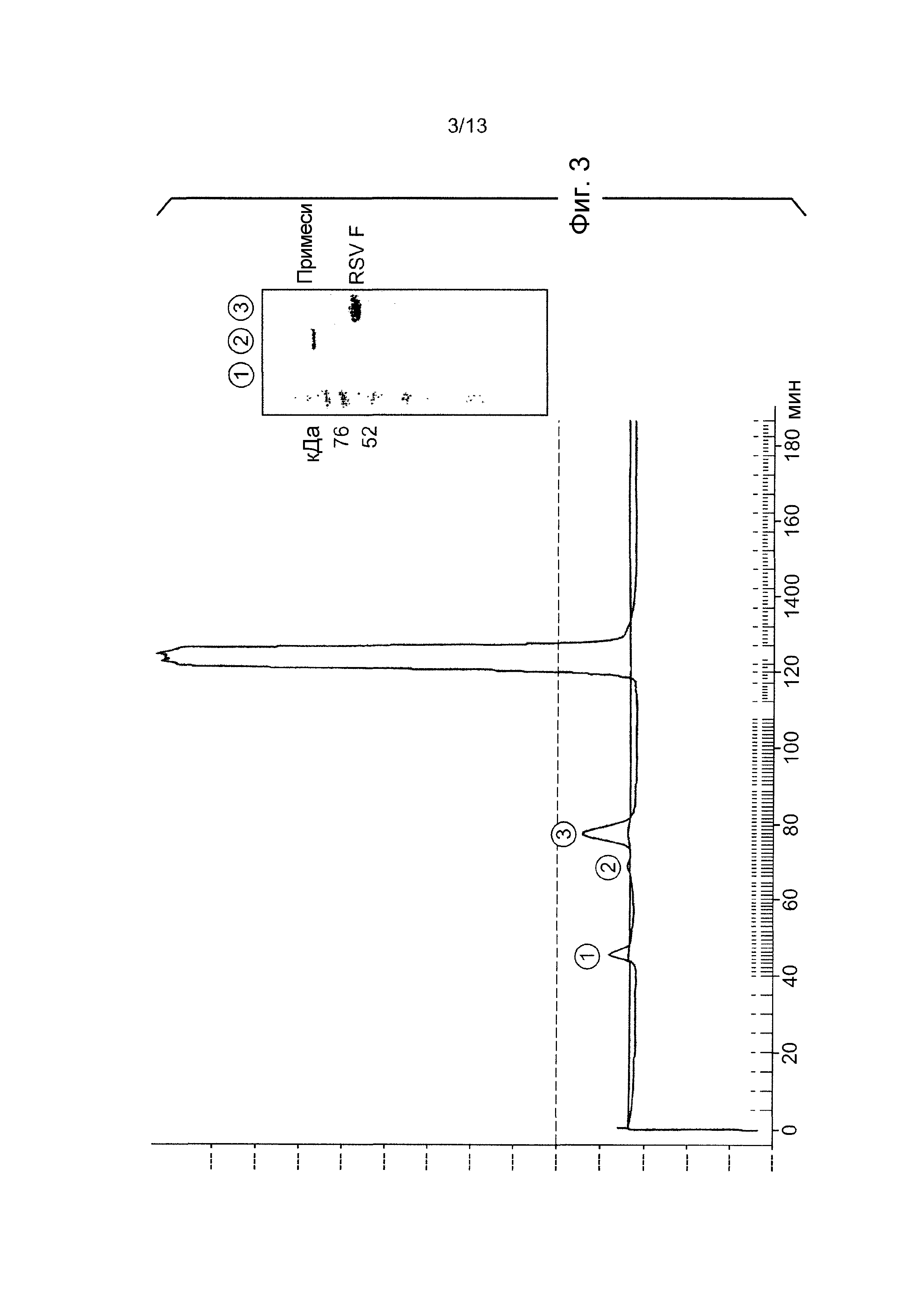
На ФИГ. 3 представлена хроматограмма и изображение электрофоретического геля, демонстрирующее очистку мономеров (3) F RSV с использованием эксклюзионной хроматографии.
На ФИГ. 4A-4F представлена нуклеотидная последовательность (SEQ ID NO: 101) плазмиды, кодирующей самореплицирующуюся молекулу РНК pT7-TC83R-FL.RSVF (A317), которая кодирует гликопротеин F респираторно-синцитиального вируса (RSV-F). Нуклеотидная последовательность, кодирующая RSV-F, подчеркнута.
На ФИГ. 5 представлено выравнивание аминокислотных последовательностей белков F из нескольких штаммов RSV. Выравнивание проводили с использованием алгоритма, описанного Corpet, Nucleic Acids Research, 1998, 16(22):10881-10890, с использованием параметров по умолчанию (таблица сравнения символов Blossum 62, штраф за внесение пропуска: 12, штраф за продолжение пропуска: A2, белок F штамма A2 (регистрационный номер AF035006) (SEQ ID NO: 102); CP52, белок F штамма CP52 (регистрационный номер AF013255) (SEQ ID NO: 103); B, белок F штамма B (регистрационный номер AF013254) (SEQ ID NO: 104); long, белок F штамма long (регистрационный номер AY911262) (SEQ ID NO: 105), и штамм 18537, белок F штамма 18537 (регистрационный номер Swiss Prot P13843) (SEQ ID NO: 106). Также представлена консенсусная последовательность белка F (SEQ ID NO: 107).
На ФИГ. 6 представлены значимые области эксклюзионных (SEC) хроматограмм для очистки выбранных антигенов F RSV. Основной пик, содержащий указанный антиген, показан звездочкой, а время удержания на колонке Superdex P200 16/60 (GE Healthcare) представлено в миллилитрах. На калиброванной колонке приблизительно время удержания 47 млс, 65 млс и 77 млс соответствует свободному объему колонки, удержанию тримера F RSV и удержанию мономера F RSV, соответственно. На ФИГ. 6A нерасщепленная конструкция Delp23 Furdel (Δp23 Furdel) очищена из пика мономера на уровне приблизительно 77 млс. Когда нерасщепленный антиген Delp23 Furdel F RSV обрабатывают трипсином, белок может образовывать розеткообразные структуры, которые после этого мигрируют на SEC в свободном объеме при приблизительно 47 млс (ФИГ. 6B). Расщепленные молекулы тримера F RSV с делецией пептида слияния очищены из пика тримера при времени удержания приблизительно 65 млс (ФИГ. 6C), хотя нерасщепленная конструкция Delp21 Furx (Δp21 Furx) очищена из пика мономера при приблизительно 77 млс (ФИГ. 6D).
На ФИГ. 7 представлены типичные EM-изображения для выбранных антигенов F RSV. На ФИГ. 7A представлено EM-изображение для F RSV Δp23 (Delp23) перед обработкой трипсином. Форма вилки на ФИГ. 7A, согласующаяся с конформацией тримера "после слияния", не всегда наблюдается в нерасщепленной конструкции Δp23 (Delp23) Furdel. Когда конструкцию Δp23 (Delp23) Furdel обрабатывали трипсином и очищали из свободного объема колонки SEC и наблюдали с помощью EM, было выявлено, что белки имеют принятые ими конформации розеткообразных структур (ФИГ. 7B). Когда конструкцию F RSV с делецией пептида слияния очищали из пика тримера на колонке SEC, наблюдали монодисперсную форму вилки, согласующуюся с тримером "после слияния" (ФИГ. 7C). На ФИГ. 7D представлены три препарата: Δp21 (Delp21) furx F RSV (обозначен как мономер), F RSV с делецией пептида слияния (дорожки, обозначенные как тример) и очищенные розеткообразные структуры F RSV (обозначенные как розеткообразные структуры). Гель содержит несколько дорожек GE Full Range Standard (стандарты молекулярной массы обозначены слева на геле), в то время как справа на геле указано приблизительное время удержания фрагментов F RSV.
На ФИГ. 8A-8C представлены графики, демонстрирующие, что мономеры (нерасщепленный Δp21 (Delp21) furx), розеткообразные структуры тримеров (расщепленный Δp23 (Delp23) Furdel) и тримеры (делеция пептида слияния) полипептидов эктодомена F RSV являются иммуногенными у хлопковых хомячков. Титры IgG против F RSV и нейтрализующих антител против RSV в сыворотке измеряли через 2 недели после 1 вакцинации (2wp1), 3 недели после 1 вакцинации (3wp1) и/или 2 недели после 2 вакцинации (2wp2).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к полипептидам и/или белкам F респираторно-синцитиального вируса (F RSV), иммуногенным композициям, содержащим полипептиды и/или белки F RSV, способам получения полипептидов и/или белков F RSV и композиций, содержащих полипептиды и/или белки F RSV, и к нуклеиновым кислотам, которые кодируют полипептиды и/или белки F RSV.
Как правило, иммуногенные композиции содержат полипептиды и/или белки F RSV, которые содержат мутации (например, замены, делеции или вставки), которые обеспечивают благоприятные характеристики, такие как одно или более из: 1) стабилизированная конформация "до слияния" или промежуточная (не "после слияния") конформация, 2) сниженное или устраненное экспонирование пептида слияния, 3) увеличенная стабильность (например, сниженная агрегация и/или деградация), и 4) более тесное сходство с активным вирусным белком F1/F2. Эти характеристики обеспечивают преимущества для иммуногенных композиций и для изготовления иммуногенных композиций. Например, как описано в настоящем документе, конформации белка F RSV не "после слияния" (т.е. конформация "до слияния", промежуточная конформация) могут быть лучшими иммуногенами и вызывать лучший ответ нейтрализующих антител. Снижение или устранение экспозиции пептида слияния, например, путем внесения мутаций или делеций в участки расщепления фурином, может снизить гидрофобность полипептида и упростить очистку, а также снизить или устранить связывание белка F RSV с клеточными мембранами у индивидуума, которому вводят этот белок. Увеличенная стабильность белка способствует получению иммуногенных композиций, в которых белок обладает сниженной тенденцией к агрегации или деградации, что обеспечивает более предсказуемый иммунный ответ, когда композицию вводят индивидууму. Наконец, мутантные полипептиды или белки F RSV, которые напоминают вирусный белок F1/F2, например, с делецией всей или части линкерной области p27, могут вызвать лучший ответ нейтрализующих антител. Другие преимущества изобретения описаны в настоящем документе.
Также изобретение относится к способам получения композиций, которые содержат белок F RSV, в частности, полипептиды эктодомена F RSV, и к композициям, включающим иммуногенные композиции, содержащие белок F RSV. Предпочтительно, полипептиды эктодомена F RSV находятся в единой форме или в динамическом равновесии между известными формами.
Определения
Как используют в настоящем документе "совокупность" относится более чем к одному полипептиду или белку F RSV, присутствующим в композиции. Совокупность может быть по существу гомогенной, в которой по существу все полипептиды или белки F RSV являются по существу одинаковыми (например, одинаковая аминокислотная последовательность, одинаковая конформация), гетерогенной, или она может иметь желаемую степень гомогенности (например, по меньшей мере, приблизительно 50%, по меньшей мере, приблизительно 55%, по меньшей мере, приблизительно 60%, по меньшей мере, приблизительно 65%, по меньшей мере, приблизительно 70%, по меньшей мере, приблизительно 75%, по меньшей мере, приблизительно 80%, по меньшей мере, приблизительно 85%, по меньшей мере, приблизительно 90%, по меньшей мере, приблизительно 95%, по меньшей мере, приблизительно 99% полипептидов или белков F RSV представляют собой конформацию "до слияния", представляют собой конформацию "после слияния", представляют собой мономеры или представляют собой тримеры).
"Конформация "после слияния"" белка F RSV представляет собой тример, характеризующийся присутствием пучка из шести спиралей, содержащего 3 области HRB и 3 области HRA.
"Конформация "до слияния" белка F RSV представляет собой конформацию, характеризующуюся тримером, который содержит тройную спираль, содержащую 3 области HRB.
Как используют в настоящем документе, "полипептид эктодомена F RSV" относится к полипептиду белка F RSV, который содержит по существу внеклеточную часть зрелого белка F RSV, с сигнальным пептидом (например, от приблизительно аминокислоты 1 до приблизительно аминокислоты 524, или от приблизительно аминокислоты 22 до приблизительно аминокислоты 524) или без него, но лишен трансмембранного домена и цитоплазматического конца встречающегося в природе белка F RSV.
Как используют в настоящем документе, "расщепленный полипептид эктодомена F RSV" относится к полипептиду эктодомена F RSV, который был расщеплен по одному или более положениям от приблизительно 101/102 до приблизительно 160/161 с образованием двух субъединиц, в которых одна из субъединиц содержит F1, а другая субъединица содержит F2.
Как используют в настоящем документе, "нерасщепленный на С-конце полипептид эктодомена F RSV" относится к полипептиду эктодомена F RSV, который был расщеплен по одному или более положениям от приблизительно 101/102 до приблизительно 131/132, и не был расщеплен по одному или более положениям от приблизительно 132/133 до приблизительно 160/161, с образованием двух субъединиц, в которых одна из субъединиц содержит F1, а другая субъединица содержит F2.
Как используют в настоящем документе, "нерасщепленный полипептид эктодомена F RSV" относится к полипептиду эктодомена F RSV, который не расщеплен в одном или более положениях от приблизительно 101/102 до приблизительно 160/161. Нерасщепленный полипептид эктодомена F RSV может представлять собой, например, мономер или тример.
Как используют в настоящем документе, "пептид слияния" относится к аминокислотам 137-154 белка F RSV.
Как используют в настоящем документе, "измененный пептид слияния" относится к пептиду слияния, в котором одна или более аминокислот независимо заменены или удалены, включая замену или делецию всех аминокислот из положений 137-154. Предпочтительно, расщепленные полипептиды эктодомена F RSV, которые содержат "измененный пептид слияния", не образуют розеткообразные структуры.
Как используют в настоящем документе, "очищенный" белок или полипептид представляет собой белок или полипептид, который продуцируют рекомбинантными или синтетическими способами, или который продуцируется его естественным хозяином, и который был выделен из других компонентов или из системы для рекомбинантной или синтетической продукции или естественного хозяина, так чтобы количество белка относительно других макромолекулярных компонентов, присутствующих в композиции, было существенно выше, чем в неочищенном препарате. Как правило, очищенный белок является, по меньшей мере, приблизительно на 50% гомогенным и более предпочтительно, по меньшей мере, приблизительно на 75%, по меньшей мере, приблизительно на 80%, по меньшей мере, приблизительно на 85%, по меньшей мере, приблизительно на 90%, по меньшей мере, приблизительно 95% или по существу гомогенным.
Как используют в настоящем документе, "по существу не содержит липидов и липопротеинов" относится к композициям, белкам и полипептидам, которые, по меньшей мере, приблизительно на 95% свободны от липидов и липопротеинов в расчете на массу, когда чистоту белка и/или полипептида (например полипептида F RSV) наблюдают на геле SDS PAGE, и общее содержание белка измеряют с использованием либо поглощения при УФ280, либо анализа BCA, и содержание липида и липопротеина определяют с использованием анализа с фосфолипазой C (Wako, код № 433-36201).
Как используют в настоящем документе, "измененный участок расщепления фурином" относится к аминокислотной последовательности в положениях приблизительно 106-109 и в положениях приблизительно 133-136 во встречающемся в природе белке F RSV, которая распознается и расщепляется фурином или фурин-подобными протеазами, но в нерасщепленном полипептиде эктодомена белка F RSV содержит одну или более аминокислотных замен, одну или более аминокислотных делеций, или комбинацию одной или более аминокислотных замен и одной или более аминокислотных делеций, так чтобы полипептид эктодомена F RSV, который содержит измененный участок расщепления фурином, секретировался из клетки, которая продуцирует его нерасщепленным в измененном участке расщепления фурином.
Признаки эктодоменов белка F RSV, пригодных для применения в этом изобретении, описаны в настоящем документе с указанием конкретных аминокислот, которые идентифицированы по положению аминокислот в последовательности белка F RSV их штамма A2 (SEQ ID NO: 1). Эктодомены белка F RSV могут иметь аминокислотную последовательность белка F из штамма A2 или любого другого желаемого штамма. Когда используют эктодомен белка F из штамма, отличного от штамма A2, аминокислоты белка F нумеруют на основании нумерации белка F из штамма A2, со вставкой пропусков при необходимости. Это можно осуществлять путем выравнивания последовательности любого желаемого белка F RSV с белком F штамма A2, как показано в настоящем документе для белков F из штамма A2, штамма CP52, штамма B, штамма long и штамма 18537. См. ФИГ. 5. Выравнивание последовательностей предпочтительно проводят с использованием алгоритма, описанного Corpet, Nucleic Acid Research, 1998, 16(22):10881-10890, с использованием параметров по умолчанию (таблица сравнения символов Blossum 62, штраф за внесение пропуска: 12, штраф за продолжение пропуска: 2).
Изобретение относится к растворимым полипептидам и белкам F RSV и иммуногенным композициям, содержащим растворимые полипептиды и белки F RSV, а также к композициям, содержащим нуклеиновые кислоты (например самореплицирующиеся молекулы РНК), которые кодируют растворимые полипептиды и белки F RSV.
Полипептиды F RSV (например полипептиды эктодоменов) могут быть в любой желаемой форме, как например, в единой форме, такой как нерасщепленные мономеры, нерасщепленные тримеры, расщепленные тримеры или розеткообразные структуры расщепленных тримеров. Полипептиды эктодомена F RSV также могут быть в двух или более формах, например, двух или более формах, которые существуют в равновесном состоянии, такое как равновесное состояние между нерасщепленными мономерами и нерасщепленными тримерами. Изобретение имеет несколько преимуществ. Например, присутствие единой желаемой формы RSV или динамического равновесия между известными формами в иммуногенной композиции обеспечивает более предсказуемый состав, растворимость и стабильность и более предсказуемый иммунный ответ при введении композиции индивидууму.
Предпочтительно, полипептиды эктодомена F RSV находятся в единой форме, такой как нерасщепленные мономеры, нерасщепленные тримеры, расщепленные тримеры, розеткообразные структуры расщепленных тримеров, или в состоянии динамического равновесия между подгруппой таких форм (например, равновесие между нерасщепленными мономерами и нерасщепленными тримерами).
В одном аспекте изобретения полипептиды и белки F RSV находятся в конформации "до слияния". Эпитопы конформации "до слияния" могут быть способны лучше индуцировать антитела, которые могут распознавать и нейтрализовать природные вирионы.
В одном варианте осуществления изобретения иммуногенная композиция содержит совокупность гликопротеинов F респираторно-синцитиального вируса в конформации "до слияния". В другом аспекте изобретения иммуногенная композиция содержит совокупность гликопротеинов F респираторно-синцитиального вируса, в которой не является предпочтительной конформация "после слияния" по сравнению с выделенными гликопротеинами F RSV.
Также изобретение относится к иммуногенной композиции, содержащей полипептид, который экспонирует эпитоп, присутствующий в конформации "до слияния" или в промежуточной конформации гликопротеина F респираторно-синцитиального вируса, но который лишен конформации гликопротеина F "после слияния".
Гликопротеин F
Гликопротеин F RSV контролирует проникновение вируса путем слияния между оболочкой вириона и плазматической мембраной клетки-хозяина. Он представляет собой интегральный белок типа I, однократно проходящий через мембрану, имеющий четыре основных домена: N-концевая транслоцирующая в ER сигнальная последовательность (SS), эктодомен (ED), трансмембранный домен (TM) и цитоплазматический конец (CT). CT содержит один пальмитоилированный остаток цистеина. Последовательность белка F является высоко консервативной среди изолятов RSV, но постоянно эволюционирует (7). В отличие от большинства парамиксовирусов, белок F в RSV может опосредовать вхождение и образование синцития, независимо от других вирусных белков (в других парамиксовирусах в дополнение к F обычно необходим HN).
мРНК F hRSV транслируется в белок-предшественник из 574 аминокислот, обозначаемый как F0, который содержит последовательность сигнального пептида на N-конце, которая удаляется сигнальной пептидазой в эндоплазматической сети. F0 расщепляется клеточными протеазами (в частности фурином) в двух участках (а.к. 109/110 и 136/137) в транс-аппарате Гольджи с удалением короткой гликозилированной встроенной последовательности и с образованием двух субъединиц, обозначенных как F1 (~50 кДа; C-конец; остатки 137-574) и F2 (~20 кДа; N-конец; остатки 1-109) (см., например, ФИГ. 1). F1 содержит гидрофобный пептид слияния на его N-конце, а также две гидрофобных области с семичленными повторами (HRA и HRB). HRA находится вблизи пептида слияния и HRB находится вблизи трансмембранного домена (см. например, ФИГ. 1). Гетеродимеры F1-F2 собираются в вирионе в качестве гомотримеров.
RSV существует в качестве единичного серотипа, но имеет две антигенных подгруппы: A и B. Гликопротеины F этих двух групп идентичны приблизительно на 90%. В изобретении можно использовать подгруппу A, подгруппу B или комбинацию или гибрид обеих из них. Примером последовательности для подгруппы A является SEQ ID NO: 1 (штамм A2; GenBank GI: 138251; Swiss Prot P03420), и для подгруппы B является SEQ ID NO: 2 (штамм 18537; GI: 138250; Swiss Prot P13843). Как SEQ ID NO: 1, так и SEQ ID NO: 2 представляют собой последовательности из 574 аминокислот. Сигнальный пептид в штамме A2 представляет собой а.к. 1-21, но в штамме 18537 он представляет собой 1-22. В обеих последовательностях TM-домен представляет собой приблизительно а.к. 530-550, но альтернативно он был описан в качестве 525-548.
SEQ ID NO: 1
1 MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIE 60
61 LSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPPTNNRARRELPRFMNYTLN 120
121 NAKKTNVTLSKKRKRRFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVS 180
181 LSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVN 240
241 AGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYV 300
301 VQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKV 360
361 QSNRVFCDTMNSLTLPSEINLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKT 420
421 KCTASNKNRGIIKTFSNGCDYVSNKGMDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDP 480
481 LVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNIMITTIIIVIIVILLS 540
541 LIAVGLLLYCKARSTPVTLSKDQLSGINNIAFSN 574
SEQ ID NO: 2
1 MELLIHRSSAIFLTLAVNALYLTSSQNITEEFYQSTCSAVSRGYFSALRTGWYTSVITIE 60
61 LSNIKETKCNGTDTKVKLIKQELDKYKNAVTELQLLMQNTPAANNRARREAPQYMNYTIN 120
121 TTKNLNVSISKKRKRRFLGFLLGVGSAIASGIAVSKVLHLEGEVNKIKNALLSTNKAVVS 180
181 LSNGVSVLTSKVLDLKNYINNRLLPIVNQQSCRISNIETVIEFQQMNSRLLEITREFSVN 240
241 AGVTTPLSTYMLTNSELLSLINDMPITNDQKKLMSSNVQIVRQQSYSIMSIIKEEVLAYV 300
301 VQLPIYGVIDTPCWKLHTSPLCTTNIKEGSNICLTRTDRGWYCDNAGSVSFFPQADTCKV 360
361 QSNRVFCDTMNSLTLPSEVSLCNTDIFNSKYDCKIMTSKTDISSSVITSLGAIVSCYGKT 420
421 KCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKLEGKNLYVKGEPIINYYDP 480
481 LVFPSDEFDASISQVNEKINQSLAFIRRSDELLHNVNTGKSTTNIMITTIIIVIIVVLLS 540
541 LIAIGLLLYCKAKNTPVTLSKDQLSGINNIAFSK 574
В изобретении может быть использована любая желаемая аминокислотная последовательность F RSV, такая как аминокислотная последовательность SEQ ID NO: 1 или 2, или последовательность, обладающая идентичностью с SEQ ID NO: 1 или 2. Как правило, она обладает, по меньшей мере, 75% идентичностью с SEQ ID NO: 1 или 2, например, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% идентичностью с SEQ ID NO: 1 или 2. Последовательность может быть встречающейся в природе в RSV.
Когда в изобретении используется эктодомен белка F, целиком или частично, он может содержать:
(i) полипептид, содержащий аминокислоты приблизительно 22-525 SEQ ID NO: 1.
(ii) полипептид, содержащий аминокислоты приблизительно 23-525 SEQ ID NO: 2.
(iii) полипептид, содержащий аминокислотную последовательность, обладающую, по меньшей мере, 75% идентичностью (например, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% идентичностью) с (i) или (ii).
(iv) полипептид, содержащий фрагмент (i), (ii) или (iii), где фрагмент содержит, по меньшей мере, один эпитоп белка F. Фрагмент обычно имеет длину, по меньшей мере, приблизительно 100 аминокислот, например, по меньшей мере, приблизительно 150, по меньшей мере, приблизительно 200, по меньшей мере, приблизительно 250, по меньшей мере, приблизительно 300, по меньшей мере, приблизительно 350, по меньшей мере, приблизительно 400, по меньшей мере, приблизительно 450 аминокислот.
Эктодомен может представлять собой форму F0 с сигнальным пептидом или без него, или он может содержать две отдельных пептидных цепи (например субъединицу F1 и субъединицу F2), которые ассоциированы друг с другом, например, субъединицы могут быть связаны дисульфидной связью. Таким образом, в эктодомене могут отсутствовать все или часть аминокислот от приблизительно 101 до приблизительно 161, такие как аминокислоты 110-136. Таким образом, эктодомен, целиком или частично, может содержать:
(v) первую пептидную цепь и вторую пептидную цепь, которая ассоциирована с первой полипептидной цепью, где первая пептидная цепь содержит аминокислотную последовательность, обладающую, по меньшей мере, 75% идентичностью (например, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99%, или даже 100% идентичностью) с от приблизительно аминокислоты 22 до приблизительно аминокислоты 101 SEQ ID NO: 1 или с от приблизительно аминокислоты 23 до приблизительно аминокислоты 101 SEQ ID NO: 2, и вторая пептидная цепь содержит аминокислотную последовательность, обладающую, по меньшей мере, 75% идентичностью (например, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99%, или даже 100% идентичностью) с от приблизительно аминокислоты 162 до приблизительно 525 SEQ ID NO: 1 или с аминокислотами приблизительно с 162 по 525 SEQ ID NO: 2.
(vi) первую пептидную цепь и вторую пептидную цепь, которая ассоциирована с первой полипептидной цепью, где первая пептидная цепь содержит аминокислотную последовательность, содержащую фрагмент от приблизительно аминокислоты 22 до приблизительно аминокислоты 101 SEQ ID NO: 1 или от приблизительно аминокислоты 23 до приблизительно аминокислоты 109 SEQ ID NO: 2, и вторая пептидная цепь содержит фрагмент от приблизительно аминокислоты 162 до приблизительно аминокислоты 525 SEQ ID NO: 1 или от приблизительно аминокислоты 161 до приблизительно аминокислоты 525 SEQ ID NO: 2. Один или оба фрагмента содержат, по меньшей мере, один эпитоп белка F. Фрагмент в первой пептидной цепи обычно имеет длину, по меньшей мере, 20 аминокислот, например, по меньшей мере, 30, по меньшей мере, 40, по меньшей мере, 50, по меньшей мере, 60, по меньшей мере, 70, по меньшей мере, 80 аминокислот. Фрагмент во второй пептидной цепи обычно имеет длину, по меньшей мере, 100 аминокислот, например, по меньшей мере, 150, по меньшей мере, 200, по меньшей мере, 250, по меньшей мере, 300, по меньшей мере, 350, по меньшей мере, 400, по меньшей мере, 450 аминокислот.
(vii) молекулу, получаемую расщеплением (i), (ii), (iii) или (iv) фурином.
Таким образом, аминокислотная последовательность, используемая для изобретения, может встречаться в природе в белке F RSV (например растворимый белок F RSV, лишенный TM и CT, аминокислоты приблизительно 522-574 SEQ ID NO: 1 или 2), и/или он может иметь одну или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30) единичных аминокислотных мутаций (инсерций, делеций или замен) относительно природной последовательности RSV. Например, известна мутация белков F для устранения их последовательностей расщепления фурином, тем самым, для предупреждения внутриклеточного процессинга. В определенных вариантах осуществления, белок F RSV лишен TM и CT (аминокислоты приблизительно 522-574 SEQ ID NO: 1 или 2) и содержит одну или более (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30) единичных аминокислотных мутаций (инсерций, делеций или замен) относительно природной последовательности RSV.
Мутации в участках расщепления фурином, расщепления трипсином и в пептиде слияния
Полипептиды или белки F RSV могут содержать одну или более мутаций, которые препятствуют расщеплению по одному или обоим участкам расщепления фурином (т.е. аминокислоты 109 и 136 SEQ ID NO: 1 и 2). Эти мутации могут предотвращать агрегацию растворимых полипептидов или белков и, тем самым, упрощать очистку; они могут предотвращать слияние клетка-клетка, если белок F RSV экспрессируется на поверхности клетки, например, путем экспрессии из вирусного репликона (например частицы репликона альфавируса), или если белок F RSV является компонентом вирусоподобной частицы. Эти мутации, отдельно или в комбинации с другими мутациями, описанными в настоящем документе, также могут стабилизировать белок в конформации "до слияния".
Примеры пригодных мутаций участка расщепления фурином включают замену аминокислотных остатков 106-109 в SEQ ID NO: 1 или 2 на RARK (SEQ ID NO: 77), RARQ (SEQ ID NO: 78), QAQN (SEQ ID NO: 79) или IEGR (SEQ ID NO: 80). Альтернативно или дополнительно аминокислотные остатки 133-136 SEQ ID NO: 1 или 2 можно заменять RKKK (SEQ ID NO: 81), ΔΔΔR, QNQN (SEQ ID NO: 82), QQQR (SEQ ID NO: 83) или IEGR (SEQ ID NO: 80). (Δ указывает на то, что аминокислотный остаток удален). Эти мутации можно комбинировать, если желательно, с другими мутациями, описанными в настоящем документе, такими как мутации в области p27 (аминокислоты 110-136 SEQ ID NO: 1 или 2), включая делецию области p27 целиком или частично.
Эти мутации участка расщепления фурином можно комбинировать, если желательно, с другими мутациями, описанными в настоящем документе, такими как мутации участка расщепления трипсином и мутации пептида слияния. Примеры пригодных мутаций участка расщепления трипсином включают делецию любого остатка лизина или аргинина приблизительно между положением 101 и положением 161 SEQ ID NO: 1 или 2, или замену любого такого остатка лизина или аргинина аминокислотой, отличной от лизина или аргинина. Например, остатки лизина и/или аргинина в области p27 (приблизительно аминокислоты 110-136 SEQ ID NO: 1 или 2) можно заменять или удалять, включая делецию области p27 целиком или частично.
В конкретных вариантах осуществления последовательность аминокислотных остатков 100-150 полипептида или белка F RSV, такая как SEQ ID NO: 1, SEQ ID NO: 2 или их растворимые эктодомены, представляет собой
(Furmt) TPATNNRARKELPRFMNYTLNNAKKTNVTLSKKRKKKFLGFLLGVGSAIAS (SEQ ID NO: 3)
(Furdel)TPATNNRARQELPRFMNYTLNNAKKTNVTLSKK---RFLGFLLGVGSAIAS (SEQ ID NO: 4)
(Furx) TPATNNQAQNELPRFMNYTLNNAKKTNVTLSQNQNQNFLGFLLGVGSAIAS (SEQ ID NO: 6)
(Furx R113Q, K123N, K124N) TPATNNQAQNELPQFMNYTLNNANNTNVTLSQNQNQNFLGFLLGVGSAIAS (SEQ ID NO: 5)
(Furx R113Q, K123Q, K124Q)) TPATNNQAQNELPQFMNYTLNNAQQTNVTLSQNQNQNFLGFLLGVGSAIAS (SEQ ID NO: 92)
(Delp21Furx) TPATNNQAQN---------------------QNQNQNFLGFLLGVGSAIAS (SEQ ID NO: 7)
(Delp23Furx)TPATNNQAQN-----------------------QNQNFLGFLLGVGSAIAS (SEQ ID NO: 8)
(Delp21 furdel)TPATNNRARQ---------------------QNQQQRFLGFLLGVGSAIAS (SEQ ID NO: 109)
(Delp23furdel)TPATNNRARQ-----------------------QQQRFLGFLLGVGSAIAS (SEQ ID NO: 9)
(Nterm Furin) TPATNNRARRELPQFMNYTLNNAQQTNVTLSQNQNQNFLGFLLGVGSAIAS (SEQ ID NO: 10)
(Cterm Furin) TPATNNQAQNELPQFMNYTLNNAQQTNVTLSKKRKRRFLGFLLGVGSAIAS (SEQ ID NO: 11)
(Fusion peptide deletion 1) TPATNNRARRELPRFMNYTLNNAKKTNVTLSKKRKRR---------SAIAS (SEQ ID NO: 12),
(Fusion peptide deletion 2) TPATNNRARRELPRFMNYTLNNAKKTNVTLSKKRKRR------GVGSAIAS (SEQ ID NO: 91), или
(Factor Xa) TPATNNIEGRELPRFMNYTLNNAKKTNVTLSKKIEGRFLGFLLGVGSAIAS (SEQ ID NO: 13); где символ "-" указывает на то, что аминокислота в этом положении удалена.
В дополнение к мутациям участка расщепления фурином и пептида слияния, или альтернативно, растворимые полипептиды или белки F RSV, такие как белки, в которых отсутствует трансмембранная область и цитоплазматический конец, могут содержать одну или более последовательностей олигомеризации. Когда присутствует последовательность олигомеризации, она предпочтительно представляет собой последовательность тримеризации. Пригодные последовательности олигомеризации хорошо известны в данной области и включают, например, бисперальный белок лейциновой молнии GCN4 дрожжей, тримеризующую последовательность из фибрина бактериофага T4 ("foldon"), и тримерный домен HA вируса гриппа. Эти и другие последовательности олигомеризации описаны в настоящем документе более подробно.
В конкретных вариантах осуществления последовательность C-конца полипептида или белка F RSV, начиная с положения 480, представляет собой:
(GCN) PLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNDKIEEILSKIYHIENEIARIKKLIGE (SEQ ID NO: 14)
(HA) PLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNEKFHQIEKEFSEVEGRIQDLEK (SEQ ID NO: 15)
(Idealized Helix) PLVFPSDEFDASISQINEKINQILAFIRKIDELLHNIN (SEQ ID NO: 16)
(foldon short) PLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNGSGYIPEAPRDGQAYVRKDGEWVLLSTFL (SEQ ID NO: 17); или
(foldon long) PLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNNKNDDKGSGYIPEAPRDGQAYVRKDGEWVLLSTFL (SEQ ID NO: 18)
В дополнение к любой комбинации мутаций участка расщепления фурином, мутаций пептида слияния и добавленных последовательностей олигомеризации, или альтернативно, полипептиды или белки F RSV, которые содержат трансмембранную область, могут содержать добавленную к ним аминокислотную последовательность, которая обеспечивает участок расщепления протеазой. Этот тип полипептида или белка F RSV можно получать путем экспрессии его на поверхности клетки, и выделять в растворимой форме после отщепления с поверхности клетки с использованием соответствующей протеазы. Как правило, аминокислотная последовательность, которая обеспечивает участок расщепления протеазой, располагается в пределах 60 аминокислот, приблизительно 50 аминокислот, приблизительно 40 аминокислот, приблизительно 30 аминокислот, приблизительно 20 аминокислот, приблизительно 10 аминокислот, или по существу рядом с N-концом трансмембранного домена (аминокислота 525 SEQ ID NO: 1 или 2). Многие пригодные аминокислотные последовательности, которые расщепляются коммерчески доступными протеазами, хорошо известны в данной области. Например, тромбин расщепляет последовательность LVPR (SEQ ID NO: 75), фактор Xa расщепляет последовательность IEGR и энтерокиназа расщепляет последовательность DDDDK (SEQ ID NO: 76). Эти аминокислотные последовательности можно встраивать в полипептид F RSV. В конкретных вариантах осуществления последовательность полипептида или белка F RSV, начиная с положения 488 по TM-область, представляет собой последовательность, представленную на ФИГ. 2.
Иммуногенные полипептиды, используемые согласно изобретению, обычно являются выделенными или очищенными. Таким образом, они не ассоциированы с молекулами, с которыми они обычно, если это возможно, встречаются в природе. Например, белок F, используемый по изобретению, не будет в форме вириона RSV (хотя он может быть в форме искусственного вириона, такого как виросома или VLP).
Полипептиды обычно получают путем экспрессии в рекомбинантной системе-хозяине. Как правило, их (например эктодомены RSV) получают экспрессией рекомбинантных конструкций, которые кодируют эктодомены, в пригодных рекомбинантных клетках-хозяевах, хотя можно использовать любые пригодные способы. Пригодные рекомбинантные клетки-хозяева включают, например, клетки насекомых (например, Aedes aegypti, Autographa californica, Bombyx mori, Drosophila melanogaster, Spodoptera frugiperda и Trichoplusia ni), клетки млекопитающих (например человека, не являющегося человеком примата, лошади, коровы, овцы, собаки, кошки и грызуна (например хомячка), клетки птиц (например, курицы, утки и гуся), бактерий (например, E. coli, Bacillus subtilis и Streptococcus spp.), клетки дрожжей (например, Saccharomyces cerevisiae, Candida albicans, Candida maltosa, Hansenual polymorpha, Kluyveromyces fragilis, Kluyveromyces lactis, Pichia guillerimondii, Pichia pastoris, Schizosaccharomyces pombe и Yarrowia lipolytica), клетки Tetrahymena (например Tetrahymena thermophila) или их комбинации. Многие пригодные клетки насекомых и клетки млекопитающих хорошо известны в данной области. Пригодные клетки насекомых включают, например, клетки Sf9, клетки Sf21, клетки Tn5, клетки Schneider S2 и клетки High Five (клональный изолят из исходной клеточной линии Trichoplusia ni BTI-TN-5B1-4 (Invitrogen)). Пригодные клетки млекопитающих включают, например, клетки яичника китайского хомячка (CHO), клетки почки эмбриона человека (клетки HEK293, как правило, трансформированные расщепленной ДНК аденовируса 5 типа), клетки NIH-3T3, клетки 293-T, клетки Vero, клетки HeLa, клетки PERC.6 (номер депонированного образца ECACC 96022940), клетки Hep G2, MRC-5 (ATCC CCL-171), WI-38 (ATCC CCL-75),фетальные клеткилегкого макака-резус (ATCC CL-160), клетки почки быка Madin-Darby ("MDBK"), клетки почки собаки Madin-Darby ("MDCK") (например, MDCK (NBL2), ATCC CCL34; или MDCK 33016, DSM ACC 2219), клетки почки детенышей хомячка (BHK), такие как BHK21-F, HKCC и т.п. Пригодные клетки птиц включают, например, эмбриональные стволовые клетки курицы (например клетки EBx®), эмбриональные фибробласты курицы, эмбриональные половые клетки курицы, клетки утки (например клеточные линии AGE1.CR и AGE1.CR.pIX (ProBioGen), которые описаны, например, в Vaccine 27:4975-4982 (2009) и WO2005/042728), клетки EB66 и т.п.
Пригодные экспрессирующие системы в клетках насекомых, такие как бакуловирусные системы, известны специалистам в данной области и описаны, например, в Summers and Smith, Texas Agricultural Experiment Station Bulletin № 1555 (1987). Материалы и способы для системы для экспрессии бакуловирус/насекомое представляют собой коммерчески доступный набор от, среди прочего, Invitrogen, San Diego CA. Системы для экспрессии в клетках птиц также хорошо известны специалистам в данной области и описаны, например, в патентах США № 5340740; 5656479; 5830510; 6114168 и 6500668; патенте Европы № EP 0787180B; патентной заявке Европы № EP03291813.8; WO 03/043415 и WO 03/076601. Аналогично бактериальные экспрессирующие системы и экспрессирующие системы в клетках млекопитающих также известны в данной области и описаны, например, в Yeast Genetic Engineering (Barr et al., eds., 1989) Butterworths, London.
Рекомбинантные конструкции, кодирующие эктодомены белка F RSV, можно получать в пригодных векторах с использованием общепринятых способов. Множество пригодных векторов для экспрессии рекомбинантных белков в клетках насекомых или млекопитающих хорошо известны и обычно применяются в данной области. Пригодные векторы могут содержать ряд компонентов, включая, но не ограничиваясь ими, один или более из следующих: ориджин репликации; ген селективного маркера; один или более элементов контроля экспрессии, таких как элемент контроля транскрипции (например, промотор, энхансер, терминатор), и/или один или более сигналов трансляции; и сигнальная последовательность или лидерная последовательность для нацеливания на секреторный путь в выбранной клетке-хозяине (например, происхождением из млекопитающих или из гетерологичного вида млекопитающих или вида не млекопитающих). Например, для экспрессии в клетках насекомых используют пригодный бакуловирусный экспрессирующий вектор, такой как pFastBac (Invitrogen), с получением рекомбинантных бакуловирусных частиц. Бакуловирусные частицы амплифицируют и используют для инфицирования клеток насекомых для экспрессии рекомбинантного белка. Для экспрессии в клетках млекопитающих, используют вектор, который запускает экспрессию конструкции в желаемой клетке-хозяине млекопитающего (например клетки яичника китайского хомячка).
Полипептиды эктодомена белка F RSV можно очищать с использованием любых пригодных способов. Например, способы очистки полипептидов эктодомена F RSV иммуноаффинной хроматографией известны в данной области. Ruiz-Arguello et al., J. Gen. Virol., 85:3677-3687 (2004). Пригодные способы очистки желаемых белков, включая осаждение и различные типы хроматографии, такие как хроматография гидрофобного взаимодействия, ионообменная, аффинная, хелатирующая и эксклюзионная хроматография, хорошо известны в данной области. Пригодные схемы очистки можно создавать с использованием двух или более из этих или других пригодных способов. Если желательно, полипептиды эктодомена белка F RSV могут включать "метку", которая упрощает очистку, такую как эпитопная метка или HIS-метка. Такие меченые полипептиды можно стандартным образом очищать, например из кондиционированной среды, с помощью хелатирующей хроматографии или аффинной хроматографии.
Полипептиды F RSV также можно получать in situ путем экспрессии нуклеиновых кислот, которые кодируют их в клетках индивидуума, например, путем экспрессии самореплицирующейся РНК, описанной в настоящем документе.
Полипептиды могут включать дополнительные последовательности в дополнение к последовательностям RSV. Например, полипептид может включать последовательность, упрощающую очистку (например, последовательность поли-His). Аналогично для целей экспрессии природный лидерный пептид белка F белок можно заменять отличающимся белком. Например, в ссылке 6 используется лидерный пептид мелиттина медоносной пчелы вместо природного пептида.
Форма и конформация полипептидов
Изобретение относится к иммуногенным композициям, которые включают любые из форм и конформаций полипептидов и белков F RSV, описанных в настоящем документе, включая любую желаемую комбинацию форм и конформаций полипептидов и белков F RSV, описанных в настоящем документе. Полипептид F RSV может представлять собой мономер или белок F RSV может представлять собой тример, содержащий три мономерных полипептида. Тримеры могут быть монодисперсными или они могут быть в форме розеткообразных структур, например, вследствие взаимодействий между пептидами слияния отдельных тримеров. Иммуногенные композиции могут содержать полипептиды, которые представляют собой мономеры, тримеры, комбинацию мономеров и тримеров (например в состоянии динамического равновесия), розеткообразные структуры тримеров и любую комбинацию указанных выше. Дополнительно как далее описано в настоящем документе белок F RSV может быть в конформации "после слияния", в конформации "до слияния" или в промежуточной конформации.
Белок F RSV может быть в конформации "до слияния", в конформации "после слияния" или в промежуточной конформации. Полагают, что "конформация "после слияния" белка F RSV является низкоэнергетической конформацией нативного F RSV, и представляет собой тример, характеризующийся присутствием пучка с шестью спиралями, содержащего 3 области HRB и 3 области HRA. Конформация "после слияния" имеет характерную форму "вилки" или "метки для мяча в гольфе" при электронной микроскопии. Конформация белка F RSV "до слияния" представляет собой конформацию, характеризующуюся тримером, который содержит двойную спираль, содержащую 3 области HRB. Пептид слияния в конформации "до слияния" не является экспонированным и, таким образом, конформации "до слияния", как правило, не образуют розеткообразных структур и имеют форму "леденца на палочке" или "шара и стержня" при электронной микроскопии.
В некоторых аспектах белок F RSV имеет конформацию "после слияния". Например, белок F RSV может быть в форме монодисперсного тримера в конформации "после слияния" или в форме розеткообразной структуры, состоящей из тримеров "после слияния".
В некоторых вариантах осуществления полипептид F RSV представляет собой мономер. В некоторых вариантах осуществления полипептид F RSV представляет собой тример.
В других аспектах белок F RSV имеет конформацию "до слияния". Без связи с конкретной теорией полагают, что конформация "до слияния" или промежуточные формы белка F RSV могут содержать эпитопы, которые являются такими же, как и эпитопы на белке F RSV, экспрессированном на природных вирионах RSV, и, таким образом, обеспечивают преимущества в отношении индукции нейтрализующих антител.
В некоторых аспектах изобретения используется полипептид, для которого не является предпочтительной конформация "после слияния" белка F. Предпочтительно, полипептиды (целиком или частично) экспонируют эпитоп белка F "до слияния" или эпитоп промежуточной конформации при превращении из конформации "до слияния" в конформацию "после слияния". Эти полипептиды могут представлять собой нативные или мутантные белки F в состоянии "до слияния", они могут представлять собой нативные или мутантные белки F в промежуточной конформации или они могут представлять собой совокупность нативных или мутантных белков, где конформация "после слияния" не является предпочтительной или предпочтительно исключена. В некоторых случаях нативный или мутантный белок можно комбинировать с одной или более дополнительными молекулами, которые способствуют поддержанию полипептидов в одном из указанных выше состояний, такими как моноклональные антитело, которое предпочтительно связывает конформацию "до слияния" или промежуточную конформацию. Дополнительно полипептиды могут представлять собой производные нативных белков F. Такие производные включают полипептиды, содержащие один или более фрагментов нативного белка F, слитые полипептиды, содержащие нативный белок F (или его фрагмент) и гетерологичную последовательность, и полипептиды, содержащие нативную последовательность белка F, имеющую одну или более мутаций. Эти (или другие) модификации могут делать непредпочтительной конформацию "после слияния". Иллюстративные подходы для того, чтобы сделать конформацию непредпочтительной, включают стабилизацию конформации "до слияния", стабилизацию промежуточной конформации, дестабилизацию конформации "после слияния" или увеличение барьера активации на одной или более стадиях, ведущих к конформации "после слияния".
В другом варианте осуществления изобретение относится к полипептиду, который экспонирует, по меньшей мере, один эпитоп, который является специфичным к конформации "до слияния" белка F или промежуточной конформации белка F. Эпитоп, который является специфическим для конформации "до слияния" белка F или промежуточной конформации белка F представляет собой эпитоп, который не присутствует в конформации "после слияния". Предпочтительно, чтобы, по меньшей мере, один эпитоп стабильно присутствовал, например, эпитоп стабильно присутствовал в растворе в течение, по меньшей мере, двенадцати часов, по меньшей мере, одних суток, по меньшей мере, двух суток, по меньшей мере, четырех суток, по меньшей мере, шести суток, по меньшей мере, одной недели, по меньшей мере, двух недель, по меньшей мере, четырех недель, или, по меньшей мере, шести недель.
Такие полипептиды могут представлять собой нативные или мутантные белки F в состоянии "до слияния", в промежуточном состоянии или в совокупности состояний, где состояние "после слияния" представлено в небольшой степени или в более низком процентном количестве, чем в выделенных нативных белках F, или они могут представлять собой производное нативного белка F. Такие производные включают полипептиды, содержащие один или более фрагментов нативного белка F, слитые полипептиды, содержащие нативный белок F (или его фрагмент) и гетерологичную последовательность, и полипептиды, содержащие нативную последовательность белка F, имеющую одну или более мутаций. Эти (или другие) модификации могут стабилизировать аминокислотную последовательность белка F в его конформации "до слияния", стабилизировать аминокислотную последовательность белка F в промежуточной конформации, дестабилизировать конформацию "после слияния" аминокислотной последовательности белка F, увеличивать энергетический барьер при переходе, ведущем к конформации "после слияния" аминокислотной последовательности белка F, или приводить к комбинации двух или более из указанных выше.
TM- и/или CT-домены белков F важны для стабильности конформации "до слияния" (8). Таким образом, эти домены обычно можно сохранять в иммуногенах в соответствии с изобретением. Поскольку может быть желательным не включать трансмембранные домены в растворимые иммуногены, функциональный эффект TM, тем не менее, может быть достигнут другими способами. Например, было подробно исследовано поведение до и после слияния белка F вируса парагриппа 5 (6), и авторы стабилизировали структуру ED "до слияния" путем слияния гетерологичного домена тримеризации с C-концом ED.
Домен олигомеризации
В другом варианте осуществления изобретения композиция может содержать полипептид (например, рекомбинантный полипептид), который содержит первый домен и второй домен, где (i) первый домен содержит белок F RSV (например эктодомен RSV, целиком или частично), и (ii) второй домен содержит гетерологичный домен олигомеризации. Второй домен обеспечивает олигомеризацию полипептида, тем самым, способствуя тому, что первый домен принимает состояние "до слияния" или промежуточное состояние. Полипептид предпочтительно присутствует в качестве олигомера, и, в частности, в качестве тримера.
Специалисту в данной области доступны различные домены олигомеризации. Они представляют собой последовательности аминокислот, которые формируют структуру, которая может взаимодействовать с доменами олигомеризации (либо с такими же, либо с отличающимися) в других полипептидах (либо в таких же, либо в отличающихся), так что несколько полипептидов могут связываться (как правило, нековалентно) с образованием олигомеров, например, тримеров. Например, тримеризации белка F ВИЧ (т.е. gp160) достигают слиянием с каталитической субъединицей аспартаттранскарбамоилазы (ATCase) E. coli, которая в природе является стабильным тримером (9). Таким образом, эту субъединицу ATCase можно использовать с настоящим изобретением. Аналогично, тримеризацию белков F ВИЧ (10) и PIV5 (6) обеспечивают путем слияния их эктодоменов с GCNt. Таким образом, домен олигомеризации, используемый для настоящего изобретения, может содержать двойную спираль белка лейциновой молнии GCN4 дрожжей (11). Тримеризации эктодомена белка HA из вируса гриппа A достигают с использованием тримеризующей последовательности ("foldon") из фибритина бактериофага T4 (GSGYIPEAPRDGQ AYVRKDGEWVLLSTFL - SEQ ID NO: 19) (12). Таким образом, домен олигомеризации, используемый для настоящего изобретения, может содержать foldon.
Встречающиеся в природе олигомеры белков (как гетероолигомеры, так и гомоолигомеры) ассоциируют множеством различных путей, например, путем связывания β-слоев в различных мономерах, путем связывания α-спиралей в различных мономерах, путем связывания гидрофобных участков поверхности, и т.д. Одним общим структурным мотивом, вовлеченным в олигомеризацию белков, является двухспиральный домен. Спиральный структурный домен α-спирали может сам по себе формировать спирали, и две, три, четыре или пять α-спиралей могут оборачиваться вокруг друг друга с образованием левовращающей суперспирали, известной как "двойная спираль", хотя были получены искусственные правовращающие суперспирали (13-19). Простота двухспирального домена сделала его популярным выбором для конструирования химерных белков с определенными состояниями олигомеризации (16).
В структуре двойной спирали α-спирали взаимодействуют через гидрофобные остатки, которые формируют аполярную ленту вдоль одной стороны каждой спирали, и также могут существовать стабилизирующие электростатические взаимодействия между боковыми цепями каждой стороны этой ленты. В семичленном повторе abcdefg в α-спирали, аполярная лента определяется гидрофобными боковыми цепями остатков a и d, а какие-либо электростатические взаимодействия происходят, главным образом, в остатках e и g. Положение a наиболее часто представляет собой Leu, Ile или Ala и положение d обычно представляет собой Leu или Ala. Остатки e и g часто представляют собой Glu или Gln, а Arg и Lys являются также частыми в положении g. Заряженные остатки часто встречаются в положениях b, c и f, поскольку эти остатки контактируют с растворителем. Однако существуют исключения для этого общего семичленного паттерна и в этом семичленном повторе часто встречаются остатки Pro. Такие исключения обычно имеют функциональное значение, включая, в качестве примера, дестабилизацию домена олигомеризации для обеспечения повторного сворачивания и перестройки, такие как происходят в белке F.
В данной области известны сотни последовательностей двухспиральных доменов, и любую пригодную последовательность можно использовать в качестве домена олигомеризации в соответствии с изобретением, при условии что он сохраняет способность олигомеризоваться с другими двухспиральными доменами и что он не нарушает функцию других доменов в полипептиде. Предпочтительно использовать двухспиральный домен, который встречается внеклеточно (20) и который в природе действует как домен олигомеризации. В качестве альтернативы применению природного двухспирального домена можно использовать искусственные двухспиральные домены (21, 22). Благодаря в высокой степени повторяющейся структуре двухспирального домена, домен особенно хорошо поддается компьютерному моделированию, поскольку каркасные части каждого аминокислотного остатка могут быть параметризованы вместо обработки каждой каркасной части в качестве уникального элемента с его собственными переменными. Домен (b) может включать последовательность лейциновой молнии или последовательность аланиновой молнии (23).
Двухспиральный домен, используемый в полипептиде по изобретению, предпочтительно представляет собой домен, который формирует тример, так что полипептид в соответствии с изобретением также может собираться в тример. Предпочтительными двухспиральными доменами являются домены, взятые из бактериальных трансмембранных белков. Предпочтительной подгруппой трансмембранных белков являются адгезины (т.е. белки клеточной поверхности, которые опосредуют адгезию к другим клеткам или к поверхностям), и в частности нефимбриальные адгезины (например, в семействе олигомерных двухспиральных адгезинов или "Oca"). Конкретные последовательности для применения по изобретению включают последовательности, описанные в ссылке 24, из адгезина YadA Yersinia enterocolitica, адгезина NadA Neisseria meningitidis, поверхностного белка UspA2 Moraxella catarrhalis, и других адгезинов, таких как адгезин HadA из Haemophilus influenzae биологической группы aegyptius и т.д. (SEQ ID NO: 28-31 и 42-58 источник литературы 24). Дополнительно эукариотический фактор транскрипции теплового шока имеет двухспиральный домен тримеризации, который может отдельно экспрессировать и, таким образом, может быть использован в соответствии с изобретением.
В аминокислотной последовательности полипептида, имеющего двухспиральную область, структура α-спиралей в виде семичленных повторов означает, что граница двухспирального домена может быть определена с некоторой точностью, однако точный остаток, обозначаемый как конец двухспиральной структуры, нельзя назвать с абсолютной точностью. Однако это отсутствие абсолютной точности не является проблемой для осуществления изобретения на практике, поскольку стандартное тестирование может выявить, необходим ли в двойной спирали какой-либо аминокислотный остаток, для которого может существовать сомнение. Тем не менее, для изобретения не требуется, чтобы границы были известны с абсолютной точностью, поскольку единственным основным требованием для изобретения является то, чтобы двухспиральный домен функционировал так, чтобы обеспечивалась олигомеризация полипептида с другими двухспиральными доменами без нарушения функции других доменов в полипептиде.
Другой класс домена олигомеризации, который можно использовать по изобретению, встречается в левовращающей тройной спирали, известной как коллагеновая спираль (25). Эти формирующие тройную спираль последовательности вовлекают последовательность основного трипептидного повтора1Gly-2Xaa-3Xaa, где2Xaa часто представляет собой Pro, и3Xaa часто представляет собой 4-гидроксипролин. Хотя этот мотив известен как "коллагеновая" спираль, он встречается во многих белках помимо просто коллагена. Таким образом, домен олигомеризации может представлять собой последовательность, содержащую множество повторов мотива с последовательностью1Gly-2Xaa-3Xaa, которая сворачивается в форме спиральной структуры, которая может олигомеризоваться с соответствующими спиральными структурами в других полипептидных цепях.
Коллаген также обеспечивает другой класс домена олигомеризации. В ссылке 26 описан мотив, встречающийся в неколлагеновом домене 1 (NC1) коллагена типа X, и этот мотив может быть использован для образования тримера и мультимера более высокого порядка без тройной спирали. Эта тримерная сборка является высоко термостабильной без межмолекулярных дисульфидных связей. Таким образом, домен олигомеризации может содержать последовательность NC1.
Другие домены олигомеризации могут происходить из трансмембранных доменов олигомерных TM-белков. Поскольку они обычно являются липофильными, гидрофобные остатки, расположенные вне их TM-областей, можно заменять заряженными остатками с получением растворимого домена. Такие способы солюбилизации трансмембранных доменов способами белковой инженерии известны в данной области, например из ссылки 27. Этот способ также используют для GCN4, где положения "a" и "d" в семичленном повторе заменены изолейцином (11): KQIEDKIEEILSKIYHIENEIARIKKLIGEA (SEQ ID NO: 20). Пригодные последовательности двойной спирали для применения в домене олигомеризации обычно имеют длину от 20 до 35 аминокислот, например от 23 до 30 аминокислотных остатков.
Домены олигомеризации, используемые для изобретения, как правило, могут поддерживать олигомерную структуру без необходимости в образовании межмолекулярных дисульфидных мостиков, однако олигомеры, содержащие связанные дисульфидной связью мономеры, не исключаются из изобретения.
В качестве альтернативы или дополнительно к применению домена олигомеризации для стабилизации белка F в его конформации "до слияния", можно использовать мутацию. Например, в ссылке 28 описано, что мутация в консервативной области субъединицы F2 белков F в вирусе обезьян 5 или вирусе Хендра может влиять на стабильность конформации "до слияния".
В некоторых случаях также для способствования конформации "до слияния" можно использовать низкое значение pH.
Стабилизация тримера домена HRB
В другом предпочтительном аспекте настоящего изобретения конформацию белка F "после слияния" можно делать непредпочтительной путем стабилизации тримера домена HRB. Домен HRB формирует тройную спираль в форме "до слияния" и, вероятно, в промежуточной форме. Как рассмотрено в предыдущем разделе, вследствие их простоты, двойные спирали широко исследованы в качестве модельных систем для межмолекулярных взаимодействий между белками и в качестве модельных систем для внутримолекулярных взаимодействий на увеличенных расстояниях (т.е. взаимодействий третичной структуры). Эти исследования пригодны в обучающих способах, которые можно использовать для стабилизации домена HRB в форме тримерной спирали. В качестве примера, один или более остатков в положениях a и/или d семичленного повтора могут быть замещены остатками, которые способствуют образованию стабильных тримерных спиралей, такие как остатки Ile. Дополнительно хотя и менее предпочтительно, напредпочтительные ионные взаимодействия в положениях e и g можно устранять или можно добавлять предпочтительные ионные взаимодействия в положениях e и g.
Предпочтительная область домена HRB для манипулирования представляет собой семичленный повтор между P484-N517. Предпочтительными примерами остатков a и d в качестве мишеней для мутации являются F488, I492, V495, I499, S502, I506, S509, L512, и V516. Остатки серина являются особенно предпочтительными, поскольку замена гидрофильных остатков гидрофобными остатками стабилизирует гидрофобное ядро двойной спирали. Другой предпочтительной мишенью может быть фенилаланин, заменяемый меньшим гидрофобным остатком, который лучше упаковывается в ядре, таким как изолейцин.
Дестабилизация тримера домена HRA
В другом предпочтительном аспекте настоящего изобретения конформацию "после слияния" белка F можно делать непредпочтительной путем стабилизации тримера домена HRA. Домен HRA формирует трехцепочечную спираль в форме "после слияния" и, возможно, в одной или более промежуточных формах. В качестве примера, один или более остатков в положениях a и/или d семичленного повтора можно заменять остатками, которые делают непредпочтительным образование стабильных тримерных спиралей. Дополнительно хотя и менее предпочтительно, можно удалять предпочтительные ионные взаимодействия в положениях e и g или можно добавлять неблагоприятные ионные взаимодействия в положениях e и g. Предпочтительно, выбирают такие мутации, которые обладают минимальным влиянием на стабильность домена HRA в конформации "до слияния", что можно смоделировать на основе доступных кристаллических структур белка PIV5 F в формах "до слияния" и "после слияния".
Другие модификации
В дополнение к указанным выше модификациям, могут быть далее разработаны модификации на основе молекулярного моделирования белков F hRSV, исходя из доступных кристаллических структур белка F PIV5 в форме "до слияния" и "после слияния". Можно вносить мутации, которые дестабилизируют конформацию "после слияния", такую как сворачивание 6HB доменов HRA и HRB, или которые стабилизируют конформацию "до слияния", такую как сворачивание HRA в конформации "до слияния". Дополнительно можно увеличивать энергетический барьер переходов, ведущих к конформации "после слияния". Хотя специалисту в данной области понятно, что стабилизация исходной конформации или дестабилизация конечной конформации могут иметь эффект увеличения энергетического барьера, можно вносить другие модификации, которые влияют на само переходное состояние.
В качестве дополнительного примера аминокислоты, N-концевые для домена HRB (приблизительно а.к. 449-482, предпочтительно V459-F483) действуют в качестве "привязи", которая позволяет домену HRB сдвигаться с одной стороны тримера белка F на другую сторону, так чтобы домен HRB мог участвовать в 6HB в конформации "после слияния". Делеция одной или более из этих аминокислот нарушает или полностью препятствует участию домена HRB в сворачивании 6HB в конформации "после слияния" белка F (см. ФИГ. 3). Дополнительно взаимодействие между "привязью" и белком F в конформации "до слияния" можно стабилизировать для предотвращения оттягивания "привязи" для обеспечения участия домена HRB в сворачивании 6HB. Примерами стабилизирующих мутаций, которые можно вносить, являются цистеиновые мостики между "привязью" и частью белка F, с которой "привязь" контактирует в конформации "до слияния".
Другим примером является стабилизация HRA в конформации "до слияния" (остатки T50-Y306). Вновь, исходя из кристаллических структур гомологичных белков F, гидрофобное ядро можно стабилизировать путем замены погруженных гидрофильных или ионных остатков гидрофобными остатками сходного размера. Также на поверхность или в ядро можно вносить цистеиновые мостики. Дополнительно как продемонстрировано с помощью тщательного анализа кристаллической структуры мутантов с лизоцимом, гидрофобные ядра или белки являются относительно жесткими и, таким образом, внесение углублений предсказуемо дестабилизировало мутанты лизоцима. Аналогично, повторное упаковывание белка F в конформации "до слияния" для устранения каких-либо естественных углублений может стабилизировать белок F в формах "до слияния" или в промежуточной форме, таким образом, делая непредпочтительной конформацию "после слияния".
Способы получения композиций
Изобретение относится к способам получения композиций и к композициям, которые содержат белок F RSV, в частности, растворимые полипептиды эктодомена F RSV, включая иммуногенные композиции. Предпочтительно полипептиды эктодомена F RSV находятся в единой форме, такой как нерасщепленные мономеры, нерасщепленные тримеры, расщепленные тримеры, розеткообразные структуры расщепленных тримеров, или в состоянии динамического равновесия между подгруппой таких форм (например в состоянии динамического равновесия между нерасщепленными мономерами и нерасщепленными тримерами). Изобретение имеет несколько преимуществ. Например, как описано в настоящем документе, изобретение относится к способам получения композиций, которые содержат преобладающую желаемую форму белка F RSV, или единичную желаемую форму белка F RSV, такую как нерасщепленные мономеры, нерасщепленные тримеры, расщепленные тримеры, розеткообразные структуры расщепленных тримеров, подгруппу таких форм в состоянии динамического равновесия (например равновесие между нерасщепленными мономерами и нерасщепленными тримерами) или смесь желаемых форм белка F RSV. Эти типы композиций можно использовать для различных целей, например, в изготовлении иммуногенных композиций, которые можно использовать для получения вакцин. Присутствие единичной желаемой формы F RSV или известных форм в состоянии динамического равновесия в иммуногенной композиции обеспечивает более предсказуемый состав, растворимость и стабильность, и более предсказуемый иммунный ответ, когда композицию вводят индивидууму.
Когда полипептиды эктодомена белка F RSV получают общепринятой рекомбинантной экспрессией в клетках-хозяевах, полипептиды расщепляются в участках расщепления фурином приблизительно в положении 109/110 и приблизительно в положении 136/137 в ходе продукции в клетке-хозяине перед их секрецией в культуральную среду. Расщепление полипептидов клетками-хозяевами позволяет повторное сворачивание полипептидов эктодомена белка F RSV, что приводит к экспонированию гидрофобного пептида слияния. Таким образом, расщепленные полипептиды эктодомена белка F RSV, вследствие присутствия экспонированного пептида слияния, образуют розеткообразные структуры и связываются с липидами и липопротеинами, которые происходят из клеток-хозяев и культуральной среды. В действительности, электронная микроскопия расщепленного эктодомена F RSV, образовавшегося в клетках насекомых и очищенного с помощью HIS6-метки, показала, что полипептиды имели форму вилки, согласующуюся с формой "после слияния", и были связаны с тем, что выглядело как остаточный клеточный дебрис. Таким образом, традиционной рекомбинантной экспрессией в клетках-хозяевах нельзя легко получить в высокой степени чистые препараты розеткообразных структур и других форм и конформаций полипептидов эктодомена белка F RSV.
Способы получения расщепленных полипептидов эктодомена белка F RSV
В одном аспекте изобретение относится к способу получения композиции, которая содержит расщепленные полипептиды эктодомена белка F RSV. Как правило, способ вовлекает предоставление нерасщепленных полипептидов эктодомена белка F RSV, а затем расщепление их с получением субъединицы F1 и субъединицы F2. Как описано в настоящем документе, нерасщепленные полипептиды эктодомена белка F RSV можно легко очищать и отделять от загрязняющих липидов и липопротеинов с использованием пригодных способов, таких как эксклюзионная хроматография. Без связи с конкретной теорией, полагают, что гидрофобный пептид слияния не экспонируется в нерасщепленных полипептидах эктодомена белка F RSV и, таким образом, нерасщепленные полипептиды не ассоциируют с примесями липидов и липопротеинов. Как далее описано в настоящем документе, нарасщепленные эктодомены белка F RSV можно расщеплять с получением субъединиц F1 и F2, которые можно очищать в качестве тримеров, розеткообразных структур тримеров или смеси тримеров и розеткообразных структур тримеров.
Нерасщепленные полипептиды эктодомена белка F RSV можно получать с использованием любого пригодного способа, например, путем рекомбинантной продукции в клетках-хозяевах, которые не содержат активный фурин или фурин-подобные протеазы в то время, когда продуцируются полипептиды эктодомена белка F RSV. Для достижения этого способа продукции можно использовать множество способов, таких как продукция в рекомбинантных клетках, подвергнутых мутации для предупреждения экспрессии фурина или фурин-подобной протеазы (в зависимости от условий или полный "нокаут"), и различные способы, которые снижают или препятствуют экспрессии фурина или фурин-подобных протеаз в клетках-хозяевах, например, с использованием РНК-интерференции или других сходных способов, или ингибирования активности фурина или фурин-подобных протеаз в клетках-хозяевах с использованием ингибиторов протеаз.
Нерасщепленные полипептиды эктодомена белка F RSV предпочтительно получают рекомбинантной экспрессией конструкций, которые кодируют эктодомен белка F RSV, в котором аминокислотная последовательность участков расщепления фурином изменена, так что полипептиды эктодомена белка F RSV секретируются клеткой-хозяином, которая продуцирует нерасщепленные полипептиды. Нерасщепленные полипептиды эктодомена белка F RSV можно получать с использованием любой пригодной клетки-хозяина, такой как клетки насекомых (например Aedes aegypti, Autographa californica, Bombyx mori, Drosophila melanogaster, Spodoptera frugiperda и Trichoplusia ni), клетки млекопитающих (например, человек, не являющийся человеком примат, лошадь, корова, овца, собака, кошка и грызун (напримерхомяк)), клетки птиц (например курицы, утки и гуся), клетки бактерий (например, E. coli, Bacillus subtilis и Streptococcus spp.), клетки дрожжей (например, Saccharomyces cerevisiae, Candida albicans, Candida maltosa, Hansenual polymorpha, Kluyveromyces fragilis, Kluyveromyces lactis, Pichia guillerimondii, Pichia pastoris, Schizosaccharomyces pombe и Yarrowia lipolytica), клетки Tetrahymena (например, Tetrahymena thermophila) или их комбинации. В данной области известно множество клеток насекомых и клеток млекопитающих. Пригодные клетки насекомых включают, например, клетки Sf9, клетки Sf21, клетки Tn5, клетки Schneider S2 и клетки High Five (клональный изолят, происходящий из исходной клеточной линии Trichoplusia ni BTI-TN-5B1-4 (Invitrogen)). Пригодные клетки млекопитающих включают, например, клетки яичника китайского хомячка (CHO), клетки почки эмбриона человека (клетки HEK293, как правило, трансформированные расщепленной ДНК аденовируса 5 типа), клетки NIH-3T3, клетки 293-T, клетки Vero, клетки HeLa, клетки PERC.6 (номер депонированного образца ECACC 96022940), клетки Hep G2, MRC-5 (ATCC CCL-171), WI-38 (ATCC CCL-75),фетальные клеткилегкого макака-резус (ATCC CL-160), клетки почки быка Madin-Darby ("MDBK"), клетки почки собаки Madin-Darby ("MDCK") (например, MDCK (NBL2), ATCC CCL34; или MDCK 33016, DSM ACC 2219), клетки почки детенышей хомячка (BHK), такие как BHK21-F, HKCC и т.п. Пригодные клетки птиц включают, например, эмбриональные стволовые клетки курицы (например клетки EBx®), эмбриональные фибробласты курицы, эмбриональные половые клетки курицы, клетки утки (например клеточные линии AGE1.CR и AGE1.CR.pIX (ProBioGen), которые описаны, например, в Vaccine 27:4975-4982 (2009) и WO2005/042728), клетки EB66 и т.п.
Пригодные экспрессирующие системы в клетках насекомых, такие как бакуловирусные системы, известны специалистам в данной области и описаны, например, в Summers and Smith, Texas Agricultural Experiment Station Bulletin № 1555 (1987). Материалы и способы для системы для экспрессии бакуловирус/насекомое представляют собой коммерчески доступный набор от, среди прочего, Invitrogen, San Diego CA. Системы для экспрессии в клетках птиц также хорошо известны специалистам в данной области и описаны, например, в патентах США № 5340740; 5656479; 5830510; 6114168 и 6500668; патенте Европы № EP 0787180B; патентной заявке Европы № EP03291813.8; WO 03/043415 и WO 03/076601. Аналогично бактериальные экспрессирующие системы и экспрессирующие системы в клетках млекопитающих также известны в данной области и описаны, например, в Yeast Genetic Engineering (Barr et al., eds., 1989) Butterworths, London.
Как правило, аминокислотную последовательность нерасщепленного эктодомена белка F RSV изменяют для предотвращения расщепления по участкам расщепления фурином приблизительно в положении 109/110 и приблизительно в положении 136/137, но она содержит природный или внесенный участок расщепления протеазой, который, при расщеплении, дает субъединицу F1 и субъединицу F2. Например, нерасщепленный полипептид эктодомена белка F RSV может иметь аминокислотную последовательность, которая изменена для предотвращения расщепления по участкам расщепления фурином приблизительно в положении 109/110 и приблизительно в положении 136/137, но содержит один или более природных или внесенных участков расщепления протеазой от приблизительно положения 101 до приблизительно положения 161.
Специалист в данной области может легко разработать и представить себе множество конкретных аминокислотных последовательностей, которые обеспечат продукцию и экспрессию клетками-хозяевами нерасщепленных полипептидов эктодомена белка F RSV, включая аминокислотные последовательности, которые не расщепляются в участках расщепления фурином в положении приблизительно 109/110 и в положении приблизительно 136/137. Как правило, одна или более аминокислот, которые являются частью или расположены рядом с участками расщепления фурином в положении приблизительно 109/110 и в положении приблизительно 136/137 независимо заменены или удалены. Известны некоторые аминокислотные замены и делеции, которые пригодны для предотвращения расщепления полипептидов эктодомена белка F RSV. Например, замены R108N, R109N, R108N/R109N, которые ингибируют расщепление в положении 109/110, и замена K131Q или делеция аминокислот в положениях 131-134, которая ингибирует расщепление в положении 136/137, описаны Gonzalez-Reyes et al., Proc. Natl. Acad. Sci. USA, 98:9859-9864 (2001). Описан нерасщепленный полипептид эктодомена F RSV, который содержит аминокислотные замены R108N/R109N/ K131Q/R133Q/ R135Q/R136Q Ruiz-Arguello et al., J. Gen. Virol. 85:3677687 (2004). Как подробно описано в настоящем документе, дополнительные аминокислотные последовательности белка F RSV, которые приводят к полипептиду эктодомена F RSV, секретируемому клеткой-хозяином в нерасщепленной форме, содержат измененные участки расщепления фурином, например, измененные аминокислотные последовательности в положениях приблизительно 106-109 и в положениях приблизительно 133-136. Измененные участки расщепления фурином содержат, по меньшей мере, одну аминокислотную замену или делецию в положениях приблизительно 106-109, и, по меньшей мере, одну аминокислотную замену или делецию в положениях приблизительно 133-136.
Аналогично, являются возможными и можно легко разработать и представить себе множество конкретных аминокислотных последовательностей нерасщепленных полипептидов эктодомена белка F RSV, которые содержат участок расщепления протеазой (например встречающийся в природе или встроенный), который при расщеплении образует первую субъединицу, которая содержит F1, и вторую субъединицу, которая содержит F2. Например, аминокислотная последовательность белка F RSV от приблизительно положения 101 до приблизительно положения 161 содержит участки расщепления трипсином, и один или более участков расщепления трипсином можно расщеплять трипсином с образованием субъединиц F1 и F2. Если желательно в нерасщепленный полипептид эктодомена белка F RSV можно встраивать один или более пригодных участков распознавания протеазой, например, от приблизительно положения 101 до приблизительно положения 161. Встроенные участки распознавания протеазой можно расщеплять с использованием соответствующей протеазы с получением субъединиц F1 и F2. Когда в аминокислотную последовательность нерасщепленного полипептида эктодомена белка F RSV вносят участок распознавания протеазы, предпочтительно, чтобы участок распознавался протеазой, которая не расщепляет эктодомен встречающегося в природе белка F RSV.
Способ согласно этому аспекту изобретения включает: a) предоставление нерасщепленных полипептидов эктодомена белка F RSV, содержащих участок расщепления протеазой, который при расщеплении образует субъединицы F1 и F2, и b) расщепление нерасщепленных полипептидов эктодомена белка F RSV протеазой, которая распознает участок расщепления протеазой. Как правило, аминокислотная последовательность нерасщепленных полипептидов эктодомена белка F RSV содержит измененные участки расщепления фурином, и полипептиды эктодомена белка F RSV секретируются из клетки-хозяина, которая продуцирует их в нерасщепленном виде по участкам расщепления фурином приблизительно в положениях 106-109 и приблизительно в положениях 131-136.
Предоставленные нерасщепленные полипептиды эктодомена белка F RSV можно очищать до желаемой степени. Например, предоставленные нерасщепленные полипептиды эктодомена белка F RSV могут быть предоставлены в качестве клеточного лизата, гомогената клеток или кондиционированной клеточной культурой среды, которая по существу не переработана (например, не переработана или только процежена), или в частично или по существу очищенной форме. В конкретных примерах предоставленные нерасщепленные полипептиды эктодомена белка F RSV предоставляют в кондиционированной клеточной культурой среде, выбранной из группы, состоящей из кондиционированной клетками насекомых среды, кондиционированной клетками млекопитающих среды, кондиционированной клетками птиц среды, кондиционированной клетками дрожжей среды, кондиционированной клетками Tetrahymena среды и их комбинаций.
Обычно предпочтительно, чтобы предоставленные нерасщепленные полипептиды эктодомена белка F RSV были очищенными, например, очищенными так, чтобы они были, по меньшей мере, приблизительно на 80%, по меньшей мере, приблизительно на 85%, по меньшей мере, приблизительно на 90%, по меньшей мере, приблизительно на 95% или по существу гомогенными. Как описано в настоящем документе, нерасщепленные полипептиды эктодомена белка F RSV можно легко очищать от липидов и липопротеинов, в то время как полученные традиционным способом расщепленные формы белка F RSV очищаются совместно с примесями липидов и липопротеинов. Таким образом, когда предоставляют очищенные нерасщепленные полипептиды эктодомена белка F RSV, способ можно использовать для легкого получения композиции, содержащей расщепленные эктодомены белка F RSV, которые по существу не содержат липидов или липопротеинов.
Пригодные способы расщепления полипептидов с использованием протеазы хорошо известны и повсеместно приняты в данной области. Как правило, полипептиды, подлежащие расщеплению, комбинируют с достаточным количеством протеазы в условиях (например, pH, концентрация полипептида и протеазы, температура), пригодных для расщепления полипептида. Многие пригодные протеазы являются коммерчески доступными, и пригодные условия для проведения расщепления полипептидов хорошо известны для многих протеаз. Если желательно, расщепленные полипептиды эктодомена белка F RSV после расщепления протеазой можно очищать.
В одном примере способа предоставляют нерасщепленные полипептиды эктодомена белка F RSV, которые содержат неизмененный пептид слияния, такие как нерасщепленный полипептид эктодомена белка F RSV, в котором ни одна из аминокислот в положениях 137-154 не замещена или не удалена. В некоторых вариантах осуществления предоставленные нерасщепленные полипептиды эктодомена белка F RSV являются очищенными. Предоставленные нерасщепленные полипептиды эктодомена белка F RSV, которые содержат неизмененный пептид слияния, расщепляют, и расщепление приводит к образованию розеткообразных структур тримеров расщепленных полипептидов эктодомена белка F RSV. Если желательно, розеткообразные структуры можно далее очищать с использованием любого пригодного способа, такого как эксклюзионная хроматография.
В другом примере способа предоставляют нерасщепленные полипептиды эктодомена белка F RSV, которые содержат измененный пептид слияния, такой как нерасщепленный пептид эктодомена белка F RSV, в котором приблизительно аминокислоты 137-152, приблизительно аминокислоты 137-153, приблизительно аминокислоты 137-145 или приблизительно аминокислоты 137-142 удалены. Также описаны другие пригодные делеции пептида слияния, такие как делеция аминокислот в положениях 137-146. Ruiz-Arguello et al., J. Gen. Virol., 85:3677-3687 (2004).
В некоторых вариантах осуществления предоставленные нерасщепленные полипептиды эктодомена белка F RSV являются очищенными. Предоставленные нерасщепленные полипептиды эктодомена белка F RSV расщепляют, и расщепление приводит к образованию тримеров расщепленных полипептидов эктодомена белка F RSV. Если желательно, тримеры можно далее очищать с использованием любых пригодных способов, таких как эксклюзионная хроматография.
В конкретных примерах способа предоставленные нерасщепленные полипептиды эктодомена белка F RSV включают, по меньшей мере, один полипептид, выбранный из группы, состоящей изfurdel и delp23 furdel (например, гомогенный расщепляемый трипсином furdel, гомогенный расщепляемый трипсином delp23 furdel или смесь расщепляемого трипсином furdel и расщепляемого трипсином delp23 furdel). Предоставленные нерасщепленные полипептиды эктодомена белка F RSV расщепляют, например трипсином, и расщепление приводит к образованию расщепленных тримеров, розеткообразных структур расщепленных тримеров или комбинации расщепленных тримеров и розеткообразных структур расщепленных тримеров полипептидов эктодомена белка F RSV. Если желательно, расщепленные тримеры и/или розеткообразные структуры расщепленных тримеров можно далее очищать с использованием любых пригодных способов, таких как эксклюзионная хроматография.
Способы получения нерасщепленных полипептидов эктодомена белка F RSV
В другом аспекте изобретение относится к способу получения композиции, которая содержит нерасщепленные полипептиды эктодомена белка F RSV. Как правило, способ вовлекает предоставление биологического материала, который содержит нерасщепленные полипептиды эктодомена белка F RSV, такого как клеточный лизат, гомогенат клеток или кондиционированная клеточной культурой среда, а затем очистку нерасщепленных полипептидов эктодомена белка F RSV. Как описано в настоящем документе, было открыто, что очищенные мономеры нерасщепленных полипептидов эктодомена белка F RSV могут подвергаться самосборке с образованием нерасщепленных тримеров, и что существует смесь нерасщепленных мономеров и нерасщепленных тримеров или равновесное состояние нерасщепленных мономеров и нерасщепленных тримеров. Без связи с конкретной теорией полагают, что равновесие направлено в сторону мономера, но что в концентрированных растворах равновесие может сдвигаться в сторону тримера.
Способ согласно этому аспекту изобретения включает: a) предоставление биологического материала, который содержит нерасщепленные полипептиды эктодомена белка F RSV, такого как клеточный лизат, гомогенат клеток или кондиционированная клеточной культурой среда; и b) очистку мономеров, тримеров или комбинации мономеров и тримеров нерасщепленных полипептидов эктодоменов белка F RSV из биологического материала. В некоторых вариантах осуществления очищают мономеры нерасщепленных полипептидов эктодомена белка F RSV, или очищают тримеры нерасщепленных полипептидов эктодомена белка F RSV, или очищают мономеры и тримеры.
Как правило, аминокислотная последовательность нерасщепленных полипептидов эктодомена белка F RSV содержит измененные участки расщепления фурином, и полипептиды эктодомена белка F RSV секретируются из клетки-хозяина, которая продуцирует их в нерасщепленном виде от приблизительно положения 101 до приблизительно положения 161 (включая участки расщепления фурином в положениях 106-109 и 131-136). В более конкретных примерах биологический материал, который содержит нерасщепленные полипептиды эктодомена белка F RSV, включает, по меньшей мере, один полипептид, выбранный из группы, состоящей из furmt, furdel, delp21 furx, delp23 furx, delp21 furdel, delp23 furdel и конструкции factor Xa, которую можно расщеплять с использованием фактора Xa.
В некоторых вариантах осуществленияаминокислотная последовательность полипептида эктодомена белка F RSV содержит измененные участки расщепления фурином, и участки расщепления другой протеазой (например участки расщепления трипсином) от приблизительно положения 101 до приблизительно положения 161 изменены или удалены для предотвращения расщепления протеазой (например трипсином). Например, хорошо известно, что трипсин расщепляет после остатков лизина и аргинина. В определенных предпочтительных вариантах осуществления аминокислотная последовательность нерасщепленного полипептида эктодомена белка F RSV содержит измененные участки расщепления фурином, один или более остатков лизина и/или аргинина (например, все остатки лизина и аргинина), присутствующие от приблизительно положения 101 до приблизительно положения 161 удалены или заменены аминокислотой, которая не является лизином или аргинином, полипептиды эктодомена белка F RSV секретируются из клетки-хозяина, которая продуцирует их нерасщепленными от приблизительно положения 101 до приблизительно положения 161, и полипептиды эктодомена белка F RSV не расщепляются трипсином от приблизительно положения 101 до приблизительно положения 161. Предпочтительно, полипептиды эктодомена белка F RSV не расщепляются трипсином, когда 1 мг/мл раствора полипептида эктодомена белка F RSV (разбавленного в 25 мМ Tris, pH 7,5, 300 мМ NaCl) обрабатывают объемом раствора трипсина в соотношении один к тысяче (трипсин из плазмы быка, разбавленный до концентрации 1 мг/мл в 25 мМ Tris pH 7,5, 300 мМ NaCl; конечное отношение масс в реакционной смеси для расщепления составляет 0,001:1 трипсин:эктодомен F RSV; трипсин используется в количестве 10-15 BAEE единиц на мг белок) в течение 1 часа при 37°C.
Если желательно, нерасщепленные полипептиды эктодомена белка F RSV (например полипептиды, которые содержат измененные участки расщепления фурином, и полипептиды, которые содержат измененные участки расщепления фурином и измененные участки расщепления трипсином), могут дополнительно содержать измененный пептид слияния, как например, нерасщепленный полипептид эктодомена белка F RSV, в котором, например, удалены приблизительно аминокислоты 137-152, удалены приблизительно аминокислоты 137-154, удалены приблизительно аминокислоты 137-145 или удалены приблизительно аминокислоты 137-142. Также описаны другие пригодные делеции пептида слияния, такие как делеция аминокислот в положениях 137-146. Ruiz-Arguello et al., J. Gen. Virol., 85:3677-3687 (2004).
В конкретных вариантах осуществления способ включает: a) предоставление биологического материала, который содержит нерасщепленные полипептиды эктодомена белка F RSV, такого как клеточный лизат, гомогенат клеток или кондиционированная клеточной культурой среда, где аминокислотная последовательность нерасщепленного полипептида эктодомена белка F RSV содержит измененные участки расщепления фурином, остатки лизина и аргинина, присутствующие от приблизительно положения 101 до приблизительно положения 161 удалены или заменены аминокислотой, которая не является лизином или аргинином, полипептиды эктодомена белка F RSV секретируются из клетки-хозяина, которая продуцирует их в нерасщепленном виде от приблизительно положения 101 до приблизительно положения 161, и полипептиды эктодомена белка F RSV не расщепляются трипсином от приблизительно положение 101 до приблизительно положения 161; и b) очистку мономеров, тримеров или комбинаций мономеров и тримеров нерасщепленных полипептидов эктодомена белка F RSV из биологического материала.
В более конкретных примерах биологический материал, который содержит нерасщепленные полипептиды эктодомена белка F RSV, включает, по меньшей мере, один полипептид, выбранный из группы, состоящей из Furx, Furx R113Q K123N K124N, delp21 furx и delp23 furx.
В других конкретных вариантах осуществления способ включает: a) предоставление биологического материала, который содержит нерасщепленные полипептиды эктодомена белка F RSV, в которых пептид слияния подвергнут мутации (например, по меньшей мере, часть пептида слияния удалена), такого как клеточный лизат, гомогенат клеток или кондиционированная клеточной культурой среда; и b) очистку нерасщепленных полипептидов эктодомена белка F RSVиз биологического материала. Нерасщепленный полипептид эктодомена белка F RSV может содержать измененные участки расщепления фурином, и полипептиды эктодомена белка F RSV секретируются из клетки-хозяина, которая продуцирует их в нерасщепленном виде от приблизительно положения 101 до приблизительно положения 161 (в том числе в участках расщепления фурином в положениях 106-109 и 131-136). Если желательно, нерасщепленный полипептид эктодомена белка F RSV с измененными участками расщепления фурином дополнительно содержит измененные или удаленные участки для других протеаз (например участки расщепления трипсином) от приблизительно положения 101 до приблизительно положения 161 для предотвращения расщепления протеазой (например трипсином). Например, один или более остатков лизина и/или аргинина (например, все остатки лизина и аргинина), присутствующих от приблизительно положения 101 до приблизительно положения 161 удалены или заменены аминокислотой, которая не является лизином или аргинином, и полипептиды эктодомена белка F RSV не расщепляются трипсином от приблизительно положения 101 до приблизительно положения 161.
Мономеры, тримеры и комбинации мономеров и тримеров нерасщепленного полипептида эктодомена белка F RSV можно очищать до желаемой степени. Как правило, предпочтительно, чтобы мономеры или тримеры нерасщепленного полипептида эктодомена белка F RSV были очищенными, например, чтобы они были, по меньшей мере, приблизительно на 75%, по меньшей мере, приблизительно на 80%, по меньшей мере, приблизительно на 85%, по меньшей мере, приблизительно на 90%, по меньшей мере, приблизительно на 95% или по существу гомогенными. Как описано в настоящем документе, нерасщепленные полипептиды эктодомена белка F RSV можно легко очищать от липидов и липопротеинов, например, эксклюзионной хроматографией. Таким образом, способ можно использовать для легкого получения композиции, содержащей мономеры, тримеры или комбинацию мономеров и тримеров расщепленных полипептидов эктодомена белка F RSV, которые по существу свободны от липидов и липопротеинов.
В одном примере способ включает предоставление кондиционированной культурой клеток насекомых среды, кондиционированной культурой клеток млекопитающих среды, кондиционированной культурой клеток птиц среды, кондиционированной клеткам Tetrahymena среды, или их комбинации. В некоторых вариантах осуществления тримеры нерасщепленных полипептидов эктодомена белка F RSV очищают. В других вариантах осуществления мономеры нерасщепленных полипептидов эктодомена белка F RSV очищают. В других вариантах осуществления мономеры и тримеры нерасщепленного полипептида эктодомена белка F RSV очищают.
Способы получения расщепленных полипептидов эктодомена белка F RSV с измененными пептидами слияния
В одном аспекте изобретение относится к способу получения композиции, которая содержит расщепленные полипептиды эктодомена белка F RSV, который содержит измененный пептид слияния. Когда в клетках-хозяевах экспрессируются полипептиды эктодомена белка F RSV, которые не содержат измененные участки расщепления фурином, клетки-хозяева процессируют полипептиды, отчасти, расщепляя полипептид в участках расщепления фурином в положениях приблизительно 109/110 и в положениях приблизительно 136/137 с образованием субъединиц F1 и F2. Процессированные полипептиды секретируются в культуру и их можно выделять в качестве связанных субъединиц F1-F2 (например, субъединиц F1 и F2 с дисульфидными связями), которые могут формировать розеткообразные структуры тримеров путем агрегации экспонированных пептидов слияния. Полипептиды эктодомена белка F RSV, которые содержат измененные пептиды слияния, можно получать в клетках-хозяевах и секретировать из клеток-хозяев в качестве ассоциированных субъединиц F1-F2, и они не агрегируют в розеткообразные структуры или с примесями липидов или липопротеинов. Без связи с конкретной теорией полагают, что полипептиды не формируют розеткообразные структуры или не ассоциируют с примесями липидов и липопротеинов, поскольку измененный пептид слияния не опосредует агрегацию.
Способ согласно этому аспекту изобретения включает: a) предоставление биологического материала, который содержит расщепленные полипептиды эктодомена белка F RSV, которые содержат измененный пептид слияния (например, по меньшей мере, часть пептида слияния удалена), такого как клеточный лизат, гомогенат клеток или кондиционированная клеточной культурой среда; и b) очистку расщепленных полипептидов эктодомена белка F RSVиз биологического материала. Очищенные расщепленные полипептиды эктодомена белка F RSV можно очищать в качестве расщепленных тримеров, розеткообразных структур расщепленных тримеров или смеси расщепленных тримеров и розеткообразных структур расщепленных тримеров. Пригодные полипептиды эктодомена белка F RSV, которые содержат измененные пептиды слияния, содержат расщепляемые участки расщепления фурином в положении приблизительно 109/110 и приблизительно 136/137 и дополнительно содержат измененный пептид слияния, как описано в настоящем документе. Например, в способе можно использовать полипептид эктодомена белка F RSV, в котором удалены приблизительно аминокислоты 137-152, удалены приблизительно аминокислоты 137-153, удалены приблизительно аминокислоты 137-145, удалены приблизительно аминокислоты 137-146 или удалены приблизительно аминокислоты 137-142. В конкретных примерах биологический материал, который содержит нерасщепленные полипептиды эктодомена белка F RSV, включает по меньшей делецию пептида слияния 1.
Расщепленные полипептиды эктодомена белка F RSV (например, расщепленные тримеры или смесь расщепленных тримеров и розеткообразных структур расщепленных тримеров) можно очищать до желаемой степени. Главным образом, предпочтительно, чтобы расщепленные полипептиды эктодомена белка F RSV были очищенными, например, чтобы они были, по меньшей мере, приблизительно на 75%, по меньшей мере, приблизительно на 80%, по меньшей мере, приблизительно на 85%, по меньшей мере, приблизительно на 90%, по меньшей мере, приблизительно на 95% или по существу гомогенными. Как описано в настоящем документе, расщепленные полипептиды эктодомена белка F RSV, которые содержат измененный пептид слияния, можно легко очищать от липидов и липопротеинов, например, эксклюзионной хроматографией. Таким образом, способ можно использовать для легкого получения композиции, содержащей тримеры, розеткообразные структуры расщепленных тримеров или комбинацию расщепленных тримеров и розеткообразных структур расщепленных тримеров, которые по существу свободны от липидов и липопротеинов.
Способы получения полипептидов эктодомена белка F RSV с C-концевыми мутациями участка расщепления фурином
В другом аспекте изобретение относится к способу получения композиции, которая содержит не расщепленные на C-конце полипептиды эктодомена RSV и к способу получения расщепленных полипептидов эктодомена белка F RSV. Без связи с конкретной теорией полагают, что нерасщепленные на C-конце полипептиды эктодомена белка F RSV расщепляются клетками, которые продуцируют белки, в участке расщепления фурином приблизительно в положении 109/110, но не расщепляются в участке расщепления фурином приблизительно в положении 136/137, и секретируются в среду в качестве субъединицы F1, связанной с субъединицей F2. Дополнительно полагают, что гидрофобный пептид слияния в не расщепленных на C-конце полипептидах эктодомена белка F RSV не экспонируется и, таким образом, не расщепленные на C-конце полипептиды не связываются с примесями липидов и липопротеинов. Как далее описано в настоящем документе, не расщепленные на C-конце эктодомены белка F RSV можно далее расщеплять с получением субъединицы F1, в которой N-конец расположен от положения 110 до приблизительно положения 161, которая связана с субъединицей F2. Такие субъединицы F1 и F2 можно очищать в качестве тримеров, розеткообразных структур тримеров или смеси тримеров и розеткообразных структур тримеров.
Как правило, аминокислотная последовательность не расщепленного на C-конце эктодомена белка F RSV изменена для предотвращения расщепления в участке расщепления фурином в положении приблизительно 136/137, но содержит встречающийся в природе или встроенный участок расщепления протеазой, который, при расщеплении, образует субъединицу F1, в которой N-конец расположен с положения 110 до приблизительно положения 161, и субъединицу F2. Например, не расщепленный на C-конце полипептид эктодомена белка F RSV может иметь аминокислотную последовательность, которая изменена для предотвращения расщепления в участках расщепления фурином в положении приблизительно 136/137, но содержит один или более встречающихся в природе или встроенных участков расщепления протеазой от приблизительно положения 101 до приблизительно положения 161. В конкретном примере аминокислотная последовательность не расщепленного на C конце эктодомена белка F RSV изменена для предотвращения расщепления в участке расщепления фурином приблизительно в положении 136/137, но содержит встречающийся в природе участок расщепления фурином приблизительно в положении 109/110.
Специалист в данной области может легко разработать и представить себе множество конкретных аминокислотных последовательностей, которые обеспечат продукцию и экспрессию клетками-хозяевами не расщепленные на C-конце полипептиды эктодомена белка F RSV, включающие аминокислотные последовательности, которые не расщепляются в участках расщепления фурином приблизительно в положении 136/137. Как правило, независимо заменяют или удаляют одну или более аминокислот, которые являются частью или расположены вблизи участков расщепления фурином приблизительно в положении 136/137. Пригодные аминокислотные замены и делеции, которые предотвращают расщепление приблизительно в положении 136/137, описаны в настоящем документе. Например, можно использовать замену K131Q, делецию аминокислот в положениях 131-134 или замены K131Q/R133Q/R135Q/R136Q, каждая из которых ингибирует расщепление в положении 136/137. В определенных вариантах осуществления не расщепленные на C-конце полипептиды эктодомена белка F RSV содержат, по меньшей мере, одну аминокислотную замену или делецию приблизительно в положениях 133-136.
Аналогично, специалист в данной области может легко разработать и представить себе множество конкретных аминокислотных последовательностей не расщепленных на C-конце полипептидов эктодомена белка F RSV, которые содержат участок расщепления протеазой (например встречающийся в природе или встроенный), который при расщеплении дает первую субъединицу, которая содержит F1, и вторую субъединицу, которая содержит F2. Например, аминокислотная последовательность белка F RSV приблизительно от положения 101 до приблизительно положения 161 содержит участки расщепления трипсином, и один или более участков расщепления трипсином могут расщепляться трипсином с образованием субъединиц F1 и F2. Если желательно, в не расщепленный на C-конце полипептид эктодомена белка F RSV можно встраивать один или более пригодных участков расщепления протеазой, например, от приблизительно положения 101 до приблизительно положения 161. Встроенные участки распознавания протеазой можно расщеплять с использованием соответствующей протеазы с образованием субъединиц F1 и F2. Когда участок распознавания протеазой встраивают в аминокислотную последовательность не расщепленного на C-конце полипептида эктодомена белка F RSV, предпочтительно, чтобы этот участок распознавался протеазой, которая не расщепляет эктодомен встречающегося в природе белка F RSV.
Не расщепленные на C-конце полипептиды эктодомена белка F RSV можно получать с использованием любого пригодного способа. Предпочтительным способом является рекомбинантная экспрессия конструкций, которые кодируют эктодомен белка F RSV, в котором аминокислотная последовательность в участке расщепления фурином приблизительно в положениях 136/137 изменена, так что клеткой-хозяином секретируются не расщепленные на C-конце полипептиды эктодомена белка F RSV, которая продуцирует полипептиды в нерасщепленном виде в участке расщепления фурином в положении приблизительно 136/137. Предпочтительно, не расщепленный на C-конце полипептид эктодомена белка F RSV секретируется клеткой-хозяином, которая продуцирует его в качестве субъединицы F1, которая ассоциирована с субъединицей F2, где N-конец субъединицы F1 находится от положения 132 приблизительно до положения 161, но не в положении 137. Не расщепленные на C-конце полипептиды эктодомена белка F RSV можно получать с использованием любой пригодной клетки-хозяина, как описано в настоящем документе.
Один способ согласно этому аспекту изобретения включает: a) предоставление не расщепленных на C-конце полипептидов эктодомена белка F RSV, которые содержат измененный участок расщепления фурином в положении 136/137, и указанные не расщепленные на C-конце полипептиды эктодомена белка F RSV секретируются из клетки, которая продуцирует их в форме фрагмента F2, который связан с субъединицей, которая содержит F1, но не расщепляется в положении 136/137, и b) расщепление предоставленных не расщепленных на C-конце полипептидов эктодомена белка F RSV протеазой, которая расщепляет эктодомен белка F RSV в участке между положениями 101 и 161, тем самым, получая указанную композицию. В конкретных вариантах осуществления, стадия b) включает расщепление предоставленных не расщепленных на C-конце полипептидов эктодомена белка F RSV протеазой, которая расщепляет эктодомен белка F RSV в участке приблизительно между положениями 101 и 132, или приблизительно между положениями 132 и 161, или приблизительно между положениями 110 и 132. Альтернативно или дополнительно в некоторых вариантах осуществления не расщепленные на C-конце полипептиды эктодомена белка F RSV содержат измененный участок расщепления фурином в положении 136/137, при условии, что измененный участок расщепления фурином не является делецией аминокислот 131-134. В конкретных примерах биологический материал, который содержит не расщепленные на C-конце полипептиды эктодомена белка F RSV, включает, по меньшей мере, N-концевой полипептид фурина.
Предоставленные не расщепленные на C-конце полипептиды эктодомена белка F RSV можно очищать до желаемой степени. Например, предоставленные не расщепленные на C-конце полипептиды эктодомена белка F RSV могут быть предоставлены в клеточном лизате, гомогенате клеток или кондиционированной клеточной культурой среде, которая по существу не переработана (например, не переработана или только процежена), или в частично или по существу очищенной форме. В конкретных примерах предоставленные не расщепленные на С-конце полипептиды эктодомена белка F RSV предоставляют в кондиционированной клеточной культурой среде, выбранной из группы, состоящей из кондиционированной клетками насекомых среды, кондиционированной клетками млекопитающих среды, кондиционированной клетками птиц среды, кондиционированной клетками дрожжей среды, кондиционированной клетками Tetrahymena среды и их комбинаций.
Обычно предпочтительно, чтобы предоставленные не расщепленные на С-конце полипептиды эктодомена белка F RSV были очищенными, например, очищенными так, чтобы они были, по меньшей мере, приблизительно на 80%, по меньшей мере, приблизительно на 85%, по меньшей мере, приблизительно на 90%, по меньшей мере, приблизительно на 95% или по существу гомогенными. Как описано в настоящем документе, не расщепленные на С-конце полипептиды эктодомена белка F RSV можно легко очищать от липидов и липопротеинов, в то время как полученные традиционным способом расщепленные формы белка F RSV очищаются совместно с примесями липидов и липопротеинов. Таким образом, когда предоставляют очищенные не расщепленные на С-конце полипептиды эктодомена белка F RSV, способ можно использовать для легкого получения композиции, содержащей расщепленные эктодомены белка F RSV, которые по существу не содержат липидов или липопротеинов.
Пригодные способы расщепления полипептидов с использованием протеазы хорошо известны и повсеместно приняты в данной области. Как правило, полипептиды, подлежащие расщеплению, комбинируют с достаточным количеством протеазы в условиях (например, pH, концентрация полипептида и протеазы, температура), пригодных для расщепления полипептида. Многие пригодные протеазы являются коммерчески доступными, и пригодные условия для проведения расщепления полипептидов хорошо известны для многих протеаз. Если желательно, расщепленные полипептиды эктодомена белка F RSV после расщепления протеазой можно очищать.
В одном примере способа предоставляют не расщепленные на C-конце полипептиды эктодомена белка F RSV, которые содержат неизмененный пептид слияния, такие как не расщепленный на C-конце полипептид эктодомена белка F RSV, в котором ни одна из аминокислот в положениях 137-154 не заменена или не удалена. В другом примере способа предоставляют не расщепленные на C-конце полипептиды эктодомена белка F RSV, которые содержат измененный пептид слияния, такие как не расщепленный на С-конце полипептид эктодомена белка F RSV, в котором приблизительно аминокислоты 137-152, приблизительно аминокислоты 137-153, приблизительно аминокислоты 137-145 или приблизительно аминокислоты 137-142 удалены. Также описаны другие пригодные делеции пептида слияния, такие как делеция аминокислот в положениях 137-146. Ruiz-Arguello et al., J. Gen. Virol., 85:3677-3687 (2004).
В некоторых вариантах осуществления предоставленные не расщепленные на C-конце полипептиды эктодомена белка F RSV являются очищенными. Предоставленные нерасщепленные полипептиды эктодомена белка F RSV расщепляют, и расщепление приводит к образованию тримеров расщепленных полипептидов эктодомена белка F RSV. Если желательно, тримеры можно далее очищать с использованием любых пригодных способов, таких как эксклюзионная хроматография.
В конкретных примерах способа предоставленные не расщепленные на C-конце полипептиды эктодомена белка F RSV содержат, по меньшей мере, N-концевой полипептид фурина (ФИГ. 1). Предоставленные не расщепленные на C-конце полипептиды эктодомена белка F RSV расщепляют, например трипсином, и расщепление приводит к образованию расщепленных тримеров, розеткообразных структур расщепленных тримеров, или комбинации расщепленных тримеров и розеткообразных структур расщепленных тримеров полипептидов эктодомена белка F RSV. Если желательно, расщепленные тримеры и/или розеткообразные структуры расщепленных тримеров можно далее очищать с использованием любых пригодных способов, таких как эксклюзионная хроматография.
Другой способ этого аспекта изобретения включает: a) предоставление биологического материала, такого как клеточный лизат, гомогенат клеток или кондиционированная клеточной культурой среда, который содержит не расщепленные на C-конце полипептиды эктодомена белка F RSV, которые содержат измененный участок расщепления фурином в положении 136/137, и указанные растворимые полипептиды эктодомена белка F RSV секретируются из клетки, которая продуцирует их в форме фрагмента F2, который ассоциирован с субъединицей, которая содержит F1, но является не расщепленной в положении 136/137, при условии, что измененный участок расщепления фурином не является делецией аминокислот 131-134; и b) очистку не расщепленных на C-конце полипептидов эктодомена белка F RSV из биологического материала, тем самым получая композицию. Предпочтительно, N-конец субъединицы F1 находится от приблизительно положения 110 до приблизительно положения 132. Более предпочтительно, N-конец субъединицы F1 находится приблизительно в положении 110. Особенно предпочтительно, чтобы N-конце субъединицы F1 не представлял собой положение 137. В конкретных примерах биологический материал, который содержит не расщепленные на C-конце полипептиды эктодомена белка F RSV, включает, по меньшей мере, N-концевой полипептид фурина.
Если желательно, не расщепленный на C-конце полипептид эктодомена белка F RSV дополнительно содержит измененные или удаленные участки для других протеаз (например, участки расщепления трипсином) от приблизительно положения 101 до приблизительно положения 161 для предотвращения расщепления протеазой (например трипсином). Например, один или более остатков лизина и/или аргинина (например, все остатки лизина и аргинина), присутствующих от приблизительно положения 101 до приблизительно положения 161, удалены или заменены аминокислотой, которая не является лизином или аргинином, и не расщепленные на C-конце полипептиды эктодомена белка F RSV не расщепляются трипсином от приблизительно положения 101 до приблизительно положения 161. Не расщепленные на C-конце полипептиды эктодомена белка F RSV могут содержать неизмененный пептид слияния или измененный пептид слияния, как описано в настоящем документе.
Не расщепленные на C-конце полипептиды эктодомена белка F RSV, например, мономеры, тримеры и комбинации мономеров и тримеров, можно очищать до желаемой степени. Как правило, предпочтительно, чтобы мономеры или тримеры не расщепленного на C-конце полипептида эктодомена белка F RSV были очищенными, например, чтобы они были, по меньшей мере, приблизительно на 75%, по меньшей мере, приблизительно на 80%, по меньшей мере, приблизительно на 85%, по меньшей мере, приблизительно на 90%, по меньшей мере, приблизительно на 95% или по существу гомогенными. Как описано в настоящем документе, не расщепленные на C-конце полипептиды эктодомена белка F RSV можно легко очищать от липидов и липопротеинов, например, эксклюзионной хроматографией. Таким образом, способ можно использовать для легкого получения композиции, содержащей не расщепленные на C-конце полипептиды эктодомена белка F RSV, например, мономеры, тримеры или комбинацию мономеров и тримеров, которые по существу свободны от липидов и липопротеинов. В конкретных примерах способа не расщепленные на C-конце полипептиды эктодомена белка F RSV содержат, по меньшей мере, N-концевой полипептид фурина (ФИГ. 1).
В одном примере способ включает предоставление кондиционированной клетками насекомых среды, кондиционированной клетками млекопитающих среды, кондиционированной клетками птиц среды, кондиционированной клетками дрожжей среды, кондиционированной клетками Tetrahymena среды или их комбинаций. В некоторых вариантах осуществления тримеры не расщепленных на C-конце полипептидов эктодомена белка F RSV очищают. В других вариантах осуществления мономеры не расщепленных на C-конце полипептидов эктодомена белка F RSV очищают. В других вариантах осуществления мономеры и тримеры не расщепленных на C-конце полипептидов эктодомена белка F RSV очищают.
Самореплицирующаяся РНК
Полипептиды RSV-F, описанные в настоящем документе, можно получать экспрессией рекомбинантных нуклеиновых кислот, которые кодируют полипептиды, в клетках индивидуума. Предпочтительными нуклеиновыми кислотами, которые можно вводить индивидууму для обеспечения продукции полипептидов RSV-F, являются самореплицирующиеся молекулы РНК. Самореплицирующиеся молекулы РНК по изобретению основаны на геномной РНК из РНК-вирусов, но они лишены генов, кодирующих один или более структурных белков. Самореплицирующиеся молекулы РНК могут транслироваться с образованием неструктурных белков вируса РНК и гетерологичных белков, кодируемых самореплицирующейся РНК.
Самореплицирующаяся РНК, как правило, содержит, по меньшей мере, один или более генов, выбранных из группы, состоящей из вирусной репликазы, вирусной протеазы, вирусных хеликаз и других неструктурных белков, и также содержит 5'- и 3'-концевые цис-регуляторные последовательности репликации, и если желательно, гетерологичные последовательности, которые кодируют желаемые аминокислотные последовательности (например, белок, антиген). В самореплицирующиеся РНК может быть включен субгеномный промотор, который контролирует экспрессию гетерологичной последовательности. Если желательно, гетерологичная последовательность может быть слита в рамке считывания с другими кодирующими областями в самореплицирующейся РНК, и/или она может находиться под контролем участка внутренней посадки рибосомы (IRES).
Самореплицирующиеся молекулы РНК по изобретению можно конструировать так, чтобы самореплицирующаяся молекула РНК не могла индуцировать продукцию инфекционных вирусных частиц. Этого можно достигать, например, удалением одного или более вирусных генов, кодирующих структурные белки, которые необходимы для образования вирусных частиц, из самореплицирующихся РНК. Например, когда самореплицирующаяся молекула РНК основана на альфа-вирусе, таком как вирус Sinebis (SIN), вирус леса Семлики, вирус венесуэльского энцефалита лошадей (VEE), может быть удален один или более генов, кодирующих структурные белки вирусы, такие как гликопротеины капсида и/или оболочки. Если желательно, самореплицирующиеся молекулы РНК по изобретению можно конструировать для индукции продукции инфекционных вирусных частиц, которые ослаблены или вирулентны, или для продукции вирусных частиц, которые способны к одному раунду последующего инфицирования.
Самореплицирующиеся молекула РНК может, когда ее доставляют в клетку позвоночных даже без каких-либо белков, приводить к продукции множества дочерних РНК путем транскрипции с нее самой (или с ее антисмысловой копии). Самореплицирующаяся РНК может прямо транслироваться после доставки в клетку, и эта трансляция обеспечивает РНК-зависимую РНК полимеразу, которая затем продуцирует транскрипты с доставленной РНК. Таким образом, доставленная РНК приводит к продукции множества дочерних РНК. Эти транскрипты являются антисмысловыми относительно доставляемой РНК и могут транслироваться сами по себе с получением экспрессии in situ продукта гена, или могут транскрибироваться с получением дополнительных транскриптов с той же смысловой цепью, что и у доставляемой РНК, которые транслируются для обеспечения экспрессии in situ кодируемого полипептида RSV-F.
Одной пригодной системой для обеспечения саморепликации является применение репликона на основе РНК альфавируса. Эти +цепочечные репликоны транслируются после доставки в клетку с образованием репликазы (или репликазы-транскриптазы). Репликаза транслируется в качестве полибелка, который подвергается ауторасщеплению с образованием комплекса репликации, который создает копии в виде геномных цепей доставленной РНК с + цепью. Эти -цепочечные транскрипты могут сами по себе транслироваться с образованием дополнительных копий +цепочечной исходной РНК, а также они могут образовывать субгеномный транскрипт, который кодирует полипептид RSV-F. Таким образом, трансляция субгеномного транскрипта приводит к экспрессии полипептида RSV-F in situ инфицированной клеткой. В пригодных репликонах альфавируса может использоваться репликаза из вируса sindbis, вируса леса Семлики, вируса восточного энцефалита лошадей, вируса венесуэльского энцефалита лошадей, и т.д.
Таким образом, предпочтительная самореплицирующаяся молекула РНК кодирует (i) РНК-зависимую РНК-полимеразу, которая может транскрибировать РНК с самореплицирующейся молекулы РНК и (ii) полипептид RSV-F. Полимераза может представлять собой репликазу альфавируса, например, содержащую белок nsP4 альфавируса.
В то время как природные геномы альфавируса кодируют структурные белки вириона в дополнение к неструктурному полибелку репликазы, предпочтительно, чтобы самореплицирующаяся молекула РНК по изобретению на основе альфавируса не кодировала структурные белки альфавируса. Таким образом, самореплицирующаяся РНК может приводить к продукции геномных РНК-копий ее самой в клетке, но не к продукции РНК-содержащих вирионов альфавируса. Неспособность продуцировать эти вирионы означает, что, в отличие от альфавируса дикого типа, самореплицирующаяся молекула РНК не может постоянно поддерживаться в инфекционной форме. Структурные белки альфавируса, которые необходимы для постоянного поддержания вирусов дикого типа, отсутствуют в самореплицирующихся РНК по изобретению и их место занято геном(ами), кодирующим требуемый продукт гена, так что субгеномный транскрипт кодирует желаемый продукт гена, а не структурные белки вириона альфавируса.
Таким образом, самореплицирующаяся молекула РНК, пригодная для изобретения, может иметь две открытых рамки считывания. Первая (5') открытая рамка считывания кодирует репликазу; вторая (3') открытая рамка считывания кодирует полипептид RSV-F. В некоторых вариантах осуществления РНК может иметь дополнительные (нижележащие) открытые рамки считывания, например, которые кодируют другие желаемые продукты генов. Самореплицирующаяся молекула РНК может иметь 5'-последовательность, которая совместима с кодируемой репликазой.
В одном аспекте самореплицирующаяся молекула РНК происходит из альфавируса или основана на нем. В других аспектах самореплицирующаяся молекула РНК происходит из или основана на вирусе, отличном от альфавируса, предпочтительно, на РНК-вирусах с положительной цепью, и более предпочтительно на пикорнавирусе, флавивируса, рубивирусе, пестивирусе, гепацивирусе, клицивирусе или коронавирусе. Пригодные последовательности альфавируса дикого типа хорошо известны и доступны из депозитариев, таких как American Type Culture Collection, Rockville, Md. Типичные примеры пригодных альфавирусов включают Aura (ATCC VR-368), вирус Bebaru (ATCC VR-600, ATCC VR-1240), Cabassou (ATCC VR-922), вирус Chikungunya (ATCC VR-64, ATCC VR-1241), вирус восточного энцефаломиелита лошадей (ATCC VR-65, ATCC VR-1242), Fort Morgan (ATCC VR-924), вирус Getah (ATCC VR-369, ATCC VR-1243), Kyzylagach (ATCC VR-927), Mayaro (ATCC VR-66), вирус Mayaro (ATCC VR-1277), Middleburg (ATCC VR-370), вирус Mucambo (ATCC VR-580, ATCC VR-1244), Ndumu (ATCC VR-371), вирус Pixuna (ATCC VR-372, ATCC VR-1245), вирус реки Росс (ATCC VR-373, ATCC VR-1246), вирус леса Семлики (ATCC VR-67, ATCC VR-1247), вирус Sindbis (ATCC VR-68, ATCC VR-1248), Tonate (ATCC VR-925), Triniti (ATCC VR-469), Una (ATCC VR-374), вирус венесуэльского энцефаломиелита лошадей (ATCC VR-69, ATCC VR-923, ATCC VR-1250 ATCC VR-1249, ATCC VR-532), вирус западного энцефаломиелита лошадей (ATCC VR-70, ATCC VR-1251, ATCC VR-622, ATCC VR-1252), Whataroa (ATCC VR-926), и Y-62-33 (ATCC VR-375).
Самореплицирующаяся РНК может быть связана с системой для доставки. Самореплицирующуюся РНК можно вводить с адъювантом или без него.
СИСТЕМЫ ДЛЯ ДОСТАВКИ РНК
Самореплицирующиеся РНК по изобретению пригодны для доставки различными способами, такими как доставка простой РНК или в комбинации с липидами, полимерами или другими соединениями, которые способствуют проникновению в клетки. Самореплицирующиеся молекулы РНК по настоящему изобретению можно вводить в клетки-мишени или индивидуумам с использованием любого пригодного способа, например, путем прямой инъекции, микроинъекции, электропорации, липофекции, биолистическими способами и т.п. Самореплицирующуюся молекулу РНК также можно вводить в клетки рецептор-опосредуемым эндоцитозом. См. например, патент США № 6090619; Wu and Wu, J. Biol. Chem., 263:14621 (1988); и Curiel et al., Proc. Natl. Acad. Sci. USA, 88:8850 (1991). Например, в патенте США № 6083741 описано введение экзогенной нуклеиновой кислоты в клетки млекопитающих путем связывания нуклеиновой кислоты с поликатионной частью (например поли-L-лизин, имеющий 3-100 остатков лизина), которая сама по себе связана со связывающей рецептор интегрина частью (например, циклический пептид, имеющий последовательность Arg-Gly-Asp).
Самореплицирующуюся молекулу РНК по настоящему изобретению можно доставлять в клетки с помощью амфифильных веществ. См. например, патент США № 6071890. Как правило, молекула нуклеиновой кислоты может образовывать комплекс с катионным амфифильным веществом. Клетки млекопитающих, контактирующие с комплексом, могут легко его захватывать.
Самореплицирующуюся РНК можно доставлять в качестве простой РНК (напримертолько в качестве водного раствора РНК) но, для усиления проникновения в клетки, а также для последующих внутриклеточных эффектов, самореплицирующуюся РНК предпочтительно вводят в комбинации с системой для доставки, такой как система для доставки в виде частиц или эмульсии. Специалистам в данной области известно большое количество систем для доставки. Такие системы для доставки включают, например, доставку на основе липосом (Debs and Zhu (1993) WO 93/24640; Mannino and Gould-Fogerite (1988) BioTechniques 6(7): 682-691; Rose, патент США № 5279833; Brigham (1991), WO 91/06309; и Felgner et al. (1987) Proc. Natl. Acad. Sci. USA 84: 7413-7414), а также применение вирусных векторов (например аденовирусных (см., например, Berns et al. (1995) Ann. NY Acad. Sci. 772: 95-104; Ali et al. (1994) Gene Ther. 1: 367-384; и Haddada et al. (1995) Curr. Top. Microbiol. Immunol. 199 (Pt 3): 297-306 для обзора), папилломавирусных, ретровирусных (см., например, Buchscher et al. (1992) J. Virol. 66(5) 2731-2739; Johann et al. (1992) J. Virol. 66 (5): 1635-1640 (1992); Sommerfelt et al., (1990) Virol. 176:58-59; Wilson et al. (1989) J. Virol. 63:2374-2378; Miller et al., J. Virol. 65:2220-2224 (1991); Wong-Staal et al., PCT/US94/05700, и Rosenburg and Fauci (1993), Fundamental Immunology, Third Edition Paul (ed) Raven Press, Ltd., New York и ссылки в ней, и Yu et al., Gene Therapy (1994) выше) и аденоассоциированных вирусных векторов (см., West et al. (1987) Virology 160:38-47; Carter et al. (1989), патент США № 4797368; Carter et al. WO 93/24641 (1993); Kotin (1994) Human Gene Therapy 5:793-801; Muzyczka (1994) J. Clin. Invst. 94:1351 и Samulski (выше) для обзора AAV-векторов; также см. Lebkowski, патент США № 5173414; Tratschin et al. (1985) Mol. Cell. Biol. 5(11):3251-3260; Tratschin, et al. (1984) Mol. Cell. Biol., 4:2072-2081; Hermonat and Muzyczka (1984) Proc. Natl. Acad. Sci. USA, 81:6466-6470; McLaughlin et al. (1988) и Samulski et al. (1989) J. Virol., 63:03822-3828) и т.п.
Три особенно пригодных системы для доставки представляют собой (i) липосомы (ii) нетоксичные и биодеградируемые полимерные микрочастицы (iii) катионные субмикронные эмульсии типа "масло-в-воде".
Липосомы
Различные амфифильные липиды могут формировать бислои в водной среде, инкапсулируя РНК-содержащее водное ядро, в виде липосомы. Эти липиды могут иметь анионную, катионную или цвиттерионную гидрофильную концевую группу. Начало формирования липосом из анионных фосфолипидов датируется 1960-ыми годами, а катионные образующие липосомы липиды исследуют с 1990-ых годов. Некоторые фосфолипиды являются анионными, в то время как другие являются цвиттерионными. Пригодные классы фосфолипидов включают, но не ограничиваются ими, фосфатидилэтаноламины, фосфатидилхолины, фосфатидилсерины и фосфатидилглицерины и некоторые пригодные фосфолипиды приведены в таблице 20. Пригодные катионные липиды включают, но не ограничиваются ими, диолеилтриметиламмонийпропан (DOTAP), 1,2-дистеарилокси-N,N-диметил-3-аминопропан (DSDMA), 1,2-диолеилокси-N,N-диметил-3-аминопропан (DODMA), 1,2-дилинолеилокси-N,N-диметил-3-аминопропан (DLinDMA), 1,2-дилиноленилокси-N,N-диметил-3-аминопропан (DLenDMA). Цвиттерионные липиды включают, но не ограничиваются ими, ацильные цвиттерионные липиды и простые эфирные цвиттерионные липиды. Примерами пригодных цвиттерионных липидов являются DPPC, DOPC и додецилфосфохолин. Липиды могут быть насыщенными или ненасыщенными.
Липосомы могут быть образованы из одного липида или из смеси липидов. Смесь может содержать (i) смесь анионных липидов (ii) смесь катионных липидов (iii) смесь цвиттерионных липидов (iv) смесь анионных липидов и катионных липидов (v) смесь анионных липидов и цвиттерионных липидов (vi) смесь цвиттерионных липидов и катионных липидов или (vii) смесь анионных липидов, катионных липидов и цвиттерионных липидов. Аналогично, смесь может содержать как насыщенные, так и ненасыщенные липиды. Например, смесь может содержать DSPC (цвитерионный насыщенный), DlinDMA (катионный ненасыщенный) и/или DMPG (анионный насыщенный). Когда используют смесь липидов, не все липидные компоненты в смеси должны быть амифифильными, один или более амифифильных липидов можно смешивать с холестерином.
Гидрофильную часть липида можно пегилировать (т.е. модифицировать ковалентном присоединением полиэтиленгликоля). Эта модификация может увеличивать стабильность и предотвращать неспецифическую адсорбцию липосом. Например, липиды могут быть конъюгированы с PEG с использованием способов, таких как способы, описанные в Heyes et al. (2005) J Controlled Release 107:276-287.
Смесь DSPC, DlinDMA, PEG-DMPG и холестерина использована в примерах. Отдельный аспект изобретения представляет собой липосому, содержащую DSPC, DlinDMA, PEG-DMG и холестерин. В этой липосоме предпочтительно инкапсулирована РНК, такая как самореплицирующаяся РНК, например,кодирующая иммуноген.
Липосомы обычно подразделяют на три группы: многослойные везикулы (MLV); небольшие однослойные везикулы (SUV) и крупные однослойные везикулы (LUV). MLV имеют множество бислоев в каждой везикуле, образующих несколько отдельных водных компартментов. SUV и LUV имеют единичный бислой, в котором инкапсулирована водная сердцевина; SUV, как правило, имеют диаметр <50 нм и LUV имеют диаметр >50 нм. Липосомы, пригодные для изобретения, в идеальном случае представляют собой LUV с диаметром в диапазоне 50-220 нм. Для композиции, содержащей совокупность LUV с различными диаметрами: (i), по меньшей мере, 80% по количеству должны иметь диаметры в диапазоне 20-220 нм, (ii) средний диаметр (Zav, по интенсивности) совокупности в идеальном случае находится в диапазоне 40-200 нм, и/или (iii) диаметры должны иметь индекс полидисперсности <0,2.
Способы получения пригодных липосом хорошо известны в данной области напримерсм. Liposomes: Methods and Protocols, Volume 1: Pharmaceutical Nanocarriers: Methods and Protocols. (ed. Weissig). Humana Press, 2009. ISBN 160327359X; Liposome Technology, volumes I, II & III. (ed. Gregoriadis). Informa Healthcare, 2006; и Functional Polymer Colloids and Microparticles volume 4 (Microspheres, microcapsules & liposomes). (eds. Arshady & Guyot). Citus Books, 2002. Один из пригодных способов вовлекает смешение (i) раствора липидов в этаноле (ii) водного раствора нуклеиновой кислоты и (iii) буфера, с последующим перемешиванием, уравновешиванием, разбавлением и очисткой (Heyes et al. (2005) J Controlled Release 107:276-87).
РНК предпочтительно инкапсулируют в липосомы, и, таким образом, липосома формирует внешний слой вокруг водной содержащей РНК-сердцевины. Было выявлено, что это инкапсулирование защищает РНК от расщепления РНКазой. Липосомы могут включать некоторую внешнюю РНК (напримерна поверхности липосом), но, по меньшей мере, половина РНК (и в идеальном случае вся РНК) является инкасулированной.
Полимерные микрочастицы
Различные полимеры могут образовывать микрочастицы для инкапсулирования или адсорбции РНК. Применение по существу нетоксичного полимера означает, что реципиент может получать частицы безопасно, и применение биодеградируемого полимера означает, что частицы могут метаболизироваться после доставки, избегая длительного существования. Пригодные полимеры также являются стерилизуемыми, чтобы облегчать получение составов фармацевтической категории.
Пригодные нетоксичные и биодеградируемые полимеры включают, но не ограничиваются ими, поли(α-гидроксикислоты), полигидроксимасляные кислоты, полилактоны (включая поликапролактоны), полидиоксаноны, поливалеролактон, простые полиортоэфиры, полиангидриды, полицианоакрилаты, происходящие из тирозина поликарбонаты, поливинилпирролидиноны или полиэфирамиды и их комбинации.
В некоторых вариантах осуществления микрочастицы сформированы из поли(α-гидроксикислот), таких как поли(лактиды) ("PLA"), сополимеры лактида и гликолида, такие как сополимер D,L-лактида и гликолида ("PLG"), и сополимеры D,L-лактида и капролактона. Пригодные PLG полимеры включают полимеры, имеющие молярное отношение лактид/гликолид в диапазоне, например, от 20:80 до 80:20 например25:75, 40:60, 45:55, 55:45, 60:40, 75:25. Пригодные полимеры PLG включают полимеры, имеющие молекулярную массу, например 5000-200000 Да, например10000-100000, 20000-70000, 40000-50000 Да.
Микрочастицы в идеальном случае имеют диаметр в диапазоне от 0,02 мкм до 8 мкм. Для композиции, содержащей совокупность микрочастиц с различными диаметрами, по меньшей мере, 80% по количеству должны иметь диаметры в диапазоне 0,03-7 мкм.
Способы получения пригодных микрочастиц хорошо известны в данной области, напримерсм. Functional Polimer Colloids and Microparticles volume 4 (Microspheres, microcapsules & liposomes). (eds. Arshady & Guyot). Citus Books, 2002; Polymers in Drug Delivery. (eds. Uchegbu & Schatzlein). CRC Press, 2006. (в частности, глава 7) и Microparticulate Systems for the Delivery of Proteins and Vaccines. (eds. Cohen & Bernstein). CRC Press, 1996. Для способствования абсорбции РНК, микрочастица может включать катионное поверхностно-активное вещество и/или липид, например, как описано в O'Hagan et al.(2001) J Virology 75:9037-9043; и Singh et al.(2003) Pharmaceutical Research20: 247-251. Альтернативным способом получения полимерных микрочастиц является формование и отверждение, например, как описано в WO2009/132206.
Микрочастицы по изобретению могут иметь зета-потенциал 40-100 мВ.
РНК можно адсорбировать на микрочастицы, и адсорбции может способствовать включение катионных материалов (напримеркатионных липидов) в микрочастицу.
Катионные эмульсии типа "масло-в-воде"
Эмульсии типа "масло-в-воде" известны в качестве адъювантов вакцин против вируса гриппа, напримерадъювант MF59TM в продукте FLUADTM, и адъювант AS03 в продукте PREPANDRIXTM. В доставке РНК в соответствии с настоящим изобретением может использоваться вода типа "масло-в-воде", при условии, что эмульсия включает одну или более катионных молекул. Например, катионный липид может быть включен в эмульсию с образованием положительно заряженной каплевидной поверхности, с которой может связываться отрицательно заряженная РНК.
Эмульсия содержит одно или более масел. Пригодное масло(а) включает масла, например из животного (такого как рыба) или растительного источника. Масло в идеальном случае является биодеградируемым (метаболизируемым) и биосовместимым. Источники растительных масел включают орехи, семена и зерна. Примерами ореховых масел являются наиболее широкодоступные арахисовое масло, соевое масло, кокосовое масло и оливковое масло. Можно использовать масло хохобы, например, полученное из бобов хохобы. Масло семян включают сафлоровое масло, хлопковое масло, подсолнечное масло, кунжутное масло и т.п. В зерновой группе, кукурузное масло является наиболее широкодоступным, однако также можно использовать масло других зерен хлебных злаков, таких как пшеница, овес, рожь, рис, метличка абиссинская, тритикале и т.п. Сложные эфиры жирных кислот с 6-10 атомами углерода и глицерина и 1,2-пропандиола, хотя и не встречаются в природе в маслах семян, можно получать гидролизом, разделением и этерификацией соответствующих материалов, начиная с масла орехов и семян. Жиры и масла из молока млекопитающих являются метаболизируемыми и, таким образом, их можно использовать. Способы разделения, очистки, сапонификации и другие способы, необходимые для получения чистых масел из животных источников, хорошо известны в данной области.
Большинство рыб содержат метаболизируемые масла, которые можно легко выделять. Например, жир печени трески, жир печени акулы и китовый жир, такой как спермацет, являются примерами нескольких рыбьих жиров, которые можно использовать для настоящего изобретения. Количество масел с разветвленной цепью синтезируют биохимически в изопреновых частях молекул из 5 атомов углерода, и их, как правило, называют терпеноидами. Сквалан, насыщенный аналог сквалена, также является предпочтительным маслом. Рыбьи жиры, включая сквален и сквалан, являются широкодоступными из коммерческих источников или их можно получать способами, известными в данной области.
Другими предпочтительными маслами являются токоферолы, в частности, в комбинации со скваленом. Когда композиция включает токоферол, можно использовать любой из α-, β-, γ-, δ-, ε- или ξ-токоферолов, однако предпочтительными являются α-токоферолы. Можно использовать как D-α-токоферол, так и DL-α-токоферол. Предпочтительным α-токоферолом является DL-α-токоферол. Можно использовать комбинацию масел, содержащую сквален и токоферол (например, DL-α-токоферол).
Предпочтительные эмульсии содержат сквален, жир печени акулы, который является разветвленным ненасыщенным терпеноидом (C30H50; [(CH3)2C[=CHCH2CH2C(CH3)]2=CHCH2-]2; 2,6,10,15,19,23-гексаметил-2,6,10,14,18,22-тетракозагексан; CAS RN 7683-64-9).
Эмульсия типа "масло-в-воде" может содержать комбинацию масел, например, сквалена и, по меньшей мере, одного другого масла.
Водный компонент эмульсии может представлять собой простую воду (напримерw.f.i.) или он может включать другие компоненты, например растворенные в нем вещества. Например, он может включать соли, обеспечивающие буфер, напримерцитратные или фосфатные соли, такие как натриевые соли. Типичные буферы включают: фосфатный буфер; Tris-буфер; боратный буфер; сукцинатный буфер; гистидиновый буфер; или цитратный буфер. Забуференная водная фаза является предпочтительной, и буферы, как правило, включают в диапазоне 5-20 мМ.
Эмульсия также включает катионный липид. Предпочтительно этот липид представляет собой поверхностно-активное вещество, так что он может способствовать образованию и стабилизации эмульсии. Пригодные катионные липиды, как правило, содержат атом азота, который является положительно заряженным в физиологических условиях, например, в качестве третичного или четвертичного амина. Этот азот может быть в гидрофильной концевой группе амфифильного поверхностно-активного вещества. Пригодные катионные липиды включают, но не ограничиваются ими: 1,2-диолеилокси-3-(триметиламмонио)пропан (DOTAP), 3'-[N-(N',N'-диметиламиноэтан)карбамоил]холестерин (DC-холестерин), диметилдиоктадециламмоний (DDA, например бромид), 1,2-димиристоил-3-триметиламмонийпропан (DMTAP), дипальмитоил(C16:0)триметиламмонийпропан (DPTAP), дистеароилтриметиламмонийпропан (DSTAP). Другие пригодные катионные липиды представляют собой: хлорид бензалкония (BAK), хлорид бензэтония, цетрамид (который содержит бромид тетрадецилтриметиламмония и, возможно, небольшие количества бромида дедецилтриметиламмония и бромида гексадецилтриметиламмония), хлорид цетилпиридиния (CPC), хлорид цетилтриметиламмония (CTAC), N,N',N'-полиоксиэтилен (10)-N-таллов-1,3-диаминопропан, бромид додецилтриметиламмония, бромид гексадецилтриметиламмония, смешанный бромид алкилтриметиламмония, хлорид бензилдиметилдодециламмония, хлорид бензилдиметилгексадециламмония, метоксид бензилтриметиламмония, бромид цетилдиметилэтиламмония, бромид диметилдиоктадециламмония (DDAB), хлорид метилбензэтония, хлорид декаметония, смешанный хлорид метилтриалкиламмония, хлорид метилтриоктиламмония), хлорид N,N-диметил-N-[2(2-метил-4-(1,1,3,3-тетраметилбутил)фенокси]этокси)этил]бензолметанаминия (DEBDA), соли диалкилдиметиламмония, хлорид [1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония, 1,2-диацил-3-(триметиламмонио)пропан (ацильная группа = димиристоил, дипальмитоил, дистеароил, диолеил), 1,2-диацил-3(диметиламмонио)пропан (ацильная группа=димиристоил, дипальмитоил, дистеароил, диолеил), холиновый эфир l,2-диолеоил-3-(4'-триметиламмонио)бутаноил-sn-глицерина, 1,2-диолеоил-3-сукцинил-sn-глицерин, холестерил-(4'-триметиламмонио)бутаноат), соли N-алкилпиридиния (например бромид цетилпиридиния и хлорид цетилпиридиния), соли N-алкилпиперидиния, дикатионные электролиты с двумя ионизированными группами, разделенными гибкой цепью (C12Me6; C12BU6), диалкилглицетилфосфорилхолин, лизолецитин, L-α-диолеилфосфатидилэтаноламин, холиновый эфир гемисукцината холестерина, липополиамины, включая, но не ограничиваясь ими, диоктадециламидоглицилспермин (DOGS), дипальмитоилфосфатидилэтаноламидоспермин (DPPES), липополи-L- (или D)- лизин (LPLL, LPDL), поли (L (или D)-лизин, конъюгированный с N-глутарилфосфатидилэтаноламином, сложный эфир дидодецилглутамата с боковой аминогруппой (C^GluPhCnN), сложный эфир дитетрадецилглутамата с боковой аминогруппой (Cl4GIuCnN+), катионные производные холестерина, включая, но не ограничиваясь ими соль холестерил-3β-оксисукцинамидоэтилентриметиламмония, холестерил-3β-оксисукцинамидоэтилен-диметиламин, соль холестерил-3β-карбоксиамидоэтилентриметиламмония и холестерил-3β-карбоксиамидоэтилендиметиламин. Другие пригодные катионные липиды описаны в US 2008/0085870 и US 2008/0057080, которые включены в настоящий документ в качестве ссылок.
Катионный липид предпочтительно является биодеградируемым (метаболизируемым) и биосовместимым.
В дополнение к маслам и катионным липидам, эмульсия может включать неионное поверхностно-активное вещество и/или цвиттерионное поверхностно-активное вещество. Такие поверхностно-активные вещества включают, но не ограничиваются ими: поверхностно-активные вещества на основе сложных эфиров полиоксиэтилена и сорбитана (обычно обозначаемые как Tween), особенно полисорбат 20 и полисорбат 80; сополимеры окиси этилена (EO), окиси пропилена (PO) и/или окиси бутилена (BO), продаваемые под торговым названием DOWFAXTM, такие как линейные блок-сополимеры EO/PO; октоксинолы, которые могут варьировать по числу повторяющихся этокси(окси-1,2-этандиильных)групп, причем конкретный интерес представляют октоксинол-9 (Triton X-100 или трет-октилфеноксиполиэтоксиэтанол); (октилфенокси)полиэтоксиэтанол (IGEPAL CA-630/NP-40); фосфолипиды, такие как фосфатидилхолин (лецитин); жирные простые эфиры полиоксиэтилена и лаурилового, цетилового, стеарилового и олеилового спиртов (известных как поверхностно-активные вещества Brij), такие как монолауриловый эфир триэтиленгликоля (Brij 30); и сложные эфиры сорбитана (обычно известные как Span), такие как триолеат сорбитана (Span 85) и монолаурат сорбитана. Предпочтительными поверхностно-активными веществами для включения в эмульсию являются полисорбат 80 (Tween 80, моноолеат полиоксиэтилена сорбитана), Span 85 (триолеат сорбитана), лецитин и Triton X-100.
Можно использовать смеси поверхностно-активных веществ, например, смеси Tween 80/Span 85. Также пригодна комбинация сложного эфира полиоксиэтилена и сорбитана, такого как моноолеат полиоксиэтилена сорбитана (Tween 80), и октоксинола, такого как трет-октилфеноксиполиэтоксиэтанол (Triton X-100). Другое пригодное сочетание включает лаурет-9 вместе со сложным эфиром полиоксиэтилена сорбитана и/или октоксинолом. Пригодные смеси могут содержать поверхностно-активное вещество с величиной HLB в диапазоне 10-20 (напримерполисорбат 80, с HLB 15,0) и поверхностно-активное вещество с величиной HLB в диапазоне 1-10 (напримерсорбитана триолеат, с HLB 1,8).
Предпочтительные количества масла (% по объему) в конечной эмульсии составляют 2-20% например5-15%, 6-14%, 7-13%, 8-12%. Особенно пригодным является содержание сквалена приблизительно 4-6% или приблизительно 9-11%.
Предпочтительные количества поверхностно-активных веществ (% по массе) в конечной эмульсии составляют от 0,001% до 8%. Например: сложные эфиры полиоксиэтилена и сорбитана (такие как полисорбат 80): от 0,2 до 4%, в частности 0,4-0,6%, 0,45-0,55%, приблизительно 0,5% или 1,5-2%, 1,8-2,2%, 1,9-2,1%, 2%, или 0,85-0,95%, или приблизительно 1%; сложные эфиры сорбитана (такие как триолеат сорбитана): от 0,02 до 2%, в частности приблизительно 0,5% или приблизительно 1%; октил- или нонилфеноксиполиоксиэтаноли (такие как Triton X-100) от 0,001 до 0,1%, в частности от 0,005 до 0,02%; простые эфиры полиоксиэтилена (такие как лаурет 9): от 0,1 до 8%, предпочтительно от 0,1 до 10% и, в частности, от 0,1 до 1% или приблизительно 0,5%.
Абсолютные количества масла и поверхностно-активного вещества и их соотношение могут варьировать в широких пределах, тем не менее, образуя эмульсию. Специалист в данной области может легко варьировать относительные соотношения компонентов для получения желаемой эмульсии, однако типичным является соотношение масс от 4:1 до 5:1 для масла и поверхностно-активного вещества (избыток масла).
Важным параметром обеспечения иммуностимулирующей активности эмульсии, в частности у крупных животных, является размер капель масла (диаметр). Наиболее эффективные эмульсии имеют размер капель в субмикронном диапазоне. Пригодными являются размеры капель в диапазоне 50-750 нм. Наиболее пригодный средний размер капель составляет менее 250 нм, например, менее 200 нм, менее 150 нм. Пригодным является средний размер капель в диапазоне 80-180 нм. Идеально, по меньшей мере, 80% (по количеству) капель масла эмульсии имеют диаметр менее 250 нм, и предпочтительно, по меньшей мере, 90%. Устройства для определения среднего размера капель в эмульсии и распределения размеров, являются коммерчески доступными. В них, как правило, используются технологии динамического рассеяния света и/или оптического считывания одиночных частиц, напримерсерии устройств AccusizerTM и NicompTM, доступных от Particle Sizing Systems (Santa Barbara, США), или устройства ZetasizerTM от Malvern Instruments (Великобритания), или устройства Particle Size Distribution Analyzer от Horiba (Kyoto, Япония).
В идеальном случае, распределение размеров капель (по количеству) имеет только один максимум т.е. существует одна совокупность капель, распределенных вблизи среднего значения (моды), вместо наличия двух максимумов. Предпочтительные эмульсии имеют полидисперсность <0,4, например0,3, 0,2 или менее.
Пригодные эмульсии с субмикронными каплями и узким распределением размеров можно получать с использованием микрофлуидизации. Этот способ снижает средний размер капель масла посредством движущихся потоков входящих компонентов через геометрически фиксированные каналы при высоком давлении и высокой скорости. Эти потоки контактируют со стенками каналов, стенами камеры и друг с другом. Полученные силы сдвига, удара и кавитации вызывают уменьшение размера капель. Можно проводить повторяющиеся стадии до тех пор, пока не достигнут эмульсии с желаемым средним значением и распределением размера капель.
В качестве альтернативы микрофлуидизации можно использовать термические способы для обеспечения инверсии фаз. Эти способы также могут обеспечить субмикронную эмульсию с узким распределением размеров частиц.
Предпочтительные эмульсии можно стерилизовать фильтрацией т.е.их капли можно пропускать через 220-нм фильтр. Помимо обеспечения стерилизации, эта процедура также удаляет какие-либо крупные капли в эмульсии.
В определенных вариантах осуществления катионный липид в эмульсии представляет собой DOTAP. Катионная эмульсия типа "масло-в-воде" может содержать от приблизительно 0,5 мг/мл до приблизительно 25 мг/мл DOTAP. Например, катионная эмульсия типа "масло-в-воде" может содержать DOTAP в концентрации от приблизительно 0,5 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,6 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,7 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,9 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,0 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,1 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,2 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,3 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,4 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,5 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,6 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,7 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 24 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 22 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 20 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 18 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 15 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 12 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 10 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 2 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,9 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,8 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,6 мг/мл, от приблизительно 0,6 мг/мл до приблизительно 1,6 мг/мл, от приблизительно 0,7 мг/мл до приблизительно 1,6 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 1,6 мг/мл, приблизительно 0,5 мг/мл, приблизительно 0,6 мг/мл, приблизительно 0,7 мг/мл, приблизительно 0,8 мг/мл, приблизительно 0,9 мг/мл, приблизительно 1,0 мг/мл, приблизительно 1,1 мг/мл, приблизительно 1,2 мг/мл, приблизительно 1,3 мг/мл, приблизительно 1,4 мг/мл, приблизительно 1,5 мг/мл, приблизительно 1,6 мг/мл, приблизительно 12 мг/мл, приблизительно 18 мг/мл, приблизительно 20 мг/мл, приблизительно 21,8 мг/мл, приблизительно 24 мг/мл и т.д. В иллюстративном варианте осуществления, катионная эмульсия типа "масло-в-воде" содержит от приблизительно 0,8 мг/мл до приблизительно 1,6 мг/мл DOTAP, как например, 0,8 мг/мл, 1,2 мг/мл, 1,4 мг/мл или 1,6 мг/мл.
В определенных вариантах осуществления катионный липид представляет собой DC холестерин. Катионная эмульсия типа "масло-в-воде" может содержать DC холестерин в количестве от приблизительно 0,1 мг/мл до приблизительно 5 мг/мл DC холестерина. Например, катионная эмульсия типа "масло-в-воде" может содержать DC холестерин в концентрации от приблизительно 0,1 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,2 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,3 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,4 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,62 мг/мл до приблизительно 5 мг/мл, от приблизительно 1 мг/мл до приблизительно 5 мг/мл, от приблизительно 1,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 2 мг/мл до приблизительно 5 мг/мл, от приблизительно 2,46 мг/мл до приблизительно 5 мг/мл, от приблизительно 3 мг/мл до приблизительно 5 мг/мл, от приблизительно 3,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 4 мг/мл до приблизительно 5 мг/мл, от приблизительно 4,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 4,92 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 4,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 4 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 3,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 3 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 2,46 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 2 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 1,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 1 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 0,62 мг/мл, приблизительно 0,15 мг/мл, приблизительно 0,3 мг/мл, приблизительно 0,6 мг/мл, приблизительно 0,62 мг/мл, приблизительно 0,9 мг/мл, приблизительно 1,2 мг/мл, приблизительно 2,46 мг/мл, приблизительно 4,92 мг/мл и т.д. В иллюстративном варианте осуществления катионная эмульсия типа "масло-в-воде" содержит от приблизительно 0,62 мг/мл до приблизительно 4,92 мг/мл DC холестерина, как например, 2,46 мг/мл.
В определенных вариантах осуществления, катионный липид представляет собой DDA. Катионная эмульсия типа "масло-в-воде" может содержать от приблизительно 0,1 мг/мл до приблизительно 5 мг/мл DDA. Например, катионная эмульсия типа "масло-в-воде" может содержать DDA в концентрации от приблизительно 0,1 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 4,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 4 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 3,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 3 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 2,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 2 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 1,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 1,45 мг/мл, от приблизительно 0,2 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,3 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,4 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,6 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,73 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,9 мг/мл до приблизительно 5 мг/мл, от приблизительно 1,0 мг/мл до приблизительно 5 мг/мл, от приблизительно 1,2 мг/мл до приблизительно 5 мг/мл, от приблизительно 1,45 мг/мл до приблизительно 5 мг/мл, от приблизительно 2 мг/мл до приблизительно 5 мг/мл, от приблизительно 2,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 3 мг/мл до приблизительно 5 мг/мл, от приблизительно 3,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 4 мг/мл до приблизительно 5 мг/мл, от приблизительно 4,5 мг/мл до приблизительно 5 мг/мл, приблизительно 1,2 мг/мл, приблизительно 1,45 мг/мл и т.д. Альтернативно катионная эмульсия типа "масло-в-воде" может содержать DDA в количестве приблизительно 20 мг/мл, приблизительно 21 мг/мл, приблизительно 21,5 мг/мл, приблизительно 21,6 мг/мл, приблизительно 25 мг/мл. В иллюстративном варианте осуществления катионная эмульсия типа "масло-в-воде" содержит от приблизительно 0,73 мг/мл до приблизительно 1,45 мг/мл DDA, как например, 1,45 мг/мл.
Для доставки самореплицирующихся молекул РНК, таких как простая РНК или в комбинации с системой для доставки, в соответствии с изобретением в заданные орган или ткань можно использовать катетеры и другие устройства. Пригодные катетеры описаны, например, в патентах США № 4186745; 5397307; 5547472; 5674192 и 6129705, все из которых включены в настоящий документ в качестве ссылок.
Настоящее изобретение относится к применению пригодных систем для доставки, таких как липосомы, полимерные микрочастицы или микрочастицы субмикронной эмульсии с инкапсулированной или адсорбированной самореплицирующейся РНК, для доставки самореплицирующейся молекулы РНК, которая кодирует полипептид RSV-F, например, для индукции иммунного ответа, отдельно или в комбинации с другой макромолекулой. Изобретение включает липосомы, микрочастицы и субмикронные эмульсии с адсорбированными и/или инкапсулированными самореплицирующимися молекулами РНК, и их комбинации.
Как продемонстрировано далее в разделе "Примеры", самореплицирующиеся молекулы РНК, связанные с липосомами и микрочастицами субмикронной эмульсией, можно эффективно доставлять в клетку хозяина и можно индуцировать иммунный ответ на белок, кодируемый самореплицирующейся РНК.
Иммуногенная композиция
Изобретение относится к иммуногенным композициям. Иммуногенные композиции могут включать одно активное иммуногенное вещество или несколько иммуногенных веществ. Например, иммуногенная композиция может содержать полипептиды F RSV, которые находятся в единой форме (например мономер, тример или розеткообразные структуры) или в двух или более формах (например смесь мономера и тримера или состояние динамического равновесия между мономером и тримером). Иммуногенная композиция может содержать самореплицирующуюся РНК, кодирующую полипептид RSV-F, и предпочтительно также она содержит пригодную систему для доставки, такую как липосомы, полимерные микрочастицы, эмульсия типа "масло-в-воде" и их комбинации.
Иммуногенные композиции по изобретению также могут содержать одно или более иммунорегуляторных веществ. Предпочтительно, одно или более иммунорегуляторных веществ могут включать один или более адъювантов, например два, три, четыре или более адъювантов. Адъюванты могут включать адъювант TH1 и/или адъювант TH2, дополнительно описанные ниже.
В другом варианте осуществления иммуногенная композиция по изобретению содержит полипептид, который экспонирует эпитоп, присутствующий в конформации "до слияния" или в промежуточной конформации гликопротеина RSV-F, но не экспонирует конформацию "после слияния" этого гликопротеина.
В другом варианте осуществления иммуногенная композиция по изобретению содержит первый полипептид и второй полипептид, где первый полипептид содержит белок F RSV, целиком или частично, и второй полипептид содержит гетерологичный домен олигомеризации. Первый полипептид может содержать эктодомен белка F RSV. Второй полипептид может представлять собой домен тримеризации из гемагглютинина вируса гриппа, домена тримеризации из spike вируса SARS, домен тримеризации из gp41 ВИЧ, NadA, модифицированного GCN4 или ATCase.
В одном аспекте изобретение относится к композиции, содержащей расщепленные полипептиды эктодомена белка F RSV, полученные путем предоставления нерасщепленных полипептидов эктодомена белка F RSV или не расщепленных на C-конце полипептидов эктодомена белка F RSV, и расщепления их с получением субъединиц F1 и F2, как описано в настоящем документе.
В другом аспекте изобретение относится к композиции, содержащей тримеры и/или мономеры нерасщепленных полипептидов эктодомена белка F RSV, полученные предоставлением биологического материала, который содержит нерасщепленные полипептиды эктодомена белка F RSV, и очистки мономеров нерасщепленных полипептидов эктодомена белка F RSV, нерасщепленных тримеров или комбинации нерасщепленных мономеров и нерасщепленных тримеров (например смесь или состояние динамического равновесия) из биологического материала, как описано в настоящем документе. В некоторых вариантах осуществления полипептид эктодомена белка F RSV содержит измененные участки расщепления фурином в положениях приблизительно 106-109 и в положениях приблизительно 133-136, и, если желательно, он дополнительно может содержать измененный пептид слияния. В других вариантах осуществления эктодомен белка F RSV содержит измененные участки расщепления фурином в положениях приблизительно 106-109 и в положениях приблизительно 133-136, и измененные участки расщепления трипсином от приблизительно положения 101 до приблизительно положения 161, и, если желательно, он может далее содержать измененный пептид слияния.
В другом аспекте изобретение относится к композиции, содержащей тримеры и/или мономеры не расщепленных на C-конце полипептидов эктодомена белка F RSV, полученные предоставлением биологического материала, который содержит не расщепленные на C-конце полипептиды эктодомена белка F RSV, и очистки мономеров нерасщепленных полипептидов эктодомена белка F RSV, нерасщепленные тримеры или комбинации нерасщепленных мономеров и нерасщепленных тримеров (например смесь или состояние динамического равновесия) из биологического материала, как описано в настоящем документе.
В другом аспекте изобретение относится к композиции, содержащей расщепленные полипептиды эктодомена белка F RSV, полученные предоставлением биологического материала, который содержит расщепленные полипептиды эктодомена белка F RSV, который содержит измененный пептид слияния (например, по меньшей мере, часть пептида слияния удалена) и очисткой тримеровполипептидов эктодомена белка F RSV из биологического материала, как описано в настоящем документе.
В другом аспекте изобретение относится к композиции, содержащей нерасщепленные полипептиды эктодомена белка F RSV, полученные предоставлением биологического материала, который содержит нерасщепленные полипептиды эктодомена белка F RSV, которые содержат измененный пептид слияния (например, по меньшей мере, часть пептида слияния удалена) и очисткой мономеров нерасщепленных полипептидов эктодомена белка F RSVиз биологического материала, как описано в настоящем документе.
Композиции по изобретению предпочтительно пригодны для введения млекопитающему, такому как человек, и включают один или более фармацевтически приемлемый носитель(ей) и/или эксципиент(ов), включая адъюванты. Подробное обсуждение таких компонентов доступно в ссылке 29. Композиции, как правило, находятся в водной форме. Когда композиция представляет собой иммуногенную композицию, она индуцирует иммунный ответ при введении млекопитающему, такому как человек. Иммуногенную композицию можно применять для получения вакцинного состава для иммунизации млекопитающего.
Иммуногенные композиции могут включать одно активное иммуногенное вещество или несколько иммуногенных веществ. Например, полипептид эктодомена белка F RSV можно использовать в одной форме (например, нерасщепленный мономер, расщепленный мономер, нерасщепленный тример, расщепленный тример или розеткообразные структуры расщепленных тримеров) или в двух или более формах (например, смесь нерасщепленного мономера и нерасщепленного тримера или динамическое равновесие между нерасщепленным мономером и нерасщепленным тримером). Дополнительно композиции могут содержать полипептид эктодомена белка F RSV и один или более других белков RSV (напримерG-белок и/или M-белок) и/или его можно комбинировать с другими иммуногенами из других патогенов.
Композиция может включать консерванты, такие как тиомерсал или 2-феноксиэтанол. Однако предпочтительно, чтобы вакцина была по существу свободна от (т.е.меньше 5 мкг/мл) ртутьсодержащего материала, например,свободнаот тиомерсала. Иммуногенные композиции, не содержащие ртути, являются более предпочтительными. Особенно предпочтительными являются не содержащие консервантов иммуногенные композиции.
Для контроля тоничности, предпочтительным является включение физиологической соли, такой как соль натрия. Предпочтительным является хлорид натрия (NaCl), который может присутствовать в количестве между 1 и 20 мг/мл. Другие соли, которые могут присутствовать, включают хлорид калия, дигидрофосфат калия, дегидрат фосфата динатрия, хлорид магния, хлорид кальция и т.п.
Композиции, как правило, могут иметь осмоляльность между 200 мосм/кг и 400 мосм/кг, предпочтительно между 240-360 мосм/кг, и более предпочтительно она может находиться в диапазоне 290-310 мосм/кг.
Композиции могут включать один или более буферов. Типичные буферы включают: фосфатный буфер; Tris-буфер; боратный буфер; сукцинатный буфер; гистидиновый буфер (в частности, с адъювантом гидроксидом алюминия); или цитратный буфер. Буферы, как правило, могут быть включены в диапазоне 5-20 мМ. pH композиции, как правило, может составлять от 5,0 до 8,1, и более конкретно от 6,0 до 8,0, например, от 6,5 до 7,5, или от 7,0 до 7,8. Способ в соответствии с изобретением, таким образом, может включать стадию доведения pH нерасфасованной вакцины перед упаковыванием.
Композиция предпочтительно является стерильной. Композиция предпочтительно является непирогенной, например, содержащей <1 EU (единица эндотоксина, стандартный показатель) на дозу, и предпочтительно <0,1 EU на дозу. Композиция предпочтительно не содержит глютена. Вакцины для человека, как правило, вводят в объеме дозировки приблизительно 0,5 мл, хотя детям можно вводить половину дозы (т.е.приблизительно 0,25 мл).
Адъюванты
Композиции по изобретению, которые содержат полипептиды RSV-F или нуклеиновые кислоты, которые кодируют RSV-F, также могут включать один или более адъювантов, например два, три, четыре или более адъювантов, которые могут функционировать, усиливая иммунные ответы (гуморальные и/или клеточные), индуцируемые у пациента, которому вводят композицию. Адъюванты могут включать TH1-адъювант и/или TH2-адъювант. Адъюванты, которые можно использовать в композициях по изобретению, включают, но не ограничиваются ими:
- Содержащая минерал композиция. Содержащие минерал композиции, пригодные для применения в изобретении в качестве адъювантов, включают минеральные соли, такие как соли кальция и соли алюминия (или их смеси). Изобретение включает минеральные соли, такие как гидроксиды (например, оксгидроксиды), фосфаты (например, гидроксифосфаты, ортофосфаты), сульфаты и т.д., или смеси различных минеральных соединений, причем предпочтительными являются соединения, имеющие любую пригодную форму (т.е. гелеобразную, кристаллическую, аморфную и т.д.) и с адсорбцией. Соли кальция включают фосфат кальция (например, частицы "CAP", описанные в ссылке 38). Соли алюминия включают гидроксиды, фосфаты, сульфаты, и т.д. Содержащие минерал композиции также можно изготавливать в качестве частиц соли металла (39). Адъюванты на основе соли алюминия описаны более подробно ниже.
- Композиции на основе масляных эмульсий (см. более подробно ниже). Композиции на основе масляных эмульсий, пригодные для применения в изобретении в качестве адъювантов включают эмульсии типа сквален-вода, такие как MF59 (5% сквален, 0,5% Tween 80 и 0,5% Span, изготовленные в идее субмикронных частиц с использованием микрофлуидизатора).
- Индуцирующие цитокины средства (более подробно см. ниже). Индуцирующие цитокины средства, пригодные для применения в изобретении, включают агонисты toll-подобного рецептора 7 (TLR7) (например соединения бензонафтиридина, описанные в WO 2009/111337).
- Сапонины (глава 22 ссылки 74), которые представляют собой гетерологичную группу стериновых гликозидов и тритерпеноидных гликозидов, которые встречаются в коре, листьях, стеблях, корнях и даже цветах широкого диапазона видов растений. Сапонин из коры дерева Quillaia saponaria Molina широко исследован в качестве адъюванта. Также сапонин можно коммерчески получать из Smilax ornata (sarsaprilla), Gypsophilla paniculata (фата невесты) и Saponaria officianalis (мыльный корень). Адъювантные составы на основе сапонина включают очищенные составы, такие как QS21, а также липидные составы, такие как ISCOM. QS21 поставляется на рынок в качестве StimulonTM. Композиции сапонина очищают с использованием ВЭЖХ и ОФ-ВЭЖХ. Идентифицированы конкретные фракции, очищенные с использованием этих способов, включая QS7, QS17, QS18, QS21, QH-A, QH-B и QH-C. Предпочтительно, сапонин представляет собой QS21. Способ получения QS21 описан в ссылке 40. Также составы на основе сапонинов могут содержать стерин, такой как холестерин (41). Комбинации сапонинов и холестеринов можно использовать для образования уникальных частиц, называемых иммуностимулирующими комплексами (ISCOM) (глава 23 ссылки 74). ISCOM, как правило, также включают фосфолипид, такой как фосфатидилэтаноламин или фосфатидилхолин. В ISCOM можно использовать любой известный сапонин. Предпочтительно, ISCOM включает один или более из QuilA, QHA и QHC. ISCOM дополнительно описан в ссылках 41-43. Необязательно, в ISCOM может отсутствовать дополнительный детергент (44). Обзор разработки адъювантов на основе сапонинов может быть найден в ссылках 45 и 46.
- Жировые адъюванты (см. более подробно ниже). Жировые адъюванты (см. более подробно ниже), включая эмульсии типа "масло-в-воде", модифицированный природный липид As, происходящий из липополисахаридов энтеробактерий, соединения фосфолипидов (такие как синтетические димеры фосфолипидов, E6020) и т.п.
- Бактериальные ADP-рибозилирующие токсины (например, термолабильный энтеротоксин E.coli "LT", холерный токсин "CT", или коклюшный токсин "PT") и их детоксифицированные производные, такие как мутантные токсины, известные как LT-K63 и LT-R72 (47). Применение детоксифицированных ADP-рибозилирующих токсинов в качестве адъювантов для слизистых оболочек описано в ссылке 48 и в качестве парентеральных адъювантов в ссылке 49.
- Биоадгезивные и мукоадгезивные вещества, такие как микросферы с этерифицированной гиалуроновой кислотой (50) или хитозан и его производные (51).
- Микрочастицы (т.е. частица диаметром от ~100 нм до ~150 мкм, более предпочтительно, диаметром от ~200 нм до ~30 мкм, или диаметром от ~500 нм до ~10 мкм), образованные из материалов, которые являются биологически деградируемыми и нетоксичными (например, поли(α-гидроксикислота), полигидроксимасляная кислота, полимер сложного ортоэфира, полиангидрид, поликапролактон и т.д.), причем предпочтительным является сополимер лактида и гликолида, необязательно обработанный для того, чтобы он имел отрицательно заряженную поверхность (например посредством SDS) или положительно заряженную поверхность (например катионным детергентом, таким как CTAB).
- Липосомы (главы 13 и 14 ссылки 74). Примеры липосомальных составов, пригодных для применения в качестве адъювантов, описаны в ссылках 52-54.
- Простые эфиры полиоксиэтилена и сложные эфиры полиоксиэтилена (55). Такие составы дополнительно включают поверхностно-активные вещества на основе сложного эфира полиоксиэтилена и сорбитана в сочетании с октоксинолом (56), а также поверхностно-активные вещества на основе алкильных простых эфиров и сложных эфиров полиоксиэтилена в сочетании, по меньшей мере, с одним дополнительным неионным поверхностно-активным веществом, таким как октоксинол (57). Предпочтительные простые эфиры полиоксиэтилена выбирают из следующей группы: полиоксиэтилен-9-лауриловый эфир (лаурет 9), полиоксиэтилен-9-стеориловый эфир, полиоксиэтилен-8-стеориловый эфир, полиоксиэтилен-4-лауриловый эфир, полиоксиэтилен-35-лауриловый эфир и полиоксиэтилен-23-лауриловый эфир.
- Мурамилпептиды, такие как N-ацетилмурамил-L-треонил-D-изоглутамин ("thr-MDP"), N-ацетил-нормурамил-L-аланил-D-изоглутамин (nor-MDP), N-ацетилглюкозаминил-N-ацетилмурамил-L-Al-D-изоглутамин-L-Ala-дипальмитоксипропиламид ("DTP-DPP", или "TheramideTM"), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин ("MTP-PE").
- Препарат протеосом белков наружной мембраны, полученный из первой грамотрицательной бактерии, в сочетании с препаратом липосахарада, полученным из второй грамотрицательной бактерии, где препараты протеосом белков наружной мембраны и липосахарида образуют стабильный нековалентный адъювантный комплекс. Такие комплексы включают "IVX-908", комплекс, состоящий из наружной мембраны и липополисахаридов Neisseria meningitidis.
- Полимер полиоксидония (58, 59) или другое N-окисленное производное полиэтиленпиперазина.
- Метилинозин-5'-монофосфат ("MIMP") (60).
- Полигидроксилированное соединение пирролизидина 61, такое как соединение формулы:

где R выбран из группы, включающей водород, прямую или разветвленную, незамещенную или замещенную, насыщенную или ненасыщенную ацильную, алкильную (например, циклоалкильную), алкенильную, алкинильную и арильную группы, или их фармацевтически приемлемая соль или производное. Примеры включают, но не ограничиваются ими: казуарин, казуарин-6-α-D-глюкопиранозу, 3-эпиказуарин, 7-эпиказуарин, 3,7-диэпиказуарин и т.д.
- лиганд CD1d, такой как α-гликозилцерамид (62-69) (например, α-галактозилцерамид), фитосфингозин-содержащие α-гликозилцерамиды, OCH, KRN7000 [(2S,3S,4R)-1-O-(α-D-галактопиранозил)-2-(N-гексакозаноиламино)-1,3,4-октадекантриол], CRONY-101, 3''-O-сульфогалактозилцерамид и т.д.
- гамма-инулин (70) или его производное, такое как алгаммулин.
- Виросомы и вирусоподобные частицы (VLP). Эти структуры, как правило, содержат один или более белков из вируса, необязательно комбинированных или включенных в состав с фосфолипидом. Они, как правило, являются непатогенными, не реплицирующимися и обычно не содержат никакого нативного вирусного генома. Вирусные белки могут быть рекомбинантно полученными или выделенными из целых вирусов. Эти вирусные белки, пригодные для применения в виросомах или VLP, включают белки, происходящие из вируса гриппа (такие как HA или NA), вируса гепатита B (такие как коровые или капсидные белки), вируса гепатита E, вируса кори, вируса Sindbis, ротавируса, вируса ящура, ретровируса, вируса Норволк, вируса папилломы человека, ВИЧ, РНК-фагов, Qß-фага (такие как белки оболочки), GA-фага, fr-фага, фага AP205 и Ty (такие как белок p1 ретротранспозона Ty).
Эти и другие адъювантно-активные вещества рассмотрены более подробно в ссылках 74 и 75.
Композиции могут включать два, три, четыре или более адъювантов. Например, они могут преимущественно включать как эмульсию типа "масло-в-воде", так и индуцирующее цитокин средство, или как содержащую минерал композицию, так и индуцирующее цитокин средство, или два адъюванта на основе эмульсии типа "масло-в-воде" или два соединения бензонафтиридина и т.д.
Антигены и адъюванты в композиции обычно смешаны.
Адъюванты на основе масляных эмульсий
Композиции на основе масляных эмульсий, пригодные для применения в изобретении в качестве адъювантов, включают эмульсии типа сквален-вода, такие как MF59 (5% сквален, 0,5% Tween 80, и 0,5% Span 85, изготовленные в виде субмикронных частиц с использованием микрофлуидизатора). Также можно использовать полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA).
Известны различные эмульсии типа "масло-в-воде", и они, как правило, включают, по меньшей мере, одно масло и, по меньшей мере, одно поверхностно-активное вещество, причем масло(а) и поверхностно-активное вещество(а) являются биодеградируемыми (метаболизируемыми) и биосовместимыми. Капли масла в эмульсии, как правило, имеют диаметр менее 5 мкм, и они могут даже иметь субмикронный диаметр, причем этих малых размеров достигают с помощью микрофлуидизатора для получения стабильных эмульсий. Капли с размером менее 220 нм являются предпочтительными, поскольку их можно подвергать стерилизации фильтрованием.
Изобретение можно использовать с маслами, такими как масла из животного (такого как рыба) или растительного источника. Источники растительных масел включают орехи, семена и зерна. Примерами ореховых масел являются наиболее широко доступные арахисовое масло, соевое масло, кокосовое масло и оливковое масло. Можно использовать масло хохобы, например, полученное из бобов хохобы. Масло семян включает сафлоровое масло, хлопковое масло, подсолнечное масло, кунжутное масло и т.п. В зерновой группе, кукурузное масло является наиболее широко доступном, однако также можно использовать масло других зерен хлебных злаков, таких как пшеница, овес, рожь, рис, метличка абиссинская, тритикале и т.п. Сложные эфиры жирных кислот с 6-10 атомами углерода и глицерина и 1,2-пропандиола, хотя и не встречаются в природе в маслах семян, можно получать гидролизом, разделением и этерификацией соответствующих материалов, начиная с масла орехов и семян. Жиры и масла из молока млекопитающих являются метаболизируемыми и, таким образом, их можно использовать для применения на практике этого изобретения. Способы разделения, очистки, сапонификации и другие способы, необходимые для получения чистых масел из животных источников, хорошо известны в данной области. Большинство рыб содержат метаболизируемые масла, которые можно легко выделять. Например, жир печени трески, жир печени акулы и китовый жир, такой как спермацет, являются примерами нескольких рыбьих жиров, которые можно использовать для настоящего изобретения. Количество масел с разветвленной цепью синтезируют биохимически в изопреновых частях молекул из 5 атомов углерода, и их, как правило, обозначают как терпеноиды. Жир печени акулы содержит разветвленные, ненасыщенные терпеноиды, известные как сквален, 2,6,10,15,19,23-гексаметил-2,6,10,14,18,22-тетракозагексаен, которые являются особенно предпочтительными для настоящего изобретения. Сквалан, насыщенный аналог сквалена, также является предпочтительным маслом. Рыбьи жиры, включая сквален и сквалан, являются широко доступными из коммерческих источников или их можно получать способами, известными в данной области. Другими предпочтительными маслами являются токоферолы (см. ниже). Можно использовать смеси масел.
Поверхностно-активные вещества можно классифицировать по их "HLB" (гидрофильный/липофильный баланс). Предпочтительные поверхностно-активные вещества по изобретению имеют HLB, по меньшей мере, 10, предпочтительно, по меньшей мере, 15 и более предпочтительно, по меньшей мере, 16. Изобретение можно использовать с поверхностно-активными веществами, включающими, но не ограничивающимися ими: поверхностно-активные вещества на основе сложных эфиров полиоксиэтилена и сорбитана (обычно обозначаемые как Tween), особенно полисорбат 20 и полисорбат 80; сополимеры окиси этилена (EO), окиси пропилена (PO) и/или окиси бутилена (BO), продаваемые под торговым названием DOWFAXTM, такие как линейные блок-сополимеры EO/PO; октоксинолы, которые могут варьировать по числу повторяющихся этокси(окси-1,2-этандиильных)групп, причем конкретный интерес представляют октоксинол-9 (Triton X-100 или трет-октилфеноксиполиэтоксиэтанол); (октилфенокси)полиэтоксиэтанол (IGEPAL CA-630/NP-40); фосфолипиды, такие как фосфатидилхолин (лецитин); этоксилаты нонилфенола, такие как TERGITOLTM серии NP, жирные простые эфиры полиоксиэтилена из лаурилового, цетилового, стеарилового и олеилового спиртов (известных как поверхностно-активные вещества Brij), такие как монолауриловый эфир триэтиленгликоля (Brij 30); и сложные эфиры сорбитана (обычно известные как SPAN), такие как триолеат сорбитана (Span 85) и монолаурат сорбитана. Предпочтительными поверхностно-активными веществами для включения в эмульсию являются Tween 80TM (моноолеат полиоксиэтилена сорбитана), Span 85 (триолеат сорбитана), лецитин и Triton X-100.
Можно использовать смеси поверхностно-активных веществ, например, смеси Tween 80TM/Span 85. Также пригодна комбинация сложного эфира полиоксиэтилена и сорбитана, такого как моноолеат полиоксиэтилена сорбитана (Tween 80TM), и октоксинола, такого как трет-октилфеноксиполиэтоксиэтанол (Triton X-100). Другое пригодное сочетание включает лаурет-9 вместе со сложным эфиром полиоксиэтилена сорбитана и/или октоксинолом.
Предпочтительные количества поверхностно-активных веществ (% по массе) представляют собой: сложные эфиры полиоксиэтилена сорбитана (такие как Tween 80TM) от 0,01 до 1%, в частности, приблизительно 0,1%; октил- или нонилфеноксиполиоксиэтанолы (такие как Triton X-100, или другие детергенты серии Triton) от 0,001 до 0,1%, в частности от 0,005 до 0,02%; простые эфиры полиоксиэтилена (такие как лаурет-9) от 0,1 до 20%, предпочтительно от 0,1 до 10% и, в частности, от 0,1 до 1% или приблизительно 0,5%.
Конкретные адъюванты на основе эмульсии типа "масло-в-воде", пригодные для изобретения, включают, но не ограничиваются ими:
- Субмикронная эмульсия сквалена, TWEEN 80TM и Span 85. Состав эмульсии по объему может представлять собой приблизительно 5% сквален, приблизительно 0,5% полисорбат 80 и приблизительно 0,5% Span 85. В единицах массы, эти отношения составляют 4,3% сквален, 0,5% полисорбат 80 и 0,48% Span 85. Этот адъювант известен в качестве "MF59" (71-73), как более подробно описано в главе 10 ссылки 74 и главе 12 ссылки 75. Эмульсия MF59 преимущественно включает цитратные ионы, например, 10 мМ натрий-цитратный буфер.
- Эмульсия сквалена, токоферола и TWEEN 80TM. Эмульсия может включать фосфатно-солевой буфер. Также она может включать Span 85 (например при 1%) и/или лецитин. Эти эмульсии могут иметь от 2 до 10% сквалена, от 2 до 10% токоферола и от 0,3 до 3% TWEEN 80TM, и массовое отношение сквалена и токоферола предпочтительно составляет <1, поскольку это обеспечивает более стабильную эмульсию. Сквален и TWEEN 80TM могут быть представлены в объемном отношении приблизительно 5:2. Одну такую эмульсию можно получать растворением TWEEN 80TM в PBS с получением 2% раствора, затем смешиванием 90 мл этого раствора со смесью (5 г DL-α-токоферола и 5 мл сквалена), затем микрофлуидизацией смеси. Полученная эмульсия может иметь субмикронные капли масла, например, со средним диаметром между 100 и 250 нм, предпочтительно приблизительно 180 нм.
- Эмульсия сквалена, токоферола и детергента Triton (например, Triton X-100). Эмульсия также может включать 3d-MPL (см. ниже). Эмульсия может содержать фосфатный буфер.
- Эмульсия, содержащая полисорбат (например, полисорбат 80), детергент Triton (например, Triton X-100) и токоферол (например α-токоферола сукцинат). Эмульсия может включать эти три компонента в массовом отношении приблизительно от 75:1 до 1:10 (например 750 мкг/мл полисорбат 80, 110 мкг/мл Triton X-100 и 100 мкг/мл α-токоферола сукцината), и эти концентрации должны учитывать любой вклад в эти компоненты от антигенов. Эмульсия также может включать сквален. Эмульсия также может включать 3d-MPL (см. ниже). Водная фаза может содержать фосфатный буфер.
- Эмульсия сквалана, полисорбата 80 и полоксамера 401 ("PLURONICTM L121"). Эмульсию можно изготавливать в фосфатно-солевом буфере, pH 7,4. Эта эмульсия является пригодным носителем для доставки мурамилдипептидов, и ее можно использовать с треонил-MDP в адъюванте "SAF-1" (76) (0,05-1% Thr-MDP, 5% сквалан, 2,5% Pluronic L121 и 0,2% полисорбат 80). Ее можно использовать без Thr-MDP, как и в адъюванте "AF" (77) (5% сквалан, 1,25% Pluronic L121 и 0,2% полисорбат 80). Предпочтительной является микрофлуидизация.
- Эмульсия, содержащая сквален, водный растворитель, гидрофильное неионное поверхностно-активное вещество на основе алкилового простого эфира полиоксиэтилена (например, цетостеарилового эфира полиоксиэтилена (12)) и гидрофобное неионное поверхностно-активное вещество (например сложный эфир сорбитана или сложный эфир маннида, такой как моноолеат сорбитана или "Span 80"). Эмульсия предпочтительно является термозависимой и/или она имеет, по меньшей мере, 90% капель масла (по объему) с размером менее 200 нм. Также эмульсия может включать один или более из: алдита; криозащитного вещества (например сахара, такого как додецилмальтозид и/или сахароза); и/или алкилполигликозида. Такие эмульсии могут быть лиофилизированными.
- Эмульсия, имеющая 0,5-50% масла, 0,1-10% фосфолипида и 0,05-5% неионного поверхностно-активного вещества. Как описано в ссылке 78, предпочтительными фосфолипидными компонентами являются фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол, фосфатидилглицерин, фосфатидная кислота, сфингомиелин и кардиолипин. Капли субмикронных размеров являются преимущественными.
- Субмикронная эмульсия типа "масло-в-воде" неметаболизируемого масла (такого как легкое минеральное масло) и, по меньшей мере, одного поверхностно-активного вещества (такого как лецитин, TWEEN 80TM или Span 80). Могут быть включены добавки, такие как сапонин QuilA, холестерин, сапонин-липофильный конъюгат (такой как GPI-0100, описанный в ссылке 79, получаемый добавлением алифатического амина к дезацилсапонину через карбоксильную группу глюкуроновой кислоты), бромид диметилдиоктадециламмония и/или N,N-диоктадецил-N,N-бис(2-гидроксиэтил)пропандиамин.
- Эмульсия, содержащая минеральное масло, неионный липофильный этоксилированный жирный спирт, и неионное гидрофильное поверхностно-активное вещество (например, этоксилированный жирный спирт и/или блок-сополимер полиоксиэтилена и полиоксипропилена).
- Эмульсия, содержащая минеральное масло, неионный гидрофильный этоксилированный жирный спирт и неионное липофильное поверхностно-активное вещество (например этоксиированный жирный спирт и/или блок-сополимер полиоксиэтилена и полиоксипропилена).
- Эмульсия, в которой сапонин (например, QuilA или QS21) и стерин (например, холестерин) связаны в качестве спиралевидных мицелл (80).
Эмульсии можно смешивать с антигеном непосредственно перед применением, во время доставки. Таким образом, адъювант и антиген можно держать по отдельности в упакованной или распределенной вакцине, готовой для конечного приготовления во время применения. Антиген, как правило, может находиться в водной форме, так чтобы в итоге получить вакцину смешиванием двух жидкостей. Объемное отношение двух жидкостей для смешивания может варьировать (например, между 5:1 и 1:5), однако, как правило, оно составляет приблизительно 1:1.
Индуцирующие цитокины средства
Индуцирующие цитокины средства для включения в композиции по изобретению способны, при введении пациенту, вызывать высвобождение иммунной системой цитокинов, включая интерфероны и интерлейкины. Предпочтительные средства могут вызывать высвобождение одного или более из: интерферона-γ; интерлейкина-1; интерлейкина-2; интерлейкина-12; TNF-α; TNF-β; и GM-CSF. Предпочтительные средства вызывают высвобождение цитокинов, ассоциированных с иммунным ответом Th1-типа, например интерферона-γ, TNF-α, интерлейкина-2. Предпочтительным является стимулирование как интерферона-γ, так и интерлейкина-2.
В результате введения композиции по изобретению, таким образом, пациент имеет T-клетки, которые, при стимуляции антигеном вируса гриппа, могут высвобождать требуемый цитокин(ы) антигенспецифическим образом. Например, T-клетки, очищенные из его крови, могут высвобождать γ-интерферон при воздействии in vitro белка F. Способы измерения таких ответов в мононуклеарных клетках периферической крови (PBMC) известны в данной области, и включают ELISA, ELISPOT, проточную цитометрию и ПЦР в режиме реального времени. Например, в ссылке 81 описано исследование, в котором проводили мониторинг антигенспецифического опосредуемого T-клетками иммунного ответа против столбнячного токсоида, конкретно ответа γ-интерферона, и выявили, что ELISPOT представляет собой наиболее чувствительный способ для отличия антигенспецифических TT-индуцируемых ответов от спонтанных ответов, но что внутрицитоплазматическая детекция цитокинов проточной цитометрией представляет собой наиболее эффективный способ для детекции эффектов повторной стимуляции.
Пригодные индуцирующие цитокины средства включают, но не ограничиваются ими:
- Иммуностимулирующий олигонуклеотид, такой как олигонуклеотид, содержащий CpG-мотив (динуклеотидная последовательность, содержащая неметилированный цитозин, связанный фосфатной связью с гуанозином), или двухцепочечную РНК, или олигонуклеотид, содержащий палиндромную последовательность, или олигонуклеотид, содержащий поли(dG)последовательность.
- 3-O-деацилированный монофосфориллипид A ("3dMPL", также известный как "MPLTM") (82-85).
- Соединение имидазохинолина, такое как IMIQUIMODTM ("R-837") (86, 87), RESIQUIMODTM ("R-848") (88), и их аналоги; и их соли (например, соли хлористоводородной кислоты). Дополнительные детали, касающиеся иммуностимулирующих имидазохинолинов, могут быть найдены в ссылках с 89 по 93.
Соединение бензонафтиридина, такое как: (a) соединение формулы:
где:
R4 выбран из H, галогена, -C(O)OR7, -C(O)R7, -C(O)N(R11R12), -N(R11R12), -N(R9)2, -NHN(R9)2, -SR7, -(CH2)nOR7, -(CH2)nR7, -LR8, -LR10, -OLR8, -OLR10, C1-C6алкила, C1-C6гетероалкила, C1-C6галоалкила, C2-C8алкена, C2-C8алкина, C1-C6алкокси, C1-C6галоалкокси, арила, гетероарила, C3-C8циклоалкила и C3-C8гетероциклоалкила, где каждая из C1-C6алкильной, C1-C6гетероалкильной, C1-C6галоалкильной, C2-C8алкеновой, C2-C8алкиновой, C1-C6алкокси, C1-C6галоалкокси, арильной, гетероарильной, C3-C8циклоалкильной и C3-C8гетероциклоалкильной групп R4 необязательно замещена 1-3 заместителями, независимо выбранными из галогена, -CN, -NO2, -R7, -OR8, -C(O)R8,-OC(O)R8, -C(O)OR8, -N(R9)2, -P(O)(OR8)2, -OP(O)(OR8)2, -P(O)(OR10)2, -OP(O)(OR10)2, -C(O)N(R9)2, -S(O)2R8, -S(O)R8, -S(O)2N(R9)2, и -NR9S(O)2R8;
каждый L независимо выбран из связи, -(O(CH2)m)t-, C1-C6алкила, C2-C6алкенилена и C2-C6алкинилена, где каждый из C1-C6алкила, C2-C6алкенилена и C2-C6алкинилена L необязательно замещены 1-4 заместителями, независимо выбранными из галогена, -R8, -OR8, -N(R9)2, -P(O)(OR8)2, -OP(O)(OR8)2, -P(O)(OR10)2, и -OP(O)(OR10)2;
R7 выбран из H, C1-C6алкила, арила, гетероарила, C3-C8циклоалкила, C1-C6гетероалкила, C1-C6галоалкила, C2-C8алкена, C2-C8алкина, C1-C6алкокси, C1-C6галоалкокси и C3-C8гетероциклоалкила, где каждый из C1-C6алкильной, арильной, гетероарильной, C3-C8циклоалкильной, C1-C6гетероалкильной, C1-C6галоалкильной, C2-C8алкеновой, C2-C8алкиновой, C1-C6алкокси, C1-C6галоалкокси и C3-C8гетероциклоалкильной групп R7необязательно замещена 1-3 группами R13;
каждый R8 независимо выбран из H, -CH(R10)2, C1-C8алкила, C2-C8алкена, C2-C8алкина, C1-C6галоалкила, C1-C6алкокси, C1-C6гетероалкила, C3-C8циклоалкила, C2-C8гетероциклоалкила, C1-C6гидроксиалкила и C1-C6галоалкокси, где каждая из C1-C8алкильной, C2-C8алкеновой, C2-C8алкиновой, C1-C6гетероалкильной, C1-C6галоалкильной, C1-C6алкокси, C3-C8циклоалкильной, C2-C8гетероциклоалкильной, C1-C6гидроксиалкильной и C1-C6галоалкокси групп R8 необязательно замещена 1-3 заместителями, независимо выбранными из -CN, R11, -OR11, -SR11, -C(O)R11,-OC(O)R11, -C(O)N(R9)2, -C(O)OR11, -NR9C(O)R11, -NR9R10, -NR11R12, -N(R9)2, -OR9, -OR10, -C(O)NR11R12, -C(O)NR11OH, -S(O)2R11, -S(O)R11, -S(O)2NR11R12, -NR11S(O)2R11, -P(O)(OR11)2, и -OP(O)(OR11)2;
каждый R9 независимо выбран из H, -C(O)R8,-C(O)OR8,-C(O)R10,-C(O)OR10, -S(O)2R10, -C1-C6алкила, C1-C6гетероалкила и C3-C6циклоалкила, или каждый R9 независимо представляет собой C1-C6алкил, который вместе с N, к которому он присоединен, образует C3-C8гетероциклоалкил, где C3-C8гетероциклоалкильное кольцо необязательно содержит дополнительный гетероатом, выбранный из N, O и S, и где каждая из C1-C6алкильной, C1-C6гетероалкильной, C3-C6циклоалкильной, или C3-C8гетероциклоалкильной групп R9 необязательно замещена 1-3 заместителями, независимо выбранными из -CN, R11, -OR11, -SR11, -C(O)R11,-OC(O)R11, -C(O)OR11, -NR11R12, -C(O)NR11R12, -C(O)NR11OH, -S(O)2R11, -S(O)R11, -S(O)2NR11R12, -NR11S(O)2R11, -P(O)(OR11)2 и -OP(O)(OR11)2;
каждый R10 независимо выбран из арила, C3-C8циклоалкила, C3-C8гетероциклоалкила и гетероарила, где арильная, C3-C8циклоалкильная, C3-C8гетероциклоалкильная и гетероарильная группы необязательно замещены 1-3 заместителями, выбранными из галогена, -R8, -OR8, -LR9, -LOR9, -N(R9)2, -NR9C(O)R8, -NR9CO2R8, -CO2R8, -C(O)R8 и -C(O)N(R9)2;
R11 и R12независимо выбраны из H, C1-C6алкила, C1-C6гетероалкила, C1-C6галоалкила, арила, гетероарила, C3-C8циклоалкила и C3-C8гетероциклоалкила, где каждая из C1-C6алкильной, C1-C6гетероалкильной, C1-C6галоалкильной, арильной, гетероарильной, C3-C8циклоалкильной и C3-C8гетероциклоалкильной групп R11 и R12 необязательно замещена 1-3 заместителями, независимо выбранными из галогена, -CN, R8, -OR8, -C(O)R8,-OC(O)R8, -C(O)OR8, -N(R9)2, -NR8C(O)R8, -NR8C(O)OR8, -C(O)N(R9)2, C3-C8гетероциклоалкила, -S(O)2R8, -S(O)2N(R9)2, -NR9S(O)2R8, C1-C6галоалкила и C1-C6галоалкокси;
или каждый из R11 и R12 независимо представляет собой C1-C6алкил и, взятые вместе с атомом N, к которому они присоединены, образуют необязательно замещенное C3-C8гетероциклоалкильное кольцо, необязательно содержащее дополнительный гетероатом, выбранный из N, O и S;
каждый R13 независимо выбран из галогена, -CN, -LR9, -LOR9, -OLR9, -LR10, -LOR10, -OLR10, -LR8, -LOR8, -OLR8, -LSR8, -LSR10, -LC(O)R8,-OLC(O)R8, -LC(O)OR8, -LC(O)R10, -LOC(O)OR8, -LC(O)NR9R11, -LC(O)NR9R8, -LN(R9)2, -LNR9R8, -LNR9R10, -LC(O)N(R9)2, -LS(O)2R8, -LS(O)R8, -LC(O)NR8OH, -LNR9C(O)R8, -LNR9C(O)OR8, -LS(O)2N(R9)2, -OLS(O)2N(R9)2, -LNR9S(O)2R8, -LC(O)NR9LN(R9)2, -LP(O)(OR8)2, -LOP(O)(OR8)2, -LP(O)(OR10)2 и -OLP(O)(OR10)2;
каждый RA независимо выбран из -R8, -R7, -OR7,-OR8, -R10, -OR10, -SR8, -NO2, -CN, -N(R9)2, -NR9C(O)R8, -NR9C(S)R8, -NR9C(O)N(R9)2, -NR9C(S)N(R9)2, -NR9CO2R8, -NR9NR9C(O)R8, -NR9NR9C(O)N(R9)2, -NR9NR9CO2R8, -C(O)C(O)R8, -C(O)CH2C(O)R8, -CO2R8, -(CH2)nCO2R8, -C(O)R8, -C(S)R8, -C(O)N(R9)2, -C(S)N(R9)2, -OC(O)N(R9)2, -OC(O)R8, -C(O)N(OR8)R8, -C(NOR8)R8, -S(O)2R8, -S(O)3R8, -SO2N(R9)2, -S(O)R8, -NR9SO2N(R9)2, -NR9SO2R8, -P(O)(OR8)2, -OP(O)(OR8)2, -P(O)(OR10)2, -OP(O)(OR10)2, -N(OR8)R8, -CH=CHCO2R8, -C(=NH)-N(R9)2, и -(CH2)nNHC(O)R8; или два соседних заместителя RA на кольце A образуют 5-6-членное кольцо, которое содержит вплоть до двух гетероатомов в качестве членов кольца;
n, независимо в каждом случае, равно 0, 1, 2, 3, 4, 5, 6, 7 или 8;
каждый m независимо выбран из 1, 2, 3, 4, 5 и 6, и
t равно 1, 2, 3, 4, 5, 6, 7 или 8; (b) соединение формулы:

где:
R4 выбран из H, галогена, -C(O)OR7, -C(O)R7, -C(O)N(R11R12), -N(R11R12), -N(R9)2, -NHN(R9)2, -SR7, -(CH2)nOR7, -(CH2)nR7, -LR8, -LR10, -OLR8, -OLR10, C1-C6алкила, C1-C6гетероалкила, C1-C6галоалкила, C2-C8алкена, C2-C8алкина, C1-C6алкокси, C1-C6галоалкокси, арила, гетероарила, C3-C8циклоалкил и C3-C8гетероциклоалкила, где каждая из C1-C6алкильной, C1-C6гетероалкильной, C1-C6галоалкильной, C2-C8алкеновой, C2-C8алкиновой, C1-C6алкокси, C1-C6галоалкокси, арильной, гетероарильной, C3-C8циклоалкильной и C3-C8гетероциклоалкильной групп R4 необязательно замещена 1-3 заместителями, независимо выбранными из галогена, -CN, -NO2, -R7, -OR8, -C(O)R8,-OC(O)R8, -C(O)OR8, -N(R9)2, -P(O)(OR8)2, -OP(O)(OR8)2, -P(O)(OR10)2, -OP(O)(OR10)2, -C(O)N(R9)2, -S(O)2R8, -S(O)R8, -S(O)2N(R9)2 и -NR9S(O)2R8;
каждый L независимо выбран из связи, -(O(CH2)m)t-, C1-C6алкила, C2-C6алкенилена и C2-C6алкинилена, где каждый из C1-C6алкила, C2-C6алкенилена и C2-C6алкинилена L необязательно замещен 1-4 заместителями, независимо выбранными из галогена, -R8, -OR8, -N(R9)2, -P(O)(OR8)2, -OP(O)(OR8)2, -P(O)(OR10)2 и -OP(O)(OR10)2;
R7 выбран из H, C1-C6алкила, арила, гетероарила, C3-C8циклоалкила, C1-C6гетероалкила, C1-C6галоалкила, C2-C8алкена, C2-C8алкина, C1-C6алкокси, C1-C6галоалкокси и C3-C8гетероциклоалкила, где каждая из C1-C6алкильной, арильной, гетероарильной, C3-C8циклоалкильной, C1-C6гетероалкильной, C1-C6галоалкильной, C2-C8алкеновой, C2-C8алкиновой, C1-C6алкокси, C1-C6галоалкокси и C3-C8гетероциклоалкильной групп R7необязательно замещена 1-3 группами R13;
каждый R8 независимо выбран из H, -CH(R10)2, C1-C8алкила, C2-C8алкена, C2-C8алкина, C1-C6галоалкила, C1-C6алкокси, C1-C6гетероалкила, C3-C8циклоалкила, C2-C8гетероциклоалкила, C1-C6гидроксиалкила и C1-C6галоалкокси, где каждая из C1-C8алкильной, C2-C8алкеновой, C2-C8алкиновой, C1-C6гетероалкильной, C1-C6галоалкильной, C1-C6алкокси, C3-C8циклоалкильной, C2-C8гетероциклоалкильной, C1-C6гидроксиалкильной и C1-C6галоалкокси групп R8 необязательно замещена 1-3 заместителями, независимо выбранными из -CN, R11, -OR11, -SR11, -C(O)R11,-OC(O)R11, -C(O)N(R9)2, -C(O)OR11, -NR9C(O)R11, -NR9R10, -NR11R12, -N(R9)2, -OR9, -OR10, -C(O)NR11R12, -C(O)NR11OH, -S(O)2R11, -S(O)R11, -S(O)2NR11R12, -NR11S(O)2R11, -P(O)(OR11)2 и -OP(O)(OR11)2;
каждый R9 независимо выбран из H, -C(O)R8,-C(O)OR8,-C(O)R10,-C(O)OR10, -S(O)2R10, -C1-C6алкила, C1-C6гетероалкила и C3-C6циклоалкила, или каждый R9 независимо представляет собой C1-C6алкил, который вместе с N, к которому он присоединен, образует C3-C8гетероциклоалкил, где C3-C8гетероциклоалкильное кольцо необязательно содержит дополнительный гетероатом, выбранный из N, O и S, и где каждая из C1-C6алкильной, C1-C6гетероалкильной, C3-C6циклоалкильной или C3-C8гетероциклоалкильной групп R9 необязательно замещена 1-3 заместителями, независимо выбранными из -CN, R11, -OR11, -SR11, -C(O)R11,-OC(O)R11, -C(O)OR11, -NR11R12, -C(O)NR11R12, -C(O)NR11OH, -S(O)2R11, -S(O)R11, -S(O)2NR11R12, -NR11S(O)2R11, -P(O)(OR11)2 и -OP(O)(OR11)2;
каждый R10 независимо выбран из арила, C3-C8циклоалкила, C3-C8гетероциклоалкила и гетероарила, где арильная, C3-C8циклоалкильная, C3-C8гетероциклоалкильная и гетероарильная группы необязательно замещены 1-3 заместителями, выбранными из галогена, -R8, -OR8, -LR9, -LOR9, -N(R9)2, -NR9C(O)R8, -NR9CO2R8, -CO2R8, -C(O)R8 и -C(O)N(R9)2;
R11 и R12 независимо выбраны из H, C1-C6алкила, C1-C6гетероалкила, C1-C6галоалкила, арила, гетероарила, C3-C8циклоалкила и C3-C8гетероциклоалкила, где каждая из C1-C6алкильной, C1-C6гетероалкильной, C1-C6галоалкильной, арильной, гетероарильной, C3-C8циклоалкильной и C3-C8гетероциклоалкильной групп R11 и R12 необязательно замещена 1-3 заместителями, независимо выбранными из галогена, -CN, R8, -OR8, -C(O)R8,-OC(O)R8, -C(O)OR8, -N(R9)2, -NR8C(O)R8, -NR8C(O)OR8, -C(O)N(R9)2, C3-C8гетероциклоалкила, -S(O)2R8, -S(O)2N(R9)2, -NR9S(O)2R8, C1-C6галоалкила и C1-C6галоалкокси;
или каждый из R11 и R12 независимо представляет собой C1-C6алкил и, взятые вместе с атомом N, к которому они присоединены, образуют необязательно замещенное C3-C8гетероциклоалкильное кольцо, необязательно содержащее дополнительный гетероатом, выбранный из N, O и S;
каждый R13 независимо выбран из галогена, -CN, -LR9, -LOR9, -OLR9, -LR10, -LOR10, -OLR10, -LR8, -LOR8, -OLR8, -LSR8, -LSR10, -LC(O)R8,-OLC(O)R8, -LC(O)OR8, -LC(O)R10, -LOC(O)OR8, -LC(O)NR9R11, -LC(O)NR9R8, -LN(R9)2, -LNR9R8, -LNR9R10, -LC(O)N(R9)2, -LS(O)2R8, -LS(O)R8, -LC(O)NR8OH, -LNR9C(O)R8, -LNR9C(O)OR8, -LS(O)2N(R9)2, -OLS(O)2N(R9)2, -LNR9S(O)2R8, -LC(O)NR9LN(R9)2, -LP(O)(OR8)2, -LOP(O)(OR8)2, -LP(O)(OR10)2 и -OLP(O)(OR10)2;
каждый RA независимо выбран из -R8, -R7, -OR7,-OR8, -R10, -OR10, -SR8, -NO2, -CN, -N(R9)2, -NR9C(O)R8, -NR9C(S)R8, -NR9C(O)N(R9)2, -NR9C(S)N(R9)2, -NR9CO2R8, -NR9NR9C(O)R8, -NR9NR9C(O)N(R9)2, -NR9NR9CO2R8, -C(O)C(O)R8, -C(O)CH2C(O)R8, -CO2R8, -(CH2)nCO2R8, -C(O)R8, -C(S)R8, -C(O)N(R9)2, -C(S)N(R9)2, -OC(O)N(R9)2, -OC(O)R8, -C(O)N(OR8)R8, -C(NOR8)R8, -S(O)2R8, -S(O)3R8, -SO2N(R9)2, -S(O)R8, -NR9SO2N(R9)2, -NR9SO2R8, -P(O)(OR8)2, -OP(O)(OR8)2, -P(O)(OR10)2, -OP(O)(OR10)2, -N(OR8)R8, -CH=CHCO2R8, -C(=NH)-N(R9)2 и -(CH2)nNHC(O)R8;
n, независимо в каждом случае, равно 0, 1, 2, 3, 4, 5, 6, 7 или 8;
каждый m независимо выбран из 1, 2, 3, 4, 5 и 6, и
t равно 1, 2, 3, 4, 5, 6, 7 или 8; или (c) фармацевтически приемлемую соль любого из (a) или (b). Другие соединения бензонафтиридина и способы получения соединений бензонафтиридина описаны в WO 2009/111337. Соединение бензонафтиридина или его соль можно применять само по себе или в комбинации с одним или более другими соединениями. Например, соединение бензонафтиридина можно использовать в комбинации с эмульсией типа "масло-в-воде" или содержащей минерал композицией. В конкретном варианте осуществления соединение бензонафтиридина используют в комбинации с эмульсией типа "масло-в-воде" (например эмульсия типа сквален-вода, такая как MF59) или содержащей минерал композицией (например, минеральной солью, такой как соль алюминия или соль кальция).
- Соединение тиосемикарбазона, такое как соединения, описанные в ссылке 94. Способы составления, изготовления и скрининга активных соединений также описаны в ссылке 94. Тиосемикарбазоны являются особенно эффективными в отношении стимуляции мононуклеарных клеток периферической крови человека для продукции цитокинов, таких как TNF-α.
- Соединение триптантрина, такое как соединения, описанные в ссылке 95. Способы составления, изготовления и скрининга активных соединений также описаны в ссылке 95. Тиосемикарбазоны являются особенно эффективными в отношении стимуляции мононуклеарных клеток периферической крови человека для продукции цитокинов, таких как TNF-α.
- Нуклеозидный аналог, такой как: (a) изаторабин (ANA-245; 7-тиа-8-оксогуанозин):
и его пролекарства; (b) ANA975; (c) ANA-025-1; (d) ANA380; (e) соединения, описанные в ссылках с 96 по 98; (f) соединения, имеющие формулу:
где:
каждый из R1 и R2 независимо представляют собой H, галоген, -NRaRb, -OH, C1-6алкокси, замещенный C1-6алкокси, C1-6гетероциклил, замещенный гетероциклил, C6-10арил, замещенный C6-1Oарил, C1-6алкил или замещенный C1-6алкил;
R3 отсутствует, представляет собой H, C1-6алкил, замещенный C1-6алкил, C6-10арил, замещенный C6-10арил, гетероциклил или замещенный гетероциклил;
каждый из R4 и R5 независимо представляет собой H, галоген, гетероциклил, замещенный гетероциклил, -C(O)-Rd, C1-6алкил, замещенный C1-6алкил, или они связаны друг с другом с образованием 5-членного кольца, как в R4-5:
причем связывания достигают в связях, указанных посредством

каждый из X1 и X2 независимо представляет собой N, C, O или S;
R8 представляет собой H, галоген, -OH, C1-6алкил, C2-6алкенил, C2-6алкинил, -OH, -NRaRb, -(CH2)n-O-Rc, -O-(C1-6алкил), -S(O)pRe или -C(O)-Rd;
R9 представляет собой H, C1-6алкил, замещенный C1-6алкил, гетероциклил, замещенный гетероциклил или R9a, где R9a представляет собой:
причем связывания достигают по связи, указанной посредством

каждый из R10 и R11 независимо представляет собой H, галоген, C1-6алкокси, замещенный C1-6алкокси, -NRaRb, или -OH;
каждый из Ra и Rb независимо представляет собой H, C1-6алкил, замещенный C1-6алкил, -C(O)Rd, C6-10арил;
каждый Rc независимо представляет собой H, фосфат, дифосфат, трифосфат, C1-6алкил или замещенный C1-6алкил;
каждый Rd независимо представляет собой H, галоген, C1-6алкил, замещенный C1-6алкил, C1-6алкокси, замещенный C1-6алкокси, -NH2, -NH(C1-6алкил), -NH(замещенный C1-6алкил), -N(C1-6алкил)2, -N(замещенный C1-6алкил)2, C6-10арил или гетероциклил;
каждый Re независимо представляет собой H, C1-6алкил, замещенный C1-6алкил, C6-10арил, замещенный C6-10арил, гетероциклил или замещенный гетероциклил;
каждый Rf независимо представляет собой H, C1-6алкил, замещенный C1-6алкил, -C(O)Rd, фосфат, дифосфат или трифосфат;
каждый n независимо представляет собой 0, 1, 2 или 3;
каждый p независимо представляет собой 0, 1, или 2; или
(g) фармацевтически приемлемая соль любого из с (a) по (f), таутомер любого из с (a) по (f), или фармацевтически приемлемая соль таутомера.
- Локсорибин (7-аллил-8-оксогуанозин) (99).
- Соединения, описанные в ссылке 100, включая: соединения ацилпиперазина, соединения индолдиона, соединения тетрагидраизохинолина (THIQ), соединения бензоциклодиона, аминоазавинильные соединения, соединения аминобензимидазолхинолинона (ABIQ) (101, 102), соединения гидрафталамида, соединения бензофенона, соединения изоксазола, соединения стерина, соединения квиназилинона, соединения пиррола (103), соединения антрахинона, соединения хиноксалина, соединения триазина, соединения пиразолопиримидина и соединения бензазола (104).
- Соединения, описанные в ссылке (105)
- Производное аминоалкилглюкозаминидфосфата, такое как RC-529 (106, 107).
- Фосфазен, такой как поли[ди(карбоксилатофенокси)фосфазен] ("PCPP"), как описано, например, в ссылках 108 и 109.
- Низкомолекулярные иммуностимуляторы (SMIP), такие как:
N2-метил-1-(2-метилпропил)-1H-имидазо[4,5-c]хинолин-2,4-диамин
N2,N2-диметил-1-(2-метилпропил)-1H-имидазо[4,5-c]хинолин-2,4-диамин
N2-этил-N2-метил-1-(2-метилпропил)-1H-имидазо[4,5-c]хинолин-2,4-диамин
N2-метил-1-(2-метилпропил)-N2-пропил-1H-имидазо[4,5-c]хинолин-2,4-диамин
1-(2-метилпропил)-N2-пропил-1H-имидазо[4,5-c]хинолин-2,4-диамин
N2-бутил-1-(2-метилпропил)-1H-имидазо[4,5-c]хинолин-2,4-диамин
N2-бутил-N2-метил-1-(2-метилпропил)-1H-имидазо[4,5-c]хинолин-2,4-диамин
N2-метил-1-(2-метилпропил)-N2-пентил-1H-имидазо[4,5-c]хинолин-2,4-диамин
N2-метил-1-(2-метилпропил)-N2-проп-2-енил-1H-имидазо[4,5-c]хинолин-2,4-диамин
1-(2-метилпропил)-2-[(фенилметил)тио]-1H-имидазо[4,5-c]хинолин-4-амин
1-(2-метилпропил)-2-(пропилтио)-1H-имидазо[4,5-c]хинолин-4-амин
2-[[4-амино-1-(2-метилпропил)-1H-имидазо[4,5-c]хинолин-2-ил](метил)амино]этанол
2-[[4-амино-1-(2-метилпропил)-1H-имидазо[4,5-c]хинолин-2-ил](метил)амино]этилацетат
4-амино-1-(2-метилпропил)-1,3-дигидро-2H-имидазо[4,5-c]хинолин-2-он
N2-бутил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1H-имидазо[4,5-c]хинолин-2,4-диамин
N2-бутил-N2-метил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1H-имидазо[4,5-c]хинолин-2,4-диамин
N2-метил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1H-имидазо[4,5-c]хинолин-2,4-диамин
N2,N2-диметил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1H-имидазо[4,5-c]хинолин-2,4-диамин
1-{4-амино-2-[метил(пропил)амино]-1H-имидазо[4,5-c]хинолин-1-ил}-2-метилпропан-2-ол
1-[4-амино-2-(пропиламино)-1H-имидазо[4,5-c]хинолин-1-ил]-2-метилпропан-2-ол
N4,N4-дибензил-1-(2-метокси-2-метилпропил)-N2-пропил-1H-имидазо[4,5-c]хинолин-2,4-диамин.
Индуцирующие цитокин средства для применения в настоящем изобретении могут представлять собой модуляторы и/или агонисты Toll-подобных рецепторов (TLR). Например, они могут представлять собой агонисты одного или более из белков TLR1, TLR2, TLR3, TLR4, TLR7, TLR8 и/или TLR9 человека. Предпочтительными средствами являются агонисты TLR4 (например, модифицированный природный липид As, происходящий из липополисахаридов энтеробактерий, соединения фосфолипидов, такие как синтетический димер фосфолипида, E6020), TLR7 (например, имидазохинолины) и/или TLR9 (например, CpG-олигонуклеотиды). Эти средства пригодны для активации каскадов врожденного иммунитета.
Индуцирующее цитокин средство можно добавлять в композицию на различных стадиях в ходе ее изготовления. Например, оно может находиться в антигенной композиции, и затем эту смесь можно добавлять в эмульсию типа "масло-в-воде". В качестве альтернативы, оно может находиться в эмульсии типа "масло-в-воде", и в этом случае средство можно либо добавлять к компонентам эмульсии перед эмульгированием, либо его можно добавлять в эмульсию после эмульгирования. Аналогично, средство может подвергаться слиянию в каплях эмульсии. Расположение и распределение индуцирующего цитокин средства в конечной композиции может зависеть от его гидрофильных/липофильных свойств, например, средство может быть расположено в водной фазе, в масляной фазе и/или на границе масло-вода.
Индуцирующее цитокин средство может быть конъюгированным с отдельным средством, таким как антиген (например CRM197). Общий обзор способов конъюгации низкомолекулярных соединений предоставлен в ссылке 110. В качестве альтернативы, адъюванты могут быть нековалентно связаны с дополнительными средствами, например, посредством гидрофобных или ионных взаимодействий.
Предпочтительные индуцирующие цитокин средства представляют собой (a) соединения бензонафтиридина, (b) иммуностимулирующие олигонуклеотиды и (c) 3dMPL.
Иммуностимулирующие олигонуклеотиды могут включать модификации/аналоги нуклеотидов, такие как фосфоротиоатные модификации, и они могут быть двухцепочечными или (исключение для РНК) одноцепочечными. В ссылках 111, 112 и 113 описаны возможные замены для аналогов, например, замена гуанозина 2'-дезокси-7-деазагуанозином. Адъювантный эффект олигонуклеотидов CpG дополнительно рассмотрен в ссылках 114-119. Последовательность CpG может быть направлена на TLR9, например, мотив GTCGTT или TTCGTT (120). Последовательность CpG может быть специфичной для индукции Th1-иммунного ответа, например, CpG-A ODN (олигодезоксинуклеотида), или она может быть специфичной для индукции B-клеточного ответа, например, CpG-B ODN. CpG-A и CpG-B ODN рассмотрены в ссылках 121-123. Предпочтительно, CpG представляет собой CpG-A ODN. Предпочтительно, CpG-олигонуклеотид сконструирован так, чтобы 5'-конец был доступен для распознавания рецептором. Необязательно, две последовательности CpG-олигонуклеотидов могут быть связаны на их 3'-концах с образованием "иммуномеров". См., например, ссылки 120 и 124-126. Пригодным CpG-адъювантом является CpG7909, также известный как PROMUNETM (Coley Pharmaceutical Group, Inc.).
Альтернативно или дополнительно к применению последовательностей CpG, можно использовать последовательности TpG (127). Эти олигонуклеотиды могут не содержать неметилированных мотивов CpG.
Иммуностимулирующий олигонуклеотид может быть богатым пиримидинами. Например, он может содержать более одного последовательно расположенного тимидинового нуклеотида (например, TTTT, как описано в ссылке 127), и/или он может иметь нуклеотидный состав с >25% тимидина (например >35%, >40%, >50%, >60%, >80%, и т.д.). Например, он может содержать более одного последовательно расположенного цитозинового нуклеотида (например CCCC, как описано в ссылке 127), и/или он может иметь нуклеотидный состав с >25% цитозина (например >35%, >40%, >50%, >60%, >80%, и т.д.). Эти олигонуклеотиды могут не содержать неметилированных мотивов CpG.
Иммуностимулирующие олигонуклеотиды, как правило, содержат, по меньшей мере, 20 нуклеотидов. Они могут содержать менее 100 нуклеотидов.
3dMPL (также известный как 3-де-O-ацилированный монофосфориллипид A или 3-O-дезацил-4'-монофосфориллипид A) представляет собой адъювант, в котором положение 3 глюкозамина с восстанавливающим концом в монофосфориллипиде A является деацетилированным. 3dMPL получают из не содержащего гептоз мутанта Salmonella minnesota, и он химически сходен с липидом A, но лишен неустойчивой к кислотам фосфорильной группы и неустойчивой к основаниям ацильной группы. Он активирует клетки моноцитарного/макрофагального ростка и стимулирует высвобождение нескольких цитокинов, включая IL-1, IL-12, TNF-α и GM-CSF (также см. ссылку 128). Получение 3dMPL исходно было описано в ссылке 129.
3dMPL может иметь форму смеси сходных молекул, отличающихся их ацилированием (например, имеющих 3, 4, 5 или 6 ацильных цепей, которые могут иметь различные длины). Два моносахарида глюкозамина (также известного как 2-дезокси-2-амино-глюкоза) являются N-ацилированными по их углеродам во 2 положении (т.е. в положениях 2 и 2'), и также они имеют O-ацилирование в 3'-положении. Группа, связанная со 2 углеродом имеет формулу -NH-CO-CH2-CR1R1'. Группа, связанная со 2' углеродом, имеет формулу -NH-CO-CH2-CR2R2'. Группа, связанная с 3'-углеродом, имеет формулу -O-CO-CH2-CR3R3. Типичной структурой является:

Каждая из групп R1, R2 и R3 независимо представляют собой -(CH2)n-CH3. Значение n предпочтительно составляет между 8 и 16, более предпочтительно между 9 и 12, и наиболее предпочтительно оно составляет 10.
Каждая из групп R1', R2' и R3' независимо может представлять собой: (a) -H; (b) -OH; или (c) -O-CO-R4, где R4 представляет собой либо -H, либо -(CH2)m-CH3, где значение m предпочтительно составляет между 8 и 16, и более предпочтительно оно составляет 10, 12 или 14. Во 2 положении, m предпочтительно составляет 14. Во 2' положении, m предпочтительно составляет 10. В 3' положении, m предпочтительно составляет 12. Группы R1', R2' и R3', таким образом, предпочтительно представляют собой -O-ацильные группы из додекановой кислоты, тетрадекановой кислоты или гексадекановой кислоты.
Когда все из R1', R2' и R3' представляют собой -H, тогда 3dMPL имеет только 3 ацильных цепи (по одной в каждом из положений 2, 2' и 3'). Когда только два из R1', R2' и R3' представляют собой -H, тогда 3dMPL может иметь 4 ацильных цепи. Когда только один из R1', R2' и R3' представляет собой -H, тогда 3dMPL может иметь 5 ацильных цепей. Когда ни один из R1', R2' и R3' не представляет собой -H, тогда 3dMPL может иметь 6 ацильных цепей. Адъювант 3dMPL, используемый в соответствии в соответствии с изобретением, может представлять собой смесь этих форм, имеющих от 3 до 6 ацильных цепей, однако предпочтительно он включает 3dMPL с 6 ацильными цепями в смеси, и, в частности, обеспечивает, чтобы форма гексоацильной цепи составляла, по меньшей мере, 10% по массе от всего 3dMPL например >20%, >30%, >40%, >50% или более. Было выявлено, что 3dMPL с 6 ацильными цепями является наиболее адъювантно-активной формой.
Таким образом, наиболее предпочтительная форма 3dMPL для включения в композиции по изобретению имеет формулу (IV), представленную ниже.
Когда 3dMPL используют в форме смеси, то указания на количества или концентрации 3dMPL в композициях по изобретению относятся к комбинированным видам 3dMPL в смеси.
В водных условиях, 3dMPL может образовывать мицеллярные агрегаты или частицы с различными размерами, например, с диаметром <150 нм или >500 нм. Любой или оба из них можно использовать в соответствии с изобретением, и лучшие частицы можно отбирать посредством общепринятого анализа. Более мелкие частицы (например, достаточно маленькие для получения прозрачной водной суспензии 3dMPL) являются предпочтительными для применения в соответствии с изобретением, вследствие их более высокой активности (130). Предпочтительные частицы имеют средний диаметр менее 220 нм, более предпочтительно менее 200 нм или менее 150 нм или менее 120 нм, и они могут даже иметь средний диаметр менее 100 нм. Однако в большинстве случаев, средний диаметр не будет составлять менее 50 нм. Эти частицы являются достаточно небольшими, чтобы быть пригодными для стерилизации фильтрацией. Диаметр частиц можно оценивать общепринятым способом динамического рассеяния света, который выявляет средний размер частиц. Когда говорят, что частицы имеют диаметр x нм, тогда распределение частиц, как правило, будет в области этого среднего значения, однако, по меньшей мере, 50% по числу (например >60%, >70%, >80%, >90% или более) частиц будут иметь диаметр в диапазоне x+25%.
3dMPL можно преимущественно использовать в сочетании с эмульсией типа "масло-в-воде". По существу все из 3dMPL могут быть расположены в водной фазе эмульсии.
3dMPL можно использовать отдельно или в комбинации с одним или более другими соединениями. Например, известно применение 3dMPL в сочетании с сапонином QS21 (131) (включая эмульсию типа "масло-в-воде" (132)), с иммуностимулирующим олигонуклеотидом, как с QS21, так и с иммуностимулирующим олигонуклеотидом, с фосфатом алюминия (133), с гидроксидом алюминия (134), или как с фосфатом алюминия, так и с гидроксидом алюминия.

Жировые адъюванты
Жировые адъюванты, которые можно использовать по изобретению, включают эмульсии типа "масло-в-воде", описанные выше, а также включают, например:
- Соединение формулы I, II или III, или его соль:

как определено в ссылке 135, такое как "ER 803058", "ER 803732", "ER 804053", "ER 804058", "ER 804059", "ER 804442", "ER 804680", "ER 804764", "ER 803022" или "ER 804057", например:
ER804057 также называется E6020. Соединение фосфолипида формулы I, II или III или его соль можно использовать само по себе или в комбинации с одним или более другими соединениями. Например, соединение формулы I, II или III можно использовать в комбинации с эмульсией типа "масло-в-воде" эмульсия или содержащей минерал композицией. В конкретном варианте осуществления E6020 используют в комбинации с эмульсией типа "масло-в-воде" (например эмульсия типа сквален-вода, такая как MF59) или содержащей минерал композицией (например, соль минерала, такая как соль алюминия или соль кальция).
- Производные липида A из Escherichia coli, такие как OM-174 (описанные в ссылках 136 и 137).
- Состав катионного липида и (как правило, нейтрального) колипида, такого как бромид аминопропилдиметилмиристолеилоксипропанаминия-дифитаноилфосфатидилэтаноламин ("VAXFECTINTM") или бромид аминопропилдиметил-бис-додецилоксипропанаминия-диолеилфосфатидилэтаноламин ("GAP-DLRIE:DOPE"). Составы, содержащие соли (+)-N-(3-аминопропил)-N,N-диметил-2,3-бис(син-9-тетрадеценилокси)-1-пропанаминия являются предпочтительными (138).
- 3-O-даацетилированный монофосфориллипид A (см. выше).
- Соединения, содержащие липиды, связанные с содержащим фосфат ациклическим остовом, такие как антагонист TLR4 E5564 (139, 140):

Липопептиды (т.е., соединения, содержащие один или более остатков жирной кислоты и два или более аминокислотных остатка), такие как липопептиды на основе глицерилцистеина. Конкретные примеры таких пептидов включают соединения следующей формулы:

в которых каждый из R1 и R2 представляет собой насыщенный или ненасыщенный, алифатический или смешанный алифатический-циклоалифатический углеводородный радикал, имеющий от 8 до 30, предпочтительно от 11 до 21, атомов углерода, который необязательно также замещен функциональными группами кислорода, R3 представляет собой водород или радикал R1-CO-O-CH2-, в котором R1имеет то же значение, что и указано выше, и X представляет собой аминокислоту, связанную пептидной связью и имеющую свободную, этерифицированную или амидированную карбоксигруппу, или аминокислотную последовательность из 2-10 аминокислот, в которой концевая карбоксигруппа находится в свободной, этерифицированной или амидированной форме. В определенных вариантах осуществления аминокислотная последовательность содержит D-аминокислоту, например, D-глутаминовую кислоту (D-Glu) или D-гамма-карбоксиглутаминовую кислоту (D-Gla).
Бактериальные липопептиды, как правило, распознают TLR2, не требуя участия TLR6. (TLR действуют совместно, обеспечивая специфическое распознавание различных пусковых факторов, и TLR2 вместе с TLR6 распознают пептидогликаны, в то время как TLR2 без TLR6 распознает липопептиды.) Их иногда классифицируют как природные липопептиды и синтетические липопептиды. Синтетические липопептиды имеют тенденцию к сходному поведению, и, главным образом, распознаются посредством TLR2.
Липопептиды, пригодные для применения в качестве адъювантов, включают соединения формулы:

где оба из хирального центра, обозначенного *, и хирального центра, обозначенного ***, находятся в R-конфигурации;
хиральный центр, обозначенный **, находится либо в R-, либо в S-конфигурации;
каждый из R1a и R1b независимо представляет собой алифатическую или циклоалифатическую-алифатическую углеводородную группу, имеющую 7-21 атомов углерода, необязательно замещенную функциональными группами кислорода, или один из R1a и R1b, но не оба, представляет собой H;
R2 представляет собой алифатическую или циклоалифатическую углеводородную группу, имеющую 1-21 атомов углерода и, необязательно, замещенную функциональными группами кислорода;
n равно 0 или 1;
As представляет собой либо -O-Kw-CO-, либо -NH-Kw-CO-, где Kw представляет собой алифатическую углеводородную группу, имеющую 1-12 атомов углерода;
As1 представляет собой D- или L-альфа-аминокислоту;
Каждый из Z1 и Z2 независимо представляет собой -OH или N-концевой радикал D- или L-альфа аминокислоты в амино-(низший алкан)-сульфоновой кислоте или пептиде, имеющем вплоть до 6 аминокислот, выбранных из D- и L-альфа-аминокарбоновых кислот и амино-низший алкил-сульфоновых кислот; и
Z3 представляет собой H или -CO-Z4, где Z4 представляет собой -OH или N-концевой радикал D- или L-альфа-аминокислоты в амино-(низший алкан)-сульфоновой кислоте или пептиде, имеющем вплоть до 6 аминокислот, выбранных из D и L-альфа-аминокарбоновых кислот и амино-низший алкил-сульфоновых кислот; или сложный эфир или амид, образованные из карбоновой кислоты таких соединений. Пригодные амиды включают -NH2 и NH(низший алкил), и пригодные сложные эфиры включают C1-C4 алкиловые сложные эфиры. (Низший алкил или низший алкан, как используют в настоящем документе, относится к C1-C6 неразветвленным или разветвленным алкилам).
Такие соединения более подроблено описаны в US 4666886. В одном конкретном варианте осуществления липопептид имеет формулу:
Другой пример типа липопептидов называется LP40, и они являются агонистами TLR2. Akdis, et al., Eur. J. Immunology, 33: 2717-26 (2003). Они являются родственными известному классу липопептидов из E. coli, называемому муреин-липопротеинами. Определенные продукты неполной деградации этих белков, названные муреин-липопептидами, описаны в Hantke, et al., Eur. J. Biochem., 34: 284-296 (1973). Они содержат пептид, связанный с N-ацетил-мурамовой кислотой и, таким образом, являются родственными мурамилпептидам, которые описаны в Baschang, et al., Tetrahedron, 45(20): 6331-6360 (1989).
Адъюванты на основе солей алюминия
Можно использовать адъюванты, известные как "гидроксид алюминия" и "фосфат алюминия". Эти названия являются общепринятыми, однако их используют только для удобства, поскольку ни один из них не имеет точного описания действительного химического соединения, которое существует (например, см. глава 9 ссылки 74). В изобретении можно использовать любой из "гидроксидных" или "фосфатных" адъювантов, которые обычно используют в качестве адъювантов.
Адъюванты, известные в качестве "гидроксида алюминия", как правило, представляют собой соли оксигидроксида алюминия, которые, как правило, являются, по меньшей мере, частично кристаллическими. Оксигидроксид алюминия, который может быть представлен формулой AlO(OH), можно отличить от других соединений алюминия, таких как гидроксид алюминия Al(OH)3, с помощью инфракрасной (IR) спектроскопии, в частности, по наличию полосы поглощения при 1070 см-1 и выраженного плеча при 3090-3100 см-1 (глава 9 ссылки 74). Степень кристалличности адъюванта на основе гидроксида алюминия отражается шириной полосы дифракции при половине высоты (WHH), со слабо кристаллическими частицами, демонстрирующими большее расширение линий вследствие меньших кристаллических размеров. Площадь поверхности возрастает по мере повышения WHH, и было выявлено, что адъюванты с более высокими значениями WHH имеют более высокую способность к поглощению антигена. Волокнистая морфология (например, как видно на трансмиссионных электронных микрофотографиях) является типичной для адъювантов на основе гидроксида алюминия. pI адъювантов на основе гидроксида алюминия, как правило, составляет приблизительно 11, т.е. адъювант сам по себе имеет положительный заряд на поверхности при физиологических значениях pH. Для адъювантов на основе гидроксида алюминия были описаны поглощающие способности между 1,8-2,6 мг белка на мг Al+++ при pH 7,4.
Адъюванты, известные как "фосфат алюминия", как правило, представляют собой гидроксифосфаты алюминия, часто также содержащие небольшие количества сульфата (т.е. сульфат гидроксифосфата алюминия). Их можно получать осаждением, и условия реакции и концентрация в ходе осаждения влияют на степень замещения фосфатом гидроксила в соли. Гидроксифосфаты, как правило, имеют молярное отношение PO4/Al между 0,3 и 1,2. Гидроксифосфаты можно отличить от строго AlPO4 наличием гидроксильных групп. Например, полоса спектра IR при 3164 см-1 (например, при нагревании до 200°С) указывает на наличие структурных гидроксилов (глава 9 ссылки 74).
Молярное отношение PO4/A13+ адъюванта на основе фосфата алюминия, как правило, может находиться между 0,3 и 1,2, предпочтительно, между 0,8 и 1,2, и более предпочтительно оно может составлять 0,95+0,1. Фосфат алюминия, как правило, может быть аморфным, в частности, для гидроксифосфатных солей. Типичным адъювантом является аморфный гидроксифосфат алюминия с молярным отношением PO4/Al между 0,84 и 0,92, включенный в количестве 0,6 мг Al3+/мл. Фосфат алюминия, как правило, может представлять собой твердые частицы (например, он может иметь пластинчатую морфологию при наблюдении на трансмиссионных электронных микрофотографиях). Типичные диаметры частиц находятся в диапазоне 0,5-20 мкм (например, приблизительно 5-10 мкм) после адсорбции антигена. Для адъювантов на основе фосфата алюминия описана адсорбционная способность между 0,7-1,5 мг белка на мг Al+++ при pH 7,4.
Точка нулевого заряда (PZC) фосфата алюминия обратно пропорционально связана со степенью замещения фосфатом гидроксила, и эта степень замещения может варьировать в зависимости от условий реакции и концентрации реактантов, используемых для получения соли осаждением. PZC также изменяется при изменении концентрации свободных фосфатных ионов в растворе (большее количество фосфата = более кислая PZC) или при добавлении буфера, такого как гистидиновый буфер (делает PZC более основным). Фосфаты алюминия, используемые в соответствии с изобретением, как правило, могут иметь PZC между 4,0 и 7,0, более предпочтительно между 5,0 и 6,5 например, приблизительно 5,7.
Суспензии солей алюминия, используемые для получения композиций по изобретению, могут содержать буфер (например, фосфатный или гистидиновый буфер или буфер Tris), однако это не всегда необходимо. Суспензии предпочтительно являются стерильными и не содержат пирогенов. Суспензия может включать свободные водные ионы фосфата, например, присутствующие в концентрации между 1,0 и 20 мМ, предпочтительно между 5 и 15 мМ, и более предпочтительно приблизительно 10 мМ. Также суспензии могут содержать хлорид натрия.
В изобретении можно использовать смесь как гидроксида алюминия, так и фосфата алюминия. В этом случае, фосфата алюминия может быть больше, чем гидроксида алюминия например, в массовом соотношении, по меньшей мере, 2:1 например >5:1, >6:1, >7:1, >8:1, >9:1 и т.д.
Концентрация Al+++ в композиции для введения пациенту предпочтительно составляет менее 10 мг/мл например, <5 мг/мл, <4 мг/мл, <3 мг/мл, <2 мг/мл, <1 мг/мл и т.д. Предпочтительный диапазон составляет между 0,3 и 1 мг/мл. Предпочтительным является максимум 0,85 мг/доза.
Помимо включения одного или более адъювантов на основе солей алюминия, адъювантный компонент может включать один или более дополнительных адъювантов или иммуностимулирующих средств. Такие дополнительные компоненты включают, но не ограничиваются ими: адъювант на основе 3-O-деацилированного монофосфориллипида A ("3d-MPL"); и/или эмульсию типа "масло-в-воде". 3d-MPL также обозначают как 3-де-O-ацилированный монофосфориллипид A или 3-O-деацил-4'-монофосфориллипид A. Название указывает на то, что положение 3 глюкозамина с восстанавливающим концом в монофосфориллипиде A является деацилированным. Его получают из не содержащего гептоз мутанта S. minnesota, и он химически сходен с липидом A, но лишен неустойчивой к кислотам фосфорильной группы и неустойчивой к основаниям ацильной группы. Он активирует клетки моноцитарного/макрофагального ростка и стимулирует высвобождение нескольких цитокинов, включая IL-1, IL-12, TNF-α и GM-CSF. Получение 3d-MPL исходно было описано в ссылке 129, и продукт изготавливается и продается Corixa Corporation под названием MPLTM. Дальнейшие детали могут быть найдены в ссылках с 82 по 85.
Применение адъюванта на основе гидроксида алюминия и/или фосфата алюминия пригодно, в частности у детей, и антигены, как правило, адсорбируют на эти соли. Также предпочтительными являются эмульсии типа "сквален-в-воде", в частности у пожилых. Пригодные комбинации адъювантов включают комбинации Th1- и Th2-адъювантов, такие как CpG и квасцы, или резиквимод и квасцы. Можно использовать комбинацию фосфата алюминия и 3dMPL. Другие комбинации, которые можно использовать, включают: квасцы и соединение бензонафтиридина или SMIP, эмульсию типа "сквален-в-воде" (такую как MF59) и соединение бензонафтиридина или SMIP, и E6020 и эмульсия типа "сквален-в-воде", (такая как MF59) или квасцы.
Композиции по изобретению могут индуцировать как клеточно-опосредуемый иммунный ответ, так и гуморальный иммунный ответ.
Главным образом, полагают, что для инициации и/или усиления клеточно-опосредуемого иммунитета и гуморального иммунитета необходимо два типа T-клеток, CD4- и CD8-клетки. CD8 T-клетки могут экспрессировать корецептор CD8 и обычно их называют цитотоксическими T-лимфоцитами (CTL). CD8 T-клетки способны распознавать и взаимодействовать с антигенами, экспонированными на молекулах MHC класса I.
CD4 T-клетки могут экспрессировать корецептор CD4 и обычно их называют T-хелперными клетками. CD4 T-клетки способны распознавать антигенные пептиды, связанные с молекулами MHC класса II. При взаимодействии с молекулой MHC класса II, CD4-клетки могут секретировать факторы, такие как цитокины. Эти секретируемые цитокины могут активировать B-клетки, цитотоксические T-клетки, макрофаги и другие клетки, которые участвуют в иммунном ответе. Хелперные T-клетки или CD4+ клетки можно далее подразделить на две функционально отличающихся подгруппы: TH1-фенотип и TH2-фенотип, которые отличаются их цитокинами и эффекторными функциями.
Активированные TH1-клетки усиливают клеточный иммунитет (включая увеличение продукции антигенспецифических CTL) и, таким образом, имеют особое значение при ответе на внутриклеточные инфекции. Активированные TH1-клетки могут секретировать один или более из IL-2, IFN-γ и TNF-β. TH1-иммунный ответ может приводить к локальным воспалительным реакциям путем активации макрофагов, NK (естественных киллерных) клеток и CD8 цитотоксических T-клеток (CTL). TH1-иммунный ответ также может действовать, расширяя иммунный ответа путем стимуляции роста B- и T-клеток посредством IL-12. TH1-стимулированные B-клетки могут секретировать IgG2a.
Активированные TH2-клетки усиливают продукцию антител и, таким образом, имеют значение при ответе на внеклеточные инфекции. Активированные TH2-клетки могут секретировать один или более из IL-4, IL-5, IL-6, и IL-10. TH2-иммунный ответ может приводить к продукции IgG1, IgE, IgA и B-клеток памяти для будущей защиты.
Усиленный иммунный ответ может включать один или более из усиленного TH1-иммунного ответа и TH2-иммунного ответа.
TH1-иммунный ответ может включать одно или более из увеличения количества CTL, увеличения уровня одного или более цитокинов, ассоциированных с TH1-иммунным ответом (таких как IL-2, IFN-γ и TNF-β), увеличения количества активированных макрофагов, увеличения активности NK или увеличения продукции IgG2a. Предпочтительно, усиленный TH1-иммунный ответ включает увеличение продукции IgG2a.
TH1-иммунный ответ можно индуцировать с использованием TH1-адъюванта. TH1-адъювант обычно индуцирует увеличенные уровни продукции IgG2a относительно иммунизации антигеном без адъюванта. TH1-адъюванты, пригодные для применения в изобретении, могут включать, например, составы сапонина, виросомы и вирусоподобные частицы, нетоксичные производные липополисахарида энтеробактерий (LPS), иммуностимулирующие олигонуклеотиды. Иммуностимулирующие олигонуклеотиды, такие как олигонуклеотиды, содержащие мотив CpG, являются предпочтительными TH1-адъювантами для применения в изобретении.
TH2-иммунный ответ может включать одно или более из увеличения уровня одного или более цитокинов, ассоциированных с TH2-иммунным ответом (таких как IL-4, IL-5, IL-6 и IL-10), или увеличения продукции IgG1, IgE, IgA и образования B-клеток памяти. Предпочтительно, усиленный TH2-иммунный ответ включает увеличение продукции IgG1.
TH2-иммунный ответ можно индуцировать с использованием TH2-адъюванта. TH2-адъювант, как правило, индуцирует увеличенные уровни продукции IgG1 относительно иммунизации антигеном без адъюванта. TH2-адъюванты, пригодные для применения в изобретении, включают, например, содержащие минерал композиции, масляные эмульсии и ADP-рибозилирующие токсины и их детоксифицированные производные. Содержащие минерал композиции, такие как соли алюминия, являются предпочтительными TH2-адъювантами для применения в изобретении.
Композиция может включать комбинацию TH1-адъюванта и TH2-адъюванта. Предпочтительно, такая композиция индуцирует усиленный TH1- и усиленный TH2-ответ, т.е. увеличение продукции как IgG1, так и IgG2a, относительно иммунизации без адъюванта. Еще более предпочтительно, композиция, содержащая комбинацию TH1- и TH2-адъюванта индуцирует увеличенный TH1- и/или увеличенный TH2-иммунный ответ относительно иммунизации одним адъювантом (т.е. относительно иммунизации TH1-адъювантом отдельно или иммунизации TH2 адъювантом отдельно).
Иммунный ответ может представлять собой один или оба из TH1-иммунного ответа и TH2-ответа. Предпочтительно, иммунный ответ обеспечивает один или более из усиленного TH1-ответа и усиленного TH2-ответа.
Усиленный иммунный ответ может представлять собой один или оба из системного иммунного ответа и иммунного ответа слизистой оболочки. Предпочтительно, иммунный ответ обеспечивает один или оба из усиленного системного иммунного ответа и усиленного иммунного ответа слизистой оболочки. Предпочтительно иммунный ответ слизистой оболочки представляет собой TH2-иммунный ответ. Предпочтительно, иммунный ответ слизистой оболочки включает увеличение продукции IgA.
Способы лечения и введения
Композиции по изобретению пригодны для введения млекопитающему, и изобретение относится к способу индукции иммунного ответа у млекопитающего, включающему стадию введения композиции (например, иммуногенной композиции) по изобретению млекопитающему. Композиции (например, иммуногенную композицию) можно использовать для получения вакцинного состава для иммунизации млекопитающего. Млекопитающим обычно является человек, и эктодоменом белка F RSV, как правило, является эктодомен белка F RSV человека. Однако млекопитающим может быть любое млекопитающее, которое является восприимчивым к инфекции RSV, такое как корова, которую можно инфицировать бычьим RSV. Например, иммунный ответ можно индуцировать введением очищенного белка F RSV, частицы альфавируса и или самореплицирующейся РНК.
Также изобретение относится к композиции по изобретению для применения в качестве лекарственного средства, например, для применения для иммунизации пациента против инфекции RSV.
Также изобретение относится к применению полипептида, как описано выше, для изготовления лекарственного средства для индукции иммунного ответа у пациента.
Иммунный ответ, индуцируемый этими способами и применениями, обычно включает антительный ответ, предпочтительно защитный антительный ответ. Способы оценки антительных ответов после вакцинации RSV хорошо известны в данной области.
Композиции по изобретению можно вводить рядом пригодных способов, таких как внутримышечная инъекция (например, руку или ногу), подкожная инъекция, интраназальное введение, пероральное введение, внутрикожное введение, чрескожное введение, трансдермальное введение и т.п. Соответствующий путь введения зависит от возраста, здоровья и других характеристик млекопитающего. Врач способен определить соответствующий путь введения на основе этих и других факторов.
Иммуногенные композиции и вакцинные составы можно применять для лечения как детей, так и взрослых, в том числе беременных женщин. Таким образом, возраст индивидуума может составлять менее 1 года, 1-5 лет, 5-15 лет, 15-55 лет, или, по меньшей мере, 55 лет. Предпочтительными для введения вакцин индивидуумами являются пожилые люди (например, >50 лет, >60 лет и предпочтительно >65 лет), молодые (например, <6 лет, как например, 4-6 лет, <5 лет) и беременные женщины. Однако вакцины пригодны не только для этих групп и их можно применять в целом в популяции.
Лечение можно проводить по схеме с одной дозой или по схеме со множеством доз. Множество доз можно использовать в схеме первичной иммунизации и/или в схеме вспомогательной иммунизации. В схеме со множеством доз различные дозы можно вводить одним и тем же или различными путями, например, первичную иммунизацию парентарельным путем, а вспомогательную иммунизацию введением на слизистую оболочку, первичную иммунизацию введением на слизистую оболочку и вторичную иммунизацию парентеральным путем, и т.д. Введение более чем одной дозы (как правило, двух доз) является особенно пригодным у иммунологически наивных пациентов. Множество доз, как правило, можно вводить с интервалом, по меньшей мере, 1 неделя (например приблизительно 2 недели, приблизительно 3 недели, приблизительно 4 недели, приблизительно 6 недель, приблизительно 8 недель, приблизительно 12 недель, приблизительно 16 недель и т.д.).
Вакцинные составы, получаемые с использованием композиции по изобретению, можно вводить пациентам по существу одновременно (например, в ходе одной медицинской консультации или посещения работника здравоохранения или центра вакцинации) с другими вакцинами.
Другие аспекты изобретения
Также изобретение относится к полипептиду (например рекомбинантному полипептиду), содержащему первый домен и второй домен, где (i) первый домен содержит эктодомен гликопротеина F RSV, целиком или частично, и (ii) второй домен содержит гетерологичный домен олигомеризации. Дополнительные детали предоставлены выше. Если домен олигомеризации содержит семичленную последовательность (напримерпоследовательность из GCN, описанная выше), то предпочтительно его семичленный повтор находится в рамке считывания с последовательностью эктодомена HR2 (если она присутствует).
Также изобретение относится к нуклеиновой кислоте (напримерДНК), кодирующей этот полипептид. Также оно относится к векторам, включающим такие нуклеиновые кислоты, и к клеткам-хозяевам, включающим такие векторы. Векторы можно использовать, например, дляцелей рекомбинантной экспрессии, иммунизации нуклеиновыми кислотами и т.д.
Также изобретение относится к композиции, содержащей молекулы, содержащие эктодомены гликопротеина F RSV, где эктодомены, по меньшей мере, 50% (например, 50%, 60%, 70%, 80%, 85%, 90%, 95% или 100%) молекул присутствуют в конформации "до слияния".
Другие вирусы
Помимо применения для RSV человека, изобретение можно использовать для других представителей Pneumoviridae и Paramyxoviridae, включая, но не ограничиваясь ими, респираторно-синцитиальный вирус быков, вирус парагриппа 1, вирус парагриппа 2, вирус парагриппа 3 и вирус парагриппа 5.
Таким образом, изобретение относится к иммуногенной композиции, содержащей гликопротеин F из Pneumoviridae или Paramyxoviridae, где гликопротеин F находится в конформации "до слияния".
Также изобретение относится к иммуногенной композиции, содержащей полипептид, который экспонирует эпитоп, присутствующий в конформации "до слияния" гликопротеина F Pneumoviridae или Paramyxoviridae, но отсутствует в конформации "после слияния" гликопротеина.
Также изобретение относится к полипептиду, содержащему первый домен и второй домен, где (i) первый домен содержит эктодомен гликопротеина F Pneumoviridae или Paramyxoviridae, целиком или частично, и (ii) второй домен содержит гетерологичный домен олигомеризации.
Также изобретение относится к этим полипептидам и композициям для применения в иммунизации, и т.д.
Также изобретение относится к композиции, содержащей молекулы, содержащие эктодомены гликопротеина F RSV, где эктодомены, по меньшей мере, 50% (например, 50%, 60%, 70%, 80%, 85%, 90%, 95% или 100%) молекул присутствуют в конформации "до слияния" или в промежуточной конформации.
Полипептиды эктодомена белка F RSV
Применяют конкретные полипептиды эктодомена белка F RSV и они включены в некоторые варианты осуществления изобретения. Некоторые из конкретных полипептидов эктодомена белка F RSV содержат измененные аминокислотные последовательности от приблизительно положения 100 до приблизительно положения 161. Аминокислотные последовательности от положения 100 до положения 150 для нескольких конкретных полипептидов эктодомена белка F RSV представлены на ФИГ. 1C. Аминокислотные последовательности нескольких конкретных полипептидов эктодомена белка F RSV представлены в настоящем документе, например, в примере 1.
Общие положения
Термин "содержащий" охватывает "включающий", а также "состоящий из" например, композиция, "содержащая" X, может состоять исключительно из X или она может включать что-либо дополнительное, например X + Y.
Слово "по существу" не исключает "полностью", например, композицию, которая "по существу не содержит" Y, может полностью не содержать Y. Когда необходимо, слово "по существу" может быть пропущено в определении в соответствии с изобретением.
Термин "приблизительно" в отношении числового значения x означает, например, x±10%.
Если нет конкретных указаний, процесс, включающий стадию смешивания двух или более компонентов, не требует какого-либо конкретного порядка смешивания. Таким образом, компоненты можно смешивать в любом порядке. Когда имеются три компонента, два компонента можно объединять друг с другом, а затем сочетание можно комбинировать с третьим компонентом, и т.д.
Когда используют материалы животных (и, в частности, крупного рогатого скота) в культуре клеток, они должны быть получены из источников, в которых отсутствуют трансмиссивные губчатые энцефалопатии (TSE), и, в частности, отсутствует губчатая энцефалопатия крупного рогатого скота (BSE). В целом, предпочтительным является культивирование клеток при полном отсутствии материалов из животных.
Когда соединение вводят в организм в качестве части композиции, тогда это соединение можно альтернативно заменять пригодным пролекарством.
Когда используют клеточный субстрат для реассортации или способов возвратной генетики, он предпочтительно представляет собой клеточный субстрат, одобренный для применения при продукции вакцин у человека, например, как в основной главе Ph Eur 5.2.3.
Идентичность между полипептидными последовательностями предпочтительно определяют посредством алгоритма поиска гомологии Smith-Waterman, осуществляемого программой MPSRCH (Oxford Molecular), с использованием аффинного поиска пропусков с параметрами: штраф за внесение делеции=12 и штраф за продолжение делеции=1.
ПРИМЕРЫ
Пример 1 - полипептиды F RSV
В этом примере предоставлены последовательности ряда примеров полипептидов (например, которые содержат сигнальные последовательности) и последовательности нуклеиновых кислот, которые можно использовать для экспрессии полипептидов RSV F по настоящему изобретению. Представленные аминокислотные последовательности включают сигнальный пептид и содержат необязательный C-концевой линкер и His-метку (GGSAGSGHHHHHH (SEQ ID NO: 90)). Когда эти полипептиды продуцируются в клетках-хозяевах, полипептид обычно процессируется клеткой для удаления сигнального пептида и, как описано в настоящем документе, некоторые из полипептидов будут расщепляться по немодифицированным участкам расщепления фурином. Изобретение включает композиции, которые содержат все формы конкретных полипептидов эктодомена белка F RSV, описанных в настоящем документе, включая зрелые формы, которые лишены сигнального пептида, формы, которые могут быть расщеплены на субъединицы, которые содержат F1 и F2, и формы, которые лишены необязательной C-концевой His-метки. Следующие примеры являются только иллюстрирующими объем настоящего изобретения, и, таким образом, не предназначены для ограничения объема никоим образом.
Примером расщепляемого фурином полипептида дикого типа является RSV F wild type Truncated HIS (SEQ ID NO: 84.
Примеры полипептидов, которые можно продуцировать в качестве мономеров, включают: RSV F Furx (SEQ ID NO: 45); RSV F old furx Truncated HIS (SEQ ID NO: 88); RSV F Furx R113Q K123N K124N Truncated HIS (SEQ ID NO: 89); RSV F delp21 furx Truncated HIS (SEQ ID NO: 47); и RSV F delP23 furx Truncated HIS (SEQ ID NO: 48).
Примеры полипептидов, которые можно получать в качестве тримеров, включают: RSV F N-term Furin Truncated HIS (SEQ ID NO: 85); RSV F Fusion Deletion Truncated HIS (SEQ ID NO: 67) и RSV F Fusion Deletion 2 Truncated HIS (SEQ ID NO: 68).
Примеры полипептидов, которые можно получать в качестве мономеров или розеткообразных структур тримеров, включают: RSV F furmt Truncated HIS (SEQ ID NO: 50); RSV F furdel Truncated HIS (SEQ ID NO: 51); RSV F delP21 furdel Truncated HIS (SEQ ID NO: 86); и RSV F delP23 furdel Truncated HIS (SEQ ID NO: 49) и RSV F Factor Xa Truncated HIS (SEQ ID NO: 52).
Примером расщепляемого полипептида дикого типа, который, вероятно, образует розетку, является RSV F C-term Furin Truncated HIS (SEQ ID NO: 87).
full
Следующий полипептид представляет собой полноразмерный полипептид F RSV
1 MELLILKANA ITTILTAVTF CFASGQNITE EFYQSTCSAV SKGYLSALRT GWYTSVITIE
61 LSNIKENKCN GTDAKVKLIK QELDKYKNAV TELQLLMQST PATNNRARRE LPRFMNYTLN
121 NAKKTNVTLS KKRKRRFLGF LLGVGSAIAS GVAVSKVLHL EGEVNKIKSA LLSTNKAVVS
181 LSNGVSVLTS KVLDLKNYID KQLLPIVNKQ SCSISNIETV IEFQQKNNRL LEITREFSVN
241 AGVTTPVSTY MLTNSELLSL INDMPITNDQ KKLMSNNVQI VRQQSYSIMS IIKEEVLAYV
301 VQLPLYGVID TPCWKLHTSP LCTTNTKEGS NICLTRTDRG WYCDNAGSVS FFPQAETCKV
361 QSNRVFCDTM NSLTLPSEVN LCNVDIFNPK YDCKIMTSKT DVSSSVITSL GAIVSCYGKT
421 KCTASNKNRG IIKTFSNGCD YVSNKGVDTV SVGNTLYYVN KQEGKSLYVK GEPIINFYDP
481 LVFPSDEFDA SISQVNEKIN QSLAFIRKSD ELLHNVNAGK STTNIMITTI IIVIIVILLS
541 LIAVGLLLYC KARSTPVTLS KDQLSGINNI AFSN (SEQ ID NO: 21)
Следующая последовательность нуклеиновой кислоты представляет собой оптимизированную кодирующую последовательность для указанной выше полипептидной последовательности.
1 ATGGAACTGC TGATCCTGAA GGCCAACGCC ATCACCACCA TCCTGACCGC CGTGACCTTC
61 TGCTTCGCCA GCGGCCAGAA CATCACCGAG GAATTCTACC AGAGCACCTG CAGCGCCGTG
121 AGCAAGGGCT ACCTGAGCGC CCTGCGGACC GGCTGGTACA CCAGCGTGAT CACCATCGAG
181 CTGTCCAACA TCAAAGAAAA CAAGTGCAAC GGCACCGACG CCAAGGTGAA ACTGATCAAG
241 CAGGAACTGG ACAAGTACAA GAACGCCGTG ACCGAGCTGC AGCTGCTGAT GCAGAGCACC
301 CCCGCCACCA ACAACCGGGC CAGAAGAGAG CTGCCCCGGT TCATGAACTA CACCCTGAAC
361 AACGCCAAGA AAACCAACGT GACCCTGAGC AAGAAGCGGA AGCGGCGGTT CCTGGGCTTC
421 CTGCTGGGCG TGGGCAGCGC CATCGCCAGC GGGGTGGCCG TGTCCAAGGT GCTGCACCTG
481 GAAGGCGAGG TGAACAAGAT CAAGTCCGCC CTGCTGTCCA CCAACAAGGC CGTGGTGTCC
541 CTGAGCAACG GCGTGAGCGT GCTGACCAGC AAGGTGCTGG ATCTGAAGAA CTACATCGAC
601 AAGCAGCTGC TGCCCATCGT GAACAAGCAG AGCTGCAGCA TCAGCAACAT CGAGACCGTG
661 ATCGAGTTCC AGCAGAAGAA CAACCGGCTG CTGGAAATCA CCCGGGAGTT CAGCGTGAAC
721 GCCGGCGTGA CCACCCCCGT GAGCACCTAC ATGCTGACCA ACAGCGAGCT GCTGTCCCTG
781 ATCAATGACA TGCCCATCAC CAACGACCAG AAAAAGCTGA TGAGCAACAA CGTGCAGATC
841 GTGCGGCAGC AGAGCTACTC CATCATGAGC ATCATCAAAG AAGAGGTGCT GGCCTACGTG
901 GTGCAGCTGC CCCTGTACGG CGTGATCGAC ACCCCCTGCT GGAAGCTGCA CACCAGCCCC
961 CTGTGCACCA CCAACACCAA AGAGGGCAGC AACATCTGCC TGACCCGGAC CGACCGGGGC
1021 TGGTACTGCG ACAACGCCGG CAGCGTGAGC TTCTTCCCCC AAGCCGAGAC CTGCAAGGTG
1081 CAGAGCAACC GGGTGTTCTG CGACACCATG AACAGCCTGA CCCTGCCCTC CGAGGTGAAC
1141 CTGTGCAACG TGGACATCTT CAACCCCAAG TACGACTGCA AGATCATGAC CTCCAAGACC
1201 GACGTGAGCA GCTCCGTGAT CACCTCCCTG GGCGCCATCG TGAGCTGCTA CGGCAAGACC
1261 AAGTGCACCG CCAGCAACAA GAACCGGGGC ATCATCAAGA CCTTCAGCAA CGGCTGCGAC
1321 TACGTGAGCA ACAAGGGCGT GGACACCGTG AGCGTGGGCA ACACACTGTA CTACGTGAAT
1381 AAGCAGGAAG GCAAGAGCCT GTACGTGAAG GGCGAGCCCA TCATCAACTT CTACGACCCC
1441 CTGGTGTTCC CCAGCGACGA GTTCGACGCC AGCATCAGCC AGGTCAACGA GAAGATCAAC
1501 CAGAGCCTGG CCTTCATCCG GAAGAGCGAC GAGCTGCTGC ACAATGTGAA TGCCGGCAAG
1561 AGCACCACCA ATATCATGAT CACCACAATC ATCATCGTGA TCATTGTGAT CCTGCTGTCT
1621 CTGATTGCCG TGGGCCTGCT GCTGTACTGC AAGGCCCGCA GCACCCCTGT GACCCTGTCC
1681 AAGGACCAGC TGTCCGGCAT CAACAATATC GCCTTCTCCA ACTGAAG (SEQ ID NO: 22)
full HIS
Следующий полипептид включает полноразмерный полипептид F RSV с последующей гексагистидиновой меткой.
1 MELLILKANA ITTILTAVTF CFASGQNITE EFYQSTCSAV SKGYLSALRT GWYTSVITIE
61 LSNIKENKCN GTDAKVKLIK QELDKYKNAV TELQLLMQST PATNNRARRE LPRFMNYTLN
121 NAKKTNVTLS KKRKRRFLGF LLGVGSAIAS GVAVSKVLHL EGEVNKIKSA LLSTNKAVVS
181 LSNGVSVLTS KVLDLKNYID KQLLPIVNKQ SCSISNIETV IEFQQKNNRL LEITREFSVN
241 AGVTTPVSTY MLTNSELLSL INDMPITNDQ KKLMSNNVQI VRQQSYSIMS IIKEEVLAYV
301 VQLPLYGVID TPCWKLHTSP LCTTNTKEGS NICLTRTDRG WYCDNAGSVS FFPQAETCKV
361 QSNRVFCDTM NSLTLPSEVN LCNVDIFNPK YDCKIMTSKT DVSSSVITSL GAIVSCYGKT
421 KCTASNKNRG IIKTFSNGCD YVSNKGVDTV SVGNTLYYVN KQEGKSLYVK GEPIINFYDP
481 LVFPSDEFDA SISQVNEKIN QSLAFIRKSD ELLHNVNAGK STTNIMITTI IIVIIVILLS
541 LIAVGLLLYC KARSTPVTLS KDQLSGINNI AFSNSGGSAG SGHHHHHH (SEQ ID NO: 23)
Следующая последовательность нуклеиновой кислоты представляет собой оптимизированную кодирующую последовательность для указанной выше полипептидной последовательности.
1 ATGGAACTGC TGATCCTGAA GGCCAACGCC ATCACCACCA TCCTGACCGC CGTGACCTTC
61 TGCTTCGCCA GCGGCCAGAA CATCACCGAG GAATTCTACC AGAGCACCTG CAGCGCCGTG
121 AGCAAGGGCT ACCTGAGCGC CCTGCGGACC GGCTGGTACA CCAGCGTGAT CACCATCGAG
181 CTGTCCAACA TCAAAGAAAA CAAGTGCAAC GGCACCGACG CCAAGGTGAA ACTGATCAAG
241 CAGGAACTGG ACAAGTACAA GAACGCCGTG ACCGAGCTGC AGCTGCTGAT GCAGAGCACC
301 CCCGCCACCA ACAACCGGGC CAGAAGAGAG CTGCCCCGGT TCATGAACTA CACCCTGAAC
361 AACGCCAAGA AAACCAACGT GACCCTGAGC AAGAAGCGGA AGCGGCGGTT CCTGGGCTTC
421 CTGCTGGGCG TGGGCAGCGC CATCGCCAGC GGGGTGGCCG TGTCCAAGGT GCTGCACCTG
481 GAAGGCGAGG TGAACAAGAT CAAGTCCGCC CTGCTGTCCA CCAACAAGGC CGTGGTGTCC
541 CTGAGCAACG GCGTGAGCGT GCTGACCAGC AAGGTGCTGG ATCTGAAGAA CTACATCGAC
601 AAGCAGCTGC TGCCCATCGT GAACAAGCAG AGCTGCAGCA TCAGCAACAT CGAGACCGTG
661 ATCGAGTTCC AGCAGAAGAA CAACCGGCTG CTGGAAATCA CCCGGGAGTT CAGCGTGAAC
721 GCCGGCGTGA CCACCCCCGT GAGCACCTAC ATGCTGACCA ACAGCGAGCT GCTGTCCCTG
781 ATCAATGACA TGCCCATCAC CAACGACCAG AAAAAGCTGA TGAGCAACAA CGTGCAGATC
841 GTGCGGCAGC AGAGCTACTC CATCATGAGC ATCATCAAAG AAGAGGTGCT GGCCTACGTG
901 GTGCAGCTGC CCCTGTACGG CGTGATCGAC ACCCCCTGCT GGAAGCTGCA CACCAGCCCC
961 CTGTGCACCA CCAACACCAA AGAGGGCAGC AACATCTGCC TGACCCGGAC CGACCGGGGC
1021 TGGTACTGCG ACAACGCCGG CAGCGTGAGC TTCTTCCCCC AAGCCGAGAC CTGCAAGGTG
1081 CAGAGCAACC GGGTGTTCTG CGACACCATG AACAGCCTGA CCCTGCCCTC CGAGGTGAAC
1141 CTGTGCAACG TGGACATCTT CAACCCCAAG TACGACTGCA AGATCATGAC CTCCAAGACC
1201 GACGTGAGCA GCTCCGTGAT CACCTCCCTG GGCGCCATCG TGAGCTGCTA CGGCAAGACC
1261 AAGTGCACCG CCAGCAACAA GAACCGGGGC ATCATCAAGA CCTTCAGCAA CGGCTGCGAC
1321 TACGTGAGCA ACAAGGGCGT GGACACCGTG AGCGTGGGCA ACACACTGTA CTACGTGAAT
1381 AAGCAGGAAG GCAAGAGCCT GTACGTGAAG GGCGAGCCCA TCATCAACTT CTACGACCCC
1441 CTGGTGTTCC CCAGCGACGA GTTCGACGCC AGCATCAGCC AGGTCAACGA GAAGATCAAC
1501 CAGAGCCTGG CCTTCATCCG GAAGAGCGAC GAGCTGCTGC ACAATGTGAA TGCCGGCAAG
1561 AGCACCACCA ATATCATGAT CACCACAATC ATCATCGTGA TCATTGTGAT CCTGCTGTCT
1621 CTGATTGCCG TGGGCCTGCT GCTGTACTGC AAGGCCCGCA GCACCCCTGT GACCCTGTCC
1681 AAGGACCAGC TGTCCGGCAT CAACAATATC GCCTTCTCCA ACAGCGGCGG CAGCGCCGGC
1741 TCTGGCCACC ACCACCATCA CCACTGAAG (SEQ ID NO: 24)
full pre HIS
Следующий полипептид включает полноразмерный полипептид F RSV с доменом тримеризации GCN4 (подчеркнут), связанным с C-концом полипептида F RSV, с последующей гексагистидиновой меткой.
1 MELLILKANA ITTILTAVTF CFASGQNITE EFYQSTCSAV SKGYLSALRT GWYTSVITIE
61 LSNIKENKCN GTDAKVKLIK QELDKYKNAV TELQLLMQST PATNNRARRE LPRFMNYTLN
121 NAKKTNVTLS KKRKRRFLGF LLGVGSAIAS GVAVSKVLHL EGEVNKIKSA LLSTNKAVVS
181 LSNGVSVLTS KVLDLKNYID KQLLPIVNKQ SCSISNIETV IEFQQKNNRL LEITREFSVN
241 AGVTTPVSTY MLTNSELLSL INDMPITNDQ KKLMSNNVQI VRQQSYSIMS IIKEEVLAYV
301 VQLPLYGVID TPCWKLHTSP LCTTNTKEGS NICLTRTDRG WYCDNAGSVS FFPQAETCKV
361 QSNRVFCDTM NSLTLPSEVN LCNVDIFNPK YDCKIMTSKT DVSSSVITSL GAIVSCYGKT
421 KCTASNKNRG IIKTFSNGCD YVSNKGVDTV SVGNTLYYVN KQEGKSLYVK GEPIINFYDP
481 LVFPSDEFDA SISQVNEKIN QSLAFIRKSD ELLHNVNAGK STTNIMITTI IIVIIVILLS
541 LIAVGLLLYC KARSTPVTLS KDQLSGINNI AFSNGSSGRM KQIEDKIEEI LSKIYHIENE
601 IARIKKLIGE SGGSAGSGHH HHHH (SEQ ID NO: 25)
Следующая последовательность нуклеиновой кислоты представляет собой оптимизированную кодирующую последовательность для указанной выше полипептидной последовательности.
1 ATGGAACTGC TGATCCTGAA GGCCAACGCC ATCACCACCA TCCTGACCGC CGTGACCTTC
61 TGCTTCGCCA GCGGCCAGAA CATCACCGAG GAATTCTACC AGAGCACCTG CAGCGCCGTG
121 AGCAAGGGCT ACCTGAGCGC CCTGCGGACC GGCTGGTACA CCAGCGTGAT CACCATCGAG
181 CTGTCCAACA TCAAAGAAAA CAAGTGCAAC GGCACCGACG CCAAGGTGAA ACTGATCAAG
241 CAGGAACTGG ACAAGTACAA GAACGCCGTG ACCGAGCTGC AGCTGCTGAT GCAGAGCACC
301 CCCGCCACCA ACAACCGGGC CAGAAGAGAG CTGCCCCGGT TCATGAACTA CACCCTGAAC
361 AACGCCAAGA AAACCAACGT GACCCTGAGC AAGAAGCGGA AGCGGCGGTT CCTGGGCTTC
421 CTGCTGGGCG TGGGCAGCGC CATCGCCAGC GGGGTGGCCG TGTCCAAGGT GCTGCACCTG
481 GAAGGCGAGG TGAACAAGAT CAAGTCCGCC CTGCTGTCCA CCAACAAGGC CGTGGTGTCC
541 CTGAGCAACG GCGTGAGCGT GCTGACCAGC AAGGTGCTGG ATCTGAAGAA CTACATCGAC
601 AAGCAGCTGC TGCCCATCGT GAACAAGCAG AGCTGCAGCA TCAGCAACAT CGAGACCGTG
661 ATCGAGTTCC AGCAGAAGAA CAACCGGCTG CTGGAAATCA CCCGGGAGTT CAGCGTGAAC
721 GCCGGCGTGA CCACCCCCGT GAGCACCTAC ATGCTGACCA ACAGCGAGCT GCTGTCCCTG
781 ATCAATGACA TGCCCATCAC CAACGACCAG AAAAAGCTGA TGAGCAACAA CGTGCAGATC
841 GTGCGGCAGC AGAGCTACTC CATCATGAGC ATCATCAAAG AAGAGGTGCT GGCCTACGTG
901 GTGCAGCTGC CCCTGTACGG CGTGATCGAC ACCCCCTGCT GGAAGCTGCA CACCAGCCCC
961 CTGTGCACCA CCAACACCAA AGAGGGCAGC AACATCTGCC TGACCCGGAC CGACCGGGGC
1021 TGGTACTGCG ACAACGCCGG CAGCGTGAGC TTCTTCCCCC AAGCCGAGAC CTGCAAGGTG
1081 CAGAGCAACC GGGTGTTCTG CGACACCATG AACAGCCTGA CCCTGCCCTC CGAGGTGAAC
1141 CTGTGCAACG TGGACATCTT CAACCCCAAG TACGACTGCA AGATCATGAC CTCCAAGACC
1201 GACGTGAGCA GCTCCGTGAT CACCTCCCTG GGCGCCATCG TGAGCTGCTA CGGCAAGACC
1261 AAGTGCACCG CCAGCAACAA GAACCGGGGC ATCATCAAGA CCTTCAGCAA CGGCTGCGAC
1321 TACGTGAGCA ACAAGGGCGT GGACACCGTG AGCGTGGGCA ACACACTGTA CTACGTGAAT
1381 AAGCAGGAAG GCAAGAGCCT GTACGTGAAG GGCGAGCCCA TCATCAACTT CTACGACCCC
1441 CTGGTGTTCC CCAGCGACGA GTTCGACGCC AGCATCAGCC AGGTCAACGA GAAGATCAAC
1501 CAGAGCCTGG CCTTCATCCG GAAGAGCGAC GAGCTGCTGC ACAATGTGAA TGCCGGCAAG
1561 AGCACCACCA ATATCATGAT CACCACAATC ATCATCGTGA TCATTGTGAT CCTGCTGTCT
1621 CTGATTGCCG TGGGCCTGCT GCTGTACTGC AAGGCCCGCA GCACCCCTGT GACCCTGTCC
1681 AAGGACCAGC TGTCCGGCAT CAACAATATC GCCTTCTCCA ACGGCAGCAG CGGCCGGATG
1741 AAGCAGATCG AGGACAAGAT CGAGGAAATC CTGAGCAAGA TCTACCACAT CGAGAACGAG
1801 ATCGCCCGGA TCAAGAAGCT GATCGGCGAA AGCGGCGGCT CTGCCGGAAG CGGCCACCAC
1861 CACCATCACC ACTGAAG (SEQ ID NO: 26)
full pre HIS 2
Следующий полипептид включает полноразмерный полипептид F RSV с доменом тримеризации GCN4 (подчеркнут), связанным с C-концом полипептида F RSV, с последующей гексагистидиновой меткой.
1 MELLILKANA ITTILTAVTF CFASGQNITE EFYQSTCSAV SKGYLSALRT GWYTSVITIE
61 LSNIKENKCN GTDAKVKLIK QELDKYKNAV TELQLLMQST PATNNRARRE LPRFMNYTLN
121 NAKKTNVTLS KKRKRRFLGF LLGVGSAIAS GVAVSKVLHL EGEVNKIKSA LLSTNKAVVS
181 LSNGVSVLTS KVLDLKNYID KQLLPIVNKQ SCSISNIETV IEFQQKNNRL LEITREFSVN
241 AGVTTPVSTY MLTNSELLSL INDMPITNDQ KKLMSNNVQI VRQQSYSIMS IIKEEVLAYV
301 VQLPLYGVID TPCWKLHTSP LCTTNTKEGS NICLTRTDRG WYCDNAGSVS FFPQAETCKV
361 QSNRVFCDTM NSLTLPSEVN LCNVDIFNPK YDCKIMTSKT DVSSSVITSL GAIVSCYGKT
421 KCTASNKNRG IIKTFSNGCD YVSNKGVDTV SVGNTLYYVN KQEGKSLYVK GEPIINFYDP
481 LVFPSDEFDA SISQVNEKIN QSLAFIRKSD ELLHNVNAGK STTNIMITTI IIVIIVILLS
541 LIAVGLLLYC KARSTPVTLS KDQLSGINNI AFSNGSSGSG RMKQIEDKIE EILSKIYHIE
601 NEIARIKKLI GESGGSAGSG HHHHHH (SEQ ID NO: 27)
Следующая последовательность нуклеиновой кислоты представляет собой оптимизированную кодирующую последовательность для указанной выше полипептидной последовательности.
1 ATGGAACTGC TGATCCTGAA GGCCAACGCC ATCACCACCA TCCTGACCGC CGTGACCTTC
61 TGCTTCGCCA GCGGCCAGAA CATCACCGAG GAATTCTACC AGAGCACCTG CAGCGCCGTG
121 AGCAAGGGCT ACCTGAGCGC CCTGCGGACC GGCTGGTACA CCAGCGTGAT CACCATCGAG
181 CTGTCCAACA TCAAAGAAAA CAAGTGCAAC GGCACCGACG CCAAGGTGAA ACTGATCAAG
241 CAGGAACTGG ACAAGTACAA GAACGCCGTG ACCGAGCTGC AGCTGCTGAT GCAGAGCACC
301 CCCGCCACCA ACAACCGGGC CAGAAGAGAG CTGCCCCGGT TCATGAACTA CACCCTGAAC
361 AACGCCAAGA AAACCAACGT GACCCTGAGC AAGAAGCGGA AGCGGCGGTT CCTGGGCTTC
421 CTGCTGGGCG TGGGCAGCGC CATCGCCAGC GGGGTGGCCG TGTCCAAGGT GCTGCACCTG
481 GAAGGCGAGG TGAACAAGAT CAAGTCCGCC CTGCTGTCCA CCAACAAGGC CGTGGTGTCC
541 CTGAGCAACG GCGTGAGCGT GCTGACCAGC AAGGTGCTGG ATCTGAAGAA CTACATCGAC
601 AAGCAGCTGC TGCCCATCGT GAACAAGCAG AGCTGCAGCA TCAGCAACAT CGAGACCGTG
661 ATCGAGTTCC AGCAGAAGAA CAACCGGCTG CTGGAAATCA CCCGGGAGTT CAGCGTGAAC
721 GCCGGCGTGA CCACCCCCGT GAGCACCTAC ATGCTGACCA ACAGCGAGCT GCTGTCCCTG
781 ATCAATGACA TGCCCATCAC CAACGACCAG AAAAAGCTGA TGAGCAACAA CGTGCAGATC
841 GTGCGGCAGC AGAGCTACTC CATCATGAGC ATCATCAAAG AAGAGGTGCT GGCCTACGTG
901 GTGCAGCTGC CCCTGTACGG CGTGATCGAC ACCCCCTGCT GGAAGCTGCA CACCAGCCCC
961 CTGTGCACCA CCAACACCAA AGAGGGCAGC AACATCTGCC TGACCCGGAC CGACCGGGGC
1021 TGGTACTGCG ACAACGCCGG CAGCGTGAGC TTCTTCCCCC AAGCCGAGAC CTGCAAGGTG
1081 CAGAGCAACC GGGTGTTCTG CGACACCATG AACAGCCTGA CCCTGCCCTC CGAGGTGAAC
1141 CTGTGCAACG TGGACATCTT CAACCCCAAG TACGACTGCA AGATCATGAC CTCCAAGACC
1201 GACGTGAGCA GCTCCGTGAT CACCTCCCTG GGCGCCATCG TGAGCTGCTA CGGCAAGACC
1261 AAGTGCACCG CCAGCAACAA GAACCGGGGC ATCATCAAGA CCTTCAGCAA CGGCTGCGAC
1321 TACGTGAGCA ACAAGGGCGT GGACACCGTG AGCGTGGGCA ACACACTGTA CTACGTGAAT
1381 AAGCAGGAAG GCAAGAGCCT GTACGTGAAG GGCGAGCCCA TCATCAACTT CTACGACCCC
1441 CTGGTGTTCC CCAGCGACGA GTTCGACGCC AGCATCAGCC AGGTCAACGA GAAGATCAAC
1501 CAGAGCCTGG CCTTCATCCG GAAGAGCGAC GAGCTGCTGC ACAATGTGAA TGCCGGCAAG
1561 AGCACCACCA ATATCATGAT CACCACAATC ATCATCGTGA TCATTGTGAT CCTGCTGTCT
1621 CTGATTGCCG TGGGCCTGCT GCTGTACTGC AAGGCCCGCA GCACCCCTGT GACCCTGTCC
1681 AAGGACCAGC TGTCCGGCAT CAACAATATC GCCTTCTCCA ACGGCAGCAG CGGCAGCGGC
1741 CGGATGAAGC AGATCGAGGA CAAGATCGAG GAAATCCTGA GCAAGATCTA CCACATCGAG
1801 AACGAGATCG CCCGGATCAA GAAGCTGATC GGCGAAAGCG GCGGCTCTGC CGGAAGCGGC
1861 CACCACCACC ATCACCACTG AAG (SEQ ID NO: 28)
ecto HIS
Следующий полипептид включает эктодомен полипептида F RSV с последующей гексагистидиновой меткой.
1 MELLILKANA ITTILTAVTF CFASGQNITE EFYQSTCSAV SKGYLSALRT GWYTSVITIE
61 LSNIKENKCN GTDAKVKLIK QELDKYKNAV TELQLLMQST PATNNRARRE LPRFMNYTLN
121 NAKKTNVTLS KKRKRRFLGF LLGVGSAIAS GVAVSKVLHL EGEVNKIKSA LLSTNKAVVS
181 LSNGVSVLTS KVLDLKNYID KQLLPIVNKQ SCSISNIETV IEFQQKNNRL LEITREFSVN
241 AGVTTPVSTY MLTNSELLSL INDMPITNDQ KKLMSNNVQI VRQQSYSIMS IIKEEVLAYV
301 VQLPLYGVID TPCWKLHTSP LCTTNTKEGS NICLTRTDRG WYCDNAGSVS FFPQAETCKV
361 QSNRVFCDTM NSLTLPSEVN LCNVDIFNPK YDCKIMTSKT DVSSSVITSL GAIVSCYGKT
421 KCTASNKNRG IIKTFSNGCD YVSNKGVDTV SVGNTLYYVN KQEGKSLYVK GEPIINFYDP
481 LVFPSDEFDA SISQVNEKIN QSLAFIRKSD ELLHNVNSGG SAGSGHHHHH H (SEQ ID NO: 29)
Следующая последовательность нуклеиновой кислоты представляет собой оптимизированную кодирующую последовательность для указанной выше полипептидной последовательности.
1 ATGGAACTGC TGATCCTGAA GGCCAACGCC ATCACCACCA TCCTGACCGC CGTGACCTTC
61 TGCTTCGCCA GCGGCCAGAA CATCACCGAG GAATTCTACC AGAGCACCTG CAGCGCCGTG
121 AGCAAGGGCT ACCTGAGCGC CCTGCGGACC GGCTGGTACA CCAGCGTGAT CACCATCGAG
181 CTGTCCAACA TCAAAGAAAA CAAGTGCAAC GGCACCGACG CCAAGGTGAA ACTGATCAAG
241 CAGGAACTGG ACAAGTACAA GAACGCCGTG ACCGAGCTGC AGCTGCTGAT GCAGAGCACC
301 CCCGCCACCA ACAACCGGGC CAGAAGAGAG CTGCCCCGGT TCATGAACTA CACCCTGAAC
361 AACGCCAAGA AAACCAACGT GACCCTGAGC AAGAAGCGGA AGCGGCGGTT CCTGGGCTTC
421 CTGCTGGGCG TGGGCAGCGC CATCGCCAGC GGGGTGGCCG TGTCCAAGGT GCTGCACCTG
481 GAAGGCGAGG TGAACAAGAT CAAGTCCGCC CTGCTGTCCA CCAACAAGGC CGTGGTGTCC
541 CTGAGCAACG GCGTGAGCGT GCTGACCAGC AAGGTGCTGG ATCTGAAGAA CTACATCGAC
601 AAGCAGCTGC TGCCCATCGT GAACAAGCAG AGCTGCAGCA TCAGCAACAT CGAGACCGTG
661 ATCGAGTTCC AGCAGAAGAA CAACCGGCTG CTGGAAATCA CCCGGGAGTT CAGCGTGAAC
721 GCCGGCGTGA CCACCCCCGT GAGCACCTAC ATGCTGACCA ACAGCGAGCT GCTGTCCCTG
781 ATCAATGACA TGCCCATCAC CAACGACCAG AAAAAGCTGA TGAGCAACAA CGTGCAGATC
841 GTGCGGCAGC AGAGCTACTC CATCATGAGC ATCATCAAAG AAGAGGTGCT GGCCTACGTG
901 GTGCAGCTGC CCCTGTACGG CGTGATCGAC ACCCCCTGCT GGAAGCTGCA CACCAGCCCC
961 CTGTGCACCA CCAACACCAA AGAGGGCAGC AACATCTGCC TGACCCGGAC CGACCGGGGC
1021 TGGTACTGCG ACAACGCCGG CAGCGTGAGC TTCTTCCCCC AAGCCGAGAC CTGCAAGGTG
1081 CAGAGCAACC GGGTGTTCTG CGACACCATG AACAGCCTGA CCCTGCCCTC CGAGGTGAAC
1141 CTGTGCAACG TGGACATCTT CAACCCCAAG TACGACTGCA AGATCATGAC CTCCAAGACC
1201 GACGTGAGCA GCTCCGTGAT CACCTCCCTG GGCGCCATCG TGAGCTGCTA CGGCAAGACC
1261 AAGTGCACCG CCAGCAACAA GAACCGGGGC ATCATCAAGA CCTTCAGCAA CGGCTGCGAC
1321 TACGTGAGCA ACAAGGGCGT GGACACCGTG AGCGTGGGCA ACACACTGTA CTACGTGAAT
1381 AAGCAGGAAG GCAAGAGCCT GTACGTGAAG GGCGAGCCCA TCATCAACTT CTACGACCCC
1441 CTGGTGTTCC CCAGCGACGA GTTCGACGCC AGCATCAGCC AGGTCAACGA GAAGATCAAC
1501 CAGAGCCTGG CCTTCATCCG GAAGAGCGAC GAGCTGCTGC ACAATGTGAA TAGCGGCGGC
1561 AGCGCCGGCT CTGGCCACCA CCACCATCAC CACTGAAG (SEQ ID NO: 30)
ecto pre HIS
Следующий полипептид включает эктодомен полипептида F RSV с доменом тримеризации GCN4 (подчеркнут), встроенным в полипептид F RSV выше участка, где должен быть TM-домен белка RSV (начиная с а.к. 517), с последующей гексагистидиновой меткой.
1 MELLILKANA ITTILTAVTF CFASGQNITE EFYQSTCSAV SKGYLSALRT GWYTSVITIE
61 LSNIKENKCN GTDAKVKLIK QELDKYKNAV TELQLLMQST PATNNRARRE LPRFMNYTLN
121 NAKKTNVTLS KKRKRRFLGF LLGVGSAIAS GVAVSKVLHL EGEVNKIKSA LLSTNKAVVS
181 LSNGVSVLTS KVLDLKNYID KQLLPIVNKQ SCSISNIETV IEFQQKNNRL LEITREFSVN
241 AGVTTPVSTY MLTNSELLSL INDMPITNDQ KKLMSNNVQI VRQQSYSIMS IIKEEVLAYV
301 VQLPLYGVID TPCWKLHTSP LCTTNTKEGS NICLTRTDRG WYCDNAGSVS FFPQAETCKV
361 QSNRVFCDTM NSLTLPSEVN LCNVDIFNPK YDCKIMTSKT DVSSSVITSL GAIVSCYGKT
421 KCTASNKNRG IIKTFSNGCD YVSNKGVDTV SVGNTLYYVN KQEGKSLYVK GEPIINFYDP
481 LVFPSDEFDA SISQVNEKIN QSLAFIRKSD ELLHNVNDKI EEILSKIYHI ENEIARIKKL
541 IGESGGSAGS GHHHHHH (SEQ ID NO: 31)
Следующая последовательность нуклеиновой кислоты является оптимизированной кодирующей последовательностью для указанной выше полипептидной последовательности.
1 ATGGAACTGC TGATCCTGAA GGCCAACGCC ATCACCACCA TCCTGACCGC CGTGACCTTC
61 TGCTTCGCCA GCGGCCAGAA CATCACCGAG GAATTCTACC AGAGCACCTG CAGCGCCGTG
121 AGCAAGGGCT ACCTGAGCGC CCTGCGGACC GGCTGGTACA CCAGCGTGAT CACCATCGAG
181 CTGTCCAACA TCAAAGAAAA CAAGTGCAAC GGCACCGACG CCAAGGTGAA ACTGATCAAG
241 CAGGAACTGG ACAAGTACAA GAACGCCGTG ACCGAGCTGC AGCTGCTGAT GCAGAGCACC
301 CCCGCCACCA ACAACCGGGC CAGAAGAGAG CTGCCCCGGT TCATGAACTA CACCCTGAAC
361 AACGCCAAGA AAACCAACGT GACCCTGAGC AAGAAGCGGA AGCGGCGGTT CCTGGGCTTC
421 CTGCTGGGCG TGGGCAGCGC CATCGCCAGC GGGGTGGCCG TGTCCAAGGT GCTGCACCTG
481 GAAGGCGAGG TGAACAAGAT CAAGTCCGCC CTGCTGTCCA CCAACAAGGC CGTGGTGTCC
541 CTGAGCAACG GCGTGAGCGT GCTGACCAGC AAGGTGCTGG ATCTGAAGAA CTACATCGAC
601 AAGCAGCTGC TGCCCATCGT GAACAAGCAG AGCTGCAGCA TCAGCAACAT CGAGACCGTG
661 ATCGAGTTCC AGCAGAAGAA CAACCGGCTG CTGGAAATCA CCCGGGAGTT CAGCGTGAAC
721 GCCGGCGTGA CCACCCCCGT GAGCACCTAC ATGCTGACCA ACAGCGAGCT GCTGTCCCTG
781 ATCAATGACA TGCCCATCAC CAACGACCAG AAAAAGCTGA TGAGCAACAA CGTGCAGATC
841 GTGCGGCAGC AGAGCTACTC CATCATGAGC ATCATCAAAG AAGAGGTGCT GGCCTACGTG
901 GTGCAGCTGC CCCTGTACGG CGTGATCGAC ACCCCCTGCT GGAAGCTGCA CACCAGCCCC
961 CTGTGCACCA CCAACACCAA AGAGGGCAGC AACATCTGCC TGACCCGGAC CGACCGGGGC
1021 TGGTACTGCG ACAACGCCGG CAGCGTGAGC TTCTTCCCCC AAGCCGAGAC CTGCAAGGTG
1081 CAGAGCAACC GGGTGTTCTG CGACACCATG AACAGCCTGA CCCTGCCCTC CGAGGTGAAC
1141 CTGTGCAACG TGGACATCTT CAACCCCAAG TACGACTGCA AGATCATGAC CTCCAAGACC
1201 GACGTGAGCA GCTCCGTGAT CACCTCCCTG GGCGCCATCG TGAGCTGCTA CGGCAAGACC
1261 AAGTGCACCG CCAGCAACAA GAACCGGGGC ATCATCAAGA CCTTCAGCAA CGGCTGCGAC
1321 TACGTGAGCA ACAAGGGCGT GGACACCGTG AGCGTGGGCA ACACACTGTA CTACGTGAAT
1381 AAGCAGGAAG GCAAGAGCCT GTACGTGAAG GGCGAGCCCA TCATCAACTT CTACGACCCC
1441 CTGGTGTTCC CCAGCGACGA GTTCGACGCC AGCATCAGCC AGGTCAACGA GAAGATCAAC
1501 CAGAGCCTGG CCTTCATCCG GAAGAGCGAC GAGCTGCTGC ACAATGTGAA TGACAAGATC
1561 GAGGAAATCC TGAGCAAGAT CTACCACATC GAGAACGAGA TCGCCCGGAT CAAGAAGCTG
1621 ATCGGCGAAA GCGGCGGCTC TGCCGGAAGC GGCCACCACC ACCATCACCA CTGAAG (SEQ ID NO: 32)
full pre HA HIS
Следующий полипептид включает полноразмерный полипептид F RSV с доменом тримеризации "после слияния" из полипептида гемагглютинина (подчеркнут), связанным с C-концом полипептида F RSV, с последующей гексагистидиновой меткой.
1 MELLILKANA ITTILTAVTF CFASGQNITE EFYQSTCSAV SKGYLSALRT GWYTSVITIE
61 LSNIKENKCN GTDAKVKLIK QELDKYKNAV TELQLLMQST PATNNRARRE LPRFMNYTLN
121 NAKKTNVTLS KKRKRRFLGF LLGVGSAIAS GVAVSKVLHL EGEVNKIKSA LLSTNKAVVS
181 LSNGVSVLTS KVLDLKNYID KQLLPIVNKQ SCSISNIETV IEFQQKNNRL LEITREFSVN
241 AGVTTPVSTY MLTNSELLSL INDMPITNDQ KKLMSNNVQI VRQQSYSIMS IIKEEVLAYV
301 VQLPLYGVID TPCWKLHTSP LCTTNTKEGS NICLTRTDRG WYCDNAGSVS FFPQAETCKV
361 QSNRVFCDTM NSLTLPSEVN LCNVDIFNPK YDCKIMTSKT DVSSSVITSL GAIVSCYGKT
421 KCTASNKNRG IIKTFSNGCD YVSNKGVDTV SVGNTLYYVN KQEGKSLYVK GEPIINFYDP
481 LVFPSDEFDA SISQVNEKIN QSLAFIRKSD ELLHNVNAGK STTNIMITTI IIVIIVILLS
541 LIAVGLLLYC KARSTPVTLS KDQLSGINNI AFSNGSSGNE KFHQIEKEFS EVEGRIQDLE
601 KSGGSAGSGH HHHHH (SEQ ID NO: 33)
Следующая последовательность нуклеиновой кислоты представляет собой оптимизированную кодирующую последовательность для указанной выше полипептидной последовательности.
1 ATGGAACTGC TGATCCTGAA GGCCAACGCC ATCACCACCA TCCTGACCGC CGTGACCTTC
61 TGCTTCGCCA GCGGCCAGAA CATCACCGAG GAATTCTACC AGAGCACCTG CAGCGCCGTG
121 AGCAAGGGCT ACCTGAGCGC CCTGCGGACC GGCTGGTACA CCAGCGTGAT CACCATCGAG
181 CTGTCCAACA TCAAAGAAAA CAAGTGCAAC GGCACCGACG CCAAGGTGAA ACTGATCAAG
241 CAGGAACTGG ACAAGTACAA GAACGCCGTG ACCGAGCTGC AGCTGCTGAT GCAGAGCACC
301 CCCGCCACCA ACAACCGGGC CAGAAGAGAG CTGCCCCGGT TCATGAACTA CACCCTGAAC
361 AACGCCAAGA AAACCAACGT GACCCTGAGC AAGAAGCGGA AGCGGCGGTT CCTGGGCTTC
421 CTGCTGGGCG TGGGCAGCGC CATCGCCAGC GGGGTGGCCG TGTCCAAGGT GCTGCACCTG
481 GAAGGCGAGG TGAACAAGAT CAAGTCCGCC CTGCTGTCCA CCAACAAGGC CGTGGTGTCC
541 CTGAGCAACG GCGTGAGCGT GCTGACCAGC AAGGTGCTGG ATCTGAAGAA CTACATCGAC
601 AAGCAGCTGC TGCCCATCGT GAACAAGCAG AGCTGCAGCA TCAGCAACAT CGAGACCGTG
661 ATCGAGTTCC AGCAGAAGAA CAACCGGCTG CTGGAAATCA CCCGGGAGTT CAGCGTGAAC
721 GCCGGCGTGA CCACCCCCGT GAGCACCTAC ATGCTGACCA ACAGCGAGCT GCTGTCCCTG
781 ATCAATGACA TGCCCATCAC CAACGACCAG AAAAAGCTGA TGAGCAACAA CGTGCAGATC
841 GTGCGGCAGC AGAGCTACTC CATCATGAGC ATCATCAAAG AAGAGGTGCT GGCCTACGTG
901 GTGCAGCTGC CCCTGTACGG CGTGATCGAC ACCCCCTGCT GGAAGCTGCA CACCAGCCCC
961 CTGTGCACCA CCAACACCAA AGAGGGCAGC AACATCTGCC TGACCCGGAC CGACCGGGGC
1021 TGGTACTGCG ACAACGCCGG CAGCGTGAGC TTCTTCCCCC AAGCCGAGAC CTGCAAGGTG
1081 CAGAGCAACC GGGTGTTCTG CGACACCATG AACAGCCTGA CCCTGCCCTC CGAGGTGAAC
1141 CTGTGCAACG TGGACATCTT CAACCCCAAG TACGACTGCA AGATCATGAC CTCCAAGACC
1201 GACGTGAGCA GCTCCGTGAT CACCTCCCTG GGCGCCATCG TGAGCTGCTA CGGCAAGACC
1261 AAGTGCACCG CCAGCAACAA GAACCGGGGC ATCATCAAGA CCTTCAGCAA CGGCTGCGAC
1321 TACGTGAGCA ACAAGGGCGT GGACACCGTG AGCGTGGGCA ACACACTGTA CTACGTGAAT
1381 AAGCAGGAAG GCAAGAGCCT GTACGTGAAG GGCGAGCCCA TCATCAACTT CTACGACCCC
1441 CTGGTGTTCC CCAGCGACGA GTTCGACGCC AGCATCAGCC AGGTCAACGA GAAGATCAAC
1501 CAGAGCCTGG CCTTCATCCG GAAGAGCGAC GAGCTGCTGC ACAATGTGAA TGCCGGCAAG
1561 AGCACCACCA ATATCATGAT CACCACAATC ATCATCGTGA TCATTGTGAT CCTGCTGTCT
1621 CTGATTGCCG TGGGCCTGCT GCTGTACTGC AAGGCCCGCA GCACCCCTGT GACCCTGTCC
1681 AAGGACCAGC TGTCCGGCAT CAACAATATC GCCTTCTCCA ACGGCAGCAG CGGCAATGAG
1741 AAGTTCCACC AGATCGAGAA AGAATTCAGC GAGGTGGAGG GCCGGATCCA GGACCTGGAA
1801 AAGAGCGGCG GCTCTGCCGG AAGCGGCCAC CACCACCATC ACCACTGAAG (SEQ ID NO: 34)
ecto pre HA HIS
Следующий полипептид включает эктодомен полипептида F RSV с доменом тримеризации "после слияния" из полипептида гемагглютинина вируса гриппа (подчеркнут), встроенного в полипептид F RSV выше участка, где должен быть TM-домен белка RSV (начиная с а.к. 517) с последующей гексагистидиновой меткой.
1 MELLILKANA ITTILTAVTF CFASGQNITE EFYQSTCSAV SKGYLSALRT GWYTSVITIE
61 LSNIKENKCN GTDAKVKLIK QELDKYKNAV TELQLLMQST PATNNRARRE LPRFMNYTLN
121 NAKKTNVTLS KKRKRRFLGF LLGVGSAIAS GVAVSKVLHL EGEVNKIKSA LLSTNKAVVS
181 LSNGVSVLTS KVLDLKNYID KQLLPIVNKQ SCSISNIETV IEFQQKNNRL LEITREFSVN
241 AGVTTPVSTY MLTNSELLSL INDMPITNDQ KKLMSNNVQI VRQQSYSIMS IIKEEVLAYV
301 VQLPLYGVID TPCWKLHTSP LCTTNTKEGS NICLTRTDRG WYCDNAGSVS FFPQAETCKV
361 QSNRVFCDTM NSLTLPSEVN LCNVDIFNPK YDCKIMTSKT DVSSSVITSL GAIVSCYGKT
421 KCTASNKNRG IIKTFSNGCD YVSNKGVDTV SVGNTLYYVN KQEGKSLYVK GEPIINFYDP
481 LVFPSDEFDA SISQVNEKIN QSLAFIRKSD ELLHNVNEKF HQIEKEFSEV EGRIQDLEKS
541 GGSAGSGHHH HHH (SEQ ID NO: 35)
Следующая последовательность нуклеиновой кислоты представляет собой оптимизированную кодирующую последовательность для указанной выше полипептидной последовательности.
1 ATGGAACTGC TGATCCTGAA GGCCAACGCC ATCACCACCA TCCTGACCGC CGTGACCTTC
61 TGCTTCGCCA GCGGCCAGAA CATCACCGAG GAATTCTACC AGAGCACCTG CAGCGCCGTG
121 AGCAAGGGCT ACCTGAGCGC CCTGCGGACC GGCTGGTACA CCAGCGTGAT CACCATCGAG
181 CTGTCCAACA TCAAAGAAAA CAAGTGCAAC GGCACCGACG CCAAGGTGAA ACTGATCAAG
241 CAGGAACTGG ACAAGTACAA GAACGCCGTG ACCGAGCTGC AGCTGCTGAT GCAGAGCACC
301 CCCGCCACCA ACAACCGGGC CAGAAGAGAG CTGCCCCGGT TCATGAACTA CACCCTGAAC
361 AACGCCAAGA AAACCAACGT GACCCTGAGC AAGAAGCGGA AGCGGCGGTT CCTGGGCTTC
421 CTGCTGGGCG TGGGCAGCGC CATCGCCAGC GGGGTGGCCG TGTCCAAGGT GCTGCACCTG
481 GAAGGCGAGG TGAACAAGAT CAAGTCCGCC CTGCTGTCCA CCAACAAGGC CGTGGTGTCC
541 CTGAGCAACG GCGTGAGCGT GCTGACCAGC AAGGTGCTGG ATCTGAAGAA CTACATCGAC
601 AAGCAGCTGC TGCCCATCGT GAACAAGCAG AGCTGCAGCA TCAGCAACAT CGAGACCGTG
661 ATCGAGTTCC AGCAGAAGAA CAACCGGCTG CTGGAAATCA CCCGGGAGTT CAGCGTGAAC
721 GCCGGCGTGA CCACCCCCGT GAGCACCTAC ATGCTGACCA ACAGCGAGCT GCTGTCCCTG
781 ATCAATGACA TGCCCATCAC CAACGACCAG AAAAAGCTGA TGAGCAACAA CGTGCAGATC
841 GTGCGGCAGC AGAGCTACTC CATCATGAGC ATCATCAAAG AAGAGGTGCT GGCCTACGTG
901 GTGCAGCTGC CCCTGTACGG CGTGATCGAC ACCCCCTGCT GGAAGCTGCA CACCAGCCCC
961 CTGTGCACCA CCAACACCAA AGAGGGCAGC AACATCTGCC TGACCCGGAC CGACCGGGGC
1021 TGGTACTGCG ACAACGCCGG CAGCGTGAGC TTCTTCCCCC AAGCCGAGAC CTGCAAGGTG
1081 CAGAGCAACC GGGTGTTCTG CGACACCATG AACAGCCTGA CCCTGCCCTC CGAGGTGAAC
1141 CTGTGCAACG TGGACATCTT CAACCCCAAG TACGACTGCA AGATCATGAC CTCCAAGACC
1201 GACGTGAGCA GCTCCGTGAT CACCTCCCTG GGCGCCATCG TGAGCTGCTA CGGCAAGACC
1261 AAGTGCACCG CCAGCAACAA GAACCGGGGC ATCATCAAGA CCTTCAGCAA CGGCTGCGAC
1321 TACGTGAGCA ACAAGGGCGT GGACACCGTG AGCGTGGGCA ACACACTGTA CTACGTGAAT
1381 AAGCAGGAAG GCAAGAGCCT GTACGTGAAG GGCGAGCCCA TCATCAACTT CTACGACCCC
1441 CTGGTGTTCC CCAGCGACGA GTTCGACGCC AGCATCAGCC AGGTCAACGA GAAGATCAAC
1501 CAGAGCCTGG CCTTCATCCG GAAGAGCGAC GAGCTGCTGC ACAATGTGAA TGAGAAGTTC
1561 CACCAGATCG AGAAAGAATT CAGCGAGGTG GAGGGCCGGA TCCAGGACCT GGAAAAGAGC
1621 GGCGGCTCTG CCGGAAGCGG CCACCACCAC CATCACCACT GAAG (SEQ ID NO: 36)
full ΔHRB HIS
Следующий полипептид включает полноразмерный полипептид F RSV с удаленным доменом HRB, с последующей гексагистидиновой меткой.
1 MELLILKANA ITTILTAVTF CFASGQNITE EFYQSTCSAV SKGYLSALRT GWYTSVITIE
61 LSNIKENKCN GTDAKVKLIK QELDKYKNAV TELQLLMQST PATNNRARRE LPRFMNYTLN
121 NAKKTNVTLS KKRKRRFLGF LLGVGSAIAS GVAVSKVLHL EGEVNKIKSA LLSTNKAVVS
181 LSNGVSVLTS KVLDLKNYID KQLLPIVNKQ SCSISNIETV IEFQQKNNRL LEITREFSVN
241 AGVTTPVSTY MLTNSELLSL INDMPITNDQ KKLMSNNVQI VRQQSYSIMS IIKEEVLAYV
301 VQLPLYGVID TPCWKLHTSP LCTTNTKEGS NICLTRTDRG WYCDNAGSVS FFPQAETCKV
361 QSNRVFCDTM NSLTLPSEVN LCNVDIFNPK YDCKIMTSKT DVSSSVITSL GAIVSCYGKT
421 KCTASNKNRG IIKTFSNGCD YVSNKGVDTV SVGNTLYYVN KQEGKSLYVK GEPNIMITTI
481 IIVIIVILLS LIAVGLLLYC KARSTPVTLS KDQLSGINNI AFSNMGGSHH HHHH (SEQ ID NO: 37)
Следующая последовательность нуклеиновой кислоты представляет собой оптимизированную кодирующую последовательность для указанной выше полипептидной последовательности.
1 ATGGAACTGC TGATCCTGAA GGCCAACGCC ATCACCACCA TCCTGACCGC CGTGACCTTC
61 TGCTTCGCCA GCGGCCAGAA CATCACCGAG GAATTCTACC AGAGCACCTG CAGCGCCGTG
121 AGCAAGGGCT ACCTGAGCGC CCTGCGGACC GGCTGGTACA CCAGCGTGAT CACCATCGAG
181 CTGTCCAACA TCAAAGAAAA CAAGTGCAAC GGCACCGACG CCAAGGTGAA ACTGATCAAG
241 CAGGAACTGG ACAAGTACAA GAACGCCGTG ACCGAGCTGC AGCTGCTGAT GCAGAGCACC
301 CCCGCCACCA ACAACCGGGC CAGAAGAGAG CTGCCCCGGT TCATGAACTA CACCCTGAAC
361 AACGCCAAGA AAACCAACGT GACCCTGAGC AAGAAGCGGA AGCGGCGGTT CCTGGGCTTC
421 CTGCTGGGCG TGGGCAGCGC CATCGCCAGC GGGGTGGCCG TGTCCAAGGT GCTGCACCTG
481 GAAGGCGAGG TGAACAAGAT CAAGTCCGCC CTGCTGTCCA CCAACAAGGC CGTGGTGTCC
541 CTGAGCAACG GCGTGAGCGT GCTGACCAGC AAGGTGCTGG ATCTGAAGAA CTACATCGAC
601 AAGCAGCTGC TGCCCATCGT GAACAAGCAG AGCTGCAGCA TCAGCAACAT CGAGACCGTG
661 ATCGAGTTCC AGCAGAAGAA CAACCGGCTG CTGGAAATCA CCCGGGAGTT CAGCGTGAAC
721 GCCGGCGTGA CCACCCCCGT GAGCACCTAC ATGCTGACCA ACAGCGAGCT GCTGTCCCTG
781 ATCAATGACA TGCCCATCAC CAACGACCAG AAAAAGCTGA TGAGCAACAA CGTGCAGATC
841 GTGCGGCAGC AGAGCTACTC CATCATGAGC ATCATCAAAG AAGAGGTGCT GGCCTACGTG
901 GTGCAGCTGC CCCTGTACGG CGTGATCGAC ACCCCCTGCT GGAAGCTGCA CACCAGCCCC
961 CTGTGCACCA CCAACACCAA AGAGGGCAGC AACATCTGCC TGACCCGGAC CGACCGGGGC
1021 TGGTACTGCG ACAACGCCGG CAGCGTGAGC TTCTTCCCCC AAGCCGAGAC CTGCAAGGTG
1081 CAGAGCAACC GGGTGTTCTG CGACACCATG AACAGCCTGA CCCTGCCCTC CGAGGTGAAC
1141 CTGTGCAACG TGGACATCTT CAACCCCAAG TACGACTGCA AGATCATGAC CTCCAAGACC
1201 GACGTGAGCA GCTCCGTGAT CACCTCCCTG GGCGCCATCG TGAGCTGCTA CGGCAAGACC
1261 AAGTGCACCG CCAGCAACAA GAACCGGGGC ATCATCAAGA CCTTCAGCAA CGGCTGCGAC
1321 TACGTGAGCA ACAAGGGCGT GGACACCGTG AGCGTGGGCA ACACACTGTA CTACGTGAAT
1381 AAGCAGGAAG GCAAGAGCCT GTACGTGAAG GGCGAGCCCA ATATCATGAT CACCACAATC
1441 ATCATCGTGA TCATTGTGAT CCTGCTGTCT CTGATTGCCG TGGGCCTGCT GCTGTACTGC
1501 AAGGCCCGCA GCACCCCTGT GACCCTGTCC AAGGACCAGC TGTCCGGCAT CAACAATATC
1561 GCCTTCTCCA ACATGGGGGG TTCTCATCAT CATCATCATC ATTGAAG (SEQ ID NO: 38)
ecto
Следующий полипептид включает только эктодомен полипептида F RSV.
1 MELLILKANA ITTILTAVTF CFASGQNITE EFYQSTCSAV SKGYLSALRT GWYTSVITIE
61 LSNIKENKCN GTDAKVKLIK QELDKYKNAV TELQLLMQST PATNNRARRE LPRFMNYTLN
121 NAKKTNVTLS KKRKRRFLGF LLGVGSAIAS GVAVSKVLHL EGEVNKIKSA LLSTNKAVVS
181 LSNGVSVLTS KVLDLKNYID KQLLPIVNKQ SCSISNIETV IEFQQKNNRL LEITREFSVN
241 AGVTTPVSTY MLTNSELLSL INDMPITNDQ KKLMSNNVQI VRQQSYSIMS IIKEEVLAYV
301 VQLPLYGVID TPCWKLHTSP LCTTNTKEGS NICLTRTDRG WYCDNAGSVS FFPQAETCKV
361 QSNRVFCDTM NSLTLPSEVN LCNVDIFNPK YDCKIMTSKT DVSSSVITSL GAIVSCYGKT
421 KCTASNKNRG IIKTFSNGCD YVSNKGVDTV SVGNTLYYVN KQEGKSLYVK GEPIINFYDP
481 LVFPSDEFDA SISQVNEKIN QSLAFIRKSD ELLHNVNAGK STTN (SEQ ID NO: 39)
Следующая последовательность нуклеиновой кислоты представляет собой оптимизированную кодирующую последовательность для указанной выше полипептидной последовательности.
1 ATGGAACTGC TGATCCTGAA GGCCAACGCC ATCACCACCA TCCTGACCGC CGTGACCTTC
61 TGCTTCGCCA GCGGCCAGAA CATCACCGAG GAATTCTACC AGAGCACCTG CAGCGCCGTG
121 AGCAAGGGCT ACCTGAGCGC CCTGCGGACC GGCTGGTACA CCAGCGTGAT CACCATCGAG
181 CTGTCCAACA TCAAAGAAAA CAAGTGCAAC GGCACCGACG CCAAGGTGAA ACTGATCAAG
241 CAGGAACTGG ACAAGTACAA GAACGCCGTG ACCGAGCTGC AGCTGCTGAT GCAGAGCACC
301 CCCGCCACCA ACAACCGGGC CAGAAGAGAG CTGCCCCGGT TCATGAACTA CACCCTGAAC
361 AACGCCAAGA AAACCAACGT GACCCTGAGC AAGAAGCGGA AGCGGCGGTT CCTGGGCTTC
421 CTGCTGGGCG TGGGCAGCGC CATCGCCAGC GGGGTGGCCG TGTCCAAGGT GCTGCACCTG
481 GAAGGCGAGG TGAACAAGAT CAAGTCCGCC CTGCTGTCCA CCAACAAGGC CGTGGTGTCC
541 CTGAGCAACG GCGTGAGCGT GCTGACCAGC AAGGTGCTGG ATCTGAAGAA CTACATCGAC
601 AAGCAGCTGC TGCCCATCGT GAACAAGCAG AGCTGCAGCA TCAGCAACAT CGAGACCGTG
661 ATCGAGTTCC AGCAGAAGAA CAACCGGCTG CTGGAAATCA CCCGGGAGTT CAGCGTGAAC
721 GCCGGCGTGA CCACCCCCGT GAGCACCTAC ATGCTGACCA ACAGCGAGCT GCTGTCCCTG
781 ATCAATGACA TGCCCATCAC CAACGACCAG AAAAAGCTGA TGAGCAACAA CGTGCAGATC
841 GTGCGGCAGC AGAGCTACTC CATCATGAGC ATCATCAAAG AAGAGGTGCT GGCCTACGTG
901 GTGCAGCTGC CCCTGTACGG CGTGATCGAC ACCCCCTGCT GGAAGCTGCA CACCAGCCCC
961 CTGTGCACCA CCAACACCAA AGAGGGCAGC AACATCTGCC TGACCCGGAC CGACCGGGGC
1021 TGGTACTGCG ACAACGCCGG CAGCGTGAGC TTCTTCCCCC AAGCCGAGAC CTGCAAGGTG
1081 CAGAGCAACC GGGTGTTCTG CGACACCATG AACAGCCTGA CCCTGCCCTC CGAGGTGAAC
1141 CTGTGCAACG TGGACATCTT CAACCCCAAG TACGACTGCA AGATCATGAC CTCCAAGACC
1201 GACGTGAGCA GCTCCGTGAT CACCTCCCTG GGCGCCATCG TGAGCTGCTA CGGCAAGACC
1261 AAGTGCACCG CCAGCAACAA GAACCGGGGC ATCATCAAGA CCTTCAGCAA CGGCTGCGAC
1321 TACGTGAGCA ACAAGGGCGT GGACACCGTG AGCGTGGGCA ACACACTGTA CTACGTGAAT
1381 AAGCAGGAAG GCAAGAGCCT GTACGTGAAG GGCGAGCCCA TCATCAACTT CTACGACCCC
1441 CTGGTGTTCC CCAGCGACGA GTTCGACGCC AGCATCAGCC AGGTCAACGA GAAGATCAAC
1501 CAGAGCCTGG CCTTCATCCG GAAGAGCGAC GAGCTGCTGC ACAATGTGAA TGCCGGCAAG
1561 AGCACCACCA ATTGAAG (SEQ ID NO: 40)
RSV F Full Length
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARRELPRFMNYTLNNAKKTNVTLSKKRKRRFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNIMITTIIIVIIVILLSLIAVGLLLYCKARSTPVTLSKDQLSGINNIAFSN (SEQ ID NO: 41)
RSV F Cleavage Enterokinase idealized
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARRELPRFMNYTLNNAKKTNVTLSKKRKRRFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQINEKINQILAFIRKIDELLHNINAGKSTTNGSGSGDDDDDKGSGSGIMITTIIIVIIVILLSLIAVGLLLYCKARSTPVTLSKDQLSGINNIAFSN (SEQ ID NO: 42)
RSV F Cleavage Thrombin idealized
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARRELPRFMNYTLNNAKKTNVTLSKKRKRRFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQINEKINQILAFIRKIDELLHNINAGKSTTNGSGSGLVPRGSGSGIMITTIIIVIIVILLSLIAVGLLLYCKARSTPVTLSKDQLSGINNIAFSN (SEQ ID NO: 43)
RSV F Cleavage FactorXa idealized
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARRELPRFMNYTLNNAKKTNVTLSKKRKRRFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQINEKINQILAFIRKIDELLHNINAGKSTTNGSGSGIEGRGSGSGIMITTIIIVIIVILLSLIAVGLLLYCKARSTPVTLSKDQLSGINNIAFSN (SEQ ID NO: 44)
RSV F furx Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNQAQNELPRFMNYTLNNAKKTNVTLSQNQNQNFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 45)
RSV F furx R113Q, K123N, K124N Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNQAQNELPQFMNYTLNNANNTNVTLSQNQNQNFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 46)
RSV F furx R113Q, K123Q, K124Q Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNQAQNELPQFMNYTLNNAQQTNVTLSQNQNQNFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 93)
RSV F delP21 furx Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNQAQN --------------------- QNQNQNFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 47) (символ "-" указывает на то, что аминокислота в этом положении удалена)
RSV F delP23 furx Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNQAQN ----------------------- QNQNFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 48) (символ "-" указывает на то, что аминокислота в этом положении удалена)
RSV F delP23 furdel Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARQ ----------------------- QQQRFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 49) (символ "-" указывает на то, что аминокислота в этом положении удалена)
RSV F furmt Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARKELPRFMNYTLNNAKKTNVTLSKKRKKKFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 50)
RSV F furdel Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARQELPRFMNYTLNNAKKTNVTLSKK --- RFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYKDHAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 51) (символ "-" указывает на то, что аминокислота в этом положении удалена)
RSV F Factor Xa Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNIEGRELPRFMNYTLNNAKKTNVTLSKKIEGRFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 52)
RSV F Short linker Foldon HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARRELPRFMNYTLNNAKKTNVTLSKKRKRRFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGSGYIPEAPRDGQAYVRKDGEWVLLSTFLGGSAGSGHHHHHH (SEQ ID NO: 53)
RSV F Long linker Foldon HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARRELPRFMNYTLNNAKKTNVTLSKKRKRRFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNNKNDDKGSGYIPEAPRDGQAYVRKDGEWVLLSTFLGGSAGSGHHHHHH (SEQ ID NO: 54)
RSV_F_ecto_pre_his
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARRELPRFMNYTLNNAKKTNVTLSKKRKRRFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNDKIEEILSKIYHIENEIARIKKLIGESGGSAGSGHHHHHH (SEQ ID NO: 55)
ECTO PRE HA HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARRELPRFMNYTLNNAKKTNVTLSKKRKRRFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNEKFHQIEKEFSEVEGRIQDLEKSGGSAGSGHHHHHH (SEQ ID NO: 56)
RSV F ECTO Furx GCN HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNQAQNELPQFMNYTLNNANNTNVTLSQNQNQNFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVN DKIEEILSKIYHIENEIARIKKLIGESGGSAGSGHHHHHH (SEQ ID NO: 57)
RSV F ECTO delp21 GCN HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNQAQN --------------------- QNQNQNFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVN DKIEEILSKIYHIENEIARIKKLIGESGGSAGSGHHHHHH (SEQ ID NO: 58) (символ "-" указывает на то, что аминокислота в этом положении удалена)
RSV F ECTO delp23 Furx GCN HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNQAQN ----------------------- QNQNFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVN DKIEEILSKIYHIENEIARIKKLIGESGGSAGSGHHHHHH (SEQ ID NO: 59) (символ "-" указывает на то, что аминокислота в этом положении удалена)
RSV F ECTO delp23 Furdel GCN HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARQ ----------------------- QQQRFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVN DKIEEILSKIYHIENEIARIKKLIGESGGSAGSGHHHHHH (SEQ ID NO: 60) (символ "-" указывает на то, что аминокислота в этом положении удалена)
RSV F Full Length Furx
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNQAQNELPQFMNYTLNNANNTNVTLSQNQNQNFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVN AGKSTTNIMITTIIIVIIVILLSLIAVGLLLYCKARSTPVTLSKDQLSGINNIAFSN (SEQ ID NO: 61)
RSV F Full Length delp21
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNQAQN --------------------- QNQNQNFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYKDHKGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVN AGKSTTNIMITTIIIVIIVILLSLIAVGLLLYCKARSTPVTLSKDQLSGINNIAFSN (SEQ ID NO: 62) (символ "-" указывает на то, что аминокислота в этом положении удалена)
RSV F Full Length p23 Furx GCN HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNQAQN ----------------------- QNQNFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVN AGKSTTNIMITTIIIVIIVILLSLIAVGLLLYCKARSTPVTLSKDQLSGINNIAFSN (SEQ ID NO: 63) (символ "-" указывает на то, что аминокислота в этом положении удалена)
RSV F Full Length p23 Furdel GCN HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARQ ----------------------- QQQRFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVN AGKSTTNIMITTIIIVIIVILLSLIAVGLLLYCKARSTPVTLSKDQLSGINNIAFSN (SEQ ID NO: 64) (символ "-" указывает на то, что аминокислота в этом положении удалена)
RSV F N-термин Furin Furx Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNQAQNELPQFMNYTLNNAQQTNVTLSKKRKRRFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 65)
RSV F C-term Furin Furx Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARRELPQFMNYTLNNAQQTNVTLSQNQNQNFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 66)
RSV F Fusion Deletion 1 Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARRELPRFMNYTLNNAKKTNVTLSKKRKRRSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 67)
RSV F Fusion Deletion 2 Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARRELPRFMNYTLNNAKKTNVTLSKKRKRRGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 68)
RSV F Furx Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNQAQNELPQFMNYTLNNAQQTNVTLSQNQNQNFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 69)
RSV F Furx Truncated
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNQAQNELPQFMNYTLNNAQQTNVTLSQNQNQNFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTN (SEQ ID NO: 70)
RSV F delP23 furdel Truncated No HIS (для клеток CHO)
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARQ ----------------------- QQQRFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTN (SEQ ID NO: 71) (символ "-" указывает на то, что аминокислота в этом положении удалена)
RSV F (Wt) Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARRELPRFMNYTLNNAKKTNVTLSKKRKRRFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 84)
RSV F old furx Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNQAQNELQRFMNYTLNNANNTNVTLSQNQNQNFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 88)
RSV F Furx R113Q K123N K124N Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNQAQNELPQFMNYTLNNAQQTNVTLSQNQNQNFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 89)
RSV F N-term Furin Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARRELPQFMNYTLNNAQQTNVTLSQNQNQNFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 85)
RSV F delP21 furdel Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNRARQ --------------------- QNQQQRFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 86)
RSV F C-term Furin Truncated HIS
MELLILKANAITTILTAVTFCFASGQNITEEFYQSTCSAVSKGYLSALRTGWYTSVITIELSNIKENKCNGTDAKVKLIKQELDKYKNAVTELQLLMQSTPATNNQAQNELPQFMNYTLNNAQQTNVTLSKKRKRRFLGFLLGVGSAIASGVAVSKVLHLEGEVNKIKSALLSTNKAVVSLSNGVSVLTSKVLDLKNYIDKQLLPIVNKQSCSISNIETVIEFQQKNNRLLEITREFSVNAGVTTPVSTYMLTNSELLSLINDMPITNDQKKLMSNNVQIVRQQSYSIMSIIKEEVLAYVVQLPLYGVIDTPCWKLHTSPLCTTNTKEGSNICLTRTDRGWYCDNAGSVSFFPQAETCKVQSNRVFCDTMNSLTLPSEVNLCNVDIFNPKYDCKIMTSKTDVSSSVITSLGAIVSCYGKTKCTASNKNRGIIKTFSNGCDYVSNKGVDTVSVGNTLYYVNKQEGKSLYVKGEPIINFYDPLVFPSDEFDASISQVNEKINQSLAFIRKSDELLHNVNAGKSTTNGGSAGSGHHHHHH (SEQ ID NO: 87)
Пример 2 - экспрессия и очистка конструкций F RSV
Конструкции F RSV ECTO и укороченные конструкции F RSV, лишенные трансмембранного домена и цитоплазматического концевого участка либо с участками расщепления фурином дикого типа, либо несущие мутации с нокаутом участков расщепления фурином и со стабилизирующими конформацию "до слияния" мутациями, клонировали в бакуловирусный экспрессирующий вектор pFastBac (Invitrogen). Несколько из этих конструкций содержат C-концевой гибкий линкер, за которым следует последовательность His6-метки, использованная для хелатирующей очистки. Исходные бакуловирусные культуры для продукции пассировали в клетках насекомых Sf9. Белки экспрессировали путем инфицирования клеток насекомых Sf9, Tn5 или High Five требуемым количеством бакуловируса и сбора супернатанта среды двое или трое суток после инфицирования, осуществляя мониторинг вестерн-блоттингом с использованием антитела против F RSV или антитела против 6HIS.
Экспрессирующую среду в большом масштабе концентрировали/очищали с помощью одной из двух общих стратегий устранения неблагоприятного эффекта ферритина, присутствующего в среде клеток насекомых, который может разрушать хелатирующую смолу. Первым подходом было концентрирование приблизительно 10-20 литров среды для экспрессии в клетках насекомых до приблизительно 300 мл с использованием колонки для концентрирования на волокне GE Healthcare Hollotube. К этой концентрированной смеси добавляли сульфат меди до конечной концентрации 500 мкМ и полученный раствор наносили на 5-мл хелатирующие колонки HiTrap. Затем с колонки элюировали связанный HIS-меченый белок с помощью 25 мМ Tris pH 7,5, 300 мМ NaCl и градиента имидазола.
Во второй стратегии очистки к супернатанту среды добавляли CuCl2 до конечной концентрации 500 мкМ. К каждому 1 литру среды добавляли четыре миллилитра хелатирующей смолы (Chelating Resin, BioRad) и взвесь качали в течение, по меньшей мере, тридцати минут при 4 градусах Цельсия и смолу и среду разделяли с помощью гравитационной колонки. Смолу промывали десятью объемами колонки буфера для уравновешивания (25 мМ Tris pH 7,5, 300 мМ NaCl) и белок F элюировали десятью объемами колонки буфера для элюирования (буфер для уравновешивания с 250 мМ имидазолом). Элюат подвергали диализу против 25 мМ Tris-буфера, pH 7,5, и полученный раствор наносили на 5-мл хелатирующую колонку Hitrap, заполненную NiSO4, и элюировали 25 мМ Tris pH 7,5, 300 мМ NaCl и градиентом имидазола.
Элюаты после градиента имидазола в любом случае оценивали с использованием вестерн-блоттинга с антителом против 6HIS и гелей с кумасси синим. Фракции, содержащие чистые конструкции, собирали, подвергали диализу против различных растворов буфер/солевой раствор и концентрировали для последующего анализа с использованием Millipore Centriprep Concentrators и/или элементов для концентрирования Vivaspin. Также авторы изобретения разработали протокол очистки эксклюзионной хроматографии, способной далее очищать монодисперсные тримеры RSV от розеткообразных структур (ниже).
SEC-анализ белков F RSV:
Документально подтвержденным признаком других слитых белков парамиксовирусов, стабилизировнных в их конформации "до слияния", является то, что даже после расщепления с экспонированием пептида слияния они не образуют розеткообразные структуры, как наблюдают для конформации "после слияния". Простой анализ эксклюзионной хроматографией позволяет идентификацию белка и определение того, образует ли белок розеткообразные структуры. Были разработаны два способа, ВЭЖХ-SEC и FPLC-SEC, которые также служат в качестве эффективной стадии очистки.
ВЭЖХ-SEC проводили с использованием колонки Biorad SEC (18 мм) с подвижной фазой 25 мМ Tris pH 7,5, 300 мМ NaCl. С использованием стандартов Biorad ВЭЖХ-SEC для калибровки системы авторы изобретения открыли, что розеткообразные структуры RSV (соответствующие расщепленным конформациям "после слияния") элюируются в свободном объеме колонки в анализе, в то время как монодисперсные тримеры RSV (предположительно тримеры из последующего EM-анализа) элюируются с кажущейся молекулярной массой приблизительно 100 кДа.
FPLC-SEC проводили на GE Healtcare FPLC с использованием колонке 16/60 Superdex 200 с подвижной фазой 25 мМ Tris pH 7,5, 300 мМ NaCl. С использованием высокомолекулырных стандартов GE Healthcare для калибровки системы авторы изобретения открыли, что розеткообразные структуры RSV элюируются в свободном объеме в анализе, в то время как монодисперсные тримеры RSV элюируются с кажущейся молекулярной массой приблизительно 100 кДа.
Электронная микроскопия (EM) белков F RSV
Растворы белка конструкций F RSV приблизительно 50 микрограмм на мл абсорбировали на покрытую углеродом решетку с тлеющим зарядом и негативно контрастировали 2% фосфовольфраматом натрия (pH 7,0) или 0,75% уринал-формиатом (не определенное количественно низкое значение pH). Решетки наблюдали на трансмиссионном электронном микроскопе Technai Spirit или JOEL 1230, действующем в диапазоне 80-120 кВ с увеличением от 20000 до 150000, в зависимости от требуемого разрешения.
Пример 3 - Детекция F RSV "до слияния" и "после слияния"
Для определения конформации белка F RSV для анализа того, является ли неблагоприятной конформация "после слияния" в белке F RSV доступен ряд способов. Примеры включают ассоциацию с липосомами, специфичные к конформации моноклональные антитела (включая антитела, которые используют в FACS, ELISA, и т.д.), электронную микроскопию, дифференциальную чувствительность к протеазам между конформациями, гель-фильтрацию, аналитическое ультрацентрифугирование, динамическое рассеяние света, эксперименты по ЯМР с заменой дейтерием, масс-спектроскопию, спектроскопию кругового дихроизма, изотермическую титрационную калориметрию, спектроскопию с триптофаном и рентгеновскую кристаллографию.
Ассоциация с липосомами
Ассоциацию с липосомами можно использовать для анализа конформации белка F RSV. Растворимые формы белка F RSV в конформации "до слияния" не ассоциируют с липосомами, в то время как конформация "после слияния" ассоциирует с липосомами.
Липосомы можно получать следующим образом: 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин, 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфоэтаноламин и холестерин в хлороформе (доступный от Avanti Polar Lipids) смешивают в молярном соотношении 8:2:5. Хлороформ упаривают в атмосфере аргона. Образуется липидная пленка, которую сушат в вакууме в течение ночи и ресуспендируют в PBS с общей концентрацией липидов 40 мМ. После пяти циклов замораживания-размораживания липиды встряхивают и экструдируют 21 раз через два 100-мкм фильтра с использованием миниэкструдера (доступного от Avanti Polar Lipids).
После получения липосом можно проводить анализ ассоциации липосом. Для каждого тестируемого образца 2 мкг полипептида F RSV для тестирования расщепляют 25 миллиединицами трипсина (доступен от Worthington Biochemical) в 100 мМ фосфатном буфере (pH 7,1) в течение 30 мин при 25°C. После расщепления в каждый образец добавляют 40 пг ингибитора трипсина сои (доступный от Worthington Biochemical) для завершения реакции. Образцы предварительно обрабатывают при 60°C в течение 30 мин, что индуцирует конформационный сдвиг с формы "до слияния" на форму "после слияния" в нативном выделенном белке RSF F. Добавляют липосомы (40 мкл на образец) и PBS (конечный объем 80 мкл), и образцы инкубируют при 60°C в течение 30 мин. Добавляют сахарозу до конечной концентрации 50% (конечный объем 500 мкл). На образцы наслаивают 500 мкл каждого из 40% сахарозы, 25% сахарозы и PBS и центрифугируют их в роторе TLS55 при 49000 об./мин. в течение 3 ч при 25°C. Фракции (500 мкл) собирают сверху градиентов. Белки солюбилизируют в 0,5% Triton X-100 и осаждают с использованием 12,5% об./об. трихлоруксусной кислоты. Полипептиды разделяют посредством SDS/PAGE и переносят на мембраны PVDF. Блоты исследуют с помощью моноклональных антител против F RSV.
Электронная микроскопия
Электронную микроскопию исследовали для анализа распределения конформаций полипептидов F RSV. Полипептиды F RSV в форме до слияния имеют форму "шара и стержня" длиной ~12 нм. Напротив, полипептиды F RSV в форме "после слияния" имеют форму "метки для мяча в гольфе" с длиной ~16 нм. Дополнительно пептиды слияния на узком конце "метки для мяча в гольфе" агрегируют с образованием структур розеткообразных структур. Таким образом, электронную микроскопию можно применять для анализа распределения конформаций в образце полипептидов F RSV благодаря легко различимым формам.
Пример 4 - Тримеры и розеткообразные структуры эктодомена F RSV
Конструкции эктодомена белка F RSV, кодирующие полипептиды, которые лишены трансмембранного домена и цитоплазматического концевого участка либо с участками расщепления фурином дикого типа, либо несущие мутации с нокаутом участков расщепления фурином и/или мутации пептида слияния, клонировали в бакуловирусный экспрессирующий вектор pFastBac (Invitrogen). Несколько из этих конструкций содержат C-концевой гибкий линкер, за которым следует последовательность HIS6-метки, использованная для хелатирующей очистки. Исходные бакуловирусные культуры для продукции пассировали в клетках насекомых Sf9. Белки экспрессировали путем инфицирования клеток насекомых Sf9, Tn5 или High Five требуемым количеством бакуловируса и сбора супернатанта среды двое или трое суток после инфицирования. Мониторинг продукции белка вестерн-блоттингом проводили с использованием антитела против F RSV или антитела против HIS6.
Экспрессирующую среду в большом масштабе концентрировали/очищали с помощью одной из двух общих стратегий устранения неблагоприятного эффекта ферритина, присутствующего в среде клеток насекомых, который может разрушать хелатирующую смолу. Первым подходом было концентрирование приблизительно 10-20 литров среды для экспрессии в клетках насекомых до приблизительно 300 мл с использованием колонки для концентрирования на волокне GE Healthcare Hollotube. К этой концентрированной смеси добавляли сульфат меди до конечной концентрации 500 мкМ и полученный раствор наносили на 5-мл хелатирующие колонки HiTrap. Затем с колонки элюировали связанный HIS-меченый с помощью 25 мМ Tris pH 7,5, 300 мМ NaCl и градиента имидазола.
Во второй стратегии очистки к супернатанту среды добавляли CuCl2 до конечной концентрации 500 мкМ. К каждому 1 литру среды добавляли четыре миллилитра хелатирующей смолы (Chelating Resin, BioRad) и взвесь качали в течение, по меньшей мере, тридцати минут при 4 градусах Цельсия и смолу и среду разделяли с помощью гравитационной колонки. Смолу промывали десятью объемами колонки буфера для уравновешивания (25 мМ Tris pH 7,5, 300 мМ NaCl) и белок F элюировали десятью объемами колонки буфера для элюирования (буфер для уравновешивания с 250 мМ имидазолом). Элюат подвергали диализу против 25 мМ Tris-буфера, pH 7,5, и полученный раствор наносили на 5-мл хелатирующую колонку Hitrap, заполненную NiSO4, и элюировали 25 мМ Tris pH 7,5, 300 мМ NaCl и градиентом имидазола.
Элюаты после градиента имидазола в каждом случае оценивали с использованием вестерн-блотов против HIS6 и/или окрашенных кумасси синим гелей для SDS-PAGE. Фракции, содержавшие чистые конструкции, собирали, подвергали диализу с помощью различных растворов буфер/физиологический раствор и концентрировали для последующего анализа с использованием концентратов Millipore Centriprep и/или элементов для концентрирования Vivaspin. В некоторых случаях мономеры, тримеры или розеткообразные структуры далее очищали с использованием эксклюзионной хроматографии.
SEC-анализ и очистка эктодоменов F RSV
Эксклюзионную хроматографию использовали для очистки и анализа мономеров, тримеров и розеткообразных структур эктодомена белка F RSV. Этот способ также позволяет очистку нерасщепленных эктодоменов белка F RSV от клеток-хозяев или примесей липидов и липопротеинов из среды. Было разработано два способа, ВЭЖХ-SEC и FPLC-SEC, которые также могут служить в качестве эффективной стадии очистки.
ВЭЖХ-SEC проводили с использованием колонки Biorad SEC (18 мм) с подвижной фазой 25 мМ Tris pH 7,5, 300 мМ NaCl. С использованием стандартов Biorad ВЭЖХ-SEC для калибровки системы авторы изобретения открыли, что розеткообразные структуры RSV (соответствующие расщепленным конформациям "после слияния") элюируются в свободном объеме колонки в анализе, в то время как мономеры RSV элюируются с кажущейся молекулярной массой приблизительно 75-85 кДа.
FPLC-SEC проводили на GE Healtcare FPLC с использованием колонки 16/60 Superdex 200 с подвижной фазой 25 мМ Tris pH 7,5, 300 мМ NaCl. С использованием высокомолекулырных стандартов GE Healthcare для калибровки системы авторы изобретения открыли, что розеткообразные структуры RSV элюируются в свободном объеме в анализе, в то время как монодисперсные тримеры RSV элюируются с кажущейся молекулярной массой приблизительно 140-160 кДа и мономеры RSV F элюируются с кажущейся молекулярной массой 75-85 кДа.
Для очистки использовали способ FPLC-SEC и собирали фракции объемом 1 мл.
Расщепление трипсином конструкций Furdel или Delp23 Furdel с образованием розеткообразных структур "после слияния"
Как правило, расщепление трипсином мономеров Delp23 Furdel проводят в соотношении 1:1000 трипсин:F RSV по массе, или 10-15 единиц BAEE трипсина на 1 мг антигена F RSV. В типичной реакции трипсин из плазмы быка (Sigma Aldrich, T8802: 10000-15000 BAEE единиц/мг трипсина) разбавляли до концентрации 1 мг/мл в 25 мМ Tris pH 7,5, 300 мМ NaCl. Раствор полипептида эктодомена белка F RSV в концентрации 1 мг/мл (разбавленный в 25 мМ Tris pH 7,5, 300 мМ NaCl) обрабатывали одним микролитром раствора трипсина (конечное соотношение масс 0,001:1 трипсин:F RSV или приблизительно 10-15 единиц BAEE трипсина на каждый миллиграмм F RSV) в течение 1 часа при 37°C. Как правило, мониторинг хода реакции проводили с помощью геля SDS-PAGE. Реакцию расщепления останавливали с использованием ингибитора трипсина. Расщепленный белок F RSV далее очищали эксклюзионной хроматографией.
Иногда к расщепленному раствору добавляли объем 1:100 иммобилизованного ингибитора трипсина (Sigma) или 1 микролитр 1 мМ ингибитора трипсина сои и смесь инкубировали при комнатной температуре в течение приблизительно 15-30 минут при осторожном качании для остановки реакции трипсина. Ингибирующую смолу отделяли от раствора белка с использованием микроцентрифужных колонок. Полученный раствор очищали с помощью SEC.
Электронная микроскопия (EM) белков F RSV
Полипептиды эктодомена белка F RSV (приблизительно 50 микрограмм на мл) абсорбировали на покрытую углеродом решетку с тлеющим зарядом и негативно контрастировали 2% фосфовольфраматом натрия (pH 7,0) или 0,75% уринал-формиатом (не определенное количественно низкое значение pH). Решетки наблюдали на трансмиссионном электронном микроскопе Technai Spirit или JOEL 1230, действующем в диапазоне 80-120 кВ с увеличением от 20000 до 150000, в зависимости от требуемого разрешения.
Анализ фосфолипидов
Анализ основан на способе анализа Wako Pure Chemical Industries, Ltd. с холиноксидазой фосфолипидов C - DAOS (Номер по каталогу 433-36201). Протокол анализа модифицирован только для снижения количества материала, использованного в анализе, и для снижения разведения образца в реакционной смеси относительно общего протокола поставщика. Для определения содержания липидов в образце F RSV, получали цветной реагент путем растворения одной бутылки цветного реагента одной бутылкой буфера (цветной реагент является стабильным в течение 1 недели при 4°C). Стандарт фосфолипида в концентрации 300 мг/дл (3 мг/мл) разбавляли до 1,5, 1,0, 0,75, 0,5 и 0,25 мг/мл дистиллированной водой. Для каждого стандарта, пустого образца с водой и образца реакционной смеси в микроцентрифужную пробирку добавляли 10 мкл цветного реагента и 2 мкл стандарта, дистиллированной воды (стандарт 0 мг/мл) или образца. Реакционные смеси кратковременно центрифугировали для обеспечения надлежащего перемешивания и пробирки инкубировали в течение 15 мин при 37°C. Для каждой точки стандарта регистрировали поглощение при 595 нм и строили стандартную кривую. Для каждого образца регистрировали поглощение при 595 нм и из полученной калибровочной кривой вычисляли концентрацию фосфолипидов.
Иммуногенность у хлопковых хомячков
Иммуногенность полипептидов эктодомена белка F RSV в формах мономеров (нерасщепленная delp21 furx), розеткообразных структур тримеров (расщепленная delp23 furdel), и тримеров (делеция пептида слияния) определяли у хлопковых хомячков (Sigmodon hispidus) в двух исследованиях. В исследовании 1 (ФИГ. 8A и 8B), 10 хлопковых хомячков на группу вакцинировали внутримышечно 10 мкг мономеров или розеткообразных структур (все из них адсоробированные на гидроксиде алюминия) на 0 и 21 сутки. Титры сывороточных IgG против F RSV и нейтрализующих антител против RSV измеряли через 2 недели после 1-ой вакцинации (2wp1) и 2 недели после 2-ой вакцинации (2wp2), или 3 недели после 1-ой вакцинации (3wp1) и 2 недели после 2-ой вакцинации (2wp2). IgG против белка F RSV (ФИГ. 8A) определяли с помощью ELISA с использованием покрытых белком F RSV планшетов и конъюгированного с пероксидазой хрена детектирующего антитела курицы против IgG хлопкового хомячка. Данные представлены в качестве log10 геометрических средних значений титров (GMT) + стандартное отклонение у отдельных хлопковых хомячков. Титры нейтрализации RSV (ФИГ. 8B) измеряли с помощью теста нейтрализации в виде уменьшения бляшек (PRNT). В кратком изложении разведения инактивированной нагреванием сыворотки предварительно инкубировали с RSV Long, а затем инокулировали на клетки HEp-2 в чашки с 12-ячейками. После инфицирования в течение 2 часов инокулят удаляли и на клетки наслаивали агарозу. Бляшки количественно определяли через 5 суток после окрашивания нейтральным красным. Титр нейтрализации определяют как обратную величину разведения сыворотки, дающую, по меньшей мере, 60% снижение количества бляшек на лунку относительно контролей (без сыворотки). Данные представлены в качестве log10 GMT + стандартная ошибка для 2 объединенных групп по 5 хлопковых хомячков на группу.
В исследовании 2 (ФИГ. 8C), 9 хлопковых хомячков на группу иммунизировали внутримышечно указанными дозами мономеров, тримеров или розеткообразных структур (каждый из них адсорбирован на гидроксид алюминия). Сывороточные титры IgG против F RSV измеряли 2wp1 как указано выше.
Результаты
Растворимый эктодомен F RSV (с немутантными участками расщепления фурином) экспрессировали, но его нельзя было очистить от примесей липидов и липопротеинов из клеток-хозяев или культуральной среды с использованием эксклюзионной хроматографии. Эти полипептиды эктодомена F RSV элюируются в свободном объеме колонки SEC вместе с примесями липидов и липопротеинов.
Для получения полипептидов эктодомена F RSV было получено несколько конструкций, которые содержат мутации в участках расщепления фурином, включая конструкции Furdel. См. ФИГ. 1. Полипептиды, полученные экспрессией конструкций Furdel секретировались из клеток в качестве нерасщепленных структур массой ~65 кДа. Мутация Furdel также препятствует экспонированию пептида слияния, что, в свою очередь, препятствует образованию розеткообразных структур. В результате растворимый F RSV Furdel мигрировал во внутреннем объеме препаративной колонки Superdex 200, что приводило к отделению как от липидного дебриса, который элюировался в свободном объеме, и так и от примесей белков насекомых. Эти результаты демонстрируют, что полипептиды эктодомена F RSV, в которых участки расщепления фурином являются мутантными, получают в качестве нарасщепленного полипептида, который можно очищать с помощью SEC. Дополнительно анализ времени удержания нерасщепленного F RSV согласовывался с тем, что полипептиды являлись мономерами, а не тримерами.
То, являлись ли полипептиды F RSV furdel мономерами, тримерами или смесью мономеров и тримеров, оценивали далее с использованием аналитического ультрацентрифугирования. Исследования по аналитическому ультрацентрифугированию проводили с использованием белка, очищенного из пика мономера при очистке с помощью SEC. Данные о скорости оседания нерасщепленного F RSV показали ступенчатый паттерн, указывая на две структуры в растворе. Анализ скорости оседания показал, что нерасщепленный эктодомен F RSV имел высокую долю мономера и небольшую долю предполагаемого тримера в растворе. Данные о равновесии собирали и предпринимали попытки для сопоставления данных либо с идеальной моделью мономера, либо с равновесной моделью мономер-тример. Однако разность при сопоставлении была низкой, особенно у дна ячейки, где концентрация белка является более высокой. Эти наблюдения указывают на то, что нерасщепленные полипептиды эктодомена F RSV, главным образом, представляют собой мономер с меньшей совокупностью собственных ассоциированных структур (возможно, тримеров) или агрегатов при более высоких концентрациях.
Дальнейший анализ выбранных полипептидов эктодомена белка F RSV проводили с использованием эксклюзионной (SEC) хроматографии. ФИГ. 6A-6D. Основные пики, содержащие мономеры, тримеры или розеткообразные структуры тримеров, указаны звездочкой на ФИГ. 6A-6D, причем время удержания на колонке Superdex P200 16/60 (GE Healthcare) указано в миллилитрах. На калиброванной колонке приблизительное время удержания 47 млс, 65 млс и 77 млс соответствует сводному объему колонки, времени удержания тримеров F и времени удержания мономеров, соответственно. На ФИГ. 6A нерасщепленную конструкцию Delp23 Furdel (Δp23 Furdel) очищали из пика мономера. Когда нерасщепленный антиген Delp23 Furdel F RSV обрабатывали трипсином, белок образовывал розеткообразные структуры, которые мигрировали на SEC в свободном объеме (ФИГ. 6B). Расщепленные структуры тримеров F RSV с делецией пептида слияния очищали из пика тримера при времени удержания приблизительно 65 млс (ФИГ. 6C) в то время как нерасщепленную конструкцию Delp21 Furx (Δp21 Furx) очищали из пика мономера приблизительно при 77 млс (ФИГ. 6D).
Несколько полипептидов эктодомена белка F RSV в нерасщепленной форме или после расщепления трипсином оценивали с помощью EM. Конструкции F RSV Furdel и delp23 Furdel имеют остатки аргинина, сохраненные в участке расщепления фурином. Эти остатки аргинина являются чувствительными к расщеплению трипсином. При расщеплении нерасщепленные структуры F0 превращались в структуры F1/F2, в которых пептид слияния экспонирован. EM-анализ подтвердил, что после расщепления трипсином нерасщепленные эктодомены RSV образовывали розеткообразные структуры тримеров через пептиды слияния, как наблюдали для сходных слитых белков. Результаты представлены в таблице 3, и показывают, что нерасщепленные полипептиды эктодомена белка F RSV можно расщеплять с образованием розеткообразных структур тримеров. Конструкция с удаленным пептидом слияния, которая расщепляется фурином, образовывала монодисперсные тримеры. Также см. ФИГ. 7A-7D. Преимущественно, образование розеткообразных структур тримеров этим путем приводит к розеткам тримеров, которые по существу свободны от липидного дебриса и липопротеинов.
Результаты исследований иммуногенности показали, что полипептиды эктодомена белка F RSV в форме мономеров (нерасщепленный delp21 furx), розеткообразных структур тримеров (расщепленный delp23 furdel) и тримеров (делеция пептида слияния) были иммуногенными у хлопковых хомячков (Sigmodon hispidus) и индуцировали нейтрализующие антитела. ФИГ. 8A-8C.
Пример 5 - Способы получения антигенов субъединиц F RSV в клетках насекомых или CHO
Очистка антигена F RSV из клеток насекомых
Субъединицы эктодомена F RSV, включающие Delp21 Furx, Delp23 Furdel и конструкции с делецией пептида слияния, экспрессировали в клетках насекомых HiFive (Invitrogen) с использованием бакуловирусной системы pFAST Bac. Субъединицу F RSV после крупномасштабной экспрессии, 10-25 литров, с помощью двухстадийного хелатирующего способа, который снижает вредоносный эффект примесей ферритина, присутствующих в среде клеток насекомых, который может разрушать хелатирующую смолу. К суперанту среды добавляли CuSO4 до конечной концентрации 500 мкМ. На каждый 1 литр среды добавляли приблизительно от десяти до двадцати миллилитров хелатирующей смолы (Chelating Resin, BioRad), взвесь качали в течение, по меньшей мере, тридцати минут при 4°C, и смолу и среду разделяли с использованием гравитационной колонки. Смолу промывали буфером для уравновешивания (25 мМ Tris pH 7,5, 300 мМ NaCl), в объеме, приблизительно равном двум объемам смолы, и эктодомен белка F элюировали приблизительно двукратным объемом колонки буфера для элюирования (буфер для уравновешивания с 250 мМ имидазолом). Элюат подвергали диализу против 25 мМ Tris-буфера, pH 7,5, 300 мМ NaCl, и полученный раствор наносили на 5-мл хелатирующую колонку Hitrap, заполненную NiSO4 (GE Healthcare). Связанный белок элюировали 25 мМ Tris pH 7,5, 300 мМ NaCl и градиентом имидазола.
Элюаты после градиента имидазола в каждом случае оценивали с использованием вестерн-блотов против HIS6 и/или окрашенных кумасси синим гелей для SDS-PAGE. Фракции, содержавшие чистые конструкции, собирали и концентрировали до приблизительно 1 мг/мл с использованием концентратов Millipore Centriprep и/или элементов для концентрирования Vivaspin для последующего анализа/очистки эксклюзионной хроматографией.
Анализ с помощью SEC и очистка эктодоменов F RSV
Эксклюзионную хроматографию (SEC) использовали для очистки и анализа нерасщепленных мономеров и расщепленных тримеров эктодомена белка F RSV. Этот способ также позволил очистку нерасщепленных эктодоменов белка F RSV от клеток-хозяев или примесей липидов и липопротеинов из среды. В случае образования чистых розеткообразных структур, нерасщепленную конструкцию Delp23 Furdel первоначально очищали в качестве мономера, а затем обрабатывали протеазой и повторно очищали с использованием SEC для очистки гомогенных розеткообразных структур (см. ниже). Было разработано два способа, ВЭЖХ-SEC и FPLC-SEC, которые также могут служить в качестве эффективной стадии очистки.
ВЭЖХ-SEC проводили с использованием колонки Biorad SEC (18 мм) с подвижной фазой 25 мМ Tris pH 7,5, 300 мМ NaCl. С использованием стандартов Biorad ВЭЖХ-SEC для калибровки системы авторы изобретения открыли, что розеткообразные структуры RSV (соответствующие расщепленным конформациям "после слияния") элюируются в свободном объеме колонки в анализе, в то время как мономеры RSV элюируются с кажущейся молекулярной массой приблизительно 75-85 кДа.
FPLC-SEC проводили на GE Healthcare FPLC с использованием колонки 16/60 Superdex 200 с подвижной фазой 25 мМ Tris pH 7,5, 300 мМ NaCl. С использованием высокомолекулырных стандартов GE Healthcare для калибровки системы авторы изобретения открыли, что розеткообразные структуры RSV элюируются в свободном объеме в анализе, в то время как монодисперсные тримеры RSV элюируются с кажущейся молекулярной массой приблизительно 140-160 кДа и мономеры RSV F элюируются с кажущейся молекулярной массой 75-85 кДа. Для очистки Delp21 Furx или Delp23 Furdel (мономеры) или Fusion Peptide Deletion (тример) RSV 0,5-2 мл приблизительно хелатирующего очищенного материала в концентрации 1 мг/мл наносили на уравновешенную колонку Superdex P200 16/60 со скоростью потока 0,5-2 мл/мин и соответствующие фракции собирали.
Расщепление трипсином конструкций Delp23 Furdel с образованием розеткообразных структур "после слияния"
Трипсин из плазмы быка (Sigma Aldrich, T8802: 10000-15000 BAEE единиц/мг трипсина) разбавляли до концентрации 1 мг/мл в 25 мМ Tris pH 7,5, 300 мМ NaCl. Раствор полипептида эктодомена белка F RSV в концентрации 1 мг/мл (разбавленный в 25 мМ Tris pH 7,5, 300 мМ NaCl) обрабатывали одним микролитром раствора трипсина (конечное соотношение масс 0,001:1 трипсин:F RSV или приблизительно 10-15 единиц BAEE трипсина на каждый миллиграмм F RSV) в течение 1 часа при 37°C. Мониторинг хода реакции проводили с помощью геля SDS-PAGE. Реакцию расщепления останавливали с использованием ингибитора трипсина (Gibco Soy Bean Trypsin Inhibitor с использованием равной массы ингибитора относительно массы трипсина). Было выявлено, что между стадией расщепления и последующей очисткой розеткообразных структур требовался период инкубации для обеспечения более высокой эффективности превращения мономера в розеткообразные структуры. Инкубацию проводили в течение от одного до 6 часов при 37°C для обеспечения более высокой эффективности образования розеткообразных структур. Расщепленный белок F RSV далее очищали от не превращенной мономерной структуры с использованием эксклюзионной хроматографии (как описано выше), где гомогенные розеткообразные структуры можно собирать во фракциях свободного объема колонки.
Очистка антигена F RSV из клеток CHO
Конструкции F RSV с делецией пептида слияния, которые не содержат HIS-метку, очищали способом катионной очистки. Материал CHO, содержавший экспрессированный тримерный антиген F RSV, концентрировали приблизительно до одной десятой исходного объема на системе для концентрирования с полыми волокнами GE Healthcare (MWCO 10000 кДа). Затем в концентрированном растворе проводили замену буфера четыре раза эквивалентным объемом 25 мМ ацетата натрия pH 6,0, 25 мМ NaCl. Полученный раствор, содержащий концентрированный тример F RSV в буфере ацетат/солевой раствор, наносили на предварительно загруженную колонку GE Healthcare HiTrap CM, которая была уравновешена буфером ацетат/солевой раствор. Белок элюировали с колонки с использованием ступенчатого градиента из 25 мМ ацетатного буфера, содержавшего 25, 150, 250, 500 или 1000 мМ NaCl (250 мМ и 500 мМ фракции NaCl, содержавшие основную часть элюированного материала). Этот материал можно было далее очищать с использованием очистки SEC, сходной с описанным выше протоколом.
Пример 6 - иммуногенность субъединиц F RSV у хлопковых хомячков
Иммуногенность и защитную способность субъединиц тримера RSV-F (RSV-F-fusion-peptide-deletion-trun) и розеткообразных структур (RSV-F-delp23-furdel-trunc,cleaved), все из которых изготовлены с квасцами или MF59, оценивали в модели на хлопковых хомячках. Антиген, использованный для ELISA в этом исследовании, представлял собой RSV-F-fusion-peptide-deletion-trunc (таблица 4). Нейтрализацию оценивали против инфекционного RSV, штамм Long (таблица 5). Все комбинации были иммуногенными, индуцирующими ответы с высоким титром специфических к RSV-F IgG и нейтрализующих RSV антител, которые усиливали с помощью второй вакцинации, и обеспечивали защиту от назального заражения RSV.
Способы
Вакцинация и заражения хлопковых хомячков
Самок хлопковых хомячков (Sigmodon hispidis)получали от Harlan Laboratories. Группы животных иммунизировали внутримышечно (внутримышечно, 100 мкл) указанными вакцинами на 0 и 21 сутки. Образцы сыворотки собирали через 3 недели после первой иммунизации (3wp1) и через 2 недели после второй иммунизации (2wp2). Иммунизированных или невакцинированных контрольных животных заражали интраназально (i.n.) с помощью 1×105 б.о.е. RSV Long через 4 недели после конечной иммунизации. Взятие крови и заражение RSV проводили под анестезии с помощью 3% изофлурана с использованием прецизионного испарителя.
Специфический для F RSV ELISA
Отдельные образцы сыворотки анализировали в отношении присутствия специфического к F RSV IgG способом твердофазного иммуноферментного анализа (ELISA). На планшеты для ELISA (96-луночные MaxiSorp, Nunc) наносили в течение ночи при 4°C 1 мкг/мл очищенного F RSV (fusion-peptide deletion-trunc) в PBS. После промывания (PBS с 0,1% Tween-20), планшеты блокировали буфером Superblock Blocking Buffer в PBS (Thermo Scientific) в течение, по меньшей мере, 1,5 часов при 37°C. Затем планшеты промывали, добавляли серийные разведения сыворотки в разбавителе для анализа (PBS с 0,1% Tween-20 и 5% сывороткой козы) из экспериментальных или контрольных хлопковых хомячков и планшеты инкубировали в течение 2 часов при 37°C. После промывания планшеты инкубировали с конъюгированным с пероксидазой хрена (HRP) антителом курицы против IgG хлопкового хомячка (Immunology Consultants Laboratory, Inc, разбавленное 1:5000 в разбавителе для анализа) в течение 1 часа при 37°C. Наконец, планшеты промывали и в каждую лунку добавляли 100 мкл раствора субстрата пероксидазы TMB (Kirkegaard & Perry Laboratories, Inc). Реакцию останавливали добавлением 100 мкл 1 M H3PO4, и проводили считывание поглощения при 450 нм с использованием устройства для считывания планшетов. Для каждого образца сыворотки строили график оптической плотности (OD) против логарифма обратной величины разведения сыворотки, полученный с помощью нелинейной регрессии (GraphPad Prism). Титры определяли как обратную величину разведения сыворотки при OD приблизительно 0,5 (нормализованную к стандартным объединенным сывороткам от инфицированных RSV хлопковых хомячков с определенным титром 1:2500, которую включали в каждый планшет).
Анализ микронейтрализации
Образцы сыворотки тестировали в отношении присутствия нейтрализующих антител с помощью анализа микронейтрализации. Двукратные серийные разведения инактивированной нагреванием сыворотки (HI) (в PBS с 5% HI-эмбриональной телячьей сывороткой(FBS)) добавляли к равному объему RSV, штамм Long, ранее титрованному до приблизительно 115 б.о.е./25 мкл. Смеси сыворотка/вирус инкубировали в течение 2 часов при 37°C и 5% CO2, для обеспечения нейтрализации, а затем 25 мкл этой смеси (содержащей приблизительно 115 б.о.е.) инокулировали в лунки 96-луночных планшетов с клетками HEp-2 в двух экземплярах. Через 2 часа при 37° и 5% CO2, на клетки наслаивали 0,75% метилцеллюлозу/EMEM 5% HI-FBS и инкубировали в течение 42 часов. Количество инфекционных вирусных частиц определяли путем детекции образования синцития с помощью иммунного окрашивания с последующим автоматическим подсчетом. Титр нейтрализации определяют как обратную величину разведения сыворотки, вызывающую, по меньшей мере, 60% снижение количества синцитиев на лунку, относительно контролей (без сыворотки).
Вирусная нагрузка
Вирусную нагрузку определяли анализом бляшек. В частности, легкие извлекали через 5 суток после RSV и одну правую долю помещали в 2,5 мл модифицированной способом Дульбекко среды Игла (DMEM, Invitrogen) с 25% сахарозой и разрушали с помощью гомогенизатора тканей. Бесклеточные супернатанты от этих образцов хранили при -80°C. Для анализа в отношении инфекционного вируса, разведения очищенного гомогената легких (в PBS с 5% HI-FBS) инокулировали на смыкающиеся монослои клеток HEp-2 в объеме 200 мкл/лунка 12-луночного планшета. Через 2 часа с периодически осторожным качанием (37°C, 5% CO2), инокулят удаляли и на клетки наслаивали 1,5 мл агарозы 1,25% SeaPlaque (Lonza) в минимальной поддерживающей среде Игла (EMEM, Lonza), дополненной 5% HI-FBS, глутамином и антибиотиками. После инкубации в течение 3-4 суток, на клетки вновь наслаивали 1 мл 1,25% агарозы в EMEM (Sigma), содержащей 0,1% нейтральный красный (Sigma). Через одни сутки подсчитывали бляшки с помощью освещенного бокса.
Альтернативным способом определения вирусной нагрузки является количественная ПЦР в реальном времени (qRT-PCR).Вирусную нагрузку можно определять способом qRT-PCR с использованием олигонуклеотидных праймеров для гена RSV-F, как описано (I. Borg et al, Eur Respir J 2003; 21:944-51) с некоторыми модификациями. В кратком изложении, РНК выделяют из 140 мкл очищенного гомогената легких или из известного количества бляшкообразующих единиц (б.о.е.) RSV (определенного анализом бляшек и разбавленного гомогенатом легкого от неинфицированных животных), с использованием набора RNeasy (Qiagen) с конечным объемом элюирования 100 мкл H2O. Синтез кДНК и ПЦР проводят в одной пробирке с использованием набора SuperScript III Platinum One-Step Quantitative RT-PCT (Invitrogen) с 5 мкл элюированной РНК, 10 мкл каждого праймера и 50 мкМ каждого зонда (праймеры и зонды от Integrated DNA Technologies). Прямой праймер: TTGGATCTGCAATCGCCA (SEQ ID NO: 72). Обратный праймер: CTTTTGATCTTGTTCACTTCTCCTTCT (SEQ ID NO: 73). Зонд: 5'-карбоксифлуоресцеин (FAM)-TGGCACTGCTGTATCTAAGGTCCTGCACT-тертаметилкарбоксиродамин(TAMRA)-3' (SEQ ID NO: 74). Амплификацию и детекцию проводят с помощью ABI Prism 7900HT или 7500 (Applied Biosystems). Пороговую величину циклов (Ct) определяют для каждого образца как количество циклов, при которых флуоресцентный сигнал сначала становится детектируемым выше установленного порога. Затем определяют эквиваленты б.о.е. для каждого образца, исходя из стандартной кривой Ct против логарифма определенного числа копий вирусной РНК.
Результаты
Хлопковых хомячков в качестве модели широко использовали для исследования патогенеза и иммунитета RSV, вследствие многих сходств между индуцируемым RSV заболеванием у хлопковых хомячков и человека. Двумя важными соответствиями являются эффективность нейтрализующих антител и усиленная гистопатология легких, ассоциированная с инактивированной формалином вакцинацией RSV. Хлопковые хомяки являются более чувствительными к инфекции RSV, чем другие небольшие животные, такие как мыши.
Для оценки иммуногенности субъединичных вакцин авторов изобретения против RSV-F, группы самок хлопковых хомяков вакцинировали внутримышечно различными дозами тримеров (RSV-F-fusion-peptide-deletion-trunc) или розеткообразных структур (RSV-F-delp23-furdel-trunc, расщепленный), каждый из которых был изготовлен либо с квасцами, либо с MF59. Во всех случаях, однократная иммунизация была достаточной для индукции как F-специфического, так и нейтрализующего антитела в сыворотке при измерении через три недели после первой вакцинации (3wp1). Всем хлопковым хомячкам вводили гомологичную вспомогательную иммунизацию через три недели после первой иммунизации, и это приводило к существенному увеличению F-специфического IgG и нейтрализующих антител при измерении через две недели (2wp2). Главным образом, иммуногенность розеткообразных структур была равной или превышающей иммуногенность у тримеров, состав MF59 увеличивал титры более, чем состав квасцов и более высокие дозы белка приводили к более высоким титрам, хотя были некоторые исключения.
Для определения защитной способности субъединичных вакцин, всех хлопковых хомячков инфицировали через четыре недели после второй вакцинации RSV назальным путем и вирусную нагрузку в легких измеряли через пять суток в анализе бляшек. Во всех случаях субъединичная вакцинация обеспечивала защиту от заражения, поскольку вирусная нагрузка в легких у вакцинированных хлопковых хомячков была более чем на три порядка ниже чем у неиммунизированных, но зараженных контрольных животных.
Пример 7 - РНК-вакцина против RSV
Синтез РНК
Плазмидная ДНК, кодирующая репликон альфавируса (ФИГ. 4, SEQ ID NO: 77) служила в качестве матрицы для синтеза РНК in vitro. Для этих экспериментов использовали полноразмерный гликопротеин слияния с поверхностью RSV (RSV-F) (ФИГ. 4). При доставке репликонов в эукариотические клетки положительная РНК транслировалась с образованием неструктурных белков, которые вместе реплицировали геномную РНК и транскрибировали большое количество субгеномной мРНК, кодирующей гетерологичный продукт гена. Вследствие отсутствия экспрессии структурных белков альфавируса, репликоны неспособны индуцировать образование инфекционных частиц. Промотор бактериофага (T7 или SP6) выше кДНК альфавируса упрощает синтез РНК репликона in vitro и рибозим вируса гепатита дельта (HDV) непосредственно ниже поли(A)-конца образует правильный 3'-конец благодаря его активности саморасщепления.
После линеаризации плазмидной ДНК ниже рибозима HDV с помощью пригодной эндонуклеазы рестрикции синтезировали избыточные транскрипты in vitro с использованием происходящей из бактериофага T7 или SP6 ДНК-зависимой РНК-полимеразы. Транскрипцию проводили в течение 2 часов при 37oC в присутствии 7,5 мМ (РНК-полимераза T7) или 5 мМ (РНК-полимераза SP6) каждого из нуклеозидтрифосфатов (ATP, CTP, GTP и UTP) согласно инструкциям, предоставленным изготовителем (Ambion, Austin, TX). После транскрипции матричную ДНК расщепляли ДНКазой TURBO (Ambion, Austin, TX). РНК репликона осаждали с помощью LiCl и разбавляли в не содержащей нуклеазу воде. Некэппированную РНК кэппировали посттрансляционно с помощью кэппирующего фермента вируса коровьей оспы (VCE) с использованием кэппирующей системы ScriptCap m7G Capping System (Epicentre Biotechnologies, Madison, WI) как описано в руководстве пользователя. Посттрансляционно кэпированную РНК осаждали с помощью LiCl и разбавляли не содержащей нуклеазу водой. Концентрацию образцов РНК определяли путем измерения оптической плотности при 260 нм. Целостность транскриптов in vitro подтверждали денатурирующим агарозным гель-электрофорезом.
Состав липидных наночастиц (липосом) RV01(01)
1,2-дилинолеилокси-N,N-диметил-3-аминопропан (DlinDMA) синтезировали с использованием ранее опубликованного способа [Heyes, J., Palmer, L., Bremner, K., MacLachlan, I. Cationic lipid saturation influences intracellular delivery of encapsulated nucleic acids. Journal of Controlled Release, 107: 276-287 (2005)]. 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC) приобретали от Genzyme. Холестерин получали от Sigma-Aldrich (St. Lois, MO). 1,2-димиристоил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-2000] (соль аммония) (PEG DMG 2000), 1,2-димиристоил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-2000] (соль аммония) приобретали от Avanti Polar Lipids (Alabaster, AL).
Получали свежие исходные растворы липидов в этаноле. 37 мг DlinDMA, 11,8 мг DSPC, 27,8 мг холестерина и 8,07 мг PEG DMG 2000 взвешивали и растворяли в 7,55 мл этанола. Свежеприготовленный исходный раствор липидов осторожно качали при 37°C в течение приблизительно 15 минут до получения гомогенной смеси. Затем 755 мкл исходного раствора добавляли к 1,245 мл этанола с получением рабочего исходного раствора липидов 2 мл. Это количество липидов использовали для образования LNP с 250 мкг РНК в соотношении 8:1 N:P (азот к фосфату). Для этого вычисления используют протонируемый азот на DlinDMA (катионный липид) и фосфатах на РНК. Предполагали, что каждый мкг самореплицирующейся молекулы РНК содержал 3 нмоль анионного фосфата, а также что каждый мкг DlinDMA содержал 1,6 нмоль катионного азота. 2 мл рабочего раствора РНК также получали из исходного раствора ~ 1 мкг/мкл в 100 мМ цитратном буфере (pH 6) (Teknova, Hollister, CA)). Три 20-мл стеклянных флакона (с мешалками) промывали раствором RNase Away (Molecular BioProducts, San Diego, CA) и промывали большим количеством воды MilliQ перед применением для удаления из флаконов примесей РНКазы. Один из флаконов использовали для рабочего раствора РНК, а другие использовали для сбора липидов и смесей РНК (как описано ниже). Рабочие растворы липидов и РНК нагревали при 37°C в течение 10 минут, а затем заполняли ими 3-см3 шприцы luer-lok (BD Medical, Franklin Lakes, NJ). 2 мл цитратного буфера (pH 6) помещали в другой 3-см3 шприц. Шприцы, содержащие РНК и липиды, соединяли со смесителем T (PEEK™ ID области перехода 500 мкм, Idex Health Science, Oak Harbor, WA) с использованием трубки FEP ([фторированный этилен-пропилен] 2 мм ID x 3 мм OD, Idex Health Science, Oak Harbor, WA). На выходе из T-смесителя также была трубка FEP (2 мм ID x 3 мм). Третий шприц, содержащий цитратный буфер, соединяли с отдельным фрагментом трубки (2 мм ID × 3 мм OD). Затем все шприцы приводили в действие со скоростью потока 7 мл/мин с использованием насоса для шприца (kdScientific, model № KDS-220, Holliston, MA). Выходящие трубки были расположены так, чтобы собирать смеси в 20-мл стеклянный флакон (при перемешивании). Эту мешалку отбирали и раствору в этаноле/воде позволяли уравновеситься до комнатной температуры в течение 1 часа. 4 мл смеси помещали в 5-см3 шприц (BD Medical), который был соединен с фрагментом трубки FEP (2 мм ID x 3 мм OD, Idex Health Science, Oak Harbor, WA) и в другой 5-см3 шприц, соединенный с трубкой FEP равной длины, помещали равное количество 100 мМ цитратного буфера (pH 6). Два шприца приводили в действие со скоростью потока 7 мл/мин с использованием насоса для шприцов и конечную смесь собирали в 20-мл стеклянный флакон (при перемешивании). Далее смесь, собранную на второй стадии смешивания (липосомы) пропускали через мембрану Mustang Q (анионо-обменная подложка, которая связывает и удаляет анионные молекулы, полученные от Pall Corporation, AnnArbor, MI, США). Перед пропусканием липосом, 4 мл 1 M NaOH, 4 мл 1 M NaCl и 10 мл 100 мМ цитратного буфера (pH 6) последовательно пропускали через мембрану Mustang. Липосомы нагревали в течение 10 минут при 37°C, а затем их пропускали через фильтр mustang. Далее, липосомы концентрировали до 2 мл и подвергали диализу против 10-15 объемов 1X PBS (от Teknova) с использованием системы проточной фильтрации вдоль потока (TFF) перед выделением конечного продукта. Систему TFF и фильтрационные мембраны с полыми волокнами приобретали от Spectrum Labs (Rancho Dominguez, CA) и использовали согласно руководству изготовителей. Использовали полисульфоновые фильтрационные мембраны с полыми волокнами (номер партии P/N: X1AB-100-20P) с пределом 100 кДа и площадью поверхности 8 см2. Для экспериментов in vitro и in vivo составы разбавляли до требуемой концентрации РНК посредством 1X PBS (от Teknova).
Способ получения катионной эмульсии 17 (CNE17)
Сквален, триолеат сорбитана (Span 85), и моноолеат сорбитана полиоксиэтилена (Tween 80) приобретали от Sigma (St. Louis, MO, USA). 1,2-диолеил-3-триметиламмонийпропан (DOTAP) приобретали от Lipoid (Ludwigshafen, Германия). Катионные наноэмульсии (CNE) приобретали аналогично заряженному MF59, как описано ранее, с небольшими модификациями (Ott, et al. Journal of Controlled Release, 79(1-3):1-5 (2002)). В кратком изложении, растворимые в масле компоненты (т.е. сквален, span 85, катионные липиды, липидные поверхностно-активные вещества) объединяли в стакане, липидные компоненты растворяли в хлороформе (CHCl3) или дихлорметане (DCM). Полученный раствор липидов добавляли прямо в масло вместе со span 85. Растворителю позволяли испариться при комнатной температуре в течение 2 часов в вытяжном шкафу, а затем водную фазу объединяли и образец гомогенизировали с использованием гомогенизатора IKA T25 при 24K об./мин. с получением гомогенного сырья. Первичные эмульсии пропускали от трех до пяти раз через гомогенизатор Microfluidezer M110S или M110PS с охлаждающей рубашкой с ледяной баней при давлении гомогенизации приблизительно 15k-20k фунт./кв. дюйм (Microfluidics, Newton, MA). 20-мл образцы партий извлекали из установки и хранили при 4°C. В таблице ниже описана композиция CNE17.
Образование комплексов с РНК
Количество азота в растворе вычисляли из концентрации катионного липида, например, DOTAP имеет 1 атом азота, который может быть протонирован, на молекулу. Концентрацию РНК использовали для вычисления количества фосфата в растворе с использованием оценки 3 нмоль фосфата на микрограмм РНК. Путем варьирования количества РНК:липида можно модифицировать соотношение N/P. Подвергали образованию комплекса РНК с CNE17 при соотношениях азот/фосфат (N/P) 10:1. С использованием этих величин РНК разбавляли до соответствующей концентрации в не содержащей РНКазу воде и добавляли прямо к равному объему эмульсии при мягком встряхивании. Раствору позволяли осесть при комнатной температуре в течение приблизительно 2 часов. После образования комплекса полученный раствор разбавляли до требуемой концентрации перед введением.
Электропорация
Электропорация является высоко эффективным способом для доставки пДНК-вакцин и этот способ использовали для доставки самореплицирующихся РНК. Мышей подвергали анестезии под изофлураном, обе задние лапы тщательно брили для обнажения области на конечности, подлежащей введению. Дозу вакцины объемом 30 мкл инъецировали в икроножную мышцу задней конечности с использованием 1/2-см3 инсулинового шприца. Мышцу подвергали электропорации с использованием системы Elgen® DNA Delivery System (Inovio, San Diego). Параметры устройства являются следующими: 60 В, 2 импульса, каждый через 60 мс. Другую дозу аналогично доставляли во вторую конечность с последующей электропорацией.
Частицы вирусного репликона (VRP)
Для сравнения РНК-вакцин с традиционными РНК-векторными подходами для достижения экспрессии in vivo репортерных генов или антигенов авторы настоящего изобретения использовали частицы вирусного репликона (VRP), продуцированные из клеток BHK способами, описанными Perri et al. В этой системе репликоны антигена (или репортерного гена), состоящие из химерных репликонов альфавируса (VCR), происходящих из генома вируса венесуэльского энцефалита лошадей (VEEV), сконструированных так, чтобы они содержали 3'-концевые последовательности (3'-UTR) вируса Sindbis и сигнал упаковывания вируса Sindbis (PS) (см. фиг. 2 Perri et al). Эти репликоны упаковывали в VRP путем коэлектропорации их в клетки почек детенышей хомячка (BHK) вместе с дефектными вспомогательными РНК, кодирующими гены капсида вируса Sindbis и гликопротеинов (см. фиг. 2 Perri et al). Затем VRP собирали и титровали стандартными способами и инокулировали в животных в культуральной жидкости или других изотонических буферах. Perri S, Greer CE, Thudium K, Doe B, Legg H, Liu H, Romero RE, Tang Z, Bin Q, Dubensky TW, Jr. et al (2003) An alphavirus replicon particle chimera derived from venezuelan equine encephalitis and sindbis viruses is a potent gene-based vaccine delivery vector. J Virol 77: 10394-10403.
Субъединичная вакцина на основе тримера F RSV
Тример F RSV представляет собой рекомбинантный белок, содержащий эктодомен F RSV с делецией области пептида слияния, препятствующей связыванию с другими тримерами. Полученная конструкцая формирует гомогенный тример, как наблюдают с помощью эксклюзионной хроматографии, и имеет предполагаемый фенотип, согласующийся с конформацией F "после слияния", как наблюдают с помощью электронной микроскопии. Белок экспрессировали в клетках насекомых и очищали с помощью HIS-метки, слитой с C-концом конструкции, с последующей эксклюзионной хроматографией с использованием общепринятых способов. Полученный образец белка проявляет более чем 95% чистоту. Для оценки вакцины на основе субъединиц F in vivo, 100 мкг/мл тримерного белка адсорбировали на 2 мг/мл квасцов с использованием 10 мМ гистидинового буфера, pH 6,3, и изотоничность доводили с помощью хлорида натрия до 150 мМ. Субъединичный F-белок адсорбировали на квасцы в течение ночи при осторожном перемешивании при 2-8°С. Заданные pH и осмомолярность конечной вакцины составляли 6,5-7,5 и 240-360 мОсм/кг. Вакцину охарактеризовали в отношении адсорбации белка с помощью SDS-PAGE (Invitrogen Corporation, США) и в отношении содержания эндотоксинов с помощью анализа LAL (Charles River Laboratories, USA). Вакцину перемешивали путем осторожного переворачивания перед иммунизацией.
Исследования иммуногенности у мышей
Группы из 10 самок мышей BALB/c в возрасте 8-10 недель и массой приблизительно 20 граммов иммунизировали на 0 сутки и на 21 сутки, и на 14, 35 и 49 сутки проводили взятие крови. Всем животным инъецировали в четырехглавую мышцу двух задних конечностей, по эквивалентному объему в каждую (50 мкл на область) для всего 100 мкл вакцины, доставляющей дозу антигена 10 мкг. Когда требовалось измерение T-клеточных ответов, селезенки собирали на 35 или 49 сутки.
Вакцинация и заражение у хлопковых хомячков
Самок хлопковых хомячков (Sigmodon hispidis)приобретали от Harlan Laboratories. Все эксперименты были одобрены и их проводили согласно Novartis Animal Care and Use Committee. Группы животных иммунизировали внутримышечно (i.m., 100 мкл) указанными вакцинами на 0 и 21 сутки. Через 2 недели после каждой иммунизации проводили взятие образцов сыворотки. Иммунизированных и невакцинированных контрольных животных заражали интраназально (i.n.) 1×105 б.о.е. RSV через 4 недели после конечной иммунизации. Взятие крови и заражение RSV проводили под анестезией 3% изофлураном с использованием прецизионного испарителя.
Анализы функции T-клеток мыши
Иммунофлуоресцентный анализ внутриклеточных цитокинов
От двух до пяти селезенок от идентично вакцинированных мышей BALB/c объединяли и получали суспензии отдельных клеток для культивирования. Получали две стимулированных антигеном культуры и две нестимулированных культуры для каждого пула спленоцитов. Стимулированные антигеном культуры содержали 1×106 спленоцитов, пептид F RSV 85-93 (1×10-6 M), пептид F RSV 249-258 (1×10-6 M), пептид F RSV 51-66 (1×10-6 M), mAb против CD28 (1 мкг/мл), и брефелдин A (1:1000). Нестимулированные культуры не содержали пептиды F RSV, а в остальном были идентичными стимулированным культурам. После культивирования в течение 6 часов при 37°C культуры обрабатывали в отношении иммунофлуоресценции. Клетки промывали, а затем окрашивали флуоресценно меченными моноклональными антителами против CD4 и против CD8 (mAb). Клетки вновь промывали, а затем фиксировали с помощью Cytofix/cytoperm в течение 20 минут. Затем фиксированные клетки промывали буфером для промывания Perm, а затем окрашивали флуоресцентно меченными mAb, специфичными к IFN-g, TNF-a, IL-2 и IL-5. Окрашенные клетки промывали, а затем анализировали на проточном цитометре LSR II. Для анализа полученных данных использовали программное обеспечение FlowJo. Подгруппы CD4+8- и CD8+4- T-клеток анализировали по отдельности. Для каждой подгруппы в данном образце определяли % положительных по цитокинам клеток. % специфичных к антигену F RSV T-клеток вычисляли в качестве разности между % положительных по цитокинам клеток в стимулированных антигеном культурах и % положительных по цитокинам клеток в нестимулированных культурах. 95% доверительный интервал для % специфичных к антигену клеток определяли с использованием стандартных способов (Statistical Methods, 7th Edition, G.W. Snedecor and W.G. Cochran).
Анализ секретируемых цитокинов
Культуры для анализа секретируемых цитокинов были сходными с культурами для иммунофлуоресцентного анализа внутриклеточных цитокинов, за исключением отсутствия в них брефелдина. Культуральные супернатанты собирали после культивирования в течение ночи при 37°C и анализировали в отношении множества цитокинов с использованием наборов для Th1/Th2-цитокинов мыши от Meso Scale Discovery. Количество каждого цитокина на культуру определяли из стандартных кривых, полученных с использованием очищенных рекомбинантных цитокинов, предоставленных изготовителем.
F RSV-специфический ELISA
Индивидуальные образцы сыворотки анализировали в отношении присутствия специфичного к F RSV IgG твердофазным иммуноферментным анализом (ELISA). На планшеты для ELISA (96-луночные MaxiSorp, Nunc) наносили в течение ночи при 4°C 1 мкг/мл очищенного F RSV (delp23-furdel-trunc, нерасщепленный) в PBS. После промывания (PBS с 0,1% Tween-20), планшеты блокировали буфером Superblock Blocking Buffer в PBS (Thermo Scientific) в течение, по меньшей мере, 1,5 часов при 37°C. Затем планшеты промывали, добавляли серийные разведения сыворотки в разбавителе для анализа (PBS с 0,1% Tween-20 и 5% сывороткой козы) из экспериментальных или контрольных хлопковых хомячков и планшеты инкубировали в течение 2 часов при 37°C. После промывания планшеты инкубировали с конъюгированным с пероксидазой хрена (HRP) антителом курицы против IgG хлопкового хомячка (Immunology Consultants Laboratory, Inc, разбавленное 1:5000 в разбавителе для анализа) в течение 1 часа при 37°C. Наконец, планшеты промывали и в каждую лунку добавляли 100 мкл раствора субстрата пероксидазы TMB (Kirkegaard & Perry Laboratories, Inc). Реакцию останавливали добавлением 100 мкл 1 M H3PO4, и проводили считывание поглощения при 450 нм с использованием устройства для считывания планшетов. Для каждого образца сыворотки строили график оптической плотности (OD) против логарифма обратной величины разведения сыворотки, полученный с помощью нелинейной регрессии (GraphPad Prism). Титры определяли как обратную величину разведения сыворотки при OD приблизительно 0,5 (нормализованную к стандартным объединенным сывороткам от инфицированных RSV хлопковых хомячков с определенным титром 1:2500, которую включали в каждый планшет).
Анализ микронейтрализации
Образцы сыворотки тестировали в отношении присутствия нейтрализующих антител с помощью теста нейтрализации в виде уменьшения бляшек (PRNT). Двукратные серийные разведения инактивированной нагреванием сыворотки (HI) (в PBS с 5% HI-эмбриональной телячьей сывороткой(FBS)) добавляли к равному объему RSV Long, ранее титрованному до приблизительно 115 б.о.е./25 мкл. Смеси сыворотка/вирус инкубировали в течение 2 часов при 37°C и 5% CO2, для обеспечения нейтрализации, а затем 25 мкл этой смеси (содержащей приблизительно 115 б.о.е.) инокулировали в лунки 96-луночных планшетов с клетками HEp-2 в двух экземплярах. Через 2 часа при 37° и 5% CO2, на клетки наслаивали 0,75% метилцеллюлозу/EMEM 5% HI-FBS и инкубировали в течение 42 часов. Количество инфекционных вирусных частиц определяли путем детекции образования синцития с помощью иммунного окрашивания с последующим автоматическим подсчетом. Титр нейтрализации определяют как обратную величину разведения сыворотки, вызывающего, по меньшей мере, 60% снижение количества синцитиев на лунку, относительно контролей (без сыворотки).
Вирусная нагрузка
Вирусную нагрузку определяли анализом бляшек. В частности, легкие извлекали через 5 суток после RSV и одну правую долю помещали в 2,5 мл модифицированной способом Дульбекко среды Игла (DMEM, Invitrogen) с 25% сахарозой и разрушали с помощью гомогенизатора тканей. Бесклеточные супернатанты от этих образцов хранили при -80°C. Для анализа в отношении инфекционного вируса, разведения очищенного гомогената легких (в PBS с 5% HI-FBS) инокулировали на смыкающиеся монослои клеток HEp-2 в объеме 200 мкл/лунка 12-луночного планшета. Через 2 часа с периодически осторожным качанием (37°C, 5% CO2), инокулят удаляли и на клетки наслаивали 1,5 мл агарозы 1,25% SeaPlaque (Lonza) в минимальной поддерживающей среде Игла (EMEM, Lonza), дополненной 5% HI-FBS, глутамином и антибиотиками. После инкубации в течение 3-4 суток, на клетки вновь наслаивали 1 мл 1,25% агарозы в EMEM (Sigma), содержащей 0,1% нейтральный красный (Sigma). Через одни сутки подсчитывали бляшки с помощью освещенного бокса.
Патология легких у хлопковых хомячков
Через пять суток после заражения RSV легкие собирали и извлекали по 4 доли от каждого животного и фиксировали 10% нейтральным забуференным формалином (NBF) путем осторожного интратрахеального вливания с последующей фиксацией погружением. Ткани обрабатывали стандартным способом для получения окрашенных гематоксилином и эозином срезов для микроскопического исследования. Данные оценивали с использованием модификации ранее опубликованных критериев [Prince GA, et al., 2001] для следующих параметров: перибронхиолит, альвеолит, бронхит, периваскулярные клеточные инфильтраты и интерстициальный пневмонит. Очаги повреждения оценивали по 4-уровневой полуколичественной шкале. Минимальное (+) изменение включало один или более небольших очагов; мягкое (++) изменение включало очаги от небольшого до среднего размера; умеренное (+++) изменение включало частые очаги и/или очаги умеренного размера; и выраженное (++++) изменение демонстрировало от экстенсивных до сливных очагов, поражающих большую часть/всю ткань.
Пример 7
A - исследование с заражением RSV хлопковых хомячков (CRIS14)
Для этого эксперимента использовали репликон A317, который экспрессирует поверхностный гликопротеин слияния RSV (RSV-F). Хлопковым хомячкам (Sigmodon hispidus), 8 животных на группу, проводили двухсторонние внутримышечные вакцинации (50 мкл на конечность) на 0 и 21 сутки с помощью простой самореплицирующейся РНК (A317, 1 мкг или 10 мкг), самореплицирующейся РНК, изготовленной в LNP [RV01(01), A317, 0,1 мкг или 1 мкг), VRP (5×106 МЕ), экспрессирующие RSV-F, субъединичную вакцину тример F/квасцы (10 мкг), или инактивированную формалином вакцину против RSV (5200 FI-б.о.е.). Сыворотку собирали для анализа антител на 14 (2wp1) и 35 (2wp2) сутки. Всех животных заражали 1×105 б.о.е. RSV интраназально на 49 сутки и легкие извлекали на 54 сутки (5dpc) для определения вирусной нагрузки и патологии легких.
Результаты


Заключение
Одной из задач этого исследования было определение иммуногенности и защитной способности РНК репликона в модели RSV на хлопковых хомячках. Другой задачей была оценка эффекта липосом и составов CNE17 на иммуногенность и эффективность вакцины. Не включенная в состав РНК репликона индуцировала сывороточные специфичные к F IgG и нейтрализующие RSV антитела после одной вакцинации, и этому ответу способствовала вторая вакцинация. Липосомы и составы CNE17 были сходным образом эффективными в этой модели, способствуя достижению F-специфических титров IgG относительно 1 мкг РНК репликона приблизительно в 8-раз и титров нейтрализации в 4-10-раз (CNE17 и липосомы, соответственно) после второй вакцинации. Все вакцины на основе репликона РНК обеспечили защиту от назального заражения RSV, снижая вирусную нагрузку в легких более чем на 3 порядка величины при измерении через 5 суток. Уровень и защитная способность иммунного ответа, индуцированного 1 мкг РНК репликона, изготовленного с липосомами, превышала ответ, индуцированный 5×106 VRP, в пределах двух раз. Тримерная субъединица с адъювантами в виде квасцов индуцировала наиболее высокие общие титры IgG против F в ELISA, индуцировала наиболее высокие титры нейтрализации и индуцировала наиболее высокую степень защиты от титров RSV в легком при заражении для любого вакцинного препарата, протестированные в этом исследовании.
Пример 7B - Исследование иммуногенности RSV-F (10-1001)
Для этого эксперимента использовали тест с репликоном A317, который экспрессирует поверхностный гликопротеин слияния RSV (RSV-F). Мышам BALB/c, 10 животных на группу, проводили билатеральные внутримышечные вакцинации (50 мкг на конечность) на 0 и 21 сутки посредством VRP, экспрессирующих RSV-F (1×106 МЕ), простой самореплицирующейся РНК (A317, 1 мкг), самореплицирующейся РНК, доставляемой с использованием электропорации (A317, 10 мкг), самореплицирующейся РНК, изготовленной в липосомах [RV01(01), A317, 0,1 мкг или 1 мкг) и самореплицирующейся РНК, изготовленной с CNE17 (A317, 0,1 мкг или 1 мкг. Сыворотку собирали для анализа антител на 14 (2wp1), 35 (2wp2) и 49 (4wp2) сутки. Селезенки извлекали из 5 мышей на группу на 49 сутки (4wp2) для анализа T-клеток.
Результаты





Заключение
Липосомальный состав значительно усиливал иммуногенность, как определяли по увеличенным титрам F-специфических IgG (8-30-кратное увеличение), титрам нейтрализации и ответам CD4 и CD8 T-клеток, относительно контроля в виде простой РНК. Неожиданно, титры F-специфических IgG и титры нейтрализации для RV01(01) в дозах как 0,1, и 1,0 мкг, были эквивалентны VRP (1×106 МЕ). T-клеточные ответы для состава LNP были эквивалентны более высокой дозе VRP (1×106 МЕ). Состав самореплицирующейся РНК с CNE17 значимо усиливал иммуногенность, как определяли по увеличению титров F-специфических IgG (2-5-кратное увеличение), титров нейтрализации и CD4 и CD8 T-клеточных ответов, относительно контроля в виде простой РНК. Электропорация РНК увеличивала иммуногенность относительно контроля в виде простой РНК, но была значимо более низкой, чем доставка липосом.
Пример 7C - Исследование иммуногенности RSV-F (10-1018)
Для этого эксперимента репликон A317, который экспрессирует поверхностный гликопротеин слияния RSV (RSV-F). Мышам BALB/c, 8 животных на группу, проводили билатеральную внутримышечную вакцинацию (50 мкл на конечность) на 0 и 21 сутки посредством VRP, экспрессирующих RSV-F (1×106 МЕ), простой самореплицирующейся РНК (A306, 1, 0,1, 0,01 мкг) и самореплицирующейся РНК, изготовленной в липосомах (RV01(01) с использованием способа 1 (A317, 10,0, 1,0, 0,1, 0,01 мкг). Взятие сыворотки для анализа антител проводили на 14 (2wp1) и (2wp2) сутки. Селезенки извлекали из 5 мышей на группу на 49 сутки (4wp2) для анализа T-клеток.
Результаты
Состав липосом RV01(01) имел средний диаметр частиц Z 158 нм с индексом полидисперсности 0,14, эффективность инкапсулирования составляла 96%. Сывороточные титры F-специфических IgG на 14 и 35 сутки представлены в таблицах 18 и 19 и T-клеточные ответы на 49 сутки представлены в таблицах 20 и 21.


Заключение
Липосомальный состав значительно усиливал иммуногенность, при определении по увеличенным F-специфическим титрам IgG и частотам T-клеток, относительно контролей в виде простой РНК. Титры F-специфических IgG и частоты CD8 T-клеток для RV01(01) в дозе 10 мкг РНК были увеличены относительно группы VRP (1×106 МЕ).
ДОПОЛНИТЕЛЬНЫЕ ССЫЛКИ:
Представленные ниже ссылки включены в настоящий документ в качестве ссылок для всего, что в них описано.
1. Fields Virology. 4th edition, 2001.
2. Snell et al. (1997) Virus Genes 14:63-72.
3. Bembridge et al. (1999) J Virol 73: 10086-10094.
4. Li et al. (1998) J Exp Med 188:681-688.
5. Патент США № 6060308.
6. Yin et al. (2006) Nature 439:38-45.
7. Kim et al. (2007) J Med Virol 79: 820-828.
8. Yin et al. (2005) Proc Natl Acad Sci USA. 102(26):9288-93.
9. Chen et al. (2004) J Virol 78:4508-16.
10. Yang et at. (2002) J Virol 76:4634-42.
11. Harbury et al. (1993) Science 262:1401-1407.
12. Stevens et al. (2004) Science 303:1866-70.
13. Burkhard et al. (2001) Trends Cell Biol 11:82-88.
14. Section 5.5.2 of Proteins by Creighton (ISBN 0-7167-2317-4).
15. Yu (2002) Adv Drug Deliv Rev 54:1113-1129.
16. Muller et al. (2000) Methods Enzymol 328:261-282.
17. Beck & Brodsky (1998) J Struct Biol 122:17-29.
18. Lupas (1996) TrendsBiochem Sci 21:375-382.
19. Adamson et al. (1993) Curr Opin Biotechnol 4:428-347.
20. Kammerer (1997) Matrix Biol 15:555-568.
21. Chao et al. (1998) J Chromatog B Biomed Sci Appl 715:307-329.
22. Arndt et al. (2002) Structure 10:1235-1248.
23. Liu & Lu (2002) J Biol Chem 277:48708-48713.
24. WO2006/011060.
25. Раздел 5.5.3. Protein by Creighton (ISBN 0-7167-2317-4).
26. Zhang & Chen (1999) J Biol Chem 274:22409-22413.
27. Slovic et al. (2003) Protein Sci 12:337-348.
28. Gardner & Dutch (2007) J Virol 8 1:8303-14.
29. Gennaro (2000) Remington: The Science and Practice of Pharmacy. 20th edition, ISBN: 0683306472.
30. Nony et al. (2001) Vaccine 27:3645-51.
31. Greenbaum et al. (2004) Vaccine 22:2566-77.
32. Zurbriggen et al. (2003) Expert Rev Vaccines 2:295-304.
33. Piascik (2003) J Am Pharm Assoc(Wash DC). 43:728-30.
34. Mann et al. (2004) Vaccine 22:2425-9.
35. Halperin et al. (1979) Am J Public Health 69:1247-50.
36. Herbert et al. (1979) J Infect Dis 140:234-8.
37. Chen et al. (2003) Vaccine 21:2830-6.
38. Патент США № 6355271.
39. WO00/23105.
40. Патент США № 5057540.
41. WO96/33739.
42. EP-A-0109942.
43. WO96/11711.
44. WO00/07621.
45. Barr et al. (1998) Advanced Drug Delivery Reviews 32:247-271.
46. Sjolanderet et al. (1998) Advanced Drug Delivery Reviews 32:321-338.
47. Pizza et al. (2000) Int J Med Microbiol 290:455-461.
48. WO95/17211.
49. WO98/42375.
50. Singh et al (2001) J Cont Release 70:267-276.
51. WO99/27960.
52. Патент США № 6090406.
53. Патент США № 5916588.
54. EP-A-0626169.
55. WO99/52549.
56. WO01/21207.
57. WO01/21152.
58. Dyakonova et al. (2004) Int Immunopharmacol 4(13):1615-23.
59. FR-2859633.
60. Signorelli & Hadden (2003) Int Immunopharmacol 3(8):1177-86.
61. WO2004/064715.
62. De Libero et al, (2005) Nature Reviews Immunology 5:485-496
63. Патент США № 5936076.
64. Old et al., J Clin Investig, 113:1631-1640
65. US2005/0192248.
66. Yang et al. (2004) Angew Chem Int Ed 43:3818-3822.
67. WO2005/102049.
68. Goffet et al (2004) Am Chem Soc 126:13602-13603.
69. WO03/105769.
70. Cooper (1995) Pharm Biotechnol 6:559-80.
71. WO90/14837.
72. Podda & Del Giudice (2003) Expert Rev Vaccines 2:197-203.
73. Podda (2001) Vaccine 19: 2673-2680.
74. Vaccine Design: The Subunit and Adjuvant Approach (eds. Powell & Newman) Plenum Press 1995 (ISBN 0-306-44867-X).
75. Vaccine Adjuvants: Preparation Methods and Research Protocols (Volume 42 of Methods in Molecular Medicine series). ISBN: 1-59259-083-7. Ed. O'Hagan.
76. Allison & Byars (1992) Res Immunol 143:519-25.
77. Hariharan et al. (1995) Cancer Res 55:3486-9.
78. WO95/1 1700.
79. Патент США № 6080725.
80. WO2005/0971 81.
81. Tassignon et al. (2005) J Immunol Meth 305:188-98.
82. Myers et al. (1990) pages 145-156 of Cellular и molecular aspects of endotoxine reactions.
83. Ulrich (2000) Chapter 16 (pages 273-282) of reference 75.
84. Johnson et al. (1999) J Med Chem 42:4640-9.
85. Baldrick et al. (2002) Regulatory Toxicol Pharmacol 35:398-413.
86. Патент США № 4680338.
87. Патент США № 4988815.
88. WO92/15582.
89. Stanley (2002) Clin Exp Dermatol 27:57 1-577.
90. Wu et al. (2004) Antiviral Res. 64(2):79-83.
91. Vasilakos et al. (2000) Cell Immunol. 204(1):64-74.
92. Патенты США № 4689338, 4929624, 5238944, 5266575, 5268376, 5346905, 5352784, 5389640, 5395937, 5482936, 5494916, 5525612, 6083505, 6440992, 6627640, 6664264, 6664265, 6667312, 6677347, 6677348, 6677349, 6683088, 6703402, 6743920, 6800624, 6809203, 6888000, и 6924293.
93. Jones (2003) Curr Opin Investig Drugs 4:214-218.
94. WO2004/060308.
95. WO2004/064759.
96. Патент США № 6924271.
97. US2005/0070556.
98. Патент США № 5658731.
99. Патент США № 5011828.
100. WO2004/87 153.
101. Патент США № 6605617.
102. WO02/18383.
102. WO2004/018455.
104. WO03/082272.
105. WO2006/002422.
106. Johnson et al. (1999) Bioorg Med Chem Lett 9:2273-2278.
107. Evans et al. (2003) Expert Rev Vaccines 2:219-229.
108. Andrianov et al. (1998) Biomaterials 19:109-115.
109. Payne et al. (1998) Adv Drug Delivery Review 31:185-196.
110. Thompson et al. (2003) Methods in Molecular Medicine 94:255-266.
111. Kandimalla et al. (2003) Nucleic Acids Research 31:2393-2400.
112. WO02/26757.
113. WO99/62923.
114. Krieg (2003) Nature Medicine 9:831-835.
115. McCluskie et al. (2002) FEMS Immunology and Medical Microbiology 32:179-185.
116. WO98/40100.
117. Патент США № 6207646.
118. Патент США № 6239116.
119. Патент США № 6429199.
120. Kandimalla et al. (2003) Biochemical Society Transactions 31 (part 3): 654-658.
121. Blackwell et al. (2003) J Immunol 170:4061-4068.
122. Krieg (2002) Trends Immunol 23:64-65.
123. WO01/95935.
124. Kandimalla et al. (2003) BBRC 306:948-953.
125. Bhagat et al. (2003) BBRC 300:853-861.
126. WO03/035836.
127. WO01/22972.
128. Thompson et al. (2005) J Leukoc Biol 78: "The low-toxicity versions of LPS, MPL® adjuvant and RC529, are efficient adjuvants for CD4+ T cells".
129. Патентная заявка Великобритании GB-A-22202 11.
130. WO94/21292.
131. WO94/00153.
132. WO95/17210.
133. WO96/26741.
134. WO93/19780.
135. WO03/011223.
136. Meraldi et al. (2003) Vaccine 21:2485-249 1.
137. Pajak et al. (2003) Vaccine 21:836-842.
138. Патент США № 6586409.
139. Wong et al. (2003) J Clin Pharmacol 43(7):735-42.
140. US2005/0215517.
Полное описание всех документов, цитированных в настоящем документе, включено в настоящий документ в качестве ссылки.
Реферат
Изобретение относится к области биотехнологии, вирусологии и иммунологии. Описаны иммуногенные композиции, содержащие белок F RSV. Композиции содержат полипептиды эктодомена белка F RSV в преобладающей или одной желаемой форме и конформации. Предложенные изобретения могут быть использованы в медицине. 2 н. и 14 з.п. ф-лы, 13 ил., 22 табл., 10 пр.
Формула
Документы, цитированные в отчёте о поиске
Субъединичный вакцинный препарат респираторно-синцитиального вируса

Комментарии