Выделение и очистка антител против il-13 с применением аффинной хроматографии с белком а - RU2603055C2
Код документа: RU2603055C2
Чертежи










Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет по предварительной заявке США № 61/253411, зарегистрированной 20 октября 2009 года, которая включена в настоящий документ путем ссылки в полном объеме.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
IL-13 человека представляет собой гликопротеин массой 17 кДа, клонированный из активированных Τ-клеток, и он продуцируется активированными Τ-клетками Th2-линии, ThO и ThI CD4+ Τ-клетками, CD8+ Τ-клетками и некоторыми не-T-клеточными популяциями, такими как тучные клетки. (Zurawski and de Vries, 1994 Immunol Today, 15, 19-26). IL-13 способствует переключению изотипа иммуноглобулина на IgE в Β-клетках человека (Punnonen, Aversa et al. 1993 Proc Natl Acad Sci U S A 90 3730-4) и супрессирует продукцию воспалительных цитокинов у человека и мыши (de Waal Malefyt et al., 1993, J Immunol, 151, 6370-81; Doherty et al., 1993, J Immunol, 151, 7151-60). IL-13 связывается со своими рецепторами IL-13Rα1 и IL-13Rα2 на поверхности клетки. IL-13Rα1 взаимодействует с IL-13 с низкой аффинностью (KD ~10 нМ) с последующим вовлечением IL-4R для образования высокоаффинного (KD ~0,4 нМ) сигнального гетеродимерного рецепторного комплекса (Aman et al., 1996, J Biol Chem, 271, 29265-70; Hilton et al., 1996, Proc Natl Acad Sci USA, 93, 497-501). Комплекс IL-4R/IL-13Rα1 экспрессируется на многих типах клеток, таких как Β-клетки, моноциты/макрофаги, дендритные клетки, эозинофилы, базофилы, фибробласты, эндотелиальные клетки, эпителиальные клетки дыхательных путей и гладкомышечные клетки дыхательных путей (Graber et al., 1998, Eur J Immunol, 28, 4286-98; Murata et al., 1998, Int Immunol, 10, 1103-10; Akaiwa et al., 2001, Cytokine, 13, 75-84). Лигирование рецепторного комплекса IL-13Rα1/IL-4R приводит к активации множества путей передачи сигнала, включая пути трансдуктора сигнала и активатора транскрипции (ST AT6) и субстрата рецептора инсулина 2 (IRS-2) (Wang et al, 1995, Blood, 864218-27; Takeda et al., 1996, J Immunol, 157, 3220-2). Отдельно цепь IL-13Rα2 обладает высокой аффинностью (KD ~0,25-0,4 нМ) к IL-13 и функционирует в качестве рецептора-ловушки, отрицательно регулирующего связывание IL-13 (Donaldson et al., 1998, J Immunol, 161, 2317-24), и сигнального рецептора, индуцирующего синтез TGF-β и фиброз через путь AP-I в макрофагах и, возможно, в других типах клеток (Fichtner-Feigl, Strober et al. 2006 Nat Med 12 99-106).
Некоторые исследования, проведенные на доклинических моделях астмы у животных, свидетельствуют о том, что IL-13 играет важную роль при астме. Эти данные включают устойчивость к астме у нокаутных по IL-13 мышей, а также ингибирование фенотипа астмы антагонистами IL-13 (растворимые рецепторы IL-13, mAb против IL-13 и т.д.) на различных моделях мышей (Wills-Karp and Chiaramonte, 2003, Curr Opin Pulm Med, 9 21-7; Wills-Karp, 2004, Immunol Rev, 202 175-90). Многочисленные исследования показали, что фармакологическое введение рекомбинантного IL-13 в легкие мышей, а также морских свинок, индуцирует гиперсекрецию слизи в дыхательных путях, эозинофилию и гиперчувствительность дыхательных путей ("AHR"); Grunig et al., 1998, Science, 282, 2261-3; Wills-Karp et al., 1998, Science, 282, 2258-61; Kibe et al., 2003, Am J Respir Crit Care Med, 167, 50-6; Vargaftig and Singer, 2003, Am J Physiol Lung Cell Mol Physiol, 284, L260-9; Vargaftig and Singer, 2003, Am J Respir Cell Mol Biol, 28, 410-9). Данные эффекты IL-13 воспроизводят в системах трансгенных мышей с конститутивной или индуцируемой экспрессией IL-13 13 (Zhu et al., 1999, J Clin Invest, 103, 779-88; Zhu et al., 2001, Am J Respir Crit Care Med, 164, S67- 70; Lanone et al., 2002, J Clin Invest, 110463-74). Хроническая трансгенная гиперэкспрессия IL-13 также индуцирует субэпителиальный фиброз и эмфизему. У мышей, дефектных по сигнальной молекуле IL-13 (и IL-4) STAT6, не может развиваться индуцируемая аллергеном AHR и сверхпродукция слизи (Kuperman et al, 2002, Nat Med, 8, 885-9). Исследования с использованием слитого белка растворимого рецептора IL-13 (sIL-13Rα2Fc) показали ключевую роль данного цитокина в экспериментальном заболевании дыхательных путей, индуцированном аллергеном овальбумином (OVA) (Grunig et al., 1998, Science, 282, 2261-3; Wills-Karp et al., 1998, Science, 282, 2258-61; Taube et al., 2002, J Immunol, 169, 6482-9). Эффективность лечения против IL-13 также демонстрировали на хронической модели астмы у мышей. Кроме проявления свойств гиперсекреции слизи и AHR, на данной модели хронической астмы демонстрируют некоторые черты заболевания человека, отсутствующие во многих острых моделях. Они включают эозинофилию ткани легкого, находящейся во внутриэпителиальных пространствах, а также фиброз гладких мышц, измеряемый по повышению накопления коллагена. Хроническую модель астмы индуцируют повторными ингаляторными провокациями OVA OVA-сенсибилизированных мышей 1 раз в неделю, всего в течение 4 недель. Антитело против IL-13, вводимое в течение последних 2 недель провокаций OVA (с 36 дня с учетом эффективности, оцениваемой на 53 день исследования), значимо ингибировало AHR, легочное воспаление, гиперплазию бокаловидных клеток, гиперсекрецию слизи и фиброз дыхательных путей (Yang et al., 2005, J Pharmacol Exp Ther, 313, 8-15). IL-13 вовлечен в патогенез астмы человека, поскольку в легких астматических пациентов были обнаружены повышенные уровни мРНК и белка IL-13, коррелирующие с тяжестью заболевания (Huang et al., 1995, J Immunol, 155, 2688-94). Кроме того, были идентифицированы генетические полиморфизмы IL-13 человека, приводящие к повышенным уровням IL-13, и они ассоциированы с астмой и атопией (Heinzmann et al., 2000, Hum Mol Genet, 9, 549-59; Hoerauf et al., 2002, Microbes Infect, 4, 37-42; Vercelli, 2002, Curr Opin Allergy Clin Immunol, 2, 389-93; Heinzmann et al., 2003, J Allergy Clin Immunol, 112, 735-9; Chen et al., 2004, J Allergy Clin Immunol, 114, 553-60; Vladich et al., 2005, J Clin Invest, 115, 747-54), и в легких пациентов с астмой были обнаружены повышенные уровни IL-13 (Huang et al., 1995, J Immunol, 155, 2688-94; Arima et al., 2002, J Allergy Clin Immunol, 109, 980-7; Berry et al., 2004, J Allergy Clin Immunol, 114, 1106-9). Также была продемонстрирована генетическая связь между IL-13 и астмой, так как индивидуумы с полиморфизмом гена IL-13, который является причиной более высоких уровней IL-13 в плазме, обладают повышенным риском атопии и астмы (Wills-Karp, 2000, Respir Res, 1, 19-23).
Вследствие роли IL-13 человека в различных нарушениях у человека были разработаны терапевтические стратегии для ингибирования или противодействия активности IL-13. В частности, проводили поиск антител, которые связываются с IL-13 и нейтрализуют его, в качестве средств для ингибирования активности IL-13. Однако в данной области существует потребность в совершенствовании способов получения и очистки таких антител для фармацевтического применения. Настоящее изобретение направлено на решение этой потребности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В конкретных вариантах осуществления настоящее изобретение относится к очищенным, выделенным антителам и фрагментам антител, которые связываются с IL-13, а также к фармацевтическим композициям, содержащим такие антитела и фрагменты. В конкретных вариантах осуществления изобретение относится к выделенным антителам или их антигенсвязывающим частям, которые связываются с IL-13 человека. Выделенные антитела против IL-13 по настоящему изобретению можно использовать в клинических условиях, а также в исследованиях и разработках. В конкретных вариантах осуществления настоящее изобретение относится к антителу против IL-13, содержащему последовательности тяжелой и легкой цепи, указанные на фигуре 1.
Определенные варианты осуществления изобретения относятся к способам очистки антител против IL-13 или их антигенсвязывающих частей из матрицы образца для получения антител, по существу не содержащих белки клетки-хозяина ("HCP") и выщелоченный белок A. В определенных аспектах матрица образца (или просто "образец") включает клеточную линию, используемую для получения антител против IL-13 по настоящему изобретению. В конкретных аспектах образец содержит клеточную линию, используемую для получения антител человека против IL-13.
В конкретных вариантах осуществления настоящее изобретение относится к способу очистки антител против IL-13, который включает первичную стадию выделения, в частности, удаления клеток и продуктов распада клеток. В некоторых вариантах осуществления способа первичная стадия выделения включает одну или несколько стадий центрифугирования или глубинной фильтрации. Для примера, а не путем ограничения, такие стадии центрифугирования можно выполнять при скорости от приблизительно 7000×g до приблизительно 11000×g. Кроме того, определенные варианты осуществления описываемого выше способа будут включать стадию глубинной фильтрации, такую как стадия обезжиривающей глубинной фильтрации.
В конкретных вариантах осуществления первично выделенный образец подвергают стадии аффинной хроматографии. Стадия аффинной хроматографии включает помещение первично выделенного образца на колонку, содержащую подходящую подложку для аффинной хроматографии. Неограничивающие примеры таких подложек для хроматографии включают, но не ограничиваются ими,, смолу с белком А, смолу с белком G, подложки для аффинной хроматографии, содержащие антиген, против которого индуцировали представляющее интерес антитело, и подложки для аффинной хроматографии, содержащие Fc-связывающий белок. Смола с белком A применима для аффинной очистки и выделения антител (IgG). В одном из аспектов колонку с белком A уравновешивают подходящим буфером до нагрузки образца. Примером подходящего буфера является буфер Трис/NaCl, pH приблизительно 7,2. После такого уравновешивания образец можно нагружать на колонку. После нагрузки колонки ее можно промыть один или несколько раз с помощью, например, равновесного буфера. До элюирования из колонки можно использовать другие промывки, включая промывки с применением различных буферов. Затем можно проводить элюирование из колонки с белком A, используя соответствующий элюирующий буфер. Примером подходящего элюирующего буфера является буфер уксусная кислота/NaCl, pH приблизительно 3,5. Элюат можно проверять с использованием методов, хорошо известных специалистам в данной области. Например, затем можно измерять поглощение при OD280. После этого для дальнейшей обработки можно получать представляющую интерес элюированную фракцию (фракции).
В конкретных вариантах осуществления настоящего изобретения за аффинной хроматографией с белком A следует стадия доведения до низкого pH. В таких вариантах осуществления pH элюата с белком A, содержащего предполагаемое антитело против IL-13 или его антигенсвязывающую часть, доводят до значения pH от приблизительно 3 до приблизительно 4. В некоторых аспектах pH доводят до значения приблизительно 3,5. Низкий pH, в частности, способствует снижению и/или инактивации pH-чувствительных вирусов, которые могут контаминировать образец. После соответствующего периода времени pH доводят до значения от приблизительно 4,5 до приблизительно 6,0, включая, без ограничения, приблизительно 5,0, и образец подвергают дополнительным стадиям очистки.
В конкретных вариантах осуществления после стадии аффинной хроматографии с белком A или доведения до низкого pH следует стадия ионного обмена. Данная стадия ионного обмена может представлять собой обмен катионов или анионов или последовательное сочетание обоих. Данная стадия может быть одной процедурой ионного обмена или может включать несколько стадий ионного обмена, таких как стадия обмена катионов с последующей стадией обмена анионов или наоборот. В одном из аспектов стадия ионного обмена является процедурой в одну стадию. В другом аспекте стадия ионного обмена включает две стадии процесса ионного обмена. Подходящей для катионного обмена колонкой является колонка, неподвижная фаза которой содержит анионные группы. Примером такой колонки является Fractogel™ SO3-. Данная стадия ионообменной хроматографии с захватом облегчает выделение антител из образца. Подходящей для анионного обмена колонкой является колонка, неподвижная фаза которой содержит катионные группы. Примером такой колонки является колонка Q Sepharose™. Альтернативой является мембранный элемент Pall Mustang Q. Также одной или несколькими стадиями ионного обмена выделяют антитела путем снижения примесей, таких как белки и ДНК клетки-хозяина, и, при необходимости, белок аффинной матрицы. Данный метод анионного обмена является проточным методом хроматографии, где представляющие интерес антитела не взаимодействуют или не связываются с анионообменной смолой (или твердой фазой). Однако многие примеси взаимодействуют и связываются с анионообменной смолой. В конкретном аспекте стадия ионного обмена представляет собой анионообменную хроматографию.
Элюат аффинной хроматографии получают для ионообменной хроматографии путем регулирования pH и ионной силы буфера для образцов. Например, pH элюата, полученного при аффинной хроматографии, можно доводить до значения pH от приблизительно 4,5 до приблизительно 8,5 в 1 Μ буфере Трис. До нагрузки образца (элюата, полученного при аффинной хроматографии) на ионообменную колонку ее можно уравновешивать с помощью подходящего буфера. Примером подходящего буфера является буфер Трис/NaCl с pH от приблизительно 4,5 до приблизительно 8. После уравновешивания колонку можно нагружать элюатом, полученным при аффинной хроматографии. После нагрузки колонку можно промыть подходящим буфером один или несколько раз. Примером подходящего буфера является сам уравновешивающий буфер. Сбор элюата можно начинать, например, при достижении поглощения (OD280) выше приблизительно 0,2 о.е.
В конкретных вариантах осуществления первую и вторую стадию ионного обмена осуществляют после первичного выделения или, в ином случае, в отсутствие стадии аффинной хроматографии. В некоторых таких вариантах осуществления образец, полученный на стадии ионного обмена, подвергают промежуточной стадии фильтрации до первой стадии ионного обмена, между двумя стадиями ионного обмена или обоим. В конкретных аспектах данная стадия фильтрации включает ультрафильтрацию/диафильтрацию ("UF/DF") с захватом. В частности, такая фильтрация облегчает концентрирование и обмен буфера антител против IL-13 и их антигенсвязывающих частей.
Конкретные варианты осуществления изобретения относятся к способу, включающему одну или несколько стадий хроматографии с гидрофобным взаимодействием ("HIC"). Подходящей колонкой для HIC является такая колонка, неподвижная фаза которой содержит гидрофобные группы. Неограничивающим примером такой колонки является колонка Phenyl HP Sepharose™. В некоторых обстоятельствах при выделении/очистке антитела против IL-13 будут образовываться агрегаты. Включение одной или нескольких стадий HIC облегчает снижение или удаление таких агрегатов. HIC также способствует удалению примесей. В конкретных вариантах осуществления на стадии HIC используют высокосолевой буфер для стимулирования взаимодействия антител против IL-13 (или их агрегатов) с гидрофобной колонкой. Затем антитела против IL-13 можно элюировать с использованием более низких концентраций соли.
В конкретных вариантах осуществления элюат, полученный при HIC, фильтруют с использованием фильтра для удаления вирусов такого как, но без ограничения, фильтр Ultipor DV50™ (Pall Corporation, East Hills, N.Y.). В таких вариантах осуществления также можно использовать альтернативные фильтры, такие как фильтры Viresolve™ (Millipore, Billerica, Mass.); фильтры Zeta Plus VR™ (CUNO; Meriden, Conn.); и фильтры Planova™ (Asahi Kasei Pharma, Planova Division, Buffalo Grove, 111.).
В конкретных вариантах осуществления изобретение относится к одной или нескольким фармацевтическим композициям, содержащим выделенное антитело против IL-13 или его антигенсвязывающую часть и приемлемый носитель. В одном из аспектов, в дополнение к антителу против IL-13, композиция дополнительно содержит одно или несколько антител или их антигенсвязывающие части. В другом аспекте композиции дополнительно содержат одно или несколько фармацевтических средств.
Чистоту представляющих интерес антител в полученном препарате образца можно анализировать с использованием методов, хорошо известных специалистам в данной области, например, эксклюзионной хроматографии, ВЭЖХ-анализа Poros™ A, HCP ELISA, ELISA с белком A и вестерн-блоттинга.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1представлены последовательности вариабельных областей тяжелой и легкой цепи неограничивающего примера антитела против IL-13.
На фигуре 2представлена функциональная диаграмма примера способа культивирования клеток, включая заданные величины, производственные тесты и пределы воздействия.
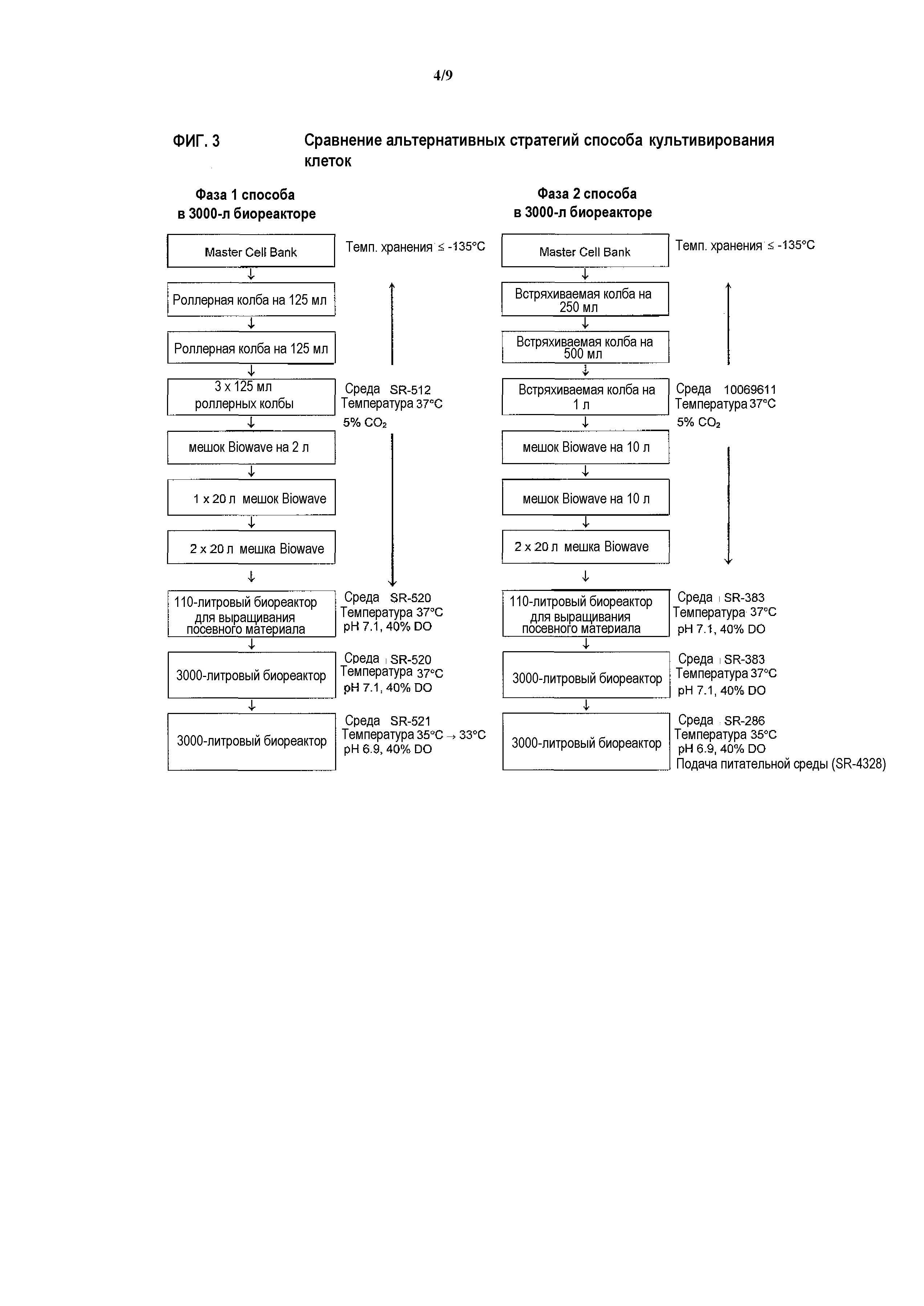
На фигуре 3представлено сравнение альтернативных стратегий культивирования клеток.
На фигуре 4представлена функциональная диаграмма способа первичного выделения и хроматографии с захватом, включая заданные величины, производственные тесты и пределы воздействия.
На фигуре 5представлено сравнение альтернативных стратегий первичного выделения и захвата.
На фигуре 6представлена функциональная диаграмма способа глубокой очистки, включая заданные величины, производственные тесты и пределы воздействия.
На фигуре 7представлено сравнение альтернативных стратегий глубокой очистки.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителам, которые связываются с IL-13. В одном из аспектов изобретение относится к выделенным антителам или их антигенсвязывающим частям, которые связываются с IL-13 человека. Выделенное антитело против IL-13 по настоящему изобретению можно использовать в клинических условиях, а также в исследованиях и разработках. Настоящее изобретение также относится к способам очистки антител против IL-13 или их антигенсвязывающих частей. Подходящие антитела против IL-13, которые могут быть очищены в контексте настоящего изобретения, описаны в заявке PCT № PCT/US2007/019660, которая включена в данное описание путем ссылки в полном объеме, включая антитело, которое затем было идентифицировано как ABT-308. Примеры последовательностей тяжелой и легкой цепи антитела против IL-13 приведены на фигуре 1. Настоящее изобретение также относится к фармацевтическим композициям, содержащим антитела против IL-13 или их антигенсвязывающие части, описываемые в настоящем документе.
Для ясности, но не для ограничения, данное подробное описание разделено на следующие подчасти:
1. Определения;
2. Образование антител;
3. Получение антител;
4. Очистка антител;
5. Методы анализа чистоты образца;
6. Дополнительные модификации;
7. Фармацевтические композиции; и
8. Применение антител.
1. Определения
Для лучшего понимания настоящего изобретения сначала приведены определения конкретных терминов.
Термин "антитело" включает молекулу иммуноглобулина, состоящую из четырех полипептидных цепей, двух тяжелых (H) цепей и двух легких (L) цепей, связанных дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно обозначаемой в настоящем документе как HCVR или VH) и константной области тяжелой цепи (CH). Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно обозначаемой в настоящем документе как LCVR или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена CL. Области VH и VL дополнительно могут быть разделены на гипервариабельные области, называемые определяющими комплементарность областями (CDR), которые чередуются с более консервативными областями, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца до карбокси-конца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Термин "антигенсвязывающая часть" антитела (или "часть антитела") включает фрагменты антитела, которые сохраняют способность специфически связываться с антигеном (например, hIL-13). Показано, что антигенсвязывающую функцию антитела могут осуществлять фрагменты полноразмерного антитела. Примеры связывающих фрагментов, охваченных термином "антигенсвязывающая часть" антитела, включают (i) Fab-фрагмент, моновалентный фрагмент, содержащий VL, VH, CL и CH1 домены; (ii) F(ab')2-фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, содержащий VH и CH1 домены; (iv) Fv-фрагмент, содержащий VL и VH домены одного плеча антитела, (v) dAb-фрагмент (публикация Ward et al., (1989) Nature 341:544-546, полное содержание которой включено в настоящий документ путем ссылки), содержащий VH домен; и (vi) выделенную определяющую комплементарность область (CDR). Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируют разные гены, они могут быть соединены с использованием рекомбинантных способов синтетическим линкером, позволяющим получать их как одну белковую цепь, в которой области VL и VH расположены парой с образованием моновалентных молекул (известных как одноцепочечный Fv (scFv); см., например, публикации Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883, полное содержание которых включено в настоящий документ путем ссылки). Такие одноцепочечные антитела также предназначены для включения в термин "антигенсвязывающая часть" антитела. Также включены другие формы одноцепочечных антител, такие как диатела. Диатела являются бивалентными, биспецифическими антителами, в которых VH и VL домены экспрессируются на одной полипептидной цепи, но с использованием линкера, который является слишком коротким, чтобы обеспечить возможность образования пар между двумя доменами на одной цепи, таким образом, вынуждая домены образовывать пары с комплементарными доменами другой цепи и создавая два антигенсвязывающих участка (см., например, публикации Holliger P., et al. (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448; Poljak R. J., et al. (1994) Structure 2:1121-1123, полное содержание которых включено в настоящий документ путем ссылки). Кроме того, антитело или его антигенсвязывающая часть могут быть частью большей молекулы иммуноадгезии, образованной ковалентной или нековалентной связью антитела или части антитела с одним или несколькими другими белками или пептидами. Примеры таких молекул иммуноадгезии включают применение коровой области стрептавидина для получения тетрамерной scFv молекулы (публикация Kipriyanov S. M. et al. (1995) Human Antibodies and Hybridomas 6:93-101, полное содержание которой включено в настоящий документ путем ссылки) и применение остатка цистеина, маркерного пептида и C-концевой полигистидиновой метки для получения бивалентных и биотинилированных молекул scFv (публикация Kipriyanov S. M et al. (1994) Mol. Immunol. 31:1047-1058, полное содержание которой включено в настоящий документ путем ссылки). Части антитела, такие как Fab- и F(ab')2-фрагменты, могут быть получены из целых антител с использованием общепринятых способов, таких как расщепление целых антител папаином или пепсином, соответственно. Кроме того, антитела, части антитела и молекулы иммуноадгезии могут быть получены с использованием стандартных способов рекомбинантной ДНК, как описано в настоящем документе. В одном из аспектов антигенсвязывающие части являются полными доменами или парами полных доменов.
Как используется в настоящем документе, фраза "интерлейкин-13 человека" (сокращенно обозначаемый в настоящем документе как hIL-13 или IL-13) относится к гликопротеину массой 17 кДа, клонированному из активированных Τ-клеток (Zurawski and de Vries, 1994 Immunol Today 15 19-26), и он продуцируется активированными Τ-клетками Th2-линии. ThO и ThI CD4+ Τ-клетки, CD8+ Τ-клетки и некоторые не-T-клеточные популяции, такие как тучные клетки, также продуцируют IL-13 (Zurawski and de Vries, 1994 Immunol Today 15 19-26). Функция IL-13 включает стимуляцию переключения изотипа иммуноглобулина на IgE в Β-клетках человека (Punnonen, Aversa et al. 1993 Proc Natl Acad Sci U S A 90 3730-4) и супрессию продукции воспалительных цитокинов у человека и мыши (de Waal et al., 1993 J Immunol 151 6370-81; Doherty et al., 1993 J Immunol 151 7151-60). IL-13 связывается с рецепторами на поверхности клетки, идентифицированными как IL-13Rα1 и IL-13Rα2. Рецептор IL-13Rα1 взаимодействует с IL-13 с низкой аффинностью (KD ~10 нМ) с последующим вовлечением IL-4R для образования высокоаффинного (KD ~0,4 нМ) сигнального гетеродимерного рецепторного комплекса (Aman et al., 1996 J Biol Chem 271 29265-70; Hilton et al., 1996 Proc Natl Acad Sci U S A 93 497-501). Комплекс IL-4R/IL-13Rα1 экспрессируется на многих типах клеток, таких как Β-клетки, моноциты/макрофаги, дендритные клетки, эозинофилы, базофилы, фибробласты, эндотелиальные клетки, эпителиальные клетки дыхательных путей и гладкомышечные клетки дыхательных путей (Graber et al., 1998 Eur J Immunol 28 4286-98; Murata et al., 1998 Int Immunol 10 1103-10; Akaiwa et al., 2001 Cytokine 13 75-84) Лигирование рецепторного комплекса IL-13Rα1/IL-4R приводит к активации множества путей передачи сигнала, включая пути трансдуктора сигнала и активатора транскрипции (STAT6) и субстрата рецептора инсулина 2 (IRS-2) (Wang et al., 1995 Blood 864218-27; Takeda et al., 1996 J Immunol 157 3220-2). Цепь IL-13Rα2 сама по себе обладает высокой аффинностью (KD ~0,25-0,4 нМ) к IL-13 и функционирует в качестве рецептора-ловушки, отрицательно регулирующего связывание IL-13 (Donaldson, Whitters et al. 1998 J Immunol 161 2317-24), и в качестве сигнального рецептора, который индуцирует синтез TGF-β и фиброз через путь AP-I в макрофагах и, возможно, в других типах клеток (Fichtner-Feigl et al., 2006 Nat Med 12 99-106). Кодирующая IL-13 нуклеиновая кислота доступна под номером доступа GenBank NM_002188, и полипептидная последовательность доступна под номером доступа GenBank NP_002179. Термин IL-13 человека предназначен для включения рекомбинантного IL-13 человека (rh IL-13), который может быть получен стандартными рекомбинантными способами экспрессии.
Термины "нумерация по Kabat", "значения по Kabat" и "обозначение по Kabat" используют взаимозаменяемо в настоящем документе. Эти общепризнанные в данной области термины относятся к системе нумерации аминокислотных остатков, которые являются более вариабельными (т.е. гипервариабельными), чем другие аминокислотные остатки в вариабельных областях тяжелой и легкой цепи антитела или его антигенсвязывающей части (Kabat et al. (1971) Ann. NY Acad, Sci. 190:382-391 and Kabat Ε. Α. et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242, полное содержание которых включено в настоящий документ путем ссылки). Что касается вариабельной области тяжелой цепи, то гипервариабельная область находится в диапазоне положений аминокислоты от 31 до 35 для CDR1, положений аминокислоты от 50 до 65 для CDR2 и положений аминокислоты от 95 до 102 для CDR3. Что касается вариабельной области легкой цепи, то гипервариабельная область находится в диапазоне положений аминокислоты от 24 до 34 для CDR1, положений аминокислоты от 50 до 56 для CDR2 и положений аминокислоты от 89 до 97 для CDR3.
Термин "антитело человека" включает антитела, обладающие вариабельными и константными областями, соответствующими последовательностям зародышевой линии иммуноглобулина человека, как описано Kabat et al. (См. Kabat et al. (1991) Sequences of proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Антитела человека по изобретению могут включать аминокислотные остатки, не кодируемые последовательностями зародышевой линии иммуноглобулина человека (например, мутации, введенные случайным или сайт-специфическим мутагенезом in vitro или соматической мутацией in vivo), например, в CDR и, в частности, CDR3. Мутации могут быть введены с использованием "подхода избирательного мутагенеза". Антитело человека может иметь по меньшей мере одно положение, замененное аминокислотным остатком, например, повышающим активность аминокислотным остатком, не кодируемым последовательностью зародышевой линии иммуноглобулина человека. Антитело человека может иметь вплоть до двадцати положений, замененных аминокислотными остатками, которые не являются частью последовательности зародышевой линии иммуноглобулина человека. В других вариантах осуществления заменяют до десяти, до пяти, до трех или до двух положений. В одном из вариантов осуществления такие замены находятся внутри областей CDR. Однако, как используется в настоящем документе, термин "антитело человека" не предназначен для включения антител, в которых последовательности CDR, полученные из зародышевой линии других видов млекопитающих, таких как мышь, пересаживают на каркасные последовательности человека.
Фраза "подход избирательного мутагенеза" включает способ повышения активности антитела посредством выбора и отдельного мутагенеза аминокислот CDR по меньшей мере одного подходящего для избирательного мутагенеза положения, гипермутации и/или положения контакта. "Подвергнутое избирательному мутагенезу" антитело человека является антителом, которое содержит мутацию в положении, выбранном с использованием подхода избирательного мутагенеза. В другом аспекте подход избирательного мутагенеза предназначен для обеспечения способа предпочтительного мутагенеза выбранных отдельных аминокислотных остатков в CDR1, CDR2 или CDR3 вариабельной области тяжелой цепи (далее в настоящем документе H1, H2 и H3, соответственно), или CDR1, CDR2 или CDR3 вариабельной области легкой цепи (далее в настоящем документе обозначаемыми как LI, L2 и L3, соответственно) антитела. Аминокислотные остатки могут быть выбраны из положений для избирательного мутагенеза, положений контактов или положений гипермутаций. Отдельные аминокислоты выбирают на основе их положения в вариабельной области легкой или тяжелой цепи. Следует понимать, что положение гипермутации также может быть положением контакта. В одном из аспектов подход избирательного мутагенеза является "нацеленным подходом". Выражение "нацеленный подход" предназначено для включения способа мутагенеза выбранных отдельных аминокислотных остатков в CDR1, CDR2 или CDR3 вариабельной области тяжелой цепи или CDR1, CDR2 или CDR3 вариабельной области легкой цепи антитела нацеленным образом, например, "нацеленного подхода по группам" или "нацеленного подхода по CDR". При "нацеленном подходе по группам" отдельные аминокислотные остатки в конкретных группах являются целевыми для избирательных мутаций, включая группы I (включая L3 и H3), II (включая H2 и L1) и III (включая L2 и H1), группы приведены в порядке предпочтения для нацеливания. При "нацеленном подходе по CDR" отдельные аминокислотные остатки в конкретных CDR являются целевыми для избирательных мутаций в следующем порядке предпочтения для нацеливания: H3, L3, H2, L1, H1 и L2. Выбранный аминокислотный остаток подвергают мутагенезу, например, по меньшей мере до двух других аминокислотных остатков, и определяют эффект мутации на активность антитела. Активность измеряют как изменение специфичности связывания/аффинности антитела и/или нейтрализующей активности антитела. Следует понимать, что подход избирательного мутагенеза можно использовать для оптимизации любого антитела, полученного из любого источника, включая фаговый дисплей, трансгенных животных с генами зародышевой линии IgG человека, антитела человека, выделенные из B-клеток человека. Подход избирательного мутагенеза можно применять на антителах, которые дополнительно не могут быть оптимизированы с использованием технологии фагового дисплея. Следует понимать, что антитела из любого источника, включая фаговый дисплей, трансгенных животных с генами зародышевой линии IgG человека, антитела человека, выделенные из B-клеток человека, могут быть подвергнуты обратной мутации до или после подхода избирательного мутагенеза.
Фраза "рекомбинантное антитело человека" включает антитела человека, которые получены, экспрессированы, созданы или выделены рекомбинантными средствами, такие как антитела, экспрессированные с использованием рекомбинантного экспрессирующего вектора, трансфицированного в клетку-хозяина, антитела, выделенные из рекомбинантной, комбинаторной библиотеки антител человека, антитела, выделенные у животного (например, мыши), трансгенного по генам иммуноглобулина человека (см., например, публикацию Taylor L. D. et al. (1992) Nucl. Acids Res. 20:6287-6295, полное содержание которой включено в настоящий документ путем ссылки), или антитела полученные, экспрессированные, созданные или выделенные любыми другими средствами, которые включают сплайсинг последовательностей генов иммуноглобулинов человека с другими последовательностями ДНК. Такие рекомбинантные антитела человека обладают вариабельными и константными областями, полученными из последовательностей зародышевой линии иммуноглобулинов человека (см., Kabat, Ε. Α., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Однако в конкретных вариантах осуществления такие рекомбинантные антитела человека подвергают мутагенезу in vitro (или, если используют животное, трансгенное по последовательностям Ig человека, соматическому мутагенезу in vivo), и, таким образом, аминокислотные последовательности VH и VL областей рекомбинантных антител являются последовательностями, которые могут не существовать в природе в репертуаре антител зародышевой линии человека in vivo, несмотря на то, что они получены из последовательностей VH и VL зародышевой линии человека и относятся к ним. Однако в конкретных вариантах осуществления такие рекомбинантные антитела являются результатом подхода избирательного мутагенеза или обратной мутации, или обоих.
"Выделенное антитело" включает антитело, которое по существу не содержит другие антитела, обладающие различными антигенными специфичностями (например, выделенное антитело, которое специфически связывает hIL-13, по существу не содержит антитела, которые специфически связывают антигены, отличные от hIL-13). Выделенное антитело, которое специфически связывает hIL-13, может связывать молекулы IL-13 других видов. Кроме того, выделенное антитело может по существу не содержать другой клеточный материал и/или химические вещества.
"Нейтрализующее антитело" (или "антитело, которое нейтрализует активность hIL-13") включает антитело, связывание с hIL-13 которого приводит к ингибированию биологической активности hIL-13. Данное ингибирование биологической активности hIL-13 можно оценивать путем измерения одного или нескольких индикаторов биологической активности hIL-13. Эти индикаторы биологической активности hIL-13 можно оценивать одним или несколькими из некоторых известных в данной области анализов in vitro или in vivo.
Термин "активность" включает активности, такие как специфичность связывания/аффинность антитела к антигену, например, антитела против hIL-13, которое связывается с антигеном IL-13, и/или нейтрализующая активность антитела, например, антитела против hIL-13, связывание которого с hIL-13 ингибирует биологическую активность hIL-13.
Фраза "поверхностный плазмонный резонанс" включает оптическое явление, позволяющее проводить анализ биоспецифических взаимодействий в реальном времени путем определения изменений концентраций белка в матрице биосенсора, например, с использованием системы BIAcore (Pharmacia Biosensor AB, Uppsala, Sweden and Piscataway, Ν.J.). Для дополнительного описания см. публикации Jonsson, U., et al. (1993) Ann. Biol. Clin. 51:19-26; Jonsson, U., et al. (1991) Biotechniques 11:620-627; Johnsson, B., el al. (1995) J. Mol. Recognit. 8:125-131; and Johnnson, B., et al. (1991) Anal. Biochem. 198:268-277, полное содержание которых включено в настоящий документ путем ссылки.
Как используется в настоящем документе, термин "Koff" предназначен для обозначения константы скорости диссоциации антитела из комплекса антитело/антиген.
Как используется в настоящем документе, термин "Kd" предназначен для обозначения константы диссоциации конкретного взаимодействия антитело-антиген.
Фраза "молекула нуклеиновой кислоты" включает молекулы ДНК и молекулы РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но в одном из аспектов является двухцепочечной ДНК.
Как используется в настоящем документе, фраза "выделенная молекула нуклеиновой кислоты" относится к нуклеиновым кислотам, кодирующим антитела или части антител (например, VH, VL, CDR3), например, те, которые связывают hIL-13 и включают молекулу нуклеиновой кислоты, в которой нуклеотидные последовательности, кодирующие антитело или часть антитела, не содержат другие нуклеотидные последовательности, кодирующие антитела или части антител, которые связывают антигены, отличные от hIL-13, причем эти другие последовательности могут естественным образом фланкировать нуклеиновую кислоту в геномной ДНК человека. Таким образом, например, выделенная нуклеиновая кислота по изобретению, кодирующая VH область антитела против hIL-13, не содержит другие последовательности, кодирующие другие VH области, которые связывают антигены, отличные, например, от hIL-13. Фраза "выделенная молекула нуклеиновой кислоты" также предназначена для включения последовательностей, кодирующих бивалентные, биспецифические антитела, такие как диатела, в которых VH и VL области не содержат другие последовательности, отличные от последовательностей диатела.
Фраза "рекомбинантная клетка-хозяин" (или просто "клетка-хозяин") включает клетку, в которую был введен рекомбинантный экспрессирующий вектор. Следует понимать, что такие термины предназначены для обозначения не только конкретного объекта клетки, но и потомства такой клетки. Поскольку в последующих поколениях могут иметь место определенные модификации по причине их мутации или воздействий окружающей среды, такое потомство фактически может не быть идентичным родительской клетке, но все равно, как используется в настоящем документе, его включают в объем термина "клетка-хозяин".
Используемый в настоящем документе термин "модифицирующий" предназначен для обозначения изменения одной или нескольких аминокислот в антителах или их антигенсвязывающих частях. Изменение может быть осуществлено добавлением, заменой или удалением аминокислот в одном или нескольких положениях. Изменение может быть осуществлено с использованием известных способов, таких как ПЦР-мутагенез.
Используемый в настоящем документе, термин "приблизительно" предназначен для обозначения диапазонов, приблизительно на 10-20% больших или меньших, чем указанное значение. В конкретных обстоятельствах специалисту в данной области будет понятно, что по причине природы указанного значения термин "приблизительно" может означать более или менее чем 10-20% отклонение от значения.
Как используется в настоящем документе, фраза "снижение/инактивация вируса" предназначена для обозначения снижения количества вирусных частиц в конкретном образце ("снижение"), а также снижение активности вирусных частиц, например, но не ограничиваясь этим, инфицирующей способности или способности реплицироваться, в конкретном образце ("инактивация"). Такие снижения количества и/или активности вирусных частиц могут составлять порядка от приблизительно 1% до приблизительно 99%, включая от приблизительно 20% до приблизительно 99%, включая от приблизительно 30% до приблизительно 99%, включая от приблизительно 40% до приблизительно 99%, включая от приблизительно 50% до приблизительно 99%, включая от приблизительно 60% до приблизительно 99%, включая от приблизительно 70% до приблизительно 99%, включая от приблизительно 80% до 99% и включая от приблизительно 90% до приблизительно 99%. В конкретных неограничивающих вариантах осуществления количество вируса, при его наличии, в очищенном препарате антитела составляет менее чем ID50 (количество вируса, инфицирующего 50 процентов целевой популяции) для данного вируса, оно составляет по меньшей мере в 10 раз меньше, чем ID50 для данного вируса, или по меньшей мере в 100 раз меньше, чем ID50 для данного вируса, или по меньшей мере в 1000 раз меньше, чем ID50 для данного вируса.
Фраза "положение контакта" включает положение аминокислоты в CDR1, CDR2 или CDR3 вариабельной области тяжелой цепи или вариабельной области легкой цепи антитела, занятое аминокислотой, которая контактирует с антигеном в одной из двадцати шести известных структур антитело-антиген. Если аминокислота в CDR в любой из двадцати шести известных разрешенных структур комплекса антитело-антиген контактирует с антигеном, то эту аминокислоту можно рассматривать как занимающую положение контакта. Положения контакта обладают большей возможностью быть занятыми аминокислотой, которая контактирует с антигенами, чем не в положении контакта. В одном из аспектов положение контакта является положением CDR, содержащим аминокислоту, которая контактирует с антигеном в более чем 3 из 26 структур (>11,5%). В другом аспекте положение контакта является положением CDR, содержащим аминокислоту, которая контактирует с антигеном в более чем 8 из 26 структур (>32%).
2. Получение антител
Используемый в данном разделе термин "антитело" относится к интактному антителу или его антигенсвязывающему фрагменту.
Антитела по настоящему описанию могут быть получены разнообразными способами, включая иммунизацию животного интересующим антигеном с последующим использованием общепринятых способов получения моноклональных антител, например, стандартного способа гибридизации соматических клеток по Kohler and Milstein (1975) Nature 256: 495. Хотя способы гибридизации соматических клеток являются предпочтительными, в принципе, можно использовать другие способы получения моноклональных антител, например, вирусную или онкогенную трансформацию Β-лимфоцитов.
Одной системой получения гибридом на животных является мышиная система. Получение гибридомы является общепризнанным способом. В данной области известны протоколы и способы иммунизации для выделения иммунизированных спленоцитов для слияния. Также известны партнеры для слияния (например, мышиные миеломные клетки) и способы слияния.
Антитело может быть антителом человека, химерным или гуманизированным антителом. Химерные или гуманизированные антитела по настоящему описанию могут быть получены на основе последовательности не принадлежащего человеку моноклонального антитела, полученного, как описано выше. ДНК, кодирующую тяжелую и легкую цепи иммуноглобулинов, можно получить из интересующей не принадлежащей человеку гибридомы и конструировать с использованием стандартных способов молекулярной биологии таким образом, что она будет содержать отличные от мышиных (например, человеческие) последовательности иммуноглобулинов. Например, для создания химерного антитела вариабельные области мыши можно связывать с константными областями человека, используя известные в данной области способы (см., например, патент США № 4816567 Cabilly et al.). Для создания гуманизированного антитела CDR области мыши можно встраивать в каркас человека с использованием известных в данной области способов (см., например, патент США № 5225539 Winter и патенты США №№ 5530101; 5585089; 5693762 и 6180370 Queen et al.).
В одном неограничивающем варианте осуществления антитела по настоящему описанию являются моноклональными антителами человека. Такие направленные против IL-13 моноклональные антитела человека могут быть получены с использованием трансгенных или трансхромосомных мышей, несущих части иммунной системы человека вместо системы мыши. Данные трансгенные и трансхромосомные мыши включают мышей, обозначаемых в настоящем документе как HuMAb Mouse® (Medarex, Inc.), KM Mouse® (Medarex, Inc.) и XenoMouse® (Amgen).
Кроме того, в данной области доступны альтернативные системы трансхромосомных животных, экспрессирующие гены иммуноглобулина человека, и их можно использовать для получения антител по описанию, таких как антитела против IL-13. Например, можно использовать мышей, несущих как трансхромосому тяжелой цепи человека, так и трансхромосому легкой цепи человека, обозначаемых как "TC мыши"; такие мыши описаны в публикации Tomizuka et al. (2000) Proc. Natl. Acad. Sci. USA 97:722-727. Кроме того, в данной области были описаны коровы, несущие трансхромосомы тяжелой и легкой цепей человека (например, Kuroiwa et al. (2002) Nature Biotechnology 20:889-894 и публикация PCT № WO 2002/092812), и они могут быть использованы для получения антител против IL-13 по настоящему описанию.
Рекомбинантные антитела человека по изобретению, включая, но не ограничиваясь ими, антитела против IL-13 или их антигенсвязывающие части, или описываемые в настоящем документе антитела, относящиеся к антителам против IL-13, можно выделять путем скрининга рекомбинантной комбинаторной библиотеки антител, например, scFv фаговой библиотеки, полученной с использованием кДНК VL и VH человека, полученной из мРНК, полученной из лимфоцитов человека. Способы получения и скрининга таких библиотек известны в данной области. В дополнение к коммерчески доступным наборам для получения фаговых библиотек (например, Pharmacia Recombinant Phage Antibody System, № в каталоге 27-9400-01; и Stratagene SurfZAPTM phage display kit, № в каталоге 240612, полное содержание которых включено в настоящий документ), примеры способов и реактивов, особенно пригодных для использования при получении и скрининге дисплейных библиотек антител, можно найти, например, в публикациях Ladner et al. U.S. Patent No. 5,223,409; Kang et al. PCT Publication No. WO 92/18619; Dower et al. PCT Publication No. WO 91/17271; Winter et al. PCT Publication No. WO 92/20791; Markland et al. PCT Publication No. WO 92/15679; Breitling et al. PCT Publication No. WO 93/01288; McCafferty et al. PCT Publication No. WO 92/01047; Garrard et al. PCT Publication No. WO 92/09690; Fuchs et al. (1991) Bio/Technology 9:1370-1372; Hay et al. (1992) Hum Antibod Hybridomas 3:81-85; Huse et al. (1989) Science 246:1275-1281; McCafferty et al., Nature (1990) 348:552-554; Griffiths et al. (1993) EMBO J 12:725-734; Hawkins et al. (1992) J Mol Biol 226:889-896; Clackson et al. (1991) Nature 352:624-628; Gram et al. (1992) PNAS 89:3576-3580; Garrard et al. (1991) Bio/Technology 9:1373-1377; Hoogenboom et al. (1991) Nuc Acid Res 19:4133-4137; and Barbas et al. (1991) PNAS 88:7978-7982; полное содержание которых включено в настоящий документ.
Моноклональные антитела человека по настоящему описанию также можно получать с использованием мышей с SCID, у которых восстанавливали клетки иммунной системы человека таким образом, чтобы после иммунизации получить гуморальный ответ человека. Такие мыши описаны, например, в патентах США №№ 5476996 и 5698767 Wilson et al.
В конкретных вариантах осуществления способы по изобретению включают антитела против IL-13 и части антител, антитела, относящиеся к антителам против IL-13 и части антител, и антитела человека и части антител со свойствами, равноценными антителам против IL-13, такими как высокоаффинное связывание с hIL-13 с низкой кинетикой диссоциации и высокой нейтрализующей способностью. В одном из аспектов изобретение относится к лечению выделенным антителом человека или его антигенсвязывающей частью, диссоциирующим от hIL-13 с Kd приблизительно 1×10-8 Μ или менее и константой скорости диссоциации 1×10-3 с-1 или менее, определяемыми поверхностным плазмонным резонансом. В конкретных неограничивающих вариантах осуществления очищенное по изобретению антитело против IL-13 конкурентно ингибирует связывание ABT-308 с IL-13 в физиологических условиях.
В еще одном варианте осуществления изобретения можно изменять антитела или их фрагменты, такие как, но без ограничения, антитела против IL-13 или их фрагменты, где константную область антитела модифицируют для снижения по меньшей мере одной биологической эффекторной функции, опосредованной константной областью, относительно немодифицированного антитела. Для модификации антитела по изобретению таким образом, что оно проявляет сниженное связывание с Fc-рецептором, сегмент константной области иммуноглобулина антитела можно подвергать мутагенезу в конкретных областях, необходимых для взаимодействий с Fc-рецептором (FcR) (см., например, публикации Canfield and Morrison (1991) J. Exp. Med. 173:1483-1491; и Lund et al. (1991) J. of Immunol. 147:2657-2662, полное содержание которых включено в настоящий документ). Снижение FcR-связывающей способности антитела также может снижать другие эффекторные функции, которые зависят от взаимодействия с FcR, такие как опсонизация и фагоцитоз и антиген-опосредованная клеточная цитотоксичность.
3. Получение антитела
3.1 Общие стратегии получения
Для экспрессии антитела по изобретению ДНК, кодирующую неполные или полноразмерные легкие и тяжелые цепи, встраивают в один или несколько экспрессирующих векторов таким образом, что гены функционально связываются с контролирующими транскрипцию и трансляцию последовательностями. (См., например, патент США № 6914128, полное содержание которого включено в настоящий документ путем ссылки). В данном контексте термин "функционально связываются" предназначен для обозначения того, что ген антитела лигируют в вектор таким образом, что контролирующие транскрипцию и трансляцию последовательности внутри вектора выполняют свою предусмотренную функцию регуляции транскрипции и трансляции гена антитела. Экспрессирующий вектор и контролирующие экспрессию последовательности выбирают так, чтобы они были совместимы с экспрессией используемой клетки-хозяина. Ген легкой цепи антитела и ген тяжелой цепи антитела могут быть встроены в отдельный вектор или, чаще, оба гена встроены в один и тот же экспрессирующий вектор. Гены антитела встраивают в экспрессирующий вектор стандартными способами (например, лигированием комплементарных участков рестрикции на фрагменте гена антитела и векторе или лигированием тупых концов, если нет участков рестрикции). Перед встраиванием последовательностей легкой или тяжелой цепи антитела или относящихся к антителу, экспрессирующий вектор уже может нести последовательности константных областей антитела. Например, одним из подходов преобразования последовательностей VH и VL антитела против IL-13 или относящихся к антителу против IL-13 в полноразмерные гены антитела является их встраивание в экспрессирующие векторы, уже кодирующие константные области тяжелой цепи и легкой цепи, соответственно, таким образом, что сегмент VH функционально связывается с сегментом (сегментами) CH внутри вектора и сегмент VL функционально связывается с сегментом CL внутри вектора. Дополнительно или альтернативно, рекомбинантный экспрессирующий вектор может кодировать сигнальный пептид, который облегчает секрецию цепи антитела из клетки-хозяина. Ген цепи антитела можно клонировать в вектор таким образом, что сигнальный пептид связывается в рамке считывания с аминоконцом гена цепи антитела. Сигнальный пептид может быть сигнальным пептидом иммуноглобулина или гетерологичным сигнальным пептидом (т.е. сигнальным пептидом из неиммуноглобулинового белка).
В дополнение к генам цепей антитела, рекомбинантный экспрессирующий вектор по изобретению может нести одну или несколько регуляторных последовательностей, контролирующих экспрессию генов цепей антитела в клетке-хозяине. Термин "регуляторная последовательность" предназначен для включения промоторов, энхансеров и других контролирующих экспрессию элементов (например, сигналов полиаденилирования), которые контролируют транскрипцию или трансляцию генов цепей антитела. Такие регуляторные последовательности описаны, например, в публикации Goeddel; Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, CA (1990), полное содержание которой включено в настоящий документ путем ссылки. Специалистам в данной области будет понятно, что конструирование экспрессирующего вектора, включая выбор регуляторных последовательностей, может зависеть от таких факторов, как выбор подлежащей трансформации клетки-хозяина, уровень экспрессии желаемого белка и т.д. Подходящие регуляторные последовательности для экспрессии в клетке-хозяине млекопитающего включают вирусные элементы, регулирующие высокие уровни экспрессии белка в клетках млекопитающих, такие как промоторы и/или энхансеры, полученные из цитомегаловируса (CMV) (такие как промотор/энхансер CMV), вируса обезьян 40 (SV40) (такие как промотор/энхансер SV40), аденовируса (например, основной поздний промотор аденовируса (AdMLP)) и полиомы. Для дополнительного описания вирусных регуляторных элементов и их последовательностей см., например, патент США № 5168062 Stinski, патент США № 4510245 Bell et al. и патент США № 4968615 Schaffher et al., полное содержание которых включено в настоящий документ путем ссылки.
В дополнение к генам цепей антитела и регуляторным последовательностям, рекомбинантный экспрессирующий вектор по изобретению может нести одну или несколько дополнительных последовательностей, таких как последовательность, регулирующая репликацию вектора в клетках-хозяевах (например, участки начала репликации), и/или ген селективного маркера. Ген селективного маркера облегчает селекцию клеток-хозяев, в которые был встроен вектор (см., например, патенты США №№ 4399216, 4634665 и 5179017 все Axel et al., полное содержание которых включено в настоящий документ путем ссылки). Например, обычно ген селективного маркера придает клетке-хозяину, в которую был введен вектор, устойчивость к лекарственным средствам, таким как G418, гигромицин или метотрексат. Подходящие гены селективных маркеров включают ген дигидрофолатредуктазы (DHFR) (для использования в dhfr-клетках-хозяевах с селекцией метотрексатом/амплификации) и ген neo (для селекции G418).
Антитело или часть антитела по изобретению можно получать рекомбинантной экспрессией генов легкой и тяжелой цепи иммуноглобулина в клетке-хозяине. Для рекомбинантной экспрессии антитела клетку-хозяина трансфицируют одним или несколькими рекомбинантными экспрессирующими векторами, несущими фрагменты ДНК, кодирующие легкие и тяжелые цепи иммуноглобулина антитела таким образом, что легкие и тяжелые цепи экспрессируются в клетке-хозяине и секретируются в среду, в которой культивируют клетки-хозяева, из которой могут быть выделены антитела. Стандартные способы рекомбинантной ДНК используют для получения генов тяжелой и легкой цепи антитела, встраивания этих генов в рекомбинантные экспрессирующие векторы и введения векторов в клетки-хозяева, такие как описано в публикациях Sambrook, Fritsch and Maniatis (eds), Molecular Cloning; A Laboratory Manual, Second Edition, Cold Spring Harbor, N.Y., (1989), Ausubel et al. (eds.) Current Protocols in Molecular Biology, Greene Publishing Associates, (1989) и в патентах США №№ 4816397 и 6914128, полное содержание которых включено в настоящий документ путем ссылки.
Для экспрессии легких и тяжелых цепей экспрессирующий вектор(ы), кодирующий(е) тяжелые и легкие цепи, трансфицируют в клетку-хозяина стандартными способами. Различные формы термина "трансфекция" предназначены для включения широкого спектра способов, обычно используемых для введения экзогенной ДНК в прокариотическую или эукариотическую клетку-хозяина, например, электропорации, осаждения фосфатом кальция, DEAE-декстран-опосредованной трансфекции и т.п. Хотя теоретически можно экспрессировать антитела по изобретению в прокариотических или эукариотических клетках-хозяевах, экспрессия антител в эукариотических клетках, таких как клетки-хозяева млекопитающих, является подходящей, поскольку в таких эукариотических клетках и, в частности, клетках млекопитающих, лучше, чем в прокариотических клетках, происходит сборка и секреция соответствующим образом свернутого и иммунологически активного антитела. Сообщалось, что прокариотическая экспрессия генов антитела неэффективна для продуцирования больших количеств активного антитела (публикация Boss and Wood (1985) Immunology Today 6:12-13, полное содержание которой включено в настоящий документ путем ссылки).
Подходящие для клонирования и экспрессии ДНК в векторах клетки-хозяева в настоящем документе являются прокариотами, дрожжами или описанными выше клетками высших эукариот. Подходящие для данных целей прокариоты включают эубактерии, такие как грамотрицательные или грамположительные организмы, например, Enterobacteriaceae, такие как Escherichia, например, E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serratia, например, Serratia marcescans, и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P, описываемая в DD 266710, опубликованном 12 апреля 1989 года), Pseudomonas, такие как P. aeruginosa, и Streptomyces. Одним из подходящих для клонирования хозяев E. coli является E. coli 294 (ATCC 31446), хотя подходят и другие штаммы, такие как E. coli Β, E. coli X1776 (ATCC 31537) и E. coli W3110 (ATCC 27325). Эти примеры являются иллюстративными, а не ограничивающими.
В дополнение к прокариотам, эукариотические микроорганизмы, такие как нитевидные грибы или дрожжи, являются подходящими хозяевами для клонирования или экспрессии кодирующих полипептиды векторов. Saccharomyces cerevisiae, или обычные пекарские дрожжи, являются наиболее часто используемыми среди низших эукариотических микроорганизмов-хозяев. Тем не менее, в настоящем документе обычно доступен и применим ряд других родов, видов и штаммов, таких как Schizosaccharomyces pombe; хозяева из Kluyveromyces, такие как, например, K. lactis, K. fragilis (ATCC 12424), K. bulgaricus (ATCC 16045), K. wickeramii (ATCC 24178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906), K. thermotolerans и K. marxianus; Yarrowia (EP 402226); Pichia pastoris (EP 183070); Candida; Trichoderma reesia (EP 244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и нитевидные грибы, такие как, например, Neurospora, Penicillium, Tolypocladium, и хозяева из Aspergillus, такие как A. nidulans и A. niger.
Подходящие клетки-хозяева для экспрессии гликозилированных антител получают из многоклеточных организмов. Примеры таких клеток включают клетки растений и насекомых. Идентифицировали многочисленные штаммы и варианты бакуловирусов и соответствующие пермиссивные клетки-хозяева насекомых из таких хозяев, как Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Общедоступными являются разнообразные штаммы вирусов для трансфекции, например, вариант L-1 Autographa californica NPV и штамм Bm-5 Bombyx mori NPV, и такие вирусы могут быть использованы в настоящем документе в качестве вирусов согласно настоящему изобретению, в частности, для трансфекции клеток Spodoptera frugiperda. Также в качестве хозяев можно использовать культуры растительных клеток хлопка, кукурузы, картофеля, сои, петунии, томата и табака.
Подходящие для экспрессии рекомбинантных антител по изобретению клетки-хозяева млекопитающих включают клетки китайского хомячка (клетки CHO) (включая клетки dhfr-CHO, описываемые в публикации Urlaub and Chasin, (1980) PNAS USA 77:4216-4220, используемые с селективным маркером DHFR, например, как описано в публикации Kaufman and Sharp (1982) Mol. Biol. 159:601-621, полное содержание которых включено в настоящий документ путем ссылки), миеломные клетки NS0, клетки COS и клетки SP2. Когда рекомбинантные экспрессирующие векторы, кодирующие гены антитела, вводят в клетки-хозяева млекопитающих, антитела получают путем культивирования клеток-хозяев в течение периода времени, достаточного для того, чтобы обеспечить возможность экспрессии антитела в клетках-хозяевах или секреции антитела в культуральной среде, в которой выращивают клетки-хозяева. Другими примерами применимых линий клеток-хозяев млекопитающих являются линия клеток почки обезьяны CV1, трансформированная SV40 (COS-7, ATCC CRL 1651); линия эмбриональных клеток почки человека (293 или клетки 293, субклонированные для выращивания в суспензионной культуре, Graham et al., J. Gen Virol: 36:59 (1977)); клетки почки новорожденного хомячка (BHK, ATCC CCL 10); клетки яичника китайского хомячка/-DHFR (CHO, Urlaub et al, Proc. Natl. Acad. Sci. USA 77:4216 (1980)); клетки Сертоли мыши (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени крыс линии buffalo (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI (Mather et al, Annals N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS4; и клетки линии гепатомы человека (Hep G2), все сведения о которых включены в настоящий документ путем ссылки.
Клетки-хозяева трансформируют описанными выше экспрессирующими или клонирующими векторами для получения антитела и культивируют в общепринятых питательных средах, модифицированных при необходимости для индукции промоторов, селекции трансформантов или амплификации генов, кодирующих желаемые последовательности.
Используемые для получения антитела клетки-хозяева можно культивировать в различных средах. Коммерчески доступные среды, такие как Ham's F10™ (Sigma), Minimal Essential Medium™ (минимальная поддерживающая среда) ((MEM), (Sigma), RPMI-1640 (Sigma) и Dulbecco's Modified Eagle's Medium™ (модифицированная по способу Дульбекко среда Игла) ((DMEM), Sigma), являются подходящими для культивирования клеток-хозяев. Кроме того, в качестве среды для культивирования клеток-хозяев может быть использована любая из сред, описанных в публикациях Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), патентах США №№ 4767704; 4657866; 4927762; 4560655; или 5122469; WO 90/03430; WO 87/00195; или патенте США № Re. 30985, полное содержание которых включено в настоящий документ путем ссылки. Любая из этих сред может быть дополнена по мере необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид и фосфат натрия, кальция, магния), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство гентамицин), микроэлементами (определяемыми как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или равноценным источником энергии. Также можно включать любые другие необходимые добавки в соответствующих концентрациях, известных специалистам в данной области. Условиями культивирования, такими как температура, pH и тому подобное, являются те, которые ранее использовались с выбранными для экспрессии клетками-хозяевами, и будут понятны обычно специалистам в данной области.
Клетки-хозяева также могут быть использованы для получения частей интактных антител, таких как Fab-фрагменты или scFv-молекулы. Следует понимать, что варианты указанного выше способа входят в объем настоящего изобретения. Например, в конкретных вариантах осуществления желательной может быть трансфекция клетки-хозяина ДНК, кодирующей легкую цепь или тяжелую цепь (но не обе) антитела по данному изобретению. Также можно использовать технологию рекомбинантных ДНК для удаления некоторых или всех ДНК, кодирующих любую из легкой и тяжелой цепи или обе, которые не являются необходимыми для связывания с IL-13, в частности, hIL-13. Молекулы, экспрессируемые из таких укороченных молекул ДНК, также входят в антитела по изобретению. Кроме того, могут быть получены бифункциональные антитела, в которых одна тяжелая и одна легкая цепь являются антителом по изобретению, а другая тяжелая и другая легкая цепь являются специфичными для антигена, отличного от IL-13, путем перекрестного связывания антитела по изобретению со вторым антителом стандартными химическими способами поперечного связывания.
В подходящей системе для рекомбинантной экспрессии антитела или его антигенсвязывающей части по изобретению рекомбинантный экспрессирующий вектор, кодирующий как тяжелую цепь антитела, так и легкую цепь антитела, вводят в клетки dhfr-CHO опосредованной фосфатом кальция трансфекцией. В рекомбинантном экспрессирующем векторе гены тяжелой и легкой цепи антитела, каждый, функционально связываются с регуляторными элементами энхансером CMV/промотором AdMLP для запуска высоких уровней транскрипции генов. Рекомбинантный экспрессирующий вектор также несет ген DHFR, который обеспечивает возможность селекции клеток CHO, трансфицированных вектором с использованием селекции метотрексатом/амплификации. Выбранные трансформанты клеток-хозяев культивируют, обеспечивая возможность экспрессии тяжелых и легких цепей антитела, и интактное антитело выделяют из среды для культивирования. Для получения рекомбинантного экспрессирующего вектора, трансфекции клеток-хозяев, селекции трансформантов, культивирования клеток-хозяев и выделения антитела из среды для культивирования используют стандартные способы молекулярной биологии.
При использовании рекомбинантных способов антитело можно получать внутриклеточно, в периплазматическом пространстве или непосредственно секретируемым в среду. В одном из аспектов, если антитело получают внутриклеточно, в качестве первой стадии, могут быть удалены продукты распада клеток-хозяев или лизированных клеток в виде макрочастиц (например, получаемые при гомогенизации), например, путем центрифугирования или ультрафильтрации. Если антитело секретируется в среду, то супернатанты таких систем экспрессии сначала можно концентрировать с использованием коммерчески доступного концентрирующего фильтра для белков, например, ультрафильтрационной установки Amicon™ или Millipore Pellicon™.
До способа по изобретению способы очистки антител от продуктов распада клеток исходно зависели от участка экспрессии антитела. Некоторые антитела могут секретироваться непосредственно из клетки в окружающие среды для выращивания; другие получают внутриклеточно. Для последних антител первая стадия способа очистки обычно включает: лизис клетки, который можно осуществлять множеством способов, включая механический сдвиг, осмотический шок или обработку ферментами. Такое разрушение высвобождает полное содержимое клетки в гомогенат, и, кроме того, получаются субклеточные фрагменты, которые трудно удалять по причине их малого размера. Как правило, их удаляют дифференциальным центрифугированием или фильтрацией. Если антитело секретируется, то супернатанты таких систем экспрессии, как правило, сначала концентрируют с использованием коммерчески доступного концентрирующего фильтра для белков, например, ультрафильтрационной установки Amicon™ или Millipore Pellicon™. Если антитело секретируется в среду, то рекомбинантные клетки-хозяева также можно отделить от среды для культивирования клеток, например, путем тангенциальной проточной фильтрации. Антитела могут быть дополнительно выделены из среды для культивирования с использованием способов очистки антитела по изобретению.
3.2. Пример стратегии получения
В конкретных вариантах осуществления начальная стадия получения антитела против IL-13 включает использование действий в роллерных колбах и мешках для культивирования Biowave для наращивания экспрессирующих антитело против IL-13 клеток CHO из одного замороженного сосуда до желаемой биомассы для инокуляции 110-литрового биореактора для выращивания посевного материала. Замороженный сосуд клеток CHO из Master Cell Bank размораживают и помещают в среду для выращивания (SR-512) и центрифугируют. Клетки ресуспендируют в среде для выращивания и наращивают при 37°C и 5% CO2 в одноразовых роллерных колбах, встряхиваемых колбах и/или мешках для культивирования Biowave увеличивающегося объема. Дублирующие 20-литровые мешки для культивирования используют для максимизации наращивания конечной клеточной массы до инокуляции в биореактор для выращивания посевного материала. Когда плотность клеток достигает значения ≥2,0×106 жизнеспособных клеток/мл из обоих 20-литровых мешков для культивирования приблизительно на 15-17 день, культуру переносят в 110-литровый биореактор для выращивания посевного материала, заполненный средой для выращивания SR-520 для дальнейшего наращивания. После инокуляции целевая температура составляет 37°C, и pH устанавливают на целевое значение 7,1 и регулируют добавлением NaOH и барботированием CO2. Растворенный кислород (DO) в биореакторе настраивают на целевое значение 40% посредством барботирования воздухом и кислородом. Когда плотность клеток достигает значения ≥2,6×106 жизнеспособных клеток/мл через приблизительно 2-4 дня, культуру переносят в 3000-литровый производственный биореактор.
В конкретных вариантах осуществления для дальнейшего наращивания культуры клеток используют частичное заполнение 3000-литрового производственного биореактора. Исходно реактор заполняют средой для выращивания (SR-520) и инокулируют партией из 110-литрового биореактора для выращивания посевного материала. В течение данной стадии неполного заполнения температуру, растворенный кислород и pH настраивают на 37°C, 40% и 7,1, соответственно. Величину pH культуры регулируют барботированием CO2 и добавлением NaOH. Как правило, клетки выращивают в течение 2-4 дней до достижения плотности на стадии получения ≥1,6×106 жизнеспособных клеток/мл.
Среду для получения SR-521 (1950 л) добавляют к культуре клеток в 3000-литровый биореактор для инициации стадии получения. Пеногаситель C добавляют для снижения пенообразования. Величину pH культуры настраивают на целевое значение 6,9 барботированием CO2 по принципу "включено-выключено" и добавлением NaOH. Температуру и растворенный кислород настраивают на целевые значения 35°C и 40%, соответственно. DO в биореакторе исходно настраивают на желаемое значение барботированием воздухом и добавлением чистого кислорода при необходимости. В конкретных вариантах осуществления температуру снижают до целевого значения 33°C при достижении плотности жизнеспособных клеток ≥3,0×106 клеток/мл, и pH и DO поддерживают при целевых значениях 6,9 и 40%, соответственно, в то время как в других вариантах осуществления поддерживают целевое значение 35°C. Глюкозу (SR-334) добавляют по мере необходимости. Культуры собирают и очищают, как указано ниже, когда жизнеспособность клеток снижается до значения ≤50%.
4. Очистка антитела
4.1 Очистка антитела в целом
Изобретение относится к способам получения очищенного (или "со сниженным содержанием HCP") препарата антитела из смеси, содержащей антитело и по меньшей мере один HCP. Настоящее изобретение также относится к способам, где в конечном очищенном препарате снижено содержание выщелоченного белка A. Способ очистки по изобретению начинают со стадии отделения, когда антитело получают с использованием описанных выше способов и общепринятых в данной области способов. В таблице 1 приведен один из вариантов осуществления схемы очистки. Варианты данной схемы, включая, но не ограничиваясь ими, варианты, где пропускают стадию аффинной хроматографии с белком А или изменяют порядок стадий ионного обмена, предусмотрены и включены в объем данного изобретения.
Как только получают очищенный раствор или смесь, содержащую антитело, отделение антитела от других белков, продуцируемых клеткой, таких как HCP, осуществляют с использованием сочетания различных способов очистки, включая стадию (стадии) ионообменного разделения и стадию (стадии) разделения с гидрофобным взаимодействием. На стадии (стадиях) разделения разделяют смеси белков на основе их заряда, степени гидрофобности или размера. В одном из аспектов изобретения разделение осуществляют с использованием хроматографии, включая катионную, анионную и с гидрофобным взаимодействием. Для каждого из данных способов доступны некоторые различные хроматографические смолы, обеспечивающие возможность точной настройки схемы очистки для конкретных включенных белков. Сущность каждого из способов разделения состоит в том, что можно заставить белки проходить через колонку с различными скоростями, достигая физического разделения, которое повышается по мере их прохождения через колонку, или селективно присоединяться к среде для разделения, затем дифференциально элюировать их различными растворителями. В некоторых случаях антитело отделяют от примесей, если примеси специфически прилипают к колонке, а антитело - нет, т.е. антитело присутствует в элюате.
Как указано выше, точная настройка схемы очистки зависит от индивидуальных особенностей белка, подвергаемого очистке. В конкретных вариантах осуществления стадии разделения по настоящему изобретению применимы для отделения антитела от одного или нескольких HCP. Антитела, которые успешно очищают с использованием описанных в настоящем документе способов, включают, но не ограничиваются ими, антитела человека IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 и IgM. В конкретных вариантах осуществления стратегии очистки по настоящему изобретению исключают использованием аффинной хроматографии с белком А, например, в отношении очистки антител IgG3, поскольку антитела IgG3 неэффективно связываются с белком A. Другие факторы, предусматривающие конкретную настройку схемы очистки, включают, но не ограничиваются ими: наличие или отсутствие Fc-области (например, в отношении полноразмерного антитела по сравнению с его Fab-фрагментом), поскольку белок A связывается с Fc-областью; конкретные последовательности зародышевой линии, используемые при получении представляющего интерес антитела; и аминокислотный состав антитела (например, первичная последовательность антитела, а также общий заряд/гидрофобность молекулы). Антитела, имеющие одну или несколько общих характеристик, можно очищать с использованием стратегий очистки, настроенных с учетом данной характеристики.
4.2 Первичное выделение
Начальные стадии способов очистки по настоящему изобретению включают первую фазу очистки от примесей и первичное выделение антитела из матрицы образца. Кроме того, процесс первичного выделения также может быть стадией, на которой снижают или инактивируют вирусы, которые могут присутствовать в матрице образца. Например, любой один или несколько из множества способов снижения/инактивации вирусов можно использовать в течение фазы первичного выделения при очистке, включая термическую инактивацию (пастеризацию), инактивацию pH, обработку растворителем/детергентом, облучение УФ и рентгеновским излучением и добавление конкретных химических инактивирующих средств, таких как β-пропиолактон или, например, фенантролин меди, как в патенте США № 4534972, полное содержание которого включено в настоящий документ путем ссылки. В конкретных вариантах осуществления настоящего изобретения матрицу образца подвергают снижению/инактивации вирусов посредством pH в течение фазы первичного выделения.
Способы снижения/инактивации вирусов посредством pH включают, но не ограничиваются ими, инкубацию смеси в течение периода времени при низком pH и последующую нейтрализацию pH и удаление частиц фильтрацией. В конкретных вариантах осуществления смесь инкубируют при pH от приблизительно 2 до 5, при pH от приблизительно 3 до 4, включая, но не ограничиваясь этим, при pH приблизительно 3,5. Величину pH смеси образца можно снизить любой подходящей кислотой включая, но не ограничиваясь ими, лимонную кислоту, уксусную кислоту, каприловую кислоту или другие подходящие кислоты. Выбор уровня pH в основном зависит от профиля стабильности препарата антитела и компонентов буфера. Известно, что на качество целевого антитела при снижении/инактивации вирусов низким pH влияют величина pH и длительность инкубации с низким pH. В конкретных вариантах осуществления длительность инкубации с низким pH будет составлять от 0,5 часов до 2 часов, включая, но не ограничиваясь этим, от 0,5 часов до 1,5 часов, и включая, но не ограничиваясь этим, длительность приблизительно 1 час. В дополнение к концентрации белка, снижение/инактивация вирусов зависит от тех параметров, которые могут ограничивать снижение/инактивацию при высоких концентрациях. Таким образом, для достижения желаемого уровня снижения/инактивации вирусов можно выбрать подходящие параметры концентрации белка, pH и длительности снижения/инактивации.
В конкретных вариантах осуществления снижения/инактивации вирусов можно добиться посредством применения подходящих фильтров. Неограничивающим примером подходящего фильтра является фильтр Ultipor DV50™ от Pall Corporation. Хотя в конкретных вариантах осуществления настоящего изобретения используют такую фильтрацию в процессе фазы первичного выделения, в других вариантах осуществления ее используют в других фазах способа очистки, включая в виде предпоследней или конечной стадии очистки. В конкретных вариантах осуществления для снижения/инактивации вирусов используют альтернативные фильтры, такие как, но не ограничиваясь ими, фильтры Viresolve™ (Millipore, Billerica, Mass.); фильтры Zeta Plus VR™ (CUNO; Meriden, Conn.); и фильтры Planova™ (Asahi Kasei Pharma, Planova Division, Buffalo Grove, I11.).
В тех вариантах осуществления, где используют снижение/инактивацию вирусов, смесь образца по мере необходимости может быть приспособлена для дополнительных стадий очистки. Например, после снижения/инактивации вирусов низким pH величину pH смеси образца обычно доводят перед продолжением способа очистки до более нейтрального pH, например, от приблизительно 4,5 до приблизительно 8,5 и, включая, но не ограничиваясь этим, приблизительно 4,9. Дополнительно, для получения желаемой проводимости смесь можно промыть водой для инъекций (WFI).
В конкретных вариантах осуществления для дополнительной очистки матрицы образца от примесей первичное выделение будет включать одну или несколько стадий центрифугирования и, таким образом, способствовать очистке антител против IL-13. Центрифугирование образца можно проводить, например, но не ограничиваясь этим, при скорости от 7000×g до приблизительно 12750×g. Что касается крупномасштабной очистки, то такое центрифугирование можно осуществлять в реальном времени со скоростью потока, установленной для достижения, например, но не ограничиваясь этим, уровня мутности в получаемом супернатанте 150 NTU. Затем такой супернатант можно собирать для дополнительной очистки.
В конкретных вариантах осуществления первичное выделение будет включать использование одной или нескольких стадий глубинной фильтрации для дополнительной очистки матрицы образца от примесей и, таким образом, способствовать очистке антитела по настоящему изобретению. Глубинные фильтры содержат фильтрационные материалы, обладающие градуируемой плотностью. Такая градуируемая плотность позволяет захватывать более крупные частицы рядом с поверхностью фильтра, в то время как меньшие частицы проникают через большие площади живого сечения на поверхности фильтра только для захвата меньшими отверстиями ближе к центру фильтра. В конкретных вариантах осуществления стадия глубинной фильтрации может быть стадией обезжиривающей глубинной фильтрации. Хотя в конкретных вариантах осуществления используют стадии глубинной фильтрации только в процессе фазы первичного выделения, в других вариантах осуществления используют глубинные фильтры, включая обезжиривающие глубинные фильтры, в процессе одной или нескольких дополнительных фаз очистки. Неограничивающие примеры глубинных фильтров, которые могут быть использованы в отношении настоящего изобретения, включают глубинные фильтры Cuno™ модели 30/60ZA (3M Corp.) и двухслойные фильтрующие картриджи 0,45/0,2 мкм Sartopore™.
4.3 Аффинная хроматография
В конкретных вариантах осуществления первично выделенный образец подвергают аффинной хроматографии для дополнительной очистки представляющего интерес антитела от HCP. В конкретных вариантах осуществления хроматографический материал способен избирательно или специфически связываться с представляющим интерес антителом. Неограничивающие примеры такого хроматографического материала включают: белок A, белок G, хроматографический материал, содержащий антиген, связываемый представляющим интерес антителом, и хроматографический материал, содержащий Fc-связывающий белок. В конкретных вариантах осуществления на стадии аффинной хроматографии включает помещение первично выделенного образца на колонку, содержащую подходящую смолу с белком A. Смола с белком A применима для аффинной очистки и выделения многообразных изотипов антител, в частности, IgG1, IgG2 и IgG4. Белок A представляет собой белок стенки бактериальной клетки, который связывается с IgG млекопитающих, главным образом, через их Fc-области. В своем природном состоянии белок A имеет пять IgG-связывающих доменов, а также другие домены неизвестной функции.
Существует несколько коммерческих источников смолы с белком A. Подходящие смолы включают, но не ограничиваются ими, MabSelect™ от GE Healthcare и ProSep Ultra Plus™ от Millipore. Неограничивающим примером подходящей колонки, заполненной MabSelect™, является колонка диаметром приблизительно 1,0 см и длиной приблизительно 21,6 см (~17 мл объема слоя). Колонку данного размера можно использовать для маломасштабной очистки, и ее можно сравнить с другими колонками, используемыми для масштабирования. Например, для более масштабной очистки можно использовать колонку 20 см × 21 см, объем слоя которой составляет приблизительно 6,6 л. Независимо от колонки, ее можно заполнять с использованием подходящей смолы, такой как MabSelect™ или ProSep Ultra Plus™.
В конкретных вариантах осуществления предпочтительно идентифицировать эффективность динамического связывания (DBC) смолы с белком A для настройки очистки под конкретное представляющее интерес антитело. Например, но не ограничиваясь этим, DBC колонки MabSelect™ или ProSept Ultra Plus™ можно определить с использованием стратегии скорости потока однократной нагрузки или двойной нагрузки. Скорость потока однократной нагрузки может быть определена при скорости приблизительно 300 см/час на всем протяжении периода нагрузки. Скорость потока двойной нагрузки можно определить путем нагрузки колонки приблизительно до 35 мг белка/мл смолы при линейной скорости приблизительно 300 см/час, затем снижая линейную скорость наполовину, делая возможным более длительное время обработки для последней части нагрузки.
В конкретных вариантах осуществления колонка с белком A может быть уравновешена подходящим буфером до нагрузки образца. Неограничивающим примером подходящего буфера является буфер Трис/NaCl, pH приблизительно 7,2. Неограничивающим примером подходящих условий уравновешивания является 25 мМ Трис, 100 мМ NaCl, pH приблизительно 7,2. После данного уравновешивания образец может быть нагружен на колонку. После нагрузки колонки ее можно промыть один или несколько раз с использованием, например, равновесного буфера. До элюирования из колонки можно использовать другие промывки, включая промывки с использованием различных буферов. Например, колонку можно промывать с использованием одного или нескольких объемов колонки 20 мМ лимонной кислоты/цитрата натрия, 0,5 Μ NaCl при pH приблизительно 6,0. После этой промывки может быть необязательно осуществлена одна или несколько промывок с использованием равновесного буфера. Затем можно проводить элюирование из колонки с белком A, используя соответствующий элюирующий буфер. Неограничивающим примером подходящего элюирующего буфера является буфер уксусная кислота/NaCl, pH приблизительно 3,5. Подходящими условиями являются, например, 0,1 Μ уксусная кислота, pH приблизительно 3,5. Мониторинг элюата можно проводить с использованием способов, хорошо известных специалистам в данной области. Например, затем можно определять поглощение при OD280. Элюат из колонки можно собирать, начиная с исходного отклонения приблизительно 0,5 о.е. до считывания приблизительно 0,5 о.е. на заднем фронте пика элюирования. Затем представляющую интерес элюированную фракцию (фракции) можно подготавливать к дополнительной обработке. Например, собранный образец можно титровать до pH приблизительно 5,0 с использованием Трис (например, 1,0 M) при pH приблизительно 10. Необязательно, данный титрованный образец можно фильтровать и дополнительно обрабатывать.
4.4 Ионообменная хроматография
В конкретных вариантах осуществления настоящее изобретение относится к способам получения препарата антитела с пониженным содержанием HCP из смеси, содержащей антитело и по меньшей мере один HCP, подвергая смесь по меньшей мере одной стадии ионообменного разделения таким образом, что получают элюат, содержащий антитело. Ионообменное разделение включает любой способ, которым разделяют два вещества на основе разницы их соответствующих ионных зарядов, и можно использовать катионообменный материал или анионообменный материал.
Использование катионообменного материала по сравнению с анионообменным материалом основано на общем заряде белка. Таким образом, в объем данного изобретения входит использованием стадии анионного обмена перед использованием стадии катионного обмена, или стадии катионного обмена перед использованием стадии анионного обмена. Кроме того, в объем данного изобретения входит использованием только стадии катионного обмена, только стадии анионного обмена, или любое последовательное сочетание двух стадий.
При осуществлении разделения исходную смесь антител можно приводить в контакт с ионообменным материалом путем использования любого из множества способов, например, путем использования периодического способа очистки или хроматографического способа.
Например, в случае периодической очистки ионообменный материал приготавливают в желаемом стартовом буфере или уравновешивают им. После приготовлении или уравновешивания получают суспензию ионообменного материала. Раствор антитела приводят в контакт с суспензией для абсорбции подлежащего разделению антитела ионообменным материалом. Раствор, содержащий HCP, не связывающиеся с ионообменным материалом, отделяют от суспензии, например, позволяя суспензии оседать и удаляя супернатант. Суспензию можно подвергать одной или нескольким стадиям промывки. При желании, суспензию можно приводить в контакт с раствором более высокой проводимости для десорбции HCP, которые связались с ионообменным материалом. Для элюирования связанных полипептидов можно повышать концентрацию соли в буфере.
В качестве способа ионообменного разделения также можно использовать ионообменную хроматографию. Методом ионообменной хроматографии разделяют молекулы на основе разницы общего заряда молекул. При очистке антитела для связывания антитело должно иметь заряд, противоположный заряду функциональной группы, присоединенной к ионообменному материалу, например, смоле. Например, антитела, которые как правило, имеют общий положительный заряд в буфере с pH ниже их pI, будут хорошо связываться с катионообменным материалом, содержащим отрицательно заряженные функциональные группы.
При ионообменной хроматографии заряженные участки на поверхности раствора притягиваются противоположными зарядами прикрепленных к хроматографической матрице групп, при условии, что ионная сила окружающего буфера является низкой. Как правило, элюирования достигают повышением ионной силы (т.е. проводимости) буфера для конкуренции с раствором для заряженных участков ионообменной матрицы. Изменение pH и, таким образом, изменение заряда раствора является другим путем достижения элюирования раствора. Изменение проводимости или pH может быть постепенным (градиентное элюирование) или поэтапным (ступенчатое элюирование).
В целях получения анионных или катионных подложек для хроматографии к матрицам могут быть присоединены анионные или катионные заместители. Неограничивающие примеры анионообменных заместителей включают диэтиламиноэтильную (DEAE), четвертичную аминоэтильную (QAE) и четвертичную аминную (Q) группы. Катионные заместители включают карбоксиметил (CM), сульфоэтил (SE), сульфопропил (SP), фосфат (P) и сульфонат (S). Целлюлозные ионобменные смолы, такие как DE23™, DE32™, DE52™, CM-23™, CM-32™ и CM-52Е доступны от Whatman Ltd. Maidstone, Kent, U.K. Также известны ионообменные материалы на основе SEPHADEX® с поперечными сшивками. Например, DEAE-, QAE-, CM- и SP-SEPHADEX® и DEAE-, Q-, CM-и S-SEPHAROSE® и SEPHAROSE® Fast Flow все доступны от Pharmacia AB.. Кроме того, DEAE- и CM-производные сополимера этиленгликоль-метакрилата, такие как TOYOPEARL™ DEAE-650S или M и TOYOPEARL™ CM-650S или Μ доступны от Toso Haas Co., Philadelphia, Pa. В конкретных вариантах осуществления стадию анионного обмена осуществляют с использованием мембранного картриджа Pall Mustang Q.
Смесь, содержащую антитело и примеси, например, HCP, нагружают на ионообменную колонку, такую как катионообменная колонка. Например, но не ограничиваясь этим, смесь можно нагружать при нагрузке приблизительно 80 г белка/л смолы в зависимости от используемой колонки. Примером подходящей катионообменной колонки является колонка диаметром 80 см и длиной 23 см, объем слоя которой составляет приблизительно 116 л. Затем нагруженную на данную катионную колонку смесь можно промывать промывочным буфером (уравновешивающим буфером). Затем антитело элюируют из колонки и получают первый элюат.
Данную стадию ионного обмена облегчает захват представляющего интерес антитела одновременно со снижением примесей, таких как HCP. В конкретных аспектах ионообменная колонка является катионообменной колонкой. Например, но не ограничиваясь этим, подходящей для такой катионообменной колонки смолой является смола CM HyperDF™. Данные смолы доступны от коммерческих источников, таких как Pall Corporation. Данный способ катионного обмена можно осуществлять при комнатной температуре или близкой к ней.
4.5 Ультрафильтрация/Диафильтрация
В конкретных вариантах осуществления настоящего изобретения для дополнительной очистки и концентрирования образца антитела используют стадии ультрафильтрации и/или диафильтрации. Ультрафильтрация подробно описана в публикации: Microfiltration and Ultrafiltration: Principles and Applications, L. Zeman и A. Zydney (Marcel Dekker, Inc., New York, N.Y., 1996); и в публикации: Ultrafiltration Handbook, Munir Cheryan (Technomic Publishing, 1986; ISBN No. 87762-456-9). Одним из способов фильтрации является тангенциальная проточная фильтрация, как описано в каталоге Millipore, названном "Pharmaceutical Process Filtration Catalogue", pp. 177-202 (Bedford, Mass., 1995/96). Как правило, ультрафильтрация предполагает обозначение фильтрации с использованием фильтров с размером пор менее чем 0,1 мкм. Используя фильтры, имеющие столь малый размер пор, можно снижать объем образца посредством пропускания буфера для образцов через фильтр, в то время как антитела остаются ниже фильтра.
Диафильтрация представляет собой способ с использованием ультрафильтров для удаления и обмена солей, сахаров и неводных растворителей, для отделения от не связавшихся молекул, для удаления низкомолекулярных материалов и/или для того, чтобы вызвать быстрое изменение ионных условий и/или условий pH. Микрорастворы наиболее эффективно удаляют добавлением растворителя в подвергнутый ультрафильтрации раствор при скорости, приблизительно равной скорости ультрафильтрации. Этим промывают микрочастицы из раствора при постоянном объеме, эффективно очищая оставшееся антитело. В конкретных вариантах осуществления настоящего изобретения, стадия диафильтрации применима для замены различных буферов, используемых в связи с настоящим изобретением, необязательно до дополнительной хроматографии или других стадий очистки, а также для удаления примесей из препаратов антител.
4.6 Хроматография с гидрофобным взаимодействием
Настоящее изобретение также предлагает способы получения препарата антитела с пониженным уровнем HCP из смеси, содержащей антитело и по меньшей мере один HCP, дополнительно включающие стадию разделения с гидрофобным взаимодействием. Например, первый элюат, получаемый из ионообменной колонки, можно помещать на материал с гидрофобным взаимодействием таким образом, что получают второй элюат, имеющий пониженный уровень HCP. Стадии хроматографии с гидрофобным взаимодействием, такие как описано в настоящем документе, как правило, осуществляют для удаления агрегатов белков, таких как агрегаты антител, и связанных со способом примесей.
При осуществлении разделения смесь образца приводят в контакт с HIC-материалом, например, используя периодический способ очистки или используя колонку. До HIC-очистки желательным может быть удаление любых хаотропных агентов или очень гидрофобных веществ, например, пропуская смесь через предколонку.
Например, в случае периодического способа очистки, HIC-материал приготавливают в желаемом уравновешивающем буфере или уравновешивают с ним. Получают суспензию HIC-материала. Раствор антитела приводят в контакт с суспензией для абсорбции подлежащего разделению антитела HIC-материалом. Раствор, содержащий HCP, которые не связываются с HIC-материалом, отделяют от суспензии, например, позволяя суспензии оседать и удаляя супернатант. Суспензию можно подвергать одной или нескольким стадиям промывки. При желании, суспензию можно приводить в контакт с раствором более низкой проводимости для десорбции антител, которые связались с HIC-материалом. Для элюирования связавшихся антител можно снижать концентрацию солей.
В то время как при ионообменной хроматографии рассчитывают на заряды антител для их выделения, в хроматографии с гидрофобным взаимодействием используют гидрофобные свойства антител. Гидрофобные группы на антителе взаимодействуют с гидрофобными группами на колонке. Чем более гидрофобный белок, тем сильнее он взаимодействует с колонкой. Таким образом, на стадии HIC удаляют примеси из клетки-хозяина (например, ДНК и другие высоко- и низкомолекулярные вещества, относящиеся к препарату).
Гидрофобные взаимодействия являются наиболее сильными при высокой ионной силе, таким образом, данную форму разделения обычно осуществляют после осаждения солей или ионообменных способов. Адсорбцию антитела на HIC-колонке предпочитают по причине высоких концентраций солей, но точные концентрации могут варьироваться в широком диапазоне в зависимости от природы антитела и конкретного выбранного HIC-лиганда. Различные ионы можно классифицировать по так называемым сериям Гофмейстера в зависимости от того, способствуют ли они гидрофобным взаимодействиям (эффекты высаливания) или разрушают структуру воды (хаотропный эффект) и приводят к ослаблению гидрофобного взаимодействия. Катионы располагают в порядке повышения эффекта высаливания Ba++; Ca++; Mg++; Li+; Cs+; Na+; K+; Rb+; NH4+, в то время как анионы можно располагать в порядке повышения хаотропного эффекта PO---; SO4--; CH3CO3-; Cl-; Br-; NO3-; ClO4-; I-; SCN-.
Как правило, сульфаты Na, Κ или NH4 эффективно способствуют лиганд-белковому взаимодействию при HIC. Могут быть составлены соли, которые влияют на силу взаимодействия, как задано следующим соотношением: (NH4)2SO4>Na2SO4>NaCl>NH4Cl>NaBr>NaSCN. В основном, применимы концентрации солей от приблизительно 0,75 до приблизительно 2 Μ сульфата аммония или от приблизительно 1 до 4 Μ NaCl.
HIC-колонки обычно содержат основную матрицу (например, агарозу с поперечными сшивками или синтетический сополимерный материал), с которой соединен гидрофобный лиганд (например, алкильные или арильные группы). Подходящая HIC-колонка содержит агарозную смолу, замещенную фенильными группами (например, колонка Phenyl Sepharose™). Многие HIC-колонки являются коммерчески доступными. Примеры включают, но не ограничиваются ими, колонку Phenyl Sepharose™ 6 Fast Flow с низким или высоким замещением (Pharmacia LKB Biotechnology, AB, Sweden); колонку Phenyl Sepharose™ High Performance (Pharmacia LKB Biotechnology, AB, Sweden); колонку Octyl Sepharose™ High Performance (Pharmacia LKB Biotechnology, AB, Sweden); колонки Fractogel™ EMD Propyl или Fractogel™ EMD Phenyl (E. Merck, Germany); подложки Macro-Prep™ Methyl или Macro-Prep™ t-Butyl (Bio-Rad, California); колонку WP ΗΙ-Propyl (C3)™ (J. T. Baker, New Jersey); и колонки Toyopearl™ на основе простого эфира, фенила или бутила (TosoHaas, PA)
4.7 Примеры стратегии очистки
В конкретных вариантах осуществления первичное выделение продолжают изначально используемыми стадиями центрифугирования и фильтрации для удаления клеток и продуктов распада клеток (включая HCP) из сбора клеток из производственного биореактора. Например, но не путем ограничения, культура, содержащая антитела, среду и клетки, может быть подвергнута центрифугированию при скорости от приблизительно 7000×g до приблизительно 11000×g. В конкретных вариантах осуществления полученный супернатант образца затем пропускают через фильтровальный тракт, содержащий многочисленные глубинные фильтры. В конкретных вариантах осуществления фильтровальный тракт содержит приблизительно двадцать 16-дюймовых глубинных фильтров Cuno™ модели 30/60ZA (3M Corp.) и приблизительно три круглых фильтровальных отделения, оснащенных тремя 30-дюймовыми фильтрующими элементами 0,45/0,2 мкм Sartopore™ 2 (Sartorius). Очищенный от примесей супернатант собирают в сосуд, такой как предварительно стерилизованный сосуд для сбора, и хранят приблизительно при 8°C. Затем эту температуру доводят до приблизительно 20°C перед стадией хроматографии с захватом или указанных ниже стадий. Следует отметить, что специалист в данной области может варьировать указанные выше условия, и все равно они будут входить в объем настоящего изобретения.
В конкретных вариантах осуществления после первичного выделения будут осуществлять аффинную хроматографию с использованием смолы с белком A. Существует несколько коммерческих источников смолы с белком A. Одной из подходящих смол является MabSelect™ от GE Healthcare. Примером подходящей колонки, заполненной MabSelect™, является колонка диаметром приблизительно 1,0 см и длиной приблизительно 21,6 см (~17 мл объема слоя). Колонку данного размера можно использовать для лабораторного масштаба. Ее можно сравнить с другими колонками, используемыми для масштабирования. Например, для коммерческого производства можно использовать колонку 20 см × 21 см, объем слоя которой составляет приблизительно 6,6 л. Независимо от колонки, колонку можно заполнять, используя подходящую смолу, такую как MabSelect™.
В конкретных аспектах колонку с белком A можно уравновешивать подходящим буфером до нагрузки образца. Примером подходящего буфера является буфер Трис/NaCl, pH от приблизительно 6 до 8, включая, но не ограничиваясь этим, приблизительно 7,2. Конкретным примером подходящих условий является 25 мМ Трис, 100 мМ NaCl, pH 7,2. После этого уравновешивания образец можно нагружать на колонку. После нагрузки колонки ее можно промыть один или несколько раз с применением, например, равновесного буфера. Перед элюированием из колонки можно использовать другие промывки, включая промывки с использованием различных буферов. Например, колонку можно промывать с использованием одного или нескольких объемов колонки 20 мМ лимонной кислоты/цитрата натрия, 0,5 Μ NaCl при pH приблизительно 6,0. После такой промывки, необязательно, можно осуществлять одну или несколько промывок с использованием равновесного буфера. Затем можно проводить элюирование из колонки с белком A, используя соответствующий элюирующий буфер. Примером подходящего элюирующего буфера является буфер уксусная кислота/NaCl, pH приблизительно 3,5. Подходящими условиями являются, например, 0,1 Μ уксусная кислота, pH 3,5. Мониторинг элюата можно проводить с использованием способов, хорошо известных специалистам в данной области. Например, затем можно определять поглощение при OD280. Элюат из колонки можно собирать, начиная с исходного отклонения приблизительно 0,5 о.е., до считывания приблизительно 0,5 о.е. на заднем фронте пика элюирования. Затем представляющую интерес элюированную фракцию (фракции) можно подготавливать к дальнейшей обработке. Например, собранный образец можно титровать до pH приблизительно 5,0 с использованием Трис (например, 1,0 M) при pH приблизительно 10. Необязательно, данный титрованный образец можно фильтровать и дополнительно обрабатывать.
Эффективность динамического связывания (DBC) колонки MabSelect™ можно определять с использованием стратегии скорости потока однократной нагрузки или двойной нагрузки. Скорость потока однократной нагрузки можно определять при скорости приблизительно 300 см/час на всем протяжении периода нагрузки. Скорость потока двойной нагрузки можно определять посредством нагрузки колонки до приблизительно 35 мг белка/мл смолы при линейной скорости приблизительно 300 см/час, затем снижая линейную скорость наполовину, делая возможным более длительное время обработки для последней части нагрузки.
Затем элюат с белком A может быть дополнительно очищен с использованием стадии pH-опосредованного снижения/инактивации вирусов. В конкретных вариантах осуществления данная стадия будет включать доведение pH элюата до величины от приблизительно 3 до приблизительно 5, включая, но не ограничиваясь этим, приблизительно 3,5, в течение приблизительно 1 часа. Снижение pH можно облегчить, используя известные препараты кислот, таких как лимонная кислота, например, 3 Μ лимонная кислота. Воздействие кислого pH снижает, если не полностью удаляет, pH-чувствительные вирусные загрязнения и осаждает некоторые загрязнения из среды/клеток. После данного этапа снижения/инактивации вирусов pH доводят до величины приблизительно 4,9 или 5,0, используя основание, такое как гидроксид натрия, например, 3 Μ гидроксид натрия, в течение приблизительно от двадцати до приблизительно сорока минут. Данное доведение можно проводить приблизительно при 20°C.
В конкретных вариантах осуществления скорректированную по pH культуру дополнительно очищают с использованием анионообменной колонки. Неограничивающим примером подходящей для данной стадии колонки является колонка диаметром 60 см и длиной 30 см, объем слоя которой составляет приблизительно 85 л. Колонку заполняют анионообменной смолой, такой как Q Sepharose™ Fast Flow от GE Healthcare. Колонку можно уравновешивать с использованием приблизительно семи объемов колонки соответствующего буфера, такого как Трис/хлорид натрия. Примером подходящих условий является 25 мМ Трис, 50 мМ хлорид натрия при pH 8,0. Специалисты в данной области могут варьировать условия, но они все равно будут входить в объем настоящего изобретения. Колонку нагружают собранным образцом с указанной выше стадии очистки белком A. В другом аспекте колонку нагружают элюатом, собранным при катионном обмене. После нагрузки колонки ее промывают уравновешивающим буфером (например, буфером Трис/хлорид натрия). Мониторинг содержащего антитело элюата можно проводить с использованием УФ-спектрофотометра при OD280нм. Данная стадия анионного обмена снижает количество связанных со способом примесей, таких как нуклеиновые кислоты, подобные ДНК, и белки клетки-хозяина. Разделение происходит за счет того, что представляющие интерес антитела по существу не взаимодействуют и не связываются с твердой фазой колонки, например, с Q Sepharose™, но многие примеси взаимодействуют и связываются с твердой фазой колонки. Анионный обмен можно осуществлять приблизительно при 12°C.
В конкретных вариантах осуществления скорректированную по pH культуру затем можно очищать с использованием катионообменной колонки. В конкретных вариантах осуществления используемый в катионообменной колонке равновесный буфер представляет собой буфер с pH приблизительно 5,0. Примером подходящего буфера является приблизительно 210 мМ ацетат натрия, pH 5,0. После уравновешивания колонку нагружают образцом, полученным на стадии первичного выделения выше. Колонку заполняют катионообменной смолой, такой как CM Sepharose™ Fast Flow от GE Healthcare. Затем колонку промывают с использованием равновесного буфера. Затем колонку подвергают стадии элюирования, используя буфер с большей ионной силой по сравнению с равновесным или промывочным буфером. Например, подходящим элюирующим буфером может быть приблизительно 790 мМ ацетат натрия, pH 5,0. Антитела элюируют, и их мониторинг можно проводить с использованием УФ-спектрофотометра, настроенного на OD280нм. В конкретном примере сбор при элюировании можно осуществлять от верхней стороны пика при 3 OD280нм до нижней стороны пика при 8 OD280нм. Следует понимать, что специалист в данной области может варьировать условия, и они все равно будут входить в объем изобретения.
В конкретных вариантах осуществления скорректированную по pH культуру, катионообменный элюат или анионообменный элюат фильтруют с использованием, например, 16-дюймового обезжиривающего фильтра Cuno™. После этой фильтрации с использованием обезжиривающего фильтра можно осуществлять фильтрацию, например, с использованием 30-дюймового двухслойного фильтрующего картриджа 0,45/0,2 мкм Sartopore™. Ионообменный элюирующий буфер можно использовать для промывки остаточного объема, оставшегося в фильтрах и подготовленного к ультрафильтрации/диафильтрации.
Для осуществления стадии ультрафильтрации/диафильтрации фильтрационную среду приготавливают в подходящем буфере, например, 20 мМ фосфате натрия, pH 7,0. Для повышения ионной силы можно добавлять соль, такую как хлорид натрия, например, 100 мМ хлорид натрия. Данная стадия ультрафильтрации/диафильтрации служит для концентрирования антител против IL-13, удаления ацетата натрия и доведения pH. Для осуществления данной стадии доступны коммерческие фильтры. Например, Millipore производит ультрафильтрующую целлюлозную мембранную кассету, отсекающую по молекулярной массе 30 кДа (MWCO). Данный способ фильтрации можно проводить при комнатной температуре или близкой к ней.
В конкретных вариантах осуществления образец с указанной выше стадии фильтрации с захватом подвергают второй стадии ионообменного разделения. В конкретных вариантах осуществления такое второе ионообменное разделение будет включать разделение на основе противоположного заряда первого ионообменного разделения. Например, если после первичного выделения используют стадию анионного обмена, то вторая стадия ионообменной хроматографии может быть стадией катионного обмена. Наоборот, если после стадии первичного выделения осуществляли стадию катионного обмена, то после этой стадии будут осуществлять стадию анионного обмена. В конкретных вариантах осуществления элюат первого ионного обмена можно непосредственно подвергать второй стадии ионообменной хроматографии, где элюат первого ионного обмена доводят до соответствующих условий буфера. Подходящие материалы и условия для анионного и катионного разделения описаны выше.
В конкретных вариантах осуществления настоящего изобретения образец, содержащий антитела, будут дополнительно обрабатывать с использованием стадии разделения с гидрофобным взаимодействием. Неограничивающим примером подходящей для такой стадии колонки является колонка диаметром 80 см и длиной 15 см, объем слоя которой составляет приблизительно 75 л, заполненная соответствующей смолой, используемой для HIC, такой как, но не ограничиваясь этим, Phenyl HP Sepharose™ от Amersham Biosciences, Upsala, Sweden. Проточный препарат, получаемый на предыдущей стадии анионообменной хроматографии, содержащий представляющие интерес антитела, может быть разведен равным объемом приблизительно 1,7 Μ сульфата аммония, 50 мМ фосфата натрия, pH 7,0. Затем он может быть подвергнут фильтрации с использованием двухслойного фильтра 0,45/0,2 мкм Sartopore™ 2 или его эквивалента. В конкретных вариантах осуществления способ хроматографии с гидрофобным взаимодействием включает два или несколько циклов.
В конкретных вариантах осуществления HIC-колонку сначала уравновешивают с использованием подходящего буфера. Неограничивающим примером подходящего буфера является 0,85 Μ сульфат аммония, 50 мМ фосфат натрия, pH 7,0. Специалист в данной области может варьировать равновесный буфер посредством изменения концентраций буферных средств и/или замены эквивалентных буферов, и он все равно будет входить в объем настоящего изобретения. В конкретных вариантах осуществления колонку затем нагружают анионообменным проточным образцом и промывают несколько раз, например, три раза, соответствующей буферной системой, такой как сульфат аммония/фосфат натрия. Пример подходящей буферной системы включает буфер 1,1 Μ сульфата аммония, 50 мМ фосфата натрия с pH приблизительно 7,0. Необязательно, колонку можно подвергать дополнительным циклам промывки. Например, второй цикл промывки может включать несколько промывок колонки, например, от одного до семи раз, с использованием соответствующей буферной системы. Неограничивающий пример подходящей буферной системы включает 0,85 М сульфат аммония, 50 мМ фосфат натрия, pH 7,0. В одном из аспектов нагруженную колонку подвергают еще и третьей промывке с использованием соответствующей буферной системы. Колонку можно промывать несколько раз, например, от одного до трех раз, с использованием буферной системы, такой как 1,1 Μ сульфат аммония, 50 мМ фосфат натрия при pH приблизительно 7,0. Кроме того, специалист в данной области может варьировать буферные условия, и они все равно будут входить в объем настоящего изобретения.
Элюирование из колонки проводят с использованием соответствующего элюирующего буфера. Подходящим примером такого элюирующего буфера является 0,5 Μ сульфат аммония, 15 мМ фосфат натрия при pH приблизительно 7,0. Представляющие интерес антитела могут быть определены и собраны с использованием общепринятого спектрофотометра от верхней стороны пика при 3 OD280нм до нижней стороны пика при 3 OD280нм.
В конкретных аспектах изобретения элюат со стадии хроматографии с гидрофобным взаимодействием подвергают фильтрации для удаления вирусных частиц, включая интактные вирусы, если таковые имеются. Неограничивающим примером подходящего фильтра является фильтр Ultipor DV50™ от Pall Corporation. На данной стадии фильтрации можно использовать другие вирусные фильтры, и они хорошо известны специалистам в данной области. HIC-элюат пропускают через предварительно увлажненный фильтр приблизительно 0,1 мкм и 2×30-дюймовый фильтровальный тракт Ultipor DV50™ приблизительно при 34 фунтов/кв. дюйм. В конкретных вариантах осуществления после способа фильтрации фильтр промывают с использованием, например, HIC-элюирующего буфера для удаления любых антител, остающихся в фильтровальном отделении. Фильтрат можно хранить в предварительно стерилизованном контейнере приблизительно при 12°C.
В конкретных вариантах осуществления указанный выше фильтрат снова можно подвергать ультрафильтрации/диафильтрации. Эта стадия является важной, если конечной точкой для специалиста является применение антитела, например, в фармацевтическом составе. При использовании данного способа можно облегчить концентрирование антитела, удаление ранее использованных буферных солей и их замену конкретным составом буфера. В конкретных вариантах осуществления проводят непрерывную диафильтрацию несколькими объемами, например, двумя объемами, состава буфера. Неограничивающим примером подходящего состава буфера является буфер 5 мМ метионина, 2% маннита, 0,5% сахарозы, pH 5,9 (без Tween). После завершения данного двухобъемного обмена концентрируют антитела. После достижения предварительно определенной концентрации антитела специалист затем может вычислить количество 10% Tween, который необходимо добавить для достижения конечной концентрации Tween приблизительно 0,005% (об./об.).
Конкретные варианты осуществления настоящего изобретения включают дополнительные стадии очистки. Примеры дополнительных способов очистки, которые можно осуществлять до, в течение или после способа ионообменной хроматографии, включают осаждение этанолом, изоэлектрофокусирование, обращено-фазную ВЭЖХ, хроматографию на силикагеле, хроматографию на гепарин-Sepharose™, дополнительную анионообменную хроматографию и/или дополнительную катионообменную хроматографию, хроматофокусирование, SDS-PAGE (электрофорез в ПААГ в присутствие SDS), осаждение сульфатом аммония, хроматографию на гидроксиапатите, электрофорез в геле, диализ и аффинную хроматографию (например, с использованием белка G, антитела, специфичного субстрата, лиганда или антигена в качестве реактива для захвата).
В конкретных вариантах осуществления настоящего изобретения антитело против IL-13 является антителом изотипа IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 или IgM, содержащим последовательности вариабельных областей тяжелой и легкой цепи, представленные на фигуре 1. В конкретных вариантах осуществления антитело против IL-13 является антителом изотипа IgG1, IgG2, IgG3 или IgG4, содержащим последовательности вариабельных областей тяжелой и легкой цепи, представленные на фигуре 1.
5. Способы анализа чистоты образца
5.1 Анализ белков клетки-хозяина
Настоящее изобретение также относится к способам определения остаточных уровней концентрации белков клетки-хозяина (HCP) в композиции выделенного/очищенного антитела. Как описано выше, желательно исключать HCP из конечного препарата целевого вещества, например, антитела против IL-13. Примеры HCP включают белки, происходящие из источника получения антитела. Неспособность идентифицировать и в достаточной степени удалять HCP из целевого антитела может приводить к снижению эффективности и/или побочным эффектам.
Как используется в настоящем документе, термин "HCP ELISA" относится к ELISA, где используемое в анализе второе антитело является специфичным к HCP, полученным из клеток, например, клеток CHO, используемых для получения антитела (например, антитела против IL-13). Второе антитело можно получать согласно общепринятым способам, известным специалистам в данной области. Например, второе антитело можно получать с использованием HCP, полученным посредством симуляции получения и серий очистки, т.е. используют ту же клеточную линию, что и для получения представляющего интерес антитела, но клеточная линия не трансфицируется ДНК антитела. В примере варианта осуществления второе антитело получают с использованием HPC, схожих с HPC, экспрессируемыми в выбранной клеточной системе экспрессии, т.е. клеточной системе экспрессии, используемой для получения целевого антитела.
Как правило, HCP ELISA включает наслаивание жидкого образца, содержащего HCP, между двумя слоями антител, т.е. первым антителом и вторым антителом. Образец подвергают инкубации, в течение которой HCP в образце захватываются первым антителом, например, но не ограничиваясь этим, аффинно очищенным (Cygnus) козьим антителом против CHO. Добавляют меченое второе антитело или смесь антител, специфичных к HCP, полученным из клеток, используемых для получения антител, например, биотинилированное антитело против HCP CHO, и оно связывается с HCP в образце. В конкретных вариантах осуществления первые и вторые антитела являются поликлональными антителами. В конкретных аспектах первые и вторые антитела являются смесями поликлональных антител, индуцированных против HCP, например, но не ограничиваясь этим, смесь биотинилированных козьих антител против белка клетки-хозяина 599/626/748. Количество HCP, содержащихся в образце, определяют с использованием соответствующего теста на основе метки второго антитела.
HCP ELISA можно использовать для определения уровня HCP в композиции антитела, такой как элюат или элюат (flow-through), полученный с использованием описанного выше способа. Настоящее изобретение также относится к композиции, содержащей антитело, где композиция не обладает определяемым уровнем HCP, как определяют твердофазным иммуноферментным анализом HCP ("ELISA").
5.2 Анализ материала для аффинной хроматографии
В конкретных вариантах осуществления настоящее изобретение также относится к способам определения остаточных уровней материала для аффинной хроматографии в композиции выделенного/очищенного антитела. В конкретном контексте такой материал выщелачивают в композиции антитела в течение способа очистки. В конкретных вариантах осуществления используют анализ для идентификации концентрации белка A в композиции выделенного/очищенного антитела. Как используется в настоящем документе, термин " ELISA с белком A" относится к ELISA, где используемое в анализе второе антитело является специфичным к белку A, используемому для очистки представляющего интерес антитела, например, антитела против IL-13. Второе антитело можно получать согласно общепринятым способам, известным специалистам в данной области. Например, второе антитело можно получать с использованием природного или рекомбинантного белка A в случае общепринятых способов получения и продуцирования антител.
Как правило, ELISA с белком A включает наслаивание жидкого образца, содержащего белок A (или возможно содержащего белок A), между двумя слоями антитела против белка A, т.е. первого антитела против белка A и второго антитела против белка A. Образец подвергают воздействию первого слоя антитела против белка A, например, но не ограничиваясь этим, поликлональных антител или смесей поликлональных антител, и инкубируют в течение периода времени, достаточного для захвата белка A в образце первым антителом. Затем добавляют меченое второе антитело, например, но не ограничиваясь этим, поликлональные антитела или смеси поликлональных антител, специфичных к белку A, и они связываются с захваченным беком A в образце. Дополнительные неограничивающие примеры антител против белка A, применимых в случае настоящего изобретения, включают антитело курицы против белка A и биотинилированные антитела против белка A. Содержащееся в образце количество белка A определяют с использованием соответствующего теста на основе метки второго антитела. Подобные анализы можно использовать для идентификации концентрации альтернативных материалов для аффинной хроматографии.
ELISA с белком A можно использовать для определения уровня белка A в композиции антитела, такой как элюат или фильтрат (flow-through), полученный с использованием описанного выше способа. Настоящее изобретение также относится к содержащей антитело композиции, где композиция не обладает определяемым уровнем белка A, как определяют твердофазным иммуноферментным анализом белка A ("ELISA").
6. Дополнительные модификации
Антитела по настоящему изобретению можно модифицировать. В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты химически модифицируют для обеспечения желаемого эффекта. Например, пегилирование антител или фрагментов антител по изобретению можно осуществлять любой из реакций пегилирования, известных в данной области, как описано, например, в следующих ссылках: Focus on Growth factors 3:4-10 (1992); EP 0154316; и EP 0401384, каждая из которых в полном объеме включена в настоящий документ путем ссылки. В одном из аспектов пегилирование осуществляют посредством реакции ацилирования или реакции алкилирования с реакционноспособной молекулой полиэтиленгликоля (или аналогичным реакционноспособным водорастворимым полимером). Подходящим водорастворимым полимером для пегилирования антител и фрагментов антител по изобретению является полиэтиленгликоль (PEG). Как используется в настоящем документе, "полиэтиленгликоль" предназначен для включения любой из форм PEG, которые были использованы для получения производных других белков, таких как моно-(Cl-ClO)-алкокси- или арилокси-полиэтиленгликоль.
Способы получения пегилированных антител и фрагментов антител по изобретению, как правило, включают стадии (a) взаимодействия антитела или фрагмента антитела с полиэтиленгликолем, таким как реакционноспособный сложный эфир или альдегидное производное PEG, в подходящих условиях, в результате чего антитело или фрагмент антитела становятся прикрепленными к одной или нескольким группам PEG, и (b) получения продуктов реакции. Специалисту в данной области будет очевиден выбор оптимальных условий реакции или реакций ацилирования на основе известных параметров и желаемого результата.
Пегилированные антитела и фрагменты антител, специфичные для IL-13, как правило, можно использовать для лечения связанных с IL-13 нарушений по изобретению путем введения антител против IL-13 и фрагментов антител, описываемых в настоящем документе. Как правило, пегилированные антитела и фрагменты антител обладают повышенным временем полужизни по сравнению с непегилированными антителами и фрагментами антител. Пегилированные антитела и фрагменты антител можно использовать отдельно, совместно или в сочетании с другими фармацевтическими композициями.
Можно получать производные антитела или части антитела по изобретению или соединять с другими функциональными молекулами (например, другим пептидом или белком). Таким образом, антитела и части антител по изобретению предназначены для включения производных и иначе модифицированных форм антител человека против hIL-13, описываемых в настоящем документе, включая молекулы иммуноадгезии. Например, антитело или часть антитела по изобретению можно функционально связывать (химическим соединением, генетическим слиянием, нековалентным соединением или иначе) с одной или несколькими другими молекулярными соединениями, такими как другое антитело (например, биспецифическое антитело или диатело), детектирующим средством, цитотоксическим средством, фармацевтическим средством и/или белком или пептидом, которые могут опосредовать соединение антитела или части антитела с другой молекулой (такими как коровая область стрептавидина или полигистидиновая метка).
Один из типов производного антитела получают поперечным сшиванием двух или более антител (одного типа или различных типов, например, для создания биспецифических антител). Подходящие сшиватели включают те, которые являются гетеробифункциональными, обладающими двумя отдельно реагирующими группами, разделенными соответствующим спейсером (например, сложный эфир м-малеимидобензоил-N-гидроксисукцинимида), или гомобифункциональными (например, дисукцинимидилсуберат). Такие линкеры доступны от Pierce Chemical Company, Rockford, IL.
Применимые детектируемые средства, с которыми можно получать производные антитела или части антитела по изобретению, включают флуоресцентные соединения. Примеры флуоресцентных детектируемых средств включают флуоресцеин, флуоресцеинизотиоцианат, родамин, 5-диметиламин-1-нафталинсульфонилхлорид, фикоэритрин и т.п. Также можно получать производные антитела с детектируемыми ферментами, такими как щелочная фосфатаза, пероксидаза хрена, глюкозооксидаза и т.п. При образовании производного антитела с детектируемым ферментом его определяют добавлением дополнительных реактивов, которые фермент использует для продуцирования детектируемого продукта реакции. Например, при наличии детектируемого средства пероксидазы хрена добавление пероксида водорода и диаминобензидина приводит к окрашенному продукту реакции, который поддается детектированию. Также можно получать производные антитела с биотином, и их можно определять посредством косвенного измерения связывания авидина или стрептавидина.
7. Фармацевтические композиции
Антитела и части антител по изобретению можно включать в фармацевтические композиции, подходящие для введения индивидууму. Обычно фармацевтическая композиция содержит антитело или часть антитела по изобретению и фармацевтически приемлемый носитель. Как используется в настоящем документе, "фармацевтически приемлемый носитель" включает любые и все растворители, диспергенты, покрытия, антибактериальные и противогрибковые средства, изотоничные и замедляющие абсорбцию средства и т.п., которые являются физиологически совместимыми. Примеры фармацевтически приемлемых носителей включают один или несколько компонентов из воды, физиологического раствора, фосфатно-солевого буфера, декстрозы, глицерина, этанола и т.п., а также их сочетания. Во многих случаях желательно включать в композицию изотоничные средства, например, сахара, полиспирты, такие как маннит, сорбит, или хлорид натрия. Фармацевтически приемлемые носители могут дополнительно содержать незначительные количества вспомогательных средств, таких как увлажнители или эмульгаторы, консерванты или буферы, повышающие срок годности или эффективность антитела или части антитела.
Антитела и части антител по изобретению могут быть включены в фармацевтическую композицию, подходящую для парентерального введения. Антитело или части антител можно получать в виде раствора для инъекций, содержащего, например, 0,1-250 мг/мл антитела. Раствор для инъекций может состоять из жидкой или лиофилизированной лекарственной формы в сосуде из бесцветного или желтого стекла, ампуле или предварительно наполненном шприце. Буфером может быть L-гистидин приблизительно 1-50 мМ (оптимально 5-10 мМ), при pH от 5,0 до 7,0 (оптимально pH 6,0). Другие подходящие буферы включают, но не ограничиваются ими, сукцинат натрия, цитрат натрия, фосфат натрия или фосфат калия. Можно использовать хлорид натрия для модификации токсичности раствора при концентрации 0-300 мМ (оптимально 150 мМ для жидких лекарственных форм). Для лиофилизированных лекарственных форм можно включать криопротекторы, преимущественно 0-10% сахарозы (оптимально 0,5-1,0%). Другие подходящие криопротекторы включают трегалозу и лактозу. Для лиофилизированных лекарственных форм можно включать наполнители, преимущественно 1-10% маннита (оптимально 24%). В жидких и лиофилизированных лекарственных формах можно использовать стабилизаторы, преимущественно 1-50 мМ L-метионина (оптимально 5-10 мМ). Другие подходящие наполнители включают глицин, аргинин, можно включать как 0-0,05% полисорбата-80 (оптимально 0,005-0,01%). Дополнительные поверхностно-активные вещества включают, но не ограничиваются ими, поверхностно-активные вещества полисорбат-20 и BRIJ.
В одном из аспектов фармацевтическая композиция включает антитело в дозе приблизительно 0,01 мг/кг-10 мг/кг. В другом аспекте доза антитела включает приблизительно 1 мг/кг, вводимый раз в две недели, или приблизительно 0,3 мг/кг, вводимые еженедельно. Специалист в данной области может устанавливать соответствующую дозу и схему введения индивидууму.
Композиции по данному изобретению могут находиться в разнообразных формах. Они включают, например, жидкие, полутвердые и твердые лекарственные формы, такие как жидкие растворы (например, растворы для инъекций и вливаний), дисперсии или суспензии, таблетки, пилюли, порошки, липосомы и суппозитории. Форма зависит, например, от предполагаемого способа введения и терапевтического применения. Типичные композиции находятся в форме растворов для инъекций или вливаний, таких как композиции, схожие с используемыми для пассивной иммунизации людей другими антителами. Один способ введения является парентеральным (например, внутривенным, подкожным, интраперитонеальным, внутримышечным). В одном из аспектов антитело вводят внутривенным вливанием или инъекцией. В другом аспекте антитело вводят внутримышечной или подкожной инъекцией.
Как правило, терапевтические композиции должны быть стерильными и стабильными в условиях производства и хранения. Композицию можно составлять в виде раствора, микроэмульсии, дисперсии, липосомы или другой упорядоченной структуры, подходящей для высокой концентрации лекарственного средства. Стерильные растворы для инъекций могут быть получены включением активного соединения (т.е. антитела или части антитела) в требуемом количестве в соответствующий растворитель с одним ингредиентом или сочетанием ингредиентов, указанных выше, в случае необходимости, с последующей фильтрационной стерилизацией. Как правило, дисперсии получают включением активного соединения в стерильное средство, которое содержит основной диспергент и другие требуемые ингредиенты из указанных выше. В случае стерильных лиофилизированных порошков для получения стерильных растворов для инъекций, способами получения являются вакуумная сушка и сушка распылением, которые приводят к получению порошка активного ингредиента и любого дополнительного желаемого ингредиента из его ранее стерильно фильтрованного раствора. Можно поддерживать соответствующую текучесть раствора, например, с использованием покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и путем использования поверхностно-активных веществ. Можно достигать пролонгированной абсорбции композиций для инъекций путем включения в композицию средства, замедляющего абсорбцию, например, моностеаратных солей и желатина.
Антитела и части антител по настоящему изобретению можно вводить множеством известных в данной области способов, одним путем/способом введения является подкожная инъекция, внутривенная инъекция или вливание. Как будет понятно специалистам в данной области, путь и/или способ введения будет варьироваться в зависимости от желаемых результатов. В конкретных вариантах осуществления активное соединение можно получить с носителем, который защищает соединение от быстрого высвобождения, таким как препарат с контролируемым высвобождением, включая имплантаты, трансдермальные пластыри и микроинкапсулированные системы доставки. Можно использовать биодеградируемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Многие способы получения таких препаратов запатентованы или, как правило, известны специалистам в данной области. См., например, публикацию Sustained and Controllled Release Drug Delivery Systems, J. R. Robinson, ed., Marcel Dekker, Inc., New York, 1978, полное содержание которой включено в настоящий документ путем ссылки.
В конкретных аспектах антитело или часть антитела по изобретению можно вводить перорально, например, с инертным разбавителем или усваиваемым съедобным носителем. Соединение (и другие ингредиенты, при желании) можно заключать в желатиновую капсулу с твердой или мягкой оболочкой, прессовать в таблетки или включать непосредственно в диету индивидуума. Для перорального терапевтического введения соединения можно включать с эксципиентами и использовать в форме перевариваемых таблеток, буккальных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, пластинок и т.п. Для введения соединения по изобретению иным способом, чем парентеральное введение, необходимым может быть покрытие соединения материалом для предотвращения его инактивации или совместное введение соединения с этим материалом.
В композиции также можно включать дополнительные активные соединения. В конкретных аспектах антитело или часть антитела по изобретению можно совместно составлять и/или совместно вводить с одним или несколькими дополнительными терапевтическими средствами, пригодными для лечения нарушений, в которых активность IL-13 является неблагоприятной. Например, антитело против hIL-13 или часть антитела по изобретению можно совместно составлять и/или совместно вводить с одним или несколькими дополнительными антителами, которые связывают другие мишени (например, с антителами, которые связывают другие цитокины или которые связывают молекулы на поверхности клетки). Кроме того, одно или несколько антител по изобретению можно использовать в сочетании с двумя или более упомянутыми выше терапевтическими средствами. В таких способах комбинированного лечения можно предпочтительно использовать более низкие дозы вводимых терапевтических средств, таким образом, избегая возможной токсичности или осложнений, связанных с различными монотерапевтическими способами. Специалисту в данной области будет понятно, что если антитела по изобретению используют как часть комбинированного лечения, желательной может быть более низкая доза антитела, чем при введении индивидууму только лишь антитела (например, можно достичь синергичного терапевтического эффекта посредством применения комбинированного лечения, которое, в свою очередь, допускает использование более низкой дозы антитела для достижения желаемого терапевтического эффекта).
Следует понимать, что антитела по изобретению или их антигенсвязывающую часть можно использовать отдельно или в комбинации с дополнительным средством, например, терапевтическим средством, причем указанное дополнительное средство выбирают специалисты в данной области по его предполагаемому предназначению. Например, дополнительное средство может быть терапевтическим средством, принятым в данной области техники как пригодное для лечения заболевания или состояния, подвергаемого лечению антителом по настоящему изобретению. Дополнительное средство также может быть средством, которое придает терапевтической композиции благоприятное свойство, например, средством, действующим на вязкость композиции.
Также следует понимать, что комбинации, которые включены в настоящее изобретение, являются комбинациями, применимыми по своему предполагаемому предназначению. Представленные ниже средства являются иллюстративными и не предназначены для ограничения изобретения. Комбинациями, которые являются частью данного изобретения, могут быть антитела по настоящему изобретению и по меньшей мере одно дополнительное средство, выбранное из списков ниже. Комбинация также может включать несколько дополнительных средств, например, два или три дополнительных средства, если комбинация является такой, что образуемая композиция может осуществлять свою предполагаемую функцию.
Некоторые комбинации представляют собой нестероидные противовоспалительные лекарственные средства, также обозначаемые как NSAIDS, которые включают лекарственные средства, такие как ибупрофен. Другие комбинации представляют собой кортикостероиды, включающие преднизолон; хорошо известные побочные эффекты применения стероидов можно снижать или даже устранять путем снижения требуемой дозы стероидов при лечении пациентов в сочетании с антителами по данному изобретению. В случае ревматоидного артрита, с антителом или частью антитела по изобретению можно комбинировать неограничивающие примеры терапевтических средств, включая следующие: супрессирующие цитокины противовоспалительные лекарственные средства (CSAID); антитела или антагонисты других цитокинов или факторов роста человека, например, TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF и PDGF. Антитела по изобретению или их антигенсвязывающие части можно объединять с антителами к молекулам поверхности клетки, таким как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80 (B7.1), CD86 (B7.2), CD90, или их лигандам, включая CD154 (gp39 или CD40L).
Некоторые комбинации терапевтических средств могут на различных участках противодействовать аутоиммунному и последующему воспалительному каскаду; примеры включают антагонисты TNF, такие как химерные, гуманизированные антитела или антитела человека против TNF, D2E7, (патентная заявка США № 08/599226, зарегистрированная 9 февраля 1996 года, полное содержание которой включено в настоящий документ путем ссылки), cA2 (Remicade™), CDP 571, фрагменты антител против TNF (например, CDP870) и растворимые TNF-рецепторы p55 или p75, их производные, (P75TNFRIgG (Enbrel™) или p55TNFRIgG (ленерцепт), растворимый рецептор IL-13 (sIL-13), а также ингибиторы TNFα-превращающего фермента (TACE); аналогично, ингибиторы IL-1 (например, ингибиторы интерлейкин-1-превращающего фермента, такие как Vx740 или IL-1RA и т.д.) могут быть эффективными по той же причине. Другие комбинации включают интерлейкин-11, анти-P7 и гликопротеиновый лиганд p-селектина (PSGL). Кроме того, другие комбинации включают других основных участников аутоиммунного ответа, которые могут действовать параллельно, зависимо или согласованно с функцией IL-13. Еще другая комбинация включает неистощающие ингибиторы CD4. Кроме того, другие комбинации включают антагонисты костимуляторного пути CD80 (B7.1) или CD86 (B7.2), включая антитела, растворимые рецепторы или антагонистические лиганды.
Антитела по изобретению или их антигенсвязывающие части также можно комбинировать со средствами, такими как метотрексат, 6-MP, азатиоприн, сульфасалазин, месалазин, олсалазин хлорохинин/гидроксихлорохин, пенцилламин, ауротиомалат (внутримышечно и перорально), азатиоприн, кохицин, кортикостероиды (перорально, ингаляционно и местными инъекциями), агонисты β-2-адренорецепторов (сальбутамол, тербуталин, салметерол), ксантины (теофиллин, аминофиллин), кромогликат, недокромил, кетотифен, ипратропий и окситропий, циклоспорин, FK506, рапамицин, микофенолат мофетил, лефлуномид, NSAID, например, ибупрофен, кортикостероиды, такие как преднизолон, ингибиторы фосфодиэстеразы, агонисты аденозина, антитромботические средства, ингибиторы комплемента, адренергические средства, средства, противодействующие передаче сигнала провоспалительных цитокинов, таких как TNFα или IL-1 (например, ингибиторы киназ IRAK, NIK, IKK, p38 или MAP), ингибиторы IL-Ιβ-превращающего фермента (например, Vx740), анти-P7, гликопротеиновый лиганд p-селектина (PSGL), ингибиторы TNFα-превращающего фермента (TACE), ингибиторы T-клеточной передачи сигнала, такие как ингибиторы киназ, ингибиторы металлопротеиназ, сульфасалазин, азатиоприн, 6-меркаптопурины, ингибиторы ангиотензин-превращающего фермента, растворимые рецепторы цитокинов и их производные (например, растворимые TNF-рецепторы p55 или p75 и производные p75TNFRIgG (Enbrel™) и p55TNFRIgG (ленерцепт), sIL-1 RI, sIL-1RII, sIL-6R, растворимый рецептор IL-13 (sIL-13)) и противовоспалительные цитокины (например, IL-4, IL-10, IL-11, IL-13 и TGFβ). Некоторые комбинации включают метотрексат или лефлуномид и, в случаях умеренного или тяжелого ревматоидного артрита, циклоспорин.
Фармацевтические композиции по изобретению могут включать "терапевтически эффективное количество" или "профилактически эффективное количество" антитела или части антитела по изобретению. "Терапевтически эффективное количество" относится к количеству, эффективному при дозировке и в течение необходимого периода времени для достижения желаемого терапевтического результата. Терапевтически эффективное количество антитела или части антитела может варьироваться в соответствии с факторами, такими как состояние заболевания, возраст, пол и вес индивидуума, и способности антитела или части антитела вызывать у индивидуума желаемый ответ. Терапевтически эффективное количество также является таковым, при котором любые токсические или неблагоприятные эффекты антитела или части антитела перевешиваются положительным терапевтическим воздействием. "Профилактически эффективное количество" относится к количеству, эффективному при дозировке и в течение необходимого периода времени для достижения желаемого профилактического результата. Как правило, поскольку профилактическую дозу используют у индивидуумов до заболевания или на его ранней стадии, профилактически эффективное количество будет меньше терапевтически эффективного количества.
Для обеспечения оптимального желаемого ответа (например, терапевтического или профилактического ответа) можно корректировать режимы дозирования. Например, можно вводить один болюс, можно вводить несколько дробных доз в течение периода времени, или дозу можно пропорционально снижать или повышать, на что указывает требование терапевтической ситуации. В конкретных вариантах осуществления особенно предпочтительно составлять парентеральные композиции в стандартной лекарственной форме для легкого введения и единообразия дозировки. Как используется в настоящем документе, стандартная лекарственная форма относится к физически дискретным элементам, пригодным в качестве единичных доз для подлежащего лечению млекопитающего; каждый элемент, содержащий предварительно определенное количество активного соединения, вычисляется для получения желаемого терапевтического эффекта совместно с необходимым фармацевтическим носителем. Определение стандартных лекарственных форм по изобретению обусловлено и непосредственно зависит от (a) уникальных характеристик активного соединения и конкретного терапевтического или профилактического эффекта, которого необходимо достигать, и (b) свойственных данной области ограничений составления такого активного соединения для лечения восприимчивости индивидуумов.
В качестве неограничивающего примера, диапазон терапевтически или профилактически эффективного количества антитела или части антитела по изобретению составляет 0,01-20 мг/кг, или 1-10 мг/кг, или 0,3-1 мг/кг. Следует отметить, что величины доз можно варьировать в зависимости от типа и тяжести подлежащего облегчению состояния. Также следует понимать, что для любого конкретного индивидуума необходимо корректировать конкретные режимы дозирования в течение периода времени в соответствии с потребностью индивидуума и профессионального мнения специалиста, осуществляющего введение или руководящего введением композиций, и приведенные в настоящем документе диапазоны доз являются исключительно примерными и не предназначены для ограничения объема или применения заявленной композиции.
8. Применение антител по изобретению
8.1 Применение антитела против IL-13 в целом
Принимая во внимание их способность связываться с IL-13, антитела против IL-13 или их антигенсвязывающие части по изобретению можно использовать для определения IL-13, в одном из аспектов, hIL-13 (например, в матрице образца, в одном из аспектов, биологическом образце, таком как сыворотка или плазма), с помощью общепринятого иммунологического анализа, такого как твердофазные иммуноферментные анализы (ELISA), радиоиммунологический анализ (RIA) или иммуногистохимия ткани. Изобретение относится к способу определения IL-13 в биологическом образце, включающему приведение образца в контакт с антителом или частью антитела по изобретению и определение связавшегося с IL-13 антитела или несвязавшегося антитела, чтобы, таким образом, определить IL-13 в образце. Антитело прямо или опосредованно метят детектируемым веществом для облегчения определения связавшегося или несвязавшегося антитела. Подходящие детектируемые вещества включают различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы и радиоактивные материалы. Примеры подходящих ферментов включают пероксидазу хрена, щелочную фосфатазу, β-галактозидазу или ацетилхолинэстеразу; примеры подходящих комплексов простетических групп включают стрептавидин/биотин и авидин/биотин; примеры подходящих флуоресцентных материалов включают умбеллиферон, флуоресцеин, флуоресцеинизотиоцианат, родамин, дихлортриазиниламин флуоресцеин, дансил хлорид или фикоэритрин; пример люминесцентного материала включает люминол; и примеры подходящего радиоактивного материала включают125I,131I,35S или3H. Определение IL-13 в образце может быть применим в случае диагностики, например, диагностики состояния, связанного с повышением IL-13, и/или может быть применим при идентификации индивидуума, для которого лечение антителом против IL-13 может быть благоприятным.
В качестве альтернативы анализам для определения, включающим меченое антитело против IL-13, IL-13 можно определять в образце конкурентным иммунологическим анализом с использованием, например, стандартов rhIL-13, меченных детектируемым веществом, и немеченого антитела против IL-13, такого как антитело против hIL-13. При таком анализе объединяют образец, меченые стандарты rhIL-13 и антитело против hIL-13 и определяют количество меченого стандарта rhIL-13, связавшегося с немеченым антителом. Количество hIL-13 в образце обратно пропорционально количеству меченого стандарта rhIL-13, связавшегося с антителом против hIL-13.
Антитела и части антител по изобретению способны нейтрализовать активность IL-13 in vitro и in vivo, в одном из аспектов активность hIL-13. Таким образом, антитела и части антител по изобретению можно использовать для ингибирования активности IL-13, например, в культуре клеток, содержащей IL-13, у человека или у других млекопитающих, имеющих IL-13, с которым антитело по изобретению перекрестно взаимодействует (например, приматов, таких как бабуин, яванский макак и макак-резус). В одном из аспектов изобретение относится к выделенному антителу человека, или его антигенсвязывающей части, нейтрализующему активность IL-13 человека и по меньшей мере одного дополнительного IL-13 примата, выбранного из группы, состоящей из IL-13 бабуина, IL-13 игрунки, IL-13 шимпанзе, IL-13 яванского макака и IL-13 макака-резуса, но не нейтрализующему активность IL-13 мыши. В одном из аспектов IL-13 представляет собой IL-13 человека. Например, в культуре клеток, содержащей или предположительно содержащей hIL-13, антитело или часть антитела по изобретению можно добавлять в среду для культивирования, чтобы ингибировать активность hIL-13 в культуре.
В другом аспекте изобретение относится к способу ингибирования активности IL-13 у индивидуума, страдающего нарушением, при котором активность IL-13 неблагоприятна. Как используется в настоящем документе, фраза "нарушение, при котором активность IL-13 неблагоприятна" предназначена для включения заболеваний и других нарушений, при которых показано, что наличие IL-13 у страдающего нарушением индивидуума отвечает или предположительно отвечает за патофизиологию нарушения или является фактором, участвующим в ухудшении нарушения. Таким образом, нарушение, при котором активность IL-13 неблагоприятна, является нарушением, при котором ожидают, что ингибирование активности IL-13 смягчит симптомы и/или прогрессирование нарушения. За такими нарушениями можно наблюдать, например, по повышению концентрации IL-13 в биологической жидкости страдающего нарушением индивидуума (например, повышение концентрации IL-13 в сыворотке, плазме, синовиальной жидкости индивидуума и т.д.), которое можно определять, например, с использованием антитела против IL-13, как описано выше. В одном из аспектов антитела или их антигенсвязывающие части можно использовать в терапии для лечения описываемых в настоящем документе заболеваний или нарушений. В другом аспекте антитела или их антигенсвязывающие части можно использовать для получения лекарственного средства для лечения описываемых в настоящем документе заболеваний или нарушений. Существуют многочисленные примеры нарушений, при которых активность IL-13 неблагоприятна. Например, IL-13 играет решающую роль в патологии, связанной с множеством заболеваний, включающих иммунные и воспалительные элементы, включая, но не ограничиваясь ими, респираторные нарушения, такие как астма и хроническая обструктивная болезнь легких. Дополнительные связанные с IL-13 нарушения, включают, но не ограничиваются ими: атопические нарушения (например, атопический дерматит и аллергический ринит); воспалительные и/или аутоиммунные состояния кожи, органов желудочно-кишечного тракта (например, воспалительные заболевания кишечника (IBD), такие как язвенный колит и/или болезнь Крона) и печени (например, цирроз, фиброз); склеродермию; опухоли или злокачественные новообразования, например, лимфому Ходжкина.
Таким образом, антитела против IL-13, или их антигенсвязывающие части или векторы, экспрессирующие их in vivo, предписывают для лечения заболеваний, таких как астма или другие воспалительные и/или аутоиммунные состояния, при которых существует аномальная экспрессия IL-13, приводящая к избытку IL-13, или в случаях осложнений в связи с экзогенно вводимым IL-13.
8.2 Применение антитела против IL-13 при респираторных нарушениях
В конкретных вариантах осуществления настоящего изобретения антитело против IL-13 или его антигенсвязывающую часть используют при лечении одного или нескольких связанных с IL-13 нарушений, включая, но не ограничиваясь ими, респираторные нарушения (например, астму (например, аллергическую и неаллергическую астму (например, астму по причине инфекции, например, респираторно-синцитиального вируса (RSV), например, у маленьких детей)), хроническую обструктивную болезнь легких (COPD) и другие состояния, включающие воспаление дыхательных путей, эозинофилию, фиброз и избыточную продукцию слизи, например, кистозный фиброз и легочный фиброз.
В конкретных вариантах осуществления настоящее изобретение относится к способам лечения (например, снижения, облегчения) или предотвращения одного или нескольких симптомов, связанных с респираторным нарушением, например, астмой (например, аллергической и неаллергической астмой); аллергиями; хронической обструктивной болезнью легких (COPD); состоянием, включающим воспаление дыхательных путей, эозинофилию, фиброз и избыточную продукцию слизи, например, кистозный фиброз и легочный фиброз. Например, симптомы астмы включают, но не ограничиваются ими, свистящее дыхание, одышку, сужение бронхов, гиперреактивность дыхательных путей, снижение жизненной емкости легких, фиброз, воспаление дыхательных путей и продукцию слизи. Способ включает введение индивидууму антитела против IL-13 или его фрагмента в количестве, достаточном для лечения (например, снижения, смягчения) или предотвращения одного или нескольких симптомов. Антитело против IL-13 можно вводить терапевтически или профилактически, или в обоих случаях. Антагонист IL-13, например, антитело против IL-13 или его фрагмент, можно вводить индивидууму отдельно или в сочетании с другими терапевтическими воздействиями, как описано в настоящем документе. В конкретных вариантах осуществления индивидуум представляет собой млекопитающего, например, человека, страдающего связанным с IL-13 нарушением, как описано в настоящем документе.
Как указано выше, подразумевают, что IL-13 играет ключевую роль, являясь причиной патологических ответов, связанных с астмой. Однако другие медиаторы различных иммунологических путей также вовлечены в патогенез астмы, и блокирование данных медиаторов, в дополнение к IL-13, может приносить дополнительный благоприятный терапевтический эффект. Таким образом, связывающие белки по изобретению можно включать в биспецифическое антитело, где биспецифическое антитело способно связываться с парами мишеней, включая, но не ограничиваясь ими, IL-13 и провоспалительный цитокин, такой как фактор некроза опухоли-α (TNFα). TNFα может усиливать воспалительный ответ при астме и может быть связанным с тяжестью заболевания (McDonnell et al, Progress in Respiratory Research (2001), 31 (New Drugs for Asthma, Allergy and COPD), 247-250).·Это позволяет предполагать, что блокирование и IL-13, и TNFα может оказывать положительное воздействие, в частности, при тяжелых заболеваниях дыхательных путей. В неограничивающем варианте осуществления биспецифическое антитело по изобретению связывает мишени IL-13 и TNFα, и его используют для лечения астмы.
В другом варианте осуществления связывающие белки по изобретению можно использовать для получения молекул биспецифического антитела, которые связывают IL-13 и IL-1beta, IL-13 и IL-9; IL-13 и IL-4; IL-13 и IL-5; IL-13 и DL-25; IL-13 и TARC; EL-13 и MDC; IL-13 и M1F; IL-13 и TGF-β; EL-13 и агонист LHR; DL-13 и CL25; IL-13 и SPRR2a; EL-13 и SPRR2b; и DL-13 и ADAM8. Настоящее изобретение также относится к биспецифическим антителам, способным связывать IL-13 и одну или несколько мишеней, вовлеченных в астму, выбранных из группы, состоящей из CSF1 (MCSF), CSF2 (GM-CSF), CSF3 (GCSF), FGF2, IFNA1, IFNB1; IFNG, гистамина и гистаминовых рецепторов, EL-1A, DL-1B, BL-2, IL-3, EL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, ELI 1, IL-12A, IL-12B, IL-14, IL-15, IL-16, IL-17, IL-18, EL-19, IL-20, IL-21, IL-22, EL-23, EL-24, EL-25, IL-26, IL-27, EL-28, IL-30, EL-31, EL-32, IL-33, KtTLG, PDGFB, IL-2RA, EL-4R, IL-5RA, IL-8RA, DL-8RB, IL-12RB1, IL-12RB2, EL-13RA1, IL-13RA2, IL-18R1, TSLP, CCL1, CCL2, CCL3, CCL4, CCL5, CCL7, CCL8, CCL13, CCL17, CCL18, CCL19, CCL20, CCL22, CCL24, CX3CL1, CXCL1, CXCL2, CXCL3, XCL1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CX3CR1, GPR2, XCR1, FOS, GATA3, JAK1, JAK3, STAT6, TBX21, TGFB1, TNFSF6, YY1, CYSLTR1, FCER1A, FCER2, LTB4R, TB4R2, LTBR и хитиназы.
ПРИМЕРЫ
1. Производство антитела против IL-13
Производственная партия лекарственного вещества представляет собой раствор моноклонального антитела ABT-308, полученного с использованием системы посевных ферментеров, производства, первичного выделения и захвата и глубокой очистки лекарственного вещества, полученного в результате одного цикла производственного реактора.
1.1 Получение среды
В соответствии с GMP Solution Records получают растворы с очищенной водой, которая удовлетворяет стандартам USP/EP/JP. Составленный раствор среды пропускают через фильтр 0,1 мкм в предварительно стерилизованный контейнер, мешок или биореактор соответствующего размера.
Фильтр 0,1 мкм после использования тестируют на целостность. Композиции для выращивания и среды для производства представлены в таблице 2.
1.2. Наращивание инокулята
Действия с роллерными колбами и мешками для культивирования Biowave служат для наращивания клеток CHO из одного замороженного сосуда MCB до желаемой биомассы для инокуляции 110-литрового биореактора для выращивания посевного материала. Замороженный сосуд из Master Cell Bank размораживают, и помещают в среду для выращивания (SR-512) и центрифугируют. Клетки ресуспендируют в среде для выращивания и наращивают при 37°C и 5% CO2 в одноразовых роллерных колбах или мешках для культивирования Biowave повышающегося объема. Дублирующие 20-литровые мешки для культивирования используют для максимизации наращивания конечной клеточной массы до инокуляции в биореактор для выращивания посевного материала. Когда плотность клеток достигает значения ≥2,0×106 жизнеспособных клеток/мл из обоих 20-литровых мешков для культивирования на приблизительно 15-17 день, культуру переносят в 110-литровый биореактор для выращивания посевного материала, наполненный средой для выращивания SR-520 для дальнейшего наращивания. После инокуляции целевая температура составляет 37°C, и pH устанавливают на целевое значение 7,1 и регулируют добавлением NaOH и барботированием CO2. Растворенный кислород (DO) в биореакторе настраивают на целевое значение 40% посредством барботирования воздухом и кислородом. Когда плотность клеток достигает значения ≥2,6×106 жизнеспособных клеток/мл после приблизительно 2-4 дней, культуру переносят в 3000-литровый производственный биореактор.
1.3 Биореактор с неполным заполнением
Частичное заполнение 3000-литрового производственного биореактора используют для дальнейшего наращивания культуры клеток. Исходно, реактор заполняют средой для выращивания (SR-520) и инокулируют партией из 110-литрового биореактора для выращивания посевного материала.
В течение данной стадии неполного заполнения температуру, растворенный кислород и pH настраивают на 37°C, 40% и 7,1, соответственно. Величину pH культуры регулируют барботированием CO2 и добавлением NaOH. Как правило, клетки выращивают в течение 2-4 дней до достижения требуемой плотности ≥1,6×106 жизнеспособных клеток/мл.
1.4 Производственный биореактор
Среду для производства SR-521 (1950 л) добавляют в культуру клеток в 3000-литровый биореактор для инициации стадии производства. Пеногаситель C добавляют для снижения пенообразования. Величину pH культуры настраивают на целевое значение 6,9 барботированием CO2 по принципу "включено-выключено" и добавлением NaOH. Температуру и растворенный кислород настраивают на целевые значения 35°C и 40%, соответственно. DO в биореакторе исходно настраивают на желаемое значение барботированием воздухом и добавлением чистого кислорода при необходимости. Температуру снижают до целевого значения 33°C при достижении плотности жизнеспособных клеток ≤3,0×106 клеток/мл, и pH и DO поддерживают на целевых значениях 6,9 и 40%, соответственно. Глюкозу (SR-334) добавляют по мере необходимости. Культуры собирают, когда жизнеспособность клеток снижается до значения ≤50%.
1.5 Осуществление способа
Осуществление способа и результаты производственных тестов представлены в таблице 3 и таблице 4, соответственно.
2. Выделение и очистка антитела против IL-13
Действия по первичному выделению и захвату включают очистку собранных клеток от примесей посредством фильтрации, захват антитела посредством аффинной хроматографии с белком A и инактивацию вирусов низким pH с последующей глубинной фильтрацией. Действия по глубокой очистке включают анионообменную хроматографию, хроматографию с гидрофобным взаимодействием, фильтрацию вирусов, ультрафильтрацию/диафильтрацию и конечную фильтрацию, бутилирование и замораживание.
2.1 Получение растворов
В соответствии с GMP Solution Records получают растворы с очищенной водой USP (USP-PW) или водой для инъекций (WFI). Большинство растворов пропускают через фильтр 0,2 мкм в подвергнутые облучению мешки, автоклавированные или обработанные паром контейнеры.
2.2 Первичное выделение и очистка от примесей
Целью первичного выделения посредством фильтрации является удаление клеток и продуктов распада клеток из собранных клеток из производственного биореактора. Необработанные собранные клетки пропускают через фильтровальный тракт, состоящий из глубинных фильтров, обезжиривающих глубинных фильтров и мембранных фильтров. Очищенный от примесей супернатант собирают в резервуар для сбора и хранят при 2-8°C. Производственные тесты для очистки собранных клеток от примесей включают концентрирование ABT-308 посредством хроматографии с Poros A, определение бионагрузки и эндотоксина.
2.3 Аффинная хроматография с белком А
Целью аффинной хроматографии с белком A является захват ABT-308 из очищенных от примесей собранных клеток и снижение связанных со способом примесей. Обычно осуществляют три цикла хроматографии для обработки всех собранных клеток. Совокупность препаратов из трех циклов объединяют для дальнейшей обработки.
Подходящую для использования колонку диаметром 45 см и длиной 22 см (35 л) заполняют смолой с белком A MabSelect® (GE Healthcare) или ProSep Ultra Plus™ (Millipore). Буфер для хранения удаляют из колонки очищенной водой USP (USP-PW), затем 0,2 Μ уксусной кислотой и окончательно промывают USP PW. Колонку уравновешивают 25 мМ Трис, 100 мМ NaCl, pH 7,2, затем нагружают очищенными от примесей собранными клетками до максимального значения 32 г белка/л смолы для смолы с белком A MabSelect® (GE Healthcare) или 45 г белка/л смолы для смолы ProSep Ultra Plus™ (Millipore). Колонку промывают 25 мМ Трис, 100 мМ NaCl, pH 7,2, затем 20 мМ цитратом натрия, 0,5 Μ NaCl, pH 6,0, и окончательно промывают вновь 25 мМ Трис, 100 мМ NaCl, pH 7,2. Антитело элюируют из колонки 0,1 Μ уксусной кислотой, pH 3,5. После каждого цикла pH совокупного элюата при необходимости доводят до целевого значения 4,1. Внутрипроизводственные тесты включают определение концентрации белка по A280, эксклюзионную ВЭЖХ, определение бионагрузки и эндотоксина.
После первого цикла колонку восстанавливают 0,2 Μ уксусной кислотой и промывают USP-PW. После второго цикла колонку восстанавливают 0,2 Μ уксусной кислотой, промывают USP-PW, затем санируют 0,1 Μ уксусной кислотой, 20% этанолом с последующей промывкой и кратковременным хранением в 50 мМ ацетате натрия, 20% этаноле, pH 5. После третьего цикла колонку восстанавливают 0,2 Μ уксусной кислотой и промывают USP-PW. Затем ее очищают 0,4 Μ уксусной кислотой, 0,5 Μ NaCl, 0,1% Tween 80, затем USP-PW, затем 50 мМ NaOH, 1,0 Μ NaCl, затем USP-PW. В конечном итоге, ее санируют 0,1 Μ уксусной кислотой, 20% этанолом с последующей промывкой и хранением в 50 мМ уксусной кислоте, 20% этаноле, pH 5,0.
2.4 Инкубация с низким pH и фильтрация
Инкубация с низким pH является специализированной стадией снижения вирусов, обеспечивающей дополнительную гарантию вирусной безопасности посредством инактивации окружающих дополнительных вирусов, которые могут присутствовать в элюате белка A. Целью фильтрации после инкубация с низким pH является удаление любых преципитатов, которые могут образовываться в процессе обработки низким pH.
Величину pH объединенных элюатов после хроматографии с белком A доводят 0,5 Μ фосфорной кислотой до целевого значения 3,5 и хранят при 18-25°C в течение 60-70 минут. Затем смесь доводят до pH 5 с помощью 1 Μ Трис, pH 10, очищают от примесей путем комбинации глубинных фильтров и мембранных фильтров, затем охлаждают до 10-14°C. Производственные тесты стадии обработки низким pH и фильтрации включают определение концентрации белка по A280, эксклюзионную ВЭЖХ, определение бионагрузки и эндотоксина.
2.5 Осуществление способа первичного выделения и захвата
Осуществление способа первичного выделения и действий по захвату приведено в таблице 5, и результаты производственных тестов приведены в таблице 6.
2.6 Анионообменная хроматография в строгих условиях
Целью стадии анионообменной хроматографии в строгих условиях является снижение связанных со способом примесей, таких как белки клетки-хозяина, ДНК и эндотоксины. Она также может служить как стадия удаления вирусов. В конкретных вариантах осуществления колонка со смолой Q Sepharose™ FF функционирует в проточном режиме, при котором антитело проходит через колонку, а примеси остаются связавшимися со смолой, в альтернативных вариантах осуществления вместо колонки со смолой Q Sepharose™ FF используют мембрану Mustang Q™ (Pall Corp.). Действия осуществляют при 10-14°C.
Подходящую для использования колонку диаметром 45 см и длиной 22 см (35 л) заполняют смолой Q Sepharose™ FF (GE Healthcare). Колонку уравновешивают 25 мМ Трис, 50 мМ NaCl, pH 8,0. Величину pH нейтрализованного и фильтрованного раствора для инактивации доводят до 8,0 с помощью 1 Μ Трис, pH 10, проводимость доводят до 5,0-6,5 и раствор фильтруют через обезжиривающие и мембранные фильтры. Нагруженную Q Sepharose™ прокачивают через колонку при максимальной нагрузке 80 г белка/л смолы. После нагрузки колонку промывают 25 мМ Трис, 50 мМ NaCl, pH 8,0, и объединяют элюат и промывочную жидкость. Она представляет собой совокупность элюата Q Sepharose™ и промывочной жидкости (QFTW). Производственные тесты на стадии Q Sepharose™ включают определение концентрации по A280, эксклюзионную ВЭЖХ, определение бионагрузки и эндотоксина.
Колонку восстанавливают 25 мМ фосфатом натрия, 1,0 Μ NaCl, pH 7,0, с последующей промывкой WFI и санируют 1,0 Μ NaOH с последующей промывкой WFI. Затем колонку нейтрализуют 25 мМ фосфатом натрия, 1,0 Μ NaCl, pH 7,0, и хранят в 25 мМ фосфате натрия, 20% изопропаноле, pH 7,0.
2.7 Хроматография с гидрофобным взаимодействием
Целью стадии использования Phenyl Sepharose™ является удаление агрегатов ABT-308, фрагментов и связанных со способом примесей. Действия осуществляют при 10-14°C.
Подходящую для использования колонку диаметром 60 см и длиной 15 см (42 л) заполняют смолой Phenyl Sepharose™ HP (GE Healthcare). Колонку уравновешивают WFI, затем 20 мМ фосфатом натрия, 1,1 Μ сульфатом аммония, pH 7,0.
Элюат Q Sepharose™ и промывочную жидкость разводят в соотношении 1:1 (об./об.) 40 мМ фосфатом натрия, 2,2 Μ сульфатом аммония, pH 7,0. Данный раствор, нагрузку Phenyl Sepharose™, пропускают через фильтр 0,2 мкм и нагружают на колонку при максимальной нагрузке 64 г белка/л смолы. Колонку промывают 25 мМ фосфатом натрия, 1,4 Μ сульфатом аммония, pH 7,0, и ABT-308 элюируют из колонки 11 мМ фосфатом натрия, 0,625 Μ сульфатом аммония, pH 7,0. Производственные тесты на стадии Phenyl Sepharose™ включают определение концентрации по A280, эксклюзионную ВЭЖХ, определение бионагрузки и эндотоксина.
Колонку восстанавливают WFI, затем санируют 1 Μ NaOH, промывают WFI и хранят в 25 мМ фосфате натрия, 20% изопропаноле, pH 7.
2.8 Нанофильтрация
Нанофильтрация является специализированной стадией удаления вирусов, обеспечивающей дополнительную гарантию вирусной безопасности посредством физического удаления дополнительных вирусов диаметром ≥20 нм, которые могут присутствовать в элюате колонки с Phenyl Sepharose™ HP. Действия осуществляют при 10-14°C.
Элюат колонки с Phenyl Sepharose™ HP пропускают через 0,1 мкм фильтр и фильтровальный тракт Ultipor DV20, предварительно увлажненный 15 мМ гистидином, pH 5,6. После фильтрации фильтровальный тракт промывают 15 мМ гистидином, pH 5,6, для выделения любых оставшихся ABT-308. После использования проводят тест целостности на фильтре DV20 и фильтр выбрасывают. Если фильтр не прошел тест целостности, раствор можно снова отфильтровать, как описано выше. Производственные тесты стадии нанофильтрации включают определение концентрации белка по Α280, эксклюзионную ВЭЖХ, определение бионагрузки и эндотоксина.
2.9 Составление лекарственного вещества ABT-308 посредством ультрафильтрации/диафильтрации
Целью стадии UF/DF является диафильтрация лекарственного вещества в конечный буферный раствор, 15 мМ гистидин, pH 5,6, и концентрирование ABT-308. Данные действия осуществляют при 10-14°C.
Нанофильтрат концентрируют до приблизительно 50 г/л с использованием 30 кДа MWCO полиэфирных сульфоновых мембран, затем подвергнутый диафильтрации буферный раствор концентрируют до приблизительно 180 г/л. Систему UF отфильтровывают от препарата и промывают буфером для диафильтрации, чтобы выделить любой продукт, оставшийся в системе. Концентрат и промывочную жидкость объединяют с получением подвергнутого диафильтрации ABT-308 в концентрации приблизительно 120-160 г/л. Концентрированное ABT-308 фильтруют через мембранные фильтры. Производственные тесты стадии ультрафильтрации/диафильтрации включают определение концентрации по A280,эксклюзионную ВЭЖХ, определение бионагрузки и эндотоксина.
После каждого запуска систему ультрафильтрации промывают WFI и очищают раствором гипохлорита натрия концентрацией 250 ч./млн., затем санируют и хранят в 0,1 Μ гидроксиде натрия.
2.10 Конечная Фильтрация, бутилирование и замораживание
Действия по фильтрации и бутилированию осуществляют в помещении класса 100 при 2-8°C в ламинарном шкафу класса 100. Составленное ABT-308 пропускают через 0,2 мкм фильтр в предварительно стерилизованные, не содержащие пирогены бутыли PETG. Помеченные бутыли помещают в пустую морозильную камеру при -80°C (номинально) до замораживания и затем переносят в морозильную камеру для хранения при -80°C (номинально). Производственные тесты конечной стадии фильтрации и бутилирования включают определение концентрации по Α280, определение бионагрузки и эндотоксина (результаты тестов лекарственного вещества).
2.11 Осуществление способа глубокой очистки
Осуществление способа первичного выделения и действий по захвату приведены в таблице 7, и результаты производственных тестов приведены в таблице 8.
3. Определение концентрации белка клетки-хозяина в композициях антитела
В данном способе описывается методика тестирования для определения остаточной концентрации белка клетки-хозяина в образцах антитела. Для наслаивания белка клетки-хозяина (антигенов) между двумя слоями специфичных антител используют твердофазный иммуноферментный анализ (ELISA). После этого проводят блокирование неспецифических участков казеином. Затем белки клетки-хозяина подвергают инкубации, в течение которой молекулы антигена захватывают первое антитело (покрывающее антитело). Затем добавляют второе антитело (биотинилированное антитело против белка клетки-хозяина), которое фиксируется на антигене (белках клетки-хозяина). Добавляют HRP-конъюгированный нейтравидин, который связывается с биотинилированным антителом против белка клетки-хозяина. После этого добавляют субстрат Κ blue. Конъюгированный с антителом фермент гидролизует хромогенный субстрат, вызывая синее окрашивание. Реакцию останавливают 2M H3PO4, при этом цвет изменяется на желтый. Интенсивность цвета прямо пропорциональна количеству связанного антигена в лунке.
Получение 50 мМ бикарбоната натрия (буфер для сорбции), pH 9,4. В стакан на 1 л добавляют: 900 мл воды Milli-Q; 4,20 г ± 0,01 г бикарбоната натрия. Перемешивают до полного растворения. Величину pH доводят 1 н. NaOH до 9,4. Переносят в мерную колбу на 1 л и доводят объем водой Milli-Q. Перемешивают переворачиванием до однородности. Фильтруют через 0,22 мкм стерильный фильтрующий элемент. Хранят при номинальной температуре 4°C в течение до 7 дней от даты получения.
Получение 0,104 Μ Na2HPO4 * 7H2O, 1,37 Μ NaCl, 0,027 Μ KC1, 0,0176 Μ KH2PO4, pH=6,8-6,9 (10X PBS). Добавляют приблизительно 400 мл воды Milli-Q в стеклянный стакан. Добавляют 13,94 г ± 0,01 г Na2HPO4×7H2O. Добавляют 40,0 г ± 0,1 г NaCl. Добавляют 1,00 г ± 0,01 г KC1. Добавляют 1,20 г ± 0,01 г KH2PO4. Перемешивают до однородности. Переносят в мерную колбу на 500 мл. Добавляют воду Milli-Q в количестве, достаточном для доведения объема до 500 мл. Перемешивают переворачиванием. Фильтруют через 0,2 мкм стерильный фильтрующий элемент. Хранят при комнатной температуре в течение до 7 дней.
Получение 1X PBS + 0,1% тритона X-100, pH 7,40: (Буфер для промывки планшета). В градуированном цилиндре на 4 л перемешивают 400 мл 10X PBS (стадия 5.2) с 3500 мл воды Milli-Q. Проверяют pH и при необходимости доводят его до величины 7,40±0,05 с помощью 1 н. HCl или 1 н. NaOH. Объем доводят водой Milli-Q. Цилиндр плотно закрывают парафильмом и перемешивают переворачиванием до однородности. Переносят в бутыль на 4 л. Удаляют 4 мл 1X PBS и выбрасывают. Добавляют 4 мл тритона X-100 к 3996 мл 1X PBS. Помещают на мешалку и перемешивают до полного растворения. Фильтруют через 0,22 мкм стерильный фильтрующий элемент необходимое для промывки планшета количество буфера с целью получения буфера для разведения. Хранят при комнатной температуре в течение до 7 дней.
Получение смеси для сорбции антител: козье антитело против CHO 599/626/748 (партия № G11201 @ 1,534 мг/мл), аффинно очищенное: Примечание: стоковые растворы хранят в сосудах при номинальной температуре -80°C. Получают аликвоты. Во время применения берут одну аликвоту на планшет. Непосредственно перед применением: разводят смесь антител до конечной концентрации 4 мкг/мл в холодном 50 мМ бикарбонате натрия, как указано ниже. Например: добавляют 31 мкл смеси антител для сорбции к 11969 мкл холодного буфера для сорбции. Осторожно перемешивают переворачиванием.
Получение биотинилированного козьего антитела против смеси белков клетки-хозяина, 599/626/748 (партия № G11202 @ 0,822 мг/мл): Примечание: стоковые растворы хранят в сосудах при номинальной температуре -80°C. Получают аликвоты. Во время применения берут одну аликвоту на планшет. Непосредственно перед применением: разводят смесь биотинилированных антител до конечной концентрации 1 мкг/мл в казеине с температурой 37°C±2°C, как указано ниже. Например: добавляют 14,6 мкл смеси биотинилированных антител к 11985 мкл казеина с температурой 37°C±2°C. Осторожно перемешивают переворачиванием.
Получение нейтравидина-HRP. Растворяют новые партии (2 мг/сосуд) до 1 мг/мл, как указано ниже: в сосуд добавляют 400 мкл воды Milli-Q, затем добавляют 1600 мкл 1X PBS для общего объема 2 мл. Осторожно перемешивают на центрифуге типа вортекс до смешивания. Хранят при номинальной температуре -20°C. Аликвоты с желаемым объемом получают таким образом, чтобы использовать 1 аликвоту на планшет. Получают в полипропиленовой пробирке. Готовят новые партии для определения рабочей концентрации. Определяют срок хранения 6 месяцев от даты получения. Например, если рабочую концентрацию определяли как 0,2 мкг/мл, то получают, как указано ниже. Непосредственно перед применением: размораживают аликвоту нейтравидина-HRP при комнатной температуре. Разводят 1 мг/мл раствора нейтравидина до 0,1 мг/мл (100 мкг/мл) казеином с температурой 37°C±2°C. Например: разводят ×10, добавляют 50 мкл нейтравидина к 450 мкл казеина. Осторожно перемешивают на центрифуге типа вортекс до смешивания. Дополнительно разводят 100 мкг/мл раствора до 0,2 мкг/мл казеином с температурой 37°C±2°C. Например: разводят ×500, добавляют 24 мкл нейтравидина (100 мкг/мл) к 11976 мкл казеина. Осторожно перемешивают на центрифуге типа вортекс до смешивания.
Получение 5,7 2M фосфорной кислоты (стоп-реагента). Получают раствор 2Μ фосфорной кислоты из концентрированной фосфорной кислоты, как указано ниже. Исходя из % фосфорной кислоты, указанного на этикетке, плотности (1,685 г/мл) и молекулярной массы по формуле соединения (98 г/моль), вычисляют объем концентрированной фосфорной кислоты, необходимый для получения 500 мл 2M фосфорной кислоты. Добавляют во флакон вычисленный выше объем концентрированной фосфорной кислоты. Доводят объем водой Milli-Q и перемешивают переворачиванием до однородности. Хранят при температуре окружающей среды в течение до 6 месяцев от даты получения.
Получение буфера для разведения (казеин, разведенный ×100 в растворе 1X PBS + 0,1% тритона X100, pH 7,4). Разводят казеин с температурой 37°C±2°C ×100 в стерильно отфильтрованном 0,22 мкм фильтром растворе 1X PBS + 0,1% тритона X100, pH 7,4 (указанного выше). Например: добавляют 1 мл казеина с температурой 37°C±2°C к 99 мл стерильно отфильтрованного 0,22 мкм фильтром раствора 1X PBS + 0,1% тритона X100, pH 7,4. Хорошо перемешивают. Получают непосредственно перед каждым применением.
Получение стандартов. Стандарты белка клетки-хозяина (стандарты антигена) (партия № G11203 @ 1,218 мг/мл): Примечание: стоковые растворы хранят в сосудах при номинальной температуре -80°C в аликвотах 70 мкл. Размораживают аликвоту при комнатной температуре. Осуществляют серийные разведения в полипропиленовых пробирках с использованием буфера для разведения.
Получение образцов. В полипропиленовых пробирках разводят конечные совокупные образцы до 24 мг/мл в буфере для разведения. Записывают концентрацию. Примечание: ниже растворы используют для получения образцов с добавкой и для получения указанных ниже растворов объемом 12 мг/мл. В полипропиленовых пробирках растворы объемом 24 мг/мл дополнительно разводят в буфере для разведения до объема 12 мг/мл. Лунки с тройным повтором нагружают каждым из растворов объемом 12 мг/мл на планшете всего из 6 лунок.
Получение добавки. В полипропиленовой пробирке получают 10 нг/мл добавки белка клетки-хозяина из полученного выше стандарта 20 нг/мл посредством его разведения 2× буфером для разведения. Нагружают три лунки раствором с добавкой 10 нг/мл на планшете. Для добавления в образцы используют стандартный раствор 20 нг/мл со стадии 6.1.
Получение образцов с добавкой. В полипропиленовых пробирках добавляют 300 мкл каждого конечного совокупного раствора 24 мг/мл к 300 мкл раствора добавки 20 нг/мл (6.1). Лунки с тройным повтором нагружают каждым из растворов образцов с добавкой, всего 6 лунок.
Получение контроля. Необходимо устанавливать диапазон контроля для каждого нового стокового контрольного раствора до применения в типовом исследовании. Стоковый контрольный раствор: получают аликвоты 150 мкл из партии концентрата лекарственного вещества ABT-308 и хранят замороженным при номинальной температуре -80°C вплоть до трех лет.
Получение рабочего контроля. Размораживают аликвоту контроля при комнатной температуре. В полипропиленовых пробирках разводят контроль до 24 мг/мл буфером для разведения. В полипропиленовых пробирках контрольный раствор 24 мг/мл дополнительно разводят буфером для разведения до 12 мг/мл. Получают однократное разведение и нагружают контроль в 3 лунки планшета.
Способы ELISA. Промывную бутыль для планшетов наполняют буфером для промывки планшета (см. стадию 5.3, 1X PBS + 0,1% тритона X-100). Заправляют промыватель планшетов. Проверяют следующие параметры: необходимо настраивать параметры следующим образом: тип планшета: 1 для каждого цикла (всего 5 циклов); объем: 400 мкл; время выдержки: 10 секунды; время аспирации: 4 секунды.
Способ анализа. На планшет наносят смесь 4 мкг/мл козьих антител для сорбции в холодном 50 мМ бикарбонате натрия по 100 мкл/лунку. Постукивают планшет боком, пока раствор для сорбции не покроет дно каждой лунки однородно, покрывают клейкой лентой и инкубируют при номинальной температуре 4°C одновременно со встряхиванием на планшетном шейкере (или равноценном) при скорости 3 в течение 18 часов ± 1 час. После инкубации в течение ночи планшет убирают из холодильной камеры и дают уравновешиваться до комнатной температуры. Вытряхивают смесь для сорбции. Промокают планшет бумажными салфетками. Блокируют казеином с температурой 37°C±2°C по 300 мкл/лунку, покрывают клейкой лентой и инкубируют при 37°C±2°C одновременно со встряхиванием на планшетном шейкере Lab-line Environ (или равноценном) при 80 об/мин. ± 5 об/мин. в течение 1 часа. В процессе блокирующей инкубации получают стандарт, образец, контроль, добавку и образцы с добавкой. Промывают планшет 5 раз промывочным буфером. Промокают планшет бумажными салфетками. С использованием 8-канальной пипетки прикапывают пипеткой по 300 мкл/лунку стандарты, образцы, добавки, образцы с добавкой и контроль в лунки планшета с тройным повтором. В каждую пустую лунку планшета прикапывают пипеткой по 100 мкл/лунку буфера для разведения, служащего в качестве пустой пробы. Покрывают клейкой лентой и инкубируют при 37°C±2°C одновременно со встряхиванием на планшетном шейкере Lab-line Environ (или равноценном) при 80 об/мин. ± 5 об/мин. в течение 1 часа. Заполняют шаблон для использования в качестве руководства при нанесении на планшет.
Настройка спектрофотометра для чтения планшетов. Настраивают шаблон, вводя концентрации стандартов. Не вводят кратности разведения для образцов, контроля, добавки или образцов с добавкой. Лунки, содержащие разбавитель, определяют как пустые пробы, подлежащие вычитанию из всех лунок. Промывают планшет промывочным буфером 5 раз. Промокают планшет бумажными салфетками. Добавляют биотинилированное козье антитело по 100 мкл/лунку. Покрывают клейкой лентой и инкубируют при 37°C±2°C одновременно со встряхиванием на планшетном шейкере Lab-line Environ (или равноценном) при 80 об/мин. ± 5 об/мин. в течение 1 часа. Промывают планшет промывочным буфером 5 раз. Промокают планшет бумажными салфетками. Добавляют раствор конъюгата нейтравидин-HRP по 100 мкл/лунку. Покрывают клейкой лентой и инкубируют при 37°C±2°C одновременно со встряхиванием на планшетном шейкере Lab-line Environ (или равноценном) при 80 об/мин. ± 5 об/мин. в течение 1 часа. Промывают планшет промывочным буфером 5 раз. Промокают планшет бумажными салфетками. Добавляют холодный субстрат K-Blue по 100 мкл/лунку, покрывают клейкой лентой и инкубируют при комнатной температуре в течение 10 минут (запускают таймер одновременно с добавлением субстрата в первый ряд) одновременно со встряхиванием на шейкере для титровальных планшетов Lab-line (или равноценном) при скорости 3. Останавливают реакцию добавлением 2M фосфорной кислоты по 100 мкл/лунку (стадия 5.7). Помещают планшет на планшетный шейкер при скорости 3 на 3-5 минут. Считывают планшет при 450 нм.
Анализ данных и вычисления. Примечание: принимаются только образцы, добавки, образцы с добавкой и контроль с оптическими плотностями, попадающими в практический предел для проведения количественного анализа (2,5 нг/мл стандарта) стандартной кривой и соответствующими указанным ниже критериям % CV или % различия. Если OD образца опускается ниже стандарта 2,5 нг/мл, то результат необходимо записывать как менее чем 2,5 нг/мл. Затем данную величину необходимо разделить на концентрацию разведенного образца (12 мг/мл) для записи величины в нг/мг. Если образец выше по концентрации белка клетки-хозяина, приводя к тому, что образец без добавки и/или с добавкой находится выше стандартной кривой, величину записывают как >100 нг/мл. Затем данную величину необходимо разделить на концентрацию разведенного образца (12 мг/мл) для записи величины в нг/мг. Величину для образца принимают нулевой по добавке для вычислений степени извлечения, если образец ниже стандарта 2,5 нг/мл.
Стандартная кривая. В шаблон протокола необходимо вносить стандартные концентрации. Применяют построение квадратичной кривой. Коэффициент смешанной корреляции должен быть = 0,99, и % CV между лунками с тройным повтором должен быть = 20%. При несоответствии данным критериям: один стандарт (1 уровень, 3 лунки) можно исключать. Если исключают 1,25 нг/мл, принимают только образцы и образцы с добавкой с оптическими плотностями, попадающими между оптическими плотностями, соответствующими 2,5 нг/мл и 100 нг/мл (оставшиеся точки стандартной кривой). Дополнительно, для тройных повторов каждого уровня стандарта, если отдельная лунка явно контаминирована или демонстрирует низкое связывание, то ее можно исключать. Если лунку исключают из уровня стандарта, то оставшиеся повторы должны иметь % различия = 20%. % CV для самого низкого стандарта, который демонстрирует величины OD, близкие к фоновым величинам (пустым пробам) на планшете, должен быть = 30%. Если исключают одну лунку, то % различия для оставшихся повторов должен быть = 35%. Если исключают самый низкий стандарт, то принимают только образцы и образцы с добавкой с оптическими плотностями, попадающими в оставшиеся оптические плотности стандартной кривой уровня.
Образцы. % CV должен быть = 20% между лунками с тройным повтором. Записывают % CV между лунками с тройным повтором. Можно исключать одну лунку из каждого разведения образца. Оставшиеся повторы должны иметь % различия = 20%. Примечание: если OD образца без добавки ниже 2,5 нг/мл OD стандарта, то критерии % различия не применяют к результатам для образца без добавки. См. вычисления выше.
Вычисляют фактическую концентрацию белков клетки-хозяина в нг/мг из средней величины (нг/мл), как указано ниже: белки клетки-хозяина CHO (нг/мг) = средний "результат для образцов без добавки (нг/мл)" _ концентрация разведенного образца (12 мг/мл).
Добавки. % CV должен быть = 20% между лунками с тройным повтором. Записывают % CV. Можно исключать одну лунку из добавки. Оставшиеся точки должны иметь % различия = 20%. См. вычисления выше. Записывают концентрацию белков клетки-хозяина в нг/мл. Данные результаты будут использовать в вычислениях степени извлечения. Полученная концентрация добавки (нг/мл) должна составлять ±20% от теоретической концентрации добавки. Записывают результат и указывают "пройден" или "не пройден". Если результат добавки не попадает в 20% от теоретического, то анализ необходимо повторить. Средняя концентрация добавки (нг/мл) × 100 = должна составлять 100% ± 20% 10 нг/мл.
Образцы с добавкой. % CV должен быть = 20% между лунками с тройным повтором. Записывают % CV между лунками с тройным повтором. Можно исключать одну лунку из каждого разведения образца с добавкой. Оставшиеся повторы должны иметь % различия = 20%. См. вычисления выше. Записывают "результат для образца с добавкой" для каждого разведения в нг/мл. Записывают % различия между дублирующими разведениями. % Различия между разведениями должен быть = 25%. Данные результаты будут использовать в вычислениях степени извлечения.
Вычисляют % степени извлечения для каждого набора разведений с использованием указанной ниже формулы: % степени извлечения = величина для образца с добавкой - величина для образца с добавкой × 100 величины добавки. Примечание: (1) если величина OD образца без добавки опускается ниже стандарта 2,5 нг/мл, то величину принимают как нулевую по вычислению % степени извлечения. % Степени извлечения должен составлять 100% ± 50% (50%-150%) для каждого разведения для каждого образца. Записывают результаты и "пройден"/"не пройден".
Контроль. % CV должен быть = 20% между лунками с тройным повтором. Записывают результат % CV. Можно исключать одну лунку из контроля. Оставшиеся повторы должны иметь % различия = 20%. См. вычисления выше. Записывают концентрацию белка клетки-хозяина в контроле в нг/мл. Вычисляют концентрацию белка клетки-хозяина в нг/мг, как указано ниже: белки клетки-хозяина (нг/мг) = результат для контроля белков клетки-хозяина в нг/мл.
4. Определение концентрации белка A в композициях антитела
При данном ELISA планшеты подвергают сорбции антителом курицы против белка A и инкубируют. Неспецифичные участки блокируют казеином в PBS. Планшеты промывают 1X PBS + 0,1% тритона X-l00 для удаления несвязавшегося материала. Образцы и стандарты Cys-protein A разводят 1X PBS + 4,1% тритона X + 10% казеина. Растворы подвергают денатурации путем нагревания при 95°C±2°C, отделяя белок A от антитела. В конкретных вариантах осуществления, например, если (GE Healthcare) растворы затем добавляют в планшет и инкубируют. В альтернативных вариантах осуществления, например, если стадия аффинной хроматографии с белком A включает использование ProSep Ultra Plus™ (Milipore), растворы охлаждают и в каждую пробирку добавляют (1:1) 0,85% NaCl + 12,5% 1 н. уксусной кислоты + 0,1% Tween 20 для дополнительного содействия отделению белка A от белка в образце. Пробирки интенсивно перемешивают на центрифуге типа вортекс, инкубируют и центрифугируют. Супернатанты удаляют и дополнительно обрабатывают. Несвязавшийся материал промывают 1X PBS + 0,1% тритона X-100. Биотинилированные антитела курицы против белка A добавляют в планшет для микротитрования и инкубируют. Планшет промывают для удаления несвязавшегося материала и добавляют конъюгат нейтравидин-пероксидаза.
Нейтравидин будет связываться с биотинилированным антителом курицы против белка A, которое связалось с лунками. Планшет снова промывают для удаления несвязавшегося нейтравидина и добавляют в планшет субстрат K-Blue (тетраметилбензидин (TMB)). Связавшийся нейтравидин гидролизует субстрат, вызывая синее окрашивание. Реакцию останавливают фосфорной кислотой, изменяющей цвет на желтый. Интенсивность желтого окрашивания в лунках прямо пропорциональна концентрации белка A, присутствующего в лунках.
Получение реактивов и растворов. Бутыли с казеином необходимо нагревать до 37°C±2°C; подвергать воздействию ультразвуком в течение 2 минут и аликвотировать. Аликвоты подлежат хранению при номинальной температуре 4°C. Когда нужно проводить анализ, необходимое количество аликвот казеина следует помещать при 37°C±2°C. Буфер для сорбции и субстрат используют холодными (взятыми при номинальной температуре 4°C непосредственно перед использованием).
50 мМ бикарбонат натрия (буфер для сорбции), pH 9,4. В стакан на 1 л добавляют: 900 мл воды Milli-Q, 4,20 г ± 0,01 г бикарбоната натрия. Перемешивают до полного растворения. Доводят pH до 9,4 с помощью 1 н. NaOH. Переносят в мерную колбу на 1 л и доводят объем водой Milli-Q. Перемешивают переворачиванием до однородности. Фильтруют через стерильный фильтрующий элемент 0,22 CA мкм. Хранят при номинальной температуре 4°C в течение до 7 дней от даты получения.
104 Μ Na2HPO4 * 7H2O, 1,37 Μ NaCl, 0,027 Μ KC1, 0,0176 Μ KH2PO4, pH=6,8-6,9. (10X PBS): В стеклянный стакан добавляют приблизительно 400 мл воды Milli-Q. Добавляют 13,94 г ± 0,01 г Na2HPO4 × 7H2O. Добавляют 40,0 г ± 0,1 г NaCl. Добавляют 1,00 г± 0,01 г KC1. Добавляют 1,20 г± 0,01 г KH2PO4. Перемешивают до однородности. Переносят в мерную колбу на 500 мл. Добавляют воду Milli-Q в количестве, достаточном для доведения объема до 500 мл. Перемешивают переворачиванием. Фильтруют через стерильный фильтрующий элемент 0,2 CA мкм. Хранят при комнатной температуре в течение до 7 дней.
1X PBS + 0,1% тритона X-100, pH 7,40: (буфер для промывки планшета). В градуированном цилиндре на 4 л смешивают 400 мл 10X PBS (см. выше) с 3500 мл воды Milli-Q. Проверяют pH и при необходимости доводят его до 7,40±0,05 с помощью 1 н. HCl или 1 н. NaOH. Доводят объем водой Milli-Q. Плотно закрывают цилиндр парафильмом и перемешивают переворачиванием до однородности. Переносят в бутыль на 4 л. Удаляют 4 мл 1X PBS и выбрасывают. Добавляют 4 мл тритона X-100 в 3996 мл 1X PBS. Помещают на мешалку и перемешивают до полного растворения. Хранят при комнатной температуре в течение до 7 дней.
Антитело курицы против белка A для сорбции. Во время применения берут одну аликвоту на планшет. Для подготовки новых партий антитела курицы против белка A необходимым может быть применение и совместная подготовка конъюгированного с биотином антитела курицы против белка A (полученного из той же партии для сорбции). Непосредственно перед применением: разводят смесь антитела в холодном 50 мМ бикарбонате натрия до концентрации, определяемой при подготовке к сорбции. Например: если при подготовке концентрацию антитела для сорбции, наносимого на планшет, определяли как 6 мкг/мл, и если концентрация в стоковом растворе составляет 3000 мкг/мл, то добавляют 24 мкл антитела для сорбции к 11976 мкл холодного буфера для сорбции. Осторожно перемешивают переворачиванием.
Биотинилированное антитело курицы против белка A. Во время применения берут одну аликвоту антитела на планшет. Для подготовки новых партий конъюгированного с биотином антитела курицы против белка A необходимым может быть применение и подготовка той же партии антитела курицы против белка A, из которого его получали. Непосредственно перед применением: разводят биотинилированное антитело в казеине с температурой 37°C±2°C до концентрации, определяемой при подготовке биотинилированного антитела. Например: если при подготовке концентрацию биотинилированного антитела, наносимого на планшет, определяли как 4 мкл/мл, и если концентрация в стоковом растворе составляет 1000 мкг/мл, то добавляют 48 мкл биотинилированного антитела к 11952 мкл казеина с температурой 37°C±2°C. Осторожно перемешивают переворачиванием.
Нейтравидин-HRP. Растворяют новые партии (2 мг/сосуд) до 1 мг/мл, как указано ниже: в сосуд добавляют 400 мкл воды Milli-Q, затем добавляют 1600 мкл 1X PBS для общего объема 2 мл. Осторожно перемешивают на центрифуге типа вортекс до смешивания. Хранят при номинальной температуре -80°C. Аликвоты с желаемым объемом получают таким образом, что применяют 1 аликвоту на планшет. Получают в полипропиленовой пробирке. Назначают срок хранения 6 месяцев от даты получения. Например, если рабочую концентрацию определяли как 0,1 мкг/мл, то получают, как указано ниже. Непосредственно перед применением аликвоту нейтравидина-HRP размораживают при комнатной температуре. Разводят 1 мг/мл раствора нейтравидина до 0,1 мг/мл (10 мкг/мл) казеином с температурой 37°C±2°C. Например: разводят X10, добавляют 50 мкл нейтравидина к 450 мкл казеина. Осторожно перемешивают на центрифуге типа вортекс до смешивания, снова разводят X10, добавляют 100 мкл X10 нейтравидина к 900 мкл казеина. Осторожно перемешивают на центрифуге типа вортекс до смешивания. Дополнительно разводят 10 мкг/мл раствора до 0,1 мкг/мл казеином с температурой 37°C±2°C. Например: разводят X100, добавляют 120 мкл нейтравидина (10 мкг/мл) к 11880 мкл казеина. Несколько раз осторожно переворачивают для перемешивания.
Стоп-реагент (используют купленную 1 н. фосфорную кислоту). Хранят при температуре окружающей среды в течение до 1 года с даты получения. Буфер для разведения (1X PBS + 4,1% тритона X-100 + 10% казеин, pH 7,4). В стакан или флакон добавляют 86 мл 1X PBS + 0,1% тритона X100, pH 7,4 (со стадии 5.3), добавляют 4 мл тритона X-100 и 10 мл блокирующего казеина в PBS и перемешивают до растворения/смешивания. Растворение тритона может занимать от 20 до 30 минут. Это приравнивают к раствору 1X PBS + 4,1% тритона X-100 + 10% казеин, pH 7,4. Фильтруют через стерильный фильтрующий элемент 0,22 CA мкм. Получают непосредственно перед каждым применением. Этого достаточно для 1 планшета.
Стандарты белка A (стандарты антигена). Примечание: Стоковые растворы хранят в сосудах при номинальной температуре -20°C в 70 мкл аликвотах. Размораживают аликвоту на льду. Осуществляют серийные разведения, в соответствии с примерами в таблице ниже, в полипропиленовых пробирках с использованием буфера для разведения (см. выше), используя концентрацию, указанную на сертификате производителя: Например, если указанная на сертификате концентрация составляет 2,1 мг/мл (2100000 нг/мл), то: Образцы размораживают на льду. В полипропиленовых микроцентрифужных пробирках разводят конечные совокупные образцы до 20 мг/мл в буфере для разведения (указано выше). Осуществляют 2 отдельных разведения. Записывают концентрацию. Используют указанные ниже растворы для получения образцов с добавкой и получения 10 мг/мл растворов. В полипропиленовых микроцентрифужных пробирках дополнительно разводят 20 мг/мл растворы до 10 мг/мл в буфере для разведения.
Получение добавки. В полипропиленовой микроцентрифужной пробирке получают 0,296 нг/мл добавки белка A из 0,593 нг/мл стандарта, полученного выше на стадии 6.1, посредством его разведения 2X буфером для разведения. Осуществляют однократное разведение. Лунки с тройным повтором для 0,296 нг/мл раствора добавки будут наносить на планшет. Для добавления в образцы используют стандартный 0,593 нг/мл раствор со стадии 6.1.
Получение образцов с добавкой. В полипропиленовых микроцентрифужных пробирках добавляют 500 мкл каждого 20 мг/мл конечного совокупного раствора к 500 мкл раствора 0,593 нг/мл добавки. Выдерживают для денатурации. Лунки с тройным повтором для каждого из растворов образцов с добавкой загружают на планшет, всего 6 лунок.
Получение контроля. Получают партию лекарственного вещества ABT-308. Получают 150 мкл аликвоты и хранят замороженными при номинальной температуре -80°C в течение трех лет от даты аликвотирования.
Рабочий контроль: Размораживают аликвоту контроля на льду. В полипропиленовых микроцентрифужных пробирках разводят контроль буфером для разведения до 10 мг/мл, чтобы конечный объем составлял 1000 мкл. Получают однократное разведение. Выдерживают для денатурации. Лунки с тройным повтором контроля загружают на планшет.
Денатурация. Для пустых проб планшета добавляют 1000 мкл буфера для разведения в микроцентрифужные пробирки, равные по количеству пустым пробам на планшете. Крышки пробирок можно закрывать парафильмом для предотвращения их открывания в процессе нагревания или поверх них можно помещать второй штатив, чтобы крышки оставались закрытыми. Нагревают стандарты, образцы без добавки, образцы с добавкой, добавку, пустые пробы и контроль при 95°C±2°C в течение 15 минут. При охлаждении с пробирок удаляют парафильм, если его использовали. Дают охлаждаться в течение 15 минут и центрифугируют в течение 5 минут приблизительно при 10000 об/мин. Переносят 700 мкл супернатанта в пробирки для загрузки на планшет. Соблюдают осторожность, чтобы не задеть осадок тритон/белок.
Инструкции для промывателя планшетов и настройка водяной бани. Бутыль промывателя планшетов наполняют буфером для промывки планшета (см. стадию 5.3, 1X PBS + 0,1% тритона X-100). Заправляют промыватель планшетов. Проверяют следующие параметры: Необходимо настраивать параметры следующим образом: тип планшета: 1 для каждого цикла (всего 4 цикла): скорость аспирации: 10 мм/с; объем: 400 мкл; время выдержки: 5 секунд; время аспирации: 6 секунд. Включают водяную баню и устанавливают на 95°C. Дают температуре водяной бане выровняться до 95°C±2°C в течение по меньшей мере 30 минут.
Способ анализа: Инструкцию можно использовать в качестве руководства, отмечая стадии при их завершении. Дополнительно, записывают все оборудование, применяемое при анализе. Количество аликвот казеина, подлежащее использованию каждый день, когда проводят анализ, необходимо помещать при 37°C±2°C. Буфер для сорбции и субстрат используют холодными. Получают стандарт, образец, контроль, добавку и образцы с добавкой перед блокирующей инкубацией и во время нее. Для получения разведений, переноса в пробирки Эппендорфа, денатурации в течение 15 минут, охлаждения в течение 15 минут, центрифугирования в течение 5 минут и переноса в пробирки может потребоваться более 1 часа блокирующей инкубации. В расчет берут по меньшей мере 40 минут до блокирования планшетов. Образцы, образцы с добавкой, стандарты, контроль, добавку для анализа и пустые пробы загружают на планшет горизонтально от ряда Β до G с использованием 12-канальной пипетки. Стандарты загружают от высокой до низкой концентрации. Планшет подвергают сорбции, добавляют биотин, добавляют нейтравидин, добавляют субстрат и добавляют стоп-раствор вертикально от колонки 2 до 11.
Планшеты подвергают сорбции с помощью 100 мкл/лунку антитела для сорбции в холодном 50 мМ бикарбонате натрия. Постукивают планшет боком, пока раствор для сорбции не покроет дно каждой лунки однородно, покрывают клейкой лентой и инкубируют при номинальной температуре 4°C одновременно со встряхиванием на планшетном шейкере (или равноценном) при скорости 3.
После инкубации в течение ночи планшет убирают из холодильной камеры и дают уравновеситься до комнатной температуры. Вытряхивают смесь для сорбции. Промокают планшет бумажными салфетками. Блокируют казеином с температурой 37°C±2°C по 300 мкл/лунку, покрывают клейкой лентой и инкубируют при 37°C±2°C одновременно со встряхиванием на планшетном шейкере Lab-line Environ (или равноценном) при 80 об/мин. ± 5 об/мин. в течение 1 часа ± 10 минут.
Стандарт, образец, контроль, добавку и образцы с добавкой получают до и в процессе блокирующей инкубации. Промывают планшет 4 раза промывочным буфером. Промокают планшет бумажными салфетками. С использованием 8-канальной пипетки прикапывают денатурированные стандарты, образцы, добавки, образцы с добавкой пустые пробы и контроль по 100 мкл/лунку в лунки планшета с тройным повтором. Внешние лунки планшета не используют, в эти лунки добавляют необработанный буфер для разведения. Покрывают клейкой лентой и инкубируют при 37°C±2°C одновременно со встряхиванием на планшетном шейкере Lab-line Environ (или равноценном) при 80 об/мин. ± 5 об/мин. в течение 2 часов. Заполняют шаблон для использования в качестве руководства при нанесении на планшет.
Настройка спектрофотометра для чтения планшетов. Промывают планшет промывочным буфером 4 раза. Промокают планшет бумажными салфетками. Добавляют биотинилированное антитело по 100 мкл/лунку. Покрывают клейкой лентой и инкубируют при 37°C±2°C одновременно со встряхиванием на планшетном шейкере Lab-line Environ (или равноценном) при 80 об/мин. ± 5 об/мин. в течение 1 часа.
Промывают планшет промывочным буфером 4 раза. Промокают планшет бумажными салфетками. Добавляют раствор конъюгата нейтравидин-HRP по 100 мкл/лунку. Запускают таймер одновременно с добавлением нейтравидина в последний ряд. Покрывают клейкой лентой и инкубируют при 37°C±2°C одновременно со встряхиванием на планшетном шейкере Lab-line Environ (или равноценном) при 80 об/мин. ± 5 об/мин. в течение 30 минут. Промывают планшет промывочным буфером 4 раза. Промокают планшет бумажными салфетками. Добавляют холодный субстрат K-Blue по 100 мкл/лунку, покрывают клейкой лентой и инкубируют при комнатной температуре в течение 10 минут (запускают таймер одновременно с добавлением субстрата в первый ряд), одновременно со встряхиванием на шейкере для титровальных планшетов Lab-line (или равноценном) при скорости 3. Останавливают реакцию добавлением 1 н. фосфорной кислоты по 100 мкл/лунку. Помещают планшет на планшетный шейкер при скорости 3 на 3 минуты. Считывают планшет при 450 нм.
Анализ данных и вычисления. Примечание: принимают только образцы, добавки, образцы с добавкой и контроль с оптическими плотностями, попадающими в практический предел для проведения количественного анализа стандартной кривой и соответствующими указанным ниже критериям % CV или % различия. Если OD образца опускается ниже стандартной кривой, то результат необходимо записывать как менее чем 0,18 нг/мл (LOQ анализа). Затем данную величину необходимо разделить на концентрацию разведенного образца (10 мг/мл) для записи величины в нг/мг. Если образец выше по концентрации белка A, приводя к тому, что образец без добавки и/или с добавкой будет выше стандартной кривой (2 нг/мл), то дополнительно разводят для попадания в стандартную кривую. Затем данную величину необходимо разделить на концентрацию разведенного образца для записи величины в нг/мг. Для вычислений степени извлечения величину для образца без добавки (нг/мл) вычитают из величины для образца с добавкой (нг/мл), даже если величина для образца без добавки (нг/мл) находится ниже кривой. Если величина получается отрицательной, или получают диапазон, то величину для образца без добавки принимают нулевой для вычислений степени извлечения.
Стандартная кривая. В шаблон протокола необходимо вносить стандартные концентрации. Применяют построение квадратичной кривой. Коэффициент смешанной корреляции должен быть = 0,99 и % CV между лунками с тройным повтором должен быть = 20%. При несоответствии данным критериям: один стандарт (1 уровень, 3 лунки) можно исключать. Если исключают 0,18 нг/мл, принимают только образцы и образцы с добавкой с оптическими плотностями, попадающими между оптическими плотностями, соответствующими 0,26 нг/мл и 2 нг/мл (оставшиеся точки стандартной кривой). Дополнительно, для тройных повторов каждого уровня стандарта, если отдельная лунка явно контаминирована или демонстрирует низкое связывание, ее можно исключить. Если лунку исключают из уровня стандарта, то оставшиеся повторы должны иметь % различия = 20%. % CV для самого низкого стандарта, демонстрирующего величины OD, близкие к фоновым величинам (пустым пробам) на планшете, должен быть = 30%. Если исключают одну лунку, то % различия для оставшихся повторов должен быть = 35%. Если исключают самый низкий стандарт, то принимают только образцы и образцы с добавкой с оптическими плотностями, попадающими в оставшиеся оптические плотности стандартной кривой уровня.
Вычисляют % различия как указано ниже: % различия = (абс. (результат для разведения 1 - результат для разведения 2)/средняя величина)×100%. Анализ необходимо повторять, если стандарты не соответствуют указанным выше критериям. Записывают величины % CV и/или % различия и результаты вычисления коэффициента смешанной корреляции для стандартной кривой.
Образцы. % CV должен быть = 20% между лунками с тройным повтором. Записывают % CV между лунками с тройным повтором. Можно исключать одну лунку для каждого разведения образца. Оставшиеся повторы должны иметь % различия = 20%. Примечание: если OD образца без добавки ниже наименьшей OD стандарта, то критерии % различия не применяют к результатам для образца без добавки. См. вычисления выше.
Записывают "результат для образца без добавки" для каждого разведения в нг/мл. Данные величины будут использовать в вычислениях степени извлечения. Вычисляют средний "результат для образца без добавки (нг/мл)" и % различия между результатами. Записывают результаты. % различия между разведениями должен быть = 25%. Вычисляют фактическую концентрацию белка A в нг/мг от средней величины (нг/мл), как указано ниже: белок A (нг/мг)= средний "результат для образца без добавки (нг/мл)"/Концентрация разведенного образца (10 мг/мл). Записывают результат.
Добавки. % CV должен быть = 20% между лунками с тройным повтором. Записывают % CV. Можно исключать одну лунку из добавки. Оставшиеся точки должны иметь % различия = 20%. См. вычисления выше. Записывают концентрацию белка A в нг/мл. Данный результат будут использовать в вычислениях степени извлечения. Полученная концентрация добавки (нг/мл) должна составлять ±20% от теоретической концентрации добавки. Записывают результат и указывают "пройден" или "не пройден". Если результат добавки не попадает в 20% от теоретического, то анализ необходимо повторять. Средняя концентрация добавки (нг/мл) × 100 = должна составлять 100% ± 20% 0,296 нг/мл.
Образцы с добавкой. % CV должен быть = 20% между лунками с тройным повтором. Записывают % CV между лунками с тройным повтором. Можно исключать одну лунку из каждого разведения образца с добавкой. Оставшиеся повторы должны иметь % различия = 20%. См. вычисления выше. Записывают "результат для образца с добавкой" для каждого разведения в нг/мл. Записывают % различия между дублирующими разведениями. % различия между разведениями должен быть = 25%. Данные результаты будут использовать в вычислениях степени извлечения. Вычисляют % степени извлечения для каждого набора разведений с использованием указанной ниже формулы: % степени извлечения = величина для образца с добавкой - величина для образца без добавки × 100 величины добавки. Примечание: для вычислений степени извлечения величину для образца без добавки (нг/мл) вычитают из величины для образца с добавкой (нг/мл), даже если величина для образца без добавки (нг/мл) находится ниже кривой. Если величина является отрицательной или получают диапазон, то величину для образца без добавки принимают нулевой для вычислений степени извлечения. % степени извлечения должен составлять 100% ± 50% (50%-150%) для каждого разведения каждого образца. Записывают результаты и "пройден"/"непройден".
Контроль. % CV должен быть = 20% между лунками с тройным повтором. Записывают результат % CV. Можно исключать одну лунку из контроля. Оставшиеся повторы должны иметь % различия = 20%.
В настоящем документе цитируются различные публикации, содержание которых, таким образом, включено путем ссылки в полном объеме.
105
Реферат
Изобретение относится к области биотехнологии и иммунологии. Описан способ выделения и очистки антител против IL-13, где использование стадии аффинной хроматографии приводит к получению, по существу, чистой композиции антитела для фармацевтического применения. Способ включает снижение/инактивацию вирусов pH, ультрафильтрацию/диафильтрацию, аффинную хроматографию, ионообменную хроматографию и хроматографию с гидрофобным взаимодействием. Кроме того, описана фармацевтическая композиция, содержащая одно или несколько антител по настоящему изобретению. 5 н. и 32 з.п. ф-лы, 7 ил., 10 табл.
Формула
(a) приведение указанной смеси образца в контакт со смолой с белком А для аффинной хроматографии, промывку указанной смолы для аффинной хроматографии буфером, содержащим 25 мМ Трис, 100 мМ NaCl, рН 7,2, затем буфером, содержащим 20 мМ цитрата натрия/лимонной кислоты, 0,5 М NaCl, рН 6,0, а затем буфером, содержащим 25 мМ Трис, 100 мМ NaCl, рН 7,2, и сбор образца после аффинной хроматографии;
(b) подвергание указанного образца после аффинной хроматографии снижению рН, таким образом, получение образца со сниженным рН, где указанный образец со сниженным рН имеет рН от приблизительно 3 до приблизительно 4;
(c) доведение указанного образца со сниженным рН до рН от приблизительно 4,5 до приблизительно 8,5 и приведение указанного образца с доведенным рН в контакт с ионообменным материалом и сбор образца после ионообменной хроматографии;
(d) приведение указанного образца после ионообменной хроматографии в контакт с материалом для хроматографии с гидрофобным взаимодействием (HIC) и сбор образца после HIC, где указанный образец после HIC содержит препарат указанного антитела со сниженным содержанием НСР или его антигенсвязывающей части.
рН указанного образца после аффинной хроматографии на стадии (b) снижают до рН 3,5,
рН указанного образца со сниженным рН на стадии (с) доводят до рН 8, и ионообменный материал представляет собой мембрану Q,
и материал для HIC на стадии (d) представляет собой агарозу, замещенную фенильными группами.
Документы, цитированные в отчёте о поиске
Удаление агрегатов с высокой молекулярной массой путем хроматографии на гидроксиапатитах

Комментарии