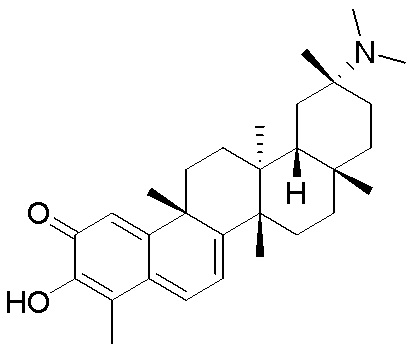
Аналоги целастрола - RU2776845C2
Код документа: RU2776845C2
Чертежи













Описание
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрошен приоритет на основании предварительной заявки США № 62/245,356, поданной 23 октября 2015, полное содержание которой включено сюда в качестве ссылки полностью.
УРОВЕНЬ ТЕХНИКИ
В 2008 по оценкам Всемирной организации здравоохранения (ВОЗ) 1,4 миллиарда взрослых людей по всему миру имели лишний вес; из них 200 миллионов мужчин и 300 миллионов женщин имели ожирение. По прогнозам более одного миллиарда людей в мире будут страдать ожирением к 2030. Ожирение является основной причиной развития расстраивающих здоровье состояний, таких как диабет 2 типа, сердечнососудистые заболевания, остеоартрит (проблема со здоровьем, вызывающая боль, опуханием и неподвижность одного или более сустава), удар, гипертония, рак (молочной железы, толстой кишки, эндометрия (относящийся к слизистой оболочке матки) и почек) и не алкогольный стеатогепатит, все которые снижают качество жизни и продолжительность жизни.
Среди экспертов в области здоровья по всему миру в настоящее время существует согласие в том, что глобальная эпидемия ожирения будет одной из ведущих причин смертности для настоящего и будущих поколений, если не остановить неуклонный рост распространенности этого расстройства. Хотя раньше данная проблема рассматривалась в основном в западных культурах, в настоящее время развивающиеся страны вступили в ряды стран, страдающих ожирением. В 1999 ОО было обнаружено, что ожирение присутствует и быстро растет во всех развивающихся регионах, даже в тех странах, где все еще существует голод. Ожирение определяется Всемирной организацией здравоохранения (ВОЗ) как субъект, имеющий значение индекса массы тела (ИМТ=масса тела в кг/рост в м2) >30 кг⋅м-2 (нормальный ИМТ=20-25 кг⋅м-2).
Лишний вес и ожирение возникают при энергетическом дисбалансе. Телу необходимо определенное количество энергии (калорий) из пищи для сохранения основных жизненных функций. Масса тела остается без изменений, когда количество съеденных калорий равно количеству калорий, которое тело использует или ʺсжигаетʺ. В течение времени, когда люди едят и пьют больше калорий, чем они сжигают, энергетический баланс сдвигается в сторону увеличения веса, лишнего веса и ожирения.
Возможным объяснением быстрого возрастания ожирения является то, что оно управляется сочетанием генетических, социальных и факторов окружающей среды. Хотя значительной части людей удается очень эффективно сохранять здоровую массу тела с помощью тщательного питания и разумного уровня физических упражнений, для многих других этот план не позволяет получить желаемое здоровое состояние. Для некоторой части людей с ожирением требуется фармакотерапия для обеспечения необходимой дополнительной поддержки питанию, упражнениям и изменению стиля жизни, который позволит достичь клинически благоприятного снижения массы тела >5%.
Не существует единственной причины для всех случаев лишнего веса и ожирения. Не существует единственного подхода, который поможет предотвратить или лечить лишний вес и ожирение. Лечение может включать сочетание поведенческих изменений, питания, упражнений и, иногда, лекарственных средств для снижения веса. В некоторых случаях крайнего ожирения, вариантов может быть хирургическое вмешательство для снижения веса. В течение последних 15 лет было зарегистрировано только четыре новых лекарственных средства, т.е. дексфенфлурамин (Redux®), сибутрамин (Meridia®, Reductil®), орлистат (Xenical®) и римонабант (Acomplia®), для лечения ожирения. Из этих лекарственных средств только три, дексфенфлурамин, сибутрамин и орлистат, получили мировую (за исключением Японии) регистрацию. Существует огромная потребность в развитии дополнительных лекарственных средств против ожирения, которые являются безопасными и эффективными.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Здесь представлены, кроме прочего, композиции, содержащие соединения, описанные здесь, и способы их применения.
В различных вариантах, представленные здесь соединения содержат структурные модификации, сравнимые с целастролом.
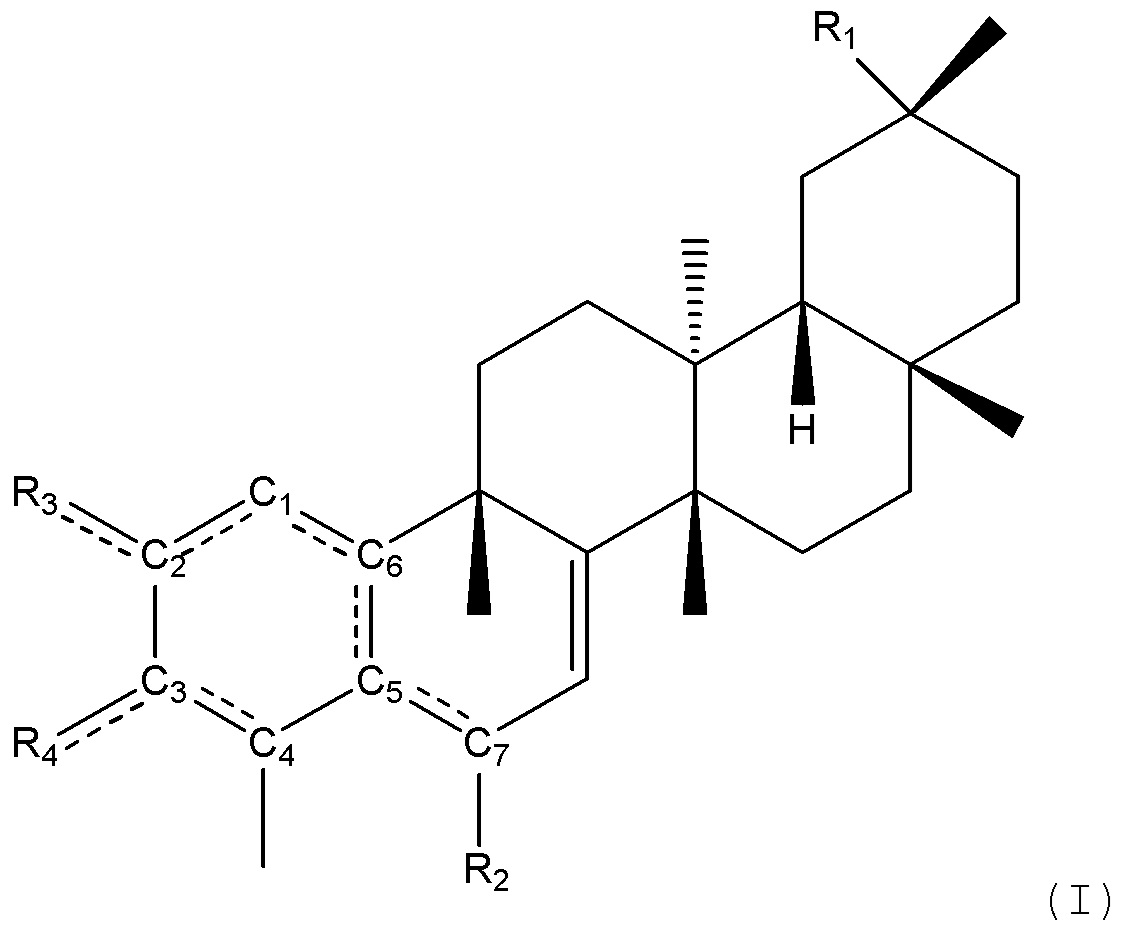
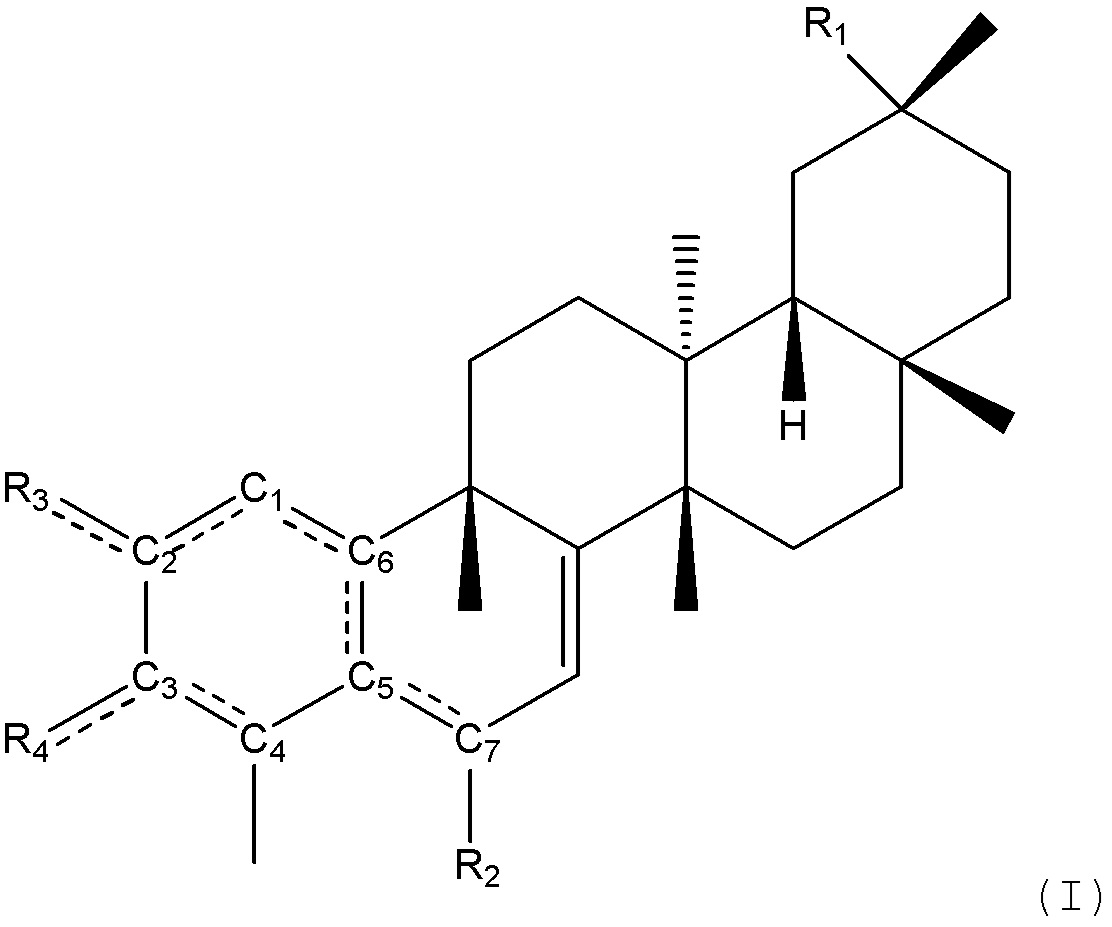
В одном аспекте, композиции могут способствовать снижению веса, снижению жира в теле, снижению потребления пищи, улучшению гомеостаза или их сочетанию. Соединения имеют структуру формулы (I):
где
пунктирные линии между C1 и C2, C2 и R3, C3 и R4, C5 и C6, C5 и C7, C1 и C6 и C3 и C4 показывают, что может присутствовать одинарная или двойная связь, как позволяет валентность;
R1 является -CN, -COOH, -COOCH2CH3, -CONHR5, -CONR5R5,-COOR5, -COOCH3,-CH2NR5R5, -CH2OCONR5R5, -CH2NR5COOR5, -CH2R5,-CH2NR5CONR5R5, -CH2OH, -CH2OR5, алкилсульфатом, алкилсульфонатом, алкилфосфатом, -CH2OSO3R5, -CH2OSO2R5, -CH2OPO3R5R5, -CH2OPO3HR5,-CH2OPO3H2, -C(=NR5)NR5R5, -NR5C(=NR5)NR5R5, -CONH2, -CH2CONR5R5, -SR5, -SO3R5, -SO2R5,-CH2NHCOR5, -CH2NHCNR5NR5R5, -CH2COSR5, CH2NR5COR5, -CH2NR5CNR5NR5R5, -CH2NR5COSR5, -CH2NHSO2R5, -CH2N R5SO2R5, -CHNR5, -CHNOR5, -H, -NH2, -NHR5, -NR5R5, -OH, -OR5, фосфатом, -OPO3R5R5, -OPO3HR5, -OPO3H2, -NCO, -NCS, -N3, - R5, -C≡CR5, -(CH=CH)R5, -SH, -SR5, -SO2H, -SO3H, -SO2NR5R5, -SO3R5, -NHCOR5, -NHCNR5NR5R5, -NHCOSR5, вторичным амидом, третичным амидом, -NR5COR5, -NR5C(=NH)NR5R5, -NR5COSR5, -NHC(=NR5)R5, -NR5C(=NR5)R5, -NHSO2(NH2), -NHSO2R5, -NR5SO2R5, -NR5SO2NR5R5, -OCOR5, -OCONR5R5, -O(C=O)OR5, -SCOR5, -O(C=NH)NR5R5, -OCSNHR5, -OS(=O2)R5, -OS(=O2)NR5R5, -SCONR5R5, -CH2-арилом, -CH2-гетероарилом,
R2 является -H, -CH3, -SCH(CH3)2, -SC(=O)CH3, -SC(=O)R5, -SCH2CH2OCOCH3, -SR5, -SOR5, -SOOR5, -SCONR5R5,
R3 является -OCOCH3, -OCOOCH2CH3, -OR7, -R7 или -NR5R5, если двойная связь присутствует между C1 и C2, C3 и C4 и C5 и C6
R4 является -OCOCH3, -OCOOCH2CH3, -OR7, -R7 или -NR5R5, если двойная связь присутствует между C1 и C2, C3 и C4, и C5 и C6;
R3 является O, если R4 является O и двойная связь присутствует между C2 и R3 и C3 и R4;
R4 является -OCH3, -OP(=O)(OCH3)2, -OH, -OCOOCH2CH3, -OCONHCH2CH3, -OCOOCH(CH3)2, -OR7, -R7 или -NR5R5, если R3 является O и двойная связь присутствует между C2 и R3; R3 и R4 также могут быть объединены с образованием гетероциклического или карбоциклического кольца;
R5 независимо выбирают в каждом случае из водорода, алкила, циклоалкила, алкокси, гетероциклоалкила, алкиларила, алкенила, алкинила, арила, амина или гетероарила, необязательно замещенных заместителями, индивидуально выбранными из алкила, алкокси, циклоалкила, простого эфира, амина, необязательно замещенного одним или более алкилом, галогена, гидроксила, простого эфира, циано, нитрила, CF3, сложного эфира, амида, циклоалкиламида, сахара, гетероариламида, необязательно замещенного алкилом и/или алкокси, мочевины, карбамата, тиоэфира, сульфата, сульфонила, сульфоновой кислоты, карбоновой кислоты и арила, или две группы R5, взятые вместе, образуют циклоалкильную, гетероциклоалкильную, арильную или гетероарильную группу, необязательно замещенную заместителями, индивидуально выбранными из алкила, циклоалкила, алкокси, гетероциклоалкила, алкиларила, алкенила, алкинила, арила, гетероарила, амина, галогена, гидроксила, простого эфира, нитрила, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, тиоэфира или группы карбоновой кислоты; и
R7 является водородом, алкилом, циклоалкилом, гетероциклоалкилом, алкиларилом, алкенилом, алкинилом, арилом или гетероарилом, необязательно замещенных заместителями, индивидуально выбранными из алкила, циклоалкила, простого эфира, амина, галогена, гидроксила, простого эфира, нитрила, циано, нитрила, CF3, сложного эфира, амида, мочевина, карбамата, тиоэфира или карбоновой кислоты,
или его фармацевтически приемлемая соль или пролекарство.
В некоторых вариантах, R1 является -NR5C(=NR5)NR5R5, -SR5, -SO3R5, -SO2R5, -NH2, -NHR5, -NR5R5, -OH, -OR5, -NCO, -NCS, -N3, -SH, -SR5, -SO2H, -SO3H, -SO2NR5R5, -SO3R5, -NHCOR5, -NHCNR5NR5R5, -NHCOSR5, -NR5COR5, -NR5C(=NH)NR5R5, -NR5COSR5, -NHC(=NR5)R5, -NR5C(=NR5)R5, -NHSO2(NH2), -NHSO2R5, -NR5SO2R5, -NR5SO2NR5R5, -OCOR5, -OCONR5R5, -O(C=O)OR5, -SCOR5, -O(C=NH)NR5R5, -OCSNHR5, -OS(=O2)R5, -OS(=O2)NR5R5 или -SCONR5R5.
В некоторых вариантах, R2 является H.
В некоторых вариантах, R4 является -OH, -OR7 или -R7, если R3 является O и двойная связь присутствует между C2 и R3.
В одном аспекте, композиции содержат соединения структуры формулы (II):
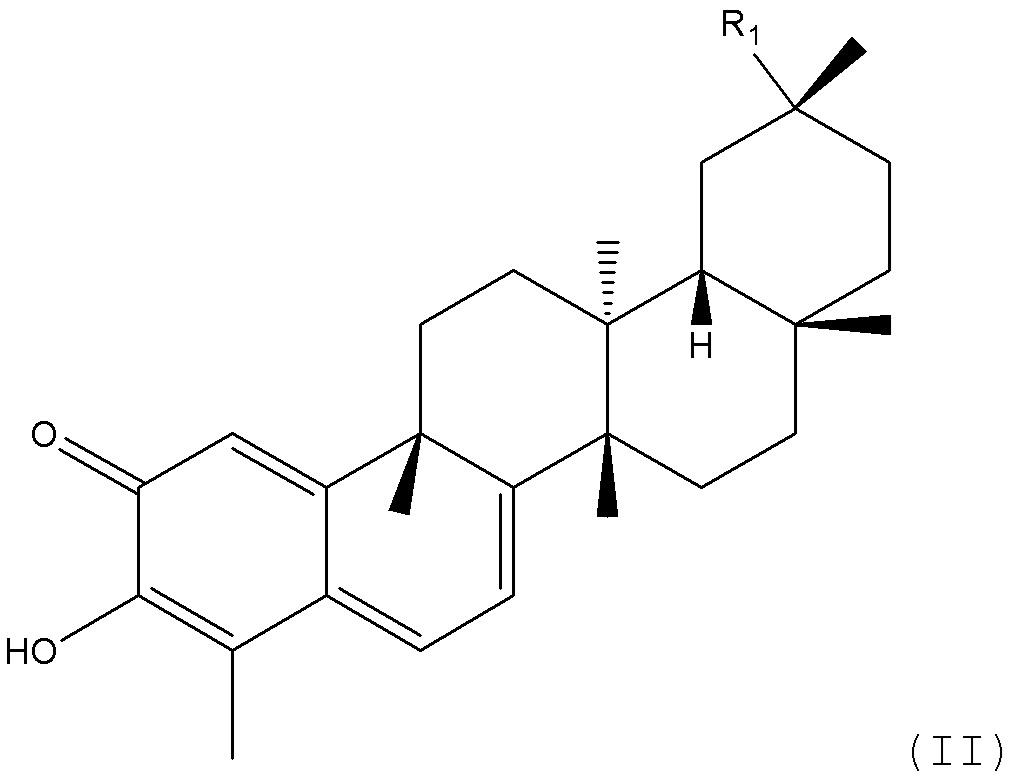
где R1 является ORa или NRaRb, где каждый Ra и Rb независимо является водородом, R5, C(=NR5)NR5R5, -CO, -CS, -COR5, -CNR5NR5R5, -COSR5, -C(=NH)NR5R5, -C(=NR5)R5, -SO2(NH2), -SO2R5, -SO2R5, -SO2NR5R5, -COR5, -CONR5R5, -(C=O)OR5, -(C=NH)NR5R5, -CSNHR5, -S(=O2)R5 или -S(=O2)NR5R5, и
R5 каждый такой, как описан в формуле (I), или
его фармацевтически приемлемая соль или пролекарство.
В некоторых вариантах, R1 является NRaRb, и может быть представлено в формуле (II)-a:
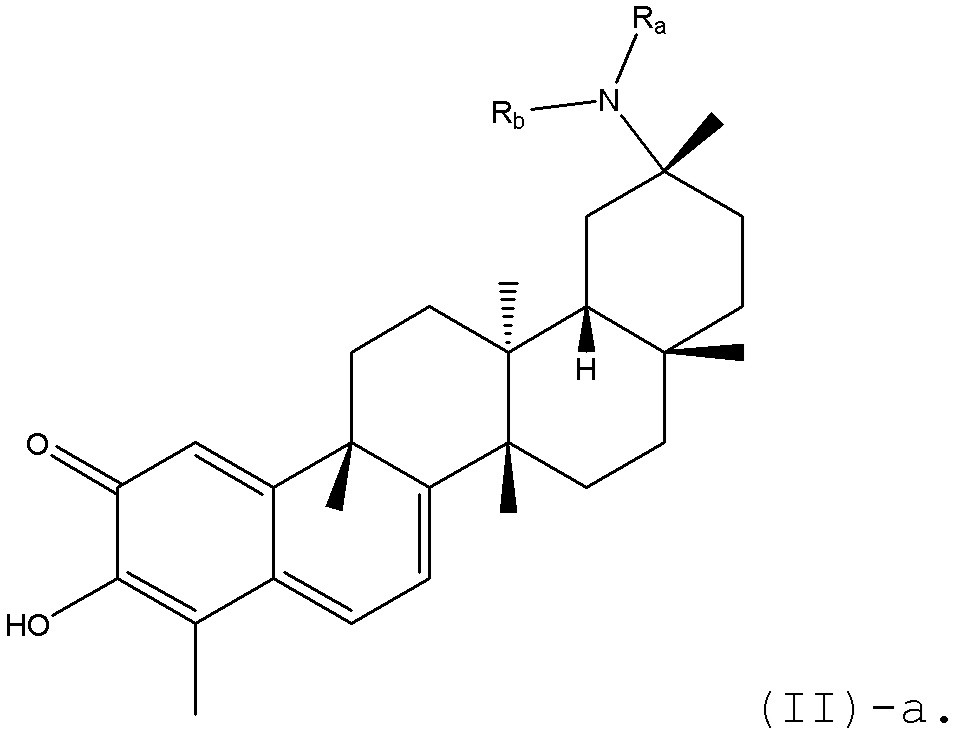
В определенных вариантах, R1 является NH(CO)R5, где R5 является, предпочтительно, алкилом, циклоалкилом или арилом.
В определенных вариантах, R1 является NHAc.
типовые соединения, но не ограниченные ими, включают следующие соединения:

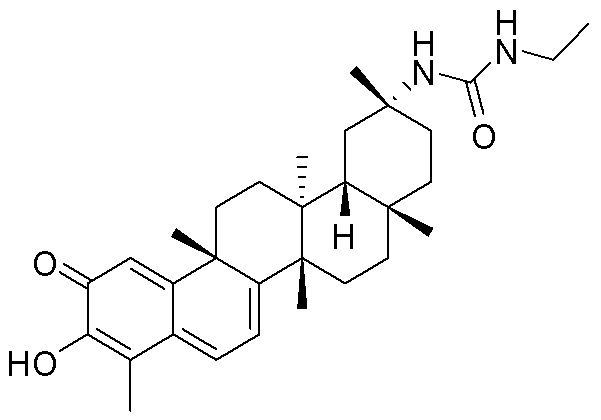
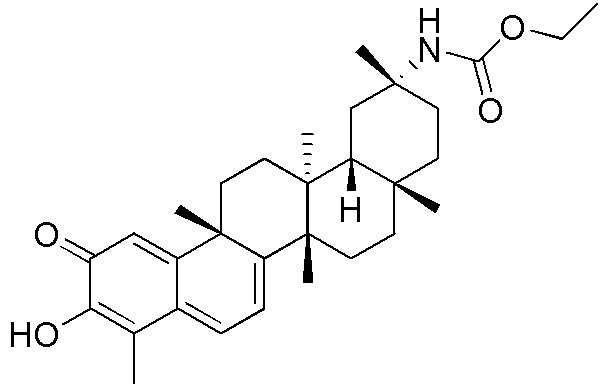
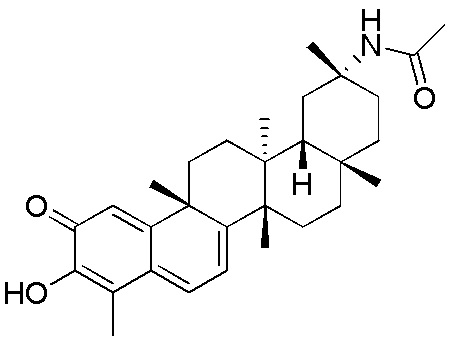
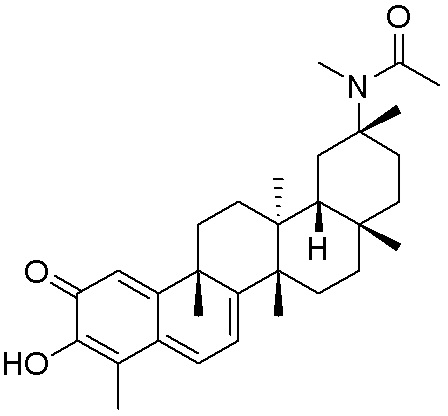

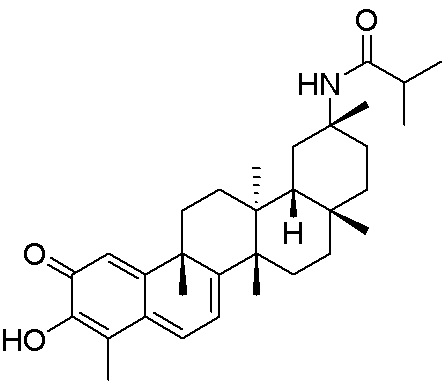
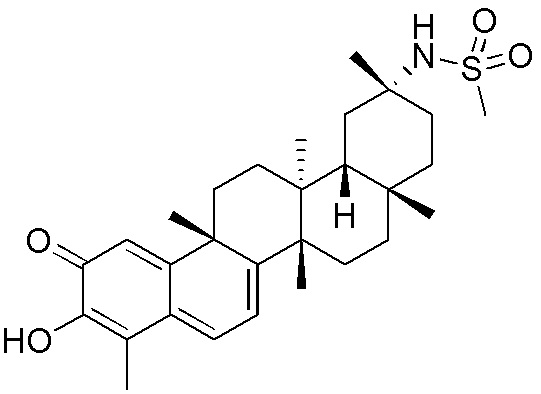
В одном аспекте, представлена фармацевтическая композиция, содержащая описанные здесь соединения, например, соединения формулы (I) и формулы (II), включая их варианты, и фармацевтически приемлемый наполнитель.
В одном аспекте, представлен способ лечения ожирения у субъекта, нуждающегося в таковом. Способ включает введение субъекту композиции, которая содержит эффективное количество соединения формулы (I), включая его варианты. Альтернативно, способ лечения ожирения у субъекта, нуждающегося в таковом, включает введение субъекту композиции, которая содержит эффективное количество соединений формулы (II), включая их варианты. Дополнительно, способ лечения ожирения у субъекта, нуждающегося в таковом, включает введение субъекту композиции, которая содержит эффективное количество соединений формулы (I), формулы (II) или их сочетаний, включая их варианты.
В некоторых вариантах, у субъекта резистентность к лептину. В некоторых вариантах, субъект имеет повышенный уровень лептина в, например, крови. В определенных вариантах, у субъекта отсутствует реакция (например, снижение аппетита, улучшение ИМТ и/или снижение массы тела на, по крайней мере, около 5%, 4%, 3%, 2% или 1%) на введение лептина, и/или эффективность введения лептина снижается со временем (например, это определяется отменой снижения массы тела или более частым чувством голода у субъекта). В некоторых вариантах, субъект имеет концентрацию лептина в крови или сыворотке около 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45, 50, 75, 100 нг/мл или более. В некоторых вариантах, субъектом является мужчина, и он имеет концентрацию лептина в крови или сыворотке около 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45, 50 нг/мл или более. В некоторых вариантах, субъектом является женщина, и она имеет концентрацию лептина в крови или сыворотке около 30, 35, 40, 45, 50, 75, 100 нг/мл или более.
В одном аспекте, введение композиции включает пероральное введение, внутривенное введение, местное введение, парентеральное введение, внутрибрюшинное введение, внутримышечное введение, интратекальное введение, внутриочаговое введение, внутричерепное введение, интраназальное введение, внутриглазное введение, внутрисердечное введение, интравитреальное введение, внутрикостное введение, интрацеребральное введение, внутриартериальное введение, внутрисуставное введение, внутрикожное введение, чрескожное введение, чресслизистое введение, подъязычное введение, энтеральное введение, сублабиальное введение, инсуффляционное введение, суппозитории, ингалируемое введение или подкожное введение.
В некоторых вариантах, способ лечения ожирения у субъекта, нуждающегося в таковом, включает пероральное введение композиции, содержащей эффективное количество одного или более описанных здесь соединений.
В некоторых вариантах, способ лечения ожирения у субъекта, нуждающегося в таковом, включает внутрибрюшинное введение композиции, содержащей эффективное количество одного или более описанных здесь соединений.
В некоторых вариантах, способ лечения ожирения у субъекта, нуждающегося в таковом, включает внутрибрюшинное введение композиции, содержащей эффективное количество одного или более описанных здесь соединений.
В одном аспекте, представлена композиция, где композицию применяют для лечения ожирение-связанного заболевания или расстройства. Ожирение-связанное заболевание или расстройство выбирают из группы, включающей ожирение, предожирение, патологическое ожирение, синдром Прадера-Вилли, ожирение, связанное с повреждением гипоталамуса, не алкогольный стеатогепатит, гиперлипидемию, гипертонию, диабет, липодистрофию, стеатоз печени, синдром Барде-Бидля, синдром Коэна, сердечнососудистое заболевание, артрит, удар, метаболический синдром и синдром MOMO (глазные аномалии макросомии, ожирения, макроцефалии).
В одном аспекте, представлен способ лечения ожирение-связанного заболевания или расстройства, включающий введение субъекту, страдающему или подверженному ожирение-связанным заболеванием или расстройством, одной или более композиций формулы (I), формулы (II) или их сочетаний. Ожирение-связанное заболевание или расстройство выбирают из группы, включающей ожирение, предожирение, патологическое ожирение, синдром Прадера-Вилли, ожирение, связанное с повреждением гипоталамуса, не алкогольный стеатогепатит, гиперлипидемию, гипертонию, диабет, липодистрофию, стеатоз печени, синдром Барде-Бидля, синдром Коэна, сердечнососудистое заболевание, артрит, удар, метаболический синдром и синдром МОМО.
В одном аспекте, композицию вводят в сочетании с другой терапией.
В некоторых аспектах, введение также включает пероральное введение, внутривенное введение, местное введение, парентеральное введение, внутрибрюшинное введение, внутримышечное введение, интратекальное введение, внутриочаговое введение, внутричерепное введение, интраназальное введение, внутриглазное введение, внутрисердечное введение, интравитреальное введение, внутрикостное введение, интрацеребральное введение, внутриартериальное введение, внутрисуставное введение, внутрикожное введение, чрескожное введение, чресслизистое введение, подъязычное введение, энтеральное введение, сублабиальное введение, инсуффляционное введение, суппозитории, ингалируемое введение или подкожное введение.
В одном аспекте, композицию вводят в форме, выбранной из группы, включающей пилюли, капсулы, таблетки, гранулы, порошки, соли, кристаллы, жидкость, сыворотки, сиропы, суспензии, гели, кремы, пасты, пленки, пластыри и пары.
В одном аспекте, субъектом является млекопитающее. Более того, субъектом является человек. В еще одном аспекте, субъектом является человек с индексом массы тела (ИМТ) более 30 кг/м2.
В одном аспекте, представлен способ лечения злокачественного образования у субъекта, нуждающегося в таковом. Способ включает введение эффективного количества одного или более описанных здесь соединений.
В одном аспекте, представлена композиция, где композицию применяют для лечения связанного со злокачественным образованием заболевания или расстройства. Связанное со злокачественным образованием заболевание или расстройство выбирают из группы, включающей рак желудка, множественную миелому, меланому, лейкоз, лимфому, почечно-клеточный рак, почечно-клеточную карциному, рак молочной железы, рак простаты, рак головы и шеи, не мелкоклеточный рак легких, рак мозга и мультиформную глиобластому (GBM).
В одном аспекте, представлен способ лечения связанного со злокачественным образованием заболевания или расстройства, включающий введение субъекту, страдающему или подверженному связанному со злокачественным образованием заболевания или расстройству, одной или более композиций формулы (I). Связанное со злокачественным образованием заболевание или расстройство выбирают из группы, включающей рак желудка, множественную миелому, меланому, лейкоз, лимфому, почечно-клеточный рак, почечно-клеточную карциному, рак молочной железы, рак простаты, рак головы и шеи, не мелкоклеточный рак легких, рак мозга и мультиформную глиобластому (GBM).
В одном аспекте, представлен набор, включающий композиции, применяемые для лечения ожирения, описанные здесь, и инструкции по применению для лечения ожирения. В некоторых вариантах, набор может применяться для перорального введения или внутрибрюшинного введения композиций для лечения ожирения.
Каждый описанный здесь вариант рассматривается как применимый для каждого из других описанных вариантов. Таким образом, все сочетания различных элементов, описанные здесь, включены в объем изобретения. Другие аспекты описаны ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
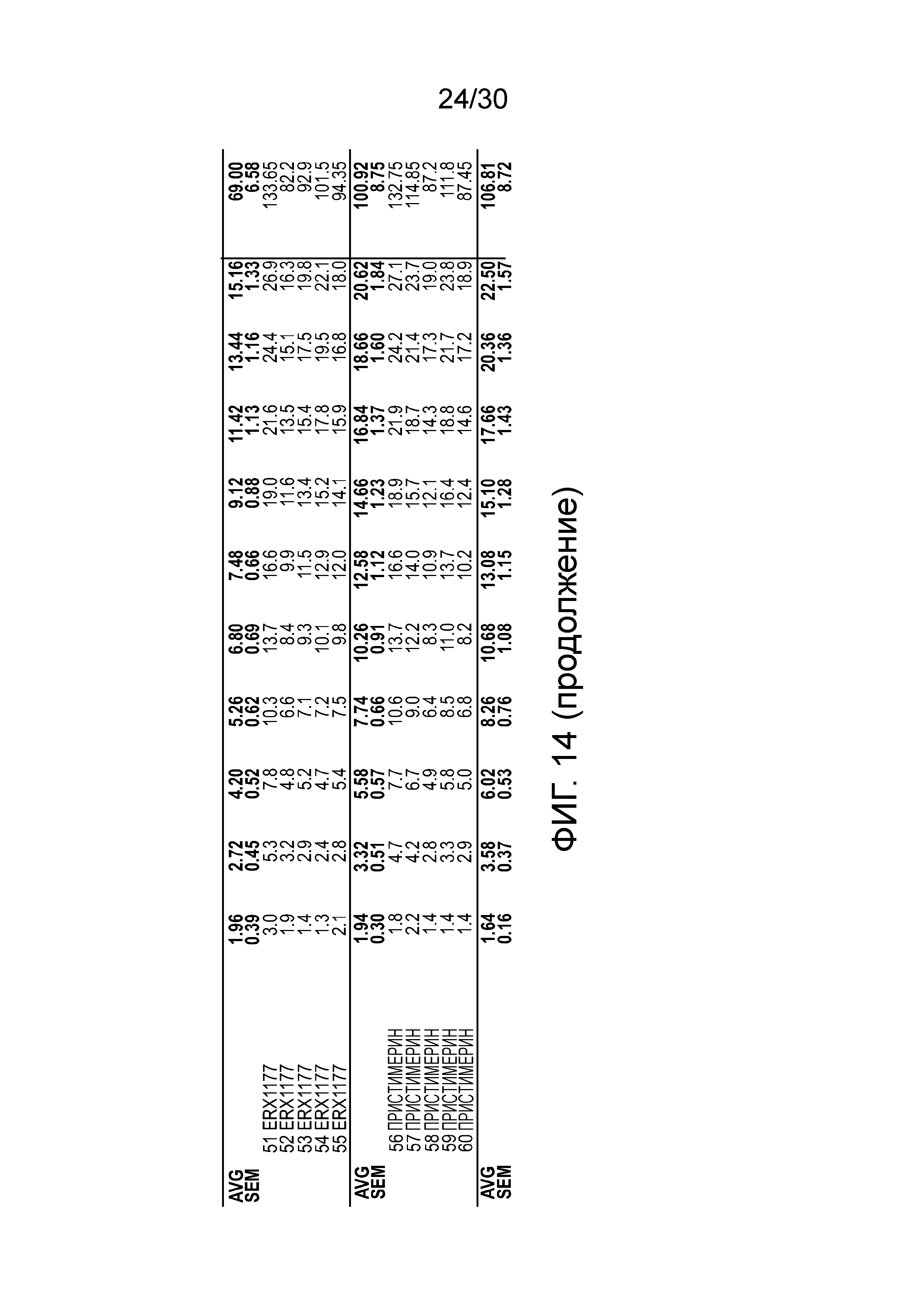
На Фиг. 1 представлен график ежедневных показателей массы тела у мышей с алиментарным ожирением (АО) во время лечения пероральным введением соединений в дозе 2000 мкг/кг, как показано в таблице 13, в течение 11 дней.
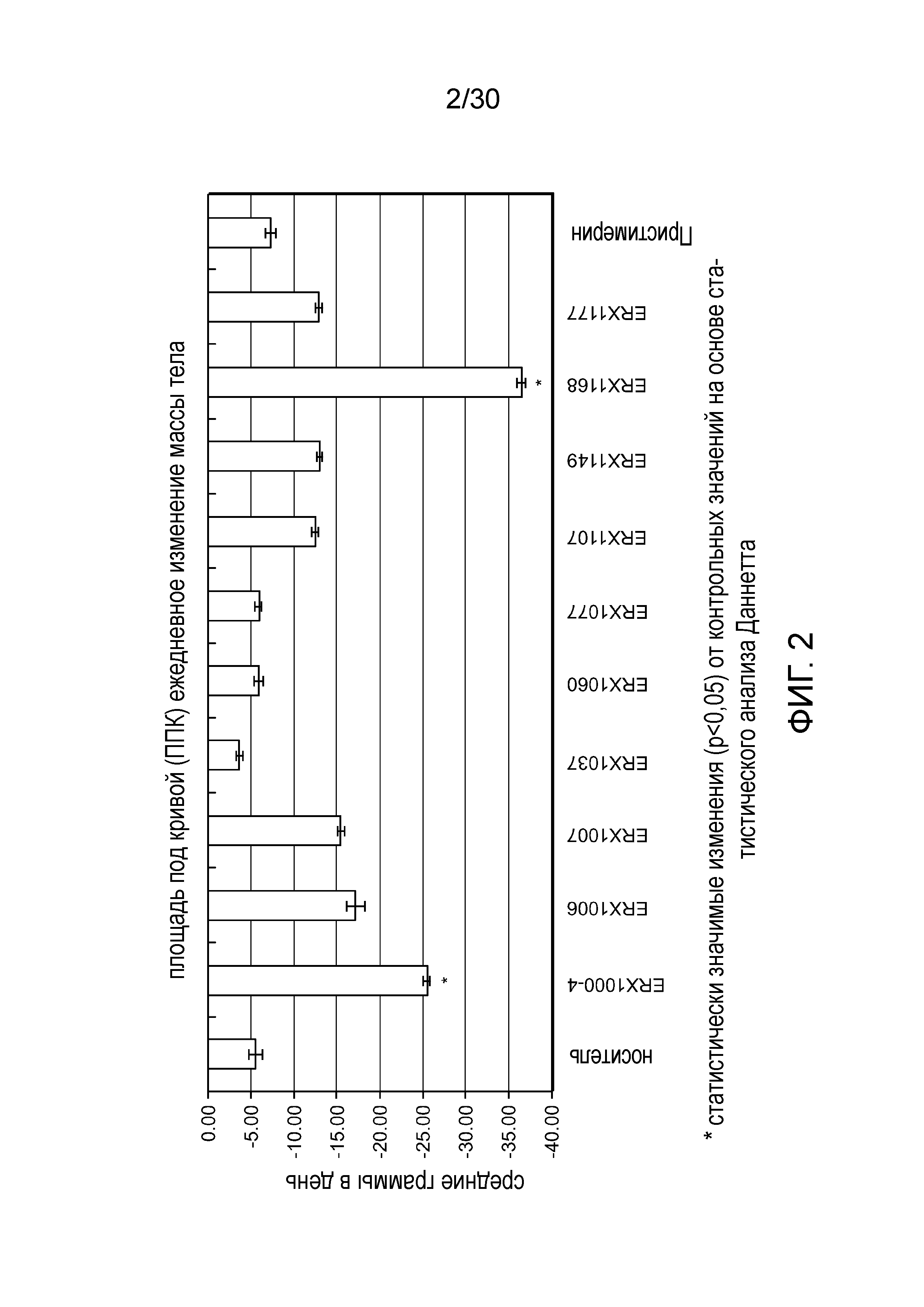
На фиг. 2 представлен график площади под кривой (ППК) ежедневного изменения массы тела у мышей с алиментарным ожирением (АО) во время лечения пероральным введением соединений в дозе 2000 мкг/кг, как показано в таблице 13, в течение 11 дней.
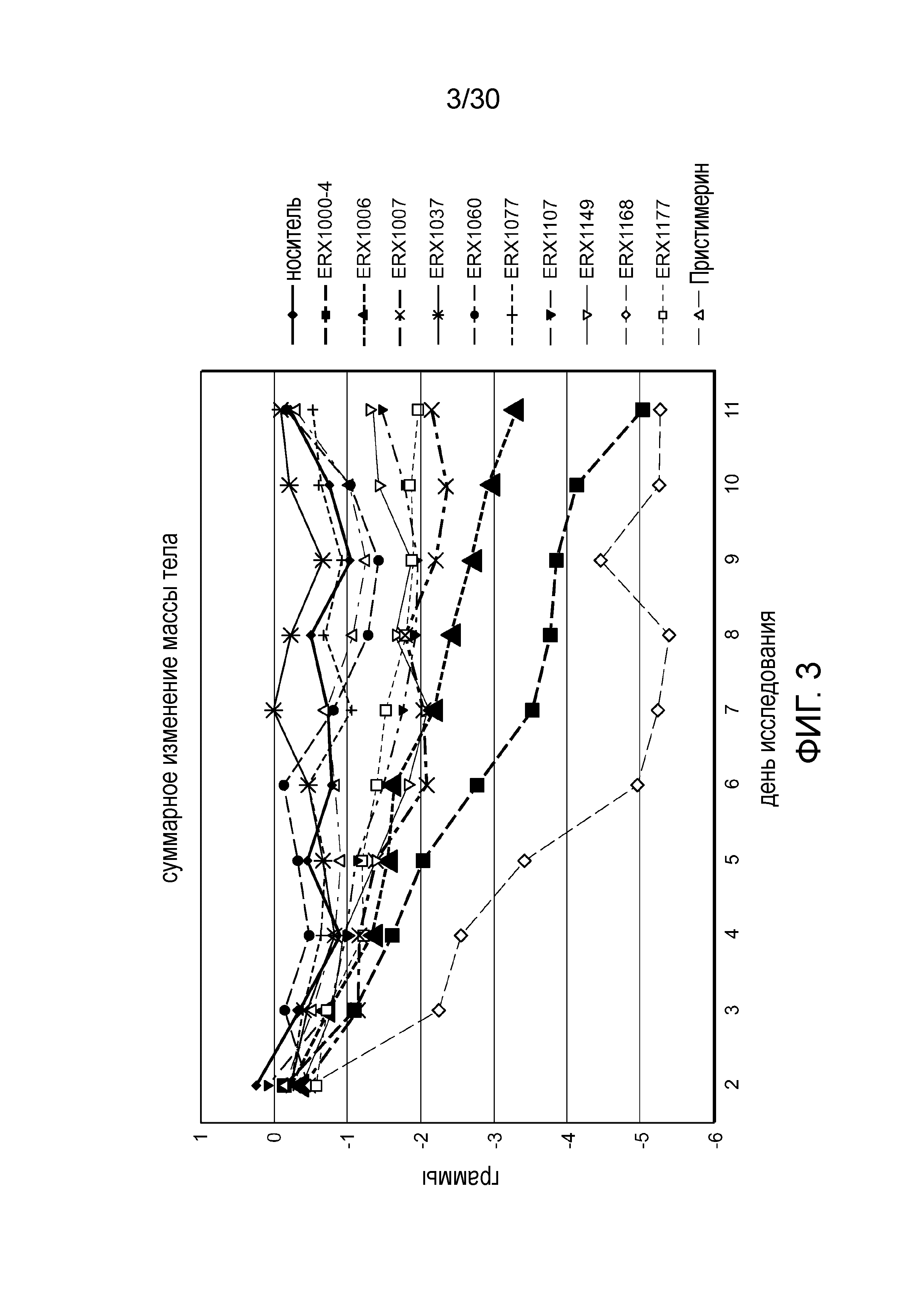
На фиг. 3 представлен график суммарного изменения массы тела у мышей с алиментарным ожирением (АО) во время лечения пероральным введением соединений в дозе 2000 мкг/кг как показано в таблице 13, в течение 11 дней.
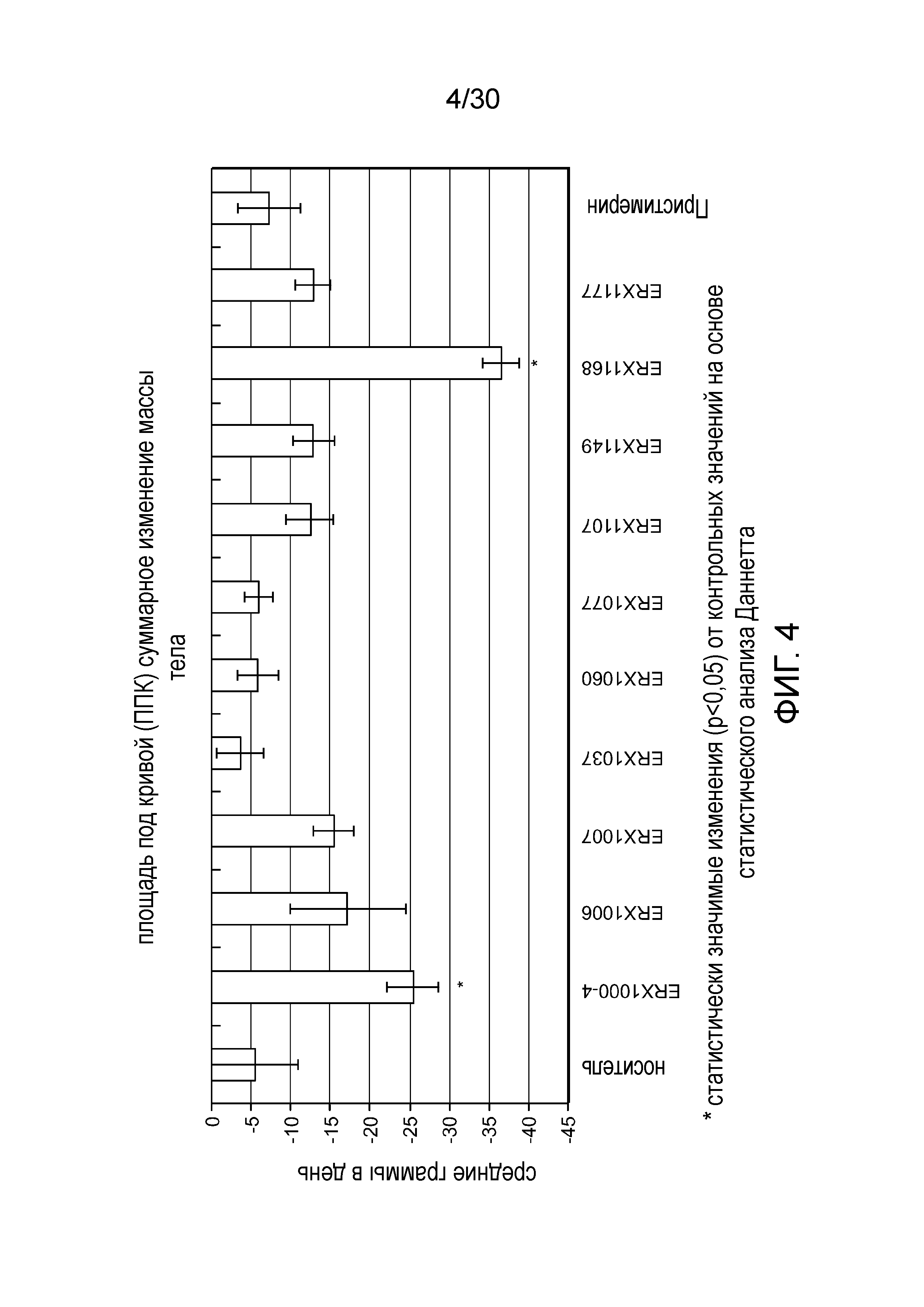
На фиг. 4 представлен график площади под кривой (ППК) суммарного изменения массы тела у мышей с алиментарным ожирением (АО) во время лечения пероральным введением соединений в дозе 2,000 мкг/кг как показано в таблице 13, в течение 11 дней.
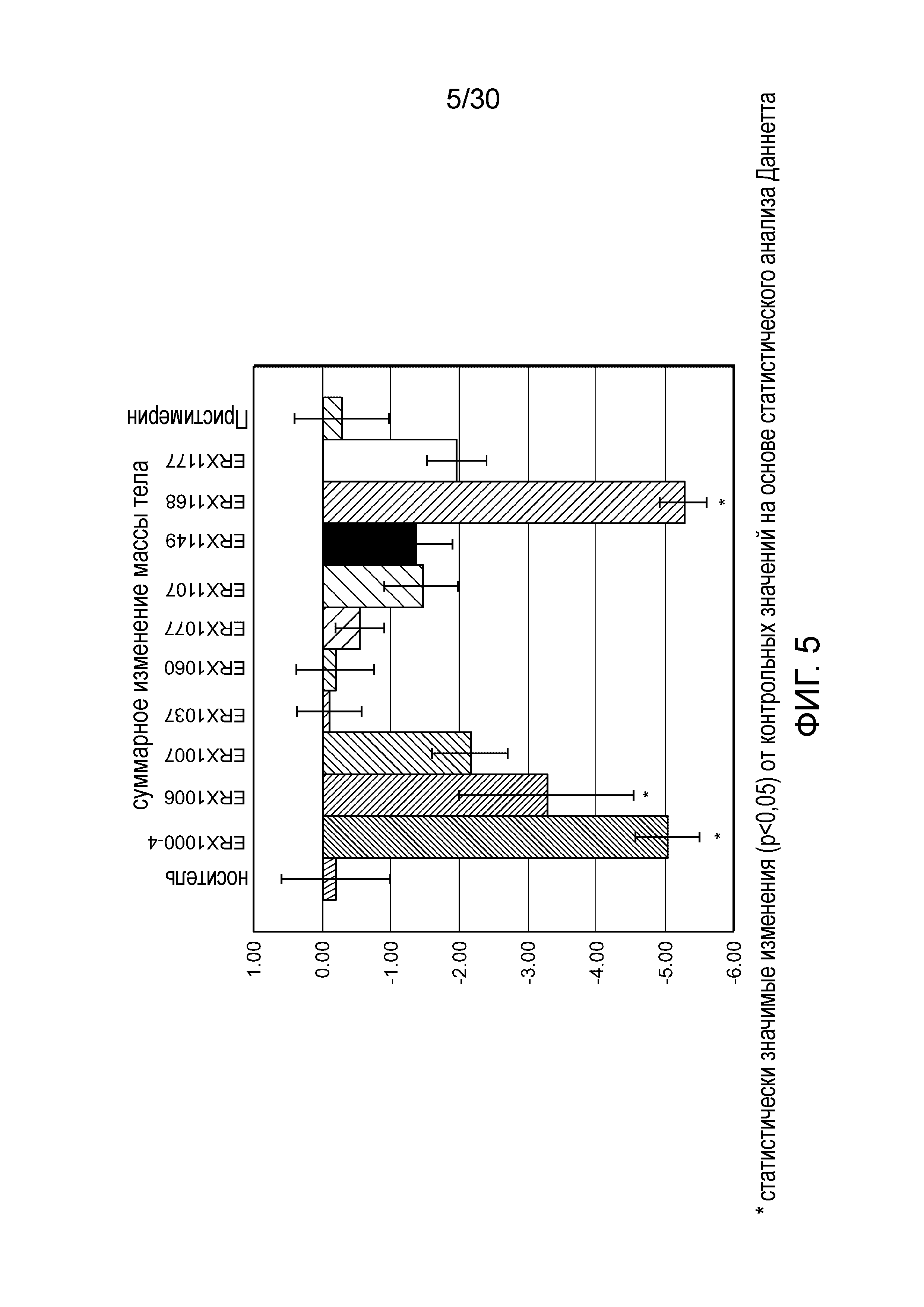
На фиг. 5 представлен график суммарного изменения массы тела у мышей с алиментарным ожирением (АО) во время лечения пероральным введением соединений в дозе 2000 мкг/кг, как показано в таблице 13, в течение 11 дней.
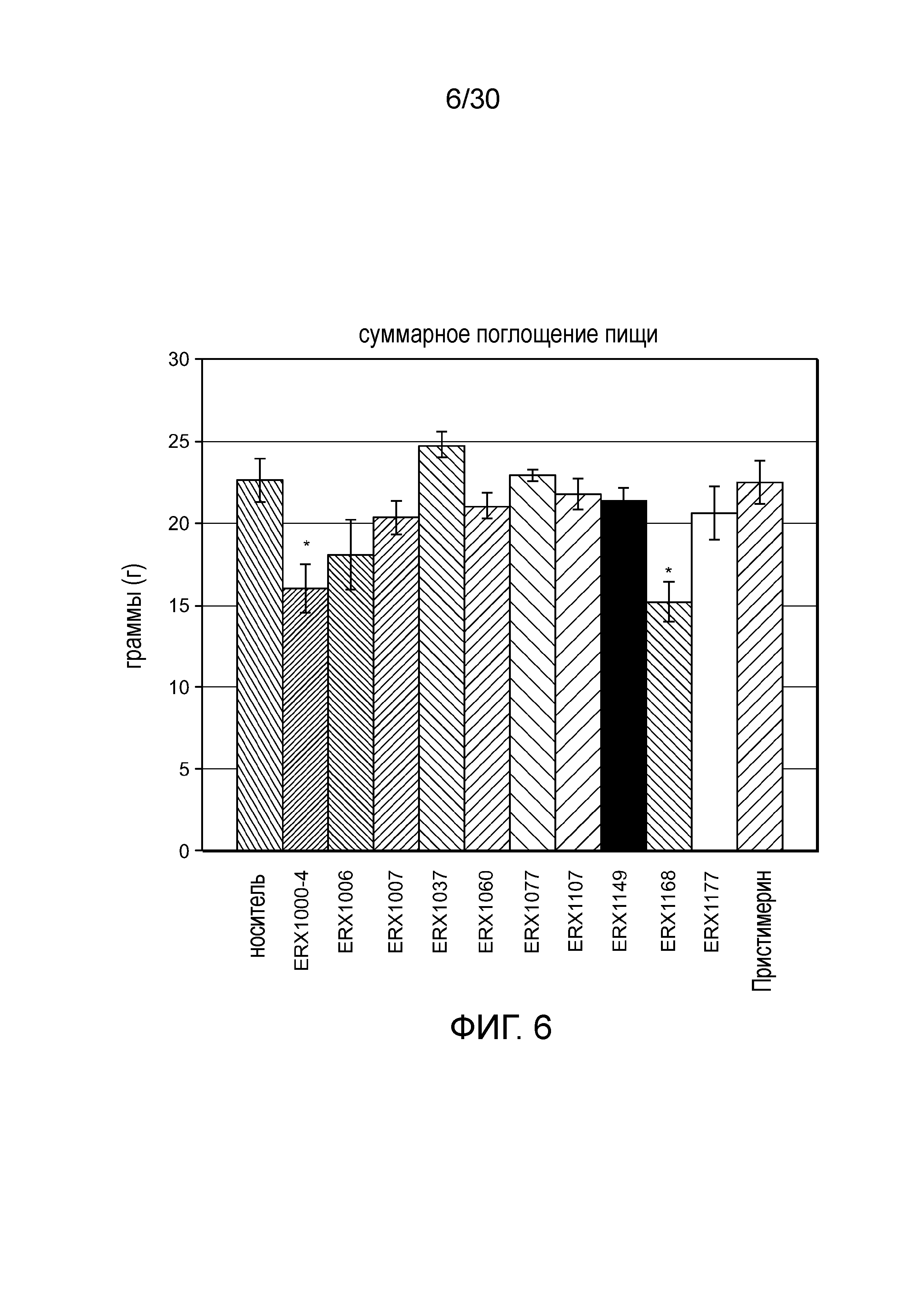
На фиг. 6 представлен график суммарного поглощения пищи у мышей с алиментарным ожирением (АО) во время лечения пероральным введением соединений в дозе 2000 мкг/кг, как показано в таблице 13, в течение 11 дней.
На фиг. 7 представлен график площади под кривой суммарного изменения массы тела (ППК) у мышей с алиментарным ожирением (АО) во время лечения пероральным введением соединений в дозе 2000 мкг/кг, как показано в таблице 13, в течение 11 дней.
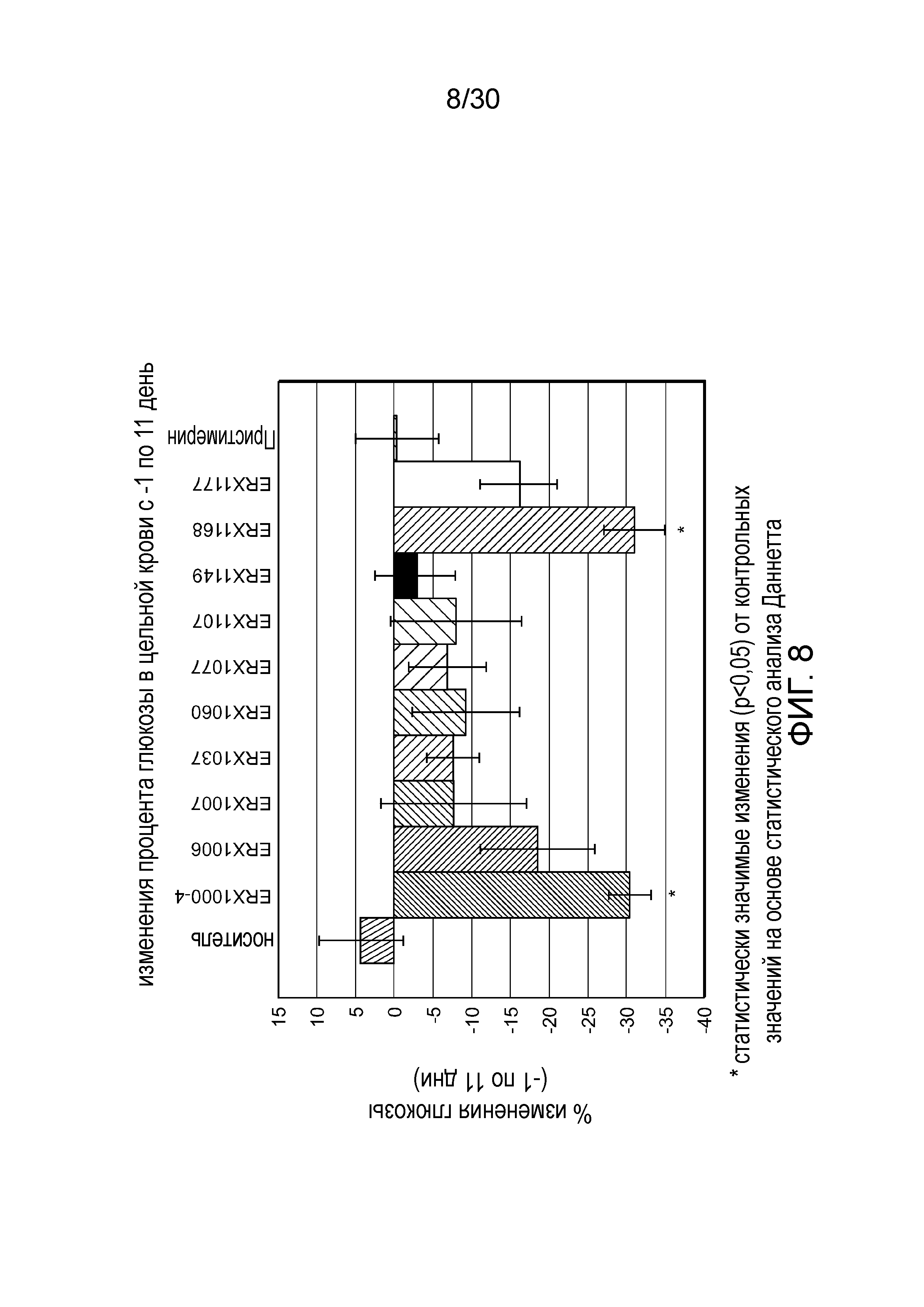
На фиг. 8 представлен график изменения процентного содержания глюкозы в цельной крови между 1 и 11 днями у мышей с алиментарным ожирением (АО) во время лечения пероральным введением соединений в дозе 2000 мкг/кг, как показано в таблице 13, в течение 11 дней.
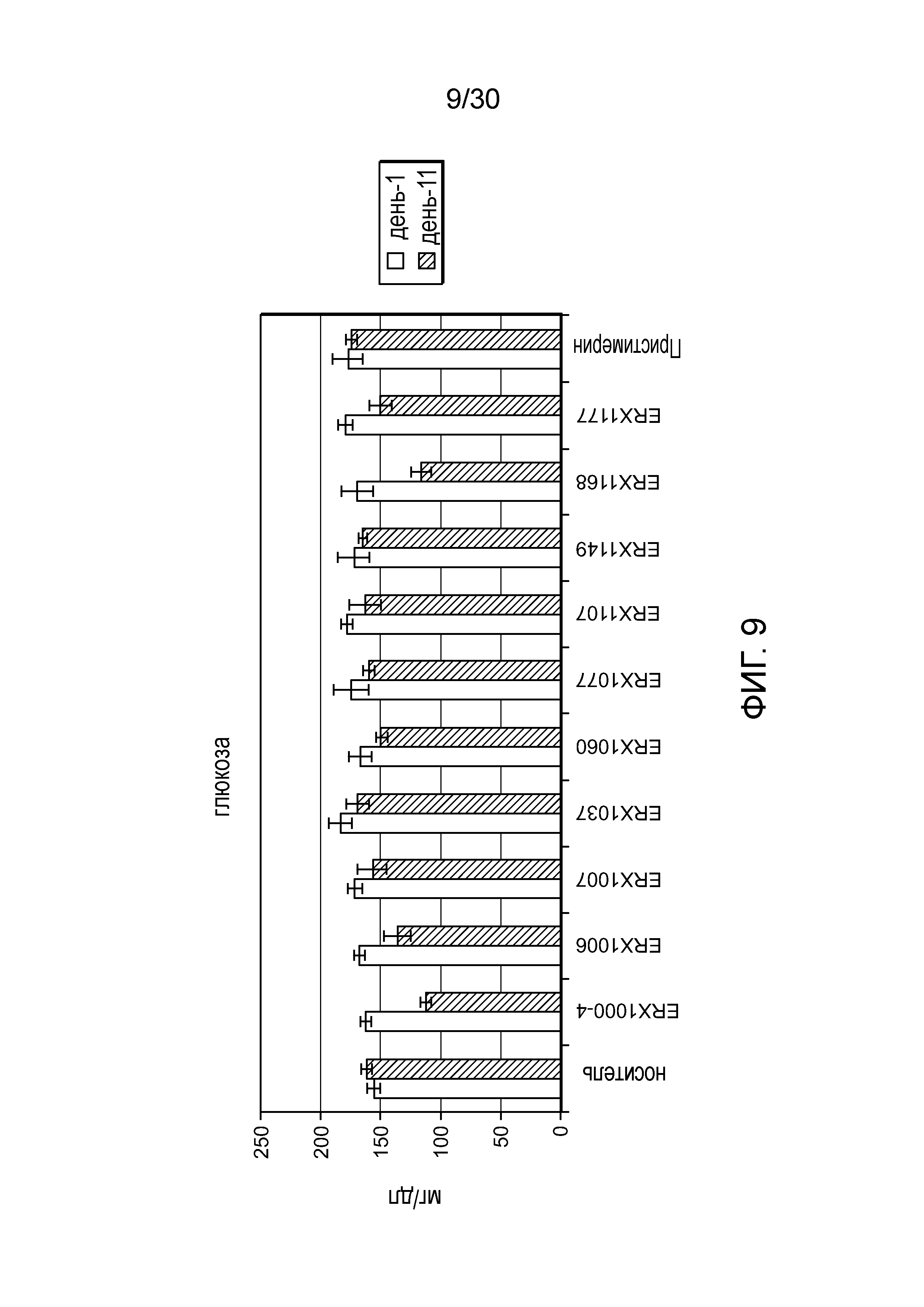
На фиг. 9 представлен график значений глюкозы между 1 и 11 днями у мышей с алиментарным ожирением (АО) во время лечения пероральным введением соединений в дозе 2000 мкг/кг, как показано в таблице 13, в течение 11 дней.
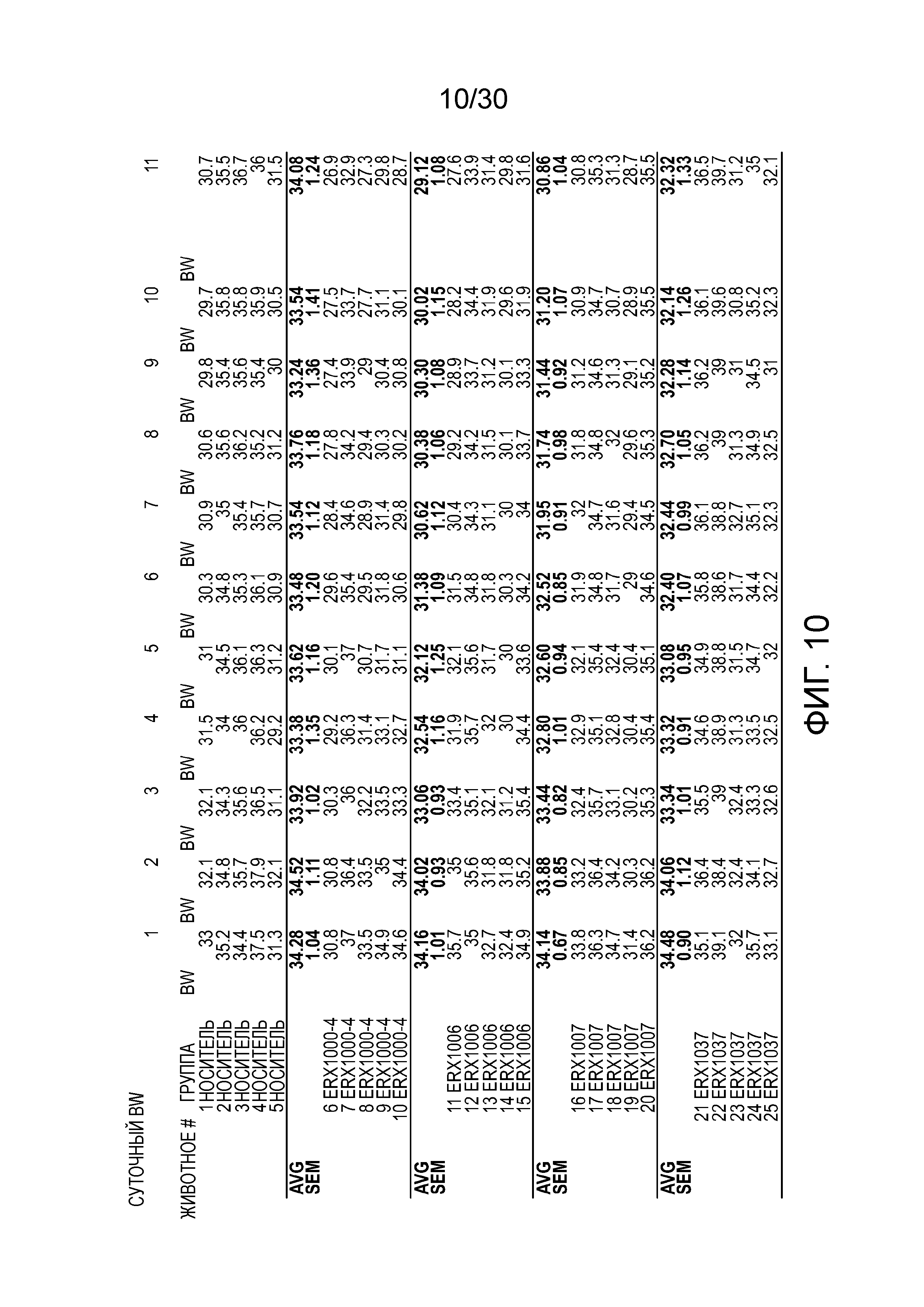
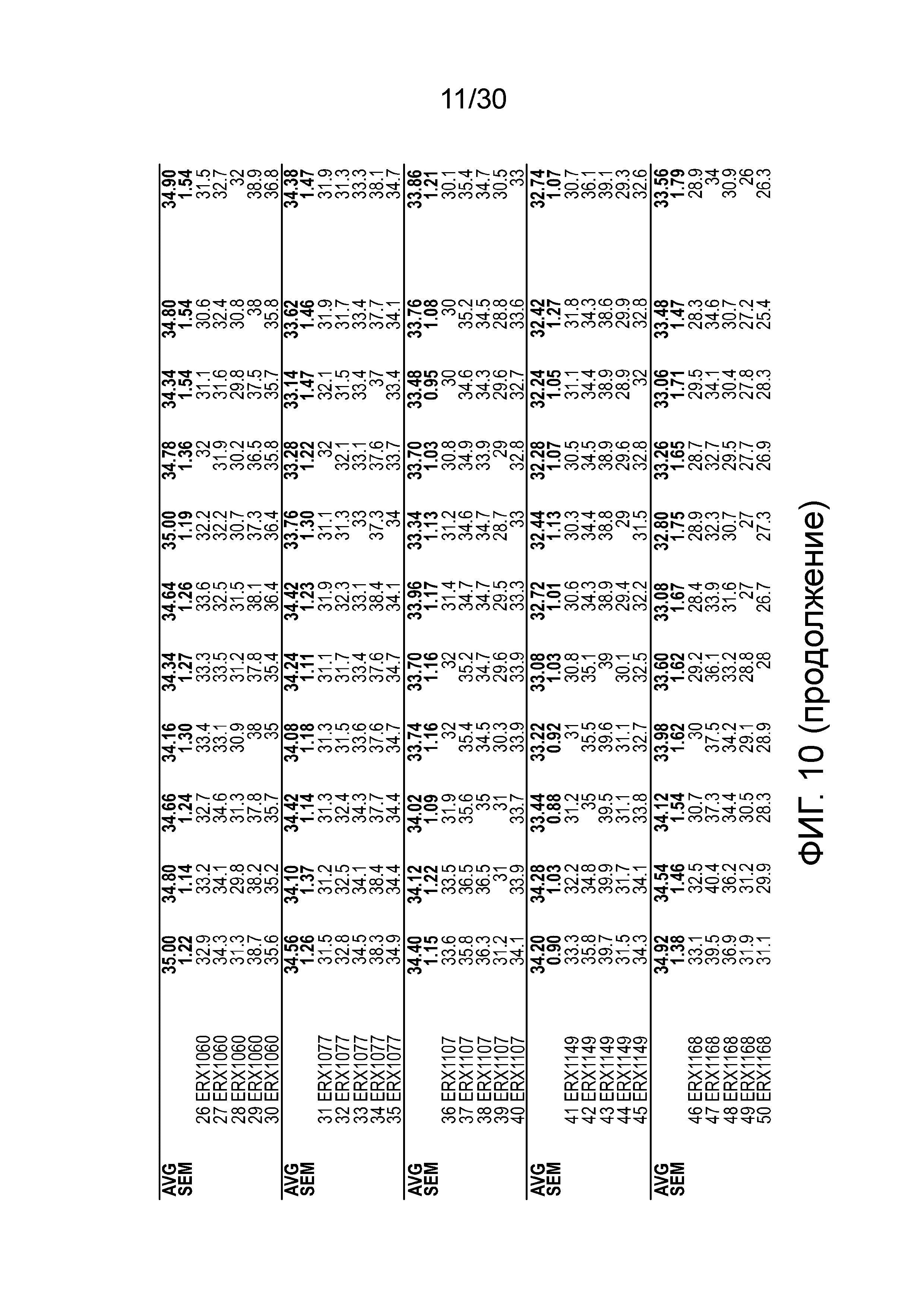
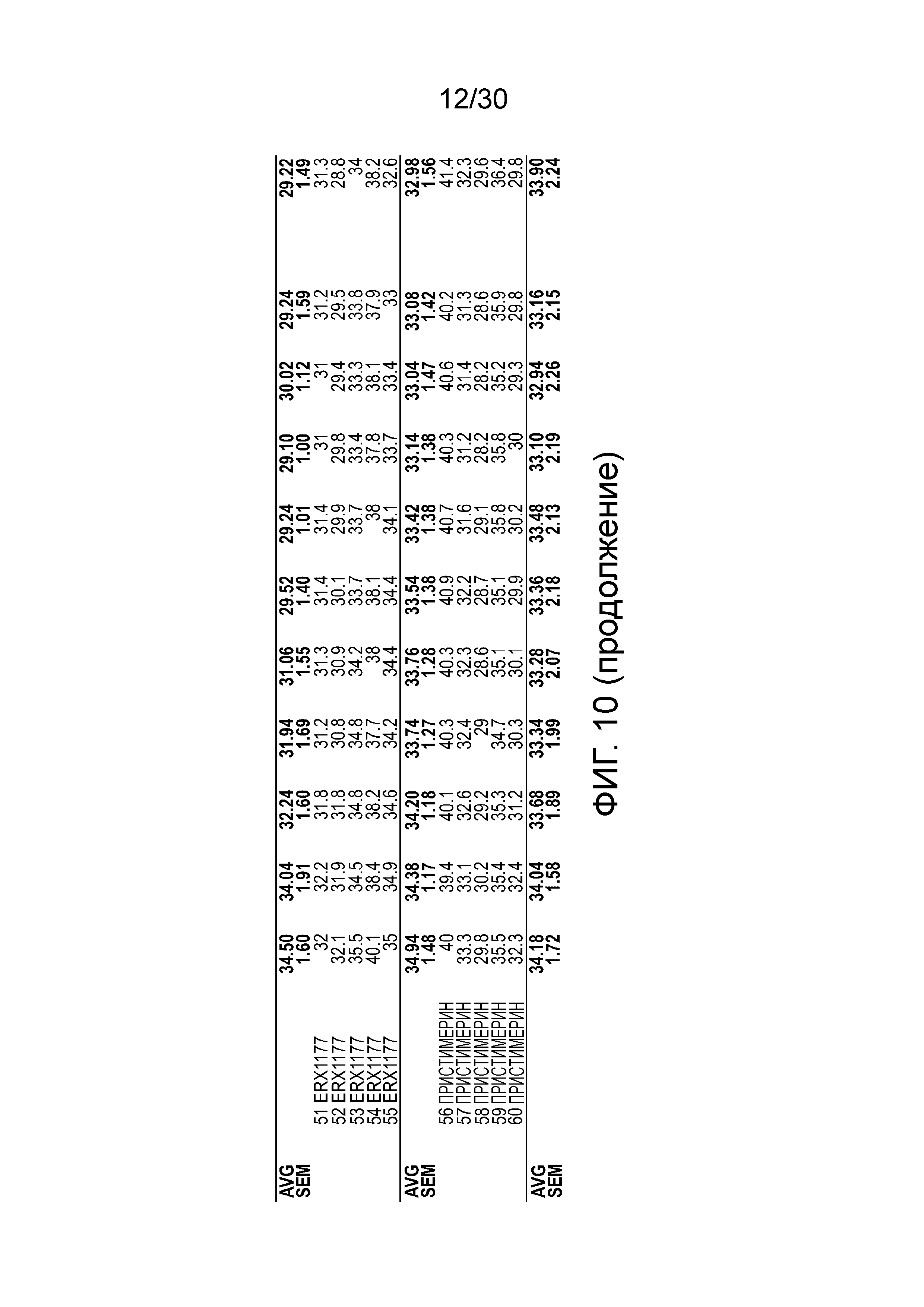
На фиг. 10 показаны данные ежедневной массы тела у мышей с алиментарным ожирением (АО) во время лечения пероральным введением соединений в дозе 2000 мкг/кг, как показано в таблице 13, в течение 11 дней.
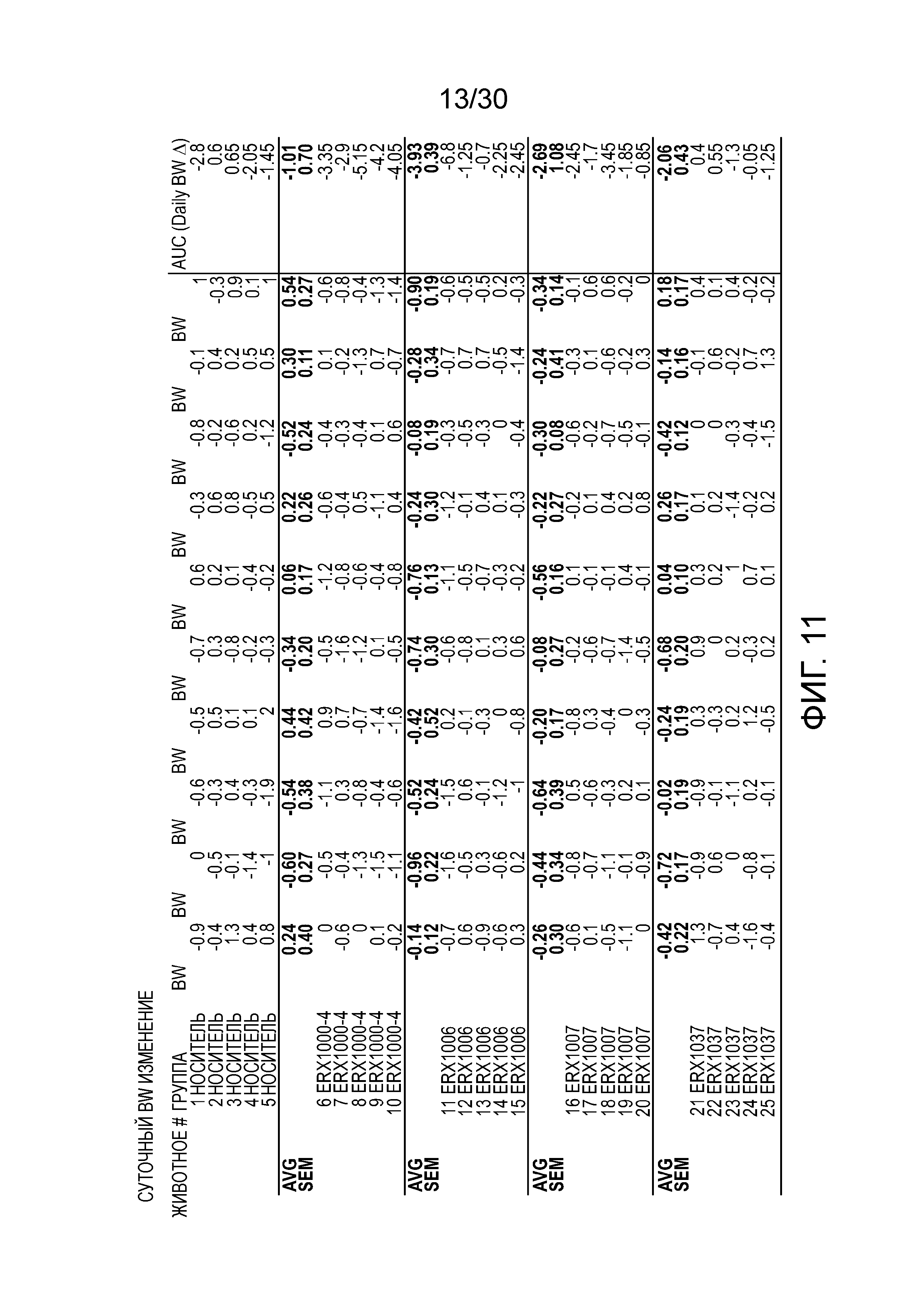
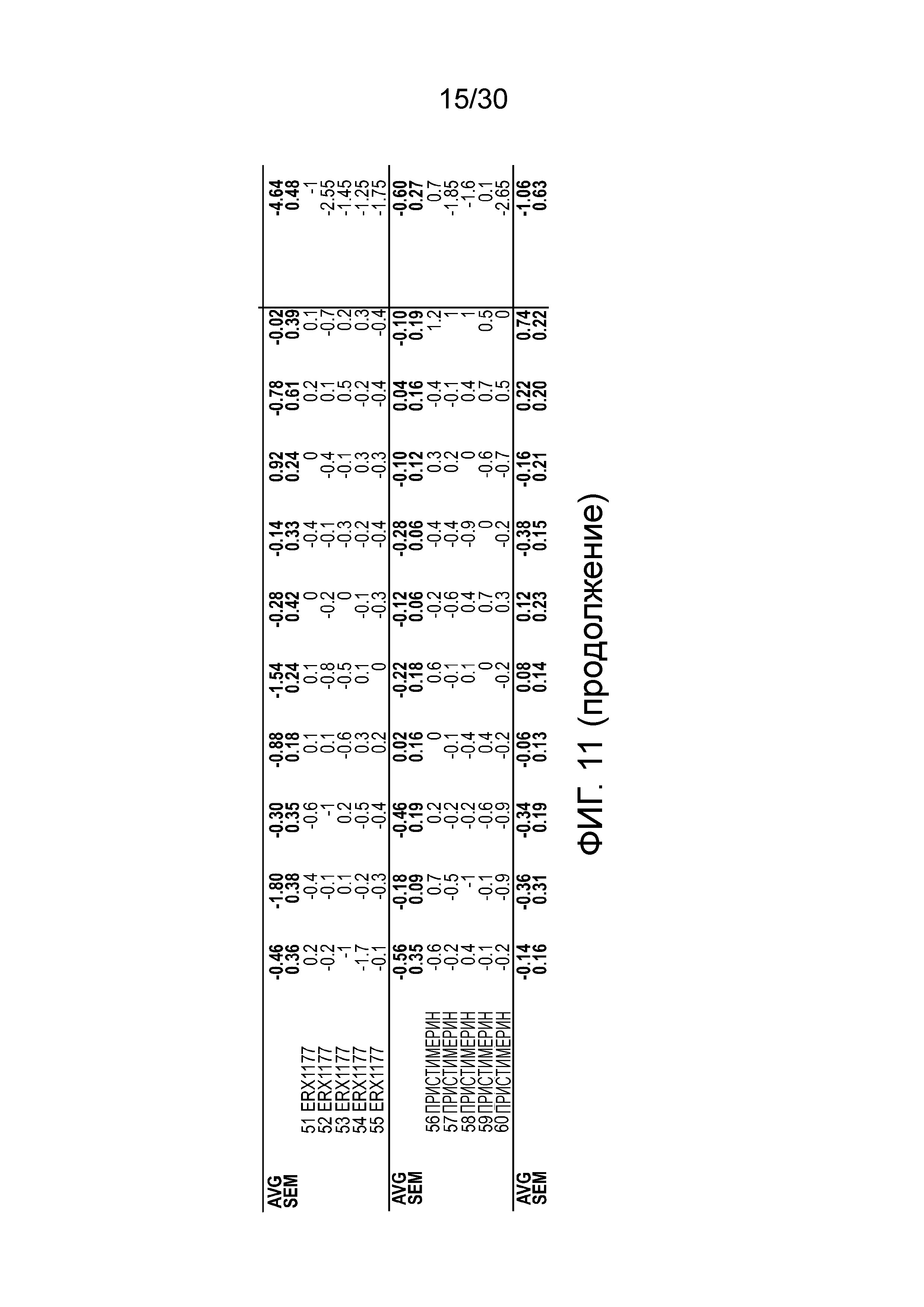
На фиг. 11 показаны данные ежедневного изменения массы тела у мышей с алиментарным ожирением (АО) во время лечения пероральным введением соединений в дозе 2000 мкг/кг, как показано в таблице 13, в течение 11 дней.
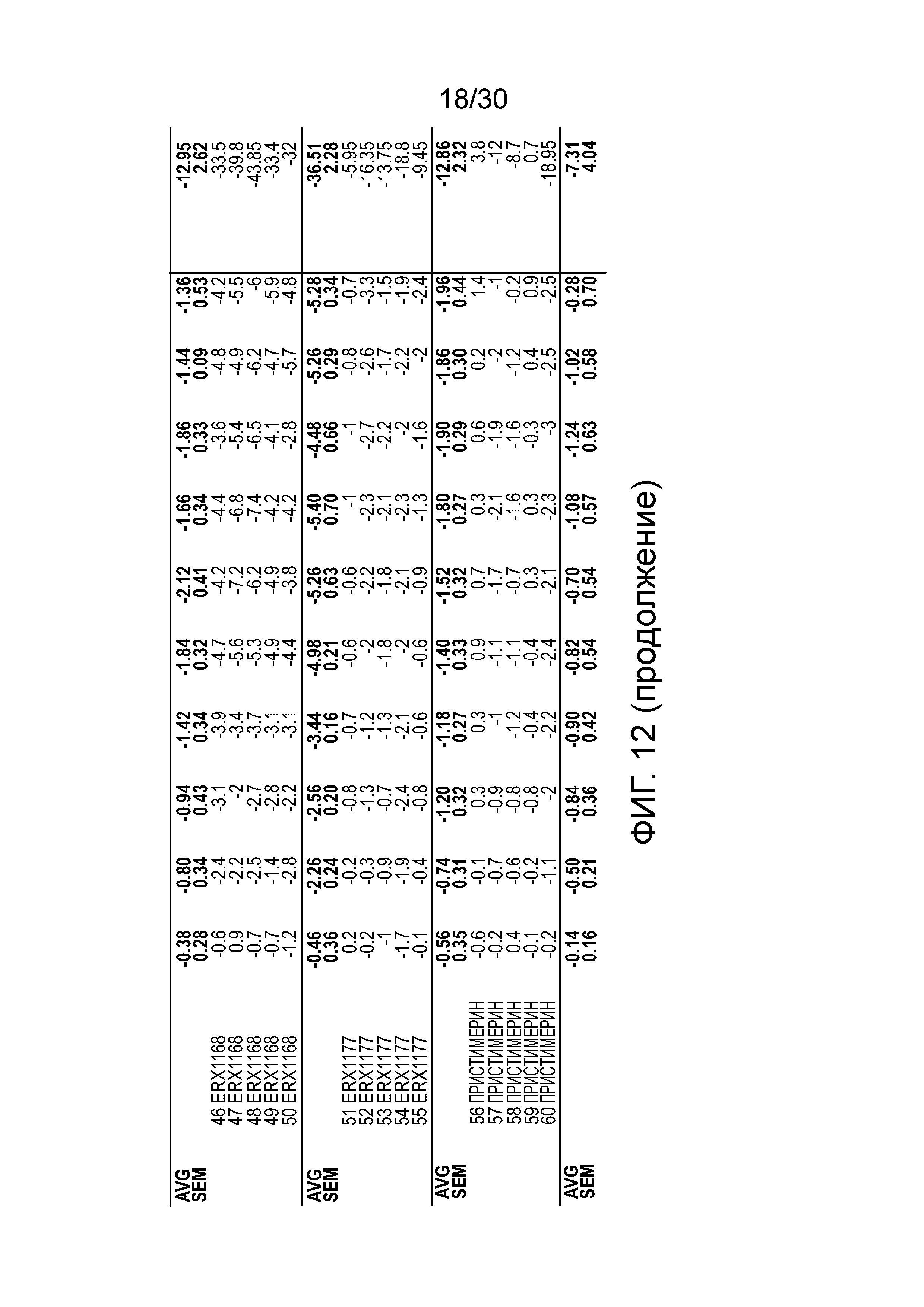
На фиг. 12 показаны данные суммарного изменения массы тела у мышей с алиментарным ожирением (АО) во время лечения пероральным введением соединений в дозе 2000 мкг/кг, как показано в таблице 13, в течение 11 дней.
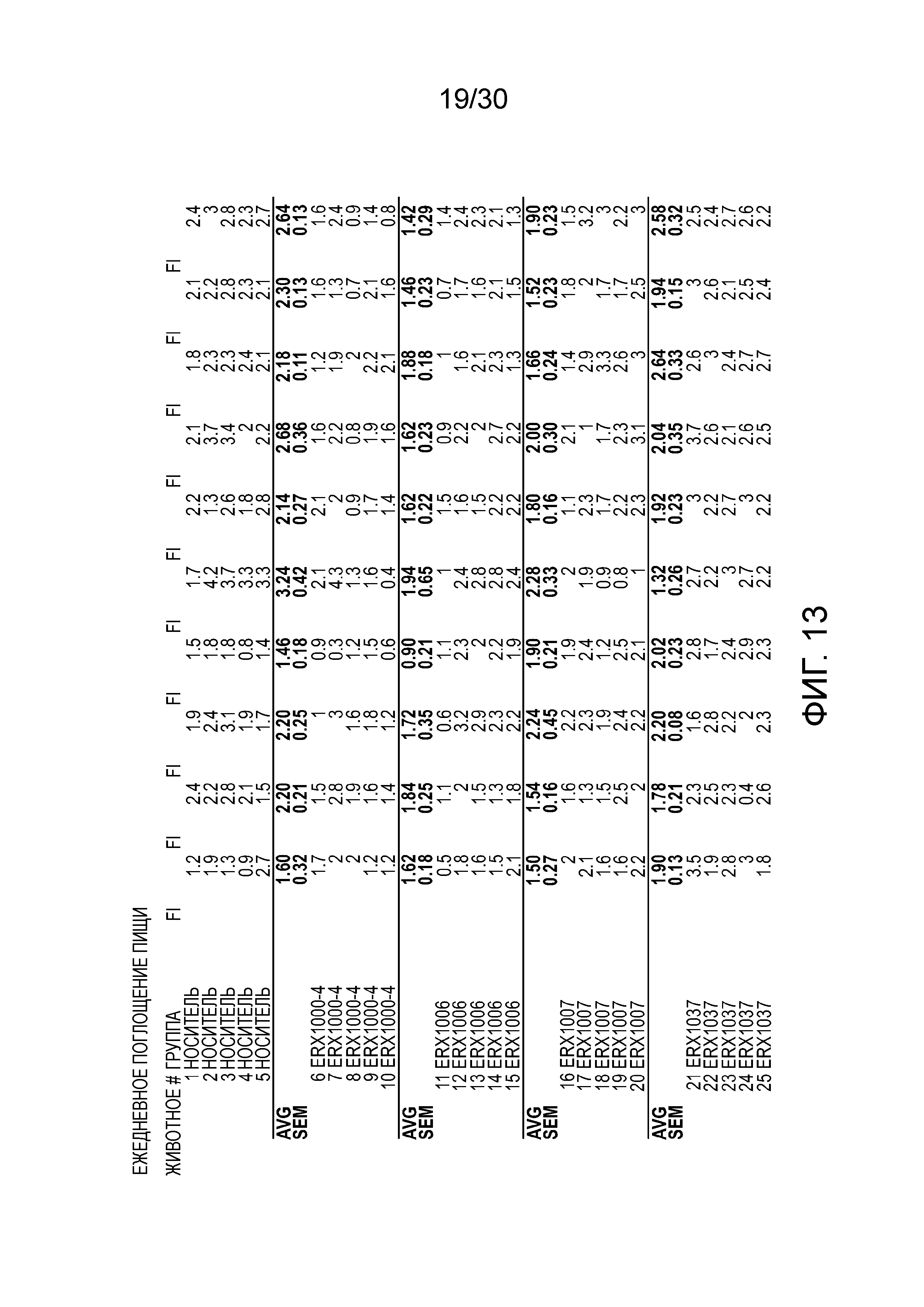
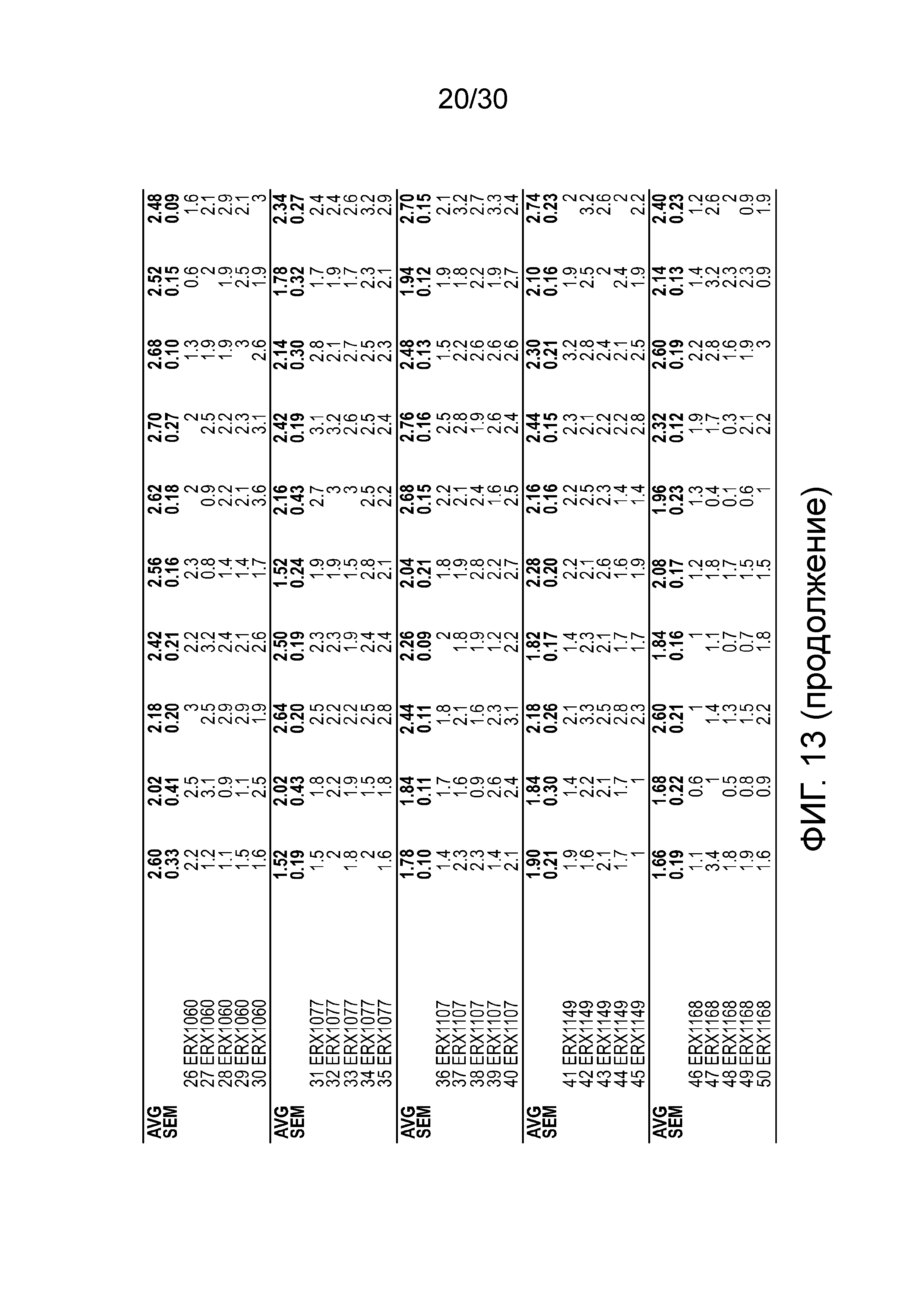
На фиг. 13 показаны данные ежедневного поглощения пищи у мышей с алиментарным ожирением (АО) после лечения введением соединений в дозе 2000 мкг/кг, как показано в таблице 13, в течение 11 дней.
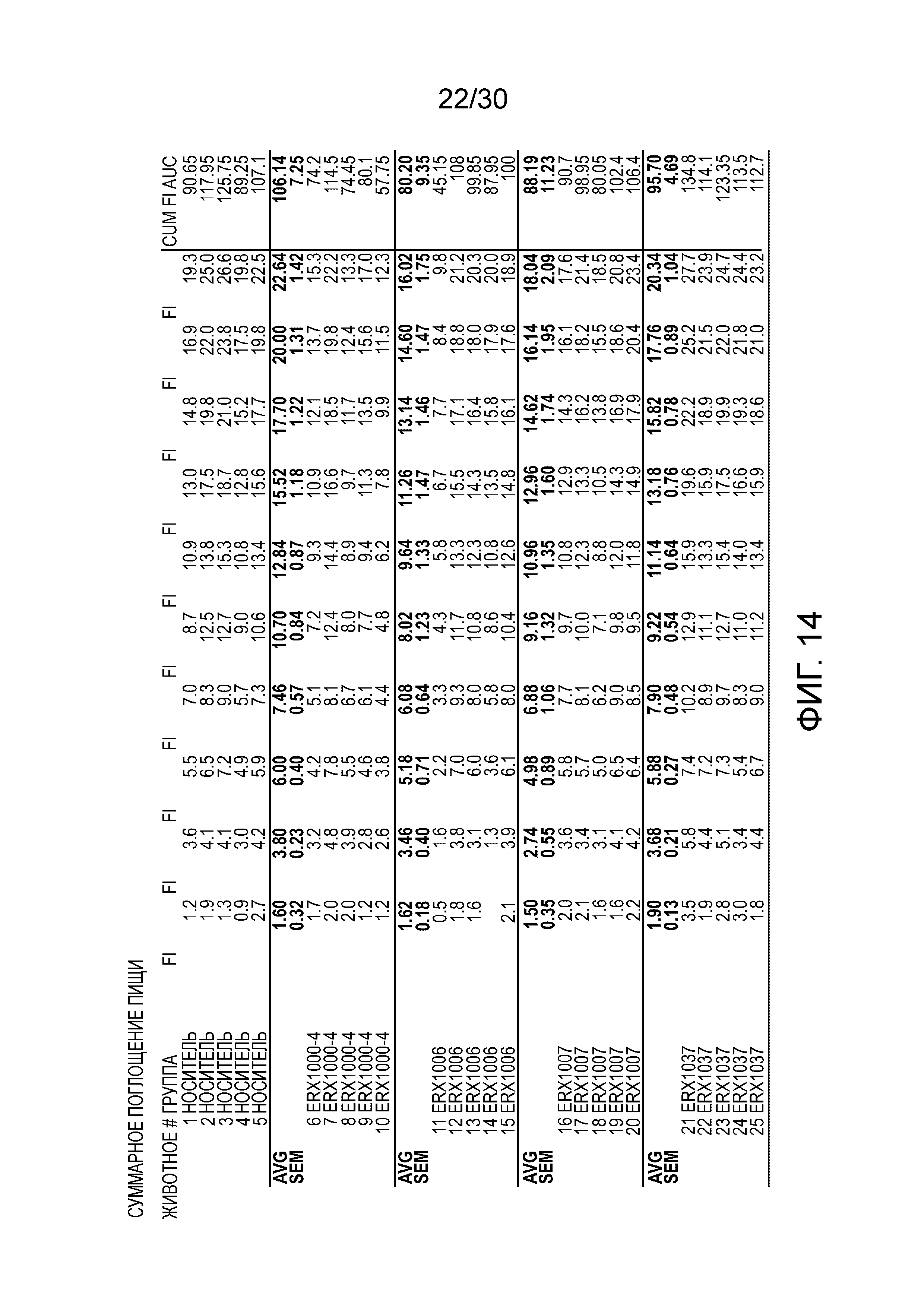
На фиг. 14 показаны данные суммарного поглощения пищи у мышей с алиментарным ожирением (АО) во время лечения пероральным введением соединений в дозе 2000 мкг/кг, как показано в таблице 13, в течение 11 дней.
На фиг. 15 показаны данные глюкозы в 1 день у мышей с алиментарным ожирением (АО) во время лечения пероральным введением соединений в дозе 2000 мкг/кг, как показано в таблице 13, в течение 11 дней.
На фиг. 16 показаны данные глюкозы на 11 день у мышей с алиментарным ожирением (АО) во время лечения пероральным введением соединений в дозе 2000 мкг/кг, как показано в таблице 13, в течение 11 дней.
На фиг. 17 показаны данные изменения глюкозы у мышей с алиментарным ожирением (АО) во время лечения пероральным введением соединений в дозе 2000 мкг/кг, как показано в таблице 13, в течение 11 дней.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОРЕТЕНИЯ
I. ОПРЕДЕЛЕНИЯ
Применяемые здесь аббревиатуры имеют обычное значение, применяемое в области химии и биологии. Химические структуры и формулы, представленные здесь, созданы по стандартным правилам химической валентности, известным в области химии.
В данном описании термин ʺоколоʺ в контексте численных значений или интервалов означает ±10% от численного значения или интервала, цитированного или заявленного, если контекст не требует более ограниченного интервала.
Понятно, что если представлен интервал параметра, все целые числа в этом интервале и их десятые доли также включены в данное изобретение. Например, ʺ0,2-5 мгʺ включает 0,2 мг, 0,3 мг, 0,4 мг, 0,5 мг, 0,6 мг и т.д., вплоть до, и включая 5,0 мг.
Если группы заместителей определены их обычными химическими формулами, написанными слева направо, они равнозначно охватывают идентичные заместители, которые получатся при написании структуры справа налево, например, -CH2O- эквивалентно -OCH2-.
Определенные соединения в соответствии с данным изобретением могут существовать в не сольватированных формах, а также сольватированных формах, включая гидрированные формы. В общем, сольватированные формы эквивалентны не сольватированным формам и включены в объем данного изобретения. Определенные соединения в соответствии с данным изобретением могут существовать во множестве кристаллических или аморфных форм. В общем, все физические формы эквивалентны по их применению, рассматриваемому в данном изобретении, и включены в объем данного изобретения.
В данном описании термин ʺсольʺ относится к ионным соединениям, которые получают реакцией нейтрализации кислоты и основания. Они состоят из сопряженного количества катионов (положительно заряженных ионов) и анионов (отрицательных ионов) так, что продукт является электрически нейтральным (без полного заряда). Эти составляющие ионы могут быть неорганическими, такими как хлорид (Cl-), или органическими, такими как ацетат (C2H3O2-); и могут быть одноатомными, например, фторид (F-) или многоатомными, такими как сульфат (SO42-).
Определенные соединения в соответствии с данным изобретением обладают асимметрическими атомами углерода (оптическими или хиральными центрами) или двойными связями; энантиомеры, рацематы, диастереомеры, таутомеры, геометрические изомеры, стереоизомерные формы, которые могут быть определены, в терминах абсолютной химии, как (R)- или (S)-, или как (D)- или (L)- для аминокислот, и отдельные изомеры также включены в объем данного изобретения. Соединения в соответствии с данным изобретением не включают такие, которые известны в данной области техники как слишком нестабильные к синтезу и/или выделению. Данное изобретение включает соединения в рацемических и оптически чистых формах. Оптически активные (R)- и (S)- или (D)- и (L)- изомеры могут быть получены с применением хиральных синтонов или хиральных реагентов, или разделены с применением обычных методов. Если описанные здесь соединения содержат олефиновые связи или другие центры геометрической асимметрии, и если не указано иначе, полагают, что соединения включают оба, E и Z, геометрических изомера.
В данном описании термин ʺизомерыʺ относится к соединениям, имеющим одинаковое количество и тип атомов и, следовательно, одинаковую молекулярную массу, но отличаются по структурному расположению или конфигурацией атомов.
Термин ʺтаутомерʺ в данном описании относится к одному или более структурным изомерам, которые существуют в равновесии и которые легко превращаются из одной изомерной формы в другую.
Специалисту в данной области техники очевидно, что определенные соединения в соответствии с данным изобретением могут существовать в таутомерных формах, где все такие таутомерные формы соединений включены в объем изобретения.
Если не указано иначе, изображенные здесь структуры также включают все стереохимические формы структуры; т.е., R и S конфигурации для каждого асимметрического центра. Поэтому отдельные стереохимические изомеры, а также энантиомерные и диастереомерные смеси данных соединений включены в объем изобретения.
Если не указаны иначе, изображенные здесь структуры также включают соединения, которые отличаются только присутствием одной или более изотопно обогащенных атомов. Например, соединения, имеющие представленные структуры за исключением замещения водорода дейтерием или тритием или замещения углерода13C- или14C-обогащенным углеродом, включены в объем данного изобретения.
Соединения в соответствии с данным изобретением также могут содержать неестественные доли атомных изотопов на одном или более атомах, которые составляют такие соединения. Например, соединения могут быть радиомечены радиоактивными изотопами, такими как, например, тритий (3H), йод-125 (125I) или углерод-14 (14C). Все изотопные варианты соединений в соответствии с данным изобретением, радиоактивные или нет, включены в объем данного изобретения.
Необходимо отметить, что в заявке те альтернативы написаны в группах Маркуша, например, каждое положение аминокислоты, которое содержит более одной возможной аминокислоты. Особенно отмечается, что каждый член группы Маркуша должен рассматриваться отдельно, тем самым составляя другой вариант, и группа Маркуша не должна считаться одной единицей.
Единственное число, применяемое здесь, означает один или более. Кроме того, фраза "замещен" в данном описании означает то, что указанная группа может быть замещена одним или более из любого или всех перечисленных заместителей. Например, если группа, такая как алкильная или гетероарильная группа, "замещена незамещенным C1-C20 алкилом или незамещенным 2-20-членным гетероалкилом", группа может содержать один или более незамещенных C1-C20 алкилов и/или один или более незамещенных 2-20-членных гетероалкилов. Более того, если часть замещена R заместителем, часть может быть названа ʺR-замещеннаяʺ. Если часть является R-замещенной, часть замещена, по крайней мере, одним R заместителем, и каждый R заместитель необязательно отличается от другого.
Термин ʺалкилʺ, сам по себе или как часть другого заместителя, означает, если не указано иначе, прямую (т.е. не разветвленную) или разветвленную не циклическую углеродную цепь (или углерод) или их сочетание, которая может быть полностью насыщена, моно- или полиненасыщена, и может включать двух- и многовалентные радикалы, имеющие указанное количество атомов углерода (т.е., C1-C10 означает от одного до десяти атомов углерода). Примеры насыщенных углеводородных радикалов включают, но не ограничены ими, такие группы, как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, (циклогексил)метил, гомологи и изомеры, например, н-пентил, н-гексил, н-гептил, н-октил и подобные. Ненасыщенной алкильной группой является такая, которая имеет одну или более двойных связей или тройных связей. Примеры ненасыщенных алкильных групп включают, но не ограничены ими, винил, 2-пропенил, кротил, 2-изопентенил, 2-(бутадианил), 2,4-пентадианил, 3-(1,4-пентадиенил), этинил, 1- и 3-пропинил, 3-бутинил и высшие гомологи и изомеры. Алкокси является алкилом, присоединенным к остатку молекулы через кислородный линкер (-O-). Алкильной частью может быть алкенильная часть. Алкильной частью может быть алкинильная часть. Алкильная часть может быть полностью насыщена.
Термин ʺалкилсульфатʺ, сам по себе или как часть другого заместителя, означает, если не указано иначе, алкил, замещенный сульфатом O(SO2)O- или его солью.
Термин ʺалкилсульфонатʺ, сам по себе или как часть другого заместителя, означает, если не указано иначе, алкил, замещенный сульфонатом (SO2)O- или его солью.
Термин ʺалкилфосфатʺ, сам по себе или как часть другого заместителя, означает, если не указано иначе, алкил, замещенный фосфатом PO4- или его солью.
Термин ʺциклоалкилʺ, сам по себе или как часть другого заместителя, означает, если не указано иначе, моноциклический или полициклический (например, бициклический или трициклический) насыщенный углеводород, который состоит из атомов водорода и углерода, расположенных в структуре, содержащей одно кольцо или множество колец, где все связи углерод-углерод являются одинарными связями. Примеры моноциклического алкила включают циклопропил, циклобутил, циклопентил, циклогексил и подобные, и примеры полициклического алкила включают норборнил, адамантил и подобные.
Термин ʺкарбоциклическийʺ, сам по себе или как часть другого заместителя, означает, если не указано иначе, циклическую углеродную цепь (или углерод), которая может быть полностью насыщена, моно- или полиненасыщена и может включать двух- и многовалентные радикалы, имеющую указанное количество атомов углерода (т.е., C1-C10 означает от одного до десяти атомов углерода). Карбоцикл может иметь структуру, содержащую одно кольцо или множество колец без ограничения. Примеры насыщенных циклических алкильных групп включают циклопропил, циклобутил, циклопентил, циклогексил и подобные, и примеры ненасыщенных карбоциклических групп включают циклопропенил, циклобутенил, циклопентенил, циклогексенил и подобные.
Термин ʺгетероалкилʺ, сам по себе или в сочетании с другим термином, означает, если не указано иначе, стабильную прямую или разветвленную не циклическую цепь или их сочетание, включающую, по крайней мере, один атом углерода и, крайней мере, один гетероатом, выбранный из группы, включающей O, N, P, Si и S, и где атомы азота и серы необязательно могут быть окислены, и гетероатом азота необязательно может быть кватернизирован. Гетероатом(ы) O, N, P, S и Si, но не ограниченные ими, могут быть размещены на любом внутреннем положении гетероалкильной группы или в положении, в котором алкильная группа присоединена к остатку молекулы. Примеры включают, но не ограничены ими: -CH2-CH2-O-CH3, -CH2-CH2-NH-CH3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -CH2-CH2, -S(O)-CH3, -CH2-CH2-S(O)2-CH3, -CH=CH-O-CH3, -Si(CH3)3, -CH2-CH=N-OCH3, -CH=CH-N(CH3)-CH3, -O-CH3, -O-CH2-CH3 и -CN. Вплоть до двух или трех гетероатомов могут быть последовательными, как в, например, -CH2-NH-OCH3 и -CH2-O-Si(CH3)3. Гетероалкильная часть может включать один гетероатом (например, O, N, S, Si или P). Гетероалкильная часть может включать два необязательно разных гетероатома (например, O, N, S, Si или P). Гетероалкильная часть может включать три необязательно разных гетероатомов (например, O, N, S, Si или P). Гетероалкильная часть может включать четыре необязательно разных гетероатомов (например, O, N, S, Si или P). Гетероалкильная часть может включать пять необязательно разных гетероатомов (например, O, N, S, Si или P). Гетероалкильная часть может включать вплоть до 8 необязательно разных гетероатомов (например, O, N, S, Si или P).
Термин ʺгетероциклическийʺ, сам по себе или в сочетании с другим термином, означает, если не указано иначе, циклическую цепь, включающую, по крайней мере, один атом углерода и, по крайней мере, один гетероатом, выбранный из группы, включающей O, N, P, Si и S, и где атомы азота и серы необязательно могут быть окислены, и гетероатом азота необязательно может быть кватернизирован. Гетероатом(ы) O, N, P, S и Si могут быть размещены в любом внутреннем положении циклической гетероалкильной группы или в положении, в котором гетероциклическая группа присоединена к остатку молекулы. Примеры включают, но не ограничены ими: -CO-, -OCOO-, -CH2-CH2-O-CH3, -CH2-CH2-NH-CH3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -CH2-CH2, -S(O)-CH3, -CH2-CH2-S(O)2-CH3, -CH=CH-O-CH3, -Si(CH3)3, -CH2-CH=N-OCH3, -CH=CH-N(CH3)-CH3, -O-CH3, -O-CH2-CH3 и -CN. Вплоть до двух или трех гетероатомов могут быть последовательными, как, например, -CH2-NH-OCH3 и -CH2-O-Si(CH3)3. Гетероалкильная часть может включать один гетероатом (например, O, N, S, Si или P). Гетероалкильная часть может включать два необязательно разных гетероатома (например, O, N, S, Si или P). Гетероалкильная часть может включать три необязательно разных гетероатома (например, O, N, S, Si или P). Гетероалкильная часть может включать четыре необязательно разных гетероатома (например, O, N, S, Si или P). Гетероалкильная часть может включать пять необязательно разных гетероатомов (например, O, N, S, Si или P). Гетероалкильная часть может включать вплоть до 8 необязательно разных гетероатомов (например, O, N, S, Si или P).
Термин ʺвторичный амидʺ, сам по себе или как часть другого заместителя, означает, если не указано иначе, амид, в котором атом азота связан прямо с двумя атомами углерода.
Термин ʺтретичный амидʺ, сам по себе или как часть другого заместителя, означает, если не указано иначе, амид, в котором атом азота связан прямо с тремя атомами углерода.
Описание соединений в соответствии с данным изобретением ограничено принципами химического связывания, известными специалистам в данной области техники. Следовательно, если группа может быть замещена одним или более из множества заместителей, такое замещение выбирают так, чтобы соответствовать принципам химического связывания и получить соединения, которые не обладают собственной нестабильностью и/или которые известны специалистам в данной области техники как вероятно нестабильные в условиях окружающей среды, таких как водный, нейтральные и некоторые известные физиологические условия. Например, гетероциклоалкил или гетероарил присоединены к остатку молекулы через гетероатом кольца в соответствии с принципами химического связывания, известными специалистам в данной области техники, чтобы избежать соединений с собственной нестабильностью.
Термины ʺлечитьʺ или ʺлечениеʺ относятся к любому признаку успеха в лечении или облегчении повреждения, заболевания, патологии или состояния, включая любые объективные или субъективные параметры, такие как уменьшение выраженности симптома; ремиссия; уменьшение симптомов или большая переносимость пациентом повреждения, патологии или состояния; замедление скорости дегенерации или ухудшения здоровья; менее ослабляющая конечная стадия дегенерации; улучшение физического или умственного состояния пациента. Лечение или облегчение симптомов может быть основано на объективных или субъективных параметрах; включая результаты физического обследования, психоневрологические исследования и/или психиатрическую оценку. Например, определенные способы в соответствии с данным изобретением лечат заболевания, связанные с увеличением массы тела, такие как ожирение.
ʺЭффективным количествомʺ является количество, достаточное для того, чтобы соединение выполнило заданную цель, по сравнению с отсутствием соединения (например, достижение эффекта, для которого его вводят, лечение заболевания, снижение активности ферментов, повышением активности ферментов, снижение сигнального пути, снижение одного или более симптомов заболевания или состояния. Примером ʺэффективного количестваʺ является количество, достаточное для способствования лечению, профилактике или снижению симптома или симптомов заболевания, которое также может быть названо ʺтерапевтически эффективным количествомʺ. ʺСнижениеʺ симптома или симптомов (и грамматические эквиваленты этой фразы) означает снижение тяжести или частоты симптома(ов) или исключением симптома(ов). ʺПрофилактически эффективным количествомʺ лекарственного средства является количество лекарственного средства, которое, при введении субъекту, окажет предполагаемое профилактическое действие, например, предотвратит или задержит наступление (или рецидив) повреждения, заболевания, патологии или состояния, или снизит вероятность наступления (или рецидива) повреждения, заболевания, патологии или состояния или их симптомов. Полное профилактическое действие не обязательно достигается введением одной дозы и может проявляться только после введения нескольких доз. Таким образом, профилактически эффективное количество может вводиться одним или более введениями. ʺКоличество, снижающее активностьʺ, в данном описании, относится к количеству антагониста, требуемому для снижения активности фермента относительно отсутствия антагониста. Точные количества зависят от цели лечения и определяются специалистом в данной области техники с применением известных методов (см., например, Lieberman, Pharmaceutical Dosage Forms (vols. 1-3, 1992); Lloyd, The Art, Science и Technology of Pharmaceutical Compounding (1999); Pickar, Dosage Calculations (1999); и Remington: The Science и Practice of Pharmacy, 20th Edition, 2003, Gennaro, Ed., Lippincott, Williams & Wilkins).
Термин ʺсвязанноеʺ или ʺсвязанное сʺ в контексте вещества или активности или функции вещества, связанной с заболеванием (например, ожирением) означает, что заболевание вызывается (полностью или частично), или симптом заболевания вызывается (полностью или частично) веществом или активностью или функцией вещества. В данном описании, то, что описано как связанное с заболеванием, если является причинным фактором, может быть целью лечения заболевания. Например, заболевание, связанное с увеличением массы тела, такое как ожирение, может лечиться агентом (например, описанным здесь соединением), эффективным для снижения набора веса.
ʺКонтрольʺ или ʺконтрольный экспериментʺ или ʺстандартный контрольʺ применяют в соответствии с обычным значением, и он относится к эксперименту, в котором субъектов или реагенты эксперимента лечат как в параллельном эксперименте, за исключением пропуска методики, реагента или переменной эксперимента. В некоторых случаях, контроль используют в качестве стандарта или для сравнения при оценке эффектов эксперимента.
Как определено здесь, термин ʺингибированиеʺ, ʺингибируетʺ, ʺингибируяʺ и подобные в отношении взаимодействия с ингибитором белка (например, антагонистом), означает негативное воздействие (например, снижение) на уровень активности или функцию белка по сравнению с уровнем активности или функцией белка при отсутствии ингибитора. В некоторых вариантах, ингибирование относится к снижению заболевания или симптомов заболевания. Таким образом, ингибирование может включать, по крайней мере, частичное, частично или полностью блокирующее стимулирование, снижение, предотвращение или задержку активации или инактивации, десенсибилизацию или подавление трансдукции сигнала или ферментной активности или количества белка.
Как определено здесь, термин ʺактивацияʺ, ʺактивироватьʺ, ʺактивирующийʺ и подобные в отношении взаимодействия активатора белка (например, агониста) означает положительное воздействие (например, повышение) на активность или функцию белка по сравнению с активностью или функцией белка в отсутствие активатора (например, описанного здесь соединения). Таким образом, активация может включать, по крайней мере, частичное, частично или полностью повышающее стимулирование, повышение или разрешение активации или активацию, сенсибилизацию или активацию трансдукции сигнала или ферментной активности или снижение количества вредного медиатора/вещества при заболевании. Активация может включать, по крайней мере, частичное, частично или полностью повышающее стимулирование, повышение или разрешение активации или активацию, сенсибилизацию или активацию трансдукции сигнала или ферментной активности или снижение количества вредного медиатора/вещества.
Термин ʺмодуляторʺ относится к композиции, которая повышает или снижает уровень целевой молекулы или функцию целевой молекулы. В некоторых вариантах, модулятором является противовоспалительный агент. В некоторых вариантах, модулятором является ингибитор лептина. В некоторых вариантах, модулятором является лиганд лептина.
ʺАгент против ожиренияʺ относится к свойству вещества или лечения снижать набор веса и способствовать потере веса. Примеры агентов против ожирения включают Сибутрамин, Фентермин, Мазиндол, Диэтилпропион, Лептин, Орлистат, Бета-3 агонисты и Римонабант.
Термин ʺстрадающий ожирениемʺ в данном описании относится к пациенту, имеющему индекс массы тела более 30 кг/м2. ʺЛишний весʺ и ʺпредожирениеʺ в данном описании относится к пациентам, имеющим индекс массы тела более 25 кг/м2. ʺМорбидное ожирениеʺ в данном описании относится к пациенту, имеющему ИМТ больше 40 кг/м2, ИМТ больше 35 кг/м2 в сочетании с одним или более сопутствующими заболеваниями, ИМТ более 30 кг/м2 в сочетании с неконтролируемым диабетом, или их сочетание.
Термин ʺпролекарствоʺ относится к фармакологическому веществу, такому как лекарственное средство, которое вводят субъекту в неактивной (или значительно менее активной) форме. При введении пролекарство метаболизируется в теле (in vivo) в соединение, имеющее желаемую фармакологическую активность.
Термины ʺпациентʺ, ʺсубъектʺ, ʺиндивидуумʺ и подобные относятся к живому организму, страдающему или подверженному заболеванию или состоянию, которое может быть лечено введением соединения или фармацевтической композиции, представленных здесь. Не ограничивающие примеры включают человека, других млекопитающих, крупный рогатый скот, крыс, мышей, собак, кошек, приматов, обезьян, коз, овец, коров, оленей и других не млекопитающих животных. В некоторых вариантах, субъектом является домашнее животное, такое как собака или кошка. В некоторых вариантах, пациентом является человек. В некоторых вариантах, пациент имеет предожирение, ожирение или морбидное ожирение. В определенных вариантах, пациент не имеет предожирение, ожирение или морбидное ожирение, но ранее имел предожирение, ожирение или морбидное ожирение. В некоторых вариантах, пациент желает снизить массу тела или имеет пониженный аппетит. Альтернативно или в дополнение, пациент имеет связанное с ожирением заболевание или расстройство. Эти примеры являются не ограничивающими. Термины ʺпациентʺ, ʺсубъектʺ, ʺиндивидуумʺ и подобные, применяемые здесь, не являются ограничивающими и, в общем, могут быть взаимозаменяемыми. То есть, индивидуум, описанный как ʺпациентʺ, не обязательно имеет данное заболевание или находится под наблюдением медицинского специалиста, но может просто искать или желать лечение при отсутствии медицинской рекомендации (например, самолечение). ʺЗаболеваниеʺ или ʺсостояниеʺ относится к состоянию или состоянию здоровья пациента или субъекта, который может быть лечен соединением, фармацевтической композицией или способом, представленными здесь. В некоторых вариантах, заболеванием является заболевание, вызывающее увеличение массы тела. В некоторых вариантах, заболеванием является ожирение. Ожирение может быть первичной причиной лечимого заболевания и/или расстройства, или также может быть результатом первичного заболевания и/или расстройства.
ʺФармацевтически приемлемый наполнительʺ и ʺфармацевтически приемлемый носительʺ относится к веществу, которое помогает введению активного агента и абсорбции субъектом, и может быть включено в композиции в соответствии с данным изобретением не вызывая значительного побочного токсикологического действия у пациента. Не ограничивающие примеры фармацевтически приемлемых наполнителей включают воду, NaCl, физиологические растворы, нормальный раствор Рингера сахарозы с лактатом, нормальный раствор глюкозы, носители, наполнители, разрыхлители, смазывающие агенты, покрытия, подсластители, вкусовые добавки, солевые растворы (такие как раствор Рингера), спирты, масла, желатины, углеводороды, такие как лактоза, амилоза или крахмал, сложные эфиры жирных кислот, гидроксиметилцеллюлозу, поливинилпирролидин и красители, и подобные. Такие препараты могут быть стерилизованы и, при желании, смешаны со вспомогательными агентами, такими как смазывающие агенты, консерванты, стабилизаторы, смачивающие агенты, эмульгаторы, соли для корректировки осмотического давления, буферы, красящие и/или ароматические вещества и подобные, которые не реагируют неблагоприятно с соединениями в соответствии с данным изобретением. Специалист в данной области техники определит, что другие фармацевтические наполнители могут применяться в соответствии с данным изобретением.
Термин "приготовление" включает составление активного соединения с инкапсулирующим материалом в качестве носителя с получением капсулы, в которой активный компонент с или без других носителей окружен носителем, который связан с ним. Также включены крахмальные капсулы и пастилки. Таблетки, порошки, капсулы, пилюли, крахмальные капсулы и пастилки могут применяться в качестве твердых лекарственных форм, подходящих для перорального введения.
В данном описании, термин "введение" означает пероральное введение, введение в виде суппозитория, местный контакт, внутривенное, парентеральное, внутрибрюшинное, внутримышечное, внутриочаговое, интратекальное, внутричерепное, интраназальное или подкожное введение, или имплантацию медленно выделяющего устройства, например, мини-осмотической помпы, субъекту. Введение производят любым путем, включая парентеральный и чресслизистый (например, буккальный, подъязычный, небный, десенный, назальный, вагинальный, ректальный или чрескожный). Парентеральное введение включает, например, внутривенное, внутримышечное, интраартериольное, внутрикожное, подкожное, внутрибрюшинное, интравентрикулярное и внутричерепное. Другие пути доставки включают, но не ограничены ими, применение липосомных композиций, внутривенную инфузию, чрескожные пластыри и т.д. Под "со-введением" понимают, что описанную здесь композицию вводят одновременно, непосредственно перед или сразу же после введения одной или более дополнительных терапий (например, агента от ожирения). Соединение может вводиться отдельно, или может вводиться пациенту совместно с другим. Co-введение включает одновременное или последовательное введение соединения отдельно или в сочетании (более одного соединения или агента). Таким образом, препараты также могут быть объединены, при желании, с другими активными веществами (например, для снижения метаболического разложения, для повышения разложения пролекарства и выделения лекарственного средства, определяемого агента). Композиции могут доставляться чрескожно, местным путем, составлено в виде аппликаторов, растворов, суспензий, эмульсий, гелей, кремов, мазей, паст, желе, красок, порошков и аэрозолей. Пероральные препараты включают таблетки, пилюли, порошки, драже, капсулы, жидкости, пастилки, крахмальные капсулы, гели, сиропы, суспензии и т.д., подходящие для съедания пациентом. Препараты твердой формы включают порошки, таблетки, пилюли, капсулы, крахмальные капсулы, суппозитории и диспергируемые гранулы. Препараты жидкой формы включают растворы, суспензии и эмульсии, например, растворы в воде или воде/пропиленгликоле. Композиции могут дополнительно включать компоненты, обеспечивающие замедленное выделение и/или комфорт. Такие компоненты включают высокомолекулярные анионные мукоимитирующие полимеры, желирующие полисахариды и тонкоизмельченные субстраты для носителей лекарственных средств. Эти компоненты более подробно обсуждаются в патентах США №№ 4,911,920; 5,403,841; 5,212,162; и 4,861,760. Полное содержание этих патентов включено сюда в качестве ссылки полностью для всех целей. Композиции также могут доставляться в виде микросфер для медленного выделения в теле. Например, микросферы могут вводиться через внутрикожную инъекцию содержащих лекарство микросфер, которые медленно выделяют под кожу (см. Rao, J. Biomater Sci. Polym. Ed. 7:623-645, 1995; в виде биоразлагаемых и инъецируемых гелевых композиций (см., например, Gao Pharm. Res. 12:857-863, 1995); или в виде микросфер для перорального введения (см., например, Eyles, J. Pharm. Pharmacol. 49:669-674, 1997). В другом варианте, композиции могут доставляться с помощью липосом, которые конденсированы с клеточной мембраной или эндоцитозированы, т.е. с применением лигандов рецептора присоединены к липосоме, которая связана с рецепторами белка поверхностной мембраны клетки, вызывая эндоцитоз. При применении липосом, особенно когда поверхность липосомы имеет рецепторные лиганды, специфические к целевым клеткам, или другим образом преимущественно направлены на определенный орган, можно сфокусироваться на доставке композиций в целевые клетки in vivo. (См., например, Al-Muhammed, J. Microencapsul. 13:293-306, 1996; Chonn, Curr. Opin. Biotechnol. 6:698-708, 1995; Ostro, Am. J. Hosp. Pharm. 46:1576-1587, 1989). Композиции также могут доставляться в виде наночастиц.
II. СОЕДИНЕНИЯ
Здесь представлены, кроме прочего, композиции, способствующие снижению массы тела, снижению жира в теле, снижению поглощения пищи, улучшения гомеостаза или их сочетанию.
В одном предпочтительном аспекте, композиция может включать соединение, имеющее структуру формулы (I):
где
пунктирные линии между C1 и C2, C2 и R3, C3 и R4, C5 и C6, C5 и C7, C1 иC6,и C3 и C4 показывают, что может присутствовать одинарная или двойная связь, как позволяет валентность;
R1 является -CN, -COOH, -COOCH2CH3, -CONHR5, -CONR5R5,-COOR5, -COOCH3, -CH2NR5R5, -CH2OCONR5R5, -CH2NR5COOR5, -CH2R5,-CH2NR5CONR5R5, -CH2OH, -CH2OR5, алкилсульфатом, алкилсульфонатом, алкилфосфатом, -CH2OSO3R5, -CH2OSO2R5, -CH2OPO3R5R5, -CH2OPO3HR5,-CH2OPO3H2 -C(=NR5)NR5R5, -NR5C(=NR5)NR5R5, -CONH2, -CH2CONR5R5, -SR5, -SO3R5, -SO2R5, -CH2NHCOR5, -CH2NHCNR5NR5R5, -CH2COSR5, CH2NR5COR5, -CH2NR5CNR5NR5R5, -CH2NR5COSR5, -CH2NHSO2R5, -CH2N R5SO2R5, -CHNR5, -CHNOR5, -H, -NH2, -NHR5, -NR5R5, -OH, -OR5, фосфатом, -OPO3R5R5, -OPO3HR5, -OPO3H2, -NCO, -NCS, -N3, - R5, -C≡CR5, -(CH=CH)R5, -SH, -SR5, -SO2H, -SO3H, -SO2NR5R5, -SO3R5, -NHCOR5, NHCNR5NR5R5, -NHCOSR5, вторичным амидом, третичным амидом, -NR5COR5, -NR5C(=NH)NR5R5, -NR5COSR5, -NHC(=NR5)R5, -NR5C(=NR5)R5, -NHSO2(NH2), -NHSO2R5, -NR5SO2R5, -NR5SO2NR5R5, -OCOR5, -OCONR5R5, -O(C=O)OR5, -SCOR5, -O(C=NH)NR5R5, -OCSNHR5, -OS(=O2)R5, -OS(=O2)NR5R5, -SCONR5R5, -CH2-арилом, -CH2-гетероарилом,
R2 является -H,-CH3, -SCH(CH3)2, -SC(=O)CH3,-SC(=O)R5, -SCH2CH2OCOCH3, -SR5, -SOR5, -SOOR5, -SCONR2,
R3 является -OCOCH3, -OCOOCH2CH3, -OR7, -R7 или -NR5R5, если двойная связь присутствует между C1 и C2, C3 и C4, и C5 и C6;
R4 является -OCOCH3, -OCOOCH2CH3, -OR7, -R7 или -NR5R5, если двойная связь присутствует между C1 и C2, C3 и C4, и C5 и C6;
R3 является O, если R4 является O и двойная связь присутствует между C2 и R3 и C3 и R4;
R4 является -OCH3, -OP(=O)(OCH3)2, -OH, -OCOOCH2CH3, -OCONHCH2CH3, -OCOOCH(CH3)2, -OR7, -R7 или -NR5R5, если R3 является O и двойная связь присутствует между C2 и R3; R3 и R4 также могут быть объединены с образованием гетероциклического или карбоциклического кольца;
R5 независимо выбирают в каждом случае из водорода, алкила, циклоалкила, алкокси, гетероциклоалкила, алкиларила, алкенила, алкинила, арила, амина или гетероарила, необязательно замещенных заместителями, индивидуально выбранными из алкила, алкокси, циклоалкила, простого эфира, амина, необязательно замещенного одним или более алкилом, галогена, гидроксила, простого эфира, циано, нитрила, CF3, сложного эфира, амида, циклоалкиламида, сахара, гетероариламида, необязательно замещенного алкилом и/или алкокси, мочевины, карбамата, тиоэфира, сульфата, сульфонила, сульфоновой кислоты, карбоновой кислоты и арила, или две R5 группы, взятые вместе, образуют циклоалкильную, гетероциклоалкильную, арильную или гетероарильную группы, необязательно замещенные заместителями, индивидуально выбранными из алкила, циклоалкила, алкокси, гетероциклоалкила, алкиларила, алкенила, алкинила, арила, гетероарила, амина, галогена, гидроксила, простого эфира, нитрила, циано, нитро, CF3, сложного эфира, мочевины, карбамата, тиоэфира или группы карбоновой кислоты;
и
R7 является водородом, алкилом, циклоалкилом, гетероциклоалкилом, алкиларилом, алкенилом, алкинилом, арилом или гетероарилом, необязательно замещенными заместителями, индивидуально выбранными из алкила, циклоалкила, простого эфира, амина, галогена, гидроксила, простого эфира, нитрила, циано, нитрила, CF3, сложного эфира, амида, мочевины, карбамата, тиоэфира или карбоновой кислоты,
или его фармацевтически приемлемую соль или пролекарство.
В некоторых вариантах, соединения формулы (I) включают такие, которые являются пролекарствами.
В некоторых вариантах, соединения формулы (I) включают такие, в которых R1 является -CONH2, которые могут быть представлены в формуле (I)-a:
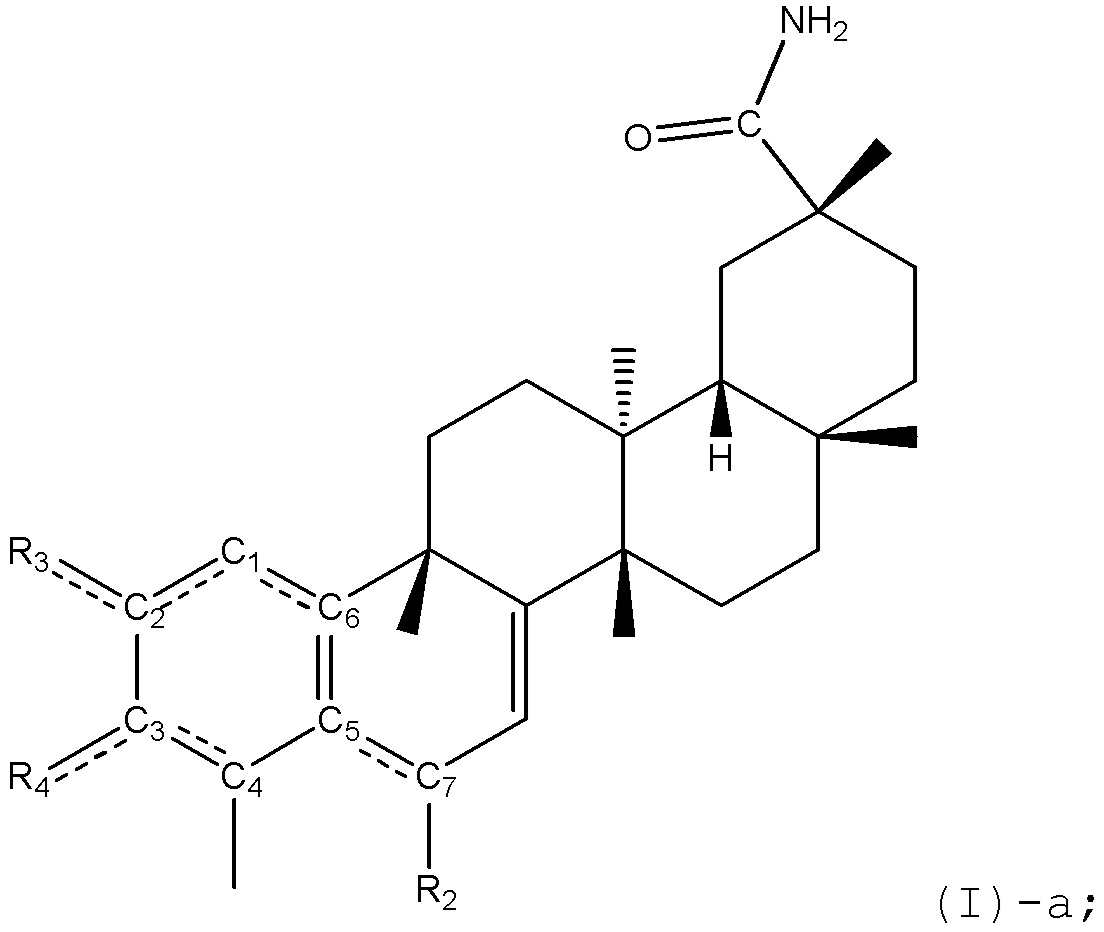
где каждый R2, R3 и R4 определен в формуле (I).
В некоторых вариантах, R2 является -H, -SCH(CH3)2, -SC(=O)CH3,
В некоторых вариантах, R3 является -OC(=O)CH3 или -OC(=O)OCH2CH3.
В некоторых вариантах, R4 является -OC(=O)CH3 или -OC(=O)OCH2CH3.
Одно из подмножеств соединений формулы (I) включает показанные ниже соединения:
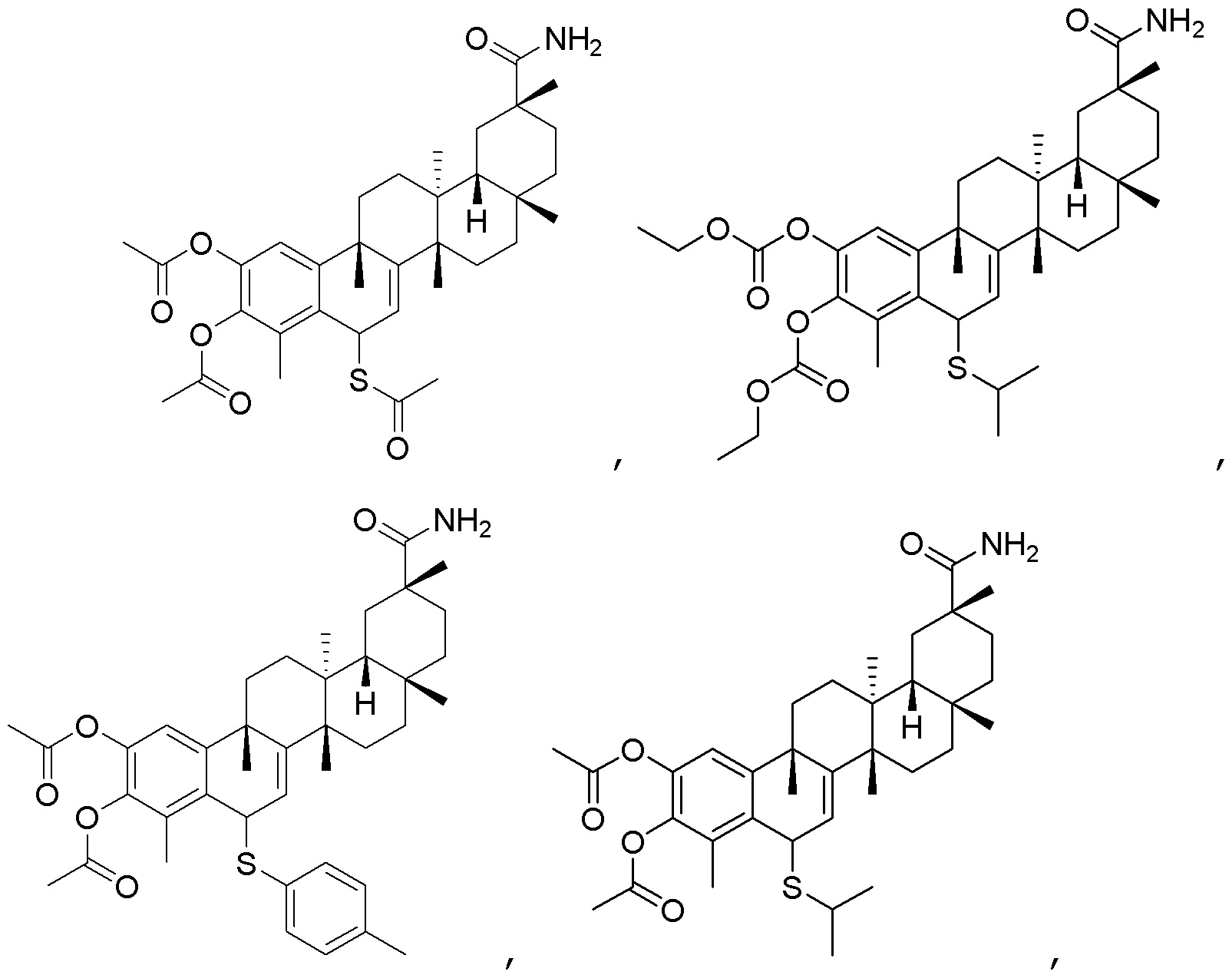
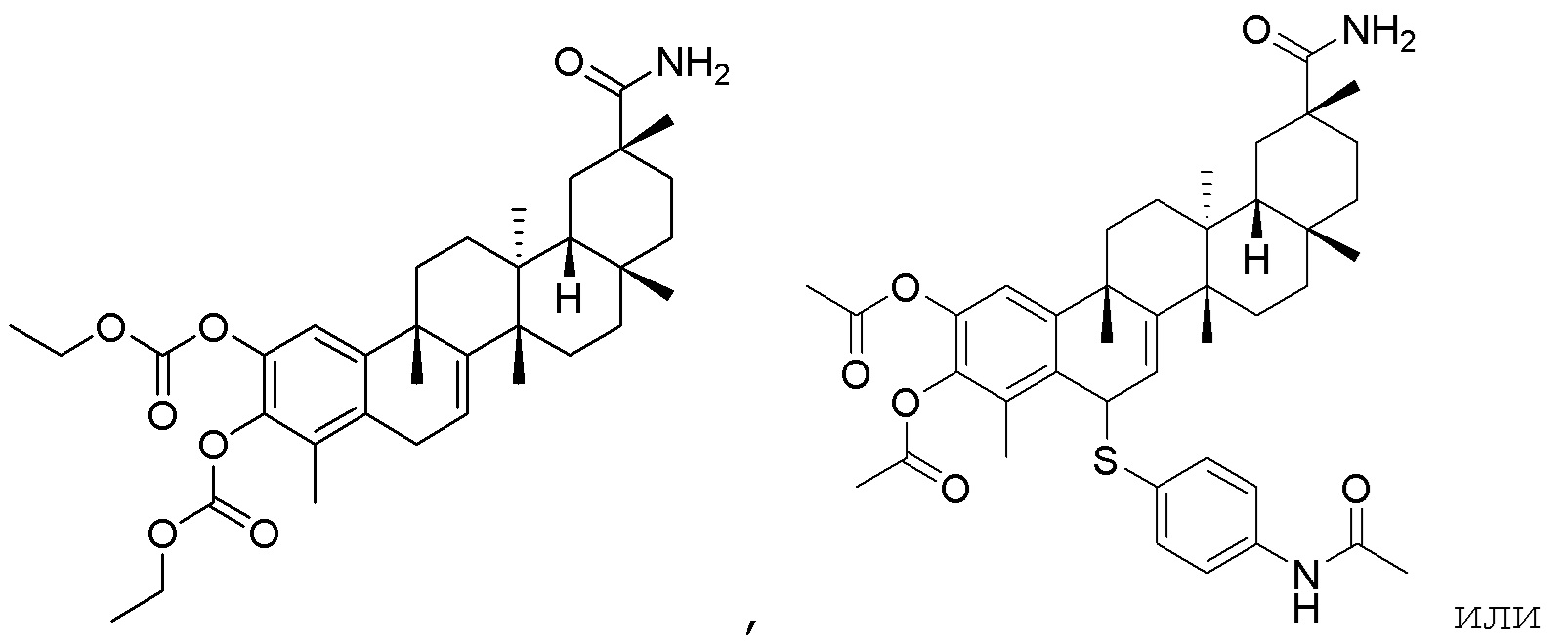
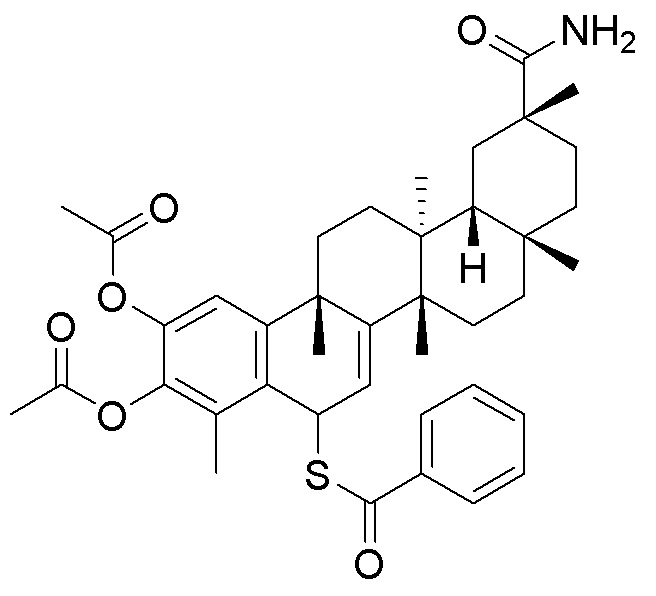
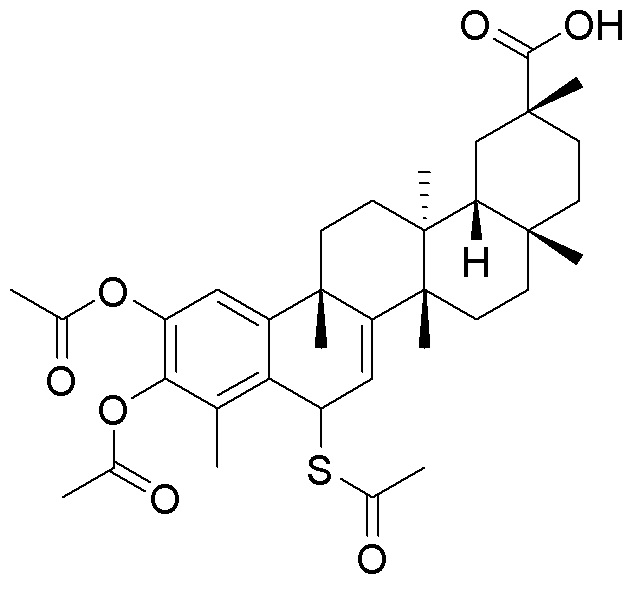
В другом варианте, соединения формулы (I) включают такие, в которых R1 является -COOH или -COOCH3.
В некоторых вариантах, R2 является -CH3, -SC(=O)CH3, -SCH(CH3)2 или -SCH2CH2OCOCH3.
В некоторых вариантах, R3 является -OCOCH3 или -OH.
В некоторых вариантах, R4 является -OCOCH3 или -OH.
Одно из подмножеств соединений формулы (I) включает показанные ниже соединения:

В некоторых вариантах, соединения формулы (I) включают такие, в которых R1 является -CN или -CH2NR5R5, таким как -CH2N(CH3)2, которые могут быть представлены как формула (I)-b или формула (I)-c, соответственно:
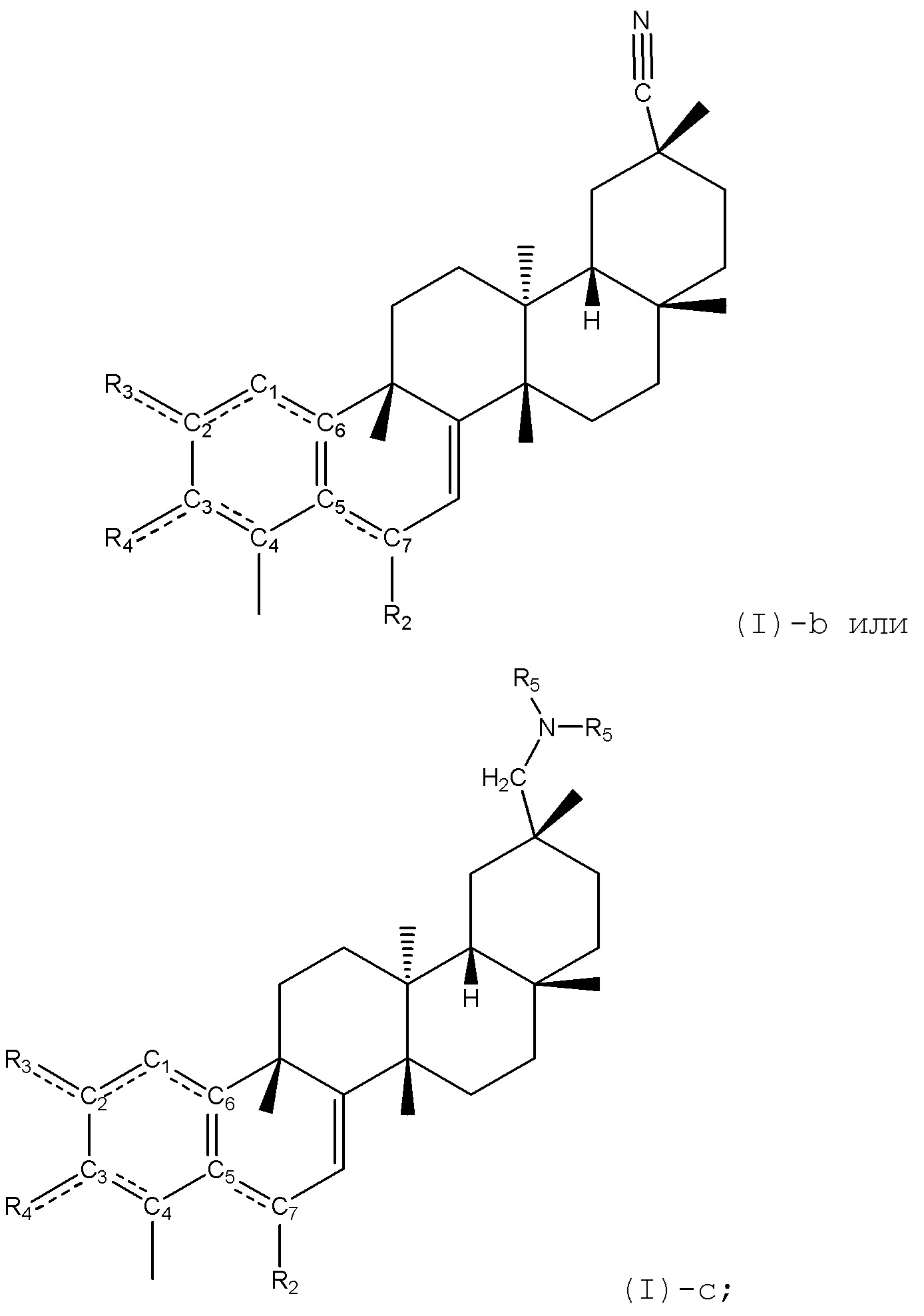
где каждый R2, R3, R4 и R5 определен в формуле (I).
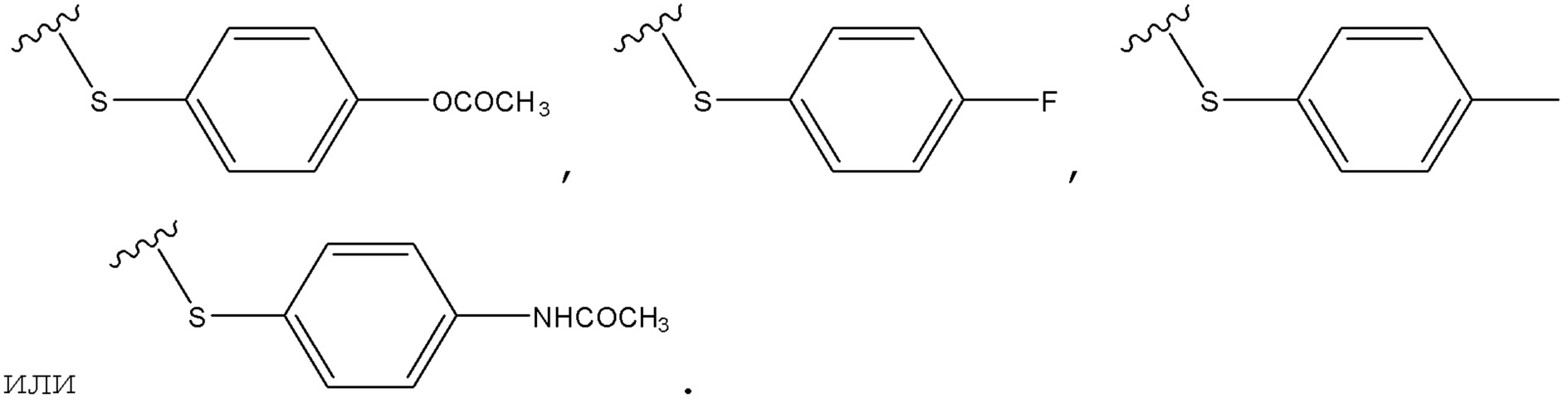
В некоторых вариантах, R2 является -SCH(CH3)2, -SC(=O)CH3, -H,
В некоторых вариантах, R3 является -OCOCH3.
В некоторых вариантах, R4 является -OCOCH3.
В некоторых вариантах R3 и R4 образуют пятичленный гетероцикл, содержащий -OCOO-.
В некоторых вариантах, R5 является алкилом, предпочтительно, CH3.
Одно из подмножеств соединений формулы (I) включает показанные ниже соединения:
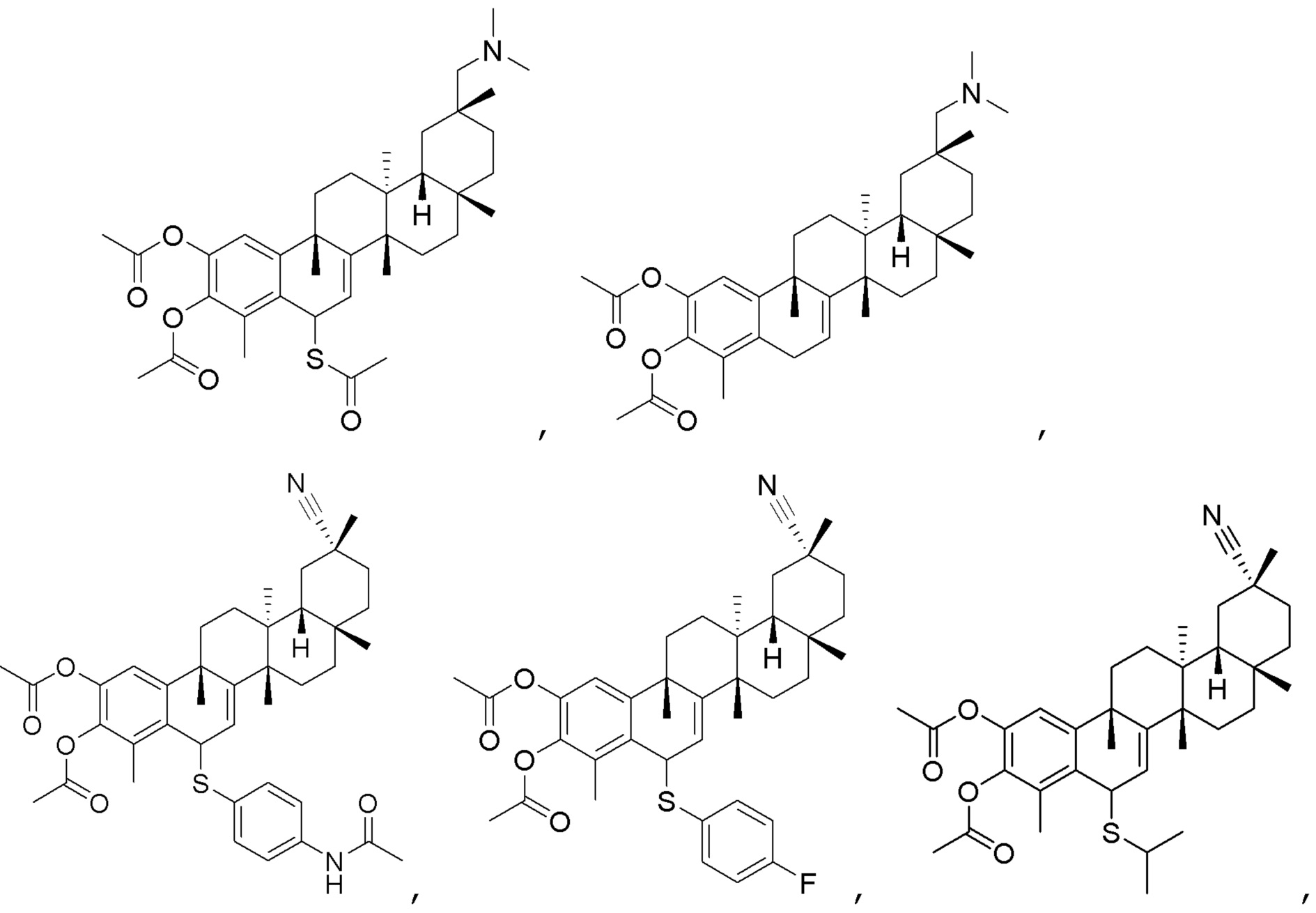
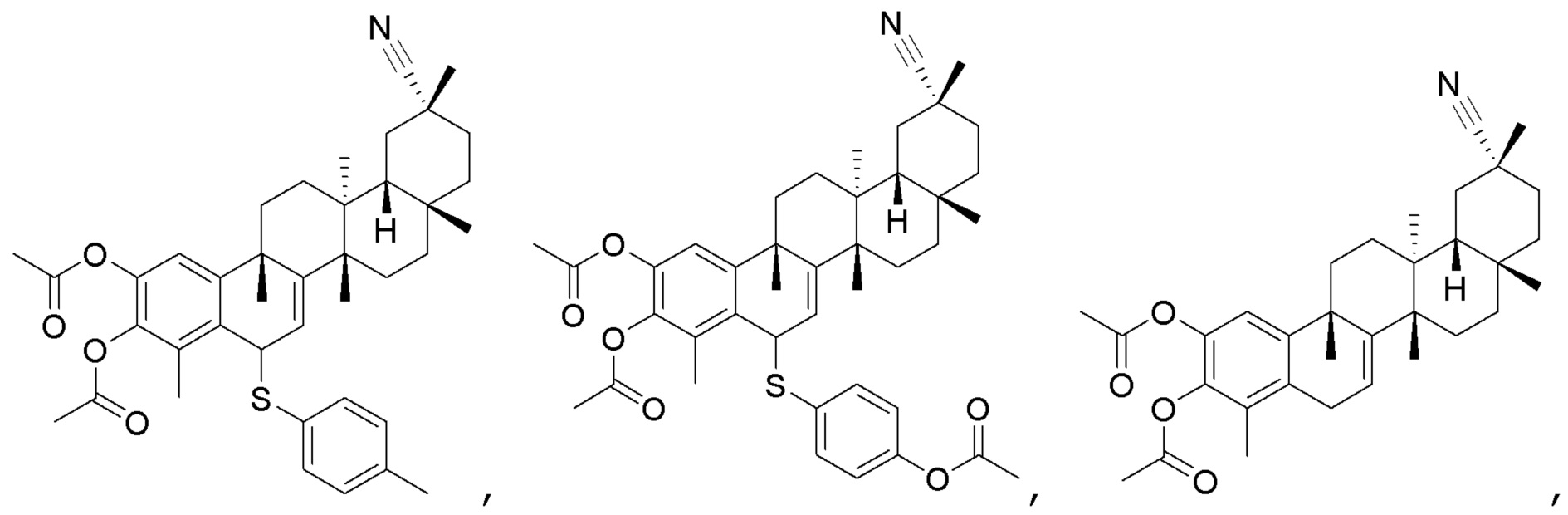

В некоторых вариантах, соединения формулы (I) включают такие, в которых R3 является O, и двойная связь присутствует между C2 и R3 и C3 и C4.
В некоторых вариантах, R1 является -C(=O)OCH2CH3, -CN, -CONH2, -CH2N(CH3)2,
В некоторых вариантах, R2 является -H.
В некоторых вариантах, R4 является -OCH3, -OP(=O)(OCH3)2, -OCH2CH3, -OH, -OCONHCH2CH3, -OCH2COOCH3, -OCOOCH2CH3, -OCH2CH2OH, -OCOOCH(CH3)2 или -OCH(CH3)2.
Одно из подмножеств соединений формулы (I) включает показанные ниже соединения:
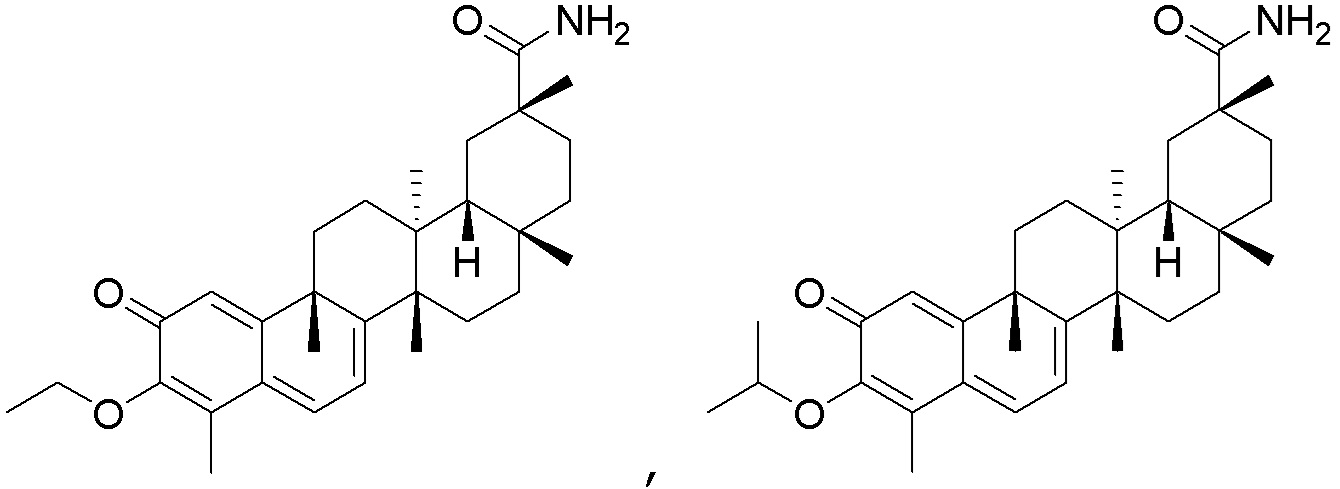
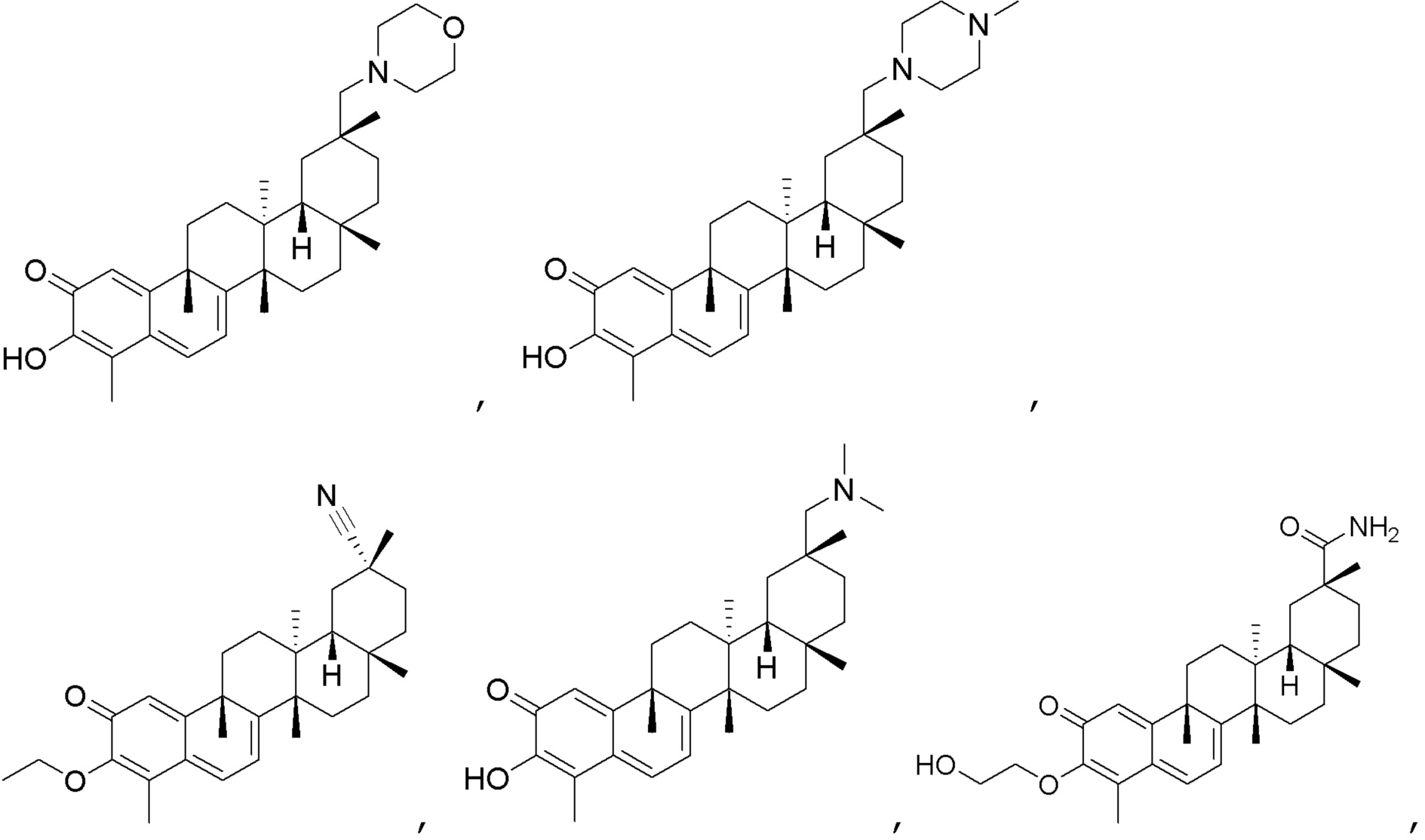
В некоторых вариантах, соединения формулы (I) включают такие, в которых R3 и R4 являются O, и двойная связь присутствует между C2 и R3 и C3 и R4.
В некоторых вариантах, R1 является COOH, COOCH3 или
В некоторых вариантах, R2 является CH3.
Одно из подмножеств соединений формулы (I) включает показанные ниже соединения:
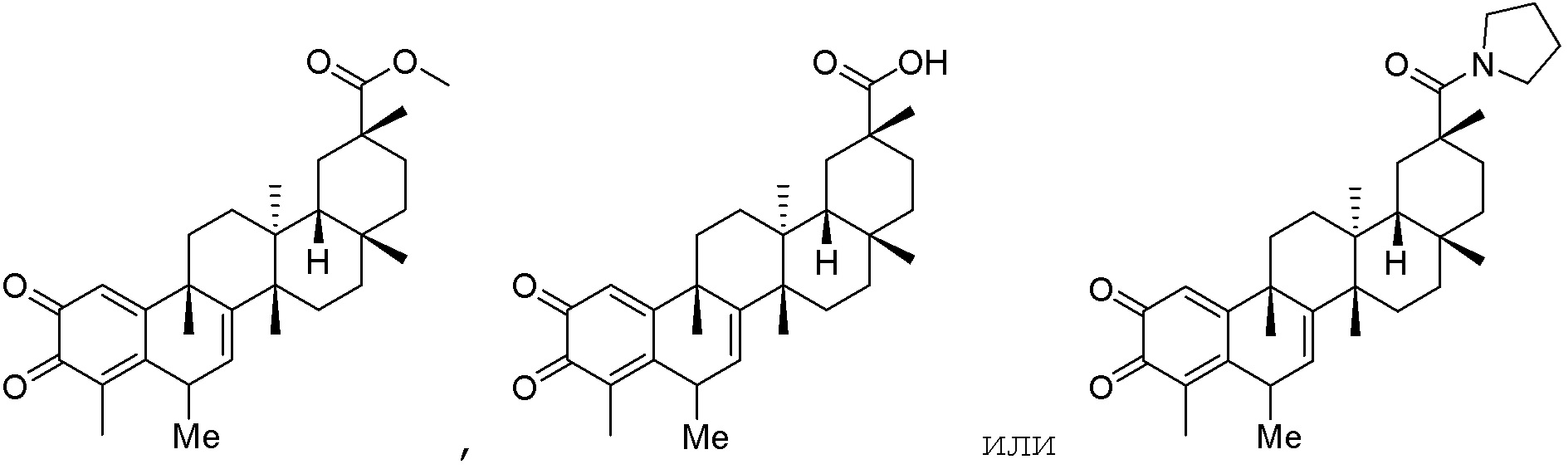
В некоторых вариантах, R1 является -NR5C(=NR5)NR5R5, -SR5, -SO3R5, -SO2R5, -NH2, -NHR5, -NR5R5, -OH, -OR5, -NCO, -NCS, -N3, -SH, -SR5, -SO2H, -SO3H, -SO2NR5R5, -SO3R5, -NHCOR5, -NHCNR5NR5R5, -NHCOSR5, -NR5COR5, -NR5C(=NH)NR5R5, -NR5COSR5, -NHC(=NR5)R5, -NR5C(=NR5)R5, -NHSO2(NH2), -NHSO2R5, -NR5SO2R5, -NR5SO2NR5R5, -OCOR5, -OCONR5R5, -O(C=O)OR5, -SCOR5, -O(C=NH)NR5R5, -OCSNHR5, -OS(=O2)R5, -OS(=O2)NR5R5, -SCONR5R5.
В некоторых вариантах, R2 является H.
В некоторых вариантах, R4 является OH, -OR7 или -R7, если R3 является O и двойная связь присутствует между C2 и R3.
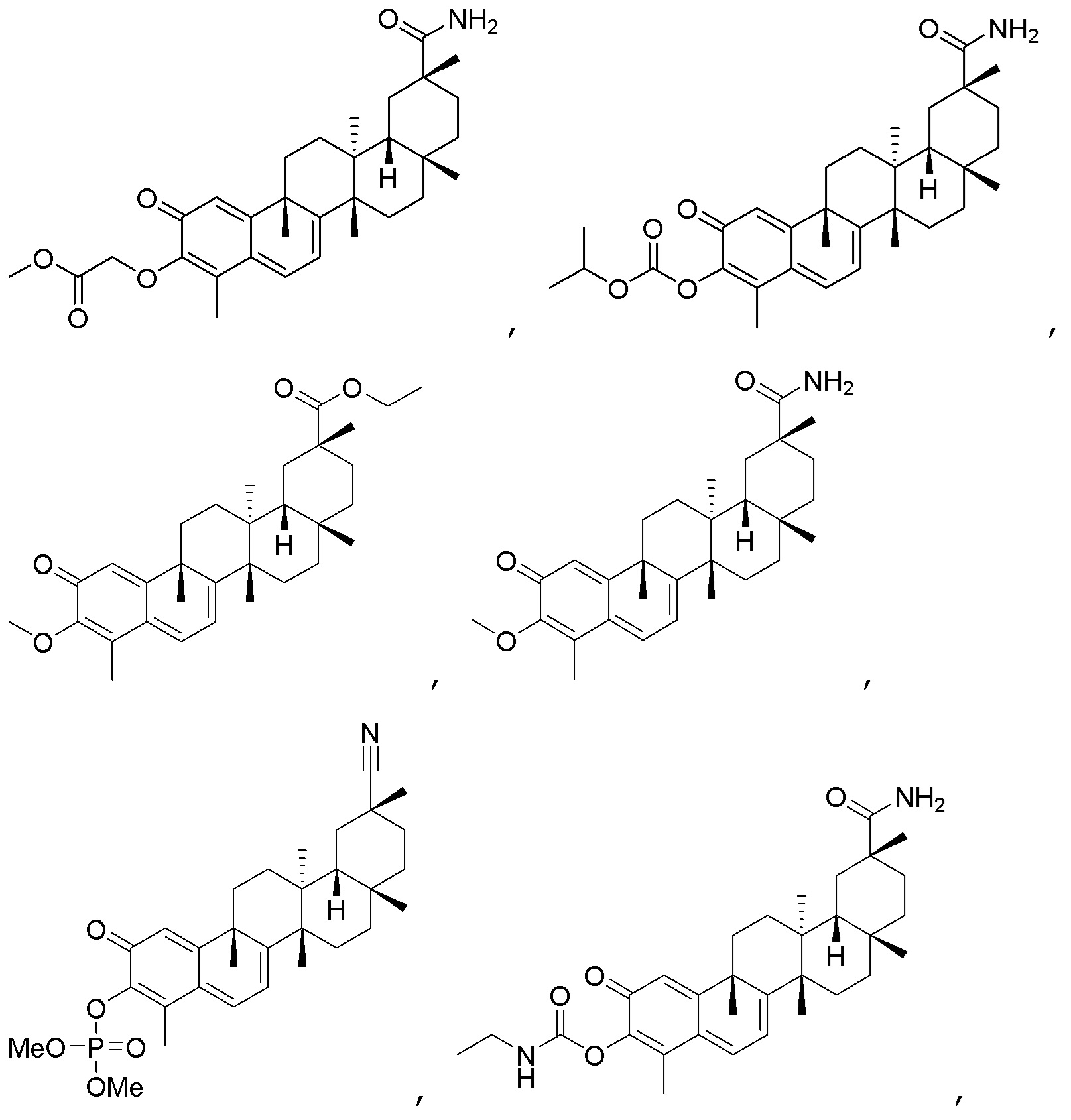
Одно из подмножеств соединений формулы (I) включает показанные ниже соединения:









В некоторых вариантах, соединения могут включать:
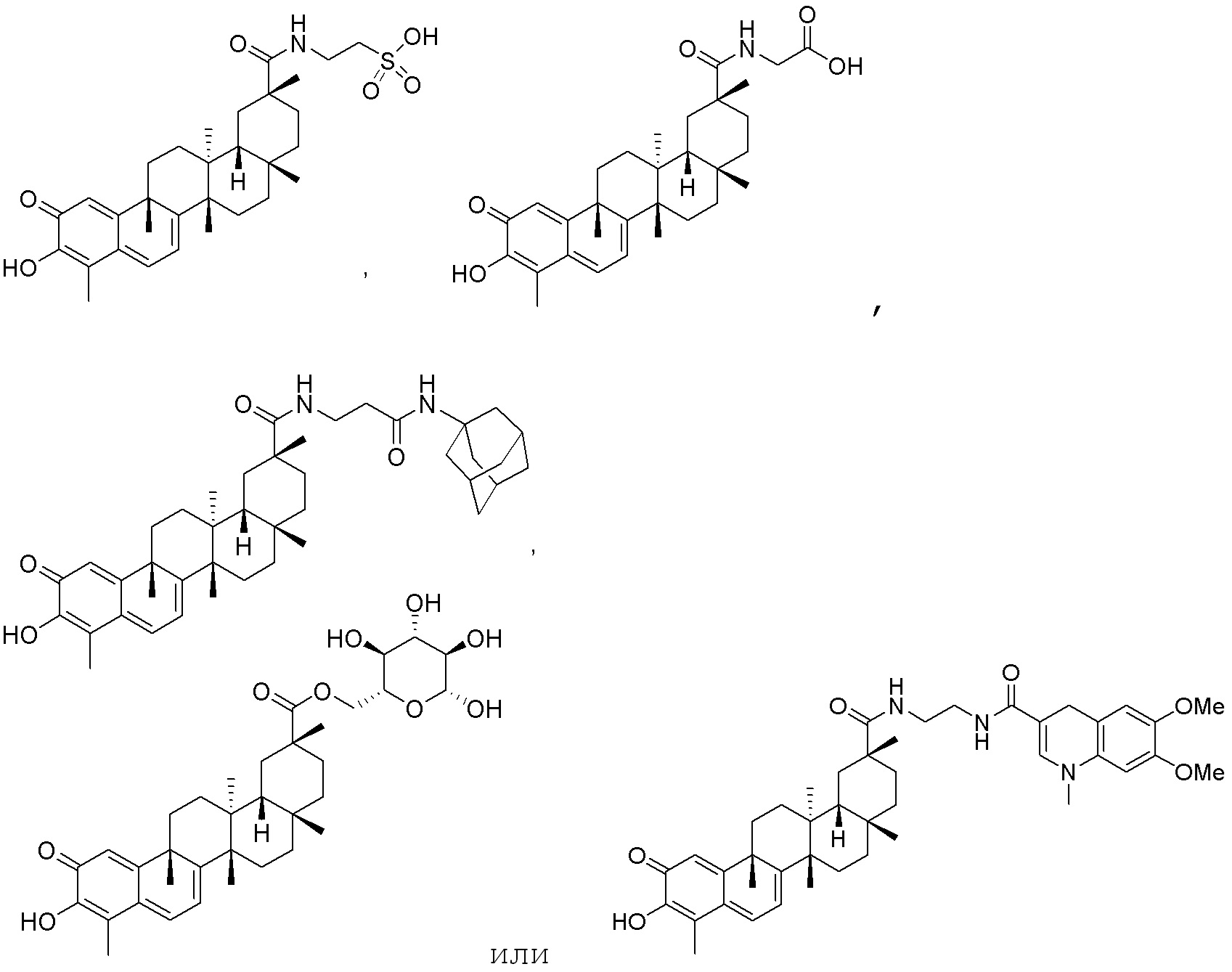
В другом предпочтительном аспекте композиция может включать соединение, имеющее структуру формулы (II):
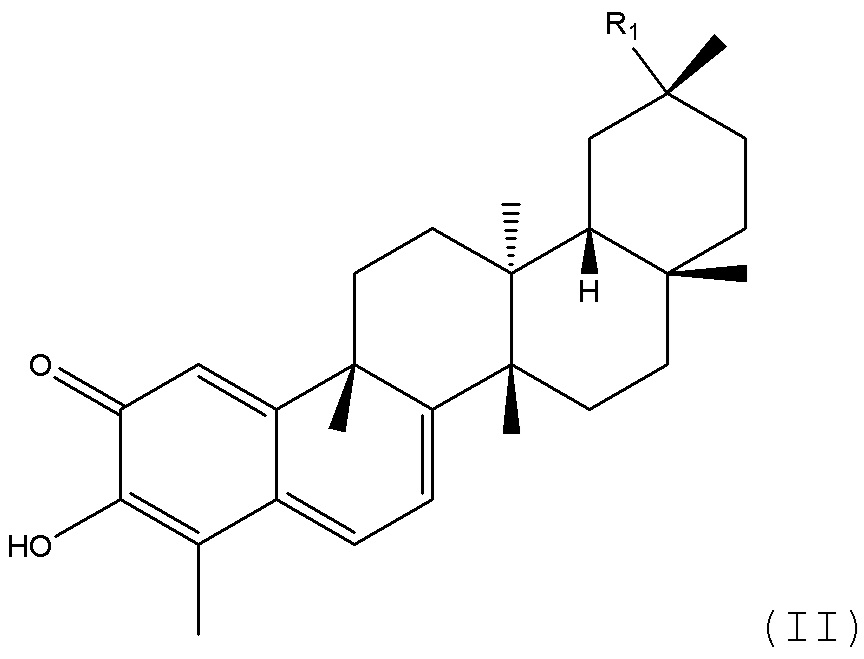
где R1 является ORa или NRaRb, где каждый Ra и Rb независимо является водородом, R5, -C(=NR5)NR5R5, -CO, -CS, -COR5, -CNR5NR5R5, -COSR5, -C(=NH)NR5R5, -C(=NR5)R5, -SO2(NH2), -SO2R5, -SO2R5, -SO2NR5R5, -COR5, -CONR5R5, -(C=O)OR5, -(C=NH)NR5R5, -CSNHR5, -S(=O2)R5 или -S(=O2)NR5R5,
R5 описан в формуле (I), или
его фармацевтически приемлемую соль или пролекарство.
В некоторых вариантах, R1 является NRaRb, которое может быть представлено в формуле (II)-a:
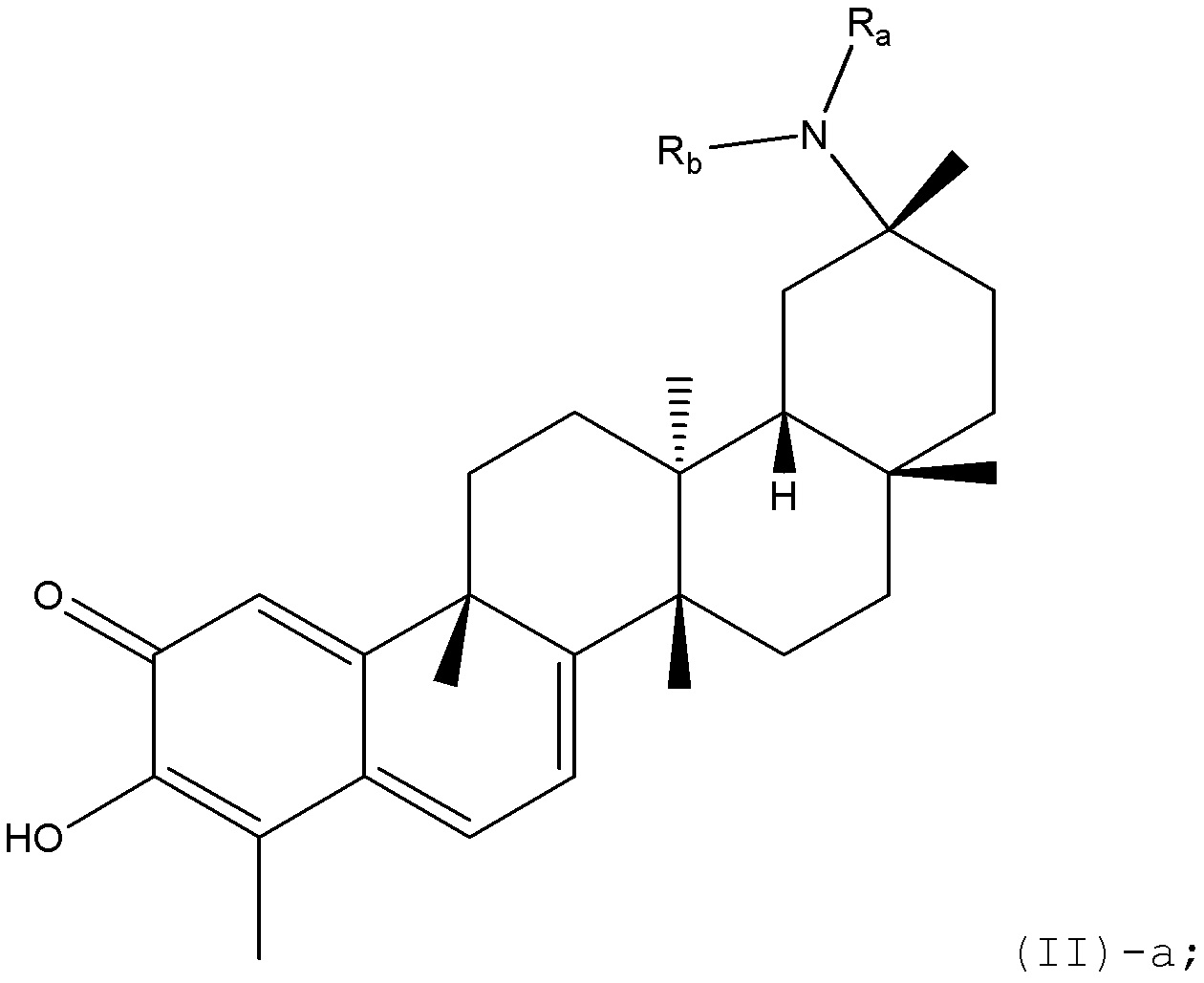
где каждый Ra или Rb определен в формуле (II).
В определенных вариантах, R1 является -NH(CO)R5, где R5 предпочтительно является алкилом, циклоалкилом или арилом, который может быть представлен в формуле (II)-b:
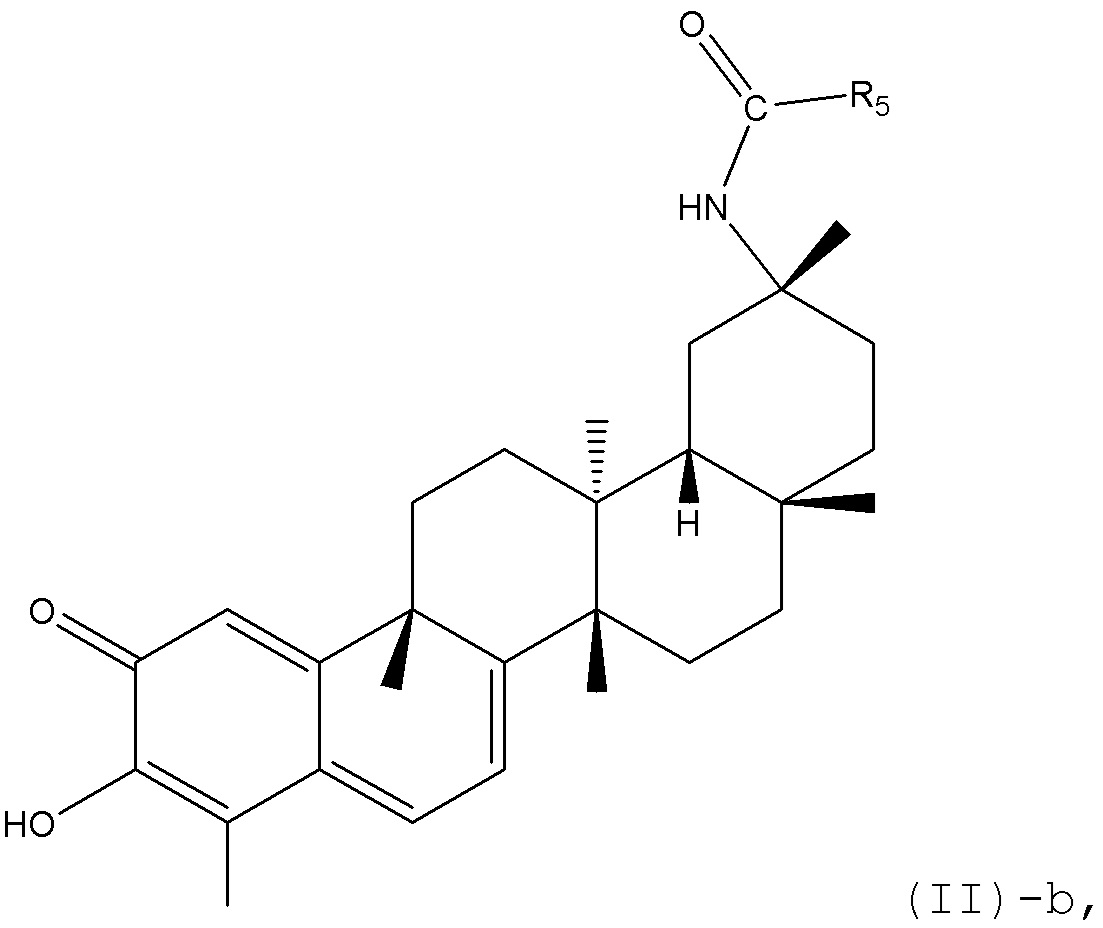
где каждый Ra или Rb определен в формуле (II).
Примеры соединений формулы (II) включают соединения, показанные ниже:
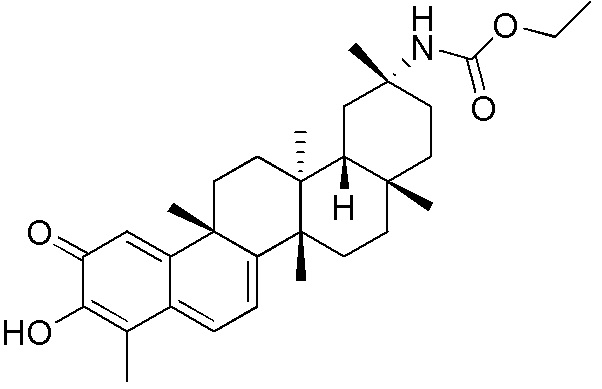
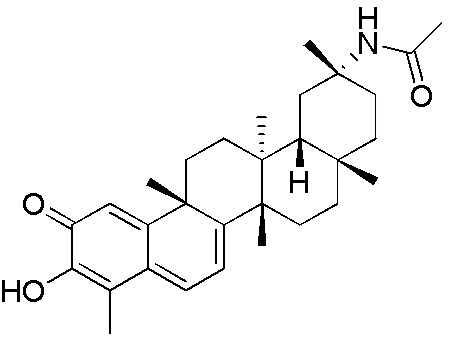
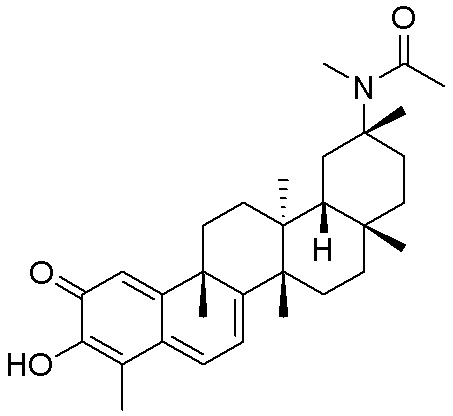
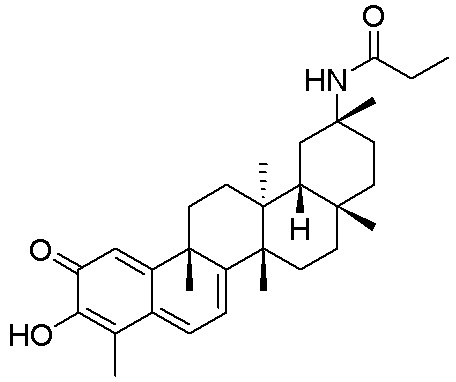
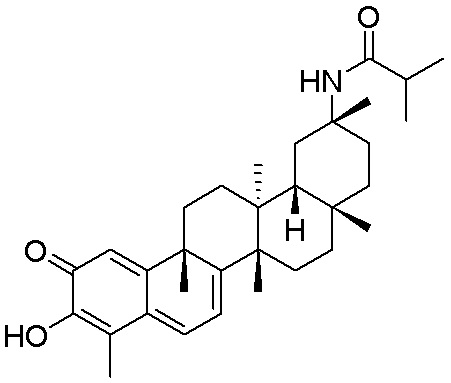
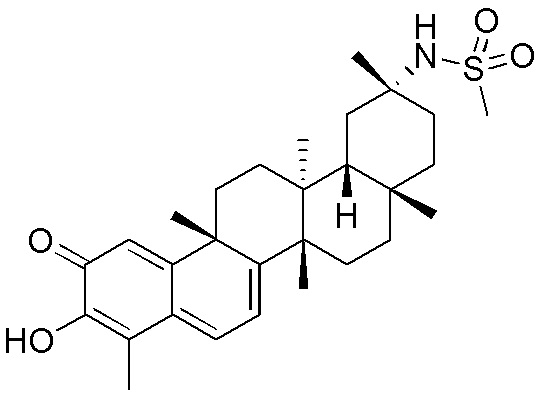
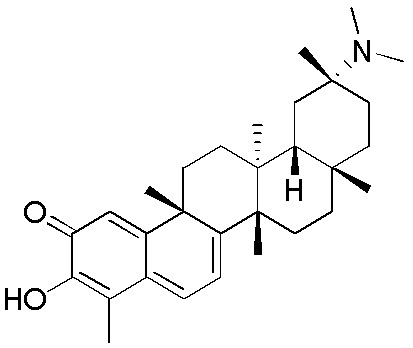
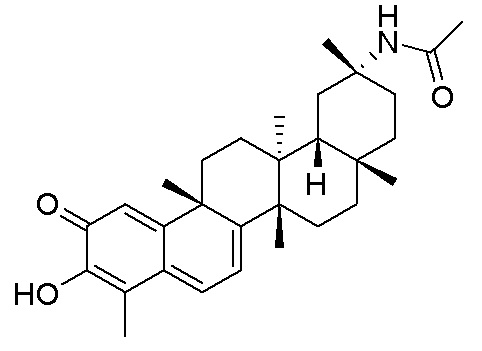
Соединения, описанные формулой (I) и формулой (II), могут быть получены с применением способов, известных в данной области техники и описанных здесь. Например, Целастрол может быть получен из коммерческих источников или выделен из растений, Tripterygium, способами, известными в данной области техники (Kutney et al, Can. J. Chem. 59:2677, 1981) и Zhang et al, Acta Pharm. Sin. 212: 592, 1986). Целастрол может быть модифицирован так, чтобы являться соединением формулы (I) или формулы (II). Полученные соединения очищают с применением обычных способов с получением соединений, не содержащих примеси. Полученные соединения на >75, >80, >85, >90, >95, >96, >97, >98, >99, >99,5% чистые. Необязательно, предпочтительные соединения являются на >99% чистыми.
Также представлены соединения формулы (I) и формулы (II), которые обладают свойствами для повышенной или практически повышенной пероральной биодоступности.
В некоторых вариантах, соединения формулы (I) и формулы (II) могут иметь большую или меньшую растворимость в воде, в водном растворе и/или физиологическом растворе, чем Целастрол, получаемый из коммерческих источников или выделяемый из растений. Например, соединения могут иметь растворимость в интервале от около 0,001 мкМ до около 150 мкМ, от 0,01 мкМ до около 100 мкМ, от 0,1 мкМ до около 100 мкМ, от 1 мкМ до около 100 мкМ, от 10 мкМ до около 100 мкМ, от 1 мкМ до около 50 мкМ, от 10 мкМ до около 50 мкМ, от 10 мкМ до около 80 мкМ, от 10 мкМ до около 25 мкМ, от 25 мкМ до около 50 мкМ, от 50 мкМ до около 100 мкМ, от 50 мкМ до около 75 мкМ, от 25 мкМ до около 75 мкМ, или растворимость, которая составляет, по крайней мере, около 0,1, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 мкМ, или растворимость менее, по крайней мере, около 0,1, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 мкМ в водном растворе (таком как физиологический раствор с фосфатным буфером (ФРФБ), например, при pH около 7, 7,1, 7,2, 7,3, 7,4, 7,5 или 7-8).
В некоторых вариантах, соединения формулы (I) и формулы (II) обладают повышенной или практически повышенной стабильностью или периодом полураспада в воде, водном растворе или физиологическом растворе. Например, соединения могут обладать практически повышенной стабильностью или резистентностью в различных условиях pH от 2 до 8 в верхней или средней частях желудочно-кишечного (ЖК) или пищеварительного трактов.
В некоторых вариантах, соединения формулы (I) и формулы (II) обладают повышенным или практически повышенным усвоением при введении субъекту. Например, соединения могут иметь значительно улучшенную проницаемость через биологические мембраны. Соединения могут демонстрировать подходящий баланс между гидрофобностью (липофильностью) и гидрофильностью с помощью локальных ионных зарядов.
В одном аспекте, композиции в соответствии с данным изобретением содержат, по крайней мере, одно соединение, обладающее пероральной эффективностью для лечения ожирения.
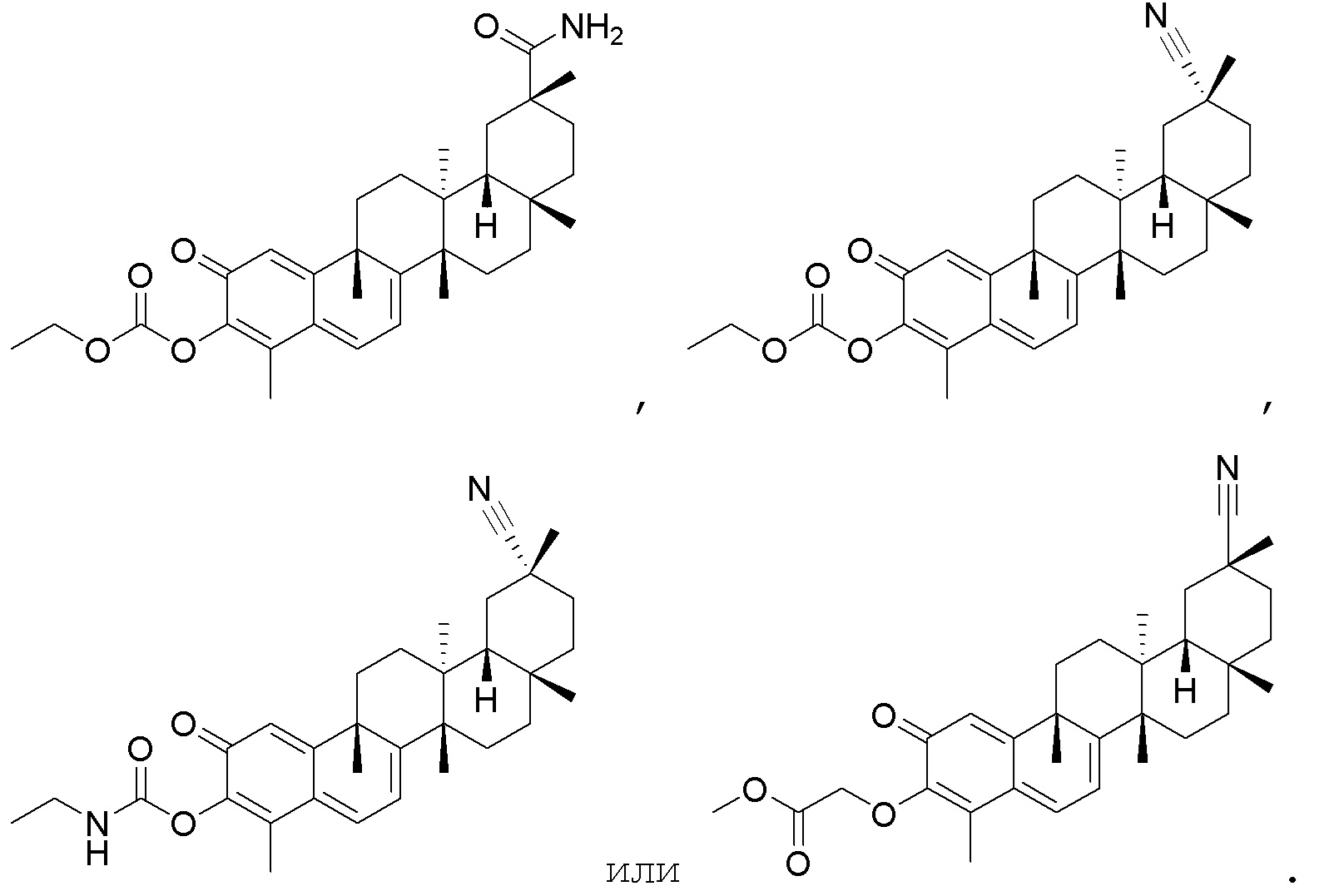
Типовые соединения, обладающие пероральной эффективностью для лечения ожирения, могут включать следующие соединения:
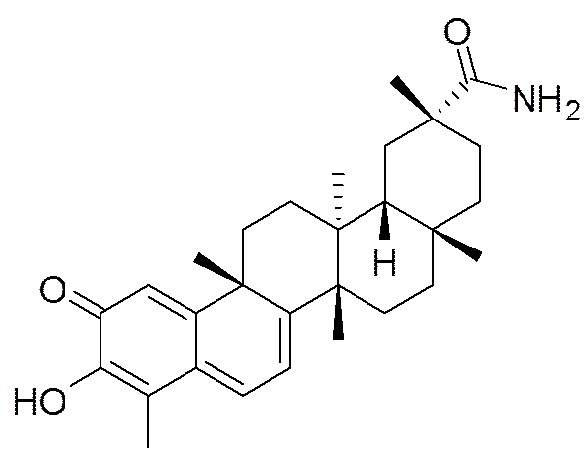
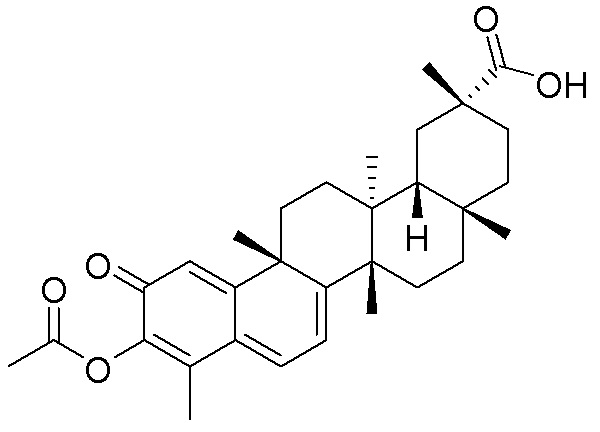
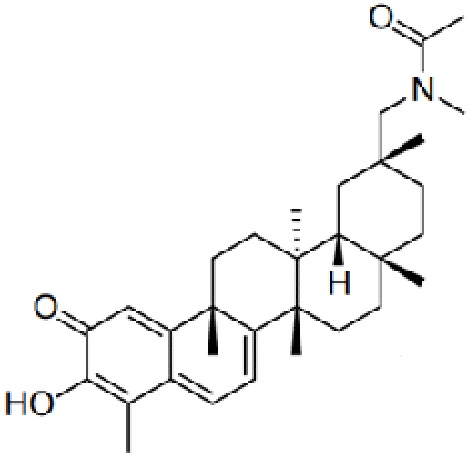
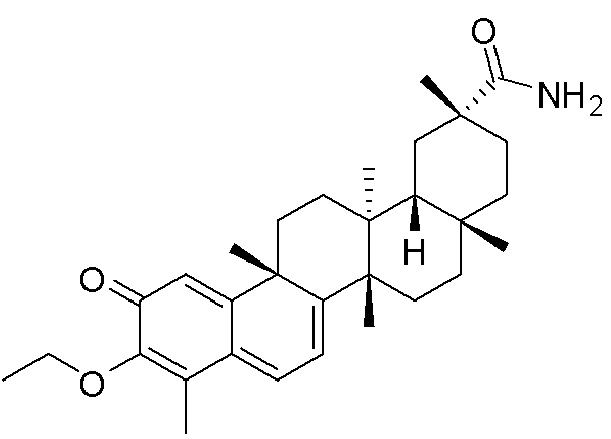
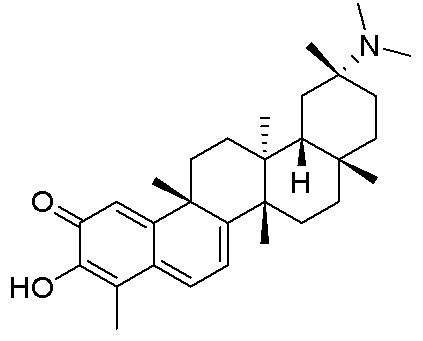
В другом аспекте, композиция содержит соединения, обладающие внутрибрюшинной эффективностью для лечения ожирения.
Примеры этих соединений, обладающих внутрибрюшинной эффективностью для лечения ожирения, включают следующие соединения:
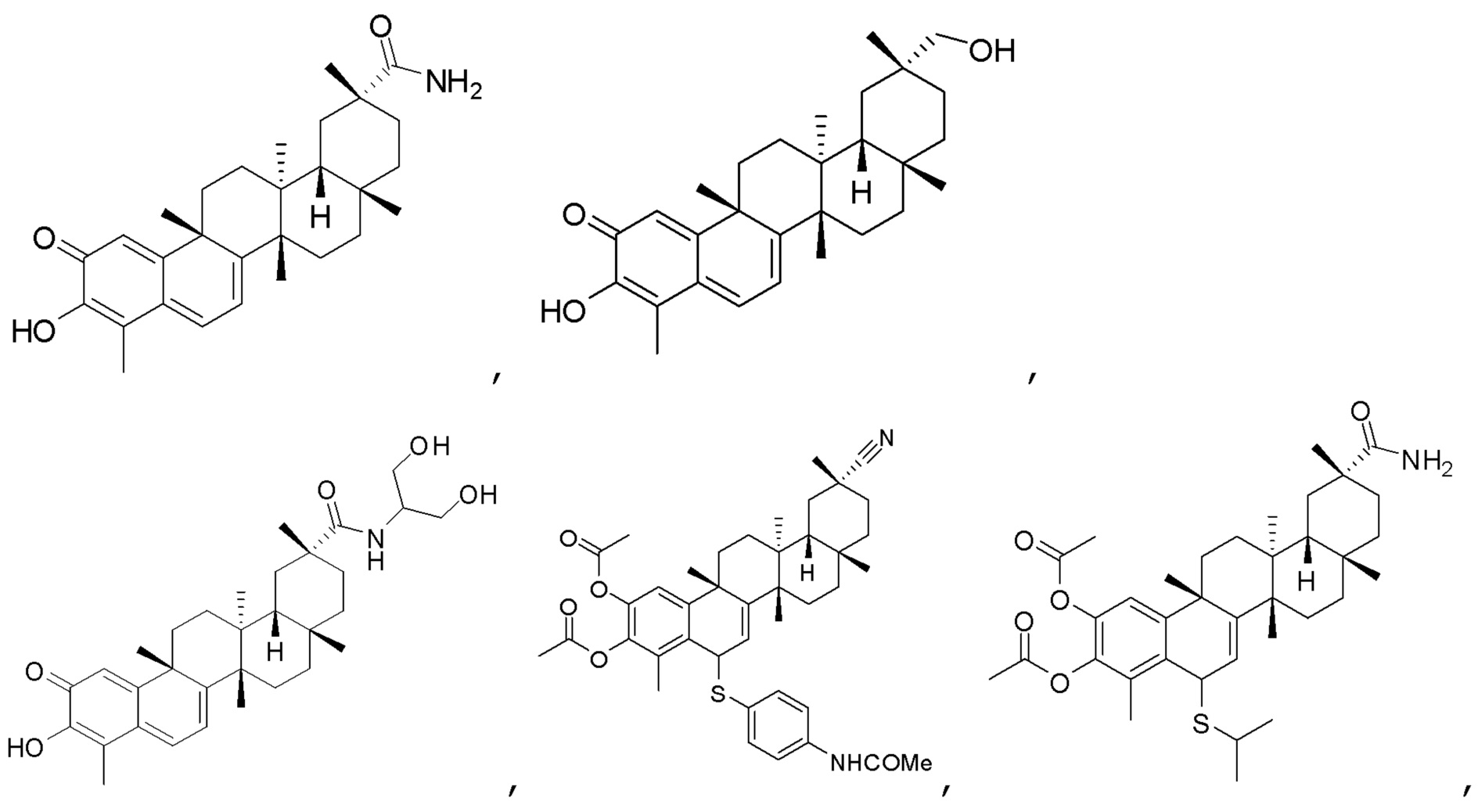
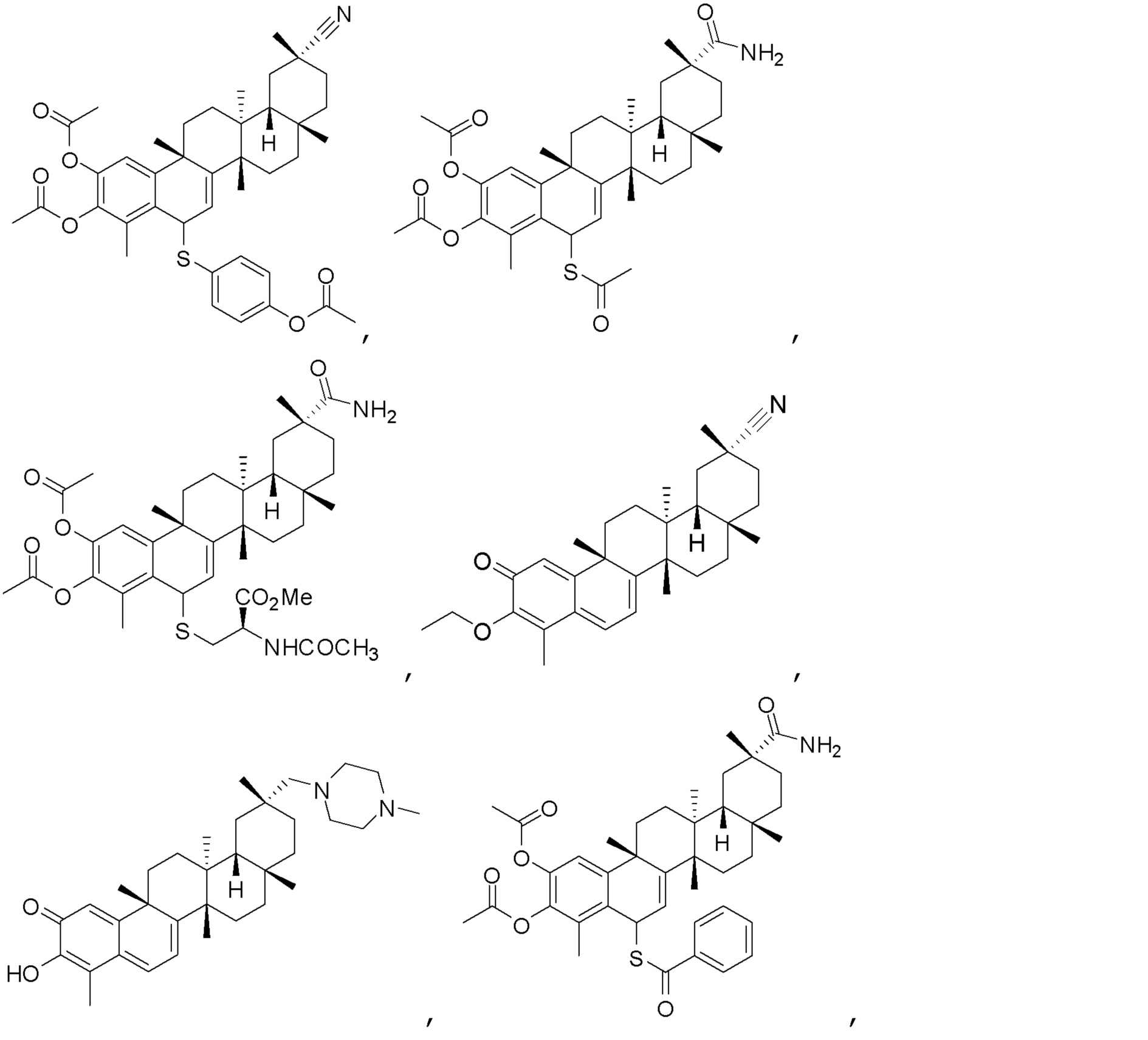
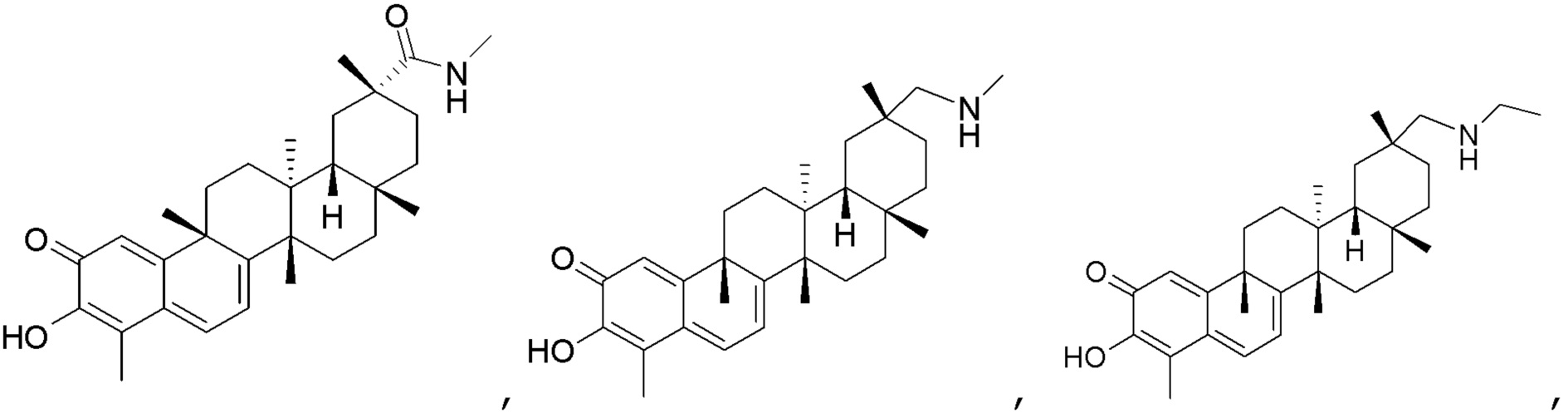
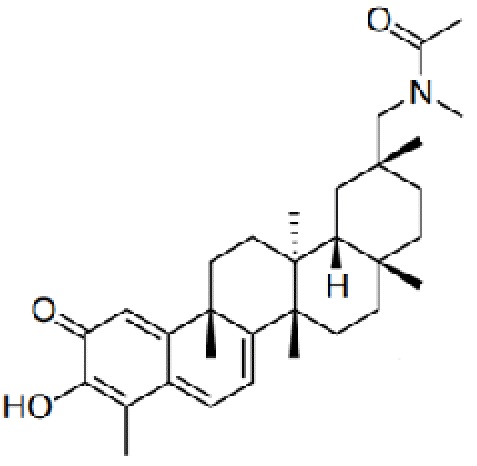
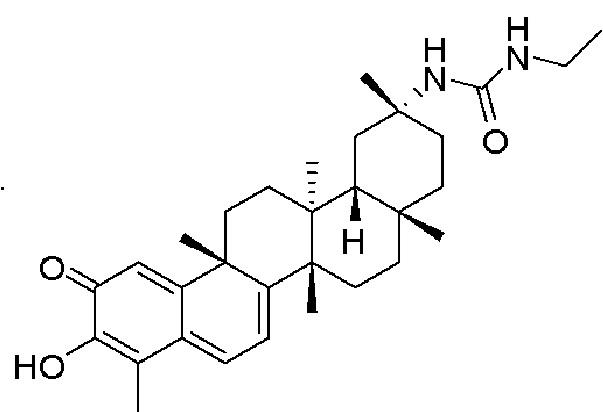
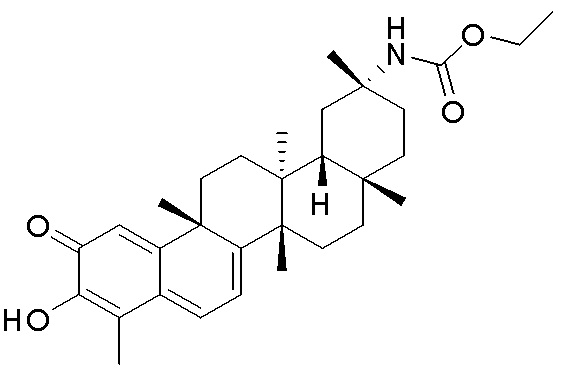
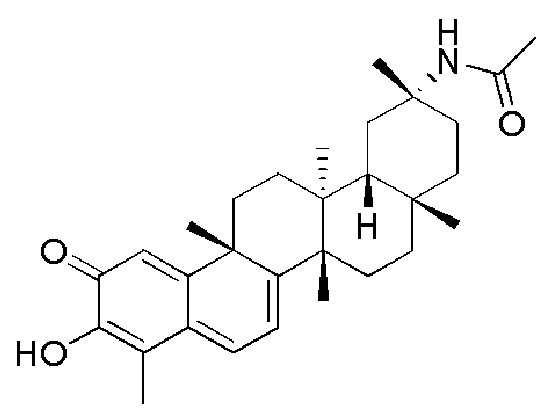
III. СПОСОБЫ ЛЕЧЕНИЯ И ДИАГНОСТИКИ
Описанные выше соединения могут применяться в лечении ожирения у субъекта, нуждающегося в таковом, которое включает введение субъекту эффективного количества соединений формулы е (I). Ожирение может быть первичной причиной заболевания и/или расстройства или может быть вызвано заболеванием и/или расстройством.
В некоторых случаях, эффективное количество соединения формулы (I) может вводиться как способ лечения увеличения массы тела у пациентов с предожирением, ожирением или морбидным ожирением.
В некоторых случаях, способ снижения телесного жира у пациентов с предожирением, ожирением или морбидным ожирением включает введение эффективного количества соединения формулы (I). Масса тела или телесный жир может быть снижен на около 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или 50%, около 5-10%, 5-25%, 10-25%, 10-50%, 25-50% или, по крайней мере, около 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или 50%.
В некоторых случаях, способ снижения поглощения пищи у пациентов с предожирением, ожирением или морбидным ожирением включает введение эффективного количества соединения формулы (I). Среднее суточное поглощение пищи (в калориях) может быть снижено на, по крайней мере, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50% или выше, или около 5-10%, 5-25%, 10-25%, 10-50%, 25-50%.
В некоторых случаях, эффективное количество соединения формулы (I) может вводиться для снижения индекса массы тела (ИМТ) пациента, страдающего ожирением. ИМТ пациента может быть понижен до значения <30 кг•м-2 (нормальный ИМТ=20-25 кг•м-2).
Наконец, способ улучшения гомеостаза глюкозы у пациентов с предожирением, ожирением или морбидным ожирением включает введение соединения формулы (I). Средние уровни глюкозы в крови натощак могут быть понижены на, по крайней мере, 10%, 12%, 15%, 18%, 20%, 25%, 30%, 35%, 40%, 45% или 50% или выше, или около 5-10%, 5-25%, 10-25%, 10-50%, 25-50%.
Ожирение
Ожирение является медицинским состоянием, при котором избыточный телесный жир аккумулируется до такой степени, что он может оказывать отрицательное действие на здоровье, что приводит к снижению средней продолжительности жизни и/или увеличению проблем со здоровьем (Haslam et al., Lancet (Review) 366 (9492): 1197-209, 2005). В Западных странах люди считаются ожиревшими, если их ИМТ, показатель, получаемый делением массы тела персоны на квадрат роста персоны, превышает 30 кг/м2, где интервал 25-30 кг/м2 определен как лишний вес. Ожирение увеличивает вероятность различных заболеваний, особенно сердечных заболеваний, диабета 2 типа, синдрома обструктивного апноэ во сне, определенных типов рака и остеоартрита (Haslam et al., Lancet (Review) 366 (9492): 1197-209, 2005). Ожирение наиболее часто вызывается сочетанием избыточного поглощения пищи, отсутствия физической активности и генетической предрасположенности, хотя некоторые причины вызваны, преимущественно, генами, эндокринными расстройствами, лекарственными средствами или психиатрическими заболеваниями. Доказательства того, что некоторые люди с ожирением едят немного, но увеличивают массу тела из-за медленного метаболизма, ограничены. В среднем, люди с ожирением имеют большие энергозатраты, чем худые люди из-за энергии, необходимой для поддержания повышенной массы тела (Kushner, Treatment of the Obese Patient, 2007).
Ожирение является медицинским состоянием, при котором избыточный телесный жир аккумулируется до такой степени, что он может оказывать неблагоприятное воздействие на здоровье. Определяют ИМТ, а также оценивают распределение жира через отношение талия/бедра и общие факторы сердечнососудистого риска (Sweeting et al., Nutr. J. 6 (1): 32, 2007). ИМТ тесно связан с процентом телесного жира и общего телесного жира (Gray et al., J. Clin. Epidemiol. 44 (6): 545-50, 1991).
ИМТ определен как масса тела пациента, деленная на квадрат его роста. ИМТ обычно выражается в килограммах на квадратный метр, исходя из того, что массу тела измеряют в килограммах и рост измеряют в метрах. Некоторые модификации определений были сделаны, когда в хирургической литературе разделили ожирение на несколько категорий, точные значения которых до сих пор обсуждаются (Sturm et al., Public Health 121 (7): 492-6, 2007). Любой ИМТ ≥35 или 40 кг/м2 означает тяжелое ожирение. ИМТ ≥35 кг/м2 и переносимые связанные с ожирением проблемы со здоровьем или ≥40-44,9 кг/м2 означает патологическое ожирение. ИМТ ≥45 или 50 кг/м2 означает суперожирение. Всемирная организация здравоохранения (ВОЗ) считает ИМТ менее 18,5 недостаточностью веса и он может означать недостаточность питания, расстройство питания иди другие проблемы со здоровьем, в то время как ИМТ равный или более 25 считается чрезмерным весом, и выше 30 считается ожирением (World Health Organization, Global Database on Body Mass Index (2006)). Краткая схема ВОЗ для классификации ИМТ представлена в таблице 1 ниже.
Таблица 1: Схема классификации индекса массы тела
Ожирение, связанное с повреждением гипоталамуса
Гипоталамическое ожирение является осложненным медицинским состоянием, которое может возникать при росте редких опухолей мозга и при других типах повреждения гипоталамуса. Краниофарингиома является одной из опухолей, которая вызывает ожирение, связанное с повреждением гипоталамуса. Повреждение гипоталамуса разрывает коммуникацию между кишечником и мозгом, что вызывает постоянное чувство голода.
Гипоталамус и гипофиз тесно интегрированы. Повреждение гипоталамуса будет влиять на восприимчивость и нормальное функционирование гипофиза. Гипоталамическое заболевание может вызвать недостаточность или ингибирование подачи сигнала в гипофиз, что приводит к дефициту одного или более следующих гормонов: тиреотропный гормон, адренокортикотропный гормон, бета-эндорфин, лютеинизирующий гормон, фолликулостимулирующий гормон и меланоцитстимулирующие гормоны. Лечение гипопитуитаризма включает гормонозаместительную терапию (Pinkney, Pituitary News 17, 2000).
Гормоны щитовидной железы отвечают за метаболическую активность. Недостаточное производство гормонов щитовидной железы вызывает подавление метаболической активности и увеличение веса. Гипоталамическое заболевание поэтому может иметь осложнения в виде ожирения (Pinkney, Pituitary News 17, 2000); (Ling, Trends in Obesity Research, 2004).
Стеатоз печени/НАСГ
Не алкогольная жировая болезнь печени (НАЖБП) является одной из причин стеатоза печени, возникающего при отложении жира (стеатозе) в печени из-за причин, отличных от избыточного потребления алкоголя. НАЖБП связана с резистентностью к инсулину и метаболическим синдромом, и может реагировать на лечение, изначальное разработанное для других инсулин-резистентных состояний (например, сахарного диабета 2 типа), такое как снижение веса, метформин и триазолидиндионы (Adams et al. Postgrad. Med. J. 82 (967): 315-22, 2006). Не алкогольный стеатогепатит (НАСГ) является наиболее крайней формой НАЖБП и считается основной причиной цирроза печени неизвестной этиологии (Clark et al. JAMA 289 (22):3000-4, 2003).
Большинство людей с НАЖБП имеют несколько или не имеют симптомов. Пациенты могут жаловаться на утомление, дискомфорт и тупые неприятные ощущения в правом верхнем квадрате живота. Может отмечаться умеренная желтуха, хотя и редко. Наиболее часто НАЖБП диагностируют в результате анализа аномального функционирования печени во время анализа крови. НАЖБП связана с резистентностью к инсулину и метаболическим синдромом (ожирение, объединенная гиперлипидемия, сахарный диабет (II типа) и высокое кровяное давление) (Adams et al. Postgrad. Med. J. 82 (967): 315-22, 2006).
Общее описание включает повышенные ферменты печени и ультразвук печени, показывающий стеатоз. Ультразвук также может применяться для исключения проблем с желчными камнями (холелитиаз). Биопсия печения (исследование ткани) является единственным анализом, общепринятым в качестве анализа, точно отделяющего НАСГ от других форм болезней печени, и он может применяться для оценки тяжести воспаления и результирующего фиброза (Adams et al. Postgrad. Med. J. 82 (967): 315-22, 2006).
Доступны другие диагностические анализы. Соответствующие анализы крови включают скорость оседания эритроцитов, глюкозу, альбумин и почечную функцию. Так как печень важна для производства белков, используемых для свертывания, часто проводят определенные исследования свертываемости, особенно МНИ (международный нормализационный индекс). Анализы крови (серология) обычно применяют для исключения вирусного гепатита (гепатита A, B, C и вирусов герпеса, таких как EBV или CMV), краснухи и аутоиммунных заболеваний. Гипотериоз наиболее распространен у пациентов с НАСГ, которых определяют через определение ТТГ (Liangpunsakul et al. J. Clin. Gastroenterol. 37(4):340-3, 2003).
Метаболический синдром
Метаболический синдром является расстройством утилизации и хранения энергии, диагностируемым при совместном проявлении трех их пяти следующих медицинских состояний: абдоминальное (центральное) ожирение, повышенное кровяное давление, повышенная глюкоза в плазме натощак, высокие триглицериды сыворотки и низкие уровни липопротеина высокой плотности (ЛПВП). Метаболический синдром повышает риск развития сердечнососудистого заболевания и диабета (Kaur, Cardiology Research и Practice, 2014) (Felizola, "Ursolic acid in experimental models и human subjects: potential as an anti-obesity/overweight treatment?" ResearchGate, 2015).
Основным признаком метаболического синдрома является центральное ожирение (также известное как висцеральное, по мужскому типу или яблочное ожирение), лишний вес, при котором жировая ткань аккумулируется в основном вокруг талии и торса. Другие признаки метаболического синдрома включают высокое кровяное давление, пониженный ЛПВП холестерин в сыворотке натощак, повышенный уровень триглицерида в сыворотке натощак (ЛПОНП триглицерид), ухудшенная глюкоза натощак, резистентность к инсулину или преддиабет. Связанные состояния включают гиперурикемию, стеатоз печени (особенно при сопровождающем ожирении), прогрессирующий до не алкогольной жировой болезни печени, синдром поликистозных яичников (у женщин), эректильная дисфункция (у мужчин) и акантокератодермия.
В объединенном промежуточном отчете целевой группы по эпидемиологии и профилактике Международной федерации диабета; Национального института болезней сердца, легких и крови; Американской ассоциации сердца; Всемирной федерации сердца; Международного общества атеросклероза; и Международной ассоциации по изучению ожирения опубликованы рекомендации по гармонизации определения метаболического синдрома (Alberti et al., Circulation 120 (16): 1640-5, 2009). Это определение признает, что риск, связанный с определенным измерением талии, отличается для разных групп населения.
Удар
Удар, также известный как острое нарушение мозгового кровообращения (CVA), цереброваскулярный инсульт (CVI) или инсульт, возникает при плохом токе крови в мозг, вызывающем смерть клеток. Существует два основных типа удара: ишемический, из-за отсутствия кровотока, и геморрагический, из-за кровотечения. Они частично приводят к тому, что мозг не функционирует правильно. Признаки и симптомы удара могут включать неспособность двигаться или чувствовать одной стороной тела, проблемы с пониманием и речью, ощущение вращения вокруг себя или потерю зрения с одной стороны среди прочего (Donnan et al., Lancet 371 (9624): 1612-23, 2008). Признаки и симптомы часто возникают после наступления удара. Если симптомы длится менее одного или двух часов, это называют преходящей ишемический атакой (ПИА). Геморрагические удары также могут быть связаны с сильной головной болью.
Основным фактором риска удара является высокое кровяное давление. Другие факторы риска включают курение табака, ожирение, высокий холестерин крови, сахарный диабет, предыдущие ПИА и фибрилляция предсердий, среди прочих (Donnan et al., Lancet 371 (9624): 1612-23, 2008). Ишемический удар обычно вызывается блокадой кровеносного сосуда. Геморрагический удар вызывается кровотечением либо непосредственно в мозг, либо в пространство, окружающее мозг. (Feigin et al., Stroke 36 (12): 2773-80, 2005). Кровотечение может возникать из-за аневризмы мозга. Диагноз обычно ставится по медицинским изображениям, таким как КТ скан или МРТ скан, вместе с физическим обследованием. Другие анализы, такие как электрокардиограмма (ЭКГ) и анализы крови проводят для определения факторов риска и исключения других возможных причин.
Удар диагностируют несколькими методами: неврологическое обследование (такое как NIHSS), КТ сканы (наиболее часто без контраста) или МРТ сканы, доплеросонография и артериография. Сам диагноз удар является клиническим, с помощью методов получения изображений. Методы получения изображений также помогают определить подтипы и причину удара. Все еще не существует общеприменимых анализов крови для диагностики самого удара, хотя анализы крови могут помочь в определении наиболее вероятной причины удара (Hill et al., Clin. Chem. 51 (11): 2001-2, 2005).
Сердечнососудистое заболевание
Сердечнососудистое заболевание (ССЗ) является классом заболеваний, которые вовлекают сердечные или кровеносные сосуды. Сердечнососудистое заболевание включает ишемическую болезнь сердца (ИБС), такую как стенокардия и инфаркт миокарда (известный как сердечный приступ) (Shanthi et al., Global Atlas on Cardiovascular Disease Prevention and Control 3-18, 2011). Другие ИБС включают удар, гипертензивную кардиопатию, ревмокардит, кардиомиопатию, фибрилляцию предсердий, врожденный порок сердца, эндокардит, аневризму аорты и заболевание периферических артерий.
Лежащие в основе механизмы варьируются в зависимости от рассматриваемого заболевания. Ишемическая болезнь сердца, удар и заболевание периферических артерий включают атеросклероз. Они могут быть вызваны высоким кровяным давлением, курением, диабетом, отсутствием упражнений, ожирением, высоким холестерином крови, плохим питанием и избыточным потреблением алкоголя, среди прочих. Высокое кровяное давление вызывает 13% смертей от ССЗ, табак вызывает 9%, диабет 6%, отсутствие упражнений 6% и ожирение 5%. Ревмокардит может возникнуть после нелеченной ангины (Shanthi et al., Global Atlas on Cardiovascular Disease Prevention and Control 3-18, 2011).
Стандартные анализы для сердечнососудистих заболеваний включают: коронарокальциноз, каротидная общая площадь тромбоцитов, повышенный липопротеин низкой плотности-p и повышенные уровни в крови мозгового натриуйретического пептида (также известного как B-тип) (BNP) (Bertazzo et al., Nat. Mat. 12, 576-583, 2013) (Inaba et al., Atherosclerosis 220 (1): 128-33, 2012) (J. Clin. Lipidol. Dec;1(6) 583-92, 2007) (Wang et al., N. Engl. J. Med. 350(7): 655-63, 2004).
Диабет
Сахарный диабет (СД), обычно называемый диабет, представляет группу метаболических заболеваний, при которых имеются высокие уровни сахара в крови в течение длительного периода. Симптомы высокого сахара в крови включают частое мочеиспускание, повышенную жажду и повышенный голод. Если его не лечить, диабет может вызвать множество осложнений (Diabetes Fact sheet N 312". WHO, 2013). Острые осложнения включают диабетический кетоацидоз и гиперосмолярную некетоацидотическую кому (Kitabchi, et al., Diabetes Care 32 (7): 1335-43, 2009). Серьезные долгосрочные осложнения включают сердечнососудистое заболевание, удар, хроническую почечную недостаточность, язвы ног и повреждение глаз.
Диабет возникает из-за того, что либо поджелудочная железа не производит достаточно инсулина, либо клетки тела не реагируют должным образом на произведенный инсулин (Shoback, Greenspan's Basic & Clinical Endocrinology (9th ed.) (2011)).
Сахарный диабет характеризуется рецидивирующим или постоянным высоким сахаром в крови, и его диагностируют через любой из следующих параметров: уровень глюкозы в крови натощак ≥7,0 ммоль/л (126 мг/дл); глюкоза в плазме ≥11,1 ммоль/л (200 мг/дл) через два часа после перорального введения 75 г глюкозы, как в пробе на переносимость глюкозы; симптомы высокого сахара крови и случайной глюкозы плазма ≥11,1 ммоль/л (200 мг/дл); и гликированный гемоглобин (HbA1C) ≥48 ммоль/моль (≥6,5 DCCT %) (National Diabetes Clearinghouse (NDIC): National Diabetes Statistics 2011" U.S. Department of Health и Human Services, 2011) (ʺDiabetes Careʺ American Diabetes Association, 2010).
Положительный результат, при отсутствии однозначного высокого сахара в крови, должен быть подтвержден повторением любого из указанных выше способов на другой день. Предпочтительно измерять уровень глюкозы натощак из-за простоты измерения и значительного времени подтверждения формальной пробы на переносимость глюкозы, которая занимает два часа для завершения и не предлагает преимущество прогнозирования, по сравнению с анализом натощак (Saydah et al., Diabetes Care 24 (8): 1397-402, 2001). Согласно текущему определению, два измерение глюкозы натощак выше 126 мг/дл (7,0 ммоль/л) считаются диагнозом сахарного диабета.
Согласно Всемирной организации здравоохранения, люби с уровнем глюкозы натощак от 6,1 до 6,9 ммоль/л (от 110 до 125 мг/дл) считаются имеющими ухудшенную глюкозу натощак; люди с глюкозой в плазме на уровне или выше 7,8 ммоль/л (140 мг/дл), но не достигающие 11,1 ммоль/л (200 мг/дл), через два часа после перорального введения 75 глюкозы считаются имеющими ухудшенную переносимость глюкозы (Definition и diagnosis of diabetes mellitus и intermediate hyperglycemia: report of a WHO/IDF consultation. World Health Organization p. 21, 2006). Из этих двух предсказуемых состояний, последнее особенно является основным фактором риска развития резко выраженного сахарного диабета, а также сердечнососудистого заболевания. Американская ассоциация диабета с 2003 года использует немного другой интервал ухудшенной глюкозы натощак, от 5,6 до 6,9 ммоль/л (100 to 125 мг/дл) (Bartoli et al., Eur. J. Int. Med. 22 (1): 8-12, 2011). Гликированный гемоглобин лучше, чем глюкоза натощак, подходит для определения риска сердечнососудистого заболевания и смерти по любой причине (Selvin et al
Редкое заболевание, несахарный диабет, имеет похожие симптомы с сахарным диабетом, но без нарушений метаболизма сахара (несахарный означает "без вкуса" на латыни) и не включает те же механизмы заболевания. Диабет является частью более широкого состояния, известного как метаболический синдром.
Гипертония
Гипертонию диагностируют на основе постоянного высокого кровяного давления. Традиционно, Национальный институт охраны здоровья и совершенствования медицинской помощи рекомендует три отдельных сфигноманометрических измерения с месячными интервалами. Американская ассоциация сердца рекомендует, по крайней мере, три измерения в, по крайней мере, два отдельных профилактических визита (Aronow et al., J. Am. Soc. Hypertension: JASH 5 (4): 259-352, 2011). Исключениями являются те, у которых отмечают очень высокое кровяное давление, особенно при плохом функционировании органов. Исходная оценка людей с гипертонией должна включать полную историю и физическое обследование. При доступности 24-часового амбулаторного мониторинга кровяного давления и домашних аппаратов для измерения кровяного давления, важно не поставить неверный диагноз тем, которые страдают смотровой гипертензией, что может привести к изменению протоколов. В Соединенном Королевстве наилучшей текущей практикой считается следовать однократному повышенному клиническому показанию при амбулаторном измерении или, менее предпочтительно, при мониторинге домашним прибором для измерения кровяного давления в течение 7 дней. Псевдогипертония у пожилых людей или синдром не сжимаемости артерий может также потребовать рассмотрения. Полагают, что это состояние возникает из-за кальциноза артерий, что вызывает аномально высокие показатели кровяного давления пневматической манжетой, хотя внутриартериальные измерения кровяного давления являются нормальными (Franklin et al., Hypertension 59 (2): 173-8, 2012). Ортостатическая гипертония возникает, когда кровяное давление повышается в положении стоя.
Гиперлипидемия
Гиперлипидемия включает аномально повышение уровни любого или всех жиров и/или липопротеинов в крови (Dorland's Medical Dictionary for Health Consumers, 2007). Она является наиболее распространенной формой дислипидемии (которая включает любые аномальные уровни жиров). Жиры (жирорастворимые молекулы) переносятся в белковой капсуле. Размер этой капсулы или липопротеина определяет ее плотность. Плотность липопротеина и тип аполипопротеинов, которые она содержит, определяет метаболический путь частицы и ее влияние на метаболизм.
Гиперлипидемии поделены на первичные и вторичные подтипы. Первичная гиперлипидемия обычно возникает из-за генетических причин (таких как мутация рецепторного белка), а вторичная гиперлипидемия возникает из-за других базовых причин, таких как диабет. Аномалии жира и липопротеина широко распространены среди населения и считаются устранимым фактором риска сердечнососудистого заболевания из-за их влияния на атеросклероз. Кроме того, некоторые формы могут предрасполагать к панкреатиту.
Гиперлипидемия является группой расстройств, характеризуемых избытком холестерина в сыворотке, особенно избытком Х-ЛПНП и/или избытком триглицеридов. Гиперхолестеринемия обычно проходит без симптомов. Гипертриглицеридемия обычно проходит без симптомов до тех пор, пока уровни триглицерида не установятся на уровне выше 1000 мг/дл - тогда симптомы включают дерматологические проявления, такие как ксантомы, проявляющиеся сыпью, и желудочно-кишечными проявлениями, такими как панкреатит. Гиперлипидемии наиболее часто определены генетически, но могут быть вызваны или усилены аномальным питанием, лекарственными средствами и определенными болезненными состояниями. Лекарственные средства, вызывающие гиперлипидемии, включают: иммуносупрессивную терапию, тиазидные диуретики, прогестины, ретиноиды, анаболические стероиды, глюкокортикоиды, ингибиторы протеазы ВИЧ, алкоголь, ретиноевую кислоту и бета-блокаторы. Заболевания, связанные с вторичными гиперлипидемиями включают: сахарный диабет (I и II типа), гипотиреоз, синдром Кушинга, хроническое заболевание почек, нефротический синдром и холестатические расстройства. Гиперлипидемия является основным устранимым фактором риска атеросклероза и сердечнососудистого заболевания, включая ишемическую болезнь сердца (Dorland's Medical Dictionary for Health Consumers, 2007).
Синдром Прадера-Вилли
Синдром Прадера-Вилли поражает приблизительно от 1 из 10000 до 1 из 25000 новорожденных (Killeen, Principles of Molecular Pathology 2004). Существует более 400000 людей, живущих с синдромом Прадера-Вилли во всем мире (Tweed, AOL Health, September 2009). Он традиционно характеризуется гипотонией, низким ростом, гиперфагией, ожирением, поведенческими расстройствами (особенно, ОКС-подобным поведением), маленькими руками и ногами, гипогонадизмом и умеренной умственной отсталостью (Killeen, Principles of Molecular Pathology 2004). Как и аутизм, синдром Прадера-Вилли является спектральным расстройством, и симптомы могут варьироваться от умеренных до тяжелых и могут меняться в течение жизни пациента.
Традиционно, синдром Прадера-Вилли диагностируют по клинической картине. В настоящее время синдром диагностируют с помощью генетического анализа; анализ рекомендован для новорожденных с выраженной гипотонией. Ранняя диагностика синдрома Прадера-Вилли позволяет ранее вмешательство. Основой диагноза является генетический анализ, особенно анализ метилирования на основе ДНК, для определения отсутствия полученной от родителей области синдрома Прадера-Вилли/синдрома Ангельмана (PWS/AS) на хромосоме 15q11-q13. Такой анализ определяет более 97% случаев. Специфический к метилированию анализ важен для подтверждения диагноза СПВ у всех пациентов, но особенно у тех, которые слишком малы для того, чтобы демонстрировать характеристики, достаточные для постановки диагноза в клинике, или которые имеют атипичные результаты (Buiting et al., Nat. Genet. 9(4):395-400, 1995).
Синдром Барде-Бидля
Синдром Барде-Бидля (СББ) является цилиопатическим генетическим расстройством человека и, которое вызывает множество эффектов и аффектов множества систем тела. Он характеризуется главным образом ожирением, пигментной дистрофией сетчатки, полидактилией, гипогонадизмом и почечной недостаточностью в некоторых случаях (Beales et al., J. Med. Genet. 36(6):437-46, 1999).
Синдром Барде-Бидля является плеотропным расстройством с различной экспрессивностью и широким спектром клинической вариабельности, наблюдаемой внутри и между семьями. Основными клиническими признаками являются колбочко-палочковая дистрофия, при возникающей в детстве потере зрения, предваряемой куриной слепотой; заднеаксиальная полидактилия; туловищное ожирение, которое проявляется во время младенчества и остается проблематичным в течение взросления; определенные расстройства обучаемости у некоторых, но не всех, личностей; гипогонадизм у мужчин и комплексные мочеполовые деформации у женщин; и почечная дисфункция, основная причина заболеваемости и смертности. Существует множество вторичных характеристик, которые иногда связаны с СББ, включая: расстройство/замедление речи, косоглазие/катаракта/астигматизм, брахидактилия/синдактилия рук и ног, частичная синдактилия (наиболее часто между вторым и третьим пальцами), задержка развития, полиурия/полидипсия (нефрогенный несахарный диабет), атаксия/плохая координация/дисбаланс, умеренная гипертония (особенно нижних конечностей), сахарный диабет, скученность зубов/гиподонтия/маленький зубной корень; высокое куполообразное небо, сердечнососудистые аномалии, вовлечение печени, аносмия, дефицит слуха и болезнь Гиршпрунга (Ross et al. The Clinical, Molecular, и Functional Genetics of Bardet-Biedl Syndrome, in Genetics of Obesity Syndromes, 2008).
Синдром Коэна
Полагают, что этот синдром является генетической мутацией в хромосоме 8 в локусе 8q22 гена COH1 (Kolehmainen et al, Am. J. Hum. Genet. 72(6):1359-69, 2003). Синдром Коэна имеет несколько характеристик, таких как ожирение, умственная отсталость и черепно-лицевая дизморфия. Он имеет аутосомно-рецессивную передачу с вариабельной экспрессией (Kivitie-Kallio et al. Am. J. Med. Genet. 102(2):125-35, 2001).
Синдром Коэна диагностируют при клиническом обследовании, но часто постановка диагноза затрудняется вариабельностью экспрессии. Осложнения на глаза, хотя и являются редкими, перечислены как атрофия зрительного нерва, офтальмомикрия, пигментный хориоретинит, дневная слепота (снижение зрения при ярком свете), миопия, косоглазие, нистагм и колобома радужной оболочки/сетчатки. Общий внешний вид характеризуется ожирением с тонкими/удлиненными руками и ногами. Часто встречаются микрогнатия, короткий губной желобок и небо с высоким сводом. Различная умственная отсталость с периодическими судорогами и глухотой также являются характеристиками синдрома Коэна.
Синдром МОМО
Синдром МОМО является крайне редким генетическим расстройством, которое принадлежит к гипертрофиям и диагностируется только в шести случаях по всему миру, и возникает при 1 из 100 миллионов родов. Наименование является акронимом четырех первичных аспектов расстройства: макросомия (избыточный вес при рождении), ожирение, макроцефалия (избыточный размер головы) и глазные аномалии (Moretti-Ferreira et al. Am. J. Med. Genet. 46(5):555-8, 1993). Также имеются общие симптомы: покатый лоб, замедленное созревание костей, умственная отсталость. Глазные аномалии в основном включают колобому сетчатки и нистагм.
Рак
Рак, также известный как злокачественное образование, злокачественное новообразование и злокачественна опухоль, является группой заболеваний, включающих аномальный рост клеток с потенциальным вторжением или распространением на другие части тела (Cancer Fact sheet N 297. World Health Organization. February 2014; Defining Cancer. National Cancer Institute. 2014). Не все опухоли являются раковыми, так как доброкачественные опухоли не распространяются (Defining Cancer. National Cancer Institute. 2014). Возможные признаки и симптомы включают: новые шишечки, аномальное кровотечение, длительный кашель, необъяснимую потерю массы тела и изменение кишечной перистальтики среди прочих (Cancer - Signs и symptoms. NHS Choices. 2014). Хотя эти симптомы могут означать рак, они также возникают по другим причинам (Cancer - Signs и symptoms. NHS Choices. 2014). Существует более 100 различных известных раков, которые поражают человека (Defining Cancer. National Cancer Institute. 2014). Раки являются большим семейством заболеваний, которые включают аномальный рост клеток с потенциальным вторжением или распространением на другие части тела (Cancer Fact sheet N 297. World Health Organization. February 2014; Defining Cancer. National Cancer Institute. 2014). Новообразование или опухоль является группой клеток, которые перенесли нерегулируемый рост, и часто образуют массу или шишечку, но могут распространяться диффузно (Cancer Glossary. cancer.org. American Cancer Society. 2013; What is cancer? cancer. gov. National Cancer Institute,2013). Предложенные характеристики рака включают: 1) интенсивность сигналов анти-роста; 2) самодостаточность в подаче сигналов роста; 3) вызывание и устойчивость ангиогенеза; 4) уклонение апоптоза; 5) активация беспредельного репликативного потенциала; и 6) активация метастазов и инвазии в ткани (Hanahan, Douglas; Weinberg, Robert A. (January 7, 2000). "The hallmarks of cancer". Cell 100 (1): 57-70). Злокачественное развитие является многостадийным процессом, который превращает нормальные клетки в клетки, которые образуют видимую массу до рака (Hanahan, Douglas; Weinberg, Robert A. (January 7, 2000). "The hallmarks of cancer". Cell 100 (1): 57-70; Hanahan, Douglas; Weinberg, Robert A. (2011). "Hallmarks of Cancer: The Next Generation". Cell 144 (5): 646-74).
Рак является заболеванием отказа регулирования роста ткани. Гены, которые регулируют рост и дифференциацию клеток, должны быть изменены для того, чтобы нормальные клетки стали раковыми (Croce CM (January 2008). "Oncogenes and cancer". N. Engl. J. Med. 358 (5): 502-11). Пораженные гены делят на две широких категории - гены-супрессоры опухолевого роста и онкогены. Гены-супрессоры опухолевого роста ингибируют деление и выживание клеток. Онкогены способствуют росту и репродукции клеток. Гены-супрессоры опухолевого роста являются генами, которые ингибируют деление и выживание клеток. Злокачественная трансформация может происходить через: пониженную экспрессию или повреждение генов-супрессоров опухолевого роста, неправильную сверхэкспрессию нормальных онкогенов или образование новых онкогенов (Knudson AG (November 2001). "Two genetic hits (more or less) to cancer". Nature Reviews Cancer 1 (2): 157-62). Рак управляется прогрессирующими генетическими аномалиями, которые включают мутации в онкогенах, хромосомные аномалии в генах-супрессорах опухолевого роста и эпигенетическими изменениями (Baylin SB, Ohm JE (February 2006). "Epigenetic gene silencing in cancer - a mechanism for early oncogenic pathway addiction?". Nature Reviews Cancer 6 (2): 107-16).
Большинство раков изначально распознаются или благодаря появлению признаков или симптомов, или благодаря скринингу. Заключительный диагноз требует исследования образца ткани патологом. Пациентам с предполагаемым раком проводят диагностические анализы, которые включают КТ, анализы крови, эндоскопию и рентген.
Злокачественные раки, которые лечат способами и композициями, описанными здесь, включают рак желудка, множественную миелому, лейкоз, лимфому, печеночно-клеточную карциному, карциному клеток почек, рак простаты, рак мозга, глиобластому, меланому, рак молочной железы, рак головы и шеи и не мелкоклеточную карциному легких.
Глиобластома, также известная как мультиформная глиобластома (МГБ) и атроцитома IV степени, является наиболее частой и наиболее агрессивной злокачественной первичной опухолью мозга. Она включает глиальные клетки и составляет 52% всех случаев опухолей тканей мозга и 20% всех опухолей внутри черепа ("Glioblastoma and Malignant Astrocytoma". American Brain Tumour Association (ABTA) 2014). Около 50% людей, у которых диагностировали МГБ, умирают в течение года, в то время как 90% в течение трех лет. Лечение может включать химиотерапию, радиацию и хирургию. Средняя выживаемость при стандартной радиации и химиотерапии темозоломидом составляет 15 месяцев (Johnson, Derek R.; O'Neill, Brian Patrick (2011). "Glioblastoma survival in the United States before and during the temozolomide era". Journal of Neuro-Oncology 107 (2): 359-64). Средняя выживаемость без лечения составляет 4½ месяцев. Хотя никакие рандомизированные контролируемые испытания не проводились, хирургия остается стандартным методом лечения (Van Meir, E. G.; Hadjipanayis, C. G.; Norden, A. D.; Shu, H. K.; Wen, P. Y.; Olson, J. J. (2010). "Exciting New Advances in Neuro-Oncology: The Avenue to a Cure for Malignant Glioma". CA: A Cancer Journal for Clinicians 60 (3): 166-93).
Хотя общие симптомы заболевания включат судороги, тошноту и рвоту, головную боль, потерю памяти и гемипарез, отдельным наиболее преобладающим симптомом является прогрессирующий дефицит памяти, личности и неврологии из-за вовлечения височной и лобной долей. Тип получаемых симптомов в высокой степени зависит от расположения опухоли, больше чем от ее патологических свойств. Опухоль может начать проявлять симптомы быстро, но в отдельных случаях является бессимптомным состоянием до тех пор, пока не достигает аномального размера.
При рассматривании на МРТ, глиобластомы часто проявляются как очаги с увеличивающимися кольцами. Внешний вид не является специфическим, однако, так как другие очаги, такие как абсцесс, метастазы, опухолеподобный рассеянный склероз и другие случаи могут иметь похожий внешний вид (Smirniotopoulos, J. G.; Murphy, F. M.; Rushing, E. J.; Rees, J. H.; Schroeder, J. W. (2007). "From the Archives of the AFIP: Patterns of Contrast Enhancement in the Brain and Meninges". Radiographics 27 (2): 525-51). Заключительный диагноз предполагаемой МГБ по КТ и МРТ требует стереотактической биопсии или краниотомию с резекцией опухоли и подтверждением патологии. Так как степень опухоли основывается на большей злокачественной части опухоли, биопсия или промежуточная резекция опухоли может неполноценную оценку очага. Получение изображений кровотока опухоли с применением перфузионной МРТ и измерение концентрации метаболита опухоли МР спектроскопией дополняет стандартную МРТ при диагностике глиобластомы, показывая повышенный относительный объем церебральной крови и повышенный холиновый пик, соответственно, но патология остается золотым стандартом (Weerakkody, Yuranga; Gaillard, Frank. "Glioblastoma". Radiopaedia.org. 2014).
Диагностика глиобластомы зависит от различения первичной глиобластомы от вторичной глиобластомы. Эти опухоли возникают спонтанно (вновь) или развивается из глиомы низшей степени, соответственно (Bleeker, FE; Molenaar, RJ; Leenstra, S (May 2012). "Recent advances in the molecular understanding of glioblastoma.". Journal of neuro-oncology 108 (1): 11-27). Первичные глиобластомы имеют худший прогноз, различная биология опухоли может давать различную реакцию на терапию, что делает ее критической оценкой для определения прогноза и терапии для пациента (Weerakkody, Yuranga; Gaillard, Frank. "Glioblastoma". Radiopaedia.org 2014). Более 80% вторичных глиобластом имеют мутацию в IDH1, в то время как эта мутация является редкой в первичной глиобластоме (5-10%). Таким образом, мутации IDH1 могут стать полезным инструментом для разделения первичной и вторичной глиобластом в будущем, так как гистопатологически они очень близки и распознавание без молекулярных биомаркеров ненадежно (The driver и passenger effects of isocitrate dehydrogenase 1 and 2 mutations in oncogenesis and survival prolongation.". Biochim Biophys Acta 1846 (2): 326-41. Dec 2014).
IV. ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
Агенты для потери массы тела, описанные выше, могут быть составлены в фармацевтические композиции, подходящие для применения в представленных способах. Такие композиции включают активный агент (соединения формулы (I)) вместе с фармацевтически приемлемым носителем или разбавителем.
В некоторых случаях фармацевтическая композиция включает соединения формулы (I), его фармацевтически приемлемую соль или пролекарство в сочетании с одним или более фармацевтически приемлемыми наполнителями.
В некоторых случаях фармацевтическую композицию, содержащую соединения формулы (I), вводят перорально, и она демонстрирует более высокую биодоступность по сравнению с Целастролом. Пероральная биодоступность может быть, по крайней мере, 1%, 2%, 3%, 4%, 5%, 10%, 15%, 20%, 30%, 40%, 50%, 60%, 80%, 90% или 95% или выше по сравнению с Целастролом. Более того, пероральная биодоступность может быть, по крайней мере, на 1%, 2%, 3%, 4%, 5%, 7%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 95% выше по сравнению с внутривенной биодоступностью соединения формулы (I), и/или, по крайней мере, 1%, 2%, 3%, 4%, 5%, 7%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 60%, 70%, 80%, 90% или 95% от уровня биодоступности, если соединение вводят внутривенно.
Представленные здесь фармацевтические композиции включают композиции, где активный ингредиент содержится в терапевтически эффективном количестве, т.е., в количестве, эффективном для достижения предполагаемой цели. действительное количество, эффективное для конкретного применения, будет зависеть, кроме прочего, от лечимого состояния. При введении в способах лечения заболевания, такие композиции будут содержать количество активного ингредиента, эффективное для достижения желаемого результата, например, потери массы тела. Определение терапевтически эффективного количества соединений находится в компетенции специалиста в данной области техники, особенно в свете представленного подробного описания.
Фармацевтически приемлемые соли могут быть получены взаимодействием свободной кислоты или основания соединения, описанного выше, со стехиометрическим количеством подходящего основания или кислоты в воде, в органическом растворителе или в их смеси. Списки подходящих солей представлены в Remington's Pharmaceutical Sciences, 20th ed., Lippincott Williams & Wilkins, Baltimore, MD, 2000, p. 704; и Handbook of Pharmaceutical salts; Properties, Selection, and Use, P. Heinrich Stahl and Camille G. Wermuth, Eds., Wiley-VCH, Weinheim, 2002.
Агент для потери массы тела также может быть фармацевтически приемлемым пролекарством любого из описанных выше соединений. Пролекарствами являются соединения, которые, при метаболизме in vivo, превращаются в соединения, имеющие желаемую фармакологическую активность. Пролекарства могут быть получены замещение подходящих функциональных групп, присутствующих в соединениях, описанных выше, ʺпро-частямиʺ как описано, например, в H. Bundgaar, Design of Prodrugs (1985). Примеры пролекарств включают производные сложного эфира, простого эфира или амида соединения, описанного выше. Дальнейшее описание пролекарств представлено в Rautio, J. et al. Nat. Rev. Drug Disc. 7:255-270, 2008.
Для получения фармацевтических композиций из описанных здесь соединений, фармацевтически приемлемые носители могут быть твердыми или жидкими. Препараты твердой формы включают порошки, таблетки, пилюли, капсулы, крахмальные капсулы, суппозитории и диспергируемые гранулы. Твердым носителем может быть одно или более веществ, которые также могут быть разбавителями, вкусовыми добавками, связующими агентами, консервантами, разрыхляющими агентами или инкапсулирующим материалом.
В порошках носителем является тонкоизмельченное твердое вещество в смеси с тонкоизмельченным активным компонентом (например, представленным здесь соединением). В таблетках, активный компонент смешивают с носителем, имеющим необходимые связующие свойства в подходящих пропорциях, и прессуют в желаемые форму и размер. Порошки и таблетки предпочтительно содержат от 5% до 70% активного соединения.
Подходящие твердые наполнители включают, но не ограничены ими, карбонат магния; стеарат магния; тальк; пектин; декстрин; крахмал; трагакант; низкоплавкий воск; масло какао; углеводороды; сахара, включающие, но не ограниченные ими, лактозу, сахарозу, маннит или сорбит, крахмал из кукурузы, пшеницы, риса, картофеля или других растений; целлюлозу, такую как метилцеллюлоза, гидроксипропилметилцеллюлоза или карбоксиметилцеллюлоза натрия; и камеди, включая аравийскую и трагакант; а также белки, включая, но не ограничиваясь ими, желатин и коллаген. При желании, могут быть добавлены разрыхляющие или солюбилизирующие агенты, такие как поперечно-сшитый поливинилпирролидон, агар, альгиновая кислота или ее соль, такая как альгинат натрия.
Сердцевины драже покрывают подходящим покрытием, таким как концентрированные растворы сахара, которые также могут содержать аравийскую камедь, тальк, поливинипирролидон, карбомер гель, полиэтиленгликоль и/или двуокись титана, лакирующие растворы и подходящие органические растворители или смеси растворителей. Красители или пигменты могут быть добавлены в покрытия для таблеток или драже для идентификации продукта или для указания количества активного соединения (т.е., дозы). Фармацевтические препараты также могут применяться перорально, с помощью, например, твердых капсул из желатина, а также мягких, герметичных капсул из желатина и покрытия, такого как глицерин или сорбит.
Для получения суппозиториев низкоплавкий воск, такой как смесь глицеридов жирной кислоты или масло какао, сначала плавят, и активный компонент гомогенно диспергируют в нем, например, перемешиванием. Расплавленную гомогенную смесь затем выливают в формы удобного размера и охлаждают до отверждения.
Жидкие препараты включают растворы, суспензии и эмульсии, например, растворы воды или воды/пропиленгликоля. Для парентеральной инъекции, жидкие препараты могут быть составлены в растворе в водном растворе полиэтиленгликоля.
Если необходимо или желательно парентеральное введение, особенно подходящими смесями для описанных здесь солей являются стерильные растворы для инъекций, предпочтительно, масляные или водные растворы, а также суспензии, эмульсии или имплантаты, включая суппозитории. В частности, носители для парентерального введения включают водные растворы декстрозы, физиологический раствор, чистую воду, этанол, глицерин, пропиленгликоль, арахисовое масло, конопляное масло, блоксополимеры полиэксиэтилена и подобные. Удобной лекарственной формой являются ампулы. Соли также могут быть введены в липосомы или вводятся через чрескожные помпы или пластыри. Фармацевтические смеси, подходящие для применения в различных вариантах, описанных здесь, хорошо известны специалистам в данной области техники и описаны, например, в Pharmaceutical Sciences (17th Ed., Mack Pub. Co., Easton, PA) и WO 96/05309, идеи которых включены сюда в качестве ссылки.
Водные растворы, подходящие для перорального применения, могут быть получены растворением активной соли (например, описанных здесь соединений, включая варианты и примеры) в воде и добавлением подходящих красителей, вкусовых добавок, стабилизаторов и загустителей, при желании. Водные суспензии, подходящие для перорального применения, могут быть получены диспергированием тонкоизмельченного активного компонента в воде с вязким материалом, таким как природные или синтетические камеди, смолы, метилцеллюлоза, циклодекстрин, карбоксиметилцеллюлоза натрия, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакант и диспергирующие и смачивающие агенты, такие как природные фосфатиды (например, лецитин), продукт конденсации алкиленоксида и жирной кислотой (например, полиоксиэтиленстеарат), продукт конденсации этиленоксида с длинноцепным алифатическии спиртом (например, гептадекаэтиленоксицетанол), продукт конденсации этиленоксида с частичным эфиром, полученным из жирной кислоты и гексита (например, моноолеат полиоксиэтиленсорбита) или продукт конденсации этиленоксида с частичным эфиром, полученным из жирной кислоты и ангидрида гексита (например, моноолеат полиоксиэтиленсорбитана). Водная суспензия также может содержать один или более консервантов, таких как этил- или н-пропил п-гидроксибензоат, один или более красящих агентов, один или более вкусовых агентов и один или более подсластителей, таких как сахароза, аспартам или сахарин. Композиции могут быть скорректированы на осмолярность.
Также включены твердые препараты, которые предназначены для превращения, непосредственного перед применением, в жидкие препараты для перорального введения. Такие жидкие формы включают растворы, суспензии и эмульсии. Эти препараты могут содержать, в дополнение к активному компоненту, красители, вкусовые добавки, стабилизаторы, буферы, искусственные и природные подсластители, диспергаторы, загустители, солюбилизирующие агенты и подобные.
Масляные суспензии могут содержать загуститель, такой как пчелиный воск, твердый парафин или цетиловый спирт. Подсластители могут быть добавлены для получения съедобного перорального препарата, такие как глицерин, сорбит или сахароза. Эти композиции могут консервироваться добавлением антиоксиданта, такого как аскорбиновая кислота. Примеры масляного носителя для инъекций представлены у Minto, J. Pharmacol. Exp. Ther. 281:93-102, 1997. Фармацевтические композиции также могут быть в форме эмульсий масло в воде. Масляной фазой может быть растительное масло или минеральное масло, описанное выше, или их смесь. Подходящие эмульгирующие агенты включают природные камеди, такие как аравийская камедь и трагакант, природные фосфатиды, такие как соевый лецитин, сложные эфиры или частичные сложные эфиры, полученные из жирных кислот, и ангидриды гексита, такие как сорбитанмоноолеат, и продукты конденсации таких частичных сложных эфиров с этиленоксидом, такие как моноолеат полиоксиэтиленсорбитана. Эмульсия также может содержать подсластители и вкусовые добавки, такие как в композиции сиропов и эликсиров. Такие композиции также могут содержать мягчительное средство, консервант или краситель.
Описанные здесь соединения могут вводиться отдельно или могут со-вводиться пациенту. Со-введение включает одновременное или последовательное введение соединений, отдельно или в сочетании (более одного соединения). Таким образом, препараты также могут быть объединены, при желании, с другими активными веществами (например, для потери массы тела).
Соединения могут вводиться через множество путей и подходов, включая, но не ограничиваясь ими: пероральное введение, внутривенное введение, местное введение, парентеральное введение, внутрибрюшинное введение, внутримышечное введение, интратекальное введение, внутриочаговое введение, внутричерепное введение, интраназальное введение, внутриглазное введение, внутрисердечное введение, интравитреальное введение, внутрикостное введение, интрацеребральное введение, внутриартериальное введение, внутрисуставное введение, внутрикожное введение, чрескожное введение, чресслизистое введение, подъязычное введение, энтеральное введение, сублабиальное введение, инсуффляционное введение, суппозитории, ингалируемое введение или подкожное введение.
Соединения могут быть получены и вводиться во множестве пероральных, парентеральных и местных лекарственных форм. Пероральные препараты включают таблетки, пилюли, порошки, драже, капсулы, жидкости, пастилки, крахмальные капсулы, гели, сиропы, суспензии и т.д., подходящие для съедания пациентом. Соли описанных здесь соединений также могут вводиться инъекцией, то есть, внутривенно, внутримышечно, чрескожно, подкожно, интрадуоденально или внутрибрюшинно. Также описанные здесь соли могут вводиться ингаляцией, например, интраназально. Дополнительно, соли могут вводиться чрескожно. Также очевидно, что множество путей введения (например, внутримышечное, пероральное, чрескожное) может применяться для введения солей описанных здесь соединений. Следовательно, также представлены фармацевтические композиции, содержащие фармацевтически приемлемый наполнитель и одну или более солей описанного здесь соединения или соединений.
Фармацевтические препараты предпочтительно имеют стандартную лекарственную форму. В такой форме препарат разделен на дозы, содержащие подходящие количества активного компонента. Стандартная лекарственная форма может быть упакованным препаратом, где упаковка содержит отдельные количества препарата, такая как упакованные таблетки, капсулы и порошки во флаконах и ампулах. Также стандартная лекарственная форма может быть капсулой, таблеткой, крахмальной капсулой или пастилкой сама по себе или может быть подходящее количество любой из них в упакованной форме.
Количество активного компонента в стандартном лекарственном препарате может варьироваться или корректироваться на килограмм массы тела, от около 0,1 мкг/кг до около 100000 мкг/кг, от 1,0 мкг/кг до 10000 мкг/кг или от 1 мкг/кг до 5000 мкг/кг, в соответствии с конкретным применением и мощностью активного компонента. Примером единичных доз может быть 1, 10, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 2000 или 5000 мкг/кг. Композиция может, при желании, также содержать другие совместимые терапевтические агенты. Множество единичных доз может вводиться в течение 24-часового периода времени. Дозы могут вводиться перорально, но также могут применяться другие пути введения, в зависимости от тяжести заболевания/расстройства пациента.
В некоторых вариантах, количество соединений формулы (I) или формулы (II) может варьироваться или корректироваться от около 1,0 мкг до 10000 мкг, например, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 2000 или 5000 мкг/кг массы тела, для лечения ожирения пероральным введением. В некоторых вариантах, количество соединений формулы (I) или формулы (II) может варьироваться или корректироваться от около 1,0 мкг до 10000 мкг, например, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 2000 или 5000 мкг/кг массы тела, для лечения ожирения внутрибрюшинным введением.
Различные варианты осуществления включают пероральное введение описанного здесь соединения. В некоторых вариантах, соединение вводят в дозе от около 0,05 до около 100 мг/кг, от около 0,1 до около 0,5 мг/кг, от около 0,1 до около 1 мг/кг, от около 0,1 до около 5 мг/кг, от около 0,1 до около 10 мг/кг, от около 0,1 до около 25 мг/кг, от около 1 до около 5 мг/кг, от около 1 до около 25 мг/кг, от около 5 до около 25 мг/кг, от около 10 до около 25 мг/кг, от около 10 до около 50 мг/кг, от около 25 до около 50 мг/кг, от около 25 до около 75 мг/кг или от около 50 до около 100 мг/кг. В определенных вариантах, соединение вводят в дозе около 0,1, 0,15, 0,2, 0,25, 0,3, 0,35, 0,4, 0,45, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или 100 мг/кг. Дозы могут вводиться, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 или более раз в сутки или в неделю. Например, соединение может вводиться один раз, два раза или три раза в сутки. В некоторых вариантах, соединение вводят до (например, за около 1, 2, 3, 4, 5 или 6 часов) или с пищей. Не ограничивающие примеры способов перевода доз для животных, таких как мыши, в эквивалентные дозы для человека известны в данной области техники. См., например, U.S. Food и Drug Administration Center for Drug Evaluation and Research (CDER) (2005) Guidance For Industry: Estimating the Maximum Safe Starting Dose in Initial Clinical Trials for Therapeutics in Adult Healthy Volunteers (доступно на www.fda.gov/downloads/drugs/guidances/ucm078932.pdf). Например, доза для мыши в мг/кг может быть переведена в эквивалентную дозу для человека (принимая во внимание человека с массой тела 60 кг) на основе площади поверхности тела умножением дозы для мыши на 0,08.
Некоторые соединения могут иметь ограниченную растворимость в воде и поэтому могут потребовать присутствия поверхностно-активного вещества или другого подходящего сорастворителя в композиции. Такие сорастворители включают: Полисорбат 20, 60 и 80; Плуроник F-68, F-84 и P-103; циклодекстрин; полиоксил 35 касторовое масло; или другие агенты, известные специалисту в данной области техники. Такие сорастворители обычно применяют в количестве от около 0,01% до около 2% массовых.
Вязкость, превышающая вязкость простых водных растворов может быть желательна для снижения вариабельности диспергирования композиций, для снижения физического разделения компонентов суспензии или эмульсии композиции и/или для другого улучшения композиции. Такие модифицирующие вязкость агенты включают, например, поливиниловый спирт, поливинилпирролидон, метилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, сульфат хондроитина и его соли, гиалуроновую кислоту и ее соли, сочетание представленных выше, и другие агенты, известные специалистам в данной области техники. Такие агенты обычно применяют в количестве от около 0,01% до около 2% массовых. Определение приемлемых количеств любого из указанных выше адъювантов легко проводится специалистом в данной области техники.
Композиции могут дополнительно включать компоненты для получения замедленного выделения и/или комфорта. Такие компоненты включают высокомолекулярные анионные мукомиметические полимеры, желирующие полисахариды и тонкоизмельченные лекарственные субстраты. Эти компоненты более подробно обсуждаются в патентах США №№ 4,911,920; 5,403,841; 5,212,162; и 4,861,760. Полное содержание этих патентов включено сюда в качестве ссылки полностью для всех целей.
Доза и частота (однократная или многократные дозы), вводимые млекопитающему, могут варьироваться в зависимости от множества факторов, например, страдает ли млекопитающее от другого заболевания, и пути введения; размера, возраста, пола, здоровья, массы тела, индекса массы тела и питания реципиента; природы и продолжительности симптомов лечимого заболевания (например, эмфиземы, астмы, РДСВ, включая кислородную токсичность, пневмонии, хронической обструктивной болезни легких (ХОБЛ), эмфиземы, кистозного фиброза, бронхолегочной дисплазии, хронического синусита, легочного фиброза), типа сопутствующего лечения, осложнений лечимого заболевания или других проблем, связанных со здоровьем. Заболевание может быть первичной причиной болезни и/или расстройства увеличения веса. Заболевание может быть вызвано первичным расстройством и/или расстройством увеличения веса. Другие терапевтические режимы или агенты могут применяться в сочетании со способами и соединениями, описанными здесь. Корректировка и изменение установленных доз (например, частоты и длительности) находятся в компетенции специалиста в данной области техники.
Для любого описанного здесь соединения терапевтически эффективное количество может быть изначально определено из исследований на клеточных культурах. Целевыми концентрациями являются такие концентрации активного соединения, которые способны достигать описанных здесь способов, что измеряют описанными здесь или известными в данной области техники способами.
Целевыми концентрациями являются такие концентрации активного соединения, которые способны достигать способов, описанных здесь, что измеряют описанными здесь или известными в данной области техники способами.
Как хорошо известно в данной области техники, терапевтически эффективные количества для применения у человека также могут быть определены из животных моделей. Например, доза для человека может быть составлена для достижения концентрации, которая определена как эффективная у животных. Доза у человека может корректироваться отслеживанием эффективности соединений и корректировкой дозы в сторону уменьшения или увеличения, как описано выше. Корректировка дозы для достижения максимальной эффективности у человека основана на описанных выше способах и других способах, и находится в компетенции специалиста в данной области техники.
Дозы могут варьироваться в зависимости от требований пациента и применяемого соединения. Доза, вводимая пациенту, в контексте данного описании должна быть достаточной для вызывания положительной терапевтической реакции у пациента с течением времени. Размер дозы также определяется существованием, природой и продолжительностью любых нежелательных побочных эффектов. Определение подходящей дозы для конкретной ситуации находится в компетенции практикующего врача. В общем, лечение начинают с небольших доз, которые меньше оптимальной дозы соединения. Затем дозу незначительно увеличивают до достижения оптимального эффекта в данных обстоятельствах. В некоторых вариантах, доза составляет от 0,001% до 10% масс./об. В других вариантах, доза составляет от 0,1% до 5% масс./об.
Количества и интервалы дозирования могут быть скорректированы индивидуально для получения уровней введенного соединения, эффективных для конкретного лечимого клинического показания. Это обеспечивает терапевтический режим, который соответствует тяжести болезненного состояния индивидуума.
С помощью представленной здесь информации может быть спланирован эффективный профилактический или терапевтический режим, который не вызовет значительной токсичности и является эффективным для лечения клинических симптомов, демонстрируемых конкретным пациентом. Такое планирование должно включать осторожный выбор активного соединения с учетом факторов, таких как мощность соединения, относительная биодоступность, масса тела пациента, присутствие и тяжесть нежелательных побочных эффектов, предпочтительный способ введения и профиль токсичности выбранного агента.
Соотношение между токсичностью и терапевтическим эффектом для конкретного соединения называется его терапевтическим индексом и может быть выражено как отношение между LD50 (количеством соединения, летальным у 50% населения) и ED50 (количеством соединения, эффективным у 50% населения). Соединения, которые имеют высокий терапевтический индекс, предпочтительны. Данные терапевтического индекса, полученные в исследованиях клеточных культур и/или исследованиях на животных, могут применяться при составлении интервала доз у человека. Дозы таких соединений предпочтительно лежит в пределах концентраций в плазме, которые включают ED50 с незначительной или отсутствующей токсичностью. Доза может варьироваться в этом интервале в зависимости от применяемой лекарственной формы и применяемого способа введения. См., например, Fingl et al., In: The Pharmacological Basis of Therapeutics, Ch.1, p.1, 1975. Точная композиция, способ введения и доза может быть выбрана конкретным терапевтом с учетом состояния пациента и конкретного способа, в котором применяют соединение.
V. НАБОР
В одном аспекте, представлен набор, содержащий композицию, применяемую для лечения ожирения, описанную здесь, и инструкции по применению для лечения ожирения. В некоторых вариантах, набор может применяться для перорального введения композиций для лечения ожирения, например, набор может также включать аппликатор для перорального введения. В некоторых вариантах, набор может применяться для внутрибрюшинного введения композиций для лечения ожирения.
ПРИМЕРЫ
Представленные ниже примеры иллюстрируют определенные конкретные варианты изобретения и не должны пониматься как ограничивающие объем изобретения.
Представленные здесь варианты далее иллюстрированы следующими примерами и подробными протоколами. Однако примеры предназначены только для иллюстрации вариантов и не должны считаться ограничивающими объем. Содержание всех ссылок и опубликованных патентов и заявок на патент, цитированные в данном описании, включены сюда в качестве ссылок.
ХИМИЯ
Представленные ниже примеры иллюстрируют определенные специфические варианты изобретения и не ограничивают объем данного изобретения.
Представленные здесь варианты далее иллюстрированы следующими примерами и подробными протоколами. Однако примеры предназначены только для иллюстрации вариантов и не должны считаться ограничивающими объем. Содержание всех ссылок и опубликованных патентов и заявок на патент, цитированные в данном описании, включены сюда в качестве ссылок.
Пример 1.
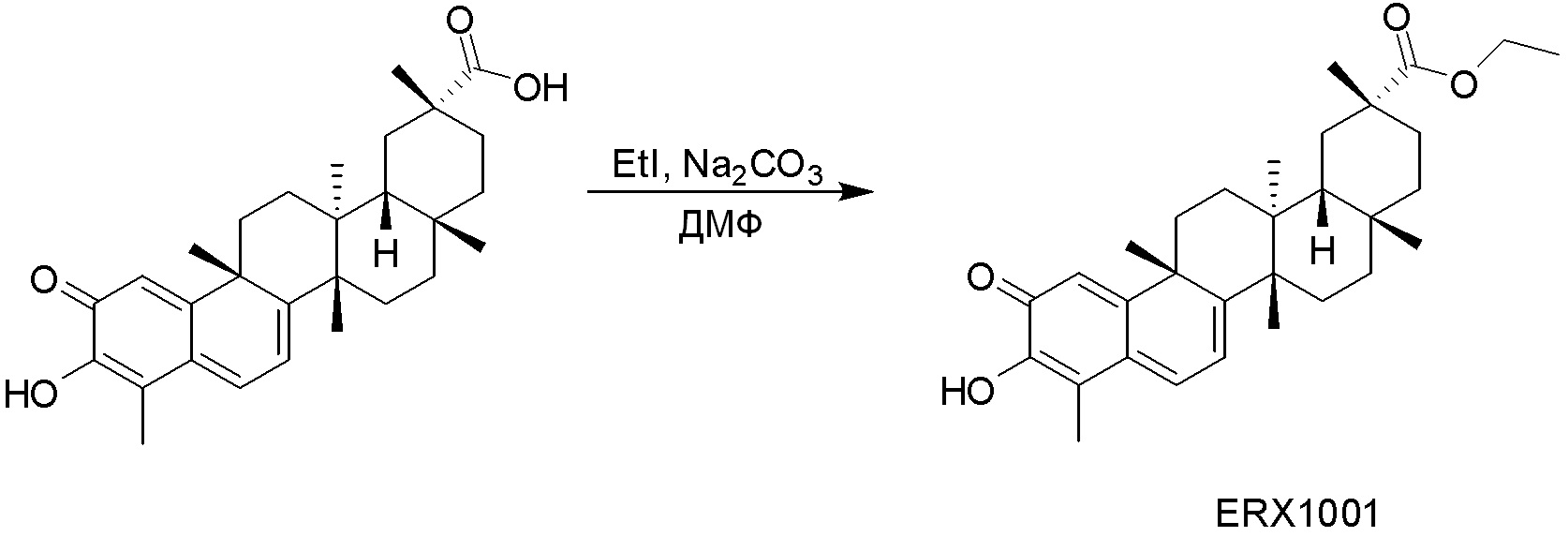
К раствору целастрола (150 мг, 0,33 ммоль) в ДМФ (3 мл) добавляют EtI (104 мг, 0,054 мл, 0,67 ммоль) и Na2CO3 (70,6 мг, 0,67 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:1) с получением продукта (70 мг, 0,146 ммоль, Выход=44%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,02 (1H, д, J=7,2 Гц), 6,96 (1H, с), 6,54 (1H, с), 6,35 (1H, д, J=7,2 Гц), 3,90-4,05 (2H, м), 2,44 (1H, д, J=15,5 Гц), 2,21 (3H, с), 2,13-2,25 (2H, м), 2,00-2,10 (1H, м), 1,77-1,93 (3H, м), 1,62-1,73 (3H, м), 1,47-1,55 (2H, м), 1,45 (3H, с), 1,32-1,42 (1H, м), 1,26 (3H, с), 1,21 (3H, т, J=7,2 Гц), 1,17 (3H, с), 1,10 (3H, с), 0,93-1,01 (1H, м), 0,56 (3H, с);13С ЯМР δ (100 МГц, CDCl3): 178,34, 178,19, 170,09, 164,71, 146,01, 134,12, 127,37, 119,55, 118,12, 117,12, 60,26, 45,04, 44,26, 42,93, 40,24, 39,40, 38,22, 36,35, 34,76, 33,51, 32,76, 31,59, 30,69, 30,55, 29,78, 29,60, 28,66, 21,63, 18,44, 14,02, 10,26; ЖХ-МС (Подвижная фаза: A: вода (0,01% ТФК) B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2,2 мл/мин; Колонка: Poroshell 120 EC-C18, 4,6×30 мм, 2,7 мкм): ву=2,20 мин, m/z=479,3 [M+H]+, чистота=100% (214, 254 нм).
Пример 2.
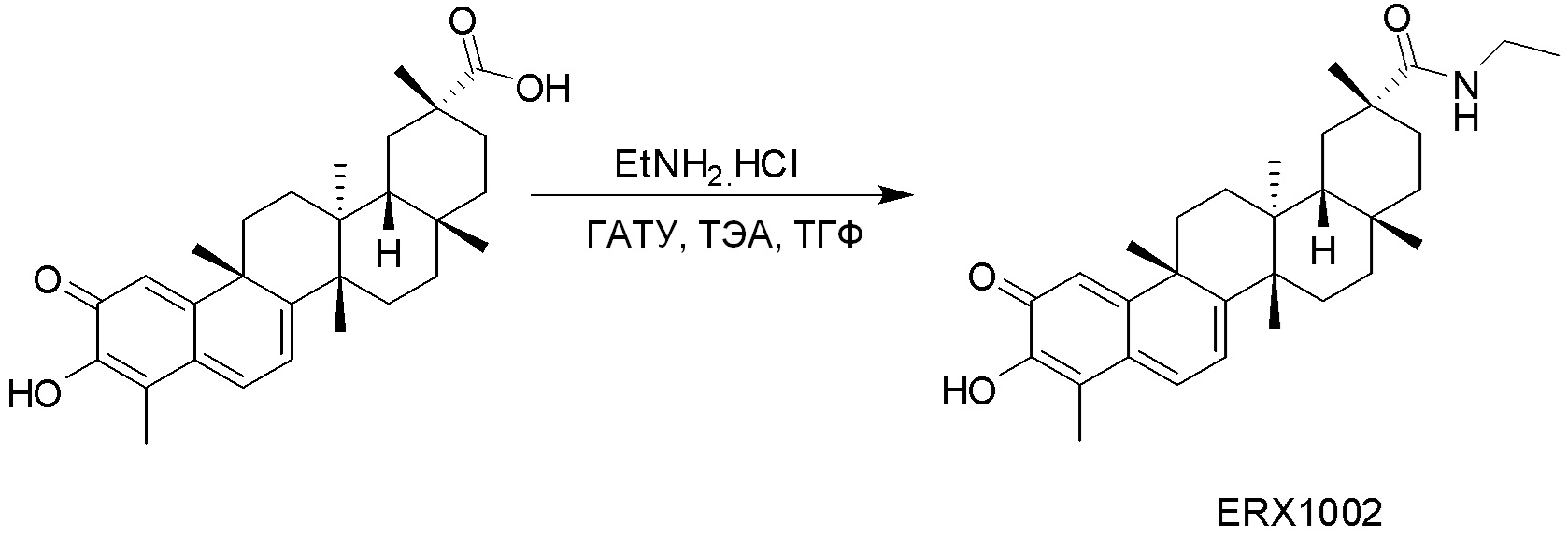
К раствору целастрола (150 мг, 0,333 ммоль) в ТГФ (3 мл) добавляют EtNH2.HCl (40 мг, 0,50 ммоль), ГАТУ (190 мг, 0,5 ммоль), затем NEt3 (101 мг, 0,14 мл, 1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:1) с получением продукта (23,5 мг, 0,0492 ммоль, Выход=15%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,01 (1H, дд, J=7,2, 0,9 Гц), 6,98 (1H, с), 6,53 (1H, д, J=0,9 Гц), 6,34 (1H, д, J=7,2 Гц), 5,62 (1H, т, J=5,0 Гц), 3,13-3,20 (2H, м), 2,46 (1H, д, J=15,8 Гц), 2,21 (3H, с), 2,10-2,17 (1H, м), 1,98-2,09 (1H, м), 1,82-1,97 (4H, м), 1,47-1,74 (7H, м), 1,44 (3H, с), 1,26 (3H, с), 1,15 (3H, с), 1,13 (3H, с), 1,06 (3H, т, J=7,2 Гц), 0,98-1,05 (1H, м), 0,65 (3H, с); ЖХ-МС (Подвижная фаза: A: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,7 мин; Скорость потока: 2,2 мл/мин; Колонка: SunFire C18,4,6×50 мм, 3,5 мкм): ву=2,33 мин, m/z=478,3 [M+H]+, чистота=100% (214, 254 нм).
Пример 3.
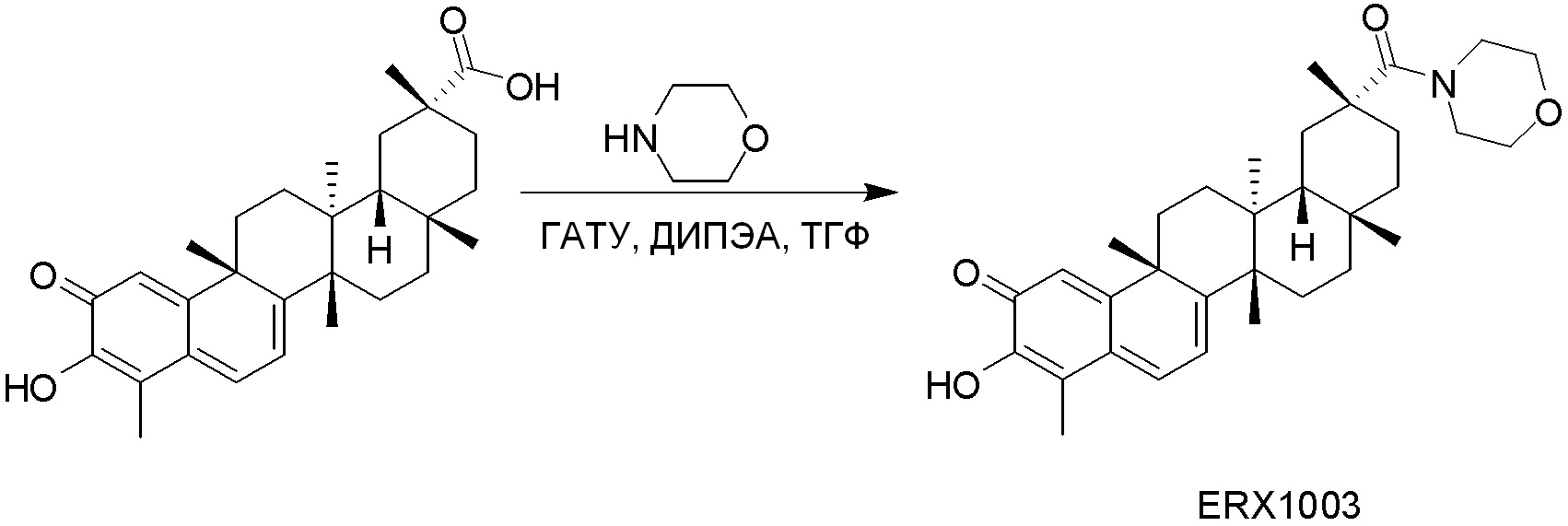
К раствору целастрола (200 мг, 0,44 ммоль) в ТГФ (5 мл) добавляют морфолин (78 мг, 0,88 ммоль), ГАТУ (254 мг, 0,66 ммоль), затем ДИПЭА (114 мг, 0,16 мл, 0,88 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:1) с получением продукта (74 мг, 0,142 ммоль, Выход=32%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,02 (1H, дд, J=7,2, 1,0 Гц), 6,97 (1H, с), 6,54 (1H, д, J=1,0 Гц), 6,36 (1H, д, J=7,2 Гц), 3,50-3,80 (8H, м), 2,28-2,36 (2H, м), 2,22 (3H, с), 2,16-2,23 (1H, м), 2,03-2,13 (1H, м), 1,49-1,93 (8H, м), 1,46 (3H, с), 1,34-1,40 (1H, м), 1,25-1,33 (1H, м), 1,30 (3H, с), 1,28 (3H, с), 1,15 (3H, с), 0,96-1,02 (1H, м), 0,61 (3H, с); ЖХ-МС (Подвижная фаза: A: вода(0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,4 мин; Скорость потока: 2,3 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,36 мин, m/z=520,3 [M+H]+, чистота=100% (214, 254 нм).
Пример 4.
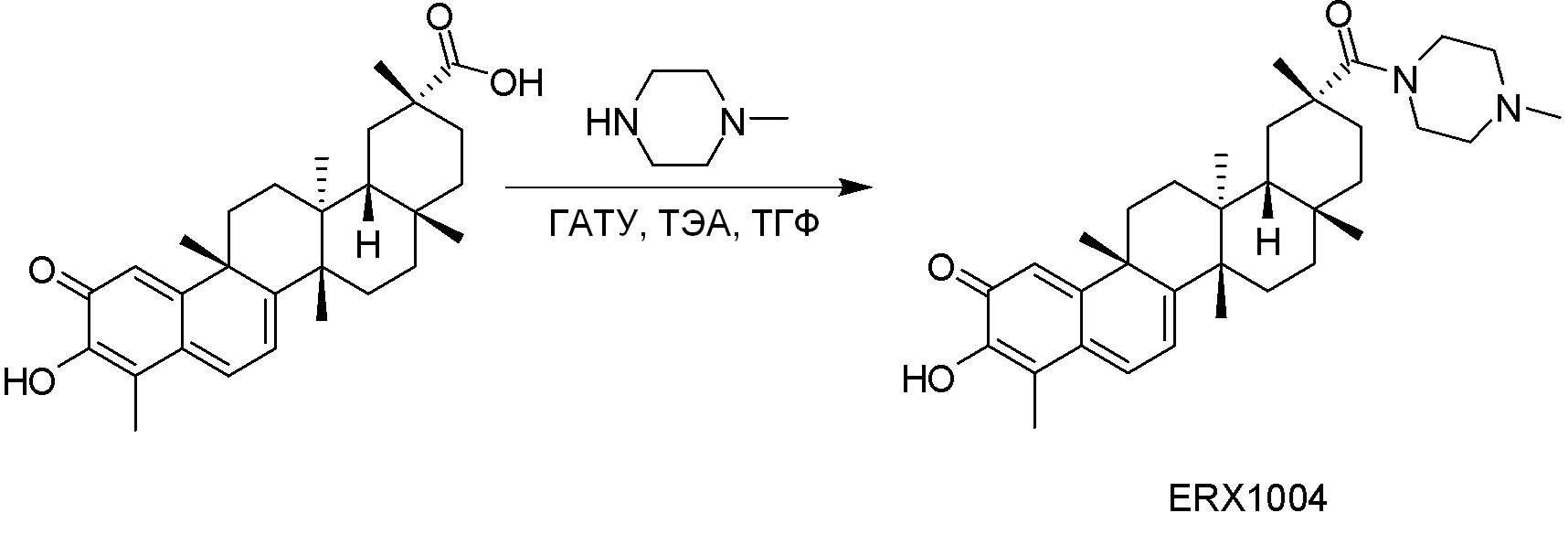
К раствору целастрола (150 мг, 0,333 ммоль) в ТГФ (3 мл) добавляют 1-метилпиперазин (50 мг, 0,055 мл, 0,50 ммоль), ГАТУ (190 мг, 0,5 ммоль), затем NEt3 (67,4 мг, 0,093 ммоль, 0,666 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2/MeOH=10:1) с получением продукта (25,2 мг, 0,0473 ммоль, Выход=14,2%) в виде красного твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 7,02 (1H, дд, J=7,2, 1,0 Гц), 6,98 (1H, ш), 6,51 (1H, д, J=1,0 Гц), 6,35 (1H, д, J=7,2 Гц), 3,60-3,80 (2H, м), 2,31-2,45 (5H, м), 2,30 (3H, с), 2,21 (3H, с), 2,04-2,19 (2H, м), 1,65-1,92 (8H, м), 1,49-1,62 (3H, м), 1,45 (3H, с), 1,33-1,39 (1H, м), 1,29 (3H, с), 1,28 (3H, с), 1,24-1,30 (1H, м), 1,14 (3H, с), 0,95-1,01 (1H, м), 0,61 (3H, с); ЖХ-МС (Подвижная фаза: A: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,7 мин; Скорость потока: 2,2 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=1,88 мин, m/z=533,3 [M+H]+, чистота=100% (214, 254 нм).
Пример 5.
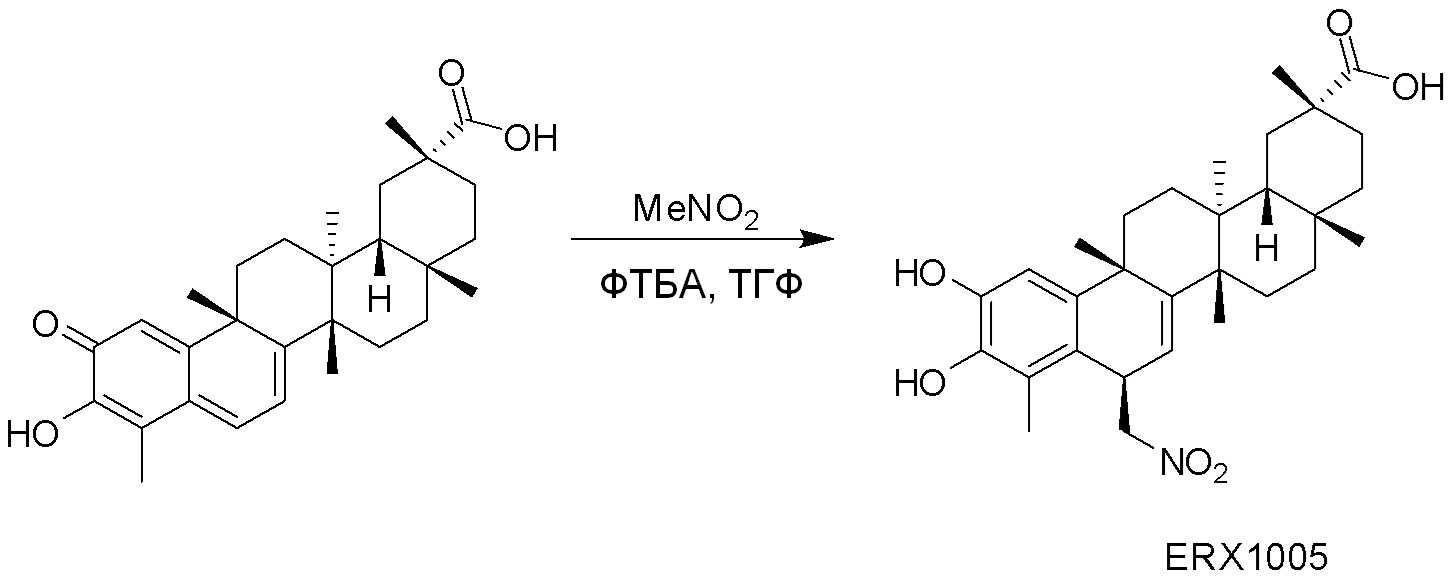
К раствору целастрола (200 мг, 0,44 ммоль) и MeNO2 (54 мг, 0,88 ммоль) в ТГФ (3 мл) добавляют 1M ФТБА в растворе ТГФ (0,22 мл, 0,22 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакцию гасят добавлением H2O (50 мл). Затем раствор экстрагируют Et2O (2×50 мл). Объединенные органические слои промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/EtOAc=1:1) с получением продукта (139,6 мг, 0,273 ммоль, Выход=62%) в виде бледно-желтого твердого вещества,1Н ЯМР: δ (400 МГц, CDCl3): 6,77 (1H, с), 5,69 (1H, д, J=5,9 Гц), 4,54 (1H, дд, J=11,3, 4,0 Гц), 4,24-4,31 (1H, м), 4,11 (1H, т, J=11,3 Гц), 2,38 (1H, д, J=15,5 Гц), 2,28 (3H, с), 1,48-2,14 (9H, м), 1,45 (3H, с), 1,29-1,39 (4H, м), 1,20 (3H, с), 1,13 (3H, с), 1,05 (3H, с), 0,84-0,92 (1H, м), 0,57 (3H, с); ЖХ-МС (Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2,2 мл/мин; Колонка: Poroshell 120 EC-C18,4,6×30 мм, 2,7 мкм): ву=1,86 мин, m/z=451,2 [M-CH2NO2]+, чистота=100% (214, 254 нм).
Пример 6.
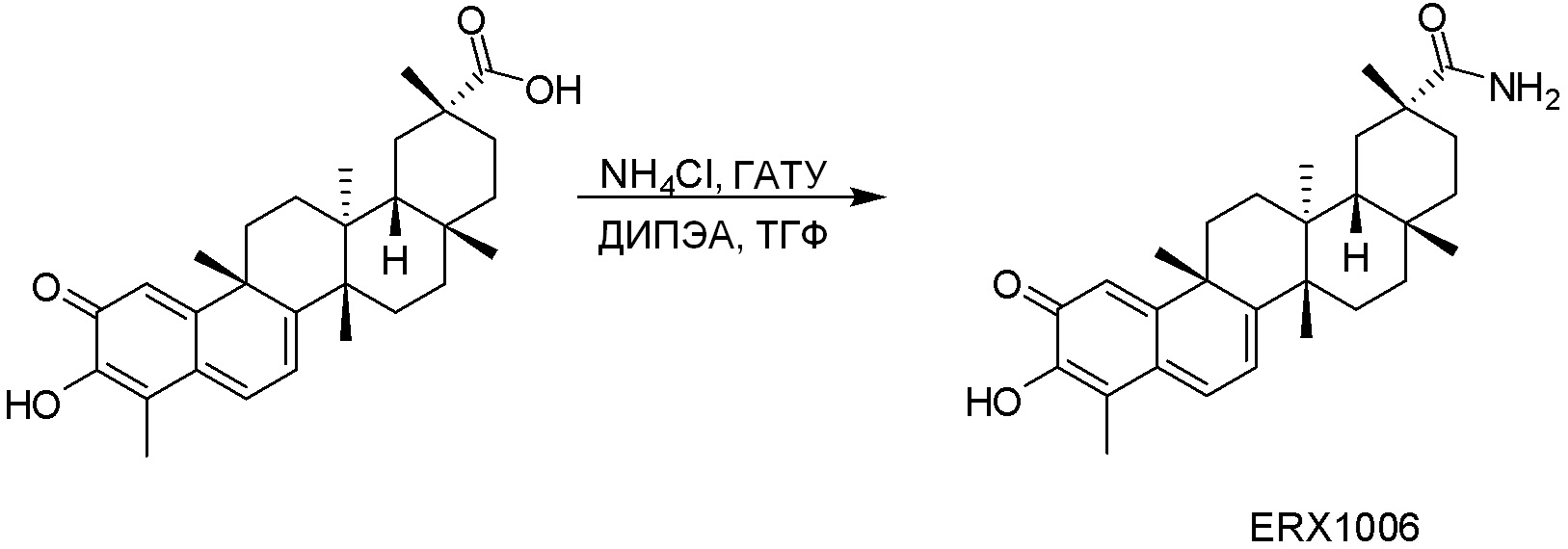
К раствору целастрола (225 мг, 0,5 ммоль) в ДМФ (10 мл) добавляют NH4Cl (80 мг, 1,5 ммоль), ГАТУ (209 мг, 0,55 ммоль), затем ДИПЭА (129 мг, 0,18 мл, 1,0 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/EtOAc=1:1) с получением продукта (200 мг, 0,445 ммоль, Выход=89%) в виде красного твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 7,01 (1H, с), 7,00 (1H, д, J=7,0 Гц), 6,51 (1H, с), 6,33 (1H, дд, J=7,0, 2,4 Гц), 5,34-5,74 (2H, ш), 2,42 (1H, д, J=15,1 Гц), 2,22 (3H, с), 2,00-2,16 (2H, м), 1,82-1,98 (4H, м), 1,46-1,72 (7H, м), 1,44 (3H, с), 1,26 (3H, с), 1,20 (3H, с), 1,12 (3H, с), 0,98-1,05 (1H, м), 0,72-0,73 (3H, с); ЖХ-МС (Подвижная фаза: A: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2,2 мл/мин; Колонка: Poroshell 120 EC-C18, 4,6×30 мм, 2,7 мкм): ву=1,81 мин, m/z=450,4 [M+H]+, чистота=100% (214, 254 нм).
Пример 7.
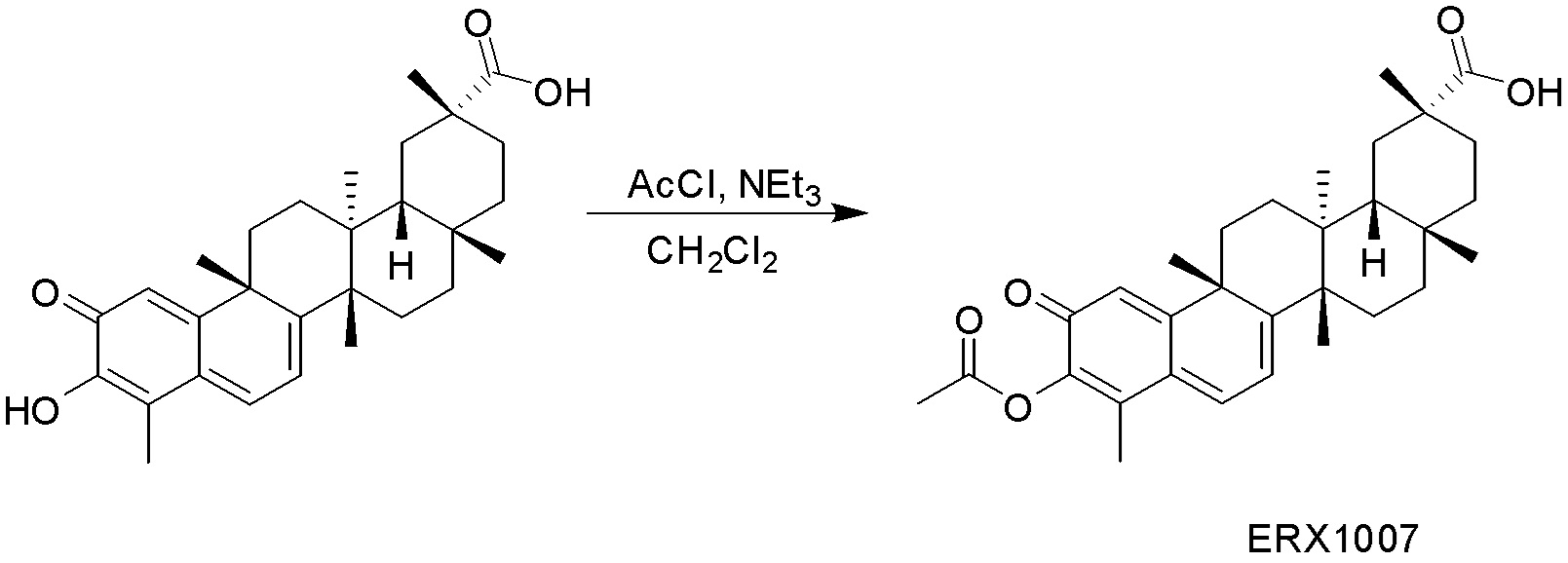
К раствору целастрола (100 мг, 0,222 ммоль) в CH2Cl2 (4 мл) добавляют NEt3 (45 мг, 0,062 мл, 0,444 ммоль) затем AcCl (20,9 мг, 0,019 ммоль, 0,266 ммоль). Реакционную смесь перемешивают при 0°C в течение 1 часа. Затем раствор разбавляют CH2Cl2 (100 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:1, затем CH2Cl2/этилацетат=1:1) с получением продукта (17,3 мг, 0,0351 ммоль, Выход=15,8%) в виде желтого твердого вещества.1Н ЯМР: δ(400 МГц, CDCl3): 7,07 (1H, д, J=7,0 Гц), 6,60 (1H, с), 6,30 (1H, д, J=7,0 Гц), 2,24 (1H, д, J=15,5 Гц), 2,35 (3H, с), 2,15 (3H, с), 2,10-2,18 (2H, м), 1,95-2,10 (2H, м), 1,78-1,90 (3H, м), 1,46-1,72 (4H, м), 1,45 (3H, с), 1,28-1,40 (2H, м), 1,25 (3H, с), 1,18 (3H, с), 1,08 (3H, с), 0,91-0,97 (1H, м), 0,66 (3H, с); ЖХ-МС (Подвижная фаза: A: H2O (0,01% ТФК); B: MeCN (0,01% ТФК); Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2 мл/мин; Колонка: SunFire C18 50×4,6 мм, 3,5 мкм): ву=2,19 мин, m/z=493,2 [M+H]+, чистота=100% (214, 254 нм).
Пример 8.

К раствору целастрола (200 мг, 0,444 ммоль) в ТГФ (5 мл) добавляют Me2NH.HCl (72,4 мг, 0,888 ммоль), ГАТУ (338 мг, 0,888 ммоль), затем NEt3 (134,8 мг, 0,186 ммоль, 1,332 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/EtOAc=1:1) с получением продукта (101,4 мг, 0,212 ммоль, Выход=48%) в виде красного твердого вещества.1Н ЯМР: δ(400 МГц, CDCl3): 7,02 (1H, дд, J=7,2, 1,2 Гц), 6,96 (1H, с), 6,53 (1H, д, J=1,2 Гц), 6,36 (1H, д, J=7,2 Гц), 3,00-3,25 (3H, ш), 2,70-3,00 (3H, ш), 2,32-2,46 (2H, м), 2,22 (3H, с), 2,06-2,20 (2H, м), 1,48-1,93 (9H, м), 1,46 (3H, с), 1,30-1,36 (1H, м), 1,29 (3H, с), 1,28 (3H, с), 1,14 (3H, с), 0,95-1,01 (1H, м), 0,54 (3H, с); ЖХ-МС (Подвижная фаза: A: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2,2 мл/мин; Колонка: Poroshell 120 EC-C18, 4,6×30 мм, 2,7 мкм): ву=1,96 мин, m/z=478,4 [M+H]+, чистота=100% (214, 254 нм).
Пример 9.
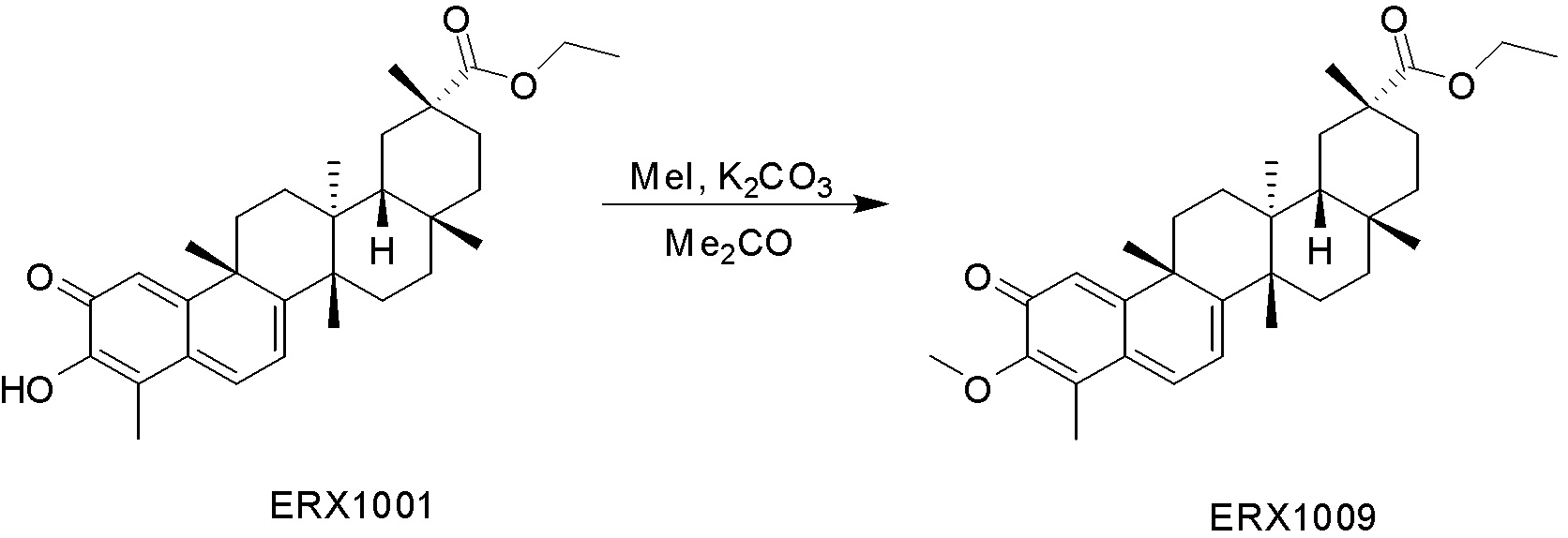
К раствору этилового эфира целастрола ERX1001 (200 мг, 0,418 ммоль) в ацетоне (4 мл) добавляют K2CO3 (115 мг, 0,836 ммоль), затем MeI (1 мл). Реакционную смесь нагревают при 40°C в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/EtOAc=2:1) с получением продукта (120 мг, 0,244 ммоль, Выход=58%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 6,98 (1H, д, J=7,2, 1,2 Гц), 6,43 (1H, д, J=1,2 Гц), 6,30 (1H, д, J=7,2 Гц), 3,90-4,06 (2H, м), 3,85 (3H, с), 2,44 (1H, д, J=15,8 Гц), 2,22 (3H, с), 2,00-2,22 (3H, м), 1,77-1,92 (3H, м), 1,48-1,72 (6H, м), 1,45 (3H, с), 1,32-1,42 (1H, м), 1,26 (3H, с), 1,21 (3H, т, J=7,0 Гц), 1,17 (3H, с), 1,10 (3H, с), 0,93-1,00 (1H, м), 0,58 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,4 мин; Скорость потока: 2,3 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,78 мин, m/z=493,3 [M+H]+, чистота=100% (214, 254 нм).
Пример 10.
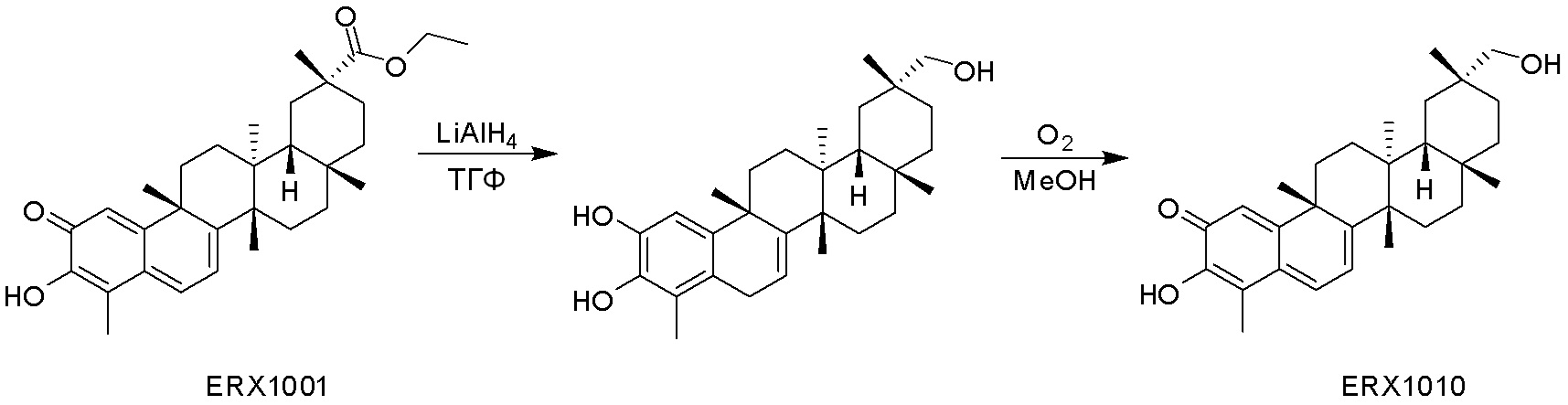
К раствору этилового эфира целастрола ERX1001 (160 мг, 0,33 ммоль) в ТГФ (20 мл) добавляют LiAlH4 (50,8 мг, 1,33 ммоль) порциями. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакцию гасят добавлением H2O (5 мл) и подкисляют до pH 6-7 добавлением 0,1 M HCl. Затем раствор разбавляют EtOAc (200 мл), фильтруют для удаления твердого вещества. Фильтрат промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме с получением неочищенного промежуточного соединения. Неочищенное промежуточное соединение растворяют в MeOH (10 мл) и окисляют баллоном O2 при нагревании при 40°C в течение ночи. Раствор концентрируют в вакууме, и остаток очищают преп-ТСХ (петролейный эфир/EtOAc=2:1) с получением продукта (58,5 мг, 0,134 ммоль, Выход=41% (2 стадии)) в виде красного твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 7,03 (1H, дд, J=7,1, 1,2 Гц), 6,97 (1H, с), 6,53 (1H, д, J=1,2 Гц), 6,38 (1H, д, J=7,1 Гц), 3,43 (1H, дд, J=10,5, 5,5 Гц), 3,22 (1H, дд, J=10,5, 4,3 Гц), 2,21 (3H, с), 2,09-2,16 (1H, м), 2,01 (1H, с), 1,54-1,94 (9H, м), 1,45 (3H, с), 1,38 (3H, с), 1,24-1,50 (4H, м), 1,19 (3H, с), 1,00 (3H, с), 0,94-1,00 (1H, м), 0,80 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК), B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,7 мин; Скорость потока: 2,2 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,48 мин, m/z=437,3 [M+H]+, чистота=100% (214, 254 нм).
Пример 11.
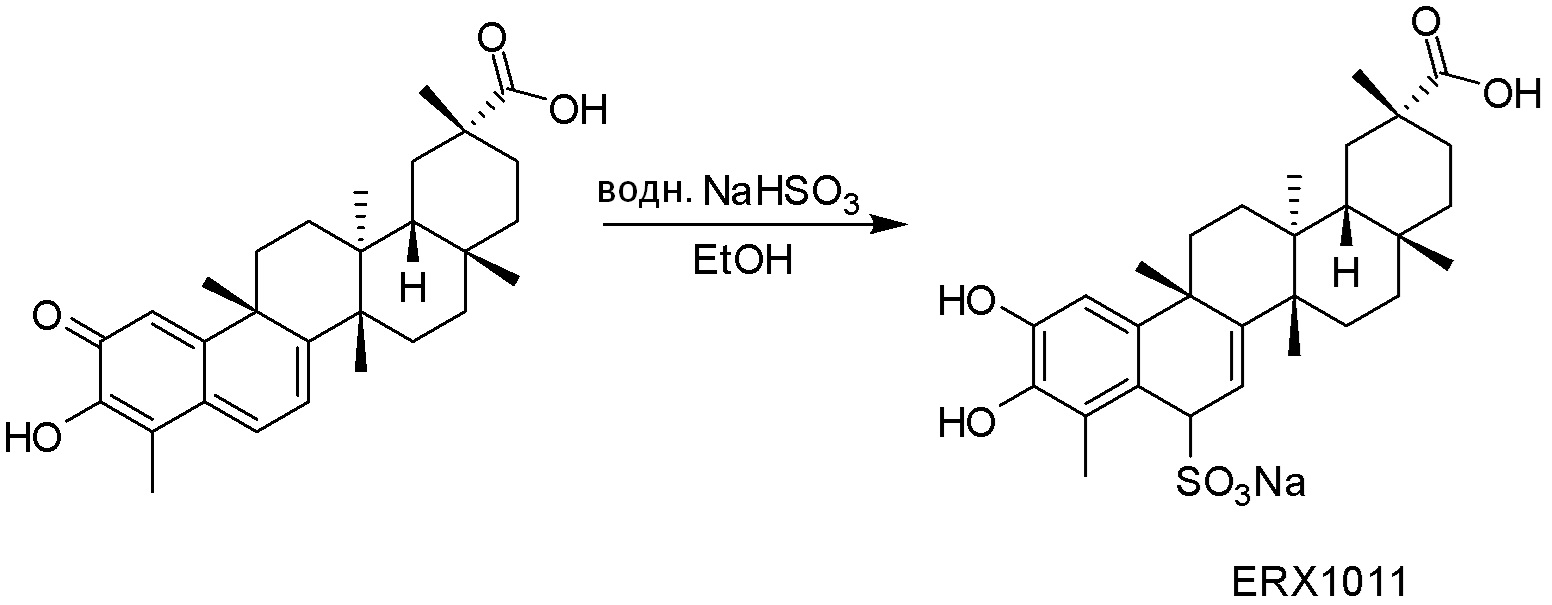
К раствору целастрола (500 мг, 1,11 ммоль) в EtOH (10 мл) добавляют NaHSO3 (127 мг, 1,22 ммоль) в 5 мл раствора H2O. Реакционную смесь перемешивают при комнатной температуре в течение 3 часов. Раствор становится практически бесцветным и прозрачным. Раствор концентрируют досуха в вакууме при 40°C с получением белого порошка. Добавляют достаточно EtOH для растворения неочищенного продукта. Раствор фильтруют, и фильтрат концентрируют в вакууме (<40°C) до около 10 мл. Раствор хранят в холодильнике в течение ночи. Твердое вещество фильтруют и растворяют в воде. После лиофилизации чистый продукт (114,7 мг, 0,207 ммоль, выход=18,6%) получают в виде белого твердого вещества,1Н ЯМР: δ(400 МГц, d6-ДМСО): 12,10 (1H, ш), 8,84 (1H, ш), 7,69 (1H, ш), 6,56 (1H, ш), 5,78 (1H, д, J=6,3 Гц), 4,44 (1H, д, J=6,3 Гц), 2,30-2,38 (1H, м), 2,20 (3H, с), 1,75-2,07 (4H, м), 1,61 (3H, с), 1,20-1,60 (9H, м), 1,17 (3H, с), 1,08 (3H, с), 1,05 (3H, с), 0,80-0,88 (1H, м), 0,60 (3H,s); ЖХ-МС (Подвижная фаза: А: вода (10 мМ гидрокарбоната аммония); B: CAN; Градиент: 5%-95% B за 1,5 мин; Скорость потока: 2,0 мл/мин; Колонка: XBridge C18, 4,6×50 мм, 3,5 мкм): ву=1,48 мин, m/z=530,8 [M-Na]- (отрицательный ион), чистота=95,47% (214 нм).
Пример 12.
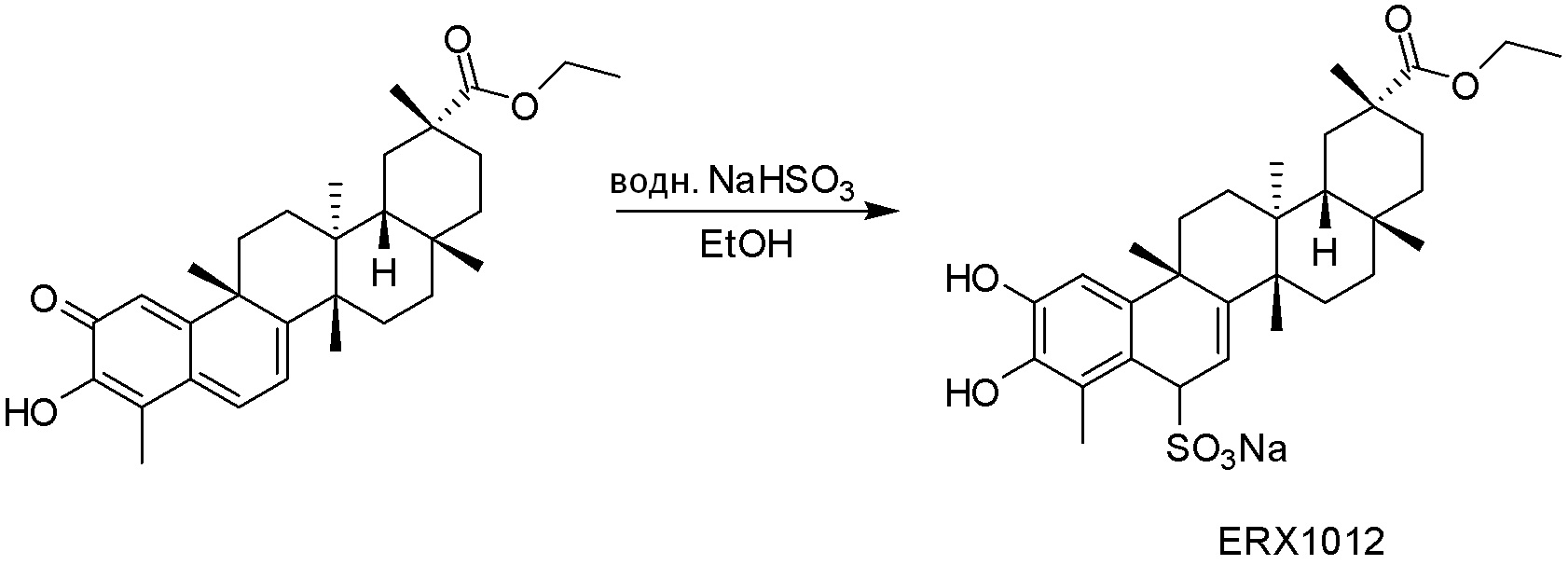
К раствору этилового эфира целастрола (500 мг, 1,045 ммоль) в EtOH (10 мл) добавляют NaHSO3 (119,6 мг, 1,149 ммоль) в 5 мл раствора H2O. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Раствор становятся бледно-желтым. Раствор концентрируют досуха в вакууме при 40°C. Остаток промывают CH2Cl2 (4×10 мл), растворяют в достаточном количестве воды, лиофилизируют в течение ночи с получением продукта (487,6 мг, 0,837 ммоль, Выход=80%) в виде бледно-желтого твердого вещества. Продукт может быть постепенно окислен в воздухе,1Н ЯМР: δ (400 МГц, d6-ДМСО): 8,78 (1H, с), 7,62 (1H, с), 6,57 (1H, с), 5,80 (1H, д, J=5,9 Гц), 4,46 (1H, д, J=5,9 Гц), 3,80-3,94 (2H, м), 2,34 (1H, д, J=15,5 Гц), 2,20 (3H, с), 1,76-2,10 (4H, м), 1,62 (3H, с), 1,27-1,65 (9H, м), 1,18 (3H, с), 1,10 (3H, с), 1,08 (3H, т, J=7,2 Гц), 1,06 (3H, с), 0,84-0,92 (1H, м), 0,45 (3H, с); ЖХ-МС (Подвижная фаза: A: вода (10 мМ гидрокарбоната аммония); B: АЦН; Градиент: 5%-95% B за 1,5 мин; Скорость потока: 2,0 мл/мин; Колонка: XBridge; C18, 4,6×50 мм, 3,5мкм): ву=1,83 мин, m/z=558,8 [M-Na]-(отрицательный ион), чистота=95,93% (214 нм).
Пример 13.
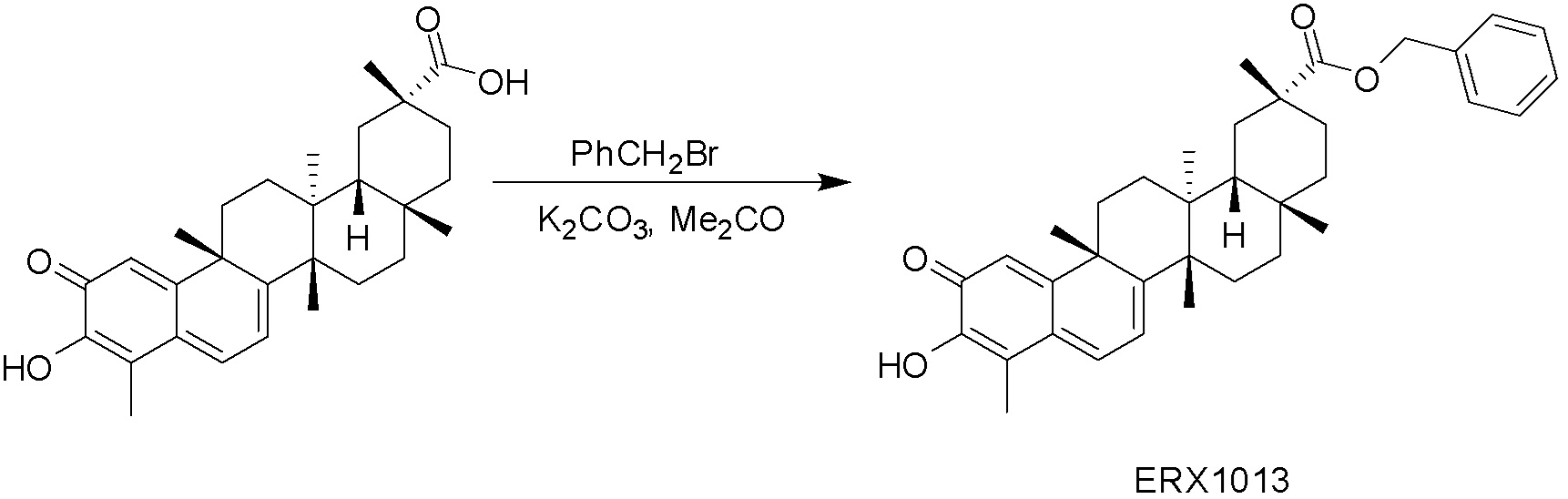
К раствору целастрола (200 мг, 0,444 ммоль) в ацетоне (5 мл) добавляют K2CO3 (184 мг, 1,332 ммоль), затем PhCH2Br (83,5 мг, 0,058 мл, 0,488 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=3:1) с получением неочищенного продукта. Но он является недостаточно чистым. Затем неочищенный продукт далее промывают петролейным эфиром при нагревании при 60°C дважды с получением продукта (40,6 мг, 0,0751 ммоль, Выход=17%) в виде желтого твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 7,27-7,36 (5H, м), 7,01 (1H, д, J=6,9 Гц), 6,98 (1H, с), 6,48 (1H, с), 6,33 (1H, д, J=6,9 Гц), 5,01 (1H, AB, J=12,3 Гц), 4,94 (1H, AB, J=12,3 Гц), 2,44 (1H, д, J=15,7 Гц), 2,20-2,28 (1H, м), 2,22 (3H, с), 1,82-2,12 (3H, м), 1,46-1,74 (8H, м), 1,42 (3H, с), 1,35-1,44 (1H, м), 1,24 (3H, с), 1,21 (3H, с), 1,09 (3H, с), 0,95-1,01 (1H, м), 0,51 (3H, с); ЖХ-МС: (Подвижная фаза: А: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,4 мин; Скорость потока: 2,3 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,91 мин, m/z=541,3 [M+H]+, чистота=97,41% (214 нм), 100%(254 нм).
Пример 14.

К раствору целастрола (200 мг, 0,444 ммоль) в ДМФ (2 мл) добавляют K2CO3 (123 мг, 0,888 ммоль), затем MeOCH2Br (61 мг, 0,04 мл, 0,488 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=5:2) с получением продукта (10,0 мг, 0,0202 ммоль, Выход=4,6%) в виде желтого твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 7,02 (1H, д, J=7,0 Гц), 6,97 (1H, с), 6,52 (1H, с), 6,35 (1H, д, J=7,0 Гц), 5,20 (1H, AB, J=5,9 Гц), 5,07 (1H, AB, J=5,9 Гц), 3,44 (3H, с), 2,45 (1H, д, J=15,6 Гц), 2,21 (3H, с), 1,30-2,26 (13H, м), 1,45 (3H, с), 1,27 (3H, с), 1,23 (3H, с), 1,11 (3H, с), 0,96-1,02 (1H, м), 0,60 (3H, с); ЖХ-МС (Подвижная фаза: A: вода (10 мМ гидрокарбоната аммония); B: АЦН; Градиент: 5%-95% B за 1,5 мин; Скорость потока: 2,0 мл/мин; Колонка: XBridge C18, 4,6×50 мм, 3,5 мкм; ву=2,75 мин, m/z=463,3 [M-OMe]+, чистота=100% (214,254 нм).
Пример 15.
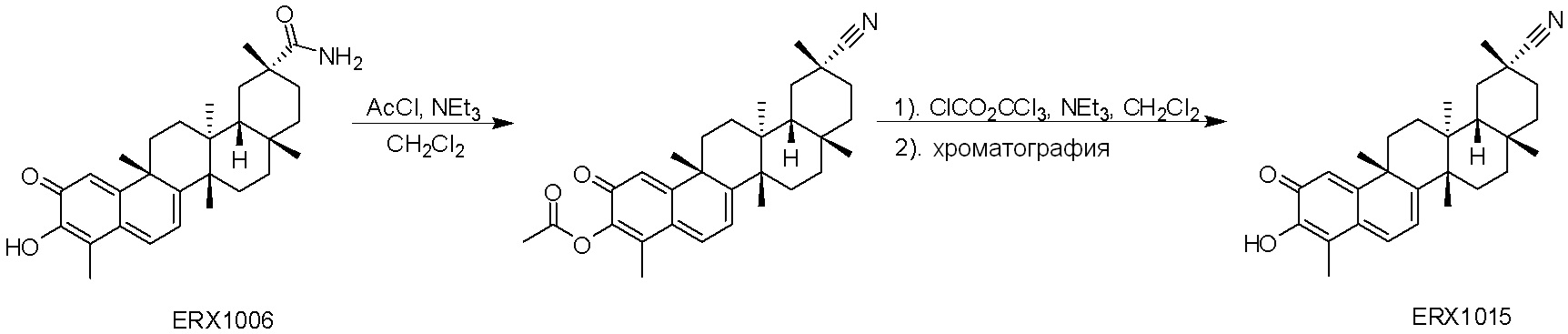
К раствору ERX1006 (1,0 г, 2,22 ммоль) в CH2Cl2 (10 мл) добавляют NEt3 (449 мг, 0,62 мл, 4,44 ммоль), затем AcCl (261 мг, 0,24 мл, 3,33 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Реакцию гасят добавлением H2O (5 мл). Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетат=5:1) с получением промежуточного соединения (910 мг, 1,92 ммоль, Выход=90%) в виде желтого твердого вещества.
К раствору промежуточного соединения (590 мг, 1,2 ммоль) в CH2Cl2 (20 мл) добавляют ClCO2CCl3 (475 мг, 2,4 ммоль), затем NEt3 (242 мг, 0,33 мл, 2,4 ммоль) по каплям. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакцию гасят добавлением H2O (5 мл). Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетат=2:1) и затем преп-ВЭЖХ с обращенной фазой с получением промежуточного соединения (120 мг, 0,278 ммоль, Выход=23%) в виде красного твердого вещества.
К раствору ERX1006 (650 мг, 1,446 ммоль) в CH2Cl2 (20 мл) добавляют (MeO)2P(O)Cl (1044 мг, 0,78 мл, 7,23 ммоль), затем NEt3 (732 мг, 0,726 мл, 7,23 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакцию гасят добавлением H2O (5 мл). Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2/MeOH=30:1) с получением продукта (321 мг, 0,744 ммоль, Выход=51%) в виде красного твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 7,02 (1H, дд, J=7,1, 1,4 Гц), 6,97 (1H, с), 6,53 (1H, д, J=1,3 Гц), 6,37 (1H, д, J=7,5 Гц), 2,22 (3H, с), 1,55-2,20 (14H, м), 1,47 (3H, с), 1,44 (3H, с), 1,29 (3H, с), 1,09-1,15 (1H, м), 1,09 (3H, с), 1,03 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,4 мин; Скорость потока: 2,3 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,38 мин, m/z=432,3 [M+H]+, чистота=100% (214,254 нм).
Пример 16.
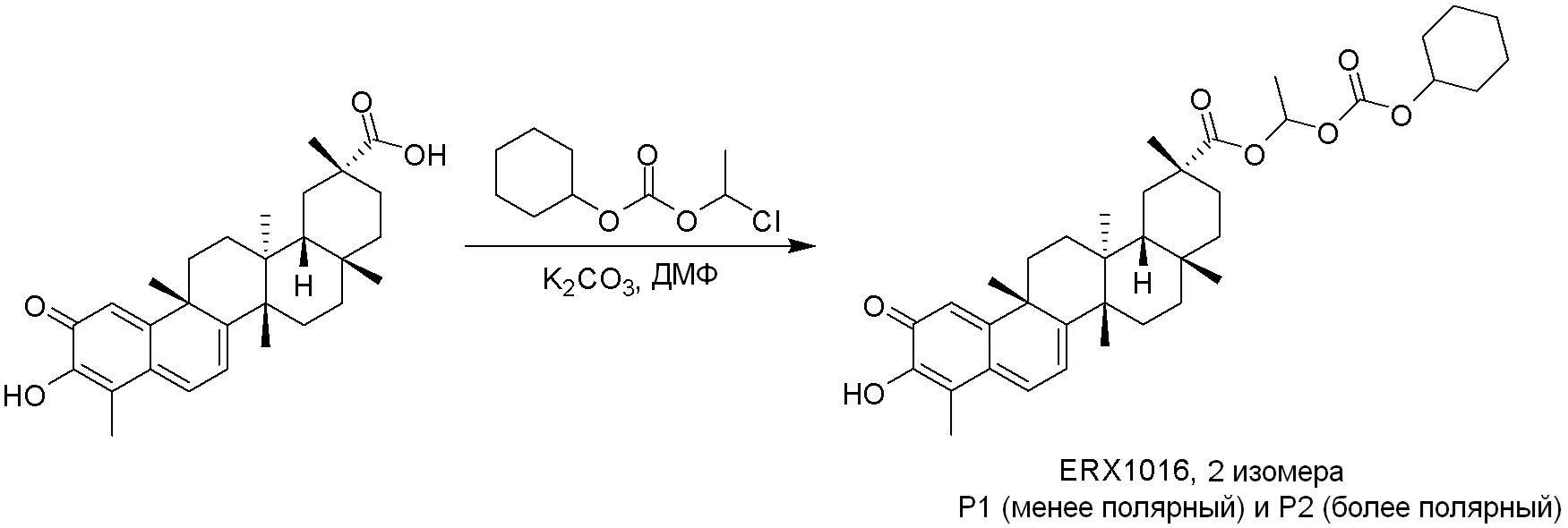
К раствору целастрола (300 мг, 0,666 ммоль) в ДМФ (4 мл) добавляют K2CO3 (184 мг, 1,332 ммоль) затем 1-хлорэтилциклогексиловый эфир карбоновой кислоты (151 мг, 0,134 мл, 0,732 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=5:2) дважды с получением изомера 1 (менее полярного, 29,7 мг, 0,0478 ммоль, Выход=7,2%) и изомера 2 (более полярного, 20,0 мг, 0,0322 ммоль, Выход=4,8%) в виде желтого твердого вещества. Изомер 1:1Н ЯМР: δ (400 МГц, CDCl3): 7,02 (1H, дд, J=7,3, 1,1 Гц), 6,98 (1H, с), 6,74 (1H, кв, J=5,5 Гц), 6,55 (1H, д, J=1,1 Гц), 6,35 (1H, д, J=7,3 Гц), 4,45-4,53 (1H, м), 2,41 (1H, д, J=16,1 Гц), 2,20 (3H, с), 1,00-2,20 (23H, м), 1,46 (3H, с), 1,45 (3H, д, J=5,5 Гц), 1,27 (3H, с), 1,20 (3H, с), 1,09 (3H, с), 0,93-1,00 (1H, м), 0,61 (3H, с); ЖХ-МС: SP-0012508-089-1-01262-LCMSA043 Подвижная фаза: А: вода (10 мМ гидрокарбоната аммония); B: АЦН; Градиент: 5%-95% B за 1,5 мин; Скорость потока: 2,0 мл/мин; Колонка: XBridge C18, 4,6×50 мм, 3,5 мкм): ву=3,11 мин, m/z=477,4 [M-C6H11OCO2]+, чистота=100% (214,254 нм). Изомер 2:1Н ЯМР: δ (400 МГц, CDCl3): 7,02 (1H, дд, J=7,1, 1,1 Гц), 6,97 (1H, с), 6,67 (1H, кв, J=5,4 Гц), 6,52 (1H, д, J=1,1 Гц), 6,35 (1H, д, J=7,1 Гц), 4,52-4,58 (1H, м), 2,41 (1H, д, J=15,9 Гц), 2,21 (3H, с), 1,05-2,25 (23H, м), 1,46 (3H, д, J=5,4 Гц), 1,45 (3H, с), 1,26 (3H, с), 1,19 (3H, с), 1,10 (3H, с), 0,94-1,01 (1H, м), 0,60 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (10 мМ гидрокарбоната аммония); B: АЦН; Градиент: 5%-95% B за 1,5 мин; Скорость потока: 2,0 мл/мин; Колонка: XBridge C18, 4,6×50 мм, 3,5 мкм): ву=3,12 мин, m/z=477,3 [M-C6H11OCO2]+, чистота=94,91% (254 нм).
Пример 17.
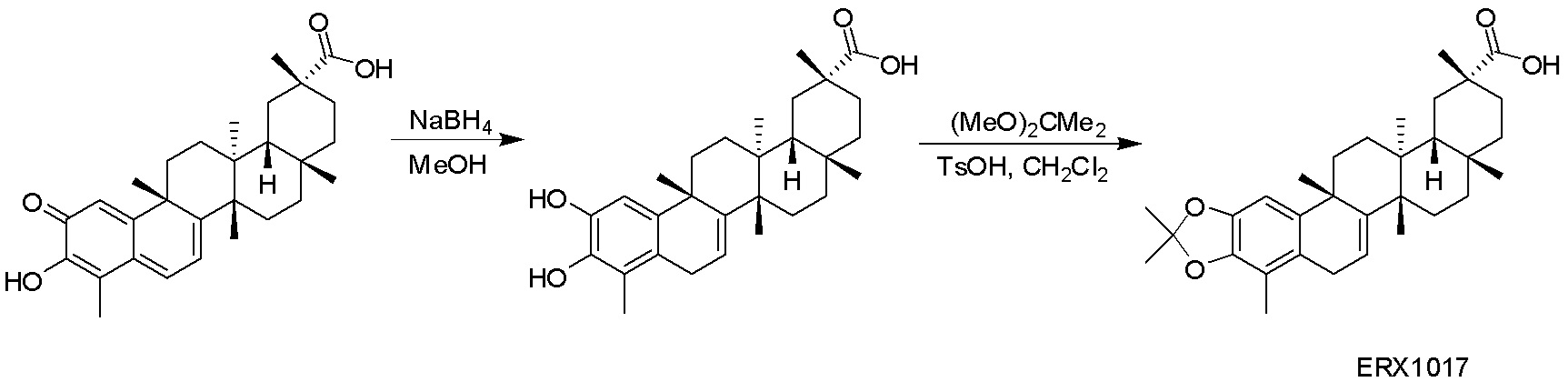
К раствору целастрола (1,8 г, 4,0 ммоль) в MeOH (20 мл) добавляют NaBH4 (1,52 г, 40 ммоль) порциями при 0°C. Реакционную смесь перемешивают при комнатной температуре в течение 30 минут. Раствор превращается из красноватого в бесцветный. Реакционную смесь гасят 0,1 M HCl и нейтрализуют до pH=7. Затем смесь экстрагируют CH2Cl2 (2×100 мл) и объединенные органические слои промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме с получением неочищенного промежуточного соединения (500 мг, 1,104 ммоль, Вд=28%) в виде белого твердого вещества.
К раствору неочищенного промежуточного соединения (300 мг, 0,66 ммоль) в CH2Cl2 (20 мл) добавляют (MeO)2CMe2 (690 мг, 6,6 ммоль), затем TsOH (12 мг, 0,066 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Раствор разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над Mg2SO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетат=10:1) с получением продукта (230 мг, 0,467 ммоль, Выход=71%) в виде белого твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 6,64 (1H, с), 5,73 (1H, дд, J=6,0, 1,5 Гц), 3,27 (1H, дд, J=20,8, 6,3 Гц), 2,98 (1H, д, J=20,8 Гц), 2,41 (1H, д, J=15,7 Гц), 2,10 (3H, с), 1,95-2,15 (4H, м), 1,69 (3H, с), 1,64 (3H, с), 1,24-1,85 (9H, м), 1,30 (3H, с), 1,20 (3H, с), 1,17 (3H, с), 1,05 (3H, с), 0,84-0,91 (1H, м), 0,68 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2,2 мл/мин; Колонка: Poroshell 120 EC-C18, 4,6×30 мм, 2,7 мкм): ву=2,34 мин, m/z=493 [M+H]+, чистота=100% (214, 254 нм).
Пример 18.
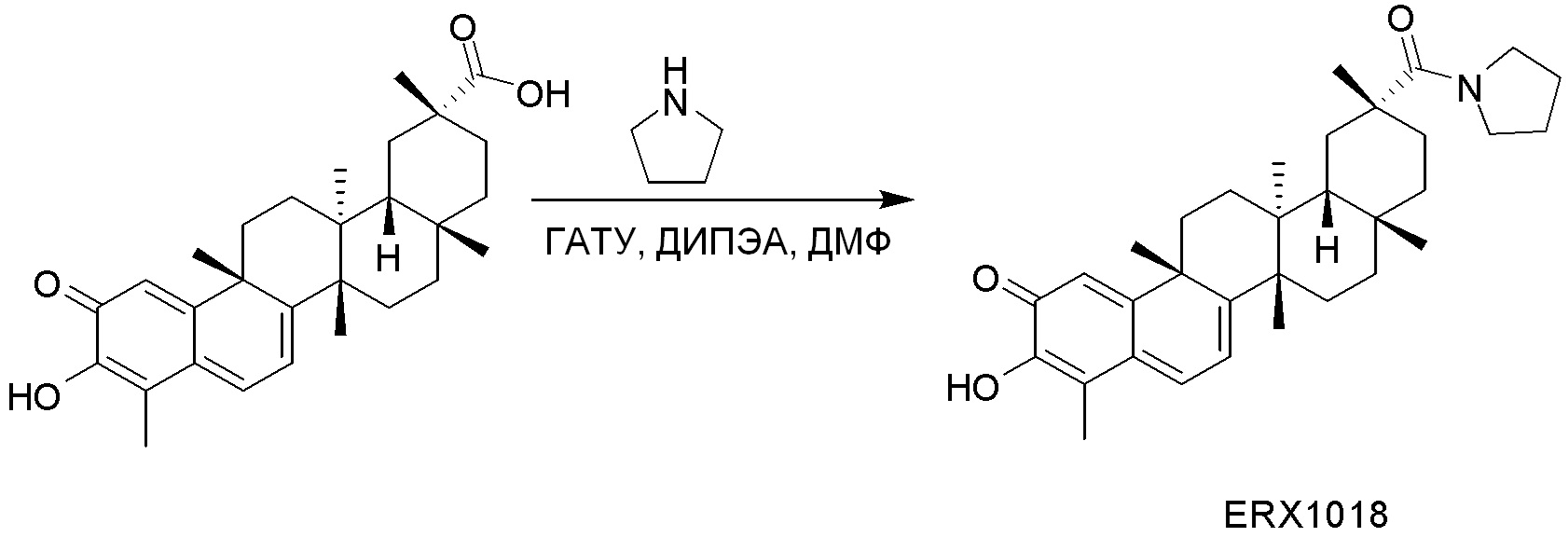
К раствору целастрола (200 мг, 0,444 ммоль) в ДМФ (10 мл) добавляют пирролидин (63 мг, 0,074 мл, 0,888 ммоль), ГАТУ (185 мг, 0,48 ммоль), затем ДИПЭА (115 мг, 0,16 мл, 0,88 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Затем раствор разбавляют CH2Cl2 (200 мл), промывают H2O (2×100 мл), затем насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:1) с получением продукта (140 мг, 0,278 ммоль, Выход=63%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,03 (1H, дд, J=7,2, 1,0 Гц), 6,96 (1H, с), 6,53 (1H, д, J=1,0 Гц), 6,35 (1H, д, J=7,2 Гц), 3,56-3,70 (2H, м), 3,39-3,50 (1H, м), 3,19-3,29 (1H, м), 2,34-2,44 (2H, м), 2,22 (3H, с), 2,09-2,20 (2H, м), 1,47-1,97 (12H, м), 1,46 (3H, с), 1,23-1,33 (2H, м), 1,27 (3H, с), 1,22 (3H, с), 1,13 (3H, с), 0,94-1,10 (1H, м), 0,55 (3H, с); ЖХ-МС: Подвижная фаза: А: вода (0,01% ТФК): B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2,2 мл/мин; Колонка: Poroshell 120 EC-C18, 4,6×30 мм, 2,7 мкм): ву=2,01 мин, m/z=504,4 [M+H]+, чистота=100% (214, 254 нм).
Пример 19.
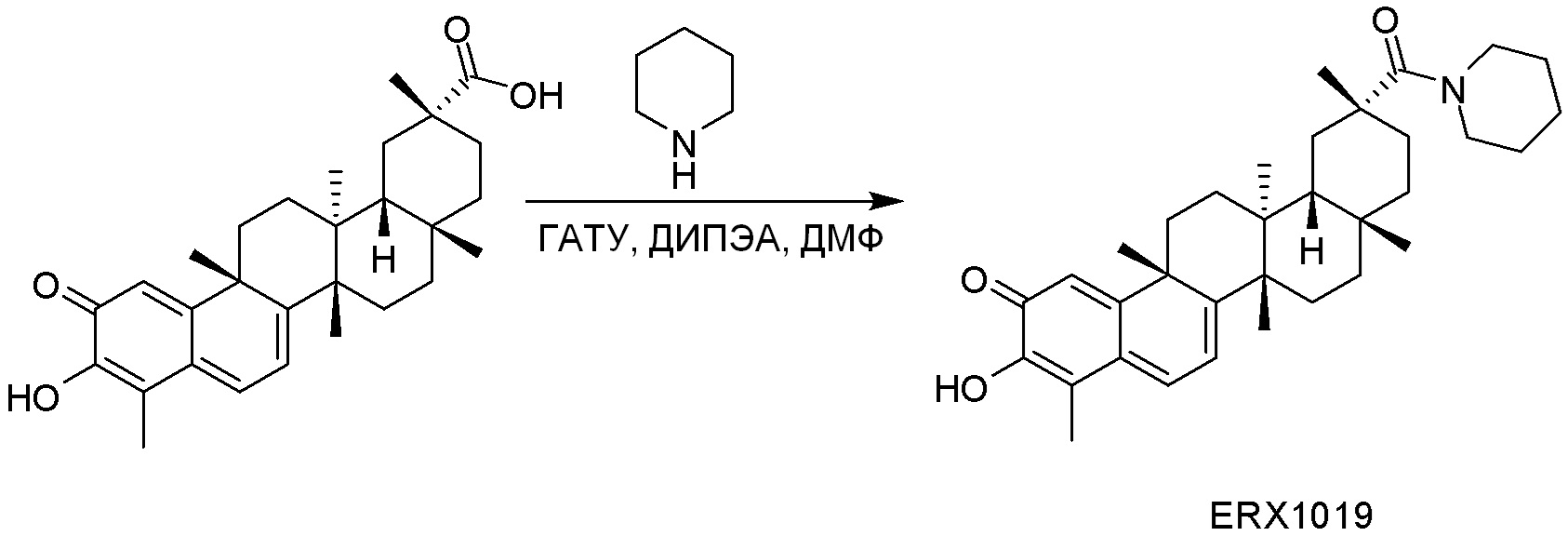
К раствору целастрола (200 мг, 0,444 ммоль) в ДМФ (10 мл) добавляют пиперидин (76 мг, 0,088 мл, 0,888 ммоль), ГАТУ (185 мг, 0,48 ммоль), затем ДИПЭА (115 мг, 0,16 мл, 0,88 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают водой (2×100 мл), затем насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:1) с получением продукта (95 мг, 0,188 ммоль, Выход=42%) в виде желтого твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 7,04 (1H, д, J=7,2 Гц), 6,97 (1H, с), 6,54 (1H, с), 6,36 (1H, д, J=7,2 Гц), 2,90-4,10 (4H, ш), 2,28-2,42 (2H, м), 2,22 (3H, с), 2,05-2,21 (2H, м), 1,24-1,92 (16H, м), 1,46 (3H, с), 1,29 (3H, с), 1,27 (3H, с), 1,14 (3H, с), 0,94-1,01 (1H, м), 0,60 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,4 мин; Скорость потока: 2,3 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,63 мин, m/z=518,5 [M+H]+, чистота=100% (214, 254 нм).
Пример 20.
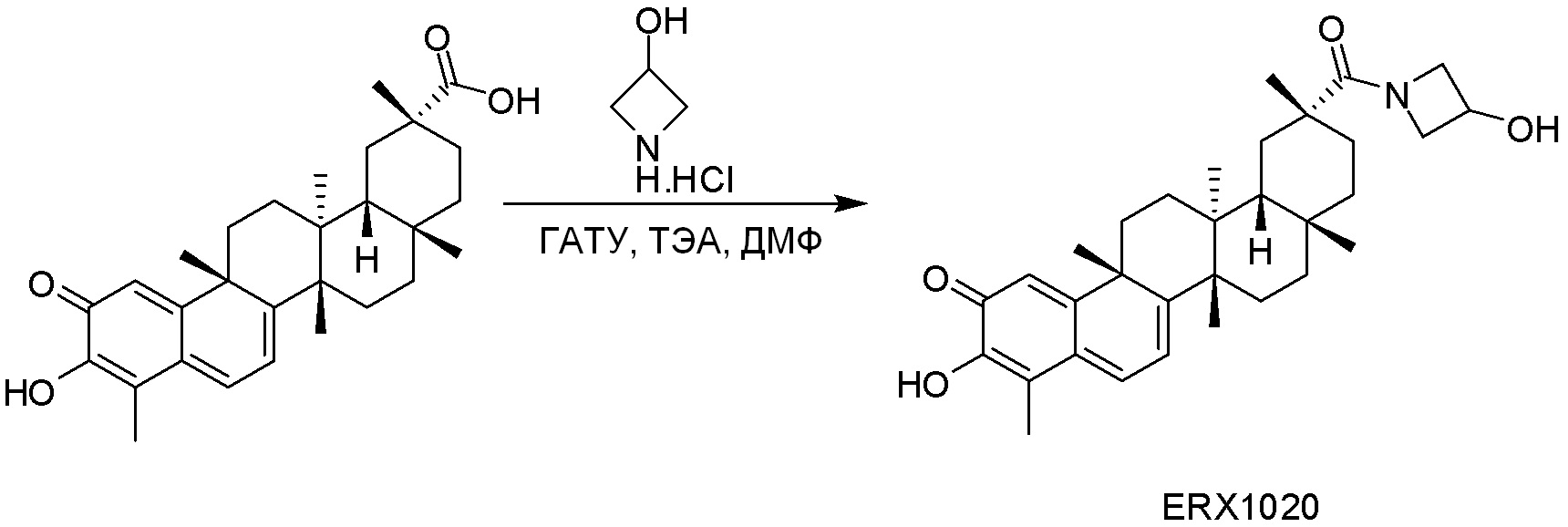
К раствору целастрола (200 мг, 0,444 ммоль) в ТГФ (5 мл) добавляют гидрохлорид 3-гидроксиацетидина (97 мг, 0,888 ммоль), ГАТУ (338 мг, 0,888 ммоль), затем NEt3 (180 мг, 0,25 мл, 1,776 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:4) и преп-ВЭЖХ с обращенной фазой с получением продукта (80,5 мг, 0,159 ммоль, Выход=36%) в виде красного твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 7,05 (1H, д, J=7,2 Гц), 6,93 (1H, с), 6,54 (1H, с), 6,36 (1H, д, J=7,2 Гц), 4,50-4,60 (2H, м), 3,55-4,30 (4H, м), 2,23 (3H, с), 1,82-2,28 (6H, м), 1,46-1,74 (6H, м), 1,43 (3H, с), 1,20-1,34 (2H, м), 1,25 (3H, с), 1,14 (3H, с), 1,11 (3H, с), 0,94-1,01 (1H, м), 0,64&0,60 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (10 мМ гидрокарбоната аммония); B: АЦН; Градиент: 5%-95% B за 1,5 мин; Скорость потока: 2,0 мл/мин; Колонка: XBridge C18, 4,6×50 мм, 3,5 мкм): ву=2,34 мин, m/z=556,4 [M+H]+, чистота=100% (214, 254 нм).
Пример 21.
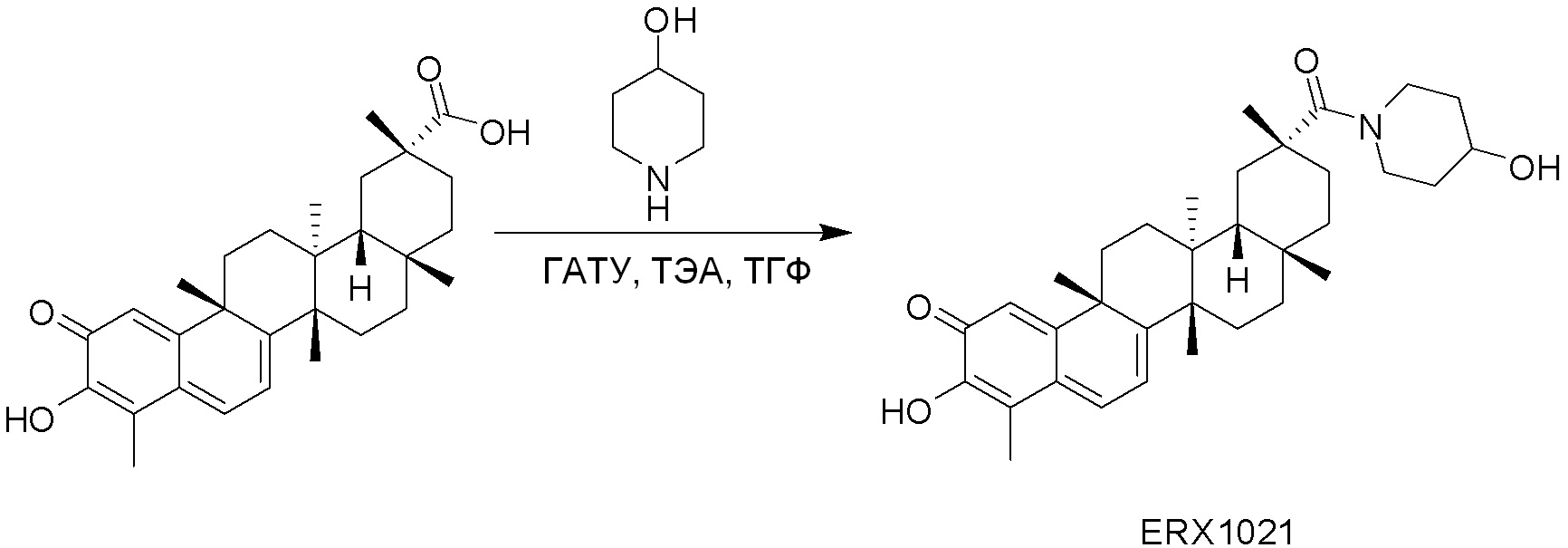
К раствору целастрола (300 мг, 0,666 ммоль) в ТГФ (7,5 мл) добавляют 4-гидроксипиперидин (135 мг, 1,33 ммоль), ГАТУ (507 мг, 1,33 ммоль), затем NEt3 (202 мг, 0,28 мл, 2,0 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (300 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:3) и преп-ВЭЖХ с обращенной фазой с получением продукта (34,8 мг, 0,0652 ммоль, Выход=9,8%) в виде желтого твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 7,03 (1H, д, J=7,1 Гц), 6,96 (1H, с), 6,53 (1H, с), 6,36 (1H, д, J=7,1 Гц), 4,0-4,4 (1H, ш), 3,94 (1H, с), 3,0-3,9 (2H, ш), 2,00-2,40 (3H, м), 2,22 (3H, с), 1,20-1,95 (17H, м), 1,46 (3H, с), 1,29 (3H, с), 1,28 (3H, с), 1,15 (3H, с), 0,95-1,02 (2H, м), 0,58 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (10 мМ гидрокарбоната аммония); B: АЦН; Градиент: 5%-95% B за 1,5 мин; Скорость потока: 2,0 мл/мин; Колонка: XBridge C18, 4,6×50 мм, 3,5 мкм): ву=2,41 мин, m/z=534,3 [M+H]+, чистота=96,7% (214 нм), 100% (254 нм).
Пример 22.
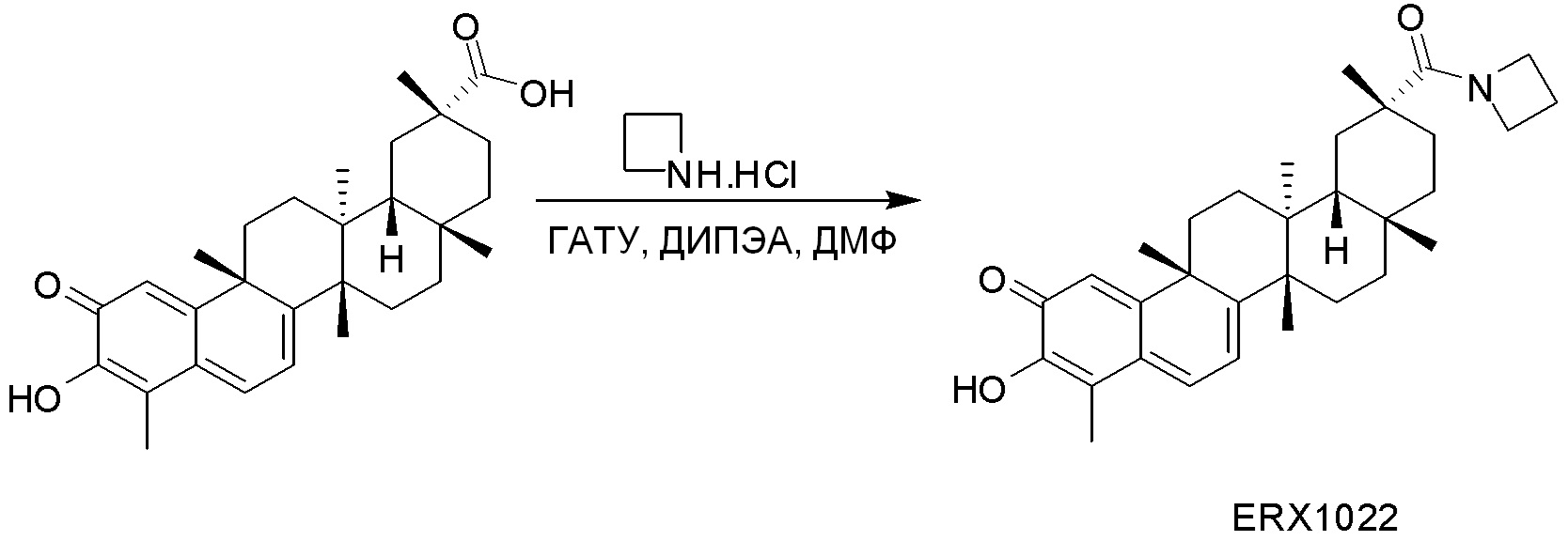
К раствору целастрола (150 мг, 0,33 ммоль) в ДМФ (10 мл) добавляют гидрохлорид азетидина (62 мг, 0,67 ммоль), ГАТУ (139 мг, 0,36 ммоль), затем ДИПЭА (86 мг, 0,12 мл, 0,67 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:4) и преп-ВЭЖХ с обращенной фазой с получением продукта (96 мг, 0,196 ммоль, Выход=52%) в виде желтого твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 7,04 (1H, д, J=7,1 Гц), 6,97 (1H, с), 6,56 (1H, с), 6,36 (1H, д, J=7,1 Гц), 4,35-4,45 (2H, м), 3,75-3,95 (2H, м), 2,22 (3H, с), 1,50-2,30 (14H, м), 1,47 (3H, с), 1,28 (3H, с), 1,24-1,34 (2H, м), 1,15 (3H, с), 1,10 (3H, с), 0,93-1,00 (1H, м), 0,66 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,4 мин; Скорость потока: 2,3 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,38 мин, m/z=490,4 [M+H]+, чистота=100% (214, 254 нм).
Пример 23.
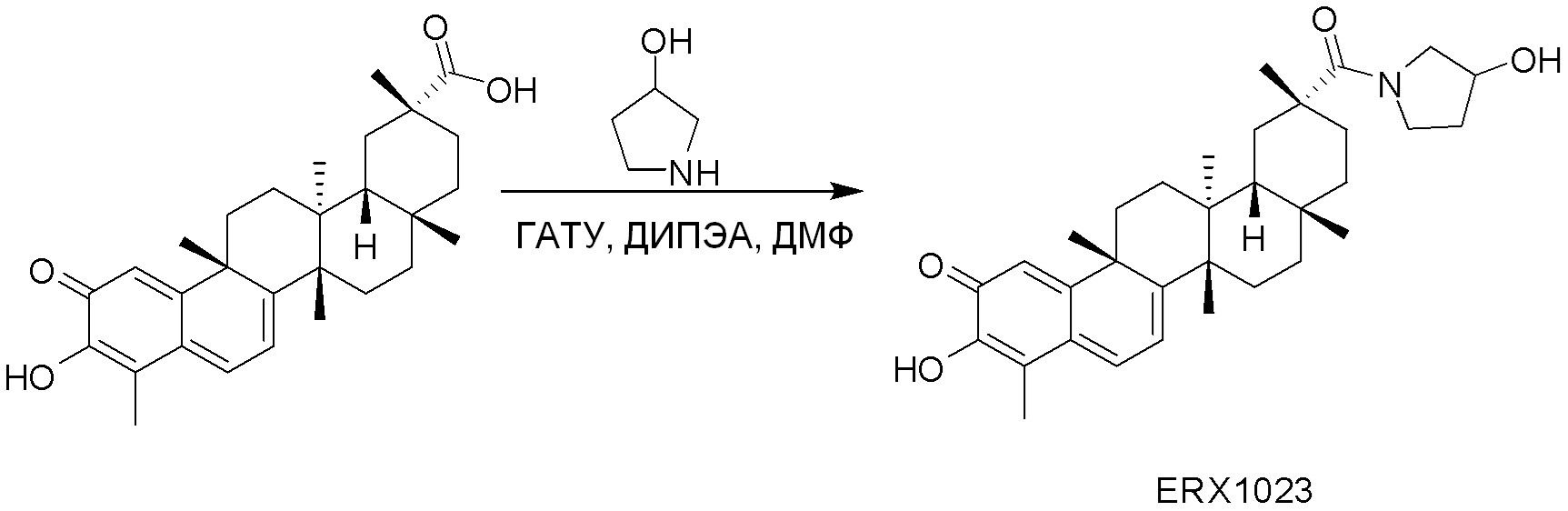
К раствору целастрола (300 мг, 0,666 ммоль) в ДМФ (10 мл) добавляют 3-гидроксипирролидин (116 мг, 1,33 ммоль), ГАТУ (279 мг, 0,73 ммоль), затем ДИПЭА (172 мг, 0,24 мл, 1,33 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (300 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:5) с получением продукта (110 мг, 0,212 ммоль, Выход=32%) в виде желтого твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 7,04 (1H, д, J=7,0 Гц), 6,95 (1H, с), 6,51&6,46 (1H, с), 6,35 (1H, д, J=7,0 Гц), 4,33-4,55 (1H, м), 3,15-3,95 (1H, м), 2,50-3,05 (1H, м), 2,20 (3H, с), 1,20-2,50 (16H, м), 1,27 (3H, с), 1,25 (3H, с), 1,20 (3H, с), 1,13 (3H, с), 0,93-1,01 (1H, м), 0,61&0,59&0,53 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,4 мин; Скорость потока: 2,3 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,23 мин, m/z=520,3 [M+H]+, чистота=100% (214,254 нм).
Пример 24.
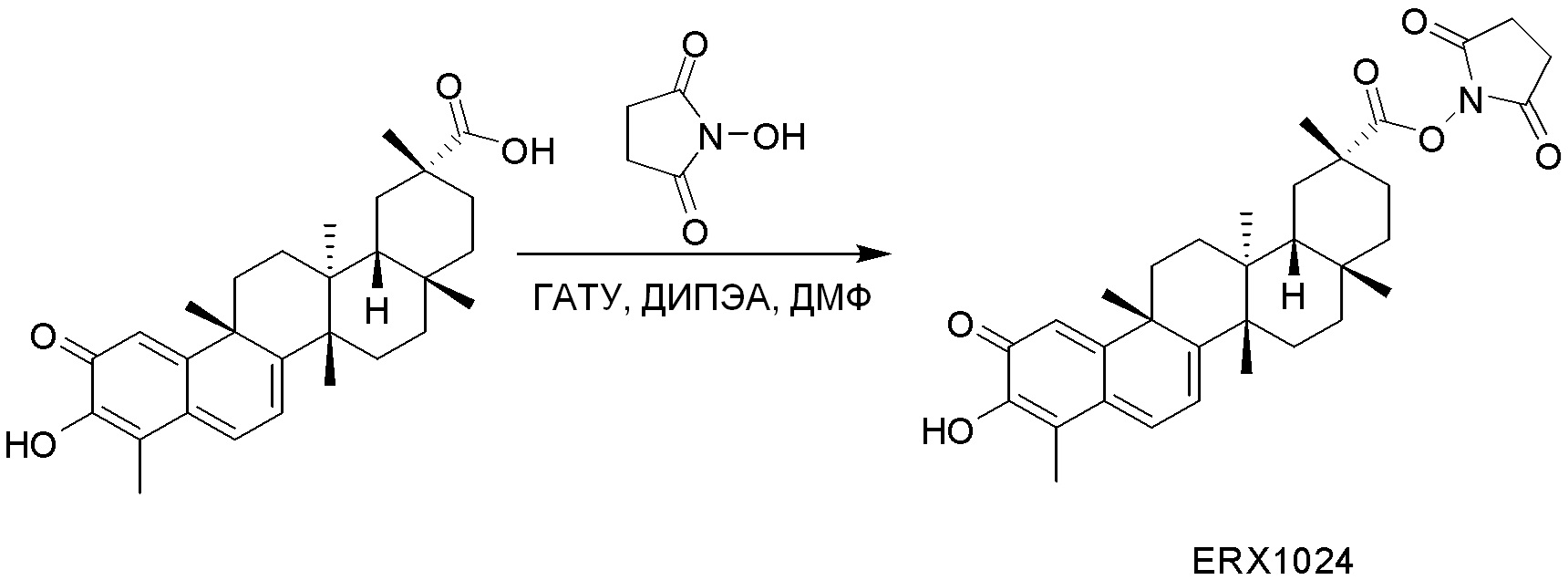
К раствору целастрола (200 мг, 0,444 ммоль) в ДМФ (15 мл) добавляют N-гидроксисукцинимид (153 мг, 1,33 ммоль), ГАТУ (185 мг, 0,48 ммоль), затем ДИПЭА (115 мг, 0,16 мл, 0,89 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (300 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2 /MeOH=40:1) с получением продукта (80 мг, 0,146 ммоль, Выход=33%) в виде желтого твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 7,01 (1H, дд, J=7,2, 1,0 Гц), 6,98 (1H, с), 6,57 (1H, д, J=1,0 Гц), 6,35 (1H, д, J=7,2 Гц), 2,70-2,90 (4H, м), 2,57 (1H, д, J=15,9 Гц), 2,28-2,35 (1H, м), 2,21 (3H, с), 1,48-2,20 (11H, м), 1,46 (6H, с), 1,25-1,30 (1H, м), 1,28 (3H, с), 1,12 (3H, с), 0,99-1,06 (1H, м), 0,71 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2,2 мл/мин; Колонка: Poroshell 120 EC-C18, 4,6×30 мм, 2,7 мкм): ву=1,97 мин, m/z=548,3 [M+H]+, чистота=100% (214 нм), 97,26% (254 нм).
Пример 25.
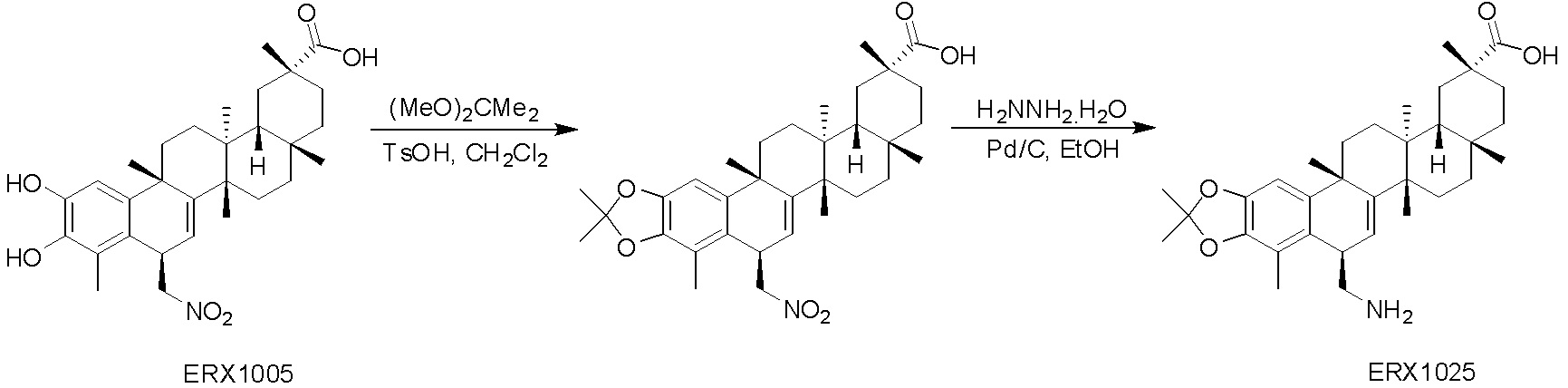
К раствору ERX1005 (500 мг, 0,97 ммоль) в CH2Cl2 (10 мл) добавляют (MeO)2CMe2 (1,01 г, 9,7 ммоль), затем p-TsOH.H2O (18 мг, 0,1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Раствор разбавляют CH2Cl2 (200 мл), промывают насыщ. NaHCO3 (100 мл), затем насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/EtOAc=10:1) с получением промежуточного соединения (350 мг, 0,635 ммоль, Выход=65%) в виде белого твердого вещества.
К раствору промежуточного соединения (300 мг, 0,54 ммоль) в EtOH (20 мл) добавляют Pd/C (50 мг), затем H2NNH2.H2O (270 мг, 5,4 ммоль). Реакционную смесь перемешивают при 75°C в течение ночи. Реакционный раствор фильтруют и концентрируют в вакууме. Остаток разбавляют CH2Cl2 (200 мл), промывают водой (2×100 мл), затем насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (CH2Cl2/MeOH=30:1) с получением продукта (160 мг, 0,29 ммоль, Выход=57%) в виде белого твердого вещества.1Н ЯМР δ (400 МГц, d4-MeOD): 6,63 (1H, с), 5,90 (1H, д, J=5,9 Гц), 3,53-3,60 (1H, м), 3,01 (1H, дд, J=12,0, 3,4 Гц), 2,43-2,55 (2H, м), 2,02-2,26 (3H, м), 2,06 (3H, с), 1,79-1,95 (3H, м), 1,54-1,76 (6H, м), 1,67 (3H, с), 1,61 (3H, с), 1,47 (3H, с), 1,43-1,51 (1H, м), 1,30-1,40 (2H, м), 1,29 (3H, с), 1,12 (3H, с), 1,10 (3H, с), 0,85-0,92 (1H, м), 0,82 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,7 мин; Скорость потока: 2,2 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=1,98 мин, m/z=522,3 [M+H]+, чистота=100% (214, 254 нм).
Пример 26.
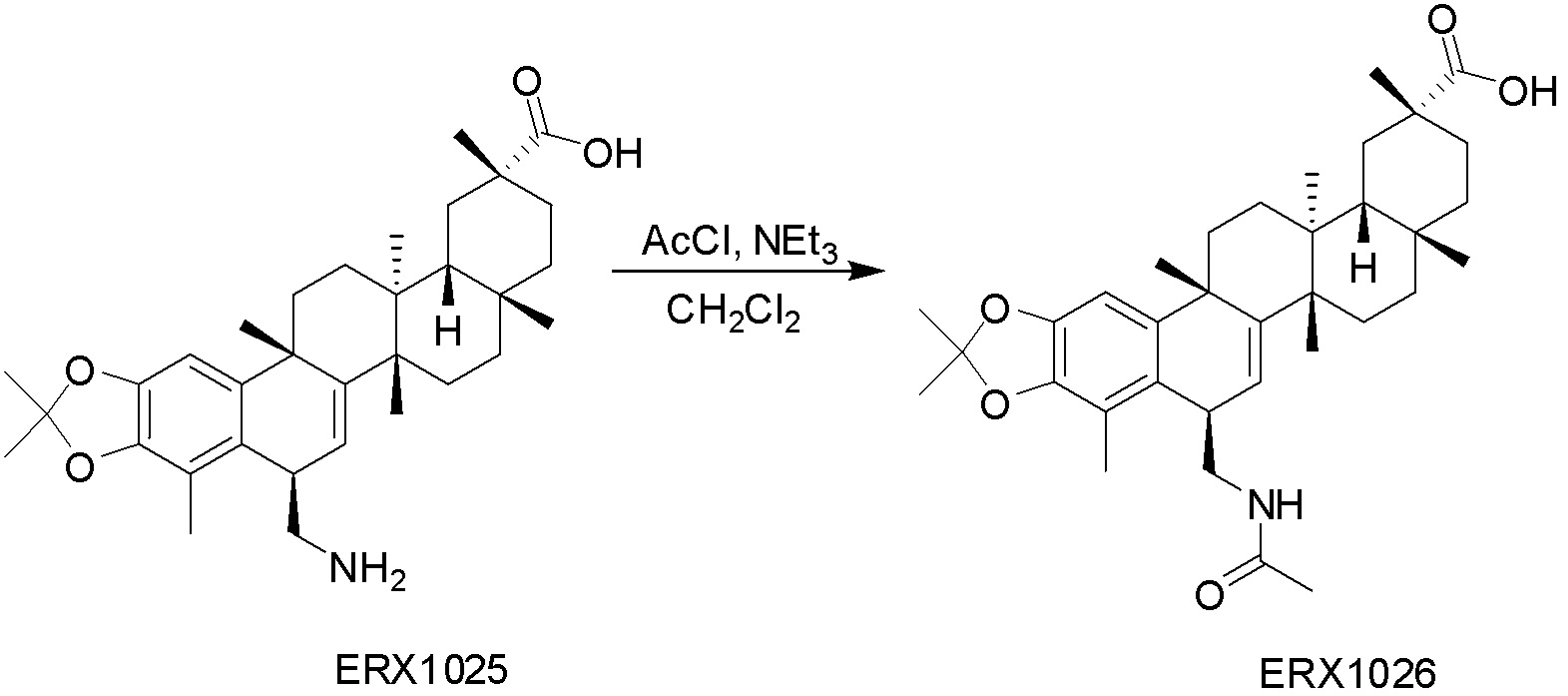
К раствору ERX1025 (90 мг, 0,17 ммоль) в CH2Cl2 (10 мл) добавляют NEt3 (34 мг, 0,34 ммоль), затем AcCl (20 мг, 0,26 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 минут. Раствор разбавляют CH2Cl2 (100 мл), промывают насыщ. NaHCO3 (50 мл) затем насыщенным раствором соли (50 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/EtOAc=10:1) с получением продукта (60 мг, 0,106 ммоль, Выход=63%) в виде белого твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 6,64 (1H, с), 6,24 (1H, т, J=5,6 Гц), 5,67 (1H, д, J=6,5 Гц), 3,68-3,75 (1H, м), 3,45-3,53 (1H, м), 3,05-3,14 (1H, м), 2,39 (1H, д, J=16,0 Гц), 2,27 (3H, с), 1,98-2,12 (2H, м), 2,05 (3H, с), 1,68 (3H, с), 1,66 (3H, с), 1,47 (3H, с), 1,04-1,82 (12H, м), 1,16 (6H, с), 1,01 (3H, с), 0,72-0,80 (1H, м), 0,45 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (10 мМ гидрокарбоната аммония); B: АЦН; Градиент: 5%-95% B за 1,5 мин; Скорость потока: 2,0 мл/мин; Колонка: XBridge C18, 4,6×50 мм, 3,5 мкм): ву=2,17 мин, m/z=564,4 [M+H]+, чистота=100% (214, 254 нм).
Пример 27.
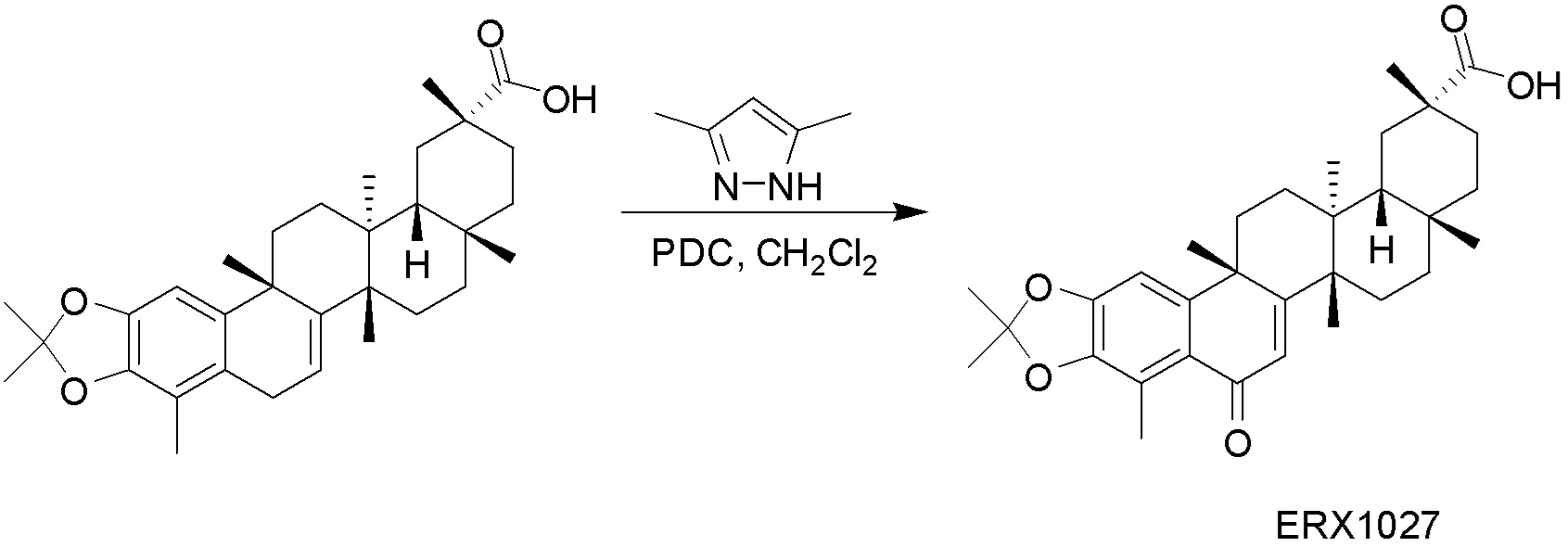
К раствору SM (860 мг, 1,746 ммоль) в CH2Cl2 (20 мл) добавляют 3,5-диметилпиразол (336 мг, 3,492 ммоль), затем PDC (647 мг, 1,746 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Раствор фильтруют через целит и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетат=4:1) с получением продукта (410 мг, 0,809 ммоль, Выход=46%) в виде белого твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 6,72 (1H, с), 6,24 (1H, с), 2,55 (3H, с), 2,41 (1H, д, J=15,6 Гц), 1,25-2,20 (13H, м), 1,70 (3H, с), 1,67 (3H, с), 1,52 (3H, с), 1,28 (3H, с), 1,16 (3H, с), 1,09 (3H, с), 0,91-0,99 (1H, м), 0,66 (3H, с); ЖХ-МС (Подвижная фаза: A: H2O (0,01% ТФК); B: MeCN (0,01% ТФК); Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2 мл/мин; Колонка: SunFire C18 50×4,6 мм, 3,5 мкм): ву=2,39 мин, m/z=507,3 [M+H]+, чистота=99,28% (214 нм), 100% (254 нм).
Пример 28.
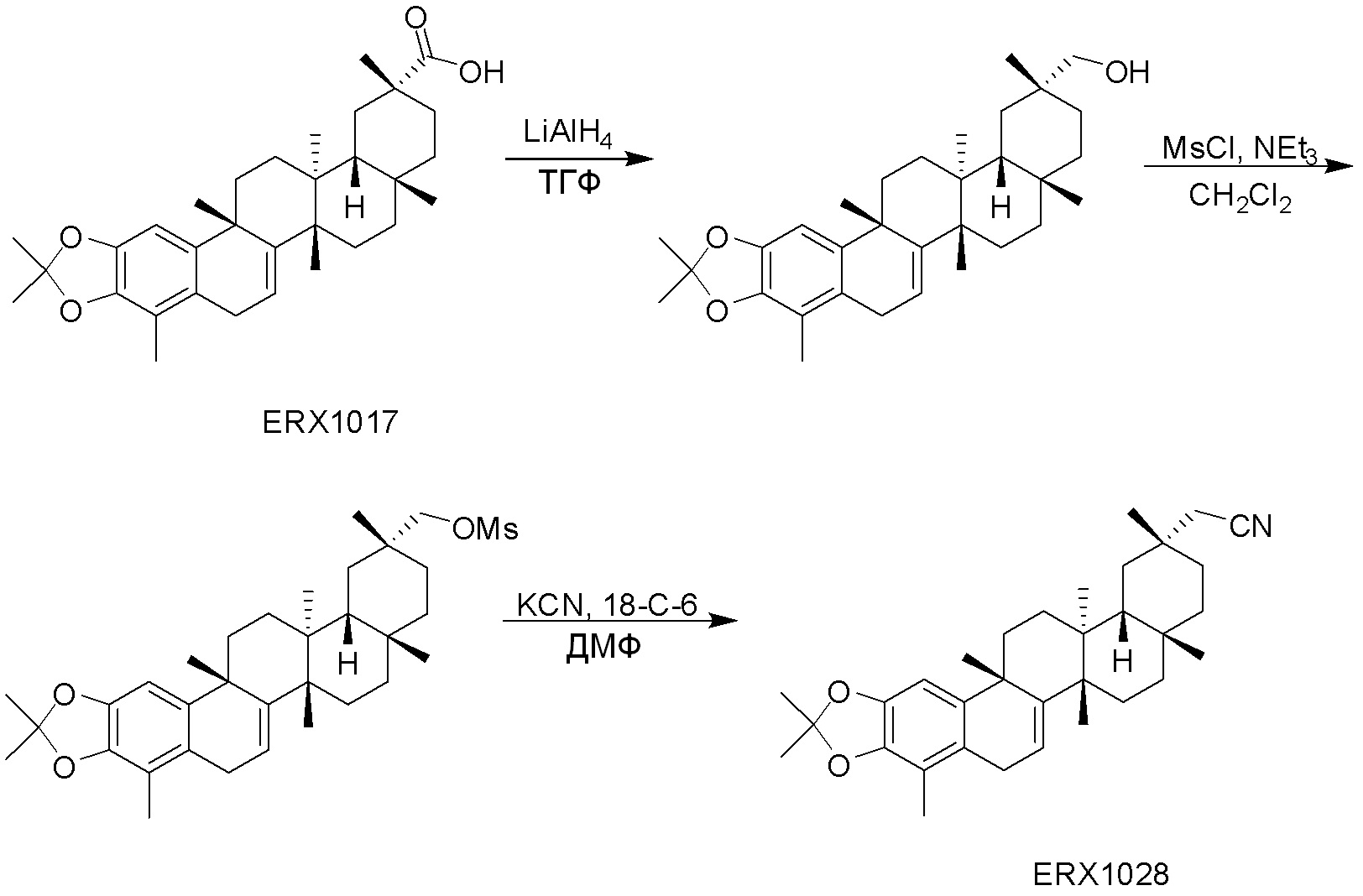
К раствору ERX1017 (300 мг, 0,61 ммоль) в ТГФ (10 мл) добавляют LiAlH4 (70 мг, 1,83 ммоль) порциями. Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Реакцию гасят добавлением воды (5 мл). Раствор разбавляют EtOAc (200 мл), фильтруют. Фильтрат отделяют, и органический слой промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/EtOAc=10:1) с получением промежуточного соединения (180 мг, 0,376 ммоль, Выход=62%) в виде белого твердого вещества.
К раствору промежуточного соединения (150 мг, 0,31 ммоль) в CH2Cl2 (10 мл) добавляют NEt3 (63 мг, 0,62 ммоль), затем MsCl (71 мг, 0,62 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Раствор разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/EtOAc=10:1) с получением промежуточного соединения (160 мг, 0,287 ммоль, Выход=93%) в виде белого твердого вещества.
К раствору промежуточного соединения (170 мг, 0,305 ммоль) в ДМФ (5 мл) добавляют KCN (99 мг, 1,528 ммоль) и 18-Краун-6 (403 мг, 1,528). Реакционную смесь нагревают при 120°C в микроволновом реакторе в течение 6 часов. Раствор разбавляют EtOAc (200 мл), промывают водой (2×100 мл), затем насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ВЭЖХ с получением продукта (110 мг, 0,226 ммоль, Выход=74%) в виде белого твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 6,65 (1H, с), 5,80 (1H, д, J=4,7 Гц), 3,30 (1H, дд, J=20,8, 6,3 Гц), 3,01 (1H, д, J=20,1 Гц), 2,46 (1H, AB, J=16,5 Гц), 2,19 (1H, AB, J=16,5 Гц), 2,11 (3H, с), 2,00-2,07 (2H, м), 1,50-1,85 (9H, м), 1,68 (3H, с), 1,64 (3H, с), 1,25-1,38 (3H, м), 1,31 (3H, с), 1,29 (3H, с), 1,16 (3H, с), 1,14 (3H, с), 0,97-1,03 (1H, м), 0,87 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2,2 мл/мин; Колонка: Poroshell 120 EC-C18, 4,6×30 мм, 2,7 мкм): ву=2,35 мин, пики МС не интегрированы, чистота=100% (214, 254 нм).
Пример 29.
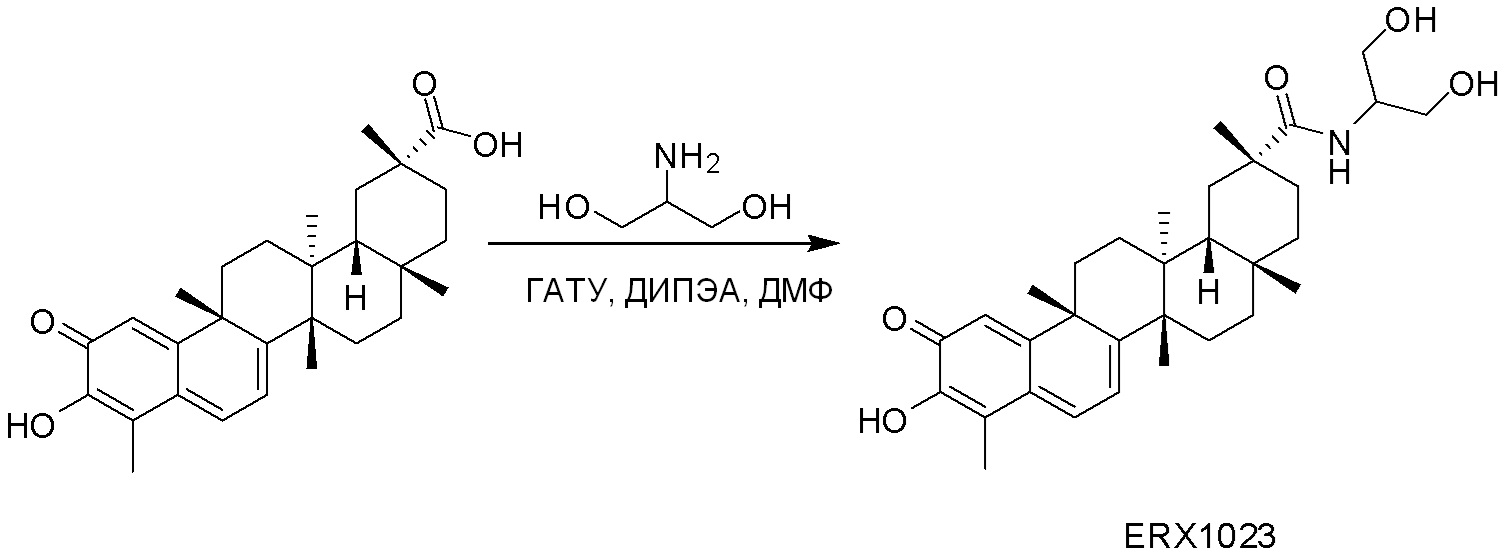
К раствору целастрола (150 мг, 0,33 ммоль) в ДМФ (10 мл) добавляют 2-амино-1,3-пропандиола (91 мг, 1,0 ммоль), ГАТУ (139 мг, 0,36 ммоль), затем ДИПЭА (129 мг, 0,17 мл, 1,0 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают водой (2×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2/MeOH=8:1) с получением продукта (60 мг, 0,115 ммоль, Выход=35%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,03 (1H, д, J=7,1 Гц), 7,00 (1H, с), 6,61 (1H, д, J=3,0 Гц), 6,53 (1H, с), 6,35 (1H, д, J=7,1 Гц), 3,45-3,90 (5H, м), 3,00-3,45 (2H, м), 2,43 (1H, д, J=15,7 Гц), 2,21 (3H, с), 1,47-2,18 (12H, м), 1,43 (3H, с), 1,26 (3H, с), 1,24-1,28 (1H, м), 1,18 (3H, с), 1,12 (3H, с), 0,95-1,05 (1H, м), 0,66 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК) B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,4 мин; Скорость потока: 2,3 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,08 мин, m/z=524,3 [M+H]+, чистота=95,73% (214 нм).
Пример 30.
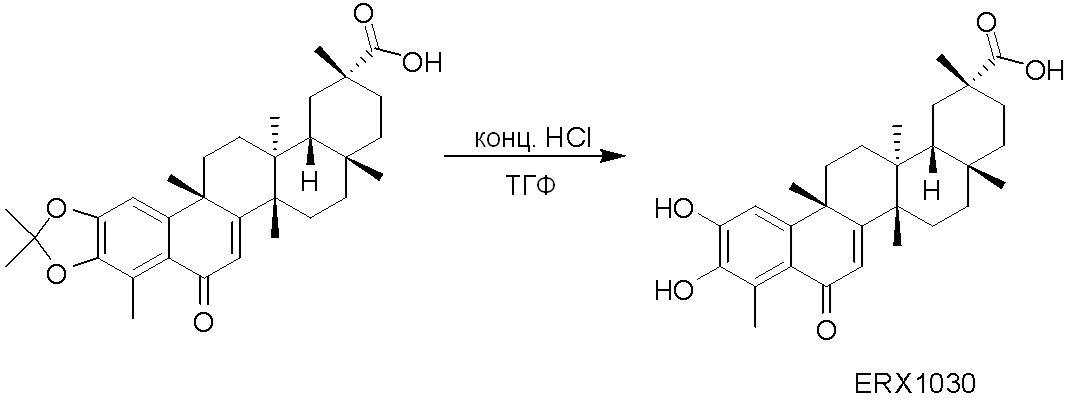
К раствору SM (90 мг, 0,178 ммоль) в ТГФ (5 мл) добавляют конц. HCl (1 мл). Реакционную смесь перемешивают при 70°C в течение 2 дней. Затем большую часть ТГФ растворителя удаляют в вакууме. Остаток разбавляют CH2Cl2 (200 мл), отделяют водный слой, сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2/MeOH=10:1) с получением продукта (4,4 мг, 0,00943 ммоль, Выход=5,3%) в виде бледно-желтого твердого вещества.1Н ЯМР δ (400 МГц, CD3OD): 6,86 (1H, с), 6,18 (1H, с), 4,62 (2H, ш), 2,55 (3H, с), 1,40-2,50 (14H, м), 1,54 (3H, с), 1,35 (3H, с), 1,18 (3H, с), 1,13 (3H, с), 0,93-1,00 (1H, м), 0,76 (3H, с); ЖХ-МС (Подвижная фаза: A:H2O (0,01% ТФК); B:MeCN (0,01% ТФК); Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2 мл/мин; Колонка: SunFire C18 50×4,6 мм, 3,5 мкм): ву=2,05 мин, m/z=467 [M+H]+, чистота=97,30% 9214 нм), 97,25% (254 нм).
Пример 31.
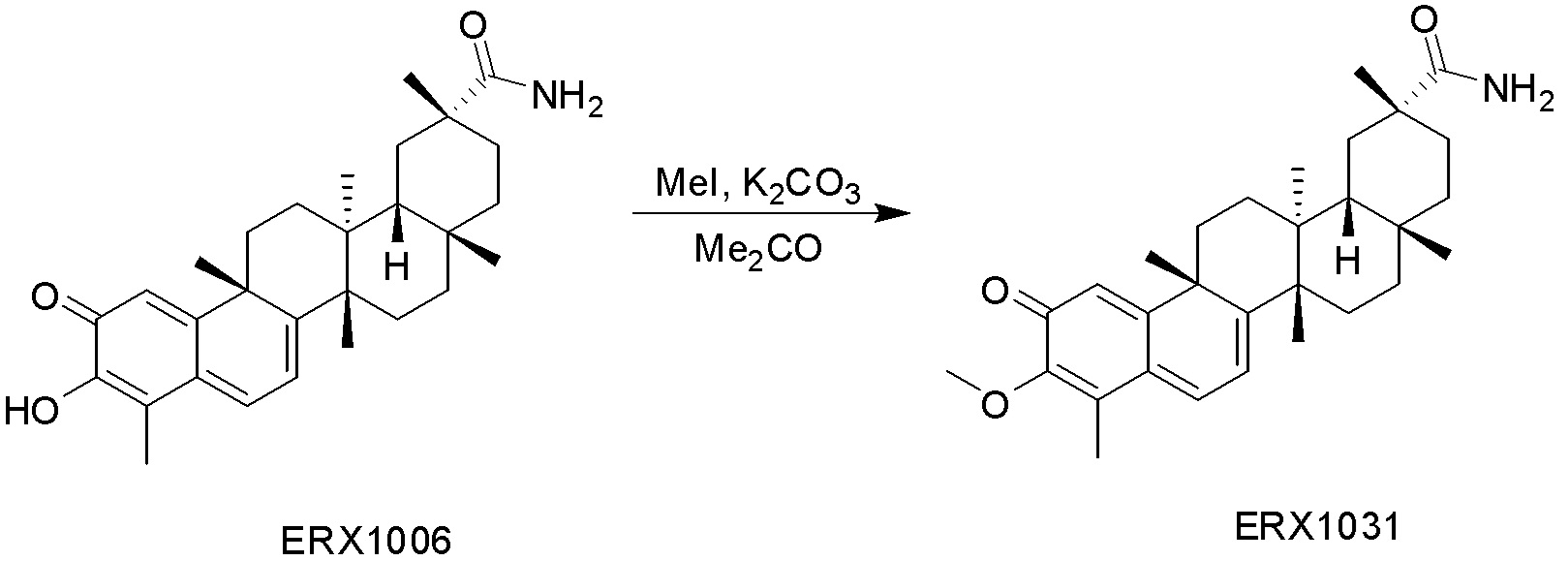
К раствору ERX1006 (60 мг, 0,133 ммоль) в ацетоне (2 мл) добавляют K2CO3 (37 мг, 0,267 ммоль), затем MeI (1 мл). Реакционную смесь перемешивают при 40°C for в течение ночи. Смесь разбавляют CH2Cl2 (300 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:2) с получением продукта (38,4 мг, 0,0826 ммоль, Выход=62%) в виде желтого твердого вещества.
1Н ЯМР δ (400 МГц, CDCl3): 6,96 (1H, дд, J=7,0, 1,0 Гц), 6,40 (1H, д, J=1,0 Гц), 6,27 (1H, д, J=7,0 Гц), 5,72 (1H, ш), 5,55 (1H, ш), 3,84 (3H, с), 2,40 (1H, д, J=15,7 Гц), 2,22 (3H, с), 1,45-2,13 (13H, м), 1,44 (3H, с), 1,25 (3H, с), 1,20 (3H, с), 1,11 (3H, с), 0,97-1,04 (1H, м), 0,73 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,4 мин; Скорость потока: 2,3 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,16 мин, m/z=464,3 [M+H]+, чистота=100% (214, 254 нм).
Пример 32.
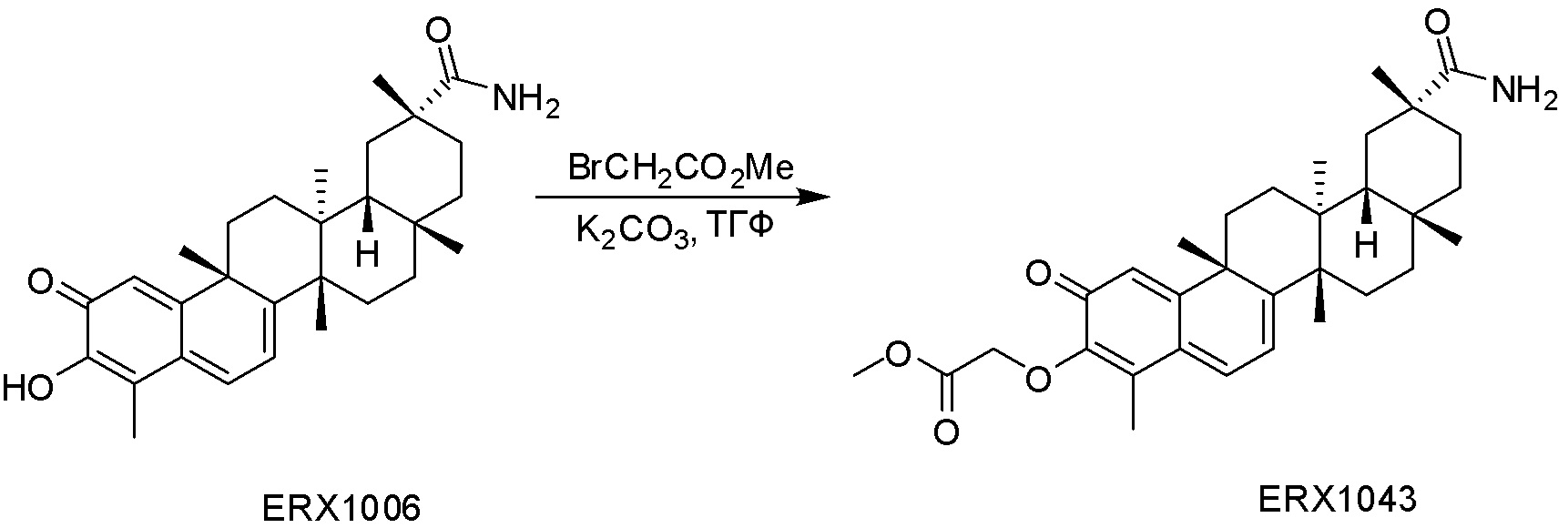
К раствору ERX1006 (100 мг, 0,22 ммоль) в ТГФ (15 мл) добавляют K2CO3 (46 мг, 0,33 ммоль), затем BrCH2CO2Me (51 мг, 0,032 мл, 0,33 ммоль). Реакционную смесь перемешивают при 50°C в течение ночи. Смесь разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/EtOAc=1:1) с получением продукта (40 мг, 0,077 ммоль, Выход=35%) в виде желтого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,01 (1H, д, J=7,1 Гц), 6,36 (1H, с), 6,29 (1H, д, J=7,1 Гц), 5,70 (1H, ш), 5,39 (1H, ш), 4,85 (2H, с), 3,77 (3H, с), 2,40 (1H, д, J=15,4 Гц), 2,31 (3H, с), 1,80-2,12 (7H, м), 1,46-1,72 (6H, м), 1,43 (3H, с), 1,26 (3H, с), 1,20 (3H, с), 1,11 (3H, с), 0,88-1,05 (1H, м), 0,74 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,4 мин; Скорость потока: 2,3 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,16 мин, m/z=522,3 [M+H]+, чистота=100% (214,254 нм).
Пример 33.
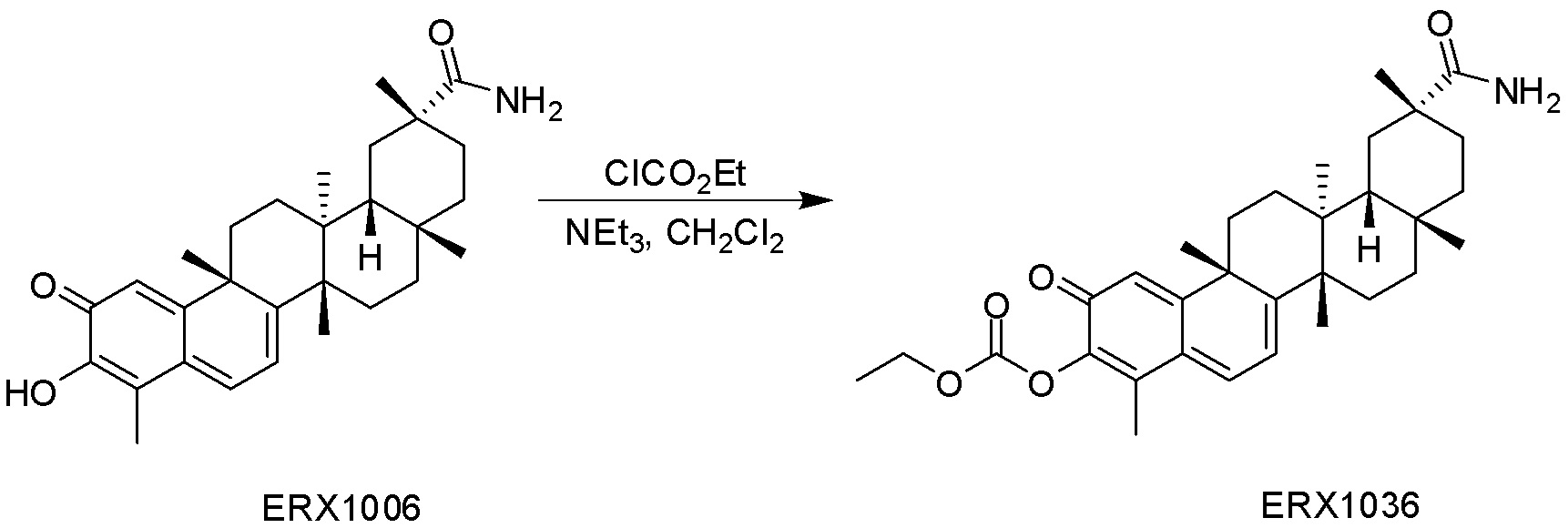
К раствору ERX1006 (300 мг, 0,667 ммоль) в CH2Cl2 (5 мл) добавляют Et3N (135 мг, 0,19 мл, 1,334 ммоль), затем ClCO2Et (145 мг, 0,13 мл, 1,334 ммоль) по каплям при 0°C. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Смесь разбавляют CH2Cl2 (300 мл), промывают насыщенным раствором соли (200 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2 /MeOH=10:1) с получением продукта (150,6 мг, 0,289 ммоль, Выход=43%) в виде желтого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 7,06 (1H, дд, J=7,0, 1,0 Гц), 6,47 (1H, д, J=1,0 Гц), 6,33 (1H, д, J=7,0 Гц), 5,67 (1H, ш), 5,26 (1H, ш), 4,32 (2H, кв, J=7,2 Гц), 2,39 (1H, д, J=15,6 Гц), 2,21 (3H, с), 1,49-2,04 (13H, м), 1,46 (3H, с), 1,39 (1H, т, J=7,2 Гц), 1,27 (3H, с), 1,21 (3H, с), 1,12 (3H, с), 0,99-1,05 (1H, м), 0,76 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,4 мин; Скорость потока: 2,3 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,15 мин, m/z=522,3 [M+H]+, чистота=100% (214, 254 нм).
Пример 34.
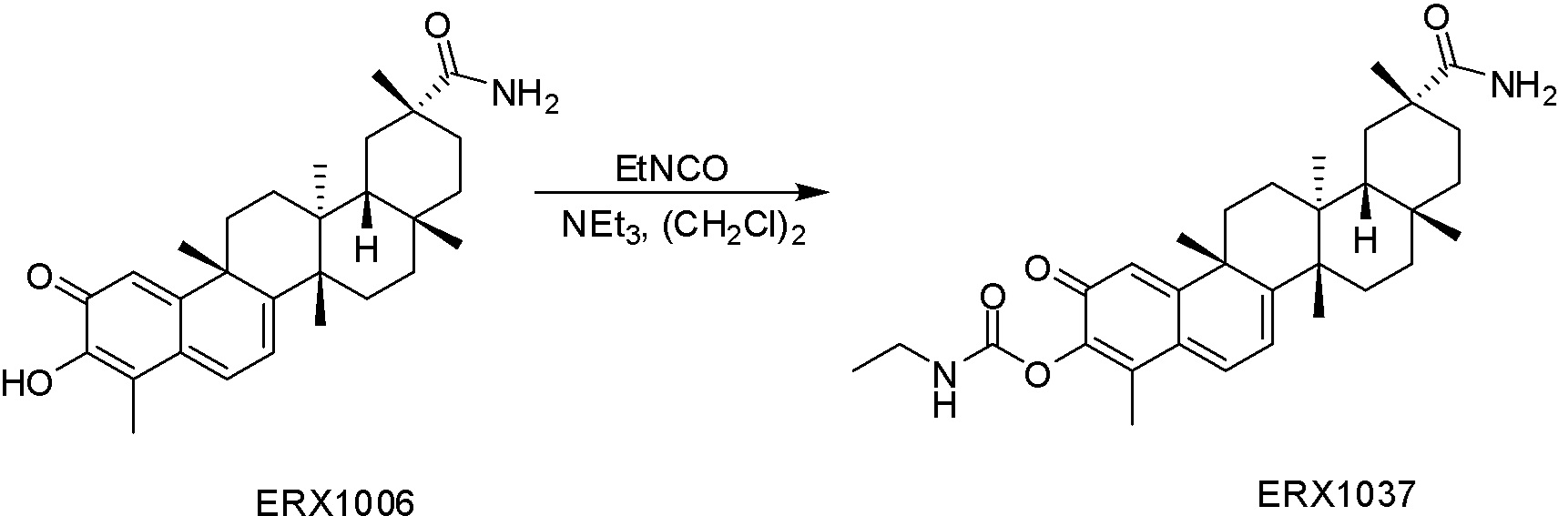
К раствору ERX1006 (300 мг, 0,667 ммоль) в (CH2Cl)2 (10 мл) добавляют Et3N (202 мг, 0,28 мл, 2,0 ммоль), затем EtNCO (142 мг, 0,158 мл, 2,0 ммоль). Реакционную смесь перемешивают при 55°C в течение ночи. Смесь разбавляют CH2Cl2 (300 мл), промывают насыщенным раствором соли (200 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2/MeOH=20:1) для удаления непрореагировавшего SM. Затем неочищенный продукт нагревают при 80°C с 20 мл этилацетата. Твердое вещество фильтруют и затем очищают преп-ТСХ (этилацетат/CH2Cl2=3:1) с получением продукта (74,7 мг, 0,143 ммоль, Выход=22%) в виде желтого твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 7,03 (1H, д, J=7,2 Гц), 6,45 (1H, с), 6,31 (1H, д, J=7,2 Гц), 5,70 (1H, ш), 5,38 (1H, ш), 5,26 (1H, т, J=5,0 Гц), 3,26-3,45 (2H, м), 2,38 (1H, д, J=15,7 Гц), 2,18 (3H, с), 1,47-2,15 (13H, м), 1,45 (3H, с), 1,26 (3H, с), 1,22 (3H, т, J=7,2 Гц), 1,20 (3H, с), 1,12 (3H, с), 0,98-1,05 (1H, м), 0,75 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,4 мин; Скорость потока: 2,3 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм; ву=2,06 мин, m/z=521,4 [M+H]+, чистота=100% (214,254 нм).
Пример 35.
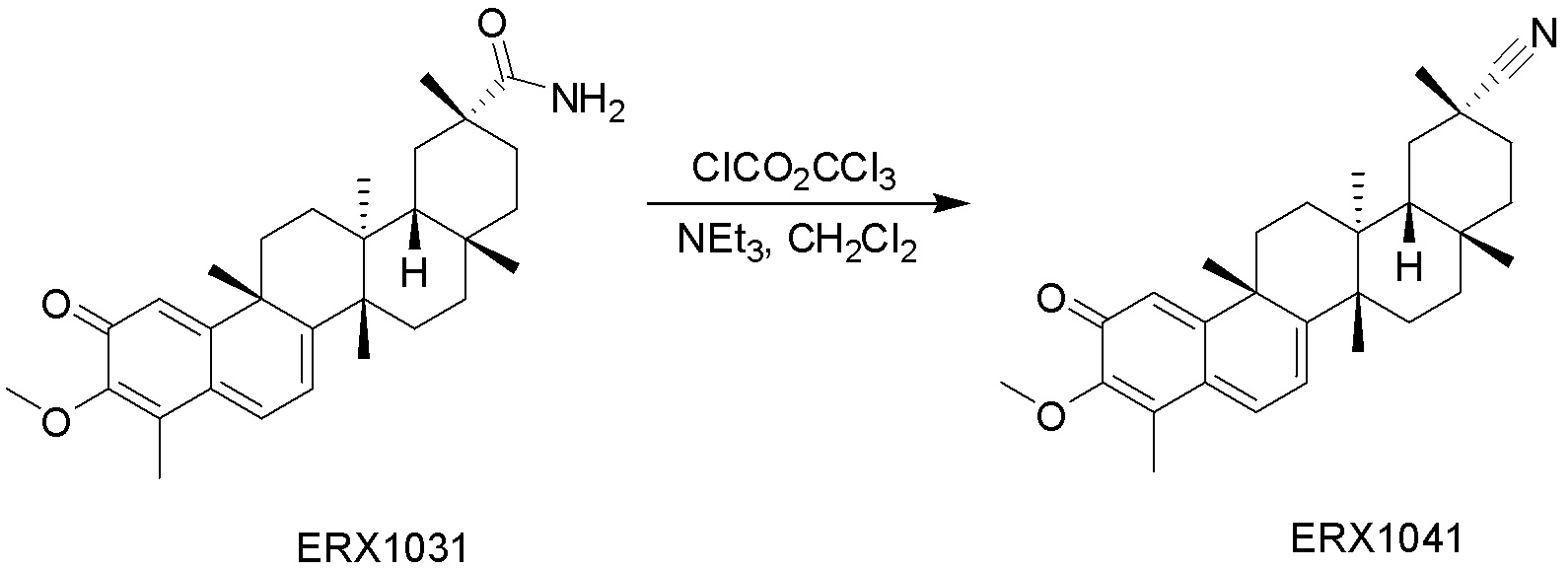
К раствору SM (160 мг, 0,345 ммоль) в CH2Cl2 (5 мл) добавляют ClCO2CCl3 (341 мг, 0,21 мл, 1,725 ммоль), затем NEt3 (175 мг, 0,24 мл, 1,725 ммоль) по каплям при 0°C. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Смесь разбавляют CH2Cl2 (300 мл), промывают насыщенным раствором соли (200 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2/MeOH=30:1) с получением продукта (71 мг, 0,159 ммоль, Выход=46%) в виде желтого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 6,97 (1H, д, J=6,9 Гц), 6,42 (1H, с), 6,32 (1H, д, J=6,9 Гц), 3,85 (3H, с), 2,22 (3H, с), 2,09-2,18 (3H, м), 1,89-2,01 (3H, м), 1,53-1,81 (8H, м), 1,47 (3H, с), 1,44 (3H, с), 1,29 (3H, с), 1,08-1,15 (1H, м), 1,09 (3H, с), 1,05 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,4 мин; Скорость потока: 2,3 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,33 мин, m/z=446,3 [M+H]+, чистота=100% (214, 254 нм).
Пример 36.
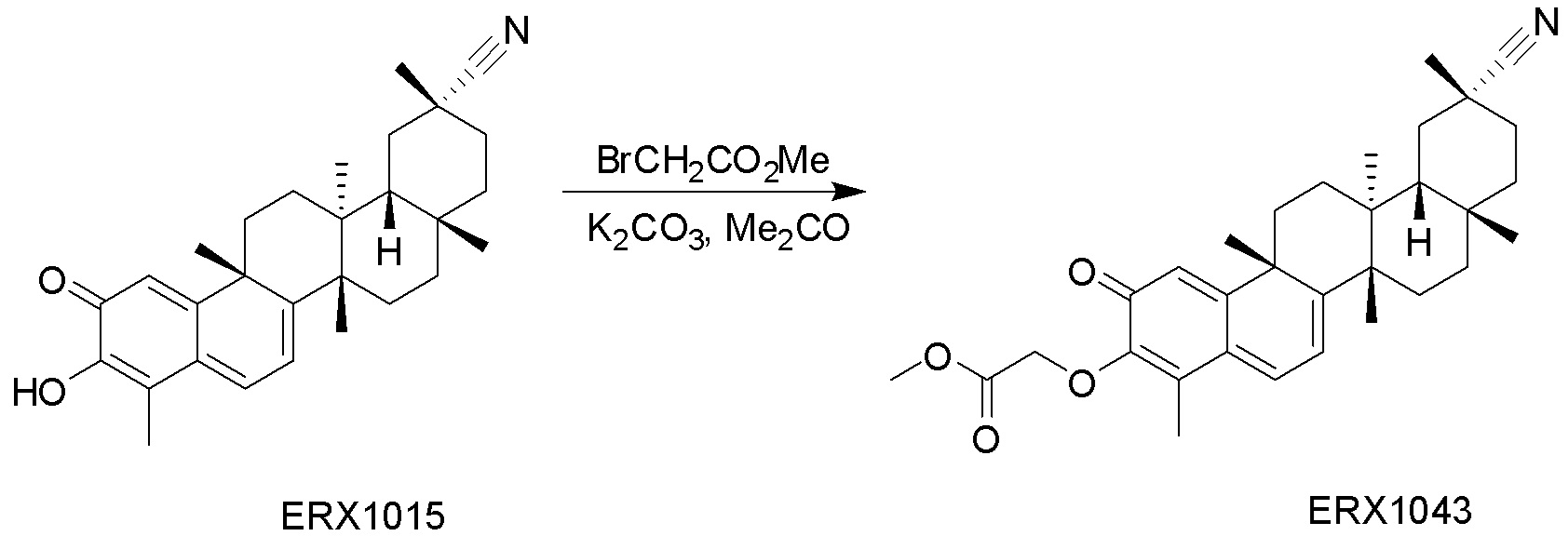
К раствору SM (100 мг, 0,232 ммоль) в ацетоне (2 мл) добавляют K2CO3 (64 мг, 0,463 ммоль), затем BrCH2CO2Me (71 мг, 0,044 мл, 0,463 ммоль). Реакционную смесь перемешивают при 55°C в течение ночи. Смесь разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2/EtOAc=10:1) с получением неочищенного продукта. Неочищенный продукт затем промывают Et2O (2×2 мл) с получением чистого продукта (55 мг, 0,109 ммоль, Выход=47%) в виде желтого твердого вещества.
1Н ЯМР δ (400 МГц, CDCl3): 7,03 (1H, дд, J=7,0, 1,0 Гц), 6,38 (1H, д, J=1,0 Гц), 6,33 (1H, д, J=7,0 Гц), 4,85 (1H, AB, J=16,5 Гц), 4,84 (1H, AB, J=16,5 Гц), 3,77 (3H, с), 2,32 (3H, с), 2,08-2,18 (3H, м), 1,89-2,00 (3H, м), 1,52-1,81 (8H, м), 1,46 (3H, с), 1,44 (3H, с), 1,29 (3H, с), 1,08-1,15 (1H, м), 1,09 (3H, с), 1,04 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,1% ТФК); B: АЦН (0,1% ТФК); Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2,2 мл/мин; Колонка: Poroshell 120 EC-C18, 4,6×30 мм, 2,7мкм): ву=1,94 мин, m/z=504,3 [M+H]+, чистота=100% (214,254 нм).
Пример 37.

К раствору ERX1015 (120 мг, 0,278 ммоль) в CH2Cl2 (5 мл) добавляют Et3N (84 мг, 0,12 мл, 0,834 ммоль), затем ClCO2Et (91 мг, 0,834 мл, 0,834 ммоль) по каплям при 0°C. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Смесь разбавляют CH2Cl2 (300 мл), промывают насыщенным раствором соли (200 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2/MeOH=50:1) с получением продукта (97,3 мг, 0,193 ммоль, Выход=69%) в виде желтого твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 7,08 (1H, д, J=7,2 Гц), 6,49 (1H, с), 6,36 (1H, д, J=7,2 Гц), 4,32 (2H, кв, J=7,2 Гц), 2,22 (3H, с), 2,09-2,20 (3H, м), 1,89-2,03 (3H, м), 1,51-1,81 (8H, м), 1,49 (3H, с), 1,44 (3H, с), 1,39 (3H, т, J=7,2 Гц), 1,30 (3H, с), 1,07-1,15 (1H, м), 1,09 (3H, с), 1,05 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК); B: АЦН (0,01% ТФК);Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2,2 мл/мин; Колонка: Poroshell 120 EC-C18, 4,6×30 мм, 2,7 мкм): ву=1,92 мин, m/z=504,4 [M+H]+, чистота=98,02% (214 нм), 97,42% (254 нм).
Пример 38.
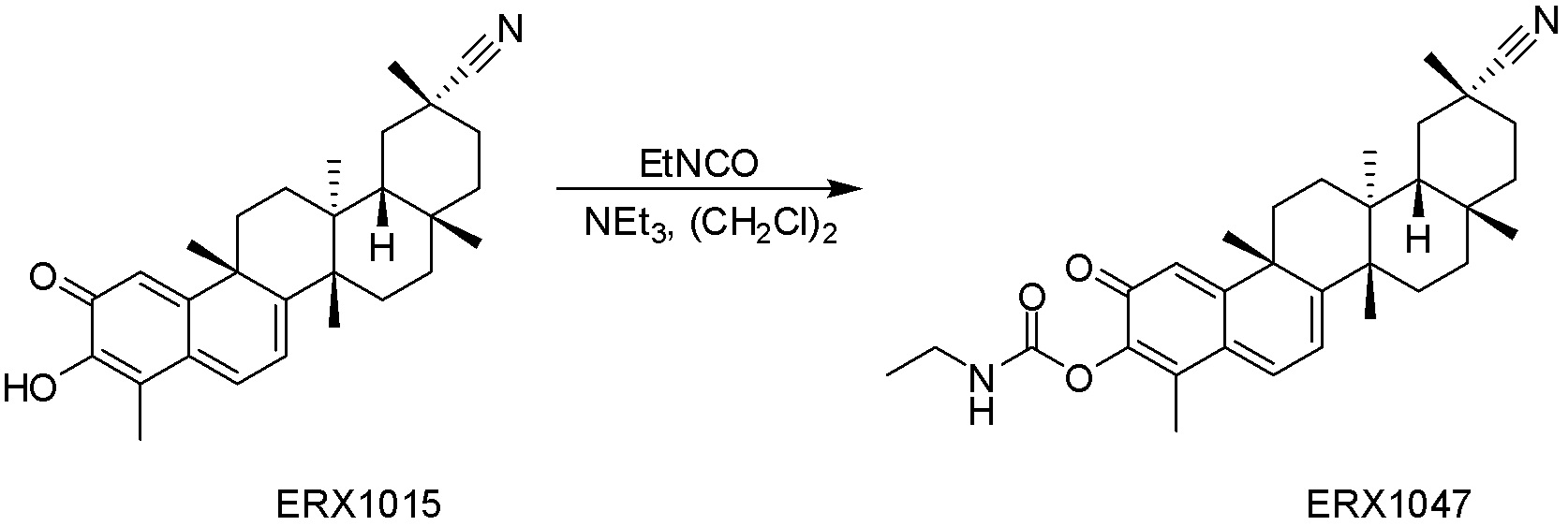
К раствору ERX1015 (100 мг, 0,232 ммоль) в (CH2Cl)2 (5 мл) добавляют Et3N (117 мг, 0,16 мл, 1,158 ммоль), затем EtNCO (82 мг, 0,0917 мл, 1,158 ммоль). Реакционную смесь перемешивают при 50°C в течение ночи. Смесь разбавляют CH2Cl2 (300 мл), промывают насыщенным раствором соли (200 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2/MeOH=20:1) с получением продукта (59,6 мг, 0,119 ммоль, Выход=51%) в виде желтого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,04 (1H, д, J=7,0 Гц), 6,47 (1H, с), 6,34 (1H, д, J=7,0 Гц), 5,17&4,71 (1H, ш), 3,19-3,36 (2H, м), 2,19 (3H, с), 2,09-2,17 (3H, м), 1,89-2,02 (4H, м), 1,54-1,81 (8H, м), 1,48 (3H, с), 1,44 (3H, с), 1,29 (3H, с), 1,20-1,27 (3H, м), 1,23&1,14 (3H, т, J=7,2 Гц), 1,09 (3H, с), 1,05 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2,2 мл/мин; Колонка: Poroshell 120 EC-C18, 4,6×30 мм, 2,7 мкм): ву=1,83 мин, m/z=503,4 [M+H]+, чистота=95,00% (214 нм), 98,55% (254 нм).
Пример 39.
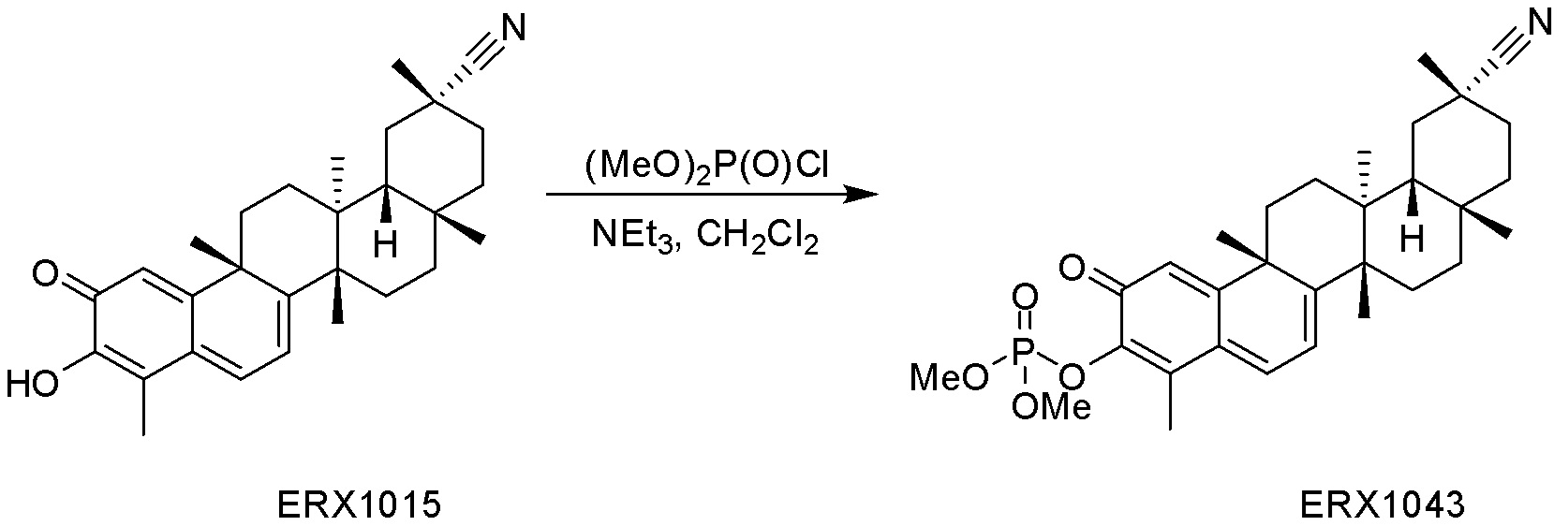
К раствору ERX1015 (100 мг, 0,23 ммоль) в CH2Cl2 (10 мл) добавляют NEt3 (47 мг, 0,065 мл, 0,46 ммоль), затем (MeO)2P(O)Cl (70 мг, 0,052 мл, 0,46 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Смесь разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/EtOAc=2:1) с получением продукта (28 мг, 0,0519 ммоль, Выход=23%) в виде желтого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 7,06 (1H, д, J=7,0 Гц), 6,47 (1H, с), 6,35 (1H, д, J=7,0 Гц), 4,00 (3H, д, J=11,4 Гц), 3,96 (3H, д, J=11,2 Гц), 2,30 (3H, д, J=1,5 Гц), 2,10-2,18 (3H, м), 1,90-2,00 (3H, м), 1,54-1,80 (8H, м), 1,47 (3H, с), 1,44 (3H, с), 1,29 (3H, с), 1,09-1,14 (1H, м), 1,09 (3H, с), 1,05 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,1% ТФК); B: АЦН (0,1% ТФК); Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2,2 мл/мин; Колонка: Poroshell 120 EC-C18, 4,6×30 мм, 2,7 мкм): ву=1,82 мин, m/z=540,3 [M+H]+, чистота=94,11% (254 нм).
Пример 40.
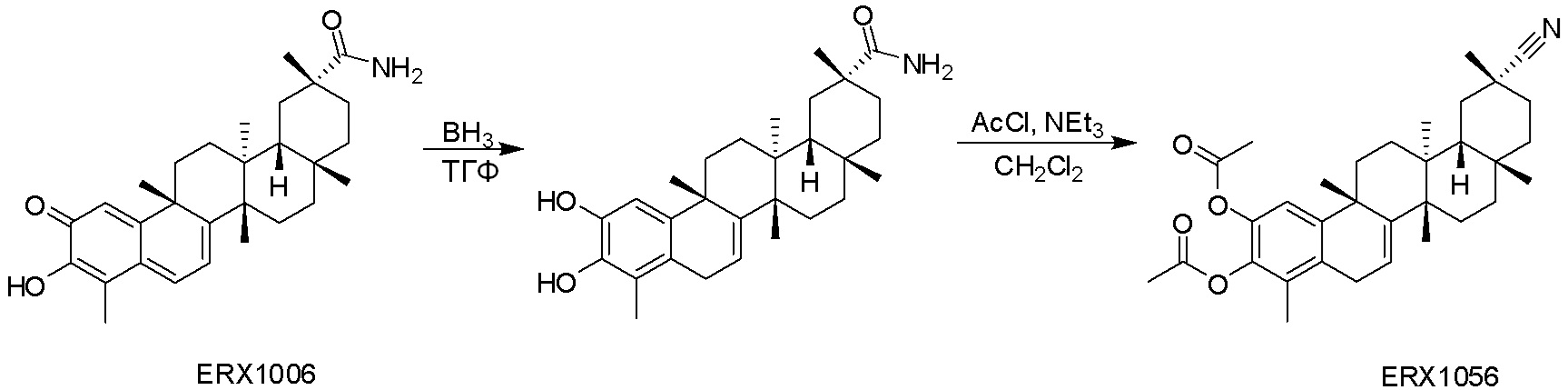
К раствору ERX1006 (250 мг, 0,56 ммоль) в ТГФ (15 мл) добавляют 1M BH3.ТГФ (1,67 мл, 1,67 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Реакцию гасят добавлением воды (5 мл). Большую часть растворителя удаляют в вакууме, и раствор подкисляют 0,1 M HCl до pH 5-6. Смесь разбавляют CH2Cl2 (200 мл), фильтруют. Фильтрат промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме с получением неочищенного продукта (250 мг, 0,554 ммоль, Вд=100%) в виде белого твердого вещества. Неочищенный продукт применяют на следующей стадии без дальнейшей очистки.
К раствору промежуточного соединения (250 мг, 0,56 ммоль) в CH2Cl2 (15 мл) добавляют NEt3 (224 мг, 0,31 мл, 2,21 ммоль), затем AcCl (174 мг, 2,21 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакцию гасят добавлением воды (5 мл). Смесь разбавляют CH2Cl2 (200 мл), промывают насыщ. Na2CO3 (2×100 мл), затем насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/EtOAc=10:1) с получением продукта (40 мг, 0,0773 ммоль, Вд=14%) в виде белого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,00 (1H, с), 5,78 (1H, д, J=6,0 Гц), 3,35 (1H, дд, J=21,0, 6,0 Гц), 3,07 (1H, д, J=21,0 Гц), 2,31 (3H, с), 2,27 (3H, с), 2,03-2,20 (4H, м), 2,07 (3H, с), 1,85-1,97 (2H, м), 1,48-1,72 (8H, м), 1,43 (3H, с), 1,36 (3H, с), 1,24 (3H, с), 1,02-1,10 (1H, м), 1,07 (3H, с), 1,06 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК); B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2,2 мл/мин; Колонка: Poroshell 120 EC-C18, 4,6×30 мм, 2,7 мкм): ву=2,06 мин, m/z=518,3 [M+H]+, чистота=97,21% (214 нм).
Пример 41.
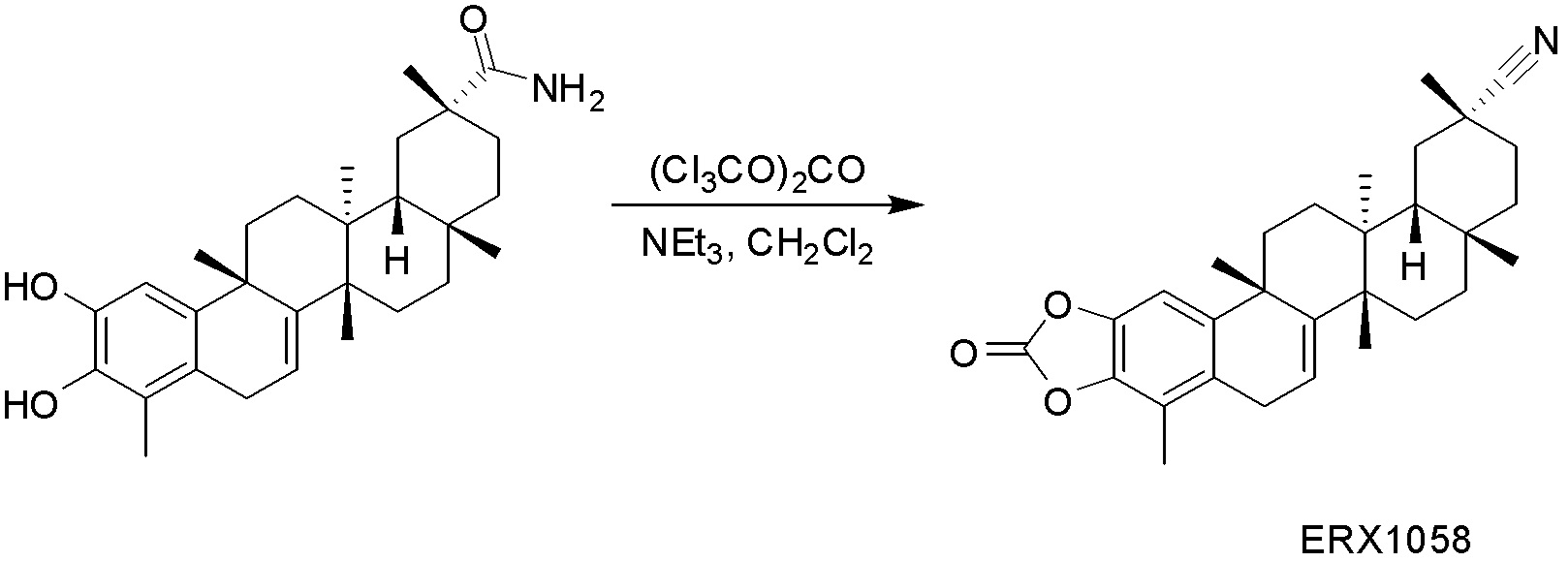
К раствору промежуточного соединения (300 мг, 0,66 ммоль) в CH2Cl2 (10 мл) добавляют NEt3 (134 мг, 0,18 мл, 1,32 ммоль), затем (Cl3CO)2CO (395 мг, 1,32 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакцию гасят добавлением воды (5 мл). Смесь разбавляют CH2Cl2 (200 мл), промывают насыщ. Na2CO3 (2×100 мл), затем насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/EtOAc=10:1) с получением продукта (70 мг, 0,152 ммоль, Вд=18%) в виде белого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 7,11 (1H, с), 5,83 (1H, д, J=6,4 Гц), 3,41 (1H, дд, J=21,0, 6,4 Гц), 3,09 (1H, д, J=21,0 Гц), 2,28 (3H, с), 2,09-2,18 (4H, м), 1,87-1,96 (2H, м), 1,49-1,72 (8H, м), 1,44 (3H, с), 1,34 (3H, с), 1,25 (3H, с), 1,06-1,11 (1H, м), 1,07 (3H, с), 1,06 (3H, с).; ЖХ-МС (Подвижная фаза: А: вода (0,1% ТФК); B: АЦН (0,1% ТФК); Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2,2 мл/мин; Колонка: Poroshell 120 EC-C18, 4,6×30 мм, 2,7 мкм): ву=2,23 мин, m/z=460,3 [M+H]+, чистота=97,77% (214 нм).
Пример 42.
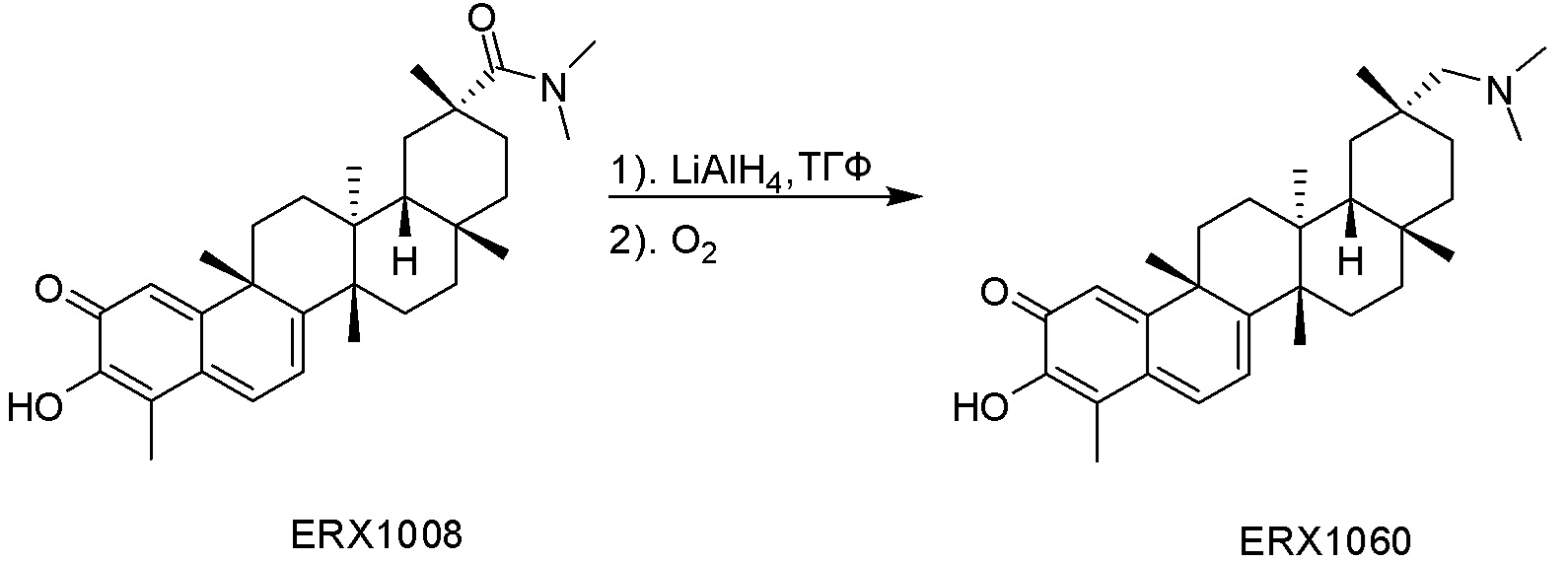
К раствору ERX1008 (477 мг, 1,0 ммоль) в безводном ТГФ (40 мл) добавляют LiAlH4 (2,38 г, 75 ммоль). Смесь кипятят с обратным холодильником в течение ночи. Реакционную смесь гасят насыщ. раствором NH4Cl. Смесь нагревают при 50°C в течение 2 часов и фильтруют через тонкий слой силикагеля. Твердое вещество промывают ТГФ (3×50 мл). Объединенный фильтрат концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2: MeOH=10:1) с получением продукта (23,9 мг, 0,0515 ммоль, Вд=5%) в виде красного твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 7,03 (1H, д, J=7,1 Гц), 6,96 (1H, с), 6,52 (1H, с), 6,39 (1H, д, J=7,1 Гц), 2,34 (6H, ш), 2,22 (3H, с), 1,95-2,25 (4H, м), 1,35-1,88 (12H, м), 1,44 (3H, с), 1,42 (3H, с), 1,24 (3H, с), 1,09 (3H, с), 0,97-1,03 (1H, м), 0,79 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК) B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,4 мин; Скорость потока: 2,3 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=1,83 мин, m/z=480,4 [M+H]+, чистота=98,20% (214 нм), 99,51% (254 нм).
Пример 43.
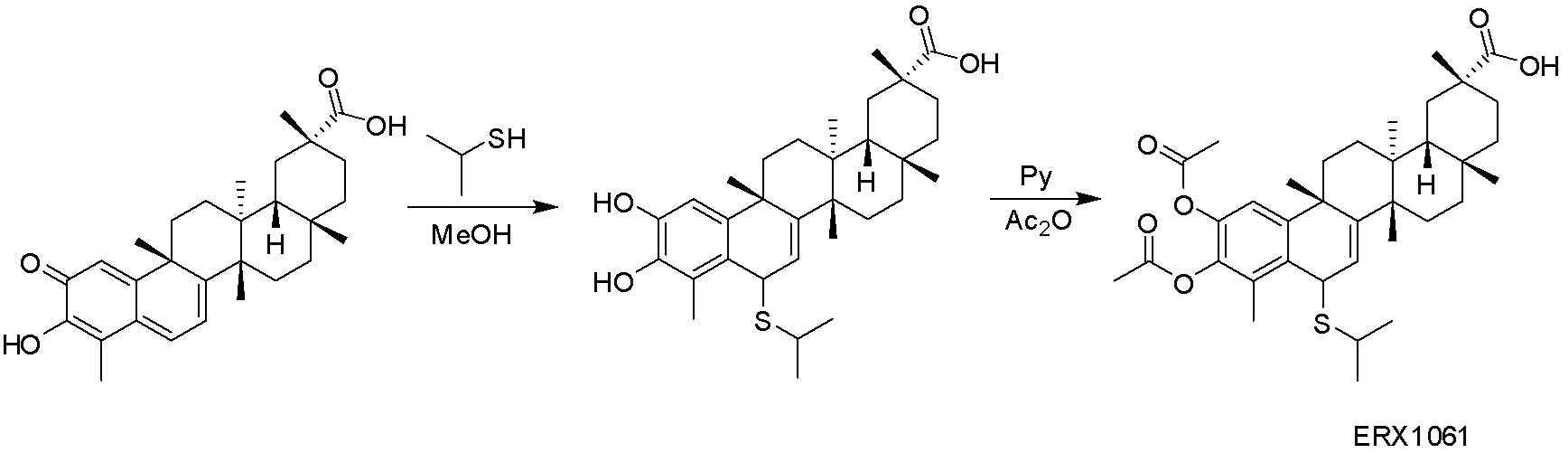
К раствору целастрола (100 мг, 0,222 ммоль) в MeOH (3 мл) добавляют i-C3H7SH (84,5 мг, 0,10 мл, 1,11 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов. Раствор превращается из красного в бледный красновато-желтый. Затем раствор концентрируют в вакууме с получением неочищенной смеси, которую применяют на следующей стадии без дальнейшей очистки.
К неочищенной смеси (117 мг, 0,222 ммоль, теоретическое количество) в Ac2O (4 мл) добавляют пиридин (0,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь разбавляют EtOAc (200 мл), промывают водой (2×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/EtOAc=5:2) с получением продукта (85,2 мг, 0,139 ммоль, общий выход=63%) в виде белого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,01 (1H, с), 5,97 (1H, д, J=6,2 Гц), 4,57 (1H, д, J=6,2 Гц), 3,11-3,22 (1H, м), 2,39 (1H, д, J=15,8 Гц), 2,30 (3H, с), 2,27 (3H, с), 2,26 (3H, с), 1,25-2,15 (13H, м), 1,58 (3H, с), 1,39 (1H, д, J=6,5 Гц), 1,27 (1H, д, J=6,5 Гц), 1,25 (3H, с), 1,16 (3H, с), 1,07 (3H, с), 0,89-0,96 (1H, м), 0,67 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК) B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,7 мин; Скорость потока: 2,2 мл/мин, Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,68 мин, m/z=535,2 [M-C3H7S]+, чистота=100% (214,254 нм).
Пример 44.
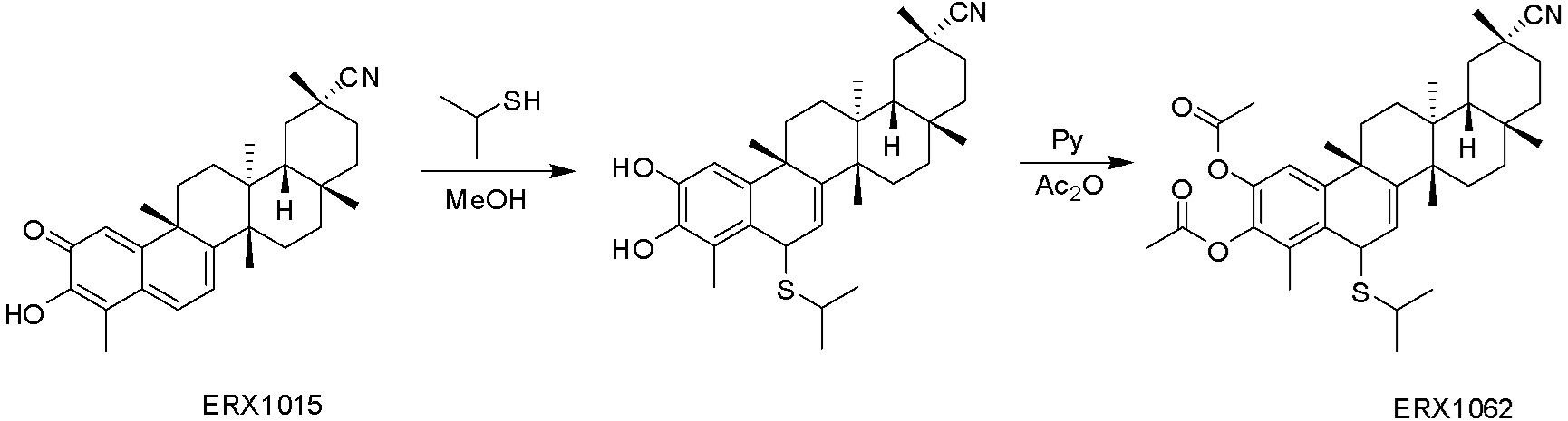
К раствору целастрола (50 мг, 0,111 ммоль) в MeOH (10 мл) добавляют i-C3H7SH (44 мг, 0,58 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Раствор превращается из красного в практически бесцветный. Затем раствор концентрируют в вакууме с получением неочищенной смеси, которую применяют на следующей стадии без дальнейшей очистки.
К неочищенной смеси (56,3 мг, 0,111 ммоль, теоретическое количество) в Ac2O (3 мл) добавляют пиридин (91 мг, 1,2 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь разбавляют EtOAc (200 мл), промывают водой (2×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/EtOAc=4:1) с получением продукта (35 мг, 0,059 ммоль, общий выход=49%) в виде белого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 7,02 (1H, с), 6,01 (1H, д, J=6,2 Гц), 4,59 (1H, д, J=6,2 Гц), 3,13-3,22 (1H, м), 2,30 (3H, с), 2,28 (3H, с), 2,26 (3H, с), 1,88-2,18 (6H, м), 1,50-1,74 (8H, м), 1,64 (3H, с), 1,43 (3H, с), 1,40 (3H, д, J=6,7 Гц), 1,29 (3H, д, J=6,7 Гц), 1,27 (3H, с), 1,06-1,11 (1H, м), 1,07 (3H, с), 1,04 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,1% ТФК) B: АЦН (0,1% ТФК); Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2,2 мл/мин
Колонка: Poroshell 120 EC-C18, 4,6×30 мм, 2,7 мкм): ву=2,11 мин, m/z=516,3 [M-C3H7S]+, чистота=100% (214,254 нм).
Пример 45.
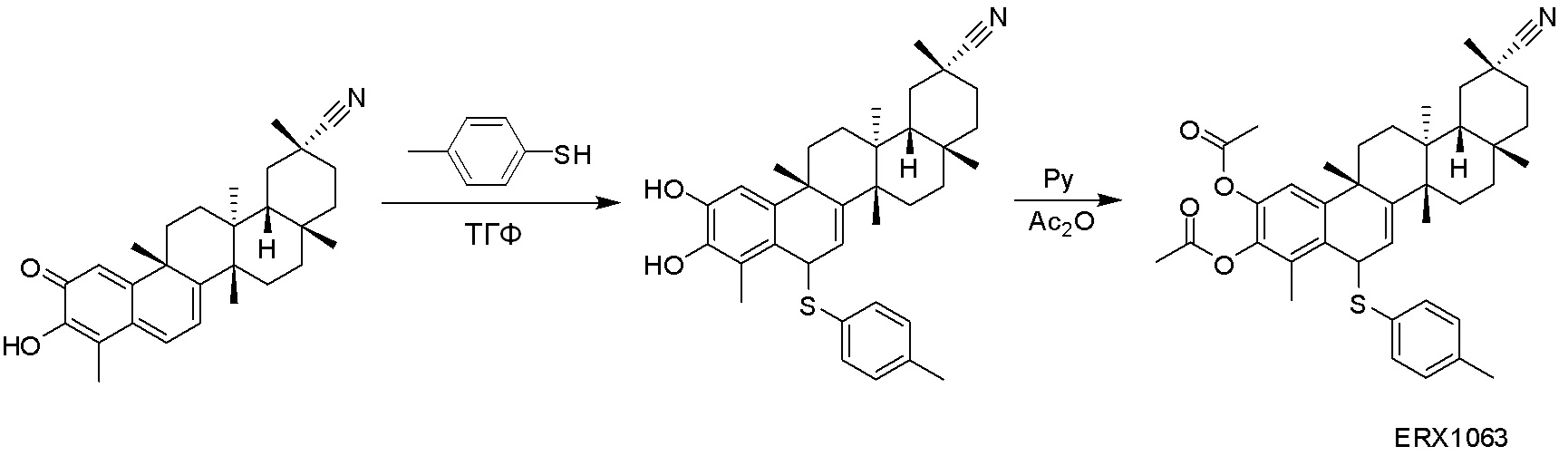
К раствору SM (50 мг, 0,116 ммоль) в ТГФ (3 мл) добавляют 4-метилбензолтиол (144 мг, 1,16 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов. Раствор превращается из темно-красного в бледно-красный. Затем раствор концентрируют в вакууме с получением неочищенной смеси, которую применяют на следующей стадии без дальнейшей очистки.
К неочищенной смеси (64,5 мг, 0,116 ммоль, теоретическое количество) в Ac2O (2 мл) добавляют пиридин (0,25 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь разбавляют EtOAc (200 мл), промывают водой (2×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/EtOAc=5:2) с получением продукта (62,4 мг, 0,0975 ммоль, общий выход=84%) в виде белого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,36 (1H, д, J=8,0 Гц), 7,12 (1H, д, J=8,0 Гц), 7,03 (1H, с), 5,77 (1H, д, J=6,1 Гц), 4,79 (1H, д, J=6,1 Гц), 2,35 (3H, с), 2,32 (3H, с), 2,28 (3H, с), 1,84-2,15 (6H, м), 1,35-1,68 (8H, м), 1,51 (3H, с), 1,42 (3H, с), 1,26 (3H, с), 1,02-1,08 (1H, м), 1,06 (3H, с), 1,00 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,1% ТФК) B: АЦН (0,1% ТФК); Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2,2 мл/мин; Колонка: Poroshell 120 EC-C18, 4,6×30 мм, 2,7 мкм): ву=2,17 мин, m/z=516,3 [M-C7H7S]+, чистота=98,54% (214 нм), 96,35% (254 нм).
Пример 46.
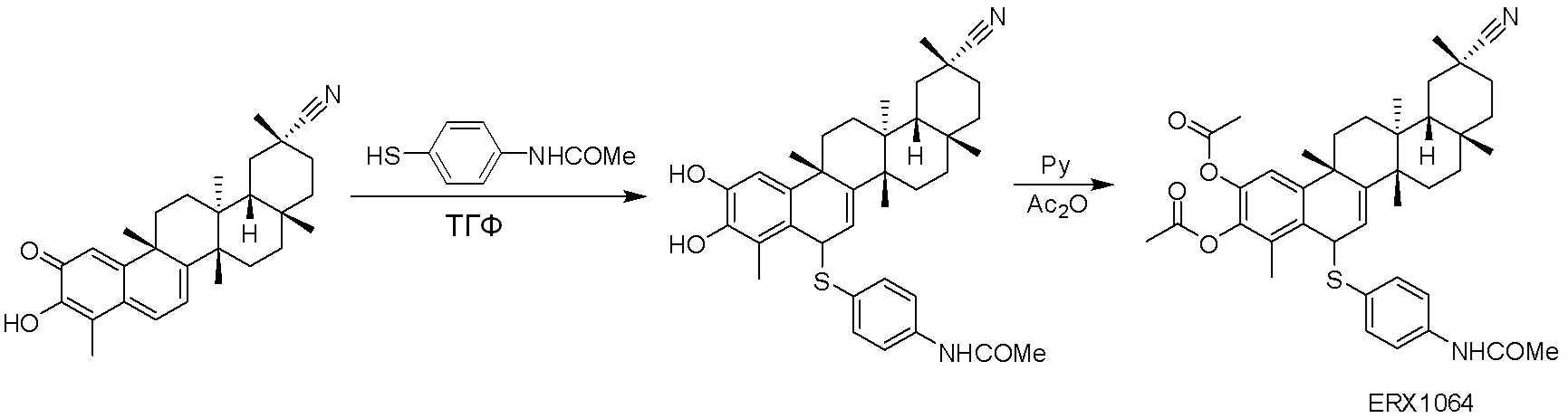
К раствору SM (50 мг, 0,116 ммоль) в ТГФ (2 мл) добавляют 4-ацетамидотиофенол (58 мг, 0,348 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Раствор превращается из темно-красного в бледно-красный. Затем раствор концентрируют в вакууме с получением неочищенной смеси, которую применяют на следующей стадии без дальнейшей очистки.
К неочищенной смеси (69,4 мг, 0,116 ммоль, теоретическое количество) в Ac2O (2 мл) добавляют пиридин (0,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь разбавляют EtOAc (200 мл), промывают водой (2×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/EtOAc=1:1) с получением продукта (45,1 мг, 0,066 ммоль, общий выход=57%) в виде белого твердого вещества.
1Н ЯМР δ (400 МГц, CDCl3): 7,47 (1H, д, J=8,6 Гц), 7,40 (1H, д, J=8,6 Гц), 7,20 (1H, с), 7,03 (1H, с), 5,76 (1H, д, J=6,2 Гц), 4,80 (1H, д, J=6,2 Гц), 2,33 (3H, с), 2,31 (3H, с), 2,28 (3H, с), 2,19 (3H, с), 1,82-2,14 (7H, м), 1,30-1,66 (7H, м), 1,49 (3H, с), 1,42 (3H, с), 1,26 (3H, с), 1,02-1,09 (1H, м), 1,06 (3H, с), 1,00 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК) B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,4 мин; Скорость потока: 2,3 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,26 мин, m/z=684,4 [M+H]+, чистота=100% (214, 254 нм).
Пример 47.
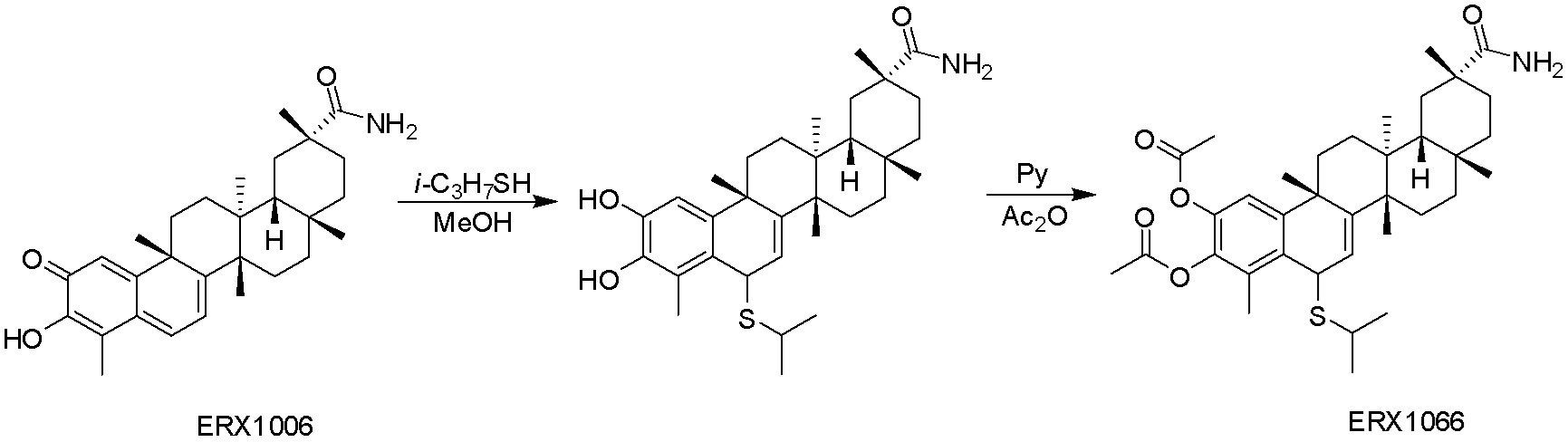
К раствору ERX1006 (90 мг, 0,2 ммоль) в MeOH (3 мл) добавляют i-C3H7SH (23 мг, 0,3 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Раствор превращается из красного в бледно-желтый. Затем раствор концентрируют в вакууме с получением неочищенной смеси.
К неочищенной смеси, полученной выше, в Ac2O (4 мл) добавляют пиридин (0,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь разбавляют EtOAc (200 мл), промывают водой (2×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ВЭЖХ (петролейный эфир/ацетон=1:1) с получением продукта (46,6 мг, 0,0764 ммоль, общий выход=38%) в виде белого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,00 (1H, с), 5,97 (1H, д, J=6,3 Гц), 5,63 (1H, ш), 5,24 (1H, ш), 4,57 (1H, д, J=6,3 Гц), 3,12-3,22 (1H, м), 2,40 (1H, д, J=15,3 Гц), 2,30 (3H, с), 2,27 (3H, с), 2,26 (3H, с), 1,42-2,10 (13H, м), 1,57 (3H, с), 1,40 (3H, д, J=6,7 Гц), 1,28 (3H, д, J=6,7 Гц), 1,26 (3H, с), 1,19 (3H, с), 1,11 (3H, с), 0,95-1,02 (1H, м), 0,74 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК) B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,7 мин; Скорость потока: 2,2 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,50 мин, m/z=610,3 [M+H]+, чистота=96,87% (214 нм).
Пример 48.
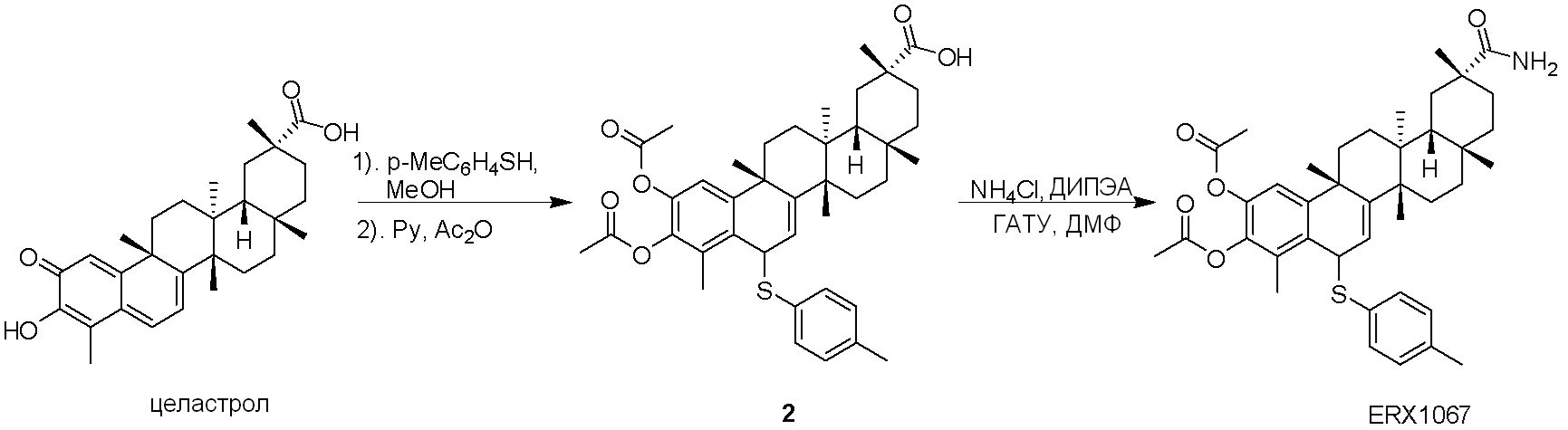
К раствору целастрола (200 мг, 0,44 ммоль) в MeOH (6 мл) добавляют p-MeC6H4SH (82 мг, 0,66 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Раствор превращается из красного в бледно-желтый. Затем раствор концентрируют в вакууме с получением неочищенной смеси
К неочищенной смеси полученной выше, в Ac2O (8 мл) добавляют пиридин (1 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь разбавляют EtOAc (200 мл), промывают водой (2×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетат=1:1) с получением продукта (30 мг, 0,0457 ммоль, Выход=10%) в виде белого твердого вещества.
К раствору соединения 2 (100 мг, 0,15 ммоль) в ДМФ (10 мл) добавляют NH4Cl (18 мг, 0,34 ммоль), ГАТУ (65 мг, 0,17 ммоль), затем ДИПЭА (39 мг, 0,3 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют EtOAc (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (EtOAc) с получением продукта (30 мг, 0,0456 ммоль, Выход=30%) в виде белого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 7,35 (1H, д, J=7,7 Гц), 7,12 (1H, д, J=7,7 Гц), 7,02 (1H, с), 5,73 (1H, д, J=6,1 Гц), 5,61 (1H, ш), 5,15 (1H, ш), 4,76 (1H, д, J=6,1 Гц), 2,38 (1H, д, J=15,2 Гц), 2,35 (3H, с), 2,32 (3H, с), 2,31 (3H, с), 2,28 (3H, с), 1,30-2,06 (13H, м), 1,48 (3H, с), 1,24 (3H, с), 1,18 (3H, с), 1,09 (3H, с), 0,94-0,99 (1H, м), 0,70 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК) B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,4 мин; Скорость потока: 2,3 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,47 мин, чистота=98,43% (214 нм), 100% (254 нм).
Пример 49.
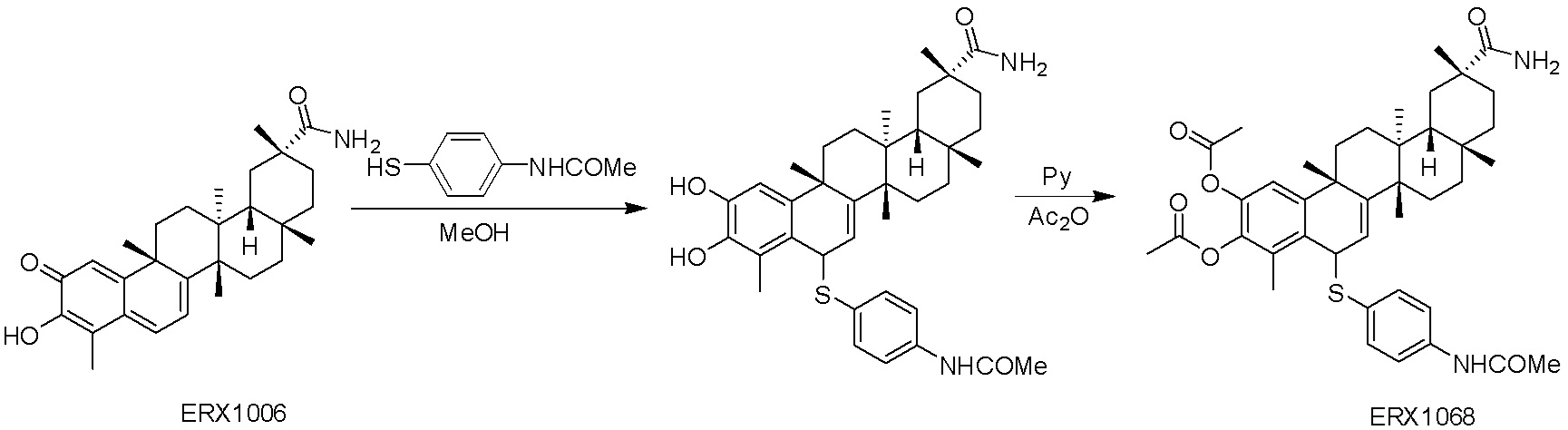
К раствору ERX1006 (500 мг, 11,0 ммоль) в MeOH (15 мл) добавляют 4-ацетамидотиофенол (250 мг, 16,0 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Раствор превращается из темно-красного в бледно-красный. Затем раствор концентрируют в вакууме с получением неочищенной смеси.
К неочищенной смеси полученной выше, в Ac2O (20 мл) добавляют пиридин (2,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь разбавляют EtOAc (200 мл), промывают водой (2×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (EtOAc) с получением продукта (250 мг, 0,357 ммоль, Выход=51%) в виде белого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 7,45 (1H, д, J=8,5 Гц), 7,39 (1H, д, J=8,5 Гц), 7,30 (1H, с), 7,01 (1H, с), 5,71 (1H, д, J=6,3 Гц), 5,63 (1H, ш), 5,21 (1H, ш), 4,76 (1H, д, J=6,3 Гц), 2,39 (1H, д, J=16,1 Гц), 2,32 (3H, с), 2,30 (3H, с), 2,28 (3H, с), 2,18 (3H, с), 1,30-2,06 (13H, м), 1,48 (3H, с), 1,23 (3H, с), 1,18 (3H, с), 1,09 (3H, с), 0,92-0,99 (1H, м), 0,69 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК) B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,4 мин; Скорость потока: 2,3 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,13 мин, m/z=701,3 [M+H]+, чистота=99,36% (214 нм), 97,26% (254 нм).
Пример 50.
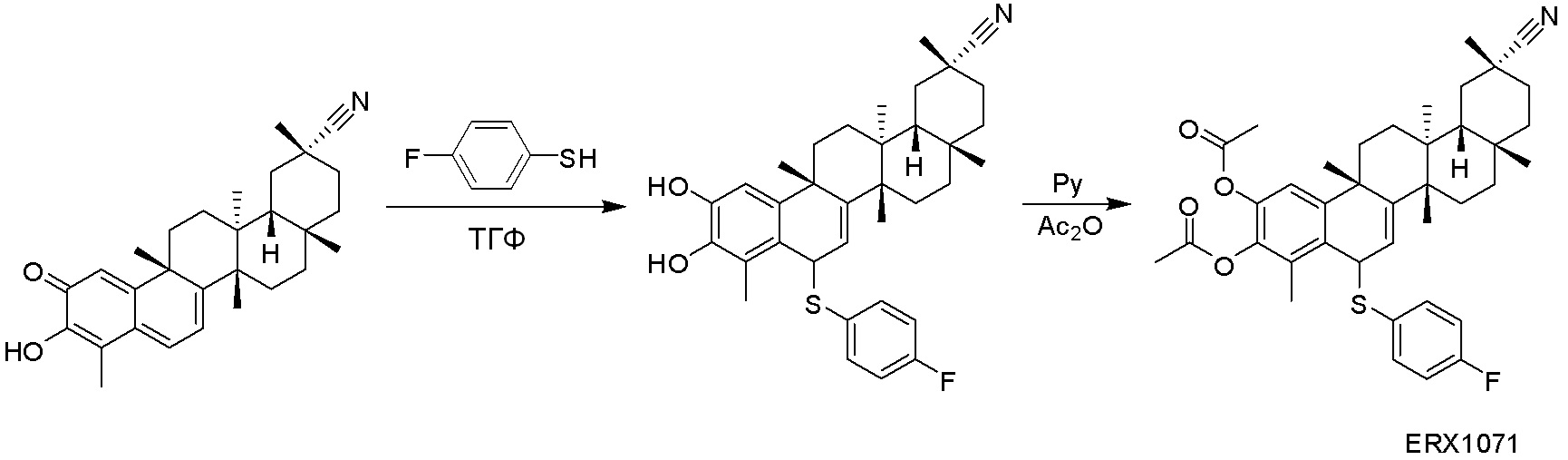
К раствору SM (50 мг, 0,116 ммоль) в ТГФ (3 мл) добавляют 4-фторбензолтиол (74 мг, 0,579 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Раствор превращается из темно-красного в бледно-красный. Затем раствор концентрируют в вакууме с получением неочищенной смеси, которую применяют на следующей стадии без дальнейшей очистки.
К неочищенной смеси (74,7 мг, 0,116 ммоль, теоретическое количество) в Ac2O (2 мл) добавляют пиридин (0,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь разбавляют EtOAc (200 мл), промывают водой (2×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/EtOAc=3:1) с получением продукта (18,2 мг, 0,0283 ммоль, Выход=24%) в виде белого твердого вещества.
1Н ЯМР δ (400 МГц, CDCl3): 7,38-7,43 (2H, м), 6,98-7,04 (3H, м), 5,72 (1H, д, J=6,0 Гц), 4,81 (1H, д, J=6,0 Гц), 2,33 (3H, с), 2,31 (3H, с), 2,28 (3H, с), 1,84-2,14 (6H, м), 1,32-1,66 (8H, м), 1,44 (3H, с), 1,42 (3H, с), 1,25 (3H, с), 1,02-1,10 (1H, м), 1,06 (3H, с), 1,00 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,1% ТФК) B: АЦН (0,1% ТФК); Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2,2 мл/мин; Колонка: Poroshell 120 EC-C18, 4,6×30 мм, 2,7 мкм): ву=2,10 мин, m/z=516,3 [M-FC6H4S]+, чистота=97,87% (214 нм), 99,10% (254 нм).
Пример 51.
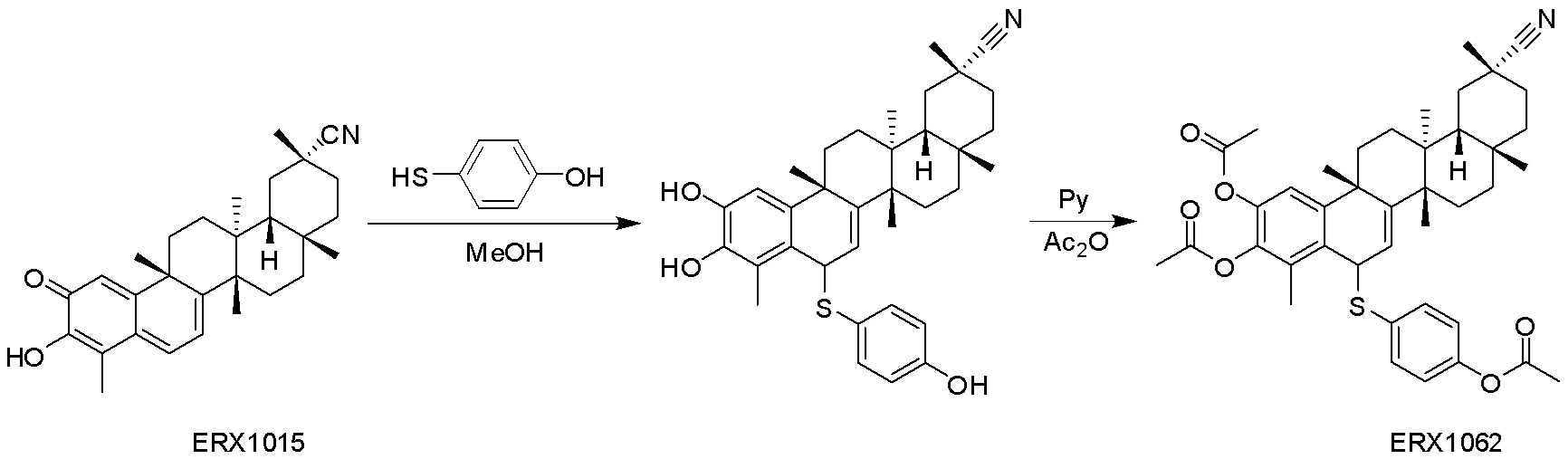
К раствору целастрола (50 мг, 0,116 ммоль) в MeOH (5 мл) добавляют 4-гидроксибензолтиол (44 мг, 0,348 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Раствор превращается из красного в практически бесцветный. Затем раствор концентрируют в вакууме с получением неочищенной смеси, которую применяют на следующей стадии без дальнейшей очистки.
К неочищенной смеси (61,9 мг, 0,116 ммоль, теоретическое количество) в Ac2O (3 мл) добавляют пиридин (0,3 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь разбавляют EtOAc (200 мл), промывают водой (2×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/EtOAc=3:1) с получением продукта (20 мг, 0,0292 ммоль, Выход=18%) в виде белого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,43 (2H, д, J=8,4 Гц), 7,04 (2H, д, J=8,4 Гц), 7,03 (1H, с), 5,79 (1H, д, J=6,3 Гц), 4,85 (1H, д, J=6,3 Гц), 2,32 (3H, с), 2,30 (6H, с), 2,28 (3H, с), 1,82-2,14 (6H, м), 1,32-1,66 (9H, м), 1,47 (3H, с), 1,42 (3H, с), 1,25 (3H, с), 1,02-1,10 (1H, м), 1,06 (3H, с), 1,00 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,1% ТФК) B: АЦН (0,1% ТФК); Градиент: 5%-95% B за 1,2 мин; Скорость потока: 2,2 мл/мин; Колонка: Poroshell 120 EC-C18, 4,6×30 мм, 2,7 мкм): ву=2,01 мин, m/z=516,3 [M-MeCO2C6H4S]+, чистота=100% (214 нм), 99,7% (254 нм).
Пример 52.
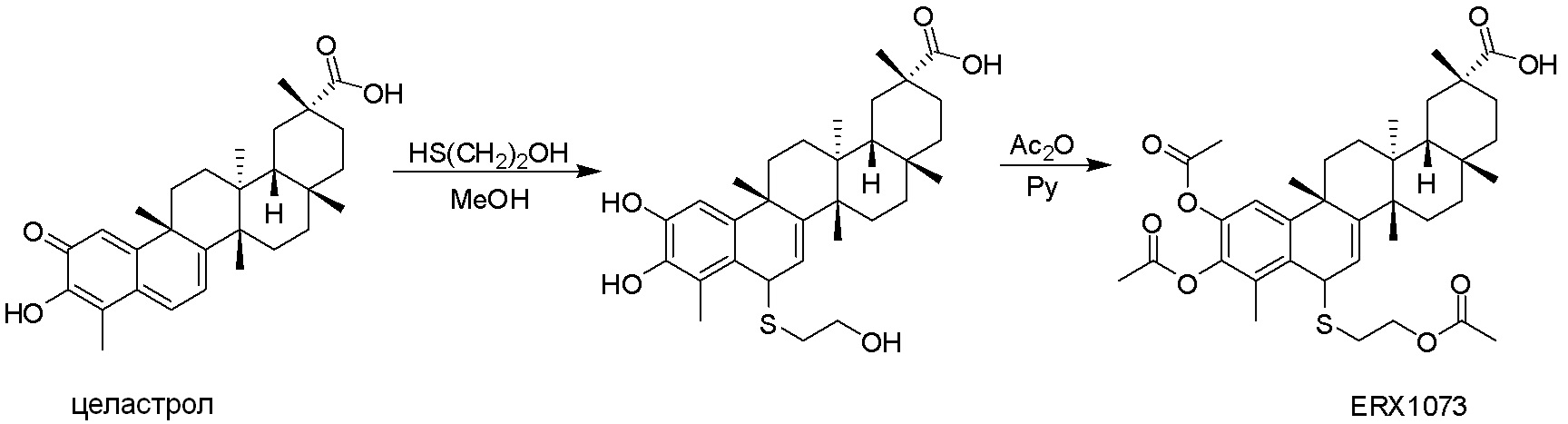
К раствору целастрола (200 мг, 0,44 ммоль) в MeOH (6 мл) добавляют HSCH2CH2OH (53 мг, 0,67 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Раствор превращается из красного в бледно-желтый. Затем раствор was концентрируют в вакууме с получением неочищенной смеси.
К неочищенной смеси полученной выше, в Ac2O (8 мл) добавляют пиридин (1 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь разбавляют EtOAc (200 мл), промывают водой (2×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (EtOAc) с получением продукта (20 мг, 0,0305 ммоль, Выход=7%) в виде белого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 7,02 (1H, с), 5,98 (1H, д, J=6,0 Гц), 4,63 (1H, д, J=6,0 Гц), 4,20-4,34 (2H, м), 2,96-3,01 (1H, м), 2,74-2,83 (1H, м), 2,38 (1H, д, J=15,5 Гц), 2,30 (3H, с), 2,27 (3H, с), 2,07 (3H, с), 1,30-2,14 (11H, м), 1,58 (3H, с), 1,25 (3H, с), 1,12 (3H, с), 1,07 (3H, с), 0,82-0,94 (3H, м), 0,65 (3H, с); ЖХ-МС: ву=2,33 мин, m/z=535,3 [M-MeCO2CH2CH2S]+, чистота=95,75% (214 нм).
Пример 53.
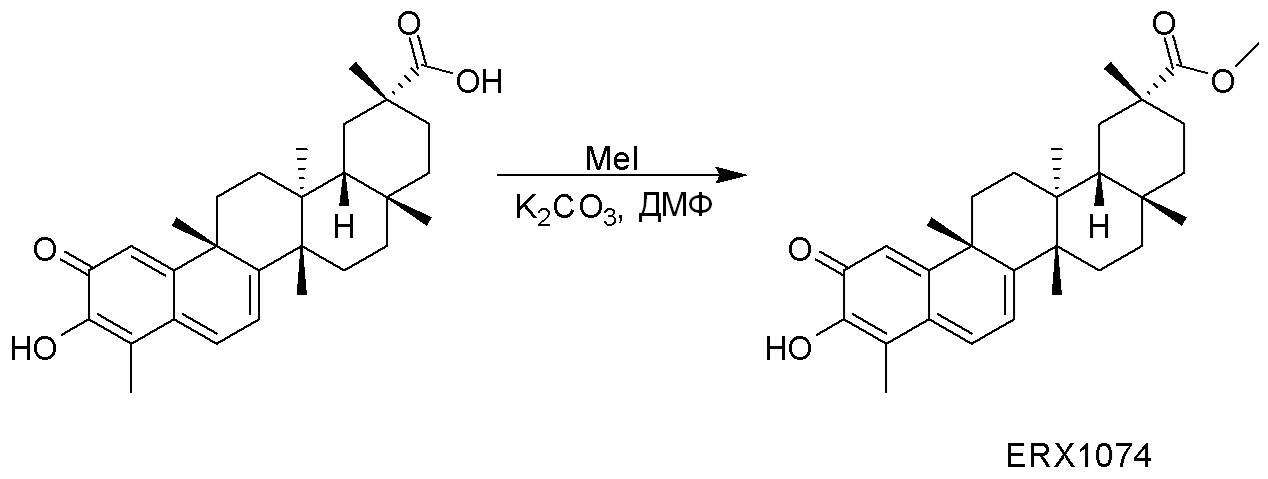
К раствору целастрола (300 мг, 0,666 ммоль) в ДМФ (3 мл) добавляют K2CO3 (184 мг, 1,332 ммоль) затем CH3I (141 мг, 0,061 мл, 0,732 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Появляется большое количество твердого вещества. Смесь разбавляют H2O (30 мл), фильтруют. Твердое вещество растворяют с CH2Cl2 (300 мл), промывают H2O (2×100 мл) затем насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=3:1) с получением продукта (87,6 мг, 0,189 ммоль, Выход=28%) в виде красновато-желтого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,02 (1H, дд, J=7,0, 1,2 Гц), 6,96 (1H, с), 6,53 (1H, д, J=1,2 Гц), 6,35 (1H, д, J=7,0 Гц), 3,55 (3H, с), 2,42 (1H, д, J=15,6 Гц), 2,18 (3H, с), 2,00-2,20 (3H, м), 1,30-1,93 (10H, м), 1,45 (3H, с), 1,26 (3H, с), 1,18 (3H, с), 1,10 (3H, с), 0,94-1,01 (1H, м), 0,53 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (10 мМ гидрокарбоната аммония) B: АЦН; Градиент: 5%-95% B за 1,5 мин; Скорость потока: 2,0 мл/мин; Колонка: XBridge C18, 4,6×50 мм, 3,5 мкм): ву=2,77 мин, m/z=465,4 [M+H]+, чистота=97,25% (214 нм), 99,77% (254 нм).
Пример 54.
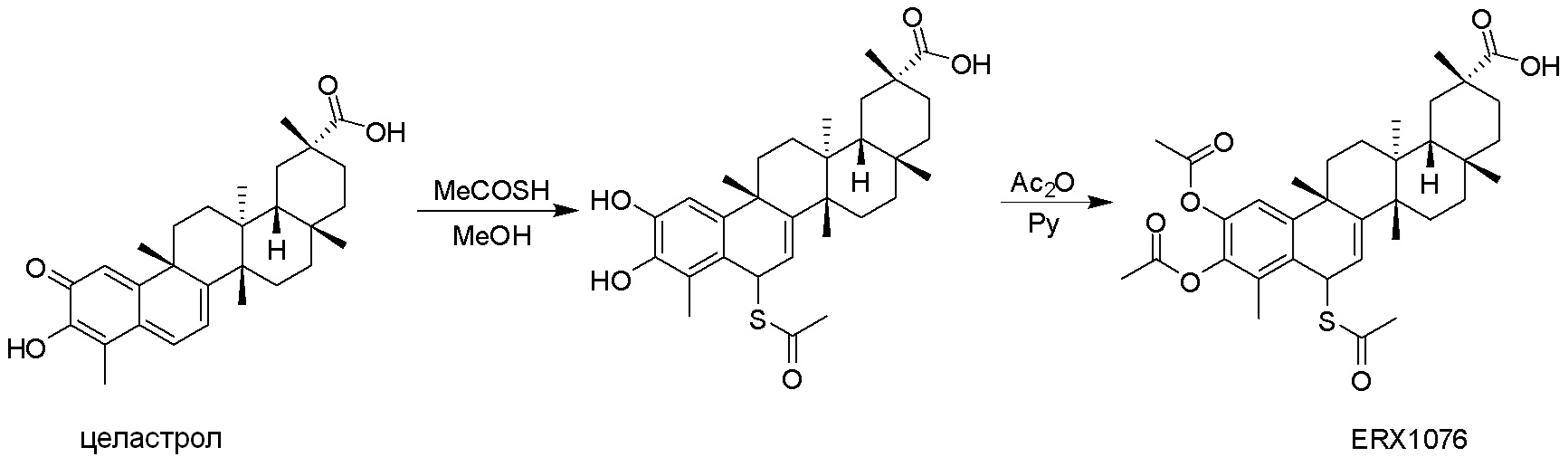
К раствору целастрола (200 мг, 0,44 ммоль) в MeOH (20 мл) добавляют MeCOSH (51 мг, 0,67 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 0,5 часа. Раствор превращается из красного в бледно-желтый. Затем раствор концентрируют в вакууме с получением неочищенной смеси.
К неочищенной смеси полученной выше, в Ac2O (8 мл) добавляют пиридин (1 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь разбавляют EtOAc (200 мл), промывают водой (2×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (EtOAc) с получением продукта (131 мг, 0,214 ммоль, Выход=49%) в виде белого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 7,02 (1H, с), 5,94&5,95 (1H, д, J=6,4 Гц), 5,36&5,37 (1H, д, J=6,4 Гц), 2,39 (1H, д, J=15,4 Гц), 2,34 (3H, с), 2,303&2,307 (3H, с), 2,269&2,273 (3H, с), 2,074&2,077 (3H, с), 1,30-2,20 (13H, м), 1,438&1,451 (3H, с), 1,215&1,253 (3H, с), 1,169&1,201 (3H, с), 1,062&1,083 (3H, с), 0,90-1,00 (1H, м), 0,666&0,702 (1H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК) B: АЦН (0,01% ТФК)
Градиент: 5%-95% B за 1,7 мин; Скорость потока: 2,2 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,49 & 2,52 мин, два пика.
Пример 55.
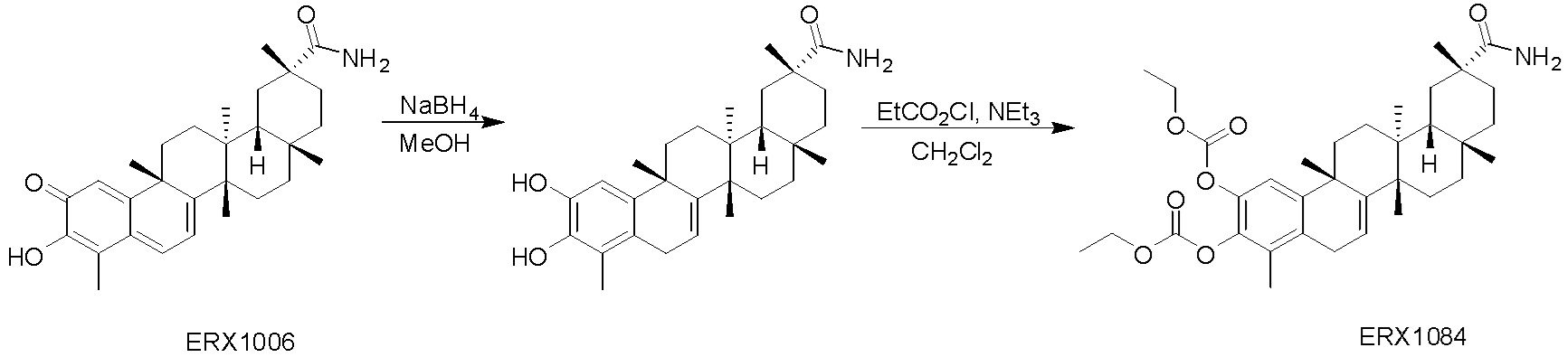
К раствору ERX1006 (200 мг, 0,445 ммоль) в MeOH (10 мл) добавляют NaBH4 (168 мг, 4,445 ммоль) порциями. Раствор превращается из красноватого в бесцветный. Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Затем реакционную смесь гасят 0,1 M HCl и подкисляют до pH 5-6 0,1 M HCl. Смесь разбавляют CH2Cl2 (300 мл), фильтруют, разделяют. Органический слой промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме с получением неочищенного промежуточного соединения, которое применяют на следующей стадии без дальнейшей очистки.
К неочищенной смеси (201 мг, 0,445 ммоль, теоретическое количество) в CH2Cl2 (10 мл) добавляют NEt3 (180 мг, 0,25 мл, 1,78 ммоль) затем EtCO2Cl (193 мг, 0,17 ммоль, 1,78 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Затем смесь разбавляют EtOAc (200 мл), промывают водой (100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/EtOAc=2:3) с получением продукта (89,3 мг, 0,150 ммоль, Выход=34%) в виде белого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,09 (1H, с), 5,75 (1H, д, J=6,1 Гц), 5,65 (1H, ш), 5,21 (1H, ш), 4,31 (2H, кв, J=7,1 Гц), 4,31 (2H, кв, J=7,1 Гц), 3,33 (1H, дд, J=20,9, 6,1 Гц), 3,06 (1H, д, J=20,9 Гц), 2,41 (1H, д, J=15,6 Гц), 2,12 (3H, с), 1,40-2,12 (13H, м), 1,38 (3H, т, J=7,1 Гц), 1,38 (3H, т, J=7,1 Гц), 1,33 (3H, с), 1,22 (3H, с), 1,19 (3H, с), 1,10 (3H, с), 0,94-1,10 (1H, м), 0,77 (3H, с);ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК) B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,4 мин; Скорость потока: 2,3 мл/мин; Колонка: SunFire C18, 4,6×50 мм, 3,5 мкм): ву=2,39 мин, m/z=596,3 [M+H]+, чистота=97,29% (214 нм).
Пример 56.
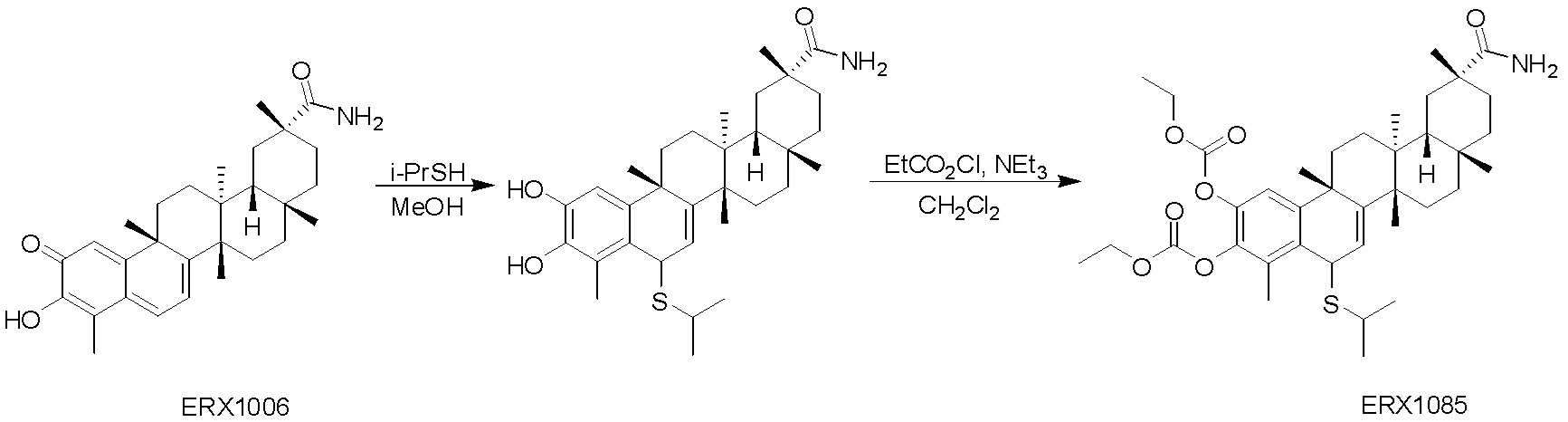
К раствору ERX1006 (200 мг, 0,445 ммоль) в MeOH (10 мл) добавляют i-PrSH (101,7 мг, 0,124 мл, 1,335 ммоль). Раствор превращается из красноватого в бледно-желтый. Реакционную смесь перемешивают при комнатной температуре в течение 0,5 часа. Раствор разбавляют CH2Cl2 (200 мл), промывают H2O (100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме с получением неочищенного промежуточного соединения, которое применяют на следующей стадии без дальнейшей очистки.
К неочищенной смеси (234 мг, 0,445 ммоль, теоретическое количество) в CH2Cl2 (10 мл) добавляют NEt3 (225 мг, 0,31 мл, 2,225 ммоль) затем EtCO2Cl (241 мг, 0,21 ммоль, 2,225 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Затем смесь разбавляют EtOAc (200 мл), промывают водой (100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/EtOAc=2:3) с получением продукта (145,6 мг, 0,217 ммоль, Выход=49%) в виде белого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,11 (1H, с), 5,97 (1H, д, J=6,3 Гц), 5,64 (1H, ш), 5,18 (1H, ш), 4,58 (1H, д, J=6,3 Гц), 3,32 (2H, кв, J=7,2 Гц), 3,31 (2H, кв, J=7,2 Гц), 3,14-3,23 (1H, м), 2,40 (1H, д, J=15,0 Гц), 2,34 (3H, с), 1,42-2,12 (13H, м), 1,56 (3H, с), 1,38 (6H, т, J=7,2 Гц), 1,37 (3H, д, J=6,9 Гц), 1,28 (3H, д, J=6,9 Гц), 1,26 (3H, с), 1,19 (3H, с), 1,11 (3H, с), 0,96-1,03 (1H, м), 0,74 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (10 мМ гидрокарбоната аммония) B: АЦН; Градиент: 5%-95% B за 1,5 мин; Скорость потока: 2,0 мл/мин; Колонка: XBridge C18, 4,6×50 мм, 3,5 мкм): ву=2,69 мин, m/z=594,2 [M-C3H7S]+, чистота=100% (214,254 нм).
Пример 57.
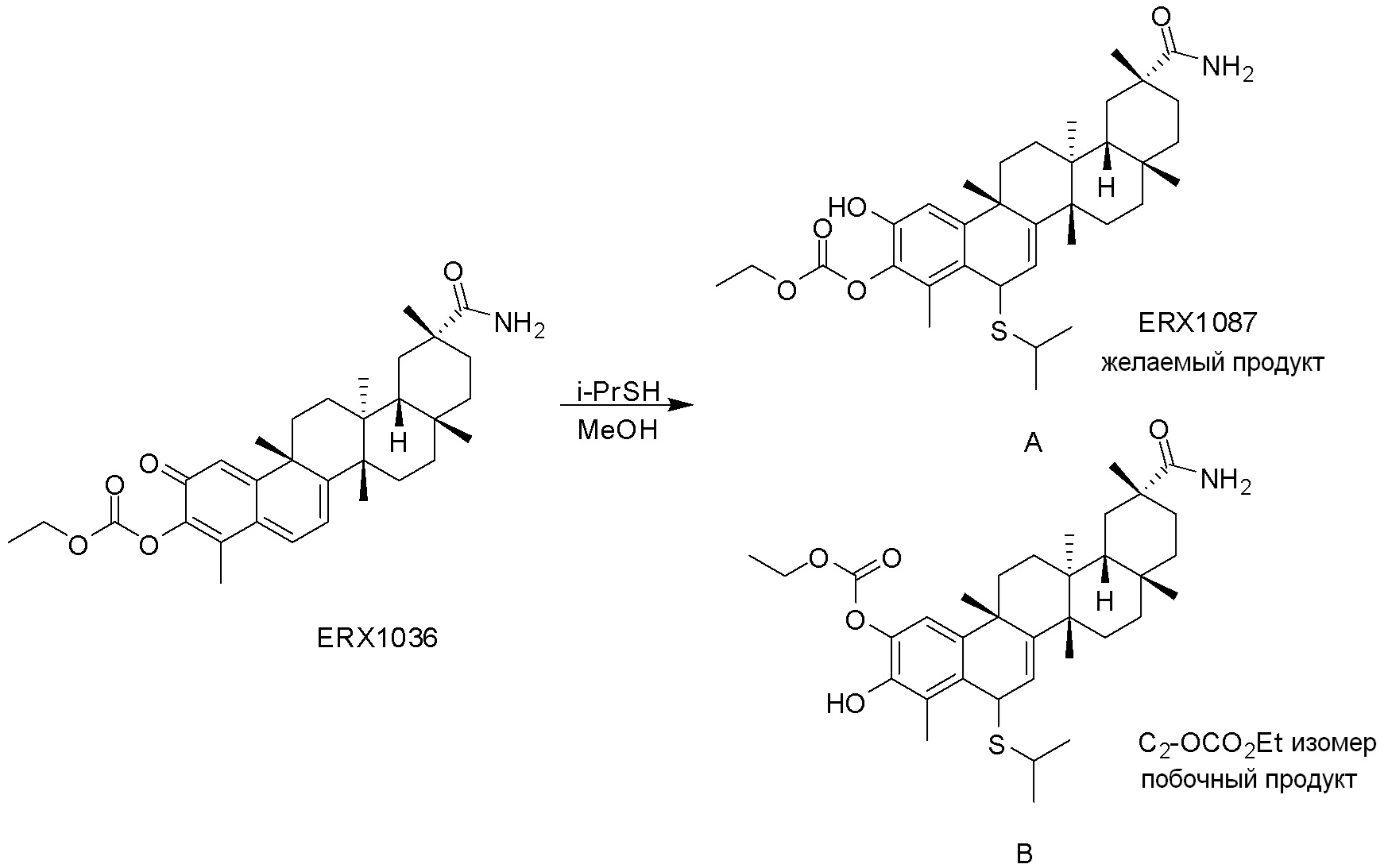
К раствору ERX1036 (329 мг, 0,631 ммоль) в MeOH (6 мл) добавляют i-PrSH (144 мг, 0,176 мл, 1,892 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Затем смесь разбавляют EtOAc (300 мл), промывают водой (2×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ дважды (петролейный эфир/EtOAc=1:3) с получением не разделенной 3:1 смеси A и B (181,8 мг, 0,304 ммоль, Выход=48%) в виде желтого твердого вещества.
1Н ЯМР: C3-OCO2Et изомер:
δ (400 МГц, CDCl3): 6,87 (1H, с), 5,97 (1H, д, J=6,2 Гц), 5,70 (1H, ш), 5,70 (1H, с), 5,26 (1H, ш), 4,56 (1H, д, J=6,2 Гц), 4,32 (2H, кв, J=7,2 Гц), 3,11-3,22 (1H, м), 2,43 (1H, д, J=15,1 Гц), 2,30 (3H, с), 1,42-2,10 (13H, м), 1,57 (3H, с), 1,39 (3H, т, J=7,2 Гц), 1,39 (3H, д, J=7,0 Гц), 1,27 (3H, д, J=7,0 Гц), 1,26 (3H, с), 1,19 (3H, с), 1,11 (3H, с), 0,95-1,03 (1H, м), 0,74 (3H, с).
C2-OCO2Et изомер:
δ (400 МГц, CDCl3): 7,04 (1H, с), 5,97 (1H, д, J=6,2 Гц), 5,70 (1H, ш), 5,38 (1H, с), 5,26 (1H, ш), 4,60 (1H, д, J=6,2 Гц), 4,34 (2H, кв, J=7,2 Гц), 3,11-3,22 (1H, м), 2,43 (1H, д, J=15,1 Гц), 2,41 (3H, с), 1,42-2,10 (13H, м), 1,57 (3H, с), 1,39 (3H, т, J=7,2 Гц), 1,39 (3H, д, J=7,0 Гц), 1,27 (3H, д, J=7,0 Гц), 1,26 (3H, с), 1,19 (3H, с), 1,11 (3H, с), 0,95-1,03 (1H, м), 0,73 (3H, с).
ЖХ-МС (Подвижная фаза: А: вода (10 мМ гидрокарбоната аммония) B: АЦН; Градиент: 5%-95% B за 1,5 мин; Скорость потока: 2,0 мл/мин; Колонка: XBridge C18, 4,6×50 мм, 3,5 мкм): ву=2,58 мин, m/z=522,3 [M-C3H7S]+, чистота=97,47% (214 нм).
Пример 58.
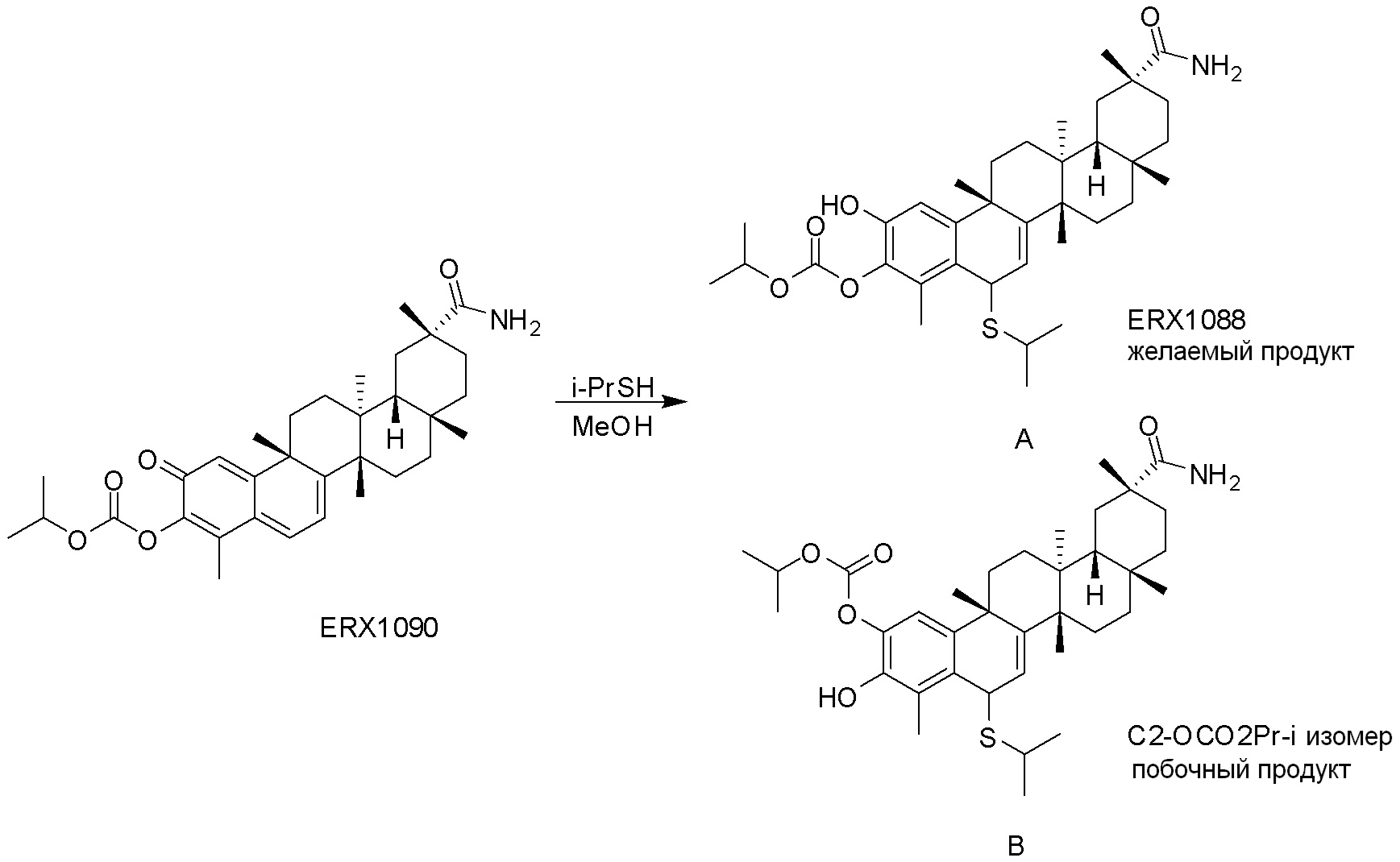
К раствору ERX1090 (277 мг, 0,517 ммоль) в MeOH (6 мл) добавляют i-PrSH (118 мг, 0,144 мл, 1,551 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Затем смесь разбавляют EtOAc (300 мл), промывают водой (2×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ дважды (петролейный эфир/EtOAc=1:3) с получением неразделенной 3:1 смеси A и B (180,4 мг, 0,295 ммоль, Выход=57%) в виде желтого твердого вещества.
1Н ЯМР: C3-OCO2Pr-i изомер:
δ (400 МГц, CDCl3): 6,87 (1H, с), 5,97 (1H, д, J=6,4 Гц), 5,73 (1H, с), 5,69 (1H, ш), 5,29 (1H, ш), 4,94-5,02 (1H, м), 4,56 (1H, д, J=6,4 Гц), 3,10-3,22 (1H, м), 2,42 (1H, д, J=15,6 Гц), 2,30 (3H, с), 1,42-2,10 (13H, м), 1,56 (3H, с), 1,39 (3H, д, J=6,8 Гц), 1,37 (6H, д, J=6,8 Гц), 1,27 (3H, д, J=6,8 Гц), 1,25 (3H, с), 1,19 (3H, с), 1,11 (3H, с), 0,94-1,02 (1H, м), 0,74 (3H, с).
C2-OCO2Pr-i изомер:
δ (400 МГц, CDCl3): 7,04 (1H, с), 5,97 (1H, д, J=6,4 Гц), 5,69 (1H, ш), 5,42 (1H, с), 5,29 (1H, ш), 4,94-5,02 (1H, м), 4,60 (1H, д, J=6,4 Гц), 3,10-3,22 (1H, м), 2,42 (1H, д, J=15,6 Гц), 2,37 (3H, с), 1,42-2,10 (13H, м), 1,56 (3H, с), 1,39 (3H, д, J=6,8 Гц), 1,37 (6H, д, J=6,8 Гц), 1,27 (3H, д, J=6,8 Гц), 1,25 (3H, с), 1,19 (3H, с), 1,11 (3H, с), 0,94-1,02 (1H, м), 0,74 (3H, с).
ЖХ-МС (фаза: А: вода (10 мМ гидрокарбоната аммония) B: АЦН; Градиент: 5%-95% B за 1,5 мин; Скорость потока: 2,0 мл/мин; Колонка: XBridge C18, 4,6×50 мм, 3,5 мкм; ву=2,62 мин, m/z=536,4 [M-C3H7S]+, чистота=95,39% (214 нм).
Пример 59.
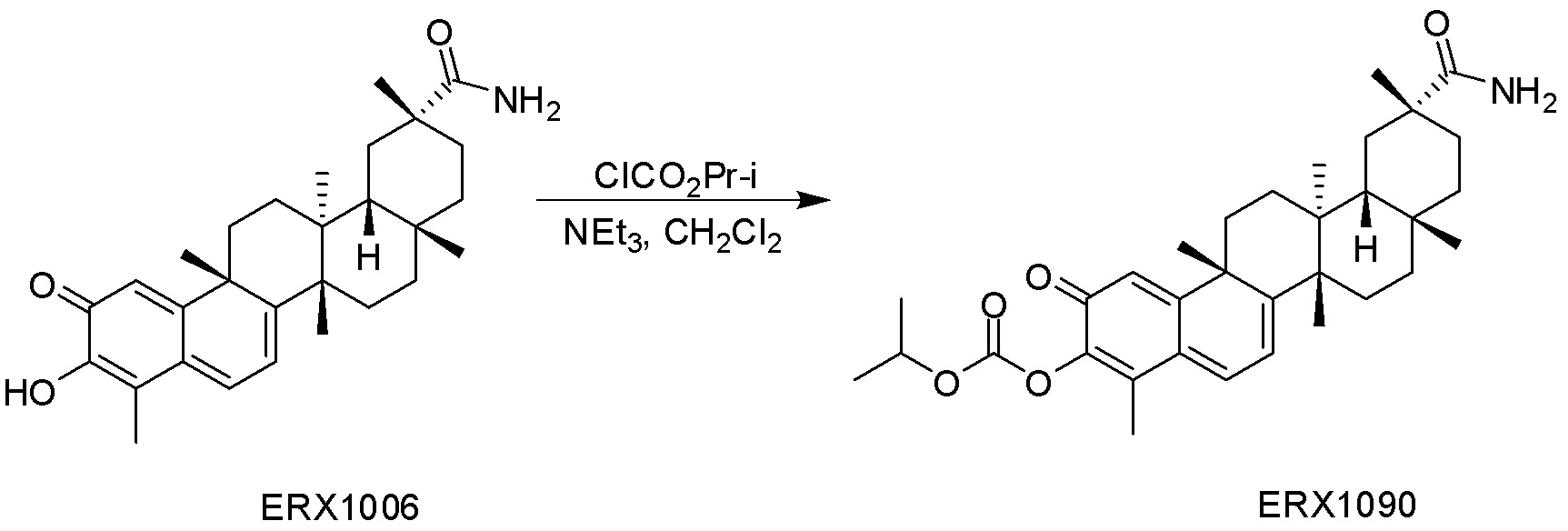
К раствору ERX1006 (300 мг, 0,667 ммоль) в CH2Cl2 (6 мл) добавляют Et3N (135 мг, 0,19 мл, 1,334 ммоль), затем 1M ClCO2Pr-i в растворе PhMe (163 мг, 1,33 мл, 1,334 ммоль) по каплям при 0°C. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Смесь разбавляют CH2Cl2 (300 мл), промывают насыщенным раствором соли (200 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:3) с получением продукта (302,6 мг, 0,565 ммоль, Выход=85%) в виде желтого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 7,06 (1H, дд, J=7,4, 1,3 Гц), 6,47 (1H, д, J=1,3 Гц), 6,32 (1H, д, J=7,4 Гц), 5,67 (1H, ш), 5,23 (1H, ш), 4,93-5,01 (1H, м), 2,39 (1H, д, J=15,4 Гц), 2,21 (3H, с), 1,82-2,14 (7H, м), 1,48-1,73 (6H, м), 1,46 (3H, с), 1,39 (3H, д, J=6,0 Гц), 1,39 (3H, д, J=6,4 Гц), 1,27 (3H, с), 1,21 (3H, с), 0,99-1,05 (1H, м), 0,76 (3H, с); ЖХ-МС (Подвижная фаза: А: вода (0,01% ТФК) B: АЦН (0,01% ТФК); Градиент: 5%-95% B за 1,4 мин; Скорость потока: 2,3 мл/мин
Колонка: Hypersil GOLD, 4,6×50 мм, 3 мкм): ву=2,11 мин, m/z=536,3 [M+H]+, чистота=97,63% (214 нм), 100% (254 нм).
Пример 60.
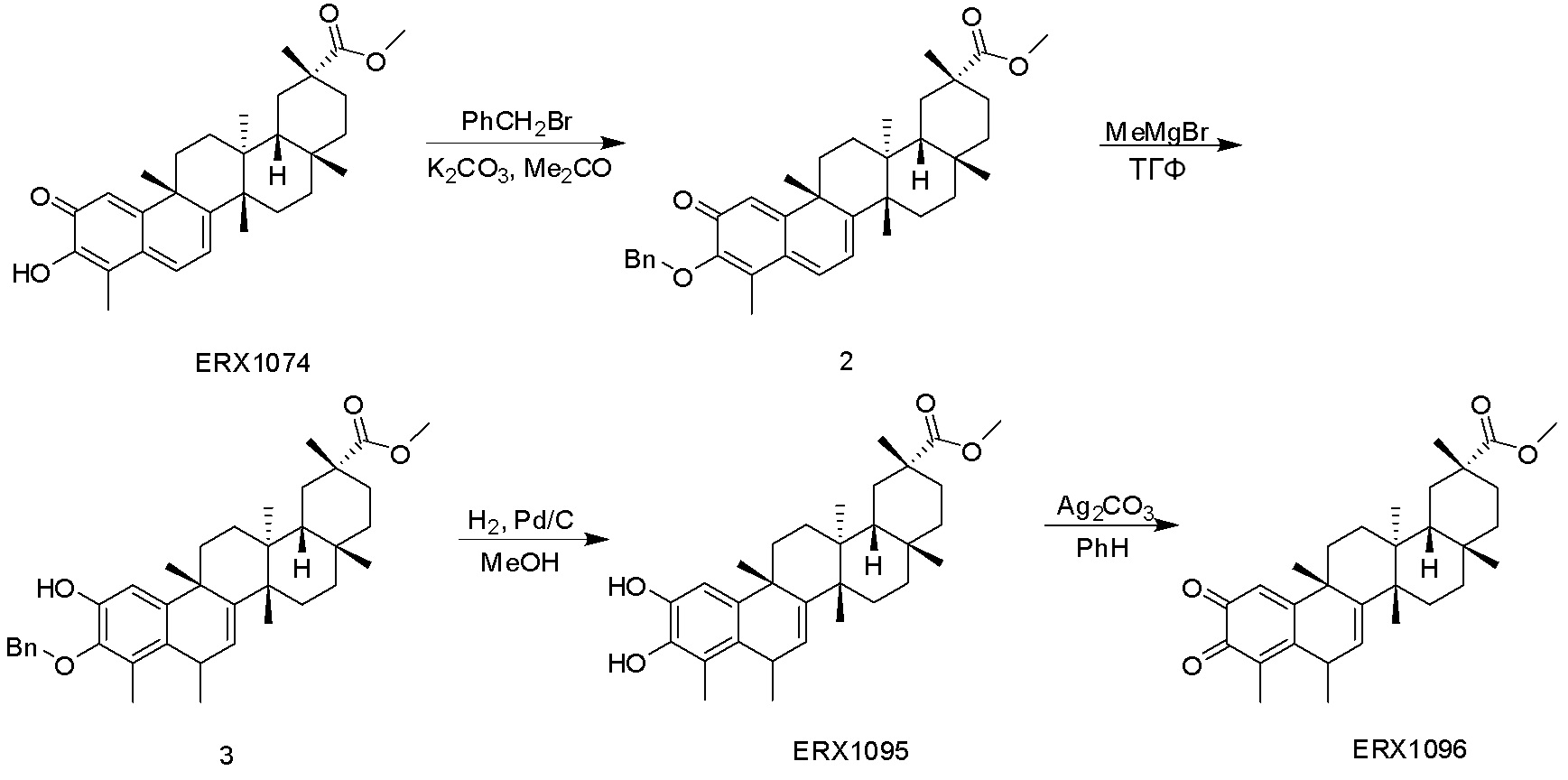
К раствору ERX1074 (2,05 г, 4,412 ммоль) в Me2CO (30 мл) добавляют K2CO3 (3,05 г, 22,06 ммоль), затем PhCH2Br (3,77 г, 2,62 мл, 22,06 ммоль). Реакционную смесь нагревают при 50°C в течение ночи. Большую часть ацетона удаляют в вакууме. Остаток растворяют в EtOAc (300 мл), промывают H2O (200 мл), насыщенным раствором соли (200 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетат=3:1) с получением продукта 2 (2,45 г, 4,416 ммоль, Вд=100%) в виде желтого твердого вещества.
К раствору соединения 2 (2,5 г, 4,51 ммоль) в безводном ТГФ (100 мл) добавляют 3 M MeMgBr в растворе ТГФ (7,5 мл, 22,5 ммоль) при 0°C по каплям. Реакционную смесь перемешивают при 0°C в течение 1 часа. Реакцию гасят добавлением H2O (50 мл) и экстрагируют CH2Cl2 (3×50 мл). Объединенные органические экстракты промывают насыщенным раствором соли (50 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетат=2:1) с получением неочищенного продукта (2,0 г, 3,53 ммоль, Вд=78%) в виде белого твердого вещества.
Раствор гидрируют баллоном водорода. Раствор фильтруют с целитом. Отфильтрованное was концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/EtOAc=2:1) с получением продукта ERX1095 (1,5 г, 3,26 ммоль, Вд=89%) в виде белого твердого вещества.
К раствору ERX1095 (130 мг, 0,27 ммоль) в бензоле (5 мл) добавляют Ag2CO3 (148 мг, 0,54 ммоль). Реакционную смесь нагревают при кт в течение ночи. Раствор фильтруют и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/EtOAc=2:1) с получением конечного продукта (80 мг, 0,167 ммоль, Вд=62%) в виде красного твердого вещества.
ERX1095 данные:
1Н ЯМР δ (500 МГц, CDCl3): 6,78 (1H, с), 5,77 (1H, д, J=6,2 Гц), 5,15 (1H, с), 5,07 (1H, с), 3,52 (3H, с), 3,44-3,50 (1H, м), 2,42 (1H, д, J=15,7 Гц), 2,22 (3H, с), 2,14-2,20 (1H, м), 2,01-2,11 (2H, м), 1,80-1,89 (2H, м), 1,30-1,70 (8H, м), 1,47 (3H, с), 1,21 (3H, с), 1,16 (3H, с), 1,16 (3H, д, J=6,8 Гц), 1,08 (3H, с), 0,91-0,97 (1H, м), 0,55 (3H, с); ЖХ-МС: ву=2,19 мин, m/z=481 [M+H]+, чистота=97,35% (214 нм).
ERX1096 данные:
1Н ЯМР δ (500 МГц, CDCl3): 6,28 (1H, с), 5,70 (1H, д, J=6,0 Гц), 3,58 (3H, с), 3,39-3,46 (1H, м), 2,39 (1H, д, J=15,7 Гц), 2,15-2,24 (1H, м), 2,02-2,10 (1H, м), 2,00 (3H, с), 1,78-1,92 (3H, м), 1,59 (3H, с), 1,24-1,74 (8H, м), 1,28 (3H, д, J=7,3 Гц), 1,18 (3H, с), 1,17 (3H, с), 1,08 (3H, с), 0,93-0,98 (1H, м), 0,60 (3H, с);13С ЯМР δ (125 МГц, CDCl3): 181,32, 180,57, 178,83, 167,19, 149,49, 146,44, 132,47, 122,64, 122,32, 51,58, 44,25, 43,88, 40,39, 38,68, 37,18, 36,59, 36,00, 34,77, 34,71, 32,75, 32,54, 31,57, 30,61, 30,48, 29,90, 28,77, 22,77, 20,50, 18,13, 11,35.
ЖХ-МС: ву=2,21 мин, m/z=479 [M+H]+, чистота=100% (214 нм).
Пример 61.
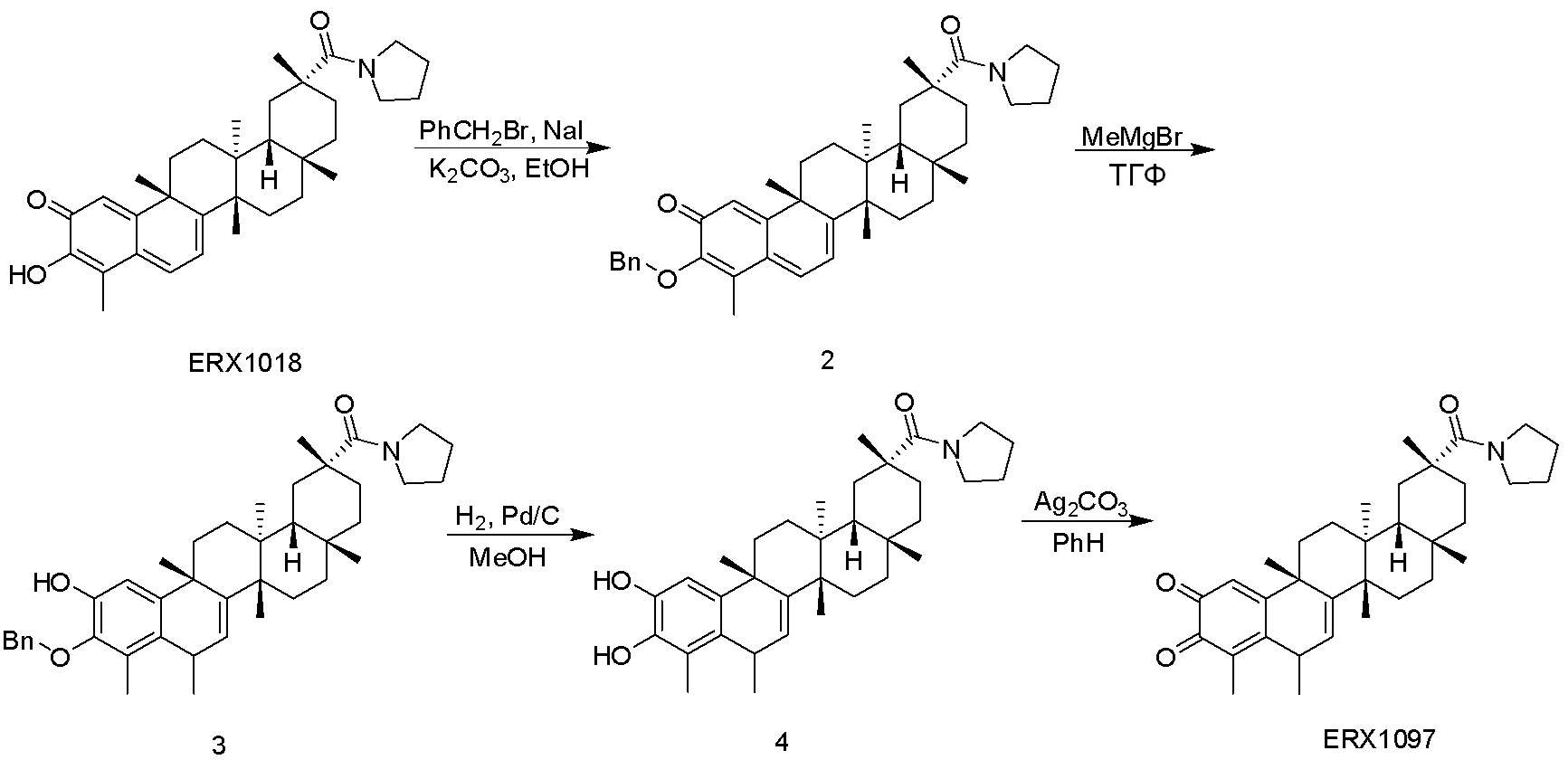
К раствору ERX1018 (503 мг, 1,0 ммоль) в EtOH (50 мл) добавляют K2CO3 (276 мг, 2,0 ммоль), NaI (6 мг, 0,04 ммоль), затем PhCH2Br (187 мг, 1,1 ммоль). Реакционную смесь нагревают при 80°C в течение ночи. Большую часть EtOH удаляют в вакууме. Остаток растворяют в CH2Cl2 (200 мл), промывают H2O (2×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетат=1:1) с получением продукта 2 (255 мг, 0,43 ммоль, Вд=43%) в виде желтого твердого вещества.
К раствору соединения 2 (100 мг, 0,17 ммоль) в безводном ТГФ (10 мл) добавляют 3 M MeMgBr в растворе ТГФ (0,57 мл, 1,7 ммоль) при 0°C по каплям. Реакционную смесь перемешивают при 0°C в течение 1 часа. Реакцию гасят добавлением H2O (50 мл) и экстрагируют CH2Cl2 (3×50 мл). Объединенные органические экстракты промывают насыщенным раствором соли (50 мл), сушат над MgSO4 и концентрируют в вакууме с получением неочищенного продукта (50 мг, 0,0824 ммоль, Вд=48%) в виде белого твердого вещества.
К раствору неочищенного соединения 3 (50 мг, 0,0824 ммоль) в MeOH (10 мл) добавляют 10% Pd/C (5 мг). Раствор гидрируют баллоном водорода. Раствор фильтруют с целитом. Отфильтрованное концентрируют в вакууме, и остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетат=1:1) с получением продукта 4 (20 мг, 0,0385 ммоль, Вд=47%) в виде белого твердого вещества.
К раствору соединения 4 (40 мг, 0,0771 ммоль) в бензоле (10 мл) добавляют Ag2CO3 (43 мг, 0,154 ммоль). Реакционную смесь нагревают при 60°C в течение 1 часа. Реакцию гасят H2O (50 мл) и экстрагируют CH2Cl2 (3×50 мл). Объединенные органические экстракты промывают насыщенным раствором соли (50 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2: MeOH=10:1) с получением конечного продукта (33 мг, 0,0637 ммоль, Вд=83%) в виде красного твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 6,27 (1H, с), 5,70 (1H, д, J=6,4 Гц), 3,58-3,68 (2H, м), 3,40-3,51 (2H, м), 3,25-3,33 (1H, м), 2,34-2,41 (2H, м), 2,09-2,18 (1H, м), 2,00 (3H, с), 1,42-1,96 (15H, м), 1,59 (3H, с), 1,26 (3H, д, J=7,1 Гц), 1,22 (3H, с), 1,19 (3H, с), 1,11 (3H, с), 0,93-0,99 (1H, м), 0,62 (3H, с); ЖХ-МС: ву=2,57 мин, m/z=518 [M+H]+, чистота=97,84% (214 нм).
Пример 62.
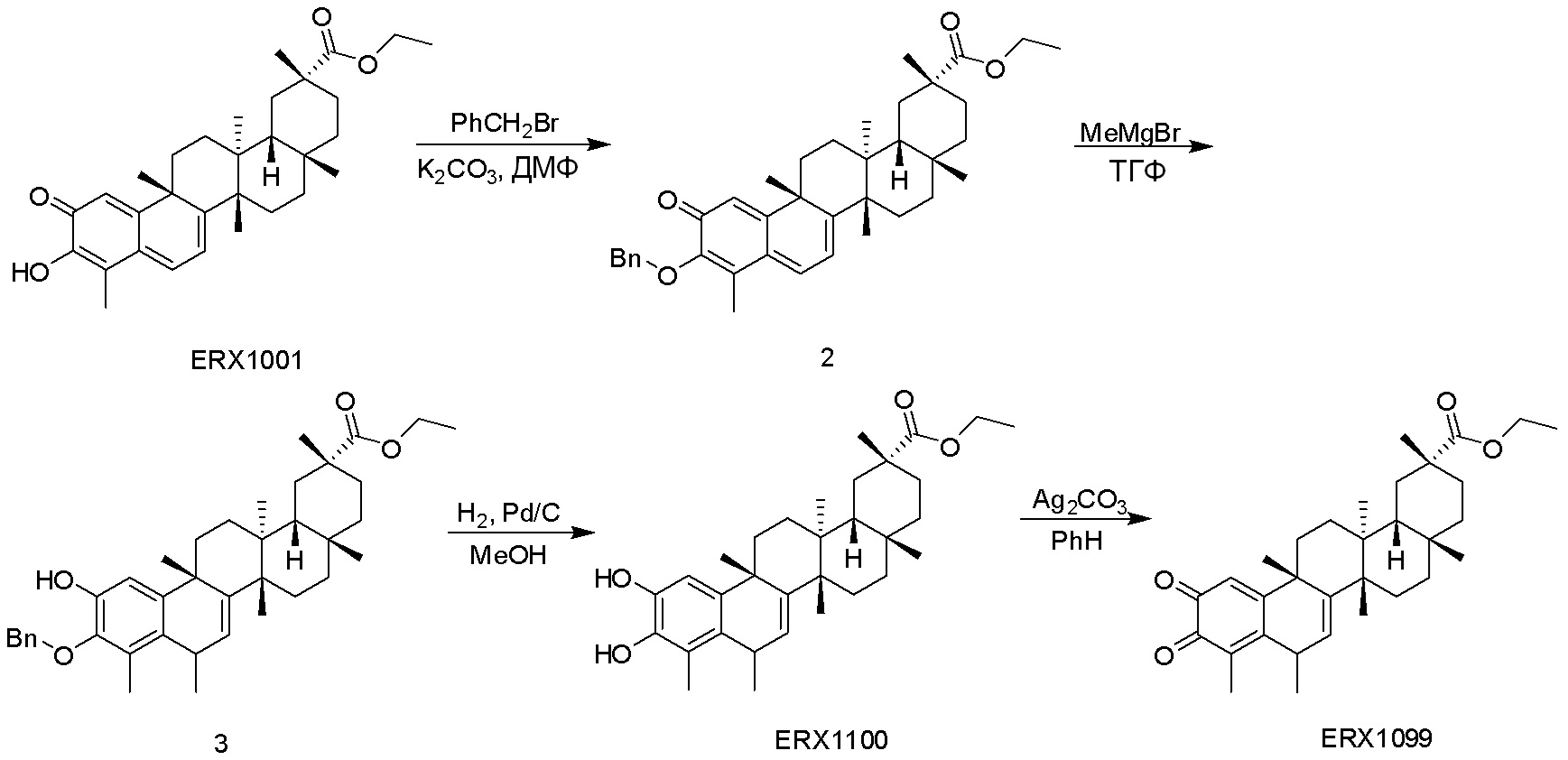
К раствору ERX1001 (478 мг, 1,0 ммоль) в ДМФ (10 мл) добавляют K2CO3 (276 г, 2,0 ммоль) затем PhCH2Br (187 мг, 1,1 ммоль). Реакционную смесь нагревают при 80°C в течение 2 часов. Реакционную смесь гасят льдом-H2O (50 мл) и фильтруют. Твердое вещество растворяют в CH2Cl2 (200 мл), промывают H2O (100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетат=3:1) с получением продукта 2 (300 мг, 0,528 ммоль, Вд=53%) в виде желтого твердого вещества.
К раствору 2 (568 г, 1,0 ммоль) в безводном ТГФ (20 мл) добавляют 3 M MeMgBr в растворе ТГФ (2,33 мл, 7,0 ммоль) при 0°C по каплям. Реакционную смесь перемешивают при 0°C в течение 1 часа. Реакцию гасят добавлением H2O (50 мл) и экстрагируют CH2Cl2 (3×50 мл). Объединенные органические экстракты промывают насыщенным раствором соли (50 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетат=2:1) с получением неочищенного продукта (400 мг, 0,685 ммоль, Вд=69%) в виде белого твердого вещества.
К раствору неочищенного продукта 3 (584 мг, 1,0 ммоль) в MeOH (10 мл) добавляют 10% Pd/C (58 мг). Раствор гидрируют баллоном водорода. Раствор фильтруют с целитом. Отфильтрованное концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/EtOAc=3:1) с получением продукта ERX1100 (450 мг, 0,911 ммоль, Вд=91%) в виде белого твердого вещества.
К раствору ERX1100 (494 мг, 1,0 ммоль) в бензоле (20 мл) добавляют Ag2CO3 (548 мг, 2,0 ммоль). Реакционную смесь нагревают при 60°C в течение ночи. Раствор фильтруют и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/EtOAc=3:1) с получением конечного продукта (200 мг, 0,813 ммоль, Вд=81%) в виде красного твердого вещества.
ERX1100 данные:
1Н ЯМР: δ (500 МГц, d6-ДМСО): 8,85 (1H, с), 7,86 (1H, с), 6,60 (1H, с), 5,73 (1H, д, J=6,2 Гц), 3,82-3,94 (2H, м), 3,32-3,40 (1H, м), 2,34 (1H, д, J=15,2 Гц), 2,06 (3H, с), 1,91-2,09 (3H, м), 1,20-1,85 (10H, м), 1,39 (3H, с), 1,17 (3H, с), 1,11 (3H, т, J=7,2 Гц), 1,11 (3H, с), 1,06 (3H, д, J=6,7 Гц), 1,06 (3H, с), 0,85-0,91 (1H, м), 0,49 (3H, с); ЖХ-МС:ву=2,85 мин, m/z=495 [M+H]+, чистота=100% (214 нм).
ERX1099 данные:
1Н ЯМР δ (500 МГц, CDCl3): 6,28 (1H, с), 5,70 (1H, д, J=5,6 Гц), 3,93-4,08 (2H, м), 3,39-3,46 (1H, м), 2,41 (1H, д, J=15,6 Гц), 2,18-2,23 (1H, м), 2,01-2,09 (1H, м), 2,00 (3H, с), 1,15-1,92 (11H, м), 1,59 (3H, с), 1,27 (3H, д, J=7,2 Гц), 1,22 (3H, т, J=7,3 Гц), 1,18 (3H, с), 1,17 (3H, с), 1,08 (3H, с), 0,92-0,98 (1H, м), 0,63 (3H, с); ЖХ-МС: ву=2,81 мин, m/z=493 [M+H]+, чистота=100% (214,254 нм).
Пример 63.
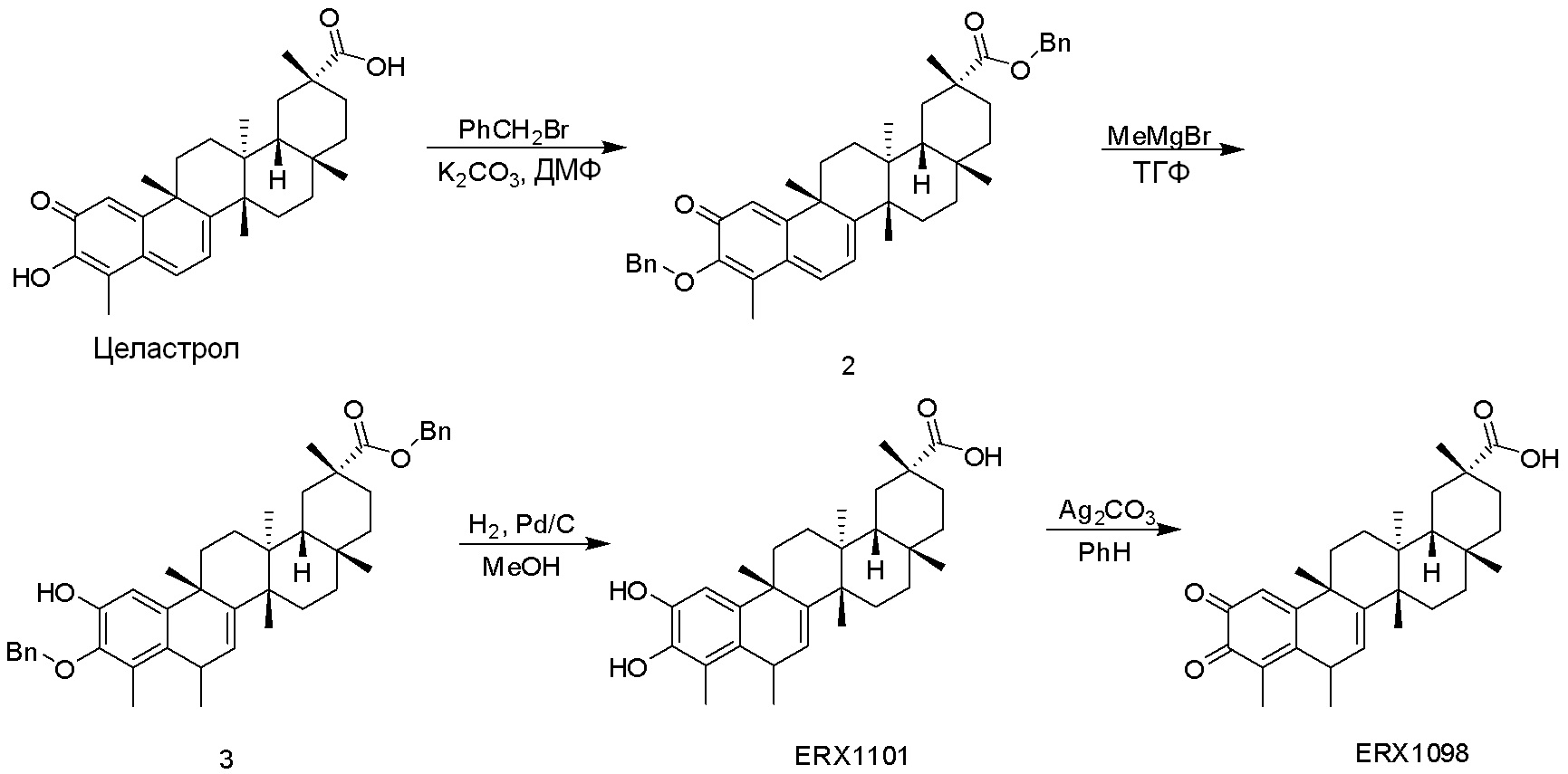
К раствору Целастрола (450 мг, 1,0 ммоль) в ДМФ (10 мл) добавляют K2CO3 (276 мг, 2,0 ммоль), затем PhCH2Br (374 мг, 2,2 ммоль). Реакционную смесь нагревают при 80°C в течение 2 часов. Реакционную смесь гасят льдом-водой (50 мл). Смесь фильтруют. Твердое вещество растворяют в CH2Cl2 (200 мл), промывают H2O (100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетат=3:1) с получением продукта 2 (400 мг, 0,635 ммоль, Вд=64%) в виде желтого твердого вещества.
К раствору соединения 2 (630 мг, 1,0 ммоль) в безводном ТГФ (20 мл) добавляют 3 M MeMgBr в растворе ТГФ (3,3 мл, 10 ммоль) при 0°C по каплям. Реакционную смесь перемешивают при 0°C в течение 1 часа. Реакцию гасят добавлением H2O (50 мл) и экстрагируют CH2Cl2 (2×100 мл). Объединенные органические экстракты промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетат=2:1) с получением неочищенного продукта (500 мг, 0,774 ммоль, Вд=77%) в виде белого твердого вещества.
К раствору соединения 3 (64,6 мг, 0,1 ммоль) в MeOH (10 мл) добавляют 10% Pd/C (6 мг). Раствор гидрируют баллоном водорода. Раствор фильтруют с целитом. Отфильтрованное концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/EtOAc=1:1) с получением продукта ERX1101 (30 мг, 0,0644 ммоль, Вд=64%) в виде белого твердого вещества.
К раствору ERX1101 (47 мг, 0,1 ммоль) в бензоле (10 мл) добавляют Ag2CO3 (55 мг, 0,2 ммоль). Реакционную смесь нагревают при 60°C в течение ночи. Раствор фильтруют и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/EtOAc=1:1) с получением конечного продукта ERX1098 (40 мг, 0,0862 ммоль, Вд=86%) в виде красного твердого вещества.
ERX1101 данные:
1Н ЯМР δ (500 МГц, d6-ДМСО): 11,9-12,2 (1H, ш), 8,80-9,10 (1H, ш), 7,80-8,10 (1H, ш), 6,60 (1H, с), 5,72 (1H, д, J=5,6 Гц), 2,35 (1H, д, J=15,3 Гц), 2,05 (3H, с), 1,94-2,05 (3H, м), 1,20-1,85 (1H, м), 1,38 (3H, с), 1,17 (3H, с), 1,08 (3H, с), 1,07 (3H, с), 1,04 (3H, с), 0,80-0,88 (1H, м), 0,65 (3H, с); ЖХ-МС: ву=2,03 мин, m/z=467,3 [M+H]+, чистота=100% (214 нм).
ERX1098 данные:
1Н ЯМР δ (400 МГц, CDCl3): 6,27 (1H, с), 6,65 (1H, д, J=6,5 Гц), 3,36-3,45 (1H, м), 2,38 (1H, д, J=13,9 Гц), 2,07-2,16 (1H, м), 2,00 (3H, с), 1,93-2,03 (1H, м), 1,32-1,90 (13H, м), 1,58 (3H, с), 1,29 (3H, д, J=7,3 Гц), 1,17 (3H, с), 1,16 (3H, с), 1,05 (3H, с), 0,86-0,94 (1H, м), 0,69 (3H, с); ЖХ-МС: ву=2,04 мин, m/z=467 [M+H]+, чистота=100% (214 нм).
Пример 64.
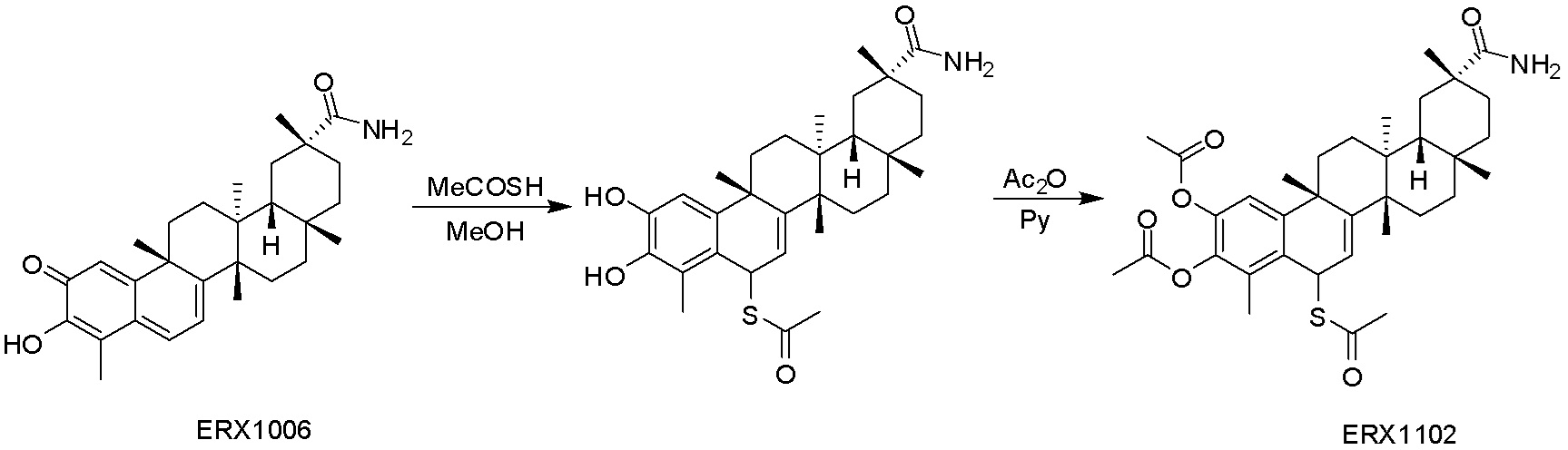
К раствору ERX1006 (200 мг, 0,44 ммоль) в MeOH (6 мл) добавляют MeCOSH (51 мг, 0,67 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Раствор превращается из красного в бледно-желтый. Затем раствор концентрируют в вакууме с получением неочищенной смеси.
К неочищенной смеси, полученной выше, в Ac2O (8 мл) добавляют пиридин (1 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь разбавляют EtOAc (200 мл), промывают водой (2×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (EtOAc) с получением продукта (100 мг, 0,164 ммоль, Выход=37%) в виде белого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 7,02 (1H, с), 5,94 (1H, д, J=6,4 Гц), 5,68 (1H, ш), 5,45 (1H, ш), 5,36 (1H, д, J=6,4 Гц), 2,43 (1H, д, J=15,9 Гц), 2,34 (3H, с), 2,31 (3H, с), 2,28 (3H, с), 2,07 (3H, с), 1,45-2,06 (13H, м), 1,43 (3H, с), 1,21 (3H, с), 1,19 (3H, с), 1,09 (3H, с), 0,96-1,02 (1H, м), 0,73 (3H, с); ЖХ-МС:ву=1,90 мин, m/z=610 [M+H]+, чистота=97,73% (214 нм).
Пример 65.
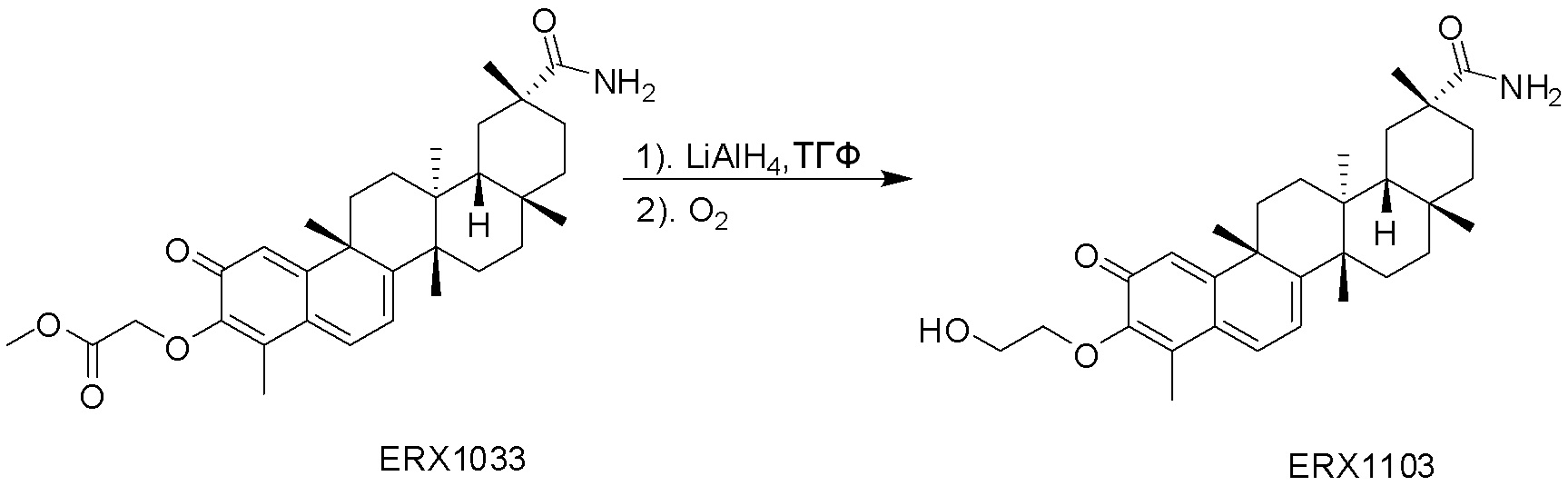
К раствору ERX1033 (200 мг, 0,58 ммоль) в ТГФ (5,0 мл) добавляют LiAlH4 (28 мг, 0,76 ммоль). Реакционную смесь перемешивают при 0°C в течение 0,5 часа. Реакционную смесь гасят насыщ. раствором NH4Cl. Раствор нагревают при 50°C на воздухе в течение 2 часов. Смесь разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2/MeOH=10:1) с получением продукта (6 мг, 0,0122 ммоль, Выход=3%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,06 (1H, дд, J=7,1, 0,9 Гц), 6,47 (1H, д, J=0,9 Гц), 6,34 (1H, д, J=7,1 Гц), 5,68 (1H, ш), 5,24 (1H, ш), 5,09 (1H, т, J=5,2 Гц), 3,98-4,10 (2H, м), 3,78-3,86 (2H, м), 2,39 (1H, д, J=15,8 Гц), 2,26 (3H, с), 1,47-2,20 (13H, м), 1,45 (3H, с), 1,27 (3H, с), 1,21 (3H, с), 1,12 (3H, с), 0,99-1,06 (1H, м), 0,76 (3H, с); ЖХ-МС: ву=2,05 мин, m/z=494,3 [M+H]+, чистота=93,7% (214nm), 100% (254 нм).
Пример 66.
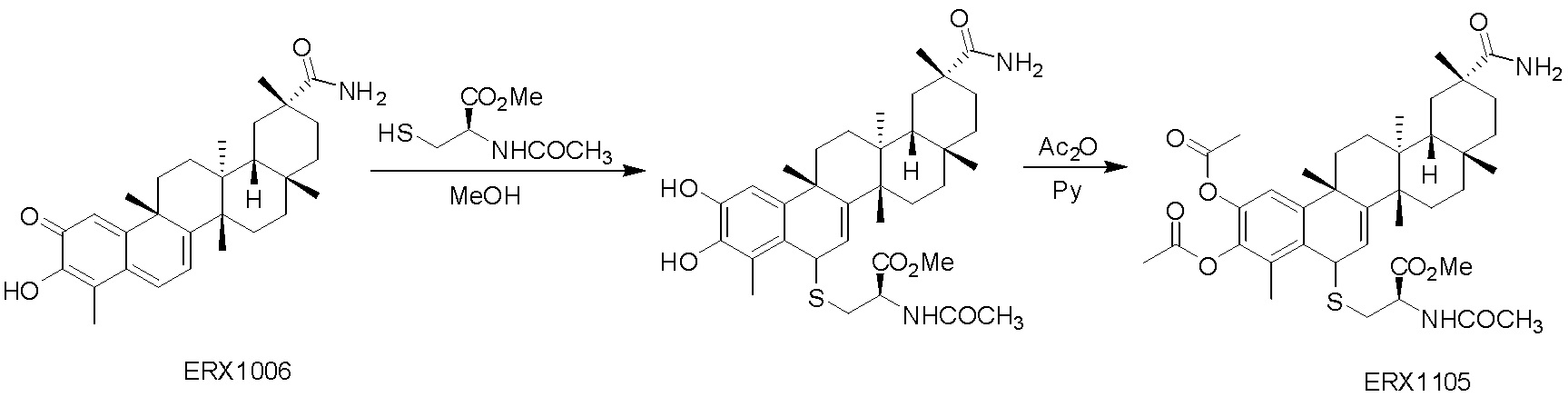
К раствору ERX1006 (200 мг, 0,444 ммоль) в MeOH (20 мл) добавляют этилового эфира N-ацетил-L-цистеина (157 мг, 0,888 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Раствор превращается из красного в бледно-желтый. Затем раствор was концентрируют в вакууме с получением неочищенной смеси.
К неочищенной смеси полученной выше, в пиридин (2 мл) добавляют Ac2O (1 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь выливают в H2O (100 мл), фильтруют. Твердое вещество растворяют в EtOAc (200 мл), промывают водой (100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (EtOAc) с получением продукта (184,2 мг, 0,259 ммоль, общий выход=58%) в виде белого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,01 (1H, с), 6,26 (1H, д, J=7,5 Гц), 5,94 (1H, д, J=6,3 Гц), 5,65 (1H, ш), 5,19 (1H, ш), 4,88 (1H, кв, J=6,0 Гц), 4,63 (1H, д, J=6,3 Гц), 3,74 (3H, с), 3,31 (1H, дд, J=13,5, 4,8 Гц), 2,93 (1H, дд, J=13,5, 5,9 Гц), 2,42 (1H, д, J=15,2 Гц), 2,31 (3H, с), 2,27 (3H, с), 2,25 (3H, с), 2,06 (3H, с), 1,45-2,10 (13H, м), 1,56 (3H, с), 1,26 (3H, с), 1,19 (3H, с), 1,11 (3H, с), 0,97-1,04 (1H, м), 0,73 (3H, с); ЖХ-МС:ву=2,00 мин, m/z=534,4 [M-SCH2CH(CO2Me)NHCOMe]+, чистота=100% (214, 254 нм).
Пример 67.
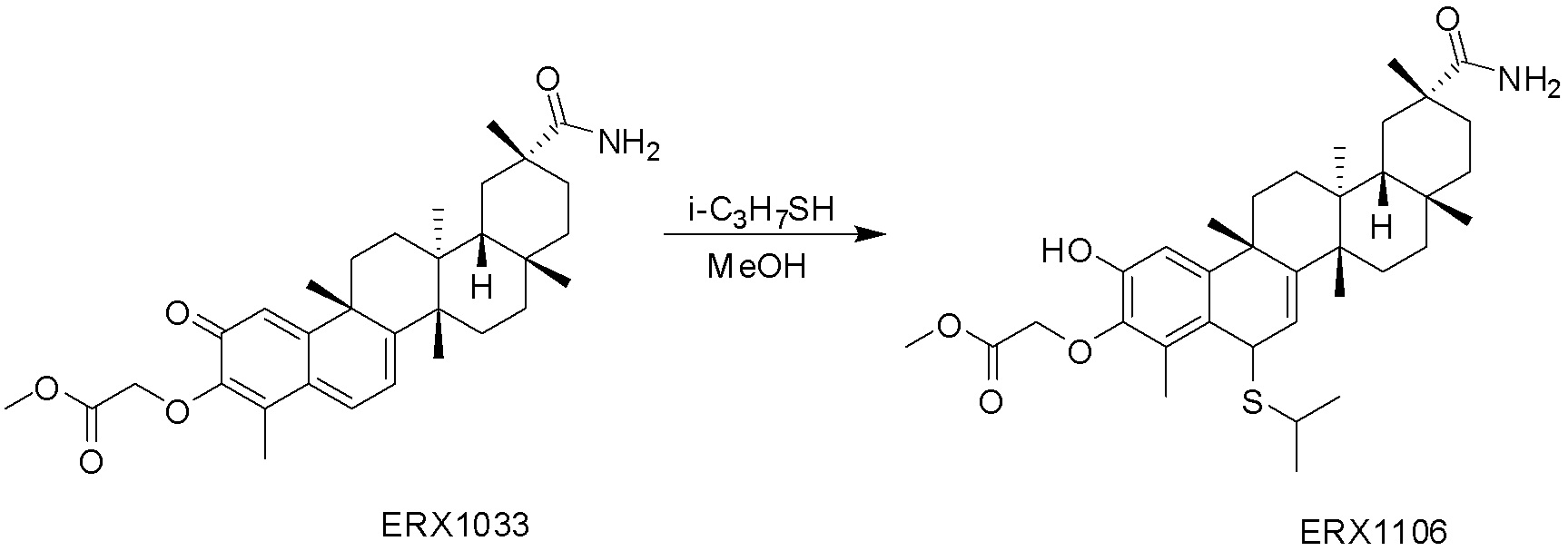
К раствору ERX1033 (52 мг, 0,1 ммоль) в MeOH (5,0 мл) добавляют i-C3H7SH (11,4 мг, 0,15 ммоль). Реакционную смесь перемешивают при к.т. в течение 2,0 часов. Раствор концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2/MeOH=10:1) с получением продукта (16 мг, 0,0268 ммоль, Выход=27%) в виде желтого твердого вещества.1Н ЯМР δ (500 МГц, d4-MeOD): 6,73 (1H, с), 6,06 (1H, д, J=6,2 Гц), 4,61 (1H, д, J=6,2 Гц), 3,80 (3H, с), 3,14-3,22 (1H, м), 2,47 (1H, д, J=15,7 Гц), 2,39 (3H, с), 2,04-2,15 (3H, м), 1,79-1,95 (3H, м), 1,45-1,71 (8H, м), 1,54 (3H, с), 1,40 (3H, д, J=6,6 Гц), 1,27 (3H, с), 1,25 (3H, д, J=6,4 Гц), 1,16 (3H, с), 1,12 (3H, с), 0,92-0,98 (1H, м), 0,77 (3H, с); ЖХ-МС: ву=2,02 мин, m/z=522,2 [M-C3H7S]+, чистота=94,01% (214nm), 86,66% (254 нм).
Пример 68.
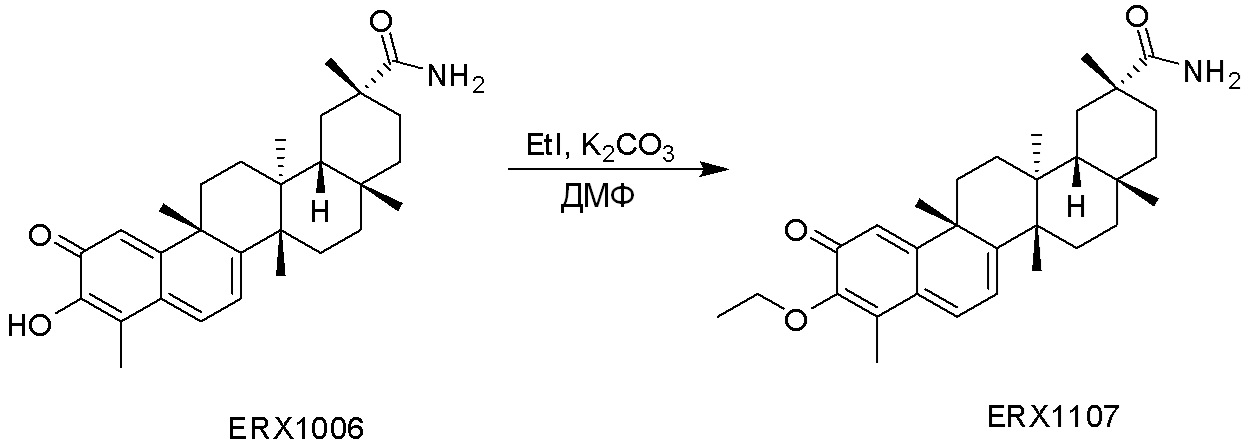
К раствору ERX1006 (45 мг, 0,1 ммоль) в ДМФ (5 мл) добавляют K2CO3 (28 мг, 0,2 ммоль), затем EtI (156 мг, 1,0 ммоль). Реакционную смесь перемешивают при 40°C в течение 4 часов. Реакционную смесь гасят льдом-водой (50 мл) и фильтруют. Твердое вещество растворяют с CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (этилацетат) с получением продукта (25 мг, 0,0523 ммоль, Выход=52%) в виде желтого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 6,94 (1H, дд, J=7,1, 1,2 Гц), 6,39 (1H, д, J=1,2 Гц), 6,28 (1H, д, J=7,1 Гц), 5,66 (1H, ш), 5,20 (1H, ш), 4,10 (2H, кв, J=7,1 Гц), 2,39 (1H, д, J=16,1 Гц), 2,22 (3H, с), 1,45-2,15 (13H, м), 1,44 (3H, с), 1,34 (3H, т, J=7,0 Гц), 1,26 (3H, с), 1,20 (3H, с), 1,12 (3H, с), 0,99-1,05 (1H, м), 0,76 (3H, с); ЖХ-МС: ву=1,83 мин, m/z=478,3 [M+H]+, чистота=100% (214, 254 нм).
Пример 69.
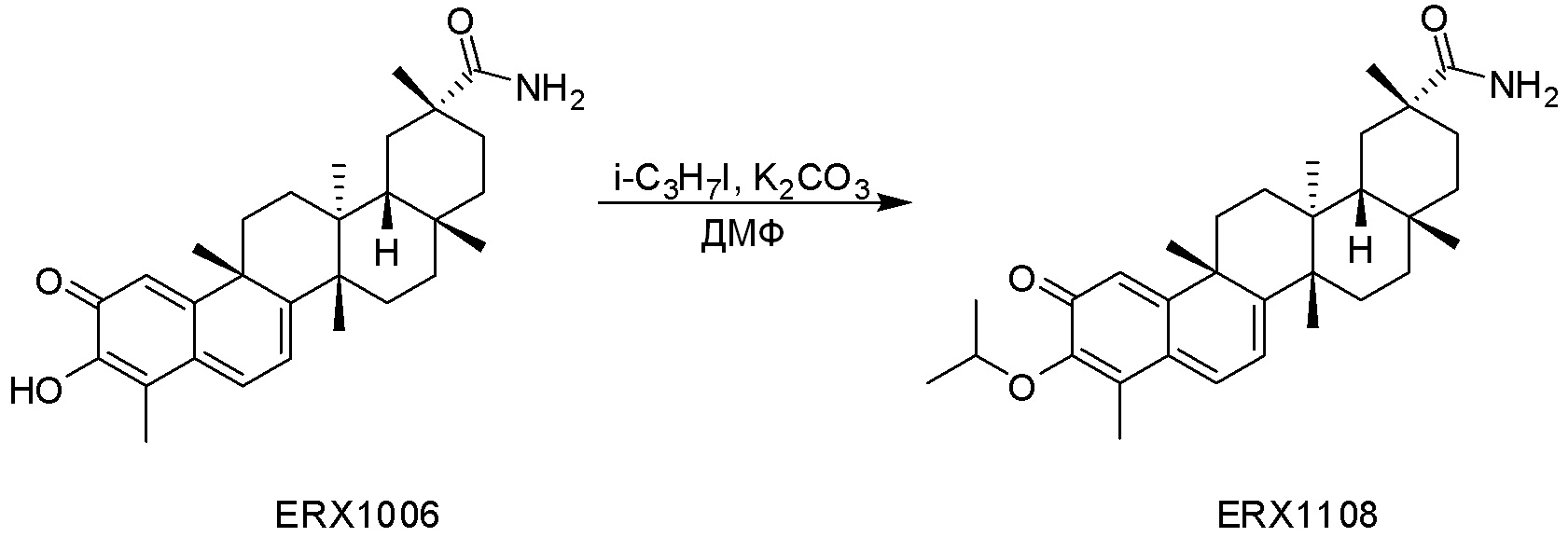
К раствору ERX1006 (45 мг, 0,1 ммоль) в ДМФ (5 мл) добавляют K2CO3 (28 мг, 0,2 ммоль), затем i-C3H7I (170 мг, 1,0 ммоль). Реакционную смесь перемешивают при 40°C в течение 4 часов. Реакционную смесь гасят льдом-водой (50 мл) и фильтруют. Твердое вещество растворяют с CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (этилацетат) с получением продукта (20 мг, 0,0407 ммоль, Выход=41%) в виде желтого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 6,92 (1H, дд, J=7,1, 1,2 Гц), 6,36 (1H, д, J=1,3 Гц), 6,27 (1H, д, J=7,1 Гц), 5,68 (1H, ш), 5,25 (1H, ш), 4,69-4,75 (1H, м), 2,39 (1H, д, J=15,9 Гц), 2,20 (3H, с), 1,47-2,13 (13H, м), 1,44 (3H, с), 1,28 (3H, д, J=6,0 Гц), 1,26 (3H, д, J=6,0 Гц), 1,26 (3H, с), 1,20 (3H, с), 1,12 (3H, с), 0,99-1,04 (1H, м), 0,77 (3H, с); ЖХ-МС:ву=1,90 мин, m/z=492,4 [M+H]+, чистота=100% (214, 254 нм).
Пример 70.
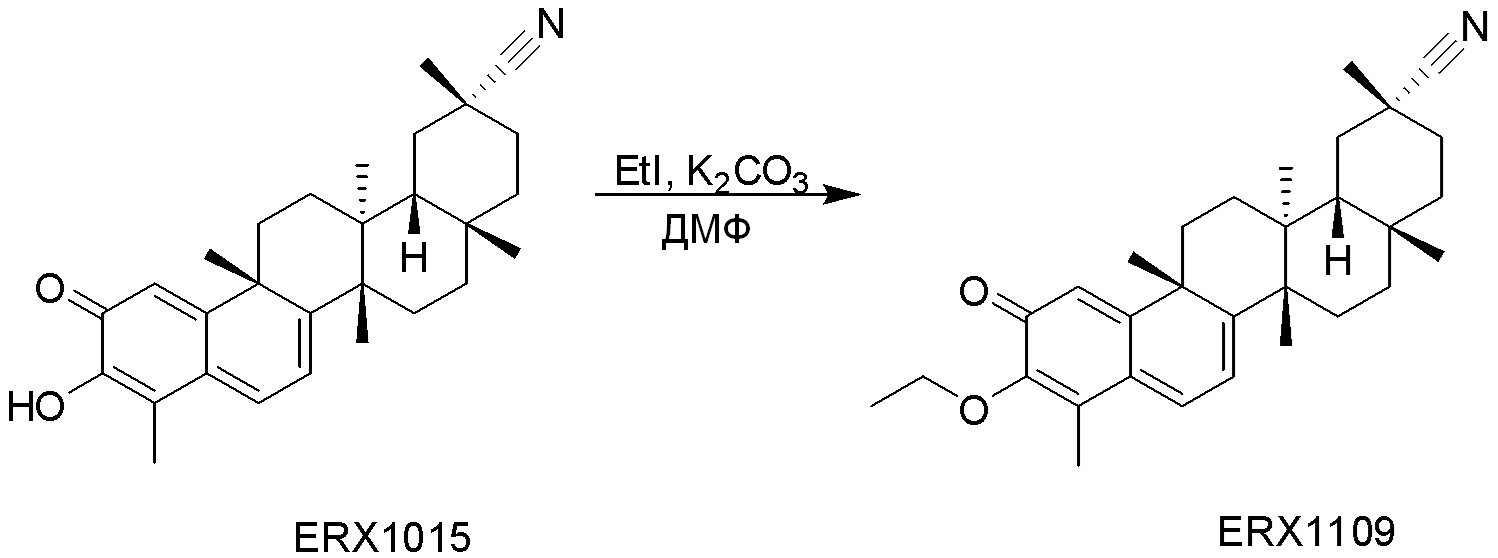
К раствору ERX1015 (80 мг, 0,174 ммоль) в EtI (1 мл) и ДМФ (2 мл) добавляют K2CO3 (72 мг, 0,522 ммоль). Реакционную смесь перемешивают при 50°C в течение ночи. Раствор разбавляют CH2Cl2 (300 мл), промывают насыщ. LiCl.H2O (2×100 мл), H2O (100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=2:1) с получением продукта (33,5 мг, 0,0729 ммоль, Выход=42%) в виде желтого твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 6,96 (1H, дд, J=7,1, 1,1 Гц), 6,41 (1H, д, J=1,2 Гц), 6,31 (1H, д, J=7,2 Гц), 4,06-4,16 (2H, м), 2,22 (3H, с), 1,54-2,18 (14, м), 1,47 (3H, с), 1,44 (3H, с), 1,35 (3H, т, J=7,1 Гц), 1,29 (3H, с), 1,08-1,15 (1H, м), 1,09 (3H, с), 1,05 (3H, с); ЖХ-МС: ву=1,98 мин, m/z=460,2 [M+H]+, чистота=100% (214, 254 нм).
Пример 71.
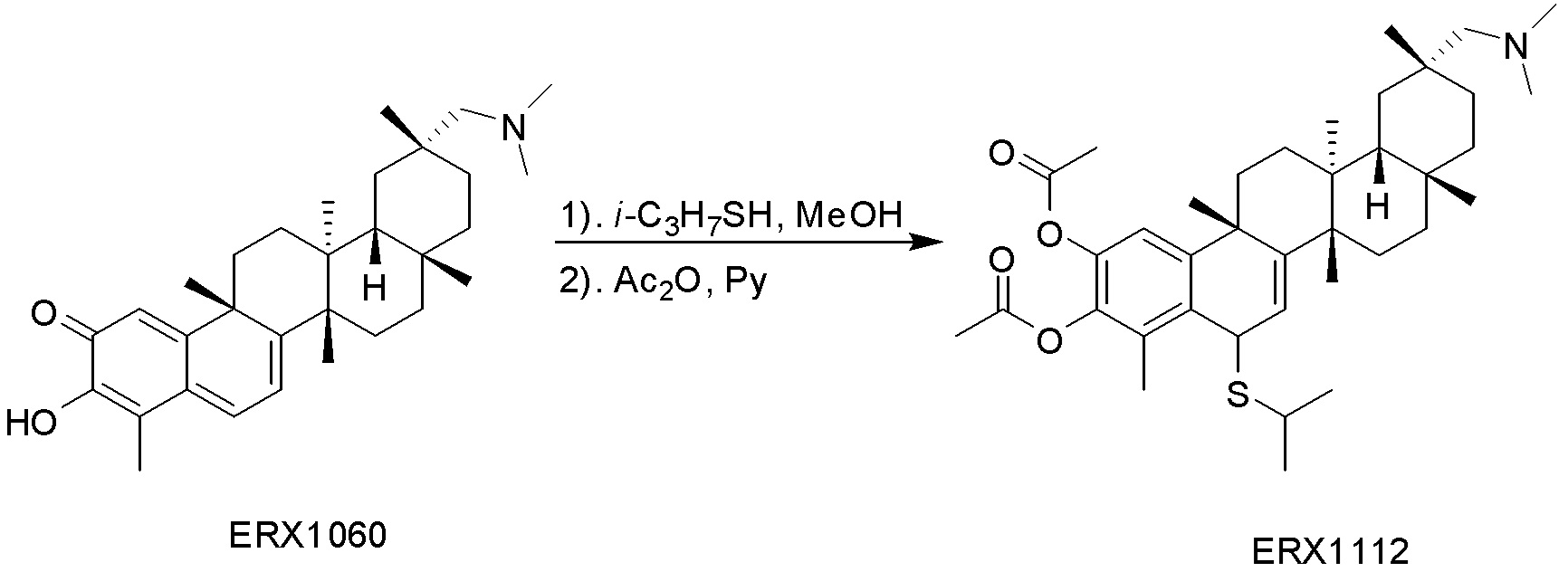
К раствору ERX1060 (30 мг, 0,0647 ммоль) в MeOH (1 мл) добавляют i-C3H7SH (7,6 мг, 0,1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Раствор превращается из красноватого в бледный красно-желтый. Затем раствор концентрируют в вакууме с получением неочищенной смеси, которую применяют на следующей стадии без дальнейшей очистки.
К неочищенной смеси полученной выше, в Ac2O (4 мл) добавляют пиридин (0,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь разбавляют CH2Cl2 (100 мл), промывают водой (2×50 мл), насыщенным раствором соли (50 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (CH2Cl2/MeOH=10:1) с получением продукта (5 мг, 0,00801 ммоль, общий выход=12%) в виде бледно-желтого твердого вещества.1Н ЯМР: δ (500 МГц, CDCl3): 7,02 (1H, с), 6,01 (1H, д, J=6,0 Гц), 4,59 (1H, д, J=6,1 Гц), 3,16-3,23 (1H, м), 2,20-2,50 (6H, ш), 2,31 (3H, с), 2,29 (3H, с), 2,27 (3H, с), 1,20-2,05 (16H, м), 1,57 (3H, с), 1,42 (3H, с), 1,41 (3H, д, J=7,0 Гц), 1,31 (3H, д, J=7,0 Гц), 1,22 (3H, с), 1,10 (3H, ш), 0,95-1,01 (1H, м), 0,77 (3H, с); ЖХ-МС: ву=1,76 мин, m/z=624,3 [M+H]+, чистота=95,93% (214 нм), 95,26% (254 нм).
Пример 72.
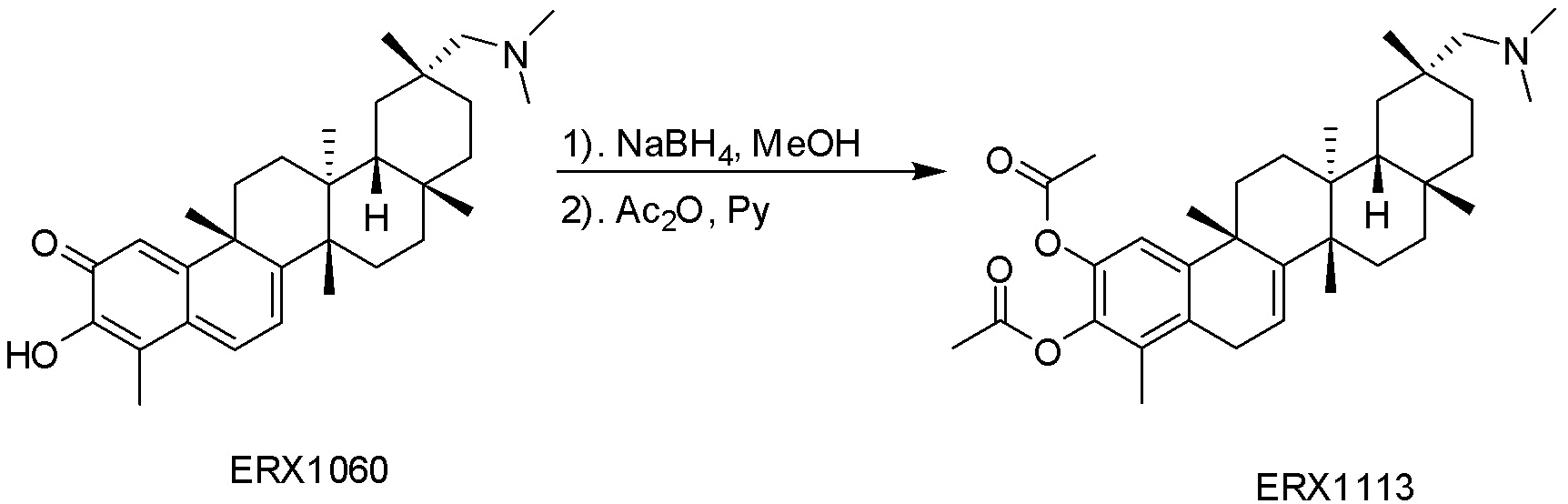
К раствору ERX1060 (70 мг, 0,15 ммоль) в MeOH (1 мл) добавляют NaBH4 (5,7 мг, 0,15 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Раствор превращается из красноватого в бледно-желтый. Затем раствор концентрируют в вакууме с получением неочищенной смеси, которую применяют на следующей стадии без дальнейшей очистки.
К неочищенной смеси полученной выше, в Ac2O (0,5 мл) добавляют пиридин (0,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь разбавляют CH2Cl2 (100 мл), промывают водой (2×50 мл), насыщенным раствором соли (50 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (CH2Cl2/MeOH=10:1) с получением продукта (10 мг, 0,0182 ммоль, Выход=12%) в виде бледно-желтого твердого вещества.1Н ЯМР: δ (500 МГц, CDCl3): 7,00 (1H, с), 5,80 (1H, дд, J=6,4, 1,9 Гц), 3,36 (1H, дд, J=20,5, 6,4 Гц), 3,09 (1H, д, J=20,5 Гц), 2,30-2,50 (6H, ш), 2,32 (3H, с), 2,20 (3H, с), 2,08 (3H, с), 1,33-2,07 (16H, м), 1,39 (3H, с), 1,31 (3H, с), 1,22 (3H, с), 1,11 (3H, ш), 0,95-1,01 (1H, м), 0,80 (3H, с); ЖХ-МС: ву=1,66 мин, m/z=550,4 [M+H]+, чистота=94,27% (214 нм).
Пример 73.
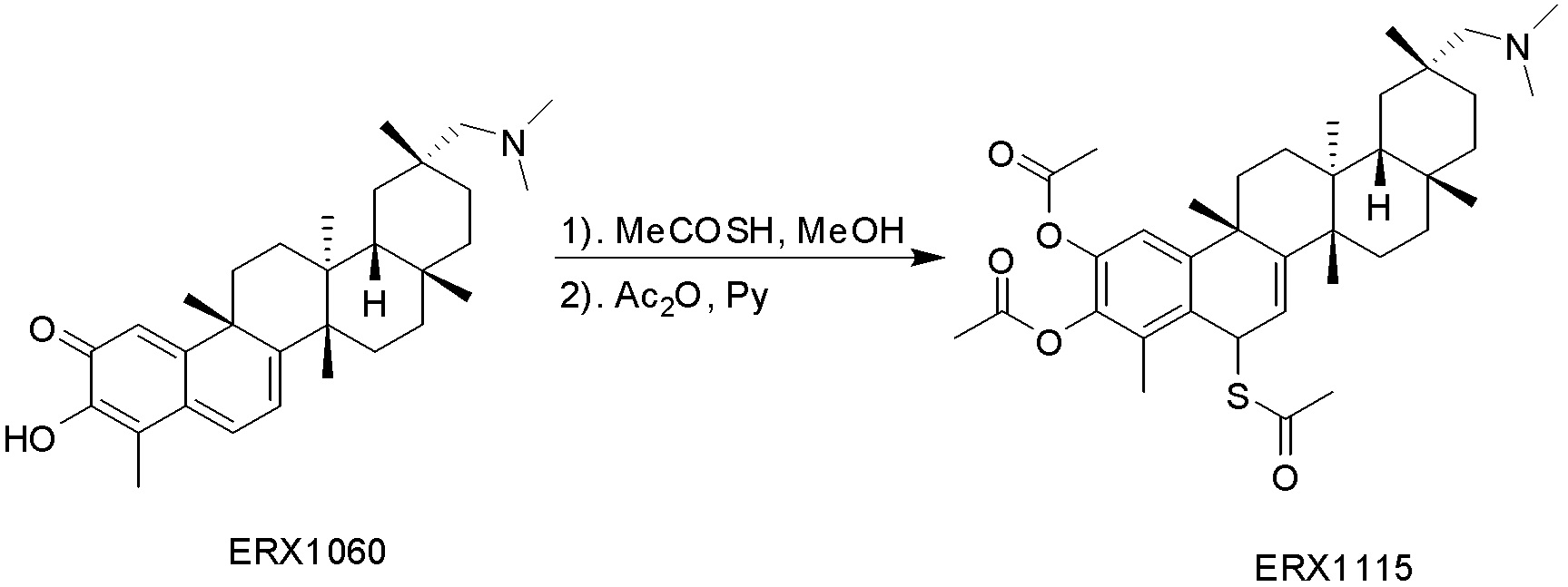
К раствору ERX1060 (20 мг, 0,0431 ммоль) в MeOH (1 мл) добавляют i-C3H7SH (5 мг, 0,0647 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Раствор превращается из красноватого в бледный красно-желтый. Затем раствор концентрируют в вакууме с получением неочищенной смеси, которую применяют на следующей стадии без дальнейшей очистки.
К неочищенной смеси полученной выше, в Ac2O (0,5 мл) добавляют пиридин (0,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь разбавляют CH2Cl2 (100 мл), промывают водой (2×50 мл), насыщенным раствором соли (50 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (CH2Cl2/MeOH=10:1) с получением продукта (10 мг, 0,016 ммоль, общий выход=37%) в виде бледно-желтого твердого вещества.1Н ЯМР: δ (500 МГц, CDCl3): 7,03 (1H, с), 5,95 (1H, д, J=6,4 Гц), 5,39 (1H, д, J=6,4 Гц), 2,26-2,50 (6H, ш), 2,36 (3H, с), 2,31 (3H, с), 2,28 (3H, с), 2,08 (3H, с), 1,25-2,06 (16H, м), 1,42 (3H, с), 1,37 (3H, с), 1,21 (3H, с), 1,11 (3H, ш), 0,94-1,00 (1H, м), 0,77 (3H, с); ЖХ-МС: ву=1,65 мин, m/z=624,3 [M+H]+, чистота=92,90% (214 нм), 97,84% (254 нм).
Пример 74.
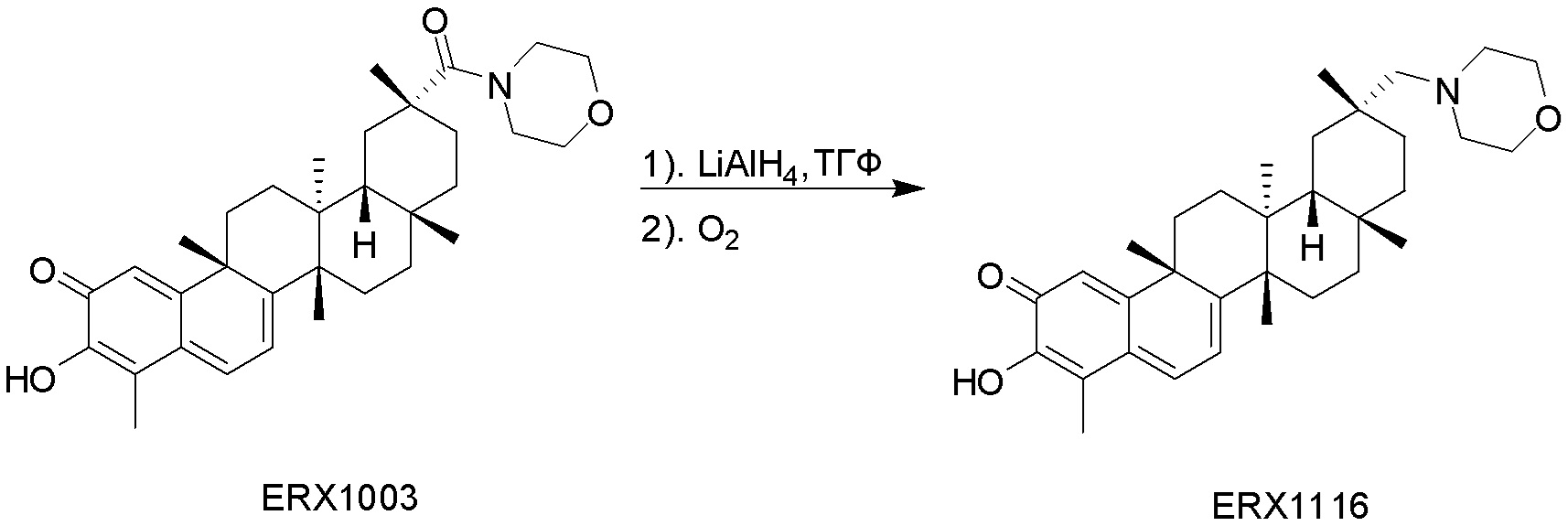
К раствору ERX1003 (90 мг, 0,174 ммоль) в безводном ТГФ (15 мл) добавляют LiAlH4 (494 мг, 13 ммоль). Смесь кипятят с обратным холодильником в течение ночи. Реакционную смесь гасят насыщ. раствором NH4Cl. Смесь нагревают при 50°C в течение 2 часов и фильтруют через тонкий слой силикагеля. Твердое вещество промывают ТГФ (3×50 мл). Объединенный фильтрат концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2: MeOH=10:1) с получением продукта (10 мг, 0,0198 ммоль, Вд=11%) в виде красного твердого вещества.1Н ЯМР: δ (500 МГц, CDCl3): 7,03 (1H, дд, J=7,3, 1,2 Гц), 6,97 (1H, с), 6,53 (1H, д, J=1,0 Гц), 6,39 (1H, д, J=6,9 Гц), 3,66 (1H, т, J=4,4 Гц), 2,46-2,53 (4H, м), 2,22 (3H, с), 2,06-2,20 (2H, м), 2,00-2,04 (1H, м), 1,30-1,91 (13H, м), 1,44 (3H, с), 1,40 (3H, с), 1,22 (3H, с), 1,01 (3H, с), 0,94-0,99 (1H, м), 0,79 (3H, с); ЖХ-МС: ву=1,60 мин, m/z=506,3 [M+H]+, чистота=100% (214,254 нм).
Пример 75.
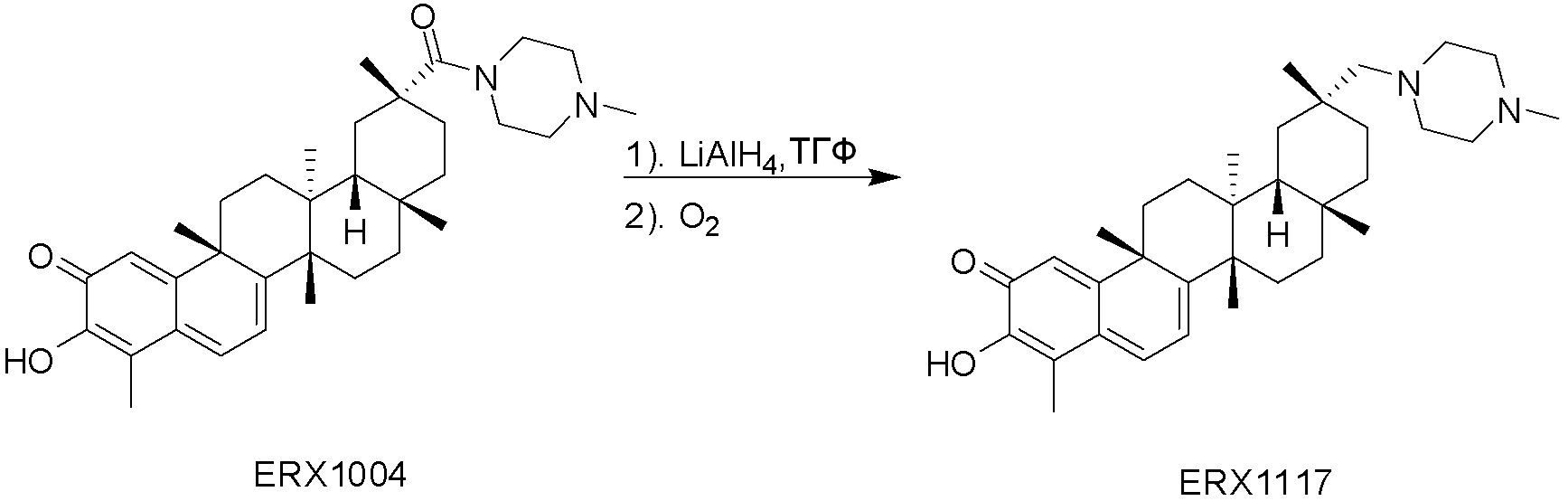
К раствору ERX1004 (150 мг, 0,282 ммоль) в безводном ТГФ (10 мл) добавляют LiAlH4 (54 мг, 1,5 ммоль). Смесь кипятят с обратным холодильником в течение ночи. Реакционную смесь гасят насыщ. раствором NH4Cl. Смесь нагревают при 50°C в течение 2 часов и фильтруют через тонкий слой силикагеля. Твердое вещество промывают ТГФ (3×50 мл). Объединенный фильтрат концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2:MeOH=10:1) с получением продукта (10 мг, 0,0193 ммоль, Вд=7%) в виде красного твердого вещества.1Н ЯМР: δ (500 МГц, CDCl3): 7,03 (1H, дд, J=7,4, 1,4 Гц), 6,96 (1H, с), 6,53 (1H, д, J=1,0 Гц), 6,39 (1H, д, J=6,9 Гц), 2,42-2,70 (8H, м), 2,37 (3H, с), 2,22 (3H, с), 1,23-2,23 (16H, м), 1,44 (3H, с), 1,40 (3H, с), 1,21 (3H, с), 1,01 (3H, с), 0,93-0,99 (1H, м), 0,78 (3H, с); ЖХ-МС: ву=1,69 мин, m/z=519,3 [M+H]+, чистота=100% (214 нм), 97,88% (254 нм).
Пример 76.
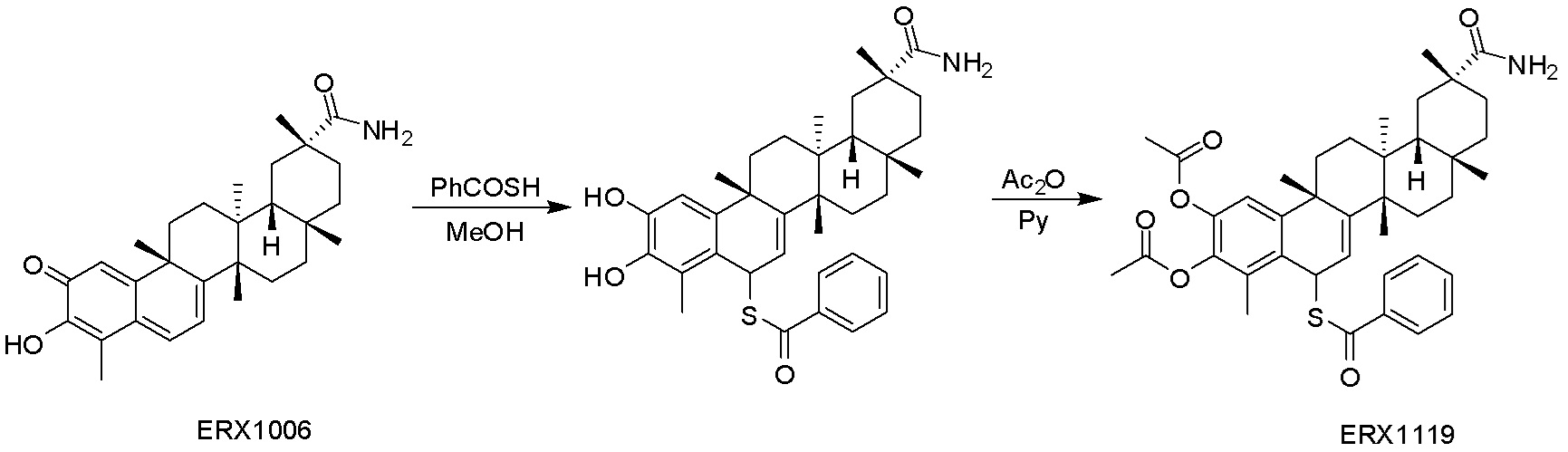
К раствору ERX1006 (100 мг, 0,222 ммоль) в MeOH (10 мл) добавляют PhCOSH (46 мг, 0,333 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Раствор превращается из красного в бледно-желтый. Затем раствор концентрируют в вакууме с получением неочищенной смеси.
К неочищенной смеси, полученной выше, в Ac2O (4 мл) добавляют пиридин (0,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь разбавляют CH2Cl2 (200 мл), промывают водой (2×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2/MeOH=10:1) с получением продукта (50 мг, 0,0744 ммоль, Выход=34%) в виде белого твердого вещества.1Н ЯМР: δ (500 МГц, CDCl3): 7,95 (2H, т, J=7,4 Гц), 7,56 (1H, т, J=7,4 Гц), 7,44 (2H, т, J=7,4 Гц), 7,06 (1H, с), 6,06 (1H, д, J=6,5 Гц), 5,68 (1H, ш), 5,60 (1H, д, J=6,5 Гц), 5,24 (1H, ш), 2,44 (1H, д, J=14,9 Гц), 2,30 (3H, с), 2,28 (3H, с), 2,12 (3H, с), 1,40-2,10 (13H, м), 1,51 (3H, с), 1,20 (3H, с), 1,19 (3H, с), 1,09 (3H, с), 0,96-1,02 (1H, м), 0,76 (3H, с); ЖХ-МС: ву=2,01 мин, массовые пики не интегрированы, чистота=99,59% (254 нм).
Пример 77.
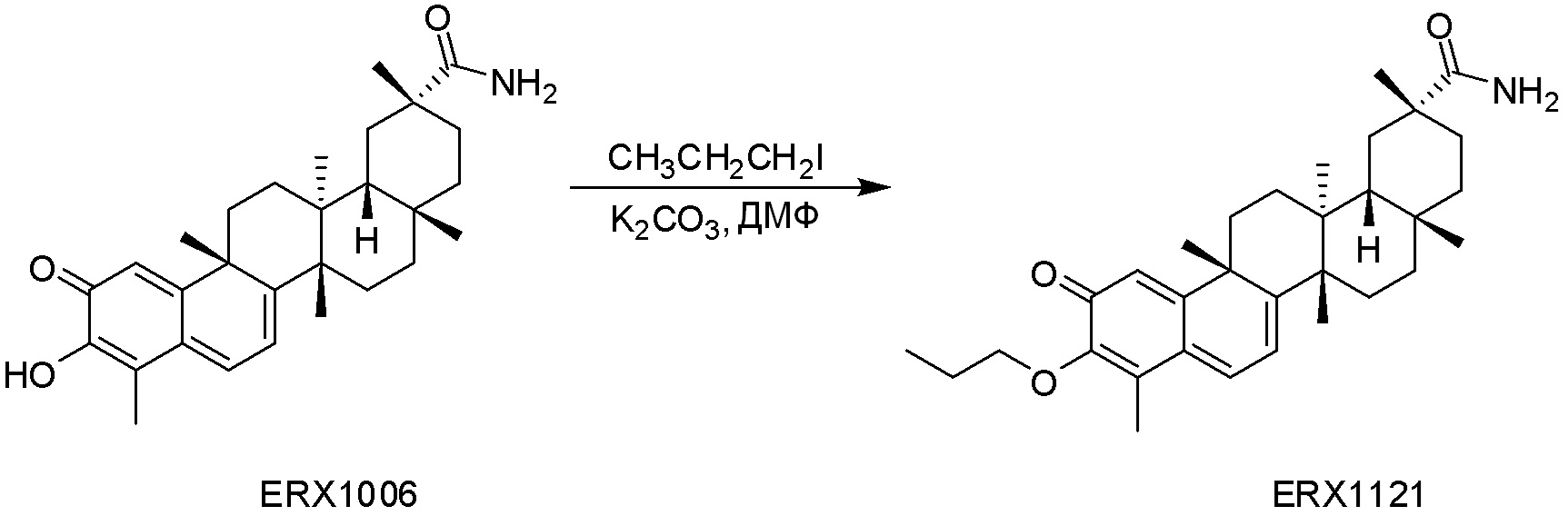
К раствору ERX1006 (200 мг, 0,445 ммоль) в ДМФ (5 мл) добавляют K2CO3 (123 мг, 0,890 ммоль), затем CH3CH2CH2I (756 мг, 0,43 мл, 4,45 ммоль). Реакционную смесь перемешивают при 50°C в течение ночи. Смесь разбавляют EtOAc (200 мл), промывают насыщ. раствором LiCl.H2O (3×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:3, два раза) с получением продукта (101 мг, 0,205 ммоль, Выход=46%) в виде желтого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 6,94 (1H, дд, J=7,0, 1,4 Гц), 6,38 (1H, д, J=1,4 Гц), 6,28 (1H, д, J=7,0 Гц), 5,70 (1H, ш), 5,35 (1H, ш), 4,00 (1H, т, J=6,8 Гц), 2,39 (1H, д, J=15,5 Гц), 2,22 (3H, с), 1,45-2,15 (15H, м), 1,44 (3H, с), 1,26 (3H, с), 1,20 (3H, с), 1,12 (3H, с), 1,00 (3H, т, J=7,6 Гц), 0,98-1,05 (1H, м), 0,75 (3H, с); ЖХ-МС: ву=1,89 мин, m/z=492,4 [M+H]+, чистота=100% (214 нм), 97,59% (254 нм).
Пример 78.
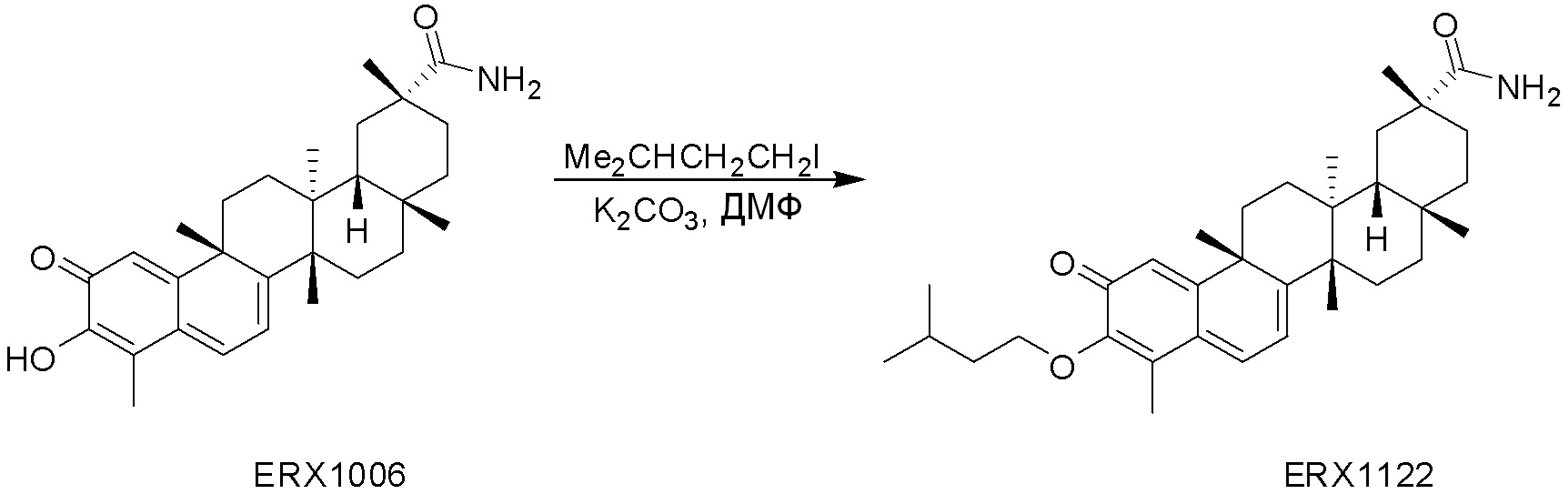
К раствору ERX1006 (200 мг, 0,445 ммоль) в ДМФ (5 мл) добавляют K2CO3 (123 мг, 0,890 ммоль), затем Me2CHCH2CH2I (881 мг, 0,59 мл, 4,45 ммоль). Реакционную смесь перемешивают при 50°C в течение ночи. Смесь разбавляют CH2Cl2 (200 мл), промывают насыщ. раствором LiCl.H2O (2×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:3) с получением продукта (88,8 мг, 0,171 ммоль, Выход=38%) в виде желтого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 6,94 (1H, д, J=7,1 Гц), 6,38 (1H, с), 6,28 (1H, д, J=7,1 Гц), 5,69 (1H, ш), 5,30 (1H, ш), 4,06 (1H, т, J=6,9 Гц), 2,39 (1H, д, J=15,7 Гц), 2,21 (3H, с), 1,45-2,14 (16H, м), 1,44 (3H, с), 1,26 (3H, с), 1,20 (3H, с), 1,12 (3H, с), 0,98-1,05 (1H, м), 0,94 (6H, д, J=6,4 Гц), 0,76 (3H, с); ЖХ-МС: ву=2,00 мин, m/z=520,4 [M+H]+, чистота=98,46% (214 нм), 98,77% (254 нм).
Пример 79.

К раствору ERX1006 (100 мг, 0,222 ммоль) в ДМФ (10 мл) добавляют K2CO3 (61 мг, 0,44 ммоль), затем йодциклопентан (217 мг, 1,11 ммоль). Реакционную смесь перемешивают при 40°C в течение ночи. Смесь разбавляют CH2Cl2 (100 мл), промывают насыщ. раствор LiCl.H2O (2×50 мл), насыщенным раствором соли (50 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (этилацетат) с получением продукта (56 мг, 0,108 ммоль, Выход=50%) в виде желтого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 6,91 (1H, дд, J=7,0, 1,1 Гц), 6,36 (1H, д, J=1,1 Гц), 6,27 (1H, д, J=7,0 Гц), 5,70 (1H, ш), 5,36 (1H, ш), 5,15-5,19 (1H, м), 2,39 (1H, д, J=15,6 Гц), 2,18 (3H, с), 1,46-2,12 (21H, м), 1,44 (3H, с), 1,26 (3H, с), 1,20 (3H, с), 1,11 (3H, с), 0,98-1,04 (1H, м), 0,76 (3H, с); ЖХ-МС: ву=1,44 мин, m/z=518,4 [M+H]+, чистота=97,22% (214 нм), 99,30% (254 нм).
Пример 80.
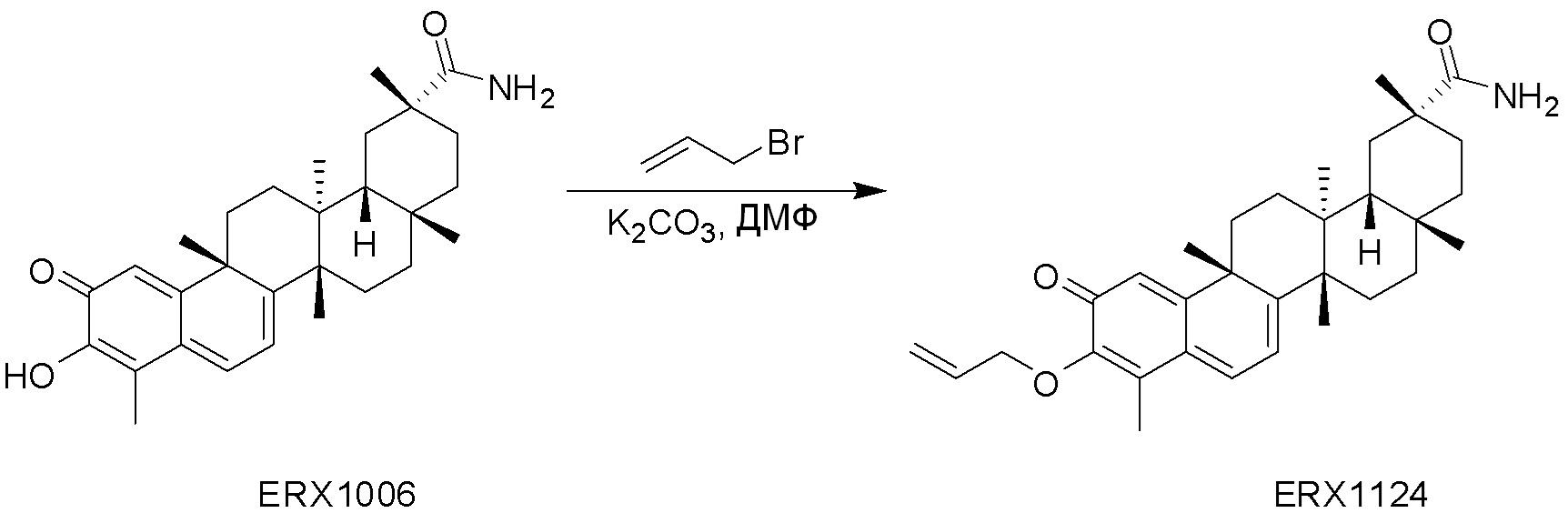
К раствору ERX1006 (180 мг, 0,4 ммоль) в ДМФ (10 мл) добавляют K2CO3 (110 мг, 0,8 ммоль), затем аллилбромид (242 мг, 2,0 ммоль). Реакционную смесь перемешивают при 40°C в течение ночи. Смесь разбавляют CH2Cl2 (100 мл), промывают насыщ. раствором LiCl.H2O (2×50 мл), насыщенным раствором соли (50 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (этилацетат) с получением продукта (98 мг, 0,2 ммоль, Выход=50%) в виде желтого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 6,95 (1H, дд, J=7,0, 1,0 Гц), 6,39 (1H, д, J=1,0 Гц), 6,28 (1H, д, J=7,0 Гц), 6,02-6,12 (1H, м), 5,68 (1H, ш), 5,34 (1H, дд, J=17,2, 1,4 Гц), 5,20 (1H, д, J=10,4 Гц), 4,60 (1H, д, J=5,1 Гц), 2,39 (1H, д, J=16,1 Гц), 2,21 (3H, с), 1,45-2,12 (13H, м), 1,44 (3H, с), 1,26 (3H, с), 1,20 (3H, с), 1,12 (3H, с), 0,98-1,05 (1H, м), 0,76 (3H, с); ЖХ-МС: ву=1,84 мин, m/z=490,2 [M+H]+, чистота=100% (214, 254 нм).
Пример 81.
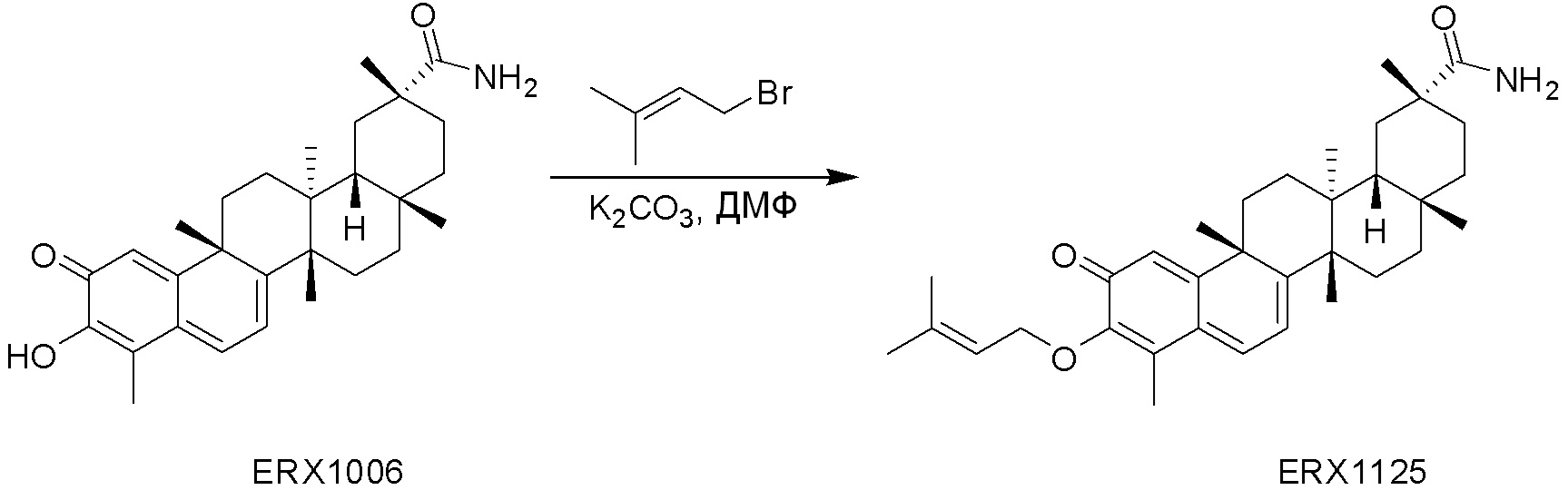
К раствору ERX1006 (100 мг, 0,22 ммоль) в ДМФ (10 мл) добавляют K2CO3 (61 мг, 0,44 ммоль), затем 3,3-диметилаллилбромид (217 мг, 1,11 ммоль). Реакционную смесь перемешивают при 40°C в течение ночи. Смесь разбавляют CH2Cl2 (100 мл), промывают насыщ. раствором LiCl.H2O (2×50 мл), насыщенным раствором соли (50 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (этилацетат) с получением продукта (56 мг, 0,11 ммоль, Выход=50%) в виде желтого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 6,94 (1H, дд, J=7,0, 1,1 Гц), 6,38 (1H, д, J=1,1 Гц), 6,27 (1H, д, J=7,0 Гц), 5,72 (1H, ш), 5,52 (1H, тт, J=7,2, 1,3 Гц), 5,46 (1H, ш), 4,54-4,63 (2H, м), 2,40 (1H, д, J=15,7 Гц), 2,20 (3H, с), 1,45-2,12 (13H, м), 1,75 (3H, с), 1,69 (3H, с), 1,43 (3H, с), 1,25 (3H, с), 1,20 (3H, с), 1,11 (3H, с), 0,98-1,04 (1H, м), 0,75 (3H, с); ЖХ-МС: ву=2,43 мин, m/z=518,3 [M+H]+, чистота=100% (214, 254 нм).
Пример 82.

К раствору ERX1006 (200 мг, 0,44 ммоль) в ДМФ (10 мл) добавляют K2CO3 (121 мг, 0,88 ммоль), затем пропаргилбромид (263 мг, 2,23 ммоль). Реакционную смесь перемешивают при 40°C в течение ночи. Смесь разбавляют CH2Cl2 (100 мл), промывают насыщ. раствор LiCl.H2O (2×50 мл), насыщенным раствором соли (50 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (этилацетат) с получением продукта (100 мг, 0,205 ммоль, Выход=47%) в виде желтого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 7,00 (1H, дд, J=7,0, 1,0 Гц), 6,39 (1H, д, J=1,0 Гц), 6,30 (1H, д, J=7,5 Гц), 5,68 (1H, ш), 5,34 (1H, ш), 4,88 (1H, AB×d, J=15,9, 2,4 Гц), 4,85 (1H, AB×d, J=15,9, 2,4 Гц), 2,42 (1H, т, J=2,3 Гц), 2,40 (1H, д, J=16,0 Гц), 2,28 (3H, с), 1,46-2,13 (13H, м), 1,45 (3H, с), 1,26 (3H, с), 1,20 (3H, с), 1,12 (3H, с), 0,99-1,05 (1H, м), 0,76 (3H, с); ЖХ-МС: ву=1,78 мин, m/z=488,3 [M+H]+, чистота=100% (214 нм), 93,38% (254 нм).
Пример 83.
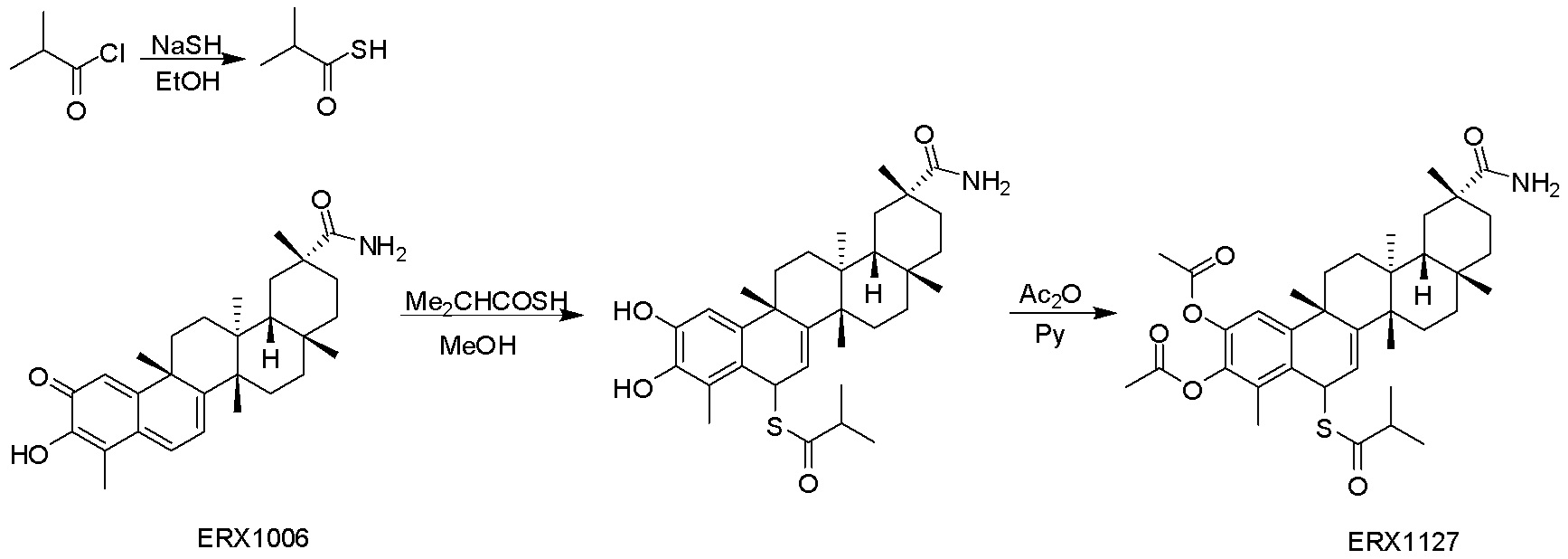
К раствору НАСГ (2,0 г, 35,7 ммоль) в EtOH (20 мл) добавляют Me2CHCOCl (4,0 г, 37,6 ммоль) по каплям. Раствор перемешивают при кт в течение 1 часа. Раствор концентрируют в вакууме и применяют на следующей стадии без дальнейшей очистки.
К раствору ERX1006 (50 мг, 0,11 ммоль) в MeOH (5 мл) добавляют Me2CHCOSH (23 мг, 0,22 ммоль) в EtOH (2 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Раствор превращается из красного в бледно-желтый. Затем раствор концентрируют в вакууме с получением неочищенной смеси (45 мг, 0,081 ммоль, Вд=74%).
К неочищенной смеси (45 мг, 0,081 ммоль) полученной выше, в Ac2O (1 мл) добавляют пиридин (1 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь разбавляют CH2Cl2 (50 мл), промывают водой (2×30 мл), насыщенным раствором соли (30 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:1) с получением продукта (10 мг, 0,0157 ммоль, Выход=20%) в виде белого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 7,01 (1H, с), 5,92 (1H, д, J=6,5 Гц), 5,67 (1Н, ш), 5,34 (1H, д, J=6,5 Гц), 5,24 (1H, ш), 2,68-2,77 (1H, м), 2,30 (3H, с), 2,27 (3H, с), 2,06 (3H, с), 1,30-2,08 (13H, м), 1,44 (3H, с), 1,20 (3H, с), 1,20 (3H, д, J=6,7 Гц), 1,19 (3H, с), 1,19 (3H, д, J=5,5 Гц), 1,09 (3H, с), 0,95-1,01 (1H, м), 0,74 (3H, с); ЖХ-МС: ву=1,99 мин, m/z=638,3 [M+H]+, чистота=96,8% (214 нм), 97,11% (254 нм).
Пример 84.
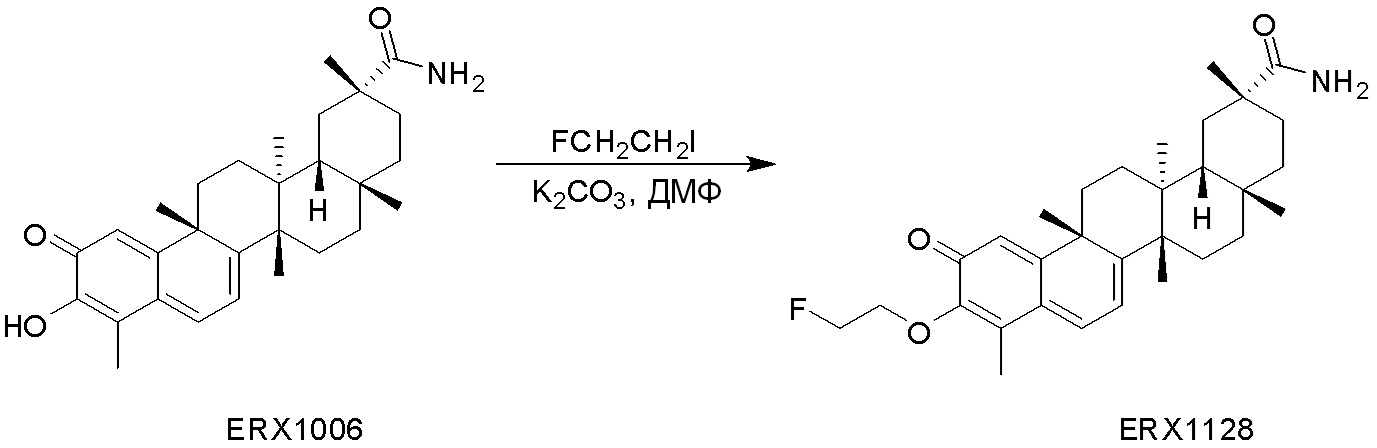
К раствору ERX1006 (200 мг, 0,445 ммоль) в ДМФ (5 мл) добавляют K2CO3 (123 мг, 0,890 ммоль), затем FCH2CH2I (774 мг, 0,36 мл, 4,45 ммоль). Реакционную смесь перемешивают при 50°C в течение 1 дня. Смесь разбавляют EtOAc (200 мл), промывают насыщ. раствором LiCl.H2O (3×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (этилацетат) с получением продукта (79,4 мг, 0,160 ммоль, Выход=36%) в виде желтого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,00 (1H, дд, J=7,0, 1,2 Гц), 6,39 (1H, д, J=1,0 Гц), 6,30 (1H, д, J=7,2 Гц), 5,69 (1H, ш), 5,31 (1H, ш), 4,66 (2H, д×т, J=47,8, 4,0 Гц), 4,37 (2H, д×т, J=31,0, 4,0 Гц), 2,40 (1H, т, J=16,1 Гц), 2,25 (3H, с), 1,46-2,14 (13H, м), 1,44 (3H, с), 1,26 (3H, с), 1,20 (3H, с), 1,12 (3H, с), 0,98-1,05 (1H, м), 0,75 (3H, с); ЖХ-МС: ву=1,77 мин, m/z=496,4 [M+H]+, чистота=98,76% (214 нм), 98,72% (254 нм).
Пример 85.
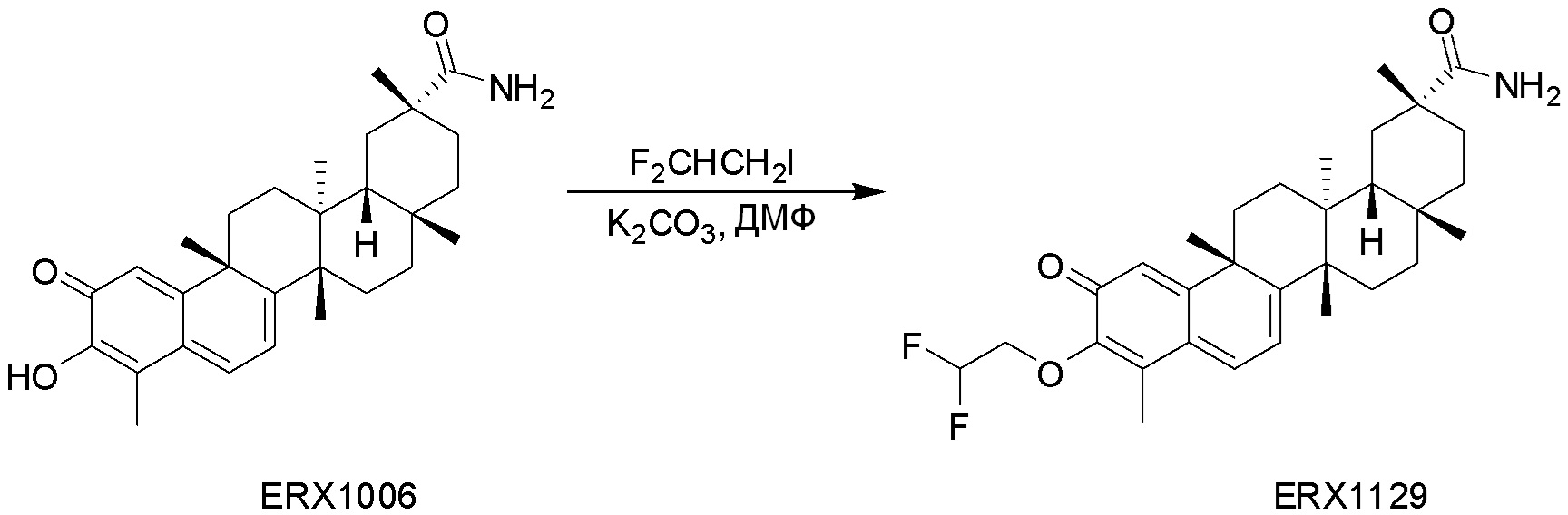
К раствору ERX1006 (200 мг, 0,445 ммоль) в ДМФ (5 мл) добавляют K2CO3 (123 мг, 0,890 ммоль), затем F2CHCH2I (854 мг, 0,39 мл, 4,45 ммоль). Реакционную смесь перемешивают при 50°C в течение 1 дня. Смесь разбавляют EtOAc (200 мл), промывают насыщ. раствором LiCl.H2O (3×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (этилацетат) с получением продукта (72,2 мг, 0,141 ммоль, Выход=32%) в виде желтого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,02 (1H, дд, J=7,0, 1,3 Гц), 6,40 (1H, д, J=1,3 Гц), 6,32 (1H, д, J=7,3 Гц), 6,10 (1H, тт, J=55,5, 4,1 Гц), 5,68 (1H, ш), 5,28 (1H, ш), 4,31 (1H, td, J=14,0, 4,0 Гц), 2,41 (1H, д, J=15,7 Гц), 2,24 (3H, с), 1,46-2,15 (13H, м), 1,45 (3H, с), 1,27 (3H, с), 1,21 (3H, с), 1,13 (3H, с), 0,99-1,06 (1H, м), 0,76 (3H, с); ЖХ-МС: ву=2,19 мин, m/z=514,4 [M+H]+, чистота=100% (214,254 нм).
Пример 86.
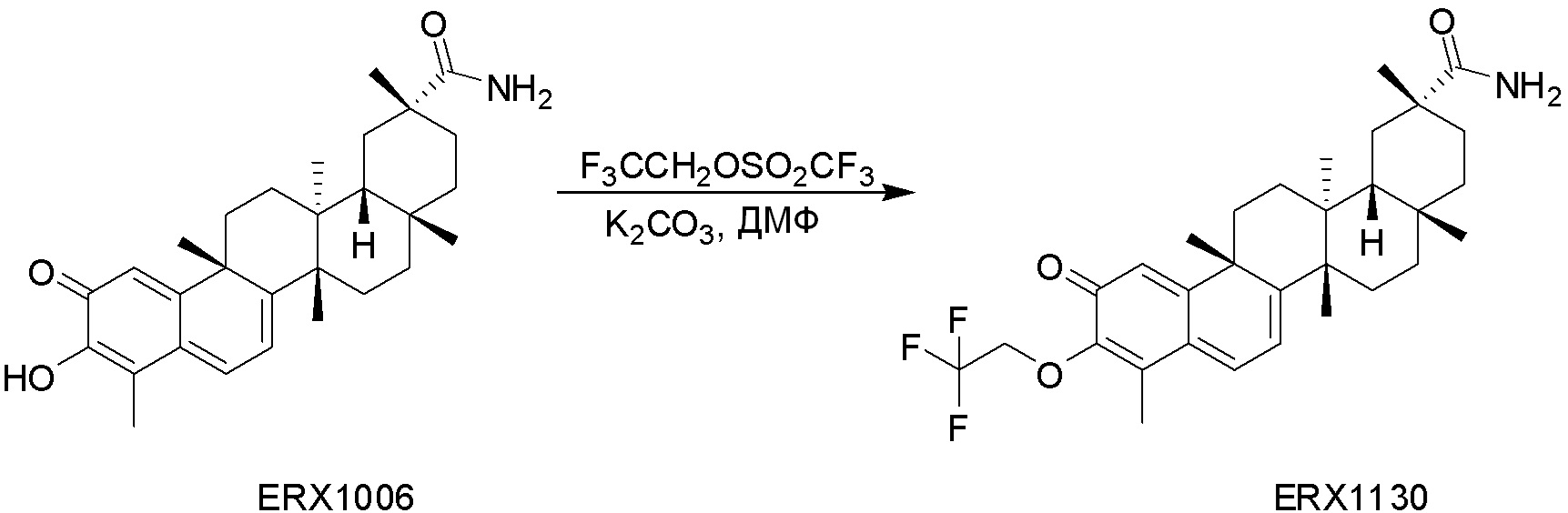
К раствору ERX1006 (50 мг, 0,11 ммоль) в ДМФ (5 мл) добавляют K2CO3 (45 мг, 0,33 ммоль), затем F3CCH2OSO2CF3 (30 мг, 0,13 ммоль). Реакционную смесь перемешивают при к.т. в течение ночи. Смесь разбавляют CH2Cl2 (100 мл), промывают насыщ. раствором LiCl.H2O (3×50 мл), насыщенным раствором соли (50 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (этилацетат) с получением продукта (30 мг, 0,0564 ммоль, Выход=51%) в виде желтого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 7,04 (1H, дд, J=7,5, 1,2 Гц), 6,40 (1H, д, J=1,2 Гц), 6,31 (1H, д, J=7,5 Гц), 5,68 (1H, ш), 5,32 (1H, ш), 4,57 (1H, кв, J=8,8 Гц), 2,40 (1H, д, J=15,9 Гц), 2,24 (3H, с), 1,47-2,14 (13H, м), 1,44 (3H, с), 1,27 (3H, с), 1,20 (3H, с), 1,12 (3H, с), 0,99-1,05 (1H, м), 0,75 (3H, с); ЖХ-МС: ву=1,27 мин, m/z=532,4 [M+H]+, чистота=100% (214,254 нм).
Пример 87.
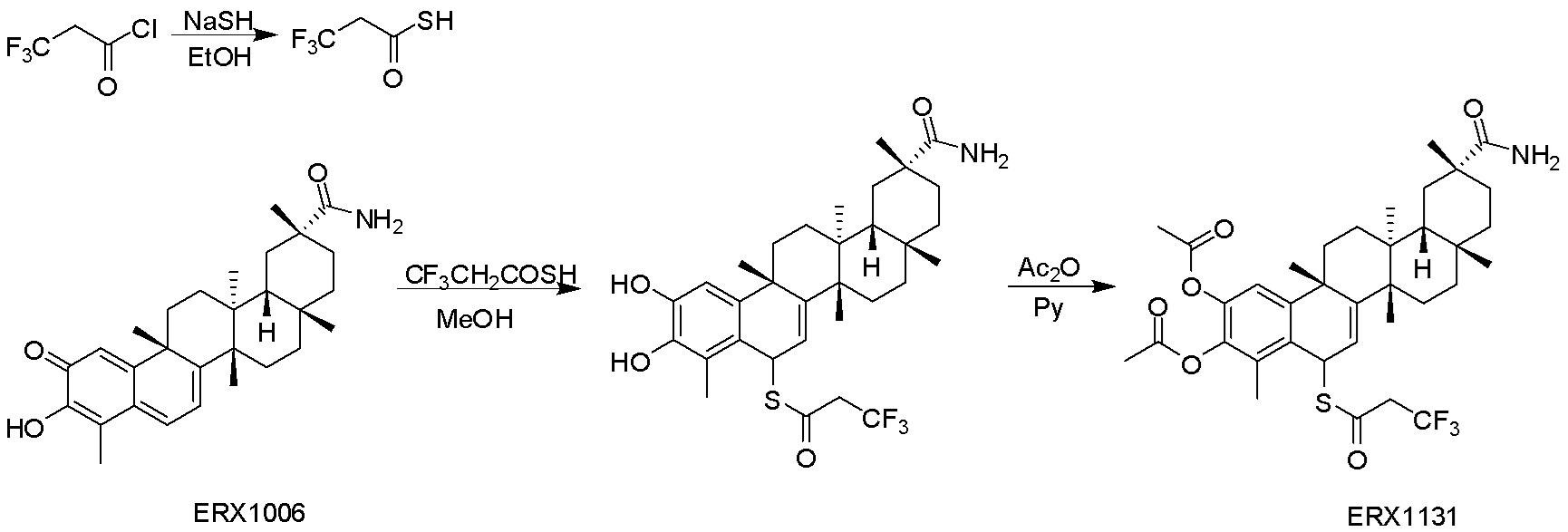
К раствору НАСГ (56 мг, 1,0 ммоль) в EtOH (5 мл) добавляют CF3CH2COCl (161 мг, 1,1 ммоль) по каплям при 0°C. Раствор перемешивают при кт в течение 1 часа. Раствор концентрируют в вакууме и применяют на следующей стадии без дальнейшей очистки.
К раствору ERX1006 (50 мг, 0,11 ммоль) в MeOH (5 мл) добавляют Me2CHCOSH (80 мг, 0,55 ммоль) в EtOH (2 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Раствор превращается из красного в бледно-желтый. Затем раствор концентрируют в вакууме с получением неочищенной смеси (50 мг, 0,0842 ммоль, Вд=77%).
К неочищенной смеси (50 мг, 0,0842 ммоль) полученной выше, в Ac2O (1 мл) добавляют пиридин (1 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь разбавляют CH2Cl2 (50 мл), промывают водой (2×30 мл), насыщенным раствором соли (30 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (PE:EA=1:1) с получением продукта (11 мг, 0,0162 ммоль, общий выход=20%) в виде белого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 7,04 (1H, с), 5,96 (1H, д, J=6,4 Гц), 5,68 (1H, ш), 5,49 (1H, д, J=6,4 Гц), 5,31 (1H, ш), 3,35 (2H, кв, J=10,0 Гц), 2,43 (1H, д, J=15,3 Гц), 2,31 (3H, с), 2,28 (3H, с), 2,07 (3H, с), 1,44-2,05 (13H, м), 1,43 (3H, с), 1,20 (3H, с), 1,18 (3H, с), 1,09 (3H, с), 0,95-1,01 (1H, м), 0,73 (3H, с); ЖХ-МС: ву=1,88 мин, m/z=678,2 [M+H]+, чистота=100% (214,254 нм).
Пример 88.
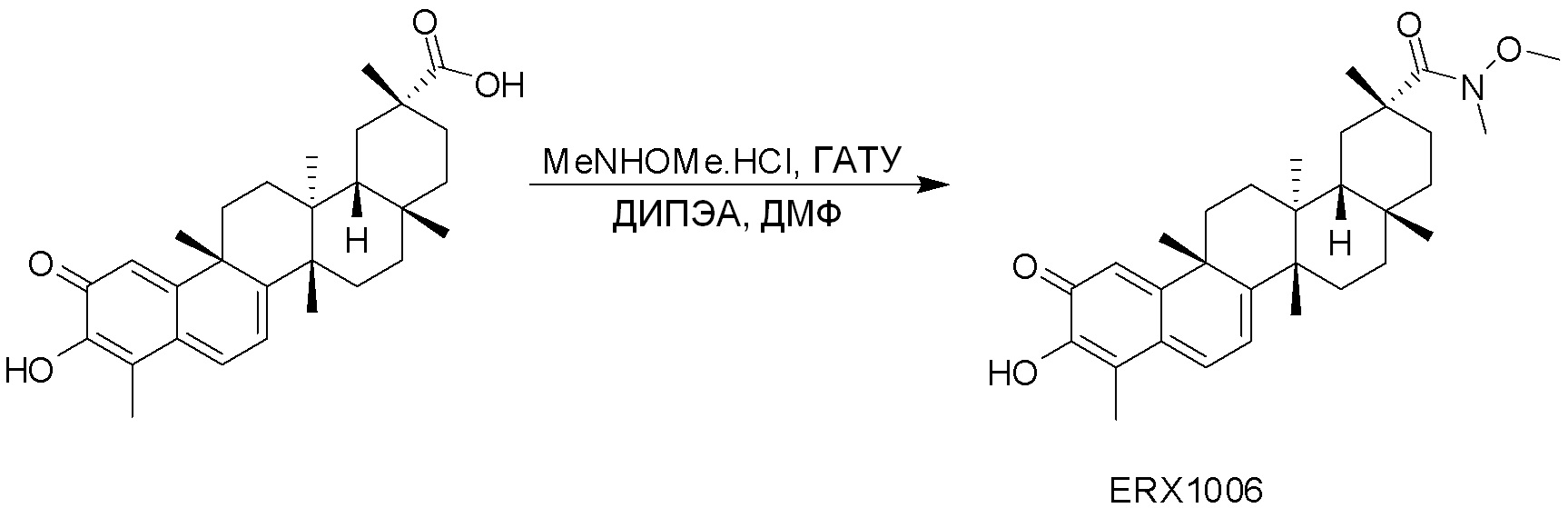
К раствору целастрола (200 мг, 0,44 ммоль) в ДМФ (5 мл) добавляют MeNHOMe.HCl (131 мг, 1,33 ммоль), ГАТУ (186 мг, 0,49 ммоль), затем ДИПЭА (115 мг, 0,89 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/EtOAc=1:1) с получением продукта (150 мг, 0,304 ммоль, Выход=69%) в виде красного твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 7,03 (1H, дд, J=7,2, 1,1 Гц), 6,96 (1H, с), 6,54 (1H, д, J=1,1 Гц), 6,35 (1H, д, J=7,2 Гц), 3,71 (3H, с), 3,05 (3H, с), 2,81 (1H, д, J=16,2 Гц), 2,22 (3H, с), 2,04-2,32 (3H, м), 1,24-1,90 (10H, м), 1,46 (3H, с), 1,26 (3H, с), 1,22 (3H, с), 1,12 (3H, с), 0,94-1,00 (1H, м), 0,50 (3H, с); ЖХ-МС: ву=2,56 мин, m/z=494,2 [M+H]+, чистота=96,78% (214 нм), 91,29% (254 нм).
Пример 89.
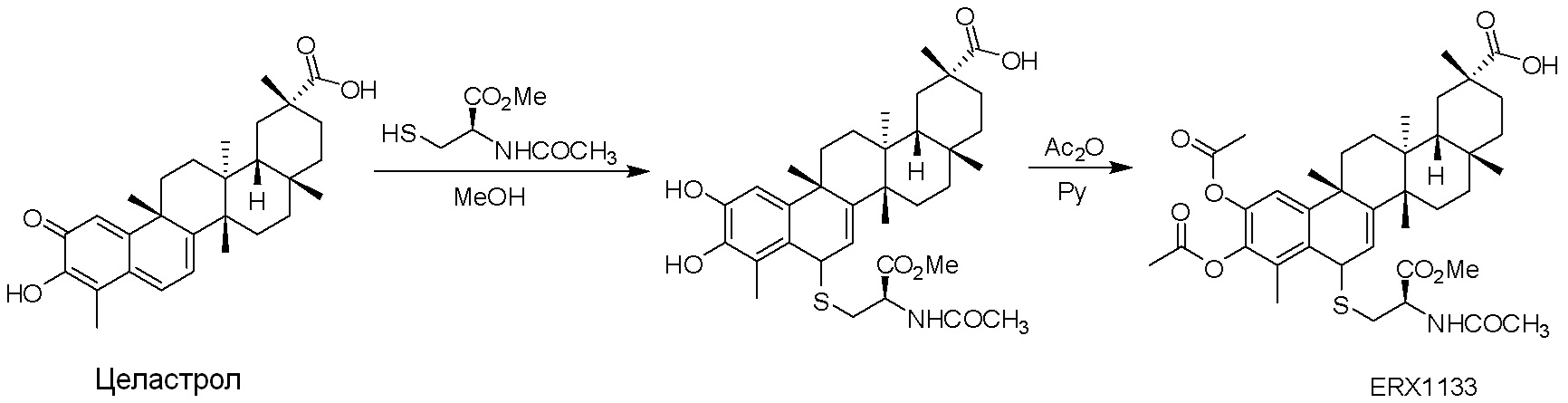
К раствору Целастрола (500 мг, 1,11 ммоль) в MeOH (20 мл) добавляют этиловый эфир N-ацетил-L-цистеина (393 мг, 2,22 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Раствор превращается из красного в бледно-желтый. Затем раствор was концентрируют в вакууме с получением неочищенной смеси.
К неочищенной смеси полученной выше, в пиридин (5 мл) добавляют Ac2O (3 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь выливают в H2O (100 мл), фильтруют. Твердое вещество растворяют в CH2Cl2 (200 мл), промывают водой (100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (EtOAc) с получением продукта (408 мг, 0,573 ммоль, общий выход=52%) в виде белого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,02 (1H, с), 6,29 (1H, д, J=6,8 Гц), 5,93 (1H, д, J=6,1 Гц), 4,89 (1H, кв, J=5,8 Гц), 4,61 (1H, д, J=6,0 Гц), 3,73 (3H, с), 3,29 (1H, дд, J=13,6, 4,9 Гц), 2,92 (1H, дд, J=13,6, 6,0 Гц), 2,39 (1H, д, J=15,9 Гц), 2,31 (3H, с), 2,27 (3H, с), 2,23 (3H, с), 2,05 (3H, с), 1,30-2,16 (13H, м), 1,56 (3H, с), 1,25 (3H, с), 1,15 (3H, с), 1,07 (3H, с), 0,89-0,97 (1H, м), 0,66 (3H, с); ЖХ-МС: ву=1,78 мин, m/z=535,2 [M-SCH2CH(CO2Me)NHCOMe]+, чистота=97,44% (214 нм), 100% (254 нм).
Пример 90.
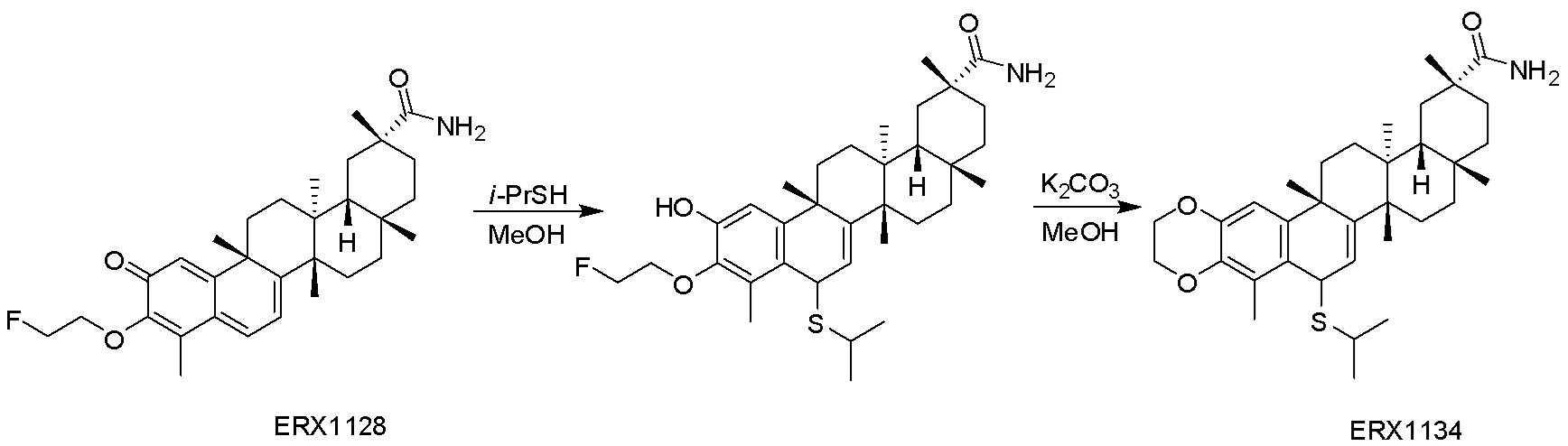
К раствору ERX1128 (125 мг, 0,252 ммоль) в MeOH (10 мл) добавляют i-PrSH (77 мг, 1,01 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Затем раствор концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:3) с получением продукта. Неочищенный продукт частично окисляют на воздухе до исходного материала.
К раствору неочищенной смеси, полученной выше, в MeOH (10 мл) добавляют K2CO3 (70 мг, 0,504 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Большую часть MeOH удаляют в вакууме. Затем смесь растворяют в CH2Cl2 (200 мл), промывают водой (100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир: этилацетат=1:2) с получением продукта (29,4 мг, 0,0533 ммоль, общий выход за две стадии=21%) в виде белого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 6,72 (1H, с), 5,98 (1H, д, J=6,3 Гц), 5,63 (1H, ш), 5,16 (1H, ш), 4,60 (1H, д, J=6,3 Гц), 4,19-4,28 (4H, м), 3,13-3,23 (1H, м), 2,39 (1H, д, J=15,2 Гц), 2,29 (3H, с), 1,43-2,10 (13H, м), 1,56 (3H, с), 1,40 (3H, д, J=6,8 Гц), 1,28 (3H, д, J=6,8 Гц), 1,25 (3H, с), 1,19 (3H, с), 1,11 (3H, с), 0,96-1,02 (1H, м), 0,74 (3H, с); ЖХ-МС: ву=2,18 мин, m/z=552,3 [M+H]+, чистота=99,56% (214 нм), 100% (254 нм).
Пример 91.

К раствору ERX1006 (50 мг, 0,11 ммоль) в CH2Cl2 (10 мл) добавляют Mg(ClO4)2 (7,4 мг, 0,03 ммоль) затем Boc2O (84 мг, 0,39 ммоль). Реакционную смесь перемешивают при 40°C в течение ночи. Смесь разбавляют CH2Cl2 (100 мл), промывают водой (3×50 мл), насыщенным раствором соли (50 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (этилацетат) с получением продукта (20 мг, 0,0364 ммоль, Выход=33%) в виде желтого твердого вещества.1Н ЯМР δ (500 МГц, CDCl3): 7,04 (1H, д, J=7,2 Гц), 6,46 (1H, с), 6,31 (1H, д, J=7,2 Гц), 5,66 (1H, ш), 5,22 (1H, ш), 2,39 (1H, д, J=15,3 Гц), 2,20 (3H, с), 1,47-2,15 (13H, м), 1,54 (9H, с), 1,45 (3H, с), 1,27 (3H, с), 1,21 (3H, с), 1,12 (3H, с), 0,99-1,05 (1H, м), 0,76 (3H, с); ЖХ-МС: ву=2,30 мин, m/z=550,2 [M+H]+, чистота=100% (214,254 нм).
Пример 92.
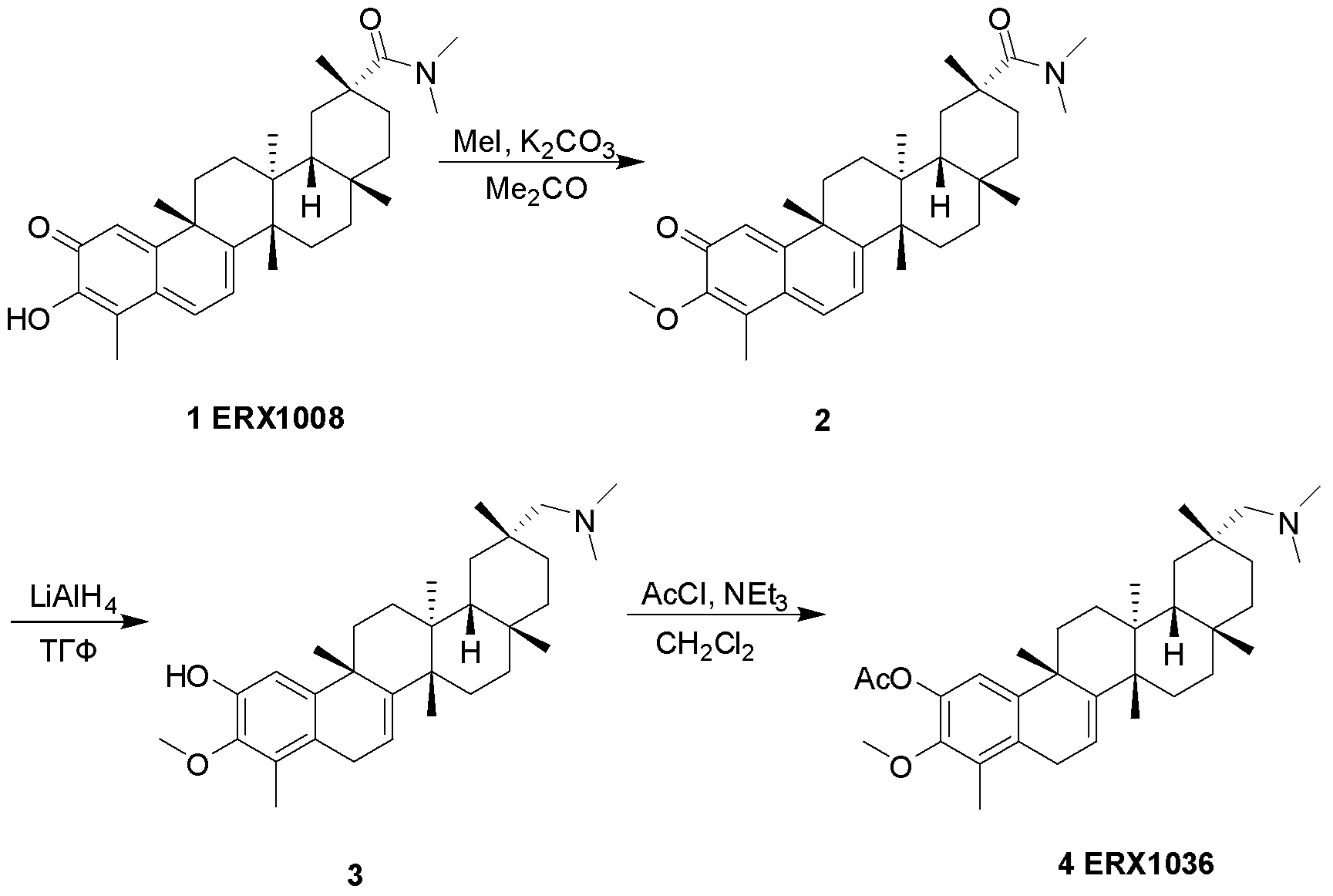
К раствору ERX1008 (800 мг, 1,68 ммоль) в ацетоне (5 мл) добавляют K2CO3 (462 мг, 3,35 ммоль), затем MeI (1,2 г, 8,4 ммоль). Реакционную смесь нагревают при 40°C в течение ночи. Смесь фильтруют, концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (элюант: петролейный эфир/этилацетат=1:1) с получением продукта 2 (530 мг, 1,078 ммоль, выход=64%) в виде желтого твердого вещества.
К раствору 2 (530 мг, 1,08 ммоль) в ТГФ (10 мл) добавляют 1,0 M LiAlH4 в растворе ТГФ (5,4 мл, 5,4 ммоль). Реакционную смесь кипятят с обратным холодильником в течение ночи. Реакционную смесь гасят насыщ. раствором NH4Cl, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (элюант: петролейный эфир/этилацетат=1:1) с получением продукта 3 (400 мг, 0,834 ммоль, выход=77%) в виде белого твердого вещества.
К раствору 3 (400 мг, 0,84 ммоль) в CH2Cl2 (10 мл) добавляют AcCl (651 мг, 8,4 ммоль) и NEt3 (840 мг, 8,4 ммоль). Затем смесь перемешивают при к.т. в течение 2 часов. Воду добавляют для гашения реакции. Смесь экстрагируют CH2Cl2 (3×20 мл). Объединенные слои промывают насыщенным раствором соли (50 мл), сушат над Na2SO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:1) с получением продукта 4 (190 мг, 0,364 ммоль, выход=43%) в виде белого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 6,89 (1H, с), 5,81 (1H, дд, J=6,3, 2,1 Гц), 3,72 (3H, с), 3,35 (1H, дд, J=20,9, 6,3 Гц), 3,06 (1H, дд, J=20,9, 2,1 Гц), 2,87 (6H, ш), 2,33 (3H, с), 2,20 (3H, с), 1,24-2,05 (19H, м), 1,39 (3H, с), 1,29 (3H, с), 1,23 (3H, с), 1,02-1,08 (1H, м), 0,79 (3H, с); ЖХМС: ву=1,73 мин, m/z=522,3 [M+H]+, чистота=100% (214,254 нм).
Пример 93.
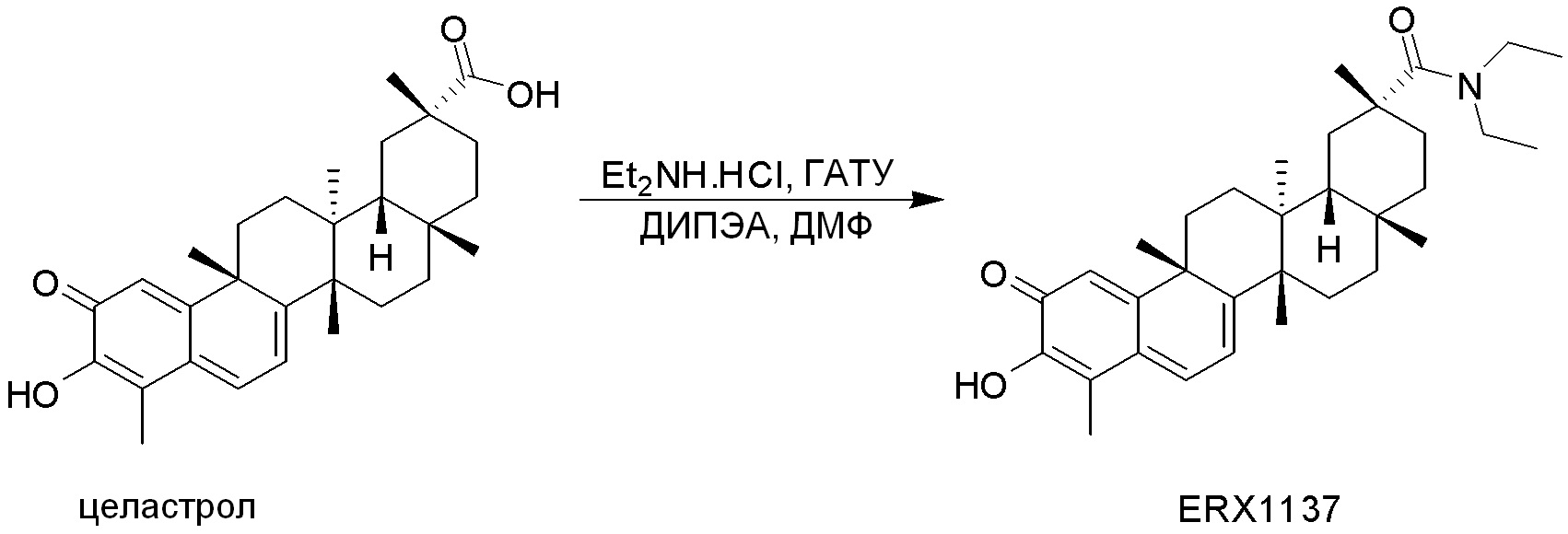
К раствору целастрола (450 мг, 1,0 ммоль) в ДМФ (10 мл) добавляют Et2NH.HCl (241 мг, 2,2 ммоль), ГАТУ (418 мг, 1,1 ммоль), затем ДИПЭА (645 мг, 5,0 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщ. раствором LiCl.H2O solution (2×200 мл), насыщенным раствором соли (200 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:1) с получением продукта (101 мг, 0,20 ммоль, Выход=20%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,03 (1H, дд, J=7,0, 1,1 Гц), 6,95 (1H, ш), 6,52 (1H, д, J=1,1 Гц), 6,36 (1H, д, J=7,1 Гц), 3,62-3,80 (1H, м), 3,10-3,42 (3H, м), 2,22 (3H, с), 1,98-2,40 (5H, м), 0,95-1,90 (16H, м), 1,45 (3H, с), 1,30 (3H, с), 1,26 (3H, с), 1,15 (3H, с), 0,63 (3H, с); ЖХ-МС: ву=1,98 мин, m/z=506,3 [M+H]+, чистота=98,77% (214 нм), 100%(254 нм).
Пример 94.
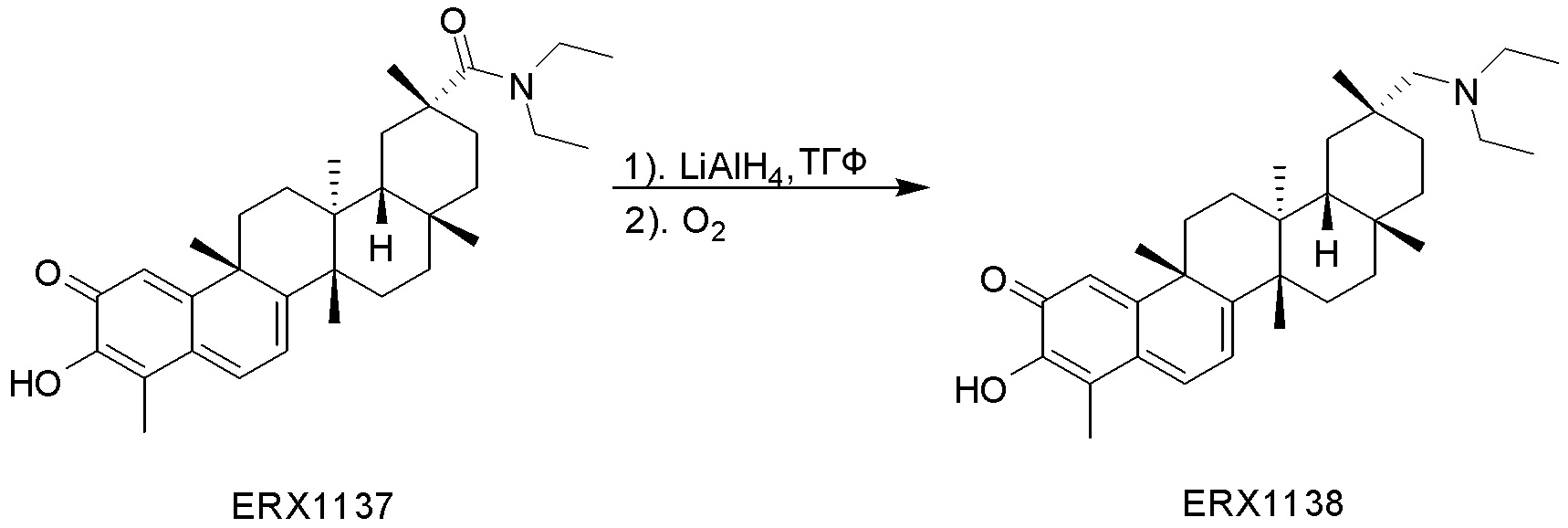
К раствору ERX1137 (100 мг, 0,198 ммоль) в ТГФ (20 мл) добавляют LiAlH4 (38 мг, 1,0 ммоль). Реакционную смесь кипятят с обратным холодильником в течение ночи. Реакционную смесь гасят насыщ. раствором NH4Cl. Смесь нагревают при 60°C в течение 3 часов. Цвет становится коричневым. Затем раствор разбавляют CH2Cl2 (200 мл), фильтруют. Фильтрат концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2/MeOH=5:1) с получением продукта (30 мг, 0,061 ммоль, Выход=31%) в виде черного твердого вещества.1Н ЯМР: δ (400 МГц, CDCl3): 7,04 (1H, д, J=7,0 Гц), 6,98 (1H, с), 6,54 (1H, с), 6,41 (1H, д, J=7,0 Гц), 2,90-3,20 (2H, м), 2,48-2,62 (3H, м), 2,24 (3H, с), 1,30-2,20 (15H, м), 1,46 (3H, с), 1,45 (3H,. с), 1,27 (3H, с), 1,26 (3H, с), 0,92-1,04 (7H, м), 0,81 (3H, с); ЖХ-МС: ву=1,34 мин, m/z=492,3 [M+H]+, чистота=95,35% (214 нм), 100%(254 нм).
Пример 95.
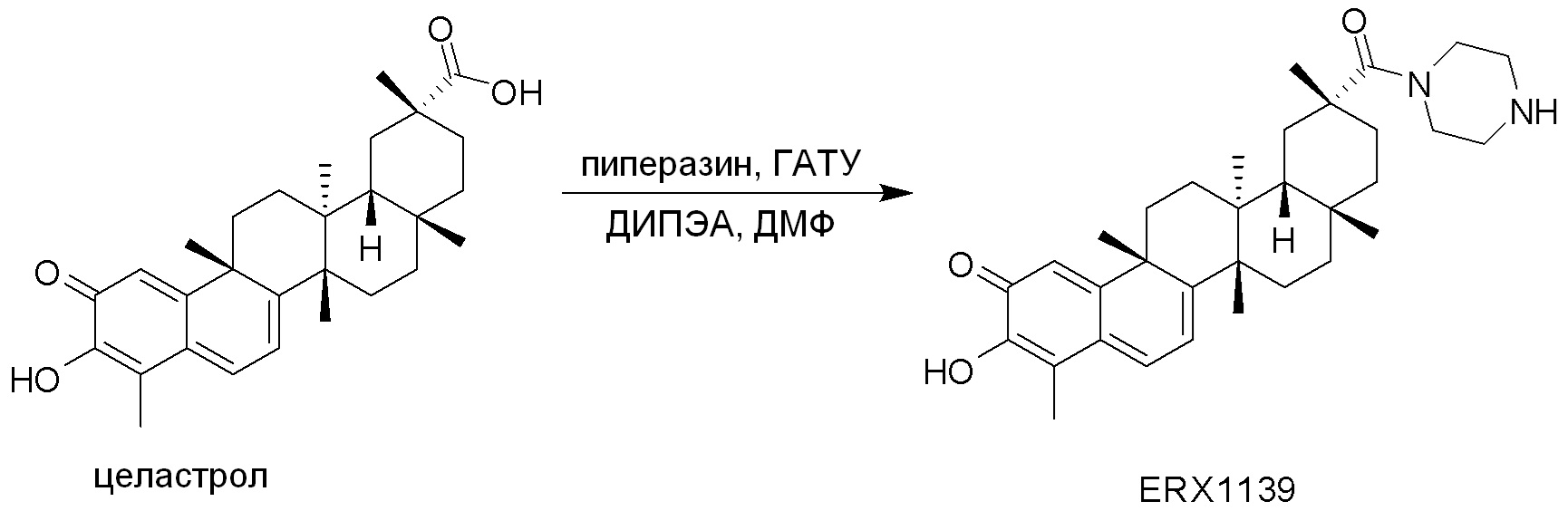
К раствору целастрола (100 мг, 0,222 ммоль) в ДМФ (5 мл) добавляют ГАТУ (101 мг, 0,266 ммоль), затем ДИПЭА (57 мг, 0,076 мл, 0,444 ммоль). Раствор перемешивают при кт в течение 1 часа. Затем добавляют пиперазин (23 мг, 0,266 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщ. раствором LiCl.H2O solution (2×200 мл), насыщенным раствором соли (200 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2/MeOH=10:1) с получением продукта (35 мг, 0,0675 ммоль, Выход=30%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,02 (1H, д, J=7,2 Гц), 6,54 (1H, с), 6,35 (1H, д, J=7,2 Гц), 3,55-3,75 (2H, м), 2,80-2,90 (3H, м), 2,28-2,39 (2H, м), 2,21 (3H, с), 1,25-2,25 (17H, м), 1,46 (3H, с), 1,29 (3H, с), 1,28 (3H, с), 1,14 (3H, с), 0,95-1,02 (1H, м), 0,62 (3H, с); ЖХ-МС: ву=1,21 мин, m/z=519,3 [M+H]+, чистота=95,17% (214 нм), 96,74%(254 нм).
Пример 96.
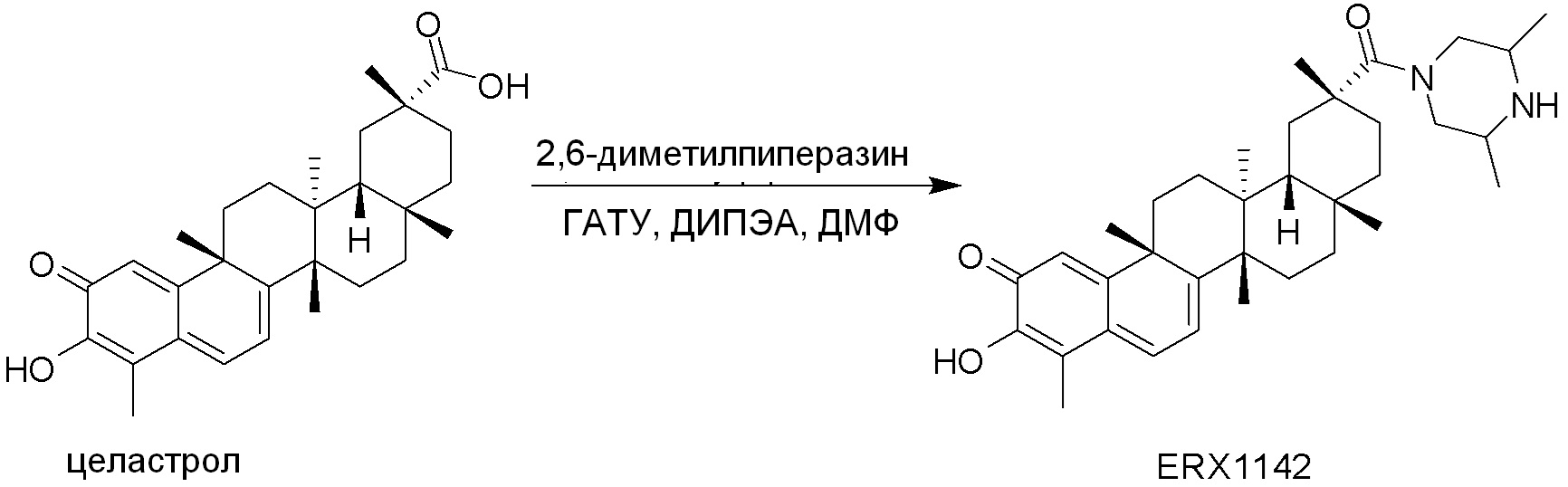
К раствору целастрола (100 мг, 0,22 ммоль) в ДМФ (5 мл) добавляют 2,6-диметилпиперазин (30 мг, 0,26 ммоль), ГАТУ (91 мг, 0,24 ммоль) затем ДИПЭА (57 мг, 0,44 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (100 мл), промывают насыщ. раствором LiCl.H2O (2×50 мл), насыщенным раствором соли (50 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2/MeOH=10:1) с получением продукта (60 мг, 0,11 ммоль, Выход=50%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,03 (1H, д, J=7,1 Гц), 6,97 (1H, ш), 6,55 (1H, с), 6,36 (1H, д, J=7,1 Гц), 4,00-4,60 (2H, м), 2,60-2,90 (2H, м), 2,28-2,40 (2H, м), 2,22 (3H, с), 1,30-2,20 (15H, м), 1,46 (3H, с), 1,29 (3H, с), 1,27 (3H, с), 1,14 (3H, с), 1,12 (6H, ш), 0,94-1,02 (1H, м), 0,59 (3H, ш); ЖХ-МС: ву=1,38 мин, m/z=547,3 [M+H]+, чистота=100% (214, 254 нм).
Пример 97.
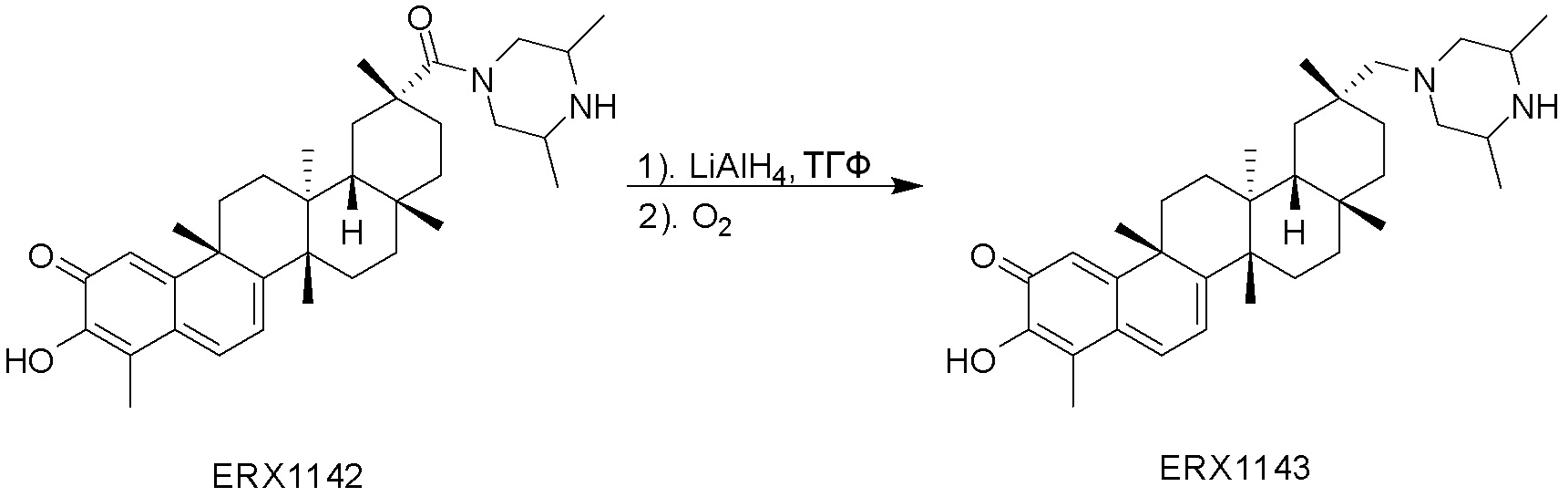
К раствору ERX1142 (88 мг, 0,16 ммоль) в ТГФ (10 мл) добавляют LiAlH4 (30 мг, 0,8 ммоль). Реакционную смесь кипятят с обратным холодильником в течение ночи. Реакционную смесь гасят насыщ. раствором NH4Cl. Смесь нагревают при 60°C в течение 3 часов. Цвет становится коричневым. Затем раствор разбавляют CH2Cl2 (200 мл), фильтруют. Фильтрат концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2/MeOH=5:1) с получением продукта (20 мг, 0,0375 ммоль, Выход=23%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,03 (1H, д, J=7,1 Гц), 6,53 (1H, с), 6,39 (1H, д, J=7,1 Гц), 2,94-3,06 (2H, м), 2,65-2,74 (2H, м), 2,22 (3H, с), 0,92-2,20 (21H, м), 1,44 (3H, с), 1,40 (3H, с), 1,21 (3H, с), 1,10 (6H, ш), 1,00 (3H, с), 0,78 (3H, с); ЖХ-МС: ву=1,25 мин, m/z=533,3 [M+H]+, чистота=97,84% (214 нм), 96,36%(254 нм).
Пример 98.

К раствору целастрола (500 мг, 1,11 ммоль) в ДМФ (10 мл) добавляют MeNH2.HCl (220 мг, 3,3 ммоль), ГАТУ (464 мг, 1,2 ммоль), затем ДИПЭА (287 мг, 2,2 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщ. раствором LiCl.H2O (2×200 мл), насыщенным раствором соли (200 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:1) с получением продукта (420 мг, 0,906 ммоль, Выход=82%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,00 (1H, дд, J=7,2, 1,2 Гц), 6,97 (1H, ш), 6,53 (1H, д, J=1,2 Гц), 6,33 (1H, д, J=7,2 Гц), 5,72 (1H, кв, J=4,7 Гц), 2,67 (3H, д, J=4,7 Гц), 2,46 (1H, д, J=15,4 Гц), 2,21 (3H, с), 1,47-2,17 (13H, м), 1,44 (3H, с), 1,26 (3H, с), 1,15 (3H, с), 1,12 (3H, с), 0,99-1,06 (1H, м), 0,62 (3H, с); ЖХ-МС: ву=1,66 мин, m/z=464,2 [M+H]+, чистота=99,0% (214 нм), 100%(254 нм).
Пример 99.
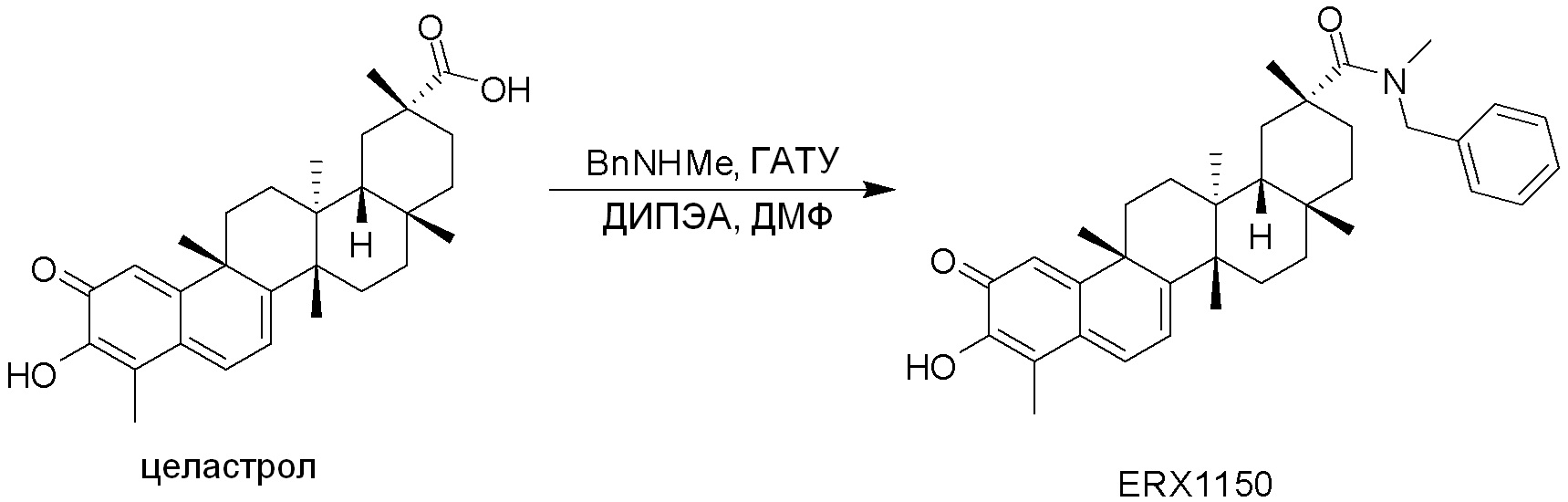
К раствору целастрола (450 мг, 1,0 ммоль) в ДМФ (10 мл) добавляют BnNHMe (363 мг, 3,0 ммоль), ГАТУ (420 мг, 1,1 ммоль), затем ДИПЭА (260 мг, 2,0 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщ. раствором LiCl.H2O (2×200 мл), насыщенным раствором соли (200 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:1) с получением продукта (370 мг, 0,669 ммоль, Выход=67%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,15-7,30 (5H, м), 7,03 (1H, дд, J=7,2, 1,1 Гц), 6,98 (1H, с), 6,53 (1H, с), 6,36 (1H, д, J=7,2 Гц), 4,85 (1H, ш), 4,00 (1H, ш), 3,08 (3H, ш), 2,35-2,48 (2H, м), 2,23 (3H, с), 2,06-2,18 (2H, м), 1,32-1,89 (10H, м), 1,46 (3H, с), 1,31 (3H, с), 1,29 (3H, с), 1,15 (3H, с), 0,97-1,04 (1H, м), 0,55 (3H, с); ЖХ-МС: ву=2,04 мин, m/z=554,2 [M+H]+, чистота=100% (214, 254 нм).
Пример 100.
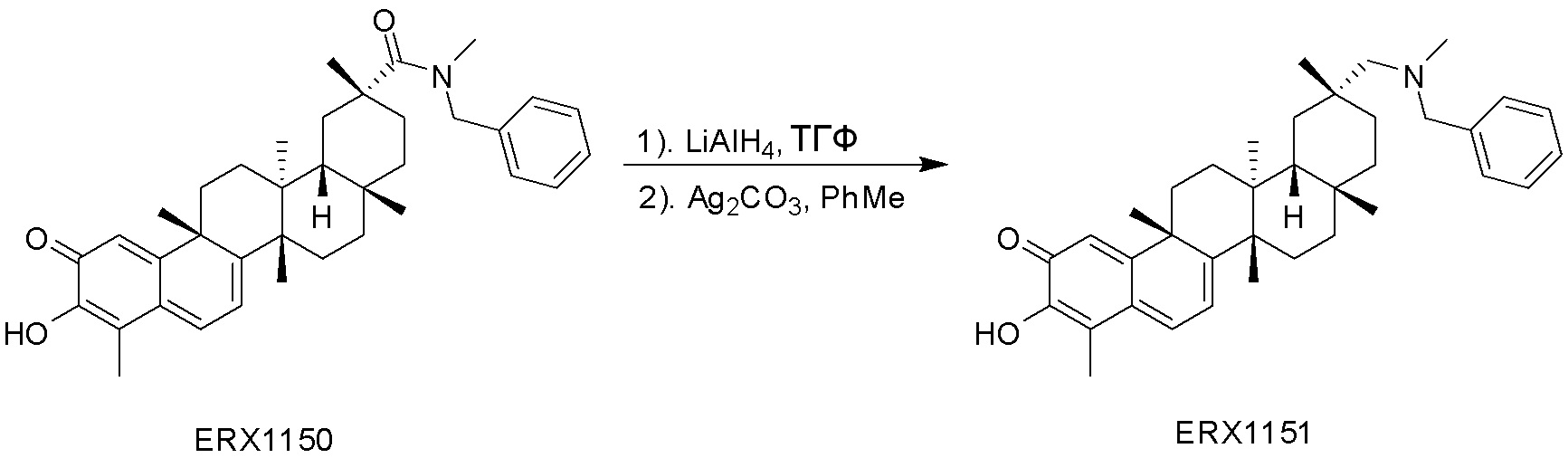
К раствору ERX1150 (100 мг, 0,18 ммоль) в ТГФ (5 мл) добавляют LiAlH4 (34 мг, 0,9 ммоль). Реакционную смесь кипятят с обратным холодильником в течение ночи. Реакционную смесь гасят насыщ. раствором NH4Cl. Затем раствор разбавляют CH2Cl2 (100 мл), фильтруют. Фильтрат отделяют, и органический слой сушат над Na2SO4 и концентрируют в вакууме. Остаток растворяют в PhMe (5 мл) и Ag2CO3 (61 мг, 0,22 ммоль) добавляют. Смесь перемешивают при к.т. в течение ночи, фильтруют и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:1) с получением продукта (15 мг, 0,0278 ммоль, Выход=25%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,19-7,36 (5H, м), 7,03 (1H, дд, J=7,1, 0,9 Гц), 6,96 (1H, с), 6,53 (1H, д, J=0,9 Гц), 6,38 (1H, д, J=7,1 Гц), 3,56 (1H, AB, J=13,8 Гц), 3,55 (1H, AB, J=13,8 Гц), 2,37 (1H, AB, J=13,5 Гц), 2,23 (3H, с), 2,22 (3H, с), 2,17 (1H, AB, J=13,5 Гц), 2,07-2,13 (1H, м), 1,17-1,90 (15H, м), 1,44 (3H, с), 1,41 (3H, с), 1,23 (3H, с), 1,06 (3H, с), 0,91-0,97 (1H, м), 0,75 (3H, с); ЖХ-МС: ву=1,48 мин, m/z=540,4 [M+H]+, чистота=100% (214, 254 нм).
Пример 101.
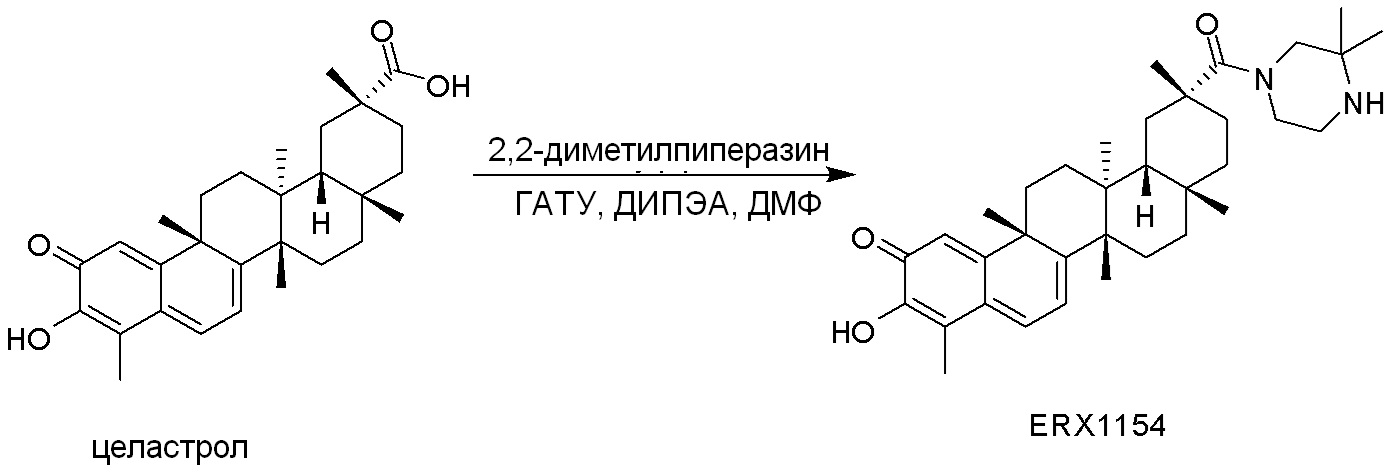
К раствору целастрола (200 мг, 0,44 ммоль) в ДМФ (10 мл) добавляют 2,2-диметилпиперазин (62 мг, 0,54 ммоль), ГАТУ (184 мг, 0,48 ммоль), затем ДИПЭА (114 мг, 0,88 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (200 мл), промывают насыщ. раствором LiCl.H2O (2×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2/MeOH=10:1) с получением продукта (100 мг, 0,183 ммоль, Выход=42%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,02 (1H, д, J=7,0 Гц), 6,54 (1H, с), 6,35 (1H, д, J=7,0 Гц), 3,35-4,20 (2H, ш), 2,95-3,10 (2H, м), 2,27-2,38 (2H, м), 2,21 (3H, с), 1,35-2,20 (16H, м), 1,45 (3H, с), 1,32 (3H, с), 1,30 (3H, с), 1,19 (3H, с), 1,18 (3H, с), 1,15 (3H, с), 0,95-1,02 (1H, м), 0,55 (3H, с); ЖХ-МС: ву=1,39 мин, m/z=547,3 [M+H]+, чистота=97,82% (214 нм), 98,76%,(254 нм).
Пример 102.
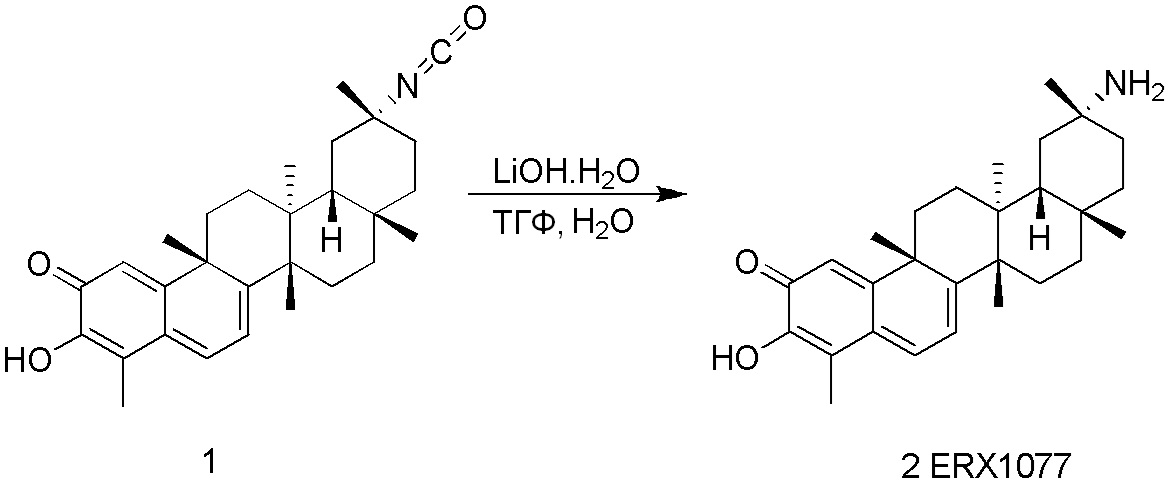
К раствору 1 (240 мг, 0,54 ммоль) в ТГФ (10 мл) и H2O (1 мл) добавляют LiOH.H2O (113 мг, 2,68 ммоль). Реакционную смесь нагревают при 50°C в течение 4 часов. Большую часть ТГФ удаляют в вакууме. Остаток экстрагируют CH2Cl2 (100×3 мл). Объединенные экстракты промывают насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2:MeOH=5:1) с получением продукта (120 мг, 0,284 ммоль, Выход=53%) в виде коричневого твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,03 (1H, дд, J=7,2, 1,3 Гц), 6,53 (1H, д, J=1,3 Гц), 6,37 (1H, д, J=7,2 Гц), 2,22 (3H, с), 2,12-2,18 (1H, м), 1,50-2,05 (16H, м), 1,46 (3H, с), 1,30 (3H, с), 1,14 (3H, с), 1,10 (3H, с), 0,94-1,01 (1H, м), 0,96 (3H, с); ЖХ-МС: ву=1,43 мин, m/z=422,3 [M+H]+, чистота=100% (214, 254 нм).
Пример 103.
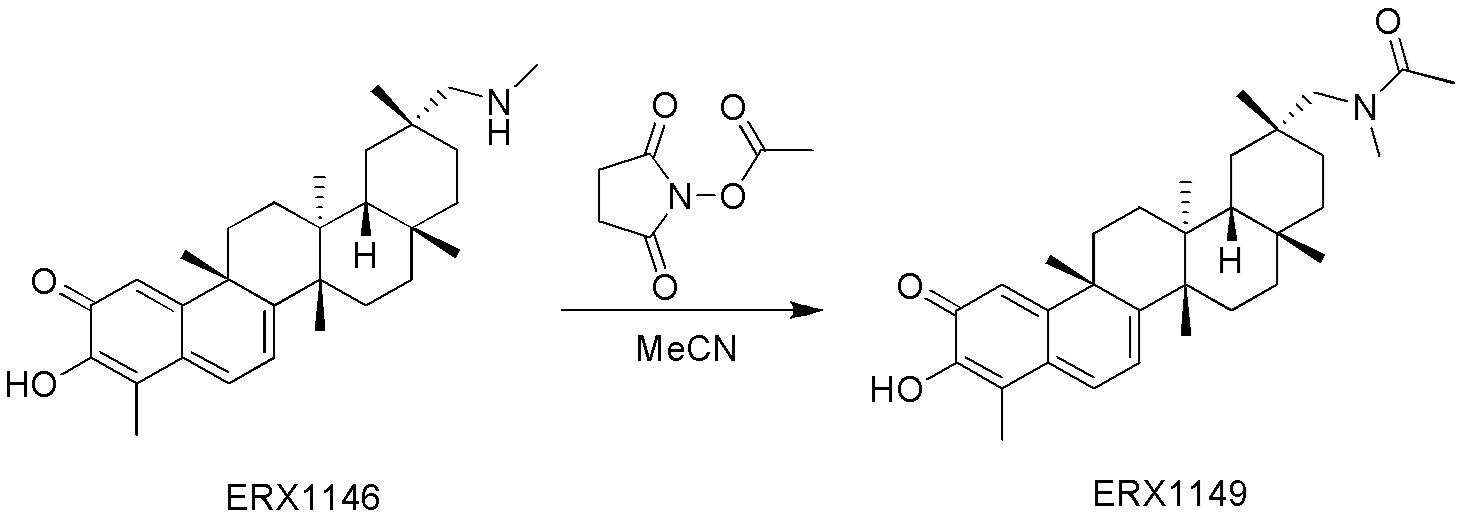
К раствору ERX1146 (80 мг, 0,18 ммоль) в MeCN (5 мл) добавляют N-гидроксисукцинимидный эфир уксусной кислоты (112 мг, 0,72 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Раствор фильтруют и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир:EtOAc=1:1) с получением продукта (32 мг, 0,065 ммоль, Выход=36%) в виде красного твердого вещества.
1Н ЯМР (две атропизомерных смеси) i) основной изомер δ (400 МГц, d6-ДМСО): 8,71 (1H, с), 7,10 (1H, д, J=7,1 Гц), 6,40 (1H, д, J=7,1 Гц), 6,37 (1H, с), 3,61 (1H, AB, J=13,2 Гц), 3,00 (3H, с), 2,79 (1H, AB, J=13,2 Гц), 2,11-2,17 (1H, с), 2,10 (3H, с), 1,98 (3H, с), 1,20-1,85 (13H, м), 1,38 (3H, с), 1,35 (3H, с), 1,17 (3H, с), 0,95 (3H, с), 0,84-0,92 (1H, м), 0,74 (3H, с); ii) меньший изомер δ (400 МГц, d6-ДМСО): 8,71 (1H, с), 7,10 (1H, д, J=7,1 Гц), 6,40 (1H, д, J=7,1 Гц), 6,37 (1H, с), 3,30 (1H, AB, J=14,8 Гц), 3,08 (1H, AB, J=14,8 Гц), 2,85 (3H, с), 2,11-2,17 (1H, с), 2,10 (3H, с), 1,99 (3H, с), 1,20-1,85 (13H, м), 1,38 (3H, с), 1,35 (3H, с), 1,22 (3H, с), 1,00 (3H, с), 0,84-0,92 (1H, м), 0,74 (3H, с). ЖХ-МС: ву=1,88 мин, m/z=492,3 [M+H]+, чистота=100% (214, 254 нм).
Пример 104
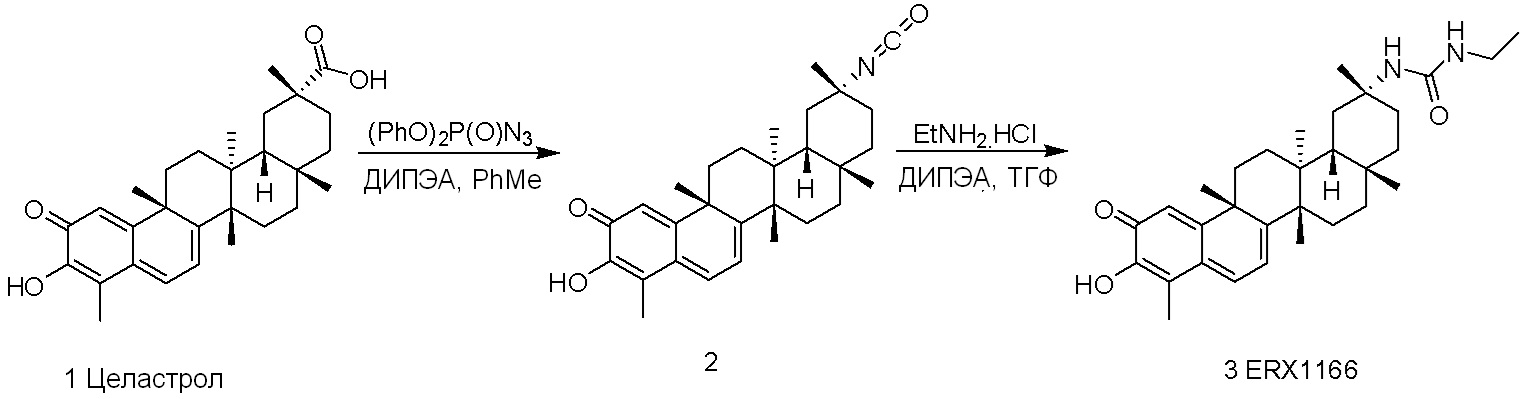
К раствору целастрола (500 мг, 1,11 ммоль) в PhMe (25 мл) добавляют ДИПЭА (430 мг, 0,57 мл, 3,33 ммоль), затем (PhO)2P(O)N3 (458 мг, 0,36 мл, 1,66 ммоль). Реакционную смесь нагревают при 100°C в течение ночи. Раствор разбавляют CH2Cl2 (200 мл), промывают H2O (200 мл), насыщенным раствором соли (200 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир:этилацетат=3:1) с получением неочищенного продукта (342 мг, 0,764 ммоль, Выход=69%) в виде красного твердого вещества.
К раствору неочищенного 2 (342 мг, 0,764 ммоль) в ТГФ (20 мл) добавляют EtNH2.HCl (312 мг, 3,82 ммоль) и ДИПЭА (494 мг, 0,65 мл, 3,82 ммоль). Реакционную смесь нагревают при 50°C в течение 3 часов. Большую часть ТГФ удаляют в вакууме. Остаток растворяют в CH2Cl2 (200 мл), промывают H2O (200 мл), насыщенным раствором соли (200 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2:MeOH=10:1) с получением продукта (233,6 мг, 0,474 ммоль, Выход=62%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,02 (1H, дд, J=7,1, 1,1 Гц), 6,98 (1H, с), 6,53 (1H, д, J=1,0 Гц), 6,36 (1H, д, J=7,3 Гц), 3,96 (1H, т, J=5,5 Гц), 3,85 (1H, с), 2,95-3,15 (2H, м), 2,89 (1H, д, J=13,8 Гц), 2,21 (3H, с), 1,45-2,20 (13H, м), 1,44 (3H, с), 1,40 (3H, с), 1,27 (3H, с), 1,12 (3H, с), 1,03 (3H, т, J=7,1 Гц), 0,94-1,01 (1H, м), 0,77 (3H, с). ЖХ-МС: ву=1,79 мин, m/z=493,3 [M+H]+, чистота=100% (214,254 нм).
Пример 105
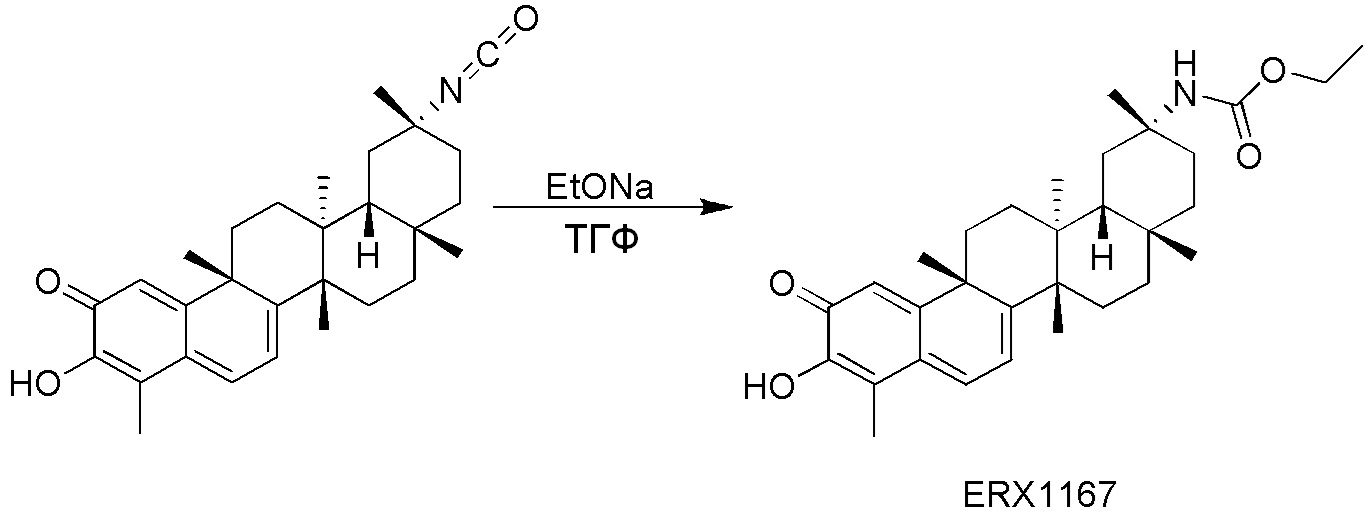
К раствору изоцианата (50 мг, 0,112 ммоль) в ТГФ (2 мл) добавляют EtONa (38 мг, 0,559 ммоль). Реакционную смесь нагревают при комнатной температуре в течение 1 часа. Реакционную смесь гасят NH4Cl (10 мл). Смесь разбавляют в CH2Cl2 (100 мл), промывают H2O (100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2:MeOH=20:1) с получением продукта (11,8 мг, 0,0239 ммоль, Выход=21%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,03 (1H, дд, J=7,2, 0,9 Гц), 6,98 (1H, с), 6,54 (1H, д, J=0,9 Гц), 6,37 (1H, д, J=7,2 Гц), 4,39 (1H, с), 3,90-4,07 (2H, м), 2,74 (1H, д, J=14,8 Гц), 2,22 (3H, с), 2,11-2,18 (1H, м), 1,20-2,05 (12H, м), 1,45 (3H, с), 1,37 (3H, с), 1,27 (3H, с), 1,14 (3H, т, J=7,0 Гц), 1,12 (3H, с), 0,95-1,01 (1H, м), 0,75 (3H, с). ЖХ-МС: ву=1,99 мин, m/z=494,3 [M+H]+, чистота=100% (214,254 нм).
Пример 106
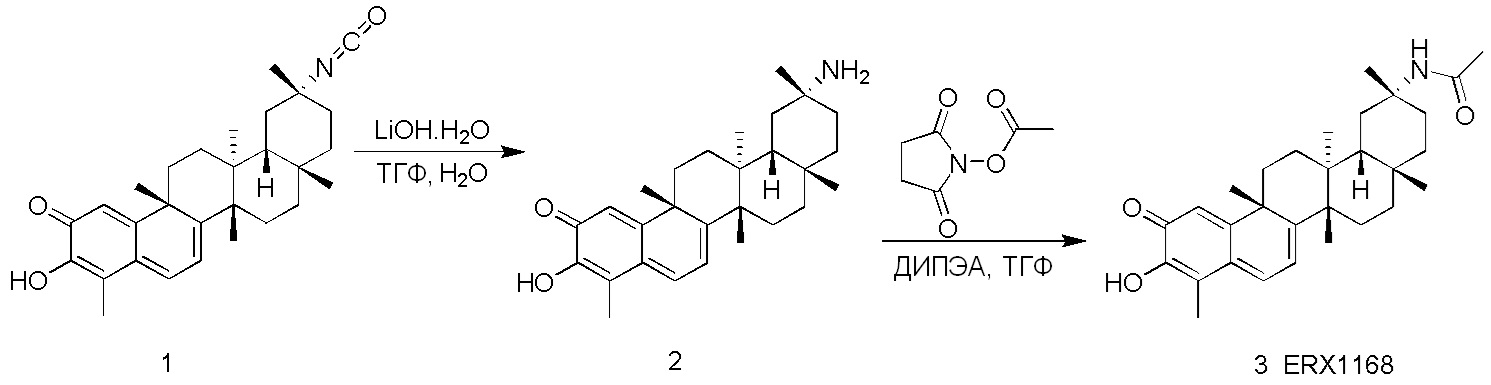
К раствору изоцианата 1 (478 мг, 1,068 ммоль) в ТГФ (20 мл) и H2O (2 мл) добавляют LiOH.H2O (220 мг, 5,24 ммоль). Реакционную смесь нагревают при 50°C в течение 4 часов. Большую часть ТГФ удаляют в вакууме. Остаток разбавляют в CH2Cl2 (100 мл), промывают 0,1 M HCl (100 мл). Весь раствор фильтруют. Органический слой промывают H2O (100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток и твердое вещество, полученное фильтрацией, растворяют в 200 мл раствора CH2Cl2:MeOH=10:1, концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2:MeOH=5:1) с получением промежуточного соединения (50 мг, 0,119 ммоль, Выход=11%) в виде коричневого твердого вещества.
К раствору промежуточного соединения 2 (50 мг, 0,119 ммоль) в ТГФ (3 мл) добавляют N-гидроксисукцинимидный эфир уксусной кислоты (93 мг, 0,594 ммоль) и ДИПЭА (77 мг, 0,10 мл, 0,594 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Большую часть ТГФ удаляют в вакууме. Остаток разбавляют в CH2Cl2 (100 мл), промывают H2O (100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=1:3) с получением продукта (17,5 мг, 0,0377 ммоль, Выход=32%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,01 (1H, дд, J=7,2, 1,2 Гц), 6,98 (1H, с), 6,54 (1H, д, J=1,2 Гц), 6,36 (1H, д, J=7,2 Гц), 5,04 (1H, с), 2,82 (1H, д, J=13,9 Гц), 2,21 (3H, с), 2,12-2,18 (1H, м), 1,60-2,05 (12H, м), 1,81 (3H, с), 1,45 (3H, с), 1,42 (3H, с), 1,28 (3H, с), 1,12 (3H, с), 0,97-1,03 (1H, м), 0,77 (3H, с). ЖХ-МС: ву=1,81 мин, m/z=464,3 [M+H]+, чистота=100% (214,254 нм).
Пример 107
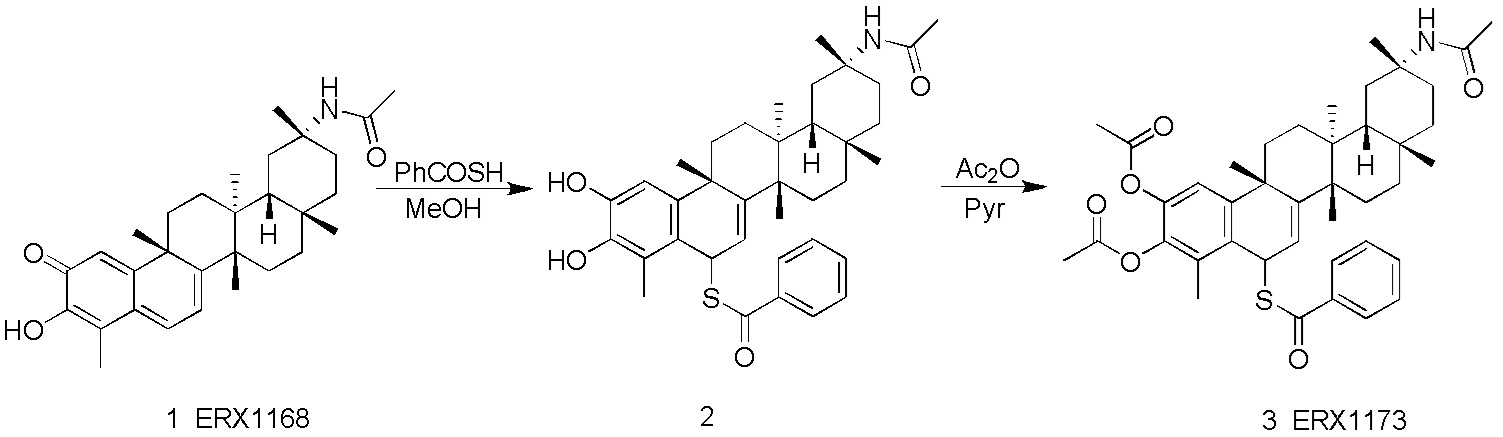
К раствору ERX1168 (116 мг, 0,258 ммоль) в MeOH (5 мл) добавляют PhCOSH (71 мг, 0,06 мл, 0,516 ммоль). Смесь сразу же превращается из красноватой в светло-желтую. Реакционную смесь перемешивают при к.т. в течение 10 минут. Раствор концентрируют в вакууме. Неочищенное промежуточное соединение 2 применяют на следующей стадии без дальнейшей очистки.
К раствору промежуточного соединения 2 (155 мг, 0,258 ммоль, теоретическое количество) в пиридине (3 мл) добавляют Ac2O (1 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем раствор разбавляют CH2Cl2 (100 мл), промывают насыщ. CuSO4,5H2O (2×100 мл), H2O (100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (петролейный эфир/этилацетат=2:3), затем перекристаллизовывают из MeCN (5 мл) с получением продукта (59,9 мг, 0,0873 ммоль, Выход=34%) в виде белого твердого вещества.
1Н ЯМР δ (400 МГц, CDCl3): 7,93-7,97 (2H, м), 7,54-7,60 (1H, м), 7,41-7,48 (2H, м), 7,07 (1H, с), 6,07 (1H, д, J=6,4 Гц), 5,60 (1H, д, J=6,4 Гц), 5,08 (1H, с), 2,77-2,86 (1H, м), 2,30 (3H, с), 2,30 (3H, с), 2,12 (3H, с), 1,81 (3H, с), 1,43-2,10 (13H, м), 1,51 (13H, с), 1,41 (3H, с), 1,20 (3H, с), 1,08 (3H, с), 0,93-1,00 (1H, м), 0,79 (3H, с). ЖХ-МС: ву=2,42 мин, m/z=686,4 [M+H]+, чистота=97,26% (214 нм), 100% (254 нм).
Пример 108
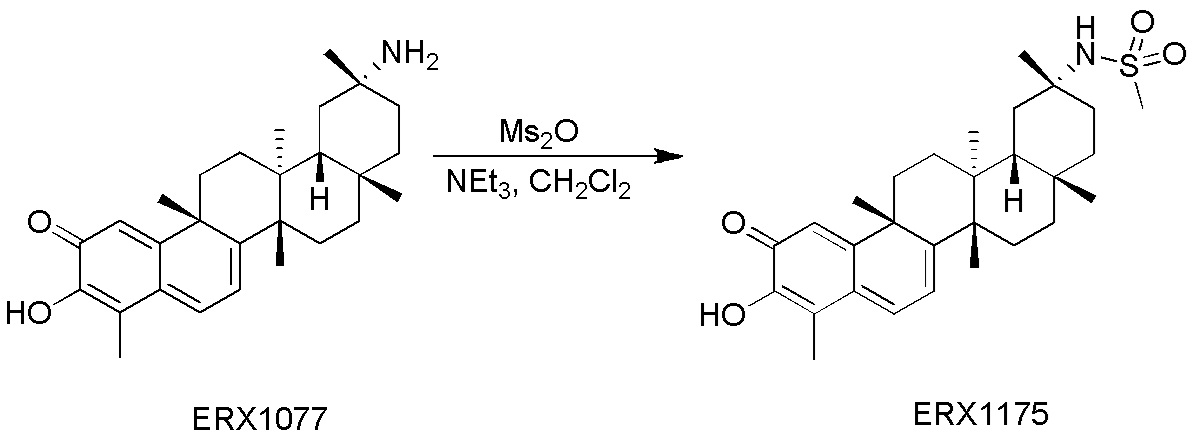
К раствору ERX1077 (220 мг, 0,52 ммоль) в CH2Cl2 (10 мл) добавляют NEt3 (105 мг, 1,04 ммоль), затем Ms2O (109 мг, 0,63 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь гасят H2O (20 мл). Раствор экстрагируют CH2Cl2 (3×20 мл). Объединенные экстракты промывают насыщенным раствором соли (50 мл), сушат над MgSO4 и концентрируют в вакууме. Остаток очищают преп-ТСХ (гексан:EtOAc=1:3) с получением продукта (22 мг, 0,044 ммоль, Выход=8,4%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,08 (1H, с), 7,02 (1H, д, J=6,2 Гц), 6,51 (1H, с), 6,37 (1H, д, J=6,2 Гц), 4,42 (1H, с), 2,96 (3H, с), 2,21 (3H, с), 2,14-2,23 (2H, м), 1,45-2,05 (12H, м), 1,49 (3H, с), 1,46 (3H, с), 1,29 (3H, с), 1,12 (3H, с), 1,00-1,06 (1H, м), 1,00 (3H, с). ЖХ-МС: ву=1,52 мин, m/z=500,3 [M+H]+, чистота=100% (214,254 нм).
Пример 109
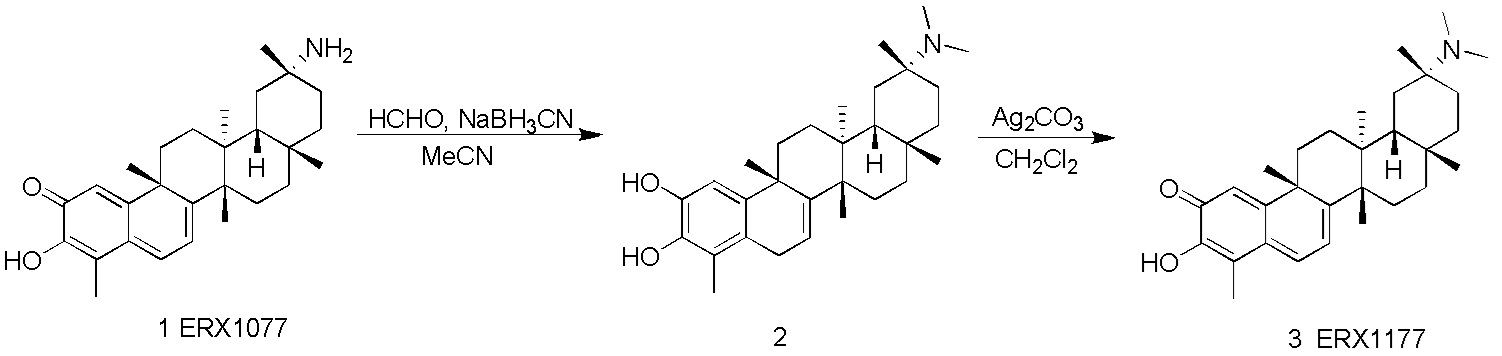
К раствору ERX1077 (880 мг, 2,087 ммоль) в MeCN (20 мл) добавляют 37% раствор HCHO (7,0 мл), затем NaBH3CN (656 мг, 10,44 ммоль) порциями. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Раствор разбавляют CH2Cl2 (200 мл), промывают 0,1 M HCl (320 мл), H2O (3×100 мл), насыщенным раствором соли (100 мл), сушат над MgSO4 и концентрируют в вакууме с получением неочищенного промежуточного соединения 2 (653 мг, 1,446 ммоль, Выход=69%) в виде белого твердого вещества.
1Н ЯМР: T242-T242-H1-20160216-SP-0012627-016-CDCL3 δ (400 МГц, CDCl3): 6,83 (1H, с), 5,77 (1H, д, J=4,5 Гц), 3,29 (1H, дд, J=20,7, 6,2 Гц), 3,01 (1H, дд, J=20,3 Гц), 2,63 (6H, с), 2,15 (3H, с), 2,01 (3H, с), 1,25-2,00 (17H, м), 1,38 (3H, с), 1,23 (3H, с), 1,19 (3H, с), 0,67 (3H, с).
К раствору неочищенного промежуточного соединения 2 (600 мг, 1,328 ммоль) в CH2Cl2 (50 мл) добавляют Ag2CO3 (733 мг, 2,657 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Раствор фильтруют и концентрируют в вакууме. Остаток очищают преп-ТСХ (CH2Cl2:MeOH=5:1) с получением продукта (86 мг, 0,191 ммоль, Выход=14%) в виде красного твердого вещества.1Н ЯМР δ (400 МГц, CDCl3): 7,02 (1H, дд, J=7,1,1,3 Гц), 6,95 (1H, с), 6,51 (1H, д, J=7,2 Гц), 6,40 (1H, д, J=1,2 Гц), 2,67 (6H, с), 2,22 (3H, с), 1,47-2,13 (15H, м), 1,46 (3H, с), 1,43 (3H, с), 1,27 (6H, с), 0,85 (3H, с). ЖХ-МС: ву=1,27 мин, m/z=450,3 [M+H]+, чистота=100% (214,254 нм).
БИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ: В.Б. ВВЕДЕНИЕ
Следующие тестируемые соединения исследуют для определения действия против ожирения при введении грызунам. Сначала тестируемые соединения составляют в дозах 50, 100, 200, 400, 500, 1000 и 2000 мкг/кг и вводят один раз в сутки в дозе 2 мл/кг в.б. в течение нескольких дней. Тестируемые соединения сравнивают с введением носителя мышам. Эксперимент состоит из двух фаз: фаза перед введением и фаза введения. Массу тела животных в каждой тестируемой группе измеряют ежедневно. Ы таблицах 2-5 суммированы параметры исследования. В таблице 6 показаны результаты тестируемых соединений, из дозы и действие против ожирения.
Таблица 2: Параметры исследования
Таблица 3: фаза перед введением
Таблица 4: фаза введения
Таблица 5: Сбор жидкого образца
Аббревиатуры: P=перед введением
Животных умерщвляют двуокись углерода (или анестезией), затем обезглавливают, проводят двухстороннюю торакотомию, кровопускание или удаление жизненно важных органов для того, чтобы обеспечить смерть после последнего сбора крови или запланированного завершения. Смещение шейных позвонков приемлемо для животных, не требующих исследования или зондовых проверок.
Любое животное, которое не выжило до окончания исследования, выбрасывают без дальнейшей оценки.
Осуществляют описательную статистику (n, среднее, стандартная ошибка среднего, стандартное отклонение). Дополнительно, однофакторный дисперсионный анализ, затем апостериорный критерий Даннетта проводят для массы тела (суммарное изменение массы тела), глюкозы (изменение процента глюкозы) и потребления пищи (суммарное потребление пищи). Площадь под кривой (для массы тела, суммарного изменения массы тела, суточного изменения массы тела и потребления пищи) вычисляют для обрабатываемых групп. В качестве подходящего сравнения, тест, такой как однофакторный дисперсионный анализ, затем апостериорный критерий Даннетта, проводят для средних показателей для группы для расчетов площади под кривой.
Все методики в этом протоколе соответствуют Закону о благополучии животных Министерства сельского хозяйства США (USDA) (9 CFR части 1, 2 и 3); Руководству по содержанию и использованию лабораторных животных (Institute for Laboratory Animal Research, The National Academies Press, Washington, D.C.); и Национальным институтам здравоохранения, отдел благополучия лабораторных животных (для исследований, финансируемых НИЗ). Если возможно, методики в этом исследовании разработаны так, чтобы избежать или минимизировать дискомфорт, стресс и боль у животных.
Это не клиническое лабораторное исследование не предназначено для проведения в полном соответствии с правилами Свода международных требований к лабораторным исследованиям (GLP) Управления по контролю за продуктами питания и лекарствами США (FDA), 21 CFR часть 58, но проводят в соответствии с типовыми инструкциями Covance.
Это исследование соответствует всем применимым разделам Руководству по содержанию и использованию лабораторных животных. Если возможно, методики в этом исследовании разработаны так, чтобы избежать или минимизировать дискомфорт, стресс и боль у животных. Все методики описаны в этом протоколе исследования или в письменных лабораторных методиках. Эти методики основаны на большинстве современных доступных технологий, касающихся правильного применения и управления лабораторными животными.
Таблица 6-A: In vivo активность соединений (В.Б. введение).
Таблица 6-B: Данные растворимости соединения.
Н/П: не приобретено
Тестируемая концентрация: 100 мкМ (1% ДМСО)
Системы тестирования: ФРФБ (pH 7,4)
Условия инкубирования: встряхивание (1000 об./мин) в течение 1 ч при комнатной температуре
Размер образца: дупликаты (n=2)
Биоаналитический метод: ЖХ-МС/МС
Комментарии:
Как показано в таблице 6-B, значения растворимости менее 10 мкМ означают, что эти соединения показывают низкую растворимость; значения растворимости от 10 мкМ до 80 мкМ означают, что эти соединения показывают умеренную растворимость; значения растворимости более 80 мкМ означают, что эти соединения показывают высокую растворимость.
Таблица 6-C: Данные растворимости соединения.
Тестируемая концентрация: 100 мкМ (1% ДМСО)
Системы тестирования: ФРФБ (pH 7,4)
Условия инкубирования: встряхивание (1000 об./мин) в течение 1 ч при комнатной температуре
Размер образца: дупликаты (n=2)
Биоаналитический метод: ЖХ-МС/МС
Как показано в таблице 6-B, значения растворимости менее 10 мкМ означают, что эти соединения показывают низкую растворимость; значения растворимости от 10 мкМ до 80 мкМ означают, что эти соединения показывают умеренную растворимость; значения растворимости более 80 мкМ означают, что эти соединения показывают высокую растворимость.
Таблица 6-D: Данные растворимости соединения
БИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ: ПЕРОРАЛЬНОЕ (П.О.) ВВЕДЕНИЕ
1. Сущность
Целью этого исследования является оценка тестируемых продуктов на мышах с алиментарным ожирением (АО).
Самцов мышей C57BL/6 АО делят на 12 групп и вводят дозы 2 мг/кг Целастрола (ERX1000-4), ERX1006, ERX1007, ERX1037, ERX1060, ERX1077, ERX1107, ERX1149, ERX1168, ERX1177, и Пристимерина группам 2-12, соответственно. Животным вводят дозы через пероральный зонд один раз в сутки в течение 10 дней в объеме 2 мл/кг. Два контрольных носителя включают 1% метилцеллюлозу (400 спз) в лимонной кислоте и фосфатном буфере.
Оцениваемые параметры включают смертность, клинические наблюдения, массу тела и потребление пищи и глюкозу крови.
Все животные выживают к запланированному окончанию испытания. Статистически значимые изменения массы тела, потребления пищи и процент изменения значения глюкозы отмечены у животных, получавших ERX1000-4 и ERX1168. Статистически значимые изменения массы тела отмечены у животных, получавших ERX1006.
2. Методы
2.1 Система тестирования и план исследования
2.1.1 Спецификация и акклиматизация животных
Самцов мышей C57BL/6 с алиментарным ожирением (АО) получают от Taconic. Животных акклиматизируют к условиям клеток в течение, по крайней мере, 1 недели до введения акклиматизирующего носителя. Животных акклиматизируют к введению через пероральный зонд носителя один раз в сутки в течение 11-14 дней фазы перед введением.
В начале введения возраст животных составляет от 21 до 22 недель, и масса тела варьируется от 29,8 до 40,1 г.
2.1.2 Условия окружающей среды, питание и вода
2.1.2.1 Размещение в клетках
Животных помещают отдельной в клетки по типу обувной коробки с подстилкой из древесных стружек и гнездами.
2.1.2.2 Вода
Воду дают ad libitum.
2.1.2.3 Питание
Животным предлагают TD95217 ad libitum, до тех пор, пока не требуется голодание для предусмотренных исследованием процедур.
2.1.2.4 Окружающая среда
Контрольные показатели окружающей среды установлены так, чтобы поддерживать следующие условия в клетках с животными: температура от 68 до 79°F, относительная влажность от 30 до 70%, и 12-часовой цикл день/ночь. Любые изменения этих условий сохраняются в исходных данных и не оказывают влияния на результат исследования.
2.1.2.5 Обогащение пищи
Животным не дают специализированно обогащенную пищу.
2.1.3 Идентификация животных и распределение для исследования
Животных идентифицируют с помощью несмываемой краски на хвосте и таблички на клетке.
Животных распределяют для исследования с применением компьютеризированного метода, разработанного для достижения баланса массы тела относительно группового распределения.
2.1.4 План исследования: Таблица 7
2.2 Тестируемый продукт и носитель
2.2.1 Тестируемый продукт
2.2.2 Носитель
Носителем является 1% метилцеллюлоза (400 спз) в лимонной кислоте и фосфатном буфере.
2.2.3 Составление тестируемого продукта
Композиции тестируемого продукта получают дважды методом смешивания. Концентрации доз основаны на тестируемом продукте, как указано.
Дозированные композиции хранят замороженными и защищенными от света.
2.3 Прижизненные методики
2.3.1 Введение дозы
Дозированные композиции вводят через пероральный зонд один раз в сутки в течение 10 дней в объеме дозы 2 мл/кг. Дозы основаны на самой последней зафиксированной запланированной массе тела.
2.3.2 Массы тела
Массы тела записывают ежедневно в дни 11-14 фазы перед введением. Массы тела собирают для всех животных ежедневно в течение фазы введения до введения.
2.3.3 Потребление пищи
Количественную оценку потребления пищи записывают ежедневно на 11-14 день фазы перед введением во время фазы введения.
2.3.4 Уровень глюкозы в крови
Кровь для определения глюкозы крови собирают у всех животных через хвостовой зажим на 14 день фазы перед введением, и 11 день фазы введения через 6 часов голодания. Каплю крови от каждого животного помещают в два разных глюкометра Accu-Chek® Aviva для оценки уровней глюкозы. Берут третье значение, при необходимости.
2.4 Заключительные процедуры
Всех животных анестезируют двуокисью углерода, умерщвляют и выбрасывают без дальнейшей оценки на 11 день.
2.5 Оценка данных и статистический анализ
Проводят описательную статистику (n, среднее, стандартная ошибка среднего, стандартное отклонение). Дополнительно, однофакторный дисперсионный анализ, затем апостериорный критерий Даннетта проводят для массы тела (суммарное изменение массы тела), глюкозы (изменение процента глюкозы) и потребления пищи (суммарное потребление пищи). Площадь под кривой (для массы тела, суммарного изменения массы тела, суточного изменения массы тела и потребления пищи) вычисляют для обрабатываемых групп. В качестве подходящего сравнения, тест, такой как однофакторный дисперсионный анализ, затем апостериорный критерий Даннетта, проводят для средних показателей для группы для расчетов площади под кривой. Любой дополнительный статистический анализ и интерпретация результатов являются ответственностью спонсора.
3. Результаты
3.1 Прижизненные оценки
3.1.1 Результат лечения животных
Результат лечения животных представлен в таблицах 11-1-11-12.
Все животные выжили к запланированному концу исследования.
3.1.2 Клинические наблюдения
Изменения клинических условий не отмечались ни для одной из леченных групп.
3.1.3 Массы тела
Данные массы тела суммированы в таблицах 9-1-9-12 и на фиг. 1-5; индивидуальные данные представлены в таблицах 12-1-12-36 и на фигурах 10-12 (ежедневная масса тела, изменение ежедневной массы тела и суммарное изменение массы тела).
ERX1000-4 имеет статистически значимое снижение площади под кривой (ППК) для ежедневного и суммарного изменения массы тела, по сравнению с контролем.
ERX1168 имеет статистически значимое снижение площади под кривой (ППК) для ежедневного и суммарного изменения массы тела, и суммарного изменения массы тела, по сравнению с контрольными.
ERX1008 имеет статистически значимые снижения суммарного изменения массы тела, по сравнению с контрольными.
3.1.4 Потребление пищи
Потребление пищи суммировано в таблицах 10-1-10-6 и на фиг. 6-7; индивидуальные данные представлены на фиг. 13-14.
ERX1000-4 имеет статистически значимые снижения суммарного потребления пищи, по сравнению с контрольными.
ERX1168 имеет статистически значимое снижение площади под кривой (ППК) для суммарного потребления пищи и суммарного потребления пищи, по сравнению с контрольными.
3.1.5 Уровень глюкозы в крови
Данные глюкозы крови суммированы на фиг. 8-9; индивидуальные данные представлены на фиг. 15-17.
ERX1000-4 имеет статистически значимые снижения изменения процента значения глюкозы, по сравнению с контрольными.
ERX1168 имеет статистически значимые снижения изменения процента значения глюкозы, по сравнению с контрольными.
4. Сопутствующая информация по исследованию
4.1 Отклонения от исследования
4.1.1 Отклонения от протокола
Таблица 8
5. РЕЗУЛЬТАТЫ
Таблица 9: Результаты in vivo активности соединений (П.О. введение).
5.1 СУММАРНАЯ МАССА ТЕЛА
Таблица 9-1
Таблица 9-2
Таблица 9-3
Таблица 9-4
Таблица 9-5
Таблица 9-6
Таблица 9-7
Таблица 9-8
Таблица 9-9
Таблица 9-10
Таблица 9-11
Таблица 9-12
5.2 СУММАРНОЕ ПОТРЕБЛЕНИЕ ПИЩИ
Таблица 10-1
Таблица 10-2
Таблица 10-3
Таблица 10-4
Таблица 10-5
Таблица 10-6
5.3 ТАБЛИЦЫ С ИНДИВИДУАЛЬНЫМИ ДАННЫМИ ЖИВОТНЫХ
Таблица 11-1: Результат для отдельного животного
Таблица 11-2
Результат для отдельного животного
Таблица 11-3
Результат для отдельного животного
Таблица 11-4
Результат для отдельного животного
Таблица 11-5
Результат для отдельного животного
Таблица 11-6
Результат для отдельного животного
Таблица 11-7
Результат для отдельного животного
Таблица 11-8
Результат для отдельного животного
Таблица 11-9
8351983
Результат для отдельного животного
Таблица 11-10
Результат для отдельного животного
Таблица 11-11
Результат для отдельного животного
Таблица 11-12
Результат для отдельного животного
Таблица 12-1: Индивидуальная масса тела
Таблица 12-2
Индивидуальная масса тела
Таблица 12-3
Индивидуальная масса тела
Таблица 12-4
Индивидуальная масса тела
Таблица 12-5
Индивидуальная масса тела
Таблица 12-6
Индивидуальная масса тела
Таблица 12-7
Индивидуальная масса тела
Таблица 12-8
Индивидуальная масса тела
Таблица 12-9
Индивидуальная масса тела
Таблица 12-10
Индивидуальная масса тела
Таблица 12-11
Индивидуальная масса тела
Таблица 12-12
Индивидуальная масса тела
Таблица 12-13
Таблица 12-14
Индивидуальная масса тела
Таблица 12-15
Индивидуальная масса тела
Таблица 12-16
Индивидуальная масса тела
Таблица 12-17
Индивидуальная масса тела
Таблица 12-18
Индивидуальная масса тела
Таблица 12-19
Индивидуальная масса тела
Таблица 12-20
Индивидуальная масса тела
Таблица 12-21
Индивидуальная масса тела
Таблица 12-22
Индивидуальная масса тела
Таблица 12-23
Индивидуальная масса тела
Таблица 12-24
Индивидуальная масса тела
Таблица 12-25
Индивидуальная масса тела
Таблица 12-26
Индивидуальная масса тела
Таблица 12-27
Индивидуальная масса тела
Таблица 12-28
Индивидуальная масса тела
Таблица 12-29
Индивидуальная масса тела
Таблица 12-30
Индивидуальная масса тела
Таблица 12-31
Индивидуальная масса тела
Таблица 12-32
Индивидуальная масса тела
Таблица 12-33
Индивидуальная масса тела
Таблица 12-34
Индивидуальная масса тела
Таблица 12-35
Индивидуальная масса тела
Таблица 12-36
Индивидуальная масса тела
6. ПРОТОКОЛ
6.1 Тестируемые продукты и план исследования
Таблица 13
План исследования
Носитель содержит 1% метилцеллюлозу (400 спз) в лимонной кислоте/фосфатном буфере
6.2. Подробности составления дозы
Таблица 14
6.3 Подробное описание тестируемых животных и условиях их содержания
Таблица 15
6.4 Прижизненные параметры
6.4.1 Фаза перед введением
Таблица 16
6.4.2. Фаза введения
Таблица 17
Реферат
Изобретение относится к соединению, имеющему структуру
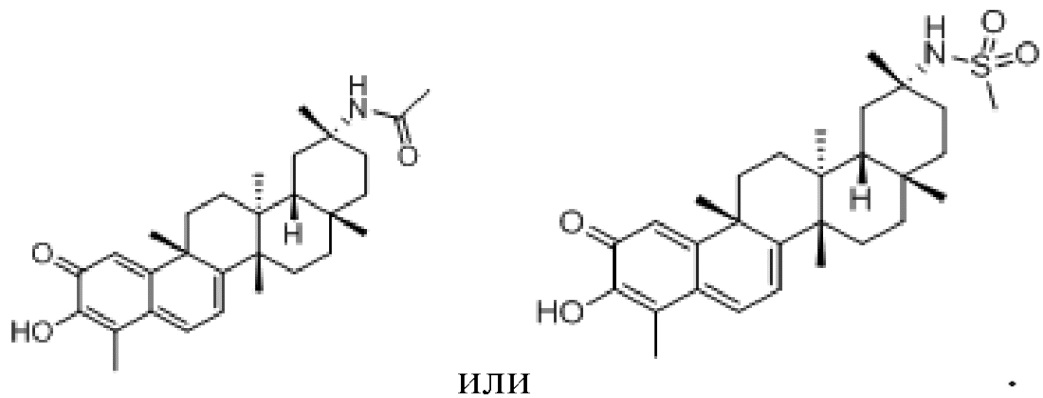
Изобретение также относится к фармацевтической композиции для лечения ожирения на основе указанного соединения. Технический результат – получены новые соединения, имеющие улучшенную пероральную биодоступность, и фармацевтическая композиция на их основе, которые могут найти применение в медицине для лечения ожирения. 6 н. и 5 з.п. ф-лы, 17 ил., 17 табл., 109 пр.
Формула

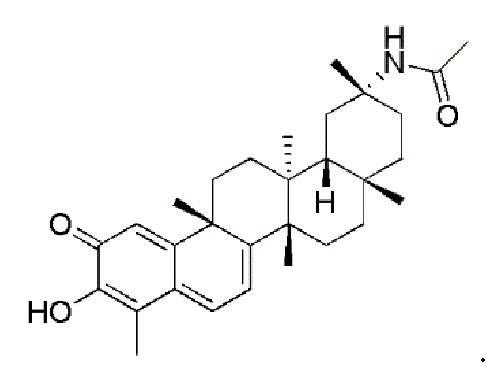
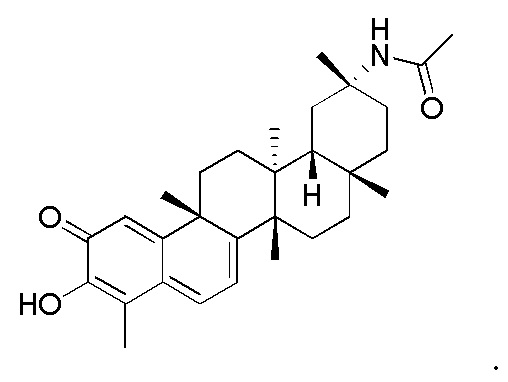
Документы, цитированные в отчёте о поиске
Производные тритерпенхинона и тритерпенфенола и их применение для лечения опухолей и паразитарных заболеваний
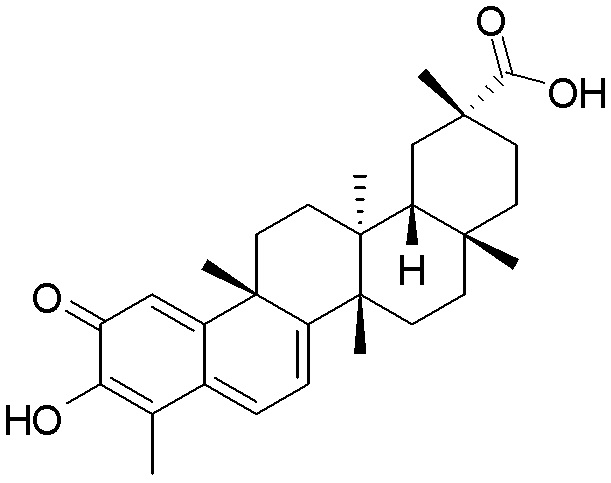

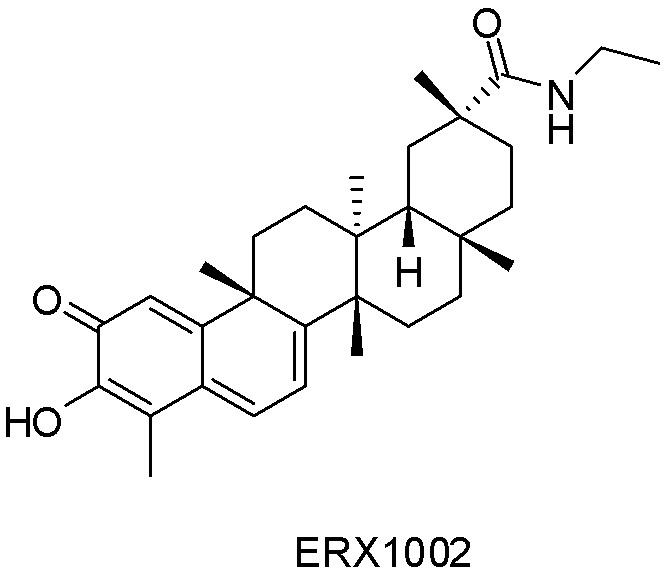
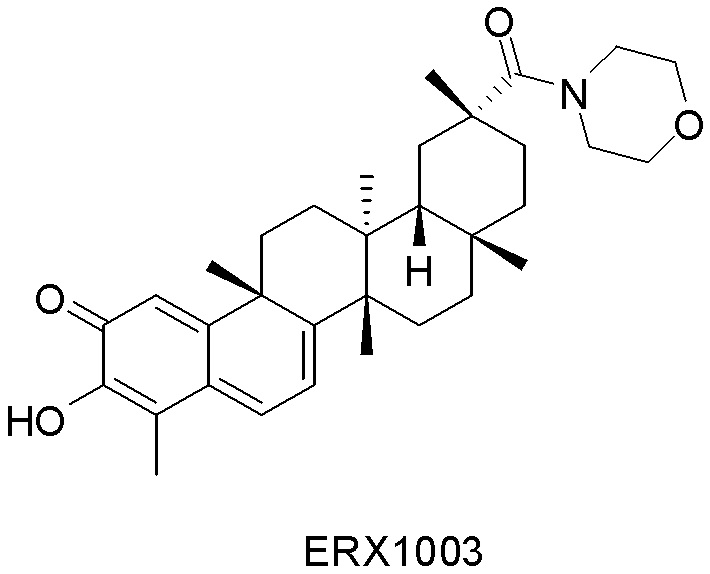
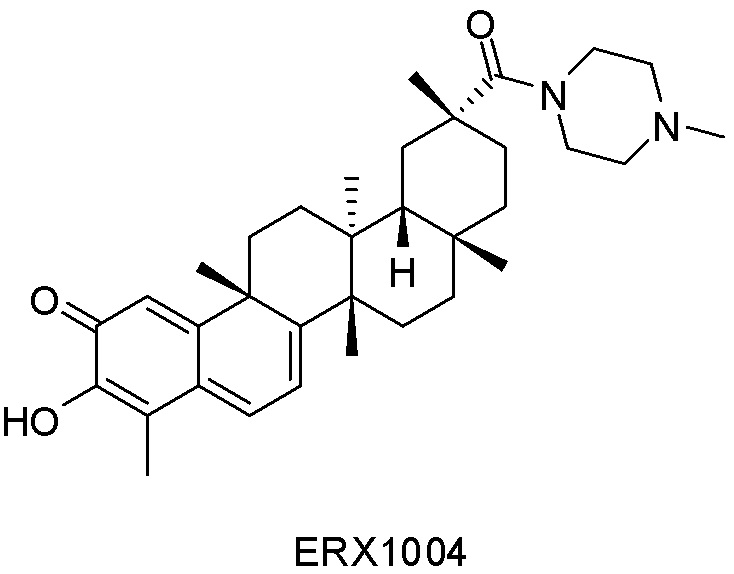
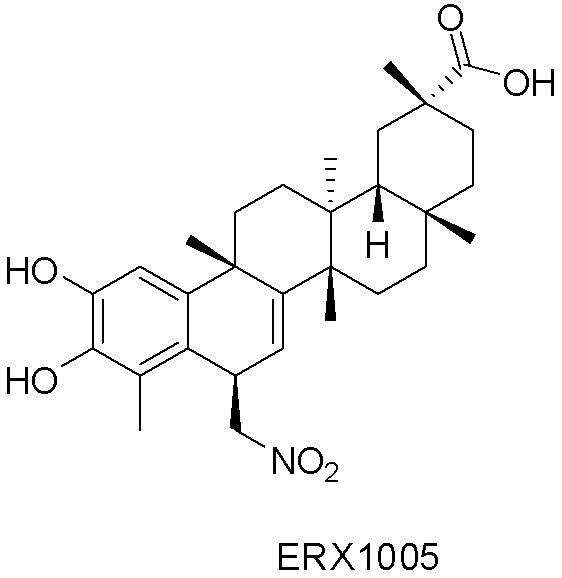
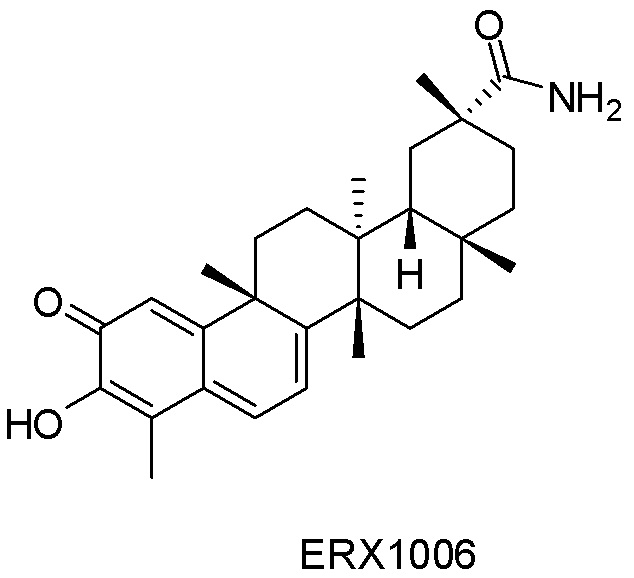
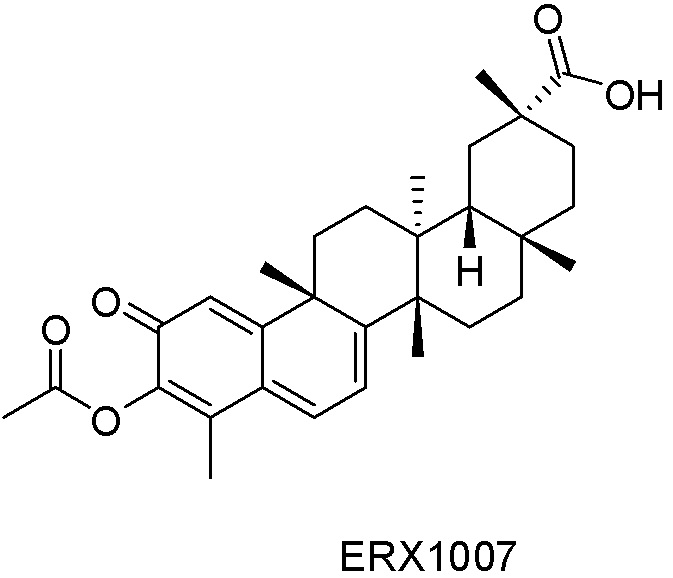
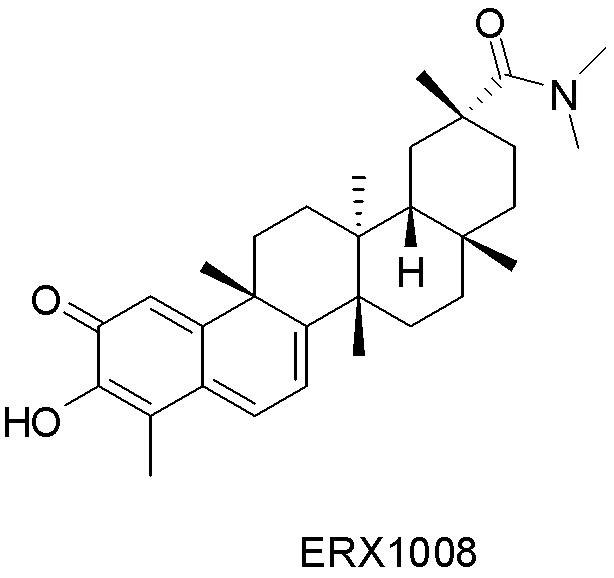
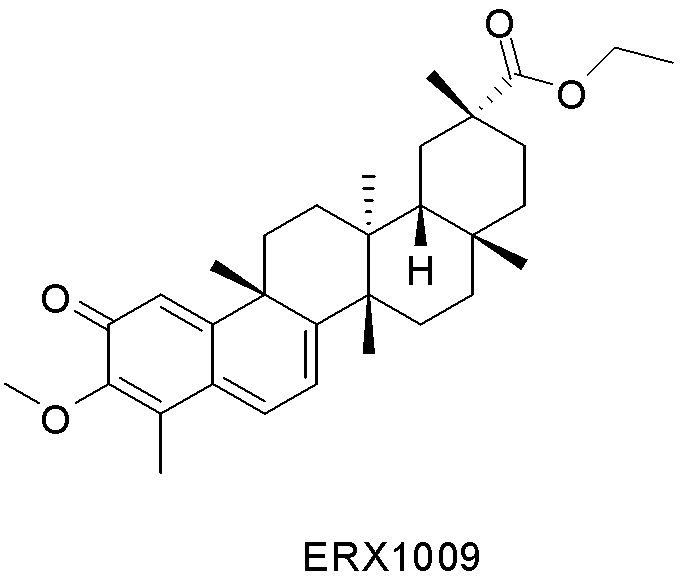
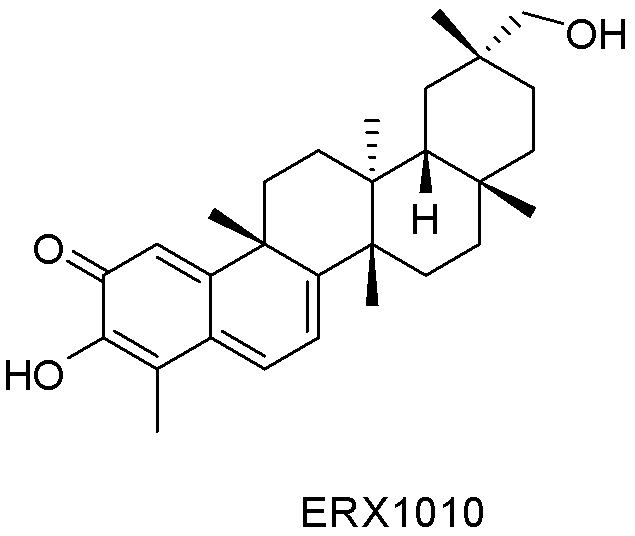
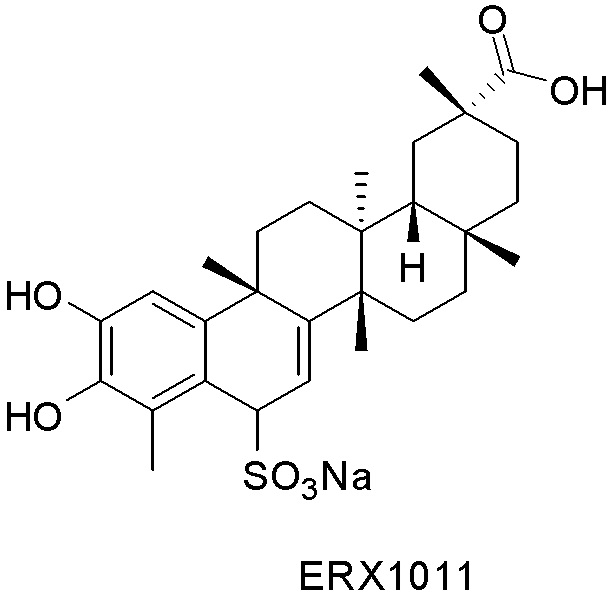
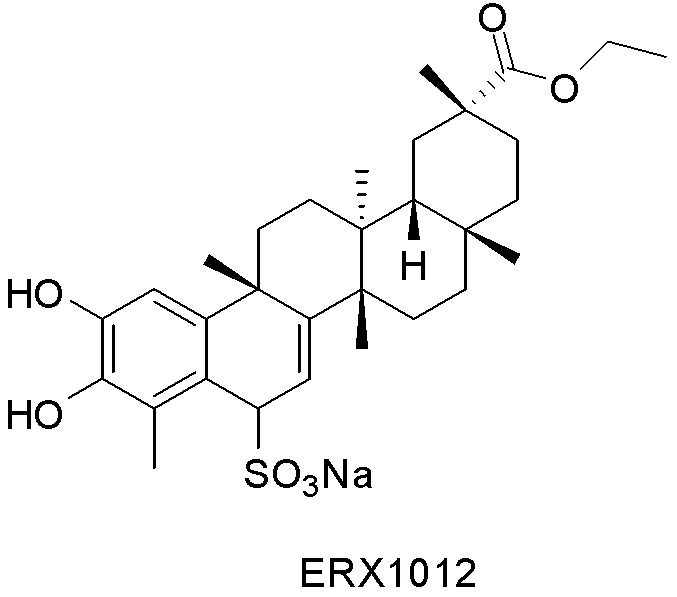
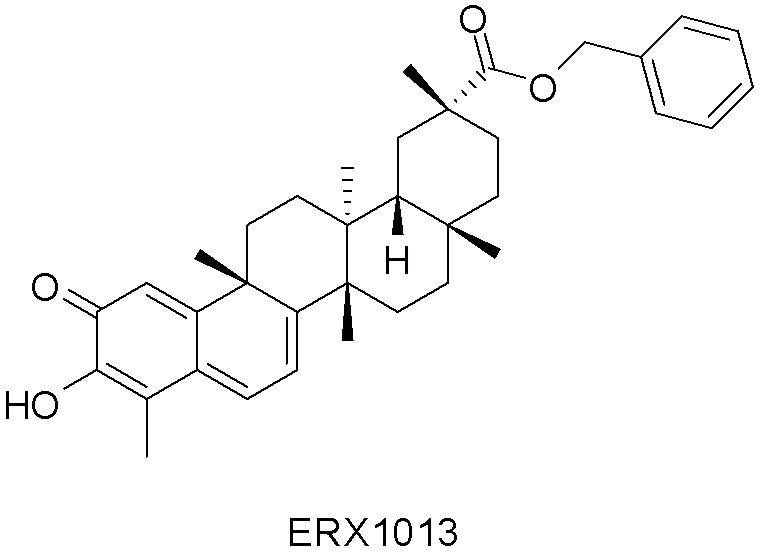
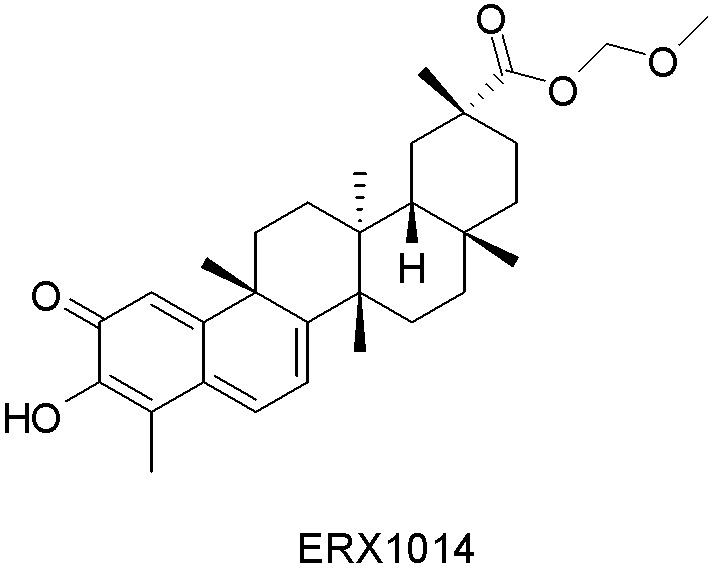

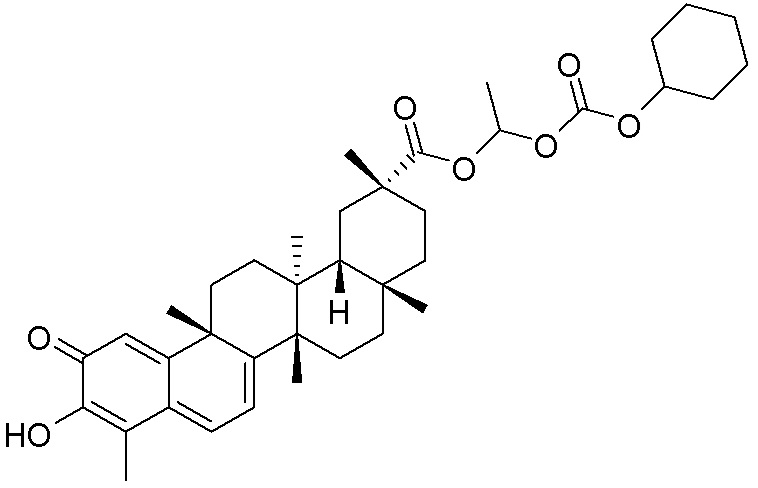
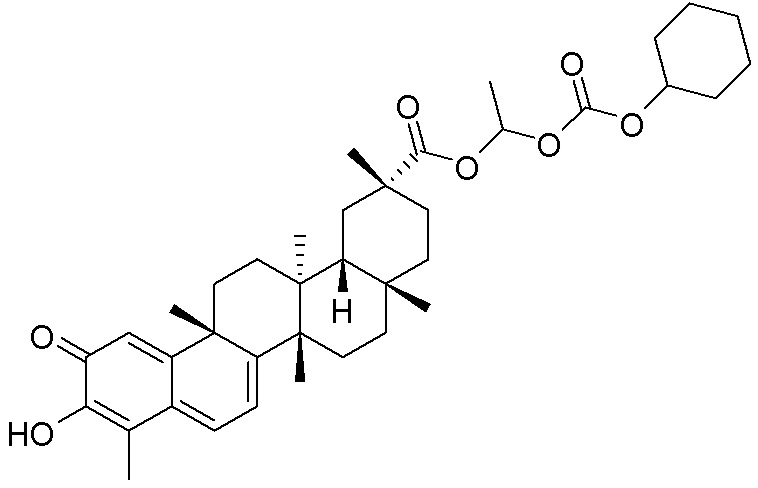
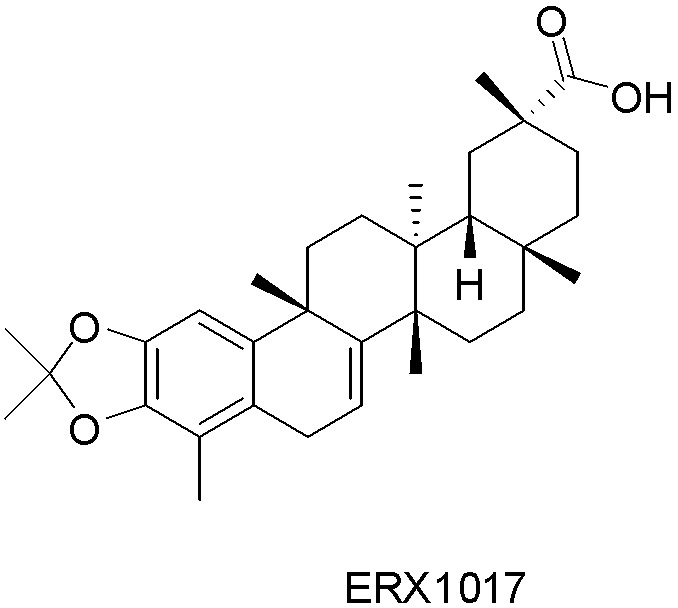
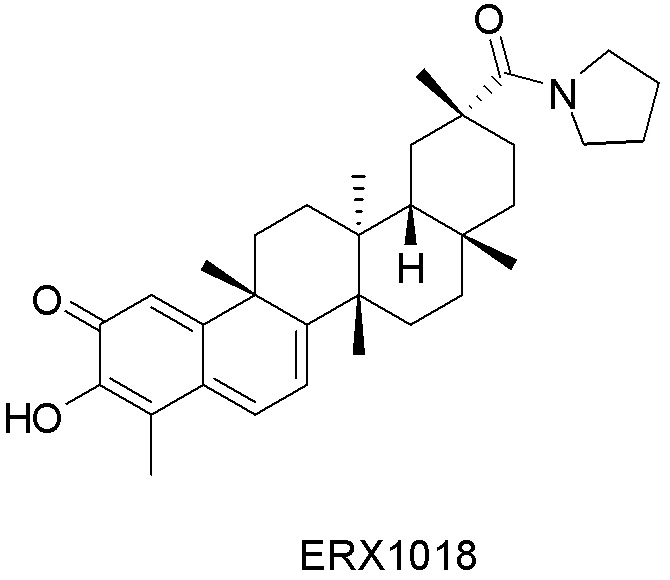
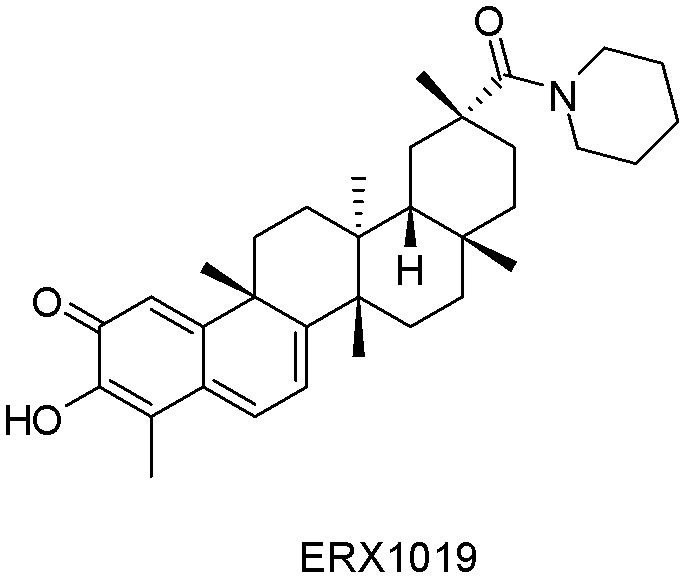
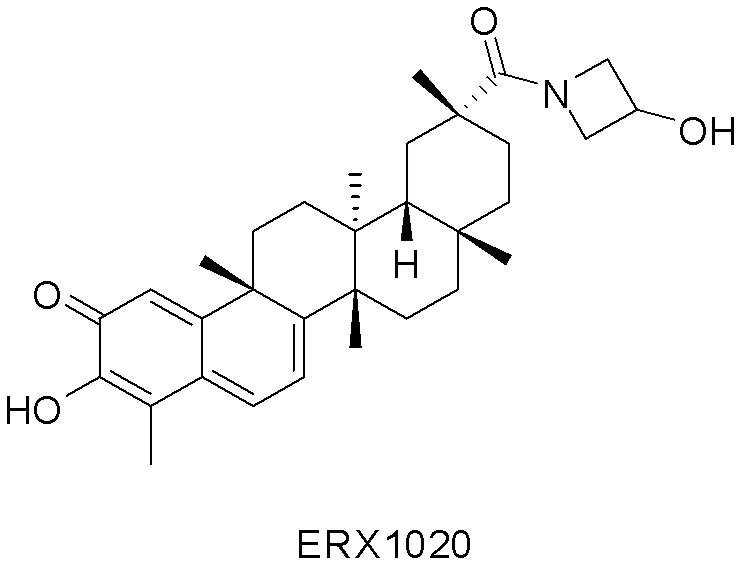
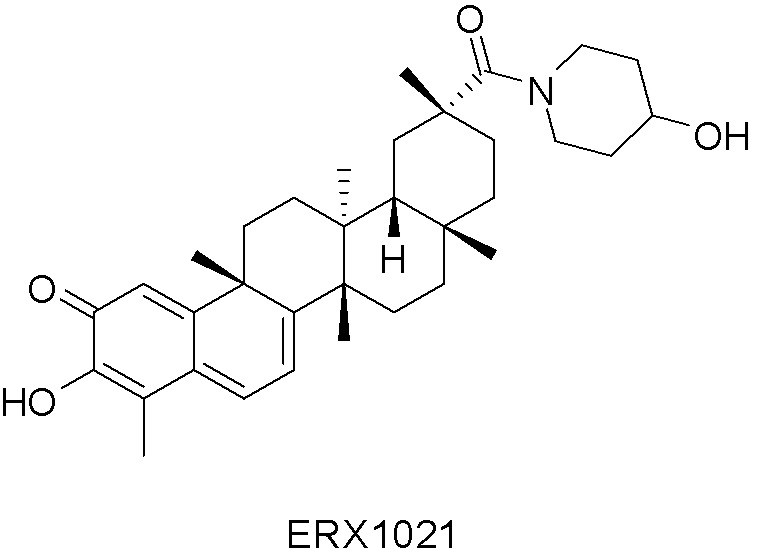
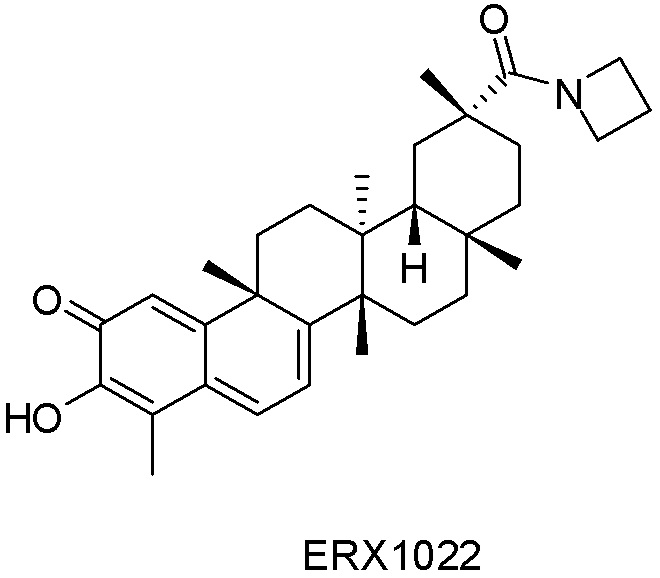
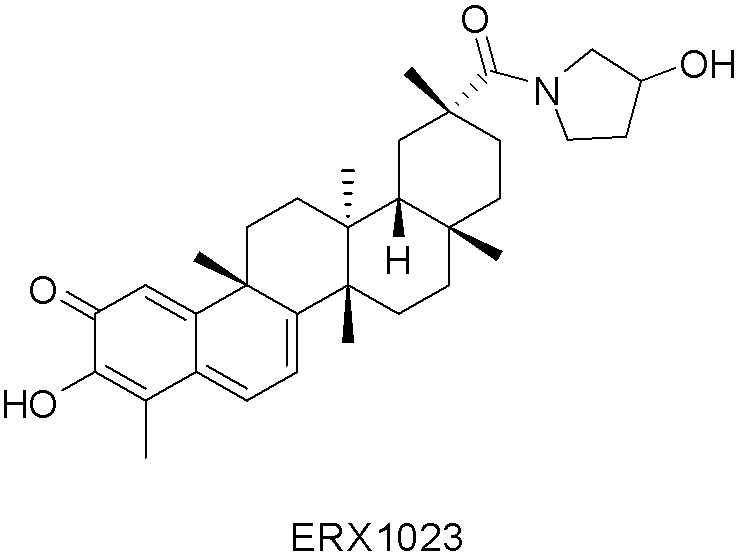
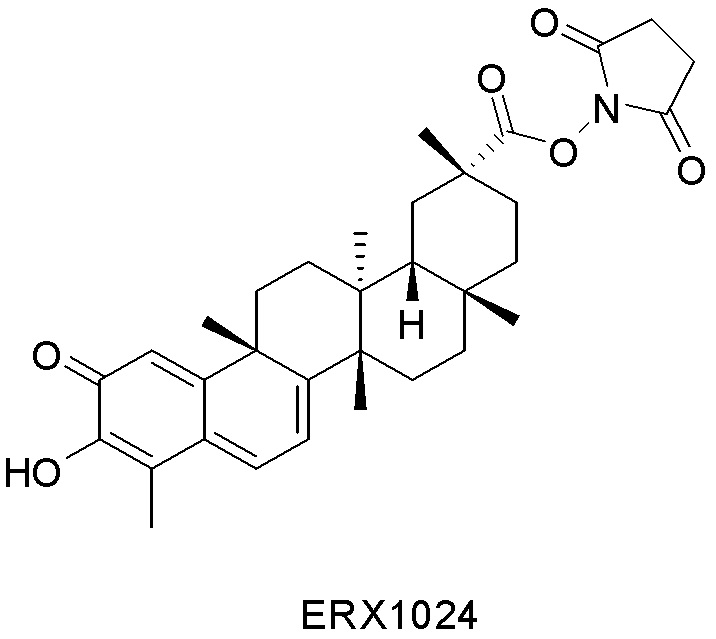
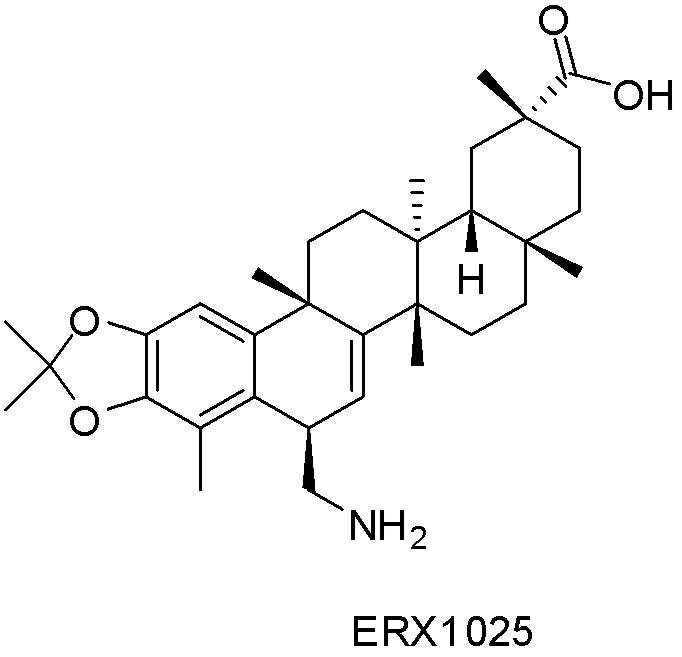
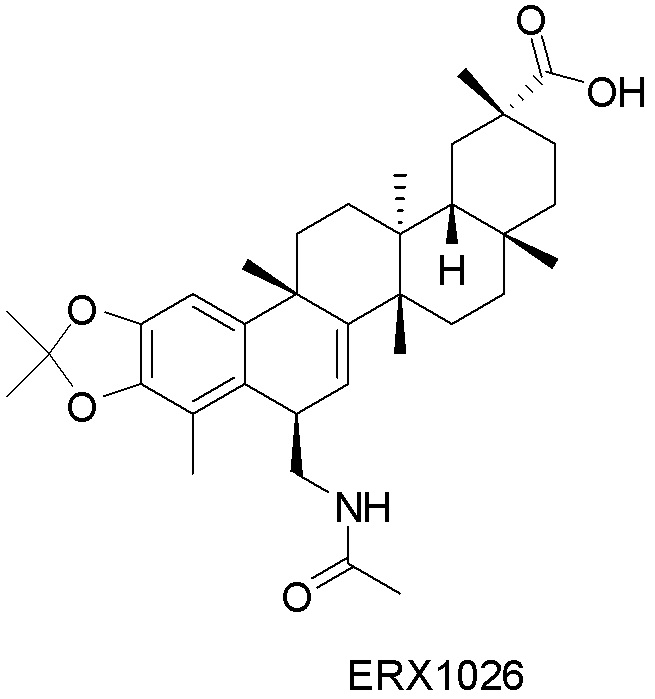
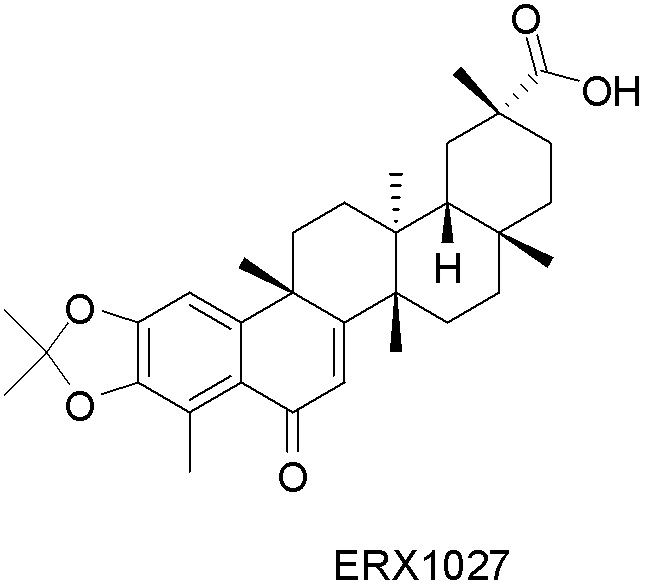
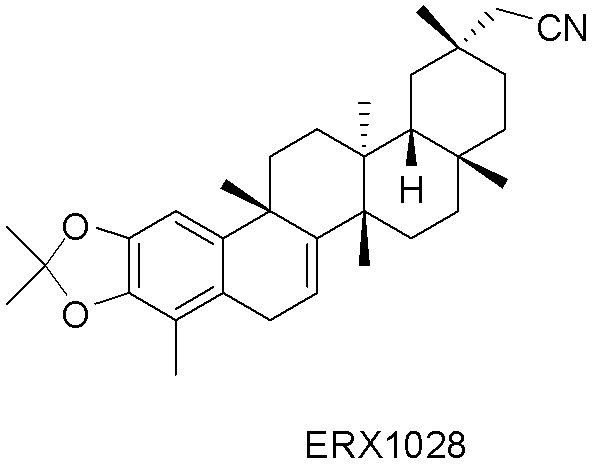
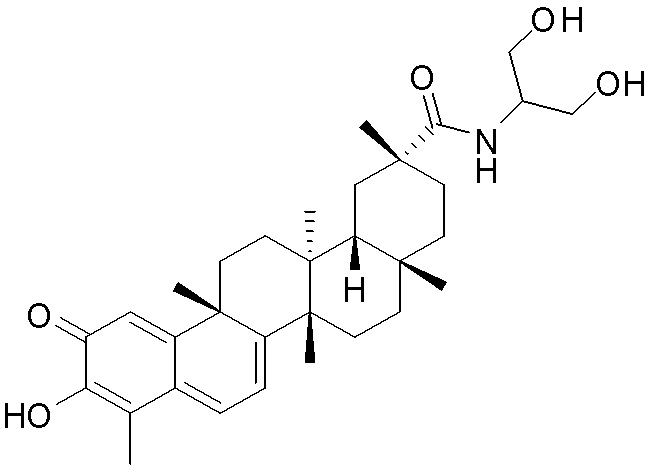
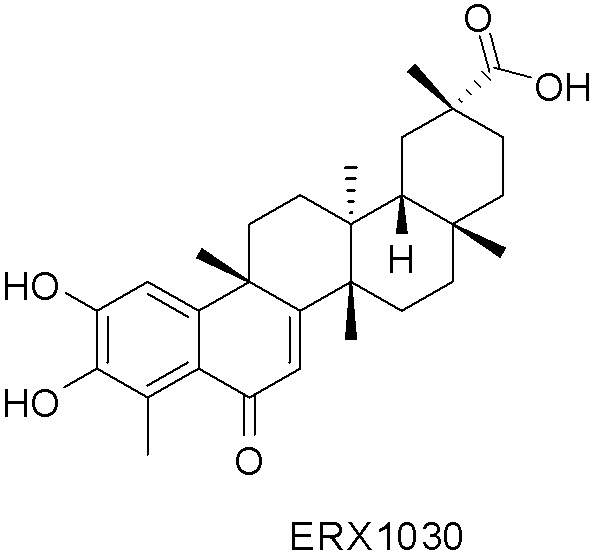
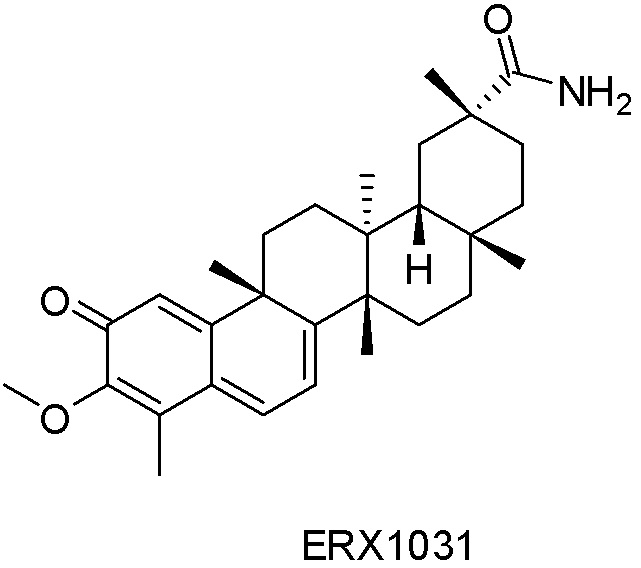
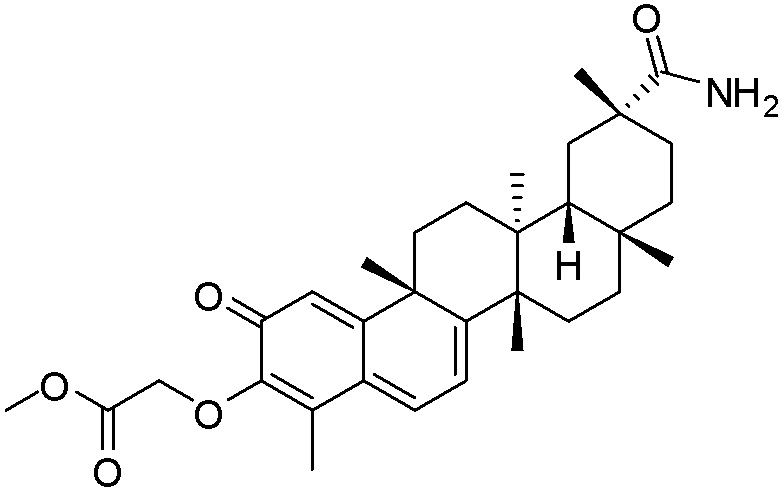

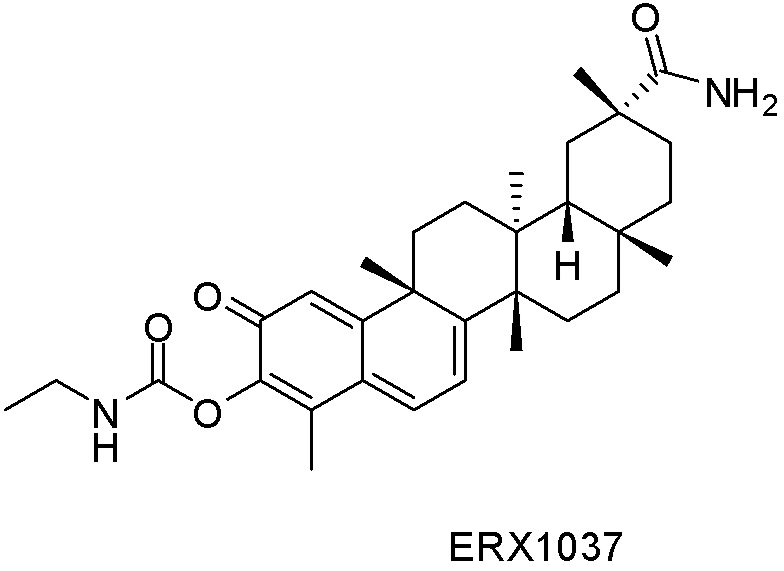

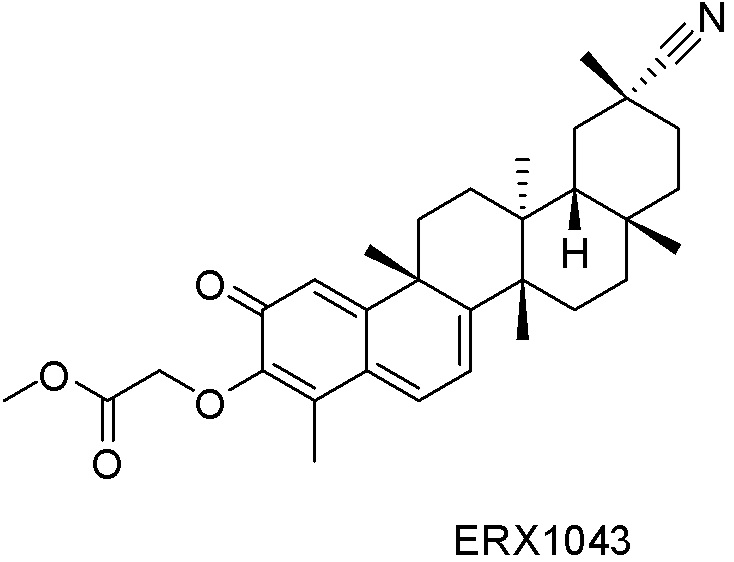

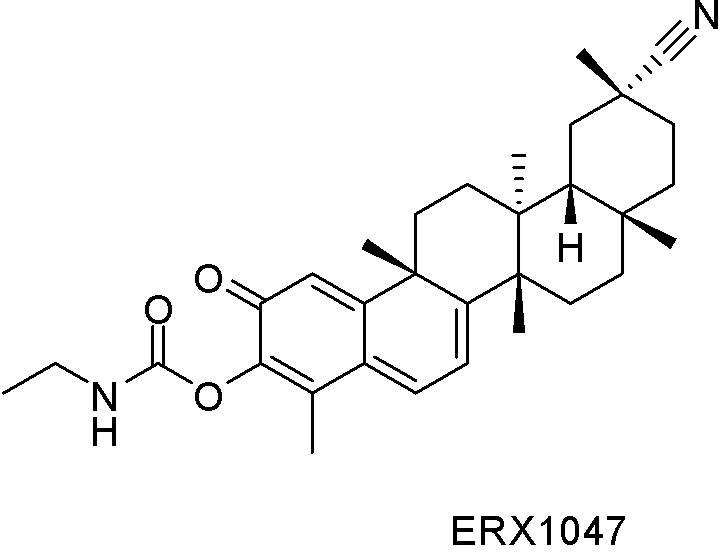
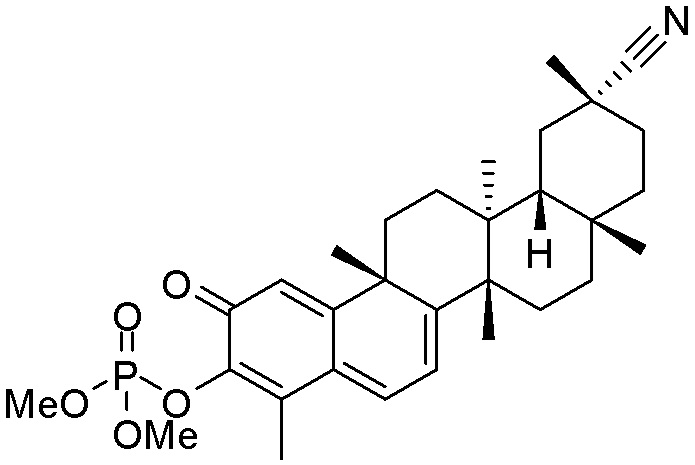
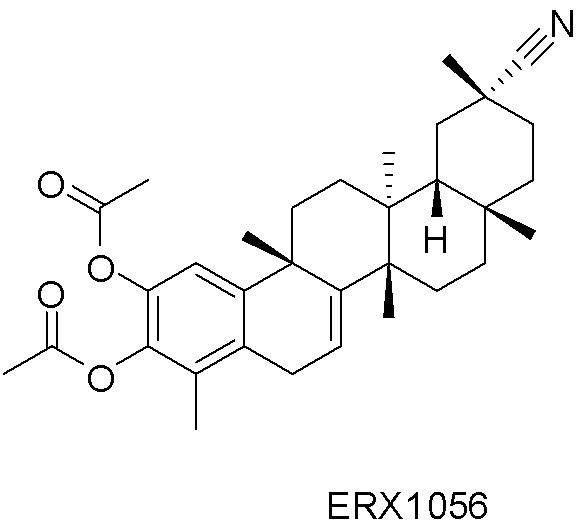
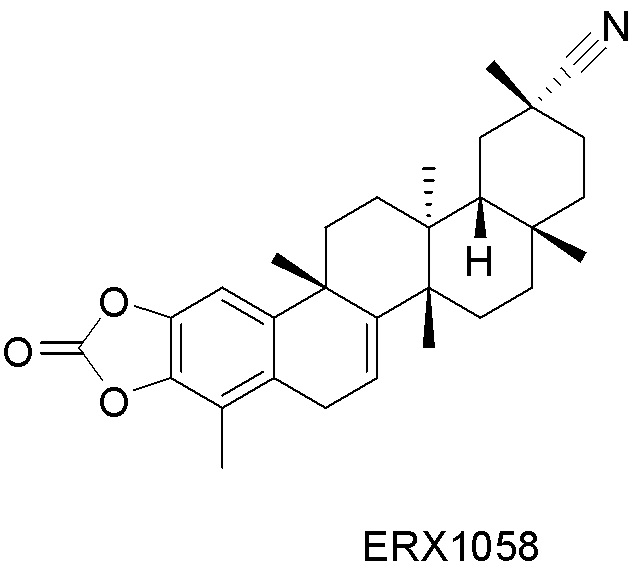
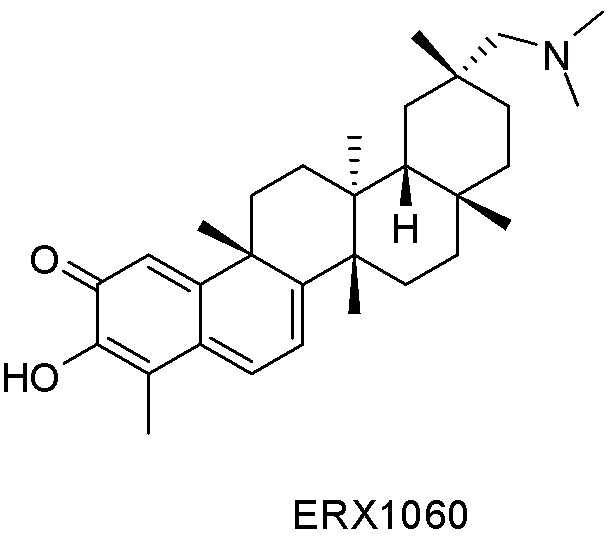
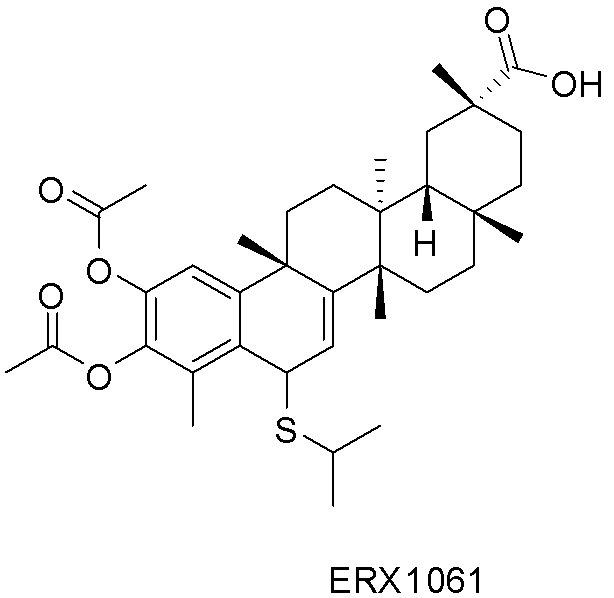
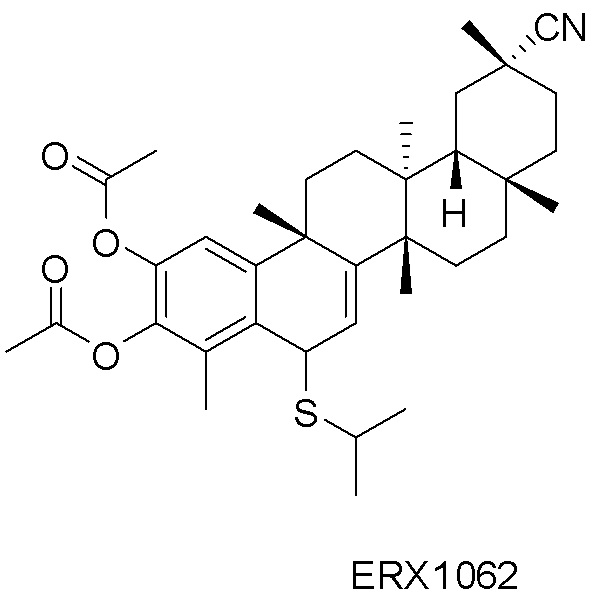
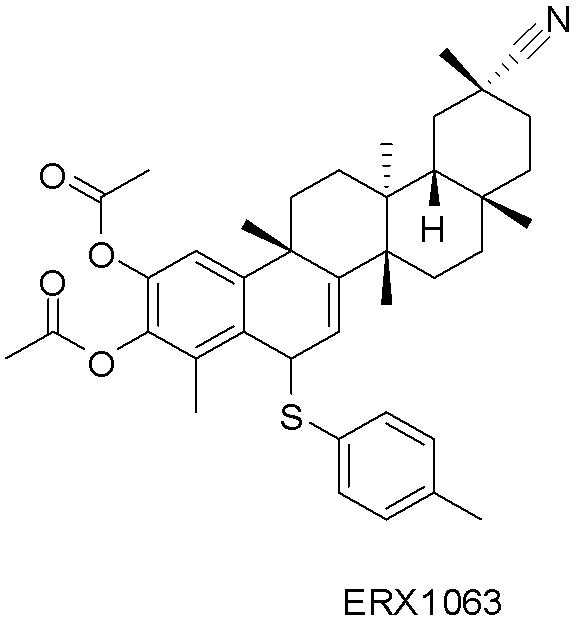
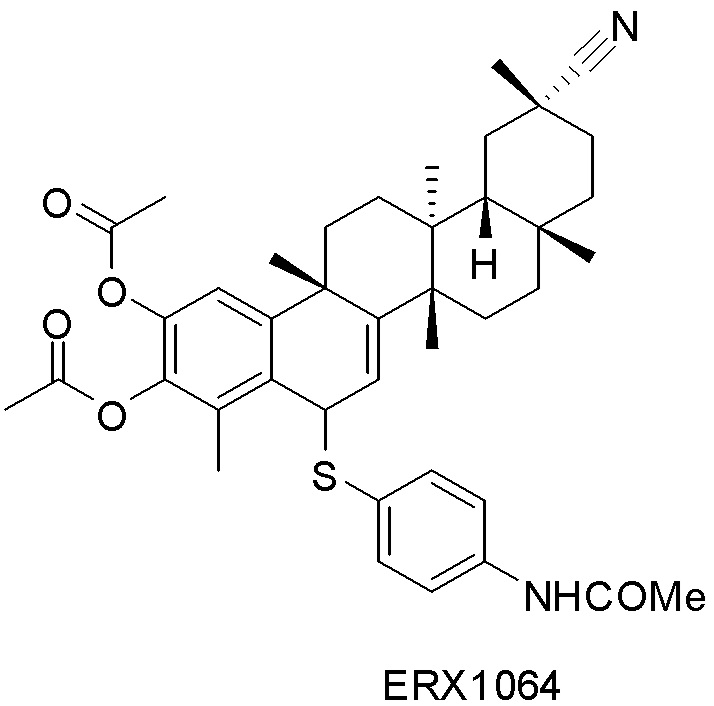
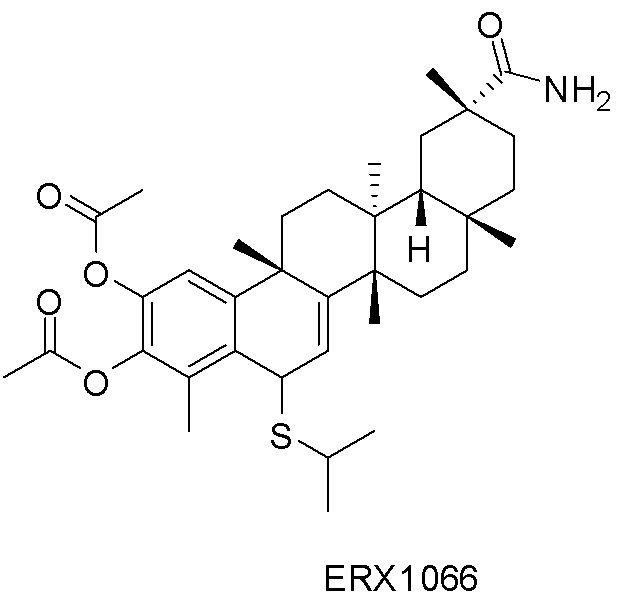
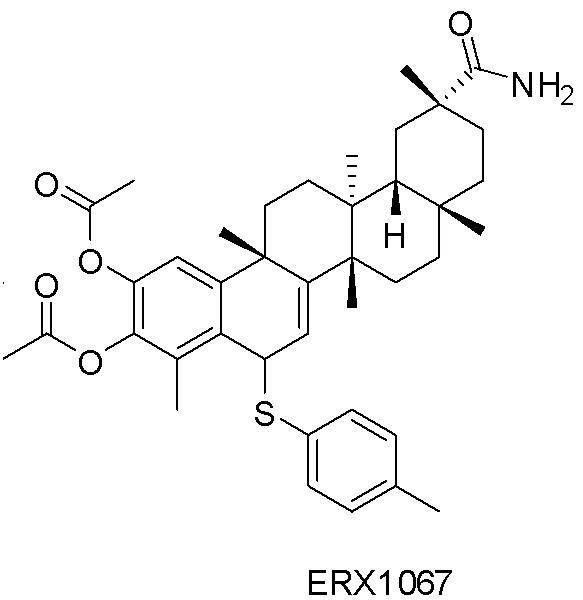
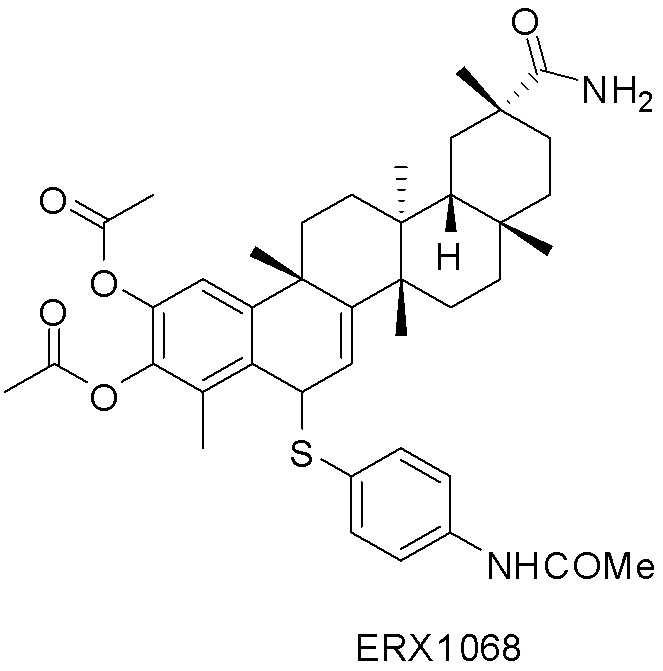
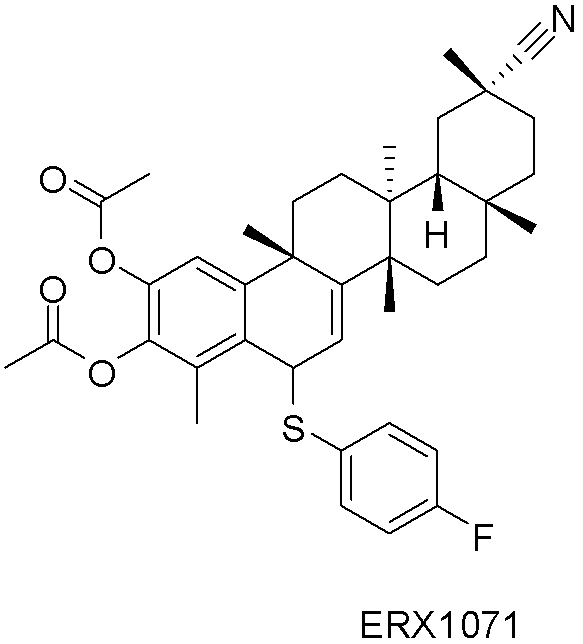
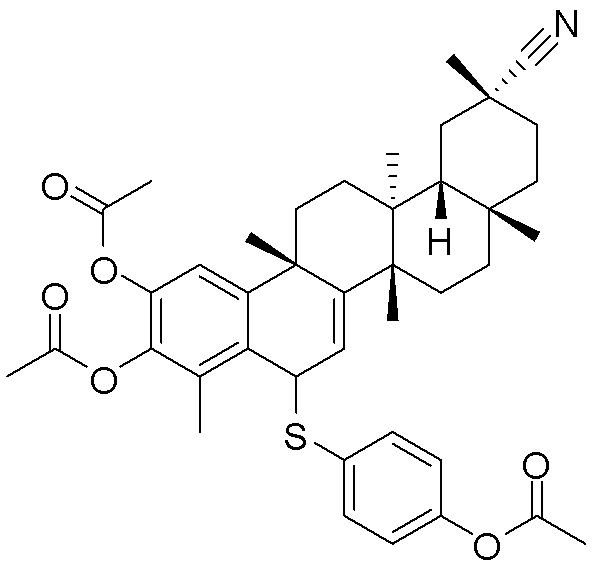
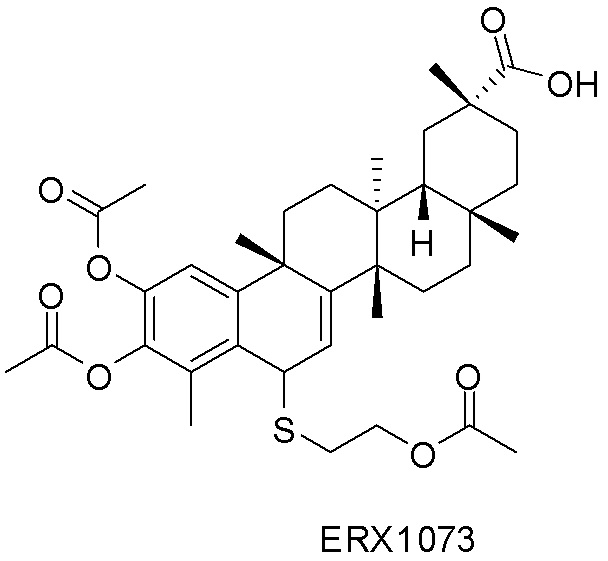
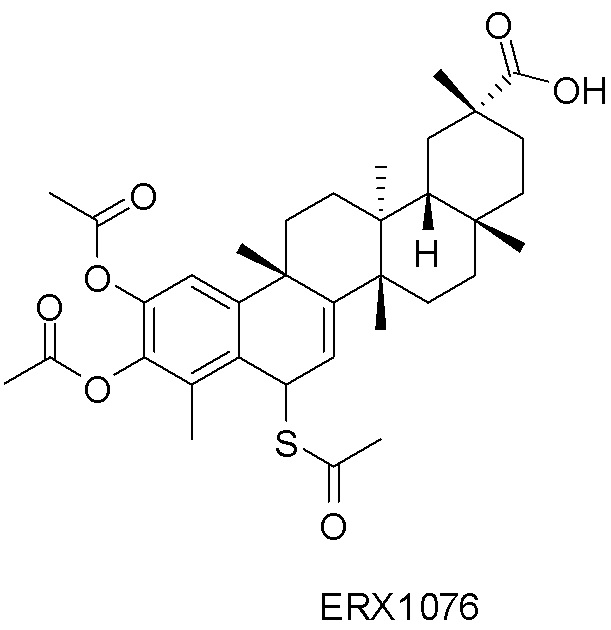
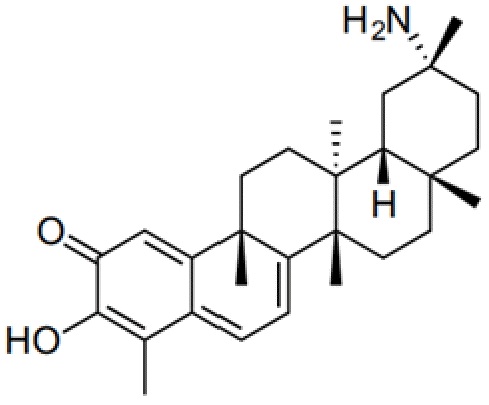
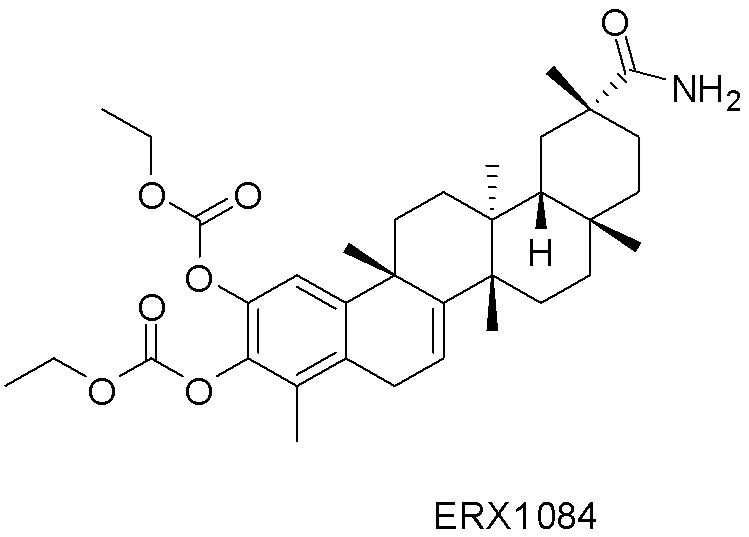
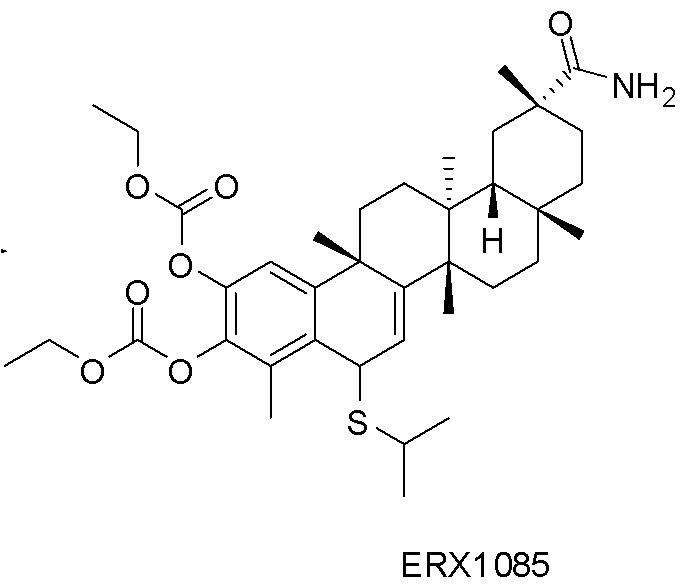
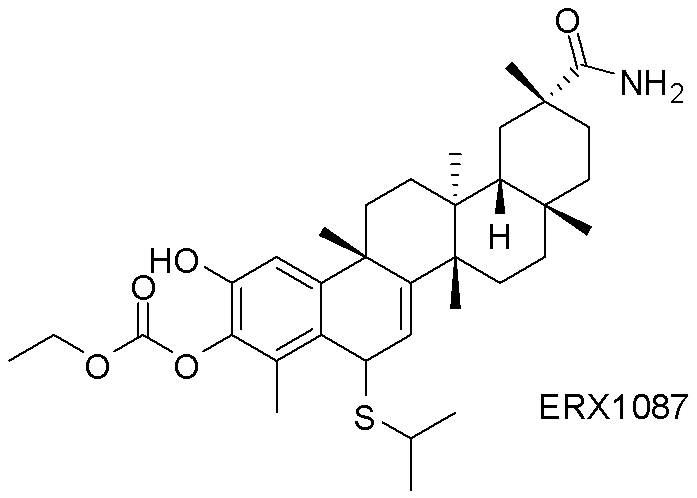
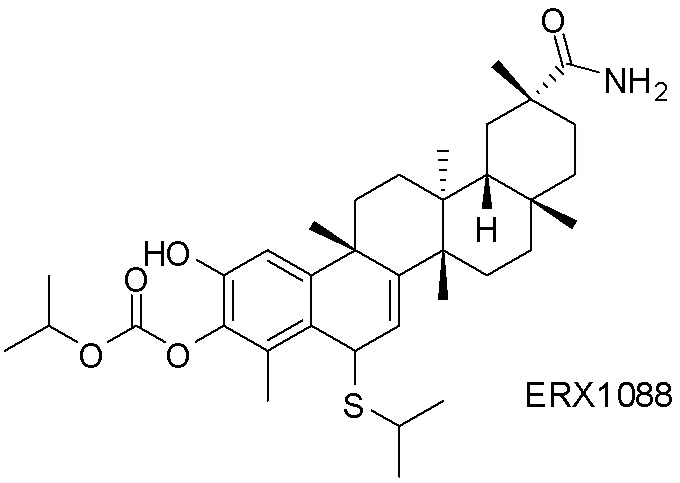
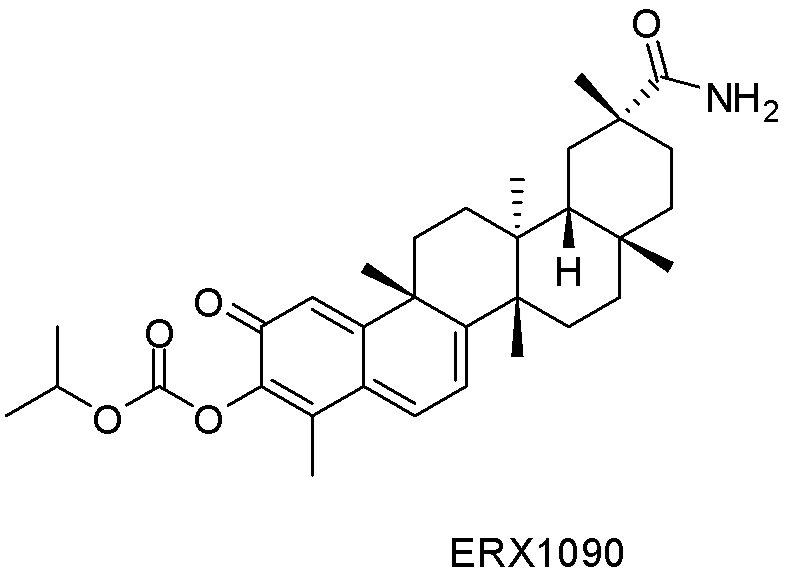
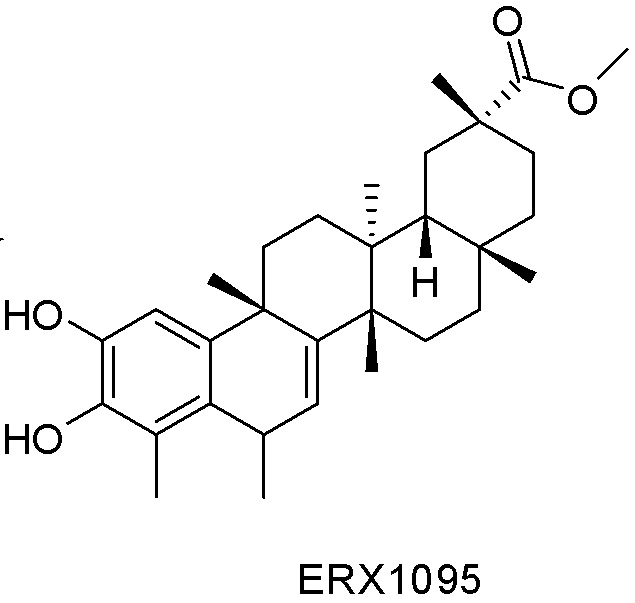
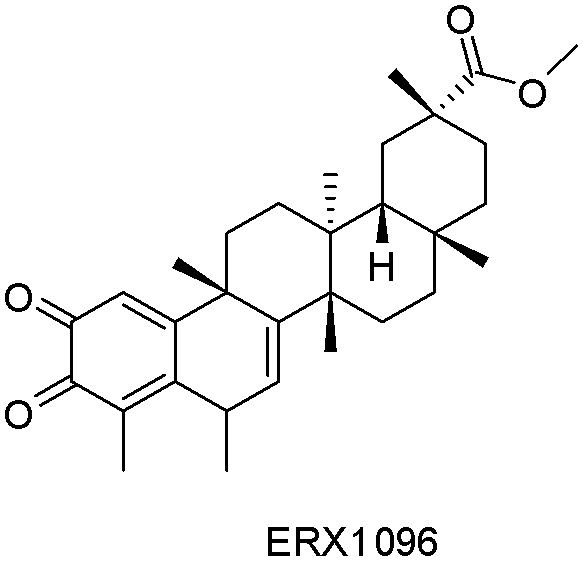
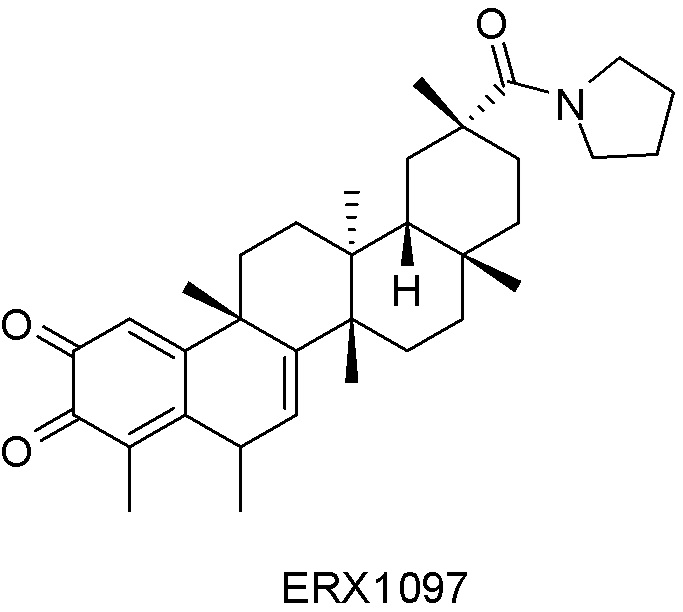
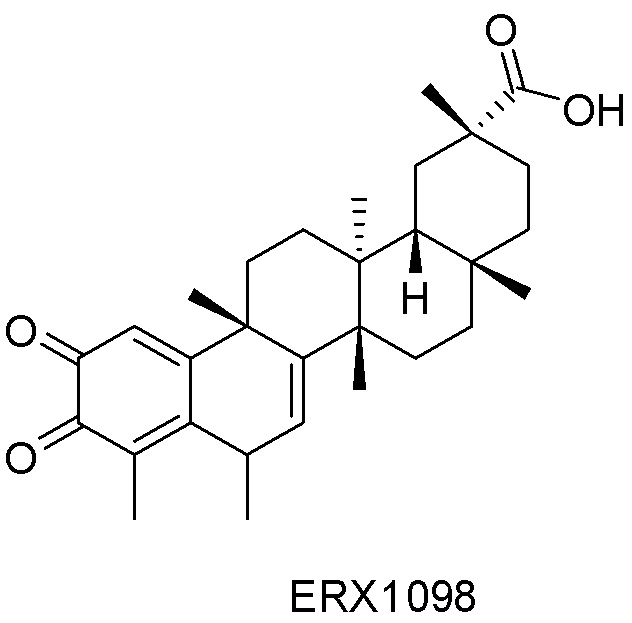
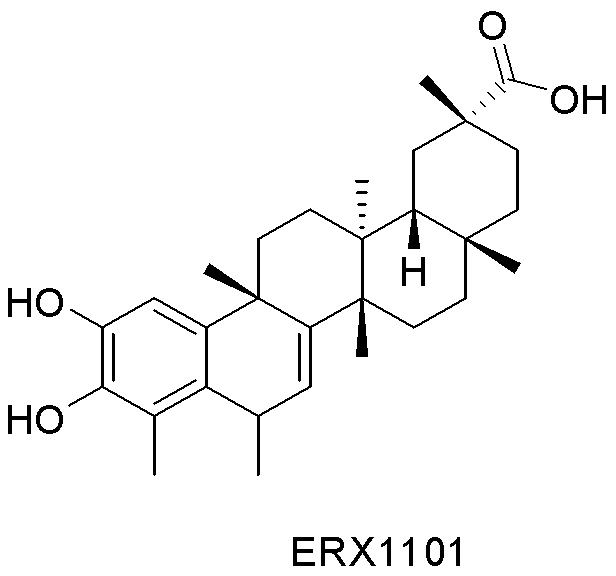
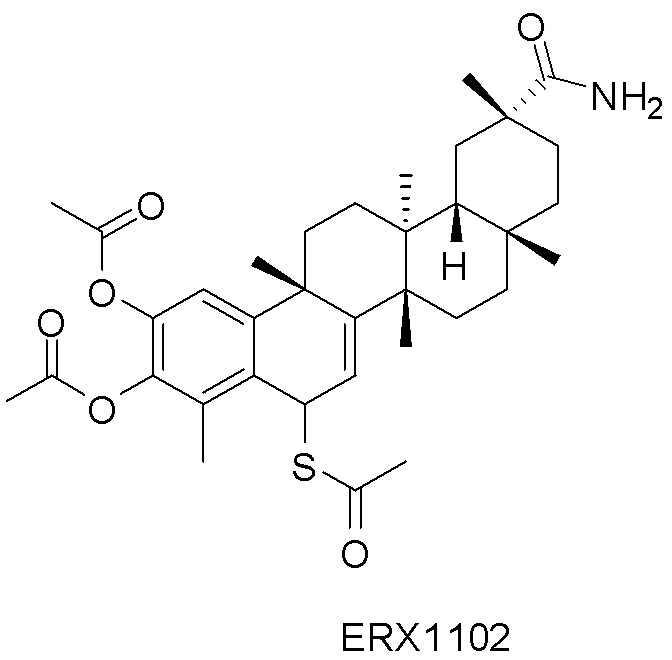
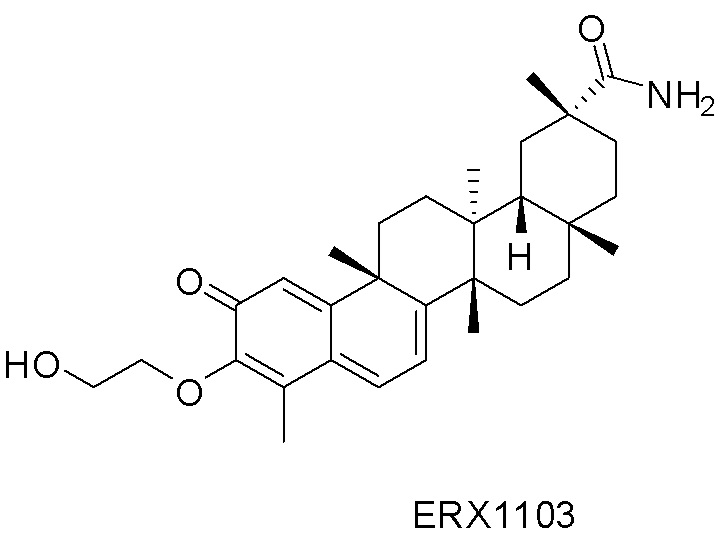
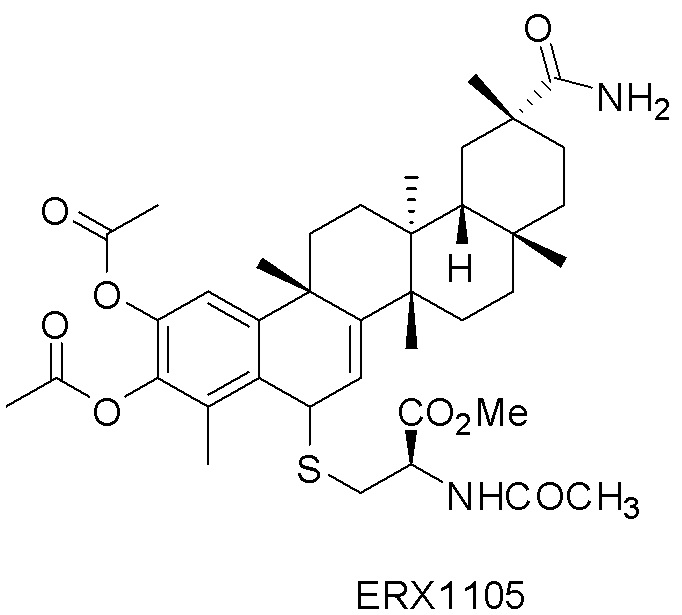
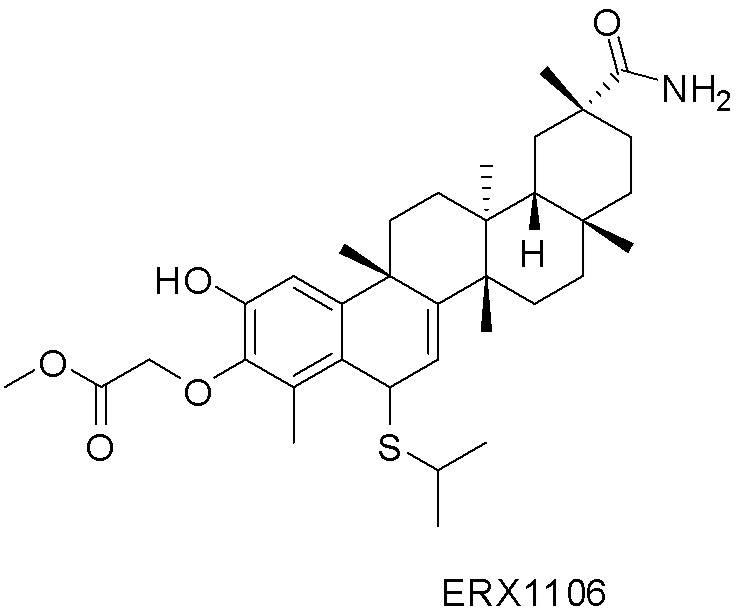
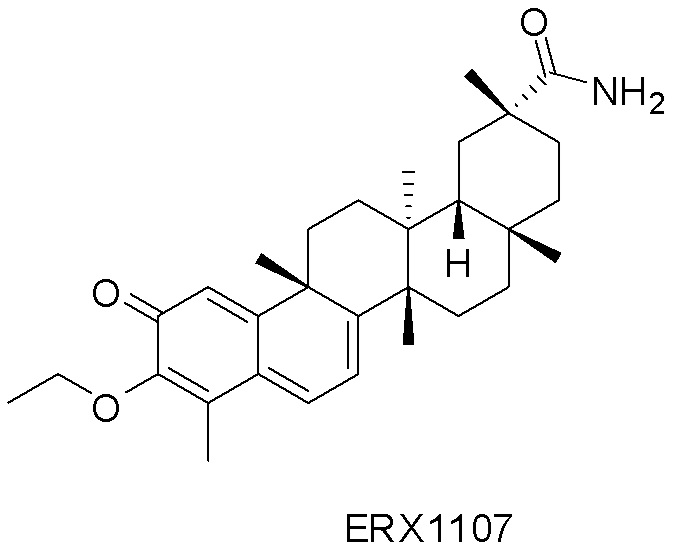
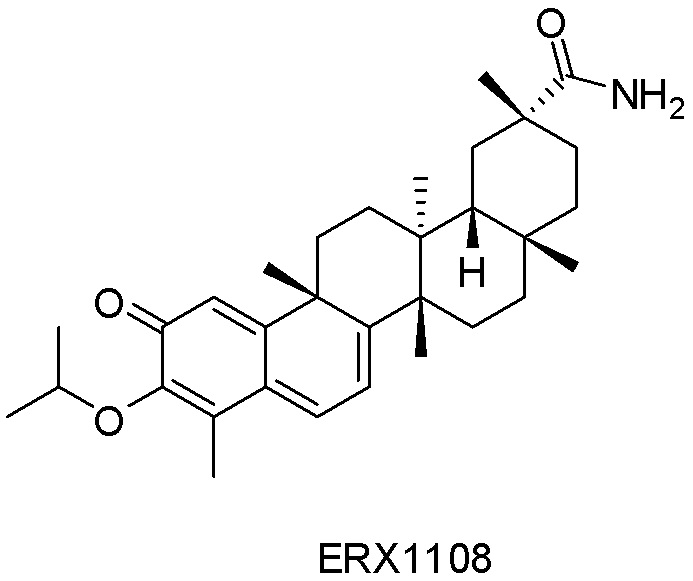
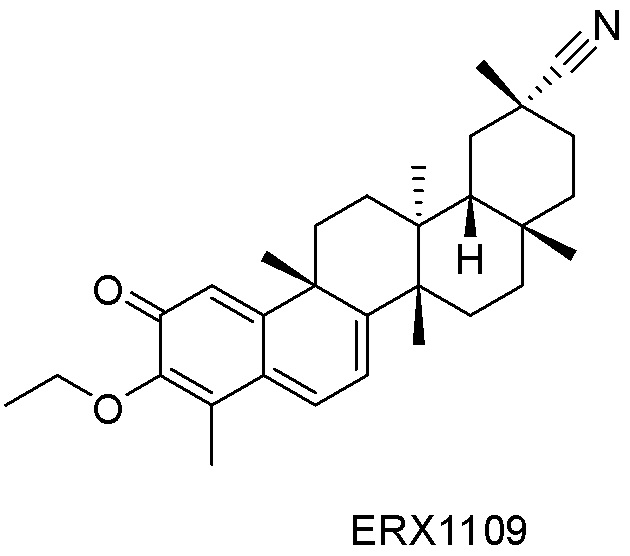
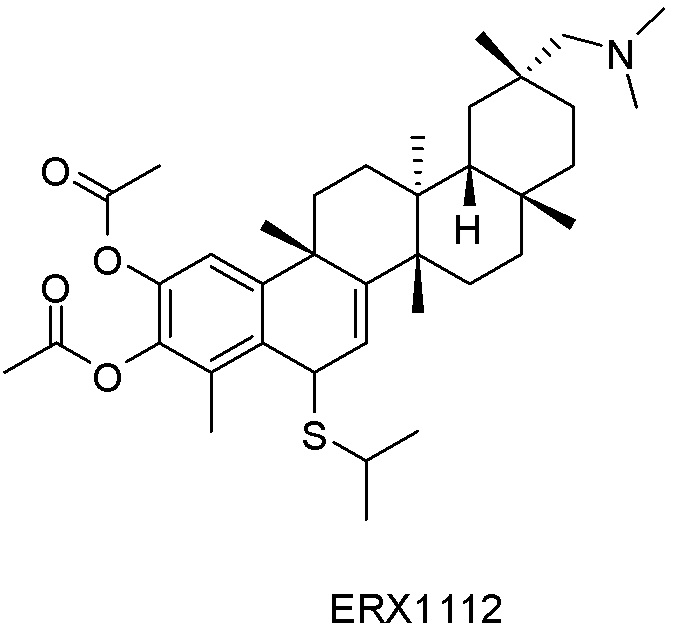
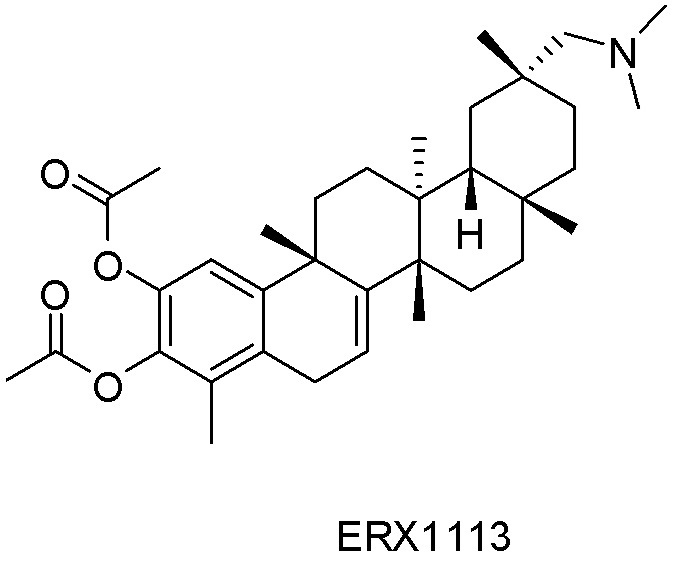

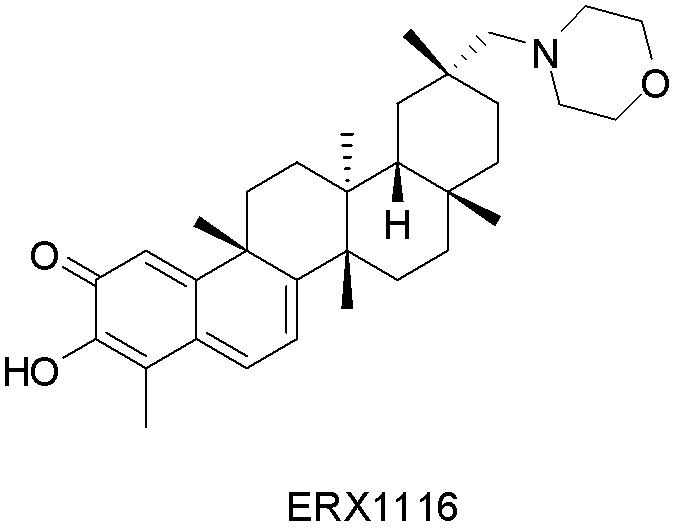
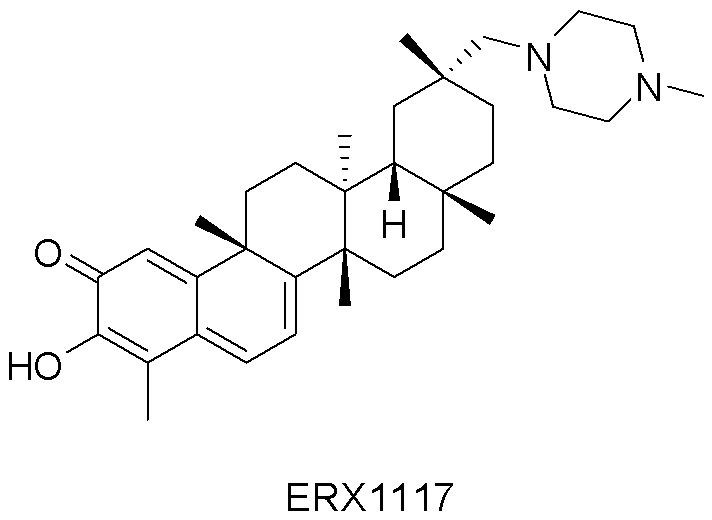
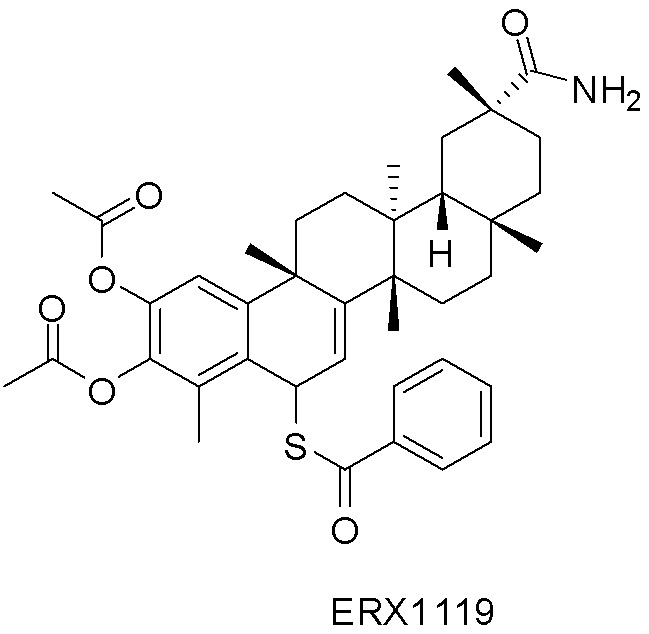
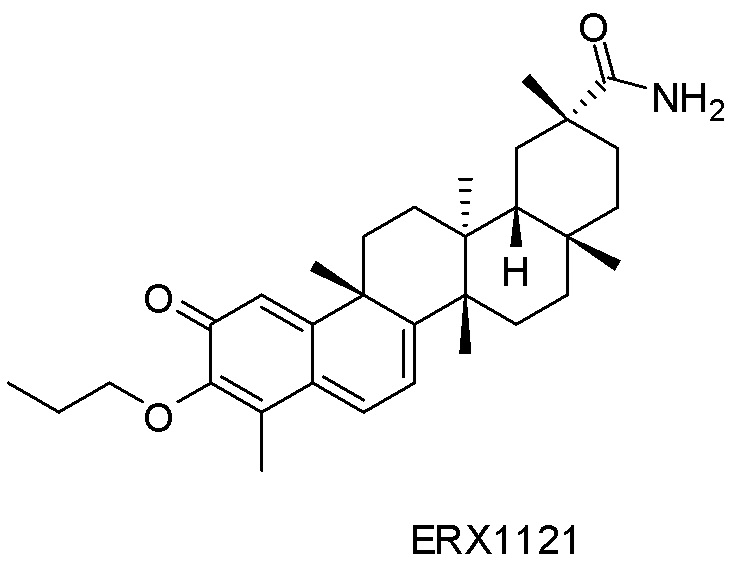
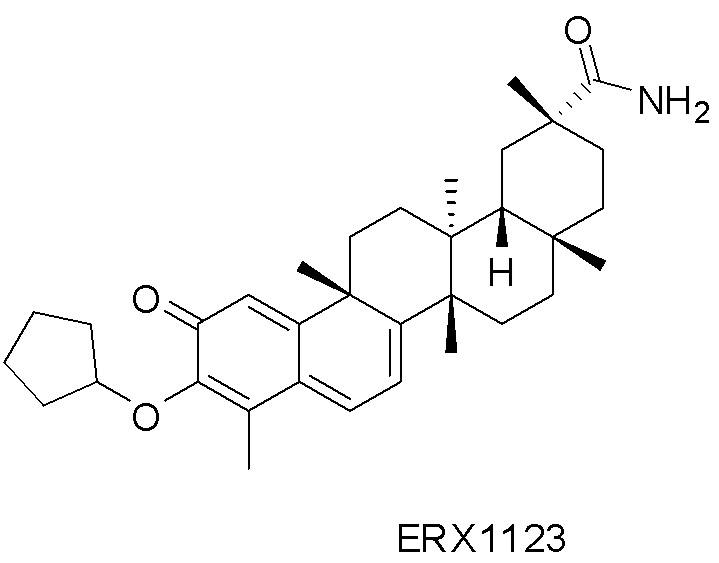
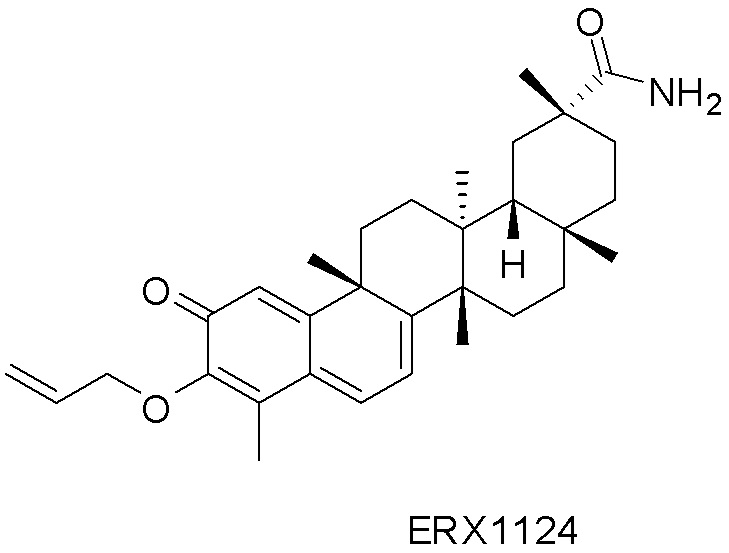
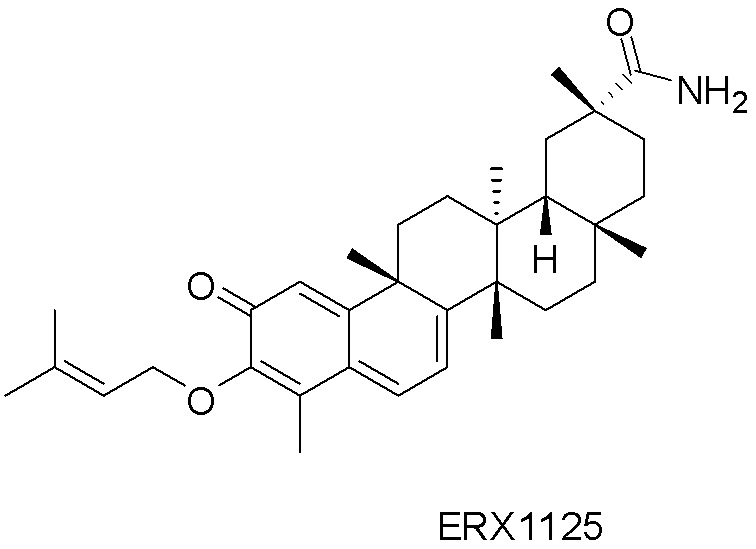
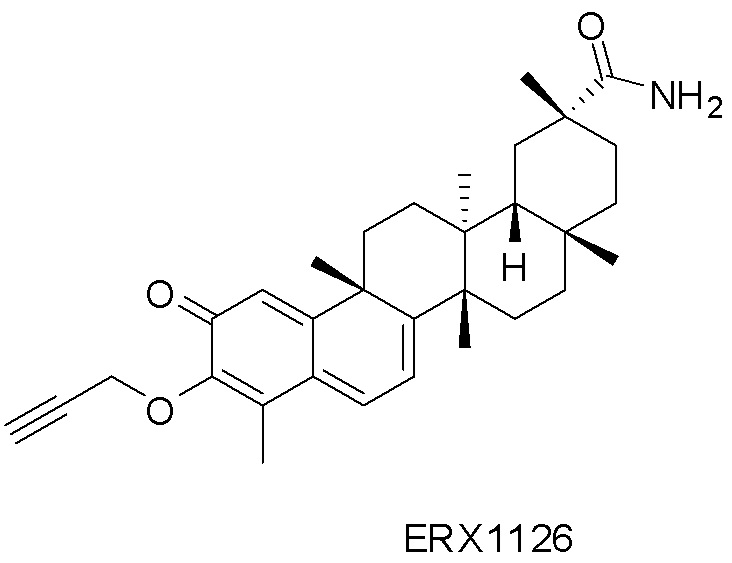
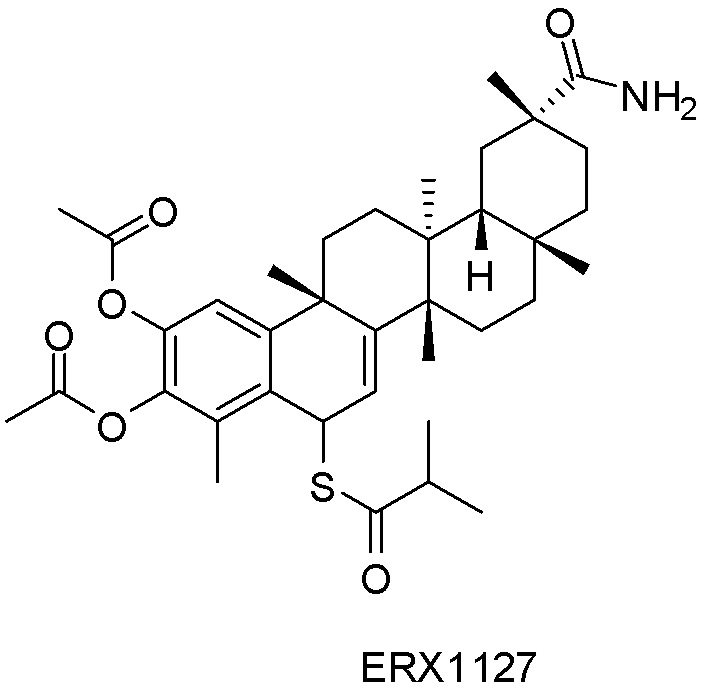
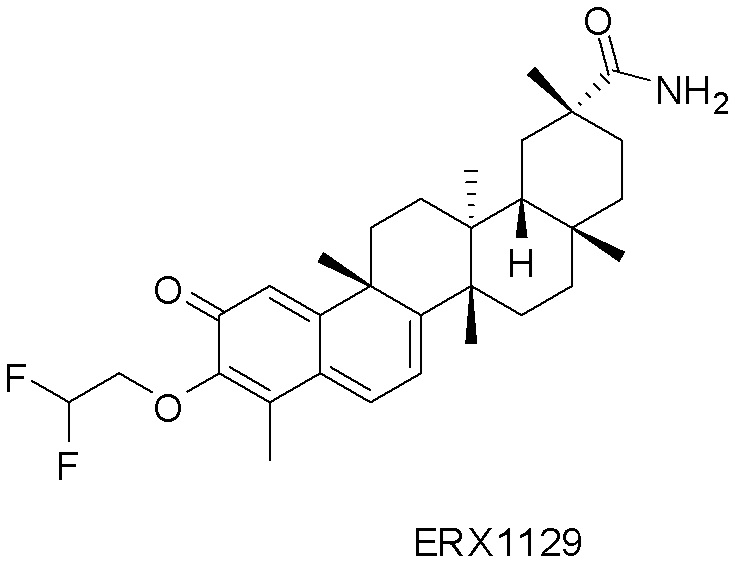
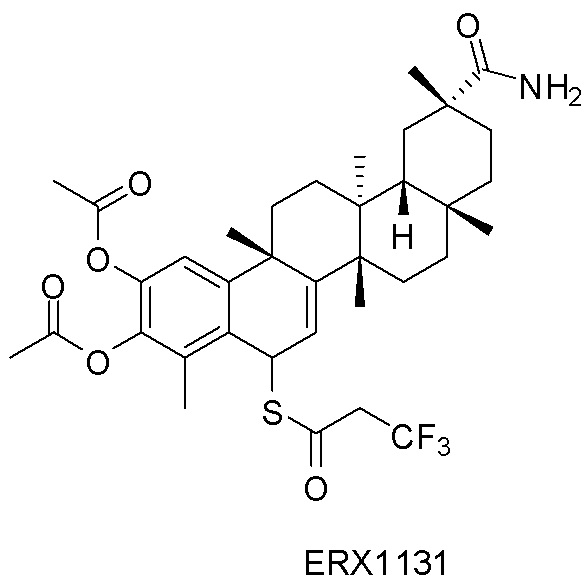
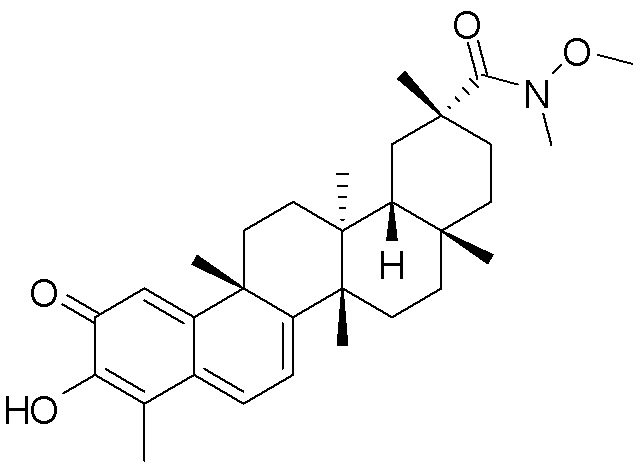
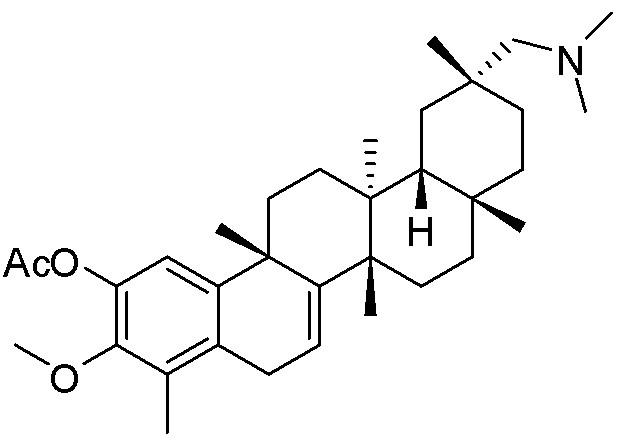

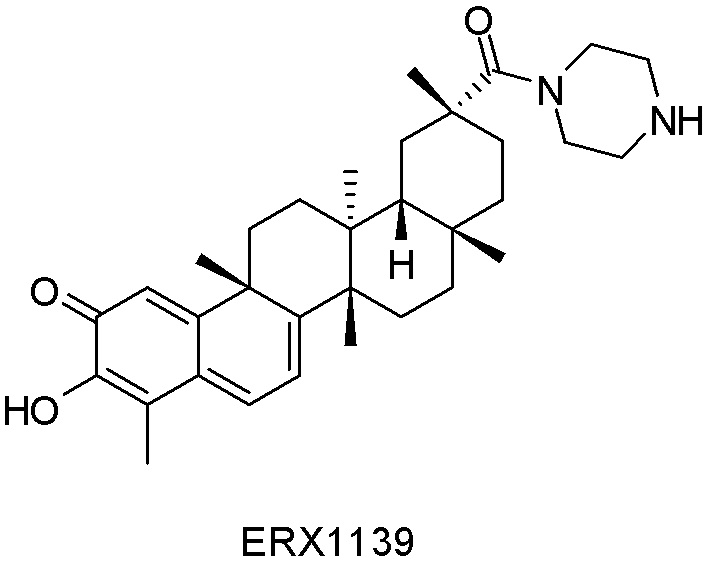
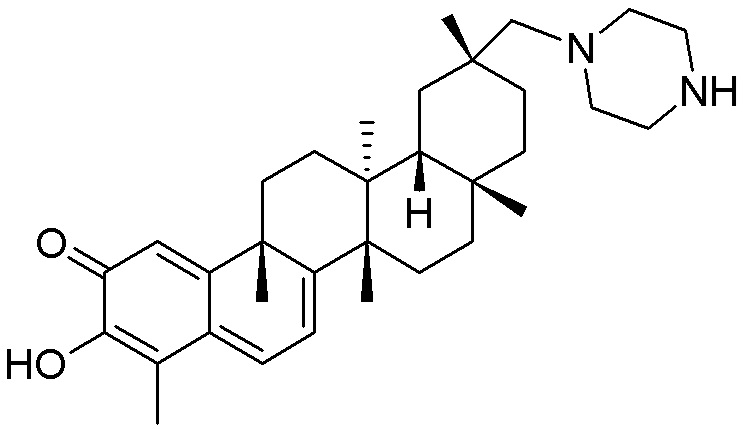
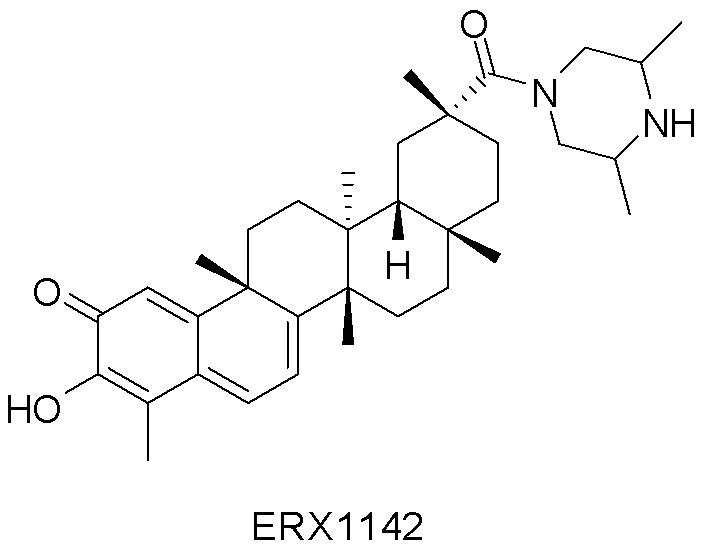
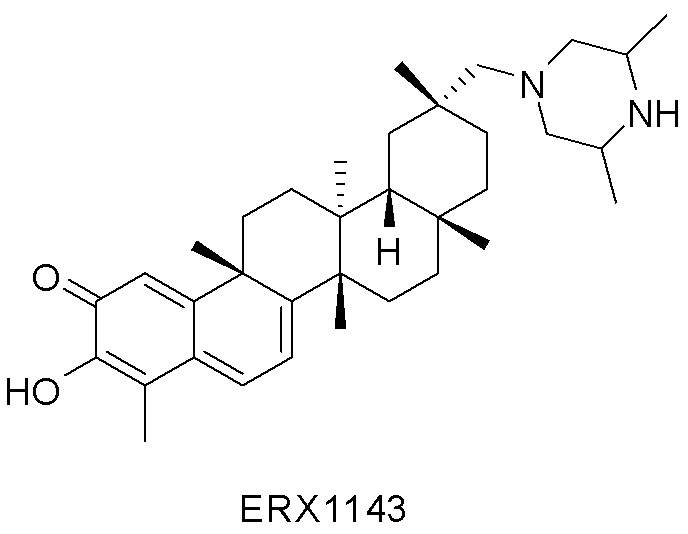
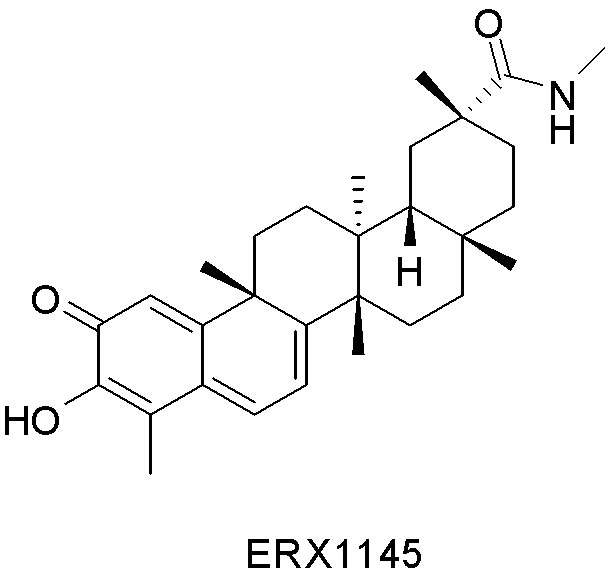
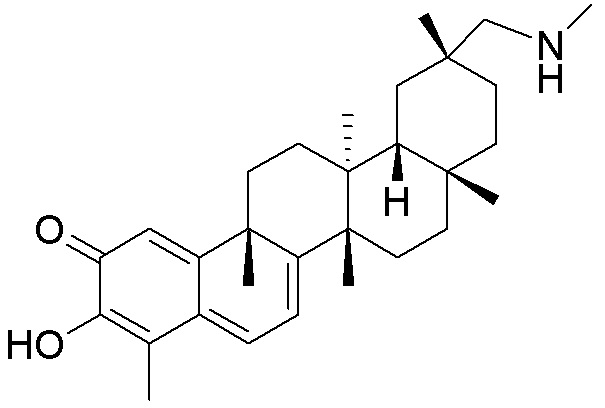
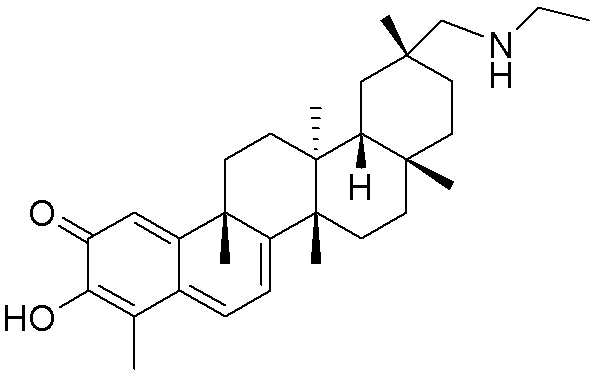
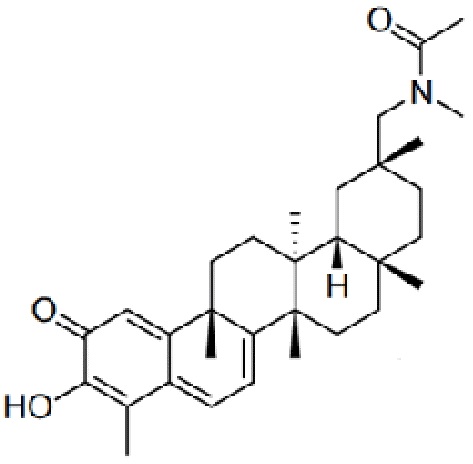
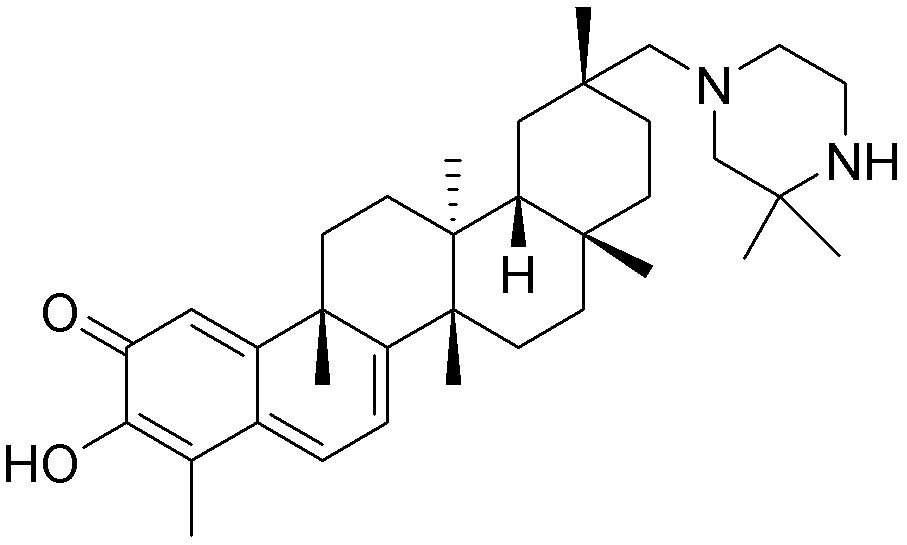
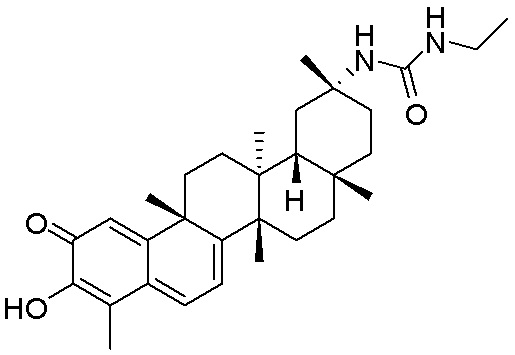
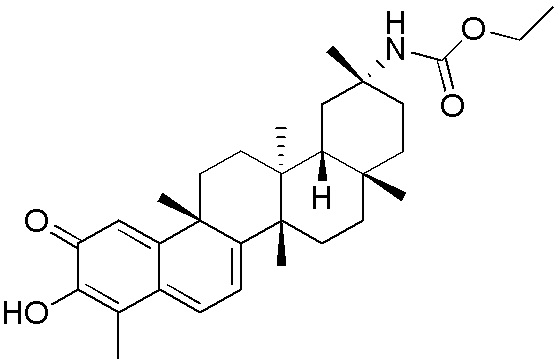
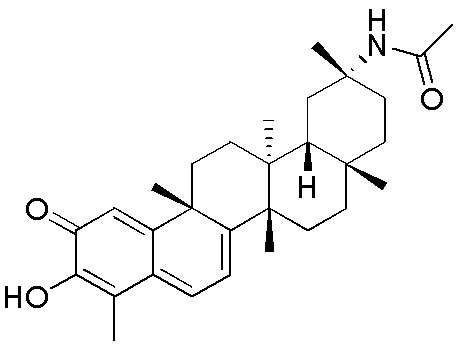
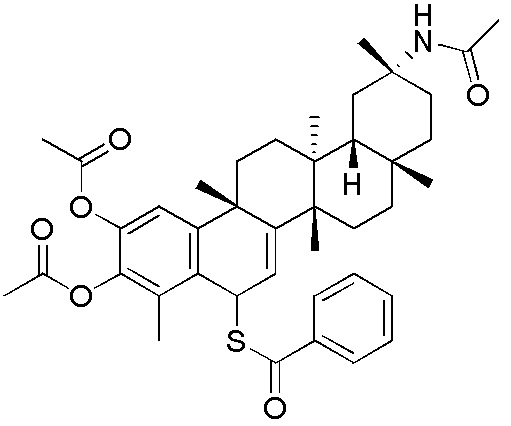
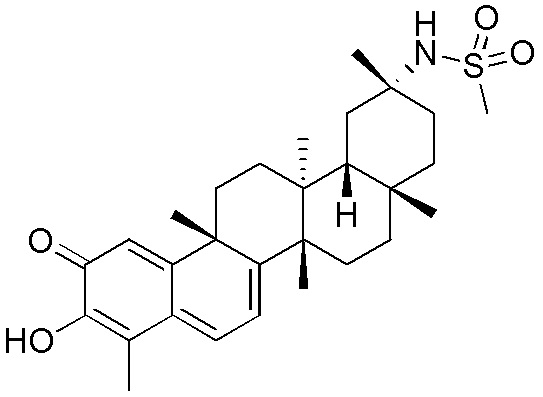
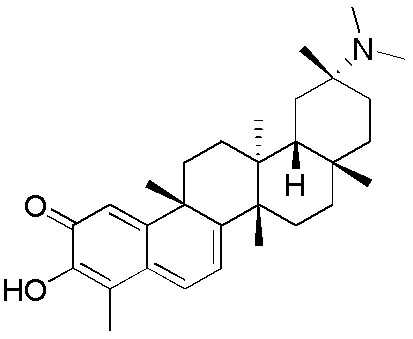
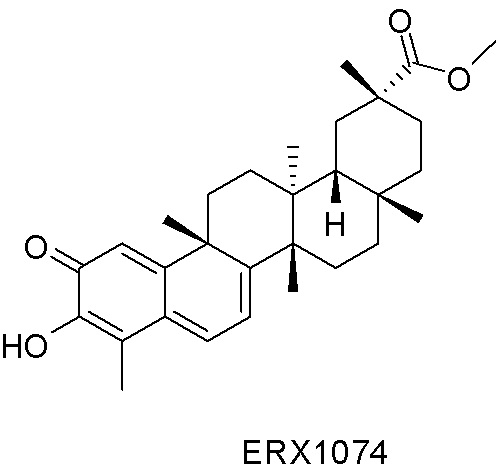
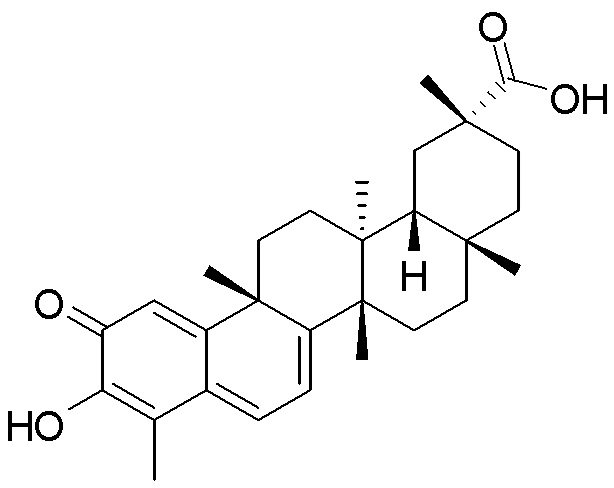
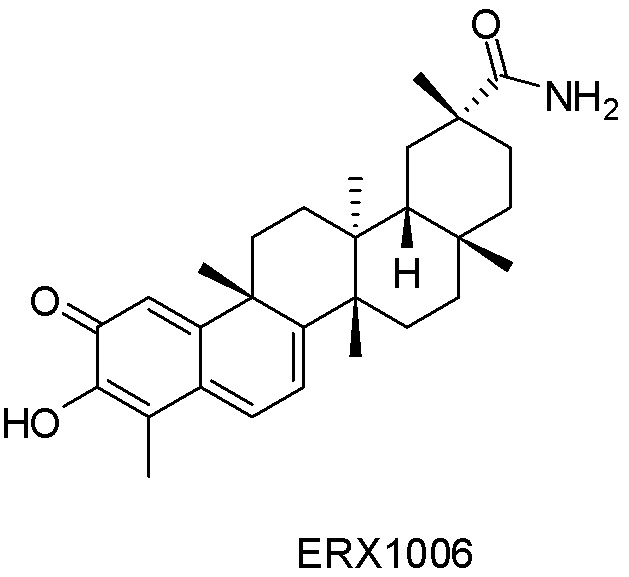
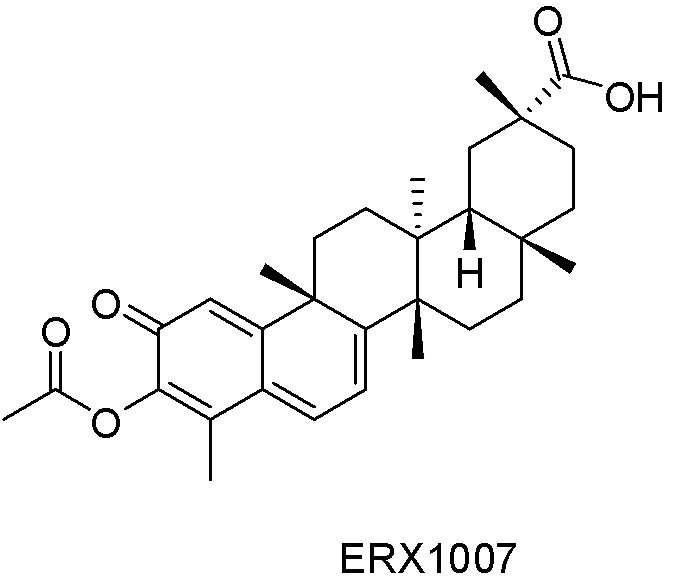
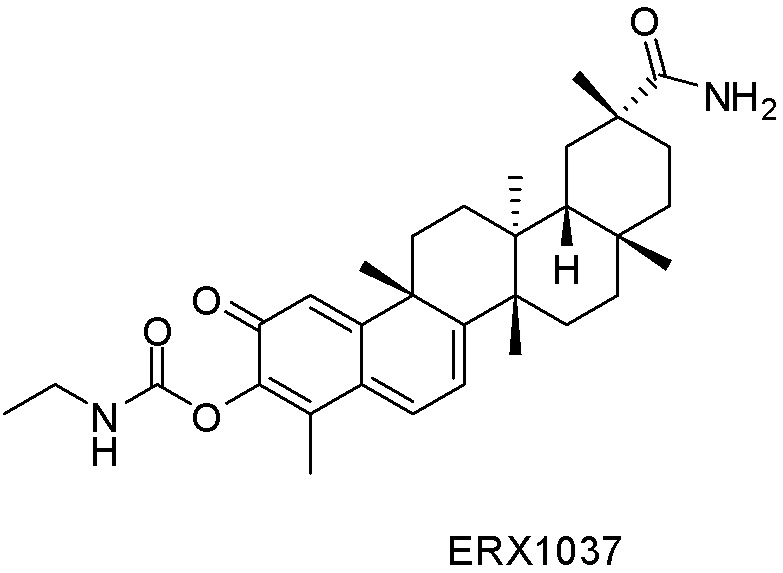
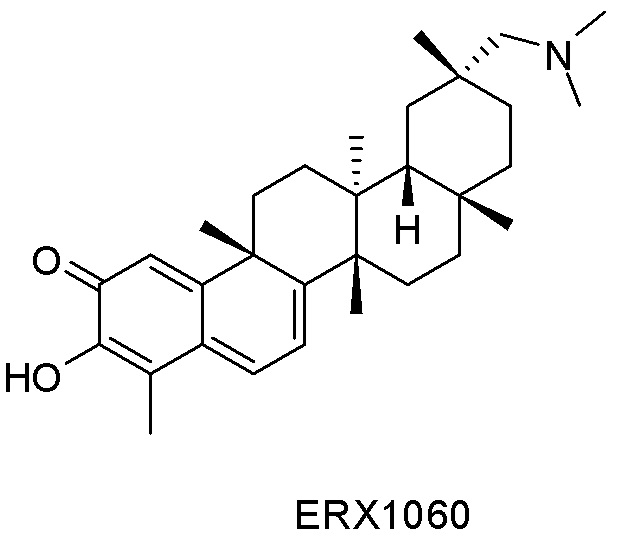
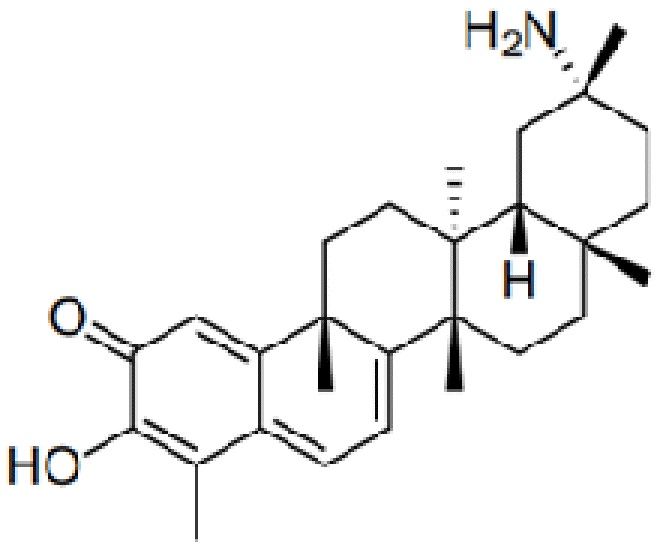
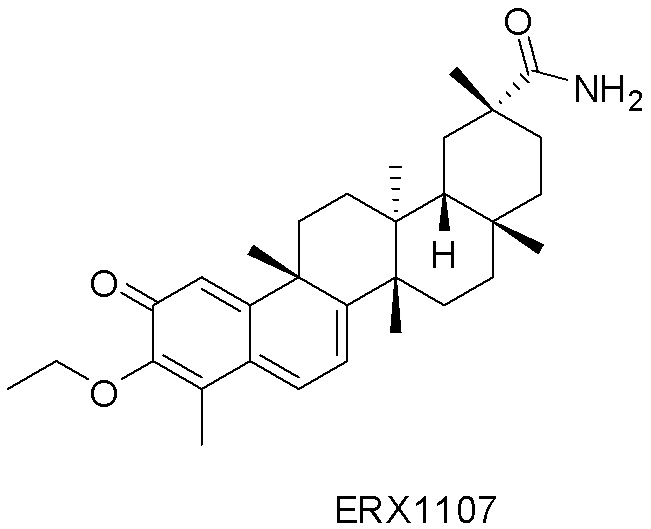
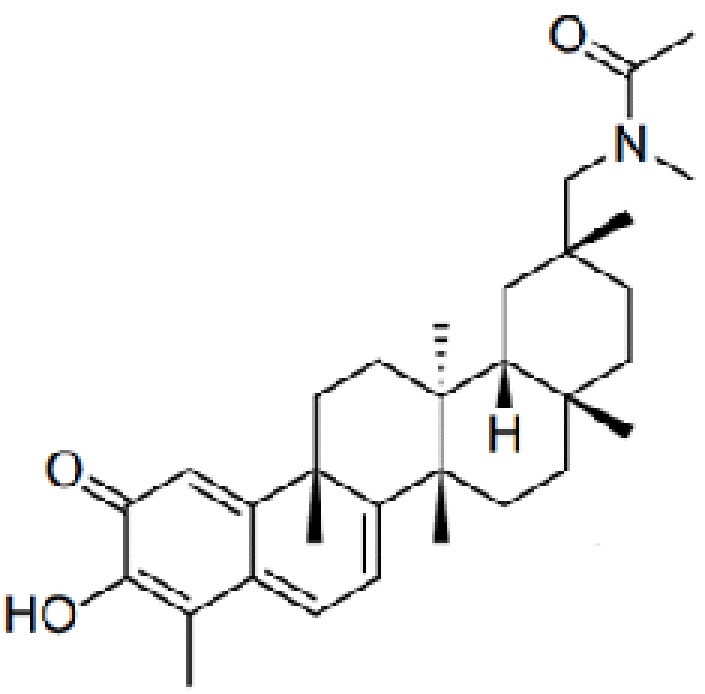
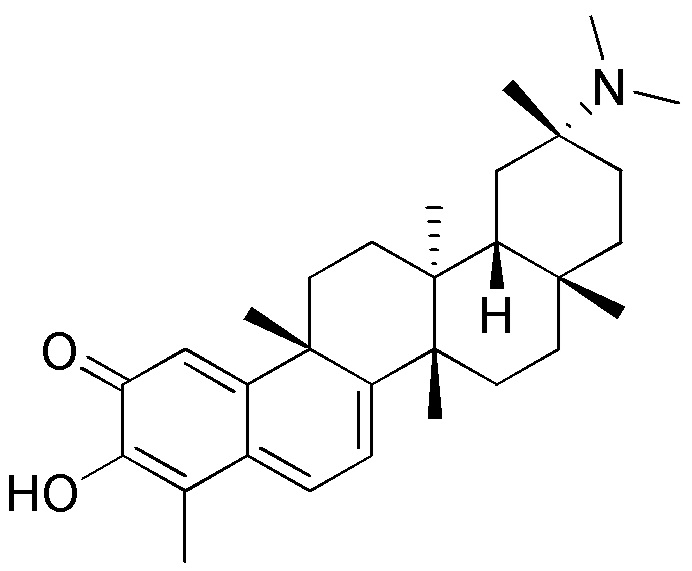
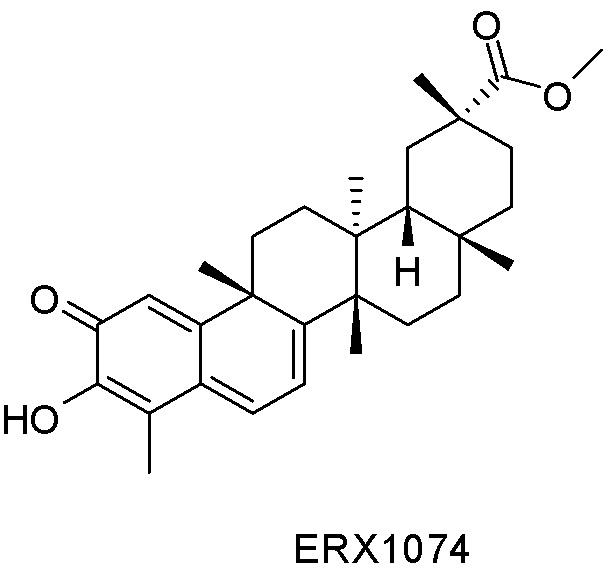

Комментарии