Нейроактивные стероиды, их композиции и применение - RU2696585C2
Код документа: RU2696585C2
Описание
РОДСТВЕННЫЕ ЗАЯВКИ
[1] Настоящая заявка испрашивает приоритет согласно 35 U.S.C. § 119(e) на основании предварительных заявок на патенты США: № 61/869440, поданной 23 августа 2013 г., № 61/869446, поданной 23 августа 2013 г. и № 62/014018, поданной 18 июня 2014 г., каждая из которых включена в настоящую заявку посредством ссылки.
Уровень техники
[2] Возбудимость мозга, которую определяют как уровень возбуждения животного в непрерывном диапазоне от комы до судорог, регулируется различными нейромедиаторами. В целом нейромедиаторы отвечают за регуляцию проводимости ионов через мембраны нейронов. В состоянии покоя мембрана нейрона обладает потенциалом (или мембранным напряжением) приблизительно -70 мВ, при этом содержимое клетки является отрицательным по отношению к окружению клетки. Потенциал (напряжение) является результатом равновесия ионов (K+, Na+, Cl-, органических анионов) в полупроницаемой мембране нейрона. Нейромедиаторы находятся в пресинаптических пузырьках и высвобождаются под влиянием нейрональных потенциалов действия. При попадании в синаптическую щель, химический медиатор раздражения, такой как ацетилхолин, будет вызывать деполяризацию мембраны, например, изменение потенциала от -70 мВ до -50 мВ. Этот эффект опосредован постсинаптическими никотиновыми рецепторами, которые стимулируются ацетилхолином, чтобы увеличить проницаемость мембраны для ионов Na+. Пониженный мембранный потенциал стимулирует нейронное возбуждение в форме постсинаптического потенциала действия.
[3] В случае ГАМК-рецепторного комплекса (ГРК) эффект возбудимости головного мозга опосредован нейромедиатором ГАМК. ГАМК имеет сильное влияние на общую возбудимость головного мозга, так как до 40% нейронов в головном мозге используют ГАМК как нейромедиатор. ГАМК регулирует возбудимость отдельных нейронов посредством регулирования проводимости хлорид-ионов через мембрану нейронов. ГАМК взаимодействует со своим сайтом узнавания на ГРК для облегчения потока хлорид-ионов по направлению электрохимического градиента ГРК в клетку. Внутриклеточное увеличение уровней данного аниона вызывает гиперполяризацию трансмембранного потенциала, делая нейрон менее чувствительным к возбуждающим сигналам, т.е. вызывает пониженную возбудимость нейронов. Другими словами, чем выше концентрация хлорид-ионов в нейроне, тем ниже возбудимость головного мозга и уровень возбуждения.
[4] Документально подтверждено, что ГРК отвечает за опосредование тревоги, судорожной активности и седации. Таким образом, ГАМК и лекарственные средства, которые действуют как ГАМК или способствуют действию ГАМК (например, терапевтически полезные барбитураты и бензодиазепины (BZs), такие как Валиум®), оказывают свое терапевтически полезное действие при взаимодействии со специфическими регуляторными сайтами на ГРК. Собранные в настоящий момент данные показывают, что в дополнение к сайтам связывания бензодиазепинов и барбитуратов, ГРК содержит отдельный сайт для нейроактивных стероидов. См., например, Lan, N. C. et al., Neurochem. Res. (1991) 16:347-356.
[5] Нейроактивные стероиды могут возникать эндогенным способом. Наиболее активные эндогенные нейроактивные стероиды представляют собой 3α-21-гидрокси-5-восстановленный прегнан-20-он и 3α-21-дигидрокси-5-восстановленный прегнан-20-он, метаболиты гормональных стероидов прогестерона и дезоксикортикостерона, соответственно. Способность этих стероидных метаболитов изменять возбудимость мозга была признана в 1986 (Majewska, M. D. et al., Science 232:1004-1007 (1986); Harrison, N.L. et al., J Pharmacol. Exp. Ther. 241:346-353 (1987)).
[6] Было продемонстрировано, что гормон яичников прогестерон и его метаболиты оказывают сильное влияние на возбудимость головного мозга (Backstrom, T. et al., Acta bstet. Gynecol. Scand. Suppl. 130:19-24 (1985); Pfaff, D.W and McEwen, B. S., Science 219:808-814 (1983); Gyermek et al., J Med Chem. 11: 117 (1968); Lambert, J. et al., Trends Pharmacol. Sci. 8:224-227 (1987)). Уровни прогестерона и его метаболитов изменяются в зависимости от фазы менструального цикла. Документально подтверждено, что уровни прогестерона и его метаболитов снижаются перед началом менструаций. Ежемесячное повторение определенных физических симптомов перед началом менструации также документально подтверждено. Эти симптомы, которые стали ассоциироваться с предменструальным синдромом (ПМС), включают стресс, тревогу и мигренозные головные боли (Dalton, K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)). У субъектов с ПМС случается ежемесячный рецидив симптомов, которые присутствуют перед менструацией и отсутствуют после менструации.
[7] Аналогичным образом, снижение прогестерона также временно коррелирует с повышением частоты припадков у женщин-эпилептиков, т.е. катамениальной эпилепсией (Laidlaw, J., Lancet, 1235-1237 (1956)). Более прямая корреляция была отмечена в отношении уменьшения метаболитов прогестерона (Rosciszewska et al., J. Neurol. Neurosurg. Psych. 49:47-51 (1986)). Кроме того, для субъектов с первичной генерализованной абсансной эпилепсией временная частота припадков коррелировала с частотой симптомов предменструального синдрома (Backstrom, T. et al., J. Psychosom. bstet. Gynaecol. 2:8-20 (1983)). Стероид дезоксикортикостерон был признан эффективным для лечения больных с эпилептическими приступами, коррелирующими с менструальным циклом (Aird, R.B. and Gordan, G., J. Amer. Med. Soc. 145:715-719 (1951)).
[8] Синдромом, также связанным с низкими уровнями прогестерона, является послеродовая депрессия (ПРД). Сразу после родов уровни прогестерона резко падают, приводя к возникновению ПРД. Симптомы ПРД варьируются от легкой депрессии до психоза, требующего госпитализации. ПРД также связано с тяжелой тревогой и раздражительностью. ПРД-ассоциированная депрессия не поддается лечению классическими антидепрессантами, и у женщин, испытывающих ПРД, чаще возникает ПМС (Dalton, K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)).
[9] В совокупности данные наблюдения подразумевают существенную роль прогестерона и дезоксикортикостерона и, более конкретно, их метаболитов в гомеостатической регуляции возбудимости головного мозга, что проявляется в увеличении судорожной активности или симптомов, ассоциированных с катамениальной эпилепсией, ПМС и ПРД. Корреляция между пониженными уровнями прогестерона и симптомами, ассоциированными с ПМС, ПРД и катамениальной эпилепсией, (Backstrom, T. et al., J Psychosom.Obstet. Gynaecol. 2:8-20 (1983)); Dalton, K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)) послужила причиной применения прогестерона в их лечении (Mattson et al., “Medroxyprogesterone therapy of catamenial epilepsy,” in Advances in Epileptology: XVth Epilepsy International Symposium, Raven Press, New York (1984), pp. 279-282 и Dalton, K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)). Однако прогестерон не всегда эффективен в лечении вышеупомянутых синдромов. Например, для прогестерона не существует взаимоотношения доза-ответ в лечении ПМС (Maddocks et al., Obstet. Gynecol. 154:573-581 (1986); Dennerstein et al., Brit. Med J 290:16-17 (1986)).
[10] Необходимы новые и улучшенные нейроактивные стероиды, которые действуют как агенты, модулирующие возбудимость головного мозга, а также как агенты для предотвращения и лечения заболеваний, связанных с ЦНС. Соединения, композиции и способы, описанные в настоящем документе, предназначены для этой цели.
Краткое описание изобретения
[11] В настоящем документе предложены C21-замещенные нейроактивные стероиды, созданные, например, чтобы действовать в качестве модуляторов ГАМК. В некоторых вариантах реализации предполагают, что такие соединения подходят в качестве терапевтических агентов для индуцирования анестезии и/или седации у субъекта. В некоторых вариантах реализации предполагают, что такие соединения подходят в качестве терапевтических агентов для лечения расстройства, связанного с ЦНС (например, расстройства сна, расстройства настроения, расстройства шизофренического спектра, судорожного расстройства, расстройства памяти и/или познавательной деятельности, расстройства движения, расстройства личности, расстройства аутистического спектра, боли, травматического повреждения головного мозга, заболевания сосудов, расстройства, связанного со злоупотреблением психоактивными веществами и/или абстинентного синдрома, или тиннитуса) у нуждающегося в этом субъекта, (например, субъекта с синдромом Ретта, синдромом ломкой Х-хромосомы или синдромом Ангельмана).
[12] В одном аспекте предложено соединение формулы (I):
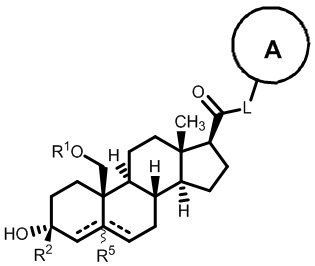
его фармацевтически приемлемая соль, где: A представляет собой необязательно замещенный азотсодержащий гетероарил или гетероциклил; L представляет собой -C(R3)(R3)-, -O-, -S- или -NR3-; R1 представляет собой водород или C1-C6 алкил, C1-C6 алкенил, C1-C6 алкинил, карбоциклил или гетероциклил; R2 представляет собой водород, C1-C6 алкил (например, C1-C6 галогеналкил) или C1-C6 алкокси; каждый R3 представляет собой независимо водород или C1-C6 алкил; R5 отсутствует или представляет собой водород; и




[13] В настоящем изобретении также предложены фармацевтические композиции, содержащие соединение согласно настоящему изобретению, и способы применения и лечения, например, такие как для индукции седации и/или анестезии для лечения расстройства, связанного с ЦНС.
[14] Стероиды формулы (I), их подкласс и их фармацевтически приемлемые соли вместе называются в настоящем документе как «соединения согласно настоящему изобретению».
[15] В другом аспекте предложена фармацевтическая композиция, содержащая соединение согласно настоящему изобретению и фармацевтически приемлемое вспомогательное вещество. В некоторых вариантах реализации соединение согласно настоящему изобретению предложено в эффективном количестве в фармацевтической композиции. В некоторых вариантах реализации соединение согласно настоящему изобретению предложено в терапевтически эффективном количестве. В некоторых вариантах реализации соединение согласно настоящему изобретению предложено в профилактически эффективном количестве.
[16] Соединения согласно настоящему изобретению, как описано в настоящем документе, действуют в некоторых вариантах реализации как модуляторы ГАМК, например, оказывая влияние на рецептор ГАМКА как положительным, так и отрицательным образом. Как модуляторы возбудимости центральной нервной системы (ЦНС), что опосредовано их способностью модулировать рецептор ГАМКA, ожидают, что такие соединения имеют активность в отношении ЦНС.
[17] Таким образом, в другом аспекте предложены способы лечения расстройства, связанного с ЦНС, у субъекта, которому это необходимо, включающие введение субъекту эффективного количества соединения согласно настоящему изобретению. В некоторых вариантах реализации расстройство, связанное с ЦНС, выбрано из группы, состоящей из расстройства сна, расстройства настроения, расстройства шизофренического спектра, судорожного расстройства, расстройства памяти и/или познавательной деятельности, расстройства движения, расстройства личности, расстройства аутистического спектра, боли, травматического повреждения головного мозга, заболевания сосудов, расстройства, связанного со злоупотреблением психоактивными веществами и/или абстинентного синдрома и тиннитуса. В некоторых вариантах реализации соединение вводят перорально, подкожно, внутривенно или внутримышечно. В некоторых вариантах реализации соединение вводят постоянно. В некоторых вариантах реализации соединение вводят в течение длительного времени, например, посредством длительной внутривенной инфузии.
[18] Другие цели и преимущества станут очевидны специалистам в данной области из рассмотрения последующего подробного описания, примеров и формулы изобретения.
Определения
Химические определения
[19] Определения специфических функциональных групп и химические термины более подробно описаны ниже. Химические элементы идентифицированы в соответствии с Периодической таблицей элементов, версия CAS, Handbook of Chemistry and Physics, 75th Ed., внутренняя обложка, а также специфические функциональные группы в целом определены как описано в настоящем документе. Кроме того, общие принципы органической химии, а также специфические функциональные фрагменты и реакционная способность описаны в Thomas Sorrell, Organic Chemistry, University Science Books, Sausalito, 1999; Smith and March, March’s Advanced rganic Chemistry, 5th Edition, John Wiley & Sons, Inc., New York, 2001; Larock, Comprehensive rganic Transformations, VCH Publishers, Inc., New York, 1989; и Carruthers, Some Modern Methods of organic Synthesis, 3rd Edition, Cambridge University Press, Cambridge, 1987.
[20] Соединения, описанные в настоящем документе, могут содержать один или более асимметрических центров, и, таким образом, могут существовать в различных изомерных формах, например, энантиомеров и/или диастереомеров. Например, соединения, описанные в настоящем документе, могут существовать в форме индивидуального энантиомера, диастереомера или геометрического изомера, или могут существовать в форме смеси стереоизомеров, включая рацемические смеси и смеси, обогащенные одним или несколькими стереоизомерами. Изомеры можно выделить из смесей с помощью способов, известных специалистам в данной области, включая хиральную высокоэффективную жидкостную хроматографию (ВЭЖХ) и образование и кристаллизацию хиральных солей; или предпочтительные изомеры могут быть получены посредством асимметрического синтеза. См., например, Jacques et al., Enantiomers, Racemates and Resolutions (Wiley Interscience, New York, 1981); Wilen et al., Tetrahedron 33:2725 (1977); Eliel, Stereochemistry of Carbon Compounds (McGraw-Hill, NY, 1962); и Wilen, Tables of Resolving Agents and Optical Resolutions p. 268 (E.L. Eliel, Ed., Univ. f Notre Dame Press, Notre Dame, IN 1972). Кроме того, настоящее изобретение охватывает соединения, описанные в настоящем документе в форме индивидуальных изомеров, по существу свободных от других изомеров, и как вариант в форме смеси различных изомеров.
[21] В настоящем документе энантиомерно чистое соединение является по существу свободным от других энантиомеров или стереоизомеров соединения (т.е. энантиомерная чистота). Другими словами, «S» форма соединения по существу является свободной от «R» формы соединения, и является, таким образом, энантиомерно чистой от «R» формы. Термин «энантиомерно чистый» или «чистый энантиомер» указывает, что соединение содержит более чем 75% по массе, более чем 80% по массе, более чем 85% по массе, более чем 90% по массе, более чем 91% по массе, более чем 92% по массе, более чем 93% по массе, более чем 94% по массе, более чем 95% по массе, более чем 96% по массе, более чем 97% по массе, более чем 98% по массе, более чем 98,5% по массе, более чем 99% по массе, более чем 99,2% по массе, более чем 99,5% по массе, более чем 99,6% по массе, более чем 99,7% по массе, более чем 99,8% по массе или более чем 99,9% по массе энантиомера. В некоторых вариантах реализации массы взяты в пересчете на общую массу всех энантиомеров или стереоизомеров соединения.
[22] В композициях, предложенных в настоящем документе, энантиомерно чистое соединение может присутствовать с другими активными или неактивными ингредиентами. Например, фармацевтическая композиция, содержащая энантиомерно чистое R-соединение, может содержать, например, примерно 90% вспомогательного вещества и примерно 10% энантиомерно чистого R-соединения. В некоторых вариантах реализации энантиомерно чистое R-соединение в таких композициях может, например, содержать по меньшей мере примерно 95% по массе R-соединения и по большей мере примерно 5% по массе S-соединения от общей массы соединения. Например, фармацевтическая композиция, содержащая энантиомерно чистое S- соединение, может содержать, например, примерно 90% вспомогательного вещества и примерно 10% энантиомерно чистого S-соединения. В некоторых вариантах реализации энантиомерно чистое S-соединение в таких композициях может, например, содержать по меньшей мере примерно 95% по массе S-соединения и по большей мере примерно 5% по массе R-соединения от общей массы соединения. В некоторых вариантах реализации активный ингредиент может быть приготовлен с малым количеством или без вспомогательного вещества или носителя.
[23] Соединение, описанное в настоящем документе, также может содержать один или более изотопных заместителей. Например, H может находиться в любой изотопной форме, включая1H,2H (D или дейтерий) и3H (T или тритий); C может находиться в любой изотопной форме, включая12C,13C и14C; может находиться в любой изотопной форме, включая16O и18O; и подобные.
[24] Артикли единственного числа неопределенной формы в настоящем документе могут быть использованы для обозначения одного или более чем одного (т.е. по меньшей мере одного) грамматических объектов документа. В качестве примера «аналог» означает один или аналог более чем один аналог.
[25] В случае, когда перечислен диапазон значений, подразумевают, что он охватывает каждое значение и поддиапазон в пределах диапазона. Например «C1-6алкил» охватывает C1, C2, C3, C4, C5, C6, C1-6, C1-5, C1-4, C1-3, C1-2, C2-6, C2-5, C2-4, C2-3, C3-6, C3-5, C3-4, C4-6, C4-5 и C5-6алкил.
[26] Следующие термины имеют значения, представленные в настоящем документе ниже, и полезны для понимания описания и предполагаемого объема настоящего изобретения.
[27] «Алкил» относится к радикалу углеводородной группы с прямой или разветвленной насыщенной цепью, содержащей от 1 до 20 атомов углерода («C1-20 алкил»). В некоторых вариантах реализации алкильная группа содержит от 1 до 12 атомов углерода («C1-12 алкил»). В некоторых вариантах реализации алкильная группа содержит от 1 до 8 атомов углерода («C1-8 алкил»). В некоторых вариантах реализации алкильная группа содержит от 1 до 6 атомов углерода («C1-6 алкил», также называемая в настоящем документе как «низший алкил»). В некоторых вариантах реализации алкильная группа содержит от 1 до 5 атомов углерода («C1-5 алкил»). В некоторых вариантах реализации алкильная группа содержит от 1 до 4 атомов углерода («C1-4 алкил»). В некоторых вариантах реализации алкильная группа содержит от 1 до 3 атомов углерода («C1-3 алкил»). В некоторых вариантах реализации алкильная группа содержит от 1 до 2 атомов углерода («C1-2 алкил»). В некоторых вариантах реализации алкильная группа содержит 1 атом углерода («C1 алкил»). В некоторых вариантах реализации алкильная группа содержит от 2 до 6 атомов углерода («C2-6алкил»). Примеры C1-6 алкильных групп включают метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), трет-бутил (C4), втор-бутил (C4), изобутил (C4), н-пентил (C5), 3-пентанил (C5), амил (C5), неопентил (C5), 3-метил-2-бутанил (C5), третичный амил (C5) и н-гексил (C6). Дополнительные примеры алкильных групп включают н-гептил (C7), н-октил (C8) и подобные. Если не обозначено иное, каждый пример алкильной группы является независимо необязательно замещенным, т.е., незамещенным («незамещенный алкил») или замещенным («замещенный алкил») одним или более заместителями; например, к примеру от 1 до 5 заместителей, от 1 до 3 заместителей или 1 заместителем. В некоторых вариантах реализации алкильная группа представляет собой незамещенный C1-10 алкил (например, -CH3). В некоторых вариантах реализации алкильная группа представляет собой замещенный C1-10 алкил. Общие аббревиатуры алкила включают Me (-CH3), Et (-CH2CH3), iPr (-CH(CH3)2), nPr (-CH2CH2CH3), n-Bu (-CH2CH2CH2CH3) или i-Bu (-CH2CH(CH3)2).
[28] «Алкенил» относится к радикалу углеводородной группы с прямой или разветвленной цепью, содержащей от 2 до 20 атомов углерода, одну или более двойных связей углерод-углерод и не содержащей тройных связей («C2-20 алкенил»). В некоторых вариантах реализации алкенильная группа содержит от 2 до 10 атомов углерода («C2-10 алкенил»). В некоторых вариантах реализации алкенильная группа содержит от 2 до 8 атомов углерода («C2-8 алкенил»). В некоторых вариантах реализации алкенильная группа содержит от 2 до 6 атомов углерода («C2-6 алкенил»). В некоторых вариантах реализации алкенильная группа содержит от 2 до 5 атомов углерода («C2-5 алкенил»). В некоторых вариантах реализации алкенильная группа содержит от 2 до 4 атомов углерода («C2-4 алкенил»). В некоторых вариантах реализации алкенильная группа содержит от 2 до 3 атомов углерода («C2-3 алкенил»). В некоторых вариантах реализации алкенильная группа содержит 2 атома углерода («C2алкенил»). Одна или более двойных связей углерод-углерод могут быть внутренними (такими как в 2-бутениле) или терминальными (такими как в 1-бутениле). Примеры C2-4 алкенильных групп включают этенил (C2), 1-пропенил (C3), 2-пропенил (C3), 1-бутенил (C4), 2-бутенил (C4), бутадиенил (C4) и подобные. Примеры C2-6 алкенильных групп включают вышеуказанные C2-4 алкенильные группы, а также пентенил (C5), пентадиенил (C5), гексенил (C6) и подобные. Дополнительные примеры алкенила включают гептенил (C7), октенил (C8), октатриенил (C8) и подобные. Если не обозначено иное, каждый пример алкенильной группы является независимо необязательно замещенным, т.е., незамещенным («незамещенный алкенил») или замещенным («замещенный алкенил») одним или более заместителями, например, к примеру от 1 до 5 заместителей, от 1 до 3 заместителей или 1 заместителем. В некоторых вариантах реализации алкенильная группа представляет собой незамещенный C2-10 алкенил. В некоторых вариантах реализации алкенильная группа представляет собой замещенный C2-10 алкенил.
[29] «Алкинил» относится к радикалу углеводородной группы с прямой или разветвленной цепью, содержащей от 2 до 20 атомов углерода, одну или более тройных связей углерод-углерод и необязательно одну или более двойных связей («C2-20 алкинил»). В некоторых вариантах реализации алкинильная группа содержит от 2 до 10 атомов углерода («C2-10 алкинил»). В некоторых вариантах реализации алкинильная группа содержит от 2 до 8 атомов углерода («C2-8 алкинил»). В некоторых вариантах реализации алкинильная группа содержит от 2 до 6 атомов углерода («C2-6 алкинил»). В некоторых вариантах реализации алкинильная группа содержит от 2 до 5 атомов углерода («C2-5 алкинил»). В некоторых вариантах реализации алкинильная группа содержит от 2 до 4 атомов углерода («C2-4 алкинил»). В некоторых вариантах реализации алкинильная группа содержит от 2 до 3 атомов углерода («C2-3 алкинил»). В некоторых вариантах реализации алкинильная группа содержит 2 атома углерода («C2 алкинил»). Одна или более тройных связей углерод-углерод могут быть внутренними (такими как в 2-бутиниле) или терминальными (такими как в 1-бутиниле). Примеры C2-4 алкинильных групп включают, не ограничиваясь, этинил (C2), 1-пропинил (C3), 2-пропинил (C3), 1-бутинил (C4), 2-бутинил (C4) и подобные. Примеры C2-6 алкинильных групп включают вышеуказанные C2-4 алкинильные группы, а также пентинил (C5), гексинил (C6) и подобные. Дополнительные примеры алкинила включают гептинил (C7), октинил (C8) и подобные. Если не обозначено иное, каждый пример алкинильной группы является независимо необязательно замещенным, т.е. незамещенным («незамещенный алкинил») или замещенным («замещенный алкинил») одним или более заместителями; например, к примеру от 1 до 5 заместителей, от 1 до 3 заместителей или 1 заместителем. В некоторых вариантах реализации алкинильная группа представляет собой незамещенный C2-10 алкинил. В некоторых вариантах реализации алкинильная группа представляет собой замещенный C2-10алкинил.
[30] «Арил» относится к радикалу моноциклической или полициклической (например, бициклической или трициклической) 4n+2 ароматической кольцевой системы (например, содержащей 6, 10 или 14 π электронов, разделенных в циклической матрице), содержащей 6-14 кольцевых атомов углерода и ноль гетероатомов, находящихся в ароматической кольцевой системе («C6-14 арил»). В некоторых вариантах реализации арильная группа содержит шесть кольцевых атомов углерода («C6арил»; например, фенил). В некоторых вариантах реализации арильная группа содержит десять кольцевых атомов углерода («C10арил»; например, нафтил, такой как 1-нафтил и 2-нафтил). В некоторых вариантах реализации арильная группа содержит четырнадцать кольцевых атомов углерода («C14арил»; например, антрацил). «Арил» также включает кольцевые системы, в которых арильное кольцо, как определено выше, конденсировано с одной или более карбоциклильными или гетероциклильными группами, при этом радикал или точка присоединения находится на арильном кольце, и в таких случаях количество атомов углерода обозначает количество атомов углерода в арильной кольцевой системе. Арильные группы включают, но не ограничиваются ими, фенил, нафтил, инденил и тетрагидронафтил. Если не обозначено иное, каждый пример арильной группы является независимо необязательно замещенным, т.е., незамещенным («незамещенный арил») или замещенным («замещенный арил») одним или более заместителями. В некоторых вариантах реализации арильная группа представляет собой незамещенный C6-14 арил. В некоторых вариантах реализации арильная группа представляет собой замещенный C6-14 арил.
[31] В некоторых вариантах реализации арильная группа замещена одной или более группами, выбранными из галогена, C1-C8 алкила, C1-C8 галогеналкила, циано, гидрокси, C1-C8 алкокси и амино.
[32] Примеры типичных замещенных арилов включают следующие

где один из R56 и R57 может представлять собой водород и по меньшей мере один из R56и R57 каждый независимо выбран из C1-C8 алкила, C1-C8 галогеналкила, 4-10 членного гетероциклила, алканоила, C1-C8 алкокси, гетероарилокси, алкиламино, ариламино, гетероариламино, NR58COR59, NR58SOR59NR58SO2R59, COOалкила, COOарила, CONR58R59, CONR58OR59, NR58R59, SO2NR58R59, S-алкила, SOалкила, SO2алкила, Sарила, SOарила, SO2арила; или R56 и R57могут быть присоединены с образованием циклического кольца (насыщенного или ненасыщенного) из от 5 до 8 атомов, необязательно содержащих один или более гетероатомов, выбранных из групп N, или S. R60 и R61 представляют собой независимо водород, C1-C8 алкил, C1-C4галогеналкил, C3-C10 циклоалкил, 4-10 членный гетероциклил, C6-C10 арил, замещенный C6-C10 арил, 5-10 членный гетероарил или замещенный 5-10 членный гетероарил.
[33] Другие типичные арильные группы, содержащие конденсированную гетероциклильную группу, включают следующие:

где каждый W выбран из C(R66)2, NR66, и S; и каждый Y выбран из карбонила, NR66, и S; и R66 представляет собой независимо водород, C1-C8 алкил, C3-C10 циклоалкил, 4-10 членный гетероциклил, C6-C10 арил и 5-10 членный гетероарил.
[34] «Гало» или «галоген» независимо или как часть заместителя означает, если не указано иное, атом фтора (F), хлора (Cl), брома (Br) или йода (I). Термин «галид» самостоятельно или как часть другого заместителя относится к атому фтора, хлора, брома или йода. В некоторых вариантах реализации галогенная группа представляет собой или фтор или хлор.
[35] «Галогеналкил» и «галогеналкокси» может включать алкильные и алкокси структуры, которые замещены одной или более галогенными группами или их комбинацией. Например, термины «фторалкил» и «фторалкокси» включают галогеналкил и галогеналкокси группы, соответственно, в которых галоген представляет собой фтор.
[36] «Гетероарил» относится к радикалу 5-10 членной моноциклической или бициклической 4n+2 ароматической кольцевой системы (например, содержащей от 6 до 10 π электронов, разделенных в циклической матрице), содержащему кольцевые атомы углерода и 1-4 кольцевые гетероатомы, расположенные в ароматической кольцевой системе, при этом каждый гетероатом независимо выбран из азота, кислорода и серы («5-10 членный гетероарил»). В гетероарильных группах, которые содержат один или более атомов азота, точка присоединения может представлять собой атом углерода или азота, как позволяет валентность. Гетероарильные бициклические кольцевые системы могут содержать один или более гетероатомов в одном или обоих кольцах. «Гетероарил» содержит кольцевые системы, в которых гетероарильное кольцо, как определено выше, конденсировано с одной или более карбоциклильными или гетероциклильными группами, при этом точка присоединения находится в гетероарильном кольце, и в таких случаях количество членов кольца обозначает количество членов кольца в гетероарильной кольцевой системе. «Гетероарил» также включает кольцевые системы, в которых гетероарильное кольцо, как определено выше, конденсировано с одной или более арильными группами, при этом точка присоединения находится в арильном или гетероарильном кольце, и в таких случаях количество членов кольца обозначает количество членов кольца в конденсированной кольцевой системе (арил/гетероарил). В бициклических гетероарильных группах, в которых одно кольцо не содержит гетероатом (например, индолил, хинолинил, карбазолил и подобные), точка присоединения может быть на обоих кольцах, т.е. на кольце, несущем гетероатом (например, 2-индолил) или кольце, не содержащем гетероатом (например, 5-индолил).
[37] В некоторых вариантах реализации гетероарильная группа представляет собой 5-10 членную ароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевые гетероатомы, расположенные в ароматической кольцевой системе, при этом каждый гетероатом независимо выбран из азота, кислорода и серы («5-10 членный гетероарил»). В некоторых вариантах реализации гетероарильная группа представляет собой 5-8 членную ароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевые гетероатомы, расположенные в ароматической кольцевой системе, при этом каждый гетероатом независимо выбран из азота, кислорода и серы («5-8 членный гетероарил»). В некоторых вариантах реализации гетероарильная группа представляет собой 5-6 членную ароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевые гетероатомы, расположенные в ароматической кольцевой системе, при этом каждый гетероатом независимо выбран из азота, кислорода и серы («5-6 членный гетероарил»). В некоторых вариантах реализации 5-6 членный гетероарил содержит 1-3 кольцевых гетероатома, выбранных из азота, кислорода и серы. В некоторых вариантах реализации 5-6 членный гетероарил содержит 1-2 кольцевых гетероатома, выбранных из азота, кислорода и серы. В некоторых вариантах реализации 5-6 членный гетероарил содержит 1 кольцевой гетероатом, выбранный из азота, кислорода и серы. Если не обозначено иное, каждый пример гетероарильной группы является независимо необязательно замещенным, т.е. незамещенным («незамещенный гетероарил») или замещенным («замещенный гетероарил») одним или более заместителями. В некоторых вариантах реализации гетероарильная группа представляет собой незамещенный 5-14 членный гетероарил. В некоторых вариантах реализации гетероарильная группа представляет собой замещенный 5-14 членный гетероарил.
[38] Примерные 5-членные гетероарильные группы, содержащие один гетероатом, включают, не ограничиваясь, пирролил, фуранил и тиофенил. Примерные 5-членные гетероарильные группы, содержащие два гетероатома, включают, не ограничиваясь, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил и изотиазолил. Примерные 5-членные гетероарильные группы, содержащие три гетероатома, включают, не ограничиваясь, триазолил, оксадиазолил и тиадиазолил. Примерные 5-членные гетероарильные группы, содержащие четыре гетероатома, включают, не ограничиваясь, тетразолил. Примерные 6-членные гетероарильные группы, содержащие один гетероатом, включают, не ограничиваясь, пиридинил. Примерные 6-членные гетероарильные группы, содержащие два гетероатома, включают, не ограничиваясь, пиридазинил, пиримидинил и пиразинил. Примерные 6-членные гетероарильные группы, содержащие три или четыре гетероатома, включают, не ограничиваясь, триазинил и тетразинил, соответственно. Примерные 7-членные гетероарильные группы, содержащие один гетероатом, включают, не ограничиваясь, азепинил, оксепинил и тиепинил. Примерные 5,6-бициклические гетероарильные группы включают, не ограничиваясь, индолил, изоиндолил, индазолил, бензотриазолил, бензотиофенил, изобензотиофенил, бензофуранил, бензоизофуранил, бензимидазолил, бензоксазолил, бензизоксазолил, бензоксадиазолил, бензтиазолил, бензизотиазолил, бензтиадиазолил, индолизинил и пуринил. Примерные 6,6-бициклические гетероарильные группы включают, не ограничиваясь, нафтиридинил, птеридинил, хинолинил, изохинолинил, циннолинил, хиноксалинил, фталазинил и хиназолинил.
[39] Примеры типичных гетероарилов включают следующие формулы:
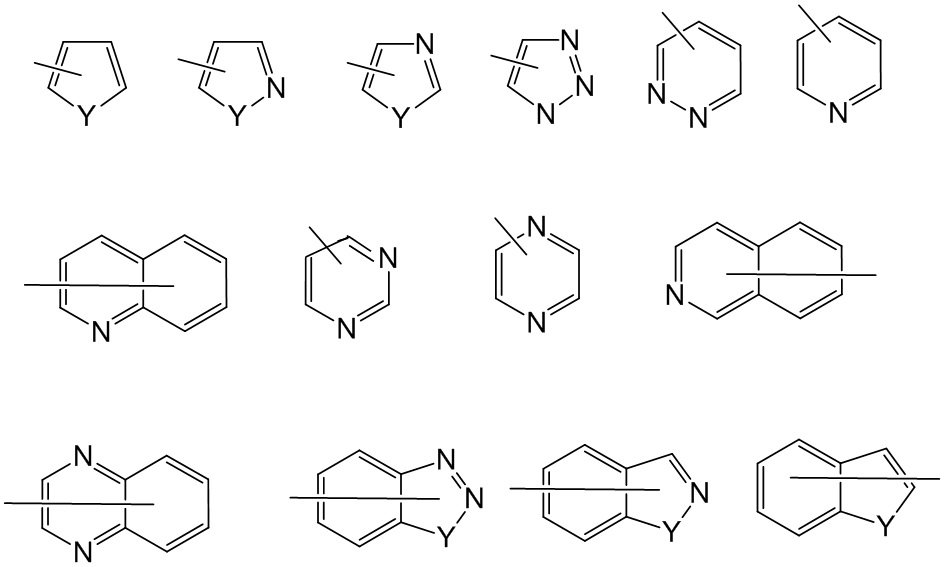
где каждый Y выбран из карбонила, N, NR65, и S; и R65 представляет собой независимо водород, C1-C8 алкил, C3-C10 циклоалкил, 4-10 членный гетероциклил, C6-C10 арил и 5-10 членный гетероарил.
[40] «Карбоциклил» или «карбоциклический» относится к радикалу неароматической циклической углеводородной группы, содержащему от 3 до 10 кольцевых атомов углерода («C3-10 карбоциклил») и ноль гетероатомов в неароматической кольцевой системе. В некоторых вариантах реализации карбоциклильная группа содержит от 3 до 8 кольцевых атомов углерода («C3-8 карбоциклил»). В некоторых вариантах реализации карбоциклильная группа содержит от 3 до 6 кольцевых атомов углерода («C3-6 карбоциклил»). В некоторых вариантах реализации карбоциклильная группа содержит от 3 до 6 кольцевых атомов углерода («C3-6 карбоциклил»). В некоторых вариантах реализации карбоциклильная группа содержит от 5 до 10 кольцевых атомов углерода («C5-10 карбоциклил»). Примерные C3-6 карбоциклильные группы включают, не ограничиваясь, циклопропил (C3), циклопропенил (C3), циклобутил (C4), циклобутенил(C4), циклопентил (C5), циклопентенил (C5), циклогексил (C6), циклогексенил (C6), циклогексадиенил (C6) и подобные. Примерные C3-8 карбоциклильные группы включают, не ограничиваясь, вышеуказанные C3-6 карбоциклильные группы, а также циклогептил (C7), циклогептенил (C7), циклогептадиенил (C7), циклогептатриенил (C7), циклооктил (C8), циклооктенил (C8), бицикло[2,2,1]гептанил (C7), бицикло[2,2,2]октанил (C8) и подобные. Примерные C3-10 карбоциклильные группы включают, не ограничиваясь, вышеуказанные C3-8 карбоциклильные группы, а также циклононил (C9), циклононенил (C9), циклодецил (C10), циклодеценил (C10), октагидро-1H-инденил (C9), декагидронафталенил (C10), спиро[4,5]деканил (C10) и подобные. Как иллюстрируют вышеуказанные примеры, в некоторых вариантах реализации карбоциклильная группа также является моноциклической («моноциклический карбоциклил») или содержит конденсированную, мостиковую или спиро кольцевую систему, такую как бициклическая система («бициклический карбоциклил»), и может быть насыщенной или может быть частично ненасыщенной. «Карбоциклил» также включает кольцевые системы, в которых карбоциклильное кольцо, как определено выше, конденсировано с одной или более арильной или гетероарильной группами, при этом точка присоединения находится на карбоциклильном кольце, и в таких случаях количество атомов углерода обозначает количество атомов углерода в карбоциклической кольцевой системе. Если не обозначено иное, каждый пример карбоциклильной группы является независимо необязательно замещенным, т.е. незамещенным («незамещенный карбоциклил») или замещенным («замещенный карбоциклил») одним или более заместителями. В некоторых вариантах реализации карбоциклильная группа представляет собой незамещенный C3-10 карбоциклил. В некоторых вариантах реализации карбоциклильная группа представляет собой замещенный C3-10 карбоциклил.
[41] В некоторых вариантах реализации «карбоциклил» представляет собой моноциклическую насыщенную карбоциклильную группу, содержащую от 3 до 10 кольцевых атомов углерода («C3-10 циклоалкил»). В некоторых вариантах реализации циклоалкильная группа содержит от 3 до 8 кольцевых атомов углерода («C3-8 циклоалкил»). В некоторых вариантах реализации циклоалкильная группа содержит от 3 до 6 кольцевых атомов углерода («C3-6 циклоалкил»). В некоторых вариантах реализации циклоалкильная группа содержит от 5 до 6 кольцевых атомов углерода («C5-6 циклоалкил»). В некоторых вариантах реализации циклоалкильная группа содержит от 5 до 10 кольцевых атомов углерода («C5-10 циклоалкил»). Примеры C5-6 циклоалкильных групп включают циклопентил (C5) и циклогексил (C5). Примеры C3-6 циклоалкильных групп включают вышеуказанные C5-6 циклоалкильные группы, а также циклопропил (C3) и циклобутил (C4). Примеры C3-8 циклоалкильных групп включают вышеуказанные C3-6 циклоалкильные группы, а также циклогептил (C7) и циклооктил (C8). Если не обозначено иное, каждый пример циклоалкильной группы является независимо незамещенным («незамещенный циклоалкил») или замещенным («замещенный циклоалкил») одним или более заместителями. В некоторых вариантах реализации циклоалкильная группа представляет собой незамещенный C3-10 циклоалкил. В некоторых вариантах реализации циклоалкильная группа представляет собой замещенный C3-10 циклоалкил.
[42] «Гетероциклил» или «гетероциклический» относится к радикалу от 3- до 10-членной неароматической кольцевой системы, содержащей кольцевые атомы углерода и от 1 до 4 кольцевых гетероатомов, где каждый гетероатом независимо выбран из азота, кислорода, серы, бора, фосфора и кремния («3-10 членный гетероциклил»). В гетероциклильных группах, которые содержат один или более атомов азота, точка присоединения может представлять собой атом углерода или азота, как позволяет валентность. Гетероциклильная группа может представлять собой или моноциклическую («моноциклический гетероциклил») или конденсированную, мостиковую или спиро кольцевую систему, такую как бициклическая система («бициклический гетероциклил») и может быть насыщенной или может быть частично ненасыщенной. Гетероциклильные бициклические кольцевые системы могут содержать один или более гетероатомов в одном или обоих кольцах. «Гетероциклил» также включает кольцевые системы, в которых гетероциклильное кольцо, как определено выше, конденсировано с одной или более карбоциклильными группами, при этом точка присоединения находится или на карбоциклильном или на гетероциклильном кольце, или кольцевые системы, в которых гетероциклильное кольцо, как определено выше, конденсировано с одной или более арильной или гетероарильной группами, при этом точка присоединения находится на гетероциклильном кольце, и в таких случаях количество членов кольца обозначает количество членов кольца в гетероциклильной кольцевой системе. Если не обозначено иное, каждый пример гетероциклила является независимо необязательно замещенным, т.е. незамещенным («незамещенный гетероциклил») или замещенным («замещенный гетероциклил») одним или более заместителями. В некоторых вариантах реализации гетероциклильная группа представляет собой незамещенный 3-10 членный гетероциклил. В некоторых вариантах реализации гетероциклильная группа представляет собой замещенный 3-10 членный гетероциклил.
[43] В некоторых вариантах реализации гетероциклильная группа представляет собой 5-10 членную неароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевые гетероатомы, при этом каждый гетероатом независимо выбран из азота, кислорода, серы, бора, фосфора и кремния («5-10 членный гетероциклил»). В некоторых вариантах реализации гетероциклильная группа представляет собой 5-8 членную неароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевые гетероатомы, при этом каждый гетероатом независимо выбран из азота, кислорода и серы («5-8 членный гетероциклил»). В некоторых вариантах реализации гетероциклильная группа представляет собой 5-6 членную неароматическую кольцевую систему, содержащую кольцевые атомы углерода и 1-4 кольцевые гетероатомы, при этом каждый гетероатом независимо выбран из азота, кислорода и серы («5-6 членный гетероциклил»). В некоторых вариантах реализации 5-6 членный гетероциклил содержит 1-3 кольцевых гетероатома, выбранных из азота, кислорода и серы. В некоторых вариантах реализации 5-6 членный гетероциклил содержит 1-2 кольцевых гетероатома, выбранных из азота, кислорода и серы. В некоторых вариантах реализации 5-6 членный гетероциклил содержит один кольцевой гетероатом, выбранный из азота, кислорода и серы.
[44] Примерные 3-членные гетероциклильные группы, содержащие один гетероатом, включают, не ограничиваясь, азирдинил, оксиранил, тиоренил. Примерные 4-членные гетероциклильные группы, содержащие один гетероатом, включают, не ограничиваясь, азетидинил, оксетанил и тиетанил. Примерные 5-членные гетероциклильные группы, содержащие один гетероатом, включают, не ограничиваясь, тетрагидрофуранил, дигидрофуранил, тетрагидротиофенил, дигидротиофенил, пирролидинил, дигидропирролил и пирролил-2,5-дион. Примерные 5-членные гетероциклильные группы, содержащие два гетероатома, включают, не ограничиваясь, диоксоланил, оксасульфуранил, дисульфуранил и оксазолидин-2-он. Примерные 5-членные гетероциклильные группы, содержащие три гетероатома, включают, не ограничиваясь, триазолинил, оксадиазолинил и тиадиазолинил. Примерные 6-членные гетероциклильные группы, содержащие один гетероатом, включают, не ограничиваясь, пиперидинил, тетрагидропиранил, дигидропиридинил и тианил. Примерные 6-членные гетероциклильные группы, содержащие два гетероатома, включают, не ограничиваясь, пиперазинил, морфолинил, дитианил, диоксанил. Примерные 6-членные гетероциклильные группы, содержащие два гетероатома, включают, не ограничиваясь, триазинанил. Примерные 7-членные гетероциклильные группы, содержащие один гетероатом, включают, не ограничиваясь, азепанил, оксепанил и тиепанил. Примерные 8-членные гетероциклильные группы, содержащие один гетероатом, включают, не ограничиваясь, азоканил, оксеканил и тиоканил. Примерные 5-членные гетероциклильные группы, конденсированные с C6 арильным кольцом (также называемые в настоящем документе как 5,6-бициклическое гетероциклическое кольцо) включают, не ограничиваясь, индолинил, изоиндолинил, дигидробензофуранил, дигидробензотиенил, бензоксазолинонил и подобные. Примерные 6-членные гетероциклильные группы, конденсированные с арильным кольцом (также называются в настоящем документе как 6,6-бициклическое гетероциклическое кольцо) включают, не ограничиваясь, тетрагидрохинолинил, тетрагидроизохинолинил и подобные.
[45] Конкретные примеры гетероциклильных групп представлены в следующих иллюстративных примерах:

где каждый W выбран из CR67, C(R67)2, NR67, и S; и каждый Y выбран из NR67, и S; и R67 представляет собой независимо водород, C1-C8 алкил, C3-C10 циклоалкил, 4-10 членный гетероциклил, C6-C10 арил и 5-10-членный гетероарил. Данные гетероциклильные кольца могут быть необязательно замещены одной или более группами, выбранными из группы, состоящей из ацила, ациламино, ацилокси, алкокси, алкоксикарбонила, алкоксикарбониламино, амино, замещенного амино, аминокарбонила (например, амидо), аминокарбониламино, аминосульфонила, сульфониламино, арила, арилокси, азидо, карбоксила, циано, циклоалкила, галогенгена, гидрокси, кето, нитро, тиола, -S-алкила, -S-арила, -S(O)-алкила, -S(O)-арила, -S(O)2-алкила и -S(O)2-арила. Замещающие группы включают карбонил или тиокарбонил, которые обеспечивают, например, производные лактама или мочевины.
[46] «Ацил» относится к радикалу -C(O)R20, где R20 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, как определено в настоящем документе. «Алканоил» представляет собой ацильную группу, где R20 представляет собой группу, отличную от водорода. Типичные ацильные группы включают, но не ограничиваются ими, формил (-CHO), ацетил (-C(=O)CH3), циклогексилкарбонил, циклогексилметилкарбонил, бензоил (-C(=O)Ph), бензилкарбонил (-C(=O)CH2Ph), --C(O)-C1-C8 алкил, -C(O)-(CH2)t(C6-C10 арил), -C(O)-(CH2)t(5-10 членный гетероарил), -C(O)-(CH2)t(C3-C10 циклоалкил) и -C(O)-(CH2)t(4-10 членный гетероциклил), где t представляет собой целое число от 0 до 4. В некоторых вариантах реализации R21 представляет собой C1-C8 алкил, замещенный галогеном или гидрокси; или C3-C10 циклоалкил, 4-10 членный гетероциклил, C6-C10 арил, арилалкил, 5-10 членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси.
[47] «Ациламино» относится к радикалу -NR22C(O)R23, где каждый пример R22 и R23 представляет собой независимо водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, как определено в настоящем документе, или R22 представляет собой аминозащитную группу. Примерные «ациламино» группы включают, но не ограничиваются ими, формиламино, ацетиламино, циклогексилкарбониламино, циклогексилметил-карбониламино, бензоиламино и бензилкарбониламино. Отдельные примерные «ациламино» группы представляют собой -NR24C(O)-C1-C8 алкил, -NR24C(O)-(CH2)t(C6-C10 арил), -NR24C(O)-(CH2)t(5-10 членный гетероарил), -NR24C(O)-(CH2)t(C3-C10 циклоалкил) и -NR24C(O)-(CH2)t(4-10 членный гетероциклил), где t представляет собой целое число от 0 до 4, и каждый R24 независимо представляет собой водород или C1-C8 алкил. В некоторых вариантах реализации R25 представляет собой H, C1-C8 алкил, замещенный галогеном или гидрокси; C3-C10 циклоалкил, 4-10 членный гетероциклил, C6-C10 арил, арилалкил, 5-10 членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси; и R26 представляет собой H, C1-C8 алкил, замещенный галогеном или гидрокси; C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси; при этом по меньшей мере один из R25 и R26 является отличным от H.
[48] «Ацилокси» относится к радикалу -OC(O)R27, где R27 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, как определено в настоящем документе. Типичные примеры включают, но не ограничиваются ими, формил, ацетил, циклогексилкарбонил, циклогексилметилкарбонил, бензоил и бензилкарбонил. В некоторых вариантах реализации R28 представляет собой C1-C8 алкил, замещенный галогеном или гидрокси; C3-C10 циклоалкил, 4-10-членный гетероциклил, C6-C10 арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси.
[49] «Алкокси» относится к группе -OR29, где R29 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. Конкретные алкокси группы представляют собой метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси, втор-бутокси, н-пентокси, н-гексокси и 1,2-диметилбутокси. Конкретные алкокси группы представляют собой низший алкокси, т.е., с количеством атомов углерода от 1 до 6. Также конкретные алкокси группы имеют от 1 до 4 атомов углерода.
[50] В некоторых вариантах реализации R29 представляет собой группу, которая содержит 1 или более заместителей, к примеру от 1 до 5 заместителей, и конкретно от 1 до 3 заместителей, конкретно 1 заместитель, выбранные из группы, состоящей из амино, замещенного амино, C6-C10 арила, арилокси, карбоксила, циано, C3-C10 циклоалкила, 4-10 членного гетероциклила, галогена, 5-10 членного гетероарила, гидрокси, нитро, тиоалкокси, тиоарилокси, тиола, алкил-S(O)-, арил-S(O)-, алкил-S(O)2- и арил-S(O)2-. Примерные «замещенные алкокси» группы включают, но не ограничиваются ими, -O-(CH2)t(C6-C10 арил), -O-(CH2)t(5-10 членный гетероарил), -O-(CH2)t(C3-C10 циклоалкил) и -O-(CH2)t(4-10 членный гетероциклил), где t представляет собой целое число от 0 до 4, и любые присутствующие арильные, гетероарильные, циклоалкильные или гетероциклильные группы могут сами быть замещены незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси. Конкретные примерные «замещенные алкокси» группы представляют собой -OCF3, -OCH2CF3, -OCH2Ph, -OCH2-циклопропил, -OCH2CH2OH и -OCH2CH2NMe2.
[51] «Амино» относится к радикалу -NH2.
[52] «Замещенный амино» относится к аминогруппе формулы -N(R38)2, где R38 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил или аминозащитную группу, где по меньшей мере один из R38 представляет собой не водород. В некоторых вариантах реализации каждый R38 независимо выбран из водорода, C1-C8 алкила, C3-C8 алкенила, C3-C8 алкинила, C6-C10 арила, 5-10 членного гетероарила, 4-10 членного гетероциклила или C3-C10 циклоалкила; или C1-C8 алкила, замещенного галогеном или гидрокси; C3-C8 алкенила, замещенного галогеном или гидрокси; C3-C8 алкинила, замещенного галогеном или гидрокси или -(CH2)t(C6-C10 арил), -(CH2)t(5-10 членный гетероарил), -(CH2)t(C3-C10 циклоалкил) или -(CH2)t(4-10 членный гетероциклил), где t представляет собой целое число от 0 до 8, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси; или обе R38 группы присоединены с образованием алкиленовой группы.
[53] Примерные «замещенные амино» группы включают, но не ограничиваются ими, -NR39-C1-C8 алкил, -NR39-(CH2)t(C6-C10 арил), -NR39-(CH2)t(5-10 членный гетероарил), -NR39-(CH2)t(C3-C10 циклоалкил) и -NR39-(CH2)t(4-10 членный гетероциклил), где t представляет собой целое число от 0 до 4, к примеру, 1 или 2, каждый R39 независимо представляет собой водород или C1-C8 алкил; и любые присутствующие алкильные группы сами могут быть замещены галогеном, замещенным или незамещенным амино или гидрокси; и любые присутствующие арильные, гетероарильные, циклоалкильные или гетероциклильные группы сами могут быть замещены незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси. Чтобы избежать сомнений, термин «замещенный амино» включает группы алкиламино, замещенный алкиламино, алкилариламино, замещенный алкилариламино, ариламино, замещенный ариламино, диалкиламино и замещенный диалкиламино, как определено ниже. Замещенный амино охватывает как монозамещенные амино, так и дизамещенные амино группы.
[54] «Азидо» относится к радикалу -N3.
[55] «Карбамоил» или «амидо» относится к радикалу -C(O)NH2.
[56] «Замещенный карбамоил» или «замещенный амидо» относится к радикалу -C(O)N(R62)2, где каждый R62 представляет собой независимо водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил или аминозащитную группу, где по меньшей мере один из R62 представляет собой не водород. В некоторых вариантах реализации R62 выбран из H, C1-C8 алкила, C3-C10 циклоалкила, 4-10 членного гетероциклила, C6-C10 арила и 5-10 членного гетероарила; или C1-C8 алкила, замещенного галогеном или гидрокси; или C3-C10 циклоалкила, 4-10 членного гетероциклила, C6-C10 арила или 5-10 членного гетероарила, каждый из которых замещен незамещенным C1-C4 алкилом, галогеном, незамещенным C1-C4 алкокси, незамещенным C1-C4 галогеналкилом, незамещенным C1-C4 гидроксиалкилом или незамещенным C1-C4 галогеналкокси или гидрокси; при этом по меньшей мере один R62 является отличным от водорода H.
[57] «Карбокси» относится к радикалу -C(O)OH.
[58] «Циано» относится к радикалу -CN.
[59] «Гидрокси» относится к радикалу -OH.
[60] «Нитро» относится к радикалу -NO2.
[61] «Этенил» относится к замещенному или незамещенному -(C=C)-. «Этилен» относится к замещенному или незамещенному -(C-C)-. «Этинил» относится к -(C≡C)-.
[62] «Азотсодержащая гетероциклильная» группа означает от 4- до 7- членную неароматическую циклическую группу, содержащую по меньшей мере один атом азота, например, но не ограничиваясь, морфолин, пиперидин (например, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пирролидин (например, 2-пирролидинил и 3-пирролидинил), азетидин, пирролидон, имидазолин, имидазолидинон, 2-пиразолин, пиразолидин, пиперазин и N-алкилпиперазины, такие как N-метилпиперазин. Конкретные примеры включают азетидин, пиперидон и пиперазон.
[63] Алкильная, алкенильная, алкинильная, карбоциклильная, гетероциклильная, арильная и гетероарильная группы, как определено в настоящем документе необязательно замещены (например, «замещенная или «незамещенная» алкильная, «замещенная или «незамещенная» алкенильная, «замещенная или «незамещенная» алкинильная, «замещенная или «незамещенная» карбоциклильная, «замещенная или «незамещенная» гетероциклильная, «замещенная или «незамещенная» арильная или «замещенная или «незамещенная» гетероарильная группа). В целом, термин «замещенный», предшествует ли ему термин «необязательно» или нет, означает, что по меньшей мере один присутствующий водород в группе (например, атом углерода или азота) замещен на допустимый заместитель, например, заместитель, который при замещении дает в результате стабильное соединение, например, соединение, которое спонтанно не подвергается трансформации, такой как перегруппировка, циклизация, расщепление или другим реакциям. Если не обозначено иное, «замещенная» группа содержит заместитель в одном или более замещаемых положениях группы, и когда более чем одно положение в любой данной структуре замещено, заместитель находится или в том же или в другом положении. Термин «замещенный» включает замещение всеми допустимыми заместителями органических соединений, любыми из заместителей, описанных в настоящем документе, которые приводят к образованию стабильного соединения. В настоящем изобретении рассмотрены любые и все такие комбинации, которые приводят к стабильному соединению. Для целей настоящего изобретения гетероатомы, такие как азот, могут иметь заместитель водород и/или любые подходящие заместители, как описано в настоящем документе, которые удовлетворяют валентностям гетероатомов и приводят к образованию стабильного остатка.
[64] Примерные заместители атома углерода включают, но не ограничиваются ими, галоген, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -ORaa, -ON(Rbb)2, -N(Rbb)2, -N(Rbb)3+X-, -N(ORcc)Rbb, -SH, -SRaa, -SSRcc, -C(=O)Raa, -CO2H, -CHO, -C(ORcc)2, -CO2Raa, -OC(=O)Raa, -OCO2Raa, -C(=O)N(Rbb)2, -OC(=O)N(Rbb)2, -NRbbC(=O)Raa, -NRbbCO2Raa, -NRbbC(=O)N(Rbb)2, -C(=NRbb)Raa, -C(=NRbb)ORaa, -OC(=NRbb)Raa, -OC(=NRbb)ORaa, -C(=NRbb)N(Rbb)2, -OC(=NRbb)N(Rbb)2, -NRbbC(=NRbb)N(Rbb)2, -C(=O)NRbbSO2Raa, -NRbbSO2Raa, -SO2N(Rbb)2, -SO2Raa, -SO2ORaa, -OSO2Raa, -S(=O)Raa, -OS(=O)Raa, -Si(Raa)3, -OSi(Raa)3 -C(=S)N(Rbb)2, -C(=O)SRaa, -C(=S)SRaa, -SC(=S)SRaa, -SC(=O)SRaa, -OC(=O)SRaa, -SC(=O)ORaa, -SC(=O)Raa, -P(=O)2Raa, -OP(=O)2Raa, -P(=O)(Raa)2, -OP(=O)(Raa)2, -OP(=O)(ORcc)2, -P(=O)2N(Rbb)2, -OP(=O)2N(Rbb)2, -P(=O)(NRbb)2, -OP(=O)(NRbb)2, -NRbbP(=O)(ORcc)2, -NRbbP(=O)(NRbb)2, -P(Rcc)2, -P(Rcc)3, -OP(Rcc)2, -OP(Rcc)3, -B(Raa)2, -B(ORcc)2, -BRaa(ORcc), C1-10 алкил, C1-10 пергалогеналкил, C2-10 алкенил, C2-10 алкинил, C3-10 карбоциклил, 3-14 членный гетероциклил, C6-14 арил и 5-14 членный гетероарил, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещены посредством 0, 1, 2, 3, 4 или 5 Rdd групп;
каждый пример Raa независимо выбран из C1-10 алкила, C1-10 пергалогеналкила, C2-10 алкенила, C2-10 алкинила, C3-10 карбоциклила, 3-14 членного гетероциклила, C6-14 арила и 5-14 членного гетероарила, или две Raa группы присоединены с образованием 3-14 членного гетероциклила или 5-14 членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещены посредством 0, 1, 2, 3, 4 или 5 Rdd групп;
каждый пример Rbb независимо выбран из водорода, -OH, -ORaa, -N(Rcc)2, -CN, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)2N(Rcc)2, -P(=O)(NRcc)2, C1-10 алкила, C1-10 пергалогеналкила, C2-10 алкенила, C2-10 алкинила, C3-10 карбоциклила, 3-14 членного гетероциклила, C6-14 арила и 5-14 членного гетероарила, или две Rbb группы присоединены с образованием 3-14 членного гетероциклила или 5-14 членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещены посредством 0, 1, 2, 3, 4 или 5 Rdd групп;
каждый пример Rcc независимо выбран из водорода, C1-10 алкила, C1-10 пергалогеналкила, C2-10 алкенила, C2-10 алкинила, C3-10 карбоциклила, 3-14 членного гетероциклила, C6-14 арила и 5-14 членного гетероарила, или две Rcc группы присоединены с образованием 3-14 членного гетероциклила или 5-14 членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещены посредством 0, 1, 2, 3, 4 или 5 Rdd групп;
каждый пример Rdd независимо выбран из галогена, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -ORee, -ON(Rff)2, -N(Rff)2, -N(Rff)3+X-, -N(ORee)Rff, -SH, -SRee, -SSRee, -C(=O)Ree, -CO2H, -CO2Ree, -OC(=O)Ree, -OCO2Ree, -C(=O)N(Rff)2, -OC(=O)N(Rff)2, -NRffC(=O)Ree, -NRffCO2Ree, -NRffC(=O)N(Rff)2, -C(=NRff)ORee, -OC(=NRff)Ree, -OC(=NRff)ORee, -C(=NRff)N(Rff)2, -OC(=NRff)N(Rff)2, -NRffC(=NRff)N(Rff)2,-NRffSO2Ree, -SO2N(Rff)2, -SO2Ree, -SO2ORee, -OSO2Ree, -S(=O)Ree, -Si(Ree)3, -OSi(Ree)3, -C(=S)N(Rff)2, -C(=O)SRee, -C(=S)SRee, -SC(=S)SRee, -P(=O)2Ree, -P(=O)(Ree)2, -OP(=O)(Ree)2, -OP(=O)(ORee)2, C1-6 алкила, C1-6 пергалогеналкила, C2-6 алкенила, C2-6 алкинила, C3-10 карбоциклила, 3-10 членного гетероциклила, C6-10 арила, 5-10 членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещены посредством 0, 1, 2, 3, 4 или 5 Rgg групп;
каждый пример Ree независимо выбран из C1-6 алкила, C1-6 пергалогеналкила, C2-6 алкенила, C2-6 алкинила, C3-10 карбоциклила, C6-10 арила, 3-10 членного гетероциклила и 3-10 членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещены посредством 0, 1, 2, 3, 4 или 5 Rgg групп;
каждый пример Rff независимо выбран из водорода, C1-6 алкила, C1-6 пергалогеналкила, C2-6 алкенила, C2-6 алкинила, C3-10 карбоциклила, 3-10 членного гетероциклила, C6-10 арила и 5-10 членного гетероарила, или две Rff группы присоединены с образованием 3-14 членного гетероциклила или 5-14 членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещены посредством 0, 1, 2, 3, 4 или 5 Rgg групп; и
каждый пример Rgg независимо представляет собой галоген, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -OC1-6 алкил, -ON(C1-6 алкил)2, -N(C1-6 алкил)2, -N(C1-6 алкил)3+X-, -NH(C1-6 алкил)2+X-, -NH2(C1-6 алкил)+X-, -NH3+X-, -N(OC1-6 алкил)(C1-6 алкил), -N(OH)(C1-6 алкил), -NH(OH), -SH, -SC1-6 алкил, -SS(C1-6 алкил), -C(=O)(C1-6 алкил), -CO2H, -CO2(C1-6 алкил), -OC(=O)(C1-6 алкил), -OCO2(C1-6 алкил), -C(=O)NH2, -C(=O)N(C1-6 алкил)2, -OC(=O)NH(C1-6 алкил), -NHC(=O)( C1-6 алкил), -N(C1-6 алкил)C(=O)( C1-6 алкил), -NHCO2(C1-6 алкил), -NHC(=O)N(C1-6 алкил)2, -NHC(=O)NH(C1-6 алкил), -NHC(=O)NH2, -C(=NH)O(C1-6 алкил),-OC(=NH)(C1-6 алкил), -OC(=NH)OC1-6 алкил, -C(=NH)N(C1-6 алкил)2, -C(=NH)NH(C1-6 алкил), -C(=NH)NH2, -OC(=NH)N(C1-6 алкил)2, -OC(NH)NH(C1-6 алкил), -OC(NH)NH2, -NHC(NH)N(C1-6 алкил)2, -NHC(=NH)NH2, -NHSO2(C1-6 алкил), -SO2N(C1-6 алкил)2, -SO2NH(C1-6 алкил), -SO2NH2,-SO2C1-6 алкил, -SO2OC1-6 алкил, -OSO2C1-6 алкил, -SOC1-6 алкил, -Si(C1-6 алкил)3, -OSi(C1-6 алкил)3 -C(=S)N(C1-6 алкил)2, C(=S)NH(C1-6 алкил), C(=S)NH2, -C(=O)S(C1-6 алкил), -C(=S)SC1-6 алкил, -SC(=S)SC1-6 алкил, -P(=O)2(C1-6 алкил), -P(=O)(C1-6 алкил)2, -OP(=O)(C1-6 алкил)2, -OP(=O)(OC1-6 алкил)2, C1-6 алкил, C1-6 пергалогеналкил, C2-6 алкенил, C2-6 алкинил, C3-10 карбоциклил, C6-10 арил, 3-10 членный гетероциклил, 5-10 членный гетероарил; где X- представляет собой противоион.
[65] «Противоион» или «анионный противоион» представляет собой отрицательно заряженную группу, связанную с катионной четвертичной аминогруппой для того, чтобы поддерживать электронную нейтральность. Примерные противоионы включают галидные ионы (например, F-, Cl-, Br-, I-), NO3-, ClO4-, H-, H2PO4-, HSO4-, сульфонатные ионы (например, метансульфонат, трифторметансульфонат, p-толуолсульфонат, бензолсульфонат, 10-камфорсульфонат, нафтален-2-сульфонат, нафтален-1-сульфоновая кислота-5-сульфонат, этан-1-сульфоновая кислота-2-сульфонат и подобные) и карбоксилатные ионы (например, ацетат, этаноат, пропаноат, бензоат, глицерат, лактат, тартрат, гликолят и подобные).
[66] Атомы азота могут быть замещенными или незамещенными, как позволяет валентность, и включают первичные, вторичные, третичные и четвертичные атомы азота. Примерные заместители атома азота включают, но не ограничиваются ими, водород, -OH, -ORaa, -N(Rcc)2, -CN, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRbb)Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)2N(Rcc)2, -P(=O)(NRcc)2, C1-10 алкил, C1-10 пергалогеналкил, C2-10 алкенил, C2-10 алкинил, C3-10 карбоциклил, 3-14 членный гетероциклил, C6-14 арил и 5-14-членный гетероарил, или две Rcc группы, присоединенные к атому азота, соединены с образованием 3-14-членного гетероциклила или 5-14-членного гетероарильного кольца, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещены посредством 0, 1, 2, 3, 4 или 5 Rdd групп, и где Raa, Rbb, Rccи Rdd определены выше.
[67] В некоторых вариантах реализации заместитель, присутствующий на атоме азота, представляет собой аминозащитную группу (также называемую в настоящем документе азотзащитной группой). Аминозащитные группы включают, но не ограничиваются ими, -OH, -ORaa, -N(Rcc)2, -C(=O)Raa, -C(=O)ORaa, -C(=O)N(Rcc)2, -S(=O)2Raa, -C(=NRcc)Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, C1-10 алкил, C2-10 алкенил, C2-10 алкинил, C3-10 карбоциклил, 3-14-членный гетероциклил, C6-14 арил и 5-14-членные гетероарильные группы, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил независимо замещены посредством 0, 1, 2, 3, 4 или 5 Rdd групп, и где Raa, Rbb, Rccи Rdd определены в настоящем документе. Аминозащитные группы хорошо известны в данной области, и включают подробно описанные в Protecting Groups in rganic Synthesis, T.W. Greene and P.G.M. Wuts, 3rd edition, John Wiley & Sons, 1999, которая включена в настоящую заявку посредством ссылки.
[68] Примерные аминозащитные группы включают, но не ограничиваются ими, амидные группы (например, -C(=O)Raa), которые включают, но не ограничиваются ими, формамид и ацетамид; карбаматные группы (например, -C(=O)ORaa), которые включают, но не ограничиваются ими, 9-флуоренилметилкарбамат (Fmoc), t-бутилкарбамат (BOC) и бензилкарбамат (Cbz); сульфонамидные группы (например, -S(=O)2Raa), которые включают, но не ограничиваются ими, p-толуолсульфонамид (Ts), метансульфонамид (Ms) и N-[2-(триметилсилил)этокси]метиламин (SEM).
[69] В некоторых вариантах реализации заместитель, присутствующий на атоме кислорода, представляет собой кислородзащитную группу (также называемую гидроксилзащитной группой). Кислородзащитные группы включают, но не ограничиваются ими, -Raa, -N(Rbb)2, -C(=O)SRaa, -C(=O)Raa, -CO2Raa, -C(=O)N(Rbb)2, -C(=NRbb)Raa, -C(=NRbb)ORaa, -C(=NRbb)N(Rbb)2, -S(=O)Raa, -SO2Raa, -Si(Raa)3,-P(Rcc)2, -P(Rcc)3, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)(ORcc)2, -P(=O)2N(Rbb)2 и -P(=O)(NRbb)2, где Raa, Rbb и Rcc определены в настоящем документе. Кислородзащитные группы хорошо известны в данной области, и включают подробно описанные в Protecting Groups in rganic Synthesis, T.W. Greene and P.G.M. Wuts, 3rd edition, John Wiley & Sons, 1999, которая включена в настоящую заявку посредством ссылки.
[70] Примерные кислородзащитные группы включают, но не ограничиваются ими, метил, метоксилметил (MOM), 2-метоксиэтоксиметил (MEM), бензил (Bn), триизопропилсилил (TIPS), t-бутилдиметилсилил (TBDMS), t-бутилметоксифенилсилил (TBMPS), метансульфонат (мезилат) и тозилат (Ts).
[71] В некоторых вариантах реализации заместитель, присутствующий на атоме серы, представляет собой серозащитную группу (также называемую тиолзащитной группой). Серозащитные группы включают, но не ограничиваются ими, -Raa, -N(Rbb)2, -C(=O)SRaa, -C(=O)Raa, -CO2Raa, -C(=O)N(Rbb)2, -C(=NRbb)Raa, -C(=NRbb)ORaa, -C(=NRbb)N(Rbb)2, -S(=O)Raa, -SO2Raa, -Si(Raa)3,-P(Rcc)2, -P(Rcc)3, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)(ORcc)2, -P(=O)2N(Rbb)2 и -P(=O)(NRbb)2, где Raa, Rbb и Rcc определены в настоящем документе. Серозащитные группы хорошо известны в данной области, и включают подробно описанные в Protecting Groups in rganic Synthesis, T.W. Greene and P.G.M. Wuts, 3rd edition, John Wiley & Sons, 1999, которая включена в настоящую заявку посредством ссылки.
[72] Данные и другие примерные заместители описаны более подробно в подробном описании, примерах и формуле изобретения. Настоящее изобретение не должно быть ограничено каким-либо образом посредством вышеприведенного примерного перечня заместителей.
Другие определения
[73] В настоящем документе термин «модулирование» относится к ингибированию или потенцированию функции рецептора ГАМК. «Модулятор» (например, модулирующее соединение) может представлять собой, например, агонист, частичный агонист, антагонист или частичный антагонист рецептора ГАМК.
[74] «Фармацевтически приемлемый» означает одобренный или одобряемый регулирующим агентством правительства США или штата или соответствующим агентством в странах, отличных от Соединенных Штатов Америки, или такой, который перечислен в Фармакопее США или других общепризнанных фармакопеях для применения у животных и более конкретно, у людей.
[75] «Фармацевтически приемлемая соль» относится к соли соединения согласно настоящему изобретению, которая является фармацевтически приемлемой, и которая обладает необходимой фармакологической активностью исходного соединения. В частности, такие соли являются нетоксичными и могут представлять собой соли присоединения неорганической или органической кислоты и соли присоединения основания. Конкретно, такие соли включают: (1) соли присоединения кислоты, образованные неорганическими кислотами такими, как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобные; или образованные органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексановая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил) бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этан-дисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталенсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, 4-метилбицикло[2,2,2]-окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, трет-бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и подобные; или (2) соли, образованные, когда протон кислоты, присутствующий в исходном соединении, также замещен ионом металла, например, ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия; или координирован с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, N-метилглюкамин и подобными. Соли дополнительно включают, только в качестве примера, натрий, калий, кальций, магний, аммоний, тетраалкиламмоний и подобные; и когда соединение содержит основную функциональность, соли нетоксичных органических или неорганических кислот, таких как гидрохлорид, гидробромид, тартрат, мезилат, ацетат, малеат, оксалат и подобные. Термин «фармацевтически приемлемый катион» относится к приемлемому катионному противоиону кислотной функциональной группы. Такие катионы иллюстрированы катионами натрия, калия, кальция, магния, аммония, тетраалкиламмония и подобными. См., например, Berge, et al., J. Pharm. Sci. (1977) 66(1): 1-79.
[76] «Сольват» относится к формам соединения, которые связаны с растворителем или водой (также называются «гидраты»), обычно посредством реакции сольволиза. Эта физическая ассоциация включает водородную связь. Традиционные растворители включают воду, этанол, уксусную кислоту и подобные. Соединения согласно настоящему изобретению могут быть получены, например, в кристаллической форме, и могут быть сольватированы или гидратированы. Подходящие сольваты включают фармацевтически приемлемые сольваты, такие как гидраты, и также включают и стехиометрические сольваты, и нестехиометрические сольваты. В некоторых случаях сольват можно выделять, например, когда одна или более молекул растворителя включены в кристаллическую решетку кристаллического твердого вещества. «Сольват» охватывает как фазу раствора, так и выделяемые сольваты. Типичные сольваты включают гидраты, этаноляты и метаноляты.
[77] В настоящем документе, термин «изотопный вариант» относится к соединению, которое содержит неприродные пропорции изотопов одного или более атомов, которые составляют данное соединение. Например, «изотопный вариант» соединения может содержать один или более нерадиоактивных изотопов, таких как, например, дейтерий (2H или D), углерод-13 (13C), азот-15 (15N) или подобные. Следует понимать, что в соединении, в котором сделаны такие изотопные замещения, следующие атомы, где они присутствуют, могут варьироваться таким образом, что, например, любой водород может представлять собой2H/D, любой углерод может представлять собой13C или любой азот может представлять собой15N, и что присутствие и расположение таких атомов может быть определено специалистом в данной области. Аналогичным образом, настоящее изобретение может включать получение изотопных вариантов с радиоизотопами, в случае, например, где полученные соединения можно применять для исследований распределения в тканях лекарственного средства и/или субстрата. Радиоактивные изотопы тритий, т.е.3H и углерод-14, т.е.14C, особенно подходят для этой цели ввиду легкости их включения и готовых средств обнаружения. К тому же, могут быть получены соединения, в которых выполнены замещения на изотопы, излучающие позитроны, такие как11C,18F,15O и13N, и которые будут полезны в исследованиях позитронной эмиссионной томографии (ПЭТ) для изучения степени занятости рецептора субстратом. Все изотопные варианты соединений, предложенных в настоящем документе, радиоактивные или нет, включены в объем настоящего изобретения.
[78] Также следует понимать, что соединения, которые имеют одинаковую молекулярную формулу, но различаются по природе или последовательностью связывания их атомов или расположением их атомов в пространстве, называют «изомеры». Изомеры, которые отличаются расположением их атомов пространстве, называют «стереоизомеры». Стереоизомеры, которые не являются зеркальными отражениями друг друга, называют «диастереоизомеры», и такие, которые являются неналагающимися зеркальными отражениями друг друга, называют «энантиомеры». Когда соединение имеет асимметрический центр, например, он связан с четырьмя различными группами, возможно существование пары энантиомеров. Энантиомер может быть охарактеризован абсолютной конфигурацией его асимметрического центра и описан правилами R- и S-секвенирования и Кана и Прелога или направлением, в котором молекула вращает плоскость поляризованного света, и обозначен как правовращающий или левовращающий (т.е. как (+) или (-)- изомеры, соответственно). Хиральное соединение может существовать как в виде индивидуального энантиомера, так и в виде их смеси. Смесь, содержащая равные пропорции энантиомеров, называется «рацемической смесью».
[79] «Таутомеры» относятся к соединениям, которые представляют собой взаимозаменяемые формы структуры конкретного соединения и которые изменяются при перемещении атомов водорода и электронов. Таким образом, две структуры могут находиться в равновесии через движение π электронов и атома (обычно H). Например, енолы и кетоны являются таутомерами, так как они быстро переходят друг в друга посредством обработки кислотой или основанием. Другим примером таутомерии являются аци- и нитро- формы фенилнитрометана, которые аналогичным образом образованы посредством обработки кислотой или основанием. Таутомерные формы могут иметь значение для достижения оптимальной химической реакционной способности и биологической активности соединения, представляющего интерес.
[80] «Субъект», которому предполагают введение, включает, но не ограничивается ими, людей (т.е. мужского или женского пола любой возрастной группы, например, педиатрический субъект (например, младенцы, дети, подростки) или взрослый субъект (например, молодые взрослые, взрослые среднего возраста или взрослые старшего возраста)) и/или животных, не являющихся человеком, например, млекопитающих, таких как приматы (например, яванский макак, макак-резус), крупный рогатый скот, свиньи, лошади, овцы, козы, грызуны, кошки и/или собаки. В некоторых вариантах реализации субъектом является человек. В некоторых вариантах реализации субъектом является не являющееся человеком животное. Термины «человек», «пациент» и «субъект» используются в настоящем документе взаимозаменяемо.
[81] Заболевание, расстройство и состояние используются в настоящем документе как взаимозаменяемые.
[82] В настоящем документе и если не обозначено иное, термины «лечить», «обработка» и «лечение» рассматривают действие, которое происходит в то время как субъект страдает от указанного заболевания, расстройства или состояния, которое уменьшает тяжесть заболевания, расстройства или состояния или задерживает или замедляет прогрессирование заболевания, расстройства или состояния («терапевтическое лечение») и также предусматривает действие, которое происходит до того, как субъект начинает страдать от указанного заболевания, расстройства или состояния («профилактическое лечение»).
[83] В целом «эффективное количество» соединения означает количество, достаточное для достижения желаемого биологического ответа, например, для лечения расстройства, связанного с ЦНС, достаточно вызвать анестезию или седацию. Специалистам в данной области будет понятно, что эффективное количество соединения согласно настоящему изобретению может изменяться в зависимости от таких факторов, как желательный биологический конечный результат, фармакокинетика соединения, заболевание, подлежащее лечению, способ введения и возраст, масса, здоровье и состояние субъекта. Эффективное количество охватывает терапевтическое и профилактическое лечение.
[84] В настоящем документе и если не обозначено иное, «терапевтически эффективное количество» соединения представляет собой количество, достаточное для обеспечения терапевтического эффекта при лечении заболевания, расстройства или состояния или для задержки или минимизации одного или более симптомов, связанных с этим заболеванием, расстройством или состоянием. Терапевтически эффективное количество соединения означает количество терапевтического агента, одного или в комбинации с другими видами терапии, которое обеспечивает терапевтическую пользу при лечении заболевания, расстройства или состояния. Термин «терапевтически эффективное количество» может включать количество, которое улучшает общую терапию, снижает или позволяет избежать симптомов или причин заболевания или состояния, или повышает терапевтическую эффективность другого терапевтического агента.
[85] В настоящем документе и если не обозначено иное, «профилактически эффективное количество» соединения представляет собой количество, достаточное для предотвращения заболевания, расстройства или состояния или одного или более симптомов, связанных с заболеванием, расстройством или состоянием, или для предотвращения его рецидива. Профилактически эффективное количество соединения означает количество терапевтического агента, одного или в комбинации с другими агентами, которое обеспечивает профилактический эффект в предотвращении заболевания, расстройства или состояния. Термин «профилактически эффективное количество» может охватывать количество, которое улучшает общую профилактику или усиливает профилактическую эффективность другого профилактического агента.
Подробное описание некоторых вариантов реализации настоящего изобретения
[86] Как в целом описано в настоящем документе, в настоящем изобретении предложены С21-замещенные нейроактивные стероиды, созданные, например, чтобы действовать в качестве модуляторов ГАМК. В некоторых вариантах реализации предполагают, что такие соединения подходят в качестве терапевтических агентов для индуцирования анестезии и/или седации у субъекта. В некоторых вариантах реализации предполагают, что такие соединения подходят в качестве терапевтических агентов для лечения расстройства, связанного с ЦНС.
Соединения
[87] В одном аспекте предложено соединение формулы (I):

его фармацевтически приемлемая соль, где: A представляет собой необязательно замещенный азотсодержащий гетероарил или гетероциклил; L представляет собой -C(R3)(R3)-, -O-, -S- или -NR3-; R1 представляет собой водород или C1-C6 алкил, C1-C6 алкенил, C1-C6 алкинил, карбоциклил или гетероциклил; R2 представляет собой водород, C1-C6 алкил (например, C1-C6 галогеналкил) или C1-C6 алкокси; каждый R3 представляет собой независимо водород или C1-C6 алкил; R5 отсутствует или представляет собой водород; и




[88] В одном аспекте предложено соединение формулы (Ia):

его фармацевтически приемлемая соль, где: A представляет собой необязательно замещенный азотсодержащий гетероарил или гетероциклил; L представляет собой -C(R3)(R3)-, -O-, -S- или -NR3-; R1 представляет собой водород или C1-C6 алкил, C1-C6 алкенил, C1-C6 алкинил, карбоциклил или гетероциклил; каждый R3 представляет собой независимо водород или C1-C6 алкил; R5 отсутствует или представляет собой водород; и




[89] В некоторых вариантах реализации соединение представляет собой соединение формулы (Ia-1):

[90] В некоторых вариантах реализации соединение представляет собой соединение формулы (Ia-2):
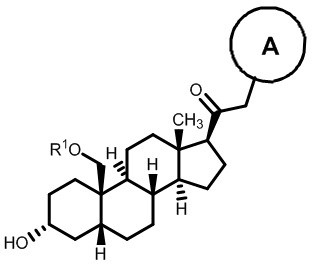
[91] В некоторых вариантах реализации A является моноциклическим или бициклическим.
[92] В некоторых вариантах реализации A является моноциклическим. В некоторых аспектах данных вариантов реализации A присоединен через азот. В некоторых вариантах реализации A представляет собой гетероарил. В некоторых аспектах данных вариантов реализации гетероарил содержит не более пяти атомов азота. В некоторых вариантах реализации A представляет собой 5-членный гетероарил или гетероциклил. В некоторых вариантах реализации A представляет собой 5-членный гетероарил или гетероциклил, содержащий не более пяти атомов азота. В некоторых вариантах реализации A представляет собой 5-членный гетероарил или гетероциклил, содержащий 2, 3 или 4 атома азота. В некоторых вариантах реализации A представляет собой пиразол, триазол или тетразол. В некоторых вариантах реализации A представляет собой незамещенный пиразол, триазол или тетразол. В некоторых вариантах реализации A представляет собой




[93] В некоторых вариантах реализации A является бициклическим. В некоторых аспектах данных вариантов реализации A присоединен через азот. В некоторых вариантах реализации A представляет собой гетероарил. В некоторых аспектах данных вариантов реализации гетероарил содержит не более пяти атомов азота. В некоторых вариантах реализации гетероарил содержит по меньшей мере два атома азота. В некоторых вариантах реализации A представляет собой гетероарил, содержащий не более четырех атомов азота. В некоторых вариантах реализации A представляет собой гетероарил, содержащий не более трех атомов азота. В некоторых вариантах реализации A представляет собой гетероарил, содержащий 2, 3 или 4 атома азота. В некоторых вариантах реализации гетероарил представляет собой бензотриазол, азабензотриазол, диазабензотриазол, бензопиразол, азабензопиразол или диазабензопиразол.
[94] В некоторых вариантах реализации соединение представляет собой соединение формулы (Ia-3):

где R4 представляет собой циано, нитро, гидрокси, галоген, C1-C6 алкил, C1-C6 алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rb)(Rc), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc); каждый Ra представляет собой водород или C1-C6 алкил; каждый Rb и Rc представляет собой независимо водород, C1-C6алкил, карбоциклил, гетероциклил, арил, гетероарил или Rb и Rc,совместно с атомом азота, к которому они присоединены, образуют кольцо (например, 3-7-членное кольцо, например, 5-7-членное кольцо; кольцо, содержащее по меньшей мере один гетероатом, например, атом азота, кислорода или серы); и n представляет собой 0, 1, 2 или 3.
[95] В некоторых вариантах реализации соединение представляет собой соединение формулы (Ia-4):
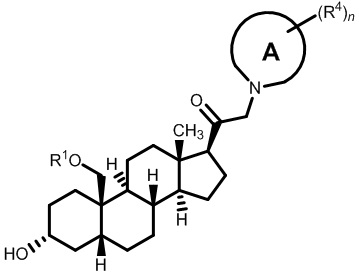
где R4 представляет собой циано, нитро, гидрокси, галоген, C1-C6 алкил, C1-C6 алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rb)(Rc), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc); каждый Ra представляет собой водород или C1-C6 алкил; каждый Rb и Rc представляет собой независимо водород, C1-C6алкил, карбоциклил, гетероциклил, арил, гетероарил или Rb и Rc,совместно с атомом азота, к которому они присоединены, образуют кольцо (например, 3-7-членное кольцо, например, 5-7-членное кольцо; кольцо, содержащее по меньшей мере один гетероатом, например, атом азота, кислорода или серы); и n представляет собой 0, 1, 2 или 3.
[96] В некоторых вариантах реализации n представляет собой 0.
[97] В некоторых вариантах реализации n представляет собой 1. В некоторых аспектах данных вариантов реализации R4 представляет собой циано, нитро, гидрокси, галоген, C1-C6 алкил, C1-C6 алкокси, -C(O)Ra,-C(O)ORa или -S(O)0-2Ra. В некоторых вариантах реализации n представляет собой 1, и R4 представляет собой циано, нитро, гидрокси, галоген, C1-C6 алкил, C1-C6 алкокси, -C(O)Ra,-C(O)ORa или -S(O)0-2Ra. В некоторых аспектах данных вариантов реализации R4 представляет собой галоген (например, F, Cl, Br). В некоторых вариантах реализации R4 представляет собой F. В некоторых вариантах реализации R4 представляет собой Cl. В некоторых вариантах реализации R4 представляет собой Br. В некоторых вариантах реализации R4 представляет собой C1-C6 алкокси (например, -OCH3, -OCH2CH3). В некоторых вариантах реализации R4 представляет собой циано. В некоторых вариантах реализации R4 представляет собой -C(O)Raили -C(O)ORa. В некоторых аспектах данных вариантов реализации Ra представляет собой C1-C6 алкил (например, -CH3, -CH2CH3). В некоторых вариантах реализации R4 представляет собой -S(O)0-2Ra. В некоторых вариантах реализации R4 представляет собой -S(O)2Ra и Ra представляет собой C1-C6 алкил. В некоторых аспектах данных вариантов реализации Ra представляет собой -CH3. В некоторых вариантах реализации R4 представляет собой -S(O)2CH3. В некоторых вариантах реализации R4 представляет собой C1-C6 алкил (например, -CH3, -CH2CH3).
[98] В некоторых вариантах реализации n представляет собой 2. В некоторых аспектах данных вариантов реализации R4 представляет собой циано, нитро, гидрокси, галоген, C1-C6 алкил, C1-C6 алкокси, -C(O)Ra,-C(O)ORa или -S(O)0-2Ra. В некоторых вариантах реализации n представляет собой 2, и R4 представляет собой циано, нитро, гидрокси, галоген, C1-C6 алкил, C1-C6 алкокси, -C(O)Ra,-C(O)ORa или -S(O)0-2Ra. В некоторых аспектах данных вариантов реализации R4 представляет собой галоген (например, F, Cl, Br). В некоторых вариантах реализации R4 представляет собой F. В некоторых вариантах реализации R4 представляет собой Cl. В некоторых вариантах реализации R4 представляет собой Br. В некоторых вариантах реализации R4 представляет собой C1-C6 алкокси (например, -OCH3, -OCH2CH3). В некоторых вариантах реализации R4 представляет собой циано. В некоторых вариантах реализации R4 представляет собой -C(O)Raили -C(O)ORa. В некоторых аспектах данных вариантов реализации Ra представляет собой C1-C6 алкил (например, -CH3, -CH2CH3). В некоторых вариантах реализации R4 представляет собой -S(O)0-2Ra. В некоторых вариантах реализации R4 представляет собой -S(O)2Ra и Ra представляет собой C1-C6 алкил. В некоторых аспектах данных вариантов реализации Ra представляет собой -CH3. В некоторых вариантах реализации R4 представляет собой C1-C6 алкил (например, -CH3, -CH2CH3).
[99] В некоторых вариантах реализации n представляет собой 1 или 2, и R4 представляет собой C1-C6 алкил или C(O)ORa. В некоторых вариантах реализации соединение R4 представляет собой метил. В некоторых вариантах реализации соединение Ra представляет собой C1-C6 алкил. В некоторых вариантах реализации Ra представляет собой этил.
[100] В некоторых вариантах реализации R1 представляет собой водород или C1-C6 алкил и R4 представляет собой -C(O)ORa.
[101] В некоторых вариантах реализации R1 представляет собой C1-C6 алкил, C1-C6 алкенил, C1-C6 алкинил, карбоциклил или гетероциклил. В некоторых вариантах реализации соединение R1 представляет собой C1-C6 алкил. В некоторых вариантах реализации соединение R1 представляет собой метил, этил или изопропил.
[102] В некоторых вариантах реализации R1 представляет собой метил, и R4 представляет собой -C(O)OEt.
В некоторых вариантах реализации соединение выбрано из:







[103] В одном аспекте предложено соединение формулы (Ib):

его фармацевтически приемлемая соль, где: A представляет собой необязательно замещенный азотсодержащий гетероарил или гетероциклил; L представляет собой -C(R3)(R3)-, -O-, -S- или -NR3-; R1 представляет собой водород или C1-C6 алкил, C1-C6 алкенил, C1-C6 алкинил, карбоциклил или гетероциклил; R2 представляет собой C1-C6 алкил (например, C1-C6 галогеналкил) или C1-C6 алкокси; каждый R3 представляет собой независимо водород или C1-C6 алкил; R5 отсутствует или представляет собой водород; и




[104] В некоторых вариантах реализации соединение представляет собой соединение формулы (Ib-1):

[105] В некоторых вариантах реализации соединение представляет собой соединение формулы (Ib-2):

[106] В некоторых вариантах реализации соединение представляет собой соединение формулы (Ib-3)

где R4 представляет собой циано, нитро, гидрокси, галоген, C1-C6 алкил, C1-C6 алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rb)(Rc), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc); каждый Ra представляет собой водород или C1-C6 алкил; каждый Rb и Rc представляет собой независимо водород, C1-C6алкил, карбоциклил, гетероциклил, арил, гетероарил или Rb и Rc,совместно с атомом азота, к которому они присоединены, образуют кольцо (например, 3-7-членное кольцо, например, 5-7-членное кольцо; кольцо, содержащее по меньшей мере один гетероатом, например, атом азота, кислорода или серы); и n представляет собой 0, 1, 2 или 3.
[107] В некоторых вариантах реализации соединение представляет собой соединение формулы (Ib-4)
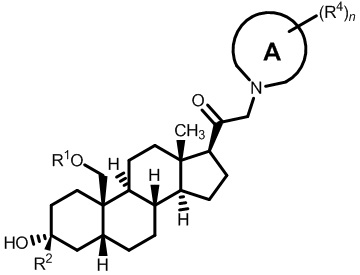
где R4 представляет собой циано, нитро, гидрокси, галоген, C1-C6 алкил, C1-C6 алкокси, -C(O)Ra, -C(O)N(Rb)(Rc), -C(O)ORa, -N(Rb)(Rc), -OC(O)N(Rb)(Rc), -OC(O)ORa, -OC(O)Ra, -S(O)0-2Ra, -S(O)0-2ORa или -S(O)0-2N(Rb)(Rc); каждый Ra представляет собой водород или C1-C6 алкил; каждый Rb и Rc представляет собой независимо водород, C1-C6алкил, карбоциклил, гетероциклил, арил, гетероарил, или Rb и Rc,совместно с атомом азота, к которому они присоединены, образуют кольцо (например, 3-7-членное кольцо, например, 5-7-членное кольцо; кольцо, содержащее по меньшей мере один гетероатом, например, атом азота, кислорода или серы); и n представляет собой 0, 1, 2 или 3.
[108] В некоторых вариантах реализации A является моноциклическим.
[109] В некоторых вариантах реализации A является бициклическим.
[110] В некоторых вариантах реализации A присоединен через азот.
[111] В некоторых вариантах реализации A представляет собой 5-членный или 6-членный гетероарил или гетероциклил. В некоторых вариантах реализации A представляет собой 5-членный или 6-членный гетероарил или гетероциклил, содержащий не более четырех атомов азота. В некоторых вариантах реализации A представляет собой 5-членный или 6-членный гетероарил или гетероциклил, содержащий 1, 2, 3 или 4 атома азота.
[112] В некоторых вариантах реализации A представляет собой гетероциклил. В некоторых вариантах реализации A представляет собой морфолин или пиперазин. В некоторых вариантах реализации A представляет собой


[113] В некоторых вариантах реализации A представляет собой гетероарил. В некоторых аспектах данных вариантов реализации гетероарил содержит не более пяти атомов азота. В некоторых вариантах реализации гетероарил представляет собой бензотриазол, азабензотриазол, диазабензотриазол, бензопиразол, азабензопиразол или диазабензопиразол. В некоторых вариантах реализации A представляет собой











[114] В некоторых вариантах реализации гетероарил является 5-членным.
[115] В некоторых вариантах реализации A содержит не более четырех атомов азота. В некоторых вариантах реализации A содержит 2, 3 или 4 атома азота. В некоторых вариантах реализации A представляет собой пиразол, триазол или тетразол. В некоторых вариантах реализации A представляет собой незамещенный пиразол, триазол или тетразол. В некоторых вариантах реализации A представляет собой
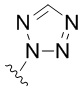



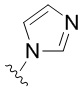


[116] В некоторых вариантах реализации R1 представляет собой C1-C6 алкил, C1-C6 алкенил, C1-C6 алкинил, карбоциклил или гетероциклил. В некоторых вариантах реализации R1 представляет собой C1-C6 алкил. В некоторых вариантах реализации R1 представляет собой метил, этил или изопропил. В некоторых вариантах реализации R1 представляет собой метил. В некоторых вариантах реализации R1 представляет собой этил.
[117] В некоторых вариантах реализации R2 представляет собой C1-C6алкил. В некоторых вариантах реализации R2 представляет собой метил. В некоторых вариантах реализации R2 представляет собой C1-C6галогеналкил. В некоторых вариантах реализации R2 представляет собой -CF3.
[118] В некоторых вариантах реализации n представляет собой 0.
[119] В некоторых вариантах реализации n представляет собой 1 или 2, и R4 представляет собой циано, галоген, C1-C6 алкил, C1-C6 алкокси, -C(O)Ra или -S(O)0-2Ra.
[120] В некоторых вариантах реализации R4 представляет собой Br, Cl или F. В некоторых вариантах реализации R4 представляет собой F. В некоторых вариантах реализации R4 представляет собой Cl. В некоторых вариантах реализации R4 представляет собой Br. В некоторых вариантах реализации R4 представляет собой -OCH3. В некоторых вариантах реализации R4 представляет собой -OCF3. В некоторых вариантах реализации R4 представляет собой циано. В некоторых вариантах реализации R4 представляет собой C1-C6 алкил. В некоторых вариантах реализации R4 представляет собой метил. В некоторых вариантах реализации R4 представляет собой -C(O)Ra. В некоторых вариантах реализации Ra представляет собой C1-C6 алкил. В некоторых вариантах реализации Ra представляет собой метил. В некоторых вариантах реализации R4 представляет собой -CF3. В некоторых вариантах реализации R4 представляет собой -S(O)2Ra. В некоторых вариантах реализации Ra представляет собой метил.
[121] В некоторых вариантах реализации R1 представляет собой C1-C6 алкил, и R4 представляет собой -C(O)Ra.В некоторых вариантах реализации R1 представляет собой метил, и R4 представляет собой -C(O)Me.
[122] В некоторых вариантах реализации n представляет собой 2, и R4 представляет собой циано, галоген, C1-C6 алкил, C1-C6 алкокси, -C(O)Ra или -S(O)0-2Ra. В некоторых вариантах реализации n представляет собой 2, один R4 представляет собой F и один R4представляет собой F. В некоторых вариантах реализации n представляет собой 2, один R4 представляет собой F и один R4представляет собой Cl. В некоторых вариантах реализации n представляет собой 2, один R4 представляет собой -OCH3 и один R4представляет собой -OCH3.
[123] В некоторых вариантах реализации n представляет собой 0 или 1; R1 представляет собой водород или C1-C6 алкил; и R2 представляет собой метил.
[124] В некоторых вариантах реализации R1 представляет собой метил, этил или изопропил. В некоторых вариантах реализации R1 представляет собой метил.
[125] В некоторых вариантах реализации R4 представляет собой C1-C6 алкил, -C(O)Ra или -S(O)0-2Ra. В некоторых вариантах реализации R4 представляет собой метил. В некоторых вариантах реализации R4 представляет собой -C(O)Me. В некоторых вариантах реализации R4 представляет собой -S(O)2Me. В некоторых вариантах реализации R4представляет собой циано.
[126] В некоторых вариантах реализации соединение выбрано из:



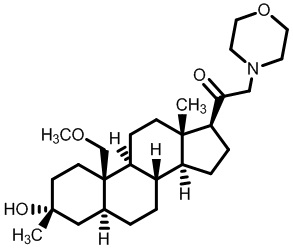




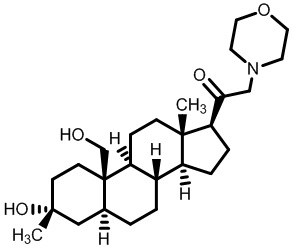


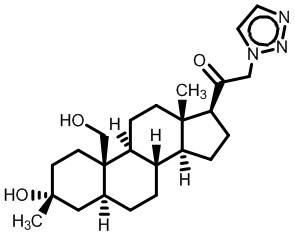


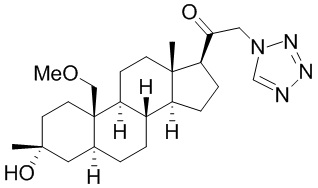



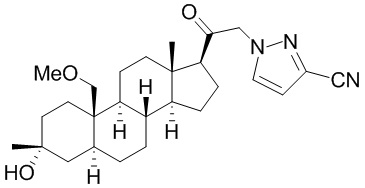








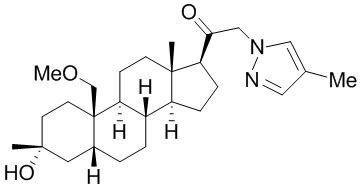




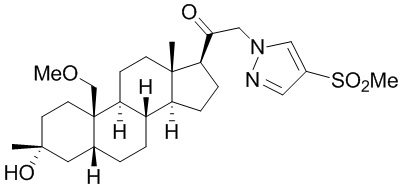






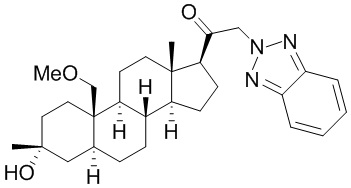





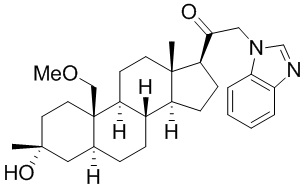
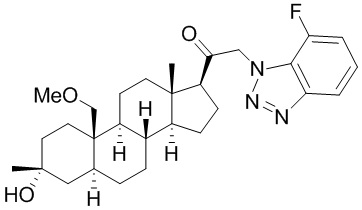




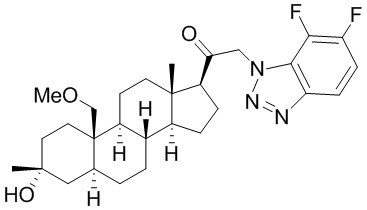







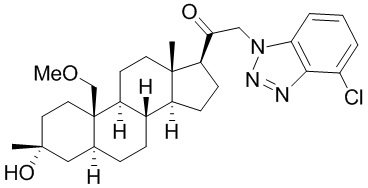

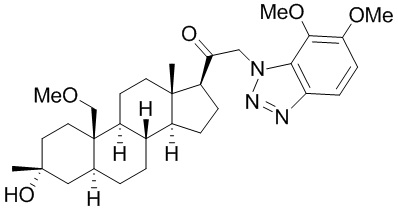



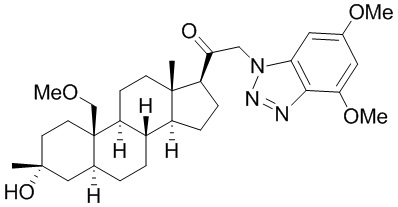


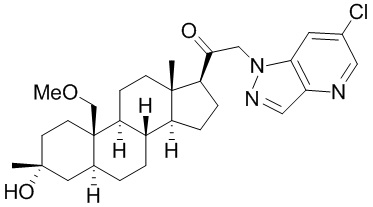




















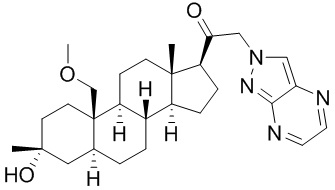

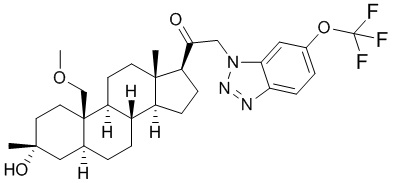



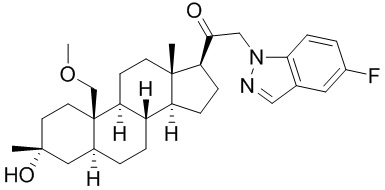

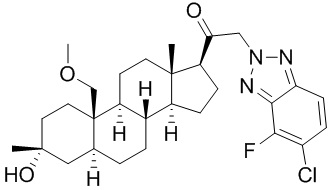
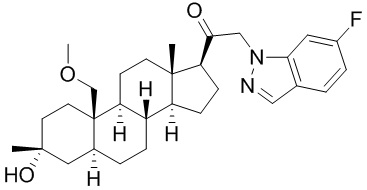


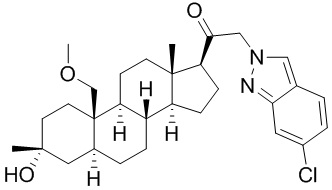
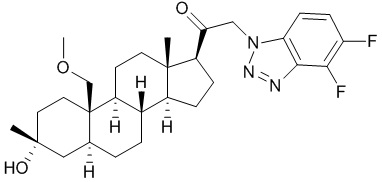
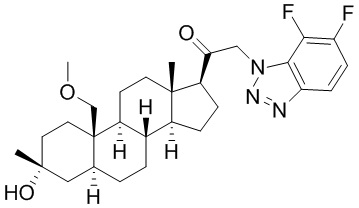








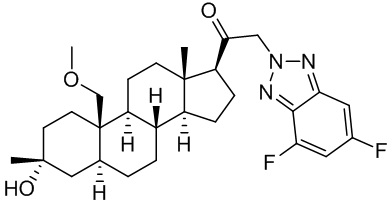











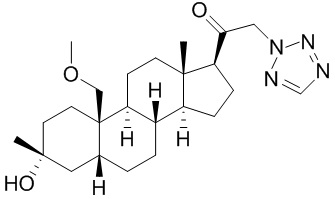

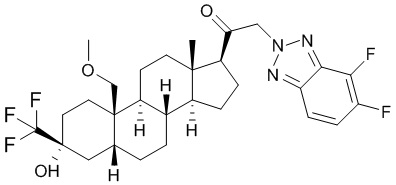





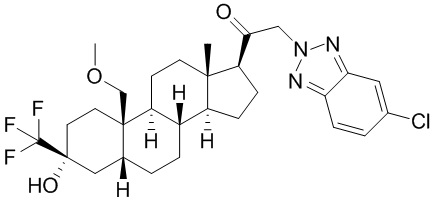



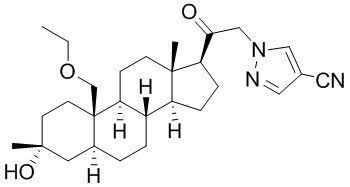


[127] В одном аспекте предложена фармацевтическая композиция, содержащая соединение по любому из предшествующих пунктов и фармацевтически приемлемое вспомогательное вещество.
[128] В одном аспекте предложен способ индуцирования седации и/или анестезии у субъекта, содержащий введение субъекту эффективного количества соединения формулы (I):

его фармацевтически приемлемой соли, где: A представляет собой необязательно замещенный азотсодержащий гетероарил или гетероциклил; L представляет собой -C(R3)(R3)-, -O-, -S- или -NR3-; R1 представляет собой водород или C1-C6 алкил, C1-C6 алкенил, C1-C6 алкинил, карбоциклил или гетероциклил; R2 представляет собой водород, C1-C6 алкил (например, C1-C6 галогеналкил) или C1-C6 алкокси; каждый R3 представляет собой независимо водород или C1-C6 алкил; R5 отсутствует или представляет собой водород; и




[129] В одном аспекте предложен способ введения эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции соединения, как описано в настоящем документе, например, соединения формулы (I), (Ia), (Ia-1), (Ia-2), (Ia-3), (Ia-4), (Ib), (Ib-1), (Ib-2), (Ib-3) или (Ib-4), субъекту, которому это необходимо, при этом субъект испытывает седацию и/или анестезию не позднее двух часов после введения.
[130] В некоторых вариантах реализации субъект испытывает седацию и/или анестезию не позднее одного часа после введения.
[131] В некоторых вариантах реализации субъект испытывает седацию и/или анестезию немедленно.
[132] В некоторых вариантах реализации соединение вводят посредством внутривенного введения.
[133] В некоторых вариантах реализации соединение вводят постоянно.
[134] В некоторых вариантах реализации субъект представляет собой млекопитающее. В некоторых вариантах реализации субъектом является человек.
[135] В некоторых вариантах реализации соединение вводят в комбинации с другим терапевтическим агентом.
[136] В одном аспекте предложен способ лечения припадков у субъекта, включающий введение субъекту эффективного количества соединения формулы (I):

его фармацевтически приемлемой соли, где: A представляет собой необязательно замещенный азотсодержащий гетероарил или гетероциклил; L представляет собой -C(R3)(R3)-, -O-, -S- или -NR3-; R1 представляет собой водород или C1-C6 алкил, C1-C6 алкенил, C1-C6 алкинил, карбоциклил или гетероциклил; R2 представляет собой водород, C1-C6 алкил (например, C1-C6 галогеналкил) или C1-C6 алкокси; каждый R3 представляет собой независимо водород или C1-C6 алкил; R5 отсутствует или представляет собой водород; и




[137] В одном аспекте предложен способ лечения эпилепсии или эпилептического статуса у субъекта, способ, включающий введение субъекту эффективного количества соединения формулы (I):

его фармацевтически приемлемой соли, где: A представляет собой необязательно замещенный азотсодержащий гетероарил или гетероциклил; L представляет собой -C(R3)(R3)-, -O-, -S- или -NR3-; R1 представляет собой водород или C1-C6 алкил, C1-C6 алкенил, C1-C6 алкинил, карбоциклил или гетероциклил; R2 представляет собой водород, C1-C6 алкил (например, C1-C6 галогеналкил) или C1-C6 алкокси; каждый R3 представляет собой независимо водород или C1-C6 алкил; R5 отсутствует или представляет собой водород; и




[138] В одном аспекте предложен способ лечения расстройств, связанных с функцией ГАМК у субъекта, которому это необходимо, при этом способ включает введение субъекту терапевтически эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции одного из соединений, как описано в настоящем документе, например, соединения формулы (I), (Ia), (Ia-1), (Ia-2), (Ia-3), (Ia-4), (Ib), (Ib-1), (Ib-2), (Ib-3) или (Ib-4).
[139] В одном аспекте предложен способ лечения расстройства, связанного с ЦНС, у субъекта, которому это необходимо, при этом способ включает введение субъекту эффективного количества соединения, как описано в настоящем документе, например, соединения формулы (I), (Ia), (Ia-1), (Ia-2), (Ia-3), (Ia-4), (Ib), (Ib-1), (Ib-2), (Ib-3) или (Ib-4) или его фармацевтически приемлемой соли. В некоторых вариантах реализации расстройство, связанное с ЦНС, представляет собой расстройство сна, расстройство настроения, расстройство шизофренического спектра, судорожное расстройство, расстройство памяти и/или познавательной деятельности, расстройство движения, расстройство личности, расстройство аутистического спектра, боль, травматическое повреждение головного мозга, заболевание сосудов, расстройство, связанное со злоупотреблением психоактивными веществами и/или абстинентный синдром или тиннитус. В некоторых вариантах реализации субъект представляет собой субъект с синдромом Ретта, синдромом ломкой Х-хромосомы или синдромом Ангельмана.
[140] В одном аспекте предложен набор, содержащий твердую композицию, содержащую соединение как описано в настоящем документе, например, соединение формулы (I), (Ia), (Ia-1), (Ia-2), (Ia-3), (Ia-4), (Ib), (Ib-1), (Ib-2), (Ib-3) или (Ib-4) и стерильный разбавитель.
Фармацевтические композиции
[141] В одном аспекте в настоящем изобретении предложена фармацевтическая композиция, содержащая соединение согласно настоящему изобретению (также называемое как «активный ингредиент») и фармацевтически приемлемое вспомогательное вещество. В некоторых вариантах реализации фармацевтическая композиция содержит эффективное количество активного ингредиента. В некоторых вариантах реализации фармацевтическая композиция содержит терапевтически эффективное количество активного ингредиента. В некоторых вариантах реализации фармацевтическая композиция содержит профилактически эффективное количество активного ингредиента.
[142] Фармацевтические композиции, предложенные в настоящем документе, можно вводить различными путями, включая, но не ограничиваясь ими, пероральное (энтеральное) введение, парентеральное (посредством инъекции) введение, ректальное введение, трансдермальное введение, интрадермальное введение, интратекальное введение, подкожное (SC) введение, внутривенное (IV) введение, внутримышечное (IM) введение и интраназальное введение.
[143] В целом, соединения, предложенные в настоящем документе, вводят в эффективном количестве. Количество фактически вводимого соединения, как правило, определяет лечащий врач в свете соответствующих обстоятельств, включая состояние, подлежащее лечению, выбранный путь введения, конкретное вводимое соединение, возраст, массу и реакцию индивидуального пациента, тяжесть симптомов пациента и подобные.
[144] При применении для предотвращения возникновения расстройства, связанного с ЦНС, соединения, предложенные в настоящем документе, вводят субъекту с риском развития этого состояния, как правило, по рекомендации и под наблюдением врача, при уровнях дозировок, описанных выше. Субъекты с риском развития конкретного состояния в целом включают субъекты, которые имеют семейную историю состояния, или субъекты, которые были идентифицированы посредством генетического тестирования или скрининга, особенно восприимчивые к развитию заболевания.
[145] Фармацевтические композиции, предложенные в настоящем документе, также можно вводить постоянно («постоянное введение»). Постоянное введение относится к введению соединения или его фармацевтической композиции в течение длительного периода времени, например, к примеру, более 3 месяцев, 6 месяцев, 1 года, 2 лет, 3 лет, 5 лет и т.д. или может продолжаться бессрочно, например, всю оставшуюся жизнь субъекта. В некоторых вариантах реализации длительное введение обеспечивает постоянный уровень соединения в крови, например, в пределах терапевтического окна в течение длительного периода времени.
[146] Фармацевтические композиции согласно настоящему изобретению можно кроме того доставлять с применением различных способов дозирования. Например, в некоторых вариантах реализации фармацевтическую композицию можно предоставлять в форме разовой дозы, например, для того, чтобы повысить концентрацию соединения в крови на эффективном уровне. Введение болюсной дозы зависит от системных уровней активного ингредиента, необходимого в организме, например, внутримышечная или подкожная болюсная доза обеспечивает медленное высвобождение активного ингредиента, в то время как разовая доза, доставленная непосредственно в вены (например, через капельницу) обеспечивает более быструю доставку, которая быстро увеличивает концентрацию активного ингредиента в крови на эффективный уровень. В других вариантах реализации фармацевтическую композицию можно вводить в форме непрерывной инфузии, например, посредством капельницы, чтобы обеспечить поддержание постоянной концентрации активного ингредиента в организме субъекта. Кроме того, в других вариантах реализации фармацевтическую композицию можно вводить сперва в качестве болюсной дозы с последующей непрерывной инфузией.
[147] Композиции для перорального введения могут быть в форме нерасфасованных жидких растворов или суспензий или нерасфасованных порошков. Чаще, однако, композиции предложены в единичных лекарственных формах для облегчения точного дозирования. Термин «единичные лекарственные формы» относится к физически дискретным единицам, подходящим в качестве единичных доз для человека и других млекопитающих, причем каждая единица содержит заданное количество активного материала, рассчитанное на получение необходимого терапевтического эффекта в сочетании с подходящим фармацевтическим вспомогательным веществом. Типичные единичные лекарственные формы включают предварительно заполненные, предварительно отмеренные ампулы или шприцы с жидкими композициями или пилюли, таблетки, капсулы или тому подобное в случае твердых композиций. В таких композициях соединение обычно представляет собой второстепенный компонент (от примерно 0,1 до примерно 50% по массе или предпочтительно от примерно 1 до примерно 40% по массе) с остатком в форме различных носителей или вспомогательных веществ и технологических добавок, пригодных для получения необходимой лекарственной формы.
[148] При пероральном введении от одной до пяти, и особенно от двух до четырех, и обычно три пероральные дозы в день представляют собой типичные схемы лечения. При использовании этих моделей дозирования каждая доза содержит от примерно 0,01 до примерно 20 мг/кг соединения, предложенного в настоящем документе, с предпочтительными дозами, каждая из которых обеспечивает от примерно 0,1 до примерно 10 мг/кг и особенно от примерно 1 до примерно 5 мг/кг.
[149] Трансдермальные дозы, как правило, выбирают таким образом, чтобы обеспечить аналогичные или более низкие уровни в крови, чем достигаемые с применением инъекционных доз, в целом в количестве от примерно 0,01 до примерно 20% по массе, предпочтительно от примерно 0,1 до примерно 20% по массе, предпочтительно от примерно 0,1 до примерно 10% по массе и более предпочтительно от примерно 0,5 до примерно 15% по массе.
[150] Уровни инъекционных доз находятся в диапазоне от примерно 0,1 мг/кг/час по меньшей мере до 20 мг/кг/час, все в течение от примерно 1 до примерно 120 часов и особенно от 24 до 96 часов. Предварительная разовая доза от примерно 0,1 мг/кг до примерно 10 мг/кг или более может быть также введена для достижения достаточного устойчивого уровня. Ожидается, что максимальная общая доза не превышает примерно 5 г/сут для пациента человека от 40 до 80 кг.
[151] Жидкие формы, подходящие для перорального введения, могут включать подходящий водный или неводный носитель с буферами, суспендирующими и диспергирующими агентами, красителями, ароматизаторами и подобными. Твердые формы могут включать, например, любой из следующих ингредиентов или соединений аналогичного характера: связующее вещество, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; вспомогательное вещество, такое как крахмал или лактоза, дезинтегрирующий агент, такой как альгиновая кислота, Примогель или кукурузный крахмал; смазывающее вещество, такое как стеарат магния; скользящее вещество, такое как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или вкусовой агент, такой как мята перечная, метилсалицилат или апельсиновая отдушка.
[152] Инъекционные композиции, как правило, основаны на инъекционном стерильном физиологическом растворе или забуференном фосфатом физиологическом растворе или других инъекционных наполнителях, известных специалисту в данной области. Как и ранее, активное соединение в таких композициях, как правило, является второстепенным компонентом, часто составляющим от примерно 0,05 до 10% по массе с остатком в форме инъекционного вспомогательного вещества и подобных.
[153] Трансдермальные композиции обычно готовят в форме мази или крема для наружного применения, содержащих активный ингредиент(ы). При приготовлении в форме мази активные ингредиенты, как правило, объединяют с парафиновой или смешиваемой с водой основой мази. Как вариант, активные ингредиенты могут быть приготовлены в форме крема, например, с кремовой основой масло-в-воде. Такие трансдермальные составы хорошо известны в данной области и в целом включают дополнительные ингредиенты для повышения проникновения через кожу и стабильности активных ингредиентов или состава. Все такие известные трансдермальные составы и ингредиенты включены в объем, предложенный в настоящем документе.
[154] Соединения, предложенные в настоящем документе, также можно вводить с помощью трансдермального устройства. Соответственно, трансдермальное введение может быть осуществлено с применением пластыря резервуарного или пористо-мембранного типа или с применением разнообразных твердых матриц.
[155] Вышеописанные компоненты для вводимых перорально, инъекционно или наружно композиций являются исключительно типичными. Другие материалы, а также методики обработки и подобное, приведены в части 8 Remington’s Pharmaceutical Sciences, 17th edition, 1985, Mack Publishing Company, Easton, Pennsylvania, которая включена в настоящую заявку посредством ссылки.
[156] Соединения согласно настоящему изобретению также можно вводить в формах с замедленным высвобождением или из систем доставки лекарственных средств с замедленным высвобождением. Описание типичных материалов для замедленного высвобождения можно найти в Remington’s Pharmaceutical Sciences.
[157] Настоящее изобретение также относится к фармацевтически приемлемой соли присоединения кислоты соединения согласно настоящему изобретению. Кислота, которую можно применять для получения фармацевтически приемлемой соли, представляет собой кислоту, которая образует нетоксичную соль присоединения кислоты, т.е., соль, содержащую фармакологически приемлемые анионы, такие как гидрохлорид, гидройодид, гидробромид, нитрат, сульфат, бисульфат, фосфат, ацетат, лактат, цитрат, тартрат, сукцинат, малеат, фумарат, бензоат, пара-толуолсульфонат и подобные.
[158] В одном аспекте в настоящем изобретении предложена фармацевтическая композиция, содержащая соединение согласно настоящему изобретению и фармацевтически приемлемое вспомогательное вещество, например, композиция, подходящая для инъекций, например, для внутривенного (IV) введения.
[159] Фармацевтически приемлемые вспомогательные вещества включают любой и все разбавители или другие жидкие носители, диспергирующие или суспендирующие агенты, поверхностно-активные агенты, изотонические агенты, консерванты, смазывающие вещества и тому подобное, в качестве подходящих для конкретной необходимой лекарственной формы, например, инъекции. Общие обсуждения по приготовлению и/или производству агентов для фармацевтических композиций можно найти, например, в Remington's Pharmaceutical Sciences, Sixteenth Edition, E.W. Martin (Mack Publishing Co., Easton, Pa., 1980) и Remington: The Science and Practice of Pharmacy, 21st Edition (Lippincott Williams & Wilkins, 2005).
[160] Например, инъекционные лекарственные средства, такие как стерильные инъекционные водные суспензии, могут быть приготовлены в соответствии с известной областью техники с применением подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Примерные вспомогательные вещества, которые можно применять, включают, но не ограничиваются ими, воду, стерильный физиологический раствор или забуференный фосфатом физиологический раствор или раствор Рингера.
[161] В некоторых вариантах реализации фармацевтическая композиция дополнительно содержит производные циклодекстрина. Наиболее распространенные циклодекстрины представляют собой α-, β- и γ- циклодекстрины, состоящие из 6, 7 и 8 α-l ,4-связанных единиц глюкозы, соответственно, необязательно содержащих один или более заместителей на связанных остатках сахара, которые включают, но не ограничиваются ими, замещенное или незамещенное метилированное, гидроксиалкилированное, ацилированное и сульфоалкилового эфира замещение. В некоторых вариантах реализации циклодекстрин представляет собой сульфоалкиловый эфир β-циклодекстрина, например, например, сульфобутиловый эфир β-циклодекстрина, также известный как Captisol®. См., например, патент США № 5376645. В некоторых вариантах реализации композиция содержит гексапропил-β-циклодекстрин. В более конкретном варианте реализации композиция содержит гексапропил-β-циклодекстрин (10-50% в воде).
[162] Инъекционные композиции могут быть стерилизованы, например, посредством фильтрации через фильтр, задерживающий бактерии, или посредством включения стерилизующих агентов в форме стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной воде или другой инъекционной среде перед применением.
[163] В целом, соединения, предложенные в настоящем документе, вводят в эффективном количестве. Количество соединения, вводимое фактически, как правило, определяет лечащий врач в свете соответствующих обстоятельств, включая состояние, подлежащее лечению, выбранный путь введения, конкретное вводимое соединение, возраст, массу, реакцию отдельного пациента, тяжесть симптомов пациента и подобное.
[164] Композиции представлены в единичных лекарственных формах для облегчения точного дозирования. Термин «единичные лекарственные формы» относится к физически дискретным единицам, подходящим в качестве единичных доз для субъектов человека и других млекопитающих, причем каждая единица содержит заданное количество активного материала, рассчитанное на получение необходимого терапевтического эффекта в сочетании с подходящим фармацевтическим вспомогательным веществом. Типичные единичные лекарственные формы включают предварительно заполненные, предварительно отмеренные ампулы или шприцы с жидкими композициями. В таких композициях соединение обычно представляет собой второстепенный компонент (от примерно 0,1 до примерно 50% по массе или предпочтительно от примерно 1 до примерно 40% по массе) с остатком в форме различных носителей или наполнителей и технологических добавок, пригодных для получения необходимой лекарственной формы.
[165] Соединения, предложенные в настоящем документе, можно вводить в качестве единственного активного агента или их можно вводить в комбинации с другими активными агентами. В одном аспекте в настоящем изобретении предложена комбинация соединения согласно настоящему изобретению и другого фармакологически активного агента. Введение в комбинации можно проводить любым способом, очевидным для специалистов в данной области, включая, например, раздельное, последовательное и параллельное и чередующееся введение.
[166] Хотя описание фармацевтических композиций, предложенных в настоящем документе, главным образом относится к фармацевтическим композициям, которые пригодны для введения человеку, специалисту в данной области будет понятно, что такие композиции, как правило, пригодны для введения в организм животных всех видов. Модификация фармацевтических композиций, пригодных для введения человеку для того, чтобы сделать композиции пригодными для введения различных животных, хорошо понятна, и фармаколог в области ветеринарии может конструировать и/или выполнить такую модификацию посредством обычного эксперимента. Общие обсуждения по приготовлению и/или производству фармацевтических композиций можно найти, например, в Remington: The Science and Practice of Pharmacy 21st ed., Lippincott Williams & Wilkins, 2005.
Способы применения и лечения
[167] Как в целом описано в настоящем документе, настоящее изобретение направлено на C21-замещенные нейроактивные стероиды, созданные, например, чтобы действовать в качестве модуляторов ГАМК. В некоторых вариантах реализации предполагают, что такие соединения подходят в качестве терапевтических агентов для индуцирования анестезии и/или седации у субъекта. В некоторых вариантах реализации предполагают, что такие соединения подходят в качестве терапевтических агентов для лечения расстройства, связанного с ЦНС (например, расстройства сна, расстройства настроения, расстройства шизофренического спектра, судорожного расстройства, расстройства памяти и/или познавательной деятельности, расстройства движения, расстройства личности, расстройства аутистического спектра, боли, травматического повреждения головного мозга, заболевания сосудов, расстройства, связанного со злоупотреблением психоактивными веществами и/или абстинентного синдрома или тиннитуса) у субъекта, которому это необходимо (например, субъект с синдромом Ретта, синдромом ломкой Х-хромосомы или синдромом Ангельмана).
[168] Таким образом, в одном аспекте в настоящем изобретении предложен способ индуцирования седации и/или анестезии у субъекта, включающий введение субъекту эффективного количества соединения согласно настоящему изобретению или его композиции. В некоторых вариантах реализации соединение вводят посредством внутривенного введения.
[169] Более ранние исследования (см., например, Gee et al., European Journal of Pharmacology, 136:419-423 (1987)) демонстрируют, что некоторые 3α-гидроксилированные стероиды являются на несколько порядков более активными, чем модуляторы ГАМК-рецепторного комплекса (ГРК), описанные другими (см., например, Majewska et al., Science 232:1004-1007 (1986); Harrison et al., J Pharmacol. Exp. Ther. 241:346-353 (1987)). Majewska et al. и Harrison et al. учат, что 3α-гидроксилированные-5-восстановленные стероиды способны лишь на значительно более низкие уровни эффективности. Экспериментальные данные in vitro и in vivo в настоящее время показали, что высокая активность этих стероидов позволяет им быть терапевтически пригодными для модуляции возбудимости головного мозга через ГРК (см., например, Gee et al., European Journal of Pharmacology, 136:419-423 (1987); Wieland et al., Psychopharmacology 118(l):65-71 (1995)).
[170] Различные синтетические стероиды также были получены в качестве нейроактивных стероидов. См., например, патент США 5232917, в котором описаны нейроактивные стероидные соединения, подходящие для лечения стресса, тревоги, бессонницы, эпилепсии и расстройств настроения, которые восприимчивы к ГРК-активным агентам, например, депрессии, терапевтически благоприятным образом. Кроме того, ранее было показано, что эти стероиды взаимодействуют с уникальным сайтом на ГРК, который отличается от других известных сайтов взаимодействия (например, барбитуратов, бензодиазепинов и ГАМК), где ранее было выявлено терапевтически благоприятное воздействие на стресс, тревогу, сон, расстройства настроения и эпилепсию (см., например, Gee, K.W. and Yamamura, H.I., “Benzodiazepines and Barbiturates: Drugs for the Treatment of Anxiety, Insomnia and Seizure Disorders,” in Central Nervous System Disorders, Horvell, ed., Marcel-Dekker, New York (1985), pp. 123-147; Lloyd, K.G. and Morselli, P.L., “Psychopharmacology of GABAergic Drugs,” in Psychopharmacology: The Third Generation of Progress, H.Y. Meltzer, ed., Raven Press, N.Y. (1987), pp. 183-195; and Gee et al., European Journal of Pharmacology, 136:419-423 (1987). Эти соединения являются желательными из-за их длительности, активности и активности при пероральном применении (наряду с другими формами введения).
[171] Соединения согласно настоящему изобретению, как описано в настоящем документе, в целом предназначены для модуляции функции ГАМК и, следовательно, чтобы действовать как нейроактивные стероиды для лечения и предотвращения состояний, связанных с ЦНС, у субъекта. Модуляция в настоящем документе относится к ингибированию или потенцированию функции рецептора ГАМК. Таким образом, соединения и фармацевтические композиции, предлагаемые в настоящем документе, находят применение в качестве терапевтических средств для предотвращения и/или лечения состояний, связанных с ЦНС, у млекопитающих, включая человека и других млекопитающих, не относящихся к человеку. Таким образом, и как было сказано ранее, настоящее изобретение включает в свой объем и распространяется на перечисленные способы лечения, а также соединения для данных способов и применение таких соединений для получения лекарственных средств, подходящих для таких способов.
[172] Примерные состояния ЦНС, связанные с модуляцией ГАМК включают, но не ограничиваются ими, расстройства сна [например, бессонницу], расстройства настроения [например, депрессию, дистимическое расстройство (например, легкую степень депрессии), биполярное расстройство (например, I и/или II), тревожные расстройства (например, генерализованное тревожное расстройство (GAD), социальное тревожное расстройство), стресс, посттравматическое стрессовое расстройство (PTSD), расстройства навязчивых состояний (например, обсессивно-компульсивное расстройство (OCD))], расстройства шизофренического спектра [например, шизофрению, шизоаффективное расстройство], судорожные расстройства [например, эпилепсию (например, эпилептический статус (SE)), припадки], расстройства памяти и/или познавательной деятельности [например, расстройства внимания (например, синдром дефицита внимания и гиперактивности (СДВГ)), деменцию (например, деменцию по типу Альцгеймера, деменцию с тельцами Леви, деменцию сосудистого типа], расстройства движения [например, болезнь Гентингтона, болезнь Паркинсона], расстройства личности [например, антисоциальное расстройство личности, обсессивно-компульсивное расстройство личности], расстройства аутистического спектра (ASD) [например, аутизм, моногенные причины аутизма, такие как синаптопатию, например, синдром Ретта, синдром ломкой X-хромосомы, синдром Ангельмана], боль [например, нейропатическую боль, болевые синдромы, связанные с травмой, острую боль, хроническую боль], травматическое повреждение головного мозга (TBI), сосудистые заболевания [например, инсульт, ишемию, сосудистые патологии], расстройства, связанные со злоупотреблением психоактивными веществами и/или абстинентные синдромы [например, пристрастие к опиатам, кокаину и/или алкоголю] и тиннитус.
[173] В другом аспекте предложена комбинация соединения согласно настоящему изобретению и другого фармакологически активного агента. Соединения, предложенные в настоящем документе, можно вводить в качестве единственного активного агента, или они могут быть введены в комбинации с другими агентами. Введение в комбинации можно проводить любым способом, очевидным специалистам в данной области, включая, например, раздельное, последовательное, параллельное и переменное введение.
[174] В другом аспекте предложен способ лечения или предотвращения возбудимости головного мозга у субъекта, восприимчивого или страдающего состоянием, связанным с возбудимостью головного мозга, включающий введение субъекту эффективного количества соединения согласно настоящему изобретению.
[175] В другом аспекте предложен способ лечения или предотвращения стресса или тревоги у субъекта, включающий введение субъекту, которому необходимо такое лечение, эффективного количества соединения согласно настоящему изобретению или его композиции.
[176] В другом аспекте предложен способ облегчения или предотвращения судорожной активности у субъекта, включающий введение субъекту, которому необходимо такое лечение, эффективного количества соединения согласно настоящему изобретению.
[177] В другом аспекте предложен способ облегчения или предотвращения бессонницы у субъекта, включающий введение субъекту, которому необходимо такое лечение, эффективного количества соединения согласно настоящему изобретению или его композиции.
[178] В другом аспекте предложен способ индуцирования сна и поддержания по существу уровня быстрого сна, который обнаруживают при нормальном сне, когда не возникает существенный рецидив бессонницы, включающий введение эффективного количества соединения согласно настоящему изобретению.
[179] В другом аспекте предложен способ облегчения или предотвращения ПМС или ПРД у субъекта, включающий введение субъекту, которому необходимо такое лечение, эффективного количества соединения согласно настоящему изобретению.
[180] В другом аспекте предложен способ лечения или предотвращения расстройств настроения у субъекта, включающий введение субъекту, которому необходимо такое лечение, эффективного количества соединения согласно настоящему изобретению. В конкретных вариантах реализации расстройство настроения представляет собой депрессию.
[181] В другом аспекте предложен способ индуцирования анестезии у субъекта, включающий введение субъекту эффективного количества соединения согласно настоящему изобретению.
[182] В другом аспекте предложен способ улучшения когнитивных функций или лечения расстройства памяти посредством введения субъекту терапевтически эффективного количества соединения согласно настоящему изобретению. В некоторых вариантах реализации расстройство представляет собой болезнь Альцгеймера. В некоторых вариантах реализации расстройство представляет собой синдром Ретта.
[183] В другом аспекте предложен способ лечения расстройств внимания посредством введения субъекту терапевтически эффективного количества соединения согласно настоящему изобретению. В некоторых вариантах реализации расстройство внимания представляет собой СДВГ.
[184] В некоторых вариантах реализации соединение вводят субъекту постоянно. В некоторых вариантах реализации соединение вводят субъекту перорально, подкожно, внутримышечно или внутривенно.
Анестезия / Седация
[185] Анестезия представляет собой фармакологически индуцированное и обратимое состояние амнезии, анальгезии, утраты реактивности, утраты рефлексов скелетных мышц, снижения реакции на стресс или всего перечисленного одновременно. Эти эффекты могут быть получены из одного лекарственного средства, которое в одиночку обеспечивает правильное сочетание эффектов, или иногда с помощью комбинации лекарственных средств (например, снотворных, седативных, паралитических, анальгетических) для достижения очень конкретных комбинаций результатов. Анестезия позволяет пациентам пройти операцию и другие процедуры без дистресса и боли, которые они испытали бы в противном случае.
[186] Седация представляет собой снижение раздражительности или волнения посредством введения фармакологического агента, в целом для облегчения медицинской процедуры или диагностической процедуры.
[187] Седация и анальгезия включают континуум состояний сознания, начиная от минимальной седации (анксиолиза) до общей анестезии.
[188] Минимальная седация также известна как анксиолиз. Минимальная седация представляет собой медикаментозное состояние, в течение которого пациент нормально реагирует на голосовые команды. Когнитивная функция и координация могут быть нарушены. На респираторную и сердечно-сосудистую функции, как правило, влияние отсутствует.
[189] Умеренная седация/анальгезия (седация с сохранением сознания) представляет собой медикаментозное угнетение сознания, в течение которого пациент целенаправленно реагирует на голосовые команды, либо по отдельности, либо в сочетании с легкой тактильной стимуляцией. Как правило, для поддержания свободной проходимости дыхательных путей вмешательства не требуется. Спонтанной вентиляции, как правило, достаточно. Сердечно-сосудистая функция обычно поддерживается.
[190] Глубокая седация/анальгезия представляет собой медикаментозное угнетение сознания, в течение которого пациент не может быть легко возбужден, но реагирует целенаправленно (не рефлекторно от болевого стимула) после повторной или болевой стимуляции. Независимая вентиляторная функция может быть нарушена, и пациенту может потребоваться помощь для поддержания свободной проходимости дыхательных путей. Спонтанной вентиляции может быть недостаточно. Сердечно-сосудистая функция обычно поддерживается.
[191] Общая анестезия представляет собой медикаментозную потерю сознания, в течение которого пациент не возбудим, даже на болевые раздражители. Способность поддерживать независимую вентиляторную функцию часто нарушается и часто требуется помощь для поддержания свободной проходимости дыхательных путей. Может потребоваться вентиляция с положительным давлением из-за угнетения спонтанной вентиляции или медикаментозного угнетения нервно-мышечной функции. Сердечно-сосудистая функция может быть нарушена.
[192] Седация в отделении интенсивной терапии (ОИТ) позволяет угнетать осознание пациентами окружающей среды и снижать их реакции на внешнее раздражение. Она может играть определенную роль в уходе за пациентом в критическом состоянии и охватывать широкий спектр контроля симптомов, которые будут варьироваться между пациентами и между отдельными людьми на протяжении их болезней. Тяжелую седацию в отделениях интенсивной терапии используют для облегчения переносимости эндотрахеальной трубки и синхронизации искусственной вентиляции легких, часто агентами, блокирующими нервно-мышечную деятельность.
[193] В некоторых вариантах реализации седацию (например, долговременную седацию, продолжительную седацию) индуцируют и поддерживают в ОИТ в течение продолжительного периода времени (например, 1 день, 2 дня, 3 дня, 5 дней, 1 неделю, 2 недели, 3 недели, 1 месяц, 2 месяца). Долговременные седативные агенты могут иметь большую продолжительность действия. Седативные агенты в ОИТ могут иметь короткий период полувыведения.
[194] Процедурные седация и анальгезия, также называемая седацией с сохранением сознания, представляет собой технику введения седативных или диссоциативных агентов с анальгетиками или без, чтобы вызвать состояние, которое позволяет субъекту переносить неприятные процедуры, поддерживая при этом кардио-респираторную функцию.
Тревожные расстройства
[195] Термин «тревожное расстройство» представляет собой общий термин, охватывающий несколько различных форм ненормального и патологического страха и тревоги. Современные психиатрические диагностические критерии распознают широкий спектр тревожных расстройств.
[196] Генерализованное тревожное расстройство является распространенным хроническим заболеванием, характеризующимся долговременной тревогой, которая не сосредоточена на каком-либо одном объекте или ситуации. Страдающие от генерализованного тревожного расстройства испытывают неспецифический стойкий страх и беспокойство и становятся слишком озабоченными повседневными вопросами. Генерализованное тревожное расстройство влияет на пожилых людей.
[197] В случае панического расстройства человек страдает от кратковременных приступов интенсивного ужаса и страха, часто отмеченных тремором, дрожью, спутанностью сознания, головокружением, тошнотой, затруднением дыхания. Эти панические атаки, определенные АПА как страх или дискомфорт, который внезапно возникает и достигает максимума менее чем за десять минут, может длиться в течение нескольких часов и может быть вызван стрессом, страхом или даже физической нагрузкой; хотя конкретная причина не всегда очевидна. Кроме того, помимо повторяющихся неожиданных панических атак диагноз панического расстройства также требует, чтобы указанные атаки имели хронические последствия: либо беспокойство за возможные последствия атак, постоянный страх будущих атак или существенные изменения в поведении, связанные с атаками. Соответственно, страдающие от панического расстройства испытывают симптомы даже вне конкретных панических эпизодов. Часто страдающие паникой замечают нормальные изменения в сердцебиении, побуждая их думать, что-то не так с их сердцем или у них сейчас начнется другая паническая атака. В некоторых случаях повышенное осознание (сверхнастороженность) функционирования организма происходит во время панических атак, в котором любые распознанные физиологические изменения интерпретируются как возможно угрожающие жизни заболевания (т.е. крайняя степень ипохондрии).
[198] Обсессивно-компульсивное расстройство является типом тревожного расстройства, прежде всего характеризующимся повторяющимися навязчивыми состояниями (тревожные, стойкие и навязчивые мысли и образы) и маниями (позывы для выполнения конкретных действий и ритуалов). Картину мыслей при ОКР можно сравнить с суевериями, поскольку она включает веру в причинную взаимосвязь, где на самом деле она не существует. Часто этот процесс является совершенно нелогичным; например, мания ходить по определенной схеме может быть использована, чтобы облегчить одержимость надвигающегося вреда. И во многих случаях мания является совершенно необъяснимой, просто желание завершить ритуал, спровоцированное нервозностью. В меньшинстве случаев страдающие ОКР могут испытывать только навязчивые состояния без каких-либо явных маний; гораздо меньшее число страдающих людей испытывают только мании.
[199] Самой крупной категорией тревожных расстройств является фобии, которые включают все случаи, в которых страх и тревога вызваны определенными раздражителями или ситуациями. Страдающие обычно предвидят страшные последствия от столкновения с объектом их страха, которым может быть что угодно, от животного до места и до биологической жидкости.
[200] Пост-травматическое стрессовое расстройство или ПТСР представляет собой тревожное расстройство, которое возникает в результате травматического опыта. Посттравматический стресс может возникнуть в результате чрезвычайной ситуации, такой как война, изнасилование, ситуации пребывания в заложниках или даже серьезная авария. Это также может быть результатом долгосрочного (хронического) воздействия сильного источника стресса, например солдаты, которые выдерживают отдельные сражения, но не могут справиться с непрерывным боем. Общие симптомы включают вспышки прошлых воспоминаний, замкнутое поведение и депрессию.
Нейродегенеративные заболевания и расстройства
[201] Термин «нейродегенеративное заболевание» включает заболевания и расстройства, которые связаны с прогрессирующей утратой структуры или функции нейронов или смерти нейронов. Нейродегенеративные заболевания и расстройства включают, но не ограничиваются ими, болезнь Альцгеймера (включая ассоциированные симптомы легкого, умеренного или тяжелого когнитивного нарушения); амиотрофический латеральный склероз (ALS); гипоксические или ишемические повреждения; атаксию и судороги (включая для лечения и предотвращения припадков, которые вызваны шизоаффективным расстройством или лекарственными средствами, используемыми для лечения шизофрении); легкую забывчивость; отек головного мозга; мозжечковую атаксию, включая синдром нейроакантоцитоза Маклеода (MLS); закрытые травмы головы; кому; контузионные повреждения (например, повреждение спинного мозга и повреждение головы); деменции, включая мультиинфарктную деменцию и сенильную деменцию; нарушения сознания; синдром Дауна; медикаментозный или индуцированный лекарствами паркинсонизм (например, острая акатизия, индуцированная нейролептиками, острая дистония, паркинсонизм или поздняя дискинезия, злокачественный нейролептический синдром или постуральный тремор, вызванный лекарственным средством); эпилепсию; синдром ломкой Х-хромосомы; синдром Жиля де ля Туретта; травму головы; нарушение и потерю слуха; болезнь Гентингтона; синдром Леннокса; дискинезию, вызванную леводопой; умственную отсталость; расстройства движения, включая акинезии и акинетические (ригидные) синдромы (включая кальцификацию базальных ядер головного мозга, кортикобазальную дегенерацию, множественную системную атрофию, комплекс паркинсонизм-боковой амиотрофический склероз-деменция, болезнь Паркинсона, постэнцефалический паркинсонизм и прогрессирующий надъядерный паралич); мышечные спазмы и расстройства, связанные с мышечной спастичностью или слабостью, включая хорею (такую как доброкачественная наследственная хорея, медикаментозная хорея, гемибаллизм, болезнь Хантингтона, нейроакантоцитоз, хорея Сиденгама и симптоматическая хорея), дискинезию (включая тики, такие как сложные тики, простые тики и симптоматические тики), миоклонус (включая генерализованный миоклонус и фокальный миоклонус), тремор (включая тремор в покое, постуральный тремор и интенционный тремор) и дистонию (включая аксиальную дистонию, дистонический графоспазм, гемиплегическую дистонию, пароксизмальную дистонию и фокальную дистонию, такую как блефароспазм, оромандибулярную дистонию и спастическую дистонию или кривошею); нейрональное повреждение, включая поражение зрения, ретинопатию или макулярную дегенерацию глаза; нейротоксичное повреждение, которое следует за церебральным ударом, тромбоэмболическим ударом, геморрагическим ударом, церебральной ишемией, церебральным вазоспазмом, гипогликемией, амнезией, гипоксией, аноксией, перинатальной асфиксией и остановкой сердца; болезнь Паркинсона; припадок; эпилептический статус; инсульт; тиннитус; тубулярный склероз и нейродегенерацию, вызванную вирусной инфекцией (например, вызванную синдромом приобретенного иммунодефицита человека (AIDS) и энцефалопатией). Нейродегенеративные заболевания также включают, но не ограничиваются ими, нейротоксичное повреждение, которое следует за церебральным ударом, тромбоэмболическим ударом, геморрагическим ударом, церебральной ишемией, церебральным вазоспазмом, гипогликемией, амнезией, гипоксией, аноксией, перинатальной асфиксией и остановкой сердца. Способы лечения и предотвращения нейродегенеративного заболевания также включают лечение или предотвращение потери особенности нейронной функции нейродегенеративного расстройства.
Эпилепсия
[202] Эпилепсия представляет собой расстройство головного мозга, которое характеризуется повторными приступами в течение долгого времени. Типы эпилепсии могут включать, но не ограничиваются ими, генерализованную эпилепсию, например, детскую абсансную эпилепсию, юношескую миоклоническую эпилепсию, эпилепсию с генерализованными тонико-клоническими судорогами при пробуждении, синдром Веста, синдром Леннокса-Гасто, локальную эпилепсию, например, височную эпилепсию, лобную эпилепсию, доброкачественную локальную эпилепсию детского возраста.
Эпилептический статус (SE)
[203] Эпилептический статус (SE) может включать, например, судорожный эпилептический статус, например, ранний эпилептический статус, установившийся эпилептический статус, рефрактерный эпилептический статус, супер-рефрактерный эпилептический статус; бессудорожный эпилептический статус, например, генерализованный эпилептический статус, комплексный парциальный эпилептический статус; генерализованные периодические эпилептиформные разряды; и периодические латерализованные эпилептиформные разряды. Судорожный эпилептический статус характеризуется наличием эпилептических припадков судорожного статуса, и может включать ранний эпилептический статус, установившийся эпилептический статус, рефрактерный эпилептический статус, супер-рефрактерный эпилептический статус. Ранний эпилептический статус лечат посредством терапии первой линии. Установившийся эпилептический статус характеризуется эпилептическими припадками статуса, которые сохраняются несмотря на лечение терапией первой линии, и вводят терапию второй линии. Рефрактерный эпилептический статус характеризуется эпилептическими припадками статуса, которые сохраняются, несмотря на лечение терапией первой линии и терапией второй линии, и в целом вводят общие анестетики. Супер-рефрактерный эпилептический статус характеризуется эпилептическими припадками статуса, которые сохраняются, несмотря на лечение терапией первой линии, терапией второй линии и общими анестетиками в течение 24 часов или более.
[204] Бессудорожный эпилептический статус может включать, например, фокальный бессудорожный эпилептический статус, например, комплексный парциальный бессудорожный эпилептический статус, простой парциальный бессудорожный эпилептический статус, слабовыраженный бессудорожный эпилептический статус; генерализованный бессудорожный эпилептический статус, например, поздний абсансный бессудорожный эпилептический статус, атипичный абсансный бессудорожный эпилептический статус или типичный абсансный бессудорожный эпилептический статус.
[205] Композиции, описанные в настоящем документе, также можно вводить в качестве профилактики субъекту, имеющему расстройство ЦНС, например, травматическое повреждение головного мозга, эпилептический статус, например, судорожный эпилептический статус, например, ранний эпилептический статус, установившийся эпилептический статус, рефрактерный эпилептический статус, супер-рефрактерный эпилептический статус; бессудорожный эпилептический статус, например, генерализованный эпилептический статус, комплексный парциальный эпилептический статус; генерализованные периодические эпилептиформные разряды; и периодические латерализованные эпилептиформные разряды; до начала припадка.
Припадок
[206] Припадок представляет собой физические нарушения или изменения в поведении, которые происходят после эпизода аномальной электрической активности в головном мозге. Термин «припадок» часто используют наравне с термином «судороги». Судороги представляют собой когда тело человека быстро и бесконтрольно дрожит. Во время судорог мышцы человека неоднократно сокращаются и расслабляются.
[207] В зависимости от типа поведения и активности головного мозга припадки делятся на две основные категории: генерализованные и парциальные (также называемые локальными или фокальными). Классификация типа припадка помогает врачам диагностировать, имеет ли пациент эпилепсию.
[208] Генерализованные припадки возникают от электрических импульсов на протяжении всего головного мозга, в то время как парциальные припадки возникают (по крайней мере, на начальном этапе) от электрических импульсов в относительно небольшой части головного мозга. Часть мозга, генерирующую припадки, иногда называют фокусом.
[209] Существует шесть типов генерализованных припадков. Наиболее распространенной и сильной и, следовательно, наиболее хорошо известной является генерализованная судорога, также называемая большим эпилептическим припадком. В этом типе припадка пациент теряет сознание и, как правило, падает в обморок. Потеря сознания сопровождается генерализованной жесткостью тела (так называемый «тоническая» фаза припадка) в течение от 30 до 60 секунд, а затем сильным подергиванием («клоническая» фаза) в течение от 30 до 60 секунд, после чего пациент переходит в глубокий сон (далее «постиктальная» или послесудорожная фаза). Во время больших генерализованных припадков могут произойти травмы и несчастные случаи, например, прикусывание языка и недержание мочи.
[210] Малые эпилептические припадки вызывают кратковременную потерю сознания (всего на несколько секунд) с несколькими или отсутствием симптомов. Пациент, чаще всего ребенок, как правило, прерывает активность и безучастно смотрит. Эти припадки начинаются и заканчиваются внезапно и могут возникать несколько раз в день. Пациенты, как правило, не знают, что у них был припадок, за исключением того, что они могут быть осведомлены о «потере времени».
[211] Миоклонические припадки состоят из эпизодических подергиваний, как правило, с обеих сторон тела. Пациенты иногда описывают подергивания как краткие поражения электрическим током. Будучи сильными, эти припадки могут привести к падению или непроизвольному бросанию предметов.
[212] Клонические припадки представляют собой повторяющиеся ритмичные подергивания, которые вовлекают обе стороны тела в одно и то же время.
[213] Тонические припадки характеризуются напряжением мышц.
[214] Атонические припадки составляют неожиданную и общую потерю тонуса мышц, особенно в руках и ногах, которая часто приводит к падению.
[215] Припадки, описанные в настоящем документе, могут включать эпилептические припадки; острые повторяющиеся припадки; кластерные припадки; постоянные припадки; непрекращающиеся припадки; длительные припадки; рецидивирующие припадки; припадки эпилептического статуса, например, рефрактерный судорожный эпилептический статус, припадки несудорожного эпилептического статуса; рефрактерные припадки; миоклонические припадки; тонические припадки; тонико-клонические припадки; простые парциальные припадки; комплексные парциальные припадки; вторично генерализованные припадки; атипичные малые эпилептические припадки; малые эпилептические припадки; атонические припадки; доброкачественные роландические припадки; фебрильные припадки; эмоциональные припадки; фокальные припадки; геластические припадки; первичные генерализованные припадки; младенческие судороги; джексоновские припадки; тяжелые двухсторонние миоклонические припадки; мультифокальные припадки; младенческие первичные припадки; ночные припадки; припадки при поражении затылочной доли; посттравматические припадки; слабовыраженные припадки; сильвиевы припадки; зрительные рефлекторные припадки; или абстинентные припадки.
Эквиваленты и объем
[216] В формуле изобретения артикли единственного числа определенной и неопределенной формы могут означать один или более одного, если иное не указано или иным образом очевидно из контекста. Формула изобретения или описания, которые включают «или» между одним или несколькими членами группы, считаются выполненными, если один, более чем один или все члены группы присутствуют, заняты или иным образом имеют отношение к данному продукту или способу, если обратное не указано или иным образом очевидно из контекста. Настоящее изобретение включает варианты реализации, в которых присутствует, используется или иным образом имеет отношение к данному продукту или способу конкретно один член группы. Настоящее изобретение включает варианты реализации, в которых присутствуют, используются или иным образом имеют отношение к данному продукту или способу более одного или все члены группы.
[217] Более того, настоящее изобретение охватывает все вариации, комбинации и перестановки, в которых одно или более ограничений, элементов, требований и описательных терминов из одного или нескольких из перечисленных пунктов введены в другой пункт. Например, любой пункт, который зависит от другого пункта, может быть изменен, чтобы включить одно или более ограничений, найденных в любом другом пункте, который зависит от того же самого основного пункта. Там, где элементы представлены в виде списков, например, в формате группы Маркуша, каждая подгруппа элементов также раскрыта, и любой элемент(ы) может быть удален из группы. Следует понимать, что, в целом, где настоящее изобретение или аспекты настоящего изобретения упоминаются как содержащие конкретные элементы и/или признаки, конкретные варианты реализации настоящего изобретения или аспекты настоящего изобретения состоят или по существу состоят из, например, элементов и/или признаков. В целях упрощения данные варианты реализации не были конкретно дословно изложены в настоящем документе. Следует также отметить, что термины «включающий» и «содержащий» предназначены раскрывать и допускать включение дополнительных элементов или стадий. В случаях, где приведены диапазоны, конечные точки включены. Кроме того, если иное не обозначено или иным образом очевидно из контекста и понимания обычного специалиста в данной области, значения, которые выражены в виде диапазонов, могут принимать любое конкретное значение или поддиапазон в пределах указанных диапазонов в различных вариантах реализации настоящего изобретения, до десятых единиц нижнего предела диапазона, если из контекста явно не следует иное.
[218] Настоящая заявка ссылается на различные выданные патенты, опубликованные патентные заявки, журнальные статьи и другие публикации, все из которых включены в настоящую заявку посредством ссылки. Если существует конфликт между любыми из включенных ссылок и настоящим описанием, описание имеет преимущество. Кроме того, любой конкретный вариант реализации настоящего изобретения, который относится к предшествующему уровню техники, может быть явным образом исключен из любого одного или более пунктов формулы изобретения. Поскольку такие варианты реализации считаются известными специалисту в данной области, они могут быть исключены, даже если исключение явно не указано в настоящем документе. Любой конкретный вариант реализации настоящего изобретения может быть исключен из любого пункта по какой-либо причине, связанной или не связанной с наличием предшествующего уровня техники.
[219] Специалистам в данной области понятно или они способны установить многие эквиваленты конкретных вариантов реализации, описанных в данном документе, с использованием не более чем рутинных экспериментов. Объем представленных вариантов реализации, описанных в настоящем документе, не должен быть ограничен приведенным выше описанием, а скорее представляет изложенное в прилагаемой формуле изобретения. Специалистам в данной области будет понятно, что различные изменения и модификации настоящего описания могут быть сделаны без отступления от сущности или объема настоящего изобретения, как определено в нижеследующей формуле изобретения.
Примеры
[220] Для того чтобы описанное в настоящем документе изобретение можно было лучше понять, изложены следующие примеры. Синтетические и биологические примеры, описанные в данной заявке, предложены для иллюстрации соединений, фармацевтических композиций и способов, предложенных в настоящем документе, и никоим образом не должны быть истолкованы как ограничивающие их объем.
Материалы и способы
[221] Соединения, предложенные в настоящем документе, могут быть получены из легко доступных исходных материалов с применением следующих общих способов и процедур. Следует понимать, что в случаях, где приведены типичные или предпочтительные условия процесса (т.е., температуры реакции, время, мольные соотношения реагентов, растворители, давления и т.д.), также можно применять другие условия процесса, если не указано иное. Оптимальные условия реакции могут изменяться в зависимости от конкретных используемых реагентов или растворителей, но такие условия могут быть определены специалистом в данной области путем рутинной оптимизации.
[222] Кроме того, как будет очевидно специалистам в этой области, традиционные защитные группы могут быть необходимы для предотвращения определенных функциональных групп от нежелательных реакций. Выбор подходящей защитной группы для конкретной функциональной группы, а также подходящих условий для защиты и снятия защиты, хорошо известны в данной области. Например, многочисленные защитные группы и их введение и снятие описаны в T.W. Greene and P.G.M. Wuts, Protecting Groups in rganic Synthesis, Second Edition, Wiley, New York, 1991, и ссылках, приведенных в ней.
Соединения, предложенные в настоящем документе, могут быть выделены и очищены с помощью известных стандартных процедур. Такие процедуры включают (но не ограничиваются ими) перекристаллизацию, колоночную хроматографию, ВЭЖХ или сверхкритическую жидкостную хроматографию (SFC). Следующие схемы предложены с подробностями, как для получения типичных гетероарилов и гетероциклилов, которые были перечислены в настоящем документе. Соединения, предложенные в настоящем документе, могут быть получены из известных или коммерчески доступных исходных материалов и реагентов специалистом в области органического синтеза. Примеры доступных хиральных колонок для применения в целях разделения/очистки энантиомеров/диастереомеров, предложенных в настоящем документе, включают, но не ограничиваются ими, ChiralPak® AD-10, CHIRALCEL® B, CHIRALCEL® B-H, CHIRALCEL® D, CHIRALCEL® D-H, CHIRALCEL® F, CHIRALCEL® G, CHIRALCEL® J и CHIRALCEL® K.
[224] 1H-ЯМР, представленный в настоящем документе (например, для промежуточных соединений) может являться частичным представлением полного спектра ЯМР соединения, например, соединения, описанного в настоящем документе. Например, представленный 1H ЯМР может исключать область δ (ppm) от примерно 1 до примерно 2,5 ppm.
[225] Примерный общий способ для препаративной ВЭЖХ: колонка: Waters RBridge prep 10 μm C18, 19*250 мм. Подвижная фаза: ацетонтрил, вода (NH4HCO3) (30 л воды, 24 г NH4HCO3, 30 мл NH3.H2O). Скорость потока: 25 мл/мин
[226] Примерный общий способ для аналитической ВЭЖХ: подвижная фаза: A: вода (10 мМ NH4HCO3), B: ацетонитрил Градиент: 5%-95% B в 1,6 или 2 мин. Скорость потока: 1,8 или 2 мл/мин; колонка: XBridge C18, 4,6*50 мм, 3,5 мкм при 45 C.
Способы синтеза
Пример 1. Общая процедура A: Получение A/B-транс основы молекулы

Стадия 1. Получение соединения A2. Тонко измельченный гидроксид калия (28,0 г, 165 ммоль) добавляли к раствору коммерчески доступного 19-гидроксиандрост-4-ен-3,17-диона (A1, 50,0 г, 165 ммоль) в безводном 1,2-диметоксиэтане (500 мл) при 0°C в атмосфере азота, после чего по частям добавляли метилсульфат (43,7 г, 208 ммоль). Смесь медленно нагревали до комнатной температуры, перемешивая в течение 18 ч в целом, в этот момент анализ смеси посредством ТСХ (7:3 гексан/этилацетат) показал окончание реакции. Смесь разбавляли водой (500 мл) и экстрагировали этилацетатом (3 x 200 мл). Объединенные органические экстракты промывали насыщенным водным раствором хлорида натрия (100 мл), сушили безводным сульфатом натрия и фильтровали. Растворители удаляли при пониженном давлении, и остаток очищали посредством колоночной хроматографии на силикагеле, проводя элюирование гептаном/этилацетатом (2:1), с получением A2 в форме желтого твердого вещества (26,8 г, 50%).
Стадия 2. Получение соединения A3. Триэтилортоформиат (6,2 мл, 37 ммоль) и п-толуолсульфоновую кислоту (400 мг, 9,3 ммоль) добавляли к раствору соединения A2 (9,9 г, 31,0 ммоль) в безводном 1,4-диоксане (40 мл) и безводном этаноле (30 мл) при комнатной температуре в атмосфере азота, и смесь перемешивали в течение 1,5 ч, в этот момент анализ смеси посредством ТСХ (7:3 гексан/этилацетат) показал окончание реакции. Смесь разбавляли насыщенным водным раствором бикарбоната натрия (100 мл), выливали в воду (300 мл) и экстрагировали этилацетатом (3 x 100 мл). Объединенные органические экстракционные растворители удаляли при пониженном давлении, и остаток очищали посредством колоночной хроматографии на силикагеле, проводя элюирование гептаном/этилацетатом (2:1), с получением соединения A3 в форме белого твердого вещества (7,0 г, 66%).
Стадия 3. Получение соединения A4. Смесь соединения A3 (7,0 г, 20,3) и палладиевого катализатора на углеродном носителе (3,0 г, 10 масс. %) в безводном этилацетате (200 мл) встряхивали в атмосфере водорода (1 атмосфера) при комнатной температуре в течение 1 ч, в этот момент анализ смеси посредством ТСХ (2:1 гексан/этилацетат) показал окончание реакции. Атмосферу меняли на азот, и смесь фильтровали через целитную пластину при пониженном давлении, промывая остаток на фильтре этилацетатом (50 мл). Отфильтрованные растворители обрабатывали 10% водным раствором хлористоводородной кислоты (100 мл), и двухфазную смесь перемешивали в течение 30 мин. Смесь экстрагировали этилацетатом (2 x 100 мл), и объединенные органические экстракты промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия (50 мл каждого), сушили безводным сульфатом натрия и фильтровали. Растворители удаляли при пониженном давлении, и остаток очищали посредством колоночной хроматографии на силикагеле, проводя элюирование гептаном/этилацетатом (4:1), с получением соединения A4 в форме бесцветного масла (3,9 г, 60%).
Стадия 4. Получение соединения A5. Гидрид натрия (1,7 г, 45 ммоль, 60% в минеральном масле) по частям добавляли к раствору триметилсульфоксония йодида (9,1 г, 45 ммоль) в безводном диметилсульфоксиде (100 мл) при комнатной температуре в атмосфере азота, и смесь перемешивали в течение 1 ч, после чего добавляли раствор соединения A4 (9,5 г, 29,8 ммоль) в безводном диметилсульфоксиде (100 мл). Полученную смесь перемешивали при комнатной температуре в течение 12 ч, в этот момент анализ смеси посредством ТСХ (7:3 гексан/этилацетат) показал окончание реакции. Смесь разбавляли водой (500 мл) и экстрагировали метил-трет-бутиловым эфиром (2 x 300 мл). Объединенные органические экстракты промывали водой (2 x 300 мл), сушили безводным сульфатом магния и фильтровали. Растворители удаляли при пониженном давлении с получением соединения A5 в форме бесцветного масла, которое применяли на следующей стадии без дополнительной очистки (7,5 г, 76%).
Стадия 5. Получение соединения A6. Гидрид лития алюминия (67 мл, 67 ммоль, 1 M раствор в тетрагидрофуране) добавляли к раствору неочищенного соединения A5 (7,5 г, 22,2 ммоль) в безводном тетрагидрофуране (5 мл) при 0°C в атмосфере азота, после чего смесь медленно нагревали до комнатной температуры, перемешивая в течение 2 ч в целом, в этот момент анализ смеси посредством ТСХ (7:3 гексан/этилацетат) показал окончание реакции. Смесь осторожно обрабатывали водой (10 мл), после чего насыщенным водным раствором хлорида натрия (30 мл) и экстрагировали этилацетатом (3 x 50 мл). Объединенные органические экстракты сушили безводным сульфатом магния, фильтровали, и растворители удаляли при пониженном давлении с получением соединения A6 в форме бесцветного масла, которое применяли на следующей стадии без дополнительной очистки (5,5 г, 74%): LCMS m/z 319 [M+H-H2O]+.
Стадия 6. Получение соединения A7. Пиридиния хлорхромат (4,0 г, 19 ммоль) одной частью добавляли к раствору неочищенного соединения A6 (4,2 г, 12,5 ммоль) в безводном дихлорметане (100 мл) при 0°C в атмосфере азота. Смесь медленно нагревали до комнатной температуры, перемешивая в течение 3 ч в целом, в этот момент анализ смеси посредством ТСХ (7:3 гексан/этилацетат) показал окончание реакции. Твердые вещества удаляли посредством фильтрации, и отфильтрованные растворители удаляли при пониженном давлении. Остаток очищали посредством колоночной хроматографии на силикагеле, проводя элюирование гептаном/этилацетатом (7:3), с получением соединения A7 в форме светло-желтого твердого вещества (2,1 г, 50%): LCMS m/z 317 [M+H-H2O]+.
Стадия 7. Получение соединения A8. Трет-бутоксид калия (4,3 г, 38 ммоль) добавляли к смеси этилтрифенилфосфония бромида (14,2 г, 38 ммоль) в безводном тетрагидрофуране (30 мл) при комнатной температуре в атмосфере азота, после чего смесь нагревали до 80°C и перемешивали в течение 1 ч. Добавляли раствор соединения A7 (3,1 г, 9,3 ммоль) в безводном тетрагидрофуране (10 мл), после чего перемешивание при 80°C продолжали в течение 2 ч, в этот момент анализ смеси посредством ТСХ (7:3 гексан/этилацетат) показал окончание реакции. Охлажденную смесь разбавляли водой (30 мл) и насыщенным водным раствором хлорида натрия (20 мл), и экстрагировали этилацетатом (2 x 100 мл). Объединенные органические экстракционные растворители удаляли при пониженном давлении, и остаток очищали посредством колоночной хроматографии на силикагеле, проводя элюирование гептаном/этилацетатом (7:3), с получением соединения A8 в форме почти белого твердого вещества (2,0 г, 66%): LCMS m/z 329 [M+H-H2O]+.
Стадия 8. Получение соединения A9. Комплекс боран-тетрагидрофуран (20,0 мл, 20 ммоль, 1 M раствор в тетрагидрофуране) добавляли к раствору соединения A8 (2,0 г, 5,8 ммоль) в безводном тетрагидрофуране (15 мл) при 0°C в атмосфере азота, после чего смесь медленно нагревали до комнатной температуры, перемешивая в течение 1 ч в целом. Смесь охлаждали на ледяной бане, и медленно добавляли 10% водный раствор гидроксида натрия (12 мл), после чего добавляли 30% водный раствор пероксида водорода (12 мл). Полученную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч, в этот момент анализ смеси посредством ТСХ (7:3 гексан/этилацетат) показал окончание реакции. Смесь экстрагировали дихлорметаном (2 x 100 мл), и объединенные органические экстракты промывали насыщенным водным раствором хлорида натрия (25 мл), сушили сульфатом натрия и фильтровали. Растворители удаляли при пониженном давлении с получением неочищенного соединения A9 в форме белого твердого вещества, которое применяли на следующей стадии без дополнительной очистки (2,5 г, >99%).
Стадия 9. Получение соединения A10. Пиридиния хлорхромат (2,4 г, 11 ммоль) одной частью добавляли к раствору неочищенного соединения A9 (2,5 г, 6,9 ммоль) в безводном дихлорметане (30 мл) при 0°C в атмосфере азота. Смесь медленно нагревали до комнатной температуры, перемешивая в течение 2 ч в целом, в этот момент анализ смеси посредством ТСХ (7:3 гексан/этилацетат) показал окончание реакции. Твердые вещества удаляли посредством фильтрации, и отфильтрованные растворители удаляли при пониженном давлении. Остаток очищали посредством колоночной хроматографии на силикагеле, проводя элюирование гептаном/этилацетатом (7:3), с получением A10 в форме почти белого твердого вещества (1,5 г, 61%).
Стадия 10. Получение соединения A11. Бромоводород (3 капли, 48% в воде) добавляли к раствору A10, 1,4 г, 3,9 ммоль) в безводном метаноле (150 мл) при комнатной температуре в темноте в атмосфере азота, после чего добавляли бром (0,4 мл, 7,7 ммоль). Смесь перемешивали в течение 1 ч, в этот момент анализ смеси посредством ТСХ (7:3 гексан/этилацетат) показал окончание реакции. Смесь выливали в ледяную воду (100 мл), обрабатывали насыщенным водным раствором бикарбоната натрия (30 мл) и экстрагировали этилацетатом (2 x 60 мл). Объединенные органические экстракты промывали насыщенным водным раствором бикарбоната натрия (4 x 100 мл) и насыщенным водным раствором хлорида натрия (50 мл), сушили сульфатом магния и фильтровали. Растворители удаляли при пониженном давлении, и остаток очищали посредством колоночной хроматографии на силикагеле, проводя элюирование гептаном/этилацетатом (1:1), с получением соединения A11 в форме бесцветного полутвердого вещества (1,2 г, 71%): LCMS m/z 441 [M+H]+.
Пример 2. Общая процедура A: Получение A/B-транс основы молекулы

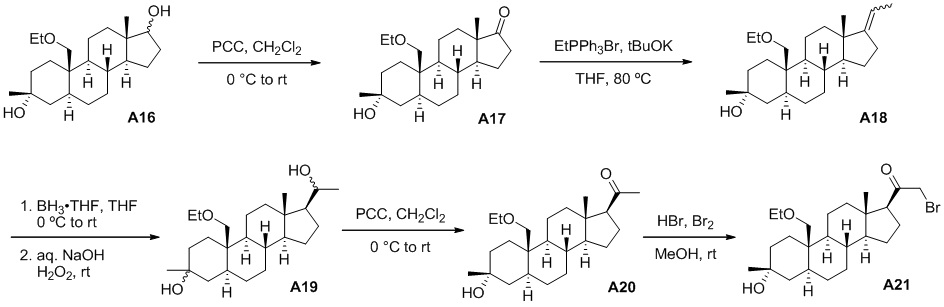
Стадия 1. Получение соединения A12. Получали согласно Общей процедуре A, Стадия 1 из A1, (10,0 г, 33 ммоль) и этилсульфата (17,3 мл, 132 ммоль), с очисткой посредством колоночной хроматографии на силикагеле с получением соединения A12 в форме желтого масла (4,6 г, 42%).
Стадия 2. Получение соединения A13. Получали согласно Общей процедуре A, Стадия 2 из соединения A12 (4,6 г, 14 ммоль) с получением неочищенного соединения A13 в форме желтого масла, которое применяли на следующей стадии без дополнительной очистки.
Стадия 3. Получение соединения A14. Получали согласно Общей процедуре A, Стадия 3 из неочищенного соединения A13, с очисткой посредством колоночной хроматографии на силикагеле с получением соединения A14 в форме желтого масла (1,5 г, 31%).
Стадия 4. Получение соединения A15. Получали согласно Общей процедуре A, Стадия 4 из соединения A14 (1,7 г, 5,1 ммоль) с получением неочищенного соединения A15 в форме желтого масла, которое применяли на следующей стадии без дополнительной очистки.
Стадия 5. Получение соединения A16. Получали согласно Общей процедуре A, Стадия 5 из неочищенного соединения A15 с получением неочищенного соединения A16 в форме желтого масла, которое применяли на следующей стадии без дополнительной очистки.
Стадия 6. Получение соединения A17. Получали согласно Общей процедуре A, Стадия 6 из неочищенного соединения A16, с очисткой посредством колоночной хроматографии на силикагеле с получением соединения A17 в форме почти белого твердого вещества (751 мг, 40%).
Стадия 7. Получение соединения A18. Получали согласно Общей процедуре A, Стадия 7 из соединения A17 (750 мг, 2,2 ммоль), с очисткой посредством колоночной хроматографии на силикагеле с получением соединения A18 в форме бесцветного масла (757 мг, 97%).
Стадия 8. Получение соединения A19. Получали согласно Общей процедуре A, Стадия 8 из соединения A18 (757 мг, 2,1 ммоль), с получением неочищенного соединения A19 в форме желтого масла, которое применяли на следующей стадии без дополнительной очистки.
Стадия 9. Получение A20. Получали согласно Общей процедуре A, Стадия 9 из неочищенного соединения A19, с очисткой посредством колоночной хроматографии на силикагеле с получением A20 в форме белого твердого вещества (515 мг, 65%): mp 106-107°C;1H ЯМР (500 МГц, CDCl3) δ 3,51 (d, J = 16,5 Гц, 1H), 3,43-3,36 (m, 3H), 2,53 (t, J = 5,0 Гц, 1H), 2,18-1,96 (m, 6H), 1,74-0,92 (m, 25H), 0,84-0,82 (m, 1H), 0,62 (s, 3H) ppm; ESI MS m/z 359 [M+H-H2O]+.
Стадия 10. Получение A21. Бромоводород (10 капель, 48% в воде) добавляли к раствору A20 (490 мг, 1,30 ммоль) в безводном метаноле (40 мл) при комнатной температуре в темноте в атмосфере азота, после чего добавляли бром (235 мг, 13,0 ммоль). Смесь перемешивали в течение 1 ч, в этот момент анализ смеси посредством ТСХ (7:3 гексан/этилацетат) показал окончание реакции. Смесь выливали в ледяную воду (100 мл), обрабатывали насыщенным водным раствором бикарбоната натрия (30 мл) и экстрагировали этилацетатом (2 x 60 мл). Объединенные органические экстракты промывали насыщенным водным раствором бикарбоната натрия (4 x 100 мл) и насыщенным водным раствором хлорида натрия (50 мл), сушили сульфатом магния и фильтровали. Растворители удаляли при пониженном давлении, и остаток очищали посредством колоночной хроматографии на силикагеле, проводя элюирование гептаном/этилацетатом (1:1), с получением соединения A21 в форме белого твердого вещества (468 мг, 79%). LCMS m/z 437 [M+H-H2O]+.
Пример 3. Общая процедура B: Получение A/B-транс основы молекулы аналогов C-21

5-Хлор-1H-бензо[d][1,2,3]триазол (470 мг, 3,06 ммоль) и карбонат калия (704 мг, 5,1 ммоль) добавляли к раствору соединения A11 (225 мг, 0,51 ммоль) в безводном тетрагидрофуране (20 мл) при комнатной температуре в атмосфере азота, и смесь перемешивали в течение 16 ч, в этот момент анализ смеси посредством ТСХ (2:1 гексан/этилацетат) показал окончание реакции. Смесь разбавляли водой (120 мл) и экстрагировали этилацетатом (3 x 100 мл). Объединенные органические экстракты промывали насыщенным водным раствором хлорида натрия (60 мл), сушили сульфатом натрия и фильтровали. Растворители удаляли при пониженном давлении, и остаток полуочищали посредством колоночной хроматографии на силикагеле, проводя элюирование гексаном/этилацетатом (3:1), с получением смеси трех региоизомеров. Остаток дополнительно очищали посредством обратнофазной препаративной ВЭЖХ с получением 35 в форме почти белого твердого вещества (150 мг, 29%): mp 205-207°C;1H ЯМР (300 МГц, CDCl3) δ 7,87 (dd, J = 1,8, 0,6 Гц, 1H), 7,81 (dd, J = 9,0, 0,6 Гц, 1H), 7,34 (dd, J = 9,0, 1,8 Гц, 1H), 5,55 (d, JAB = 17,1 Гц, 1H), 5,46 (d, JAB = 17,1 Гц, 1H), 3,48 (d, J = 9,9 Гц, 1H), 3,38 (d, J = 10,2 Гц, 1H), 3,30 (s, 3H), 2,66 (t, J = 8,7 Гц, 1H), 2,30-2,18 (m, 1H), 2,18-2,09 (m, 1H), 2,09-2,00 (m, 1H), 1,82-1,38 (m, 11H), 1,38-1,06 (m, 10H), 1,06-0,92 (m, 1H), 0,92-0,80 (m, 1H), 0,76 (s, 3H) ppm; ESI MS m/z 514 [M+H]+.
Посредством дополнительного элюирования получали 36 в форме почти белого твердого вещества (86 мг, 17%): mp 97-101°C;1H ЯМР (300 МГц, CDCl3) δ 8,03-7,97 (m, 1H), 7,36-7,31 (m, 2H), 5,42 (d, JAB = 18,3 Гц, 1H), 5,34 (d, JAB = 18,0 Гц, 1H), 3,49 (d, J = 9,9 Гц, 1H), 3,38 (d, J = 9,9 Гц, 1H), 3,31 (s, 3H), 2,72 (t, J = 8,7 Гц, 1H), 2,30-2,10 (m, 2H), 2,10-2,00 (m, 1H), 1,85-1,40 (m, 11H), 1,39-0,80 (m, 12H), 0,75 (s, 3H) ppm; ESI MS m/z 5140 [M+H]+.
Посредством дополнительного элюирования получали 37 в форме почти белого твердого вещества (112 мг, 21%): mp 106-110°C;1H ЯМР (300 МГц, CDCl3) δ 8,06 (d, J = 1,2 Гц, 1H), 7,45 (dd, J = 9,0, 1,5 Гц, 1H), 7,27 (d, J = 8,7 Гц, 1H), 5,41 (s, 2H), 3,49 (d, J = 9,9 Гц, 1H), 3,38 (d, J = 10,2 Гц, 1H), 3,30 (s, 3H), 2,71 (t, J = 8,7 Гц, 1H), 2,29-2,00 (m, 3H), 1,83-1,44 (m, 11H), 1,44-0,82 (m, 12H), 0,74 (s, 3H) ppm; ESI MS m/z 514 [M+H]+.
Пример 4. Получение соединения 8.
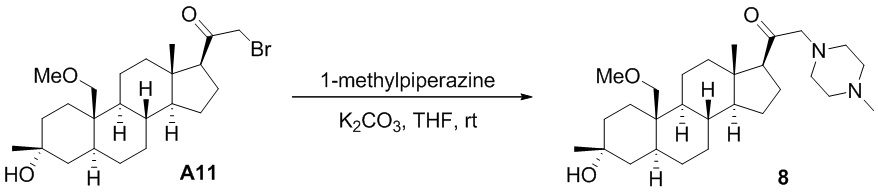
Получали согласно Общей процедуре B из соединения A11 (50 мг, 0,114 ммоль) и N-метилпиперазина (227 мг, 2,27 ммоль), с очисткой посредством обратнофазной препаративной ВЭЖХ с получением соединения 8 в форме белого твердого вещества (36,6 мг, 70%): mp 136-137°C;1H ЯМР (500 МГц, CDCl3) δ 3,46 (d, J = 10,0 Гц, 1H), 3,36 (d, J = 10,0 Гц, 1H), 3,28 (s, 3H), 3,17 (s, 2H), 2,60-2,51 (m, 8H), 2,30 (s, 3H), 2,18-2,14 (m, 1H), 2,02 (dt, J = 13,0, 3,5 Гц, 1H), 1,88 (dt, J = 12,0, 3,5 Гц, 1H), 1,71-1,46 (m, 10H), 1,34-1,72 (m, 11H), 0,98-0,84 (m, 1H), 0,84-0,80 (m, 1H), 0,64 (s, 3H) ppm; ESI MS m/z 461 [M+H]+.
Пример 5. Получение соединений 3 и 1.

Получали согласно Общей процедуре B из соединения A11 (300 мг, 0,67 ммоль) и 1H-1,2,3-триазола (188 мг, 2,71 ммоль), с очисткой посредством обратнофазной препаративной ВЭЖХ с получением соединения 3 в форме белого твердого вещества (36,6 мг, 70%): mp 72-74°C;1H ЯМР (300 МГц, CDCl3) δ 7,75 (d, J = 1,2 Гц, 1H), 7,63 (d, J = 1,2 Гц, 1H), 5,20 (q, J = 18,0 Гц, 2H), 3,46 (d, J = 9,9 Гц, 1H), 3,37 (d, J = 10,2 Гц, 1H), 2,65 (t, J = 9,0 Гц, 1H), 2,09-2,01 (m, 1H), 1,78-1,68 (m, 4H), 1,60-1,49 (m, 13H), 1,46-1,26 (m, 9H), 1,23-0,87 (m, 2H), 0,63 (s, 3H) ppm; ESI MS m/z 430 [M+H]+.
Посредством дополнительного элюирования получали соединение 1 в форме почти белого твердого вещества (110 мг, 38%): mp 157-150°C;1H ЯМР δ 7,67 (s, 2H), 5,23 (q, J = 17,0 Гц, 2H), 3,47 (d, J = 10,0 Гц, 1H), 3,37 (d, J = 10,0 Гц, 1H), 3,28 (s, 3H), 2,57 (t, J = 9,5 Гц, 1H), 2,24-2,17 (m, 1H), 2,09-2,01 (m, 2H), 1,75-1,67 (m, 4H), 1,62-1,47 (m, 10H), 1,38-1,23 (m, 3H), 1,23-1,08 (m, 4H), 1,02-0,92 (m, 1H), 0,86-0,81 (m, 1H), 0,73 (s, 3H) ppm; ESI MS m/z 430 [M+H]+.
Пример 6. Получение соединения 13.

Получали согласно Общей процедуре B из соединения A11 (25 мг, 0,057 ммоль) и 5-хлортриазола (106 мг, 1,14 ммоль), с очисткой посредством обратнофазной препаративной ВЭЖХ с получением соединения 13 в форме белого твердого вещества (16,8 мг, 65%): mp 141-142°C;1H ЯМР (500 МГц, CDCl3) δ 7,85 (s, 1H), 7,80 (s, 1H), 4,95 (dd, J = 62,5, 17,5 Гц, 2H), 3,47 (dd, J = 10,0 Гц, 1H), 3,37 (dd, J = 10,0 Гц, 1H), 3,28 (s, 3H), 2,60 (t, J = 9,0 Гц, 1H), 2,23-2,20 (m, 1H), 2,05-2,01 (m, 2H), 1,76-1,69 (m, 4H), 1,63-1,49 (m, 7H), 1,47-1,10 (m, 10H), 0,99-0,97 (m, 1H), 0,87-0,85 (m, 1H), 0,69 (s, 3H) ppm; ESI MS m/z 436 [M+H-H2O]+.
Пример 7. Получение соединениий 14 и 15.

Получали согласно Общей процедуре B из соединения A11 (60 мг, 0,14 ммоль) и тетразола (57 мг, 0,81 ммоль), с полуочисткой посредством колоночной хроматографии на силикагеле, после чего посредством обратнофазной препаративной ВЭЖХ с получением соединения 15 в форме почти белого твердого вещества (6 мг, 10%): mp 88-91°C;1H ЯМР (500 МГц, CDCl3) δ 8,73 (s, 1H), 5,30 (d, JAB = 18,5 Гц, 1H), 5,17 (d, JAB = 18,5 Гц, 1H), 3,47 (d, J = 10,0 Гц, 1H), 3,37 (d, J = 10,0 Гц, 1H), 3,29 (s, 3H), 2,66 (t, J = 9,0 Гц, 1H), 2,28-2,20 (m, 1H), 2,07-2,00 (m, 2H), 1,82-1,69 (m, 4H), 1,65-1,40 (m, 7H), 1,35-1,09 (m, 10H), 1,04-0,95 (m, 1H), 0,92-0,83 (m, 1H), 0,69 (s, 3H) ppm; ESI MS m/z 431 [M+H]+.
Посредством дополнительного элюирования получали соединение 14 в форме почти белого твердого вещества (7 мг, 12%): mp 72-75°C;1H ЯМР (500 МГц, CDCl3) δ 8,56 (s, 1H), 5,47 (d, JAB = 17,0 Гц, 1H), 5,42 (d, JAB = 17,5 Гц, 1H), 3,47 (d, J = 10,5 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,29 (s, 3H), 2,64 (t, J = 9,0 Гц, 1H), 2,27-2,19 (m, 1H), 2,18-2,00 (m, 2H), 1,80-1,68 (m, 4H), 1,66-1,46 (m, 6H), 1,44-1,37 (m, 1H), 1,35-1,08 (m, 10H), 1,04-0,94 (m, 1H), 0,90-0,83 (m, 1H), 0,74 (s, 3H) ppm; ESI MS m/z 431 [M+H]+.
Пример 8. Получение соединений 16 и 17.

Получали согласно Общей процедуре B из соединения A11 (215 мг, 0,49 ммоль) и 5-метил-1H-тетразола (253 мг, 2,92 ммоль), с полуочисткой посредством колоночной хроматографии на силикагеле, после чего посредством обратнофазной препаративной ВЭЖХ с получением 16 в форме почти белого твердого вещества (56 мг, 26%): mp 88-91°C;1H ЯМР (300 МГц, CDCl3) δ 5,13 (d, JAB = 18,0 Гц, 1H), 5,06 (d, JAB = 18,0 Гц, 1H), 3,48 (d, J = 10,0 Гц, 1H), 3,37 (d, J = 10,0 Гц, 1H), 3,29 (s, 3H), 2,66 (t, J = 9,0 Гц, 1H), 2,47 (s, 3H), 2,27-2,15 (m, 1H), 2,08-1,98 (m, 2H), 1,85-1,38 (m, 11H), 1,37-0,95 (m, 11H), 0,91-0,83 (m, 1H), 0,70 (s, 3H) ppm; ESI MS m/z 445 [M+H]+.
Посредством дополнительного элюирования получали 17 в форме почти белого твердого вещества (95 мг, 44%): mp 71-74°C;1H ЯМР (500 МГц, CDCl3) δ 5,37 (d, JAB = 17,0 Гц, 1H), 5,32 (d, JAB = 17,5 Гц, 1H), 3,47 (d, J = 10,0 Гц, 1H), 3,37 (d, J = 10,0 Гц, 1H), 3,29 (s, 3H), 2,62 (t, J = 9,0 Гц, 1H), 2,56 (s, 3H), 2,26-2,18 (m, 1H), 2,09-2,00 (m, 2H), 1,80-1,68 (m, 4H), 1,65-1,46 (m, 6H), 1,43-1,08 (m, 11H), 1,04-0,94 (m, 1H), 0,90-0,82 (m, 1H), 0,73 (s, 3H) ppm; ESI MS m/z 445 [M+H]+.
Пример 9. Получение соединения 18.

Получали согласно Общей процедуре B из соединения A11 (21 мг, 0,047 ммоль) и 4-хлор-1H-пиразола (29 мг, 0,28 ммоль), с полуочисткой посредством колоночной хроматографии на силикагеле, после чего посредством обратнофазной препаративной ВЭЖХ с получением 18 в форме почти белого твердого вещества (10 мг, 46%): mp 100-104°C;1H ЯМР (500 МГц, CDCl3) δ 7,45 (s, 1H), 7,40 (s, 1H), 4,90 (d, JAB = 17,5 Гц, 1H), 4,80 (d, JAB = 17,5 Гц, 1H), 3,46 (d, J = 10,0 Гц, 1H), 3,37 (d, J = 10,0 Гц, 1H), 3,28 (s, 3H), 3,13 (s, 3H), 2,57 (t, J = 9,0 Гц, 1H), 2,26-2,16 (m, 1H), 2,07-1,98 (m, 2H), 1,76-1,67 (m, 4H), 1,63-1,46 (m, 6H), 1,41-1,07 (m, 11H), 1,03-0,92 (m, 1H), 0,91-0,80 (m, 1H), 0,69 (s, 3H) ppm; ESI MS m/z 463 [M+H]+.
Пример 10. Получение соединения 19.

Получали согласно Общей процедуре B из соединения A11 (30 мг, 0,06 ммоль) и 1H-пиразол-3-карбонитрила (25 мг, 0,03 ммоль), с полуочисткой посредством колоночной хроматографии на силикагеле, после чего посредством обратнофазной препаративной ВЭЖХ с получением 19 в форме почти белого твердого вещества (17 мг, 56%): mp 115-120°C;1H ЯМР (300 МГц, CDCl3) δ 7,47 (d, J = 2,4 Гц, 1H), 6,72 (d, J = 2,4 Гц, 1H), 5,00 (q, J = 18,0 Гц, 2H), 3,49 (d, J = 9,9 Гц, 1H), 3,39 (d, J = 10,2 Гц, 1H), 3,29 (s, 3H), 2,65 (t, J = 9,0 Гц, 1H), 2,09-2,01 (m, 1H), 1,78-1,68 (m, 4H), 1,60-1,49 (m, 10H), 1,46-1,26 (m, 9H), 1,23-0,87 (m, 2H), 0,63 (s, 3H) ppm; ESI MS m/z 436 [M+H-H2O]+.
Пример 11. Получение соединения 20.

Получали согласно Общей процедуре B из соединения A11 (130 мг, 0,29 ммоль) и 4-метил-1H-пиразола (247 мг, 3,01 ммоль) с замещением цезия карбонатом (480 мг, 1,5 ммоль) в безводном ацетонитриле (8 мл), с полуочисткой посредством колоночной хроматографии на силикагеле, после чего посредством обратнофазной препаративной ВЭЖХ с получением 20 в форме почти белого твердого вещества (15 мг, 11%): mp 67-71°C;1H ЯМР (500 МГц, CDCl3) δ 7,33 (s, 1H), 7,16 (s, 1H), 4,87 (d, JAB = 18,0 Гц, 1H), 4,79 (d, JAB = 17,5 Гц, 1H), 3,46 (d, J = 10,0 Гц, 1H), 3,37 (d, J = 10,0 Гц, 1H), 3,28 (s, 3H), 3,13 (s, 3H), 2,56 (t, J = 8,5 Гц, 1H), 2,23-2,15 (m, 1H), 2,09 (s, 3H), 2,07-2,00 (m, 2H), 1,75-1,65 (m, 4H), 1,62-1,45 (m, 6H), 1,40-1,08 (m, 11H), 1,02-0,94 (m, 1H), 0,89-0,82 (m, 1H), 0,69 (s, 3H) ppm; ESI MS m/z 443 [M+H]+.
Пример 12. Получение соединения 21.
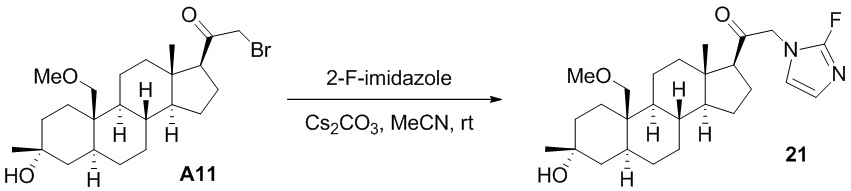
Получали согласно Общей процедуре B из соединения A11 (50 мг, 0,13 ммоль) и 2-фторимидазола гидрохлорида (75 мг, 0,61 ммоль) с замещением цезия карбонатом (200 мг, 0,62 ммоль) в безводном ацетонитриле (4 мл), с полуочисткой посредством колоночной хроматографии на силикагеле, после чего посредством обратнофазной препаративной ВЭЖХ с получением 21 в форме желтого твердого вещества (35 мг, 69%): mp 78-81°C;1H ЯМР (300 МГц, CDCl3) δ 6,91 (d, J = 1,5 Гц, 1H), 6,64 (s, J = 1,5 Гц, 1H), 5,54 (d, JAB = 18,3 Гц, 1H), 4,41 (d, JAB = 18,0 Гц, 1H), 3,48 (d, J = 10,0 Гц, 1H), 3,37 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,54 (t, J = 9,0 Гц, 1H), 2,28-2,14 (m, 1H), 2,09-1,98 (m, 2H), 1,80-1,64 (m, 4H), 1,64-1,46 (m, 6H), 1,44-0,80 (m, 13H), 0,69 (s, 3H) ppm; ESI MS m/z 470 [M+H]+.
Пример 13. Получение соединения 23.

Получали согласно Общей процедуре B из соединения A11 (75 мг, 0,17 ммоль) и 4-метилимидазола (279 мг, 3,4 ммоль), с полуочисткой посредством колоночной хроматографии на силикагеле, после чего посредством обратнофазной препаративной ВЭЖХ с получением 23 в форме белого твердого вещества (18 мг, 24%): mp 87-89°C;1H ЯМР (500 МГц, CDCl3) δ 7,40 (s, 1H), 6,56 (s, 1H), 4,63 (dd, J = 18,0, 10,8 Гц, 2H), 3,47 (d, J = 10,0 Гц, 1H), 3,37 (d, J = 10,0 Гц, 1H), 3,29 (s, 3H), 2,60-2,54 (m, 1H), 2,24-2,17 (m, 3H), 2,08 (s, 1H), 2,04-2,01 (m, 1H), 1,96-1,93 (m, 1H), 1,76-1,68 (m, 4H), 1,63-1,46 (m, 6H), 1,42-1,09 (m, 11H), 1,02-0,93 (m, 1H), 0,87-0,82 (m, 1H), 0,68 (s, 3H) ppm; APCI MS m/z 443 [M+H]+.
Пример 14. Получение соединения 24.

Получали согласно Общей процедуре B из соединения A11 (100 мг, 0,23 ммоль) и 4-(метилсульфонил)-1H-пиразола (99 мг, 0,68 ммоль), с полуочисткой посредством колоночной хроматографии на силикагеле, после чего посредством обратнофазной препаративной ВЭЖХ с получением 24 в форме белого твердого вещества (6 мг, 5%): mp 90-92°C;1H ЯМР (500 МГц, CDCl3) δ 7,91 (s, 1H), 7,86 (s, 1H), 5,02 (d, JAB = 18,0 Гц, 1H), 4,90 (d, JAB = 17,5 Гц, 1H), 3,47 (d, J = 10,0 Гц, 1H), 3,37 (d, J = 10,0 Гц, 1H), 3,28 (s, 3H), 3,13 (s, 3H), 2,61 (t, J = 9,0 Гц, 1H), 2,26-2,16 (m, 1H), 2,07-2,00 (m, 2H), 1,78-1,68 (m, 4H), 1,64-1,46 (m, 6H), 1,44-1,36 (m, 1H), 1,35-1,08 (m, 10H), 1,04-0,94 (m, 1H), 0,89-0,82 (m, 1H), 0,69 (s, 3H) ppm; APCI MS m/z 507 [M+H]+.
Пример 15. Получение соединений 25 и 26.

Получали согласно Общей процедуре B из соединения A21 (150 мг, 0,33 ммоль) и 5-метилтетразола (554 мг, 6,6 ммоль), с очисткой посредством обратнофазной препаративной ВЭЖХ с получением 25 в форме белого твердого вещества (43,6 мг, 28%): mp 71-72°C;1H ЯМР (500 МГц, CDCl3) δ 5,34 (dd, J = 26,5, 17,5 Гц, 2H), 3,52 (d, J = 10,0 Гц, 1H), 3,42-3,38 (m, 3H), 2,62 (t, J = 9,0 Гц, 1H), 2,56 (s, 3H), 2,24-2,22 (m, 1H), 2,08-2,03 (m, 2H), 1,75-1,48 (m, 11H), 1,39-1,08 (m, 13H), 0,99-0,98 (m, 1H), 0,86-0,85 (m, 1H), 0,72 (s, 3H) ppm; ESI MS m/z 459 [M+H]+.
Посредством дополнительного элюирования получали 26 в форме белого твердого вещества (14,9 мг, 7%): mp 82-83°C;1H ЯМР (500 МГц, CDCl3) δ 5,09 (dd, J = 37,0, 18,0 Гц, 2H), 3,52 (d, J = 10,0 Гц, 1H), 3,43-3,37 (m, 3H), 2,65 (t, J = 9,0 Гц, 1H), 2,47 (s, 3H), 2,24-2,22 (m, 1H), 2,06-2,03 (m, 2H), 1,75-1,41 (m, 11H), 1,33-1,09 (m, 13H), 0,99-0,98 (m, 1H), 0,87-0,86 (m, 1H), 0,69 (s, 3H) ppm; ESI MS m/z 459 [M+H]+.
Пример 16. Общая процедура C: Получение A/B-цис основы молекулы

Стадия 1. Получение соединения C2. Смесь коммерчески доступного 19-гидроксиандрост-4-ен-3,17-диона (A1, 13,6 г, 45 ммоль) и палладиевого катализатора на углеродном носителе (3,2 г, 10 масс. %) в безводном тетрагидрофуране (150 мл) встряхивали в атмосфере водорода (50 psi) при комнатной температуре в течение 12 ч, в этот момент анализ смеси посредством ТСХ (2:1 гексан/этилацетат) показал окончание реакции. Атмосферу меняли на азот, и смесь фильтровали через целитную пластину при пониженном давлении, промывая остаток на фильтре этанолом. Отфильтрованные растворители удаляли при пониженном давлении с получением C2 в форме белого твердого вещества, которое применяли на следующей стадии без дополнительной очистки (13,0 г, 95%): LCMS m/z 305 [M+H]+.
Стадия 2. Получение соединения C3. Пиридина гидрохлорид (750 мг, 6,5 ммоль) добавляли к раствору неочищенного соединения C2 (15,0 г, 49 ммоль) в этиленгликоле (65 мл) и безводном толуоле (180 мл) при комнатной температуре в атмосфере азота. Смесь нагревали с обратным холодильником в течение 12 ч с удалением воды с помощью аппарата Дина-Старка, в этот момент анализ смеси посредством ТСХ (2:1 гексан/этилацетат) показал окончание реакции. Растворители удаляли из охлажденной смеси при пониженном давлении, и остаток обрабатывали насыщенным водным раствором хлорида натрия (50 мл) и экстрагировали этилацетатом (3 x 50 мл). Объединенные органические экстракты промывали насыщенным водным раствором хлорида натрия (3 x 10 мл), сушили безводным сульфатом натрия и фильтровали. Растворители удаляли при пониженном давлении с получением соединения C3 в форме бесцветного масла, которое применяли на следующей стадии без дополнительной очистки (20,3 г, >99%):1H ЯМР (300 МГц, CDCl3) δ 4,11-3,81 (m, 8H), 3,60-3,54 (m, 1H), 2,05-1,92 (m, 3H), 1,81-163 (m, 4H), 1,59-1,35 (m, 12H), 1,28-1,12 (m, 5H), 0,8 (s, 3H) ppm; LCMS m/z 393 [M+H]+.
Стадия 3. Получение соединения C4. Раствор неочищенного соединения C3 (20,3 г, 49 ммоль) в безводном тетрагидрофуране (120 мл) по каплям добавляли к суспензии гидрида натрия (7,9 г, 197 ммоль, 60% в минеральном масле) в безводном тетрагидрофуране (120 мл) при 0°C в атмосфере азота, после чего смесь перемешивали при 0°C в течение 30 мин. По каплям добавляли йодометан (15,3 мл, 246 ммоль), после чего смесь нагревали до 35°C и перемешивали в течение 3 ч, в этот момент анализ смеси посредством ТСХ (3:1 гексан/этилацетат) показал окончание реакции. Охлажденную смесь обрабатывали насыщенным раствором хлорида аммония (100 мл) и экстрагировали этилацетатом (2 x 50 мл). Объединенные органические экстракты промывали насыщенным водным раствором хлорида натрия (2 x 20 мл), сушили безводным сульфатом натрия и фильтровали. Растворители удаляли при пониженном давлении с получением неочищенного соединения C4 в форме желтого масла, которое применяли на следующей стадии без дополнительной очистки (25,6 г, >99%): LCMS m/z 407 [M+H]+.
Стадия 4. Получение соединения C5. Смесь неочищенного соединения C4 (25,5 г, 49 ммоль) в тетрагидрофуране (150 мл) и ацетоне (90 мл) при комнатной температуре обрабатывали посредством 2 н. HCl (123 мл), и смесь перемешивали в течение 16 ч, в этот момент анализ смеси посредством ТСХ (2:1 гексан/этилацетат) показал окончание реакции. Реакционную смесь доводили до pH 8 посредством медленного добавления насыщенного водного раствора бикарбоната натрия и экстрагировали этилацетатом (3 x 125 мл). Объединенные органические экстракты промывали насыщенным водным раствором хлорида натрия (2 x 20 мл), сушили безводным сульфатом натрия и фильтровали. Растворители удаляли при пониженном давлении, и остаток очищали посредством колоночной хроматографии на силикагеле, проводя элюирование гексаном/этилацетатом (2:1), с получением соединения C5 в форме белого твердого вещества (10,6 г, 67%):1H ЯМР (300 МГц, CDCl3) δ 3,62-3,59 (m, 1H), 3,36-3,33 (m, 4H), 2,67-2,63 (m, 1H), 2,58-2,45 (m, 1H), 2,42-2,27 (m, 3H), 2,25-1,84 (m, 6H), 1,71-1,23 (m, 11H), 0,89 (s, 3H) ppm; LCMS m/z 319 [M+H]+.
Стадия 5. Получение соединения C6. Йод (84 мг, 0,3 ммоль) добавляли к раствору соединения C5 (10,6 г, 33 ммоль) в безводном метаноле (200 мл) при комнатной температуре в атмосфере азота, после чего смесь нагревали до 60°C и перемешивали в течение 90 мин, в этот момент анализ смеси посредством ТСХ (2:1 гексан/этилацетат) показал окончание реакции. Охлажденную смесь обрабатывали 1 н. раствором гидроксида натрия (200 мл) и экстрагировали гексаном/этилацетатом (3:1, 3 x 100 мл). Объединенные органические экстракты промывали насыщенным водным раствором хлорида натрия (2 x 25 мл), сушили безводным сульфатом натрия и фильтровали. Растворители удаляли при пониженном давлении с получением соединения C6 в форме бесцветного масла, которое применяли на следующей стадии без дополнительной очистки (13,8 г, >99%); LCMS m/z 365 [M+H]+.
Стадия 6. Получение соединения C7. Трет-бутоксид калия (11,2 г, 100 ммоль) добавляли к смеси этилтрифенилфосфония бромида (36,9 г, 100 ммоль) в безводном тетрагидрофуране (150 мл) при комнатной температуре в атмосфере азота, после чего смесь нагревали до 60°C и перемешивали в течение 4 ч. Добавляли раствор соединения C6 (13,8 г, 33 ммоль) в безводном тетрагидрофуране (100 мл), после чего перемешивание при 60°C продолжали в течение 18 ч. Охлажденную смесь разбавляли водой (200 мл) и гексаном (100 мл) и экстрагировали этилацетатом (3 x 100 мл). Объединенные органические экстракты промывали насыщенным водным раствором хлорида натрия (2 x 25 мл), обрабатывали посредством 2 н. HCl (100 мл) и перемешивали при комнатной температуре в течение 3 ч. Полученную смесь промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, сушили сульфатом натрия и фильтровали. Растворители удаляли при пониженном давлении, и остаток очищали посредством колоночной хроматографии на силикагеле, проводя элюирование гексаном/этилацетатом (9:1), с получением соединения C7 в форме бесцветного масла (9,2 г, 84%): LCMS m/z 331 [M+H]+.
Стадия 7. Получение соединения C8. Бис(2,6-ди-трет-бутил-4-метилфеноксид)метилалюминий (40,6 мл, 16 ммоль, 0,4 M в толуоле) одной частью добавляли к раствору соединения C7 (1,8 г, 5,4 ммоль) в безводном толуоле (20 мл) при -78°C в атмосфере азота, после чего смесь перемешивали в течение 10 мин. По каплям добавляли метилмагния бромид (11,6 мл, 16 ммоль, 1,4 M в тетрагидрофуране/толуоле), после чего смесь перемешивали при -78°C в течение 1 ч. Смесь нагревали до температуры ледяной бани и медленно обрабатывали посредством 2 н. HCl (60 мл), нагревали до комнатной температуры и экстрагировали этилацетатом (3 x 50 мл). Объединенные органические экстракты промывали насыщенным водным раствором хлорида натрия (2 x 20 мл), сушили сульфатом натрия и фильтровали. Растворители удаляли при пониженном давлении, и остаток очищали посредством колоночной хроматографии на силикагеле, проводя элюирование гексаном/этилацетатом (2:1), с получением неочищенного соединения C8 в форме белого полутвердого вещества (1,5 г, 91%); LCMS m/z 347 [M+H]+.
Стадия 8. Получение соединения C9. Комплекс боран-тетрагидрофуран (27,6 мл, 27,6 ммоль, 1,0 M раствор в тетрагидрофуране) добавляли к раствору соединения C8 (2,4 г, 6,9 ммоль) в безводном тетрагидрофуране (24 мл) при 0°C в атмосфере азота, после чего смесь медленно нагревали до комнатной температуры, перемешивая в течение 4 ч в целом. Смесь охлаждали на ледяной бане, и медленно добавляли 10% водный раствор гидроксида натрия (20 мл), после чего добавляли 30% водный раствор пероксида водорода (20 мл). Полученную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч, и затем обрабатывали насыщенным водным раствором хлорида натрия (100 мл) и экстрагировали дихлорметаном (3 x 100 мл). Объединенные органические экстракты промывали насыщенным водным раствором хлорида натрия (25 мл), сушили сульфатом натрия и фильтровали. Растворители удаляли при пониженном давлении с получением неочищенного соединения C9 в форме белого твердого вещества, которое применяли на следующей стадии без дополнительной очистки (2,7 г, >99%); LCMS m/z 365 [M+H]+.
Стадия 9. Получение C10. Хлорхромат пиридиния (6,0 г, 28 ммоль) одной частью добавляли к раствору соединения C9 (2,7 г, 6,9 ммоль) в дихлорметане (100 мл) при 0°C в атмосфере азота, после чего смесь медленно нагревали до комнатной температуры, перемешивая в течение 16 ч в целом. Твердые вещества удаляли посредством фильтрации, и отфильтрованные растворители удаляли при пониженном давлении. Остаток полуочищали посредством колоночной хроматографии на силикагеле, проводя элюирование гексаном/этилацетатом (1:1), после чего дополнительную очистку посредством обратнофазной препаративной ВЭЖХ с получением C10 в форме белого твердого вещества (2,15 г, 86%): mp 142-144°C;1H ЯМР (300 МГц, CDCl3) δ 3,55 (d, J = 9,0 Гц, 1H), 3,33 (s, 3H), 3,19 (d, J = 9,0 Гц, 1H), 2,53 (t, J = 9,0 Гц, 1H), 2,21-2,11 (m, 4H), 2,08-1,87 (m, 3H), 2,14-1,91 (m, 7H), 1,77-1,36 (m, 16H), 1,28 (s, 3H), 1,26-1,07 (m, 2H), 0,60 (s, 3H) ppm; LCMS m/z 345 [M+H-H2O]+.
Стадия 10. Получение соединения C11. Бромоводород (5 капель, 48% в воде) добавляли к раствору (C10, 2,15 г, 5,9 ммоль) в безводном метаноле (150 мл) при комнатной температуре в темноте в атмосфере азота, после чего добавляли бром (0,6 мл, 12 ммоль), и смесь перемешивали в течение 90 мин. Смесь выливали в ледяную воду (250 мл) и обрабатывали 2 н. раствором гидроксида натрия (20 мл), после чего насыщенным водным раствором бикарбоната натрия (100 мл). Твердые вещества собирали при пониженном давлении и очищали посредством колоночной хроматографии на силикагеле, проводя элюирование гексаном/этилацетатом (1:1), с получением соединения C11 в форме белого твердого вещества (1,4 г, 53%): LCMS m/z 442 [M+H]+.
Пример 17. Альтернативное получение промежуточного соединения C9.

Стадия 1. Получение соединения C2. К раствору Pd/C (1 г, 10 % wet) в ТГФ (10 мл) добавляли раствор A1 (10 г, 33,07 ммоль) в сухом ТГФ (140 мл), добавленный в смеси. После того, как ТСХ показала полное расходование исходного материала, смесь фильтровали с CH2Cl2 (300 мл) и концентрировали. Остаток очищали посредством колоночной хроматографии на силикагеле (PE:EA=8:1-4:1-2:1-1:1-EA) с получением C2 (8,3 г, 82,43 %) в форме белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ (ppm)= 3,96 (d, J=8,0 Гц, 1H), 3,69 (d, J=8,0 Гц, 1H), 2,69-2,65 (m, 1H), 2,45-2,29 (m, 4H), 2,12-1,69 (m, 8H), 1,63-1,23 (m, 7H), 0,88 (s, 3H)
Стадия 2. Получение соединения C20. К раствору соединения C2 (15 г, 49,3 ммоль) в ТГФ (150 мл) добавляли KOH (8,4 г, 149,7 ммоль) и Me2SO4 (12,9 г, 100,67 моль) при 0°C. Затем смесь нагревали до 25°C и перемешивали при той же температуре в течение 3 ч. ТСХ (PE:EA=1:4) показала, что исходный материал почти израсходован. Смесь гасили посредством добавления 300 мл воды. Полученный раствор экстрагировали посредством EtOAc (200 mL*3). Объединенные органические соли промывали насыщенным водным раствором NaCl (50 мл), сушили над безводным Na2SO4 и выпаривали под вакуумом с получением неочищенного продукта, который очищали посредством колоночной хроматографии на силикагеле (петролейный эфир/этилацетат =4/1) с получением соединения C20 (9,5 г, 60,5%) в форме белого твердого вещества.
Стадия 3. Получение соединения C21. К раствору соединения 2,6-ди-трет-бутил-4-метилфенола (4,15 г, 18,84 ммоль) в толуоле (8 мл) по каплям добавляли AlMe3 (4,7 мл, 9,42 ммоль, 2 M в толуоле) при температуре ниже 25°C. Раствор перемешивали при комнатной температуре в течение 1 ч. Затем по каплям добавляли раствор соединения C20 (1 г, 3,14 ммоль) в толуоле (3 мл) при -78°C. После перемешивания при той же температуре в течение 1 ч, по каплям добавляли MeMgBr (5,23 мл, 15,7 ммоль, 3M в этиловом эфире) при -78°C. Полученный раствор перемешивали при от -78°C до -50°C в течение 3 ч. ТСХ (PE/EtOAc = 1/1) показала окончание реакции. Реакцию гасили насыщенным водным раствором NH4Cl (200 мл) при -78°C. Полученную смесь фильтровали через целитную пластинку, и пластинку промывали EtOAc (100 мл). Объединенный органический слой отделяли, промывали солевым раствором (100 мл x 2) и концентрировали под вакуумом. Неочищенный продукт очищали посредством колоночной хроматографии с диоксидом кремния (петролейный эфир/этилацетат =4/1) с получением соединения C21 (1 г, 95%) в форме бледно-желтого масла.
Стадия 4. Получение соединения C22. К раствору PPh3EtBr (42,17 г, 113,6 ммоль) в ТГФ (40 мл) добавляли раствор t-BuOK (12,75 г, 113,6 ммоль) в ТГФ (40 мл) при 0°C. После перемешивания при 60°C в течение 1 ч, по каплям добавляли раствор соединения C21 (7,6 г, 22,72 ммоль) в ТГФ (40 мл) при 60°C. Затем реакционную смесь перемешивали при 60°C в течение 8 ч. ТСХ (PE/EtOAc = 3/1) показала, что исходный материал также оставался. К раствору PPh3EtBr (42,17 г, 113,6 ммоль) в ТГФ (40 мл) добавляли раствор t-BuOK (12,75 г, 113,6 ммоль) в ТГФ (40 мл) при 0°C. После перемешивания при 60°C в течение 1 ч. раствор добавляли к реакционной смеси. Затем реакционную смесь перемешивали при 60°C в течение 8 ч. ТСХ (PE/EA=3/1) показала, что исходный материал также оставался, и реакционная смесь была почти без изменений. Реакционную смесь фильтровали, и фильтрат концентрировали под вакуумом для удаления большей части растворителя. Остаток распределяли между EtOAc (300 мл) и водой (100 мл x 3). Органический слой промывали солевым раствором (100 мл), сушили над Na2SO4 и концентрировали под вакуумом. Неочищенный продукт очищали посредством колонки с диоксидом кремния (PE:EA=5:1) с получением соединения C22 (4,0 г, 50,8%) в форме бледно-желтого масла.1H ЯМР (400 МГц, CDCl3) δ 5,15-5,09(m, 1H), 3,58(d, J=9,2Гц, 1H), 3,49(s, 1H), 3,33(s, 3H),3,20(d, J=8,8Гц, 1H), 2,40-1,10(m, 28H), 0,85(s, 3H).
Стадия 5. Получение соединения C9. К раствору соединения C22 (2,5 г, 7,21 ммоль) в ТГФ (30 мл) по каплям добавляли раствор BH3-Me2S (7,21 мл, 32,88 ммоль) при 0°C. Раствор перемешивали при 25°C в течение 3 ч. ТСХ (PE/EtOAc = 1/1) показала окончание реакции. После охлаждения до 0°C, очень медленно добавляли раствор NaOH (27,5 мл, 3M). После окончания добавления, медленно добавляли H2O2 (15 мл, 30%), и внутреннюю температуру поддерживали ниже 10°C. Полученный раствор перемешивали при комнатной температуре в течение 2 ч. Полученный раствор экстрагировали посредством EtOAc (100 мл x3). Объединенный органический раствор промывали насыщенным водным раствором Na2S2O3 (100 мл), солевым раствором (100 мл), сушили над Na2SO4 и концентрировали под вакуумом с получением неочищенного продукта соединения C23 (2,5 г, 95,15%) в форме белого твердого вещества. Неочищенный продукт применяли на следующей стадии без дополнительной очистки.
Пример 18. Общая процедура E: Получение A/B-цис основы молекулы аналогов C-21

Получение соединений 73, 74 и 75. 5-Фтор-1H-бензо[d][1,2,3]триазол (112 мг, 0,82 ммоль) и карбонат калия (373 мг, 2,7 ммоль) добавляли к раствору соединения C11 (120 мг, 0,27 ммоль) в безводном тетрагидрофуране (12 мл) при комнатной температуре в атмосфере азота, и смесь перемешивали в течение 16 ч, в этот момент анализ смеси посредством ТСХ (2:1 гексан/этилацетат) показал окончание реакции. Смесь разбавляли водой (80 мл) и экстрагировали этилацетатом (3 x 80 мл). Объединенные органические экстракты промывали насыщенным водным раствором хлорида натрия (2 x 25 мл), сушили сульфатом натрия и фильтровали. Растворители удаляли при пониженном давлении, и остаток полуочищали посредством колоночной хроматографии на силикагеле, проводя элюирование гексаном/этилацетатом (3:1), с получением смеси трех региоизомеров. Остаток дополнительно очищали посредством обратнофазной препаративной ВЭЖХ с получением 73 в форме белого твердого вещества (44 мг, 33%): mp 82-84°C;1H ЯМР (500 МГц, CDCl3) δ 7,86 (dd, J = 9,0, 4,5 Гц, 1H), 7,46 (dd, J = 9,0, 2,5 Гц, 1H), 7,20 (ddd, J = 9,0, 9,0, 2,0 Гц, 1H), 5,50 (d, JAB = 17,5 Гц, 1H), 5,46 (d, JAB = 17,0 Гц, 1H), 3,54 (d, J = 9,5 Гц, 1H), 3,34 (s, 3H), 3,21 (d, J = 9,0 Гц, 1H), 2,64 (t, J = 9,0 Гц, 1H), 2,27-2,18 (m, 1H), 2,18-2,11 (m, 1H), 1,96-1,88 (m, 2H), 1,83-1,40 (m, 12H), 1,39-1,10 (m, 10H), 0,73 (s, 3H) ppm; ESI MS m/z 496 [M-H]-.
Посредством дополнительного элюирования получали 75 в форме белого твердого вещества (25 мг, 18%): mp 205-207°C;1H ЯМР (500 МГц, CDCl3) δ 7,72-7,68 (m, 1H), 7,31-7,27 (m, 2H), 5,43 (d, JAB = 18,0 Гц, 1H), 5,36 (d, JAB = 18,0 Гц, 1H), 3,54 (d, J = 9,0 Гц, 1H), 3,34 (s, 3H), 3,23 (d, J = 9,0 Гц, 1H), 2,70 (t, J = 9,0 Гц, 1H), 2,27-2,18 (m, 1H), 2,18-2,12 (m, 1H), 1,97-1,88 (m, 2H), 1,84-1,72 (m, 3H), 1,70-1,58 (m, 3H), 1,57-1,43 (m, 6H), 1,40-1,12 (m, 10H), 0,71 (s, 3H) ppm; ESI MS m/z 498 [M+H]+.
Посредством дополнительного элюирования получали 74 в форме почти белого твердого вещества (30 мг, 22%): mp 195-197°C;1H ЯМР (500 МГц, CDCl3) δ 8,04 (dd, J = 9,0, 4,5 Гц, 1H), 7,15 (dt, J = 9,0, 2,5 Гц, 1H), 6,97 (dd, J = 7,5, 2,0 Гц, 1H), 5,40 (d, JAB = 18,0 Гц, 1H), 5,33 (d, JAB = 18,0 Гц, 1H), 3,54 (d, J = 9,0 Гц, 1H), 3,34 (s, 3H), 3,22 (d, J = 9,0 Гц, 1H), 2,70 (t, J = 9,0 Гц, 1H), 2,27-2,18 (m, 1H), 2,18-2,12 (m, 1H), 1,97-1,89 (m, 2H), 1,84-1,72 (m, 3H), 1,71-1,57 (m, 3H), 1,57-1,42 (m, 6H), 1,40-1,12 (m, 10H), 0,72 (s, 3H) ppm; ESI MS m/z 498 [M+H]+.
Пример 19. Получение соединения 27.

Получали согласно Общей процедуре E, Стадия 2 из соединения C11 (60 мг, 0,14 ммоль) и 1H-пиразол-4-карбонитрила (63 мг, 0,67 ммоль), с очисткой посредством колоночной хроматографии на силикагеле с получением соединения 27 в форме почти белого твердого вещества (27,3 мг, 44%): mp 176-178°C;1H ЯМР (300 МГц, CDCl3) δ 7,83 (d, J = 12,3 Гц, 2H), 4,95 (q, J = 18,3 Гц, 2H), 3,53 (d, J = 9,0 Гц, 1H), 3,33 (s, 3H), 3,22 (d, J = 9,0 Гц, 1H), 2,59 (t, J = 9,3 Гц, 1H), 2,26-1,35 (m, 17H), 1,31-1,08 (m, 9H), 0,66 (s, 3H) ppm; ESI MS m/z 437 [M+H-H2O]+.
Пример 20. Получение соединения 28.

Получали согласно Общей процедуре E, Стадия 2 из соединения C11 (80 мг, 0,18 ммоль) и 4-метил-1H-пиразола (45 мг, 0,54 ммоль) с замещением цезия карбонатом (177 мг, 0,54 ммоль) в безводном ацетонитриле (6 мл) при 65°C, с очисткой посредством колоночной хроматографии на силикагеле с получением соединения 28 в форме белого твердого вещества (58 мг, 73%): mp 158-160°C;1H ЯМР (500 МГц, CDCl3) δ 7,34 (s, 1H), 7,16 (s, 1H), 4,86 (d, JAB = 17,5 Гц, 1H), 4,78 (d, JAB = 18,0 Гц, 1H), 3,54 (d, J = 9,0 Гц, 1H), 3,32 (s, 3H), 3,19 (d, J = 9,0 Гц, 1H), 2,54 (t, J = 9,5 Гц, 1H), 2,23-2,13 (m, 1H), 2,09 (s, 3H), 2,07-2,02 (m, 1H), 1,97-1,87 (m, 2H), 1,80-1,35 (m, 12H), 1,33-1,10 (m, 10H), 0,66 (s, 3H) ppm; ESI MS m/z 443 [M+H]+.
Пример 21. Получение соединениий 29 и 30.

Получали согласно Общей процедуре E, Стадия 2 из соединения C11 (100 мг, 0,23 ммоль) и 5-метилтетразола (95 мг, 1,13 ммоль), с полуочисткой посредством колоночной хроматографии на силикагеле, после чего посредством обратнофазной препаративной ВЭЖХ с получением 29 в форме почти белого твердого вещества (12,2 мг, 12%): mp 90-92°C;1H ЯМР (300 МГц, CDCl3) δ 5,09 (q, J = 18,0 Гц, 2H), 3,53 (d, J = 9,0 Гц, 1H), 3,33 (s, 3H), 3,22 (d, J = 9,0 Гц, 1H), 2,65 (t, J = 9,0 Гц, 1H), 2,47 (s, 3H), 2,25-1,58 (m, 9H), 1,55-1,14 (m, 17H), 0,67 (s, 3H) ppm; ESI MS m/z 428 [M+H-H2O]+.
Посредством дополнительного элюирования получали 30 в форме почти белого твердого вещества (13,4 мг, 13%): mp 70-72°C;1H ЯМР (300 МГц, CDCl3) δ 5,34 (s, 2H), 3,54 (d, J = 9,0 Гц, 1H), 3,33 (s, 3H), 3,20 (d, J = 9,0 Гц, 1H), 2,64-2,57 (m, 4H), 2,43-1,91 (m, 6H), 1,81-1,10 (m, 20H), 0,70 (s, 3H) ppm; ESI MS m/z 428 [M+H-H2O]+.
Пример 22. Получение соединениий 31 и 32.

Получали согласно Общей процедуре E, Стадия 2 из соединения C11 (82 мг, 0,18 ммоль) и 1H-1,2,3-триазола (75 мг, 1,08 ммоль), с полуочисткой посредством колоночной хроматографии на силикагеле, после чего посредством обратнофазной препаративной ВЭЖХ с получением 32 в форме почти белого твердого вещества (17 мг, 22%): mp 80-83°C;1H ЯМР (500 МГц, CDCl3) δ 7,79 (s, 1H), 7,66 (s, 1H), 5,26 (d, JAB = 18,0 Гц, 1H), 5,13 (d, JAB = 18,0 Гц, 1H), 3,53 (d, J = 9,0 Гц, 1H), 3,33 (s, 3H), 3,20 (d, J = 9,0 Гц, 1H), 2,64 (t, J = 9,0 Гц, 1H), 2,26-2,16 (m, 1H), 2,12-2,06 (m, 1H), 1,96-1,70 (m, 6H), 1,66-1,42 (m, 6H), 1,35-1,10 (m, 11H), 0,90-0,83 (m, 1H), 0,66 (s, 3H) ppm; ESI MS m/z 430 [M+H]+.
Посредством дополнительного элюирования получали 31 в форме почти белого твердого вещества (12 мг, 16%): mp 71-74°C;1H ЯМР (500 МГц, CDCl3) δ 7,68 (s, 2H), 5,24 (d, JAB = 17,5 Гц, 1H), 5,21 (d, JAB = 17,5 Гц, 1H), 3,54 (d, J = 9,0 Гц, 1H), 3,33 (s, 3H), 3,19 (d, J = 9,0 Гц, 1H), 2,56 (t, J = 9,0 Гц, 1H), 2,24-2,15 (m, 1H), 2,11-2,05 (m, 1H), 1,96-1,88 (m, 2H), 1,82-1,68 (m, 3H), 1,66-1,40 (m, 6H), 1,40-1,09 (m, 11H), 0,90-0,83 (m, 1H), 0,70 (s, 3H) ppm; ESI MS m/z 430 [M+H]+.
Пример 23. Получение соединения 33.
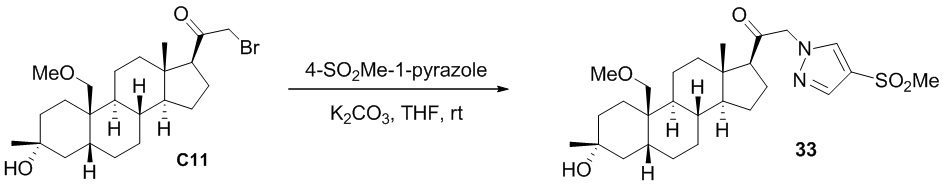
Получали согласно Общей процедуре E, Стадия 2 из соединения C11 (80 мг, 0,18 ммоль) и 4-(метилсульфонил)-1H-пиразола (79 мг, 0,54 ммоль), с полуочисткой посредством колоночной хроматографии на силикагеле, после чего посредством обратнофазной препаративной ВЭЖХ с получением 33 в форме белого твердого вещества (62 мг, 69%): mp 110-112°C;1H ЯМР (500 МГц, CDCl3) δ 7,92 (s, 1H), 7,86 (s, 1H), 5,00 (d, JAB = 18,0 Гц, 1H), 4,90 (d, JAB = 17,5 Гц, 1H), 3,53 (d, J = 9,0 Гц, 1H), 3,33 (s, 3H), 3,21 (d, J = 9,0 Гц, 1H), 3,13 (s, 3H), 2,60 (t, J = 9,0 Гц, 1H), 2,25-2,15 (m, 1H), 2,08-2,02 (m, 1H), 1,96-1,88 (m, 2H), 1,82-1,71 (m, 3H), 1,67-1,56 (m, 3H), 1,54-1,41 (m, 6H), 1,39-1,13 (m, 10H), 0,67 (s, 3H) ppm; ESI MS m/z 505 [M-H]-.
Пример 24. Получение соединения 34.
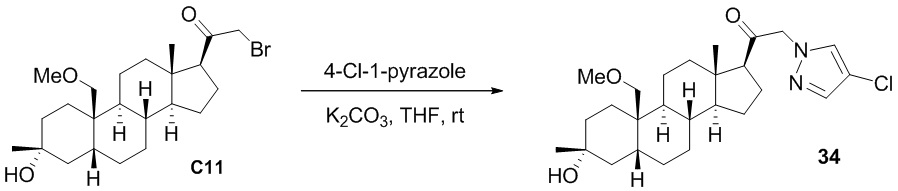
Получали согласно Общей процедуре E, Стадия 2 из соединения C11 (80 мг, 0,18 ммоль) и 4-хлор-1H-пиразола (45 мг, 0,54 ммоль), с очисткой посредством колоночной хроматографии на силикагеле с получением соединения 34 в форме белого твердого вещества (58 мг, 70%): mp 163-165°C;1H ЯМР (500 МГц, CDCl3) δ 7,45 (s, 1H), 7,41 (s, 1H), 4,99 (d, JAB = 17,5 Гц, 1H), 4,80 (d, JAB = 17,5 Гц, 1H), 3,53 (d, J = 9,0 Гц, 1H), 3,33 (s, 3H), 3,21 (d, J = 9,0 Гц, 1H), 2,56 (t, J = 9,0 Гц, 1H), 2,24-2,14 (m, 1H), 2,07-2,01 (m, 1H), 1,96-1,88 (m, 2H), 1,80-1,69 (m, 3H), 1,66-1,35 (m, 9H), 1,34-1,10 (m, 10H), 0,66 (s, 3H) ppm; ESI MS m/z 463 [M+H]+.
Пример 25. Получение соединения 38.

Получали согласно Общей процедуре B из соединения A11 (31 мг, 0,071 ммоль) и 2H-пиразоло[4,3-b]пиридина (168 мг, 1,41 ммоль), с очисткой посредством обратнофазной препаративной ВЭЖХ с получением 38 в форме белого твердого вещества (8,7 мг, 25%): mp 153-154°C;1H ЯМР (500 МГц, CDCl3) δ 8,60 (d, J = 3,5 Гц, 1H), 8,28 (s, 1H), 7,59 (d, J = 8,5 Гц, 1H), 7,29 (dd, J = 8,5, 4,5 Гц, 1H), 5,16 (dd, J = 29,0, 18,0 Гц, 2H), 3,48 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,66 (t, J = 9,0 Гц, 1H), 2,22-2,00 (m, 1H), 2,13-2,11 (m, 1H), 2,10-2,08 (m, 1H), 1,79-1,40 (m, 11H), 1,33-1,11 (m, 10H), 0,99-0,97 (m, 1H), 0,88-0,86 (m, 1H), 0,73 (s, 3H) ppm; ESI MS m/z 480 [M+H]+.
Пример 26. Получение соединений 39 и 40.

Получали согласно Общей процедуре B из соединения A11 (21 мг, 0,047 ммоль) и 1H-бензотриазола (33 мг, 0,28 ммоль), с полуочисткой посредством колоночной хроматографии на силикагеле, после чего посредством обратнофазной препаративной ВЭЖХ с получением 39 в форме почти белого твердого вещества (13 мг, 58%): mp 78-80°C;1H ЯМР (500 МГц, CDCl3) δ 8,11-8,07 (m, 1H), 7,51-7,46 (m, 1H), 7,40-7,36 (m, 1H), 7,33 (d, J = 7,5, 1H), 5,41 (s, 2H), 3,48 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,71 (t, J = 9,0 Гц, 1H), 2,27-2,18 (m, 1H), 2,17-2,10 (m, 1H), 2,08-2,02 (m, 1H), 1,82-1,68 (m, 4H), 1,67-1,42 (m, 7H), 1,35-1,09 (m, 10H), 1,05-0,95 (m, 1H), 0,91-0,83 (m, 1H), 0,76 (s, 3H) ppm; ESI MS m/z 480 [M+H]+.
Посредством дополнительного элюирования получали 40 в форме почти белого твердого вещества (7 мг, 30%): mp 70-72°C;1H ЯМР (500 МГц, CDCl3) δ 7,90-7,85 (m, 2H), 7,41-7,36 (m, 2H), 5,54 (d, JAB = 17,0 Гц, 1H), 5,48 (d, JAB = 17,0 Гц, 1H), 3,48 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,290 (s, 3H), 2,63 (t, J = 9,0 Гц, 1H), 2,28-2,20 (m, 1H), 2,17-2,12 (m, 1H), 2,07-2,01 (m, 1H), 1,80-1,68 (m, 4H), 1,67-1,46 (m, 6H), 1,45-1,36 (m, 1H), 1,35-1,08 (m, 10H), 1,04-0,94 (m, 1H), 0,90-0,82 (m, 1H), 0,77 (s, 3H) ppm; ESI MS m/z 480 [M+H]+.
Пример 27. Получение соединений 41, 42 и 43.
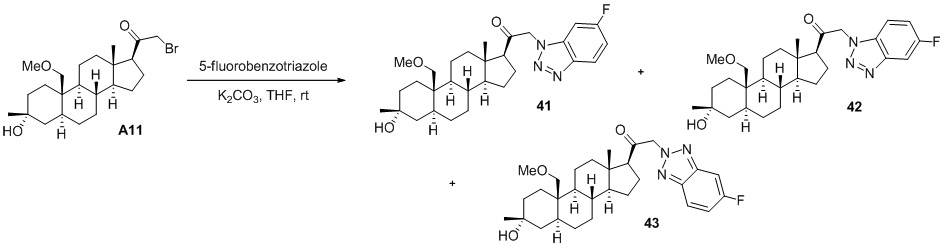
Получали согласно Общей процедуре B из соединения A11 (100 мг, 0,23 ммоль) и 5-фторбензотриазола (124 мг, 0,91 ммоль), с очисткой посредством обратнофазной препаративной ВЭЖХ с получением 43 в форме почти белого твердого вещества (39,2 мг, 40%): mp 55-60°C;1H ЯМР (300 МГц, CDCl3) δ 7,86 (dd, J = 4,8, 4,5 Гц, 1H), 7,46 (dd, J = 9,0, 2,1 Гц, 1H), 7,23-7,16 (m, 1H), 5,49 (q, J = 18,0 Гц, 2H), 3,48 (d, J = 9,9 Гц, 1H), 3,38 (d, J = 9,9 Гц, 1H), 3,37 (s, 3H), 2,66 (t, J = 8,7 Гц, 1H), 2,29-2,01 (m, 3H), 1,79-1,50 (m, 15H), 1,45-1,05 (m, 6H), 1,01-0,82 (m, 2H), 0,76 (s, 3H) ppm; ESI MS m/z 498 [M+H]+.
Посредством дополнительного элюирования получали 41 в форме почти белого твердого вещества (21,2 мг, 34%): mp 65-70°C;1H ЯМР (300 МГц, CDCl3) δ 8,03 (dd, J = 9,0, 4,5 Гц, 1H), 7,18-7,12 (m, 1H), 6,99-6,58 (m, 1H), 5,37 (q, J = 18,3 Гц, 2H), 3,47 (d, J = 10,2 Гц, 1H), 3,38 (d, J = 10,2 Гц, 1H), 3,31 (s, 3H), 2,72 (t, J = 9,0 Гц, 1H), 2,28-2,02 (m, 3H), 1,79-1,33 (m, 13H), 1,29-0,84 (m, 10H), 0,75 (s, 3H) ppm; ESI MS m/z 498 [M+H]+.
Посредством дополнительного элюирования получали 42 в форме почти белого твердого вещества (21,2 мг, 34%): mp 60-65°C;1H ЯМР (300 МГц, CDCl3) δ 7,73 (d, J = 9,9 Гц, 1H), 7,35-7,21 (m, 2H), 5,40 (q, J = 18,3 Гц, 2H), 3,49 (d, J = 9,9 Гц, 1H), 3,37 (d, J = 10,2 Гц, 1H), 3,30 (s, 3H), 2,72 (t, J = 9,0 Гц, 1H), 2,28-2,03 (m, 3H), 1,82-1,46 (m, 9H), 1,37-1,16 (m, 12H), 1,06-0,84 (m, 2H), 0,74 (s, 3H) ppm; ESI MS m/z 498 [M+H]+.
Пример 28. Получение соединений 44 и 45.

Получали согласно Общей процедуре B из соединения A11 (50 мг, 0,11 ммоль) и 1H-пиразоло[3,4-c]пиридина (67 мг, 0,57 ммоль), с очисткой посредством обратнофазной препаративной ВЭЖХ с получением 44 в форме почти белого твердого вещества (7,5 мг, 14%): mp 160-162°C;1H ЯМР (300 МГц, CDCl3) δ 9,26 (s, 1H), 8,17 (d, J = 6,0 Гц, 1H), 7,97 (d, J = 0,9 Гц, 1H), 7,53 (dd, J = 6,0, 1,2 Гц, 1H), 5,27 (q, J = 18,0 Гц, 2H), 3,46 (d, J = 9,9 Гц, 2H), 3,37 (d, J = 10,2 Гц, 2H), 2,68 (t, J = 9,3 Гц, 1H), 2,30-2,19 (m, 1H), 1,18-2,01 (m, 3H), 1,79-1,64 (m, 5H), 1,61-1,45 (m, 7H), 1,39-1,08 (m, 8H), 1,05-0,84 (m, 3H), 0,74 (s, 3H) ppm; ESI MS m/z 480 [M+H]+.
Посредством дополнительного элюирования получали 45 в форме почти белого твердого вещества (14,2 мг, 26%): mp 92-94°C;1H ЯМР (300 МГц, CDCl3) δ 8,80 (s, 1H), 8,34 (d, J = 5,4 Гц, 1H), 8,09 (d, J = 0,6 Гц, 1H), 7,64 (dd, J = 5,7, 1,2 Гц, 1H), 5,25 (q, J = 18,0 Гц, 2H), 3,48 (d, J = 9,9 Гц, 2H), 3,38 (d, J = 9,9 Гц, 2H), 3,31 (s, 3H), 2,70 (t, J = 8,7 Гц, 1H), 2,27-1,98 (m, 3H), 1,81-1,44 (m, 10H), 1,34-1,12 (m, 9H), 1,10-0,81 (m, 2H), 0,74 (s, 3H) ppm; ESI MS m/z 480 [M+H]+.
Пример 29. Получение соединения 46.

Получали согласно Общей процедуре B из соединения A11 (50 мг, 0,114 ммоль) и бензимидазола (268 мг, 2,3 ммоль), с очисткой посредством обратнофазной препаративной ВЭЖХ с получением 46 в форме белого твердого вещества (36,5 мг, 67%): mp 104-105°C;1H ЯМР (500 МГц, CDCl3) δ 7,99 (s, 1H), 7,86-7,82 (m, 1H), 7,33-7,29 (m, 2H), 7,20-7,18 (m, 1H), 4,93 (dd, J = 24,0, 18,5 Гц, 2H), 3,49 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,66 (t, J = 9,0 Гц, 1H), 2,24-2,22 (m, 1H), 2,07-2,05 (m, 1H), 1,80-1,42 (m, 11H), 1,34-1,11 (m, 11H), 0,99-0,98 (m, 1H), 0,88-0,86 (m, 1H), 0,73 (s, 3H) ppm; ESI MS m/z 479 [M+H]+.
Пример 30. Получение соединений 47, 48 и 49.

Получали согласно Общей процедуре B из соединения A11 (100 мг, 0,227 ммоль) и 4-фторбензотриазола (311 мг, 2,27 ммоль), с очисткой посредством обратнофазной препаративной ВЭЖХ с получением 49 в форме белого твердого вещества (22,5 мг, 20%): mp 125-126°C;1H ЯМР (500 МГц, CDCl3) δ 7,67 (d, J = 8,5 Гц, 1H), 7,32-7,30 (m, 1H), 7,03 (dd, J = 10,5, 7,5 Гц, 1H), 5,54 (dd, J = 28,0, 17,0 Гц, 2H), 3,48 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,67 (t, J = 9,0 Гц, 1H), 2,24-2,22 (m, 1H), 2,15-2,13 (m, 1H), 2,05-2,03 (m, 1H), 1,78-1,50 (m, 9H), 1,42-1,40 (m, 1H), 1,34-1,12 (m, 11H), 0,99-0,98 (m, 1H), 0,87-0,86 (m, 1H), 0,77 (s, 3H) ppm; ESI MS m/z 498 [M+H]+.
Посредством дополнительного элюирования получали 47 в форме белого твердого вещества (7,3 мг, 6%): mp 83-84°C;1H ЯМР (500 МГц, CDCl3) δ 7,86 (d, J = 8,0 Гц, 1H), 7,29-7,27 (m, 1H), 7,13 (dd, J = 10,5, 7,5 Гц, 1H), 5,54 (s, 2H), 3,49 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,70 (t, J = 9,0 Гц, 1H), 2,24-2,22 (m, 1H), 2,15-2,13 (m, 1H), 2,06-2,04 (m, 1H), 1,79-1,73 (m, 4H), 1,63-1,43 (m, 7H), 1,34-1,13 (m, 10H), 1,02-1,00 (m, 1H), 0,89-0,87 (m, 1H), 0,75 (s, 3H) ppm; ESI MS m/z 498 [M+H]+.
Посредством дополнительного элюирования получали 48 в форме белого твердого вещества (26,3 мг, 23%): mp 129-130°C;1H ЯМР (500 МГц, CDCl3) δ 7,42 (td, J = 8,0, 4,5 Гц, 1H), 7,10 (d, J = 8,5 Гц, 1H), 7,04 (dd, J = 10,0, 7,5 Гц, 1H), 5,42 (s, 2H), 3,49 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,70 (t, J = 9,0 Гц, 1H), 2,23-2,21 (m, 1H), 2,15-2,13 (m, 1H), 2,06-2,04 (m, 1H), 1,78-1,46 (m, 10H), 1,34-1,12 (m, 11H), 1,01-0,99 (m, 1H), 0,89-0,88 (m, 1H), 0,74 (s, 3H) ppm; ESI MS m/z 498 [M+H]+.
Пример 31. Получение соединений 50 и 51.

Получали согласно Общей процедуре B из соединения A11 (140 мг, 0,32 ммоль) и 5-метоксибензотриазола (132 мг, 0,89 ммоль), с очисткой посредством обратнофазной препаративной ВЭЖХ с получением 50 в форме белого твердого вещества (12,9 мг, 8%): mp 165-166°C;1H ЯМР (500 МГц, CDCl3) δ 7,72 (d, J = 10,0 Гц, 1H), 7,07-7,05 (m, 2H), 5,43 (dd, J = 29,5, 17,0 Гц, 2H), 3,87 (s, 3H), 3,47 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,29 (s, 3H), 2,63 (t, J = 9,0 Гц, 1H), 2,24-2,22 (m, 1H), 2,14-2,12 (m, 1H), 2,05-2,04 (m, 1H), 1,77-1,69 (m, 4H), 1,62-1,10 (m, 17H), 0,99-0,98 (m, 1H), 0,86-0,84 (m, 1H), 0,76 (s, 3H) ppm; ESI MS m/z 510 [M+H]+.
Посредством дополнительного элюирования получали 51 в форме белого твердого вещества (11,8 мг, 7%): mp 106-107°C;1H ЯМР (500 МГц, CDCl3) δ 7,93 (d, J = 9,0 Гц, 1H), 7,02 (dd, J = 9,0, 2,0 Гц, 1H), 6,61 (d, J = 2,0 Гц, 1H), 5,33 (d, J = 3,5 Гц, 2H), 3,88-3,86 (m, 3H), 3,48 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,70 (t, J = 9,0 Гц, 1H), 2,23-2,21 (m, 1H), 2,15-2,13 (m, 1H), 2,06-2,04 (m, 1H), 1,76-1,70 (m, 4H), 1,64-1,44 (m, 6H), 1,34-1,13 (m, 11H), 0,99-0,98 (m, 1H), 0,89-0,87 (m, 1H), 0,75 (s, 3H) ppm; ESI MS m/z 510 [M+H]+.
Пример 32. Получение соединений 52, 53 и 54.

Получали согласно Общей процедуре B из соединения A11 (100 мг, 0,23 ммоль) и 4,5-дифторбензотриазола (352 мг, 2,3 ммоль), с очисткой посредством обратнофазной препаративной ВЭЖХ с получением 54 в форме белого твердого вещества (46,0 мг, 32%): mp 86-87°C;1H ЯМР (500 МГц, CDCl3) δ 7,63 (ddd, J = 9,0, 3,5, 1,0 Гц, 1H), 7,30-7,28 (m, 1H), 5,53 (dd, J = 31,5, 17,0 Гц, 2H), 3,48 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,65 (t, J = 9,0 Гц, 1H), 2,24-2,22 (m, 1H), 2,14-2,12 (m, 1H), 2,06-2,04 (m, 1H), 1,78-1,73 (m, 4H), 1,63-1,41 (m, 7H), 1,34-1,12 (m, 10H), 1,03-1,00 (m, 1H), 0,88-0,86 (m, 1H), 0,77 (s, 3H) ppm; ESI MS m/z 498 [M+H-H2O]+.
Посредством дополнительного элюирования получали 52 в форме белого твердого вещества (19,3 мг, 13%): mp 82-83°C;1H ЯМР (500 МГц, CDCl3) δ 7,80 (ddd, J = 9,0, 3,5, 1,0 Гц, 1H), 7,23-7,21 (m, 1H), 5,52 (s, 2H), 3,49 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,70 (t, J = 9,0 Гц, 1H), 2,23-2,21 (m, 1H), 2,14-2,12 (m, 1H), 2,07-2,05 (m, 1H), 1,79-1,72 (m, 4H), 1,64-1,44 (m, 7H), 1,35-1,13 (m, 10H), 1,02-1,01 (m, 1H), 0,89-0,88 (m, 1H), 0,75 (s, 3H) ppm; ESI MS m/z 516 [M+H]+.
Посредством дополнительного элюирования получали 53 в форме белого твердого вещества (34,3 мг, 24%): mp 144-145°C;1H ЯМР (500 МГц, CDCl3) δ 7,38-7,37 (m, 1H), 7,04 (ddd, J = 9,0, 3,0, 1,0 Гц, 1H), 5,41 (dd, J = 22,5, 18,0 Гц, 2H), 3,49 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,71 (t, J = 9,0 Гц, 1H), 2,24-7,22 (m, 1H), 2,12,14-2,12 (m, 1H), 2,07-2,05 (m, 1H), 1,78-1,71 (m, 4H), 1,64-1,47 (m, 7H), 1,34-1,13 (m, 10H), 1,02-1,01 (m, 1H), 0,89-0,88 (m, 1H), 0,74 (s, 3H) ppm; ESI MS m/z 516 [M+H]+.
Пример 33. Получение соединений 55 и 56.
Получали согласно Общей процедуре B из соединения A11 (125 мг, 0,28 ммоль) и 4,6-дифтор-1H-бензо[d][1,2,3]триазола (219 мг, 1,60 ммоль), с полуочисткой посредством колоночной хроматографии на силикагеле, после чего посредством обратнофазной препаративной ВЭЖХ с получением 55 в форме почти белого твердого вещества (28 мг, 19%): mp 182-186°C;1H ЯМР (300 МГц, CDCl3) δ 7,30 (dd, J = 8,1, 1,5 Гц, 1H), 6,90 (ddd, J = 9,9, 9,9, 2,1 Гц, 1H), 5,55 (d, JAB = 17,1 Гц, 1H), 5,47 (d, JAB = 17,1 Гц, 1H), 3,48 (d, J = 9,9 Гц, 1H), 3,37 (d, J = 10,2 Гц, 1H), 3,30 (s, 3H), 2,67 (t, J = 8,7 Гц, 1H), 2,30-2,17 (m, 1H), 2,17-2,09 (m, 1H), 2,09-1,99 (m, 1H), 1,83-1,66 (m, 4H), 1,66-1,40 (m, 7H), 1,40-0,81 (m, 12H), 0,76 (s, 3H) ppm; ESI MS m/z 516 [M+H]+.
Посредством дополнительного элюирования получали 56 в форме почти белого твердого вещества (19 мг, 13%): mp 96-100°C;1H ЯМР (300 МГц, CDCl3) δ 6,87 (ddd, J = 9,6, 9,6, 1,8 Гц, 1H), 6,79 (ddd, J = 7,5, 2,1, 0,6 Гц, 1H), 5,41 (d, JAB = 18,0 Гц, 1H), 5,34 (d, JAB = 18,3 Гц, 1H), 3,49 (d, J = 9,9 Гц, 1H), 3,38 (d, J = 9,9 Гц, 1H), 3,31 (s, 3H), 2,72 (t, J = 8,7 Гц, 1H), 2,30-2,00 (m, 3H), 1,85-1,41 (m, 11H), 1,38-0,82 (m, 12H), 0,74 (s, 3H) ppm; SI MS m/z 516 [M+H]+.
Пример 34. Получение соединений 57 и 58.
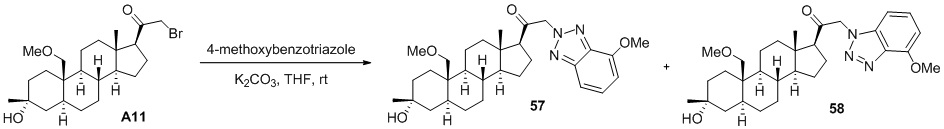
Получали согласно Общей процедуре B из соединения A11 (100 мг, 0,23 ммоль) и 4-метоксибензотриазола (675 мг, 4,5 ммоль), с очисткой посредством обратнофазной препаративной ВЭЖХ с получением 58 в форме светло-коричневого твердого вещества (27 мг, 23%): mp 78-80°C;1H ЯМР (500 МГц, CDCl3) δ 7,39 (t, J = 8,0 Гц, 1H), 6,86 (d, J = 8,1 Гц, 1H), 6,70 (d, J = 7,8 Гц, 1H), 5,37 (dd, J = 18,0, 2,7 Гц, 2H), 4,12 (s, 3H), 3,48 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,1 Гц, 1H), 3,30 (s, 3H), 2,68 (t, J = 9,0 Гц, 1H), 2,24-2,18 (m, 1H), 2,14-2,09 (m, 1H), 2,06-2,02 (m, 1H), 1,76-1,69 (m, 4H), 1,64-1,55 (m, 3H), 1,54-1,37 (m, 4H), 1,36-1,19 (m, 10H), 1,18-1,08 (m, 2H), 1,04-0,93 (m, 1H), 0,90-0,84 (m, 2H), 0,75 (s, 3H) ppm; APCI MS m/z 510 [M+H]+.
Посредством дополнительного элюирования получали 57 в форме почти белого твердого вещества (33 мг, 29%): mp 200-202°C;1H ЯМР (500 МГц, CDCl3) δ 7,63 (d, J = 8,4 Гц, 1H), 7,24 (d, J = 8,3 Гц, 1H), 6,76 (d, J = 7,7 Гц, 1H), 5,58 (dd, J = 17,9, 9,3 Гц, 2H), 3,89 (s, 3H), 3,49 (d, J = 10,0 Гц, 1H), 3,39 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,67 (t, J = 8,9 Гц, 1H), 2,25-2,18 (m, 1H), 2,15-2,11 (m, 1H), 2,06-2,02 (m, 1H), 1,73-1,67 (m, 3H), 1,65-1,47 (m, 7H), 1,42-1,11 (m, 12H), 1,04-0,95 (m, 1H), 0,89-10,84 (m, 1H), 0,75 (s, 3H) ppm; APCI MS m/z 510 [M+H]+.
Пример 35. Получение соединений 59, 60 и 61.

Получали согласно Общей процедуре B из соединения A11 (150 мг, 0,34 ммоль) и 4-хлорбензотриазола (156 мг, 1,02 ммоль), с полуочисткой посредством колоночной хроматографии на силикагеле, после чего посредством обратнофазной препаративной ВЭЖХ с получением 61 в форме светло-коричневого твердого вещества (64 мг, 37%): mp 170-172°C;1H ЯМР (500 МГц, CDCl3) δ 7,79 (dd, J = 8,5, 0,5 Гц, 1H), 7,40 (dd, J = 7,0, 0,5 Гц, 1H), 7,32 (dd, J = 8,5, 7,5 Гц, 1H), 5,57 (d, JAB = 17,0 Гц, 1H), 5,53 (d, JAB = 17,0 Гц, 1H), 3,48 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,66 (t, J = 9,0 Гц, 1H), 2,28-2,18 (m, 1H), 2,17-2,10 (m, 1H), 2,07-2,01 (m, 1H), 1,81-1,68 (m, 4H), 1,66-1,46 (m, 6H), 1,44-1,36 (m, 1H), 1,35-1,08 (m, 10H), 1,04-0,94 (m, 1H), 0,90-0,83 (m, 1H), 0,77 (s, 3H) ppm; ESI MS m/z 514 [M+H]+.
Посредством дополнительного элюирования получали 59 в форме светло-коричневого твердого вещества (8 мг, 4%): mp 162-164°C;1H ЯМР (500 МГц, CDCl3) δ 7,99 (d, J = 8,5 Гц, 1H), 7,43 (d, J = 7,5, 1H), 7,29 (t, J = 7,5, 1H), 5,71 (s, 2H), 3,48 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,72 (t, J = 9,0 Гц, 1H), 2,27-2,10 (m, 2H), 2,08-2,02 (m, 1H), 1,85-1,37 (m, 11H), 1,35-1,09 (m, 10H), 1,05-0,95 (m, 1H), 0,91-0,83 (m, 1H), 0,76 (s, 3H) ppm; APCI MS m/z 514 [M+H]+.
Посредством дополнительного элюирования получали 60 в форме светло-коричневого твердого вещества (32 мг, 18%): mp 105-107°C;1H ЯМР (500 МГц, CDCl3) δ 7,43-7,36 (m, 2H), 7,23 (dd, J = 7,5, 1,5 Гц, 1H), 5,42 (s, 2H), 3,49 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,71 (t, J = 9,0 Гц, 1H), 2,27-2,18 (m, 1H), 2,18-2,10 (m, 1H), 2,08-2,01 (m, 1H), 1,82-1,68 (m, 4H), 1,67-1,42 (m, 7H), 1,35-1,09 (m, 10H), 1,05-0,95 (m, 1H), 0,91-0,84 (m, 1H), 0,75 (s, 3H) ppm; ESI MS m/z 514 [M+H]+.
Пример 36. Получение соединений 62, 63 и 64.
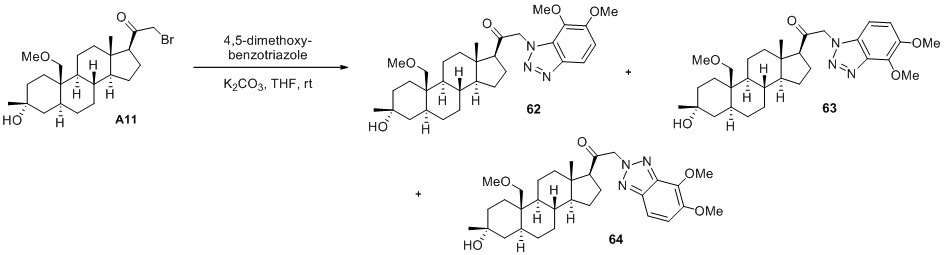
Получали согласно Общей процедуре B из соединения A11 (100 мг, 0,23 ммоль) и 4,5-диметокси-1H-бензо[d][1,2,3]триазола (101 мг, 0,57 ммоль), с полуочисткой посредством колоночной хроматографии на силикагеле, после чего посредством обратнофазной препаративной ВЭЖХ с получением 64 в форме светло-желтого твердого вещества (32 мг, 26%): mp 188-190°C;1H ЯМР (500 МГц, CDCl3) δ 7,50 (d, J = 9,0 Гц, 1H), 7,22 (d, J = 9,5 Гц, 1H), 5,49 (d, JAB = 17,0 Гц, 1H), 5,43 (d, JAB = 17,0 Гц, 1H), 4,27 (s, 3H), 3,95 (s, 3H), 3,48 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,29 (s, 3H), 2,63 (t, J = 8,5 Гц, 1H), 2,27-2,17 (m, 1H), 2,16-2,10 (m, 1H), 2,07-2,01 (m, 1H), 1,79-1,68 (m, 4H), 1,65-1,46 (m, 7H), 1,42-1,08 (m, 10H), 1,03-0,93 (m, 1H), 0,89-0,81 (m, 1H), 0,76 (s, 3H) ppm; APCI MS m/z 540 [M+H]+.
Посредством дополнительного элюирования получали 63 в форме белого твердого вещества (19 мг, 15%): mp 88-90°C;1H ЯМР (500 МГц, CDCl3) δ 7,24 (d, J = 9,0 Гц, 1H), 6,82 (d, J = 9,0 Гц, 1H), 5,36 (d, JAB = 18,0 Гц, 1H), 5,32 (d, JAB = 18,0 Гц, 1H), 4,57 (s, 3H), 3,93 (s, 3H), 3,49 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,69 (t, J = 9,0 Гц, 1H), 2,26-2,17 (m, 1H), 2,16-2,10 (m, 1H), 2,08-2,01 (m, 1H), 1,80-1,68 (m, 4H), 1,66-1,41 (m, 7H), 1,36-1,09 (m, 10H), 1,04-0,94 (m, 1H), 0,90-0,83 (m, 1H), 0,74 (s, 3H) ppm; APCI MS m/z 540 [M+H]+.
Посредством дополнительного элюирования получали 62 в форме белого твердого вещества (13 мг, 11%): mp 110-112°C;1H ЯМР (500 МГц, CDCl3) δ 7,75 (br s, 1H), 7,11 (d, J = 7,5 Гц, 1H), 5,54 (d, JAB = 18,0 Гц, 1H), 5,50 (d, JAB = 18,0 Гц, 1H), 3,96 (s, 3H), 3,90 (s, 3H), 3,48 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,69 (t, J = 8,5 Гц, 1H), 2,28-2,01 (m, 3H), 1,83-1,68 (m, 4H), 1,65-1,47 (m, 6H), 1,44-1,37 (m, 1H), 1,36-1,08 (m, 10H), 1,04-0,94 (m, 1H), 0,90-0,83 (m, 1H), 0,76 (s, 3H) ppm; APCI MS m/z 540 [M+H]+.
Пример 37. Получение соединений 65 и 66.

Получали согласно Общей процедуре B из соединения A11 (125 мг, 0,28 ммоль) и 4,6-диметокси-1H-бензо[d][1,2,3]триазола (127 мг, 0,71 ммоль), с очисткой посредством колоночной хроматографии на силикагеле с получением 65 в форме светло-желтого твердого вещества (42 мг, 28%): mp 106-108°C;1H ЯМР (500 МГц, CDCl3) δ 6,67 (d, J = 2,0 Гц, 1H), 6,33 (d, J = 2,0 Гц, 1H), 5,43 (d, JAB = 17,0 Гц, 1H), 5,38 (d, JAB = 17,0 Гц, 1H), 3,98 (s, 3H), 3,96 (s, 3H), 3,47 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,29 (s, 3H), 2,61 (t, J = 9,0 Гц, 1H), 2,26-2,16 (m, 1H), 2,13-2,07 (m, 1H), 2,07-2,00 (m, 1H), 1,77-1,67 (m, 4H), 1,63-1,46 (m, 7H), 1,39-1,08 (m, 10H), 1,02-0,93 (m, 1H), 0,88-0,80 (m, 1H), 0,75 (s, 3H) ppm; APCI MS m/z 540 [M+H]+.
Посредством дополнительного элюирования получали 66 в форме почти белого твердого вещества (52 мг, 34%): mp 110-112°C;1H ЯМР (500 МГц, CDCl3) δ 6,34 (d, J = 2,0 Гц, 1H), 6,16 (d, J = 2,0 Гц, 1H), 5,28 (s, 2H), 4,06 (s, 3H), 3,84 (s, 3H), 3,48 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,29 (s, 3H), 2,66 (t, J = 9,0 Гц, 1H), 2,25-2,16 (m, 1H), 2,13-2,08 (m, 1H), 2,07-2,01 (m, 1H), 1,79-1,67 (m, 4H), 1,64-1,46 (m, 6H), 1,45-1,37 (m, 1H), 1,35-1,08 (m, 10H), 1,03-0,93 (m, 1H), 0,89-0,82 (m, 1H), 0,74 (s, 3H) ppm; APCI MS m/z 540 [M+H]+.
Пример 38. Получение соединения 67.

Получали согласно Общей процедуре B из соединения A11 (200 мг, 0,45 ммоль) и 6-бром-1H-пиразоло[4,3-b]пиридина (450 мг, 2,27 ммоль), с полуочисткой посредством колоночной хроматографии на силикагеле, после чего посредством обратнофазной препаративной ВЭЖХ с получением 67 в форме почти белого твердого вещества (43 мг, 17%): mp 102-105°C;1H ЯМР (300 МГц, CDCl3) δ 8,60 (d, J = 1,5 Гц, 1H), 8,23 (s, 1H), 7,75 (s, 1H), 5,16 (d, JAB = 18,0 Гц, 1H), 5,06 (d, JAB = 18,0 Гц, 1H), 3,48 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,68 (t, J = 9,3 Гц, 1H), 2,30-1,93 (m, 3H), 1,92-1,38 (m, 11H), 1,37-0,80 (m, 12H), 0,73 (s, 3H) ppm; ESI MS m/z 558 [M+H]+.
Пример 39. Получение соединений 68 и 69.

Получали согласно Общей процедуре B из соединения A11 (86 мг, 0,19 ммоль) и 6-хлор-1H-пиразоло[4,3-b]пиридина (570 мг, 3,7 ммоль), с очисткой посредством обратнофазной препаративной ВЭЖХ с получением 68 в форме белого твердого вещества (12 мг, 12%): mp 88-90°C;1H ЯМР (500 МГц, CDCl3) δ 8,59 (s, 1H), 8,51 (s, 1H), 8,34 (s, 1H), 5,40-5,22 (m, 2H), 3,48 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,67 (t, J = 8,6 Гц, 1H), 2,27-2,21 (m, 1H), 2,11-1,86 (m, 2H), 1,85-1,41 (m, 11H), 1,34-1,09 (m, 11H), 1,04-0,93 (m, 1H), 0,91-0,81 (m, 1H), 0,73 (s, 3H) ppm; APCI MS m/z 514 [M+H]+.
Посредством дополнительного элюирования получали 69 в форме белого твердого вещества (40 мг, 40%): mp 115-117°C;1H ЯМР (500 МГц, CDCl3) δ 8,58 (s, 1H), 8,40 (s, 1H), 7,77 (s, 1H), 5,18 (dd, J = 18,0, 32,1 Гц, 2H), 3,49 (d, J = 10,0 Гц, 1H), 3,38 (d, J = 10,0 Гц, 1H), 3,30 (s, 3H), 2,69 (t, J = 8,9 Гц, 1H), 2,24-2,18 (m, 1H), 2,14-2,10 (m, 1H), 2,07-2,03 (m, 1H), 1,80-1,68 (m, 4H), 1,67-1,56 (m, 3H), 1,55-1,42 (m, 4H), 1,39-1,11 (m, 10H), 1,05-0,98 (m, 1H), 0,91-0,85 (m, 1H), 0,73 (s, 3H) ppm; APCI MS m/z 514 [M+H]+.
Пример 40. Получение соединений 70, 71 и 72.

Получали согласно Общей процедуре B из соединения A21 (200 мг, 0,44 ммоль) и 5-хлорбензотриазола (1,35 г, 8,8 ммоль), с очисткой посредством обратнофазной препаративной ВЭЖХ с получением 72 в форме белого твердого вещества (12,6 мг, 5%): mp 76-77°C;1H ЯМР (500 МГц, CDCl3) δ 7,87 (d, J = 1,5 Гц, 1H), 7,81 (d, J = 9,0 Гц, 1H), 7,34 (dd, J = 9,0, 1,5 Гц, 1H), 5,50 (dd, J = 32,5, 17,0 Гц, 2H), 3,52 (d, J = 9,5 Гц, 1H), 3,43-3,38 (m, 3H), 2,65 (t, J = 9,0 Гц, 1H), 2,25-2,23 (m, 1H), 2,14-2,13 (m, 1H), 2,06-2,04 (m, 1H), 1,77-1,48 (m, 10H), 1,41-1,38 (m, 1H), 1,33-1,11 (m, 13H), 1,02-1,00 (m, 1H), 0,88-0,86 (m, 1H), 0,75 (s, 3H) ppm; ESI MS m/z 528 [M+H]+.
Посредством дополнительного элюирования получали 70 в форме белого твердого вещества (17,1 мг, 7%): mp 69-70°C;1H ЯМР (500 МГц, CDCl3) δ 8,00 (d, J = 9,0 Гц, 1H), 7,35-7,33 (m, 2H), 5,37 (dd, J = 40,5, 18,0 Гц, 2H), 3,53 (d, J = 9,5 Гц, 1H), 3,43-3,40 (m, 3H), 2,72 (t, J = 9,0 Гц, 1H), 2,24-2,23 (m, 1H), 2,16-2,14 (m, 1H), 2,08-2,06 (m, 1H), 1,79-1,42 (m, 11H), 1,37-1,13 (m, 11H), 1,01-0,99 (m, 1H), 0,88 (t, J = 7,0 Гц, 3H), 0,74 (s, 3H) ppm; ESI MS m/z 528 [M+H]+.
Посредством дополнительного элюирования получали 71 в форме белого твердого вещества (23,6 мг, 10%): mp 82-83°C;1H ЯМР (500 МГц, CDCl3) δ 8,06 (d, J = 1,5 Гц, 1H), 7,45 (dd, J = 9,0, 1,5 Гц, 1H), 7,28 (d, J = 9,0 Гц, 1H), 5,40 (dd, J = 29,5, 18,0 Гц, 2H), 3,53 (d, J = 10,0 Гц, 1H), 3,42-3,39 (m, 3H), 2,71 (t, J = 9,0 Гц, 1H), 2,24-2,23 (m, 1H), 2,16-2,14 (m, 1H), 2,08-2,05 (m, 1H), 1,77-1,48 (m, 11H), 1,33-1,13 (m, 11H), 1,02-0,99 (m, 1H), 0,88 (t, J = 7,0 Гц, 3H), 0,74 (s, 3H) ppm; ESI MS m/z 528 [M+H]+.
Пример 41. Получение соединения 76.

Получали согласно Общей процедуре E, Стадия 2 из соединения C11 (120 мг, 0,27 ммоль) и 5-хлорбензимидазола (125 мг, 0,82 ммоль), с полуочисткой посредством колоночной хроматографии на силикагеле, после чего посредством обратнофазной препаративной ВЭЖХ с получением 76 в форме белого твердого вещества (19 мг, 14%): mp 85-87°C;1H ЯМР (300 МГц, CDCl3) δ 7,88-7,80 (m, 2H), 7,35 (d, J = 9,1 Гц, 1H), 5,49 (s, 2H), 3,55 (d, J = 9,0 Гц, 1H), 3,34 (s, 3H), 3,22 (d, J = 9,0 Гц, 1H), 2,64 (t, J = 8,5 Гц, 1H), 2,27-2,12 (m, 2H), 1,94-1,85 (m, 2H), 1,84-1,36 (m, 15H), 1,35-1,14 (m, 10H), 0,73 (s, 3H) ppm; APCI MS m/z 514 [M+H]+.
Пример 42. Получение соединений 77, 78 и 79.

Получали согласно Общей процедуре E, Стадия 2 из соединения C11 (120 мг, 0,27 ммоль) и 4,5-дифтор-1H-бензо[d][1,2,3]триазола (126 мг, 0,82 ммоль), с полуочисткой посредством колоночной хроматографии на силикагеле, после чего посредством обратнофазной препаративной ВЭЖХ с получением 79 в форме белого твердого вещества (62 мг, 44%): mp 103-105°C;1H ЯМР (500 МГц, CDCl3) δ 7,64 (ddd, J = 9,0, 3,5, 1,0 Гц, 1H), 7,32-7,26 (m, 1H), 5,54 (d, JAB = 17,0 Гц, 1H), 5,49 (d, JAB = 17,0 Гц, 1H), 3,54 (d, J = 9,0 Гц, 1H), 3,34 (s, 3H), 3,22 (d, J = 9,0 Гц, 1H), 2,65 (t, J = 9,0 Гц, 1H), 2,27-2,18 (m, 1H), 2,17-2,11 (m, 1H), 1,97-1,88 (m, 2H), 1,84-1,73 (m, 3H), 1,68-1,40 (m, 9H), 1,40-1,11 (m, 10H), 0,74 (s, 3H) ppm; ESI MS m/z 514 [M-H]-.
Посредством дополнительного элюирования получали 77 в форме белого твердого вещества (20 мг, 14%): mp 98-100°C;1H ЯМР (500 МГц, CDCl3) δ 7,81 (ddd, J = 9,0, 4,0, 1,0 Гц, 1H), 7,24-7,19 (m, 1H), 5,54 (d, JAB = 18,5 Гц, 1H), 5,50 (d, JAB = 18,5 Гц, 1H), 3,55 (d, J = 9,0 Гц, 1H), 3,34 (s, 3H), 3,22 (d, J = 9,0 Гц, 1H), 2,71 (t, J = 9,0 Гц, 1H), 2,27-2,17 (m, 1H), 2,17-2,10 (m, 1H), 1,98-1,89 (m, 2H), 1,88-1,72 (m, 3H), 1,70-1,42 (m, 9H), 1,40-1,10 (m, 10H), 0,72 (s, 3H) ppm; ESI MS m/z 514 [M-H]-.
Посредством дополнительного элюирования получали 78 в форме почти белого твердого вещества (39 мг, 28%): mp 100-102°C;1H ЯМР (500 МГц, CDCl3) δ 7,41-7,34 (m, 1H), 7,05 (ddd, J = 9,0, 3,0, 1,0 Гц, 1H), 5,44 (d, JAB = 18,0 Гц, 1H), 5,36 (d, JAB = 18,0 Гц, 1H), 3,53 (d, J = 9,0 Гц, 1H), 3,34 (s, 3H), 3,23 (d, J = 9,0 Гц, 1H), 2,70 (t, J = 9,0 Гц, 1H), 2,26-2,17 (m, 1H), 2,17-2,11 (m, 1H), 1,98-1,88 (m, 2H), 1,84-1,73 (m, 3H), 1,69-1,42 (m, 9H), 1,41-1,12 (m, 10H), 0,71 (s, 3H) ppm; ESI MS m/z 514 [M-H]-.
Пример 43. Получение соединения 80.

Получали согласно Общей процедуре E, Стадия 2 из соединения C11 (100 мг, 0,23 ммоль) и бензимидазола (80 мг, 0,68 ммоль), с очисткой посредством обратнофазной препаративной ВЭЖХ с получением 80 в форме белого твердого вещества (68 мг, 63%): mp 130-132°C;1H ЯМР (300 МГц, CDCl3) δ 8,74 (b s, 1H), 7,91-7,87 (m, 1H), 7,41-7,38 (m, 2H), 7,25-7,22 (m, 1H), 5,16 (dd, J = 18,3, 5,8 Гц, 2H), 3,54 (d, J = 9,1 Гц, 1H), 3,34 (s, 3H), 3,23 (d, J = 9,1 Гц, 1H), 2,71 (t, J = 8,9 Гц, 1H), 2,29-2,08 (m, 2H), 1,94-1,09 (m, 26H), 0,72 (s, 3H) ppm; APCI MS m/z 479 [M+H]+.
Пример 44. Получение соединений 81, 82 и 83.

Получали согласно Общей процедуре E, Стадия 2 из соединения C11 (120 мг, 0,27 ммоль) и 4-фтор-1H-бензо[d][1,2,3]триазола (112 мг, 0,82 ммоль), с очисткой посредством обратнофазной препаративной ВЭЖХ с получением 82 в форме почти белого твердого вещества (40 мг, 30%): mp 199-201°C;1H ЯМР (500 МГц, CDCl3) δ 7,45-7,40 (m, 1H), 7,11 (d, J = 8,3 Гц, 1H), 7,06-7,02 (m, 1H), 5,41 (dd, J = 18,0, 9,2 Гц, 2H), 3,54 (d, J = 9,0 Гц, 1H), 3,34 (s, 3H), 3,23 (d, J = 9,0 Гц, 1H), 2,70 (t, J = 8,9 Гц, 1H), 2,27-2,13 (m, 2H), 1,97-1,89 (m, 2H), 1,83-1,68 (m, 5H), 1,67-1,43 (m, 9H), 1,41-1,12 (m, 9H), 0,72 (s, 3H) ppm; APCI MS m/z 498 [M+H]+.
Посредством дополнительного элюирования получали 81 в форме белого твердого вещества (20 мг, 15%): mp 98-100°C;1H ЯМР (500 МГц, CDCl3) δ 7,86 (d, J = 8,4 Гц, 1H), 7,31-7,26 (m, 1H), 7,15-7,11 (m, 1H), 5,43 (dd, J = 18,2, 0,95 Гц, 2H), 3,55 (d, J = 9,0 Гц, 1H), 3,34 (s, 3H), 3,22 (d, J = 9,0 Гц, 1H), 2,70 (t, J = 9,0 Гц, 1H), 2,25-2,12 (m, 2H), 1,97-1,75 (m, 6H), 1,70-1,44 (m, 9H), 1,39-1,13 (m, 10H), 0,72 (s, 3H) ppm; APCI MS m/z 498 [M+H]+.
Посредством дополнительного элюирования получали 83 в форме почти белого твердого вещества (48 мг, 36%): mp 172-174°C;1H ЯМР (500 МГц, CDCl3) δ 7,67 (d, J = 8,6 Гц, 1H), 7,35-7,30 (m, 1H), 7,06-7,02 (m, 1H), 5,53 (dd, J = 17,0, 2,6 Гц, 2H), 3,55 (d, J = 9,0 Гц, 1H), 3,34 (s, 3H), 3,21 (d, J = 9,0 Гц, 1H), 2,65 (t, J = 9,0 Гц, 1H), 2,26-2,13 (m, 3H), 1,96-1,89 (m, 2H), 1,83-1,71 (m, 3H), 1,67-1,40 (m, 9H), 1,37-1,11 (m, 9H), 0,74 (s, 3H) ppm; APCI MS m/z 498 [M+H]+.
Пример 45. Получение соединения 4.

К раствору соединения A11 (40 мг, 0,09 ммоль) в ТГФ (2 мл) добавляли морфолин (390 мг, 4,5 ммоль) и K2CO3 (120 мг, 0,9 ммоль). Полученный раствор перемешивали при комнатной температуре в течение ночи. Затем LCMS показала окончание реакции. Реакционную смесь разбавляли посредством EtOAc (40 мл) и промывали солевым раствором (15 мл x 2). Органический слой сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали посредством препаративной ВЭЖХ с получением соединения 4 (18 мг, 45%) в форме белого твердого вещества. Соединение 4:1H ЯМР: (500 МГц, CDCl3), δ (ppm), 3,79-3,77 (m, 4H), 3,48 (AB, 1H, J=10 Гц), 3,38 (AB, 1H, J=10 Гц), 3,30 (s, 3H), 3,22 (s, 2H), 2,58 (t, 1H, J=9,3 Гц), 2,5 (s, 4H), 1,25 (s, 3H), 0,66 (s, 3H).
Пример 46. Получение соединения 2.

К раствору соединения A11 (40 мг, 0,09 ммоль) в ТГФ (2 мл) добавляли 1H-пиразол (300 мг, 4,5 ммоль) и K2CO3 (120 мг, 0,9 ммоль). Полученный раствор перемешивали при комнатной температуре в течение ночи. Затем LCMS показала окончание реакции. Реакционную смесь разбавляли посредством EtOAc (40 мл) и промывали солевым раствором (15 мл x 3). Органический слой сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали посредством препаративной ВЭЖХ с получением 2 (16 мг, 40%) в форме белого твердого вещества. Соединение 2:1H ЯМР: (500 МГц, CDCl3), δ (ppm), 7,57 (d, 1H, J=1 Гц), 7,43 (d, 1H, J=1,5 Гц), 6,35 (s, 1H), 4,98 (AB, 1H, J=17,5 Гц), 4,90 (AB, 1H, J=18 Гц), 3,48 (AB, 1H, J=10,5 Гц), 3,39 (AB, 1H, J=9,5 Гц), 3,31 (s, 3H), 2,60 (t, 1H, J=8,8 Гц), 1,25 (s, 3H), 0,72 (s, 3H).
Пример 47. Получение соединения 5.

Соединение A11 (30 мг, 0,07 ммоль), K2CO3 (50 мг) и 1-(пиперазин-1-ил)этанон (200 мг) растворяли в ТГФ (3 мл) и перемешивали при комнатной температуре в течение ночи. Растворитель удаляли под вакуумом, и остаток очищали посредством препаративной ВЭЖХ с получением соединения 5 (6 мг, 20%) в форме белого твердого вещества. Соединение 5:1H ЯМР: (400 МГц, CDCl3), δ (ppm), 3,68-3,66 (m, 2H), 3,51 (t, 2H, J=5 Гц), 3,45 (AB, 1H, J=10 Гц), 3,37 (AB, 1H, J=10 Гц), 3,28 (s, 3H), 3,21 (s, 2H), 2,52-2,44 (m, 5H), 2,08 (s, 3H), 1,23 (s, 3H), 0,64 (s, 3H).
Пример 48. Получение соединения B11.
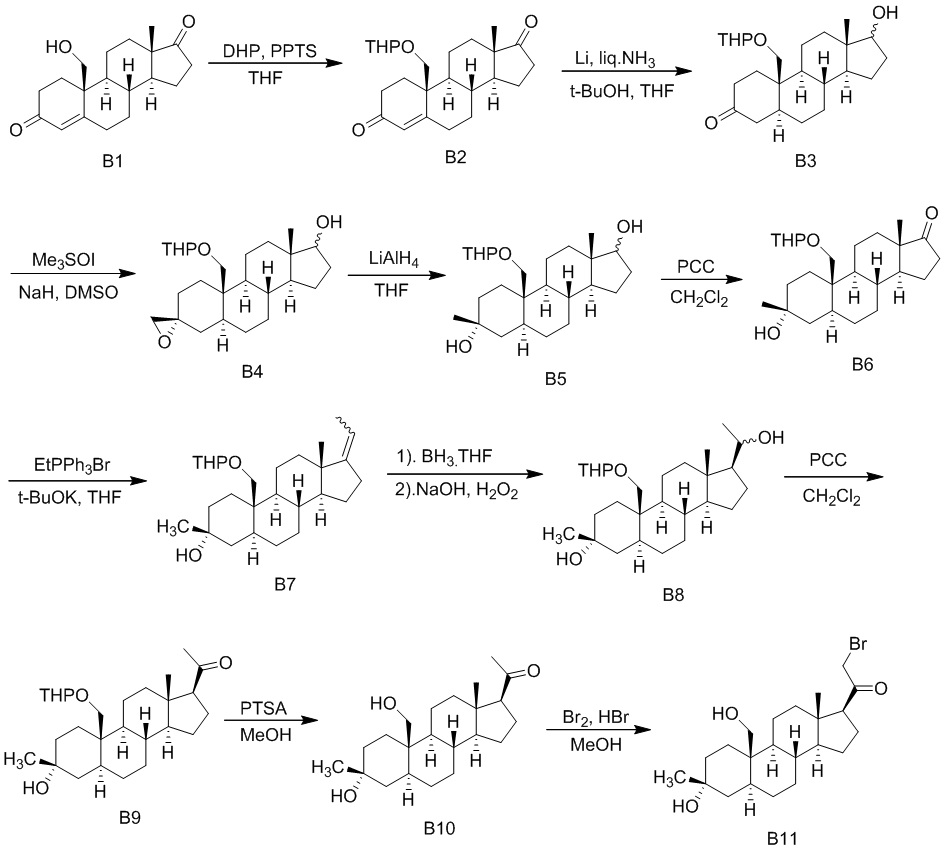
Стадия 1. Получение соединения B2. Соединение B1 (10,0г, 33ммоль) растворяли в 100 мл ТГФ. Добавляли дигидропиран (25мл, 270ммоль) и PPTS (4,16, 16ммоль), и полученную реакционную смесь интенсивно перемешивали в течение 15 ч при комнатной температуре. После концентрирования при пониженном давлении реакционную смесь растворяли в EtOAc (500 мл), промывали водой (300 мл) и солевым раствором (300 мл), сушили над сульфатом натрия и концентрировали при пониженном давлении, остаток очищали посредством хроматографии на силикагеле (элюент: петролейный эфир /EtOAc =10/1~3/1) с получением соединения B2 12,52 г (97,65%). Соединение B2: LC-MS: m/z=409,0 [M +Na]+
Стадия 2. Получение соединения B3. Металлический литий (3,0 г, 0,4 ммоль) добавляли в конденсированный аммиак (500 мл) в трехгорлой колбе при -70℃. Затем по каплям добавляли раствор соединения B2 (5,0 г, 13ммоль) и трет-BuOH (0,95 г, 13ммоль) в безводном тетрагидрофуране (100 мл) и перемешивали в течение 0,8 часов. Добавляли хлорид аммония (30,0 ч) для гашения реакции, и оставляли для испарения аммиака в течение ночи. Остаток экстрагировали посредством EtOAc (300 мл). Органические слои промывали насыщенным раствором NaCl (2×200 мл), сушили над Na2SO4и концентрировали при пониженном давлении, остаток очищали посредством хроматографии на силикагеле (элюент: петролейный эфир /EtOAc =10/1~2/1) с получением 2,0 г соединения 3 (39,60%). Соединение B3: LC-MS: m/z=413,3 [M +Na]+
Стадия 3. Получение соединения B4. Me3SOI (16,9 г,76,80 ммоль) растворяли в 80 мл ДМСО и добавляли NaH (1,84г,76,80ммоль). Смесь перемешивали при комнатной температуре в течение 1 часа, затем добавляли соединение B3 (6,0 г, 15,36 ммоль), растворенное в 60 мл ДМСО. Раствор перемешивали при комнатной температуре в течение ночи. Затем к реакционной смеси добавляли воду (10 мл). Водную реакционную смесь экстрагировали EtOAc (300 мл x 3). Экстракты сушили над Na2SO4, фильтровали, концентрировали. Неочищенное соединение B4 непосредственно применяли на следующей стадии без дополнительной очистки.
Стадия 4. Получение соединения B5. Неочищенное соединение B4 медленно добавляли к суспензии LiAlH4 (1,75 г, 51 ммоль) в 100 мл сухого ТГФ при 0°C. Смесь перемешивали при комнатной температуре в течение 2 ч, затем медленно добавляли 2,1 г 15% водн. NaOH для гашения реакции. Реакционную смесь экстрагировали посредством EtOAc (200 мл x 3). Органические слои сушили над MgSO4, фильтровали и концентрировали. Неочищенное соединение B5 непосредственно применяли на следующей стадии без дополнительной очистки.
Стадия 5. Получение соединения B6. Неочищенное соединение B5 растворяли в 100 мл сухого CH2Cl2 и добавляли 4,0 г PCC при 0°C. Затем смесь перемешивали при комнатной температуре в течение 6 ч. Затем реакционную смесь фильтровали, концентрировали и очищали посредством флэш-хроматографии на силикагеле с применением 10/1~3/1 петролейный эфир: этилацетат=10/1-3/1 элюирования с получением соединения B6, 3,10 г (50,89%, выход трех стадий).
Стадия 6. Получение соединения B7. К суспензии этилтрифенилфосфония бромида (14,20 г, 38,3 ммоль) в сухом ТГФ (40мл) добавляли KOtBu (4,30 г, 38,3 ммоль) в атмосфере N2. Смесь нагревали с обратным холодильником в течение 1 часа, в течение этого времени смесь становилась ярко оранжевой. Затем соединение B6 (3,1 г, 7,66ммоль) в сухом ТГФ (25мл) добавляли к вышеуказанному кипящему с обратным холодильником раствору и перемешивали с обратным холодильником в течение ночи. После охлаждения до комнатной температуры, раствор выливали в солевой раствор (100мл). Водный раствор экстрагировали этилацетатом (100 мл x 3). Экстракты промывали солевым раствором (30mL x 2), сушили над Na2SO4, фильтровали, концентрировали и очищали посредством колоночной хроматографии на силикагеле (петролейный эфир /EtOAC с 10/1 до 4/1) с получением соединения B7 2,2 г (68,97%) в форме белого твердого вещества. Кроме того, также получали C-3 изомер (0,30 г, 9,63%).
Стадия 7. Получение соединения B8. К раствору соединения B7 (3 г, 7,2ммоль) в сухом ТГФ (20мл) добавляли комплекс боран-тетрагидрофуран (29 мл 1,0 M раствор в ТГФ), и реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа. Медленно добавляли 10% водный раствор NaOH (20 мл). Смесь охлаждали во льду, и медленно добавляли 30% водный раствор H2О2 (20мл). Смесь перемешивали при температуре окружающей среды в течение 1 часа, и затем экстрагировали посредством CH2Cl2 (3 x 100 мл). Объединенные экстракты CH2Cl2 промывали 10% водным раствором Na2S2О3 (50 мл), которые непосредственно применяли на следующей стадии без дополнительной очистки.
Стадия 8. Получение соединения B9. Объединенные CH2Cl2 экстракты соединения B8 из последней стадии применяли без дополнительной очистки. Добавляли 3,5 г PCC при 0°C. Затем смесь перемешивали при комнатной температуре в течение 6 ч, смесь фильтровали, концентрировали и очищали посредством флэш-хроматографии на силикагеле с применением 12/1~7/1(петролейный эфир :этилацетат) элюирования с получением 1,28 г соединения B9 (41,23% две стадии). Соединение B9: LC-MS: m/z=455,3[M +Na]+.1H ЯМР (500 МГц, CDCl3) δ(ppm): 4,57&4,53(1H, t, J=3,5 Гц), 3,96&3,87 (1H, AB, J=11,0 Гц,), 3,82 (1H, t, J=9,5 Гц), 3,56~3,53 (1H, m), 3,44&3,27 (1H, AB, J=10,5 Гц), 2,53 (1H, t, J=9,0 Гц), 2,12&2,11 (3H, s), 1,22&1,21 (3H, s), 0,64&0,61 (1H, s).
Стадия 9. Получение соединения B10. Соединение B9 (1,28г, 2,96 ммоль) растворяли в 50 мл сухого MeOH и добавляли 100 мг PTSA. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь концентрировали при пониженном давлении. Данную смесь продукта разделяли посредством флэш-хроматографии на силикагеле с применением 8/1~2/1 (петролейный эфир:EtOAc) элюирования с получением 674 мг соединения B10 (65,32%). Соединение B10: LC-MS: m/z=331,3[M-H2O+H]+, m/z=349,2[M +H]+ 1H ЯМР (500 МГц, CDCl3) δ(ppm): 3,89 (1H, AB, J=12,0 Гц), 3,72 (1H, AB, J=12,0 Гц), 2,53 (1H, t, J=9,0 Гц), 2,11 (3H, s), 1,22 (3H, s), 0,64 (3H, s).13C ЯМР (125,77 МГц, CDCl3) δ (ppm): 209,78, 69,68, 63,80, 60,12, 57,07, 54,39, 44,36, 42,04, 41,18, 39,62, 39,31, 36,05, 35,39, 31,85, 31,68, 31,54, 28,04, 27,91, 24,39, 22,86, 22,75, 13,72.
Стадия 10. Получение соединения B11. Соединение B10 (50 мг, 0,14 ммоль) растворяли в 5 мл сухого MeOH и добавляли 3 капли Br2 и 2 капли водного раствора HBr. Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем реакционную смесь обрабатывали триэтиламином при 0°C, концентрировали при пониженном давлении и непосредственно применяли на следующей стадии без дополнительной очистки. Соединение B11: LC-MS: m/z=410,1&411,2[M-H2O+H]+.
Пример 49. Получение соединения 9.

Неочищенное соединение B11 применяли непосредственно, добавляли 8 мл ТГФ и 100 мг K2CO3, 0,5 мл морфолина. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Раствор разбавляли этилацетатом (100 мл). Полученный раствор промывали солевым раствором (100 мл), сушили над сульфатом натрия и концентрировали под вакуумом. Остаток очищали посредством обратнофазной препаративной ВЭЖХ с получением 25 мг (41,18%, две стадии из 50 мг соединения B10) продукта 9 в форме белого твердого вещества. Соединение 9:1H ЯМР (500 МГц, CDCl3) δ(ppm): 3,89(1H, dd, J=4,0 Гц, J=11,5 Гц),3,76 (4H, t, J=4,5 Гц), 3,72 (1H, dd, J=3,0 Гц, J=11,0 Гц), 3,19 (2H, s), 2,58 (1H, t, J=9,5 Гц), 2,45-2,55 (4H, m), 2,20~2,15(1H, m), 2,07~2,04(1H, m), 1,92~1,89(1H, m),1,23(3H, s), 0,67(3H, s).
Пример 50. Получение соединений 12 и 10.
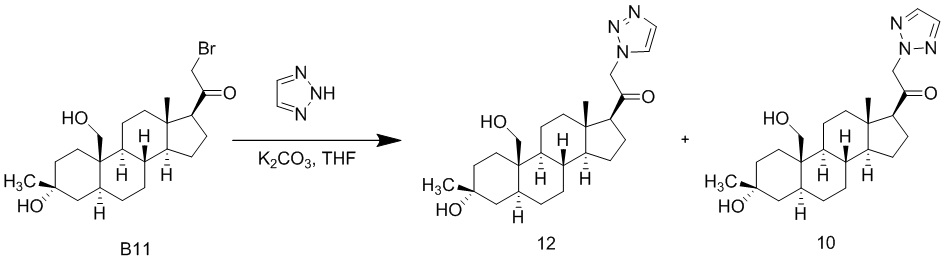
Неочищенное соединение B11 применяли непосредственно, и добавляли 8 мл сухого ТГФ и 100 мг K2CO3,0,5 мл 1H-1,2,3-триазола. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Раствор разбавляли EtOAc (100 мл). Полученный раствор промывали солевым раствором (100 мл), сушили над сульфатом натрия и концентрировали под вакуумом. Остаток очищали посредством обратнофазной препаративной ВЭЖХ с получением 10 мг соединения 12 и 19 мг соединения 10 в форме белого твердого вещества.
Соединение 12:1H ЯМР (500 МГц, CDCl3) δ(ppm): 7,76(1H, s), 7,64 (1H, s), 5,24 (1H, AB, J=17,5 Гц), 5,16 (1H, AB, J=18,0 Гц), 3,89 (1H, AB, J=11,5 Гц), 3,73 (1H, AB, J=11,5 Гц), 2,65 (1H, t, J=9,0 Гц), 2,25~2,19 (1H, m), 2,10~2,05 (2H, m), 1,23 (3H, s), 0,71 (3H, s).
Соединение 10:1H ЯМР (500 МГц, CDCl3) δ(ppm): 7,68 (2H, s), 5,25 (1H, AB, J=17,5 Гц), 5,22 (1H, AB, J=17,5 Гц) 3,89 (1H, AB, J=11,5 Гц), 3,73 (1H, AB, J=11,5 Гц), 2,58 (1H, t, J=8,5 Гц), 2,24~2,20 (1H, m), 2,11~2,04 (21H, m), 1,23 (3H, s), 0,75 (3H, s).
Пример 51. Получение соединения 11.

Неочищенное соединение B11 применяли непосредственно, добавляли 8 мл сухого ТГФ и 100 мг K2CO3, 0,5 мл пиразола. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Раствор разбавляли этилацетатом (100 мл). Полученный раствор промывали солевым раствором (100 мл), сушили над сульфатом натрия и концентрировали под вакуумом. Остаток очищали посредством обратнофазной препаративной ВЭЖХ с получением 30 мг соединения 11 в форме белого твердого вещества. Соединение 11:1H ЯМР (500 МГц, CDCl3) δ(ppm): 7,54 (1H, d, J=1,0 Гц), 7,40 (1H, dt, J=2,0 Гц), 6,33 (1H, t, J=1,5 Гц), 4,94 (1H, AB, J=17,5 Гц), 4,90 (1H, AB, J=17,0 Гц), 3,88 (1H, AB, J=11,5 Гц), 3,73 (1H, AB, J=12,0 Гц), 2,58 (1H, t, J=8,5 Гц) 2,23~2,17 (1H, m), 2,07~2,05 (2H, m), 1,23 (3H, s), 0,72 (3H, s).
Пример 52. Получение соединения 6.

Неочищенное соединение B11 применяли непосредственно, добавляли 8 мл сухого ТГФ и 100 мг K2CO3,0,5 мл 1-(пиперазин-1-ил)этанона. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем раствор разбавляли этилацетатом (100 мл). Полученный раствор промывали солевым раствором (100 мл), сушили над сульфатом натрия и концентрировали под вакуумом. Остаток очищали посредством обратнофазной препаративной ВЭЖХ с получением 29 мг (43,64%, две стадии из 50мг соединения B10) соединения 6 в форме белого твердого вещества. Соединение 6:1H ЯМР (500 МГц, CDCl3) δ(ppm): 3,89(1H,AB, J=11,5 Гц), 3,72(1H,AB, J=11,5 Гц), 3,68~3,65 (2H,m),3,51(2H,t, J=5,0 Гц) 3,21(3H,s), 2,55 (1H,t, J=9,5 Гц), 2,45 (3H, t, J=5,0 Гц) , 1,23 (3H, s), 0,67(3H, s)
Пример 53. Получение соединения 7.

59 мг (0,12 ммоль) неочищенного соединения B11 растворяли в 8 мл ТГФ и добавляли 100 мг (0,77ммоль) K2CO3, 100 мг (0,61ммоль) 1-(метилсульфонил)пиперазина. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Раствор разбавляли этилацетатом (100 мл). Полученный раствор промывали солевым раствором (100 мл), сушили над сульфатом натрия и концентрировали под вакуумом. Остаток очищали посредством обратнофазной препаративной ВЭЖХ с получением 8 мг (0,02 ммоль,10,9%) продукта 7 в форме белого твердого вещества. Соединение 7:1H ЯМР (500 МГц, CDCl3) δ(ppm): 3,89(1H,AB, J=11,5 Гц), 3,72(1H,AB, J=12 Гц), 3,30(4H,t, J=5,0 Гц),3,25(2H, s), 2,78(3H, s) 2,61(4H,t, J=5,0 Гц), 2,52(1H,t, J=8,5 Гц), 2,13~2,01(1H,m), 1,23(3H,s), 0,67(3H, s).
Пример 54. Получение соединения E15.


Стадия 1. Получение E2. К раствору E1 (250,0 г, 0,83 моль) в пиридине (1 л) по каплям добавляли Ac2O (168,8 г, 1,65 моль) при 19°C. После окончания добавления, реакционную смесь перемешивали при 19°C в течение ночи. ТСХ (петролейный эфир: этилацетат =1:1) показала, что реакция окончена. Затем реакционную смесь концентрировали под вакуумом, остаток выливали в воду и экстрагировали дихлорметаном (3x500 мл), органические слои промывали 2 н. HCl (200 мл), насыщенным NaHCO3(300 мл), солевым раствором, и сушили над безводным сульфатом натрия, фильтровали, концентрировали с получением неочищенного целевого продукта E2 (283,7 г, 99,7%) в форме коричневого масла.1H ЯМР (E2): (400 МГц, CDCl3) δ 5,95-5,90 (m, 1H), 4,70-4,64 (m, 1H), 4,20-4,13 (m, 1H), 2,68-2,55 (m, 1H), 2,54-2,30 (m, 5H), 2,15-1,90 (m, 6H), 1,90-1,75 (m, 4H), 1,63-1,38 (m, 2H), 1,33-1,07 (m, 4H), 0,90 (s, 3H).
Стадия 2. Получение E3. К раствору E2 (250,0 г, 0,73 моль) в 1,4-диоксане (700 мл) и EtOH (467 мл) добавляли CH(OEt)3 (227,2 г, 1,53 моль) и p-TsOH (2,8 г, 14,60 ммоль) при 29°C. После окончания добавления, реакционную смесь перемешивали в течение 1 ч при 29°C. ТСХ (петролейный эфир: этилацетат =3:1) показала, что реакция окончена. Затем реакционную смесь гасили насыщенным NaHCO3 (300 мл) и выливали в воду,экстрагировали посредством EtOAc (3x500 мл), органические слои промывали солевым раствором и сушили над безводным сульфатом натрия, фильтровали, концентрировали, перекристаллизовывали из петролейного эфира: этилацетата=10:1 с получением целевого продукта E3 (155,8 г, 57,6%) в форме белого твердого вещества.1H ЯМР (E3) : (400 МГц, CDCl3) δ 5,42-5,38 (m, 1H), 5,15-5,10 (m, 1H), 4,46-4,50 (m, 1H), 4,32-4,25 (m, 1H), 4,05-3,98 (m, 1H), 3,85-3,70 (m, 2H), 2,53-2,42 (m, 1H), 2,37-2,20 (m, 3H), 2,18-1,91 (m, 7H), 1,90-1,72 (m, 3H), 1,62-1,48 (m, 2H), 1,40-1,20 (m, 6H), 1,20-1,12 (m, 1H), 0,90 (s, 3H).
Стадия 3. Получение E4. К раствору E3 (30,0 г, 80,54 ммоль) в EtOAc (400 мл) добавляли Pd/C (1,5 г, 50% воды) в атмосфере N2. Реакционную смесь дегазировали под вакуумом и несколько раз продували H2. Затем реакционную смесь перемешивали в течение 1 ч при 15°C в атмосфере H2. Затем ее фильтровали, и фильтрат перемешивали при15°C, добавляли 10% HCl (100 мл), и реакционную смесь перемешивали в течение 1 ч при 15°C. ТСХ (петролейный эфир: этилацетат =3:1) показала, что реакция окончена. Реакционную смесь выливали в воду и экстрагировали EtOAc (3x200 мл), органические слои промывали насыщенным NaHCO3, солевым раствором и сушили над безводным сульфатом натрия, фильтровали, концентрировали и очищали посредством колонки с силикагелем (петролейный эфир: этилацетат=10:1-3:1) с получением продукта E4 (33,0 г, выход: 59,1 %) в форме бесцветного масла.1H ЯМР (E4): (400 МГц, CDCl3) δ 4,75-4,50 (m, 1H), 4,45-4,38 (m, 1H), 2,55-2,35 (m, 5H), 2,31-2,20 (m, 1H), 2,15-2,05 (m, 4H), 2,05-1,65 (m, 6H), 1,60-1,15 (m, 7H), 1,15-1,00 (m, 1H), 0,95-0,85 (m, 4H).
Стадия 4. Получение E5. К раствору E4 (31,0 г, 89,48 ммоль) и этан-1,2-диола (50 мл) в толуоле (200 мл) добавляли каталитическое количество пиридина HCl (0,3 г, 2,60 ммоль) при 16°C. После окончания добавления реакционную смесь нагревали до кипения и удаляли воду посредством ловушки Дина-Старка в течение 18 ч. ТСХ (петролейный эфир: этилацетат =3:1) показала, что реакция окончена. Затем реакционную смесь охлаждали до 16°C, выливали в воду и экстрагировали посредством EtOAc (3x100 мл), органические слои промывали солевым раствором и сушили над безводным сульфатом натрия, фильтровали, концентрировали с получением неочищенного продукта E5 (36,9 г, выход: 94,8 %) в форме белого твердого вещества., который применяли на следующей стадии.1H ЯМР (E5): (400 МГц, CDCl3) δ 4,40-4,30 (m, 2H), 4,20-4,10 (m, 2H), 4,00-3,80 (m, 8H), 2,20-1,90 (m, 5H), 1,85-1,05 (m, 20H), 1,05-0,75 (m, 5H).
Стадия 5. Получение E6. К раствору E5 (55,0 г, 126,56 ммоль) в ТГФ (200 мл) и MeOH (50 мл) добавляли 4 н. LiOH (94,9 мл, 379,69 ммоль) при 20°C. После окончания добавления, реакционную смесь перемешивали в течение 18 ч при 20°C. ТСХ (петролейный эфир: этилацетат =3:1) показала, что реакция окончена. Затем реакционную смесь выливали в воду и экстрагировали посредством EtOAc (3x200 мл), органические слои промывали солевым раствором и сушили над безводным сульфатом натрия, фильтровали, концентрировали с получением неочищенного продукта E6 (46,3 г, выход: 93,1 %) в форме белого твердого вещества.1H ЯМР (E6): (400 МГц, CDCl3) δ 4,00-3,75 (m, 10H), 2,25-2,15 (m, 1H), 2,05-1,90 (m, 1H), 1,85-1,60 (m, 8H), 1,60-1,40 (m, 7H), 1,35-1,00 (m, 5H), 1,00-0,75 (m, 5H).
Стадия 6. Получение E7. К суспензии 60% NaH (9,6 г, 0,24 моль) в сухом ТГФ (100 мл) по каплям добавляли раствор соединения E6 (46,3 г, 0,12 моль) в сухом ТГФ (200 мл) при 25°C в атмосфере N2. Смесь перемешивали в течение 30 мин, затем по каплям добавляли MeI (51,1 г, 0,36 моль) при 25°C. После окончания добавления, реакционную смесь перемешивали в течение 4 ч при 45°C. ТСХ (петролейный эфир: этилацетат =3:1) показала, что реакция окончена. Реакционную смесь охлаждали до комнатной температуры, гасили насыщенным NH4Cl (200 мл), выливали в воду, экстрагировали посредством EtOAc (3x200 мл), органические слои промывали солевым раствором и сушили над безводным сульфатом натрия, фильтровали, концентрировали с получением неочищенного продукта E7 (50,0 г, неочищенный продукт) в форме желтого твердого вещества.1H ЯМР (E7): (400 МГц, CDCl3) δ 3,95-3,80 (m, 8H), 3,55-3,40 (m, 2H), 3,28 (s, 3H), 2,18-2,10 (m, 1H), 2,01-1,95 (m, 1H), 1,81-1,57 (m, 8H), 1,46-1,37 (m, 8H), 1,29-1,18 (m, 4H), 1,02-0,85 (m, 7H).
Стадия 7. Получение E8. К раствору соединения E7 (50,0 г, 0,12 моль) в ТГФ (200 мл) и ацетоне (40 мл) добавляли водный раствор 2 н. HCl (40 мл). После окончания добавления, реакционную смесь перемешивали в течение 18 ч при 25°C. ТСХ (петролейный эфир: этилацетат =3:1) показала, что реакция окончена. Затем реакционную смесь выливали в воду, экстрагировали посредством EtOAc (3x200 мл), органические слои промывали насыщенным NaHCO3, солевым раствором и сушили над безводным сульфатом натрия, фильтровали, концентрировали с получением неочищенного продукта E8 (41,0 г, неочищенный продукт) в форме желтого твердого вещества, который непосредственно применяли на следующей стадии.1H ЯМР (E8): (400 МГц, CDCl3) δ 3,73-3,58 (m, 2H), 3,34 (s, 3H), 2,55-2,40 (m, 3H), 2,42-2,30 (m, 1H), 2,20-1,65 (m, 8H), 1,60-1,20 (m, 10H), 1,10-0,75 (m, 7H).
Стадия 8. Получение E9. К раствору E8 (40,0 г, 125,7 ммоль) в сухом ТГФ (500 мл) по каплям добавляли K-селектрид (151 мл, 150,8 ммоль, 1 M в ТГФ) при -78°C в атмосфере N2. После окончания добавления, реакционную смесь перемешивали в течение 3 ч при -78oC. ТСХ (петролейный эфир: этилацетат =3:1) показала, что реакция окончена. Реакционную смесь медленно гасили посредством 30% H2O2 (17,1 г, 150,5 ммоль) при -78°C, затем реакционную смесь выливали в насыщенный NH4Cl, экстрагировали посредством EtOAc (3x100 мл). Органическую фазу промывали насыщенным Na2S2O3, солевым раствором, сушили над сульфатом натрия и выпаривали с получением неочищенного продукта. Неочищенный продукт очищали промыванием в PE: EtOAc=10:1 с получением целевого продукта E9 (23,5 г, 58%) в форме белого твердого вещества.1H ЯМР (E9): (400 МГц, CDCl3) δ 4,10 (m, 1H), 3,52 (d, 1H), 3,42 (d, 1H), 3,30 (s, 3H), 2,50-2,40 (m, 1H), 2,16-2,03 (m, 1H), 1,98-1,90 (m, 2H), 1,86-1,64 (m, 10H), 1,55-1,47 (m, 3H), 1,32-1,17 (m, 6H), 1,12-0,95 (m, 1H), 0,88-0,81 (m, 4H).
Стадия 9. Получение E10. К суспензии Ph3PEtBr (25,97 г, 70 ммоль) в сухом ТГФ (100 мл) по каплям добавляли раствор t-BuOK (7,70 г, 70 ммоль) в сухом ТГФ (50 мл) в атмосфере N2 при 0°C. Смесь перемешивали при комнатной температуре в течение 1,5 ч. Затем по каплям добавляли раствор E9 (2,8 г, 8,75 ммоль) в ТГФ (30 мл), и полученную смесь перемешивали при 60°C в течение 12 ч. ТСХ (петролейный эфир: этилацетат = 3:1) показала, что исходный материал был полностью израсходован. Реакцию гасили насыщенным водным раствором NH4Cl (100 мл) и экстрагировали EtOAc (50 мл x 2). Объединенные органические фазы сушили над Na2SO4 и концентрировали под вакуумом. Остаток очищали посредством колоночной хроматографии на силикагеле (элюент: петролейный эфир: этилацетат = 40:1) с получением E10 (1,8 г, 62%) в форме белого порошка.1H ЯМР(E10: (400 МГц, CDCl3) δ 5,15-5,05 (m, 1H), 4,13-4,05 (m, 1H), 3,55-3,35 (m, 2H), 3,30 (s, 3H), 2,45-1,90 (m, 4H), 1,80-1,35 (m, 13H), 1,30-0,95 (m, 8H), 0,90 (s, 3H), 0,85-0,70 (m, 1H).
Стадия 10. Получение E11. К раствору E10 (1,8 г, 5,41 ммоль) в ДМФА (20 мл) добавляли имидазол (737 мг, 10,82 ммоль) и TBSCl (1,22 г, 8,12 ммоль). Смесь перемешивали в течение ночи при комнатной температуре. ТСХ (петролейный эфир: этилацетат = 3:1) показала, что исходный материал был полностью израсходован. Реакционную смесь разбавляли посредством EtOAc (20 мл) и промывали солевым раствором (20 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали под вакуумом. Неочищенный продукт очищали хроматографией на силикагеле, проводя элюирование петролейным эфиром с получением E11 (2,33 г, 96%) в форме белого твердого вещества.1H ЯМР(E11: (400 МГц, CDCl3) δ 5,11-5,09 (m, 1H), 4,01-4,00 (m, 1H), 3,50-3,39 (m, 2H), 3,29 (s, 3H), 2,40-2,30 (m, 1H), 2,25-2,10 (m, 2H), 1,90-1,82 (m, 1H), 1,53-1,40 (m, 5H), 1,30-0,95 (m, 8H), 0,89-0,88 (m, 9H), 0,86-0,75 (m, 2H), 0,02-0,01 (m, 6H).
Стадия 11. Получение E12. К раствору 9-BBN (81 мл, 40,84 ммоль) добавляли E11 (2,33 г, 5,06 ммоль) в ТГФ (20 мл). Смесь перемешивали при 60°C в течение16 ч. Затем смесь охлаждали до комнатной температуры, и по каплям добавляли 10% водный раствор NaOH (40 мл) и H2O2 (20 мл). После перемешивания в течение 1 ч, смесь гасили водным раствором Na2S2O3и экстрагировали EtOAc (100 мл). Органические слои объединяли и сушили над безводным сульфатом натрия. Органическую фазу концентрировали под вакуумом. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле (элюент: петролейный эфир: этилацетат = 40:1) с получением E12 (2,3 г, 90%) в форме белого твердого вещества.1H ЯМР(E12): (400 МГц, CDCl3) δ 4,00-3,99 (m, 1H), 3,71-3,65 (m, 1H), 3,49-3,38 (m, 2H), 3,28 (s, 3H), 2,42-2,39 (m, 1H), 1,89-1,82 (m, 5H), 1,75-1,46 (m, 17H), 1,38-1,00 (m, 14H), 0,89 (s, 9H), 0,68 (s, 3H), 0,00 (m, 6H).
Стадия 12. Получение E13. К раствору E12 (2,1 г, 4,52 ммоль) в CH2Cl2 (20 мл) добавляли реагент Десс-Мартина (3,8 г, 9,04 ммоль). Смесь перемешивали при 12°C в течение 5 ч. ТСХ (петролейный эфир : этилацетат=3:1) показала, что исходный материал был полностью израсходован. Смесь гасили смешанным раствором Na2S2O3/NaHCO3 (3:1, 12 г) в воде (50 мл). Смесь экстрагировали посредством EtOAc (200 мл). Органические слои сушили над безводным сульфатом натрия. Органическую фазу концентрировали под вакуумом с получением E13 в форме белого твердого вещества (2,3 г, неочищенное вещество).1H ЯМР(E13): (400 МГц, CDCl3) 4,00-3,99 (m, 1H), 3,49-3,38 (m, 2H), 3,27 (s, 3H), 2,41-2,39 (m, 2H), 2,20-2,12 (m, 1H), 2,11 (s, 3H), 2,00-1,95 (m, 1H), 1,89-1,84 (m, 3H), 1,75-1,45 (m, 14H), 1,42-0,92 (m, 11H), 0,89 (s, 9H), 0,87-0,82 (m, 1H), 0,62 (s, 3H), 0,00 (m, 6H).
Стадия 13. Получение E14. К раствору E13 (230 мг, 0,48 ммоль) в CH2Cl2 (6 мл) добавляли TFA (1 мл). Смесь перемешивали при 15°C в течение 30 мин. ТСХ (петролейный эфир: этилацетат =3:1) показала, что исходный материал был полностью израсходован. Реакцию гасили водным раствором NaHCO3 (10 мл) и экстрагировали EtOAc (30 мл x 2). Органический слой сушили над безводным сульфатом натрия. Органическую фазу концентрировали под вакуумом. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле (элюент: петролейный эфир: этилацетат = 10:1) с получением E14 (166 мг, 95%) в форме белого твердого вещества.1H ЯМР (E14): (400 МГц, CDCl3) 4,12-4,11 (m, 1H), 3,52-3,42 (m, 2H), 3,30 (s, 3H), 2,58-2,53 (m, 1H), 2,20-2,16 (m, 1H), 2,13 (s, 3H), 2,06-1,97 (m, 2H), 1,75-1,60 (m, 8H), 1,59-1,10 (m, 11H), 1,03-0,92 (m, 1H), 0,90-0,82 (m, 1H), 0,63 (s, 3H).
Стадия 14. Получение E15. К раствору E14 (2 г, 5,21 ммоль) в MeOH (25 мл) добавляли HBr (5 капель) и Br2 (8 мл). Смесь перемешивали при комнатной температуре в течение 4 ч. LC-MS показала, что исходный материал был израсходован. Реакционную смесь разбавляли посредством H2O (20 мл) и экстрагировали EtOAc (50 мл). Органический слой сушили над безводным сульфатом натрия. Органическую фазу концентрировали под вакуумом. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле (элюент: петролейный эфир: этилацетат = 10:1) с получением E15 (1 г, 41%) в форме белого твердого вещества.1H-ЯМР показал присутствие 70% E15 и 30% E14.1H ЯМР(E15):(400 МГц, CDCl3) 4,11-4,10 (m, 1H), 3,94-3,88 (m, 2H), 3,49-3,39 (m, 2H), 3,28 (s, 3H), 2,84-2,79 (m, 1H), 2,20-2,15 (m, 1H), 2,04-1,87 (m, 2H), 1,74-1,60 (m, 8H), 1,57-1,16 (m, 12H), 1,03-0,76 (m, 2H), 0,64 (s, 3H).
Пример 55. Получение соединений 90 и 91.

К раствору K2CO3 (952 мг, 6,9 ммоль) в ДМФА (20 мл) добавляли 2H-1,2,3-триазол (969 мг, 13,8 ммоль). Смесь перемешивали при комнатной температуре в течение 30 мин, и затем добавляли раствор E15 (1 г, 2,3 ммоль) в ДМФА (20 мл). Смесь перемешивали при комнатной температуре в течение ночи. ТСХ (петролейный эфир: этилацетат =1:1) показала, что исходный материал был полностью израсходован. Реакционную смесь разбавляли посредством EtOAc (50 мл) и промывали солевым раствором (50 мл). Органический слой сушили над безводным сульфатом натрия. Органическую фазу концентрировали под вакуумом. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле (элюент: петролейный эфир: этилацетат = 5:1) с получением 90 (204 мг, 21%) в форме белого порошка и 91 (437 мг, 45%) в форме белого порошка.1H ЯМР(90): (400 МГц, CDCl3) 7,70 (s, 2H), 5,31-5,20 (m, 2H), 4,13-4,12 (m, 1H), 3,52-3,43 (m, 2H), 3,31 (s, 3H), 2,63-2,58 (m, 1H), 2,24-2,22 (m, 1H), 2,12-1,97 (m, 2H), 1,78-1,62 (m, 9H), 1,54-1,10 (m, 10H), 1,09-0,96 (m, 1H), 0,91-0,84 (m, 1H), 0,75 (s, 3H).1H ЯМР(91): (400 МГц, CDCl3) 7,75 (s, 1H), 7,63 (s, 1H), 5,27-5,11 (m, 2H), 4,13-4,10 (m, 1H), 3,50-3,40 (m, 2H), 3,28 (s, 3H), 2,67-2,64 (m, 1H), 2,26-2,18 (m, 1H), 2,08-1,92 (m, 2H), 1,74-1,25 (m, 15H), 1,19-0,87 (m, 8H), 0,69 (s, 3H).
Пример 56. Получение соединения 92.

Смесь E15 (200 мг, 0,45 ммоль), K2CO3 (188 мг, 1,36 ммоль), этил 1H-пиразол-3-карбоксилата (317 мг, 2,27 ммоль) и ДМФА (2 мл) перемешивали при 25°C в течение 12 часов. ТСХ показала окончание реакции. Смесь разбавляли посредством EtOAc (20 мл), промывали солевым раствором (30 мл*3), и органический слой сушили над безводным Na2SO4, и затем концентрировали с получением неочищенного продукта. Его очищали посредством колоночной хроматографии (петролейный эфир: этилацетат = 4:1) с получением 92 (96 мг, 44,4 %) в форме белого твердого вещества.1H ЯМР (92): (400 МГц, CDCl3) δ 7,42 (d, J=2,4 Гц, 1H), 6,86 (d, J=2,4 Гц, 1H), 5,05-4,95 (m, 2H), 4,39 (q, J=7,2Гц, 2H), 4,20-4,10 (m, 1H), 3,49-3,39 (m, 2H), 3,28 (s, 3H) ,2,60-2,55 (m, 1H), 2,22 -1,91 (m, 3H), 1,75-1,50 (m, 6H), 1,45-1,10 (m, 15H), 1,05-0,92 (m, 1H), 0,90-0,84 (m, 1H), 0,70 (s, 3H)
Пример 57. Получение соединения 93.
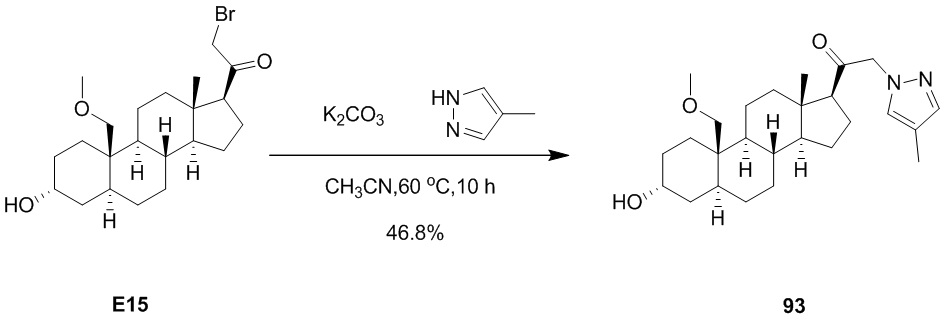
К раствору E15 (200 мг, 0,47 ммоль) в CH3CN (15 мл) при 29°C затем в смесь добавляли K2CO3 (194,01 г, 1,4 ммоль) и 4-метил-1H-пиразол (192,09 мг, 2,34 ммоль) при 29°C. Раствор перемешивали при 60°C в течение 10 ч. После того, как ТСХ показала, что исходный материал был полностью израсходован, смесь концентрировали. Смесь экстрагировали CH2Cl2 (30 мл) и NaCl (водн) (20 мл *2). Объединенные органические слои сушили над Na2SO4 и концентрировали с получением неочищенного продукта. Продукт очищали посредством колоночной хроматографии на силикагеле, проводя элюирование посредством (петролейный эфир /этилацетат=10:1 до 6:1) с получением 93 (94,4 мг, выход: 46,81 %).1H ЯМР (93): (400 МГц, CDCl3) δ 7,36 (s, 1H ), 7,18 (s, 1H), 4,85 (dd, J = 34 Гц, J = 17,6 Гц, 2H), 4,15-4,10 (m, 1H), 3,47 (dd, J = 28,8Гц, J = 10 Гц , 2H), 3,31 (s , 3H), 2,62-2,55 (m, 1H), 2,28 - 2,18 (m, 1H), 2,13-1,97 (m, 5H), 1,78-1,64 (m, 8H), 1,48-1,13 (m, 10H), 1,04-0,84 (m, 2H), 0,71 (s, 3H)
Пример 58. Получение соединений 94, 95 и 96.

К раствору E15 (150 мг, 0,35 ммоль) в ДМФА (6 мл) добавляли Cs2CO3 (343 мг, 1,05 ммоль) и 4-метил-1, 2, 3-триазол (145 мг, 1,75 ммоль) при 28°C. Реакционную смесь перемешивали при той же температуре в течение 6 ч. ТСХ показала, что исходный материал был полностью израсходован. Смесь выливали в воду (20 мл) и экстрагировали посредством EtOAc (10 мл *2). Объединенные органические слои сушили над Na2SO4 и концентрировали с получением неочищенного продукта. Неочищенный продукт очищали посредством препаративной ВЭЖХ с получением чистого 94 (35,8 мг) и смеси 95 и 96 (20 мг). Затем смесь очищали посредством SFC с получением 95 (3,9 мг) и 96 (5,6 мг). Общий выход: 23,7%. Структуру трех целевых продуктов подтверждали посредством NOE.
1H ЯМР (94): (400 МГц, CDCl3) δ 7,42 (s, 1H), 5,19-5,08 (m, 2H), 4,13-4,09 (m, 1H), 3,53-3,38 (m, 2H), 3,29 (s, 3H), 2,61-2,54 (m, 1H), 2,33 (s, 3H), 2,26-2,15 (m, 1H), 2,11-1,95 (m, 2H), 1,78-1,61 (m, 9H), 1,52-1,06 (m, 9H) , 1,04-0,81 (m, 2H) , 0,72 (s, 3H) .
1H ЯМР (95): (400 МГц, CDCl3) δ 7,50 (s, 1H), 5,23-5,05 (m, 2H), 4,15-4,06 (m, 1H), 3,58-3,42 (m, 2H), 3,31 (s, 3H), 2,71-2,61 (m, 1H), 2,33-2,14 (m, 6H), 2,12-1,96 (m, 4H), 1,34-1,18 (m, 10H), 1,06-0,83 (m, 6H), 0,70 (s, 3H) .
1H ЯМР (96): (400 МГц, CDCl3) δ 7,35 (s, 1H), 5,22-5,02 (m, 2H), 4,15-4,10 (m, 1H), 3,56-3,39 (m, 2H), 3,31 (s, 3H), 2,67-2,61 (m, 1H), 2,39 (s, 3H), 2,29-1,88 (m, 10H), 1,33-1,22 (m, 10H), 1,02-0,97 (m, 1H), 0,92-0,84 (m, 2H) , 0,70 (s, 3H).
Пример 59. Получение 97 и 98.

К раствору A11 (360 мг, 0,82 ммоль) в ацетоне (2,5 мл) добавляли 5,6-дифтор-2H-бензо[d] [1,2,3]триазол (BB-1) (190 мг, 1,23 ммоль) и K2CO3 (230 мг, 1,64 ммоль). Смесь перемешивали при 30°C в течение 3 часов. ТСХ показала окончание реакции. К смеси добавляли воду (2 мл), экстрагировали посредством EtOAc (5 мл * 2). Объединенный органический слой концентрировали под вакуумом, очищали посредством препаративной ВЭЖХ с получением 97 (25 мг, 6%) и 98 (141 мг, 33%) в форме белого твердого вещества.
1H ЯМР (97): (400 МГц, CDCl3) δ 7,59 (t, J = 8,4 Гц, 2H), 5,53-5,42 (m, 2H), 3,48-3,36 (m, 2H), 3,29 (s, 3H), 2,65 (t, J = 8,4 Гц, 1H), 2,27-2,02 (m, 3H), 1,80-0,85 (m, 23H), 0,75 (s, 3H). LCMS (97): tR = 1,366 мин в 2 мин хроматографии, 10-80AB, чистота 96,3%, MS ESI в расчете на C29H40F2N3O3 [M+H]+ 516, обнаружено 498([M+H-18]+).
1H ЯМР (98): (400 МГц, CDCl3) δ 7,83 (t, J = 8,0 Гц, 1H), 7,12 (t, J = 7,6 Гц, 1H), 5,43-5,32 (m, 2H), 3,50-3,37 (m, 2H), 3,30 (s, 3H), 2,80-2,68 (m, 1H), 2,30-2,02 (m, 3H), 1,80-0,85 (m, 23H), 0,75 (s, 3H). LCMS (98): tR = 1,317 мин в 2 мин хроматографии, 10-80AB, чистота 99,6%, MS ESI в расчете на C29H40F2N3O3 [M+H]+ 516, обнаружено 516.
Схема A. Общая процедура для получения соединений 99-146.

Пример 76. Получение соединений 154 и 155.

К раствору соединения D6 (300 мг, 0,679 ммоль) в ацетоне (5 мл) добавляли K2CO3 (186 мг, 1,35 ммоль) и 2H-пиразоло[3,4-b]пиразин (120 мг, 1,01 ммоль). После перемешивания при 25°C в течение 3 ч, LCMS показала окончание реакции, один продукт (27%) и один продукт (21%). Реакционную смесь концентрировали под вакуумом для удаления большей части растворителя с получением остатка. Остаток растворяли в EtOAc (50 мл) и промывали водой (50 мл). Реакционную смесь экстрагировали посредством EtOAc (50 мл * 3). Органические слои объединяли и концентрировали под вакуумом с получением неочищенного продукта. Неочищенный продукт очищали посредством препаративной ВЭЖХ (FA) с получением соединения 154 (4 мг, 1,22%) в форме белого твердого вещества и соединения 155 (4 мг,1,22%) в форме белого твердого вещества.
1H ЯМР (154) (выход 1,2%): (400 МГц, CDCl3) δ 8,64 (d, J = 2,0 Гц, 1H), 8,56 (d, J = 2,0 Гц , 1H), 8,26 (s, 1H), 5,40-5,19 (m, 2H), 3,54 (d, J = 8,4 Гц, 1H), 3,33 (s, 3H), 3,20 (d, J = 9,2 Гц, 1H), 2,68 (t, J = 8,8 Гц, 1H), 2,30-1,20 (m, 26H), 0,72 (d, J = 13,2 Гц , 3H). LCMS tR = 1,155 мин в 2 мин хроматографии, 10-80AB, чистота 96,2%, MS ESI в расчете на C28H41N4O3 [M+H]+ 481, обнаружено 481.
1H ЯМР (155) (выход 1,2%): (400 МГц, CDCl3) δ 8,59 (d, J = 2,4 Гц, 1H), 8,44 (d, J = 2,0 Гц, 1H), 8,34 (s, 1H), 5,36-5,24 (m, 2H), 3,55 (d, J = 9,2 Гц, 1H), 3,34 (s, 3H), 3,22 (d, J = 9,2 Гц, 1H), 2,68 (t, J = 8,8 Гц, 1H), 2,30-1,20 (m, 26H), 0,71 (s, 3H). LCMS tR = 0,854 мин в 1,5 мин хроматографии, 10-80AB, чистота 96,8%, MS ESI в расчете на C28H41N4O3 [M+H]+ 481, обнаружено 463[M+H-18]+.
Пример 77. Получение соединения 156.

1H ЯМР (156) (выход 41 %): (400 МГц, CDCl3) δ 7,88 (s, 1H), 7,83 (s, 1H), 5,07-4,87 (m, 2H), 3,55 (d, J = 9,0 Гц, 1H), 3,35 (s, 3H), 3,22 (d, J = 9,0 Гц, 1H), 2,65-2,58 (m, 1H), 2,28-2,15 (m, 1H), 2,10-2,01 (m, 1H), 1,97-1,91 (m, 2H), 1,82-1,40 (m, 14H), 1,35-1,09 (m, 8H), 0,68 (s, 3H). LCMS tR = 2,744 мин в 4 мин хроматографии, 10-80AB, чистота 100,0 %, MS ESI в расчете на C27H39N3O3Na [M+Na]+ 477, обнаружено 477.
Пример 78. Получение соединения 147.
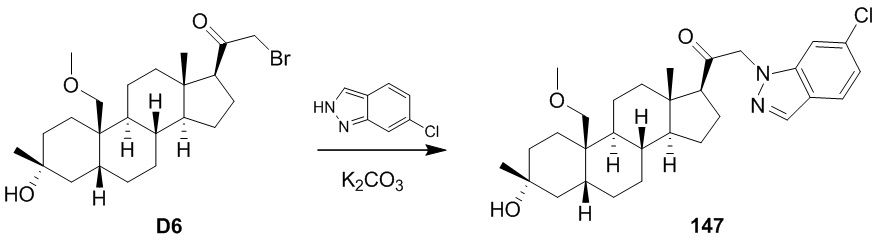
1H ЯМР (147) (выход 4 %): (400 МГц, CDCl3) δ 8,03 (s, 1H), 7,68 (d, J = 8,5 Гц, 1H), 7,22 (s, 1H), 7,15 (d, J = 8,5 Гц, 1H), 5,20-5,03 (m, 2H), 3,57 (d, J = 9,0 Гц, 1H), 3,36 (s, 3H), 3,23 (d, J = 9,0 Гц, 1H), 2,65 (t, J = 8,7 Гц, 1H), 2,30-2,09 (m, 2H), 1,99-1,91(m, 2H), 1,77-1,45 (m, 14H), 1,34-1,14 (m, 8H), 0,73 (s, 3H). LCMS tR = 3,185 мин в 4 мин хроматографии, 10-80AB, чистота 100,0 %, MS ESI в расчете на C30H42ClN2O3 [M+H]+ 513, обнаружено 513.
Пример 79. Получение соединения 157.

1H ЯМР (157) (выход 3,5%): (400 МГц, CDCl3) δ 7,47-7,43 (m, 1H), 7,14-7,06 (m, 2H), 5,49-5,38 (m, 2H), 3,55 (t, J = 9,2 Гц, 1H), 3,36 (d, J = 4,0 Гц, 3H), 3,25 (d, J = 8,8 Гц, 1H), 2,73 (s, 1H), 2,30-1,20 (m, 26H), 0,74 (s, 3H). LCMS tR = 0,931 мин в 1,5 мин хроматографии, 5-95AB, чистота 96,8%, MS ESI в расчете на C29H41FN3O3 [M+H]+ 498, обнаружено 520[M+Na]+.
Пример 80. Получение соединения 158.

1H ЯМР (158) (выход 18 %): (400 МГц, CDCl3) δ 7,50 (d, J = 2,5 Гц, 1H), 6,75 (d, J = 2,5 Гц, 1H), 5,08-4,90 (m, 2H), 3,55 (d, J = 9,0 Гц, 1H), 3,37-3,31 (m, 3H), 3,22 (d, J = 9,0 Гц, 1H), 2,64-2,57 (m, 1H), 2,28-01 (m, 2H), 1,99-1,91 (m, 2H), 1,84-1,40 (m, 14H), 1,39 - 1,08 (m, 8H), 0,67 (s, 3H). LCMS tR = 2,821 мин в 4 мин хроматографии, 10-80AB, чистота 100,0 %, MS ESI в расчете на C27H39N3O3Na [M+Na]+ 476, обнаружено 476.
Пример 81. Получение соединения 159.

1H ЯМР (159) (выход:13 %): (400 МГц, CDCl3) δ 7,48 (s, 1H), 6,60 (d, J = 2,0 Гц, 1H), 5,07-4,88 (m, 2H), 3,56 (d, J = 9,0 Гц, 1H), 3,35 (s, 3H), 3,22 (d, J = 9,0 Гц, 1H), 2,65-2,54 (m, 1H), 2,28-2,15 (m, 1H), 2,10-2,02 (m, 1H), 1,99-1,90 (m, 2H), 1,84-1,37 (m, 14 H), 1,36-1,07 (m, 8 H), 0,68 (s, 3H). LCMS tR = 3,049 мин в 4 мин хроматографии, 10-80AB, чистота 100,0 %, MS ESI в расчете на C27H40F3N2O3 [M+H]+ 497, обнаружено 479 [M+H-H2O]+.
Пример 82. Получение соединения 160.

1H ЯМР (160) (выход 11 %): (400 МГц, CDCl3) δ 8,59 (s, 1H), 5,47 (s, 2H), 3,56 (d, J = 9,0 Гц, 1H), 3,35 (s, 3H), 3,23 (d, J = 9,0 Гц, 1H), 2,66 (t, J = 8,8 Гц, 1H), 2,30-2,16 (m, 1H), 2,15-2,05 (m, 1H), 1,98-1,89 (m, 2H), 1,84-1,41 (m, 14H), 1,40-1,11 (m, 9H), 0,72 (s, 3H). LCMS tR = 2,667 мин в 4 мин хроматографии, 10-80AB, чистота 100,0 %, MS ESI в расчете на C24H39N4O3 [M+H]+ 431, обнаружено 413 [M+H-18]+.
Пример 83. Получение соединения F5.

Стадия 1. Получение соединения F1. К раствору C2 (2 г, 6,28 ммоль) в ТГФ (30 мл) в колбу добавляли CsF (953 мг, 6,28 ммоль) при 0°C, затем по каплям добавляли TMSCF3(1,33 г, 9,42 ммоль). Реакцию оставляли нагреваться до 25°C и перемешивали в течение 2ч. ТСХ (PE:EtOAc=3:1) показала, что исходный материал был полностью израсходован. Затем реакционную смесь обрабатывали 2M водн. HCl (10 мл) и перемешивали в течение 6 ч. Реакционную смесь затем разбавляли H2O (30 мл) и экстрагировали EtOAc (30 мл x2). Объединенный органический слой промывали солевым раствором (20 мл), сушили над Na2SO4 и концентрировали с получением неочищенного продукта, который очищали колонкой с силикагелем (PE:EtOAc=50:1 до 10:1) с получением продукта F1 (1,1 г, 45,0% выход) в форме желтого масла.1H ЯМР (400 МГц, CDCl3) δ 3,49(d, J = 8,0Гц, 1H), 3,32-3,22(m, 4H), 2,46-2,39(m, 1H), 2,10-1,71(m, 8H), 1,68-1,10 (m, 14H), 0,85(s, 3H).
Стадия 2. Получение соединения F2. К раствору этилтрифенилфосфония бромида (5,19 г, 14,0 ммоль) в ТГФ (30 мл) добавляли t-BuOK (1,57 г, 14,0 ммоль). Реакционную смесь нагревали до 60°C в течение 1 ч, и к смеси добавляли F1 (1,1 г, 2,83 ммоль), которую перемешивали при 60°C в течение дополнительных 8 ч. ТСХ (PE:EtOAc= 3:1) показала окончание реакции. Реакционную смесь охлаждали, затем разбавляли H2O(30 мл) и экстрагировали EtOAc (30 мл x2). Объединенный органический слой промывали солевым раствором (20 мл), сушили над Na2SO4 и концентрировали. Остаток очищали колонкой с силикагелем (PE:EtOAc=100:1 to 15:1) с получением продукта F2 (1 г, 88,6% выход) в форме желтого масла.1H ЯМР (400 МГц, CDCl3) δ 5,15-5,02(m, 1H), 3,56(d, J = 8,0Гц, 1H), 2,46-2,39(m, 1H), 3,34(s, 3H), 3,29(d, J = 8,0Гц, 1H), 2,43-1,80 (m, 7H), 1,58-1,10 (m, 19H), 0,90(s, 3H).
Стадия 3. Получение соединения F3. К раствору F2 (1 г, 2,49 ммоль) в ТГФ (15 мл) под защитой N2 по каплям добавляли раствор BH3-Me2S (2,48 мл, 10 M) при 0°C. Раствор перемешивали при 25°C в течение 4 ч. ТСХ (PE/EtOAc = 3/1) показала окончание реакции. После охлаждения до 0°C очень медленно добавляли раствор NaOH (9,93 мл, 3M), высвобождалось большое количество газа. После окончания добавления, медленно добавляли H2O2 (4,53 мл, 33%), и внутреннюю температуру поддерживали ниже 10°C. Полученный раствор перемешивали при 25°C в течение 1 ч. Полученный раствор экстрагировали посредством EtOAc (20 мл x3). Объединенный органический раствор промывали насыщенным водным раствором Na2S2O3 (20 мл x 3), солевым раствором (20 мл), сушили над Na2SO4 и концентрировали под вакуумом с получением неочищенного продукта (1 г) в форме желтого масла. Неочищенный продукт применяли на следующей стадии без дополнительной очистки.
Стадия 4. Получение соединения F4. Смесь F3 (1,0 г, 2,38 ммоль), PCC (0,767 г, 3,56 ммоль) и силикагель (0,843 г, масс./масс. = 1/1,1) в ДХМ (15 мл) перемешивали при 25°C в течение 2 ч, реакционная смесь становилась коричневой. ТСХ (PE/EtOAc = 3/1) показала окончание реакции. Раствор фильтровали, и остаток на фильтре промывали посредством ДХМ (20 мл). Объединенный фильтрат концентрировали под вакуумом. Остаток очищали колонкой с силикагелем, проводя элюирование посредством PE:EtOAc = от 15:1 до 8:1 с получением F5 (800 мг, 80,6 %) в форме белого твердого вещества. MS ESI в расчете на C24H41O4 [M+H]+ 417, обнаружено 399 ( [M+H-18]+) .1H ЯМР (400 МГц, CDCl3) δ 3,52(d, J=8,0Гц, 1H), 3,33(s, 3H), 3,28(d, J=8,0Гц, 1H), 2,58-2,52 (m, 1H), 2,20-1,60(m, 15H), 1,53-1,10(m, 11H), 0,62(s, 3H).
Стадия 5. Получение соединения F5. К раствору F4 (0,5 г, 1,20 ммоль) и каталитического количества концентрированной HBr (12,1 мг, 40% в воде) в MeOH (15 мл) по каплям добавляли дибром (230 мг, 1,44 ммоль) при 0°C. Реакционную смесь перемешивали при 25°C в течение 1 ч. ТСХ (PE:EtOAc = 3:1) показала окончание реакции. Реакцию гасили насыщенным водным раствором NaHCO3 и pH доводили до 7~8. Реакционную смесь экстрагировали посредством ДХМ (20 мл x 2). Объединенный органический слой промывали солевым раствором(20 мл), сушили над Na2SO4 и концентрировали с получением неочищенного продукта F5 (500 мг) в форме желтого масла.
Пример 84. Получение соединений 161 и 162.

K2СО3, ацетон, 25оС
К раствору соединения F5 (150 мг, 0,302 ммоль) в ацетоне (5 мл) добавляли K2CO3 (62,6 мг, 0,453 ммоль) и 4,5-дифтор-2H-бензо[d][1,2,3]триазол (70,2 мг, 0,453 ммоль). После перемешивания при 25°C в течение 3 ч, ТСХ (PE:EA=3:1) показала окончание реакции. Реакционную смесь фильтровали, и фильтрат концентрировали под вакуумом с получением неочищенного продукта (150 мг). Неочищенный продукт очищали посредством препаративной ВЭЖХ (HCl) с получением соединения 162 (18 мг, 10,4%) в форме белого твердого вещества и соединения 161 (31 мг, 18%) в форме белого твердого вещества.
1H ЯМР (161) (выход 10,4%): (400 МГц, CDCl3) δ 7,42-7,36 (m, 1H), 7,09-7,06 (m, 1H), 5,53-5,35 (m, 2H), 3,50 (t, J = 9,2 Гц, 1H), 3,34-3,29 (m, 4H), 2,71 (d, J = 8,8 Гц, 1H), 2,20-1,00 (m, 23H), 0,74 (s, 3H). LCMS tR = 1,350 мин в 2 мин хроматографии, 10-80AB, чистота 100%, MS ESI в расчете на C29H37F5N3O3 [M+H]+ 570, обнаружено 570.
1H ЯМР (162) (выход 18%): (400 МГц, CDCl3) δ 7,68-7,64 (m, 1H), 7,37-7,29 (m, 1H), 5,59-5,49 (m, 2H), 3,51 (t, J = 7,6 Гц, 1H), 3,34-3,29 (m, 4H), 2,69 (d, J = 8,8Гц, 1H), 2,24-1,14 (m, 23H), 0,77 (s, 3H). LCMS tR = 1,398 мин в 2 мин хроматографии, 10-80AB, чистота 100%, MS ESI в расчете на C29H37F5N3O3 [M+H]+ 570, обнаружено 570.
Пример 85. Получение соединений 163, 164 и 165.

1H ЯМР (163) (выход 11%): (400 МГц, CDCl3) δ 7,73 (t, J=5,6 Гц, 1H), 7,09-7,06 (m, 2H), 5,48-5,38 (m, 2H), 3,88(s, 3H), 3,50 (d, J=8,8Гц, 1H), 3,31 (s, 3H), 3,28 (d, J=9,2 Гц, 1H), 2,62 (t, J=8,8 Гц, 1H), 2,17-1,11 (m, 23H), 0,74 (s, 3H). LCMS tR = 1,354 мин в 2 мин хроматографии, 10-80AB, чистота 100%, MS ESI в расчете на C30H41F3N3O4 [M+H]+ 564, обнаружено 564.
1H ЯМР (164) (выход 11%): (400 МГц, CDCl3) δ 7,38 (d, J = 1,6 Гц, 1H), 7,21 (d, J = 7,2 Гц, 1H), 7,15 (dd, J1 = 7,2 Гц, J2 = 1,6 Гц, 1H), 5,34(s, 2H), 3,89 (s, 3H), 3,49 (d, J = 6,8 Гц, 1H), 3,31 (s, 3H), 3,28 (d, J = 6,8 Гц, 1H), 2,66 (t, J = 7,2 Гц, 1H), 2,35-1,10 (m, 23H), 0,71 (s, 3H). LCMS tR = 0,964 мин в 1,5 мин хроматографии, 5-95AB, чистота 95%, MS ESI в расчете на C30H41F3N3O4 [M+H]+ 564, обнаружено 564.
1H ЯМР (165) (выход 19%): (400 МГц, CDCl3) δ 7,91 (d, J = 9,2 Гц, 1H), 7,01 (dd, J1 = 9,2 Гц, J2 = 2,0 Гц, 1H), 6,59 (d, J = 2,0 Гц, 1H), 5,38-5,27(m, 2H), 3,85 (s, 3H), 3,49 (d, J = 9,2 Гц, 1H), 3,31 (s, 3H), 3,28 (d, J = 9,2 Гц, 1H), 2,67 (t, J = 8,4 Гц, 1H), 2,43 (brs, 1H), 2,30-1,05 (m, 23H), 0,71 (s, 3H). LCMS tR = 1,354 мин в 2 мин хроматографии, 10-80AB, чистота 100%, MS ESI в расчете на C30H41F3N3O4 [M+H]+ 564, обнаружено 564.
Пример 86. Получение соединения 166.

1H ЯМР (166) (выход 10,5%): (400 МГц, CDCl3) δ 7,73 (t, J = 5,6 Гц, 1H), 7,09-7,06 (m, 2H), 5,48-5,38 (m, 2H), 3,88(s, 3H), 3,50 (d, J = 8,8Гц, 1H), 3,31 (s, 3H), 3,28 (d, J = 9,2 Гц, 1H), 2,62 (t, J = 8,8 Гц, 1H), 2,17-1,11 (m, 22H), 0,74 (s, 3H). LCMS tR = 1,354 мин в 2 мин хроматографии, 10-80AB, чистота 100%, MS ESI в расчете на C30H41F3N3O4 [M+H]+ 564, обнаружено 564.
Пример 87. Получение соединений 167, 168 и 169.
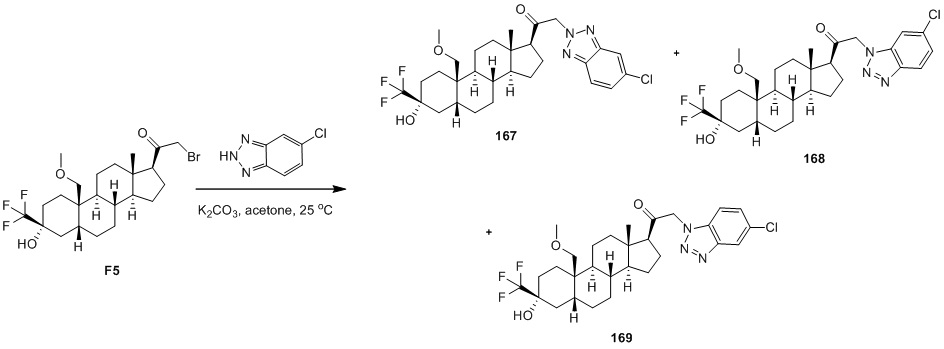
1H ЯМР (167) (выход 1%): (400 МГц, CDCl3) δ 7,89-7,83 (m, 2H), 7,38 (t, J = 7,2 Гц, 1H), 5,56-5,46 (m, 2H), 3,52 (d, J = 9,2 Гц, 1H), 3,34(s, 1H), 3,30 (d, J = 9,2Гц, 1H), 2,65 (t, J = 4,4Гц, 1H), 2,26-1,07 (m, 25H), 0,76 (s, 3H). LCMS tR = 1,424 мин в 2 мин хроматографии, 10-80AB, чистота 99%, MS ESI в расчете на C29H38ClF3N3O3 [M+H]+ 568, обнаружено 568.
1H ЯМР (168) (выход 6%): (400 МГц, CDCl3) δ 8,01-7,99 (m, 1H), 7,36-7,34 (m, 2H), 5,43-5,31 (m, 2H), 3,50 (d, J=8,8 Гц, 1H), 3,28-3,35(m, 4H), 2,70 (t, J = 8,8Гц, 1H), 2,24-1,13 (m, 23H), 0,73 (s, 3H). LCMS tR = 1,009 мин в 1,5 мин хроматографии, 5-95AB, чистота 97%, MS ESI в расчете на C29H38ClF3N3O3 [M+H]+ 568, обнаружено 568.
1H ЯМР (169) (выход 8%): (400 МГц, CDCl3) δ 8,07 (s, 1H), 7,45 (t, J = 7,2 Гц, 1H), 7,29 (s, 1H), 5,34-5,45 (m, 2H), 3,49 (d, J=8,8 Гц, 1H), 3,28-3,32(m, 4H), 2,70 (t, J = 9,2Гц, 1H), 2,20-0,88 (m, 23H), 0,71 (s, 3H). LCMS tR = 0,995 мин в 1,5 мин хроматографии, 5-95AB, чистота 99%, MS ESI в расчете на C29H38ClF3N3O3 [M+H]+ 568, обнаружено 568.
Пример 88. Получение соединения C19.

Стадия 1. Получение соединения C12. К раствору C2 (4 г, 13,14 ммоль) в 15 мл CH2Cl2 добавляли 1H-имидазол (2,68 г, 39,42 ммоль) и трет-бутилхлордиметилсилан (2,97 г, 19,71 ммоль) при 25°C, реакционную смесь перемешивали при 25°C в течение 16 ч. Реакционную смесь фильтровали посредством 50 мл CH2Cl2 и выпаривали под вакуумом. Остаток очищали посредством колоночной хроматографии на силикагеле (PE:EtOAc= 50:1-30:1-20:1-15:1-10:1) с получением C12 (5 г, 90,87 % выход) в форме белого твердого вещества.1H ЯМР: (400 МГц, CDCl3) δ 3,81 (d, J = 8,0 Гц, 1H), 3,58 (d, J = 8,0 Гц, 1H), 2,62-2,55 (m, 1H), 2,48-2,43 (m, 1H), 2,40-2,28 (m, 3H), 2,26-2,07 (m, 2H), 1,87-1,86 (m, 1H), 1,84-1,75 (m, 4 H), 1,56-1,27 (m, 10H), 0,87 (s, 12H), 0,042(s, 6H).
Стадия 2. Получение соединения C13. К раствору C12 (15,79г, 71,64 ммоль) в 30 мл толуола по каплям добавляли раствор AlMe3(17,91 мл, 3экв.) при 0°C. Через 1 ч по каплям добавляли раствор (5R,8R,9S,10R,13S,14S)-10-(((трет-бутилдиметилсилил)окси)метил)-13-метилдодекагидро-1H-циклопента[a]фенантрен-3,17(2H,4H)-диона (5 г, 11,94 ммоль) в толуоле (40 мл) при -78°C, реакционную смесь перемешивали при -78°C в течение 1 ч, и затем к смеси по каплям добавляли раствор MeMgBr (11,94 мл, 3 экв.) при -78°C, который перемешивали при -78°C в течение дополнительных 2 ч. После того, как ТСХ (PE:EtOAc = 3:1 ) показала, что исходный материал был полностью израсходован, реакционную смесь гасили водным раствором NH4Cl (15 мл), фильтровали и промывали посредством 500 мл EtOAc. Органический слой экстрагировали посредством 300 мл EtOAc, промывали солевым раствором и концентрировали. Остаток очищали посредством колоночной хроматографии на силикагеле (PE:EA=100-50:1-20:1-10:1-4:1) с получением C13 (5 г, 96,3%) в форме белого твердого вещества.1H ЯМР (400 МГц, CDCl3), δ 3,76 (d, J = 8,0 Гц, 1H), 3,40 (d, J = 8,0 Гц, 1H), 2,44-2,39 (m, 1H), 2,09-1,70 (m, 6H), 1,61-1,18 (m, 19H), 0,89 (s, 12H) , 0,04 (s, 6H).
Стадия 3. Получение соединения C14. К раствору C13 (7 г, 16,1 ммоль) в 70 мл MeOH добавляли раствор HBr (6,5 г, 32,2 ммоль, 40% в воде). Реакционную смесь перемешивали при 25°C в течение 0,7 ч. После того, как ТСХ (PE:EtOAc = 3:1) показала, что исходный материал был полностью израсходован, реакционную смесь гасили насыщенным водным раствором NaHCO3(200 мл) и экстрагировали 500 мл EtOAc, промывали солевым раствором (100 мл) и концентрировали с получением продукта C14 (5,6 г, неочищенный продукт) в форме белого твердого вещества.
Стадия 4. Получение соединения C15. К раствору PPh3EtBr (51,8 г, 140 ммоль) в ТГФ (40 мл) добавляли раствор t-BuOK (15,7 г, 140 ммоль) в ТГФ (40 мл) при 0°C. После перемешивания при 60°C в течение 1 ч, по каплям добавляли раствор соединения C14 (9 г, 28,0 ммоль) в ТГФ (40 мл) при 60°C. Затем реакционную смесь перемешивали при той же температуре в течение 8 ч. ТСХ (PE/EtOAc = 3/1) показала окончание реакции, и был обнаружен основной продукт с более низкой полярностью. Реакционную смесь экстрагировали посредством EtOAc (300 мл) три раза. Органический слой промывали солевым раствором (100 мл), сушили над Na2SO4 и концентрировали под вакуумом с получением неочищенного продукта. Неочищенный продукт очищали колонкой с силикагелем (PE:EA=5:1) с получением соединения C15 (5,0 г, 53,5%) в форме бледно-желтого масла.1H ЯМР (400 МГц, CDCl3) δ 5,15-5,05 (m, 1H), 3,94 (d, J = 10,8Гц, 1H), 3,56 (d, J = 10,8Гц, 1H), 2,40-2,12 (m, 3H), 2,01-1,71(m, 3H), 1,69-1,12(m, 24H), 0,85(s, 3H).
Стадия 5. Получение соединения C16. К раствору C15 (500 мг, 1,50 ммоль) в ТГФ (15 мл) в колбе под защитой азотом N2 добавляли NaH (171 мг, 4,5 ммоль, 60% в масле) по частям. Реакционную смесь перемешивали в течение 10 мин. Затем добавляли йодэтан (701 мг, 4,5 ммоль). Реакционную смесь нагревали и перемешивали при 50°C в течение дополнительных 2 ч. ТСХ (PE:EA=3:1) показала окончание реакции, и был обнаружен основной продукт с более низкой полярностью. Реакционную смесь гасили водным раствором NH4Cl(10 мл), экстрагировали посредством EtOAc(20 мл x 2). Объединенные органические слои промывали водным раствором NaCl (20 мл) и сушили над Na2SO4, затем концентрировали. Остаток очищали посредством колоночной хроматографии на силикагеле (PE:EtOAc=15:1 to 8:1) с получением продукта C16 (500 мг, 91,9 % выход) в форме желтого масла.1H ЯМР (400 МГц, CDCl3) δ 5,12-5,09(m, 1H), 3,60(d, J = 9,2 Гц, 1H), 3,48-3,42(m, 2H), 3,23(d, J = 9,2 Гц, 1H), 2,38-2,12(m, 3H), 1,95-1,72(m, 3H), 1,65-1,10 (m, 26H), 0,85(s, 3H).
Стадия 6. Получение соединения C17. К раствору C16 (500 мг, 1,38 ммоль) в ТГФ (15 мл) по каплям добавляли раствор BH3-Me2S (1,38 мл, 10 M) при 0°C. Раствор перемешивали при 25°C в течение 4 ч. ТСХ (PE:EtOAc = 3:1) показала, что реакция была почти окончена, и был обнаружен основной продукт с более высокой полярностью. После охлаждения до 0°C, очень медленно добавляли NaOH (5,5 мл, 3M). После окончания добавления, медленно добавляли H2O2 (2,51 мл, 33%), и внутреннюю температуру поддерживали ниже 10°C. Полученный раствор перемешивали при 25°C в течение 2 ч. Полученный раствор экстрагировали посредством EtOAc (20 мл x 3). Объединенный органический раствор промывали насыщенным водным раствором Na2S2O3 (30 мл x 3), солевым раствором (30 мл), сушили над Na2SO4 и концентрировали под вакуумом с получением неочищенного продукта (500 мг) в форме желтого масла. Неочищенный продукт применяли на следующей стадии без дополнительной очистки.
Стадия 7. Получение соединения C18. Суспензию C17 (500 мг, 1,32 ммоль), PCC (426 мг, 1,98 ммоль) и силикагеля (469 мг, масс./масс. = 1/1,1) в ДХМ (15 мл) перемешивали при 30°C в течение 2 ч, реакционная смесь становилась коричневой. ТСХ (PE/EtOAc = 3/1) показала окончание реакции, и был обнаружен основной продукт с более низкой полярностью. Раствор фильтровали, и остаток на фильтре промывали посредством ДХМ (20 мл). Объединенный фильтрат концентрировали под вакуумом. Остаток очищали посредством колоночной хроматографии на силикагеле, проводя элюирование посредством PE/EtOAc = 15/1 to 5/1 с получением C18 (400 мг, 80,3 %) в форме белого твердого вещества. MS ESI в расчете на C24H40O3 [M+H]+ 377, обнаружено 359([M+H-18]+) .1H ЯМР (400 МГц, CDCl3) δ 3,58 (d, J = 9,2Гц, 1H), 3,49-3,42 (m, 2H), 3,24 (d, J = 9,2Гц, 1H), 2,56-2,51 (m, 1H), 2,18-1,65 (m, 12H), 1,60-1,10(m, 19H), 0,61(s, 3H).
Стадия 8. Получение соединения C19. К раствору C18 (400 мг, 1,06 ммоль) и каталитического количества концентрированной HBr (10,7 мг, 40% в воде) в MeOH (15 мл) по каплям добавляли дибром (254 мг, 1,59 ммоль) при 0°C. Реакционную смесь перемешивали при 25°C в течение 1 ч. ТСХ (PE:EtOAc = 3:1) показала окончание реакции, и был обнаружен основной продукт с более низкой полярностью. Реакцию гасили насыщенным водным раствором NaHCO3 и pH доводили до 7~8. Реакционную смесь экстрагировали посредством ДХМ (20 мл x 2). Объединенный органический слой промывали солевым раствором (20 мл), сушили над Na2SO4 и концентрировали с получением неочищенного продукта C19 (400 мг, 82,8 % выход) в форме желтого масла.
Пример 89. Получение соединения 170.
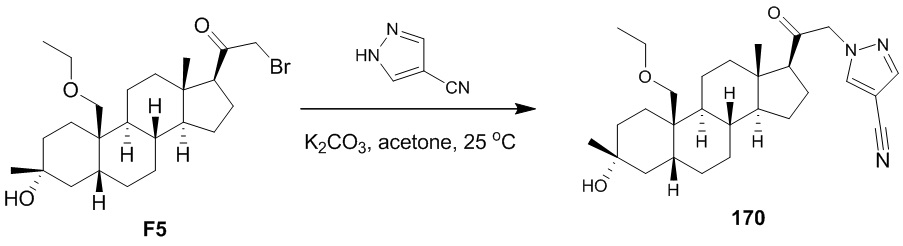
К раствору соединения F5 (150 мг, 0,329 ммоль) в ацетоне (5 мл) добавляли K2CO3 (68,1 мг, 0,493 ммоль) и 1H-пиразол-4-карбонитрил (45,8 мг, 0,493 ммоль). После перемешивания при 25°C в течение 3 ч, LCMS показала окончание реакции. Реакционную смесь фильтровали, и фильтрат концентрировали под вакуумом с получением неочищенного продукта (150 мг). Неочищенный продукт очищали посредством препаративной ВЭЖХ (HCl) с получением необходимого продукта 170 (13 мг, 8,41%) в форме белого твердого вещества.
1H ЯМР (170) (выход 8,4%): (400 МГц, CDCl3) δ 7,86(s,1H), 7,81 (s, 1H), 5,03-4,87 (m, 2H), 3,54(d, J = 9,2Гц, 1H), 3,68-3,41(m, 2H), 3,24 (d, J = 9,2Гц,1H), 2,59 (t, J = 9,2Гц, 1H), 2,21-1,15 (m, 29H), 0,65 (s, 3H). LCMS tR = 0,949 мин в 1,5 мин хроматографии, 5-95AB, чистота 98,6%, MS ESI в расчете на C28H42N3O3 [M+H]+ 467, обнаружено 450[M+H-18]+.
Пример 90. Альтернативное получение соединения A21.

Стадия 1. Получение соединения E16. К раствору ((5S,8R,9S,10R,13S,14S)-13-метил-3,17-диоксогексадекагидро-1H-циклопента[a]фенантрен-10-ил)метил ацетата (E4, 5 г, 14,4 ммоль) в ТГФ (50 мл) по каплям добавляли MeMgBr (15 мл, 3M в эфире, 450 ммоль), чтобы контролировать внутреннюю температуру ниже -70°C. Затем смесь перемешивали в течение 1 часа при -78°C. ТСХ показала окончание реакции. К смеси добавляли раствор NH4Cl (6 г) в воде (30 мл), и внутреннюю температуру повышали до -20°C. Затем смесь нагревали до 20°C. Органический слой отделяли. Водную фазу экстрагировали посредством EtOAc (50 мл). Объединенный органический слой сушили над Na2SO4, концентрировали под вакуумом и очищали колоночной хроматографией (PE: EtOAc =6:от 1 до 3:1) с получением ((3R,5S,8R,9S,10R,13S,14S) -3-гидрокси-3,13-диметил-17-оксогексадекагидро-1H-циклопента[a]фенантрен-10-ил)метил ацетата (E16, 2,4 г, 46%) и ((3S,5S,8R,9S,10R,13S,14S)-3-гидрокси-3,13-диметил-17-оксогексадекагидро-1H-циклопента[a]фенантрен-10-ил)метил ацетата (1 г, 19%) в форме белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 4,29 (d, J = 12,1 Гц, 1H), 4,13 (d, J = 12,1 Гц, 1H), 2,48-2,35 (m, 1H), 2,11-1,85 (m, 7H), 1,85-1,59 (m, 6H), 1,55-1,22 (m, 11H), 1,09 - 0,74 (m, 7H).
Стадия 2. Получение соединения E17. К суспензии PPh3EtBr (4,61 г, 12,4 ммоль) в ТГФ (10 мл) добавляли раствор t-BuOK (1,86 г, 16,6 ммоль) в ТГФ (20 мл) при 20°C. Цвет суспензии становился темно-красным. После перемешивания при 60°C в течение 1 ч, по каплям добавляли раствор ((3R,5S,8R,9S,10R,13S,14S) -3-гидрокси-3,13-диметил-17-оксогексадекагидро-1H-циклопента[a]фенантрен-10-ил)метил ацетата (E16, 1,5 г, 4,14 ммоль) в ТГФ (20 мл) при 60°C. Затем реакционную смесь перемешивали при 60°C в течение 16 ч. ТСХ показала окончание реакции. К реакционной смеси добавляли NH4Cl (50 мл, насыщенный водный раствор). Цвет смеси становился светло-желтым. Органический слой разделяли. Водную фазу экстрагировали посредством EtOAc (50 мл). Объединенный органический слой концентрировали под вакуумом, очищали посредством колоночной хроматографии на силикагеле (PE: EtOAc =10:1 to 4:1) с получением (3R,5S,8S,9S,10R,13S,14S)-17-этилиден-10-(гидроксиметил)-3,13-диметилгексадекагидро-1H-циклопента[a]фенантрен-3-ола (E17, 1,0 г, 72,6%) в форме белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 5,19-5,08 (m, 1H), 3,93 (d, J = 11,5 Гц, 1H), 3,74 (d, J = 11,5 Гц, 1H), 2,44-2,33 (m, 1H), 2,32-2,13 (m, 2H), 2,12-2,04 (m, 1H), 1,87 - 1,71 (m, 2H), 1,69 - 1,43 (m, 12H), 1,38 - 1,08 (m, 11H), 1,07 - 0,74 (m, 6H)
Стадия 3. Получение соединения A18. К раствору E17 (0,8 г, 2,4 ммоль) в ТГФ (10 мл) по частям добавляли гидрид натрия (475 мг, 11,9 ммоль) и йодэтан (1,85 г, 11,9 ммоль). Смесь перемешивали при 50°C в течение 12 часов. Реакционную смесь гасили водой, экстрагировали посредством EtOAc (10 мл * 2). Объединенный органический слой сушили над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали посредством колоночной хроматографии на силикагеле (PE:EA = 50:1) с получением A18 (0,5 г, 57,5%) в форме бесцветного масла.1H ЯМР (400 МГц, CDCl3) δ 5,13-5,08 (m, 1H), 3,52 (d, J = 9,6 Гц, 1H), 3,43-3,38 (m, 3H), 2,38-2,32 (m, 1H), 2,25-2,12 (m, 2H), 2,06-2,01 (m, 1H), 1,74-1,57 (m, 2H), 1,56-1,39 (m, 6H), 1,31-1,27 (m, 2H), 1,24-1,16 (m, 11H), 1,14-1,07 (m, 2H), 1,05-0,91 (m, 2H), 0,88 (s, 3H), 0,87-0,74 (m, 3H).
Стадия 4. Получение соединения A19. К раствору A18 (0,5 г, 1,38 ммоль) в ТГФ (5 мл) при 0°C по каплям добавляли BH3-Me2S (0,69 мл, 6,9 ммоль). Раствор перемешивали при 30°C в течение 2 ч. ТСХ (PE/EtOAc = 5/1) показала окончание реакции. После охлаждения до 0°C, очень медленно добавляли водный раствор NaOH (5,51 г, 10% в воде). После окончания добавления, медленно добавляли H2O2 (1,56 г, 30%), и внутреннюю температуру поддерживали ниже 10°C. Полученный раствор перемешивали при комнатной температуре в течение 1 ч. Образовывалось белое твердое вещество. К смеси добавляли EtOAc (5 мл) и фильтровали. Остаток на фильтре промывали посредством EtOAc (5 мл). Объединенный органический слой отделяли, промывали посредством Na2S2O3 (5 мл, 20%, водн.), сушили над Na2SO4 и концентрировали под вакуумом с получением A19 (0,4 г, чистота: 78%, выход: 59,7%) в форме бесцветного масла, которое непосредственно применяли без дополнительной очистки. LCMS tR = 1,085 мин в 2 мин хроматографии, 30-90AB, чистота 77,6%, MS ESI в расчете на C24H42O3 [M+H]+379, обнаружено 361 ([M+H-18]+).
Стадия 5. Получение соединения A20. К раствору A19 (0,4 г, 0,824 ммоль, чистота: 78%) в дихлорметане (5 мл) добавляли силикагель (1 г) и PCC (0,885 г, 4,11 ммоль). Суспензию перемешивали при 30°C в течение 16 часов. ТСХ (PE:EA = 5:1) показала, что реакция была полностью окончена. Реакционную смесь фильтровали, и фильтрат концентрировали. Остаток очищали посредством колоночной хроматографии на силикагеле (PE:EA=10:1) с получением A20 (0,2 г, 64,4%) в форме светло-желтого масла.1H ЯМР (400 МГц, CDCl3) δ 3,50 (d, J = 10,0 Гц, 1H), 3,42-3,37 (m, 3H), 2,53 (t, J = 8,8 Гц, 1H), 2,20-2,15 (m, 1H), 2,11 (s, 3H), 2,07-1,97 (m, 2H), 1,73-1,64 (m, 4H), 1,50-1,47 (m, 2H), 1,37-1,25 (m, 6H), 1,21- 1,14 (m, 9H), 1,12-0,75 (m, 5H), 0,61 (s, 3H). LCMS tR = 1,124 мин в 2 мин хроматографии, 30-90AB, чистота 100%, MS ESI в расчете на C24H40O3 [M+H]+377, обнаружено 359 ([M+H-18]+).
Стадия 6. Получение соединения A21. К раствору A20 (0,2 г, 0,531 ммоль) в метаноле (2 мл) добавляли HBr (8,93 мг, 0,053 ммоль, 48% в воде) и Br2 (127 мг, 0,796 ммоль). Смесь перемешивали при 30°C в течение 2 часов. Реакционную смесь гасили водным раствором NaHCO3, чтобы довести рН примерно до 8. Смесь выливали в воду (10 мл) и экстрагировали EtOAc (10 мл * 2). Объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением A21 (0,2 г, 82,6%) в форме светло-желтого твердого вещества, которое применяли без дополнительной очистки. LCMS tR = 1,184 мин в 2 мин хроматографии, 30-90AB, чистота 100%, MS ESI в расчете на C24H39BrO3 [M+H]+455, обнаружено 437 ([M+H-18]+).
Пример 91. Получение соединения 171.
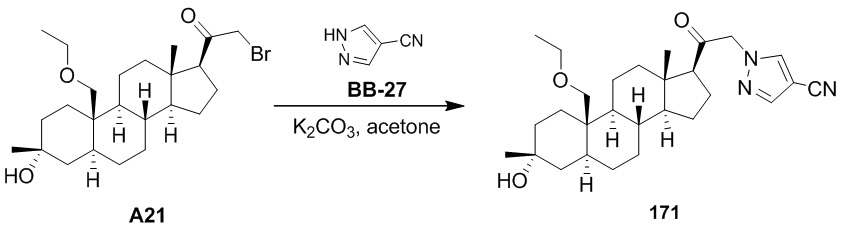
К раствору A21 (90 мг, 0,197 ммоль) в ацетоне (2 мл) добавляли карбонат калия (67,9 мг, 0,492 ммоль) и 1H-пиразол-4-карбонитрил (27,4 мг, 0,295 ммоль). Суспензию перемешивали при 40°C в течение 12 часов. Реакционную смесь охлаждали и фильтровали, и фильтрат концентрировали. Остаток очищали посредством препаративной ВЭЖХ с получением 171 (22 мг, 23,8%) в форме белого твердого вещества.1H ЯМР (400 МГц, CDCl3) δ 7,85 (s, 1H), 7,81 (s, 1H), 5,02 (d, J = 18,0 Гц, 1H), 4,89 (m, J = 18,0 Гц, 1H), 3,51 (d, J = 9,2 Гц, 1H), 3,42-3,37 (m, 3H), 2,60 (t, J = 9,2 Гц, 1H), 2,25-2,17 (m, 1H), 2,06-1,99 (m, 2H), 1,75-1,69 (m, 4H), 1,54-1,50 (m, 3H), 1,46-0,81 (m, 19H), 0,67 (s, 3H). LCMS tR = 1,109 мин в 2 мин хроматографии, 30-90AB, чистота 100%, MS ESI в расчете на C28H41N3O3 [M+H]+468, обнаружено 490 ([M+Na]+).
Пример 92. Получение соединений 172 и 173.

К раствору 2-бром-1-((3R,5S,8S,9S,10R,13S,14S,17S)-10-(этоксиметил)-3-гидрокси- 3,13-диметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона (90 мг, 0,197 ммоль) в ацетоне (2 мл) добавляли карбонат калия (67,9 мг, 0,492 ммоль) и 4,5-дифтор-2H-бензо[d][1,2,3]триазол (45,7 мг, 0,295 ммоль). Смесь перемешивали при 50°C в течение 16 часов. Смесь охлаждали, фильтровали и концентрировали. Остаток очищали посредством препаративной ВЭЖХ с получением 2-(4,5-дифтор-2H-бензо[d][1,2,3]триазол-2-ил)-1-((3R,5S, 8S,9S,10R,13S,14S,17S)-10-(этоксиметил)-3-гидрокси-3,13-диметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона (172, 10 мг, 9,28%, чистота: 97%) в форме светло-желтого твердого вещества и 2-(4,5-дифтор-1H-бензо[d][1,2,3]триазол-1-ил)-1-((3R,5S,8S,9S,10R,13S, 14S,17S)-10-(этоксиметил)-3-гидрокси-3,13-диметилгексадекагидро-1H-циклопента[a]фенантрен-17-ил)этанона (173, 15 мг, 14,0%, чистота: 98%) в форме светло-желтого твердого вещества.
1H ЯМР (172): (400 МГц, CDCl3) δ 7,63 (dd, J = 3,2 Гц, 8,8 Гц, 1H), 7,31-7,24 (m, 2H), 5,57-5,46 (m, 2H), 3,53 (d, J = 9,6 Гц, 1H), 3,43-3,40 (m, 3H), 2,66 (t, J = 8,8 Гц, 1H), 2,27-2,03 (m, 3H), 1,79-1,69 (m, 4H), 1,65-1,57 (m, 4H), 1,32-1,26 (m, 6H), 1,22-1,12 (m, 8H), 1,09-0,82 (m, 4H), 0,76 (s, 3H). LCMS tR = 1,066 мин в 1,5 мин хроматографии, 5-95AB, чистота 97%, MS ESI в расчете на C30H42F2N3O3 [M+H]+ 530, обнаружено 512([M+H-18]+).
1H ЯМР (173): (400 МГц, CDCl3) δ 7,40-7,33 (m, 1H), 7,05 (d, J = 7,2 Гц, 1H), 5,46-5,35 (m, 2H), 3,52 (d, J = 10,0 Гц, 1H), 3,43-3,38 (m, 3H), 2,71 (t, J = 8,4 Гц, 1H), 2,24-2,03 (m, 3H), 1,75-1,69 (m, 4H), 1,62-1,53 (m, 4H), 1,32-1,16 (m, 14H), 1,13-0,83 (m, 4H), 0,72 (s, 3H). LCMS tR = 1,037 мин в 1,5 мин хроматографии, 5-95AB, чистота 98%, MS ESI в расчете на C30H42F2N3O3 [M+H]+ 530, обнаружено 530([M+H]+).
[223] Методы анализа
Соединения, предложенные в настоящем документе, можно оценить с применением различных анализов; примеры которых описаны ниже.
Ингибирование связывания TBPS стероидами
[224] Описаны анализы связывания TBPS с применением кортикальных мембран головного мозга крыс в присутствии 5 мкМ ГАМК (Gee et al, J. Pharmacol. Exp. Ther. 1987, 241, 346-353; Hawkinson et al, Mol. Pharmacol. 1994, 46, 977-985; Lewin, A.H et al., Mol. Pharmacol. 1989, 35, 189-194).
[225] Вкратце, кору быстро удаляли после обезглавливания крыс линии Спраг-Доули под анестезией диоксидом углерода (200-250 г). Кору гомогенизировали в 10 объемах ледяного 0,32 M раствора сахарозы с применением стеклянного/тефлонового гомогенизатора и центрифугировали при 1500 x g в течение 10 мин при 4°C. Полученные супернатанты центрифугировали при 10000 x g в течение 20 мин при 4°C с получением пеллет P2. Пеллеты P2 ресуспендировали в 200 мМ NaCl/50 мМ Na-K фосфатном буфере pH 7,4 и центрифугировали при 10000 x g в течение 10 мин при 4°C. Данную процедуру промывки повторяли дважды, и пеллеты ресуспендировали в 10 объемах буфера. Аликвоты (100 мкл) суспензий мембран инкубировали с 3 нМ [35S]-TBPS, и 5 мкл аликвоты тестируемого лекарственного средства растворяли в диметилсульфоксиде (ДМСО) (конечная 0,5%) в присутствии 5 мкМ ГАМК. Инкубирование приводили к конечному объему 1,0 мл буфером. Неспецифическое связывание определяли в присутствии 2 мкМ немеченого TBPS и в диапазоне от 15 до 25 %. Через 90 мин инкубирования при комнатной температуре, анализ прекращали посредством фильтрации через стекловолоконные фильтры (Schleicher и Schuell No. 32) с применением сборщика клеток (Brandel), и трижды промывали ледяным буфером. Радиоактивность, задержанную на фильтре, определяли посредством жидкостно-сцинтилляционной спектрометрии. Нелинейную аппроксимацию кривой по общим данным для каждого лекарственного средства, усредненным для каждой концентрации, выполняли с применением Prism (GraphPad). Данные соответствовали частичной, а не полной модели ингибирования, если сумма квадратов значительно ниже по критерию F. Аналогичным образом, данные соответствовали двухкомпонентной вместо однокомпонентной модели ингибирования, если сумма квадратов значительно ниже по критерию F. Концентрацию тестируемого соединения, вызывающую 50% ингибирование (IC50) специфического связывания и максимальную степень ингибирования (Imax), определяли для отдельных экспериментов с той же моделью, используемой для общих данных, и затем рассчитывали средние величины ± стандартная ошибка среднего отдельных экспериментов. В качестве положительного контроля для этих исследований служил пикротоксин для сильного ингибирования связывания TBPS, как это было продемонстрировано.
[226] Различные соединения подвергают можно подвергать скринингу для определения их активности в качестве модуляторов связывания [35S]-TBPS in vitro. Эти анализы выполняют или можно выполнять в соответствии с описанными выше процедурами.
[227] Для Таблицы 1, «A» показывает IC50< 10 нМ, «B» показывает IC50 от10 нМ до 50 нМ, «C» показывает IC50> от 50 нМ до 100 нМ, «D» показывает IC50> от 100 нМ до 500 нМ и «E» показывает IC50> 500 нМ.
Таблица 1.
Электрофизиология фиксации потенциала рекомбинантных рецепторов ГАМКA α1β2γ2 и α4β3δ
[228] Электрофизиологию клетки применяли для измерения фармакологических свойство наших модуляторов рецептора ГАМКA в гетерологичных клеточных системах. Каждое соединение тестировали на его способность влиять на ГАМК-опосредованные токи при субмаксимальной дозе агониста (ГАМК EC20 = 2 мкМ). Клетки LTK стабильно трансфицировали субъединицами α1β2γ2рецептора ГАМК, и клетки CHO временно трансфицировали субъединицами α4β3δ липофектаминовым способом. Клетки переносили со степенью смыкания монослоя примерно 50-80%, и затем и высевали на 35 мм стерильные чашки для культивирования, содержащие 2 мл полной среды культивирования без антибиотиков или антимикотиков. Сливающиеся кластеры клеток соединяли электрически (Pritchett et al., Science , 1988, 242, 1306-1308.). Из-за того, что для удаленных клеток ответы не соответствуют фиксации напряжения и из-за неопределенности в отношении степени сцепления (Verdoorn et al., Neuron 1990, 4, 919-928), клетки культивировали при плотности, которая дает возможность записи отдельных клеток (без видимого соединения с другими клетками).
[229] Токи целых слеток измеряли с помощью усилителей HEKA EPC-10 с применением программного обеспечения PatchMaster или с применением платформы QPatch с высокой пропускной способностью (Sophion). Омывающий раствор для всех экспериментов содержал (в мМ): NaCl 137 мМ, KCl 4 мМ, CaCl2 1,8 мМ, MgCl2 1 мМ, HEPES 10 мМ, D-глюкозу 10 мМ, pH (NaOH) 7,4. В некоторых случаях также добавляли 0,005% кремофора. Внутриклеточный (пипетка) раствор содержал: KCl 130 мМ, MgCl2 1 мМ, Mg-ATP 5 мМ, HEPES 10 мМ, EGTA 5 мМ, pH 7,2. В течение эксперимента клетки и растворы выдерживали при комнатной температуре (19°C - 30°C). Для ручной записи фиксации потенциала, чашки для культивирования клеток помещали в держатель чашек микроскопа и непрерывно омывали (1 мл/мин) омывающим раствором. После формирования гигаомного контакта между контактными электродами и клеткой (диапазон сопротивления пипетки: 2,5 МОм - 6,0 МОм; диапазон сопротивления уплотнения:> 1 ГОм), клеточную мембрану разрывали концом пипетки для обеспечения электрического доступа к содержимому клетки (цельноклеточная очаговая конфигурация). Для экспериментов с применением QPatch системы клетки переносили в форме суспензии в систему QPatch в омывающий раствор и осуществляли автоматическую запись целых клеток.
[230] Напряжение клеток фиксировали при удерживании потенциала -80 мВ. Для анализа тестируемых образцов рецепторы ГАМК стимулировали посредством 2 мкМ ГАМК после последовательного предварительного инкубирования возрастающих концентраций тестируемых образцов. Продолжительность предварительного инкубирования составляла 30 с, и продолжительность стимула ГАМК составляла 2 с. Тестируемые образцы растворяли в ДМСО с получением базового раствора (10 мМ). Тестируемые образцы разбавляли до 0,01, 0,1, 1 и 10 мкМ в омывающем растворе. Все концентрации тестируемых образцов тестировали на каждой клетке. Относительное процентное потенцирование определяли как пиковую амплитуду в ответ на ГАМК EC20 в присутствии тестируемого образца, деленную на пиковую амплитуду в ответ только на ГАМК EC20, умноженную на 100.
Таблица 2.
Электрофизиологическая оценка примерных соединений на ГАМКA-R.
Для Tаблицы 2. Эффективность рецепторов ГАМКA α1β2γ2 и α4β3δ %: “A” 10-100, “B” >100-500, “C” >500; D показывает, что данные недоступны или не были определены.
Потенцирование рецептора ГАМК
[231] Для исследования эффектов соединений в концентрации 10 мкМ на рецепторы ГАМКA, составленные из α1β2γ2 или α4β3δ субъединиц, экспрессируемых в ооцитах из Xenopus laevis, применяли двухэлектронную технику фиксации напряжения (TEVC). Токи, вызванные ГАМК, записывали из ооцитов, которые экспрессировали рецепторы ГАМК, и исследовали модулирующие эффекты тестируемых образцов на данные токи.
[232] Яичники получали из женских особей Xenopus Laevis под глубокой анестезией посредством охлаждения до 4°C и погружения в трикаин метансульфонат (MS-222 в концентрации 150 мг/л) в бикарбонате натрия (300 мг/л). После анестезии животных обезглавливали и прокалывали спинной мозг согласно правилам прав животных Женевского кантона. Маленький кусок яичника изолировали для немедленного препарирования, в то время как оставшуюся часть помещали при 4°C в стерильный раствор Барта, содержащий в мМ NaCl 88, KCl 1, NaHCO32,4, HEPES 10, MgSO4,7H2O 0,82, Ca(NO3)2,4H2O 0,33, CaCl2,6H2O 0,41, при pH 7,4 и дополненный 20 мкг/мл канамицина, 100 единиц/мл пенициллина и 100 мкг/мл стрептомицина. Все записи осуществляли при 18°C, и клетки поливали средой, содержащей в мМ: NaCl 82,5, KCl 2,5, HEPES 5, CaCl2,2H2O,.6H2O 1, pH 7,4.
[233] Плазмиды, содержащие РНК человека GABRA1/GABRB2/GABRG2 и GABRA4/GABRB3/GABRD генов вводили в ооциты с применением патентованного автоматизированного устройства для инъекций (Hogg et al., J. Neurosci. Methods, (2008) 169: 65-75). Данные гены кодируют субъединицы α1β2γ2 и α4β3δ ГАМКA соответственно. Экспрессию рецептора оценивали с помощью электрофизиологии по меньшей мере два дня спустя. Отношение инъекции РНК для α1β2γ2 составляло 1:1:1, и для α4β3δ составляло 5:1:5. Электрофизиологические записи осуществляли с использованием автоматизированного способа при оборудовании стандартными TEVC, и данные получали и анализировали с использованием патентованного программного обеспечения для сбора и анализа данных, работающего под Matlab (Mathworks Inc.). Мембранный потенциал ооцитов поддерживали при -80mV в течение эксперимента. Для того, чтобы исследовать влияние патентованных соединений, токи вызывали посредством применения 10 мкМ (α1β2γ2) или 3 мкМ (α4β3δ) ГАМК в течение 30 секунд. Данные концентрации приближены к концентрации ЕС50 ГАМК для каждого подтипа рецептора. Затем ооциты вновь подвергали воздействию ГАМК в течение 30 с. Через 15 с после начала применения ГАМК, тестируемые образцы совместно применяли в концентрации 10 мкМ для 15 с. Оценивали потенцирование пикового тока. Данные фильтровали при 10 Гц, снимали при 100 Гц и анализировали с применением программного обеспечения для сбора и анализа данных, работающего под Matlab (Mathworks Inc.). Для статистического анализа величины обрабатывали с помощью Excel (Microsoft) или Matlab (mathworks Inc.). Для получения средних измерений со стандартными отклонениями все эксперименты проводили с применением по меньшей мере трех клеток.
[234] ГАМК готовили в форме концентрированного базового раствора (10-1M) в воде, затем разводили в среде для записи с получением необходимой для тестирования концентрации. Соединения получали в форме базового раствора (10-2M) в ДМСО, и затем разводили в среде для записи с получением необходимой для тестирования концентрации. Остаточный ДМСО не превышал концентрации 1%, которая, как было показано, не влияет на функцию ооцитов Xenopus.
Таблица 3. Электрофизиологическая оценка примерных соединений на ГАМКA-R.
Для Таблицы 3. Эффективность рецепторов ГАМКA α1β2γ2 и α4β3δ %: “A” 50-500, “B” >500-1000, “C” >1000-1500, “D” >1500-2000; “E” >2000.
Реферат
Изобретение относится к соединению формулы (), в которой A представляет собой 5-членный гетероарил с 2-4 атомами азота, 5,6-бициклический гетероарил с 2-4 атомами азота или 6-членный гетероциклил с 2 гетероатомами, независимо выбранными из азота и кислорода, где A присоединен через азот и необязательно замещен 1-4 заместителями, каждый из которых независимо выбран из циано, галогена, C-C-алкила, C-C-галогеналкила, C-C-алкокси, -OC-C-галогеналкила, -C(O)R, -C(O)ORи -S(O)2R; каждый Ra представляет собой C-C-алкил; L представляет собой –C(R)(R)–; Rпредставляет собой водород или C-Cалкил; Rпредставляет собой водород, C-Cалкил или C-Cгалогеналкил; каждый Rпредставляет собой водород; Rпредставляет собой водород; ипредставляет собой одинарную связь. Изобретение также относится к применению соединения формулы (). Технический результат: получены новые соединения формулы (), обладающие модулирующей ГАМК активностью. 2 н. и 36 з. п. ф-лы, 3 табл., 92 пр.().
Формула









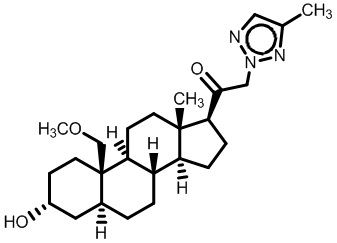
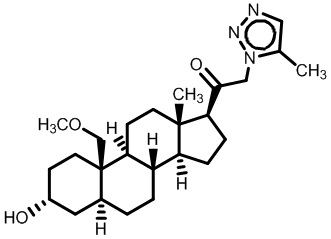
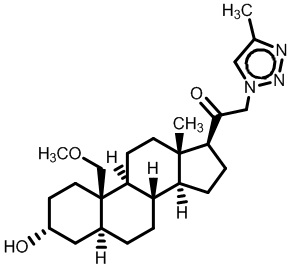













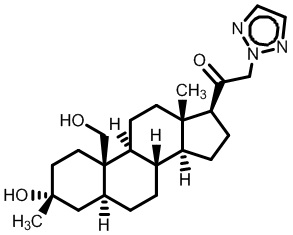












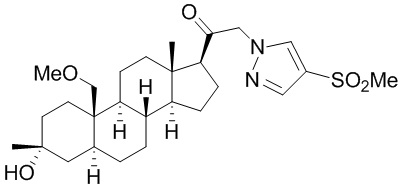



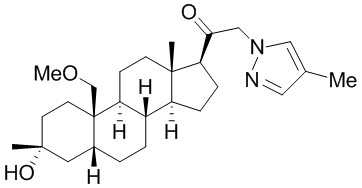













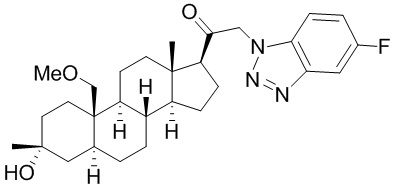


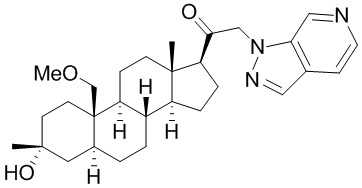




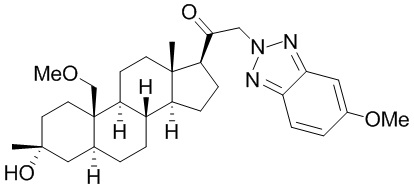


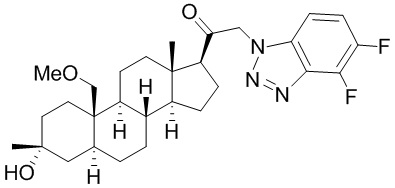



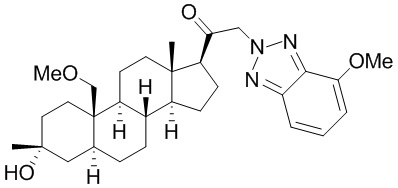

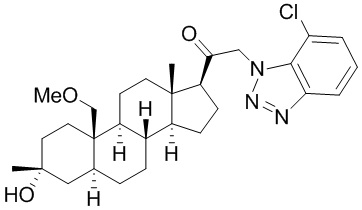


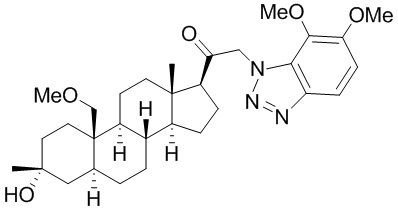




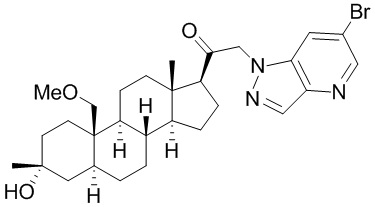

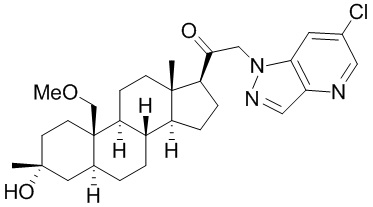

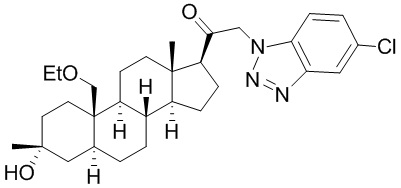






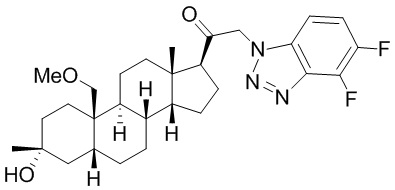




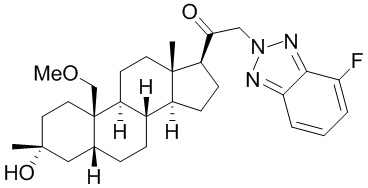







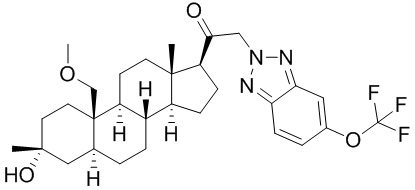







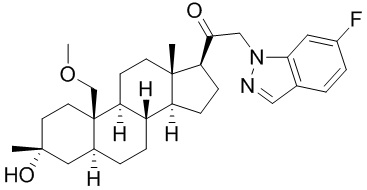

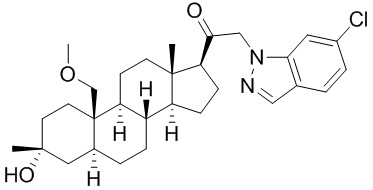





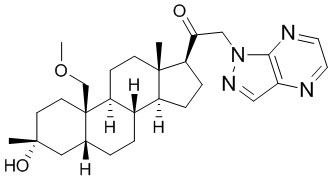






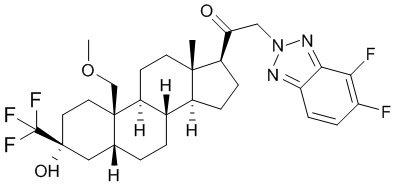





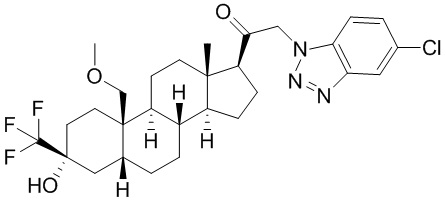






Документы, цитированные в отчёте о поиске
3альфа-гидрокси-3бета-метоксиметил-21-гетероцикл-замещенные стероиды, фармацевтическая композиция, способ облегчения или профилактики бессонницы или погружения в наркоз
Нейроактивные стероиды, фармацевтический препарат, способ лечения или профилактики различных нарушений, способ индукции сна и способ индукции анестезии с их использованием, способ модулирования комплекса рецептор гамкa-хлоридный ионофор




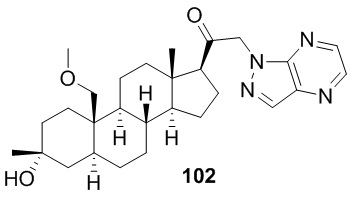








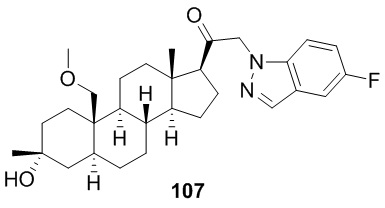





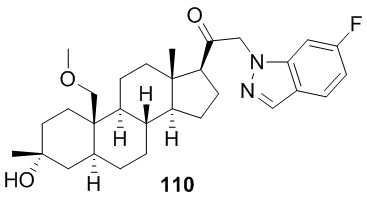


















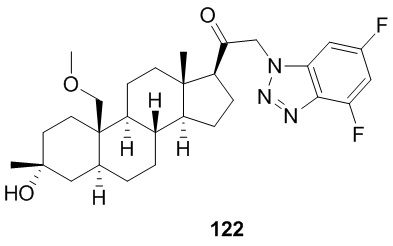






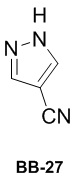
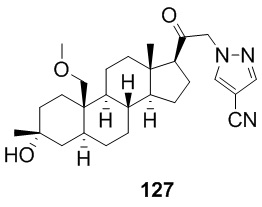

Комментарии