Способ ферментации низкомолекулярного сахара - RU2658778C2
Код документа: RU2658778C2
Чертежи



















































Описание
Все патенты, патентные заявки и публикации, на которые в настоящем документе приводятся ссылки или которые прилагаются к настоящему документу в виде приложений A-E, полностью включены в настоящий документ в качестве ссылок.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к переработке биомассы и к продуктам, полученным из нее.
УРОВЕНЬ ТЕХНИКИ
Различные углеводы, такие как целлюлозные и лигноцеллюлозные материалы, например, в волокнистой форме, производят, перерабатывают и используют в больших количествах во многих областях применения. Часто такие материалы используют однократно, а затем выбрасывают в качестве отходов или просто считают отходами, например, сточные воды, жмых, древесные опилки и солома.
Различные целлюлозные и лигноцеллюлозные материалы, их использование и области применения описаны в патентах США №№ 7307108, 7074918, 6448307, 6258876, 6207729, 5973035 и 5952105; и в различных патентных заявках США, включая "FIBROUS MATERIALS AND COMPOSITES", PCT/US2006/010648, поданную 23 марта 2006 года, и "FIBROUS MATERIALS AND COMPOSITES", публикацию патентной заявки США № 2007/0045456.
Поскольку целлюлозные и лигноцеллюлозные материалы широко доступны, а отходы целлюлозных и лигноцеллюлозных материалов требуют утилизации, было бы выгодно найти таким материалам хорошее применение. Рассматривается применение целлюлозных и лигноцеллюлозных материалов для получения биотоплив, таких как этанол, однако это пока еще не осуществлено коммерчески в большом масштабе.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Главным образом, в настоящем документе описаны углеводсодержащие материалы (например, материал биомассы или получаемые из биомассы материалы), например, крахмальные материалы, целлюлозные материалы, лигноцеллюлозные материалы или материал биомассы, которые представляют собой низкомолекулярные сахара (например, моносахариды, дисахариды или трисахариды) или включают их значительные количества, и способы получения и переработки таких материалов для изменения их структуры, например, для функционализации этих материалов одним или несколькими желаемыми типами и количествами функциональных групп. Также описаны продукты, получаемые из структурно измененных материалов. Например, многие из способов, описанных в настоящем документе, могут обеспечить целлюлозные и/или лигноцеллюлозные материалы, которые имеют более низкую молекулярную массу и/или кристалличность относительно исходного материала. Многие из способов, описанных в настоящем документе, обеспечивают материалы, которые могут более легко утилизироваться различными микроорганизмами, продуцируя полезные продукты, такие как водород, спирты (например, этанол или бутанол), органические кислоты (например, уксусную кислоту), углеводороды, сопродукты (например, белки) или смеси любых из них.
В некоторых случаях функционализированная биомасса является более растворимой и легче утилизируемой микроорганизмами по сравнению с биомассой, которая не является функционализированной. Кроме того, многие из функционализированных материалов, описанных в настоящем документе, менее подвержены окислению и могут иметь улучшенную долгосрочную стабильность (например, окисление на воздухе в условиях окружающей среды). Многие из полученных продуктов, такие как этанол или н-бутанол, можно использовать в качестве топлива для энергоснабжения автомобилей, грузовых автомобилей, тракторов, кораблей или поездов, например, в качестве топлива для двигателей внутреннего сгорания или в качестве сырья для топливного элемента. Многие из полученных продуктов также можно использовать для энергоснабжения воздушных судов, таких как самолеты, например, имеющие реактивные двигатели, или вертолеты. Кроме того, продукты, описанные в настоящем документе, можно использовать для генерирования электрической энергии, например, в общепринятых парогенераторных установках или в установках на основе топливных элементов.
Другой аспект изобретения вытекает из понимания того, что добавление биомассы, такой как функционализированный целлюлозный или лигноцеллюлозный материал, к смеси, включающей низкомолекулярный сахар, может способствовать конверсии низкомолекулярного сахара в такой продукт, как сгораемое топливо, такое как этанол. Авторами изобретения выявлено, что включение биомассы в смесь с низкомолекулярным сахаром, растворителем или системой растворителей и микроорганизмом значительно повышает выход продукта, получаемого путем конверсии сахара, например спирта, такого как этанол, в некоторых случаях, без значительной конверсии или истощения самой биомассы. Включение биомассы также может предотвратить неполную, медленную или "застрявшую" конверсию продукта, например, путем ферментации.
Биомасса может сама по себе не конвертироваться в продукт (такой как этанол), или она может частично или полностью конвертироваться в продукт вместе с низкомолекулярным сахаром.
В случаях, когда биомасса частично конвертируется, площадь поверхности и пористость биомассы увеличиваются относительно площади поверхности и пористости исходной биомассы, что может эффективно повысить скорость конверсии низкомолекулярного сахара в продукт.
В некоторых случаях биомасса может представлять собой остатки целлюлозного или лигноцеллюлозного материала, подвергнутого осахариванию, например, лигнин и/или другие материалы, которые остаются после конвертирования целлюлозы в сахар.
Таким образом, в одном аспекте изобретение относится к способу, который включает конвертирование низкомолекулярного сахара или материала, который включает низкомолекулярный сахар, в смеси с биомассой, микроорганизмом и растворителем или системой растворителей, например, водой или смесью воды и органического растворителя, в продукт, например, отличный от сахара. Примеры растворителей или систем растворителей включают воду, гексан, гексадиен, глицерин, хлороформ, толуол, этилацетат, петролейный эфир, сжиженный нефтяной газ (LPG), ионные жидкости и их смеси. Растворитель или система растворителей могут быть в форме одной фазы или двух или более фаз. Биомасса может быть, например, в волокнистой форме.
В некоторых случаях наличие материала биомассы (например, обработанного любым способом, описанным в настоящем документе, или необработанного), присутствующего в процессе производства продукта, такого как этанол, может повысить скорость получения продукта. Без связи с какой-либо конкретной теорией полагают, что наличие присутствующего твердого вещества, такого как твердое вещество с большой площадью поверхности и/или высокой пористостью, может повысить скорости реакции путем увеличения эффективной концентрации растворенных веществ и предоставления субстрата, на котором может протекать реакция.
Например, облученный или необлученный материал биомассы, например, бумажное волокно, можно добавлять в процесс ферментации, например в процессе ферментации кукуруза-этанол или ферментации экстракта сахарного тростника, для повышения скорости продукции на 10, 15, 20, 30, 40, 50, 75, 100% или более, например, на 150%. Материал биомассы может иметь большую площадь поверхности, высокую пористость и/или низкую объемную плотность. В некоторых вариантах осуществления биомасса присутствует в смеси в количестве от приблизительно 0,5% до приблизительно 50 масс.%, таком как от приблизительно 1 масс.% до приблизительно 25 масс.% или от приблизительно 2 масс.% до приблизительно 12,5 масс.%. В других вариантах осуществления биомасса присутствует в количествах более чем приблизительно 0,5 масс.%, например, более чем приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9 или даже более чем приблизительно 10 масс.%. Например, в некоторых вариантах осуществления в процесс ферментации низкомолекулярного сахара может быть добавлен окисленный, обработанный ультразвуком, подвергнутый паровому взрыву и/или подвергнутый пиролизу материал биомассы, такой как бумага или хлопковое волокно, например, для повышения скорости ферментации и выхода.
Поскольку материал биомассы сам по себе не расходуется в процессе конверсии, материал биомассы можно повторно использовать в многократных серийных процессах или его можно использовать непрерывно для производства относительно большого объема продукта.
Некоторые варианты осуществления включают один или несколько из следующих признаков.
Биомасса может содержать волокнистый материал. Конвертирование может включать предоставление микроорганизму возможности конвертировать по меньшей мере часть низкомолекулярного сахара в этанол. Например, конвертирование может включать ферментацию. Микроорганизм может включать дрожжи, например, выбранные из группы, состоящей из S. cerevisiae и P. stipitis, или бактерию, такую как Zymomonas mobilis. Конвертирование может проявлять % продуктивности по меньшей мере 140%, в некоторых случаях, по меньшей мере 170%.
Способ может дополнительно включать облучение волокнистого материала перед смешиванием, например, ионизирующим излучением, например, в общей дозе по меньшей мере 5 Мрад. Облучение можно проводить с использованием пучка частиц. Облучение можно проводить в условиях, выбранных для снижения молекулярной массы биомассы.
Биомасса может иметь объемную плотность менее чем приблизительно 0,5 г/см3. Биомасса может иметь площадь поверхности BET более чем 0,25 м2/г и/или отношение длины к диаметру по меньшей мере 5. Биомасса может иметь пористость более 50%, например, более 70%.
Способ может дополнительно включать предварительную физическую обработку биомассы, например, путем дробления или уменьшения размера биомассы путем жернового помола, механического разрезания или отрывания, измельчения на стержневой мельнице или измельчения растиранием на воздухе. Биомасса может иметь внутренние волокна, и ее можно дробить до такой степени, чтобы ее внутренние волокна были по существу обнажены.
Биомасса может представлять собой или включать целлюлозный или лигноцеллюлозный материал. Например, биомасса может быть выбрана из группы, состоящей из бумаги, бумажной продукции, бумажных отходов, древесины, прессованной древесины, древесных опилок, сельскохозяйственных отходов, сточных вод, силоса, трав, рисовой шелухи, жмыха, хлопка, джута, пеньки, льна, бамбука, сизаля, абаки, соломы, сердцевин кукурузных початков, кукурузной соломы, проса, люцерны, сена, рисовой шелухи, кокосовых волокон, хлопка, морской травы, водорослей и их смесей.
Способ может дополнительно включать воздействие на биомассу ферментативным гидролизом и, в некоторых случаях, конвертирование гидролизованного материала в продукт.
В другом аспекте изобретение относится к способу растворения целлюлозного или лигноцеллюлозного материала, включающему смешивание целлюлозного или лигноцеллюлозного материала с системой растворителей, содержащей ДМСО и соль.
Системы растворителей для целлюлозных и лигноцеллюлозных материалов включают системы ДМСО-соль. Такие системы включают, например, ДМСО в сочетании с солью лития, магния, калия, натрия или цинка. Соли лития включают LiCl, LiBr, LiI, перхлорат лития и нитрат лития. Соли магния включают нитрат магния и хлорид магния. Соли калия включают йодид и нитрат калия. Примеры солей натрия включают йодид и нитрат натрия. Примеры солей цинка включают хлорид и нитрат цинка. Любая соль может быть безводной или гидратированной. Типичные загрузки соли в ДМСО составляют от приблизительно 1 до приблизительно 50%, например, от приблизительно 2 до 25, от приблизительно 3 до 15 или от приблизительно 4 до 12,5 масс.%.
В других вариантах осуществления соль может представлять собой фторидную соль, например фторид тетрабутиламмония. Способ может дополнительно включать облучение целлюлозного или лигноцеллюлозного материала. Целлюлозный или лигноцеллюлозный материал может быть выбран из группы, состоящей из бумаги, бумажной продукции, бумажных отходов, древесины, прессованной древесины, древесных опилок, сельскохозяйственных отходов, сточных вод, силоса, трав, рисовой шелухи, жмыха, хлопка, джута, пеньки, льна, бамбука, сизаля, абаки, соломы, сердцевин кукурузных початков, кукурузной соломы, проса, люцерны, сена, рисовой шелухи, кокосовых волокон, хлопка, морской травы, водорослей и их смесей. В некоторых случаях целлюлозный или лигноцеллюлозный материал имеет объемную плотность менее чем приблизительно 0,5 г/см3 (перед добавлением в систему растворителей) и пористость по меньшей мере 50%.
В настоящем документе описаны материалы, которые включают множество сахаридных звеньев, организованных в виде молекулярной цепи, где от приблизительно 1 из каждых 2 до приблизительно 1 из каждых 250 сахаридных звеньев включают группу карбоновой кислоты или ее сложного эфира, или соли. В другом аспекте материалы включают множество таких молекулярных цепей. Например, приблизительно 1 из каждых 8, 1 из каждых 10, 1 из каждых 50 или 1 из каждых 100 сахаридных звеньев каждой цепи может включать группу карбоновой кислоты или ее сложного эфира, или соли. В некоторых вариантах осуществления сахаридные звенья могут включать 5 или 6 углеродных сахаридных звеньев. Такая цепь может иметь от приблизительно 10 до приблизительно 200 сахаридных звеньев, например, от приблизительно 10 до приблизительно 100 или от приблизительно 10 до приблизительно 50. Например, каждая цепь может включать гемицеллюлозу или целлюлозу. В некоторых вариантах осуществления каждая цепь также включает сахаридные звенья, которые включают нитрозогруппы, нитрогруппы или нитрильные группы.
В некоторых вариантах осуществления средняя молекулярная масса материалов относительно стандартов PEG может составлять от приблизительно 1000 до приблизительно 1000000, например, от 1500 до 200000 или от 2000 до 10000. Например, средняя молекулярная масса материалов относительно стандартов PEG может составлять менее чем приблизительно 10000.
В настоящем документе описаны способы изменения молекулярной и/или надмолекулярной структуры сырья биомассы, которые включают 1) облучение сырья биомассы радиационным излучением, таким как фотоны, электроны или ионы с энергией, достаточной для ионизации сырья биомассы, с созданием первого уровня радикалов, например, которые поддаются детекции с помощью спектрометра электронного спинового резонанса; 2) гашение радикалов до такой степени, чтобы радикалы были на втором более низком уровне, чем первый уровень, таком как уровень, который более не поддается детекции с помощью спектрометра электронного спинового резонанса, например, такой как уровень менее чем приблизительно 1014 спинов; и 3) переработку облученного сырья биомассы с получением продукта. Если желательно, перед облучением и/или после облучения сырье биомассы может быть подготовлено путем уменьшения одного или нескольких размеров отдельных фрагментов сырья биомассы.
В некоторых вариантах осуществления стадия переработки включает получение продукта, такого как топливо, такое как сгораемое топливо, такое как топливо для двигателей, авиационное топливо или топливо для топливного элемента, например, для генерирования электричества, путем конвертирования облученного сырья биомассы с помощью микроорганизма, способного конвертировать по меньшей мере часть, например, по меньшей мере приблизительно 1 масс.%, биомассы в продукт.
В некоторых вариантах осуществления облучение проводят на сырье биомассы при одновременном воздействии на сырье биомассы воздухом, азотом, кислородом, гелием или аргоном. В некоторых вариантах осуществления предварительная обработка может включать предварительную обработку сырья биомассы способом парового взрыва.
В некоторых вариантах осуществления способ дополнительно включает уменьшение одного или нескольких размеров отдельных фрагментов биомассы, например путем дробления, влажного или сухого измельчения, нарезания, сжатия, прессования или комбинации любого из этих способов. Например, дробление можно проводить с помощью резательного устройства с вращающимся ножом. Дробление может обеспечить получение волокон, имеющих среднее отношение длины к диаметру, превышающее 5/1 или составляющее по меньшей мере 5. В некоторых вариантах осуществления подготовленная биомасса может иметь площадь поверхности BET более 0,25 м2/г. В некоторых случаях биомасса имеет внутренние волокна, и биомассу можно дробить до такой степени, чтобы внутренние волокна биомассы были по существу обнажены. Биомассу можно дробить до такой степени, чтобы она имела объемную плотность менее чем приблизительно 0,35 г/см3.
В некоторых вариантах осуществления способ не включает гидролиз биомассы кислотой или основанием. Например, по меньшей мере приблизительно 70 масс.% биомассы могут быть негидролизованными, например, по меньшей мере 95 масс.% биомассы являются негидролизованными. В конкретных вариантах осуществления биомасса по существу не является гидролизованной.
В некоторых вариантах осуществления облучение проводят на биомассе, в которой менее чем приблизительно 25 масс.% биомассы смочено жидкостью, такой как вода. Конкретно, в некоторых вариантах осуществления осуществляют по меньшей мере один способ предварительной обработки биомассы, в котором биомассу по существу не смачивают жидкостью, такой как вода. Биомасса может иметь, например, менее чем приблизительно 5 масс.% удерживаемой воды, измеренной при 25°C и относительной влажности 50%.
В некоторых вариантах осуществления облучение проводят на биомассе, в которой менее чем приблизительно 25 масс.% биомассы находится в набухшем состоянии, причем набухшее состояние характеризуется наличием объема, превышающего более чем приблизительно на 2,5% объем в ненабухшем состоянии. В других вариантах осуществления биомассу смешивают с вызывающим набухание средством или она включает его.
В любом из способов, описанных в настоящем документе, можно применять давление. Например, облучение можно проводить на биомассе под давлением более чем приблизительно 2,5 атмосферы (0,25 МПа), например, более чем приблизительно 5 или 10 атмосфер (0,5 или 0,1 МПа).
В другом аспекте смесь включает низкомолекулярный сахар, материал биомассы и растворитель. В некоторых случаях смесь также включает микроорганизм.
Примеры сырья биомассы включают бумагу, бумажную продукцию, бумажные отходы, древесину, прессованную древесину, древесные опилки, сельскохозяйственные отходы, сточные воды, силос, травы, рисовую шелуху, жмых, хлопок, джут, пеньку, лен, бамбук, сизаль, абаку, солому, сердцевины кукурузных початков, кукурузную солому, просо, люцерну, сено, рисовую шелуху, кокосовые волокна, хлопок, синтетические целлюлозы, морскую траву, водоросли или их смеси. Биомасса может представлять собой или включать синтетический материал.
Примеры сортов топлива включают один или несколько компонентов, выбранных из водорода, спиртов и углеводородов. Например, спирты могут представлять собой этанол, н-пропанол, изопропанол, н-бутанол или их смеси.
Облучение, например, можно проводить с использованием ионизирующего излучения, такого как гамма-лучи, пучок электронов или ультрафиолетовое C-излучение, имеющее длину волны от приблизительно 100 нм до приблизительно 280 нм. Облучение можно проводить с использованием множества способов применения радиационного облучения. Ионизирующее излучение может включать излучение пучка электронов. Например, радиационное излучение можно применять в общей дозе от приблизительно 10 Мрад до приблизительно 150 Мрад, например, при уровне дозы от приблизительно 0,5 до приблизительно 10 Мрад/сутки или от 1 Мрад/с до приблизительно 10 Мрад/с. В некоторых вариантах осуществления облучение включает применение двух или более источников излучения, таких как гамма-лучи и пучок электронов.
В некоторых вариантах осуществления биомасса включает первую целлюлозу, имеющую первую среднечисленную молекулярную массу, и углеводный материал содержит вторую целлюлозу, имеющую вторую среднечисленную молекулярную массу, которая ниже, чем первая среднечисленная молекулярная масса. Например, вторая среднечисленная молекулярная масса ниже, чем первая среднечисленная молекулярная масса, более чем приблизительно в один раз. В некоторых вариантах осуществления, первая целлюлоза имеет первую кристалличность, а вторая целлюлоза имеет вторую кристалличность, более низкую, чем первая кристалличность. Например, вторая кристалличность может быть ниже, чем первая кристалличность, более чем приблизительно на 10%.
В некоторых вариантах осуществления первая целлюлоза может иметь первый уровень окисления, а вторая целлюлоза имеет второй уровень окисления, превышающий первый уровень окисления.
Материал биомассы может дополнительно включать буфер, такой как бикарбонат натрия или хлорид аммония, электролит, такой как хлорид калия или хлорид натрия, фактор роста, такой как биотин и/или пара оснований, таких как урацил, поверхностно-активное вещество, минерал или хелатирующий агент.
В некоторых вариантах осуществления способы включают предварительную обработку одним или несколькими способами предварительной обработки в дополнение к облучению. Например, два или более различных способов предварительной обработки могут включать радиационное облучение и обработку ультразвуком, радиационное облучение и окисление, и радиационное облучение и пиролиз. Необязательно, предварительная обработка биомассы может включать паровой взрыв.
Для дальнейшего содействия снижению молекулярной массы биомассы с любым способом, описанным в настоящем документе, может быть использован фермент, например, целлюлолитический фермент, или химический реагент, например, гипохлорит натрия, кислота, основание или вызывающее набухание средство. Ферментативную и/или химическую обработку можно проводить до, в процессе или после облучения или другой предварительной обработки.
Если используют микроорганизм, то он может представлять собой природный микроорганизм или полученный способами инженерии микроорганизм. Например, микроорганизм может представлять собой бактерию, например, целлюлолитическую бактерию, гриб, например, дрожжи, растение или одноклеточный организм, например, водоросли, простейшие или подобные грибам простейшие, например, слизистую плесень. Если организмы являются совместимыми, то могут быть использованы смеси. Как правило, различные микроорганизмы могут продуцировать ряд полезных продуктов, таких как топливо, путем действия на материалы, например, ферментации. Например, путем ферментации или других процессов можно получать спирты, органические кислоты, углеводороды, водород, белки или смеси любых из этих материалов.
Примеры продуктов, которые можно продуцировать с использованием способов, описанных в настоящем документе, включают моно- и полифункциональные C1-C6 алкиловые спирты, моно- и полифункциональные карбоновые кислоты, C1-C6 углеводороды и их комбинации. Конкретные примеры подходящих спиртов включают метанол, этанол, пропанол, изопропанол, бутанол, этиленгликоль, пропиленгликоль, 1,4-бутандиол, глицерин и их комбинации. Конкретные примеры подходящих карбоновых кислот включают муравьиную кислоту, уксусную кислоту, пропионовую кислоту, масляную кислоту, валериановую кислоту, капроевую кислоту, пальмитиновую кислоту, стеариновую кислоту, щавелевую кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, олеиновую кислоту, линолевую кислоту, гликолевую кислоту, молочную кислоту, γ-гидроксимасляную кислоту и их комбинации. Примеры подходящих углеводородов включают метан, этан, пропан, пентан, н-гексан и их комбинации. Многие из этих продуктов можно использовать в качестве топлива. Другие продукты описаны в предварительной заявке США с серийным номером 61/139453, полное содержание которой включено в настоящий документ в качестве ссылки. Продуцируемые продукты или сопродукты могут представлять собой продукты, предназначенные для применения в продуцированном виде, или продуцированные продукты могут представлять собой промежуточные продукты для любого другого процесса, описанного в настоящем документе, или любого процесса, описанного в заявке, включенной в настоящий документ в качестве ссылки.
Примеры микроорганизмов, которые можно использовать для получения полезных продуктов, включают бактерии, дрожжи и их комбинации. Например, микроорганизм может представлять собой бактерию, например, целлюлолитическую бактерию, гриб, например, дрожжи, растение или одноклеточный организм, например, водоросли, простейшие или подобные грибам простейшие, например, слизистую плесень.
В любом из способов, описанных в настоящем документе, радиационное излучение можно применять из устройства, которое находится в хранилище.
Термин "волокнистый материал", как используют в настоящем документе, представляет собой материал, который включает множество рыхлых, дискретных и разделимых волокон. Например, волокнистый материал может быть получен из источника волокон, представляющего собой отбеленную крафт-бумагу, путем дробления, например, с помощью резательного устройства с вращающимся ножом.
Термин "сито", как используют в настоящем документе, означает элемент, способный просеивать материал в соответствии с размером. Примеры сит включают пластину с отверстиями, цилиндр или тому подобное, или проволочное сито, или матерчатую ткань.
Термин "пиролиз", как используют в настоящем документе, означает разрушение связей в материале путем применения тепловой энергии. Пиролиз может происходить, когда рассматриваемый материал находится в вакууме или погружен в газообразное вещество, такое как окисляющий газ, например, воздух или кислород, или восстанавливающий газ, такой как водород.
Содержание кислорода определяют элементным анализом путем пиролиза образца в печи, работающей при 1300°C или выше.
Термин "биомасса" включает любое нефоссилизированное, т.е. возобновляемое, органическое вещество. Различные типы биомассы включают растительную биомассу (определенную ниже), микробную биомассу, животную биомассу (любой побочный продукт животноводства, отходы животноводства и т.д.) и биомассу городских отходов (жилые отходы и отходы легкой промышленности с подлежащими вторичной переработке материалами, такими как выброшенный металл и стекло). Также термин "биомасса" включает исходные или использованные целлюлозные материалы, такие как тряпье и полотенца, изготовленные из хлопка или хлопковой смеси.
Термин "растительная биомасса" и "лигноцеллюлозная биомасса" относятся практически к любому происходящему от растений органическому материалу (древесному или недревесному). Растительная биомасса может включать, но ими не ограничиваясь, сельскохозяйственные или продовольственные культуры (например, сахарный тростник, сахарную свеклу или кукурузные зерна), или их экстракт (например, сахар из сахарного тростника и кукурузный крахмал из кукурузы), сельскохозяйственные культуры и сельскохозяйственные отходы и остатки, такие как кукурузная солома, пшеничная солома, рисовая солома, жмых сахарного тростника, хлопок и т.п. Кроме того, растительная биомасса включает, но не ограничивается ими, деревья, древесные энергетические культуры, древесные отходы и остатки, такие как щепки хвойного дерева, отходы из коры, древесные опилки, потоки отходов бумажной и целлюлозной промышленности, древесное волокно и т.п. Кроме того, в качестве другого источника растительной биомассы потенциально можно в большом масштабе выращивать кормовую посевную траву, такую как просо и т.п. Для городских территорий наилучшее потенциальное растительное сырье биомассы включает отходы садоводства (например, скошенная трава, листья, обрезанные части деревьев и валежник) и отходы переработки овощей.
"Лигноцеллюлозное сырье" представляет собой любой тип растительной биомассы, такой как, но не ограничиваясь перечисленным, биомасса недревесных растений, возделываемые культуры, такие как, но не ограничиваясь ими, травы, например, но не ограничиваясь ими, C4-травы, такие как просо, спартина, плевел, мискант (китайский тростник), двукисточник тростниковидный (канареечник трубковидный) или их комбинации, или остатки переработки сахара, такие как жмых или свекловичная пульпа, сельскохозяйственные остатки, например, соевая солома, кукурузная солома, рисовая солома, рисовая шелуха, ячменная солома, сердцевина кукурузного початка, пшеничная солома, солома конолы, рисовая солома, овсяная солома, овсяная шелуха, кукурузное волокно, утилизированное волокно древесной пульпы, древесные опилки, твердая древесина, например, дерево и опилки осины, мягкая древесина или их комбинации. Кроме того, лигноцеллюлозное сырье может включать целлюлозные отходы производства, такие как, но не ограничиваясь ими, газетная бумага, картон, древесные опилки и т.п.
Лигноцеллюлозное сырье может включать один вид волокна или, альтернативно, лигноцеллюлозное сырье может включать смесь волокон, источником которых является различное лигноцеллюлозное сырье. Кроме того, лигноцеллюлозное сырье может содержать свежее лигноцеллюлозное сырье, частично высушенное лигноцеллюлозное сырье, полностью высушенное лигноцеллюлозное сырье или их комбинацию.
Для целей данного описания, углеводы представляют собой материалы, которые полностью состоят из одного или нескольких сахаридных звеньев или которые включают один или несколько сахаридных звеньев. Сахаридные звенья могут быть функционализированными в области кольца посредством одной или нескольких функциональных групп, таких как группы карбоновой кислоты, аминогруппы, нитрогруппы, нитрозогруппы или нитрильные группы, и, тем не менее, считаться углеводами. Углеводы могут быть полимерными (например, равными 10-меру, 100-меру, 1000-меру, 10000-меру или 100000-меру, или превышающими их), олигомерными (например, равными 4-меру, 5-меру, 6-меру, 7-меру, 8-меру, 9-меру или 10-меру, или превышающими их), тримерными, димерными или мономерными. Если углеводы образованы из более чем одного повторяющегося звена, то все элементы могут быть одинаковыми или различными.
Примеры полимерных углеводов включают целлюлозу, ксилан, пектин и крахмал, в то время как примерами димерных углеводов являются целлобиоза и лактоза. Примеры мономерных углеводов включают глюкозу и ксилозу.
Углеводы могут быть частью надмолекулярной структуры, например, ковалентно присоединенной к структуре. Примеры таких материалов включают лигноцеллюлозные материалы, такие как материалы, находящиеся в дереве.
Крахмальный материал является материалом, который представляет собой крахмал или производное крахмала или включает значительные количества крахмала или производного крахмала, например, более чем приблизительно 5 масс.% крахмала или производного крахмала. Для целей данного описания, крахмал представляет собой материал, который включает амилозу, амилопектин или их физическую и/или химическую смесь, например, смесь амилозы и пектина, составляющую 20:80 или 30:70 масс.%. Например, рис, кукуруза и их смеси представляют собой крахмальные материалы. Производные крахмала включают, например, мальтодекстрин, кислотно-модифицированный крахмал, основно-модифицированный крахмал, отбеленный крахмал, окисленный крахмал, ацетилированный крахмал, ацетилированный и окисленный крахмал, фосфатный модифицированный крахмал, генетически модифицированный крахмал и крахмал, который является устойчивым к расщеплению.
Для целей данного описания, низкомолекулярный сахар представляет собой углевод или его производное, которые имеют молекулярную массу по формуле (за исключением влагосодержания) менее чем приблизительно 2000, например, менее чем приблизительно 1800, 1600, менее чем приблизительно 1000, менее чем приблизительно 500, менее чем приблизительно 350 или менее чем приблизительно 250. Например, низкомолекулярный сахар может представлять собой моносахарид, например, глюкозу или ксилозу, дисахарид, например, целлобиозу или сахарозу, или трисахарид.
Сгораемое топливо представляет собой материал, способный сгорать в присутствии кислорода. Примеры сгораемых видов топлива включают этанол, н-пропанол, н-бутанол, водород и смеси любых двух или более из них.
Вызывающие набухание средства, как используют в настоящем документе, представляют собой материалы, которые вызывают видимое набухание, например, увеличение объема целлюлозных и/или лигноцеллюлозных материалов относительно ненабухшего состояния, составляющее 2,5%, когда такие материалы применяют в качестве раствора, например, водного раствора. Их примеры включают щелочные вещества, такие как гидроксид натрия, гидроксид калия, гидроксид лития и гидроксиды аммония, подкислители, такие как минеральные кислоты (например, серная кислота, хлористоводородная кислота и фосфорная кислота), соли, такие как хлорид цинка, карбонат кальция, карбонат натрия, сульфат бензилтриметиламмония, и основные органические амины, такие как этилендиамин.
"Раздробленный материал", как используют в настоящем документе, представляет собой материал, который включает отдельные волокна, в которых по меньшей мере приблизительно 50% отдельных волокон имеют отношение длина/диаметр (L/D) по меньшей мере приблизительно 5 и которые имеют объемную плотность в несжатом состоянии менее чем приблизительно 0,6 г/см3. Таким образом, раздробленный материал отличается от материала, который является нарезанным, порубленным или растертым.
Изменение молекулярной структуры сырья биомассы, как используют в настоящем документе, означает изменение расположения химических связей, например, типа и количества функциональных групп или конформации структуры. Например, изменение молекулярной структуры может включать изменение надмолекулярной структуры материала, окисление материла, изменение средней молекулярной массы, изменение средней кристалличности, изменение площади поверхности, изменение степени полимеризации, изменение пористости, изменение степени разветвления, привитую сополимеризацию с другими материалами, изменение размера кристаллического домена или изменение размера всего домена.
Данная заявка включает в качестве ссылки полное содержание международной заявки № PCT/US2007/022719, поданной 26 октября 2007 года. Полное описание каждой из следующих патентных заявок США включено в настоящий документ в качестве ссылок: предварительные заявки США с серийными номерами 61/049391; 61/049394; 61/049395; 61/049404; 61/049405; 61/049406; 61/049407; 61/049413; 61/049415; и 61/049419, все поданы 30 апреля 2008 года; предварительные заявки США с серийными номерами 61/073432; 61/073436; 61/073496; 61/073530; 61/073665; и 61/073674, все поданы 18 июня 2008 года; предварительная заявка США с серийным номером 61/106861, поданная 20 октября 2008 года; предварительная заявка США с серийными номерами 61/139324 и 61/139453, обе поданы 19 декабря 2008 года, и патентные заявки США с серийными номерами 12/417707; 12/417720; 12/417840; 12/417699; 12/417731; 12/417900; 12/417880; 12/417723; 12/417786; и 12/417904, все поданы 3 апреля 2009 года.
Если не определено иначе, все технические и научные термины, используемые в настоящем документе, имеют те же значения, которые обычно подразумевают специалисты в области, к которой относится данное изобретение. Несмотря на то, что на практике или при тестировании настоящего изобретения можно использовать способы и материалы, сходные или эквивалентные способам или материалам, описанным в настоящем документе, подходящие способы и материалы описаны ниже. Все публикации, патентные заявки, патенты и другие ссылки, упомянутые в настоящем документе, полностью включены в качестве ссылок. В случае противоречия следует руководствоваться настоящим описанием, включая определения. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения.
Другие признаки и преимущества изобретения станут очевидными из представленного ниже подробного описания и формулы изобретения.
ОПИСАНИЕ ЧЕРТЕЖЕЕЙ
На ФИГ. 1 представлена блок-схема, иллюстрирующая конверсию биомассы в продукты и побочные продукты.
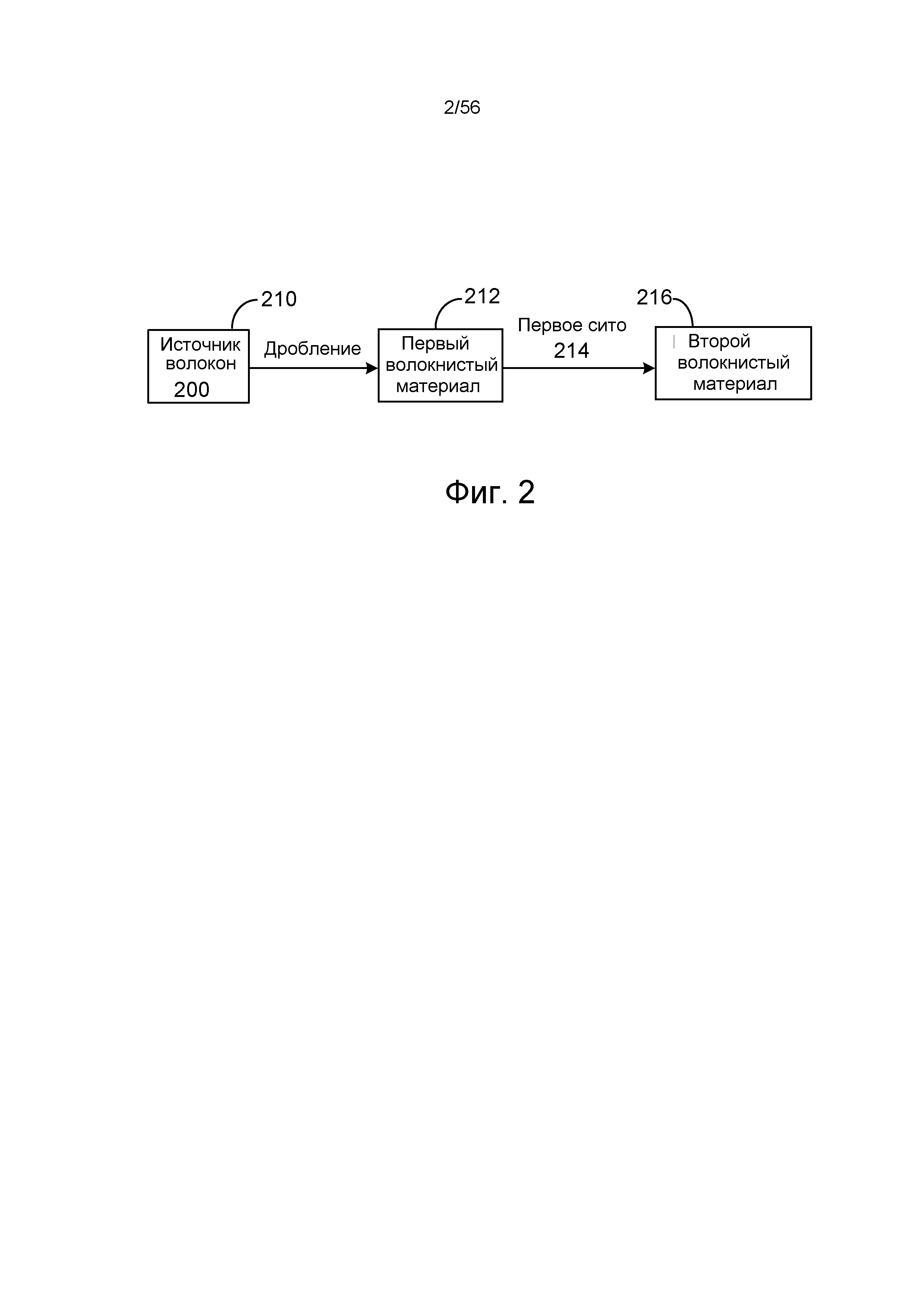
На ФИГ. 2 представлена блок-схема, иллюстрирующая конверсию источника волокна в первый и второй волокнистый материал.
На ФИГ. 3 представлен вид в поперечном разрезе резательного устройства с вращающимся ножом.
На ФИГ. 4 представлена блок-схема, иллюстрирующая конверсию источника волокна в первый, второй и третий волокнистый материал.
На ФИГ. 5 представлена блок-схема, иллюстрирующая уплотнение материала.
На ФИГ. 6 представлено перспективное изображение пресса для гранулирования.
На ФИГ. 7A представлен уплотненный волокнистый материал в форме гранул.
На ФИГ. 7B представлено поперечное сечение полых гранул, в которых центр полости находится на одной линии с центром гранулы.
На ФИГ. 7C представлено поперечное сечение полой гранулы, в которой центр полости смещен относительно центра гранулы.
На ФИГ. 7D представлено поперечное сечение трехдольной гранулы.
На ФИГ. 8 представлена блок-схема, иллюстрирующая последовательность обработки для переработки сырья.
На ФИГ. 9 представлен перспективный вид в сечении гамма-излучателя, находящегося в бетонном хранилище.
На ФИГ. 10 представлен увеличенный перспективный вид области R ФИГ. 9.
На ФИГ. 11A представлена блок-схема, иллюстрирующая последовательность предварительной обработки сырья облучением пучком электронов.
На ФИГ. 11B показано схематичное представление ионизированной биомассы, а затем окисленной или гашеной.
На ФИГ. 12 представлен схематичный вид системы для обработки ультразвуком технологического потока целлюлозного материала в жидкой среде.
На ФИГ. 13 представлен схематичный вид устройства для обработки ультразвуком, имеющего два преобразователя, присоединенных к одному рупору.
На ФИГ. 14 представлена блок-схема, иллюстрирующая систему для пиролитической предварительной обработки сырья.
На ФИГ. 15 представлен в поперечном разрезе боковой вид камеры для пиролиза.
На ФИГ. 16 представлен в поперечном разрезе боковой вид камеры для пиролиза.
На ФИГ. 17 представлен в поперечном разрезе боковой вид пиролизера, который включает нагревательную нить.
На ФИГ. 18 представлен схематично в поперечном разрезе боковой вид пиролизера по точке Кюри.
На ФИГ. 19 представлен схематично в поперечном разрезе боковой вид печного пиролизера.
На ФИГ. 20 представлен схематично в поперечном разрезе вид сверху лазерного устройства для пиролиза.
На ФИГ. 21 представлен схематично в поперечном разрезе вид сверху устройства для мгновенного пиролиза с вольфрамовой нитью.
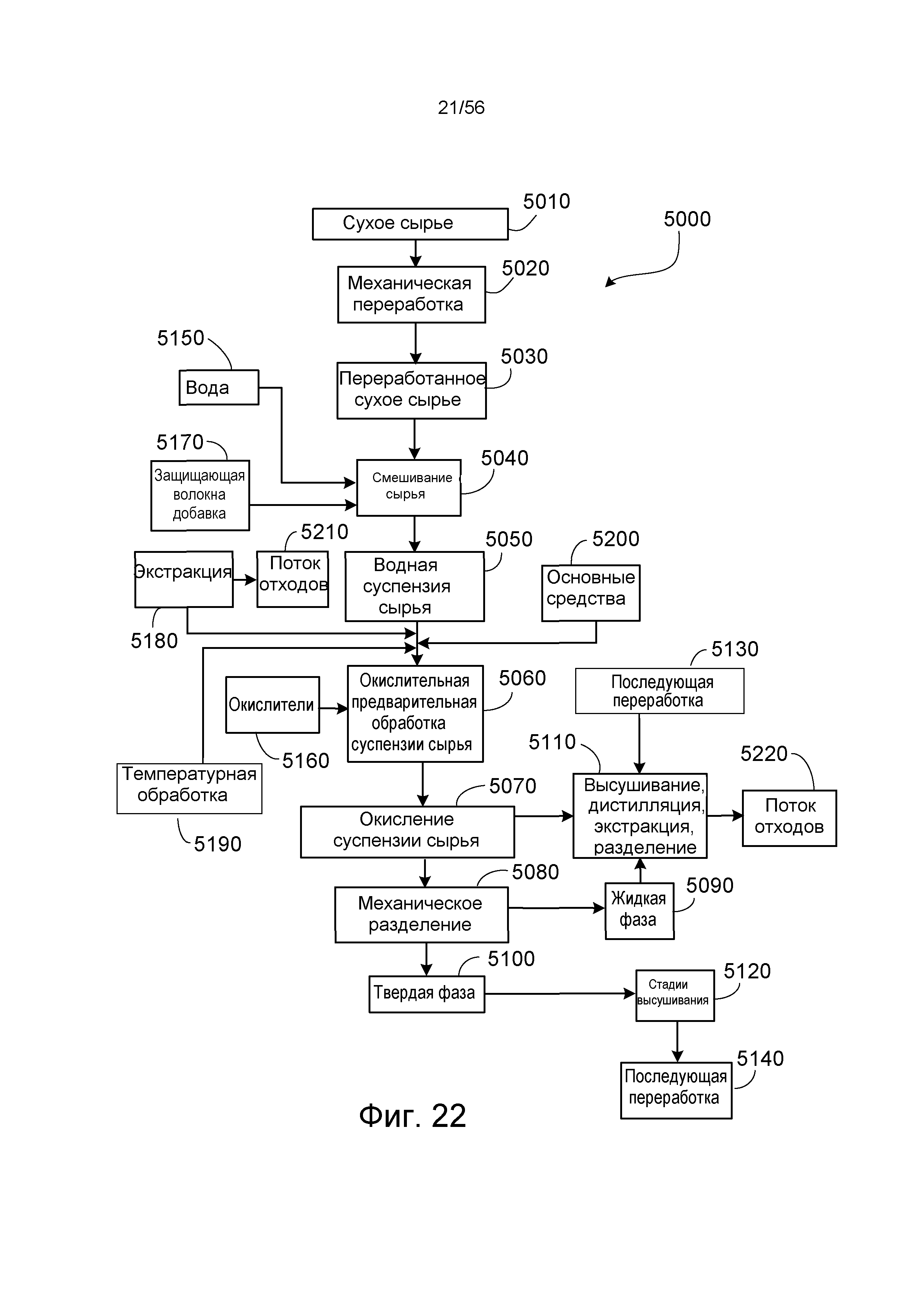
На ФИГ. 22 представлена блок-схема, иллюстрирующая систему для окислительной предварительной обработки сырья.
На ФИГ. 23 представлена блок-схема, иллюстрирующая общий вид процесса конвертирования источника волокна в продукт, например, этанол.
На ФИГ. 24 представлен схематично в поперечном разрезе вид устройства для парового взрыва.
На ФИГ. 25 представлен схематично в поперечном разрезе боковой вид гибридного устройства для обработки пучком электронов/ультразвуком.
На ФИГ. 26 представлен снимок, полученный с помощью сканирующего электронного микроскопа при увеличении 25X, волокнистого материала, полученного из бумаги с многослойным покрытием. Волокнистый материал получали на резательном устройстве с вращающимся ножом c использованием сита с отверстиями 1/8 дюйма (0,32 см).
На ФИГ. 27 представлен снимок, полученный с помощью сканирующего электронного микроскоп при увеличении 25X, волокнистого материала, полученного из отбеленного крафт-картона. Волокнистый материал получали на резательном устройстве с вращающимся ножом c использованием сита с отверстиями 1/8 дюйма (0,32 см).
На ФИГ. 28 представлен снимок, полученный с помощью сканирующего электронного микроскопа при увеличении 25X, волокнистого материала, полученного из отбеленного крафт-картона. Волокнистый материал дважды дробили на резательном устройстве с вращающимся ножом с использованием сита с отверстиями 1/16 дюйма (0,16 см) при каждом дроблении.
На ФИГ. 29 представлен снимок, полученный с помощью сканирующего электронного микроскопа при увеличении 25X, волокнистого материала, полученного из отбеленного крафт-картона. Волокнистый материал три раза дробили на резательном устройстве с вращающимся ножом. В ходе первого дробления использовали сито 1/8 дюйма (0,32 см); в ходе второго дробления использовали сито 1/16 дюйма (0,16 см) и в ходе третьего дробления использовали сито 1/32 дюйма (0,08 см).
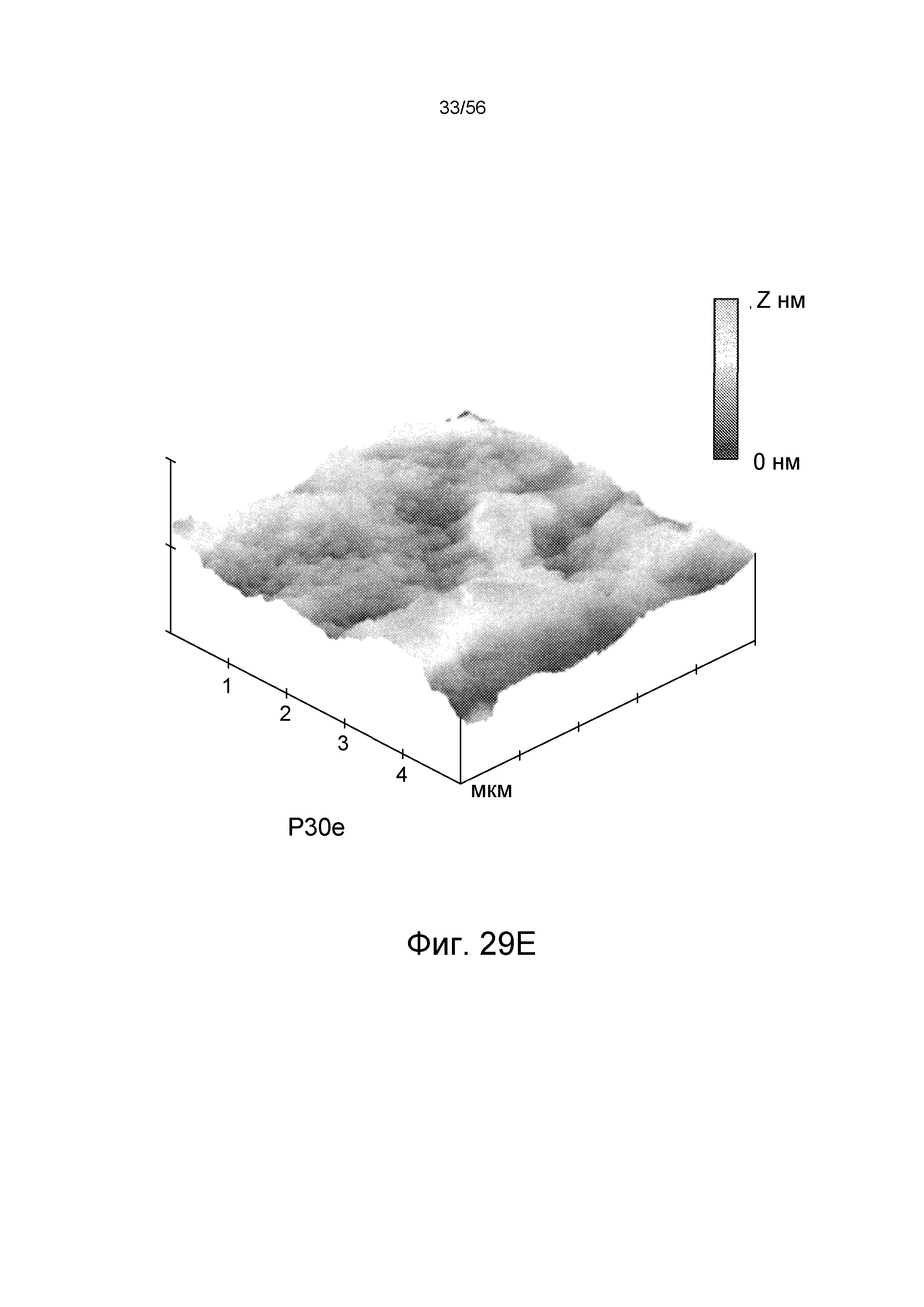
На ФИГ. 29A-29F представлены 3-D спектры Рамана поверхности волокон из образцов P132, P132-10, P132-100, P-1e, P-30e и P-100e, соответственно.
На ФИГ. 30 представлен схематичный боковой вид устройства для обработки ультразвуком, а на ФИГ. 31 представлен в поперечном разрезе вид через ячейку для переработки ФИГ. 30.
На ФИГ. 32 представлен снимок, полученный с помощью сканирующего электронного микроскопа при увеличении 1000X, волокнистого материала, полученного путем дробления проса на резательном устройстве с вращающимся ножом, а затем пропускания раздробленного материала через сито 1/32 дюйма (0,08 см).
На ФИГ. 33 и 34 представлены снимки, полученные с помощью сканирующего электронного микроскопа при увеличении 1000X, волокнистого материала ФИГ. 32 после облучения гамма-лучами в дозе 10 Мрад и 100 Мрад, соответственно.
На ФИГ. 35 представлены снимки, полученные с помощью сканирующего электронного микроскопа при увеличении 1000X, волокнистого материала ФИГ. 32 после облучения дозой 10 Мрад и обработки ультразвуком.
На ФИГ. 36 представлены снимки, полученные с помощью сканирующего электронного микроскопа при увеличении 1000X, волокнистого материала ФИГ. 32 после облучения дозой 100 Мрад и обработки ультразвуком.
На ФИГ. 37 представлен инфракрасный спектр крафт-картона, нарезанного на резательном устройстве с вращающимся ножом.
На ФИГ. 38 представлен инфракрасный спектр крафт-бумаги ФИГ. 37 после облучения гамма-излучением в дозе 100 Мрад.
На ФИГ. 38A-38I представлены спектры1H-ЯМР для образцов P132, P132-10, P132-100, P-1e, P-5e, P-10e, P-30e, P-70e и P-100e в примере 23. На ФИГ. 38J представлено сравнение обменного протона при ~16 м.д. на ФИГ. 8A-38I. На ФИГ. 38K представлен13C-ЯМР образца P-100e. На ФИГ. 38L-38M представлены13C-ЯМР образца P-100e с временем удержания 10 секунд. На ФИГ. 38N представлен1H-ЯМР образца P-100e в концентрации 10% масс./масс.
На ФИГ. 39 представлен схематичный вид процесса конверсии биомассы.
На ФИГ. 40 представлен схематичный вид другого процесса конверсии биомассы.
ПОДРОБНОЕ ОПИСАНИЕ
Биомассу (например, растительную биомассу, такую как биомасса, которая представляет собой или включает один или несколько низкомолекулярных сахаров, животная биомасса и биомасса городских отходов) можно перерабатывать для получения полезных продуктов, таких как топлива, например, топлива для двигателей внутреннего сгорания, реактивных двигателей или сырье для топливных элементов. Кроме того, используя способы, описанные в настоящем документе, можно получать функционализированные материалы, имеющие желательные типы и количества функциональных групп, таких как группы карбоновой кислоты, енольные группы, альдегидные группы, кетоновые группы, нитрильные группы, нитрогруппы или нитрозогруппы. Такие функционализированные материалы могут быть, например, более растворимыми, легче утилизируемыми различными микроорганизмами или они могут быть более стабильными в течение длительного времени, например, менее подверженными окислению. В настоящем документе описаны системы и процессы, в которых могут использоваться различные материалы биомассы, такие как целлюлозные материалы, лигноцеллюлозные материалы, крахмальные материалы или материалы, которые представляют собой или которые включают низкомолекулярные сахара, в качестве сырьевых материалов. Такие материалы часто являются легко доступными, но могут быть трудно перерабатываемыми, например, путем ферментации, или они могут давать неоптимальные выходы при достаточно низкой скорости. Сырьевые материалы сначала физически подготавливают для переработки, часто путем уменьшения размера исходных сырьевых материалов. Физически подготовленное сырье можно подвергать предварительной обработке или перерабатывать с использованием одного или нескольких способов, выбранных из радиационного облучения, обработки ультразвуком, окисления, пиролиза и парового взрыва. Различные системы и способы для предварительной обработки можно использовать в комбинациях по две, три или даже четыре из этих технологий.
В некоторых случаях, для предоставления материалов, которые включают углевод, такой как целлюлоза, который может конвертироваться микроорганизмом в ряд желательных продуктов, таких как сгораемые топлива (например, этанол, бутанол или водород), сырье, которое включает одно или несколько сахаридных звеньев, можно обрабатывать одним или несколькими способами, описанными в настоящем документе. Другие продукты и сопродукты, которые можно продуцировать, включают, например, продукты питания для человека, корма для животных, фармацевтические препараты и нутрицевтики. Представлен ряд примеров, которые находятся в диапазоне от лабораторных осуществлений отдельных способов предварительной обработки до крупномасштабных установок по переработке биомассы.
ТИПЫ БИОМАССЫ
Как правило, любой материал биомассы, который представляет собой или включает углеводы, полностью состоящие из одного или нескольких сахаридных звеньев или включающие один или несколько сахаридных звеньев, можно перерабатывать любым из способов, описанных в настоящем документе. Например, материал биомассы может представлять собой целлюлозные или лигноцеллюлозные материалы, крахмальные материалы, такие как зерна кукурузы, зерна риса или другие пищевые продукты, или материалы, которые представляют собой или включают один или несколько низкомолекулярных сахаров, таких как сахароза или целлобиоза.
Например, такие материалы могут включать бумагу, бумажную продукцию, древесину, родственные древесине материалы, прессованную древесину, травы, рисовую шелуху, жмых, хлопок, джут, пеньку, лен, бамбук, сизаль, абаку, солому, сердцевины кукурузных початков, рисовую шелуху, кокосовые волокна, водоросли, морскую траву, хлопок, синтетические целлюлозы или смеси любых из них. Подходящие материалы включают материалы, приведенные в разделе "Сущность изобретения", выше.
Источники волокон включают источники целлюлозных волокон, включая бумагу и бумажную продукцию (например, бумагу с многослойным покрытием и крафт-бумагу), и лигноцеллюлозные источники волокон, включая древесину и родственные древесине материалы, например, прессованную древесину. Другие подходящие источники волокон включают природные источники волокон, например, травы, рисовую шелуху, жмых, хлопок, джут, пеньку, лен, бамбук, сизаль, абаку, солому, сердцевины кукурузных початков, рисовую шелуху, кокосовые волокна; источники волокон с высоким содержанием α-целлюлозы, например, хлопок; и синтетические источники волокон, например, экструдированную пряжу (ориентированную пряжу или неориентированную пряжу). Природные или синтетические источники волокон могут быть получены из лоскутов исходных текстильных материалов, например, остатков, или они могут представлять собой использованные отходы, например, тряпье. Когда в качестве источников волокон используют бумажную продукцию, она может представлять собой натуральные материалы, например, куски исходных материалов, или они могут представлять собой использованные отходы. Помимо исходных сырьевых материалов, также в качестве источников волокон можно использовать отходы использованных продуктов, промышленные (например, субпродукты) отходы и отходы переработки (например, сбросные воды от переработки бумаги). Также источник волокон может быть получен или образован из отходов человека (например, сточные воды), животных или растений. Дополнительные источники волокон описаны в патентах США №№ 6448307, 6258876, 6207729, 5973035 и 5952105.
В некоторых вариантах осуществления углевод представляет собой или включает материал, имеющий одну или несколько β-1,4-связей и обладающий среднечисленной молекулярной массой от приблизительно 3000 до 50000. Такой углевод представляет собой или включает целлюлозу (I), которая образована из (β-глюкозы 1) путем конденсации β(1→4)-гликозидных связей. Эта связь противоположна α(1→4)-гликозидным связям, присутствующим в крахмале и других углеводах.

Крахмальные материалы включают сам крахмал, например, кукурузный крахмал, пшеничный крахмал, картофельный крахмал или рисовый крахмал, производное крахмала или материал, который включает крахмал, такой как продукт питания или сельскохозяйственная культура. Например, крахмальный материал может представлять собой аракачу, гречку, банан, ячмень, маниоку, кудзу, кислицу, саго, сорго, обычный домашний картофель, сладкий картофель, таро, ямс (батат) или одно или несколько бобовых, таких как конские бобы, чечевица или горох. Смеси этих и/или других крахмальных материалов также считаются крахмальными материалами. В конкретных вариантах осуществления крахмальный материал получают из кукурузы. Различные кукурузные крахмалы и их производные описаны в публикации "Corn Starch", Corn Refiners Association (11th Edition, 2006), которая прилагается к настоящему документу в виде приложения A.
Материалы биомассы, которые включают низкомолекулярные сахара, могут содержать, например, по меньшей мере приблизительно 0,5 масс.% низкомолекулярного сахара, например, по меньшей мере приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 12,5, 25, 35, 50, 60, 70, 80, 90 или даже по меньшей мере приблизительно 95 масс.% низкомолекулярного сахара. В некоторых случаях биомасса состоит по существу из низкомолекулярного сахара, например, более чем на 95 масс.%, например, 96, 97, 98, 99 или по существу 100 масс.% низкомолекулярного сахара.
Материалы биомассы, которые включают низкомолекулярные сахара, могут представлять собой сельскохозяйственные продукты или пищевые продукты, такие как сахарный тростник или сахарная свекла, или их экстракт, например, сок сахарного тростника или сахарной свеклы. Материалы биомассы, которые включают низкомолекулярные сахара, могут представлять собой по существу чистые экстракты, такие как нерафинированный или кристаллизованный столовый сахар (сахароза). Низкомолекулярные сахара включают производные сахаров. Например, низкомолекулярные сахара могут быть олигомерными (например, равными 4-меру, 5-меру, 6-меру, 7-меру, 8-меру, 9-меру или 10-меру, или превышающими их), тримерными, димерными или мономерными. Если углеводы образованы более чем одним повторяющимся звеном, то каждое повторяющееся звено может быть одинаковым или различным.
Конкретные примеры низкомолекулярных сахаров включают целлобиозу, лактозу, сахарозу, глюкозу и ксилозу, а также их производные. В некоторых случаях производные сахаров быстрее растворяются в растворе или утилизируются микробами, продуцируя полезный материал, такой как этанол или бутанол. Несколько таких сахаров и производных сахаров представлены ниже.


Для получения продуктов, описанных в настоящем документе, таких как этанол, можно использовать смеси любых материалов биомассы, описанных в настоящем документе. Например, для получения любого продукта, описанного в настоящем документе, можно использовать смеси целлюлозных материалов и крахмальных материалов.
СИСТЕМЫ ДЛЯ ОБРАБОТКИ БИОМАССЫ
На ФИГ. 1 представлена система для конвертирования биомассы 100, в частности, биомассы со значительными количествами целлюлозных и лигноцеллюлозных компонентов и/или крахмальных компонентов, в полезные продукты и побочные продукты. Система 100 включает подсистему для подготовки исходного материала 110, подсистему для предварительной обработки 114, подсистему для основной переработки 118 и подсистему для последующей переработки 122. В подсистему для подготовки исходного материала 110 подается биомасса в сырой форме, и в ней биомасса физически подготавливается для применения в качестве сырья для последующих процессов (например, для уменьшения размера и гомогенизации биомассы), и хранится биомасса как в сырой форме, так и в форме сырья. Сырье биомассы со значительными количествами целлюлозных и/или лигноцеллюлозных компонентов или крахмальных компонентов может иметь высокую среднюю молекулярную массу и кристалличность, которые могут осложнять переработку сырья в полезные продукты (например, ферментацию сырья для получения этанола). Например, в других системах для переработки целлюлозного, лигноцеллюлозного или крахмального сырья используются кислоты, основания и ферменты. Как описано в настоящем документе, в некоторых вариантах осуществления такая обработка является ненужной или необходима только в небольших или каталитических количествах.
В подсистему для предварительной обработки 114 подается сырье из подсистемы для подготовки сырья 110, и в ней сырье подготавливается для применения в основных процессах производства, например, путем уменьшения средней молекулярной массы и кристалличности сырья. Из подсистемы для предварительной обработки 114 предварительно обработанное сырье подается в подсистему для основной переработки 118, и в ней продуцируются полезные продукты (например, этанол, другие спирты, фармацевтические препараты и/или продукты питания). В некоторых случаях продукт, выходящий из подсистемы для первичной переработки 118, является пригодным непосредственно, однако в других случаях требуется дополнительная переработка, осуществляемая подсистемой для последующей переработки 122. Подсистема для последующей переработки 122 обеспечивает дальнейшую переработку потока продукта из системы для первичной переработки 118, которая требуется для него (например, дистилляция и денатурация этанола), а также обработку потоков отходов из других подсистем. В некоторых случаях сопродукты подсистем 114, 118, 122 также могут быть непосредственно или косвенно пригодны в качестве вторичных продуктов и/или для повышения общей эффективности системы 100. Например, подсистема для последующей переработки 122 может производить обработанную воду для рециркуляции в качестве технической воды в других подсистемах и/или может производить сгораемые отходы, которые могут быть использованы в качестве топлива для бойлеров, генерирующих пар и/или электричество.
На оптимальный размер установки для конверсии биомассы влияют факторы, включающие экономичность масштаба и тип и доступность биомассы, используемой в качестве сырья. Увеличение размера установки имеет тенденцию к повышению экономичности масштаба, ассоциированной с процессами в установке. Однако возрастающий размер установки также имеет тенденцию к повышению затрат (например, затрат на транспортировку) на единицу сырья. Исследования, анализирующие эти факторы, указывают на то, что приемлемый размер установок для конверсии биомассы может варьировать от 2000 до 10000 тонн сухого сырья в сутки, в зависимости, по меньшей мере частично, от типа используемого сырья. Тип сырья также может влиять на требования по хранению на установке, где установки, предназначенные, главным образом, для переработки сырья, доступность которого варьирует сезонно (например, кукурузная солома), требуют в большей степени хранения сырья на месте, чем за пределами установки, по сравнению с установками, предназначенными для переработки сырья, доступность которого является относительно постоянной (например, макулатура).
ФИЗИЧЕСКАЯ ПОДГОТОВКА
В некоторых случаях способы переработки начинаются с физической подготовки сырья, например, уменьшения размера исходных сырьевых материалов, например, путем нарезания, растирания, дробления или рубки. В некоторых случаях рыхлое сырье (например, переработанная бумага, крахмальные материалы или просо) подготавливают дроблением или резанием. Для удаления из потока сырья слишком крупных объектов или нежелательных объектов, например, таких как камни или гвозди, можно использовать сита и/или магниты.
Системы для подготовки сырья могут быть сконфигурированы для продукции потоков сырья с конкретными характеристиками, такими как, например, конкретные максимальные размеры, конкретные соотношения длины и ширины или конкретные соотношения площадей поверхностей. В качестве части подготовки сырья можно регулировать объемную плотность сырья (например, повышать или снижать).
Уменьшение размера
В некоторых вариантах осуществления материал, подлежащий переработке, имеет форму волокнистого материала, который включает волокна, получаемые дроблением источника волокон. Например, дробление можно проводить с помощью резательного устройства с вращающимся ножом.
Например, и ссылаясь на ФИГ. 2, источник волокна 210 дробят, например, в резательном устройстве с вращающимся ножом, с получением первого волокнистого материала 212. Первый волокнистый материал 212 пропускают через первое сито 214, имеющее средний размер отверстий 1,59 мм или менее (1/16 дюйма, 0,0625 дюйма), с получением второго волокнистого материала 216. Если желательно, источник волокна можно измельчать перед дроблением, например, с помощью устройства для измельчения. Например, если в качестве источника волокна используют бумагу, то бумагу сначала можно измельчить до полосок шириной, например, от 1/4 до 1/2 дюйма (от 0,64 до 1,28 см), с использованием устройства для измельчения, например, устройства для измельчения с винтами со встречным вращением, такого как устройство производства Munson (Utica, N.Y.). В качестве альтернативы измельчению, размер бумаги можно уменьшать, нарезая до желаемого размера, с использованием гильотинного резательного инструмента. Например, гильотинный резательный инструмент можно использовать для разрезания бумаги на листы, например, шириной 10 дюймов (25,4 см) и длиной 12 дюймов (30,5 см).
В некоторых вариантах осуществления дробление источника волокна и пропускание полученного первого волокнистого материала через первое сито проводят одновременно. Дробление и пропускание также можно проводить способом периодического действия.
Например, резательное устройство с вращающимся ножом можно использовать для одновременного дробления источника волокна и просеивания первого волокнистого материала. Ссылаясь на ФИГ. 3, резательное устройство с вращающимся ножом 220 включает воронку 222, в которую может быть загружен измельченный источник волокна 224, полученный измельчением источника волокна. Измельченный источник волокна дробится между стационарными лезвиями 230 и вращающимися лезвиями 232 с получением первого волокнистого материала 240. Первый волокнистый материал 240 пропускается через сито 242, и полученный второй волокнистый материал 244 собирается в корзину 250. Для облегчения сбора второго волокнистого материала корзина может иметь давление ниже номинального атмосферного давления, например, по меньшей мере на 10% ниже номинального атмосферного давления, например, по меньшей мере на 25% ниже номинального атмосферного давления, по меньшей мере на 50% ниже номинального атмосферного давления или по меньшей мере на 75% ниже номинального атмосферного давления. В некоторых вариантах осуществления для поддержания давления в корзине ниже номинального атмосферного давления используют источник вакуума 252.
Дробление может быть предпочтительным для "раскрытия" и "напряжения" волокнистых материалов, делая целлюлозу материалов более чувствительной к расщеплению цепи и/или снижению кристалличности. Раскрытые материалы также могут быть более чувствительными к окислению при облучении.
Источник волокна можно дробить в сухом состоянии, в гидратированном состоянии (например, имеющим вплоть до 10 масс.% абсорбированной воды) или во влажном состоянии, например, имея от приблизительно 10 масс.% до приблизительно 75 масс.% воды. Источник волокна можно дробить даже при частичном или полном погружении под жидкость, такую как вода, этанол, изопропанол.
Источник волокна также можно дробить в атмосфере газа (такого как поток или атмосфера газа, отличного от воздуха), например, в кислороде или азоте, или паре.
Другие способы получения волокнистых материалов включают, например, жерновой помол, механическое разрыхление или разрывание, измельчение на стержневой мельнице или измельчение растиранием на воздухе.
Если желательно, волокнистые материалы можно разделять, например, постоянно или партиями, на фракции согласно их длине, ширине, плотности, типу материала или некоторой комбинации этих признаков.
Например, черные металлы можно отделять от любого волокнистого материала пропусканием волокнистого материала, который включает черный металл, мимо магнита, например, электромагнита, а затем пропуская полученный волокнистый материал через серию сит, где каждое сито имеют отверстия различного размера.
Волокнистые материалы также можно разделять, например, с использованием высокоскоростного газа, например, воздуха. При таком подходе волокнистые материалы разделяют отведением различных фракций, которые, если желательно, можно подвергнуть фотонной характеризации. Такое устройство для разделения рассмотрено в Lindsey et al, патент США № 6883667.
Волокнистые материалы можно облучать непосредственно после их подготовки, или их можно высушивать, например, приблизительно при 105°C в течение 4-18 часов, так чтобы перед применением содержание влаги составляло, например, менее чем приблизительно 0,5%.
Если желательно, из волокнистых материалов, которые включают лигнин, можно удалять лигнин. Также для облегчения разрушения материалов, которые включают целлюлозу, материал можно обрабатывать перед облучением нагреванием, химическим реагентом (например, минеральной кислотой, основанием или сильным окислителем, таким как гипохлорит натрия) и/или ферментом.
В некоторых вариантах осуществления средний размер отверстия первого сита составляет менее 0,79 мм (1/32 дюйма, 0,03125 дюйма), например, менее 0,51 мм (1/50 дюйма, 0,02000 дюйма), менее 0,40 мм (1/64 дюйма, 0,015625 дюйма), менее 0,23 мм (0,009 дюйма), менее 0,20 мм (1/128 дюйма, 0,0078125 дюйма), менее 0,18 мм (0,007 дюйма), менее 0,13 мм (0,005 дюйма) или даже менее 0,10 мм (1/256 дюйма, 0,00390625 дюйма). Сито изготавливают переплетением мононити, имеющей соответствующий диаметр для получения желаемого размера отверстия. Например, мононити могут быть изготовлены из металла, например, нержавеющей стали. По мере уменьшения размеров отверстий структурные требования для мононити повышаются. Например, для размеров отверстий менее 0,40 мм может быть преимущественным изготовление сит из мононитей, полученных из материала, отличного от нержавеющей стали, например, титана, сплавов титана, аморфных металлов, никеля, вольфрама, родия, рения, керамики или стекла. В некоторых вариантах осуществления сито изготавливают из пластины, например, металлической пластины, имеющей отверстия, например, вырезанные в пластине с использованием лазера. В некоторых вариантах осуществления площадь отверстий в сите составляет менее 52%, например, менее 41%, менее 36%, менее 31%, менее 30%.
В некоторых вариантах осуществления второй волокнистый материал дробят и пропускают через первое сито или сито с отличающимся размером. В некоторых вариантах осуществления второй волокнистый материал пропускают через второе сито, имеющее средний размер отверстий, равный или меньший, чем размер первого сита.
Ссылаясь на ФИГ. 4, третий волокнистый материал 220 может быть получен из второго волокнистого материала 216 дроблением второго волокнистого материала 216 и пропусканием полученного материала через второе сито 222, имеющее средний размер отверстий меньший, чем у первого сита 214.
Как правило, волокна волокнистых материалов могут иметь относительно высокое среднее соотношение длины и диаметра (например, более 20 к 1), даже если их подвергали дроблению более одного раза. Кроме того, волокна волокнистых материалов, описанные в настоящем документе, могут иметь относительно узкое распределение длины и/или соотношения длины и диаметра.
Как используют в настоящем документе, среднюю ширину волокон (т.е. диаметр) определяют оптически, случайным образом выбирая приблизительно 5000 волокон. Средняя длина волокон представляет собой корригированные длины, взвешенные по длине. Площадь поверхности BET (Brunauer, Emmet and Teller) представляет собой многоточечную площадь поверхности, и пористость представляет собой величину, определяемую ртутной порометрией.
Среднее соотношение длины и диаметра второго волокнистого материала 14 может составлять, например, более чем 8/1, например, более чем 10/1, более чем 15/1, более чем 20/1, более чем 25/1 или более чем 50/1. Средняя длина второго волокнистого материала 14 может составлять, например, от приблизительно 0,5 мм до 2,5 мм, например, от приблизительно 0,75 мм до 1,0 мм, и средняя ширина (т.е. диаметр) второго волокнистого материала 14 может составлять, например, от приблизительно 5 мкм до 50 мкм, например, от приблизительно 10 мкм до 30 мкм.
В некоторых вариантах осуществления стандартное отклонение длины второго волокнистого материала 14 составляет менее 60% от средней длины второго волокнистого материала 14, например, менее 50% от средней длины, менее 40% от средней длины, менее 25% от средней длины, менее 10% от средней длины, менее 5% от средней длины или даже менее 1% от средней длины.
В некоторых вариантах осуществления площадь поверхности BET второго волокнистого материала превышает 0,1 м2/г, например, превышает 0,25 м2/г, превышает 0,5 м2/г, превышает 1,0 м2/г, превышает 1,5 м2/г, превышает 1,75 м2/г, превышает 5,0 м2/г, превышает 10 м2/г, превышает 25 м2/г, превышает 35 м2/г, превышает 50 м2/г, превышает 60 м2/г, превышает 75 м2/г, превышает 100 м2/г, превышает 150 м2/г, превышает 200 м2/г или даже превышает 250 м2/г. Пористость второго волокнистого материала 14 может, например, превышать 20%, превышать 25%, превышать 35%, превышать 50%, превышать 60%, превышать 70%, например, превышать 80%, превышать 85%, превышать 90%, превышать 92%, превышать 94%, превышать 95%, превышать 97,5%, превышать 99% или даже превышать 99,5%.
В некоторых вариантах осуществления соотношение среднего отношения длины к диаметру первого волокнистого материала и среднего отношения длины к диаметру второго волокнистого материала составляет, например, менее 1,5, например, менее 1,4, менее 1,25, менее 1,1, менее 1,075, менее 1,05, менее 1,025 или даже по существу равно 1.
В конкретных вариантах осуществления второй волокнистый материал снова дробят и полученный волокнистый материал пропускают через второе сито, имеющее средний размер отверстий меньший, чем у первого сита, с получением третьего волокнистого материала. В таких случаях соотношение среднего отношения длины к диаметру второго волокнистого материала и среднего отношения длины к диаметру третьего волокнистого материала может составлять, например, менее 1,5, например, менее 1,4, менее 1,25 или даже менее 1,1.
В некоторых вариантах осуществления третий волокнистый материал пропускают через третье сито с получением четвертого волокнистого материала. Четвертый волокнистый материал можно, например, пропускать через четвертое сито с получением пятого материала. Аналогичные процессы просеивания можно повторять столько раз, сколько желательно, для получения желаемого волокнистого материала, имеющего желательные свойства.
Уплотнение
Уплотненные материалы могут быть переработаны любым из способов, описанных в настоящем документе, или любой материал, описанный в настоящем документе, например, любой волокнистый материал, описанный в настоящем документе, может быть переработан любым одним или несколькими способами, описанными в настоящем документе, а затем уплотнен, как описано в настоящем документе.
Материал, например, волокнистый материал, имеющий низкую объемную плотность, можно уплотнять до продукта, имеющего более высокую объемную плотность. Например, композицию материала, имеющую объемную плотность 0,05 г/см3, можно уплотнять изолированием волокнистого материала в относительно газонепроницаемой структуре, например, в мешке, изготовленном из полиэтилена, или в мешке, изготовленном из чередующихся слоев полиэтилена и нейлона, с последующим удалением из структуры заключенного в нее газа, например, воздуха. После удаления воздуха из структуры волокнистый материал может иметь, например, объемную плотность более 0,3 г/см3, например, 0,5 г/см3, 0,6 г/см3, 0,7 г/см3 или более, например, 0,85 г/см3. После уплотнения продукт можно перерабатывать любым из способов, описанных в настоящем документе, например, облучением, например, гамма-излучением. Это может быть полезно, когда желательно транспортировать материал в другое место, например, в удаленное производственное предприятие, где композиция волокнистого материала может быть добавлена в раствор, например, для получения этанола. После прокалывания по существу газонепроницаемой структуры уплотненный волокнистый материал может возвратиться практически к его первоначальной объемной плотности, например, более 60% от его первоначальной объемной плотности, например, 70%, 80%, 85% или более, например, 95% от его первоначальной объемной плотности. Для уменьшения статического электричества в волокнистом материале в материал может быть добавлено средство, снимающее статические заряды.
В некоторых вариантах осуществления структура, например, мешок, изготовлена из материала, который растворяется в жидкости, такой как вода. Например, структура может быть изготовлена из поливинилового спирта, так что она растворяется при контакте с системой на основе воды. Такие варианты осуществления позволяют добавлять уплотненные структуры непосредственно в растворы, которые включают микроорганизм, без первоначального высвобождения содержимого структуры, например, разрезанием.
Ссылаясь на ФИГ. 5, материал биомассы можно комбинировать с любыми желательными добавками и связующим средством, а затем уплотнять с применением давления, например, пропуская материал через определенный зазор между прижимными валиками со встречным вращением или пропуская материал через пресс для гранулирования. Во время применения давления можно необязательно применять нагревание для облегчения уплотнения волокнистого материала. Затем уплотненный материал можно облучать.
В некоторых вариантах осуществления материал перед уплотнением имеет объемную плотность менее 0,25 г/см3, например, 0,20 г/см3, 0,15 г/см3, 0,10 г/см3, 0,05 г/см3 или менее, например, 0,025 г/см3. Объемную плотность определяют с использованием ASTM D1895B. В кратком изложении, способ включает заполнение образцом мерного цилиндра с известным объемом и определение массы образца. Объемную плотность вычисляют делением массы образца в граммах на известный объем цилиндра в кубических сантиметрах.
Предпочтительные связующие вещества включают связующие вещества, которые растворимы в воде, набухают под действием воды или которые имеют температуру перехода в стеклообразное состояние менее 25°C, при определении дифференциальной сканирующей калориметрией. Под растворимыми в воде связующими веществами подразумевают связующие вещества, имеющие растворимость в воде по меньшей мере приблизительно 0,05 масс.%. Под набухающими в воде связующими веществами подразумевают связующие вещества, объем которых возрастает более чем на 0,5% под действием воды.
В некоторых вариантах осуществления связующие вещества, которые являются растворимыми в воде или набухающими при ее воздействии, включают функциональные группы, которые способны образовывать связь, например, водородную связь, с волокнами волокнистого материала, например, целлюлозного волокнистого материала. Например, функциональная группа может представлять собой группу карбоновой кислоты, карбоксилатную группу, карбонильную группу, например, альдегида или кетона, группу сульфоновой кислоты, сульфонатную группу, группу фосфорной кислоты, фосфатную группу, амидную группу, аминогруппу, гидроксильную группу, например, спирта, и комбинации этих групп, например, группы карбоновой кислоты и гидроксильной группы. Конкретные примеры мономеров включают глицерин, глиоксаль, аскорбиновую кислоту, мочевину, глицин, пентаэритрит, моносахарид или дисахарид, лимонную кислоту и винную кислоту. Подходящие сахариды включают глюкозу, сахарозу, лактозу, рибозу, фруктозу, маннозу, арабинозу и эритрозу. Примеры полимеров включают полигликоли, полиэтиленоксид, поликарбоновые кислоты, полиамиды, полиамины и полисульфоновые кислоты, полисульфонаты. Конкретные примеры полимеров включают полипропиленгликоль (PPG), полиэтиленгликоль (PEG), полиэтиленоксид, например, POLYOX®, сополимеры этиленоксида и пропиленоксида, полиакриловую кислоту (PAA), полиакриламид, полипептиды, полиэтиленимин, поливинилпиридин, поли(натрий-4-стиролсульфонат) и поли(2-акриламидо-метил-1-пропансульфоновую кислоту).
В некоторых вариантах осуществления связующее средство включает полимер, который имеет температуру перехода в стеклообразное состояние менее 25°C. Примеры таких полимеров включают термопластичные эластомеры (TPE). Примеры TPE включают полиэфир-блок-амиды, такие как полиэфир-блок-амиды, доступные под торговым названием PEBAX®, полиэфирные эластомеры, такие как полиэфирные эластомеры, доступные под торговым названием HYTREL®, и стирольные блок-сополимеры, такие как блок-сополимеры, доступные под торговым названием KRATON®. Другие подходящие полимеры, имеющие температуру перехода в стеклообразное состояние менее 25°C, включают сополимер этилена и винилацетата (EVA), полиолефины, например, полиэтилен, полипропилен, сополимеры этилен-пропилен, и сополимеры этилена и альфа-олефинов, например, 1-октена, такие как сополимеры, доступные под торговым названием ENGAGE®. В некоторых вариантах осуществления, например, когда материал представляет собой превращенную в волокнистую массу бумагу с многослойным покрытием, материал уплотняют без добавления специального полимера с низкой температурой перехода в стеклообразное состояние.
В конкретном варианте осуществления связующее вещество представляет собой лигнин, например, природный или синтетически модифицированный лигнин.
Подходящее количество связующего вещества, добавляемого к материалу, вычисленное в расчете на массу сухого вещества, составляет, например, от приблизительно 0,01% до приблизительно 50%, например, 0,03%, 0,05%, 0,1%, 0,25%, 0,5%, 1,0%, 5%, 10% или более, например, 25%, в расчете на общую массу уплотненного материала. Связующее вещество можно добавлять к материалу в виде неразбавленной чистой жидкости, в виде жидкости, в которой растворено связующее вещество, в виде сухого порошка связующего вещества или в виде гранул связующего вещества.
Уплотненный волокнистый материал можно изготавливать в прессе для гранулирования. Ссылаясь на ФИГ. 6, пресс для гранулирования 300 имеет загрузочную воронку 301 для содержания неуплотненного материала 310, который включает углеводсодержащий материал, такой как целлюлоза. Загрузочная воронка соединена со шнеком 312, который приводится в движение двигателем с переменной скоростью 314, так чтобы неуплотненный материал мог транспортироваться в устройство для перемешивания 320, в котором неуплотненный материал перемешивается лопастями 322, которые вращаются с помощью двигателя 330 устройства для перемешивания. Другие ингредиенты, например, любые добавки и/или наполнители, описанные в настоящем документе, могут быть добавлены через входной канал 332. Если желательно, во время нахождения волокнистого материала в устройстве для перемешивания можно добавлять нагревание. После перемешивания материал выводится из устройства для перемешивания через рукав 340 к другому шнеку 342. Рукав, контролируемый приводным механизмом 344, позволяет беспрепятственное прохождение материала из устройства для перемешивания к шнеку. Шнек вращается под действием двигателя 346 и контролирует подачу волокнистого материала в узел матрицы с роликами 350. Конкретно, материал подается в полую цилиндрическую матрицу 352, которая вращается вокруг горизонтальной оси и которая имеет радиальные отверстия 250 матрицы. Матрица 352 вращается вокруг оси под действием двигателя 360, который включает прибор для измерения мощности, указывающий общую энергию, потребляемую двигателем. Уплотненный материал 370, например, в форме гранул, падает из желоба 372 и собирается и перерабатывается, например, облучением.
Удобно, чтобы после уплотнения материал был в виде гранул или стружек, принимающих различную форму. Затем гранулы можно облучать. В некоторых вариантах осуществления гранулы или стружки имеют цилиндрическую форму, например, имея максимальный поперечный размер, например, 1 мм или более, например, 2 мм, 3 мм, 5 мм, 8 мм, 10 мм, 15 мм или более, например, 25 мм. Другие удобные формы включают гранулы или стружки, которые имеют пластинчатую форму, например, имея толщину 1 мм или более, например, 2 мм, 3 мм, 5 мм, 8 мм, 10 мм или более, например, 25 мм; ширину, например, 5 мм или более, например, 10 мм, 15 мм, 25 мм, 30 мм или более, например, 50 мм; и длину 5 мм или более, например, 10 мм, 15 мм, 25 мм, 30 мм или более, например, 50 мм.
Далее, ссылаясь на ФИГ. 7A-7D, гранулы можно изготавливать так, чтобы они имели внутри полость. Как показано, полость может быть расположена, главным образом, на одной линии с центром гранулы (ФИГ. 7B), или она может быть смещена от центра гранулы (ФИГ. 7C). Изготовление гранулы, полой внутри, может повысить скорость растворения в жидкости после облучения.
Далее, ссылаясь на ФИГ. 7D, гранула может иметь, например, поперечную форму, которая является многодольной, например, трехдольной, как показано, или четырехдольной, пятидольной, шестидольной или десятидольной. Изготовление гранул с такой поперечной формой также может повысить скорость растворения в растворе после облучения.
Альтернативно, уплотненный материал может иметь любую другую желаемую форму, например, уплотненный материал может иметь форму пластины, цилиндра или брикета.
Примеры
В одном примере в качестве сырья могут быть использованы картонные коробки для сока объемом полгаллона (1,9 л), изготовленные из белого крафт-картона, имеющего объемную плотность 20 фунт/фут3 (0,32 г/см3). Картон можно складывать до плоского состояния, а затем подавать в устройство для измельчения с получением похожего на конфетти материала, имеющего ширину от 0,1 (0,25 см) дюйма до 0,5 дюйма (1,27 см), длину от 0,25 дюйма (0,63 см) до 1 дюйма (2,54 см) и толщину, эквивалентную толщине исходного материала (приблизительно 0,075 дюйма (0,19 см)). Похожий на конфетти материал можно подавать в резательное устройство с вращающимся ножом, которое дробит похожие на конфетти фрагменты, разрывая фрагменты и высвобождая волокнистый материал.
В некоторых случаях, несколько систем устройство для измельчения-устройство для дробления могут быть расположены с последовательной продукцией. В одном варианте осуществления две системы устройство для измельчения-устройство для дробления могут быть расположены последовательно, где продукт первого устройства для дробления подается в качестве входящего материала во второе устройство для измельчения. В другом варианте осуществления три системы устройство для измельчения-устройство для дробления могут быть расположены последовательно, где продукт первого устройства для дробления подается в качестве входящего материала во второе устройство для измельчения, а продукт второго устройства для дробления подается в качестве входящего материала в третье устройство для измельчения. Ожидается, что несколько прохождений через системы устройство для измельчения-устройство для дробления могут уменьшить размер частиц и увеличить общую площадь поверхности в потоке исходных материалов.
В другом примере волокнистый материал, полученный измельчением и дроблением картонных коробок для сока, может быть обработан для увеличения его объемной плотности. В некоторых случаях, волокнистый материал может быть обрызган водой или разбавленным маточным раствором POLYOX™ WSR N10 (полиэтиленоксид), приготовленным в воде. Затем смоченный волокнистый материал можно переработать в прессе для гранулирования, действующем при комнатной температуре. Прессом для гранулирования можно увеличить объемную плотность потока исходного материала более чем на один порядок.
ПРЕДВАРИТЕЛЬНАЯ ОБРАБОТКА
Физически подготовленное сырье можно предварительно обрабатывать для использования в способах основной продукции, например, путем снижения средней молекулярной массы и кристалличности сырья и/или увеличения площади поверхности и/или пористости сырья. В некоторых вариантах осуществления целлюлозный и/или лигноцеллюлозный материал включает первую целлюлозу, имеющую первую среднечисленную молекулярную массу, и полученный углевод включает вторую целлюлозу, имеющую вторую среднечисленную молекулярную массу, которая ниже, чем первая среднечисленная молекулярная масса. Например, вторая среднечисленная молекулярная масса ниже, чем первая среднечисленная молекулярная масса, более чем приблизительно на 25%, например, она может быть меньше в 2×, 3×, 5×, 7×, 10×, 25× и даже 100×.
В некоторых вариантах осуществления первая целлюлоза имеет первую кристалличность, а вторая целлюлоза имеет вторую кристалличность, которая ниже, чем первая кристалличность, например, приблизительно на 2, 3, 5, 10, 15 или 25%.
В некоторых вариантах осуществления первая целлюлоза имеет первый уровень окисления, а вторая целлюлоза имеет второй уровень окисления, превышающий первый уровень окисления, например, на 2, 3, 4, 5, 10 или 25%.
Способы предварительной обработки могут включать один или несколько способов, выбранных из облучения, обработки ультразвуком, окисления, пиролиза и парового взрыва. Можно использовать различные системы предварительной обработки, комбинируя две, три или даже четыре из этих технологий.
Комбинированная предварительная обработка
В некоторых вариантах осуществления биомассу можно перерабатывать с использованием двух или более любых способов, описанных в настоящем документе, таких как два, три, четыре или более способов, выбранных из радиационного облучения, обработки ультразвуком, окисления, пиролиза и парового взрыва, либо до, либо в промежутке, либо после подготовки сырья, как описано в настоящем документе. Способы можно применять к биомассе в любом порядке или одновременно. Например, углевод можно получать, применяя радиационное облучение, обработку ультразвуком, окисление, пиролиз, и, необязательно, паровой взрыв к целлюлозному и/или лигноцеллюлозному материалу (в любом порядке или одновременно). Затем полученный углеводсодержащий материал может быть конвертирован одним или несколькими микроорганизмами, такими как бактерии, дрожжи или смеси дрожжей и бактерий, в ряд желаемых продуктов, как описано в настоящем документе. Комплексные способы могут обеспечить получение материалов, которые могут более легко утилизироваться различными микроорганизмами вследствие их более низкой молекулярной массы, более низкой кристалличности и/или более высокой растворимости. Комплексные способы могут обеспечить синергию и могут снизить общие требуемые затраты энергии по сравнению с любым отдельным способом.
Например, в некоторых вариантах осуществления предоставлено сырье, которое включает углевод, полученный способом, который включает облучение и обработку ультразвуком, облучение и окисление, облучение и пиролиз или облучение и паровой взрыв (в любом порядке или одновременно) целлюлозного и/или лигноцеллюлозного материала. Затем предоставленное сырье можно привести в контакт с микроорганизмом, обладающим способностью конвертировать по меньшей мере часть, например, по меньшей мере приблизительно 1 масс.%, сырья в продукт, такой как сгораемое топливо.
Условия предварительной обработки
В некоторых вариантах осуществления способ не включает гидролиз целлюлозного и/или лигноцеллюлозного материала, в частности, кислотой или основанием, например, минеральной кислотой, такой как хлористоводородная или серная кислота. Если желательно, часть сырья может включать гидролизованный материал, или может не включать его. Например, в некоторых вариантах осуществления по меньшей мере приблизительно 70 масс.% сырья представляют собой негидролизованный материал, например, по меньшей мере 95 масс.% сырья представляют собой негидролизованный материал. В некоторых вариантах осуществления по существу все сырье представляет собой негидролизованный материал.
Любое сырье или любой реактор или ферментер, загруженный сырьем, может включать буфер, такой как бикарбонат натрия, хлорид аммония или Tris; электролит, такой как хлорид калия, хлорид натрия или хлорид кальция; фактор роста, такой как биотин, и/или пару оснований, таких как урацил или его эквивалент; поверхностно-активное вещество, такое как Tween® или полиэтиленгликоль; минерал, такой как кальций, хром, медь, йод, железо, селен или цинк; или хелатирующий агент, такой как этилендиамин, этилендиаминтетрауксусная кислота (ЭДТА) (или ее солевая форма, например, ЭДТА натрия или калия) или димеркапрол.
Когда используют радиационное облучение, его можно применять для любого образца, который является сухим или влажным, или даже диспергированным в жидкости, такой как вода. Например, облучение можно проводить на целлюлозном и/или лигноцеллюлозном материале, в котором менее чем приблизительно 25 масс.% целлюлозного и/или лигноцеллюлозного материала имеет поверхность, смоченную жидкостью, такой как вода. В некоторых вариантах осуществления облучение проводят на целлюлозном и/или лигноцеллюлозном материале, в котором целлюлозный и/или лигноцеллюлозный материал по существу не смочен жидкостью, такой как вода.
В некоторых вариантах осуществления любую переработку, описанную в настоящем документе, проводят после того, как целлюлозный и/или лигноцеллюлозный материал остается сухим в полученном виде или после его высушивания, например, с использованием нагревания и/или пониженного давления. Например, в некоторых вариантах осуществления целлюлозный и/или лигноцеллюлозный материал имеет менее чем приблизительно 5 масс.% удерживаемой воды, измеренной при 25°C и при относительной влажности 50%.
Если желательно, в любом способе, описанном в настоящем документе, можно использовать вызывающее набухание средство, как определено в настоящем документе. В некоторых вариантах осуществления, когда целлюлозный и/или лигноцеллюлозный материал перерабатывают с использованием радиационного облучения, менее чем приблизительно 25 масс.% целлюлозного и/или лигноцеллюлозного материала находится в набухшем состоянии, причем набухшее состояние характеризуется как наличие объема, более чем на 2,5% превышающего объем в ненабухшем состоянии, например, более чем на 5,0, 7,5, 10 или 15% превышающего объем в ненабухшем состоянии. В некоторых вариантах осуществления, когда в отношении целлюлозного и/или лигноцеллюлозного материала применяют радиационное облучение, целлюлозный и/или лигноцеллюлозный материал по существу не находится в набухшем состоянии. В конкретных вариантах осуществления, когда используют радиационное облучение, целлюлозный и/или лигноцеллюлозный материал включает вызывающее набухание средство, и набухший целлюлозный и/или лигноцеллюлозный материал получает дозу менее чем приблизительно 10 Мрад.
Когда в каком-либо способе используют радиационное облучение, его можно применять при одновременном воздействии на целлюлозный и/или лигноцеллюлозный материал воздуха, обогащенного кислородом воздуха или даже самого кислорода, или он может находиться под инертным газом, таким как азот, аргон или гелий. Если желательно максимальное окисление, то может быть использована окислительная атмосфера, такая как воздух или кислород.
Когда используют радиационное облучение, его можно применять к биомассе, такой как целлюлозный и/или лигноцеллюлозный материал, при давлении более чем приблизительно 2,5 атмосферы (253 кПа), например, более чем 5 (506 кПа), 10 (1012 кПа), 15 (1518 кПа), 20 (2036 кПа) или даже более чем приблизительно 50 атмосфер (5060 кПа).
Обработка радиационным излучением
Для переработки исходного сырья из широкого множества различных источников можно использовать одну или несколько последовательностей переработки в целях экстракции из сырья полезных веществ, а также в целях получения частично деградированного органического материала, который выполняет функцию входящего потока в последующих стадиях и/или последовательностях переработки. Облучение может снижать молекулярную массу и/или кристалличность сырья. В некоторых вариантах осуществления для облучения материалов используют энергию, накопленную в материале, которая высвобождает электрон из его атомной орбитали. Радиационное облучение можно осуществлять с помощью 1) тяжелых заряженных частиц, таких как альфа-частицы или протоны, 2) электронов, образованных, например, при бета-распаде или в ускорителях электронных пучков, или 3) электромагнитного радиационного излучения, например, гамма-лучей, рентгеновских лучей или ультрафиолетовых лучей. При одном подходе для облучения сырья можно использовать радиационное излучение, генерируемое радиоактивными веществами. В некоторых вариантах осуществления можно использовать любую комбинацию из (1)-(3) в любом порядке или одновременно. При другом подходе для облучения сырья можно использовать электромагнитное излучение (например, генерируемое с использованием источников электронных пучков). Применяемые дозы зависят от желаемого эффекта и конкретного сырья. Например, высокие дозы радиационного облучения могут разрушать химические связи в компонентах сырья, а низкие дозы радиационного облучения могут повысить образование химических связей (например, поперечное сшивание) в компонентах сырья. В некоторых случаях, когда желательно расщепление цепи и/или желательна функционализация цепи полимера, можно использовать более тяжелые, чем электроны, частицы, такие как протоны, группа ядер гелия, ионы аргона, ионы кремния, ионы неона, ионы углерода, ионы фосфора, ионы кислорода или ионы азота. Когда желательно расщепление цепи с раскрытием кольца, положительно заряженные частицы можно использовать как имеющие свойства кислоты Льюиса для усиленного расщепления цепи с раскрытием кольца. Например, когда являются желательными кислородсодержащие функциональные группы, можно проводить облучение в присутствии кислорода или даже облучение ионами кислорода. Например, когда являются желательными азотсодержащие функциональные группы, можно проводить облучение в присутствии азота или даже облучение ионами азота.
Ссылаясь на ФИГ. 8, в одном способе первый материал 2, который представляет собой или включает целлюлозу, имеющую первую среднечисленную молекулярную массу (TMN1), облучают, например, обработкой ионизирующим излучением (например, в форме гамма-излучения, рентгеновского излучения, ультрафиолетового (УФ) света от 100 нм до 280 нм, пучка электронов или других заряженных частиц), с получением второго материала 3, который включает целлюлозу, имеющую вторую среднечисленную молекулярную массу (TMN2), которая ниже, чем первая среднечисленная молекулярная масса. Второй материал (или первый и второй материал) можно смешивать с микроорганизмом (например, бактерией или дрожжами), который может утилизировать второй и/или первый материал, продуцируя топливо 5, которое представляет собой или включает водород, спирт (например, этанол или бутанол, такой как н-, втор- или трет-бутанол), органическую кислоту, углеводород или смеси любых из них.
Поскольку второй материал 3 имеет целлюлозу, обладающую сниженной молекулярной массой относительно первого материала, и, в некоторых случаях, также сниженной кристалличностью, второй материал, как правило, является более способным к диспергированию, набуханию и/или растворению в растворе, содержащем микроорганизм. Эти свойства делают второй материал 3 более подверженным химическому, ферментативному и/или биологическому воздействию относительно первого материала 2, что может в значительной степени повысить скорость продукции и/или уровень продукции желаемого продукта, например, этанола. Радиационным облучением также можно стерилизовать материалы.
В некоторых вариантах осуществления вторая среднечисленная молекулярная масса (MN2) ниже, чем первая среднечисленная молекулярная масса (TMN1), более чем приблизительно на 10%, например, на 15, 20, 25, 30, 35, 40, 50%, 60%, или даже более чем приблизительно на 75%.
В некоторых случаях второй материал имеет целлюлозу, которая обладает кристалличностью (TC2), которая ниже, чем кристалличность (TC1) целлюлозы первого материала. Например, (TC2) может быть ниже, чем (TC1), более чем приблизительно на 10%, например, на 15, 20, 25, 30, 35, 40, или даже более чем приблизительно на 50%.
В некоторых вариантах осуществления исходный индекс кристалличности (перед облучением) составляет от приблизительно 40 до приблизительно 87,5%, например, от приблизительно 50 до приблизительно 75% или от приблизительно 60 до приблизительно 70%, и индекс кристалличности после облучения составляет от приблизительно 10 до приблизительно 50%, например, от приблизительно 15 до приблизительно 45% или от приблизительно 20 до приблизительно 40%. Однако, в некоторых вариантах осуществления, например, после экстенсивного облучения, индекс кристалличности может составлять менее чем 5%. В некоторых вариантах осуществления материал после облучения является по существу аморфным.
В некоторых вариантах осуществления исходная среднечисленная молекулярная масса (перед облучением) составляет от приблизительно 200000 до приблизительно 3200000, например, от приблизительно 250000 до приблизительно 1000000 или от приблизительно 250000 до приблизительно 700000, и среднечисленная молекулярная масса после облучения составляет от приблизительно 50000 до приблизительно 200000, например, от приблизительно 60000 до приблизительно 150000 или от приблизительно 70000 до приблизительно 125000. Однако, в некоторых вариантах осуществления, например, после экстенсивного облучения, среднечисленная молекулярная масса может составлять менее чем приблизительно 10000 или даже менее чем приблизительно 5000.
В некоторых вариантах осуществления второй материал может иметь уровень окисления (TO2), превышающий уровень окисления (TO1) первого материала. Более высокий уровень окисления материала может содействовать его способности к диспергированию, набуханию и/или растворению, дополнительно усиливая подверженность материалов химическому, ферментативному или биологическому воздействию. В некоторых вариантах осуществления, для повышения уровня окисления второго материала относительно первого материала, облучение проводят в окислительной атмосфере, например, в атмосфере воздуха или кислорода, получая второй материал, который является более окисленным, чем первый материал. Например, второй материал может иметь большее количество гидроксильных групп, альдегидных групп, кетоновых групп, сложноэфирных групп или групп карбоновой кислоты, которые могут повышать его гидрофильность.
Ионизирующее излучение
Каждая форма радиационного излучения ионизирует биомассу через конкретные взаимодействия, определяемые энергией радиационного излучения. Тяжелые заряженные частицы в основном ионизируют вещество через кулоновское рассеяние; более того, эти взаимодействия генерируют энергетические электроны, которые могут далее ионизировать вещество. Альфа-частицы идентичны ядру атома гелия и образуются путем альфа-распада различных радиоактивных ядер, таких как изотопы висмута, полония, астата, радона, франция, радия, некоторых актиноидов, таких как актиний, торий, уран, нептуний, кюрий, калифорний, америций и плутоний.
Когда используют частицы, они могут быть нейтральными (незаряженными), положительно заряженными или отрицательно заряженными. Когда они заряжены, заряженные частицы могут нести один положительный или отрицательный заряд, или несколько зарядов, например, один, два, три или даже четыре или более зарядов. В случаях, когда желательно расщепление цепи, могут быть желательными положительно заряженные частицы, отчасти, вследствие их кислотного характера. Когда используют частицы, частицы могут иметь массу покоящегося электрона или массу, превышающую, например, в 500, 1000, 1500 или 2000, или более раз массу покоящегося электрона. Например, частицы могут иметь массу от приблизительно 1 атомной единицы до приблизительно 150 атомных единиц, например, от приблизительно 1 атомной единицы до приблизительно 50 атомных единиц или от приблизительно 1 до приблизительно 25, например, 1, 2, 3, 4, 5, 10, 12 или 15 атомных единиц. Ускорители, используемые для ускорения частиц, могут быть DC-электростатическими, DC-электродинамическими, RF-линейными, линейными с магнитной индукцией или непрерывными. Например, циклотронные ускорители доступны от IBA, Belgium, такие как система Rhodotron®, а ускорители DC-типа доступны от RDI, в настоящее время IBA Industrial, такие как Dynamitron®. Ионы и ускорители ионов рассмотрены в публикациях Introductory Nuclear Physics, Kenneth S. Krane, John Wiley & Sons, Inc. (1988), Krsto Prelec, FIZIKA B 6 (1997) 4, 177-206, копия которой прилагается в виде приложения B, Chu, William T., "Overview of Light-Ion Beam Therapy", Columbus-Ohio, ICRU-IAEA Meeting, 18-20 March 2006, копия которой прилагается к настоящему документу в приложении C, Iwata, Y. et al, "Alternating-Phase-Focused 1H-DTL for Heavy-Ion Medical Accelerators", Proceedings of EPAC 2006, Edinburgh, Scotland, копия которых прилагается к настоящему документу в виде приложения D, и Leitner, CM. et al., "Status of the Superconducting ECR Ion Source Venus", Proceedings of EPAC 2000, Vienna, Austria, которая прилагается к настоящему документу в виде приложения E.
Электроны взаимодействуют путем кулоновского рассеяния и торможения радиационного излучения, вызываемого изменениями скорости электронов. Электроны могут генерироваться радиоактивными ядрами, которые претерпевают бета-распад, такими как изотопы йода, цезия, технеция и иридия. Альтернативно, в качестве источника электронов на основе термоионной эмиссии можно использовать электронную пушку.
Электромагнитное радиационное излучение воздействует посредством следующих трех процессов: фотоэлектрическое поглощение, комптоновское рассеяние и образование пар. Преобладающее воздействие определяется энергией падающего радиационного излучения и атомного числа материала. Сумма взаимодействий, приводящих к поглощению радиационного излучения в целлюлозном материале, может быть выражена с помощью массового коэффициента поглощения.
Электромагнитное излучение подразделяют на гамма-лучи, рентгеновские лучи, ультрафиолетовые лучи, инфракрасные лучи, микроволны или радиоволны, в зависимости от длины волны.
Например, для облучения материалов можно использовать гамма-излучение. Ссылаясь на ФИГ. 9 и 10 (увеличенный вид области R), гамма-излучатель 10 включает источники гамма-излучения 408, например, таблетки60Co, рабочий стол 14 для содержания материалов, подлежащих облучению, и накопитель 16, например, изготовленный из множества железных пластин, все из которых находятся в камере с бетонной защитой (хранилище) 20, которая включает вход в виде лабиринта 22 позади освинцованной двери 26. Накопитель 16 включает множество каналов 30, например, шестнадцать или более каналов, позволяющих источникам гамма-излучения проходить на своем пути через накопитель вблизи рабочего стола.
В процессе работы образец, подлежащий облучению, помещают на рабочий стол. Облучатель сконфигурирован так, чтобы доставлять желаемый уровень дозы и чтобы с экспериментальным блоком 31 было соединено управляющее оборудование. Затем оператор покидает защитную камеру, проходя через вход в виде лабиринта и через освинцованную дверь. Оператор обслуживает контрольную панель 32, инструктируя компьютер 33 о приведении источников радиационного излучения 12 в рабочее положение с использованием цилиндра 36, присоединенного к гидравлическому насосу 40.
Гамма-излучение обладает преимуществом значительной глубины проникновения в различные материалы образца. Источники гамма-лучей включают радиоактивные ядра, такие как изотопы кобальта, кальция, технеция, хрома, галлия, индия, йода, железа, криптона, самария, селена, натрия, таллия и ксенона.
Источники рентгеновских лучей включают столкновение электронного пучка с металлическими мишенями, такими как вольфрам или молибден, или сплавы, или компактные источники света, такие как источники света, производимые коммерчески Lyncean.
Источники ультрафиолетового излучения включают дейтериевые или кадмиевые лампы.
Источники инфракрасного излучения включают керамические лампы с окном из сапфира, цинка или селенидов.
Источники микроволн включают клистроны, источники Slevin RF-типа или источники атомных пучков, в которых используется газообразный водород, кислород или азот.
В способах, описанных в настоящем документе, можно использовать различные другие устройства для облучения, включая полевые ионизационные источники, электростатические сепараторы ионов, полевые ионизационные генераторы, источники с термоионной эмиссией, источники ионов со сверхвысокочастотным разрядом, рециркуляционные или статические ускорители, динамические линейные ускорители, ускорители Ван-де-Граафа и изогнутые тандемные ускорители. Такие устройства раскрыты, например, в предварительной заявке США с серийным № 61/073665, содержание которой полностью включено в настоящий документ в качестве ссылки.
Электронный пучок
В некоторых вариантах осуществления в качестве источника радиационного излучения используют пучок электронов. Пучок электронов обладает преимуществом высоких уровней доз (например, 1, 5 или даже 10 Мрад в секунду), высокой производительности, меньшей защитной изоляции и меньшего количества изолирующего оборудования. Электроны также могут быть более эффективными в отношении обеспечения расщепления цепи. Кроме того, электроны, обладающие энергией 4-10 МэВ, могут иметь глубину проникновения от 5 до 30 мм или более, например, 40 мм.
Электронные пучки можно генерировать, например, с помощью электростатических генераторов, каскадных генераторов, трансформаторных генераторов, низкоэнергетических ускорителей со сканирующей системой, низкоэнергетических ускорителей с линейным катодом, линейных ускорителей и импульсных ускорителей. Электроны могут быть пригодны в качестве источника ионизирующего излучения, например, для относительно тонких стопок материалов, например, менее чем 0,5 дюйма (1,27 см), например, менее чем 0,4 дюйма (1,02 см), 0,3 дюйма (0,76 см), 0,2 дюйма (0,51 см) или менее чем 0,1 дюйма (0,25). В некоторых вариантах осуществления энергия каждого электрона в электронном пучке составляет от приблизительно 0,3 МэВ до приблизительно 2,0 МэВ (мегаэлектронвольт), например, от приблизительно 0,5 МэВ до приблизительно 1,5 МэВ или от приблизительно 0,7 МэВ до приблизительно 1,25 МэВ.
На ФИГ. 11A представлена принципиальная технологическая схема 3000, которая включает различные стадии в последовательности предварительной обработки сырья электронным пучком. На первой стадии 3010 сухое сырье подается из источника исходного материала. Как рассмотрено выше, сухое сырье из источника исходного материала может быть предварительно переработано перед доставкой к устройствам для облучения электронным пучком. Например, если сырье получено из растительных источников, определенные части растительного материала могут быть удалены перед сбором растительного материала и/или перед доставкой растительного материала с помощью устройства для транспортировки сырья. Альтернативно или дополнительно, как отражено на необязательной стадии 3020, сырье биомассы можно подвергать механической переработке (например, для уменьшения средней длины волокон в сырье) перед доставкой к устройствам для облучения электронным пучком.
На стадии 3030 сухое сырье перемещается в устройство для транспортировки сырья (например, на конвейерную ленту) и распределяется по поперечной длине устройства для транспортировки сырья приблизительно равномерно по объему. Это можно осуществлять, например, вручную или путем индукции локализованного вибрационного движения в некоторой точке устройства для транспортировки сырья перед переработкой путем облучения электронным пучком.
В некоторых вариантах осуществления, смесительная система подает химический реагент 3045 в сырье в необязательном процессе 3040, в котором образуется суспензия. Объединение воды с переработанным сырьем в стадии смешивания 3040 приводит к водной суспензии сырья, которую можно транспортировать, например, через систему труб, а не с использованием, например, конвейерной ленты.
Следующая стадия 3050 представляет собой цикл, который охватывает воздействие на сырье (в сухой форме или в форме суспензии) облучения электронного пучка из одного или нескольких (например, N) устройств для облучения электронным пучком. Суспензия сырья продвигается через каждый из N "потоков" электронных пучков на стадии 3052. Движение через потоки и между ними может происходить с постоянной скоростью, или во время прохождения сквозь каждый поток может быть пауза, с последующим быстрым перемещением к следующему потоку. На стадии 3053 небольшая часть суспензии сырья подвергается воздействию каждого потока в течение некоторого заданного времени воздействия.
Устройства для облучения электронным пучком могут быть коммерчески приобретены от Ion Beam Applications, Louvain-la-Neuve, Belgium или the Titan Corporation, San Diego, CA. Типичная энергия электронов может составлять 1 МэВ, 2 МэВ, 4,5 МэВ, 7,5 МэВ или 10 МэВ. Типичная мощность устройства для облучения электронным пучком может составлять 1 кВт, 5 кВт, 10 кВт, 20 кВт, 50 кВт, 100 кВт, 250 кВт или 500 кВт. Эффективность деполимеризации суспензии сырья зависит от используемой энергии электронов и применяемой дозы, в то время как время воздействия зависит от мощности и дозы. Типичные дозы могут иметь значения 1 кГр, 5 кГр, 10 кГр, 20 кГр, 50 кГр, 100 кГр или 200 кГр.
При выборе оптимальных характеристик мощности устройства для облучения электронным пучком учитывают затраты на работу, капитальные затраты, амортизационные затраты и зона размещения устройства. При выборе оптимальных уровней экспозиционной дозы облучения электронным пучком учитывают расход энергии и вопросы экологии, безопасности и здоровья (ESH). При выборе оптимальной энергии электронов учитывают расход энергии; в данном случае, более низкая энергия электронов может быть выгодной с точки зрения содействия деполимеризации определенной суспензии сырья (см., например, Bouchard, et al., Cellulose (2006) 13: 601-610). Как правило, генераторы размещены в хранилищах, например, из свинца или бетона, или освинцованного бетона.
Для обеспечения более эффективного процесса деполимеризации может быть полезным проведение облучения электронным пучком с двойным проходом. Например, устройство для транспортировки сырья может направлять сырье (в сухой форме или в форме суспензии) вниз и в обратном направлении относительно его первоначального направления транспортировки. Системы с двойным проходом могут обеспечить переработку более густых суспензий сырья и могут обеспечить более однородную деполимеризацию сквозь толщину суспензии сырья.
Устройство для облучения электронным пучком может генерировать либо фиксированный луч, либо сканирующий луч. Преимущественным может быть сканирующий луч с большой длиной развертки сканирования и высокими скоростями сканирования, поскольку это может эффективно заменить большую ширину фиксированного луча. Кроме того, доступна длина развертки 0,5 м, 1 м, 2 м или более.
После того как часть суспензии сырья будет транспортирована через N устройств для облучения электронным пучком, в некоторых вариантах осуществления может быть необходимым, как на стадии 3060, механическое разделение жидких и твердых компонентов суспензии сырья. В этих вариантах осуществления из жидкой части суспензии сырья отфильтровывают остаточные твердые частицы и возвращают их на стадию приготовления суспензии 3040. Затем твердую часть суспензии сырья перемещают на следующую стадию переработки 3070 с помощью устройства для транспортировки сырья. В других вариантах осуществления сырье поддерживают в форме суспензии для дополнительной переработки.
Электромагнитное излучение
В вариантах осуществления, в которых облучение проводят с помощью электромагнитного излучения, электромагнитное излучение может иметь, например, энергию на фотон (в электронвольтах) более 102 эВ, например, более 103, 104, 105, 106 или даже более 107 эВ. В некоторых вариантах осуществления электромагнитное излучение имеет энергию на фотон от 104 до 107, например, от 105 до 106 эВ. Электромагнитное излучение может иметь частоту, например, более 1016 Гц, более 1017 Гц, 1018, 1019, 1020 или даже более 1021 Гц. В некоторых вариантах осуществления электромагнитное излучение имеет частоту от 1018 до 1022 Гц, например, от 1019 до 1021 Гц.
Дозы
В некоторых вариантах осуществления облучение (с любым источником радиационного излучения или комбинацией источников) проводят до тех пор, пока материал не получит дозу по меньшей мере 0,25 Мрад, например, по меньшей мере 1,0 Мрад, по меньшей мере 2,5 Мрад, по меньшей мере 5,0 Мрад или по меньшей мере 10,0 Мрад. В некоторых вариантах осуществления облучение проводят до тех пор, пока материал не получит дозу от 1,0 Мрад до 6,0 Мрад, например, от 1,5 Мрад до 4,0 Мрад.
В некоторых вариантах осуществления облучение проводят при уровне дозы от 5,0 до 1500,0 килорад/час, например, от 10,0 до 750,0 килорад/час или от 50,0 до 350,0 килорад/час.
В некоторых вариантах осуществления используют два или более источников радиационного излучения, таких как два или более источников ионизирующего излучения. Например, образцы можно обрабатывать, в любом порядке, пучком электронов, а затем гамма-излучением и УФ-излучением, имеющим длину волны от приблизительно 100 нм до приблизительно 280 нм. В некоторых вариантах осуществления образцы обрабатывают с использованием трех источников ионизирующего излучения, таких как пучок электронов, гамма-излучение и энергетическое УФ-излучение.
Альтернативно, в другом примере волокнистый материал, который включает целлюлозный и/или лигноцеллюлозный материал, облучают и, необязательно, обрабатывают звуковой энергией, например, ультразвуком.
В одном примере в качестве сырья используют картонные коробки для сока объемом в полгаллона (1,9 л), изготовленные из белого крафт-картона, имеющего объемную плотность 20 фунт/фут3 (0,32 г/см3). Картон можно складывать до плоского состояния, а затем подавать в последовательность из трех систем устройство для измельчения-устройство для дробления, расположенных последовательно, где продукт первого устройства для дробления подается в качестве входящего материала во второе устройство для измельчения, а продукт второго устройства для дробления подается в качестве входящего материала в третье устройство для измельчения. Волокнистый материал, полученный в системе устройство для измельчения-устройство для дробления, может быть обрызган водой и переработан с помощью пресса для гранулирования, работающего при комнатной температуре. Уплотненные гранулы можно поместить в стеклянную ампулу, из которой откачивают воздух при высоком вакууме, а затем вновь заполнить газообразным аргоном. Ампулу запаивают в атмосфере аргона. Альтернативно, в другом примере ампулу запаивают в атмосфере воздуха. Гранулы в ампуле облучают гамма-излучением в течение приблизительно 3 часов при уровне дозы приблизительно 1 Мрад в час с получением облученного материала, в котором целлюлоза имеет более низкую молекулярную массу, чем исходный материал.
Добавки для усиления снижения молекулярной массы в процессе облучения
В некоторых вариантах осуществления, перед облучением, к биомассе могут быть добавлены различные материалы, например, твердые вещества или жидкости, для усиления снижения молекулярной массы. В случаях, когда используется жидкость, жидкость может контактировать с наружными поверхностями биомассы и/или жидкость может находиться во внутренних частях биомассы, например, она может быть влита в биомассу.
Например, материал может представлять собой нейтральное слабое основание, такое как аланин, аммиак, смесь аммиак/вода, например, 25 масс.% аммиака в воде, вода, метиламин, диметиламин, триметиламин, пиридин, или анионное основание, такое как соль уксусной кислоты (например, ацетат натрия), карбонат натрия, бикарбонат натрия или соль иона сероводорода (например, гидросульфид натрия).
Альтернативно, материал может представлять собой нейтральную слабую кислоту, такую как муравьиная кислота, уксусная кислота, трихлоруксусная кислота, водород, сероводородная кислота, или катионную кислоту, такую как соль аммония.
Гашение и контролируемая функционализация биомассы
После обработки одним или несколькими типами ионизирующего излучения, такими как фотонное излучение (например, рентгеновские лучи или гамма-лучи), облучение электронным пучком или частицы тяжелее электронов, которые положительно или отрицательно заряжены (например, протоны или ионы углерода), любые из углеводсодержащих материалов или смесей, описанных в настоящем документе, становятся ионизированными; т.е. они включают радикалы на уровнях, которые поддаются детекции с помощью спектрометра электронного спинового резонанса. Современный практический предел детекции радикалов составляет приблизительно 1014 спинов при комнатной температуре. После ионизации любой материал биомассы, который был ионизирован, можно гасить для снижения уровня радикалов в ионизированной биомассе, например, так чтобы радикалы более не поддавались детекции с помощью спектрометра электронного спинового резонанса. Например, радикалы можно гасить, применяя достаточное давление на биомассу и/или используя текучую среду, контактирующую с ионизированной биомассой, такую как газ или жидкость, которая реагирует (гасит) с радикалами. Использование газа или жидкости по меньшей мере для содействия гашению радикалов также позволяет оператору контролировать функционализацию ионизированной биомассы желаемым количеством и типом функциональных групп, таких как группы карбоновой кислоты, енольные группы, альдегидные группы, нитрогруппы, нитрильные группы, аминогруппы, алкиламиногруппы, алкильные группы, хлоралкильные группы или хлорфторалкильные группы. В некоторых случаях такое гашение может повысить стабильность некоторых из ионизированных материалов биомассы. Например, гашение может повысить устойчивость биомассы к окислению. Функционализация путем гашения также может повысить растворимость любой биомассы, описанной в настоящем документе, может повысить ее термическую стабильность, которая может быть важна при изготовлении композитов и картонов, описанных в настоящем документе, и может улучшить утилизацию материала различными микроорганизмами. Например, функциональные группы, которыми наделен материал биомассы в результате гашения, могут действовать в качестве рецепторных участков для связывания микроорганизмами, например, для усиления гидролиза целлюлозы различными микроорганизмами.
На ФИГ. 11B проиллюстрировано изменение молекулярной и/или надмолекулярной структуры сырья биомассы путем предварительной обработки сырья биомассы ионизирующим излучением, таким как электроны или ионы с энергией, достаточной для ионизации сырья биомассы, с обеспечением первого уровня радикалов. Как показано на ФИГ. 11B, если ионизированная биомасса остается в атмосфере, она окисляется, например, до такой степени, что образуются группы карбоновой кислоты за счет реакции с атмосферным кислородом. В некоторых случаях для некоторых материалов такое окисление является желательным, поскольку оно может способствовать дальнейшему снижению молекулярной массы углеводсодержащей биомассы, и окислительные группы, например, группы карбоновой кислоты, в некоторых случаях могут быть полезными для растворимости и утилизации микроорганизмом. Однако поскольку радикалы могут "жить" в течение некоторого времени после облучения, например, более 1 суток, 5 суток, 30 суток, 3 месяцев, 6 месяцев или даже более 1 года, свойства материала могут продолжать меняться с течением времени, что, в некоторых случаях, может быть нежелательным. Детекция радикалов в облученных образцах с помощью спектроскопии электронного спинового резонанса и время жизни радикалов в таких образцах рассмотрены в публикациях Bartolotta et al., Physics in Medicine and Biology, 46 (2001), 461-471 и Bartolotta et al., Radiation Protection Dosimetry, Vol. 84, Nos. 1-4, pp. 293-296 (1999), которые прилагаются к настоящему документу в виде приложения F и приложения G, соответственно. Как представлено на ФИГ. 11B, ионизированную биомассу можно гасить для функционализации и/или стабилизации ионизированной биомассы. В любой момент времени, например, когда материал является "живым", "частично живым" или полностью погашенным, предварительно обработанную биомассу можно конвертировать в продукт, например, топливо, продукт питания или композит.
В некоторых вариантах осуществления гашение включает применение давления к биомассе, например, путем механической деформации биомассы, например, прямым механическим сжатием биомассы в одном, двух или трех измерениях, или применяя давление к текучей среде, в которую биомасса погружена, например, изостатическое прессование. В таких случаях деформация материала сама по себе дает радикалы, которые часто захватываются в кристаллические домены, достаточно близко для того, чтобы радикалы могли рекомбинировать или реагировать с другой группой. В некоторых случаях давление применяют вместе с применением нагревания, такого как количество тепла, достаточное для повышения температуры биомассы до уровня выше температуры плавления или до температуры размягчения компонента биомассы, такого как лигнин, целлюлоза или гемицеллюлоза. Нагревание может увеличить молекулярную подвижность в полимерном материале, что может способствовать гашению радикалов. Если для гашения используют давление, то оно может быть выше приблизительно 1000 фунт/кв. дюйм (6,9 МПа), например, выше приблизительно 1250 фунт/кв. дюйм (8,6 МПа), 1450 фунт/кв. дюйм (10 МПа), 3625 фунт/кв. дюйм (25,2 МПа), 5075 фунт/кв. дюйм (35 МПа), 7250 фунт/кв. дюйм (50 МПа), 10000 фунт/кв. дюйм (69 МПа) или даже выше 15000 фунт/кв. дюйм (103,4 МПа).
В некоторых вариантах осуществления гашение включает приведение в контакт биомассы с текучей средой, такой как жидкость или газ, например, газ, способный реагировать с радикалами, такой как ацетилен или смесь ацетилена в азоте, этилен, хлорированные этилены или хлорфторэтилены, пропилен или смеси этих газов. В других конкретных вариантах осуществления гашение включает приведение в контакт биомассы с жидкостью, например, с жидкостью, растворимой в биомассе, или по меньшей мере способной проникать в биомассу и реагировать с радикалами, такими как диен, такой как 1,5-циклооктадиен. В некоторых конкретных вариантах осуществления гашение включает приведение в контакт биомассы с антиоксидантом, таким как витамин E. Если желательно, сырье биомассы может включать антиоксидант, диспергированный в нем, и гашение может происходить вследствие того, что антиоксидант, диспергированный в сырье биомассы, контактирует с радикалами.
Возможны другие способы гашения. Например, для гашения любого ионизированного материала биомассы, описанного в настоящем документе, можно использовать любой способ гашения радикалов в полимерных материалах, описанный Muratoglu et al., публикация патентной заявки США № 2008/0067724 и Muratoglu et al., патент США № 7166650, которые прилагаются в виде приложения H и приложения I, соответственно. Кроме того, для гашения любого ионизированного материала биомассы можно использовать любой агент для гашения (описанный как "сенсибилизирующий агент" в указанных выше описаниях Muratoglu) и/или любой антиоксидант, описанный в любой ссылке Muratoglu.
Функционализацию можно усилить с использованием тяжелых заряженных ионов, таких как любой из более тяжелых ионов, описанных в настоящем документе. Например, если желательно усилить окисление, для облучения можно использовать заряженные ионы кислорода. Если желательны азотные функциональные группы, то можно использовать ионы азота или ионы, которые включают азот. Аналогично, если желательны группы серы или фосфора, то при облучении можно использовать ионы серы или фосфора.
В некоторых вариантах осуществления после гашения любой из гашеных материалов, описанных в настоящем документе, можно дополнительно обрабатывать одним или несколькими способами, выбранными из радиационного облучения, такого как ионизирующее или неионизирующее излучение, обработки ультразвуком, пиролиза и окисления для дополнительного изменения молекулярной и/или надмолекулярной структуры.
В конкретных вариантах осуществления функционализированные материалы, описанные в настоящем документе, обрабатывают кислотой, основанием, нуклеофилом или кислотой Льюиса для дополнительного изменения молекулярной и/или надмолекулярной структуры, такого как дополнительное снижение молекулярной массы. Примеры кислот включают органические кислоты, такие как уксусная кислота, и минеральные кислоты, такие как хлористоводородная, серная и/или азотная кислота. Примеры оснований включают сильные минеральные основания, такие как источник ионов гидроксида, основные ионы, такие как фторидные ионы, или более слабые органические основания, такие как амины. Даже вода и бикарбонат натрия, например, когда они растворены в воде, могут обеспечивать изменение молекулярной и/или надмолекулярной структуры, такое как дополнительное снижение молекулярной массы.
Облучение пучком частиц в текучих средах
В некоторых случаях целлюлозные или лигноцеллюлозные материалы можно подвергать облучению пучком частиц в присутствии одной или нескольких дополнительных текучих сред (например, газов и/или жидкостей). Воздействие на материал пучка частиц в присутствии одной или нескольких дополнительных текучих сред может повысить эффективность обработки.
В некоторых вариантах осуществления материал подвергается облучению пучком частиц в присутствии текучей среды, такой как воздух. Частицы, ускоренные в одном или нескольких типах ускорителей, описанных в настоящем документе (или в ускорителе другого типа) выходят из ускорителя через выходное отверстие (например, тонкую мембрану, такую как металлическая фольга), проходят через объем пространства, занимаемого текучей средой, а затем падают на материал. В дополнение к прямой обработке материала, некоторые из частиц образуют дополнительные химические частицы путем взаимодействия с частицами текучей среды (например, ионы и/или радикалы, генерируемые различными составляющими воздуха, такими как озон и оксиды азота). Эти образовавшиеся химические частицы также могут взаимодействовать с материалом и могут действовать в качестве инициаторов различных реакций разрушения химических связей в материале. Например, любой образовавшийся окислитель может окислять материал, что может приводить к уменьшению молекулярной массы.
В определенных вариантах осуществления в путь пучка частиц перед попаданием его на материал можно селективно подавать дополнительные текучие среды. Как рассмотрено выше, в результате реакций между частицами пучка и частицами поданных текучих сред могут образовываться дополнительные химические частицы, которые реагируют с материалом и могут способствовать функционализации материала и/или иным образом селективно изменять определенные свойства материала. Одну или несколько дополнительных текучих сред можно направлять на путь пучка, например, из подводящей трубы. Направление и скорость потока текучей среды(сред), которую(ые) подают, можно выбирать в соответствии с желаемой мощностью и/или направлением облучения для контроля эффективности обработки в целом, включая как эффекты, которые являются следствием обработки частицами, так и эффекты, которые являются следствием взаимодействия динамически образовавшихся частиц из поданной текучей среды с материалом. В дополнение к воздуху, типичные текучие среды, которые можно подавать в пучок ионов, включают кислород, азот, один или несколько благородных газов, один или несколько галогенов и водород.
Облучение материалов биомассы с низкой объемной плотностью и охлаждение облученной биомассы
В процессе обработки материалов биомассы ионизирующим излучением, особенно при высоких уровнях доз, таких как уровни более 0,15 Мрад в секунду, например, 0,25 Мрад/c, 0,35 Мрад/c, 0,5 Мрад/с, 0,75 Мрад/c или даже более 1 Мрад/с, материалы биомассы могут сохранять значительные количества тепла, так что температура материалов биомассы повышается. В то время как, в некоторых вариантах осуществления, повышенные температуры могут быть преимущественными, например, когда желательна более высокая скорость реакции, является полезным контроль нагревания биомассы для сохранения контроля над химическими реакциями, инициируемыми ионизирующим излучением, такими как поперечное сшивание, расщепление цепей и/или привитая сополимеризация, например, для сохранения управления процессом. Материалы с низкой объемной плотностью, такие как материалы, имеющие объемную плотность менее чем приблизительно 0,4 г/см3, например, менее чем приблизительно 0,35, 0,25 или менее чем приблизительно 0,15 г/см3, особенно при комбинировании с материалами, которые имеют тонкие поперечные срезы, такими как волокна, имеющие небольшие поперечные размеры, как правило, легче охладить. Кроме того, фотоны и частицы могут, главным образом, проникать глубже в материалы, имеющие относительно низкую объемную плотность, или через них, что может позволить переработку более крупных объемов материалов при более высоких скоростях и может позволить применение фотонов и частиц, имеющих более низкую энергию, например, 0,25 МэВ, 0,5 МэВ, 0,75 МэВ или 1,0 МэВ, что может снизить требования к экранированию для безопасности.
Например, в одном способе изменения молекулярной и/или надмолекулярной структуры сырья биомассы, биомассу предварительно обрабатывают при первой температуре ионизирующим излучением, таким как фотоны, электроны или ионы (например, однозарядные или многозарядные катионы или анионы), в течение достаточного времени и/или при достаточной дозе для повышения температуры сырья биомассы до второй температуры, превышающей первую температуру. Затем предварительно обработанную биомассу охлаждают до третьей температуры, которая ниже второй температуры. Наконец, если желательно, охлажденную биомассу можно обрабатывать один или несколько раз радиационным излучением, например, ионизирующим излучением. Если желательно, после и/или в процессе каждой обработки радиационным облучением биомассу можно охлаждать.
Сырье биомассы можно физически подготавливать, как рассмотрено выше, например, путем уменьшения одного или нескольких размеров отдельных фрагментов сырья биомассы, так чтобы сырье могло более эффективно перерабатываться, например, легче охлаждаться и/или быть более проницаемым для ионизирующего излучения.
В некоторых вариантах осуществления ионизирующее излучение применяют в общей дозе менее 25 Мрад или менее 10 Мрад, например, менее 5 Мрад или менее 2,5 Мрад, и со скоростью более 0,25 Мрад в секунду, например, более 0,5, 0,75 или более 1,0 Мрад/с, перед охлаждением биомассы.
Предварительную обработку сырья биомассы ионизирующим излучением можно проводить по мере пневматической транспортировки сырья биомассы в текучую среду, такую как газ, например, азот или воздух. Для облегчения уменьшения молекулярной массы и/или функционализации материалов газ можно насыщать любым вызывающим набухание средством, описанным в настоящем документе, и/или водяным паром. Например, можно использовать кислотный водяной пар. Для облегчения уменьшения молекулярной массы воду можно подкислять органической кислотой, такой как муравьиная или уксусная кислота, или минеральной кислотой, такой как серная или хлористоводородная кислота.
Предварительную обработку сырья биомассы ионизирующим излучением можно проводить по мере попадания сырья биомассы под действие силы тяжести. Этот процесс может эффективно уменьшать объемную плотность сырья биомассы по мере его переработки, и он может способствовать охлаждению сырья. Например, биомассу можно транспортировать с первой первый ленты на первой высоте над уровнем земли, а затем она может попадать на вторую ленту на втором уровне над уровнем земли, более низким, чем первый уровень. Например, в некоторых вариантах осуществления задний край первой ленты и передний край второй ленты образуют зазор. Преимущественно, ионизирующее излучение, такое как пучок электронов, протонов или других ионов, можно применять в области зазора с целью предотвращения повреждения системы для транспортировки биомассы.
Охлаждение биомассы может включать приведение в контакт биомассы с текучей средой, такой как газ, при температуре ниже первой или второй температуры, такой как газообразный азот при или приблизительно при 77 K (-196°C). Можно использовать даже воду, такую как вода при температуре ниже номинальной комнатной температуры (например, 25 градусов Цельсия).
Часто предпочтительно, чтобы сырье биомассы имело внутренние волокна, и перед облучением ионизирующим излучением сырье биомассы было раздроблено до такой степени, чтобы его внутренние волокна были по существу обнажены. Это дробление может обеспечить получение материала с низкой объемной плотностью, имеющего небольшие поперечные размеры, что может способствовать снижению молекулярной массы и/или функционализации биомассы. Например, в некоторых вариантах осуществления биомасса представляет собой или включает отдельные волокна и/или частицы, имеющие максимальный размер не более чем приблизительно 0,5 мм, например, не более чем приблизительно 0,25 мм, не более чем приблизительно 0,1 мм или не более чем приблизительно 0,05 мм.
В некоторых вариантах осуществления сырье биомассы, к которому применяют ионизирующее излучение, имеет объемную плотность менее чем приблизительно 0,35 г/см3, например, менее чем приблизительно 0,3, 0,25, 0,20 или менее чем приблизительно 0,15 г/см3 в процессе применения ионизирующего излучения. В таких вариантах осуществления сырье биомассы можно охлаждать, а затем к охлажденной биомассе можно применять ионизирующее излучение. В некоторых преимущественных вариантах осуществления сырье биомассы представляет собой или включает отдельные волокна и/или частицы, имеющие максимальный размер не более чем приблизительно 0,5 мм, например, не более чем приблизительно 0,25 мм, не более чем приблизительно 0,1 мм, не более чем приблизительно 0,05 мм или не более чем приблизительно 0,025 мм.
Обработка ультразвуком
Для переработки исходного сырья из широкого множества различных источников с целью экстракции из сырья полезных веществ, а также для обеспечения частично разрушенного органического материала, который выполняет функцию входящего потока для дальнейших стадий и/или последовательностей переработки, можно использовать одну или несколько серий обработки ультразвуком. Обработкой ультразвуком можно уменьшить молекулярную массу и/или кристалличность сырья.
Вновь ссылаясь на ФИГ. 8, в одном способе первый материал 2, который включает целлюлозу, имеющую первую среднечисленную молекулярную массу (TMN1), диспергируют в среде, такой как вода, и обрабатывают ультразвуком или иным образом подвергают кавитации с получением второго материала 3, который включает целлюлозу, имеющую вторую среднечисленную молекулярную массу (TMN2), которая ниже, чем первая среднечисленная молекулярная масса. Второй материал (или, в определенных вариантах осуществления, первый и второй материал) можно смешивать с микроорганизмом (например, бактерией или дрожжами), который может утилизировать второй и/или первый материал, продуцируя топливо 5, которое включает водород, спирт, органическую кислоту, углеводород или смеси любых из них.
Поскольку второй материал содержит целлюлозу, имеющую сниженную молекулярную массу относительно первого материала и, в некоторых случаях, также сниженную кристалличность, второй материал, как правило, является более способным к диспергированию, набуханию и/или растворению в растворе, содержащем микроорганизм, например, в концентрации более 106 микроорганизмов/мл. Эти свойства делают второй материал 3 более подверженным химическому, ферментативному и/или микробному воздействию относительно первого материала 2, что может в значительной степени повысить скорость продукции и/или уровень продукции желаемого продукта, например, этанола. Обработкой ультразвуком также можно стерилизовать материалы, но ее не следует применять, пока микроорганизмы предположительно являются живыми.
В некоторых вариантах осуществления вторая среднечисленная молекулярная масса (MN2) ниже, чем первая среднечисленная молекулярная масса (TMN1), более чем приблизительно на 10%, например, на 15, 20, 25, 30, 35, 40, 50%, 60% или даже более чем приблизительно на 75%.
В некоторых случаях второй материал содержит целлюлозу, обладающую кристалличностью (TC2), которая ниже, чем кристалличность (TC1) целлюлозы первого материала. Например, (TC2) может быть ниже, чем (TC1), более чем приблизительно на 10%, например, на 15, 20, 25, 30, 35, 40 или даже более чем приблизительно на 50%.
В некоторых вариантах осуществления исходный индекс кристалличности (перед обработкой ультразвуком) составляет от приблизительно 40 до приблизительно 87,5%, например, от приблизительно 50 до приблизительно 75% или от приблизительно 60 до приблизительно 70%, и индекс кристалличности после обработки ультразвуком составляет от приблизительно 10 до приблизительно 50%, например, от приблизительно 15 до приблизительно 45% или от приблизительно 20 до приблизительно 40%. Однако в определенных вариантах осуществления, например, после экстенсивной обработки ультразвуком, индекс кристалличности может составлять менее чем 5%. В некоторых вариантах осуществления материал после обработки ультразвуком является по существу аморфным.
В некоторых вариантах осуществления исходная среднечисленная молекулярная масса (перед обработкой ультразвуком) составляет от приблизительно 200000 до приблизительно 3200000, например, от приблизительно 250000 до приблизительно 1000000 или от приблизительно 250000 до приблизительно 700000, и среднечисленная молекулярная масса после обработки ультразвуком составляет от приблизительно 50000 до приблизительно 200000, например, от приблизительно 60000 до приблизительно 150000 или от приблизительно 70000 до приблизительно 125000. Однако в некоторых вариантах осуществления, например, после экстенсивной обработки ультразвуком, среднечисленная молекулярная масса может составлять менее чем приблизительно 10000 или даже менее чем приблизительно 5000.
В некоторых вариантах осуществления второй материал может иметь уровень окисления (TO2), превышающий уровень окисления (TO1) первого материала. Более высокий уровень окисления материала может содействовать его способности к диспергированию, набуханию и/или растворению, дополнительно повышая подверженность материалов химическому, ферментативному или микробному воздействию. В некоторых вариантах осуществления, для повышения уровня окисления второго материала относительно первого материала, обработку ультразвуком проводят в окислительной атмосфере, получая второй материал, который является более окисленным, чем первый материал. Например, второй материал может иметь большее количество гидроксильных групп, альдегидных групп, кетоновых групп, сложноэфирных групп или групп карбоновой кислоты, которые могут повышать его гидрофильность.
В некоторых вариантах осуществления, среда для обработки ультразвуком представляет собой водную среду. Если желательно, среда может включать окислитель, такой как пероксид (например, пероксид водорода), диспергирующее средство и/или буфер. Примеры диспергирующих средств включают ионные диспергирующие средства, например, лаурилсульфат натрия, и неионные диспергирующие средства, например, поли(этиленгликоль).
В других вариантах осуществления среда для обработки ультразвуком является неводной. Например, обработку ультразвуком можно проводить в углеводороде, например, толуоле или гептане, в простом эфире, например, диэтиловом эфире или тетрагидрофуране, или даже в сжиженном газе, таком как аргон, ксенон или азот.
Без связи с какой-либо конкретной теорией полагают, что обработка ультразвуком разрушает связи в целлюлозе путем образования пузырей в среде, содержащей целлюлозу, которые растут, а затем резко опадают. В процессе опадания пузырей, которое может происходить в течение менее чем наносекунды, имплозивная сила повышает локальную температуру в пузыре до приблизительно 5100 K (~4827°C) (в некоторых случаях даже выше; см., например, Suslick et al, Nature 434, 52-55) и создает давление от нескольких сот атмосфер до свыше 1000 атмосфер или более. Именно эти высокие температуры и давление разрушают связи. Кроме того, без связи с какой-либо конкретной теорией полагают, что уменьшенная кристалличность является следствием, по меньшей мере частично, чрезвычайно высоких скоростей охлаждения в процессе опадания пузырей, которые могут превышать приблизительно 1011 K/секунда. Высокие скорости охлаждения, как правило, не позволяют целлюлозе организоваться и кристаллизоваться, что приводит к материалам, которые имеют уменьшенную кристалличность. Ультразвуковые системы и ультразвуковая химия рассмотрены, например, в публикациях Olli et al, патент США № 5766764; Roberts, патент США № 5828156; Mason, Chemistry with Ultrasound, Elsevier, Oxford, (1990); Suslick (editor), Ultrasound: its Chemical, Physical and Biological effects, VCH, Weinheim, (1988); Price, "Current Trends in Sonochemistry" Royal Society of Chemistry, Cambridge, (1992); Suslick et al., Ann. Rev. Mater. Sci. 29, 295, (1999); Suslick et al., Nature 353, 414 (1991); Hiller et al., Phys. Rev. Lett. 69, 1182 (1992); Barber et al., Nature, 352, 414 (1991); Suslick et al., J. Am. Chem. Soc, 108, 5641 (1986); Tang et al., Chem. Comm., 2119 (2000); Wang et al., Advanced Mater., 12, 1137 (2000); Landau et al., J. of Catalysis, 201, 22 (2001); Perkas et al., Chem. Comm., 988 (2001); Nikitenko et al., Angew. Chem. Inter. Ed. (December 2001); Shafi et al., J. Phys. Chem B 103, 3358 (1999); Avivi et al., J. Amer. Chem. Soc. 121, 4196 (1999); и Avivi et al., J. Amer. Chem. Soc. 122, 4331 (2000).
Системы для обработки ультразвуком
На ФИГ. 12 представлена общая система, в которой поток целлюлозного материала 1210 смешивается с потоком воды 1212 в емкости 1214 с образованием технологического потока 1216. Первый насос 1218 выводит технологический поток 1216 из емкости 1214 в направлении проточной ячейки 1224. Ультразвуковой преобразователь 1226 передает ультразвуковую энергию технологическому потоку 1216 по мере того, как технологический поток проходит через проточную ячейку 1224. Второй насос 1230 выводит технологический поток 1216 из проточной ячейки 1224 в направлении последующей переработки.
Емкость 1214 включает первый приемник 1232 и второй приемник 1234 в гидравлическом сообщении с объемом 1236. Конвейер (не показан) доставляет поток целлюлозного материала 1210 в емкость 1214 через первый приемник 1232. Поток воды 1212 попадает в емкость 1214 через второй приемник 1234. В некоторых вариантах осуществления, поток воды 1212 попадает в объем 1236 по касательной линии, что обеспечивает образующий завихрение поток в объеме 1236. В определенных вариантах осуществления поток целлюлозного материала 1210 и поток воды 1212 может подаваться в объем 1236 вдоль противоположных осей для улучшения перемешивания в объеме.
Клапан 1238 контролирует течение потока воды 1212 через второй приемник 1232 для получения желаемого соотношения целлюлозного материала и воды (например, приблизительно 10% целлюлозного материала, масса к объему). Например, 2000 тонн/сутки целлюлозного материала можно комбинировать с количеством воды от 1 миллиона до 1,5 миллионов галлонов/сутки (от 3800 до 5700 м3/сутки), например, 1,25 миллионов галлонов/сутки (4700 м3/сутки).
Смешивание целлюлозного материала и воды в емкости 1214 контролируется размером объема 1236 и скоростями перетекания целлюлозного материала и воды в объем. В некоторых вариантах осуществления объем 1236 имеет размер, обеспечивающий минимальное время нахождения целлюлозного материала и воды при смешивании. Например, когда через емкость 1214 протекает 2000 тонн/сутки целлюлозного материала и 1,25 миллионов галлонов/сутки (4700 м3/сутки) воды, объем 1236 может составлять приблизительно 32000 галлонов (120 м3) для достижения минимального времени нахождения при смешивании, составляющего приблизительно 15 минут.
Емкость 1214 включает мешалку 1240 в гидравлическом сообщении с объемом 1236. Мешалка 1240 перемешивает содержимое объема 1236, полностью диспергируя целлюлозный материал в воде объема. Например, мешалка 1240 может представлять собой вращающуюся лопасть, расположенную в емкости 1214. В некоторых вариантах осуществления, мешалка 1240 диспергирует целлюлозный материал по существу гомогенно в воде.
Кроме того, емкость 1214 включает выход 1242 в гидравлическом сообщении с объемом 1236 и технологическим потоком 1216. Смесь целлюлозного материала и воды в объеме 1236 вытекает из емкости 1214 через выход 1242. Выход 1242 расположен вблизи дна емкости 1214 для обеспечения выталкивания под действием силы тяжести смеси целлюлозного материала и воды из емкости 1214 в технологический поток 1216.
Первый насос 1218 (например, любой из нескольких насосов с вихревым рабочим колесом, изготовленных Essco Pumps & Controls, Los Angeles, California) перемещает содержимое технологического потока 1216 в направлении проточной ячейки 1224. В некоторых вариантах осуществления первый насос 1218 перемешивает содержимое технологического потока 1216, так что смесь целлюлозного материала и воды становится по существу гомогенной на входе 1220 проточной ячейки 1224. Например, первый насос 1218 перемешивает технологический поток 1216, создавая турбулентный поток вдоль технологического потока между первым насосом и входом 1220 проточной ячейки 1224.
Проточная ячейка 1224 включает реакторный объем 1244 в гидравлическом сообщении с входом 1220 и выходом 1222. В некоторых вариантах осуществления реакторный объем 1244 представляет собой трубу из нержавеющей стали, способную выдерживать повышенные давления (например, 10 бар). Дополнительно или альтернативно, реакторный объем 1244 включает прямоугольное поперечное сечение.
Проточная ячейка 1224, кроме того, включает теплообменник 1246 в тепловом контакте по меньшей мере с частью реакторного объема 1244. Охлаждающая текучая среда 1248 (например, вода) вливается в теплообменник 1246 и поглощает тепло, генерируемое в процессе обработки технологического потока 1216 ультразвуком в реакторном объеме 1244. В некоторых вариантах осуществления скорость потока и/или температура охлаждающей текучей среды 1248 в теплообменнике 1246 контролируются в целях поддержания приблизительно постоянной температуры в реакторном объеме 1244. В некоторых вариантах осуществления температура реакторного объема 1244 поддерживается при 20-50°C, например, при 25, 30, 35, 40 или 45°C. Дополнительно или альтернативно, в других частях всего процесса может быть использовано тепло, перенесенное на охлаждающую текучую среду 1248 из реакторного объема 1244.
Переходный отсек 1226 обеспечивает гидравлическое сообщение между реакторным объемом 1244 и бустером 1250, соединенным (например, механически соединенным с использованием фланца) с ультразвуковым преобразователем 1226. Например, переходный отсек 1226 может включать фланец и блок уплотнительных колец, расположенных так, чтобы создавать герметичное соединение между реакторным объемом 1244 и бустером 1250. В некоторых вариантах осуществления ультразвуковой преобразователь 1226 представляет собой ультразвуковой преобразователь с высокой мощностью, изготовленный Hielscher Ultrasonics of Teltow, Germany.
В рабочем состоянии генератор 1252 доставляет электричество к ультразвуковому преобразователю 1226. Ультразвуковой преобразователь 1226 включает пьезоэлектрический элемент, который преобразует электрическую энергию в звук в ультразвуковом диапазоне. В некоторых вариантах осуществления материалы обрабатывают ультразвуком с использованием звука, имеющего частоту от приблизительно 16 кГц до приблизительно 110 кГц, например, от приблизительно 18 кГц до приблизительно 75 кГц или от приблизительно 20 кГц до приблизительно 40 кГц (например, звука, имеющего частоту от 20 кГц до 40 кГц). В некоторых примерах обработку ультразвуком проводят при частоте от приблизительно 15 кГц до приблизительно 25 кГц, например, от приблизительно 18 кГц до 22 кГц. В конкретных вариантах осуществления обработку ультразвуком можно проводить с использованием рупора в 1 кВт или более, например, в 2, 3, 4, 5 или даже 10 кВт.
Затем ультразвуковую энергию доставляют в рабочую среду через бустер 1248. Ультразвуковая энергия, проходящая через бустер 1248 в реакторном объеме 1244, создает серию сжатий и разрежений технологического потока 1216 с интенсивностью, достаточной для обеспечения кавитации в технологическом потоке 1216. Кавитация дезагрегирует целлюлозный материал, диспергированный в технологическом потоке 1216. Кавитация также приводит к продукции свободных радикалов в воде технологического потока 1216. Эти свободные радикалы действуют, дополнительно разрушая целлюлозный материал в технологическом потоке 1216.
Как правило, к технологическому потоку 16, текущему со скоростью приблизительно 0,2 м3/с (приблизительно 3200 галлонов/мин), применяют ультразвуковую энергию, составляющую от 5 до 4000 МДж/м3, например, 10, 25, 50, 100, 250, 500, 750, 1000, 2000 или 3000 МДж/м3. После воздействия ультразвуковой энергии в реакторном объеме 1244 технологический поток 1216 покидает проточную ячейку 1224 через выходной канал 1222. Второй насос 1230 перемещает технологический поток 1216 на последующую переработку (например, любой из нескольких насосов с вихревым рабочим колесом, изготовленных Essco Pumps & Controls, Los Angeles, California).
Несмотря на то, что были описаны определенные варианты осуществления, возможны другие варианты осуществления. В качестве примера, хотя технологический поток 1216 был описан в виде единого пути течения, возможны другие схемы. Например, в некоторых вариантах осуществления технологический поток 1216 включает множество параллельных путей течения (например, течение со скоростью 10 галлонов/мин (38 л/мин)). Дополнительно или альтернативно, множество параллельных путей течения технологического потока 1216 протекают в отдельных проточных ячейках и обрабатываются ультразвуком параллельно (например, с использованием множества ультразвуковых преобразователей по 16 кВт).
В качестве другого примера, хотя один ультразвуковой преобразователь 1226 был описан как соединенный с проточной ячейкой 1224, возможны другие схемы. В некоторых вариантах осуществления в проточной ячейке 1224 расположено множество ультразвуковых преобразователей 1226 (например, в проточной ячейке 1224 может быть расположено десять ультразвуковых преобразователей). В некоторых вариантах осуществления звуковые волны, генерированные каждым из множества ультразвуковых преобразователей 1226, отрегулированы по времени (например, синхронизированы несовпадающими друг с другом по фазе) для усиления кавитационного действия на технологический поток 1216.
В качестве другого примера, хотя была описана одна проточная ячейка 1224, возможны другие схемы. В некоторых вариантах осуществления второй насос 1230 перемещает технологический поток во вторую проточную ячейку, где второй бустер и ультразвуковой преобразователь дополнительно обрабатывают ультразвуком технологический поток 1216.
В качестве другого примера, хотя реакторный объем 1244 был описан как закрытый объем, в определенных вариантах осуществления реакторный объем 1244 является открытым для окружающих условий. В таких вариантах осуществления предварительную обработку ультразвуком можно проводить по существу одновременно с другими способами предварительной обработки. Например, ультразвуковую энергию можно применять к технологическому потоку 1216 в реакторном объеме 1244 одновременно с подачей в технологический поток 1216 электронного пучка.
В качестве другого примера, хотя описан поточный способ, возможны другие схемы. В некоторых вариантах осуществления обработку ультразвуком можно проводить периодическим способом. Например, объем можно заполнять 10% (масса по объему) смесью целлюлозного материала в воде и подвергать воздействию звука с интенсивностью от приблизительно 50 Вт/см2 до приблизительно 600 Вт/см2, например, от приблизительно 75 Вт/см2 до приблизительно 300 Вт/см2 или от приблизительно 95 Вт/см2 до приблизительно 200 Вт/см2. Дополнительно или альтернативно, смесь в объеме можно обрабатывать ультразвуком в течение от приблизительно 1 часа до приблизительно 24 часов, например, от приблизительно 1,5 часов до приблизительно 12 часов или от приблизительно 2 часов до приблизительно 10 часов. В определенных вариантах осуществления материал обрабатывают ультразвуком в течение заданного периода времени, а затем дают отстояться в течение второго заданного периода времени перед повторной обработкой ультразвуком.
Теперь ссылаясь на ФИГ. 13, в некоторых вариантах осуществления два электроакустических преобразователя механически соединены с одним рупором. Как показано, пара пьезоэлектрических преобразователей 60 и 62 присоединена к щелевому прямоугольному рупору 64 соответствующими промежуточными соединительными рупорами 70 и 72, последние из которых также известны как вспомогательные рупоры. Механическая вибрация, обеспечиваемая преобразователями, отвечающими на высокочастотную электрическую энергию, применяемую к ним, передается соответствующим соединительным рупорам, которые могут быть сконструированы так, чтобы обеспечивать механическое усиление, например, с соотношением от 1 до 1,2. Рупоры представлены с соответствующими крепежными фланцами 74 и 76 для поддержания системы преобразователей и рупоров в стационарном корпусе.
Вибрация, передаваемая от преобразователей через соединительные или вспомогательные рупоры, передается входной поверхности 78 рупора и передается через рупор на расположенную напротив поверхность выхода 80, которая, в процессе работы, находится в вынужденном контакте с обрабатываемым объектом (не показано), к которому применяют вибрацию.
Высокочастотная электрическая энергия, обеспечиваемая источником энергии 82, подается к каждому из преобразователей, электрически соединенных параллельно, через компенсационный трансформатор 84 и соответствующие последовательно соединенные конденсаторы 86 и 90, причем один конденсатор соединен последовательно путем электрического соединения с каждым из преобразователей. Компенсационный трансформатор также известен как "balun", что означает "симметрирующее устройство". Компенсационный трансформатор включает магнитный сердечник 92 и пару идентичных катушек 94 и 96, также называемых первичной катушкой и вторичной катушкой, соответственно.
В некоторых вариантах осуществления преобразователи включают коммерчески доступные пьезоэлектрические преобразователи, такие Branson Ultrasonics Corporation модели 105 или 502, каждая из которых сконструирована для работы при 20 кГц и максимальной мощности 3 кВт. Разность потенциалов при включении питания для обеспечения максимальной динамической амплитуды на поверхности выхода преобразователя составляет 930 среднеквадратичных вольт. Электрический ток через преобразователь может варьировать от нуля до 3,5 ампер в зависимости от сопротивления нагрузки. При 930 среднеквадратичных вольт колебания на выходе составляют приблизительно 20 микрометров. Максимальное отклонение конечного напряжения для одной и той же динамической амплитуды, таким образом, может составлять 186 вольт. Такое отклонение в напряжении может приводить к большим блуждающим токам между преобразователями. Симметрирующее устройство 430 гарантирует уравновешенное состояние путем обеспечения равного тока через преобразователи, таким образом, устраняя возможность блуждающих токов. Размер проволоки в катушке необходимо выбирать для тока максимальной нагрузки, указанного выше, и максимальная разность потенциалов, возникающая на входе катушки, составляет 93 вольт.
В качестве альтернативы применению ультразвуковой энергии можно использовать высокочастотные ротор-статорные устройства. Этот тип устройства генерирует микрокавитационные силы с большой силой сдвига, которые могут дезинтегрировать биомассу при контакте с такими силами. Два типа коммерчески доступных высокочастотных ротор-статорных устройств для диспергирования представляют собой устройства Supraton™, производимые Krupp Industrietechnik GmbH и поставляемые на рынок Dorr-Oliver Deutschland GmbH of Connecticut, и устройства Dispax™, производимые и поставляемые на рынок Ika-Works, Inc. of Cincinnati, Ohio. Работа такого микрокавитационного устройства рассмотрена Stuart, патент США № 5370999.
Хотя ультразвуковой преобразователь 1226 описан как включающий один или несколько пьезоэлектрических активных элементов для генерирования ультразвуковой энергии, возможны другие схемы. В некоторых вариантах осуществления ультразвуковой преобразователь 1226 включает активные элементы, изготовленные из других типов магнитострикционного материала (например, черных металлов). Конструкция и работа такого ультразвукового преобразователя с высокой мощностью рассмотрена Hansen et al., патент США № 6624539. В некоторых вариантах осуществления ультразвуковая энергия переносится на технологический поток 16 посредством электрогидравлической системы.
Хотя ультразвуковой преобразователь 1226 описан как использующий электромагнитный ответ магнитострикционных материалов для выработки ультразвуковой энергии, возможны другие схемы. В некоторых вариантах осуществления к технологическому потоку 16 можно применять акустическую энергию в форме интенсивной ударной волны с использованием подводного разряда. В некоторых вариантах осуществления ультразвуковая энергия переносится на технологический поток 16 через термодинамическую систему. Например, акустические волны с высокой плотностью энергии можно генерировать, применяя потенциал через замкнутый объем электролита, тем самым нагревая замкнутый объем и вызывая повышение давления, которое впоследствии передается через распространяющую звук среду (например, технологический поток 1216). Схема и работа такого термогидравлического преобразователя рассмотрена Hartmann et al., патент США 6383152.
Пиролиз
Одну или несколько последовательностей переработки пиролизом можно использовать для переработки исходного сырья из широкого множества различных источников для экстракции из сырья полезных веществ, а также для получения частично разрушенного органического материала, который служит в качестве входящего потока для последующих стадий и/или последовательностей переработки.
Вновь ссылаясь на ФИГ. 8, в одном способе первый материал 2, который включает целлюлозу, имеющую первую среднечисленную молекулярную массу (TMN1), подвергают пиролизу, например, нагреванием первого материала в трубчатой печи, с получением второго материала 3, который включает целлюлозу, имеющую вторую среднечисленную молекулярную массу (TMN2), которая ниже, чем первая среднечисленная молекулярная масса. Второй материал (или, в определенных вариантах осуществления, первый и второй материал) смешивают с микроорганизмом (например, бактерией или дрожжами), который может утилизировать второй и/или первый материал, продуцируя топливо 5, которое включает водород, спирт (например, этанол или бутанол, такой как н-, втор- или трет-бутанол), органическую кислоту, углеводород или смеси любых из них.
Поскольку второй материал содержит целлюлозу, имеющую сниженную молекулярную массу относительно первого материала и, в некоторых случаях, также уменьшенную кристалличность, второй материал, как правило, является более способным к диспергированию, набуханию и/или растворению в растворе, содержащем микроорганизм, например, в концентрации более 106 микроорганизмов/мл. Эти свойства делают второй материал 3 более подверженным химическому, ферментативному и/или микробному воздействию относительно первого материала 2, что может в значительной степени повысить скорость продукции и/или уровень продукции желаемого продукта, например, этанола. Путем пиролиза также можно стерилизовать первый и второй материалы.
В некоторых вариантах осуществления вторая среднечисленная молекулярная масса (MN2) ниже, чем первая среднечисленная молекулярная масса (TMN1), более чем приблизительно на 10%, например, на 15, 20, 25, 30, 35, 40, 50%, 60% или даже более чем приблизительно на 75%.
В некоторых случаях второй материал содержит целлюлозу, обладающую кристалличностью (TC2), которая ниже, чем кристалличность (TC1) целлюлозы первого материала. Например, (TC2) может быть ниже, чем (TC1), более чем приблизительно на 10%, например, на 15, 20, 25, 30, 35, 40 или даже более чем приблизительно на 50%.
В некоторых вариантах осуществления исходная кристалличность (перед пиролизом) составляет от приблизительно 40 до приблизительно 87,5%, например, от приблизительно 50 до приблизительно 75% или от приблизительно 60 до приблизительно 70%, и индекс кристалличности после пиролиза составляет от приблизительно 10 до приблизительно 50%, например, от приблизительно 15 до приблизительно 45% или от приблизительно 20 до приблизительно 40%. Однако в определенных вариантах осуществления, например, после экстенсивного пиролиза, индекс кристалличности может составлять менее чем 5%. В некоторых вариантах осуществления материал после пиролиза является по существу аморфным.
В некоторых вариантах осуществления исходная среднечисленная молекулярная масса (перед пиролизом) составляет от приблизительно 200000 до приблизительно 3200000, например, от приблизительно 250000 до приблизительно 1000000 или от приблизительно 250000 до приблизительно 700000, и среднечисленная молекулярная масса после пиролиза составляет от приблизительно 50000 до приблизительно 200000, например, от приблизительно 60000 до приблизительно 150000 или от приблизительно 70000 до приблизительно 125000. Однако в некоторых вариантах осуществления, например, после экстенсивного пиролиза, среднечисленная молекулярная масса может составлять менее чем приблизительно 10000 или даже менее чем приблизительно 5000.
В некоторых вариантах осуществления второй материал может иметь уровень окисления (TO2), превышающий уровень окисления (TO1) первого материала. Более высокий уровень окисления материала может содействовать его способности к диспергированию, набуханию и/или растворению, дополнительно повышая подверженность материалов химическому, ферментативному или микробному воздействию. В некоторых вариантах осуществления для повышения уровня окисления второго материала относительно первого материала пиролиз проводят в окислительной атмосфере, получая второй материал, который является более окисленным, чем первый материал. Например, второй материал может иметь большее количество гидроксильных групп, альдегидных групп, кетоновых групп, сложноэфирных групп или групп карбоновой кислоты, которые могут повышать его гидрофильность.
В некоторых вариантах осуществления пиролиз материалов является непрерывным. В других вариантах осуществления материал подвергают пиролизу в течение заданного периода времени, а затем ему позволяют охладиться в течение второго заданного периода времени перед повторным пиролизом.
Системы для пиролиза
На ФИГ. 14 представлена технологическая схема 6000, которая включает различные стадии пиролитической системы для предварительной обработки сырья. На первой стадии 6010 из источника исходного материала подается сухое сырье.
Как описано выше, перед доставкой в камеру для пиролиза сухое сырье из источника исходного материала может быть предварительно переработано. Например, если сырье получено из растительных источников, то определенные части растительного материала могут быть удалены перед сбором растительного материала и/или перед доставкой растительного материала в устройство для транспортировки сырья. Альтернативно или дополнительно, сырье биомассы можно подвергать механической переработке 6020 (например, для снижения средней длины волокон в сырье) перед доставкой в камеру для пиролиза.
После механической переработки сырье проходит стадию коррекции влажности 6030. Характер стадии коррекции влажности зависит от содержания влаги в механически переработанном сырье. Как правило, пиролиз сырья происходит наиболее эффективно, когда содержание влаги в сырье составляет от приблизительно 10% до приблизительно 30% (например, от 15% до 25%) по массе сырья. Если содержание влаги в сырье превышает приблизительно 40 масс.%, то избыточная тепловая нагрузка, обеспечиваемая содержанием воды в сырье, повышает расход энергии на последующих стадиях пиролиза.
В некоторых вариантах осуществления, если сырье имеет содержание влаги, превышающее приблизительно 30 масс.%, то можно примешивать к нему более сухой сырьевой материал 6220, который имеет низкое содержание влаги, получая смешанное сырье на стадии 6030 со средним содержанием влаги, которое находится в пределах, указанных выше. В определенных вариантах осуществления сырье с высоким содержанием влаги можно просто сушить, распределяя сырьевой материал на двигающемся конвейере, который циклически пропускает сырье через встроенный в линию нагревательный элемент. Нагревательным элементом выпаривается часть воды, присутствующей в сырье.
В некоторых вариантах осуществления, если сырье со стадии 6020 имеет содержание влаги, которое является слишком низким (например, ниже чем приблизительно 10 масс.%), то механически переработанное сырье можно объединять с более влажным сырьевым материалом 6230 с более высоким содержанием влаги, таким как отстой сточных вод. Альтернативно или дополнительно, для увеличения содержания влаги в сухое сырье стадии 6020 можно добавлять воду 6240.
На стадии 6040 сырье - теперь с содержанием в нем влаги, скорректированным для того, чтобы оно попадало в приемлемые пределы - может быть предварительно нагрето на необязательной стадии 6040 предварительного нагревания. Стадию предварительного нагревания 6040 можно использовать для повышения температуры сырья до 75°C-150°C при подготовке для последующего пиролиза сырья. В зависимости от природы сырья и конкретной конструкции камеры для пиролиза предварительное нагревание сырья может обеспечить, чтобы распределение тепла в сырье оставалось в ходе пиролиза более однородным, и может снизить тепловую нагрузку на камеру для пиролиза.
Затем сырье транспортируется в камеру для пиролиза, чтобы проходил пиролиз на стадии 6050. В некоторых вариантах осуществления транспортировке сырья способствует добавление в поток сырья одного или нескольких сжатых газов 6210. Газы создают градиент давления в канале для транспортировки сырья, продвигая сырье в камеру для пиролиза (и даже через камеру для пиролиза). В определенных вариантах осуществления транспортировка сырья происходит механически; а именно, сырье в камеру для пиролиза транспортирует система транспортировки, которая включает конвейер, такой как винтовой транспортер.
Также в сырье можно добавлять другие газы 6210 перед камерой для пиролиза. В некоторых вариантах осуществления, например, к сырью можно добавлять один или несколько каталитических газов для содействия разложению сырья в процессе пиролиза. В определенных вариантах осуществления в сырье можно добавлять один или несколько поглотителей для улавливания летучих веществ, высвобождающихся в процессе пиролиза. Например, в ходе пиролиза могут высвобождаться различные соединения на основе серы, такие как сульфиды, и в сырье можно добавлять такое средство, как газообразный водород, для обеспечения десульфуризации продуктов пиролиза. Водород соединяется с сульфидами с образованием газообразного сероводорода, который может быть удален из подвергнутого пиролизу сырья.
Пиролиз сырья в камере может включать нагревание сырья до относительно высоких температур, которые вызывают частичное разложение сырья. Как правило, сырье нагревается до температуры в диапазоне от 150°C до 1100°C. Температура, до которой сырье нагревается, зависит от ряда факторов, включающих состав сырья, средний размер частиц сырья, содержание влаги и желаемые продукты пиролиза. Для многих типов сырья биомассы используют, например, температуры пиролиза от 300°C до 550°C.
Время нахождения сырья в камере для пиролиза, как правило, зависит от ряда факторов, включая температуру пиролиза, состав сырья, средний размер частиц сырья, содержание влаги и желаемые продукты пиролиза. В некоторых вариантах осуществления сырьевые материалы подвергают пиролизу при температуре, которая немного выше температуры разложения материала в инертной атмосфере, например, от приблизительно 2°C выше до приблизительно 10°C выше температуры разложения или от приблизительно 3°C выше до приблизительно 7°C выше температуры разложения. В таких вариантах осуществления материал, как правило, выдерживают при этой температуре в течение более чем 0,5 часа, например, более 1,0 часа или более чем приблизительно 2,0 часов. В других вариантах осуществления материалы подвергают пиролизу при температуре, значительно превышающей температуру разложения материала в инертной атмосфере, например, от приблизительно 75°C выше до приблизительно 175°C выше температуры разложения или от приблизительно 85°C выше до приблизительно 150°C выше температуры разложения. В таких вариантах осуществления материал, как правило, выдерживают при этой температуре в течение менее 0,5 часа, например, менее 20 минут, менее 10 минут, менее 5 минут или менее 2 минут. В других вариантах осуществления материалы подвергают пиролизу при экстремальной температуре, например, от приблизительно 200°C выше до приблизительно 500°C выше температуры разложения материала в инертной окружающей среде или от приблизительно 250°C выше до приблизительно 400°C выше температуры разложения. В таких вариантах осуществления материал обычно выдерживают при этой температуре менее 1 минуты, например, менее 30 секунд, 15 секунд, 10 секунд, 5 секунд, 1 секунды или менее 500 мс. Такие варианты осуществления, как правило, называют мгновенным пиролизом.
В некоторых вариантах осуществления сырье в камере нагревается относительно быстро до выбранной температуры пиролиза. Например, камера может быть сконструирована для нагревания сырья со скоростью от 500°C/с до 11000°C/с, например, от 500°C/с до l000°C/c.
Турбулентное течение сырьевого материала в камере для пиролиза обычно является преимущественным, поскольку оно обеспечивает относительно эффективную передачу тепла сырьевому материалу от нагревающей подсистемы. Турбулентного течения можно достигать, например, прогоняя сырьевой материал через камеру с использованием одного или нескольких нагнетаемых газов-носителей 6210. Как правило, газы-носители являются относительно инертными в отношении сырьевого материала, даже при высоких температурах в камере для пиролиза. Иллюстративные газы-носители включают, например, азот, аргон, метан, монооксид углерода и диоксид углерода. Альтернативно или дополнительно, механические системы транспортировки, такие как винтовые транспортеры, могут транспортировать сырье и осуществлять его циркуляцию в камере для пиролиза, создавая турбулентное течение сырья.
В некоторых вариантах осуществления пиролиз сырья происходит по существу в отсутствие кислорода и других реактивных газов. Кислород может быть удален из камеры для пиролиза периодическим продуванием камеры азотом под высоким давлением (например, при давлении азота 2 бара или более). После продувания камеры газовая смесь, присутствующая в камере для пиролиза (например, в процессе пиролиза сырья), может включать менее 4 мол.% кислорода (например, менее 1 мол.% кислорода и даже менее 0,5 мол.% кислорода). Отсутствие кислорода обеспечивает отсутствие возгорания сырья при повышенных температурах пиролиза.
В определенных вариантах осуществления в сырье могут подаваться и присутствовать в процессе пиролиза относительно небольшие количества кислорода. Этот способ называют окислительным пиролизом. Как правило, окислительный пиролиз происходит в несколько стадий нагревания. Например, на первой стадии нагревания сырье нагревается в присутствии кислорода для обеспечения частичного окисления сырья. На этой стадии расходуется доступный кислород в камере для пиролиза. Затем на последующих стадиях нагревания температуру сырья дополнительно повышают. Однако в результате израсходования всего кислорода в камере возгорания сырья не происходит, а происходит пиролитическое разложение сырья без возгорания (например, с образованием углеводородных продуктов). Как правило, процесс нагревания сырья в камере для пиролиза с целью инициации разложения является эндотермическим. Однако при окислительном пиролизе образование диоксида углерода путем окисления сырья является экзотермическим процессом. Тепло, высвобождаемое при образовании диоксида углерода, может способствовать дальнейшим стадиям нагревания при пиролизе, тем самым снижая тепловую нагрузку, обеспечиваемую сырьем.
В некоторых вариантах осуществления пиролиз протекает в инертном окружении, например, при окружении сырьевых материалов аргоном или газообразным азотом. В определенных вариантах осуществления пиролиз может протекать в окислительной окружающей среде, такой как воздух или аргон, обогащенный воздухом. В некоторых вариантах осуществления пиролиз может протекать в восстанавливающих окружающих условиях, например, при окружении сырьевых материалов газообразным водородом. Для содействия пиролизу к материалу до или в процессе пиролиза можно добавлять различные химические вещества, такие как окислители, восстановители, кислоты или основания. Например, можно добавлять серную кислоту, или можно добавлять пероксид (например, бензоилпероксид).
Как рассмотрено выше, можно использовать множество различных условий переработки в зависимости от таких факторов, как состав сырья и желаемые продукты пиролиза. Например, для содержащего целлюлозу сырьевого материала можно использовать относительно мягкие условия пиролиза, включая температуры мгновенного пиролиза от 375°C до 450°C и время нахождения менее 1 секунды. В качестве другого примера, для органического твердого материала отходов, такого как отстой сточных вод, обычно используют температуры мгновенного пиролиза от 500°C до 650°C при времени нахождения от 0,5 до 3 секунд. Как правило, многие из параметров процесса пиролиза, включая время нахождения, температуру пиролиза, турбулентность сырья, содержание влаги, состав сырья, состав продуктов пиролиза и совокупный состав газов, могут регулироваться автоматически системой регуляторов и автоматизированной системой контроля.
После стадии пиролиза 6050 продукты пиролиза проходят стадию гашения 6250 для снижения температуры продуктов перед дальнейшей переработкой. Обычно стадия гашения 6250 включает обрызгивание продуктов пиролиза потоками охлаждающей воды 6260. Охлаждающая вода также образует суспензию, которая включает твердый нерастворенный продукт и различные растворенные продукты. Также в потоке продуктов присутствует смесь, которая включает различные газы, в том числе газообразные продукты, газы-носители и другие типы технологических газов.
Поток продуктов транспортируется через встроенный в линию газопровод в газовый сепаратор, который осуществляет стадию отделения газов 6060, на которой газообразные продукты и другие газы отделяются от суспензии, образованной при гашении продуктов пиролиза. Отделенная смесь газов необязательно направляется в вентилятор 6130, который повышает давление газа путем продувания смеси воздухом. Смесь газов может быть подвергнута стадии фильтрации 6140, на которой смесь газов проходит через один или несколько фильтров (например, фильтров с активированным углем) для удаления частиц и других примесей. На следующей стадии 6150 фильтрованный газ может подвергаться сжатию и храниться до применения. Альтернативно, фильтрованный газ может быть подвергнут дальнейшим стадиям переработки 6160. Например, в некоторых вариантах осуществления фильтрованный газ может быть подвергнут конденсации для отделения различных газообразных соединений из смеси газов. Различные соединения могут включать, например, различные углеводородные продукты (например, спирты, алканы, алкены, алкины, простые эфиры), образованные в процессе пиролиза. В определенных вариантах осуществления фильтрованный газ, содержащий смесь углеводородных компонентов, может быть объединен с парогазом 6170 (например, смесью водяного пара и кислорода) и подвергнут процессу крекинга для снижения молекулярной массы углеводородных компонентов.
В некоторых вариантах осуществления камера для пиролиза включает источники тепла, которые сжигают углеводородные газы, такие как метан, пропан и/или бутан, нагревая сырье. Часть 6270 отделенных газов может быть рециркулирована в камеру для пиролиза для сгорания, генерируя технологическое тепло для поддержания процесса пиролиза.
В определенных вариантах осуществления в камеру для пиролиза может поступать технологическое тепло, которое может быть использовано для повышения температуры сырьевых материалов. Например, при облучении сырья радиационном излучением (например, гамма-излучением, облучением электронным пучком или другими типами радиационного облучения) сырьевые материалы могут нагреваться до относительно высоких температур. Нагретые сырьевые материалы могут охлаждаться системой теплообмена, которая удаляет часть избыточного тепла из облученного сырья. Система теплообмена может быть сконфигурирована для транспортировки части тепловой энергии в камеру для пиролиза с целью нагревания (или предварительного нагревания) сырьевого материала, снижая, тем самым, расход энергии на процесс пиролиза.
Суспензия, содержащая жидкие и твердые продукты пиролиза, может подвергаться необязательной стадии обезвоживания 6070, в которой избыток воды может быть удален из суспензии с помощью таких процессов, как механическое сжатие и выпаривание. Избыток воды 6280 может быть отфильтрован, а затем рециркулирован для дальнейшего применения при гашении продуктов разложения пиролиза на стадии 6250.
Затем обезвоженная суспензия проходит стадию механического разделения 6080, на которой твердый материал продукта 6110 отделяется от жидкого материала продукта 6090 с помощью серии фильтров тонкой очистки с возрастанием степени очистки. На стадии 6100 жидкий материал продукта 6090 может быть впоследствии конденсирован (например, выпариванием) для удаления отработанной воды 6190 и очищен такими способами, как экстракция. Экстракция может включать добавление одного или нескольких органических растворителей 6180, например, для отделения продуктов, таких как масла, от таких продуктов, как спирты. Подходящие органические растворители включают, например, различные углеводороды и галогенуглеводороды. Затем очищенные жидкие продукты 6200 могут быть подвергнуты дальнейшим стадиям переработки. Отработанная вода 6190 может быть отфильтрована, если необходимо, и рециркулирована для дальнейшего применения при гашении продуктов разложения путем пиролиза на стадии 6250.
После отделения на стадии 6080 твердый материал продукта 6110 необязательно подвергается стадии высушивания 6120, которая может включать выпаривание воды. Затем твердый материал 6110 может быть сохранен для последующего применения или подвергнут дальнейшим стадиям переработки, в зависимости от ситуации.
Параметры процесса пиролиза, рассмотренные выше, являются иллюстративными. Как правило, величины этих параметров могут широко варьировать в зависимости от природы сырья и желаемых продуктов. Более того, можно использовать широкое множество различных способов пиролиза, включая применение источников тепла, таких как пламя углеводородов и/или печи, инфракрасные лазеры, микроволновые нагреватели, индукционные нагреватели, резистивные нагреватели и другие нагревающие устройства и конфигурации.
Для разложения сырья можно использовать широкое множество различных камер для пиролиза. В некоторых вариантах осуществления, например, пиролиз сырья может включать нагревание материала с использованием резистивного нагревательного элемента, такого как металлическая нить или металлическая лента. Нагревание может происходить путем прямого контакта между резистивным нагревательным элементом и материалом.
В определенных вариантах осуществления пиролиз может включать нагревание материала путем индукции, например, с использованием пиролизера по точке Кюри. В некоторых вариантах осуществления пиролиз может включать нагревание материала путем применения радиационного излучения, такого как инфракрасное радиационное излучение. Радиационное излучение может генерироваться лазером, таким как инфракрасный лазер.
В определенных вариантах осуществления пиролиз может включать нагревание материала конвективной теплотой. Конвективное тепло может генерироваться протекающим потоком нагретого газа. Нагретый газ может поддерживаться при температуре менее чем приблизительно 1200°C, например, менее чем приблизительно 1000°C, менее чем 750°C, менее чем 600°C, менее чем 400°C или даже менее чем 300°C. Нагретый газ может поддерживаться при температуре выше, чем приблизительно 250°C. Конвективное тепло может генерироваться нагретым телом, окружающим первый материал, например, как в печи.
В некоторых вариантах осуществления пиролиз может включать нагревание материала паром при температуре выше, чем приблизительно 250°C.
Вариант осуществления камеры для пиролиза представлен на ФИГ. 15. Камера 6500 включает изолированную стенку камеры 6510 с вентиляционным отверстием 6600 для отработанных газов, множество топок 6520, которые генерируют тепло для процесса пиролиза, транспортный канал 6530 для транспортировки сырья через камеру 6500, винтовой транспортер 6590 для транспортировки сырья через канал 6530 в турбулентном потоке и систему для гашения 6540, которая включает винтовой транспортер 6610 для транспортировки продуктов пиролиза, водяные форсунки 6550 для обрызгивания продуктов пиролиза охлаждающей водой и газовый сепаратор для отделения газообразных продуктов 6580 от суспензии 6570, содержащей твердые и жидкие продукты.
Другой вариант осуществления камеры для пиролиза представлен на ФИГ. 16. Камера 6700 включает изолированную стенку камеры 6710, канал для подачи сырья 6720, наклонную внутреннюю стенку камеры 6730, топки 6740, которые генерируют тепло для процесса пиролиза, вентиляционное отверстие 6750 для отработанных газов и газовый сепаратор 6760 для отделения газообразных продуктов 6770 от жидких и твердых продуктов 6780. Камера 6700 сконфигурирована для вращения в направлении, показанном стрелкой 6790, для обеспечения надлежащего перемешивания и турбулентного потока сырья в камере.
Следующий вариант осуществления камеры для пиролиза представлен на ФИГ. 17. Филаментный пиролизер 1712 включает держатель образца 1713 с резистивным нагревающим элементом 1714 в форме проволоки, намотанной вокруг открытого пространства, определяемого держателем образца 1713. Необязательно, нагретый элемент может вращаться вокруг оси 1715 (как указано стрелкой 1716) для переворачивания материала, который включает целлюлозный материал, в держателе образца 1713. Пространство 1718, определяемое ограждением 1719, поддерживается при температуре выше комнатной температуры, например, от 200 до 250°C. При обычном применении газ-носитель, например, инертный газ, или окислительный или восстановительный газ, двигается в поперечном направлении через держатель образца 1713, в то время как рестриктивный нагревающий элемент вращается и нагревается до желаемой температуры, например, 325°C. После соответствующего периода времени, например, от 5 до 10 минут, пиролизованный материал удаляется из держателя образца. Систему, представленную на ФИГ. 17, можно масштабировать и делать непрерывной. Например, вместо использования в качестве нагревательного элемента проволоки, нагревательный элемент может представлять собой винт винтового транспортера. Материал может постоянно попадать в держатель образца, сталкиваясь с нагретым винтом, который осуществляет пиролиз материала. В то же время, винт может выталкивать пиролизованный материал из держателя образца, обеспечивая возможность поступления нового непиролизованного материала.
Другой вариант осуществления камеры для пиролиза представлен на ФИГ. 18, на которой показан пиролизер по точке Кюри 1820, который включает камеру для образца 1821, в которой находится ферромагнитная фольга 1822. Камеру для образца 1821 окружает радиочастотная катушка 1823. Пространство 1824, определяемое ограждением 1825, поддерживается при температуре выше комнатной температуры, например, от 200 до 250°C. При обычном применении газ-носитель двигается в поперечном направлении через держатель образца 1821, в то время как фольга 1822 подвергается индуктивному нагреванию применяемым радиочастотным полем для пиролиза материала при желаемой температуре.
Другой вариант осуществления камеры для пиролиза представлен на ФИГ. 19. Печной пиролизер 130 включает подвижный держатель образца 131 и печь 132. При обычном применении образец опускается (как указано стрелкой 137) в зону нагрева 135 печи 132, в то время как газ-носитель заполняет кожух 136 и двигается в поперечном направлении через держатель образца 131. Образец нагревается до желаемой температуры в течение желательного периода времени для получения пиролизованного продукта. Пиролизованный продукт удаляется из пиролизера путем поднятия держателя образца (как указано стрелкой 134).
В определенных вариантах осуществления, как показано на ФИГ. 20, целлюлозную мишень 140 можно подвергать пиролизу путем обработки мишени, которая содержится в вакуумной камере 141, лазерным излучением, например, излучением, имеющим длину волны от приблизительно 225 нм до приблизительно 1500 нм. Например, мишень можно разрушать при 266 нм, используя четвертую гармоническую волну лазера Nd-YAG (Spectra Physics, GCR170, San Jose, Calif). Показанная оптическая конфигурация позволяет практически монохроматическому свету 143, сгенерированному лазером 142, направляться с использованием зеркал 144 и 145 на мишень после прохождения через линзу 146 в вакуумной камере 141. Как правило, давление в вакуумной камере поддерживается на уровне менее 10-6 мм рт. ст. В некоторых вариантах осуществления используют инфракрасное излучение, например, излучение от лазера Nd-YAG, составляющее 1,06 микрометров. В таких вариантах осуществления с целлюлозным материалом можно объединять чувствительный к инфракрасному излучению краситель с получением целлюлозной мишени. Инфракрасный краситель может усиливать нагревание целлюлозного материала. Разрушение лазером описано Blanchet-Fincher et al. в патенте США № 5942649.
Ссылаясь на ФИГ. 21, в некоторых вариантах осуществления целлюлозный материал может быть подвергнут мгновенному пиролизу путем покрытия вольфрамовой нити 150, такой как вольфрамовая нить от 5 до 25 мм, желаемым целлюлозным материалом, в то время когда материал содержится в вакуумной камере 151. Для обеспечения пиролиза через нить пропускают ток, который вызывает быстрое нагревание нити в течение желаемого периода времени. Как правило, нагревание продолжают в течение секунд, а затем нити дают остыть. В некоторых вариантах осуществления нагревание проводят несколько раз для обеспечения желаемой степени пиролиза.
В определенных вариантах осуществления углеводсодержащий материал биомассы можно нагревать в отсутствие кислорода в реакторе с псевдоожиженным слоем. Если желательно, углеводсодержащая биомасса может иметь относительно тонкие поперечные срезы и может включать любые из волокнистых материалов, описанных в настоящем документе, для эффективного переноса тепла. Материал можно нагревать путем теплообмена от горячих металлических или керамических, например стеклянных, гранул или песка в реакторе, и полученные пиролизованные жидкость или масло можно транспортировать в центральную очистительную установку для получения сгораемых топлив или других полезных продуктов.
Окисление
Для переработки исходного сырья из широкого множества различных источников в целях экстракции из сырья полезных веществ и получения частично разрушенного органического материала, который служит в качестве входящего потока для дальнейших стадий и/или последовательностей переработки, можно использовать одну или несколько последовательностей окислительной переработки.
Вновь ссылаясь на ФИГ. 8, первый материал 2, который включает целлюлозу, имеющую первую среднечисленную молекулярную массу (TMN1) и имеющую первое содержание кислорода (TO1), подвергают окислению, например, нагреванием первого материала в трубчатой печи в потоке воздуха или обогащенного кислородом воздуха, с получением второго материала 3, который включает целлюлозу, имеющую вторую среднечисленную молекулярную массу (TMN2) и имеющую второе содержание кислорода (TO2), которое ниже, чем первое содержание кислорода (TO1). Второй материал (или, в определенных вариантах осуществления, первый и второй материал) можно, например, смешивать со смолой, такой как расплавленная термопластичная смола, или с микроорганизмом с получением композита 4, имеющего желаемые механические свойства, или топлива 5.
Такие материалы также можно комбинировать с твердым веществом и/или жидкостью. Например, жидкость может быть в форме раствора, а твердое вещество может быть в форме частиц. Жидкость и/или твердое вещество могут включать микроорганизм, например, бактерию, и/или фермент. Например, бактерия и/или фермент могут действовать на целлюлозный или лигноцеллюлозный материал, продуцируя топливо, такое как этанол, или сопродукт, такой как белок. Топлива и сопродукты описаны в FIBROUS MATERIALS AND COMPOSITES, USSN 11/453951, поданной 15 июня 2006 года. Полное содержание каждой из указанных выше заявок включено в настоящий документ в качестве ссылки.
В некоторых вариантах осуществления вторая среднечисленная молекулярная масса не более чем на 97% ниже первой среднечисленной молекулярной массы, например, не более чем на 95%, 90, 85, 80, 75, 70, 65, 60, 55, 50, 45, 40, 30, 20, 12,5, 10,0, 7,5, 5,0, 4,0, 3,0, 2,5, 2,0 или не более чем на 1,0% ниже первой среднечисленной молекулярной массы. Величина снижения молекулярной массы зависит от применения.
В некоторых вариантах осуществления, в которых материалы используют для получения топлива или сопродукта, исходная среднечисленная молекулярная масса (перед окислением) составляет от приблизительно 200000 до приблизительно 3200000, например, от приблизительно 250000 до приблизительно 1000000 или от приблизительно 250000 до приблизительно 700000, и среднечисленная молекулярная масса после окисления составляет от приблизительно 50000 до приблизительно 200000, например, от приблизительно 60000 до приблизительно 150000 или от приблизительно 70000 до приблизительно 125000. Однако в некоторых вариантах осуществления, например, после экстенсивного окисления, среднечисленная молекулярная масса может составлять менее чем приблизительно 10000 или даже менее чем приблизительно 5000.
В некоторых вариантах осуществления второе содержание кислорода по меньшей мере приблизительно на 5% превышает первое содержание кислорода, например, превышает на 7,5%, 10,0%, 12,5%, 15,0% или 17,5%. В некоторых предпочтительных вариантах осуществления второе содержание кислорода по меньшей мере приблизительно на 20,0% превышает содержание кислорода в первом материале. Содержание кислорода измеряют элементным анализом путем пиролиза образца в печи, работающей при 1300°C или более. Подходящим устройством для элементного анализа является анализатор LECO CHNS-932 с печью для высокотемпературного пиролиза VTF-900.
В некоторых вариантах осуществления окисление первого материала 200 не приводит к существенному изменению кристалличности целлюлозы. Однако в некоторых случаях, например, после чрезмерного окисления, второй материал имеет целлюлозу, обладающую кристалличностью (TC2), которая ниже кристалличности (TC1) целлюлозы первого материала. Например, (TC2) может быть ниже, чем (TC1), приблизительно более чем на 5%, например, на 10, 15, 20 или даже 25%. Это может быть желательным для повышения растворимости материалов в жидкости, такой как жидкость, которая включает бактерию и/или фермент.
В некоторых вариантах осуществления исходный индекс кристалличности (перед окислением) составляет от приблизительно 40 до приблизительно 87,5%, например, от приблизительно 50 до приблизительно 75% или от приблизительно 60 до приблизительно 70%, и индекс кристалличности после окисления составляет от приблизительно 30 до приблизительно 75,0%, например, от приблизительно 35,0 до приблизительно 70,0% или от приблизительно 37,5 до приблизительно 65,0%. Однако в определенных вариантах осуществления, например, после экстенсивного окисления, индекс кристалличности может составлять менее чем 5%. В некоторых вариантах осуществления материал после окисления является по существу аморфным.
Без связи с какой-либо конкретной теорией полагают, что окисление повышает количество образующих водородные связи групп в целлюлозе, таких как гидроксильные группы, альдегидные группы, кетоновые группы, группы карбоновой кислоты или ангидридные группы, которые могут повысить ее способность к диспергированию и/или ее растворимость (например, в жидкости). Чтобы дополнительно повысить способность к диспергированию в смоле, смола может включать компонент, который содержит образующие водородные связи группы, такие как одна или несколько ангидридных групп, групп карбоновой кислоты, гидроксильных групп, амидных групп, аминогрупп или смесей любых из этих групп. В некоторых предпочтительных вариантах осуществления компонент включает полимер, сополимеризованный с малеиновым ангидридом и/или имеющий привитой малеиновый ангидрид. Такие материалы доступны от Dupont под торговым названием FUSABOND®.
Как правило, окисление первого материала 200 происходит в окислительной среде. Например, окисление может быть осуществлено или ускорено пиролизом в окислительной среде, такой как воздух или аргон, обогащенный воздухом. Для содействия окислению к материалу перед окислением или в процессе окисления могут быть добавлены различные химические вещества, такие как окислители, кислоты или основания. Например, перед окислением можно добавлять пероксид (например, бензоилпероксид).
Системы для окисления
На ФИГ. 22 представлена технологическая схема 5000, которая включает различные стадии в системе окислительной предварительной обработки сырья. На первой стадии 5010 из источника исходного материала подается сухое сырье. Источник исходного материала может включать, например, платформу или контейнер для хранения, которые соединены с расположенным на одной линии реактором для окисления через конвейерную ленту или другое устройство для транспортировки сырья.
Как описано выше, перед доставкой в реактор для окисления сухое сырье из источника исходного материала может быть предварительно переработано. Например, если сырье получено из растительных источников, то определенные части растительного материала могут быть удалены перед сбором растительного материала и/или перед доставкой растительного материала в устройство для транспортировки сырья. Альтернативно или дополнительно, сырье биомассы можно подвергать механической переработке (например, для снижения средней длины волокон в сырье) перед доставкой в реактор для окисления.
После механической переработки 5020 сырье 5030 транспортируется в систему для смешивания, которая подает воду 5150 в сырье в процессе механического смешивания. Объединение воды с переработанным сырьем на стадии смешивания 5040 приводит к водной суспензии 5050 сырья, которую затем можно обрабатывать одним или несколькими окислителями.
Как правило, в смесь добавляют один литр воды на каждые 0,02-1,0 кг сухого сырья. Соотношение сырья и воды в смеси зависит от источника сырья и конкретных окислителей, используемых далее в процессе в целом. Например, при обычных промышленных последовательностях переработки лигноцеллюлозной биомассы водная суспензия 5050 сырья включает от приблизительно 0,5 кг до приблизительно 1,0 кг сухой биомассы на литр воды.
В некоторых вариантах осуществления на стадии смешивания сырья 5040 в суспензию сырья также может быть добавлена одна или несколько защищающих волокна добавок 5170. Защищающие волокна добавки способствуют снижению деградации определенных типов волокон биомассы (например, целлюлозных волокон) в процессе окисления сырья. Защищающие волокна добавки можно использовать, например, если желаемый продукт переработки лигноцеллюлозного сырья включает целлюлозные волокна. Типичные защищающие волокна добавки включают соединения магния, такие как гидроксид магния. Концентрации защищающих волокна добавок в суспензии 5050 сырья могут составлять, например, от 0,1% до 0,4% сухой массы сырья биомассы.
В определенных вариантах осуществления водную суспензию 5050 сырья можно подвергать необязательной экстракции 5180 органическим растворителем для удаления из суспензии нерастворимых в воде веществ. Например, экстракция суспензии 5050 одним или несколькими органическими растворителями приводит к очищенной суспензии и потоку органических отходов 5210, который включает нерастворимые в воде вещества, такие как жиры, масла и другие неполярные вещества на основе углеводородов. Подходящие растворители для проведения экстракции суспензии 5050 включают, например, различные спирты, углеводороды и галогенуглеводороды.
В некоторых вариантах осуществления водную суспензию 5050 сырья можно подвергать необязательной термической обработке 5190 для дальнейшей подготовки сырья к окислению. Пример термической обработки включает нагревание суспензии сырья в присутствии сжатого пара. В волокнистом сырье биомассы сжатый пар обеспечивает набухание волокон, предоставляя большую часть поверхностей волокон водному растворителю и окислителям, которые подаются на последующих стадиях переработки.
В определенных вариантах осуществления водную суспензию 5050 сырья можно подвергать необязательной обработке основными веществами 5200. Обработка одним или несколькими основными веществами может облегчить отделение лигнина от целлюлозы в лигноцеллюлозном сырье биомассы, тем самым улучшая последующее окисление сырья. Типичные основные вещества включают гидроксиды щелочных и щелочноземельных металлов, такие как гидроксид натрия, гидроксид калия и гидроксид кальция. Как правило, можно использовать множество основных веществ, обычно в концентрациях от приблизительно 0,01% до приблизительно 0,5% сухой массы сырья.
Водная суспензия 5050 сырья транспортируется (например, через встроенную в линию систему труб) в камеру, которая может представлять собой камеру для предварительной окислительной переработки или реактор для окисления. На стадии предварительной окислительной переработки 5060 в жидкую суспензию 5050 сырья добавляют один или несколько окислителей 5160 с образованием окислительной среды. В некоторых вариантах осуществления, например, окислители 5160 могут включать пероксид водорода. Пероксид водорода можно добавлять в суспензию 5050 в виде водного раствора и в соотношениях в диапазоне от 3% до 30-35 масс.% суспензии 5050. Пероксид водорода имеет ряд преимуществ в качестве окислителя. Например, водный раствор пероксида водорода является относительно недорогим, относительно химически стабильным и не является особенно вредным относительно других окислителей (и, таким образом, не требует обременительных процедур содержания и дорогостоящего защитного оборудования). Более того, пероксид водорода разлагается с образованием воды в процессе окисления сырья, так что очистка потока отходов является относительно несложной и недорогой.
В определенных вариантах осуществления окислители 5160 могут включать кислород (например, газообразный кислород) либо отдельно, либо в комбинации с пероксидом водорода. Газообразным кислородом можно барботировать суспензию 5050 в соотношениях в диапазоне от 0,5 до 10 масс.% суспензии 5050. Альтернативно или дополнительно, газообразный кислород также можно подавать в водную фазу при равновесии с суспензией 5050 (например, паровая головка над суспензией 5050). Газообразный кислород можно подавать либо в камеру для предварительной окислительной переработки, либо в реактор для окисления (или в оба), в зависимости от конфигурации системы для окислительной переработки. Обычно, например, парциальное давление кислорода в паре над суспензией 5050 превышает атмосферное давление кислорода и находится в диапазоне от 0,5 бар до 35 бар в зависимости от природы сырья.
Газообразный кислород можно подавать в чистой форме, или он может быть смешан с одним или несколькими газами-носителями. Например, в некоторых вариантах осуществления, воздух под высоким давлением предоставляет кислород в водяном паре. В определенных вариантах осуществления газообразный кислород может непрерывно подаваться в паровой фазе для обеспечения того, чтобы в процессе переработки сырья концентрация кислорода в паре оставалась в определенных заданных пределах. В некоторых вариантах осуществления газообразный кислород может быть сначала введен в достаточной концентрации для окисления сырья, а затем сырье может транспортироваться в закрытую, находящуюся под давлением емкость (например, реактор для окисления) для переработки.
В определенных вариантах осуществления окислители 5160 могут включать выделяющийся кислород (например, радикалы кислорода). Как правило, выделяющийся (атомарный) кислород образуется, при необходимости, в реакторе для окисления или в камере, находящейся в гидравлическом сообщении с реактором для окисления, в результате одной или нескольких реакций разложения. Например, в некоторых вариантах осуществления, атомарный кислород может образоваться в результате реакции между NO и O2 в газовой смеси или в растворе. В определенных вариантах осуществления атомарный кислород может образоваться при разложении HOCl в растворе. Другие способы, с помощью которых может образоваться атомарный кислород, включают электрохимическое генерирование, например, в растворе электролитов.
Как правило, выделяющийся кислород является эффективным окислителем благодаря относительно высокой реакционной способности кислородных радикалов. Однако выделяющийся кислород также может быть относительно селективным окислителем. Например, когда лигноцеллюлозное сырье обрабатывается выделяющимся кислородом, преимущественно происходит селективное окисление лигнина относительно других компонентов сырья, таких как целлюлоза. В результате, окисление сырья выделяющимся кислородом обеспечивает способ селективного удаления фракции лигнина из определенных типов сырья. Обычно, для достижения эффективного окисления используют концентрации выделяющегося кислорода от приблизительно 0,5% до 5% сухой массы сырья.
Без связи с теорией полагают, что выделяющийся кислород реагирует с лигноцеллюлозным сырьем по меньшей мере по двум различным механизмам. По первому механизму выделяющийся кислород подвергается реакции присоединения к лигнину, приводя к частичному окислению лигнина, которое солюбилизирует лигнин в водном растворе. В результате, солюбилизированный лигнин может быть удален из остальной части сырья путем промывания. По второму механизму выделяющийся кислород разрушает бутановые поперечные сшивки и/или раскрывает ароматические кольца, которые соединены через бутановые поперечные сшивки. В результате, растворимость водного раствора лигнина возрастает, способствуя отделению фракции лигнина от остальной части сырья путем промывания.
В некоторых вариантах осуществления окислители 5160 включают озон (O3). Применение озона может вносить некоторые условия обращения с химическими реагентами в последовательности окислительной переработки. При чрезмерно энергичном нагревании водный раствор озона может быстро разложиться с потенциально неблагоприятными последствиями как для людей, являющихся операторами системы, так и для оборудования системы. Таким образом, озон обычно образуется в термически изолированной емкости с утолщенными стенками, отдельно от емкости, которая содержит суспензию сырья, и транспортируется к ней на соответствующей стадии способа.
Без связи с теорией полагают, что озон разлагается на кислород и радикалы кислорода, и что радикалы кислорода (например, атомарный кислород) ответственны за окислительные свойства озона так, как описано выше. Озон, как правило, предпочтительно окисляет фракцию лигнина в лигноцеллюлозных материалах, оставляя фракцию целлюлозы относительно незатронутой.
Условия окисления на основе озона сырья биомассы, как правило, зависят от природы биомассы. Например, для целлюлозного и/или лигноцеллюлозного сырья концентрации озона от 0,1 г/м3 до 20 г/м3 сухого сырья обеспечивают эффективное окисление сырья. Как правило, содержание воды в суспензии 5050 составляет от 10 масс.% до 80 масс.% (например, от 40 масс.% до 60 масс.%). В процессе окисления на основе озона температура суспензии 5050 может поддерживаться в диапазоне от 0°C до 100°C, чтобы избежать интенсивного разложения озона.
В некоторых вариантах осуществления суспензия 5050 сырья может быть обработана водным щелочным раствором, который включает один или несколько гидроксидов щелочных или щелочноземельных металлов, таких как гидроксид натрия, гидроксид калия и гидроксид кальция, а затем обработана содержащим озон газом в реакторе для окисления. Было выявлено, что этот процесс значительно увеличивает разложение биомассы в суспензии 5050. Как правило, например, концентрация ионов гидроксида в щелочном растворе составляет от 0,001 масс.% до 10 масс.% суспензии 5050. После смачивания сырья путем контакта со щелочным раствором в реактор для окисления подается содержащий озон газ, где он контактирует с сырьем и окисляет его.
Окислители 5160 могут также включать другие вещества. В некоторых вариантах осуществления, например, в суспензию 5050 можно подавать окислители на основе галогена, такие как хлор и кислородные соединения хлора (например, гипохлорит). В определенных вариантах осуществления в суспензию 5050 можно подавать азотсодержащие окислители. Иллюстративные азотсодержащие окислители включают, например, NO и NO2. Азотсодержащие вещества также могут объединяться с кислородом в суспензии 5050, создавая дополнительные окислители. Например, как NO, так и NO2, объединяются с кислородом в суспензии 5050 с образованием нитратных соединений, которые являются эффективными окислителями для сырья биомассы. Окислители на основе галогена и азота могут, в некоторых вариантах осуществления, обеспечивать отбеливание сырья биомассы, в зависимости от природы сырья. Отбеливание может быть желательным для определенных получаемых из биомассы продуктов, которые экстрагируются на последующих стадиях переработки.
Другие окислители могут включать, например, различные пероксикислоты, пероксиуксусные кислоты, персульфаты, перкарбонаты, перманганаты, тетроксид осмия и оксиды хрома.
После стадии предварительной окислительной переработки 5060 суспензия 5050 сырья окисляется на стадии 5070. Если окислители 5160 добавляются к суспензии 5050 в реакторе для окисления, то окисление протекает в этом же реакторе. Альтернативно, если окислители 5160 добавляются к суспензии 5050 в камере для предварительной обработки, то суспензия 5050 транспортируется в реактор для окисления через встроенную в линию систему труб. После попадания внутрь реактора для окисления окисление сырья биомассы продолжается при контролируемых наборах окружающих условий. Обычно, например, реактор для окисления представляет собой цилиндрическую емкость, которая закрыта от внешней окружающей среды и находится под давлением. Возможна как циклическая, так и непрерывная работа, хотя окружающие условия, как правило, легче контролировать при поточных циклических действиях по переработке.
Окисление суспензии 5050 сырья обычно происходит в реакторе для окисления при повышенных температурах. Например, температура суспензии 5050 в реакторе для окисления обычно поддерживается выше 100°C, в диапазоне от 120°C до 240°C. Для многих типов сырья биомассы окисление является особенно эффективным, если температура суспензии 5050 поддерживается в диапазоне от 150°C до 220°C. Суспензию 5050 можно нагревать с использованием различных теплообменных устройств. Например, в некоторых вариантах осуществления реактор для окисления контактирует с нагревательной баней, которая включает масло или расплавленные соли. В определенных вариантах осуществления серия теплообменных труб окружает реактор для окисления и контактирует с ним, и циркулирующая горячая текучая среда в трубах нагревает суспензию 5050 в реакторе. Другие нагревательные устройства, которые могут быть использованы для нагревания суспензии 5050, включают, например, резистивные нагревательные элементы, индукционные нагреватели и микроволновые источники.
Время нахождения суспензии 5050 сырья в реакторе для окисления можно варьировать по желанию для переработки сырья. Как правило, суспензия 5050 находится в реакторе при окислении от 1 минуты до 60 минут. Для относительно мягкого материала биомассы, такого как лигноцеллюлозный материал, время нахождения в реакторе для окисления может составлять от 5 минут до 30 минут, например, при давлении кислорода в реакторе от 3 до 12 бар и при температуре суспензии от 160°C до 210°C. Однако для других типов сырья время нахождения в реакторе для окисления может быть больше, например, до 48 часов. Чтобы определить соответствующее время нахождения суспензии 5050 в реакторе для окисления, аликвоты суспензии можно извлекать из реактора через определенные интервалы и анализировать для определения концентраций конкретных представляющих интерес продуктов, таких как сложные сахариды. Информацию о повышении концентраций определенных продуктов в суспензии 5050 как функции времени можно использовать для определения времени нахождения для конкретных классов сырьевых материала.
В некоторых вариантах осуществления в процессе окисления суспензии 5050 сырья можно проводить коррекцию pH суспензии путем добавления в реактор для окисления одного или нескольких химических веществ. Например, в определенных вариантах осуществления окисление протекает более эффективно при pH в диапазоне приблизительно 9-11. Для поддержания pH в этом диапазоне в реактор для окисления могут быть введены такие вещества, как гидроксиды щелочных и щелочноземельных металлов, карбонаты, аммиак и буферные растворы.
В процессе окисления может быть важной циркуляция суспензии 5050 для обеспечения достаточного контакта между окислителями 5160 и сырьем. Циркуляции суспензии можно добиться, используя различные способы. Например, в некоторых вариантах осуществления реактор для окисления может быть оборудован устройством для механического перемешивания, которое включает лопасти крыльчатки или колесо с лопастями. В определенных вариантах осуществления реактор для окисления может представлять собой петлевой реактор, в котором водный растворитель, в котором суспендировано сырье, одновременно дренируется со дна реактора и рециркулирует в верхнюю часть реактора путем накачивания, тем самым обеспечивая, чтобы суспензия постоянно многократно перемешивалась и не застаивалась в реакторе.
После завершения окисления сырья суспензия транспортируется в устройство для разделения, где протекает стадия механического разделения 5080. Как правило, стадия механического разделения 5080 включает одну или несколько стадий тонкой фильтрации с возрастанием степени фильтрации суспензии для механического разделения твердых и жидких составляющих.
Жидкая фаза 5090 отделяется от твердой фазы 5100, после чего эти две фазы перерабатываются независимо. Твердая фаза 5100 необязательно может претерпевать стадию высушивания 5120, например, в устройстве для высушивания. Стадия высушивания 5120 может включать, например, механическое распределение твердого материала на поверхности для высушивания, и выпаривание воды из твердой фазы 5100 путем осторожного нагревания твердого материала. После стадии высушивания 5120 (или, альтернативно, без стадии высушивания 5120) твердая фаза 5100 транспортируется для дальнейших стадий переработки 5140.
Жидкая фаза 5090 необязательно может подвергаться стадии высушивания 5110 для уменьшения концентрации воды в жидкой фазе. В некоторых вариантах осуществления, например, стадия высушивания 5110 может включать выпаривание и/или дистилляцию и/или экстракцию воды из жидкой фазы 5090 путем осторожного нагревания жидкости. Альтернативно или дополнительно, для удаления воды из жидкой фазы 5090 можно использовать один или несколько химических осушающих реагентов. После стадии высушивания 5110 (или, альтернативно, без стадии высушивания 5110) жидкая фаза 5090 транспортируется для дальнейших стадий переработки 5130, которые могут включать различные стадии химической и биологической обработки, такие как химический и/или ферментативный гидролиз.
На стадии высушивания 5110 образуется поток отходов 5220, водный раствор, который включает растворенные химические вещества, такие как кислоты и основания, в относительно низких концентрациях. Обработка потока отходов 5220 может включать, например, нейтрализацию pH одной или несколькими минеральными кислотами или основаниями. В зависимости от концентрации растворенных солей в потоке отходов 5220 раствор может подвергаться частичной деионизации (например, путем пропускания потока отхода через ионообменную систему). Затем поток отходов, который включает, главным образом, воду, может рециркулировать в общем процессе (например, в виде воды 5150), отведен к другому процессу или сброшен.
Как правило, в случае лигноцеллюлозного сырья биомассы, после стадии разделения 5070 жидкая фаза 5090 включает множество растворимых поли- и олигосахаридов, которые затем могут быть отделены и/или восстановлены до сахаридов с меньшей длиной цепи путем дельнейших стадий переработки. Твердая фаза 5100 обычно включает, главным образом, целлюлозу, например, с меньшими количествами образующихся из гемицеллюлозы и лигнина продуктов.
В некоторых вариантах осуществления окисление можно проводить при повышенной температуре в реакторе, таком как камера для пиролиза. Например, вновь ссылаясь на ФИГ. 17, сырьевые материалы могут быть окислены в филаментном пиролизере 1712. При обычном применении окисляющий газ-носитель, например, воздух или смесь воздух/аргон, двигается в поперечном направлении через держатель образца 1713, в то время как резистивный нагревательный элемент вращается и нагревается до желаемой температуры, например, 325°C. После соответствующего периода времени, например, от 5 до 10 минут, окисленный материал удаляется из держателя образца. Систему, представленную на ФИГ. 17, можно масштабировать и делать непрерывной. Например, вместо проволоки в качестве нагревательного элемента, нагревательный элемент может представлять собой винт винтового транспортера. Материал может непрерывно попадать в держатель образца, наталкиваясь на нагретый винт, который осуществляет пиролиз материала. В то же время, винт может выталкивать окисленный материал из держателя образца, обеспечивая возможность для ввода нового неокисленного материала.
Сырьевые материалы также могут быть окислены в любой из систем для пиролиза, представленных на ФИГ. 18-20 и описанных выше в разделе "Системы для пиролиза".
Вновь ссылаясь на ФИГ. 21, сырьевые материалы могут быть быстро окислены путем покрытия вольфрамовой нити 150, вместе с окислителем, таким как пероксид, желаемым целлюлозным материалом, в то время как материал находится в вакуумной камере 151. Для обеспечения окисления через нить пропускают ток, который вызывает быстрое нагревание нити в течение желаемого периода времени. Обычно нагревание продолжают в течение нескольких секунд, а затем нити дают охладиться. В некоторых вариантах осуществления нагревание проводят несколько раз для обеспечения желаемой степени окисления.
Вновь ссылаясь на ФИГ. 12, в некоторых вариантах осуществления сырьевые материалы могут быть окислены с помощью звука и/или кавитации. Как правило, для достижения окисления материалы обрабатывают ультразвуком в окислительной среде, такой как вода, насыщенная кислородом или другим химическим окислителем, таким как пероксид водорода.
Вновь ссылаясь на ФИГ. 9 и 10, в определенных вариантах осуществления, для содействия окислению сырьевых материалов используют ионизирующее излучение. Как правило, для достижения окисления материалы облучают в окислительной среде, такой как воздух или кислород. Например, для облучения материалов можно использовать гамма-излучение и/или облучение электронным пучком.
Другие способы
Паровой взрыв можно использовать отдельно без любого из способов, описанных в настоящем документе, или в комбинации с любым из способов, описанных в настоящем документе.
На ФИГ. 23 показано общее представление всего процесса конвертирования источника волокна 400 в продукт 450, такой как этанол, способом, который включает дробление и паровой взрыв с получением волокнистого материала 401, который затем гидролизуется и конвертируется, например, ферментируется, с получением продукта. Источник волокна может быть преобразован в волокнистый материал 401 рядом возможных способов, включая по меньшей мере один способ дробления и по меньшей мере один способ парового взрыва.
Например, один вариант включает дробление источника волокна с последующей необязательной стадией(ями) просеивания и необязательной дополнительной стадией(ями) дробления для получения раздробленного источника волокна 402, который затем может быть подвергнут паровому взрыву с образованием волокнистого материала 401. После процесса парового взрыва необязательно следует процесс извлечения волокон для удаления жидкостей или "раствора" 404, образовавшихся в процессе парового взрыва. Материал, полученный после парового взрыва раздробленного источника волокна, может быть дополнительно раздроблен на необязательной дополнительной стадии(ях) дробления и/или необязательной стадии(ях) просеивания.
В другом способе волокнистый материал 401 сначала повергается паровому взрыву с образованием подвергнутого паровому взрыву источника волокна 410. Затем полученный подвергнутый паровому взрыву источник волокна подвергается необязательному способу извлечения волокон для удаления жидкостей или раствора. Затем полученный подвергнутый паровому взрыву источник волокна может дробиться с получением волокнистого материала. Подвергнутый паровому взрыву источник волокна также может подвергаться одной или нескольким дополнительным стадиям просеивания и/или одной или нескольким необязательным дополнительным стадиям дробления. Способ дробления и парового взрыва источника волокна для получения раздробленного и подвергнутого паровому взрыву волокнистого материала дополнительно рассмотрен ниже.
Перед дроблением или паровым взрывом источник волокна может быть нарезан на фрагменты или полосы материала типа конфетти. Процессы дробления осуществляют на материале в сухом состоянии (например, имеющем менее 0,25 масс.% поглощенной воды), в гидратированном состоянии или даже когда материал частично или полностью погружен в жидкость, такую как вода или изопропанол. Также способ необязательно может включать стадии высушивания выходящего потока после парового взрыва или дробления для обеспечения дополнительных стадий сухого дробления или парового взрыва. Стадии дробления, просеивания и парового взрыва могут быть проведены в присутствии или в отсутствие различных химических растворов.
В способе парового взрыва источник волокна или раздробленный источник волокна контактируют с паром под высоким давлением, и пар диффундирует в структуры источника волокна (например, лигноцеллюлозные структуры). Затем пар конденсируется под высоким давлением, тем самым "смачивая" источник волокна. Влага в источнике волокна может осуществлять гидролиз любых ацетильных групп в источнике волокна (например, ацетильных групп во фракциях гемицеллюлозы), образуя органические кислоты, такие как уксусная и уроновая кислоты. Кислоты, в свою очередь, могут катализировать деполимеризацию гемицеллюлозы, высвобождение ксилана и ограниченных количеств глюкана. Затем, когда давление сбрасывается, "смоченный" источник волокна (или раздробленный источник волокна, и т.д.) "взрывается". Конденсированная влага мгновенно испаряется вследствие резкого снижения давления, и расширение водяного пара оказывает сдвиговое усилие на источник волокна (или раздробленный источник волокна, и т.д.). Достаточное сдвиговое усилие приводит к механическому разрушению внутренних структур (например, лигноцеллюлозных структур) источника волокна.
Затем раздробленный и подвергнутый паровому взрыву волокнистый материал преобразуется в полезный продукт, такой как этанол. В некоторых вариантах осуществления волокнистый материал конвертируется в топливо. Одним из способов конвертирования волокнистого материала в топливо является гидролиз для получения поддающихся ферментации сахаров, 412, которые затем подвергают ферментации с образованием продукта. Также можно использовать другие известные или неизвестные способы конвертирования волокнистых материалов в топлива.
В некоторых вариантах осуществления, перед смешиванием с микроорганизмом, раздробленный и подвергнутый паровому взрыву волокнистый материал 401 стерилизуют для уничтожения каких-либо конкурирующих микроорганизмов, которые могут находиться на волокнистом материале. Например, волокнистый материал можно стерилизовать путем воздействия на волокнистый материал радиационного излучения, такого как инфракрасное излучение, ультрафиолетовое излучение или ионизирующее излучение, такое как гамма-излучение. Микроорганизмы можно также уничтожать с использованием химических стерилизующих средств, таких как отбеливатель (например, гипохлорит натрия), хлоргексидин или этиленоксид.
Одним из способов гидролиза раздробленного и подвергнутого паровому взрыву волокнистого материала является использование целлюлаз. Целлюлазы представляют собой группу ферментов, которые действуют синергично, гидролизуя целлюлозу. Также можно использовать коммерчески доступный ферментный комплекс Accellerase® 1000, который содержит комплекс ферментов, которые обеспечивают преобразование лигноцеллюлозной биомассы в поддающиеся ферментации сахара.
Согласно современному пониманию, компоненты целлюлазы включают эндоглюканазы, экзоглюканазы (целлобиогидролазы) и b-глюкозидазы (целлобиазы). Синергизм между целлюлазными компонентами существует, когда гидролиз комбинацией двух или более компонентов превышает сумму видов активности, проявляемых отдельными компонентами. Общепринятый механизм действия целлюлазной системы (в частности, системы T. longibrachiatum) на кристаллическую целлюлозу состоит в том, что эндоглюканаза гидролизует внутренние β-1,4-гликозидные связи аморфных областей, тем самым увеличивая количество экспонированных невосстанавливающих концов. Затем экзоглюканазы отщепляют целлобиозные звенья от невосстанавливающих концов, которые, в свою очередь, гидролизуются b-глюкозидазами до отдельных глюкозных звеньев. Существует несколько конфигураций как эндо-, так и экзоглюканаз, отличающихся стереоспецифичностью. Как правило, для оптимального гидролиза целлюлозы требуется синергическое действие компонентов в различных конфигурациях. Однако целлюлазы являются более склонными гидролизовать аморфные области целлюлозы. Существует линейная зависимость между кристалличностью и скоростями гидролиза, причем более высокие индексы кристалличности соответствуют более медленным скоростям гидролиза ферментом. Аморфные области целлюлозы гидролизуются с удвоенной скоростью относительно кристаллических областей. Гидролиз раздробленного и подвергнутого паровому взрыву волокнистого материала может быть проведен любым способом гидролиза биомассы.
Паровой взрыв биомассы иногда вызывает образование побочных продуктов, например, токсических веществ, которые являются ингибиторными для активности микробов и ферментов. Таким образом, способ конвертирования раздробленного и подвергнутого паровому взрыву волокнистого материала в топливо может необязательно включать стадию известкования перед ферментацией для осаждения некоторых из токсических веществ. Например, значение pH раздробленного и подвергнутого паровому взрыву волокнистого материала можно увеличивать так, чтобы оно превышало pH 10, добавлением гидроксида кальция (Ca(OH)2) с последующей стадией снижения pH до приблизительно 5 добавлением H2SO4. Затем подвергнутый известкованию волокнистый материал можно использовать в таком виде без удаления преципитата. Как показано на ФИГ. 23, необязательную стадию известкования проводят непосредственно перед стадией гидролиза раздробленного и подвергнутого паровому взрыву волокнистого материала, но также предусматривается проведение стадии известкования после стадии гидролиза и перед стадией ферментации.
На ФИГ. 24 представлен пример устройства для парового взрыва 460. Устройство для парового взрыва 460 включает реакционную камеру 462, в которую помещается источник волокна и/или волокнистый материал через входное отверстие 464 для источника волокна. Закрытие клапана 465 входного отверстия для источника волокна закрывает реакционную камеру. Кроме того, реакционная камера включает отверстие для входа сжатого пара 466, которое включает паровой клапан 467. Реакционная камера, кроме того, включает выходное отверстие для сброса давления взрыва 468, которое включает клапан 469 выходного отверстия, соединенный с циклоном 470 через соединительную трубу 472. Когда реакционная камера содержит источник волокна и/или раздробленный источник волокна и закрыта закрывающими клапанами 465, 467 и 469, в реакционную камеру 462 доставляется пар путем открытия клапана 467 входного отверстия для пара, позволяющего пару выходить через входное отверстие для пара 466. После того, как реакционная камера достигает заданной температуры, что может занимать приблизительно 20-60 секунд, начинается время выдерживания. Реакционная камера выдерживается при заданной температуре в течение желаемого времени выдерживания, которое обычно составляет приблизительно от 10 секунд до 5 минут. В конце периода выдерживания клапан выходного отверстия открывается, позволяя сброс давления взрыва. Процесс сброса давления взрыва обеспечивает продвижение содержимого реакционной камеры 462 из выходного отверстия для сброса давления взрыва 468, через соединительную трубу 472, в циклон 470. Затем подвергнутый паровому взрыву источник волокна или волокнистый материал выходит из циклона в форме суспензии в корзину для сбора 474, в то время как большая часть остаточного пара выходит из циклона в атмосферу через вентиляционное отверстие 476. Устройство для парового взрыва дополнительно включает выходное отверстие для промывания 478 с клапаном 479 выходного отверстия для промывания, соединенным с соединительной трубой 472. Клапан 479 выходного отверстия для промывания закрыт в процессе использования устройства для парового взрыва 460 при паровом взрыве, но открыт в процессе промывания реакционной камеры 462.
Заданная температура реакционной камеры 462 предпочтительно составляет от 180 до 240 градусов Цельсия или от 200 до 220 градусов Цельсия. Время выдерживания предпочтительно составляет от 10 секунд до 30 минут или от 30 секунд до 10 минут, или от 1 минуты до 5 минут.
Поскольку процесс парового взрыва приводит к осадку в виде подвергнутого паровому взрыву волокнистого материала, подвергнутый паровому взрыву волокнистый материал необязательно может подвергаться процессу извлечения волокон, где от подвергнутого паровому взрыву волокнистого материала отделяется "раствор". Эта стадия извлечения волокон является целесообразной, поскольку она обеспечивает процессы дальнейшего дробления и/или просеивания и может обеспечить возможность конверсии волокнистого материала в топливо. Процесс выделения волокон проводят с использованием сетчатой ткани для отделения волокон от раствора. Кроме того, также могут быть включены процессы высушивания для получения волокнистого материала или подвергнутого паровому взрыву источника волокна для последующей переработки.
Комбинирование устройств для облучения, пиролиза, обработки ультразвуком и/или окисления
В некоторых вариантах осуществления может быть полезным комбинирование двух или более отдельных устройств для облучения, обработки ультразвуком, пиролиза и/или окисления в единое гибридное устройство. С использованием такого гибридного устройства можно проводить несколько процессов рядом или даже одновременно, что дает преимущество увеличения производительности предварительной обработки и потенциальной экономии затрат.
Например, рассматриваются процессы облучения электронным пучком и обработки ультразвуком. Каждый отдельный процесс эффективен в отношении снижения средней молекулярной массы целлюлозного материала на порядок или более, и на несколько порядков при последовательном проведении.
Процессы как облучения, так и обработки ультразвуком, можно применять с использованием гибридного устройства для обработки электронным пучком/ультразвуком, как проиллюстрировано на ФИГ. 25. Гибридное устройство для обработки электронным пучком/ультразвуком 2500 изображено над пустой ванной (глубина ~3-5 см) для суспензии целлюлозного материала 2550, диспергированного в водной окислительной среде, такой как пероксид водорода или пероксид карбамида. Гибридное устройство 2500 имеет источник энергии 2510, который питает как излучатель электронного пучка 2540, так и рупоры для обработки ультразвуком 2530.
Излучатель электронного пучка 2540 генерирует электронный пучок, который проходит через устройство для нацеливания электронного пучка 2545, чтобы попасть на суспензию 2550, содержащую целлюлозный материал. Устройство для нацеливания электронного пучка может представлять собой сканер, который пропускает луч на протяжении диапазона вплоть до приблизительно 6 футов (183 см) в направлении, приблизительно параллельном поверхности суспензии 2550.
На любой стороне излучателя электронного пучка 2540 находятся рупоры для обработки ультразвуком 2530, которые доставляют энергию ультразвуковой волны к суспензии 2550. Рупоры для обработки ультразвуком 2530 заканчиваются съемной насадкой 2535, которая контактирует с суспензией 2550.
Рупоры для обработки ультразвуком 2530 имеют риск повреждения вследствие длительного остаточного воздействия облучения электронным пучком. Таким образом, рупоры могут быть защищены стандартным экраном 2520, например, изготовленным из свинца или содержащего тяжелый металл сплава, такого как металл Липовица, который является непроницаемым для излучения электронного пучка. Однако должны быть предприняты меры предосторожности, чтобы убедиться в том, что присутствие экрана не влияет на ультразвуковую энергию. Съемные наконечники 2535, которые сконструированы из того же материала, что и рупоры 2530, и присоединены к рупорам 2530, контактируют с целлюлозным материалом 2550 в процессе переработки и, как ожидается, могут быть повреждены. Таким образом, съемные наконечники 2535 сконструированы так, чтобы их было легко заменить.
Следующим преимуществом такого одновременного процесса обработки электронным пучком и ультразвуком состоит в том, что эти два процессы имеют взаимодополняющие результаты. В случае облучения отдельно электронным пучком, недостаточная доза может приводить к поперечному сшиванию некоторых из полимеров в целлюлозном материале, которое снижает эффективность процесса деполимеризации в целом. Для достижения степени деполимеризации, подобной той, которая достигается с использованием облучения электронным пучком и обработки ультразвуком по отдельности, можно также использовать более низкие дозы облучения электронным пучком и/или облучения ультразвуком. Устройство для облучения электронным пучком также можно комбинировать с одним или несколькими из высокочастотных ротор-статорных устройств, которые можно использовать в качестве альтернативы устройствам для обработки ультразвуком.
Также возможны другие комбинации устройств. Например, устройство для обработки ионизирующим излучением, которое генерирует гамма-излучение, испускаемое, например, таблетками60Co, можно комбинировать с источником электронного пучка и/или источником ультразвуковой волны. В этом случае требования к экранированию могут быть более строгими.
Радиационные устройства для предварительной обработки биомассы, рассмотренные выше, также можно комбинировать с одним или несколькими устройствами, которые осуществляют одну или несколько последовательностей переработки пиролизом. Такая комбинация также может иметь преимущество высокой производительности. Тем не менее, необходима предосторожность, поскольку могут быть противоположные требования между некоторыми способами радиационного облучения и пиролизом. Например, при использовании устройств для облучения ультразвуком может потребоваться погружение сырья в жидкую окислительную среду. С другой стороны, как рассмотрено выше, для образца сырья, подвергаемого пиролизу, может быть предпочтительно, чтобы оно имело конкретное содержание влаги. В этом случае, новые системы автоматически измеряют и проводят мониторинг конкретного содержания влаги и регулируют его. Кроме того, некоторые или все из указанных выше устройств, особенно устройство для пиролиза, можно комбинировать с устройством для окисления, как рассмотрено выше.
ОСНОВНЫЕ СПОСОБЫ
Ферментация
Как правило, различные микроорганизмы могут продуцировать ряд полезных продуктов, таких как топливо, путем воздействия на предварительно обработанный материал биомассы, например, его ферментации. Например, ферментацией или другими способами могут быть продуцированы спирты, органические кислоты, углеводороды, водород, белки или смеси любых из этих материалов.
Микроорганизм может представлять собой природный микроорганизм или полученный способами инженерии микроорганизм. Например, микроорганизм может представлять собой бактерию, например, целлюлолитическую бактерию, гриб, например, дрожжи, растение или одноклеточный организм, например, водоросли, простейшие или подобные грибам одноклеточные организмы, например, слизистую плесень. Когда организмы являются совместимыми, можно использовать смеси организмов.
Для содействия разрушению материалов, которые включают целлюлозу, можно использовать один или несколько ферментов, например, целлюлолитический фермент. В некоторых вариантах осуществления материалы, которые включают целлюлозу, сначала обрабатывают ферментом, например, объединяя материал и фермент в водном растворе. Затем этот материал можно объединять с микроорганизмом. В других вариантах осуществления материалы, которые включают целлюлозу, один или несколько ферментов и микроорганизм объединяют одновременно, например, путем объединения в водном растворе.
Также, для содействия разрушению материалов, которые включают целлюлозу, материалы после облучения можно обрабатывать нагреванием, химическим реагентом (например, минеральной кислотой, основанием или сильным окислителем, таким как гипохлорит натрия) и/или ферментом.
В процессе ферментации сахара, высвобождающиеся на стадии целлюлолитического гидролиза или осахаривания, ферментируются, например, в этанол, ферментирующим микроорганизмом, таким как дрожжи. Подходящие ферментирующие микроорганизмы способны конвертировать углеводы, такие как глюкоза, ксилоза, арабиноза, манноза, галактоза, олигосахариды или полисахариды, в продукты ферментации. Ферментирующие микроорганизмы включают штаммы рода Saccharomyces spp. например, Saccharomyces cerevisiae (пекарские дрожжи), Saccharomyces distaticus, Saccharomyces uvarum; род Kluyveromyces, например, виды Kluyveromyces marxianus, Kluyveromyces fragilis; род Candida, например, Candida pseudotropicalis и Candida brassicae, Pichia stipitis (родственник Candida shehatae, род Clavispora, например, виды Clavispora lusitaniae и Clavispora opuntiae, род Pachysolen, например, виды Pachysolen tannophilus, род Bretannomyces, например, вид Bretannomyces clausenii (Philippidis, G. P., 1996, Cellulose bioconversion technology, in Handbook on Bioethanol: Production and Utilization, Wyman, C.E., ed., Taylor & Francis, Washington, DC, 179-212).
Коммерчески доступные дрожжи включают, например, Red Star®/Lesaffre Ethanol Red (доступные от Red Star/Lesaffre, USA), FALI® (доступные от Fleischmann's Yeast, отделения Burns Philip Food Inc., USA), SUPERSTART® (доступные от Alltech), GERT STRAND® (доступные от Gert Strand AB, Sweden) и FERMOL® (доступные от DSM Specialties).
Бактерии, которые могут осуществлять ферментацию биомассы в этанол и другие продукты, включают, например, Zymomonas mobilis и Clostridium thermocellum (Philippidis, 1996, выше). Leschine et al. (International Journal of Systematic and Evolutionary Microbiology 2002, 52, 1155-1160) выделили анаэробные, мезофильные, целлюлолитические бактерии из лесной почвы, Clostridium phytofermentans sp. nov., которые преобразуют целлюлозу в этанол.
Ферментацию биомассы в этанол и другие продукты можно проводить с использованием определенных типов термофильных или полученных методами генной инженерии микроорганизмов, таких как виды Thermoanaerobacter, включая T. mathranii, и виды дрожжей, такие как виды Pichia. Примером штамма T. mathranii является A3M4, описанный в публикациях Sonne-Hansen et al. (Applied Microbiology and Biotechnology 1993, 38, 537-541) или Ahring et al. (Arch. Microbiol. 1997, 168, 114-119).
Для ферментации или конверсии можно использовать дрожжи и бактерии Zymomonas. Оптимальное значение pH для дрожжей составляет приблизительно от pH 4 до pH 5, в то время как оптимальное значение pH для Zymomonas составляет приблизительно от pH 5 до pH 6. Типичное время ферментации составляет приблизительно от 24 до 96 часов при температурах в диапазоне от 26°C до 40°C, однако термофильные микроорганизмы предпочитают более высокие температуры.
Ферменты, которые разрушают биомассу, такую как целлюлоза, до более низкомолекулярных углеводсодержащих материалов, таких как глюкоза, в процессе осахаривания, называют целлюлолитическими ферментами или целлюлазами. Эти ферменты могут представлять собой комплекс ферментов, которые действуют синергично, разрушая кристаллическую целлюлозу. Примеры целлюлолитических ферментов включают: эндоглюканазы, целлобиогидролазы и целлобиазы (β-глюкозидазы). Целлюлозный субстрат первоначально гидролизуется эндоглюканазами в случайных областях, продуцируя олигомерные промежуточные соединения. Затем эти промежуточные соединения становятся субстратами для экзо-расщепляющих глюканаз, таких как целлобиогидролаза, с образованием целлобиозы, отщепляемой от концов полимера целлюлозы. Целлобиоза представляет собой растворимый в воде, связанный β-1,4-связью димер глюкозы. Наконец, целлобиаза расщепляет целлобиозу с образованием глюкозы.
Целлюлаза способна разрушать биомассу и может иметь грибное или бактериальное происхождение. Подходящие ферменты включают целлюлазы из родов Bacillus, Pseudomonas, Humicola, Fusarium, Thielavia, Acremonium, Chrysosporium и Trichodertna, а также включают виды Humicola, Coprinus, Thielavia, Fusarium, Myceliophthora, Acremonium, Cephalosporium, Scytalidium, Penicillium или Aspergillus (см., например, EP 458162), особенно целлюлазы, продуцируемые штаммами, выбранными из видов Humicola insolens (переклассифицированного как Scytalidium thermophilum, см., например, патент США № 4435307), Coprinus cinereus, Fusarium oxysporum, Myceliophthora thermophila, Meripilus giganteus, Thielavia terrestris, Acremonium sp., Acremonium persicinum, Acremonium acremonium, Acremonium brachypenium, Acremonium dichromosporum, Acremonium obclavatum, Acremonium pinkertoniae, Acremonium roseogriseum, Acremonium incoloratum и Acremonium furatum; предпочтительно из видов Humicola insolens DSM 1800, Fusarium oxysporum DSM 2672, Myceliophthora thermophila CBS 117.65, Cephalosporium sp. RYM-202, Acremonium sp. CBS 478.94, Acremonium sp. CBS 265.95, Acremonium persicinum CBS 169.65, Acremonium acremonium AHU 9519, Cephalosporium sp. CBS 535.71, Acremonium brachypenium CBS 866.73, Acremonium dichromosporum CBS 683.73, Acremonium obclavatum CBS 311.74, Acremonium pinkertoniae CBS 157.10, Acremonium roseogriseum CBS 134.56, Acremonium incoloratum CBS 146.62 и Acremonium furatum CBS 299.70H. Целлюлолитические ферменты также могут быть получены из Chrysosporium, предпочтительно штамма Chrysosporium lucknowense. Кроме того, можно использовать Trichoderma (в частности, Trichoderma viride, Trichoderma reesei и Trichoderma koningii), алкалофильные Bacillus (см., например, патент США № 3844890 и EP 458162) и Streptomyces (см., например, EP 458162). Бактерия, Saccharophagus degradans, продуцирует смесь ферментов, способных осуществлять разрушение ряда целлюлозных материалов, и ее также можно использовать в этом процессе.
Из почвы также были выделены анаэробные целлюлолитические бактерии, например, новые целлюлолитические виды Clostridium, Clostridium phytofermentans sp. nov. (см. Leschine et. al, International Journal of Systematic and Evolutionary Microbiology (2002), 52, 1155-1160).
Также можно использовать целлюлолитические ферменты, полученные с использованием рекомбинантной технологии (см., например, WO 2007/071818 и WO 2006/110891).
Используемые целлюлолитические ферменты могут быть получены ферментацией указанных штаммов микроорганизмов на питательной среде, содержащей подходящие источники углерода и азота и неорганические соли, с использованием способов, известных в данной области (см., например, Bennett, J. W. and LaSure, L. (eds.), More Gene Manipulations in Fungi, Academic Press, CA 1991). Подходящие среды доступны от коммерческих поставщиков, или их можно получать согласно опубликованным композициям (например, в каталогах American Type Culture Collection). Диапазоны температур и другие условия, подходящие для выращивания и продукции целлюлазы, известны в данной области (см., например, Bailey, J.E., and Ollis, D.F., Biochemical Engineering Fundamentals, McGraw-Hill Book Company, NY, 1986).
Обработку целлюлозы целлюлазой обычно проводят при температурах от 30°C до 65°C. Целлюлазы активны в диапазоне pH приблизительно от 3 до 7. Длительность стадии осахаривания может составлять вплоть до 120 часов. Дозировка целлюлазного фермента обеспечивает достаточно высокий уровень конверсии целлюлозы. Например, соответствующая дозировка целлюлазы, как правило, составляет от 5,0 до 50 единиц фильтровальной бумаги (FPU или МЕ) на грамм целлюлозы. FPU является стандартной мерой и определяется и измеряется согласно Ghose (1987, Pure and Appl. Chem. 59:257-268).
Можно использовать переносные ферментеры, как описано в предварительной патентной заявке США с серийным номером 60/832735, в настоящее время опубликованная международная заявка № WO 2008/011598.
Газификация
В дополнение к применению пиролиза для предварительной обработки сырья, пиролиз также можно использовать для переработки предварительно обработанного сырья в целях экстракции полезных материалов. В частности, можно использовать форму пиролиза, известную как газификация, для получения топливных газов вместе с различными другими газообразными, жидкими и твердыми продуктами. Для проведения газификации предварительно обработанное сырье подается в камеру для пиролиза и нагревается до высокой температуры, обычно 700°C или более. Используемая температура зависит от ряда факторов, включая природу сырья и желаемые продукты.
Для содействия газификации в камеру для пиролиза также добавляют некоторые количества кислорода (например, в виде чистого газообразного кислорода и/или в виде воздуха) и пара (например, перегретого пара). Эти соединения реагируют с углеродсодержащим сырьевым материалом в многостадийной реакции с образованием смеси газов, называемой синтетическим газом (или "сингазом" (синтез-газом)). По существу, в ходе газификации в камеру для пиролиза подается ограниченное количество кислорода для обеспечения сгорания части сырьевого материала с образованием монооксида углерода и генерирования технологического тепла. Затем технологическое тепло может быть использовано для запуска второй реакции, которая преобразует дополнительный сырьевой материал в водород и монооксид углерода.
На первой стадии общей реакции нагревание сырьевого материала приводит к углистым остаткам, которые могут включать широкое множество различных соединений на основе углеводородов. Могут образоваться определенные летучие вещества (например, определенные газообразные углеводородные материалы), что приводит к снижению общей массы сырьевого материала. Затем, на второй стадии реакции, часть летучего материала, которая образуется на первой стадии, реагирует с кислородом в реакции горения с образованием как монооксида углерода, так и диоксида углерода. При этой реакции горения высвобождается тепло, которое запускает третью стадию реакции. На третьей стадии диоксид углерода и пар (например, вода) реагируют с углистыми остатками, образовавшимися на первой стадии, с образованием монооксида углерода и газообразного водорода. Монооксид углерода также может реагировать с паром, по водно-газовой реакции изменения (water gas shift), с образованием диоксида углерода и дополнительного газообразного водорода.
Газификация может быть использована в качестве основного процесса для получения продуктов непосредственно из предварительно обработанного сырья, например, для последующей транспортировки и/или продажи. Альтернативно или дополнительно, газификацию можно использовать в качестве вспомогательного процесса получения топлива для общей системы переработки. Богатый водородом синтез-газ, который образуется в процессе газификации, можно сжигать, например, для генерирования электричества и/или технологического тепла, которое может быть направлено для использования в других частях системы переработки. В результате, общая система переработки может быть по меньшей мере частично самообеспечивающейся. В процессе и/или после газификации также можно получить ряд других продуктов, включая пиролизные масла и газообразные вещества на основе углеводородов; их можно разделять и хранить или транспортировать, если желательно.
Для газификации предварительно обработанного сырья пригодно множество различных камер для пиролиза, включая камеры для пиролиза, описанные в настоящем документе. В частности, системы реакторов с псевдоожиженным слоем, в которых предварительно обработанное сырье подвергают флюидизации в паре и кислороде/воздухе, обеспечивают относительно высокую производительность и непосредственное выделение продуктов. Твердые углистые остатки, которые остаются после газификации в системе с псевдоожиженным слоем (или в других камерах для пиролиза), можно сжигать для генерирования дополнительного технологического тепла, используемого для запуска последующих реакций газификации.
ПОСЛЕДУЮЩАЯ ПЕРЕРАБОТКА
Дистилляция
После ферментации полученные текучие среды могут быть подвергнуты дистилляции с использованием, например, "бражной колонны" для отделения этанола и других спиртов от большей части воды и остаточных твердых веществ. Пар, выходящий из бражной колонны, может представлять собой, например, 35 масс.% этанол, и он может подаваться в ректификационную колонну. Смесь практически азеотропного (92,5%) этанола и воды из ректификационной колонны может быть очищен до чистого (99,5%) этанола с использованием молекулярных сит паровой фазы. Осадок бражных колонн может быть направлен на первую ступень трехступенчатого испарителя. Обратный холодильник ректификационной колонны может обеспечить тепло для этой первой ступени. После первой ступени твердые вещества можно отделить с использованием центрифуги и сушить во вращающейся сушке. Часть (25%) продукта из центрифуги можно повторно использовать для ферментации, а остаток может быть отправлен на вторую и третью ступени испарителя. Большая часть конденсата испарителя может быть возвращена в процесс в виде довольно чистого конденсата, где его небольшая часть выделяется на обработку отработанной воды для предотвращения образования соединений с низкой температурой кипения.
Обработка отработанной воды
Обработку отработанной воды используют для минимизации потребностей в добавочной воде для установки по переработке воды для повторного применения в установке. Обработка отработанной воды также может давать топливо (например, отстой и биогаз), которое можно использовать для повышения общей эффективности процесса продукции этанола. Например, как более подробно описано ниже, отстой и биогаз можно использовать для генерирования пара и электричества, которые можно использовать в различных производственных процессах.
Отработанную воду первоначально прокачивают через сито (например, решетку) для удаления крупных частиц, которые собираются в мусорный контейнер. В некоторых вариантах осуществления крупные частицы отправляют на мусорные свалки. Дополнительно или альтернативно, крупные частицы сжигают для генерирования пара и/или электричества, как подробно описано ниже. Как правило, расстояние в решетке составляет от 1/4 дюйма (0,6 см) до 1 дюйма (2,5 см) (например, 1/2 дюйма (1,3 см)).
Затем отработанная вода протекает в емкость для уравновешивания, где концентрация органических соединений в отработанной воде уравновешивается в течение времени отстаивания. Как правило, время отстаивания составляет от 8 часов до 36 часов (например, 24 часа). В емкости расположен смеситель для перемешивания содержимого емкости. В некоторых вариантах осуществления для перемешивания содержимого емкости используют смесители, расположенные по всей емкости. В определенных вариантах осуществления смеситель по существу перемешивает содержимое емкости для уравновешивания, так чтобы условия (например, концентрация и температура отработанной воды) по всей емкости были единообразными.
Первый насос перекачивает воду из емкости для уравновешивания через жидкостно-жидкостной теплообменник. Теплообменник регулируется (например, путем регулирования скорости потока текучей среды через теплообменник), так чтобы отработанная вода, выходящая из теплообменника, имела желаемую температуру для анаэробной обработки. Например, желаемая температура для анаэробной обработки может составлять от 40°C до 60°C.
После выхода из теплообменника отработанная вода попадает в один или несколько анаэробных реакторов. В некоторых вариантах осуществления концентрация отстоя в каждом анаэробном реакторе является такой же, как и общая концентрация отстоя в отработанной воде. В других вариантах осуществления в анаэробном реакторе отстой имеет более высокую концентрацию, чем общая концентрация отстоя в отработанной воде.
В каждый анаэробный реактор, содержащий отработанную воду, отмеряют питательный раствор, содержащий азот и фосфор. Питательный раствор реагирует с отстоем в анаэробном реакторе с образованием биогаза, который может содержать 50% метан и имеет теплоту сгорания приблизительно 12000 британских тепловых единиц, или Btu, на фунт (28000 кДж/кг). Биогаз выходит из каждого анаэробного реактора через вентиляционное отверстие и попадает в коллектор, где множество потоков биогаза объединяются в единый поток. Компрессор перекачивает поток биогаза в паровой котел или двигатель внутреннего сгорания, как более подробно описано ниже. В некоторых вариантах осуществления компрессор также перекачивает единый поток биогаза через катализатор десульфуризации. Кроме того или альтернативно, компрессор может перекачивать единый поток биогаза через седиментационную ловушку.
Второй насос перекачивает анаэробный выходящий поток из анаэробных реакторов в один или несколько аэробных реакторов (например, реакторов для активного ила). В каждом аэробном реакторе расположен аэратор для смешивания анаэробного выходящего потока, отстоя и кислорода (например, кислорода, содержащегося в воздухе). В каждом аэробном реакторе окисление клеточного материала в анаэробном выходящем потоке приводит к продукции диоксида углерода, воды и аммиака.
Аэробный выходящий поток перемещается (например, посредством силы тяжести) в сепаратор, где из обработанной воды отделяется отстой. Часть отстоя возвращается в один или несколько аэробных реакторов для создания повышенной концентрации отстоя в аэробных реакторах, тем самым способствуя аэробному разрушению клеточного материала в отработанной воде. Конвейер удаляет избыток отстоя из сепаратора. Как более подробно описано ниже, избыток отстоя используется в качестве топлива для генерирования пара и/или электричества.
Обработанная вода выкачивается из сепаратора в отстойник. Твердые вещества, диспергированные в обработанной воде, оседают на дно отстойника и впоследствии удаляются. После периода отстаивания обработанную воду выкачивают из отстойника через фильтр тонкой очистки для удаления каких-либо дополнительных твердых веществ, остающихся в воде. В некоторых вариантах осуществления в обработанную воду добавляют хлор для уничтожения патогенных бактерий. В некоторых вариантах осуществления для дополнительной очистки обработанной воды используют один или несколько способов физико-химической сепарации. Например, обработанную воду можно прокачивать через реактор для абсорбции углем. В качестве другого примера, обработанную воду можно прокачивать через реактор обратного осмоса.
В процессах, описанных в настоящем документе, когда в каком-либо из процессов используют воду, она может представлять собой бытовые сточные воды, например, городские сточные воды или фекальные воды. В некоторых вариантах осуществления сточную или фекальную воду стерилизуют перед применением. Стерилизацию можно проводить любым желаемым способом, например, посредством облучения, паровой или химической стерилизации.
Сжигание отходов
Продукция спирта из биомассы может приводить к образованию различных потоков побочных продуктов, пригодных для генерирования пара и электричества с целью использования в других частях установки. Например, пар, генерированный при сжигании потоков побочных продуктов, можно использовать в процессе дистилляции. В качестве другого примера, электричество, генерированное сжиганием потоков побочных продуктов, можно использовать для питания генераторов электронных пучков и ультразвуковых преобразователей, используемых для предварительной обработки.
Побочные продукты, используемые для генерирования пара и электричества, образуются из множества источников на протяжении всего процесса. Например, анаэробное расщепление отработанной воды дает биогаз с высоким содержанием метана и небольшое количество сточной биомассы (отстоя). В качестве другого примера, твердые вещества после дистилляции (например, неконвертированный лигнин, целлюлоза и гемицеллюлоза, остающиеся после предварительной обработки и основных процессов) можно использовать в качестве топлива.
Биогаз отводится к двигателю внутреннего сгорания, соединенному с электрическим генератором, для генерирования электричества. Например, биогаз можно использовать в качестве источника топлива в двигателе для природного газа с электрозажиганием. В качестве другого примера, биогаз можно использовать в качестве источника топлива в двигателе для природного газа с прямым впрыскиванием. В качестве другого примера, биогаз можно использовать в качестве источника топлив для турбины внутреннего сгорания. Дополнительно или альтернативно, двигатель внутреннего сгорания может быть спроектирован в конфигурации для комбинированного производства электрической и тепловой энергии. Например, тепло выхлопных газов от двигателей внутреннего сгорания можно использовать для обеспечения горячей воды или пара по всему производству.
Отстой и твердые вещества после дистилляции сжигают для нагревания воды, протекающей через теплообменник. В некоторых вариантах осуществления вода, протекающая через теплообменник, выпаривается и перегревается с образованием пара. В определенных вариантах осуществления пар используют в реакторе для предварительной обработки и при теплообмене в процессах дистилляции и выпаривания. Дополнительно или альтернативно, пар расширяется, питая многоступенчатую паровую турбину, соединенную с электрическим генератором. Пар, выходящий из паровой турбины, конденсируется охлаждающей водой и возвращается в теплообменник для повторного нагревания до пара. В некоторых вариантах осуществления скорость потока воды через теплообменник регулируется для обеспечения заданной выработки электричества от паровой турбины, соединенной с электрическим генератором. Например, в теплообменник может быть добавлена вода, чтобы обеспечить работу паровой турбины выше пороговых условий (например, турбина вращается достаточно быстро для вращения электрического генератора).
Наряду с тем, что были описаны некоторые варианты осуществления, возможны другие варианты осуществления.
В качестве примера, в то время как описано, что биогаз отводится в двигатель внутреннего сгорания, соединенный с электрическим генератором, в определенных вариантах осуществления биогаз можно пропускать через установку риформинга топлива для продукции водорода. Затем водород преобразуется в электричество посредством топливного элемента.
В качестве другого примера, в то время как описано, что биогаз сжигается отдельно от отстоя и твердых веществ после дистилляции, в определенных вариантах осуществления все сточные побочные продукты можно сжигать вместе с образованием пара.
ПРОДУКТЫ/СОПРОДУКТЫ
Спирты
Продуцированный спирт может представлять собой одноатомный спирт, например, этанол, или многоатомный спирт, например, этиленгликоль или глицерин. Примеры спиртов, которые могут быть продуцированы, включают метанол, этанол, пропанол, изопропанол, бутанол, например, н-, втор- или трет-бутанол, этиленгликоль, пропиленгликоль, 1,4-бутандиол, глицерин или смеси этих спиртов.
Каждый из спиртов, продуцированных на установке, имеет коммерческую ценность в качестве промышленного сырья. Например, этанол можно использовать для изготовления лаков и отдушек. В качестве другого примера, метанол можно использовать как растворитель, используемый в качестве компонента в жидкости стеклоочистителя. В качестве другого примера, бутанол можно использовать в пластификаторах, смолах, глазури и тормозных жидкостях.
Биоэтанол, продуцируемый на установке, является ценным в качестве ингредиента, используемого в пищевой промышленности и производстве напитков. Например, этанол, продуцируемый на установке, может быть очищен до степени пищевого спирта и использован в качестве основного ингредиента в алкогольных напитках.
Биоэтанол, продуцируемый на установке, также имеет коммерческую ценность в качестве транспортного топлива. Применение этанола в качестве транспортного топлива может быть осуществлено с относительно небольшим вложением капитала от производителей и владельцев двигателей с электрозажиганием (например, изменение регулировки впрыска, соотношение топлива и воздуха и компоненты системы впрыска топлива). Многие производители автомобилей в настоящее время предлагают автомобили на гибком топливе, способные работать на смесях этанол/бензин, содержащих вплоть до 85 об.% этанола (например, стандартное оборудование на Chevy Tahoe 4×4).
Биоэтанол, продуцируемый на этой установке, можно использовать в качестве топлива для двигателей в целях улучшения экологических и экономических условий за пределами установки. Например, этанол, продуцируемый на этой установке и используемый в качестве топлива, может снизить выбросы парниковых газов из антропогенных источников (например, транспортных источников). В качестве другого примера, этанол, продуцируемый на этой установке и используемый в качестве топлива для двигателей, также может сменить потребляемый бензин, полученный из нефти и очищенный.
Биоэтанол имеет более высокое октановое число, чем общепринятый бензин и, таким образом, может быть использован для улучшения рабочих характеристик (например, для обеспечения более высоких степеней сжатия) двигателей с электрозажиганием. Например, небольшие количества (например, 10 об.%) этанола можно смешивать с бензином, чтобы он действовал в качестве повышающей октановое число добавки в топливо, используемое в двигателях с электрозажиганием. В качестве другого примера, с бензином можно смешивать более высокие количества (например, 85 об.%) этанола для дополнительного увеличения октанового числа и замены больших объемов бензина.
Стратегии биоэтанола рассмотрены, например, DiPardo в Journal of Outlook for Biomass Ethanol Production and Demand (EIA Forecasts), 2002; Sheehan в Biotechnology Progress, 15:8179, 1999; Martin в Enzyme Microbes Technology, 31:274, 2002; Greer в BioCycle, 61-65, April 2005; Lynd в Microbiology and Molecular Biology Reviews, 66:3, 506-577, 2002; Ljungdahl et al, в патенте США № 4292406; и Bellamy, в патенте США № 4094742.
Органические кислоты
Продуцированные органические кислоты могут включать монокарбоновые кислоты или поликарбоновые кислоты. Примеры органических кислот включают муравьиную кислоту, уксусную кислоту, пропионовую кислоту, масляную кислоту, валериановую кислоту, капроновую кислоту, пальмитиновую кислоту, стеариновую кислоту, щавелевую кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, олеиновую кислоту, линолевую кислоту, гликолевую кислоту, молочную кислоту, γ-гидроксимасляную кислоту или смеси этих кислот.
Продукты питания
В некоторых вариантах осуществления весь процесс ферментации или его часть можно прерывать перед полным конвертированием целлюлозного материала в этанол. Промежуточные продукты ферментации включают высокие концентрации сахара и углеводов. Эти промежуточные продукты ферментации можно использовать для приготовления продуктов питания, потребляемых человеком или животными. В некоторых вариантах осуществления предварительная обработка целлюлозного материала облучением обеспечивает стерильность промежуточных продуктов ферментации (например, пригодную для употребления человеком). В некоторых вариантах осуществления промежуточные продукты ферментации требуют последующей переработки перед применением в качестве продуктов питания. Например, для удаления влаги из промежуточных продуктов ферментации с целью облегчения хранения, обработки и повышения срока годности можно использовать сушилку. Дополнительно или альтернативно, промежуточные продукты ферментации можно измельчать до тонкодисперсных частиц в лабораторной мельнице из нержавеющей стали для получения подобного муке вещества.
Корм для животных
Барду и растворимые вещества можно конвертировать в ценный побочный продукт процесса дистилляции-дегидратации. После процесса дистилляции-дегидратации, барду и растворимые вещества можно сушить для улучшения возможности хранения или обработки материала. Полученная сухая барда и растворимые вещества (DDGS) имеют низкое содержание крахмала, высокое содержание жиров, высокое содержание белка, высокое содержание волокон и высокое содержание фосфора. Таким образом, например, DDGS может быть ценной в качестве кормового источника для животных (например, в качестве кормового источника для молочного скота). DDGS можно впоследствии комбинировать с питательными добавками, чтобы удовлетворить конкретные пищевые потребности конкретных категорий животных (например, баланс усвояемого лизина и фосфора для рационов свиней).
Фармацевтические препараты
Процессы предварительной обработки, рассмотренные выше, можно применять в отношении растений с лекарственными свойствами. В некоторых вариантах осуществления обработка ультразвуком может стимулировать биологическую активность и/или биодоступность лекарственных компонентов растений с лекарственными свойствами. Дополнительно или альтернативно, облучение стимулирует биологическую активность и/или биодоступность лекарственных компонентов растений с лекарственными свойствами. Например, обработку ультразвуком и облучение можно комбинировать при предварительной обработке коры ивы для стимуляции продукции салицина.
Нутрицевтики
В некоторых вариантах осуществления промежуточные продукты ферментации (например, продукты, которые включают высокие концентрации сахара и углеводов) можно дополнять для создания нутрицевтика. Например, промежуточные продукты ферментации можно дополнять кальцием для создания нутрицевтика, который обеспечивает энергию и помогает улучшить или поддержать прочность костей.
Сопродукты
Лигниновый остаток
Как описано выше, содержащие лигнин остатки после процессов основной и предварительной обработки имеют ценность в качестве топлива высокой/средней энергии, и их можно использовать для генерирования энергии и пара, используемых в производственных процессах. Однако такие лигниновые остатки представляют собой новый тип твердого топлива, потребность в котором вне пределов установки невелика, а стоимость высушивания их для транспортировки приводит только к снижению их потенциальной ценности. В некоторых случаях газификация остатков лигнина может конвертировать их в более высокоценный продукт с меньшими затратами.
Другие сопродукты
Клеточный материал, фурфураль и уксусная кислота идентифицированы в качестве потенциальных сопродуктов для оборудования по переработке биомассы в топливо. Интерстициальный клеточный материал может быть ценным, однако он может потребовать значительной очистки. Рынки сбыта фурфураля и уксусной кислоты являются актуальными, хотя маловероятно, что они являются достаточно большими для того, чтобы поглотить продукцию полностью коммерциализованной промышленности по переработке лигноцеллюлозы в этанол.
ПРИМЕРЫ
Представленные ниже примеры предназначены для иллюстрации и не ограничивают идеи данного описания.
Пример 1 - Получение волокнистого материала из бумаги с многослойным покрытием
Стапель массой 1500 фунтов (680 кг) из чистых картонных коробок для сока объемом полгаллона (1,9 л), изготовленных из белого крафт-картона без печати, имеющего объемную плотность 20 фунт/фут3 (0,32 г/см3), получали от International Paper. Каждую картонную коробку складывали до плоского состояния, а затем подавали в устройство для измельчения 3 hp Flinch Baugh со скоростью приблизительно от 15 до 20 фунтов в час (6,8-9,1 кг/ч). Устройство для измельчения было оборудовано двумя 12-дюймовыми (30-см) вращающимися лезвиями, двумя фиксированными лезвиями и 0,30-дюймовым (0,8-см) разгрузочным ситом. Расстояние между вращающимися и фиксированными лезвиями устанавливали на 0,10 дюйма (0,25 см). Выходящий из устройства материал для измельчения напоминал конфетти с шириной от 0,1 дюйма (0,25 см) до 0,5 дюйма (1,3 см), длиной от 0,25 дюйма (0,6 см) до 1 дюйма (2,5 см) и толщиной, эквивалентной толщине исходного материала (приблизительно 0,075 дюйма (0,2 см)).
Похожий на конфетти материал подавали в резательное устройство с вращающимся ножом Munson, модель SC30. Модель SC30 оборудована четырьмя вращающимися лезвиями, четырьмя фиксированными лезвиями и разгрузочным ситом, имеющим отверстия 1/8 дюйма (0,32 см). Зазор между вращающимися и фиксированными лезвиями устанавливали приблизительно на 0,020 дюйма (0,05 см). Резательное устройство с вращающимся ножом дробило похожие на конфетти фрагменты остриями лезвия, разрывая фрагменты и высвобождая волокнистый материал со скоростью приблизительно один фунт в час (454 грамм в час). Волокнистый материал имел площадь поверхности BET 0,9748 м2/г +/- 0,0167 м2/г, пористость 89,0437% и объемную плотность (при 0,53 фунт/кв. дюйм абс. (3,7 кПа)) 0,1260 г/мл. Средняя длина волокон составляла 1,141 мм, а средняя ширина волокон составляла 0,027 мм, давая среднее L/D 42:1. Снимок волокнистого материала, полученный с помощью сканирующего электронного микроскопа при увеличении 25X, представлен на ФИГ. 26.
Пример 2 - Получение волокнистого материала из отбеленного крафт-картона
Стапель массой 1500 фунтов (680 кг) из чистого отбеленного крафт-картона, имеющего объемную плотность 30 фунт/фут3 (0,48 г/см3), получали от International Paper. Материал складывали до плоского состояния, а затем подавали в устройство для измельчения 3 hp Flinch Baugh со скоростью приблизительно от 15 до 20 фунтов в час (6,8-9,1 кг/ч). Устройство для измельчения было оборудовано двумя 12-дюймовыми (30-см) вращающимися лезвиями, двумя фиксированными лезвиями и 0,30-дюймовым (0,8-см) разгрузочным ситом. Расстояние между вращающимися и фиксированными лезвиями устанавливали на 0,10 дюйма (0,25 см). Выходящий из устройства материал для измельчения напоминал конфетти с шириной от 0,1 дюйма (0,25 см) до 0,5 дюйма (1,3 см), длиной от 0,25 дюйма (0,6 см) до 1 дюйма (2,5 см) и толщиной, эквивалентной толщине исходного материала (приблизительно 0,075 дюймов (0,2 см)). Похожий на конфетти материал подавали в резательное устройство с вращающимся ножом Munson, модель SC30. Разгрузочное сито имело отверстия 1/8 дюйма (0,32 см). Зазор между вращающимися и фиксированными лезвиями устанавливали приблизительно на 0,020 дюйма (0,05 см). Резательное устройство с вращающимся ножом дробило похожие на конфетти фрагменты остриями лезвия, разрывая фрагменты и высвобождая волокнистый материал со скоростью приблизительно один фунт в час (454 грамм в час). Волокнистый материал имел площадь поверхности BET 1,1316 м2/г +/- 0,0103 м2/г, пористость 88,3285% и объемную плотность (при 0,53 фунт/кв. дюйм абс. (3,7 кПа)) 0,1497 г/мл. Средняя длина волокон составляла 1,063 мм, а средняя ширина волокон составляла 0,0245 мм, давая среднее L/D 43:1. Снимок волокнистого материала, полученный с помощью сканирующего электронного микроскопа при увеличении 25X, представлен на ФИГ. 27.
Пример 3 - Получение дважды раздробленного волокнистого материала из отбеленного крафт-картона
Стапель массой 1500 фунтов (680 кг) из чистого отбеленного крафт-картона, имеющего объемную плотность 30 фунт/фут3 (0,48 г/см3), получали от International Paper. Материал складывали до плоского состояния, а затем подавали в устройство для измельчения 3 hp Flinch Baugh со скоростью приблизительно от 15 до 20 фунтов в час (6,8-9,1 кг/ч). Устройство для измельчения было оборудовано двумя 12-дюймовыми (30-см) вращающимися лезвиями, двумя фиксированными лезвиями и 0,30-дюймовым (0,8-см) разгрузочным ситом. Расстояние между вращающимися и фиксированными лезвиями устанавливали на 0,10 дюйма (0,25 см). Выходящий из устройства для измельчения материал напоминал конфетти (см. выше). Похожий на конфетти материал подавали в резательное устройство с вращающимся ножом Munson, модель SC30. Разгрузочное сито имело отверстия 1/16 дюйма (0,16 см). Зазор между вращающимися и фиксированными лезвиями устанавливали приблизительно на 0,020 дюйма (0,05 см). Резательное устройство с вращающимся ножом дробило похожие на конфетти фрагменты остриями лезвия, разрывая фрагменты и высвобождая волокнистый материал со скоростью приблизительно один фунт в час (454 грамм в час). Материал, полученный после первого дробления, снова подавали в ту же описанную выше установку и снова дробили. Полученный волокнистый материал имел площадь поверхности BET 1,4408 м2/г +/- 0,0156 м2/г, пористость 90,8998% и объемную плотность (при 0,53 фунта на кв. дюйм абс. (3,7 кПа)) 0,1298 г/мл. Средняя длина волокон составляла 0,891 мм, а средняя ширина волокон составляла 0,026 мм, давая среднее L/D 34:1. Снимок волокнистого материала, полученный с помощью сканирующего электронного микроскопа при увеличении 25X, представлен на ФИГ. 28.
Пример 4 - Получение трижды раздробленного волокнистого материала из отбеленного крафт-картона
Стапель массой 1500 фунтов (680 кг) из чистого отбеленного крафт-картона, имеющего объемную плотность 30 фунт/фут3 (0,48 г/см3), получали от International Paper. Материал складывали до плоского состояния, а затем подавали в устройство для измельчения 3 hp Flinch Baugh со скоростью приблизительно от 15 до 20 фунтов в час (6,8-9,1 кг/ч). Устройство для измельчения было оборудовано двумя 12-дюймовыми (30-см) вращающимися лезвиями, двумя фиксированными лезвиями и 0,30-дюймовым (0,8-см) разгрузочным ситом. Расстояние между вращающимися и фиксированными лезвиями устанавливали на 0,10 дюйма (0,25 см). Выходящий из устройства для измельчения материал напоминал конфетти (см. выше). Похожий на конфетти материал подавали в резательное устройство с вращающимся ножом Munson, модель SC30. Разгрузочное сито имело отверстия 1/8 дюйма (0,32 см). Зазор между вращающимися и фиксированными лезвиями устанавливали приблизительно на 0,020 дюйма (0,05 см). Резательное устройство с вращающимся ножом дробило похожие на конфетти фрагменты краями лезвий. Материал, полученный после первого дробления, снова подавали в ту же установку и сито заменяли на сито с отверстиями 1/16 дюйма (0,16 см). Материал дробили. Материал, полученный после второго дробления, снова подавали в ту же установку и сито заменяли на сито с отверстиями 1/32 дюйма (0,08 см). Этот материал дробили. Полученный волокнистый материал имел площадь поверхности BET 1,6897 м2/г +/- 0,0155 м2/г, пористость 87,7163% и объемную плотность (при 0,53 фунта на кв. дюйм абс. (3,7 кПа)) 0,1448 г/мл. Средняя длина волокон составляла 0,824 мм, а средняя ширина волокон составляла 0,0262 мм, давая среднее L/D 32:1. Снимок волокнистого материала, полученный с помощью сканирующего электронного микроскопа при увеличении 25X, представлен на ФИГ. 29.
Пример 5 - Получение уплотненного волокнистого материала из отбеленного крафт-картона без добавления связующего вещества
Волокнистый материал получали согласно примеру 2. Приблизительно 1 фунтом (454 г) воды обрызгивали каждые 10 фунтов (4540 г) волокнистого материала. Волокнистый материал уплотняли с использованием пресса для гранулирования California Pellet Mill 1100, действующего при 75°C. Получали гранулы, имеющие объемную плотность в диапазоне от приблизительно 7 фунтов/фут3 (0,11 г/см3) до приблизительно 15 фунтов/фут3 (0,24 г/см3).
Пример 6 - Получение уплотненного волокнистого материала из отбеленного крафт-картона со связующим веществом
Волокнистый материал получали согласно примеру 2.
Приготавливали исходный раствор POLYOX™ WSR N10 (полиэтиленоксид) в воде в концентрации 2 масс.%.
Приблизительно 1 фунтом (454 г) исходного раствора обрызгивали каждые 10 фунтов (4540 г) волокнистого материала. Волокнистый материал уплотняли с использованием пресса для гранулирования California Pellet Mill 1100, действующего при 75°C. Получали гранулы, имеющие объемную плотность в диапазоне от приблизительно 15 фунтов/фут3 (0,24 г/см3) до приблизительно 40 фунтов/фут3 (0,64 г/см3).
Пример 7 - Уменьшение молекулярной массы целлюлозы в волокнистой крафт-бумаге гамма-излучением при минимальном окислении
Волокнистый материал получают согласно примеру 4. Волокнистую крафт-бумагу уплотняют согласно примеру 5.
Уплотненные гранулы помещают в стеклянную ампулу, имеющую максимальную вместимость 250 мл. Стеклянную ампулу вакуумируют в глубоком вакууме (10-5 торр) в течение 30 минут, а затем обратно заполняют газообразным аргоном. Ампулу запаивают в атмосфере аргона. Гранулы в ампуле облучают гамма-излучением в течение приблизительно 3 часов при уровне дозы приблизительно 1 Мрад в час с получением облученного материала, в котором целлюлоза имеет более низкую молекулярную массу, чем в исходном материале волокнистой крафт-бумаги.
Пример 8 - Уменьшение молекулярной массы целлюлозы в волокнистой крафт-бумаге гамма-излучением при максимальном окислении
Волокнистый материал получают согласно примеру 4. Волокнистую крафт-бумагу уплотняют согласно примеру 5.
Уплотненные гранулы помещают в стеклянную ампулу, имеющую максимальную вместимость 250 мл. Стеклянную ампулу запаивают в атмосфере воздуха. Гранулы в ампуле облучают гамма-излучением в течение приблизительно 3 часов при уровне дозы приблизительно 1 Мрад в час с получением облученного материала, в котором целлюлоза имеет более низкую молекулярную массу, чем в исходном материале волокнистой крафт-бумаги.
Пример 9 - Обработка электронным пучком
Образцы обрабатывали электронным пучком с использованием находящегося в хранилище ускорителя с незатухающими волнами Rhodotron® TT200, доставляющего электроны с энергией 5 МэВ при выходной мощности 80 кВт. В таблице 1 описаны использованные параметры. В таблице 2 описана номинальная доза, использованная для ID образца (в Мрад) и соответствующая доза, доставленная в образец (в кГр).
Пример 10 - Способы определения молекулярной массы целлюлозных и лигноцеллюлозных материалов с помощью гель-проникающей хроматографии
Целлюлозные и лигноцеллюлозные материалы для анализа обрабатывали согласно примеру 4. Материалы образцов, представленные в следующих таблицах, включают крафт-бумагу (P), пшеничную солому (WS), люцерну (A), целлюлозу (С), просо (SG), травы (G), крахмал (ST) и сахарозу (S). Число "132" в ID образца относится к размеру частиц материала после дробления через сито с отверстиями 1/32 дюйма (0,08 см). Число после дефиса относится к дозировке радиационного излучения (Мрад) и "US" относится к ультразвуковой обработке. Например, ID образца "P132-10" относится к крафт-бумаге, которую подвергали дроблению до размера частиц калибра 132 и облучали дозой 10 Мрад.
Для образцов, которые облучали электронным пучком (e-пучком), число после дефиса относится к количеству энергии, доставляемой к образцу. Например, ID образца "P-100e" относится к крафт-бумаге, которой доставлена доза энергии приблизительно 100 Мрад или приблизительно 1000 кГр (таблица 2).
Гель-проникающую хроматографию (GPC) используют для определения распределения молекулярной массы полимеров. В ходе анализа GPC раствор полимерного образца пропускают через колонну, заполненную пористым гелем, улавливающим небольшие молекулы. Образец разделяется на основе размера молекул, причем более крупные молекулы элюируются быстрее молекул меньших размеров. Время удержания каждого компонента наиболее часто определяют с помощью индекса рефракции (RI), рассеяния света при испарении (ELS) или ультрафиолетового излучения (UV) и сравнивают с калибровочной кривой. Затем полученные данные используют для вычисления распределения молекулярной массы для образца.
Распределение молекулярной массы используют вместо индивидуальной молекулярной массы, чтобы охарактеризовать синтетические полимеры. Для описания этого распределения используют статистические средние значения. Наиболее распространенными из этих средних значений являются "среднечисленная молекулярная масса" (Mn) и "средневзвешенная молекулярная масса" (Mw).
Mn аналогична стандартному арифметическому среднему значению, ассоциированному с группой чисел. В случае применения к полимерам Mn относится к средней молекулярной массе молекул в полимере. Mn вычисляют, предполагая один уровень значимости каждой молекулы, независимо от ее индивидуальной молекулярной массы. Среднюю Mn вычисляют по следующей формуле, где Ni представляет собой количество молекул с молярной массой, равной Mi.

Mw представляет собой другой статистический идентификатор распределения молекулярной массы, который в большей степени акцентируется на более крупных молекулах, чем на молекулах меньшего размера, в распределении. Ниже представлена формула для статистического вычисления средневзвешенной молекулярной массы.

Индекс полидисперсности или PI определяют как отношение Mw/Mn. Чем более высоким является PI, тем более широким или более дисперсным является распределение. Наиболее низкое значение, которое может иметь PI, составляет 1. Оно соответствует монодисперсному образцу, т.е. полимеру, в котором все молекулы в распределении имеют одинаковую молекулярную массу.
Пиковое значение молекулярной массы (Mp) является другим описательным признаком, определяемым как характер распределения молекулярной массы. Оно означает молекулярную массу, которая наиболее распространена в распределении. Эта величина также дает представление о распределении молекулярной массы.
Большинство измерений GPC проводят относительно различных стандартов полимеров. Точность результатов зависит от того, насколько близко характеристики анализируемого полимера совпадают с характеристиками используемого стандарта. Ожидаемая ошибка воспроизводимости между различными сериями определений, калиброванными по отдельности, составляет приблизительно 5-10% и является характерной для ограниченной точности определений GPC. Таким образом, результаты GPC являются наиболее пригодными, когда проводят сравнение между распределениями молекулярной массы различных образцов в ходе одной серии определений.
Для лигноцеллюлозных образцов перед анализом GPC требовалась подготовка. Сначала приготавливали насыщенный раствор (8,4 масс.%) хлорида лития (LiCl) в диметилацетамиде (DMAc). Приблизительно 100 мг образца добавляли приблизительно к 10 г свежеприготовленного насыщенного раствора LiCl/DMAc и смесь нагревали приблизительно до 150°C-170°C при перемешивании в течение 1 часа. Полученные растворы имели цвет, главным образом, от светло-желтого до темно-желтого. Температуру растворов снижали приблизительно до 100°C и нагревали в течение дополнительных 2 часов. Затем температуру растворов снижали приблизительно до 50°C и раствор образца нагревали в течение приблизительно 48-60 часов. Следует отметить, что образцы, облученные при 100 Мрад, легче солюбилизировались по сравнению с их необработанными аналогами. Кроме того, раздробленные образцы (обозначенные числом 132) имели немного более низкую среднюю молекулярную массу по сравнению с ненарезанными образцами.
Полученные растворы образцов разбавляли 1:1 с использованием DMAc в качестве растворителя и фильтровали через 0,45-мкм фильтр PTFE. Затем отфильтрованные растворы образцов анализировали с помощью GPC, используя параметры, описанные в таблице 7. Пиковые средние молекулярные массы (Mp) образцов, при определении гель-проникающей хроматографией (GPC), обобщенно представлены в таблицах 3-6. Каждый образец приготавливали в двух экземплярах и каждый препарат образца анализировали в двух параллелях (две инъекции), всего с четырьмя инъекциями на образец. Для получения калибровочной кривой для шкалы молекулярной массы приблизительно от 580 до 750000 Дальтон использовали полистирольные стандарты PS1A и PS1B EasiCal®.
Пример 11. Анализ поверхности путем времяпролетной масс-спектрометрии вторичных ионов (ToF-SIMS)
Времяпролетная масс-спектрометрия вторичных ионов (ToF-SIMS) представляет собой чувствительную к поверхности спектроскопию, в которой используются импульсный ионный пучок (Cs или микрофокусированный Ga) для удаления молекул из наиболее удаленной поверхности образца. Частицы удаляются с атомных монослоев на поверхности (вторичные ионы). Затем эти частицы ускоряются в "пролетной трубке" и их масса определяется путем измерения точного времени, за которое они достигают детектора (т.е. время пролета). ToF-SIMS обеспечивает подробную элементную и молекулярную информацию о поверхности, тонких слоях, поверхностях контакта образца и осуществляет полный трехмерный анализ. Ее применение является широко распространенным, включая полупроводники, полимеры, краски, покрытия, стекло, бумагу, металлы, керамику, биоматериалы, фармацевтические препараты и органическую ткань. Поскольку ToF-SIMS является методом исследования, детектируются все элементы в периодической таблице, включая H. Данные ToF-SIMS представлены в таблицах 8-11. Использованные параметры представлены в таблице 12.
В ToF-SIMS используется сфокусированный импульсный пучок частиц (как правило, Cs или Ga) для выбивания химических частиц с поверхности материалов. Частицы, образующиеся ближе к области воздействия, имеют тенденцию стать диссоциированными ионами (положительными или отрицательными). Вторичные частицы, образованные дальше от области воздействия, имеют тенденцию стать молекулярными соединениями, как правило, фрагментами значительно более крупных органических макромолекул. Затем частицы ускоряются на их пути по направлению к детектору. Поскольку можно измерить "время пролета" частиц из времени воздействия на детектор по шкале наносекунд, то можно получать разрешение по массам до 0,00X атомных единиц массы (т.е. одна тысячная часть массы протона). В обычных условиях работы результаты анализа ToF-SIMS включают: масс-спектр, который охватывает все атомные массы в диапазоне 0-10000 а.е.м., развернутый в растр пучок создает карты распределения любой представляющей интерес массы на субмикронной шкале, и профили глубины формируются в результате удаления поверхностных слоев путем распыления под ионным пучком. Анализ отрицательных ионов показал, что полимер имел повышенные количества групп CNO, CN и NO2.
Пример 12. Рентгеновская фотоэлектронная спектроскопия (XPS)/электронная спектроскопия для химического анализа (ESCA)
Рентгеновской фотоэлектронной спектроскопией (XPS) (иногда называемой "ESCA") измеряют химический состав верхних пяти нанометров поверхности; в XPS используется энергия фотоионизации и анализ методом энергетической дисперсии испускаемых фотоэлектронов для исследования состава и электронного состояния поверхностной области образца. Рентгеновская фотоэлектронная спектроскопия основана на однократном вхождении протона/выходе электрона. Мягкие рентгеновские лучи стимулируют эжекцию фотоэлектронов, кинетическую энергию которого измеряют с помощью анализатора электростатической энергии электронов. Небольшие изменения энергии вызываются валентными состояниями атомов при химическом сдвиге, от которых происходит эжекция электронов; таким образом, измерение обеспечивает химическую информацию о поверхности образца.
Спектры XPS получают путем облучения материала пучком рентгеновских лучей алюминия или магния при одновременном измерении кинетической энергии (KE) и количества электронов, которые покидают верхние 1-10 нм анализируемого материала (см. аналитические параметры, таблица 17). Способ XPS является в высокой степени специфичным к поверхности вследствие короткого диапазона фотоэлектронов, которые возбуждаются в твердом веществе. Энергию фотоэлектронов, выходящих из образца, определяют с использованием концентрического полусферического анализатора (CHA), и это дает спектр с серией фотоэлектронных пиков. Энергия связи пиков является характерной для каждого элемента. Площади пиков можно использовать (с соответствующими коэффициентами чувствительности) для определения состава материалов поверхности. Форма каждого пика и энергия связи могут немного изменяться вследствие химического состояния испускающего атома. Таким образом, XPS также может предоставить информацию о химических связях. XPS не является чувствительной к водороду или гелию, но может выявлять все другие элементы. XPS требует условий сверхглубокого вакуума (UHV), и ее широко используют для анализа поверхности полимеров, покрытий, катализаторов, композитов, волокон, керамики, фармацевтических/медицинских материалов и материалов биологического происхождения. Данные XPS представлены в таблицах 13-16.
Пример 13. Анализ методом Рамановской спектроскопии
Спектры Рамана получали для поверхности волокон из образцов: P132, P132-100, P-1e и P-100e. Измерения проводили с использованием спектрометра "LabRam" J-Y. Для измерений использовали лазер HeNe (длина волны 632,8 нм) и решетку 600 гр/мм. Измерения проводили конфокально с использованием геометрии обратного рассеяния (180°) под микроскопом Olympus BX40. Образцы имели спектр Рамана, типичный для целлюлозы.
Пример 14. Анализ поверхности методом сканирующей зондовой микроскопии (SPM) с использованием атомно-силового микроскопа (AFM)
Целью этого анализа было получение с помощью атомно-силового микроскопа (AFM) изображений образцов, представленных в таблицах 18 и 19, для измерения шероховатости поверхности.
Сканирующая зондовая микроскопия (SPM) представляет собой ветвь микроскопии, которая формирует изображения поверхностей с использованием физического зонда, который сканирует образец. Изображение поверхности получают путем механического смещения зонда в растровой развертке образца, построчно, и регистрации взаимодействия зонд-поверхность как функции положения зонда. Атомно-силовой микроскоп (AFM) или сканирующий силовой микроскоп (SFM) представляет собой тип сканирующего зондового микроскопа с очень высоким разрешением, для которого продемонстрировано разрешение фракций размером нанометр, более чем в 1000 раз лучшее, чем предел дифракции света. Зонд (или образец под стационарным зондом), как правило, смещается с помощью пьезоэлектрической трубки. Такие сканеры сконструированы для точного перемещения в любой из трех перпендикулярных осей (x,y,z). Следуя за растром, сенсорные данные формируют изображения взаимодействия зонд-поверхность. Отклик сенсора используется для поддержания зонда при постоянной силе или расстоянии от поверхности объекта. Для атомно-силовой микроскопии сенсор представляет собой позиционно-чувствительный фотодетектор, который регистрирует угол отклонения от лазерного пучка, сфокусированного на вершине консоли.
Изображения AFM получали с использованием NanoScope III Dimension 5000 (Digital Instruments, Santa Barbara, California, USA). Инструмент калибровали против коррелируемого стандарта NIST с точностью лучше, чем 2%. Использовали силиконовые наконечники NanoProbe. Использовали способы обработки изображений, включающие автоматическое выравнивание, подгонку к плоскости или свертывание.
Визуализировали одну случайную область на верхней части отдельного волокна площадью 5 мкм × 5 мкм. Перспективные (3-D) изображения этих поверхностей включены в преувеличенном масштабе по вертикали, что указано на графиках (ФИГ. 29A-29F). Проводили анализ шероховатости и выражали ее в: (1) среднеквадратической шероховатости, RMS; (2) средней шероховатости, Ra; и (3) максимальной высоте (пик-к-углублению), Rmax. Результаты обобщенно представлены в таблицах 18 и 19.
Пример 15 - Определение кристалличности облученного материала методом рентгенодифракции
Рентгенодифракция (XRD) представляет собой метод, посредством которого кристаллический образец облучают моноэнергетическими рентгеновскими лучами. Регистрируют взаимодействие структуры решетки образца с этими рентгеновскими лучами, что дает информацию о подвергаемой облучению кристаллической структуре. Полученный характерный "отпечаток" дает возможность идентификации кристаллических соединений, присутствующих в образце. С использованием анализа соответствия по всему паттерну (the Rietvelt Refinement) можно проводить количественные анализы образцов, содержащих более одного кристаллического соединения.
Каждый образец помещали на держатель с нулевым фоном и помещали в дифрактометр Phillips PW1800, использующий радиационное излучение Cu. Затем проводили сканирование в диапазоне от 5° до 50° с размером шага 0,05° и временем подсчета 2 часа в каждом случае.
После получения дифрактограмм идентифицировали фазы с помощью Powder Diffraction File, опубликованного International Centre for Diffraction Data. Во всех образцах идентифицированная кристаллическая фаза представляла собой целлюлозу - Ia, которая имеет триклинную структуру.
Отличительным признаком для 20 образцов является ширина пика, которая связана с размером кристаллического домена. Экспериментальную ширину пика использовали для вычисления размера домена и процентной кристалличности, которые представлены в таблице 4.
Процентную кристалличность (Xc %) определяют как отношение площади кристаллической фазы к общей площади под пиками рентгенодифракции,

где
Ac = площадь для кристаллической фазы
Aa = площадь для аморфной фазы
Xc = процент кристалличности
Для определения процентной кристалличности каждого образца было необходимо сначала определить количество аморфной фазы. Это осуществляют путем оценки площади каждой дифрактограммы, которая может быть отнесена к кристаллической фазе (отображаемой более острыми пиками) и некристаллической фазе (отображаемой широкими буграми под паттерном и имеющей центр при 22° и 38°).
Для минимизации ошибки в этих вычислениях вследствие широких кристаллических пиков, а также высокой интенсивности фона использовали систематический процесс. Во-первых, применяли линейный фон, а затем отменяли его. Во-вторых, каждый из двух гауссовых пиков с центром при 22° и 38° с шириной 10-12° приводили в соответствие с буграми под кристаллическими пиками. В-третьих, определяли площадь под двумя широкими гауссовыми пиками и остальной части паттерна. Наконец, вычисляли процентную кристалличность путем деления площади под кристаллическим пиком на общую интенсивность (после вычитания фона). Размер домена и % кристалличность образцов при определении путем рентгенодифракции (XRD) представлены в таблице 20.
Пример 16 - Анализ облученных материалов путем порометрии
Ртутный анализ размера пор и объема пор (таблица 21) основан на пропускании ртути (несмачивающей жидкости) в пористую структуру при строго контролируемых давлениях. Поскольку ртуть не смачивает большинство веществ и не проникнет в поры самопроизвольно вследствие капиллярного действия, ее необходимо загонять в пустоты образца путем приложения внешнего давления. Давление, требуемое для заполнения пустот, обратно пропорционально размеру пор. Для заполнения крупных пустот требуется только небольшая величина силы или давления, в то время как для заполнения очень маленьких пор требуется значительно более высокое давление.
Таблица 21
Распределение размера и объема пор посредством ртутной порометрии

AutoPore 9520 может достигать максимального давления 414 МПа или 60000 фунт/кв. дюйм абс. В нем имеются четыре станции низкого давления для приготовления образца и сбора данных о макропорах при давлении от 0,2 фунт/кв. дюйм абс. (1,4 кПа) до 50 фунт/кв. дюйм абс. (345 кПа). В нем имеются две камеры высокого давления, в которых собираются данные при давлении от 25 фунт/кв. дюйм абс. (172 кПа) до 60000 фунт/кв. дюйм абс. (414 МПа). Образец помещают в чашеобразное устройство, называемое пенетрометром, которое соединено со стеклянным капиллярным стержнем с металлическим покрытием. По мере проникновения ртути в пустоты в образце и вокруг него, она продвигается вниз по капиллярному стержню. Потеря ртути из капиллярного стержня приводит к изменению электроемкости. Изменение электроемкости в процессе эксперимента конвертируется в объем ртути, исходя из известного объема стержня применяемого пенетрометра. Доступно множество пенетрометров с различными размерами чаши (образца) и капилляров для адаптации к большинству размеров и конфигураций образцов. В таблице 22, ниже, определены ключевые параметры, вычисляемые для каждого образца.
Пример 17 - Анализ размера частиц облученных материалов
Способ определения размера частиц посредством рассеяния света основан на теории Ми (которая также включает теорию Фраунгофера). Теория Ми предсказывает взаимосвязь интенсивности и угла в виде функции размера сферических рассеивающих частиц при условии, что другие переменные системы известны и поддерживаются постоянными. Этими переменными являются длина волны падающего света и относительный показатель преломления материала образца. Применение теории Ми дает подробную информацию о размере частиц. В таблице 23 обобщенно представлен размер частиц при использовании в качестве параметров срединного диаметра, среднего диаметра и модального диаметра.
Размер частиц определяли посредством рассеяния лазерного излучения (дисперсия сухого образца) с помощью Malvern Mastersizer 2000, используя следующие условия:
Соответствующее количество образца подавали на вибрационный лоток. Скорость подачи и давление воздуха корректировали для обеспечения того, чтобы частицы были надлежащим образом диспергированы. Ключевым компонентом является выбор давления воздуха, которое разбивает агломераты, но не нарушает целостность образца. Требуемое количество образца варьирует в зависимости от размера частиц. Как правило, образцы с мелкими частицами требуют меньшего количества материала, чем образцы с крупными частицами.
Пример 18 - Анализ площади поверхности облученных материалов
Площадь поверхности каждого образца анализировали с использованием системы Micromeritics ASAP 2420 Accelerated Surface Area and Porosimetry System. Образцы приготавливают путем первоначального дегазирования в течение 16 часов при 40°C. Далее, вычисляют свободное пространство (как теплое, так и холодное) с гелием, а затем пробирку с образцом вновь вакуумируют для удаления гелия. Сбор данных начинается после этого второго вакуумирования, и он состоит в установлении заданного давления, которое контролирует, сколько газа дозировано в образец. При каждом заданном давлении определяют и записывают количество адсорбированного газа и истинное давление. Давление внутри пробирки с образцом измеряют с помощью датчика давления. Дополнительные дозы газа продолжают поступать до достижения заданного давления и обеспечения уравновешивания. Количество адсорбированного газа определяют суммированием множества доз для образца. Давление и количество определяют изотерму адсорбции газа, и их используют для вычисления ряда параметров, включая площадь поверхности BET (таблица 24).
Модель BET для изотерм представляет собой широко используемую теорию для вычисления удельной площади поверхности. Анализ включает определение емкости монослоя поверхности образца путем вычисления количества, требуемого для покрытия всей поверхности одним плотно упакованным слоем криптона. Для определения общей площади поверхности емкость монослоя умножают на площадь поперечного сечения молекулы пробного газа. Удельная площадь поверхности представляет собой площадь поверхности аликвоты образца, деленную на массу образца.
Пример 19 - Определение длины волокон в облученных материалах
Тестирование распределения длин волокон проводили в трех параллелях на представленных образцах с использованием системы Techpap MorFi LB01. Средняя длина и ширина волокон представлены в таблице 25.
Пример 20 - Ультразвуковая обработка облученного и необлученного проса
Просо дробили согласно примеру 4. Просо обрабатывали только ультразвуком или облучением гамма-лучами в дозе 10 Мрад или 100 Мрад, а затем обработкой ультразвуком. Полученные материалы соответствуют G132-BR (необлученному), G132-10-BR (10 Мрад и обработка ультразвуком) и G132-100-BR (100 Мрад и обработка ультразвуком), как показано в таблице 1. Обработку ультразвуком проводили для каждого образца в течение 30 минут с использованием ультразвука частотой 20 кГц из рупора 1000 Вт в условиях рециркуляции. Каждый образец диспергировали в воде в концентрации приблизительно 0,10 г/мл.
На ФИГ. 30 и 31 представлено устройство, используемое для обработки ультразвуком. Устройство 500 включает преобразователь 502, соединенный с бустером 504, соединяющимся с рупором 506, изготовленным из титана или сплава титана. Рупор, который имеет изоляцию 510, изготовленную из VITON®, по его периметру на его осуществляющей обработку стороне, образует непроницаемое для жидкости уплотнение с ячейкой для переработки 508. Осуществляющая обработку сторона рупора погружена в жидкость, такую как вода, в которой диспергирован образец, подлежащий обработке ультразвуком. Мониторинг давления в ячейке проводят с помощью датчика давления 512. При функционировании образец продвигается насосом 517 из емкости 516 через ячейку для переработки и обрабатывается ультразвуком. После обработки ультразвуком образец собирается в емкости 520. Процесс может быть обратимым в том, что содержимое емкости 520 может быть отправлено через ячейку для переработки и собрано в емкости 516. Этот процесс можно повторять несколько раз до тех пор, пока не будет достигнут желаемый уровень переработки образца.
Пример 21 - Снимки, полученные с помощью сканирующего электронного микроскопа, необлученного проса по сравнению с облученным и облученным и обработанным ультразвуком просом
Образцы проса для снимков, получаемых с помощью сканирующего электронного микроскопа, наносили на углеродную ленту и покрывали распылением золота (70 секунд). Изображения получали с помощью сканирующего электронного микроскопа с полевой эмиссией JEOL 6500.
На ФИГ. 32 представлен снимок, полученный с помощью сканирующего электронного микроскопа при увеличении 1000X, волокнистого материала, полученного дроблением проса на резательном устройстве с вращающимся ножом, а затем пропусканием раздробленного материала через сито 1/32 дюйма (0,08 см).
На ФИГ. 33 и 34 представлены снимки, полученные с помощью сканирующего электронного микроскопа при увеличении 1000X, волокнистого материала ФИГ. 32 после облучения гамма-лучами дозой 10 Мрад и 100 Мрад, соответственно.
На ФИГ. 35 представлены снимки, полученные с помощью сканирующего электронного микроскопа при увеличении 1000X, волокнистого материала ФИГ. 32 после облучения 10 Мрад и обработки ультразвуком.
На ФИГ. 36 представлены снимки, полученные с помощью сканирующего электронного микроскопа при увеличении 1000X, волокнистого материала ФИГ. 32 после облучения 100 Мрад и обработки ультразвуком.
Пример 22 - Инфракрасные спектры с Фурье-преобразованием (FT-IR) облученной и необлученной крафт-бумаги
Анализ FT-IR проводили на Nicolet/Impact 400. Результаты указывают на то, что образцы P132, P132-10, P132-100, P-1e, P-5e, P-10e, P-30e, P-70e и P-100e соответствуют материалу на основе целлюлозы.
На ФИГ. 37 представлен инфракрасный спектр крафт-картона, раздробленного согласно примеру 4, а на ФИГ. 38 представлен инфракрасный спектр крафт-бумаги ФИГ. 37 после облучения гамма-излучением в дозе 100 Мрад. Облученный образец демонстрирует дополнительный пик в области A (с центром приблизительно на уровне 1730 см-1), который не выявляется в необлученном материале. Следует отметить, что увеличение уровня поглощения карбонильных групп при ~1650 см-1 было выявлено у образцов от P132 к P132-10 и к P132-100. Аналогичные результаты наблюдали для образцов P-1e, P-5e, P-10e, P-30e, P-70e и P-100e.
Пример 23 - Спектры ядерного магнитного резонанса протона и углерода-13 (1H-ЯМР и13C-ЯМР) облученной и необлученной крафт-бумаги
Подготовка образца
Образцы P132, P132-10, P132-100, P-1e, P-5e, P-10e, P-30e, P-70e и P-100e подготавливали для анализа путем растворения в ДМСО-d6 с 2% тригидратом фторида тетрабутиламмония. Образцы, которые подвергались более низким уровням облучения, были по существу менее растворимыми, чем образцы, подвергнутые более высокому уровню облучения. Необлученные образцы образовывали гель в этой смеси растворителей, однако нагревание до 60°C разрешало пики в спектрах ЯМР. Образцы, подвергнутые более высоким уровням облучения, были растворимыми при концентрации 10% масс./масс.
Анализ
Спектры1H-ЯМР образцов в концентрации 15 мг/мл показали отчетливый, очень широкий резонансный пик с центром на уровне 16 м.д. (ФИГ. 38A-38J). Этот пик является характерным для обменного протона -OH для енолов, и он был подтвержден по "колебаниям d2О". Был проведен анализ модельных соединений (ацетилацетона, глюкуроновой кислоты и кетогулоновой кислоты), и он подтвердил, что этот пик действительно был обменным енольным протоном. Этот представленный енольный пик был в высокой степени чувствительным к действиям концентрации, и авторы настоящего изобретения не были способны заключить, был ли этот резонанс следствием енола или, возможно, карбоновой кислоты.
Протонные резонансы карбоновых кислот модельных соединений были аналогичны протонным резонансам, наблюдаемым в случае обработанных образцов целлюлозы. Эти модельные соединения имели смещенную вверх область на ~5-6 м.д. Приготовление P-100e в более высоких концентрациях (~10% масс./масс.) привело к резкому снижению смещения области в ту область, где были выявлены резонансы карбоновых кислот модельных соединений (~6 м.д.) (ФИГ. 38N). Эти результаты привели к заключению, что этот резонанс является ненадежным для того, чтобы охарактеризовать эту функциональную группу, однако данные указывают на то, что количество обменных атомов водорода возрастает по мере увеличения уровня облучения образца. Также не было выявлено винильных протонов.
Спектры13C-ЯМР образцов подтверждают присутствие карбонильной группы карбоновой кислоты или производного карбоновой кислоты. Этот новый пик (на уровне 168 м.д.) не присутствует в необработанных образцах (ФИГ. 38K). Спектр13C-ЯМР с длительной задержкой обеспечил возможность количественного определения сигнала для P-100e (ФИГ. 38L-38M). Сравнение интегрирования резонанса карбонильных групп с резонансами приблизительно при 100 м.д. (сигналы C1) указывает на то, что отношение углерода карбонильных групп к C1 составляет 1:13,8 или приближенно 1 карбонильная группа на каждые 14 глюкозных звеньев. Химический сдвиг при 100 м.д. хорошо коррелирует с глюкуроновой кислотой.
Титрование
Образцы P-100e и P132-100 (1 г) суспендировали в деионизированной воде (25 мл). К каждому образцу добавляли индикатор ализарин желтый при перемешивании. P-100e был более трудным для смачивания. Оба образца титровали 0,2 M раствором NaOH. Результат был едва различимым, и его подтверждали с использованием pH-бумаги. Исходное значение pH образцов составило ~4 для обоих образцов. Для P132-100 потребовалось 0,4 миллиэквивалента гидроксида, что дает молекулярную массу для карбоновой кислоты 2500 а.е.м. Если для мономера используют 180 а.е.м., то это указывает на то, что для 13,9 мономерных звеньев существует одна группа карбоновой кислоты. Аналогично, для P-100e требовалось 3,2 миллиэквивалента гидроксида, что, согласно расчетам, соответствует одной группе карбоновой кислоты для каждых 17,4 мономерных звеньев.
Заключения
C-6 углерод целлюлозы, по-видимому, окислен до карбоновой кислоты (производное глюкуроновой кислоты), и это окисление является неожиданно специфическим. Это окисление согласуется с ИК-полосой, которая увеличивается при облучении на уровне ~1740 см-1, что соответствует алифатической карбоновой кислоте. Результаты титрования согласуются с количественным13C-ЯМР. Повышенная растворимость образца при более высоких уровнях облучения хорошо коррелирует с возрастающим количеством протонов карбоновой кислоты. Предполагаемый механизм деградации "C-6-окисленной целлюлозы" представлен ниже на схеме 1.
Схема 1

Пример 24 - Комбинирование предварительной обработки электронным пучком и ультразвуком
Просо используют в качестве сырья и дробят резательным устройством с вращающимся ножом Munson до волокнистого материала. Затем волокнистый материал равномерно распределяют на открытом лотке, изготовленном из олова, с площадью более 500 дюймов2 (12,7 м). Волокнистый материал распределяют так, чтобы он имел толщину приблизительно 1-2 дюйма (2,5-5 см) в открытом лотке. Волокнистый материал можно распределять в пластмассовые мешки при более низких дозах облучения (менее 10 Мрад) и оставлять открытым на металлическом лотке при более высоких дозах облучения.
Затем отдельные образцы волокнистого материала подвергают последовательным дозам облучения электронным пучком до достижения общей дозы 1 Мрад, 2 Мрад, 3 Мрад, 5 Мрад, 10 Мрад, 50 Мрад и 100 Мрад. Некоторые образцы поддерживают в тех же условиях, что и остальные образцы, но не облучают, чтобы они служили в качестве контролей. После охлаждения облученный волокнистый материал отправляют на дальнейшую переработку посредством устройства для обработки ультразвуком.
Устройство для обработки ультразвуком включает преобразователь, связанным с бустером, соединяющимся с рупором, изготовленным из титана или сплава титана. Рупор, который имеет изоляцию, изготовленную из VITON®, по его периметру на его осуществляющей обработку стороне, образует непроницаемое для жидкости уплотнение с ячейкой для переработки. Осуществляющая обработку сторона рупора погружена в жидкость, такую как вода, в которой диспергирован образец, подлежащий обработке ультразвуком. Мониторинг давления в ячейке проводят с помощью датчика давления. При функционировании каждый образец продвигается насосом через ячейку для переработки и обрабатывается ультразвуком.
Чтобы приготовить облученный волокнистый материал для обработки ультразвуком, облученный волокнистый материал извлекают из любого контейнера (например, пластмассовых мешков) и диспергируют в воде в концентрации приблизительно 0,10 г/мл. Обработку ультразвуком проводят на каждом образце в течение 30 минут, используя ультразвук с частотой 20 кГц из рупора 1000 Вт в условиях рециркуляции. После обработки ультразвуком облученный волокнистый материал собирается в емкости. Этот процесс может повторяться много раз до достижения желаемого уровня переработки, исходя из мониторинга структурных изменений проса. Далее, некоторые облученные образцы содержат в тех же условиях, что и остальные образцы, но не обрабатывают ультразвуком, чтобы они служили в качестве контролей. Кроме того, также в качестве контролей служат некоторые образцы, которые не облучали или не обрабатывали ультразвуком. Таким образом, некоторые контроли не обрабатывают, некоторые только облучают, а некоторые только обрабатывают ультразвуком.
Пример 25 - Тестирование предварительно обработанной биомассы с помощью микроорганизмов
Конкретные лигноцеллюлозные материалы, предварительно обработанные, как описано в настоящем документе, анализируют в отношении токсичности для распространенных штаммов дрожжей и бактерий, используемых в биотопливной промышленности для стадии ферментации при получении этанола. Кроме того, исследуют содержание сахара и совместимость с целлюлазными ферментами для определения эффективности процесса обработки. Тестирование предварительно обработанных материалов проводят в две фазы следующим образом.
Фаза 1. Токсичность и содержание сахара
Токсичность предварительно обработанных трав и бумажного сырья определяют в дрожжах Saccharomyces cerevisiae (винные дрожжи) и Pichia stipitis (ATCC 66278), а также в бактериях Zymomonas mobilis (ATCC 31821) и Clostridium thermocellum (ATCC 31924). Для каждого из организмов проводят исследование роста для определения оптимального времени инкубации и забора образцов.
Каждое сырье затем инкубируют, в двух параллелях, с S. cerevisiae, P. stipitis, Z. mobilis и C. thermocellum в стандартной микробиологической среде для каждого организма. Для двух штаммов дрожжей, S. cerevisiae и P. stipitis, используют бульон YM. Для Z. mobilis используют среду RM и для C. thermocellum используют среду CM4. Для сравнения используют положительный контроль, с добавлением чистого сахара, но без сырья. В процессе инкубации в течение 12-часового периода, получают всего пять образцов в моменты времени 0, 3, 6, 9 и 12 часов и анализируют их в отношении жизнеспособности (подсчет в чашках для Z. mobilis и прямой подсчет для S. cerevisiae) и концентрации этанола.
Содержание сахара в сырье определяют с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ), оборудованной либо колонкой Shodex™ sugar SP0810, либо колонкой Biorad Aminex® HPX-87P. Каждое сырье (приблизительно 5 г) смешивают с подвергнутой обратному осмосу (RO) водой в течение 1 часа. Жидкую часть смеси удаляют и анализируют на содержание глюкозы, галактозы, ксилозы, маннозы, арабинозы и целлобиозы. Анализ проводят согласно протоколу Determination of Structural Carbohydrates and Lignin in Biomass от National Bioenergy Center.
Фаза 2. Совместимость целлюлазы
Сырье тестируют, в двух параллелях, с помощью коммерчески доступного Accellerase™ 1000, содержащего комплекс ферментов, который восстанавливает лигноцеллюлозную биомассу до ферментируемых сахаров, при рекомендованной температуре и концентрации в колбе Эрленмейера. Колбы инкубируют при умеренном встряхивании приблизительно при 200 об/мин в течение 12 часов. В течение этого периода времени получают образцы каждые три часа в моменты времени 0, 3, 6, 9 и 12 часов для определения концентрации восстанавливающих сахаров (Hope and Dean, Biotech J., 1974, 144:403) в жидкой части колб.
Пример 26 - Анализ концентрации сахара с использованием ВЭЖХ
13 Образцов анализировали на концентрацию сахара (ВЭЖХ) и токсичность в отношении 3 микроорганизмов (Pichia stipitis, Saccharomyces cerevisiae и Zymomonas mobilis). В таблице 26 представлено оборудование, использованное для этих экспериментов. В таблицах 27 и 28 представлен список сахаров (включая производителя и номера партий), использованных для получения стандарта ВЭЖХ, и протокол, использованный для получения стандарта ВЭЖХ, соответственно.
Анализ
Каждый образец (1 грамм) смешивали с подвергнутой обратному осмосу водой при 200 об/мин и 50°C в течение ночи. Величину pH образца доводили до 5-6 и его фильтровали через 0,2-мкм шприцевой фильтр. Образцы перед анализом хранили при -20°C для поддержания целостности образцов. Наблюдения, сделанные в ходе приготовления образцов, представлены в таблице 29.
Стандарты были только что приготовленными из 4 мг/мл маточного раствора 6 объединенных сахаров: глюкозы, ксилозы, целлобиозы, арабинозы, маннозы и галактозы. Маточный раствор готовили растворением 0,400 грамм каждого сахара в 75 мл воды Nanopure (фильтрованной через 0,3-микронный фильтр). После растворения маточный раствор разбавляли до 100 мл с использованием мерной колбы и хранили при -20°C. Рабочие растворы стандартов в концентрации 0,1, 0,5, 1, 2 и 4 мг/мл получали путем серийного разведения маточного раствора водой Nanopure. Кроме того, из маточного раствора также приготавливали стандарт для проверки в концентрации 1,5 мг/мл.
Концентрации сахаров анализировали согласно протоколу Determination of Structural Carbohydrates in Biomass (NREL Biomass Program, 2006), и этот протокол полностью включен в настоящий документ в качестве ссылки. Использовали SHODEX SUGAR SP0810 COLUMN с испарительным детектором рассеяния света. Стандарт для проверки (стандарт в концентрации 1,5 мг/мл) анализировали после каждых 8 инъекций для уверенности в том, что целостность колонки и детектора сохранялись на протяжении эксперимента. Коэффициент вариации стандартной кривой (величина R2) составлял по меньшей мере 0,989, и концентрация стандартов для проверки находилась в пределах 10% от истинной концентрации. Условия ВЭЖХ были следующими:
Результаты
Результаты анализа ВЭЖХ представлены в таблицах 31, 32 и 33.
Пример 27 - Исследование токсичности
Двенадцать образцов анализировали на токсичность в отношении панели из трех продуцирующих этанол культур. В этом исследовании к образцам добавляли глюкозу в целях определения различия между голоданием культур и токсичностью образцов. Тринадцатый образец тестировали на токсичность в отношении Pichia stipitis. Обобщение использованного протокола приведено в таблице 32. Описание химических реагентов и оборудования, использованных при тестировании токсичности, представлено в таблицах 34-36.
Тестирование проводили с использованием трех микроорганизмов, как описано ниже.
Saccharomyces cerevisiae ATCC 24858 (American Type Culture Collection)
Культуру S. cerevisiae на скошенной среде получали из регидратированной лиофилизированной культуры, полученной от ATCC. Часть материала культуры на скошенной среде наносили штрихами на бульон YM + агар в концентрации 20 г/л (pH 5,0) и инкубировали при 30°C в течение 2 суток. В колбу Эрленмейера объемом 250 мл, содержащую 50 мл среды (20 г/л глюкозы, 3 г/л дрожжевого экстракта и 5,0 г/л пептона, pH 5,0) инокулировали одну колонию из чашки YM и инкубировали в течение 24 часов при 25°C и 200 об/мин. После роста в течение 23 часов отбирали образцы и анализировали их в отношении оптической плотности (600 нм в УФ-спектрофотометре) и чистоты (краситель Грама). Исходя из этих результатов была выбрана одна колба (названная посевной колбой) с OD 14,8 и для инокуляции всех тестируемых колб был выбран чистый краситель Грама.
Тестируемые емкости представляли собой колбы Эрленмейера на 500 мл, содержащие 100 мл стерильной среды, описанной выше. Все колбы автоклавировали при 121°C и 15 фунт/кв. дюйм (0,1 МПа) перед добавлением тестируемых материалов. Тестируемые материалы не стерилизовали, поскольку автоклавирование изменяет содержимое образцов. Тестируемые образцы добавляли во время инокуляции (а не перед ней) для снижения вероятности контаминации. В дополнение к тестируемым образцам, в каждую колбу добавляли 1 мл (1% об./об.) материала посевной колбы. Колбы инкубировали, как описано выше, в течение 36 часов.
Pichia stipitis NRRL Y-7124 (ARS Culture Collection)
Культуру P. stipitis на скошенной среде получали из регидратированной лиофилизированной культуры, полученной от ARS Culture Collection. Часть материала культуры на скошенной среде наносили штрихами на бульон YM + агар в концентрации 20 г/л (pH 5,0) и инкубировали при 30°C в течение 2 суток. В колбу Эрленмейера объемом 250 мл, содержащую 100 мл среды (40 г/л глюкозы, 1,7 г/л азотистого основания дрожжей, 2,27 г/л мочевины, 6,56 г/л пептона, 40 г/л ксилозы, pH 5,0) инокулировали небольшое количество материала из чашки и инкубировали в течение 24 часов при 25°C и 125 об/мин. После роста в течение 23 часов отбирали образцы и анализировали их в отношении оптической плотности (600 нм в УФ-спектрофотометре) и чистоты (краситель Грама). Исходя из этих результатов была выбрана одна колба (названная посевной колбой) с OD 5,23 и для инокуляции всех тестируемых колб был выбран чистый краситель Грама.
Тестируемые емкости представляли собой колбы Эрленмейера на 250 мл, содержащие 100 мл стерильной среды, описанной выше. Все колбы автоклавировали при 121°C и 15 фунт/кв. дюйм (0,1 МПа) и перед добавлением тестируемых материалов в колбы добавляли стерилизованную фильтрацией (0,22-мкм фильтр) среду. Тестируемые материалы не стерилизовали, поскольку автоклавирование изменяет содержимое образцов, а стерилизация фильтрованием не пригодна для стерилизации твердых веществ. Тестируемые образцы добавляли во время инокуляции (а не перед ней) для снижения вероятности контаминации. В дополнение к тестируемым образцам, в каждую колбу добавляли 1 мл (1% об./об.) материала посевной колбы. Колбы инкубировали, как описано выше, в течение 48 часов.
Zymomonas mobilis ATCC 31821 (American Type Culture)
Культуру Z. mobilis на скошенной среде получали из регидратированной лиофилизированной культуры, полученной от ATTC. Часть материала культуры на скошенной среде наносили штрихами на чашки DYE (глюкоза 20 г/л, дрожжевой экстракт 10 г/л, агар 20 г/л, pH 5,4) и инкубировали при 30°C и 5% CO2 в течение 2 суток. В 20-мл пробирку с завинчивающейся крышкой, содержащую 15 мл среды (25 г/л глюкозы, 10 г/л дрожжевого экстракта, 1 г/л MgSO4 7H2O, 1 г/л (NH4)2SO4, 2 г/л KH2PO4, pH 5,4) инокулировали одну колонию и инкубировали ее в течение 24 часов при 30°C без вращения. После роста в течение 23 часов отбирали образцы и анализировали их в отношении оптической плотности (600 нм в УФ-спектрофотометре) и чистоты (краситель Грама). Исходя из этих результатов была выбрана одна пробирка (OD 1,96) для инокуляции другой посевной колбы. В другую посевную колбу на 125 мл, содержащую 70 мл среды, описанной выше, инокулировали 700 мкл (1% об./об.) и инкубировали в течение 24 часов при 30°C при встряхивании. После роста в течение 23 часов отбирали образцы и анализировали их в отношении оптической плотности (600 нм в УФ-спектрофотометре) и чистоты (краситель Грама). Исходя из этих результатов была выбрана одна колба (названная посевной колбой) с OD 3,72 для инокуляции всех тестируемых колб.
Тестируемые емкости представляли собой колбы Эрленмейера на 250 мл, содержащие 100 мл стерильной среды, описанной выше, за исключением добавления дрожжевого экстракта в количестве 5 г/л. Все колбы автоклавировали при 121°C и 15 фунт/кв. дюйм (0,1 МПа) и перед добавлением тестируемых материалов в колбы добавляли стерилизованную фильтрацией (0,22-мкм фильтр) среду. Тестируемые материалы не стерилизовали, поскольку автоклавирование изменяет содержимое образцов, а стерилизация фильтрованием не пригодна для стерилизации твердых веществ. Тестируемые образцы добавляли во время инокуляции для снижения вероятности контаминации. В дополнение к тестируемым образцам, в каждую колбу добавляли 1 мл (1% об./об.) материала посевной колбы. Колбы инкубировали, как описано выше, в течение 36 часов.
Анализ
Два образца анализировали в отношении концентрации клеток (с использованием посева штриховым нанесением для Z. mobilis и прямого подсчета (гемоцитометр и микроскоп для S. cerevisiae и P. stipitis). Соответствующим образом разбавленные образцы Z. mobilis наносили штрихами на планшеты с дрожжевым экстрактом с декстрозой (глюкоза 20 г/л, дрожжевой экстракт 10 г/л, агар 20 г/л, pH 5,4), инкубировали при 30°C и 5% CO2 в течение 2 суток и подсчитывали количество колоний. Соответствующим образом разбавленные образцы S. cerevisiae и P. stipitis смешивали с 0,05% трипановым синим и помещали в гемоцитометр Neubauer. Клетки подсчитывали при увеличении 40X.
Три образца анализировали в отношении концентрации этанола с использованием анализатора YSI Biochem на основе анализа алкогольдегидрогеназы (YSI, Interscience). Образцы центрифугировали при 14000 об/мин в течение 20 минут и супернатант хранили при -20°C для сохранения целостности. Перед анализом образцы разбавляли до концентрации этанола в диапазоне 0-3,2 г/л. Стандарт в виде этанола в концентрации 3,2 г/л анализировали приблизительно после каждых 30 образцов для уверенности в том, что целостность мембраны сохранялась на протяжении анализа. Оптическая плотность (600 нм) образцов не описана, поскольку твердые тестируемые образцы препятствовали измерению поглощения вследствие мутности образцов, и оно было неточным.
Результаты анализа этанола
Для сравнения каждого образца с контролем для каждого микроорганизма использовали выход (таблицы 37-39). Однако % выход нельзя использовать для сравнения между штаммами. При сравнении штаммов следовало анализировать общую концентрацию этанола. При анализе данных % выход менее 80% может указывать на токсичность, когда он сопровождается низким количеством клеток. Уравнение, используемое для определения % выхода, представляет собой:
% выход = (этанол в образце/этанол в контроле) × 100
Результаты анализа концентрации клеток
% Клеток используют для сравнения каждого образца с контролем для каждого организма (таблицы 40-42). Однако % клеток нельзя использовать для сравнения между штаммами. При сравнении штаммов следовало использовать общую концентрацию клеток. При анализе данных % выход менее 70% может указывать на токсичность, когда он сопровождается низкой концентрацией этанола. Уравнение, используемое для определения % выхода, представляет собой:
% клеток = (количество клеток в образце/количество клеток в контроле)×100
Пример 28 - Ферментация во вращающейся колбе образцов целлюлозы при использовании P. stipitis
Краткое изложение
Тринадцать образцов тестировали в отношении продукции этанола в культуре P. stipitis без добавления сахара. Их тестировали в присутствии и в отсутствие целлюлазы (ферментный комплекс Accellerase 1000®, Genencor). Оборудование и реагенты, использованные для эксперимента, приведены ниже в таблицах 43-45.
Культуру P. stipitis на скошенной среде NRRL Y-7124 получали из регидратированной лиофилизированной культуры, полученной от ARS Culture Collection. Часть материала культуры на скошенной среде наносили штрихами на бульон для дрожжей и плесени (YM) + агар в концентрации 20 г/л (pH 5,0) и инкубировали при 30°C в течение 2 суток. В колбу Эрленмейера объемом 250 мл, содержащую 100 мл среды (40 г/л глюкозы, 1,7 г/л азотистого основания дрожжей, 2,27 г/л мочевины, 6,56 г/л пептона, 40 г/л ксилозы, pH 5,0) инокулировали одну колонию и ее инкубировали в течение 24 часов при 25°C и 100 об/мин. После роста в течение 23 часов отбирали образцы и анализировали их в отношении оптической плотности (600 нм в УФ-спектрофотометре) и чистоты (краситель Грама). Исходя из этих результатов была выбрана одна колба (названная посевной колбой) с OD 6,79 и для инокуляции всех тестируемых колб был выбран чистый краситель Грама.
Тестируемые емкости представляли собой колбы Эрленмейера на 250 мл, содержащие 100 мл среды (1,7 г/л азотистого основания дрожжей, 2,27 г/л мочевины и 6,56 г/л пептона). В среду колбы для роста не добавляли никакого сахара (глюкозу или ксилозу). Все колбы автоклавировали при 121°C и 15 фунт/кв. дюйм (0,1 МПа) и перед добавлением тестируемых материалов в колбы добавляли стерилизованную фильтрацией (0,22-мкм фильтр) среду. Тестируемые материалы не стерилизовали, поскольку автоклавирование изменяет содержимое образцов, а стерилизация фильтрованием не пригодна для стерилизации твердых веществ. Тестируемые образцы (приведенные в таблице 46) добавляли во время инокуляции (а не перед ней) для снижения вероятности контаминации. В дополнение к тестируемым образцам, в каждую колбу добавляли 1 мл (1% об./об.) материала посевной колбы. В колбы, содержащие образец P132-100, требовалось добавление 0,4 мл 1 M NaOH для доведения pH до 5,0. Колбы инкубировали при 30°C и 150 об/мин в течение 96 часов.
Один набор дублированных колб на исходный материал содержал ферментный комплекс Accellerase® (1,25 мл на колбу, наиболее высокая рекомендованная доза составляет 0,25 мл на грамм биомассы, Genencor) для попытки одновременного осахаривания и ферментации (SSF). Другой набор дублированных колб не содержал ферментный комплекс Accellerase®. Анализировали всего 52 колбы.
Также анализировали шесть контрольных колб. Колбы положительного контроля содержали порошковую целлюлозу SolkaFloc 200 NF (партия # UA158072, International Fiber Corporation) в концентрации 2,5 грамм на 100-мл колбу (25 грамм на л) с добавлением ферментного комплекса Accellerase® и без него. Кроме того, использовали контроль, содержащий только сахара (глюкозу и ксилозу).
Анализ
Образцы анализировали в отношении концентрации этанола (таблицы 47, 48 и 49) с использованием анализатора YSI Biochem на основе анализа алкогольдегидрогеназы (YSI, Interscience). Образцы центрифугировали при 14000 об/мин в течение 20 минут и супернатант хранили при -20°C. Перед анализом образцы разбавляли до концентрации этанола в диапазоне 0-3,2 г/л. Стандарт в виде этанола в концентрации 2,0 г/л анализировали приблизительно после каждых 30 образцов для уверенности в том, что целостность мембраны сохранялась на протяжении анализа.
Результаты
Пример 29- Анализ с целлюлазой
Краткое изложение
Тринадцать образцов тестировали в отношении чувствительности к целлюлазе с использованием промышленной целлюлазы (Accellerase® 1000, Genencor) при оптимальных условиях температуры и pH.
Протокол
Протокол представляет собой модификацию NREL "Laboratory Analytical Procedure LAP-009 Enzymatic Saccharification of Lignocellulosic Biomass". Образец материала добавляли к 10 мл 0,1 M натрий-цитратного буфера (pH 4,8) и 40 мг/мл тетрациклина (для предотвращения роста бактерий) в 50-мл пробирке в двух экземплярах. Количество образца, добавляемого в каждую пробирку, приведено в таблице 50. Некоторые образцы было трудно смешивать (P132, P132-10, P132-100), так что их добавляли при более низкой концентрации. Также включали положительный контроль в виде 0,2 грамм порошковой целлюлозы SolkaFloc 200 NF (партия # UA158072, International Fiber Corporation) и отрицательный контроль (без образца). В пробирки добавляли достаточное количество подвергнутой обратному осмосу воды (RO), доводя объем всего до 20 мл. Как натрий-цитратный буфер, так и воду, нагревали до 50°C перед применением.
Фермент Accellerase® 1000 добавляли в каждую пробирку в дозировке 0,25 мл на грамм биомассы (наиболее высокая дозировка, рекомендованная Genencor). Пробирки инкубировали под углом 45° при 150 об/мин и 50°C (рекомендовано Genencor) в течение 72 часов. Образцы брали через 0, 3, 6, 9, 12, 18, 24, 48 и 72 часов (таблицы 52 и 53), их центрифугировали при 14000 об/мин в течение 20 минут и супернатант замораживали при -20°C. Концентрацию глюкозы в образцах анализировали с помощью анализатора YSI Biochem (Interscience), используя условия, описанные в таблице 51. Стандартный раствор глюкозы, 2,5 г/л, приготавливали растворением 2,500 грамм глюкозы (Sigma Cat# G7528-5KG, партия #: 107H0245) в дистиллированной воде. После растворения общий объем доводили до 1 л дистиллированной водой в мерной колбе. Стандарт был свежеприготовленным, и хранили его при 4°C.
Результаты
График 1. Концентрация глюкозы (Наилучшие 4 продуцента)

Количество целлюлозы, расщепленной в пробирке, вычисляли следующим образом:
г/мл глюкозы × 20 мл (объем образца) × 0,9 (для поправки на молекулу воды, добавляемую при гидролизе целлюлозы)
Процент всего образца, высвобожденный в виде глюкозы (в таблице 53 ниже), вычисляли следующим образом:
г расщепленной целлюлозы/г добавляемого образца (для деталей см. таблицу 5) * 100
Пример 30 - Ферментация во вращающейся колбе с использованием Pichia stipitis
Краткое изложение
Ферментацию во вращающейся колбе с использованием Pichia stipitis проводили с использованием четырех целлюлозных материалов, имеющих наиболее высокий % выход, исходя из таблицы 36.
Протокол
Эксперименты проводили согласно параметрам, приведенным в таблицах 54-56.
Получение посевного материала
Для всех представленных ниже экспериментов с вращающейся колбой посевные колбы получали с использованием следующего способа.
Рабочий банк клеток P. stipitis NRRL Y-7124 получали из регидратированной лиофилизированной культуры, полученной от ARS Culture Collection. Криофлаконы, содержащие культуру P. stipitis в 15% об./об. глицерине, хранили при -75°C. Часть размороженного материала рабочего банка клеток наносили штрихами на бульон для дрожжей и плесени (YM) + 20 г/л агар (pH 5,0) и инкубировали при 30°C в течение 2 суток. Чашки выдерживали в течение 2 суток при 4°C перед использованием. В колбу Эрленмейера объемом 250 мл, содержащую 100 мл среды (40 г/л глюкозы, 1,7 г/л азотистого основания дрожжей, 2,27 г/л мочевины, 6,56 г/л пептона, 40 г/л ксилозы, pH 5,0) инокулировали одну колонию и ее инкубировали в течение 24 часов при 25°C и 100 об/мин. После роста в течение 23 часов отбирали образцы и анализировали их в отношении оптической плотности (600 нм в УФ-спектрофотометре) и чистоты (краситель Грама). Исходя из этих результатов одну колбу (названную посевной колбой) при оптической плотности от 4 до 8 и с чистым красителем Грамма использовали для инокуляции всех тестируемых колб.
Три эксперимента проводили с использованием образцов A132-10, A132-100, G132-10 и G132-100. В эксперименте #1 тестировали эти четыре образца в отношении концентрации этанола при различных концентрациях ксилозы и при постоянных концентрациях глюкозы. В эксперименте #2 тестировали эти четыре образца в отношении концентрации этанола при удвоенной концентрации исходного материала, использованного в экспериментах, представленных в таблице 36. Наконец, в эксперименте #3 эти четыре образца тестировали в отношении концентрации этанола при различных концентрациях как ксилозы, так и глюкозы, одновременно.
Эксперимент #1-Варьирование концентрации ксилозы
Четыре целлюлозных образца (A132-10, A132-100, G132-10 и G132-100) тестировали при различных концентрациях ксилозы, как представлено в таблице 57, ниже.
Тестируемые емкости (всего 40, 250-мл колбы Эрленмейера) содержали 100 мл среды. Приготавливали пять различных типов среды с количеством ксилозы и глюкозы, приведенным в таблице 57. Кроме того, среда содержала 1,7 г/л азотистых оснований дрожжей (Becton Dickinson #291940), 2,27 г/л мочевины (ScholAR Chemistry #9472706) и 6,56 г/л пептона (Becton Dickinson #211677). Все колбы автоклавировали при 121°C и 15 фунт/кв. дюйм (0,1 МПа) и перед добавлением тестируемых материалов в колбы добавляли стерилизованную фильтрованием (0,22-мкм фильтр) среду. Колбы выдерживали при комнатной температуре в течение 4 суток и осматривали в отношении контаминации (мутности) перед использованием. Тестируемые материалы не стерилизовали, поскольку автоклавирование изменяет содержимое образцов, а стерилизация фильтрованием не пригодна для стерилизации твердых веществ. Тестируемые образцы (A132-10, A132-100, G132-10 и G132 в количестве 5 г на 100 мл) добавляли во время инокуляции (а не перед ней) для уменьшения возможности контаминации. В дополнение к тестируемым образцам, в каждую колбу добавляли 1 мл (1% об./об.) материала посевной колбы. Колбы инкубировали при 30°C и 150 об/мин в течение 72 часов.
К сожалению, одна колба (образец A132-100 со 100% ксилозой) была разбита в ходе тестирования. Таким образом, все результаты после 24 часов инкубации описаны для одной колбы. После инкубации в течение 72 часов 100% исходного количества целлюлозного материала (5,0 г) добавляли в колбы со 100% ксилозой (всего 7 колб, одна колба, содержащая образец A132-100, была разбита) и проводили инкубацию, как описано выше, в течение дополнительных 48 часов.
Анализ
Образцы отбирали из 40 тестируемых колб при времени инкубации 0, 6, 12, 24, 36, 48 и 72 часов. Кроме того, образцы отбирали через 24 и 48 часов после добавления второго количества исходного материала в колбы со 100% ксилозой (см. таблицу 58).
Всего 292 образца анализировали в отношении концентрации этанола с использованием анализатора YSI Biochem на основе анализа алкогольдегидрогеназы (YSI, Interscience). Образцы центрифугировали при 14000 об/мин в течение 20 минут и супернатант хранили при -20°C. Примечательно, что на время 0 образцы было необходимо фильтровать через 0,45-мкм шприцевой фильтр. Перед анализом образцы разбавляли до концентрации этанола в диапазоне 0-3,2 г/л. Стандарт в виде этанола в концентрации 2,0 г/л анализировали приблизительно после каждых 30 образцов для уверенности в том, что целостность мембраны сохранялась.
Всего 47 образцов анализировали в отношении количества клеток. Образцы отбирали после инкубации в течение 72 часов и через 48 часов после добавления дополнительного целлюлозного материала. Соответствующим образом разбавленные образцы смешивали с 0,05% трипановым синим и загружали в гемоцитометр Neubauer. Клетки подсчитывали при увеличении 40X.
Эксперимент #2- Анализ 2X концентрации исходного материала
Тестируемые емкости (всего 8, 250-мл колбы Эрленмейера) содержали 100 мл среды. Среда содержала 40 г/л глюкозы, 40 г/л ксилозы, 1,7 г/л азотистых оснований дрожжей (Becton Dickinson #291940), 2,27 г/л мочевины (ScholAR Chemistry #9472706) и 6,56 г/л пептона (Becton Dickinson #211677). Колбы подготавливали, как в эксперименте #1. Тестируемые образцы (A132-10, A132-100, G132-10 и G132-100 в концентрации 10 г на 100 мл) добавляли во время инокуляции (а не перед ней) для снижения вероятности контаминации. В дополнение к тестируемым образцам, в каждую колбу добавляли 1 мл (1% об./об.) материала посевной колбы. Колбы инкубировали при 30°C и 150 об/мин в течение 72 часов.
Анализ
Образцы отбирали из 8 тестируемых колб в момент времени инкубации 0, 6, 12, 24, 36, 48 и 72 часов. Анализ этанола 56 образцов проводили согласно эксперименту #1 и его результаты представлены в таблице 59. Подсчет клеток проводили на образце, полученном через 72 часа, согласно эксперименту #1, и его результаты представлены в таблице 60.
Эксперимент #3 - Варьирование концентраций ксилозы и глюкозы
Четыре целлюлозных образца (A132-10, A132-100, G132-10 и G132-100) тестировали при различных концентрациях ксилозы и глюкозы, как представлено в таблице ниже (таблица 61).
Тестируемые емкости (всего 32, 250-мл колбы Эрленмейера) содержали 100 мл среды. Приготавливали четыре различных типа среды с количеством ксилозы и глюкозы, приведенным в таблице 61. Кроме того, среда содержала 1,7 г/л азотистых оснований дрожжей (Becton Dickinson #291940), 2,27 г/л мочевины (ScholAR Chemistry #9472706) и 6,56 г/л пептона (Becton Dickinson #211677). Колбы подготавливали согласно эксперименту #1. Тестируемые образцы (A132-10, A132-100, G132-10 и G132-100) добавляли во время инокуляции (а не перед ней) для уменьшения вероятности контаминации. В дополнение к тестируемым образцам, в каждую колбу добавляли 1 мл (1% об./об.) материала посевной колбы. Колбы инкубировали при 30°C и 150 об/мин в течение 72 часов.
Анализ
Образцы отбирали из 32 тестируемых колб в момент времени инкубации 0, 6, 12, 24, 36, 48 и 72 часов. (см. таблицы 62-65). Всего 224 образца анализировали в отношении концентрации этанола с использованием анализатора YSI Biochem на основе анализа алкогольдегидрогеназы (YSI, Interscience). Образцы центрифугировали при 14000 об/мин в течение 20 минут и супернатант хранили при -20°C. Следует отметить, что требовалось центрифугирование некоторых образцов, а затем их фильтрование через 0,45-мкм шприцевой фильтр. Перед анализом образцы разбавляли до концентрации этанола в диапазоне 0-3,2 г/л. Стандарт в виде этанола в концентрации 2,0 г/л анализировали приблизительно после каждых 30 образцов для уверенности в том, что целостность мембраны YSI сохранялась.
Таблица 62
Результаты в отношении этанола для образца A132-10

* Анализ из эксперимента #3
Таблица 63
Результаты в отношении этанола для образца A132-100

* Анализ из эксперимента #3
** Все результаты основаны на анализе одной колбы
Таблица 64
Результаты в отношении этанола для образца G132-10
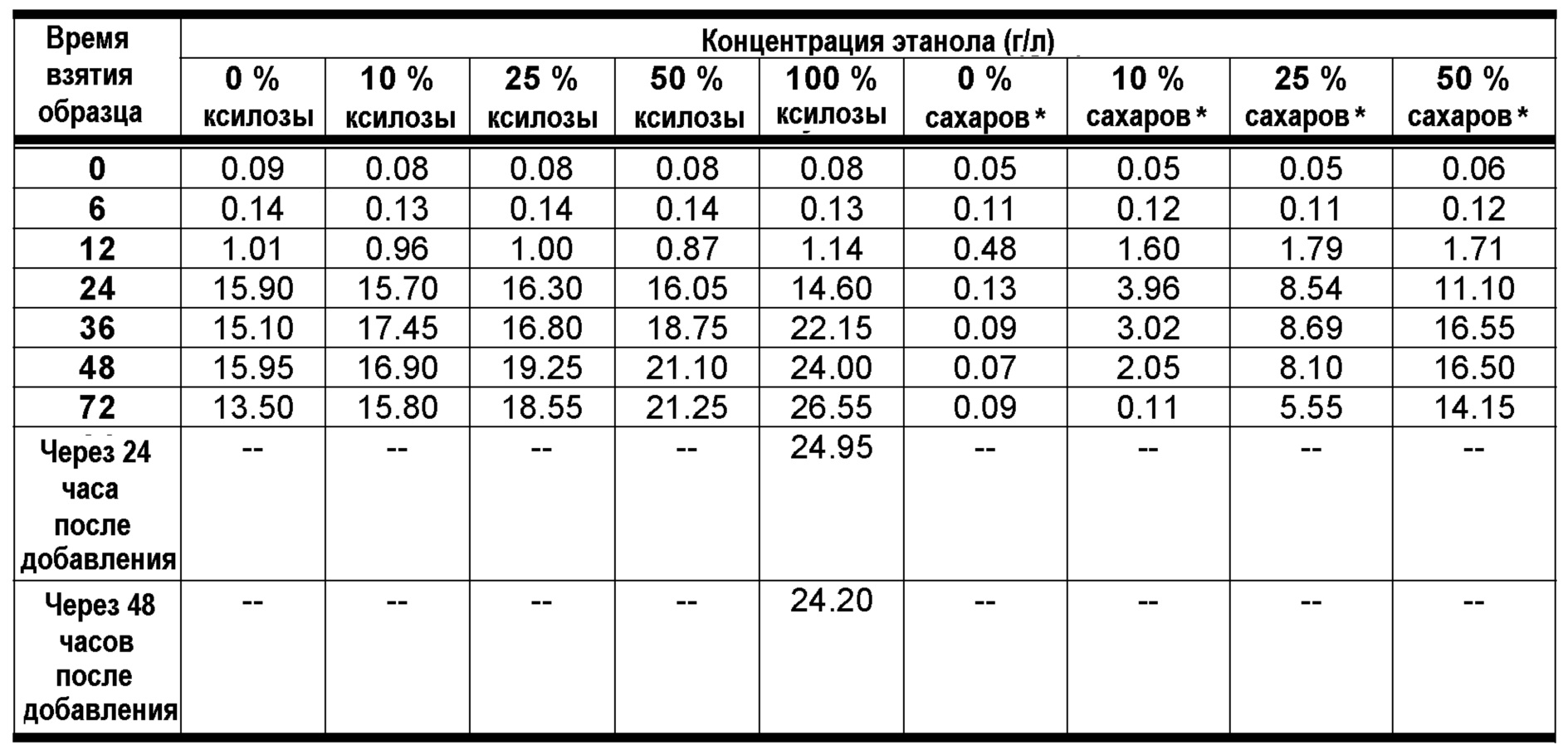
* Анализ из эксперимента #3
Таблица 65
Результаты в отношении этанола для образца G132-10

* Анализ из эксперимента #3
Взятие образцов проводили после инкубации в течение 72 часов для подсчета клеток (см. таблицы 66-67). Соответствующим образом разбавленные образцы смешивали с 0,05% трипановым синим и загружали в гемоцитометр Neubauer. Клетки подсчитывали при увеличении 40X.
Результаты
Для инокуляции всех тестируемых колб эксперимента #1 и #2 использовали одну посевную колбу. Измеренная оптическая плотность (600 нм) в посевной колбе составила 5,14 и концентрация клеток составила 4,65×108 клеток/мл (таблицы 65-66). Таким образом, исходная концентрация клеток в тестируемых колбах составила приблизительно 4,65×106 клеток/мл.
Для инокуляции колб эксперимента #3 использовали вторую посевную колбу. Оптическая плотность (600 нм) в посевной колбе составила 5,78 и концентрация клеток составила 3,75×108 клеток/мл. Таким образом, исходная концентрация клеток в тестируемых колбах составила приблизительно 3,75×l06 клеток/мл.
Таблица 66
Количества клеток после инкубации в течение 72 часов
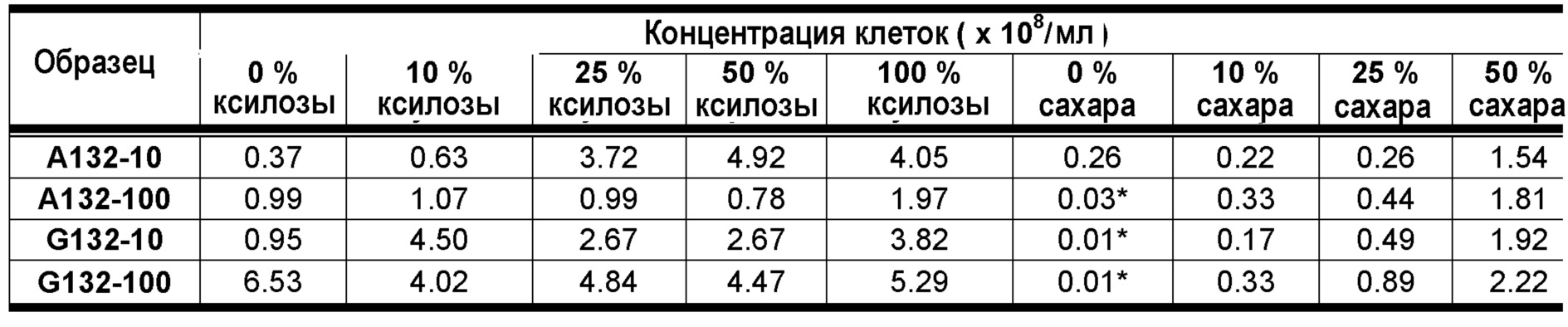
*Образцы были значительно контаминированы после роста в течение 72 часов. Это является ожидаемым, поскольку Pichia плохо росли без добавления сахара, и контаминирующие организмы (из нестерильных образцов) были способны перерасти Pichia.
Пример 31 - Тестирование токсичности лигноцеллюлозных образцов в отношении P. stipitis и S. cerevisiae
Краткое изложение
Тридцать семь образцов анализировали на токсичность в отношении двух продуцирующих этанол культур, Saccharomyces cerevisiae и Pichia stipitis. В этом исследовании к образцам добавляли глюкозу в целях определения различия между голоданием культур и токсичностью образцов.
Протокол
Краткое изложение использованного протокола приведено в таблице 68. Описание реагентов, использованных при тестировании токсичности, приведено в таблице 69. Для каждой недели тестирования получали по две контрольных колбы (без добавления образца) для каждого микроорганизма. Всего анализировали 82 колбы.
В процессе экспериментов в течение первых 24 часов инкубации в колбах с P. stipitis, содержащих образцы C, C-1e, C-5e, и C-10e, не появлялся ни этанол, ни клетки. Для подтверждения результатов тест повторяли. Второй тест подтвердил некоторое ингибирование роста P. stipitis при добавлении в колбы образцов C, C1E, C5E и C10E.
Тестируемые образцы
Семь тестируемых образцов (все с обозначением "C") измельчали с использованием кофемолки, подходящей для небольших образцов. Образцы измельчали до сопоставимого размера частиц (между образцами) при визуальном осмотре. Образец под номером C-10e измельчался легко до частиц малого размера.
Все образцы добавляли в колбы при концентрации 50 грамм на литр, за исключением шести образцов "P" (25 грамм на литр). Эти образцы имели цвет от белого до не совсем белого и визуально выглядели рыхлыми, а при концентрации 50 грамм на литр колбы не перемешивались надлежащим образом (недостаточно свободной жидкости). Образцы "S" растворялись легко, и впоследствии их можно было добавлять в колбы в более высоких концентрациях. Образцы "A" и "G" впоследствии можно было добавлять в количестве 100 грамм на литр.
Тестирование проводили с использованием двух микроорганизмов, как описано ниже.
Saccharomyces cerevisiae ATCC 24858 (American Type Culture Collection)
Рабочий банк клеток S. cerevisiae ATCC 24858 получали из регидратированной лиофилизированной культуры, полученной от American Type Culture Collection. Криофлаконы, содержащие культуру S. cerevisiae в 15% об./об. глицерине, хранили при температуре -75°C. Часть размороженного материала рабочего банка клеток наносили штрихами на бульон для дрожжей и плесени (YM) + 20 г/л агар (pH 5,0) и инкубировали при 30°C в течение 2 суток. В колбу Эрленмейера объемом 250 мл, содержащую 50 мл среды (20 г/л глюкозы, 3 г/л дрожжевого экстракта и 5,0 г/л пептона, pH 5,0), инокулировали одну колонию с чашки с YM и ее инкубировали в течение 24 часов при 25°C и 200 об/мин. После роста в течение 23 часов отбирали образцы и анализировали их в отношении оптической плотности (600 нм в УФ-спектрофотометре) и чистоты (краситель Грама). Исходя из этих результатов одну колбу (названную посевной колбой) с OD 9-15 и чистым красителем Грама использовали для инокуляции колб для роста. После роста в течение 23 часов посевная колба имела низкую OD (5,14) и количество клеток (1,35×108 клеток/мл). Следует отметить, что колония, взятая из посевной чашки, была меньше, чем обычно. Таким образом, в каждую тестируемую емкость добавляли 0,5 мл посевного материала (в противоположность планируемому 0,1 мл).
Тестируемые емкости представляли собой 500-мл колбы Эрленмейера, содержащие 100 мл стерильной среды, описанной выше. Все колбы автоклавировали при 121°C и 15 фунт/кв. дюйм (0,1 МПа) перед добавлением тестируемых материалов. Тестируемые материалы не стерилизовали, поскольку автоклавирование изменяет содержимое образцов. Тестируемые образцы добавляли во время инокуляции (а не перед ней) для снижения вероятности контаминации. В дополнение к тестируемым образцам, в каждую колбу добавляли 0,5-1,0 мл (0,5-1% об./об.) материала посевной колбы. Колбы инкубировали, как описано выше, в течение 72 часов.
Pichia stipitis (ARS Culture Collection)
Рабочий банк клеток P. stipitis NRRL Y-7124 получали из регидратированной лиофилизированной культуры, полученной от ARS Culture Collection. Криофлаконы, содержащие культуру P. stipitis в 15% об./об. глицерине, хранили при -75°C. Часть размороженного материала рабочего банка клеток наносили штрихами на бульон для дрожжей и плесени (YM) + 20 г/л агар (pH 5,0) и инкубировали при 30°C в течение 2 суток. Чашки выдерживали в течение 5 суток при 4°C перед использованием. В колбу Эрленмейера объемом 250 мл, содержащую 100 мл среды (40 г/л глюкозы, 1,7 г/л азотистого основания дрожжей, 2,27 г/л мочевины, 6,56 г/л пептона, 40 г/л ксилозы, pH 5,0), инокулировали одну колонию и ее инкубировали в течение 24 часов при 25°C и 125 об/мин. После роста в течение 23 часов отбирали образцы и анализировали их в отношении оптической плотности (600 нм в УФ-спектрофотометре) и чистоты (краситель Грама). Исходя из этих результатов одну колбу (названную посевной колбой) с оптической плотностью 5-9 и чистым красителем Грама использовали для инокуляции всех тестируемых колб.
Тестируемые емкости представляли собой 250-мл колбы Эрленмейера, содержащие 100 мл стерильной среды, описанной выше. Все колбы автоклавировали при 121°C и 15 фунт/кв. дюйм (0,1 МПа) и перед добавлением тестируемых материалов в колбы добавляли стерилизованную фильтрацией (0,22-мкм фильтр) среду. Тестируемые материалы не стерилизовали, поскольку автоклавирование изменяет содержимое образцов, а стерилизация фильтрованием не пригодна для стерилизации твердых веществ. Тестируемые образцы добавляли во время инокуляции (а не перед ней) для снижения вероятности контаминации. В дополнение к тестируемым образцам, в каждую колбу добавляли 1 мл (1% об./об.) материала посевной колбы. Колбы инкубировали, как описано выше, в течение 72 часов.
Анализ
Образцы отбирали из посевных колб непосредственно перед инокуляцией и из каждой колбы через 24 и 72 часа и анализировали их в отношении концентрации клеток с использованием прямого подсчета. Соответствующим образом разбавленные образцы S. cerevisiae и P. stipitis смешивали с 0,05% трипановым синим и загружали в гемоцитометр Neubauer. Клетки подсчитывали при увеличении 40X.
Образцы отбирали из каждой колбы в моменты времени 0, 6, 12, 24, 36, 48 и 72 часов и анализировали в отношении концентрации этанола с использованием анализатора YSI Biochem на основе анализа алкогольдегидрогеназы (YSI, Interscience). Образцы центрифугировали при 14000 об/мин в течение 20 минут и супернатант хранили при -20°C. Перед анализом образцы разбавляли до концентрации этанола 0-3,2 г/л. Стандарт в виде этанола в концентрации 2,0 г/л анализировали приблизительно после каждых 30 образцов для уверенности том, что целостность мембраны сохранялась на протяжении анализа.
Вычисления
Для сравнения количества клеток и концентрации этанола с контрольными колбами использовали следующие вычисления.
% выход = (концентрация этанола в тестируемой колбе/этанол в контроле)*100% клеток = (количество клеток в тестируемой колбе/количество клеток в контрольной колбе)*100
Результаты
Посевная колба с S. cerevisiae имела оптическую плотность (600 нм) 5,14 и концентрацию клеток 1,35×108 клеток/мл. Половину материала посевной колбы добавляли в каждую из тестируемых колб. Таким образом, исходная концентрация клеток в каждой колбе составляла 6,75×105/мл. В течение второй недели тестирования посевная колба с S. cerevisiae имела оптическую плотность (600 нм) 4,87 и концентрацию клеток 3,15×107 клеток/мл. Один мл материала посевной колбы добавляли в каждую из тестируемых колб. Таким образом, исходная концентрация клеток в каждой колбе составляла 6,30×105/мл. Значение pH в колбах с S. cerevisiae в момент взятия образца 0 часов представлено в таблице 71. Значение pH содержимого колб находилось в пределах оптимальных значений pH для роста S. cerevisiae (pH 4-6). Корректирования pH не требовалось.
Концентрация и выход этанола в колбах с S. cerevisiae представлены в таблицах 72 и 73. Наиболее высокие концентрации этанола продуцировались серией S.
Концентрация клеток и % клеток в колбах с S. cerevisiae представлены в таблице 74. Во всех колбах наблюдали большие количества клеток; однако не все клетки, по-видимому, продуцировали этанол.
Посевная колба с P. stipitis имела оптическую плотность (600 нм) 5,01 и концентрацию клеток 3,30×108 клеток/мл. Один мл материала посевной колбы добавляли в каждую из тестируемых колб. Таким образом, исходная концентрация клеток в каждой колбе составляла 3,30×106/мл. В течение второй недели тестирования посевная колба с P. stipitis имела оптическую плотность (600 нм) 5,45 и концентрацию клеток 3,83×108 клеток/мл. Один мл материала посевной колбы добавляли в каждую из тестируемых колб. Таким образом, исходная концентрация клеток в каждой колбе составляла 3,83×106/мл. Значение pH в колбах с P. stipitis в момент взятия образца 0 часов представлено в таблице 75. Значение pH содержимого колб находилось в пределах оптимальных значений pH для роста P. stipitis (pH 4-7). Корректирования pH не требовалось.
Концентрация и выход этанола в колбах с P. stipitis представлены в таблицах 76 и 77. Наиболее высокие концентрации этанола имели серии G и A. Колбы с C-30e, C-50e и C-100e также содержали высокие концентрации этанола. Концентрация клеток и % клеток в колбах с P. stipitis представлены в таблице 78. В колбах с обозначением S наблюдали низкие концентрации клеток. Низкие количества клеток также наблюдали в колбах, содержащих образцы C, C1E, C5E и C10E в момент взятия образца 24 часа.
Обобщение результатов клеточной токсичности
Zymomonas mobilis
Как показано на диаграмме 1A, повышенные количества клеток (например, более чем в контроле) наблюдали в образцах, содержащих P-132-10, G-132-10 и WS-132-10 в момент времени 24 часа. Количества клеток в присутствии всех других образцов были сравнимы с контролем. Это наблюдение указывает на то, что субстраты не были токсичными в отношении Z. mobilis в течение вплоть до 24 часов после посева.
В момент времени 36 часов наблюдали снижение количества клеток (например, за счет потери клеток или гибели клеток) во всех образцах, включая контроль. Наибольшее снижение количества клеток наблюдали для образцов, содержащих P-132-10, G-132-10. Возможная причина этого эффекта является общей для всех образцов, включая контроль. Таким образом, причиной этого эффекта являются не тестируемые субстраты, поскольку они отличаются в каждом образце и не присутствуют в контроле. Возможное объяснение этого наблюдения включает несоответствующие условия культивирования (например, температуру, состав среды) или концентрации этанола в образце.
Диаграмма 1A. Концентрации клеток Z. mobilis

Как показано на диаграмме 1B, все клетки продуцировали сравнимые количества этанола (например, 5-10 г/л) в каждый момент времени, независимо от субстрата. Согласно данным по количеству клеток, представленным на диаграмме 1A, концентрация этанола в каждом образце достигала пика в момент времени 24 часа. В противоположность данным о количестве клеток, концентрация этанола не снижалась в последующие моменты времени. Это было ожидаемым, поскольку этанол не удаляли из системы. Кроме того, эти данные указывают на то, что продукция этанола в этих образцах могла быть следствием ферментации глюкозы в культуральной среде. Оказалось, что ни один из этих субстратов не повышал продукцию этанола.
Диаграмма 1B. Концентрации этанола для Z. mobilis

Рассмотренные вместе диаграммы 1A и 1B указывают на то, что концентрации этанола выше, чем приблизительно 6 г/л, могут быть токсичными для Z mobilis. Эти данные также представлены в виде процента, нормализованного относительно контроля, как показано на диаграмме 1C.
Диаграмма 1C. % рост и продукция этанола для Z. mobilis

Pichia stipitis
Как показано на диаграмме 2A, количества клеток были сравнимы с контролем. Более того, несмотря на то, что в образцах, содержащих G-132 и WS-132, присутствовали немного сниженные количества клеток, для G-132-10, G-132-100, A-132-10 или A-132-100 снижения количества клеток не наблюдали. Таким образом, маловероятно, что субстраты G или A являются токсичными. Скорее, сниженные количества клеток, наблюдаемые для G-132 и WS-132, вероятно вызваны экспериментальной ошибкой или присутствием непереработанного субстрата, каким-либо образом препятствовавшего росту клеток. В целом, эти данные указывают на то, что глюкоза, присутствующая в контрольных и экспериментальных образцах, вероятно, является достаточной для содействия оптимальному росту P. stipitis, и что присутствие дополнительного субстрата в образце не увеличивает эту скорость роста. Данные результаты также указывают на то, что ни один из образцов не является токсичным для P. stipitis.
Диаграмма 2A. Концентрации клеток P. stipitis

Как показано на диаграмме 2B, несмотря на небольшие количества клеток, представленные на диаграмме 2B, значительно увеличенную продукцию этанола наблюдали во всех образцах, содержащих экспериментальный субстрат. Концентрации этанола возрастали с течением времени для каждого из трех протестированных моментов времени. Наиболее высокая концентрация этанола наблюдалась для A-132-10 в момент времени 48 часов (например, приблизительно 26,0 г/л). Путем сравнения концентраций субстратов с наиболее высокими уровнями продукции этанола и данными о количестве клеток, представленными на диаграмме 2B, можно видеть, что P. stipitis, по-видимому, не являются чувствительными к повышению концентраций этанола. Более того, продукция этанола, по-видимому, не связана с количеством клеток, а скорее связана с типом субстрата, присутствующего в образце.
Диаграмма 2B. Концентрации этанола для P. stipitis

Рассмотренные вместе результаты, представленные на диаграммах 2A и 2B, указывают на то, что экспериментальные субстраты не содействуют повышенному росту P. stipitis, однако они в значительной степени увеличивают количество этанола, продуцируемого этим типом клеток. Эти данные также представлены в виде процента, нормализованного относительно контроля, как показано на диаграмме 2C.
Диаграмма 2C. % рост и продукция этанола для P. stipitis

Saccharomyces cerevisiae
Как показано на диаграмме 3A, G-132-100, A-132, A-132-10, A-132-100 и WS-132 обеспечивали значительно увеличенные количества клеток по сравнению с контролем. Ни для одного из образцов не наблюдали значительного снижения количества клеток. Эти результаты указывают на то, что ни один из этих образцов не является токсичным для S. cerevisiae.
Диаграмма 3A. Концентрации клеток S. cerevisiae

Как показано на диаграмме 3B, увеличенную продукцию этанола наблюдали в обработанных клетках в случае каждого типа клеток по сравнению с контролем. Сравнение этих образцов, содержащих наибольшее количество этанола, с данными о количестве клеток, представленными на диаграмме 3A, указывает на то, что концентрации этанола более 5 г/л могут оказывать неблагоприятное действие на количество клеток. Однако это наблюдение имеет место не для всех образцов.
Диаграмма 3B. Концентрации этанола для S. cerevisiae

Эти данные также представлены в виде процента, нормализованного относительно контроля, как показано на диаграмме 3C.
Диаграмма 3C. % рост и продукция этанола для S. cerevisiae
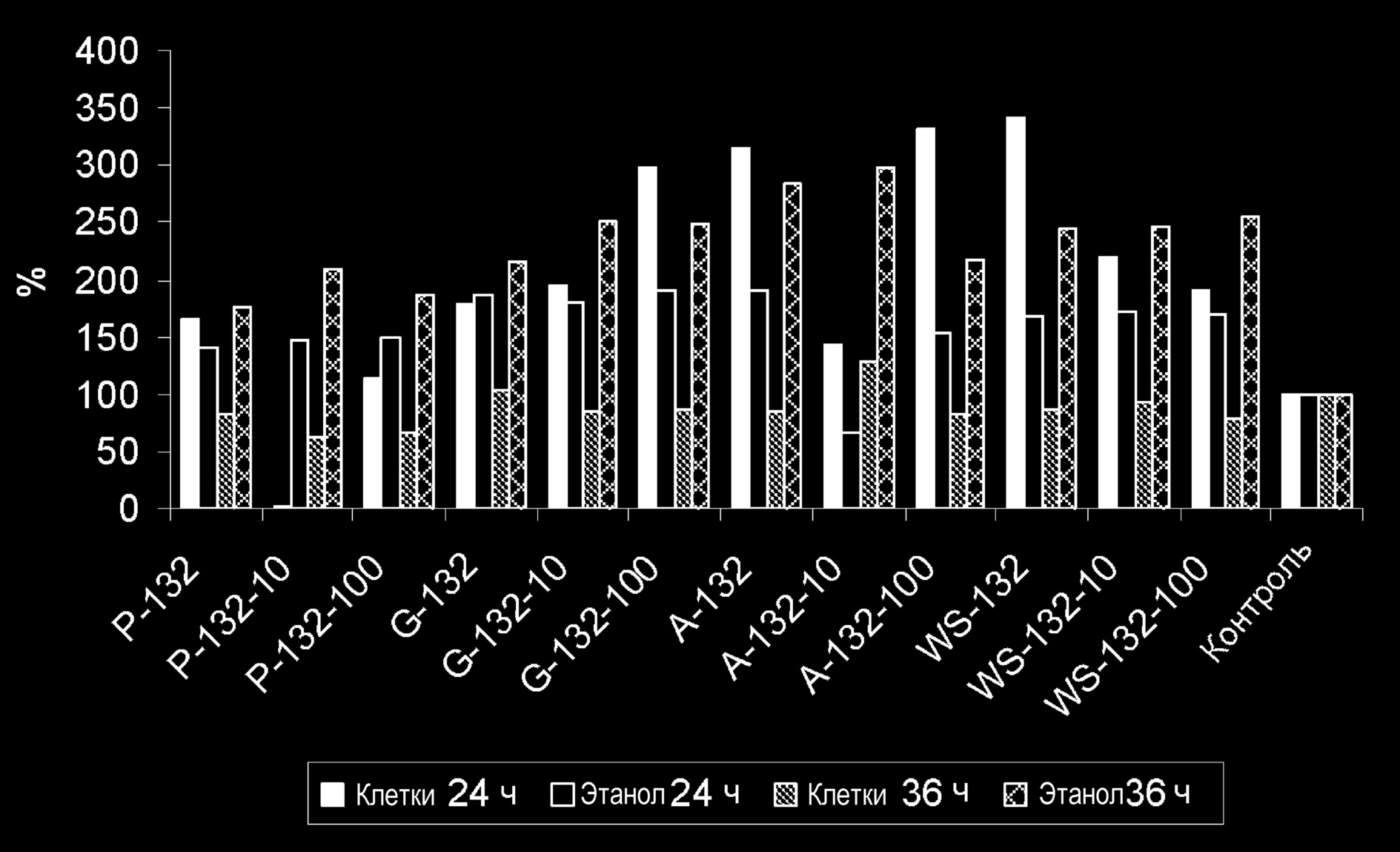
В заключение, оказалось, что ни один из протестированных образцов не является токсичным в Z. mobilis, P. stipitis или S. cerevisiae. Более того, оказалось, что P. stipitis является наиболее эффективным среди трех типов клеток в отношении продукции этанола из протестированных экспериментальных субстратов.
Пример 32 - Продукция спирта с использованием предварительной обработки в виде облучения-обработки ультразвуком
На оптимальный размер установок для конверсии биомассы влияют факторы, включающие экономию за счет масштаба и типа и доступности биомассы, используемой в качестве сырья. Увеличение размера установки имеет тенденцию к повышению экономии за счет масштаба, ассоциированную с производственными процессами. Однако увеличение размера установки также имеет тенденцию к увеличению затрат (например, затрат на транспортировку) на единицу сырья биомассы. Исследования, в которых анализируются эти факторы, указывают на то, что приемлемый размер установок по конверсии биомассы может находиться в диапазоне от 2000 до 10000 тонн сухого сырья биомассы в сутки. Установка, описанная ниже, масштабирована для переработки 2000 тонн сухого сырья биомассы в сутки.
На ФИГ. 39 представлена технологическая схема системы для конверсии биомассы, сконфигурированной для переработки проса. Подсистема подготовки исходного материала перерабатывает неочищенное сырье биомассы для удаления чужеродных объектов и обеспечивает частицы постоянного размера для дальнейшей переработки. Подсистема для предварительной обработки изменяет молекулярную структуру (например, снижает среднюю молекулярную массу и кристалличность) сырья биомассы посредством облучения сырья биомассы, смешивания облученного сырья биомассы с водой с образованием суспензии и применения ультразвуковой энергии к суспензии. Облучение и обработка ультразвуком преобразуют целлюлозный и лигноцеллюлозный компоненты сырья биомассы в поддающиеся ферментации материалы. Подсистема основной переработки ферментирует глюкозу и другие низкомолекулярные сахара, присутствующие после предварительной обработки, с образованием спиртов.
Подготовка исходного материала
Выбранный уровень заданного исходного материала для предприятия составляет 2000 тонн сухого материала биомассы проса в сутки. Заданный исходный материал представляет собой порубленное и/или раздробленное просо.
Сырье биомассы, в форме связок проса, доставляют к установке на грузовых автомобилях с прицепом. Когда грузовые автомобили прибывают, их взвешивают и разгружают вилочными погрузчиками. Некоторые связки отправляют в местное хранилище, а другие помещают непосредственно на конвейеры. Оттуда связки транспортируются в автоматическую разворачивающую систему, которая разрезает пластмассовые упаковки и/или сетку, окружающую связки. Затем сырье биомассы транспортируется мимо магнитного сепаратора для удаления инородных металлов, после чего оно подается в системы устройство для нарезания-устройство для дробления, где уменьшается размер материала. Наконец, сырье биомассы транспортируется в подсистему для предварительной обработки.
В некоторых случаях связки проса обернуты пластмассовой сетью для обеспечения того, чтобы они не распадались при транспортировке, а также они могут быть завернуты в пластмассовую пленку для защиты связки от погодных условий. Связки являются либо квадратными, либо круглыми. Связки доставляются на установки из отдаленного хранилища на больших грузовых автомобилях с прицепами.
Поскольку просо доступно только сезонно, требуется длительное хранение для обеспечения установки исходным материалом круглый год. Хранилище для длительного хранения может состоять из 400-500 акров непокрытых сгруппированных связок в районе (или нескольких районах), достаточно близко к установке по производству этанола. Местное кратковременное хранилище, эквивалентное 72 часам производства, обеспечивают на открытых площадках. Связки и окружающие подъездные пути, а также транспортирующие конвейеры находятся на бетонной плите. Бетонную плиту используют вследствие требуемого объема грузооборота для доставки необходимого большого количества сырья биомассы. Бетонная плита минимизирует количество стоячей воды в области хранения, а также уменьшает воздействие грязи на сырье биомассы. Хранящийся материал обеспечивает кратковременное снабжение в течение выходных дней, праздничных дней и когда нормальная прямая доставка материала на переработку прерывается.
Связки разгружаются вилочными погрузчиками и помещаются прямо на конвейеры для транспортировки связок или на площадку кратковременного хранения. Связки также извлекаются из кратковременного хранилища вилочными погрузчиками и погружаются на конвейеры для транспортировки связок.
Связки направляются к одной из двух станций для разворачивания. Развернутые связки разбивают с использованием расправляющей планки, а затем их выгружают на конвейер, который проходит мимо магнитного сепаратора для удаления металла перед дроблением. Для улавливания случайного магнитного металла предоставляется железный магнит с примесями, а приемное решето удаляет чрезмерно большой и чужеродный материал перед множеством систем устройство для нарезания-устройство для дробления, которые уменьшают размер сырья биомассы до надлежащего размера для предварительной обработки. Системы устройство для нарезания-устройство для дробления включают устройства для нарезания и резательные устройства с вращающимся ножом. Устройства для нарезания уменьшают размер исходного сырья биомассы и подают полученный материал в резательные устройства с вращающимся ножом. Резательные устройства с вращающимся ножом одновременно дробят сырье биомассы и просеивают полученный материал.
Для ограничения общего времени простоя вследствие требуемого обслуживания и/или перерывов в работе подсистемы для подготовки исходного материала предоставляются три силоса для хранения. Каждый силос может содержать приблизительно 55000 кубических футов (1560 м3) сырья биомассы (~3 часа работы установки).
Предварительная обработка
Конвейерная лента перемещает сырье биомассы от подсистемы для подготовки исходного материала 110 в подсистему для предварительной обработки 114. Как показано на ФИГ. 40, в подсистеме для предварительной обработки 114 сырье биомассы облучается с использованием излучателей электронного пучка, смешивается с водой с образованием суспензии и подвергается воздействию ультразвуковой энергии. Как рассмотрено выше, облучение сырья биомассы изменяет молекулярную структуру (например, снижает среднюю молекулярную массу и кристалличность) сырья биомассы. Перемешивание облученного сырья биомассы в суспензию и применение ультразвуковой энергии к суспензии дополнительно изменяет молекулярную структуру сырья биомассы. Применение радиационного облучения и обработки ультразвуком последовательно может оказывать синергическое действие в том, что комбинация способов, по-видимому, обеспечивает более значительные изменения молекулярной структуры (например, снижает среднюю молекулярную массу и кристалличность) по сравнению с изменениями, которые может эффективно обеспечить любой из способов самостоятельно. Без связи с теорией, в дополнение к снижению полимеризации сырья биомассы путем разрушения внутримолекулярных связей между сегментами целлюлозных и лигноцеллюлозных компонентов сырья биомассы, облучение может делать общую физическую структуру сырья биомассы более хрупкой. После перемешивания хрупкого сырья биомассы в суспензию применение ультразвуковой энергии дополнительно изменяет молекулярную структуру (например, снижает среднюю молекулярную массу и кристалличность), а также может уменьшать размер частиц сырья биомассы.
Облучение электронным пучком
Конвейерная лента 491, несущая сырье биомассы в подсистему для предварительной обработки, распределяет сырье биомассы на множество потоков исходного материала (например, 50 потоков исходного материала), каждый из которых ведет к отдельным излучателям электронного пучка 492. В этом варианте осуществления сырье биомассы облучается в сухом состоянии. Каждый поток исходного материала переносится на отдельной конвейерной ленте к связанному с ней излучателю электронного пучка. Каждая конвейерная лента для облучения сырья может иметь ширину приблизительно один метр. Перед тем как достичь излучателя электронного пучка, в каждой конвейерной ленте индуцируется локализованная вибрация для равномерного распределения сухого сырья биомассы по поперечной ширине конвейерной ленты.
Излучатель электронного пучка 492 (например, устройства для облучения электронным пучком, коммерчески доступные от Titan Corporation, San Diego, CA), сконфигурирован для применения дозы электронов 100 килогрэй, применяемой при мощности 300 кВт. Излучатели электронного пучка представляют собой устройства со сканирующим лучом с шириной сектора 1 метр, соответствующей ширине конвейерной ленты. В некоторых вариантах осуществления используют излучатели электронного пучка с большой фиксированной шириной пучка. Факторы, включающие ширину ленты/пучка, желаемую дозу, плотность сырья биомассы и применяемую мощность, регулируют количество излучателей электронного пучка, требуемых для установки по переработке 2000 тонн сухого исходного материала в сутки.
Обработка ультразвуком
Перед применением ультразвуковой энергии облученное сырье биомассы смешивают с водой с образованием суспензии. Может быть отдельная система обработки ультразвуком, связанная с каждым потоком подачи электронного пучка, или несколько потоков электронного пучка могут быть соединены в качестве подачи для одной системы обработки ультразвуком.
В каждой системе для обработки ультразвуком облученное сырье биомассы подается в емкость 1214 через первое впускное отверстие 1232, а вода подается в емкость 1214 через второе впускное отверстие 1234. Соответствующие клапаны (ручные или автоматические) регулируют поток сырья биомассы и поток воды для получения желаемого соотношения сырья биомассы и воды (например, 10% целлюлозного материала, масса по объему). Каждая емкость 1214 включает смеситель 1240 для перемешивания содержимого объема 1236 и диспергирования сырья биомассы в воде.
В каждой системе для обработки ультразвуком суспензия перекачивается (например, с использованием насоса с вихревым рабочим колесом 1218) из емкости 1214 в и через проточную ячейку 1224, включающую ультразвуковой преобразователь 1226. В некоторых вариантах осуществления насос 1218 адаптирован для встряхивания суспензии 1216, так чтобы смесь сырья биомассы и воды была по существу однородной во входном канале 1220 проточной ячейки 1224. Например, насос 1218 может встряхивать суспензию 1216, создавая турбулентный поток, который сохраняется на протяжении трубопровода между первым насосом и входным каналом 1220 проточной ячейки 1224.
В проточной ячейке 1224 ультразвуковой преобразователь 1226 передает ультразвуковую энергию на суспензию 1216, по мере того как суспензия протекает через проточную ячейку 1224. Ультразвуковой преобразователь 1226 преобразует электрическую энергию в высокочастотную механическую энергию (например, ультразвуковую энергию), которая затем доставляется в суспензию через бустер 48. Коммерчески доступными являются ультразвуковые преобразователи (например, от Hielscher USA, Inc. of Ringwood, New Jersey), которые способны доставлять постоянную мощность 16 киловатт.
Ультразвуковая энергия, проходящая через бустер 1248 в реакторном объеме 1244, создает серию сжатий и разрежений в технологическом потоке 1216 с интенсивностью, достаточной для обеспечения кавитации в технологическом потоке 1216. Кавитация осуществляет дезагрегацию компонентов сырья биомассы, включая, например, целлюлозный и лигноцеллюлозный материал, диспергированный в технологическом потоке 1216 (например, суспензии). Кавитация также приводит к образованию свободных радикалов в воде технологического потока 1216 (например, суспензии). Эти свободные радикалы действуют, дополнительно разрушая целлюлозный материал в технологическом потоке 1216. Как правило, к технологическому потоку 1216, содержащему фрагменты тополиных опилок, применяют ультразвуковую энергию приблизительно 250 МДж/м3. К другому сырью биомассы можно применять другие уровни ультразвуковой энергии (от приблизительно 5 до приблизительно 4000 МДж/м3, например, 10, 25, 50, 100, 250, 500, 750, 1000, 2000 или 3000). После воздействия ультразвуковой энергии в реакторном объеме 1244 технологический поток 1216 выходит из проточной ячейки 24 через выходной канал 1222.
Проточная ячейка 1224 также включает теплообменник 1246 в тепловом контакте по меньшей мере с частью реакторного объема 1244. Охлаждающая текучая среда 1248 (например, вода) поступает в теплообменник 1246 и поглощает тепло, генерированное, когда технологический поток 1216 (например, суспензия) облучается в реакторном объеме 1244. В некоторых вариантах осуществления поток охлаждающей текучей среды 1248 в теплообменник 1246 регулируется для поддержания приблизительно постоянной температуры в реакторном объеме 1244. Дополнительно или альтернативно, температура охлаждающей текучей среды 1248, поступающей в теплообменник 1246, регулируется для поддержания приблизительно постоянной температуры в реакторном объеме 1244.
Выпускной канал 1242 проточной ячейки 1224 расположен вблизи дна емкости 1214 для индукции подачи под действием силы тяжести технологического потока 1216 (например, суспензии) из емкости 1214 в направлении входного канала второго насоса 1230, который перекачивает технологический поток 1216 (например, суспензию) в направлении подсистемы основной переработки.
Системы для обработки ультразвуком могут включать один путь течения (как описано выше) или несколько параллельных путей течения, каждый из которых ассоциирован с индивидуальным элементом для обработки ультразвуком. Множественные элементы для обработки ультразвуком также могут быть расположены последовательно для увеличения количества энергии облучения, применяемой к суспензии.
Основная переработка
Перед ферментацией вакуумный фильтр с вращающимся барабаном удаляет из суспензии твердые частицы. Жидкость из фильтра выкачивается в охлажденном состоянии перед поступлением в ферментеры. Отфильтрованные твердые частицы проходят через подсистему последующей переработки для дополнительной переработки.
Емкости для ферментации представляют собой большие емкости из нержавеющей стали под низким давлением, с коническим дном и медленными мешалками. Несколько емкостей для первой стадии ферментации могут быть расположены последовательно. Температура в емкостях для первой стадии ферментации регулируется до 30 градусов Цельсия с использованием внешних теплообменников. Дрожжи добавляют в емкость для первой стадии ферментации в начале каждой серии емкостей, и они проходят через другие последовательно расположенные емкости.
Вторая стадия ферментации состоит из двух последовательных непрерывных ферментеров. Оба ферментера постоянно перемешиваются медленными механическими мешалками. Температура регулируется охлажденной водой во внешних теплообменниках при постоянной рециркуляции. Рециркуляционные насосы представляют собой насосы винтового типа, поскольку концентрация твердых частиц является высокой.
Отходящие газы из емкостей для ферментации и ферментеров перед выходом в атмосферу объединяются и промываются в колонке со встречным потоком воды. Отходящие газы промывают для извлечения этанола, а не для контроля выброса в атмосферу.
Последующая переработка
Дистилляция
Дистилляцию и адсорбцию на молекулярные сита используют для извлечения этанола из сырой ферментационной бражки и получения 99,5% этанола. Дистилляцию проводят в двух колоннах - первая, называемая бражной колонной, удаляет растворенный CO2 и наибольшую часть воды, а вторая концентрирует этанол практически до азеотропной смеси.
Вся вода из практически азеотропной смеси удаляется адсорбцией на парофазные молекулярные сита. Регенерация адсорбционных колонн требует, чтобы смесь этанол-вода возвращалась в процесс дистилляции для извлечения.
Отходящие при ферментации газы (содержащие, главным образом CO2, но также некоторое количество этанола), а также отходящий из бражной колонны газ очищаются в водяном скруббере, извлекающем практически весь этанол. Выходящий из скруббера газ подается в первую колонну для дистилляции вместе с ферментационной бражкой.
Осадок после первой дистилляции содержит все неконвертированные нерастворимые и растворенные твердые вещества. Нерастворимые твердые вещества обезвоживаются фильтром, работающим под давлением, и отправляются в камеру сгорания. Жидкость из фильтра, работающего под давлением, которая не используется повторно, концентрируется в многокорпусном испарителе с использованием сбросного тепла от дистилляции. Концентрированный сироп из испарителя смешивается с твердыми веществами, отправляемыми в камеру сгорания, и конденсат испарителя используется в качестве относительно чистой оборотной воды для переработки.
Поскольку количество воды для дистилляции, которая может быть использована повторно, ограничено, в процесс включен испаритель. Общее количество воды из фильтра, работающего под давлением, которая непосредственно возвращается в процесс, установлено на 25%. В этом потоке оказываются органические соли, такие как ацетат или лактат аммония, накопленные компоненты жидкости, не утилизируемые организмом, или неорганические соединения в биомассе. Повторное использование слишком большого количества этого материала может приводить к уровням ионной силы и осмотического давления, которые могут быть вредными для эффективности ферментирующего организма. Для воды, которая не используется повторно, испаритель концентрирует растворенные твердые вещества в сироп, который может быть отправлен в камеру сгорания, минимизируя нагрузку при обработке отработанной воды.
Обработка отработанной воды
Отделение обработки отработанной воды обрабатывает технологическую воду для повторного применения в целях снижения потребностей установки в добавочной воде. Отработанную воду сначала процеживают для удаления крупных частиц, которые собираются в мусорный контейнер и отправляются на мусорную свалку. После процеживания проводят анаэробное расщепление и аэробное расщепление для расщепления органического материала в потоке. Анаэробное расщепление приводит к потоку биогаза, богатому метаном, который подается в камеру сгорания. Аэробное расщепление приводит к относительно чистому потоку воды для повторного применения в процессе, а также к отстою, который, главным образом, состоит из клеточной массы. Отстой также сгорает в камере сгорания. Эта схема процеживания/анаэробного расщепления/аэробного расщепления является стандартной в современной промышленности по производству этанола, и оборудование производительностью 1-5 миллионов галлонов в сутки может быть получено от поставщиков в виде «готовых к немедленному использованию» единиц.
Камера сгорания, паровой котел и турбогенератор
Назначением подсистемы камеры сгорания, котла и турбогенератора является сжигание различных потоков побочных продуктов для генерирования пара и электричества. Например, некоторая часть лигнина, целлюлозы и гемицеллюлозы остается неконвертированной в ходе предварительной обработки и основных процессов. Большая часть отработанной воды из процесса концентрируется в сироп с высоким содержанием растворимых твердых веществ. Анаэробное расщепление оставшейся отработанной воды приводит к образованию биогаза с высоким содержанием метана. Аэробное расщепление приводит к небольшому количеству сбросной биомассы (отстоя). Сжигание этих потоков побочных продуктов для генерирования пара и электричества позволяет установке быть автономной с точки зрения энергии, снижает стоимость утилизации твердых отходов и создает дополнительную прибыль посредством продаж избыточного электричества.
Три потока первичного топлива (твердые вещества после дистилляции, биогаз и сироп испарителя) подаются в камеру сгорания с циркулирующим псевдоожиженным слоем. Небольшое количество сбросной биомассы (отстоя) после обработки отработанной воды также отправляется в камеру сгорания. Вентилятор подает воздух в камеру сгорания. Обработанная вода попадает в контур теплообменника в камере сгорания и выпаривается и подвергается избыточному нагреванию до пара при 510°C (950°F) и 86 атм. (1265 фунт/кв. дюйм абс. (8,7 МПа)). Печные газы из камеры сгорания предварительно нагревают входящий в камеру сгорания воздух, а затем проникают в тканевый фильтр для удаления частиц, которые отправляют на мусорную свалку. Газ выходит через дымовую трубу.
Для генерирования электричества используют многоступенчатую турбину. Из турбины выходит пар в трех различных состояниях для инжекции в реактор для предварительной обработки и теплообмена при дистилляции и выпаривании. Остальной пар конденсируется охлаждающей водой и возвращается в систему воды питания котла вместе с конденсатом из различных теплообменников в процессе. В качестве добавочной воды для замены потока, используемого в прямой инжекции, используют воду из скважины.
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Описан ряд вариантов осуществления изобретения. Тем не менее, понятно, что можно проводить различные модификации без отклонения от сущности и объема изобретения.
В некоторых вариантах осуществления относительно низкие дозы радиационного излучения, необязательно, в комбинации со звуковой энергией, например, с ультразвуковой энергией, применяют для поперечного сшивания, прививки или иного увеличения молекулярной массы природного или синтетического углеводсодержащего материала, такого как любой из материалов в любой форме (например, волокнистой форме), описанных в настоящем документе, например, раздробленных или нераздробленных целлюлозных или лигноцеллюлозных материалов, таких как целлюлоза. Поперечное сшивание, прививку или иное увеличение молекулярной массы природного или синтетического углеводсодержащего материала можно проводить контролируемым или предопределенным образом путем выбора типа или типов используемого радиационного излучения (например, e-пучок и ультрафиолетовое излучение или e-пучок и гамма-излучение) и/или дозы или количества доз применяемого радиационного излучения. Такой материал, имеющий увеличенную молекулярную массу, может быть пригодным при изготовлении композита, такого как композит волокно-смола, имеющий улучшенные механические свойства, такие как износостойкость, сопротивление сжатию, прочность на излом, ударная прочность, прочность при изгибе, модуль упругости при растяжении, модуль упругости при изгибе и удлинение при разрыве. Поперечное сшивание, прививка или иное увеличение молекулярной массы выбранного материала может повысить термическую стабильность материала относительно необработанного материала. Повышение термической стабильности выбранного материала может обеспечить возможность обработки при более высоких температурах без деградации. Кроме того, обработка материалов радиационным излучением может стерилизовать материалы, что может снизить их тенденцию к гниению, например, в составе композита. Поперечное сшивание, прививку или иное увеличение молекулярной массы природного или синтетического углеводсодержащего материала можно проводить контролируемым и предопределенным образом для конкретного применения с целью обеспечения оптимальных свойств, таких как прочность, путем выбора типа или типов используемого радиационного излучения и/или дозы или доз применяемого радиационного излучения.
Когда используют комбинацию радиационного излучения, например, радиационного излучения в низкой дозе, и звуковой энергии, например, звуковой или ультразвуковой энергии, можно повысить выход материала и/или минимизировать потребление энергии.
Смола может представлять собой любую термопластичную пластмассу, термореактивную пластмассу, эластомер, адгезив или смеси этих смол. Подходящие смолы включают любую смолу или смесь смол, описанных в настоящем документе.
В дополнение к смоле отдельно, материал, имеющий повышенную молекулярную массу, можно комбинировать, смешивать с другими материалами или добавлять к другим материалам, таким как металлы, сплавы металлов, керамика (например, цемент), лигнин, органические или неорганические добавки, эластомеры, битумы, стекло или смеси любых из этих материалов и/или смол. При добавлении к цементу можно получать армированные волокном цементы, имеющие улучшенные механические свойства, такие как свойства, описанные в настоящем документе, например, сопротивление сжатию и/или прочность на излом.
Поперечное сшивание, прививка или иное повышение молекулярной массы природного или синтетического углеводсодержащего материала с использованием радиационного излучения может обеспечить полезные материалы во многих формах и для многих областей применения. Например, углеводсодержащий материал может быть в форме бумажного продукта, такого как бумага, бумажная масса или бумажные отходы, прессованная древесина, ламинаты из проклеенных пиломатериалов, например, шпон или фанера, пиломатериалы, например, пиломатериалы из сосны, тополя, дуба или даже пробкового дерева. Обработка бумаги, прессованной древесины, ламинатов или пиломатериалов может повысить их механические свойства, такие как их прочность. Например, обработка пиломатериалов из сосны радиационным излучением может придать высокую прочность структурному материалу.
Если бумагу изготавливают с использованием радиационного излучения, то радиационного излучение может быть использовано в любой момент ее производства. Например, можно облучать бумажную массу, можно облучать предварительную форму из прессованных волокон или можно облучать саму готовую бумагу. В некоторых вариантах осуществления радиационное излучение применяют более чем в один на протяжении процесса производства.
Например, волокнистый материал, который включает первый целлюлозный и/или лигноцеллюлозный материал, имеющий первую молекулярную массу, можно облучать так, чтобы получить второй целлюлозный и/или лигноцеллюлозный материал, имеющий вторую молекулярную массу, превышающую первую молекулярную массу. Например, если в качества источника излучения используют гамма-излучение, то можно использовать дозу от приблизительно 0,2 Мрад до приблизительно 10 Мрад, например, от приблизительно 0,5 Мрад до приблизительно 7,5 Мрад или от приблизительно 2,0 Мрад до приблизительно 5,0 Мрад. Если используют облучение e-пучком, то можно использовать меньшую дозу (относительно гамма-излучения), такую как доза от приблизительно 0,1 Мрад до приблизительно 5 Мрад, например, от приблизительно 0,2 Мрад до приблизительно 3 Мрад или от приблизительно 0,25 Мрад до приблизительно 2,5 Мрад. После относительно низкой дозы радиационного излучения второй целлюлозный и/или лигноцеллюлозный материал можно комбинировать с таким материалом, как смола, и придавать ему форму композита, например, формованием прессованием, инжекционным формованием или экструзией. Формирование композитов смола-волокно описано в WO 2006/102543. После формирования композитов их можно облучать для дополнительного увеличения молекулярной массы углеводсодержащего материала, находящегося в композите.
Альтернативно, волокнистый материал, который включает первый целлюлозный и/или лигноцеллюлозный материал, имеющий первую молекулярную массу, можно комбинировать с материалом, таким как смола, для получения композита, а затем композит можно облучать относительно низкой дозой радиационного излучения, чтобы получить второй целлюлозный и/или лигноцеллюлозный материал, имеющий вторую молекулярную массу, превышающую первую молекулярную массу. Например, если в качестве источника радиационного излучения используют гамма-излучение, то можно применять дозу от приблизительно 1 Мрад до приблизительно 10 Мрад. Использование этого подхода увеличивает молекулярную массу материала, когда он находится вместе с матрицей, такой как матрица из смолы. В некоторых вариантах осуществления смола представляет собой способную к поперечному сшиванию смолу, и, по существу, она подвергается поперечному сшиванию по мере увеличения молекулярной массы углеводсодержащего материала, что может создавать синергический эффект для обеспечения максимальных механических свойств композита. Например, такие композиты могут иметь превосходные характеристики при низкой температуре, например, уменьшенную тенденцию к разрушению и/или растрескиванию при низких температурах, например, при температурах ниже 0°C, например, ниже -10°C, -20°C, -40°C, -50°C, -60°C или даже ниже -100°C, и/или превосходные характеристики при высоких температурах, например, способность поддерживать их полезные механические свойства при относительно высоких температурах, например, при температурах выше 100°C, например, выше 125°C, 150°C, 200°C, 250°C, 300°C, 400°C или даже выше 500°C. Кроме того, такие композиты могут иметь превосходную химическую устойчивость, например, устойчивость к набуханию в растворителе, например, в углеводородном растворителе, устойчивость к химическому воздействию, например, сильных кислот, сильных оснований, сильных окислителей (например, хлора или отбеливателя) или восстановителей (например, активных металлов, таких как натрий и калий).
В некоторых вариантах осуществления смола или другой материал матрицы не подвергается поперечному сшиванию в процессе облучения. В некоторых вариантах осуществления применяют дополнительное радиационное излучение, когда углеводсодержащий материал находится в матрице для дополнительного увеличения молекулярной массы углеводсодержащего материала. В некоторых вариантах осуществления радиационное излучение приводит к образованию связей между матрицей и углеводсодержащим материалом.
В некоторых вариантах осуществления углеводсодержащий материал имеет форму волокон. В таких вариантах осуществления, когда волокна используют в композите, волокна могут быть случайным образом ориентированы в матрице. В других вариантах осуществления волокна могут быть по существу ориентированными, например, в одном, двух, трех или четырех направлениях. Если желательно, волокна могут быть непрерывными или дискретными.
К волокнистым материалам, уплотненным волокнистым материалам или к любым другим материалам и композитам, описанным в настоящем документе, можно добавлять одну из представленных ниже добавок. Добавки, например, в форме твердого вещества, жидкости или газа, можно добавлять, например, к комбинации волокнистого материала и смолы. Добавки включают наполнители, такие как карбонат кальция, графит, волластонит, слюду, стекло, стекловолокно, диоксид кремния и тальк; неорганические ингибиторы горения, такие как тригидрат оксида алюминия или гидроксид магния; органические ингибиторы горения, такие как хлорированные и бромированные органические соединения; измельченные строительные отходы; измельченный шинный каучук; углеродное волокно; или металлическое волокно или порошки (например, алюминий, нержавеющая сталь). Эти добавки могут усилить, расширить или изменить электрические, механические свойства или свойства совместимости. Другие добавки включают лигнин, отдушки, связующие вещества, средства, улучшающие совместимость, например, малеинированный полипропилен, технологические добавки, смазывающие вещества, например, фторированный полиэтилен, пластификаторы, антиоксиданты, замутнители, термостабилизаторы, красящие вещества, пенообразующие вещества, добавки, модифицирующие ударную прочность, полимеры, например, деградируемые полимеры, фотостабилизаторы, биоциды, антистатические средства, например, стеараты или этоксилированные амины жирных кислот. Подходящие антистатические соединения включают проводящие углистые вещества, углеродные волокна, металлические наполнители, катионные соединения, например, четвертичные аммониевые соединения, например, хлорид N-(3-хлор-2-гидроксипропил)триметиламмония, алканоламиды и амины. Типичные представители деградируемых полимеров включают полигидроксикислоты, например, полилактиды, полигликолиды и сополимеры молочной кислоты и гликолевой кислоты, поли(гидроксимасляную кислоту), поли(гидроксивалериановую кислоту), сополимер лактида и e-капролактона, сополимер гликолида и e-капролактона, поликарбонаты, поли(аминокислоты), поли(гидроксиалканоат)ы, полиангидриды, сложные полиортоэфиры и смеси этих полимеров.
Когда включены описанные добавки, они могут присутствовать в количествах, вычисленных в расчете на сухую массу, составляющих от менее 1% вплоть до 80% в расчете на общую массу волокнистого материала. Более типично, количества находятся в диапазоне от приблизительно 0,5 масс.% до приблизительно 50 масс.%, например, 5%, 10%, 20%, 30% или более, например, 40%.
Любые добавки, описанные в настоящем документе, могут быть инкапсулированными, например, высушенными распылительной сушкой, или микроинкапсулированными, например, для защиты добавок от нагревания или влажности в процессе хранения.
Волокнистые материалы, уплотненные волокнистые материалы, смолы или добавки могут быть окрашены. Например, волокнистый материал может быть окрашен перед комбинированием со смолой и смешиванием с образованием композитов. В некоторых вариантах осуществления это окрашивание может быть полезно при маскировании или скрывании волокнистого материала, особенно крупных агломератов волокнистого материала, в подвергнутых формованию или экструзии частях, когда это желательно. Такие крупные агломераты, когда они присутствуют в относительно высоких концентрациях, могут выглядеть как крупинки на поверхностях подвергнутых формованию или экструзии частей.
Например, желаемый волокнистый материал можно окрашивать с использованием кислотного красителя, прямого красителя или реактивного красителя. Такие красители доступны от Spectra Dyes, Kearny, NJ или Keystone Aniline Corporation, Chicago, IL. Конкретные примеры красителей включают SPECTRA™ LIGHT YELLOW 2G, SPECTRACID™ YELLOW 4GL CONC 200, SPECTRANYL™ RHODAMINE 8, SPECTRANYL™ NEUTRAL RED B, SPECTRAMINE™ BENZOPERPURINE, SPECTRADIAZO™ BLACK OB, SPECTRAMINE™ TURQUOISE G и SPECTRAMINE™ GREY LVL 200%, каждый из которых доступен от Spectra Dyes.
В некоторых вариантах осуществления с красителями смешивают концентраты красителей в смолах, содержащих пигменты. Когда такие смеси затем смешивают с желательным количеством волокнистого материала, волокнистый материал может окрашиваться in-situ в процессе смешивания. Концентраты красителей доступны от Clariant.
Может быть полезным добавление в волокнистый материал, уплотненный волокнистый материал или композиты ароматизатора или отдушки. Например, для композитов может быть предпочтительно иметь запах и/или быть подобными природному дереву, например, кедру. Например, отдушки, например, с ароматом природной древесины, можно вводить в смолу, используемую для изготовления композита. В некоторых вариантах осуществления отдушку вводят непосредственно в смолу в виде масла. Например, масло можно вводить в смолу с использованием роликовой мельницы, например, смесителя Banbury® или экструдера, например, двухшнекового экструдера со встречным движением шнеков. Примером смесителя Banbury® является смеситель F-Series Banbury® производства Farrel. Примером двухшнекового экструдера является WP ZSK 50 MEGAcompunder™ производства Krupp Werner & Pfleiderer. После введения ароматизированную смолу можно добавлять к волокнистому материалу и экструдировать или формовать. Альтернативно, маточные смеси смол с ароматизаторами являются коммерчески доступными от International Flavors and Fragrances под торговым названием PolyIff™ или от RTP Company. В некоторых вариантах осуществления количество отдушки в композите составляет от приблизительно 0,005 масс.% до приблизительно 10 масс.%, например, от приблизительно 0,1% до приблизительно 5% или от 0,25% до приблизительно 2,5%.
Другие отдушки с ароматом природной древесины включают отдушки с ароматом хвойных деревьев или красного дерева. Другие отдушки включают отдушки с ароматом мяты перечной, вишни, земляники, персика, лайма, мяты курчавой, корицы, аниса, базилика, бергамота, черного перца, камфоры, ромашки, цитронеллы, эвкалипта, сосны, пихты, герани, имбиря, грейпфрута, жасмина, можжевеловой ягоды, лаванды, лимона, мандарина, майорана, мускуса, мирры, апельсина, пачули, розы, розмарина, шалфея, сандала, чайного дерева, тимьяна, грушанки, иланг-иланга, ванили, "новой машины" или смеси этих отдушек. В некоторых вариантах осуществления количество отдушки в комбинации волокнистый материал-отдушка составляет от приблизительно 0,005 масс.% до приблизительно 20 масс.%, например, от приблизительно 0,1% до приблизительно 5% или от 0,25% до приблизительно 2,5%.
Хотя был описан волокнистый материал, такой как целлюлозные и лигноцеллюлозные волокнистые материалы, для получения композитов можно использовать другие наполнители. Например, можно использовать неорганические наполнители, такие как карбонат кальция (например, осажденный карбонат кальция или природный карбонат кальция), арагонитовая глина, орторомбические глины, кальцитовая глина, ромбоэдрические глины, каолин, глина, бентонитовая глина, дикальцийфосфат, трикальцийфосфат, пирофосфат кальция, нерастворимый метафосфат натрия, осажденный карбонат кальция, ортофосфат магния, тримагнийфосфат, гидроксиапатиты, синтетические апатиты, оксид алюминия, ксерогель на основе диоксида кремния, алюмосиликатные комплексы металлов, алюмосиликаты натрия, силикат циркония, диоксид кремния или комбинации неорганических добавок. Наполнители могут иметь, например, размер частиц более 1 микрометра, например, более 2 микрометров, 5 микрометров, 10 микрометров, 25 микрометров или даже более 35 микрометров.
Также можно использовать наполнители в диапазоне нанометров отдельно или в сочетании с волокнистыми материалами любого размера и/или формы. Наполнители могут быть в форме, например, частиц, пластины или волокна. Например, можно использовать глины нанометрового размера, кремниевые и углеродные нанотрубки и кремниевые и углеродные нанопровода. Наполнитель может иметь поперечный размер менее 1000 нм, например, менее 900 нм, 800 нм, 750 нм, 600 нм, 500 нм, 350 нм, 300 нм, 250 нм, 200 нм, менее 100 нм или даже менее 50 нм.
В некоторых вариантах осуществления наноглина представляет собой монтмориллонит. Такие глины доступны от Nanocor, Inc. и Southern Clay Products, и они описаны в патентах США №№ 6849680 и 6737464. Глины можно подвергать поверхностной обработке перед примешиванием, например, в смолу или волокнистый материал. Например, глину можно подвергать поверхностной обработке, так чтобы ее поверхность имела ионные свойства, например, катионные или анионные.
Также можно использовать агрегированные или агломерированные наполнители нанометрового диапазона или наполнители нанометрового диапазона, которые собираются в надмолекулярные структуры, например, самоагрегированные надмолекулярные структуры. Агрегированные наполнители или наполнители с надмолекулярной структурой могут иметь открытую или закрытую структуру, и они могут иметь различные формы, например решетчатую, трубчатую или сферическую.
Таким образом, другие варианты осуществления входят в объем представленной ниже формулы изобретения.
Реферат
Изобретение относится к способу ферментации низкомолекулярного сахара. Предложен способ ферментации низкомолекулярного сахара, предусматривающий смешивание в водной среде низкомолекулярного сахара, одного или более ферментирующих микроорганизмов, лигноцеллюлозного материала, облученного ионизирующим облучением при дозе облучения, составляющей от 0,25 Мрад до 10 Мрад. Причем ферментирующие микроорганизмы связываются на лигноцеллюлозном материале, облученном ионизирующим облучением. Осуществляют ферментацию низкомолекулярного сахара с получением продукта ферментации. Причем микроорганизм является дрожжевым грибом или бактерией, а продукт ферментации выбирают из группы, состоящей из моно- и полифункциональных C1-C6 алкилспиртов, моно- и полифункциональных карбоновых кислот, C1-С6 углеводородов и их комбинаций. Изобретение обеспечивает эффективную ферментацию низкомолекулярного сахара. 14 з.п. ф-лы, 64 ил., 78 табл., 32 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ производства этанола из целлюлозосодержащих отходов (варианты) и способ получения глюкозы изцеллюлозосодержащих отходов

Комментарии