Пиридиновый комплекс циркония, каталитическая система, включающая указанный пиридиновый комплекс циркония, и способ (со)полимеризации сопряженных диенов - RU2690857C2
Код документа: RU2690857C2
Чертежи















Описание
Настоящее изобретение относится к пиридиновому комплексу циркония.
Более конкретно настоящее изобретение относится к пиридиновому комплексу циркония и к его применению в каталитической системе для (со)полимеризации сопряженных диенов.
Настоящее изобретение также относится к каталитической системе для (со)полимеризации сопряженных диенов, содержащей указанный пиридиновый комплекс циркония.
Также настоящее изобретение относится к способу (со)полимеризации сопряженных диенов, в частности, к способу полимеризации 1,3-бутадиена, отличающемся тем, что в нем используют указанную каталитическую систему.
Известно, что стереоспецифическая (со)полимеризация сопряженных диенов является очень важным способом в химической промышленности для получения продуктов, которые принадлежат к наиболее широко используемым каучукам.
Указанная стереоспецифическая (со)полимеризация может давать полимеры, имеющие различную структуру, а именно 1,4-транс структуру, 1,4-цис структуру, 1,2 структуру и, в случае ассиметричных сопряженных диенов (например, изопрена), 3,4 структуру. Стереорегулярные полимеры, имеющие 1,4-цис структуру и 1,4-транс структуру, также могут быть изотактическими или синдиотактическими, если вдоль полимерной цепи присутствуют ассиметричные атомы углерода, как, например, в случае полимеров, полученных по реакции полимеризации 1,3-пентадиена. Стереорегулярные полимеры, имеющие 1,2 структуру или 3,4 структуру также могут быть изотактическими или синдиотактическими и, в зависимости от структуры сопряженного диена, который полимеризуют, двойная связь в полимерной боковой цепи может иметь 1,4-транс структуру или 1,4-цис структуру.
Вышеупомянутые стереорегулярные полимеры можно получить только путем стереоспецифической полимеризации с использованием каталитических систем типа Циглера-Натты, обычно получаемых путем объединения соединений переходных металлов или соединений лантанидов, таких как, например, галогениды, алкоголяты, карбоксилаты, металлоорганические соединения, содержащие лиганды различных типов, с подходящими алкилирующими агентами, такими как алкильные производные алюминия (например, Al(R)3, где R может быть, например, метилом, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом) или алюмоксаны (например, метилалюмоксан (МАО)). Это обусловлено тем, что стереоспецифическая полимеризация, в отличие от других способов полимеризации (например, радикальной полимеризации, анионной полимеризации) отличается: (1) высокой региоселективностью, а именно она позволяет получить полимеры, образованные из однотипной структуры (а именно, 1,4 структуры, или 1,2 структуры, или 3,4 структуры), (2) высокой стереоселективностью, а именно она позволяет получить полимеры, имеющие высокий конфигурационный порядок, если в сопряженном диене присутствуют центры стерической изомерии (например, внутренняя двойная связь, ассиметричный атом углерода). Дополнительные подробности, касающиеся указанной стереоспецифической полимеризации, можно найти, например, в Porri L. et al., "Comprehensive Polymer Science" (1989), Eastmond G.C. et al. Eds., Pergamon Press, Oxford, UK, Vol. 4, Part II, pp. 53-108; Thiele S.К.H. et al., "Macromolecular Science. Part C: Polymer Reviews" (2003), C43, pp. 581-628; Osakada K. et al., "Advanced Polymer Science" (2004), Vol. 171, pp. 137-194; Ricci G. et al., "Advances in Organometallic Chemistry Research" (2007), Yamamoto K. Ed., Nova Science Publishers, Inc., USA, pp. 1-36; Ricci G. et al., "Coordination Chemistry Reviews" (2010), Vol. 254, pp. 661-676; Friebe L. et al., "Advanced Polymer Science" (2006), Vol. 204, pp. 1-154.
Также известно, что характерные свойства и применения вышеупомянутых стереорегулярных полимеров, в частности полибутадиена и полиизопрена, значительно изменяются в зависимости от микроструктуры указанных полимеров. Таким образом, они находятся в диапазоне от обычных эластичных полимеров, используемых для получения смесей для производства шин (то есть полибутадиена и полиизопрена, имеющих высокое 1,4-цис содержание), отличающихся чрезвычайно низкими температурами стеклования (Tg) (приблизительно -110°C для полибутадиена), до кристаллических полимеров (то есть 1,2 синдиотактического полибутадиена и 3,4 синдиотактического изопрена), в основном используемых для производства обувных подошв и отличающихся относительно высокой температурой плавления (Tm) (приблизительно 220°C для 1,2 синдиотактического полибутадиена).
Стереоспецифическая полимеризация сопряженных диенов с использованием каталитических систем на основе переходных металлов началась в 1954 сразу после первых результатов, полученных при полимеризации пропилена. Первые используемые каталитические системы получали путем объединения тетрахлорида титана (TiCl4) или трихлорида титана (TiCl3) с алкилалюминием, то есть каталитических систем, ранее используемых для полимеризации этилена или пропилена.
Первым синтезированным стереорегулярным диеновым полимером был полиизопрен, имеющий структуру, чрезвычайно похожую на структуру натурального каучука (а именно, 1,4-цис структуру), описанную Home S.Е. et al. in "Industrial & Engineering Chemistry" (1956), Vol. 48(4), pp. 784-791, за которым вскоре последовал полиизопрен, имеющий структуру, аналогичную структуре гуттаперчи (а именно, 1,4-транс структуру), описанную Natta G. et al. in "Chemical Abstract” (1959), Vol. 53, pp. 3756 и в итальянской патентной заявке IT 536631.
К началу 60-ых уже были синтезированы все стереоизомеры полибутадиена, а именно 1,4-цис, 1,4-транс, 1,2-синдиотактические и 1,2-изотактические стереоизомеры. Затем были предложены и изучены другие различные каталитические системы, полученные путем объединения соединений (например, галогенидов, алкоголятов, карбоксилатов) переходных металлов (например, титана (Ti), ванадия (V), хрома (Cr), железа (Fe), кобальта (Со), никеля (Ni)) или лантанидов (например, неодима (Nd), празеодима (Pr), гадолиния (Gd), лантана (La)) с подходящими алкилирующими агентами (например, триэтилалюминием (AlEt3), диэтилалюминийхлоридом (AlEt2Cl)). Также известно, что из различных полимеров, получаемых из стереоспецифической полимеризации 1,3-бутадиена (то есть 1,4-цис, 1,4-транс, 1,2-синдиотактической, 1,2-изотактической, 1,2-атактической, смешанной 1,4-цис/1,2 структуры, имеющей переменное содержание 1,2 звеньев), только 1,4-цис полибутадиен и 1,2 синдиотактический полибутадиен получают промышленно и извлекают из этого прибыль.
Полибутадиен, имеющий высокое 1,4-цис содержание в синтетическом эластомере, обычно имеет содержание 1,4-цис звеньев 96%-97%, температуру плавления (Tm) приблизительно -2°C, температуру кристаллизации (Тс) приблизительно -25°C и температуру стеклования (Tg) менее -100°C, при этом его свойства очень похожи на свойства натурального каучука и его основным использованием является получение эластомерных смесей, в частности эластомерных смесей для производства шин для легковых и/или грузовых автомобилей. В частности, при производстве шин используют полибутадиен, имеющий высокое содержание 1,4-цис звеньев. Обычно 1,4-цис полибутадиен получают с помощью способов полимеризации, в которых используют различные каталитические системы на основе титана (Ti), кобальта (Со), никеля (Ni), неодима (Nd).
1,2 синдиотактический полибутадиен является плохо растворимым кристаллическим полимером, имеющим температуру плавления от 200°C до 220°C, которая изменяется в зависимости от уровня синдиотактичности (другими словами, от процентной доли содержащихся в нем синдиотактических пентад), и его обычно используют для производства прозрачных пленок, шлангов, в особенности для производства подошв для обуви.
Таким образом, существует множество каталитических систем, используемых при полимеризации 1,3-бутадиена.
Например, в области полимеризации сопряженных диенов известны каталитические системы на основе ванадия (V) из-за их способности обеспечивать полимеры, имеющие 1,4-транс структуру, и они безусловно являются наиболее важными системами для получения 1,4-транс полибутадиена. Дополнительные подробности, касающиеся указанных каталитических систем, можно найти, например, в упомянутых выше Porri L. et al., "Comprehensive Polymer Science" (1989), Eastmond G.C. et al. Eds., Pergamon Press, Oxford, UK, Vol. 4, Part II, pp. 53-108.
Гетерогенные каталитические системы, полученные путем объединения галогенидов ванадия (например, трихлорида ванадия (VCl3), тетрахлорида ванадия (VCl4)) с алкильными соединениями алюминия (например, триэтилалюминием (AlEt3), диэтилалюминийхлоридом (AlEt2Cl)), обеспечивают высокомолекулярный кристаллический 1,4-транс полибутадиен (содержание 1,4-транс 97%-100%), имеющий температуру плавления (Tm) приблизительно 145°C. Дополнительные подробности, касающиеся указанных каталитических систем, можно найти, например, в Natta G. et al., "La Chimica e L’lndustria" (1959), Vol. 40, p. 362 и "Chemical Abstract’ (1959), Vol. 53, p. 195; Natta G. et al., "La Chimica e L’lndustria" (1959), Vol. 41, p. 116 и "Chemical Abstract” (1959), Vol. 53, p. 15619.
Полибутадиен, имеющий высокой содержание 1,4-транс звеньев, но обладающий более низкой молекулярной массой, можно получить, используя гомогенные каталитические системы, такие, например, как хлорид ванадия (III) (трис-тетрагидрофуран) / диэтилалюминийхлорид (VCl3(THF)3/AlEt2Cl), ацетилацетонат ванадия (III) / диэтилалюминийхлорид [V(acac)3/AlEt2Cl] и ацетилацетонат ванадия (III) /метилалюмоксан [V(асас)3/МАО]. Дополнительные подробности, касающиеся указанных каталитических систем можно найти, например, в Ricci G. et al., "Polymer Communication" (1991), Vol. 32, pp. 514-517; Ricci G. et al., "Journal of Polymer Science Part A: Polymer Chemistry" (2007), Vol. 45, pp. 4635-4646; Natta G. et al., "Atti Accademia Nazionale dei Lincei-Classe di Scienze fisiche, matematiche e naturali” (1961), Vol. 31(5), p. 189 и "Chemical Abstract’ (1962), Vol. 57, p. 4848; Porri L. et al., "Die Makromolekulare Chemie" (1963), Vol. 61(1), pp. 90-103.
Некоторые из вышеупомянутых гомогенных каталитических систем, например, ацетилацетонат ванадия (III)/триэтилалюминий [V(acac)3/AlEt3], представляют некоторый интерес для получения 1,2 полибутадиена, как описано, например, в Natta G. et al., "La Chimica e L’lndustria" (1959), Vol. 41, p. 526 и "Chemical Abstract’ (1960), Vol. 54, p. 1258.
Каталитические системы, полученные путем объединения циклопентадиенильных производных ванадия, такие, например, как бис(циклопентадиенил)ванадийхлорид (CP2VCl) и метилциклопентадиенилванадий дихлорид бис-триэтилфосфин [(C5H4Me)VCl2(PEt3)2], способны обеспечить полибутадиен, имеющий преимущественно 1,4-цис структуру (содержание 1,4-цис звеньев приблизительно 85%). Дополнительные подробности, касающиеся указанных каталитических систем можно найти, например, в Porri L. et al., "Metalorganic Catalyst for Synthesis and Polymerization" (1999), Kaminsky W. Ed., Springer-Verlag Berlin Heidelberg, pp. 519-530; Porri L. et al., "Metallocene-Based Polyolefins" (2000), Scheirs J. et al. Eds., John Wiley & Sons Ltd., pp. 115-141; Natta G. et al., "Atti Accademia Nazionale dei Lincei - Classe di Scienze fisiche, matematiche e naturali" (1961), Vol. 31(5), p. 189 and "Chemical Abstract’ (1962), Vol. 57, p. 4848; Porri L. et al., "Die Makromolekulare Chemie" (1963), Vol. 61(1), pp. 90-103.
Каталитические системы на основе хрома играют значительную роль в области полимеризации сопряженных диенов, находясь среди первых каталитических систем, способных к обеспечению полибутадиена, имеющего 1,2 структуру. Например, каталитические системы, полученные путем объединения растворимого соединения хрома, такого, например, как ацетилацетонат хрома (III) [Cr(асас)3] или хромпентакарбонилпиридин [Cr(СО)5пиридин], с алкильными соединениями алюминия (например, триэтилалюминием (AlEt3)), давали возможность получать 1,2 полибутадиен, имеющий изо- или синдиотактическую структуру, в зависимости от используемого молярного соотношения Al/Cr: синдиотактическую при низком соотношении Al/Cr, то есть при соотношении от 2 до 6, изотактическую при высоком соотношении Al/Cr, то есть при соотношении от 6 до 10, как описано, например, в in Natta G. et al., "La Chimica e L’lndustria" (1959), Vol. 41, p. 1163. Важно отметить, и это подтверждает их значение, что до сих пор изотактический 1,2 полибутадиен был получен только с использованием каталитических систем на основе хрома.
В более поздние годы были разработаны новые, более активные и стереоспецифические, каталитические системы путем объединения различных комплексов хрома (II) (Cr(II)) с бидентатными фосфиновыми лигандами и метилалюмоксаном (МАО), как описано, например, в Ricci G. et al., "Chromium: Environmental, Medical and Material Studies" (2011), Salden M. P. Ed., Nova Science Publishers Inc., USA, pp. 121-140; Ricci G. et al., "Macromolecules" (2001), Vol. 34, pp. 5766-5769; Ricci G. et al., "Polymer Bullettin" (2002), Vol. 48, pp. 25-31; Ricci G. et al., "Organometallics" (2004), Vol. 23(15), pp. 3727-3732; Ricci G. et al., "Journal of Molecular Catalysis A: Chemical" (2007), Vol. 267, pp. 102-107; Ricci G. et al., "Macromolecular Symposia" (2004), Vol. 260(1), pp. 172-178. Указанные каталитические системы делали возможным получение 1,2 полибутадиена, имеющего содержание 1,2 звеньев, составляющее вплоть до 95%, имеющего различающуюся регулярность молекулярной структуру, а именно изо- или синдиотактичную, в зависимости от типа фосфина, координированного с атомом хрома. В частности, преимущественно изотактические полимеры были получены с использованием менее стерически затрудненных фосфинов (например, бис(диметилфосфин)метан (dmpm), бис(фенилфосфин)метан (dppm)), в то время как использование более стерически затрудненных фосфинов (например, 1,2-бис(диметилфосфин)этана (dmpe), 1,2-бис(диэтилфосфин)этана (depe), бис(дифенилфосфин)амина (dppa), 1,2-бис(дифенилфосфин)этана (dppe)) давало возможность синтезировать высоко синдиотактический 1,2 полибутадиен.
Между тем, в отличие от других переходных металлов, таких как титан (Ti), ванадий (V), хром (Cr), кобальт (Со) и никель (Ni), каталитические системы на основе железа (Fe) были изучены относительно немного. Тем не менее, были получены чрезвычайно активные каталитические системы, даже если они не отличаются высокой стереоспецифичностью. Это справедливо, например, для каталитических систем на основе комплексов дихлорида железа или диэтилжелеза с ароматическими аминами (например, фенантролином, бипиридином) и алкильными соединениями алюминия (например, триизобутилалюминием (Al(iBu)3), триэтилалюминием (AlEt3), метилалюмоксаном (МАО)), которые обеспечивают в ходе полимеризации 1,3-бутадиена преимущественно 1,2 полибутадиен (примерно 70%, оставшиеся звенья представляют собой 1,4-цис тип) с полным превращением мономера (то есть 1,3-бутадиена) за очень короткий срок. Дополнительные подробности, касающиеся указанных каталитических систем, можно найти, например, в Bazzini С. et al., "Macromolecular Rapid Communications" (2002), Vol. 23(15), pp. 922-927; Ricci G. et al., "Journal of Molecular Catalysis A: Chemicaf (2003), Vol. 204-205, pp. 287-293; Bazzini C. et al., "Polymer" (2004), Vol. 45, pp. 2871-2875; Ricci G. et al., "Ferrocenes: Compounds, Properties and Applications" (2011), Phillips E.S. Ed., Nova Science Publishers Inc., USA, pp. 273-314.
Каталитические системы на основе кобальта вероятно являются наиболее универсальными каталитическими системами из различных каталитических систем на основе переходных металлов для полимеризации сопряженных диенов, так как с подходящими изменениями в их каталитическом составе они дают возможность получения, при этом показывая высокую активность и стереоспецифичность, всех возможных стереоизомеров 1,3-бутадиена: 1,4-цис полибутадиена, 1,2 полибутадиена, полибутадиена, имеющего смешанную 1,4-цис/1,2 структуру, 1,4-транс полибутадиена. Дополнительные подробности, касающиеся указанной стереоспецифической полимеризации, можно найти, например, в Porri L. et al., "Comprehensive Polymer Science" (1989), Eastmond G.C. et al. Eds., Pergamon Press, Oxford, UK, Vol. 4, Part II, pp. 53-108; Thiele S. К.H. et al., "Macromolecular Science. Part C: Polymer Reviews" (2003), C43, pp. 581-628; Osakada K. et al., "Advanced Polymer Science" (2004), Vol. 171, pp. 137-194; Ricci G. et al., "Advances in Organometallic Chemistry Research" (2007), Yamamoto K. Ed., Nova Science Publishers, Inc., USA, pp. 1-36; Ricci G. et al., "Coordination Chemistry Reviews" (2010), Vol. 254, pp. 661-676, упомянутых выше, и в Ricci G. et al., "Cobalt: Characteristics, Compounds, and Applications" (2011), Lucas J. Vidmar Ed., Nova Science Publishers, Inc., USA, pp. 39-81.
Каталитические системы ацетилацетонат кобальта (II) / диэтилалюминийхлорид/ вода [Co(acac)2/AlEt2Cl/H2O] и ацетилацетонат кобальта (III) /триэтилалюминий/вода/сероуглерод [Co(acac)3/AlEt3/H2O/CS2] все еще используют для промышленного производства 1,4-цис полибутадиена и синдиотактического 1,2 полибутадиена, соответственно.
В последние несколько лет были получены новые каталитические системы путем объединения комплексов дихлорида кобальта (CoCl2) с фосфиновыми лигандами, как описано, например, в Ricci G. et al., "Journal of Molecular Catalysis A: Chemicat’ (2005), Vol. 226, pp. 235-241; Ricci G. et al., "Macromolecules" (2005), Vol. 38, pp. 1064-1070; Ricci G. et al., "Journal of Organometallic Chemistry" (2005), Vol. 690, pp. 1845-1854; Takeuchi M. et al., "Polymer International" (1992), Vol. 29, pp. 209-212; Takeuchi M. et al., "Polymer International" (1995), Vol. 36, pp. 41-45; Takeuchi M. et al., "Macromolecular Chemistry and Physics" (1996), Vol. 197, pp. 729-743.
Особенность вышеупомянутых новых каталитических систем состоит в том, что они делают возможным получение полибутадиена, имеющего регулируемую микроструктуру (1,4-цис, 1,2, смешанную 1,4-цис/1,2 структуру) путем изменения типа лиганда, координированного с кобальтом. Например, полибутадиен, имеющий высокое содержание 1,4-цис звеньев, был получен в случае затрудненных алифатических фосфинов (например, три-трет-бутилфосфин (PtBu3), триизопропилфосфин (PiPr3)), при этом полибутадиен, имеющий смешанную 1,4-цис/1,2 структуру был получен с использованием алифатических фосфинов, обладающих более низкой стерической затрудненностью (например, триэтилфосфин (PEt3), три-н-пропилфосфин (PnPr3)), как описано, например, в Ricci G. et al., "Cobalt: Characteristics, Compounds, and Applications" (2011), Lucas J. Vidmar Ed., Nova Science Publishers, Inc., USA, pp. 39-81; Ricci G. et al, "Journal of Molecular Catalysis A: Chemical” (2005), Vol. 226, pp. 235-241, упомянутых выше.
Тем временем использование каталитических систем на основе комплексов с ароматическими фосфинами приводило к образованию преимущественно 1,2 полибутадиена, имеющего повышенный уровень синдиотактичности, по мере увеличения стерической затрудненности фосфина.
За эти годы для полимеризации 1,3-бутена были использованы различные каталитические системы на основе никеля, такие как нафтенат никеля (II) / диэтилалюминийхлорид / вода [Ni(нафтенат)2/AlEt2Cl/H2O], циклопентадиенилникеля (II) / метилалюмоксан [NiCp2/MAO], ацетилацетонат никеля (II) / метилалюмоксан [Ni(acac)2/MAO], как описано, например, в Porri L. et al., "Comprehensive Polymer Science" (1989), Eastmond G.C. et al. Eds., Pergamon Press, Oxford, UK, Vol. 4, Part II, pp. 53-108; Thiele S.К.H. et al., "Macromolecular Science. Part C: Polymer Reviews" (2003), C43, pp. 581-628; Osakada K. et al., "Advanced Polymer Science" (2004), Vol. 171, pp. 137-194, упомянутых выше, и в Oliva P. et al., "Die Makromolekulare Chemie, Rapid Communications" (1990), Vol. 11(11), pp. 519-524; Sato H. et al., "Bulletin of the Chemical Society of Japan" (1992), Vol. 65, No. 5, pp. 1299-1306; Longo P. et al., "Macromolecular Rapid Communications" (1998), Vol. 19(1), pp. 31-34.
Некоторые из вышеупомянутых каталитических систем на основе никеля имеют активность и стереоспецифичность, сравнимые с теми, которые имеют каталитические системы на основе кобальта, и представляют промышленный интерес. В частности, каталитическую систему триэтилалюминий/октаноат никеля (II)/комплекс трифторид бора - диэтиловый эфир [Al/Et3/Ni(октаноат)2/BF3⋅OEt2] в настоящее время используют для промышленного производства полибутадиена, имеющего высокое 1,4-цис содержание (то есть содержание 1,4-цис звеньев 96%-97%), как описано, например, в немецком патенте DE 2113527 и в Throckmorton М.С. et al., "Rubber Chemistry and Technology" (1972), Vol. 45, pp. 268-277; Saltman W. et al., "Rubber Chemistry and Technology" (1973), Vol. 46, pp. 1055-1067.
Каталитические системы на основе лантанидов также известны из-за их высокой специфичности в 1,4-цис полимеризации не только 1,3-бутадиена, но также многих других замещенных бутадиенов, как описано, например, в Porri L. et al., "Comprehensive Polymer Science" (1989), Eastmond G.C. et al. Eds., Pergamon Press, Oxford, UK, Vol. 4, Part II, pp. 53-108; Osakada K. et al., "Advanced Polymer Science" (2004), Vol. 171, pp. 137-194; Ricci G. et al., "Advances in Organometallic Chemistry Research" (2007), Yamamoto K. Ed., Nova Science Publishers, Inc., USA, pp. 1-36; Ricci G. et al., "Coordination Chemistry Reviews" (2010), Vol. 254, pp. 661-676; Friebe L. et al., "Advanced Polymer Science" (2006), Vol. 204, pp. 1-154, упомянутых выше.
Каталитические системы на основе неодима (Nd), гадолиния (Gd) и празеодима (Rr) были изучены китайскими исследователями в начале 60-х, как описано, например, в Hsieh L. et al., "Rubber Chemistry and Technology" (1972), Vol. 45, pp. 268, и немедленно было обнаружено, что они имеют некоторые преимущества по сравнению с другими каталитическими системами, используемыми для синтеза 1,4-цис полибутадиена. В частности, указанные каталитические системы обеспечивают полибутадиен, имеющий 1,4-цис структуру, которая является более линейной, чем структура, полученная с использованием каталитических систем на основе кобальта (Со), никеля (Ni) и титана (Ti), и поэтому более подходит для производства шин, что является несомненно наиболее важным практическим применением 1,4-цис полибутадиена.
Обычные каталитические системы, содержащие соединения на основе неодима, получают путем реакции соединения неодима, такого, например, как ацетилацетонат неодима (III) [Nd(acac)3], 2-этилгексоноат неодима (III) [Nd(ОСОС7Н15)3], с хлорным донором, таким, например, как диэтилалюминийхлорид (AlEt2Cl), этилалюминий сесквихлорид (Al2Et3Cl3), трет-бутилхлорид, и с алкильными соединениями алюминия, такими как триизобутилалюминий (AliBu3), гидрид диизобутилалюминия (AliBu2H). Указанную каталитическую систему в настоящее время используют для промышленного производства полибутадиена, имеющего очень высокое 1,4-цис содержание, то есть содержание 1,4-цис звеньев 98%. Дополнительные подробности, касающиеся указанной каталитической системы можно найти, например, в Friebe L. et al., "Advanced Polymer Science" (2006), Vol. 204, pp. 1-154, упомянутой выше; Cabassi F. et al., "Transition Metal Catalyzed Polymerizations" (1988), Quirk R.P. Ed., Cambridge University Press, MA, USA, p. 655; Ricci G. et al.,"Polymer Communication" (1987), Vol. 28, p. 223; Wilson D. J. et al., "Polymer Bulletin" (1992), Vol. 27, pp. 407-411; Porri L. et al., "Macromolecular Symposia" (1998), Vol. 128(1), pp. 53-61; Porri L. et al., "ACS Symposium Sereies" (2000), Vol. 749, pp. 15-30.
Каталитическая система хлорид титана (IV) / триалкилалюминий (TiCl4/Al(R)3, в которой R может представлять собой, например, метил, этил, изобутил, циклогексил) была первым катализатором, использованным для полимеризации 1,3-бутадиена, как описано, например, в Porri L. et al., "Comprehensive Polymer Science" (1989), Eastmond G.C. et al. Eds., Pergamon Press, Oxford, UK, Vol. 4, Part II, pp. 53-108; Home S.E. et al., "Industrial Engineering Chemistry" (1956), Vol. 48, pp. 784-791, упомянутых выше. В зависимости от молярного соотношения Al/Ti можно получить полибутадиены, имеющие преимущественно 1,4-цис структуру (то есть содержание 1,4-цис звеньев 65%-70%), или полибутадиены, имеющие смешанную 1,4-цис/1,4-транс структуру. Полибутадиены, имеющие более высокое содержание 1,4-цис звеньев, приблизительно 92%-95%, были получены путем объединения различных типов алкильных соединений, таких, например, как соединения формулы Al(R)3, в которой R может быть, например, метилом, этилом, изобутилом, циклогексилом, предпочтительно триизобутилалюминием [Al(iBu)3], с каталитическими системами на основе титана, содержащими йод (например, иодид титана (IV) (Til4), дихлорид дииодида титана (TiCl2I2), трихлорид иодида титана (TiCl3I)), как описано, например, в Porri L. et al., "Comprehensive Polymer Science" (1989), Eastmond G.C. et al. Eds., Pergamon Press, Oxford, UK, Vol. 4, Part II, pp. 53-108, упомянутых выше; Cooper W. et al., "The Stereo Rubbers" (1997), W.M. Saltman Ed., Wiley, New York, p. 21; Marconi W. et al., "La Chimica e l’lndustria" (1963), Vol. 45, pp. 522-528; Marconi W. et al., "Journal of Polymer Science Part A: General Papers" (1965), Vol. 3(2), pp. 735-752.
Каталитические системы на основе титана были первыми, которые использовали для синтеза полибутадиена, имеющего высокое содержание 1,4-цис звеньев, и они действовали как основа для разработки промышленно используемых способов для указанного синтеза, как в Европе, так и в Соединенных Штатах. В настоящее время доступны более активные и стереоспецифические каталитические системы на основе других металлов, таких, например, как кобальт (Со), никель (Ni) и неодим (Nd).
Однако каталитические системы на основе титана также способны, с подходящими изменениями каталитического состава, к получению полибутадиена, имеющего 1,2 структуру и 1,4-транс структуру. Например, каталитическая система трихлорид α-титана/триэтилалюминий (α-TiCl3/AlEt3) была первым катализатором, использованным для получения 1,4-транс полибутадиена, как описано, например, в Porri L. et al., "Comprehensive Polymer Science" (1989), Eastmond G.C. et al. Eds., Pergamon Press, Oxford, UK, Vol. 4, Part II, pp. 53-108; Natta G. et al. in "Chemical Abstract” (1959), Vol. 53, pp. 3756 и в итальянской патентной заявке IT 536631, упомянутых выше.
В отличие от каталитических систем на основе титана, каталитические системы на основе циркония были изучены намного меньше, вероятно из-за того, что их считали малоэффективными для полимеризации сопряженных диенов. Однако совсем недавно был описан новый катализатор на основе пиридинового комплекса циркония, который может приводить к получению полибутадиена, имеющего высокое содержание 1,4-цис звеньев (то есть содержание 1,4-цис звеньев ≥99,9%), дополнительные подробности, касающиеся указанного катализатора, можно найти в Annunziata L. et al., "Macromolecules" (2011), Vol. 44, pp. 1934-1941.
Так как (со)полимеры сопряженных диенов, в частности полибутадиен, имеющий высокое содержание 1,4-транс звеньев, можно преимущественно использовать для производства шин, в частности для протекторов шин, имеющих хорошую износостойкость, а также в обувной промышленности (например, при производстве обувных подошв), изучение новых каталитических систем, способных обеспечивать указанные (со)полимеры, все еще представляет большой интерес.
Заявитель поставил себе задачу найти новый комплекс циркония, который можно использовать в каталитической системе, способной обеспечить (со)полимеры сопряженных диенов, такие, например, как линейный или разветвленный полибутадиен, имеющий высокое содержание 1,4-транс звеньев, то есть содержание 1,4-транс звеньев ≥94%.
Заявитель здесь обнаружил новый пиридиновый комплекс циркония, имеющего общую формулу (I), описанную ниже, который способен обеспечить (со)полимеры сопряженных диенов, такие, например, как линейный или разветвленный полибутадиен, имеющий высокое содержание 1,4-транс звеньев, то есть содержание 1,4-транс звеньев ≥94%.
Настоящее изобретение поэтому относится к пиридиновому комплексу циркония, имеющему общую формулу (I):
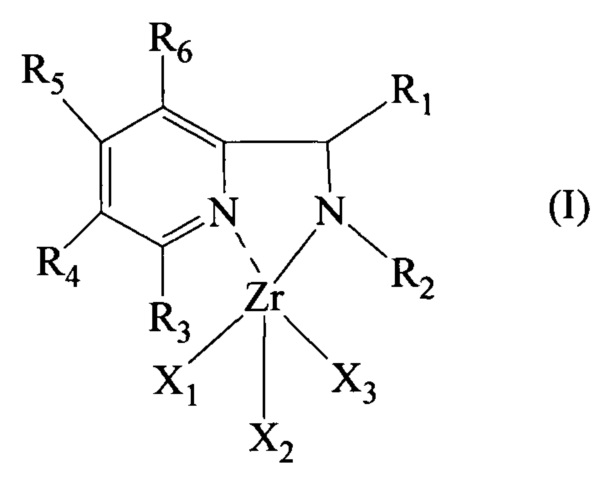
в которой:
- R1 и R2, одинаковые или различные, представляют собой атом водорода или выбраны из линейных или разветвленных, возможно галогенированных С1-С20, предпочтительно С1-С15, алкильных групп, возможно замещенных циклоалкильных групп, возможно замещенных арильных групп,
- R3, R4, R5 и R6, одинаковые или различные, представляют собой атом водорода или выбраны из линейных или разветвленных, возможно галогенированных С1-С20, предпочтительно С1-С15, алкильных групп, возможно замещенных циклоалькильных групп, возможно замещенных арильных групп, нитрогрупп, гидроксильных групп, аминогрупп,
- X1, Х2 и Х3, одинаковые или различные, представляют собой атом галогена, такой, например, как хлор, бром, йод, предпочтительно хлор, или выбраны из линейных или разветвленных С1-С20, предпочтительно C1-C15 алкильных групп, -OCOR7 групп или -OR7 групп, где R7 выбран из линейных или разветвленных С1-С20, предпочтительно С1-С15, алкильных групп, или один из X1, Х2 и Х3 представляет собой группу, имеющую общую формулу (II):

в которой R1, R2, R3, R4, R5 и R6, имеют такие же значения, как описаны выше.
Для целей настоящего описания и нижеследующей формулы изобретения определения численных интервалов всегда включают конечные значения, если не указано другое.
Для целей настоящего описания и нижеследующей формулы изобретения термин «включающий» также включает термины «по существу состоящий из» или «состоящий из».
Термин «С1-С20 алкильные группы» относится к линейным или разветвленным алкильным группам, содержащим от 1 до 20 атомов углерода. Конкретными примерами С1-С20 алкильных групп являются метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, пентил, гексил, гептил, октил, н-нонил, н-децил, 2-бутилоктил, 5-метилгексил, 4-этилгексил, 2-этилгептил, 2-этилгексил.
Термин «возможно галогенированные С1-С20 алкильные группы» относится к линейным или разветвленным, насыщенным или ненасыщенным алкильным группам, содержащим от 1 до 20 атомов углерода, в которых по меньшей мере один из атомов водорода замещен атомом галогена, таким, например, как фтор, хлор, бром, предпочтительно фтор, хлор. Конкретными примерами возможно галогенированных С1-С20 алкильных групп являются фторметил, дифторметил, трифторметил, трихлорметил, 2,2,2-трифторэтил, 2,2,2-трихлорэтил, 2,2,3,3-тетрафторпропил, 2,2,3,3,3-пентафторпропил, перфторпентил, перфтороктил, перфтордецил.
Термин «циклоалкильные группы» относится к циклоалкильным группам, содержащим от 3 до 30 атомов углерода. Указанные циклоалкильные группы могут быть возможно замещенными одной или более группами, одинаковыми или различными, выбранными из атомов галогена, гидроксильных групп, C1-С12 алкильных групп, С1-С12 алкоксильных групп, цианогрупп, аминогрупп, нитрогрупп. Конкретными примерами циклоалкильных являются циклопропил, 2,2-дифторциклопропил, циклобутил, циклопентил, циклогексил, гексаметилциклогексил, пентаметилциклопентил, 2-циклооктилэтил, метилциклогексил, метоксициклогексил, фторциклогексил, фенилциклогексил.
Термин «арильные группы» относится к ароматическим карбоциклическим группам. Указанные ароматические карбоциклические группы могут быть возможно замещенными одной или более группами, одинаковыми или различными, выбранными из атомов галогена, таких, например, как фтор, хлор, бром, гидроксильных групп, - С1-12 алкильных групп, C1-С12 алкоксильных групп, цианогрупп, аминогрупп, нитрогрупп. Конкретными примерами арильных групп являются фенил, метилфенил, триметилфенил, метоксифенил, гидроксифенил, фенилоксифенил, фторфенил, пентафторфенил, хлорфенил, бромфенил, нитрофенил, диметиламинофенил, нафтил, фенилнафтил, фенантрен, антрацен.
В предпочтительном воплощении настоящего изобретения в указанном пиридиновом комплексе циркония, имеющим общую формулу (I):
- R1 и R2, одинаковые или различные, представляют собой атом водорода или выбраны из С1-С20 алкильных групп, предпочтительно являются метилом, возможно замещенных арильных групп, предпочтительно являются фенилом или фенилом, замещенным одной или более метильными, изопропильными, трет-бутильными группами, предпочтительно R1 является атомом водорода или метилом и R2 является фенилом или фенилом, замещенным одной или более метильными, изопропильными, трет-бутильными группами,
- R3, R4, R5 и R6, идентичные друг другу, представляют собой атом водорода,
- X1, Х2 и Х3, одинаковые или различные, представляют собой атом галогена, такой, например, как хлор, бром, йод, предпочтительно хлор, или один из X1, Х2 и Х3 представляет собой группу, имеющую общую формулу (II):

в которой R1, R2, R3, R4, R5 и R6, имеют такие же значения, как описаны выше.
По настоящему изобретению пиридиновый комплекс циркония, имеющий общую формулу (I), нужно понимать, как находящийся в любой физической форме, такой, например, как выделенная и очищенная твердая форма, растворенная в подходящем растворителе форма или форма, нанесенная на подходящие органические или неорганические твердые вещества, предпочтительно имеющая гранулированную или порошковую физическую форму.
Пиридиновый комплекс циркония, имеющий общую формулу (I), получают из лигандов, имеющих общую формулу (III):

в которой R1, R2, R3, R4, R5 и R6, имеют такие же значения, как описаны выше.
Конкретными примерами лигандов, подходящих для целей настоящего изобретения, являются лиганды, имеющие следующие формулы (L1)-(L7):




Указанные лиганды, имеющие формулы (L1)-(L7), можно получить с помощью способов, известных в уровне техники. Например, указанные лиганды, имеющие формулы (L1)-(L7), можно получить с помощью способов, включающих: (1) реакции конденсации между подходящим анилином и 2-пиридинкарбоксиальдегидом или 2-ацетилпиридином с образованием соответствующего имина, как описано, например, в Wu J. et al., "Journal of American Chemistry Society" (2009), Vol. 131(36), pp. 12915-12917; Laine V.T. et al., "European Journal of Inorganic Chemistry (1999), Vol. 6, pp. 959-964; Bianchini C. et al., "New Journal of Chemistry" (2002), Vol. 26(4), pp. 387-397; Lai Yi-C. et al., "Tetrahedron" (2005), Vol. 61(40), pp. 9484-9489, (2) превращения синтезированного имина в соответствующий амин, как описано, например, в Nienkemper К. et al., "Journal of Organometallic Chemistry" (2008), Vol. 693(8-9), pp. 1572-1589; Lin Y. et al., "Dalton Transactions" (2012), Vol. 41(22), pp. 6661-6670.
Пиридиновый комплекс циркония, имеющий общую формулу (I), можно получить с помощью способов, известных в уровне техники. Например, указанный пиридиновый комплекс циркония можно получить путем реакции между соединениями циркония, имеющими общую формулу Zr(X)4, в которой X является атомом галогена, таким, например, как хлор, бром, йод, предпочтительно хлор, как таковым или образующим комплекс с эфирами (например, диэтилэфиром, тетрагидрофураном (ТГФ), диметоксиэтаном), с лигандами, имеющими формулы (L1)-(L7), как указано выше, причем указанные лиганды используют в стехиометрическом количестве, действуя предпочтительно в присутствии по меньшей мере одного растворителя, который можно выбрать, например, из хлорсодержащих растворителей (например, метиленхлорида), растворителей простых эфиров (например, тетрагидрофурана (ТГФ)), углеводородных растворителей (например, толуола) или их смесей при температуре от 25°C до 110°C, предпочтительно при температуре кипячения растворителя с обратным холодильником. В другом случае, если один из X1, Х2 и Х3 представляет собой группы, имеющие общую формулу (II):

в которой R1, R2, R3, R4, R5 и R6, имеют такие же значения, как описаны выше, указанные лиганды перед тем, как они прореагируют с вышеупомянутыми соединениями циркония, взаимодействуют с алкиллитием, таким, например, как н-бутиллитий (n-BuLi), с получением соли указанных лигандов, которая затем реагирует с вышеупомянутыми соединениями циркония, действуя как описано выше. Полученный таким образом пиридиновый комплекс циркония можно затем извлечь с помощью способов, известных в уровне техники, таких, например, как осаждение с использованием осадителя (например, пентана), после чего следует разделение путем фильтрования или декантации и, при необходимости, последующего растворения в подходящем растворителе, после чего следует низкотемпературная кристаллизация.
В рамках настоящего описания и следующей формулы изобретения выражение «комнатная температура» относится к температуре от 20°C до 25°C.
Как указано ранее, настоящее изобретение также относится к каталитической системе для (со)полимеризации сопряженных диенов, содержащей указанный пиридиновый комплекс циркония, имеющий общую формулу (I).
Настоящее изобретение поэтому также относится к каталитической системе для (со)полимеризации сопряженных диенов, содержащей:
(a) по меньшей мере один пиридиновый комплекс циркония, имеющий общую формулу (I),
(b) по меньшей мере один со-катализатор, выбранный из органических соединений элемента М’, отличного от углерода, причем указанный элемент М’ выбран из элементов, принадлежащих к группам 2, 12, 13 или 14 Периодической таблицы элементов, предпочтительно из бора, алюминия, цинка, магния, галлия, олова, еще более предпочтительно из алюминия, бора.
В целом, образование каталитической системы, содержащей пиридиновый комплекс циркония, имеющий общую формулу (I), и со-катализатор (b), предпочтительно выполняют в инертной жидкой среде, более предпочтительно в углеводородном растворителе. Выбор пиридинового комплекса циркония, имеющего общую формулу (I), и со-катализатора (b), а также конкретной используемой методики может изменяться в зависимости от молекулярных структур и от требуемого результата, как подобным образом сообщали в соответствующей литературе, доступной специалисту, для других комплексов переходных металлов с иминовыми лигандами, такой, например, как L.К. Johnson et al., in "Journal of the American Chemical Society" (1995), Vol. 117, pp. 6414-6415, and by G. van Koten et al., in "Advances in Organometallic Chemistry" (1982), Vol. 21, pp. 151-239.
В дополнительном предпочтительном воплощении настоящего изобретения указанный со-катализатор (b) можно выбрать из (b1) алкильных соединений алюминия, имеющих общую формулу (IV):
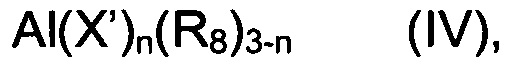
в которой X’ представляет собой атом галогена, такой, например, как хлор, бром, йод, фтор, R8 выбран из линейных или разветвленных С1-С20 алкильных групп, циклоалкильных групп, арильных групп, причем указанные группы возможно замещены одним или более атомами кремния или германия, и n является целым числом от 0 до 2.
В дополнительном предпочтительном воплощении настоящего изобретения указанный со-катализатор (b) можно выбрать из (b2) органических кислородсодержащих соединений элемента М’, отличного от углерода, принадлежащего к группам 13 или 14 Периодической таблицы элементов, предпочтительно из органических кислородсодержащих соединений алюминия, галлия, олова. Указанные органические кислородсодержащие соединения (b2) можно определить как органические соединения М’, в которых этот последний связан по меньшей мере с одним атомом кислорода и по меньшей мере с одной органической группой, образованной алкильной группой, содержащей от 1 до 6 атомов углерода, предпочтительно метилом.
В дополнительном предпочтительном воплощении настоящего изобретения указанный со-катализатор (b) можно выбрать из (b3) соединений или смесей металлоорганических соединений элемента М’, отличного от углерода, способных к реакции с пиридиновым комплексом циркония, имеющего общую формулу (I), с извлечением из него σ-связанного заместителя X1, Х2 или Х3 с образованием, с одной стороны, по меньшей мере одного нейтрального соединения и, с другой стороны, ионного соединения, состоящего из катиона, содержащего металл (Zr), координированный лигандом, и не координированного органического аниона, содержащего металл М’, чей отрицательный заряд делокализован на структуре со многими центрами.
Необходимо отметить, что в целях настоящего описания и нижеследующей формулы изобретения термин «Периодическая таблица элементов» относится к "IUPAC Periodic Table of the Elements", версия, датированная 22 июня 2007, доступная по следующему адресу в Интернет: www.iupac.org/fileadmin/user_upload/news/IUPAC_Periodic_Table-1Jun12.pdf.
Конкретными примерами алкильных соединений алюминия, имеющих общую формулу (IV), которые особенно подходят для целей настоящего изобретения, являются триметилалюминий, три-(2,3,3-триметилбутил)алюминий, три-(2,3-диметилгексил)алюминий, три-(2,3-диметилбутил)алюминий, три-(2,3-диметилпентил)алюминий, три-(2,3-диметилгептил)алюминий, три-(2-метил-3-этилпентил)алюминий, три-(2-метил-3-этилгексил)алюминий, три-(2-метил-3-этилгептил)алюминий, три-(2-метил-3-пропилгексил)алюминий, триэтилалюминий, три-(2-этил-3-метилбутил)алюминий, три-(2-этил-3-метилпентил)алюминий, три-(2,3-диэтилпентилалюминий), три-н-пропилалюминий, триизопропилалюминий, три-(2-пропил-3-метилбутил)алюминий, три-(2-изопропил-3-метилбутил)алюминий, три-н-бутилалюминий, триизобутилалюминий (TIBA), три-(трет-бутил)алюминий, три-(2-изобутил-3-метилпентил)алюминий, три-(2,3,3-триметилпентил)алюминий, три-(2,3,3-триметилгексил)алюминий, три-(2-этил-3,3-диметилбутил)алюминий, три-(2-этил-3,3-диметилпентил)алюминий, три-(2-изопропил-3,3-диметилбутил)-алюминий, три-(2-триметилсилилпропил)-алюминий, три-(2-метил-3-фенилбутил)алюминий, три-(2-этил-3-фенилбутил)алюминий, три-(2,3-диметил-3-фенилбутил)алюминий, три-(2-фенилпропил)алюминий, три-(2-(4-фторфенил)пропил)алюминий, три-(2-(4-хлорфенил)пропил)алюминий, три-(2-(3-изопропилфенил)-три-(2-фенилбутил))алюминий, три-(3-метил-2-фенилбутил)алюминий, три-(2-фенилпентил)алюминий, три-(2-(пентафторфенил)пропил)алюминий, три-(2,2-дифенилэтил)алюминий, три-(2-фенилметилпропил)алюминий, трипентилалюминий, тригексилалюминий, трициклогексилалюминий, триоктилалюминий, гидрид диэтилалюминия, гидрид ди-н-пропилалюминия, гидрид ди-н-бутилалюминия, гидрид диизобутилалюминия (DIBAH), гидрид дигексилалюминия, гидрид диизогексилалюминия, гидрид диоктилалюминия, гидрид диизооктилалюминия, дигидрид этилалюминия, дигидрид н-пропилалюминия, дигидрид изобутилалюминия, хлорид диэтилалюминия (DEAC), дихлорид моноэтилалюминия (EADC), хлорид диметилалюминия, хлорид диизобутилалюминия, дихлорид изобутилалюминия, сесквихлорид этилалюминия (EASC), а также соответствующие соединения, в которых один из углеводородных заместителей замещен атомом водорода, и те, в которых один или два из углеводородных заместителей замещены изобутильной группой. Особенно предпочтительными являются триэтилалюминий, триизобутилалюминий (TIBA), гидрид диизобутилалюминия (DIBAH).
Предпочтительно, когда алкильные соединения алюминия, имеющие общую формулу (IV), используют для образования каталитической системы для (со)полимеризации по настоящему изобретению, их можно поместить в контакт с пиридиновым комплексом циркония, имеющим общую формулу (I), в таком соотношении, что молярное отношение циркония, присутствующего в пиридиновом комплексе циркония, имеющем общую формулу (I), к алюминию, присутствующему в алкильных соединениях алюминия, имеющих общую формулу (IV), может составлять от 5 до 5000, предпочтительно от 10 до 1000. Последовательность, в которой пиридиновый комплекс циркония, имеющий общую формулу (I), и алкилалюминий, имеющий общую формулу (IV), помещают в контакт друг с другом не является особенно критической.
Дополнительные подробности относительно алкильных соединений алюминия общей формулы (IV) можно найти в международной патентной заявке WO 2011/061151.
В особенно предпочтительном воплощении указанные органические кислородсодержащие соединения (b2) можно выбрать из алюмоксанов, имеющих общую формулу (V):

в которой R9, R10 и R11, одинаковые или различные, представляют собой атом водорода, атом галогена, такой, например, как хлор, бром, йод, фтор, или выбраны из линейных или разветвленных С1-С20 алкильных групп, циклоалкильных групп, арильных групп, причем указанные группы возможно замещены одним или более атомами кремния или германия, и р является целым числом от 0 до 1000.
Как известно, алюмоксаны являются соединениями, содержащими Al-O-Al связи, имеющими переменное отношение O/Al, получаемыми с помощью способов, известных в уровне техники, таких, например, как путем реакции при регулируемых условиях алкилалюминия или галогенида алкилалюминия с водой или с другими соединениями, содержащими заранее заданное количество доступной воды, как, например, когда триметилалюминий реагирует с гексагидратом сульфата алюминия, пентагидратом сульфата меди или пентагидратом сульфата железа.
Указанные алюмоксаны и, в частности, метилалюмоксан (МАО), являются соединениями, получаемыми с помощью известных способов металлоорганической химии, таких, например, как путем добавления триметилалюминия в суспензию гидрата сульфата алюминия в гексане.
Предпочтительно, когда алюмоксаны, имеющие общую формулу (V), используют для образования каталитической системы для (со)полимеризации по настоящему изобретению, их можно привести в контакт с пиридиновым комплексом циркония, имеющим общую формулу (I), в таком соотношении, что молярное отношение алюминия (Al), присутствующего в алюмоксане, имеющем общую формулу (V), к цирконию, присутствующему в пиридиновом комплексе, имеющем общую формулу (I), составляет от 10 до 10000, предпочтительно от 100 до 5000. Последовательность, в которой пиридиновый комплекс циркония, имеющий общую формулу (I), и алюмоксан, имеющий общую формулу (V), приводят в контакт друг с другом, не является особенно критической.
Наряду с вышеупомянутыми предпочтительными алюмоксанами, имеющими общую формулу (V), определение соединения (b2) по настоящему изобретению также включает галлоксаны, в которых галлий играет роль алюминия в общей формуле (V), и станноксаны, в которых олово играет роль алюминия в общей формуле (V), применение которых в качестве со-катализаторов полимеризации олефинов в присутствии металлоценовых комплексов известно. Дополнительные подробности, касающиеся указанных галлоксанов и станноксанов можно найти, например, в американских патентах US 5128295 and US 5258475.
Конкретными примерами алюмоксанов, имеющих общую формулу (V), которые особенно подходят для целей настоящего изобретения, являются метилалюмоксан (МАО), этилалюмоксан, н-бутилалюмоксан, тетраизобутилалюмоксан (TIBAO), трет-бутилалюмоксан, тетра-(2,4,4-триметилпентил)алюмоксан (TIOAO), тетра-(2,3-диметилбутил)алюмоксан (TDMBAO), тетра-(2,3,3-триметилбутил)алюмоксан (ТТМВАО), Метилалюмоксан (МАО), как таковой или в сухой форме (сухой МАО), является особенно предпочтительным.
Дополнительные подробности, касающиеся алюмоксанов, имеющих общую формулу (V), можно найти в международной патентной заявке WO 2011/061151.
В предпочтительном воплощении настоящего изобретения указанные соединения или смеси соединений (b3) можно выбрать из органических соединений алюминия и, в особенности, бора, таких, например, как те, которые представлены следующими общими формулами:
[(RC)WH4-W]⋅[B(RD)4]-; B(RD)3; Al(RD)3; B(RD)3P; [Ph3C]+⋅[B(RD)4]-; [(RC)3PH]+⋅[B(RD)4]-; [Li]+⋅[B(RD)4]-; [Li]+⋅[Al(RD)4]-
в которых w является целым числом от 0 до 3, каждая RC группа независимо представляет собой алкильную или арильную группу, содержащую от 1 до 10 атомов углерода, и каждая RD группа независимо представляет собой частично или полностью, предпочтительно полностью, фторированную арильную группу, содержащую от 6 до 20 атомов углерода, Р представляет собой возможно замещенный пиррольный радикал.
Предпочтительно, когда соединения или смеси соединений (b3) используют для образования каталитических систем для (со)полимеризации по настоящему изобретению, их можно привести в контакт с пиридиновым комплексом циркония, имеющим общую формулу (I), в таком соотношении, что молярное отношение металла (М’), присутствующего в соединениях или смесях соединений (b3), к цирконию (Zr), присутствующему в пиридиновом комплексе циркония, имеющем общую формулу (I), составляет от 0,1 до 15, предпочтительно от 0,5 до 10, более предпочтительно от 1 до 6. Последовательность, в которой пиридиновый комплекс циркония, имеющий общую формулу (I), и соединения или смеси соединений (b3) приводят в контакт друг с другом, не является особенно критической.
Указанные соединения или смеси соединений (b3), особенно, если X1, Х2 и Х3 в пиридиновом комплексе циркония, имеющем общую формулу (I), отличны от алкила, необходимо использовать в сочетании с алюмоксаном, имеющим общую формулу (V), таким, например, как метилалюмоксан (МАО), или предпочтительно с алкилалюминием, имеющим общую формулу (IV), более предпочтительно триалкилалюминием, содержащим от 1 до 8 атомов углерода в каждом алкильном остатке, таким, например, как триметилалюминий, триэтилалюминий, триизобутилалюминий (TIBA).
Примеры методик, обычно используемых для получения каталитических систем для (со)полимеризации по настоящему изобретению, если используют соединения или смеси соединений (b3), качественно обрисовывают в следующем перечне, который, однако, никаким образом не ограничивает общий объем охраны настоящего изобретения:
(m1) приведение пиридинового комплекса циркония, имеющего общую формулу (I), в котором по меньшей мере один из X1, Х2 и Х3 является алкильной группой, в контакт по меньшей мере с одним соединением или смесями соединений (b3), катион которых способен к реакции с указанной алкильной группой с образованием нейтрального соединения, и анион которых является объемным, некоординирующим и способным к делокализации отрицательного заряда,
(m2) взаимодействие пиридинового комплекса циркония, имеющего общую формулу (I), по меньшей мере с одним алкилалюминием, имеющим общую формулу (IV), предпочтительно триалкилалюминием, используемым в молярном избытке от 10/1 до 300/1, с последующим взаимодействием с сильной кислотой Льюиса, такой как трис(пентафторфенил)бор (соединение (b3)), в практически стехиометрическом количестве или в небольшом избытке по отношению к цирконию (Zr),
(m3) приведение в контакт и взаимодействие пиридинового комплекса циркония, имеющего общую формулу (I), с молярным избытком от 10/1 до 1000/1, предпочтительно от 100/1 до 500/1, по меньшей мере с одним триалкилалюминием или галогенидом алкилалюминия, который можно представить формулой AlR’’’mZ3-m, в которой R’’’ является линейной или разветвленной C1-C8 алкильной группой или их смесью, Z является галогеном, предпочтительно хлором или бромом, и m является десятичным числом от 1 до 3, с последующим добавлением в полученную таким образом композицию по меньшей мере одного соединения или смеси соединений (b3) в таком количестве, что отношение указанного соединения или смеси соединений (b3) или алюминия указанного соединения или смеси соединений (b3) к цирконию (Zr) пиридинового комплекса циркония, имеющего общую формулу (I), составляет от 0,1 до 15, предпочтительно от 1 до 6.
Примеры соединений или смесей соединений (b3), способных к получению ионной каталитической системы для реакции с пиридиновым комплексом, имеющим общую формулу (I), по настоящему изобретению описывают, хотя и в связи с образованием ионных металлоценовых комплексов, в следующих публикациях, содержание которых включено в данный документ посредством ссылки:
- W. Beck et al., "Chemical Reviews" (1988), Vol. 88, pp. 1405-1421,
- S.H. Stares, "Chemical Reviews" (1993), Vol. 93, pp. 927-942,
- европейские патентные заявки ЕР 277003, ЕР 495375, ЕР 520732, ЕР 427697, ЕР 421659, ЕР 418044,
- опубликованные международные патентные заявки WO 92/00333, WO 92/05208.
Конкретными примерами соединений или смесей соединений (b3), особенно подходящих для целей настоящего изобретения, являются трибутиламмоний-тетракис-пентафторфенилборат, трибутиламмоний-тетракис-пентафторфенилалюминат, трибутиламмоний-тетракис-((3,5-ди-(трифторфенил))борат, трибутиламмоний-тетракис-(4-фторфенил)борат, N,N-диметилбензиламмоний-тетракис-пентафторфенилборат, N,N-диметилгексиламмоний-тетракис-пентафторфенилборат, N,N-диметиланилиний-тетракис-(пентафторфенил)борат, N,N-диметиланилиний-тетракис-(пентафторфенил)алюминат, ди(пропил)аммоний-тетракис-(пентафторфенил)борат, ди-(циклогексил)аммоний-тетракис-(пентафторфенил)борат, трифенилкарбен-тетракис-(пентафторфенил)борат, трифенилкарбен-тетракис-(пентафторфенил)алюминат, трис(пентафторфенил)бор, трис(пентафторфенил)алюминий или их смеси. Предпочтительными являются тетракис-пентафторфенилбораты.
В целях настоящего описания и нижеследующей формулы изобретения термины «моль» и «молярное отношение» оба используют в связи с соединениями, образованными молекулами, и в связи с атомами и ионами, не принимая во внимание термины грамм-атом или атомное отношение для последних, даже если эти термины являются более научно правильными.
В целях настоящего изобретения в вышеупомянутую каталитическую систему можно при необходимости добавлять другие добавки или компоненты, для того, чтобы приспособить ее к соответствию конкретным практическим требованиям. Полученные таким образом каталитические системы необходимо таким образом считать входящими в объем охраны настоящего изобретения. Добавки и/или компоненты, которые можно добавлять в получение и/или состав каталитической системы по настоящему изобретению, представляют собой, например, инертные растворители, такие, например, как алифатические и/или ароматические углеводороды, алифатические и/или ароматические эфиры, слабо координирующие добавки (например, основания Льюиса), выбранные, например, из неполимеризуемых олефинов, стерически затрудненные или электрон-дефицитные эфиры, галогенирующие агенты, такие, например, как силангалогениды, галогенированные, преимущественно хлорированные, углеводороды или их смеси.
Указанную каталитическую систему можно получить, как указано ранее, с помощью способов, известных в уровне техники. Например, указанную каталитическую систему можно получить отдельно (предварительно полученную) и затем ввести в среду (со)полимеризации. Для этой цели указанную каталитическую систему можно получить путем взаимодействия по меньшей мере одного пиридинового комплекса циркония (а), имеющего общую формулу (I), с по меньшей мере одним со-катализатором (b), при необходимости в присутствии других добавок или компонентов, выбранных из перечисленных выше, в присутствии растворителя, такого, например, как толуол, гептан, при температуре от 20°C до 60°C в течение времени от 10 секунд до 10 часов, предпочтительно от 30 секунд до 5 часов. Больше подробностей, касающихся получения указанной каталитической системы, можно найти в представленных ниже примерах.
Альтернативно, указанную каталитическую систему можно получить in situ, то есть непосредственно в среде (со)полимеризации. Для этого указанную каталитическую систему можно получить путем раздельного введения пиридинового комплекса циркония (а), имеющего общую формулу (I), со-катализатора (b) и заранее выбранного сопряженного диена(ов), подлежащего (со)полимеризации, действуя в условиях, в которых проводят (со)полимеризацию.
В целях настоящего изобретения вышеупомянутые каталитические системы также можно нанести на инертные твердые вещества, предпочтительно образованные оксидами кремния и/или алюминия, такими как диоксид кремния, оксид алюминия или алюмосиликаты. Для нанесения указанных каталитических систем можно использовать известные способы нанесения, включающие, обобщенно говоря, контакт в подходящей инертной жидкой среде между носителем, возможно активированным путем нагревания до температуры выше 200°C, и одного или обоих компонентов (а) и (b) каталитической системы по настоящему изобретению. В целях настоящего изобретения не обязательно наносить оба компонента, также возможно присутствие на поверхности носителя только пиридинового комплекса циркония (а), имеющего общую формулу (I), или со-катализатора (b). В этом последнем случае компонент, отсутствующий на поверхности, затем приводят в контакт с нанесенным компонентом в момент, когда это требуется для образования активного катализатора полимеризации.
Пиридиновый комплекс циркония (а), имеющий общую формулу (I), и каталитические системы на его основе, которые были нанесены на твердое вещество путем функционализирования указанного твердого вещества и образования ковалентной связи между твердым веществом и пиридиновым комплексом циркония (а), имеющим общую формулу (I), также входят в объем охраны настоящего изобретения.
Также настоящее изобретение относится к способу (со)полимеризации сопряженных диенов, отличающемуся применением указанной каталитической системы.
Количество пиридинового комплекса циркония (а), имеющего общую формулу (I), и со-катализатора (b), которое можно использовать в (со)полимеризации сопряженных диенов, изменяется в зависимости от способа (со)полимеризации, который требуется для практической реализации. Однако указанное количество является таким, чтобы получить молярное отношение циркония (Zr), присутствующего в пиридиновом комплексе циркония (а), имеющим общую формулу (I), к металлу, присутствующему в со-катализаторе (b), например, алюминию, если со-катализатор (b) выбран из алкильных соединений алюминия (b1) или алюмоксанов (b2), к бору, если со-катализатор (b) выбран из соединений или смесей соединений (b3), имеющих общую формулу (III), которое находится в диапазоне указанных выше значений.
Конкретными примерами сопряженных диенов, которые можно (со)полимеризировать, используя каталитическую систему по настоящему изобретению, являются 1,3-бутадиен, 2-метил-1,3-бутадиен (изопрен), 2,3-диметил-1,3-бутадиен, 1,3-пентадиен, 1,3-гексадиен, цикло-1,3-гексадиен. Предпочтительным является 1,3-бутадиен. Вышеупомянутые (со)полимеризуемые сопряженные диены можно использовать сами по себе или в смеси двух или более диенов. В последнем случае, когда используют смесь двух или более диенов, получают сополимер.
В особенно предпочтительном воплощении изобретение относится к способу полимеризации 1,3-бутадиена, отличающемуся применением указанной каталитической системы.
Вообще говоря, указанную (со)полимеризацию можно выполнять в присутствии растворителя полимеризации, вообще выбранного из инертных органических растворителей, таких, например, как насыщенные алифатические углеводороды, такие, например, как бутан, пентан, гексан, гептан или их смеси, насыщенные циклоалифатические углеводороды, такие, например, как циклопентан, циклогексан, циклогексан или их смеси, моноолефины, такие, например, как 1-бутен, 2-бутен или их смеси, ароматические углеводороды, такие, например, как бензол, толуол, ксилол или их смеси, галогенированные углеводороды, такие, например как метиленхлорид, хлороформ, четыреххлористый углерод, трихлорэтилен, перхлорэтилен, 1,2-дихлорэтан, хлорбензол, бромбензол, хлортолуол или их смеси. Предпочтительно растворитель (со)полимеризации выбирают из насыщенных алифатических углеводородов.
Альтернативно, указанную (со)полимеризацию можно проводить, используя тот же сопряженный диен(ы), который подлежит (со)полимеризации, в качестве растворителя (со)полимеризации в способе, известном как способ объемной полимеризации.
Вообще говоря, концентрация сопряженного диена, подлежащего (со)полимеризации, в указанном растворителе (со)полимеризации составляет от 5% масс. до 50% масс., предпочтительно от 10% масс. до 20% масс. по отношению к полной массе смеси сопряженного диена и инертного органического растворителя.
Вообще говоря, указанную (со)полимеризацию можно выполнять при температуре от -70°C до +100°C, предпочтительно от -20°C до +80°C.
Что касается давления, предпочтительно действовать при давлении компонентов смеси, которые необходимо (со)полимеризировать.
Указанную (со)полимеризацию можно проводить непрерывно или партиями.
Как указано выше, указанный способ дает возможность получить (со)полимеры сопряженных диенов, такие как линейный или разветвленный полибутадиен, имеющий высокое содержание 1,4-транс звеньев, то есть содержание 1,4-транс звеньев ≥94%.
В целях лучшего понимания настоящего изобретения и для применения его на практике, далее приведены некоторые иллюстративные, неограничивающие примеры.
Примеры
Реагенты и материалы
В следующем списке указаны реагенты и материалы, использованные в следующих примерах изобретения, любые их возможные предварительные обработки и их производители:
- 2,6-диизопропиланилин (Aldrich): использовали как таковой,
- 2-трет-бутиланилин (Aldrich): использовали как таковой,
- 2-бензоилпиридин (Aldrich): использовали как таковой,
- анилин (Aldrich): перегоняли при пониженном давлении и хранили в инертной атмосфере,
- 2,4,6-триметиланилин (Aldrich): использовали как таковой,
- 2-пиридинкарбоксиальдегид (Aldrich): использовали как таковой,
- 2-ацетилпиридин (Aldrich): использовали как таковой,
- дихлорметан (Carlo Erba, RPE): использовали как таковой,
- метанол (Carlo Erba, RPE): использовали как таковой или при необходимости обезвоживали путем перегонки над магнием (Mg),
- боргидрид натрия (Aldrich): использовали как таковой,
- этилацетат (Aldrich): использовали как таковой,
- гексан (Aldrich): чистый, ≥99%, перегоняли над натрием (Na) в инертной атмосфере,
- этиловый эфир (Aldrich): использовали как таковой,
- муравьиная кислота (Aldrich): использовали как таковую,
- гептан (Aldrich): чистый, ≥99%, перегоняли над натрием (Na) в инертной атмосфере,
- сульфат натрия (Aldrich): использовали как таковой,
- хлороформ (Aldrich): использовали как таковой,
- толуол (Aldrich): чистый, ≥99.5%, перегоняли над натрием (Na) в инертной атмосфере,
- тетрахлорид циркония (ZrCl4) (Stream Chemicals): использовали как таковой,
- комплекс тетрахлорид циркония: тетрагидрофуран (1:2) [ZrCl4(ТГФ)2] (Aldrich): использовали как таковой,
- тетрагидрофуран (ТГФ) (Carlo Erba, RPE), выдерживали при кипячении с обратным холодильником над калием/бензофеноном и затем перегоняли над азотом,
- н-бутиллитий (Aldrich): использовали как таковой,
- 1,3-бутадиен (Air Liquide): чистый, ≥99,5%, выпаривали из контейнера перед каждым получением, сушили путем пропускания через колонку, набитую молекулярными ситами, и концентрировали внутри реактора, который был предварительно охлажден до -20°C;
- метилалюмоксан (МАО) (раствор в толуоле при 10% масс.) (Aldrich): использовали как таковой или в сухой форме (сухой МАО), полученной путем удаления свободного триметилалюминия вместе с растворителем из толуолового раствора в вакууме и сушки полученного остатка по-прежнему в вакууме,
- соляная кислота в 37%-ном водном растворе (Aldrich): использовали как таковую,
- триизобутилалюминий (TIBA) (Aldrich): использовали как таковой,
- дейтерированный тетрахлорэтилен (C2D2Cl4) (Acros): использовали как таковой,
- дейтерированный хлороформ (CDCl3) (Acros): использовали как таковой.
Использовали следующие методы анализа и определения характеристик.
Элементный анализ
а) Определение Zr
Чтобы определить массовое содержание циркония (Zr) в пиридиновых комплексах циркония, используемых в целях настоящего изобретения, точно взвешенную навеску, составляющую приблизительно 30-50 мг образца, работая в сухом боксе под током азота, помещали в платиновый тигель объемом приблизительно 30 мл вместе со смесью 1 мл 40%-ной фтороводородной кислоты (HF), 0,25 мл 96%-ной серной кислоты (H2SO4) и 1 мл 70%-ной азотной кислоты (HNO3). Тигель затем нагревали на плите, повышая температуру до появления белых серных испарений (приблизительно 200°C). Полученную таким образом смесь охлаждали до комнатной температуры (20°C-25°C), добавляли 1 мл 70%-ной азотной кислоты (HNO3) и затем доводили обратно до температуры, при которой появлялись испарения. После того, как данную последовательность повторяли еще дважды, получали чистый и почти бесцветный раствор. Затем в него на холоду добавляли 1 мл азотной кислоты (HNO3) и приблизительно 15 мл воды, при этом нагревая до 80°C в течение приблизительно 30 минут. Полученный таким образом образец разбавляли водой чистоты Milli-Q до массы, составляющей приблизительно 50 г, точно взвешенной, для получения раствора, на котором выполняли инструментальное аналитическое определение, используя спектрометр оптической эмиссионной спектрометрии с индуктивно связанной плазмой (ИСП-ОЭС) Thermo Optek IRIS Advantage Duo ICP-OES путем сравнения с растворами известной концентрации. Для этого для каждого аналита получали калибровочную кривую в интервале 0-10 частей на млн путем измерения растворов известного титра, полученных путем разбавления по массе стандартных растворов.
Перед выполнением спектрофотометрического определения раствор образца, полученный как указано выше, далее разбавляли по массе, так чтобы получить концентрации, близкие к концентрациям стандартных образцов. Все образцы приготавливали в двойном количестве. Результаты считали приемлемыми, если данные отдельных двойных испытаний отличались не более чем на 2% от их среднего значения.
б) Определение хлора
Для этой цели образцы пиридиновых комплексов циркония, используемых в целях настоящего изобретения, массой приблизительно 30-50 мг, точно взвешивали в химические стаканы объемом 100 мл в сухом боксе под током азота. Добавляли 2 г карбоната натрия (Na2CO3) и, вне сухого бокса, 50 мл воды Milli-Q. Эту смесь доводили до кипения на плите при перемешивании магнитной мешалкой в течение приблизительно 30 минут. Ее оставляли охлаждаться, добавляли разбавленную 1/5 серную кислоту (H2SO4) до кислой реакции и выполняли титрование с использованием 0,1 н-ного нитрата серебра (AgNO3) с помощью потенциометрического титратора.
в) Определение углерода, водорода и азота
Углерод, водород и азот в пиридиновых комплексах циркония, используемых в целях настоящего изобретения, а также в лигандах, используемых в целях настоящего изобретения, определяли, используя автоматический анализатор Carlo Erba 1106.
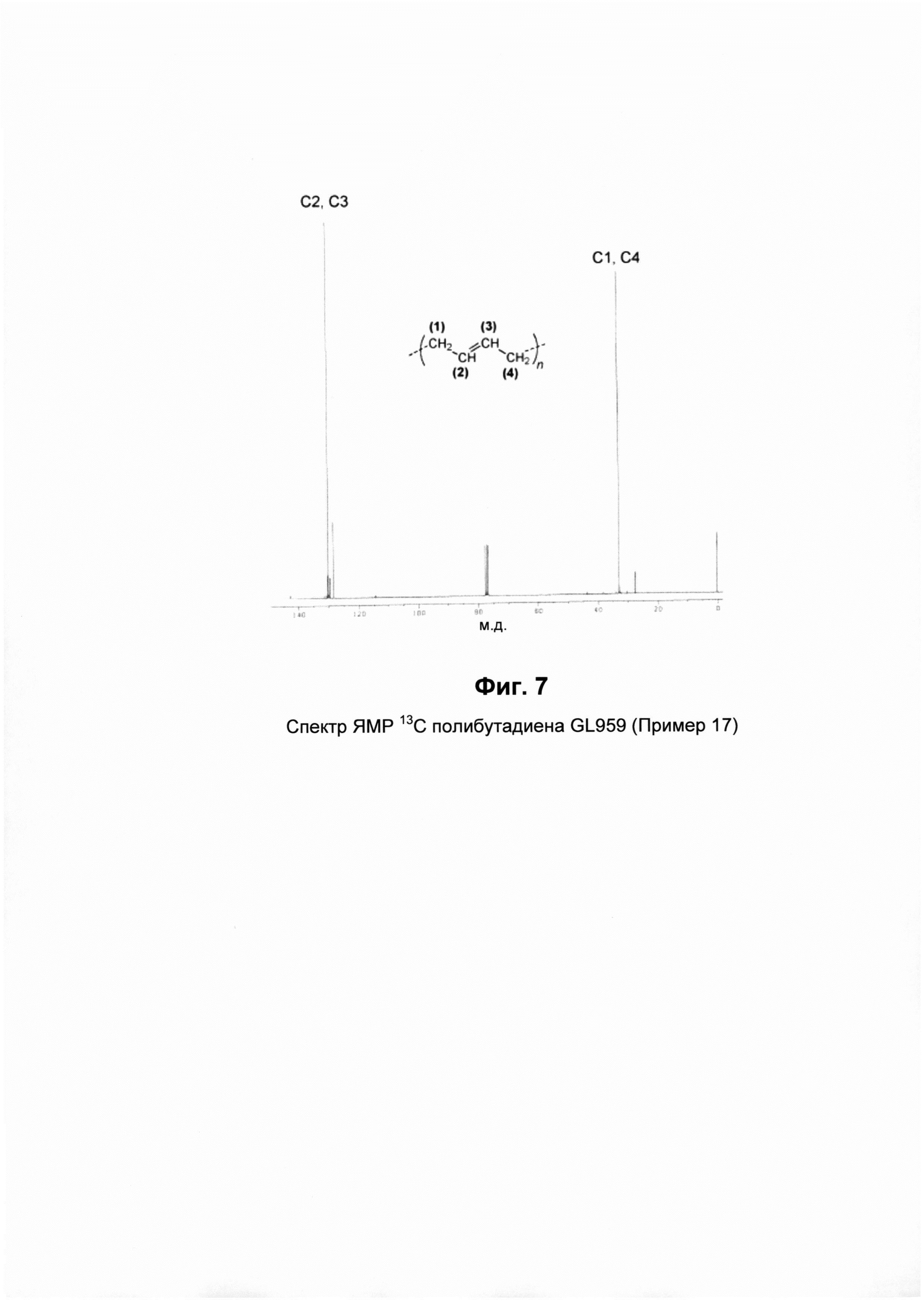
Спектры ЯМР13С и1Н
Спектры ЯМР13С и1Н записывали на спектрометре ядерного магнитного резонанса Bruker Avance 400, используя дейтерированный тетрахлорэтилен (C2D2Cl4) при 103°C и гексаметилдисилоксан (HDMS) в качестве внутреннего стандарта, или используя дейтерированный хлороформ (CDCl3) при 25°C и тетраметилсилан (TMS) в качестве внутреннего стандарта. Для этой цели использовали полимерные растворы, имеющие концентрации, составляющие 10% масс, по отношению к полной массе полимерного раствора.
Микроструктуру полимеров (то есть содержание 1,4-транс звеньев (%)) определяли путем анализа вышеупомянутых спектров на основе того, что описано в литературе Mochel, V.D., в "Journal of Polymer Science Part A-1: Polymer Chemistry" (1972), Vol. 10, Issue 4, pp. 1009-1018.
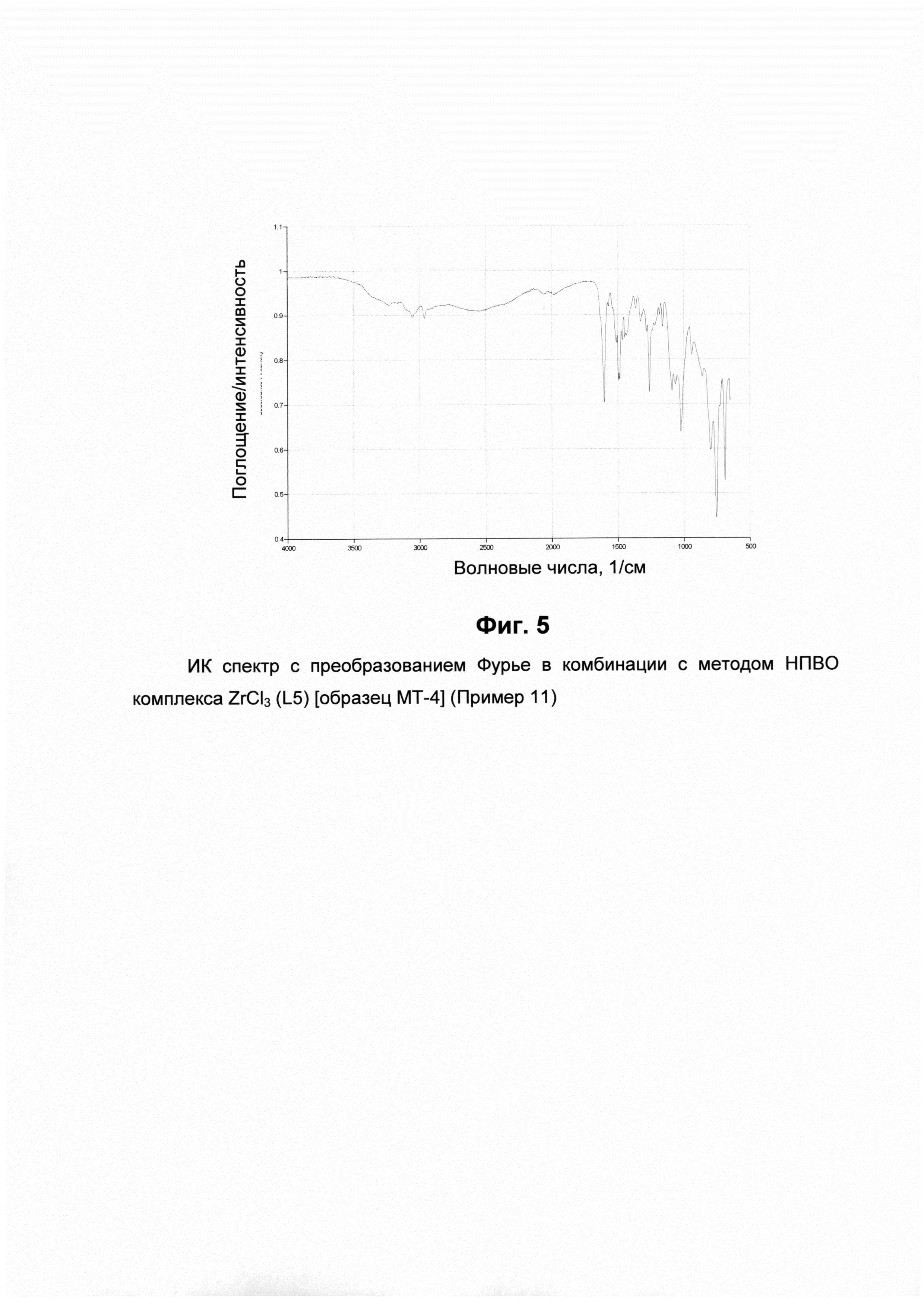
ИК спектры с преобразованием Фурье в комбинации с методом нарушенного полного внутреннего отражения (НПВО)
ИК спектры с преобразованием Фурье в комбинации с методом (НПВОР) записывали на спектрофотометре Bruker IFS 48, оборудованном горизонтальным НПВО соединением Thermo Spectra-Tech. Секция, в которую помещают подлежащие анализу образцы, представляет собой вспомогательное устройство Fresnel ATR (Shelton, СТ, USA), в котором используют кристаллы селенида циркония (ZnSe) с углом падения 45° в горизонтальном направлении. ИК спектры с преобразованием Фурье в комбинации с методом НПВО пиридиновых комплексов циркония, используемых в настоящем изобретении, получали путем помещения подлежащих анализу образцов пиридиновых комплексов циркония в указанную секцию.
ИК спектры с преобразованием Фурье
ИК спектры с преобразованием Фурье записывали на спектрофотометрах Thermo Nicolet Nexus 670 и Bruker IFS 48.
ИК спектры с преобразованием Фурье полимеров получали из полимерных пленок на таблетках бромида калия (KBr), причем указанную пленку получали путем нанесения раствора подлежащего анализу полимера в горячем о-дихлорбензоле. Концентрация анализируемых полимерных растворов составляла 10% масс. по отношению к полной массе полимерного раствора.
Термический анализ (методом ДСК)
ДСК (дифференциальная сканирующая калориметрия) термический анализ для определения температуры плавления (Tm) и температуры кристаллизации (Тс) полученных полимеров выполняли, используя дифференциальный сканирующий калориметр Perkin Elmer Pyris. Для этой цели 5 мг полимера анализировали со скоростью сканирования от 1°C/мин до 20°C/ мин в инертной атмосфере азота.
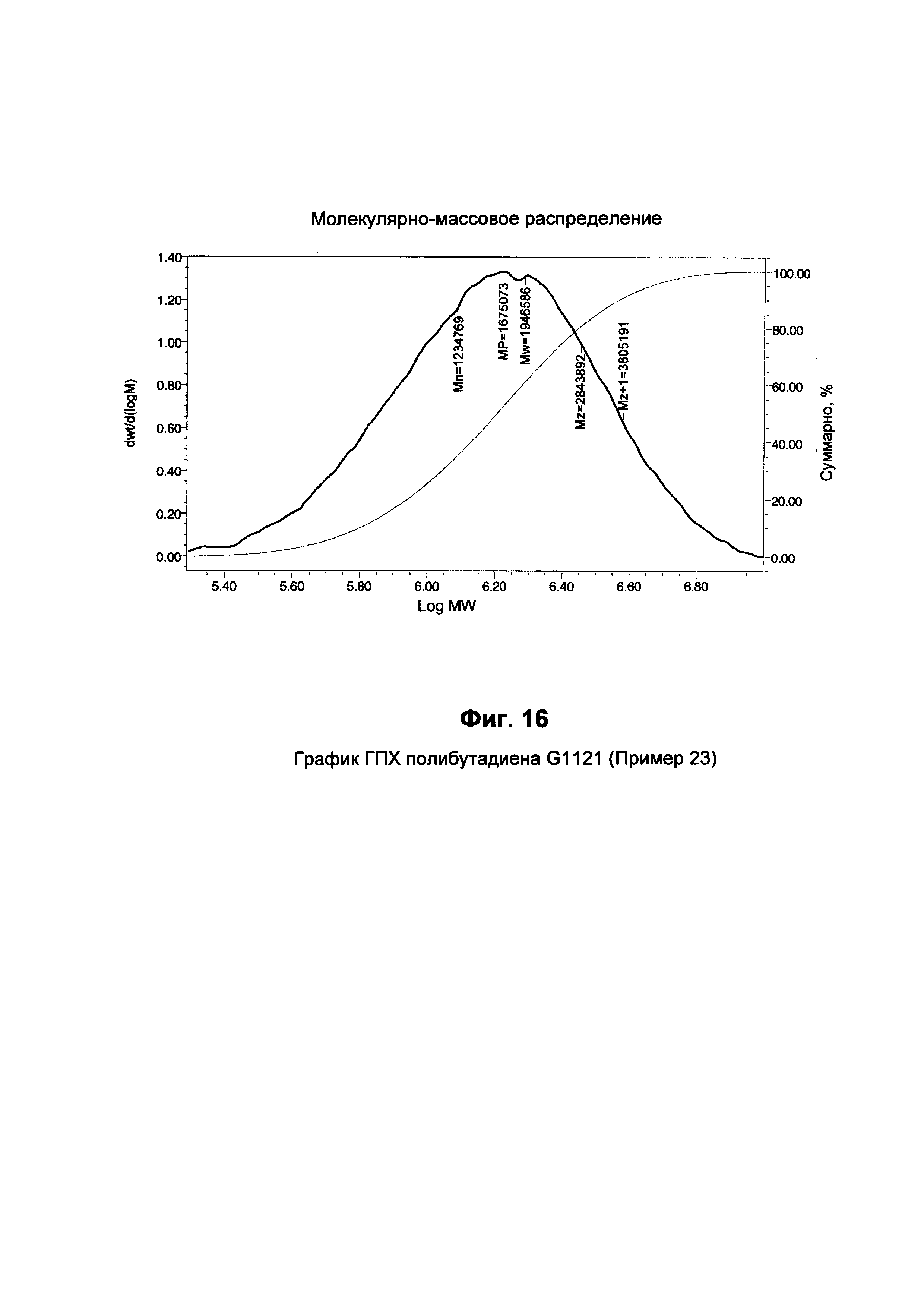
Определение молекулярной массы
Определение молекулярной массы (ММ) полученного полимера выполняли с помощью ГПХ (гельпроникающей хроматографии), действуя при следующих условиях:
- насос Agilent 1100
- ИК детектор Agilent 1100
- колонка Mixed-A PL
- растворитель/элюент: тетрагидрофуран (ТГФ)
- скорость потока: 1 мл/мин
- температура: 25°C
- вычисление молекулярной массы: универсальный метод калибровки.
Приведены среднемассовая молекулярная масса (Mw) и показатель полидисперсности (ППД), соответствующий отношению Mw/Mn (Mn = среднечисленная молекулярная масса).
Газовая хроматография - масс-спектрометрия (ГХ - МС)
Газовую хроматографию - масс-спектрометрию (ГХ - МС) выполняли, используя одноквадрупольный масс-спектрометр Thermo ISQ. Для этой цели образцы лигандов, подлежащие анализу, растворяли в метиленхлориде (CH2Cl2) при концентрации 0,1 мг/мл и анализировали, используя указанный спектрометр, действуя при следующих условиях:
- средства ионизации: электронная ионизация (ЭИ)
- ГХ градиент температуры: 50°C за 2 мин, нагрев со скоростью 10°C/мин до 300°C
- температура инжектора: 300°C
- объем вводимой пробы: 1,30 мкл
- температура «переходной линии»: 280°C
- температура источника ионов: 250°C
- параметры квадрупольного сканирования: 35 а.е.м. - 500 а.е.м. с временем сканирования 0,2 с.
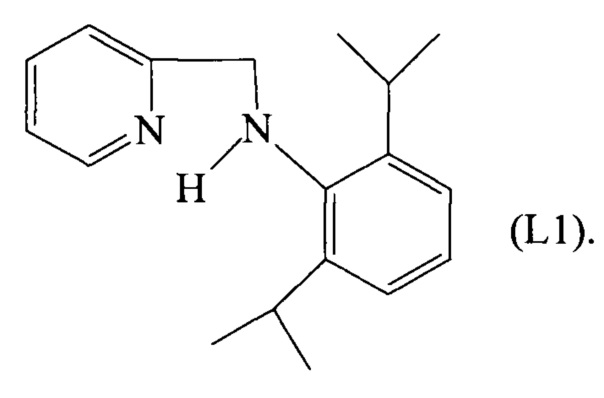
Пример 1. Синтез лиганда, имеющего формулу (L1)
1.1 Синтез соединения, имеющего формулу (L1a)

В сосуд объемом 500 мл, оборудованный ловушкой Дина-Старка для азеотропного удаления воды, в раствор 2,6-диизопропиланилина (27,93 г, 157,5 ммоль) в дихлорметане (300 мл) добавляли 2-пиридинкарбоксиальдегид (16,86 г, 157,5 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 20 часов и затем сушили в вакууме с получением 41,7 г желтого твердого вещества (выход 99%), соответствующего соединению, имеющему формулу (L1a).
Элементный анализ (обнаруженное (вычисленное)): С: 81,14% (81,16%), Н: 8,33% (8,32%), N: 10,6% (10,52%).
1Н-ЯМР (CDCl3, δ м.д. (миллионных долей)): 8,72 (д, 1Н, РуН), 8,32 (с, 1Н CH=N), 8,27 (д, 1Н РуН), 7,86 (т, 1Н РуН), 7,39 (м, 1Н РуН), 7,11-7,20 (м, 3H ArH), 3,00 (септ, 2Н СНМе2), 1,18 (д, 12Н С(СН3)2).
1.2 Синтез лиганда, имеющего формулу (L1)
В реактор объемом 2 литра, снабженный мешалкой, загружали 28 г (105,1 ммоль) соединения, имеющего формулу (L1a), полученного как описано выше, и 1800 мл безводного метанола, всю смесь охлаждали до 0°C и затем небольшими порциями добавляли боргидрид натрия (70 г, 1850 ммоль). Полученную смесь оставляли при комнатной температуре при перемешивании на ночь и затем быстро охлаждали солевым раствором и экстрагировали с использованием этилацетата. Растворитель затем удаляли путем перегонки при пониженном давлении и полученный остаток очищали путем элюирования на хроматографической колонке с силикагелем (элюент: смесь гексана и этилацетата в отношении 9/1 (об/об)) и затем обрабатывали холодным этиловым эфиром с получением 16,9 г белого кристаллического твердого вещества (выход 60%), соответствующего лиганду, имеющему формулу (L1).
ГХ-МС: М+=m/z 268, [М-С3Н7]+=m/z 225, [M-C6H6N]+=m/z 176, m/z 93 C6H7N.
1Н-ЯМР (CDCl3, δ м.д.): 8,61 (д, 1H, o-PyH), 7,66 (тд, 1Н, РуН), 7,30 (д, 1Н, РуН), 7,21 (м, 1Н, РуН), 7,04-7,12 (м, 3H, ArH), 4,20 (с, 2Н, СН2), 4,10 (с, 1Н, NH), 3,47 (м, 2Н, -СН(СН3)2), 1,42 (д, 12Н, -СН(СН3)2).
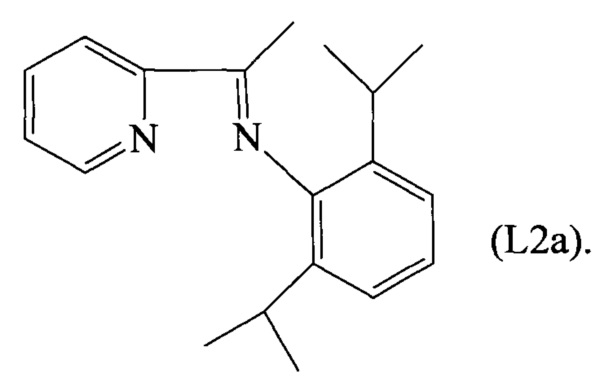
Пример 2. Синтез лиганда, имеющего формулу (L2)

2.1 Синтез соединения, имеющего формулу (L2a)
В сосуд объемом 500 мл в раствор 2,6-диизопропиланилина (13,3 г, 75 ммоль) в метаноле (300 мл) добавляли 2-ацетилпиридин (9,1 г, 75 ммоль), полученную смесь оставляли при перемешивании при комнатной температуре в течение 48 часов. Полученный осадок отфильтровывали и затем сушили в вакууме с получением 14 г желтого кристаллического порошка (выход 67%), соответствующего соединению, имеющему формулу (L2a).
Элементный анализ (обнаруженное (вычисленное)): С: 81,37% (81,38%), Н: 8,64% (8,63%), N: 10,01% (9,99%).
1Н-ЯМР (CDCl3, δ м.д.): 8,69 (д, 1Н, РуН), 8,38 (д, 1Н, РуН), 7,82 (т, 1Н, РуН), 7,39 (м, 1Н, РуН), 7,11-7,20 (м, 3H, ArH), 2,75 (м, 2Н, СНМе2), 2,21 (с, 3H, N=CH-Me), 1,15 (д, 12Н, CH(CH3)2).
2.2 Синтез лиганда, имеющего формулу (L2)
В реактор объемом 2 литра, снабженный мешалкой, загружали 24 г (85 ммоль) соединения, имеющего формулу (L2a), полученного как описано выше, и 900 мл безводного метанола, всю смесь охлаждали до 0°C и затем небольшими порциями добавляли боргидрид натрия (48,6 г, 1285 ммоль). Полученную смесь оставляли при комнатной температуре при перемешивании на ночь и затем быстро охлаждали солевым раствором и экстрагировали с использованием этилацетата. Растворитель затем удаляли путем перегонки при пониженном давлении и полученный остаток очищали путем элюирования на хроматографической колонке с силикагелем (элюент: смесь гексана и этилацетата в отношении 9/1 (об/об)) и затем обрабатывали холодным этиловым эфиром с получением 11 г белого кристаллического твердого вещества (выход 46%), соответствующего лиганду, имеющему формулу (L2).
Элементный анализ (обнаруженное (вычисленное)): С: 81,03% (80,80%), Н: 9,42% (9,28%), N: 10,01% (9,92%).
ГХ-МС: М+=m/z 282, [М-С3Н7]+=m/z 239, [M-C7H8N]+=m/z 176, [М-C12H18N]+=m/z 106.
1Н-ЯМР (CDCl3, δ м.д.): 8,64 (д, 1Н, НРу), 7,53 (дт, 1Н, НРу), 7,2 (д, 1Н, НРу), 7,00-7,12 (м, 1Н, НРу; м, 3H, ArH), 4,0-4,2 (м, 1Н, NCH(CH3); м, 1Н, NH), 3,30 (септ, 2Н, -СН(СН3)2), 1,55 (д, 3H, -NCH(CH3)), 1,10 (с, 12Н, -СН(СН3)2).
Пример 3. Синтез лиганда, имеющего формулу (L3)

3.1 Синтез соединения, имеющего формулу (L3a)

В сосуд объемом 500 мл в раствор 2-трет-бутиланилина (15,89 г, 106,5 ммоль) в метаноле (300 мл) добавляли 2-ацетилпиридин (12,9 г, 106,5 ммоль), полученную смесь оставляли при перемешивании при комнатной температуре в течение 48 часов. Растворитель затем удаляли упариванием и полученный остаток кристаллизовали с использованием метанола с получением 20 г желтого кристаллического порошка (выход 75%), соответствующего соединению, имеющему формулу (L3a).
Элементный анализ (обнаруженное (вычисленное)): С: 81,17% (80,91%), Н: 8,14% (7,99%), N: 10,91% (11,10%).
3.2 Синтез лиганда, имеющего формулу (L3)
В реактор объемом 2 литра, снабженный мешалкой, загружали 28 г (111 ммоль) соединения, имеющего формулу (L3a), полученного как описано выше, и 800 мл безводного метанола, всю смесь охлаждали до 0°C и затем небольшими порциями добавляли боргидрид натрия (38 г, 1004 ммоль). Полученную смесь оставляли при комнатной температуре при перемешивании на ночь и затем быстро охлаждали солевым раствором и экстрагировали с использованием этилацетата. Растворитель затем удаляли путем перегонки при пониженном давлении и полученный остаток очищали путем элюирования на хроматографической колонке с силикагелем (элюент: смесь гексана и этилацетата в отношении 9/1 (об/об)) и затем обрабатывали холодным этиловым эфиром с получением 11 г белого кристаллического твердого вещества (выход 39%), соответствующего лиганду, имеющему формулу (L3).
Элементный анализ (обнаруженное (вычисленное)): С: 80,00% (80,27%), Н: 9,12% (8,72%), N: 11,31% (11,01%).
ГХ-МС: М+=m/z 254, [М-СН3]+=m/z 239, [М-С4Н9]+=m/z 197, m/z=183, m/z 132 C7H10N2, [M-C10H14N]+=m/z 106, [M-C12H18N]+=m/z 78.
1Н-ЯМР (CDCl3, δ м.д.): 8,64 (д, 1H, НРу), 7,7 (тд, 1H, РуН), 7,36 (д, 1Н, НРу), 7,25 (д, 1Н, ArH), 7,18 (тд, 1Н, РуН), 6,98 (тд, 1Н, РуН), 6,98 (тд, 1Н, РуН), 6,48 (д, 1Н, РуН), 5,0 (широкий с, 1Н, NH), 4,7 (кварт, 1Н, NCH(CH3)), 1,57 (д, 3H, -NCH(CH3)), 1,5 (с, 9Н, -С(СН3)3).
Пример 4. Синтез лиганда, имеющего формулу (L4)

4.1 Синтез соединения, имеющего формулу (L4a)

В сосуд объемом 500 мл в раствор 2-бензоилпиридина (20 г, 109 ммоль) в метаноле (200 мл) добавляли анилин (11,2 г, 120 ммоль) и несколько капель муравьиной кислоты, полученную смесь оставляли при перемешивании при комнатной температуре в течение 48 часов. Затем полученную смесь сушили в вакууме и полученный осадок очищали путем элюирования на хроматографической колонке с силикагелем (элюент: смесь гептана и этилацетата в отношении 99/1 (об/об)) с получением 14,4 г желтоватого масла (выход 51%), соответствующего соединению, имеющему формулу (L4a).
Элементный анализ (обнаруженное (вычисленное)): С: 84.00% (83,69%), Н: 5,83% (5,46%), N: 11,52% (10,84%).
ГХ-МС: М+=m/z 258, m/z 180, 155, 77, 51.
4.2 Синтез лиганда, имеющего формулу (L4)
В реактор объемом 2 литра, снабженный мешалкой, загружали 14 г (85 ммоль) соединения, имеющего формулу (L4a), полученного как описано выше, и 900 мл безводного метанола, всю смесь охлаждали до 0°C и затем небольшими порциями добавляли боргидрид натрия (31 г, 819 ммоль). Полученную смесь оставляли при комнатной температуре при перемешивании на ночь и затем быстро охлаждали солевым раствором и экстрагировали с использованием этилацетата. Растворитель затем удаляли путем перегонки при пониженном давлении и полученный остаток очищали путем элюирования на хроматографической колонке с силикагелем (элюент: смесь гексана и этилацетата в отношении 9/1 (об/об)) и затем обрабатывали холодным этиловым эфиром с получением 12,5 г белого кристаллического твердого вещества (выход 56,5%), соответствующего лиганду, имеющему формулу (L4).
Элементный анализ (обнаруженное (вычисленное)): С: 83,30% (83,04%), Н: 6,87% (6,19%), N: 11,01% (10,76%).
ГХ-МС: М+=m/z 260, m/z 182, 168, 104, 77 51.
1Н-ЯМР (CDCl3, δ м.д.): 8,6 (м, 1Н, РуН), 7,62-7,69 (м, 1Н, РуН), 7,45-7,50 (м, 2Н, ArH), 7,30-7,38 (м, 1Н, НРу; м, 2Н, ArH), 7,23-7,27 (м, 1Н, ArH), 7,18-7,21 (м, 1Н, РуН), 7,05-7,13 (м, 2Н, NH-ArH), 6,60-6,65 (м, 3H, NH-ArH), 5,55 (с, 1Н, NH), 5,50 (с, 1Н, -NCH).
Пример 5. Синтез лиганда, имеющего формулу (L5)

5.1 Синтез соединения, имеющего формулу (L5a)

В сосуд объемом 500 мл в раствор анилина (26,1 г, 280 ммоль) в метаноле (250 мл) добавляли 2-пиридинкарбоксиальдегид (30 г, 280 ммоль) и несколько капель муравьиной кислоты, полученную смесь оставляли при перемешивании при комнатной температуре в течение 48 часов. Затем полученную смесь сушили в вакууме и полученный осадок очищали путем элюирования в хроматографической колонне с силикагелем (элюент: смесь гептана и этилацетата в отношении 99/1 (об/об)) с получением 38 г желтоватого твердого вещества (выход 74,5%), соответствующего соединению, имеющему формулу (L5a).
Элементный анализ (обнаруженное (вычисленное)): С: 80,00% (79,10%), Н: 5,83% (5,53%), N: 15,71% (15,37%).
1Н-ЯМР (CDCl3, δ м.д.): 8,70 (д, 1Н, НРу), 8,59 (с, 1Н СН=N), 8,19 (д, 1Н, НРу), 7,77 (dт, 1Н, НРу), 7,23-7,42 (м, 1Н, НРу; м, 5Н, Ar).
5.2 Синтез лиганда, имеющего формулу (L5)
В реактор объемом 2 литра, снабженный мешалкой, загружали 13 г (71,3 ммоль) соединения, имеющего формулу (L5a), полученного как описано выше, и 700 мл безводного метанола, всю смесь охлаждали до 0°C и затем небольшими порциями добавляли боргидрид натрия (40 г, 1057 ммоль). Полученную смесь оставляли при комнатной температуре при перемешивании на ночь и затем быстро охлаждали солевым раствором и экстрагировали с использованием этилацетата. Растворитель затем удаляли путем перегонки при пониженном давлении и полученный остаток очищали путем элюирования на хроматографической колонке с силикагелем (элюент: смесь гексана и этилацетата в отношении 9/1 (об/об)) и затем обрабатывали холодным этиловым эфиром с получением 9,12 г белого кристаллического твердого вещества (выход 69,5%), соответствующего лиганду, имеющему формулу (L5).
ГХ-МС: М+=m/z 184, [M-C6H6N]+=m/z 106, [M-C7H7N2]+=m/z 77.
1Н-ЯМР (CDCl3, δ м.д.): 8,60 (дд, 1H, РуН), 7,64 (м, 1Н, РуН), 7,35 (д, 1Н, РуН), 7,22-7,17 (м, 1Н, Ру, 2Н, ArH), 6,75 (дт, 1Н, ArH), 6,69 (д, 2Н, ArH), 4,8 (с, 1Н, NH), 4,48 (с, 2Н, Py-CH2N).
Пример 6. Синтез лиганда, имеющего формулу (L6)

6.1 Синтез соединения, имеющего формулу (L6a)

В сосуд объемом 500 мл в раствор 2,6-диметиланилина (31 г, 250 ммоль) в метаноле (250 мл) добавляли 2-пиридинкарбоксиальдегид (26,8 г, 250 ммоль) и несколько капель муравьиной кислоты, полученную смесь оставляли при перемешивании при комнатной температуре в течение 24 часов. Затем полученную смесь сушили на сульфате натрия и фильтровали и растворитель удаляли упариванием в вакууме, полученный осадок промывали холодным метанолом с получением 47 г оранжевого твердого вещества (выход 89%), соответствующего соединению, имеющему формулу (L6a).
Элементный анализ (обнаруженное (вычисленное)): С: 80,00% (79,97%), Н: 6,81% (6,71%), N: 13,71% (13,37%).
1Н-ЯМР (CDCl3, δ м.д.): 8,70 (д, 1Н, НРу), 8,33 (с, 1Н, CH=N), 8,23 (д, 1Н, НРу), 7,82 (дт, 1Н, НРу), 7,38 (ддд, 1Н, НРу), 6,91-7,15 (м, 5Н, Ar), 2,16 (с, 6Н, Ar-СН3).
6.2 Синтез лиганда, имеющего формулу (L6)
В реактор объемом 2 литра, снабженный мешалкой, загружали 18 г (85,6 ммоль) соединения, имеющего формулу (L6a), полученного как описано выше, и 800 мл безводного метанола, всю смесь охлаждали до 0°C и затем небольшими порциями добавляли боргидрид натрия (24 г, 634 ммоль). Полученную смесь оставляли при комнатной температуре при перемешивании на ночь и затем быстро охлаждали солевым раствором и экстрагировали с использованием этилацетата. Растворитель затем удаляли путем перегонки при пониженном давлении и полученный остаток очищали путем элюирования на хроматографической колонке с силикагелем (элюент: смесь гексана и этилацетата в отношении 9/1 (об/об)) и затем обрабатывали холодным этиловым эфиром с получением 9,15 г белого кристаллического твердого вещества (выход 50,4%), соответствующего лиганду, имеющему формулу (L6).
ГХ-МС: М+=m/z 212, [M-C6H6N]+=m/z 120.
1Н-ЯМР (CDCl3, δ м.д.): 8,63 (д, 1Н, РуН), 7,65 (дт, 1Н, РуН), 7,27 (д, 1Н, РуН), 7,20 (дд, 1Н, РуН), 7,02 (д, 2Н, ArH), 6,85 (м, 1Н, ArH), 4,4 (широкий с, 1Н, NH), 4,31 (с, 2Н, Py-CH2N), 2,35 (с, 6Н, ArCH3).
Пример 7. Синтез лиганда, имеющего формулу (L7)

7.1 Синтез соединения, имеющего формулу (L7a)

В сосуд объемом 500 мл в раствор 2,4,6-триметиланилина (12,6 г, 93 ммоль) в метаноле (250 мл) добавляли 2-пиридинкарбоксиальдегид (10 г, 93 ммоль) и несколько капель муравьиной кислоты, полученную смесь оставляли при перемешивании при комнатной температуре в течение 48 часов. Затем растворитель удаляли упариванием в вакууме и полученный маслянистый остаток очищали путем элюирования на хроматографической колонке с силикагелем (элюент: смесь гептана и этилацетата в отношении 99/1 (об/об)) с получением с получением 17 г желтоватого твердого вещества (выход 81%), соответствующего соединению, имеющему формулу (L7a).
Элементный анализ (обнаруженное (вычисленное)): С: 80,56% (80,32%), Н: 7,22% (7,19%), N: 13,11% (12,49%).
ГХ-МС: М+=m/z 224, [М-СН3]+=m/z 209, [M-C5H4N]+=m/z 146.
1Н-ЯМР (CDCl3, δ м.д.): 8,70 (м, 1Н, НРу), 8,35 (с, 1Н CH=N), 8.29 (д, 1Н, НРу), 7.84 (тдд, 1Н, НРу), 7,41 (м, 1Н, НРу), 6,91 (с, 2Н ArH), 2,31 (с, 3H Ar(СН3)), 2,10 (с, 6HAr(СН3)2).
7.2 Синтез лиганда, имеющего формулу (L7)
В реактор объемом 2 литра, снабженный мешалкой, загружали 13 г (58 ммоль) соединения, имеющего формулу (L7a), полученного как описано выше, 80 мл безводного метанола, 80 мл хлороформа и небольшими порциями боргидрид натрия (2,2 г, 58 ммоль). Полученную смесь оставляли при комнатной температуре при перемешивании на ночь. Растворители затем удаляли путем перегонки при пониженном давлении и полученный остаток экстрагировали с использованием смеси этилацетата (50 мл) и воды (50 мл). Полученные органические экстракты промывали, используя воду, до нейтрального состояния, обезвоживали над сульфатом натрия, отфильтровывали и подвергали перегонке при пониженном давлении для удаления оставшегося растворителя с получением маслянистого окрашенного в желтый цвет остатка. К указанному маслянистому остатку добавляли 25 мл холодного гептана с получением 5,15 г белого кристаллического твердого вещества (выход 39%), соответствующего лиганду, имеющему формулу (L7).
ГХ-МС: М+=m/z 226, [M-C6H6N]+=m/z 134.
1Н-ЯМР (CDCl3, δ м.д.): 8,59 (д, 1Н, РуН), 7,65 (дт, 1Н, РуН), 7,27 (д, 1Н, РуН), 7,20 (м, 1Н, РуН), 6,8 (д, 2Н, ArH), 4,2 (с, 2Н, Py-CH2N), 4,1 (широкий с, 1Н, NH), 2,28 (с, 6Н, ArCH3), 2,2 (с, 3H, Ar-CH3).
Пример 8. Синтез ZrCl3(L1) (образец ВМ2-199)
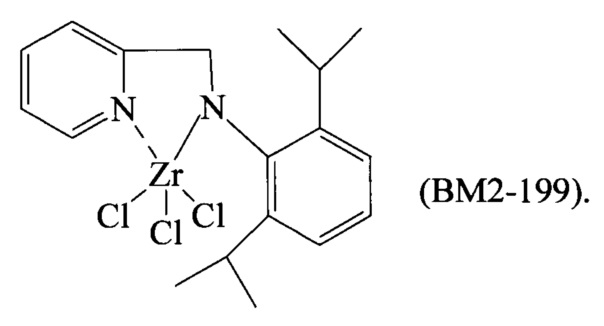
Тетрахлорид циркония (ZrCl4) (0,500 г, 2,14 ммоль) вводили в длинногорлую колбу объемом 100 мл вместе с раствором лиганда, имеющего формулу (L1) (0,599 г, 2,22 ммоль, молярное отношение L1/Zr=1,03), полученного как описано в примере 1, в толуоле (15 мл). Полученную смесь оставляли при перемешивании при комнатной температуре в течение 30 минут и затем нагревали при кипячении с обратным холодильником в течение 2 часов. Образованное твердое вещество извлекали путем фильтрации, промывали гептаном (2×2 мл) и сушили при пониженном давлении при комнатной температуре с получением 0,66 г (выход 66%) светло-желтого микрокристаллического твердого продукта, соответствующего комплексу ZrCl3(L1).
Элементный анализ (обнаруженное (вычисленное)): С: 45,87% (46,49%), Н: 4,65% (4,98%), N: 5,45% (6,02%), Zr: 18,72% (19,62%), CI: 21,65% (22,87%).
На Фиг. 1 показан ИК спектр с преобразованием Фурье в комбинации с методом НПВО полученного комплекса ZrCl3(L1).
На Фиг. 2 показан спектр ЯМР1Н полученного комплекса ZrCl3(L1).
Пример 9. Синтез ZrCl3(L2) (образец ВМ2-207)

Тетрахлорид циркония (ZrCl4) (0,398 г, 1,71 ммоль) вводили в длинногорлую колбу объемом 100 мл вместе с раствором лиганда, имеющего формулу (L2) (0,507 г, 1,80 ммоль, молярное отношение L2/Zr=1,05), полученного как описано в примере 2, в толуоле (10 мл). Полученную смесь оставляли при перемешивании при комнатной температуре в течение 30 минут и затем нагревали при кипячении с обратным холодильником в течение 2 часов. Образованное твердое вещество извлекали путем фильтрации, промывали гептаном (2×2 мл) и сушили при пониженном давлении при комнатной температуре с получением 0,71 г (выход 86%) светло-желтого микрокристаллического твердого продукта, соответствующего комплексу ZrCl3(L2).
Элементный анализ (обнаруженное (вычисленное)): С: 46,87% (47,64%), Н: 4,85% (5,26%), N: 5,21% (5,84%), Zr: 19,87% (19,04%), Cl: 21,89% (22,20%).
На Фиг. 3 показан ИК спектр с преобразованием Фурье в комбинации с методом НПВО полученного комплекса ZrCl3(L2).
На Фиг. 4 показан спектр ЯМР1Н полученного комплекса ZrCl3(L2).
Пример 10. Синтез ZrCl3(L3) (образец МТ-2)

Тетрахлорид циркония (ZrCl4) (0,525 г, 2,25 ммоль) вводили в длинногорлую колбу объемом 100 мл вместе с раствором лиганда, имеющего формулу (L3) (0,570 г, 2,24 ммоль, молярное отношение L3/Zr=1), полученного как описано в примере 3, в толуоле (10 мл). Полученную смесь оставляли при перемешивании при комнатной температуре в течение 30 минут и затем нагревали при кипячении с обратным холодильником в течение 2 часов. Образованное твердое вещество извлекали путем фильтрации, промывали гептаном (2×2 мл) и сушили при пониженном давлении при комнатной температуре с получением 0,81 г (выход 80%) светло-желтого микрокристаллического твердого продукта, соответствующего комплексу ZrCl3(L3).
Элементный анализ (обнаруженное (вычисленное)): С: 44,82% (45,28%), Н: 4,05% (4,69%), N: 5,95% (6,21%), Zr: 19,99% (20,23%), Cl: 23,00% (23,58%).
Пример 11. Синтез ZrCl3(L5) (образец МТ-4)

Тетрахлорид циркония (ZrCl4) (0,368 г, 1,58 ммоль) вводили в длинногорлую колбу объемом 100 мл вместе с раствором лиганда, имеющего формулу (L5) (0,289 г, 1,58 ммоль, молярное отношение L5/Zr=1), полученного как описано в примере 5, в толуоле (10 мл). Полученную смесь оставляли при перемешивании при комнатной температуре в течение 30 минут и затем нагревали при кипячении с обратным холодильником в течение 2 часов. Образованное твердое вещество извлекали путем фильтрации, промывали гептаном (2×2 мл) и сушили при пониженном давлении при комнатной температуре с получением 0,26 г (выход 43%) светло-желтого микрокристаллического твердого продукта, соответствующего комплексу ZrCl3(L5).
Элементный анализ (обнаруженное (вычисленное)): С: 36,87% (37,85%), Н: 2,65% (2,91%), N: 6,95% (7,36%), Zr: 22,98% (23,95%), Cl: 27,42% (27,93%).
На Фиг. 5 показан ИК спектр с преобразованием Фурье в комбинации с методом НПВО полученного комплекса ZrCl3(L5).
Пример 12. Синтез ZrCl3(L6) (образец МТ-30)

Тетрахлорид циркония (ZrCl4) (0,317 г, 1,36 ммоль) вводили в длинногорлую колбу объемом 100 мл вместе с раствором лиганда, имеющего формулу (L6) (0,289 г, 1,36 ммоль, молярное отношение L6/Zr=1), полученного как описано в примере 6, в толуоле (10 мл). Полученную смесь оставляли при перемешивании при комнатной температуре в течение 30 минут и затем нагревали при кипячении с обратным холодильником в течение 2 часов. Образованное твердое вещество извлекали путем фильтрации, промывали гептаном (2×2 мл) и сушили при пониженном давлении при комнатной температуре с получением 0,50 г (выход 90%) светло-желтого микрокристаллического твердого продукта, соответствующего комплексу ZrCl3(L6).
Элементный анализ (обнаруженное (вычисленное)): С: 41,52% (41,12%), Н: 3,15% (3,70%), N: 6,15% (6,85%), Zr: 21,95% (22,31%), Cl: 25,75% (26,01%).
Пример 13. Синтез ZrCl3(L7) (образец МТ-52)

Тетрахлорид циркония (ZrCl4) (0,351 г, 1,51 ммоль) вводили в длинногорлую колбу объемом 100 мл вместе с раствором лиганда, имеющего формулу (L7) (0,341 г, 1,51 ммоль, молярное отношение L7/Zr=1), полученного как описано в примере 7, в толуоле (10 мл). Полученную смесь оставляли при перемешивании при комнатной температуре в течение 30 минут и затем нагревали с обратным холодильником в течение 2 часов. Образованное твердое вещество извлекали путем фильтрации, промывали гептаном (2×2 мл) и сушили при пониженном давлении при комнатной температуре с получением 0,50 г (выход 78%) светло-желтого микрокристаллического твердого продукта, соответствующего комплексу ZrCl3(L7).
Элементный анализ (обнаруженное (вычисленное)): С: 42,00% (42,60%), Н: 3,75% (4,05%), N: 6,01% (6,62%), Zr: 20,87% (21,57%), Cl: 24,98% (25,15%).
Пример 14. Синтез ZrCl3(L4) (образец МТ-56)

Тетрахлорид циркония (ZrCl4) (0,212 г, 0,910 ммоль) вводили в длинногорлую колбу объемом 100 мл вместе с раствором лиганда, имеющего формулу (L4) (0,236 г, 0,910 ммоль, молярное отношение L4/Zr=1), полученного как описано в примере 4, в толуоле (10 мл). Полученную смесь оставляли при перемешивании при комнатной температуре в течение 30 минут и затем нагревали при кипячении с обратным холодильником в течение 2 часов. Образованное твердое вещество извлекали путем фильтрации, промывали гептаном (2×2 мл) и сушили при пониженном давлении при комнатной температуре с получением 0,245 г (выход 62%) светло-желтого микрокристаллического твердого продукта, соответствующего комплексу ZrCl3(L4).
Элементный анализ (обнаруженное (вычисленное)): С: 46,88% (47,32%), Н: 3,01% (3,30%), N: 5,76% (6,13%), Zr: 29,44% (19,96%), Cl: 24,01% (23,27%).
Пример 15. Синтез ZrCl2(L5)2 (образец МТ-81)

В длинногорлую колбу объемом 100 мл вводили раствор лиганда, имеющего формулу (L5) (0,38 г, 2,08 ммоль), полученного как описано в примере 5, в тетрагидрофуране (10 мл), весь раствор охлаждали до -70°C и затем по капле добавляли раствор н-бутиллития (0,87 мл, 2,17 ммоль) в гексане с получением желто-оранжевой суспензии. Полученную суспензию нагревали до комнатной температуры и оставляли при перемешивании при этой температуре в течение 3 часов. Затем по каплям добавляли раствор комплекса тетрахлорид циркония : тетрагидрофуран (1:2) [ZrCl4(ТГФ)2] (0,391 г, 1,04 ммоль, молярное отношение L5/Zr=2) в тетрагидрофуране (30 мл), после добавления первых 10 мл получали оранжевый раствор, при этом в конце добавления получали желтый раствор, который оставляли при перемешивании при комнатной температуре на одну ночь. Затем растворитель удаляли путем перегонки при пониженном давлении при комнатной температуре с получением желтого остатка, который обрабатывали дихлорметаном (15 мл). Полученную суспензию фильтровали и фильтрат концентрировали до половины объема, обрабатывая гексаном (20 мл), и удерживали при -30°C в течение одной ночи. Затем полученный остаток извлекали путем фильтрации, промывали гептаном (2×1 мл) и сушили в вакууме при комнатной температуре с получением 0,27 г (выход 35%) коричневого микрокристаллического твердого продукта, соответствующего комплексу ZrCl2(L5)2.
Элементный анализ (обнаруженное (вычисленное)): С 53,79% (53,54%), Н: 3,89% (4,19%), N: 10,99% (10,60%), Zr: 18,01% (17,26%), Cl: 12,98% (13,41%).
Пример 16 (GL957)
В тестовой пробирке объемом 50 мл конденсировали на холоду (-20°) 2 мл 1,3-бутадиена, что приблизительно равно 1,4 г. Затем добавляли 4,65 мл толуола и температуру полученного таким образом раствора доводили до 20°C. Затем добавляли раствор метилалюмоксана (МАО) в толуоле (15,75 мл, 2,5×10-2 2 моль, что приблизительно равно 1,45 г), после чего добавляли комплекс ZrCl3(L1) (образец ВМ2-199) (4,6 мл раствора в толуоле с концентрацией 5 мг/мл, 5×10-5 моль, что приблизительно равно 23 мг), полученный как описано в примере 8. Всю смесь выдерживали при перемешивании магнитной мешалкой при 20°C в течение 6 часов. Полимеризацию затем резко пркращали путем добавления 2 мл метанола, содержащего несколько капель соляной кислоты. Полученный полимер затем коагулировали путем добавления 40 мл метанольного раствора, содержащего 4% антиоксиданта Irganox® 1076 (Ciba), с получением 0,97 г полибутадиена, имеющего содержание 1,4-транс звеньев, составляющее 96%. Дополнительные характеристики способа и полученного полибутадиена показаны в таблице 1.
На Фиг. 6(a) показан ИК спектр с преобразованием Фурье полученного полибутадиена.
Пример 17 (GL959)
В тестовой пробирке объемом 50 мл конденсировали на холоду (-20°) 2 мл 1,3-бутадиена, что приблизительно равно 1,4 г. Затем добавляли 4,45 мл толуола и температуру полученного таким образом раствора доводили до 20°C. Затем добавляли раствор метилалюмоксана (МАО) в толуоле (15,75 мл, 2,5×10-2 2 моль, что приблизительно равно 1,45 г), после чего добавляли комплекс ZrCl3(L2) (образец ВМ2-207) (4,8 мл раствора в толуоле с концентрацией 5 мг/мл, 5×10-5 моль, что приблизительно равно 24 мг), полученный как описано в примере 9. Всю смесь поддерживали при перемешивании магнитной мешалкой при 20°C в течение 7 часов. Полимеризацию затем резко прекращали путем добавления 2 мл метанола, содержащего несколько капель соляной кислоты. Полученный полимер затем коагулировали путем добавления 40 мл метанольного раствора, содержащего 4% антиоксиданта Irganox® 1076 (Ciba), с получением 0,63 г полибутадиена, имеющего содержание 1,4-транс звеньев, составляющее 95%. Дополнительные характеристики способа и полученного полибутадиена показаны в таблице 1.
На Фиг. 6(b) показан ИК спектр с преобразованием Фурье полученного полибутадиена.
На Фиг. 7 показан спектр ЯМР13С полученного полибутадиена.
На Фиг. 12 показан хроматограмма ГПХ полученного полибутадиена.
Пример 18 (ММ20)
В первой тестовой пробирке объемом 50 мл конденсировали на холоду (-20°) 2 мл 1,3-бутадиена, что приблизительно равно 1,4 г. Затем добавляли 10,1 мл толуола и температуру полученного таким образом раствора доводили до 20°C. Затем добавляли раствор сухого метилалюмоксана (сухой МАО) в толуоле (10 мл, 3×10-2 моль, что приблизительно равно 1,74 г). Во вторую тестовую пробирку объемом 10 мл вводили комплекс ZrCl3(L2) (образец ВМ2-207) (2,9 мл раствора в толуоле с концентрацией 5 мг/мл, 3×10-5 моль, что приблизительно равно 14,4 мг), полученный как описано в примере 9, и триэтилалюминий (2 мл раствора в толуоле с концентрацией 0,052 г/мл, 9×10-4 моль, что приблизительно равно 104 мг), всю смесь поддерживали при перемешивании при комнатной температуре в течение 10 минут и полученный раствор полностью добавляли в указанную первую пробирку. Всю смесь поддерживали при перемешивании Магнитной мешалкой при 20°C в течение 2 часов. Полимеризацию затем резко прекращали путем добавления 2 мл метанола, содержащего несколько капель соляной кислоты. Полученный полимер затем коагулировали путем добавления 40 мл метанольного раствора, содержащего 4% антиоксиданта Irganox® 1076 (Ciba), с получением 1,24 г полибутадиена, имеющего содержание 1,4-транс звеньев, составляющее 99%. Дополнительные характеристики способа и полученного полибутадиена показаны в таблице 1.
На Фиг. 6(c) показан ИК спектр с преобразованием Фурье полученного полибутадиена.
На Фиг. 8 показан спектр ЯМР1Н полученного полибутадиена.
На Фиг. 9 показан спектр ЯМР13С полученного полибутадиена.
На Фиг. 13 показана хроматограмма ГПХ полученного полибутадиена.
На Фиг. 18 показаны диаграммы ДСК полученного полибутадиена.
Пример 19 (G1125)
В первой тестовой пробирке объемом 25 мл конденсировали на холоду (-20°) 2 мл 1,3-бутадиена, что приблизительно равно 1,4 г. Затем добавляли 9,3 мл толуола и температуру полученного таким образом раствора доводили до 20°C. Затем добавляли раствор сухого метилалюмоксана (сухой МАО) в толуоле (10 мл, 3×10-2 моль, что приблизительно равно 1,74 г). Во вторую тестовую пробирку объемом 10 мл вводили комплекс ZrCl3(L3) (образец МТ-2) (2,7 мл раствора в толуоле с концентрацией 5 мг/мл, 3×10-5 моль, что приблизительно равно 13,4 мг), полученный как описано в примере 10, и диизобутилалюминий (DIBAH) (3 мл раствора в толуоле с концентрацией 0,040 г/мл, 8,4×10-4 моль, что приблизительно равно 120 мг), всю смесь поддерживали при перемешивании при комнатной температуре в течение 10 минут и полученный раствор полностью добавляли в указанную первую пробирку. Всю смесь поддерживали при перемешивании Магнитной мешалкой при 20°C в течение 4 часов. Полимеризацию затем резко прекращали путем добавления 2 мл метанола, содержащего несколько капель соляной кислоты. Полученный полимер затем коагулировали путем добавления 40 мл метанольного раствора, содержащего 4% антиоксиданта Irganox® 1076 (Ciba), с получением 1,24 г полибутадиена, имеющего содержание 1,4-транс звеньев, составляющее 99%. Дополнительные характеристики способа и полученного полибутадиена показаны в таблице 1.
На Фиг. 6(d) показан ИК спектр с преобразованием Фурье полученного полибутадиена.
Пример 20 (G1112)
В тестовой пробирке объемом 25 мл конденсировали на холоду (-20°) 2 мл 1,3-бутадиена, что приблизительно равно 1,4 г. Затем добавляли 5,15 мл толуола и температуру полученного таким образом раствора доводили до 20°C. Затем добавляли раствор метилалюмоксана (МАО) в толуоле (15,75 мл, 2,5×10-2 2 моль, что приблизительно равно 1,45 г), после чего добавляли комплекс ZrCl3(L6) (образец МТ-30) (4,1 мл раствора в толуоле с концентрацией 5 мг/мл, 3×10-5 моль, что приблизительно равно 20,5 мг), полученный как описано в примере 12. Всю смесь поддерживали при перемешивании Магнитной мешалкой при 20°C в течение 7 часов. Полимеризацию затем резко прекращали путем добавления 2 мл метанола, содержащего несколько капель соляной кислоты. Полученный полимер затем коагулировали путем добавления 40 мл метанольного раствора, содержащего 4% антиоксиданта Irganox® 1076 (Ciba), с получением 0,68 г полибутадиена, имеющего содержание 1,4-транс звеньев, составляющее 95%. Дополнительные характеристики способа и полученного полибутадиена показаны в таблице 1.
На Фиг. 10 показан спектр ЯМР1Н полученного полибутадиена.
На Фиг. 11 показан спектр ЯМР13С полученного полибутадиена.
Пример 21 (ММ21)
В первой тестовой пробирке объемом 25 мл конденсировали на холоду (-20°) 2 мл 1,3-бутадиена, что приблизительно равно 1,4 г. Затем добавляли 9,54 мл толуола и температуру полученного таким образом раствора доводили до 20°C. Затем добавляли раствор сухого метилалюмоксана (сухой МАО) в толуоле (10 мл, 3×10-2 моль, что приблизительно равно 1,74 г). Во вторую тестовую пробирку объемом 10 мл вводили комплекс ZrCl3(L6) (образец МТ-30) (2,7 мл раствора в толуоле с концентрацией 5 мг/мл, 3×10-5 моль, что приблизительно равно 13,44 мг), полученный как описано в примере 12, и триизобутилалюминий (TIBA) (3 мл раствора в толуоле с концентрацией 0,056 г/мл, 8,4×10-4 моль, что приблизительно равно 167 мг), всю смесь поддерживали при перемешивании при комнатной температуре в течение 10 минут и полученный раствор полностью добавляли в указанную первую пробирку. Всю смесь поддерживали при перемешивании магнитной мешалкой при 20°C в течение 4 часов. Полимеризацию затем резко прекращали путем добавления 2 мл метанола, содержащего несколько капель соляной кислоты. Полученный полимер затем коагулировали путем добавления 40 мл метанольного раствора, содержащего 4% антиоксиданта Irganox® 1076 (Ciba), с получением 1,15 г полибутадиена, имеющего содержание 1,4-транс звеньев, составляющее 99%. Дополнительные характеристики способа и полученного полибутадиена показаны в таблице 1.
На Фиг. 6(e) показан ИК спектр с преобразованием Фурье полученного полибутадиена.
На Фиг. 14 показан хроматограмма ГПХ полученного полибутадиена.
Пример 22 (G1120)
В тестовой пробирке объемом 25 мл конденсировали на холоду (-20°) 2 мл 1,3-бутадиена, что приблизительно равно 1,4 г. Затем добавляли 4,65 мл толуола и температуру полученного таким образом раствора доводили до 20°C. Затем добавляли раствор метилалюмоксана (МАО) в толуоле (15,75 мл, 2,5×10-2 2 моль, что приблизительно равно 1,45 г), после чего добавляли комплекс ZrCl3(L4) (образец МТ-56) (4,6 мл раствора в толуоле с концентрацией 5 мг/мл, 5×10-5 моль, что приблизительно равно 23 мг), полученный как описано в примере 14. Всю смесь поддерживали при перемешивании магнитной мешалкой при 20°C в течение 6 часов. Полимеризацию затем резко прекращали путем добавления 2 мл метанола, содержащего несколько капель соляной кислоты. Полученный полимер затем коагулировали путем добавления 40 мл метанольного раствора, содержащего 4% антиоксиданта Irganox® 1076 (Ciba), с получением 0,55 г полибутадиена, имеющего содержание 1,4-транс звеньев, составляющее 95%. Дополнительные характеристики способа и полученного полибутадиена показаны в таблице 1.
На Фиг. 15 показана хроматограмма ГПХ полученного полибутадиена.
Пример 23 (G1121)
В тестовой пробирке объемом 25 мл конденсировали на холоду (-20°) 2 мл 1,3-бутадиена, что приблизительно равно 1,4 г. Затем добавляли 2,15 мл толуола и температуру полученного таким образом раствора доводили до 20°C. Затем добавляли раствор метилалюмоксана (МАО) в толуоле (15,75 мл, 2,5×10-2 моль, что приблизительно равно 1,45 г), после чего добавляли комплекс ZrCl2(L5)2 (образец МТ-81) (5,3 мл раствора в толуоле с концентрацией 5 мг/мл, 5×10-5 моль, что приблизительно равно 26,4 мг), полученный как описано в примере 15. Всю смесь выдерживали при перемешивании магнитной мешалкой при 20°C в течение 5 часов. Полимеризацию затем резко прекращали путем добавления 2 мл метанола, содержащего несколько капель соляной кислоты. Полученный полимер затем коагулировали путем добавления 40 мл метанольного раствора, содержащего 4% антиоксиданта Irganox® 1076 (Ciba), с получением 1,36 г полибутадиена, имеющего содержание 1,4-транс звеньев, составляющее 94%. Дополнительные характеристики способа и полученного полибутадиена показаны в таблице 1.
На Фиг. 16 показана хроматограмма ГПХ полученного полибутадиена.
На Фиг. 17 показаны диаграммы ДСК полученного полибутадиена.

(a) температура плавления
(b) температура кристаллизации
Реферат
Изобретение относится к пиридиновому комплексу циркония, имеющему общую формулу (I):в которой Rи R, одинаковые или различные, представляют собой атом водорода или выбраны из C-Cалкильных групп, таких как метил, возможно замещенных арильных групп, таких как фенил или фенил, замещенный одной или более метильными, изопропильными, трет-бутильными группами, R, R, Rи R, идентичные друг другу, представляют собой атом водорода, X, Xи X, одинаковые или различные, представляют собой атом галогена, такого как хлор, бром, йод, или один из X, Xи Xпредставляет собой группу, имеющую общую формулу (II):где R, R, R, R, Rи Rимеют такие же значения, как описаны выше. Также предложены каталитическая система, способ полимеризации сопряженных диенов и способ полимеризации 1,3-бутадиена. Предложенный комплекс можно использовать в каталитической системе, которая обеспечивает получение полибутадиена с высоким содержанием 1,4-транс звеньев. 4 н. и 6 з.п. ф-лы, 18 ил., 1 табл., 23 пр.
Формула


Документы, цитированные в отчёте о поиске
Каталитическая система, способ полимеризации этилена и способ полимеризации линейных или разветвленных α-олефинов

Комментарии