Трициклические соединения бензопирана в качестве противоаритмических агентов - RU2380370C2
Код документа: RU2380370C2
Описание
Область техники
Настоящее изобретение относится к производным бензопирана, оказывающим пролонгирующее воздействие на рефракторный период, которые используются для лечения аритмии у млекопитающих, включая человека.
Уровень техники
В качестве производных бензопирана известны производные 4-ациламинобензопирана, проиллюстрированные на примере Кромакалима (например, выложенная заявка на патент Японии No. Sho. 58-67683). Известно, что данные производные 4-ациламинобензопирана, например Кромакалима, открывают АТФ-чувствительный К+ канал и поэтому являются эффективными для лечения гипертензии и астмы, но не имеется каких-либо упоминаний об их эффективности для лечения аритмии вследствие пролонгирующего воздействия на рефракторный период.
Кроме того, сообщалось, что производные 4-аминобензопирана, которые обладают β3-рецептор-стимулирующим действием, как предполагается, являются эффективными для лечения ожирения (например, WO 03/014113), но в данном документе не имеется каких-либо упоминаний об их эффективности для лечения аритмии вследствие пролонгирующего воздействия на рефракторный период.
Раскрытие изобретения
Между тем обычные антиаритмические агенты, оказывающие пролонгирующее воздействие на рефракторный период в качестве основного механизма (такие как лекарственные средства класса I по классификации антиаритмических агентов согласно Vaughan Williams или d-зоталол, или дофетилид, принадлежащие к классу III), вызывают терапевтические проблемы, индуцируя аритмию с высокой степенью опасности, приводящую к внезапной смерти среди прочего от такой причины как трепетание-мерцание (желудочков) вследствие пролонгирования потенциала действия вентикулярной мышцы, что коррелирует с пролонгирующим воздействием на рефракторный период. Таким образом, существует потребность в лекарственных средствах с меньшим количеством побочных эффектов.
Для решения указанной проблемы авторы настоящего изобретения исследовали соединения, оказывающие пролонгирующее воздействие на рефракторный период и селективные в отношении мышцы предсердия, а не вентикулярной мышцы, и установили, что соединение формулы (I) или (II) оказывает пролонгирующее воздействие на рефракторный период селективно в отношении мышцы предсердия и не оказывают какого-либо влияния на рефракторный период и потенциал действия вентикулярной мышцы. Таким образом было осуществлено настоящее изобретение.
Таким образом, настоящее изобретение включает следующие аспекты:
(1) производное бензопирана формулы (I) или (II) или его фармацевтически приемлемая соль

где R1 и R2 независимо представляют собой атом водорода, C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена) или гидроксигруппой), или C6-14арильную группу (где арильная группа может быть необязательно замещена атомом галогена, гидроксигруппой, нитрогруппой, цианогруппой, C1-6алкильной группой (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена) или гидроксигруппой) или C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена));
R3 представляет собой гидроксигруппу или C1-6алкилкарбонилоксигруппу, или R3 образует связь вместе с R4;
R4 представляет собой атом водорода или R4 образует связь вместе с R3;
m представляет собой целое число от 0 до 4;
n представляет собой целое число от 0 до 4;
V представляет собой простую связь, CR7R8, где R7 представляет собой - C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, гидроксигруппой, C1-6алкоксигруппой (где C1-6алкоксигруппа может быть необязательно замещена атомом галогена), C6-14арильной группой, C2-9гетероарильной группой (где каждая арильная группа или гетероарильная группа может быть необязательно замещена 1-3 заместителями R10, где R10 представляет собой атом галогена; гидроксигруппу; C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, гидроксигруппой или C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена)); C1-6алкоксигруппу (где алкоксигруппа может быть необязательно замещена атомом галогена); нитрогруппу; цианогруппу; формильную группу; формамидную группу; сульфониламиногруппу; сульфонильную группу; аминогруппу; C1-6алкиламиногруппу; ди-C1-6алкиламиногруппу; C1-6алкилкарбониламиногруппу; C1-6алкилсульфониламиногруппу; аминокарбонильную группу; C1-6алкиламинокарбонильную группу; ди-C1-6алкиламинокарбонильную группу; C1-6алкилкарбонильную группу; C1-6алкоксикарбонильную группу; аминосульфонильную группу; C1-6алкилсульфонильную группу; карбоксильную группу или C6-14арилкарбонильную группу, и когда присутствует несколько групп R10, они могут быть одинаковыми или отличаться друг от друга); C1-6алкилкарбонилоксигруппой; нитрогруппой; цианогруппой; формильной группой; формамидной группой; аминогруппой; C1-6алкиламиногруппой; ди-C1-6алкиламиногруппой; C1-6алкилкарбониламиногруппой; C1-6алкилсульфониламиногруппой; аминокарбонильной группой; C1-6алкиламинокарбонильной группой; ди-C1-6алкиламинокарбонильной группой; C1-6алкилкарбонильной группой; C1-6алкоксикарбонильной группой; аминосульфонильной группой; C1-6алкилсульфонильной группой; карбоксильной группой или сульфонильной группой);
- C6-14арильную группу, C2-9гетероарильную группу (где каждая арильная группа или гетероарильная группа может быть необязательно замещена 1-3 заместителями R10, где R10 имеет вышеуказанные значения);
- гидроксигруппу;
- С1-6алкоксигруппу (где алкоксигруппа может быть необязательно замещена атомом галогена) или
- нитрогруппу; цианогруппу; формильную группу; формамидную группу; сульфониламиногруппу; сульфонильную группу; аминогруппу; C1-6алкиламиногруппу; ди-C1-6алкиламиногруппу; C1-6алкилкарбониламиногруппу; Cl-6алкилсульфониламиногруппу; аминокарбонильную группу; C1-6алкиламинокарбонильную группу; ди-C1-6алкиламинокарбонильную группу; C1-6алкилкарбонильную группу; C1-6алкоксикарбонильную группу; аминосульфонильную группу; C1-6алкилсульфонильную группу; карбоксильную группу, C6-14арилкарбонильную группу или C2-9гетероарилкарбонильную группу (где каждая арилкарбонильная группа или гетероарилкарбонильная группа может быть необязательно замещена 1-3 заместителями R10, где R10имеет вышеуказанные значения), и
R8 представляет собой
- атом водорода,
- С1-6алкильную группу (где C1-6алкильная группа может быть необязательно замещена атомом галогена, гидроксигруппой, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), C6-14арильной группой, C2-9гетероарильной группой (где каждая арильная группа или гетероарильная группа может быть необязательно замещена 1-3 заместителями R17, где R17 имеет такое же значение, что и R10), C1-6алкилкарбонилоксигруппой; нитрогруппой; цианогруппой; формильной группой; формамидной группой; аминогруппой; C1-6алкиламиногруппой; ди-C1-6алкиламиногруппой; C1-6алкилкарбониламиногруппой; C1-6алкилсульфониламиногруппой; аминокарбонильной группой; C1-6алкиламинокарбонильной группой; ди-C1-6алкиламинокарбонильной группой; C1-6алкилкарбонильной группой; C1-6 алкоксикарбонильной группой; аминосульфонильной группой; C1-6алкилсульфонильной группой; карбоксильной группой или сульфонильной группой);
- C6-14арильную группу, C2-9гетероарильную группу (где каждая арильная группа или гетероарильная группа может быть необязательно замещена 1-3 заместителями R17, где R17 имеет такое же значение, что и R10);
- гидроксигруппу;
- С1-6алкоксигруппу (где алкоксигруппа может быть необязательно замещена атомом галогена) или
- нитрогруппу; цианогруппу; формильную группу; формамидную группу; сульфониламиногруппу; сульфонильную группу; аминогруппу; C1-6алкиламиногруппу; ди-C1-6алкиламиногруппу; C1-6алкилкарбониламиногруппу; Cl-6алкилсульфониламиногруппу; аминокарбонильную группу; C1-6алкиламинокарбонильную группу; ди-C1-6алкиламинокарбонильную группу; C1-6алкилкарбонильную группу; C1-6алкоксикарбонильную группу; аминосульфонильную группу; C1-6алкилсульфонильную группу; карбоксильную группу, C6-14арилкарбонильную группу или C2-9гетероарилкарбонильную группу (где каждая арилкарбонильная группа или гетероарилкарбонильная группа может быть необязательно замещена 1-3 заместителями R17, где R17имеет такое же значение, что и R10), или
R7 вместе с R8 могут представлять собой =O или =S, или
V представляет собой NR9, где R9 представляет собой атом водорода, C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), гидроксигруппой, C6-14арильной группой, C2-9гетероарильной группой (где каждая арильная группа или гетероарильная группа может быть необязательно замещена 1-3 заместителями R17, где R17 имеет такое же значение, что и R10); C1 6алкиламинокарбонильной группой, ди-C1-6алкиламинокарбонильной группой, C1-6алкилкарбонильной группой, C3-8циклоалкилкарбонильной группой, C1-6алкоксикарбонильной группой, C1-6алкилсульфонильной группой, карбоксильной группой, C6-14арилкарбонильной группой или C2-9гетероарилкарбонильной группой), C1-6 алкиламинокарбонильную группу, ди-C1-6алкиламинокарбонильную группу, C1-6алкилкарбонильную группу,
C3-8циклоалкилкарбонильную группу, C1-6алкоксикарбонильную группу, C1-6алкилсульфонильную группу, C6-14арилсульфонильную группу, C2-9гетероарилсульфонильную группу (где каждая арилсульфонильная группа или гетероарилсульфонильная группа может быть необязательно замещена 1-3 заместителями R17, где R17 имеет такое же значение, что и R10), карбоксильную группу; C6-14арилкарбонильную группу или C2-9гетероарилкарбонильную группу (где каждая арилкарбонильная группа или гетероарилкарбонильная группа может быть необязательно замещена 1-3 заместителями R17, где R17 имеет такое же значение, что и R10), или
V представляет собой O, S; SO или SO2;
R5 представляет собой атом водорода или C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена) или гидроксигруппой) и
R6представляет собой
- атом водорода,
- C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой),
- C3-8циклоалкильную группу, C3-8циклоалкенильную группу (где циклоалкильная группа или циклоалкенильная группа может быть необязательно замещена атомом галогена, C1-6алкильной группой (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой),
- аминогруппу, C1-6 алкиламиногруппу, ди-C1-6 алкиламиногруппу, С6-14 ариламиногруппу, C2-9 гетероариламиногруппу (где каждая ариламиногруппа или гетероариламиногруппа может быть необязательно замещена 1-3 заместителями R18, где R18 имеет такое же значение, что и R10);
- C6-14 арильную группу, С2-9 гетероарильную группу (где каждая арильная группа или гетероарильная группа может быть необязательно замещена 1-3 заместителями R18, где R18 имеет такое же значение, что и R10) или
- С2-9 гетероциклическую группу (где гетероциклическая группа может быть необязательно замещена атомом галогена, C1-6 алкильной группой (где алкильная группа может быть необязательно замещена атомом галогена, C1-6 алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), C1-6 алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), C6-14 арильной группой, С2-9 гетероарильной группой (где каждая арильная группа или гетероарильная группа может быть необязательно замещена 1-3 заместителями R18, где R18 имеет такое же значение, что и R10), гидроксигруппой, нитрогруппой, цианогруппой, формильной группой, формамидной группой, аминогруппой, C1-6 алкиламиногруппой, ди-C1-6 алкиламиногруппой, C1-6 алкилкарбониламиногруппой, C1-6 алкилсульфониламиногруппой, аминокарбонильной группой, C1-6 алкиламинокарбонильной группой, ди-C1-6 алкиламинокарбонильной группой, C1-6 алкилкарбонильной группой, C1-6 алкоксикарбонильной группой; аминосульфонильной группой, C1-6 алкилсульфонильной группой, карбоксильной группой или C6-14арилкарбонильной группой);
A представляет собой 5-, 6- или 7-членное кольцо, конденсированное с бензольным кольцом (где 5-, 6- или 7-членное кольцо может быть необязательно замещено 1-6 заместителями R21, где R21 имеет такое же значение, что и R10, и когда присутствует несколько заместителей R21, они могут быть одинаковыми или отличаться друг от друга), в состав кольца могут входить атом кислорода, атом азота или атом серы в количестве от 1 до 3 по отдельности или в сочетании друг с другом, число ненасыщенных связей в кольце равно 1, 2 или 3, включая ненасыщенную связь сконденсированного с ним бензольного кольца, атомы углерода в составе кольца, могут представлять собой карбонил или тиокарбонил;
(2) производное бензопирана или его фармацевтически приемлемая соль по п. 1, где A представляет собой
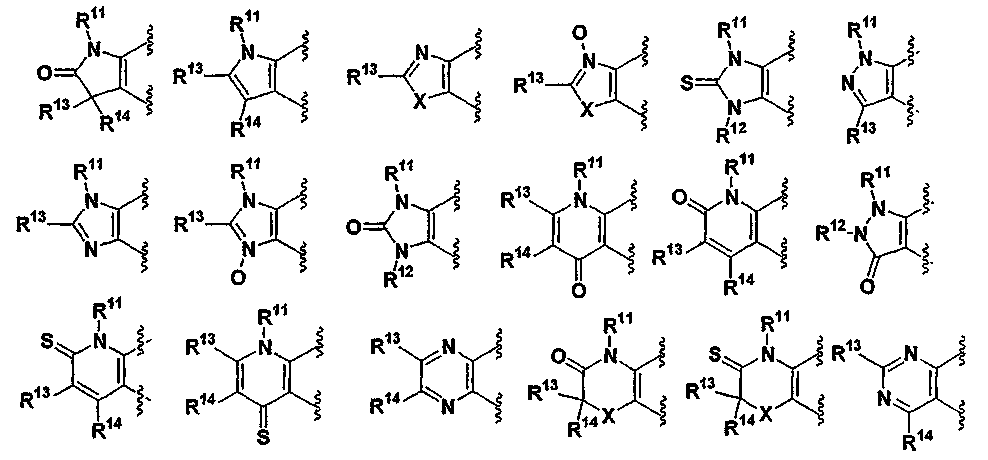


где R11 и R12 независимо представляют собой атом водорода, C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), гидроксигруппой, C6-14арильной группой, C2-9гетероарильной группой (где каждая арильная группа или гетероарильная группа может быть необязательно замещена 1-3 заместителями R19, где R19 имеет такое же значение, что и R10), C1-6алкиламинокарбонильной группой, ди-C1-6алкиламинокарбонильной группой, C1-6алкилкарбонильной группой, C3-8циклоалкилкарбонильной группой,
C1-6алкоксикарбонильной группой, C1-6алкилсульфонильной группой, карбоксильной группой, C6-14арилкарбонильной группой или C2-9гетероарилкарбонильной группой), C6-14арильную группу, C2-9гетероарильную группу (где каждая арильная группа или гетероарильная группа может быть необязательно замещена 1-3 заместителями R19, где R19 имеет такое же значение, что и R10), C1-6алкиламинокарбонильную группу, ди-C1-6алкиламинокарбонильную группу,
C1-6алкилкарбонильную группу, C3-8циклоалкилкарбонильную группу, C1-6алкоксикарбонильную группу, C1-6алкилсульфонильную группу, C6-14арилсульфонильную группу, C2-9гетероарилсульфонильную группу (где каждая арилсульфонильная группа или гетероарилсульфонильная группа может быть необязательно замещена 1-3 заместителями R19, где R19 имеет такое же значение, что и R10), карбоксильную группу; C6-14арилкарбонильную группу или C2-9гетероарилкарбонильную группу (где каждая арилкарбонильная группа или гетероарилкарбонильная группа может быть необязательно замещена 1-3 заместителями R19, где R19 имеет такое же значение, что и R10),
R13, R14, R15 и R16 независимо представляют собой атом водорода, атом галогена,
C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, гидроксигруппой, C6-14арильной группой, C2-9гетероарильной группой (где каждая арильная группа или гетероарильная группа может быть необязательно замещена 1-3 заместителями R20, где R20 имеет то же значение, что и R10), C1-6алкиламинокарбонильной группой, ди-C1-6алкиламинокарбонильной группой, C1-6алкилкарбонильной группой, C3-8циклоалкилкарбонильной группой, C1-6алкоксикарбонильной группой, C1-6алкилсульфонильной группой, карбоксильной группой, C6-14арилкарбонильной группой или C2-9гетероарилкарбонильной группой), C1-6алкоксигруппу (где алкоксигруппа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), карбоксильной группой, аминогруппой, гидроксигруппой, C6-14арильной группой или C2-9гетероарильной группой (где каждая арильная группа или гетероарильная группа может быть необязательно замещена 1-3 заместителями R20, где R20 имеет то же значение, что и R10)), C1-6тиоалкоксигруппу (где тиоалкоксигруппа может быть необязательно замещена атомом галогена, С1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), карбоксильной группой, гидроксигруппой, C6-14арильной группой или C2-9гетероарильной группой (где каждая арильная группа или гетероарильная группа может быть необязательно замещена 1-3 заместителями R20, где R20 имеет такое же значение, что и R10)), гидроксигруппу, C6-14арильную группу, C2-9гетероарильную группу (где каждая арильная группа или гетероарильная группа может быть необязательно замещена 1-3 заместителями R20, где R20 имеет такое же значение, что и R10), C1-6алкилкарбонилоксигруппу, нитрогруппу, цианогруппу, формильную группу, формамидную группу, аминогруппу, сульфонильную группу, C1-6алкиламиногруппу, ди-C1-6алкиламиногруппу, C6-14ариламиногруппу, C2-9гетероариламиногруппу (где каждая ариламиногруппа или гетероариламиногруппа может быть необязательно замещена 1-3 заместителями R20, где R20 имеет такое же значение, что и R10), C1-6алкилкарбониламиногруппу, C1-6алкилсульфониламиногруппу, аминокарбонильную группу, C1-6алкиламинокарбонильную группу, ди-C1-6алкиламинокарбонильную группу, C1-6алкилкарбонильную группу, C6-14арилкарбонильную группу, C2-9гетероарилкарбонильную группу (где каждая арилкарбонильная группа или гетероарилкарбонильная группа может быть необязательно замещена 1-3 заместителями R20, где R20 имеет такое же значение, что и R10), C1-6алкоксикарбонильную группу, аминосульфонильную группу, C1-6алкилсульфонильную группу, C6-14арилсульфонильную группу, C2-9гетероарилсульфонильную группу (где каждая арилсульфонильная группа или гетероарилсульфонильная группа может быть необязательно замещена 1-3 заместителями R20, где R20 имеет такое же значение, что и R10), карбоксильную группу, сульфонильную группу или С2-9 гетероциклическую группу (где гетероциклическая группа может быть необязательно замещена атомом галогена, C1-6 алкильной группой (где алкильная группа может быть необязательно замещена атомом галогена, C1-6 алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), C1-6 алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), C6-14 арильной группой, С2-9 гетероарильной группой (где каждая арильная группа или гетероарильная группа могут быть необязательно замещены 1-3 заместителями R20, где R20 имеет такое же значение, что и R10), гидроксигруппой, нитрогруппои, цианогруппои, формильнои группой, формамидной группой, аминогруппой, C1-6 алкиламиногруппой, ди-С1-6 алкиламиногруппой, C1-6 алкилкарбониламиногруппой, C1-6 алкилсульфониламиногруппой, аминокарбонильной группой, C1-6 алкиламинокарбонильной группой, ди-С1-6 алкиламинокарбонильной группой, C1-6 алкилкарбонильной группой, C1-6 алкоксикарбонильной группой, аминосульфонильной группой, C1-6 алкилсульфонильной группой, карбоксильной группой или С6-14 арилкарбонильной группой),
Х представляет собой О, S, SO или SO2;
(3) производное бензопирана или его фармацевтически приемлемая соль, как указано в (2), где R1 и R2 представляют собой метильную группу, R3 представляет собой гидроксигруппу и R4 представляет собой атом водорода;
(4) производное бензопирана или его фармацевтически приемлемая соль, как указано в (3), где R5 представляет собой атом водорода, m представляет собой целое число от 0 до 3 и n представляет собой целое число от 0 до 2;
(5) производное бензопирана или его фармацевтически приемлемая соль, как указано в (4), где V представляет собой простую связь;
(6) производное бензопирана или его фармацевтически приемлемая соль, как указано в (5), где m представляет собой целое число от 1 до 3, n равно 0 и R6 представляет собой С6-14 арильную группу, где арильная группа может быть необязательно замещена 1-3 заместителями R18, где R18 имеет такое же значение, что и R10;
(7) производное бензопирана или его фармацевтически приемлемая соль, как указано в (6), где m равно 2;
(8) производное бензопирана или его фармацевтически приемлемая соль, как указано в (7), где R6 представляет собой C6-14 арильную группу, где арильная группа может быть необязательно замещена 1-3 атомами галогена или аминогруппой, и когда присутствует множество заместителей, они могут быть одинаковыми или отличаться друг от друга;
(9) производное бензопирана или его фармацевтически приемлемая соль, как указано в (5), где m представляет собой целое число от 1 до 3, n равно 0, и R6 представляет собой C2-9 гетероарильную группу, где гетероарильная группа может быть необязательно замещена 1-3 заместителями R18, где R18 имеет такое же значение, что и R10;
(10) производное бензопирана или его фармацевтически приемлемая соль, как указано в (9), где m равно 2;
(11) производное бензопирана или его фармацевтически приемлемая соль, как указано в (10), где R6 представляет собой 2-пиридильную группу, 3-пиридильную группу или 4-пиридильную группу;
(12) производное бензопирана или его фармацевтически приемлемая соль, как указано в (5), где m представляет собой целое число от 1 до 3, n равно 0 и R6 представляет собой C2-4алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), C3-8циклоалкильную группу, C3-8циклоалкенильную группу (где циклоалкильная группа или циклоалкенильная группа может быть необязательно замещена атомом галогена, C1-6алкильной группой (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), или C2-9гетероциклическую группу (где гетероциклическая группа может быть необязательно замещена атомом галогена, C1-6алкильной группой (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), гидроксигруппой или аминогруппой);
(13) производное бензопирана или его фармацевтически приемлемая соль, как указано в (12), где m равно 2;
(14) производное бензопирана или его фармацевтически приемлемая соль, как указано в (13), где R6 представляет собой н-пропильную группу, изопропильную группу, ц-пентильную группу, ц-гексильную группу, 1-ц-пентенильную группу, 2-ц-пентенильную группу, 3-ц-пентенильную группу, 1-ц-гексенильную группу, 2-ц-гексенильную группу или 3-ц-гексенильную группу;
(15) производное бензопирана или его фармацевтически приемлемая соль, как указано в (4), где V представляет собой CR7R8;
(16) производное бензопирана или его фармацевтически приемлемая соль, как указано в (15), где R7 представляет собой гидроксигруппу, C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), C1-6алкоксигруппу (где алкоксигруппа может быть необязательно замещена атомом галогена), C1-6алкиламиногруппу, ди-C1-6алкиламиногруппу или карбоксильную группу, и R8 представляет собой атом водорода или C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), или R7 и R8 вместе представляют собой =O или =S;
(17) производное бензопирана или его фармацевтически приемлемая соль, как указано в (16), где R7 представляет собой гидроксигруппу, C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, гидроксигруппой или карбоксильной группой) или карбоксильную группу, и R8 представляет собой атом водорода или C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, гидроксигруппой или карбоксильной группой) или R7 и R8 вместе представляют собой =O;
(18) производное бензопирана или его фармацевтически приемлемая соль, как указано в (17), где R7 представляет собой гидроксигруппу, и R8представляет собой атом водорода;
(19) производное бензопирана или его фармацевтически приемлемая соль, как указано в (15), где m представляет собой целое число от 1 до 2, n равно 0 и R6 представляет собой C6-14арильную группу или C2-9гетероарильную группу, где каждая арильная группа или гетероарильная группа может быть необязательно замещена 1-3 заместителями R18, где R18имеет то же значение, что и R10;
(20) производное бензопирана или его фармацевтически приемлемая соль, как указано в (19), где R7 представляет собой гидроксигруппу, C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), C1-6алкоксигруппу (где алкоксигруппа может быть необязательно замещена атомом галогена), C1-6алкиламиногруппу, ди-C1-6алкиламиногруппу или карбоксильную группу, и R8 представляет собой атом водорода или C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), или R7 и R8 вместе представляют собой =O или =S;
(21) производное бензопирана или его фармацевтически приемлемая соль, как указано в (20), где R7 представляет собой гидроксигруппу, C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, гидроксигруппой или карбоксильной группой) или карбоксильную группу, и R8 представляет собой атом водорода или C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, гидроксигруппой или карбоксильной группой) или R7 и R8 вместе представляют собой =O;
(22) производное бензопирана или его фармацевтически приемлемая соль, как указано в (21), где R7 представляет собой гидроксигруппу и R8 представляет собой атом водорода.
(23) производное бензопирана или его фармацевтически приемлемая соль, как указано в (22), где m равно 1, n равно 0 и R6 представляет собой C6-14арильную группу, где арильная группа может быть необязательно замещена 1-3 атомами галогена или аминогруппами, и если присутствует множество заместителей, они могут быть идентичными или отличаться друг от друга;
(24) производное бензопирана или его фармацевтически приемлемая соль, как указано в (15), где m представляет собой целое число от 1 до 2, n равно 0 и R6 представляет собой C1-4алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), C3-8циклоалкильную группу, C3-8циклоалкенильную группу (где циклоалкильная группа или циклоалкенильная группа может быть необязательно замещена атомом галогена, C1-6алкильной группой (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), или C2-9гетероциклическую группу (где гетероциклическая группа может быть необязательно замещена атомом галогена, C1-6алкильной группой (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой);
(25) производное бензопирана или его фармацевтически приемлемая соль, как указано в (24), где R7 представляет собой гидроксигруппу, C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где C1-6алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), C1-6алкоксигруппу (где C1-6алкоксигруппа может быть необязательно замещена атомом галогена), C1-6алкиламиногруппу, ди-C1-6алкиламиногруппу или карбоксильную группу, и R8 представляет собой атом водорода или C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где С1-6 алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), или R7 и R8 вместе представляют собой =O или =S;
(26) производное бензопирана или его фармацевтически приемлемая соль, как указано в (25), где R7 представляет собой гидроксигруппу, C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, гидроксигруппой или карбоксильной группой) или карбоксильную группу, и R8представляет собой атом водорода или C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, гидроксигруппой или карбоксильной группой), или R7 и R8 вместе представляют собой =O;
(27) производное бензопирана или его фармацевтически приемлемая соль, как указано в (26), где R7 представляет собой гидроксигруппу и R8 представляет собой атом водорода;
(28) производное бензопирана или его фармацевтически приемлемая соль, как указано в (27), где R6 представляет собой н-пропильную группу, изопропильную группу, ц-пентильную группу, ц-гексильную группу, 1-ц-пентенильную группу, 2-ц-пентенильную группу, 3-ц-пентенильную группу, 1-ц-гексенильную группу, 2-ц-гексенильную группу или 3-ц-гексенильную группу;
(29) производное бензопирана или его фармацевтически приемлемая соль, как указано в (15), где R7 и R8 вместе представляют собой =O или =S и R6 представляет собой аминогруппу, C1-6алкиламиногруппу, ди-C1-6алкиламиногруппу, C6-14ариламиногруппу, C2-9гетероариламиногруппу (где каждая ариламиногруппа или гетероариламиногруппа может быть необязательно замещена 1-3 заместителями
R18, где R18 имеет такое же значение, что и R10), или C2-9гетероциклическую группу (где гетероциклическая группа может быть необязательно замещена атомом галогена, C1-6алкильной группой (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой);
(30) производное бензопирана или его фармацевтически приемлемая соль, как указано в (4), где V представляет собой NR9;
(31) производное бензопирана или его фармацевтически приемлемая соль, как указано в (30), где m представляет собой целое число от 1 до 3, n равно 0 и R6 представляет собой C6-14арильную группу или C2-9гетероарильную группу, где каждая арильная группа или гетероарильная группа может быть необязательно замещена 1-3 заместителями R18, где R18имеет такое же значение, что и R10;
(32) производное бензопирана или его фармацевтически приемлемая соль, как указано в (31), где m равно 2;
(33) производное бензопирана или его фармацевтически приемлемая соль, как указано в (30), где m представляет собой целое число от 1 до 3, n равно 0 и R6 представляет собой атом водорода, C2-4алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, С1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), C3-8циклоалкильную группу, C3-8циклоалкенильную группу (где циклоалкильная группа или циклоалкенильная группа может быть необязательно замещена атомом галогена, С1-6алкильной группой (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), или C2-9гетероциклическую группу (где гетероциклическая группа может быть необязательно замещена атомом галогена, C1-6алкильной группой (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой), C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой, карбоксильной группой или гидроксигруппой);
(34) производное бензопирана или его фармацевтически приемлемая соль, как указано в (33), где m равно 2;
(35) производное бензопирана или его фармацевтически приемлемая соль, как указано в (3), которое представляет собой соединение формулы (I);
(36) производное бензопирана или его фармацевтически приемлемая соль, как указано в (3), которое представляет собой соединение формулы (II);
(37) производное бензопирана или его фармацевтически приемлемая соль, как указано в (8), (11), (14), (23), (28) или (35), где кольцевая структура А представляет собой

где R11, R13, R14 и R15 имеют вышеуказанные значения;
(38) производное бензопирана или его фармацевтически приемлемая соль, как указано в (37), где R11 представляет собой атом водорода или C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомомгалогена), аминогруппой или гидроксигруппой) и R13, R14 и R15 независимо представляют собой атом водорода, атом галогена, C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, аминогруппой, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена) или гидроксигруппой), C3-8циклоалкильную группу (где циклоалкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой или гидроксигруппой), C1-6алкоксигруппу (где алкоксигруппа может быть необязательно замещена атомом галогена, аминогруппой, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена) или гидроксигруппой), C1-6алкилкарбонильную группу, аминокарбонильную группу, аминогруппу, карбоксильную группу или цианогруппу;
(39) производное бензопирана или его фармацевтически приемлемая соль, как указано в (38), где R11 представляет собой атом водорода или C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, аминогруппой или гидроксигруппой) и R13, R14 и R15 независимо представляют собой атом водорода, атом галогена, C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, аминогруппой или гидроксигруппой), карбоксильную группу, аминогруппу или цианогруппу;
(40) производное бензопирана или его фармацевтически приемлемая соль, как указано в (39), где R11 представляет собой атом водорода, R13 представляет собой атом водорода, атом галогена, карбоксильную группу или C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, аминогруппой или гидроксигруппой), R14 представляет собой атом водорода и R15 представляет собой атом водорода, атом галогена или C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, аминогруппой или гидроксигруппой);
(41) производное бензопирана или его фармацевтически приемлемая соль, как указано в (8), (11), (14), (23), (28) или (35), где кольцевая структура А представляет собой

где R11, R12, R13 и R14 имеют вышеуказанные значения;
(42) производное бензопирана или его фармацевтически приемлемая соль, как указано в (41), где R11 и R12 независимо представляют собой атом водорода или C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой или гидроксигруппой) и
R13 и R14 независимо друг от друга представляют собой атом водорода, атом галогена, С1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, аминогруппой, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена) или гидроксигруппой), C1-6алкоксигруппу (где алкоксигруппа может быть необязательно замещена атомом галогена, аминогруппой, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), или гидроксигруппой), C1-6алкилкарбонильную группу, аминогруппу или цианогруппу;
(43) производное бензопирана или его фармацевтически приемлемая соль, как указано в (42), где R11 и R12 независимо представляют собой атом водорода или C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, аминогруппой или гидроксигруппой) и R13 и R14 независимо представляют собой атом водорода, атом галогена, C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, аминогруппой или гидроксигруппой), аминогруппу или цианогруппу;
(44) производное бензопирана или его фармацевтически приемлемая соль, как указано в (43), где R11, R12, R13 и R14 представляют собой атом водорода;
(45) производное бензопирана или его фармацевтически приемлемая соль, как указано в (8), (11), (14), (23), (28) или (35), где кольцевая структура А представляет собой

где R11, R13 и R14 имеют вышеуказанные значения;
(46) производное бензопирана или его фармацевтически приемлемая соль, как указано в (45), где R11 представляет собой атом водорода или C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), аминогруппой или гидроксигруппой), R13 и R14независимо представляют собой атом водорода, атом галогена, C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, аминогруппой, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена) или гидроксигруппой), C1-6алкоксигруппу (где алкоксигруппа может быть необязательно замещена атомом галогена, аминогруппой, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена) или гидроксигруппой), аминогруппу или цианогруппу, и X представляет собой O, S, SO или SO2;
(47) производное бензопирана или его фармацевтически приемлемая соль, как указано в (46), где R11 представляет собой атом водорода или C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, аминогруппой или гидроксигруппой), R13 и R14независимо представляют собой атом водорода, атом галогена или C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, аминогруппой или гидроксигруппой) и X представляет собой O;
(48) производное бензопирана или его фармацевтически приемлемая соль, как указано в (47), где R11 представляет собой атом водорода или C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, аминогруппой или гидроксигруппой), R13 и R14представляют собой атом водорода, и X представляет собой O;
(49) производное бензопирана или его фармацевтически приемлемая соль, как указано в (8), (11), (14), (23), (28) или (35), где кольцевая структура А представляет собой

где R11, R12, R13 и R14 имеют вышеуказанные значения;
(50) производное бензопирана или его фармацевтически приемлемая соль, как указано в (49), где R11и R12 независимо представляют собой атом водорода или C1-6 алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), C6-14арильной группой (где арильная группа может быть необязательно замещена атомом галогена, гидроксигруппой или
C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена)), аминогруппой или гидроксигруппой), и R13 и R14 независимо представляют собой атом водорода, атом галогена, C1-6алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, аминогруппой, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена) или гидроксигруппой), C1-6алкоксигруппу (где алкоксигруппа может быть необязательно замещена атомом галогена, аминогруппой, C1-6алкоксигруппой (где алкоксигруппа может быть необязательно замещена атомом галогена), или гидроксигруппой), аминогруппу или цианогруппу;
(51) производное бензопирана или его фармацевтически приемлемая соль, как указано в (50), где R11 и R12 независимо представляют собой атом водорода или C1-6 алкильную группу (где алкильная группа может быть необязательно замещена атомом галогена, аминогруппой или гидроксигруппой) и R13 и R14 представляют собой атом водорода;
(52) производное бензопирана или его фармацевтически приемлемая соль, которое представляет собой
2,2,7,9-тетраметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
2,2,7-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
3-гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-карбонитрил,
3-гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-карбоксамид,
{3-гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-ил}этанон,
3,3-диметил-1-[(2-фенилэтил)амино]-2,3-дигидро-1H-пирано[3,2-f]хинолин-2-ол,
7-гидроксиметил-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
3-гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-карбоновую кислоту,
4-(бензиламино)-7-хлор-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
4-{[(1,3-бензодиоксол-5-ил)метил]амино}-7-хлор-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-[(3-фенилпропил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(4-фторфенил)этил]амино}-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(2-фторфенил)этил]амино}-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(4-хлорфенил)этил]амино}-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
4-{[2-(4-аминофенил)этил]амино}-7-хлор-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-[(2-гидрокси-2-фенилэтил)амино]-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-[(2-фенилбутил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
4-{[2-(1,3-бензодиоксол-5-ил)этил]амино}-7-хлор-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(1-пиперидинил)этил]амино}-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(1-метил-2-пирролидинил)этил]амино}-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
4-[(2-анилиноэтил)амино]-7-хлор-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-({2-[этил(3-метилфенил)амино]этил}амино)-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[(1-этил-(R)-2-пирролидинил)метил]амино}-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-[(2,2-диэтоксиэтил)амино]-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(3-тиенил)этил]амино}-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-[2-(1-пиразолилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(4-метилпиразол-1-ил)этил]амино}-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(4-хлорпиразол-1-ил)этил]амино}-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(2-пиридил)этил]амино}-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(3-пиридил)этил]амино}-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(4-пиридил)этил}амино}-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-этиламино-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-изобутиламино-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-[(циклопропилметил)амино]-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-изопентиламино-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-[(2-циклопентилэтил)амино]-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(1-циклопентенил)этил]амино}-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-[(5-метилгексан-2-ил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-пентиламино-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-[(2-циклогексилэтил)амино]-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(тетрагидропиран-4-ил)этил]амино}-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-[{2-(4-тианил)этил}амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-({[6-(4-хлорфенил)-3-пиридинил]метил}амино)-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
4-[(2-бензофурилметил)амино]-7-хлор-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-[(2-гидроксипентил)амино]-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хиноксалин-3-ол,
4-{[2-(2-фторфенил)этил]амино}-2,2-диметил-З,4-дигидро-2Н-пирано[2,3-g]хиноксалин-3-ол,
4-{[2-(4-фторфенил)этил]амино}-2,2-диметил-З,4-дигидро-2Н-пирано[2,3-g]хиноксалин-3-ол,
4-[(2-гидрокси-2-фенилэтил)амино]-2,2-диметил-З,4-дигидро-2Н-пирано[2,3-g]хиноксалин-3-ол,
2,2-диметил-4-пентиламино-3,4-дигидро-2Н-пирано[2,3-g]хиноксалин-3-ол,
2,2,7,8-тетраметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-1-пирано[2,3-g]хиноксалин-3-ол,
7,8-диэтил-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хиноксалин-3-ол,
2,2,8-триметил-7-фенил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хиноксалин-3-ол,
2,2,7-триметил-8-фенил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хиноксалин-3-ол,
2,2,8-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хиноксалин-3-ол,
4-[(2-циклогексилэтил)амино]-2,2-диметил-3,4-дигидро-2H-пирано[2,3-g]хиноксалин-3-ол,
3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-2,3,4,6-тетрагидропирано[2,3-f]бензимидазол-7-он,
7-гидрокси-6,6-диметил-8-[(2-фенилэтил)амино]-4,6,7,8-тетрагидро-1,5-диокса-4-азаантрацен-3-он,
7-гидрокси-4,6,6-триметил-8-[(2-фенилэтил)амино]-4,6,7,8-тетрагидро-1,5-диокса-4-азаантрацен-3-он,
6,6-диметил-8-[(2-фенилэтил)амино]-2,3,4,6,7,8-гексагидро-1,5-диокса-4-азаантрацен-7-ол,
7-гидрокси-6,6-диметил-8-[(2-фенилэтил)амино]-1,6,7,8-тетрагидро-4,5-диокса-1-азаантрацен-2-он,
6,6-диметил-8-[(2-фенилэтил)амино]-1,2,3,6,7,8-гексагидро-4,5-диокса-1-азаантрацен-7-ол,
9-гидроксиметил-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3,7-диол,
7-аминометил-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-6λ5-окси-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3g]хинолин-3-ол,
7-хлор-4-{[2-(4-фторфенил)этил]амино}-2,2,9-триметил-6λ5-окси-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-6λ5-окси-4-пентиламино-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
4-{[2-(4-фторфенил)этил]амино}-7-гидроксиметил-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол или
2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол.
(53) Производное бензопирана или его фармацевтически приемлемая соль, которое представляет собой
2,2,7-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
3,3-диметил-1-[(2-фенилэтил)амино]-2,3-дигидро-1H-пирано[3,2-f]хинолин-2-ол,
7-гидроксиметил-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(4-фторфенил)этил]амино}-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(2-фторфенил)этил]амино}-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(4-хлорфенил)этил]амино}-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3g]хинолин-3-ол,
3-гидрокси-2,2,9-триметил-4-[2-(фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-карбоновую кислоту,
4-{[2-(4-аминофенил)этил]амино}-7-хлор-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-[(2-гидрокси-2-фенилэтил)амино]-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(1-пиперидинил)этил]амино}-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(4-хлорпиразол-1-ил)этил]амино}-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(2-пиридил)этил]амино}-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(3-пиридил)этил]амино}-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(4-пиридил)этил]амино}-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-изопентиламино-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-[(2-циклопентилэтил)амино]-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(1-циклопентенил)этил]амино}-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-пентиламино-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-[(2-циклогексилэтил)амино]-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-[(2-гидроксипентил)амино]-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хиноксалин-3-ол,
4-{[2-(2-фторфенил)этил]амино}-2,2-диметил-3,4-дигидро-2H-пирано[2,3-g]хиноксалин-3-ол,
4-{[2-(4-фторфенил)этил]амино}-2,2-диметил-3,4-дигидро-2H-пирано[2,3-g]хиноксалин-3-ол,
4-[(2-гидрокси-2-фенилэтил)амино]-2,2-диметил-3,4-дигидро-2H-пирано[2,3-g]хиноксалин-3-ол,
2,2-диметил-4-пентиламино-3,4-дигидро-2H-пирано[2,3-g]хиноксалин-3-ол,
4-[(2-циклогексилэтил)амино]-2,2-диметил-3,4-дигидро-2H-пирано[2,3-g]хиноксалин-3-ол,
7-гидрокси-6,6-диметил-8-[(2-фенилэтил)амино]-4,6,7,8-тетрагидро-1,5-диокса-4-азаантрацен-3-он,
7-гидрокси-4,6,6-триметил-8-[(2-фенилэтил)амино]-4,6,7,8-тетрагидро-1,5-диокса-4-азаантрацен-3-он,
7-гидрокси-6,6-диметил-8-[(2-фенилэтил)амино]-7,8-дигидро-1H,6H-4,5-диокса-1-азаантрацен-2-он,
9-гидроксиметил-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3,7-диол,
7-аминометил-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-6λ5-окси-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(4-фторфенил)этил]амино}-2,2,9-триметил-6λ5-окси-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-6λ5-окси-4-пентиламино-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
4-{[2-(4-фторфенил)этил]амино}-7-гидроксиметил-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол или
2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол;
(54) лекарственное средство, включающее производное бензопирана или его фармацевтически приемлемую соль, как указано в любом из пунктов (1)-(53), в качестве активного ингредиента, и
(55) лекарственное средство для лечения аритмии, включающее производное бензопирана или его фармацевтически приемлемую соль, как указано в любом из пунктов (1)-(53), в качестве активного ингредиента.
Соединение согласно настоящему изобретению оказывает сильное пролонгирующее воздействие на рефракторный период и его можно использовать в качестве лекарственного средства для лечения аритмии.
Лучший способ осуществления изобретения
Соответствующие заместители в соединениях (I) или (II) согласно настоящему изобретению конкретно определены ниже.
Тем временем в данном описании "н" означает нормальный, "изо" означает изо, "втор" означает вторичный, "трет" означает третичный, "ц" означает цикло, "o" означает орто-, "м" означает мета, "п" означает пара; "Ph" означает фенил, "Py" означает пиридил, "Bn" означает бензил, "Me" означает метил, "Et" означает этил, "Pr" означает пропил, "Bu" означает бутил, "Pen" означает пентил, "Hex" означает гексил, "Ac" означает ацетил, "Boc" означает третичный бутоксикарбонил и "MOM" означает метоксиметил.
Примерами C2-4алкильной группы являются такие группы, как этил, н-пропил, изопропил, н-бутил, изобутил, ц-бутил, трет-бутил и тому подобные.
Примерами C1-4алкильной группы являются такие группы, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, ц-бутил, трет-бутил и тому подобные.
Примерами C1-6алкильной группы являются такие группы, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, ц-бутил, трет-бутил, 1-пентил, 2-пентил, 3-пентил, изопентил, неопентил, 2,2-диметилпропил, 1-гексил, 2-гексил, 3-гексил, 1-метил-н-пентил, 1,1,2-триметил-н-пропил, 1,2,2-триметил-н-пропил, 3,3-диметил-н-бутил и тому подобные.
Предпочтительно могут быть отмечены метил, этил, н-пропил, изопропил, н-бутил, н-пентил и изопентил.
Примерами C3-8циклоалкильной группы являются такие группы как ц-пропил, ц-бутил, 1-метил-ц-пропил, 2-метил-ц-пропил, ц-пентил, 1-метил-ц-бутил, 2-метил-ц-бутил, 3-метил-ц-бутил, 1,2-диметил-ц-пропил, 2,3-диметил-ц-пропил,1-этил-ц-пропил, 2-этил-ц-пропил, ц-гексил, ц-гептил, ц-октил, 1-метил-ц-гексил, 2-метил-ц-гексил, 3-метил-ц-гексил, 1,2-диметил-ц-гексил, 2,3-диметил-ц-пропил, 1-этил-ц-пропил, 1-метил-ц-пентил, 2-метил-ц-пентил, 3-метил-ц-пентил, 1-этил-ц-бутил, 2-этил-ц-бутил, 3-этил-ц-бутил, 1,2-диметил-ц-бутил, 1,3-диметил-ц-бутил, 2, 2-диметил-ц-бутил, 2,3-диметил-ц-бутил, 2,4-диметил-ц-бутил, 3,3-диметил-ц-бутил, 1-н-пропил-ц-пропил, 2-н-пропил-ц-пропил, 1-изопропил-ц-пропил, 2-изопропил-ц-пропил, 1,2,2-триметил-ц-пропил, 1,2,3-триметил-ц-пропил, 2,2,3-триметил-ц-пропил, 1-этил-2-метил-ц-пропил, 2-этил-1-метил-ц-пропил, 2-этил-2-метил-ц-пропил, 2-этил-3-метил-ц-пропил и тому подобные.
Предпочтительно можно отметить ц-пентил и ц-гексил.
Примерами С3-8 циклоалкенильной группы являются такие группы как 1-ц-пентенил, 2-ц-пентенил, 3-ц-пентенил, 1-метил-2-ц-пентенил, 1-метил-3-ц-пентенил, 2-метил-1-ц-пентенил, 2-метил-2-ц-пентенил, 2-метил-3-ц-пентенил, 2-метил-4-ц-пентенил, 2-метилен-ц-пентил, 3-метил-1-ц-пентенил, 3-метил-2-ц-пентенил, 3-метил-3-ц-пентенил, 3-метил-4-ц-пентенил, 3-метилен-ц-пентил, 1-ц-гексенил, 2-ц-гексенил, 3-ц-гексенил, 1-ц-гептенил, 2-ц-гептенил, 3-ц-гептенил, 4-ц-гептенил, 1-ц-октенил, 2-ц-октенил, 3-ц-октенил, 4-ц-октенил и тому подобные.
Предпочтительно можно отметить 1-ц-пентенил, 2-ц-пентенил, 3-ц-пентенил, 1-ц-гексенил, 2-ц-гексенил и 3-ц-гексенил.
Примерами атома галогена являются атом фтора, атом хлора, атом брома и атом иода. Предпочтительно можно отметить атом фтора, атом хлора и атом брома.
Примерами C1-6 алкоксигруппы являются такие группы как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, ц-бутокси, трет-бутокси, 1-пентилокси, 2-пентилокси, 3-пентилокси, изопентилокси, неопентилокси, 2,2-диметилпропокси, 1-гексилокси, 2-гексилокси, 3-гексилокси, 1-метил-н-пентилокси, 1,1,2-триметил-н-пропокси, 1,2,2-триметил-н-пропокси, 3,3-диметил-н-бутокси и тому подобные.
Предпочтительно можно отметить метокси, этокси, н-пропокси и изопропокси.
Примерами C1-6тиоалкоксигруппы являются такие группы как метилтио, этилтио, н-пропилтио, изопропилтио, ц-пропилтио, н-бутилтио, изобутилтио, ц-бутилтио, трет-бутилтио, н-пентилтио, изопентилтио, неопентилтио, трет-пентилтио, н-гексилтио, ц-гексилтио и тому подобные.
Примерами C1-6алкилкарбонилоксигруппы являются такие группы как метилкарбонилокси, этилкарбонилокси, н-пропилкарбонилокси, изопропилкарбонилокси, н-бутилкарбонилокси, изобутилкарбонилокси, ц-бутилкарбонилокси, трет-бутилкарбонилокси, 1-пентилкарбонилокси, 2-пентилкарбонилокси, 3-пентилкарбонилокси, изопентилкарбонилокси, неопентилкарбонилокси, трет-пентилкарбонилокси, 1-гексилкарбонилокси, 2-гексилкарбонилокси, 3-гексилкарбонилокси, 1-метил-н-пентилкарбонилокси, 1,1,2-триметил-н-пропилкарбонилокси, 1,2,2-триметил-н-пропилкарбонилокси, 3,3-диметил-н-бутилкарбонилокси и тому подобные.
Предпочтительно можно отметить метилкарбонилокси, этилкарбонилокси, н-пропилкарбонилокси, изопропилкарбонилокси, н-бутилкарбонилокси и трет-бутилкарбонилокси.
Примерами C6-14арильной группы являются такие группы как фенил, o-бифенилил, м-бифенилил, п-бифенилил, α-нафтил, β-нафтил, 1-антрил, 2-антрил, 9-антрил, 1-фенантрил, 2-фенантрил, 3-фенантрил, 4-фенантрил, 9-фенантрил и тому подобные.
Предпочтительно можно отметить фенил, o-бифенилил, м-бифенилил, п-бифенилил, α-нафтил и β-нафтил.
C2-9гетероарильная группа включает C2-6гетероциклическую группу, имеющую одно 5-7-членное кольцо, и С5-9гетероциклическую группу, имеющую два конденсированных кольца с числом членов от 8 до 10, которая может содержать от 1 до 3 гетероатомов, выбранных из группы, состоящей из атома кислорода, атома азота и атома серы по отдельности или в сочетании.
Примерами C2-6гетероциклической группы, имеющей одно 5-7-членное кольцо, являются такие группы как 2-тиенильная группа, 3-тиенильная группа, 2-фурильная группа, 3-фурильная группа, 2-пиранильная группа, 3-пиранильная группа, 4-пиранильная группа, 1-пирролильная группа, 2-пирролильная группа, 3-пирролильная группа, 1-имидазолильная группа, 2-имидазолильная группа, 4-имидазолильная группа, 1-пиразолильная группа, 3-пиразолильная группа, 4-пиразолильная группа, 2-тиазолильная группа, 4-тиазолильная группа, 5-тиазолильная группа, 3-изотиазолильная группа, 4-изотиазолильная группа; 5-изотиазолильная группа, 2-оксазолильная группа, 4-оксазолильная группа, 5-оксазолильная группа, 3-изоксазолильная группа, 4-изоксазолильная группа, 5-изоксазолильная группа, 2-пиридильная группа, 3-пиридильная группа, 4-пиридильная группа, 2-пирадинильная группа, 2-пиримидинильная группа, 4-пиримидинильная группа, 5-пиримидинильная группа, 3-пиридазинильная группа, 4-пиридазинильная группа, 2-1,3,4-оксадиазолильная группа, 2-1,3,4-тиадиазолильная группа, 3-1,2,4-оксадиазолильная группа, 5-1,2,4-оксадиазолильная группа, 3-1,2,4-тиадиазолильная группа, 5-1,2,4-тиадиазолильная группа, 3-1,2,5-оксадиазолильная группа, 3-1,2,5-тиадиазолильная группа и тому подобные.
Примерами С5-9гетероциклической группы, имеющей два конденсированных кольца с числом членов от 8 до 10, являются 2-бензофуранильная группа, 3-бензофуранильная группа, 4-бензофуранильная группа, 5-бензофуранильная группа, 6-бензофуранильная группа, 7-бензофуранильная группа, 1-изобензофуранильная группа, 4-изобензофуранильная группа, 5-изобензофуранильная группа, 2-бензотиенильная группа, 3-бензотиенильная группа, 4-бензотиенильная группа, 5-бензотиенильная группа, 6-бензотиенильная группа, 7-бензотиенильная группа, 1-изобензотиенильная группа, 4-изобензотиенильная группа, 5-изобензотиенильная группа, 2-хроменильная группа, 3-хроменильная группа, 4-хроменильная группа, 5-хроменильная группа, 6-хроменильная группа, 7-хроменильная группа, 8-хроменильная группа, 1-индолизинильная группа, 2-индолизинильная группа, 3-индолизинильная группа, 5-индолизинильная группа, 6-индолизинильная группа, 7-индолизинильная группа, 8-индолизинильная группа, 1-изоиндолильная группа, 2-изоиндолильная группа, 4-изоиндолильная группа, 5-изоиндолильная группа, 1-индолильная группа, 2-индолильная группа, 3-индолильная группа, 4-индолильная группа, 5-индолильная группа, 6-индолильная группа, 7-индолильная группа, 1-индазолильная группа, 2-индазолильная группа, 3-индазолильная группа, 4-индазолильная группа, 5-индазолильная группа, 6-индазолильная группа, 7-индазолильная группа, 1-пуринильная группа, 2-пуринильная группа, 3-пуринильная группа, 6-пуринильная группа, 7-пуринильная группа, 8-пуринильная группа, 2-хинолильная группа, 3-хинолильная группа, 4-хинолильная группа, 5-хинолильная группа, 6-хинолильная группа, 7-хинолильная группа, 8-хинолильная группа, 1-изохинолильная группа, 3-изохинолильная группа, 4-изохинолильная группа, 5-изохинолильная группа, 6-изохинолильная группа, 7-изохинолильная группа, 8-изохинолильная группа, 1-фталазинильная группа, 5-фталазинильная группа, 6-фталазинильная группа, 1-2,7-нафтиридинильная группа, 3-2,7-нафтиридинильная группа, 4-2,7-нафтиридинильная группа, 1-2,6-нафтиридинильная группа, 3-2,6-нафтиридинильная группа, 4-2,6-нафтиридинильная группа, 2-1,8-нафтиридинильная группа, 3-1,8-нафтиридинильная группа, 4-1,8-нафтиридинильная группа, 2-1,7-нафтиридинильная группа, 3-1,7-нафтиридинильная группа, 4-1,7-нафтиридинильная группа, 5-1,7-нафтиридинильная группа, 6-1,7-нафтиридинильная группа, 8-1,7-нафтиридинильная группа, 2-,6-нафтиридинильная группа, 3-1,6-нафтиридинильная группа, 4-1,6-нафтиридинильная группа, 5-1,6-нафтиридинильная группа, 7-1,6-нафтиридинильная группа, 8-1,6-нафтиридинильная группа, 2-1,5-нафтиридинильная группа, 3-1,5-нафтиридинильная группа, 4-1,5-нафтиридинильная группа, 6-1,5-нафтиридинильная группа, 7-1,5-нафтиридинильная группа, 8-1,5-нафтиридинильная группа, 2-хиноксалинильная группа, 5-хиноксалинильная группа, 6-хиноксалинильная группа, 2-хиназолинильная группа, 4-хиназолинильная группа, 5-хиназолинильная группа, 6-хиназолинильная группа, 7-хиназолинильная группа, 8-хиназолинильная группа, 3-циннолинильная группа, 4-циннолинильная группа, 5-циннолинильная группа, 6-циннолинильная группа, 7-циннолинильная группа, 8-циннолинильная группа, 2-птеридинильная группа, 4-птеридинильная группа, 6-птеридинильная группа, 7-птеридинильная группа и тому подобные.
Предпочтительно можно отметить 2-пиридильную группу, 3-пиридильную группу и 4-пиридильную группу.
C2-9гетероциклическая группа включает гетероциклическую группу, имеющую одно кольцо или два конденсированных кольца, содержащую 1 или более атомов, свободно выбранных из атома кислорода, атома азота и атома серы, и 2-9 атомов углерода, и конкретно включает следующие группы:


Примерами C1-6алкиламиногруппы являются такие группы, как метиламино, этиламино, н-пропиламино, изопропиламино, ц-пропиламино, н-бутиламино, изобутиламино, втор-бутиламино, трет-бутиламино, ц-бутиламино, 1-пентиламино, 2-пентиламино, 3-пентиламино, изопентиламино, неопентиламино, трет-пентиламино, ц-пентиламино, 1-гексиламино, 2-гексиламино, 3-гексиламино, ц-гексиламино, 1-метил-н-пентиламино, 1,1,2-триметил-н-пропиламино, 1,2,2-триметил-н-пропиламино, 3,3-диметил-н-бутиламино и тому подобные.
Предпочтительно можно отметить метиламино, этиламино, н-пропиламино, изопропиламино и н-бутиламино.
Примерами ди-C1-6алкиламиногруппы являются такие группы, как диметиламино, диэтиламино, ди-н-пропиламино, ди-изопропиламино, ди-ц-пропиламино, ди-н-бутиламино, ди-изобутиламино, ди-втор-бутиламино, ди-трет-бутиламино, ди-ц-бутиламино, ди-1-пентиламино, ди-2-пентиламино, ди-3-пентиламино, ди-изопентиламино, ди-неопентиламино, ди-трет-пентиламино, ди-ц-пентиламино, ди-1-гексиламино, ди-2-гексиламино, ди-3-гексиламино, ди-ц-гексиламино, ди-(1-метил-н-пентил)амино, ди-(1,1,2-триметил-н-пропил)амино, ди-(1,2,2-триметил-н-пропил)амино, ди-(3,3-диметил-н-бутил)амино, метил(этил)амино, метил(н-пропил)амино, метил(изопропил)амино, метил(ц-пропил)амино, метил(н-бутил)амино, метил(изобутил)амино, метил(втор-бутил)амино, метил(трет-бутил)амино, метил(ц-бутил)амино, этил(н-пропил)амино, этил(изопропил)амино, этил(ц-пропил)амино, этил(н-бутил)амино, этил(изобутил)амино, этил(втор-бутил)амино, этил(трет-бутил)амино, этил(втор-бутил)амино, н-пропил(изопропил)амино, н-пропил(ц-пропил)амино, н-пропил(н-бутил)амино, н-пропил(изобутил)амино, н-пропил(втор-бутил)амино, н-пропил (трет-бутил)амино, н-пропил(ц-бутил)амино, изопропил(ц-пропил)амино, изопропил(н-бутил)амино, изопропил(изобутил)амино, изопропил(втор-бутил)амино, изопропил(трет-бутил)амино, изопропил(ц-бутил)амино, ц-пропил(н-бутил)амино, ц-пропил(изобутил)амино, ц-пропил(втор-бутил)амино, ц-пропил(трет-бутил)амино, ц-пропил(ц-бутил)амино, н-бутил(изобутил)амино, н-бутил(втор-бутил)амино, н-бутил(трет-бутил)амино, н-бутил(ц-бутил)амино, изобутил(втор-бутил)амино, изобутил(трет-бутил)амино, изобутил(ц-бутил)амино, втор-бутил(трет-бутил)амино, втор-бутил(ц-бутил)амино, трет-бутил(ц-бутил)амино и тому подобные.
Предпочтительно можно отметить диметиламино, диэтиламино, ди-н-пропиламино, ди-изопропиламино и ди-н-бутиламино.
Примерами C1-6алкилкарбониламиногруппы являются такие группы, как метилкарбониламино, этилкарбониламино, н-пропилкарбониламино, изопропилкарбониламино, н-бутилкарбониламино, изобутилкарбониламино, втор-бутилкарбониламино, трет-бутилкарбониламино, 1-пентилкарбониламино, 2-пентилкарбониламино, 3-пентилкарбониламино, изопентилкарбониламино, неопентилкарбониламино, трет-пентилкарбониламино, 1-гексилкарбониламино, 2-гексилкарбониламино, 3-гексилкарбониламино и тому подобные.
Предпочтительно можно отметить метилкарбониламино, этилкарбониламино, н-пропилкарбониламино, изопропилкарбониламино и н-бутилкарбониламино.
Примерами C1-6алкилсульфониламиногруппы являются такие группы, как метилсульфониламино, этилсульфониламино, н-пропилсульфониламино, изопропилсульфониламино, н-бутилсульфониламино, изобутилсульфониламино, втор-бутилсульфониламино, трет-бутилсульфониламино, 1-пентилсульфониламино, 2-пентилсульфониламино, 3-пентилсульфониламино, изопентилсульфониламино, неопентилсульфониламино, трет-пентилсульфониламино, 1-гексилсульфониламино, 2-гексилсульфониламино, 3-гексилсульфониламино и тому подобные.
Предпочтительно можно отметить метилсульфониламино, этилсульфониламино, н-пропилсульфониламино, изопропилсульфониламино и н-бутилсульфониламино.
Примерами C1-6алкиламинокарбонильной группы являются такие группы, как метиламинокарбонил, этиламинокарбонил, н-пропиламинокарбонил, изопропиламинокарбонил, н-бутиламинокарбонил, изобутиламинокарбонил, втор-бутиламинокарбонил, трет-бутиламинокарбонил, 1-пентиламинокарбонил, 2-пентиламинокарбонил, 3-пентиламинокарбонил, изопентиламинокарбонил, неопентиламинокарбонил, трет-пентиламинокарбонил, 1-гексиламинокарбонил, 2-гексиламинокарбонил, 3-гексиламинокарбонил и тому подобные.
Предпочтительно можно отметить метиламинокарбонил, этиламинокарбонил, н-пропиламинокарбонил, изопропиламинокарбонил и н-бутиламинокарбонил.
Примерами ди-C1-6алкиламинокарбонильной группы являются такие группы, как диметиламинокарбонил, диэтиламинокарбонил, ди-н-пропиламинокарбонил, ди-изопропиламинокарбонил, ди-ц-пропиламинокарбонил, ди-н-бутиламинокарбонил, ди-изобутиламинокарбонил, ди-ц-бутиламинокарбонил, ди-трет-бутиламинокарбонил, ди-ц-бутиламинокарбонил, ди-1-пентиламинокарбонил, ди-2-пентиламинокарбонил, ди-3-пентиламинокарбонил, ди-изопентиламинокарбонил, ди-неопентиламинокарбонил, ди-трет-пентиламинокарбонил, ди-ц-пентиламинокарбонил, ди-1-гексиламинокарбонил, ди-2-гексиламинокарбонил, ди-3-гексиламинокарбонил, ди-ц-гексиламинокарбонил, ди-(1-метил-н-пентил)аминокарбонил, ди-(1,1,2-триметил-н-пропил)аминокарбонил, ди-(1,2,2-триметил-н-пропил)аминокарбонил, ди-(3,3-диметил-н-бутил)аминокарбонил, метил(этил)аминокарбонил, метил(н-пропил)аминокарбонил, метил(изопропил)аминокарбонил, метил(ц-пропил)аминокарбонил, метил(н-бутил)аминокарбонил, метил(изобутил)аминокарбонил, метил(втор-бутил)аминокарбонил, метил(трет-бутил)аминокарбонил, метил(ц-бутил)аминокарбонил, этил(н-пропил)аминокарбонил, этил(изопропил)аминокарбонил, этил(ц-пропил)аминокарбонил, этил(н-бутил)аминокарбонил, этил(изобутил)аминокарбонил, этил(втор-бутил)аминокарбонил, этил(трет-бутил)аминокарбонил, этил(ц-бутил)аминокарбонил, н-пропил(изопропил)аминокарбонил, н-пропил(ц-пропил)аминокарбонил, н-пропил(н-бутил)аминокарбонил, н-пропил(изобутил)аминокарбонил, н-пропил(втор-бутил)аминокарбонил, н-пропил(трет-бутил)аминокарбонил, н-пропил(ц-бутил)аминокарбонил, изопропил(ц-бутил)аминокарбонил, изопропил(н-бутил)аминокарбонил, изопропил(изобутил)аминокарбонил, изопропил(втор-бутил)аминокарбонил, изопропил(трет-бутил)аминокарбонил, изопропил(ц-бутил)аминокарбонил, ц-пропил(н-бутил)аминокарбонил, бутил)аминокарбонил, н-пропил(трет-бутил)аминокарбонил, н-пропил(ц-бутил)аминокарбонил, изопропил(ц-пропил)аминокарбонил, изопропил(н-бутил)аминокарбонил, изопропил(изобутил)аминокарбонил, изопропил(втор-бутил)аминокарбонил, изопропил(трет-бутил)аминокарбонил, изопропил(ц-бутил)аминокарбонил, ц-пропил(н-бутил)аминокарбонил, ц-пропил(изобутил)аминокарбонил, ц-пропил(втор-бутил)аминокарбонил, ц-пропил(трет-бутил)аминокарбонил, ц-пропил(ц-бутил)аминокарбонил, н-бутил(изобутил)аминокарбонил, н-бутил(втор-бутил)аминокарбонил, н-бутил(трет-бутил)аминокарбонил, н-бутил(ц-бутил)аминокарбонил, изобутил(втор-бутил)аминокарбонил, изобутил(трет-бутил)аминокарбонил, изобутил(ц-бутил)аминокарбонил, втор-бутил (трет-бутил)аминокарбонил, втор-бутил(ц-бутил)аминокарбонил, трет-бутил(ц-бутил)аминокарбонил и тому подобные.
Предпочтительно можно отметить диметиламинокарбонил, диэтиламинокарбонил, ди-н-пропиламинокарбонил, ди-изопропиламинокарбонил, ди-ц-пропиламинокарбонил и ди-н-бутиламинокарбонил.
Примерами C1-6 алкилкарбонильной группы являются такие группы, как метилкарбонил, этилкарбонил, н-пропилкарбонил, изопропилкарбонил, н-бутилкарбонил, изобутилкарбонил, ц-бутилкарбонил, трет-бутилкарбонил, 1-пентилкарбонил, 2-пентилкарбонил, 3-пентилкарбонил, изопентилкарбонил, неопентилкарбонил, трет-пентилкарбонил, 1-гексилкарбонил, 2-гексилкарбонил, 3-гексилкарбонил и тому подобные.
Предпочтительно можно отметить метилкарбонил, этилкарбонил, н-пропилкарбонил, изопропилкарбонил и н-бутилкарбонил.
Примерами C3-8циклоалкилкарбонильной группы являются такие группы, как ц-пропилкарбонил, ц-бутилкарбонил, 1-метил-ц-пропилкарбонил, 2-метил-ц-пропилкарбонил, ц-пентилкарбонил, 1-метил-ц-бутилкарбонил, 2-метил-ц-бутилкарбонил, 3-метил-ц-бутилкарбонил, 1,2-диметил-ц-пропилкарбонил, 2,3-диметил-ц-пропилкарбонил, 1-этил-ц-пропилкарбонил, 2-этил-ц-пропилкарбонил, ц-гексилкарбонил, ц-гептилкарбонил, ц-октилкарбонил, 1-метил-ц-гексилкарбонил, 2-метил-ц-гексилкарбонил, 3-метил-ц-гексилкарбонил, 1,2-диметил-ц-гексилкарбонил, 2,3-диметил-ц-пропилкарбонил, 1-этил-ц-пропилкарбонил, 1-метил-ц-пентилкарбонил, 2-метил-ц-пентилкарбонил, 3-метил-ц-пентилкарбонил, 1-этил-ц-бутилкарбонил, 2-этил-ц-бутилкарбонил, 3-этил-ц-бутилкарбонил, 1,2-диметил-ц-бутилкарбонил, 1,3-диметил-ц-бутилкарбонил, 2,2-диметил-ц-бутилкарбонил, 2,3-диметил-ц-бутилкарбонил, 2,4-диметил-ц-бутилкарбонил, 3,3-диметил-ц-бутилкарбонил, 1-н-пропил-ц-пропилкарбонил, 2-н-пропил-ц-пропилкарбонил, 1-изопропил-ц-пропилкарбонил, 2-изопропил-ц-пропилкарбонил, 1,2,2-триметил-ц-пропилкарбонил, 1,2,3-триметил-ц-пропилкарбонил, 2,2,3-триметил-ц-пропилкарбонил, 1-этил-2-метил-ц-пропилкарбонил, 2-этил-1-метил-ц-пропилкарбонил, 2-этил-2-метил-ц-пропилкарбонил, 2-этил-3-метил-ц-пропилкарбонил и тому подобные.
Предпочтительно можно отметить ц-пентилкарбонил и ц-гексилкарбонил.
Примерами C1-6алкоксикарбонильной группы являются такие группы, как метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил, н-бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил, 1-пентилоксикарбонил, 2-пентилоксикарбонил, 3-пентилоксикарбонил, изопентилоксикарбонил, неопентилоксикарбонил, трет-пентилоксикарбонил, 1-гексилоксикарбонил, 2-гексилоксикарбонил, 3-гексилоксикарбонил и тому подобные.
Предпочтительно можно отметить метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил, н-бутоксикарбонил, изобутоксикарбонил, ц-бутоксикарбонил и трет-бутоксикарбонил.
Примерами C1-6алкилсульфонильной группы являются такие группы, как метансульфонил, трифторметансульфонил, этансульфонил и тому подобные.
Примерами C6-14арилкарбонильной группы являются такие группы, как бензоил, o-бифенилилкарбонил, м-бифенилилкарбонил, п-бифенилилкарбонил, α-нафтилкарбонил, β-нафтилкарбонил, 1-антрилкарбонил, 2-антрилкарбонил, 9-антрилкарбонил, 1-фенантрилкарбонил, 2-фенантрилкарбонил, 3-фенантрилкарбонил, 4-фенантрилкарбонил, 9-фенантрилкарбонил и тому подобные.
Предпочтительно можно отметить бензоил, o-бифенилилкарбонил, м-бифенилилкарбонил, п-бифенилилкарбонил, α- и β-нафтилкарбонил.
C2-9гетероарилкарбонильная группа включает C2-6гетероциклическую карбонильную группу, имеющую одно 5-7-членное кольцо, и С5-9гетероциклическую карбонильную группу, имеющую два конденсированных кольца, с числом членов от 8 до 10, которая может содержать от 1 до 3 гетероатомов, выбранных из группы, состоящей из атома кислорода, атома азота и атома серы по отдельности или в сочетании.
Примерами C2-6гетероциклической карбонильной группы, имеющей одно 5-7-членное кольцо, являются такие группы, как 2-тиенилкарбонильная группа, 3-тиенилкарбонильая группа, 2-фурилкарбонильная группа, 3-фурилкарбонильная группа, 2-пиранилкарбонильная группа, 3-пиранилкарбонильная группа, 4-пиранилкарбонильная группа, 1-пирролилкарбонильная группа, 2-пирролилкарбонильная группа, 3-пирролилкарбонильная группа, 1-имидазолилкарбонильная группа, 2-имидазолилкарбонильная группа, 4-имидазолилкарбонильная группа, 1-пиразолилкарбонильная группа, 3-пиразолилкарбонильная группа, 4-пиразолилкарбонильная группа, 2-тиазолилкарбонильная группа, 4-тиазолилкарбонильная группа, 5-тиазолилкарбонильная группа, 3-изотиазолилкарбонильная группа, 4-изотиазолилкарбонильная группа, 5-изотиазолилкарбонильная группа, 2-оксазолилкарбонильная группа, 4-оксазолилкарбонильная группа, 5-оксазолилкарбонильная группа, 3-изоксазолилкарбонильная группа, 4-изоксазолилкарбонильная группа, 5-изоксазолилкарбонильная группа, 2-пиридилкарбонильная группа, 3-пиридилкарбонильная группа, 4-пиридилкарбонильная группа, 2-пирадинилкарбонильная группа, 2-пиримидинилкарбонильная группа, 4-пиримидинилкарбонильная группа, 5-пиримидинилкарбонильная группа, 3-пиридазинилкарбонильная группа, 4-пиридазинилкарбонильная группа, 2-1,3,4-оксадиазолилкарбонильная группа, 2-1,3,4-тиадиазолилкарбонильная группа, 3-1,2,4-оксадиазолилкарбонильная группа, 5-1,2,4-оксадиазолилкарбонильная группа, 3-1,2,4-тиадиазолилкарбонильная группа, 5-1,2,4-тиадиазолилкарбонильная группа, 3-1,2,5-оксадиазолилкарбонильная группа, 3-1,2,5-тиадиазолилкарбонильная группа и тому подобные.
Примерами С5-9гетероциклической карбонильной группы, имеющей два конденсированных кольца, с числом членов от 8 до 10, являются 2-бензофуранилкарбонильная группа, 3-бензофуранилкарбонильная группа, 4-бензофуранилкарбонильная группа, 5-бензофуранилкарбонильная группа, 6-бензофуранилкарбонильная группа, 7-бензофуранилкарбонильная группа, 1-изобензофуранилкарбонильная группа, 4-изобензофуранилкарбонильная группа, 5-изобензофуранилкарбонильная группа, 2-бензотиенилкарбонильная группа, 3-бензотиенилкарбонильная группа, 4-бензотиенилкарбонильная группа, 5-бензотиенилкарбонильная группа, 6-бензотиенилкарбонильная группа, 7-бензотиенилкарбонильная группа, 1-изобензотиенилкарбонильная группа, 4-изобензотиенилкарбонильная группа, 5-изобензотиенилкарбонильная группа, 2-хроменилкарбонильная группа, 3-хроменилкарбонильная группа, 4-хроменилкарбонильная группа, 5-хроменилкарбонильная группа, 6-хроменилкарбонильная группа, 7-хроменилкарбонильная группа, 8-хроменилкарбонильная группа, 1-индолизинилкарбонильная группа, 2-индолизинилкарбонильная группа, 3-индолизинилкарбонильная группа, 5-индолизинилкарбонильная группа, 6-индолизинилкарбонильная группа, 7-индолизинилкарбонильная группа, 8-индолизинилкарбонильная группа, 1-изоиндолилкарбонильная группа, 2-изоиндолилкарбонильная группа, 4-изоиндолилкарбонильная группа, 5-изоиндолилкарбонильная группа, 1-индолилкарбонильная группа, 2-индолилкарбонильная группа, 3-индолилкарбонильная группа, 4-индолилкарбонильная группа, 5-индолилкарбонильная группа, 6-индолилкарбонильная группа, 7-индолилкарбонильная группа, 1-индазолилкарбонильная группа, 2-индазолилкарбонильная группа, 3-индазолилкарбонильная группа, 4-индазолилкарбонильная группа, 5-индазолилкарбонильная группа, 6-индазолилкарбонильная группа, 7-индазолилкарбонильная группа, 1-пуринилкарбонильная группа, 2-пуринилкарбонильная группа, 3-пуринилкарбонильная группа, 6-пуринилкарбонильная группа, 7-пуринилкарбонильная группа, 8-пуринилкарбонильная группа, 2-хинолилкарбонильная группа, 3-хинолилкарбонильная группа, 4-хинолилкарбонильная группа, 5-хинолилкарбонильная группа, 6-хинолилкарбонильная группа, 7-хинолилкарбонильная группа, 8-хинолилкарбонильная группа, 1-изохинолилкарбонильная группа, 3-изохинолилкарбонильная группа, 4-изохинолилкарбонильная группа, 5-изохинолилкарбонильная группа, 6-изохинолилкарбонильная группа, 7-изохинолилкарбонильная группа, 8-изохинолилкарбонильная группа, 1-фталазинилкарбонильная группа, 5-фталазинилкарбонильная группа, 6-фталазинилкарбонильная группа, 1-2,7-нафтиридинилкарбонильная группа, 3-2,7-нафтиридинилкарбонильная группа, 4-2,7-нафтиридинилкарбонильная группа, 1-2,6-нафтиридинилкарбонильная группа, 3-2,6-нафтиридинилкарбонильная группа, 4-2,6-нафтиридинилкарбонильная группа, 2-1,8-нафтиридинилкарбонильная группа, 3-1,8-нафтиридинилкарбонильная группа, 4-1,8-нафтиридинилкарбонильная группа, 2-1,7-нафтиридинилкарбонильная группа, 3-1,7-нафтиридинилкарбонильная группа, 4-1,7-нафтиридинилкарбонильная группа, 5-1,7-нафтиридинилкарбонильная группа, 6-1,7-нафтиридинилкарбонильная группа, 8-1,7-нафтиридинилкарбонильная группа, 2-1,6-нафтиридинилкарбонильная группа, 3-1,6-нафтиридинилкарбонильная группа, 4-1,6-нафтиридинилкарбонильная группа, 5-1,6-нафтиридинилкарбонильная группа, 7-1,6-нафтиридинилкарбонильная группа, 8-1,6-нафтиридинилкарбонильная группа, 2-1,5-нафтиридинилкарбонильная группа, 3-1,5-нафтиридинилкарбонильная группа, 4-1,5-нафтиридинилкарбонильная группа, 6-1,5-нафтиридинилкарбонильная группа, 7-1,5-нафтиридинилкарбонильная группа, 8-1,5-нафтиридинилкарбонильная группа, 2-хиноксалинилкарбонильная группа, 5-хиноксалинилкарбонильная группа, 6-хиноксалинилкарбонильная группа, 2-хиназолинилкарбонильная группа, 4-хиназолинилкарбонильная группа, 5-хиназолинилкарбонильная группа, 6-хиназолинилкарбонильная группа, 7-хиназолинилкарбонильная группа, 8-хиназолинилкарбонильная группа, 3-циннолинилкарбонильная группа, 4-циннолинилкарбонильная группа, 5-циннолинилкарбонильная группа, 6-циннолинилкарбонильная группа, 7-циннолинилкарбонильная группа, 8-циннолинилкарбонильная группа, 2-птеридинилкарбонильная группа, 4-птеридинилкарбонильная группа, 6-птеридинилкарбонильная группа, 7-птеридинилкарбонильная группа и тому подобные.
Предпочтительно можно отметить 2-пиридилкарбонильную группу, 3-пиридилкарбонильную группу и 4-пиридилкарбонильную группу.
Примерами C6-14арилсульфонильной группы являются такие группы, как фенилсульфонил, o-бифенилилсульфонил, м-бифенилилсульфонил, п-бифенилилсульфонил, α-нафтилсульфонил, β-нафтилсульфонил, 1-антрилсульфонил, 2-антрилсульфонил, 9-антрилсульфонил, 1-фенантрилсульфонил, 2-фенантрилсульфонил, 3-фенантрилсульфонил, 4-фенантрилсульфонил, 9-фенантрилсульфонил и тому подобные.
Предпочтительно можно отметить фенилсульфонил, o-бифенилилсульфонил, м-бифенилилсульфонил, п-бифенилилсульфонил, α-нафтилсульфонил и β-нафтилсульфонил.
C2-9гетероарилсульфонильная группа включает C2-6гетероциклическую сульфонильную группу, имеющую одно 5-7-членное кольцо, и С5-9гетероциклическую сульфонильную группу, имеющую два конденсированных кольца, с числом членов от 8 до 10, которая может содержать от 1 до 3 гетероатомов, выбранных из группы, состоящей из атома кислорода, атома азота и атома серы по отдельности или в сочетании.
Примерами C2-6гетероциклической сульфонильной группы, имеющей одно 5-7-членное кольцо, являются такие группы как 2-тиенилсульфонильная группа, 3-тиенилсульфонильная группа, 2-фурилсульфонильная группа, 3-фурилсульфонильная группа, 2-пиранилсульфонильная группа, 3-пиранилсульфонильная группа, 4-пиранилсульфонильная группа, 1-пирролилсульфонильная группа, 2-пирролилсульфонильная группа, 3-пирролилсульфонильная группа, 1-имидазолилсульфонильная группа, 2-имидазолилсульфонильная группа, 4-имидазолилсульфонильная группа, 1-пиразолилсульфонильная группа, 3-пиразолилсульфонильная группа, 4-пиразолилсульфонильная группа, 2-тиазолилсульфонильная группа, 4-тиазолилсульфонильная группа, 5-тиазолилсульфонильная группа, 3-изотиазолилсульфонильная группа, 4-изотиазолилсульфонильная группа, 5-изотиазолилсульфонильная группа, 2-оксазолилсульфонильная группа, 4-оксазолилсульфонильная группа, 5-оксазолилсульфонильная группа, 3-изоксазолилсульфонильная группа, 4-изоксазолилсульфонильная группа, 5-изоксазолилсульфонильная группа, 2-пиридилсульфонильная группа, 3-пиридилсульфонильная группа, 4-пиридилсульфонильная группа, 2-пирадинилсульфонильная группа, 2-пиримидинилсульфонильная группа, 4-пиримидинилсульфонильная группа, 5-пиримидинилсульфонильная группа, 3-пиридазинилсульфонильная группа, 4-пиридазинилсульфонильная группа, 2-1,3,4-оксадиазолилсульфонильная группа, 2-1,3,4-тиадиазолилсульфонильная группа, 3-1,2,4-оксадиазолилсульфонильная группа, 5-1,2,4-оксадиазолилсульфонильная группа, 3-1,2,4-тиадиазолилсульфонильная группа, 5-1,2,4-тиадиазолилсульфонильная группа, 3-1,2,5-оксадиазолилсульфонильная группа, 3-1,2,5-тиадиазолилсульфонильная группа и тому подобные.
Примерами С5-9гетероциклической сульфонильной группы, имеющей два конденсированных кольца с числом членов от 8 до 10, являются 2-бензофуранилсульфонильная группа, 3-бензофуранилсульфонильная группа, 4-бензофуранилсульфонильная группа, 5-бензофуранилсульфонильная группа, 6-бензофуранилсульфонильная группа, 7-бензофуранилсульфонильная группа, 1-изобензофуранилсульфонильная группа, 4-изобензофуранилсульфонильная группа, 5-изобензофуранилсульфонильная группа, 2-бензотиенилсульфонильная группа, 3-бензотиенилсульфонильная группа, 4-бензотиенилсульфонильная группа, 5-бензотиенилсульфонильная группа, 6-бензотиенилсульфонильная группа, 7-бензотиенилсульфонильная группа, 1-изобензотиенилсульфонильная группа, 4-изобензотиенилсульфонильная группа, 5-изобензотиенилсульфонильная группа, 2-хроменилсульфонильная группа, 3-хроменилсульфонильная группа, 4-хроменилсульфонильная группа, 5-хроменилсульфонильная группа, 6-хроменилсульфонильная группа, 7-хроменилсульфонильная группа, 8-хроменилсульфонильная группа, 1-индолизинилсульфонильная группа, 2-индолизинилсульфонильная группа, 3-индолизинилсульфонильная группа, 5-индолизинилсульфонильная группа, 6-индолизинилсульфонильная группа, 7-индолизинилсульфонильная группа, 8-индолизинилсульфонильная группа, 1-изоиндолилсульфонильная группа, 2-изоиндолилсульфонильная группа, 4-изоиндолилсульфонильная группа, 5-изоиндолилсульфонильная группа, 1-индолилсульфонильная группа, 2-индолилсульфонильная группа, 3-индолилсульфонильная группа, 4-индолилсульфонильная группа, 5-индолилсульфонильная группа, 6-индолилсульфонильная группа, 7-индолилсульфонильная группа, 1-индазолилсульфонильная группа, 2-индазолилсульфонильная группа, 3-индазолилсульфонильная группа, 4-индазолилсульфонильная группа, 5-индазолилсульфонильная группа, 6-индазолилсульфонильная группа, 7-индазолилсульфонильная группа, 1-пуринилсульфонильная группа, 2-пуринилсульфонильная группа, 3-пуринилсульфонильная группа, 6-пуринилсульфонильная группа, 7-пуринилсульфонильная группа, 8-пуринилсульфонильная группа, 2-хинолилсульфонильная группа, 3-хинолилсульфонильная группа, 4-хинолилсульфонильная группа, 5-хинолилсульфонильная группа, 6-хинолилсульфонильная группа, 7-хинолилсульфонильная группа, 8-хинолилсульфонильная группа, 1-изохинолилсульфонильная группа, 3-изохинолилсульфонильная группа, 4-изохинолилсульфонильная группа, 5-изохинолилсульфонильная группа, 6-изохинолилсульфонильная группа, 7-изохинолилсульфонильная группа, 8-изохинолилсульфонильная группа, 1-фталазинилсульфонильная группа, 5-фталазинилсульфонильная группа, 6-фталазинилсульфонильная группа, 1-2,7-нафтиридинилсульфонильная группа, 3-2,7-нафтиридинилсульфонильная группа, 4-2,7-нафтиридинилсульфонильная группа, 1-2,6-нафтиридинилсульфонильная группа, 3-2,6-нафтиридинилсульфонильная группа, 4-2,6-нафтиридинилсульфонильная группа, 2-1,8-нафтиридинилсульфонильная группа, 3-1,8-нафтиридинилсульфонильная группа, 4-1,8-нафтиридинилсульфонильная группа, 2-1,7-нафтиридинилсульфонильная группа, 3-1,7-нафтиридинилсульфонильная группа, 4-1,7-нафтиридинилсульфонильная группа, 5-1,7-нафтиридинилсульфонильная группа, 6-1,7-нафтиридинилсульфонильная группа, 8-1,7-нафтиридинилсульфонильная группа, 2-1,6-нафтиридинилсульфонильная группа, 3-1,6-нафтиридинилсульфонильная группа, 4-1,6-нафтиридинилсульфонильная группа, 5-1,6-нафтиридинилсульфонильная группа, 7-1,6-нафтиридинилсульфонильная группа, 8-1,6-нафтиридинилсульфонильная группа, 2-1,5-нафтиридинилсульфонильная группа, 3-1,5-нафтиридинилсульфонильная группа, 4-1,5-нафтиридинилсульфонильная группа, 6-1,5-нафтиридинилсульфонильная группа, 7-1,5-нафтиридинилсульфонильная группа, 8-1,5-нафтиридинилсульфонильная группа, 2-хиноксалинилсульфонильная группа, 5-хиноксалинилсульфонильная группа, 6-хиноксалинилсульфонильная группа, 2-хиназолинилсульфонильная группа, 4-хиназолинилсульфонильная группа, 5-хиназолинилсульфонильная группа, 6-хиназолинилсульфонильная группа, 7-хиназолинилсульфонильная группа, 8-хиназолинилсульфонильная группа, 3-циннолинилсульфонильная группа, 4-циннолинилсульфонильная группа, 5-циннолинилсульфонильная группа, 6-циннолинилсульфонильная группа, 7-циннолинилсульфонильная группа, 8-циннолинилсульфонильная группа, 2-птеридинилсульфонильная группа, 4-птеридинилсульфонильная группа, 6-птеридинилсульфонильная группа, 7-птеридинилсульфонильная группа и тому подобные.
Предпочтительно можно отметить 2-пиридилсульфонильную группу, 3-пиридилсульфонильную группу и 4-пиридилсульфонильную группу.
Примерами C6-14ариламиногруппы являются такие группы, как фениламино, o-бифенилиламино, м-бифенилиламино, п-бифенилиламино, α-нафтиламино, β-нафтиламино, 1-антриламино, 2-антриламино, 9-антриламино, 1-фенантриламино, 2-фенантриламино, 3-фенантриламино, 4-фенантриламино, 9-фенантриламино и тому подобные.
Предпочтительно можно отметить фениламино, o-бифенилиламино, м-бифенилиламино, п-бифенилиламино, α-нафтиламино и β-нафтиламино.
C2-9гетероариламиногруппа включает C2-6гетероциклическую аминогруппу, имеющую одно 5-7-членное кольцо, и С5-9гетероциклическую аминогруппу, имеющую два конденсированных кольца с числом членов от 8 до 10, которая может содержать от 1 до 3 гетероатомов, выбранных из группы, состоящей из атома кислорода, атома азота и атома серы по отдельности или в сочетании.
Примерами C2-6гетероциклической аминогруппы, содержащей единственное 5-7-членное кольцо, являются такие группы как 2-тиениламиногруппа, 3-тиениламиногруппа, 2-фуриламиногруппа, 3-фуриламиногруппа, 2-пираниламиногруппа, 3-пираниламиногруппа, 4-пираниламиногруппа, 1-пирролиламиногруппа, 2-пирролиламиногруппа, 3-пирролиламиногруппа, 1-имидазолиламиногруппа, 2-имидазолиламиногруппа, 4-имидазолиламиногруппа, 1-пиразолиламиногруппа, 3-пиразолиламиногруппа, 4-пиразолиламиногруппа, 2-тиазолиламиногруппа, 4-тиазолиламиногруппа, 5-тиазолиламиногруппа, 3-изотиазолиламиногруппа, 4-изотиазолиламиногруппа, 5-изотиазолиламиногруппа, 2-оксазолиламиногруппа, 4-оксазолиламиногруппа, 5-оксазолиламиногруппа, 3-изоксазолиламиногруппа, 4-изоксазолиламиногруппа, 5-изоксазолиламиногруппа, 2-пиридиламиногруппа, 3-пиридиламиногруппа, 4-пиридиламиногруппа, 2-пирадиниламиногруппа, 2-пиримидиниламиногруппа, 4-пиримидиниламиногруппа, 5-пиримидиниламиногруппа, 3-пиридазиниламиногруппа, 4-пиридазиниламиногруппа, 2-1,3,4-оксадиазолиламиногруппа, 2-1,3,4-тиадиазолиламиногруппа, 3-1,2,4-оксадиазолиламиногруппа, 5-1,2,4-оксадиазолиламиногруппа, 3-1,2,4-тиадиазолиламиногруппа, 5-1,2,4-тиадиазолиламиногруппа, 3-1,2,5-оксадиазолиламиногруппа, 3-1,2,5-тиадиазолиламиногруппа и тому подобные.
Примерами C5-9гетероциклической аминогруппы с конденсированными двумя кольцами с числом атомов от 8 до 10 являются 2-бензофураниламиногруппа, 3-бензофураниламиногруппа, 4-бензофураниламиногруппа, 5-бензофураниламиногруппа, 6-бензофураниламиногруппа, 7-бензофураниламиногруппа, 1-изобензофураниламиногруппа, 4-изобензофураниламиногруппа, 5-изобензофураниламиногруппа, 2-бензотиениламиногруппа, 3-бензотиениламиногруппа, 4-бензотиениламиногруппа, 5-бензотиениламиногруппа, 6-бензотиениламиногруппа, 7-бензотиениламиногруппа, 1-изобензотиениламиногруппа, 4-изобензотиениламиногруппа, 5-изобензотиениламиногруппа, 2-хромениламиногруппа, 3-хромениламиногруппа, 4-хромениламиногруппа, 5-хромениламиногруппа, 6-хромениламиногруппа, 7-хромениламиногруппа, 8-хромениламиногруппа, 1-индолизиниламиногруппа, 2-индолизиниламиногруппа, 3-индолизиниламиногруппа, 5-индолизиниламиногруппа, 6-индолизиниламиногруппа, 7-индолизиниламиногруппа, 8-индолизиниламиногруппа, 1-изоиндолиламиногруппа, 2-изоиндолиламиногруппа, 4-изоиндолиламиногруппа, 5-изоиндолиламиногруппа, 1-индолиламиногруппа, 2-индолиламиногруппа, 3-индолиламиногруппа, 4-индолиламиногруппа, 5-индолиламиногруппа, 6-индолиламиногруппа, 7-индолиламиногруппа, 1-индазолиламиногруппа, 2-индазолиламиногруппа, 3-индазолиламиногруппа, 4-индазолиламиногруппа, 5-индазолиламиногруппа, 6-индазолиламиногруппа, 7-индазолиламиногруппа, 1-пуриниламиногруппа, 2-пуриниламиногруппа, 3-пуриниламиногруппа, 6-пуриниламиногруппа, 7-пуриниламиногруппа, 8-пуриниламиногруппа, 2-хинолиламиногруппа, 3-хинолиламиногруппа, 4-хинолиламиногруппа, 5-хинолиламиногруппа, 6-хинолиламиногруппа, 7-хинолиламиногруппа, 8-хинолиламиногруппа, 1-изохинолиламиногруппа, 3-изохинолиламиногруппа, 4-изохинолиламиногруппа, 5-изохинолиламиногруппа, 6-изохинолиламиногруппа, 7-изохинолиламиногруппа, 8-изохинолиламиногруппа, 1-фталазиниламиногруппа, 5-фталазиниламиногруппа, 6-фталазиниламиногруппа, 1-2,7-нафтиридиниламиногруппа, 3-2,7-нафтиридиниламиногруппа, 4-2,7-нафтиридиниламиногруппа, 1-2,6-нафтиридиниламиногруппа, 3-2,6-нафтиридиниламиногруппа, 4-2,6-нафтиридиниламиногрупп, 2-1,8-нафтиридиниламиногруппа, 3-1,8-нафтиридиниламиногруппа, 4-1,8-нафтиридиниламиногруппа, 2-1,7-нафтиридиниламиногруппа, 3-1,7-нафтиридиниламиногруппа, 4-1,7-нафтиридиниламиногруппа, 5-1,7-нафтиридиниламиногруппа, 6-1,7-нафтиридиниламиногруппа, 8-1,7-нафтиридиниламиногруппа, 2-1,6-нафтиридиниламиногруппа, 3-1,6-нафтиридиниламиногруппа, 4-1,6-нафтиридиниламиногруппа, 5-1,6-нафтиридиниламиногруппа, 7-1,6-нафтиридиниламиногруппа, 8-1,6-нафтиридиниламиногруппа, 2-1,5-нафтиридиниламиногруппа, 3-1,5-нафтиридиниламиногруппа, 4-1,5-нафтиридиниламиногруппа, 6-1,5-нафтиридиниламиногруппа, 7-1,5-нафтиридиниламиногруппа, 8-1,5-нафтиридиниламиногруппа, 2-хиноксалиниламиногруппа, 5-хиноксалинламиногруппа, 6-хиноксалиниламиногруппа, 2-хиназолиниламиногруппа, 4-хиназолиниламиногруппа, 5-хиназолиниламиногруппа, 6-хиназолиниламиногруппа, 7-хиназолиниламиногруппа, 8-хиназолиниламиногруппа, 3-циннолиниламиногруппа, 4-циннолиниламиногруппа, 5-циннолиниламиногруппа, 6-циннолиниламиногруппа, 7-циннолиниламиногруппа, 8-циннолиниламиногруппа, 2-птеридиниламиногруппа, 4-птеридиниламиногруппа, 6-птеридиниламиногруппа, 7-птеридиниламиногруппа и тому подобные.
Предпочтительно могут быть отмечены 2-пиридиламиногруппа, 3-пиридиламиногруппа и 4-пиридиламиногруппа.
Конкретными примерами заместителей в соединениях, использованных в настоящем изобретении, являются следующие.
Конкретные примеры R1 и R2 предпочтительно представляют собой метил.
Конкретными примерами R3 предпочтительно является гидроксигруппа.
Конкретными примерами R4 являются предпочтительно атомы водорода.
Конкретными примерами R5 являются предпочтительно атомы водорода.
Конкретными примерами групп -N-(CH2)m-V-(CH2)n-R6 предпочтительно являются следующие группы 1)-4):
1)







2)
3)

4)

Конкретными примерами А предпочтительно являются перечисленные в следующих пунктах 1) и 2):
Предпочтительные соединения, использованные в настоящем изобретении, включают следующие:
(1) производное бензопирана формулы (I) или (II) или его фармацевтически приемлемая соль, где как R1, так и R2 представляют собой метил, R3 представляет собой гидроксигруппу и R4 представляет собой атом водорода;
(2) производное бензопирана или его фармацевтически приемлемая соль, как указано в пункте (1), которое представляет собой соединение формулы (I);
(3) производное бензопирана или его фармацевтически приемлемая соль, как указано в пункте (2), где V представляет собой связь, m представляет собой целое число от 1 до 3, n равно 0 или 1 и R6 представляет собой бензольное кольцо;
(4) производное бензопирана или его фармацевтически приемлемая соль, как указано в пункте (3), где V представляет собой CR7R8, где R7 представляет собой гидроксигруппу, и R8представляет собой атом водорода и m равно 0 или 1;
(5) производное бензопирана или его фармацевтически приемлемая соль, как указано в пункте (3), где R6 представляет собой алкильную группу, циклоалкильную группу или циклоалкенильное кольцо;
(6) производное бензопирана или его фармацевтически приемлемая соль, как указано в пункте (5), где V представляет собой CR7R8, где R7 представляет собой гидроксигруппу, и R8 представляет собой атом водорода и m равно 0 или 1;
(7) производное бензопирана или его фармацевтически приемлемая соль, как указано в пункте (3), где А представляет собой группу формулы (VIII)

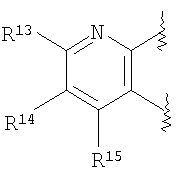
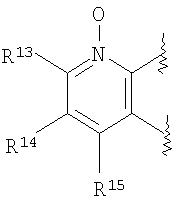




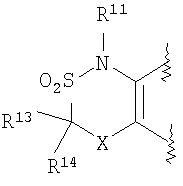



(8) производное бензопирана или его фармацевтически приемлемая соль, как указано в пункте (4), где А представляет собой группу формулы (VIII);
(9) производное бензопирана или его фармацевтически приемлемая соль, как указано в пункте (5), где А представляет собой группу формулы (VIII);
(10) производное бензопирана или его фармацевтически приемлемая соль, как указано в пункте (6), где А представляет собой группу формулы (VIII).
В конце описания представлены конкретные примеры соединений, которые могут использоваться в настоящем изобретении, но настоящее изобретение ими не ограничено. В данном случае "Me" означает метил, "Et" означает этил, "Pr" означает пропил, "Bu" означает бутил, "Ac" означает ацетил (СОСН3) и "-" означает связь.
Соединения согласно настоящему изобретению содержат асимметрические атомы углерода в 3-положении и 4-положении, таким образом, присутствуют оптические изомеры, основанные на асимметрических атомах углерода, и оптически активные вещества также могут использоваться в заявке по настоящему изобретению наряду с рацемическими модификациями. Кроме того, могут быть включены цис- и транс-изомеры на основании конфигурации в 3-положении и 4-положении, но транс-изомер является предпочтительным.
Далее, когда соединения могут образовывать соли, их фармацевтически приемлемые соли также можно использовать в качестве активных ингредиентов.
Примерами фармацевтически приемлемой соли являются такие соли, как гидрохлориды, гидробромиды, сульфаты, метансульфонаты, ацетаты, бензоаты, тартраты, фосфаты, лактаты, малеаты, фумараты, малаты, глюконаты, салицилаты и тому подобные.
Предпочтительно можно отметить гидрохлориды, малеаты и метансульфонаты.
Соединения формулы (I-a) или (II-a), то есть соединения формулы (I) или (II), где R4 представляет собой атом водорода и R3 представляет собой гидроксигруппу, могут быть получены взаимодействием соединения формулы (1) или (2) с соединением формулы (3) в инертном растворителе, как показано на схеме ниже.

В качестве растворителей, использованных в реакции соединения формулы (1) или (2) с соединением формулы (3), можно отметить следующие.
Можно отметить растворители сульфоксидного типа, например диметилсульфоксид; растворители амидного типа, например диметилформамид и диметилацетамид; растворители типа простых эфиров, например диэтиловый эфир, диметоксиэтан, тетрагидрофуран и диоксан; галогенированные растворители, например дихлорметан, хлороформ и дихлорэтан; растворители нитрильного типа, например ацетонитрил и пропионитрил; растворители типа ароматических углеводородов, например бензол и толуол; растворители углеводородного типа, например гексан и гептан; растворители сложноэфирного типа, например этилацетат; растворители спиртового типа, например метанол, этанол, 1-пропанол, 2-пропанол и этиленгликоль; вода. Кроме того, реакция может быть осуществлена в отсутствие любого растворителя. Предпочтительно можно отметить растворители типа простых эфиров, растворители нитрильного типа и растворители спиртового типа.
Температура реакции обычно составляет от -80°С до температуры кипения растворителя, использованного в реакции, предпочтительно от -10 до 100°C.
Молярное соотношение реагирующих веществ находится в диапазоне 0,5-4,0, предпочтительно 1,0-2,0, для соотношения соединение (3)/соединение (1) или (2).
В реакции можно использовать кислотные катализаторы.
Используемые кислотные катализаторы включают неорганические кислоты, например соляную кислоту и серную кислоту, кислоты Льюиса, например хлорид алюминия, тетрахлорид титана, комплекс эфирата трехфтористого бора, перхлорная кислота, перхлорат лития, бромид лития и трифторметансульфонат иттербия.
Предпочтительными кислотными катализаторами являются бромид лития и перхлорат лития.
Синтез оптически активных соединений формулы (I) или (II) осуществляют с использованием способа оптического разделения рацемата (выложенная заявка на патент Японии No.Hei 3-141286, патент США No. 5097037 и патент EP No. 409165).
Кроме того, синтез соединения формулы (1) или (2) проводят с использованием следующего способа синтеза.
- Общий способ синтеза бензопиранового кольца
Бензопирановое кольцо может быть синтезировано в соответствии с известными способами (способы, описанные в J. М. Evans et al., J. Med. Chem. 1984, 27, 1127; J. Med. Chem. 1986, 29, 2194; J. Т. North et al., J. Org. Chem. 1995, 60, 3397, а также в выложенных заявках на патент Японии №№ Sho 56-57785, Sho 56-57786, Sho 58-188880, Hei 2-141, Hei 10-87650 и Hei 11-209366 и тому подобные);
- Индола или оксииндола
Т. Sakamoto et al., Heterocycles, 1986, 24, 31,
М.Belley et. al., Synthesis, 2001, 222,
A. D. Cross et al., J. Chem. Soc., 1961, 2714;
- Имидазолинона
J. Kitteringham et. al., Synthetic Commun., 2000, 30, 1937;
- Хинолина
C.Imor et al., Synthetic Commun., 1996, 26, 2197,
Y. Kitahara et al., Tetrahedron, 1997, 53, 6001,
A. G. Osborne et al., J. Chem. Soc. Perkin Trans. 1, 1993, 181,
R.Т. Shuman et al., J. Org. Chem., 1990, 55, 738,
Т. Sakamoto et al., Chem. Pharm. Bull., 1981, 29, 2485,
Y. Tsuji et al., J. Org. Chem., 1987, 52, 1673,
Z. Song et al., J. Heterocyclic Chem., 1993, 30, 17;
- Хинолинoна
М. R. Sabol et al., Synthetic Commun., 2000, 30, 427,
Z-Y. Yang et al., Tetrahedron Lett., 1999, 40, 4505,
H-B. Sun et al., Synthesis, 1997, 1249,
A.Guiotto et al., J. Heterocyclic Chem. 1989, 26, 917,
K. Konno et al., Heterocycles 1986, 24, 2169,
E. Fernandez et al., Synthesis 1995, 1362;
- Бензотиазола или триазола
N. B. Ambati et al., Synthetic Commun., 1997, 27, 1487,
D. E. Burton. et al., J. Chem. Soc (C), 1968, 1268;
- Хиноксалина или хиноксалинона
J.H.Liu et al., J. Org. Chem., 2000, 65, 3395,
J.J.Li et al., Tetrahedron Lett., 1999, 40, 4507,
Y.Ahmed et al., Bull. Chem. Soc. Jpn., 1987, 60, 1145;
- Бензоакадинона
G.H.Jones et al., J. Med. Chem., 1987, 30, 295,
J.L.Wright et al., J. Med. Chem., 2000, 43, 3408,
M.Kluge et al., J. Heterocyclic Chem., 1995, 32, 395,
Соединение формулы (1-а) или (2-а), то есть соединение формулы (I) или (II), где А представляет собой группу формулы
(5), R4 представляет собой атом водорода и R3 представляет собой гидроксигруппу, может быть получено из соединения формулы (6) или (7) в соответствии с известными способами (способы, описанные в J.M.Evans et al., J. Med. Chem. 1984, 27, 1127; J. Med. Chem. 1986, 29, 2194; J.T.North et al., J. Org. Chem. 1995, 60, 3397, а также выложенных заявках на патент Японии №№. Sho 56-57785, Sho 56-57786, Sho 58-188880, Hei 2-141, Hei 10-87650 и Hei 11-209366 и тому подобные).


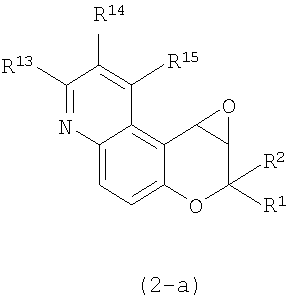

Соединение формулы (6) или (7) может быть получено взаимодействием соединения (8) с соединением (9) (см. Y.Tsuji et al., J. Org. Chem., 1987, 52, 1673).
Катализатор переходного металла

В качестве растворителей, использованных в реакции соединения формулы (8) с соединением формулы (9), можно отметить следующие.
Можно отметить растворители сульфоксидного типа, например диметилсульфоксид; растворители амидного типа, например диметилформамид и диметилацетамид; растворители типа простых эфиров, например диэтиловый эфир, диметоксиэтан, тетрагидрофуран, диоксан и диметиловый эфир диэтиленгликоля; галогенированные растворители, например дихлорметан, хлороформ и дихлорэтан; растворители нитрильного типа, например ацетонитрил и пропионитрил; растворители типа ароматических углеводородов, например бензол и толуол; растворители углеводородного типа, например гексан и гептан; растворители сложноэфирного типа, например этилацетат; растворители спиртового типа, например метанол, этанол, 1-пропанол, 2-пропанол и этиленгликоль; воду. Кроме того, реакция может быть осуществлена в отсутствие любого растворителя. Предпочтительно можно отметить растворители типа простых эфиров, растворители нитрильного типа и растворители спиртового типа.
Температура реакции обычно составляет обычно от -80°С до температуры кипения растворителя, использованного в реакции, предпочтительно от -10 до 200°С.
Молярное соотношение реагирующих веществ находится в диапазоне 0,1-4,0, предпочтительно 0,5-2,0, для соотношения соединение (8)/соединение (9).
В реакции можно использовать катализаторы переходных металлов и лиганды.
Катализаторы переходных металлов включают хлорид рутения, дихлортрис(трифенилфосфин)рутений, дибромтрис(трифенилфосфин)рутений, дигидридтетракис (трифенилфосфин) рутений, (η4-циклооктадиен) (η6-циклооктатриен)рутений, димер дихлортрикарбонила рутения, додекакарбонилтрирутений, (η5-пентаметилциклопентадиенил)хлор (η4-циклооктадиен) рутений, ацетат палладия, хлорид палладия, дихлорбис(трифенилфосфин)палладий, тетракистрифенилфосфинпалладий, бис(дибензилиденацетон)палладий, хлорид родия, хлортрис(трифенилфосфин)родий, гидридкарбонилтристрифенилфосфинродий, гидридтрис(трифенилфосфин)родий, ди-µ-хлортетракарбонилдиродий, хлоркарбонилбис(трифенилфосфин)иридий, димер (η5-пентаметилциклопентадиенил)дихлориридия, никельтетракистрифенилфосфин, дикобальтоктакарбонил, (η5-циклопентадиенил)дикарбонилкобальт и тому подобные.
Предпочтительно можно отметить хлорид рутения.
Лиганды включают монодентатные фосфиновые лиганды, например триметилфосфин, триэтилфосфин, три-н-пропилфосфин, триизопропилфосфин, три-н-бутилфосфин, три-трет-бутилфосфин, трициклогексилфосфин, трифенилфосфин и три(о-толул)фосфин, бидентатные фосфиновые лиганды, например 1,2-бисдифенилфосфиноэтан, 1,3-бисдифенилфосфинопропан, 1,4-бисдифенилфосфинобутан и 1,2-диэтилфосфиноэтан, фосфитные лиганды, например триэтилфосфит, трибутилфосфит, трифенилфосфит и три(о-толил)фосфит.
Предпочтительными являются трифенилфосфин, три-н-бутилфосфин и три-трет-бутилфосфин.
Соединение формулы (6) или (7) также может быть получено взаимодействием соедиения (8) с соединением (10) в присутствии кислотного катализатора (см. Y. Kitahara et al., Tetrahedron lett., 1997, 53, 6001, Z. Song et al., J. Heterocyclic Chem., 1993, 30, 17).

В качестве растворителей, использованных в реакции соединения формулы (8) с соединением формулы (10), можно отметить следующие.
Можно отметить растворители сульфоксидного типа, например диметилсульфоксид; растворители амидного типа, например диметилформамид и диметилацетамид; растворители типа простых эфиров, например диэтиловый эфир, диметоксиэтан, тетрагидрофуран, диоксан и диметиловый эфир диэтиленгликоля; галогенированные растворители, например дихлорметан, хлороформ и дихлорэтан; растворители нитрильного типа, например ацетонитрил и пропионитрил; растворители типа ароматических углеводородов, например бензол и толуол; растворители углеводородного типа, например гексан и гептан; растворители сложноэфирного типа, например этилацетат; растворители спиртового типа, например метанол, этанол, 1-пропанол, 2-пропанол и этиленгликоль; растворители типа органических кислот, например уксусная кислота и трифторуксусная кислота, и воду. Кроме того, реакция может быть осуществлена в отсутствие любого растворителя. Предпочтительно можно отметить растворители типа простых эфиров, растворители нитрильного типа, растворители спиртового типа и растворители типа органической кислоты.
Используемые кислотные катализаторы включают неорганические кислоты, например соляную кислоту, серную кислоту, азотную кислоту и фосфорную кислоту, органические сульфоновые кислоты, например метансульфоновую кислоту и п-толуолсульфоновую кислоту, кислоты Льюиса, например хлорид алюминия, тетрахлорид титана, комплекс эфирата трехфтористого бора, перхлорную кислоту, хлорид цинка, бромид цинка, иодид цинка, хлорид железа(III), хлорид железа(II), хлорид меди(I) и хлорид меди(II). Предпочтительно можно отметить соляную кислоту и хлорид цинка.
Температура реакции обычно составляет обычно от -80°С до температуры кипения растворителя, использованного в реакции, предпочтительно от -10 до 200°C.
Молярное соотношение реагирующих веществ находится в диапазоне 1-10, предпочтительно 1-3, для соотношения соединение (10)/соединение (8).
Кроме того, синтез оптически активных соединений для соединений формулы (1) или (2) может проводиться с использованием метода асимметрического синтеза (PCT переведенная публикация патента Японии No. Hei 5-507645, выложенная заявка на патент Японии No. Hei 5-301878 и Hei 7-285983, выложенная заявка на европейский патент No. 535377 и патент США No. 5420314).
Соединение формулы (I-a) или (II-a), то есть соединение формулы (I) или (II), где R4 представляет собой атом водорода и R3 представляет собой гидроксигруппу, может быть получено проведением восстановительного аминирования соединения формулы (11) или (12) и соединения формулы (13) в инертном растворителе, как показано на схеме ниже.

В качестве растворителей, использованных в реакции соединения формулы (11) или (12) с соединением формулы (13), можно отметить следующие.
Можно отметить растворители сульфоксидного типа, например диметилсульфоксид; растворители амидного типа, например диметилформамид и диметилацетамид; растворители типа простых эфиров, например диэтиловый эфир, диметоксиэтан, тетрагидрофуран и диоксан; галогенированные растворители, например дихлорметан, хлороформ и дихлорэтан; растворители нитрильного типа, например ацетонитрил и пропионитрил; растворители типа ароматических углеводородов, например бензол и толуол; растворители углеводородного типа, например гексан и гептан; растворители сложноэфирного типа, например этилацетат; растворители спиртового типа, например метанол, этанол, 1-пропанол, 2-пропанол и этиленгликоль; и воду. Кроме того, реакция может быть осуществлена в отсутствие любого растворителя. Предпочтительно можно отметить растворители типа простых эфиров и растворители спиртового типа.
Соединение формулы (I-b) или (II-b), то есть соединение формулы (I) или (II), где R4 представляет собой атом водорода и R3 представляет собой гидроксигруппу, m равно 1, V представляет собой CR7OH, может быть получено взаимодействием соединения формулы (11) или (12) с соединением формулы (14) в инертном растворителе, как показано на схеме ниже.

В качестве растворителей, использованных в реакции соединения формулы (11) или (12) с соединением формулы (14), можно отметить следующие.
Можно отметить растворители сульфоксидного типа, например диметилсульфоксид; растворители амидного типа, например диметилформамид и диметилацетамид; растворители типа простых эфиров, например диэтиловый эфир, диметоксиэтан, тетрагидрофуран и диоксан; галогенированные растворители, например дихлорметан, хлороформ и дихлорэтан; растворители нитрильного типа, например ацетонитрил и пропионитрил; растворители типа ароматических углеводородов, например бензол и толуол; растворители углеводородного типа, например гексан и гептан; растворители сложноэфирного типа, например этилацетат; растворители спиртового типа, например метанол, этанол, 1-пропанол, 2-пропанол и этиленгликоль; и воду. Кроме того, реакция может быть осуществлена в отсутствие любого растворителя. Предпочтительно можно отметить растворители типа простых эфиров, растворители нитрильного типа и растворители спиртового типа.
Температура реакции обычно составляет обычно от -80°С до температуры кипения растворителя, использованного в реакции, предпочтительно от -10 до 100°C.
Молярное соотношение реагирующих веществ находится в диапазоне 0,5-4,0, предпочтительно 1,0-2,0, для соотношения соединение (14)/соединение (11) или (12).
В реакции можно использовать кислотный катализатор.
Используемые кислотные катализаторы включают неорганические кислоты, например соляную кислоту и серную кислоту, кислоты Льюиса, напимер хлорид алюминия, тетрахлорид титана, комплекс эфирата трехфтористого бора, перхлорную кислоту, перхлорат лития, бромид лития и трифторметансульфонат иттербия.
Предпочтительными кислотными катализаторами являются бромид лития и перхлорат лития.
Соединения формулы (I-c) или (II-c), то есть соединения формулы (I) или (II), где R4 представляет собой атом водорода, R3 представляет собой гидроксигруппу и A представляет собой группу формулы (15), также может быть получено взаимодействием соединения формулы (16) или (17) с соединением формулы (18) в инертном растворителе, как показано на схеме ниже.
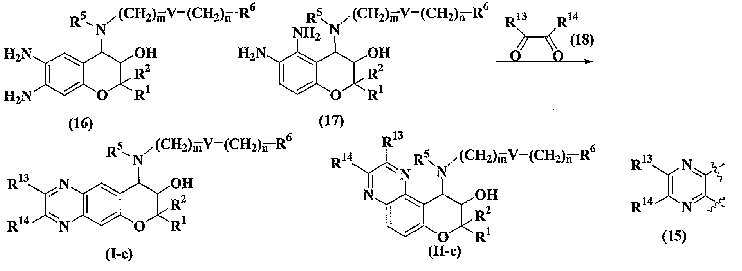
В качестве растворителей, использованных в реакции соединения формулы (16) или (17) с соединением формулы (18), можно отметить следующие.
Можно отметить растворители сульфоксидного типа, например диметилсульфоксид; растворители амидного типа, например диметилформамид и диметилацетамид; растворители типа простых эфиров, например диэтиловый эфир, диметоксиэтан, тетрагидрофуран и диоксан; галогенированные растворители, например дихлорметан, хлороформ и дихлорэтан; растворители нитрильного типа, например ацетонитрил и пропионитрил; растворители типа ароматических углеводородов, например бензол и толуол; растворители углеводородного типа, например гексан и гептан; растворители сложноэфирного типа, например этилацетат; растворители спиртового типа, например метанол, этанол, 1-пропанол, 2-пропанол и этиленгликоль; и воду. Кроме того, реакция может быть осуществлена в отсутствие любого растворителя. Предпочтительно можно отметить растворители спиртового типа.
Температура реакции обычно составляет обычно от -80°С до температуры кипения растворителя, использованного в реакции, предпочтительно от -10 до 50°C.
Молярное соотношение реагирующих веществ находится в диапазоне 0,5-4,0, предпочтительно 0,8-2,0, для соотношения соединение (18)/соединение (16) или (17).
Соединение формулы (I-d) или (II-d), то есть соединение формулы (I) или (II), где R4 представляет собой атом водорода, R3 представляет собой гидроксигруппу и A представляет собой группу формулы (19), также может быть получено восстановлением соединения формулы (20) или (21) в инертном растворителе, как показано на схеме ниже.

Соединение формулы (I-e) или (II-e), то есть соединение формулы (I) или (II), где R4 представляет собой атом водорода, R3 представляет собой гидроксигруппу и A представляет собой группу формулы (22) (X представляет собой SO2 или CO и Y представляет собой S или O), также может быть получено путем циклизации соединения формулы (23) или (24) в инертном растворителе в основных условиях, как показано на схеме ниже.

Соединения формулы (I) или (II), которые не включены в соединения формулы (с I-a по I-e) и (с II-a по II-e), то есть соединения формулы (I) или (II), где R3 и R4 вместе представляют собой связь или R4 представляет собой атом водорода, и R3 представляет собой C1-6алкилкарбонилоксигруппу, могут быть получены способом, аналогичным описанному в выложенных заявках на патент Японии № Sho 52-91866 и Hei 10-87650.
Как описано выше, авторы настоящего изобретения обнаружили, что соединения формулы (I) или (II) оказывают сильное пролонгирующее воздействие на рефракторный период. Эффект пролонгирования рефракторного периода представляет собой один из механизмов антиаритмического действия и является важным индикатором, который можно использовать для заключения об эффективности при клинической аритмии. Обычные антиаритмические агенты, оказывающие пролонгирующее воздействие на рефракторный период в качестве основного механизма (такие как d-зоталол, принадлежащий к классу III по классификации антиаритмических агентов согласно Vaughan Williams) представляли терапевтические проблемы, индуцируя аритмию с высокой степенью опасности, приводящую к внезапной смерти от такой причины как трепетание-мерцание (желудочков) среди прочего вследствие пролонгирования потенциала действия вентикулярной мышцы, что коррелирует с пролонгирующим воздействием на рефракторный период и, следовательно, становится терапевтической проблемой при аритмии главным образом мышцы предсердия (такой как суправентикулярная тахикардия, трепетание предсердия, фибрилляции предсердия и тому подобное).
Для решения проблем авторы настоящего изобретения провели исследование соединений, оказывающих пролонгирующее воздействие на рефракторный период, селективное в отношении мышцы предсердия по сравнению с вентикулярной мышцей, и установили, что соединения формулы (I) или (II) оказывают пролонгирующее воздействие на рефракторный период селективно в отношении мышцы предсердия и не оказывают какого-либо влияния на рефракторный период и потенциал действия вентикулярной мышцы. Различие между открытием авторов настоящего изобретения и предшествующим уровнем техники заключается в обеспечении пролонгирующего воздействия на рефракторный период, селективно для мышцы предсердия, при использовании данной группы соединений, что может быть продемонстрировано с помощью таких фактов, как отсутствие влияния на продолжительность потенциала действия изолированной вентикулярной мышцы и отсутствие влияния на QT на электрокардиограмме анестизированных животных. Как следует из вышеизложеного, соединения по настоящему изобретению не демонстрируют индуцирующего действия на аритмию в вентикулярной мышце, поэтому они могут внести свой вклад в более безопасное применение при аритмии главным образом мышцы предсердия по сравнению с предшествующим уровнем развития техники. Настоящее изобретение обеспечивает преимущества для терапевтического или профилактического применения в качестве агентов против фибрилляции предсердия, агентов против трепетания предсердия и агентов против тахикардии предсердия, по отношению к пароксизмальной, хронической, предоперационной, во время операции и послеоперационной аритмии предсердия, для предотвращения развития заболевания, преводящего к эмболии вследствие аритмии предсердного происхождения, предотвращения развития заболевания, приводящего к желудочковой аритмии или тахикардии вследствие аритмии или тахикардии предсердия и для предотвращения угрожающего жизни прогноза благодаря профилактическому воздействию на аритмию или тахикардию предсердия, приводящих к желудочковой аритмии или тахикардии.
Авторы настоящего изобретения разработали фармацевтическую композицию и ветеринарную фармацевтическую композицию, содержащую в эффективном количестве соединение формулы (I) или (II) для лечения данных состояний.
В качестве форм введения соединения по настоящему изобретению можно отметить парентеральные формы введения, такие как инъекции (подкожные, внутривенные, внутримышечные и внутрибрюшинные инъекции), мази, суппозитории, аэрозоли и тому подобное, и пероральные формы введения, такие как таблетки, капсулы, гранулы, пилюли, сиропы, растворы, эмульсии, суспензии и тому подобное.
Описанные выше фармацевтическая или ветеринарная фармацевтическая композиция содержат соединение согласно настоящему изобретению в количестве примерно 0,01-99,5%, предпочтительно примерно 0,1-30%, из расчета на общий вес композиции.
В дополнение к соединению согласно настоящему изобретению в композиции, содержащей соединение, могут содержаться другие фармацевтические или ветеринарные фармацевтически активные соединения.
Кроме того, данные композиции могут содержать множество соединений согласно настоящему изобретению.
Количество соединения согласно настоящему изобретению для использования при клиническом введении может изменяться в зависимости от возраста, веса и чувствительности пациента, симптоматического состояния и тому подобного, но эффективное количество при клиническом введении обычно составляет примерно 0,003-1,5 г, предпочтительно 0,01-0,6 г, в сутки для взрослого человека. Однако при необходимости можно использовать количество, выходящее за пределы вышеуказанного диапазона.
Соединение согласно настоящему изобретению вводят в состав препаративных форм для введения с помощью обычных фармацевтических способов.
То есть таблетки, капсулы, гранулы и пилюли для перорального введения получают с использованием эксципиентов, таких как сахароза, лактоза, глюкоза, крахмал и маннит, связующих веществ, таких как гидроксипропилцеллюлоза, сироп, аравийская камедь, желатин, сорбит, трагакантовая камедь, метилцеллюлоза и поливинилпирролидон; дезинтегрирующих агентов, таких как крахмал, карбоксиметилцеллюлоза и ее кальциевая соль, микрокристаллическая целлюлоза и полиэтиленгликоль; смазывающих веществ, таких как тальк, стеарат магния или кальция и диоксид кремния; смазывающих агентов, таких как лаурат натрия и глицерин и тому подобного.
Препаративные формы для инъекций, растворы, эмульсии, суспензии, сиропы и аэрозоли получают с использованием растворителей для активного соединения, таких как вода, этиловый спирт, изопропиловый спирт, пропиленгликоль, 1,3-бутиленгликоль и полиэтиленгликоль; поверхностно-активных веществ, таких как сложный эфир сорбитана и жирной кислоты, полиоксиэтиленовый сложный эфир сорбитана и жирной кислоты, полиоксиэтиленовый сложный эфир жирной кислоты, полиоксиэтиленовый простой эфир гидрированного касторового масла и лецитина; суспендирующих агентов, таких как карбоксиметиловая соль натрия, производные целлюлозы, такие как метилцеллюлоза или тому подобное, и природные каучуки, такие как аравийская камедь, трагакантовая камедь или тому подобное, и консервантов, таких как сложные эфиры п-гидроксибензойной кислоты, хлорид бензалкония, соли сорбиновой кислоты и тому подобное.
Для мазей, которые представляют собой чрескожно адсорбируемые фармацевтические препаративные формы, используют белый вазелин, жидкий парафин, высшие спирты, макроголовые мази, гидрофильные мази, водные основы гелевого типа и тому подобное.
Суппозитории получают с использованием, например, кокосовых жиров, полиэтиленгликоля, ланолина, триглицерида жирных кислот, кокосового масла, полисорбата и тому подобного.
Примеры
Настоящее изобретение далее подробно проиллюстрировано с помощью примеров, но настоящее изобретение не ограничено данными примерами.
[Примеры синтеза]
Кроме того, Ph,Ph саленовый комплекс марганца (XX) и Cyc,Ph саленовый комплекс марганца (XY) обозначают оптически активные соединения, имеющие нижеприведенную формулу, которые были синтезированы в соответствии со способом, аналогичным описанному в выложенной заявке на патент Японии No. Hei 7-285983.

Пример синтеза 1
3/2 малеат (±)-транс-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
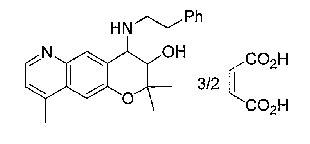
2,2,9-Триметил-2H-пирано[2,3-g]хинолин
К раствору 6-амино-2,2-диметилхромена (10,1 г, 57,7 ммоль) в этаноле (500 мл) добавляли при комнатной температуре метилвинилкетон (33,0 мл, 404 ммоль), м-нитробензолсульфоновую кислоту (21,1 г, 104 ммоль), хлорид цинка (1,97 г, 14,4 ммоль) и 35% соляную кислоту (24 мл, 289 ммоль) и полученную смесь перемешивали при 110°С в течение 5 часов. По завершении реакции этанол отгоняли, добавляли воду и полученный раствор нейтрализовали гидрокарбонатом натрия и экстрагировали этилацетатом. Полученную органическую фазу промывали водным раствором хлорида натрия и сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией среднего давления (гексан/этилацетат=3/1) и получали целевой продукт (выход: 38%).
Коричневый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,51 (с, 6Н), 2,59 (д, J=0,6 Гц, 3Н), 5,90 (д, J=9,9 Гц, 1Н), 6,59 (д, J=9,9 Гц, 1Н), 7,11 (д, J=3,6 Гц, 1Н), 7,25 (с, 1Н), 7,68 (с, 1Н), 8,57 (д, J=4, 4 Гц, 1Н).
Масс-спектр (ESI+) m/z: 226 [М+1]+.
(±)-транс-2,2,9-Триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол
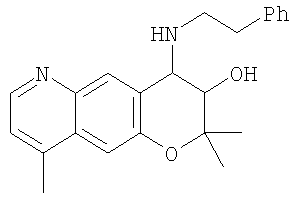
К раствору 2,2,9-триметил-2Н-пирано[2,3-g]хинолина (530 мг, 2,35 ммоль) в диметилсульфоксиде (8 мл) добавляли при комнатной температуре N-бромсукцинимид (920 мг, 5,17 ммоль) и воду (1,6 мл) и полученную смесь перемешивали при комнатной температуре в течение 3 часов. По завершении реакции к реакционному раствору добавляли воду и полученный раствор экстрагировали этилацетатом. К водной фазе добавляли водный раствор гидрокарбоната натрия и полученный раствор дополнительно экстрагировали этилацетатом. Объединенные органические фазы сушили над безводным сульфатом магния и растворитель отгоняли, получая неочищенный продукт (±)-транс-3-бром-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-4-ола. К этой смеси добавляли при комнатной температуре 1,4-диоксан (30 мл) и 1 моль/л водный раствор гидроксида натрия (5,64 мл) и полученный раствор перемешивали при комнатной температуре в течение 2,5 часов. По завершении реакции к реакционному раствору добавляли воду и полученный раствор экстрагировали этилацетатом, сушили над безводным сульфатом магния и растворитель отгоняли, получая неочищенный продукт 3,4-эпокси-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолина. К остатку добавляли при комнатной температуре 1,4-диоксан (3,2 мл), перхлорат лития (250 мг, 2,35 ммоль) и 2-фенилэтиламин (0,35 мл, 2,82 ммоль) и полученную смесь перемешивали при 75°C в течение 5 часов. По завершении реакции к реакционному раствору добавляли водный раствор гидрокарбоната натрия, полученный раствор экстрагировали этилацетатом, органическую фазу промывали водным раствором гидрокарбоната натрия затем водным раствором хлорида натрия и сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией (гексан/этилацетат= 1/1) и получали целевой продукт (3 стадии, выход: 26%).
1H-ЯМР (CDCl3) δ: 1,26 (c, 3H), 1,55 (c, 3H), 2,59 (c, 3H), 2,83 (т, J=6,8 Гц, 2H), 2,96-3,12 (м, 3H), 3,60 (д, J=10,5 Гц, 1H), 3,88 (дд, J=1,1 Гц, 10,5 Гц, 1H), 7,13 (д, J=4,2 Гц, 1H), 7,18-7,32 (м, 6H), 7,98 (д, J=1,1 Гц, 1H), 8,60 (д, J=4,4 Гц, 1H).
Масс-спектр (ESI+) m/z: 363 [М+1]+
К раствору (±)-транс-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола (219 мг, 0,60 ммоль) в этилацетате (3 мл) добавляли по каплям раствор малеиновой кислоты (77 мг, 0,66 ммоль) в этилацетате (1 мл), полученный реакционный раствор охлаждали до 0°C, добавляли к нему гексан (10 мл) и выпавшее в осадок твердое вещество отфильтровывали, получая 3/2 малеат (±)-транс-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола (выход: 72%).
Желтые кристаллы
т.пл.:172-174°C (разложение)
1H-ЯМР (ДМСО-d6) δ: 1,17 (c, 3H), 1,50 (c, 3H), 2,59 (c, 3H), 2,94-3,37 (м, 4H), 4,10 (дд, J=6,1 Гц, 9,4 Гц, 1H), 4,72 (д, J=9,4 Гц, 1H), 6,09 (c, 3H), 6,33 (д, J=6,1 Гц, 1H), 7,23-7,35 (м, 6H), 7,42 (c, 1H), 8,43 (c, 1H), 8,66 (д, J=4,1 Гц, 1H).
Пример синтеза 2
(±)-транс-2,2,7,9-Тетраметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол

Данное соединение синтезировали в соответствии со способом примера синтеза 1.
2,2,7,9-Тетраметил-2H-пирано[2,3-g]хинолин

(Выход: 59%)
Черно-коричневый маслянистый продукт
1H-ЯМР (CDCl3) δ: 1,49 (c, 6H), 2,54 (c, 3H), 2,62 (c, 3H), 5,86 (д, J=9,9 Гц, 1H), 6,55 (д, J=9,9 Гц, 1H), 7,00 (c, 1H), 7,20 (c, 1H), 7,60 (c, 1H)
Масс-спектр (ESI+) m/z: 240 [М+1]+
(±)-транс-3-Бром-2,2,7,9-тетраметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-4-ол

(Выход: 82%)
1H-ЯМР (CDCl3) δ: 1,47 (c, 3H), 1,68 (c, 3H), 2,58 (c, 3H), 2,70 (c, 3H), 4,28 (д, J=9,6 Гц, 1H), 5,14 (д, J=9,6 Гц, 1H), 7,08 (c, 1H), 7,28 (c, 1H), 8,37 (c, 1H).
Масс-спектр (ESI+) m/z: 336, 338 [М+1]+
(±)-транс-2,2,7,9-Тетраметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол (выход: 17%)
Белые кристаллы т.пл.:144-147°C
1H-ЯМР (CDCl3) δ: 1,25 (c, 3H), 1,54 (c, 3H), 1,90 (ушир. c, 1H), 2,55 (c, 3H), 2,65 (c, 3H), 2,81 (т, J=6,8 Гц, 2H), 2,97-3,10 (м, 2H), 3,19 (ушир.с, 1H), 3,58 (д, J=10,5 Гц, 1H), 3,85 (д, J=10,5 Гц, 1H), 7,04 (c, 1H), 7,17-7,31 (м, 6H), 7,91 (c, 1H).
Масс-спектр (ESI+) m/z: 377 [М+1]+
Масс-спектр (ESI-) m/z: 421 [М+45]+ (HCOOH аддукт)
Пример синтеза 3
1 малеат (±)-транс-2,2,8,9-тетраметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола

Данное соединение синтезировали в соответствии со способом примера синтеза 1.
2,2,8,9-Тетраметил-2H-пирано[2,3-g]хинолин

(Выход: 50%)
1H-ЯМР (CDCl3) δ: 1,50 (c, 6H), 2,50 (c, 3H), 2,66 (c, 3H), 5,87 (д, J=9,9 Гц, 1H), 6,57 (д ,J=9,9 Гц, 1H), 7,26 (c, 1H), 7,63 (c, 1H), 8,48 (c, 1H)
Масс-спектр (ESI+) m/z: 240 [М+1]+
(±)-транс-3-Бром-2,2,7,9-тетраметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-4-ол

(Выход: 65%)
1H-ЯМР (CDCl3) δ: 1,48 (c, 3H), 1,69 (c, 3H), 1,80 (ушир. c, 1H), 2,46 (c, 3H), 2,56 (c, 3H), 4,28 (д, J=9,6 Гц, 1H), 5,15 (д, J=9,6 Гц, 1H), 7,25 (c, 1H), 8,42 (c, 1H), 8,57 (c, 1H)
Масс-спектр (ESI+) m/z: 336, 338 [М+1]+
1 малеат (±)-транс-2,2,8,9-тетраметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
(Выход: 4%)
Белые кристаллы
т.пл.: 199-203°C
1H-ЯМР (ДМСО-d6) δ: 1,17 (c, 3H), 1,50 (c, 3H), 2,41 (c, 3H), 2,49 (c, 3H), 2,89-3,40 (м, 4H), 4,07 (дд, J=5,5 Гц, 9,4 Гц, 1H), 4,66 (д, J=9,4 Гц, 1H), 6,05 (c, 2H), 6,28 (д, J=5,5 Гц, 1H), 7,22-7,35 (м, 5H), 7,43 (c, 1H), 8,36 (c, 1H), 8,59 (c, 1H)
Масс-спектр (ESI+) m/z: 377 [М+1]+
Масс-спектр (ESI-) m/z: 421 [М+45]+ (HCOOH аддукт)
Пример синтеза 4
3/2 малеат (±)-транс-2,2,7-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола

2,2,7-Триметил-2H-пирано[2,3-g]хинолин
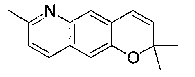
К 6-амино-2, 2-диметилхромену (1,00 г, 5,71 ммоль) добавляли при комнатной температуре 35% соляную кислоту (1,43 мл, 17,1 ммоль), п-хлоранил (1,40 г, 5,71 ммоль) и н-бутанол (1,3 мл) и температуру повышали до 120°C. Добавляли раствор кротилового альдегида (0,567 мл, 6,84 ммоль) в н-бутаноле (0,52 мл) и полученную смесь перемешивали при 120°C в течение 20 минут. Добавляли раствор хлорида цинка (0,777 г, 5,71 ммоль) в тетрагидрофуране (10 мл) и полученную смесь перемешивали при 120°C в течение 20 минут. По завершении реакции добавляли водный раствор гидрокарбоната натрия полученный раствор экстрагировали этилацетатом и сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией (гексан/этилацетат= 2/1) и перекристаллизовывали из этилацетата, получая целевой продукт (выход: 22%).
Серое твердое вещество
1H-ЯМР (CDCl3) δ: 1,48 (c, 6H), 2,67 (c, 3H), 5,87 (д, J=9,9 Гц, 1H), 6,55 (д, J=9,9 Гц, 1H), 7,05 (c, 1H), 7,16 (д, J=8,5 Гц, 1H), 7,64 (c, 1H), 7,86 (д, J=8,5 Гц, 1H)
Масс-спектр (ESI+) m/z: 226 [М+1]+
Масс-спектр (ESI-) m/z: 225 [М]+
(±)-транс-3-Бром-2,2,7-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-4-ол

Данное соединение синтезировали в соответствии со способом примера синтеза 1.
(Выход: 24%)
3/2 малеат (±)-транс-2,2,7-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
(Выход: 12%)
Белые кристаллы
1H-ЯМР (ДМСО-d6) δ: 1,15 (c, 3H), 1, 48 (c, 3H), 2,63 (c, 3H), 2,70-3,38 (м, 4H), 4,09 (дд, J=5,8 Гц, 9,4 Гц, 1H), 4,68 (д, J=9,4 Гц, 1H), 6,08 (c, 3H), 6,29 (д, J=5,8 Гц, 1H), 7,22-7,35 (м, 6H), 7,40 (c, 1H), 8,10 (д, J=8,5 Гц, 1H), 8,33 (c, 1H)
Масс-спектр (ESI+) m/z: 363 [М+1]+
Масс-спектр (ESI-) m/z: 407 [М+45]+ (HCOOH аддукт)
Пример синтеза 5
2 малеат (±)-транс-2,2,8-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола

Данное соединение синтезировали в соответствии со способом примера синтеза 1.
2,2,8-Триметил-2H-пирано[2,3-g]хинолин

(Выход: 17%)
1H-ЯМР (CDCl3) δ: 1,48 (c, 6H), 2,45 (c, 3H), 5,87 (д, J=9,9 Гц, 1H), 6,56 (д, J=9,9 Гц, 1H), 7,00 (c,1H), 7,64 (c, 1H), 7,70 (c, 1H), 8,54 (д, J=8,5 Гц, 1H)
Масс-спектр (ES+) m/z: 226 [М+1]+
(±)-транс-3-Бром-2,2,8-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-4-ол

(Выход: 54%)
Масс-спектр (ESI+) m/z: 322, 324 [М+1]+
2 малеат (±)-транс-2,2,8-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
(Выход: 20%)
Белые кристаллы
1H-ЯМР (ДМСО-d6) δ: 1,15 (c, 3H), 1,49 (c, 3H), 2,45 (c, 3H), 2,97-3,39 (м, 4H), 4,09 (дд, J=6,1 Гц, 9,4 Гц,1H), 4,71 (д, J=9,1 Гц, 1H), 6,15 (c, 4H), 6,32 (д, J=6,3 Гц, 1H), 7,19-7,36 (м, 5H), 7,97 (c, 1H), 8,39 (c, 1H), 8,67 (c, 1H).
Пример синтеза 6
1 малеат (±)-транс-7-хлор-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3g]хинолин-3-ола

К раствору 2,2,9-триметил-2H-пирано[2,3-g]хинолина (1,56 г, 6,92 ммоль) в хлороформе (15,6 мл) добавляли по каплям при комнатной температуре раствор м-хлорпербензойной кислоты (2,61 г, 15,2 ммоль) в смеси хлороформ (6,4 мл)-метанол (1,6 мл) и полученную смесь перемешивали при комнатной температуре в течение 1,5 часов. По завершении реакции реакционный раствор экстрагировали водным раствором тиосульфата натрия и полученную органическую фазу промывали водным раствором гидрокарбоната натрия, затем водным раствором хлорида натрия и сушили над безводным сульфатом магния. После отгонки растворителя к остатку добавляли при комнатной температуре хлороформ (33 мл), п-толуолсульфонилхлорид (1,32 г, 6,92 ммоль) и карбонат калия (0,954 г, 6,92 ммоль) и полученную смесь перемешивали при 70°C в течение 3 часов. По завершении реакции к реакционному раствору добавляли воду и экстрагировали его хлороформом. Полученную органическую фазу промывали водным раствором хлорида натрия и сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией (гексан/этилацетат = 2/1) и получали целевой продукт (выход: 67%).

Бледно-желтое твердое вещество
1H-ЯМР (CDCl3) δ: 1,42 (c, 6H), 2,48 (д, J=0,8 Гц, 3H), 5,83 (д, J=9,9 Гц, 1H), 6,47 (д, J=9,9 Гц, 1H), 7,03 (д, J=3,6 Гц, 1H), 7,11 (c, 1H), 7,50 (c, 1H).
Масс-спектр (ESI+) m/z: 260 [М+1]+
(±)-транс-3-Бром-7-хлор-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-4-ол
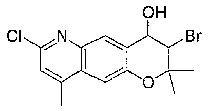
Далее, целевое соединение синтезировали в соответствии со способом примера синтеза 1.
(Выход: 44%)
Масс-спектр (ESI+) m/z: 356, 358 [М+1]+
1 малеат (±)-транс-7-хлор-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
(Выход: 58%)
Белые кристаллы
т.пл.: 221-226°C (разложение)
1H-ЯМР (ДМСО-d6) δ: 1,17 (c, 3H), 1,49 (c, 3H), 2,60 (c, 3H), 2,93-3,32 (м, 4H), 4,05 (м, 1H), 4,65 (д, J=9,4 Гц, 1H), 6,05 (c, 2H), 6,28 (ушир. c, 1H), 7,22-7,34 (м, 5H), 7,43 (c, 2H), 8,32 (c, 1H).
Масс-спектр (ESI+) m/z: 397 [М+1]+
Масс-спектр (ESI-) m/z: 441 [М+45]+ (HCOOH аддукт)
Пример синтеза 7
1 малеат (±)-транс-3-гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-карбонитрила

2,2,9-Триметил-2H-пирано[2,3-g]хинолин-7-карбонитрил

К раствору 2,2,9-триметил-2H-пирано[2,3-g]хинолина (4,36 г, 19,3 ммоль) в хлороформе (43,6 мл) добавляли по каплям при комнатной температуре раствор м-хлорпербензойной кислоты (7,35 г, 42,6 ммоль) в смеси хлороформ (17,4 мл) - метанол (4,36 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. По завершении реакции реакционный раствор экстрагировали водным раствором тиосульфата натрия и полученную органическую фазу промывали водным раствором гидрокарбоната натрия, затем водным раствором хлорида натрия и сушили над безводным сульфатом магния. После отгонки растворителя добавляли к остатку при комнатной температуре ацетонитрил (19,3 мл), триметилсилилцианид (7,27 мл, 57,9 ммоль) и триэтиламин (5,38 мл, 38,6 ммоль) и полученный раствор перемешивали при 70°C в течение 3,5 часов. По завершении реакции добавляли к реакционному раствору водный раствор гидрокарбоната натрия, экстрагировали его хлороформом и сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией (гексан/этилацетат = 2/1) и получали целевой продукт (выход: 55%).
Бледно-желтое твердое вещество
1H-ЯМР (CDCl3) δ: 1,52 (c, 6H), 2,62 (д, J=0,6 Гц, 3H), 5,97 (д, J=9,9 Гц, 1H), 6,58 (д, J=9,9 Гц, 1H), 7,23 (c, 1H), 7,40 (c, 1H), 7,71 (c, 1H).
Масс-спектр (ESI+) m/z: 251 [М+1]+
(±)-транс-3-Бром-4-гидрокси-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-карбонитрил

Далее, целевое соединение синтезировали в соответствии со способом примера синтеза 1.
(Выход: 36%)
Масс-спектр (ESI+) m/z: 349 [М+1]+
1 малеат (±)-транс-3-гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-карбонитрила
Белые кристаллы
т.пл.: 218-220°C (разложение)
1H-ЯМР (ДМСО-d6) δ: 1,20 (c, 3H), 1,51 (c, 3H), 2,65 (c, 3H), 2,96-3,33 (м, 4H), 4,04-4,06 (м, 1H), 4,64 (ушир. c, 1H), 6,05 (c, 2H), 6,29 (ушир. c, 1H), 7,25-7,31 (м, 5H), 7,50 (c, 1H), 7,85 (c, 1H), 8,49 (c, 1H).
Масс-спектр (ESI+) m/z: 388 [М+1]+
Масс-спектр (ESI-) m/z: 432 [М+45]+ (HCOOH аддукт)
Пример синтеза 8
(±)-транс-3,3-Диметил-1-[(2-фенилэтил)амино]-2,3-дигидро-1H-пирано
[3,2-f]хинолин-2-ол
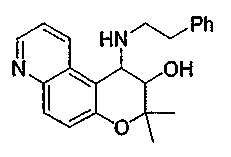
6-[(1,1-диметил-2-пропинил)окси]хинолин
Раствор 2-метил-3-бутин-2-ола (2,45 мл, 25,1 ммоль) и 1,8-диазабицикло-[5,4,0]-7-ундецена (4,25 мл, 28,4 ммоль) в ацетонитриле (15,5 мл) перемешивали при 0°C в течение 30 минут и добавляли по каплям трифторуксусный ангидрид (3,55 мл, 25,1 ммоль). Полученную смесь добавляли по каплям к раствору смеси 6-гидроксихинолина (2,43 г, 16,7 ммоль), хлорида меди (I) (8,3 мг, 0,0835 ммоль), ацетонитрила (15,5 мл) и 1,8-диазабицикло-[5,4,0]-7-ундецена (4,25 мл, 28,4 ммоль) при 0°C и перемешивали при 0°C в течение 3 часов. Полученный раствор подкисляли 1 моль/л HCl и экстрагировали этилацетатом, полученную водную фазу нейтрализовали водным раствором гидрокарбоната натрия, экстрагировали этилацетатом и сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией (гексан/этилацетат = от 1/1 до 1/3) и получали целевой продукт.
Бледно-желтое твердое вещество
т.пл.: 65-67°C
1H-ЯМР (CDCl3) δ: 1,86 (c, 6H), 2,70 (c, 1H), 7,69-7,71 (2H), 7,80 (c, 1H), 8,33 (д, J=8,3 Гц, 1H), 8,45 (д, J=8,3 Гц 1Н), 9,01 (ушир. с, 1Н)
Масс-спектр (El) m/z: 211 [М]+
3,3-Диметил-3Н-пирано[3,2-f]хинолин

Раствор 6-[(1,1-диметил-2-пропинил)окси]хинолина (16,7 ммоль) в 1,2-дихлорбензоле (10 мл) перемешивали при 180°С в течение 1 часа. По завершении реакции растворитель отгоняли и остаток перекристаллизовывали из смеси гексан-этилацетат, получая целевое соединение (2 стадии, количествен.).
Зеленые кристаллы
т.пл.: 104-107°С
1H-ЯМР (CDCl3) δ: 1,54 (с, 6Н), 5,89 (д, J=10,2 Гц, 1Н), 6,93 (д, J=10,2 Гц, 1Н), 7,50 (д, J=9,1 Гц, 1Н), 7,73 (ушир. с, 1Н), 8,31 (д, J=9,1 Гц, 1Н), 8,74 (д, J=8,5 Гц, 1Н), 9,03 (ушир. с, 1Н).
Масс-спектр (EI) m/z: 211 [M]+.
(±)-транс-3,3-Диметил-1-[(2-фенилэтил)амино]-2,3-дигидро-1H-пирано[3,2-f]хинолин-2-ол
Далее, целевое соединение синтезировали в соответствии со способом примера синтеза 1.
т.пл.: 180-182°С
1H-ЯМР (CDCl3) δ: 1,32 (с, 3Н), 1,44 (с, 3Н), 1,63 (ушир. с, 1Н), 2,43 (ушир. с, 1Н), 2,69-2,84 (м, 3Н), 2,92-2,97 (м, 1Н), 3,83 (д, J=5,0 Гц, 1Н), 4,09 (д, J=5,5 Гц, 1Н), 7,10-7,29 (м, 6H), 7,86 (д, J=9,1 Гц, 1H), 8,13 (д, J=7,7 Гц, 1H), 8,71 (дд, J=1,7 Гц, 4,1 Гц, 1H)
Масс-спектр (ESI+) m/z: 349 [М+1]+
Масс-спектр (ESI-) m/z: 393 [М+45]+ (HCOOH аддукт)
Пример синтеза 9
(±)-транс-8-Хлор-3,3-диметил-1-[(2-фенилэтил)амино]-2,3-дигидро-1H-пирано[3,2-хинолин-2-ол

С использованием 3,3-диметил-3H-пирано[3,2-f]хинолина целевое соединение синтезировали аналогично способу примера синтеза 6.
8-Хлор-3,3-диметил-3H-пирано[3,2-f]хинолин

(Выход: 82%)
Красно-коричневый маслянистый продукт
1H-ЯМР (CDCl3) δ: 1,49 (c, 6H), 5,77 (д, J=9,9 Гц, 1H), 6,87 (д, J=9,9 Гц, 1H), 7,27 (д, J=9,1 Гц, 1H), 7,34 (д, J=8,8 Гц, 1H), 7,80 (д, J=9,1 Гц, 1H), 8,19 (д, J=8,8 Гц, 1H).
Масс-спектр (ESI+) m/z: 246 [М+1]+
(±)-транс-2-Бром-8-хлор-3,3-диметил-2,3-дигидро-1H-пирано[3,2-f]хинолин-1-ол

(Выход: 45%)
(±)-транс-8-Хлор-3,3-диметил-1-[(2-фенилэтил)амино]-2,3-дигидро-1H-пирано[3,2-f]хинолин-2-ол
(Выход: 60%)
Белые кристаллы
т.пл.: 141-143°C
1H-ЯМР (CDCl3) δ: 1,28 (c, 3H), 1,44 (c, 3H), 1,64 (ушир. c, 2H), 2,65-2,78 (м, 3H), 2,86-2,96 (м, 1H), 3,84 (д, J=6,1 Гц, 1H), 4,06 (д, J=5,8 Гц, 1H), 7,08-7,30 (м, 7H), 7,98 (д, J=9,1 Гц, 1H), 8,22 (д, J=8,8 Гц, 1H).
Масс-спектр (ESI+) m/z: 383 [М+1]+
Масс-спектр (ESI-) m/z: 427 [М+45]+ (HCOOH аддукт)
Пример синтеза 10
(±)-транс-2-Гидрокси-3,3-диметил-1-[(2-фенилэтил)амино]-2,3-дигидро-1H-пирано[3,2-nхинолин-8-карбонитрил

С использованием 3,3-диметил-3H-пирано[3,2-f]хинолина целевое соединение синтезировали аналогично способу примера синтеза 7.
3,3-Диметил-3H-пирано[3,2-f]хинолин-8-карбонитрил
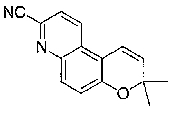
(Выход: количественный)
Желтое твердое вещество
1H-ЯМР (CDCl3) δ: 1,52 (c, 6H), 5,80 (д, J=9,9 Гц, 1H), 6,89 (д, J=10,2 Гц, 1H), 7,37 (д, J=9,4 Гц, 1H), 7,65 (д, J=8,8 Гц, 1H), 7,95 (д, J=9,4 Гц, 1H), 8,64 (д, J=8,8 Гц, 1H).
Масс-спектр (ESI+) m/z: 237[М+1]+
Масс-спектр (ESI-) m/z: 235 [М-1]+
(±)-транс-2-Бром-1-гидрокси-3,3-диметил-2,3-дигидро-1H-пирано[3,2-f]хинолин-8-карбонитрил

(Выход: 49%)
1H-ЯМР (CDCl3) δ: 1,50 (c, 3H), 1,69 (c, 3H), 2,72 (д, J=4,1 Гц, 1H), 4,35 (д, J=7,2 Гц, 1H), 5,43 (дд, J=3,9 Гц, 7,2 Гц, 1H), 7,36 (д, J=9,1 Гц, 1H), 7,70 (д, J=8,8 Гц, 1H), 8,03 (д, J=9,4 Гц, 1H), 8,72 (д, J=8,5 Гц, 1H)
Масс-спектр (ESI+) m/z: 333, 335 [М+1]+
Масс-спектр (ESI-) m/z: 379 [М+45]+ (HCOOH аддукт)
(±)-транс-2-Гидрокси-3,3-диметил-1-[(2-фенилэтил)амино]-2,3-дигидро-1H-пирано[3,2-f]хинолин-8-карбонитрил
(Выход: 72%)
Белые кристаллы
т.пл.: 93-96°C
1H-ЯМР (CDCl3) δ: 1,30 (c, 3H), 1,46 (c, 3H), 1,60 (ушир. c, 3H), 2,13 (ушир.с, 1H), 2,66-2,79 (м, 3H), 2,88-2,98 (м, 1H), 3,87 (д, J=5,8 Гц, 1H), 4,08 (д, J=6,1 Гц, 1H), 7,09 (д, J=6,3 Гц, 1H), 7,10 (д, J=7,4 Гц, 1H), 7,23-7,27 (м, 3H), 7,30 (д, J=9,1 Гц, 1H), 7,41 (д, J=8,8 Гц, 1H), 7,92 (д, J=9,1 Гц, 1H), 8,38 (д, J=8,5 Гц, 1H)
Масс-спектр (ESI+) m/z: 374 [М+1]+
Масс-спектр (ESI-) m/z: 418 [М+45]+ (HCOOH аддукт)
Пример синтеза 11
(±)-транс-2-Гидрокси-3,3-диметил-1-[(2-фенилэтил)амино]-2,3-дигидро-1H-пирано[3,2-f]хинолин-8-карбоксамид

К раствору (±)-транс-2-гидрокси-3,3-диметил-1-[(2-фенилэтил)амино]-2,3-дигидро-1H-пирано[3,2-f]хинолин-8-карбонитрила (400 мг, 1,07 ммоль) в трет-бутаноле (40 мл) добавляли при комнатной температуре гидроксид калия (800 мг, 14,3 ммоль) и полученную смесь перемешивали при 90°C в течение 2 часов. По завершении реакции к реакционному раствору добавляли водный раствор хлорида натрия, экстрагировали его этилацетатом и полученную органическую фазу сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией (гексан/этилацетат = 1/1) и перекристаллизовывали из смеси гексан-этилацетат, получая целевой продукт (выход: 54%).
Белые кристаллы
т.пл.: 197-199°С
1H-ЯМР (CDCl3) δ: 1,32 (c, 3H), 1,47 (c, 3H), 1,71 (ушир.с, 2H), 2,29 (ушир.с, 1H), 2,69-2,76 (м, 3H), 2,89-2,97 (м, 1H), 3,86 (ушир.с, 1H), 4,13 (д, J=5,8 Гц, 1H), 5,62 (ушир.с, 1H), 7,10 (д, J=6,9 Гц, 1H), 7,10 (д, J=7,4 Гц, 1H), 7,20-7,28 (м, 4H), 7,89 (д, J=9,4 Гц, 1H), 7,98 (ушир. c, 1H), 8,07 (д, J=8,8 Гц, 1H), 8,31 (д, J=8,8 Гц, 1H).
Масс-спектр (ESI+) m/z: 392 [М+1]+
Масс-спектр (ESI-) m/z: 436 [М+45]+ (HCOOH аддукт)
Пример синтеза 12
1 малеат (3R*,4S*)-2,2,7,9-тетраметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
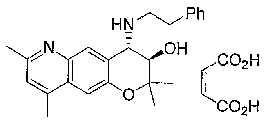
(3R*,4R*)-3,4-эпокси-2,2,7,9-тетраметил-3,4-дигидро-2H-пирано[2,3-g]хинолин

К раствору 2,2,7,9-тетраметил-2H-пирано[2,3-g]хинолина (4,64 г, 19,4 ммоль) в этилацетате (70 мл) добавляли при комнатной температуре N-метилимидазол (0,303 мл, 3,88 ммоль) и Ph,Ph саленовый комплекс марганца (XX) (201 мг, 0,194 ммоль), добавляли по каплям водный раствор гипохлорита натрия (25,6 г, 1,513 моль/кг, 38,8 ммоль) и полученную смесь перемешивали в течение 1 часа. Далее на водяной бане добавляли водный раствор гипохлорита натрия (25,6 г, 1,513 моль/кг, 38,8 ммоль) и полученную смесь перемешивали на водяной бане в течение 1 часа. По завершении реакции добавляли к реакционному раствору водный раствор тиосульфата натрия, полученную смесь фильтровали через целит и экстрагировали. Органическую фазу промывали водным раствором гидрокарбоната натрия, затем водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией (гексан/этилацетат = 1/3) и получали целевой продукт (выход: 68%).
> 99,9% ee; CHIRALPAKAD-RH 20 мM фосфатный буфер (pH 8,0)/ацетонитрил = 60/40, время удерживания: 5,7 мин.
1H-ЯМР (CDCl3) δ: 1,30 (c, 3H), 1,64 (c, 3H), 2,56 (c, 3H), 2,66 (c, 3H), 3,59 (д, J=4,4 Гц, 1H), 4,14 (д, J=4,4 Гц, 1H), 7,08 (c, 1H), 7,29 (c, 1H), 8,04 (c, 1H)
Масс-спектр (ESI+) m/z: 256 [М+1]+
1 малеат (3R*,4S*)-2,2,7,9-тетраметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
К раствору (3R*,4R*)-3,4-эпокси-2,2,7,9-тетраметил-3,4-дигидро-2H-пирано[2,3-g]хинолина (0,80 г, 3,14 ммоль) в 1,4-диоксане (1,6 мл) добавляли при комнатной температуре перхлорат лития (334 мг, 3,14 ммоль) и 2-фенилэтиламин (0,473 мл, 3,77 ммоль) и полученную смесь перемешивали при 70°C в течение 1 часа. По завершении реакции добавляли к реакционному раствору водный раствор гидрокарбоната натрия, экстрагировали его этилацетатом и полученную органическую фазу промывали водным раствором гидрокарбоната натрия, затем водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией (этилацетат). Далее после отгонки растворителя добавляли этилацетат (2 мл) и добавляли по каплям раствор малеиновой кислоты (376 мг, 3,23 ммоль) в этилацетате (8 мл). Полученное выпавшее в осадок твердое вещество отфильтровывали, получая целевой продукт (выход: 86%).
Белые кристаллы
т.пл.: 215-219°C (разложение)
1H-ЯМР (ДМСО-d6) δ: 1,16 (c, 3H), 1,49 (c, 3H), 2,55 (c, 3H), 2,58 (c, 3H), 2,93-3,39 (м, 4H), 4,07 (дд, J=6,4 Гц, 9,4 Гц, 1H), 4,64 (д, J=9,4 Гц, 1H), 6,05 (c, 2H), 6,27 (д, J=5,8 Гц, 1H), 7,24-7,26 (м, 4H), 7,30 (c, 1H), 7,33 (c, 1H), 7,36 (c, 1H), 8,31 (c, 1H)
Масс-спектр (ESI+) m/z: 377 [М+1]+
Масс-спектр (ESI-) m/z: 421 [М+45]+ (HCOOH аддукт)
Пример синтеза 13
1 малеат (3R*,4S*)-2,2,7-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола

Данное соединение синтезировали в соответствии со способом примера синтеза 12.
(3R*,4R*)-3,4-Эпокси-2,2,7-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин
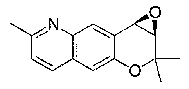
99,3% ee; CHIRALPAKAD-RH 20 мM фосфатный буфер (pH 8,0)/ацетонитрил = 60/40, время удерживания: 6,2 мин.
1H-ЯМР (CDCl3) δ: 1,28 (c, 3H), 1,64 (c, 3H), 2,71 (c, 3H), 3,59 (д, J=4,4 Гц, 1H), 4,15 (д, J=4,4 Гц, 1H), 7,13 (c, 1H), 7,23 (д, J=8,5 Гц, 1H), 7,91 (д, J=8,5 Гц, 1H), 8,05 (c, 1H)
Масс-спектр (ESI+) m/z: 242 [М+1]+
1 малеат (3R*,4S*)-2,2,7-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
Белые кристаллы
т.пл.: 214-217°C (разложение)
1H-ЯМР (ДМСО-d6) δ: 1,15 (c, 3H), 1,48 (c, 3H), 2,62 (c, 3H), 2,93-3,14 (м, 4H), 4,03-4,07 (м, 1H), 4,61 (ушир. c, 1H), 6,04 (c, 2H), 6,23 (ушир. c, 1H), 7,23-7,39 (м, 7H), 8,09 (д, J=8,5 Гц, 1H), 8,31 (c, 1H).
Масс-спектр (ESI+) m/z: 363 [М+1]+
Масс-спектр (ESI-) m/z: 407 [М+45]+ (HCOOH аддукт)
Пример синтеза 14
1 малеат (3R*,4S*)-3-гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-карбонитрила
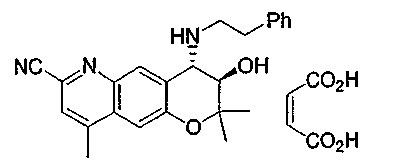
Данное соединение синтезировали в соответствии со способом примера синтеза 12.
(3R*,4R*)-3,4-Эпокси-3-гидрокси-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-карбонитрил
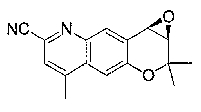
(Выход: 33%)
99,1% ee; CHIRALCEL OJ-R ацетонитрил/метанол/0,01 М водный раствор хлорида натрия =1/3/3, время удерживания: 18,6 мин.
1H-ЯМР (CDCl3) δ: 1,33 (c, 3H), 1,66 (c, 3H), 2,65 (c, 3H), 3,64 (д, J=4,1 Гц, 1H), 4,17 (д, J=4,4 Гц, 1H), 7,33 (c, 1H), 7,47 (c, 1H), 8,18 (c, 1H)
Масс-спектр (ESI+) m/z: 267 [М+1]+
Масс-спектр (ESI-) m/z: 265 [М-1]+
1 малеат (3R*,4S*)-3-гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-карбонитрила
(Выход: 23%)
Бледно-коричневые кристаллы
1H-ЯМР (ДМСО-d6) δ: 1,20 (c, 3H), 1,52 (c, 3H), 2,66 (c, 3H), 2,98-3,33 (м, 4H), 4,09 (м, 1H), 4,71 (ушир. c, 1H), 6,09 (c, 2H), 6,33 (ушир. c, 1H), 7,23-7,34 (м, 5H), 7,51 (c, 1H), 7,86 (c, 1H), 8,51 (c, 1H)
Масс-спектр (ESI+) m/z: 388 [М+1]+
Масс-спектр (ESI-) m/z: 432 [М+45]+ (HCOOH аддукт)
Пример синтеза 15
(3R*,4S*)-3-Гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-карбоксамид

Данное соединение синтезировали из (3R*,4S*)-3-гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-карбонитрила аналогично способу примера синтеза 11 (выход: 9%).
Белые кристаллы
т.пл.:168-169°C
1H-ЯМР (CDCl3) δ: 1,26 (c, 3H), 1,57 (c, 3H), 1,83 (ушир. c, 3H), 2,65 (c, 2H), 2,90-3,16 (м, 4H), 3,66 (д, J=10,2 Гц, 1H), 3,95 (д, J=10,5 Гц, 1H), 5,61 (ушир.с, 1H), 7,24-7,36 (м, 5H), 7,85 (c, 1H), 8,00 (ушир. c, 1H), 8,04 (c, 1H)
Масс-спектр (ESI+) m/z: 406 [М+1]+
Масс-спектр (ESI-) m/z: 450 [М+45]+ (HCOOH аддукт)
Пример синтеза 16
1 малеат (3R*4S*)-{3-гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-ил}этанона
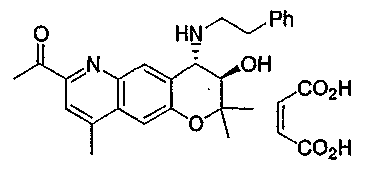
Данное соединение синтезировали в соответствии со способом примера синтеза 12.
(3R*,4S*)-{3-Гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-ил}этанон

К раствору (3R*,4S*)-3-гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-карбонитрила (120 мг, 0,309 ммоль) в смеси бензол (1,6 мл) -диэтиловый эфир (1,4 мл) добавляли по каплям при 0-5°C 3,0 М раствор метилмагнийбромида в диэтиловом эфире (0,30 мл) и полученную смесь перемешивали в течение 2 часов. Добавляли по каплям раствор 3,0 М метилмагнийбромида в диэтиловом эфире (0,50 мл) при 0-5°C и полученную смесь дополнительно перемешивали в течение 30 минут. По завершении реакции добавляли водный раствор хлорида аммония и полученный раствор экстрагировали этилацетатом. Полученную органическую фазу сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией и получали целевой продукт (выход: 25%).
1H-ЯМР (CDCl3) δ: 1,19 (c, 3H), 1,49 (c, 3H), 2,53 (д, J=0,8 Гц, 3H), 2,76 (c, 3H), 2,77-3,06 (м, 5H), 3,55 (д, J=10,5 Гц, 1H), 3,81 (дд, J=1,4 Гц, 10,5 Гц, 1H), 7,15-7,29 (м, 6H), 7,78 (c, 1H), 7,85 (д, J=1,4 Гц, H)
Масс-спектр (ESI+) m/z: 405 [М+1]+
1 малеат (3R*,4S*)-{3-гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-ил}этанона
К раствору (3R*,4S*)-{3-гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-ил)этанона (31,3 мг, 0,077 ммоль) в этилацетате (2 мл) добавляли по каплям раствор малеиновой кислоты (10,0 мг, 0,086 ммоль) в этилацетате (2 мл) и выпавшее в осадок твердое вещество отфильтровывали, получая целевой продукт (выход: 80%).
Белые кристаллы
т.пл.: 230-234°C (разложение)
1H-ЯМР (ДМСО-d6) δ: 1,18 (c, 3H), 1,51 (c, 3H), 2,66 (c, 3H), 2,74 (c, 3H), 2,98-3,34 (м, 4H), 4,10 (м, 1H), 4,66 (ушир. c, 1H), 6,05 (c, 2H), 6,29 (ушир. c, 1H), 7,25-7,36 (м, 5H), 7,48 (c, 1H), 7,87 (c, 1H), 8,56 (c, 1H).
Пример синтеза 17
(1S*,2R*)-3,3-Диметил-1-[(2-фенилэтил)амино]-2,3-дигидро-1H-пирано[3,2-f]хинолин-2-ол

Данное соединение синтезировали в соответствии со способом примера синтеза 12.
(Выход по 2 стадиям 4%)
Белые кристаллы
т.пл.:170-171°C
1H-ЯМР (CDCl3) δ: 1,31 (c, 3H), 1,45 (c, 3H), 1,61 (ушир. c, 6H), 2,71-2,84 (м, 3H), 2,91-2,97 (м, 1H), 3,83 (д, J=5,5 Гц, 1H), 4,11 (д, J=5,5 Гц, 1H), 7,12 (д, J=7,98 Гц, 1H), 7,18-7,25 (м, 5H), 7,90 (д, J=9,1 Гц, 1H), 8,15 (д, J=8,5 Гц, 1H), 8,73 (дд, J=1,4 Гц, 4,1 Гц, 1H).
Масс-спектр (ESI+) m/z: 349 [М+1]+
Масс-спектр (ESI-) m/z: 393 [М+45]+ (HCOOH аддукт)
Эпокси-форма, 97,1% ee; CHIRALCEL OJ-R ацетонитрил/метанол/0,01 М водный раствор хлорида натрия = 1/3/3, время удерживания: 7,0 мин.
Пример синтеза 18
1 малеат (3R*,4S*)-7-гидроксиметил-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола

Данное соединение синтезировали в соответствии со способом примера синтеза 12.
(2,2,9-Триметил-2H-пирано[2,3-g]хинолин-7-ил)метилацетат
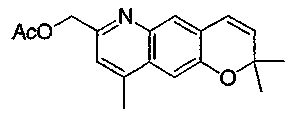
К раствору 2,2,7,9-тетраметил-2H-пирано[2,3-g]хинолина (3,0 г, 12,5 ммоль) в хлороформе (30,0 мл) добавляли по каплям при комнатной температуре раствор м-хлорпербензойной кислоты (4,76 г, 27,6 ммоль) в смеси хлороформ (12 мл)-метанол (3 мл) и полученную смесь перемешивали при комнатной температуре в течение 30 минут. По завершении реакции добавляли к реакционному раствору водный раствор тиосульфата натрия и экстрагировали. Полученную органическую фазу промывали гидрокарбонатом натрия, затем водным раствором хлорида натрия и сушили над безводным сульфатом магния. После отгонки растворителя к остатку добавляли уксусный ангидрид (12 мл) и полученную смесь перемешивали при 150°C в течение 1 часа. По завершении реакции уксусный ангирид отгоняли, остаток нейтрализовали водным раствором карбоната натрия, экстрагировали хлороформом, полученную органическую фазу промывали водным раствором хлорида натрия и сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией среднего давления (гексан/этилацетат = 2/1) и получали целевой продукт (выход: 64%).
Черный маслянистый продукт
1H-ЯМР (CDCl3) δ: 1,50 (c, 6H), 2,17 (c, 3H), 2,61 (c, 3H), 5,30 (c, 2H), 5,90 (д, J=9,91 Гц, 1H), 6,57 (д, J=9,9 Гц, 1H), 7,19 (c, 1H), 7,24 (c, 1H), 7,70 (c, 1H).
Масс-спектр (ESI+) m/z: 298 [М+1]+
(3R*,4R*)-(3,4-Эпокси-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-ил)метилацетат
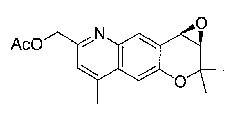
> 99,9% ee; CHIRALPAKAD-RH 20 мM фосфатный буфер (pH 8,0)/ацетонитрил = 60/40, время удерживания: 5,4 мин.
Масс-спектр (ESI+) m/z: 314 [М+1]+
(3R*,4S*)-7-Гидроксиметил-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол

К раствору (3R*4R*)-(3,4-эпокси-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-ил)метилацетата (403 мг, 1,29 ммоль) в 1,4-диоксане (1 мл) добавляли при комнатной температуре перхлорат лития (137 мг, 1,29 ммоль) и 2-фенилэтиламин (0,195 мл, 1,55 ммоль) и полученную смесь перемешивали при 70°C в течение 1,5 часов. После завершения реакции к реакционному раствору добавляли водный раствор гидрокарбоната натрия и экстрагировали его этилацетатом. Полученную органическую фазу промывали водным раствором гидрокарбоната натрия, затем водным раствором хлорида натрия и сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией среднего давления (гексан/этилацетат = 1/1) и получали целевой продукт (выход: 32%).
1H-ЯМР (CDCl3) δ: 1,24 (c, 3H), 1,55 (c, 3H), 2,58 (c, 3H), 2,87-3,08 (м, 5H), 3,63 (д, J=10,2 Гц, 1H), 3,81 (д, J=10,5 Гц, 1H), 4,82 (c, 2H), 7,02 (c, 1H), 7,23-7,36 (м, 6H), 7,75 (c, 1H).
Масс-спектр (ESI+) m/z: 393 [М+1]+
Масс-спектр (ESI-) m/z: 437 [М+45]+ (HCOOH аддукт)
1 малеат (3R*,4S*)-7-гидроксиметил-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
К раствору (3R*'4S*)-7-гидроксиметил-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола (157 мг, 0,407 ммоль) в этилацетате (4 мл) добавляли по каплям раствор малеиновой кислоты (52 мг, 0,448 ммоль) в этилацетате (2 мл) и выпавшее в осадок твердое вещество отфильтровывали, получая целевое соединение (выход: 80%).
Бледно-желтые кристаллы
т.пл.: 216-221°С
1H-ЯМР (ДМСО-d6) δ: 1,17 (с, 3Н), 1,50 (с, 3Н), 2,60 (с, 3Н), 2,98-3,40 (м, 4Н), 4,06-4,11 (м, 1Н), 3,81 (д, J=10,5 Гц, 1Н), 4,66-4,69 (3Н), 5,50 (ушир. с, 1Н), 6,06 (с, 2Н), 6,30 (ушир. с, 1Н), 7,23-7,35 (м, 5Н), 7,40 (с, 1Н), 7,47 (с, 1Н), 8,35 (с, 1Н).
Пример синтеза 19
1 малеат (3R*,4S*)-7-хлор-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол

Данное соединение синтезировали в соответствии со способом примера синтеза 12.
(3R*,4R*)-7-Хлор-3,4-эпокси-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин

(Выход: 78%)
99,1% ее; CHIRALCEL OJ-R ацетонитрил/метанол/0,01 М водный раствор хлорида натрия = 1/3/3, время удерживания: 18,9 мин. Желтый аморфный продукт.1H-ЯМР (CDCl3) δ: 1,28 (c, 3H), 1,65 (c, 3H), 2,59 (д, J=0,8 Гц, 3H), 3,60 (д, J=4,4 Гц, 1H), 4,13 (д, J=4,4 Гц, 1H), 7,19 (c, 1H), 7,29 (д, 1H), 8,02 (c, 1H)
Масс-спектр (ESI+) m/z: 276 [М+1]+
1 малеат (3R*,4S*)-7-хлор-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола (выход по 2 стадиям: 34%)
Примеры синтеза 20-49
Примеры синтеза 20-49 были выполнены аналогично способу примера синтеза 19.
Пример синтеза 20
(3R*,4S*)-4-(Бензиламино)-7-хлор-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 81 %)
Бесцветный аморфный продукт
1H-ЯМР (CDCl3) δ: 1,28 (c, 3H), 1,58 (c, 3H), 1,60 (ушир. c, 1H), 2,60 (c, 3H), 3,12 (c, 1H), 3,72 (д, J=10,3 Гц, 1H), 3,91 (д, J=10,3 Гц, 1H), 3,85-4, 00 (м, 2H), 7,17 (c, 1H), 7,30-7,40 (м, 6H), 8,08 (c, 1H)
Масс-спектр (ESI+) m/z: 383 [М+1]+
Масс-спектр (ESI-) m/z: 427 [M+45]+ (HCOOH аддукт)
Пример синтеза 21
(3R*,4S*)-4-{[(1,3-Бензодиоксол-5-ил)метил]амино}-7-хлор-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол
(Выход: 92%)
Бледно-желтый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,28 (с, 3Н), 1,57 (с, 3Н), 2,59 (с, 3Н), 3,70 (д, J=10,3 Гц, 1Н), 3,82 (ABq, J=12,8 Гц, 2Н), 3,97 (дд, J=10,3, 1,2 Гц, 1Н), 5,96 (с, 2Н), 6,77 (д, J=8,0 Гц, 1Н), 6,82 (дд, J=8,0, 1,6 Гц, 1Н), 6,89 (д, J=l,6 Гц, 1Н), 7,13 (с, 1Н), 7,30 (с, 1Н), 8,04 (с, 1Н).
Масс-спектр (ESI+) m/z: 427 [M+1]+
Пример синтеза 22
(3R*,4S*)-7-Хлор-2,2,9-триметил-4-[(3-фенилпропил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол
(Выход: 72%)
Бесцветный аморфный продукт
1H-ЯМР (CDCl3) δ: 1,28 (с, 3Н), 1,57 (с, 3Н), 1,80-1,95 (м, 2Н), 2,59 (с, 3Н), 2,65-2,85 (м, 5Н), 3,24 (с, 1Н), 3,61 (д, J=10,4 Гц, 1Н), 3,86 (д, J=10,4 Гц, 1Н), 7,10-7,20 (м, 3Н), 7,25-7,35 (м, 3Н), 7,94 (с, 1Н)
Масс-спектр (ESI+) m/z: 411 [М+1]+
Масс-спектр (ESI-) m/z: 455 [M+45]+ (HCOOH аддукт)
Пример синтеза 23
(3R*,4S*)-7-Хлор-4-{[2-(4-фторфенил)этил]амино}-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол
(Выход: 96%)
Бесцветный аморфный продукт
1H-ЯМР (CDCl3) δ: 1,25 (с, 3Н), 1,55 (с, 3Н), 1,57 (ушир. с, 1Н), 2,58 (с, 3Н), 2,80 (т, J=6,9 Гц, 2Н), 2,90-3,10 (м, 3Н), 3,58 (д, J=10,4 Гц, 1Н), 3,86 (д, J=10,4 Гц, 1Н), 6,95-7,05 (м, 2Н), 7,15-7,20 (м, 3Н), 7,26 (с, 1Н), 7,89 (с, 1Н)
Масс-спектр (ESI+) m/z: 415[M+1]+
Пример синтеза 24
(3R*,4S*)-7-Хлор-4-{[2-(2-фторфенил)этил]амино}-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол
(Выход: 79%)
Бесцветный аморфный продукт
1H-ЯМР (CDCl3) δ: 1,25 (с, 3Н), 1,54 (с, 3Н), 1,61 (ушир. с, 1Н), 2,57 (с, 3Н), 2,86 (т, J=6,9 Гц, 2Н), 2,95-3,10 (м, 3Н), 3,56 (д, J=10,4 Гц, 1Н), 3,85 (д, J=10,4 Гц, 1Н), 7,00-7,25 (м, 6Н), 7,90 (с, 1Н)
Масс-спектр (ESI+) m/z: 415 [М+1]+
Пример синтеза 25
(3R*,4S*)-7-Хлор-4-{[2-(4-хлорфенил)этил]амино}-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол
(Выход: 78%)
Бесцветный аморфный продукт
Пример синтеза 26
(3R*,4S*)-4-{[2-(4-Аминофенил)этил]амино}-7-хлор-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол
(Выход: 40%)
Бесцветный аморфный продукт
1H-ЯМР (CDCl3) δ: 1,23 (c, 3H), 1,55 (c, 3H), 1,58 (ушир. c, 3H), 2,57 (c, 3H), 2,71 (т, J=7,4 Гц, 2H), 2,85-3,05 (м, 2H), 3,11 (ушир. c, 1H), 3,57 (д, J=10,4 Гц, 1H), 3,84 (д, J=10,4 Гц, 1H), 6,65 (д, J=8,5 Гц, 2H), 7,01 (д, J=8,5 Гц, 2H), 7,11 (c, 1H), 7,25 (c, 1H), 7,81 (c, 1H)
Масс-спектр (ESI+) m/z: 412 [М+1]+
Масс-спектр (ESI-) m/z: 456 [М+45]+ (HCOOH аддукт)
Пример синтеза 27
(3R*,4S*)-7-Хлор-4-[(2-гидрокси-2-фенилэтил)амино]-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 72%)
Бесцветный аморфный продукт
1H-ЯМР (CDCl3) δ: 1,27 (c, 1,5H), 1,28 (c, 1,5H), 1,56 (c, 3H), 1,77 (ушир. c, 2H), 2,57 (c, 3H), 2,85-3,15 (м, 2H), 3,68 (д, J=10,2 Гц, 1H), 3,75 (д, J=10,2 Гц, 1H), 4,75-4,85 (м, 1H), 7,25 (c, 1H), 7,27-7,40 (c, 6H), 7,99 (c, 0,5H), 8,00 (c, 0,5H)
Масс-спектр (ESI+) m/z: 413 [М+1]+
Масс-спектр (ESI-) m/z: 457 [М+45]+ (HCOOH аддукт)
Пример синтеза 28
(3R*,4S*)-7-Хлор-2,2,9-триметил-4-[(2-фенилбутил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 50%)
Бледно-коричневый аморфный продукт
1H-ЯМР (CDCl3) δ: 0,86 (т, J=7,3 Гц, 3H), 1,20 (c, 3H), 1,53 (c, 3H), 1,51-1,71 (м, 2H), 2,57 (c, 3H), 2,57-2,64 (м,1H), 2,86 (дд, J=11,6, 9,1 Гц, 1H), 2,86 (дд, J=11,6, 5,2 Гц, 1H), 3,55 (д, J=10,2 Гц, 1H), 3,74 (д, J=10,2 Гц, 1H), 7,15 (c,1H), 7,20-7,32 (м, 4H), 7,35-7,41 (м, 2H), 7,74 (c, 1H)
Масс-спектр (ESI+) m/z: 425 [М+1]+
Пример синтеза 29
(3R*,4S*)-4-{[2-(1,3-Бензодиоксол-5-ил)этил]амино}-7-хлор-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 62%)
Бледно-коричневый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,26 (c, 3H), 1,56 (c, 3H), 1,66 (ушир., 1H), 2,57 (c, 3H), 2,74 (т, J=6,9 Гц, 2H), 2,89-3,00 (м, 2H), 3,1 (ушир., 1H), 3,60 (д, J=10,4 Гц, 1H), 3,86 (д, J=10,4 Гц, 1H), 5,95 (AB-квартет, 2H), 6,66-6,77 (м, 3H), 7,15 (c, 1H), 7,26 (c, 1H), 7,83 (c, 1H)
Масс-спектр (ESI+) m/z: 441 [М+1]+
Пример синтеза 30
(3R*,4S*)-7-Хлор-2,2,9-триметил-4-{[2-(1-пиперидинил)этил]амино}-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 61 %)
Бледно-желтый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,29 (c, 3H), 1,58 (c, 3H), 1,60 (ушир. c, 2H), 1,50-1,70 (м, 6H), 2,30-2,60 (м, 6H), 2,58 (c, 3H), 3,06 (т, J=5,8 Гц, 2H), 3,54 (д, J=10,4 Гц, 1H), 3,80 (д, J=10,4 Гц, 1H), 7,13 (c, 1H), 7,23 (c, 1H), 8,06 (c, 1H)
Масс-спектр (ESI+) m/z: 404 [М+1]+
Масс-спектр (ESI-) m/z: 448 [М+45]+ (HCOOH аддукт)
Пример синтеза 31
(3R*,4S*)-7-Хлор-2,2,9-триметил-4-{[2-(1-метил-2-пирролидинил)этил]амино}-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 55%)
Бесцветный аморфный продукт
1H-ЯМР (CDCl3) δ: 1,29 (c, 3H), 1,58 (c, 3H), 1,49-2,00 (м, 8H), 2,10-2,25 (м, 2H), 2,34 (c, 1,5H), 2,35 (c, 1,5H), 2,58 (c, 3H), 2,65-2,85 (м, 2H), 3,00-3,15 (м, 1H), 3,62 (д, J=10,4 Гц, 0,5H), 3,70 (д, J=10,4 Гц, 0,5H), 3,85 (д, J=10,4 Гц, 0,5H), 3,88 (д, J=10,4 Гц, 0,5H), 7,15 (c, 1H), 7,27 (c, 1H), 7,96 (c, 1H)
Масс-спектр (ESI+) m/z: 404 [М+1]+
Масс-спектр (ESI-) m/z: 448 [М+45]+ (HCOOH аддукт)
Пример синтеза 32
(3R*,4S*)-4-[(2-Анилиноэтил)амино]-7-хлор-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 78%)
Бледно-желтый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,27 (c, 3H), 1,56 (c, 3H), 1,77 (ушир.с, 3H), 2,58 (c, 3H), 2,95-3,10 (м, 2H), 3,30 (т, J=5,5 Гц, 2H), 3,64 (д, J=10,2 Гц, 1H), 3,93 (д, J=10,2 Гц, 1H), 6,65-6,80 (м, 3H), 7,15-7,20 (м, 3H), 7,28 (c, 1H), 7,98 (c, 1H)
Масс-спектр (ESI+) m/z: 412 [М+1]+
Масс-спектр (ESI-) m/z: 456 [М+45]+ (HCOOH аддукт)
Пример синтеза 33
(3R*,4S*)-7-Хлор-4-({2-[этил(3-метилфенил)амино]этил}амино)-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 90%)
Бледно-желтый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,23 (т, J=6,9 Гц, 3Н), 1,26 (с, 3Н), 1,55 (с, 3Н), 1,62 (ушир. с, 1Н), 2,27 (с, 3Н), 2,57 (с, 3Н), 2,80-3,00 (м, 2Н), 3,30-3,50 (м, 5Н), 3,61 (д, J=10,1 Гц, 1Н), 3,91 (д, J=10,1 Гц, 1Н), 6,60-6,70 (м, 4Н), 7,05-7,15 (м, 2Н), 7,96 (с, 1Н)
Масс-спектр (ESI+) m/z: 454 [M+1]+
Масс-спектр (ESI-) m/z: 498 [М+45]+ (НСООН аддукт)
Пример синтеза 34
(3R*,4S*)-7-Хлор-2,2,9-триметил-4-{[1-этил-(R)-2-пирролидинил)метил]амино}-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол
(Выход: 93%)
Бледно-желтый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,27 (с, 1Н), 1,32 (т, J=7,1 Гц, 2Н), 1,56 (с, 3Н), 1,95-2,12 (ушир., 4Н), 2,56 (с, 3Н), 2,71-2,81 (ушир., 2Н), 2,98-3,37 (м, 4Н), 3,64-4,01 (м, 5Н), 7,12 (с, 1Н), 7,22 (с, 1Н), 8,01 (с, 1Н)
Масс-спектр (ESI+) m/z: 405 [M+1]+
Масс-спектр (ESI+) m/z: 448 [M+45]+(НСООН аддукт)
Пример синтеза 35
1-малеат (3R*,4S*)-7-хлор-4-[(2,2-диэтоксиэтил)амино]-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ола
(Выход: 88%)
Белое твердое вещество
1H-ЯМР (CDCl3) δ: 1,23-1,30 (м, 9Н), 1,57 (с, 3Н), 2,64 (с, 3Н), 3,50-3,85 (м, 4Н), 4,02 (д, J=10,2 Гц, 1Н), 6,27 (с, 1Н), 7,37 (с, 1Н), 7,49 (с, 1Н), 8,13 (с, 1Н)
Свободная форма
(3R*,4S*)-7-хлор-2,2,9-триметил-4-[(2,2-диэтоксиэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол
Бледно-желтый аморфный продукт
Масс-спектр (ESI+) m/z: 410 [M+1]+
Масс-спектр (ESI-) m/z: 453 [M+45]+ (НСООН аддукт)
Пример синтеза 36
(3R*,4S*)-7-Хлор-2,2,9-триметил-4-{[2-(3-тиенил)этил]амино}-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол
(Выход: 57%)
Бледно-желтый аморфный продукт
1Н-ЯМР (CDCl3) δ: 1,24 (с, 3Н), 1,55 (с, 3Н), 2,56 (с, 3Н), 2,84 (т, J=6,8 Гц, 2Н), 2,90-3,09 (м, 2Н), 3,60 (д, J=10,5 Гц, 1Н), 3,86 (д, J=10,5 Гц, 1Н), 6,94-7, 01 (м, 2Н), 7,13 (с, 1Н), 7,24-7,29 (м, 2Н), 7,89 (с, 1Н)
Масс-спектр (ESI+) m/z: 404 [М+1]+
Масс-спектр (ESI-) m/z: 447 [М+45]+ (НСООН аддукт)
Пример синтеза 37
(3R*,43*)-4-[2-(1Н-Пиразол-1-ил)этиламино]-7-хлор-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол
(Выход: 59%)
Бледно-желтый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,28 (с, 3Н), 1,58 (с, 3Н), 1,86 (ушир. с, 1H), 2,57 (c, 3H), 3,26-3,31 (м, 2H), 3,63 (д, J=10,1 Гц, 1H), 3,87 (д, J=10,1 Гц, 1H), 4,24-4,32 (м, 2H), 5,00 (ушир. c, 1H), 6,32 (дд, J=1,7, 3,4 Гц, 1H), 7,14 (c, 1H), 7,25 (c, 1H), 7,45 (д, J=1,7 Гц, 1H), 7,58 (д, J=1,7 Гц, 1H), 8,00 (c, 1H)
Масс-спектр (ESI+) m/z: 387 [М+1]+
Пример синтеза 38
(3R*,4S*)-7-Хлор-2,2,9-триметил-4-{[2-(4-метилпиразол-1-ил)этил]амино}-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 70%)
Бесцветный аморфный продукт
1H-ЯМР (CDCl3) δ: 1,28 (c, 3H), 1,58 (c, 3H), 2,00 (ушир.с, 1H), 2,10 (c, 3H), 2,57 (c, 3H), 3,16-3,31 (м, 2H), 3,64 (д, J=10,2 Гц, 1H), 3,87 (д, J=10,2 Гц, 1H), 4,11-4,30 (м, 2H), 5,20 (ушир.с, 1H), 7,13 (c, 1H), 7,21 (c, 1H), 7,24 (c, 1H), 7,36 (c, 1H), 7,98 (c, 1H)
Масс-спектр (ESI+) m/z: 401 [М+1]+
Пример синтеза 39
(3R*,4S*)-7-Хлор-4-{[2-(4-хлорпиразол-1-ил)этил]амино}-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 89%)
Бледно-желтый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,28 (c, 3H), 1,58 (c, 3H), 1,84 (ушир.с, 1H), 2,58 (c, 3H), 3,26-3,29 (м, 2H), 3,61 (д, J=10,4 Гц, 1H), 3,87 (д, J=10,4 Гц, 1H), 4,16-4,29 (м, 2H), 4,51 (ушир.с, 1H), 7,15 (c, 1H), 7,26 (c, 1H), 7,45 (c, 1H), 7,48 (c, 1H), 7,97 (c, 1H)
Масс-спектр (ESI+) m/z: 421 [М+1]+
Пример синтеза 40
(3R*,4S*)-7-Хлор-2,2,9-триметил-4-{[2-(2-пиридил)этил]амино}-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 83%)
Желтый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,32 (c, 3H), 1,61 (c, 3H), 1,82 (ушир.с, 1H), 2,57 (c, 3H), 2,92-3,12 (м, 2H), 3,26-3,30 (м, 2H), 3,74 (д, J=10,2 Гц, 1H), 3,92 (д, J=10,2 Гц, 1H), 7,13 (c, 1H), 7,17-7,27 (м, 3H), 7,64-7,70 (м, 1H), 8,06 (c, 1H), 8,56 (д, J=5,0 Гц, 1H)
Масс-спектр (ESI+) m/z: 398 [М+1]+
Пример синтеза 41
(3R*,4S*)-7-Хлор-2,2,9-триметил-4-{[2-(3-пиридил)этил]амино}-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 61%)
Коричневый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,26 (c, 3H), 1,55 (c, 3H), 1,73 (ушир.с, 1H), 2,58 (c, 3H), 2,80-2,85 (м, 2H), 2,92-3,07 (м, 2H), 3,23 (ушир.с, 1H), 3,61 (д, J=10,4 Гц, 1H), 3,89 (д, J=10,4 Гц, 1H), 7,16 (c, 1H), 7,22-7,27 (м, 2H), 7,55 (д, J=7,7 Гц, 1H), 7,93 (c, 1H), 8,47-8,48 (м, 2H)
Масс-спектр (ESI+) m/z: 398 [М+1]+
Пример синтеза 42
(3R*,4S*)-7-Хлор-2,2,9-триметил-4-{[2-(4-пиридил)этил]амино}-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 47%)
Бледно-коричневый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,26 (c, 3H), 1,55 (c, 3H), 1,89 (ушир.с, 1H), 2,58 (c, 3H), 2,80-2,85 (м, 2H), 2,94-3,11 (м, 2H), 3,60 (ушир.с, 1H), 3,63 (д, J=10,4 Гц, 1H), 3,90 (д, J=10,4 Гц, 1H), 7,15 (д, J=5,7 Гц, 1H), 7,16 (c, 1H), 7,27 (c, 1H), 7,96 (c, 1H), 8,47 (д, J=5,7 Гц, 2H)
Масс-спектр (ESI+) m/z: 398 [М+1]+
Пример синтеза 43
(3R*,4S*)-7-Хлор-4-этиламино-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 95%)
Бледно-желтый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,18 (т, J=7,1 Гц, 3H), 1,29 (c, 3H), 1,58 (c, 3H), 2,58 (c, 3H), 2,68-2,91 (м, 2H), 3,63 (д, J=10,4 Гц, 1H), 3,87 (дд, J=10,4, 1,2 Гц, 1H), 7,15 (д, J=1,1 Гц, 1H), 7,27 (c, 1H), 7,93 (д, J=1,1 Гц, 1H)
Масс-спектр (ESI+) m/z: 321 [М+1]+
Пример синтеза 44
(3R*,4S*)-7-Хлор-4-изобутиламино-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 96%)
Бледно-коричневый аморфный продукт
1H-ЯМР (CDCl3) δ: 0,94-0,98 (м, 6H), 1,29 (c, 3H), 1,58 (c, 3H), 1,68-1,76 (м, 1H), 2,50-2,62 (м, 2H), 2,58 (c, 3H), 3,36 (ушир.с, 1H), 3,63 (д, J=10,2 Гц, 1H), 3,88 (дд, J=10,2, 1,1 Гц, 1H), 7,15 (c, 1H), 7,28 (c, 1H), 7,93 (c, 1H)
Масс-спектр (ESI+) m/z: 239 [М+1]+
Пример синтеза 45
(3R*,4S*)-7-Хлор-4-[(циклопропилметил)амино]-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 85%)
Бледно-коричневый аморфный продукт
1H-ЯМР (CDCl3) δ: 0,13-0,20 (м, 2H), 0,48-0,54 (м, 2H), 0,95-1,01 (м, 1H), 1,29 (c, 3H), 1,58 (c, 3H), 1,8 (ушир. c, 1H), 2,53 (м, 1H), 2,58 (c, 3H), 2,70 (м, 1H), 3,63 (д, J=10,4 Гц, 1H), 3,91 (д, J=10,4 Гц, 1H), 7,15 (c, 1H), 7,27 (c, 1H), 7,90 (c, 1H)
Масс-спектр (ESI+) m/z: 347 [М+1]+
Пример синтеза 46
(3R*,4S*)-7-Хлор-4-изопентиламино-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 64%)
Бледно-желтый аморфный продукт
1H-ЯМР (CDCl3) δ: 0,90 (д, 6H), 1,29 (c, 3H), 1,39-1, 46 (м, 2H), 1,58 (c, 3H), 1,62-1,74 (м, 2H), 2,58 (c, 3H), 2,64-2,85 (м, 2H), 3,64 (д, J=10,4 Гц, 1H), 3,87 (д, J=10,4 Гц, 1H), 7,15 (c, 1H), 7,28 (c, 1H), 7,93 (c, 1H)
Масс-спектр (ESI+) m/z: 363 [М+1]+
Пример синтеза 47
(3R*,4S*)-7-Хлор-4-[2-(циклопентилэтил)амино]-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 78%)
Бледно-желтое твердое вещество
1H-ЯМР (CDCl3) δ: 1,08-1,11 (м, 2H), 1,29 (c, 3H), 1,49-1,62 (м, 6H), 1,54 (c, 3H), 1,71-1,83 (м, 3H), 2,58(c, 3H), 2,67-2,82 (м, 2H), 3,63 (д, J=10,4 Гц, 1H), 3,86 (д, J=10,4 Гц, 1H), 7,15 (c, 1H), 7,27 (c, 1H), 7,93 (c, 1H)
Масс-спектр (ESI+) m/z: 389 [М+1]+
Пример синтеза 48
(3R*,4S*)-7-Хлор-4-{[2-(1-циклопентенил)этил]амино]}-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 70%)
Бледно-коричневый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,28 (c, 3H), 1,58 (c, 3H), 1,86-1,94 (м, 2H), 2,22-2,34 (м, 7H), 2,58 (c, 3H), 2,79-2,96 (м, 2H), 3,63 (д, J=10,5 Гц, 1H), 3,87 (дд, J=10,5, 1,2 Гц, 1H), 5,44 (c, 1H), 7,15 (c, 1H), 7,27 (c, 1H), 7,92 (c, 1H)
Масс-спектр (ESI+) m/z: 387 [М+1]+
Пример синтеза 49
(3R*,4S*)-7-Хлор-2,2,9-триметил-4-[(5-метилгексан-2-ил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 83%)
Бледно-желтый аморфный продукт
1H-ЯМР (CDCl3) δ: 0,91 (дд, J=6,6 Гц, 9,6 Гц, 6H), 1,13-1,34 (м, 9H), 1,56 (c, 6H), 2,57 (c, 3H), 3,22-3,44 (м, 2H), 3,80-3,85 (ушир.с, 1H), 7,14 (c, 1H), 7,26 (c, 1H), 7,96-7,98 (ушир. c, 1H)
Масс-спектр (ESI+) m/z: 392 [М+2]+
Масс-спектр (ESI-) m/z: 435 [М+45]+ (HCOOH аддукт)
Пример синтеза 50
1 малеат (3S*,4R*)-7-хлор-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол

Данное соединение синтезировали с использованием энантиомера Ph,Ph саленового комплекса марганца (XX) (далее упоминаемого как ent-Ph,Ph саленовый комплекс марганца).
(3S*,4S*)-7-Хлор-3,4-эпокси-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин

К раствору 7-хлор-2,2,9-триметил-2H-пирано[2,3-g]хинолина (200 мг, 0,77 ммоль) в этилацетате (3,0 мл) добавляли при комнатной температуре N-метилимидазол (0,012 мл, 0,154 ммоль) и ent-Ph,Ph саленовый комплекс марганца (8,0 мг, 0,0077 ммоль) и добавляли по каплям водный раствор гипохлорита натрия (1,0 г, 1,513 моль/кг, 1,54 ммоль) и полученную смесь перемешивали в течение 40 минут. Добавляли по каплям водный раствор гипохлорита натрия (1,0 г, 1,513 моль/кг, 1,54 ммоль) и полученную смесь дополнительно перемешивали при комнатной температуре в течение 30 минут. По завершении реакции добавляли к реакционному раствору водный раствор тиосульфата натрия, полученный раствор фильтровали через целит и экстрагировали. Органическую фазу промывали водным раствором гидрокарбоната натрия, затем водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией (гексан/этилацетат = 10/1), получая (3S*,4S*)-7-хлор-3,4-эпокси-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин (выход: 94%).
>99,9% ee; CHIRALCEL OJ-R ацетонитрил/метанол/0,01 М водный раствор хлорида натрия = 1/3/3, время удерживания: 44,3 мин.
1 малеат (3S*,4R*)-7-хлор-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
К раствору (3S*,4S*)-7-хлор-3,4-эпокси-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолина (199 мг, 0,72 ммоль) в 1,4-диоксане (0,4 мл) добавляли при комнатной температуре перхлорат лития (77,0 мг, 0,72 ммоль) и 2-фенилэтиламин (0,11 мл, 0,87 ммоль) и полученную смесь перемешивали при 70°C в течение 3 часов. По завершении реакции добавляли к реакционному раствору водный раствор гидрокарбоната натрия, экстрагировали его этилацетатом, полученную органическую фазу промывали водным раствором хлорида натрия и затем сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией среднего давления (гексан/этилацетат = 3/1). Далее, после отгонки растворителя добавляли этилацетат (2 мл) и добавляли по каплям раствор малеиновой кислоты (50,3 мг, 0,43 ммоль) в этилацетате (2 мл). Выпавшее в осадок твердое вещество отфильтровывали, получая 1 малеат (3S*,4R*)-7-хлор-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола (выход: 41%).
Белые кристаллы
т.пл.: 240-242°С
1H-ЯМР (ДМСО-d6) δ: 1,18 (с, 3Н), 1,50 (с, 3Н), 2,60 (с, 3Н), 2,97-3,32 (м, 4Н), 4,04-4,09 (м, 1Н), 4,65 (д, J=9, 6 Гц, 1Н), 6,05 (с, 2Н), 6,29 (ушир. с, 1Н), 7,23-7,35 (м, 5Н), 7,44 (с, 2Н), 8,32 (с, 1Н)
Масс-спектр (ESI+) m/z: 397 [М+1]+
Масс-спектр (ESI-) m/z: 441 [М+45]+ (НСООН аддукт)
Пример синтеза 51
1 малеат (3S*4R*)-2,2,7,9-тетраметил-4-[(2-фенетил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ола

Данное соединение синтезировали в соответствии со способом примера синтеза 50.
(Выход по 2 стадиям: 25%)
Эпоксид 99,1% ее, CHIRALPAK AD-RH 20 мМ фосфатный буфер (pH 8,0)/ацетонитрил 60/40, время удерживания: 10,3 мин.
Белые кристаллы
т.пл.: 215-216°С (разложение)
1H-ЯМР (ДМСО-d6) δ: 1,16 (с, 3Н), 1,49 (с, 3Н), 2,55 (с, 3Н), 2,58 (с, 3Н), 2,97-3,32 (м, 4Н), 4,02-4,04 (м, 1Н), 4,62 (ушир. с, 1Н), 6,04 (с, 2Н), 6,25 (ушир. с, 1Н), 7,24-7,36 (м, 7Н), 8,31 (с, 1Н)
Масс-спектр (ESI+) m/z: 377 [M+1]+
Пример синтеза 52
Гидрохлорид (3R*,4S*)-7-хлор-2,2,9-триметил-4-пентиламино-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола

(3R*,4S*)-4-Амино-7-хлор-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол

К раствору (3R*,4R*)-7-хлор-3,4-эпокси-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолина (2,0 г, 7,25 ммоль) в этаноле (20 мл) добавляли водный аммиак (10 мл) и полученную смесь перемешивали в запаянной трубке при 90°C в течение 3 часов. По завершении реакции реакционный раствор концентрировали и добавляли к нему этилацетат. Полученный раствор промывали водой и затем насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (гексан/этилацетат= 1/2), получая целевой продукт (выход: 86%).
Белые кристаллы
1H-ЯМР (CDCl3) δ: 1,30 (c, 3H), 1,58 (c, 3H), 1,67 (ушир. c, 2H), 2,59 (c, 3H), 3,28 (ушир. c, 1H), 3,45 (д, J=10,4 Гц, 1H), 3,85 (д, J=10,4 Гц, 1H), 7,15 (c, 1H), 7,26 (c, 1H), 8,02 (c, 1H)
(3R*,4S*)-7-Хлор-2,2,9-триметил-4-пентиламино-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол

К раствору (3R*,4S*)-4-амино-7-хлор-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола (60 мг, 0,205 ммоль) в метаноле (1,2 мл) добавляли бутиловый альдегид (35 мг, 0,041 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 20 минут. Добавляли к смеси цианоборгидрид натрия (52 мг, 0,82 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. По завершении реакции добавляли к смеси насыщенный водный раствор гидрокарбоната натрия, полученный раствор экстрагировали этилацетатом, промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 3/1), получая целевой продукт (выход: 41%).
Бесцветный аморфный продукт
1H-ЯМР (CDCl3) δ: 0,90 (т, J=6,9 Гц, 3H), 1,29 (c, 3H), 1,20-1,45 (м, 4H), 1,55-1,70 (м, 4H), 2,58 (c, 3H), 2,60-2,82 (м, 2H), 3,63 (д, J=10,4 Гц, 1H), 3,86 (д, J=10,4 Гц, 1H), 7,15 (c, 1H), 7,28 (c, 1H), 7,93 (c, 1H)
Масс-спектр (ESI+) m/z: 363 [М+1]+
Масс-спектр (ESI-) m/z: 407 [М+45]+ (HCOOH аддукт)
Гидрохлорид (3R*,4S*)-7-хлор-2,2,9-триметил-4-пентиламино-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
К раствору (3R*,4S*)-7-хлор-2,2,9-триметил-4-пентиламино-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола (28 мг, 0,77 ммоль) в простом эфире (560 мкл) добавляли по каплям 4 М раствор хлористого водорода в простом эфире (56 мкл) и полученную смесь перемешивали при 0°C в течение 15 минут. Твердый продукт отфильтровывали, промывали эфиром и сушили, получая целевой продукт (выход: 88%).
Бесцветные кристаллы
т.пл.: 291-294°C (разложение)
Примеры синтезов 53-57
Соединения примеров синтезов 53-57 были синтезированы в соответствии со способом примера синтеза 52.
Пример синтеза 53
Гидрохлорид (3R*,4S*)-7-хлор-4-[(2-циклогексилэтил)амино]-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
Свободная форма
(3R*,4S*)-7-Хлор-4-[(2-циклогексилэтил)амино]-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 31%)
Бесцветный аморфный продукт
1H-ЯМР (CDCl3) δ: 0,90-1,00 (м, 2H), 1,05-1,25 (м, 6H), 1,29 (c, 3H), 1,58 (c, 3H) 1,60-1,70 (м, 7H), 2,58 (c, 3H), 2,75-2,85 (м, 2H), 3,63 (д, J=10,4 Гц, 1H), 3,86 (д, J=10,4 Гц, 1H), 7,15 (c, 1H), 7,27 (c, 1H), 7,93 (c, 1H)
Гидрохлорид
Гидрохлорид (3R*,4S*)-7-хлор-4-[(2-циклогексилэтил)амино]-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
(Выход: 76%)
Бесцветные кристаллы
т.пл.:294-295°C (разложение)
Масс-спектр (ESI+) m/z: 403 [М+1]+
Масс-спектр (ESI-) m/z: 447 [М+45]+ (HCOOH аддукт)
Пример синтеза 54
Гидрохлорид (3R*,4S*)-7-хлор-4-[{2-(тетрагидропиран-4-ил)этил}амино]-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
Свободная форма
(3R*,4S*)-7-Хлор-4-[{2-(тетрагидропиран-4-ил)этил}амино]-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 65%)
Бесцветный аморфный продукт
1H-ЯМР (CDCl3) δ: 1,29 (с, 3Н), 1,20-1,40 (м, 4Н), 1,58 (с, 3Н), 1,50-1,80 (м, 4Н), 2,59 (с, 3Н), 2,65-2,90 (с, 2Н), 3,20-3,40 (м, 3Н), 3,64 (д, J=10,4 Гц, 1Н), 3,70-3,75 (м, 1Н), 3,85 (д, J=10,4 Гц, 1Н), 3,80-4,00 (м, 3Н), 7,16 (с, 1Н), 7,28 (с, 1Н), 7,92 (с, 1Н)
Масс-спектр (ESI+) m/z: 405 [M+1]+
Масс-спектр (ESI-) m/z: 449[М+45]+ (НСООН аддукт)
Гидрохлорид
Гидрохлорид (3R*,4S*)-7-хлор-4-[{2-(тетрагидропиран-4-ил)этил}амино]-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ола
(Выход: 72%)
Бесцветные кристаллы
т.пл.: 318-320°С (разложение)
Пример синтеза 55
(3R*,4S*)-7-Хлор-2,2,9-триметил-4-{[2-(4-тианил)этил]амино}-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол
(Выход; 63%)
Бесцветный аморфный продукт
1H-ЯМР (CDCl3) δ: 1,28 (с, 3Н), 1,40-1,60 (м, 5Н), 1,56 (с, 1Н), 1,90-2,00 (м, 2Н), 2,59 (с, 3Н), 2,50-2,85 (м, 6Н), 3,23 (с, 1Н), 3,63 (д, J=10,4 Гц, 1Н), 3,87 (д, J=10,4 Гц, 1Н), 7,16 (с, 1Н), 7,28 (с, 1Н), 7,91 (с, 1Н)
Масс-спектр (ESI+) m/z: 421 [М+1]+
Масс-спектр (ESI-) m/z: 465 [М+45]+ (HCOOH аддукт)
Пример синтеза 56
Гидрохлорид (3R*,4S*)-7-хлор-4-({[6-(4-хлорфенил)-3-пиридинил]метил}амино)-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
Свободная форма
(3R*,4S*)-7-Хлор-4-({[6-(4-хлорфенил)-3-пиридинил]метил}амино)-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 16%)
1H-ЯМР (CDCl3) δ: 1,30 (c, 3H), 1,59 (c, 3H), 1,60 (ушир. c, 1H), 2,60 (c, 3H), 2,98 (c, 1H), 3,75-4,10 (м, 4H), 7,19 (c, 1H), 7,34 (c, 1H), 7,45 (д, J=8,8 Гц, 2H), 7,71 (д, J=9,0 Гц, 1H), 7,80 (дд, J=9,0, 2,2 Гц, 1H), 7,96 (д, J=8,8 Гц, 2H), 8,09 (c, 1H), 8,66 (д, J=2,2 Гц, 1H)
Масс-спектр (ESI+) m/z: 494 [М+1]+
Масс-спектр (ESI-) m/z: 538 [М+45]+ (HCOOH аддукт)
Гидрохлорид
Гидрохлорид (3R*,4S*)-7-хлор-4-({[6-(4-хлорфенил)-3-пиридинил]метил}амино)-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
(Выход: 67%)
Бледно-желтое твердое вещество
Пример синтеза 57
(3R*,4S*)-4-[(2-Бензофурилметил)амино]-7-хлор-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 74%)
Бесцветный аморфный продукт
1H-ЯМР (CDCl3) δ: 1,28 (c, 3H), 1,58 (c, 3H), 2,0 (ушир.), 2,59 (c, 3H), 3,35 (ушир.,1H), 3,75 (д, J=10,2 Гц, 1H), 4,04 (дд, J=10,2, 1,1 Гц, 1H), 4,06 (c, 2H), 6,60 (c, 1H), 7,16 (c, 1H), 7,18-7,27 (м, 2H), 7,30 (c, 1H), 7,46 (д, J=8,3 Гц, 1H), 7,49-7,52 (м, 1H), 8,08 (д, J=1,1 Гц, 1H)
Масс-спектр (ESI+) m/z: 423 [М+1]+
Пример синтеза 58
(3R*,4S*)-7-Хлор-4-[(2-гидроксипентил)амино]-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
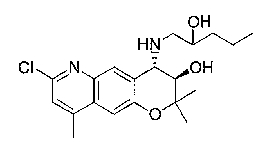
В токе азота 1,2-эпоксипентан (71 мкл, 0,682 ммоль) добавляли к раствору (3R*,4S*)-4-амино-7-хлор-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола (100 мг, 0,343 ммоль) и перхлората лития (36 мг, 0,343 ммоль) в диоксане (0,50 мл) при комнатной температуре и полученную смесь перемешивали при 70°C в течение 25 часов. По завершении реакции к смеси добавляли этилацетат, полученный реакционный раствор промывали насыщеным водным раствором гидрокарбоната натрия и затем насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 1/1), получая целевой продукт (выход: 59%).
Бледно-желтый аморфный продукт
1H-ЯМР (CDCl3) δ: 0,93 (т, J=6,9 Гц, 3Н), 1,28 (с, 3Н), 1,30-1,50 (м, 4Н), 1,57 (с, 3Н), 1,91 (ушир. с, 3Н), 2,59 (с, 3Н), 2,60-2,70 (м, 1Н), 2,85-3,00 (м, 1Н), 3,60-3,75 (м, 2Н), 3,90-4,00 (м, 1Н), 7,16 (с, 1Н), 7,28 (с, 1Н), 7,99 (с, 0,5Н), 8,00 (с, 0,5Н)
Масс-спектр (ESI+) m/z: 379 [М+1]+
Масс-спектр (ESI-) m/z: 423 [M+45]+(НСООН аддукт)
Пример синтеза 59
1 малеат (8R*,9S*)-7,7-диметил-9-[(2-фенилэтил)амино]-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ола

(3R*,43*)-6,7-Диамино-3,4-дигидро-2,2-диметил-4-(2-фенилэтиламино)-2Н-1-бензопиран-3-ол

В токе водорода при 1 атмосфере раствор (3R*4S*)-6-амино-3,4-дигидро-2,2-диметил-7-нитро-4-(2-фенилэтиламино)-2Н-бензопиран-3-ола (10,0 г, 28,0 ммоль) и 5% палладия-на-угле (тип AER, 1 г) в этаноле (200 мл) перемешивали при комнатной температуре в течение 6 часов. По завершении реакции реакционный раствор фильтровали через целит и концентрировали, получая целевой продукт (выход: 98%).
Черный аморфный продукт
1Н-ЯМР (CDCl3) δ: 1,13 (с, 3Н), 1,43 (с, 3Н), 2,60-3,00 (м, 4Н), 2,5-3,5 (ушир., 6Н), 3,47 (д, J=9, 6 Гц, 1Н), 3,51 (д, J=9,6 Гц, 1Н), 6,12 (с, 1Н), 6,14 (с, 1Н), 7,15-7,50 (м, 5Н)
Масс-спектр (ESI) m/z: 400 [M+1]+, 327 (bp).
(8R*,9S*)-7,7-Диметил-9-[(2-фенилэтил)амино]-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол

К раствору (3R*,4S*)-6,7-диамино-3,4-дигидро-2,2-диметил-4-(2-фенилэтиламино)-2Н-бензопиран-3-ола (1,5 г, 4,58 ммоль) в этаноле (30 мл) добавляли 40% водный раствор глиоксаля (997 мг, 6,87 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 30 минут. По завершении реакции к смеси добавляли этилацетат, полученный раствор промывали насыщеным водным раствором гидрокарбоната натрия и затем насыщенным водным раствором хлорида натрия, затем сушили над сульфатом магния и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 1/1), получая целевой продукт (выход: 74%).
1H-ЯМР (CDCl3) δ: 1,26 (с, 3Н), 1,56 (с, 3Н), 1,60 (ушир. с, 1Н), 2,86 (т, J=6,9 Гц, 1Н), 2,90-3,10 (м, 3Н), 3,62 (д, J=10,4 Гц, 1Н), 3,90 (д, J=10,4 Гц, 1Н), 7,24-7,40 (м, 5Н), 7,42 (с, 1Н), 7,94 (с, 1Н), 8,05 (д, J=l,7 Гц, 1Н), 8,72 (д, J=1,7 Гц, 1Н)
Масс-спектр (ESI+) m/z: 350 [M+l]+
Масс-спектр (ESI-) m/z: 349 [M-1]+
1 малеат (8R*,9S*)-7,7-диметил-9-[(2-фенилэтил)амино]-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ола
К раствору (8R*,9S*)-7,7-диметил-9-[(2-фенилэтил)амино]-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ола (1,18 г, 3,38 ммоль) в этилацетате (22 мл) добавляли при комнатной температуре малеиновую кислоту (471 мг, 4,06 ммоль) и полученную смесь перемешивали в течение 10 минут. По завершении реакции твердый продукт отфильтровывали, промывали этилацетатом и сушили, получая целевой продукт (выход: 61%).
Светло-серые кристаллы
т.пл.: 176-179°С (разложение)
1H-ЯМР (ДМСО-d6) δ: 1,20 (с, 3Н), 1,52 (с, 3Н), 2,90-3,70 (м, 6Н), 4,00-4,15 (м, 1Н), 4,71 (д, J=9,1 Гц, 1Н), 6,07 (с, 2Н), 6,34 (ушир. с, 1Н), 7,15-7,45 (м, 5Н), 7,43 (с, 1Н), 8,50 (с, 1Н), 8,84 (с, 1Н), 8,88 (с, 1Н)
Пример синтеза 60
Гидрохлорид (8R*,9S*)-9-{[2-(2-фторфенил)этил]амино}-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ола

Пример синтеза 60 был выполнен аналогично способу примера синтеза 59.
(3R*,4S*)-6,7-Диамино-4-{[2-(2-фторфенил)этил]амино}-2,2-диметил-3,4-дигидро-2Н-бензопиран-3-ол

(Выход: 87%)
Черный аморфный продукт
Масс-спектр (ESI+) m/z: 346 [M+1]+
Масс-спектр (ESI-) m/z: 380 [M+45]+ (НСООН аддукт)
(8R*,9S*)-9-{[2-(2-Фторфенил)этил]амино}-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол

(Выход: 25%)
Серый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,26 (с, 3Н), 1,57 (с, 3Н), 1,74 (ушир. с, 2Н), 2,85-3,15 (м, 4Н), 3,61 (д, J=10,4 Гц, 1Н), 3,91 (д, J=10,4 Гц, 1Н), 7,00-7,15 (м, 3Н), 7,15-7,35 (м, 2Н), 7,42 (с, 1Н), 7,98 (с, 1Н), 8,66 (д, J=1,7 Гц, 1Н), 8,72 (д, J=1,7 Гц, 1Н)
Масс-спектр (ESI+) m/z: 368 [M+1]+
Масс-спектр (ESI-) m/z: 412 [М+45]+ (НСООН аддукт)
Гидрохлорид (8R*,9S*)-9-{[2-(2-фторфенил)этил]амино}-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ола
(Выход: 95%)
Бесцветные кристаллы
т.пл.: 265-268°С (разложение)
Пример синтеза 61
Гидрохлорид (8R*,9S*)-9-{[2-(4-фторфенил)этил]амино}-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ола
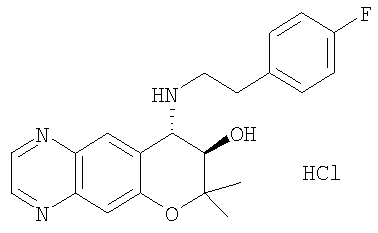
Пример синтеза 61 проводили аналогично способу синтеза примера 59.
(3R*,4S*)-6,7-Диамино-4-[{2-(4-фторфенил)этил}амино]-2,2-диметил-3,4-дигидро-2Н-1-бензопиран-3-ол

(Выход: 87%)
Черный аморфный продукт
lH-ЯМР (CDCl3) δ: 1,13 (с, 3Н), 1,45 (с, 3Н), 1,90 (ушир. с, 4Н), 2,75-3,00 (м, 6Н), 3,50-3,70 (м, 2Н), 6,16 (с, 1Н), 6,29 (с, 1Н), 7,02 (т, J=8,5 Гц, 2Н), 7,17 (т, J=8,5 Гц, 2Н)
(8R*,9S*)-9-{[2-(4-Фторфенил)этил]амино}-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол

(Выход: 23%)
Розовый маслянистый продукт
1H-ЯМР (CDCl3) δ: 1,27 (с, 3Н), 1,57 (с, 3Н), 1,69 (ушир. с, 2Н), 2,83 (т, J=6,9 Гц, 2Н), 2,90-3,10 (м, 4Н), 3,64 (д, J=10,4 Гц, 1Н), 3,92 (д, J=10,4 Гц, 1Н), 6,95-7,05 (м, 2Н), 7,15-7,25 (м, 2Н), 7,42 (с, 1Н), 7,94 (с, 1Н), 8,66 (д, J=1,7 Гц, 1Н), 8,73 (д, J=1,7 Гц, 1Н)
Гидрохлорид (8R*,9S*)-9-{[2-(4-фторфенил)этил]амино}-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ола
(Выход: 95%)
Коричневые кристаллы
т.пл.: 191-197°С (разложение)
Пример синтеза 62
(8R*,9S*)-9-[(2-Гидрокси-2-фенилэтил)амино]-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол
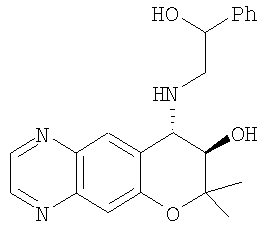
Пример синтеза 62 был выполнен аналогично способу примера синтеза 59.
(3R*,4S*)-6,7-Диамино-4-[(2-гидрокси-2-фенилэтил)амино]-2,2-диметил-3,4-дигидро-2Н-1-бензопиран-3-ол

(Выход: 92%)
Два диастереомера, которые не могут быть разделены
Черный аморфный продукт
1H-ЯМР (CDCl3) δ: 1,16 (с, 3Н), 1,43 (с, 3Н), 2,31 (ушир. с, 7Н), 2,70-3,05 (м, 3Н), 3,50-3,70 (м, 2Н), 4,70-4,80 (м, 1Н), 6,16 (с, 1Н), 6,53 (с, 0,5Н), 6,58 (с, 0,5Н), 7,20-7,40 (с, 5Н)
(8R*,9S*)-9-[(2-Гидрокси-2-фенилэтил)амино]-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол
(Выход: 66%)
Два диастереомера, которые не могут быть разделены
Серый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,30 (с, 3Н), 1,58 (с, 1,5Н), 1,59 (с, 1,5Н), 1,70 (ушир. с, 3Н), 2,90-3,10 (м, 2Н), 3,71 (д, J=10,5 Гц, 1Н), 3,95-4,05 (м, 1Н), 7,20-7,45 (м, 6Н), 8,10 (с, 0,5Н), 8,12 (с, 0,5Н), 8,64 (д, J=1,9 Гц, 1Н), 8,73 (д, J=1,9 Гц, 1Н)
Масс-спектр (ESI+) m/z: 366 [M+1]+
Масс-спектр (ESI-) m/z: 410 [М+45]+ (НСООН аддукт)
Пример синтеза 63
Гидрохлорид (8R*,9S*)-7,7-диметил-9-пентиламино-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ола
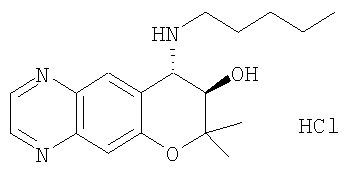
Пример синтеза 63 был выполнен аналогично способу примера синтеза 59.
(3R*,4S*)-6,7-Диамино-2,2-диметил-4-пентиламино-3,4-дигидро-2Н-1-бензопиран-3-ол

(Выход: 98%)
Коричневый аморфный продукт
1H-ЯМР (CDCl3) δ: 0,80-0,90 (м, 3Н), 0,99 (с, 3Н), 1,26 (с, 3Н), 1,30-1,50 (м, 5Н), 2,20-2,30 (м, 1Н), 2,40-2,50 (м, 4Н), 3,30-3,60 (м, 4Н), 3,90 (ушир. с, 2Н), 4,34 (ушир. с, 2Н), 4,93 (д, J=4,4 Гц, 1Н), 5,89 (с, 1Н), 6,59 (с, 1Н).
(8R*,9S*)-7,7-Диметил-9-пентиламино-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол

(Выход: 36%)
Оранжевый аморфный продукт
1H-ЯМР (CDCl3) δ: 0,90 (т, J=7,4 Гц, 3Н), 1,32 (с, 3Н), 1,20-1,40 (м, 3Н), 1,60-1,70 (м, 3Н), 1,61 (с, 3Н), 1,81 (ушир. с, 2Н), 2,60-2,90 (м, 2Н), 3,68 (д, J=10,2 Гц, 1Н), 3,93 (д, J=10,2 Гц, 1Н), 7,44 (с, 1Н), 8,04 (с, 1Н), 8,66 (д, J=1,9 Гц, 1Н), 8,74 (д, J=1,9 Гц, 1Н)
Гидрохлорид (8R*,9S*)-7,7-диметил-9-пентиламино-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ола
(Выход: 96%)
Бледно-желтые кристаллы
т.пл.: 209-212°С (разложение)
Масс-спектр (ESI+) m/z: 316 [М+1]+
Пример синтеза 64
1 малеат (8R*,9S*)-2,3,7,7-тетраметил-9-[(2-фенилэтил)амино]-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ола

Пример синтеза 64 был выполнен аналогично способу примера синтеза 59.
(8R*,9S*)-2,3,7,7-Тетраметил-9-[(2-фенилэтил)амино]-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол

(Выход: 80%)
Белый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,24 (с, 3Н), 1,54 (с, 3Н), 2,68 (с, 6Н), 2,84 (т, J=6,9 Гц, 2Н), 2,90-3,10 (м, 4Н), 3,59 (д, J=10,2 Гц, 1Н), 3,86 (д, J=10,2 Гц, 1Н), 7,20-7,40 (м, 6Н), 7,82 (с, 1Н).
Масс-спектр (ESI+) m/z: 378 [M+1]+
Масс-спектр (ESI-) m/z: 380 [М+45]+ (НСООН аддукт)
Пример синтеза 65
(8R*,9S*)-2,3-Диэтил-7,7-диметил-9-[(2-фенилэтил)амино]-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол

Пример синтеза 65 был выполнен аналогично способу примера синтеза 59.
(Выход: 79%)
Белое твердое вещество
1H-ЯМР (CDCl3) δ: 1,23 (с, 3Н), 1,39 (q, J=6, 6 Гц, 6Н), 1,54 (с, 3Н), 2,80-2,90 (м, 2Н), 2,95-3,10 (м, 10Н), 3,60 (д, J=10,4 Гц, 1Н), 3,85 (д, J=10,4 Гц, 1Н), 7,20-7,40 (м, 6Н), 7,81 (с, 1Н).
Масс-спектр (ESI+) m/z: 406 [М+1]+
Пример синтеза 66
(8R*,9S*)-3,7,7-Триметил-9-[(2-фенилэтил)амино]-2-фенил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол

Пример синтеза 66 был выполнен аналогично способу примера синтеза 59.
(Выход: 33%, низкополярный компонент)
Белый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,27 (с, 3Н), 1,57 (с, 3Н), 1,66 (ушир. с. 2Н), 2,72 (с, 3Н), 2,83 (т, J=6, 9 Гц, 2Н), 2,90-3,15 (м, 4Н), 3,61 (д, J=10,2 Гц, 1Н), 3,88 (д, J=10,2 Гц, 1Н), 7,15-7,35 (м, 5Н), 7,36 (с, 1Н), 7,50-7,60 (м, 3Н), 7,60-7,70 (м, 2Н), 7,97 (с, 1Н)
Масс-спектр (ESI+) m/z: 440 [M+1]+
Пример синтеза 67
(8R*,9S*)-2,7,7-Триметил-9-[(2-фенилэтил)амино]-3-фенил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол

Пример синтеза 67 был проведен аналогично способу примера синтеза 59.
(Выход: 29%, высокополярный компонент)
1H-ЯМР (CDCl3) δ: 1,26 (с, 3Н), 1,55 (с, 3Н), 2,72 (с, 3Н), 2,86 (т, J=6,9 Гц, 2Н), 2,95-3,12 (м, 4Н), 3,62 (д, J=10,2 Гц, 1Н), 3,91 (д, J=10,2 Гц, 1Н), 7,20-7,35 (м, 5Н), 7,42 (с, 1Н), 7,45-7,55 (м, 3Н), 7,60-7,70 (м, 2Н), 7,90 (с, 1Н)
Масс-спектр (ESI+) m/z: 440 [M+1]+
Пример синтеза 68
1 малеат (8R*,9S*)-3,7,7-Триметил-9-[(2-фенилэтил)амино]-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ола

Пример синтеза 68 был выполнен аналогично способу примера синтеза 59.
(8R*,9S*)-3,7,7-Триметил-9-[(2-фенилэтил)амино]-8,9-дигидро-7Н-пирано [2,3-g]хиноксалин-8-ол
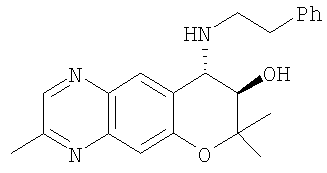
(Выход: 52%)
Белый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,25 (с, 3Н), 1,55 (с, 3Н), 2,72 (с, 3Н), 2,84 (т, J=6,9 Гц, 2Н), 2,90-3,10 (м, 4Н), 3,61 (д, J=10,4 Гц, 1Н), 3,87 (д, J=10,4 Гц, 1Н), 7,15-7,40 (м, 6Н), 7,89 (с, 1Н), 8,54 (с, 1Н)
1 малеат (8R*,9S*)-3,7,7-триметил-9-[(2-фенилэтил)амино]-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ола
Бесцветные кристаллы, т.пл.: 189-192°С (разложение)
Пример синтеза 69
Гидрохлорид (8R*,9S*)-9-[(2-циклогексилэтил)амино]-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ола

(8R*,9S*)-9-Амино-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол

К раствору (3R*,4S*)-4,6,7-триамино-2,2-диметил-3,4-дигидро-2Н-1-бензопиран-3-ола (280 мг, 1,25 ммоль) в этаноле (5,6 мл) добавляли 40% водный раствор глиоксаля (226 мг, 1,56 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. По завершении реакции добавляли к смеси 1 моль/л соляную кислоту, полученный раствор промывали этилацетатом, полученную водную фазу доводили до pH 14 с использованием 1 моль/л водного раствора гидроксида натрия. Затем полученный раствор экстрагировали этилацетатом, промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (этилацетат/метанол = 10/1), получая целевой продукт (выход: 35%).
Бледно-коричневый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,26 (с, 3Н), 1,58 (с, 3Н), 2,17 (ушир. с, 3Н), 3,49 (д, J=10,7 Гц, 1Н), 3,92 (д, J=10,7 Гц, 1Н), 7,41 (с, 1Н), 8,13 (с, 1Н), 8,65 (с, 1Н), 8,72 (с, 1Н).
Масс-спектр (ESI+) m/z: 246 [M+1]+
(8R*,9S*)-9-[(2-Циклогексилэтил)амино]-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол

К раствору (8R*,93*)-9-амино-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ола (100 мг, 0,408 ммоль) в метаноле (2 мл) добавляли циклогексилметиловый альдегид (103 мг, 0,816 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 20 минут. Добавляли к смеси цианоборгидрид натрия (51 мг, 0,816 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. По завершении реакции добавляли к смеси насыщенный водный раствор гидрокарбоната натрия, полученный раствор экстрагировали этилацетатом, промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 2/1), получая целевой продукт (выход: 48%).
Желтый маслянистый продукт
1H-ЯМР (CDCl3) δ: 0,80-1,00 (м, 2Н), 1,10-1,40 (м, 4Н), 1,31 (с, 3Н), 1,44 (т, J=7,1 Гц, 1Н), 1,60 (с, 3Н), 1,65-1,80 (м, 6Н), 2,65-2,90 (м, 2Н), 3,68 (д, J=10,4 Гц, 1Н), 3,93 (д, J=10,4 Гц, 1Н), 7,44 (с, 1Н), 8,04 (с, 1Н), 8,67 (д, J=l,9 Гц, 1Н), 8,73 (д, J=l,9 Гц, 1Н)
Гидрохлорид (8R*,9S*)-9-[(2-циклогексилэтил)амино]-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ола
(Выход: 89%)
Желтые кристаллы, т.пл.: 258-259°С (разложение)
Масс-спектр (ESI+) m/z: 356 [M+1]+
Масс-спектр (ESI-) m/z: 400 [M+45]+ (HCOOH аддукт)
Пример синтеза 70
(±)-транс-7-Гидрокси-6,6-диметил-8-[(2-фенилэтил)амино]-3,6,7,8-тетрагидрохромено[7,6-d]имидазол-2(1Н)-он

К раствору (±)-транс-6,7-диамино-2,2-диметил-4-(2-фенилэтиламино)-3,4-дигидро-2Н-1-бензопиран-3-ола (500 мг, 1,53 ммоль) в диоксане (7 мл) добавляли 4 моль/л растворе хлористый водород/диоксан (0,38 мл) и полученную смесь перемешивали при комнатной температуре в течение 15 минут. Затем добавляли к этой смеси фенилхлорформиат (0,21 мл, 1,53 ммоль) и триэтиламин (0,21 мл, 1,53 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Далее добавляли к ней триэтиламин (0,63 мл, 4,58 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 2 часов. По завершении реакции добавляли к смеси 1 моль/л соляную кислоту и доводили таким образом до pH 7-8. После этого полученный реакционный раствор экстрагировали этилацетатом, промывали насыщенным водным раствором хлорида натрия, затем сушили над сульфатом натрия и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (метанол/хлороформ = 1/20), получая целевой продукт (выход: 4%).
Желтый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,15 (с, 3Н), 1,30-1,41 (ушир., 1Н), 1,45 (с, 3Н), 2,71-3,96 (м, 4Н), 3,51 (д, J=9,9 Гц, 1Н), 3,67 (д, J=9,9 Гц, 1Н), 6,51 (с, 1Н), 7,12-7,48 (м, 7Н), 7,76 (с, 1Н)
Масс-спектр (ESI+) m/z: 354 [M+1]+
Пример синтеза 71
(7R*,8S*)-7-Гидрокси-6,6-диметил-8-[(2-фенилэтил)амино]-4,6,7,8-тетрагидро-1,5-диокса-4-азаантрацен-3-он

4-(1,1-Диметил-2-пропинилокси)анизол

К раствору 4-метоксифенола (15,0 г, 121 ммоль) в ацетонитриле (75 мл) добавляли при охлаждении льдом 1,8-диазабицикло[5,4,0]ундецен (23,9 г, 157 ммоль) и полученную смесь перемешивали при 0°С в течение 30 минут (Раствор 1). К раствору 2-метил-3-бутин-2-ола (11,7 г, 139 ммоль) в ацетонитриле (75 мл) добавляли при охлаждении льдом 1,8-диазабицикло[5,4,0]ундецен (23,9 г, 157 ммоль), полученную смесь перемешивали при 0°С в течение 30 минут, затем добавляли трифторуксусный ангидрид (25,4 г, 121 ммоль) и полученную смесь перемешивали при 0°С в течение 30 минут (Раствор 2). К Раствору 1 добавляли хлорид меди(I) (36 мг, 0,36 ммоль) и затем добавляли к нему по каплям Раствор 2 в течение 15 минут. После завершения прибавления по каплям температуру поднимали до комнатной и смесь перемешивали в течение ночи. По завершении реакции добавляли к реакционному раствору водный раствор хлорида аммония и растворитель отгоняли при пониженном давлении. К остатку добавляли 1 моль/л водный раствор соляной кислоты, полученную смесь экстрагировали этилацетатом, органическую фазу промывали один раз 1 моль/л водным раствором соляной кислоты, дважды насыщенным водным раствором гидрокарбоната натрия и один раз насыщенным водным раствором хлорида натрия. Затем органическую фазу сушили над безводным сульфатом магния. После отгонки растворителя остаток непосредственно использовали в следующей реакции.
6-Метокси-2,2-диметил-2H-1-бензопиран
Раствор 4-(1,1-диметил-2-пропенилокси)анизола в 1,2-дихлорбензоле (50 мл) перемешивали при 190°C в течение 2 часов. По завершении реакции растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией (гексан/хлороформ = 3/1) и получали целевой продукт в виде красного маслянистого вещества (выход по 2 стадиям: 61%).
1H-ЯМР (CDCl3) δ: 1,41 (c, 6H), 3,75 (c, 3H), 5,64 (д, J=9,9 Гц, 1H), 6,28 (д, J=9,9 Гц, 1H), 6,55 (д, J=2,7 Гц, 1H), 6,64-6,73 (м, 2H)
ЖХ/масс-спектр (ESI+): 191 [М++1]
6-Метокси-2,2-диметил-7-нитро-2H-1-бензопиран

Раствор смеси уксусной кислоты (6,2 мл) и уксусного ангидрида (6,2 мл), содержащий 6-метокси-2,2-диметил-2H-1-бензопиран (3,1 г, 16,4 ммоль) охлаждали льдом, добавляли по каплям азотную кислоту (1,37 мл, 18,0 ммоль) и затем смесь перемешивали при 0°C в течение 1 часа. По завершении реакции добавляли к реакционному раствору 1 моль/л водный раствор гидроксида натрия, полученный раствор экстрагировали этилацетатом (150 мл). Органическую фазу промывали дважды 1 моль/л водным раствором гидроксида натрия и один раз насыщенным водным раствором хлорида натрия. Затем органическую фазу сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией (гексан/этилацетат= 6/1) и получали целевой продукт в виде желтых кристаллов (выход: 79%).
1H-ЯМР (CDCl3) δ: 1,44 (c, 6H), 3,91 (c, 3H), 5,85 (д, J=9,6 Гц, 1H), 6,33 (д, J=9,6 Гц, 1H), 6,69 (c, 1H), 7,34 (c, 1H)
ЖХ/масс-спектр (ESI+): 236 [М++1]
(3R*,4R*)-3,4-Эпокси-6-метокси-2,2-диметил-7-нитро-3,4-дигидро-2H-1-бензопиран

К раствору (300 мл) ацетонитрила, содержащему 6-метокси-2,2-диметил-7-нитро-2H-1-бензопиран (10,0 г, 42,5 ммоль), добавляли при комнатной температуре N-метилимидазол (0,678 мл, 8,50 ммоль), Ph,Ph саленовый комплекс марганца (XX)
(880 мг, 0,850 ммоль) и иодозобензол (18,7 мг, 85,0 ммоль) и смесь перемешивали в течение 2 часов. По завершении реакции добавляли к реакционному раствору водный раствор тиосульфата натрия, полученный раствор фильтровали через целит. Полученный фильтрат экстрагировали этилацетатом. Органическую фазу промывали водой и раствором хлорида натрия, и затем сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией (гексан/этилацетат = 4/1) и получали целевой продукт в виде желтых кристаллов (выход: 75%, оптическая чистота: 99,7% ee).
1H-ЯМР (CDCl3) δ: 1,26 (c, 3H), 1,58 (c, 3H), 3,53 (д, J=4,3 Гц, 1H), 3,90 (д, J=4,3 Гц, 1H), 3,95 (c, 3H), 7,08 (c, 1H), 7,33 (c, 1H)
Масс-спектр (EI): 251 [М+]
ВЭЖХ: 18,6 мин (энантиомер 24,1 мин)
Условия ВЭЖХ: CHIRALCEL OJ-RH, MeCN/MeOH/0,01 M NaCl водн. =1/3/5, 1,0 мл/мин, 40° C, 256 нм
(3R*,4S*)-6-Метокси-2,2-диметил-7-нитро-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-3-ол
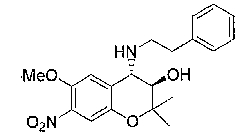
К раствору (3R*,4R*)-3,4-эпокси-6-метокси-2,2-диметил-7-нитро-3,4-дигидро-2H-1-бензопирана (2,50 г, 9,95 ммоль) в 1,4-диоксане (5,0 мл) добавляли при комнатной температуре перхлорат лития (1,06 г, 9,95 ммоль) и 2-фенилэтиламин (1,50 мл, 11,9 ммоль) и смесь перемешивали при 80°C в течение 1 часа. По завершении реакции добавляли к реакционному раствору насыщенный водный раствор хлорида аммония и полученный раствор экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. После отгонки растворителя остаток очищали колоночной хроматографией (гексан/этилацетат = 6/4) и получали целевой продукт в виде оранжевого аморфного вещества (количественный выход).
1H-ЯМР (CDCl3) δ: 1,15 (c, 3H), 1,47 (c, 3H), 2,73-2,95 (м, 4H), 3,60 (д, J=10,0 Гц, 1H), 3,68 (д, J=10,0 Гц, 1H), 3,73 (c, 3H), 6,78 (c, 1H), 7,21-7,35 (м, 6H)
Масс-спектр (EI): 372 [М+]
трет-Бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-7-нитро-3,4-дигидро-2H-1-бензопиран-4-илкарбамат

К раствору (3R*,4S*)-6-метокси-2,2-диметил-7-нитро-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-3-ола (407 мг, 1,09 ммоль) и ди-трет-бутилкарбоната (477 мг, 2,19 ммоль) в тетрагидрофуране (6,0 мл) добавляли при 0°С триэтиламин (305 мл, 2,19 ммоль) и смесь перемешивали в течение ночи при комнатной температуре. После завершения реакции к реакционному раствору добавляли насыщенный водный раствор карбоната натрия и полученный раствор экстрагировали этилацетатом. Органическую фазу промывали 1 моль/л водным раствором соляной кислоты и насыщенным раствором хлорида натрия и затем сушили над безводным сульфатом натрия. После отгонки растворителя остаток очищали колоночной хроматографией (гексан/этилацетат = 4/1) и получали целевой продукт в виде желтого аморфного вещества (выход: 88%).
Масс-спектр (EI): 473 [М++1]
трет-Бутил(2-фенилэтил)(3R*,4S*)-7-амино-3-гидрокси-6-метокси-2,2-диметил-3,4-дигидро-2H-1-бензопиран-4-илкарбамат

Раствор трет-бутил(2-фенилэтил)(3R*,4S*)-3-гидрокси-6-метокси-2,2-диметил-7-нитро-3,4-дигидро-2H-1-бензопиран-4-илкарбамата (1,32 г, 2,80 ммоль) и 5% палладия-на-угле (132 мг) в метаноле (26 мл) перемешивали в течение ночи в атмосфере водорода. После завершения реакции реакционный раствор фильтровали через целит. После отгонки растворителя остаток очищали колоночной хроматографией (гексан/этилацетат = 4/1) и получали целевой продукт (выход: 94%).
Бесцветное твердое вещество.
ЖХ/масс-спектр (ESI) m/z: 443 [М++1]
трет-Бутил(2-фенилэтил)(3R*,4S*)-[7-(2-хлорацетиламино)-3-гидрокси-6-метокси-2,2-диметил-3,4-дигидро-2H-1-бензопиран-4-ил]карбамат
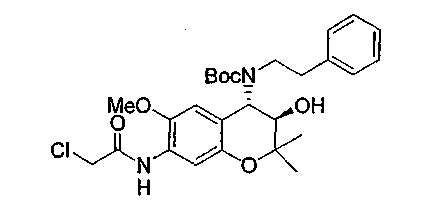
К раствору трет-бутил(2-фенилэтил)(3R*,4S*)-7-амино-3-гидрокси-6-метокси-2,2-диметил-3,4-дигидро-2H-1-бензопиран-4-илкарбамата (270 мг, 0,61 ммоль) в тетрагидрофуране добавляли при комнатной температуре триэтиламин (128 мкл, 0,92 ммоль) и хлорацетилхлорид (73 мкл, 0,92 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 2,5 часов. По завершении реакции добавляли к реакционному раствору этанол (1 мл) и насыщенный водный раствор хлорида аммония и полученный раствор экстрагировали этилацетатом, промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 5/1) и получали целевой продукт (выход: 91%).
Бесцветный маслянистый продукт
2-Хлор-N-[(3R*,4S*)-3,6-дигидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-7-ил]ацетамид

К раствору трет-бутил (2-фенилэтил)(3R*,4S*)-[7-(2-хлорацетиламино)-3-гидрокси-6-метокси-2,2-диметил-3,4-дигидро-2H-1-бензопиран-4-ил]карбамата (251 мг, 0,48 ммоль) в хлористом метилене (5 мл) добавляли при 0°C трихлорид бора (1 М раствор в хлористом метилене, 2,42 мл, 2,42 ммоль) и полученную смесь перемешивали в течение 2 часов. По завершении реакции добавляли к смеси воду, полученный раствор экстрагировали этилацетатом, промывали насыщеным водным раствором гидрокарбоната натрия и затем насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 2/1) и получали целевой продукт (выход: 70%).
Бледно-розовый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,33 (c, 3H), 1,44 (c, 3H), 2,75-3,00 (м, 4H), 3,50 (д, J=9,6 Гц, 1H), 3,60 (д, J=9,6 Гц, 1H), 4,23 (c, 2H), 6,58 (c, 1H), 6,83 (c, 1H), 7,20-7,35 (м, 5H), 8,47 (c, 1H)
Масс-спектр (ESI+) m/z: 405 [М+1]+
Масс-спектр (ESI-) m/z: 403 [М-1]+
(7R*,8S*)-7-Гидрокси-6,6-диметил-8-[(2-фенилэтил)амино]-4,6,7,8-тетрагидро-1,5-диокса-4-азаантрацен-3-он
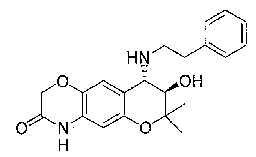
К раствору 2-хлор-N-[(3R*4S*)-3,6-дигидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-7-ил]ацетамида (120 мг, 0,30 ммоль) в метаноле (1,2 мл) добавляли при комнатной температуре водный раствор гироксида натрия (1 моль/л, 1,5 мл) и полученную смесь перемешивали в течение 4 часов. По завершении реакции добавляли к смеси насыщенный водный раствор хлорида аммония, полученный раствор экстрагировали этилацетатом, промывали насыщенным водным раствором гидроксида натрия (1 моль/л) и затем насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 1/1) и получали целевой продукт (выход: 72%).
Бесцветное твердое вещество
1H-ЯМР (CDCl3) δ: 1,14 (c, 3H), 1,44 (c, 3H), 2,75-3,00 (м, 4H), 3,47 (д, J=9,9 Гц, 1H), 3,56 (д, J=9,9 Гц, 1H), 4,50 (д, J=15,4 Гц, 1H), 4,55 (д, J=15,4 Гц, 1H), 6,27 (c, 1H), 6,68 (c, 1H), 7,20-7,35 (м, 5H), 7,74 (c, 1H)
Масс-спектр (ESI+) m/z: 369 [М+1]+
Масс-спектр (ESI-) m/z: 367 [М-1]+
Пример синтеза 72
Малеат (7R*,8S*)-6,6-диметил-8-[(2-фенилэтил)амино]-2,3,4,6,7,8-гексагидро-1,5-диокса-4-азаантрацен-7-ола
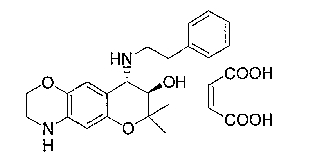
К раствору (7R*,8S*)-7-гидрокси-6,6-диметил-8-[(2-фенилэтил)амино]-4,6,7,8-тетрагидро-1,5-диокса-4-азаантрацен-3-она (42 мг, 0,11 ммоль) в тетрагидрофуране (1,2 мл) добавляли при комнатной температуре литийалюминийгидрид (1 М раствор в тетрагидрофуране, 570 мкл, 0,57 ммоль) и полученную смесь перемешивали при 90°C в течение 1,5 часов. По завершении реакции добавляли к смеси насыщенный водный раствор гидрокарбоната натрия, полученный раствор экстрагировали этилацетатом, промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. К раствору полученной смеси в этилацетате (600 мкл) добавляли малеиновую кислоту (13 мг, 0,11 ммоль) и гексан (1 мл) при комнатной температуре и полученную смесь перемешивали при комнатной температуре в течение 15 минут. Полученные кристаллы отфильтровывали и получали целевой продукт (выход: 60%).
Бледно-коричневое твердое вещество
1H-ЯМР (ДМСО-d6) δ: 1,04 (c, 3H), 1,36 (c, 3H), 2,85-3,30 (м, 6H), 3,80-3,85 (м, 1H), 4,11 (д, J=4,2 Гц, 2H), 4,15-4,20 (м, 1H), 6,05 (c, 2H), 6,18 (c, 1H), 6,76 (c, 1H), 7,20-7,40 (м, 5H)
Пример синтеза 73
Гидрохлорид (7R*,8S*)-7-гидрокси-4,6,6-триметил-8-[(2-фенилэтил)амино]-4,6,7,8-тетрагидро-1,5-диокса-4-азаантрацен-3-она
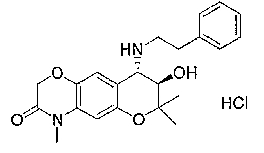
трет-Бутил-(2-фенилэтил)(7R*,8S*)-[7-гидрокси-6,6-диметил-3-оксо-4,6,7,8-тетрагидро-1,5-диокса-4-азаантрацен-8-ил]карбамат

К раствору (7R*,8S*)-7-гидрокси-6,6-диметил-8-[(2-фенилэтил)амино]-4,6,7,8-тетрагидро-1,5-диокса-4-азаантрацен-3-она (150 мг, 0,41 ммоль) в тетрагидрофуране (3 мл) добавляли при комнатной температуре триэтиламин (85 мкл, 0,61 ммоль) и ди-трет-бутилкарбонат (178 мг, 0,81 ммоль) и полученную смесь перемешивали при 90°С в течение 1,5 часов. По завершении реакции к смеси добавляли насыщенный водный раствор хлорида аммония, полученный раствор экстрагировали этилацетатом, промывали насыщенным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 3/1) и получали целевой продукт (выход: 85%).
Масс-спектр (ESI+) m/z: 469 [М+1]+
Масс-спектр (ESI-) m/z: 467 [М-1]+
трет-Бутил(2-фенилэтил)(7R*,8S*)-[7-гидрокси-4,6,6-триметил-3-оксо-4,6,7,8-тетрагидро-1,5-диокса-4-азаантрацен-8-ил]карбамат

К раствору трет-бутил-(2-фенилэтил)(7R*,8S*)-[7-гидрокси-6,6-диметил-3-оксо-4,6,7,8-тетрагидро-1,5-диокса-4-азаантрацен-8-ил]карбамата (106 мг, 0,23 ммоль) в диметилформамиде (2 мл) добавляли при комнатной температуре карбонат калия (79 мг, 0,57 ммоль) и иодистый метил (28 мкл, 0,46 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 4 часов. По завершении реакции к смеси добавляли насыщенный водный раствор хлорида аммония, полученный раствор экстрагировали этилацетатом, промывали насыщенным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 2/1) и получали целевой продукт (выход: 100%).
Масс-спектр (ESI+) m/z: 505 [М+23]+ (Na аддукт)
Масс-спектр (ESI-) m/z: 527 [М+45]+ (HCOOH аддукт)
(7R*8S*)-7-Гидрокси-4,6,6-триметил-8-[(2-фенилэтил)амино]-4,6,7,8-тетрагидро-1,5-диокса-4-азаантрацен-3-он

К раствору трет-бутил(2-фенилэтил)(7R*,8S*)-[7-гидрокси-4,6,6-триметилo-3-оксо-4,6,7,8-тетрагидро-1,5-диокса-4-азаантрацен-8-ил]карбамата (115 мг, 0,24 ммоль) в простом эфире (2,2 мл) добавляли при комнатной температуре 4 моль/л раствор хлористого водорода в диоксане (500 мкл) и полученную смесь перемешивали при комнатной температуре в течение 5 часов, а затем при 50°C в течение 30 минут. По завершении реакции добавляли к смеси насыщенный водный раствор гидрокарбоната натрия, полученный раствор экстрагировали этилацетатом, промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 1/2) и получали целевой продукт (выход: 76%).
Бесцветный маслянистый продукт
1H-ЯМР (CDCl3) δ: 1,17 (c, 3H), 1,47 (c, 3H), 2,75-3,00 (м, 4H), 3,29 (c, 3H), 3,49 (д, J=9,9 Гц, 1H), 3,58 (д, J=9,9 Гц, 1H), 4,52 (д, J=15,1 Гц, 1H), 4,58 (д, J=15,1 Гц, 1H), 6,42 (c, 1H), 6,68 (c, 1H), 7,20-7,35 (м, 5H)
Масс-спектр (ESI+) m/z: 383 [М+1]+
Масс-спектр (ESI-) m/z: 427 [М+45]+ (HCOOH аддукт)
Гидрохлорид (7R*,8S*)-7-гидрокси-4,6,6-триметил-8-[(2-фенилэтил)амино]-4,6,7,8-тетрагидро-1,5-диокса-4-азаантрацен-3-она
К раствору (7R*8S*)-7-гидрокси-4,6,6-триметил-8-[(2-фенилэтил)амино]-4,6,7,8-тетрагидро-1,5-диокса-4-азаантрацен-3-она (65 мг, 0,17 ммоль) в простом эфире (2,2 мл) добавляли при комнатной температуре 4 моль/л хлористый водород в диоксане (200 мкл) и полученную смесь перемешивали при комнатной температуре в течение 10 минут. По завершении реакции полученные кристаллы отфльтровывали и получали целевой продукт (выход: 93%).
Бледно-розовое твердое вещество
Пример синтеза 74
(±)-транс-7-Гидрокси-6,6-диметил-8-[(2-фенилэтил)амино]-1,6,7,8-тетрагидро-4,5-диокса-1-азаантрацен-2-он

2-Метоксиметокси-4-(1,1-диметил-2-пропионилокси)-1-нитробензол

К раствору 4-фтор-2-нитрофенола (1,6 г, 10,2 ммоль) в тетрагидрофуране (32 мл) добавляли при комнатной температуре хлорметилметиловый эфир (1,23 г, 15,3 ммоль) и диизопропилэтиламин (2,66 мл, 15,3 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. По завершении реакции добавляли к смеси насыщенный водный раствор хлорида аммония, полученный раствор экстрагировали этилацетатом, промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. К раствору полученной смеси в диметилацетамиде (17 мл) при 0°C добавляли гидрид натрия (553 мг, 12,3 ммоль) и 1-метил-2-бутин-1-ол (1,23 мл, 12,7 ммоль) и полученную смесь перемешивали в течение 7 часов. По завершении реакции к смеси добавляли насыщенный водный раствор хлорида аммония, полученный раствор экстрагировали этилацетатом, промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 5/1) и получали целевой продукт (выход: 94%).
Желтый маслянистый продукт
7-Метоксиметокси-2,2-диметил-6-нитро-2H-1-бензопиран

Раствор 2-метоксиметокси-4-(1,1-диметил-2-пропионилокси)-1-нитробензола (2,1 г, 7,92 ммоль) в дихлорбензоле (21 мл) перемешивали при 200°C в течение 0,5 часа. По завершении реакции, полученную смесь концентрировали и очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 5/1). Таким образом была получена смесь (1:1) целевого продукта и региоизомера (выход: 77%).
Желтый маслянистый продукт
1H-ЯМР (CDCl3) δ: 1,46 (c, 6H), 3,53 (c, 1,5 H), 3,58 (c, 1,5H), 5,10 (c, 1H), 5,27 (c, 1H), 5,64 (д, J=10,4 Гц, 0,5H), 5,74 (д, J=10,4 Гц, 0,5H), 6,27 (д, J=10,4 Гц, 0,5H), 6,60-6,70 (м, 1,5H), 7,67 (c, 0,5H), 7,77 (д, J=9,1 Гц, 0,5H).
(±)-транс-3-Бром-7-метоксиметокси-2,2-диметил-6-нитро-3,4-дигидро-2H-1-бензопиран-4-ол

К водному раствору смеси 7-метоксиметокси-2,2-диметил-6-нитро-2H-1-бензопирана и региоизомера (1,5 г, 5,65 ммоль) в диметилсульфоксиде (17 мл) добавляли при комнатной температуре N-бромсукцинимид (1,21 г, 6,78 ммоль) и полученную смесь перемешивали в течение 3 часов. По завершении реакции добавляли к смеси насыщенный водный раствор хлорида аммония, полученный раствор экстрагировали этилацетатом, промывали насыщеным водным раствором гидрокарбоната натрия и затем насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 7/1) и получали целевой продукт (выход: 27%).
Желтое твердое вещество
1H-ЯМР (CDCl3) δ: 1,45 (c, 3H), 1,63 (c, 3H), 2,73 (д, J=4,4 Гц, 1H), 3,52 (c, 3H), 4,08 (д, J=9,4 Гц, 1H), 4,88 (дд, J=9,4, 4,4 Гц, 1H), 6,71 (c, 1H), 8,16 (c, 1H).
3,4-Эпокси-7-метоксиметокси-2,2-диметил-6-нитро-3,4-дигидро-2H-1-бензопиран

К раствору (±)-транс-3-бром-7-метоксиметокси-2,2-диметил-6-нитро-3,4-дигидро-2H-1-бензопиран-4-ола (550 мг, 1,52 ммоль) в диоксане (5,5 мл) добавляли при комнатной температуре 1 моль/л водный раствор гидроксида натрия (1,82 мл, 1,82 ммоль) и полученную смесь перемешивали в течение 2 часов. По завершении реакции добавляли к смеси воду, полученный раствор экстрагировали этилацетатом, промывали насыщенным водным раствором тиосульфата натрия и затем насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 4/1) и получали целевой продукт (выход: 78%).
Желтый маслянистый продукт
1H-ЯМР (CDCl3) δ: 1,32 (c, 3H), 1,59 (c, 3H), 3,51 (c, 3H), 3,52 (д, J=3,9 Гц, 1H), 3,91 (д, J=3,9 Гц, 1H), 5,26 (c, 2H), 6,73 (c, 1H), 8,05 (c, 1H)
(±)-транс-7-Метоксиметокси-2,2-диметил-6-нитро-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-3-ол

К раствору 3,4-эпокси-7-метоксиметокси-2,2-диметил-6-нитро-3,4-дигидро-2H-1-бензопирана (332 мг, 1,18 ммоль) в диоксане (1,3 мл) добавляли при комнатной температуре перхлорат лития (126 мг, 1,18 ммоль) и 2-фенилэтиламин (214 мг, 1,77 ммоль) и полученную смесь перемешивали в течение 2 часов. По завершении реакции добавляли к смеси насыщенный водный раствор гидрокарбоната натрия, полученный раствор экстрагировали этилацетатом, промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 3/1) и получали целевой продукт (выход: 73%).
Желтый маслянистый продукт
1H-ЯМР (CDCl3) δ: 1,19 (c, 3H), 1,47 (c, 3H), 2,75-3,00 (м, 4H), 3,45-3,55 (м, 2H), 3,50 (c, 3H), 5,24 (c, 2H), 6,66 (c, 1H), 7,15-7,40 (м, 5H), 7,72 (c, 1H)
(±)-транс-6-Амино-7-метоксиметокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-3-ол

К раствору (±)-транс-7-метоксиметокси-2,2-диметил-6-нитро-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопирана (265 мг, 0,66 ммоль) в этаноле (5 мл) добавляли при комнатной температуре 5% палладий-на-угле (тип AER, 13 мг) и полученную смесь перемешивали в токе водорода в течение ночи. По завершении реакции полученный раствор фильтровали через целит, концентрировали и получали целевой продукт (выход: 98%).
Коричневый маслянистый продукт
1H-ЯМР (CDCl3) δ: 1,13 (c, 3H), 1,43 (c, 3H), 2,70-3,05 (м, 8H), 3,51 (c, 3H), 3,52-3,60 (м, 2H), 5,12 (c, 2H), 6,21 (c, 1H), 6,51 (c, 1H), 7,20-7,50 (м, 5H).
2-Хлор-N-{(±)-транс-3-гидрокси-7-метоксиметокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-6-ил}ацетамид

К транс-6-амино-7-метоксиметокси-2,2-диметил-4-[(2-фенилэтил)амино]-
3,4-дигидро-2H-1-бензопиран-3-олу (242 мг, 0,65 ммоль) в растворе смеси этилацетат-диметилформамид (5 мл), добавляли при 0°C 4 М раствор хлористого водорода в диоксане (194 мкл, 0,78 ммоль) и полученную смесь перемешивали в течение 5 минут. Добавляли к смеси хлористый хлорацетил (88 мг, 0,78 ммоль) и полученную смесь перемешивали в течение 15 минут. По завершении реакции добавляли к этой смеси этанол и насыщенный водный раствор гидрокарбоната натрия, полученный раствор экстрагировали этилацетатом, промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 1/1) и получали целевой продукт (выход: 79%).
Бледно-розовый маслянистый продукт
1H-ЯМР (CDCl3) δ: 1,17 (c, 3H), 1,45 (c, 3H), 2,75-3,00 (м, 4H), 3,43 (д, J=9,9 Гц, 1H), 3,50 (c, 3H), 3,59 (д, J=9,9 Гц, 1H), 4,20 (c, 2H), 5,19 (c, 2H), 6,61 (c, 1H), 7,15-7,30 (м, 5H), 8,14 (c, 1H), 8,73 (c, 1H).
Масс-спектр (ESI+) m/z: 449 [М+1]+
Масс-спектр (ESI-) m/z: 447 [М-1]+
2-Хлор-N-{(±)-транс-3,7-дигидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-6-ил}ацетамид

К раствору 2-хлор-N-{(±)-транс-гидрокси-7-метоксиметокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-6-ил}ацетамида (228 мг, 0,51 ммоль) в хлористом метилене (6 мл) добавляли при 0°C трибромид бора (1 М раствор в хлористом метилене, 2,42 мл, 2,42 ммоль) и полученную смесь перемешивали в течение 2 часов. По завершении реакции добавляли к этой смеси метанол и насыщенный водный раствор гидрокарбоната натрия, полученный раствор экстрагировали этилацетатом, промывали насыщенным водным раствором гидрокарбоната натрия и затем насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали, получая целевой продукт (выход: 100%).
Бесцетный аморфный продукт
Масс-спектр (ESI+) m/z: 405 [М+1]+
Масс-спектр (ESI-) m/z: 403 [М-1]+
(±)-транс-7-Гидрокси-6,6-диметил-8-[(2-фенилэтил)амино]-1,6,7,8-тетрагидро-4,5-диокса-1-азаантрацен-2-он

К раствору 2-хлор-N-{(±)-транс-3,7-дигидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-6-ил}ацетамида (187 мг, 0,46 ммоль) в метаноле (2 мл) добавляли при комнатной температуре водный раствор гидроксида натрия (1 моль/л, 1,8 мл) и полученную смесь перемешивали в течение 3 часов. По завершении реакции добавляли к смеси насыщенный водный раствор хлорида аммония, полученный раствор экстрагировали этилацетатом, промывали 1 моль/л водным раствором гидроксида натрия и затем насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 1/3) и получали целевой продукт (выход: 61%).
Бесцветный маслянистый продукт
1H-ЯМР (CDCl3) δ: 1,14 (c, 3H), 1,45 (c, 3H), 2,65-3,00 (м, 4H), 3,53 (д, J=9,9 Гц, 1H), 3,57 (д, J=9,9 Гц, 1H), 4,50 (д, J=15,4 Гц, 1H), 4,56 (д, J=15,4 Гц, 1H), 5,99 (c, 1H), 6,40 (c, 1H), 7,15-7,40 (м, 5H).
Масс-спектр (ESI+) m/z: 369 [М+1]+
Пример синтеза 75
1 малеат (±)-транс-6,6-диметил-8-[(2-фенилэтил)амино]-1,2,3,6,7,8-гексагидро-4,5-диокса-1-азаантрацен-7-ола

(±)-транс-6,6-Диметил-8-[(2-фенилэтил)амино]-1,2,3,6,7,8-гексагидро-4,5-диокса-1-азаантрацен-7-ол

К (±)-транс-7-гидрокси-6,6-диметил-8-[(2-фенилэтил)амино]-1,6,7,8-
тетрагидро-4,5-диокса-1-азаантрацен-2-она (67 мг, 0,18 ммоль) добавляли при комнатной температуре литийалюминийгидрид (1 М раствор в тетрагидрофуране, 910 мкл, 0,91 ммоль) и полученную смесь перемешивали при 90°C в течение 0,5 часа. По завершении реакции добавляли к смеси насыщенный водный раствор гидрокарбоната натрия, полученный раствор экстрагировали этилацетатом, промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали. Полученную смесь очищали колоночной хроматографией на силикагеле (этилацетат) и получали целевой продукт (выход: 59%).
Бесцветный маслянистый продукт
1H-ЯМР (CDCl3) δ: 1,13 (c, 3H), 1,43 (c, 3H), 2,75-3, 00 (м, 4H), 3,30-3,35 (м, 2H), 3,50-3,70 (м, 2H), 4,15-4,25 (м, 2H), 6,12 (c, 1H). 6,25 (c, 1H), 7,20-7,35 (м, 5H)
Масс-спектр (ESI+) m/z: 355 [М+1]+
Масс-спектр (ESI-) m/z: 389 [М+45]+ (HCOOH аддукт)
1 малеат (±)-транс-6,6-диметил-8-[(2-фенилэтил)амино]-1,2,3,6,7,8-гексагидро-4,5-диокса-1-азаантрацен-7-ола
К раствору (±)-транс-6,6-диметил-8-[(2-фенилэтил)амино]-1,2,3,6,7,8-гексагидро-4,5-диокса-1-азаантрацен-7-ола в этилацетате (800 мкл) добавляли при комнатной температуре малеиновую кислоту (14 мг, 0,12 ммоль) и полученную смесь перемешивали в течение 10 минут. Добавляли к смеси гексан (1 мл) и полученную смесь перемешивали при 0°C в течение 30 минут. Полученные кристаллы отфильтровывали и получали целевой продукт (выход: 73%).
Бледно-серые кристаллы
т.пл.:162-162°C (разложение)
1H-ЯМР (ДМСО-d6) δ: 1,04 (c, 3H), 1,36 (c, 3H), 2,85-3,30 (м, 6H), 3,80-3,85 (м, 1H), 4,11 (д, J=4,2 Гц, 2H), 4,15-4,20 (м, 1H), 6,05 (c, 2H), 6,18 (c,1H), 6,76 (c, 1H), 7,20-7,40 (м, 5H).
Пример синтеза 76
(3R*,4S*)-4-{[2-(4-Фторфенил)этил]амино}-7-гидроксиметил-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол

Данное соединение синтезировали в соответствии со способом примера синтеза 18. (Выход: 42%).
Белые кристаллы
т.пл.:147-152°C
1H-ЯМР (CDCl3) δ: 1,26 (c, 3H), 1,56 (c, 3H), 2,59 (c, 3H), 2,84-2,86 (м, 2H), 2,92-3,09 (м, 2H), 3,64 (д, J=10,5 Гц, 1H), 3,89 (д, J=10,2 Гц, 1H), 4,83 (c, 2H), 6,99-7,05 (м, 3H), 7,12-7,23 (м, 2H), 7,29 (c, 1H), 7,81 (c, 1H)
Масс-спектр (ESI+) m/z: 411 [М+1]+
Масс-спектр (ESI-) m/z: 455 [М+45]+ (HCOOH аддукт)
Пример синтеза 77
1 малеат (3R*,4S*)-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола

2,2-Диметил-2H-пирано[2,3-g]хинолин

В атмосфере азота к раствору 6-амино-2,2-диметилхромена (3,88 г, 22,1 ммоль) и трихлорида рутения (55,0 мг, 0,265 ммоль) в диметиловом эфире диметиленгликоля (8 мл) добавляли при комнатной температуре 1,3-пропандиол (0,639 мл, 8,84 ммоль) и три-н-бутилфосфин (0,132 мл, 0,530 ммоль) и полученную смесь перемешивали при 180°C в течение 5 часов. По завершении реакции комплекс рутения удаляли на колонке с флорисилом и отгоняли растворитель. Остаток очищали колоночной хроматографией среднего давления (гексан/этилацетат = 5/1) и получали целевой продукт (выход: 59%).
Коричневый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,49 (c, 6H), 5,91 (д, J=9,9 Гц, 1H), 6,59 (д, J=9,9 Гц, 1H), 7,08 (c, 1H), 7,24-7,28 (м, 1H), 7,67 (c, 1H), 7,93 (д, J=8,0 Гц, 1H), 8,70 (дд, J=4,1 Гц, 1,7 Гц, 1H).
Масс-спектр (ESI+) m/z: 212 [М+1]+
(3R*,4R*)-3,4-Эпокси-2,2-диметил-3,4-дигидро-2H-пирано[2,3-g]хинолин

Данное соединение синтезировали в соответствии со способом примера синтеза 12.
(Выход: 65%)
CHIRALPAKAD-RH 20 мM фосфатный буфер (pH 8,0)/ацетонитрил = 60/40, время удерживания: 7,3 мин).
Коричневое твердое вещество
1H-ЯМР (CDCl3) δ: 1,30 (c, 3H), 1,65 (c, 3H), 3,61 (д, J=4,4 Гц, 1H), 4,18 (д, J=4,4 Гц, 1H), 7,17 (c, 1H), 7,34 (дд, J=8,5 Гц, 4,4 Гц, 1H), 8,01 (д, J=7,7 Гц, 1H), 8,12 (c, 1H), 8,79 (дд, J=4,1 Гц, 1,7 Гц, 1H)
Масс-спектр (ESI+) m/z: 228 [М+1]+
(3R*,4S*)-2,2-Диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол

(Выход: 58%)
Масс-спектр (ESI+) m/z: 349[М+1]+
Масс-спектр (ESI-) m/z: 393 [М+45]+ (HCOOH аддукт)
1 малеат (3R*,4S*)-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол
(Выход: 79%)
Белые кристаллы
т.пл.:187-192°C (разложение)
1H-ЯМР (ДМСО-d6) δ: 1,16 (c, 3H), 1,50 (c, 3H), 2,94-3,00 (м, 1H), 3,09-3,20 (м, 2H), 3,34-3,37 (м, 1H), 4,07-4,11 (м, 1H), 4,69 (д, J=9,4 Гц, 1H), 6,05 (c, 2H), 6,32 (ушир. c, 1H), 7,23-7,39 (м, 6H), 7,49 (дд, J=8,3 Гц, 4,1 Гц, 1H), 8,22 (д, J=8,3 Гц, 1H), 8,44 (c, 1H), 8,80 (д, J=3,9 Гц, 1H)
Пример синтеза 78
(3R*,4S*)-7-Хлор-2,2,9-триметил-4-{[2-(1-пирролидинил)этил]амино}-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол

Данное соединение синтезировали в соответствии со способом примера синтеза 19.
(Выход: 30%)
Оранжевый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,19 (c, 3H), 1,50 (c, 3H), 2,05-2,15 (ушир., 2H), 2,49 (c, 3H), 3,09-3,32 (м, 10H), 4,60-5,20 (ушир., 2H), 7,06 (c, 1H), 7,11 (c, 1H), 7, 88 (c, 1H)
Масс-спектр (EI+) m/z: 390 [М+1]+.
Пример синтеза 79
(3R*,4S*)-7-Хлор-2,2,9-триметил-4-{[2-(1,2,4-триазол-1-ил)этил]амино}-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол

Данное соединение синтезировали в соответствии со способом примера синтеза 19.
(Выход: 32%)
Бледно-желтое твердое вещество
1H-ЯМР (CDCl3) δ: 1,28 (c, 3H), 1,57 (c, 3H), 2,00 (ушир.), 2,58 (c, 3H), 3,23-3,35 (м, 2H), 3,63 (д, J=10,2 Гц, 1H), 3,90 (д, J=10,2 Гц, 1H), 4,29-4,38 (м, 2H), 7,15 (c, 1H), 7,27 (c, 1H), 7,99 (м, 2H), 8,18 (c, 1H).
Масс-спектр (ESI+) m/z: 388 [М+1]+
Пример синтеза 80
(3R*,4S*)-7-Гидроксиметил-2,2,9-триметил-4-пентиламино-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол

Данное соединение синтезировали в соответствии со способом примера синтеза 18.
(Выход: 38%)
Бледно-желтые кристаллы
1H-ЯМР (CDCl3) δ: 0,88-0,93 (м, 3H), 1,29 (c, 3H), 1,33-1,37 (м, 4H), 1,59 (c, 3H), 1,60 (м, 2H), 2,60 (c, 3H), 2,66-2,84 (м, 2H), 3,68 (д, J=10,5 Гц, 1H), 3,94 (д, J=10,5 Гц, 1H), 4,83 (c, 2H), 7,04 (c, 1H), 7,31 (c, 1H), 7,99 (c, 1H).
Масс-спектр (ESI+) m/z: 359 [М+1]+
Пример синтеза 81
(3R*,4S*)-4-[(2-Циклопентилэтил)амино]-2,2-диметил-3,4-дигидро-2H-пирано[2,3-g]хиноксалин-3-ол

Данное соединение синтезировали в соответствии со способом примера синтеза 59.
(3R*,4S*)-6,7-Диамино-4-[(2-циклопентилэтил)амино]-2,2-диметил-3,4-дигидро-2H-1-бензопиран-3-ол

Черный аморфный продукт
(3R*,4S*)-4-[(2-Циклопентилэтил)амино]-2,2-диметил-3,4-дигидро-2H-пирано[2,3-g]хиноксалин-3-ол
1H-ЯМР (CDCl3) δ: 1,05 (м, 2Н), 1,31 (с, 3Н), 1,50-1,90 (м, 9Н), 1,59 (с, 3Н), 2,60-2,90 (м, 2Н), 3,37 (ушир.с, 1Н), 3,68 (д, J=10,4 Гц, 1Н), 3,93 (д, J=10,4 Гц, 1Н), 7,44 (с, 1Н), 8,03 (с, 1Н), 8,66 (д, J=1,7 Гц, 1Н), 8,74 (д, J=1,7 Гц, 1Н).
Пример синтеза 82
(3R*,4S*)-3-Гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-карбоновая кислота

К раствору (3R*,4S*)-3-гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-карбонитрила, описанного в примере синтеза 14 (465 мг, 1,20 ммоль), в этаноле (5 мл) добавляли при комнатной температуре водный раствор гидроксида натрия (3 моль/л, 5 мл) и полученную смесь перемешивали в течение 2 часов при кипении с обратным холодильником. После охлаждения до комнатной температуры полученный раствор нейтрализовали 1 моль/л соляной кислотой, выпавшее в осадок коричневое твердое вещество отфильтровывали и получали целевой продукт (выход: 90%).
Коричневое твердое вещество
1H-ЯМР (CDCl3) δ: 1,07 (c, 3H), 1,41 (c, 3H), 2,46 (c, 3H), 2,89-3,08 (ушир., 2H), 3,10-3,28 (ушир., 2H), 4,03-4,22 (ушир., 1H), 4,30-4,44 (ушир., 1H), 7,01-7,54 (м, 7H), 7,86 (c, 1H), 8,51-8,73 (ушир., 1H).
Масс-спектр (ESI+) m/z: 407 [М+1]+
Пример синтеза 83
2 малеат (3R*,4S*)-7-аминометил-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола

(3R*,4S*)-7-Аминометил-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол

К раствору (3R*,4S*)-3-гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-карбонитрила, описанного в примере синтеза 14 (110 мг, 0,283 ммоль), в уксусной кислоте (5 мл) добавляли при комнатной температуре 10% Pd/C (22 мг) и полученную смесь перемешивали в течение 2 часов в атмосфере водорода. По завершении реакции полученный раствор фильтровали через целит, растворитель отгоняли, затем добавляли к остатку водный раствор карбоната натрия и полученный раствор экстрагировали хлороформом, сушили над безводным сульфатом магния, растворитель отгоняли, получая неочищенный продукт (3R*,4S*)-7-аминометил-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол (75,1 мг).
1H-ЯМР (CDCl3) δ: 1,14 (c, 3H), 1,46 (c, 3H), 2,48 (c, 3H), 2,73 (т, J=6,6 Гц, 2H), 2,88-2,95 (м, 2H), 3,53 (д, J=10,5 Гц, 1H), 3,77 (д, J=10,2 Гц, 1H), 3,98 (c, 2H), 7,04 (c, 1H), 7,12-7,23 (м, 6H), 7,84 (c, 1H).
Масс-спектр (ESI+) m/z: 392 [М+1]+
2 малеат (3R*, 4S*)-7-аминометил-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
(выход по 2-стадиям: 14%)
Коричневые кристаллы
т.пл.: 136-140°C
1H-ЯМР (ДМСО-d6) δ: 1,18 (c, 3H), 1,49 (c, 3H), 2,60 (c, 3H), 2,90-3,00 (м, 2H), 3,24-3,35 (м, 2H), 4,02 (ушир.с, 1H), 4,33 (c, 2H), 4,51 (ушир.с, 1H), 6,04 (c, 4H), 7,21-7,42 (м, 7H), 8,32 (ушир.с, 2H), 8,36 (c, 1H)
Пример синтеза 84
1 малеат (3R*,4S*)-9-гидроксиметил-2,2-диметил-4-[(2-фенилэтил)амино)]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола

Данное соединение синтезировали в соответствии со способом примера синтеза 18.
(2,2-Диметил-2H-пирано[2,3-g]хинолин-9-ил)метилацетат
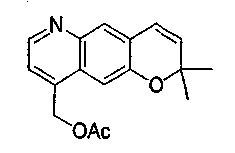
К раствору 2,2,9-триметил-2H-пирано[2,3-g]хинолина, описанного в примере синтеза 1 (3,30 мг, 14,6 ммоль), в хлороформе (33 мл) добавляли по каплям при комнатной температуре раствор м-хлорпербензойной кислоты (5,54 г, 19,5 ммоль) в смеси хлороформ (13,2 мл) - метанол (3,3 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. По завершении реакции добавляли к смеси водный раствор тиосульфата натрия и полученный раствор экстрагировали. Полученную органическую фазу промывали водным раствором гидрокарбоната натрия, затем водным раствором хлорида натрия и сушили над безводным сульфатом магния. После отгонки растворителя добавляли к остатку при комнатной температуре уксусный ангидрид (46 мл) и полученную смесь перемешивали при 150°C в течение 1 часа. По завершении реакции уксусный ангидрид отгоняли, остаток нейтрализовали водным раствором карбоната натрия, экстрагировали хлороформом, полученную органическую фазу промывали водным раствором хлорида натрия и сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией среднего давления (гексан/этилацетат = 1/1) и получали целевой продукт (выход: 34%).
1H-ЯМР (CDCl3) δ: 1,41 (c, 6H), 2,09 (c, 3H), 5,37 (c, 2H), 5,84 (д, J=9,9 Гц, 1H), 6,49 (д, J=9,9 Гц, 1H), 7,09 (c, 1H), 7,24 (д, J=4,4 Гц, 1H), 7,66 (c, 1H), 8,61 (д, J=4,4 Гц, 1H).
Масс-спектр (ESI+) m/z: 284 [М+1]+
(3R*, 4R*)-(3,4-Эпокси-2,2-диметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-9-ил)метилацетат

(Выход: 58%)
99,5% ee; CHIRALPAK AD-RH 20 мM фосфатный буфер (pH 8,0)/ацетонитрил = 60/40, время удерживания: 9,5 мин.
Бледно-желтое твердое вещество
1H-ЯМР (CDCl3) δ: 1,31 (c, 3H), 1,66 (c, 3H), 2,18 (c, 3H), 3,62 (д, J=4,4 Гц, 1H), 4,18 (д, J=4,4 Гц, 1H), 5,47 (д, J=2,2 Гц, 2H), 7,28 (c, 1H), 7,38 (д, J=4,1 Гц, 1H), 8,16 (c, 1H), 8,78 (д, J=4,4 Гц, 1H).
Масс-спектр (ESI+) m/z: 300 [М+1]+
(3R*,4S*)-9-Гидроксиметил-2,2-диметил-4-[(2-фенилэтил)амино)]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол

(Выход: 80%)
Коричневый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,23 (c, 3H), 1,52 (c, 3H), 2,77-2,81 (м, 2H), 2,90-3,04 (м, 2H), 3,58 (д, J=10,5 Гц, 1H), 3,83 (д, J=10,4 Гц, 1H), 5,08 (c, 2H), 7,17-7,21 (м, 4H), 7,26-7,31 (м, 2H), 7,44 (д, J=4,4 Гц, 1H), 7,98 (c, 1H), 8,65 (т, J=4,7 Гц, 1H).
Масс-спектр (ESI+) m/z: 379 [М+1]+
Масс-спектр (ESI-) m/z: 423 [М+45]+ (HCOOH аддукт)
1 малеат (3R*,4S*)-9-гидроксиметил-2,2-диметил-4-[(2-фенилэтил)амино)]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
(Выход: 88%)
Белые кристаллы
т.пл.:163-169°C (разложение)
1H-ЯМР (ДМСО-d) δ: 1,17 (c, 3H), 1,50 (c, 3H), 2,94-3,01 (м, 1H), 3,09-3,21 (м, 2H), 3,35-3,38 (м, 2H), 4,09 (дд, J=9,6 Гц, 6,3 Гц, 1H), 4,72 (д, J=9,4 Гц, 1H), 4,91 (c, 2H), 5,57 (ушир.с, 1H), 6,08 (c, 2H), 6,34 (д, J=5,5 Гц, 1H), 7,23-7,39 (м, 6H), 7,52 (д, J=4,4 Гц, 1H), 8,45 (c, 1H), 8,77 (д, J=4,4 Гц, 1H)
Пример синтеза 85
3/2 малеат (3R*,4S*)-2,2,9-триметил-4-[(2-фенилэтил)амино)]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3,7-диола

Данное соединение синтезировали в соответствии со способом примера синтеза 18.
(2,2,9-Триметил-2H-пирано[2,3-g]хинолин-7-ил)ацетат

К раствору 2,2,9-триметил-2H-пирано[2,3-g]хинолина, описанного в примере синтеза 1 (3,30 г, 14,6 ммоль), в хлороформе (33 мл) добавляли по каплям при комнатной температуре раствор м-хлорпербензойной кислоты (5,54 г, 19,5 ммоль) в смеси хлороформ (13,2 мл) - метанол (3,3 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. По завершении реакции добавляли к смеси водный раствор тиосульфата натрия и полученный раствор экстрагировали. Полученную органическую фазу промывали водным раствором гидрокарбоната натрия, затем водным раствором хлорида натрия и сушили над безводным сульфатом магния. После отгонки растворителя добавляли к остатку при комнатной температуре уксусный ангидрид (46 мл) и полученную смесь перемешивали при 150°C в течение 1 часа. По завершении реакции отгоняли уксусный ангидрид, остаток нейтрализовали водным раствором карбоната натрия, экстрагировали хлороформом, полученную органическую фазу промывали водным раствором хлорида натрия и сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией среднего давления (гексан/этилацетат = 1/1) и получали целевой продукт (выход: 23%).
Красный маслянистый продукт
1H-ЯМР (CDCl3) δ: 1,49 (c, 6H), 2,395 (c, 3H), 2,404 (c, 3H), 5,90 (д, J=9,9 Гц, 1H), 6,58 (д, J=9,9 Гц, 1H), 7,23 (c, 1H), 7,74 (c, 1H), 8,48 (c, 1H).
Масс-спектр (ESI+) m/z: 284 [М+1]+
[(3R*,4R*)-3,4-Эпокси-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-7-ил]ацетат
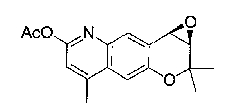
(Выход: 37%)
CHIRALPAKAD-RH 20 мM фосфатный буфер (pH 8,0)/ацетонитрил = 60/40, время удерживания: 6,6 мин.
Коричневый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,29 (c, 3H), 1,64 (c, 3H), 2,41 (c, 6H), 3,60 (д, J=4,4 Гц, 1H), 4,15 (д, J=4,1 Гц, 1H), 7,31 (c, 1H), 8,10 (c, 1H), 8,47 (c, 1H).
Масс-спектр (ESI+) m/z: 300 [М+1]+
(3R*,4S*)-2,2,9-Триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3,7-диол

(Выход: 46%)
Коричневый аморфный продукт
1H-ЯМР (CDCl3) δ: 1,25 (c, 3H), 2,05 (c, 3H), 2,48 (c, 3H), 2,80 (т, J=6,6 Гц, 2H), 2,93-3,12 (м, 2H), 3,58 (д, J=10,2 Гц, 1H), 3,84 (д, J=10,2 Гц, 1H), 7,12-7,25 (м, 6H), 8,02 (c, 1H), 8,66 (c, 1H).
Масс-спектр (ESI+) m/z: 379 [М+1]+
Масс-спектр (ESI-) m/z: 377 [М-1]+
3/2 малеат (3R*,4S*)-2,2,9-триметил-4-[(2-фенилэтил)амино)]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3,7-диол
(Выход: 70%)
Белые кристаллы
т.пл.: 184-188°C (разложение)
1H-ЯМР (ДМСО-d6) δ: 1,16 (c, 3H), 1,49 (c, 3H), 2,35 (c, 3H), 2,94-3,00 (м, 1H), 3,10-3,22 (м, 2H), 3,36-3,42 (м, 1H), 4,04-4,10 (м, 1H), 4,66 (д, J=9,4 Гц, 1H), 6,12 (c, 3H), 6,33 (д, J=5,8 Гц, 1H), 7,23-7,36 (м, 6H), 8,30 (c, 1H), 8,49 (c, 1H), 10,12 (c, 1H).
Пример синтеза 86
Гидрохлорид (3R*,4S*)-7-хлор-2,2,9-триметил-6λ5-окси-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола

трет-Бутил(2-фенилэтил)[(3R*,4S*)-7-хлор-3-гидрокси-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-4-ил]карбамат
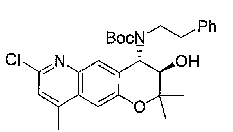
К раствору (3R*,4S*)-7-хлор-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола, описанного в примере синтеза 19 (391 мг, 0,99 ммоль), и ди-трет-бутилдикарбоната (430 мг, 1,97 ммоль) в тетрагидрофуране (8 мл) добавляли по каплям триэтилэтиламин (600 мкл, 4,29 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Далее добавляли к смеси при комнатной температуре ди-трет-бутилдикарбонат (430 мг, 1,97 ммоль) и полученную смесь перемешивали в течение ночи. По завершении реакции добавляли к смеси водный раствор карбоната натрия и полученный раствор экстрагировали этилацетатом. Полученную органическую фазу промывали водным раствором хлорида натрия и сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией среднего давления (гексан/этилацетат = 10/1) и получали целевой продукт (выход: 87%).
Масс-спектр (ESI+) m/z: 497 [М+1]+
Масс-спектр (ESI-) m/z: 541 [М+45]+ (HCOOH аддукт)
трет-Бутил(2-фенилэтил)[(3R*,4S*)-7-хлор-3-гидрокси-2,2,9-триметил-6λ5-окси-3,4-дигидро-2H-пирано[2,3-g]хинолин-4-ил]карбамат

К раствору трет-бутил(2-фенилэтил)[(3R*,4S*)-7-хлор-3-гидрокси-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-4-ил]карбамата (100 мг, 0,20 ммоль) в хлороформе (1 мл) добавляли по каплям при комнатной температуре раствор м-хлорпербензойной кислоты (75,9 мг, 0,44 ммоль) в смеси хлороформ (0,4 мл)-метанол (0,1 мл) и полученную смесь перемешивали при комнатной температуре в течение 30 минут. При комнатной температуре дополнительно добавляли раствор м-хлорпербензойной кислоты (75,9 мг, 0,44 ммоль) в хлороформе (0,4 мл) и полученную смесь перемешивали в течение ночи. По завершении реакции добавляли к смеси водный раствор тиосульфата натрия и полученный раствор экстрагировали. Полученную органическую фазу промывали водным раствором гидрокарбоната натрия, затем водным раствором хлорида натрия и сушили над безводным сульфатом магния. После отгонки растворителя остаток очищали колоночной хроматографией среднего давления (гексан/этилацетат = от 3/1 до 1/1) и получали целевой продукт (выход: 41%).
Масс-спектр (ESI+) m/z: 513 [М+1]+
Масс-спектр (ESI-) m/z: 557 [М+45]+ (HCOOH аддукт)
Гидрохлорид (3R*,4S*)-7-хлор-2,2,9-триметил-6λ5-окси-4-[(2-фенилэтил)амино)]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
К раствору трет-бутил(2-фенилэтил)[(3R*,4S*)-7-хлор-3-гидрокси-2,2,9-триметил-6λ5-окси-3,4-дигидро-2H-пирано[2,3-g]хинолин-4-ил]карбамата (41,7 мг, 0,081 ммоль) в 1,4-диоксане (0,2 мл) добавляли при комнатной температуре 4 моль/л раствор хлористого водорода в диоксане (0,42 мл) и полученную смесь перемешивали при 80°C в течение 1 часа. По завершении реакции выпавшее в осадок твердое вещество отфильтровывали и промывали диизопропиловым эфиром, получая целевой продукт (выход: 72%).
Белые кристаллы
т.пл.: 174-179°C (разложение)
1H-ЯМР (ДМСО-d6) δ: 1,14 (c, 3H), 1,49 (c, 3H), 2,53 (c, 3H), 3,00-3,55 (м, 4H), 4,21 (д, J=9,1 Гц, 1H), 4,76 (ушир.с, 1H), 7,23-7,31 (м, 6H), 7,45 (c, 1H), 7,65 (c, 1H), 9,08 (c, 1H), 9,37 (ушир.с, 1H), 10,16 (ушир.с, 1H).
Масс-спектр (ESI+) m/z: 413, 415 [М+1]+
Масс-спектр (ESI-) m/z: 457, 459 [М+45]+ (HCOOH аддукт)
Пример синтеза 87
Гидрохлорид (3R*,4S*)-7-хлор-4-{[2-(4-фторфенил)этил]амино}-2,2,9-триметил-6λ5-окси-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола

Данное соединение синтезировали с использованием соединения примера синтеза 23 аналогично способу примера синтеза 86.
трет-Бутил[2-(4-фторфенил)этил][(3R*,4S*)-7-хлор-3-гидрокси-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-4-ил]карбамат

Масс-спектр (ESI+) m/z: 515, 517 [М+1]+
Масс-спектр (ESI-) m/z: 559, 561 [М+45]+ (HCOOH аддукт)
трет-Бутил[2-(4-фторфенил)этил][(3R*,4S*)-7-хлор-3-гидрокси-2,2,9-триметил-6λ5-окси-3,4-дигидро-2H-пирано[2,3-g]хинолин-4-ил]карбамат

(выход по 2 стадиям: 30%).
Масс-спектр (ESI+) m/z: 531, 533 [М+1]+
Масс-спектр (ESI-) m/z: 575, 577 [М+45]+ (HCOOH аддукт)
Гидрохлорид (3R*,4S*)-7-хлор-4-{[2-(4-фторфенил)этил]амино}-2,2,9-триметил-6λ5-окси-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола
(выход: 71%).
Бледно-желтые кристаллы
т.пл.: 193-198°C (разложение)
1H-ЯМР (ДМСО-d6) δ: 1,14 (c, 3H), 1,49 (c, 3H), 2,53 (c, 3H), 2,96-3,06 (м, 1H), 3,16-3,18 (м, 2H), 3,36 (ушир.с, 1H), 4,19-4,22 (м, 1H), 4,75-4,78 (м, 1H), 7,13 (т, J=9,08 Гц, 2H), 7,26-7,31 (м, 2H), 7,45 (c, 1H), 7,65 (c, 1H), 9,06 (c, 1H), 9,37 (ушир.с, 1H), 10,16 (ушир.с, 1H).
Масс-спектр (ESI+) m/z: 431, 433 [М+1]+
Масс-спектр (ESI-) m/z: 475, 477 [М+45]+
Пример синтеза 88
Гидрохлорид (3R*,4S*)-7-хлор-2,2,9-триметил-6λ5-окси-4-пентиламино-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ола

Данное соединение синтезировали с использованием соединения примера синтеза 52 аналогично способу примера синтеза 86.
трет-Бутил(пентил)[(3R*,4S*)-7-хлор-3-гидрокси-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-4-ил]карбамат
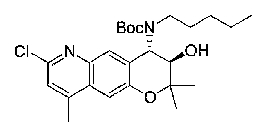
Масс-спектр (ESI+) m/z: 463, 465 [М+1]+
Масс-спектр (ESI-) m/z: 507, 509 [М+45]+ (HCOOH аддукт)
трет-Бутил(пентил)[(3R*,4S*)-7-хлор-3-гидрокси-2,2,9-триметил-6λ5-окси-3,4-дигидро-2H-пирано[2,3-g]хинолин-4-ил]карбамат

(выход по 2 стадиям: 23%).
Масс-спектр (ESI+) m/z: 479, 481[М+1]+
Масс-спектр (ESI-) m/z: 523, 525 [М+45]+ (HCOOH аддукт)
Гидрохлорид (3R*,4S*)-7-хлор-
2,2,9-триметил-6λ5-окси-4-пентиламино-3,4-дигидро-2H-пирано[2,3g]хинолин-3-ола
(выход: 60%).
Бледно-желтые кристаллы
т.пл.: 226-230°C (разложение)
1H-ЯМР (ДМСО-d6) δ: 0,86 (т, J=6,3 Гц, 3H), 1,16 (c, 3H), 1,27-1,29 (м, 4H), 1,50 (c, 3H), 1,60-1,72 (м, 2H), 2,54 (c, 3H), 2,86 (ушир.с, 1H), 3,07 (ушир.с, 1H), 4,07-4,10 (м, 1H), 4,71 (д, J=8,5 Гц, 1H), 6,51 (д, J=4,7 Гц, 1H), 7,47 (c, 1H), 7,67 (c, 1H), 9,04 (c, 1H), 9,19 (ушир.с, 1H), 9,74 (ушир.с, 1H).
Масс-спектр (ESI+) m/z: 379, 381 [М+1]+
Масс-спектр (ESI-) m/z: 423, 425 [М+45]+ (HCOOH аддукт)
Пример синтеза 89
(6S*,7R*)-8,8-Диметил(-6-[(2-фенилэтил)амино)]-1,6,7,8-тетрагидрохромен[7,6-e][1,3,4]оксатиазин-7-ол-2,2-диоксид

трет-Бутил(2-фенилэтил)[(3R*,4S*)-7-{[(хлорметил)сульфонил]амино}-3-гидрокси-6-метокси-2,2-диметил-3,4-дигидро-2H-1-бензопиран-4-ил]карбамат

К раствору трет-бутил(2-фенилэтил)[(3R*,4S*)-7-амино-3-гидрокси-6-метокси-2,2-диметил-3,4-дигидро-2H-1-бензопиран-4-ил]карбамата, описанного в примере синтеза 71 (1,04 г, 2,35 ммоль), в пиридине (1,90 мл, 23,5 ммоль) добавляли хлорметансульфонилхлорид (0,31 мл, 3,52 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 10 часов. По завершении реакции добавляли к смеси 1 моль/л водный раствор соляной кислоты (примерно 30 мл) для доведения рН примерно до 7 и затем полученный раствор экстрагировали этилацетатом, промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и концентрировали. Полученную смесь очищали колоночной хроматографией (гексан/этилацетат = 3/1) и получали целевой продукт (выход: 81%).
Бесцветный маслянистый продукт
ЖХ/масс-спектр (ESI+) m/z: 555 [М+1]+
ЖХ/масс-спектр (ESI-) m/z: 553 [М-1]+
1-Хлор-N-{(3R*,4S*)-3,6-дигидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-7-ил}метансульфонамид
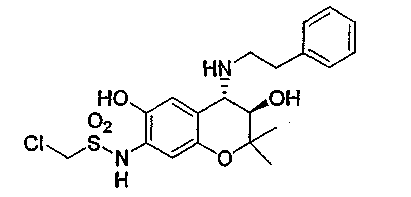
К раствору трет-бутил(2-фенилэтил)[(3R*,4S*)-7-{[(хлорметил)сульфонил]амино}-3-гидрокси-6-метокси-2,2-диметил-3,4-дигидро-2H-1-бензопиран-4-ил]карбамата (400 мг, 0,72 ммоль) в дихлорметане (4,0 мл) добавляли при охлаждении на ледяной бане 1 моль/л раствор трехбромистого бора в дихлорметане (3,61 мл, 3,61 ммоль) и полученную смесь перемешивали при 0°C в течение 1 часа. Добавляли воду и полученную смесь дополнительно перемешивали в течение 30 минут. Полученное твердое вещество отфильтровывали, промывали водой и затем хлороформом. Твердое вещество сушили при 60°C в течение 3 часов при пониженном давлении и получали целевой продукт с количественным выходом.
ЖХ/масс-спектр (ESI+) m/z: 441 [М+1]+
ЖХ/масс-спектр (ESI-) m/z: 439 [М-1]+
2,2-Диоксид (6S*,7R*)-8,8-диметил-6-[(2-фенилэтил)амино]-1,6,7,8-тетрагидрохромен[7,6-e][1,3,4]оксатиазин-7-ола
К раствору 1-хлор-N-{(3R*,4S*)-3,6-дигидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-1-бензопиран-7-ил}метансульфонамида (220 мг, 0,50 ммоль) в метаноле (2,2 мл) добавляли 1 моль/л водный раствор гидроксида натрия (1,00 мл, 1,00 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 3 часов. Затем температуру повышали до 50°C и смесь дополнительно перемешивали в течение 2 часов. По завершении реакции раствор охлаждали при хранении, нейтрализовали насыщенным водным раствором хлорида аммония, экстрагировали 4 раза хлороформом и сушили над безводным сульфатом натрия. Растворитель отгоняли и получали целевой продукт (выход: 37%).
Желтое твердое вещество
1H-ЯМР (CDCl3) δ: 1,13 (c, 3H), 1,44 (c, 3H), 2,54 (ушир.с, 3H), 2,79-3,02 (м, 4H), 3,49 (д, J=10,0 Гц, 1H), 3,59 (д, J=10,0 Гц, 1H), 4,86 (c, 2H), 6,23 (c, 1H), 6,78 (c, 1H), 7,21-7,35 (м, 5H).
ЖХ/масс-спектр (ESI+) m/z: 405 [М+1]+
ЖХ/масс-спектр (ESI-) m/z: 403 [М-1]+
Пример синтеза 90
(±)-транс-6-Бензил-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-2,3,4,6-тетрагидропирано[2,3-f]индол-7-он

N-Бензил-5-метоксиизатин
К раствору 5-метоксиизотина (15,0 г, 84,7 ммоль) в ДМФ (100 мл) добавляли при 0°C гидрид натрия (5,1 г, 127 ммоль) и бромистый бензил (12,1 мл, 101,6 ммоль) и полученную смесь перемешивали в течение 1 часа. Добавляли воду и полученный раствор экстрагировали этилацетатом. Полученную органическую фазу промывали насыщенным водным раствором хлорида аммония и затем насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и концентрировали, получая целевой продукт (выход: 96%).
Коричневое твердое вещество
1H-ЯМР (CDCl3) δ: 3,77 (c, 3H), 4,91 (c, 2H), 6,67 (д, J=8,5 Гц, 1H), 7,0-7,1 (м, 1H), 7,15 (м, 1H), 7,25-7,45 (м, 5H)
N-Бензил-5-гидроксиизатин

К раствору N-бензил-5-метоксиизатина (3,0 г, 11,2 ммоль) в дихлорметане (60 мл) добавляли хлорид алюминия (3,7 г, 28,1 ммоль) и полученную смесь перемешивали при 100°C в течение 1 часа. Добавляли воду и полученный раствор экстрагировали этилацетатом. Полученную органическую фазу промывали насыщеным водным раствором гидрокарбоната натрия и затем насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и концентрировали, получая целевой продукт (выход: 78%).
Красное твердое вещество
Масс-спектр (ESI+) m/z: 254[М+1]+
Масс-спектр (ESI-) m/z: 252[М-1]+
6-Бензил-2,2-диметил-2H-пирано[2,3-f]индол-7,8-дион

В токе азота раствор N-бензил-5-гидроксиизатина (4,74 г, 18,7 ммоль), иодида калия (5,09 г, 31,8 ммоль), карбоната калия (5,17 г, 37,4 ммоль), иодида меди (71 мг, 0,37 ммоль) и 3-хлор-3-метил-1-бутина (4,83 мл, 43,0 ммоль) в ДМФ (47 мл) перемешивали при 70°C в течение 2 часов. По завершении реакции добавляли к смеси насыщенный водный раствор хлорида аммония, полученный раствор экстрагировали этилацетатом. Полученную органическую фазу промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия, концентрировали и очищали колоночной хроматографией на короткой колонке с силикагелем (хлороформ).
Добавляли 1,2-дихлорбензол (9 мл) и полученную смесь перемешивали при 200°C в течение 30 минут. После концентрирования реакционного раствора остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 5/1), получая целевой продукт (выход: 8%).
Красный маслянистый продукт
Масс-спектр (ESI+) m/z: 320 [М+1]+
6-Бензил-2,2-диметил-2H-пирано[2,3-f]индол-7-он
К раствору 6-бензил-2,2-диметил-2H-пирано[2,3-f]индол-7,8-диона (500 мг, 1,57 ммоль) в ДМФ (5 мл) добавляли моногидрат гидразина (2,5 мл) и полученную смесь перемешивали при 100°C в течение 1,5 часов. Добавляли к смеси воду и полученный раствор экстрагировали этилацетатом. Полученную органическую фазу промывали насыщенным водным раствором хлорида аммония и затем насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия, концентрировали и очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 3/1), получая целевой продукт (выход: 65%).
Желтый аморфный продукт
Масс-спектр (ESI+) m/z: 306 [М+1]+
(±)-транс-6-Бензил-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-2,3,4,6-тетрагидропирано[2,3-f]индол-7-он
К 6-бензил-2,2-диметил-2H-пирано[2,3-f]индол-7-ону (210 мг, 0,69 ммоль) в растворе смеси хлороформ-вода добавляли гидрокарбонат натрия (115 мг, 1,38 ммоль) и м-хлорпербензойную кислоту (237 мг, 1,38 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 3,5 часов. Добавляли к реакционному раствору водный раствор гидрокарбоната натрия и насыщенный водный раствор тиосульфата натрия, полученный раствор экстрагировали хлороформом, промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия и концентрировали. К полученному остатку добавляли 2-фенилэтиламин (173 мкл, 1,38 ммоль), перхлорат лития (73 мг, 0,69 ммоль) и диоксан (1 мл) и полученную смесь перемешивали при 70°C в течение 2 часов. К реакционному раствору добавляли воду и полученный раствор экстрагировали этилацетатом. Полученную органическую фазу промывали насыщеным водным раствором гидрокарбоната натрия и затем насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия, концентрировали, очищали колоночной хроматографией на силикагеле (гексан/этилацетат = 1/1) и перекристаллизовывали из этилацетата, получая целевой продукт (выход по 2 стадиям: 16%).
Бледно-розовые кристаллы
Т.пл.:195°C (разложение)
1H-ЯМР (CDCl3) δ: 1,16 (c, 3H), 1,45 (c, 3H), 2,8-3,2 (м, 4H), 3,51 (c, 2H), 3,59 (д, J=4,4 Гц, 1H), 3,73 (м, 1H), 4,75 (д, J=15,7 Гц, 1H), 4,84 (д, J=15,7 Гц, 1H), 6,51 (c, 1H), 6,73 (c, 1H), 7,2-7,4 (м, 10H).
Масс-спектр (ESI+) m/z: 443 [М+1]+
Масс-спектр (ESI-) m/z: 441[М-1]+
Пример синтеза 91
(±)-транс-4-{[2-(Циклогекса-1,3-диен-2-ил)этил]амино}-3-гидрокси-2,2-диметил-2,3,4,6-тетрагидропирано[2,3-f]индол-7-он

В токе азота к жидкому аммиаку (5 мл) добавляли натрий (90 мг, 3,91 ммоль) при -78°C и перемешивали полученную смесь. Добавляли по каплям при -45°C раствор (±)-транс-6-бензил-3-гидрокси-2,2-диметил-4-[(2-фенилэтил)амино]-2,3,4,6-тетрагидропирано[2,3-f]индол-7-она (173 мг, 0,39 ммоль) в ТГФ (2 мл) и полученную смесь перемешивали в течение 15 минут. По завершении реакции добавляли к смеси насыщенный водный раствор хлорида аммония, полученный раствор экстрагировали этилацетатом. Полученную органическую фазу промывали водой и затем насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, концентрировали и очищали колоночной хроматографией на силикагеле (этилацетат), получая целевой продукт (выход: 19%).
Белое твердое вещество
1H-ЯМР (CDCl3) δ: 1,21 (c, 3H), 1,49 (c, 3H), 2,27 (т, J=6,9 Гц, 2H), 2,6-2,8 (м, 4H), 2,82-3,02 (м, 2H), 3,44 (м, 2H), 3,63 (д, J=4,4 Гц, 1H), 3,81 (д, J=4,4 Гц, 1H), 5,54 (c, 1H), 5,74 (c, 2H), 6,72 (c, 1H), 6,86 (c, 1H), 8,78 (c, 1H).
[Примеры композиций]
Пример композиции 1
Таблетка:
Вышеуказанные ингредиенты смешивают обычным способом и затем получают 10000 покрытых сахаром таблеток, каждая из которых содержит 1 мг активного ингредиента на таблетку.
Пример композиции 2
Капсула:
Вышеуказанные ингредиенты смешивают обычным способом и затем наполняют смесью желатиновые капсулы, получая 10000 капсул, каждая из которых содержит 1 мг активного ингредиента на капсулу.
Пример композиции 3
Мягкая капсула:
Вышеуказанные ингредиенты смешивают обычным способом и затем наполняют смесью мягкие желатиновые капсулы № 3, получая 10000 капсул, каждая из которых содержит 1 мг активного ингредиента на капсулу.
Пример композиции 4
Мазь:
Вышеуказанные ингредиенты смешивают обычным способом, получая 1%-ную мазь.
Пример композиции 5
Суппозиторий:
(* торговое название для соединения триглицеридного типа).
Вышеуказанные ингредиенты смешивали в расплавленном состоянии обычным способом, выливали в контейнеры для суппозиториев, охлаждали до отверждения и получали 1000 суппозиториев (1 г), каждый из которых содержал 1 мг активного ингредиента на суппозиторий.
Пример композиции 6
Инъекционная композиция:
[Пример фармакологического теста]
Влияние на эффективный рефракторный период
Метод
Биглей анестезировали пентобарбиталом натрия, проводили торакотомию вдоль средней линии под легкими и делали надрез на перикардии для обнажения сердца. Электрокардиограмму (ЭКГ) регистрировали с использованием биполярных электродов, присоединенных к поверхности свободной стенки правого предсердия, правого предсердия и свободной стенки правого желудочка. Ванусные нервы стимулировали с использованием устройства для электростимуляции с нихромовой проволокой, вставленной в вагусные нервы с двух сторон шеи. Условия для электростимуляции вагусных нервов устанавливали таким образом, что RR интервалы на ЭКГ были увеличены примерно на 10 мсек по сравнению с интервалами до начала стимуляции.
Эффективные рефракторные периоды предсердия и желудочка определяли с использованием S1-S2 метода экстрастимуляции при длине основного цикла в 300 мсек во время двухсторонней стимуляции вагусного нерва с использованием программируемого электрического стимулятора. За рядом 10 основных стимулов (S1) следовал преждевременный экстрастимул (S2), в 2 раза превышающий диастолический порог. Интервал S1-S2 последовательно уменьшали на 2 мсек и определяли эффективный рефракторный период как момент, когда S2 не мог дать увеличенной ответной реакции.
Для оценки действия лекарственного средства определяли эффективные рефракторные периоды предсердия и желудочка перед введением лекарственного средства, затем внутривенно вводили соответствующее соединение в дозе 0,3 мг/кг или 0,6 мг/кг и определяли через 5 минут после введения эффективные рефракторные периоды предсердия и желудочка.
Результаты представлены в виде времени пролонгирования эффективных рефракторных периодов предсердия и желудочка, т.е. [эффективный рефракторный период после введения лекарственного средства]- [эффективный рефракторный период перед введением лекарственного средства] (мсек).
Результаты
Соединения по настоящему изобретению продемонстрировали пролонгирующее воздействие на эффективный рефракторный период селективно для предсердия, как показано в таблице ниже.
Эффект изобретения
Таким образом, соединения согласно настоящему изобретению, оказывающие пролонгирующее воздействие на эффективный рефракторный период селективно для предсердия, могут использоваться в качестве агентов против фибрилляции предсердия и суправентикулярных антиаритмических агентов и полезны в качестве лекарственных средств. Кроме того, поскольку соединения согласно настоящему изобретению оказывают незначительное влияние на желудочки, они могут внести свой вклад в безопасное лечение вышеуказанных аритмических состояний.


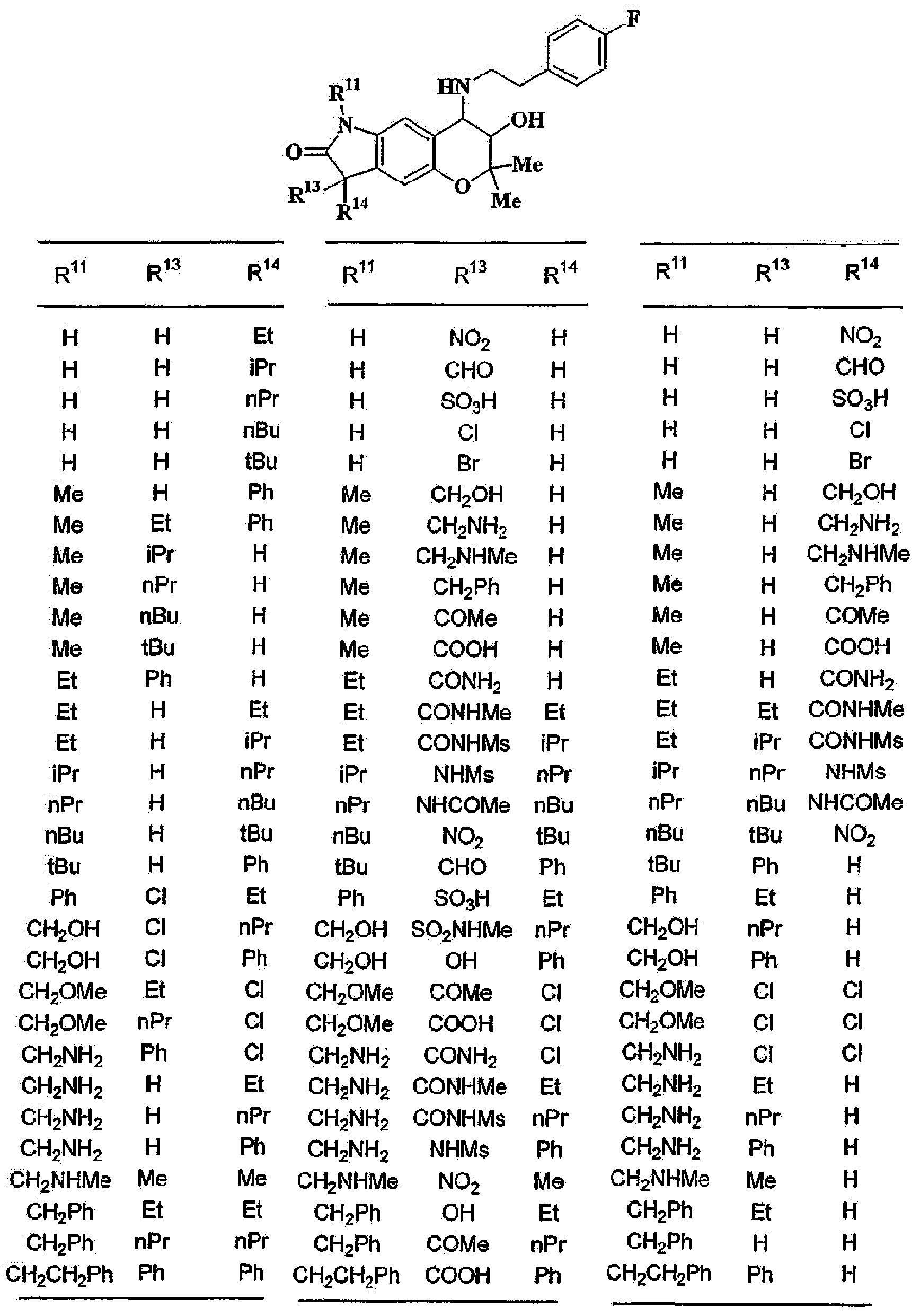



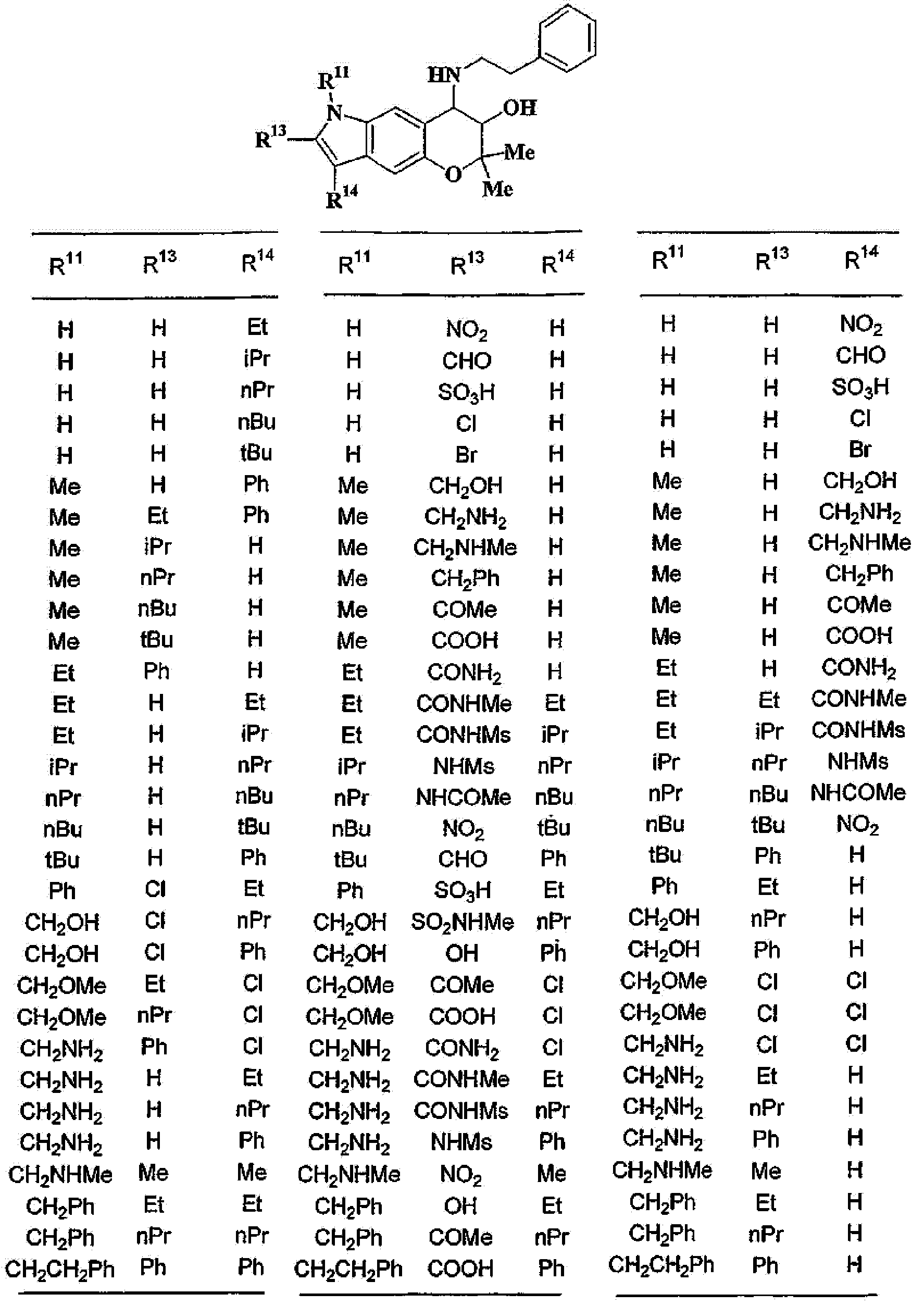



















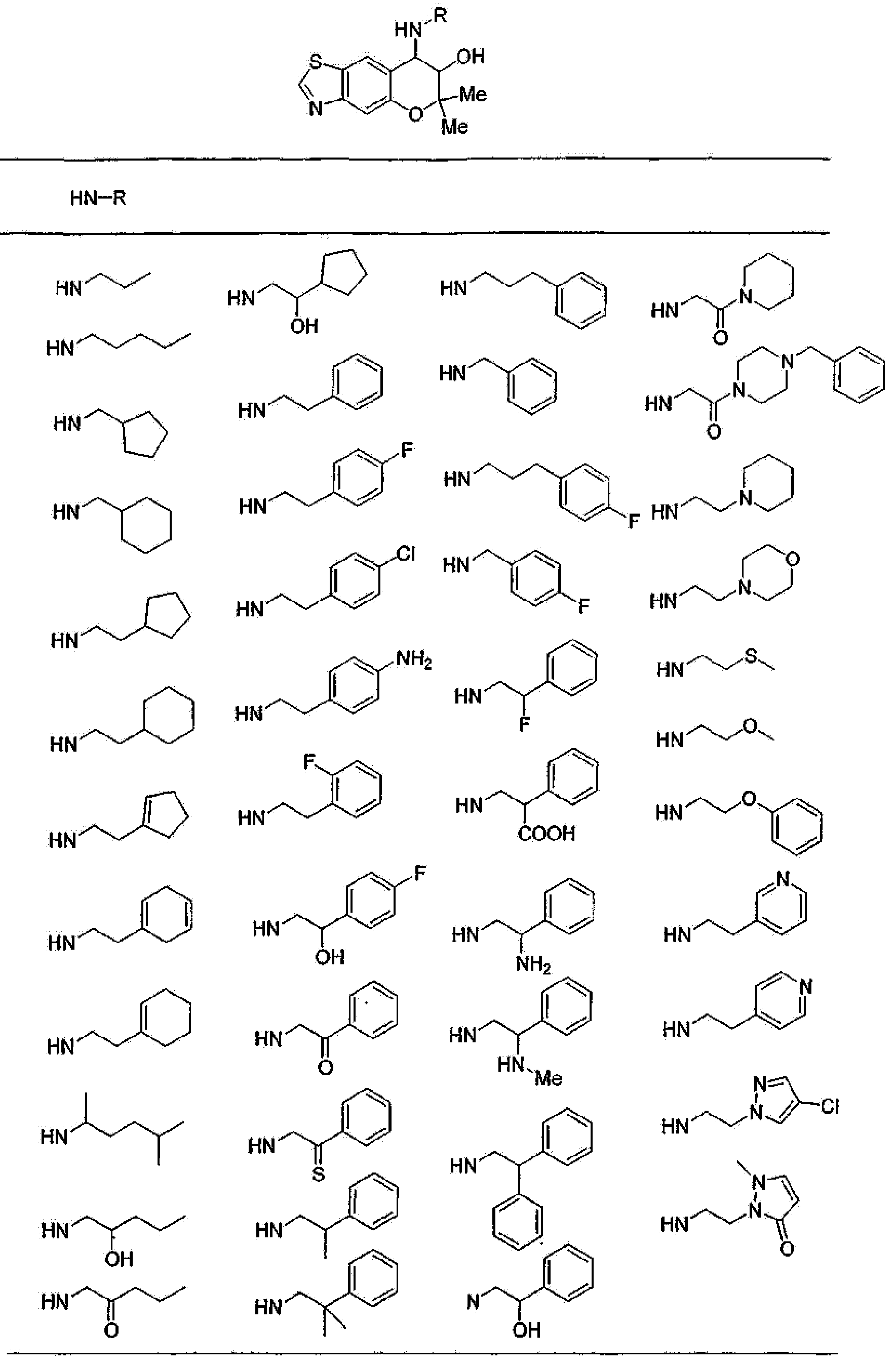
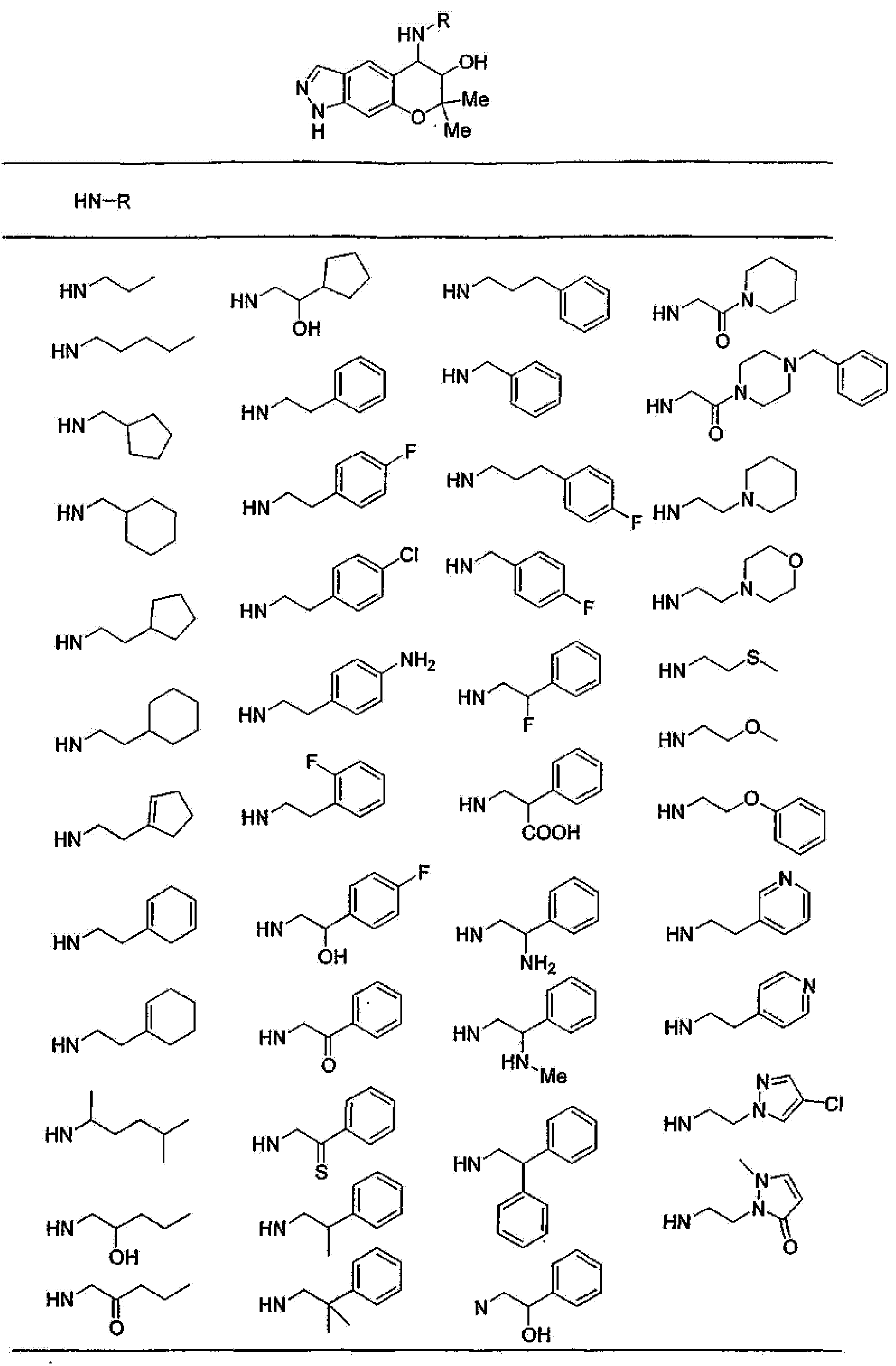



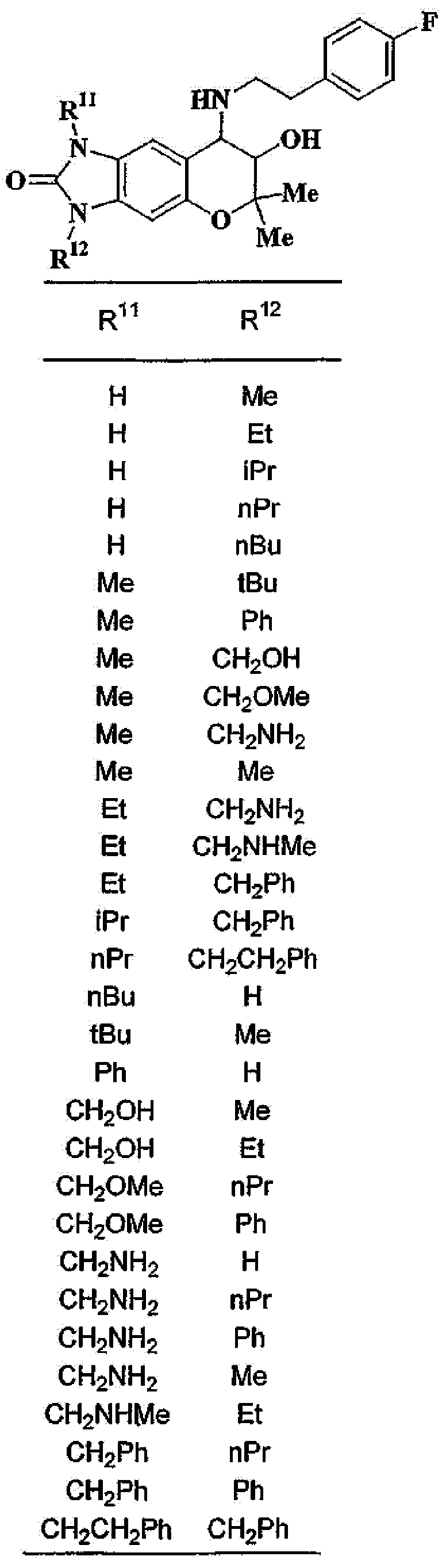
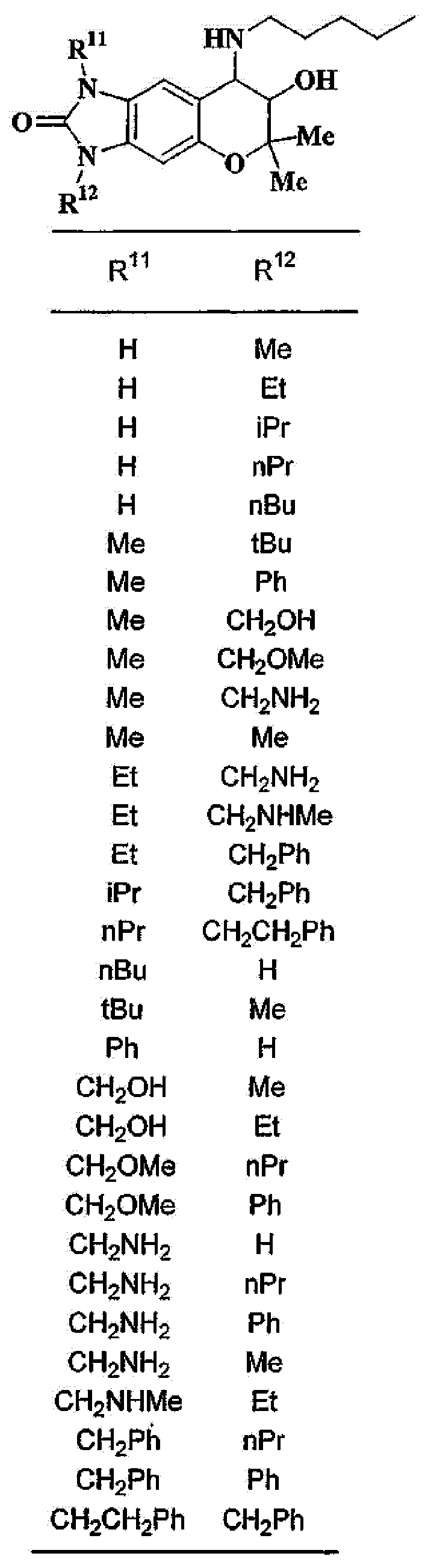

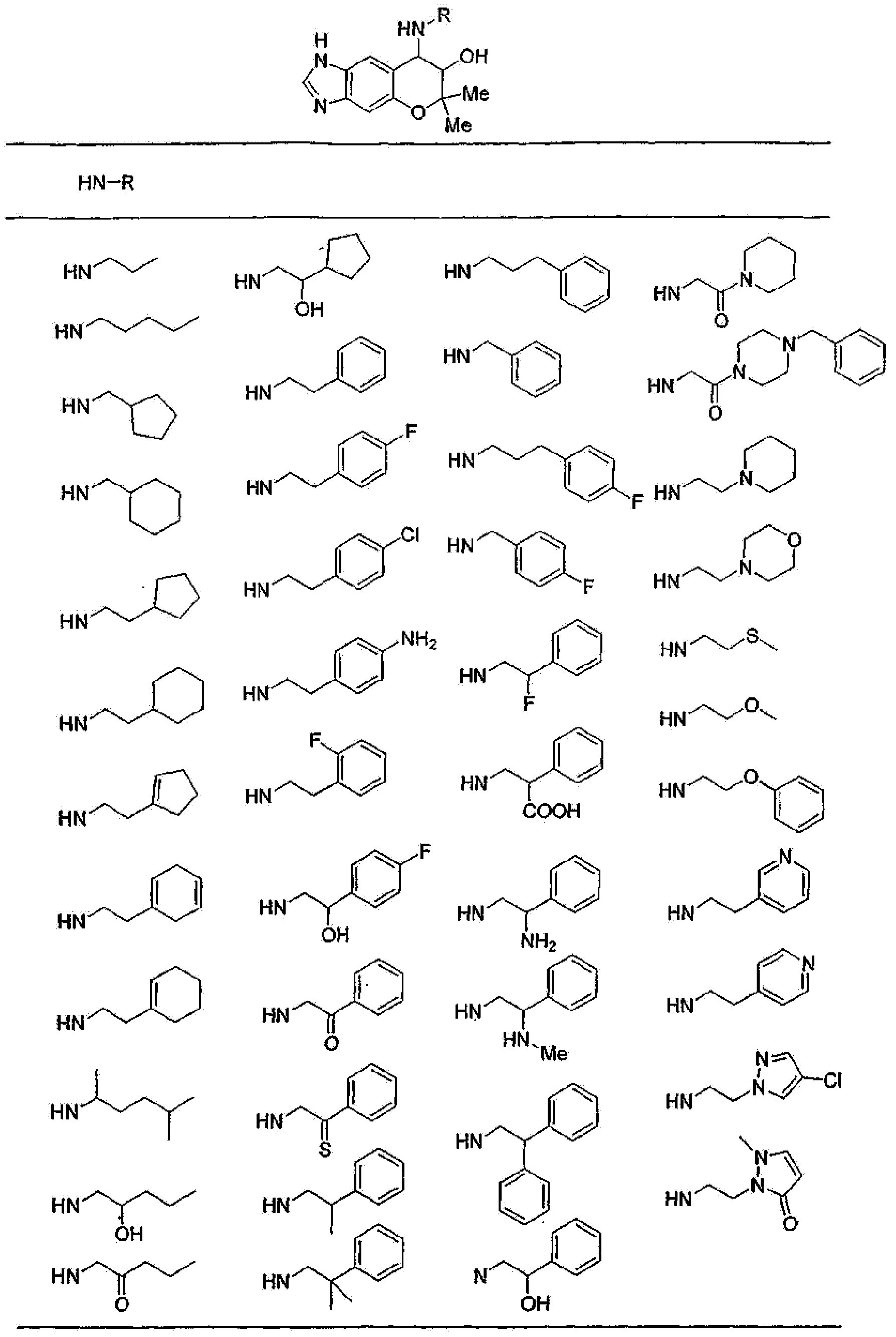















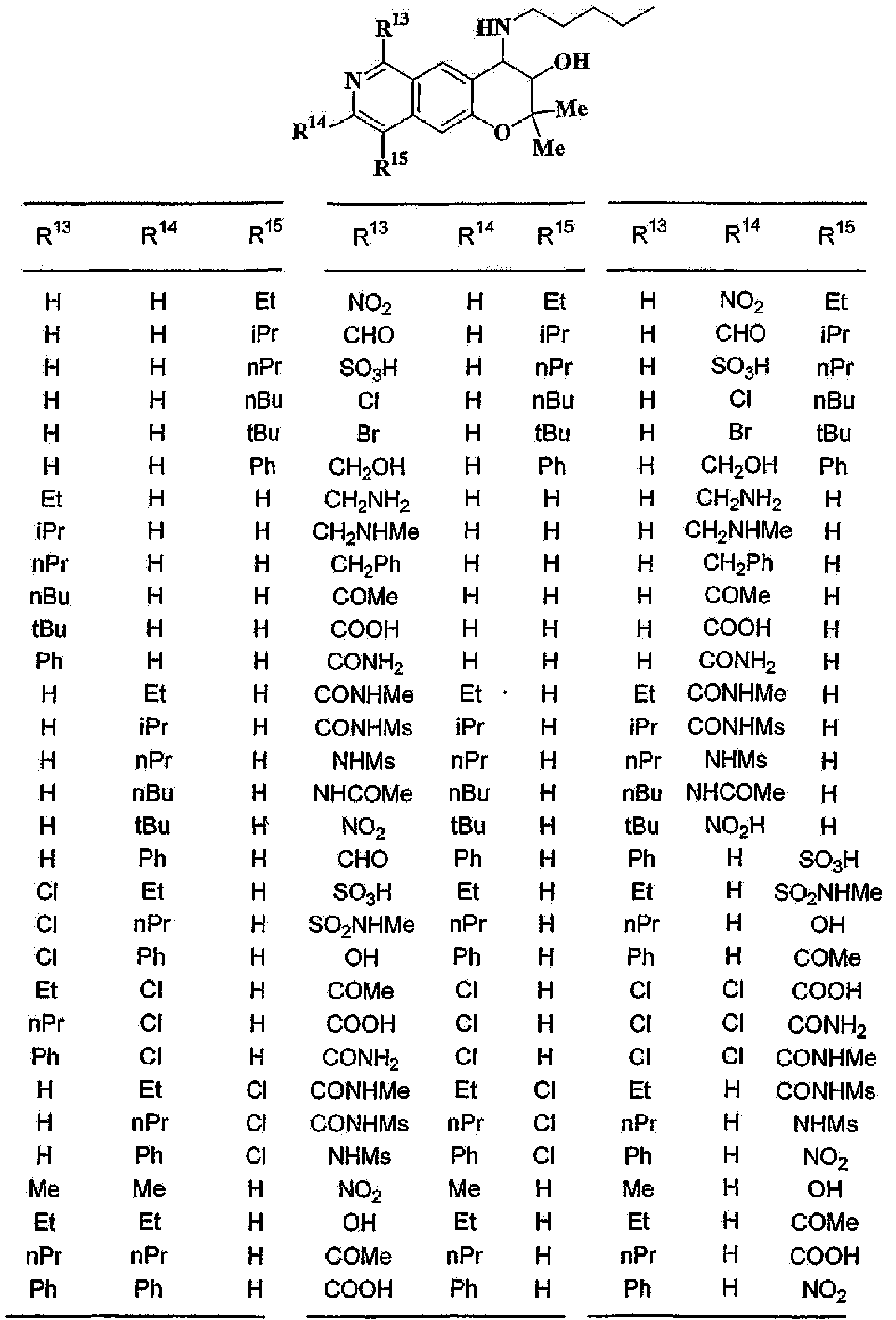




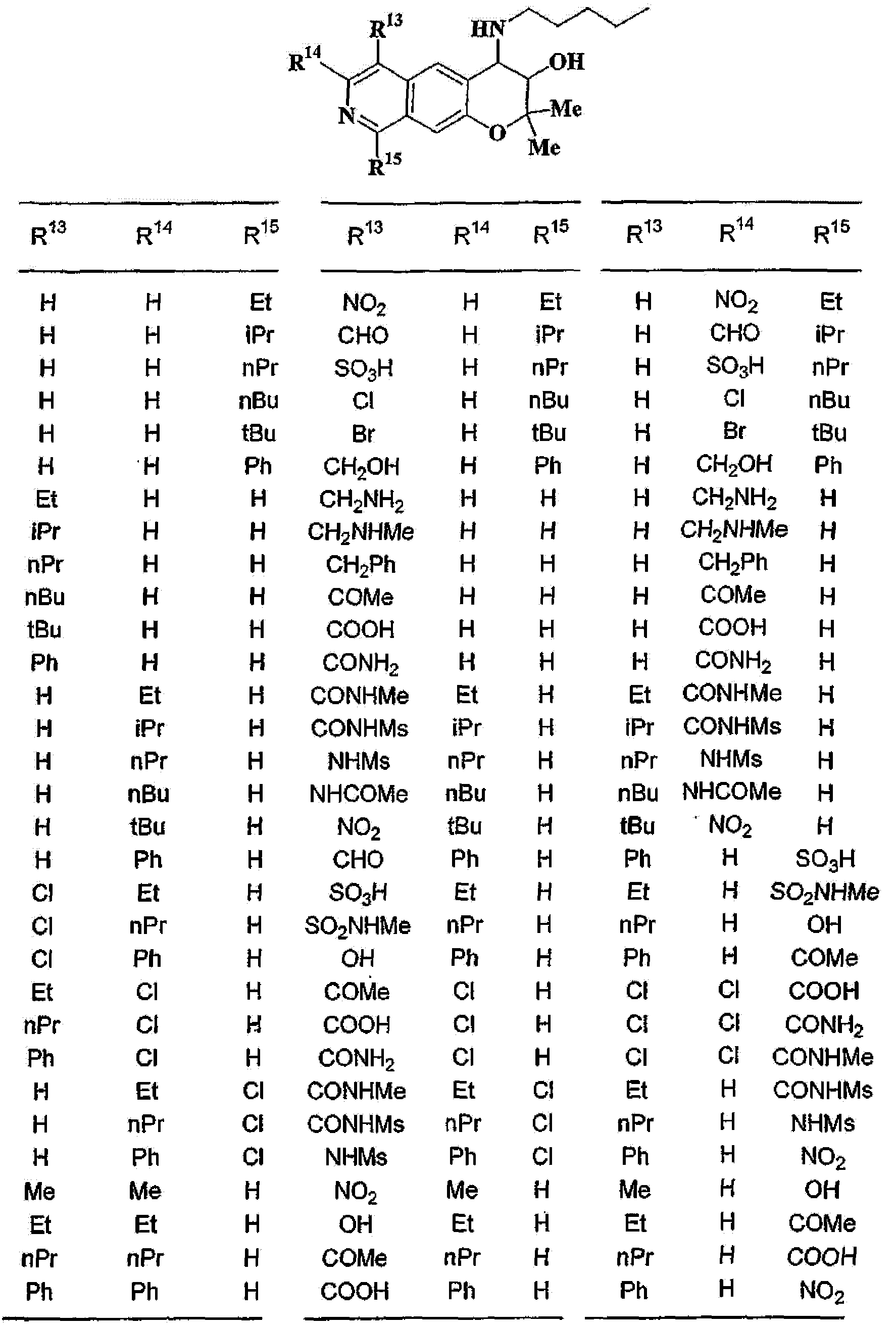
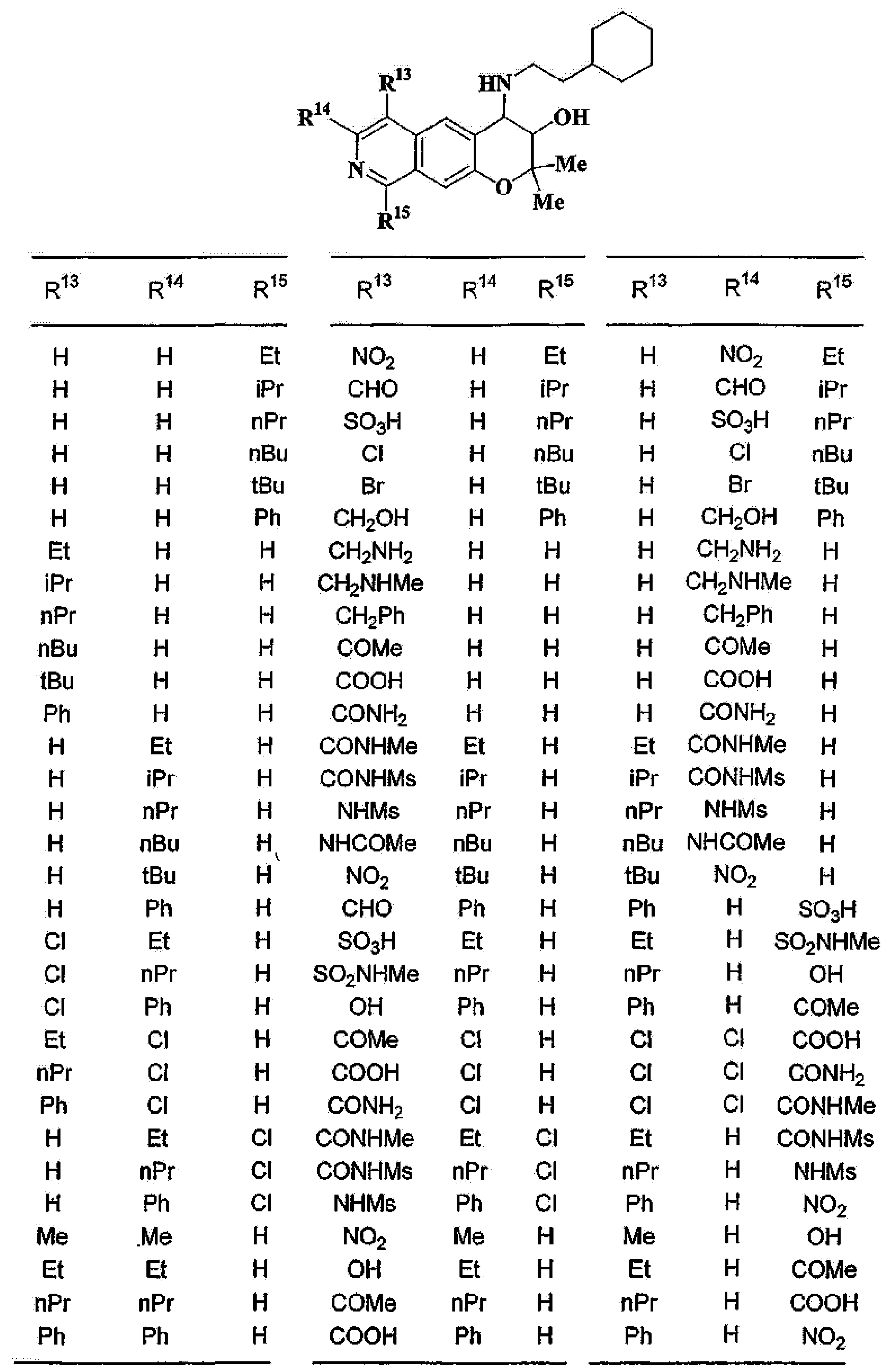

















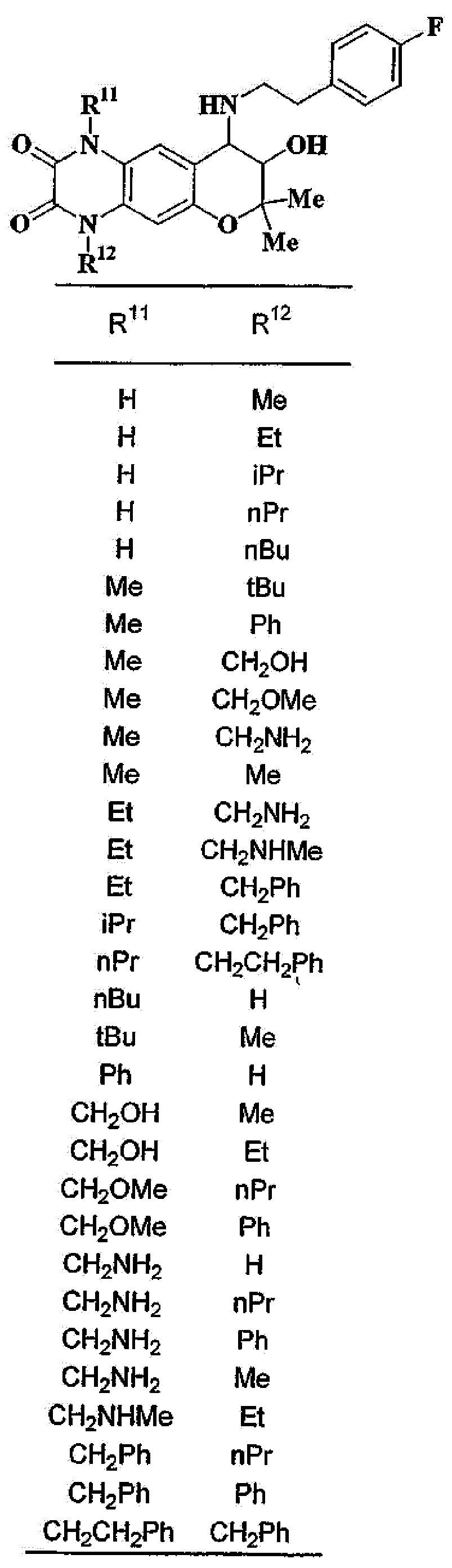

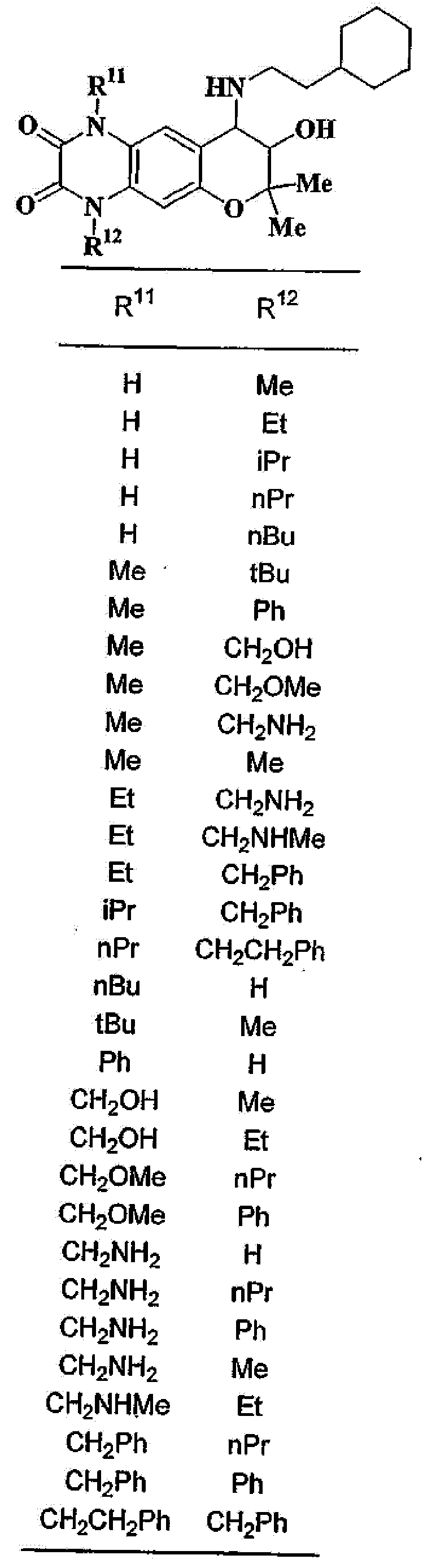















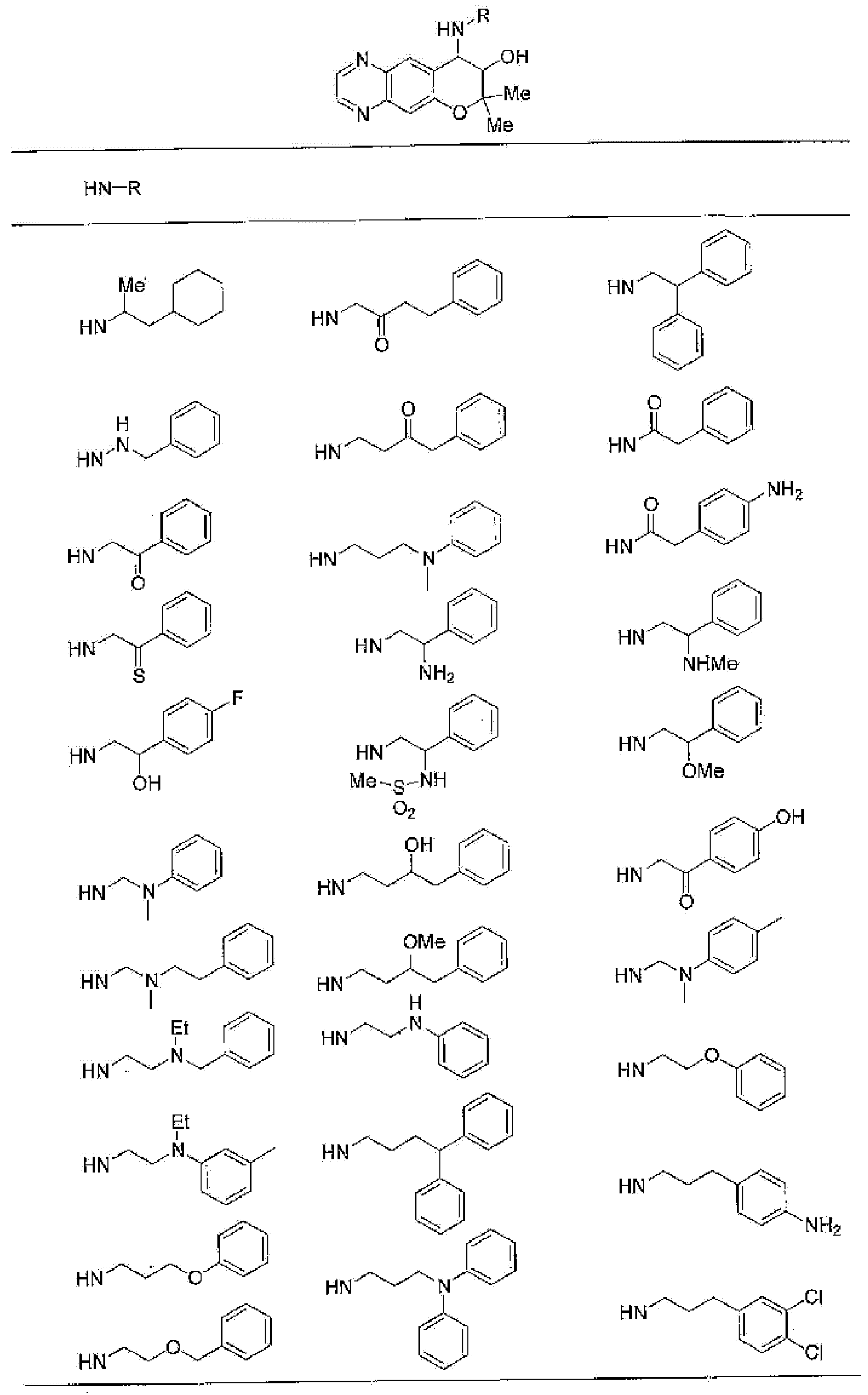
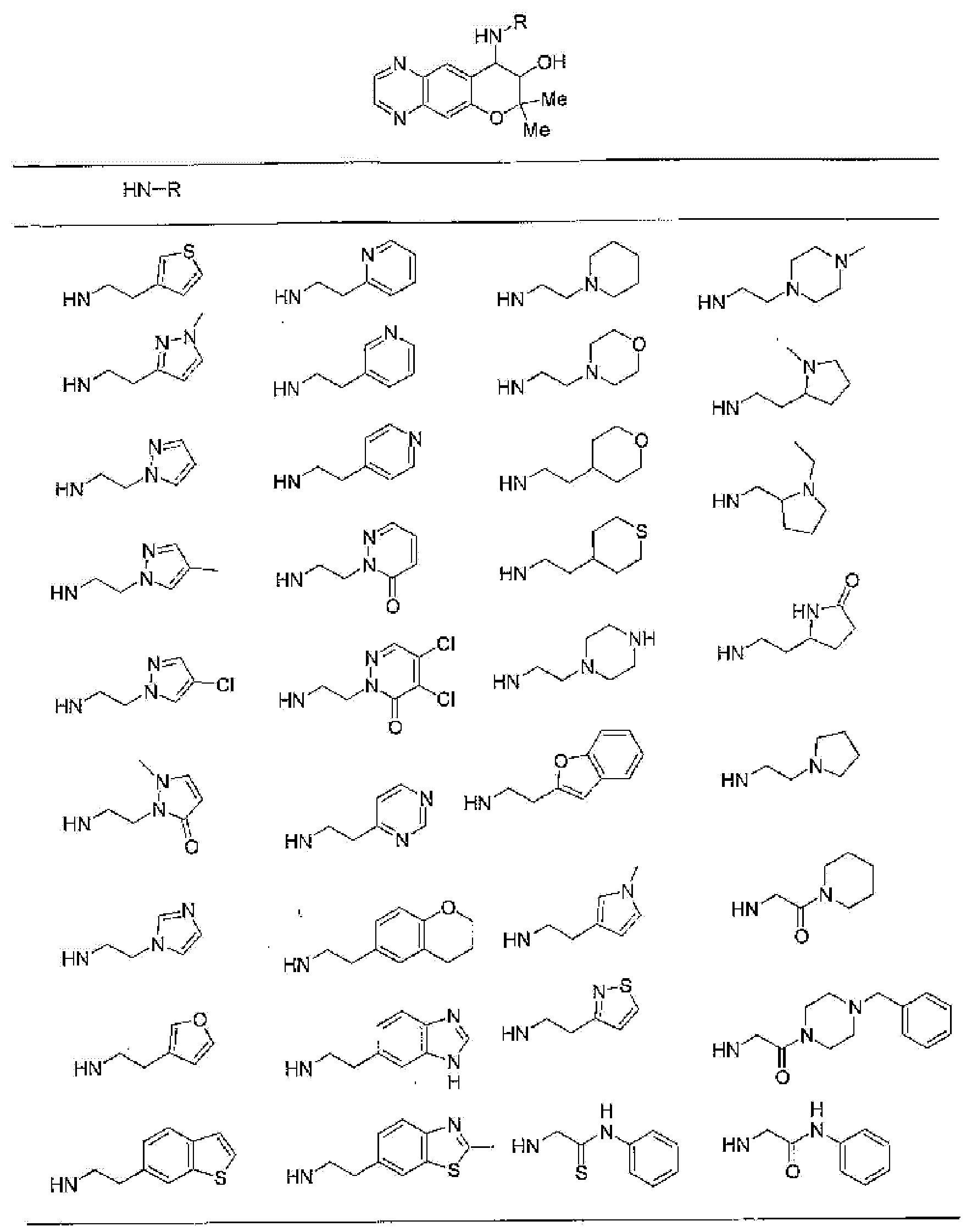

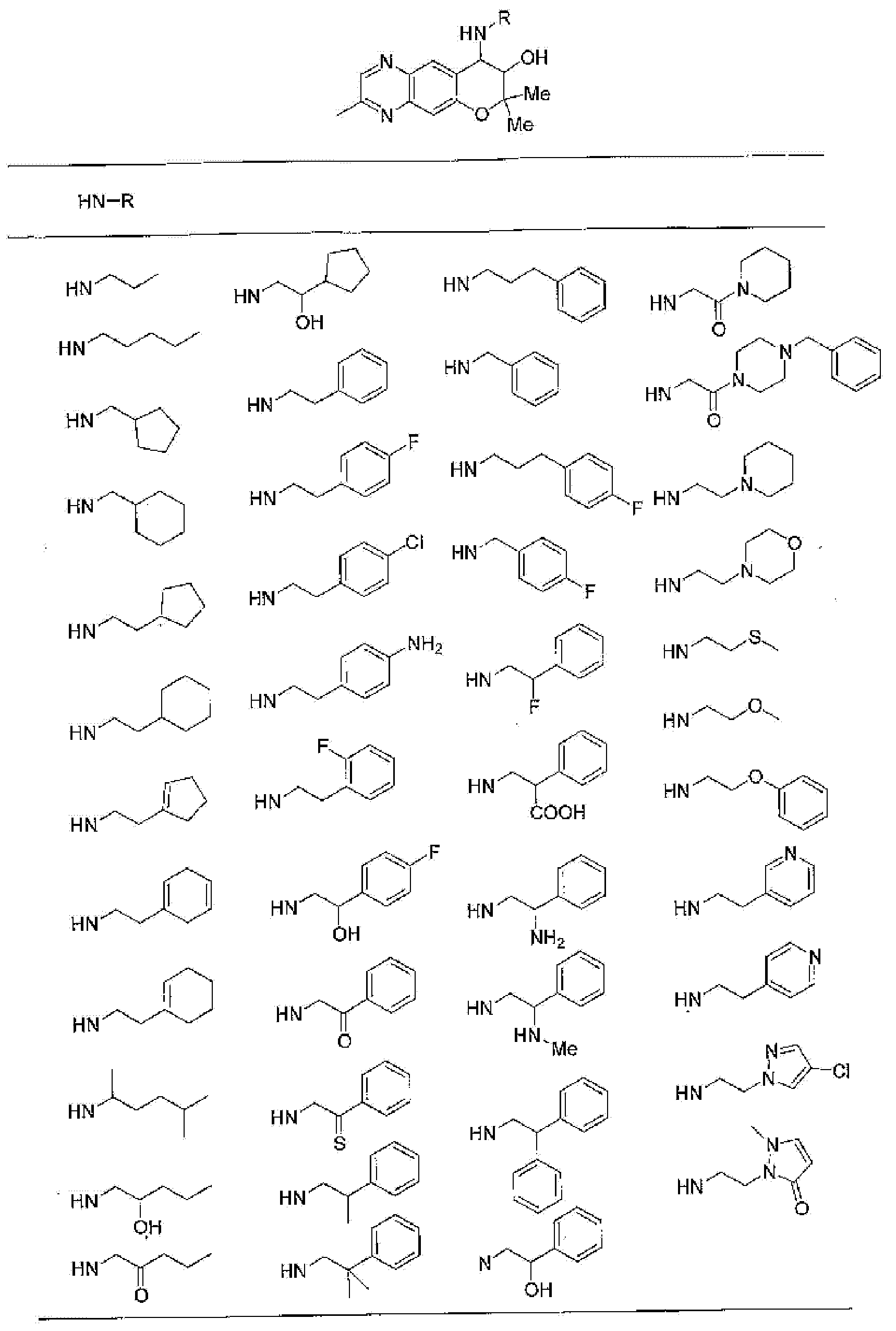









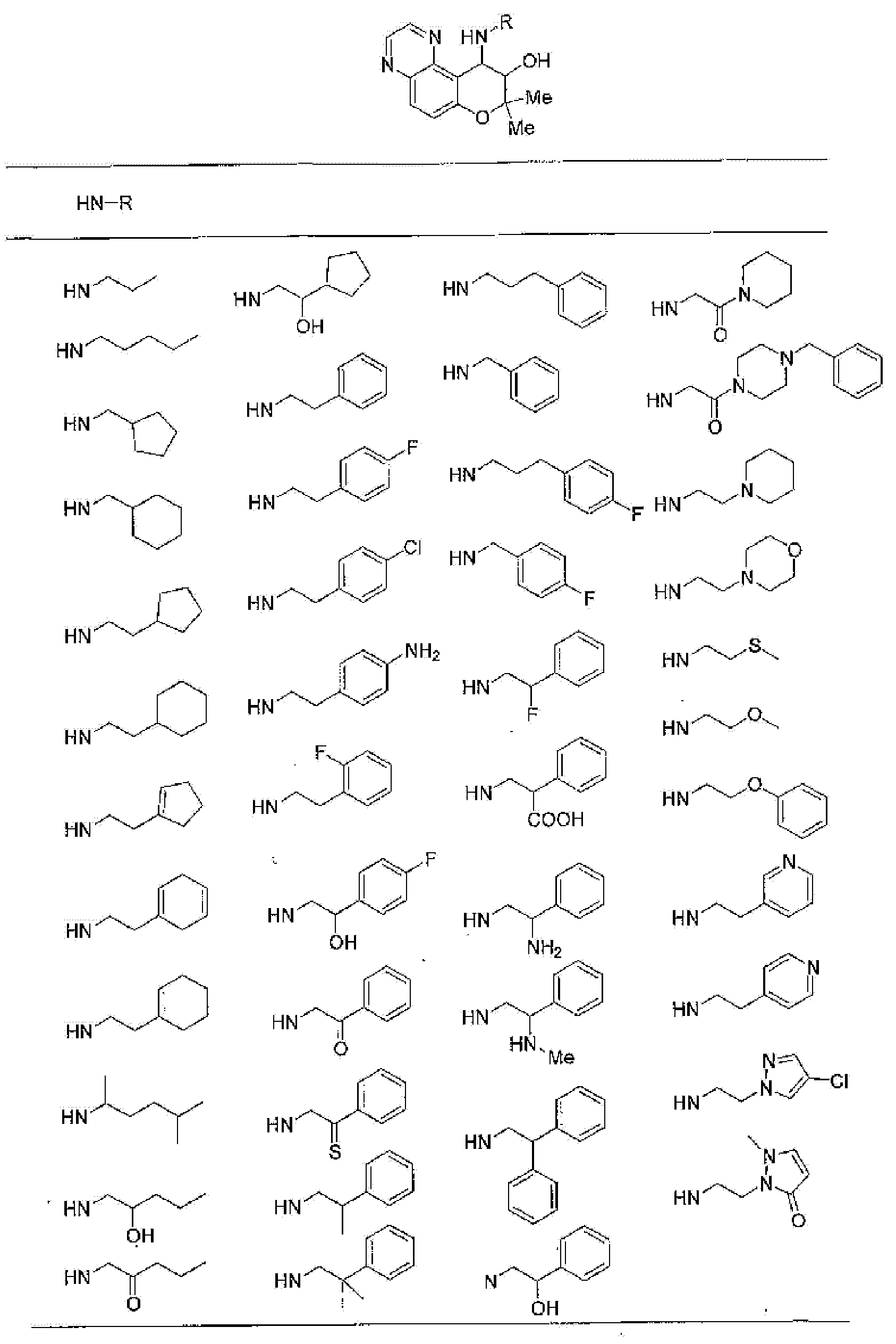






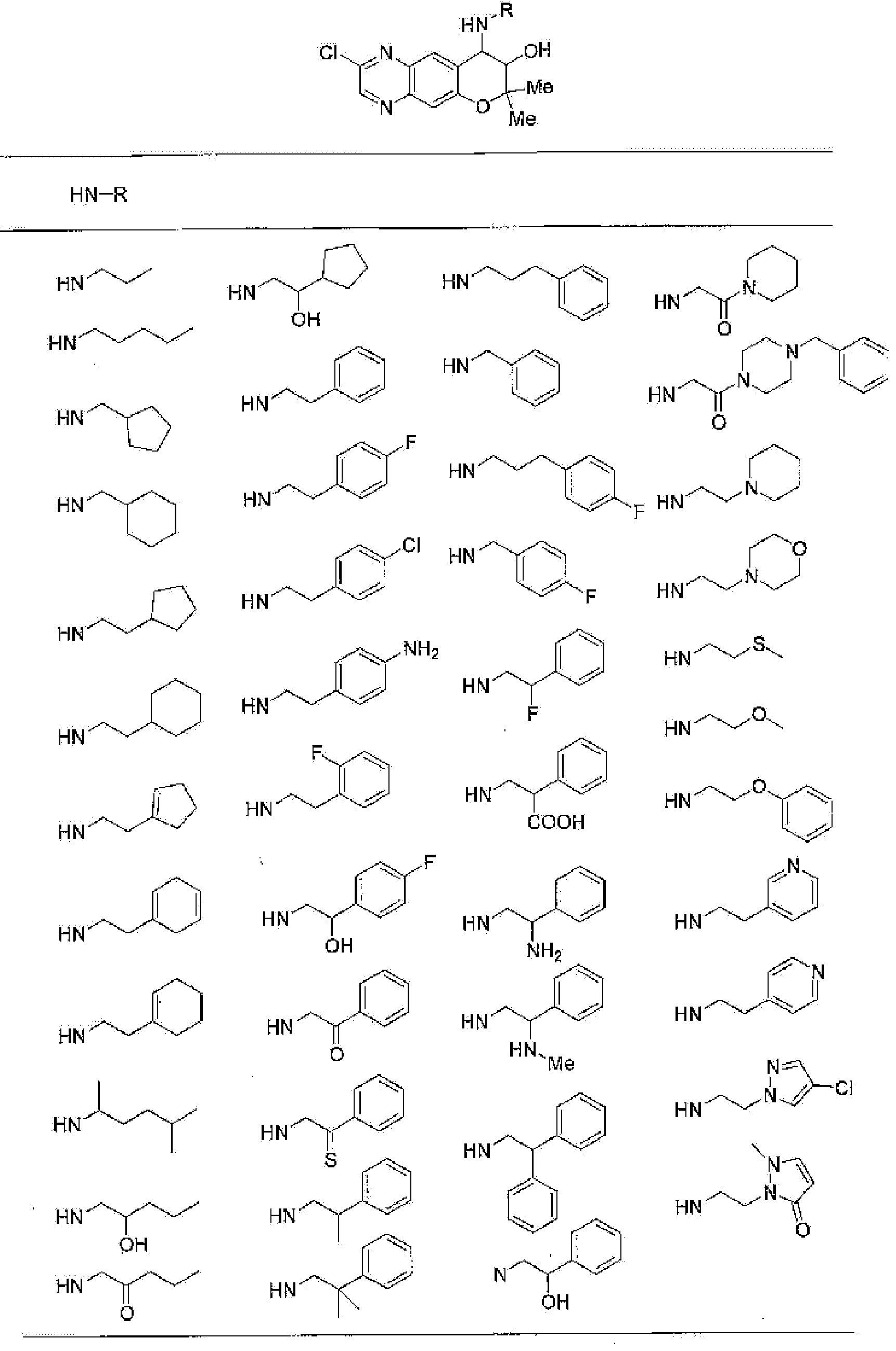



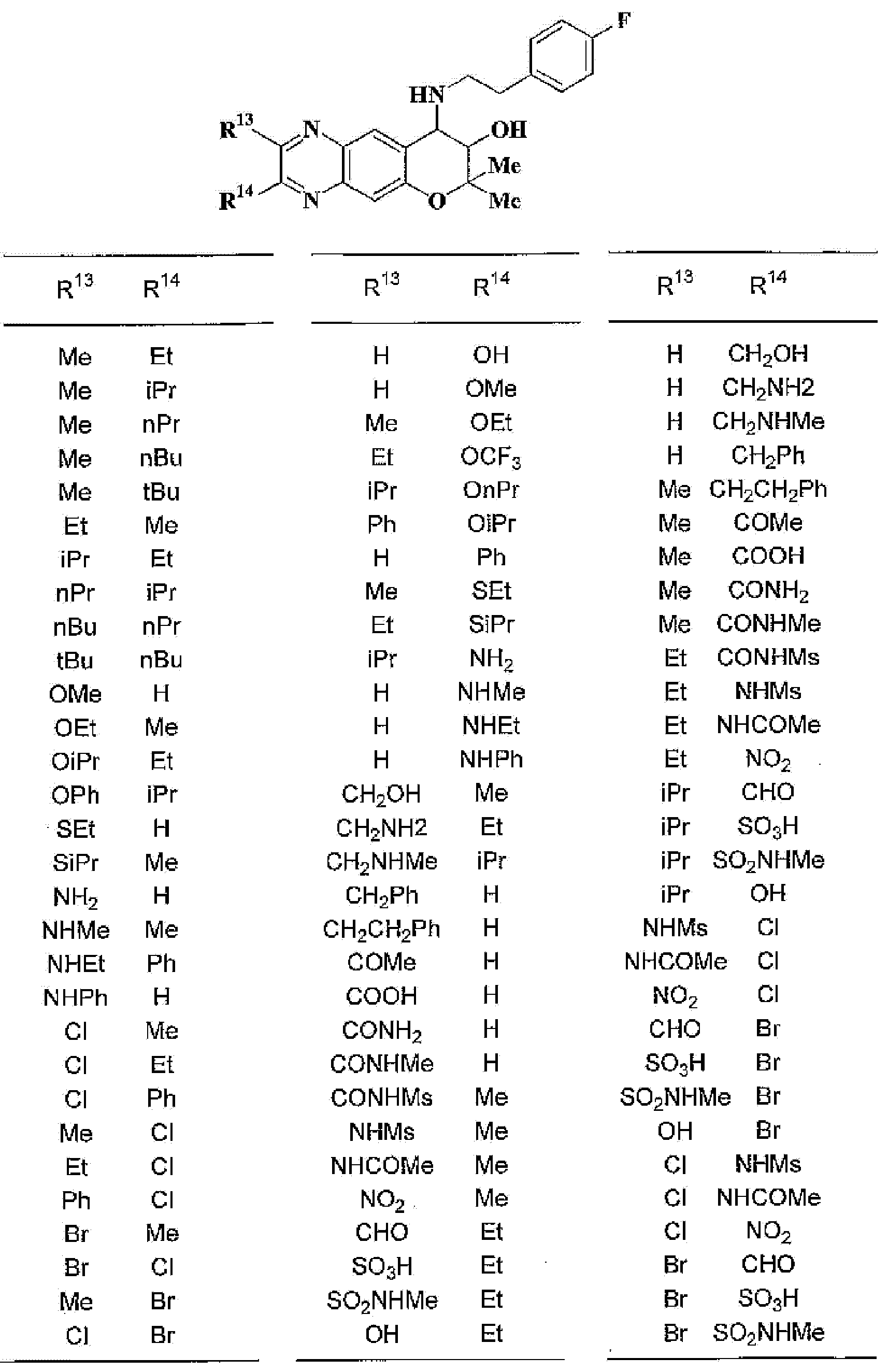

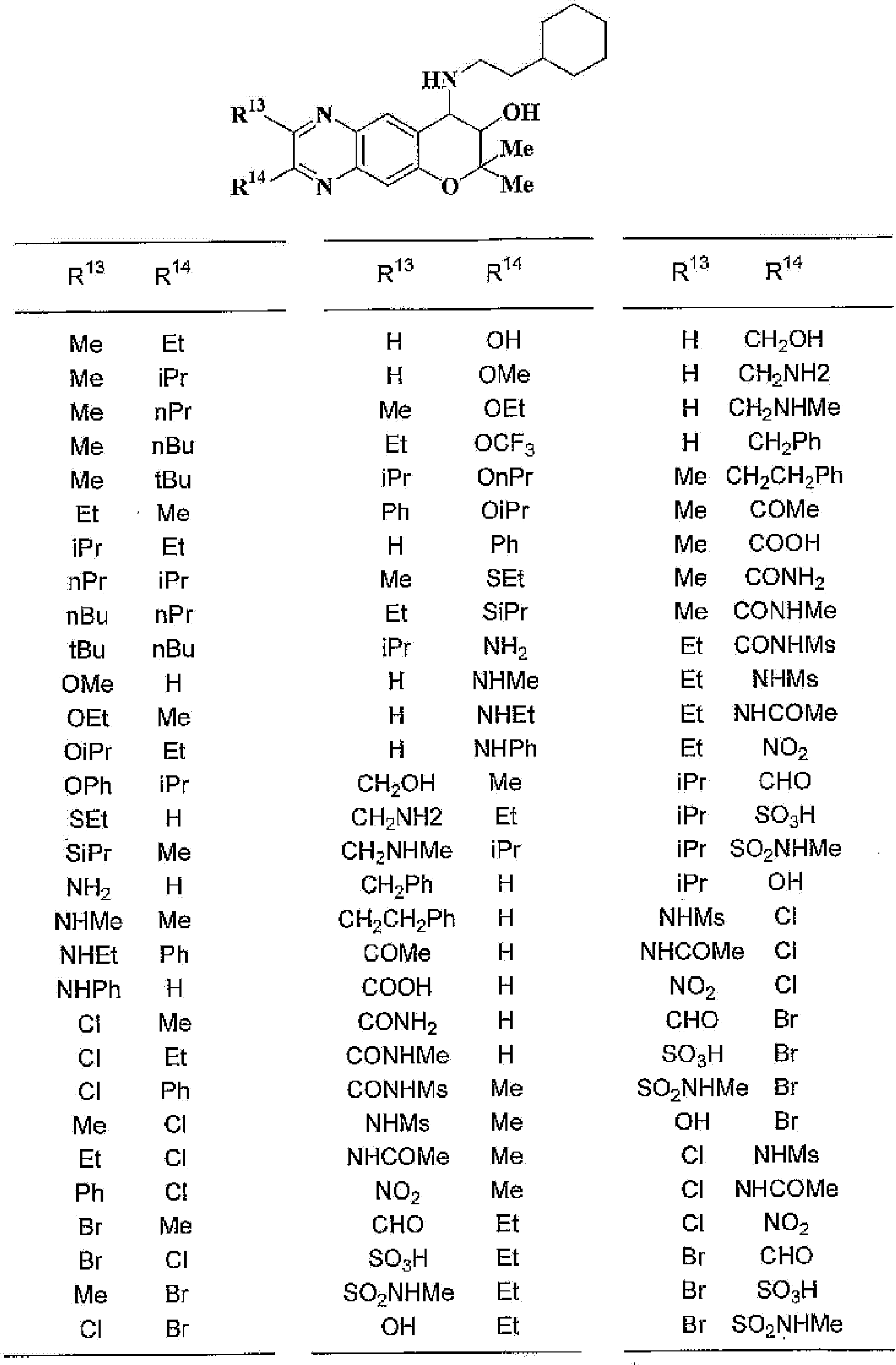










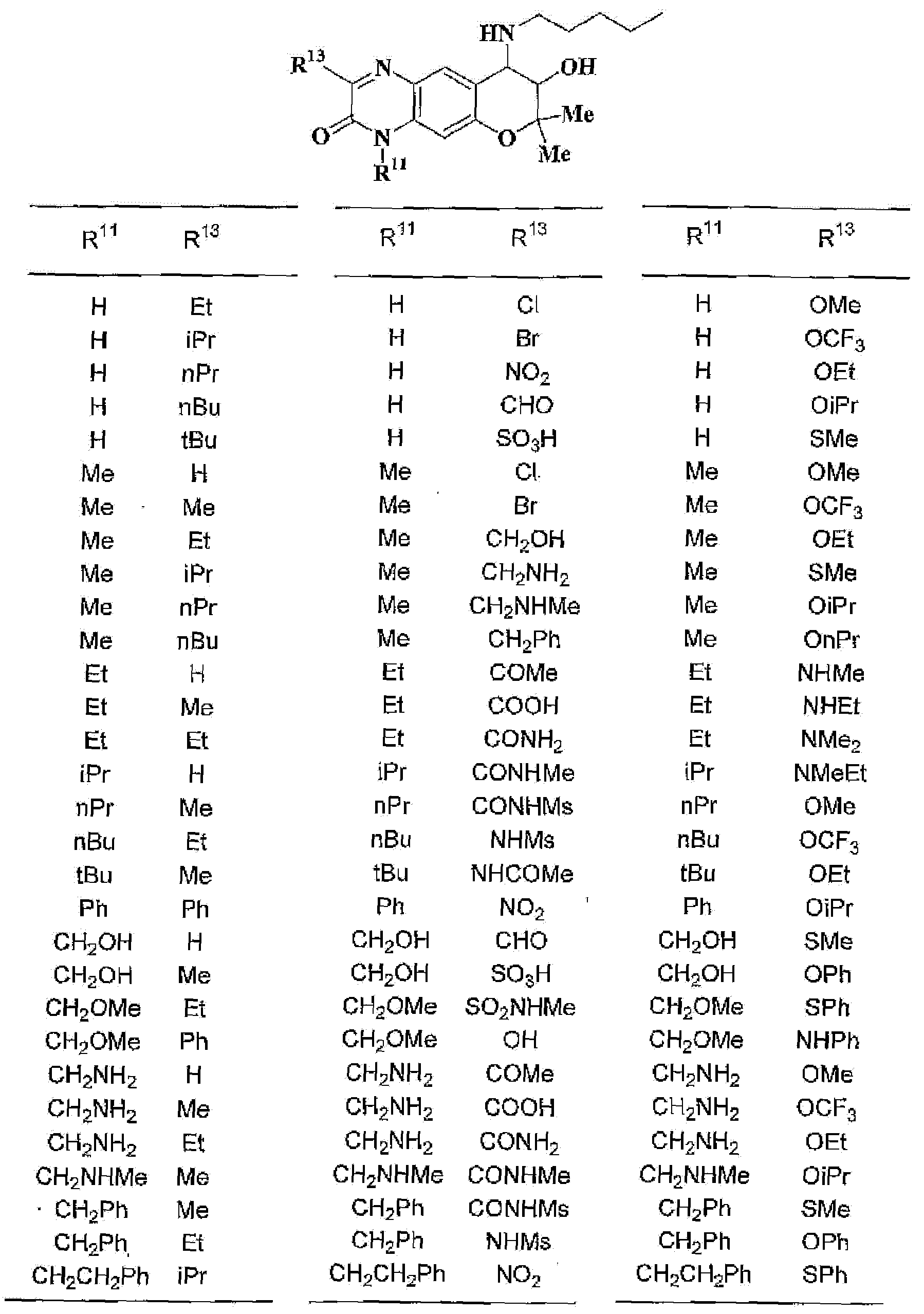
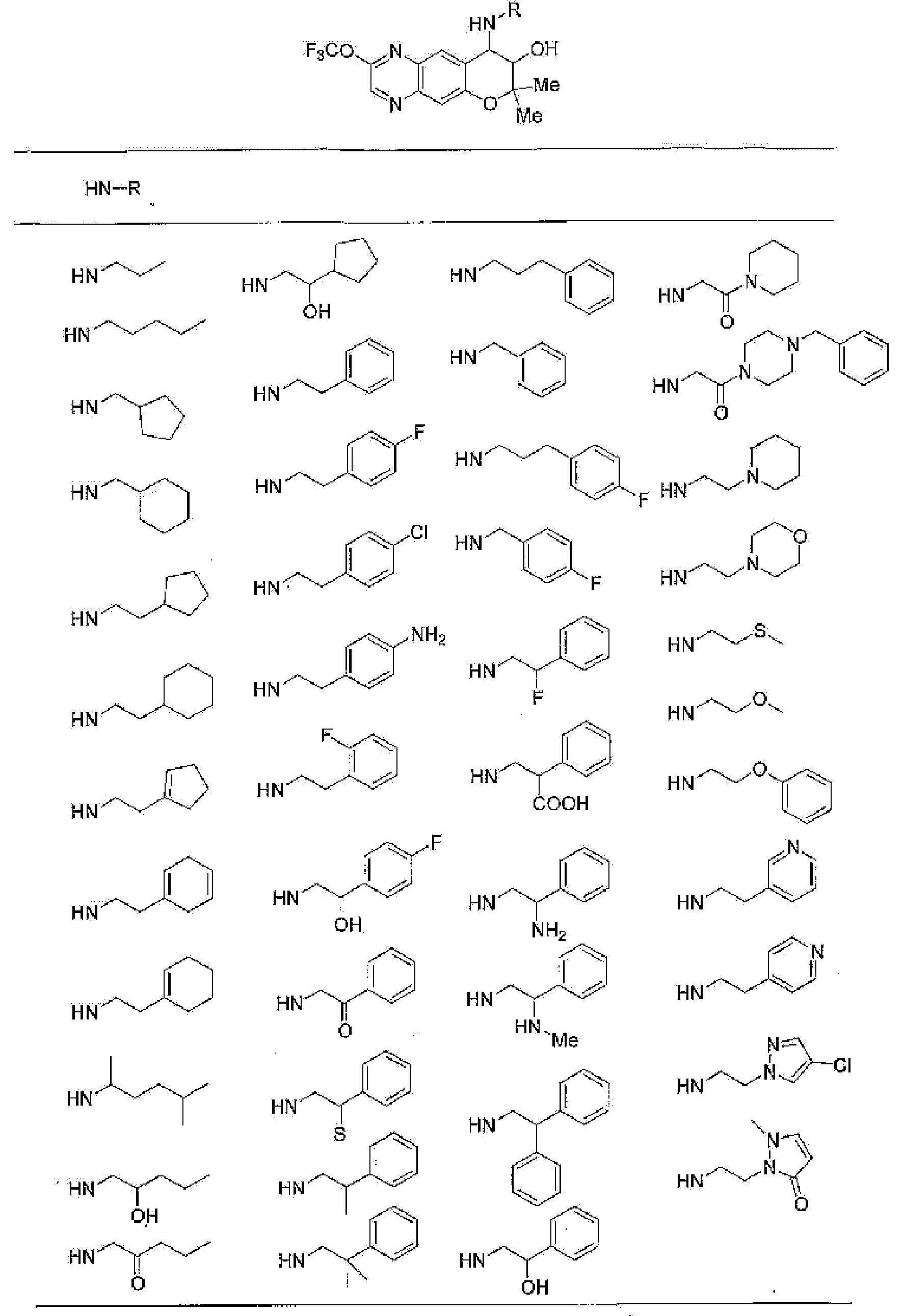
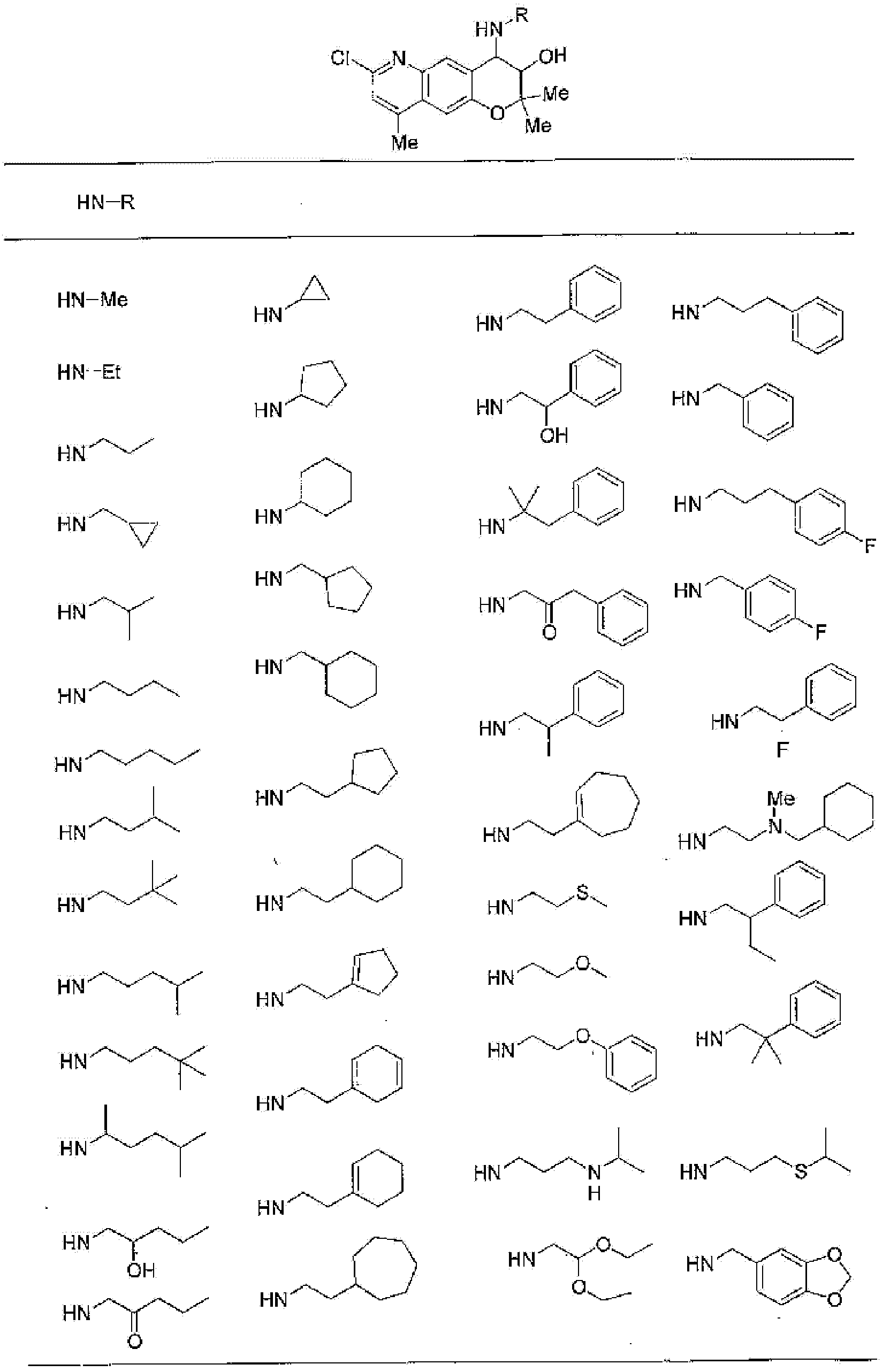


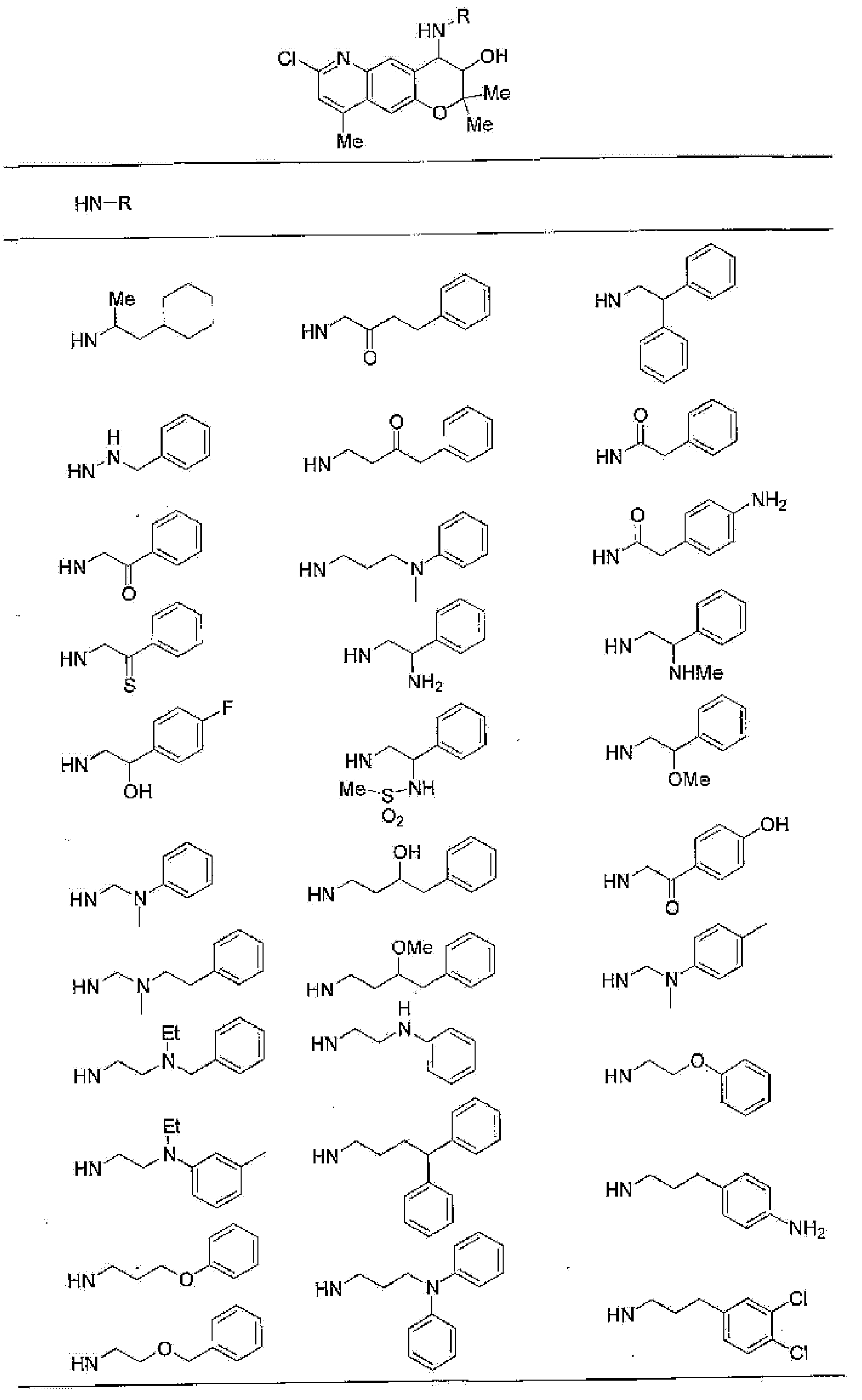
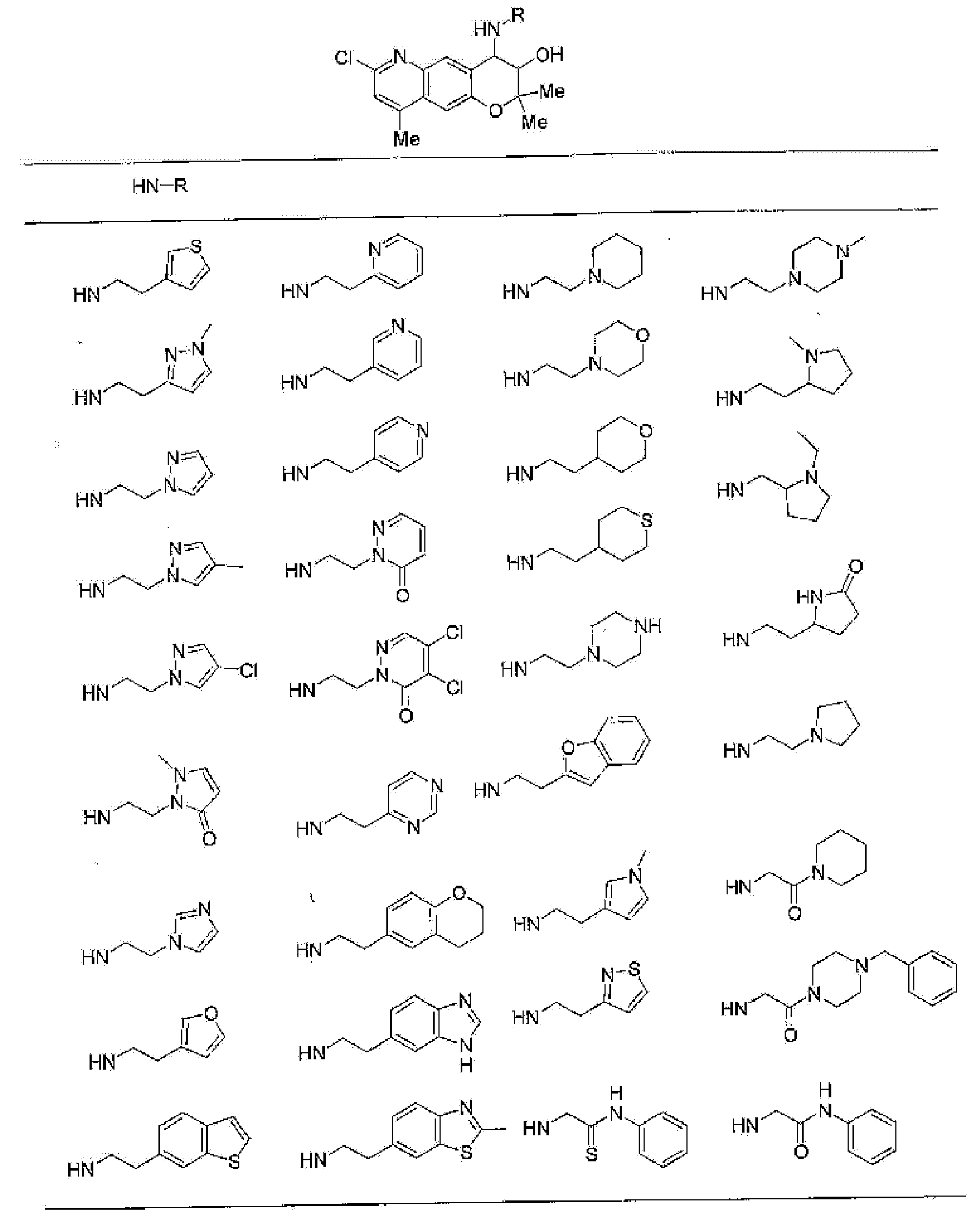




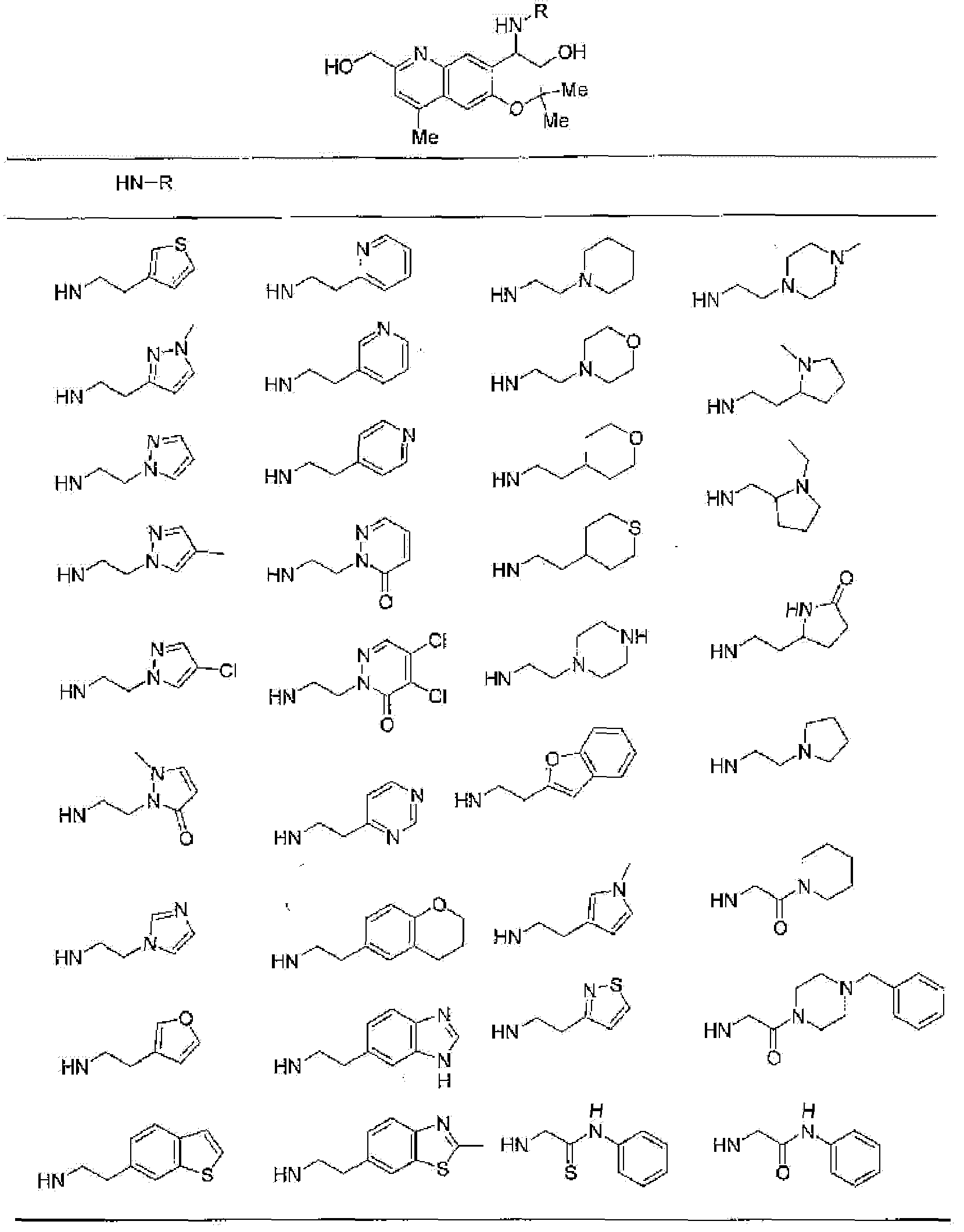

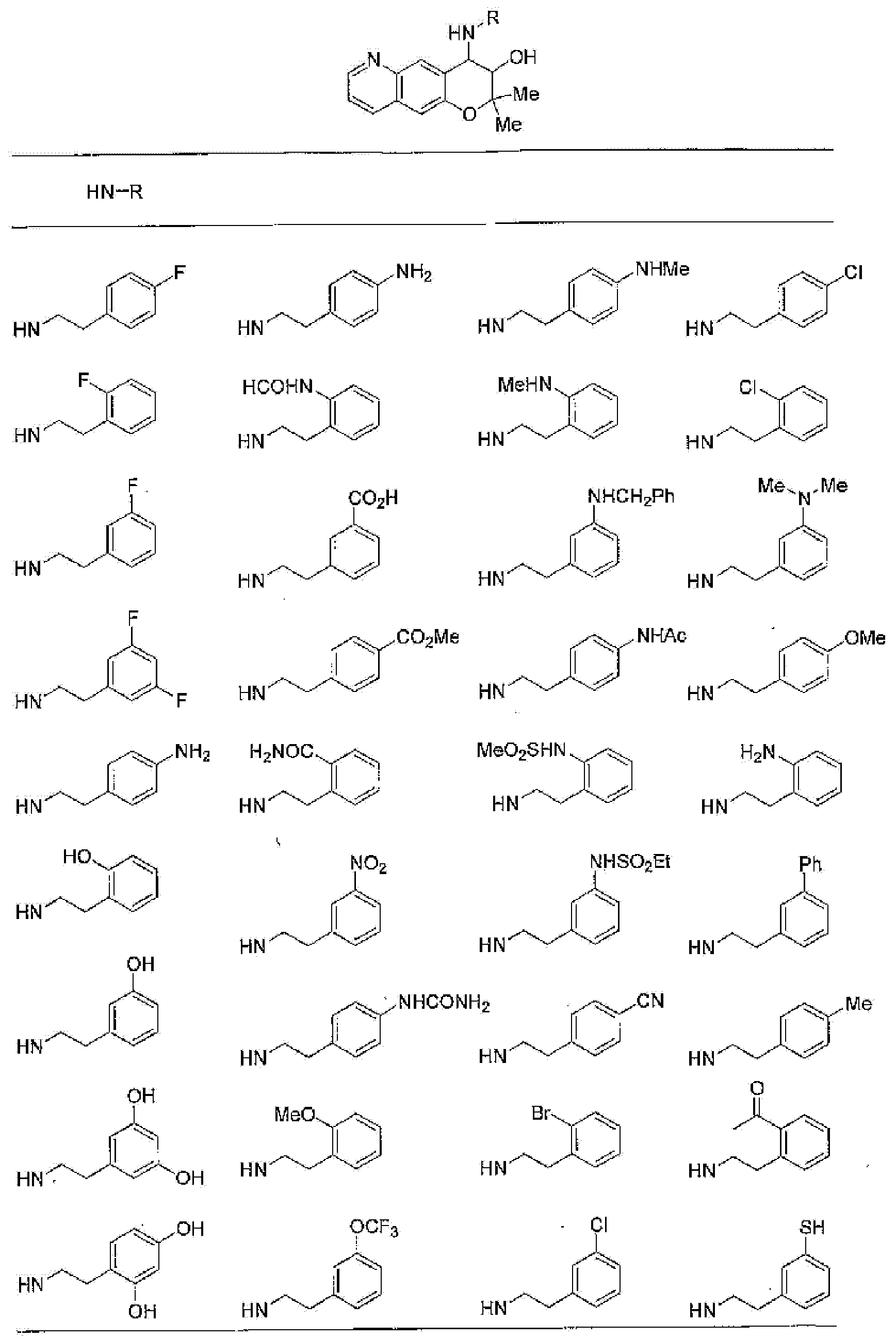


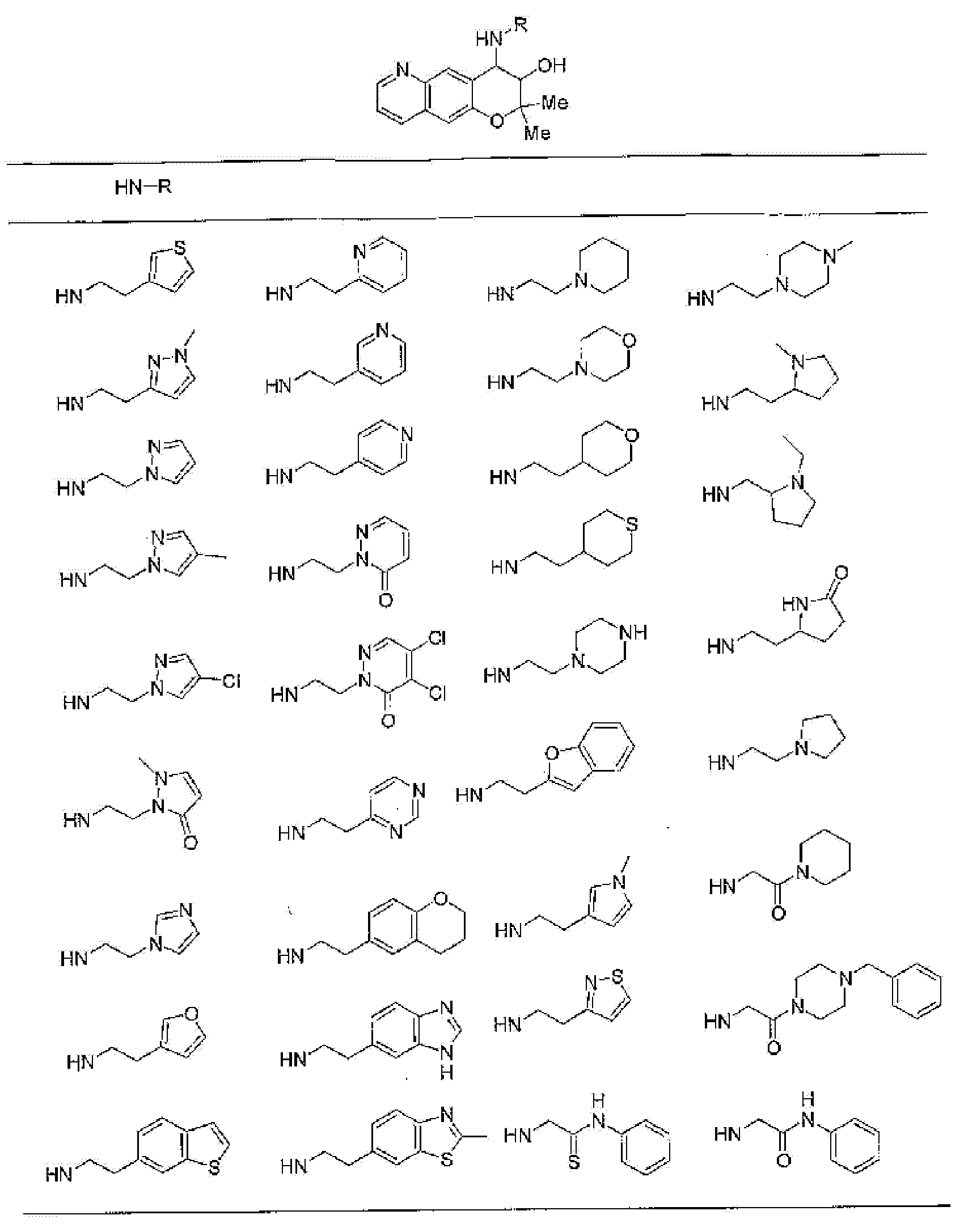



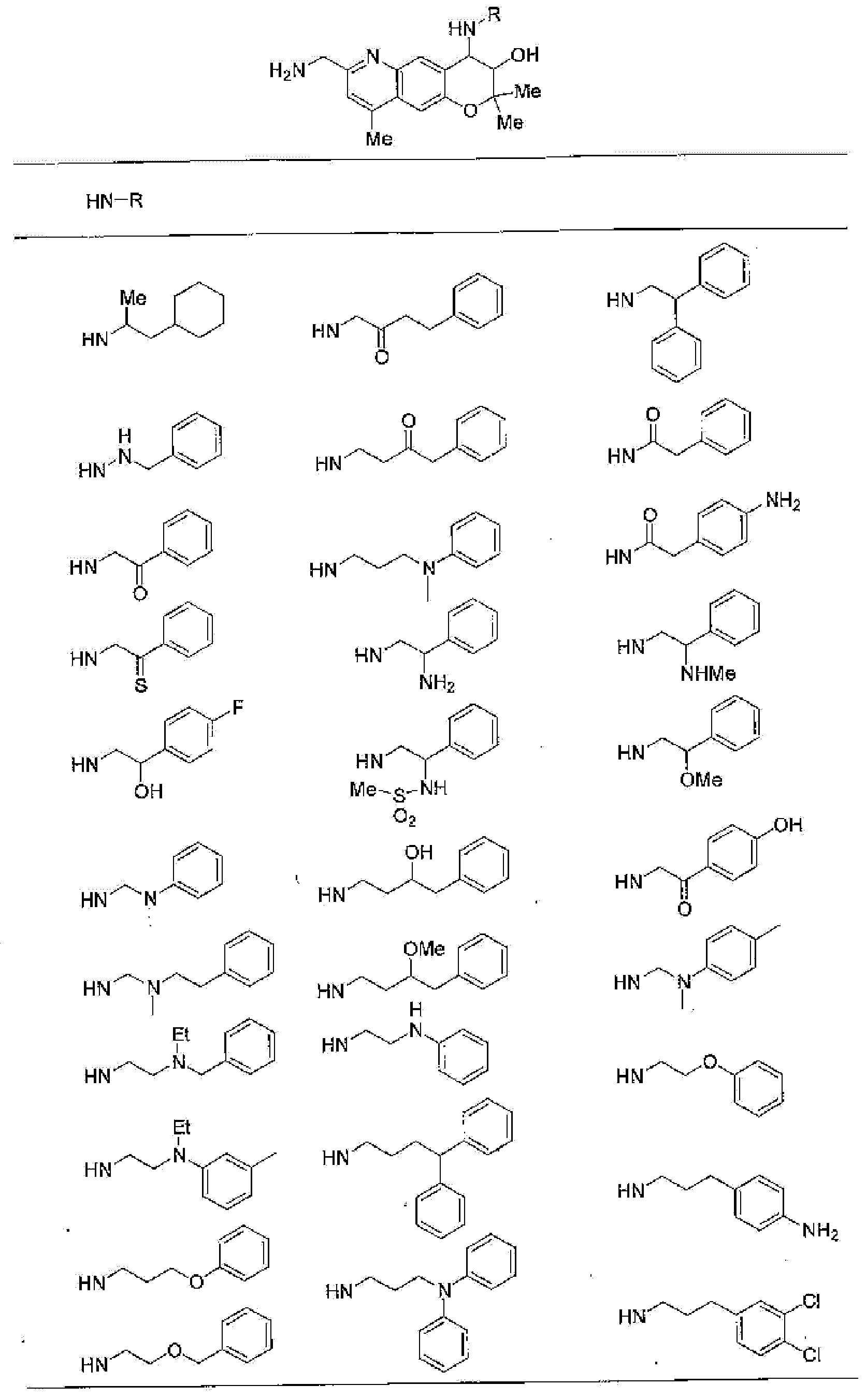












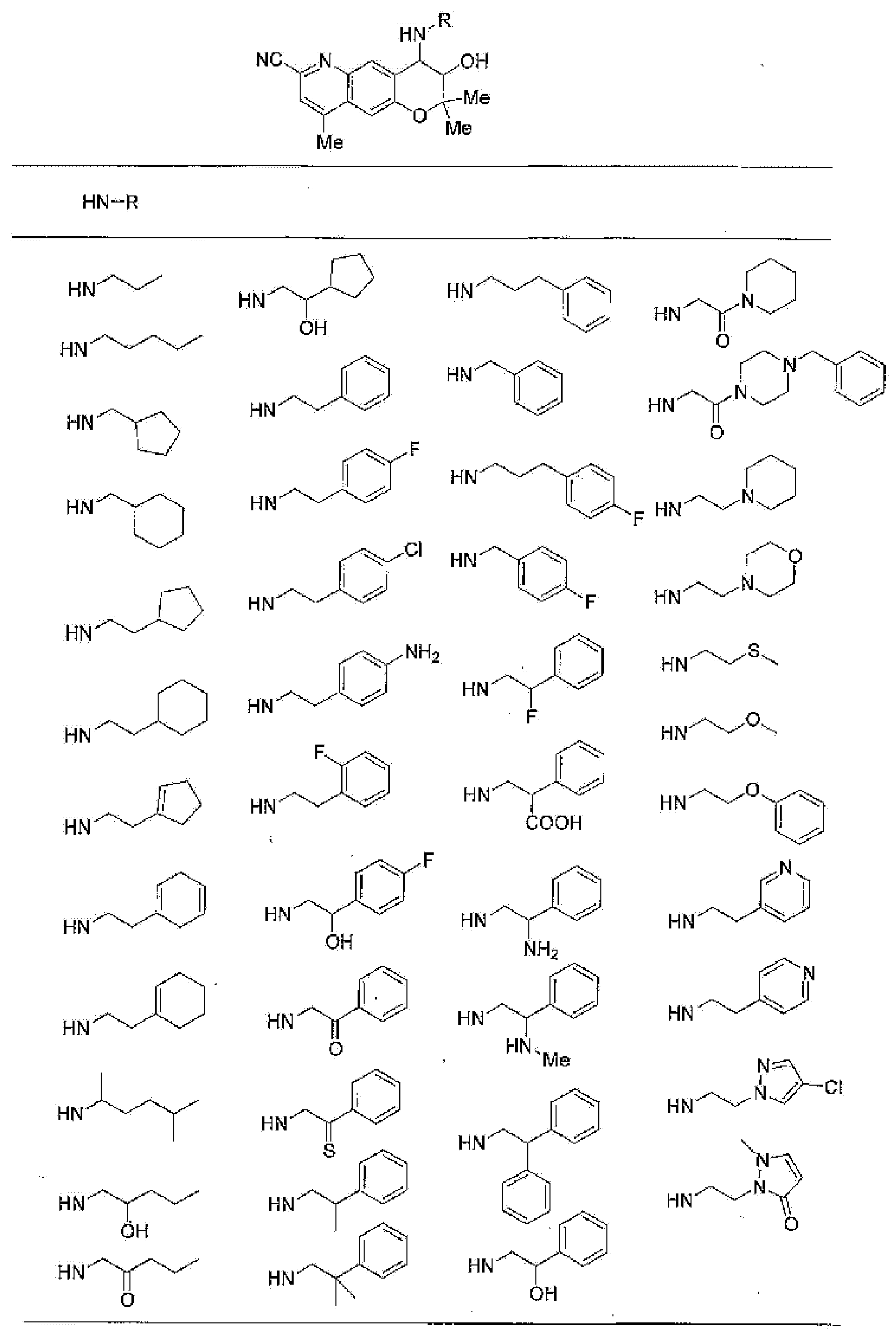
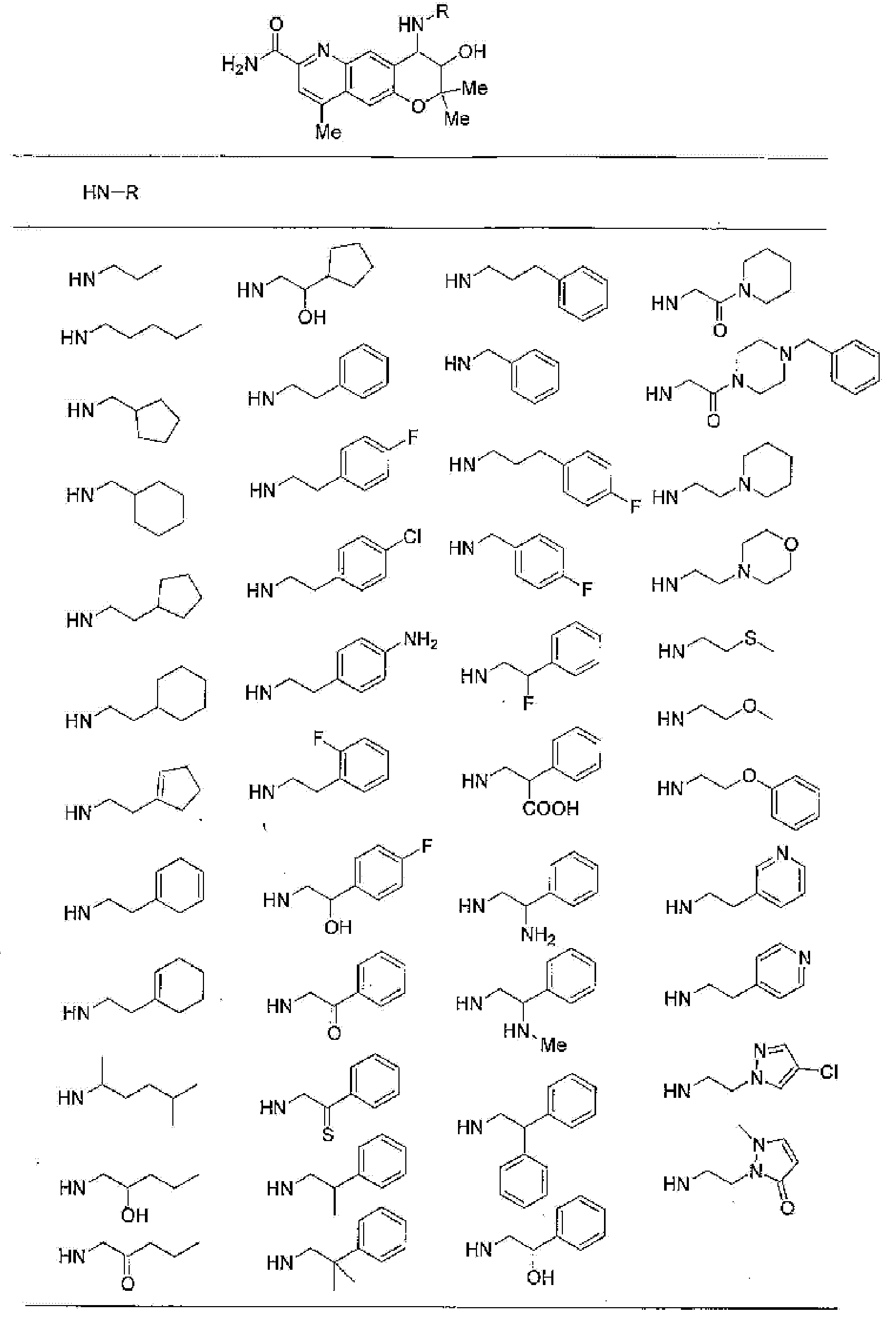




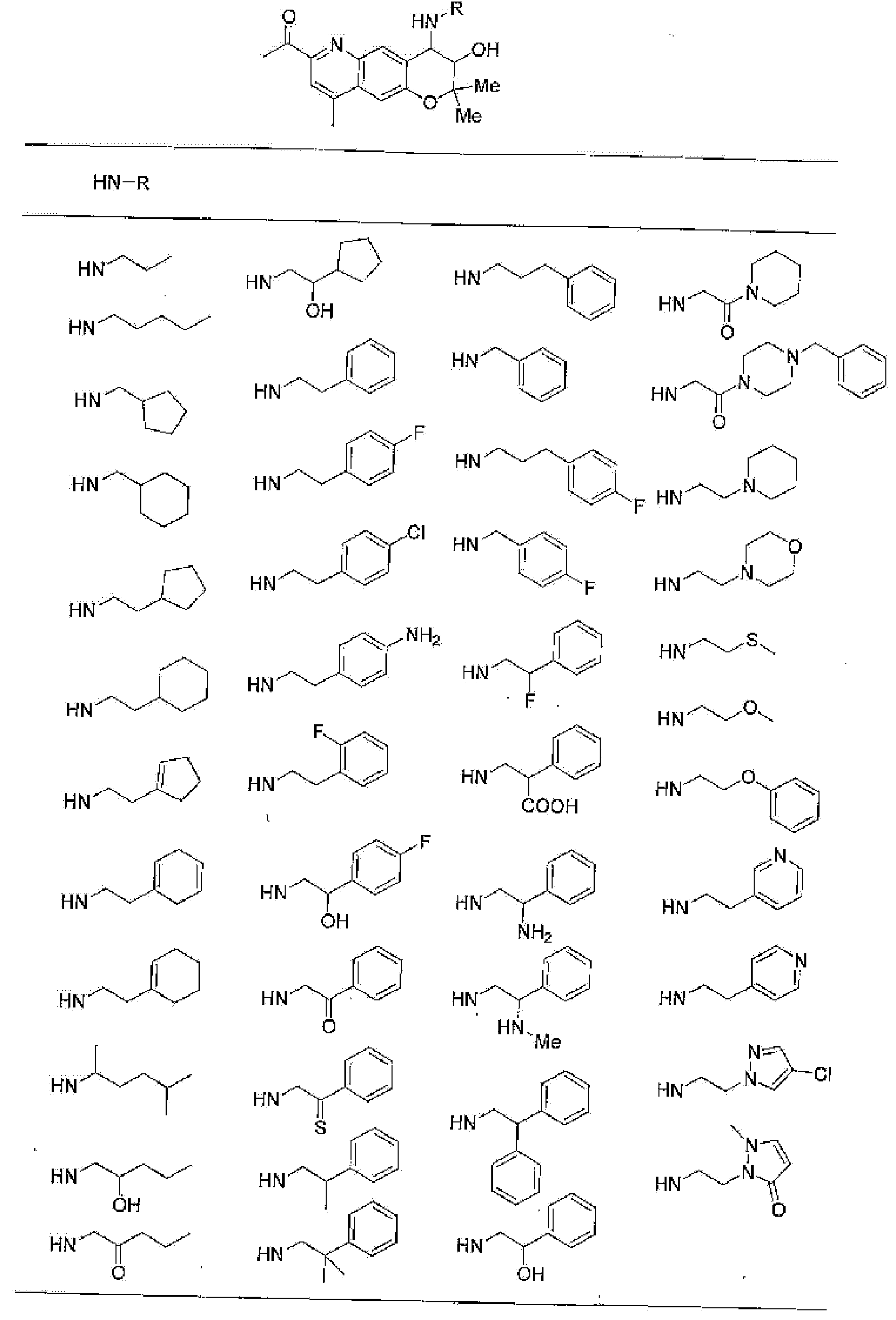

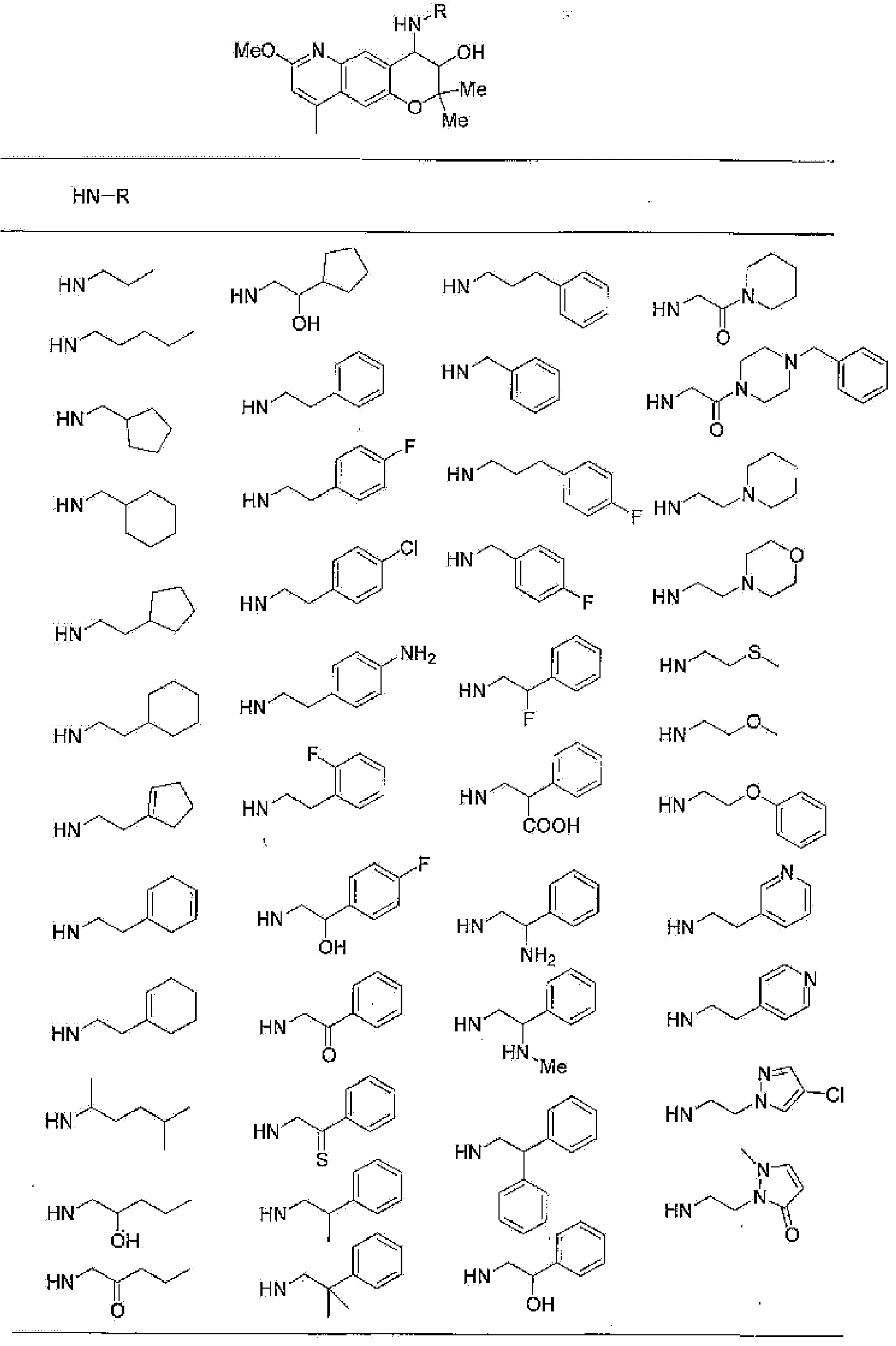
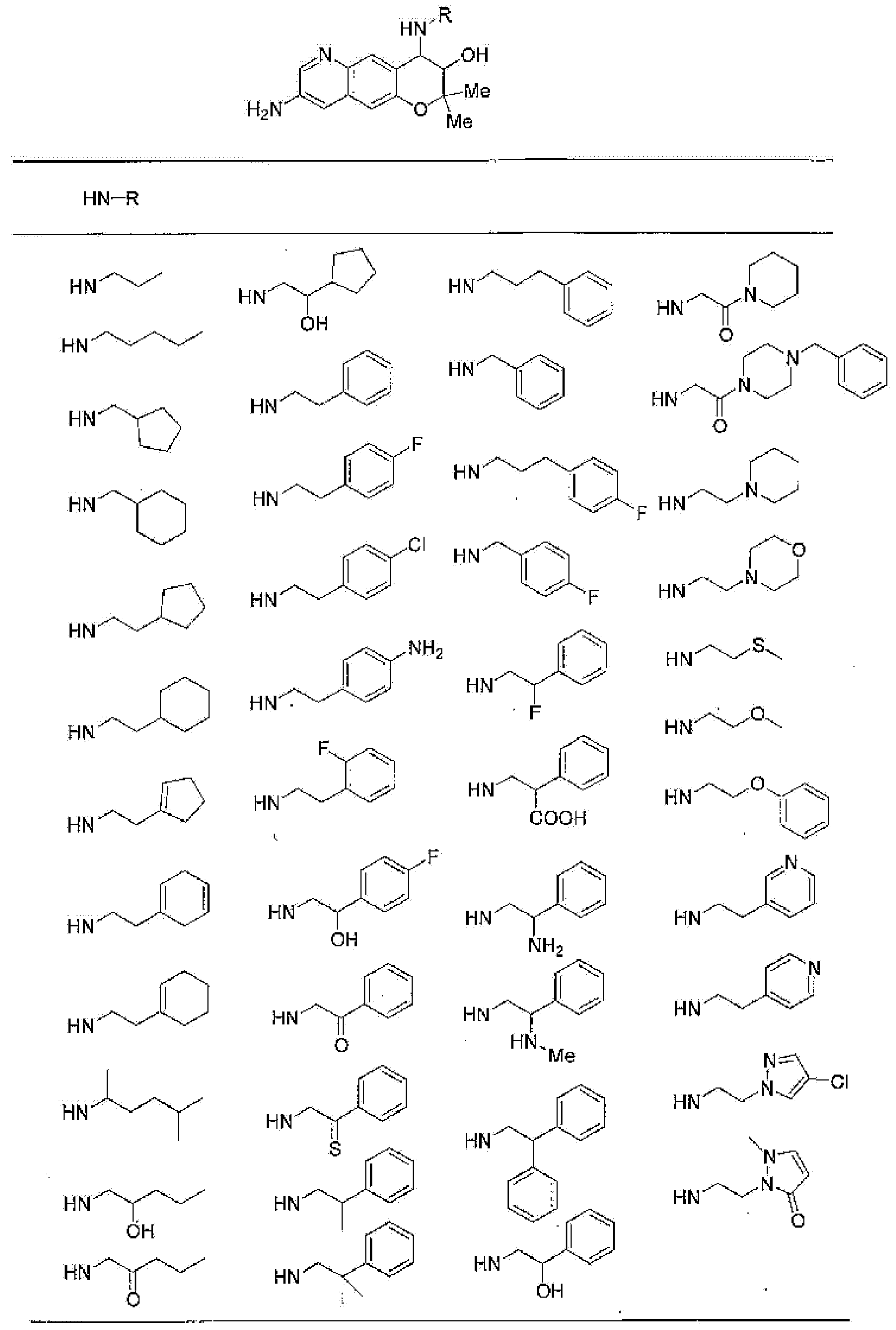




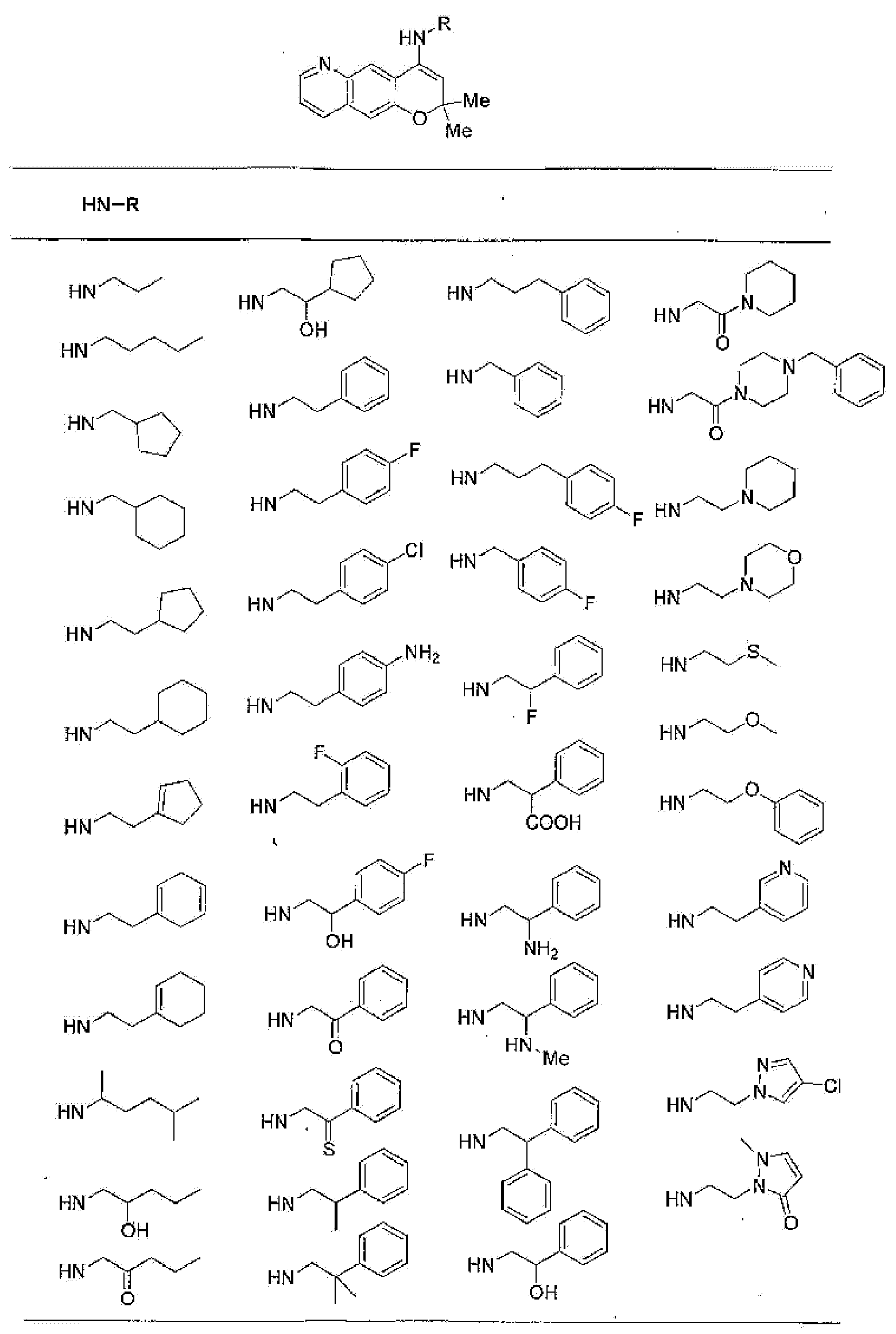

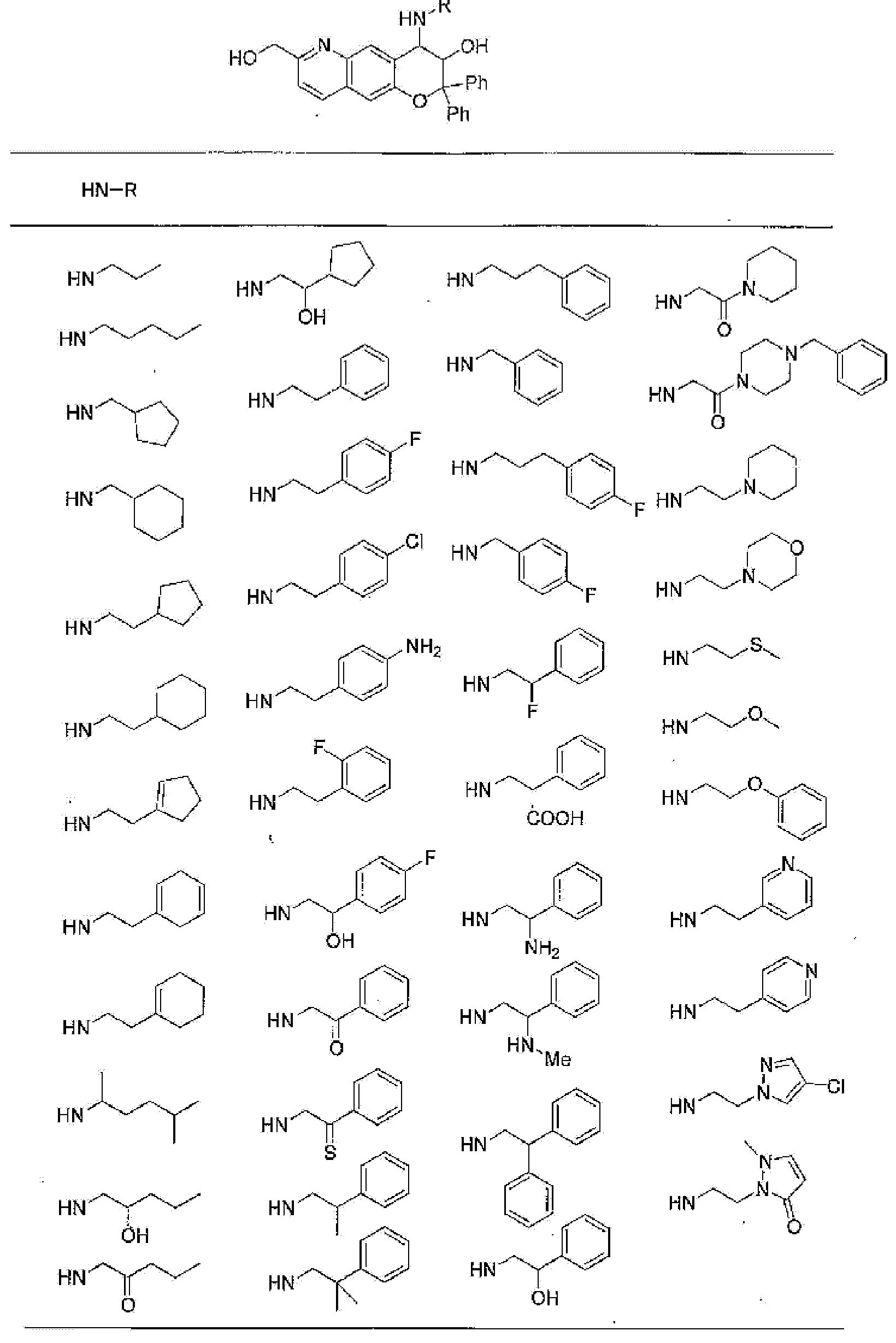

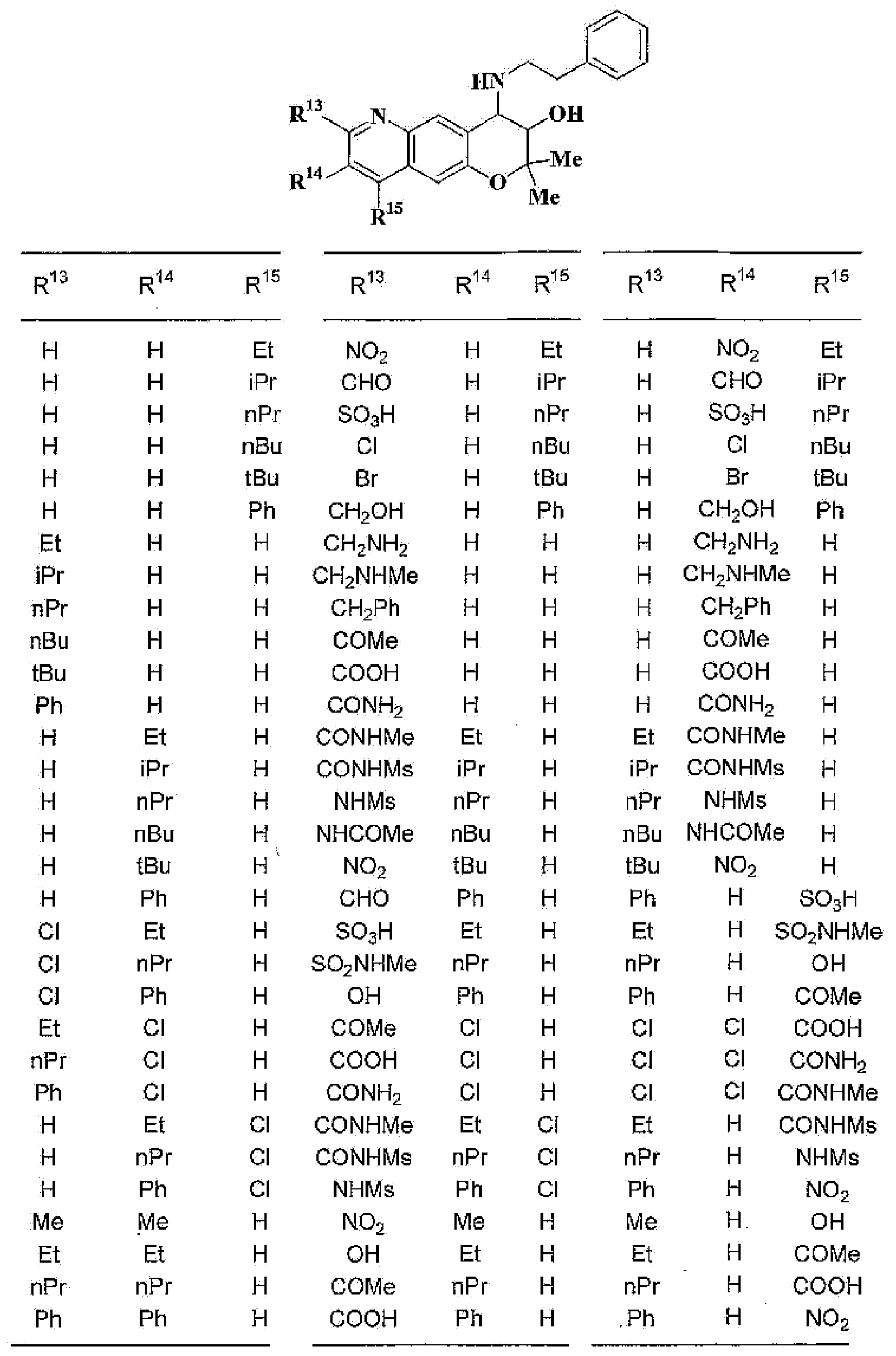

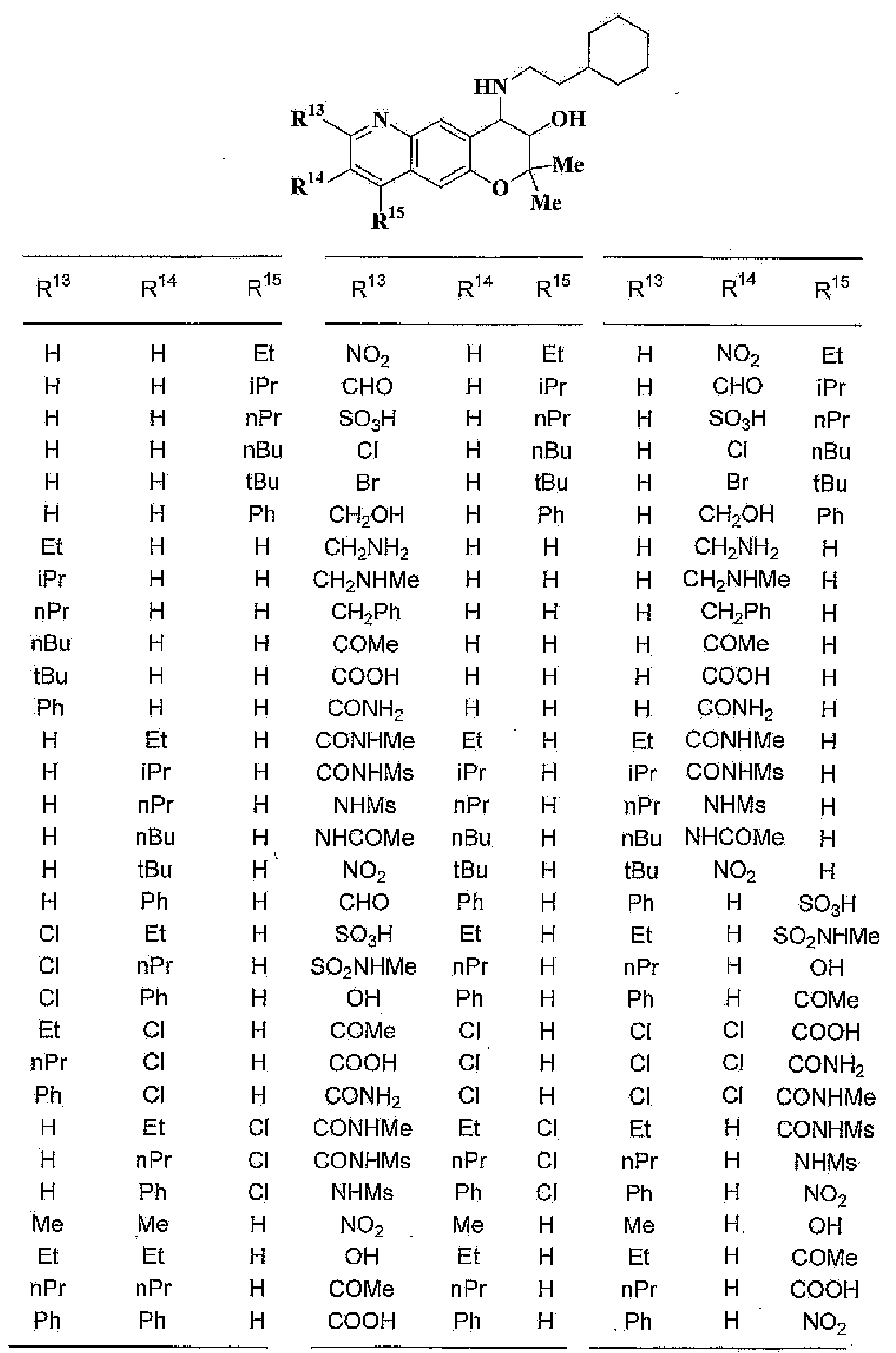


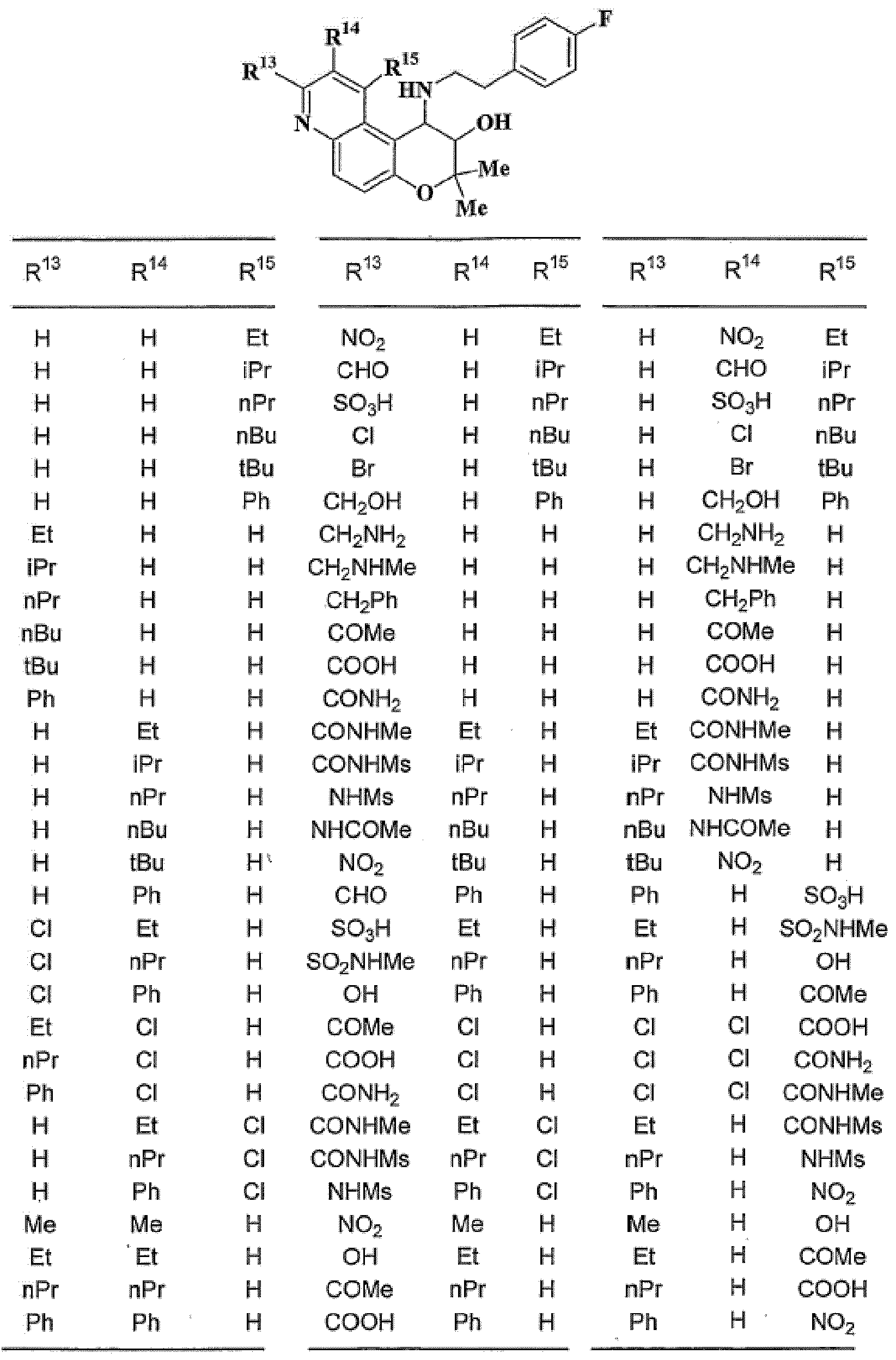
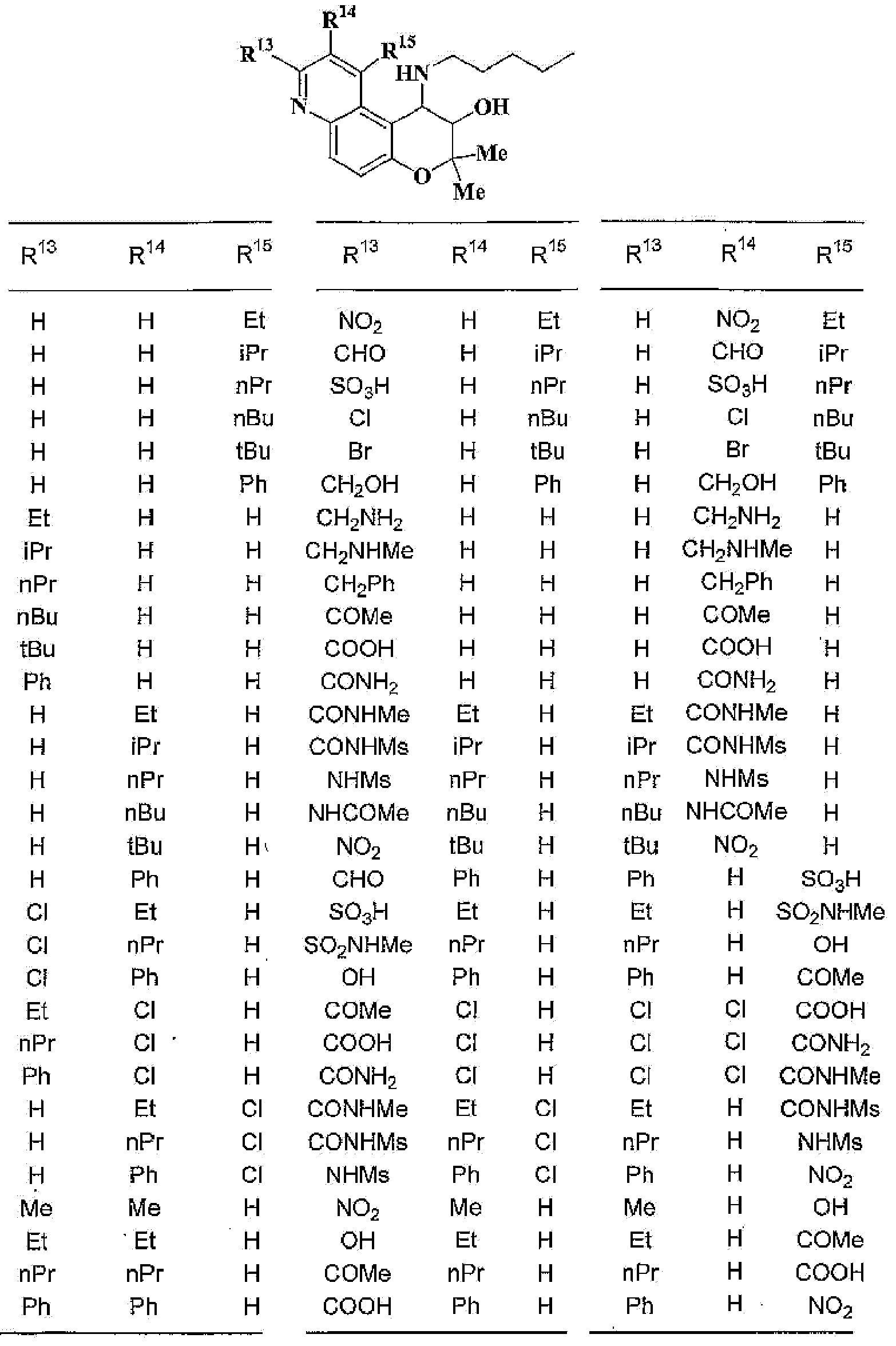




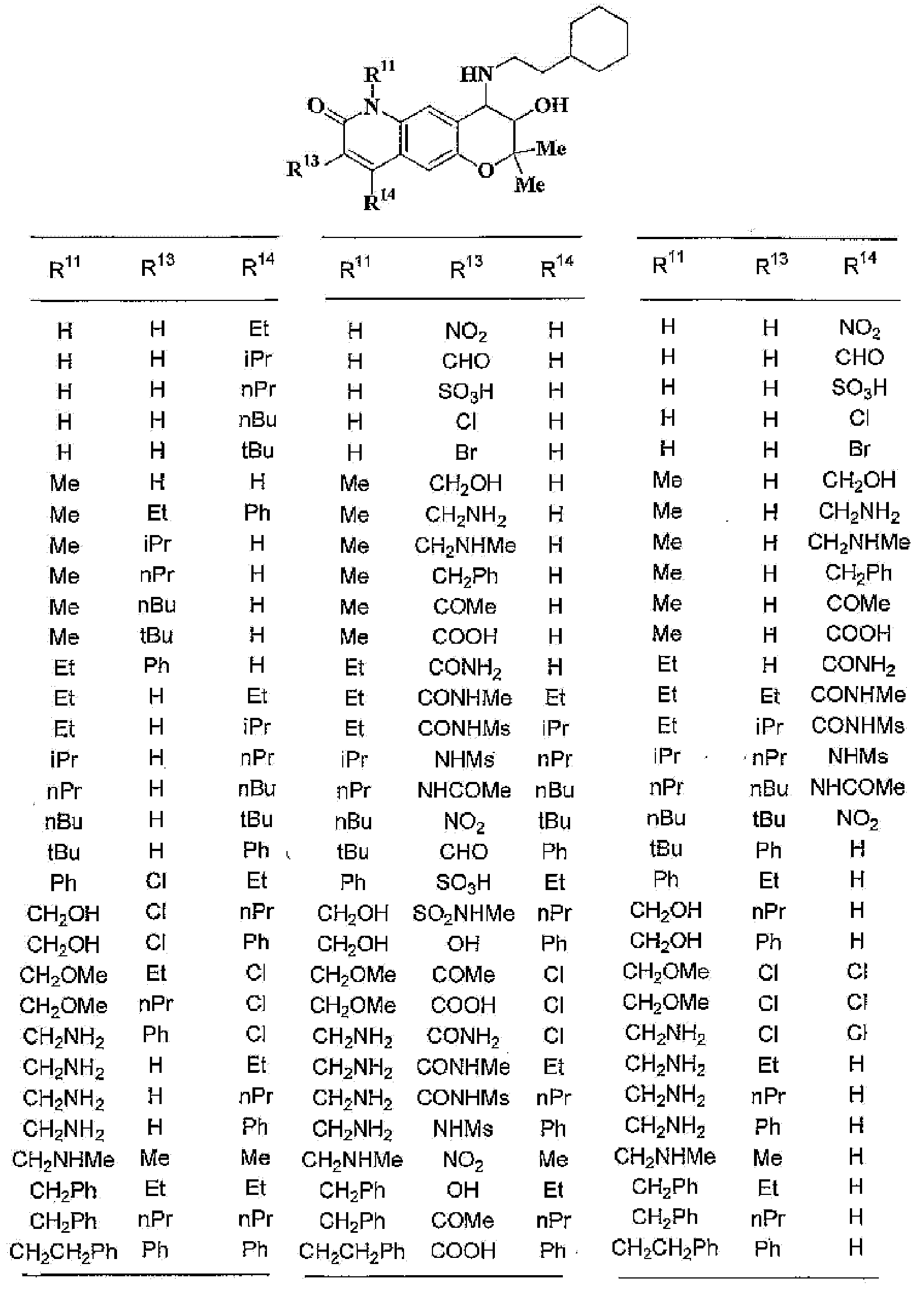

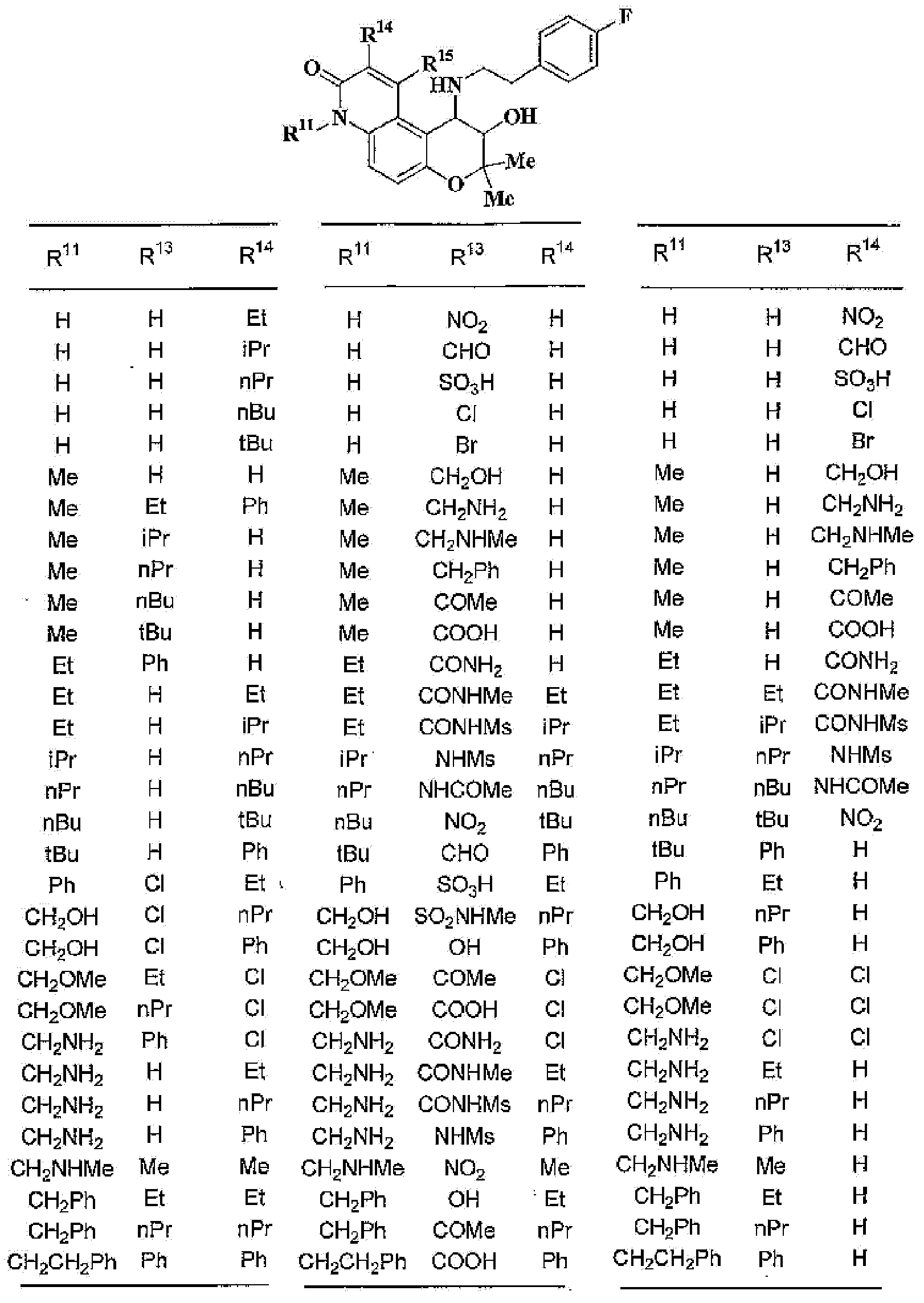



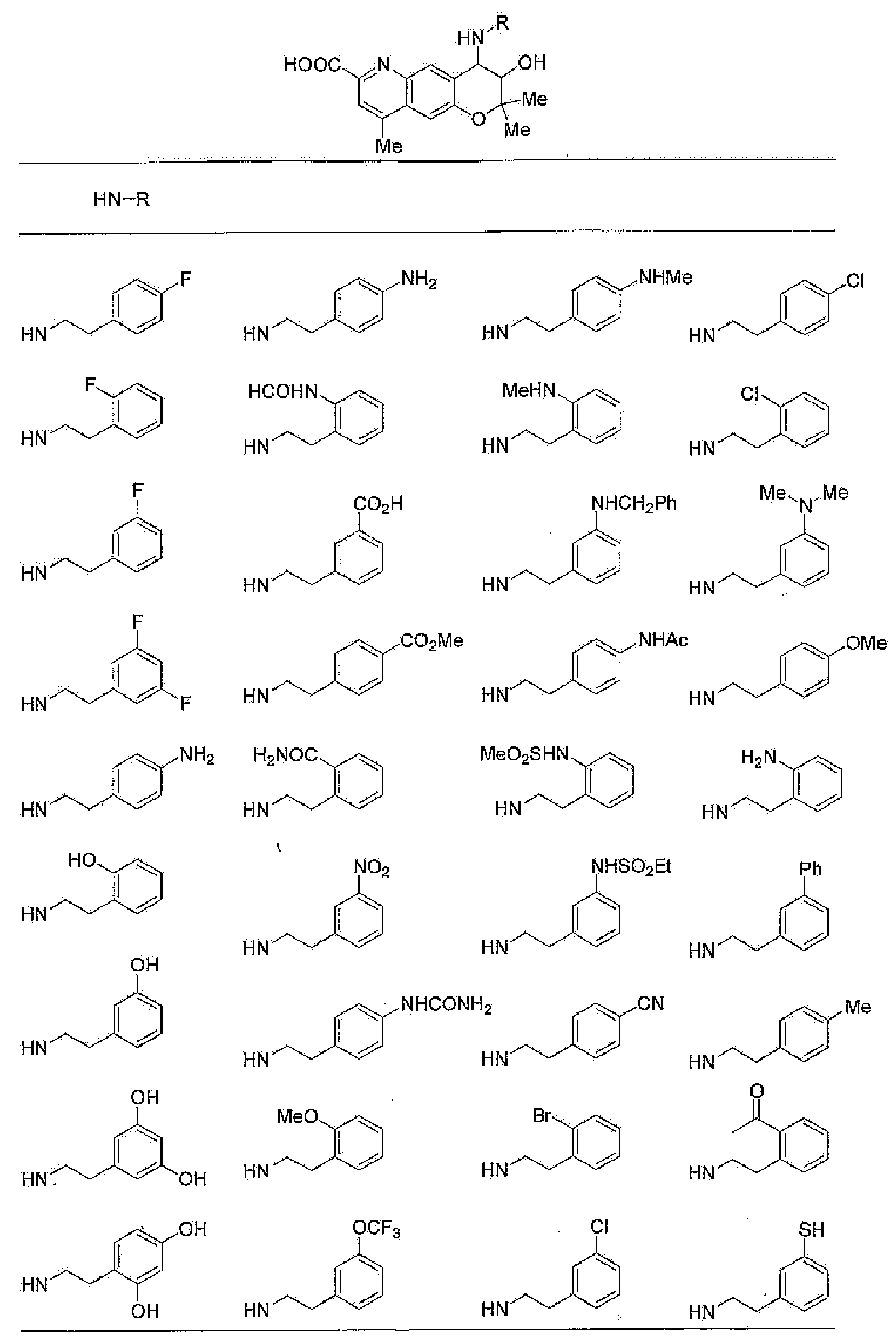
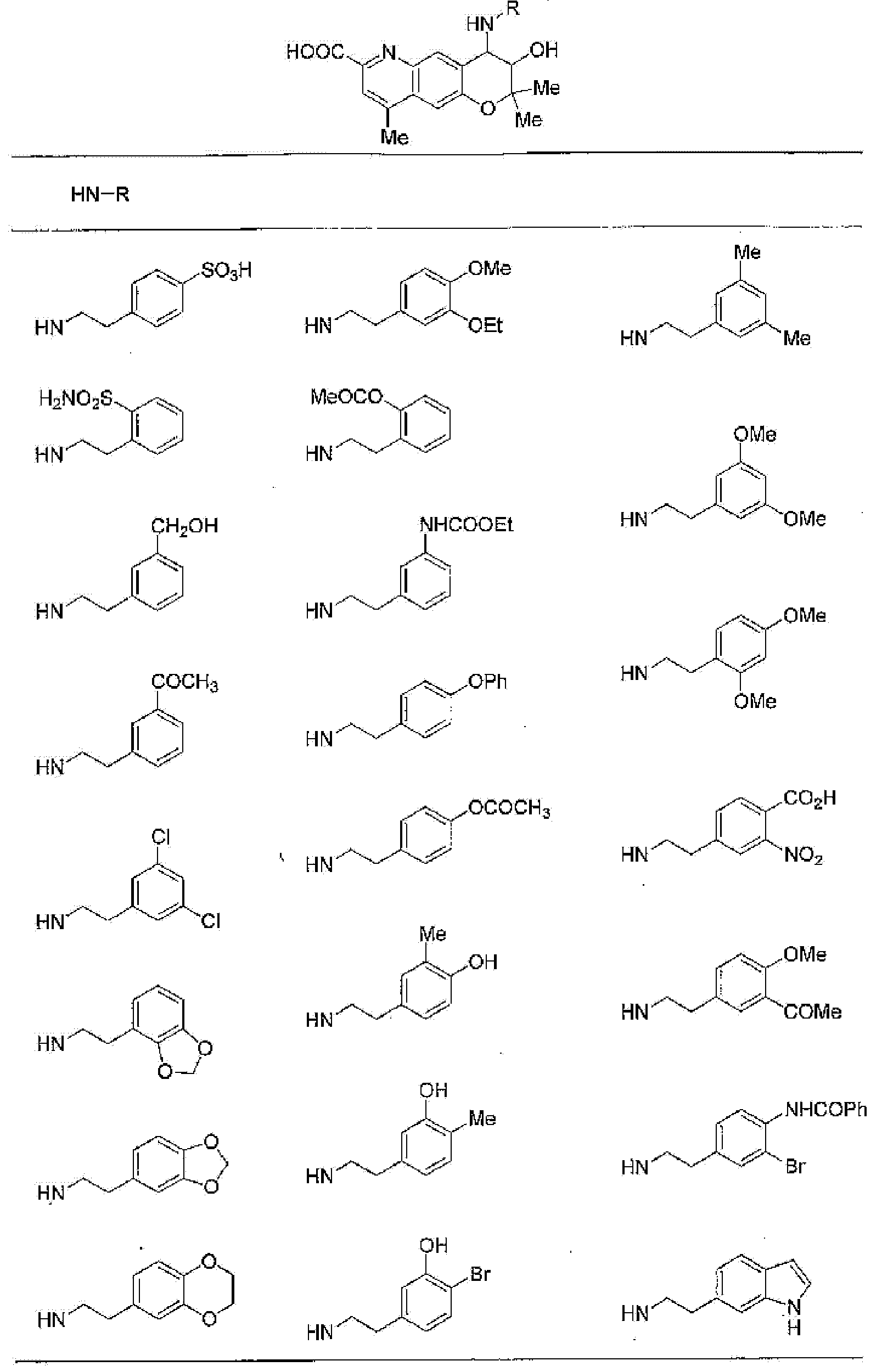














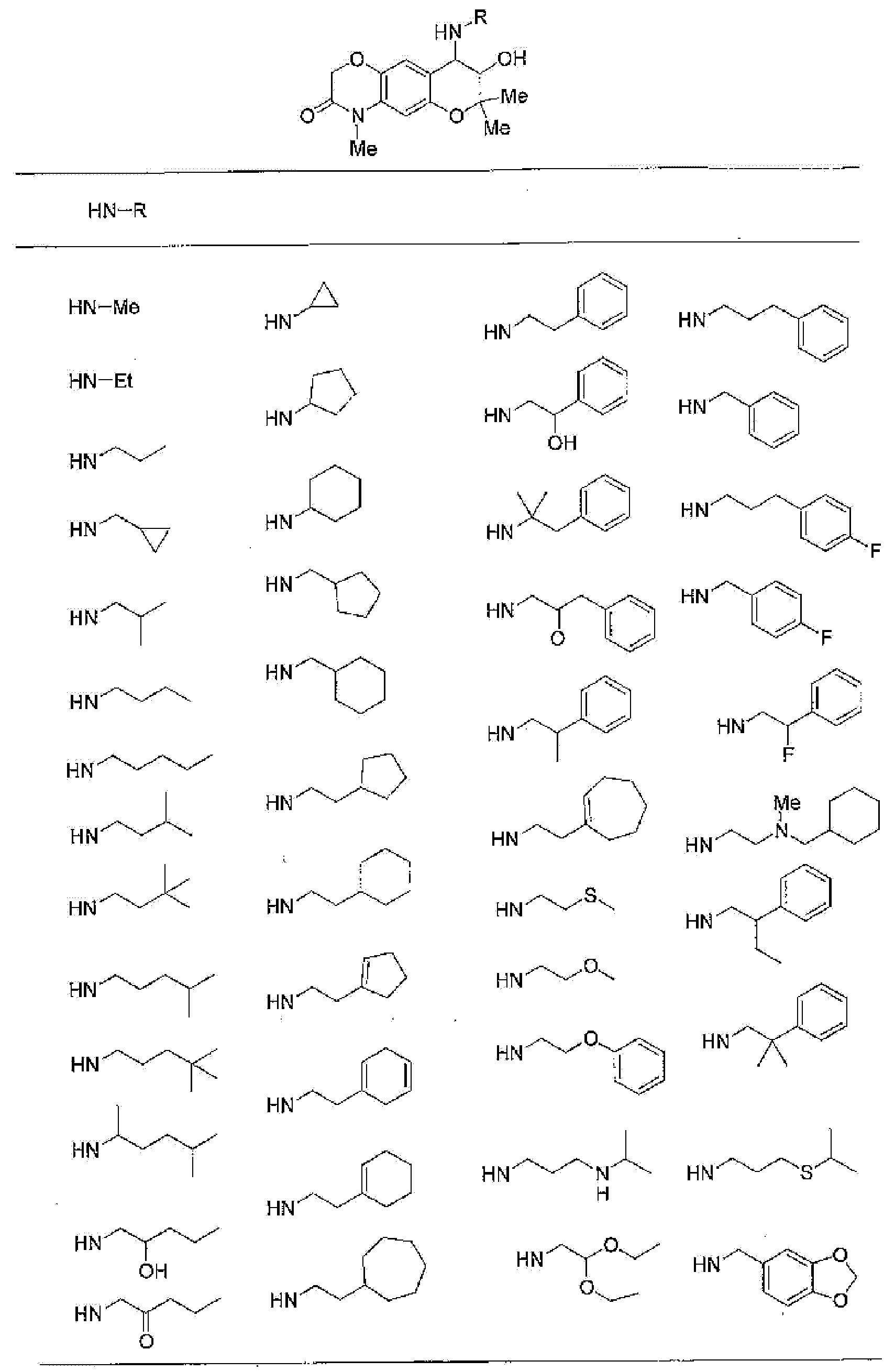
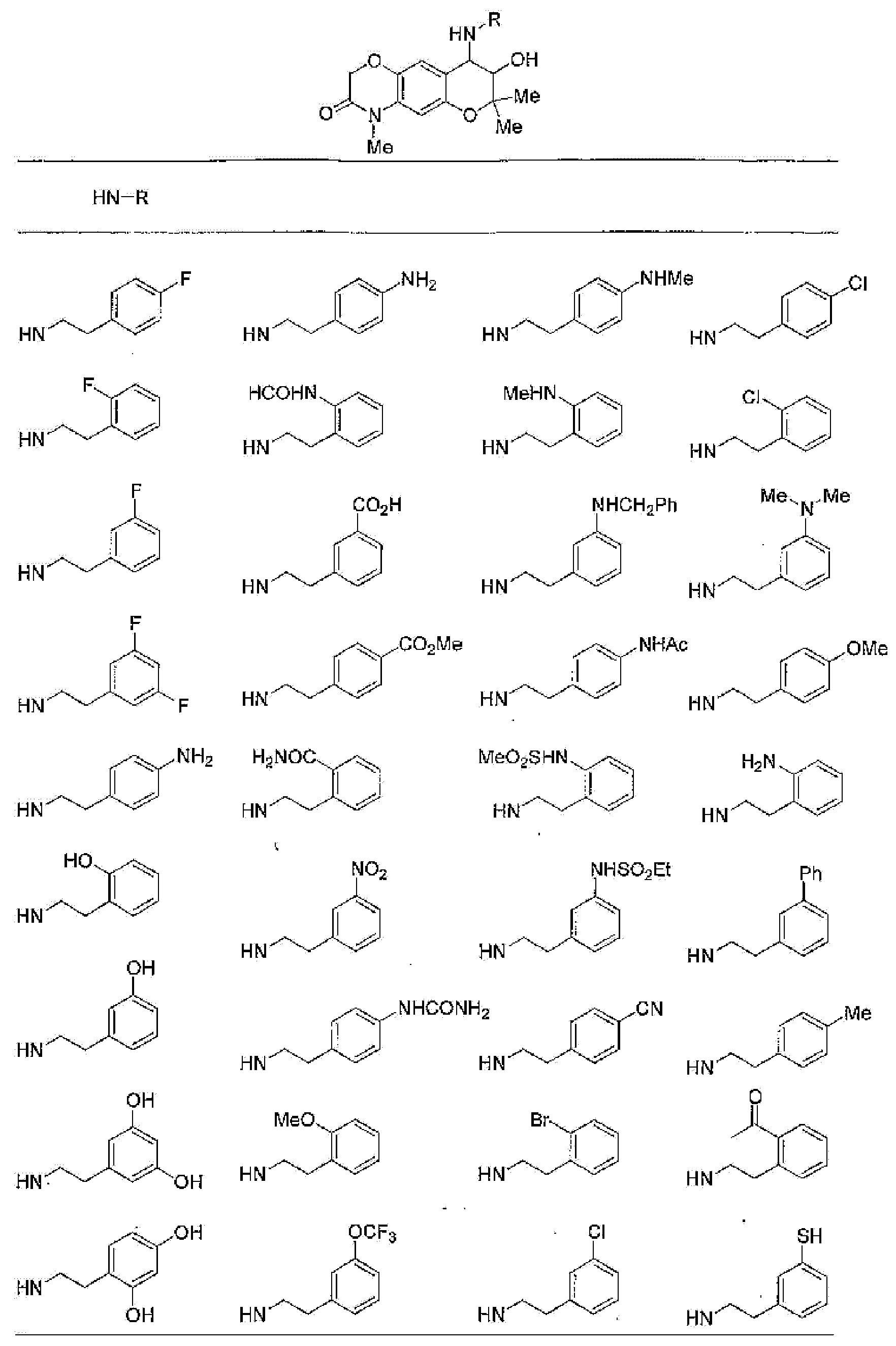

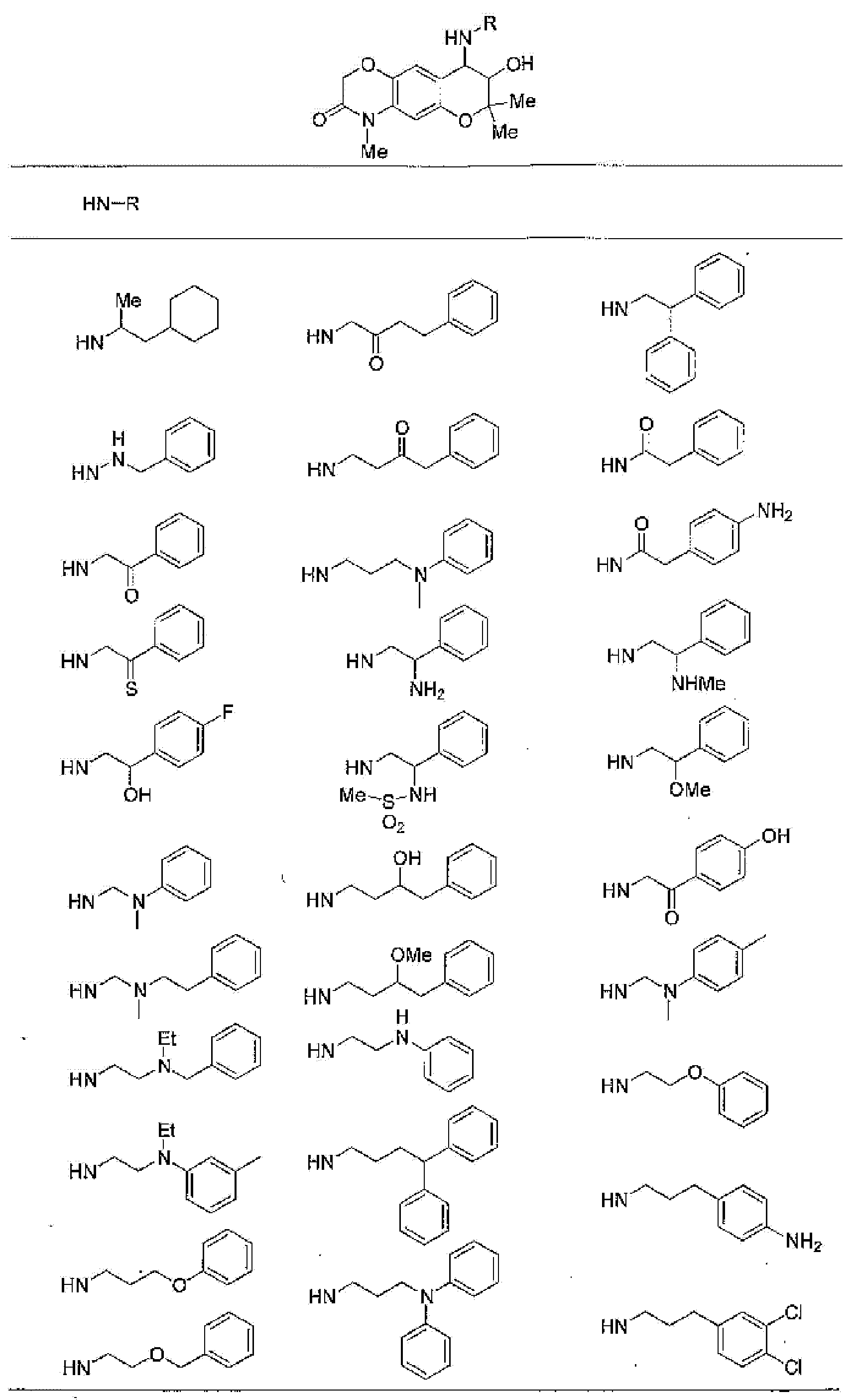


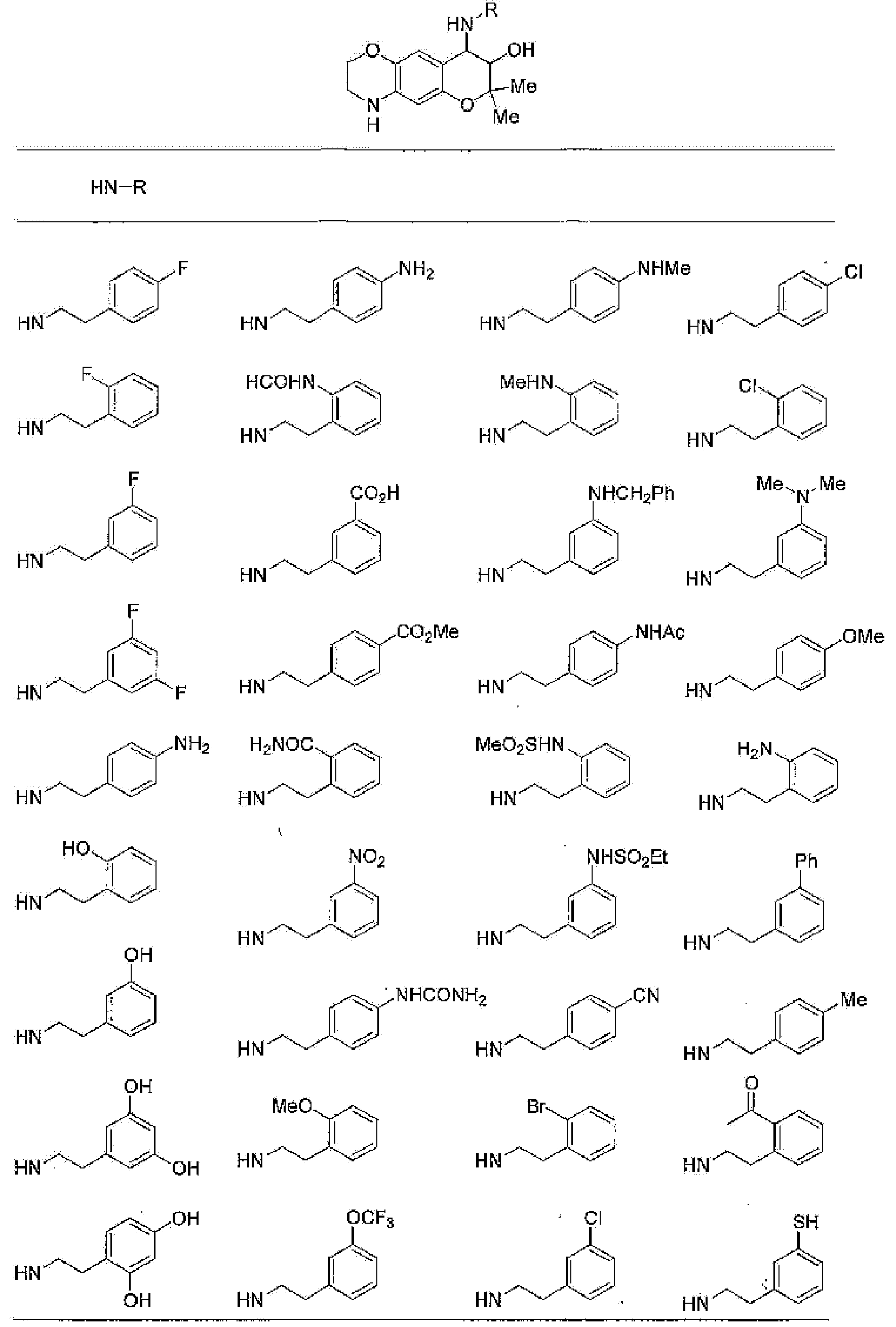


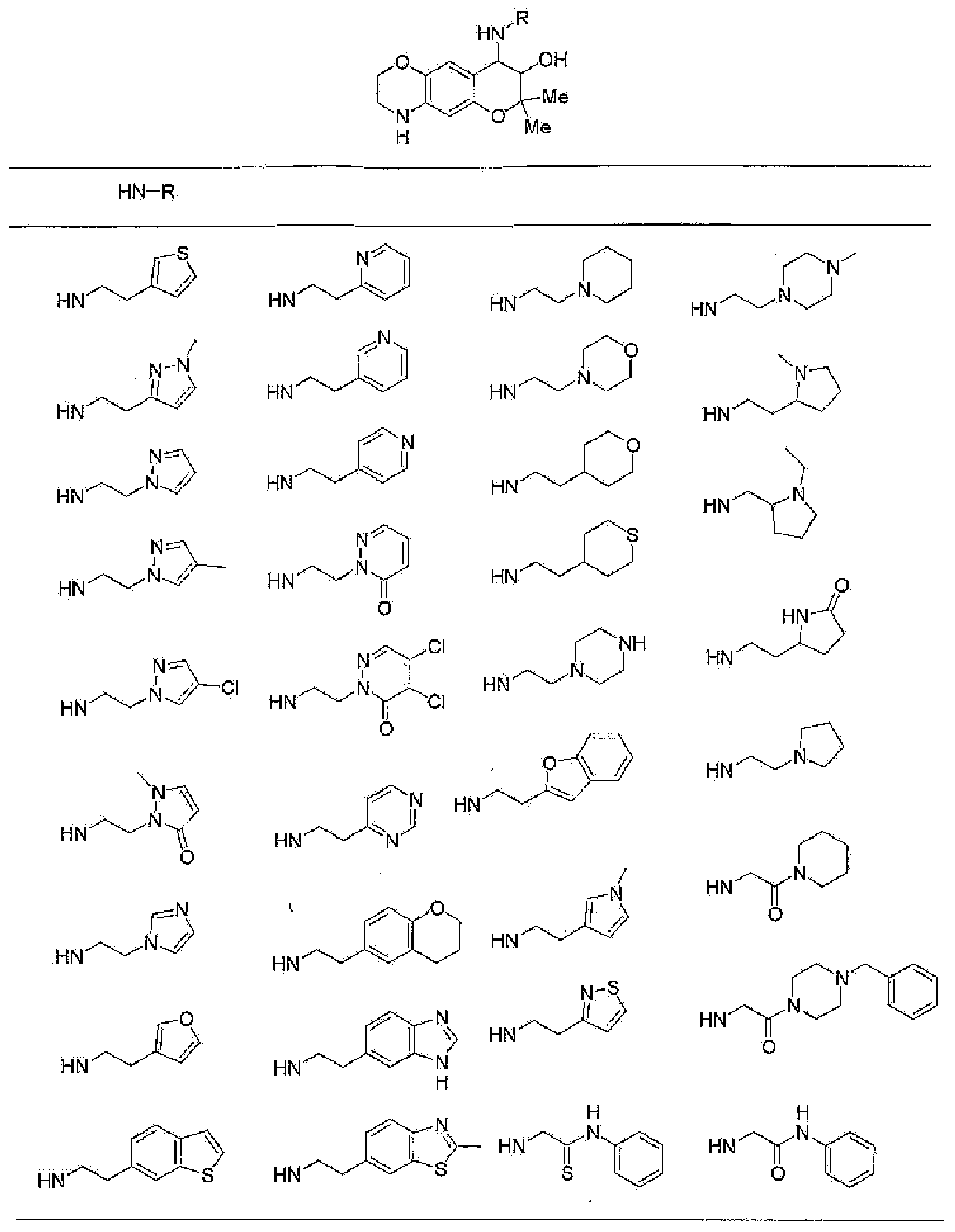




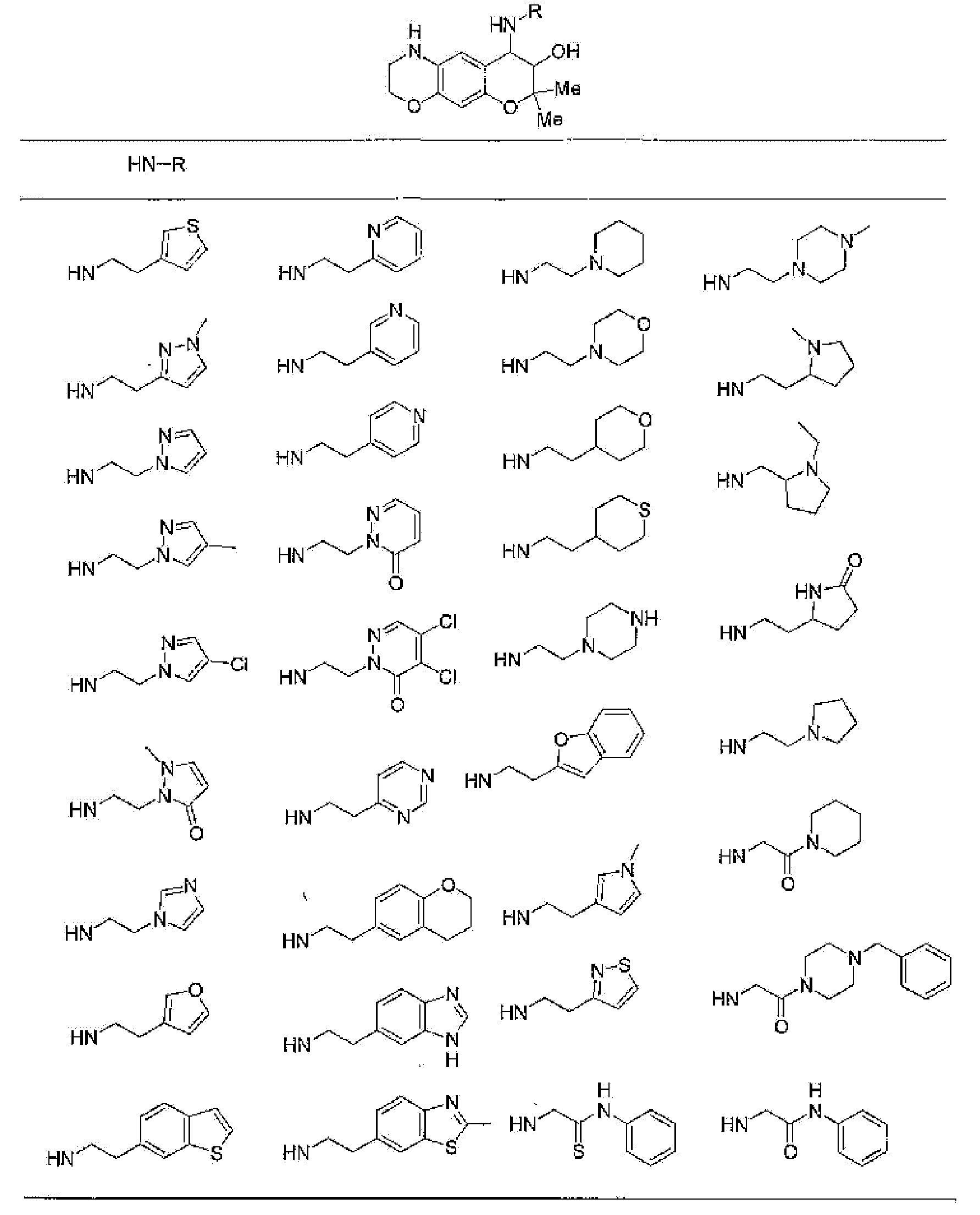

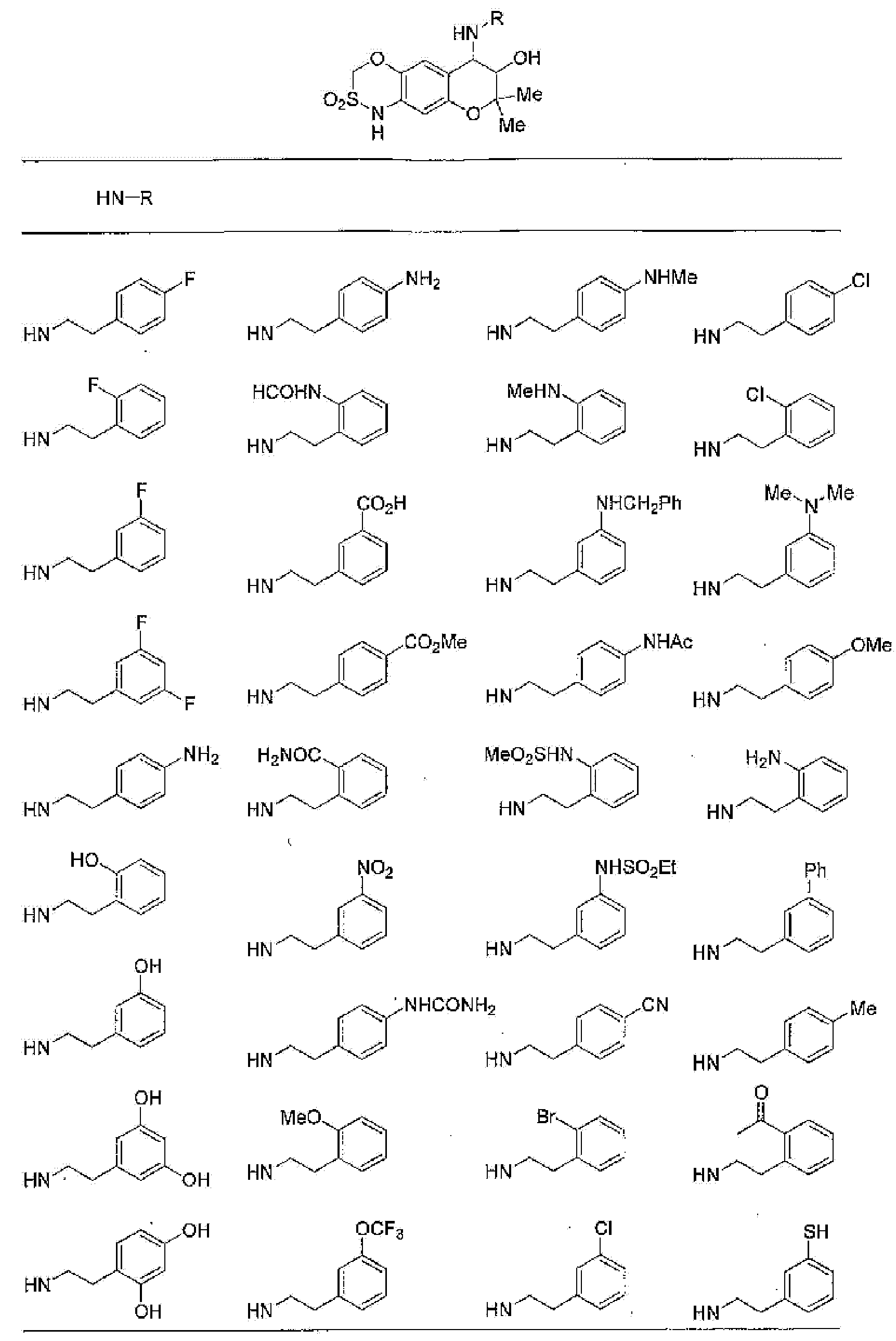






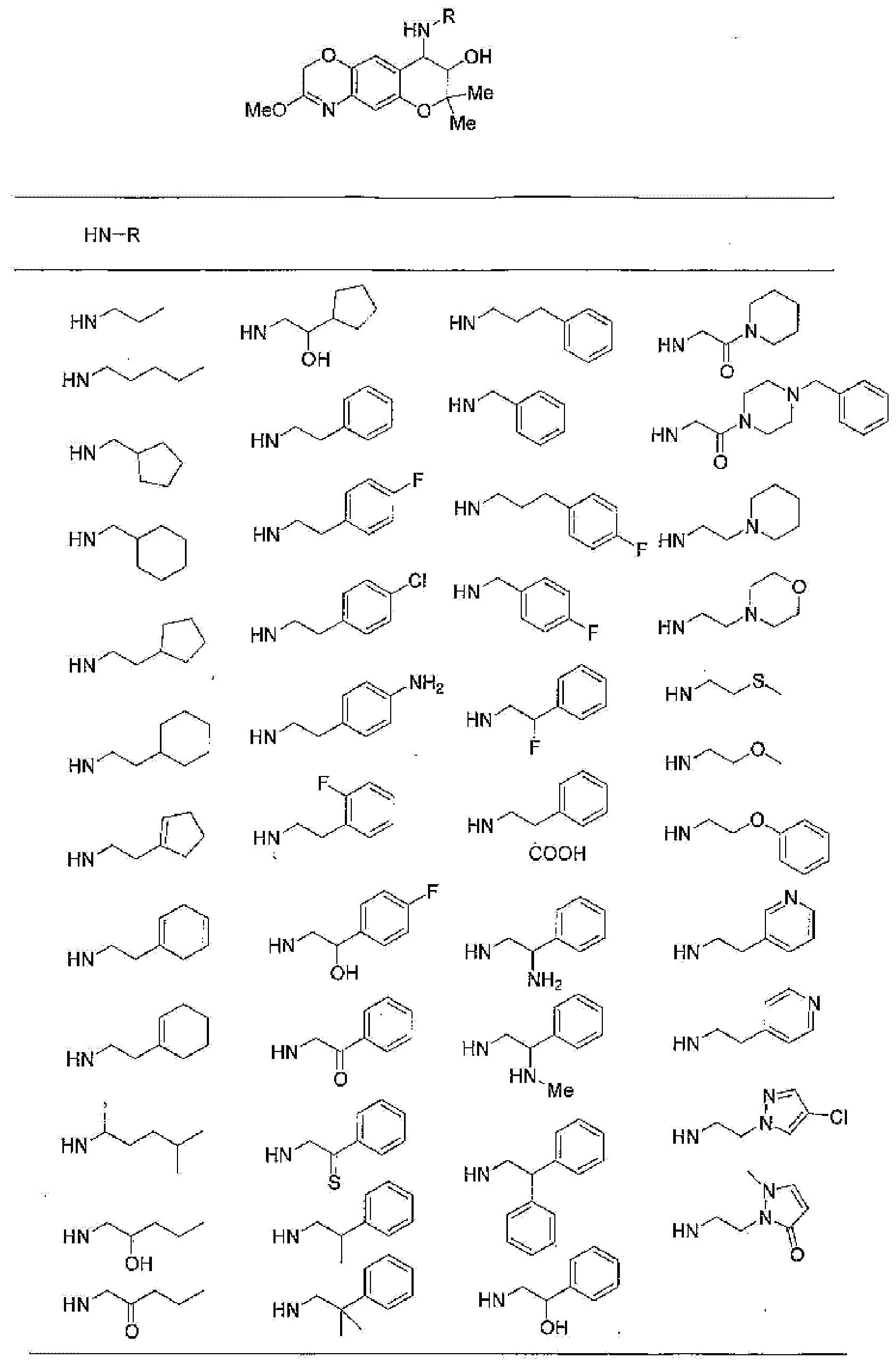


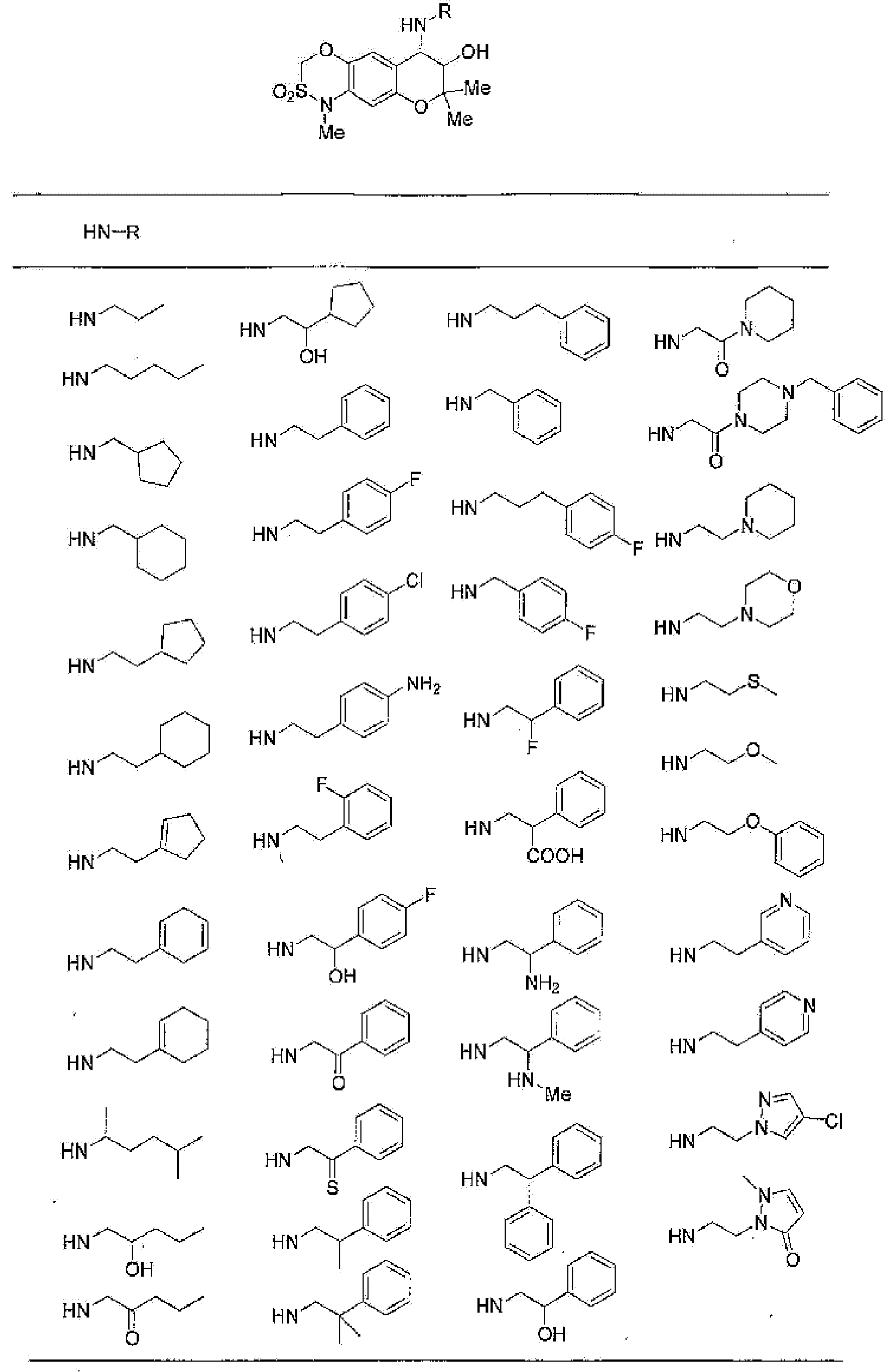






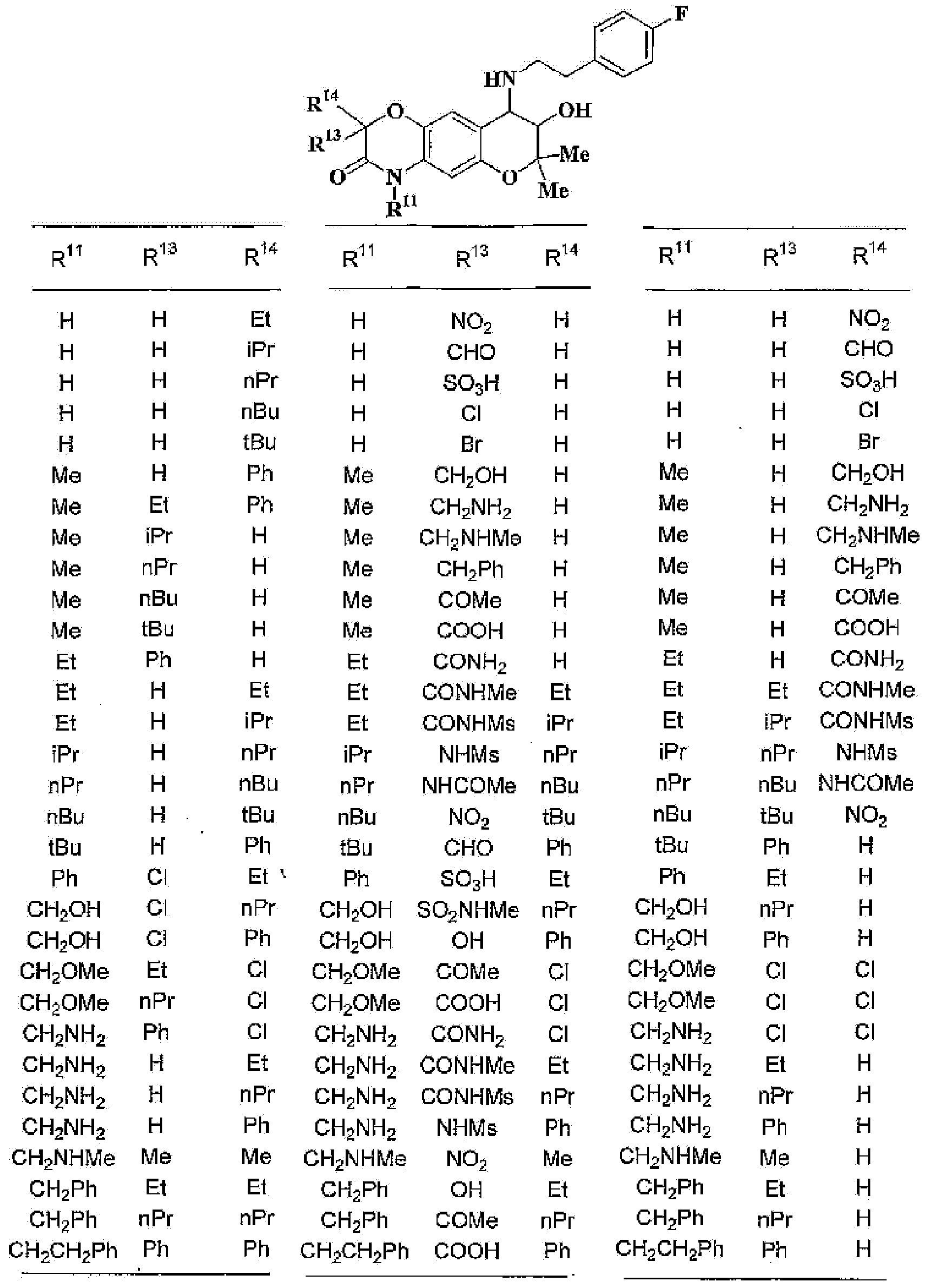






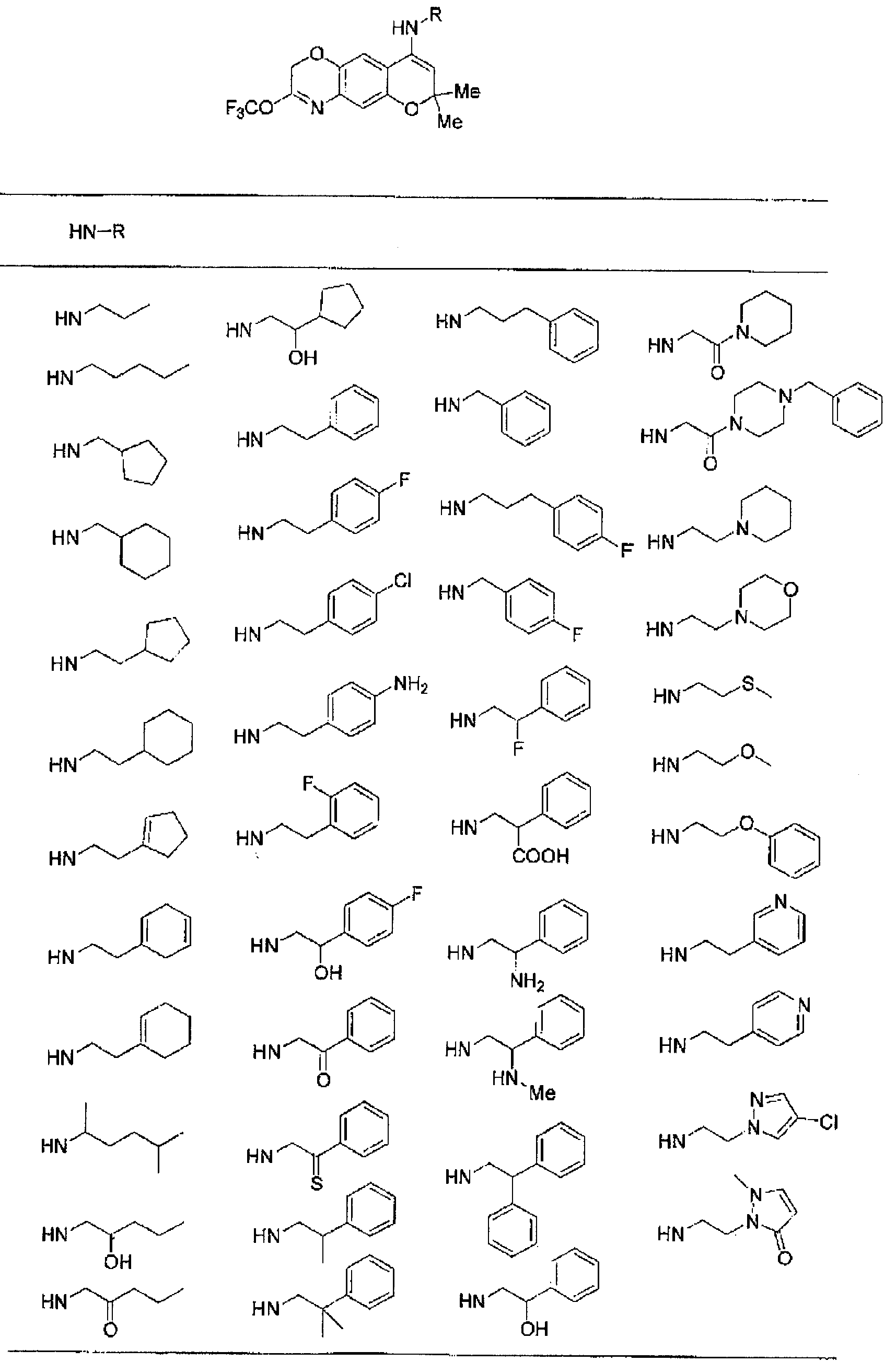
Реферат
Данное изобретение относится к производным бензопирана формулы (I) или (II) ! ! или их фармацевтически приемлемым солям, где R1 и R2 независимо представляют собой атом водорода или C1-6алкильную группу, R3 представляет собой гидроксигруппу, R4 представляет собой атом водорода, m представляет собой целое число от 1 до 4, n представляет собой целое число от 0 до 4, V представляет собой простую связь, CR7R8 или NR9, R5 представляет собой атом водорода, R6 представляет собой атом водорода, C1-6алкильную группу, С3-8циклоалкильную группу, С3-8циклоалкенильную группу, аминогруппу, C1-6алкиламиногруппу, С6-14арильную группу, ! С2-9гетероарильную группу или С2-9 гетероциклическую группу, А представляет собой 5- или 6-членное кольцо, конденсированное с бензольным кольцом, в составе кольца могут содержаться атом кислорода, атом азота или атом серы в количестве от 1 до 3 или по отдельности, или в сочетании, число ненасыщенных связей в кольце равно 1, 2 или 3, включая ненасыщенную связь в конденсированном бензольном кольце, атомы углерода в составе кольца могут представлять собой карбонил или тиокарбонил. Данные соединения могут использоваться в качестве антиаритмических агентов. 12 н. и 35 з.п. ф-лы., 1 табл.
Формула


где R1 и R2 независимо представляют собой атом водорода или C1-6 алкильную группу;
R3 представляет собой гидрокси группу;
R4 представляет собой атом водорода;
m представляет собой целое число от 1 до 4;
n представляет собой целое число от 0 до 4;
V представляет собой простую связь, CR7R8, где R7 представляет собой
С1-6 алкильную группу;
гидрокси группу или
C1-6 алкокси группу, и
R8 представляет собой
атом водорода,
С1-6 алкильную группу;
гидрокси группу или
C1-6 алкокси группу, или
V представляет собой NR9, где R9 представляет собой атом водорода или C1-6 алкильную группу;
R5 представляет собой атом водорода;
R6 представляет собой
атом водорода,
С1-6 алкильную группу,
С3-8 циклоалкильную группу, С3-8 циклоалкенильную группу,
аминогруппу, C1-6 алкиламиногруппу;
С6-14 арильную группу, C2-9 гетероарильную группу или C2-9 гетероциклическую группу (где каждая из арильной группы, гетероарильной группы или гетероциклической группы может быть необязательно замещена атомом галогена, C1-6 алкильной группой, С6-14 арильной группой (где арильная группа может быть необязательно замещена 1-3 атомами галогена) или аминогруппой);
А представляет собой




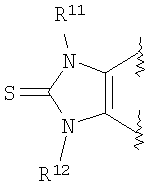






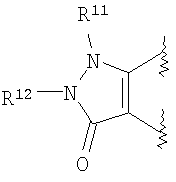


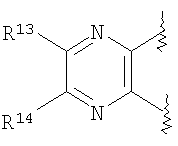
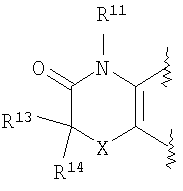





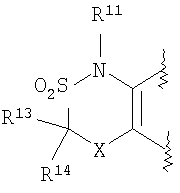


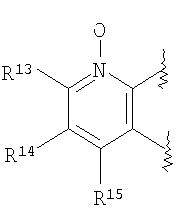


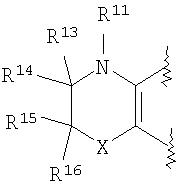

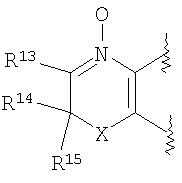


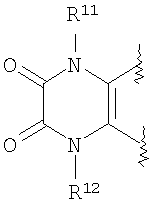
где R11 и R12 независимо представляют собой атом водорода, C1-6 алкильную группу (где алкильная группа может быть необязательно замещена фенильной группой), R13, R14, R15 и R16 независимо представляют собой атом водорода, атом галогена, C1-6 алкильную группу (где алкильная группа может быть необязательно замещена аминогруппой или гидрокси группой), гидрокси группу, фенильную группу, цианогруппу, аминокарбонильную группу, C1-6 алкилкарбонильную группу или карбоксильную группу, и
Х представляет собой О, S, SO или SO2.
R1 и R2 представляют собой метильную группу.
R6представляет собой 2-пиридильную группу, 3-пиридильную группу или 4-пиридильную группу.
С6-14 арильную группу или С2-9 гетероарильную группу, где каждая арильная группа или гетероарильная группа может быть необязательно замещена 1-3 атомами галогена или аминогруппами, и когда присутствует множество заместителей, они могут быть одинаковыми или отличаться друг от друга.
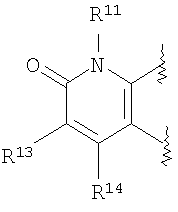


где R11, R13, R14 и R15 имеют вышеуказанные значения.
R14представляет собой атом водорода, и R15 представляет собой атом водорода или C1-6 алкильную группу (где алкильная группа может быть необязательно замещена аминогруппой или гидрокси группой).
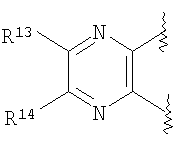


где R11, R12, R13 и R14 имеют вышеуказанные значения.
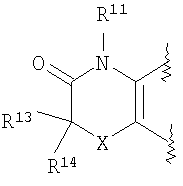
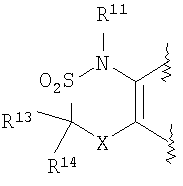
где R11, R13 и R14 имеют вышеуказанные значения.



где R11, R12, R13 и R14 имеют вышеуказанные значения.
2,2,7,9-тетраметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
2,2,7-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
3-гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-7-карбонитрил,
3-гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]xинoлин-7-кapбoкcaмид,
{3-гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-7-ил}этанон,
3,3-диметил-1-[(2-фенилэтил)амино]-2,3-дигидро-1Н-пирано[3,2-f]хинолин-2-ол,
7-гидроксиметил-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
3-гидрокси-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-7-карбоновую кислоту,
4-(бензиламино)-7-хлор-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
4-{[(1,3-бензодиоксол-5-ил)метил]амино}-7-хлор-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-[(3-фенилпропил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(4-фторфенил)этил]амино}-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(2-фторфенил)этил]амино}-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(4-хлорфенил)этил]амино}-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
4-{[2-(4-аминофенил)этил]амино}-7-хлор-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-[(2-гидрокси-2-фенилэтил)амино]-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-[(2-фенилбутил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
4-{[2-(1,3-бензодиоксол-5-ил)этил]амино}-7-хлор-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(1-пиперидинил)этил]амино}-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(1-метил-2-пирролидинил)этил]амино}-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
4-[(2-анилиноэтил)амино]-7-хлор-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-({2-[этил(3-метилфенил)амино]этил}амино)-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[(1-этил-(R)-2-пирролидинил)метил]амино}-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-[(2,2-диэтоксиэтил)амино]-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(3-тиенил)этил]амино}-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
4-[2-(1Н-пиразол-1-ил)этиламино]-7-хлор-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(4-метилпиразол-1-ил)этил]амино}-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(4-хлорпиразол-1-ил)этил]амино}-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(2-пиридил)этил]амино}-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(3-пиридил)этил]амино}-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(4-пиридил)этил}амино}-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-xлop-4-этилaминo-2,2,9-тpимeтил-3,4-дигидpo-2H-пиpaнo[2,3-g]xинoлин-3-oл,
7-xлop-4-изoбyтилaминo-2,2,9-тpимeтил-3,4-дигидpo-2H-пиpaнo[2,3-g]xинoлин-3-oл,
7-хлор-4-[(циклопропилметил)амино]-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-изопентиламино-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-[(2-циклопентилэтил)амино]-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(1-циклопентенил)этил]амино}-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-[(5-метилгексан-2-ил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-xлop-2,2,9-тpимeтил-4-пeнтилaминo-3,4-дигидpo-2H-пиpaнo[2,3-g]xинoлин-3-oл,
7-хлор-4-[(2-циклогексилэтил)амино]-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(тетрагидропиран-4-ил)этил]амино}-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-[{2-(4-тианил)этил}амино]-3,4-дигидро-2Н-пирано [2,3-g]хинолин-3-ол,
7-хлор-4-([6-(4-хлорфенил)-3-пиридинил]метил}амино)-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
4-[(2-бензофурилметил)амино]-7-хлор-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-[(2-гидроксипентил)амино]-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7,7-димeтил-9-[(2-фeнилэтил)aминo]-8,9-дигидpo-7H-пиpaнo[2,3-g]xинoкcaлин-8-oл,
9-{[2-(2-фторфенил)этил]амино}-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол,
9-{[2-(4-фторфенил)этил]амино}-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол,
9-[(2-гидрокси-2-фенилэтил)амино]-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол,
7,7-димeтил-9-пeнтилaминo-8,9-дигидpo-7H-пиpaнo[2,3-g]xинoкcaлин-8-oл,
2,2,7,7-тeтpaмeтил-9-[(2-фeнилэтил)aминo]-8,9-дигидpo-7H-пиpaнo[2,3-g]xинoкcaлин-8-ол,
2,3-диэтил-7,7-диметил-9-[(2-фенилэтил)амино]-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол,
3,3,7-триметил-9-[(2-фенилэтил)амино]-2-фенил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол,
2,7,7-триметил-9-[(2-фенилэтил)амино]-3-фенил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол,
3,3,7-триметил-9-[(2-фенилэтил)амино]-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол,
9-[(2-циклогексилэтил)амино]-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хинолин-8-ол,
7-гидрокси-6,6-диметил-8-[(2-фенилэтил)амино]-3,6,7,8-тетрагидрохромено[7,6-d]имидазол-2(1Н)-он,
7-гидрокси-6,6-диметил-8-[(2-фенилэтил)амино]-4,6,7,8-тетрагидро-1,5-диокса-4-азаантрацен-3-он,
7-гидрокси-4,6,6-триметил-8-[(2-фенилэтил)амино]-4,6,7,8-тетрагидро-1,5-диокса-4-азаантрацен-3-он,
6,6-диметил-8-[(2-фенилэтил)амино]-2,3,4,6,7,8-гексагидро-1,5-диокса-4-азаантрацен-7-ол,
7-гидрокси-6,6-диметил-8-[(2-фенилэтил)амино]-1,6,7,8-тетрагидро-4,5-диокса-1-азаантрацен-2-он,
6,6-диметил-8-[(2-фенилэтил)амино]-1,2,3,6,7,8-гексагидро-4,5-диокса-1-азаантрацен-7-ол,
9-гидроксиметил-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
2,2,9-тpимeтил-4-[(2-фeнилэтил)aминo]-3,4-дигидpo-2H-пиpaнo[2,3-g]xинoлин-3,7-диол,
7-аминометил-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-6λ5-окси-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(4-фторфенил)этил]амино}-2,2,9-триметил-6λ5-окси-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-xлop-2,2,9-тpимeтил-6λ5-oкcи-4-пeнтилaминo-3,4-дигидpo-2H-пиpaнo[2,3-g]xинoлин-3-ол,
4-{[2-(4-фторфенил)этил]амино}-7-гидроксиметил-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол или
2,2-димeтил-4-[(2-фeнилэтил)aминo]-3,4-дигидpo-2H-пиpaнo[2,3-g]xинoлин-3-oл.
2,2,7-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
3,3-диметил-1-[(2-фенилэтил)амино]-2,3-дигидро-1Н-пирано[3,2-g]хинолин-2-ол,
7-гидроксиметил-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(4-фторфенил)этил]амино}-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(2-фторфенил)этил]амино}-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(4-хлорфенил)этил]амино}-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
3-гидрокси-2,2,9-триметил-4-[2-(фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-7-карбоновую кислоту,
4-{[2-(4-аминофенил)этил]амино}-7-хлор-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-[(2-гидрокси-2-фенилэтил)амино]-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(1-пиперидинил)этил]амино}-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-([2,3-хлорпиразол-1-ил)этил]амино}-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(2-пиридил)этил]амино}-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(3-пиридил)этил]амино}-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-4-{[2-(4-пиридил)этил]амино}-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-xлop-4-изопентиламино-2,2,9-триметил-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-[(2-циклопентилэтил)амино]-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(1-циклопентенил)этил]амино}-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-xлop-2,2,9-тpимeтил-4-пeнтилaминo-3,4-дигидpo-2H-пиpaнo[2,3-g]xинoлин-3-oл,
7-хлор-4-[(2-циклогексилэтил)амино]-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-[(2-гидроксипентил)амино]-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7,7-димeтил-9-[(2-фeнилэтил)aминo]-8,9-дигидpo-7H-пиpaнo[2,3-g]xинoкcaлин-8-oл,
9-{[2-(2-фторфенил)этил]амино}-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол,
9-{[2-(4-фторфенил)этил]амино}-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол,
9-[(2-гидрокси-2-фенилэтил)амино]-7,7-диметил-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол,
7,7-диметил-9-пентиламино-8,9-дигидро-7Н-пирано[2,3-g]хиноксалин-8-ол,
9-[(2-циклoгeкcилэтил)aминo]-7,7-димeтил-8,9-дигидpo-7H-пиpaнo[2,3-g]xинoкcaлин-8-ол,
7-гидрокси-6,6-диметил-8-[(2-фенилэтил)амино]-4,6,7,8-тетрагидро-1,5-диокса-4-азаантрацен-3-он,
7-гидрокси-4,6,6-триметил-8-[(2-фенилэтил)амино]-4,6,1,8-тетрагидро-1,5-диокса-4-азаантрацен-3-он,
7-гидрокси-6,6-диметил-8-[(2-фенилэтил)амино]-7,8-дигидро-1Н,6Н-4,5-диокса-1-азаантрацен-2-он,
9-гидроксиметил-2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
2,2,9-тpимeтил-4-[(2-фeнилэтил)aминo]-3,4-дигидpo-2H-пиpaнo[2,3-g]xинoлин-3,7-диол,
7-аминометил-2,2,9-триметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-2,2,9-триметил-6λ5-окси-4-[(2-фенилэтил)амино]-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-хлор-4-{[2-(4-фторфенил)этил]амино}-2,2,9-триметил-6λ5-окси-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол,
7-xлop-2,2,9-тpимeтил-6λ5-oкcи-4-пeнтилaминo-3,4-дигидpo-2H-пиpaнo[2,3-g]xинoлин-3-ол,
4-{[2-(4-фторфенил)этил]амино}-7-гидроксиметил-2,2,9-триметил-3,4-дигидро-2Н-пирано[2,3-g]хинолин-3-ол или
2,2-диметил-4-[(2-фенилэтил)амино]-3,4-дигидро-2H-пирано[2,3-g]хинолин-3-ол.
Документы, цитированные в отчёте о поиске
Способ оптического разделения пиранобензоксадиазольного соединения












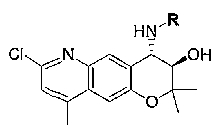



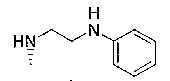

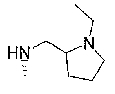
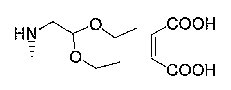


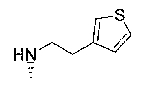
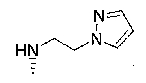
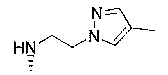
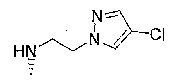

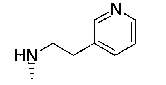











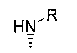

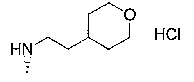


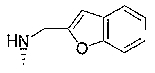

Комментарии