Способ оптического разделения пиранобензоксадиазольного соединения - RU2026297C1
Код документа: RU2026297C1
Чертежи

Описание
Изобретение относится к способам оптического разделения пиранобензоксадиазольного соединения, которые являются важным промежуточным продуктом при синтезе оптически активного производного пиранобензоксадиазола, полезного при лечении гипертензии (артериальной гипертонии) и астмы.
В форме рацемической смеси, как это описано в
Выкладке патента Японии N 49788/1990 и в патенте США N 4900752, получается производное пиранобензоксадиазола формулы III
O

когда R1 - атом водорода, R2 - атом водорода, группа С(Z) CH3-nXn, в которой Z представляет атом кислорода или атом серы, а Х и n являются такими, как это определено выше, или группа С(Z) NHCH3-nXn, в которой Z и n представляют такими, как этом определено выше; и когда R1 не представляет атом водорода, R1 и R2 - вместе группа (СН2)m-1C(Z), где m - целое число 4 или 5, Z определено выше, группу (СН2)m-2 NHC(Z) или группу (СН2)m-2OC(Z), где Z и m являются такими, как это определено выше.
Соединение III проявляет интенсивные сосудорасширяющие и гипотензивные (понижающие артериальное давление) активности и таким образом, как это ожидается, являются полезными в качестве лекарственного средства для лечения гипертензии, стенокардии, аритмии, нарушений мозгового кровообращения, астмы.
Как это описано в выкладке патента Японии N 49788/1990, соединение III может быть синтезировано следующим образом. Схема реакции 1.







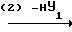
В приведенных выше схемах реакции, Y представляет уходящую группу, такую как атом галогена (например атом хлора, брома или йода), ацетокси-группа или трифторацетокси-группа;
Y1 представляет атом хлора, атом брома, атом йода, орто- или пара-толуолсульфонатную группу или метансульфонатную группу; и
m, n и Х являются такими, как это определено выше.
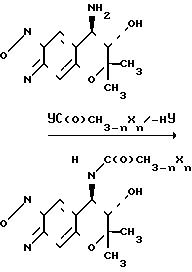
Соединение (А), которое является соединением III, в котором R1представляет атом водорода, может быть получено путем взаимодействия пиранобензоксадиазольного соединения, которое получается в форме рацемической смеси (в кратце называется как соединение (± I) в дальнейшем), с ацилирующим реагентом YС(О)-СН3-nXn, в котором Х, Y и n являются такими, как это определено выше, необязательно в присутствии основания (относится к схеме реакции 1).
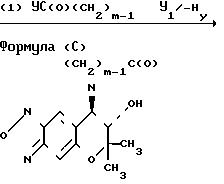
Соединение (В), которое является соединением (III), в котором R1представляет атом водорода, может быть получено путем взаимодействия соединения (± I) с изоцианатом С(О)NCH3-nXn или изотиоцианатом XnCH3-nNC(S), в котором Х, Z и n являются такими, как это определено выше (относится к схеме реакции 2). Соединение (С), которое является соединением (III), в котором R1 и R2 вместе представляют группу (СН2)m-1C(O), может быть получено путем взаимодействия соединения (± I) с ацилирующим реагентом YC(O)(CH2)m-1 Y1, в котором Y, Y1 и m являются такими, как это определено выше, необязательно в присутствии основания, а затем циклизацией продукта реакции необязательно в присутствии основания (относится к схеме реакции 3).
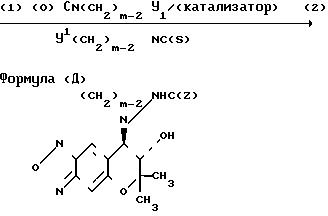
Соединение (Д), которое является соединением III, где R1 и R2вместе представляют группу (СН2)m-2 NHC(Z), где Z и m являются такими, как это определено выше, может быть получено путем взаимодействия соединения ( ±I) с изоцианатом (O)CN(CH2)m-2Y1 или изотиоцианатом (S)CN(CH2)m-2Y1, в которой Y1 и m являются такими, как это определено выше, а затем циклизацией продукта реакции необязательно в присутствии основания (относится к схеме реакции 4).
Соединение (Е), которое является соединением (III), в котором R1 и R2 вместе представляют группу СН2)m-2OC(O), в которой m является таким, как это определено выше, может быть получено путем взаимодействия соединения ( ± I) с галогенкарбонатом YC(O)O(CH2)m-2Y1, в котором Y, Y1и m являютсят такими, как это определено выше, необязательно в присутствии основания, а затем циклизацией продукта реакции необязательно в присутствии основания (относится к схеме реакции 5).
В указанных схемах реакции, соединение III, в котором Z является атомом серы, может быть получено сульфирирование соответствующего соединения, в котором Z является атомом кислорода, с помощью реагента Ловиссона.
Как описывается в выкладке патента Японии N 49788/1990, соединение ( ±I) может быть получено следующим образом.
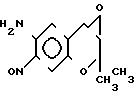

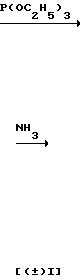
Соединение ( ±I) может быть получено путем обработки известного соединения (F) с гипохлоритом натрия, восстановлением N-оксидной группы соединения (С), полученного таким образом, с помощью восстановителя, такого как триэтилфосфит, а затем взаимодействием полученного таким образом соединения (Н) с аммиаком в инертном растворителе.
Однако нигде не сообщено об оптическом разделении соединения (±I).
Кроме того, упомянутое рацемическое соединение III, которое обладает асимметрическими атомами углерода в положениях 3 и 4 пиранового цикла, имеет два оптических изомера (соединения (IIIж) и (IIIжж)). Однако упомянутая выкладка патента Японии N 49788/1990 не описывает ни эти оптически активные производные пиранобензоксадиазола, ни какой-либо способ получения этих оптически активных производных.
В медицине часто наблюдается, что оптические изомеры отличаются друг от друга по фармакологической активности и безопасности (безвредности). Поэтому является желательным оптически разделять эти изомеры для того, чтобы разрабатывать лучшие лекарственные средства.
Обнаружено, что оптически активное производное пиранобензоксадиазола [соответствующее соединению (IIIж)], которое синтезируется через оптически активное пиранобензоксадиазольное соединение, показывающее правое вращение в этаноле [соответствующее соединению ( ±I), которое будет описано ниже], заметно является превосходным по сравнению с оптически активным производным пиранобензоксадиазола [соответствующим соединению (IIIжж)], которое синтезируется через энантиомер [соответствующий соединению (-)I, которое будет описано ниже] , с точки зрения лекарственной активности, определяя таким образом цельность изобретения.
Таким образом, изобретение относится к способу оптического разделения соединения ( ±I), который включает реакцию взаимодействия
пиранобензоксадиазольного соединения формулы ( ±I)
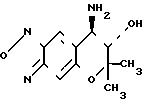
HO
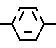

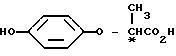
Соединение II, которое является оптически активным разделяющим реагентом и встречается в виде двух оптических изомеров соединения ([+] II) и ([-] II), мождет быть синтезировано по методу, описанному в выкладке патента Японии N 83144/1986.
Теперь способ оптического разделения соединения ( ±I) на соединение ([+] I) и его антипод, а именно, соединение ([-] I), будет описан подробно. Схема реакции 1
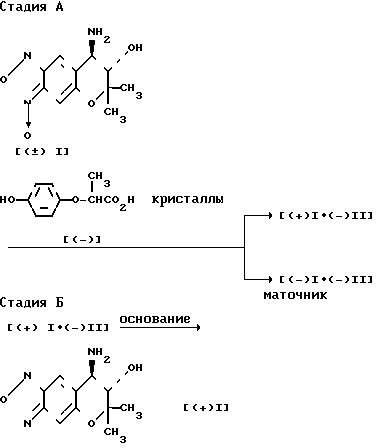
В стадии А, соединение (± I) подвергается взаимодействию с соединением ([-] II), которое используется в качестве оптически активного разделяющего реагента, и кристаллизуется. Таким образом диастереомерная соль ([+] I ˙ [-] II) может быть легко получена в форме кристаллов.
Однако должны здесь отметить, что полученные кристаллы могут быть сольватированы в зависимости от используемого растворителя (см. примеры).
Подобным образом диастереомерная соль ([-] I ˙[+] II) может быть легко получена при использовании соединения ([+] II) в качестве оптически активного разделяющего реагента.
Таким образом соответствующий оптический изомер соединения (± I) может быть легко получен, выбирая соответствующим образом разделяющий реагент.
В качестве растворителя, который используется в стадии А, предпочтительными являются кетоны, такие как ацетон и метил-изобутилкетон, хотя настоящее изобретение не ограничивает выбора растворителя. В этом случае диастереомерная соль кристаллизуется в форме сольвата.
Температура реакции обычно может варьировать от -20 до 100оС, предпочтительно от 10 до 30оС.
Температура кристаллизации обычно может варьировать в пределах от -20 до 50оС, предпочтительно от -10 до 20оС.
Выкристаллизованная таким образом диастереомерная соль может быть дополнительно перекристаллизована, например из ацетона, тем самым получая кристаллическую диастереомерную соль с высокой чистотой.
В стадии Б, кристаллическая диастереомерная соль ([+] I ˙ [-] II) или ее сольват подвергается реакции с основанием, выбираемым из следующих - бикарбоната натрия, бикарбоната калия, карбоната натрия, карбоната калия, гидроокиси натрия и гидроокиси калия. Таким образом целевое соединение ([+] I), показывающее правое вращение в этаноле, может быть легко получено.
Подобным образом, соединение ([-] I) может быть легко получено из диастереомерной соли ([-] I ˙ [+] II) или ее сольвата.
Оптическая чистота соединения ([+] I) может быть определена путем взаимодействия указанного соединения с метил-изоцианатом,
получая тем самым соединение мочевины формулы ([+] IV)
O
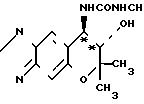
Оптическая чистота соединения ([-] I) может быть определена подобным путем.
Как будет видно в примере испытаний, соединение (IIIж), полученное из соединения ([+] I) в соответствии с методом, описанным в патенте Японии N 49788/1990, показывает исключительно высокую активность при понижении кровяного давления, по сравнению с энантиомером (соединение (IIIжж)), полученным из соединения ([-] I).
Поэтому очевидно, что применение соединения (III*) при лечении, например, гипертензии является более эффективным, чем применение соединения (III).
Анализ с использованием оптически активной жидкостной хроматографической колонки (Чиралсел ОС, производимый фирмой Дэйсел Кемикал Индастриз Лимитед) доказывает, что не происходит рацемизации во время получения соединения (IIIж) из соединения ([+] I) или получения соединения (IIIжж) из соединения ([-] I).
(1) Пример испытаний (гипотензивная активность).
Соединения (IIIж) и (IIIжж) были каждый по отдельности растворены или суспендированы в 0,5% -ном водном растворе метилцеллюлозы и принудительно внесены пероральным путем трем самцам спонтанно гипертензивных крыс 11-недельного возраста с использованием желудочного зонда.
Животные были предварительно обогреты в обогреваемом ящике при 50оС в течение 3-5 мин, а затем перенесены в ограничительную клетку при 37оС, чтобы измерить систолическое кровяное давление методом хвостовой манжетки (К11-210-1, производимой Натсуме Сейсакушко Ко., Лимитед). В табл. 1 приведены проценты понижения кровяного давления спустя 1 ч после введения лекарственного средства. Каждая величина представляет среднее значение от трех животных, подвергнутых испытанию.
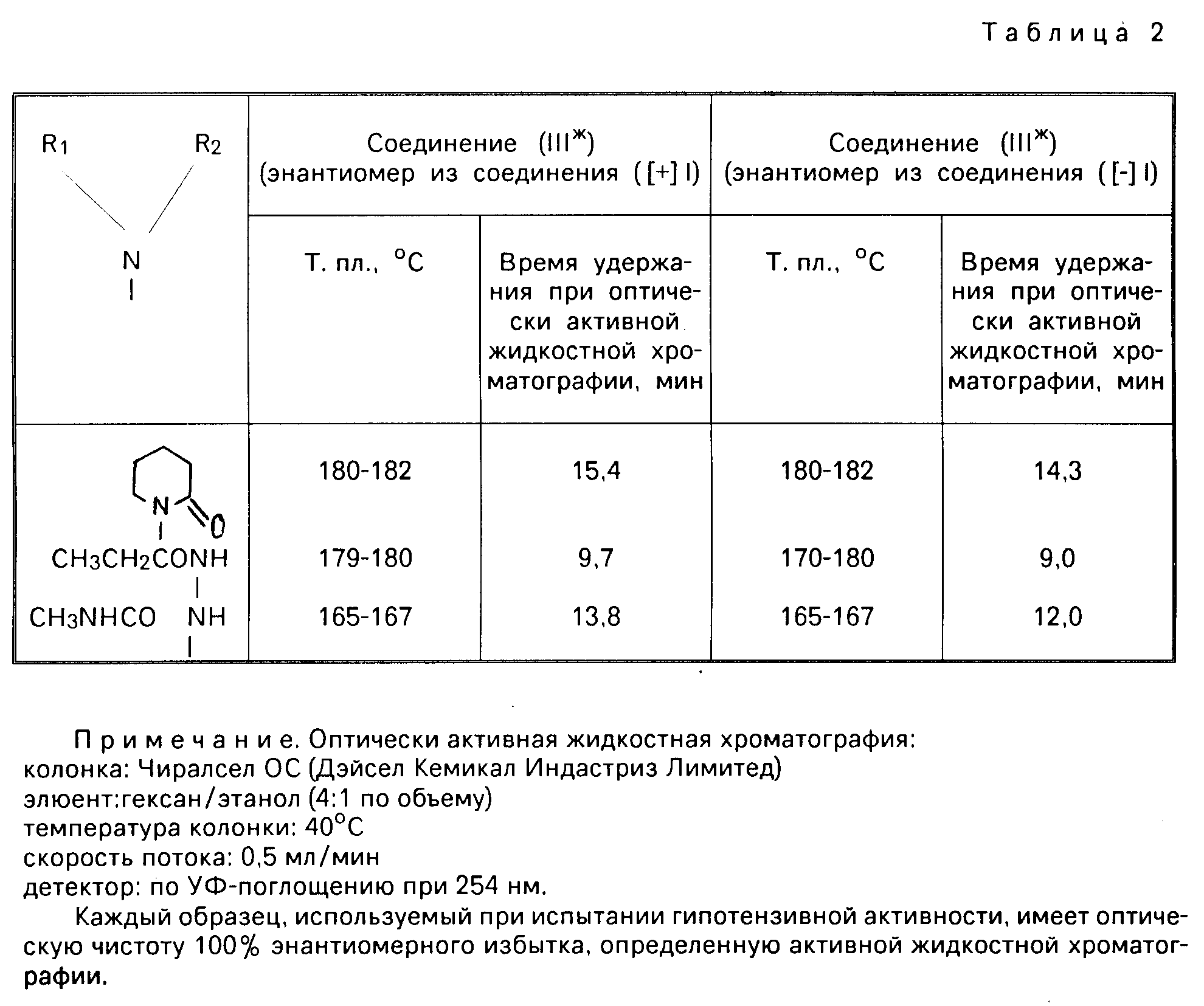
В табл. 2 приведены аналитические данные соединений (IIIж) и (IIIжж).
П р и м е р 1. Стадия А: разделение диастереомерной соли (ацетонового сольвата ([+] I ˙ [-] II) и диастереомерной соли (ацетонового сольвата ([-] I ˙ [+] II).
В 100 г ацетона растворяют 117,6 г (0,500 ммоля) [± ] - 7, 8-дигидро-6,6-диметил-7-окси-8-амино-6Н-пирано[2,3-f] бенз-2,1,3-оксадиазола (соединение ([± ] I)) и 92,9 г (0,510 ммоля) (-)-2-(4-оксифенокси)-пропионовой кислоты (соединение ([-] II)) и смесь перемешивают в течение 3 ч при охлаждении со льдом.
Выпадающие таким образом в осадок кристаллы фильтруют путем отсасывания, промывают с помощью 500 мл охлажденного льдом ацетона и высушивают при пониженном давлении. Таким образом получают 64,6 г диастереомерной соли (ацетоновый сольват ([+] I ˙[-] II)) в форме светло-желтых кристаллов (выход: 27,2%, оптическая чистота: 95,7% энантиомерного избытка).
Эту диастереомерную соль (ацетоновый сольват ([+] I ˙[-] II)) нагревают при кипячении с обратным холодильником в 270 г ацетона, а затем отгоняют 77 г ацетона. Остаток кристаллизуют при охлаждении со льдом в течение 2 ч. Таким образом оптическая чистота диастереомерной соли (ацетонового сольвата ([+] I ˙ [-] II)) повышается до 100% энантиомерного избытка (выход 80%).
При измерении т. пл. этого вещества оно начинает медленно разлагаться примерно при 102оС. В результате неводного титрования с помощью хлорной кислоты в уксусной кислоте в качестве растворителя было подтверждено, что одна молекула ацетона находится в сольватной форме.
С другой стороны, фильтраты объединяют и ацетон удаляют из фильтратов. Затем к остатку добавляют 1500 мл этилацетата, 1000 мл воды, 32,8 г (0,39 ммоля) бикарбоната натрия и 200 г хлористого натрия и смесь встряхивают.
Полученный раствор оставляют стоять, чтобы тем самым вызвать разделение фаз. Этилацетатную фазу собирают и к ней добавляют 200 мл воды, 6,56 г (0,078 ммоля) бикарбоната натрия и 40 г хлористого натрия. Полученную смесь снова встряхивают и оставляют стоять, чтобы тем самым вызвать разделение фаз.
Полученную таким образом этилацетатную фазу высушивают путем добавления безводного сульфата натрия и фильтруют, а затем из нее отгоняют этилацетат. Таким образом получают 94,7 г коричневого твердого вещества.
Это коричневое твердое вещество и 73,4 г (0,403 ммоля) [+]-2-(4-оксифенокси)-пропионовой кислоты (соединение ([+] II) растворяют в 700 г ацетона и перемешивают в течение 3 ч при охлаждении со льдом.
Выпадающие в осадок таким образом кристаллы фильтруют путем отсасывания, промывают с помощью 280 мл охлажденного льдом ацетона, а затем высушивают при пониженном давлении. Таким образом получают 75,79 г диастереомерной соли ([-] I ˙ [+] II) ацетоновой сольват) в форме светло-желтых кристаллов (выход 31,9%, оптическая чистота: 100% энантомерного избытка).
При измерении т.пл. этого продукта реакции он начинает медленно разлагаться примерно при 102оС. В результате неводного титрования с помощью хлорной кислоты в уксусной кислоте подтверждено, что одна молекула ацетона сольватирована.
Стадия Б: разделение соединений ([+] I) и ([-] I) Формула ([+] I)
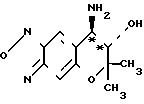
К 66,7 г (0, 140 ммоля) диастереомерной соли (ацетоновый сольват ([+] I ˙ [-] II) добавляют 1000 мл этилацетатa, 700 г воды, 17,0 г (0,160 ммоля) карбоната натрия и 140 г хлористого натрия, за которым следует встряхивание, и оставляют стоять, чтобы тем самым вызывать разделение фаз.
Этилацетатную фазу собирают и промывают с помощью 200 мл воды, 2,1 (0,020 ммоля) карбоната натрия и 40 г хлористого натрия.
Кроме того, эту фазу промывают водным раствором хлористого натрия (40 г/200 мл воды). Затем этилацететную фазу высушивают добавлением безводного сульфата натрия и фильтруют. После отгонки этилацетатa получают 32,85 г соединения ([+] I) (выход 96%).
Отдельно, диастереомерную соль (ацетоновый сольват ([-] I ˙[+] I) обрабатывают подобным
образом, как это описано выше. Таким образом получают соединение ([-] I). (аналитичные данные): т.пл.: 145-146оС (для обоих соединений ([+] I) и ([-] I)). Оптическое вращение:
соединение ([+] I): [α ]Д25 + 189о (С = =0,050, этанол
соединение ([-] I): [α ]Д25 - 189о (С = =0,50, этанол)
Оптическая чистота определяется при условиях, указанных в табл. 2.
Каждое испытуемое соединение подвергают взаимодействию с метилизоцианатом. Мочевиновое соединение, полученное таким образом, анализируют с использованием оптически активной жидкостной хроматографической колонки (Чиралсел ОС, производимой фирмой Дэйсел Кемикал Индастриз Лимитед).
Каждое из соединений ([+] I) и ([-] I) показывает оптическую чистоту 100% энантомерного избытка.
ЯМР спектр: каждое из обоих соединений ([+] I) и ([-] I) показывает спектр, индентичный со спектром соединения ([± ] I), т.е. рацемической смеси.
ЯМР (СДСl3) + ДМСО-d6) м.д.:
1,26 (3H), 1,49 (3Н), 2,80-3,30 (3Н), 3,33 (1Н), 3,76 (1Н), 6,82 (1Н) и
7,98 (1Н).
П р и м е р 2. Стадия А: разделение диастереомерной соли (метил-изобутил кетоновый сольват ([+] I ˙[-] II) и диастереомерной соли (метил-изобутилкетоновый сольват ([-] I ˙[+] II).
В 27,8 г метилизобутилкетона растворяют 4,70 г (20 ммолей) (± )-7,8-дигидро-6,6-диметил-7-окси-8-амино-6Н-пирано[2,3-f] - бенз-2,1,3- оксадиазола (соединение [± ] I)) и 3,70 г (20,3 ммолей) (-)-2-(4-оксифенокси)-пропионовой кислоты (соединение ([-] II) и раствор перемешивают при 21оС в течение 15 мин.
К полученному таким образом раствору добавляют 10 мг затравочного кристалла (метилизобутилкетонового сольвата [+] I ˙ [-] II). Перемешивание продолжают в течение дополнительных 2 ч, чтобы тем самым выкристаллизовать продукт реакции. Затем прекращают перемешивание и реакционную смесь оставляют стоять в холодильнике в течение ночи.
Выпадающие таким образом кристаллы собирают отсасыванием, промывают с помощью 7,1 г холодного метилизобутилкетона и высушивают при пониженном давлении. Таким образом получают 4,59 г диастереомерной соли (метилизобутилкетонового сольвата [+] I ˙ [-] II) в форме светло-желтых кристаллов (выход 44,4%).
При измерении т.пл. этого продукта реакции он начинает медленно разлагаться примерно при 95оС. В результате неводного титрования с помощью хлорной кислоты в уксусной кислоте подтверждено, что одна молекула метилизобутилкетона сольватирована.
С другой стороны, фильтраты объединяют и к нему добавляют 28,2 г 20%-ного водного раствора хлористого натрия и 1,22 г (11,5 ммолей) карбоната натрия. Полученную смесь встряхивают, оставляют стоять, чтобы тем самым вызвать разделение фаз. Метилизобутилкетоновую фазу собирают и встряхивают снова вместе с 9,4 г 20%-ного водного раствора хлористого натрия. Затем ее оставляют стоять, чтобы тем самым вызвать разделение фаз.
К полученной таким образом метилизобутилкетоновой фазе добавляют 2,07 г (11,4 ммолей) (+)-2-(4-оксифенокси)-пропионовой кислоты (соединение ([+] II)). После растворения соединения путем перемешивания при комнатной температуре к этому раствору добавляют 10 мг затравочного кристалла (метилизобутилкетонового сольвата ([-] I ˙ [+] 11), чтобы тем самым выкристаллизовать продукт реакции. Затем реакционную смесь оставляют стоять в холодильнике в течение ночи.
Выпадающие таким образом кристаллы фильтруют путем отсасывания, промывают с помощью 7,1 г охлажденного метилизобутилкетона и высушивают при пониженном давлении. Таким образом получают 4,25 г диастереомерной соли (метилизобутилкетонового сольвата ([+] I ˙ [-] II) в виде светло-желтых кристаллов (выход 41,1%).
При измерении т.пл. этого продукта реакции он начинает медленно разлагаться примерно 95оС. В результате неводного титрования с помощью хлорной кислоты в уксусной кислоте подтверждено, что одна молекула метилизобутилкетона сольватирована.
Стадия Б: разделение соединений ([+] I) и ([-] I).
К 4,26 г (8,23 ммолей) диастереомерной соли (метилизобутилкетонового сольвата ([+] I ˙ [-] II), полученной в стадии А, добавляют 53,4 г этилацетата, 42,7 г воды, 0,873 г (8,23 ммолей) карбоната натрия и 10,7 г хлористого натрия, за которым следует встряхивание и оставление стоять, чтобы тем самым вызвать разделение фаз. Этилацетатную фазу собирают и промывают с 14,2 г воды и 3,6 г хлористого натрия.
Этилацетатную фазу высушивают добавлением в нее безводного сульфата натрия и фильтруют. После отгонки 48,6 г этилацетата к остатку добавляют 7,3 г гексана, за которым следует кристаллизация при охлаждении со льдом в течение 3 ч. Затем выпадающие таким образом кристаллы собирают. Таким образом получают 1,84 г соединения ([+] I) (выход 95%).
Диастереомерную соль (метилизобутилкетоновый сольват ([-] I ˙ [+] II) образуют таким же образом, что и описанный выше.
Таким образом получают соединение ([-] I).
Соединения ([+] I) и ([-] I) показывают, каждое из них, оптическую чистоту 100% энантиомерного избытка. Рекомендуемый пример 1.
Синтез (+)-7,8-дигидро-6,6-диметил-7-окси-8-(н-(1-оксо-5-хлор)-пентил)-амино
-6Н-пирано[2,3-f] бенз-2,1,3-оксадиазола (интермедиат) Формула (+)-формы
O
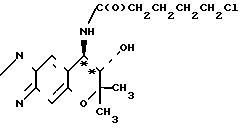
715 мг (3,04 ммоля) (+)-7,8-дигидро-6,6-диметил-7-окси-8-амино-6Н-пирано[2,3-f] бенз-2,1,3 -оксадиазола (соединение [+] I), 470 мкл триэтиламина и 70 мл хлористого метилена перемешивают при комнатной температуре. К полученному раствору добавляют 430 мкл (3,34 ммоля) хлорангидрида 5-хлорвалериановой кислоты. После реакции в течение 2 ч реакционную смесь промывают водой трижды. Метилхлористую фазу высушивают над безводным сульфатом натрия и фильтруют. После отгонки растворителя получают названное соединение. Этот продукт реакции далее не очищают каким-либо образом, но как таковой подвергают следующей реакции.
(б) Синтез (+)-7,8-дигидро-6,6-диметил-7-окси-8-(2-оксо-пиперидинил)-6Н -пирано[2,3-f] бенз-2,1,3-оксадиазола (соответствующего соединению (IIIж)) Формула
(+)-формы
O

В 200 мл ацетона суспендируют 1,08 г (+)-7,8-дигидро-6, 6-диметил-7-окси-8-(н-(1-оксо-5-хлор)-пентил) -амино-6Н-пирано[2,3-f]бенз-2,1,3-оксадиазола, 8,40 г (60,8 ммолей) карбоната калия и 1,01 г (6,08 ммолей) йодистого калия и смесь нагревают при кипячении с обратным холодильником в течение 10 ч в атмосфере азота.
После охлаждения нерастворимые вещества отфильтровываюи и фильтрат разбавляют этилацетатом, промывают водой дважды и рассолом (соляным раствором) один раз и высушивают над безводным сульфатом натрия.
После отгонки растворителя остаток обрабатывают на препаративной силикагелевой тонкослойной хроматографии (проявляющий растворитель: этилацетат). Таким образом получают 40 мг названного соединения (выход 4%). Некоторую часть этого продукта реакции кристаллизуют затем из этилацетата, чтобы тем самым получить светло-желтые кристаллы.
Аналитические данные: т.пл. 180-182оС. Оптическая чистота: 100% энантиомерного избытка (см. табл. 2). Рекомендуемый пример 2.
Синтез (-)-7,8-дигидро-6,6-диметил-7-окси-8-(п-1-оксо-5-хлор)-пентил-амино -6Н-пирано[2,3-f] бенз-2,1,3-оксадиазола (интермедиат) Формула (-)-формы
O
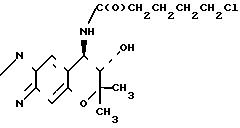
При комнатной температуре перемешивают 769 мг (3,27 ммоля) (-)-7,8-дигидро-6,6-диметил-7-окси-8-амино-6Н-пирано[2,3-f] бенз -2,1, 3-оксадиазола (соединение [-] I), 500 мкл (3,60 ммолей) триэтиламина и 70 мл хлористого метилена. К полученному раствору добавляют 465 мкл (3,60 ммолей) хлорангидрида 5-хлорвалериановой кислоты. После реакции взаимодействия в течение 2 ч, реакционную смесь промывают водой трижды. Метиленхлористую фазу высушивают над безводным сульфатом натрия и фильтруют. После отгонки растворителя получают названное соединение.
Этот продукт реакции далее не очищают каким-либо образом, но как таковой используют в следующей реакции.
(б) Синтез (-)-7,8-дигидро-6, 6-диметил-7-окси-8-(2-оксо-1-пиперидинил)-6Н-пирано [2,3-f] бенз-2,1,3-оксадиазола (соответствует соединению (IIIжж)).
Формула (-)-формы
O

В 200 мл ацетона суспендируют 1,16 г (-)-7,8-дигидро-6, 6-диметил-7-окси-8-п-(1- оксо-5-хлор)-пентил)-амино-6Н- пирано[2,3-f] бенз-2,1,3-оксадиазола, 9,04 г (65,4 ммолей) карбоната калия и 1,09 г (6,54 ммолей) йодистого калия и смесь нагревают при кипячении с обратным холодильником в течение девяти часов в атмосфере азота.
После охлаждения нерастворимые вещества отфильтровывают и фильтрат разбавляют этилацетатом, промывают водой дважды и рассолом один раз и высушивают над безводным сульфатом натрия.
После отгонки растворителя остаток обрабатывают с помощью препаративной тонкослойной хроматографии на силикагеле (проявляющий растворитель: этилацетат). Таким образом получают 47 мг названного соединения (выход 5%). Некоторую часть этого продукта реакции кристаллизуют затем из этилацетата, чтобы тем самым получить светло-желтые кристаллы. Аналитические данные: т. пл. 180-182оС. Оптическая чистота: 100% энантиомерного избытка (см. табл. 2). Рекомендуемый пример 3.
Синтез (+)-7,
8-дигидро-6,6-диметил-7-окси-8-пропиониламино-6Н- пирано-[2,3-f] -бенз-2,1,3-оксадиазола (соответствует соединению (IIIж)). Формула (+)-формы
O


При комнатной температуре перемешивают 1,29 г (5,48 ммолей) (+)-7,8-дигидро-6,2-диметил-7-окси-8-амино-6Н-пирано-[2,3-f] бенз-2,1, 3-оксадиазола (соединение [+] I), 690 мг (6,8 ммолей) триэтиламина и 40 мл хлористого метилена, добавляя при этом к смеси 610 мг (6,6 ммолей) пропионилхлорида (хлорангидрид пропионовой кислоты). Смесь перемешивают при комнатной температуре в течение 4 ч. Реакционную смесь экстрагируют с помощью 600 мл этилацетата и 300 мл воды. Органическую фазу собирают и высушивают над безводным сульфатом натрия. Фильтрат и остаток, полученный после отгонки растворителя, кристаллизуют из смеси растворителей, содержащей 10 г этилацетата и 5 г гексана, оставляют стоять в холодильнике в течение ночи, а затем фильтруют путем отсасывания. Полученные кристаллы промывают с помощью 3 мл смеси этилацетата/гексана (2:1) дважды и высушивают при пониженном давлении, чтобы тем самым получить названное соединение в виде бесцветного вещества. Аналитические данные: т.пл. 170-180оС. Оптическая чистота: 100% э. т. (см. табл. 2). Рекомендуемый пример 4.
Синтез (-)-7,8-дигидро-6,
6-диметил-7-окси-8-пропиониламино-6Н-пирано-[2,3-f] бенз-2,1,3-оксадиазола (соответствующего соединению (IIIжж) Формула (-)-формы
O
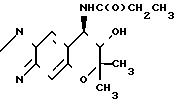
При комнатной температуре перемешивают 52 мг (0,22 ммоля) (-)-7,8-дигидро-6,6-диметил-7-окси-8-(н-(1-оксо-5-хлор)-пентил)-амино-6Н-пир ано-[2, 3-f] -бенз-2,1,3-оксадиазола (соединение) (-) 1), 34 мкл (0,24 ммоля) триэтиламина и 5 мл хлористого метилена, добавляя при этом к смеси 21 мкл (0,24 ммоля) пропионил-хлорида. Смесь перемешивают при комнатной температуре в течение 6 ч.
После завершения реакции реакционную смесь промывают водой трижды и высушивают над безводным сульфатом магния. После отгонки растворителя остаток перекристаллизовывают из этанола, чтобы тем самым получить 15 мг названного чистого соединения (выход 23%). Аналитические данные: т.пл. 179-180оС. Оптическая чистота: 100% э.и. (см. табл. 2). Рекомендуемый пример 5.
Синтез (+)-7,8-дигидро-6,6-диметил-7-окси-8-метилуреидо-6Н-пирано-[2,3-f] -бенз-2,1,3-оксадиазола (соответствующего соединению (+) - IV)
Формула
(+) - формы
O
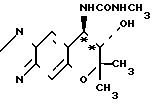
При комнатной температуре перемешивают 300 мг (1,29 ммоля) (+)-7,8-дигидро-6, 6-диметил-7-окси-амино-6Н-пирано-[2,3-f]- бенз-2,1,3- оксадиазола (соединение (+) и I) и 15 мл хлористого метилена. К полученному раствору добавляют 120 мг (2,10 ммоля) метилизоцианата. Смесь перемешивают при комнатной температуре (20оС) в течение 5 ч.
Реакционную смесь кристаллизуют в холодильнике и кристаллы, выпадающие в осадок таким образом, фильтруют. Таким образом получают 214 мг названного соединения в виде бесцветных кристаллов (выход 58%). Аналитические данные: т. пл. 165-167оС. Оптическая чистота: 100% э.и. (см. табл. 2). Рекомендуемый пример 6.
Синтез (-)-7,8-дигидро-6,6-диметил-7-окси-метилуреидо-6Н-пирано-[2,3-f] - бенз-2,1,3-оксадиазола (соответствующего соединению (2) IV). Формула (-)-формы
O
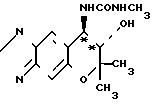
При комнатной температуре перемешивают 300 мг (1,28 ммоля) (-)-7,8-дигидро-6, 6-диметил-7-окси-8-амино-6Н-пирано-[2,3-f] -бенз- 2,1,3-оксадиазола (соединение (2) 1) и 20 мл хлористого метилена. К полученному раствору добавляют 120 мг (2,10 ммоля) метилизоцианата. Смесь перемешивают при комнатной температуре (20оС) в течение 5 ч.
Рекомендуемую смесь кристаллизуют в холодильнике и выпадающие таким образом кристаллы фильтруют. Таким образом получают 195 мг названного соединения в виде бесцветных кристаллов (выход 52%). Аналитические данные: т. пл. 165-167оС. Оптическиая чистота: 100% э.и. (см. табл. 2). Рекомендуемый пример 7.
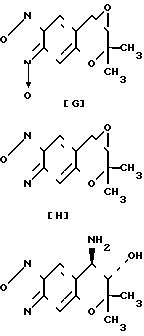
Синтез 7,8-дигидро-6,6-диметил-7,8-эпокси-6Н-пирано-[2,3-f] -бенз- 2,1,3-оксадиазола-3-оксида (соединение (G)). Формула
O

При комнатной температуре перемешивают 4,41 г (18,9 ммолей) 6-амино-3,4-дигидро-2,2-диметил-3,4-эпокси-7-нитро-2Н-бен- зо-[b] пирано (соединение (F)), 1,29 г (32 ммолей) гидроокси натрия, 400 мл этанола и 40 мл воды, добавляя медленно по каплям в эту смесь 32,2 г (26 ммолей) 6%-ного водного раствора гипохлорита натрия. Затем полученную смесь перемешивают в течение 1ч.
После завершения реакции добавляют 1 л водного раствора обычной соли и смесь экстрагируют этилацетатом трижды. Этилацетатные фазы объединяют, промывают рассолом и высушивают над безводным сульфатом натрия.
После отгонки растворителя остаток обрабатывают для очистки с помощью колоночной хроматографии на силикагеле (проявляющий растворитель: этилацетат/гексан 1:2 по объему). Таким образом получают 4,00 г названного соединения в виде желтых кристаллов (выход 92%). Аналитические данные: т.пл. 144-145оС. Рекомендуемый пример 8.
Синтез 7,8-дигидро-6,6-диметил-7,7-эпокси-6Н-пирано-[2,3-f] -бенз- 2,1,3-оксадиазола (соединение (Н)).
O
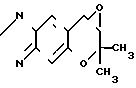
При 60оС перемешивают 1,00 г (4,27 ммоля) 7,8-дигидро-6,6-диметил-7,8-эпокси-6Н-пирано-[2,3-f] -бенз-2,1,3- оксадиазол-3-оксида (соединение (G)) и 6 мл бензола, добавляя при этом по каплям в пределах 15 мин 0,80 мл(4,70 ммоля) триэтилфосфита.
Затем полученную смесь перемешивают в течение 3 ч.
После отгонки растворителя остаток подвергают очистке с помощью хроматографии на силикагелевой колонке (проявляющий растворитель: этилацетат/гексан 1:1 по объему). Таким образом получают 0,82 г названного соединения (выход 88%).
Некоторую часть этого вещества перекристаллизовывают из гексана, чтобы тем самым получить желтые кристаллы. Аналитические данные: т.пл. 97-99оС. Рекомендуемый пример 9.
Синтез 7,8-дигидро-6,6-диметил-7-окси-8-амино-6Н-пирано-[2,3-f] - бенз-2,1,3-оксадиазола (соединение [+] I). Формула
O
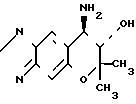
В 25 мл 16,7%-ного раствора аммиака в этаноле растворяют 0,82 г (3,8 ммоля) 7,8-дигидро-6,8-диметил-7, 8-эпокси-6Н-пирано- [2,3-f]- бенз-2,1,3-оксадиазола (соединение (Н)), а затем смеси позволяют реагировать в толстостенной стеклянной трубке под давлением при 60оС в течение 48 ч.
Растворитель реакции отгоняют и остаток подвергают хроматографии на силикагелевой колонке (проявляющий растворитель: смесь этилацетатa и метaнола 5:1 по объему), чтобы тем самым получить 0, 77 г названного соединения в виде коричневого твердого вещества (выход 87%).
Некоторую часть этого вещества перекристаллизовывают из этанола, чтобы тем самым получить чистое названное соединение в виде бесцветных кристаллов. Аналитические данные: т.пл. 159-162оС.
ЯМР (СДСl3 + ДМСО-d6) м.д.:
1,26 (3Н), 1,49 (3Н), 2,80-3,30
(3Н), 3,33 (1Н), 3,78 (1Н), 6,82 (1Н) и 7,98 (1Н).
Масс-спектр: 133 (50%), 163 (100%) и 235 (М+, 3%).
Реферат
Использование: в медицине в качестве лекарственного средства для лечения гипертензии, стенокардии, аритмии, астмы и нарушения мозгового кровообращения. Сущность изобретения: продукт, ф-лы
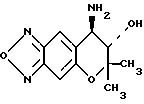
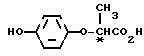
Формула

отличающийся тем, что осуществляют реакцию взаимодействия соединения формулы (±)I с оптически активной карбоновой кислотой формулы II:
с последующей обработкой полученной кристаллической диастереомерной соли или ее сольвата основанием.

Комментарии