Карборанилпорферины и их применение - RU2477161C2
Код документа: RU2477161C2
Описание
Эффективность радиационных и химических методов при лечении раковых заболеваний ограничивается отсутствием селективного нацеливания терапевтического агента на опухолевые клетки. В попытках сохранить нормальные ткани современные методы лечения опухолей применяют дозы облучения и/или химиотерапевтического средства, ограниченные уровнями, которые значительно ниже оптимальных или клинически адекватных. Поэтому создание соединений, способных, либо самостоятельно, либо как часть терапевтического метода, селективно нацеливаться на опухолевые клетки и разрушать их, является областью интенсивного исследования.
Вследствие известной аффинности порфиринов к неопластическим тканям возник большой интерес к использованию порфиринов в качестве агентов для доставки при лечении новообразований головного мозга, головы и шеи и родственных опухолей. Порфирины в целом относятся к классу окрашенных ароматических тетрапирролов, из них некоторые обнаружены в природе в растениях и животных, например хлорофилл и гем соответственно.
Порфирины и другие тетрапирролы со сравнительно продолжительным периодом жизни триплетного состояния уже использовались для лечения злокачественных опухолей методом фотодинамической терапии (PDT). При PDT пациенту сначала вводят инъекцию фотосенсибилизирующего лекарственного средства, как правило, порфирина. Опухолевые клетки, теперь фотосенсибилизированные, становятся чувствительными к разрушению под действием интенсивного лазерного пучка красного цвета. Полагают, что биохимический механизм поражения клеток при PDT в значительной степени опосредуется синглетным кислородом, который образуется при переносе энергии от возбужденной светом молекулы порфирина на молекулу кислорода. Однако PDT лимитируется в основном ограниченной пенетрацией красного излучения, которая составляет лишь несколько миллиметров в глубину.
Рентгеновская терапия (XRT) является наиболее распространенной лучевой (радиационной) терапией, применяемой при различных формах рака. При обычной XRT пациента облучают, используя фракционированную рентгеновскую радиотерапию без радиосенсибилизатора. Однако, если перед облучением инъецировать редиосенсибилизатор, опухолевые клетки, теперь радиосенсибилизированные, становятся более чувствительными к разрушению под действием рентгеновского облучения, нежели соседние ткани. Рентгеновские лучи относятся к радиации с низкой линейной передачей энергии (LET) из-за скорости, с которой этот тип радиации "депонирует, отлагает " энергию по мере прохождения через ткань. При использовании соединений, применяемых в настоящее время в клинической XRT, не наблюдается высокой скорости контроля опухоли при лечении рака головы и шеи и других смертельно опасных видов рака.
Обнадеживающей новой формой радиационной терапии рака с высокой LET является бор-нейтронозахватная терапия (БНЗТ, BNCT). BNCT (БНЗТ) представляет собой бимодальную форму терапии рака, основанную на селективной аккумуляции стабильного нуклида бора, известного как бор-10, или10В, в опухоли с последующим облучением опухоли тепловыми нейтронами. Тепловые нейтроны сталкиваются с бором-10, вызывая деление ядер (реакция распада). Деление ядер вызывает высоколокализованное высвобождение огромного количества энергии в форме высокоинтенсивной (с высокой LET) радиации, которая может убивать клетки более эффективно (повышенный относительный биологический эффект), чем низкоинтенсивная (с низкой LET) радиация, такая как рентгеновские лучи.
При захвате тепловыми нейтронами бора-10 протекает следующая реакция:
10B+n→11B
11B→7Li+4He+γ (478 кэВ)
В этой ядерной реакции ядра бора-10 захватывают нейтрон, образуя метастабильный нуклид11В, который самопроизвольно и почти мгновенно распадается на частицы4He и7Li, общая средняя кинетическая энергия которых равна 2.34 мэВ. Две эти ионизированные частицы проходят в мягкой ткани около 9 мкм и 5 мкм (7±2 мкм) в противоположных направлениях соответственно.
Расстояния, проходимые частицами4He и7Li, сравнимы с диаметром многих опухолевых и ассоциированных с опухолями клеток. Поэтому эффект BNCT приводит к появлению высоколокализованной высокоинтенсивной (с высокой LET) ионизирующей радиации внутри опухоли. Таким образом, целевая опухоль получает большую дозу радиации, в то же время соседняя нормальная ткань сохраняется.
При опухолях головного мозга после введения борсодержащего соединения головной мозг (голову) пациента облучают в области опухоли падающим на поверхность (лазерным) лучом или эпитепловыми (0.5 эВ-10 кэВ) нейтронами. Нейтроны постепенно становятся тепловыми (средняя энергия, примерно, 0.04 эВ) по мере того, как они все более глубоко проникают внутрь (в голову). Когда нейтроны становятся тепловыми, они легче захватываются бором-10, концентрирующимся в опухолевых клетках и/или в тканях, поддерживающих опухоль, так как сечение захвата (тепловых нейтронов) обратно пропорционально их скорости.
При BNCT борсодержащее соединение должно быть нетоксическим или иметь низкую токсичность при введении в терапевтически эффективных количествах, а также должно быть способно селективно аккумулироваться в опухолевой ткани. Хотя преимуществом ВРА является его низкая химическая токсичность, он накапливается (аккумулируется) в важных здоровых тканях в количествах, которые более чем нежелательны. В частности, отношение концентрации бора в опухолях при сравнении нормального мозга и мозга, имеющего опухоль, составляет, примерно, 3:1. Такая низкая специфичность ограничивает максимальную дозу ВРА для опухоли, так как допустимая для здоровой (нормальной) ткани доза является лимитирующим фактором.
Порфирины применимы не только для лечения опухолей, но эти соединения пригодны также для визуализации и диагностики опухолей. Преимуществом порфирина является то, что его молекула способна образовывать хелат с ионами металлов, находящимися внутри молекулы. Кроме того, такие хелатированные порфирины могут функционировать как инструмент для визуализации при мониторинге концентрации порфирина и/или диагностических агентов в реальном времени. Например, при образовании хелата с парамагнитными ионами металлов порфирины могут играть роль контрастных агентов при магнитно-резонансной визуализации (MRI), а при хелатировании ионов радиоактивных металлов порфирины могут выступать в роли визуализирующих агентов в однофотонной эмиссионной компьютерной томографии (SPECT) или в позитронной эмиссионной томографии (PET).
Кроме того, применяя хелатированные борсодержащие порфирины в BNCT, можно неинвазивно, точно и быстро определять концентрацию и распределение бора в и вокруг опухоли и во всех тканях подвергающейся облучению области до и во время облучения. Такая диагностическая информация позволяет проводить BNCT быстрее, более точно и более безопасно, снижая воздействие эпитепловых нейтронов в тканях, о которых известно, что они содержат высокие уровни бора. Кратковременное облучение избавило бы пациента от неудобства и дискомфорта, вызываемых продолжительным нахождением головы в часто неудобном положении в отверстии реактора. Однако предполагаемое применение генерирующихся в ускорителе нейтронов, по-видимому, дает значительно более слабый поток и, следовательно, обеспечивает более длительное время облучения, так что становятся важными соединения с более продолжительным временем пребывания (удерживания) в опухоли.
Следовательно, необходимы новые соединения, в особенности борсодержащие порфирины, с продолжительным временем нахождения (пребывания, удерживания) в опухолях, которые селективно нацелены на опухолевые клетки и разрушают их с минимальным поражением здоровой (нормальной) ткани. Кроме того, существует необходимость в более эффективных методах лечения опухолей головного мозга, головы и шеи и родственных опухолей, и, более конкретно, более эффективные методы XRT и BNCT и применяемые в них соединения для доставки бора.
Сущность изобретения
Настоящее изобретение относится к низкотоксичным борсодержащим соединениям и способам их применения для лечения, визуализации и диагностики опухолей. Более конкретно, настоящее изобретение относится к низкотоксичным карборансодержащим нитропорфиринам и способам их применения, в частности, в бор-нейтронозахватной терапии (BNCT) или рентгенотерапии (XRT), для лечения опухолей мозга, головы и шеи и близлежащих (соседних) тканей.
В частности, настоящее изобретение относится к карборансодержащим порфиринам формулы:
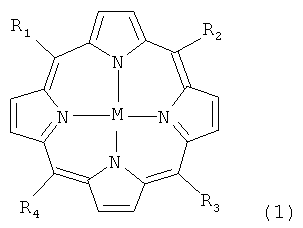
где
R1, R2, R3 и R4, независимо, обозначают -NO2, -NH2, галоген или заместитель, представленный следующей формулой

где заместители Y, независимо, находятся в орто-, мета- или параположении в фенильном кольце и, независимо, обозначают водород, "гидрокарбил" (нециклический углеводородный остаток различной степени насыщенности), неароматический карбоциклический радикал (углеродный цикл), неароматический гетероциклический радикал, арил, алкиларил, арилалкил; или
"гидрокарбильную", неароматическую карбоциклическую, неароматическую гетероциклическую, арильную, алкиларильную или арилалкильную группу, замещенную 1-4 гидрофильными группами, выбранными из групп: гидрокси, алкокси, -C(O)OR5, -SOR6, -SO2R6, нитро, амидо, уреидо, карбамато, -SR7, -NR8R9 или полиалкиленоксида; или заместитель, представленный формулой (3)

при условии, что, по меньшей мере, один из R1, R2, R3 и R4 обозначает заместитель, представленный формулой (2), где Y представлен формулой (3);
где Х обозначает кислород или серу;
R5, R6, R7, R8, R9, R10 и R11, независимо, выбирают из водорода и C1-С4 гидрокарбила;
Z обозначает карборановый кластер, содержащий, по меньшей мере, два атома углерода и, по меньшей мере, три атома бора, или, по меньшей мере, один атом углерода и, по меньшей мере, пять атомов бора, в каркасной структуре;
r обозначает 0 или целое число от 1 до 20;
а обозначает целое число от 1 до 4; и
также при условии, что, по меньшей мере, один из R1, R2, R3 и R4 обозначает заместитель, представленный -NO2, -NH2 или галоген; и
М обозначает либо два иона водорода, единичный ион одновалентного металла, два иона одновалентного металла, ион двухвалентного металла, ион трехвалентного металла, ион четырехвалентного металла, ион пятивалентного металла, ион шестивалентного металла, причем заряд комплекса порфирин-металл, образованного единственным ионом одновалентного металла и порфирином, нейтрализован противоионом, а заряд комплекса порфирин-металл, образованного ионом трехвалентного, четырехвалентного, пятивалентного, шестивалентного металла, нейтрализован соответствующим числом противоанионов, дианионов или трианионов.
Z, предпочтительно, выбирают из карборанов -С2НВ9Н10 или -С2НВ10Н10, где -С2НВ9Н10 обозначает нидо орто-, мета- или паракарборан, а -С2НВ10Н10 обозначает клозо орто-, мета- или паракарборан.
М, предпочтительно, обозначает ванадий (V), марганец (Mn), железо (Fe), рутений (Ru), технеций (Те), хром (Cr), платину (Pt), кобальт (Со), никель (Ni), медь (Си), цинк (Zn), германий (Ge), индий (In), олово (Sn), иттрий (Y), золото (Au), барий (Ba), вольфрам (W) или гадолиний (Gd). В более предпочтительном варианте изобретения М обозначает (Си) или никель (Ni).
В одном варианте изобретения два из R1, R2, R3 и R4 обозначают заместители, представленные формулой (2); а обозначает 1;Y представлен формулой -X-(CR10R11)r-Z; R10 и R11 обозначают Н; г обозначает 1; Z обозначает -С2НВ10Н10, заместители - X-(CR10R11)r-Z находятся в метаположении фенильного ядра; два заместителя R1-R4, не представленные формулой (2), обозначают -NO2 или -Br, а заместители, представленные формулой (2), находятся в цис-положении в порфириновом цикле.
В другом варианте изобретения два из заместителей R1, R2, R3 и R4 изображаются формулой (2); а обозначает 1; Y представлен формулой - X-(CR10R11)r-Z; R10 и R11обозначают Н; r обозначает 1; Z обозначает - С2НВ10Н10, заместители - Х-(CR10R11)r-Z находятся в метаположении фенильного ядра; два заместителя R1-R4, не представленные формулой (2), обозначают -NO2 или -Br, а заместители, представленные формулой (2), находятся в трансположении в порфириновом цикле.
Еще в одном варианте изобретения, когда порфириновому соединению в качестве противоиона требуется дианион, этим дианионом является порфириновый дианион (имеющий заряд минус два). Порфириновое соединение, имеющее заряд минус два, может представлять собой карборансодержащее соединение по настоящему изобретению при условии, что М отсутствует.
Настоящее изобретение включает также способы визуализации с помощью SPECT, PET или MRI, а также бимодальные формы терапии рака, такие как BNCT, XRT и PDT, которые требуют введения субъекту композиции, которая содержит одно или более порфириновых соединений, описанных выше. В предпочтительном варианте изобретения композиция представляет собой практически одно или более порфириновых соединений, описанных выше.
Подробное описание изобретения
Изобретение относится к карборансодержащим порфиринам (порфириновым соединениям) формулы:

R1, R2, R3 и R4, независимо, обозначают -NO2, -NH2, галоген или заместитель, представленный следующей формулой

при условии, что, по меньшей мере, один из R1 R2, R3 и R4 обозначает заместитель, изображенный формулой (2), и при условии, что, по меньшей мере, один из R1, R2, R3 и R4 обозначает заместитель, представленный как NO2, NH2 или галоген.
Заместители Y, независимо, находятся в одном или в обоих из орто-, мета- или параположений фенильного кольца и их количество составляет целое число от 1 до 4. Заместители Y обозначают водород, гидрокарбил, неароматический карбоциклический радикал (углеродный цикл), неароматический гетероциклический радикал, арил, алкиларил, арилалкил или алкильную, неароматическую карбоциклическую, неароматическую гетероциклическую, арильную, алкиларильную или арилалкильную группу, замещенную 1-4 гидрофильными группами, выбранными из групп: гидрокси, алкокси, -C(O)OR5, -SOR6, -SO2R6, нитро, амидо, уреидо, карбамато, -SR7, -NR8R9 или полиалкиленоксид; или заместитель, представленный формулой (3)

при условии, что, по меньшей мере, один из Y представлен формулой (3);
В формуле (3) Х обозначает кислород или серу; R5, R6, R7, R8, R9, R10 и R11, независимо, выбирают из водорода и C1-C4 гидрокарбила; а r обозначает 0 или целое число от 1 до 20.
Z обозначает карборановый кластер. Карборановый кластер состоит из атомов бора и атомов углерода. Карбораны представляют собой полиэдры (многогранники).
Z содержит, по меньшей мере, два атома углерода и, по меньшей мере, три атома бора, или, по меньшей мере, один атом углерода и; по меньшей мере, пять атомов бора в каркасной структуре. Некоторые примеры карборановых кластеров включают правильные полиэдрические карборановые кластеры, также известные как клозо структуры, а также ионизированные фрагменты полиэдрических кластеров, также известные как нидо структуры. Некоторые примеры предпочтительных карборанов по настоящему изобретению включают -С2НВ9Н10 или -С2НВ10Н10, где -С2НВ9Н10 обозначает нидо орто-, мета- или паракарборан, а -С2НВ10Н10 обозначает клозо орто-, мета- или паракарборан.
Введение электроноакцепторной группы, такой как нитрогруппа или галоген, в мезо- положения порфиринового кольца повышает сродство порфиринового макроцикла к электрону и, следовательно, делает получающееся в результате соединение более эффективным сенсибилизатором для рентгеновского излучения.
Электроноакцепторными группами могут являться -NO2, -NH2 или галоген. Галоген может представлять собой хлор, фтор, бром или йод. Предпочтительно, галоген представляет собой бром.
В предпочтительном варианте изобретения два из R1, R2, R3 и R4 обозначают -NO2. В другом предпочтительном варианте изобретения два из R1, R2, R3 и R4обозначают -Br.
Гидрокарбильная (углеводородная) группа является линейной или разветвленной гидрокарбильной группой, содержащей 1-20 углеродных атомов, включающей, необязательно, до трех двойных или тройных связей. Некоторые примеры гидрокарбильных групп включают метил, этил, н-пропил, изопропил, н-бутил, вт-бутил, трет-бутил, пропенил, 2-бутенил, 3-бутенил, 3-бутинил, 2-метил-2-бутенил, н-пентил, додецил, гексадецил, октадецил и эйкозил.
Гидрокарбильная группа может быть незамещенной или иметь в качестве заместителей столько гидрофильных групп, сколько может допустить Гидрокарбильная группа, например, 1-4. Некоторые примеры подходящих гидрофильных групп включают гидрокси, алкокси, -C(O)OR5, -SOR6, -SO2R6, нитро, амидо, уреидо, карбамато, -SR7, -NR8R9 или полиалкиленоксида. R5, R6, R7, R8 и R9, независимо, выбирают из водорода и гидрокарбилных групп по определению выше, за исключением того, что гидрокарбильные группы для R5, R6, R7 и R8 содержат 1-4 атомов углерода.
Атомы углерода гидрокарбильной группы могут быть также замещены 1-4 гетероатомами. В данном описании гетероатомами являются О, S, N или NR10. R10выбирают из водорода и гидрокарбильных групп по определению выше. Гетероатомы обычно не связаны друг с другом и, предпочтительно, отделены друг от друга, по меньшей мере, одним атомом углерода. Предпочтительно, на каждые два углеродных атома приходится не более одного гетероатома.
Неароматическое карбоциклическое или гетероциклическое кольцо представляет собой 4-, 5-, 6-, 7- или 8- членное карбоциклическое или гетероциклическое кольцо. Цикл может быть насыщенным или может содержать столько ненасыщенных (т.е. двойных или тройных) связей, сколько может допустить карбоциклическое кольцо.
Некоторые примеры насыщенных карбоциклических колец включают циклобутановое, циклопентановое, циклогексановое и циклогептановое кольцо. Некоторые примеры ненасыщенных карбоциклических колец включают циклобутеновое, циклопентеновое, циклогексеновое и 1,3- циклогептадиеновое кольцо.
Гетероциклическое кольцо содержит столько гетероатомов, т.е. О, S, N или NR10, сколько может допустить, например 1-4. Некоторые примеры насыщенных и ненасыщенных неароматических гетероциклических колец включают циклы пирролидинильный, пиперидиновый, тетрагидрофурановый, фурановый, тиофеновый, 1,3-оксазолидиновый, имидазольный и пиррольный. Гетероциклические кольца могут, необязательно, быть замещенными гидрокарбонилом по определению выше или 1-4 гидрофильными группами, также по определению выше.
Неароматическое карбоциклическое или гетероциклическое кольцо (цикл, циклическая система) может быть бициклическим. Некоторые примеры карбоциклических колец включают бицикло[2.2.2]октан, бицикло[3.1.1]гептан, бицикло[3.3.0]октан, бицикло[4.3.0]нон-3-ен. Примеры неароматических гетероциклических колец (систем) включают 1,4-азабицикло[2.2.2]октан и 2-азабицикло [3.1.1]гептан.
Арильная группа может являться либо ароматической карбоциклической или гетероциклической группой. Ароматическое карбоциклическое кольцо, предпочтительно, представляет собой фенил.
Арильные кольца могут быть, необязательно, замещены гидрокарбилом по определению выше с образованию алкиларильной или алкилалкильной групп. Арильная, алкиларильная или алкилалкильная группы могут быть замещены 1-4 гидрофильными группами по определению выше.
Ароматические гетероциклические кольца содержат 1-4 гетероатома, а именно, О, S, N или NR10. Циклы, как правило, являются 5-, 6- или 7- членными. Некоторые примеры ароматических гетероциклических колец включают тиофеновый, пиридиновый, оксазольный, тиазольный, оксазиновый и пиразиновый циклы. Ароматическое гетероциклическое кольцо может быть замещено 1-4 гидрофильными группами по определению выше.
Любой из вышеуказанных циклов может быть также конденсирован с 1-3 дополнительных 5-, 6- или 7- членных арильных циклов. Некоторые примеры конденсированных циклов включают циклы (циклические системы) нафталина, антрацена, фенантрена, трифенилена, хризена, индолина, хинолина и тетраазанафталина (птеридина).
В данном описании алкоксигруппа содержит гидрокарбильный фрагмент по определению выше. Некоторые примеры алкоксигрупп включают группы метокси, этокси, пропокси, н-бутокси, трет-бутокси и додецилокси.
Полиалкиленоксид определяется формулой -(СН2)d-О-[(CH2)e-O-]x-[(СН2)f-O-]y-(СН2)g-OR', где, независимо, d обозначает 0 или целое число от 1 до 10, е обозначает 0 или целое число от 1 до 10, f обозначает число от 1 до 10, g обозначает число от 1 до 10, х и у, каждый независимо, обозначает 1 или 0, и R' обозначает либо Н, либо гидрокарбильную группу по определению выше, при условии, что когда е обозначает 0, тогда х обозначает 0; когда f обозначает 0, тогда у обозначает 0; когда е не обозначает 0, тогда х обозначает 1; и когда f не обозначает 0, тогда у обозначает 1.
Предпочтительным полиалкиленоксидом по изобретению является полиэтиленоксид. Полиэтиленоксид определяется формулой -(СН2)d-O-[(СН2)е-O-]х-[(СН2)f-O-]y-(СН2)g-OR', где, независимо, d обозначает 0 или 2, е обозначает 0 или 2, f обозначает 2, g обозначает 2, х и у, каждый независимо, обозначает 1 или 0, и R' обозначает либо Н, либо этильную группу, при условии, что когда е обозначает 0, тогда х обозначает 0; когда f обозначает 0, тогда у обозначает 0; когда е не обозначает 0, тогда х обозначает 1; и когда f не обозначает 0, тогда у обозначает 1.
В формуле (I) M может обозначать либо два иона водорода, единичный ион одновалентного металла, либо два иона одновалентного металла. Некоторые примеры подходящих ионов одновалентного металла включают Li+1, Na+1, К+1, Cu+1, Ag+1, Au+1 и Tl+1. Когда М обозначает ион одновалентного металла, заряд образующегося комплекса порфирин-металл нейтрализуется (уравновешивается) противокатионом. Некоторые примеры уравновешивающих (нейтрализующих) заряд катионов (противокатионов) включают любые из вышеприведенных ионов одновалентных металлов и аммониевые и фосфониевые катионы, такие как тетраметиламмоний, тетрабутиламмоний, тетрафениламмоний, тетраметилфосфоний, тетрабутилфосфоний и тетрафенилфосфоний. Противокатионы могут быть либо связаны, либо ассоциированы некоторым образом с комплексом порфирин-металл.
М может также обозначать ион двухвалентного металла. Некоторые примеры подходящих ионов двухвалентных металлов включают V+2, Mn+2, F+1, Ru+2, Co+2, Ni+2, Cu+2, Pd+2, Pt+2, Zn+2, Са+2, Mg+2, Sr+2 и Ва+2.
Или же М может обозначать ион трехвалентного, четырехвалентного, пятивалентного или шестивалентного металла. Некоторые примеры подходящих ионов трехвалентных металлов включают Gd+3, Y+3, In+3, Cr+3, Ga+3, Al+3, Eu+3 и Dy+3. Некоторые примеры подходящих ионов четырехвалентных металлов включают Те+4, Ge+4, Sn+4 и Pt+4. Примером подходящего иона пятивалентного металла является Tc+5. Некоторые примеры подходящих ионов пятивалентных металлов включают W+6, Tc+6 и Мо+6.
Заряд образующегося катионного комплекса порфирин-металл нейтрализуется соответствующим числом противоанионов. Анионы могут представлять собой моноанионы, дианионы или трианионы. Например, заряд катионного комплекса порфирин-металл с участием иона трехвалентного металла может нейтрализоваться единичным моноанионом с противоположным зарядом (противомоноанионом), а заряд такого комплекса с участием иона четырехвалентного металла может нейтрализоваться единичным противодианионом или двумя противомоноанионами и т.д.
Некоторые примеры подходящих противомоноанионов включают хлорид, перхлорат, сульфат, нитрат и тетрафторборат. Некоторые примеры подходящих дипротивоанионов включают оксид, сульфид или порфириновое соединение с зарядом минус два (дианион). Порфириновое соединение, имеющее заряд минус два (дианион), может представлять собой порфириновое соединение по настоящему изобретению при условии, что М отсутствует. Примером подходящего противотрианиона является фосфат.
Противомоноанион, противодианион или противотрианион может быть либо связан, либо ассоциирован некоторым образом с подходящим карборансодержащим порфирином по настоящему изобретению. Карборансодержащий порфирин может быть также связан или ассоциирован с нейтральными молекулами, такими как сольватирующие молекулы, например, воды, ацетонитрила, метанола и т.д.
М может представлять собой ион радиоактивного металла, визуализируемый с помощью однофотонной эмиссионной компьютерной томографии (SPECT) или позитронной эмиссионной томографии (PET). Некоторые примеры радиоактивных металлов, применимых для SPECT, включают67Cu,99mTc и111In, а примеры радиоактивных металлов, применимых для PET, включают64Cu,55Со. М может также являться радиоактивным металлом, применимым для терапии в качестве радиофармпрепарата. Некоторые примеры радиоактивных металлов, применимых для такой терапии, включают90Y,188Re,67Cu.
М может также представлять собой ион парамагнитного металла, детектируемый магнит-резонансной томографией (MRI). Некоторые примеры таких металлов включают Mn, Fe, Co и Gd.
Помимо этого, М может представлять собой ион металла, пригодный для бор-нейтронозахватной терапии (БНЗТ, BNCT), рентгенотерапии (XRT) или фотодинамической терапии (PDT); или их комбинации. Ионы металлов, пригодные для BNCT, включают ионы металлов, описанные до настоящего времени, за исключением фотоактивных, таких как Zn и Sn. Такие фотоактивные металлы, и в частности фотоактивные металлы со сравнительно продолжительным периодом жизни триплетного состояния, являются предпочтительными для PDT. Так как доза для BNCT в 100-1000 раз выше, чем доза для PDT, это может привести в результате к значительной аккумуляции фотоактивных металлов в коже, если такие металлы используются в BNCT. Такая аккумуляция фотоактивного металла может вызвать биологическое поражение. По этим причинам фотоактивные металлы, такие как Zn и Sn нежелательны для BNCT или XRT, так как даже небольшое накопление их в коже может вызвать кожное поражение. Предпочтительными являются нефотоактивные металлы, такие как Cu, Со или Ni. Помимо этого, для XRT, высокие Z ионы, такие как Pt или Au, могут даже обеспечить дополнительный эффект киллинга клеток, если энергия рентгеновских лучей выше их К края.
Изобретение также относится к методам лечения опухолей. В предпочтительном варианте изобретения методом лечения злокачественных опухолей, в особенности опухолей мозга, является BNCT (бор-нейтронозахватная терапия). Клиническую BNCT злокачественных опухолей мозга проводили в медицинском отделении Национальной Лаборатории в Брукхевене (Brookhaven National Laboratory Medical Department), используя п-боронофенилаланин (ВРА) в качестве носителя бора (Chanana et al., Neurosurgery, 44, 1182-1192, 1999).
Описание способа BNCT из статьи Chanana et al. вводится в данное описание в качестве ссылки. Рядовые специалисты в данной области техники смогут легко адаптировать этот метод к соединениям по изобретению.
При BNCT злокачественных опухолей мозга в соответствии со способом по настоящему изобретению, например, пациенту сначала делают инфузию карборансодержащего порфирина формулы (I), высокообогащенного бором-10. Затем карборансодержащий порфирин концентрируется, предпочтительно, в опухоли мозга внутри объема эффективного облучения, который у опухолей мозга может составлять значительную часть мозга. Например, опухоли, локализованные в большей части одной полусферы или во всей этой полусфере мозга и в некоторой части противоположной полусферы или в целой противоположной полусфере мозга, могут аккумулировать борсодержащие порфирины.
Затем область опухоли облучают термическими нейтронами (первичное облучение), некоторые из них захватываются бором-10, концентрирующемся в опухоли. Относительная вероятность того, что медленные термальные нейтроны будут захвачены бор-10 нуклидом, высока по сравнению с вероятностью захвата всеми другими нуклидами, обычно присутствующими в тканях млекопитающих, при условии, что концентрация бора-10 в опухолевых тканях выше 30 мкг/г.
В ядерной реакции сразу после захвата нейтрона участвует очень малая часть ядер бор-10 в опухоли и вблизи опухоли, поэтому для того, чтобы BNCT была клинически эффективна, необходима высокая концентрация бора-10 в целевой ткани. Поэтому для того, чтобы концентрацию бора-10 в целевой ткани сделать максимальной, карборановые кластеры делают высокообогащенными бором-10. Конкретно, бор в карборановом кластере обогащают до содержания бора-10, по меньшей мере, 95атом%.
Преимуществом лечения рака по настоящему изобретению по сравнению с предыдущим уровнем техники является то, что борсодержащие порфирины по настоящему изобретению селективно накапливаются в новообразованиях в более высоких концентрациях и при повышенных отношениях содержания бора в мозге и крови, пораженных опухолью, к содержанию бора в здоровом мозге и здоровой крови по сравнению с применяемыми в настоящее время в клинике борсодержащими соединениями.
Кроме того, порфирины по настоящему изобретению, которые испытывались in vivo, являются нетоксическими в теоретически терапевтически эффективных дозах. Повышенная селективность и пониженная токсичность карборансодержащих порфиринов по настоящему изобретению способствуют селективной деструкции опухолевой ткани с минимальным нарушением здоровых тканей и функции тканей при облучении.
Другим преимуществом карборансодержащих порфиринов по настоящему изобретению является их повышенная полярность, сообщаемая полярными группами NO2, NH2 и галогеном. Более высокая полярность таких групп делает порфирины менее липофильными, что может влиять на уменьшение количества вводимого эмульгирующего сорастворителя. Следовательно, можно улучшить микролокализацию внутри опухолевой клетки, что дает повышенный относительный биологический эффект. Результаты ВЭЖХ показывают, что динитропорфирины и дибромпорфирины более полярны, так как у них меньше время удерживания, чем у медьсодержащего тетрафенилкарборанилпорфирина (CuTCPH) или медьсодержащего октабром-тетракарборанилфенилпорфирина(CuTCPBr).
Кроме того, когда Х в порфиринах обозначает кислород, простые эфирные связи в карборансодержащих порфиринах по настоящему изобретению более полярны, чем углерод- углеродные связи и, следовательно, обеспечивают дальнейшее уменьшение липофильности. В то же время простые эфирные связи обладают почти такой же устойчивостью к гидролизу и другим видам химического воздействия, что и углерод-углеродная связь.
Для накопления нужного количества соединения по настоящему изобретению в опухоли пациенту обычно вводят в виде системной инъекции или инфузии около 10-50 миллиграмм бора-10 на кг веса тела в фармацевтически приемлемом носителе. Носитель может включать такие имеющиеся в продаже растворители, как Кремофор EL, пропиленгликоль, Твин 80, полиэтиленгликоль или липосомы. Соединение вводят в виде одной или более доз, причем последнюю дозу дают, примерно, за один час - за одну неделю до облучения эпитермальными нейтронами.
Время экспозиции с нейтронами зависит от концентрации порфирина в крови, которая снижается во времени быстрее, чем концентрация порфирина в опухоли. Однако время (тайминг) введения карборансодержащего порфирина зависит от различных факторов, общеизвестных специалистам в области клинической BNCT, включая фармакокинетических характеристик соединения (например, скорости проникновения соединения в опухоль и кровеносные сосуды опухоли), и скорости экскреции из и/или метаболизма соединения в опухоли и различных других тканях, которые абсорбируют соединение.
В другом предпочтительном варианте изобретения способом лечения злокачественных опухолей является XRT. Как правило, XRT представляет собой обычную радиотерапию, которая включает низкоинтенсивным (с низкой линейной передачей энергии, LET) рентгеновским излучением, назначаемым в виде многократных фракций облучения в течение недель. Кроме того, это лечение может также включать радиохирургию, такую как гамма-нож, который применяют в виде значительно меньшего количества фракций или даже в виде одной фракции. В любом случае перед облучением в качестве бимодальной формы терапии можно вводить агент, повышающий радиацию. В настоящее время такие агенты, повышающие радиацию, включают соединения, такие как нитроимидазол или Gd тексафирин. В настоящем изобретении повышение (радиации) основано на селективной аккумуляции порфирина в опухолевой ткани в пролечиваемом объеме, с тем, чтобы последующее облучение поражало опухолевую ткань селективно относительно здоровых соседних тканей.
В другом предпочтительном варианте изобретения способом лечения злокачественных опухолей по настоящему изобретению является PDT. PDT является бимодальной формой терапии рака, основанной на аккумуляции порфирина в опухоли с последующим облучением опухоли красным лазерным лучом. В результате активации светом электрон порфирина возбуждается и переходит из синглетного основного состояния в синглетное возбужденное состояние. Затем электрон может либо вернуться в основное синглетное состояние с эмиссией света, вызывая флуоресценцию, или он может изменить свой спин за счет интеркомбинационной конверсии на триплетное состояние. При распаде триплета обратно до основного состояния синглета он может перенести энергию триплетному дикислороду (в основном триплетном состоянии), который образует высокореактивный синглетный кислород. Биомолекулы, которые наиболее легко реагируют с синглетным кислородом, включают ненасыщенные липиды и остатки альфа-аминокислот, каждый из которых является главным составляющим биологических мембран. За некоторым порогом обратимых или восстановимых поражений поражение мембран, особенно эндотелиальных клеток мембран, может привести к локальному тромбозу сосудов и остановке кровообращения.
При применении PDT по настоящему изобретению пациенту сначала вводят инъекцию или инфузию фотосенсибилизатора карборансодержащего порфирина формулы (I). Затем применяют волоконно-оптические зонды для освещения опухолевой ткани. Для злокачественных опухолей предпочтительно, чтобы пики оптической плотности PDT-фотосенсибилизаторов были в области достаточно длинных волн для проникновения в опухоль на максимальную глубину.
В предпочтительном варианте изобретения терапевтическое лечение злокачественных опухолей дополняется (усиливается) применением SPECT или PET. При использовании SPECT пациенту сначала, в виде инфузии или инъекции, вводят соединение формулы (1), в котором М обозначает ион радиоактивного металла, испускающего гамма-лучи. Затем неинвазивным способом сканируют голову пациента и концентрацию радионуклида, и, следовательно, опосредованно, среднюю концентрацию бора, определяют (изображают) в каждом пикселе или векселе, представляющем мозг или ткань опухоли мозга. При этом на каждом изображении мозга можно провести линии контура, изображающие зоны с одинаковой концентрацией бора-10.
Метод SPECT мозга, по меньшей мере, на порядок более чувствителен к следам изотопов, чем обычная радиография или компьютерная томография. Кроме того, результаты SPECT, в отличие от обычной радиографии, можно анализировать, получая количественную информацию либо в определенных объемах, либо в векселях изображений мозга, при концентрациях бора, релевантных лечению методом BNCT как на стадии разработки, так и на стадии осуществления. SPECT сканирование может показать присутствие опухоли у пациента, а также его локализацию в головном мозге или в другом месте тела. SPECT сканирование является неинвазивным, быстрым и удобным.
Однако визуализируемый с помощью позитронно-эмиссионной PET радиоизотоп Cu-64 является более легкодоступным, чем Cu-67, используемый в SPECT. В связи со значительно большей доступностью Cu-64 мы проводили преклинические PET исследования, используя порфирин, меченный Cu-64.
В другом предпочтительном варианте изобретения терапевтическое лечение злокачественных опухолей дополняется MRI. При использовании MRI пациенту сначала с помощью инъекции или инфузии вводят раствор карборансодержащего порфирина формулы (1), хелатированного подходящим парамагнитным ионом металла. При опухоли мозга сканируют затем голову пациента и визуализируют и количественно определяют концентрацию парамагнитного иона металла, следовательно, концентрацию бора в головном мозге. Метод MRI, использующий соединения по настоящему изобретению, может сделать возможным быстрое улучшенное нацеливание и планирование нейтронного облучения при BNCT до, во время и после инфузии, когда борсодержащее соединение перераспределяется в крови, опухолевой и здоровой ткани.
Синтез карборансодержащих порфиринов по настоящему изобретению проводят в виде ряда отдельных стадий. Ниже сначала кратко описываются стадии синтеза, необходимые для получения предпочтительных карборансодержащих нитропорфиринов по настоящему изобретению, причем два заместителя из R1, R2, R3 и R4 обозначают карборанилметоксифенильные группы и два заместителя обозначают нитрогруппы. Специалисты в данной области техники легко могут определить условия этих реакций.
В конкретных примерах описан предпочтительный метод синтеза соединений по настоящему изобретению. Объем данного изобретения никоим образом не ограничивается примерами, представленными в данном описании. Например, карборанилпорфиринамины и карборанилпорфирингалогениды можно синтезировать, используя смесь различных исходных и осуществляя аналогичную реакцию, такую как циклизация Линдсея (Lindsey), показанную на реакционной схеме 2.
Реакционная схема 1

где Х обозначает О или S, a Z обозначает любой карборановый кластер, содержащий, по меньшей мере, два атома углерода и, по меньшей мере, три атома бора, или, по меньшей мере, один атом углерода и, по меньшей мере, пять атомов бора в каркасной структуре. В условиях циклизации по Линдсею в качестве кислотного катализатора используют кислоту Льюиса, такую как трехфтористый бор, или кислоту Бренстеда, такую как трифторуксусная кислота, в неполярном апротонном растворителе, таком как хлористый метилен (DCM). Например, карборановый кластер может представлять собой -С2НВ9Н10 или -С2НВ10Н10, где -С2НВ9Н10 обозначает нидо орто-, мета- или пара- карборан, а -С2НВ10Н10 обозначает клозо орто-, мета- или пара-карборан.
Реакционная схема 2

где Х и Z имеют значение по определению выше. Q обозначает -NO2, -NH2 или галоген. Более подробно условия реакции описаны в примерах 4 и 6.
Реакционная схема 3

где Х и Z имеют значение по определению выше. В предпочтительном варианте изобретения М выбирают из группы, состоящей из ванадия (V), марганца (Mn), железа (Fe), рутения (Ru), технеция (Те), хрома (Cr), платины (Pt), кобальта (Со), никеля (Ni), меди (Cu), цинка (Zn), германия (Ge), индия (In), олова (Sn), иттрия (Y), золота (Au), бария (Ва), вольфрама (W) и гадолиния (Gd). В более предпочтительном варианте изобретения М обозначает (Cu) или никель (Ni). Используемая соль металла содержит ион металла М, хелатированного порфирином. Например, для соединения, в котором М, желательно, обозначает медь, в качестве соли металла можно использовать ацетат меди, т.е. Cu(ОАс)2.H2O. Растворитель А представляет собой любой растворитель или смесь растворителей, способный(ая), по меньшей мере, частично растворять порфирин и соль металла и не препятствующая включению металла в порфирин.
Порфирин V получают по реакционным схемам 1-3. Подробно синтез описан в примерах 1-5, см. ниже. Порфирин V имеет следующую структуру:
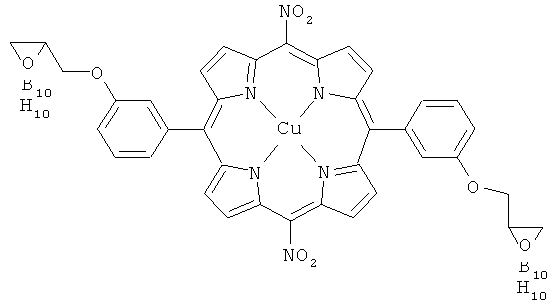
В вышеприведенном Порфирине V R1 и R3 обозначают - NO2; R2 и R4представлены формулой (2); Y представлен формулой (3); R10 и R11 обозначают Н; Z обозначает -С2НВ10Н10 карборан; заместители Y находятся в метаположении фенильного кольца; и М обозначает Cu.
Порфирин VII получают по реакционным схемам 1-3. Синтез подробно описан далее, в примерах 1-4 и 6-7. Порфирин VII имеет следующую структуру:

В вышеприведенном Порфирине VII R1 и R3 обозначают -Br; R2 и R4 представлены формулой (2); Y представлен формулой (3); R10 и R11 обозначают Н; Z обозначает -С2НВ10Н10 карборан; заместители Y находятся в метаположении фенильного кольца; и М обозначает Cu.
Примеры
Примеры представлены ниже с целью иллюстрации и для того, чтобы описать лучший способ по изобретению в настоящее время. Объем изобретения никоим образом не ограничивается представленными в данном описании примерами.
Пример 1
Синтез пиррометана (I)
Приррометан 1 получают по методике Clezy and Smythe, Aust J Chem, 1969, 22, 239 и Bruckner et al., J Porph Phthal, 1998, 2, 455. Коротко говоря, дипиррилтион, полученный из пиррола и тиофосгена, восстанавливают натрийборогидридом, получая пиррометан (I).
Пример 2
Синтез 3-о-карборанилметоксибензальдегида (II)
3-о-Карборанилметоксибензальдегид (II) синтезируют по методу, описанному Miura et al., Tet Let, 1990, 31, 2247-2250.
Пример 3
Синтез дикарборанилфенилпорфирина (III)
Получают по методу, аналогичному описанному Bruckner et al., J Porph Phthal, 1998, 2, 455. Пиррометан (I) (97 мг, 0.66 ммоля) растворяют в сухом DCM (120 мл) в чистой сухой колбе на 250 мл, снабженной магнитной мешалкой. Раствор дезоксигенируют, продувая через него азот при перемешивании в течение 10 мин. Прибавляют 3-о-Карборанилметоксибензальдегид (II) (172 мг, 0.699 ммоля) и раствор дезоксигенируют еще в течение 5 мин. К раствору прибавляют трифторуксусную кислоту [ТФК, TFA] (11.5 мл, 0.155 ммоля) и раствор оставляют на ночь перемешиваться при комнатной температуре в атомосфере азота. Через ~18 час прибавляют п-хлоранил (500 мг, 2.03 ммоля), после чего раствор немедленно окрашивается в темно-бордовый цвет. Раствор кипятят в течение 1 часа, после чего спектр оптического поглощения показывает наличие нужного порфирина. Прибавляют водный раствор бисульфита натрия для восстановления избыточного п-хлоранила до гидрохинона, что упрощает очистку. Через 10 мин реакционную смесь обрабатывают, добавляя DCM, несколько раз промывают органический слой водой/рассолом и сушат органический слой безводным сульфатом натрия. Растворители удаляют и красный остаток растирают с метанолом для удаления гидрохинона. Твердое вещество пурпурного цвета очищают флеш-хроматографией (силикагель. 30% гексана/DCM), выход ~27 мг (~9%).
Продукт имеет следующий1H ЯМР спектр (м.д., растворитель CDCl3): 10.344 (с, 2Н, Н метина); 9.419 (д, J=4.6 Гц, 4Н, Н пиррола); 9.058 (д, J=4.6 Гц, 4Н, Н пиррола); 7.9 73 (д, J=7.1 Гц, 2Н, ArH); 7/720-7/7 68 (м, 6Н, ArH); 4.656 (с, 4Н, ОСН2-карборан); 4.220 (с, 2Н, СН карборана); 1.5-2.9 (уш м, 20 Н, ВН) - 3.177 (с, 2Н, NH). Электронный спектр поглощения (УФ- видимый свет) продукта (в хлористом метилене) имеет следующие максимумы в нанометрах длин волн: 406, 502, 535, 574.
Пример 4
Синтез 5,15-динитро-10,20-бис(3-[о-карборанилметокси]фенил)порфирина (IV)
Получают по методу, аналогичному описанному Arnold et al, Aus J Chem, 1997, 50, 495-503. Дикарборанилфенилпорфирин (III) (20 мг, 0.025 ммоля) растворяют в безводном 1,2-дихлорэтане (DCE) (15 мл) и безводном ацетонитриле (15 мл) в чистой сухой колбе на 100 мл, снабженной магнитной мешалкой под азотом. К раствору порфирина прибавляют раствор йода (64 мг, 0.25 ммоля) в ацетонитриле (5 мл) и перемешивают при кипячении 1 час. К этому раствору прибавляют раствор нитрита серебра (80 мг, 0.53 ммоля) в ацетонитриле (5 мл) и перемешивают еще 2 час при кипячении, а затем в течение ночи при комнатной температуре. ТСХ (силикагель, 30% гексана/DCM) показывает присутствие нового продукта почти с таким же Rf, но зеленого, а не красного. Оптический спектр показывает, что это, по-видимому, заданный продукт. Реакционную смесь фильтруют через стеклянный фильтр и растворители отгоняют в вакууме. Остаток растворяют в хлороформе и элюируют через небольшой слой силикагеля.
Продукт имеет следующий1H ЯМР спектр (м.д., растворитель CDCl3): 9.31 (д, J=4.1 Гц, 4Н, Н пиррола); 9.00 (д, J=4.1 Гц, 4Н, Н пиррола); 7.889 (м, 2Н, ArH); 7.739-7.778 (м, 2Н, ArH); 7.65-7.671 (м, 2Н, ArH); 7.339-7.365 (м, 2Н, ArH); 4.650 (с, 4Н, ОСН2-карборан); 3.490 (с, 2Н, карборан СН); 1.5-2.9 (уш м, 20Н, ВН); -3.10 (с, 2Н, NH). Электронный спектр поглощения (УФ-видимый свет) продукта (в хлористом метилене) имеет следующие максимумы в нанометрах длин волн: 421, 513, 555, 589, 652.
Пример 5
Синтез медь (II) 5,15-динитро-10,20-бис(3-[о-карборанилметокси]фенил) порфирина (V)
Свободное основание 5,15-динитро-10,20-бис(3-[о-карборанилметокси]фенил)порфирин (IV) растворяют в хлороформе и к этому раствору прибавляют ацетат меди(II) моногидрат. Смесь кипятят при перемешивании в течение ночи. Оптическая спектроскопия показывает, что металлирование завершено. К реакционной смеси прибавляют DCM и трижды промывают водой, сушат (безводным сульфатом натрия) и отгоняют растворители.
Электронный спектр поглощения (УФ-видимый свет) продукта (в хлористом метилене) имеет следующие максимумы в нанометрах длин волн: 426, 545, 583.
Пример 6
Синтез 5,15-дибром-10,20-бис(3-[о-карборанилметокси]фенил)порфирина (VI)
Дикарборанилфенилпорфирин (III) обрабатывают N-бромсукцинимидом (NBS) по методу, аналогичному описанному С.Liu et al., (Chem Comm 2006, 770-772), a именно, исходный порфирин IV (126 мг, 0.156 ммоля) растворяют в смеси DCM: метанол (9/1 об/об; 30 мл). К этому раствору при перемешивании при комнатной температуре прибавляют NBS (55.6 мг, 0.312 ммоля). Примерно через 15 минут оптический спектр поглощения и ТСХ (TLC) (в 50% гексана в DCM) показывают отсутствие исходного. В оптическом спектре наблюдается сдвиг полосы Сорета в красную область с 406 к 421 нм, а TLC показывает присутствие менее полярного продукта. Реакцию прекращают, добавляя воду, и реакционную смесь обрабатывают. Сырой продукт очищают, используя элюцию с помощью DCM через слой силикагеля. Далее отфильтровывают продукт (48 мг), не растворимый в DCM, и объединяют его с продуктом (44 мг), очищенным препаративной ТСХ (диоксид кремния; 10% этилацетата в гексане). По данным ВЭЖХ отфильтрованный продукт имеет чистоту 90%, а продукт, очищенный с помощью ТСХ, имеет чистоту 83%. Общий выход в расчете на чистоту 100% составляет 84 мг (53%).
1H ЯМР спектр показывает, что мезопротоны отсутствуют.1H ЯМР спектр (м.д., растворитель CDCl3): 9.628 (д, J=3.6 Гц, 4Н, Н пиррола); 8.815 (д, J=4.4 Гц, 4Н, Н пиррола); 7.867 (д, 2Н, ArH); 7.654-7.725 (м, 2Н, ArH); 7.296- 7.324 (м, 2Н, ArH); (м, 2Н, ArH); 4.628 (с, 4Н, ОCH2-карборан); 4.190 (с, 2Н, карборан СН); 1.5-3.0 (уш м, 20Н, ВН); -2.766 (с, 2Н, NH),
Пример 7
Синтез медь(II) 5,15-дибром-10,20-бис(3-[о-карборанилметокси]фенил) порфирина (VII)
Свободное основание дибромпорфирин VI металлируют ацетатом меди с образованием Cu(II) порфирина по методике, описанной в Примере 5. Получают 12.4 мг медьсодержащего порфирина VII с чистотой 90% (аналитическая ВЭЖХ). Спектр UV-Vis в DCMmax(нм): 418, 546. C38H42N4O2B20Br2Cu вычислено 1026.330; MALDI-TOF в дитраноле в качестве матрицы: m/z=1026.93.
Пример 8
Приготовление растворов порфиринов
Порфирин (V) эмульгируют в растворе 9% Кремофора EL и 18% пропиленгликоля в физиологическом солевом растворе.
Для приготовления раствора, содержащего ~3.7 мг/мл порфирина в растворе 9% Кремофора EL (CRM) и 18% пропиленгликоля (PRG), порфирин растворяют в тетрагидрофуране (THF) (1.5% от общего объема), а затем нагревают при 40°С 15 мин. Затем добавляют CRM (9% от общего объема) и смесь нагревают при 60°С 2 часа, при этом отгоняется основная часть THF. Охлаждают до комнатной температуры, прибавляют PRG (18% от общего объема), а затем при энергичном перемешивании по каплям медленно прибавляют физиологический солевой раствор (71.5% от общего объема). Раствор дегазируют, перемешивая в вакууме (~30 мм Hg, 4 кПа) 30-60 мин, а затем фильтруют (Millipore, 8 мкм).
Пример 9
Биораспределение порфиринового соединения V в организме мышей, несущих ЕМТ-6 карциномы
Мышам BALB/c, несущим карциномы молочной железы ЕМТ-6, имплантированные подкожно с дорсальной стороны грудной клетки, вводят общую дозу 105 миллиграмм порфиринового соединения V на килограмм веса тела (23.7 мг В/кг). В первый и второй дни после последней инъекции мышей умерщвляют и берут опухоль, кровь, мозг и печень для анализа на бор. Перед анализом на бор кровь сначала анализируют для определения гематологических показателей, которые показывают токсичность. На Таблице 1 показаны средние концентрации бора для различных типов ткани мышей BALB/c.
Пример 10
Изменение веса и гематологических показателей в результате введения порфирина V
Результаты предварительного исследования биораспределения показывают, что порфирин V является, по-видимому, перспективным кандидатом в качестве сенсибилизатора как для BNCT, так и для XRT. Хотя отношение бора в опухоли: крови составляет только 1:1 через один день после инъекций, оно повышается до >30:1 через два дня после инъекций. При относительно низкой дозе порфирина лишь ~100 мг/кг (24 мг/кг В) к опухоли доставляется, значительное количество бора, ~50 частей на миллион (м.д.). Напротив, величины для печени и селезенки ниже, чем можно было ожидать, даже для такой низкой дозы. Способность бора и порфирина нацеливаться на опухоль, в процентах от инъецируемой в опухоль дозы на грамм сырой ткани (~10.5%/г), следует считать довольно эффективной по сравнению с CuTCPH, наиболее изученным порфирином этого класса, способность которого составляет 6.1%/г на той же модели опухоли.
Пример 11
Биораспределение порфиринового соединения VII в организме мышей, несущих ЕМТ-6 карциномы
Соединение VII вводят мышам, несущим опухоль, аналогично Примеру 8, но в немного более высокой общей дозе 143 мг/кг веса тела в виде 3 i.p.инъекций за 8 часов.
Пример 12
Данные биораспределения порфирина VII, приведенные в Таблице 3, показывают, что аналогично другим липофильным порфиринам, содержащим четыре тетракарборанилфенильных фрагмента в мезоположении вместо двух в данном изобретении, к опухолевой ткани можно доставить высокие количества бора и порфирина. Хотя отношение бора в опухоли: крови составляет менее 1:1 через один день после последней инъекции, еще через один день оно повышается до ~7:1, причем в опухоли концентрация бора немного выше. Это немного, если в этой дозе какая-либо токсичность ассоциируется с порфирином.
Таким образом, хотя описаны предпочтительные варианты настоящего изобретения, специалисты в данной области техники понимают, что, не отступая от сущности изобретения, можно осуществить другие варианты изобретения, которые включают все такие дополнительные модификации и изменения, которые входят в формулу изобретения.
Реферат
Настоящее изобретение относится к борсодержащему соединению формулы:где R, R, Rи R, независимо, обозначают -NO, галоген или заместитель, представленный следующей формулой;где заместители Y, независимо, находятся в орто-, мета- или параположении в фенильном кольце и, независимо, обозначают водород или заместитель, представленный формулой (3):;при условии, что, по меньшей мере, один из R, R, Rи Rобозначает заместитель, изображенный формулой (2), где Y представлен формулой (3); где Х обозначает кислород или серу; Rи R, независимо, выбирают из водорода и C-Cгидрокарбила; Z обозначает карборановый кластер, содержащий, по меньшей мере, два атома углерода и, по меньшей мере, три атома бора, или, по меньшей мере, один атом углерода и, по меньшей мере, пять атомов бора в каркасной структуре; r обозначает 0 или целое число от 1 до 20; а обозначает целое число от 1 до 4; и также при условии, что, по меньшей мере, один из R, R, Rи Rобозначает заместитель, представленный -NOили галогеном; и М обозначает либо два иона водорода, ион двухвалентного металла, ион трехвалентного металла, ион четырехвалентного металла, причем заряд комплекса порфирин-металл, образованного ионом трехвалентного, четырехвалентного металла, нейтрализован соответствующим числом противоанионов, дианионов. Также предложены способ визуализации опухоли и соседних тканей и способ бимодальной формы терапии рака. Изобретение позволяет получить карборанилпорферины с продолжительным временем нахождения в опухолях, которые селективно нацелены на опухолевые клетки и разрушают их с минимальным поражением здоровой ткани. 6 н. и 18 з.п. ф-лы, 4 табл., 12 пр.
Формула
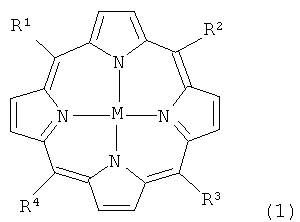
где R1, R2, R3 и R4 независимо обозначают -NO2, галоген или заместитель, представленный следующей формулой

где заместители Y независимо находятся в орто-, мета- или пара-положении в фенильном кольце и независимо обозначают водород или заместитель, представленный формулой (3)

при условии, что, по меньшей мере, один из R1, R2, R3 и R4 обозначает заместитель, изображенный формулой (2), где Y представлен формулой (3);
где Х обозначает кислород или серу;
R10 и R11 независимо выбирают из водорода и C1-C4 гидрокарбила;
Z обозначает карборановый кластер, содержащий, по меньшей мере, два атома углерода и, по меньшей мере, три атома бора или, по меньшей мере, один атом углерода и, по меньшей мере, пять атомов бора в каркасной структуре;
r обозначает 0 или целое число от 1 до 20;
а обозначает целое число от 1 до 4; и
также при условии, что, по меньшей мере, один из R1, R2, R3 и R4обозначает заместитель, представленный -NO2 или галогеном; и
М обозначает либо два иона водорода, ион двухвалентного металла, ион трехвалентного металла, ион четырехвалентного металла, причем заряд комплекса порфирин-металл, образованного ионом трехвалентного, четырехвалентного металла, нейтрализован соответствующим числом противоанионов, дианионов.
i. два из R1, R2, R3 и R4 обозначают заместители, представленные формулой (2);
ii. а обозначает 1;
iii. Y представлен формулой (3);
iv. заместители Y находятся в мета-положениях фенильных циклов; и
v. два заместителя R1-R4, не представленные формулой (2), обозначают -NO2 или галоген.

где R1, R2, R3 и R4 независимо обозначают -NO2, галоген или заместитель, представленный следующей формулой

где заместители Y независимо находятся в орто-, мета- или пара-положении в фенильном кольце и независимо обозначают водород или заместитель, представленный формулой (3)

при условии, что, по меньшей мере, один из R1, R2, R3 и R4 обозначает заместитель, представленный формулой (2), где Y представлен формулой (3);
где Х обозначает кислород или серу;
R10 и R11 независимо выбирают из водорода и C1-C4 гидрокарбила;
Z обозначает карборановый кластер, содержащий, по меньшей мере, два атома углерода и, по меньшей мере, три атома бора или, по меньшей мере, один атом углерода и, по меньшей мере, пять атомов бора в каркасной структуре;
r обозначает 0 или целое число от 1 до 20;
а обозначает целое число от 1 до 4; и
также при условии, что, по меньшей мере, один из R1, R2, R3 и R4 обозначает заместитель, представленный -NO2 или галогеном; и
М обозначает либо два иона водорода, ион двухвалентного металла, ион трехвалентного металла, ион четырехвалентного металла, причем заряд комплекса порфирин-металл, образованного ионом трехвалентного, четырехвалентного металла, нейтрализован соответствующим числом противоанионов, дианионов; и диагностическую визуализацию указанного субъекта.

где
i. два заместителя из R1, R2, R3 и R4 представлены формулой (2);
ii. а обозначает 1;
iii. Y представлен формулой (3);
iv. заместители Y находятся в мета-положении фенильного кольца;
v. два заместителя из R1-R4, не представленные формулой (2), обозначают -NO2 или Br;
vi. заместители, представленные формулой (2), находятся в трансположении ("транс-конфигурации");
vii. Z выбирают из карборанов -C2HB9H10 или -С2НВ10Н10, где -C2HB9H10 обозначает нидо орто-, мета- или пара-карборан, а -С2НВ10Н10 обозначает клозо орто-, мета- или пара-карборан;
viii. M обозначает ванадий, марганец, железо, рутений, технеций, хром, платину, кобальт, никель, медь, цинк, германий, индий, олово, иттрий, золото, барий, вольфрам или гадолиний; и
ix. Х обозначает кислород, R10 и R11 обозначают водород и r обозначает 1;
и визуализацию указанного субъекта.

где R1, R2, R3 и R4 независимо обозначают -NO2, галоген или заместитель, представленный следующей формулой

где заместители Y независимо находятся в орто-, мета- или пара-положении фенильном кольце и независимо обозначают водород или заместитель, представленный формулой (3)

при условии, что, по меньшей мере, один из R1, R2, R3 и R4 обозначает заместитель, представленный формулой (2), где Y представлен формулой (3);
где Х обозначает кислород или серу;
R10 и R11 независимо выбирают из водорода и C1-C4 гидрокарбила;
Z обозначает карборановый кластер, содержащий, по меньшей мере, два атома углерода и, по меньшей мере, три атома бора или, по меньшей мере, один атом углерода и, по меньшей мере, пять атомов бора в каркасной структуре;
r обозначает 0 или целое число от 1 до 20;
а обозначает целое число от 1 до 4; и
также при условии, что, по меньшей мере, один из R1, R2, R3 и R4обозначает заместитель, представленный -NO2 или галогеном; и
М обозначает либо два иона водорода, ион двухвалентного металла, ион трехвалентного металла, ион четырехвалентного металла, причем заряд комплекса порфирин-металл, образованного ионом трехвалентного, четырехвалентного металла, нейтрализован соответствующим числом противоанионов, противодианионов;
и облучение указанного субъекта.

где
i. два заместителя из R1, R2, R3 и R4 представлены формулой (2);
ii. а обозначает 1;
iii. Y представлен формулой (3);
iv. заместители Y находятся в мета-положении фенильного кольца;
v. два заместителя из R1-R4, не представленные формулой (2), обозначают -NO2 или Br;
vi. заместители, представленные формулой (2), находятся в трансположении ("транс-конфигурации");
vii. Z выбирают из карборанов -C2HB9H10 или -C2HB10H10, где -C2HB9H10 обозначает нидо орто-, мета- или пара-карборан, а C2HB10H10 обозначает клозо орто-, мета- или пара-карборан;
viii. M обозначает ванадий, марганец, железо, рутений, технеций, хром, платину, кобальт, никель, медь, цинк, германий, индий, олово, иттрий, золото, барий, вольфрам или гадолиний; и
ix. Х обозначает кислород, R10 и R11 обозначают водород и r обозначает 1;
и облучение указанного субъекта.

где R1, R2, R3 и R4 независимо обозначают -NO2, галоген или заместитель, представленный следующей формулой

где заместители Y независимо находятся в орто-, мета- или пара-положении в фенильном кольце и независимо обозначают водород или заместитель, представленный формулой (3)

при условии, что, по меньшей мере, один из R1, R2, R3 и R4 обозначает заместитель, представленный формулой (2), где Y представлен формулой (3);
где Х обозначает кислород или серу;
R10 и R11 независимо выбирают из водорода и C1-C4 гидрокарбила;
Z обозначает карборановый кластер, содержащий, по меньшей мере, два атома углерода и, по меньшей мере, три атома бора или, по меньшей мере, один атом углерода и, по меньшей мере, пять атомов бора в каркасной структуре;
r обозначает 0 или целое число от 1 до 20;
а обозначает целое число от 1 до 4; и
также при условии, что, по меньшей мере, один из R1, R2, R3 и R4обозначает заместитель, представленный -NO2 или галогеном; и
М обозначает ион трехвалентного, четырехвалентного металла; и при этом заряд комплекса порфирин-металл нейтрализуется одним или более порфириновых соединений, имеющих заряд минус два (двухвалентный отрицательный ион).

где R1, R2, R3 и R4 независимо обозначают -NO2, галоген или заместитель, представленный следующей формулой

где заместители Y независимо находятся в орто-, мета- или пара-положении в фенильном кольце и независимо обозначают водород или заместитель, представленный формулой (3)

при условии, что, по меньшей мере, один из R1, R2, R3 и R4 обозначает заместитель, представленный формулой (2), где Y представлен формулой (3);
где Х обозначает кислород или серу;
R10 и R11 независимо выбирают из водорода и C1-C4 гидрокарбила;
Z обозначает карборановый кластер, содержащий, по меньшей мере, два атома углерода и, по меньшей мере, три атома бора или, по меньшей мере, один атом углерода и, по меньшей мере, пять атомов бора в каркасной структуре;
r обозначает 0 или целое число от 1 до 20;
а обозначает целое число от 1 до 4; и
также при условии, что, по меньшей мере, один из R1, R2, R3 и R4 обозначает заместитель, представленный -NO2 или галогеном.
Документы, цитированные в отчёте о поиске
Новые металлопорфирины и их применение в качестве радиосенсибилизаторов в лучевой терапии

Комментарии